에스트라디올
Estradiol
 | |
 | |
| 이름 | |
|---|---|
| 발음 | /snc str da da o l / ES-tr†-DY-ohl[1][2] |
| 우선 IUPAC 이름 (1S,3aS,3bR,9bS,11aS)-11a-메틸-2,3,3a,3b,4,5,9b,10,11a-데카히드로-1H-시클로펜타[a]페난트렌-1,7-디올 | |
| 기타 이름 에스트라디올; E2; 17β-에스트라디올; 에스트라-1, 3, 5(10)-트리엔-3, 17β-디올; 17β-에스트라디올 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.000.022 |
| EC 번호 |
|
| 케그 | |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C18H24O2 | |
| 몰 질량 | 272.38 g/g |
자화율(δ) | - 802.6·10cm−63/수직 |
| 약리학 | |
| G03CA03 (WHO) | |
| 라이선스 데이터 | |
| 구강, 설하, 비강내, 국소/경피, 질, 근육내 또는 피하(에스테르로서), 피하 임플란트 | |
| 약동학: | |
| 구강: 5%[3] 미만 | |
| 최대 98%:[3][4] • 알부민 : 60% • : 38 % • 무료: 2% | |
| 간(수산화, 황산화, 글루쿠론화를 통해) | |
| 경구 : 13~20시간[3] 언어 외: 8~18시간[5] 국소(겔): 36.5시간[6] | |
| 소변: 54%[3] 대변: 6 [3]% | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
에스트라디올(E2)은 에스트로겐 스테로이드 호르몬으로 주요 여성 성호르몬이다.그것은 발정 및 생리 여성의 생식 주기 조절에 관여한다.에스트라디올은 가슴, 엉덩이 확대, 여성 관련 지방 분포 패턴과 같은 여성 2차 성징의 발달에 책임이 있다.또한 사춘기, 성인기, 임신 [7]중 유선, 자궁, 질과 같은 여성 생식 조직의 발달과 유지에도 중요하다.그것은 뼈, 지방, 피부, 간, 그리고 뇌를 포함한 많은 다른 조직에도 중요한 영향을 미친다.
비록 남성의 에스트라디올 수치가 여성보다 훨씬 낮지만, 에스트라디올은 남성에게도 중요한 역할을 한다.인간과 다른 포유류를 제외하고, 에스트라디올은 대부분의 척추동물과 갑각류, 곤충, 어류, 그리고 다른 동물 [8][9]종에서도 발견된다.
에스트라디올은 특히 난소의 모낭 내에서 생성되지만 고환, 부신, 지방, 간, 가슴, 그리고 뇌를 포함한 다른 조직에서도 생성된다.에스트라디올은 일련의 반응과 [10]중간체를 통해 콜레스테롤로부터 체내에서 생산된다.주요 경로는 안드로스테디온의 형성을 수반하며, 안드로스테디온은 방향분해효소에 의해 에스트로네로 변환되고 이후 에스트라디올로 변환된다.또는 안드로스테디온은 테스토스테론으로 전환될 수 있으며, 테스토스테론은 에스트라디올로 전환될 수 있다.여성의 폐경이 되면 난소에 의한 에스트로겐의 생산이 중단되고 에스트라디올 수치는 매우 낮은 수준으로 감소한다.
에스트라디올은 천연 호르몬으로서의 역할 외에도, 예를 들어 갱년기 호르몬 치료와 성전환 여성의 여성화 호르몬 치료에서 의약품으로 사용됩니다. 의약품으로서의 에스트라디올에 대한 정보는 에스트라디올(약물) 기사를 참조하십시오.
생물학적 기능
성적 발달
여성의 2차 성징의 발달은 에스트로겐, 구체적으로는 에스트라디올에 의해 [11][12]추진된다.이러한 변화는 사춘기에 시작되고, 대부분은 생식기에 강화되며, 폐경 후 에스트라디올 지지가 감소하면서 덜 뚜렷해진다.따라서, 에스트라디올은 가슴 발달을 일으키고, 뼈, 관절, 지방 [11][12]증착에 영향을 미치는 체형의 변화를 일으킨다.반면 우리는 pubertal가 급성장할(간접적으로를 통해 성장이 커지면서 호르몬의 분비.)[13]과 골단 폐쇄(thereb를 조정한다 여성에서는 에스트라디올, 엉덩이, 여성의 지방 분포(로 지방은 가슴, 엉덩이, 허벅지에 특히와 엉덩이에 예치)은 음부, 음문의 성숙 확장, 가슴 성장을 유인하는 지역이다.y내가([11][12]최종 키 흉내내기) 남녀 모두.
재생산
여성 생식계
암컷에서 에스트라디올은 생식기 조직의 성장호르몬으로 작용하여 질, 자궁선, 자궁내막 및 나팔관 내벽을 지지한다.그것은 근막의 성장을 촉진한다.에스트라디올은 난소에서 난모세포를 유지하기 위해 필요한 것으로 보인다.월경 주기 동안, 성장하는 모낭에 의해 생성된 에스트라디올은 양성 피드백 시스템을 통해 황체화 호르몬 급증을 유도하고 배란을 유도하는 시상하부-하수체 이벤트를 유발합니다.황체 단계에서 에스트라디올은 프로게스테론과 함께 착상용 자궁내막을 준비한다.임신 중에는 태반의 생성으로 에스트라디올이 증가한다.에스트라디올은 에스트론, 에스트리올과 함께 임신에 미치는 영향은 명확하지 않다.그들은 자궁 혈류, 근막 성장을 촉진하고, 유방 성장을 촉진하며, 종국적으로는 자궁경부 연화 및 근막 옥시토신 [citation needed]수용체의 발현을 촉진할 수 있다.개코원숭이의 경우, 에스트라디올이 임신 유지에 역할을 한다는 것을 암시하면서, 에스트로겐 분비를 막는 것은 임신 손실로 이어진다.연구는 노동의 시작 과정에서 에스트로겐의 역할을 조사하고 있다.황체 단계에서 프로게스테론이 [citation needed]노출되기 전에 에스트라디올의 작용이 필요하다.
남성 생식계
에스트라디올(및 일반적으로 에스트로겐)이 남성 번식에 미치는 영향은 복잡하다.에스트라디올은 주로 포유류 고환의 레이디그 세포에서 방향화효소의 작용에 의해 생성되지만 일부 생식세포와 미성숙한 [14]포유류의 세르톨리 세포에서도 생성된다.그것은 남성 [15]정자세포의 아포토시스(apoptosis)를 예방하는 기능을 한다.1990년대 초반 일부 연구는 세계적으로 정자 수가 감소하는 것과 [16]환경에서의 에스트로겐 노출 사이에 연관성이 있다고 주장했지만, 이후 연구는 그러한 연관성이나 정자 [17][18]수의 일반적인 감소의 증거를 발견하지 못했다.난임 남성의 하위 집단에서 에스트라디올 생산을 억제하면 정액 [19]분석을 개선할 수 있다.
클라인펠터 증후군과 같은 특정 성염색체 유전 조건을 가진 남성들은 에스트라디올 [20]수치가 더 높을 것이다.
골격계
에스트라디올은 뼈에 지대한 영향을 미친다.그것이 없는 개인들(또는 다른 에스트로겐들)은 후두엽 폐쇄가 지연되거나 [21]일어나지 않을 수 있기 때문에 키가 크고 내시처럼 될 것이다.골밀도 또한 영향을 받아 초기 골감소증과 [22]골다공증을 일으킨다.낮은 수준의 에스트라디올은 또한 골절을 예측할 수 있으며, 폐경 후 여성의 골절 [23]발생률이 가장 높다.폐경이 지난 여성들은 상대적인 에스트로겐 [24]결핍으로 인해 골량이 급격히 감소하는 것을 경험한다.
피부 건강
에스트로겐 수용체와 프로게스테론 수용체는 각질세포와 [25][26]섬유아세포를 포함한 피부에서 검출되었다.폐경기 이후 여성호르몬의 감소는 위축, 얇아짐, 그리고 피부의 주름 증가와 피부탄력, 단단함, [25][26]강도의 감소를 초래한다.이러한 피부 변화는 피부 노화의 가속화를 구성하며 콜라겐 함량의 감소, 표피 피부 세포의 형태상의 불규칙함, 피부 섬유 사이의 접지 물질 감소, 모세혈관과 [25][26]혈류 감소의 결과이다.폐경기에는 피부도 건조해져 피부 수분과 표면지질([25]피지 생성)이 감소하기 때문이다.만성 노화, 광노화와 함께 폐경기 에스트로겐 결핍은 피부 [25]노화에 주로 영향을 미치는 세 가지 주요 요인 중 하나이다.
에스트로겐 단독 또는 프로게스토겐과의 조합으로 이루어진 호르몬 대체 요법은 폐경 [25][26]후 여성의 피부에 잘 문서화되고 상당한 유익한 효과를 가지고 있다.이러한 장점에는 피부 콜라겐 함량 증가, 피부 두께 및 탄력 증가, 피부 수분 공급 및 표면 지질 [25][26]증가가 포함됩니다.국소적인 에스트로겐은 [25]피부에 비슷한 이로운 영향을 미치는 것으로 밝혀졌다.또한 국소 2% 프로게스테론 크림이 피부 탄력과 탄력을 유의하게 증가시키고 폐경 전후 여성의 [26]주름을 눈에 띄게 감소시킨다는 연구 결과가 나왔다.반면 피부 수화 및 표면 지질은 국소 프로게스테론과 [26]함께 유의미한 변화를 보이지 않았다.이러한 발견들은 에스트로겐과 같이 프로게스테론이 피부에 이로운 영향을 미치며 독립적으로 피부 [26]노화로부터 보호할 수 있다는 것을 암시한다.
신경계
에스트로겐은 스테로이드 전구체로부터 뇌에서 생성될 수 있다.항산화제로서는 신경 보호 기능이 [27]있는 것으로 밝혀졌다.
생리 주기의 양성 및 음성 피드백 루프는 성선 [28]도트로핀을 조절하기 위한 시상하부-하수체 시스템과의 연결고리로서 난소 에스트라디올을 포함한다.시상하부-뇌하수체-성선축 참조).
에스트로겐은 여성의 정신 건강에 중요한 역할을 하는 것으로 여겨지며 호르몬 수치, 기분 그리고 행복 사이의 연관성이 제안된다.에스트로겐의 급격한 감소나 변동, 또는 장기간 지속된 낮은 수준의 에스트로겐은 상당한 기분 저하와 관련이 있을 수 있습니다.에스트로겐 수치가 안정화 및/또는 [29][30]복구된 후 산후, 폐경기, 폐경기 후 우울증으로부터의 임상 회복이 효과적인 것으로 나타났다.
때 estrogen에 부수적으로 안드로겐 박탈과 months,[31일]의 기간 에스트로겐이나 안드로겐 중요한 부분이 성관계를 뇌의 분화, 둘 다를 것으로 알려지게 노출되어 성적으로 이형 뇌 구조의 트랜스젠더 여성들의 분량과 정확하게 전형적인 여성의 뇌 구조를 바꿔 발견되었다.미리선천적으로 그리고 나중에.
또한 많은 척추동물에서 성체 수컷 성행동의 프로그래밍이 태아기와 [32]유아기 초기에 생성된 에스트라디올에 크게 의존하고 있다는 증거가 있다.비록 [33]다른 포유류의 증거가 연관성을 나타내는 경향이 있지만, 이 과정이 인간의 성행동에 중요한 역할을 하는지는 아직 알려지지 않았다.
에스트로겐은 옥시토신의 분비를 증가시키고 [34]뇌에서 옥시토신 수용체의 발현을 증가시키는 것으로 밝혀졌다.여성의 경우 에스트라디올 1회 복용량이 순환하는 옥시토신 [35]농도를 증가시키기에 충분한 것으로 밝혀졌다.
부인과 암
에스트라디올은 유방암, 난소암, 자궁내막암과 같은 암의 발생과 진행과 관련이 있다.에스트라디올은 주로 에스트로겐 수용체 α(ERα)와 에스트로겐 수용체 β(ERβ)[36][37]라고 불리는 두 개의 핵 수용체와 상호작용함으로써 표적 조직에 영향을 미친다.이러한 에스트로겐 수용체의 기능 중 하나는 유전자 발현을 조절하는 것이다.일단 에스트라디올이 ER에 결합하면, 수용체 복합체는 특정 DNA 배열에 결합하여 DNA에 손상을 입히고 세포 분열과 DNA 복제가 증가할 수 있습니다.진핵세포는 손상된 DNA에 반응하여 세포주기의 G1, S, 또는 G2상을 자극하거나 손상시켜 DNA 복구를 시작한다.그 결과,[38] 세포 형성과 암세포 증식이 일어난다.
심혈관계
에스트로겐은 특정 혈관에 영향을 미친다.관상동맥에서 [39]동맥혈류 개선이 입증되었다.
임신 중 에스트라디올의 높은 수치는 응고를 증가시키고 정맥혈전 색전증의 위험을 증가시킨다.
| 임신 및 산후 기간 동안 인구 10,000명당 첫 번째 VTE의 절대 발생률 | ||||||||
|---|---|---|---|---|---|---|---|---|
| 스웨덴 데이터 A | 스웨덴 데이터 B | 영어 데이터 | 덴마크 데이터 | |||||
| 기간 | N | 레이트(95% CI) | N | 레이트(95% CI) | N | 레이트(95% CI) | N | 레이트(95% CI) |
| 임신외 | 1105 | 4.2 (4.0–4.4) | 1015 | 3.8 (?) | 1480 | 3.2 (3.0–3.3) | 2895 | 3.6 (3.4–3.7) |
| 전생대 | 995 | 20.5 (19.2–21.8) | 690 | 14.2 (13.2–15.3) | 156 | 9.9 (8.5–11.6) | 491 | 10.7 (9.7–11.6) |
| 삼중기 1 | 207 | 13.6 (11.8–15.5) | 172 | 11.3 (9.7–13.1) | 23 | 4.6 (3.1–7.0) | 61 | 4.1 (3.2–5.2) |
| 삼중기 2 | 275 | 17.4 (15.4–19.6) | 178 | 11.2 (9.7–13.0) | 30 | 5.8 (4.1–8.3) | 75 | 5.7 (4.6–7.2) |
| 삼중기 | 513 | 29.2 (26.8–31.9) | 340 | 19.4 (17.4–21.6) | 103 | 18.2 (15.0–22.1) | 355 | 19.7 (17.7–21.9) |
| 배송에 대하여 | 115 | 154.6 (128.8–185.6) | 79 | 106.1 (85.1–132.3) | 34 | 142.8 (102.0–199.8) | – | |
| 산후 | 649 | 42.3 (39.2–45.7) | 509 | 33.1 (30.4–36.1) | 135 | 27.4 (23.1–32.4) | 218 | 17.5 (15.3–20.0) |
| 산후조기 | 584 | 75.4 (69.6–81.8) | 460 | 59.3 (54.1–65.0) | 177 | 46.8 (39.1–56.1) | 199 | 30.4 (26.4–35.0) |
| 늦은 산후 | 65 | 8.5 (7.0–10.9) | 49 | 6.4 (4.9–8.5) | 18 | 7.3 (4.6–11.6) | 319 | 3.2 (1.9–5.0) |
| 임신 및 산후 기간 중 첫 번째 VTE의 발생률 비율(IRR) | ||||||||
| 스웨덴 데이터 A | 스웨덴 데이터 B | 영어 데이터 | 덴마크 데이터 | |||||
| 기간 | IRR* (95% CI) | IRR* (95% CI) | IRR (95% CI)★ | IRR (95% CI)★ | ||||
| 임신외 | 참조(예: 1.00) | |||||||
| 전생대 | 5.08 (4.66–5.54) | 3.80 (3.44–4.19) | 3.10 (2.63–3.66) | 2.95 (2.68–3.25) | ||||
| 삼중기 1 | 3.42 (2.95–3.98) | 3.04 (2.58–3.56) | 1.46 (0.96–2.20) | 1.12 (0.86–1.45) | ||||
| 삼중기 2 | 4.31 (3.78–4.93) | 3.01 (2.56–3.53) | 1.82 (1.27–2.62) | 1.58 (1.24–1.99) | ||||
| 삼중기 | 7.14 (6.43–7.94) | 5.12 (4.53–5.80) | 5.69 (4.66–6.95) | 5.48 (4.89–6.12) | ||||
| 배송에 대하여 | 37.5 (30.9–44.45) | 27.97 (22.24–35.17) | 44.5 (31.68–62.54) | – | ||||
| 산후 | 10.21 (9.27–11.25) | 8.72 (7.83–9.70) | 8.54 (7.16–10.19) | 4.85 (4.21–5.57) | ||||
| 산후조기 | 19.27 (16.53–20.21) | 15.62 (14.00–17.45) | 14.61 (12.10–17.67) | 8.44 (7.27–9.75) | ||||
| 늦은 산후 | 2.06 (1.60–2.64) | 1.69 (1.26–2.25) | 2.29 (1.44–3.65) | 0.89 (0.53–1.39) | ||||
| 주의: 스웨덴 데이터 A = 확인에 관계없이 VTE용 코드를 사용합니다.스웨덴 데이터 B = 알고리즘이 적용된 VTE만 사용.산후조기=산후 6주.늦은 산후=산후 6주 이상 경과.* = 연령 및 연도에 따라 조정됩니다.② = 제공된 데이터를 바탕으로 산출한 미조정 비율.출처: | ||||||||
기타 기능
에스트라디올은 간에 복합적인 영향을 미친다.그것은 리포단백질, 결합단백질, 그리고 혈액 [citation needed]응고에 책임이 있는 단백질을 포함한 여러 단백질의 생산에 영향을 미친다.많은 양의 에스트라디올은 예를 들어 임신의 콜레스트증처럼 콜레스트증을 유발할 수 있다.
자궁내막증, 자궁평활근종, 자궁출혈 [citation needed]등 에스트로겐에 따라 달라지는 부인과 질환도 있다.
생물학적 활동
에스트라디올은 주로 핵 스테로이드 호르몬 수용체인 에스트로겐 수용체(ER)의 작용제 역할을 한다.ER에는 ERα와 ERβ라는 두 가지 하위 유형이 있으며, 에스트라디올은 이들 두 수용체에 효력적으로 결합하고 활성화한다.ER 활성화의 결과는 에스트라디올이 체내에서 생물학적 영향을 매개하는 지배적인 메커니즘인 ER 발현 세포에서 유전자 전사와 발현을 조절하는 것이다.에스트라디올은 또한 최근에 발견된 에스트라디올의 비핵 수용체 GPER(GPR30)와 같은 막 에스트로겐 수용체(mERs)의 작용제로서 작용하며, 이를 통해 다양한 비게놈 [41]효과를 매개할 수 있다.ER의 경우와는 달리 GPER는 에스트라디올에 대해 선택적인 것으로 보이며 에스트론 및 [42]에스트리올과 같은 다른 내인성 에스트로겐에 대해 매우 낮은 친화력을 보인다.GPER 이외의 mER에는 ER-X, ERx 및 G-mER가q [43][44]포함됩니다.
ERα/ERβ는 p23단백질과 면역필린을 포함한 열충격단백질 90(HSP90)의 주위에 형성된 다분자 샤페론 복합체에 갇힌 비활성상태이며 세포질 및 부분적으로 핵에 위치한다.E2 고전 경로 또는 에스트로겐 고전 경로에서 에스트라디올은 세포질로 들어가 ER과 상호작용합니다.E2와 결합하면 ER은 분자 샤페론 복합체로부터 분리되어 이량화, 핵으로 이동 및 특정 DNA 배열(에스트로겐 반응 요소, ERE)에 결합할 수 있게 되어 몇 시간이고 며칠에 걸쳐 유전자 전사가 가능합니다.
쥐에게 피하주사를 투여하면 에스트라디올은 [45][46][47]에스트론보다 약 10배, 에스트리오르보다 약 100배 더 강력하다.이처럼 에스트라디올은 에스트로겐으로서의 에스트로겐과 에스트리올의 역할이 무시할 [47]수 없는 것으로 알려져 있지만 체내 주요 에스트로겐이다.
| 에스트로겐 | ER RBA (%) | 자궁중량(%) | 자궁확장증 | LH 레벨(%) | SHBG RBA (%) |
|---|---|---|---|---|---|
| 통제 | – | 100 | – | 100 | – |
| 에스트라디올 (E2) | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| 에스트론 (E1) | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| 에스트리올 (E3) | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| 에스테트롤(E4) | 0.5 ± 0.2 | ? | 활발하지 않은 | ? | 1 |
| 17α-에스트라디올 | 4.2 ± 0.8 | ? | ? | ? | ? |
| 2-히드록시에스트라디올 | 24 ± 7 | 285 ± 8 | +b | 31–61 | 28 |
| 2-메톡시에스트라디올 | 0.05 ± 0.04 | 101 | 활발하지 않은 | ? | 130 |
| 4-히드록시에스트라디올 | 45 ± 12 | ? | ? | ? | ? |
| 4-메톡시에스트라디올 | 1.3 ± 0.2 | 260 | ++ | ? | 9 |
| 4-플루오로에스트라디올a | 180 ± 43 | ? | +++ | ? | ? |
| 2-히드록시에스트론 | 1.9 ± 0.8 | 130 ± 9 | 활발하지 않은 | 110–142 | 8 |
| 2-메톡시에스트론 | 0.01 ± 0.00 | 103 ± 7 | 활발하지 않은 | 95–100 | 120 |
| 4-히드록시에스트론 | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-메톡시에스트론 | 0.13 ± 0.04 | 338 | ++ | 65–92 | 12 |
| 16α-히드록시에스트론 | 2.8 ± 1.0 | 552 ± 42 | +++ | 7–24 | 0.5 미만 |
| 2-히드록시에스트리올 | 0.9 ± 0.3 | 302 | +b | ? | ? |
| 2-메톡시에스트리올 | 0.01 ± 0.00 | ? | 활발하지 않은 | ? | 4 |
| 주의: 값은 평균 ± SD 또는 범위입니다.ER RBA = 랫드 자궁세포의 에스트로겐 수용체에 대한 상대적 결합 친화력.자궁중량 = 피하 삽입 삼투압 펌프를 통해 1μg/hour를 연속 투여한 후 72시간 후 난소 적출된 랫드의 자궁습중량 변화율.LH 수준 = 피하 임플란트를 통해 24~72시간 연속 투여 후 난소 적출된 쥐의 기준선에 상대적인 황체화 호르몬 수준.각주: = 합성(즉, 내인성이 아님).b = 48시간 이내에 고원이 생기는 비정형 자궁영양 효과(에스트라디올의 자궁영양이 최대 72시간까지 선형적으로 지속됨)출처:"템플릿"을 참조해 주세요. | |||||
생화학
생합성
에스트라디올은 다른 스테로이드 호르몬과 마찬가지로 콜레스테롤에서 유래한다.측쇄개열 후 δ5 또는 δ4 경로를 사용하여 안드로스테디온이 주요 중간체이다.안드로스테디온의 일부는 테스토스테론으로 변환되고, 테스토스테론은 방향족분해효소에 의해 에스트라디올로 변환된다.대체 경로에서 안드로스테니온은 에스트론으로 방향족화되고, 에스트론은 17β-히드록시스테로이드탈수소효소(17β-HSD)[49]를 통해 에스트라디올로 변환된다.
생식기에 여성의 에스트라디올은 안드로스테디온(테카 모낭세포에서 생성됨)의 에스트라디올로의 방향족화에 의해 난소의 과립세포에 의해 생성되며, 이어서 에스트라디올에서 에스트라디올로의 전환이 17β-HSD에 의해 생성된다.소량의 에스트라디올은 부신피질에서도 생성되며, 남성의 경우 [medical citation needed]고환에서도 생성된다.
에스트라디올은 생식선에서만 생성되는 것이 아니다; 특히 지방 세포는 에스트라디올에 대한 활성 전구체를 생성하며,[50] 폐경 후에도 계속 그렇게 할 것이다.에스트라디올은 뇌와 동맥벽에서도 생성된다.
남성의 경우 순환 에스트라디올의 약 15~25%가 고환에서 [51][52]생성된다.나머지는 테스토스테론의 말초 방향족화를 통해 에스트라디올로, 안드로스테디온의 에스트라디올로 합성된다(그 후 말초 17β-HSD를 [51][52]통해 에스트라디올로 변환된다).이러한 말초 방향족화는 주로 지방 조직에서 발생하지만 뼈, 간, [51]뇌와 같은 다른 조직에서도 발생합니다.남성의 경우 하루에 약 40~[51]50μg의 에스트라디올이 생산된다.
분배
혈장 중 에스트라디올은 주로 SHBG와 결합하고 알부민에도 결합한다.2.21%(± 0.04%)의 극히 일부만이 자유롭고 생물학적으로 활성 상태이며, 생리 [53]주기 내내 일정하게 유지되는 백분율이다.
대사
에스트라디올의 불활성화에는 에스트론이나 에스트리올과 같은 덜 활성인 에스트로겐으로의 전환이 포함된다.에스트리올은 주요 비뇨기 [citation needed]대사물입니다.에스트라디올은 간에서 결합되어 에스트라디올 황산염, 에스트라디올 글루쿠로니드 등의 에스트로겐 결합체를 형성하고 신장을 통해 배설된다.수용성 복합체 중 일부는 담관을 통해 배설되며 장에서 가수분해된 후 부분적으로 재흡수된다.이 장간 순환은 에스트라디올 수치를 유지하는 데 기여한다.
에스트라디올은 또한 수산화 과정을 통해 카테콜 에스트로겐으로 대사된다.간에서는 2-히드록시에스트라디올로의 2-히드록시에스틸화를 통해 CYP1A2, CYP3A4, CYP2C9에 의해 비특이적으로 대사되며,[54] CYP2C19 및 CYP2C8에 의해 17β-히드록시에스탈수소화된다.
에스트라디올은 에스트라디올 팔미틴산염 및 스테아린산염과 같은 지방성 에스트라디올 형태로 에스테르와 추가로 결합되며, 이들 에스테르는 지방조직에 저장되며 매우 오래 지속되는 에스트라디올의 [56][57]저장소로 작용할 수 있다.
배설물
에스트라디올은 글루쿠로니드와 황산 에스트로겐 결합체의 형태로 소변에 배설된다.여성들에게 라벨이 부착된 에스트라디올을 정맥주사 한 후, 거의 90%는 4-5일 [58][59]이내에 소변과 대변으로 배설된다.장간 재순환은 에스트라디올의 [58]배설 지연을 일으킨다.
레벨

폐경 전 여성의 에스트라디올 수치는 생리 주기 내내 매우 다양하며 기준 범위는 [61]소스마다 매우 다양하다.에스트라디올 수치는 최소이며, 대부분의 실험실에 따르면 초기부터 중간 모낭 단계(또는 [62][63]월경 주기의 첫 주) 동안 20에서 80 pg/mL까지이다.에스트라디올의 수치는 이 기간 동안 그리고 배란 [61][62]전 단계까지 중간에서 후반의 모낭 단계(또는 생리 주기의 둘째 주)에 걸쳐 점진적으로 증가한다.배란 전(약 24시간에서 48시간의 기간)에 에스트라디올 수치는 일시적으로 급증하여 월경 [61]주기 중 가장 높은 농도에 도달한다.이때 순환수치는 일반적으로 130~200pg/mL 사이이지만, 일부 여성의 경우 300~400pg/mL까지 높을 수 있으며, 일부 실험실의 기준범위 상한(예를 들어 750pg/mL)[61][62][64][65][66]은 더욱 크다.배란 후(또는 중간 주기) 및 월경 주기 후반 또는 황체 단계 중 에스트라디올 수치는 초기 및 중간 황체 단계 동안 약 100~150 pg/mL 사이에서 변동하며, 황체 단계 후반 또는 월경 며칠 전에는 약 40 pg/mL의 [61][63]저치에 도달한다.전체 월경 주기 동안 에스트라디올의 평균 통합 수준은 80, 120, 150 pg/mL로 [63][67][68]공급원에 따라 다양하게 보고되었다.상반된 보고서가 존재하지만, 한 연구에서는 젊은 여성의 평균 통합 에스트라디올 수준이 150 pg/mL인 반면, 나이 든 [68]여성의 평균 통합 수준은 50 - 120 pg/mL이었다.
암컷의 생식년 동안, 에스트라디올의 수치 마땅히 그 에스트론보다 생리 주기의 초반 여포기 동안을 제외하고, 따라서, 에스트라디올이 주된 에스트로겐 절대 혈청 레벨과 발정 활동의 측면에서 인적 여성의 생식년 동안으로 여겨질 수 있는 더 높다.[표창 필요한]임신 중 에스트리올은 주요 순환 에스트로겐이 되고, 폐경기 중에는 에스트리올이 체내에서 발생하는 유일한 시기이다(둘 다 혈청 [citation needed]수준에 근거한다.남성들이 테스토스테론에서 생성하는 에스트라디올은 폐경 후 여성의 혈청 수준과 거의 비슷한 수준으로 존재한다([citation needed]각각 <35 pg/mL 대비 14–55).또 70대 남성의 에스트라디올 농도를 70대 여성의 농도와 비교하면 [69]남성의 약 2~4배 높은 것으로 보고됐다.
| 그룹. | E2 (prod ) | E2 (표준) | E1 (표준) | Ratio |
|---|---|---|---|---|
| 푸베르탈a 걸스 태너 스테이지 1(어린 시절) 태너 2기(8~12세) 태너 3기(10~13세) 태너 스테이지 IV(11~14세) 태너 스테이지 V(12~15세) 엽상(1~14일째) Luteal (15~28일 | ? ? ? ? ? ? | 9 (9 ~ 20) pg/mL 15 (9 ~ 30) pg/mL 27 (9 ~ 60) pg/mL 55 (16 ~ 85) pg/mL 50(30~100) pg/mL 130 (70 ~300) pg/mL | 13 (9 ~ 23) pg/mL 18 (10 ~ 37) pg/mL 26(17~58) pg/mL 36 (23 ~69) pg/mL 44(30~89) pg/mL 75(39~160) pg/mL | ? ? ? ? ? ? |
| 프리버탈 보이즈 | ? | 2 ~ 8 페이지 / ml | ? | ? |
| 폐경 전 여성 초기 모낭상(1~4일째) 모낭중기(5~9일째) 후기 모낭상(10~14일째) 황체상(15~28일) 경구 피임약(무배란제) | 30 ~ 100 µg/일 100 ~ 160 µg/일 320 – 1일 µg 300 µg/일 ? | 40~60 페이지/ml 60 ~ 100 pg/ml 200~400 pg/ml 190 페이지/ml 12~50 페이지/ml | 40~60 페이지/ml ? 170 ~ 200 pg/ml 100~150 페이지/ml ? | 0.5–1 ? 1–2 1.5 ? |
| 폐경 후 여성 | 18 µg/일 | 5~20 페이지/ml | 30~70 페이지/ml | 0.3–0.8 |
| 임산부 초산기(1~12주) 임신 2기(13~26주) 3개월째(27~40주) | ? ? ? | 1,000 ~ 5,000 pg/ml 5,000~15,000 pg/ml 10,000 ~ 40,000 pg/ml | ? ? ? | ? ? ? |
| 남자a | 20 ~ 60 µg/일 | 27(20~55) pg/mL | 20 ~ 90 pg/ml | 0.4–0.6 |
| 각주: = 형식은 "평균 값(범위)" 또는 "범위"입니다.출처:"템플릿"을 참조해 주세요. | ||||
측정.
여성의 경우, 혈청 에스트라디올은 임상 실험실에서 측정되며 주로 난소의 활동을 반영한다.에스트라디올 혈액 검사는 [70]혈중 에스트라디올 양을 측정합니다.난소, 태반, [70]부신의 기능을 확인할 때 사용합니다.이것은 무월경이나 생리기능 장애를 가진 여성들에게서 기준 에스트로겐을 검출할 수 있고, 저에스트로겐과 폐경 상태를 검출할 수 있다.또한 불임치료 중 에스트로겐 모니터링은 모낭성장을 평가하고 치료 모니터링에 유용하다.에스트로겐을 생성하는 종양은 지속적으로 높은 수준의 에스트라디올과 다른 에스트로겐을 보여줄 것이다.성조숙증에서는 에스트라디올 수치가 부적절하게 증가한다.
범위
개별 실험실 결과는 항상 테스트를 수행한 실험실에서 제공한 범위를 사용하여 해석해야 합니다.
| 환자 유형 | 하한 | 상한 | 구성 단위 |
|---|---|---|---|
| 성인 남성 | 오십[71] | 이백[71] | pmol/L |
| 14 | 55 | pg/mL | |
| 성인 여성(후상 , 5일째) | 칠십[71] 95% PI(표준) | 오백[71] 95% PI | pmol/L |
| 110[72] 90 % PI (중고) 그림에서)를 참조해 주세요) | 220[72] 90 % PI | ||
| 19 (95% PI) | 140 (95% PI) | pg/mL | |
| 30 (90 % PI) | 60 (90 % PI) | ||
| 성인 여성(배란 전) 피크시) | 400[71] | 1500[71] | pmol/L |
| 110 | 410 | pg/mL | |
| 성인 여성 (황체상) | 칠십[71] | 600[71] | pmol/L |
| 19 | 160 | pg/mL | |
| 성인 여성 – 무료 (단백질 결합 없음) | 0.5[73][original research?] | 9개[73][original research?] | pg/mL |
| 1.7[73][original research?] | 33[73][original research?] | pmol/L | |
| 폐경 후 여성 | 없음[71] | 130 미만[71] | pmol/L |
| 없음 | 35 미만 | pg/mL |
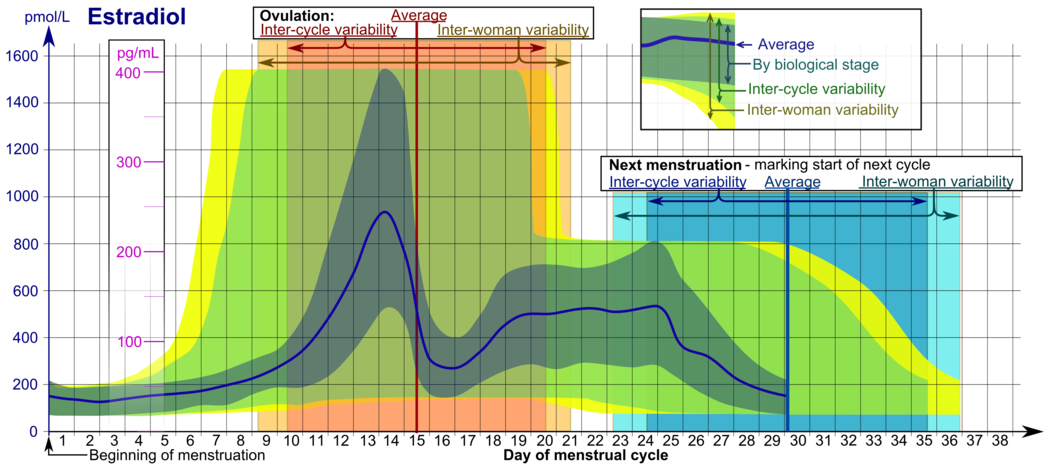
- 생물학적 단계로 표시된 범위는 생물학적 진행의 다른 마커에 대하여 면밀하게 관찰된 생리 주기에서 사용할 수 있으며, 시간 척도는 평균 주기에 비해 각각 얼마나 빠른지 또는 얼마나 느린지 압축 또는 연장할 수 있다.
- 주기간 변동성은 생리 시작만 알고 있지만 여성이 평균 배란 주기 길이와 시간을 정확히 알고 있고, 시간 척도가 여성의 평균까지 압축되거나 늘어나는 등 어느 정도 규칙적인 모니터링되지 않은 사이클에서 사용하는 것이 더 적합하다.연령 주기 길이가 모집단의 평균보다 각각 짧거나 길다.
- 평균 배란주기 길이와 시간을 알 수 없는 경우에 여성간 변동성을 나타내는 범위가 더 적합하지만, 월경 시작만 [74]제시되어 있다.
정상적인 생리 주기에서 에스트라디올 수치는 일반적으로 월경 시 50 pg/mL 미만으로 측정되며, 모낭 발달과 함께 상승하며(피크: 200 pg/mL), 배란 시 잠시 하락한 후 황체 단계에서 두 번째 피크를 위해 다시 상승한다.황체기 말기에는 임신이 없는 한 에스트라디올 수치가 월경 수준으로 떨어진다.
임신 중에는 에스트라디올을 포함한 에스트로겐 수치가 월경을 향해 꾸준히 상승한다.이 에스트로겐의 근원은 태아 부신에서 생성되는 프로호르몬을 방향족화하는 태반이다.
| 섹스. | 성호르몬 | 생식 기능 단계 | 피 생산율 | 생식선 분비율 | 대사 클리어런스 레이트 | 기준 범위(세럼 레벨) | |
|---|---|---|---|---|---|---|---|
| SI 유닛 | 비유닛SI | ||||||
| 남자들 | 안드로스테디온 | – | 2.8 mg/일 | 1.6 mg/일 | 2,200 L/일 | 2.8~7.3 nmol/L | 80 ~ 210 ng/dL |
| 테스토스테론 | – | 6.5 mg/일 | 6.2mg/일 | 950 L/일 | 6.9~34.7 nmol/L | 200~1000ng/dL | |
| 에스트로네 | – | 150μg/일 | 110μg/일 | 2050 L/일 | 37 ~ 250 pmol / L | 10 ~ 70 pg / mL | |
| 에스트라디올 | – | 60μg/일 | 50μg/일 | 1,600 L/일 | 37~210 pmol/L 미만 | 10 ~ 57 pg / mL | |
| 황산에스트론 | – | 80μg/일 | 중요하지 않다 | 167 L/일 | 600 ~ 2,500 pmol / L | 200~900 pg/mL | |
| 여성들. | 안드로스테디온 | – | 3.2mg/일 | 2.8 mg/일 | 2,000 L/day | 3.1~12.2 nmol/L | 89~350 ng/dL |
| 테스토스테론 | – | 190μg/일 | 60μg/일 | 500 L/일 | 0.7~2.8 nmol/L | 20 ~ 81 ng/dL | |
| 에스트로네 | 엽상 | 110μg/일 | 80μg/일 | 2,200 L/일 | 110~400 pmol/L | 30~110 pg/mL | |
| 황체상 | 260μg/일 | 150μg/일 | 2,200 L/일 | 310 ~ 660 pmol / L | 80~180 pg/mL | ||
| 갱년기 후 | 40μg/일 | 중요하지 않다 | 1610 L/일 | 22 ~ 230 pmol / L | 6 ~ 60 pg / mL | ||
| 에스트라디올 | 엽상 | 90μg/일 | 80μg/일 | 1,200 L/일 | 37~360 pmol/L 미만 | 10 ~ 98 pg / mL | |
| 황체상 | 250μg/일 | 240μg/일 | 1,200 L/일 | 699 ~ 1250 pmol / L | 190 ~ 341 pg/mL | ||
| 갱년기 후 | 6μg/일 | 중요하지 않다 | 910 L/일 | 37~140 pmol/L 미만 | 10 ~ 38 pg / mL | ||
| 황산에스트론 | 엽상 | 100μg/일 | 중요하지 않다 | 146 L/일 | 700~3600 pmol/L | 250 ~ 1300 pg / mL | |
| 황체상 | 180μg/일 | 중요하지 않다 | 146 L/일 | 1100 ~ 7300 pmol / L | 400 ~ 2600 pg / mL | ||
| 프로게스테론 | 엽상 | 2 mg/일 | 1.7 mg/일 | 2100 L/일 | 0.3~3nmol/L | 0.1~0.9ng/mL | |
| 황체상 | 25 mg/일 | 24 mg/일 | 2100 L/일 | 19~45 nmol/L | 6~14 ng/mL | ||
메모 및 소스 주의: "순환 중 스테로이드 농도는 그것이 분비선에서 분비되는 속도, 전구체 또는 호르몬이 스테로이드로 대사되는 속도, 그리고 그것이 조직에 의해 추출되어 대사되는 속도에 의해 결정됩니다.스테로이드 분비율은 단위시간당 분비샘에서 분비되는 화합물의 총량을 말한다.분비율은 시간이 지남에 따라 분비샘에서 정맥 유출물을 추출하고 동맥 및 말초 정맥 호르몬 농도를 빼서 평가했습니다.스테로이드 대사 클리어런스율은 단위시간당 호르몬이 완전히 제거된 혈액의 양으로 정의된다.스테로이드 호르몬의 생산률은 분비선에서 나오는 분비물과 프로호르몬을 관심 스테로이드로 전환하는 것을 포함한 모든 가능한 원천에서 화합물의 혈액으로 들어가는 것을 말한다.정상 상태에서 모든 공급원에서 혈액으로 유입되는 호르몬의 양은 제거 속도(산출 속도=대사 제거 속도×농도)에 혈중 농도를 곱한 값과 같다.프로호르몬 대사가 스테로이드 순환 풀에 거의 기여하지 않으면 생산률은 분비율에 근접할 것입니다.출처:"템플릿"을 참조해 주세요. | |||||||
의료용
에스트라디올은 주로 갱년기 증상을 위한 호르몬 치료와 성전환 호르몬 대체 치료에 [75]약물로 사용된다.
화학
주요 내인성 에스트로겐 구조 |
에스트라디올은 에스트란 [75]스테로이드이다.17β-에스트라디올(17α-에스트라디올과 구별하기 위해) 또는 에스트라-1,3,5(10)-트리엔-3,17β-디올이라고도 한다.그것은 두 개의 수산기, 하나는 C3 위치에 있고 다른 하나는 17β 위치에 있으며, 그리고 세 개의 이중 결합이 A 고리에 있다.에스트라디올은 두 개의 수산기 때문에 종종 E2로 약칭된다.구조적으로 관련된 에스트로겐, 에스트로겐(E1), 에스트리올(E3), 에스테트롤(E4)은 각각 1기, 3기, 4기의 수산기를 가진다.
신경정신약리학
무작위화된 이중맹인 위약 대조 연구에서 에스트라디올은 공정성 민감도에 성별 특이적 영향을 미치는 것으로 나타났다.전반적으로, 최후통첩 게임의 수정된 버전에서 일정 금액의 분배가 공정하거나 불공정하다고 여겨졌을 때, 에스트라디올은 남성들 사이에서 공정한 제안의 수용률을 증가시키고 여성들 사이에서 그것을 감소시켰다.그러나 플라시보 그룹 중 "에스트라디올 치료를 받는다는 단순한 믿음이 남녀 모두에게 불공평한 제안의 수용을 현저하게 증가시켰다"는 것은 이른바 "환경적" 요인이 최후통첩 [76]게임의 이러한 발표에 대한 반응을 정리하는 데 역할을 했음을 보여준다.
역사
에스트로겐의 발견은 보통 미국 과학자 에드거 앨런과 에드워드 A가 한 것으로 여겨진다. 1923년,[77][78] 그들은 돼지 난포에서 액체를 주입하면 성적으로 미성숙하고 난소 적출된 [77][78][79]쥐와 쥐에서 사춘기와 발정형 변화(질, 자궁, 유선 변화와 성적 수용성 포함)를 일으키는 것을 관찰했다.이러한 발견은 난소에서 생성되고 성적 성숙과 [77][78][79]번식에 관여하는 호르몬의 존재를 증명했다.발견 당시 앨런과 도이는 이 호르몬에 이름을 붙이지 않고 단순히 "오바리안 호르몬" 또는 "엽기 호르몬"[78]이라고 불렀다; 다른 사람들은 그것을 페미닌, 메니콜린, 멘포르몬, 텔리키닌,[80][81] 그리고 에메닌이라고 다양하게 불렀다.1926년,[82][80] 파크스와 벨러비는 동물에게 발정을 유발하는 호르몬을 설명하기 위해 에스트린이라는 용어를 만들었다.1929년 앨런과 도이시, 독일 과학자 아돌프 부테난트에 의해 독립적으로 에스트로겐이 분리 정제됐고 1930년 마리안이 에스트로겐을 분리 정제했다.[78][83][84]
3대 에스트로겐 중 가장 강력한 에스트라디올은 3대 에스트로겐 중 마지막으로 확인됐다.[78][82]그것은 에스트론의 [78]감소를 통해 합성한 Schwenk와 Hildebrant에 의해 1933년에 발견되었다.에스트라디올은 1935년 Doisy에 의해 암퇘지 난소에서 분리 및 정제되었으며 화학 구조는 동시에 [85]결정되었으며, 디히드로테엘린, 디히드로폴리쿨린, 디히드로폴리큘린,[78][86][87] 디히드로시에스트린으로 다양하게 언급되었다.1935년, 에스트라디올이라는 이름과 에스트로겐이라는 용어는 국제연맹 건강기구의 성호르몬 위원회에 의해 공식적으로 설립되었습니다; 이것은 에스트로네 (처음에는 테엘린, 프로기논, 폴리쿨린, 케토히드록시에스트린으로 불렸던)와 에스트리올 (초기에는 테엘린과 트리히드록시에스트린으로 불렸던)이라는 이름을 따랐습니다.1932년 런던에서 [82][88]열린 국제성호르몬표준화회의의 첫 번째 회의에서 광채를 발했다.이후 1940년 인호펜과 홀웨그에 의해 콜레스테롤로부터 에스트라디올의 부분 합성이 개발되었고 1948년 [78]어너와 미셰르에 의해 전체 합성이 개발되었다.
사회와 문화
어원학
에스트라디올이라는 이름은 에스트라-, Gk에서 유래했다. 에스트라-(oistros, 문자 그대로 "버브 또는 영감"[89]을 의미하는 oistros)와 화학 용어이자 접미사인 -diol은 화합물이 두 개의 수산기를 가진 알코올의 일종임을 나타낸다.
레퍼런스
- ^ Ford SR, Roach SS (7 October 2013). Roach's Introductory Clinical Pharmacology. Lippincott Williams & Wilkins. pp. 525–. ISBN 978-1-4698-3214-2.
- ^ Hochadel M (1 April 2015). Mosby's Drug Reference for Health Professions. Elsevier Health Sciences. pp. 602–. ISBN 978-0-323-31103-8.
- ^ a b c d e Stanczyk FZ, Archer DF, Bhavnani BR (June 2013). "Ethinyl estradiol and 17β-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment". Contraception. 87 (6): 706–27. doi:10.1016/j.contraception.2012.12.011. PMID 23375353.
- ^ Falcone T, Hurd WW (2007). Clinical Reproductive Medicine and Surgery. Elsevier Health Sciences. pp. 22–. ISBN 978-0-323-03309-1.
- ^ Price TM, Blauer KL, Hansen M, Stanczyk F, Lobo R, Bates GW (March 1997). "Single-dose pharmacokinetics of sublingual versus oral administration of micronized 17 beta-estradiol". Obstetrics and Gynecology. 89 (3): 340–5. doi:10.1016/S0029-7844(96)00513-3. PMID 9052581. S2CID 71641652.
- ^ Naunton M, Al Hadithy AF, Brouwers JR, Archer DF (2006). "Estradiol gel: review of the pharmacology, pharmacokinetics, efficacy, and safety in menopausal women". Menopause. 13 (3): 517–27. doi:10.1097/01.gme.0000191881.52175.8c. PMID 16735950. S2CID 42748448.
- ^ Ryan KJ (August 1982). "Biochemistry of aromatase: significance to female reproductive physiology". Cancer Research. 42 (8 Suppl): 3342s–3344s. PMID 7083198.
- ^ Mechoulam R, Brueggemeier RW, Denlinger DL (September 1984). "Estrogens in insects". Cellular and Molecular Life Sciences. 40 (9): 942–944. doi:10.1007/BF01946450. S2CID 31950471.
- ^ Ozon R (1972). "Estrogens in Fishes, Amphibians, Reptiles, and Birds". In Idler DR (ed.). Steroids In Nonmammalian Vertebrates. Oxford: Elsevier Science. pp. 390–414. ISBN 978-0323140980.
- ^ Saldanha, Colin J., Luke Remage-Healey, Barney A.슐린저."시냅스에서의 스테로이드 합성과 작용"내분비 리뷰 32.4 (2011): 532–549.
- ^ a b c McMillan JA, Feigin RD, DeAngelis C, Jones MD (2006). Oski's Pediatrics: Principles & Practice. Lippincott Williams & Wilkins. pp. 550–. ISBN 978-0-7817-3894-1.
- ^ a b c Craig CR, Stitzel RE (2004). Modern Pharmacology with Clinical Applications. Lippincott Williams & Wilkins. pp. 706–. ISBN 978-0-7817-3762-3.
- ^ Preedy VR (2 December 2011). Handbook of Growth and Growth Monitoring in Health and Disease. Springer Science & Business Media. pp. 2661–. ISBN 978-1-4419-1794-2.
- ^ Carreau S, Lambard S, Delalande C, Denis-Galeraud I, Bilinska B, Bourguiba S (April 2003). "Aromatase expression and role of estrogens in male gonad : a review". Reproductive Biology and Endocrinology. 1: 35. doi:10.1186/1477-7827-1-35. PMC 155680. PMID 12747806.
- ^ Pentikäinen V, Erkkilä K, Suomalainen L, Parvinen M, Dunkel L (May 2000). "Estradiol acts as a germ cell survival factor in the human testis in vitro". The Journal of Clinical Endocrinology and Metabolism. 85 (5): 2057–67. doi:10.1210/jcem.85.5.6600. PMID 10843196.
- ^ Sharpe RM, Skakkebaek NE (May 1993). "Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract?". Lancet. 341 (8857): 1392–5. doi:10.1016/0140-6736(93)90953-E. PMID 8098802. S2CID 33135527.
- ^ Handelsman DJ (2001). "Estrogens and falling sperm counts". Reproduction, Fertility, and Development. 13 (4): 317–24. doi:10.1071/rd00103. PMID 11800170.
- ^ Fisch H, Goldstedin R (2003). "Environmental estrogens and sperm counts" (PDF). Pure and Applied Chemistry. 75 (11–12): 2181–2193. doi:10.1351/pac200375112181. S2CID 11068097.
- ^ Raman JD, Schlegel PN (February 2002). "Aromatase inhibitors for male infertility". The Journal of Urology. 167 (2 Pt 1): 624–9. doi:10.1016/S0022-5347(01)69099-2. PMID 11792932.
- ^ Visootsak J, Graham JM (October 2006). "Klinefelter syndrome and other sex chromosomal aneuploidies". Orphanet Journal of Rare Diseases. 1 (42): 42. doi:10.1186/1750-1172-1-42. PMC 1634840. PMID 17062147.
- ^ Vanderschueren D, Laurent MR, Claessens F, Gielen E, Lagerquist MK, Vandenput L, et al. (December 2014). "Sex steroid actions in male bone". Endocrine Reviews. 35 (6): 906–60. doi:10.1210/er.2014-1024. PMC 4234776. PMID 25202834.
- ^ Carani C, Qin K, Simoni M, Faustini-Fustini M, Serpente S, Boyd J, et al. (July 1997). "Effect of testosterone and estradiol in a man with aromatase deficiency". The New England Journal of Medicine. 337 (2): 91–5. doi:10.1056/NEJM199707103370204. PMID 9211678.
- ^ Bergh C, Wennergren D, Möller M, Brisby H (21 December 2020). "Fracture incidence in adults in relation to age and gender: A study of 27,169 fractures in the Swedish Fracture Register in a well-defined catchment area". PLOS ONE. 15 (12): e0244291. Bibcode:2020PLoSO..1544291B. doi:10.1371/journal.pone.0244291. PMC 7751975. PMID 33347485.
- ^ Albright F, Smith PH, Richardson AM (31 May 1941). "Postmenopausal Osteoporosis: Its Clinical Features". JAMA. 116 (22): 2465–2474. doi:10.1001/jama.1941.02820220007002.
- ^ a b c d e f g h Raine-Fenning NJ, Brincat MP, Muscat-Baron Y (2003). "Skin aging and menopause : implications for treatment". American Journal of Clinical Dermatology. 4 (6): 371–8. doi:10.2165/00128071-200304060-00001. PMID 12762829. S2CID 20392538.
- ^ a b c d e f g h Holzer G, Riegler E, Hönigsmann H, Farokhnia S, Schmidt JB, Schmidt B (September 2005). "Effects and side-effects of 2% progesterone cream on the skin of peri- and postmenopausal women: results from a double-blind, vehicle-controlled, randomized study". The British Journal of Dermatology. 153 (3): 626–34. doi:10.1111/j.1365-2133.2005.06685.x. PMID 16120154. S2CID 6077829.
- ^ Behl C, Widmann M, Trapp T, Holsboer F (November 1995). "17-beta estradiol protects neurons from oxidative stress-induced cell death in vitro". Biochemical and Biophysical Research Communications. 216 (2): 473–82. doi:10.1006/bbrc.1995.2647. PMID 7488136.
- ^ Meethal SV, Liu T, Chan HW, Ginsburg E, Wilson AC, Gray DN, Bowen RL, Vonderhaar BK, Atwood CS (August 2009). "Identification of a regulatory loop for the synthesis of neurosteroids: a steroidogenic acute regulatory protein-dependent mechanism involving hypothalamic-pituitary-gonadal axis receptors". Journal of Neurochemistry. 110 (3): 1014–27. doi:10.1111/j.1471-4159.2009.06192.x. PMC 2789665. PMID 19493163.
- ^ Douma SL, Husband C, O'Donnell ME, Barwin BN, Woodend AK (2005). "Estrogen-related mood disorders: reproductive life cycle factors". Advances in Nursing Science. 28 (4): 364–75. doi:10.1097/00012272-200510000-00008. PMID 16292022. S2CID 9172877.
- ^ Lasiuk GC, Hegadoren KM (October 2007). "The effects of estradiol on central serotonergic systems and its relationship to mood in women". Biological Research for Nursing. 9 (2): 147–60. doi:10.1177/1099800407305600. PMID 17909167. S2CID 37965502.
- ^ Hulshoff HE, Cohen-Kettenis PT, Van Haren NE, Peper JS, Brans RG, Cahn W, Schnack HG, Gooren LJ, Kahn RS (July 2006). "Changing your sex changes your brain: influences of testosterone and estrogen on adult human brain structure". European Journal of Endocrinology. 155 (suppl_1): 107–114. doi:10.1530/eje.1.02248.
- ^ Harding CF (June 2004). "Hormonal modulation of singing: hormonal modulation of the songbird brain and singing behavior". Annals of the New York Academy of Sciences. 1016 (1): 524–39. Bibcode:2004NYASA1016..524H. doi:10.1196/annals.1298.030. PMID 15313793. S2CID 12457330. Archived from the original on 27 September 2007.
- ^ Simerly RB (27 March 2002). "Wired for reproduction: organization and development of sexually dimorphic circuits in the mammalian forebrain" (PDF). Annual Review of Neuroscience. 25: 507–36. doi:10.1146/annurev.neuro.25.112701.142745. PMID 12052919.
- ^ Goldstein I, Meston CM, Davis S, Traish A (17 November 2005). Women's Sexual Function and Dysfunction: Study, Diagnosis and Treatment. CRC Press. pp. 205–. ISBN 978-1-84214-263-9.
- ^ Acevedo-Rodriguez A, Mani SK, Handa RJ (2015). "Oxytocin and Estrogen Receptor β in the Brain: An Overview". Frontiers in Endocrinology. 6: 160. doi:10.3389/fendo.2015.00160. PMC 4606117. PMID 26528239.
- ^ Bulzomi P, Bolli A, Galluzzo P, Leone S, Acconcia F, Marino M (January 2010). "Naringenin and 17beta-estradiol coadministration prevents hormone-induced human cancer cell growth". IUBMB Life. 62 (1): 51–60. doi:10.1002/iub.279. PMID 19960539. S2CID 7903757.
- ^ Sreeja S, Santhosh Kumar TR, Lakshmi BS, Sreeja S (July 2012). "Pomegranate extract demonstrate a selective estrogen receptor modulator profile in human tumor cell lines and in vivo models of estrogen deprivation". The Journal of Nutritional Biochemistry. 23 (7): 725–32. doi:10.1016/j.jnutbio.2011.03.015. PMID 21839626.
- ^ Thomas CG, Strom A, Lindberg K, Gustafsson JA (June 2011). "Estrogen receptor beta decreases survival of p53-defective cancer cells after DNA damage by impairing G₂/M checkpoint signaling". Breast Cancer Research and Treatment. 127 (2): 417–27. doi:10.1007/s10549-010-1011-z. PMID 20623183. S2CID 6752694.
- ^ Collins P, Rosano GM, Sarrel PM, Ulrich L, Adamopoulos S, Beale CM, McNeill JG, Poole-Wilson PA (July 1995). "17 beta-Estradiol attenuates acetylcholine-induced coronary arterial constriction in women but not men with coronary heart disease". Circulation. 92 (1): 24–30. doi:10.1161/01.CIR.92.1.24. PMID 7788912.
- ^ Abdul Sultan A, West J, Stephansson O, Grainge MJ, Tata LJ, Fleming KM, Humes D, Ludvigsson JF (November 2015). "Defining venous thromboembolism and measuring its incidence using Swedish health registries: a nationwide pregnancy cohort study". BMJ Open. 5 (11): e008864. doi:10.1136/bmjopen-2015-008864. PMC 4654387. PMID 26560059.
- ^ Prossnitz ER, Barton M (May 2014). "Estrogen biology: new insights into GPER function and clinical opportunities". Molecular and Cellular Endocrinology. 389 (1–2): 71–83. doi:10.1016/j.mce.2014.02.002. PMC 4040308. PMID 24530924.
- ^ Prossnitz ER, Arterburn JB, Sklar LA (2007). "GPR30: A G protein-coupled receptor for estrogen". Mol. Cell. Endocrinol. 265–266: 138–42. doi:10.1016/j.mce.2006.12.010. PMC 1847610. PMID 17222505.
- ^ Soltysik K, Czekaj P (April 2013). "Membrane estrogen receptors - is it an alternative way of estrogen action?". Journal of Physiology and Pharmacology. 64 (2): 129–42. PMID 23756388.
- ^ Micevych PE, Kelly MJ (2012). "Membrane estrogen receptor regulation of hypothalamic function". Neuroendocrinology. 96 (2): 103–10. doi:10.1159/000338400. PMC 3496782. PMID 22538318.
- ^ Labhart A (6 December 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 548–. ISBN 978-3-642-96158-8.
- ^ Tucker SB (2007). Maternal, Fetal, & Neonatal Physiology: A Clinical Perspective. Elsevier Health Sciences. pp. 43–. ISBN 978-1-4160-2944-1.
- ^ a b Hall JE (31 May 2015). Guyton and Hall Textbook of Medical Physiology E-Book. Elsevier Health Sciences. pp. 1043–. ISBN 978-0-323-38930-3.
- ^ Häggström M, Richfield D (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Boron WF, Boulpaep EL (2003). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. p. 1300. ISBN 978-1-4160-2328-9.
- ^ Mutschler E, Schäfer-Korting M (2001). Arzneimittelwirkungen (in German) (8 ed.). Stuttgart: Wissenschaftliche Verlagsgesellschaft. pp. 434, 444. ISBN 978-3-8047-1763-3.
- ^ a b c d Melmed S (1 January 2016). Williams Textbook of Endocrinology. Elsevier Health Sciences. pp. 710–. ISBN 978-0-323-29738-7.
- ^ a b Marcus R, Feldman D, Dempster DW, Luckey M, Cauley JA (13 June 2013). Osteoporosis. Academic Press. pp. 331–. ISBN 978-0-12-398252-0.
- ^ Wu CH, Motohashi T, Abdel-Rahman HA, Flickinger GL, Mikhail G (August 1976). "Free and protein-bound plasma estradiol-17 beta during the menstrual cycle". The Journal of Clinical Endocrinology and Metabolism. 43 (2): 436–45. doi:10.1210/jcem-43-2-436. PMID 950372.
- ^ Cheng ZN, Shu Y, Liu ZQ, Wang LS, Ou-Yang DS, Zhou HH (February 2001). "Role of cytochrome P450 in estradiol metabolism in vitro". Acta Pharmacologica Sinica. 22 (2): 148–54. PMID 11741520.
- ^ Lee AJ, Cai MX, Thomas PE, Conney AH, Zhu BT (August 2003). "Characterization of the oxidative metabolites of 17beta-estradiol and estrone formed by 15 selectively expressed human cytochrome p450 isoforms". Endocrinology. 144 (8): 3382–98. doi:10.1210/en.2003-0192. PMID 12865317.
- ^ Oettel M, Schillinger E (6 December 2012). Estrogens and Antiestrogens I: Physiology and Mechanisms of Action of Estrogens and Antiestrogens. Springer Science & Business Media. pp. 235–237. ISBN 978-3-642-58616-3.
- ^ Oettel M, Schillinger E (6 December 2012). Estrogens and Antiestrogens II: Pharmacology and Clinical Application of Estrogens and Antiestrogen. Springer Science & Business Media. pp. 268, 271. ISBN 978-3-642-60107-1.
- ^ a b Dorfman, Ralph I. (1961). "Steroid Hormone Metabolism". Radioactive Isotopes in Physiology Diagnostics and Therapy / Künstliche Radioaktive Isotope in Physiologie Diagnostik und Therapie. pp. 1223–1241. doi:10.1007/978-3-642-49761-2_39. ISBN 978-3-642-49477-2.
- ^ Sandberg AA, Slaunwhite WR (August 1957). "Studies on phenolic steroids in human subjects. II. The metabolic fate and hepato-biliary-enteric circulation of C14-estrone and C14-estradiol in women". J. Clin. Invest. 36 (8): 1266–78. doi:10.1172/JCI103524. PMC 1072719. PMID 13463090.
- ^ https://www.ilexmedical.com/files/PDF/Estradiol_ARC.pdf[베어 URL PDF]
- ^ a b c d e Becker JB, Berkley KJ, Geary N, Hampson E, Herman JP, Young E (4 December 2007). Sex Differences in the Brain: From Genes to Behavior. Oxford University Press. pp. 64–. ISBN 978-0-19-804255-6.
Estradiol levels are minimal during the earliest days of the follicular phase, but increasing concentrations are released into the general circulation as the follicle matures. The highest levels are reached about 24 to 48 hours before the LH peak. In fact, the pre-ovulatory peak in estradiol represents its highest concentration during the entire menstrual cycle. Serum concentrations at this time are typically about 130–200 pg/mL, but concentrations as high as 300–400 pg/mL can be achieved in some women. Following a transient fall in association with ovulation, estradiol secretion is restored by production from the corpus luteum during the luteal phase. Plateau levels of around 100–150 pg/mL (Abraham, 1978; Thorneycroft et al., 1971) are most often seen during the period from −10 to −5 days before the onset of menses. With the regression of the corpus luteum, estradiol levels fall, gradually in some women and precipitously in others, during the last few days of the luteal phase. This ushers in the onset of menses, the sloughing of the endometrium. Serum estradiol during menses is approximately 30–50 pg/mL. (Source.)
- ^ a b c Strauss JR, Barbieri RL (2009). Yen and Jaffe's Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. Elsevier Health Sciences. pp. 807–. ISBN 978-1-4160-4907-4.
In most laboratories, serum estradiol levels range from 20 to 80 pg/mL during the early to midfollicular phase of the menstrual cycle and peak at 200 to 500 pg/mL during the preovulatory surge. During the midluteal phase, serum estradiol levels range from 60 to 200 pg/mL.
- ^ a b c Christian C, von Schoultz B (15 March 1994). Hormone Replacement Therapy: Standardized or Individually Adapted Doses?. CRC Press. pp. 60–. ISBN 978-1-85070-545-1.
Plasma levels of estradiol range from 40 to 80 pg/ml during the 1st week of the ovarian cycle (early follicular phase) and from 80 to 300 pg/ml during the 2nd week (mid- and late follicular phase including periovulatory peak). Then during the 3rd and 4th weeks, estradiol fluctuates between 100 and 150 pg/ml (early and mid-luteal phase) to 40 pg/ml a few days before menstruation (late luteal phase). The mean integrated estradiol level during a full 28-day normal cycle is around 80 pg/ml.
- ^ Jameson JL, De Groot LJ (18 May 2010). Endocrinology: Adult and Pediatric. Elsevier Health Sciences. pp. 2812–. ISBN 978-1-4557-1126-0.
Midcycle: 150-750 pg/mL
- ^ Hay ID, Wass JA (26 January 2009). Clinical Endocrine Oncology. John Wiley & Sons. pp. 623–. ISBN 978-1-4443-0023-9.
Mid-cycle: 110-330 pg/mL
- ^ Dons RF (12 July 1994). Endocrine and Metabolic Testing Manual. CRC Press. pp. 8–. ISBN 978-0-8493-7657-3.
Ovulatory: 200-400 pg/mL
- ^ Notelovitz M, van Keep PA (6 December 2012). The Climacteric in Perspective: Proceedings of the Fourth International Congress on the Menopause, held at Lake Buena Vista, Florida, October 28 – November 2, 1984. Springer Science & Business Media. pp. 397–. ISBN 978-94-009-4145-8.
[...] following the menopause, circulating estradiol levels decrease from a premenopausal mean of 120 pg/ml to only 13 pg/ml.
- ^ a b Müller EE, MacLeod RM (6 December 2012). Neuroendocrine Perspectives. Springer Science & Business Media. pp. 121–. ISBN 978-1-4612-3554-5.
[...] [premenopausal] mean [estradiol] concentration of 150 pg/ml [...]
- ^ Sayed Y, Taxel P (December 2003). "The use of estrogen therapy in men". Current Opinion in Pharmacology. 3 (6): 650–4. doi:10.1016/j.coph.2003.07.004. PMID 14644018.
- ^ a b "Estradiol blood test: MedlinePlus Medical Encyclopedia". medlineplus.gov. Retrieved 6 May 2019.
- ^ a b c d e f g h i j GPNotebook - 레퍼런스 범위(oestradiol) 2009년 9월 27일 취득
- ^ a b 값 하루에 1에서 최경주 R, 에버 하트:미국의 시인. R, Chevailler MC, 퀸 FA, 비쇼프 P인 스트라이커 R(2006년):에 LH 나서면서 찍은 사진."상세한 참조 값의 생리 주기의 애보트 ARCHITECT 분석기로 다른 단계 동안에 호르몬, 여포 자극 호르몬, 에스트라디올, 황체 호르몬 황체화 설정에 관한 연구".임상 화학과 실험실 의학 44(7):883–7. doi:10.1515/CCLM.2006.160. PMID 16776638.S2CID 524952.PDF로
- ^ a b c d 총 금액에 0.022를 곱한 값(2.2%)은 다음과 같습니다.
- ^ Häggström M (2014). "Reference ranges for estradiol, progesterone, luteinizing hormone and follicle-stimulating hormone during the menstrual cycle". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.001. ISSN 2002-4436.
- ^ a b Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration". Climacteric. 8 (1 Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Coenjaerts M, Pape F, Santoso V, Grau F, Stoffel-Wagner B, Philipsen A, Schultz J, Hurlemann R, Scheele D (September 2021). "Sex differences in economic decision-making: Exogenous estradiol has opposing effects on fairness framing in women and men". Eur. Neuropsychopharmacol. 50 (2): 46–54. doi:10.1016/j.euroneuro.2021.04.006. ISSN 0924-977X. PMID 33957337. S2CID 233982738.
- ^ a b c Loriaux DL, Loriaux L (14 March 2016). A Biographical History of Endocrinology. John Wiley & Sons. pp. 345–. ISBN 978-1-119-20246-2.
- ^ a b c d e f g h i Lauritzen C, Studd JW (22 June 2005). Current Management of the Menopause. CRC Press. pp. 44–. ISBN 978-0-203-48612-2.
- ^ a b Allen E, Doisy EA (1923). "An Ovarian Hormone". Journal of the American Medical Association. 81 (10): 819. doi:10.1001/jama.1923.02650100027012. ISSN 0002-9955.
- ^ a b Gruhn JG, Kazer RR (11 November 2013). Hormonal Regulation of the Menstrual Cycle: The Evolution of Concepts. Springer Science & Business Media. pp. 69–73. ISBN 978-1-4899-3496-3.
- ^ Newerla GJ (1944). "The History of the Discovery and Isolation of the Female Sex Hormones". New England Journal of Medicine. 230 (20): 595–604. doi:10.1056/NEJM194405182302001. ISSN 0028-4793.
- ^ a b c Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 750–. ISBN 978-1-4511-4847-3.
- ^ Parl FF (2000). Estrogens, Estrogen Receptor and Breast Cancer. IOS Press. pp. 4–. ISBN 978-0-9673355-4-4.
- ^ Sartorelli AC, Johns DG (27 November 2013). Antineoplastic and Immunosuppressive Agents. Springer Science & Business Media. pp. 104–. ISBN 978-3-642-65806-8.
- ^ Shoupe D, Haseltine FP (6 December 2012). Contraception. Springer Science & Business Media. pp. 2–. ISBN 978-1-4612-2730-4.
- ^ MacCorquodale DW, Thayer SA, Doisy EA (1935). "The Crystalline Ovarian Follicular Hormone". Experimental Biology and Medicine. 32 (7): 1182. doi:10.3181/00379727-32-8020P. ISSN 1535-3702. S2CID 83557813.
- ^ Chemicals Identified in Human Biological Media: A Data Base. Design and Development Branch, Survey and Analysis Division, Office of Program Integration and Information, Office of Pesticides and Toxic Substances, Environmental Protection Agency. 1981. pp. 114–.
- ^ Fausto-Sterling A (2000). Sexing the Body: Gender Politics and the Construction of Sexuality. Basic Books. pp. 189–. ISBN 978-0-465-07714-4.
- ^ "Greek Word Study Tool: oistros". Perseus Digital Library. Retrieved 28 December 2011.