에스트론
Estrone
 | |
 | |
| 이름들 | |
|---|---|
| IUPAC이름 3-하이드록시에스트라-1,3,5(10)-트리엔-17-원 | |
| 계통 IUPAC명 (3aS,3bR,9bS,11aS)-7-하이드록시-11a-메틸-2,3,3a,3b,4,5,9b,10,11a-데카하이드로-1H-사이클로펜타-1-원 | |
| 기타이름 외스트론; E1 | |
| 식별자 | |
3D 모델(JSMO) | |
| ChEBI | |
| 쳄블 | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.000.150 |
| 케그 | |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C18H22O2 | |
| 어금니 질량 | 270.366 g/mol |
| 융점 | 254.5 |
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |
에스트론이라고도 불리는 에스트론(E1)은 스테로이드, 약한 에스트로겐, 그리고 [1]경미한 여성 성호르몬입니다.그것은 에스트라디올과 [1]에스트리올과 함께 세 가지 주요 내생 에스트로겐 중 하나입니다.다른 에스트로겐과 마찬가지로 에스트로겐은 콜레스테롤로부터 합성되고 주로 생식선에서 분비되지만 지방 [2]조직의 부신 안드로겐으로부터 형성될 수도 있습니다.에스트라디올에 비해 에스트론과 에스트리올 모두 [1]에스트로겐보다 훨씬 약한 활성을 가지고 있습니다.에스트론은 에스트라디올로 전환될 수 있으며, 주로 에스트라디올의 전구체 [1][3]또는 대사 중간체 역할을 합니다.에스트라디올의 [4][1]전구물질이자 대사물질입니다.
에스트론은 천연 호르몬으로서의 역할 외에도 갱년기 호르몬 치료 등에서 약물로서 사용되어 왔습니다. 에스트론에 대한 자세한 내용은 약물로서 에스트론(약물) 기사를 참조하십시오.
생물학적 활동
에스트론은 에스트로겐, 특히 에스트로겐 수용체 ERα와 [1][5]ERβ의 작용제입니다.에스트라디올보다 훨씬 덜 강력한 에스트로겐이기 때문에 상대적으로 약한 [1][5][6]에스트로겐입니다.쥐의 피하주사로 투여되는 에스트라디올은 에스트로네보다 약 10배, [7]에스트리올보다 약 100배 더 강력합니다.한 연구에 따르면 인간 ERα와 ERβ에 대한 에스트론의 상대적 결합 친화도는 에스트라디올의 4.0%와 3.5%였고, ERα와 ERβ에서 에스트론의 상대적 트랜스활성화능은 [5]에스트라디올의 2.6%와 4.3%였습니다.따라서 에스트론의 에스트로겐 활성은 에스트라디올의 [1]약 4%로 보고되고 있습니다.에스트론은 에스트라디올, 에스트리올과 달리 에스트로겐 표적 [1]조직에 축적되지 않습니다.에스트론은 에스트라디올로 변형될 수 있기 때문에, 생체 내 에스트론의 에스트로겐 작용의 대부분 또는 전부는 실제로 [1][8]에스트라디올로의 전환에 기인합니다.따라서 에스트론은 에스트라디올의 전구체 [3]또는 프로호르몬으로 간주됩니다.에스트라디올 및 에스트리올과 달리, 에스트론은 G 단백질-커플드 에스트로겐 수용체의 리간드가 아닙니다(친화도 > 10,000 nM).[9]
임상 연구에서 [1][10][11][12]에스트라디올의 상대적으로 불활성인 전구체로서의 에스트론의 특성이 확인되었습니다.에스트라디올의 경구 투여로, 에스트라디올 [1]수치와 에스트라디올 수치의 비율은 폐경 전 여성과 에스트라디올의 비경구(비구강) 경로에서 정상적인 생리적 상황에서보다 평균 약 5배 높습니다.에스트라디올의 갱년기 교체 용량의 경구 투여는 에스트라디올의 낮은 엽상 수준을 초래하는 반면 에스트라디올의 수준은 [1][13][14]임신 초기에 나타난 높은 수준과 유사합니다.경구 에스트라디올을 사용하지만 경피 에스트라디올을 사용하지 않는 에스트라디올의 현저한 증가된 수준에도 불구하고, 임상 연구는 유사한 수준의 에스트라디올을 달성하는 경구 및 경피 에스트라디올의 용량이 황체형성 호르몬 및 fo의 억제를 포함한 측정 측면에서 동등하고 유의하지 않은 다른 효력을 가지고 있음을 보여주었습니다.라일릭자극호르몬 수치, 골흡수 억제, 열섬광 [1][10][11][12][15]등 갱년기 증상 완화또한 에스트라디올 수준은 이러한 효과와 상관관계가 있는 것으로 밝혀진 반면 에스트론 수준은 [10][11]그렇지 않았습니다.이러한 결과는 에스트로네가 에스트로네틱 활성이 매우 낮다는 것을 확인시켜 주고, 또한 에스트로네가 에스트라디올의 [1][10][11][12]에스트로네틱 활성을 약화시키지 않는다는 것을 보여줍니다.이것은 고농도의 에스트론이 에스트라디올의 [16][17][18]작용을 부분적으로 대항할 수 있다는 것을 암시하는 세포가 없는 체외 연구와 모순됩니다.
| 에스트로겐 | ER RBA (%) | 자궁체중(%) | 자궁위축증 | LH 수준(%) | SHBG RBA (%) |
|---|---|---|---|---|---|
| 통제 | – | 100 | – | 100 | – |
| 에스트라디올 (E2) | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| 에스트론 (E1) | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| 에스트리올 (E3) | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| 에스테트롤 (E4) | 0.5 ± 0.2 | ? | 활발하지 않은 | ? | 1 |
| 17α-에스트라디올 | 4.2 ± 0.8 | ? | ? | ? | ? |
| 2-하이드록시에스트라디올 | 24 ± 7 | 285 ± 8 | +b | 31–61 | 28 |
| 2-메톡시에스트라디올 | 0.05 ± 0.04 | 101 | 활발하지 않은 | ? | 130 |
| 4-하이드록시에스트라디올 | 45 ± 12 | ? | ? | ? | ? |
| 4-메톡시에스트라디올 | 1.3 ± 0.2 | 260 | ++ | ? | 9 |
| 4-플루오로에스트라디올a | 180 ± 43 | ? | +++ | ? | ? |
| 2-하이드록시에스트론 | 1.9 ± 0.8 | 130 ± 9 | 활발하지 않은 | 110–142 | 8 |
| 2-메톡시에스트로네 | 0.01 ± 0.00 | 103 ± 7 | 활발하지 않은 | 95–100 | 120 |
| 4-하이드록시에스트론 | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-메톡시에스트로네 | 0.13 ± 0.04 | 338 | ++ | 65–92 | 12 |
| 16α-하이드록시에스트론 | 2.8 ± 1.0 | 552 ± 42 | +++ | 7–24 | <0.5 |
| 2-하이드록시에스티올 | 0.9 ± 0.3 | 302 | +b | ? | ? |
| 2-메톡시에스티롤 | 0.01 ± 0.00 | ? | 활발하지 않은 | ? | 4 |
| 참고: 값은 평균 ± SD 또는 범위입니다.= ER RBA 쥐의 자궁 세포질의 에스트로겐 수용체에 대한 상대적인 결합 친화력.자궁 무게 = 피하 주입 삼투 펌프를 통해 1 μg/시간의 연속 투여로 72시간 후 난소절제된 쥐의 자궁 습윤 무게의 백분율 변화. 수준 = 피하 삽입물을 통해 24~72시간 연속 투여한 후 난소절제 쥐의 기저치에 대한 황체형성 호르몬 수준.각주: = 합성(즉, 내생성이 아님).= b 전형적인 자궁위축 효과로 48시간 이내에 고원(에스트라디올의 자궁위축은 72시간까지 선형적으로 지속됨).출처:템플릿 참조. | |||||
생화학

생합성
에스트론은 콜레스테롤로부터 생합성됩니다.주요 경로는 안드로스텐디온을 중간생성물로 포함하며, 안드로스텐디온은 아로마타제 효소에 의해 에스트로네로 변환됩니다.이러한 반응은 생식선과 특정한 다른 조직, 특히 지방 조직에서 모두 일어나고, 이후 이러한 조직에서 [2]에스트로네가 분비됩니다.안드로스테디온의 방향화뿐만 아니라 에스트론은 간, 자궁, [1]유선을 포함한 다양한 조직에서 17β-하이드록시스테로이드 탈수소효소(17β-HSD)에 의해 에스트라디올로부터 가역적으로 형성됩니다.
조치 메커니즘:
에스트론이 작동하는 방법은 몸 안의 특정 조직의 세포에 들어가서 핵 수용체에 달라붙는 것입니다.그리고 나서 이 상호작용은 유전자가 어떻게 발현되는지에 영향을 미쳐 [20]몸 안에서 다양한 생리적 반응을 일으킵니다.
분배
에스트론은 [1]순환에서 성호르몬 결합 글로불린(SHBG)에 약 16%, 알부민에 80%가 결합되어 있으며, 나머지(2.0~4.0%)는 자유롭게 순환하거나 결합되지 [21]않습니다.SHBG에 [1]대한 에스트라디올의 상대적 결합 친화도는 약 24%입니다.이와 같이 에스트론은 SHBG에 [22]상대적으로 잘 결합되지 않습니다.
신진대사
에스트론은 설포전달효소와 글루쿠로니다아제에 의해 에스트론 황산염, 에스트론 글루쿠로니드와 같은 에스트로겐 결합체로 결합되며, 사이토크롬 P450 효소에 의해 2-하이드록시에스트론 및 4-하이드록시에스트론과 같은 카테콜 에스트로겐 또는 [1]에스트리올로 하이드록실화될 수도 있습니다.이 두 가지 변형은 주로 [1]간에서 일어납니다.에스트론은 또한 17β-HSD에 [1]의해 에스트라디올로 가역적으로 전환될 수 있습니다.에스트론의 혈액 반감기는 10분에서 70분 정도로 [23]에스트라디올과 비슷합니다.
배설
에스트론은 에스트론 [1]황산염과 같은 에스트로겐 결합체의 형태로 소변으로 배출됩니다.여성에게 라벨이 부착된 에스트론을 정맥 주사한 후 거의 90%[23]가 4-5일 이내에 소변과 대변으로 배설됩니다.장간 재순환은 [23]에스트론의 배설 지연을 야기합니다.
에스트로겐은 에스트로겐의 3가지 주요 유형 중 하나로 태반,[25] 난소, 말초 조직 등 신체의 여러 부분에서 생성됩니다.
레벨들
| 섹스. | 성호르몬 | 생식 단계 | 피 생산율 | 고나달 분비율 | 대사적 정리율 | 기준 범위(세럼 레벨) | |
|---|---|---|---|---|---|---|---|
| SI 단위들 | 비단위SI | ||||||
| 남자들 | 안드로스테네디온 | – | 2.8 mg/일 | 1.6 mg/일 | 2200 L/day | 2.8~7.3nmol/L | 80-210ng/dL |
| 테스토스테론 | – | 6.5 mg/일 | 6.2 mg/일 | 950 L/day | 6.9~34.7nmol/L | 200-1000ng/dL | |
| 에스트론 | – | 하루에 150μg | 110μg/일 | 2050 L/day | 37–250 pmol/L | 10-70 pg/mL | |
| 에스트라디올 | – | 일 60μg | 하루 50μg | 1600 L/day | <37-210pmol/L | 10-57pg/mL | |
| 황산에스트론 | – | 일 80μg | 보잘것없는 | 167 L/day | 600-2500 pmol/L | 200~900pg/mL | |
| 여성들. | 안드로스테네디온 | – | 3.2 mg/일 | 2.8 mg/일 | 2000 L/day | 3.1~12.2 nmol/L | 89–350ng/dL |
| 테스토스테론 | – | 하루 190μg | 일 60μg | 500L/일 | 0.7~2.8nmol/L | 20-81ng/dL | |
| 에스트론 | 난포상 | 110μg/일 | 일 80μg | 2200 L/day | 110-400pmol/L | 30~110pg/mL | |
| 황체상 | 260μg/일 | 하루에 150μg | 2200 L/day | 310-660 pmol/L | 80–180 pg/mL | ||
| 폐경 후 일시정지 | 하루 40μg | 보잘것없는 | 1610 L/일 | 22-230pmol/L | 6–60 pg/mL | ||
| 에스트라디올 | 난포상 | 일 90μg | 일 80μg | 1200 L/day | <37-360pmol/L | 10-98 pg/mL | |
| 황체상 | 일 250μg | 일240μg | 1200 L/day | 699–1250 pmol/L | 190~341pg/mL | ||
| 폐경 후 일시정지 | 1일 6μg | 보잘것없는 | 910 L/일 | <37-140pmol/L | 10~38pg/mL | ||
| 황산에스트론 | 난포상 | 하루 100μg | 보잘것없는 | 146 L/일 | 700-3600 pmol/L | 250-1300 pg/mL | |
| 황체상 | 일 180μg | 보잘것없는 | 146 L/일 | 1100-7300 pmol/L | 400~2600pg/mL | ||
| 프로게스테론 | 난포상 | 하루에 2mg | 1.7 mg/일 | 2100 L/day | 0.3~3nmol/L | 0.1~0.9ng/mL | |
| 황체상 | 하루 25mg | 24mg/일 | 2100 L/day | 19~45nmol/L | 6-14ng/mL | ||
노트 및 소스 참고: "순환에서 스테로이드의 농도는 분비선에서 분비되는 비율, 전구체 또는 호르몬이 스테로이드로 대사되는 비율, 조직에 의해 추출되어 대사되는 비율에 의해 결정됩니다.스테로이드의 분비율은 단위 시간당 분비선으로부터 화합물이 총 분비되는 것을 말합니다.분비율은 시간이 지남에 따라 선으로부터 정맥 배출물을 샘플링하고 동맥 및 말초 정맥 호르몬 농도를 빼냄으로써 평가되었습니다.스테로이드의 대사 제거율은 단위 시간당 호르몬이 완전히 제거된 혈액의 양으로 정의됩니다.스테로이드 호르몬의 생성 속도는 분비선으로부터의 분비와 관심있는 스테로이드로의 프로호르몬의 전환을 포함하여 가능한 모든 원천으로부터 화합물의 혈액으로 들어가는 것을 말합니다.안정적인 상태에서 모든 공급원에서 혈액으로 들어오는 호르몬의 양은 혈액 농도(생산율 = 대사량 클리어런스율 × 농도)에 클리어링 중인 비율(클리어링율)과 같습니다.프로호르몬 대사가 스테로이드의 순환 풀에 거의 기여하지 않는다면, 생산 속도는 분비 속도에 근접할 것입니다."출처:템플릿 참조. | |||||||
독성:
에스트론을 너무 많이 사용하거나 다량 복용하면 독성을 일으켜 메스꺼움, 구토 등의 증상을 유발할 수 있습니다.에스트론은 품질과 [25]효과를 유지하기 위해 원래의 포장이나 용기에 보관해야 합니다.
화학
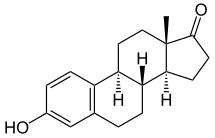
에스트라-1,3,5(10)-트리엔-3-올-17-원(estra-1,3,5-trien-3-ol-17-one)은 C1, C3 및 C5 위치에 이중 결합, C3 위치에 하이드록실기 및 C17 위치에 케톤기를 갖는 자연적으로 발생하는 에스트란 스테로이드.에스트론이라는 이름은 에스트린(에스트라-1,3,5(10)-트리엔)과 케톤이라는 화학 용어에서 유래되었습니다.
에스트론의 화학식은 CHO이고18222 분자량은 270.366 g/mol입니다.백색의 무취 고체 결정성 분말로 녹는점은 254.5°C(490°F), 비중은 1.[26][27]23입니다.에스트론은 일산화탄소(CO)와 이산화탄소(CO2)[26] 제품으로 고온에서 연소가 가능합니다.
의료용
에스트론은 갱년기 증상에 대한 호르몬 치료와 같은 의학적 용도의 주사된 에스트로겐으로 사용되어 왔으나, 현재는 대부분 [28]시판되지 않고 있습니다.
에스트론은 호르몬 대체요법(HRT)의 일환으로 폐경기와 폐경기 이후 여성의 에스트로겐 결핍으로 인한 증상을 치료하는 데 자주 사용됩니다.이 요법은 전반적인 건강 증진과 에스트로겐 불균형과 관련된 갱년기 증상 완화를 목적으로 합니다.또한, 골절 위험이 높고 대체 약물을 사용할 수 없는 폐경 후 여성의 골다공증을 예방하기 위해 에스트론과 다른 에스트로겐이 사용됩니다.에스트로겐은 체내에서 효율적으로 흡수되어 간에서 비활성화되어 HRT 및 골다공증 [25]예방에 효과적입니다.
금기사항
에스트론의 사용에는 몇 가지 금기 사항이 있는데, 일부 예를 들면 과민성, 일부 암의 과거력, 뇌졸중, 정맥 혈전색전증(VTE), 현재 임신 중이거나 모유 수유 중인 사람 등이 있습니다.에스트로겐은 프로게스토겐 [29]등급의 다른 호르몬과 단독으로 사용하거나 다른 호르몬과 함께 사용할 경우 가장 낮은 유효 용량과 가능한 가장 짧은 치료 기간 동안 사용할 수 있는 상자형 경고문을 보유하고 있습니다.
유방암
에스트론은 유방암을 가지고 있거나 의심되는 사람들에게 금물입니다.에스트로겐을 사용하면 침습성 [30]유방암에 걸릴 위험이 높아지기 때문에 폐경 후 여성에게 유방암과 함께 상자형 경고문구를 붙입니다.유방암에 걸린 사람들은 [31]에스트로겐을 복용할 때 고칼슘혈증과 뼈 전이의 위험이 더 커집니다.유방암에 걸린 폐경 후 여성은 에스트론 수치가 증가하는 등 혈중 호르몬 수치에 변화가 있을 때 허약 증후군이 발생하는 것으로 볼 수 있습니다.폐경기 이후 여성에게서 생성되는 에스트로겐의 주요 유형인 에스트론은 프리페일(prefrail)로 분류된 에스트론과 [32]노쇠로 분류된 에스트론에서 표준 수준보다 더 높은 농도를 보였습니다.
정맥혈전색전증
에스트로겐을 사용하는 사람들에게서 VTE의 위험이 증가하고, 현재 VTE를 사용했거나 사용한 경험이 있는 사람들에게서는 에스트로겐을 [30][33]사용하면 VTE가 재발할 위험이 더 큽니다.산후 3주 이내에 에스트로겐을 사용하면 VTE [34]발생 위험이 높아질 수 있습니다.가족력, 유전적 변이: 인자 V 라이덴 및 프로트롬빈-G20210A, 에스트로겐 [35]사용으로 임신-산후에 초기 VTE 발생 위험 또한 증가합니다.
모유수유
에스트로겐의 사용은 모유 수유 능력에 영향을 줄 수 있고 모유의 구성 성분을 변화시킬 수 있습니다.에스트로겐은 수유를 억제하기 위해 사용되어 왔는데, 이는 수유 기간의 총 감소와 부피 감소 또는 모유를 생산할 수 없는 결과를 초래할 수 있습니다.생성된 모유의 조성 또한 우유 내 단백질의 농도를 감소시키는 것으로 보여졌습니다.모유 수유 중 에스트로겐을 복용하던 어머니들의 아기들은 체중 [34]증가 속도가 더 느려졌습니다.
부작용
흔한
에스트로겐의 사용에서 볼 수 있는 몇 가지 일반적인 부작용은 다음과 같습니다: 가슴 붓기, 가슴 압통, 질 가려움, 비정상적인 자궁 출혈, 체중 증가, 탈모, 황달, 아나필락시스.[36]
역효과
에스트로겐의 사용과 함께 볼 수 있는 부작용으로는 정맥혈전색전증(VTE), 뇌졸중, 유방암, 고혈압, 질염의 [36][29]위험 증가가 있습니다.
역사
에스트론은 최초로 [37][38]발견된 스테로이드 호르몬입니다.1929년에 미국 과학자 Edward Doisy와 Edgar Allen과 독일 생화학자 Adolf Butenandt에 의해 독립적으로 발견되었지만, Doisy와 Allen은 [37][39][40]Butenandt보다 두 달 전에 분리했습니다.그들은 임신한 [39][40][41]여성의 소변에서 결정형 형태의 에스트로네를 분리하고 정제했습니다.도이지와 앨런은 그것을 테엘린이라고 이름 지었고, 부테난트는 그것을 프로피뇽이라고 이름 지었고, 이후 그 [40][42]물질에 대한 그의 두 번째 출판물에서 그것을 모낭린이라고 언급했습니다.부테난트는 나중에 에스트로네의 고립과 [41][43]성호르몬에 대한 그의 연구로 1939년 노벨상을 수상했습니다.에스트로네의 분자식은 [44]1931년에 알려졌고,[40][39] 화학 구조는 1932년에 부테난트에 의해 밝혀졌습니다.에스트론은 그 구조의 해명에 따라 케토하이드록시에스트린 또는 옥소하이드록시에스트린으로 [45][46]추가적으로 언급되었고, 1932년 런던에서 [47][48]열린 성호르몬 표준화 국제회의의 첫 회의에서 C17 케톤 그룹에 기초하여 에스트론이라는 이름이 공식적으로 확립되었습니다.
1936년 러셀 얼 마커가 에르고스테롤로부터 에스트로네의 부분적인 합성을 해냈고,[49][50] 에스트로네의 최초의 화학적 합성이었습니다.1939년 또는 1940년에 [49]한스 헬로프 인호펜과 월터 홀웨그에 의해 콜레스테롤로부터 에스트로네의 대체 부분 합성이 개발되었고,[48] 1948년에 아너와 미셰르에 의해 에스트로네의 전체 합성이 달성되었습니다.
승인.
FDA는 에스트로네의 안전성과 유효성을 기준으로 연방 식품·의약품·[25]화장품법 제505조에 명시된 규정에 따라 승인했습니다.
참고문헌
- ^ a b c d e f g h i j k l m n o p q r s t u v Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration". Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b Hornstein T, Schwerin JL (1 January 2012). Biology of Women. Cengage Learning. pp. 369–. ISBN 978-1-285-40102-7.
- ^ a b van Keep PA, Utian WH, Vermeulen A (6 December 2012). The Controversial Climacteric: The workshop moderators' reports presented at the Third International Congress on the Menopause, held in Ostend, Belgium, in June 1981, under the auspices of the International Menopause Society. Springer Science & Business Media. p. 92. ISBN 978-94-011-7253-0.
- ^ Chervenak J (October 2009). "Bioidentical hormones for maturing women". Maturitas. 64 (2): 86–89. doi:10.1016/j.maturitas.2009.08.002. PMID 19766414.
- ^ a b c Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, et al. (May 2006). "Evaluation of ligand selectivity using reporter cell lines stably expressing estrogen receptor alpha or beta". Biochemical Pharmacology. 71 (10): 1459–1469. doi:10.1016/j.bcp.2006.02.002. PMID 16554039.
- ^ Ruggiero RJ, Likis FE (2002). "Estrogen: physiology, pharmacology, and formulations for replacement therapy". Journal of Midwifery & Women's Health. 47 (3): 130–138. doi:10.1016/s1526-9523(02)00233-7. PMID 12071379.
- ^ Labhart A (6 December 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 548–. ISBN 978-3-642-96158-8.
- ^ Fishman J, Martucci CP (1980). "New Concepts of Estrogenic Activity: The Role of Metabolites in the Expression of Hormone Action". In Pasetto N, Paoletti R, Ambrus JL (eds.). The Menopause and Postmenopause. pp. 43–52. doi:10.1007/978-94-011-7230-1_5. ISBN 978-94-011-7232-5.
- ^ Prossnitz ER, Arterburn JB (July 2015). "International Union of Basic and Clinical Pharmacology. XCVII. G Protein-Coupled Estrogen Receptor and Its Pharmacologic Modulators". Pharmacological Reviews. 67 (3): 505–540. doi:10.1124/pr.114.009712. PMC 4485017. PMID 26023144.
- ^ a b c d Selby P, McGarrigle HH, Peacock M (March 1989). "Comparison of the effects of oral and transdermal oestradiol administration on oestrogen metabolism, protein synthesis, gonadotrophin release, bone turnover and climacteric symptoms in postmenopausal women". Clinical Endocrinology. 30 (3): 241–249. doi:10.1111/j.1365-2265.1989.tb02232.x. PMID 2512035. S2CID 26077537.
- ^ a b c d Powers MS, Schenkel L, Darley PE, Good WR, Balestra JC, Place VA (August 1985). "Pharmacokinetics and pharmacodynamics of transdermal dosage forms of 17 beta-estradiol: comparison with conventional oral estrogens used for hormone replacement". American Journal of Obstetrics and Gynecology. 152 (8): 1099–1106. doi:10.1016/0002-9378(85)90569-1. PMID 2992279.
- ^ a b c Fåhraeus L, Larsson-Cohn U (December 1982). "Oestrogens, gonadotrophins and SHBG during oral and cutaneous administration of oestradiol-17 beta to menopausal women". Acta Endocrinologica. 101 (4): 592–596. doi:10.1530/acta.0.1010592. PMID 6818806.
- ^ Wright JV (December 2005). "Bio-identical steroid hormone replacement: selected observations from 23 years of clinical and laboratory practice". Annals of the New York Academy of Sciences. 1057 (1): 506–524. Bibcode:2005NYASA1057..506W. doi:10.1196/annals.1356.039. PMID 16399916. S2CID 38877163.
- ^ Friel PN, Hinchcliffe C, Wright JV (March 2005). "Hormone replacement with estradiol: conventional oral doses result in excessive exposure to estrone". Alternative Medicine Review. 10 (1): 36–41. PMID 15771561.
- ^ De Lignieres B, Basdevant A, Thomas G, Thalabard JC, Mercier-Bodard C, Conard J, et al. (March 1986). "Biological effects of estradiol-17 beta in postmenopausal women: oral versus percutaneous administration". The Journal of Clinical Endocrinology and Metabolism. 62 (3): 536–541. doi:10.1210/jcem-62-3-536. PMID 3080464.
- ^ Kloosterboer HJ, Schoonen WG, Verheul HA (11 April 2008). "Proliferation of Breast Cells by Steroid Hormones and Their Metabolites". In Pasqualini JR (ed.). Breast Cancer: Prognosis, Treatment, and Prevention. CRC Press. pp. 343–366. ISBN 978-1-4200-5873-4.
- ^ Sasson S, Notides AC (July 1983). "Estriol and estrone interaction with the estrogen receptor. II. Estriol and estrone-induced inhibition of the cooperative binding of [3H]estradiol to the estrogen receptor". The Journal of Biological Chemistry. 258 (13): 8118–8122. doi:10.1016/S0021-9258(20)82036-5. PMID 6863280.
- ^ Lundström E, Conner P, Naessén S, Löfgren L, Carlström K, Söderqvist G (2015). "Estrone - a partial estradiol antagonist in the normal breast". Gynecological Endocrinology. 31 (9): 747–749. doi:10.3109/09513590.2015.1062866. PMID 26190536. S2CID 13617050.
- ^ Häggström M, Richfield D (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric : The Journal of the International Menopause Society. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Jameson JL, De Groot LJ (18 May 2010). Endocrinology – E-Book: Adult and Pediatric. Elsevier Health Sciences. pp. 2813–. ISBN 978-1-4557-1126-0.
- ^ Buchsbaum HJ (6 December 2012). The Menopause. Springer Science & Business Media. pp. 62, 64. ISBN 978-1-4612-5525-3.
- ^ a b c Dorfman RI (1961). "Steroid Hormone Metabolism". Radioactive Isotopes in Physiology Diagnostics and Therapy / Künstliche Radioaktive Isotope in Physiologie Diagnostik und Therapie. pp. 1223–1241. doi:10.1007/978-3-642-49761-2_39. ISBN 978-3-642-49477-2.
- ^ Sandberg AA, Slaunwhite WR (August 1957). "Studies on phenolic steroids in human subjects. II. The metabolic fate and hepato-biliary-enteric circulation of C14-estrone and C14-estradiol in women". The Journal of Clinical Investigation. 36 (8): 1266–1278. doi:10.1172/JCI103524. PMC 1072719. PMID 13463090.
- ^ a b c d "Estrogen". PubChem. U.S. National Library of Medicine.
- ^ a b "Material Safety Data Sheet Estrone" (PDF). ScienceLab.com. Retrieved 21 February 2013.
- ^ "Estrone -PubChem". National Center for Biotechnology Information. Retrieved 6 September 2009.
- ^ "Drugs@FDA: FDA Approved Drug Products".
- ^ a b Cusi K, Isaacs S, Barb D, Basu R, Caprio S, Garvey WT, et al. (May 2022). "American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD)". Endocrine Practice. 28 (5): 528–562. doi:10.1016/j.eprac.2022.03.010. PMID 35569886.
- ^ a b Crandall CJ, Hovey KM, Andrews CA, Chlebowski RT, Stefanick ML, Lane DS, et al. (January 2018). "Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women's Health Initiative Observational Study". Menopause. 25 (1): 11–20. doi:10.1097/GME.0000000000000956. PMC 5734988. PMID 28816933.
- ^ The NAMS 2017 Hormone Therapy Position Statement Advisory Panel (July 2017). "The 2017 hormone therapy position statement of The North American Menopause Society". Menopause. 24 (7): 728–753. doi:10.1097/GME.0000000000000921. PMID 28650869.
{{cite journal}}:author1=일반 이름(도움말)이 있습니다. - ^ García-Sánchez J, Mafla-España MA, Tejedor-Cabrera C, Avellán-Castillo O, Torregrosa MD, Cauli O (March 2022). "Plasma Aromatase Activity Index, Gonadotropins and Estrone Are Associated with Frailty Syndrome in Post-Menopausal Women with Breast Cancer". Current Oncology. 29 (3): 1744–1760. doi:10.3390/curroncol29030144. PMC 8947022. PMID 35323344.
- ^ "Different kinds of oral contraceptive pills in polycystic ovary syndrome: a systematic review and meta-analysis". academic.oup.com. Retrieved 31 July 2023.
- ^ a b "Contraceptives, Oral, Combined", Drugs and Lactation Database (LactMed®), Bethesda (MD): National Institute of Child Health and Human Development, 2006, PMID 30000354, retrieved 31 July 2023
- ^ van Vlijmen EF, Veeger NJ, Middeldorp S, Hamulyák K, Prins MH, Büller HR, Meijer K (August 2011). "Thrombotic risk during oral contraceptive use and pregnancy in women with factor V Leiden or prothrombin mutation: a rational approach to contraception". Blood. 118 (8): 2055–61, quiz 2375. doi:10.1182/blood-2011-03-345678. PMID 21659542.
- ^ a b Delgado BJ, Lopez-Ojeda W (2023). "Estrogen". StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30855848. Retrieved 31 July 2023.
- ^ a b Bullough VL (19 May 1995). Science In The Bedroom: A History Of Sex Research. Basic Books. pp. 128–. ISBN 978-0-465-07259-0.
When Allen and Doisy heard about the [Ascheim-Zondek test for the diagnosis of pregnancy], they realized there was a rich and easily handled source of hormones in urine from which they could develop a potent extract. [...] Allen and Doisy's research was sponsored by the committee, while that of their main rival, Adolt Butenandt (b. 1903) of the University of Gottingen was sponsored by a German pharmaceutical firm. In 1929, both terms announced the isolation of a pure crystal female sex hormone, estrone, in 1929, although Doisy and Allen did so two months earlier than Butenandt.27 By 1931, estrone was being commercially produced by Parke Davis in this country, and Schering-Kahlbaum in Germany. Interestingly, when Butenandt (who shared the Nobel Prize for chemistry in 1939) isolated estrone and analyzed its structure, he found that it was a steroid, the first hormone to be classed in this molecular family.
- ^ Nielsch U, Fuhrmann U, Jaroch S (30 March 2016). New Approaches to Drug Discovery. Springer. pp. 7–. ISBN 978-3-319-28914-4.
The first steroid hormone was isolated from the urine of pregnant women by Adolf Butenandt in 1929 (estrone; see Fig. 1) (Butenandt 1931).
- ^ a b c Parl FF (2000). Estrogens, Estrogen Receptor and Breast Cancer. IOS Press. pp. 4–5. ISBN 978-0-9673355-4-4.
[Doisy] focused his research on the isolation of female sex hormones from hundreds of gallons of human pregnancy urine based on the discovery by Ascheim and Zondeck in 1927 that the urine of pregnant women possessed estrogenic activity [9]. In the summer of 1929, Doisy succeeded in the isolated of estrone (named by him theelin), simultaneously with but independent of Adolf Butenandt of the University of Gottingen in Germany. Doisy presented his results on the crystallization of estrone at the XIII International Physiological Congress in Boston in August 1929 [10].
- ^ a b c d Laylin JK (30 October 1993). Nobel Laureates in Chemistry, 1901–1992. Chemical Heritage Foundation. pp. 255–. ISBN 978-0-8412-2690-6.
Adolt Friedrich Johann Butenandt was awarded the Nobel Prize in chemistry in 1939 "for his work on sex hormones"; [...] In 1929 Butenandt isolated estrone [...] in pure crystalline form. [...] Both Butenandt and Edward Doisy isolated estrone simultaneously but independently in 1929. [...] Butenandt took a big step forward in the history of biochemistry when he isolated estrone from the urine of pregnant women. [...] He named it "progynon" in his first publication, and then "folliculine", [...] By 1932, [...] he could determine its chemical structure, [...]
- ^ a b Greenberg A (14 May 2014). Chemistry: Decade by Decade. Infobase Publishing. pp. 127–. ISBN 978-1-4381-0978-7.
Rational chemical studies of human sex hormones began in 1929 with Adolph Butenandt's isolation of pure crystalline estrone, the follicular hormone, from the urine of pregnant women. [...] Butenandt and Ruzicka shared the 1939 Nobel Prize in chemistry.
- ^ Labhart A (6 December 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 511–. ISBN 978-3-642-96158-8.
E. A. Doisy and A. Butenandt reported almost at the same time on the isolation of an estrogen-active substance in crystalline form from the urine of pregnant women. N. K. Adam suggested that this substance be named estrone because of the C-17-ketone group present (1933).
- ^ Rooke T (1 January 2012). The Quest for Cortisone. MSU Press. pp. 54–. ISBN 978-1-60917-326-5.
In 1929 the first estrogen, a steroid called "estrone," was isolated and purified by Doisy; he later won a Nobel Prize for this work.
- ^ Loriaux DL (23 February 2016). "Russel Earl Marker (1902–1995) - The Mexican Yam". A Biographical History of Endocrinology. Wiley. pp. 345–. ISBN 978-1-119-20247-9.
- ^ Campbell AD (1933). "Concerning Placental Hormones and Menstrual Disorders". Annals of Internal Medicine. 7 (3): 330. doi:10.7326/0003-4819-7-3-330. ISSN 0003-4819.
- ^ Fluhmann CF (November 1938). "Estrogenic Hormones: Their Clinical Usage". California and Western Medicine. 49 (5): 362–366. PMC 1659459. PMID 18744783.
- ^ Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 750–. ISBN 978-1-4511-4847-3.
In 1926, Sir Alan S. Parkes and C.W Bellerby coined the basic word "estrin" to designate the hormone or hormones that induce estrus in animals, the time when female mammals are fertile and receptive to males. [...] The terminology was extended to include the principal estrogens in humans, estrone, estradiol, and estriol, in 1932 at the first meeting of the International Conference on the Standardization of Sex Hormones in London, [...]
- ^ a b Oettel M, Schillinger E (6 December 2012). Estrogens and Antiestrogens I: Physiology and Mechanisms of Action of Estrogens and Antiestrogens. Springer Science & Business Media. pp. 2–. ISBN 978-3-642-58616-3.
The structure of the estrogenic hormones was stated by Butenandt, Thayer, Marrian, and Hazlewood in 1930 and 1931 (see Butenandt 1980). Following the proposition of the Marrian group, the estrogenic hormones were given the trivial names of estradiol, estrone, and estriol. At the first meeting of the International Conference on the Standardization of Sex Hormones, in London (1932), a standard preparation of estrone was established. [...] The partial synthesis of estradiol and estrone from cholesterol and dehydroepiandrosterone was accomplished by Inhoffen and Howleg (Berlin 1940); the total synthesis was achieved by Anner and Miescher (Basel, 1948).
- ^ a b Watkins ES (6 March 2007). "Beginnings". The Estrogen Elixir: A History of Hormone Replacement Therapy in America. JHU Press. pp. 21–. ISBN 978-0-8018-8602-7.
- ^ Pincus G, Thimann KV (2 December 2012). The Hormones V1: Physiology, Chemistry and Applications. Elsevier. pp. 360–. ISBN 978-0-323-14206-9.




