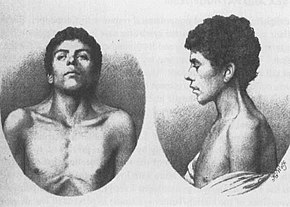
누난 증후군
Noonan syndrome| 누난 증후군 | |
|---|---|
| 기타 이름 | 남성 터너 증후군, 누난-에흐크 증후군, 터너 유사 증후군, 울리히-누난 증후군[1] |
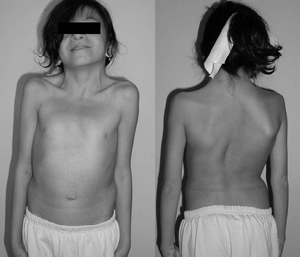 | |
| 누난 증후군에 걸린 12살 소녀. 일반적인 물갈퀴 목. 늑골 기형이 있는 이중 구조 곡선. | |
| 전문 | 의학유전학, 소아과 |
| 증상 | 약간 특이한 얼굴 생김새, 짧은 키, 선천성 심장병, 출혈 문제, 골격 기형[1] |
| 합병증 | 백혈병[1] |
| 평상시 시작 | 출생시[2] 현재 |
| 종류들 | 1~6타입[3] |
| 원인들 | 유전자 돌연변이(자체 우성)[1] |
| 진단법 | 증상에 근거하여 의심됨, 유전자 검사로[4][2] 확인됨 |
| 차등진단 | 심근경색증후군, 터너증후군, 코스텔로증후군, 신경섬유종 1형[2][3] |
| 치료 | 증상에[3] 따라 |
| 약물 | 성장호르몬[3] |
| 예후 | 심장 질환의[3] 심각성에 따라 다름 |
| 빈도 | 1000명 중 1명(2000명 중 1명)[4] |
누난증후군(NS)은 얼굴 생김새가 경미하고 키가 작으며 선천성 심장병, 출혈 문제, 골격 기형 등이 나타날 수 있는 유전적 질환이다.[1] 얼굴 특징으로는 넓은 간격의 눈, 밝은 색의 눈, 낮은 세트의 귀, 짧은 목, 작은 아래턱 등이 있다.[1] 심장 질환은 폐판막 협착증을 포함할 수 있다.[1] 가슴뼈는 돌출되거나 움푹 들어간 반면 척추는 비정상적으로 구부러져 있을 수 있다.[1] 신드롬의 지능은 보통이다.[1] NS의 합병증은 백혈병을 포함할 수 있다.[1]
많은 유전적 돌연변이가 누난 증후군을 일으킬 수 있다.[1] 그 질환은 사람의 부모로부터 자가 우성 질환으로 유전되거나 새로운 돌연변이로 발생할 수 있다.[3][1] 누난 증후군은 RASopathy의 일종으로, RAS/MAPK 세포 신호 경로 내에서 과활성화를 수반하는 기본적인 메커니즘이다.[1] 이 진단은 증상, 의료 영상, 혈액 검사를 바탕으로 의심될 수 있다.[2][4] 확인은 유전자 검사를 통해 이루어질 수 있다.[2]
NS에 대한 치료법은 알려져 있지 않다.[5] 치료는 증상과 기저에 있는 문제들에 바탕을 두고 있으며, 학교에서의 추가적인 지원이 필요할 수도 있다.[3] 유년기의 성장 호르몬 요법은 영향을 받은 사람의 최종 키를 증가시킬 수 있다.[3] 장기적 결과는 일반적으로 심장 질환의 심각성에 따라 결정된다.[3]
1000명 중 1명꼴로 추산되는 사람들이 NS에 의해 가벼운 영향을 받는 반면, 2000명 중 1명꼴로 더 심각한 형태의 질환을 가지고 있다.[4] 수컷이 암컷보다 더 자주 영향을 받는 것으로 보인다.[2] 이 질환은 1883년에 처음 설명되었고 1963년에 추가 사례를 설명한 미국의 소아심장전문의 재클린 누난의 이름을 따서 명명되었다.[2]
징후 및 증상


누난 증후군을 진단하는 가장 흔한 징후는 독특한 얼굴 특징과 근골격계 기능이다. 얼굴 특성은 유아기에 가장 두드러지게 나타나며, 누난 증후군을 가진 많은 사람들의 나이가 들면서 덜 뚜렷해진다.[7]
머리
누난증후군의 특징으로는 목 뒤쪽에 과다한 피부를 가진 큰 머리, 목의 나페에 낮은 헤어라인, 앞머리에 높은 헤어라인, 삼각형 얼굴형, 넓은 이마, 짧은 물갈퀴형 목 등이 있다.
눈에서 비대증(넓게 설정된 눈)은 누난 증후군을 가진 사람의 95%에 존재하는 결정적인 특징이다. 여기에는 서사시적 주름(눈 안쪽 모서리의 피부 추가 접힘), 쌍꺼풀(눈꺼풀의 낙하), 프루토시스(눈이 퉁퉁 붓는 눈), 스트라비스무스(눈의 안쪽으로 또는 바깥쪽으로 돌림), 니스타그무스(눈의 흔들림) 및 굴절 시각 오류가 동반될 수 있다.
코는 작을 수도 있고, 넓을 수도 있고, 위로 나올 수도 있다.
누난 증후군을 가진 사람들에게 귀와 청각 시스템의 발달은 영향을 받을 수 있다. 이로 인해 귀(90% 이상), 귀(90% 이상), 귀의 뒤쪽으로 회전하는 귀(외측 림)가 두꺼워질 수 있으며(90% 이상), 귀의 불완전한 접힘, 만성 이염 매체(이염), 청력 손실로 이어질 수 있다.
누난 증후군에서도 입의 발달이 영향을 받을 수 있다. 이로 인해 깊게 홈이 파여진 인중(상단 립라인) (90% 이상), 미세그나티아(밑턱 미완성), 높은 아치형 미각, 관절 장애(줄 서지 않음)가 발생하여 치아에 문제가 생길 수 있다. 위의 근육 발현과 마찬가지로 입안에서도 혀 조절이 잘 되지 않는 것이 관찰될 수 있다.
스킨
누난 증후군의 피부 징후와 증상은 림프세데마(사지의 림프부종), 켈로이드성형, 과도한 흉터성형, 과케라토시스(외피층의 과잉 발달), 색소성 네비(암흑색소성 피부점), 결합조직질환 등이다.
근골격계
누난 증후군에 사지와 사지에 이상이 생길 수 있다. 이것은 무뚝뚝하게 끝이 난 손가락, 손가락과 발가락에 여분의 패딩, 손등과 발톱의 부종, 그리고 큐빅 발구스(팔꿈치의 넓은 운반 각도)로 나타날 수 있다.
단신장의 경우 성장 호르몬이 IGF-1(또는 그 대안으로 독립형으로서 IGF-1)과 결합되어 신장/최종 높이를 더 빨리 달성하는 데 사용될 수 있다. 누난 증후군을 가진 개인의 최종 성인 키는 남성이 약 161~167cm, 여성이 150~155cm로 정상의 하한에 근접한다.[8]
척추 이상 증상은 최대 30%까지 나타날 수 있으며, 이 경우 60% 이상에서 교정하기 위해 수술이 필요할 수 있다. 누난 증후군의 다른 근골격계 징후는 관절 수축(긴장) 또는 관절 초이동성(루센스)과 연관될 수 있는 구별되지 않은 결합 질환과 관련이 있다. 척추뼈의 날개짓, 척추측만증, 가슴뼈 두드러기(펙투스 카리나툼), 가슴뼈 우울증(펙투스 굴착체)의 형태로 추가 요인이 나타날 수 있다. 근육 이상은 저혈압(낮은 근육톤)으로 나타날 수 있으며, 복부 근육톤이 나빠져 군주병(뒷쪽 빈 공간 증가)으로 이어질 수 있다.
하트
누난 증후군은 선천성 심장병의 두 번째로 흔한 증후군이다. 여기에는 폐동맥협착(50~60%), 심방중격결함(10~25%), 심실중격결함(5~20%), 비대심근병증(12~35%) 등이 포함된다.
폐
어떤 사람들에게는 폐 기능이 제한적이라고 보고되었다.
위장
누난 증후군과 관련된 여러 가지 위장병(GI) 증상들이 있다. 여기에는 삼키는 어려움, 낮은 내장의 운동성, 위낭비(위 비우기 지연), 장내 부적응, 잦은 구토 또는 강제 구토가 포함된다. 이러한 소화기 문제는 식욕 저하, 유아기에서 사춘기로 번성하지 못하고(75%) 때로는 급유관의 필요성으로 이어질 수 있다.
일반적 시스템
누난 증후군을 가진 일부 남성의 경우 고환이 내려가지 않는다(크립토르키디즘).
순환
누난 증후군을 가진 사람들에게 후경부 히그로마(webed neck)와 림프부종을 포함한 림프 이상은 나타날 수 있다.
누난 증후군과 관련된 많은 출혈 질환이 있는데, 여기에는 혈소판 기능장애, 혈전 장애, 인자 VII:C의 부분적 결핍, 인자 XI:C의 부분적 결핍, 인자 XII:C의 부분적 결핍, 인자 XII:C의 부분적 결핍, 플라스미노겐 활성제 타입-1(PA-PA)과 조직 플라스미노겐 활성제의 불균형이 포함된다. 활동 폰 윌레브란드병, 아메가카리아로시성혈소판감소판감소증(저혈소판수), 장기 활성 부분 혈소판막염 시간, 복합 응고 결함과 연관되어 있다. 이 누난증 동반 장애는 쉽게 멍이 들거나 출혈과 연관될 수 있다.
신경학
간혹 치아리 기형(타입 1)이 발생하여 수두증으로 이어질 수 있다. 발작도 보고되었다.
원인들

형제자매의 재발과 부모에서 자녀로 명백한 전염은 오래 전부터 자가 지배적 유전과 가변적 발현을 가진 유전적 결함을 시사해 왔다. Ras/mitogen 활성화 단백질 키나아제 신호 경로의 돌연변이는 NS 사례의 약 70%를 담당하는 것으로 알려져 있다.[9]
NS를 가진 사람들은 그것을 자손에게 전달할 확률을 50%까지 가지고 있다. 영향을 받는 부모가 NS를 가진 자녀에게 항상 식별되는 것은 아니라는 사실은 다음과 같은 몇 가지 가능성을 시사한다.
- 표현은 인식되지 않을 정도로 미묘할 수 있다(변수 표현성)
- NS는 서로 다른 원인의 유사한 조건을 두 개 이상 구성하는 이질적이며, 이들 중 일부는 유전되지 않을 수 있다.
- 많은 수의 사례들이 산발적인 새로운 돌연변이를 나타낼 수 있다.
| 유형 | Man 데이터베이스에서 온라인 멘델리안 상속 | 유전자 | 년도 발견 | 로커스 | 건수의 비율 | 설명 | 참조. |
|---|---|---|---|---|---|---|---|
| NS1 | 163950 | PTPN11 | 2001 | 12Q24.1 | 50% | PTPN11 유전자는 Tyrosine phosphatase SHP-2 단백질을 암호화한다. 이 단백질은 세포 분열, 분화, 이주를 조절하는 배아 발달에 관여하는 여러 세포내 신호 전달 경로의 구성 요소로서, 반월심장 밸브 형성에 중요한 표피 성장 인자 수용체에 의해 매개되는 하나를 포함한다. PTPN11을 포함하는 염색체 부위의 중복을 야기할 수도 있다. | [10] [11] |
| NS2 | 605275 | 알 수 없음, 자동 열성 | [12] | ||||
| NS3 | 609942 | 크라스 | 2006 | 12p12.1 | <5% | [13] | |
| NS4 | 610733 | SOS1 | 2006 | 2p22 | 10% | SOS1에서 돌연변이를 활성화하면 NS. SHP-2와 SOS1이 Ras/MAP 키나제 경로를 긍정적으로 조절할 수 있으므로, 이 규정의 난이도가 NS 개발을 매개한다는 것을 알 수 있다.[14] | [15] |
| NS5 | 611553 | RAF1 | 2007 | 3p25 | 3–17% | [16] |
NRAS, HRAS, BRAF, SHOC2, MAP2K1, MAP2K2, CCL에서의 이질적 돌연변이는 NS의 더 적은 비율과 관련 표현형과도 연관되어 있다.[17]
"뉴로피브로마토증-누난증후군"으로 알려진 질환은 신경피브로민과 관련이 있다.[18]
진단
NS는 위에 나열된 알려진 돌연변이의 존재에 의해 유전적으로 확인될 수 있다. 그러나 14개의 원인 유전자를 확인했음에도 불구하고 알려진 돌연변이의 부재는 더 많은 것이 발견되지 않은 유전자가 NS를 유발할 수 있기 때문에 진단을 배제하지는 않을 것이다. 따라서 NS의 진단은 여전히 임상적 특성에 기초하고 있다. 즉, 의사가 라벨을 보증할 수 있는 충분한 특징을 가지고 있다고 느낄 때 만들어진다. 유전자 진단의 주요 가치는 추가 의료 및 개발 평가를 안내하고, 기능에 대한 다른 가능한 설명은 배제하며, 보다 정확한 재발 위험 추정치가 가능하다는 것이다. 더 많은 유전자형-피노타입 상관관계 연구가 수행되고 있는 가운데, 양성 유전자 진단이 임상의사가 특정 유전자 돌연변이에 특정한 가능한 이상 징후를 인지하는 데 도움이 될 것이다. 예를 들어, KRAS의 돌연변이를 가진 사람들에게서 비대성 심근증의 증가는 나타나고 PTPN11의 돌연변이에 대해 청소년 골수성 백혈병의 위험 증가가 존재한다. 향후 연구들은 한 개인이 어떤 유전적 돌연변이를 가지고 있느냐에 따라 달라지는 NS 증상의 표적 관리로 이어질 수 있다.
태어나기 전
의사가 누난 증후군의 진단을 고려하게 할 수 있는 태아적 특징으로는 낭포성 히그로마, 낭포성 반투명성 증가, 흉막유출, 부종 등이 있다.[19]
차등진단
터너 증후군은 신장 이상과 발육 지연과 유사하지만 터너 증후군은 여성에게서만 발견되며 종종 다르게 표현된다. 터너 증후군의 경우 발달지연 발생률이 낮고, 좌심장 결함은 일정하며, 신장 이상 발생은 훨씬 낮다.[20]
기타 RASopathies
- 왓슨 증후군 - 왓슨 증후군은 단신, 폐판막 협착증, 가변적 지적 발달, 피부색소 변화 등 누난 증후군과 유사한 특징을 많이 가지고 있다.[20][21]
- 심근경색증후군 - CFC 증후군은 심장과 임파 기능이 비슷해 누난 증후군과 매우 유사하다. 그러나 CFC증후군에서 지적장애와 위장장애는 종종 더 심각하고 뚜렷하다.[20][22]
- 코스텔로 증후군 - CFC 증후군처럼 코스텔로 증후군은 누난 증후군과 겹치는 특징이 있다. 그러나 그 조건은 유전적 원인에 의해 구별될 수 있다.[23][24]
- 신경섬유종증 1(NF1)
- 윌리엄스 증후군[20][26]
관리
합병증에 따라 치료법이 다르지만 일반인의 치료법을 반영해 상당히 표준적인 경향이 있다.[20] 진단 시, 진단 후, 진단 후 및 증상일 경우 취해야 할 조치를 설명하는 일반, 개발, 치과, 성장 및 공급, 심혈관계, 청각학, 혈액학, 신장 및 골격 등을 포함한 시스템으로 분류된 관리 지침은 미국 컨소시엄에 의해 발표되었다.[19]
구체적으로는 심혈관 합병증의 치료는 일반 인구를 닮고 출혈 이온 치료는 특정인자 결핍이나 혈소판 응집술에 의해 유도된다.[20]
- 신경심리학적 검사는 학교와 진로에 필요한 지원을 맞춤형으로 할 수 있는 강점과 도전을 찾는 것이 좋다.
- 학령기 아동을 위한 개별화된 교육 프로그램 계획과 같은 교육 맞춤화가 필요한 경우도 있다.
- 언어 및 발음에 문제가 있는 경우 음성 치료
- 총 및 미세 동력 지연에 대한 물리치료 및 작업치료
- 저혈압과 운동장애는 종종 필체에 영향을 미친다. 필적 수요를 줄일 수 있는 숙소는 성능을 향상시키고 장기적인 손 기능을 절약할 수 있을 것이다.
- 어떤 시스템, 특히 심혈관 시스템에서 발견되는 이상에 대한 주기적인 추적 및 평생 모니터링이 권장된다.[27][8]
마취위험
누난증후군을 가진 소수의 사람들이 악성 열병에 걸린다고 보고되었지만, 악성 열병과 관련이 있는 것으로 알려진 질병의 유전자 돌연변이는 누난증후군과 다르다.[28]
예후
누난 증후군을 가진 사람들의 수명은 일반 인구와 비슷할 수 있지만 누난 증후군은 사망에 기여할 수 있는 몇 가지 건강 상태와 연관될 수 있다. 누난 증후군을 가진 사람들의 사망률에 가장 큰 기여는 심혈관 질환의 합병증이다.[29][8] 따라서 예후는 주로 심장병의 유무에 따라 결정되며, 질병의 종류와 중증도(질병이 있는 경우)에 따라 결정된다.[8] 가장 주목할 만한 것은, 비대성 심근증을 가진 누난 증후군은 사망률 증가와 관련이 있다.[29][8]
역사
Jacqueline Nunan은 아이오와 대학에서 소아심장전문의로 연습하고 있었는데, 희귀한 형태의 심장결함, 판막폐협착증을 가진 아이들은 키가 작고, 물갈퀴가 달린 목, 눈이 넓고, 귀가 낮은 등 종종 특징적인 신체적 외모를 가지고 있다는 것을 알아차렸다. 소년 소녀 모두 영향을 받았다. 이러한 특징들은 때때로 가족 내에서 달리는 것이 보였지만 총 염색체 이상과는 관련이 없었다. 그녀는 선천성 심장병 클리닉에서 833명의 누난 증후군을 가진 사람들을 연구하여 다른 선천성 기형을 찾았고, 1963년에 " 선천성 심장병을 가진 아이들의 비심장성 기형"이라는 논문을 발표했다.[30] 이는 선천성 심장병 외에도 얼굴 생김새, 흉부 기형, 키가 작은 9명의 어린이들을 묘사했다.
누난 박사의 제자였던 존 오피츠 박사는 누난 박사가 묘사한 아이들과 닮은 아이들을 보고 처음으로 '누난 증후군'이라고 부르기 시작했다. 누난 박사는 1968년 '터너 피노타입과 함께 한 하이퍼텔로리즘'이라는 논문을 발표해 누난 증후군을 나타내는 증상을 보인 19명의 환자를 연구했다.[31] 1971년 심혈관계결함 심포지엄에서 '노난증후군'이라는 명칭이 공식적으로 인정받게 되었다.
참조
- ^ a b c d e f g h i j k l m "Noonan syndrome". Genetics Home Reference. Retrieved 24 December 2018.
- ^ a b c d e f g "Noonan Syndrome". NORD (National Organization for Rare Disorders). 2016. Retrieved 24 December 2018.
- ^ a b c d e f g h i "Noonan syndrome". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Retrieved 25 December 2018.
- ^ a b c d Bhambhani V, Muenke M (January 2014). "Noonan syndrome". American Family Physician. 89 (1): 37–43. PMC 4099190. PMID 24444506.
- ^ "Noonan Syndrome - Children's Health Issues". Merck Manuals Consumer Version. Retrieved 25 December 2018.
- ^ a b Nosan G, Bertok S, Vesel S, Yntema HG, Paro-Panjan D (December 2013). "A lethal course of hypertrophic cardiomyopathy in Noonan syndrome due to a novel germline mutation in the KRAS gene: case study". Croatian Medical Journal. 54 (6): 574–8. doi:10.3325/cmj.2013.54.574. PMC 3893993. PMID 24382853.
- ^ Romano, Alicia A.; Allanson, Judith E.; Dahlgren, Jovanna; Gelb, Bruce D.; Hall, Bryan; Pierpont, Mary Ella; Roberts, Amy E.; Robinson, Wanda; Takemoto, Clifford M.; Noonan, Jacqueline A. (October 2010). "Noonan syndrome: clinical features, diagnosis, and management guidelines". Pediatrics. 126 (4): 746–759. doi:10.1542/peds.2009-3207. ISSN 1098-4275. PMID 20876176. S2CID 11297756.
- ^ a b c d e Allanson, Judith E.; Roberts, Amy E. (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), "Noonan Syndrome", GeneReviews®, University of Washington, Seattle, PMID 20301303, retrieved 2019-11-18
- ^ Razzaque MA, Komoike Y, Nishizawa T, Inai K, Furutani M, Higashinakagawa T, Matsuoka R (March 2012). "Characterization of a novel KRAS mutation identified in Noonan syndrome". American Journal of Medical Genetics. Part A. 158A (3): 524–32. doi:10.1002/ajmg.a.34419. PMID 22302539. S2CID 34135931.
- ^ Tartaglia M, Mehler EL, Goldberg R, Zampino G, Brunner HG, Kremer H, et al. (December 2001). "Mutations in PTPN11, encoding the protein tyrosine phosphatase SHP-2, cause Noonan syndrome". Nature Genetics. 29 (4): 465–8. doi:10.1038/ng772. PMID 11704759. S2CID 14627986.
- ^ Shchelochkov OA, Patel A, Weissenberger GM, Chinault AC, Wiszniewska J, Fernandes PH, et al. (April 2008). "Duplication of chromosome band 12q24.11q24.23 results in apparent Noonan syndrome". American Journal of Medical Genetics. Part A. 146A (8): 1042–8. doi:10.1002/ajmg.a.32215. PMID 18348260. S2CID 205309115.
- ^ van Der Burgt I, Brunner H (September 2000). "Genetic heterogeneity in Noonan syndrome: evidence for an autosomal recessive form". American Journal of Medical Genetics. 94 (1): 46–51. doi:10.1002/1096-8628(20000904)94:1<46::AID-AJMG10>3.0.CO;2-I. PMID 10982482.
- ^ Schubbert S, Zenker M, Rowe SL, Böll S, Klein C, Bollag G, et al. (March 2006). "Germline KRAS mutations cause Noonan syndrome". Nature Genetics. 38 (3): 331–6. doi:10.1038/ng1748. PMID 16474405. S2CID 8193354.
- ^ Bentires-Alj M, Kontaridis MI, Neel BG (March 2006). "Stops along the RAS pathway in human genetic disease". Nature Medicine. 12 (3): 283–5. doi:10.1038/nm0306-283. PMID 16520774. S2CID 6989331.
- ^ Roberts AE, Araki T, Swanson KD, Montgomery KT, Schiripo TA, Joshi VA, et al. (January 2007). "Germline gain-of-function mutations in SOS1 cause Noonan syndrome". Nature Genetics. 39 (1): 70–4. doi:10.1038/ng1926. PMID 17143285. S2CID 10222262.
- ^ Razzaque MA, Nishizawa T, Komoike Y, Yagi H, Furutani M, Amo R, et al. (August 2007). "Germline gain-of-function mutations in RAF1 cause Noonan syndrome". Nature Genetics. 39 (8): 1013–7. doi:10.1038/ng2078. PMID 17603482. S2CID 29753972.
- ^ "Download Catalog - Mayo Medical Laboratories". www.mayomedicallaboratories.com.
- ^ De Luca A, Bottillo I, Sarkozy A, Carta C, Neri C, Bellacchio E, et al. (December 2005). "NF1 gene mutations represent the major molecular event underlying neurofibromatosis–Noonan syndrome". American Journal of Human Genetics. 77 (6): 1092–101. doi:10.1086/498454. PMC 1285166. PMID 16380919.
- ^ a b Roberts, Amy E.; Allanson, Judith E.; Tartaglia, Marco; Gelb, Bruce D. (2013-01-26). "Noonan syndrome". Lancet. 381 (9863): 333–342. doi:10.1016/S0140-6736(12)61023-X. ISSN 1474-547X. PMC 4267483. PMID 23312968.
- ^ a b c d e f g Allanson, Judith E.; Roberts, Amy E. (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), "Noonan Syndrome", GeneReviews®, University of Washington, Seattle, PMID 20301303, retrieved 2019-11-25
- ^ Allanson, J. E.; Upadhyaya, M.; Watson, G. H.; Partington, M.; MacKenzie, A.; Lahey, D.; MacLeod, H.; Sarfarazi, M.; Broadhead, W.; Harper, P. S. (November 1991). "Watson syndrome: is it a subtype of type 1 neurofibromatosis?". Journal of Medical Genetics. 28 (11): 752–756. doi:10.1136/jmg.28.11.752. ISSN 0022-2593. PMC 1017110. PMID 1770531.
- ^ Armour, C. M.; Allanson, J. E. (April 2008). "Further delineation of cardio-facio-cutaneous syndrome: clinical features of 38 individuals with proven mutations". Journal of Medical Genetics. 45 (4): 249–254. doi:10.1136/jmg.2007.054460. ISSN 1468-6244. PMID 18039946. S2CID 9742395.
- ^ Kerr, B.; Delrue, M.-A.; Sigaudy, S.; Perveen, R.; Marche, M.; Burgelin, I.; Stef, M.; Tang, B.; Eden, O. B.; O'Sullivan, J.; De Sandre-Giovannoli, A. (May 2006). "Genotype-phenotype correlation in Costello syndrome: HRAS mutation analysis in 43 cases". Journal of Medical Genetics. 43 (5): 401–405. doi:10.1136/jmg.2005.040352. ISSN 1468-6244. PMC 2564514. PMID 16443854.
- ^ Gripp, Karen W.; Lin, Angela E.; Stabley, Deborah L.; Nicholson, Linda; Scott, Charles I.; Doyle, Daniel; Aoki, Yoko; Matsubara, Yoichi; Zackai, Elaine H.; Lapunzina, Pablo; Gonzalez-Meneses, Antonio (2006-01-01). "HRAS mutation analysis in Costello syndrome: Genotype and phenotype correlation". American Journal of Medical Genetics Part A. 140A (1): 1–7. doi:10.1002/ajmg.a.31047. ISSN 1552-4825. PMID 16329078. S2CID 27334655.
- ^ Bertola, Debora R.; Pereira, Alexandre C.; Passetti, Fábio; de Oliveira, Paulo S.L.; Messiaen, Ludwine; Gelb, Bruce D.; Kim, Chong A.; Krieger, José Eduardo (2005-07-30). "Neurofibromatosis–Noonan syndrome: Molecular evidence of the concurrence of both disorders in a patient". American Journal of Medical Genetics Part A. 136A (3): 242–245. doi:10.1002/ajmg.a.30813. ISSN 1552-4825. PMID 15948193. S2CID 40235559.
- ^ Morris, Colleen A. (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), "Williams Syndrome", GeneReviews®, University of Washington, Seattle, PMID 20301427, retrieved 2019-11-25
- ^ "Noonan syndrome - Symptoms, diagnosis and treatment BMJ Best Practice". bestpractice.bmj.com. Retrieved 2019-11-18.
- ^ "Does Noonan Syndrome Increase Malignant Hyperthermia Susceptibility? - MHAUS". www.mhaus.org. Retrieved 2019-11-25.
- ^ a b "DynaMed". www.dynamed.com. Retrieved 2019-11-11.
- ^ Noonan JA, Ehmke DA (1963). "Associated noncardiac malformations in children with congenital heart disease". Midwest Soc Pediatr Res. 63: 468–70.
- ^ Noonan, Jacqueline A. (1968-10-01). "Hypertelorism With Turner Phenotype: A New Syndrome With Associated Congenital Heart Disease". American Journal of Diseases of Children. 116 (4): 373–80. doi:10.1001/archpedi.1968.02100020377005. ISSN 0002-922X. PMID 4386970.
외부 링크
| 위키미디어 커먼스는 누난 증후군과 관련된 미디어를 보유하고 있다. |