인돌
Indole이 기사의 선두 부분은 너무 전문적이어서 대부분의 독자들이 이해할 수 없을 것이다.(2022년 7월 (이를 에 대해 학습합니다) |
 | |
 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 1H-인돌[1] | |
| 기타 이름 2,3-벤조피롤, 케톨, 1-벤자졸 | |
| 식별자 | |
3D 모델(JSmol) | |
| 3 DMet | |
| 107693 | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.004.019 |
| EC 번호 |
|
| 3477 | |
| 케그 | |
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C8H7N | |
| 몰 질량 | 117.15g/140−1 |
| 외모 | 흰색 솔리드 |
| 냄새 | 대변이나 재스민 같은 것 |
| 밀도 | 1.1747 g/cm3, 솔리드 |
| 녹는점 | 52 ~ 54 °C (126 ~129 °F, 325 ~327 K) |
| 비등점 | 253 ~ 254 °C (487 ~489 °F, 526 ~527 K) |
| 0.19g/100ml(20°C) 뜨거운 물에 녹다 | |
| 산도(pKa) | 16.2 (DMSO의 경우 21.0) |
| 기본성(pKb) | 17.6 |
자화율(δ) | - 85.0 · 10−6 cm3 / 세로 |
| 구조. | |
| Pna21 | |
| 평면 | |
| 벤젠의 2.11D | |
| 위험 요소 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 요소 | 피부 민감성 |
| GHS 라벨링: | |
  | |
| 위험. | |
| H302, H311 | |
| P264, , , , , , , , , | |
| 플래시 포인트 | 121 °C (250 °F, 394 K) |
| 안전 데이터 시트(SDS) | [1] |
| 관련 화합물 | |
기타 캐티온 | 인돌륨 |
관련 방향족 화합물 | 벤젠, 벤조프란, 카르바졸, 카르보린, 인덴, 벤조티오펜, 인돌린 이자틴, 메틸인돌, 옥신돌, 피롤, 스카톨, 벤조포스폴 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
인돌은 식 CHN의87 방향족 복소환 유기화합물이다.그것은 6원짜리 벤젠 고리와 5원짜리 피롤 고리가 융합된 이환 구조를 가지고 있다.인돌은 자연환경에 널리 분포되어 있으며 다양한 박테리아에 의해 생산될 수 있다.세포간 신호 분자로서 인돌은 포자 형성, 플라스미드 안정성, 약물에 대한 내성, 바이오막 형성 및 독성을 [2]포함한 세균 생리의 다양한 측면을 조절합니다.아미노산 트립토판은 인돌 유도체이며 신경전달물질 [3]세로토닌의 전구체이다.
일반 속성 및 발생
인돌은 실온에서 고체입니다.사람 배설물에서 자연적으로 발생하며 강한 분변 냄새가 난다.그러나 매우 낮은 농도에서는 꽃향기가 [4]나고 많은 향수의 성분이다.콜타르에서도 발생합니다.
대응하는 치환기를 인도릴이라고 한다.
인돌은 주로 위치 3에서 친전자성 치환을 거친다(오른쪽 여백 그림 참조).치환인돌은 신경전달물질 세로토닌 및 멜라토닌 호르몬을[5] 포함한 트립토판 유래 트립타민 알칼로이드 및 자연발생 사이키델릭 약물 디메틸트립타민 및 실로시빈의 구조요소(및 일부 화합물의 합성 전구체)이다.다른 인도성 화합물로는 식물 호르몬 옥신(인도릴-3-아세트산, IAA), 트립토폴, 항염증 약물인 인도메타신 및 베타블로커 핀드롤이 있다.
는 단어와 oleum indigo의 이름 indole은 여러가지로 이뤄진 이후 indole 먼저 oleum과 인디고 염료의 처리에 의해 격리되었다.
역사
Indole 화학은 색소 남색의 연구와 함께 발전하기 시작했다.Indigo이사틴에 가고, 그 다음 oxindole로 바뀔 수 있다.그리고 나서, 1866년, 아돌프 폰 바이어 아연 가루를 사용하여 indole에 oxindole을 줄였다.[6]1869년에, 그는 indole을 위한 공식 제안했다.[7]
19세기 말까지 특정한 인돌 유도체 중요한 염료.그건 저는 인돌 substituent 많은 중요한 종류의 알칼로이드, 인돌 알칼로이드(예를 들어, 트립 토판과 오옥신)로 알려진, 연구의 아직도 활발한 지역 오늘 참석하다 1930년대에는 인돌에 관심의 증대.[8]
생합성 및 기능
Indole은shikimate 경로에 anthranilate을 통해 biosynthesized 있다.[3]그것은 중간의 생합성의 트립 토판, 어디에서 계속 안에 있는 트립 토판 합성 효소 분자 사이의 제거의 3-phospho-glyceraldehyde고가 응결과 세린.언제 indole은 세포에서 필요하다면, 보통 트립 토판에서 tryptophanase에서 생산된 것이다.[9]
한 세포 간 신호 분자로서, 인돌 세균성 생리학의 포자 형성, 플라스미드 안정성, 마약에 대한 저항, biofilm 형성과 병독성을 포함한 다양한 측면을 규제한다.[2]인돌 파생 상품의 많은 세로토닌 등 신경 전달 물질 등과 같은 중요한 통화 기능을 가지고 있다.[3]
인간의 위장의 미소 생물학(에 의해Tryptophan 신진대사.) |
의료 응용 프로그램
인돌과 그 유도체는 결핵, 말라리아, 당뇨병, 암, 편두통, 경련, 고혈압, 메티실린 내성 황색포도상구균(MRSA)의 세균 감염, 심지어 [14][15][16][17][18]바이러스에도 효과가 있습니다.
모의 루트
인돌과 그 유도체도 [19][20][21]다양한 방법으로 합성할 수 있다.
주요 산업 경로는 촉매가 있는 상태에서 에틸렌 글리콜과 기상 반응을 통해 아닐린에서 시작합니다.
일반적으로 반응은 200 ~ 500 °C 사이에서 이루어진다.수율은 최대 60%까지 상승할 수 있습니다.인돌의 다른 전구체로는 포르밀톨루이딘, 2-에틸아닐린 및 2-(2-니트로페닐)에탄올이 있으며, 이들 모두는 환화를 [22]겪는다.
림그루버-바초인돌합성
Leimgruber-Batcho 인돌 합성은 인돌과 치환 인돌을 [23]합성하는 효율적인 방법이다.1976년 특허로 처음 공개된 이 방법은 고수익으로 대체 인돌을 발생시킬 수 있다.이 방법은 많은 제약약들이 특별히 치환된 인돌로 구성되어 있는 제약업계에서 특히 인기가 있다.
피셔 인돌 합성
대체 인돌을 합성하는 가장 오래되고 신뢰할 수 있는 방법 중 하나는 에밀 피셔에 의해 1883년에 개발된 피셔 인돌 합성이다.피셔 인돌 합성을 사용하면 인돌 자체의 합성에 문제가 있지만, 종종 2- 및/또는 3-위치로 치환된 인돌을 생성하기 위해 사용된다.그러나 피셔 인돌 합성을 이용하여 페닐히드라진을 피루브산과 반응시킨 후 형성된 인돌-2-카르복실산을 탈탄산화함으로써 인돌을 합성할 수 있다.이것은 또한 마이크로파 [24]조사를 이용한 원포트 합성에서도 달성되었다.
기타 인돌 형성 반응
- 바르톨리 인돌 합성
- 비슐러뫼라우인돌합성
- 카도간-순드베르그 인돌 합성
- 후쿠야마 인돌 합성
- 가스만 인돌 합성
- 헤메츠버거인돌합성
- 라록 인돌 합성
- 마델룽 합성
- Nenitzescu 인돌
- 인돌 재발급 합성
- 배이어-에머링 인돌 합성
- 디엘-리즈 반응에서[25][26] 디메틸 아세틸렌디카르복실레이트는 부가물에 대해 1,2-디페닐히드라진과 반응하며, 자일렌은 디메틸인돌-2,3-디카르복실레이트와 아닐린을 생성한다.다른 용제와 함께, 다른 생산물이 형성된다: 빙하 아세트산 피라졸론, 피리딘 피라졸린.
인돌의 화학반응
기본성
대부분의 아민과 달리, 인돌은 염기성이 아니다: 피롤과 마찬가지로 고리의 방향족 특성은 질소 원자에 있는 유일한 전자 쌍이 양성자화를 [27]할 수 없다는 것을 의미한다.그러나 염산과 같은 강한 산은 인돌을 양성자로 만들 수 있다.인돌은 벤젠 고리 외부에 위치한 분자 부분의 에나민 유사 반응성 때문에 N1이 아닌 C3에서 주로 양성자화된다.양성자화된 형태의 pK는a -3.6이다.산성 조건 하에서 많은 인돌릭 화합물(예: 트립타민)의 민감도는 이 양성자화에 의해 유발된다.
친전자성 치환
친전자성 방향족 치환에 대한 인돌의 가장 반응성이 높은 위치는 벤젠보다 10배13 높은 C3입니다.예를 들어 아미노산 트립토판의 생합성에서 인산화 세린에 의해 알킬화된다.인돌의[28] 빌스마이어-해크 포밀화는 상온에서만 C3에서 수행됩니다.
필롤 고리는 인돌의 가장 반응성이 높은 부분이기 때문에 일반적으로 N1, C2, C3가 치환된 후에만 카보사이클릭(벤젠) 고리의 친전자 치환이 이루어진다.주목할 만한 예외는 C3를 완전히 양성자화하기에 충분한 산성 상태에서 친전자 치환을 했을 때 발생한다.이 경우 C5가 친전자성 [29]공격의 가장 흔한 장소이다.
유용한 합성 중간체인 그라민은 인돌과 디메틸아민 및 포름알데히드의 만니히 반응을 통해 생산된다.인돌-3-아세트산과 합성 트립토판의 전구체이다.
N-H 산도와 유기금속 인돌 음이온 복합체
N-H 중심은 DMSO에서 pK가a 21이므로 완전한 탈양성자화를 위해서는 수소화 나트륨 또는 n-부틸 리튬과 같은 매우 강력한 염기와 무수 조건이 필요합니다.결과적으로 생기는 유기 금속 유도체는 두 가지 방식으로 반응할 수 있다.나트륨 또는 칼륨 화합물과 같은 이온성 염류가 많을수록 질소-1에서 친전자성분과 반응하는 경향이 있는 반면, 공유가 높은 마그네슘 화합물(인돌 그리냐드 시약)과 아연 복합체는 탄소 3에서 반응하는 경향이 있습니다(아래 그림 참조).유사한 방식으로 DMF 및 DMSO와 같은 극성 비프로톤 용제는 질소에 대한 공격을 선호하는 경향이 있는 반면 톨루엔과 같은 극성 용제는 C3 [30]공격을 선호합니다.
탄소산도와 C2석화
N–H 양성자 다음으로, C2의 수소는 인돌에서 가장 산성이 높은 양성자이다.N-보호 인돌과 부틸 리튬 또는 리튬 디이소프로필아미드와의 반응으로 C2 위치에서만 석화가 이루어진다.이 강한 친핵성은 다른 전자 친핵체와 함께 사용될 수 있다.
버그만과 베네말름은 [32]카트리츠키처럼 [31]치환되지 않은 인돌의 두 위치를 석화하는 기술을 개발했어요
인돌의 산화
인돌은 전자가 풍부하기 때문에 쉽게 산화된다.N-브로모수시니미드와 같은 단순 산화제는 인돌 1을 옥신돌(4 및 5)로 선택적으로 산화한다.
인돌의 순환 부하
인돌의 C2-C3 파이 결합만이 사이클로드디션 반응을 할 수 있다.분자내 변이체는 종종 분자간 사이클로드 디케이션보다 높은 수율을 보인다.예를 들어 Padwa 등입니다.[33]이 Diels-Alder 반응을 발전시켜 고급 스트리치닌 중간체를 형성했습니다.이 경우 2-아미노퓨란은 디엔이고, 인돌은 친디엔이다.인돌은 또한 분자 내 [2+3] 및 [2+2] 사이클로드 상태를 거친다.
보통의 수확량에도 불구하고, 인돌 유도체의 분자간 순환 부하는 잘 [34][35][36][37]입증되었다.한 예로 트립토판 유도체와 알데하이드 [38]사이의 픽테-스펜글러 반응이 있으며, 이는 디아스테레오머의 혼합물을 생성하여 원하는 제품의 수율을 감소시킵니다.
수소화
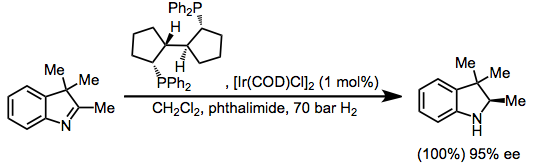
인돌은 이민 서브유닛의 [39]수소화에 민감하다.
「 」를 참조해 주세요.
레퍼런스
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 213. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ a b Lee, Jin-Hyung; Lee, Jintae (2010). "Indole as an intercellular signal in microbial communities". FEMS Microbiology Reviews. 34 (4): 426–44. doi:10.1111/j.1574-6976.2009.00204.x. ISSN 0168-6445. PMID 20070374.
- ^ a b c Nelson, David L.; Cox, Michael M. (2005). Principles of Biochemistry (4th ed.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Purves, Dale; Augustine, George J; Fitzpatrick, David; Katz, Lawrence C; LaMantia, Anthony-Samuel; McNamara, James O; Williams, S Mark. "Olfactory Perception in Humans". Olfactory Perception in Humans. Retrieved 20 October 2020.
- ^ Lee, Jung Goo (21 October 2019). "The Neuroprotective Effects of Melatonin: Possible Role in the Pathophysiology of Neuropsychiatric Disease" (PDF). Brain Sciences. 9 (285). doi:10.3390/brainsci9100285. PMID 31640239. Retrieved 11 June 2022.
- ^ Baeyer, A. (1866). "Ueber die Reduction aromatischer Verbindungen mittelst Zinkstaub" [On the reduction of aromatic compounds by means of zinc dust]. Annalen der Chemie und Pharmacie. 140 (3): 295–296. doi:10.1002/jlac.18661400306.
- ^ Baeyer, A.; Emmerling, A. (1869). "Synthese des Indols" [Synthesis of indole]. Berichte der Deutschen Chemischen Gesellschaft. 2: 679–682. doi:10.1002/cber.186900201268.
- ^ Van Order, R. B.; Lindwall, H. G. (1942). "Indole". Chem. Rev. 30: 69–96. doi:10.1021/cr60095a004.
- ^ Stephanopoulos, George; Aristidou, Aristos A.; Nielsen, Jens (1998-10-17). Metabolic Engineering: Principles and Methodologies. Academic Press. p. 251. ISBN 9780080536286.
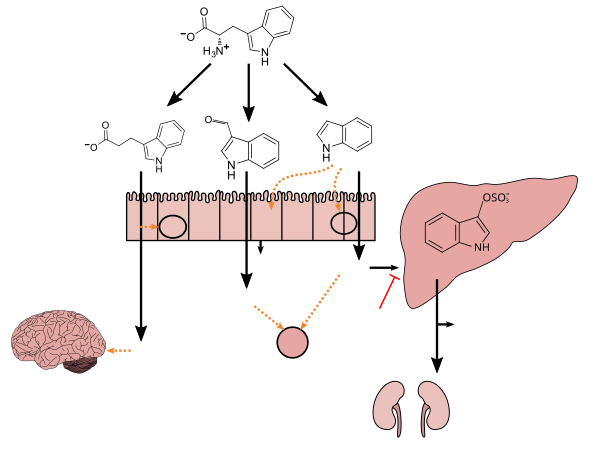
- ^ a b c d e f g h i Zhang LS, Davies SS (April 2016). "Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions". Genome Med. 8 (1): 46. doi:10.1186/s13073-016-0296-x. PMC 4840492. PMID 27102537.
Lactobacillus spp. convert tryptophan to indole-3-aldehyde (I3A) through unidentified enzymes [125]. Clostridium sporogenes convert tryptophan to IPA [6], likely via a tryptophan deaminase. ... IPA also potently scavenges hydroxyl radicals
표 2: 미생물 대사물: 그 합성, 작용 메커니즘 및 건강과 질병에 미치는 영향
그림 1: 인돌과 그 대사물이 숙주의 생리학 및 질병에 작용하는 분자 메커니즘 - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (March 2009). "Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites". Proc. Natl. Acad. Sci. U.S.A. 106 (10): 3698–3703. Bibcode:2009PNAS..106.3698W. doi:10.1073/pnas.0812874106. PMC 2656143. PMID 19234110.
Production of IPA was shown to be completely dependent on the presence of gut microflora and could be established by colonization with the bacterium Clostridium sporogenes.
IPA 대사도 - ^ "3-Indolepropionic acid". Human Metabolome Database. University of Alberta. Retrieved 12 June 2018.
- ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (July 1999). "Potent neuroprotective properties against the Alzheimer beta-amyloid by an endogenous melatonin-related indole structure, indole-3-propionic acid". J. Biol. Chem. 274 (31): 21937–21942. doi:10.1074/jbc.274.31.21937. PMID 10419516. S2CID 6630247.
[Indole-3-propionic acid (IPA)] has previously been identified in the plasma and cerebrospinal fluid of humans, but its functions are not known. ... In kinetic competition experiments using free radical-trapping agents, the capacity of IPA to scavenge hydroxyl radicals exceeded that of melatonin, an indoleamine considered to be the most potent naturally occurring scavenger of free radicals. In contrast with other antioxidants, IPA was not converted to reactive intermediates with pro-oxidant activity.
- ^ Ramesh, Deepthi; Joji, Annu; Vijayakumar, Balaji Gowrivel; Sethumadhavan, Aiswarya; Mani, Maheswaran; Kannan, Tharanikkarasu (15 July 2020). "Indole chalcones: Design, synthesis, in vitro and in silico evaluation against Mycobacterium tuberculosis". European Journal of Medicinal Chemistry. 198: 112358. doi:10.1016/j.ejmech.2020.112358. ISSN 0223-5234. PMID 32361610. S2CID 218490655.
- ^ Qin, Hua-Li; Liu, Jing; Fang, Wan-Yin; Ravindar, L.; Rakesh, K. P. (15 May 2020). "Indole-based derivatives as potential antibacterial activity against methicillin-resistance Staphylococcus aureus (MRSA)". European Journal of Medicinal Chemistry. 194: 112245. doi:10.1016/j.ejmech.2020.112245. ISSN 0223-5234. PMID 32220687. S2CID 214695328.
- ^ Thanikachalam, Punniyakoti Veeraveedu; Maurya, Rahul Kumar; Garg, Vishali; Monga, Vikramdeep (15 October 2019). "An insight into the medicinal perspective of synthetic analogs of indole: A review". European Journal of Medicinal Chemistry. 180: 562–612. doi:10.1016/j.ejmech.2019.07.019. ISSN 0223-5234. PMID 31344615. S2CID 198911553.
- ^ Kumari, Archana; Singh, Rajesh K. (1 August 2019). "Medicinal chemistry of indole derivatives: Current to future therapeutic prospectives". Bioorganic Chemistry. 89: 103021. doi:10.1016/j.bioorg.2019.103021. ISSN 0045-2068. PMID 31176854. S2CID 182950054.
- ^ Jia, Yanshu; Wen, Xiaoyue; Gong, Yufeng; Wang, Xuefeng (15 August 2020). "Current scenario of indole derivatives with potential anti-drug-resistant cancer activity". European Journal of Medicinal Chemistry. 200: 112359. doi:10.1016/j.ejmech.2020.112359. ISSN 0223-5234. PMID 32531682. S2CID 219021072.
- ^ Gribble, G. W. (2000). "Recent developments in indole ring synthesis—methodology and applications". J. Chem. Soc. Perkin Trans. 1 (7): 1045. doi:10.1039/a909834h.
- ^ Cacchi, S.; Fabrizi, G. (2005). "Synthesis and Functionalization of Indoles Through Palladium-catalyzed Reactions". Chem. Rev. 105 (7): 2873–2920. doi:10.1021/cr040639b. PMID 16011327.
- ^ Humphrey, G. R.; Kuethe, J. T. (2006). "Practical Methodologies for the Synthesis of Indoles". Chem. Rev. 106 (7): 2875–2911. doi:10.1021/cr0505270. PMID 16836303.
- ^ Collin, Gerd; Höke, Hartmut. "Indole". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a14_167.
- ^ "Indol NSP" (PDF).
- ^ Bratulescu, George (2008). "A new and efficient one-pot synthesis of indoles". Tetrahedron Letters. 49 (6): 984. doi:10.1016/j.tetlet.2007.12.015.
- ^ Diels, Otto; Reese, Johannes (1934). "Synthesen in der hydroaromatischen Reihe. XX. Über die Anlagerung von Acetylen-dicarbonsäureester an Hydrazobenzol" [Syntheses in the hydroaromatic series. XX. The addition of acetylene dicarboxylic acid ester to hydrazobenzene]. Justus Liebig's Annalen der Chemie. 511: 168. doi:10.1002/jlac.19345110114.
- ^ Huntress, Ernest H.; Bornstein, Joseph; Hearon, William M. (1956). "An Extension of the Diels-Reese Reaction". J. Am. Chem. Soc. 78 (10): 2225. doi:10.1021/ja01591a055.
- ^ Dewick, Paul M. (2013-03-20). Essentials of Organic Chemistry: For Students of Pharmacy, Medicinal Chemistry and Biological Chemistry. John Wiley & Sons. p. 143. ISBN 9781118681961.
- ^ James, P. N.; Snyder, H. R. (1959). "Indole-3-aldehyde". Organic Syntheses. 39: 30. doi:10.15227/orgsyn.039.0030.
- ^ Noland, W. E.; Rush, K. R.; Smith, L. R. (1966). "Nitration of Indoles. IV. The Nitration of 2-Phenylindole". J. Org. Chem. 31: 65–69. doi:10.1021/jo01339a013.
- ^ Heaney, H.; Ley, S. V. (1974). "1-Benzylindole". Organic Syntheses. 54: 58. doi:10.15227/orgsyn.054.0058.
- ^ Bergman, J.; Venemalm, L. (1992). "Efficient synthesis of 2-chloro-, 2-bromo-, and 2-iodoindole". J. Org. Chem. 57 (8): 2495. doi:10.1021/jo00034a058.
- ^ Katritzky, Alan R.; Li, Jianqing; Stevens, Christian V. (1995). "Facile Synthesis of 2-Substituted Indoles and Indolo[3,2-b]carbazoles from 2-(Benzotriazol-1-ylmethyl)indole". J. Org. Chem. 60 (11): 3401–3404. doi:10.1021/jo00116a026.
- ^ Lynch, S. M.; Bur, S. K.; Padwa, A. (2002). "Intramolecular Amidofuran Cycloadditions across an Indole π-Bond: An Efficient Approach to the Aspidosperma and Strychnos ABCE Core". Org. Lett. 4 (26): 4643–5. doi:10.1021/ol027024q. PMID 12489950.
- ^ Cox, E. D.; Cook, J. M. (1995). "The Pictet-Spengler condensation: a new direction for an old reaction". Chemical Reviews. 95 (6): 1797–1842. doi:10.1021/cr00038a004.
- ^ Gremmen, C.; Willemse, B.; Wanner, M. J.; Koomen, G.-J. (2000). "Enantiopure Tetrahydro-β-carbolines via Pictet–Spengler Reactions with N-Sulfinyl Tryptamines". Org. Lett. 2 (13): 1955–1958. doi:10.1021/ol006034t. PMID 10891200.
- ^ Larghi, Enrique L.; Amongero, Marcela; Bracca, Andrea B. J.; Kaufman, Teodoro S. (2005). "The intermolecular Pictet–Spengler condensation with chiral carbonyl derivatives in the stereoselective syntheses of optically-active isoquinoline and indole alkaloids". Arkivoc. RL-1554K (12): 98–153. doi:10.3998/ark.5550190.0006.c09.
- ^ Kaufman, Teodoro S. (2005). "Synthesis of Optically-Active Isoquinoline and Indole Alkaloids Employing the Pictet–Spengler Condensation with Removable Chiral Auxiliaries Bound to Nitrogen". In Vicario, J. L. (ed.). New Methods for the Asymmetric Synthesis of Nitrogen Heterocycles. Thiruvananthapuram: Research SignPost. pp. 99–147. ISBN 978-81-7736-278-7.
- ^ Bonnet, D.; Ganesan, A. (2002). "Solid-Phase Synthesis of Tetrahydro-β-carbolinehydantoins via the N-Acyliminium Pictet–Spengler Reaction and Cyclative Cleavage". J. Comb. Chem. 4 (6): 546–548. doi:10.1021/cc020026h. PMID 12425597.
- ^ Zhu, G.; 장, X.사면체: 비대칭 1998, 9, 2415
일반 참고 자료
- Houlihan, W. J., ed. (1972). Indoles Part One. New York: Wiley Interscience.[ISBN 실종]
- Sundberg, R. J. (1996). Indoles. San Diego: Academic Press. ISBN 978-0-12-676945-6.
- Joule, J. A.; Mills, K. (2000). Heterocyclic Chemistry. Oxford, UK: Blackwell Science. ISBN 978-0-632-05453-4.
- Joule, J. (2000). E. J., Thomas (ed.). Science of Synthesis. Vol. 10. Stuttgart: Thieme. p. 361. ISBN 978-3-13-112241-4.
- Schoenherr, H.; Leighton, J. L. (2012). "Direct and Highly Enantioselective Iso-Pictet-Spengler Reactions with α-Ketoamides: Access to Underexplored Indole Core Structures". Org. Lett. 14 (10): 2610–3. doi:10.1021/ol300922b. PMID 22540677.
외부 링크
- 인돌 합성(최근 방법 개요)
- chemsynthesis.com에서 인돌의 합성 및 특성