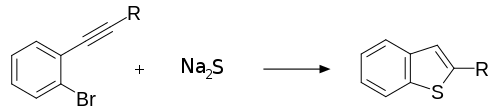벤조티오페네
Benzothiophene | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 1-벤조티오페네 | |
| 기타 이름 벤조[b]티오페인 티아나프테네 벤조티오푸란 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.002.178 |
| EC 번호 |
|
펍켐 CID |
|
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C8H6S | |
| 어금질량 | 134.20 g.20−1 g.20 |
| 외관 | 화이트솔리드 |
| 밀도 | 1.15g/cm3 |
| 녹는점 | 32°C(90°F, 305K) |
| 비등점 | 221 °C(430 °F, 494 K) |
| 위험 | |
| GHS 라벨 표시: | |
  | |
| 경고 | |
| H302, H411 | |
| P264, P270, P273, P301+P312, P330, P391, P501 | |
| 플래시 포인트 | 110°C(230°F, 383K) |
| 관련 화합물 | |
관련 화합물 | 티오페네 인디엔, 벤조푸란, 인도엘레 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
벤조티오페인은 분자식 CHS와86 나프탈렌(모스볼)과 비슷한 냄새가 나는 방향족 유기 화합물이다. 그것은 자연적으로 리그나이트 타르와 같은 석유 관련 침전물의 구성원으로서 발생한다. 벤조티오페네는 가정용이 없다. 벤조[b]티오페인 외에 두 번째 이성질체가 알려져 있다: 벤조[c]티오페인.[3]
벤조티오펜은 연구에서의 사용을 더 크고, 보통은 생물 활동적인 구조의 합성을 위한 시작 재료로 발견한다. 랄록시펜, 질레우톤, 세르타코나졸 등 의약품의 화학구조와 BTCP에서도 발견된다. 티오인디고 등의 염료 제조에도 쓰인다.
합성
대부분의 벤조티오페네의 합성물은 향후 반응의 전조로 대체된 벤조티오페네스를 만든다. 예를 들어 위치 2에서 알킬 대체물로 벤조티오페인을 형성하기 위해 황화나트륨 또는 황화칼륨을 함유한 알킬 대체 알킬 2-브로모벤젠의 반응이 그 예다.[4]
티우레아는 황화 나트륨이나 황화칼륨 대신 시약으로 사용할 수 있다.[5]
금 촉매가 있으면 보다 복잡한 2,3분해 벤조티오페네를 합성할 수 있다.[6]
참조
- ^ 머크 지수, 11판, 9232
- ^ "Thianaphthene". www.sigmaaldrich.com. Sigma Aldrich. Retrieved 12 November 2020.
- ^ Cava, Michael P.; Lakshmikantham, M. V. (1975). "Nonclassical Condensed Thiophenes". Accounts of Chemical Research. 8 (4): 139–44. doi:10.1021/ar50088a005.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Sun, Lei-Lei; Deng, Chen-Liang; Tang, Ri-Yuan; Zhang, Xing-Guo (16 September 2011). "CuI/TMEDA-Catalyzed Annulation of 2-Bromo Alkynylbenzenes with Na2S: Synthesis of Benzo[b]thiophenes". The Journal of Organic Chemistry. American Chemical Society (ACS). 76 (18): 7546–7550. doi:10.1021/jo201081v. ISSN 0022-3263. PMID 21812478.
- ^ Kuhn, Marius; Falk, Florian C.; Paradies, Jan (5 August 2011). "Palladium-Catalyzed C–S Coupling: Access to Thioethers, Benzo[b]thiophenes, and Thieno[3,2-b]thiophenes". Organic Letters. American Chemical Society (ACS). 13 (15): 4100–4103. doi:10.1021/ol2016093. ISSN 1523-7060. PMID 21732682.
- ^ Nakamura, Itaru; Sato, Takuma; Yamamoto, Yoshinori (3 July 2006). "Gold-Catalyzed Intramolecular Carbothiolation of Alkynes: Synthesis of 2,3-Disubstituted Benzothiophenes from (α-Alkoxy Alkyl) (ortho-Alkynyl Phenyl) Sulfides". Angewandte Chemie International Edition. Wiley. 45 (27): 4473–4475. doi:10.1002/anie.200601178. ISSN 1433-7851. PMID 16767784.