사이클로옥타데카노네네
Cyclooctadecanonaene | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 (1Z,3E,5E,7Z,9E,11E,13Z,15E,17E)-사이클로옥타데카-1,3,5,7,9,11,13,15,17-nonaene | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
펍켐 CID | |||
| |||
| |||
| 특성. | |||
| C18H18 | |||
| 어금질량 | 234.3 g·190−1 | ||
| 외관 | 적갈색 결정체 | ||
| 구조[1] | |||
| 단색의 | |||
| P21/n | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
사이클록타데카노나엔 또는 [18]안눌렌은 화학식
18
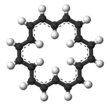
18 CH를 포함한 유기 화합물이다. 에비젠으로 알려진 고농축합물의 종류에 속하며 방향성이 있다. [18]annulene이 가리키는 일반적인 이소체는 가장 안정적인 것으로, 내부 수력발전소 6개와 외부 수력발전소 12개를 포함하고 있으며, 시스·트랜스·트랜스·트랜스·트랜스·트랜스·트랜스·트랜스·트랜스·트랜스 구성에서 9개의 공식 이중결합이 있다. 적갈색 결정 고형분인 것으로 알려졌다.
방향성
특히 [18]안눌렌은 벤젠([6]안눌렌)이 완전 방향성을 가진 후 첫 번째 무효체로서, π체계는 4n + 2 전자(n = 4)를 포함하고 있으며, 내부에 6개의 수소 원자를 편안하게 수용하여 평면형상을 채택할 수 있을 만큼 크므로 후켈의 통치를 만족시킨다. [18]annulene에 대한 방향족 안정화의 발견은 간단한 버전의 발란스 본드 이론이 4n + 2 규칙을 쉽게 설명하지 못했기 때문에 분자 궤도 이론에 기초한 초기 이론적 예측을 확인하는 데 역사적으로 중요하다.
이 화합물의 H NMR은 방향족 링 전류를 가진 시스템의 특징을 나타내며, 외부 하이드로겐의 12H 신호는 9.25ppm이고, 내부 하이드로겐의 6H 신호는 -60°C에서 THF-d의8 놀라운 -2.9ppm으로 공명한다. 반면, 단일 신호는 5.45ppm(두 개별 신호의 가중 평균)으로 120°C에서 관측된다. 이는 해당 온도에서 외부와 내부 수력관의 급속한 교환과 일치한다. [18]annulene의 결합 길이는 단일 탄소-탄소 결합과 이중 탄소 결합 사이에 있으며, 결정적으로 관측된 결합 길이는 138.9 pm(결합 가장자리)과 140.7 pm(결합 가장자리)이다. 이러한 결합 길이는 상당한 소산화를 나타낸다. 탈색증의 호감도는 다시 방향성에 대한 증거로 해석된다. 비교를 위해, 이 값들은 벤젠의 결합 길이 (140 pm)에 가깝다.[1]
수소화 엔탈피에 근거하여 전체 공명 에너지는 37 kcal/mol로 추정되었다.[2] 이것은 벤젠과 거의 같다. 그러나 이 에너지는 6개 대신 18개 원자에 걸쳐 퍼져 있기 때문에 [18]안눌렌은 벤젠보다 더 약한 안정화를 경험한다. 반응성 측면에서 볼 때, 각각 약하게 방향족과 비자동족인 [14]안눌렌과 [10]안눌렌에 비해 공기 및 경량성이 다소 높다. 그럼에도 불구하고, 그것은 다른 폴리엔과 마찬가지로 급속하게 전기영양 첨가 과정을 거치고, [18]안눌렌에 대한 프리델-크래프트 형태의 반응을 일으키려는 시도는 실패했다.[3]
[18]annulene을 18전자의 방향족계통으로 통상적으로 해석함에도 불구하고, 2014년 이론 연구는 [18]annulene은 그 방향성과 연관된 완전히 소산된 π 결합을 3개만 가지고 있다고 생각할 수 있는 반면, 다른 6 π 결합은 변방의 3-중앙 2-전자("3c-2e") π 결합을 나타낸다. 분자의[4]
합성
이 화합물은 프란츠 손드하이머에 의해 처음 합성되었다.[5] 원래 합성은 구리로 디알킨 1,5헥사디엔의 에글린튼 반응에 의해 시작되었다.II) 트리머를 제공하기 위해 피리딘에 아세테이트를 넣은 다음 테르트부탄올에 테르트-산화칼륨으로 감응 및 이소머라이징을 하고 린들러 촉매로 수소 유기 환원법으로 결론을 내렸다.[6]
참고 항목
참조
- ^ a b Jux, Norbert; R. Schleyer, Paul v; Majetich, George; Meyer, Karsten; Hampel, Frank; W. Heinemann, Frank; V. Nizovtsev, Alexey; Lungerich, Dominik (2016). "[18]Annulene put into a new perspective". Chemical Communications. 52 (25): 4710–4713. doi:10.1039/C6CC01309K. PMID 26953607.
- ^ Oth, Jean F. M.; Bünzli, Jean-Claude; De Julien De Zélicourt, Yves (1974-11-06). "The Stabilization Energy of [18] Annulene. A thermochemical determination". Helvetica Chimica Acta. 57 (7): 2276–2288. doi:10.1002/hlca.19740570745. ISSN 0018-019X.
- ^ Sondheimer, F., Wolovsky, R. and Amiel, Y. (1962). "Unsaturated Macrocyclic Compounds. XXIII. The Synthesis of the Fully Conjugated Macrocyclic Polyenes Cyclooctadecanonaene ([18]Annulene), Cyclotetracosadodecaene ([24]Annulene), and Cyclotriacontapentadecaene ([30]Annulene)". J. Am. Chem. Soc. 68 (2): 274–284. doi:10.1021/ja00861a030.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Ivanov, A.; Boldyrev. A (2014). "Deciphering aromaticity in porphyrinoids via adaptive natural density partitioning". Org. Biomol. Chem. 12 (32): 6145–6150. doi:10.1039/C4OB01018C. PMID 25002069.
- ^ 문헌과 일부 인터넷 참조 자료에서 손드하이머는 때때로 샌드하이머로 철자가 틀리기도 한다.
- ^ K. Stöckel and F. Sondheimer (1988). "[18]Annulene". Organic Syntheses.; Collective Volume, vol. 6, p. 68


![Synthesis of [18]annulene](https://upload.wikimedia.org/wikipedia/commons/thumb/4/4b/18_Annulene_Synthesis.svg/788px-18_Annulene_Synthesis.svg.png)


