셀룰로플라스민
Ceruloplasmin| CP | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | CP, CP-2, 셀룰로플라스민(철산화효소), 셀룰로플라스민, AB073614 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 117700 MGI: 88476 HomoloGene: 75 GeneCard: CP | ||||||||||||||||||||||||||||||||||||||||||||||||||
| EC 번호 | 1.16.3.1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
세룰로플라스민(또는 케룰로플라스민)은 사람에게서 CP [5][6][7]유전자에 의해 암호화되는 페록시다아제 효소이다.
세룰로플라스민은 혈중 구리를 운반하는 주요 단백질로 철분 대사에 관여한다.그것은 [8]1948년에 처음 기술되었다.또 다른 단백질인 헤파이스틴은 셀룰로플라스민과의 상동성으로 알려져 있으며 철분 및 아마도 구리 대사에 관여한다.
기능.
Ceruloplasmin(CP)은 간에서 합성되는 효소(EC 1.16.3.1)로 [9]구리의 원자 6개를 포함하고 있다.세룰로플라스민은 건강한 사람의 [10]혈장에서 전체 구리의 95% 이상을 운반합니다.나머지는 매크로글로불린에 의해 설명된다.세룰로플라스민은 구리 의존성 산화효소 활성을 나타내며, 이는 Fe(철)가2+ Fe(철)[11]로3+ 산화될 수 있으므로 철분 상태에서만 철분을 운반할 수 있는 트랜스페린과 관련하여 혈장 내 수송을 돕는다.사람의 셀룰로플라스민의 분자량은 151kDa로 보고되었다.
광범위한 연구에도 불구하고, CP의 정확한 기능에 대해서는 아직 많이 알려져 있지 않지만, 대부분의 기능은 CP가 Cu 중심 존재에 초점을 맞춘 데 기인한다.여기에는 Cu를 간외 조직으로 전달하는 구리 수송, 장액 및 혈장 내 생체아민 수준을 제어하는 아민 산화효소 활성, 혈장 내 산소 및 기타 유리기의 제거, 트랜스페린을 [12]통한 세포로부터의 철분 수출이 포함됩니다.
돌연변이는 구리와 CP의 결합을 방해하고 철 대사를 방해하며 철 과부하를 일으키는 것으로 알려져 있습니다.
셀룰로플라스민은 비교적 큰 효소이다(약 10nm). 크기가 클수록 구리가 운반되는 동안 사람의 소변에서 손실되는 것을 방지할 수 있다.
활성 사이트 구조
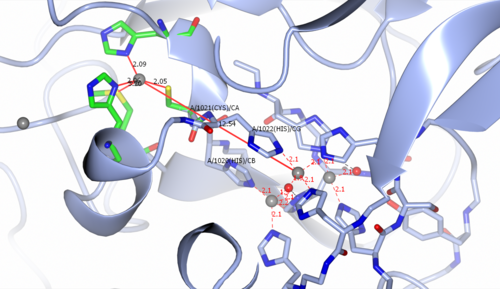
CP의 멀티코퍼 활성 부위에는 타입 I(T1) 단핵[12] 구리 중심부가 12-13Ω 떨어져 있습니다(그림 2 참조).3핵 중심은 2개의 타입 III(T3) 동전과 1개의 타입 II(T2) 동이온으로 구성됩니다.두 개의 T3 구리 이온은 수산화 배위자에 의해 브리징되며, 다른 수산화 배위자는 T2 구리 이온을 단백질에 연결합니다.삼핵 중심은 2개의 히스티딘(His1020, His1022) 잔류물과 1개의 Cys(1021) 잔류물로 브리지됩니다.기질은 T1 중심 부근에 결합하고 T12+ Cu 이온에 의해 산화되어 환원된+ Cu 산화 상태를 형성한다.그런 다음 환원된+ T1 Cu는 1개의 Cys와 2개의 His 브리징 잔류물을 통해 전자를 3핵 구리 중심으로 전달합니다.기판에서 구리 중심으로 4개의 전자가 전달된 후, O는2 삼핵 중심에서 결합하고 4개의 전자 환원을 거쳐 2개의 물 [12]분자를 형성한다.
규정
GAIT 요소라고 불리는 시스 조절 요소는 Ceruloplasmin [13]전사체의 선택적 변환 소음에 관여합니다.사일런싱은 IFN-감마 활성화 번역 억제제(GAIT)라고 불리는 세포질 억제제 복합체의 [14]GAIT 요소와의 결합을 필요로 한다.
임상적 의의
다른 혈장 단백질과 마찬가지로, 합성 능력의 감소로 인해 간 질환 환자의 수치가 떨어집니다.
셀룰로플라스민 수치가 낮은 메커니즘:
- 유전자 발현 저하(아세룰로플라스민혈증)
- 구리 수준은 일반적으로 낮습니다.
- 구리는 ATP7A 결핍으로 인해 장 장벽을 넘지 않습니다(멘크스병, 후두엽 뿔 증후군).
- 간세포에는 ATP7B(윌슨병)가 없기 때문에 ER-Golgi 네트워크의 내강으로 구리가 전달되지 않는다.
구리의 가용성은 초기 단백질의 번역에는 영향을 주지 않습니다.그러나 구리가 없는 아포엔자임은 불안정하다.아포세룰로플라스민은 간세포 내에서 크게 분해되며, 방출되는 소량은 홀로세룰로플라스민의 5.5일에 비해 순환 반감기가 5시간으로 짧다.
세룰로플라스민은 혈액 [15]검사를 통해 측정될 수 있다; 이것은 면역측정법을 사용하여 측정될 수 있다.샘플은 회전 및 분리되며, 섭씨 4°C 전후로 3일간 보관됩니다.이 검사는 윌슨병의 징후가 있는지 확인하기 위한 것입니다.할 수 있는 또 다른 검사는 소변 구리 농도 검사이다; 이것은 혈액 검사보다 덜 정확한 것으로 밝혀졌다.간 조직 검사도 할 수 있습니다.
매우 드문 세룰로플라스민 유전자(CP)의 돌연변이는 철분 과부하 고페리틴혈증을 특징으로 하는 유전병 아세룰로플라스민혈증으로 이어질 수 있다.뇌에서, 이러한 철분 과다는 소뇌 운동실조증, 진행성 치매, 추체외 신호와 같은 특징적인 신경학적 징후와 증상을 초래할 수 있습니다.과도한 철분은 간, 췌장, 망막에 축적되어 각각 간경변, 내분비 이상, 시력 상실로 이어질 수 있다.
부족.
세룰로플라스민 수치가 정상보다 낮을 경우 다음을 나타낼 수 있습니다.
- 윌슨병(희귀한 [영국 발병률 2/10,000][16] 구리 저장병).
- 멘크스병(멘크스 꼬임머리 증후군)(희소 – 영국 발병률 1/100,000)
- 구리 결핍
- 아세룰로플라스민혈증[17]
- 아연 독성
초과
정상보다 높은 세룰로플라스민 수치는 다음을 나타내거나 확인할 수 있습니다.
- 구리 독성/아연 결핍증
- 임신.
- 경구 피임약[18] 사용
- 림프종
- 급성 및 만성 염증(급성상 반응물질)
- 류마티스 관절염
- 협심증[19]
- 알츠하이머 병[20]
- 정신 분열증[21]
- Obsessive-compulsive 장애[22]
기준 범위
세룰로 프라 스민 인간에게 일반 혈액 농도는 20–50 mg/dL.
참조
- ^ a b c GRCh38:Ensembl 방출 89:ENSG00000047457-Ensembl, 5월 2017년.
- ^ a b c GRCm38:Ensembl 방출 89:ENSMUSG00000003617-Ensembl, 5월 2017년.
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Takahashi N, Ortel TL, Putnam FW (Jan 1984). "Single-chain structure of human ceruloplasmin: the complete amino acid sequence of the whole molecule". Proceedings of the National Academy of Sciences of the United States of America. 81 (2): 390–4. doi:10.1073/pnas.81.2.390. PMC 344682. PMID 6582496.
- ^ Koschinsky ML, Funk WD, van Oost BA, MacGillivray RT (Jul 1986). "Complete cDNA sequence of human preceruloplasmin". Proceedings of the National Academy of Sciences of the United States of America. 83 (14): 5086–90. doi:10.1073/pnas.83.14.5086. PMC 323895. PMID 2873574.
- ^ Royle NJ, Irwin DM, Koschinsky ML, MacGillivray RT, Hamerton JL (May 1987). "Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively". Somatic Cell and Molecular Genetics. 13 (3): 285–92. doi:10.1007/BF01535211. PMID 3474786. S2CID 45686258.
- ^ Holmberg CG, Laurell CB (1948). "Investigations in serum copper. II. Isolation of the Copper containing protein, and a description of its properties". Acta Chem Scand. 2: 550–56. doi:10.3891/acta.chem.scand.02-0550.
- ^ O'Brien PJ, Bruce WR (2009). Endogenous Toxins: Targets for Disease Treatment and Prevention, 2 Volume Set. John Wiley & Sons. pp. 405–6. ISBN 978-3-527-32363-0.
- ^ Hellman NE, Gitlin JD (2002). "Ceruloplasmin metabolism and function". Annual Review of Nutrition. 22: 439–58. doi:10.1146/annurev.nutr.22.012502.114457. PMID 12055353.
- ^ Song D, Dunaief JL (2013). "Retinal iron homeostasis in health and disease". Frontiers in Aging Neuroscience. 5: 24. doi:10.3389/fnagi.2013.00024. PMC 3695389. PMID 23825457.
- ^ a b c Bertini, Ivano (2007). Biological Inorganic Chemistry. California, USA: University Science Books. pp. 426–442. ISBN 1-891389-43-2.
- ^ Sampath P, Mazumder B, Seshadri V, Fox PL (Mar 2003). "Transcript-selective translational silencing by gamma interferon is directed by a novel structural element in the ceruloplasmin mRNA 3' untranslated region". Molecular and Cellular Biology. 23 (5): 1509–19. doi:10.1128/MCB.23.5.1509-1519.2003. PMC 151701. PMID 12588972.
- ^ Mazumder B, Sampath P, Fox PL (Oct 2005). "Regulation of macrophage ceruloplasmin gene expression: one paradigm of 3'-UTR-mediated translational control". Molecules and Cells. 20 (2): 167–72. PMID 16267389.
- ^ "Ceruloplasmin Test: MedlinePlus Medical Test". medlineplus.gov. Retrieved 2021-12-10.
- ^ Scheinberg IH, Gitlin D (Oct 1952). "Deficiency of ceruloplasmin in patients with hepatolenticular degeneration (Wilson's disease)". Science. 116 (3018): 484–5. doi:10.1126/science.116.3018.484. PMID 12994898.
- ^ Gitlin JD (Sep 1998). "Aceruloplasminemia". Pediatric Research. 44 (3): 271–6. doi:10.1203/00006450-199809000-00001. PMID 9727700.
- ^ Elkassabany NM, Meny GM, Doria RR, Marcucci C (Apr 2008). "Green plasma-revisited". Anesthesiology. 108 (4): 764–5. doi:10.1097/ALN.0b013e3181672668. PMID 18362615.
- ^ Ziakas A, Gavrilidis S, Souliou E, Giannoglou G, Stiliadis I, Karvounis H, Efthimiadis G, Mochlas S, Vayona MA, Hatzitolios A, Savopoulos C, Pidonia I, Parharidis G (2009). "Ceruloplasmin is a better predictor of the long-term prognosis compared with fibrinogen, CRP, and IL-6 in patients with severe unstable angina". Angiology. 60 (1): 50–9. doi:10.1177/0003319708314249. PMID 18388036. S2CID 843454.
- ^ Lutsenko S, Gupta A, Burkhead JL, Zuzel V (Aug 2008). "Cellular multitasking: the dual role of human Cu-ATPases in cofactor delivery and intracellular copper balance". Archives of Biochemistry and Biophysics. 476 (1): 22–32. doi:10.1016/j.abb.2008.05.005. PMC 2556376. PMID 18534184.
- ^ Wolf TL, Kotun J, Meador-Woodruff JH (Sep 2006). "Plasma copper, iron, ceruloplasmin and ferroxidase activity in schizophrenia". Schizophrenia Research. 86 (1–3): 167–71. doi:10.1016/j.schres.2006.05.027. PMID 16842975. S2CID 38267889.
- ^ Virit O, Selek S, Bulut M, Savas HA, Celik H, Erel O, Herken H (2008). "High ceruloplasmin levels are associated with obsessive compulsive disorder: a case control study". Behavioral and Brain Functions. 4: 52. doi:10.1186/1744-9081-4-52. PMC 2596773. PMID 19017404.
읽고 추가
- Hellman NE, Gitlin JD (2002). "Ceruloplasmin metabolism and function". Annual Review of Nutrition. 22: 439–58. doi:10.1146/annurev.nutr.22.012502.114457. PMID 12055353.
- Mazumder B, Seshadri V, Fox PL (Feb 2003). "Translational control by the 3'-UTR: the ends specify the means". Trends in Biochemical Sciences. 28 (2): 91–8. doi:10.1016/S0968-0004(03)00002-1. PMID 12575997.
- Giurgea N, Constantinescu MI, Stanciu R, Suciu S, Muresan A (Feb 2005). "Ceruloplasmin - acute-phase reactant or endogenous antioxidant? The case of cardiovascular disease". Medical Science Monitor. 11 (2): RA48-51. PMID 15668644.
- Kingston IB, Kingston BL, Putnam FW (Dec 1977). "Chemical evidence that proteolytic cleavage causes the heterogeneity present in human ceruloplasmin preparations". Proceedings of the National Academy of Sciences of the United States of America. 74 (12): 5377–81. doi:10.1073/pnas.74.12.5377. PMC 431726. PMID 146197.
- Polosatov MV, Klimov PK, Masevich CG, Samartsev MA, Wünsch E (Apr 1979). "Interaction of synthetic human big gastrin with blood proteins of man and animals". Acta Hepato-Gastroenterologica. 26 (2): 154–9. PMID 463490.
- Schilsky ML, Stockert RJ, Pollard JW (Dec 1992). "Caeruloplasmin biosynthesis by the human uterus". The Biochemical Journal. 288 (2): 657–61. doi:10.1042/bj2880657. PMC 1132061. PMID 1463466.
- Walker FJ, Fay PJ (Feb 1990). "Characterization of an interaction between protein C and ceruloplasmin". The Journal of Biological Chemistry. 265 (4): 1834–6. doi:10.1016/S0021-9258(19)39903-X. PMID 2105310.
- Fleming RE, Gitlin JD (May 1990). "Primary structure of rat ceruloplasmin and analysis of tissue-specific gene expression during development". The Journal of Biological Chemistry. 265 (13): 7701–7. doi:10.1016/S0021-9258(19)39171-9. PMID 2332446.
- Yang FM, Friedrichs WE, Cupples RL, Bonifacio MJ, Sanford JA, Horton WA, Bowman BH (Jun 1990). "Human ceruloplasmin. Tissue-specific expression of transcripts produced by alternative splicing". The Journal of Biological Chemistry. 265 (18): 10780–5. doi:10.1016/S0021-9258(18)87015-6. PMID 2355023.
- Yang F, Naylor SL, Lum JB, Cutshaw S, McCombs JL, Naberhaus KH, McGill JR, Adrian GS, Moore CM, Barnett DR (May 1986). "Characterization, mapping, and expression of the human ceruloplasmin gene". Proceedings of the National Academy of Sciences of the United States of America. 83 (10): 3257–61. doi:10.1073/pnas.83.10.3257. PMC 323492. PMID 3486416.
- Mercer JF, Grimes A (Jul 1986). "Isolation of a human ceruloplasmin cDNA clone that includes the N-terminal leader sequence". FEBS Letters. 203 (2): 185–90. doi:10.1016/0014-5793(86)80739-6. PMID 3755405. S2CID 23472934.
- Rask L, Valtersson C, Anundi H, Kvist S, Eriksson U, Dallner G, Peterson PA (Jan 1983). "Subcellular localization in normal and vitamin A-deficient rat liver of vitamin A serum transport proteins, albumin, ceruloplasmin and class I major histocompatibility antigens". Experimental Cell Research. 143 (1): 91–102. doi:10.1016/0014-4827(83)90112-X. PMID 6337857.
- Kressner MS, Stockert RJ, Morell AG, Sternlieb I (1984). "Origins of biliary copper". Hepatology. 4 (5): 867–70. doi:10.1002/hep.1840040512. PMID 6479854. S2CID 43824397.
- Takahashi N, Bauman RA, Ortel TL, Dwulet FE, Wang CC, Putnam FW (Jan 1983). "Internal triplication in the structure of human ceruloplasmin". Proceedings of the National Academy of Sciences of the United States of America. 80 (1): 115–9. doi:10.1073/pnas.80.1.115. PMC 393320. PMID 6571985.
- Dwulet FE, Putnam FW (Feb 1981). "Complete amino acid sequence of a 50,000-dalton fragment of human ceruloplasmin". Proceedings of the National Academy of Sciences of the United States of America. 78 (2): 790–4. doi:10.1073/pnas.78.2.790. PMC 319888. PMID 6940148.
- Kingston IB, Kingston BL, Putnam FW (Apr 1980). "Primary structure of a histidine-rich proteolytic fragment of human ceruloplasmin. I. Amino acid sequence of the cyanogen bromide peptides". The Journal of Biological Chemistry. 255 (7): 2878–85. doi:10.1016/S0021-9258(19)85822-2. PMID 6987229.
외부 링크
- Aceruloplasminemia에 대한 GeneReviews/NCBI/NIH/UW 엔트리
- Aceruloplasminemia에 대한 OMIM 엔트리
- PDB for UniProt: P00450(Human Ceruloplasmin)에서 PDBe-KB에서 사용할 수 있는 모든 구조 정보의 개요.