RU2043361C1 - Способ получения производных 2'-дезокси-2'-фторрибонуклеозидов или их фармацевтически приемлемых солей - Google Patents
Способ получения производных 2'-дезокси-2'-фторрибонуклеозидов или их фармацевтически приемлемых солей Download PDFInfo
- Publication number
- RU2043361C1 RU2043361C1 SU904831211A SU4831211A RU2043361C1 RU 2043361 C1 RU2043361 C1 RU 2043361C1 SU 904831211 A SU904831211 A SU 904831211A SU 4831211 A SU4831211 A SU 4831211A RU 2043361 C1 RU2043361 C1 RU 2043361C1
- Authority
- RU
- Russia
- Prior art keywords
- deoxy
- fluoro
- ribofuranosyl
- purine
- group
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/173—Purine radicals with 2-deoxyribosyl as the saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/20—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Macromolecular Compounds Obtained By Forming Nitrogen-Containing Linkages In General (AREA)
- Local Oxidation Of Silicon (AREA)
- Element Separation (AREA)
Abstract
Использование: в качестве соединения, обладающего противоинфекционной активностью. Сущность: продукт-производные 2'-дезокси-2'-фторрибонуклеозиды ф-лы I или их фармацевтически приемлемые соли, где Y-H, NH2, X-NR3R4, где R3 и R4 оба или порознь-Н, C1-C6 -алкил, C2-C6 -алкенил, C3-C7 -циклоалкил X-Z-R5 где Z-0, S R5=R3 или X-О,Н, R1 и R2 оба или порознь ОН, -OCOR6H где R6 алкил C1-C6 -OR6H или -OCOCHR9NR10R11 где R10 и R11-H н. или изо- C1-C6 -алкил, R9-H н. или изо C1-C4 -алкил, или R1 и R2 моно-,ди- или трифосфатная сложноэфирная группа, исключая случай, когда R1 и R2 каждый ОН, или R1 -моно-, ди- или трифосфатная 5′ -сложноэфирная группа, и/или а) X-OH, Y-NH2, или б) X-NH2, Y-Н. Реагент 1: пуриновое основание PuH, где Pu соединение ф-лы Pu ,а X и Y указано выше или его соль. Реагент 2: соединение ф-лы II , где R и R указано выше, W-пурин или пиримидин, отличный от Pu, после чего проводят превращение групп R1 и R2-OH в другую группу, или R1 и R2 в группу ОН. 5 з.п.ф-лы, 2 табл.
Description
Изобретение относится к химическим соединениям, обладающим противоинфекционной активностью, к способам их получения, к содержащим их композициям и их применению, в частности, для лечения вызванных паразитами и вирусами заболеваний. Более конкретно, изобретение относится к 2'-дезокси-2'-фторрибонуклеозидам и их производным.
В области противовирусной химиотерапии известно немного лекарств, способных бороться с вирусом как таковым, что связано трудностью борьбы с вирусом при одновременном отсутствии повреждения пораженных вирусом клетки-хозяина. Недавно установлено, что отдельные стадии в жизненном цикле, варьирующиеся от вида к виду, определяются самим вирусом. Однако, вследствие большой схожести в функционировании вируса и клеток-хозяев, эффективное воздействие, как доказано, с трудом поддается определению.
Одну группу вирусных патогенов, поражающих человека с древних времен и принесших смерть многим миллионам за многие века, образуют вирусы гриппа. Эти вирусы, в особенности вирусы гриппа А и В остаются одной из основных причин возникновения острых респираторных заболеваний во всем мире и в настоящее время.
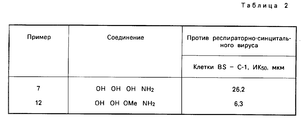
Виpусы гриппа принадлежат к семейству вирусов с отрицательным тяжем Orthomyxoviridae. Другим вирусом с отрицательным тяжем, оказывающим важное влияние на здоровье, является респираторно-синцитальный вирус (РСВ), принадлежащий к роду пневмовирусов семейства Paramyxoviridae. РСВ является основной причиной заболевания нижнего дыхательного тракта в младенчестве и детстве.
Фторированные нуклеозиды ранее предложены для лечения вирусных и вызываемых паразитами заболеваний. Например, в заявке на Европейский патент 0287313 описаны 2',3'-дидезоксинуклеозиды, замещенные в 2'-положении фтором и предназначенные для борьбы с вирусом иммунодефицита человека. В заявке не Европейский патент 0219829 описаны 2"-дезокси-2'-фтор-β -D-арабинофуранозильные нуклеозиды, предназначенные для применения в качестве противопаразитных средств, в особенности против лейшманиоза. Способы получения определенных 2'-фтор-2'-дезоксирибонуклеозидов описаны Vesu-Qi и др. (Nucleosides and Nucleotides 2, 373-, 1983) и Ikehara и др. (Chem.Pharm.Bull. 29, 1034-, 1981).
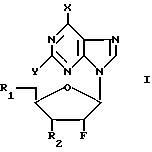
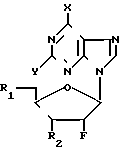
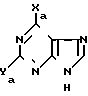
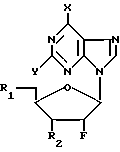
Нами найдено, что соединения формулы (I) и их фармацевтически приемлемые слои являются противоинфекционными средствами, в особенности по отношению к вирусам. К примеру, соединения формулы (I) проявляют активность против роста гриппа, в частности, гриппа А и В и РСВ-инфекций, а также по отношению к некоторым простейшим, например: Trichomonas vaginalis и Giardia lamblia. В формуле (I)
Y-H или NH2, Х представляет группу NR3R4, где R3 и R4 могут быть одинаковыми или различными, и каждый представляет водород, С1-С6-алкил, С2-С6-алкенил, С3-С7-циклоалкил, каждая из групп возможно замещена одним или несколькими атомами галогена, или же Х представляет группу Z-R5, где Z кислород или сера и R5 принимает значения, указанные для R3, или же Х галоген или водород, R1 и R2, которые могут быть одинаковыми или различными, каждый представляет гидроксил, группу -OCOR6H, где R6 двухвалентная группа, представленная нормальным или разветвленным С2-С6-алкиленом, С2-С6-алкениленом или С3-С7-циклоалкиленом, каждый из которых возможно замещен одним или несколькими гидроксилами, группу -OCO2R7, где R7 ковалентная связь или принимает значения, указанные для R6, группу -OCOR6-COOR6, где R6 принимает вышеуказанные значения и R8 выбирают из: водорода, нормального или разветвленного С1-С6-алкила или С1-С6-алкенила, каждый из которых возможно замещен одним или несколькими гидроксилами, группу -OCOR7-Z-Ar, где R7 принимает вышеуказанные значения, Z- ковалентная связь или кислород и Ar-ароматический цикл, например: моноциклический арил (например фенил) или гетероарил (например, пиридин) незамещенный или замещенный одним или несколькими атомами галогена, С1-С6-алкилами или С1-С6-алкилоксигруппами, группу -OR6H, где R6 принимает вышеуказанные значения, группу -OR6-Z-Ar, где R6, Z и Ar принимают вышеуказанные значения, группу -OCOCHR9NR10R11, где R10 и R11 принимают значения, указанные для R8 и R9 представляет водород, нормальный или разветвленный С1-С4-алкил, возможно замещенный одним или несколькими гидроксилами, меркаптогруппами, C1-C3-алкоксигруппами или С1-С3-алкилтиогруппами, группу R12-A, где R12 C1-C4-алкилен, возможно замещенный одним или несколькими гидроксилами, и А 4-П-тичленный ароматическая или неароматическая циклическая или гетероциклическая система, содержащая 3-10 атомов углерода и 0,1,2 или 3 атома азота в цикле, атомы углерода и/или азота в цикле возможно замещены одним или несколькими гидроксилами, группу -OCO-R13, где R13 4-7-мичленный гетероцикл, содержащий 3-6 атомов углерода и 0,1 или 2 атома азота, атомы углерода и/или азота в цикле возможно замещены одним или несколькими гидроксилами, моно- или трифосфатную эфирную группу.
Y-H или NH2, Х представляет группу NR3R4, где R3 и R4 могут быть одинаковыми или различными, и каждый представляет водород, С1-С6-алкил, С2-С6-алкенил, С3-С7-циклоалкил, каждая из групп возможно замещена одним или несколькими атомами галогена, или же Х представляет группу Z-R5, где Z кислород или сера и R5 принимает значения, указанные для R3, или же Х галоген или водород, R1 и R2, которые могут быть одинаковыми или различными, каждый представляет гидроксил, группу -OCOR6H, где R6 двухвалентная группа, представленная нормальным или разветвленным С2-С6-алкиленом, С2-С6-алкениленом или С3-С7-циклоалкиленом, каждый из которых возможно замещен одним или несколькими гидроксилами, группу -OCO2R7, где R7 ковалентная связь или принимает значения, указанные для R6, группу -OCOR6-COOR6, где R6 принимает вышеуказанные значения и R8 выбирают из: водорода, нормального или разветвленного С1-С6-алкила или С1-С6-алкенила, каждый из которых возможно замещен одним или несколькими гидроксилами, группу -OCOR7-Z-Ar, где R7 принимает вышеуказанные значения, Z- ковалентная связь или кислород и Ar-ароматический цикл, например: моноциклический арил (например фенил) или гетероарил (например, пиридин) незамещенный или замещенный одним или несколькими атомами галогена, С1-С6-алкилами или С1-С6-алкилоксигруппами, группу -OR6H, где R6 принимает вышеуказанные значения, группу -OR6-Z-Ar, где R6, Z и Ar принимают вышеуказанные значения, группу -OCOCHR9NR10R11, где R10 и R11 принимают значения, указанные для R8 и R9 представляет водород, нормальный или разветвленный С1-С4-алкил, возможно замещенный одним или несколькими гидроксилами, меркаптогруппами, C1-C3-алкоксигруппами или С1-С3-алкилтиогруппами, группу R12-A, где R12 C1-C4-алкилен, возможно замещенный одним или несколькими гидроксилами, и А 4-П-тичленный ароматическая или неароматическая циклическая или гетероциклическая система, содержащая 3-10 атомов углерода и 0,1,2 или 3 атома азота в цикле, атомы углерода и/или азота в цикле возможно замещены одним или несколькими гидроксилами, группу -OCO-R13, где R13 4-7-мичленный гетероцикл, содержащий 3-6 атомов углерода и 0,1 или 2 атома азота, атомы углерода и/или азота в цикле возможно замещены одним или несколькими гидроксилами, моно- или трифосфатную эфирную группу.
Изобретение, кроме того, включает соединения формулы (I) и их соли, предназначенные для использования в медицинской практике.
Рекомендуемые сложноэфирные группы формул: -OCOCHR9-NR10R11 и -OCO-R13 включают сложные эфиры природных α-аминокислот, охватываемые вышеприведенным определением. Особенно рекомендуется сложноэфирная группа формулы -OCOCHR9NR10R11, в которой R9 C1-C4-алкил, а R10 и R11 оба водорода, например: валин или аланин.
Необходимо указать, что соединения формулы (I) могут существовать в различных таутомерных формах, и когда Х-группа ОН, тогда Х может также представлять оксо-группу. Соединения формулы (I) могут также существовать в α или β-аномерных формах. Изобретение таким образом включает в свой объем каждый из индивидуальных α и β-аномеров и их смеси.
Соединения формулы (I) и их фармацевтически приемлемые соли далее называются соединениями изобретения. Термин "активный компонент" в применяемом здесь значении относится к соединению изобретения, если из контекста не следует что-то иное.
Активность активных компонентов по отношению к группе А и В ранее не была известна, и настоящим изобретением также даются фармацевтические составы, содержащие соединение формулы (I) или его фармацевтически приемлемую соль, особенно пригодные для ингибирования развития гриппа А и В у животных и человека. Таким образом, нами даются твердые составы, содержащие активный компонент и твердый носитель, или состав для ингаляций, содержащий активный компонент и текущий носитель для ингаляций.
Изобретение, кроме того, включает:
(а) способ лечения или профилактики вирусной инфекции, в частности, гриппа или РСВ-инфекции, или вызванной простейшими инфекции, к примеру: Trichomonas vaginalis или Giardia lamblia, в организме хозяина, например млекопитающего, в том числе и человека и мышей, заключающийся в введении млекопитающему эффективного нетоксичного количества соединения изобретения.
(а) способ лечения или профилактики вирусной инфекции, в частности, гриппа или РСВ-инфекции, или вызванной простейшими инфекции, к примеру: Trichomonas vaginalis или Giardia lamblia, в организме хозяина, например млекопитающего, в том числе и человека и мышей, заключающийся в введении млекопитающему эффективного нетоксичного количества соединения изобретения.
(b) применение соединения изобретения для приготовления медикаментов, предназначенных для лечения или профилактики инфекций, включая вирусные инфекции, в частности, вызванные вирусом гриппа или РСВ-инфекции, или вызванной простейшими инфекции, например: Trichomonas vaginalis и Giardia lamblia.
Некоторые соединения формулы (I) и их соли являются новыми соединениями, и такие новые соединения и соли составляют еще один аспект изобретения. К новым соединениям относится соединения формулы (I) согласно вышеприведенному определению за исключением тех, в которых R1 и R2 каждый гидроксил или R1 моно-, ди- или трифосфатный 5'-эфир, а R2 гидроксил, или R1 гидроксил, а R2 моно-, ди- или трифосфатный 3'-эфир и либо (а) Х=ОН и Y=NH2, либо (b) Х=NH2 и Y=H.
Предпочтительные соединения изобретения включают те соединения, в которых R1 и R2 либо оба ОН, либо R1 монофосфат, а R2 ОН, Y=Н или NH2 и Х группа-, -NR3R4, где R3 и R4, которые могут быть одинаковыми или различными, представлены водородом, С1-С6-алкилом, или Х группа Z-R5, где Z 0 или S и R5 C1-C6-алкил, или Х галоген или водород.
Особенно рекомендуемые соединения формулы (I) включают соединения, в которых R1 и R2 оба ОН, Y NH2 и Х=Н, ОН, NH2 или Z-R5, где Z 0 и R5 С1-С6-алкил.
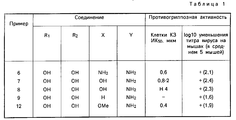
Примеры особенно рекомендуемых соединений формулы (I) включают:
(I) 2,6-Диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9H-пурин.
(I) 2,6-Диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9H-пурин.
(2) 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
(3) 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин.
(4) 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-метокси-9Н-пурин.
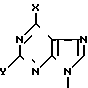
Изобретение, кроме того, включает способ получения новых соединений формулы (I) и их фармацевтически приемлемых солей, который заключается либо в: (А) реакции пуринового основания формулы PuH, где Pu представляет пуриновый остаток формулы:
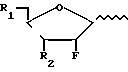
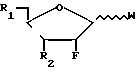
(Pu) где X и Y принимают вышеуказанные значения, или его соли с соединением формулы (II)
где R1 и R2 принимают вышеуказанные значения и W представляет фосфатный эфир или его соль, или пуриновый или пиримидиновый фрагмент (отличный от Pu), с образованием соединения формулы (I), либо (В) реакции соединения формулы (III)
(где Ха, Ya, RIa и R2a принимают значения, указанные соответственно для Х,Y,R1 и R2, или их предшественники, например, защищенные формы этих групп при условии, что, по меньшей мере, одна из групп Х,Y,R1 и R2 представлена в виде предшественника) со средством, служащим превращению группы предшественницы в целевую группу,
(I) реакции соединения формулы (I), в котором по меньшей мере, одна из групп R1 и R2-гидроксил, с соответствующим средством, служащим превращению гидроксила в альтернативную группу, представленную группой R1 и/или R2.
(Pu) где X и Y принимают вышеуказанные значения, или его соли с соединением формулы (II)
где R1 и R2 принимают вышеуказанные значения и W представляет фосфатный эфир или его соль, или пуриновый или пиримидиновый фрагмент (отличный от Pu), с образованием соединения формулы (I), либо (В) реакции соединения формулы (III)
(где Ха, Ya, RIa и R2a принимают значения, указанные соответственно для Х,Y,R1 и R2, или их предшественники, например, защищенные формы этих групп при условии, что, по меньшей мере, одна из групп Х,Y,R1 и R2 представлена в виде предшественника) со средством, служащим превращению группы предшественницы в целевую группу,
(I) реакции соединения формулы (I), в котором по меньшей мере, одна из групп R1 и R2-гидроксил, с соответствующим средством, служащим превращению гидроксила в альтернативную группу, представленную группой R1 и/или R2.
(II) реакции соединения формулы (I), в котором R1 и/или R2 отличен от гидроксила, со средством, служащим превращению R1 и/или R2 в гидроксил.
Способ (А), который особенно пригоден и для получения соединений формулы (I), где R1 и R2 обa гидроксил, Y=H или NH2, может быть проведен ферментивно реакцией пуринового основания формулы PuH, где Х и Y принимают вышеуказанные значения, или его соли с соединением формулы (II)
где R1 и R2 принимают вышеуказанные значения и W представляет фосфатный эфир или его соль, или пуриновый или пирипидиновый фрагмент (отличный от Pu) в присутствии по меньшей мере одного фермента фосфорилазы, такого как: фосфорилаза пуринового нуклеозида и фосфорилаза тимидина и неорганического фосфата или его соли, или фермента трансферазы, например, N-дезоксирибозильной трансферазы. Для осуществления указанной реакции рекомендуется, чтобы пуриновый или пиримидиновый фрагмент находился в β-положении, фосфатный эфир или его соль в α-положении.
где R1 и R2 принимают вышеуказанные значения и W представляет фосфатный эфир или его соль, или пуриновый или пирипидиновый фрагмент (отличный от Pu) в присутствии по меньшей мере одного фермента фосфорилазы, такого как: фосфорилаза пуринового нуклеозида и фосфорилаза тимидина и неорганического фосфата или его соли, или фермента трансферазы, например, N-дезоксирибозильной трансферазы. Для осуществления указанной реакции рекомендуется, чтобы пуриновый или пиримидиновый фрагмент находился в β-положении, фосфатный эфир или его соль в α-положении.
Соответствующие пуриновые основания формулы PuН являются продажными продуктами, например, производства Пасифик Кемикл Лаборэториз или Сигма Кемикл Компэни, или могут быть синтезированы обычными методами, хорошо известными специалисту или которые могут быть легко найдены в литературе. К примеру, пуриновые основания, в которых 2-заместитель аминогруппа или водород и 6-заместитель аминогруппа или метилтиогруппа, являются продажными продуктами. Пурины, в которых 2-заместитель аминогруппа, а 6-заместитель метил-аминогруппа, могут быть получены методом Montgomery и Holum (I.A.C.S 80, 404, 1958). Пурины, в которых 2-заместитель аминогруппа и 6-заместитель алкоксигруппа, могут быть синтезированы по методике, описанной Balsiger и Montgomery (J.Org.Chem.20, 1573, 1960).
Соединения формулы (II) могут быть получены методами, хорошо известными специалисту или могут быть легко найдены в литературе. К примеру 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил может быть получен по методике, описанной Codington и др. (J.Org.Chem. 29, 558, 1964). 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин может быть получен по методике, описанной S.Vesugi и др. (Nucleoside and Nucleotids 2, 373-, 1983).
Что касается способа (В), который особенно применим для получения соединений формулы (I) из соединений формулы (III), где R1a и R2a оба гидроксил, то защищенные группы Xa, Ya, R1a и R2a в соединениях формулы (III) могут быть защищены обычными защищающими аминогруппу или гидроксил группами, такими как ацил, например аралкил, например бензил или триалкилсилил, такой как трет-бутилдиметилсилил, при этом конкретный тип защитной группы зависит от природы защищаемой группы.
Защитные группы могут быть затем удалены кислотным или щелочным гидролизом, гидрогенолизом или ферментивно. Ацильные группы обычно удаляют щелочным гидролизом, а сильные группы кислотным гидролизом или в присутствии фторид иона. Аралкильные группы, такие как бензил предпочтительно удаляют каталитическим гидрогеногенолизом, обычно в присутствии катализатора, такого как палладий на угле или восстановлением, например, щелочным металлом (например натрием) в приемлемом растворителе, таком как жидкий аммиак. Найдено, что применение бензильной защитной группы особенно предпочтительно для получения соединений формулы (I), в которых Х гидроксил или аминогруппа. группами, такими как ацил, например аралкил, например бензил или триалкилсилил, такой как трет-бутилдиметилсилил, при этом конкретный тип защитной группы зависит от природы защищаемой группы.
Защитные группы могут быть затем удалены кислотным или щелочным гидролизом, гидрогенолизом или ферментивно. Ацильные группы обычно удаляют щелочным гидролизом, а сильные группы кислотным гидролизом или в присутствии фторид иона. Аралкильные группы, такие как бензил предпочтительно удаляют каталитическим гидрогеногенолизом, обычно в присутствии катализатора, такого как палладий на угле или восстановлением, например, щелочным металлом (например натрием) в приемлемом растворителе, таком как жидкий аммиак. Найдено, что применение бензильной защитной группы особенно предпочтительно для получения соединений формулы (I), в которых Х гидроксил или аминогруппа.
Для получения соединения формулы (I), где R1 и/или R2 представляет группу -OCOCHR9NR10R11, способом (В) группы R1a и/или R2a могут быть защищены, например: 9-фторенилметилоксикарбонилом (ФМОК), трет-бутилоксикарбонилом (t-БОК) или карбобензилоксигруппой (КБЗ) с последующим удалением защитной группы обычными средствами и получением аноминокислоты CHR9NR10R11.
Исходные соединения формулы (III) могут быть легко получены реакцией соответствующего пуринового основания формулы (IV)
где Ха и Ya принимают вышеуказанные значения, или его соли с пиримидиновым нуклеозидом, содержащим соответствующий остаток сахара, например, 1-(2-дезокси-2-фтор- β-D-рибонуранозил)урацилом в присутствии одного или нескольких ферментов фосфорилаз, к примеру, фосфорилазы пуринового нуклеозида и фосфорилазы тимидина, или фермента трансферазы, например, N-дезоксирибозильной трансферазы.
где Ха и Ya принимают вышеуказанные значения, или его соли с пиримидиновым нуклеозидом, содержащим соответствующий остаток сахара, например, 1-(2-дезокси-2-фтор- β-D-рибонуранозил)урацилом в присутствии одного или нескольких ферментов фосфорилаз, к примеру, фосфорилазы пуринового нуклеозида и фосфорилазы тимидина, или фермента трансферазы, например, N-дезоксирибозильной трансферазы.
Или же исходное соединение вышеприведенной формулы (III) может быть получено химическим путем реакцией соединения формул (IV), где Xa и Ya принимают вышеуказанные значения, или его силилированного производного, или его соли с соединением формулы (III), где R1 и R2 принимают вышеуказанные значения, или его другой защитной по гидроксилу формы и W представляет приемлемую отходящую группу, например, атом галогена, такой как хлор, ациклоксигруппу, такую как ацетоксигруппа, алкоксигруппу, такую, как метоксигруппа в присутствии катализатора, такого как хлорид олова (IV) или тремилсилилтрифталата в приемлемом растворителе, таком как ацетонитрил.
Пуриновые основания формулы (IV) могут быть получены из соответствующих пуриновых оснований, в которых 6-заместитель представлен приемлемой отходящей группой, например, атомом галогена, такого как хлор, путем нуклеофильного замещения этой группы. Так, пуриновое основание формулы (IV), где Ха бензилоксигруппа, может быть получено, например, обработкой соответствующего 6-хлорпурина спиртом, таким как бензиловый спирт в присутствии основания, например, гидрида натрия в приемлемом растворителе, таком как тетрагидрофуран (ТГФ). Пуриновые основания формулы (IV), где Ха бензиламиногруппа, могут быть получены обработкой соответствующего 6-хлорпурина амином, например, бензиламином в присутствии основания, например, амина, такого как триэтиламин в приемлемом растворителе, таком как метанол. Такие пуриновые основания, применяемые в качестве вышеупомянутых исходных продуктов, могут быть и продажными соединениями (Олдрич Кемикл Компэни) или могут быть получены методами, хорошо известными специалисту, или которые могут быть легко найдены в химической литературе.
Пиримидиновые нуклеотиды, используемые при получении соединений формулы (III) вышеуказанными способами, могут быть получены методами, хорошо известными специалисту, или которые могут быть легко найдены в химической литературе. К примеру 1-(2-дезокси-2-фтор- β-D-рибофуранозил)пиримидины, такие как 1-(2-дезокси-2-фтор- β-D-рибофуранолиз)урацил могут быть получены методом, описанным Codington и др. (J.Org.Chem. 29, 558, 1964).
Необходимо указать, что соединения формулы (III) могут представлять собой соединения изобретения. Так, например, Ха может представлять -NR3R4, где R3 и R4 принимают вышеуказанные значения. Такие соединения могут быть обработаны ферментом дезаминазой, такой как дезаминаза аденозина и превращены в соединение формулы (I), где Х гидроксил.
Соединение формулы (I), где R1 и /или R2 гидроксил, может быть превращено в соответствующий фармацевтически приемлемый сложный эфир формулы (I) согласно вышеприведенному определению в реакции с приемлемым этерифицирующим средством согласно хорошо известным методикам, например, по методике, приведенной Martin и др. J.Pharm.Sci. (1987) 76, 180. Так, для получения эфира с соответствующей карбоновой кислоты согласно вышеприведенному определению исходное соединение формулы (I) может быть введено в реакцию с ангидридом кислоты или галоидангидридом, например, хлорангидридом, соответствующим карбоновой кислоте формулы: QCOOH, где Q представляет группу -R6H, -OR7H, -R6COOR8, -R7-Z-Ar, -CHR9NR10R11 или R13, где R6, R7, R8, R9, R10, R11, R13, Z и Ar принимают вышеуказанные значения, в присутствии приемлемого основания, такого как триэтиламин.
Вышеуказанные исходные соединения формулы (II), где R1 и/или R2 гидроксил, могут быть введены в реакцию с этерифицирующим средством, после чего полученное соединение может быть введено в реакцию с пуриновым основанием формулы PuH по способу (А).
Соединения изобретения, в которых R1 и/или R2 представлен моно-, ди- или трифосфатной эфирной группой, могут быть получены из соединений формулы (I), в которых R1 и/или R2 гидроксил, последовательным фосфорилированием через моно-, ди- и трифосфатные производные обычным химическим путем или ферментивным путем, например, с помощью нуклеозид-киназы или фосфотрансферазы в присутствии нуклеотид-трифосфата, например, АТФ.
Соединение формулы (I), в котором R1 и/или R2 гидроксил, может быть превращено в соответствующий формацевтически приемлемый простой эфир формулы (I) согласно вышеприведенному определению, в реакции с приемлемым алкилирующим средством обычным образом, например, с соединением формулы: Q1-HaI, где Q1 представляет группу -R6H или -R6-Z-Ar, где R6 и Ar принимают вышеуказанные значения и HaI галоген, например, йод.
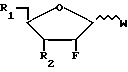
Или же такое алкилирующее средство может быть введено в реакции с сахаром формулы
(где V-алкоксигруппа, такая как метоксигруппа или ацилоксигруппа, такая как ацетоксигруппа) с получением соответствующего 3'-, 5'- или 3',5'-ди(простого)эфира (Bessodes M. и др. Synthesis (1968) 560) и конденсацией полученного простого эфира с приемлемым пуриновым основанием формулы PuH с образованием нуклеозида, из которого вышеприведенным способом (В) удаляют защитную группу.
(где V-алкоксигруппа, такая как метоксигруппа или ацилоксигруппа, такая как ацетоксигруппа) с получением соответствующего 3'-, 5'- или 3',5'-ди(простого)эфира (Bessodes M. и др. Synthesis (1968) 560) и конденсацией полученного простого эфира с приемлемым пуриновым основанием формулы PuH с образованием нуклеозида, из которого вышеприведенным способом (В) удаляют защитную группу.
В том случае, когда полученный на первом этапе вышеприведенного способа продукт является моно(простым) эфиром, например, 5'-эфиром, тогда другой гидроксил может быть введен в реакцию с карбоновой кислотой или ее производным, например: ангидридом или галоидангидридом, например, хлорангидридом, соответствующим кислоте формуле: QCOOH, где Q принимает вышеуказанные значения, с получением моно (простого) эфира-моно (сложного) эфира сахара, например, 3'-(сложный) эфир-5'-(простой) эфир сахара. Полученный сахар может быть сконденсирован с приемлемым пурином с образованием нуклеозида, о чем шла речь выше, или согласно ссылке на Codington I.F. и др. Carbohyd.Res. (1966) 1455.
Соединения изобретения могут быть получены из соединений формулы 1', где 1' соединение, соответствующее соединению формулы (I), в котором R1 и R2 заменены другими защитными группами. Такие другие защитные группы могут быть удалены или введены в реакцию с образованием групп R1 и R2, принимающих вышеуказанные значения.
Соединения изобретения при их получении вышеописанным путем могут быть использованы для получения соединений изобретения, в которых R1 и/или R2 гидроксил, путем удаления простой эфирной и/или сложноэфирной групп.
В зависимости от условий осуществления способа и от исходных соединений конечный продукт формулы (I) получают либо в виде свободного основания, либо в виде соли. Как свободное основание, так и соли конечного продукта включены в объем изобретения. Так щелочные, нейтральные или смешанные соли могут быть получены, как могут быть получены полу-, моно-, сескви- или полигидраты. Соли, образованные добавлением кислоты к новым соединениям, могут быть переведены известным путем в свободные основания с помощью щелочных агентов, таких как: щелочь или ионнообменник. Полученные свободные основания могут также образовывать соли с органическими и неорганическими кислотами.
Соли изобретения, которые могут быть использованы обычным образом для лечения, включают фармацевтически приемлемые соли оснований, например, образованные приемлемым основанием, такие как соли щелочного металла (например, натрия), щелочноземельного металла (например, магния), аммония и соли NX4 (где Х С1-С4N-алкил).
Изобретение, кроме того, включает новые промежуточные соединения: 2-амино-6-бензиламино-(2-дезокси-2-фтор- β-D- рибофуранозил)-9Н-пурин, 2-амино-6-бензилокси-(2-дезокси-2-фтор- β-D-рибофура- нозил)-9Н-пирин и 2-амино-6-бензилтио-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
Соединения изобретения могут быть введены реципиентом, таким как млекопитающие, включая и человека, любым путем, приемлемым для выявленных симптомов, и приемлемые пути включают: пероральный. легочный, ректальный, насальный, местный (в том числе трансбукальный и подъязычный), вагинальный и парентеральный (в том числе: подкожный, внутримышечный, внутривенный, внутрикожный, внутриоболочечный и эпидуральный). Необходимо указать, что предпочтительный путь введения может меняться в зависимости от состояния реципиента.
Необходимое количество отдельного активного компонента для лечения вирусной инфекции, в том числе гриппа и РСВ-инфекции зависит от целого ряда факторов, включая тяжести подвергаемых лечению симптомов и конкретного реципиента, и полностью определяется компетенцией лечащего врача. В целом приемлемая эффективная доза будет находиться в интервале 0,1-100 мг на килограмм массы тела реципиента в день, предпочтительно 5-30 мг на кг массы тела реципиента в день, и наиболее предпочтительно 10-20 мг на кг массы тела реципиента в день, а оптимальная доза составляет, примерно, 15 мг на 1 кг массы тела в день (если нет особых указаний, то все массы активного компонента рассчитаны на родовое соединение, а для его солей и сложных эфиров цифр должны быть пропорциональны увеличены). Эффективная доза возможно может быть поделена на две, три, четыре или более доз, вводимых через соответствующие промежутки в течение дня. Такие субдозы могут вводиться в единичных дозировочных формах, например, содержащих 1-2000 мг, предпочтительно 20-500 мг и наиболее предпочтительно 100-400 мг активного компонента в единичной дозировочной форме.
Соединения изобретения могут быть введены как таковые или в сочетании с другими лечебными средствами, например, с амантидином или с рибавирином известными противогриппозными средствами, или с анальгетиком, например: кодэином, парацетoмолом, аспирином, ибупрофеном, или с противовоспалительным средством таким как: индометацин, мефенамовая кислота, напоксен или ибупрофен, или любыми другими средствами, если сочетание с соединением изобретения дает благоприятный лечебный эффект.
Хотя соединение изобретения может быть введено как таковое, тем не менее рекомендуется вводить его в виде фармацевтического состава. Составы изобретения включают, по меньшей мере, один активный компонент согласно вышеприведенному определению в смеси с одним или несколькими фармацевтически приемлемыми носителями и возможно другими лечебными компонентами. Носители должны быть "приемлемыми" с точки зрения совместимости с другими компонентами состава и безвредности для реципиента.
Такие составы включают составы, пригодные для перорального, легочного, ректального, насального, местного (в том числе трансбуккального или подъязычного), вагинального или парентерального (включая: подкожного, внутримышечного, внутривенного, внутрикожного, внутриоболочного и эпидурального) введения. Составы могут быть представлены единичными дозировочными формами, которые могут быть получены методами, хорошо известными фармацевтам. Такие методы включают этап приведение в контактирование активного компонента с носителем, содержащим один или несколько сопутствующих компонентов. В целом составы получают равномерным и однородным смешиванием активного компонента с жидкими носителями или мелко размельченными твердыми носителями, или носителями обоего вида с последующим, если необходимо, формованием продукта.
Составы изобретения, пригодные для перорального введения, могут быть представлены отдельными единицами, такими так: капсулы, пакетики или таблетками, каждая из которых содержит заданное количество активного компонента или в виде гранул или порошка, раствора или суспензии в водной или неводной жидкости или эмульсии типа масло в воде, или эмульсии типа вода в масле. Активный компонент может быть также представлен в виде болюса или пасты, или может быть также представлен внутри липосомы.
Таблетки могут быть приготовлены прессованием или формованием, возможно вместе с одним или несколькими сопутствующими компонентами. Прессованные таблетки могут быть получены прессованием в соответствующей машине активного компонента в свободно текучем состоянии, например, в виде порошка или гранул, возможно в смеси со связующим средством (например: повидоном, желатином, гидроксипропилметилцеллюлозой), смазкой, инертным разбавителем, консервантом, размельчителем (натрийгликолятом крахмала, сшитым повидоном, сшитой найтрийкарбоксиметилцеллюлозой), поверхностно-активным или диспергирующим веществом. Формованные таблетки могут быть получены формованием в соответствующем аппарате смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. На таблетки может быть нанесено покрытие или на них может быть сделано рифление и могут быть приготовлены таким образом, чтобы обеспечить медленное и регулируемое выделение из них активного компонента использованием, например, в различных количествах гидроксипропилметилцеллюлозы с обеспечением целевого характера выделения.
Капсулы могут быть изготовлены заполнением рыхлым или прессованным порошком на соответствующей заполняющей машине, возможно вместе с одной или несколькими добавками. Примеры приемлемых добавок включают: связующие вещества, такие как: повидон, желатин, смазки, инертные разбавители, размельчители те же, что и для таблеток. Капсулы могут быть приготовлены так, чтобы содержать гранулы или дискретные субъединицы с обеспечением медленного или регулируемого выделения необходимого компонента. Этого можно достигнуть экструдированием и сфероидированием влажной смеси лекарства плюс экструдирующая добавка (например, микрокристаллическая целлюлоза), плюс разбавитель, такой как лактоза. Полученные в результате сфероиды могут быть покрыты полупроницаемoй мембранной (например: этилцеллюлозой, Эодраджит WE30D) с приданием свойств пролонгированного действия.
При местном введении составы предпочтительно наносят в виде мази или крема, содержащих активный компонент в количестве, например, 0,075-20 мас. /мас. предпочтительно 0,2-15 мас./мас и наиболее предпочтительно 0,5-10 мас. /мас. При введении в состав мази активные компоненты могут быть использованы в смеси с парафинистой или смешивающейся с водой основой мази. Или же активные компоненты могут быть введены в состав крема с кремовой основой типа масло в воде или типа вода в масле.
При желании водная фаза кремовой основы может включать, например, по меньшей мере, 30 мас./мас. многоатомного спирта, т.е. спирта с двумя или более гидроксилами, такого как: пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин, полиэтиленгликоль и их смеси. Местные составы при желании могут включать соединение, способствующее абсорбции или проникновению активного компонента через кожу или другую пораженную площадь. Примеры таких способствующих проникновению через кожу веществ включают диметилсульфоксид и родственные ему аналоги.
Масляная фаза эмульсий изобретения может состоять из известных компонентов, составленных обычным образом. Хотя такая фаза может состоять только из эмульгатора (известного также под названием эмульгента), тем не менее желательно, чтобы такая фаза представляла собой смесь по меньшей мере одного эмульгатора с жиром или маслом, или одновременно с жиром и маслом. Рекомендуется гидрофильный эмульгатор включать в смеси липофильным эмульгатором, действующим как стабилизатор. Также рекомендуется одновременно включать масло и жир. Совместно при наличии или отсутствии стабилизатора(ов) эмульгатор(ы) образуют так называемый эмульгирующий воск, и такой воск в смеси с маслом и/или жиром, составляет так называемую эмульгирующую основу мази, которая образует маслянистую дисперсную фазу кремовых составов.
Эмульгаторы и стабилизаторы эмульсии, применимые в составах изобретения, включают, Твин 60, Спэн 80, цетостеариловый спирт, пиристиловый спирт, моностеарат глицерина и лаурилсульфат натрия.
Выбор приемлемых масел или жиров для состава определяется достижением целевых косметических свойств, поскольку растворимость активного соединения в большинстве масел, с наибольшей вероятностью применяемых в фармацевтических эмульсионных составах, очень низка. Так крем желательно должен представлять собой несальный, неокрашивающий и смываемый продукт приемлемой консистенции, позволяющей избежать утечек из тюбиков и других контейнеров. Могут быть использованы моно- и диэфиры с алкильной цепью нормального или изо-строения, такие как: диизидипат, изоцетилстеарат, диэфиры пропиленгликоля с жирными кислотами кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь эфиров изо-строения, известная под названием Кродамол САР, причем три последних являются предпочтительными эфирами. Указанные эфиры могут применяться по отдельности или в смеси, что зависит от целевых свойств. Или же могут быть использованы высокоплавкие липиды, такие как: белый мягкий парафин и/или жидкий парафин, или другие минеральные масла.
Составы, пригодные для местного нанесения на глаза, кроме того, включают глазные мази, в которых активный компонент растворен или суспендирован в приемлемом носителе, особенно в водном растворителе, предназначенном для активного компонента. Рекомендуется присутствие активного компонента в подобных составах в концентрации 0,5-20% предпочтительно 0,5-10% особенно около 1,5% мас./мас.
Составы, пригодные для местного введения через рот, включают лепешки, содержащие активный компонент во вкусовой основе, обычно в сахарозе, камеди акации или трагаканте, пастилки, содержащие активный компонент в инертной основе, такой как: желатин и глицерин или в сахарозе и камеди акации, и средство для полоскания рта, содержащее активный компонент в приемлемом жидком носителе.
Составы для ректального введения могут быть представлены сечками на приемлемой основе, включающей, к примеру, масло какао или высший жирный спирт (например твердый воск фирмы Юэропен Фармакопея), или триглицериды и насыщенные жирные кислоты (например Витепсол).
Составы для носального введения в тех случаях, когда носителем является твердое вещество, включают грубые порошки с размером частиц, например, в интервале 20-500 мкм, которые вводят точно также, как нюхательный табак, т. е. быстрым вдыханием через носовой проход из контейнера с порошком, подносимого близко к носу. Приемлемые составы, в которых носителем является жидкость, для введения путем впрыскивания через нос или в виде капель для носа включают водные или масляные растворы активного компонента.
Приемлемые составы для введения ингаляций включают мелкодисперсные дусты или туманы, которые могут быть образованы с помощью различного типа находящихся под давлением дозированных аэрозолей, распылителей и инсуффляторов.
При легочном введении через рот размер частиц порошка или капель обычно находится в интервале 0,5-10 мкм, предпочтительно 1-5 мкм для гарантирования попадания в бронхиальное дерево. При введении через нос рекомендуемый размер частиц 10-500 мкм для гарантирования удерживания в новосой полости.
Дозирующие ингаляторы представляют собой находящиеся под давлением аэрозольные дозаторы, обычно содержащие суспензию или раствор состава активного компонента в сжиженном пропелленте. При употреблении такие устройства подают состав через клапан, способный отмерять необходимый объем, как правило, 10-150 мкм, с образованием мелкодисперсного аэрозоля активного компонента. Приемлемые пропелены включают: пропан, бутан, некоторые хлорфторуглероды, обычно обозначаемые как "ХВС" например дифтордихлорметан, трихлорфторметан, дихлортетрафторэтан и их смеси. Состав может дополнительно содержать сорастворители, например этанол, поверхностно-активные вещества, такие как: олеиновая кислота или триолеат сорбита, антиокислители и/или приемлемые вкусовые добавки.
Распылители являются продажными устройствами, превращающими растворы или суспензии активного компонента в аэрозольный лечебный туман либо с помощью ускорения сжатого газа при прохождении через узкое отверстие Вентури (обычно, воздуха или кислорода), либо с помощью ультразвукового возбуждения. Приемлемые составы, предназначенные для употребления в распылителях, состоят их активного компонента, а жидком носителе в количестве до 40 мас./мас. на состав, предпочтительно менее 20 мас./мас. Носителем обычно служит вода или разбавленный водный спиртовой раствор, предпочтительно сделанный изотоническим к жидкостям организма добавлением, например, хлорида натрия. Возможные добавки включают консерванты, если состав не готовится стерильным, к примеру метилгидроксибензоат, антиокислители, вкусовые добавки, летучие масла, буферные добавки и поверхностно-активные вещества.
Приемлемые составы для введения инсуффляцией включают мелко распыленные порошки, которые могут быть поданы с помощью инсуффлятора или могут быть доставлены в носовую полость на манер нюхательного табака. В инсуффляторе порошок содержится в капсулах или патронах, обычно изготовленных из желатина или пластика, и которые либо пробивают, либо вскрывают in situ, после чего порошок поступает в воздух, пропускаемый через устройство в ходе ингаляции или же подаваемого с помощью ручного насоса. Порошок, используемый в инсуффляторе состоит либо только из активного компонента, либо из порошковой смеси, включающей активный компонент, приемлемый порошкообразный разбавитель, такой как лактоза и возможно поверхностно-активное вещество. Активный компонент обычно составляет 0,1-100% мас./мас. состава.
Сжатые аэрозольные составы предпочтительно составляют таким образом, что каждая отмеренная доза содержит 0,05-5 мг соединения изобретения. Аналогично, порошковые составы для инсуффляции составляют таким образом, что каждая единичная доза содержит 0,5-50 мг. Составы в виде раствора или суспензии для распыления составляют так, что поставляемая доза составляет 1-1500 мг. Соединения изобретения или их составы могут вводиться с помощью таких устройств один или несколько раз в день одной или несколькими дозами, например, тремя или четырьмя, которые даются в каждом случае.
Составы для вагинального введения могут быть представлены в виде пессария, тампона, крема, геля, пасты, пенных или распыляемых составов, содержащих помимо активного компонента и такие носители, которые подходят для данного назначения.
Составы пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиокислители, буферные смеси, бактериостатический фактор и растворимые вещества, придающие составу изотоничность по отношению к крови намеченного реципиента, а также водные и неводные стерильные суспензии, которые могут содержать суспендирующие средства и загустители, липосомы или другие системы их микрочастиц, предназначенные для доставки соединения к компонентам крови или к одному или нескольким органам. Составы могут быть представлены в единичной дозе или в виде контейнера с несколькими дозами, например, запаянных ампул и сосудов и могут храниться в высушенном заморозкой (лиофилизованном) состоянии, требующим добавления всего лишь стерильного жидкого носителя, к примеру воды для инъекций непосредственно перед употреблением. Растворы и суспензии для инъекций могут быть приготовлены экспромтом из стерильных порошков, гранул и таблеток ранее описанного типа.
К рекомендуемым единичным дозированным составам относятся составы, содержащие ежедневную дозу или единичную ежедневную субдозу, о чем говорилось выше, или соответствующую долю такой дозы активного компонента.
Необходимо указать, что кроме уже упоминавшихся выше компонентов составы настоящего изобретения могут включать и другие добавки, обычно применяемые в фармакологии, с учетом типа рассматриваемого состава. Так, например составы, пригодные для перорального введения, могут включать вкусовые добавки.
Нижеследующие примеры приводятся с целью иллюстрации изобретения, и ни в коей мере не предназначены для его ограничения.
П р и м е р 1. Получение 9-(2-дезокси-3,5-ди-0-пропионил-2фтор- β-D-рибофуранозид)гуанина.
К раствору 9-(2-дезокси-2-фтор- -D-рибофуранозил)гуанина (170 мг 0,6 ммоля), 4-диметиламинопиридина (ДМАП) (8 мг) и триэтиламина (0,41 мл, 5 экв) в N,N-диметилформамиде (ДМФА) (4 мл) при комнатной температуре и перемешивании прибавляют пропионовый ангидрид (0,16 мл, 2,1 экв). Через 20 ч добавляют метанол (2 мл) и еще через час смесь испаряют в вакууме и остаток хроматографируют на SiO2 способом вытеснения. Элюированием смесью CHCl3/MeOH (10:1), затем (6: 1) получают заглавное соединение в виде белого вещества с т.пл. 198-200оС.
Анализ, вычислено для 0,2 гидрата: C 47,93, H 5,13, N 17,47.
Найдено: C 48,22, H 4,94, N 17,00
П р и м е р 2. Получение 9-(2-дезокси-3,5-ди-0-ацетил-2-фтор- β-D-рибофуранозил) гуанина и 9-(2-дезокси-2-фтор-3,5-ди-0-ацетил- β-D-рибофуранозил)-2-N-ацетилгуанина.
П р и м е р 2. Получение 9-(2-дезокси-3,5-ди-0-ацетил-2-фтор- β-D-рибофуранозил) гуанина и 9-(2-дезокси-2-фтор-3,5-ди-0-ацетил- β-D-рибофуранозил)-2-N-ацетилгуанина.
К раствору 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина (160 мг, 0,56 ммоля), ДМАП (8 мг) и триэтиламина (400 мкл, 5 экв) в ДМФА (4 мл) при перемешивании и комнатной температуре прибавляют уксусный ангидрид (0,16 мл, 2,5 экв). Через 22 ч желтый раствор испаряют в вакууме, совместно с метанолом и толуолом и хроматографируют на SiO2 вытеснительным способом с элюированием CHCl3-MeOH (6:1). Элюирующийся первым компонент испаряют и после совместного испарения с толуолом получают триацетилпроизводное в виде белой пены.
Анализ. Вычислено для 0,1 толуата: C 47,69; H 4,51; N 16,65
Найдено: C 47,47; H 4,37; N 16,82.
Найдено: C 47,47; H 4,37; N 16,82.
Отбором и испарением фракций, содержащих элюирующийся вторым компонент, получают диацетилпроизводное в виде белого вещества с т.пл. 232-234 (разл.).
Анализ, вычислено для 0,25 этанолата: С 45,73; H 4,63; N 18,39.
Найдено: C 46,02; H 4,34; N 18,19.
П р и м е р 3. Получение 9-(2-дезокси-2-фтор-3-0-пивалоил- β-D-рибофуранозил) гуанина и 9-(2-дезокси-2-фтор-3,5-ди-0-пивалоил- β-D-рибофуранозил)гуанина.
К раствору 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина (200 мг, 0,7 ммоля), ДМАП (10 мг) и триэтиламина (0,5 мл) в ДМФА (6 мл) при комнатной температуре, прибавляют триметилуксусный ангидрид (160 мкл 1,1 экв) и полученный раствор перемешивают 24 ч. Добавляют еще 80 мкл триметилуксусного ангидрида и перемешивание продолжается пять дней. Реакционную смесь разбавляют метанолом (1 мл), испаряют при пониженном давлении с получением белого вещества, которое хроматографируют на SiO2 вытеснительным способом с элюированием CHCl3-MeOH (15:1), затем (10:1), (6:1) и наконец (4:1).
Элюирующаяся третьей фракция (УФ-контроль) является 3,5-бис-пивалотом, представляющим собой после промывания эфиром воскообразное вещество сс т.пл. 250-252оС (разл.).
Анализ для C20H28FN5O6 ˙0,5H2O. Вычислено: C 51,94; H 6,32; N 15,15
Найдено: C 51.99; H 6,23; N 14,83
Элюирующаяся четвертой фракция (УФ-контроль) содержит 3'-пивалат в виде белого порошка, постепенно темнеющего в интервале 260-320оС при определении температуры плавления. Анализ для C15H20FN5O5 ˙0,7H2O.
Найдено: C 51.99; H 6,23; N 14,83
Элюирующаяся четвертой фракция (УФ-контроль) содержит 3'-пивалат в виде белого порошка, постепенно темнеющего в интервале 260-320оС при определении температуры плавления. Анализ для C15H20FN5O5 ˙0,7H2O.
Вычислено: C 47,17; H 5,65; N 18,34
Найдено: C 47,10; H 5,36; N 17,93.
Найдено: C 47,10; H 5,36; N 17,93.
П р и м е р 4. Получение 9-(2-дезокси-2-фтор-3,5-ди-0-пивалоил- β-D-рибофуранозил)аденина и 9-(2-дезокси-2-фтор- 5-0-пивалоил- β-D-рибофуранозил)аденина.
К раствору 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденина (250 мг, 0,93 ммоля), ДМАП (10 мг) и триэтиламина (0,65 мл) в ДМФА (7 мл) при комнатной температуре и перемешивании прибавляют триметилуксусный ангидрид (226 мкл, 1,2 экв). Через 24 ч добавляют еще 60 мкл триметилуксусного ангидрида и через последующие 24 ч еще 20 мкл. Спустя день реакционную смесь разбавляют MeOH, испаряют в вакууме, совместно испаряют с этанолом и очищают вытеснительной хроматографией на SiO2 с элюированием CHCl3-MeOH (18:1), (15:1) и, наконец, (10:1). Элюирующаяся первой фракция (УФ-контроль) содержит 3,5-бисэфир, представляющий собой после промывания эфиром белое вещество с т.пл. 157-158оС.
Анализ для C20H26FN5O5˙0,3H2O
Вычислено: C 54,24; H 6,51; N 15,82.
Вычислено: C 54,24; H 6,51; N 15,82.
Найдено: C 54,40; H 6,33; N 15,48.
Элюирующая второй фракции (УФ-контроль) содержит 3'-пивалат в виде белого вещества с т.пл. 204-205оС.
Анализ для С15H20FN5O4 ˙0,3H2O
Вычислено: C 50,22; H 5,79; N 19,53
Найдено: C 50,25; H 5,58; N 19,31.
Вычислено: C 50,22; H 5,79; N 19,53
Найдено: C 50,25; H 5,58; N 19,31.
Элюирующая третьей фракция (УФ-контроль) содержит 5-пивалат в виде белой пены, т.пл. 130-134оС.
Анализ для C15H20FN5O4 ˙0,2H2O
Вычислено: C 50,46; H 5,76; N 19,52.
Вычислено: C 50,46; H 5,76; N 19,52.
Найдено: C 50,57; H 5,65; N 19,45.
П р и м е р 5. Получение 9-(2-дезокси-2-фтор-3,5-ди-0-валерил- β-D-рибофуранозил)аденина, 9-(2-дезокси-2-фтор-3-0- валерил- β-D-рибофуранозил)аденина и 9-(2-дезокси-2-фтор-5-0-валерил- β-D-рибофуранозил)аденина.
К раствору 9-(2-дезокси-2-фтор-β -D-рибофуранозил)аденина (300 мг, 1,11 ммоля), ДМАП (10 мг) и триэтиламина (0,9 мл) в сухом ДМФА (8 мл) при комнатной температуре и перемешивании прибавляют валериановый ангидрид (263 мкл, 1,2 экв). С интервалом в 24 и 48 ч добавляют еще по 30 мкл валерианового ангидрида. Через день после последнего добавления реакционную смесь разбавляют МеОН, после чего обрабатывают и хроматографируют по методике получения пивалатов. Первый элюируемый компонент содержит (УФ-контроль) 3',5'-бисэфир, кристаллизующийся в виде белых игл после промывания эфиром, т.пл. 96-98оС.
Анализ для C20H28FN5O5
Вычислено: C 54,91; H 6,45; N 16,01
Найдено: С 54,93; H 6,49; N 15,89.
Вычислено: C 54,91; H 6,45; N 16,01
Найдено: С 54,93; H 6,49; N 15,89.
Элюирующийся вторым компонент содержит 3'-валерат (УФ-контроль), т.пл. 182-182оС.
Анализ для C15H20FN5O4.
Вычислено: C 50,98; H 5,71; N 19,82.
Вычислено: C 50,98; H 5,71; N 19,82.
Найдено: C 50,91; H 5,82; N 19,46.
Элюирующийся третьим компонент содержит (УФ-контроль) 5'-валерат, кристаллизующийся при промывании эфиром, т.пл. 115-117оС.
Анализ для C15H20FN5O4.
Вычислено: C 50,98; H 5,71; N 19,82
Найдено: С 50,76; H 5,81; N 19,44.
Найдено: С 50,76; H 5,81; N 19,44.
П р и м е р 6. 2,6-Диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
2,6-Диаминопурин (Пэсифик Кемикл Лэборэториз, 0,8 г 4,8 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г 1,6 ммоля), который может быть получен по методике I. F. Codington и др. (J.Org.Chem.29,558, 1964) суспендируют в 50 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04 (мас./об.) азида калия. Добавляют тимидин-фосфорилазу (3850 МЕ) и фосфорилазу пуриновых нуклеозидов 3760 МЕ) (Т.А. Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США 4381344) и полученную суспензию перемешивают при 37оС. На 12-й день реакционную смесь фильтруют. Фильтрат наносят на колонку с анионнообменной смолой (1,5х15 см, Био-Ред АС IX2, гидроксидная форма). После промывания колонки смесью вода-метанол (7:3) продукт элюируют смесью вода-метанол (1:1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 1,2 гидрата, т.пл. 124оС.
УФ λmax (ε х 10-3): 0,1 н HCl 291 (10,2), 252 (11,8), pH7 278,5 (10,3), 255 (9,69) 0,1 н (NaOH), 279 (10,6), 255 (9,69).
Анализ для C10H13FN6O3 ˙1,2H2O.
Вычислено: С 39,27; H 5,07; N 27,48; F 6,21.
Найдено: C 39,22; H 5,09; N 27,39; F 6,45.
1Н-ЯМР (80 МГц, Ме2SO-d6) δ 7,94 (С, 1Н, Н-8), 6,74 и 5,79 (2 уш.с. 4Н, 2-NH2 и 6-NH2), 6,04 (дв. д, 1Н, Н-1',IF, 1 16,5 Гц, I 3,4 Гц), 5,64 (м, 1,5Н, 0,5 (Н-2') и 3'-ОН), 5,25 (т, 1Н, 5'-ОН, I 5,5 Гц), 4,98 (м, 0,5Н, 0,5 (Н-2'), 4,41 (м, 1Н, Н-3'), 3,93 (м, 1Н, 5-4'), 3,65 (м, 2Н, Н-5' и Н-5').
П р и м е р 7. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин.
В 15 мл воды растворяют 2,6-диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденина (получение см.пример 6, 0,2 г, 0,64 ммоля), добавляют аденозин-дезаминазу из кишечника теленка (4 МЕ, Борингер Меннхайм) и раствор инкубируют 4 дня при 37оС. Затем раствор охлаждают до 4оС, через 3 ч суспензию фильтруют с получением первой порции кристаллического продукта. Основной объем фильтрат уменьшают в вакууме и образовавшуюся суспензию охлаждают до 4оС. Суспензию фильтруют с удалением второй порции кристаллического продукта. Обе порции кристаллического продукта объединяют, суспендируют в воде и лиофилизацией получают заглавное соединение в виде 1,3 гидрата, т.пл. > 250оС (разл.).
УФ λmax нм (ε х 10-3): 0,1 н HCl 257 (12,2), 280 (sh), 0,1 нNaOH 257-264 (10,9).
Анализ для C10H12FN5O4 ˙1,3H2O
Вычислено: C 38,91; H 4,77; N 22,69; F 6,16.
Вычислено: C 38,91; H 4,77; N 22,69; F 6,16.
Найдено: C 38,60; H 4,82; N 22,51; F 6,44.
1Н-ЯМР (80 мГц, Ме2SO-d6) δ 10,63 (уш.с. 1Н, N1-Н), 7,94 (с,1Н, Н-8), 6,51 (уш. с. 2Н, 2-NH2), 6 (дв.д, 1Н, Н-1, IF, I' 16,5 Гц, I 2,9 Гц), 5,59 (м, 1,5Н, 0,5 (Н-2') и 3'-ОН), 5,1 (т,1Н, 5'-ОН, I 5,6 Гц), 4,9 (м, 0,5Н, 0,5 (Н-2'), 4,37 (м, 1Н, Н-3'), 3,9 (м, 1н, Н-4'), 3,65 (м, 2Н, Hα -5' и Hβ -5').
П р и м е р 8. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин.
Аденин (Манн Ризерч Лэбораториз, Инк. 0,8 г, 5,9 ммоля) и 1-(2-дезокси-2-фтор- β--D-рибофуранозил)урацил (0,4 г 1,6 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964), суспендируют в 10 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас. /об.) азида калия. К суспензии добавляют тимидин-фосфоридазу (2400 МЕ) и фосфорилазу периновых нуклеозидов (3900 МЕ) (Т.А.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и перемешивают при 37оС. На 6-й день реакционную смесь разбавляют до 100 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,05% (мас./об.), азида калия. На 17-й день суспензию фильтруют и фильтрат испаряют. Остаток суспендируют в теплой воде, суспензию фильтруют и фильтрат переносят на колонку (1,5х13 см) с анионнообменной смолой (Био-Ред AGIX2, гидрооксидная форма). Продукт элюируют водой, содержащие продукт фракции объединяют и растворитель удаляют в вакууме. Остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,6 гидрата, т.пл. 225-227оС (разл.).
УФ λmax нм (ε х10-3): 0,1 н HCl 257 (14,6) 0,1 н NaOH 260 (14,9).
Анализ для C10H12FN5O3 ˙0,6H2O
Вычислено: C 42,89; H 4,57; N 25,01; F 6,78.
Вычислено: C 42,89; H 4,57; N 25,01; F 6,78.
Найдено: C 42,94; H 4,76; N 24,98; F 6,89
1Н-ЯМР (250 мГц, Me2SO-d6) δ 8,35 и 8,14 (2с, 2Н,Н-8 и Н-2), 7,36 (с, 2Н, 6-NH2), 6,21 (дв.д. 1Н, Н-1',IF,1' 16,8 Гц, I 3 Гц), 5,71 (д, 1Н, 3'-ОН, I 6 Гц), 5,42 (дв.дв.д.1Н, Н-2', IF2' 53 Гц, I1', 2' 3 Гц, I2',3' 4,5 Гц), 5,25 (т, 1Н, 5'-ОН, I 5,6 Гц), 4,47 (м, 1Н, Н-3'), 3,97 (м, 1Н, Н-4'), 3,74 (м, 1Н, Hα -5'), 3.56 (м, 1Н, Hβ-5').
1Н-ЯМР (250 мГц, Me2SO-d6) δ 8,35 и 8,14 (2с, 2Н,Н-8 и Н-2), 7,36 (с, 2Н, 6-NH2), 6,21 (дв.д. 1Н, Н-1',IF,1' 16,8 Гц, I 3 Гц), 5,71 (д, 1Н, 3'-ОН, I 6 Гц), 5,42 (дв.дв.д.1Н, Н-2', IF2' 53 Гц, I1', 2' 3 Гц, I2',3' 4,5 Гц), 5,25 (т, 1Н, 5'-ОН, I 5,6 Гц), 4,47 (м, 1Н, Н-3'), 3,97 (м, 1Н, Н-4'), 3,74 (м, 1Н, Hα -5'), 3.56 (м, 1Н, Hβ-5').
П р и м е р 9. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
2-Аминопурин (вега Биокемикэлз, 0,4 г 3 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,2 г, 0,71 ммоля), который может быть получен по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964), суспендируют в 35 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. К суспензии добавляют тимидин-фосфорилазу (1930 МЕ) и фосфорилазу пуриновых нуклеозидов (1880 МЕ) (Т.А.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и перемешивают при 37оС. На 24-й день реакционную смесь разбавляют водой до 200 мл с добавлением тимидин-фосфорилазы (1390 МЕ) и фосфорилазы пуриновых нуклеозидов (1880 МЕ). На 35-й день суспенизию испаряют, остаток растворяют в смеси вода-метанол (7:3) и наносят на колонку (1,5х15 см) с анионнообменной смолой (Био-Ред AGIX2, гидроксидная форма). Продукт элюируют смесью вода-метанол (7:3), содержащие продукт фракции объединяют и растворитель удаляют в вакууме. Остаток растворяют в воде и лиофилизацией получают заглавное соединение, некоторое анализируют в воде 0,6 гидрата, т.пл. 151-153оС.
УФ λmax нм ( ε х 10-3): 0,1 н HCl 313 (4), 240-245, рН 7,304 (7), 243, 0,1 н NaOH 304 (7,3), 243.
Анализ для C10H12FN5O3 ˙0,6H2O
Вычислено: C 42,89; H 4,75; N 25,01; F 6,78.
Вычислено: C 42,89; H 4,75; N 25,01; F 6,78.
Найдено: C 43,02; H 4,71; N 25,12; F 6,58.
1Н-ЯМР (80 мГц, Me2SO-d6) δ 8,62 и 8,31 (2с, 2Н, Н-8 и Н-6), 6,62 (уш.с. 2Н. 2-NH2), 6,16 (дв.д. 1Н, Н-1', IF,1' 16,7 Гц, I 2,7 Гц), 5,71 (м, 1,5Н, 3'-ОН и 0,5 (Н-2')), 5,12 (м, 1,5 Н, 5'-ОН и 0,5 (Н-2'), 4,4 (м, 1Н, Н-3'), 3.97 (м, 1Н, Н-4'), 3,66 (м, 2Н, Hα 5" и Hβ -5').
П р и м е р 10. Хлоргидрат 2-амино-6-циклопропиламино-9Н-пурина.
Раствор 2-амино-6-хлорпурина (Олдрич Кемикл Компэни, 4,66 г, 27,5 ммолей) и циклопропиламина (Олдрич Кемикл Компэни, 12,5 г, 220 ммолей) в MeOH (100 мл) нагревают 18 ч при 50оС. Затем добавляют 2-метоксиэтанол (50 мл) и реакционную смесь нагревают еще 6 ч при 70оС. После охлаждения небольшое количество непрореагировавшего исходного продукта отфильтровывают, фильтрат испаряют и остаток очищают на колонке с силикагелем (5-10% MeOH в CHCl3). Полученный продукт дважды перекристаллизовывают из MeOH и один раз из E10H и получают 1,45 г (23%) продукт в виде хлоргидрата с т.пл.253-257оС.
1Н-ЯМР (Me2SO-d6) δ 6,7-6,82 (м, 4, СН2СН2), 3,04 (уш. с. 1, CHN), 7,35-7,55 (уш. с. 2, NH2), 8,13 (с, 1, СН), 9,49 (уш.с. 1, NHCH), 13-13,3 (уш.с. 2, NH2).
Анализ для C8H10N6HCl ˙1,0H2O
Вычислено: C 41,57; H 5,01; N 36,35; Cl 15,34.
Вычислено: C 41,57; H 5,01; N 36,35; Cl 15,34.
Найденo: C 41,55; H 5,01; N 36,28; Cl 15,40.
2-Амино-6-(циклопропиламино)-9-(2-де- зокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
Хлоргидрат 2-амино-6-(циклопропиламино)-9H-пурина (0,3 г, 1,3 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,6 ммоля), который может быть получен по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964), растворяют в 50 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,05% (мас./об.) азида калия. Затем добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ):(Т.А.Krenitsky и др.Biochemistry 20, 3615, 1981 и патент США N 438144) и реакционную смесь инкубируют при 37оС. На 5-й день добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ). На 21-й день реакционную смесь переносят в колонку (2,5х8 см) с анионообменной смолой (Био-Ред ACIX2, гидроксидная форма), колонку промывают водой и продукт элюируют смесью вода-метанол (7: 3). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,6 гидрата, т.пл. 120оС (частично плавится при 80оС).
УФ λmax нм (ε х 10-3): 0,1 н HCl 295,5 (14,3), 254 (12,7), рН 7 282 (14,8), 262 (sh), 0,1 н NaOH 282 (15,2), 262 (sh).
Анализ для C13H17FN6O3 ˙ 0,6H2O.
Вычислено: С 46,59; H 5.47; N 25,08; F 5,67.
Найдено: C 46,46; H 5,35; N 25,03; F 5,91.
1Н-ЯМР (220 мГц, MeSo2-d6) δ 7,93 (с, 1Н, Н-8). 7,38 (уш.д. 1Н, 6-NH, I 4,5 Гц), 6,04 (дв.д. 1Н, Н-1', IF,1 16,4 Гц, I 3,3 Гц), 5,88 (уш.с. 2Н, 2-NH), 5,62 (д, 1Н, 3'-ОН, I 5,9 Гц), 5,3 (кажущийся дв.т. 1Н, Н-2', IF,2 53,7 Гц, I 3,8 Гц), 5,23 (т, 1Н, 5'-ОН, I 5,4 Гц), 4,38 (м, 1Н, Н-3'), 3,922 (м, 1Н, Н-4'), 3,69 (м, 1Н, Hα -5'), 3,59 (м, 1Н, Hβ -5'), 3,1 (м, 1Н, N-CH), 0,62 (м, 4Н, СН2СН2).
П р и м е р 11. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)-6-метокси-9Н-пурин.
6-метоксипурин (Сигма Кемикл Компэни 0,8 г, 5,3 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,6 ммоля), который может быть получен по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964), суспендируют в 20 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас. /об.) азида калия. К суспензии добавляют тимидин-фосфорилазу (2400 МЕ) и фосфорилазу пуриновых нуклеонизидов (3900 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и инкубируют при 37оС. На 6-й день реакционную смесь разбавляют до 100 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. На 16-й день добавляют тимидин-фосфорилазу (2640 МЕ) и фосфорилазу пуриновых нуклеозидов (4360 МЕ). На 45-й день реакционную смесь испаряют, остаток суспендируют в теплом метаноле и суспензию фильтруют. Фильтрат испаряют, остаток растворяют в теплой воде и переносят в колонку (2,5х7 см) с анионообменной смолой (Био-Ред AGIX2, гидрооксидная форма). После промывания водой продукт элюируют смесью метанол-вода (9: 1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,3 гидрата, т.пл. 182оС.
УФ λmax нм (ε х 10-3): 0,1 н HCl 250 (8,72), 259 (sh), рН 7 248 (8,95, 259 (sh), 0,1 н NaOH 250 (9,14), 253 (sh).
Анализ для C11H13FN4O4 ˙0,3H2O.
Вычислено: C 45,61; H 4,73; N 19,34; F 6,56.
Найдено: C 45,72; H 4,66; N 19,47; F 6,72.
1Н-ЯМР (300 мГц, Me2SO-d6) δ 58,63 и 8,58 (2с, 2Н, Н-8 и Н-2), 6,34 (дв. д. 1Н, H-1', IF,1' 7,1 Гц, I 2,4 Гц), 5,76 (д, 1Н, 3'-ОН, I 6,1 Гц), 5,45 (дв. дв. д, 1Н, Н-2', IF 2' 52,7 Гц, I1',2' 2,4 Гц, I2',3' 4,4 Гц), 5,17 (т, 1Н, 5'-ОН, I 5,1 Гц), 4,5 (м, 1Н, Н-3'), 4,11 (с, 3Н, О-СН3), 4 (м, 1Н, Н-4'), 3,75 (м, 1Н, Hα -5'), 3,62 (м, 1Н, Hβ -5').
П р и м е р 12. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-метокси-9Н-пурин.
2-Амино-6-метоксипурин (0,8 г, 4,8 ммоля), который может быть получен по методике R.W.Balsiger, I.A. Montgomery, (J.Org.Chem, 20, 1573, 1960), и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г 1,6 ммоля), который может быть получен по методике I.F.Codington и дp. (J.Org.Chem. 29, 558, 1964), суспендируют в 20 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. Затем добавляют тимидин-фосфорилазу (2400 МЕ) и фосфорилазу пуриновых нуклеозидов 3900 МЕ) (Т.А.Krenitsky и др. Biochemistry, 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 6-й день реакционную смесь разбавляют до 100 мл калийфосфатным буфером 5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия. На 10-й день реакционную смесь разбавляют до 200 мл калийфосфатного буфера (5 мМ рН 7), содержащего 0,04% (мас. /об) азида калия. На 16-й день добавляют тимидин-фосфорилазу (2640 МЕ) и фосфорилазу пуриновых нуклеозидов (4360 МЕ). На 24-й день реакционную смесь фильтруют и фильтрат испаряют. Остаток растворяют в метаноле и переносят в колонку (2,5х7 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью метанол-вода (9:1). После удаления растворителя в вакууме остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,5 гидрата, т.пл. 200-202оС.
УФ λmax нм (ε х 10-3): 0,1 н HCl 288 (7,85) 244,5 (6,43) рН 7 279,5 (8,09), 248 (8,85) 0,1 н NaOH 280 (8,4) 248,5 (8,59).
Анализ для C11H14FN5O4 ˙0,5H2O.
Вычислено: C 42,86; H 4,90; N 22,78; F 6,16.
Найдено: C 42,81; H 4,92; N 22,69; F 6,29.
1Н-ЯМР (300 мГц, Me2SO-d6) δ 8,12 (с, 1Н, Н-8), 6,57 (уш.с. 2Н, 2-NH2), 6,11 (дв. д, 1Н. Н-1',IF,1' 16,6 Гц), I 2,7 Гц), 5,69 (д, 1Н, 3'-OH, I 6,1 Гц). 5,31 (дв. дв.д. 1Н, Н-2, IF, 2'F 53Гц, I1',2' 2,7 Гц, I2',3' 4,4 Гц), 5,17 (т, 1Н, 5'-ОН, I 4,2 Гц), 4,4 (м, 1Н, Н-3), 3,95 (м, 4Н, Н-4 и О-СН3), 3,74 (м, 1Н, Hα -5'), 3,58 (м, 1Н, Hβ -5').
П р и м е р 13. 6-Циклопропиламино-9Н-пурин.
Раствор 6-хлорпурина (Олдрич Кемикл Компэни, 4,23 г, 27 ммолей) и циклопропиламина (Олдрич Кемикл Компани, 12,5 г, 22 ммоля) нагревают 48 ч при 60оС. Растворитель удаляют и сырой продукт очищают на колонке с силикагелем с элюированием CHCl3, содержащим 5% МеОН, и получением 5,9 г твердого вещества кремового цвета, перекристаллизацией которого из МеОН получают две фракции по 2,69 г и 1,16 г (общий выход 81,4%), т.пл. 237-240оС.
Анализ для C8H9N5.
Вычислено: C 54,85; H 5,18; N 39,87.
Найдено: C 54,69; H 5,22; N 39,87.
6-(Циклопропиламино)-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
6-(Циклопропиламино)-9Н-пурин (0,2 г, 1,1 ммоля), и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,6 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org.Chem 29, 558, 1964), суспендируют в 20 мл калийфосфатного буфера 5 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. Значение рН суспензии устанавливают равным 7 добавлением КОН. Затем добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ) (T. A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 5-й день добавляют 0,2 г 6-(циклопропиламино)пурина, тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ). На 9-й день добавляют 0,2 г 6-(циклопропиламино) пурина и добавление КОН устанавливают рН 7 в реакционной смеси. Также добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ). На 20-й день в реакционной смеси добавлением N4OH устанавливают рН 9,4 и реакционную смесь переносят в колонку (2,5 х 8,5 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью вода-метанол (7:3). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,4 гидрата, т.пл. 207-208оС.
УФ λmax нм ( ε х10-3): 0,1 н HCl 264 (19.1), рН 7 268 (18,2), 0,1 н, NaOH 268 (18,6).
Анализ для C13H16FN5O3 ˙0,4H2O.
Вычислено: C 49,33; H 5,35; N 22,13; F 6,00.
Найдено: C 49,33; H 5,33; N 22,11; F 6,14.
1Н-ЯМР (200 мГц, Me2SO-d6) δ 8,35 и 8,24 (2с, 2Н, Н-8 и Н-2), 7,98 (уш. д. 1Н, 6-NH, I 4,1 Гц). 6,23 (дв.д. 1Н, Н-1',IF,1' 16,8 Гц, I 2,9 Гц), 5,68 (д, 1Н, 3'-ОН, I 5,9 Гц), 5,42 (дв.дв.д, 1Н, Н-2', IF,2' 53 Гц, I1',2' 2,9 Гц, I2', 3' 4,6 Гц), 5,2 (т, 1Н, 5-ОН, I 5,6 Гц), 4,46 (м, 1Н, Н-3'), 3.97 (м, 1Н, Н-4'), 3,73 (м, 1Н,Hα -5'), 3,55 (м, 1Н, Hβ -5'), 3,04 (м, 1Н, N -CH), 0,66 (м. 4Н, СН2СН2).
П р и м е р 14. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-этокси-9Н-пурин.
2-Амино-6-этоксипурин (0,8 г, 4,5 ммоля), который может быть синтезирован по методике R.W.Balsiger, I.A.Montgomery (O.Org.Chem. 25, 1573, 1960), и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,5 г, 2,1 ммоля), который может быть получен по методике I.F.Codington и др. (J.Org.Сhem. 29, 558, 1964), суспендируют в 50 мл калийфосфатногo буфера (5 мМ, рН 7), содержащего 0,4% (мас./об.) азида калия. Добавлением КОН в суспензии устанавливают рН 7. Затем добавляют тимидин-фосфорилазу (4000 МЕ) и фосфорилазу пуриновых нуклеозидов (14000 МЕ) (Т.A.Krenitsky и др. Biochemistry 20, 3615, 1981, и патент США N 4381344) и реакционную смесь перемешивают при 37оС. На 4-й день добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (6980 МЕ) и реакционную смесь добавляют до 250 мл калийфосфатным буфером (5 мМ, рН 7), содержащем 0,04% (мас. /об. ) азида калия. На 14-й день растворитель удаляют в вакууме, остаток суспендируют в воде и для осаждения белка добавляют метанол. После фильтрования суспензии фильтрат испаряют. Остаток растворяют в горячей воде и переносят в колонку (1,5х15 см) с анионообменной смолой (Био-Ред АСIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью метанол-вода (1:1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,7 гидрата, т.пл. 85оС (частично плавится при 50оС).
УФ λmax нм ( ε х10-3): 0,1 н HCl 288 (8,78) 244,5 (7,19) рН 7 280 (8,96), 247,5 (9,55), 0,1 н NaOH 280 (9,25), 249 (9,15).
Анализ для С12Н16FN5O4 ˙0,7H2O.
Вычислено: C 44,23; H 5,38; N 21,49; F 5,83.
Найдено: С 44,30; H 5,43; N 21,39; F 5,81.
1Н-ЯМР (200 мГц, Me2SO-d6) δ 8,09 (с, 1Н, Н-8), 6,49 (уш.с. 2Н, 2-NH2), 6,08 (дв.д. 1Н, Н-1',IF1' 16,4 Гц, I 2,7 Гц). 5,67 (д, 1Н, 3'-OH, I 6,1 Гц), 5,42 (м, 0,5 Н, 0,5 (Н-2)), 5,15 (м, 1Н, 0,5 (Н-2') и 5'-ОН), 4,44 (к, 2Н, 6-ОСН2, I 7 Гц), 4,4 (м, 1Н, Н-3), 3,92 (м, 1Н, Н-4'), 3,73 (м, 1Н, Hα-5'), 3,56 (м, 1Н, Hβ -5'), 1,34 (т,3Н, СН3, I 7 Гц).
П р и м е р 15. 2-Амино-6-хлор-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
Реакция 1. 2-Амин-6-хлорпурин (сигма Кемикл Компэни), 0,8 г, 4,7 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,6 ммоля), который может быть синтезирован по методике I.F.Codington и др. J.Org.Chem. 29, 558, 1964), суспендируют в 50 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас. /об.) азида калия. Добавлением КОН в суспензию устанавливают рН 7, после чего добавляют тимидин-фосфорилазу (3850 МЕ) и фосфорилазу пуриновых нуклеозидов (6500 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 22-й день реакционную смесь разбавляют до 100 мл калийфосфатным буфером (5 мМ, рН 7) содержащим 0,04% (мас./об.) азида калия с добавлением тимидин-фосфорилазы (1270 МЕ) и фосфорилазы пуриновых нуклеозидов (2180 МЕ). На 32-й день реакционную смесь разбавляют до 200 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия, с добавлением тимидин-фосфорилазы (2540 МЕ) и фосфорилазы пуриновых нуклеозидов (4360 МЕ). На 61-й день реакционную смесь фильтруют, фильтрат испаряют и остаток хранят при 4оС. фосфорилазу (3850 МЕ) и фосфорилазу пуриновых нуклеозидов (6500 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 22-й день реакционную смесь разбавляют до 100 мл калийфосфатным буфером (5 мМ, рН 7) содержащим 0,04% (мас./об.) азида калия с добавлением тимидин-фосфорилазы (1270 МЕ) и фосфорилазы пуриновых нуклеозидов (2180 МЕ). На 32-й день реакционную смесь разбавляют до 200 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия, с добавлением тимидин-фосфорилазы (2540 МЕ) и фосфорилазы пуриновых нуклеозидов (4360 МЕ). На 61-й день реакционную смесь фильтруют, фильтрат испаряют и остаток хранят при 4оС.
Реакция 2. 2-Амино-6-хлорпурин (Сигма-Кемикл Компэни, 0,8 г, 4,7 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,6 ммоля) суспендируют в 25 мл калийфосфатного буфера (10 мМ, рН 7), содержащим 0,04% (мас. /об.) азида калия. Затем добавляют тимидин-фосфорилазу (4000 МЕ) и фосфорилазу пуриновых нуклеозидов (6500 МЕ) и суспензию перемешивают при 37оС. На 10-й день реакционную смесь разбавляют до 100 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия, с добавлением тимидин-фосфорилазы (2640 МЕ) и фосфорилазы пуриновых нуклеозидов (4360 МЕ). На 53-й день реакционную смесь фильтруют, фильтрат испаряют и остаток хранят при 4оС. Остатки от реакций 1 и 2 суспендируют в воде и объединяют. Суспензию нагревают и фильтруют. Содержащийся в фильтрате продукт очищают хроматографией на колонке (7,5х90 см) Биогеля Р-2 (Био-Ред) с применением в качестве растворителя смеси н-пропанол-вода (3:7), затем хроматографией на колонке (5х90 см) Сефадекса G-10 (Фармация ЛКВ) с применением в качестве растворителя смеси н-пропанол-вода (3:7). Содержащие только продукт фракции объединяют и растворитель удаляют в вакууме. Остаток суспендируют и лиофилизацией получают заглавное соединение (партия 1). Фракции, содержащие продукт плюс примеси, элюирующиеся с колонки Сефадекса G-10, объединяют и растворитель удаляют в вакууме. Остаток растворяют в смеси вода-MeCN (49:1) и продукт подвергают дальнейшей очистке хроматографией с обращением фаз на С18 окиси кремния (хай-хром Преп-40-ODS, Регис Кемикл Ко), с применением в качестве растворителя смеси вода-MeCN (49: 1). Содержание продукт фракции объединяют и для удаления остатков окиси кремния фильтруют через нейлоновый фильтр с размером пор 0,2 мкм. После удаления растворителя в вакууме остаток растворяют в воде и фильтруют через микропористый мембранный фильтр (0,22 Миллипор GS). Лиофилизацией фильтрата получают заглавное соединение, которое анализируют в виде 0,5 гидрата (партия 2).
Данные для партии 1.
Т. пл. 212оС (частичное плавление при 205оС) УФ λmax нм ( ε х 10-3): 0,1 н HCl 309 (6), 2,47 (5,6), рН 7, 307,5 (6,3), 247 (5,8), 0,1 н NaOH 307 (6,4) 247 (5,3).
Анализ для C10H11CHFN5O3.
Вычислено: C 39,55; H 3,65; N 23,06; Cl 11,67; F 6,26.
Найдено: C 39,69; H 3,82; N 22,84; Cl 11,64; F 6,14.
1H-ЯМР (300 мГц, Me2SO-d6) δ 8,37 (с, 1Н, Н-8), 7,07 (уш. с. 2Н, 2-NH2), 6,12 (дв. д. Н-1', IF,1'= 16,6 Гц, I 2 Гц), 5,72 (д, 1Н, 3'-ОН, I 6,4 Гц), 5,34 (дв.дв. д, 1Н, Н-2', IF,2' 52,9 Гц, I1',2' 2 Гц, I2', 3' 4,2 Гц), 5,19 (т, 1Н, 5'-OH, I 5,3 Гц), 4,42 (м, 1Н, Н-3), 3,96 (м, 1Н, Н-4), 3,76 (м, 1Н, Hα -5'), 3,61 (м, 16, Hβ -5').
Данные для партии 2.
Т.пл.215оС.
УФ λmax нм: 0,1 н HCl 309,5 246,5; рН 7 307,5, 247; 0,1 н. NaOH 307,5. 247.
Анализ для C10H11ClFN5O3 ˙0,5H2O
Вычислено: C 38,41; H 3,97; N 22,40; Cl 11,34; F 6,08.
Вычислено: C 38,41; H 3,97; N 22,40; Cl 11,34; F 6,08.
Найдено: С 38,73; H 3,79; N 22,14; Cl 11,16; F 6,10.
1Н-ЯМР (80 мГц, Me2SO-d6) δ 8,36 (с, 1Н, Н-8), 7,03 (уш.с. 2Н. 2-NH2), 6,13 (дв.д. 1Н, Н-1',IF, 1' 16,8 Гц, I 3,2 Гц), 5,68 (м, 1, 5Н, 0,5 (Н-2') и 3'-OH), 5,15 (м, 1,5Н, 0,5 (Н-2') и 5'-ОН), 4,35 (м, 1Н, Н-3'), 3,9 (м, 1Н, Н-4'), 3,72 (м, 2Н, Hα -5' и Hβ 5').
П р и м е р 16. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-метиламино-9Н-пурин.
2-Амино-6-метиламинопурин (I.A.Mantgomery, L.B.Holum, I.A.C.S. 80, 404, 1958, 0,51 г, 3.1 ммоля) и 1-(2-дезокси-2-фтор- β-D-фуранозил)урацил (0,52 г, 2,1 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964) суспендируют в 50 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. Затем добавляют тимидин-фосфорилазу (4000 МЕ) и фосфорилазу пуриновых нуклеозидов (14000 МЕ) (T. A.Krenitsky и др. Biochemistry, 20, 3615, 1081 и патент США N 4381344) и суспензию перемешивают при 37оС. На 6-й день реакционную смесь разбавляют до 250 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% азида натрия, с добавлением 0,49 г 2-амино-6-метиламинопурина, тимидин-фосфорилазы (4000 МЕ) и фосфорилазы пуриновых нуклеозидов (14000 МЕ). На 14-й день реакционную смесь испаряют, остаток суспендируют в смеси метанол-вода и суспензию фильтруют. Фильтрат испаряют, остаток растворяют в воде и переносят в колонку (2,5х13 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью метанол-вода (1: 1). После удаления растворителя в вакууме остаток растворяют в воде и фильтруют через мембранный фильтр с размером пор 0,22 мкм. Лиофилизацией фильтрата получают заглавное соединение, которое анализируют в виде 0,5 гидрата, т.пл. 172оС.
УФ λmax нм (Σ х10-3): 0,1 н. HCl 292,5 (11,5), 255 (12,1); рН 7 279,5 (13,4), 263 (sh); 0,1 н. NaOH 280 (13,7), 263 (sh).
Анализ для C11H15FN6O3 ˙ 0,5H2O
Вычислено: С 43,00; Н 5,25; N 27,35; F 6,18.
Вычислено: С 43,00; Н 5,25; N 27,35; F 6,18.
Найдено: C 42,99; H 5,28; N 27,33; F 6,16.
1Н-ЯМР (200 мГц, Me2SO-d6) δ 7,92 (с, 1Н, H-8), 7,28 (уш.с, 1Н, 6-NH), 6,13 (дв.д, 1Н, Н-1',IF,1' 16,3 Гц, I 3,3 Гц), 5,91 (уш.с, 2Н, 2-NH2), 5,64 (дб 1Н, 3'-ОН, I 5,8 Гц), 5,29 (дв.дв.д, 1Н, Н-2', IF,2' 53 Гц, I1',2' 3,3 Гц, I,2',3' 4,4 Гц), 5,27 (т, 1Н, 5'-OH, I 5,5 Гц), 4,37 (м, 1Н, Н-3'), 3,92 (м, 1Н, Н-4'), 3,72 (м, 1Н, Hα -5'), 3,6 (м, 1Н, Hβ-5'), 2,86 (уш.с. 3Н, N-CH3).
П р и м е р 17. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гипоксантин.
6-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин 0,29 г, 1 ммоль, получение см. пример 8) растворяют в 100 мл воды, добавляют аденозин-дезаминазу кишечника теленка (4 МЕ, Берингер Маннхайм) и раствор инкубируют 24 ч при 37оС. Растворитель удаляют в вакууме, остаток растворяют в смеси воды с н-пропанолом (7:3) и хроматографируют на колонке (5х90 см) Сефадекса С-10 (Фармация ЛКВ) с применением в качестве растворителя смеси воды с н-пропанолом (7: 3). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде гидрата, т.пл. 175оС (частичное плавление при 125оС).
УФ λmax нм (ε х 10-3): 0,1 н. HCl 249 (11,8), рН 7, 248,5 (12):0,1 н. NaOH 253 (13).
Анализ для C10H11FN4O4 ˙H2O.
Вычислено: C 41,67; H 4,55; N 19,44; F 6,59.
Найдено: С 41,72; H 4,58; N 19,46; F 6,37.
1Н-ЯМР (300 мГц, Me2SO-d6) δ: 8,33 и 8,09 (2с, 2Н, Н-8 и Н-2), 6,21 (дв. д. 1Н, Н-1, IF1' 16,8 Гц, I 2,4 Гц), 5,75 (уш.с. 1Н, 3'-ОН), 5,36 (дв.дв.д, 1Н, Н-2', IF-, 2' 52,7 Гц, I1', 2' 2,4 Гц, I1',3' 4,4 Гц), 5,2 (уш.с. 1Н, 5'ОН), 4,43 (кажущийся дв.м. 1Н, Н-3', IF,3' 18,9 Гц), 3,97 (м, 1Н, Н-4'), 3,75 (м, 1Н, Hα -5'), 5,59 (м, 1Н, Hβ -5').
П р и м е р 18. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-пропокси-9Н-пурин.
2-Амино-6-пропоксипурин (0,3 г, 1,6 ммоля), который может быть синтезирован по методике R.W.Balsiger, I.A. Momtgomery (J.Org.Chem. 25, 1573, 1960) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,52 г, 2,1 ммоля), который может быть получен по методике I.Г.Соо и оlо и др. (J.Org.Chem. 29, 558, 1964), суспендируют в 50 мл калийфосфатного буфера (2мМ, рН 7) содержащего 0,04 (масc. /об) азида натрия. Добавлением КОН устанавливают рН суспензии 7 и затем добавляют тимидин-фосфорилазу (4000 МЕ) и фосфорилазу пуриновых нуклеозидов (14000 МЕ) (T.A.Krenitsky и др. Biochemistry 30, 3615, 1981 и патент США N 4381344) и реакционную смесь перемешивают при 37оС. На 6-й день реакционную смесь разбавляют до 250 мл калийфосфатным буфером (5 мМ, рН 7), содержащем 0,04% (мас./об.), с добавлением тимидин-фосфорилазы (4000 МЕ) и фосфорилазы пуриновых нуклеозидов (14000 МЕ). На 14-й день растворитель удаляют в вакууме, остаток суспендируют в водном метаноле и суспензию фильтруют. Фильтрат испаряют, остаток растворяют в горячей воде и переносят на колонку (2,5х13 см) с анионообменной смолой (Био-Ред, AGIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью метанол-вода (1: 1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,9 гидрата, т.пл. 93оС (частичное плавление при 65оС).
УФ λmax нм (ε х10-3): 0,1 н. HCl 989 (9,05), 245 (7,37), рН 7 280 (9,28), 248 (9,82); 0,1 н. NaOH 280,5 (9,67), 249,5 (9,55).
Анализ для C13H18FN5O4˙ 0,9H2O
Вычислено: C 45,69; H 5,78; N 20,49; F 5,56.
Вычислено: C 45,69; H 5,78; N 20,49; F 5,56.
Найдено: C 45,75; H 5,61; N 20,51; F 5,6.
1Н-ЯМР (200 мГц, Me2SO-d6) δ 8,09 (с, 1Н, Н-8), 6,49 (уш.с. 2Н, 2-NH2), 6,08 (дв.д, 1Н, Н-1, IF,1' 16,4 Гц, I 2,7 Гц), 5,65 (д, 1Н, 3'-ОН, I 6 Гц), 5,42 (кажущийся т, 0,5 Н, 0,5 (Н-2'); I 3,5 Гц), 5,14 (м, 1,5 Н, 0,5 (Н-2') и 5'-ОН), 4,36 (м, 3Н, Н-3' и 6-OCH2), 3,92 (м, 1Н, Н-4'), 3,69 (м, 1Н, Hα -5'), 3,6 (м, 1Н, Hβ -5'), 1,75 (кажущийся секстет, 2Н, СН2, I 7,1 Гц), 0,95 (т. 3Н, СН3, I 7,4 Гц).
П р и м е р 19. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-йод-9Н-пурин.
2-Амино-6-иодопурин (0,8 г, 3,1 ммоль), который может быть получен по методике R.T.Koda и др. (J.Pharm.Sci. 57, 2056, 1968) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,39 г, 1,6 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org.Chem.29, 558, 1964), суспендируют в 20 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. Добавлением КОН в суспензии устанавливают рН 7, после чего добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (3250 МЕ) (T. A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 12-й день добавлением уксусной кислоты устанавливают рН 6,8 и добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (3250 МЕ). На 26-й день реакционную смесь разбавляют до 500 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия, с добавлением тимидин-фосфорилазы (2000 МЕ) и фосфорилазы пуриновых нуклеозидов (3250 МЕ). На 40-й день реакционную смесь фильтруют, фильтрат испаряют, остаток суспендируют в смеси воды с н-пропанолом (7: 3) и фильтруют. Фильтрат испаряют, остаток суспендируют в метаноле и затем фильтруют. Содержащийся в фильтрате продукт очищают хроматографией на колонке (5х90 см) Биогеля Р-2 (Био-Ред) с применением в качестве растворителя смеси воды с н-пропанолом (7:3), затем хроматографированием на колонке (5х90 см) Сефадекса G-10 (Фармация ЛКВ) с применением в качестве растворителя смеси воды с н-пропанолом (7:3). После удаления растворителя в вакууме остаток суспендируют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,6 гидрата, т.пл. 135оС (частичное плавление при 108-110оС).
УФ λmax нм ( ε х10-3): 0,1 н.HCl 318 (7,94); рН 7 315 (8,3), 0,1 н.NaOH 315 (8,36).
Анализ для C10H11FIN5O3 ˙0,6H2O.
Вычислено: С 29,59; H 3,03; N 17,25; F 4,68; I 31,26.
Найдено: C 29,69; H 3,06; N 17,22; F 4,44; I 31,47.
1Н-ЯМР (300 мГц, Me2SO-d6) δ 8,33 (с, 1Н, Н-8), 6,96 (уш.с. 2Н, 2-NH2), 6,09 (дв. д. 1Н, Н-1',IF,1' 16,7 Гц, I 2,4 Гц), 5,69 (д, 1Н, 3'-OH, I 6,3 Гц), 5,33 (дв.дв.д, 1Н, Н-2', IF,2' 52,8 Гц, I1',2' 2,4 Гц, I2',3' 4,2 Гц), 5,16 (т, 1Н, 5'-OH. I 5,3 Гц), 4,42 (м, 1Н, Н-3'), 3,95 (м, 1Н, Н-4'), 3,77 (м, 1Н, Hα -5') 3,6 (м, 1Н, Hβ -5').
П р и м е р 20. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)-6-метиламино-9Н-пурин.
6-Метиламинопурин (Сигма Кемикл Компэни, 0,8 г, 5,4 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,39 г, 1,6 ммоля), который может быть синтезирован по методике I.F.Codington и дp. (J.Org.Chem. 29, 558, 1964), суспендируют в 20 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас. /об. ) азида калия. Затем добавляют тимидин-фосфорилазу (2400 МЕ) и фосфорилазу пуриновых нуклеозидов (3900 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 6-й день реакционную смесь разбавляют до 100 мл калий-фосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия. На 17-й день реакционную смесь фильтруют, фильтрат испаряют, остаток растворяют в воде и переносят в колонку (2,5х7 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). Продукт элюируют водой. Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в воде и фильтруют через мембранный фильтр с размером пор 0,2 мкм. Лиофилизацией фильтрата получают заглавное соединение, т.пл. 140оС (дает усадку при 65оС, частичное плавление при 110оС).
УФ λmax нм ( ε x10-3): 0,1 н. HCl 261,5 (16,2), рН 7 265,5 (15); 0,1 н. NaOH 266 (15,3).
Анализ для C11H14FN5O3.
Вычислено: C 46,64; H 4,98; N 24,72; F 6,71.
Найдено: C 46,48; H 5,07; N 24,63; F 6,93.
1Н-ЯМР (300 мГц, Me2SO-d6) δ: 8,37 и 8,25 (2с, 2Н, Н-8 и Н-2), 7,86 (уш. с. 1Н, 6-NH), 6,24 (дв.д. 1Н, Н-1', IF, 1'=16,8 Гц, I 3,2 Гц), 5,74 (д. 1Н, 3'-ОН, I 6,1 Гц), 5,44 (дв.дв.д. 1Н, Н-2',IF,2' 53 Гц, I1',2' 3,2 Гц, I2',3' 4,4 Гц), 5,28 (т, 1Н, 5'-OH, I 5,6 Гц), 4,49 (м, 1Н, Н-3'), 3,99 (м, 1Н, Н-4'), 3,75 (м, 1Н, Hα -5'), 3,58 (м, 1Н, Hβ -5'), 2,95 (уш.с. 3Н, N-СН3).
П р и м е р 21. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)-6-этокси-9Н-пурин.
6-Этоксипурин (Сигма Кемикл Компэни, 0,2 г, 1,2 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,6 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964), суспендируют в 20 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас. /об. ) азида калия. Добавлением КОН в суспензии устанавливают рН 7, добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ) (T. A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 5-й день добавляют дополнительные количества тимидин-фосфорилазы (2000 МЕ) и фосфорилазы пуриновых нуклеозидов (2770 МЕ). На 9-й день добавляют 0,2 г 6-этоксипурина, добавлением КОН устанавливают рН 7 и добавляют тимидин-фосфорилазу (2000 МЕ) и фосфорилазу пуриновых нуклеозидов (5540 МЕ). На 28-й день суспензию фильтруют, фильтрат переносят на колонку 2,5 х 8,5 см с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). После промывания водой продукт элюируют смесью метанол-вода (3: 7). Содержащие продукт фракции объединяют и растворитель удаляют в вакууме. Остаток растворяют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,5 гидрата, т.пл. 85-87оС (частичное плавление при 60оС).
УФ λmax нм (ε х 10-3): 0,1 н. HCl 249 (11,4); рН 7, 248 (11,7), 0,1 н. NaOH 249 (12).
Анализ для C12H15FN4O4 ˙0,5H2O.
Вычислено: C 46,91; H 5,25; N 18,23; F 6,18.
Найдено: C 46,80; H 5,23; N 18,21; F 6,65.
1Н-ЯМР (200 мГц, Me2SO-d6) δ 8,59 и 8,53 (2с, 2Н, Н-8 и Н-2), 6,31 (дв. д. 1Н, Н-1',IF,1' 17 Гц, I 2,5 Гц), 5,7 (д, 1Н, 3'-OH, I 6,3 Гц), 5,43 (дв. дв. д, 1Н, Н-2',IF,1' 52,9 Гц, I1',2' 2,5 Гц, I2',3' 4,4 Гц), 5,12 (т, 1Н, 5'-ОН, I 5,4 Гц), 4,59 (к, 2Н, 6-OCH2, I 7 Гц), 4,51 (м, 1Н, Н-3'), 3,98 (м, 1Н, Н-4'), 3,73 (м, 1Н, Hα -4'), 3,61 (м, 1Н, Hβ-5'), 1,4 (т, 3Н, -СН3, I 7 Гц).
П р и м е р 22. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-метилтио-9Н-пурин.
2-Амино-6-метилтиопурин (Сигма Кемикл Компэни, 0,6 г, 3,3 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,3 г, 1,2 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org.Chem. 29, 558, 1964), суспендируют в 200 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. Затем добавляют тимидин-фосфорилазу (4000 МЕ) и фосфорилазу пуриновых нуклеозидов (6500 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 14-й день реакционную смесь разбавляют до 400 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.) азида калия, с добавлением тимидин-фосфорилазы (8000 МЕ) и фосфорилазы пуриновых нуклеозидов (6500 МЕ). На 25-й день добавлением КОН в реакционной смеси устанавливают рН 6,9. На 39-й день реакционную смесь отфильтровывают, фильтрат переносят на колонку (2,5х13 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма) и продукт элюируют смесью метанол-вода (3:7). После удаления растворителя в вакууме остаток суспендируют в воде и лиофилизацией получают заглавное соединение, которое анализируют в виде 0,5 гидрата, т.пл. 85-87оС.
УФ λmax нм (ε х10-3): 0,1 н. HCl 327 (11,6), 250 (11,2), 263 (sh). рН 7, 311 (12,8), 257 (sh), 246 (15,1), 0,1 н. NaOH 311 (13,3), 257 (sh), 246 (14,8).
Анализ для C11H14FN5O3S ˙0,5H2O
Вычислено: C 40.74; H 4,66; N 21,59; F 5,80; S 9,89.
Вычислено: C 40.74; H 4,66; N 21,59; F 5,80; S 9,89.
Найдено: C 40,79; H 4,66; N 21,55; F 5,89; S 9,84.
1Н-ЯМР (80 мГц, Me2SO-d6) δ: 8,17 (с, 1Н, Н-8), 6,57 (уш.с, 2Н, 2-NH2), 6,14 (дв.д. 1Н, Н-1',IF.1' 16,4 Гц, I 3,2 Гц), 5,64 (м, 1,5 Н, 0,5 (Н-2') и 3'-ОН), 5,11 (м, 1,5 Н, 0,5 (Н-2') и 5'-OH), 4,4 (м, 1Н, Н-3'), 3,95 (м, 1Н, Н-4'), 3,65 (м, 1Н, Hα -5', и Hβ -5'), 2,58 (с, 3Н, 6-СН3).
П р и м е р 23. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)-6-йод-9Н-пурин.
6-иодопурин (Сигма Кемикл Компэни, 0,7 г, 2,7 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,7 ммоля), который может быть синтезирован по методике I.F.Codington и др. (J.Org. Chem. 29, 558, 1964) суспендируют в 20 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас./об.) азида калия. Затем добавляют тимидин-фосфорилазу (2640 МЕ) и фосфорилазу пуриновых нуклеозидов (4360 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 21-й день реакционную смесь разбавляют до 50 мл калийфосфатным буфером (5 мМ, рН 7), содержащим 0,04% (мас./об.), с добавлением тимидин-фосфорилазы (4000 МЕ) и фосфорилазы пуриновых нуклеозидов (3250 МЕ). На 57-й день реакционную смесь отфильтровывают, фильтрат испаряют, остаток растворяют в смеси воды с н-пропанолом (7: 3) и переносят на колонку (7,5х90 см) Биогеля Р-2 (Био-Ред), где в качестве растворителя применяют смесь воды с н-пропанолом (7: 3). Содержащие продукт фракции объединяют, растворитель упаривают в вакууме, остаток растворяют в горячем метаноле, после чего добавляют воду до момента образования осадка. Метанол удаляют в вакууме и после выдерживания в течение ночи суспензию отфильтровывают. В фильтровальном пироге содержится основная масса продукта. Фильтрат испаряют и вышеприведенную процедуру повторяют с целью осаждения остатков продукта. Фильтровальные пироги объединяют и суспендируют в воде. Лиофилизацией получают заглавное соединение, т.пл. 198-200оС (разл.).
УФ lambda<N>max нм (ε х10-3): 0,1 н. HCl 275 (11,1), 257 (sh), рН 7 275 (11,1), 258 (sh), 0,1 н. NaOH 276 (9,98), 257 (sh), 303 (sh).
Анализ для C10H10FIN4O3.
Вычислено: C 31,6; H 2,65; N 14,74; F 5,00; I 33,39.
Найдено: С 31,7; H 2,7; N 14,69; F 4,96; I 33,48.
1Н-ЯМР (80 мГц, Me2SO-d6) δ 8,87 и 8,66 (2с, 2Н, Н-8 и Н-2), 6,53 (дв.д. 1Н, Н-1',IF,1' 17 Гц, I 2 Гц), 5,76 (м, 1,5 H, 0,5 (Н-2') и 3'-ОН), 5,14 (м, 1, 5Н, 0,5 (Н-2') и 5'-ОН), 4-51 (м, 1Н, Н-3'), 3,99 (м, 1Н, Н-4'), 43,7 (м, 2Н, Hα-5' и Hβ -5').
П р и м е р 24. Получение 9-(2-дезокси-2-фтор-5-O-L-валинил-β-D-pибофуранозил) аденина и его дихлоргидрата.
К раствору 9-(2-дезокси-2-фтор- β-D-pибофуранозил)аденина (500 мг, 1,86 ммоля), ФМОК-L-валина (820 мг, 1,3 экв) и ДМАП (10 мг) в сухом ДМФА (14 мл) при 0оС и перемешивании прибавляют раствор дициклогексилкарбодимида (ДЦК, 520 мг, 1,35 экв) в CH2Cl2 (2 мл). Смесь оставляют нагреваться до комнатной температуры, перемешивают 90 мин и затем испаряют в вакууме. После совместного испарения с этанолом остаток переносят в смесь СHCl3-MeOH (9:1) и отфильтровывают. Фильтрат испаряют и остаток подвергают вытеснительной хроматографии на SiO2 с элюированием градиентом E+ОН в CHCl3 (5-10%).
Элюирующая первой фракция представляет собой 3',5'-бисэфир (230 мг) с некоторой примесью дициклогексилмочевины. Второй фракцией является 3'-моноэфир и третья фракция содержит 5'-моноэфир (190 мг).
5'-ФМОК защищенный валинат затем обрабатывают в течение 5 минут при комнатной температуре раствором пиперидина (1 мл) в ДМФА (4 мл), испаряют в вакууме, растворяют в воде (25 мл) и промывают CHCl3 (30 мл). После испарения воды получают бесцветную смолу, которую переносят в водную уксусную кислоту, испаряют и после совместного испарения с этанолом и эфиром получают 5-O-валинат в виде гигроскопичного аморфного вещества (100 мг) т.пл. (разлагается выше 150оС).
Анализ для C15H21FN6O4˙1,5CH3CO2Hx x1,5H2O
Вычислено: C 44,53; H 6,23; N 17,32.
Вычислено: C 44,53; H 6,23; N 17,32.
Найдено: C 44,38; H 6,32; N 16,94.
Дихлоргидрат получают растворением 5'-O-валината в изопропаноле с последующим добавлением изопропанола, предварительно насыщенного газообразным хлористым водородом, и затем испарением растворителя. Белое вещество переносят в MeOH и осаждают при 0оС эфиром. Фильтрованием получают дихлоргидрат, т.пл. 210-213оС.
Анализ для C15H21FN6O4 2HCl˙0,5H2O
Вычислено: C 40,00; H 5,37; N 18,67.
Вычислено: C 40,00; H 5,37; N 18,67.
Найдено: C 40,26; H 5,19; N 18,74.
П р и м е р 25. Дихлоргидрат-2-амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурина.
К раствору 2-амино-9-(2-дезокси- β-D-рибофуранозил)-9Н-пурина (300 мг, 1,11 ммоля) в MeOH (20 мл) прибавляют изопропанол (2,5 мл), предварительно насыщенный газообразным хлористым водородом (HCl). Затем добавляют ацетон (15 мл) и раствор испаряют при комнатной температуре в вакууме почти досуха. Ополаскиванием этилацетатом (15 мл) получают белое вещество, которое отфильтровывают и промывают эфиром, т.пл. 160-163оС.
Анализ для C10H12FN5O3 2HCl.
Вычислено: C 35,01; H 4,12; N 20,42; F 5,55.
Найдено: C 34,79; H 4,23; N 20,32; F 5,66.
П р и м е р 26. Дихлоргидрат 2,6-диамино-9-(2-дезокси-2-фтор- -D-рибофуранозил)-9Н-пурина.
К раствору 2,6-диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурина (300 мг, 1,06 ммоля) в МеОН (30 мл) добавляют изопропанол (2 мл), предварительно насыщенный газообразным HCl. Затем раствор испаряют до небольшого объема (5 мл) и добавляют Е+ОН (15 мл) с осаждением дихлоргидрата в виде белого вещества с т.пл. 165-168оС (разл.).
Анализ для C10H13FN6O3 ˙2HCl.
Вычислено: C 33,62; H 4,23; N 23,53; F 5,32.
Найдено: С 33,54; H 4,24; N 22,98; F 5,33.
П р и м е р 27. Натриевая соль 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина.
К 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанину (50 мг, 0,175 ммоля) добавляют раствор NaOH (7 мг) в воде (2 мл) и смесь осторожно нагревают до образования прозрачного раствора. Последующий лиофилизацией раствора получают заглавное соединение в виде белого вещества с т.пл. 185-190оС (разл.).
Анализ для C10H11FN5O4Na ˙1,75H2O.
Вычислено: C 35,45; H 4,31; N 20,67.
Найдено: C 35,59; H 4,33; N 20,64.
П р и м е р 28. Хлоргидрат 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина.
К раствору 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина (300 мг, 1,05 ммоля) в МеОН (200 мл) прибавляют раствор изопропанола (2 мл), предварительно насыщенного газообразным HCl, с последующим добавлением ацетона (50 мл). Раствор испаряют до небольшого объема (30 мл), добавляют ацетон (150 мл) и смесь вновь уменьшают до небольшого объема. Операцию повторяют до конечного объема 10 мл, в котором добавляют E+ОН (20 мл) и затем Е+ОАс (40 мл). При стоянии осаждается продукт в виде белого вещества, т.пл. 192-193оС (разл.)
Анализ для C10H12FN5O4HCl˙0,4H2O
Вычислено: C 36,51; H 4,23; N 21,29; Cl 10,77.
Анализ для C10H12FN5O4HCl˙0,4H2O
Вычислено: C 36,51; H 4,23; N 21,29; Cl 10,77.
Найдено: С 36,50; H 4,54; N 21,36; Cl 10,90.
П р и м е р 29. Хлоргидрат 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденина.
К раствору 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденина (500 мл, 1,86 ммоля) в МеОН (40 мл) и воде (10 мл) прибавляют раствор изопропанола (15 мл), предварительно насыщенного газообразным HCl. Раствор испаряют при комнатной температуре в вакууме и после ополаскивания Е+ОН (25 мл) получают заглавное соединение в виде белого вещества с т.пл. 205-210оС (разл.).
Анализ для C10H12FN5O3 HCl.
Вычислено: C 39,29; H 4,29; N 22,91; Cl 11,60.
Найдено: C 39,36; H 4,34; N 22,89; Cl 11,52.
П р и м е р 30. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин -5'-монофосфат.
9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин (пример 8, 0,47 г, 1,7 ммоля) растворяют в 7 мл 1,3-диметил-3,4,5,6-тетрагидро- 2(1Н)-пиримидинона и после охлаждения раствора в бане метанола со льдом до -8оС при интенсивном перемешивании прибавляют 0,64 мл хлорокиси фосфора (7 ммолей). Спустя 3 мин реакцию прекращают добавлением 10 мл холодной воды. Полученную реакционную смесь выдерживают 15 мин на льду и затем нейтрализуют до рН 8 добавлением гидроокиси аммония.
Разделение продуктов осуществляют с помощью анионообменной хроматографии на ДЭАЭ-Сефадексе А-25. Реакционную смесь разбавляют до 600 мл водой и переносят на хроматографическую колонку, заполненную примерно 80 мл ДЭАЭ-Сефадекса А-25, предварительно уравновешенного 50 мМ бикарбоната аммония. С целью удаления неорганического фосфата колонку промывают 2,5 л 50 Мм бикарбонатом аммония. Нуклеотиды элюируют 2 л линейного градиента бикарбоната аммония (50-500 мМ). Первый элюируется 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденин-5-монофосфат, затем 9-(2-дезокси-2-фтор- β-D-рибофуранозил)- 3,5-биофосфат. Содержащие каждый нуклеотид фракции объединяют и сушат в вакууме с удалением воды и бикарбоната аммония.
По вышеприведенной схеме получают аммониевую соль 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденин-5'-монофосфата, но фармакологически желательна натриевая соль. Обмен аммониевый соли на натриевую соль осуществляют на анионообменной смоле Дауэкс 50. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин-5'-монофосфат (1,3 ммоля) в 10 мл воды переносят в колонку, заполненную примерно 10 мл Био-Ред AG50W-Х8 (натриевая форма), предварительно уравновешенной водой. Фракции, содержащие 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденин-5'-монофосфат, объединяют и после лиофилизации получают 0,49 г (1,2 ммоля, выход 72%) продукта.
1Н-ЯМР (ДМСО-d6) δ 8 (с, 1Н, Н2), 707 (с, 1Н, Н8), 5,7 и 5,9 (дв.д. 16, Н1', расщеплен Н2',F), 4,8 и 5 (дв.д. 1Н, Н2', расщеплен Н1',F), 4,1 (м, 1Н, Н3'), 3,9 (м, 1Н, Н4'), 3,6 (2Н, м, Н5').
1Н-ЯМР (D2O) δ 8,5 (с, 1Н, Н2), 8,2 (с, 1Н, Н8), 6,3 и 6,5 (д, 1Н, Н1', расщеплен Н2',F), 5,3 и 5,6 (д, 1Н, Н2', расщеплен Н1'F), 4,7 (м, 1Н, Н3'), 4,4 (м, 1Н, Н4'), 4,1 (м, 2Н, Н5').
31Р-ЯМР (D2O): 1,46 (с)
УФ-спектр: в 0,1 М HCl ε λmax при 256 нм, в 400 мМ фосфата аммония (рН 5,5) λmax при 259 нм, в 0,1 М NaOH λmax при 259 нм. Масс-спектр дает два основных пика при молекулярных ионных фрагментах массой 270 и 136, соответствующих соответственно 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденину.
УФ-спектр: в 0,1 М HCl ε λmax при 256 нм, в 400 мМ фосфата аммония (рН 5,5) λmax при 259 нм, в 0,1 М NaOH λmax при 259 нм. Масс-спектр дает два основных пика при молекулярных ионных фрагментах массой 270 и 136, соответствующих соответственно 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденину.
Полное расщепление нуклеозида наблюдается после инкубирования с 5-нуклеотидазой (Сигма).
Отношение основание:фосфат 1:1,03. Концентрацию всего фосфата определяют по методике B.N.Ames в "Методах ферментологии", т.8, с.115-118, 1966. Концентрацию нуклеозида определяют по коэффициенту экстинкции в УФ-спектре нуклеозида.
Полное расщепление нуклеозида наблюдается после инкубирования с 5-нуклеотидазой (Сигма).
Отношение основание:фосфат 1:1,03. Концентрацию всего фосфата определяют по методике B.N.Ames в "Методах ферментологии", т.8, с.115-118, 1966. Концентрацию нуклеозида определяют по коэффициенту экстинкции в УФ-спектре нуклеозида.
П р и м е р 31. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин -5'-монофосфат (ФМАФ).
9-(2-Дезокси-2-фтор- β-D-рибофуранозил)аденин (пример 8, 1,2 мг, 4,3 мкмоля), 22 мкмоля n-нитрофенилфосфата (1 М раствор, доведенный до рН 5,4 добавлением уксусной кислоты) и 0,05 мл нуклеозид-фосфотрансферазы из Serratia marcescеns/A. Fyfe и др. I.Biol.Chem. 253, 8721-8727 (1978) и патент США N 4136175, январь 23, 1979), смешивают с водой до конечного объема 0,22 мл. Инкубирование ведут около суток при 37оС. Реакционную смесь полностью наносят в виде пятен на пластинку целлюлозы для препаративной тонкослойной хроматографии и проявляют смесью н-пропанол- 15 М NH4OH-H2O (6:3:1). После высушивания пластинки содержащие нуклеотид площади соскребают и нуклеотид элюируют с целлюлозы водой. 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденин-5'-монофосфат получен с выходом 25% (1,1 мкмоля). УФ-спектр: в воде λmax при 257 нм.
Данное соединение полностью расщепляется щелочной фосфатазой и 5'-нуклеотидазой с образованием 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденина.
Отношение основание фосфат 1:8, что указывает на загрязнение неорганическим фосфатом.
П р и м е р 32. 9-(2-Дезокси-2-фтор- β-D-рибофуранозид)аденин-3,5-биофосфат получен в виде аммониевой соли после испарения фракций из ионообменной колонки (см.пример 30) (0,35 ммоля, выход 20%).
Соединение охарактеризовано распределением пятен, наблюдаемых на ТСХ пластинках после инкубирования с нуклеазой Р1(Берингер Маннхайм), щелочной фосфатазой (Берингер Маннхайм), 3-нуклеотидазой (Сигма) и 5'-нуклеотидазой, щелочная фосфoтаза полностью расщепляет 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденин-3', 5'-бисфосфат до соответствующего нуклеотида: нуклеаза Р1 и 3-нуклеотидаза расщепляет его до 9-(2-дезокси-2-фтор- β-D-рибофуранозил)аденин-5'-монофосфата, 5'-нуклеотидаза не расщепляют это соединение. Полученные результаты согласуются с тем, что известно для указанных ферментов и для других известных аналогов нуклеозид-фосфатов. УФ-спектр: в 400 мМ фосфате аммония (рН 5,5) max при 259 нм.
П р и м е р 33. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин-5'-монофосфат.
9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин (пример 7, 0,9 мг 2,9 мкмоля), 15 мкмолей п-нитрофенилфосфата (1 М раствор, доведенный до рН 5,4 добавлением уксусной кислоты) и 0,04 мл нуклеозид-фосфотрансферазы из Serratia marcescens/A. Fyde и др. J.Biol.Chem. 253, 8721-8727 (1978) и патент США (4136175, январь 23, 1979) смешивают с водой до конечного объема 0,15 мл. Инкубирование ведут при 37оС около суток. Реакционную смесь полностью переносят в виде пятна на пластину из целлюлозы для препаративной тонкослойной хроматографии и затем проявляют смесью н-пропанол-15 М NH4OH-H2O (6:3: 1). После высушивания пластинки содержащие нуклеотид площади соскребают и затем нуклеотид элюируют с целлюлозы водой. 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанин-5'-монофосфат получен с выходом 11% (0,33 мкмоля). УФ-спектр: в воде max при 248 нм, плечо 267 нм.
Полученное соединение полностью расщепляется щелочной фосфoтазой и 5'-нуклеотидазой с образованием нуклеозида-9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина.
Отношение основание фосфат 1:30, что указывает на загрязнение неорганическим фосфатом.
П р и м е р 34. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин -5'-монофосфат (ФГМФ).
9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин (0,0158 г 5,2х10-5 моля) растворяют в 0,2 мл триэтилфоcфата и охлаждают до -8оС. При перемешивании одной порцией прибавляют хлорокись фосфора (0,015 мл, 1,6 х 10-4 моля) и реакционный сосуд обертывают алюминиевой фольгой для защиты реагентов от действия света. Температуру оставляют повышаться до 0оС и перемешивают 4 ч. Реакционную смесь нейтрализуют добавлением льда и затем добавлением 1 н. NaOH устанавливают рН 7. Полученный водный раствор экстрагируют CHCl3 (2х2 мл). Значение рН в водном растворе вновь устанавливают равным 7,5.
Полученное соединение очищают хроматографией на ДЭАЭ-Сефадексе аналогично примеру 30, но с градиентом бикарбоната аммония 50-600 мМ. Выход диаммониевой соли 40% (9 мг, 0,02 ммоля).
УФ-спектр: в 0,1 М HCl λmax при 254 нм, плечо при 275 нм.
Данное соединение полностью расщепляется щелочной фосфатазой и 5'-нуклеотидазой с образованием нуклеозида-9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанина.
Отношение основание фосфат 1:0,9.
П р и м е р 35. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил)гуанин-5- трифосфат (ФГТФ).
Трифосфат синтезируют ферментивно из 5'-монофосфата. Пять мг (13 мкмолей) 2'-ФГМФ примера 34 инкубируют при 37оС в конечном объеме 2 мл со следующими компонентами (конечная концентрация): 10 мМ аденозин-трифосфата, 50 мМ калий PIPES (рН 6,8), 10 мМ МоCl2, 12,5 мМ фосфоенолпирувата, 4 МЕ/мл нуклеозид-дифосфаткиназы (Берингер Маннхайм), 0,77 МЕ/мл гуанилаткиназы (Берингер Манхайм) и 20 МЕ/мл пируват-киназы (Берингер Манхайм). Аналитической ионообменной ВЭЖХ обнаруживается небольшое количество 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанин-5'-дифосфата (ФГДФ), но преобладающим продуктом является 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанин-5'-трифосфат, который выделяют с помощью препаративной ионообменной ВЭЖХ на колонке Ватман Партисил SAX Магнум 9 с элюированием градиентом (10 мМ 1 М) фосфата калия, рН 3,5. Содержащие 2'-ФГТФ подвергают дополнительной очистке на ДЭАЭ-Сефадексе по методике примера 30. После высушивания фракций получено 7 мг 2'-ФГТФ в виде диаммониевой соли (80% 10 мкмолей).
УФ-спектр: в 0,1 М HCl λmax при 254 нм, плечо при 275 нм, в 0,1 М NaOH λmax при 255-262 нм.
Отношение основание фосфат 1:2,5.
П р и м е р 36. 9-(2-Дезокси-2-фтор- β-D-рибофуранозил) гуанин-5'-трифосфат.
Пятьдесят мг (120 мкмолей) 2'-ФГМФ, полученного аналогично примеру 34, инкубируют при 37оС в конечном объеме 20 мл со следующими компонентами (конечная концентрация) 10 мМ аденозинтрифосфата, 50 мМ калий (PIPES) (рН 6,8), 10 мМ MgCl2, 12,5 мМ фосфоенолпирувата, 4 МЕ/мл нуклеозиддифосфат-киназы (Берингер Маннхайм), 0,77 МЕ/мл гуанилат-киназы (Берингер Маннхайм) и 20 МЕ/мл пируват-киназы (Берингер Маннхайм). Аналитической ионообменной ВЭЖХ обнаруживаются небольшие количества 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанин -5'-дифосфат, но преобладающим продуктом является 9-(2-дезокси-2-фтор- β-D-рибофуранозил)гуанин-5'-трифосфат, который выделяют с помощью препаративной ионообменной ВЭЖХ на колонке Ватман Партисил SAX Магнум 9 с элюированием градиентом (10 мМ 1М) фосфата калия, рН 3,5. Содержащие 2'-ФГТФ фракции подвергают по методике примера 30 дополнительной очистке на ДЭAЭ-Сефадексе. После высушивания фракций получено 50 мг 2'-ФГТФ, в виде диаммониевой соли, но с примесью аденозиндифосфата, 2'-ФГДФ и аленозинтрифосфата. Проведена повторная очистка с помощью препаративной ВЭЖХ и затем на ДЭАЭ-Сефадексе. Получена триаммониевая соль (36 мг, 63 мкмоля, выход 50%). УФ-спектр: в 0,1 М HCl λmax при 254 нм, плечо при 275 нм.
Отношение основание фосфат 1:2,9.
П р и м е р 37. 2,6-Диамино-9-(2-дезокси-2-фтор-3,5-ди -0-пивалоил- β-D-рибофуранозил)-9Н-пурин и 2,6-диамино-9-(2-дезокси-2-фтор-5-0-пивалоил- β-D-рибофуранозил)-9Н-пурин.
К раствору 2,6-диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурина (100 мг, 0,35 ммоля) в ДМФА (3 мл) и Е+3N (3 мл) добавляют триметилуксусный ангидрид (78 мкл) и раствор перемешивают около суток при комнатной температуре. Прибавляют дополнительные 80 мкл триметилуксусного ангидрида и перемешивание продолжают еще 3 дня. Затем смесь нейтрализуют МеОН, испаряют в вакууме и подвергают вытеснительной хроматографии на SiO2 с элюированием смесями CHCl3-MeOH (30:1), (20:1), (10:1), (6:1), (4:1) и наконец (3:1). В результате получают бисэфир (74 мг) в виде полутвердого вещества после ополаскивания эфиром, т. пл.143-145оС (разл.). Масс-спектр высокого разрешения (Е.I): найдено для С15H21FN6O4 368,1612, вычислено 368, 1608.
Отбором и испарением соответствующих фракций получают также и моно-5'-пивалат (16 мг), т. пл. 123-125оС. Масс-спектр высокого разрешения (E.I): найдено для С20H29FN6O5 452,2181, вычислено 452,2183.
П р и м е р 38. 2-Амино-6-бензиламино-9-(2'-дезокси-2'-фтор- β-D-рибофуранозил)-9Н-пурин.
2-Амино-6-бензиламинопурин (0,2 г, 0,83 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,244 г, 1 ммоль) смешивают с 10 мл калийфосфатного буфера (10 мМ, рН 6,8), тимидин-фосфорилазой (8200 единиц) и фосфорилазой пуриновых нуклеозидов (7850 единиц) Krenitsky и др. Biochemistry, 20, 3616, 1981 и патент США N 4381344) и смесь перемешивают 40 ч при 45oС. Выделение продукта осуществляют добавлением метанола (15 мл), удалением твердых веществ фильтрованием и испарением метанола в присутствии 10 мл силикагеля. Сухой гель наносят на верхнюю часть колонки (5х23 см) с окисью кремния и продукт элюируют смесью хлороформ метанол (99:1). Фракции, содержащие только продукт, объединяют и после удаления растворителя в вакууме получают 0,087 г 2-амино-6-бензиламино-9-(2'-дезокси-2'-фтор- β-D-рибофуранозил) -9Н-пурина.
1Н-ЯМР (200 мГц) δ: 7,95 (с, 1Н, Н8), 7,85 (уш.полоса, 1Н, NH), 7,2-7,5 (м, 5Н, фенил), 6,04 (дв.д. Н1',I,1' 16,4 Гц, I 3,1 Гц) 5,93 (уш.полоса, 2Н, NH2), 5,64 (д, 1Н, ОН, I 5,9 Гц), 5,44, 5,17 (дв.т. 1Н, Н2'), 5,26 (т, 1Н, ОН-5'), 5,64 (уш. полоса, 2Н, СН2), 4,38 (м, 1Н, Н3'), 3,9 (уш.полоса, 1Н, Н4'), 3,5-3,75 (м, 2Н, Н5').
Восстановление полученного соединения может быть осуществлено по методике Vodu Vigneaud O.K. Behrens J.Biol.Chem. 117, 27 (1937).
П р и м е р 39. 2-Амино-6-бензилтио-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
2-Амино-6-бензилпурин (Сигма Кемикл Компэни, 0,8 г 3,1 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,4 г, 1,7 ммоля), который может быть синтезирован по методике I.F.Codington и др. J.Org.Chem. 29, 558, 1964) суспендируют в 20 мл калийфосфатного буфера (10 мМ, рН 7), содержащего 0,04% (мас. /об. ) азида калия. Затем добавляют тимидин-фосфорилазу (2640 МЕ) и фосфорилазу пуриновых нуклеозидов (4360 МЕ) (Т.A.Krenitsky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344) и суспензию перемешивают при 37оС. На 21-й день реакционную смесь разбавляют до 150 мл калийфосфатным буфером 5 мМ, рН 7) содержащим 0,04% (мас./об.) азида калия, с добавлением тимидин-фосфорилазы (4000 МЕ) и фосфорилазы пуриновых нуклеозидов (6500 МЕ). На 43-й день реакционную смесь разбавляют до 250 мл водой с добавлением тимидин-фосфорилазы 2000 МЕ) и фосфорилазы пуриновых нуклеозидов (3250 МЕ). На 69-й день добавлением КОН в реакционной смеси устанавливают рН 7,1. На 77-й день реакционную смесь испаряют. Остаток растворяют в горячем водном метаноле и переносят в колонку (2,5х7 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма) и продукт элюируют смесью метанол-вода (9:1). Содержащие продукт фракции объединяют и растворитель удаляют в вакууме. Остаток растворяют в смеси ацетонитрил-вода 49:1) и переносят в колонку (2,5 х с силикагелем 60 (ЕМ Сайенс). Продукт элюируют смесью ацетонитрил-вода (49:1), содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток суспендируют в воде и лиофилизацией получают 0,201 г заглавного соединения, которое анализируют в виде 0,1 гидрата, т.пл. 180оС.
УФ λmax нм (ε х10-3): 0,1 н. HCl 322,5 (11,8), 250 (10,6), рН 7,311, 5 (14,2), 247 (14,3) 0,1 н. NaOH 312 (14), 247 (13,5).
Анализ для C17H18FN5O3S ˙0,1H2O
Вычислено: C 51,93; H 4,66; N 17,81; F 4,83; S 8,15
Найдено: C 51,96; H 4.66; N 17,86; F 4,68; S 8,15.
Вычислено: C 51,93; H 4,66; N 17,81; F 4,83; S 8,15
Найдено: C 51,96; H 4.66; N 17,86; F 4,68; S 8,15.
1Н-ЯМР (300 мГц, Me2SO-d6) δ 8,19 (с, 1Н, Н-8), 7,47 (кажущийся д, 2Н, Ar, I 7,6 Гц), 7,28 (м, 3Н, Ar), 6,74 (уш.с. 2Н, 2-NH2), 6,1 (дв.д. 1Н, Н-1', IF,1' 16,6 Гц, I 2,4 Гц), 5,68 (д, 1Н, 3'-ОН, I 6,4 Гц), 5,32 (дв.дв.д, 1Н, Н-2', IF,2' 53 Гц, I1',2' 2,4 Гц, I2',3' 4,4 Гц), 5,15 (т, 1Н, 5'-ОН, I 6 Гц). 4,55 (ав.квартет, 2Н, 6-SCH2, геминальный I -13,7 Гц), 4,41 (м, 1Н, Н-3'), 3,94 (м, 1Н, Н-4'), 3,74 (м, 1Н, Hα -5'). 3,58 (м, 1Н, Hβ -5').
П р и м е р 40. 2,6-Диамино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
2,6-Диаминопурин (Пэсифик Кемикл Лабораториз, 2 г 12,7 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,8 г, 3,3 ммоля), который может быть синтезирован по методике I.F.Codington и др. J.Org.Chem. 29, 558, 1964) суспендируют в 500 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас. /об. ) азида калия. Затем добавляют тимидин-фосфорилазу (41700 МЕ) и фосфорилазу пуриновых нуклеозидов (83300 МЕ) (Т.A.Krenitsky и дp. Biochemistry 20, 3615, 1981 и патент США N 4381344), адсорбированных на ДЭАЭ-целлюлозе (10,5 н, 25 мл) и суспензию встряхивают при 37оС. Через 24 ч добавляют 2 г 1,6-диаминопурина и температуру повышают до 50оС. Спустя еще 24 ч реакционную смесь фильтруют, фильтровальный пирог промывают водой, фильтраты объединяют и растворитель удаляют в вакууме. Остаток растворяют в горячей воде и добавлением NH4OH устанавливают рН 9,4. Полученный раствор переносят в колонку (2,5х13 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью метанол-вода (9: 1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток обрабатывают вышеописанным образом. Содержащие продукт фракции объединяют и растворитель удаляют в вакууме. Остаток растворяют в воде и лиофилизацией получают 0,89 г заглавного соединения, которое анализируют в виде 0,5 гидрата, т.пл. 125-127оС.
Анализ для C10H13FN6O3.0,5H2O
Вычислено: С 40,96; H 4,81; N 28,66; F 6,48.
Вычислено: С 40,96; H 4,81; N 28,66; F 6,48.
Найдено: C 41,03; H 4,8; N 28,69; F 6,5.
УФ max нм ( х10-3): рН 7 279,5 (9,52), 256 (9,06).
Строение также подтверждено данными 1Н-ЯМР. объединяют, растворитель удаляют в вакууме, остаток обрабатывают вышеописанным образом. Содержащие продукт фракции объединяют и растворитель удаляют в вакууме. Остаток растворяют в воде и лиофилизацией получают 0,89 г заглавного соединения, которое анализируют в виде 0,5 гидрата, т.пл. 125-127оС.
Анализ для C10H13FN6O3 ˙0,5H2O
Вычислено: С 40,96; H 4,81; N 28,66; F 6,48.
Вычислено: С 40,96; H 4,81; N 28,66; F 6,48.
Найдено: C 41,03; H 4,8; N 28,69; F 6,5.
УФ λmax нм ( ε х10-3): рН 7 279,5 (9,52), 256 (9,06).
Строение также подтверждено данными 1Н-ЯМР.
П р и м е р 41. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
2-Аминопурин (Пасифик Кэмикл Лабораториз, 3 г, 22,2 ммоля) и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил 0,5 г, 2 ммоля), который может быть синтезирован по методике I. F.Codington и др. J.Org.Chem. 29, 558, 1964), суспендируют в 25 мл калийфосфатного буфера (5 мМ, рН 7), содержащего 0,04% (мас. /об. ) азида калия. Затем добавляют тимидин-фосфорилазу (41700 МЕ) и фосфорилазу пуриновых нуклеозидов (83300 МЕ) (T.A.Krenistky и др. Biochemistry 20, 3615, 1981 и патент США N 4381344), абсорбированных на 10,5 г ДЭАЭ-целлюлозе (25 мл) и суспензию встряхивают при 37оС. Через 24 ч добавляют 3 г 2,6-диаминопурина и температуру повышают до 50оС. Спустя еще 24 ч реакционную смесь отфильтровывают, фильтровальный пирог промывают водой, фильтраты соединяют и растворитель удаляют в вакууме. Остаток суспендируют в воде и фильтруют. Фильтровальный пирог экстрагируют водой (25оС), пока на пироге не остается больше продукта. Фильтраты объединяют, добавлением NH4OH устанавливают рН 9,4 и полученный раствор переносят в колонку (2,5 х 20 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма). После промывания колонки водой продукт элюируют смесью метанол-вода (9:1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в смеси хлороформ-метанол-вода (75:25:4) и переносят в колонку 5х25 см) с силикагелем 60. Продукт элюируют смесью хлороформ-метанол-вода (75:25: 4). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в горячей воде и фильтруют через мембранный фильтр с размером пор 0,22 мкм. Лиофилизацией фильтрата получают 0,5 г заглавного соединения, которое анализируют в виде 0,5 гидрата, т.пл. 153-155оС.
УФ λmax нм (ε х 10-3): pH 7 304 (6,35), 243,5 (5,95)
Анализ для C10H12FN5O3 ˙0,5H2O
Вычислено: C 43,17; H 4,71; N 25,17; F 6,83.
Анализ для C10H12FN5O3 ˙0,5H2O
Вычислено: C 43,17; H 4,71; N 25,17; F 6,83.
Найдено: С 43,08; H 4,74; N 25,11; F 6,89
Строение, кроме того, подтверждено данными 1Н-ЯМР.
Строение, кроме того, подтверждено данными 1Н-ЯМР.
П р и м е р 42. 2-Амино-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-6-метокси-9Н-пурин.
2-Амино-6-метоксипурин (2 г, 12 ммолей), который может быть синтезирован по методике R. W. Balsiger, I.A.Montgomery, J.Org.Chem. 20, 1573, 1960), и 1-(2-дезокси-2-фтор- β-D-рибофуранозил)урацил (0,88 г, 3,6 ммоля), который может быть синтезирован по методике I.F.Codington и др. J.Org.Chem. 29, 558, 1964) суспендируют в 250 мл калийфосфатного буфера (5 мМ, рН 7) содержащего 0,04% (мас. /об.) азида калия. Добавлением КОН в суспензии устанавливают рН 7, после чего добавляют тимидин-фосфорилазу (41700 МЕ) и фосфорилазу пуриновых нуклеозидов (83300 МЕ) (T.A.Krenitsky и др. Biochemistry 20, 3615, 1981, и патент США N 4381344), абсорбированных на 10,5 г ДЭАЭ-целлюлозы (25 мл) и суспензию встряхивают при 37оС. Через 24 ч добавляют 1 г 2-амино-6-метоксипурина и 250 мл вышеуказанного буфера и температуру повышают до 50оС. Спустя еще 24 ч реакционную смесь фильтруют, фильтровальный пирог промывают водой, фильтраты соединяют и растворитель удаляют в вакууме. Остаток растворяют в теплой воде и добавлением NH2OH устанавливают рН 9,4. Полученный раствор переносят в колонку 2,5 х 15 см) с анионообменной смолой (Био-Ред AGIX2, гидроксидная форма) и после промывания колонки водой продукт элюируют смесью метанол-вода (9: 1). Содержащие продукт фракции объединяют, растворитель удаляют в вакууме, остаток растворяют в теплой воде и фильтруют через мембранный фильтр с размером пор 0,22 мкм из нейлона. Лиофилизацией фильтрата получают заглавное соединение, которое анализируют в виде 0,5 гидрата (0,91 г), т.пл. 200оС.
УФ λmax нм (ε х 10-3): рН 7 279,5 (9,24), 247,5 (9,99).
Анализ для C11H14FN6O4 ˙0,5H2O
Вычислено: C 42,86; H 4,90; N 22,72; F 6,16.
Вычислено: C 42,86; H 4,90; N 22,72; F 6,16.
Найдено: C 42,93; H 4,90; N 22,73; F 6,15.
Строение кроме того подтверждено данными 1Н-ЯМР.
П р и м е р 43. 2-Амино-6-бензилокси-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурин.
2-Амино-6-бензилоксипурин (2,5 г, 10,3 ммоля) и 2-дезокси-2-фторуридин (2,64 г, 10,8 ммоля) смешивают с 50 мл калийфосфатного буфера (10 мМ, рН 6,8) к смеси добавляют тимидин-фосфорилазу (8000 единиц) и фосфорилазу пуриновых нуклеозидов (21600 единиц) и перемешивают при 45оС. Через пять дополнительно прибавляют 16000 единиц тимидин-фосфорилазы и 21600 единиц фосфорилазы пуриновых нуклеозидов и содержимое реакционного сосуда перемешивают 48 ч при 45оС. Основная часть продукта содержится в осадке, который отделяют фильтрованием и растворяют в метаноле. Продукт выделяют хроматографией на окиси кремния с применением в качестве подвижной фазы смеси этилацетат-хлороформ-метанол (8: 1:1). Фракции, содержащие только продукт, объединяют и после испарения растворителя получают 1,44 г 2-амино-6-бензилокси-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурина.
1Н-ЯМР (200 мГц в ДМСО) δ 8,11 (с, 1Н, Н8), 7,3-7,5 (м, 5Н, фенил), 6,59 (уш.полоса, 2Н, NH2), 6,09 (дв.д. 1Н, IF,1' 16,5 Гц, I 2,6 Гц), 5,66 (д, 1Н, ОН, I 6,1 Гц), 5,48 (с, 2Н, СН2), 5,25-5,53 (уш.д. 1Н, Н2'), 5,2 (м, 1Н, ОН-5'), 4,3-4,5 (м, 1Н, Н3'), 3,9 (уш.полоса, 1Н, Н4'), 3,5-3,8 (м, 2Н, Н5').
Получение соединения примера 7 из 2-амино-6-бензилокси-9-(2-дезокси-2-фтор- β-D-рибофуранозил)-9Н-пурина осуществлено по методике EI Amin и др. J. Org.Chem, 44, 3442 (1979).
Фармацевтические составы
В нижеследующих примерах составов "активным компонентом" может быть любое соединение формулы (I) или его фармацевтически приемлемая соль, например, соединения примеров 6,7,9 и 12.
В нижеследующих примерах составов "активным компонентом" может быть любое соединение формулы (I) или его фармацевтически приемлемая соль, например, соединения примеров 6,7,9 и 12.
П р и м е р 44. Таблетированные составы.
Нижеследующие составы А, В и С получены важным гранулированием компонентов совместно с раствором повидона и с последующим добавлением стеарата магния и таблетированием. Состав А мг/таблетку мг/таблетку (а) Активный компонент 250 250 (b) Лактоза В.Р. 210 26 (с) Повидон В.Р. 15 9 (d) Гликолят натрийкрахмала 20 12 (е) Стеарат магния 5 3 Итого 500 300 Состав В мг/таблетку мг/таблетку (а) Активный компонент 250 250 (b) Лактоза 150 (с) Авицель РН 101 60 26 (d) Повидон В.Р. 15 9 (е) Гликолят натрийкрахмала 20 12 (f) Стеарат магния 5 3 Итого 500 300 Состав С мг/таблетку Активный компонент 100 Лактоза 200 Крахмал 50 Повидон 5 Стеарат магния 4 Итого 359
Нижеследующие составы D и E получены непосредственно прессованием смешанных компонентов. Состав D мг/капсулу Активный компонент 250 Преджелатинизи- рованный крахмал NF15 150 Итого 400 Состав Е мг/капсулу Активный компонент 250 Лактоза 150 Авицель 100 Итого 500
Состав F (состав с регулируемым выделением).
Нижеследующие составы D и E получены непосредственно прессованием смешанных компонентов. Состав D мг/капсулу Активный компонент 250 Преджелатинизи- рованный крахмал NF15 150 Итого 400 Состав Е мг/капсулу Активный компонент 250 Лактоза 150 Авицель 100 Итого 500
Состав F (состав с регулируемым выделением).
Состав готовят влажным гранулированием нижеперечисленных компонентов с раствором повидона с последующим добавлением стеарата магния и прессованием.
мг/таблетку (а) Активный компонент 500 (b) Гидроксипропил метилцеллюлоза (Метоцель К4М Премиумэ) 112 (с) Лактоза В.Р. 53 (d) Повидон В.Р.С. 28 (е) Стеарат магния 7 Итого 700
Выделение происходит в течение 6-8 ч и завершается через 12 ч.
Выделение происходит в течение 6-8 ч и завершается через 12 ч.
П р и м е р 45. Капсулированные составы.
Состав А.
Капсулированный состав получают смешиванием компонентов состава D примерa 44 и заполнением, состоящих из двух частей твердых желатиновых капсул. Состав В мг/капсулу (а) Активный компонент 250 (b) Лактоза В.Р. 143 (с) Гликолят натрийкрахмала 25 (d) Стеарат магния 2 Итого 420
Капсулы получают смешиванием вышеперечисленных компонентов и заполнением состоящих из двух частей твердых желатиновых капсул. Состав С мг/капсулу (а) Активный компонент 250 (b) Макрогол 4000 ВР 350 Итого 600
Капсулы готовят плавлением Макрогола 4000 ВР, диспергированием активного компонента в расплаве и заполнением расплавом состоящих из двух частей твердых желатиновых капсул. Состав L мг/капсулу Активный компонент 250 Лецитин 100 Арахисовое масло 100 Итого 450
Капсулы получают диспергированием активного компонента в лецитине и арахисовом масле и заполнением дисперсией мягких эластичных желатиновых капсул.
Капсулы получают смешиванием вышеперечисленных компонентов и заполнением состоящих из двух частей твердых желатиновых капсул. Состав С мг/капсулу (а) Активный компонент 250 (b) Макрогол 4000 ВР 350 Итого 600
Капсулы готовят плавлением Макрогола 4000 ВР, диспергированием активного компонента в расплаве и заполнением расплавом состоящих из двух частей твердых желатиновых капсул. Состав L мг/капсулу Активный компонент 250 Лецитин 100 Арахисовое масло 100 Итого 450
Капсулы получают диспергированием активного компонента в лецитине и арахисовом масле и заполнением дисперсией мягких эластичных желатиновых капсул.
Состав Е (капсулы с регулируемым выделением).
Капсулированные составы с регулируемым выделением, приведенные ниже, получают экструдированием компонентов (а), (b) и (с) с помощью экструдера с последующим сферонизированием экструдата и высушиванием. Высушенные гранулы затем покрывают регулирующей выделение мембраной (d) и заполняют состоящие из двух частей твердые гранулы. Состав Е мг/капсулу (а) Активный компонент 250 (b) Микрокристал- лическая целлюлоза 125 (с) Лактоза ВР 125 (d) Этилцеллюлоза 13 Итого 513
П р и м е р 46. Инъектируемые составы
Состав А Активный компонент 0,2 г Раствор соляной кислоты, 0,1 М q.s. до рН 4-7 Раствор гидроксида натрия, 0,1 М q.s. до рН 4-7 Стерильная вода q.s. до 10 мл
Активный компонент растворяют в большей части воды (35-40оС) и устанавливают рН 4-7 добавлением либо соляной кислоты, либо гидроксида натрия в зависимости от обстоятельств. После этого партию доводят до необходимого объема водой и фильтруют через стерильный микропористый фильтр в стерильные янтарные стеклянные сосудики на 10 мл (тип I) и герметизируют стерильными пробками и герметизирующими уплотнениями.
П р и м е р 46. Инъектируемые составы
Состав А Активный компонент 0,2 г Раствор соляной кислоты, 0,1 М q.s. до рН 4-7 Раствор гидроксида натрия, 0,1 М q.s. до рН 4-7 Стерильная вода q.s. до 10 мл
Активный компонент растворяют в большей части воды (35-40оС) и устанавливают рН 4-7 добавлением либо соляной кислоты, либо гидроксида натрия в зависимости от обстоятельств. После этого партию доводят до необходимого объема водой и фильтруют через стерильный микропористый фильтр в стерильные янтарные стеклянные сосудики на 10 мл (тип I) и герметизируют стерильными пробками и герметизирующими уплотнениями.
Состав В Активный компонент 0,125 г Стерильный без пирогена фосфатный буфер с рН 7 до 25 мл
П р и м е р 47. Внутримышечная инъекция. Активный компонент 0,2 г Бензиловый спирт 0,1 г Гликофурол 75 1,45 г Вода для инъекций q.s. до 3 мл
В гликофуроле растворяют активный компонент, затем добавляют и растворяют бензиловый спирт, после чего добавляют до 3 мл воду. Смесь фильтруют через стерильный микропористый фильтр и герметично закрывают в стерильных из янтарного стекла сосудиках на 3 мл (тип I). П р и м е р 48. Сироп. Активный компонент 0,25 г Раствор сорбита 1,50 г Глицерин 2,00 г Бензоат натрия 0,005 г Вкусовая добавка, Пийч 17.42.3169 0,0125 мл Очищенная вода q.s. до 5 мл
Активный компонент растворяют в глицерине и большей части очищенной воды. К полученному раствору добавляют водный раствор бензоата натрия с последующим добавлением раствора сорбита и наконец вкусовой добавки. Воду добавляют до необходимого объема и все хорошо смешивают. П р и м е р 49. Капсулированный
порошок для ингаляций. Активный компонент (порошок с размером частиц 0,5-70 мкм) 4 мг Лактоза (порошок с размером частиц 30-90 мкм) 46 мг
Порошки смешивают до гомогенной смеси, которой заполняют твердые желатиновые капсулы подходящего размера, 50 мг смеси на капсулу. П р и м е р 50. Аэрозоль для
ингаляций. Активный компонент (порошок 0,5-7 мкм) 200 мг Триолеат сорбита 100 мг Натрийсахарин (порошок 0,5-7 мкм) 5 кг Ментол 2 мг Трихлорфторметан 4,2 мг Дихлордифторметан до 10 мл
В трихлорметане растворяют триолеат сорбита и ментол. В полученной смеси диспергируют натрийсахарин и активный компонент, после чего переносят в приемлемый аэрозольный конвейер, после чего через клапанную систему инъектируют дихлордифторметан. Полученная композиция обеспечивает 2 мг активного компонента в каждой дозе на 100 мкл.
П р и м е р 47. Внутримышечная инъекция. Активный компонент 0,2 г Бензиловый спирт 0,1 г Гликофурол 75 1,45 г Вода для инъекций q.s. до 3 мл
В гликофуроле растворяют активный компонент, затем добавляют и растворяют бензиловый спирт, после чего добавляют до 3 мл воду. Смесь фильтруют через стерильный микропористый фильтр и герметично закрывают в стерильных из янтарного стекла сосудиках на 3 мл (тип I). П р и м е р 48. Сироп. Активный компонент 0,25 г Раствор сорбита 1,50 г Глицерин 2,00 г Бензоат натрия 0,005 г Вкусовая добавка, Пийч 17.42.3169 0,0125 мл Очищенная вода q.s. до 5 мл
Активный компонент растворяют в глицерине и большей части очищенной воды. К полученному раствору добавляют водный раствор бензоата натрия с последующим добавлением раствора сорбита и наконец вкусовой добавки. Воду добавляют до необходимого объема и все хорошо смешивают. П р и м е р 49. Капсулированный
порошок для ингаляций. Активный компонент (порошок с размером частиц 0,5-70 мкм) 4 мг Лактоза (порошок с размером частиц 30-90 мкм) 46 мг
Порошки смешивают до гомогенной смеси, которой заполняют твердые желатиновые капсулы подходящего размера, 50 мг смеси на капсулу. П р и м е р 50. Аэрозоль для
ингаляций. Активный компонент (порошок 0,5-7 мкм) 200 мг Триолеат сорбита 100 мг Натрийсахарин (порошок 0,5-7 мкм) 5 кг Ментол 2 мг Трихлорфторметан 4,2 мг Дихлордифторметан до 10 мл
В трихлорметане растворяют триолеат сорбита и ментол. В полученной смеси диспергируют натрийсахарин и активный компонент, после чего переносят в приемлемый аэрозольный конвейер, после чего через клапанную систему инъектируют дихлордифторметан. Полученная композиция обеспечивает 2 мг активного компонента в каждой дозе на 100 мкл.
Противовирусная активность.
Штаммы гриппа А и В испытывают в монослоях первичных клеток куриного зародыша (КЗ) в многоячеистых подносах. Активность соединений определяют в испытаниях на снижение выхода или на уменьшение бляшек, в которых клеточный монослой инфицирует суспензией вируса гриппа и затем покрывают жидкой средой снижение выхода или питательной агарозой в виде геля с гарантированием того, что через культуру не происходит распространение вируса (уменьшение бляшек). Соединение с известной молярностью в интервале концентраций вводят в верхний слой среды питательной агарозы. Выход вируса или число бляшек для каждой концентрации выражают в виде процента от контроля, на основании чего строят кривую реакции. На основании кривой определяют 50%-ную ингибирующую концентрацию (ИК50). Респираторно-синцитальный вирус (РСВ) исследуют на клетках BS-C-1 (клетки почки африканской зеленой обезьяны) в аналогичном испытании на уменьшение бляшек/ос. Полученные результаты приведены в табл.1 и 2.
Ингибирующую активность in vivo определяют на мышах для штаммов гриппа А и В использованием модели "через нос в легкие". Мышей инфицируют вирусом с помощью аэрозоля в замкнутом боксе, после чего лечат испытуемыми соединениями в различные промежутки времени после инфицирования при различных путях введения, в том числе: пероральном, внутрибрюшинном и в виде аэрозоля. Через 24 ч мышей умерщвляют, готовят 10%-ную суспензию легких и титруют на присутствие вируса. Результаты регистрируют как снижение распространения вируса по сравнению с неподвергавшимися лечению контрольными мышами.
Appleyard, Gand Mader, H.B.Plaque Formation by Influenza Vi-ruses in the Presence of Trypsin. J.Gen. Virol. 25, 351-357. (1974). Collins, P. and Bauer, D. J. Relative Potencies of Anti-Herpes Compounds, Ann. N.Y. Acad. Sci. 284. 49-59. (1977). Hayden, F.G. Cotek, M. and Douglas. R.G. Plaque Inhibition Assay for Drug Susceptibility Testing of Influenza Viruses. Antimicro Agents and Chemo. 17. 865-870. (1980). Tisdale, M. and Bauer, D.J. A comparison of test methods in influenza chemotherapy. J. Antimicrobio. Chemother. 1 suppl. 55-62 (1975).
Claims (6)
1. Способ получения производных 2' -дезокси-2'-фторрибонуклеозидов общей формулы 1
где Y-Н или NH2;
X группа NR3R4, где R3 и R4, одинаковые или различные, Н, С1 С6-алкил, С2 С6-алкенил, С3 С7-циклоалкил, или X группа Z R5, где Z кислород или сера, R5 имеет те же значения, что и R3, или X галоген или водород;
R1 и R2, одинаковые или различные, гидроксигруппа, группа - ОСОR6Н, где R6 С1 С6-алкилен нормального или изостроения, группа ОR6Н, где R6 имеет указанные значения, группа ОСОСНR9NR1 0R1 1, где R1 0 и R1 1 водород или С1
С6-алкил нормального или изостроения, R9 водород или C1 C4-алкил нормального или изостроения, или R1 и R2 моно-, ди- или трифосфатная сложноэфирная группа, исключая случай, когда R1 и R2 каждый - гидроксигруппа, или R1-моно-
ди- или трифосфатная 5′-сложноэфирная группа и R2 гидрокси-, или R1 гидрокси и R2-моно-, ди- или трифосфатная 3′-сложноэфирная группа, и/или а) Х ОН; У NH2 или Н, или б) X NH2 и Y H,
или их фармацевтически приемлемых солей, отличающийся тем, что проводят взаимодействие пуринового основания общей формулы PuH, где Pu остаток общей формулы
где X и Y имеют указанные значения,
или его соли с соединением общей формулы II
где R1 и R2 имеют указанные значения;
W фосфатная сложноэфирная группа или ее соль, либо пуриновый или пиримидиновый фрагмент, отличный от Pu,
с образованием соединения формулы I, после чего проводят последовательно превращение или групп R1 и R2 одна из которых гидроксил, в другую группу R1 и/или R2, или превращение групп R1 и/или R2, отличных от гидроксила, в группу, где R1 и/или R2 гидроксил.
где Y-Н или NH2;
X группа NR3R4, где R3 и R4, одинаковые или различные, Н, С1 С6-алкил, С2 С6-алкенил, С3 С7-циклоалкил, или X группа Z R5, где Z кислород или сера, R5 имеет те же значения, что и R3, или X галоген или водород;
R1 и R2, одинаковые или различные, гидроксигруппа, группа - ОСОR6Н, где R6 С1 С6-алкилен нормального или изостроения, группа ОR6Н, где R6 имеет указанные значения, группа ОСОСНR9NR1 0R1 1, где R1 0 и R1 1 водород или С1
С6-алкил нормального или изостроения, R9 водород или C1 C4-алкил нормального или изостроения, или R1 и R2 моно-, ди- или трифосфатная сложноэфирная группа, исключая случай, когда R1 и R2 каждый - гидроксигруппа, или R1-моно-
ди- или трифосфатная 5′-сложноэфирная группа и R2 гидрокси-, или R1 гидрокси и R2-моно-, ди- или трифосфатная 3′-сложноэфирная группа, и/или а) Х ОН; У NH2 или Н, или б) X NH2 и Y H,
или их фармацевтически приемлемых солей, отличающийся тем, что проводят взаимодействие пуринового основания общей формулы PuH, где Pu остаток общей формулы
где X и Y имеют указанные значения,
или его соли с соединением общей формулы II
где R1 и R2 имеют указанные значения;
W фосфатная сложноэфирная группа или ее соль, либо пуриновый или пиримидиновый фрагмент, отличный от Pu,
с образованием соединения формулы I, после чего проводят последовательно превращение или групп R1 и R2 одна из которых гидроксил, в другую группу R1 и/или R2, или превращение групп R1 и/или R2, отличных от гидроксила, в группу, где R1 и/или R2 гидроксил.
2. Способ по п. 1, отличающийся тем, что R1 и R2 оба ОН, или R1 монофосфат, а R2 ОН, Y Н или NH2, а X NR3R4, где R3 и R4, одинаковые или различные, Н, С1 С6-алкил, при условии, если Y Н, то R3 и R4 оба не являются Н, или X группа Z R5, где Z кислород или сера, R5 С1 С6-алкил, или X галоген или Н.
3. Способ по п.1, отличающийся тем, что R1 и R2 оба ОН, Y - NH2 и X Н, NH2 или Z R5, где Z кислород и R5 - С1 С6-алкил, или его фармацевтическая приемлемая соль.
4. Способ по п.1, отличающийся тем, что получают соединение 2,6-диамино-9(2-дезокси-2-фтор- β-D- рибофуранозил)-9Н-пурин.
5. Способ по п.1 отличающийся тем, что получают соединение 2-амино-9-(2-дезокси-2-фтор- β-D- рибофуранозил)-9Н-пурин или его фармацевтически приемлемые соли.
6. Способ по п.1, отличающийся тем, что получают соединение 2-амино-9-(2-дезокси-2-фтор -β-D- рибофуранозил)-6-метокси-9Н-пурин или его фармацевтически приемлемые соли.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB898920534A GB8920534D0 (en) | 1989-09-11 | 1989-09-11 | Antiviral compounds |
| GB8920534-8 | 1989-09-11 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2043361C1 true RU2043361C1 (ru) | 1995-09-10 |
Family
ID=10662891
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| SU904831211A RU2043361C1 (ru) | 1989-09-11 | 1990-09-10 | Способ получения производных 2'-дезокси-2'-фторрибонуклеозидов или их фармацевтически приемлемых солей |
| RU94002475/14A RU94002475A (ru) | 1989-09-11 | 1994-01-14 | Фармацевтическая композиция и ее применение для лечения вирусных инфекций |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU94002475/14A RU94002475A (ru) | 1989-09-11 | 1994-01-14 | Фармацевтическая композиция и ее применение для лечения вирусных инфекций |
Country Status (19)
| Country | Link |
|---|---|
| EP (2) | EP0671410A1 (ru) |
| JP (1) | JPH03145497A (ru) |
| KR (1) | KR910006293A (ru) |
| AT (1) | ATE135365T1 (ru) |
| AU (1) | AU644095B2 (ru) |
| CA (1) | CA2025009A1 (ru) |
| DD (1) | DD297650A5 (ru) |
| DE (1) | DE69025834D1 (ru) |
| FI (1) | FI904445A0 (ru) |
| GB (1) | GB8920534D0 (ru) |
| HU (1) | HUT54704A (ru) |
| IE (1) | IE903269A1 (ru) |
| MY (1) | MY130035A (ru) |
| NZ (1) | NZ235244A (ru) |
| PL (1) | PL164967B1 (ru) |
| PT (1) | PT95261A (ru) |
| RU (2) | RU2043361C1 (ru) |
| TW (2) | TW226333B (ru) |
| ZA (1) | ZA907187B (ru) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA008609B1 (ru) * | 1998-02-25 | 2007-06-29 | Эмори Юниверсити | 2'-фторнуклеозиды |
| USRE44330E1 (en) | 1995-06-19 | 2013-07-02 | Lifescan Inc. | Electrochemical cell |
| RU2663584C2 (ru) * | 2014-04-23 | 2018-08-07 | Синбиас Фарма АГ | Способ синтеза клофарабина |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FI95384C (fi) * | 1989-04-06 | 1996-01-25 | Squibb Bristol Myers Co | Menetelmä 3'-deoksi-3'-substituoitujen metyylinukleosidien valmistamiseksi ja menetelmässä käytettäviä välituotteita |
| US5859221A (en) * | 1990-01-11 | 1999-01-12 | Isis Pharmaceuticals, Inc. | 2'-modified oligonucleotides |
| US5670633A (en) * | 1990-01-11 | 1997-09-23 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides that detect and modulate gene expression |
| US6005087A (en) | 1995-06-06 | 1999-12-21 | Isis Pharmaceuticals, Inc. | 2'-modified oligonucleotides |
| US6399754B1 (en) | 1991-12-24 | 2002-06-04 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides |
| US5872232A (en) * | 1990-01-11 | 1999-02-16 | Isis Pharmaceuticals Inc. | 2'-O-modified oligonucleotides |
| US5914396A (en) * | 1990-01-11 | 1999-06-22 | Isis Pharmaceuticals, Inc. | 2'-O-modified nucleosides and phosphoramidites |
| WO1991015498A2 (en) * | 1990-04-04 | 1991-10-17 | Nycomed Imaging As | Nucleoside derivatives |
| US5610289A (en) * | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5378825A (en) * | 1990-07-27 | 1995-01-03 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs |
| US5677437A (en) * | 1990-07-27 | 1997-10-14 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5618704A (en) * | 1990-07-27 | 1997-04-08 | Isis Pharmacueticals, Inc. | Backbone-modified oligonucleotide analogs and preparation thereof through radical coupling |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5792844A (en) * | 1990-07-27 | 1998-08-11 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent nitrogen atoms |
| WO1992011276A1 (en) * | 1990-12-18 | 1992-07-09 | Sloan-Kettering Institute For Cancer Research | Novel synthesis of 2'-'up' fluorinated 2''-deoxy-arabinofuranosylpurines |
| US5672697A (en) * | 1991-02-08 | 1997-09-30 | Gilead Sciences, Inc. | Nucleoside 5'-methylene phosphonates |
| US5965722A (en) * | 1991-05-21 | 1999-10-12 | Isis Pharmaceuticals, Inc. | Antisense inhibition of ras gene with chimeric and alternating oligonucleotides |
| US7119184B2 (en) | 1991-08-12 | 2006-10-10 | Isis Pharmaceuticals, Inc. | Oligonucleotides having A-DNA form and B-DNA form conformational geometry |
| US6307040B1 (en) | 1992-03-05 | 2001-10-23 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides that detect and modulate gene expression |
| US5393841A (en) * | 1993-11-09 | 1995-02-28 | Shell Oil Company | Dissimilar arm asymmetric radial or star block copolymers for adhesives and sealants |
| US5898031A (en) | 1996-06-06 | 1999-04-27 | Isis Pharmaceuticals, Inc. | Oligoribonucleotides for cleaving RNA |
| US7812149B2 (en) | 1996-06-06 | 2010-10-12 | Isis Pharmaceuticals, Inc. | 2′-Fluoro substituted oligomeric compounds and compositions for use in gene modulations |
| US9096636B2 (en) | 1996-06-06 | 2015-08-04 | Isis Pharmaceuticals, Inc. | Chimeric oligomeric compounds and their use in gene modulation |
| DK0917879T3 (da) * | 1997-11-22 | 2002-11-04 | Roche Diagnostics Gmbh | Forbedret fremgangsmåde til stabilisering af proteiner |
| YU44900A (sh) | 1998-01-31 | 2003-01-31 | Glaxo Group Limited | Derivati 2-(purin-9-il)tetrahidrofuran-3,4-diola |
| ES2402597T3 (es) | 2000-10-18 | 2013-05-07 | Gilead Pharmasset Llc | Nucleósidos modificados para el tratamiento de infecciones víricas y proliferación celular anormal |
| US7132453B2 (en) | 2002-03-15 | 2006-11-07 | Vanderbilt University | Method of using prostacyclin to treat respiratory syncytial virus infections |
| WO2004044133A2 (en) | 2002-11-05 | 2004-05-27 | Isis Pharmaceuticals, Inc. | Modified oligonucleotides for use in rna interference |
| US8569474B2 (en) | 2004-03-09 | 2013-10-29 | Isis Pharmaceuticals, Inc. | Double stranded constructs comprising one or more short strands hybridized to a longer strand |
| US8394947B2 (en) | 2004-06-03 | 2013-03-12 | Isis Pharmaceuticals, Inc. | Positionally modified siRNA constructs |
| US7884086B2 (en) | 2004-09-08 | 2011-02-08 | Isis Pharmaceuticals, Inc. | Conjugates for use in hepatocyte free uptake assays |
| WO2008109080A2 (en) * | 2007-03-01 | 2008-09-12 | Siemens Medical Solutions Usa, Inc. | Nucleoside based proliferation imaging markers |
| WO2010101951A1 (en) | 2009-03-02 | 2010-09-10 | Alnylam Pharmaceuticals, Inc. | Nucleic acid chemical modifications |
| WO2011123621A2 (en) | 2010-04-01 | 2011-10-06 | Alnylam Pharmaceuticals Inc. | 2' and 5' modified monomers and oligonucleotides |
| WO2018110643A1 (ja) * | 2016-12-14 | 2018-06-21 | ヤマサ醤油株式会社 | 抗ウイルス活性を示すヌクレオシド誘導体 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4751221A (en) * | 1985-10-18 | 1988-06-14 | Sloan-Kettering Institute For Cancer Research | 2-fluoro-arabinofuranosyl purine nucleosides |
| CA1340645C (en) * | 1987-04-17 | 1999-07-13 | Victor E. Marquez | Acid stable dideoxynucleosides active against the cytopathic effects of human immunodeficiency virus |
-
1989
- 1989-09-11 GB GB898920534A patent/GB8920534D0/en active Pending
-
1990
- 1990-09-07 DD DD90343871A patent/DD297650A5/de not_active IP Right Cessation
- 1990-09-07 EP EP95107762A patent/EP0671410A1/en not_active Withdrawn
- 1990-09-07 AT AT90309838T patent/ATE135365T1/de not_active IP Right Cessation
- 1990-09-07 DE DE69025834T patent/DE69025834D1/de not_active Expired - Lifetime
- 1990-09-07 EP EP90309838A patent/EP0417999B1/en not_active Expired - Lifetime
- 1990-09-10 TW TW079107576A patent/TW226333B/zh active
- 1990-09-10 KR KR1019900014464A patent/KR910006293A/ko not_active Application Discontinuation
- 1990-09-10 IE IE326990A patent/IE903269A1/en unknown
- 1990-09-10 PT PT95261A patent/PT95261A/pt not_active Application Discontinuation
- 1990-09-10 CA CA002025009A patent/CA2025009A1/en not_active Abandoned
- 1990-09-10 PL PL90286820A patent/PL164967B1/pl unknown
- 1990-09-10 MY MYPI90001550A patent/MY130035A/en unknown
- 1990-09-10 FI FI904445A patent/FI904445A0/fi not_active Application Discontinuation
- 1990-09-10 TW TW082105888A patent/TW246641B/zh active
- 1990-09-10 RU SU904831211A patent/RU2043361C1/ru active
- 1990-09-10 ZA ZA907187A patent/ZA907187B/xx unknown
- 1990-09-10 HU HU905841A patent/HUT54704A/hu unknown
- 1990-09-10 NZ NZ235244A patent/NZ235244A/xx unknown
- 1990-09-10 AU AU62350/90A patent/AU644095B2/en not_active Ceased
- 1990-09-11 JP JP2241057A patent/JPH03145497A/ja active Pending
-
1994
- 1994-01-14 RU RU94002475/14A patent/RU94002475A/ru unknown
Non-Patent Citations (4)
| Title |
|---|
| Заявка ЕР 0062921, кл. C 07H 19/16, 1982. * |
| Заявка ЕР N 314011, кл. C 07H 19/16, 1989. Chem.Pharm.Bull; 29, 1034, 1981. * |
| Патент DD N 158903, кл. C 07H 19/16, 1983. * |
| Патент GB N 1573777, кл. C 07H 19/16, 1980. * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| USRE44330E1 (en) | 1995-06-19 | 2013-07-02 | Lifescan Inc. | Electrochemical cell |
| EA008609B1 (ru) * | 1998-02-25 | 2007-06-29 | Эмори Юниверсити | 2'-фторнуклеозиды |
| RU2663584C2 (ru) * | 2014-04-23 | 2018-08-07 | Синбиас Фарма АГ | Способ синтеза клофарабина |
Also Published As
| Publication number | Publication date |
|---|---|
| PL164967B1 (pl) | 1994-10-31 |
| HUT54704A (en) | 1991-03-28 |
| TW246641B (ru) | 1995-05-01 |
| PL286820A1 (en) | 1991-04-22 |
| MY130035A (en) | 2007-05-31 |
| ATE135365T1 (de) | 1996-03-15 |
| AU644095B2 (en) | 1993-12-02 |
| RU94002475A (ru) | 1996-11-10 |
| EP0417999A1 (en) | 1991-03-20 |
| TW226333B (ru) | 1994-07-11 |
| DD297650A5 (de) | 1992-01-16 |
| NZ235244A (en) | 1992-11-25 |
| FI904445A0 (fi) | 1990-09-10 |
| DE69025834D1 (de) | 1996-04-18 |
| AU6235090A (en) | 1991-03-14 |
| ZA907187B (en) | 1992-05-27 |
| IE903269A1 (en) | 1991-03-27 |
| KR910006293A (ko) | 1991-04-29 |
| EP0671410A1 (en) | 1995-09-13 |
| JPH03145497A (ja) | 1991-06-20 |
| EP0417999B1 (en) | 1996-03-13 |
| GB8920534D0 (en) | 1989-10-25 |
| CA2025009A1 (en) | 1991-03-12 |
| PT95261A (pt) | 1991-05-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2043361C1 (ru) | Способ получения производных 2'-дезокси-2'-фторрибонуклеозидов или их фармацевтически приемлемых солей | |
| EP0680488B1 (en) | 2,6-diaminopurine derivatives | |
| EP0269574B1 (en) | Novel adenosine derivatives and pharmaceutical compositions containing them as an active ingredient | |
| ES2324816T3 (es) | Derivados de 2-aminocarbonil-9h-purina. | |
| FI89805C (fi) | Foerfarande foer framstaellning av terapeutiskt anvaendbara, substituerade purinarabinosider | |
| US6753322B2 (en) | 2-aminocarbonyl-9H-purine derivatives | |
| JPH08501071A (ja) | 1,5−アンヒドロヘキシトールヌクレオシド類似体および該類似体の医薬としての使用 | |
| EP0286425B1 (en) | Therapeutic nucleosides | |
| NL8803140A (nl) | Adenosinederivaten. | |
| HU203363B (en) | Process for producing 2',3'-dideoxy-2',2'-difluoronucleosides and pharmaceutical compositions comprising same as active ingredient | |
| US5420115A (en) | Method for the treatment of protoza infections with 21 -deoxy-21 -fluoropurine nucleosides | |
| JPH06228186A (ja) | 2’−デオキシ−(2’s)−アルキルピリミジンヌクレオシド誘導体 | |
| WO1999043690A1 (fr) | Compose de l-4'-arabinofuranonucleoside et composition medicinale le contenant | |
| EP0375183A1 (en) | Antiviral dimers and trimers | |
| US5153180A (en) | Fluorinated nucleosides and process for treating retrovirus infections therewith | |
| JPH02164881A (ja) | 治療用ヌクレオシド化合物 | |
| EP0287215B1 (en) | Therapeutic nucleosides | |
| JPH0232094A (ja) | 抗感染性ヌクレオシド | |
| EP0375164B1 (en) | Antiviral compounds | |
| RU2112765C1 (ru) | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ ПРОТИВ ВИРУСНОЙ ИНФЕКЦИИ И β D-АРАБИНОФУРАНОЗИЛ-2-АМИНО-6-МЕТОКСИ-9Н-ПУРИНЫ | |
| RU2039752C1 (ru) | Способ получения замещенных пуриновых арабинозидов или его фармацевтически приемлемых производных | |
| HU192472B (en) | Process for preparing /e/-5-/2-bromo-vinyl/-uracyl derivatives | |
| Mikhailopulo et al. | Formation of an Unexpected 2-Deoxy-α-D-Threo-Pentofuranosyl Azide by Reaction of O2, 3′-Anhydro-5′-O-trityl-2′-deoxycytidine with Lithium Azide | |
| JPH02247191A (ja) | 抗レトロウイルス剤としてのプリンおよびピリミジン非環状ヌクレオシドの環状モノホスフエート類 | |
| CS203095B2 (cs) | Způsob přípravy substituovaných purinů |