KR20120081596A - 약제학적 조성물, 약제학적 용량형, 이들의 제조방법, 치료방법 및 이들의 용도 - Google Patents
약제학적 조성물, 약제학적 용량형, 이들의 제조방법, 치료방법 및 이들의 용도 Download PDFInfo
- Publication number
- KR20120081596A KR20120081596A KR1020127008433A KR20127008433A KR20120081596A KR 20120081596 A KR20120081596 A KR 20120081596A KR 1020127008433 A KR1020127008433 A KR 1020127008433A KR 20127008433 A KR20127008433 A KR 20127008433A KR 20120081596 A KR20120081596 A KR 20120081596A
- Authority
- KR
- South Korea
- Prior art keywords
- pharmaceutical composition
- sglt
- patient
- tablets
- dosage form
- Prior art date
Links
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 129
- 238000000034 method Methods 0.000 title claims abstract description 105
- 239000002552 dosage form Substances 0.000 title claims description 74
- 238000002360 preparation method Methods 0.000 title abstract description 11
- 230000008569 process Effects 0.000 title description 26
- 229940123518 Sodium/glucose cotransporter 2 inhibitor Drugs 0.000 claims abstract description 139
- 239000003814 drug Substances 0.000 claims abstract description 82
- 229940079593 drug Drugs 0.000 claims abstract description 74
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 48
- 201000010099 disease Diseases 0.000 claims abstract description 25
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 claims description 129
- 229960003105 metformin Drugs 0.000 claims description 100
- 239000000203 mixture Substances 0.000 claims description 98
- OETHQSJEHLVLGH-UHFFFAOYSA-N metformin hydrochloride Chemical compound Cl.CN(C)C(=N)N=C(N)N OETHQSJEHLVLGH-UHFFFAOYSA-N 0.000 claims description 96
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 73
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 68
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 64
- 239000008103 glucose Substances 0.000 claims description 64
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims description 60
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 claims description 58
- 210000004369 blood Anatomy 0.000 claims description 54
- 239000008280 blood Substances 0.000 claims description 54
- 235000000346 sugar Nutrition 0.000 claims description 53
- 201000009104 prediabetes syndrome Diseases 0.000 claims description 46
- 206010022489 Insulin Resistance Diseases 0.000 claims description 45
- 238000011282 treatment Methods 0.000 claims description 43
- 229920002261 Corn starch Polymers 0.000 claims description 40
- 239000008120 corn starch Substances 0.000 claims description 40
- 208000002705 Glucose Intolerance Diseases 0.000 claims description 38
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 claims description 32
- 206010012601 diabetes mellitus Diseases 0.000 claims description 32
- 230000002641 glycemic effect Effects 0.000 claims description 32
- 206010056997 Impaired fasting glucose Diseases 0.000 claims description 31
- 239000002356 single layer Substances 0.000 claims description 31
- 235000019359 magnesium stearate Nutrition 0.000 claims description 29
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 claims description 28
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 claims description 28
- 229960004329 metformin hydrochloride Drugs 0.000 claims description 28
- 230000002265 prevention Effects 0.000 claims description 28
- 239000011230 binding agent Substances 0.000 claims description 27
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 claims description 27
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 claims description 27
- 238000004519 manufacturing process Methods 0.000 claims description 27
- 239000000945 filler Substances 0.000 claims description 26
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 claims description 26
- 229960003943 hypromellose Drugs 0.000 claims description 26
- 239000000314 lubricant Substances 0.000 claims description 26
- 239000000377 silicon dioxide Substances 0.000 claims description 26
- 208000001145 Metabolic Syndrome Diseases 0.000 claims description 24
- 208000008589 Obesity Diseases 0.000 claims description 24
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 claims description 24
- 235000020824 obesity Nutrition 0.000 claims description 24
- 229920000168 Microcrystalline cellulose Polymers 0.000 claims description 23
- 208000035475 disorder Diseases 0.000 claims description 23
- 235000019813 microcrystalline cellulose Nutrition 0.000 claims description 23
- 239000007888 film coating Substances 0.000 claims description 22
- 238000009501 film coating Methods 0.000 claims description 22
- 201000001421 hyperglycemia Diseases 0.000 claims description 22
- -1 metformin Chemical class 0.000 claims description 22
- 239000008108 microcrystalline cellulose Substances 0.000 claims description 21
- 229940016286 microcrystalline cellulose Drugs 0.000 claims description 21
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 claims description 21
- 229920001531 copovidone Polymers 0.000 claims description 19
- 230000004584 weight gain Effects 0.000 claims description 17
- 235000019786 weight gain Nutrition 0.000 claims description 17
- 206010033307 Overweight Diseases 0.000 claims description 16
- 239000004014 plasticizer Substances 0.000 claims description 16
- 239000000454 talc Substances 0.000 claims description 16
- 229910052623 talc Inorganic materials 0.000 claims description 16
- 239000004408 titanium dioxide Substances 0.000 claims description 16
- 208000004611 Abdominal Obesity Diseases 0.000 claims description 15
- 206010060378 Hyperinsulinaemia Diseases 0.000 claims description 15
- 201000008980 hyperinsulinism Diseases 0.000 claims description 15
- 230000000291 postprandial effect Effects 0.000 claims description 15
- 230000004580 weight loss Effects 0.000 claims description 15
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 14
- 230000003451 hyperinsulinaemic effect Effects 0.000 claims description 14
- 238000011068 loading method Methods 0.000 claims description 14
- 230000009467 reduction Effects 0.000 claims description 14
- 239000002202 Polyethylene glycol Substances 0.000 claims description 12
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 12
- 239000003795 chemical substances by application Substances 0.000 claims description 12
- 208000030159 metabolic disease Diseases 0.000 claims description 12
- 239000000049 pigment Substances 0.000 claims description 12
- 229920001223 polyethylene glycol Polymers 0.000 claims description 12
- 102000017011 Glycated Hemoglobin A Human genes 0.000 claims description 11
- 108091005995 glycated hemoglobin Proteins 0.000 claims description 11
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 11
- 239000007787 solid Substances 0.000 claims description 11
- 230000002159 abnormal effect Effects 0.000 claims description 10
- 238000009825 accumulation Methods 0.000 claims description 10
- 210000004185 liver Anatomy 0.000 claims description 10
- 210000002966 serum Anatomy 0.000 claims description 10
- 206010065941 Central obesity Diseases 0.000 claims description 9
- 208000002249 Diabetes Complications Diseases 0.000 claims description 9
- 208000031773 Insulin resistance syndrome Diseases 0.000 claims description 9
- 230000007850 degeneration Effects 0.000 claims description 9
- 230000003914 insulin secretion Effects 0.000 claims description 9
- 208000028867 ischemia Diseases 0.000 claims description 9
- 208000017169 kidney disease Diseases 0.000 claims description 9
- 208000010125 myocardial infarction Diseases 0.000 claims description 9
- 230000007823 neuropathy Effects 0.000 claims description 9
- 230000002093 peripheral effect Effects 0.000 claims description 9
- 238000009097 single-agent therapy Methods 0.000 claims description 9
- 201000001320 Atherosclerosis Diseases 0.000 claims description 8
- 208000002177 Cataract Diseases 0.000 claims description 8
- 206010019280 Heart failures Diseases 0.000 claims description 8
- 206010054805 Macroangiopathy Diseases 0.000 claims description 8
- 208000017442 Retinal disease Diseases 0.000 claims description 8
- 206010038923 Retinopathy Diseases 0.000 claims description 8
- 208000006011 Stroke Diseases 0.000 claims description 8
- 230000006872 improvement Effects 0.000 claims description 8
- 201000001119 neuropathy Diseases 0.000 claims description 8
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 8
- 229940123208 Biguanide Drugs 0.000 claims description 7
- 229920000881 Modified starch Polymers 0.000 claims description 7
- 239000002775 capsule Substances 0.000 claims description 7
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 claims description 7
- 235000010355 mannitol Nutrition 0.000 claims description 7
- 229940045902 sodium stearyl fumarate Drugs 0.000 claims description 7
- 208000004476 Acute Coronary Syndrome Diseases 0.000 claims description 6
- 208000031229 Cardiomyopathies Diseases 0.000 claims description 6
- 208000008960 Diabetic foot Diseases 0.000 claims description 6
- 208000007718 Stable Angina Diseases 0.000 claims description 6
- 230000035487 diastolic blood pressure Effects 0.000 claims description 6
- 229940124531 pharmaceutical excipient Drugs 0.000 claims description 6
- 208000037803 restenosis Diseases 0.000 claims description 6
- 230000035488 systolic blood pressure Effects 0.000 claims description 6
- 230000002792 vascular Effects 0.000 claims description 6
- 208000007814 Unstable Angina Diseases 0.000 claims description 5
- 230000015556 catabolic process Effects 0.000 claims description 5
- 230000003915 cell function Effects 0.000 claims description 5
- 238000006731 degradation reaction Methods 0.000 claims description 5
- SZVJSHCCFOBDDC-UHFFFAOYSA-N ferrosoferric oxide Chemical compound O=[Fe]O[Fe]O[Fe]=O SZVJSHCCFOBDDC-UHFFFAOYSA-N 0.000 claims description 5
- 208000031104 Arterial Occlusive disease Diseases 0.000 claims description 4
- 239000003472 antidiabetic agent Substances 0.000 claims description 4
- 230000036765 blood level Effects 0.000 claims description 4
- 230000001747 exhibiting effect Effects 0.000 claims description 4
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 claims description 4
- 206010002388 Angina unstable Diseases 0.000 claims description 3
- 108010023302 HDL Cholesterol Proteins 0.000 claims description 3
- 229940125708 antidiabetic agent Drugs 0.000 claims description 3
- 208000021328 arterial occlusion Diseases 0.000 claims description 3
- 235000005911 diet Nutrition 0.000 claims description 3
- 230000037213 diet Effects 0.000 claims description 3
- 201000004332 intermediate coronary syndrome Diseases 0.000 claims description 3
- 238000012423 maintenance Methods 0.000 claims description 3
- 244000309464 bull Species 0.000 claims description 2
- 230000006866 deterioration Effects 0.000 claims description 2
- 238000007922 dissolution test Methods 0.000 claims description 2
- 230000001737 promoting effect Effects 0.000 claims description 2
- 150000004283 biguanides Chemical class 0.000 claims 2
- 206010002383 Angina Pectoris Diseases 0.000 claims 1
- 238000009207 exercise therapy Methods 0.000 claims 1
- 229940000425 combination drug Drugs 0.000 abstract description 35
- 239000003826 tablet Substances 0.000 description 140
- 150000001875 compounds Chemical class 0.000 description 79
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 55
- 239000008187 granular material Substances 0.000 description 52
- 238000005469 granulation Methods 0.000 description 42
- 238000000576 coating method Methods 0.000 description 38
- 230000003179 granulation Effects 0.000 description 35
- 239000000725 suspension Substances 0.000 description 34
- 239000011248 coating agent Substances 0.000 description 33
- 102000004877 Insulin Human genes 0.000 description 27
- 108090001061 Insulin Proteins 0.000 description 27
- 229940125396 insulin Drugs 0.000 description 27
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 24
- 238000009472 formulation Methods 0.000 description 21
- 239000007788 liquid Substances 0.000 description 21
- 238000009477 fluid bed granulation Methods 0.000 description 20
- 239000008213 purified water Substances 0.000 description 20
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 19
- 239000004480 active ingredient Substances 0.000 description 18
- 238000005507 spraying Methods 0.000 description 16
- 239000007941 film coated tablet Substances 0.000 description 15
- 229910002016 Aerosil® 200 Inorganic materials 0.000 description 14
- 150000001555 benzenes Chemical class 0.000 description 13
- 235000013980 iron oxide Nutrition 0.000 description 13
- 229960003511 macrogol Drugs 0.000 description 13
- 238000002156 mixing Methods 0.000 description 13
- 239000000243 solution Substances 0.000 description 11
- 206010018429 Glucose tolerance impaired Diseases 0.000 description 10
- 239000012530 fluid Substances 0.000 description 10
- 238000000634 powder X-ray diffraction Methods 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- 150000003839 salts Chemical class 0.000 description 10
- 239000002245 particle Substances 0.000 description 9
- 239000000843 powder Substances 0.000 description 9
- 238000013268 sustained release Methods 0.000 description 9
- 239000012730 sustained-release form Substances 0.000 description 9
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 8
- 208000001280 Prediabetic State Diseases 0.000 description 8
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 8
- 238000004090 dissolution Methods 0.000 description 8
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 8
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 8
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 8
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 8
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 235000019197 fats Nutrition 0.000 description 7
- 238000011321 prophylaxis Methods 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- 238000010171 animal model Methods 0.000 description 6
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 6
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 6
- 239000007884 disintegrant Substances 0.000 description 6
- 238000009826 distribution Methods 0.000 description 6
- 239000010410 layer Substances 0.000 description 6
- 230000005855 radiation Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- XNCOSPRUTUOJCJ-UHFFFAOYSA-N Biguanide Chemical compound NC(N)=NC(N)=N XNCOSPRUTUOJCJ-UHFFFAOYSA-N 0.000 description 5
- 229920002785 Croscarmellose sodium Polymers 0.000 description 5
- 208000004930 Fatty Liver Diseases 0.000 description 5
- 206010019708 Hepatic steatosis Diseases 0.000 description 5
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 5
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 5
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 5
- 238000007906 compression Methods 0.000 description 5
- 230000006835 compression Effects 0.000 description 5
- 229960001681 croscarmellose sodium Drugs 0.000 description 5
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 208000010706 fatty liver disease Diseases 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 230000007774 longterm Effects 0.000 description 5
- 231100000240 steatosis hepatitis Toxicity 0.000 description 5
- 239000001069 triethyl citrate Substances 0.000 description 5
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 5
- 235000013769 triethyl citrate Nutrition 0.000 description 5
- 238000005303 weighing Methods 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 4
- 239000004372 Polyvinyl alcohol Substances 0.000 description 4
- 108091006269 SLC5A2 Proteins 0.000 description 4
- 102000000070 Sodium-Glucose Transport Proteins Human genes 0.000 description 4
- 108010080361 Sodium-Glucose Transport Proteins Proteins 0.000 description 4
- 102000058081 Sodium-Glucose Transporter 2 Human genes 0.000 description 4
- 125000001309 chloro group Chemical group Cl* 0.000 description 4
- 125000004093 cyano group Chemical group *C#N 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 229920002451 polyvinyl alcohol Polymers 0.000 description 4
- 229940002612 prodrug Drugs 0.000 description 4
- 239000000651 prodrug Substances 0.000 description 4
- 238000007789 sealing Methods 0.000 description 4
- 239000006188 syrup Substances 0.000 description 4
- 235000020357 syrup Nutrition 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 3
- 206010012655 Diabetic complications Diseases 0.000 description 3
- 208000013016 Hypoglycemia Diseases 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 240000006394 Sorghum bicolor Species 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- 238000013270 controlled release Methods 0.000 description 3
- 208000029078 coronary artery disease Diseases 0.000 description 3
- 229960000913 crospovidone Drugs 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 208000033679 diabetic kidney disease Diseases 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- 230000002526 effect on cardiovascular system Effects 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000013632 homeostatic process Effects 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 230000002218 hypoglycaemic effect Effects 0.000 description 3
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- WTFXARWRTYJXII-UHFFFAOYSA-N iron(2+);iron(3+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[O-2].[Fe+2].[Fe+3].[Fe+3] WTFXARWRTYJXII-UHFFFAOYSA-N 0.000 description 3
- 238000003475 lamination Methods 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 3
- 239000008184 oral solid dosage form Substances 0.000 description 3
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 3
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 229920003169 water-soluble polymer Polymers 0.000 description 3
- CZMRCDWAGMRECN-UHFFFAOYSA-N 2-{[3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy}-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound OCC1OC(CO)(OC2OC(CO)C(O)C(O)C2O)C(O)C1O CZMRCDWAGMRECN-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 206010054044 Diabetic microangiopathy Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010076181 Proinsulin Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 208000001647 Renal Insufficiency Diseases 0.000 description 2
- 229940100389 Sulfonylurea Drugs 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000007910 chewable tablet Substances 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 201000009101 diabetic angiopathy Diseases 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 239000007938 effervescent tablet Substances 0.000 description 2
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000013265 extended release Methods 0.000 description 2
- 230000037406 food intake Effects 0.000 description 2
- 238000007446 glucose tolerance test Methods 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000009478 high shear granulation Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- VBMVTYDPPZVILR-UHFFFAOYSA-N iron(2+);oxygen(2-) Chemical class [O-2].[Fe+2] VBMVTYDPPZVILR-UHFFFAOYSA-N 0.000 description 2
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 2
- 201000006370 kidney failure Diseases 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 229960001375 lactose Drugs 0.000 description 2
- 239000012669 liquid formulation Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 231100000682 maximum tolerated dose Toxicity 0.000 description 2
- 235000012054 meals Nutrition 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 238000007410 oral glucose tolerance test Methods 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 238000004381 surface treatment Methods 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 150000003626 triacylglycerols Chemical class 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- ZOBPZXTWZATXDG-UHFFFAOYSA-N 1,3-thiazolidine-2,4-dione Chemical compound O=C1CSC(=O)N1 ZOBPZXTWZATXDG-UHFFFAOYSA-N 0.000 description 1
- VOUAQYXWVJDEQY-QENPJCQMSA-N 33017-11-7 Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)NCC(=O)NCC(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)CCC1 VOUAQYXWVJDEQY-QENPJCQMSA-N 0.000 description 1
- 102000011690 Adiponectin Human genes 0.000 description 1
- 108010076365 Adiponectin Proteins 0.000 description 1
- 206010001580 Albuminuria Diseases 0.000 description 1
- 229940077274 Alpha glucosidase inhibitor Drugs 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 201000004569 Blindness Diseases 0.000 description 1
- 108010075254 C-Peptide Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 1
- 206010063547 Diabetic macroangiopathy Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 206010056340 Diabetic ulcer Diseases 0.000 description 1
- 208000005189 Embolism Diseases 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 101710198884 GATA-type zinc finger protein 1 Proteins 0.000 description 1
- 102000051325 Glucagon Human genes 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 206010018473 Glycosuria Diseases 0.000 description 1
- 108010010234 HDL Lipoproteins Proteins 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000716682 Homo sapiens Sodium/glucose cotransporter 2 Proteins 0.000 description 1
- 101000716695 Homo sapiens Solute carrier family 5 member 4 Proteins 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 229920003083 Kollidon® VA64 Polymers 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 206010028851 Necrosis Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 102100040918 Pro-glucagon Human genes 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108091006277 SLC5A1 Proteins 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- 102000058090 Sodium-Glucose Transporter 1 Human genes 0.000 description 1
- 102100020883 Solute carrier family 5 member 4 Human genes 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 229940123464 Thiazolidinedione Drugs 0.000 description 1
- 206010066901 Treatment failure Diseases 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000003888 alpha glucosidase inhibitor Substances 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 229940127003 anti-diabetic drug Drugs 0.000 description 1
- 230000002058 anti-hyperglycaemic effect Effects 0.000 description 1
- 230000003276 anti-hypertensive effect Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000007894 caplet Substances 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 230000007211 cardiovascular event Effects 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- UHZZMRAGKVHANO-UHFFFAOYSA-M chlormequat chloride Chemical compound [Cl-].C[N+](C)(C)CCCl UHZZMRAGKVHANO-UHFFFAOYSA-M 0.000 description 1
- 230000009693 chronic damage Effects 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229940099112 cornstarch Drugs 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000001938 differential scanning calorimetry curve Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000007919 dispersible tablet Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000012738 dissolution medium Substances 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000013561 fixed dose combination tablet Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 230000001434 glomerular Effects 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 230000035780 glucosuria Effects 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 108010049074 hemoglobin B Proteins 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 102000052543 human SLC5A2 Human genes 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000003345 hyperglycaemic effect Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000004026 insulin derivative Substances 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 208000006443 lactic acidosis Diseases 0.000 description 1
- 238000007561 laser diffraction method Methods 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 210000000110 microvilli Anatomy 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000008185 minitablet Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 description 1
- 239000002687 nonaqueous vehicle Substances 0.000 description 1
- 230000000414 obstructive effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 238000004634 pharmacological analysis method Methods 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 201000001474 proteinuria Diseases 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000013878 renal filtration Effects 0.000 description 1
- 230000033764 rhythmic process Effects 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000004626 scanning electron microscopy Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 238000007873 sieving Methods 0.000 description 1
- 210000002356 skeleton Anatomy 0.000 description 1
- 238000001374 small-angle light scattering Methods 0.000 description 1
- 235000002639 sodium chloride Nutrition 0.000 description 1
- PUZPDOWCWNUUKD-UHFFFAOYSA-M sodium fluoride Chemical compound [F-].[Na+] PUZPDOWCWNUUKD-UHFFFAOYSA-M 0.000 description 1
- 229940121377 sodium-glucose co-transporter inhibitor Drugs 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000007944 soluble tablet Substances 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 210000002536 stromal cell Anatomy 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 235000011044 succinic acid Nutrition 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000002636 symptomatic treatment Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 210000005239 tubule Anatomy 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/351—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom not condensed with another ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2086—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat
- A61K9/209—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat containing drug in at least two layers or in the core and in at least one outer layer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/286—Polysaccharides, e.g. gums; Cyclodextrin
- A61K9/2866—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/12—Ophthalmic agents for cataracts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Biophysics (AREA)
- Inorganic Chemistry (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Ophthalmology & Optometry (AREA)
- Emergency Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Vascular Medicine (AREA)
- Child & Adolescent Psychology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명은 SGLT-2 억제제 약물 및 파트너 약물의 고정 용량 병용물을 포함하는 약제학적 조성물 및 이들의 제조방법, 및 특정 질환을 치료하기 위한 이들의 용도에 관한 것이다.
Description
본 발명은 SGLT-2 억제제 약물 및 파트너 약물의 고정 용량 병용물을 포함하는 약제학적 조성물 및 이들의 제조방법, 및 특정 질환을 치료하기 위한 이들의 용도에 관한 것이다.
보다 상세한 측면에서, 본 발명은 선택된 SGLT-2 억제제 약물 및 특정의 파트너 약물의 고정 용량 병용물(FDC; fixed dose combination)을 위한 경구 고체 용량형에 관한 것이다. 또한, 본 발명은 상기 약제학적 용량형의 제조방법에 관한 것이다. 추가로, 본 발명은 선택된 질환 및 의학적 상태, 특히 그 중에서도 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애, 공복 혈당 장애 및 고혈당증 등으로부터 선택된 하나 이상의 상태의 치료 및/또는 예방에서의 약제학적 조성물 및 약제학적 용량형의 용도에 관한 것이다. 또한, 본 발명은 상기 질환 및 의학적 상태의 치료 및/또는 예방 방법에 관한 것이고, 여기서, 본 발명에 따르는 약제학적 조성물 또는 약제학적 용량형을 이를 필요로 하는 환자에게 투여한다.
2형 당뇨병은 높은 빈도의 합병증으로 인해 기대 수명을 현저히 감소시키는 점차 만연되고 있는 질환이다. 당뇨병-관련 미세혈관 합병증으로 인해, 2형 당뇨병은 현재 산업화된 세계에서 성인-발병성 시력 상실, 신부전 및 절단수술의 가장 빈번한 원인이다. 또한, 2형 당뇨병의 존재는 심혈관 질환의 위험이 2배 내지 5배 증가하는 것과 관련이 있다.
질환이 장기간 지속된 후, 대부분의 2형 당뇨병 환자들은 결국 경구 치료에 실패하게 될 것이며, 매일 주사와 1일 수회의 당 측정이 필요한 인슐린 의존성이 될 것이다.
UKPDS(United Kingdom Prospective Diabetes Study)에서는 메트포르민, 설포닐우레아 또는 인슐린을 이용한 집중 치료는 단지 제한된 혈당 조절 개선(HbA1c 차이 약 0.9%)을 제공한다는 것을 입증하였다. 또한, 집중 치료를 받은 환자들에서조차 팔의 혈당 조절은 경시적으로 현저하게 악화되었고, 이로 인해 β-세포 기능이 저하되었다. 중요하게는, 집중 치료는 대혈관 합병증, 즉 심혈관 사건의 현저한 감소와 관계가 없었다. 따라서, 다수의 2형 당뇨병 환자들은 부분적으로는 기존의 항고혈당 요법의 장기적 효능에서의 제한, 내약성 및 투약의 불편함 때문에 부적절하게 치료되고 있다.
요법(예를 들어, 1선 또는 2선, 및/또는 단일 또는 (초기 또는 추가) 병용 요법)에 통상적으로 사용되는 경구 당뇨병 치료 약물로는, 제한 없이, 메트포르민, 설포닐우레아, 티아졸리딘디온, 글리니드 및 α-글루코시다제 억제제가 포함된다.
높은 치료 실패 발생율은 2형 당뇨병 환자에서 높은 비율의 장기적 고혈당증-관련 합병증 또는 만성 손상(예를 들어, 당뇨병성 신증, 망막증 또는 신경병증과 같은 미세혈관 및 대혈관 합병증, 또는 심혈관 합병증 포함)의 주요 원인이다.
따라서, 혈당 조절에 관하여, 질환-완화 특성에 관하여, 및 심혈관 발병률 및 사망률 감소에 관하여 양호한 효능을 갖는 동시에 개선된 안전성 프로파일을 나타내는, 방법, 약제 및 약제학적 조성물에 대한 충족되지 않은 의학적 요구가 존재한다.
SGLT2 억제제는 2형 당뇨병 환자의 혈당 조절을 치료하거나 개선하기 위해 개발 중인 새로운 부류의 제제를 나타낸다. 종래 기술, 예를 들어 WO 제01/27128호, WO 제03/099836호, WO 제2005/092877호, WO 제2006/034489호, WO 제2006/064033호, WO 제2006/117359호, WO 제2006/117360호, WO 제2007/025943호, WO 제2007/028814호, WO 제2007/031548호, WO 제2007/093610호, WO 제2007/128749호, WO 제2008/049923호, WO 제2008/055870호, WO 제2008/055940호에는 SGLT2 억제제로서 글루코피라노실-치환된 벤젠 유도체가 기재되어 있다. 글루코피라노실-치환된 벤젠 유도체는 뇨 당 배설의 유도제로서 및 당뇨병 치료 약제로서 제안된다.
당의 신장 여과 및 재흡수는 기타의 기전들 중에서 정상 상태 혈장 당 농도에 기여하며, 따라서 당뇨병 치료 표적으로서 작용할 수 있다. 여과된 당의 신장 상피 세포를 통한 재흡수는 세관 내의 브러쉬-보더 멤브레인(brush-border membrane)에 위치하는 나트륨-의존성 당 공동운반체(SGLT)를 통해 나트륨 구배에 따라 진행된다. 발현 패턴 뿐만 아니라 물리-화학적 특성들이 상이한 3종 이상의 SGLT 아이소폼이 존재한다. SGLT2는 전적으로 신장에서 발현되는 반면, SGLT1은 장, 결장, 골격 및 심근과 같은 기타 조직에서도 추가적으로 발현된다. SGLT3은 운반 기능을 전혀 갖지 않는, 장 간질 세포 내의 당 센서인 것으로 밝혀졌다. 잠재적으로, 기타 관련된, 그러나 아직 확인되지 않은, 유전자들도 신장 당 재흡수에 추가로 기여할 수 있다. 정상 혈당치에서는 당이 신장에서 SGLT에 의해 완전히 재흡수되지만, 10mM 보다 높은 당 농도에서는 신장의 재흡수 용량이 포화되어 당뇨(glucosuria)("진성 당뇨병")를 유발한다. 이 역치 농도는 SGLT2-억제에 의해 감소될 수 있다. SGLT 억제제인 플로리진을 이용한 실험에서, SGLT-억제는 사구체 여과액으로부터 혈액으로의 당의 재흡수를 부분적으로 억제하여 혈당 농도 및 당뇨의 감소를 유발한다는 것이 입증되었다.
발명의 목적
본 발명의 목적은 SGLT2 억제제 및 파트너 약물에 대한 높은 함량 균일성을 갖는, SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물을 제공하는 것이다.
본 발명의 또다른 목적은 파트너 약물에 대해 매우 높은 약물 부하를 갖고 SGLT2 억제제에 대해 매우 낮은 약물 부하를 갖는, SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물을 제공하는 것이다.
본 발명의 또다른 목적은 시간 및 비용 면에서 약제학적 용량형의 효과적인 제조를 허용하는 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물을 제공하는 것이다.
본 발명의 또다른 목적은 조성물의 제조 공정 동안 부착(sticking) 및 캡 형성(capping)을 피하거나 감소시키는 SGLT-2 억제제 및 파트너 약물을 포함하는 약제학적 조성물을 제공하는 것이다.
본 발명의 또다른 목적은 조성물의 제조 공정 동안 필름화를 피하거나 감소시키는 SGLT-2 억제제 및 파트너 약물을 포함하는 약제학적 조성물을 제공하는 것이다.
본 발명의 또다른 목적은 허용가능한 크기를 갖는 SGLT-2 억제제 및 파트너 약물을 포함하는 약제학적 용량형을 제공하는 것이다.
본 발명의 또다른 목적은 짧은 붕해 시간을 갖고, 우수한 용해 특성을 갖고/갖거나 환자에서 SGLT-2 억제제의 높은 생체이용성을 가능하게 하는 SGLT-2 억제제 및 파트너 약물을 포함하는 약제학적 용량형을 제공하는 것이다.
본 발명의 또다른 목적은 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형, 및 대사 장애, 특히 2형 진성 당뇨병을 예방하거나, 서서히 진행시키거나, 지연시키거나, 치료하기 위한 방법을 제공하는 것이다.
본 발명의 추가의 목적은 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형, 및 혈당 조절의 개선을 필요로 하는 환자, 특히 2형 진성 당뇨병 환자에서 혈당 조절을 개선하기 위한 방법을 제공하는 것이다.
본 발명의 또다른 목적은 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형, 및 혈당 조절이 불충한 환자에서 혈당 조절을 개선시키기 위한 방법을 제공하는 것이다.
본 발명의 또다른 목적은 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형, 및 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행을 예방하거나 서행시키거나 지연시키기 위한 방법을 제공하는 것이다.
본 발명의 또다른 목적은 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형, 및 진성 당뇨병 합병증으로 이루어진 그룹으로부터의 상태 또는 장애를 예방하거나, 서서히 진행시키거나, 지연시키거나, 치료하기 위한 방법을 제공하는 것이다.
본 발명의 추가의 목적은 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형, 및 체중 감소 또는 체중 증가 예방을 필요로 하는 환자에서 체중을 감소시키거나 체중 증가를 예방하기 위한 방법을 제공하는 것이다.
본 발명의 또다른 목적은 대사 장애, 특히 진성 당뇨병, 내당능 장애(IGT), 공복 혈당 장애(IFG) 및/또는 고혈당증 치료를 위한 높은 효능을 갖고, 양호한 내지 매우 양호한 약리학적 및/또는 약동학적 및/또는 물리화학적 특성들을 갖는, 각각 SGLT2 억제제 및 파트너 약물을 포함하는 약제학적 조성물 및 약제학적 용량형을 제공하는 것이다.
본 발명의 또다른 목적은 비용 및/또는 시간의 측면에서 효율적인, 본 발명에 따르는 약제학적 용량형의 제조방법을 제공하는 것이다.
본 발명의 추가의 목적들은 상기 및 하기 기재 내용과 실시예를 통해 당업자에게 명백해질 것이다.
발명의 요약
한 측면에서, 본 발명은 약제학적 활성 성분으로서 SGLT-2 억제제 및 파트너 약물 및 하나 이상의 부형제를 포함하는 약제학적 조성물을 제공한다. 한 측면에서, 본 발명에 따르는 약제학적 조성물은 고체 약제학적 조성물, 예를 들어, 경구 투여용 고체 약제학적 조성물이다.
한 측면에서, 본 발명에 따르는 약제학적 조성물 내에서 SGLT-2 억제제와 병용되는 파트너 약물은 비구아나이드(예를 들면, 메트포르민, 예를 들어, 메트포르민 하이드로클로라이드)이다.
본 발명의 의미 내에서 바람직한 파트너 약물은 메트포르민, 특히 메트포르민 하이드로클로라이드(1,1-디메틸비구아나이드 하이드로클로라이드 또는 메트포르민 HCl)이다.
일반적으로, 사용될 수 있는 약제학적 부형제는 하나 이상의 충전제, 하나 이상의 결합제 또는 희석제, 하나 이상의 윤활제, 하나 이상의 붕해제, 및 하나 이상의 활주제, 하나 이상의 필름-피복제, 하나 이상의 가소제, 하나 이상의 안료 등으로 이루어진 그룹으로부터 선택될 수 있다.
본 발명의 약제학적 조성물(정제)은 일반적으로 결합제를 포함한다.
보다 상세히, 본 발명의 약제학적 조성물(정제)은 일반적으로 하나 이상의 충전제(예를 들면, D-만니톨, 옥수수 전분 및/또는 예비젤라틴화 전분 및/또는 미세결정성 셀룰로스), 결합제(예를 들면, 코포비돈), 윤활제(예를 들면, 마그네슘 스테아레이트, 나트륨 스테아릴 푸마레이트) 및 활주제(예를 들면, 콜로이드성 무수 실리카)를 포함한다.
적합하게, 본 발명에 사용된 약제학적 부형제는 통상의 물질, 예를 들어, D-만니톨, 옥수수 전분, 미세결정성 셀룰로스, 충전제로서의 예비젤라틴화 전분, 결합제로서의 코포비돈, 윤활제로서의 마그네슘 스테아레이트 또는 나트륨 스테아릴 푸마레이트, 활주제로서의 콜로이드성 무수 실리카, 필름-피복제로서의 하이프로멜로스, 가소제로서의 프로필렌 글리콜, 안료로서의 이산화티탄, 산화철 레드/옐로우/블랙 또는 이들의 혼합물, 및 탈크 등이다.
본 발명에 따르는 전형적인 조성물은 결합제로서의 코포비돈(코폴리비돈 또는 콜리돈(Kollidon) VA64로서 공지되기도 함)을 포함한다.
추가로, 본 발명에 따르는 전형적인 조성물은 충전제로서의 옥수수 전분, 결합제로서의 코포비돈, 윤활제로서의 마그네슘 스테아레이트, 및 활주제로서의 콜로이드성 무수 실리카를 포함한다.
추가로, 본 발명에 따르는 전형적인 조성물은 충전제로서의 미세결정성 셀룰로스, 결합제로서의 코포비돈, 윤활제로서의 마그네슘 스테아레이트 또는 나트륨 스테아릴 푸마레이트, 및 활주제로서의 콜로이드성 무수 실리카 및 임의로 붕해제로서의 크로스포비돈 또는 크로스카멜로스 나트륨을 포함한다.
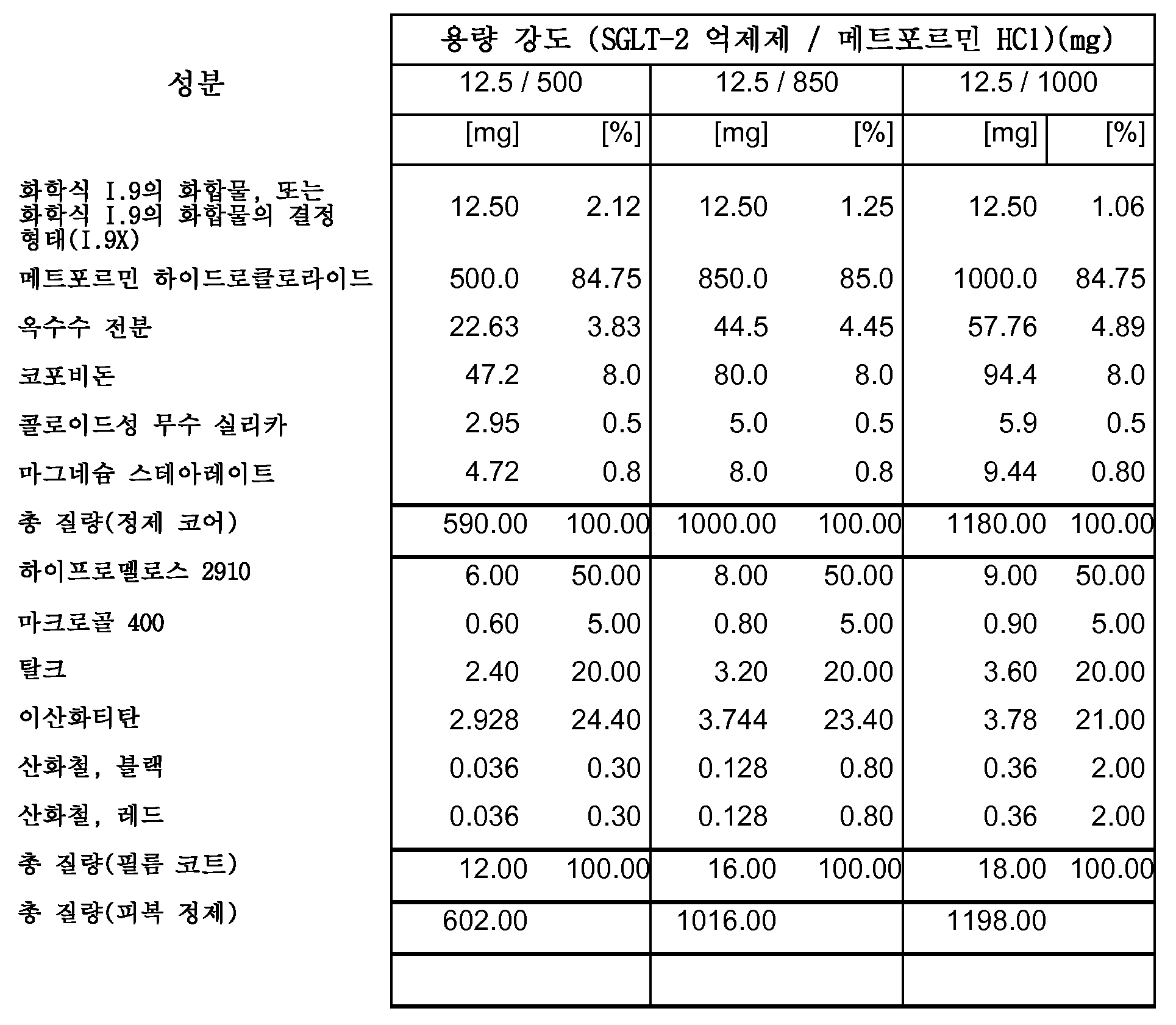
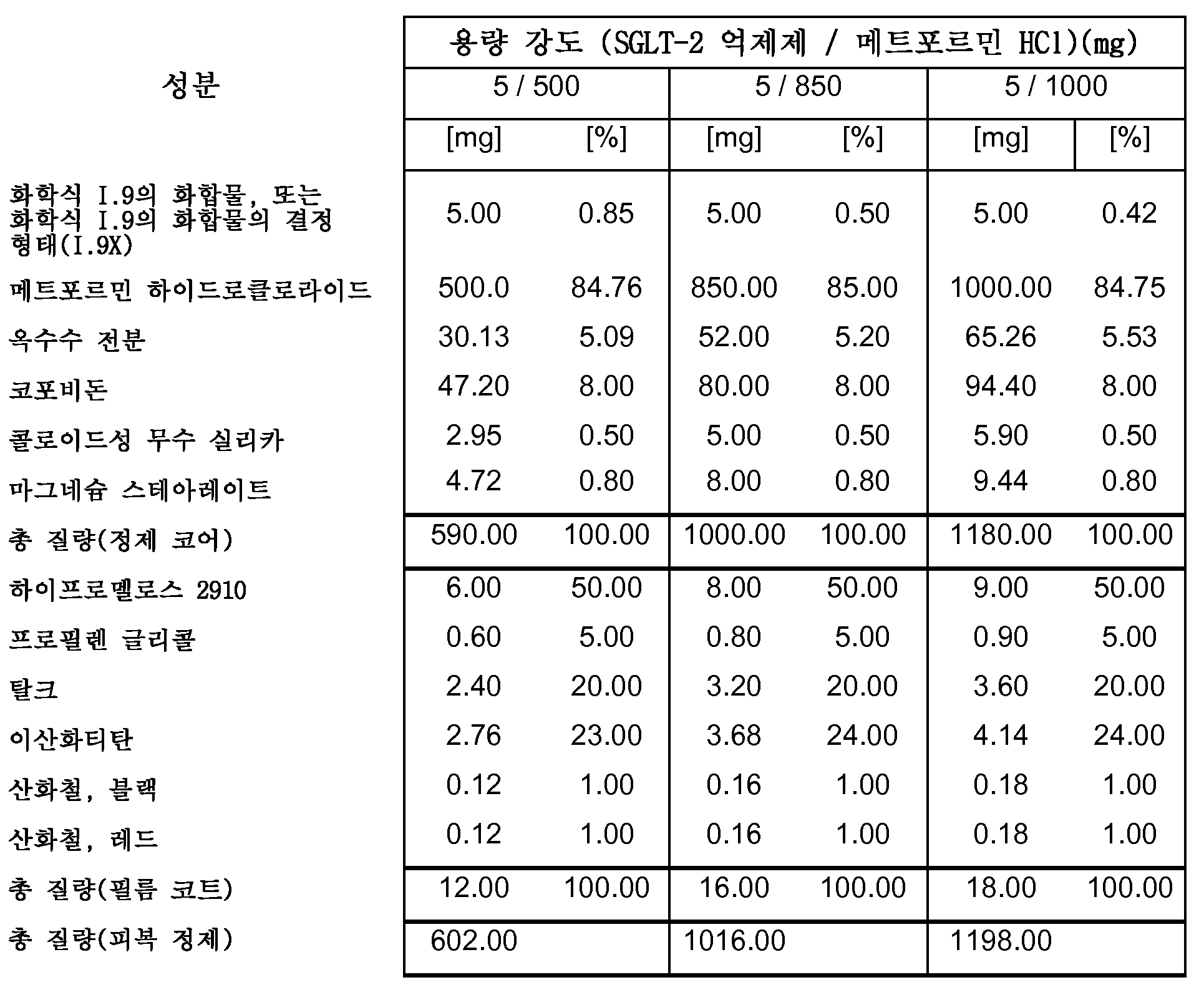
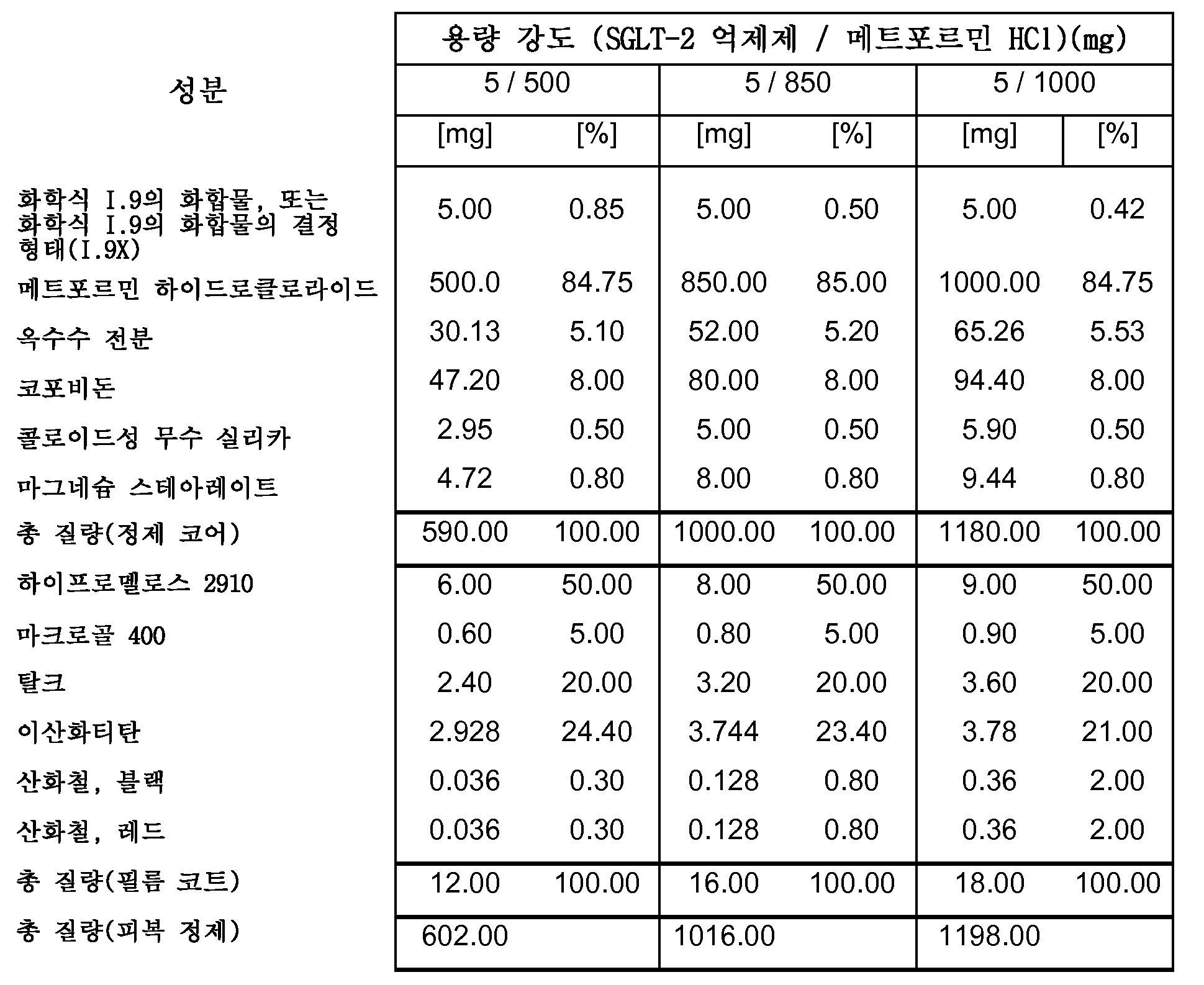
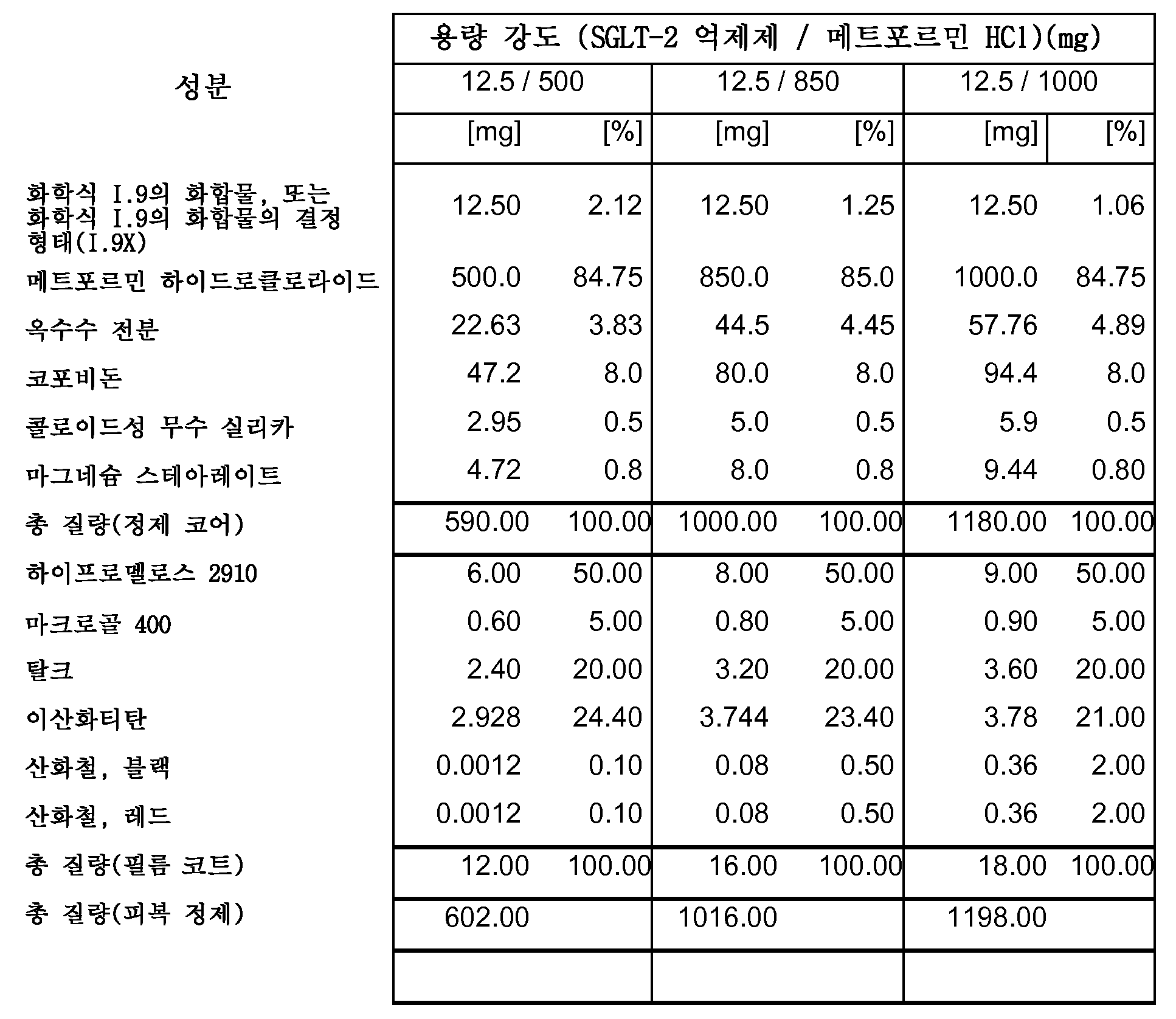
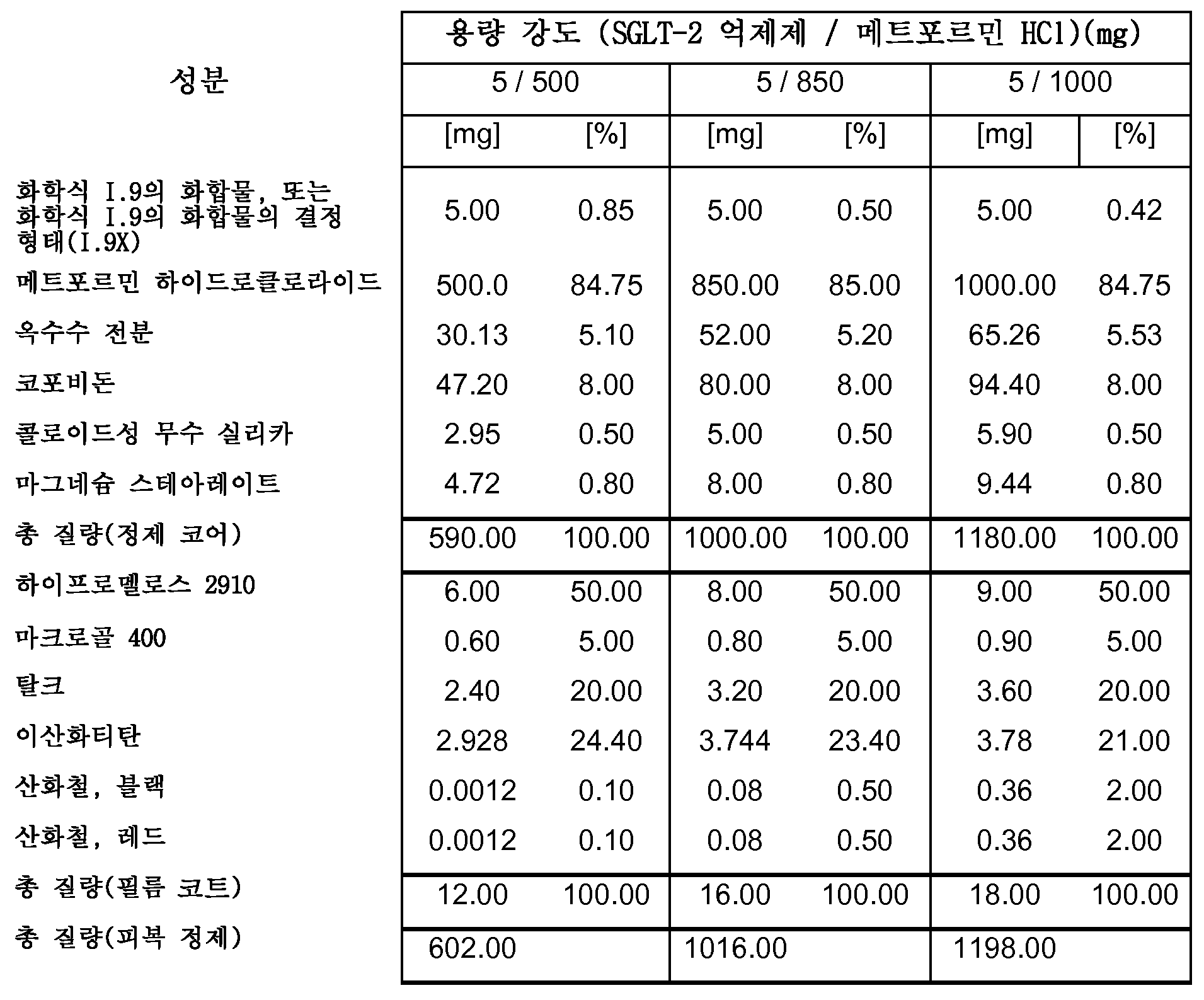
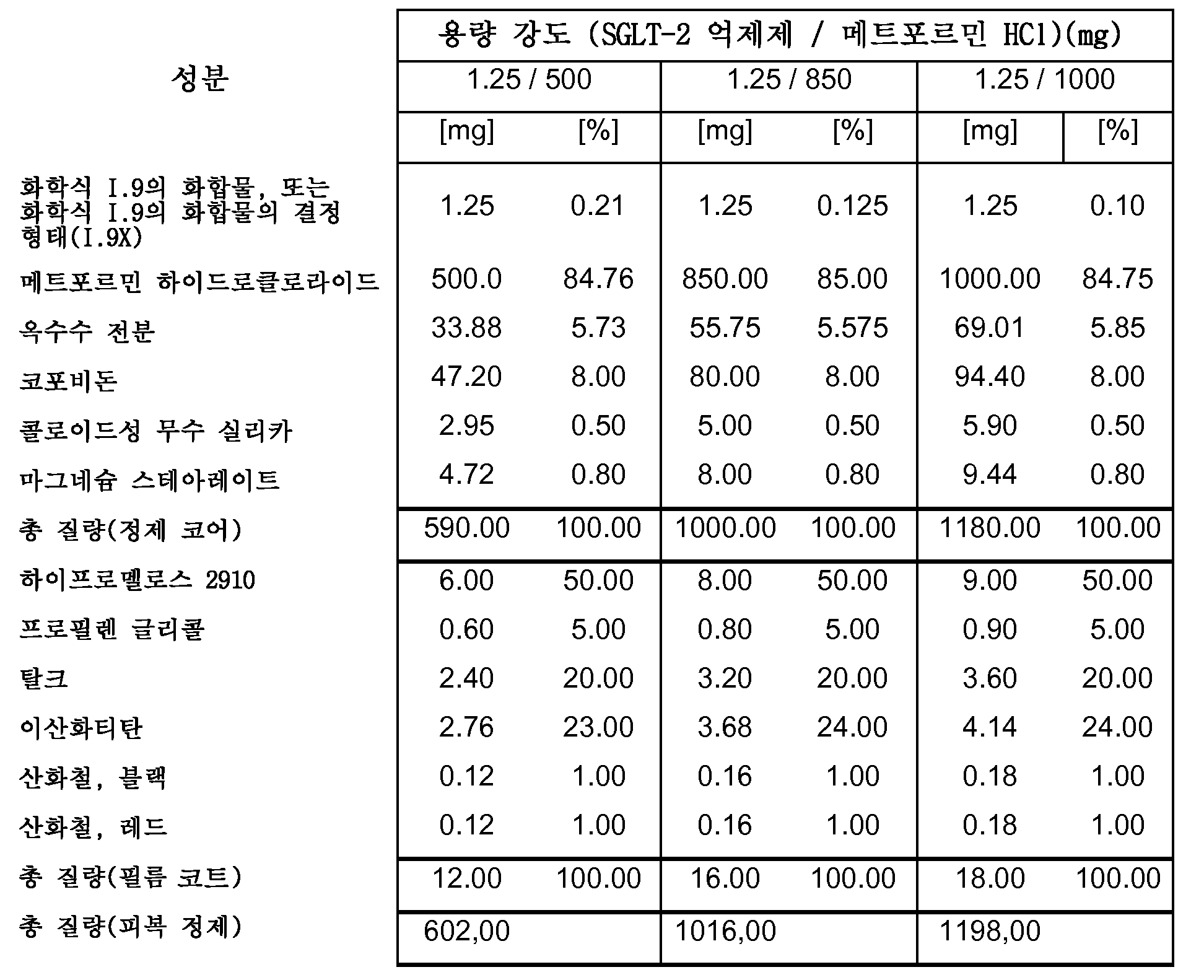
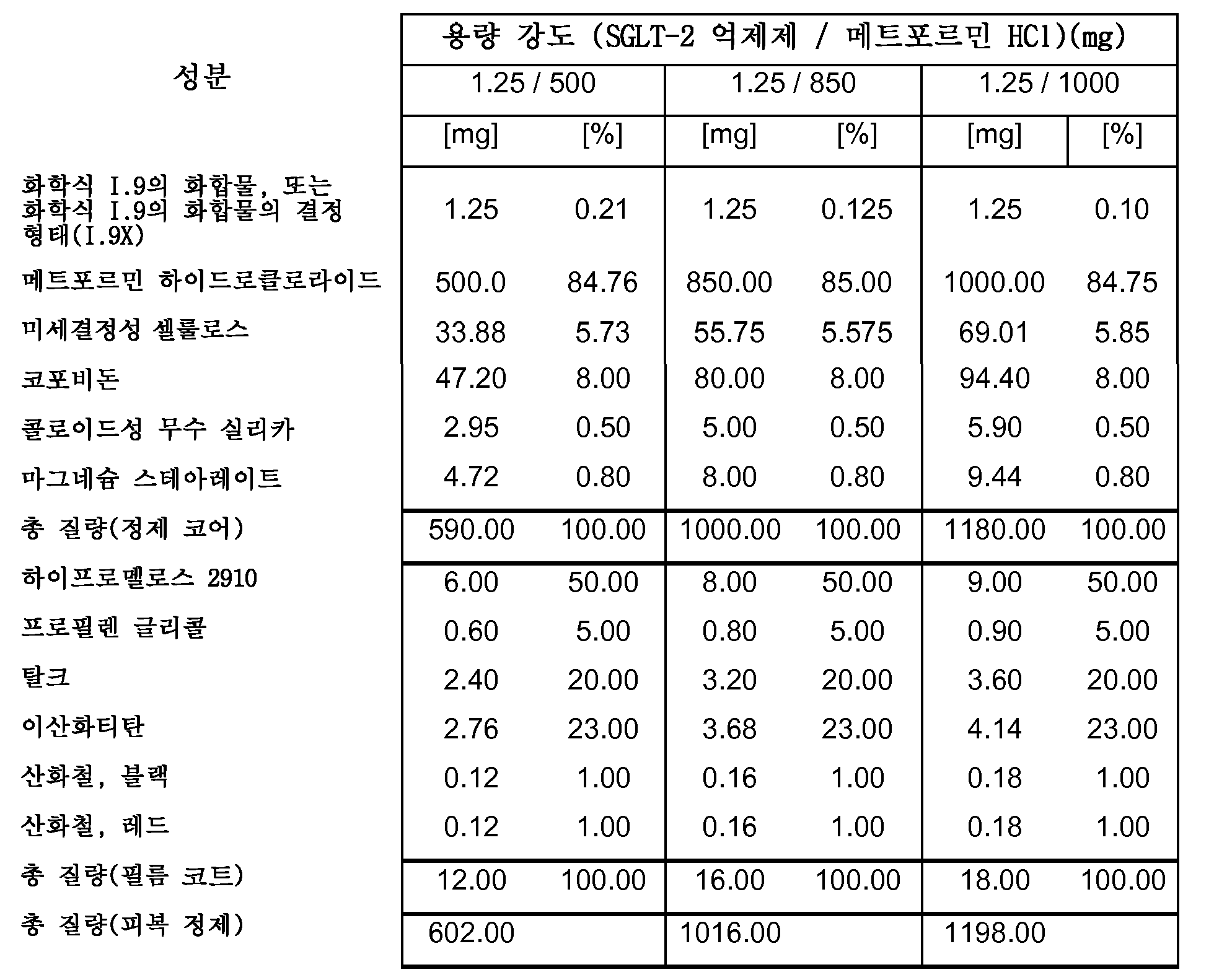
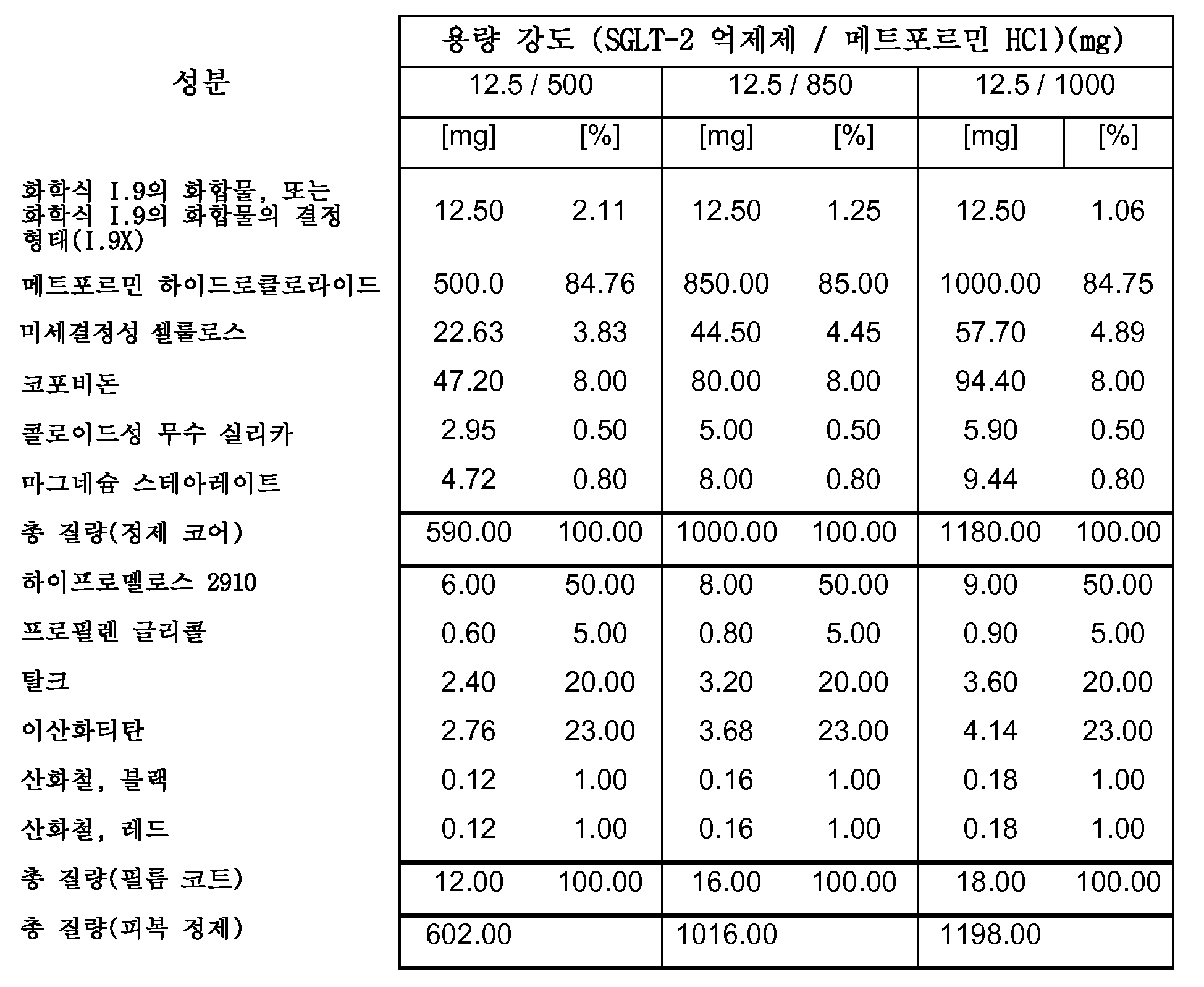
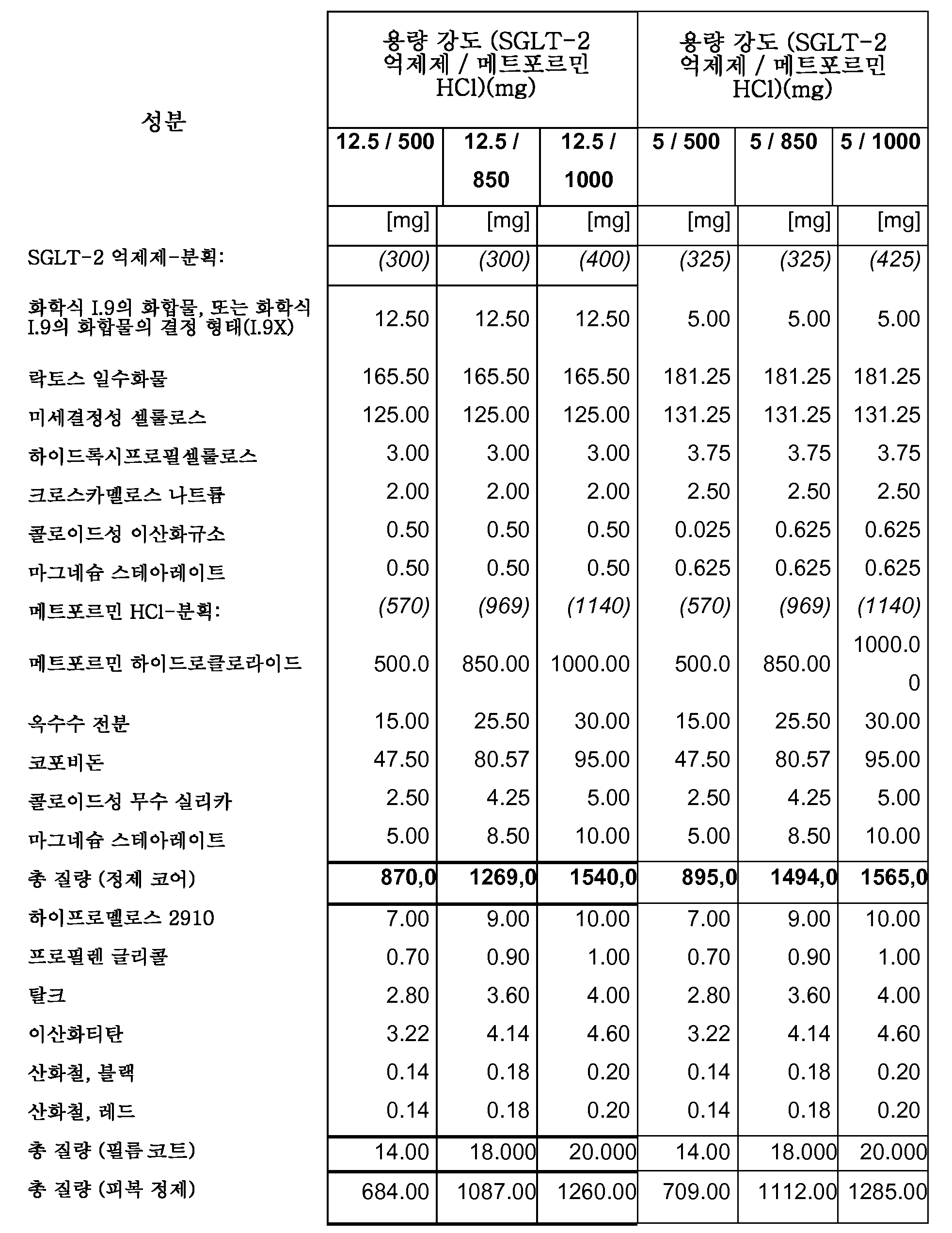
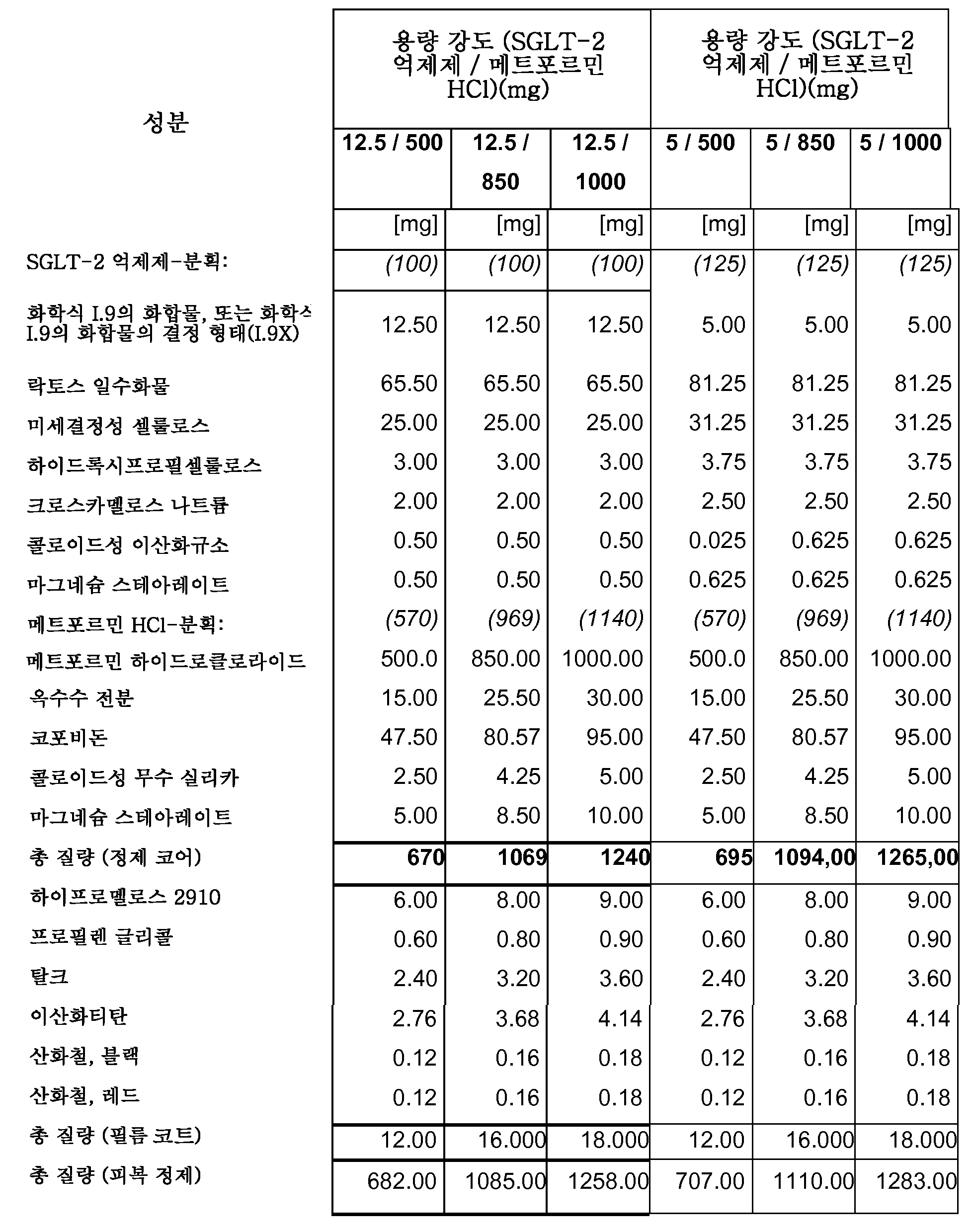
따라서, 특히, 본 발명은 SGLT-2 억제제, 메트포르민 하이드로클로라이드 및 하나 이상의 약제학적 부형제, 특히 하나 이상의 충전제, 하나 이상의 결합제, 하나 이상의 활주제 및/또는 하나 이상의 윤활제를 포함하는 약제학적 조성물(특히, 경구 고체 용량형, 특히 정제)에 관한 것이다.
보다 특히, 본 발명은 SGLT-2 억제제, 메트포르민 하이드로클로라이드, 결합제로서의 코포비돈 및 하나 이상의 추가의 약제학적 부형제를 포함하는 약제학적 조성물(특히, 경구 고체 용량형, 특히 정제)에 관한 것이다.
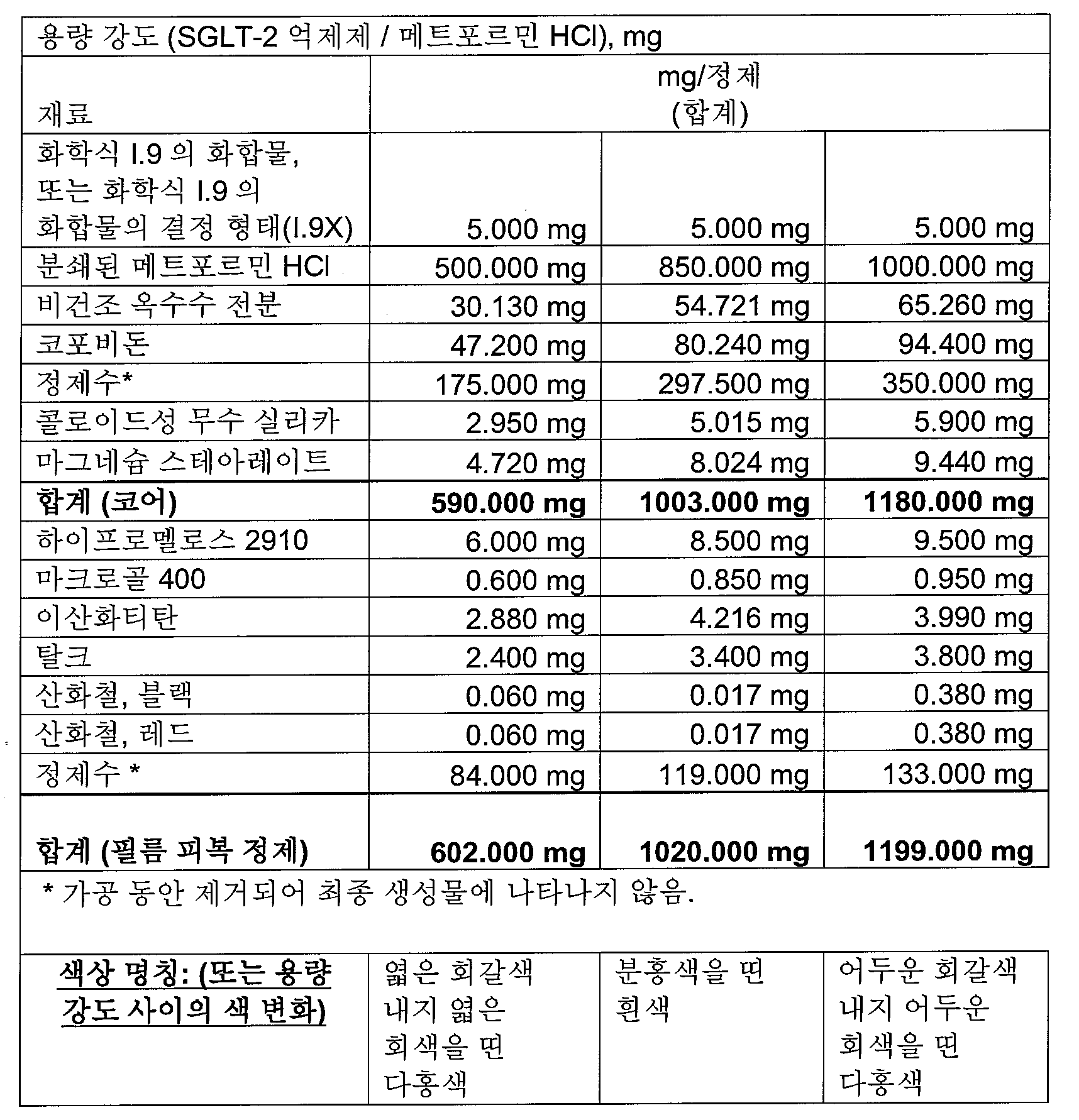
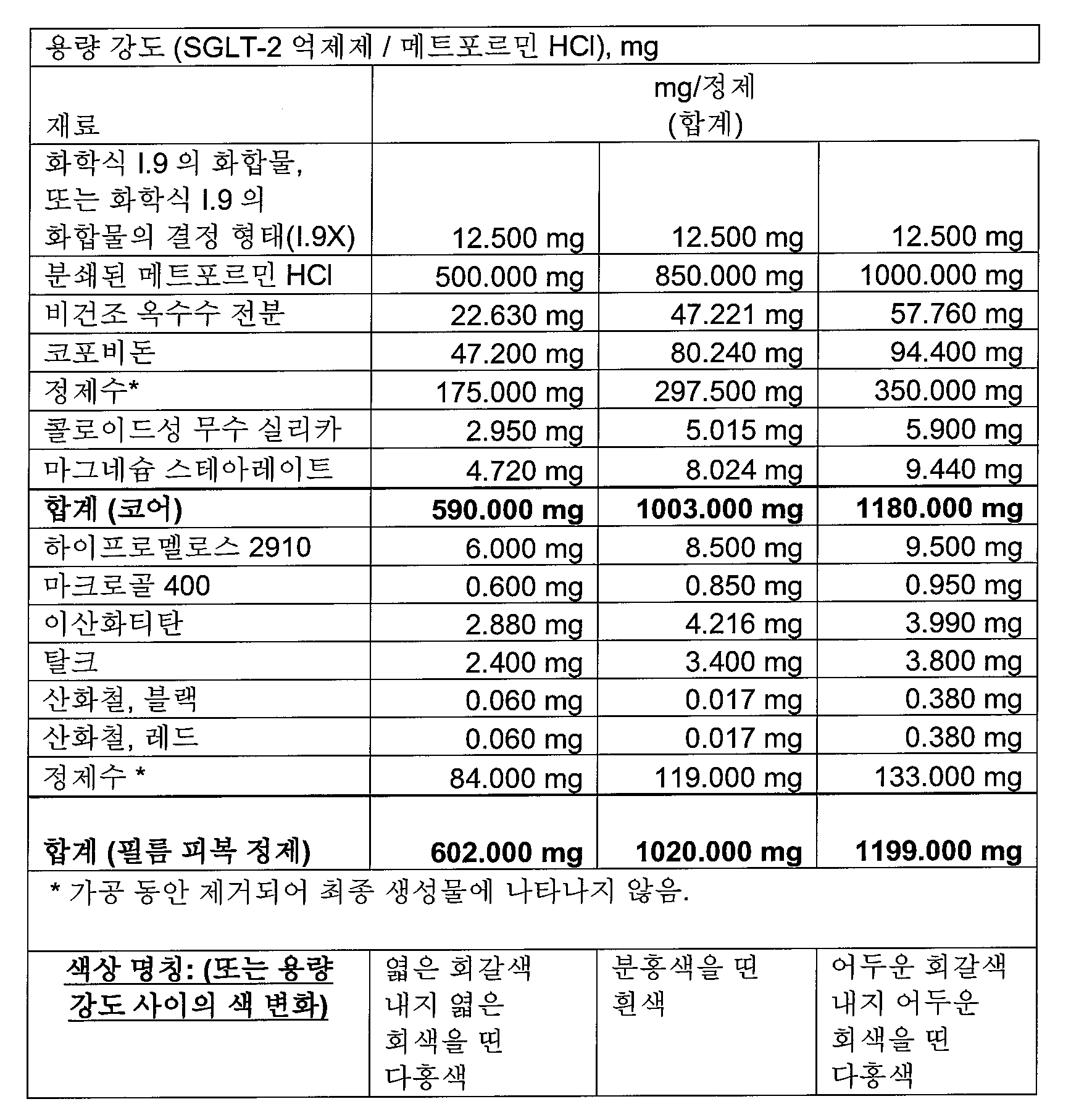
본 발명의 전형적인 약제학적 조성물은 SGLT-2 억제제 분획(전체 SGLT-2 억제제 분획의 중량%)으로 다음을 포함할 수 있다:
0.1-10% SGLT-2 억제제,
0.1-3% SGLT-2 억제제,
0.4-2.2% SGLT-2 억제제, 또는
0.1-2.11% SGLT-2 억제제.
본 발명의 전형적인 약제학적 조성물은 또한 SGLT-2 억제제 분획(전체 SGLT-2 억제제 분획의 중량%)으로 다음을 포함할 수 있다:
0.1-10% SGLT-2 억제제,
0.1-3% SGLT-2 억제제,
0.4-2.2% SGLT-2 억제제, 또는
0.1-2.12% SGLT-2 억제제.
본 발명의 전형적인 약제학적 조성물은 하나 이상의 다음 양(전체 피복 정제 질량의 중량%)을 포함할 수 있다:
0.1-2.11% SGLT-2 억제제,
47-88% 메트포르민 HCl,
3.9-8.3% 결합제(예를 들면, 코포비돈),
2.3-8.0% 충전제 1(예를 들면, 옥수수 전분),
0-4.4% 충전제 2(예를 들면, 예비젤라틴화 전분),
0-33% 충전제 3(예를 들면, D-만니톨),
0.7-1.5% 윤활제(예를 들면, 마그네슘 스테아레이트),
0.05-0.5% 활주제(예를 들면, 콜로이드성 무수 실리카),
0.00-3.0% 붕해제(예를 들면, 크로스포비돈 또는 크로스카멜로스 나트륨).
본 발명의 전형적인 약제학적 조성물은 하나 이상의 다음 양(전체 피복 정제 질량의 중량%)을 포함할 수 있다:
0.1-2.12% SGLT-2 억제제,
47-88% 메트포르민 HCl,
3.9-8.3% 결합제(예를 들면, 코포비돈),
2.3-8.0% 충전제 1(예를 들면, 옥수수 전분),
0-4.4% 충전제 2(예를 들면, 예비젤라틴화 전분),
0-33% 충전제 3(예를 들면, D-만니톨),
0.7-1.5% 윤활제(예를 들면, 마그네슘 스테아레이트),
0.05-0.5% 활주제(예를 들면, 콜로이드성 무수 실리카),
0.00-3.0% 붕해제(예를 들면, 크로스포비돈 또는 크로스카멜로스 나트륨).
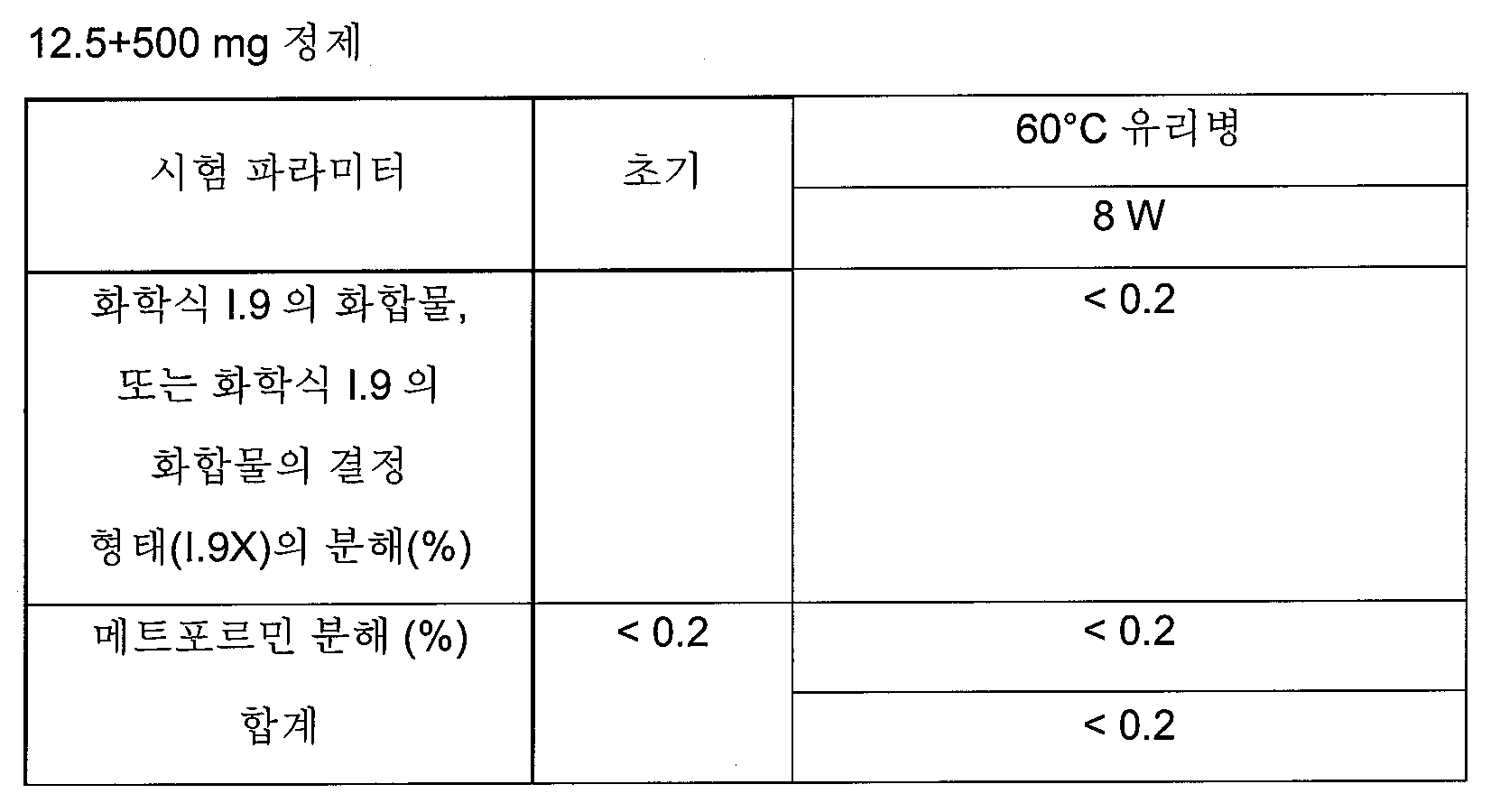
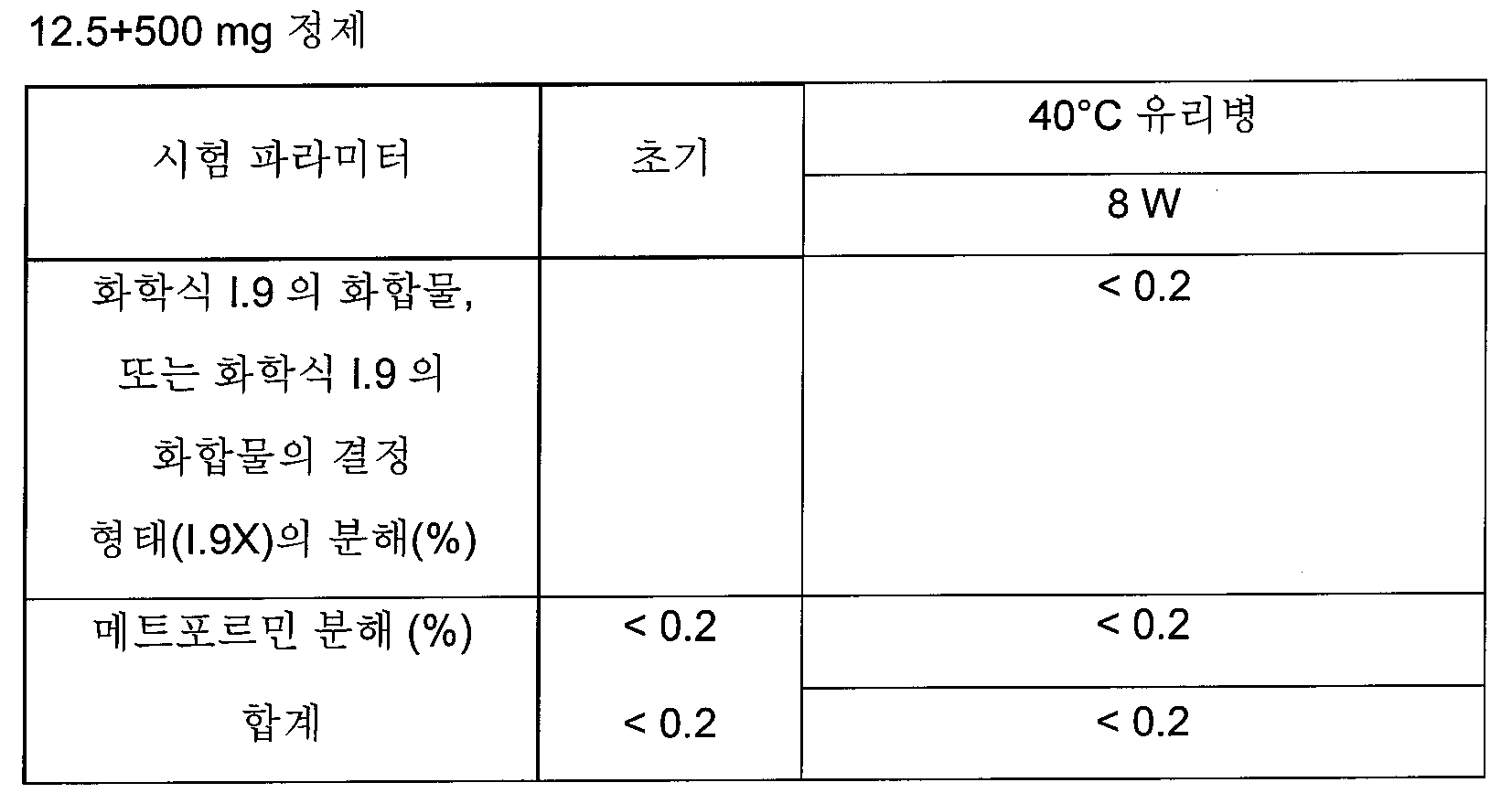
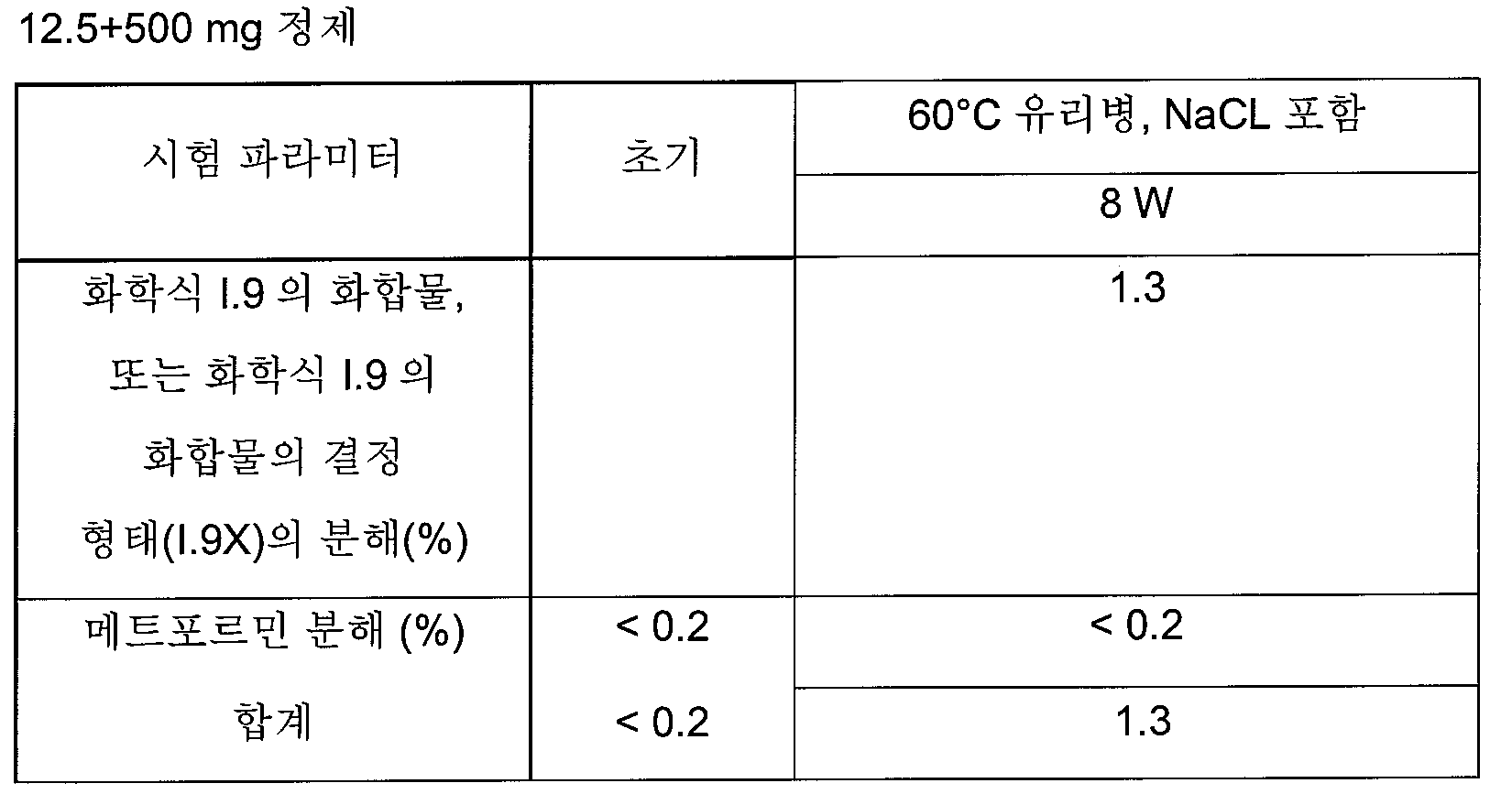
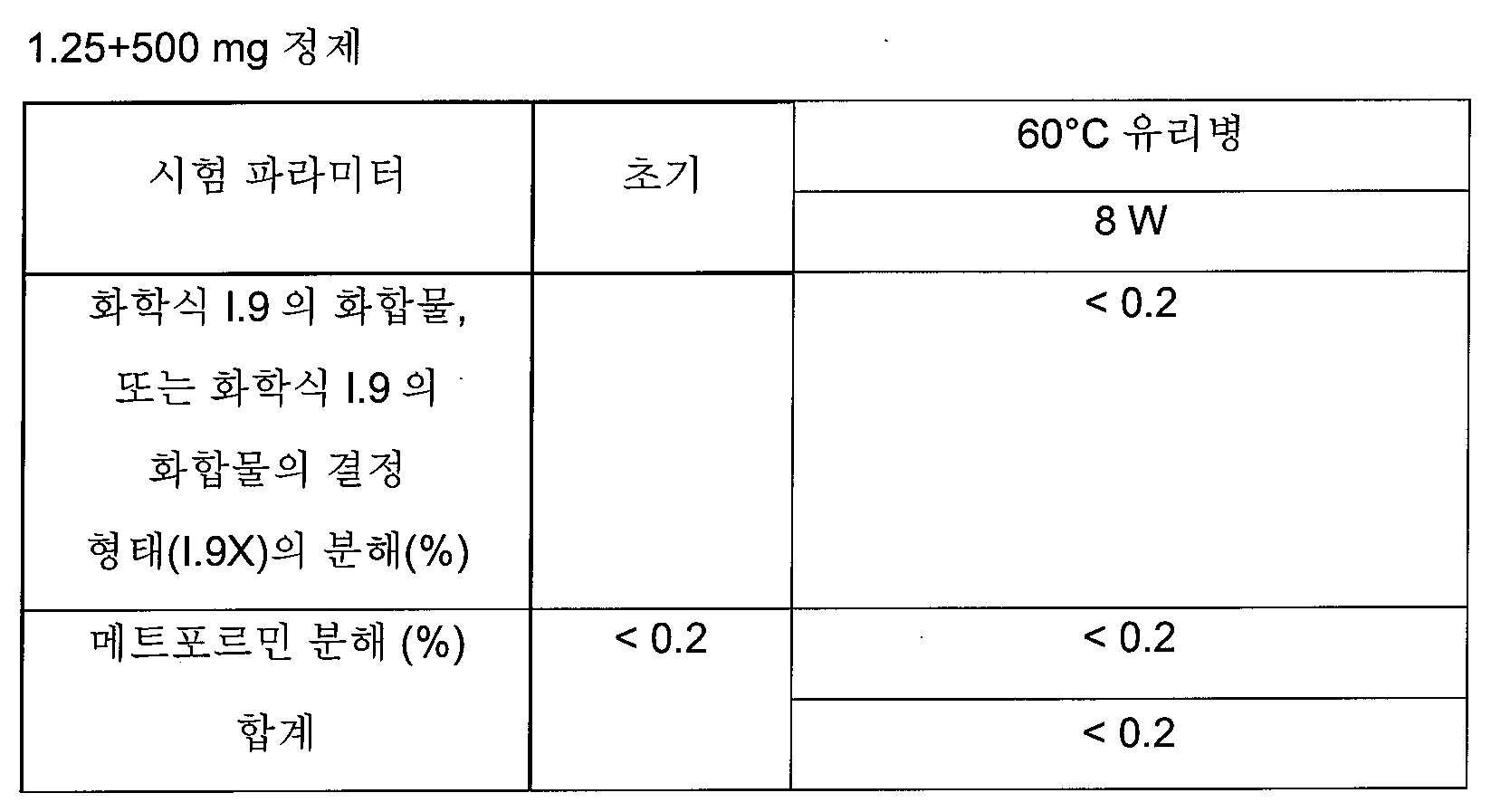
하나의 양태에서, FDC 제형은 화학적으로 안정하고, a) 시험관내 용해 프로파일과 유사성을 나타내고/내거나 자유 병용물(free combination)에 생체등가이고, 또는 b) 시험관내 및 생체내 성능을 목적하는 수준으로 조정한다. 바람직한 양태에서, 본 발명은 합리적인 정제 크기와 함께, 각각의 개별적인 실체의 상응하는 모노 정제의 원래 용해 프로파일을 유지시키는 화학적으로 안정한 FDC 제형에 관한 것이다.
하나의 양태에서, 본 발명의 약제학적 조성물은 유동층 과립화를 사용하여 제조된다.
본 발명의 FDC 제형에 대한 추가의 세부사항, 예를 들어, 특히 본 발명 내에서 사용된 특정 용량형(정제) 및 이들의 제조방법과 관련하여 성분, 성분의 비(예를 들어, SGLT-2 억제제, 메트포르민 하이드로클로라이드 및/또는 부형제의 비)는 상기 및 하기 내용(예로서, 다음 실시예를 포함)으로부터 당해 기술 분야의 숙련가에게 자명해질 것이다.
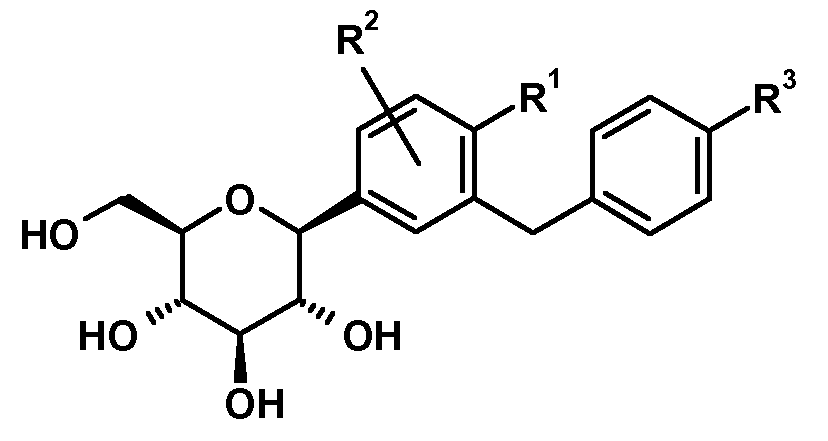
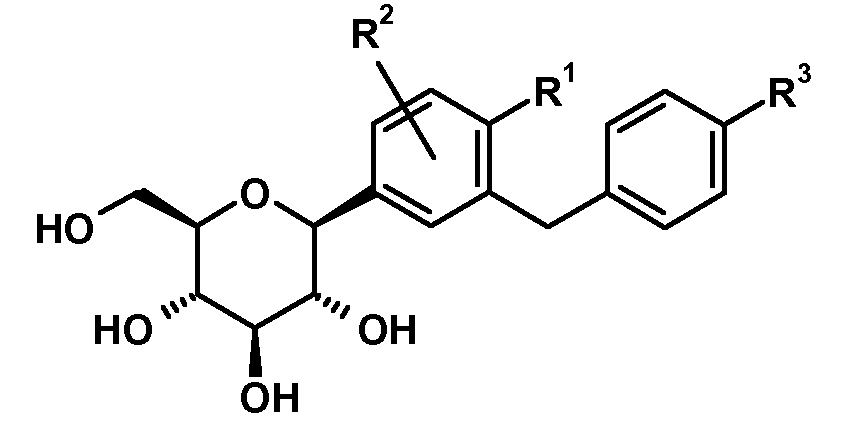
바람직하게는, SGLT2 억제제는 화학식 I의 글루코피라노실-치환된 벤젠 유도체 또는 앞서 언급된 SGLT2 억제제 중 어느 하나의 프로드럭으로부터 선택된다.
화학식 I
상기 화학식 I에서,
R1은 Cl, 메틸 또는 시아노를 나타내고;
R2는 H, 메틸, 메톡시 또는 하이드록시를 나타내고;
R3은 에틸, 사이클로프로필, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다.
상기 화학식 I의 글루코피라노실-치환된 벤젠 유도체에서, 다음의 치환체 정의가 바람직하다.
바람직하게는, R1은 클로로 또는 시아노; 특히 클로로를 나타낸다.
바람직하게는, R2는 H를 나타낸다.
바람직하게는, R3은 에틸, 사이클로프로필, 에티닐, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다. 더욱 바람직하게는, R3은 사이클로프로필, 에티닐, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다. 가장 바람직하게는, R3은 에티닐, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다.
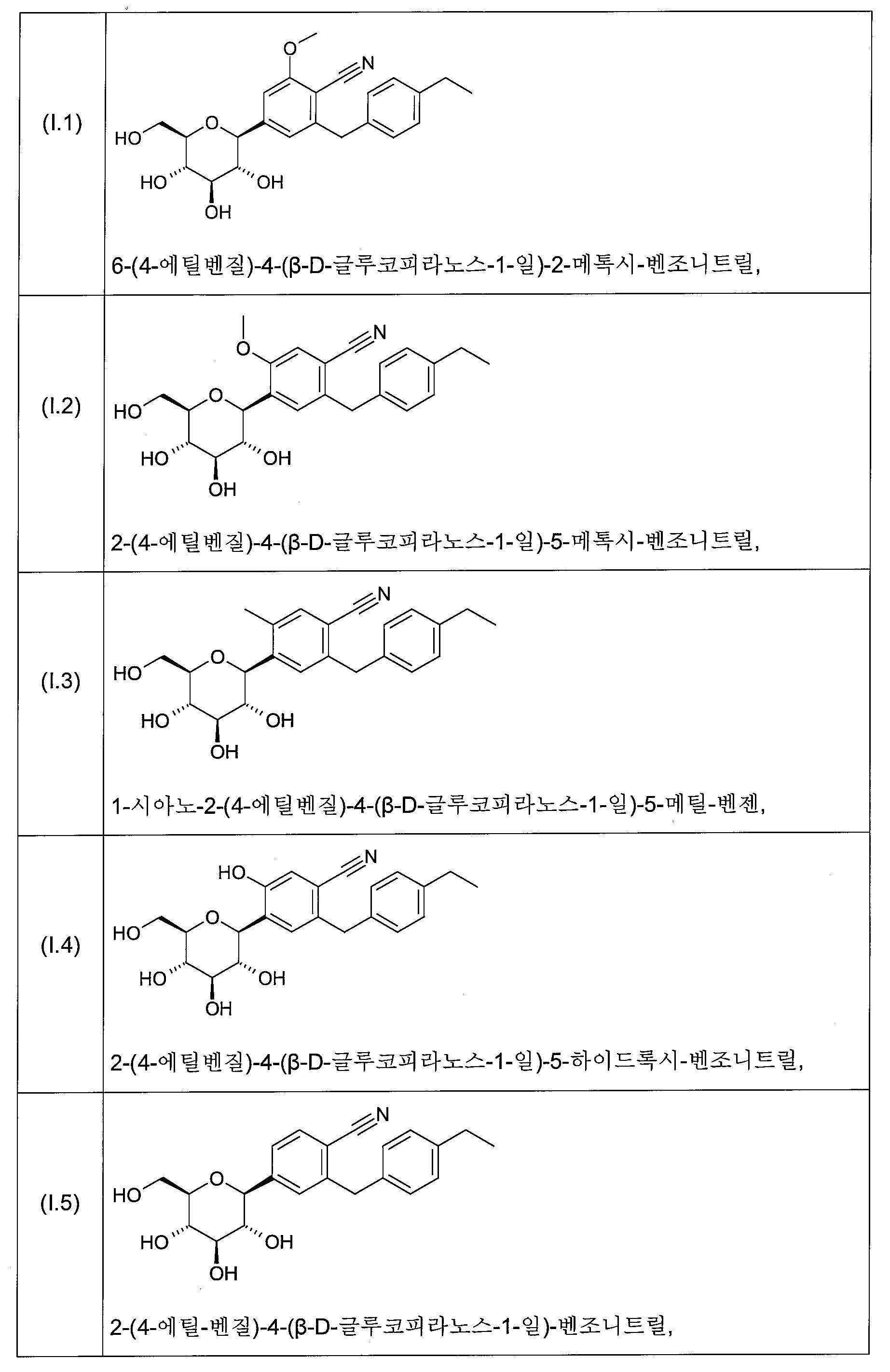
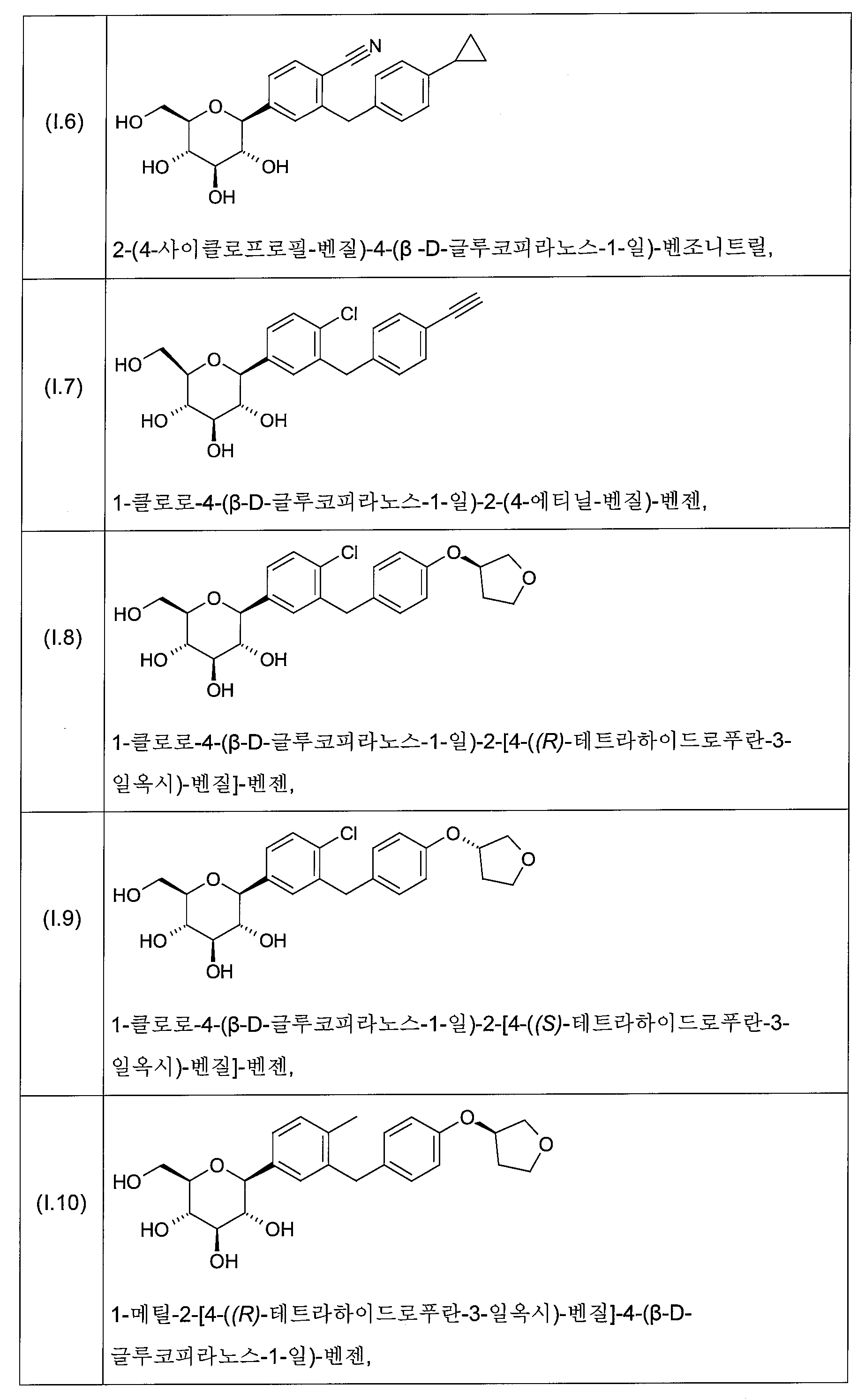
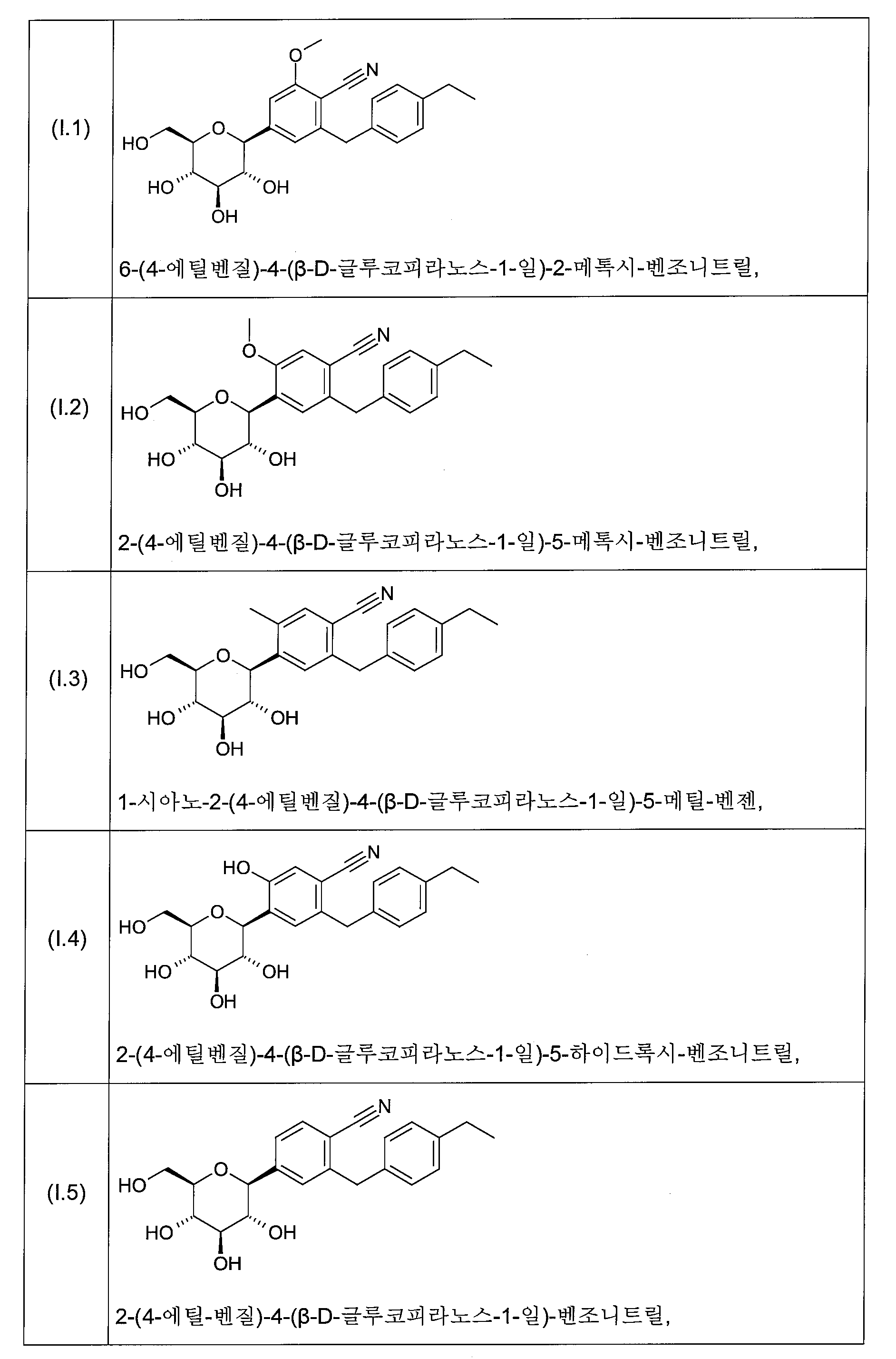
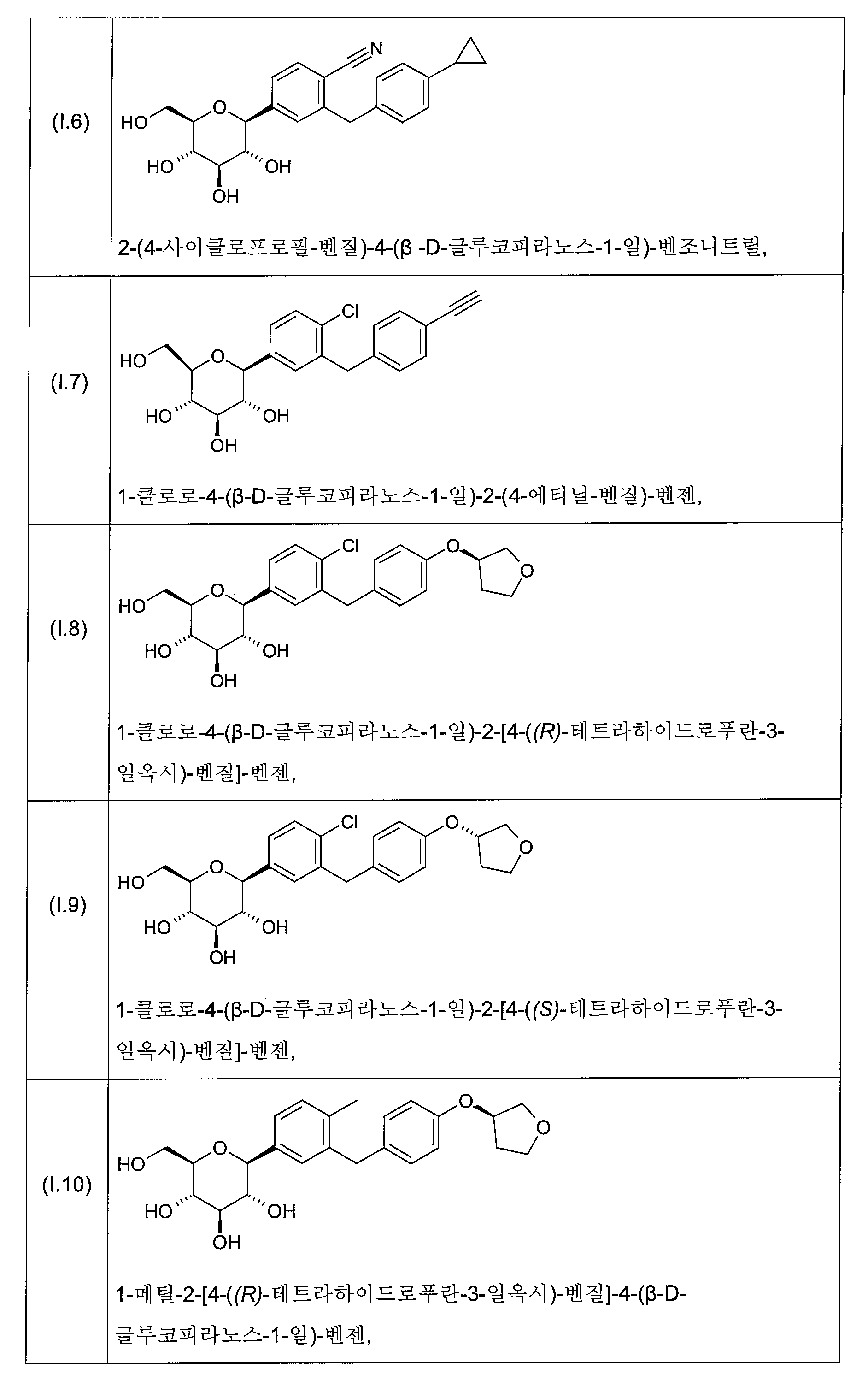
화학식 I의 바람직한 글루코피라노실-치환된 벤젠 유도체는 화학식 I.1 내지 I.11의 화합물들의 그룹으로부터 선택된다:
화학식 I의 더욱 더 바람직한 글루코피라노실-치환된 벤젠 유도체는 화학식 I.6, I.7, I.8, I.9 및 I.11의 화합물들로부터 선택된다.
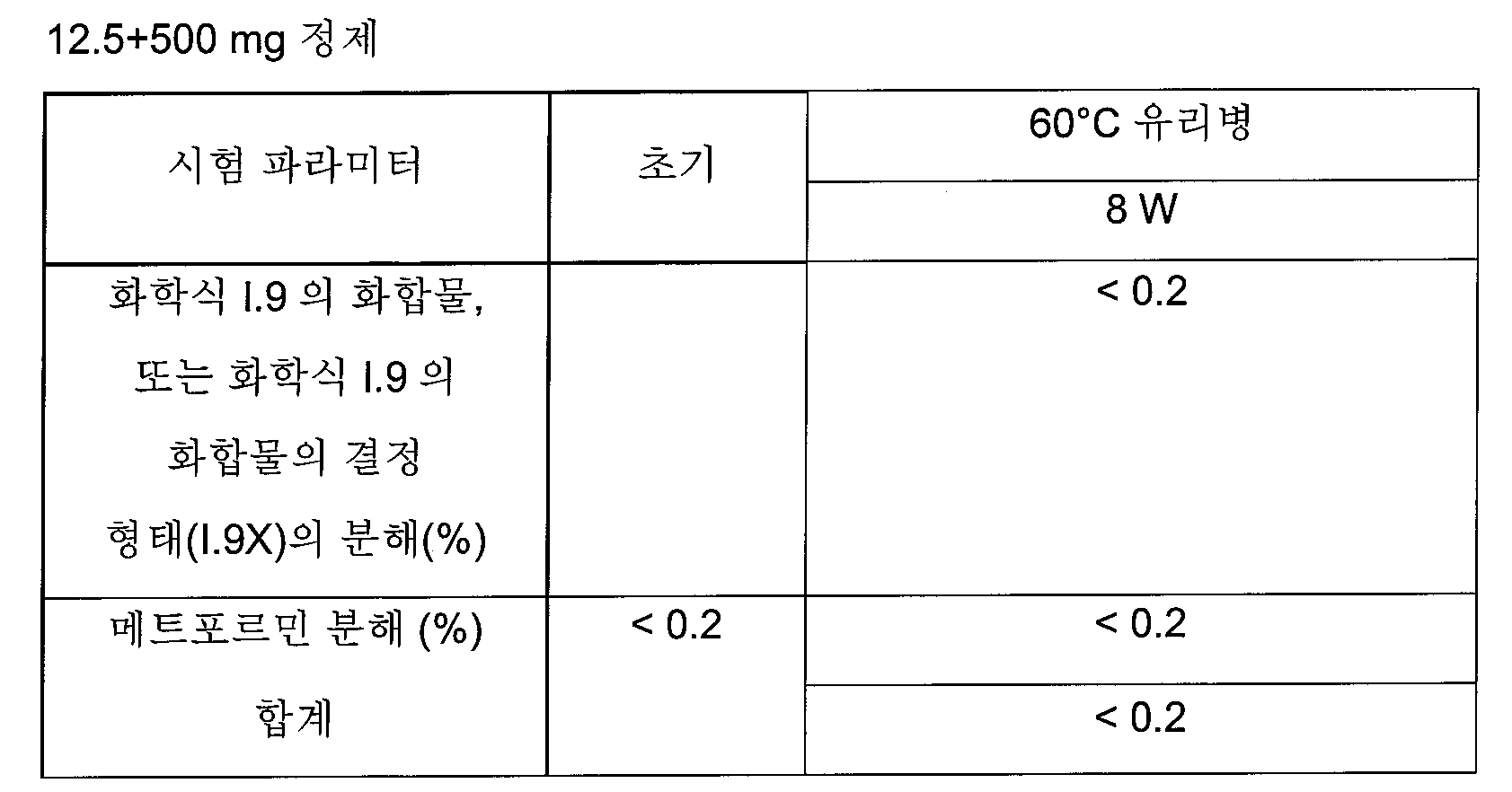
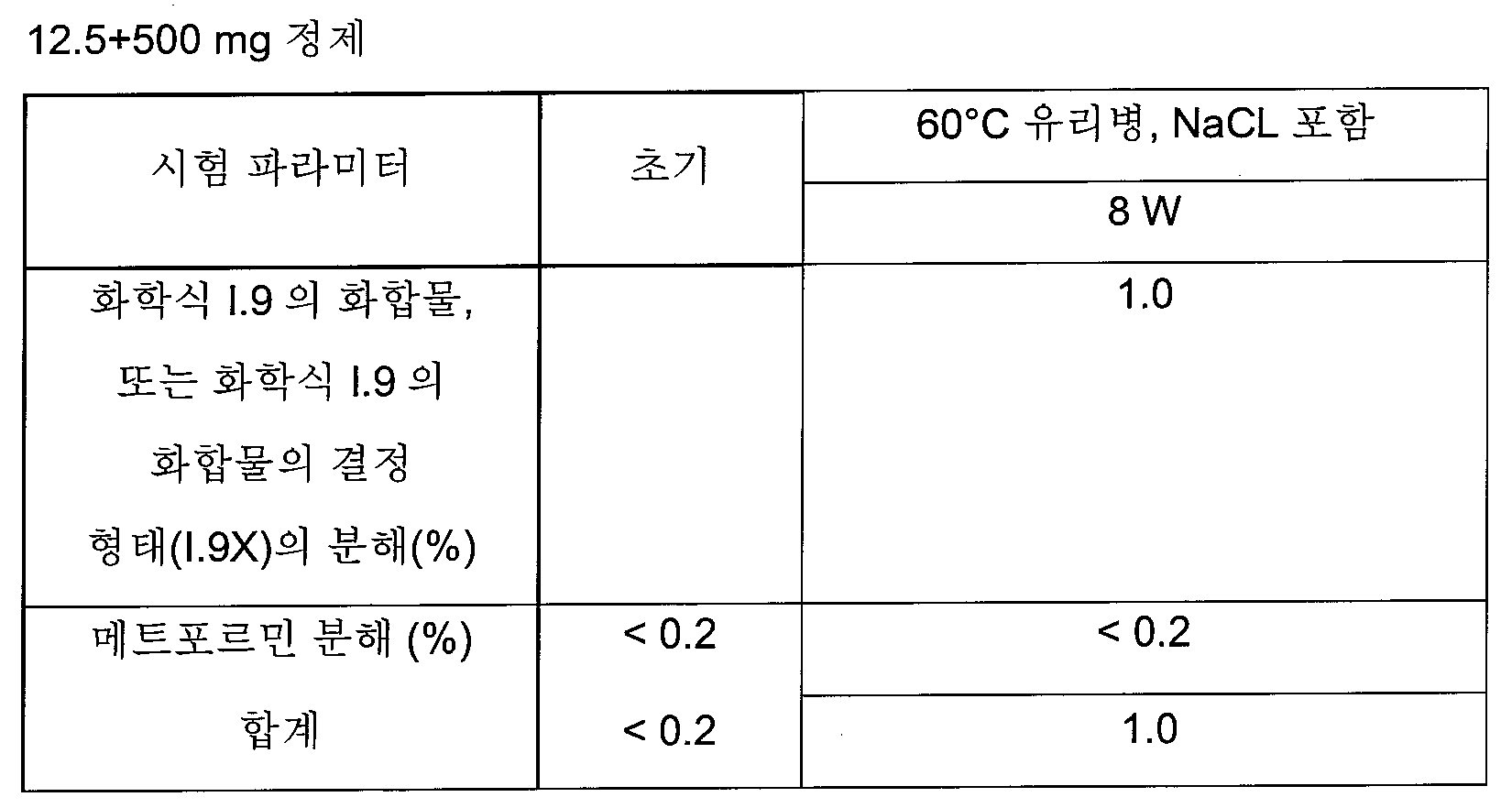
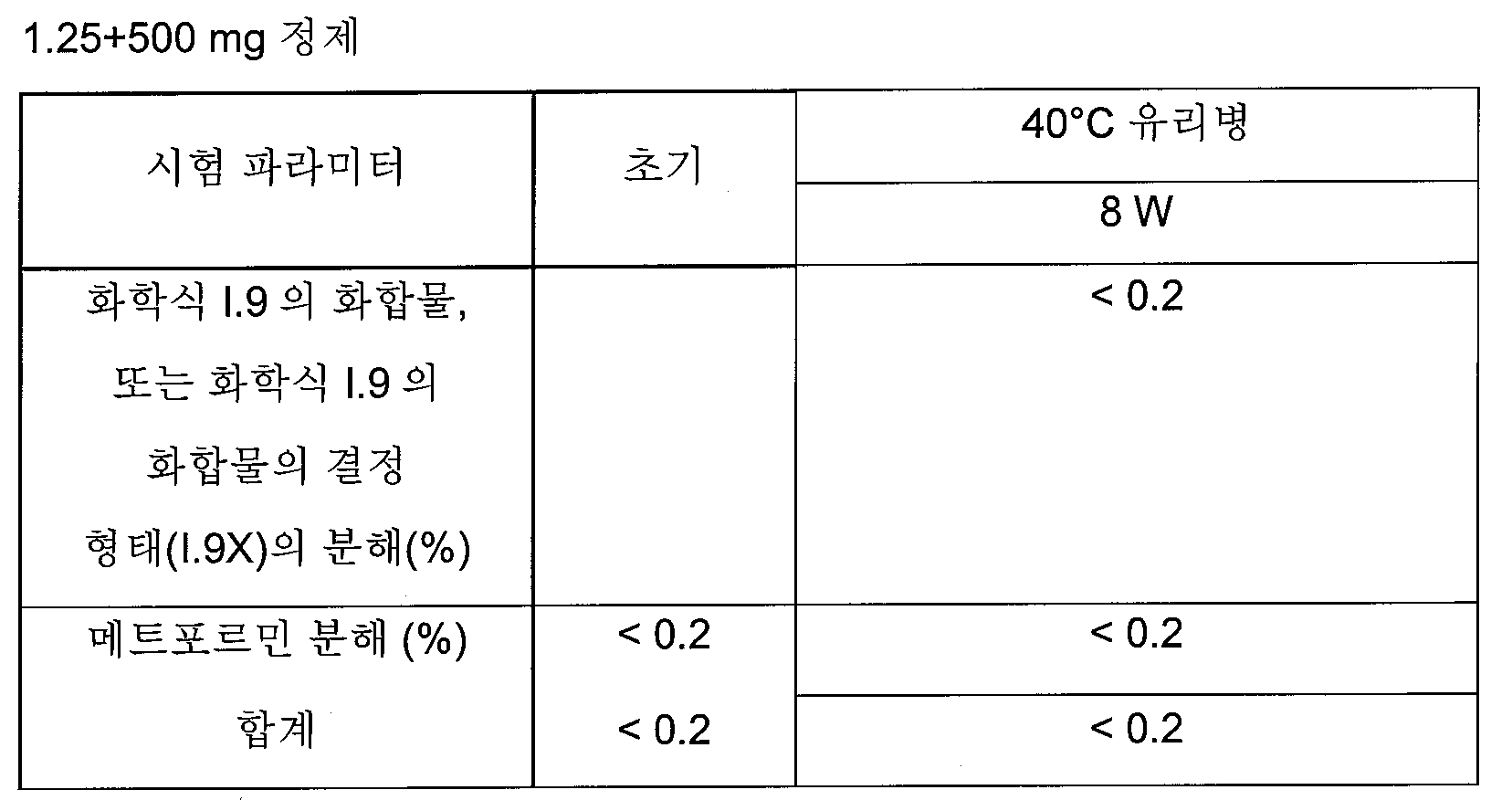
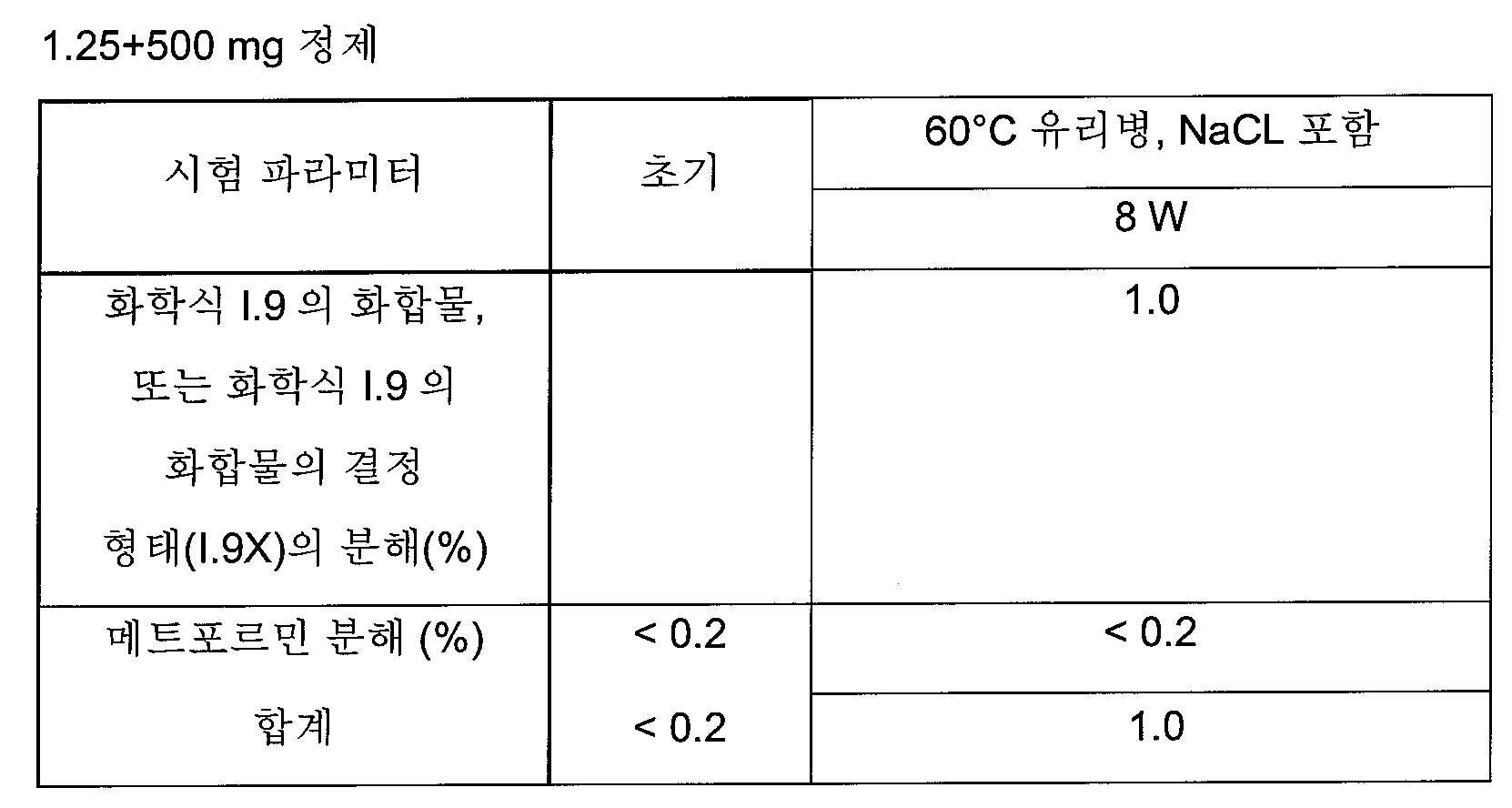
화학식 I의 더욱 더 바람직한 글루코피라노실-치환된 벤젠 유도체는 화학식 I.8 및 I.9의 화합물 또는 화학식 I.9의 화합물의 결정성 형태(1.9X)로부터 선택된다.
본 발명에 따르는 약제학적 조성물은 시간과 비용 측면에서 약제학적 용량형, 예를 들면, 정제 및 캡슐제의 높은 함량 균일성을 허용하고 효율적 제조를 가능하게 한다. 또한, 하나의 양태에서, 이들 약제학적 용량형은, 특히 정제이다.
따라서, 또다른 측면에서, 본 발명은 본 발명에 따르는 약제학적 조성물을 포함하는 약제학적 용량형을 제공한다. 한 측면에서, 본 발명에 따르는 약제학적 용량형은 고체 약제학적 용량형, 예를 들어, 경구 투여용 고체 약제학적 용량형이다.
또다른 측면에서, 본 발명은 하나 이상의 과립화 공정을 포함하는, 본 발명에 따르는 약제학적 용량형의 제조방법을 제공하고, 여기서, 약제학적 활성 성분을 하나 이상의 부형제와 함께 과립화한다.
SGLT2 억제제 및 이후 정의된 바와 같은 파트너 약물을 포함하는 약제학적 조성물은 대사 장애를 예방하거나, 서서히 진행시키거나, 지연시키거나, 치료하기 위해, 특히 환자에서 혈당 조절을 개선시키기 위해 유리하게 사용될 수 있음이 밝혀질 수 있다. 이는 2형 진성 당뇨병, 과체중, 비만, 진성 당뇨병 합병증 및 근접(neighboring) 질환 상태의 치료 및 예방에 있어서 새로운 치료학적 가능성을 열어준다.
따라서, 제1 측면에서, 본 발명은 본 발명의 약제학적 조성물 또는 약제학적 용량형을 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애(IGT), 공복 혈당 장애(IFG), 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애의 예방, 진행의 서행, 지연 또는 치료를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애(IGT), 공복 혈당 장애(IFG), 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애를 예방하거나, 진행을 서행시키거나, 지연시키거나, 치료하는 방법을 제공한다.
본 발명의 또다른 측면에 따르면, 본 발명의 약제학적 조성물 또는 약제학적 용량형을 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 혈당 조절을 개선하고/하거나 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c를 감소시키는 방법을 제공한다.
본 발명에 따르는 약제학적 조성물은 또한, 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성 및/또는 대사 증후군에 관련된 질환 또는 상태에 관한 중요한 질환-조절 특성들을 가질 수 있다.
본 발명의 또다른 측면에 따르면, 본 발명의 약제학적 조성물 또는 약제학적 용량형을 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행의 예방, 서행, 지연 또는 역전을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행을 예방하거나, 서행시키거나, 지연시키거나, 역전시키는 방법을 제공한다.
본 발명에 따르는 약제학적 조성물을 사용함으로써, 혈당 조절의 개선을 필요로 하는 환자에서 혈당 조절을 개선시킬 수 있고, 또한 증가된 혈당 수준과 관련되거나 증가된 혈당 수준에 의해 유발된 상태 및/또는 질환을 치료할 수 있다.
본 발명의 또다른 측면에 따르면, 본 발명의 약제학적 조성물 또는 약제학적 용량형을 백내장 및 미세혈관 및 대혈관 질환, 예를 들어 신장병증, 망막병증, 신경병증, 조직 허혈, 당뇨발, 아테롬성동맥경화증, 심근 경색증, 급성 관상동맥 증후군, 불안정성 협심증, 안정성 협심증, 뇌졸중, 말초 동맥 폐쇄성 질환, 심근병증, 심부전, 심장 박동 장애 및 혈관 재협착과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애의 예방, 진행의 서행, 지연 또는 치료를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 백내장 및 미세혈관 및 대혈관 질환, 예를 들어 신장병증, 망막병증, 신경병증, 조직 허혈, 당뇨발, 아테롬성동맥경화증, 심근 경색증, 급성 관상동맥 증후군, 불안정성 협심증, 안정성 협심증, 뇌졸중, 말초 동맥 폐쇄성 질환, 심근병증, 심부전, 심장 박동 장애 및 혈관 재협착과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애를 예방하거나, 서서히 진행시키거나, 지연시키거나, 치료하는 방법이 제공된다. 특히, 과관류, 단백뇨 및 알부민뇨와 같은 당뇨병성 신장병증의 하나 이상의 측면이 치료될 수 있거나, 이들의 진행이 서행될 수 있거나, 이들의 발병이 지연되거나 예방될 수 있다. 용어 "조직 허혈"은 특히 당뇨병성 대혈관병증, 당뇨병성 미세혈관병증, 상처 치유 장애 및 당뇨병성 궤양을 포함한다. 용어 "미세혈관 및 대혈관 질환" 및 "미세혈관 및 대혈관 합병증"은 본원에서 상호교환적으로 사용된다.
본 발명에 따르는 약제학적 조성물의 투여에 의해 및 SGLT2 억제제의 활성으로 인해, 과잉 혈당 수준이 지방과 같은 불용성 저장 형태로 전환되지 않고 환자의 뇨를 통해 배설된다. 따라서, 체중 증가가 전혀 없거나 심지어 체중 감소가 일어난다.
본 발명의 또다른 측면에 따르면, 본 발명의 약제학적 조성물 또는 약제학적 용량형을 체중의 감소, 체중 증가의 예방 또는 체중 감소의 촉진을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 체중을 감소시키거나, 체중 증가를 예방하거나, 체중 감소를 촉진시키는 방법이 제공된다.
본 발명에 따르는 약제학적 조성물에서 SGLT2 억제제의 약리학적 효과는 인슐에 의존하지 않는다. 따라서, 췌장 베타 세포에서의 추가적 변형 없이 혈당 조절의 개선이 가능하다. 본 발명에 따르는 약제학적 조성물의 투여에 의해, 예를 들어 췌장 베타 세포의 아폽토시스 또는 괴사와 같은 베타 세포 변성 및 베타 세포 기능성 저하가 지연되거나 예방될 수 있다. 또한, 췌장 세포의 기능성은 개선되거나 회복될 수 있으며, 췌장 베타 세포의 수와 크기가 증가된다. 고혈당증에 의해 교란된 췌장 베타 세포의 분화 상태 및 증식은 본 발명에 따르는 약제학적 조성물을 사용한 치료에 의해 정상화될 수 있다는 것이 입증될 수 있다.
본 발명의 또다른 측면에 따르면, 본 발명의 약제학적 조성물 또는 약제학적 용량형을 췌장 베타 세포의 변성 및/또는 췌장 베타 세포 기능성 저하의 예방, 서행, 지연 또는 치료 및/또는 췌장 베타 세포 기능성의 개선 및/또는 회복 및/또는 췌장 인슐린 분비 기능성의 회복을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 췌장 베타 세포의 변성 및/또는 췌장 베타 세포 기능성 저하를 예방하거나, 서행시키거나, 지연시키거나, 치료하고/하거나 췌장 베타 세포 기능성을 개선 및/또는 회복시키고/시키거나 췌장 인슐린 분비 기능성을 회복시키는 방법이 제공된다.
본 발명에 따르는 약제학적 조성물의 투여에 의해 간에서 지방의 이상 축적이 감소되거나 억제될 수 있다. 따라서, 본 발명의 또다른 측면에 따라서, 상기 및 하기 정의된 SGLT2 억제제를 간 지방의 이상 축적으로 인한 질환 또는 상태의 예방, 서행, 지연 또는 치료를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 간 지방의 이상 축적으로 인한 질환 또는 상태를 예방하거나, 서행하거나, 지연시키거나, 치료하는 방법이 제공된다. 간 지방의 이상 축적으로 인한 질환 또는 상태는 특히 일반적 지방간, 비-알콜성 지방간(NAFL), 비-알콜성 지방간염(NASH), 과영양-유도된 지방간, 당뇨병성 지방간, 알콜-유도된 지방간 또는 독성 지방간으로 이루어진 그룹으로부터 선택된다.
이의 결과로서, 본 발명의 또다른 측면은, 본 발명의 약제학적 조성물 또는 약제학적 용량형을 인슐린 감수성의 유지 및/또는 개선 및/또는 고인슐린혈증 및/또는 인슐린 저항성의 치료 또는 예방을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 인슐린 감수성을 유지 및/또는 개선시키고/시키거나 고인슐린혈증 및/또는 인슐린 저항성을 치료하거나 예방하는 방법을 제공한다.
본 발명의 또다른 측면에 따르면,
상기 및 하기 기술된 바와 같이, SGLT2 억제제를 투여함을 특징으로 하는,
- 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애(IGT), 공복 혈당 장애(IFG), 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소; 또는
- 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행의 예방, 서행, 지연 또는 역전; 또는
- 백내장 및 미세혈관 및 대혈관 질환, 예를 들어, 신장병증, 망막병증, 신경병증, 조직 허혈, 당뇨발, 아테롬성동맥경화증, 심근 경색증, 급성 관상동맥 증후군, 불안정성 협심증, 안정성 협심증, 뇌졸중, 말초 동맥 폐쇄성 질환, 심근병증, 심부전, 심장 박동 장애 및 혈관 재협착과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 체중 감소 또는 체중 증가 예방 또는 체중 감소 촉진; 또는
- 췌장 베타 세포 변성 및/또는 췌장 베타 세포 기능성 저하의 예방, 서행, 지연 또는 치료, 및/또는 췌장 베타 세포 기능성의 개선 및/또는 회복, 및/또는 췌장 인슐린 분비 기능성의 회복; 또는
- 간 지방의 이상 축적으로 인한 질환 또는 상태의 예방, 서행, 지연 또는 치료; 또는
- 인슐린 감수성의 유지 및/또는 개선, 및/또는 고인슐린혈증 및/또는 인슐린 저항성의 치료 또는 예방을 필요로 하는 환자에서,
- 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애(IGT), 공복 혈당 장애(IFG), 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소; 또는
- 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행의 예방, 서행, 지연 또는 역전; 또는
- 백내장 및 미세혈관 및 대혈관 질환, 예를 들어, 신장병증, 망막병증, 신경병증, 조직 허혈, 당뇨발, 아테롬성동맥경화증, 심근 경색증, 급성 관상동맥 증후군, 불안정성 협심증, 안정성 협심증, 뇌졸중, 말초 동맥 폐쇄성 질환, 심근병증, 심부전, 심장 박동 장애 및 혈관 재협착과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 체중 감소 또는 체중 증가 예방 또는 체중 감소 촉진; 또는
- 췌장 베타 세포 변성 및/또는 췌장 베타 세포 기능성 저하의 예방, 서행, 지연 또는 치료, 및/또는 췌장 베타 세포 기능성의 개선 및/또는 회복, 및/또는 췌장 인슐린 분비 기능성의 회복; 또는
- 간 지방의 이상 축적으로 인한 질환 또는 상태의 예방, 서행, 지연 또는 치료; 또는
- 인슐린 감수성의 유지 및/또는 개선, 및/또는 고인슐린혈증 및/또는 인슐린 저항성의 치료 또는 예방을 위한 약제를 제조하기 위한, 본 발명에 따르는 약제학적 조성물 또는 약제학적 용량형의 용도가 제공된다.
본 발명의 또다른 측면에 따르면, 상기 및 하기 기술된 바와 같은 치료적 및 예방적 방법을 위한 약제를 제조하기 위한 본 발명에 따르는 약제학적 조성물 또는 약제학적 용량형의 용도가 제공된다.
정의
본 발명에 따르는 약제학적 조성물의 "활성 성분"이라는 용어는 본 발명에 따르는 SGLT2 억제제를 의미한다. "활성 성분"은 또한 본원에서 때때로 "활성 물질"로서 언급된다.
사람 환자의 "체질량 지수" 또는 "BMI"이라는 용어는 체중(㎏)을 신장(m)의 제곱으로 나눈 것으로 정의되며, BMI는 ㎏/㎡의 단위를 갖는다.
용어 "과체중"은 개체의 BMI가 25㎏/㎡ 이상, 30㎏/㎡ 미만인 상태로서 정의된다. 용어 "과체중" 및 "비만 전단계"는 상호교환하여 사용된다.
용어 "비만"은 개체의 BMI가 30㎏/㎡ 이상인 상태로서 정의된다. WHO 정의에 따르면, 용어 비만은 다음과 같이 분류될 수 있다: 용어 "I종 비만"은 BMI가 30㎏/㎡ 이상, 35㎏/㎡ 미만인 상태이고, 용어 "II종 비만"은 BMI가 35㎏/㎡ 이상, 40㎏/㎡ 미만인 상태이며, 용어 "III종 비만"은 BMI가 40㎏/㎡ 이상인 상태이다.
용어 "내장 비만"은 허리 둘레 대 엉덩이 둘레의 비율이 남성의 경우 1.0 이상, 여성의 경우 0.8 이상으로 측정된 상태로서 정의된다. 이는 인슐린 저항성 및 당뇨병 전기의 발병에 대한 위험을 나타낸다.
용어 "복부 비만"은 통상적으로 허리 둘레가 남성의 경우 > 40인치 또는 102㎝이고, 여성의 경우 > 35인치 또는 94㎝인 상태로서 정의된다. 일본 민족 또는 일본 환자에 대해, 복부 비만은 허리 둘레가 남성의 경우 ≥ 85㎝, 여성의 경우 ≥ 90㎝로서 정의될 수 있다(참조예: 일본 대사 증후군 진단에 대한 연구 위원회).
용어 "정상 혈당"은 대상의 공복 혈당 농도가 정상 범위인 70㎎/㎗(3.89mmol/ℓ) 초과, 110㎎/㎗(6.11mmol/ℓ) 미만인 상태로서 정의된다. 용어 "공복"은 의학적 용어로서 보통의 의미를 갖는다.
용어 "고혈당증"은 대상의 공복 혈당 농도가 정상 범위를 넘는, 즉 110㎎/㎗(6.11mmol/ℓ)를 초과하는 상태로서 정의된다. 용어 "공복"은 의학적 용어로서 통상의 의미를 갖는다.
용어 "저혈당증"은 대상의 혈당 농도가 정상 범위 60 내지 115㎎/㎗(3.3 내지 6.3mmol/ℓ) 미만인 상태로서 정의된다.
용어 "식후 고혈당증"은 대상의 식후 2시간의 혈당 또는 혈청 당 농도가 200㎎/㎗(11.11mmol/ℓ)를 초과하는 상태로서 정의된다.
용어 "공복 혈당 장애" 또는 "IFG"는 대상의 공복 혈당 농도 또는 공복 혈청 당 농도가 100 내지 125㎎/㎗(즉, 5.6 내지 6.9mmol/ℓ), 특히 110㎎/㎗ 초과 및 126㎎/㎗(7.00mmol/ℓ) 미만인 상태로서 정의된다. "정상 공복 당"을 갖는 대상은 공복 당 농도가 100㎎/㎗ 미만, 즉 5.6mmol/ℓ 미만이다.
용어 "내당능 장애" 또는 "IGT"는 대상의 식후 2시간의 혈당 또는 혈청 당 농도가 140㎎/㎗(7.78mmol/ℓ) 초과 및 200㎎/㎗(11.11mmol/ℓ) 미만인 상태로서 정의된다. 이상 내당능, 즉 식후 2시간의 혈당 또는 혈청 당 농도는, 절식 후 당 75g을 섭취한지 2시간 후의 혈장 1㎗당 당(㎎)의 혈당치로서 측정될 수 있다. "정상 내당능"을 가진 대상은 식후 2시간의 혈당 또는 혈청 당 농도가 140㎎/㎗(7.78mmol/ℓ) 미만이다.
용어 "고인슐린혈증"은 정상 혈당이거나 정상 혈당이 아닌 인슐린 저항성을 갖는 대상의 공복 또는 식후 혈청 또는 혈장 인슐린 농도가, 허리 둘레 대 엉덩이 둘레의 비율이 < 1.0(남성의 경우) 또는 < 0.8(여성의 경우)인 인슐린 저항성이 없는 정상의 마른 개체의 것보다 더 높은 상태로서 정의된다.
용어 "인슐린 감작", "인슐린 저항성 개선" 또는 "인슐린 저항성 감소"는 동의어이며, 상호교환하여 사용된다.
용어 "인슐린 저항성"은 정상 혈당 상태를 유지하기 위해 당 부하에 대한 정상 반응을 초과하는 순환하는 인슐린 수준이 요구되는 상태로서 정의된다[참조: Ford ES, et al., JAMA. (2002) 287:356-9]. 인슐린 저항성의 측정 방법은 정상 혈당-고인슐린혈증 클램프 시험이다. 당에 대한 인슐린의 비율은 조합된 인슐린-당 주입 기술의 영역 내에서 결정된다. 당 흡수가 조사된 배경 모집단의 25번째 백분위수(25th percentile) 미만인 경우 인슐린 저항성인 것으로 나타난다(WHO 정의). 클램프 시험보다 덜 힘든 것으로서, 정맥내 내당 시험 동안, 혈중 인슐린 및 당 농도를 고정된 시간 간격에서 측정하고 이로부터 인슐린 저항성을 산출하는, 이른바 최소 모델이 있다. 이 방법으로, 간의 인슐린 저항성과 말초 인슐린 저항성을 구별하는 것은 가능하지 않다.
추가로, 인슐린 저항성, 인슐린 저항성을 갖는 환자의 요법에 대한 반응, 인슐린 감수성 및 고인슐린혈증은 인슐린 저항성의 신뢰성 있는 지표인 "인슐린 저항성에 대한 항상성 모델 검정(HOMA-IR)" 스코어를 검정하여 정량화할 수 있다(참조: Katsuki A, et al., Diabetes Care 2001; 24: 362-5). 인슐린 감수성에 대한 HOMA-지수 측정 방법(참조: Matthews et al., Diabetologia 1985, 28: 412-19), 인슐린에 대한 비손상 프로인슐린의 비율 측정 방법[참조: Forst et al., Diabetes 2003, 52(Suppl.1): A459] 및 정상 혈당 클램프 연구를 추가로 참조한다. 또한, 혈장 아디포넥틴 농도가 인슐린 감수성의 잠재적 대체물로서 모니터링될 수 있다. 항상성 검정 모델(HOMA)-IR 스코어에 의한 인슐린 저항성의 평가는 다음의 식으로 산출된다(참조: Galvin P, et al., Diabet Med 1992;9:921-8):
HOMA-IR = [공복 혈청 인슐린(μU/㎖)] × [공복 혈장 당(mmol/ℓ)/22.5]
일반적으로, 인슐린 저항성을 평가하는 매일의 임상 실습에서는 기타의 파라미터들이 사용된다. 바람직하게는, 예를 들면, 환자의 트리글리세라이드 농도가 사용되는데, 증가된 트리글리세라이드 수준은 인슐린 저항성의 존재와 상당히 연관되어 있기 때문이다.
IGT 또는 IFG 또는 2형 당뇨병의 발병 소인이 있는 환자는 고인슐린혈증이 있는 정상 혈당의 환자이며, 정의에 의하자면, 인슐린 저항성이다. 인슐린 저항성을 갖는 전형적 환자는 통상적으로 과체중 또는 비만이다. 인슐린 저항성이 검측될 수 있는 경우, 이는 특히 당뇨병 전기의 존재에 대한 강력한 지표이다. 따라서, 당 항상성을 유지하기 위해 건강한 사람보다 2 내지 3배 더 많은 인슐린을 필요로 할 수 있으며, 이는 어떠한 임상적 증상도 나타내지 않는다.
췌장 베타-세포의 기능을 검사하는 방법은 인슐린 감수성, 고인슐린혈증 또는 인슐린 저항성에 관한 상기된 방법들과 유사하다: 베타-세포 기능의 개선은 예를 들면, 베타-세포 기능에 대한 HOMA-지수(참조: Matthews et al., Diabetologia 1985, 28: 412-19), 인슐린에 대한 비손상 프로인슐린의 비(참조: Forst et al., Diabetes 2003, 52(Suppl.1): A459), 경구 내당 시험 또는 식사 내성 시험 후의 인슐린/C-펩타이드 분비를 측정하거나, 빈번하게 샘플링된 정맥내 내당 시험 후 고혈당 클램프 연구 및/또는 최소 모델링을 사용하여(참조: Stumvoll et al., Eur J Clin Invest 2001, 31: 380-81) 측정할 수 있다.
용어 "당뇨병 전기"는 개체가 2형 당뇨병의 발병을 일으키기 쉬운 상태이다. 당뇨병 전기는 내당능 장애의 정의를 상한의 정상 범위 100㎎/㎗ 이상의 공복 혈당(참조: J. B. Meigs, et al. Diabetes 2003; 52:1475-1484) 및 공복 고인슐린혈증(상승된 혈장 인슐린 농도)을 갖는 개체를 포함하는 것으로 확장시킨다. 당뇨병 전기를 심각한 건강 위협으로서 확인하기 위한 과학적이고 의학적인 기준은 문헌[참조: Position Statement entitled "The Prevention or Delay of Type 2 Diabetes" issued jointly by the American Diabetes Association and the National Institute of Diabetes and Digestive and Kidney Diseases (Diabetes Care 2002; 25:742-749)].
인슐린 저항성을 갖기 쉬운 개체는 다음 특성들 중 2개 이상을 갖는 개체들이다: 1) 과체중 또는 비만, 2) 고혈압, 3) 고지혈증, 4) IGT 또는 IFG 또는 2형 당뇨병을 진단받은 1인 이상의 직계 가족. 인슐린 저항성은 HOMA-IR 스코어를 계산하여 이들 개체에서 확인할 수 있다. 본 발명의 목적상, 인슐린 저항성은 개체의 HOMA-IR 스코어가 > 4.0이거나 HOMA-IR 스코어가 당 및 인슐린 분석의 실험실 수행에 대해 정의된 정상 범위의 상한치를 초과하는 임상적 상태로서 정의된다.
용어 "2형 당뇨병"은 대상의 공복 혈당 또는 혈청 당 농도가 125㎎/㎗(6.94mmol/ℓ)를 초과하는 상태로서 정의된다. 혈당 수치 측정은 관례적인 의학적 분석의 표준 과정이다. 내당 시험을 수행하는 경우, 당뇨병 환자의 혈당 수준은 비어있는 위에 당 75g을 섭취한지 2시간 후 혈장 1㎗당 당 200㎎(11.1mmol/ℓ)을 초과할 것이다. 내당 시험에서는 절식한지 10 내지 12시간 후 피검 환자에게 당 75g을 경구 투여하고, 당를 섭취하기 직전 및 이를 섭취한지 1시간 및 2시간 후에 혈당 수준을 기록한다. 건강한 대상에서, 당을 섭취하기 전의 혈당 수준은 혈장 1㎗당 60㎎ 내지 110㎎이고, 당을 섭취한지 1시간 후에는 1㎗당 200㎎ 미만이며, 2시간 후에는 1㎗당 140㎎ 미만이다. 2시간 후 수치가 140 내지 200㎎인 경우, 이는 이상 내당능으로 간주된다.
용어 "후기 단계 2형 진성 당뇨병"은 2차 약물 실패(drug failure), 인슐린 요법에 대한 징후 및 미세혈관 및 대혈관 합병증, 예를 들면, 당뇨병성 신장병증, 또는 관상동맥 심장 질환(CHD)으로의 진행을 갖는 환자들을 포함한다.
용어 "HbA1c"는 헤모글로빈 B 쇄의 비-효소적 당화(glycation) 생성물을 일컫는다. 이의 측정은 당업자에게 익히 공지되어 있다. 진성 당뇨병 치료의 모니터링에 있어서 HbA1c 값은 매우 중요하다. 이의 생성은 혈당 수준 및 적혈구 수명에 본질적으로 의존하기 때문에, "혈당 기억(blood sugar memory)"의 의미에서 HbA1c는 4 내지 6주 전의 평균 혈당 수준을 반영한다. HbA1c 값이 집중적인 당뇨병 치료에 의해 일관되게 잘 조절된(즉, 시료에서 전체 헤모글로빈의 < 6.5%) 당뇨병 환자는 당뇨병성 미세혈관병증으로부터 훨씬 잘 보호된다. 예를 들면, 메트포르민 자체는 당뇨병 환자에서 1.0 내지 1.5% 정도의 HbA1c 값의 평균 개선을 달성한다. 이러한 HbA1C 값의 감소는 HbA1c의 목적하는 표적 범위 < 6.5%, 바람직하게는 < 6%을 달성하기 위한 모든 당뇨병 환자에서 충분하지 않다.
본 발명의 범위 내에서 용어 "불충분한 혈당 조절" 또는 "부적절한 혈당 조절"은 환자의 HbA1c 값이 6.5% 이상, 특히 7.0% 이상, 더욱 바람직하게는 7.5% 이상, 특히 8% 이상인 상태를 의미한다.
"X 증후군"(대사 장애의 맥락에서 사용된 경우)이라고도 언급되고 "이상대사 증후군"이라고도 언급되는 "대사 증후군"은 인슐린 저항성인 기본 특성을 갖는 증후군 복합이다(참조: Laaksonen DE, et al. Am J Epidemiol 2002;156:1070-7). ATP III/NCEP 가이드라인[참조: Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, 및 Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) JAMA: Journal of the American Medical Association (2001) 285:2486-2497]에 따르면, 대사 증후군의 진단은 다음 위험 인자들 중의 3개 이상이 나타날 경우에 판단된다:
1. 허리 둘레가 남성의 경우 > 40인치 또는 102㎝이고, 여성의 경우 > 35인치 또는 94㎝로서 정의되는 복부 비만; 또는 일본 민족 또는 일본 환자에 대해 허리 둘레가 남성의 경우 ≥ 85㎝, 여성의 경우 ≥ 90㎝로서 정의되는 복부 비만;
2. 트리글리세라이드: ≥ 150㎎/㎗
3. HDL-콜레스테롤 < 40㎎/㎗(남성)
4. 혈압 ≥ 130/85mmHg(SBP ≥ 130 또는 DBP ≥ 85)
5. 공복 혈당 ≥ 100㎎/㎗
NCEP 정의는 승인되었다[참조: Laaksonen DE, et al., Am J Epidemiol. (2002) 156:1070-7]. 혈중 트리글리세라이드 및 HDL 콜레스테롤은 또한 의학 분석의 표준 방법에 의해 측정될 수 있으며, 이는 예를 들어 문헌[참조: Thomas L (Editor): "Labor und Diagnose", TH-Books Verlagsgesellschaft mbH, Frankfurt/Main, 2000]에 기술되어 있다.
통상적으로 사용되는 정의에 따르면, 고혈압은 수축기 혈압(SBP)이 140mmHg 값을 초과하고 확장기 혈압(DBP)이 90mmHg 값을 초과하는 경우에 진단된다. 환자가 명백한 당뇨병을 앓고 있는 경우, 수축기 혈압을 130mmHg 이하의 수준으로 감소시키고 확장기 혈압을 80mmHg 이하로 감소시키는 것이 현재 권장된다.
본 발명의 범위 내에서 용어 "SGLT2 억제제"는 나트륨-당 운반체 2(SGLT2), 특히 사람 SGLT2에 대해 억제 효과를 나타내는 화합물, 특히 글루코피라노실-유도체, 즉 글루코피라노실-잔기를 갖는 화합물에 관한 것이다. IC50으로 측정된 hSGLT2에 대한 억제 효과는 바람직하게는 1,000nM 이하, 더욱 바람직하게는 100nM 이하, 가장 바람직하게는 50nM 이하이다. hSGLT2에 대한 억제 효과는 문헌에 공지된 방법들에 의해, 특히 전문이 본원에 참조로서 인용된 출원 WO 제2005/092877호 또는 WO 제2007/093610호(23/24페이지)에 기술된 바와 같이 측정될 수 있다. "SGLT2 억제제"란 용어는 또한 각각의 결정 형태들을 포함하는, 약제학적으로 허용되는 이의 염, 수화물 및 용매화물을 포함한다.
용어 "치료" 및 "치료하는"은 이미 상기 상태가 발병된, 특히 명백한 형태로 발병된 환자의 치료학적 처치를 포함한다. 치료학적 처치는 특정 징후의 증상을 경감시키기 위한 증상적 치료, 또는 징후 상태를 역전시키거나 부분적으로 역전시키기 위한 원인 치료 또는 질환의 진행을 중단시키거나 서행시키기 위한 원인 치료일 수 있다. 따라서, 본 발명의 조성물 및 방법은 예를 들어, 경시적 치료학적 처치로서 뿐 아니라 만성적 요법을 위해 사용될 수 있다.
용어 "예방적으로 치료하는", "예방을 위해 치료하는" 및 "예방하는"은 상호교환적으로 사용되며, 앞서 언급된 상태로 발병될 위험이 있는 환자를 치료하여 상기 위험을 감소시키는 것을 포함한다.
용어 "정제"는 피복물을 갖지 않는 정제 및 하나 이상의 피복물을 갖는 정제를 포함한다. 또한, 용어 "정제"는 1층, 2층, 3층 또는 그 이상의 층을 갖는 정제 및 압축-피복된 정제를 포함하며, 여기서, 앞서 언급된 형태의 정제들 각각은 하나 이상의 피복물을 갖거나 갖지 않을 수 있다. 용어 "정제"는 또한 소형(mini) 정제, 용융 정제, 저작성 정제, 발포성 정제 및 경구 붕해성 정제를 포함한다.
용어 "약전(pharmacopoe 및 pharmacopoeias)"은 다음과 같은 표준 약전을 의미한다: "USP 31-NF 26 through Second Supplement" (United States Pharmacopeial Convention) 또는 the "European Pharmacopoeia 6.3" (European Directorate for the Quality of Medicines and Health Care, 2000-2009)
상세한 설명
본 발명에 따르는 측면, 특히 약제학적 조성물, 방법 및 용도는 상기 및 하기 정의된 바와 같은 SGLT2 억제제를 의미한다.
바람직하게는, SGLT2 억제제는 화학식 I의 글루코피라노실-치환된 벤젠 유도체 또는 상기한 SGLT2 억제제 중의 하나의 프로드럭으로부터 선택된다.
화학식 I
상기 화학식 I에서,
R1은 Cl, 메틸 또는 시아노를 나타내고;
R2는 H, 메틸, 메톡시 또는 하이드록시를 나타내고;
R3은 에틸, 사이클로프로필, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다.
화학식 I의 화합물 및 이들의 합성 방법은 예를 들어 다음의 특허 출원들에 기술되어 있다: WO 제2005/092877호, WO 제2006/117360호, WO 제2006/117359호, WO 제2006/120208호, WO 제2006/064033호, WO 제2007/031548호, WO 제2007/093610호, WO 제2008/020011호, WO 제2008/055870.
상기 화학식 I의 글루코피라노실-치환된 벤젠 유도체에서, 다음의 치환체 정의가 바람직하다.
바람직하게는, R1은 클로로 또는 시아노; 특히 클로로를 나타낸다.
바람직하게는, R2는 H를 나타낸다.
바람직하게는, R3은 에틸, 사이클로프로필, 에티닐, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다. 더욱 바람직하게는, R3은 사이클로프로필, 에티닐, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다. 가장 바람직하게는, R3은 에티닐, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시를 나타낸다.
화학식 I의 바람직한 글루코피라노실-치환된 벤젠 유도체는 화학식 I.1 내지 I.11의 화합물들의 그룹으로부터 선택된다:
화학식 I의 더욱 더 바람직한 글루코피라노실-치환된 벤젠 유도체는 화학식 I.6, I.7, I.8, I.9 및 I.11의 화합물들로부터 선택된다.
화학식 I의 더욱 더 바람직한 글루코피라노실-치환된 벤젠 유도체는 화학식 I.8 및 I.9의 화합물들로부터 선택된다.
본 발명에 따르면, 앞서 열거된 화학식 I의 글루코피라노실-치환된 벤젠 유도체의 정의는 이들의 수화물, 용매화물 및 다형태 및 이들의 프로드럭도 포함하는 것으로 이해된다. 바람직한 화학식 I.7의 화합물에 관하여, 유리한 결정 형태는 국제 특허 출원 WO 제2007/028814호에 기술되어 있으며, 이의 전문은 본원에 참조로서 인용된다. 바람직한 화학식 I.8의 화합물에 관하여, 유리한 결정 형태는 국제 특허 출원 WO 제2006/117360호에 기술되어 있으며, 이의 전문은 본원에 참조로서 인용된다. 바람직한 화학식 I.9의 화합물에 관하여, 유리한 결정 형태는 국제 특허 출원 WO 제2006/117359호에 기술되어 있으며, 이의 전문은 본원에 참조로서 인용된다. 바람직한 화학식 I.11의 화합물에 관하여, 유리한 결정 형태는 국제 특허 출원 WO 제2008/049923호에 기술되어 있으며, 이의 전문은 본원에 참조로서 인용된다. 이들 결정 형태들은 SGLT2 억제제의 양호한 생체이용률을 가능하게 하는 양호한 용해도 특성들을 갖는다. 또한, 결정 형태들은 물리화학적으로 안정하며, 따라서 약제학적 조성물의 양호한 저장 수명 안정성을 제공한다.
명백하게 하기 위해, 특정 SGLT2 억제제와 관련하여 상기 인용된 상기 문헌들 각각의 내용은 구체적으로 전문이 본원에 참조로서 인용된다.
화학식 I.9의 화합물의 바람직한 결정 형태(I.9X)는 18.84, 20.36 및 25.21 °2Θ(±0.1 °2Θ)에서의 피크들을 포함하는 X-선 분말 회절 패턴에 의해 확인될 수 있고, 여기서, 상기 X-선 분말 회절 패턴(XRPD)은 CuKα1 방사선을 사용하여 작성된다.
특히, 상기 X-선 분말 회절 패턴은 14.69, 18.84, 19.16, 19.50, 20.36 및 25.21 °2Θ(±0.1 °2Θ)에서의 피크들을 포함하고, 여기서, 상기 X-선 분말 회절 패턴은 CuKα1 방사선을 사용하여 작성된다.
특히, 상기 X-선 분말 회절 패턴은 14.69, 17.95, 18.43, 18.84, 19.16, 19.50, 20.36, 22.71, 23.44, 24.81, 25.21 및 25.65 °2Θ(±0.1 °2Θ)에서의 피크들을 포함하고, 여기서, 상기 X-선 분말 회절 패턴은 CuKα1 방사선을 사용하여 작성된다.
더욱 상세하게, 결정 형태(I.9X)는 표 1에 함유된 °2Θ(±0.1 °2Θ)에서의 피크들을 포함하는, CuKα1 방사선을 사용하여 작성된 X-선 분말 회절 패턴에 의해 확인된다.
표 1: 결정 형태(I.9X)의 X-선 분말 회절 패턴(30°2Θ까지의 피크들만 열거됨)
보다 더 상세하게, 결정 형태(I.9X)는 WO 제2006/117359호의 도 1에 도시된 바와 같은 °2Θ(±0.1 °2Θ)에서의 피크들을 포함하는, CuKα1 방사선을 사용하여 작성된 X-선 분말 회절 패턴에 의해 확인된다.
또한, 결정 형태(I.9X)는 약 151℃±5℃의 융점(DSC를 통해 측정; 개시-온도로서 평가; 가열 속도 10K/분)에 의해 확인된다. 수득된 DSC 곡선은 WO 제2006/117359호의 도 2에 도시되어 있다.
X-선 분말 회절 패턴은, 본 발명의 범위 내에서, 위치-감지 검측기(OED)가 장착된 전송 방식의 STOE-STADI P-회절계와, X-선 공급원으로서 Cu-어노드(CuKα1 방사선, λ=1,54056Å, 40kV, 40mA)를 사용하여 기록한다. 상기 표 1에서, "2Θ[°]" 값은 회절 각도(°)를 의미하고, "d[Å]" 값은 격자 면들 사이의 명시된 거리(Å)를 의미한다. WO 제2006/117359호의 도 1에 도시된 강도는 cps(초당 계수) 단위로 제공된다.
실험적 오차를 허용하기 위해, 상술된 2Θ 값은 ±0.1 °2θ, 특히 ±0.05 °2θ까지 정확한 것으로 간주되어야 한다. 다시 말해, 화학식 I.9의 화합물의 주어진 결정 시료가 본 발명에 따르는 결정 형태인지를 평가할 때, 시료에 대해 실험적으로 관찰된 2Θ 값이 고유 값(characteristic value)의 ±0.1 °2θ 이내에 있는 경우, 특히 고유 값의 ±0.05 °2θ 이내에 있는 경우, 이는 상기 고유 값과 동일한 것으로 간주되어야 한다.
융점은 DSC 821(Mettler Toledo)을 사용하여 DSC(시차 주사 열량계)에 의해 측정된다.
하나의 양태에서, 본 발명에 따르는 약제학적 조성물 또는 용량형은 화학식 I.9의 화합물을 함유하고, 여기서, 화학식 I.9의 화합물의 50중량% 이상은 상기 정의된 바와 같은 이의 결정 형태(I.9X)의 형태로 존재한다. 바람직하게는, 상기한 조성물 또는 용량형에서, 화학식 I.9의 화합물의 80중량% 이상, 더욱 바람직하게는 90중량% 이상이 상기 정의된 바와 같은 이의 결정 형태(I.9X)의 형태로 존재한다.
SGLT2 억제제의 바람직한 용량 범위는 하루에 0.5mg 내지 200mg, 더욱 더 바람직하게는 1 내지 100mg, 가장 바람직하게는 1 내지 50mg 범위 내이다. 경구 투여가 바람직하다. 따라서, 본 발명의 약제학적 조성물은 상기한 양, 특히 0.5 내지 50mg, 바람직하게는 1 내지 25mg, 더욱 더 바람직하게는 2.5 내지 12.5mg을 포함할 수 있다. 본 발명에 사용하기 위한 특별한 용량 강도(예를 들면, 정제 또는 캡슐제 당)는, 예를 들어, SGLT2 억제제, 예를 들어, 화학식 I의 화합물, 특히 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X) 0.5, 1, 1.25, 2, 2.5, 5, 7.5, 10, 12.5, 15, 20, 25 또는 50mg이다. 특히 바람직한 용량 강도(예를 들면, 정제 또는 캡슐제 당)는, 예를 들어, SGLT2 억제제, 예를 들어, 화학식 I의 화합물, 특히 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X) 0.5, 1, 1.25, 2.5, 5, 10 또는 12.5mg이다.
한 측면에서, 본 발명에 따르는 약제학적 조성물 내에서 SGLT2와 병용되는 파트너 약물은 비구아나이드(예를 들면, 메트포르민, 예를 들어, 메트포르민 하이드로클로라이드)이다.
본 발명의 의미 내에서 바람직한 파트너 약물은 메트포르민, 특히 메트포르민 하이드로클로라이드(1,1-디메틸비구아나이드 하이드로클로라이드 또는 메트포르민 HCl)이다.
비구아나이드 항고혈압제 메트포르민은 미국 특허 제3,174,901호에 기재되어 있다. 당해 메트포르민(디메틸디구아나이드) 및 이의 하이드로클로라이드 염의 제조는 최신 기술이고, 문헌[참조: Emil A. Werner and James Bell, J. Chem. Soc. 121, 1922, 1790-1794]에 최초로 기술되었다. 메트포르민의 기타 약제학적으로 허용되는 염은 1999년 3월 4일자로 출원된 미국 출원 연속 제09/262,526호 또는 미국 특허 제3,174,901호에서 찾을 수 있다. 본원에서 사용된 메트포르민이 메트포르민 하이드로클로라이드 염인 것이 바람직하다.
메트포르민은 일반적으로 각종 용량 용법을 사용하여 1일당 약 250mg 내지 3000mg, 특히 500mg 내지 2000mg, 2500mg 이하의 다양한 양으로 투여된다. 파트너 약물 메트포르민의 용량 범위는 일반적으로 100mg 내지 500mg 또는 200mg 내지 850mg(1일 1 내지 3회), 또는 1일 1회 또는 2회 300mg 내지 1000mg이다. 본 발명에 사용하기 위한 메트포르민 하이드로클로라이드의 단위 용량 강도는 100mg 내지 2000mg 또는 100mg 내지 1500mg, 바람직하게는 250mg 내지 1000mg일 수 있다. 특별한 용량 강도는 메트포르민 하이드로클로라이드 250, 500, 625, 750, 850 및 1000mg일 수 있다. 이러한 메트포르민 하이드로클로라이드의 단위 용량 강도는 2형 당뇨병을 치료하기 위해 미국에서 시판 승인된 용량 강도를 나타낸다. 본 발명의 고정 용량 병용 약제학적 조성물에 도입하기 위한 메트포르민 하이드로클로라이드의 보다 특별한 단위 용량 강도는 500, 850 및 1000mg의 메트포르민 하이드로클로라이드이다.
본 발명의 추가의 측면에서, 본 발명은 불순물 및/또는 분해 생성물을 실질적으로 함유하지 않거나 단지 약간만 포함하는 본 발명의 약제학적 조성물, 제형, 블렌드 또는 용량형을 제공하고; 이것은, 예를 들어, 당해 조성물, 제형, 블렌드 또는 용량형이 개별적 또는 전체 불순물 또는 분해 생성물(들)을 총 중량 기준으로 약 < 5%, 또는 약 < 4%, 또는 약 < 3%, 또는 약 2% 미만, 바람직하게는 약 1% 미만, 더욱 바람직하게는 약 0.5% 미만, 더욱 더 바람직하게는 약 0.2% 미만을 포함함을 의미한다.
본 발명의 FDC 제형용 용량형:
본 발명의 또다른 목적은 합리적인 정제 크기, 우수한 정제 특성(예를 들면, 안정성, 경도, 취성, 붕해성, 용해 프로파일, 함량 균일성 등)을 갖는 본 발명의 FDC 제형을 개발하는 것이다.
따라서, 본 발명의 FDC 제형에 적합한 용량형은 필름-피복 정제(약물 부하를 위한 필름-피복물, 예를 들어, 특히 파트너 약물을 함유하는 정제 코어 상에 필름-피복에 의한 SGLT-2 억제제 약물 부하), 단층 정제, 이층 정제, 삼층 정제 및 압축 피복 정제(예를 들면, SGLT-2 억제제 코어를 갖는 정제내 정제(tablet-in-tablet) 또는 불스아이 정제(bull's eye tablet))이고, 이러한 용량형은 목적하는 약제학적 프로파일 및 사용된 SGLT-2 억제제 및 파트너 약물의 특성을 고려하여 목적을 달성하기 위한 우수한 척도인 것으로 밝혀졌다. 상기한 용량형은 각 모노 정제의 원래 용해 프로파일을 유지시키거나 목적하는 수준 및 합리적인 정제 크기로 조정하여 FDC 제형에 적용가능한 것으로 밝혀졌다.
본 발명의 전형적인 단층 정제는 SGLT-2 억제제, 메트포르민 하이드로클로라이드, 하나 이상의 충전제(예를 들면, 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈), 하나 이상의 활주제(예를 들면, 콜로이드성 무수 실리카) 및 하나 이상의 윤활제(예를 들면, 마그네슘 스테아레이트)를 포함한다.
본 발명의 한 양태에서, 본 발명은 경구 고체 약제학적 조성물, 바람직하게는 정제, 특히 단층 정제에 관한 것으로, 여기서, 다음 중의 하나 이상을 적용한다:
- 메트포르민 하이드로클로라이드의 백분율은 전체 정제 코어의 약 84중량%이고,
- SGLT-2 억제제의 백분율은 전체 정제 코어의 약 0.1중량% 내지 2.12중량%, 예를 들어, 0.1중량% 내지 2.11중량%이고,
- 정제 파쇄 강도는 100N 이상이고,
- 정제 취성은 0.5% 이하이고,
- 정제 코어 중량은 약 560 내지 약 1180mg이고,
- 정제 붕해 시간은 15분 이하이다.
하나의 양태에서, SGLT-2 억제제는 화학식 I의 화합물, 특히 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X)이다.
본 발명의 바람직한 양태에서, 본 발명은,
예를 들어, 0.5, 1, 1.25, 2.5, 5, 10 또는 12.5mg의 양의 화학식 I의 화합물, 예를 들어, 화학식 I.9의 화합물 또는 이의 결정 형태(1.9X),
예를 들어, 500mg, 850mg 또는 1000mg의 양의 메트포르민, 특히 메트포르민 하이드로클로라이드, 및
하나 이상의 약제학적 부형제, 특히 하나 이상의 충전제(예를 들면, 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈), 하나 이상의 활주제(예를 들면, 콜로이드성 무수 실리카) 및/또는 하나 이상의 윤활제(예를 들면, 마그네슘 스테아레이트) 뿐만 아니라,
임의로, 하나 이상의 필름-피복제(예를 들면, 하이프로멜로스), 하나 이상의 가소제(예를 들면, 프로필렌 글리콜, 폴리에틸렌 글리콜 또는 트리에틸 시트레이트), 하나 이상의 안료(예를 들면, 이산화티탄, 산화철 레드/옐로우/블랙 또는 이들의 혼합물) 및/또는 하나 이상의 활주제(예를 들면, 탈크)를 포함하는 필름-코트(film-coat)를 포함하거나 이들로부터 제조되는 경구 고체 약제학적 조성물, 바람직하게는 정제, 특히 단층 정제에 관한 것이다.
본 발명의 추가의 측면에서, 본 발명은, 예를 들어, 당해 기술 분야의 숙련가에게 공지된 방법을 사용하고/하거나 본원에 기술된 방식으로 본 발명의 조성물, 제형, 블렌드 또는 용량형을 제조하는 방법을 제공하고, 예를 들어, 이들은 상기 및 하기 언급된 구성 요소 및/또는 성분 또는 이들의 예비혼합물을 사용함(예를 들면, 혼합, 배합, 블렌딩 및/또는 구성함)을 포함하는 방법에 의해 수득될 수 있고, 뿐만 아니라, 또한 본 발명은 추가로 이러한 방법 또는 공정에 의해 수득가능하고/하거나 상기 및 하기 언급된 구성 요소, 성분, 예비 혼합물 및/또는 혼합물로부터 수득가능한 조성물, 제형, 블렌드 또는 용량형을 제공한다.
본 발명의 정제를 제조하는 방법은 하나 이상의 최종 블렌드를 과립 형태로 정제화함(예를 들면, 압축)을 포함한다. 본 발명에 따르는 (최종) 블렌드(들)의 과립은 당해 기술 분야의 숙련가에게 익히 공지된 방법(예를 들면, 고전단 습식 과립화 또는 유동층 과립화)으로 제조할 수 있다. 본 발명에 따르는 과립 뿐만 아니라 본 발명의 과립을 제조하기 위한 과립화 공정(이들의 개별 단계 포함)의 세부사항은 예의 방법으로 다음 실시예에 기술된다.
단층 조성물을 포함하는 과립을 제조하기 위한 예시적 과립화 공정은,
i.) 결합제(예를 들면, 코포비돈) 및, 임의로, SGLT-2 억제제(예를 들면, 화학식 I의 화합물, 예를 들어, 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X))를 주위 온도에서 용매 또는 용매의 혼합물, 예를 들어, 정제수에 배합하여(예를 들면, 용해시키거나 분산시켜) 과립화 액체를 생성하는 단계;
ii.) 메트포르민 HCl, 충전제(예를 들면, 옥수수 전분) 및, 임의로, SGLT-2 억제제를 적합한 혼합기(예를 들면, 유동층 과립화기)에서 블렌딩하여 예비-혼합물을 생성하는 단계[여기서, SGLT-2 억제제는 단계 i.)에서 수득된 과립화 액체 또는 단계 ii.)에서 수득된 예비 혼합물에 포함시킬 수 있고, 바람직하게는 SGLT-2 억제제는 과립화 액체에 분산되고, 예비 혼합물 중에는 부재한다];
iii.) 과립화 액체를 예비 혼합물에 분무하고, 혼합물을, 예를 들어, 유동층 과립화기에서, 바람직하게는 무수 조건하에 과립화하는 단계;
iv.) 과립화물을, 예를 들어, 약 70℃ 주입구 공기 온도에서 목적하는 건조시 손실 값 1 내지 3% 범위, 예를 들어, 0.8 내지 2%가 수득될 때까지 과립을 건조시키는 단계;
v.) 건조된 과립화물을, 예를 들어, 메쉬 크기 0.5 내지 1.0mm의 체를 통해 체질하여 탈괴상화하는 단계;
vi.) 체질된 과립화물 및 바람직하게는 체질된 활주제(예를 들면, 콜로이드성 무수 실리카)를 적합한 블렌더에서 블렌딩하는 단계;
vii.) 바람직하게는 체질된 윤활제(예를 들면, 마그네슘 스테아레이트)를, 예를 들어, 자유 낙하 블렌더에서 최종 블렌딩을 위한 과립화물에 첨가하는 단계를 포함한다.
우선적으로, 본 발명에 따르는 단층 정제는 SGLT-2 억제제 및 메트포르민을 포함하는 혼합물을 포함하거나, 이들 혼합물로부터 수득가능하다.
본 발명의 전형적인 이층 정제는
SGLT-2 억제제, 하나 이상의 충전제(예를 들면, D-만니톨, 예비젤라틴화 전분 및 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈) 및 하나 이상의 윤활제(예를 들면,마그네슘 스테아레이트)를 포함하는 SGLT-2 억제제 분획, 및
메트포르민 하이드로클로라이드, 하나 이상의 충전제(예를 들면, 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈), 하나 이상의 활주제(예를 들면, 콜로이드성 무수 실리카) 및 하나 이상의 윤활제(예를 들면, 마그네슘 스테아레이트)를 포함하는 메트포르민 HCl 분획을 포함한다.
본 발명의 전형적인 압축 피복 정제(예를 들면, 정제내 정제 또는 불스아이 정제)는
SGLT-2 억제제, 하나 이상의 충전제(예를 들면, D-만니톨, 예비젤라틴화 전분 및 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈) 및 하나 이상의 윤활제(예를 들면,마그네슘 스테아레이트)를 포함하는 SGLT-2 억제제 분획, 및
메트포르민 하이드로클로라이드, 하나 이상의 충전제(예를 들면, 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈), 하나 이상의 활주제(예를 들면, 콜로이드성 무수 실리카) 및 하나 이상의 윤활제(예를 들면, 마그네슘 스테아레이트)를 포함하는 메트포르민 HCl 분획을 포함한다.
본 발명의 전형적인 필름-피복 정제(메트포르민 HCl 정제 상의 SGLT-2 억제제 피복물, 즉 약물 부하를 위해 필름-피복에 의한 약물 적층)는
메트포르민 하이드로클로라이드, 하나 이상의 충전제(예를 들면, 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈), 하나 이상의 활주제(예를 들면, 콜로이드성 무수 실리카) 및 하나 이상의 윤활제(예를 들면, 마그네슘 스테아레이트)를 포함하는 메트포르민 HCl 코어 분획[여기서, 상기한 코어 분획은 하나 이상의 필름-피복제(예를 들면, 하이프로멜로스), 하나 이상의 가소제(예를 들면, 프로필렌 글리콜, 마크로골 400, 마크로골 6000, 마크로골 8000), 하나 이상의 안료(예를 들면, 이산화티탄, 산화철 레드/옐로우/블랙 또는 이들의 혼합물) 및 하나 이상의 활주제(예를 들면, 탈크)를 포함하는 필름-코트로 밀봉 피복된다]; 및
SGLT-2 억제제, 하나 이상의 필름-피복제(예를 들면, 하이프로멜로스) 및 하나 이상의 가소제(예를 들면, 프로필렌 글리콜, 마크로골 400, 마크로골 6000, 또는 마크로골 8000, 트리에틸 시트레이트)를 포함하는 SGLT-2 억제제 층을 포함한다.
본 발명의 또다른 전형적인 필름-피복 정제(메트포르민 HCl 정제 상의 SGLT-2 억제제 피복물, 즉 약물 부하를 위한 필름-피복에 의한 약물 적층)는
메트포르민 하이드로클로라이드, 하나 이상의 충전제(예를 들면, 옥수수 전분), 하나 이상의 결합제(예를 들면, 코포비돈), 하나 이상의 활주제(예를 들면, 콜로이드성 무수 실리카) 및 하나 이상의 윤활제(예를 들면, 마그네슘 스테아레이트)를 포함하는 메트포르민 HCl 코어 분획[여기서, 상기한 코어 분획은 하나 이상의 필름-피복제(예를 들면, 하이프로멜로스), 하나 이상의 가소제(예를 들면, 프로필렌 글리콜, 마크로골 400, 마크로골 6000, 또는 마크로골 8000, 트리에틸 시트레이트), 하나 이상의 안료(예를 들면, 이산화티탄, 산화철 레드/옐로우/블랙 또는 이들의 혼합물) 및 하나 이상의 활주제(예를 들면, 탈크)를 포함하는 필름-코트로 밀봉 피복된다]; 및
SGLT-2 억제제, 하나 이상의 필름-피복제(예를 들면, 하이프로멜로스) 및 하나 이상의 가소제(예를 들면, 프로필렌 글리콜, 마크로골 400, 마크로골 6000, 또는 마크로골 8000, 트리에틸 시트레이트)를 포함하는 SGLT-2 억제제 층을 포함한다.
바람직하게는, 이러한 상기 정제(단층, 이층, 압축 피복 및 약물 피복 정제)는 추가로 최종 필름-코트로 오버-코팅되고, 이는 필름-피복제(예를 들면, 하이프로멜로스), 가소제(예를 들면, 프로필렌 글리콜, 마크로골 400, 마크로골 6000, 또는 마크로골 8000, 트리에틸 시트레이트), 안료(예를 들면, 이산화티탄, 산화철 레드/옐로우/블랙 또는 이들의 혼합물) 및 활주제(예를 들면, 탈크)를 포함한다. 통상적으로, 이러한 추가의 필름 오버-코트(over-coat)는 조성물의 총 질량의 1 내지 4%, 바람직하게는 1 내지 2%를 나타낼 수 있다.
본 발명에 따르는 약제학적 조성물 또는 용량형은 즉시 방출 약제학적 조성물 또는 용량형, 또는 서방출 약제학적 조성물 또는 용량형일 수 있다.
본 발명의 즉시 방출 약제학적 용량형은 바람직하게는 각각의 활성 성분에 대해 45분 후에 각각의 활성 성분의 75중량% 이상, 더욱 더 바람직하게는 90중량% 이상이 용해되도록 하는 용해 특성을 갖는다. 특별한 양태에서, 특히 본 발명에 따르는 단층 정제(정제 코어 및 필름-피복 정제 포함)의 각각의 활성 성분에 대해 30분 후에 각각의 활성 성분의 70 내지 75중량% 이상(바람직하게는 80중량% 이상)이 용해된다. 추가의 양태에서, 특히 본 발명에 따르는 단층 정제(정제 코어 및 필름-피복 정제 포함)의 각각의 활성 성분에 대해 15분 후에, 각각의 활성 성분의 55 내지 60중량% 이상이 용해된다. 용해 특성은 표준 용해 시험, 예를 들어, 표준 약전(예를 들어, 50 또는 75 또는 100rpm의 진탕 속도, 37℃의 온도에서 용해 매질 pH 6.8을 사용하는 패들 방법 사용)에 따라 측정될 수 있다.
지속-방출(time-release) 용량형은 즉시 방출 용량형이 아닌 제형을 의미한다. 지속-방출 용량형에서, 활성 성분의 방출은 느리고 경시적으로 발생한다. 지속-방출 용량형은 또한 서방출(SR; sustained-release), 지연 작용(SA; sustained-action), 연장 방출(ER, XR, 또는 XL; extended-release), 지속-방출 또는 경시적-방출(timed-release), 제어 방출(CR; controlled-release), 변형 방출(MR; modified release), 또는 연속 방출(CR 또는 Contin; continuous-release)로 공지된다. 한 측면에서, 지속-방출 용량형은 하나 이상의 활성 성분이 서서히 방출되는 이층 정제일 수 있다. 한 측면에서, 본 발명에 따르는 약제학적 조성물 및 약제학적 용량형에서, SGLT-2 억제제, 예를 들어, 화학식 I의 화합물, 예를 들어, 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X), 또는 파트너 약물, 예를 들어, 비구아나이드, 예를 들어, 메트포르민, 예를 들어, 메트포르민 하이드로클로라이드는 지속-방출성이다.
또다른 측면에서, 본 발명에 따르는 약제학적 조성물 및 약제학적 용량형에서, SGLT-2 억제제, 예를 들어, 화학식 I의 화합물, 예를 들어, 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X), 또는 파트너 약물, 예를 들어, 비구아나이드, 예를 들어, 메트포르민, 예를 들어, 메트포르민 하이드로클로라이드는 지속-방출성이다.
본 발명에 따르는 약제학적 조성물 및 약제학적 용량형에서, SGLT-2 억제제, 예를 들어, 화학식 I의 화합물, 예를 들어, 화학식 I.9의 화합물 또는 이의 결정 형태(I.9X)는 바람직하게는 각각의 활성 약제학적 성분의 90% 이상이 200㎛보다 작은 입자 크기를 갖는, 즉 X90 < 200㎛, 더욱 바람직하게는 X90 ≤ 150㎛인 입자 크기 분포(바람직하게는 용적 기준)를 갖는다. 더욱 바람직하게는 입자 크기 분포는 X90 ≤ 100㎛, 더욱 바람직하게는 X90 ≤ 90㎛, 더욱 더 바람직하게는 X90 ≤ 75㎛이다. 또한, 입자 크기 분포는 바람직하게는 X90 > 1㎛, 더욱 바람직하게는 X90 ≥ 5㎛, 가장 바람직하게는 X90 ≥ 10㎛이다. 따라서, 바람직한 입자 크기 분포는 1㎛ < X90 < 200㎛, 특히 1㎛ < X90 ≤ 150㎛, 더욱 바람직하게는 5㎛ ≤ X90 ≤ 150㎛, 더욱 더 바람직하게는 5㎛ ≤ X90 ≤ 100㎛, 더욱 더 바람직하게는 10㎛ ≤ X90 ≤ 100㎛이다. SGLT-2 억제제의 바람직한 입자 크기 분포의 예는 20㎛ ≤ X90 ≤ 50㎛이다. 입자 크기 분포가 상기 지시된 바와 같은 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)를 포함하는 약제학적 조성물이 목적하는 특성(예를 들면, 용해, 함량 균일성, 제조 등과 관련하여)을 나타낸다는 것이 밝혀질 수 있다. 지시된 입자 크기 특성은 레이저 회절 방법, 특히 낮은 각 레이저 광 산란, 즉 프라운호퍼 회절(Fraunhofer diffraction)로 측정된다. 대안적으로, 입자 크기 특성은 또한 현미경(예를 들면, 전자 현미경 또는 주사 전자 현미경)으로 측정될 수 있다. 상이한 기술로 측정된 입자 크기 분포의 결과가 서로 상호관련될 수 있다.
메트포르민 HCl 분획의 최적의 제형:
본 발명의 또다른 목적은 본 발명에 따르는 약제학적 조성물의 메트포르민 HCl 분획의 향상된 제형을 제공하는 것이다.
메트포르민 HCl 파트의 경우, 합리적인 소형 정제 크기에 대한 전제조건으로서 높은 약물 부하가 달성되는 것이 유리하다.
따라서, 본 발명의 정제의 메트포르민 HCl의 약물 부하 및 압축성(압축력-파쇄 강도 프로파일)은 수용성 중합체, 특히 코폴리비돈을 사용한 메트포르민 HCl의 표면 처리로 향상될 수 있다는 것이 밝혀졌다.
폴리비닐 알콜(PVA), 하이프로멜로스(HPMC), 하이드록시프로필 셀룰로스(HPC), 메틸 셀룰로스(MC), 포비돈(PVP) 및 코폴리비돈을 포함하는 다수의 수용성 중합체를 시험하여 압축성(압축력-파쇄 강도 프로파일)을 향상시킬 수 있다. 결과적으로, PVA는 압축성과 관련하여 최선의 효과를 나타내지만, 제조성은 유동층 과립화 동안 점착 문제 때문에 불량할 수 있다. 더욱이, PVA는 본 발명의 특정의 SGLT-2 억제제의 안정성에 대한 이의 부정적인 영향 때문에 최종적으로 선택되지 않을 수 있다.
제형 최적화 연구는 83%를 초과하는 메트포르민 HCl의 약물 부하를 갖고 수용성 중합체 코폴리비돈에 의한 메트포르민 HCl의 표면 처리에 의해 향상된 파쇄 강도를 갖는 조성물을 확인하였다.
따라서, 최종적으로, 코폴리비돈이 선택되고, 유리하게는 안정한 제형을 유도하고, 과립화 용액의 점도는 수용액을 제조하고 유동층 과립화기에 의한 분무를 작동시키기에 충분히 낮다.
본 발명이 치료 또는 예방을 필요로 하는 환자를 언급할 때, 이는 주로 사람에서의 치료 및 예방에 관한 것이지만, 약제학적 조성물은 또한 포유동물에서의 수의학에서도 상응하게 사용될 수 있다. 본 발명의 범위 내에서, 성인 환자는 바람직하게는 18세 이상 연령의 사람이다.
상술된 바와 같이, 본 발명에 따른 약제학적 조성물의 투여에 의해 및 특히 본원의 SGLT2 억제제의 높은 SGLT2 억제 활성의 관점에서, 과잉 혈당은 환자의 뇨를 통해 배설되어 어떤 체중 증가도 일어나지 않고, 심지어 체중 감소가 일어날 수 있다. 따라서, 본 발명에 따른 치료 또는 예방은 유리하게는, 과체중 및 비만, 특히 I종 비만, II종 비만, III종 비만, 내장 비만 및 복부 비만으로 이루어진 그룹으로부터 선택된 하나 이상의 상태를 진단받은, 상기 치료 또는 예방을 필요로 하는 환자들에 적합하다. 또한, 본 발명에 따른 치료 또는 예방은 유리하게는, 체중 증가가 금기되어 있는 환자들에 적합하다. 본 발명에 따르는 약제학적 조성물 뿐만 아니라 방법은 단지 두개의 병용 파트너를 사용하는 상응하는 단일요법 또는 요법과 비교하여 보다 다수의 환자 및 장시간 치료학적 처치의 경우 HbA1c 값을 목적하는 표적 범위로, 예를 들어, 7% 미만, 바람직하게는 6.5% 미만으로 감소시킨다.
본 발명에 따른 약제학적 조성물, 특히 당해 SGLT2 억제제는 혈당 조절, 특히 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈(HbA1c) 감소의 관점에서 매우 양호한 효능을 나타낸다. 본 발명에 따른 약제학적 조성물을 투여함으로써, 바람직하게는 0.5% 이상, 훨씬 더 바람직하게는 1.0% 이상의 HbA1c 감소를 달성할 수 있고, 상기 감소는 특히 1.0% 내지 2.0% 범위 내이다.
추가로, 본 발명에 따르는 방법 및/또는 용도는 다음 상태들 중의 하나, 둘 또는 그 이상을 나타내는 환자들에서 유리하게 적용될 수 있다:
(a) 110㎎/㎗ 초과, 특히 125㎎/㎗ 초과의 공복 혈당 또는 혈청 당 농도;
(b) 140㎎/㎗ 이상의 식후 혈장 당;
(c) 6.5% 이상, 특히 7.0% 이상, 특히 7.5% 이상, 더욱 특히 8.0% 이상의 HbA1c 값.
본 발명은 또한 2형 당뇨병을 갖거나 당뇨병 전기의 초기 징후를 나타내는 환자에서 혈당 조절을 개선시키기 위한 약제학적 조성물의 용도를 기재한다. 따라서, 본 발명은 또한 당뇨병 예방을 포함한다. 따라서, 상기한 당뇨병 전기의 징후들 중의 하나가 나타나자 마자 혈당 조절 개선을 위해 본 발명에 따르는 약제학적 조성물을 사용하는 경우, 명백한 2형 진성 당뇨병의 발병이 지연되거나 예방될 수 있다.
추가로, 본 발명에 따르는 약제학적 조성물은 인슐린 의존성을 갖는 환자, 즉 인슐린 또는 인슐린 유도체 또는 인슐린 대체물 또는 인슐린 또는 이의 유도체 또는 대체물을 포함하는 제형으로 치료되거나 또는 그렇지 않으면 이들로 치료될 것이거나 이들로의 치료가 필요한 환자의 치료에 특히 적합하다. 상기 환자로는 2형 당뇨병 환자 및 1형 당뇨병 환자가 포함된다.
따라서, 본 발명의 바람직한 양태에 따르면, 상기 및 하기 정의된 바와 같은 SGLT2 억제제를 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 혈당 조절을 개선하고/하거나 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c를 감소시키는 방법이 제공되고, 상기 환자는 내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성, 대사 증후군 및/또는 2형 또는 1형 진성 당뇨병을 진단받았다.
본 발명의 또다른 바람직한 양태에 따르면, 2형 진성 당뇨병 환자, 특히 성인 환자에서 식이와 운동에 대한 보조제로서 혈당 조절을 개선하는 방법이 제공된다.
따라서, 본 발명에 따르는 방법 및/또는 용도는 다음 상태들 중의 하나, 둘 또는 그 이상을 나타내는 환자들에서 유리하게 적용될 수 있다:
(a) 식이와 운동만으로는 불충분한 혈당 조절,
(b) 메트포르민 경구 단일요법에도 불구하고, 특히 최대 허용된 용량의 메트포르민 경구 단일요법에도 불구하고 불충분한 혈당 조절,
(c) 또다른 항당뇨병 약제로의 경구 단일요법에도 불구하고, 특히 최대 허용된 용량의 기타 항당뇨병 약제로의 경구 단일요법에도 불구하고 불충분한 혈당 조절.
본 발명에 따르는 SGLT2 억제제의 투여에 의한 혈당 수준 감소는 인슐린에 의존하지 않는다. 따라서, 본 발명에 따르는 약제학적 조성물은 다음 상태들 중의 하나 이상을 진단받은 환자들을 치료하는데 특히 적합하다:
- 인슐린 저항성,
- 고인슐린혈증,
- 당뇨병 전기,
- 특히 후기 단계 2형 진성 당뇨병을 갖는 2형 진성 당뇨병,
- 1형 진성 당뇨병.
추가로, 본 발명에 따르는 약제학적 조성물은 다음 상태들 중의 하나 이상을 진단받은 환자들을 치료하는데 특히 적합하다:
(a) 비만(I종, II종 및/또는 III종 비만 포함), 내장 비만 및/또는 복부 비만,
(b) 트리글리세라이드 혈중 수준 ≥ 150㎎/㎗,
(c) HDL-콜레스테롤 혈중 수준: 여성 환자의 경우 < 40㎎/㎗ 및 남성 환자의 경우 < 50㎎/㎗,
(d) 수축기 혈압 ≥ 130mmHg 및 확장기 혈압 ≥ 85mmHg,
(e) 공복 혈당 수준 ≥ 110㎎/㎗.
내당능 장애(IGT), 공복 혈당 장애(IFG), 인슐린 저항성 및/또는 대사 증후군을 진단받은 환자는 심혈관 질환, 예를 들면, 심근 경색증, 관상동맥 심장 질환, 심부전, 혈전색전성 사건의 발병 위험이 증가되는 것 때문에 고통받는 것으로 사료된다. 본 발명에 따른 혈당 조절은 심혈관 위험의 감소를 유도할 수 있다.
본 발명에 따르는 약제학적 조성물은 양호한 안전성 프로파일을 나타낸다. 따라서, 본 발명에 따르는 치료 또는 예방은 또다른 항당뇨병 약물, 예를 들면, 메트포르민을 사용한 단일요법이 금기되는 환자 및/또는 치료학적 용량에서 이러한 약물에 대해 불내성을 갖는 환자에서 유리하게 적용될 수 있다. 특히, 본 발명에 따르는 치료 또는 예방은 신부전 또는 신장 질환, 심장 질환, 심부전, 간 질환, 폐 질환, 이화 상태(catabolytic states) 및/또는 락트산염 산증 위험의 장애들 중의 하나 이상에 대한 위험 증가를 나타내거나 위험 증가를 갖는 환자, 또는 임신 중이거나 수유 중인 여성 환자에 유리하게 적용될 수 있다.
추가로, 본 발명에 따른 약제학적 조성물의 투여는 저혈당증 위험을 전혀 나타내지 않거나 낮게 나타낸다는 것을 발견할 수 있다. 따라서, 본 발명에 따른 치료 또는 예방은 저혈당증 위험 증가를 나타내거나 위험 증가를 갖는 환자에서도 유리하게 적용될 수 있다.
본 발명에 따르는 약제학적 조성물은 상기 및 하기 기술된 질환 및/또는 상태의 장기간의 치료 또는 예방, 특히 2형 진성 당뇨병 환자의 장기간 혈당 조절에 특히 적합하다.
상기 및 하기 사용된 용어 "장기간"은 12주 초과, 바람직하게는 25주 초과, 더욱 바람직하게 1년 초과의 기간 내의 환자의 치료 또는 투여를 나타낸다.
따라서, 본 발명의 특히 바람직한 양태는 2형 진성 당뇨병 환자, 특히 후기 단계 2형 당뇨병 환자, 특히 과체중, 비만(I종, II종 및/또는 III종 비만 포함), 내장 비만 및/또는 복부 비만을 추가적으로 진단받은 환자에서의 혈당 조절 개선, 특히 장기간의 혈당 조절 개선을 위한 요법, 바람직하게는 경구 요법을 위한 방법을 제공한다.
환자에게 투여되는 본 발명에 따르는 약제학적 조성물의 양 및 본 발명에 따른 치료 또는 예방에 사용하기 위해 필요한 양은 투여 경로, 치료 또는 예방이 필요한 상태의 성질 및 중증도, 환자의 연령, 체중 및 상태 및 동시 사용되는 약제에 따라 달라지며, 궁극적으로는 주치의의 재량에 따르는 것으로 이해된다. 그러나, 일반적으로 본 발명에 따른 SGLT2 억제제 및 파트너 약물은 이들의 투여에 의해 치료되는 환자의 혈당 조절이 개선되기에 충분한 양으로 약제학적 조성물 또는 용량형에 포함된다.
이하, 본 발명에 따른 약제학적 조성물 및 방법 및 용도에 사용되는 SGLT2 억제제 및 파트너 약물의 양의 바람직한 범위를 기술한다. 상기 범위는 성인 환자, 특히 사람, 예를 들면, 체중 약 70㎏의 사람에 대해 1일 투여되는 양을 말하며, 1일 2회, 3회, 4회 또는 그 이상의 투여에 대해 및 기타 투여 경로 및 환자의 연령과 관련하여 상응하게 조정될 수 있다.
본 발명의 범위 내에서, 약제학적 조성물은 바람직하게는 경구 투여된다. 기타의 용량형도 가능하며, 이하 기술된다. 바람직하게는, SGLT2 억제제 및 파트너 약물을 포함하는 하나 이상의 용량형은 경구용이거나 또는 통상적으로 익히 공지되어 있다.
개별 또는 다중 용량형으로서, 바람직하게는 부품의 키트(kit of parts)로서 존재하는 약제학적 조성물은 환자 개개의 치료학적 요구에 유연하게 부합하는 병용 요법에 유용하다.
제1 양태에 따르면, 바람직한 부품의 키트는 SGLT2 억제제 및 파트너 약물 및 적어도 하나의 약제학적으로 허용되는 담체를 포함하는 용량형을 함유하는 용기를 포함한다.
본 발명의 추가의 측면은, 본 발명에 따르는 개별 용량형으로서 존재하는 약제학적 조성물 및 상기 개별 용량형의 병용 또는 교대 투여에 대한 지침서를 포함하는 라벨 또는 패키지 삽입물을 포함하는 제품(manufacture)이다.
제1 양태에 따르면, 제품은 (a) 본 발명에 따르는 약제학적 조성물 및 (b) 약물 투여 지침서를 포함하는 라벨 또는 패키지 삽입물을 포함한다.
본 발명에 따르는 약제학적 조성물의 목적하는 용량은 편리하게는 1일 1회 제공될 수 있거나, 예를 들어 1일 2회, 3회 또는 그 이상의 용량으로서 적절한 간격으로 투여되는 분할 용량으로 제공될 수 있다.
약제학적 조성물은 액체 또는 고체 형태로 또는 흡입 또는 통기에 의한 투여에 적합한 형태로 경구, 직장, 비강, 국소(구강 및 설하 포함), 경피, 질내 또는 비경구(근육내, 피하 및 정맥내 포함) 투여용으로 제형화될 수 있다. 경구 투여가 바람직하다. 제형은, 적절한 경우, 편리하게는 구별된 용량 단위로 제공될 수 있고, 약제 기술 분야에 익히 공지된 방법들 중의 어느 하나로 제조될 수 있다. 모든 방법들은 활성 성분을 액체 담체 또는 미분된 고체 담체 또는 이들 둘 다와 같은 하나 이상의 약제학적으로 허용되는 담체와 회합한 후, 필요한 경우, 생성물을 목적하는 제형으로 성형하는 단계를 포함한다.
약제학적 조성물은 정제, 과립, 미세 과립, 분말, 캡슐제, 캐플릿, 연질 캡슐제, 환제, 경구 용액, 시럽, 건조 시럽, 저작성 정제, 트로키, 발포성 정제, 점적제, 현탁제, 속붕해성 정제, 경구용 속분산성 정제 등의 형태로 제형화될 수 있다.
약제학적 조성물 및 용량형은 바람직하게는 제형의 기타 성분들과 상용성이고 이의 수용자에 유해하지 않다는 의미에서 "허용가능한" 하나 이상의 약제학적으로 허용되는 담체를 포함한다. 약제학적으로 허용되는 담체의 예는 당해 기술 분야의 숙련가에게 공지되어 있다.
경구 투여에 적합한 약제학적 조성물은 편리하게는 각각 소정량의 활성 성분을 함유하는, 연질 젤라틴 캡슐제를 포함하는 캡슐제, 사셰 또는 정제와 같은 분리된 단위로서; 분말 또는 과립으로서; 용액, 현탁액 또는 에멀젼으로서, 예를 들면, 시럽, 엘릭시르 또는 자가-유화 전달 시스템(SEDDS; self-emulsifying delivery systems)으로서 제공될 수 있다. 활성 성분은 또한 볼러스(bolus), 연약 또는 페이스트로서 제공될 수도 있다. 경구 투여용 정제 및 캡슐제는 결합제, 충전제, 윤활제, 붕해제 또는 습윤제와 같은 통상적 부형제를 함유할 수 있다. 정제는 당해 기술 분야에 익히 공지된 방법들에 따라 피복될 수 있다. 경구 액체 제제는, 예를 들면, 수성 또는 유성 현탁제, 용액, 에멀젼, 시럽 또는 엘릭시르의 형태로 존재할 수 있거나, 사용전 물 또는 기타 적합한 비히클과 함께 구성하기 위한 건조 생성물로서 제공될 수 있다. 이러한 액체 제제는 현탁화제, 유화제, 비수성 비히클(식용 오일을 포함할 수 있다) 또는 방부제와 같은 통상의 첨가제를 함유할 수 있다.
본 발명에 따르는 약제학적 조성물은 (예를 들어, 주사, 예를 들어 볼러스 주사 또는 연속 주입에 의한) 비경구 투여용으로 제형화될 수 있고, 앰풀, 예비충전식 시린지, 소용적 주입의 단위 용량형으로 또는 방부제가 첨가된 다중 용량 용기에 제공될 수 있다. 조성물은 유성 또는 수성 비히클 중의 현탁액, 용액 또는 에멀젼의 형태일 수 있으며, 현탁화제, 안정화제 및/또는 분산제와 같은 제형화제를 함유할 수 있다. 대안적으로, 활성 성분은 사용 전 적합한 비히클, 예를 들면, 멸균 발열원 비함유 물(pyrogen-free water)과 함께 구성하기 위한, 멸균 고체의 무균 단리에 의해 또는 용액으로부터의 동결건조에 의해 수득되는 분말 형태로 존재할 수 있다.
담체가 고체인 직장 투여에 적합한 약제학적 조성물은 가장 바람직하게는 단위 용량 좌약으로서 제공된다. 적합한 담체로는 코코아 버터 및 당해 기술 분야에서 통상적으로 사용되는 기타 물질이 포함되고, 좌약은 편리하게는 활성 화합물(들)을 연질 또는 용융 담체(들)와 혼합한 후 금형 내에서 냉각 및 성형하여 형성할 수 있다.
본 발명에 따르는 약제학적 조성물 및 방법은 상기한 바와 같은 질환 및 상태의 치료 및 예방에 있어서 유리한 효과를 나타낸다. 예를 들면, 효능, 용량 강도, 용량 빈도수, 약력학적 특성, 약동학적 특성, 낮은 부작용, 편리성 및 순응도 등에 대하여 유리한 효과가 나타날 수 있다.
본 발명에 따른 SGLT2 억제제 및 이의 프로드럭의 제조방법은 당해 기술 분야의 숙련가에게 공지되어 있다. 유리하게는, 본 발명에 따르는 화합물은 앞서 인용된 바와 같은 특허 출원들을 비롯한 문헌에 기술된 바와 같은 합성 방법들을 사용하여 제조될 수 있다. 바람직한 제조방법은 WO 제2006/120208호 및 WO 제2007/031548호에 기술되어 있다. 화학식 I.9의 화합물에 관하여, 유리한 결정 형태는 전문이 본원에 인용된 국제 특허 출원 WO 제2006/117359호에 기술되어 있다.
활성 성분들은 약제학적으로 허용되는 염의 형태로 존재할 수 있다. 약제학적으로 허용되는 염으로는, 이에 제한되는 것은 아니지만, 염산, 황산 및 인산과 같은 무기산의 염; 옥살산, 아세트산, 시트르산, 말산, 벤조산, 말레산, 푸마르산, 타르타르산, 석신산 및 글루탐산과 같은 유기 카복실산의 염 및 메탄설폰산 및 p-톨루엔설폰산과 같은 유기 설폰산의 염이 포함된다. 염은 화합물과 산을 용매 및 분해제 중에서 적합한 양 및 비율로 배합하여 형성할 수 있다. 이들은 또한 다른 염의 형태로부터 양이온 또는 음이온 교환에 의해 수득될 수도 있다.
활성 성분 또는 약제학적으로 허용되는 이의 염은 수화물 또는 알콜 부가물과 같은 용매화물 형태로 존재할 수 있다.
본 발명의 범위 내에서 앞서 언급된 모든 약제학적 조성물 및 방법은 당해 기술 분야에 공지된 동물 모델에 의해 시험될 수 있다. 이하, 본 발명에 따르는 약제학적 조성물 및 방법의 약리학적으로 관련된 특성들을 평가하는데 적합한 생체내 실험들을 기술한다.
본 발명에 따르는 약제학적 조성물 및 방법은 db/db 마우스, ob/ob 마우스, 주커(Zucker) 비만(fa/fa) 래트 또는 주커 당뇨병 비만(ZDF) 래트와 같은 유전학적 과인슐린 또는 당뇨병 동물에서 시험될 수 있다. 또한, 이들은 스트렙토조토신으로 예비처리된 한위스타(HanWistar) 또는 스프라그 돌리 래트(Sprague Dawley rat)와 같은 실험적으로 유도된 당뇨병을 갖는 동물에서 시험될 수 있다.
본 발명에 따른 혈당 조절에 대한 효과는 상술된 동물 모델에서의 경구 내당 시험에서 단일 투여한 후 시험될 수 있다. 밤새 절식한 동물의 경구 당 도전(challenge) 후 혈당의 시간 과정을 추적한다. 본 발명에 따르는 약제학적 조성물은, 최대 당 농도의 감소 또는 당 AUC의 감소에 의해 측정된 바와 같이, 예를 들어, 또다른 단일요법에 비해 당 일탈을 현저하게 개선시킨다. 또한, 상기한 동물 모델에게 다중 투약한 후, 혈당 조절에 대한 효과는 혈중 HbA1c 값을 측정하여 결정할 수 있다. 본 발명에 따르는 약제학적 조성물은, 예를 들어, 또다른 단일요법에 비해 또는 이중-병용요법에 비해 HbA1c를 현저히 감소시킨다.
본 발명에 따르는 치료의 개선된 인슐린 비의존성은 상기한 동물 모델에서의 경구 내당 시험에서 단일 투약 후 입증될 수 있다. 밤새 절식한 동물에서 당 도전 후 혈장 인슐린의 시간 과정을 추적한다.
단일 또는 다중 투약 후 본 발명에 따르는 치료에 의한 활성 GLP-1 수준의 증가는 상기한 동물 모델에서 공복 또는 식후 상태에서의 혈장 중의 이들의 수준을 측정함으로써 결정할 수 있다. 마찬가지로, 혈장 중의 글루카곤 수준의 감소를 동일 조건하에 측정할 수 있다.
베타-세포 재생 및 신생에 대한 본 발명에 따르는 SGLT2 억제제 및 파트너 약물의 효과는, 상기한 동물 모델에서 다중 투약 후, 췌장 인슐린 함량의 증가를 측정함으로써, 또는 췌장 절편의 면역조직화학적 염색 후 형태계측학적 분석에 의해 베타-세포 질량의 증가를 측정함으로써, 또는 단리된 췌장 섬세포 내의 당-자극된 인슐린 분비의 증가를 측정함으로써 결정될 수 있다.
본 발명은 본원에 기술된 특정 양태로 범위가 제한되지 않아야 한다. 본원에 기술된 것 이외에, 본 발명의 다양한 변형이 본 명세서로부터 당해 기술 분야의 숙련가에게 자명해질 수 있다. 이러한 변형은 첨부되는 특허청구범위의 범위에 속하는 것으로 의도된다.
본원에 인용된 모든 특허 출원은 전문이 참조로서 인용된다.
본 발명의 추가의 양태, 특색 및 이점은 하기 실시예로부터 자명해질 수 있다. 다음 실시예는, 예로써 본 발명의 원리를 제한하지 않고 예시한다.
실시예
1. 단층 정제
본 발명의 SGLT-2 억제제(화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC의 단층 정제(필름-피복 정제)의 조성물의 예는 표 1.1 내지 1.11에 제시된다.
표 1.1: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.2: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.3: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.4: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.5: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.6: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.7: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.8: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.9: MCC를 갖는 SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.10: MCC를 갖는 SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
표 1.11: SGLT-2 억제제 + 메트포르민 HCl FDC 단층 정제의 조성물의 예
SGLT-2 억제제의 광범위한 용량 범위, 예를 들어, 1.25, 5 또는 12.5mg이 사용될 수 있고, 이러한 경우, 결합제 옥수수 전분 또는 미세결정성 셀룰로스의 양은 조정된다. 옥수수 전분 대신, 미세결정성 셀룰로스가 사용될 수 있다. 제조 절차의 추가 설명에서는 옥수수 전분만이 기술된다.
제조 절차(단층 정제):
본 발명의 SGLT-2 억제제(예를 들면, 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC 단층 정제는 유동층 과립화 공정 및 회전 압축기를 사용하는 통상의 정제화 공정에 의해 제조된다. 메트포르민 HCl 및 옥수수 전분, SGLT-2 억제제를 분말로서 첨가하고, 예비혼합한 후, 코폴리비돈(콜리돈 VA64) 및 정제수로 이루어진 "과립화 액체"의 분무에 의해 유동층 과립화를 수행하거나, "과립화 액체"에 직접 분산시킨다. 대안적으로, SGLT-2 억제제를 메트포르민-HCl 및 옥수수 전분과 함께 분말로서 유동층 과립화기에 첨가한다. 유동층 과립화 종료 후, 과립화물을 적합한 스크린으로 체질하였다. 체질된 과립화물을 콜로이드성 무수 실리카(에어로실 200) 및 윤활제로서 마그네슘 스테아레이트와 블렌딩한다. 최종 혼합물을 통상의 회전 정제 압축기를 사용하여 정제로 압축시킨다.
정제 코어는, 필름 형성제로서 하이프로멜로스, 가소제로서 프로필렌 글리콜, 활주제로서 탈크 및 안료 블랙, 레드, 옐로우 산화철 및 레드/옐로우/블랙의 혼합물 및 이산화티탄을 함유하는 수성 필름-피복 현탁액으로 필름-피복시킬 수 있다.
단층 정제의 바람직한 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl 및 옥수수 전분을 분배 전에 메쉬 크기 0.5 내지 1mm의 스크린을 사용하여 체질한다.
b) 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9) 및 최종적으로 코폴리비돈을 각각 용해시키고, 주위 온도에서 프로펠러 믹서를 사용하여 정제수에 분산시켜 "과립화 액체"를 제조한다.
c) 메트포르민 HCl 및 옥수수 전분을 적합한 유동층 과립화기의 챔버 속에서 흡인시키고, 약 36℃의 생성물 표적 온도 이하로 예열한다. 예열은 선택적이다. 대안적으로, 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9) 및 메트포르민-HCl 및 옥수수 전분을 적합한 유동층 과립화기의 챔버 속으로 흡인시킨다.
d) 생성물 표적 온도에 도달한 직후, "과립화 액체"를 무수 조건하에 유동층 과립화를 위해 혼합물에 분무하여 과립화 동안 블록킹을 예방한다.
e) 분무 말기에, 생성되는 과립화물을 약 70℃ 유입구 공기 온도에서 목적하는 LOD 값(즉, 1 내지 3%, 예를 들어, 0.8 내지 2%)에 도달할 때까지 건조시켰다.
f) 과립화물을 메쉬 크기 0.5 내지 1.0mm의 스크린을 사용하여 체질한다.
g) 체질된 과립화물 및 콜로이드성 무수 실리카(에어로실 200)를 적합한 블렌더로 블렌딩한다. 에어로실 200은 사용 전에 0.8mm-스크린을 통해 체질된 과립화물 소량과 함께 예비 체질되어야 한다.
h) 마그네슘 스테아레이트를 0.8mm 체를 통해 통과시키고, 과립화물에 첨가한다. 이어서, "최종 블렌드"를 자유 낙하 블렌더 중에서 최종 블렌딩하여 제조한다.
i) "최종 블렌더"를 회전 압축기를 사용하여 정제로 압축시킨다.
j) 이산화티탄, 폴리에틸렌 글리콜 또는 프로필렌 글리콜 및 산화철(옐로우, 레드, 블랙 또는 이들의 혼합물)을 고전단 호모-믹서를 사용하여 정제수에 분산시킨다. 이어서, 하이프로멜로스 및 탈크를 첨가하고, 호모-믹서 및 프로펠러 믹서를 사용하여 주위 온도에서 분산시켜 "피복 현탁액"을 제조한다.
k) 정제 코어를 목적하는 중량 증가까지 "피복 현탁액"으로 피복시켜 "필름-피복 정제"를 제조한다. "피복 현탁액"은 사용 전에 다시 교반시켜야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다.
단층 정제의 바람직한 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl을 칭량 전에 메쉬 크기 0.5 내지 1mm의 스크린을 사용하여 체질한다.
b) 코폴리비돈을 주위 온도에서 프로펠러 믹서를 사용하여 정제수에 용해시켜 "과립화 액체"를 제조한다.
c) 이를 용기에 첨가한 다음, 유동층 과립화기에서 메트포르민 HCl 및 옥수수 전분과 블렌딩한다.
d) "과립화 액체"를 무수 조건하에 유동층 과립화를 위해 혼합물에 분무하여 과립화 동안 블록킹을 예방한다.
e) 분무 말기에, 생성되는 과립화물을 70 내지 80℃에서 목적하는 LOD 값(즉, 1 내지 3%, 예를 들어, 0.8 내지 2%)까지 건조시키고, 이때 LOD는 2% 이상이다.
f) 과립화물을 메쉬 크기 0.5 내지 1.0mm의 스크린을 사용하여 체질한다.
g) 체질된 과립화물 및 콜로이드성 무수 실리카(에어로실 200)를 적합한 블렌더로 블렌딩한다. 에어로실 200은 사용 전에 0.5mm 스크린으로 체질되어야 한다.
h) 마그네슘 스테아레이트를 0.5mm 체를 통해 통과시키고, 과립화물에 첨가한다. 이어서, "최종 블렌드"를 블렌더 중에서 최종 블렌딩하여 제조한다.
i) "최종 블렌더"를 회전 압축기를 사용하여 정제로 압축시킨다.
j) 하이프로멜로스 및 폴리에틸렌 글리콜 또는 프로필렌 글리콜을 프로펠러 믹서를 사용하여 정제수에 용해시킨다. 탈크, 이산화티탄 및 산화철(옐로우, 레드 및/또는 블랙 또는 이들의 혼합물)을 호모-믹서를 사용하여 정제수에 분산시킨다. 현탁액을 하이프로멜로스 용액에 첨가한 다음, 프로펠러 믹서를 사용하여 주위 온도에서 혼합하여 "피복 현탁액"을 제조한다.
k) 정제 코어를 목적하는 중량 증가까지 "피복 현탁액"으로 피복시켜 "필름-피복된 정제"를 제조한다. "피복 현탁액"은 사용 전에 다시 교반시켜야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다.
2. 이층 정제
본 발명의 SGLT-2 억제제(화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC의 이층 정제(필름-피복 정제)의 조성물의 예는 표 2에 제시된다.
표 2: SGLT-2 억제제 + 메트포르민 HCl 이층 정제의 조성물의 예
SGLT-2 억제제의 광범위한 용량 범위, 예를 들어, 1.25, 5 또는 12.5mg이 사용될 수 있고, 이러한 경우, 결합제 옥수수 전분 또는 미세결정성 셀룰로스의 양은 조정된다. 옥수수 전분 대신, 미세결정성 셀룰로스가 사용될 수 있다. 제조 절차의 추가 설명에서는 옥수수 전분만이 기술된다.
제조 절차(이층 정제):
본 발명의 SGLT-2 억제제(예를 들면, 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC 이층 정제는 고전단 습식 과립화 공정(SGLT-2 억제제-과립화물의 경우), 유동층 과립화 공정(메트포르민 HCl-과립화물의 경우) 및 다층 회전 압축기를 사용하는 이층 정제화 공정에 의해 제조된다.
SGLT-2 억제제-과립화물 : 고전단 과립화기를 사용함에 의한, 활성 SGLT-2 억제제.
전체 제조 공정은 다음 단계로 이루어진다:
1) 하이드록시프로필 셀룰로스(HPC)를 체질한다.
2) 과립내 미세결정성 셀룰로스 분획, SGLT-2 억제제, 락토스, HPC 및 크로스카멜로스 나트륨을 과립화기에 첨가한다.
3) 물과 함께 상기 블렌드를 과립화한다.
4) 과립화물을 유동층 건조기에서 건조시킨다: 1.5% 미만 LOD
5) 블렌더 용기 속에서 과립을 밀링한다.
? 쿼드로 밀(Quadro mill)
? 쿼드로 밀 스크린- 18메쉬
6) 텀블 블렌더의 용기 중 밀링된 과립 상에서 다음을 체질한다.
? 콜로이드성 이산화규소와 20 내지 25메쉬를 통해 체질된 과립외 미세결정성 셀룰로스 분획을 갖는 예비혼합물
? 과립외 미세결정성 셀룰로스의 나머지 및 블렌드
7) 마그네슘 스테아레이트와 블렌딩된 과립화물의 일부를 예비혼합하고, 블렌더 중에서 나머지 과립화물에 대해 체질한다(18메쉬).
후속적으로, "최종 블렌드 A"는 적합한 블렌더에서 최종 블렌딩으로 제조한다.
메트포르민 HCl-과립화물 : 메트포르민 HCl 및 옥수수 전분, 유동층 과립화를 코폴리비돈(콜리돈 VA64) 및 정제수로 이루어진 "과립화 액체"를 분무하여 수행한다. 대안적으로, SGLT-2 억제제를 메트포르민-HCl 및 옥수수 전분과 함께 유동층 과립화기에 분말로서 첨가한다. 유동층 과립화 종결 후, 과립화물을 적합한 스크린으로 체질한다. 체질된 과립화물을 콜로이드성 무수 실리카(에어로실 200) 및 윤활제로서 마그네슘 스테아레이트와 블렌딩한다.
메트포르민 HCl-과립화물의 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl을 칭량하기 전에 메쉬 크기 0.5 내지 1mm의 스크린을 사용하여 체질한다.
b) 코폴리비돈을 프로펠러 믹서를 사용하여 주위 온도에서 정제수에 용해시켜 "과립화 액체"를 제조한다.
c) "과립화 액체"를 무수 조건하에 유동층 과립화를 위해 혼합물에 분무하여 과립화 동안 블록킹을 예방한다.
d) 분무 말기에, 생성되는 과립화물을 목적하는 LOD 값(즉, 0.8 내지 2%, 예를 들어, 1 내지 2%)까지 70 내지 80℃에서 건조시키고, 이러한 경우, LOD는 2% 이상이다.
e) 과립화물은 메쉬 크기 0.5 내지 1.0mm의 스크린으로 체질한다.
f) 체질된 과립화물 및 콜로이드성 무수 실리카(에어로실 200)를 적합한 블렌더로 블렌딩한다. 에어로실 200은 사용 전에 0.5mm 스크린으로 체질되어야 한다.
g) 마그네슘 스테아레이트를 0.5mm 체를 통해 통과시키고, 과립화물에 첨가한다. 후속적으로, "최종 블렌드 B"를 블렌더에서 최종 블렌딩하여 제조한다.
"최종 블렌드 A" 및 "최종 블렌드 B"를 다층 회전 압축기를 사용하여 이층 정제로 압축시킨다. 정제 코어를, 필름 형성제로서 하이프로멜로스, 가소제로서 폴리에틸렌 글리콜 또는 프로필렌 글리콜, 활주제로서 탈크 및 안료 옐로우, 레드, 블랙 산화철 및 이들의 혼합물 및 이산화티탄을 함유하는 수성 필름-피복 현탁액으로 필름-피복할 수 있다.
필름-피복을 위한 제조 공정을 보다 구체적으로 설명하는 기술:
a) 하이프로멜로스 및 폴리에틸렌 글리콜 또는 프로필렌 글리콜을 프로펠러 믹서를 사용하여 정제수에 용해시킨다. 탈크, 이산화티탄 및 산화철(옐로우, 레드또는 옐로우와 레드)을 호모-믹서를 사용하여 정제수에 분산시킨다. 현탁액을 하이프로멜로스 용액에 첨가한 다음, 주위 온도에서 프로펠러 믹서를 사용하여 혼합하여 "피복 현탁액"을 제조한다.
b) 정제 코어를 목적하는 중량 증가까지 "피복 현탁액"으로 피복하여 "필름-피복 정제"를 제조한다. "필름 현탁액"은 사용 전에 다시 교반시켜야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다.
3. 정제내 정제 또는 불스아이 정제
본 발명의 SGLT-2 억제제(화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC의 정제내 정제 또는 불스아이 정제(필름-피복 정제)의 조성물의 예는 표 3에 제시된다.
표 3: 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X) + 메트포르민 HCl FDC의 정제내 정제 또는 불스아이 정제의 조성물의 예
SGLT-2 억제제의 광범위한 용량 범위, 예를 들어, 1.25, 5 또는 12.5mg이 사용될 수 있고, 이러한 경우, 결합제로서의 옥수수 전분 또는 미세결정성 셀룰로스의 양은 조정된다. 옥수수 전분 대신, 미세결정성 셀룰로스가 사용될 수 있다. 제조 절차의 추가 설명에서는 옥수수 전분만이 기술된다.
제조 절차(정제내 정제 또는 불스아이 정제):
본 발명의 SGLT-2 억제제(예를 들면, 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC 정제내 정제 또는 불스아이 정제는 고전단 습식 과립화 공정(SGLT-2 억제제-과립화물의 경우), 회전 압축기(SGLT-2 억제제 코어-정제의 경우), 유동층 과립화 공정(메트포르민 HCl-과립화물의 경우) 및 압축기-피복기를 사용하는 압축 피복 공정에 의해 제조된다.
SGLT-2 억제제-과립화물 : 고전단 과립화기를 사용함에 의한, 활성 SGLT-2 억제제.
전체 제조 공정은 다음 단계로 이루어진다:
1) 하이드록시프로필 셀룰로스(HPC)를 체질한다.
2) 과립내 미세결정성 셀룰로스 분획, SGLT-2 억제제, 락토스, HPC 및 크로스카멜로스 나트륨을 과립화기에 첨가한다.
3) 물과 함께 상기 블렌드를 과립화한다.
4) 과립화물을 유동층 건조기에서 건조시킨다: 1.5% 미만 LOD
5) 블렌더 용기 속에서 과립을 밀링한다.
? 스크린- 18메쉬를 갖는 쿼드로 밀
6) 텀블 블렌더의 용기 중 밀링된 과립 상에서 다음을 체질한다.
? 콜로이드성 이산화규소와 20 내지 25메쉬를 통해 체질된 과립외 미세결정성 셀룰로스 분획을 갖는 예비혼합물
? 상기 과립외 미세결정성 셀룰로스의 나머지 및 블렌드
7) 마그네슘 스테아레이트와 블렌딩된 과립의 분획을 예비혼합하고, 블렌더 중에서 나머지 과립에 대해 체질한다(18메쉬).
후속적으로, "최종 블렌드"는 자유 낙하 블렌더에서 최종 블렌딩하여 제조한다.
8) SGLT-2 억제제의 "최종 블렌드"를 회전 압축기를 사용하여 정제로 압축한다.
메트포르민 HCl-과립화물 : 메트포르민 HCl 및 옥수수 전분, 유동층 과립화를 코폴리비돈(콜리돈 VA64) 및 정제수로 이루어진 "과립화 액체"를 분무하여 수행한다. 또는, SGLT-2 억제제를 메트포르민-HCl 및 옥수수 전분과 함께 유동층 과립화기에 분말로서 첨가한다. 유동층 과립화 종결 후, 과립화물을 적합한 스크린으로 체질한다. 체질된 과립화물을 콜로이드성 무수 실리카(에어로실 200) 및 윤활제로서 마그네슘 스테아레이트와 블렌딩한다.
메트포르민 HCl-과립화물의 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl을 칭량하기 전에 메쉬 크기 0.5 내지 1mm의 스크린을 사용하여 체질한다.
b) 코폴리비돈은 프로펠러 믹서를 사용하여 주위 온도에서 정제수에 용해시켜 "과립화 액체"를 제조한다.
d) "과립화 액체"를 무수 조건하에 유동층 과립화를 위해 혼합물에 분무하여 과립화 동안 블록킹을 예방한다.
e) 분무 말기에, 생성되는 과립화물을 목적하는 LOD 값(즉, 0.8 내지 2%, 예를 들어, 1 내지 2%)까지 70 내지 80℃에서 건조시키고, 이러한 경우, LOD는 2% 이상이다.
f) 과립화물은 메쉬 크기 0.5 내지 1.0mm의 스크린으로 체질한다.
g) 체질된 과립화물 및 콜로이드성 무수 실리카(에어로실 200)를 적합한 블렌더로 블렌딩한다. 에어로실 200은 사용 전에 0.5mm 스크린으로 체질되어야 한다.
h) 마그네슘 스테아레이트를 0.5mm 체를 통해 통과시키고, 과립화물에 첨가한다. 후속적으로, "메트포르민 HCl-과립화물"(최종 블렌드)을 블렌더에서 최종 블렌딩하여 제조한다.
"SGLT-2 억제제 코어-정제" 및 "메트포르민 HCl-과립화물"을 압축기-피복기를 사용하여 정제내 정제 또는 불스아이 정제로 압축시킨다. 정제내 정제 및 불스아이 정제 사이의 차이는 코어 정제의 위치이다.
정제내 정제의 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl-과립화물의 반을 다이에 충전시킨다.
b) 화학식 I.9의 화합물 또는 화학식 I.9의 화합물의 결정 형태(I.9X)의 코어 정제를 메트포르민 HCl-과립화물의 표면에 위치시킨다.
c) 코어 정제를 메트포르민 HCl-과립화물의 또 하나의 반으로 피복시킨 다음, 정제(정제내 정제)로 압축시킨다.
불스아이 정제의 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl-과립화물을 다이에 충전시킨다.
b) 화학식 I.9의 화합물 또는 화학식 I.9의 화합물의 결정 형태(I.9X)의 코어 정제를 다이에서 메트포르민 HCl-과립화물의 표면에 위치시킨 다음, 정제(불스아이 정제)로 압축시킨다.
정제를 필름 형성제로서 하이프로멜로스, 가소제로서 폴리에틸렌 글리콜 또는 프로필렌 글리콜, 활주제로서 탈크 및 안료 옐로우, 레드, 블랙 산화철 및 이들의 혼합물 및 이산화티탄을 함유하는 수성 필름-피복 현탁액으로 필름-피복시킬 수 있다.
필름-피복을 위한 제조 공정을 보다 구체적으로 설명하는 기술:
a) 하이프로멜로스 및 폴리에틸렌 글리콜 또는 프로필렌 글리콜을 프로펠러 믹서를 사용하여 정제수에 용해시킨다. 탈크, 이산화티탄 및 산화철(옐로우, 레드, 블랙 또는 이들의 혼합물)을 호모-믹서를 사용하여 정제수에 분산시킨다. 현탁액을 하이프로멜로스 용액에 첨가한 다음, 주위 온도에서 프로펠러 믹서를 사용하여 혼합하여 "피복 현탁액"을 제조한다.
b) 정제 코어를 목적하는 중량 증가까지 "피복 현탁액"으로 피복하여 "필름-피복 정제"를 제조한다. "필름 현탁액"은 사용 전에 다시 교반시켜야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다.
4. 메트포르민 HCl 정제 상에 SGLT-2 억제제-약물 적층(약물 부하를 위한 필름-피복)
메트포르민 HCl 정제에 필름-피복에 의한 약물 부하로 제조되는 본 발명의 SGLT-2 억제제(화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC(필름-피복 정제)의 조성물의 예는 표 4에 제시된다.
표 4: 메트포르민 HCl 정제 상의 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X) + 메트포르민 HCl FDC SGLT-2 억제제 피복물의 조성물의 예
SGLT-2 억제제의 광범위한 용량 범위, 예를 들어, 1.25, 5 또는 12.5mg이 사용될 수 있고, 이러한 경우, 결합제로서의 옥수수 전분 또는 미세결정성 셀룰로스의 양은 조정된다. 옥수수 전분 대신, 미세결정성 셀룰로스가 사용될 수 있다. 제조 절차의 추가 설명에서는 옥수수 전분만이 기술된다.
제조 절차(메트포르민 HCl 정제 상에 필름-피복에 의한 SGLT-2 억제제-약물 적층):
약물 피복물을 갖는 SGLT-2 억제제(예를 들면, 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X)) + 메트포르민 HCl FDC는 유동층 과립화 공정, 통상의 정제화 공정 및 3단계(밀봉 피복, 약물 부하 및 오버-코트)를 갖는 필름-피복 공정으로 제조된다. 오버-코트는, 안정성이 허용되는 경우, 약물 부하와 합하여 생략될 수 있다.
메트포르민 HCl-과립화물 : 메트포르민 HCl 및 옥수수 전분, 유동층 과립화를 코폴리비돈(콜리돈 VA64) 및 정제수로 이루어진 "과립화 액체"를 분무하여 수행한다. 대안적으로, SGLT-2 억제제를 메트포르민-HCl 및 옥수수 전분과 함께 유동층 과립화기에 분말로서 첨가한다. 유동층 과립화 종결 후, 과립화물을 적합한 스크린으로 체질한다. 체질된 과립화물을 콜로이드성 무수 실리카(에어로실 200) 및 윤활제로서 마그네슘 스테아레이트와 블렌딩한다. 최종 블렌드를 통상의 회전 압축기를 사용하여 정제로 압축시킨다.
메트포르민 HCl-과립화물의 제조 공정을 보다 구체적으로 설명하는 기술:
a) 메트포르민 HCl을 칭량하기 전에 메쉬 크기 0.5 내지 1mm의 스크린을 사용하여 체질한다.
b) 코폴리비돈은 프로펠러 믹서를 사용하여 주위 온도에서 정제수에 용해시켜 "과립화 액체"를 제조한다.
d) "과립화 액체"를 무수 조건하에 유동층 과립화를 위해 혼합물에 분무하여 과립화 동안 블록킹을 예방한다.
e) 분무 말기에, 생성되는 과립화물을 목적하는 LOD 값(즉, 0.8 내지 2%, 예를 들어, 1 내지 2%)까지 70 내지 80℃에서 건조시키고, 이러한 경우, LOD는 2% 이상이다.
f) 과립화물은 메쉬 크기 0.5 내지 1.0mm의 스크린으로 체질한다.
g) 체질된 과립화물 및 콜로이드성 무수 실리카(에어로실 200)를 적합한 블렌더로 블렌딩한다. 에어로실 200은 사용 전에 0.5mm 스크린으로 체질되어야 한다.
h) 마그네슘 스테아레이트를 0.5mm 체를 통해 통과시키고, 과립화물에 첨가한다. 후속적으로, "최종 블렌드"를 블렌더에서 최종 블렌딩하여 제조한다.
i) "최종 블렌더"는 통상의 회전 압축기를 사용하여 정제로 압축시킨다.
필름-피복: 정제를 (1) 필름 형성제로서 하이프로멜로스, 가소제로서 폴리에틸렌 글리콜(마크로골, 특히 마크로골 400, 6000 또는 8000), 다른 가소제로서 프로필렌 글리콜, 활주제로서 탈크 및 안료 옐로우 산화철 및/또는 레드 산화철 또는 산화철 블랙과의 혼합물 및 이산화티탄을 함유하는 수성 필름-피복 현탁액에 의한 밀봉 피복, (2) 필름 형성제로서 하이프로멜로스, 가소제로서 폴리에틸렌 글리콜 또는 프로필렌 글리콜, 약물 물질로서 화학식 I.9의 화합물 또는 화학식 I.9의 화합물의 결정 형태(I.9X)를 함유하는 수성 필름-피복 현탁액에 의한 약물-부하 및 (3) 필름 형성제로서 하이프로멜로스, 가소제로서 폴리에틸렌 글리콜 또는 프로필렌 글리콜, 활주제로서 탈크 및 안료 옐로우 산화철 및/또는 레드 및/또는 블랙 산화철 및 이산화티탄을 함유하는 수성 필름-피복 현탁액에 의한 오버-코트로 필름-피복된다.
피복기에 의한 필름-피복을 위한 제조 공정을 보다 구체적으로 설명하는 기술:
a) 하이프로멜로스 및 폴리에틸렌 글리콜 또는 프로필렌 글리콜을 프로펠러 믹서를 사용하여 정제수에 용해시킨다. 탈크, 이산화티탄 및 산화철(옐로우, 레드, 블랙 또는 옐로우 및 레드 및 블랙 및 이들의 혼합물)을 호모-믹서를 사용하여 정제수에 분산시킨다. 현탁액을 하이프로멜로스 용액에 첨가한 다음, 프로펠러 믹서를 사용하여 주위 온도에서 혼합하여 "밀봉 피복" 및 "오버-코트"를 위한 "피복 현탁액"을 제조한다.
b)하이프로멜로스, 폴리에틸렌 글리콜 또는 프로필렌 글리콜을 프로펠러 믹서를 사용하여 정제수에 용해시킨다. 화학식 I.9의 화합물 또는 화학식 I.9의 화합물의 결정 형태(I.9X)(활성 약물)를 하이프로멜로스 용액에 첨가한 다음, 프로펠러 믹서를 사용하여 주위 온도에서 분산시켜 "약물 부하"용 "약물 현탁액"을 제조한다.
c) 메트포르민 HCl 정제를 목적하는 중량 증가까지 "피복 현탁액"으로 피복시켜 "밀봉 피복물"을 형성한다. "피복 현탁액"은 사용 전에 다시 교반시켜야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다.
d) 밀봉-피복 후, "약물 현탁액"을 메트포르민 HCl 정제의 표면에 적용하여 "약물 층"을 형성한다(약물 부하). "약물 현탁액"은 사용 전에 다시 교반해야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다. 피복 종점은 이용가능한 PAT(Process Analysis Technology)로 측정할 수 있다.
e) 약물 부하 후, "피복 현탁액"을 화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X) 약물 부하 정제에 적용하여 "오버-코트"를 형성하고 "필름-피복 정제"를 제조한다. "피복 현탁액"은 사용 전에 다시 교반시켜야 하고, 피복 (분무) 공정 동안 서서히 교반을 유지시켜야 한다.
생성물 설명:
화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X) + 메트포르민 HCl FDC 단층 정제(정제 코어 및 필름-피복 정제)의 생성물 기술은 각각 표 8 및 9에 제시된다.
표 8a
표 8b
표 9a
표 9b
안정성 데이터:
화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X) + 메트포르민 HCl FDC 단층 정제(표 1.1 및 1.7)의 안정성 데이터는 하기 표에 제시된다.
안정성 데이터:
화학식 I.9의 화합물, 또는 화학식 I.9의 화합물의 결정 형태(I.9X) + 메트포르민 HCl FDC 단층 정제(표 1.9 및 1.10)의 안정성 데이터는 하기 표에 제시된다.
Claims (38)
- SGLT-2 억제제, 파트너 약물 및 하나 이상의 약제학적 부형제를 포함하는 약제학적 조성물.
- 제1항에 있어서, 상기 파트너 약물이 메트포르민, 예를 들어, 메트포르민 하이드로클로라이드를 포함하는 비구아나이드로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제1항 또는 제2항에 있어서, 상기 SGLT-2 억제제가 약 0.5mg 내지 약 50mg, 특히 약 1mg 내지 약 25mg의 용량 범위로 존재하는, 약제학적 조성물.
- 제3항에 있어서, 상기 SGLT-2 억제제가 0.5, 1, 1.25, 2.5, 5, 10 또는 12.5mg의 용량 강도로 존재하는, 약제학적 조성물.
- 제3항에 있어서, 상기 SGLT-2 억제제가 5mg 또는 12.5mg의 용량 강도로 존재하는, 약제학적 조성물.
- 제1항 내지 제5항 중의 어느 한 항에 있어서, 상기 파트너 약물이 메트포르민 하이드로클로라이드인, 약제학적 조성물.
- 제6항에 있어서, 메트포르민 하이드로클로라이드가 약 100mg 내지 약 1500mg의 용량 범위로 존재하는, 약제학적 조성물.
- 제7항에 있어서, 메트포르민 하이드로클로라이드가 500mg, 850mg 또는 1000mg의 용량 강도로 존재하는, 약제학적 조성물.
- 제1항 내지 제8항 중의 어느 한 항에 있어서, 상기 부형제가 미세결정성 셀룰로스(MCC)를 포함하는 하나 이상의 충전제; D-만니톨, 옥수수 전분 및 예비젤라틴화 전분; 코포비돈을 포함하는 결합제; 마그네슘 스테아레이트 또는 나트륨 스테아릴 푸마레이트를 포함하는 윤활제; 및 콜로이드성 무수 실리카를 포함하는 활주제로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제1항 내지 제9항 중의 어느 한 항에 있어서, 결합제로서 코포비돈을 포함하는, 약제학적 조성물.
- 제10항에 있어서, 충전제로서의 옥수수 전분, 윤활제로서의 마그네슘 스테아레이트 또는 나트륨 스테아릴 푸마레이트 및 활주제로서의 콜로이드성 무수 실리카 중의 하나 이상을 추가로 포함하는, 약제학적 조성물.
- 제10항에 있어서, 충전제로서의 미세결정성 셀룰로스, 윤활제로서의 마그네슘 스테아레이트 또는 나트륨 스테아릴 푸마레이트 및 활주제로서의 콜로이드성 무수 실리카 중의 하나 이상을 추가로 포함하는, 약제학적 조성물.
- 제10항에 있어서, 충전제로서의 미세결정성 셀룰로스, 윤활제로서의 나트륨 스테아릴 푸마레이트 및 활주제로서의 콜로이드성 무수 실리카 중의 하나 이상을 추가로 포함하는, 약제학적 조성물.
- 제1항 내지 제13항 중의 어느 한 항에 있어서, 정제 용량형인, 약제학적 조성물.
- 제14항에 있어서, 상기 정제가 단층 정제, 이층 정제, 압축 피복 정제(정제내 정제(tablet-in-tablet) 및 불스아이 정제(bull's eye tablet) 포함), 및 약물 부하를 위해 필름-피복된 정제로부터 선택되는, 약제학적 조성물.
- 제14항 또는 제15항에 있어서, 상기 정제가 필름-코트(film-coat)를 포함하는, 약제학적 조성물.
- 제16항에 있어서, 상기 필름-코트가 필름-피복제, 예를 들어, 하이프로멜로스; 가소제, 예를 들어, 프로필렌 글리콜 또는 폴리에틸렌 글리콜; 임의로 활주제, 예를 들어, 탈크, 및 임의로 하나 이상의 안료, 예를 들어, 이산화티탄, 산화철 레드 및/또는 산화철 옐로우 및/또는 산화철 블랙 및 이들의 혼합물을 포함하는, 약제학적 조성물.
- 제1항 내지 제17항 중의 어느 한 항에 있어서, 상기 약제학적 조성물이 단층 정제이고,
다음 중의 하나 이상을 적용할 수 있는, 약제학적 조성물:
- 메트포르민 하이드로클로라이드의 백분율은 전체 정제 코어의 약 84중량%이고,
- SGLT-2 억제제의 백분율은 전체 정제 코어의 약 0.1% 내지 2.5중량%이고,
- 정제 파쇄 강도는 100N 이상이고,
- 정제 취성은 0.5% 이하이고,
- 정제 코어 중량은 약 550 내지 약 1180mg이고,
- 정제 붕해 시간은 15분 이하이다. - 제14항 내지 제18항 중의 어느 한 항에 있어서, 용해 시험에서 45분 후, 각각의 SGLT-2 억제제 및 파트너 약물이 75중량% 이상 용해됨을 특징으로 하는 즉시 방출 용량형인, 약제학적 조성물.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물을 포함하는 약제학적 용량형.
- 제20항에 있어서, 고체 약제학적 용량형 캡슐제 또는 정제임을 특징으로 하는, 약제학적 용량형.
- 제20항 또는 제21항에 있어서, 상기 SGLT-2 억제제를 약 0.5mg 내지 약 50mg, 특히 약 1mg 내지 약 25mg의 양으로 포함하는, 약제학적 용량형.
- 제20항, 제21항 또는 제22항 중의 어느 한 항에 있어서, 메트포르민 하이드로클로라이드를 약 100mg 내지 약 1500mg의 양으로 포함하는, 약제학적 용량형.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애, 공복 혈당 장애, 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애의 예방, 진행의 서행, 지연 또는 치료를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애, 공복 혈당 장애, 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애를 예방하거나, 진행을 서행시키거나, 지연시키거나, 치료하는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 혈당 조절을 개선하고/하거나 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c을 감소시키는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 내당능 장애, 공복 혈당 장애, 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행의 예방, 서행, 지연 또는 역전을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 내당능 장애, 공복 혈당 장애, 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행을 예방하거나, 서행시키거나, 지연시키거나, 역전시키는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 백내장 및 미세혈관 및 대혈관 질환, 예를 들어 신장병증, 망막병증, 신경병증, 조직 허혈, 당뇨발, 아테롬성동맥경화증, 심근 경색증, 급성 관상동맥 증후군, 불안정성 협심증, 안정성 협심증, 뇌졸중, 말초 동맥 폐쇄성 질환, 심근병증, 심부전, 심장 박동 장애 및 혈관 재협착과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애의 예방, 진행의 서행, 지연 또는 치료를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 백내장 및 미세혈관 및 대혈관 질환, 예를 들어 신장병증, 망막병증, 신경병증, 조직 허혈, 당뇨발, 아테롬성동맥경화증, 심근 경색증, 급성 관상동맥 증후군, 불안정성 협심증, 안정성 협심증, 뇌졸중, 말초 동맥 폐쇄성 질환, 심근병증, 심부전, 심장 박동 장애 및 혈관 재협착과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애를 예방하거나, 진행을 서행시키거나, 지연시키거나, 치료하는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 체중의 감소, 체중 증가의 예방 또는 체중 감소의 촉진을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 체중을 감소시키거나, 체중 증가를 예방하거나, 체중 감소를 촉진시키는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 췌장 베타 세포의 변성 및/또는 췌장 베타 세포 기능성 저하의 예방, 서행, 지연 또는 치료 및/또는 췌장 베타 세포 기능성의 개선 및/또는 회복 및/또는 췌장 인슐린 분비 기능성의 회복을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 췌장 베타 세포의 변성 및/또는 췌장 베타 세포 기능성 저하를 예방하거나, 서행시키거나, 지연시키거나, 치료하고/하거나 췌장 베타 세포 기능성을 개선 및/또는 회복시키고/시키거나 췌장 인슐린 분비 기능성을 회복시키는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 간 지방의 이상 축적으로 인한 질환 또는 상태의 예방, 서행, 지연 또는 치료를 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 간 지방의 이상 축적으로 인한 질환 또는 상태를 예방하거나, 서행시키거나, 지연시키거나, 치료하는 방법.
- 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물 또는 제20항 내지 제23항 중의 어느 한 항에 따르는 약제학적 용량형을 인슐린 감수성의 유지 및/또는 개선 및/또는 고인슐린혈증 및/또는 인슐린 저항성의 치료 또는 예방을 필요로 하는 환자에게 투여함을 특징으로 하는, 상기 환자에서 인슐린 감수성을 유지 및/또는 개선시키고/시키거나 고인슐린혈증 및/또는 인슐린 저항성을 치료하거나 예방하는 방법.
- 제24항 내지 제31항 중의 어느 한 항에 따르는 방법에 사용하기 위한 약물을 제조하기 위한 SGLT2 억제제의 용도.
- 제24항 내지 제31항 중의 어느 한 항에 따르는 방법에 사용하기 위한 약물을 제조하기 위한, 메트포르민 또는 메트포르민 하이드로클로라이드를 포함하는 비구아나이드의 용도.
- - 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애, 공복 혈당 장애, 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소; 또는
- 내당능 장애, 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행의 예방, 서행, 지연 또는 역전; 또는
- 백내장 및 미세혈관 및 대혈관 질환, 예를 들어, 신장병증, 망막병증, 신경병증, 조직 허혈, 아테롬성동맥경화증, 심근 경색증, 뇌졸중, 말초 동맥 폐쇄성 질환과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 체중 감소 또는 체중 증가 예방 또는 체중 감소 촉진; 또는
- 췌장 베타 세포 변성 및/또는 췌장 베타 세포 기능성 저하의 예방, 서행, 지연 또는 치료, 및/또는 췌장 베타 세포 기능성의 개선 및/또는 회복, 및/또는 췌장 인슐린 분비 기능성의 회복; 또는
- 간 지방의 이상 축적으로 인한 질환 또는 상태의 예방, 서행, 지연 또는 치료; 또는
- 인슐린 감수성의 유지 및/또는 개선, 및/또는 고인슐린혈증 및/또는 인슐린 저항성의 치료 또는 예방을 필요로 하는 환자에서,
- 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애, 공복 혈당 장애, 고혈당증, 식후 고혈당증, 과체중, 비만 및 대사 증후군으로 이루어진 그룹으로부터 선택된 대사 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 혈당 조절의 개선 및/또는 공복 혈장 당, 식후 혈장 당 및/또는 당화 헤모글로빈 HbA1c의 감소; 또는
- 내당능 장애, 인슐린 저항성으로부터 및/또는 대사 증후군으로부터 2형 진성 당뇨병으로의 진행의 예방, 서행, 지연 또는 역전; 또는
- 백내장 및 미세혈관 및 대혈관 질환, 예를 들어, 신장병증, 망막병증, 신경병증, 조직 허혈, 아테롬성동맥경화증, 심근 경색증, 뇌졸중, 말초 동맥 폐쇄성 질환과 같은 진성 당뇨병 합병증으로 이루어진 그룹으로부터 선택된 상태 또는 장애의 예방, 진행의 서행, 지연 또는 치료; 또는
- 체중 감소 또는 체중 증가 예방 또는 체중 감소 촉진; 또는
- 췌장 베타 세포 변성 및/또는 췌장 베타 세포 기능성 저하의 예방, 서행, 지연 또는 치료, 및/또는 췌장 베타 세포 기능성의 개선 및/또는 회복, 및/또는 췌장 인슐린 분비 기능성의 회복; 또는
- 간 지방의 이상 축적으로 인한 질환 또는 상태의 예방, 서행, 지연 또는 치료; 또는
- 인슐린 감수성의 유지 및/또는 개선, 및/또는 고인슐린혈증 및/또는 인슐린 저항성의 치료 또는 예방을 위한 약제를 제조하기 위한, 제1항 내지 제19항 중의 어느 한 항에 따르는 약제학적 조성물의 용도. - 상기 환자가 과체중, 비만, 내장 비만 및 복부 비만으로 이루어진 그룹으로부터 선택된 상태 중의 하나 이상을 진단받은 개체인, 제24항 내지 제31항 중의 어느 한 항에 따르는 방법 또는 제32항 내지 제34항 중의 어느 한 항에 따르는 용도.
- 상기 환자가 다음 상태들 중의 하나, 둘 또는 그 이상을 나타내는 개체인, 제24항 내지 제31항 중의 어느 한 항에 따르는 방법 또는 제32항 내지 제34항 중의 어느 한 항에 따르는 용도:
(a) 110㎎/㎗ 초과, 특히 125㎎/㎗ 초과의 공복 혈당 또는 혈청 당 농도,
(b) 140㎎/㎗ 이상의 식후 혈장 당,
(c) 6.5% 이상, 특히 7.0% 이상의 HbA1c 값. - 상기 환자가 다음 상태들 중의 하나, 둘 또는 그 이상을 나타내는 개체인, 제24항 내지 제31항 중의 어느 한 항에 따르는 방법 또는 제32항 내지 제34항 중의 어느 한 항에 따르는 용도:
(a) 비만, 내장 비만 및/또는 복부 비만,
(b) 트리글리세라이드 혈중 수준 ≥ 150㎎/㎗,
(c) HDL-콜레스테롤 혈중 수준: 여성 환자의 경우 < 40㎎/㎗ 및 남성 환자의 경우 < 50㎎/㎗,
(d) 수축기 혈압 ≥ 130mmHg 및 확장기 혈압 ≥ 85mmHg,
(e) 공복 혈당 수준 ≥ 110㎎/㎗. - 상기 환자가 식이 및 운동에도 불구하고 또는 항당뇨병제, 특히 메트포르민을 사용하는 단일요법에도 불구하고 불충분한 혈당 조절을 갖는, 제24항 내지 제31항 중의 어느 한 항에 따르는 방법 또는 제32항 내지 제34항 중의 어느 한 항에 따르는 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP09172081 | 2009-10-02 | ||
| EP09172081.3 | 2009-10-02 | ||
| PCT/EP2010/064619 WO2011039337A1 (en) | 2009-10-02 | 2010-10-01 | Pharmaceutical composition, pharmaceutical dosage form, process for their preparation, methods for treating and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20120081596A true KR20120081596A (ko) | 2012-07-19 |
| KR101747152B1 KR101747152B1 (ko) | 2017-06-14 |
Family
ID=43384552
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127008433A KR101747152B1 (ko) | 2009-10-02 | 2010-10-01 | 약제학적 조성물, 약제학적 용량형, 이들의 제조방법, 치료방법 및 이들의 용도 |
Country Status (37)
| Country | Link |
|---|---|
| US (3) | US10610489B2 (ko) |
| EP (3) | EP3150200B1 (ko) |
| JP (1) | JP5738300B2 (ko) |
| KR (1) | KR101747152B1 (ko) |
| CN (2) | CN104873974A (ko) |
| AP (1) | AP3438A (ko) |
| AR (1) | AR078517A1 (ko) |
| AU (1) | AU2010302641B2 (ko) |
| BR (1) | BR112012009376B8 (ko) |
| CA (1) | CA2776288C (ko) |
| CL (1) | CL2012000793A1 (ko) |
| CY (1) | CY1118661T1 (ko) |
| DK (2) | DK2482806T3 (ko) |
| EA (1) | EA027181B1 (ko) |
| EC (1) | ECSP12011834A (ko) |
| ES (2) | ES2985063T3 (ko) |
| FI (1) | FI3150200T3 (ko) |
| HK (1) | HK1213498A1 (ko) |
| HR (2) | HRP20240752T1 (ko) |
| HU (2) | HUE067332T2 (ko) |
| IL (1) | IL218257A (ko) |
| IN (1) | IN2012DN02805A (ko) |
| LT (2) | LT3150200T (ko) |
| MA (1) | MA33608B1 (ko) |
| ME (1) | ME02564B (ko) |
| MX (1) | MX2012003102A (ko) |
| NZ (1) | NZ598323A (ko) |
| PE (1) | PE20120955A1 (ko) |
| PL (2) | PL2482806T3 (ko) |
| PT (2) | PT3150200T (ko) |
| RS (2) | RS65542B1 (ko) |
| SI (2) | SI2482806T1 (ko) |
| TN (1) | TN2012000143A1 (ko) |
| TW (1) | TWI477509B (ko) |
| UA (1) | UA106634C2 (ko) |
| UY (1) | UY32919A (ko) |
| WO (1) | WO2011039337A1 (ko) |
Families Citing this family (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7407955B2 (en) | 2002-08-21 | 2008-08-05 | Boehringer Ingelheim Pharma Gmbh & Co., Kg | 8-[3-amino-piperidin-1-yl]-xanthines, the preparation thereof and their use as pharmaceutical compositions |
| DE102004054054A1 (de) | 2004-11-05 | 2006-05-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verfahren zur Herstellung chiraler 8-(3-Amino-piperidin-1-yl)-xanthine |
| UA91546C2 (uk) * | 2005-05-03 | 2010-08-10 | Бьорінгер Інгельхайм Інтернаціональ Гмбх | КРИСТАЛІЧНА ФОРМА 1-ХЛОР-4-(β-D-ГЛЮКОПІРАНОЗ-1-ИЛ)-2-[4-((S)-ТЕТРАГІДРОФУРАН-3-ІЛОКСИ)-БЕНЗИЛ]-БЕНЗОЛУ, СПОСІБ ЇЇ ОДЕРЖАННЯ ТА ЇЇ ЗАСТОСУВАННЯ ПРИ ПРИГОТУВАННІ ЛІКАРСЬКИХ ЗАСОБІВ |
| US7772191B2 (en) | 2005-05-10 | 2010-08-10 | Boehringer Ingelheim International Gmbh | Processes for preparing of glucopyranosyl-substituted benzyl-benzene derivatives and intermediates therein |
| ATE491700T1 (de) * | 2005-09-08 | 2011-01-15 | Boehringer Ingelheim Int | KRISTALLINE FORMEN VON 1-CHLORO-4-(ß-D- |
| PE20080697A1 (es) * | 2006-05-03 | 2008-08-05 | Boehringer Ingelheim Int | Derivados de benzonitrilo sustituidos con glucopiranosilo, composiciones farmaceuticas que contienen compuestos de este tipo, su uso y procedimiento para su fabricacion |
| CN101437823B (zh) | 2006-05-04 | 2014-12-10 | 勃林格殷格翰国际有限公司 | 多晶型 |
| EP1852108A1 (en) | 2006-05-04 | 2007-11-07 | Boehringer Ingelheim Pharma GmbH & Co.KG | DPP IV inhibitor formulations |
| PE20110235A1 (es) | 2006-05-04 | 2011-04-14 | Boehringer Ingelheim Int | Combinaciones farmaceuticas que comprenden linagliptina y metmorfina |
| JP2010507629A (ja) * | 2006-10-27 | 2010-03-11 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 4−(β−D−グルコピラノス−1−イル)−1−メチル−2−[4−((S)−テトラヒドロフラン−3−イルオキシ)−ベンジル]−ベンゼンの結晶形、その製造方法及び医薬品を製造するための使用 |
| CL2008002427A1 (es) | 2007-08-16 | 2009-09-11 | Boehringer Ingelheim Int | Composicion farmaceutica que comprende 1-cloro-4-(b-d-glucopiranos-1-il)-2-[4-((s)-tetrahidrofurano-3-iloxi)bencil]-benceno combinado con 1-[(4-metilquinazolin-2-il)metil]-3-metil-7-(2-butin-1-il)-8-(3-(r)-aminopiperidin-1-il)xantina; y su uso para tratar diabetes mellitus tipo 2. |
| CA2706018C (en) | 2007-11-30 | 2015-11-24 | Boehringer Ingelheim International Gmbh | 1, 5-dihydro-pyrazolo [3,4-d]pyrimidin-4-one derivatives and their use as pde9a modulators for the treatment of cns disorders |
| UA105362C2 (en) | 2008-04-02 | 2014-05-12 | Бьорингер Ингельхайм Интернациональ Гмбх | 1-heterocyclyl-1, 5-dihydro-pyrazolo [3, 4-d] pyrimidin-4-one derivatives and their use as pde9a modulators |
| AR071175A1 (es) | 2008-04-03 | 2010-06-02 | Boehringer Ingelheim Int | Composicion farmaceutica que comprende un inhibidor de la dipeptidil-peptidasa-4 (dpp4) y un farmaco acompanante |
| BRPI0916997A2 (pt) | 2008-08-06 | 2020-12-15 | Boehringer Ingelheim International Gmbh | Inibidor de dpp-4 e seu uso |
| UY32030A (es) | 2008-08-06 | 2010-03-26 | Boehringer Ingelheim Int | "tratamiento para diabetes en pacientes inapropiados para terapia con metformina" |
| BRPI0918527A2 (pt) | 2008-09-08 | 2015-12-01 | Boehring Ingelheim Internat Gmbh | compostos para o tratamento de disturbios do cns |
| US20200155558A1 (en) | 2018-11-20 | 2020-05-21 | Boehringer Ingelheim International Gmbh | Treatment for diabetes in patients with insufficient glycemic control despite therapy with an oral antidiabetic drug |
| NZ592924A (en) | 2008-12-23 | 2014-05-30 | Boehringer Ingelheim Int | Salt forms of a xanthine derivative |
| AR074990A1 (es) | 2009-01-07 | 2011-03-02 | Boehringer Ingelheim Int | Tratamiento de diabetes en pacientes con un control glucemico inadecuado a pesar de la terapia con metformina |
| US20110046076A1 (en) * | 2009-02-13 | 2011-02-24 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| NZ594567A (en) | 2009-03-31 | 2013-12-20 | Boehringer Ingelheim Int | 1-heterocyclyl-1, 5-dihydro-pyrazolo [3, 4-d] pyrimidin-4-one derivatives and their use as pde9a modulators |
| MX2012002942A (es) * | 2009-09-30 | 2012-04-11 | Boehringer Ingelheim Int | Metodo para la preparacion de una forma cristalina de 1-cloro-4-(beta-d-glucopiranos-1-il)-2-(4-((s)-teteahidrofuran-3- iloxi)bencil)-benceno. |
| EA022032B1 (ru) | 2009-09-30 | 2015-10-30 | Бёрингер Ингельхайм Интернациональ Гмбх | Способ получения глюкопиранозилзамещенных производных бензилбензола |
| UY32919A (es) | 2009-10-02 | 2011-04-29 | Boehringer Ingelheim Int | Composición farmacéutica, forma de dosificación farmacéutica, procedimiento para su preparación, mé todos para su tratamiento y sus usos |
| ES2856888T3 (es) * | 2009-11-13 | 2021-09-28 | Astrazeneca Ab | Formulaciones de tabletas bicapa |
| ES2693686T3 (es) | 2009-11-13 | 2018-12-13 | Astrazeneca Ab | Formulaciones de comprimidos de liberación inmediata |
| BR112012012641A2 (pt) | 2009-11-27 | 2020-08-11 | Boehringer Ingelheim International Gmbh | TRATAMENTO DE PACIENTES DIABÉTICOS GENOTIPADOS COM INIBIDORES DE DPP-lVTAL COMO LINAGLIPTINA |
| MX341025B (es) | 2010-05-05 | 2016-08-04 | Boehringer Ingelheim Int Gmbh * | Terapia de combinacion. |
| ES2802243T3 (es) | 2010-06-24 | 2021-01-18 | Boehringer Ingelheim Int | Terapia para la diabetes |
| ES2626006T3 (es) | 2010-08-12 | 2017-07-21 | Boehringer Ingelheim International Gmbh | Derivados de 6-cicloalquil-1,5-dihidro-pirazolo[3,4-d]pirimidin-4-ona y su uso como inhibidores de PDE9A |
| AR083878A1 (es) | 2010-11-15 | 2013-03-27 | Boehringer Ingelheim Int | Terapia antidiabetica vasoprotectora y cardioprotectora, linagliptina, metodo de tratamiento |
| US8809345B2 (en) | 2011-02-15 | 2014-08-19 | Boehringer Ingelheim International Gmbh | 6-cycloalkyl-pyrazolopyrimidinones for the treatment of CNS disorders |
| UY33937A (es) | 2011-03-07 | 2012-09-28 | Boehringer Ingelheim Int | Composiciones farmacéuticas que contienen inhibidores de dpp-4 y/o sglt-2 y metformina |
| US20130035298A1 (en) | 2011-07-08 | 2013-02-07 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| EP3517539B1 (en) | 2011-07-15 | 2022-12-14 | Boehringer Ingelheim International GmbH | Substituted dimeric quinazoline derivative, its preparation and its use in pharmaceutical compositions for the treatment of type i and ii diabetes |
| WO2013053076A1 (en) | 2011-10-10 | 2013-04-18 | Zensun (Shanghai)Science & Technology Limited | Compositions and methods for treating heart failure |
| US9555001B2 (en) | 2012-03-07 | 2017-01-31 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition and uses thereof |
| TR201202948A2 (tr) * | 2012-03-15 | 2012-07-23 | Ali̇ Rai̇f İlaç Sanayi̇ A.Ş. | Dapagliflozin ve uzatılmış salınımlı metaformin içeren tablet formülasyonu. |
| US9192617B2 (en) | 2012-03-20 | 2015-11-24 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| WO2013171167A1 (en) | 2012-05-14 | 2013-11-21 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in the treatment of podocytes related disorders and/or nephrotic syndrome |
| WO2013174767A1 (en) | 2012-05-24 | 2013-11-28 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in modifying food intake and regulating food preference |
| BR112015006656A8 (pt) | 2012-10-08 | 2020-01-21 | Sensun Shanghai Science & Tech Co Ltd | composições e métodos para o tratamento de insuficiência cardíaca em pacientes diabéticos |
| CA2812016A1 (en) * | 2013-04-05 | 2014-10-05 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| ES2702174T3 (es) | 2013-04-05 | 2019-02-27 | Boehringer Ingelheim Int | Usos terapéuticos de empagliflozina |
| CA2812519A1 (en) * | 2013-04-05 | 2014-10-05 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| US20140303097A1 (en) | 2013-04-05 | 2014-10-09 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| US11813275B2 (en) | 2013-04-05 | 2023-11-14 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| MX2021004308A (es) * | 2013-04-18 | 2022-10-26 | Boehringer Ingelheim Int | Empagliflozina para usarse en el tratamiento de micro y macroalbuminuria. |
| WO2015101916A1 (en) | 2013-12-30 | 2015-07-09 | Mylan Laboratories Ltd. | Process for the preparation of empagliflozin |
| WO2015128453A1 (en) | 2014-02-28 | 2015-09-03 | Boehringer Ingelheim International Gmbh | Medical use of a dpp-4 inhibitor |
| CN104586834A (zh) * | 2014-12-12 | 2015-05-06 | 周连才 | 一种艾帕列净和二甲双胍的药物组合物及其制备方法 |
| CN104623684B (zh) * | 2015-02-11 | 2020-12-25 | 浙江华海药业股份有限公司 | 一种恩格列净甘露醇组合物的制备方法 |
| CN107432869A (zh) * | 2016-05-27 | 2017-12-05 | 天津药物研究院有限公司 | 包含盐酸二甲双胍和恩格列净的双层片及其制备方法 |
| AU2017276758A1 (en) | 2016-06-10 | 2018-11-08 | Boehringer Ingelheim International Gmbh | Combinations of Linagliptin and metformin |
| CR20190142A (es) * | 2016-09-07 | 2019-05-22 | Saniona As | Composiciones de tesofensina |
| BR112019008384A2 (pt) | 2016-11-10 | 2019-07-09 | Boehringer Ingelheim Int | composição farmacêutica, processos para tratamento e seus usos |
| CN106924237B (zh) * | 2017-03-03 | 2019-12-03 | 杭州华东医药集团新药研究院有限公司 | 一种含有恩格列净和盐酸二甲双胍的药物组合物 |
| WO2020058095A1 (en) | 2018-09-19 | 2020-03-26 | Galenicum Health S.L.U. | Pharmaceutical compositions of empagliflozin |
| EP4326237A2 (en) * | 2021-04-23 | 2024-02-28 | Flow Pharma Inc. | Microsphere formulations comprising multiple non-identical peptides and methods for making the same |
| CN113648304A (zh) * | 2021-09-06 | 2021-11-16 | 扬子江药业集团上海海尼药业有限公司 | 一种含达格列净的药物组合物及其制备方法和应用 |
| EP4285894A1 (en) | 2022-05-31 | 2023-12-06 | Sanovel Ilac Sanayi Ve Ticaret A.S. | A formulation of empagliflozin and metformin hydrochloride |
| EP4285893A1 (en) | 2022-05-31 | 2023-12-06 | Sanovel Ilac Sanayi Ve Ticaret A.S. | A combination comprising empagliflozin and metformin hydrochloride |
| WO2024128996A1 (en) * | 2022-12-16 | 2024-06-20 | Santa Farma Ilac Sanayii A.S. | Monolayer tablet composition of empagliflozin and metformin hydrochloride |
| EP4410280A1 (en) | 2023-02-02 | 2024-08-07 | Sanovel Ilac Sanayi Ve Ticaret A.S. | Film coating tablets of empagliflozin and metformin hydrochloride |
Family Cites Families (161)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3174901A (en) * | 1963-01-31 | 1965-03-23 | Jan Marcel Didier Aron Samuel | Process for the oral treatment of diabetes |
| NL167151C (nl) | 1971-04-09 | 1981-11-16 | Acf Chemiefarma Nv | Werkwijze ter bereiding van geneesmiddelen met anti-parasitaire werking op basis van halogeen bevatten- de 2,2'-methyleendifenolderivaten, alsmede werkwijze ter bereiding van deze geneeskrachtige verbindingen. |
| NO154918C (no) * | 1977-08-27 | 1987-01-14 | Bayer Ag | Analogifremgangsmaate til fremstilling av terapeutisk aktive derivater av 3,4,5-trihydroksypiperidin. |
| DE2758025A1 (de) | 1977-12-24 | 1979-07-12 | Bayer Ag | Neue derivate von 3,4,5-trihydroxypiperidin, verfahren zu ihrer herstellung und ihre verwendung |
| DE2951135A1 (de) * | 1979-12-19 | 1981-06-25 | Hoechst Ag, 6230 Frankfurt | Sulfonylharnstoffe, verfahren zu ihrer herstellung, pharmazeutische praeparate auf basis dieser verbindungen und ihre verwendung |
| JPS5639056A (en) | 1980-07-16 | 1981-04-14 | Kanebo Ltd | Preparation of n,n,n',n'-tetraacylated nucleus halogenated aromatic diamine |
| JPS58164502A (ja) | 1982-03-26 | 1983-09-29 | Chugai Pharmaceut Co Ltd | 除草用組成物 |
| US4602023A (en) * | 1985-06-03 | 1986-07-22 | Warner-Lambert Company | Diphenic acid monoamides |
| US4786755A (en) * | 1985-06-03 | 1988-11-22 | Warner-Lambert Company | Diphenic acid monoamides |
| US4786023A (en) * | 1987-08-19 | 1988-11-22 | Harris Leverett D | Drafting implement holder |
| US5145684A (en) | 1991-01-25 | 1992-09-08 | Sterling Drug Inc. | Surface modified drug nanoparticles |
| JPH1085502A (ja) * | 1996-09-19 | 1998-04-07 | Konica Corp | 晶析方法 |
| US5807580A (en) | 1996-10-30 | 1998-09-15 | Mcneil-Ppc, Inc. | Film coated tablet compositions having enhanced disintegration characteristics |
| AU6024998A (en) | 1997-01-15 | 1998-08-07 | Glycomed Incorporated | Aryl c-glycoside compounds and sulfated esters thereof |
| JPH11124392A (ja) | 1997-10-21 | 1999-05-11 | Sankyo Co Ltd | C−グリコシル化されたアリールスズ化合物 |
| US6613806B1 (en) * | 1999-01-29 | 2003-09-02 | Basf Corporation | Enhancement of the efficacy of benzoylbenzenes |
| RU2232767C2 (ru) * | 1999-08-31 | 2004-07-20 | Киссеи Фармасьютикал Ко., Лтд. | Глюкопиранозилоксипиразольные производные, фармацевтические композиции, содержащие эти производные, и промежуточные соединения для их получения |
| US6515117B2 (en) | 1999-10-12 | 2003-02-04 | Bristol-Myers Squibb Company | C-aryl glucoside SGLT2 inhibitors and method |
| PH12000002657B1 (en) | 1999-10-12 | 2006-02-21 | Bristol Myers Squibb Co | C-aryl glucoside SGLT2 inhibitors |
| US6498193B2 (en) * | 1999-12-22 | 2002-12-24 | Trustees Of Dartmouth College | Treatment for complications of type 2 diabetes |
| JP4456768B2 (ja) | 2000-02-02 | 2010-04-28 | 壽製薬株式会社 | C−配糖体を含有する薬剤 |
| US6627611B2 (en) * | 2000-02-02 | 2003-09-30 | Kotobuki Pharmaceutical Co Ltd | C-glycosides and preparation of thereof as antidiabetic agents |
| US6683056B2 (en) | 2000-03-30 | 2004-01-27 | Bristol-Myers Squibb Company | O-aryl glucoside SGLT2 inhibitors and method |
| US6627634B2 (en) | 2000-04-08 | 2003-09-30 | Boehringer Ingelheim Pharma Kg | Bicyclic heterocycles, pharmaceutical compositions containing them, their use, and processes for preparing them |
| EA005994B1 (ru) * | 2000-09-29 | 2005-08-25 | Киссеи Фармасьютикал Ко., Лтд. | Производные глюкопиранозилоксибензилбензола и содержащие их лекарственные композиции |
| AU2002223127A1 (en) | 2000-11-30 | 2002-06-11 | Kissei Pharmaceutical Co., Ltd. Intellectual Property | Glucopyranosyloxybenzyl benzene derivatives, medicinal compositions containing the same and intermediates in the production thereof |
| US7019012B2 (en) | 2000-12-20 | 2006-03-28 | Boehringer Ingelheim International Pharma Gmbh & Co. Kg | Quinazoline derivatives and pharmaceutical compositions containing them |
| TWI255817B (en) * | 2001-02-14 | 2006-06-01 | Kissei Pharmaceutical | Glucopyranosyloxybenzylbenzene derivatives and medicinal use thereof |
| JP4147111B2 (ja) | 2001-02-27 | 2008-09-10 | キッセイ薬品工業株式会社 | グルコピラノシルオキシピラゾール誘導体およびその医薬用途 |
| US6936590B2 (en) * | 2001-03-13 | 2005-08-30 | Bristol Myers Squibb Company | C-aryl glucoside SGLT2 inhibitors and method |
| JP3698067B2 (ja) * | 2001-03-30 | 2005-09-21 | Jsr株式会社 | 電子吸引性基および電子供与性基を有するモノマー、それを用いた共重合体、ならびにプロトン伝導膜 |
| CA2444481A1 (en) | 2001-04-11 | 2002-10-24 | Bristol-Myers Squibb Company | Amino acid complexes of c-aryl glucosides for treatment of diabetes and method |
| JP2002338471A (ja) | 2001-05-23 | 2002-11-27 | Asahi Kasei Corp | 勃起機能不全のための治療薬 |
| EP1432720A1 (en) * | 2001-09-05 | 2004-06-30 | Bristol-Myers Squibb Company | O-pyrazole glucoside sglt2 inhibitors and method of use |
| WO2003031458A1 (en) | 2001-10-12 | 2003-04-17 | Dana-Farber Cancer Institute | Methods for synthesis of diarylmethanes |
| GB0206215D0 (en) | 2002-03-15 | 2002-05-01 | Novartis Ag | Organic compounds |
| DE10231370B4 (de) * | 2002-07-11 | 2006-04-06 | Sanofi-Aventis Deutschland Gmbh | Thiophenglycosidderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zur Herstellung dieser Arzneimittel |
| TWI254635B (en) | 2002-08-05 | 2006-05-11 | Yamanouchi Pharma Co Ltd | Azulene derivative and salt thereof |
| JP4540475B2 (ja) * | 2002-08-08 | 2010-09-08 | キッセイ薬品工業株式会社 | ピラゾール誘導体、それを含有する医薬組成物、その医薬用途及びその製造中間体 |
| US7407955B2 (en) * | 2002-08-21 | 2008-08-05 | Boehringer Ingelheim Pharma Gmbh & Co., Kg | 8-[3-amino-piperidin-1-yl]-xanthines, the preparation thereof and their use as pharmaceutical compositions |
| EA016166B1 (ru) | 2002-08-21 | 2012-02-28 | Бёрингер Ингельхайм Фарма Гмбх & Ко. Кг | 8-[3-аминопиперидин-1-ил]ксантины, способ их получения и их применение в качестве лекарственных средств |
| KR100665919B1 (ko) | 2002-11-20 | 2007-03-08 | 니뽄 다바코 산교 가부시키가이샤 | 4-옥소퀴놀린 화합물 및 hiv 인테그라제 저해제로서의그의 용도 |
| JP3567162B1 (ja) | 2002-11-20 | 2004-09-22 | 日本たばこ産業株式会社 | 4−オキソキノリン化合物及びそのhivインテグラーゼ阻害剤としての利用 |
| JP4651934B2 (ja) | 2002-12-04 | 2011-03-16 | キッセイ薬品工業株式会社 | ベンジルフェノール誘導体、それを含有する医薬組成物およびその医薬用途 |
| DE10258007B4 (de) | 2002-12-12 | 2006-02-09 | Sanofi-Aventis Deutschland Gmbh | Aromatische Fluorglycosidderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zur Herstellung dieser Arzneimittel |
| DE10258008B4 (de) | 2002-12-12 | 2006-02-02 | Sanofi-Aventis Deutschland Gmbh | Heterocyclische Fluorglycosidderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zur Herstellung dieser Arzneimittel |
| CN100391963C (zh) | 2003-01-03 | 2008-06-04 | 布里斯托尔-迈尔斯斯奎布公司 | 制备c-芳基葡糖苷sglt2抑制剂的方法 |
| EP1597266A4 (en) | 2003-02-27 | 2008-02-20 | Bristol Myers Squibb Co | NON-CRYOGENIC PROCESS FOR THE PRODUCTION OF GLYCOSIDES |
| NZ542399A (en) | 2003-03-14 | 2009-01-31 | Astellas Pharma Inc | C-glycoside derivatives and salts thereof |
| US7674486B2 (en) * | 2003-05-14 | 2010-03-09 | Indus Biotech Pvt. Ltd. | Synergistic composition for the treatment of diabetes mellitus |
| EP1664073A2 (en) * | 2003-06-03 | 2006-06-07 | The Regents of the University of California | Compositions and methods for treatment of disease with acetylated disaccharides |
| JP2004359630A (ja) | 2003-06-06 | 2004-12-24 | Yamanouchi Pharmaceut Co Ltd | ジフルオロジフェニルメタン誘導体及びその塩 |
| FR2855756B1 (fr) * | 2003-06-06 | 2005-08-26 | Ethypharm Sa | Comprime orodispersible multicouche |
| US20050027236A1 (en) | 2003-07-30 | 2005-02-03 | Medtronic Ave, Inc. | Aspiration catheter having a variable over-the-wire length and methods of use |
| US6995183B2 (en) | 2003-08-01 | 2006-02-07 | Bristol Myers Squibb Company | Adamantylglycine-based inhibitors of dipeptidyl peptidase IV and methods |
| PL1651658T5 (pl) | 2003-08-01 | 2020-11-30 | Mitsubishi Tanabe Pharma Corporation | Nowe związki o działaniu inhibitującym transporter zależny od sodu |
| WO2005012318A2 (en) | 2003-08-01 | 2005-02-10 | Janssen Pharmaceutica Nv | Substituted fused heterocyclic c-glycosides |
| JP4131216B2 (ja) | 2003-08-20 | 2008-08-13 | Jsr株式会社 | ポリアリーレンおよびその製造方法、ならびに高分子固体電解質およびプロトン伝導膜 |
| ES2322059T3 (es) | 2003-08-26 | 2009-06-16 | Boehringer Ingelheim International Gmbh | Glucopiranosiloxi-pirazoles, medicamentos que contienen a estos compuestos, su uso y procedimiento para su preparacion. |
| US7375090B2 (en) * | 2003-08-26 | 2008-05-20 | Boehringer Ingelheim International Gmbh | Glucopyranosyloxy-pyrazoles, pharmaceutical compositions containing these compounds, the use thereof and processed for the preparation thereof |
| US20050085680A1 (en) * | 2003-10-21 | 2005-04-21 | Joseph Auerbach | Method for industrial decontamination |
| AU2004290897B2 (en) | 2003-11-17 | 2009-02-26 | Novartis Ag | Use of dipeptidyl peptidase IV inhibitors |
| DE10361133A1 (de) | 2003-12-22 | 2005-07-21 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Glucopyranosyloxy-substituierte Aromaten, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| US7371732B2 (en) * | 2003-12-22 | 2008-05-13 | Boehringer Ingelheim International Gmbh | Glucopyranosyloxy-substituted aromatic compounds, medicaments containing such compounds, their use and process for their manufacture |
| BR122018073405B1 (pt) | 2004-01-20 | 2023-04-25 | Novartis Ag | Comprimido farmacêutico produzido por compressão direta compreendendo inibidor de dipeptidilpeptidase iv |
| EP1559419A1 (en) | 2004-01-23 | 2005-08-03 | Fournier Laboratories Ireland Limited | Pharmaceutical formulations comprising metformin and a fibrate, and processes for their obtention |
| AU2005219777B2 (en) | 2004-03-04 | 2011-02-03 | Kissei Pharmaceutical Co., Ltd. | Fused heterocycle derivative, medicinal composition containing the same, and medicinal use thereof |
| WO2005085237A1 (ja) | 2004-03-04 | 2005-09-15 | Kissei Pharmaceutical Co., Ltd. | 縮合複素環誘導体、それを含有する医薬組成物およびその医薬用途 |
| ES2387881T3 (es) * | 2004-03-16 | 2012-10-03 | Boehringer Ingelheim International Gmbh | Derivados de benceno sustituidos por glucopiranosilo, medicamentos que contienen estos compuestos, su uso y procedimiento para su preparación |
| WO2005117861A1 (en) | 2004-06-04 | 2005-12-15 | Novartis Ag | Use of organic compounds |
| US7393836B2 (en) | 2004-07-06 | 2008-07-01 | Boehringer Ingelheim International Gmbh | D-xylopyranosyl-substituted phenyl derivatives, medicaments containing such compounds, their use and process for their manufacture |
| US20070293690A1 (en) | 2004-07-08 | 2007-12-20 | Hiroshi Tomiyama | Process for Production of Azulene Derivatives and Intermediates for the Synthesis of the Same |
| DE102004034690A1 (de) | 2004-07-17 | 2006-02-02 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Methyliden-D-xylopyranosyl-und Oxo-D-xylopyranosyl-substituierte Phenyle, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| TW200606129A (en) | 2004-07-26 | 2006-02-16 | Chugai Pharmaceutical Co Ltd | Novel cyclohexane derivative, its prodrug, its salt and diabetic therapeutic agent containing the same |
| EP1773800A1 (de) * | 2004-07-27 | 2007-04-18 | Boehringer Ingelheim International GmbH | D-glucopyranosyl-phenyl-substituierte cyclen, diese verbindungen enthaltende arzneimittel, deren verwendung und verfahren zu ihrer herstellung |
| WO2006018150A1 (de) * | 2004-08-11 | 2006-02-23 | Boehringer Ingelheim International Gmbh | D-xylopyranosyl-phenyl-substituierte cyclen, diese verbindungen enthaltende arzneimittel, deren verwendung und verfahren zu ihrer herstellung |
| AR051446A1 (es) | 2004-09-23 | 2007-01-17 | Bristol Myers Squibb Co | Glucosidos de c-arilo como inhibidores selectivos de transportadores de glucosa (sglt2) |
| DE102004048388A1 (de) | 2004-10-01 | 2006-04-06 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | D-Pyranosyl-substituierte Phenyle, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| EP1828216B1 (en) | 2004-12-16 | 2008-09-10 | Boehringer Ingelheim International GmbH | Glucopyranosyl-substituted benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| GB0428180D0 (en) * | 2004-12-23 | 2005-01-26 | Biopartners Ltd | Combination therapy |
| GT200600008A (es) * | 2005-01-18 | 2006-08-09 | Formulacion de compresion directa y proceso | |
| WO2006089872A1 (en) | 2005-02-23 | 2006-08-31 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted ( (hetero)arylethynyl-benzyd-benzene derivatives and use thereof as sodium-dependent glucose cotransporter 2 (sglt2) inhibitors |
| CA2605245A1 (en) | 2005-04-15 | 2006-10-19 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted (heteroaryloxy-benzyl)-benzene derivatives as sglt inhibitors |
| UA91546C2 (uk) * | 2005-05-03 | 2010-08-10 | Бьорінгер Інгельхайм Інтернаціональ Гмбх | КРИСТАЛІЧНА ФОРМА 1-ХЛОР-4-(β-D-ГЛЮКОПІРАНОЗ-1-ИЛ)-2-[4-((S)-ТЕТРАГІДРОФУРАН-3-ІЛОКСИ)-БЕНЗИЛ]-БЕНЗОЛУ, СПОСІБ ЇЇ ОДЕРЖАННЯ ТА ЇЇ ЗАСТОСУВАННЯ ПРИ ПРИГОТУВАННІ ЛІКАРСЬКИХ ЗАСОБІВ |
| US7723309B2 (en) | 2005-05-03 | 2010-05-25 | Boehringer Ingelheim International Gmbh | Crystalline forms of 1-chloro-4-(β-D-glucopyranos-1-yl)-2-[4-((R)-tetrahydrofuran-3-yloxy)-benzyl]-benzene, a method for its preparation and the use thereof for preparing medicaments |
| US7772191B2 (en) | 2005-05-10 | 2010-08-10 | Boehringer Ingelheim International Gmbh | Processes for preparing of glucopyranosyl-substituted benzyl-benzene derivatives and intermediates therein |
| WO2007000445A1 (en) | 2005-06-29 | 2007-01-04 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted benzyl-benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| AR054871A1 (es) * | 2005-07-27 | 2007-07-25 | Boehringer Ingelheim Int | Derivados de (hetero)cicloalquiletinil-bencil)-benceno sustituidos con glucopiranosilo, medicamentos que contienen dichos compuestos, sus uso y proceso para su fabricacion |
| KR100780553B1 (ko) * | 2005-08-18 | 2007-11-29 | 한올제약주식회사 | 메트포르민 서방정 및 그의 제조방법 |
| US7452872B2 (en) | 2005-08-24 | 2008-11-18 | Salix Pharmaceuticals, Inc. | Formulations and uses of 2-hydroxy-5-phenylazobenzoic acid derivatives |
| WO2007025943A2 (en) | 2005-08-30 | 2007-03-08 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted benzyl-benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| ATE491700T1 (de) | 2005-09-08 | 2011-01-15 | Boehringer Ingelheim Int | KRISTALLINE FORMEN VON 1-CHLORO-4-(ß-D- |
| AR056195A1 (es) | 2005-09-15 | 2007-09-26 | Boehringer Ingelheim Int | Procedimientos para preparar derivados de (etinil-bencil)-benceno sustituidos de glucopiranosilo y compuestos intermedios de los mismos |
| JOP20180109A1 (ar) | 2005-09-29 | 2019-01-30 | Novartis Ag | تركيبة جديدة |
| EP1942902A1 (en) | 2005-09-30 | 2008-07-16 | Boehringer Ingelheim Vetmedica Gmbh | Pharmaceutical preparation containing meloxicam |
| EA200801773A1 (ru) | 2006-02-15 | 2009-02-27 | Бёрингер Ингельхайм Интернациональ Гмбх | Глюкопиранозилзамещенные производные бензонитрила, фармацевтические композиции, содержащие такие соединения, их применение и способ их получения |
| PE20080697A1 (es) * | 2006-05-03 | 2008-08-05 | Boehringer Ingelheim Int | Derivados de benzonitrilo sustituidos con glucopiranosilo, composiciones farmaceuticas que contienen compuestos de este tipo, su uso y procedimiento para su fabricacion |
| PE20110235A1 (es) | 2006-05-04 | 2011-04-14 | Boehringer Ingelheim Int | Combinaciones farmaceuticas que comprenden linagliptina y metmorfina |
| EP1852108A1 (en) | 2006-05-04 | 2007-11-07 | Boehringer Ingelheim Pharma GmbH & Co.KG | DPP IV inhibitor formulations |
| NZ573687A (en) | 2006-05-19 | 2010-10-29 | Taisho Pharmaceutical Co Ltd | C-phenyl glycitol compound for the treatment of diabetes |
| SI2269583T1 (sl) | 2006-06-16 | 2014-12-31 | Lek Pharmaceuticals D.D. | Farmacevtski pripravek, ki vsebuje hidroklorotiazid in telmisartan |
| AR061627A1 (es) | 2006-06-27 | 2008-09-10 | Novartis Ag | Formas de dosificacion solidas de valsartan, amlodipina, e hidroclorotiazida, y metodo para elaborarlas |
| TW200817424A (en) | 2006-08-04 | 2008-04-16 | Daiichi Sankyo Co Ltd | Benzylphenyl glucopyranoside derivatives |
| JP5384343B2 (ja) | 2006-08-15 | 2014-01-08 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | グルコピラノシル−置換シクロプロピルベンゼン誘導体、そのような化合物を含む医薬組成物、sglt阻害剤としてのそれらの使用及びそれらの製造方法 |
| JP2010501010A (ja) | 2006-08-17 | 2010-01-14 | ウェルスタット セラピューティクス コーポレイション | 代謝障害のための併用処置 |
| WO2008034859A1 (en) | 2006-09-21 | 2008-03-27 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted difluorobenzyl-benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| JP2010507629A (ja) * | 2006-10-27 | 2010-03-11 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 4−(β−D−グルコピラノス−1−イル)−1−メチル−2−[4−((S)−テトラヒドロフラン−3−イルオキシ)−ベンジル]−ベンゼンの結晶形、その製造方法及び医薬品を製造するための使用 |
| TW200829258A (en) | 2006-11-06 | 2008-07-16 | Boehringer Ingelheim Int | Glucopyranosyl-substituted benzyl-benzonitrile derivatives, medicaments containing such compounds, their use and process for their manufacture |
| CA3007700A1 (en) | 2006-11-09 | 2008-05-15 | Boehringer Ingelheim International Gmbh | Combination therapy with sglt-2 inhibitors and their pharmaceutical compositions |
| WO2008062273A2 (en) | 2006-11-20 | 2008-05-29 | Cadila Pharmaceuticals Limited | Solid oral dosage form having antidiabetic drug combination |
| ATE514692T1 (de) | 2007-01-26 | 2011-07-15 | Sanofi Aventis | Phenothiazin derivate, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| US20100081625A1 (en) * | 2007-01-26 | 2010-04-01 | Boehringer Ingelheim International Gmbh | Methods for preventing and treating neurodegenerative disorders |
| ITFI20070042A1 (it) | 2007-02-21 | 2008-08-22 | Laboratori Guidotti Spa | Formulazione farmaceutica e compressa comprendente detta formulazione. |
| US7879807B2 (en) * | 2007-02-21 | 2011-02-01 | Boehringer Ingelheim International Gmbh | Tetrasubstituted glucopyranosylated benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| WO2008101938A1 (en) | 2007-02-21 | 2008-08-28 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted benzyl-benzonitrile derivatives, medicaments containing such compounds, their use and process for their manufacture |
| TW200904405A (en) | 2007-03-22 | 2009-02-01 | Bristol Myers Squibb Co | Pharmaceutical formulations containing an SGLT2 inhibitor |
| TW200904454A (en) | 2007-03-22 | 2009-02-01 | Bristol Myers Squibb Co | Methods for treating obesity employing an SGLT2 inhibitor and compositions thereof |
| PE20090696A1 (es) | 2007-04-20 | 2009-06-20 | Bristol Myers Squibb Co | Formas cristalinas de saxagliptina y procesos para preparar las mismas |
| US20080287529A1 (en) * | 2007-05-18 | 2008-11-20 | Bristol-Myers Squibb Company | Crystal structures of sglt2 inhibitors and processes for preparing same |
| CL2008002425A1 (es) | 2007-08-16 | 2009-09-11 | Boehringer Ingelheim Int | Composición farmacéutica que comprende un inhibidor de sglt2 y 1-(4-metil-quinazolin-2-il)metil-3metil-7-(-2-butin-1-il)-8-(3-(r)-amino-piperidin-1il)-xantina, un inhibidor de dpp iv y su uso para el tratamiento de la obesidad y de la diabetes tipo 1 y 2 y complicaciones de esta. |
| CL2008002427A1 (es) | 2007-08-16 | 2009-09-11 | Boehringer Ingelheim Int | Composicion farmaceutica que comprende 1-cloro-4-(b-d-glucopiranos-1-il)-2-[4-((s)-tetrahidrofurano-3-iloxi)bencil]-benceno combinado con 1-[(4-metilquinazolin-2-il)metil]-3-metil-7-(2-butin-1-il)-8-(3-(r)-aminopiperidin-1-il)xantina; y su uso para tratar diabetes mellitus tipo 2. |
| ME03072B (me) | 2007-09-10 | 2019-01-20 | Janssen Pharmaceutica Nv | Postupak za dobijanje jedinjenja која su korisna као inhibiтori sgl т |
| CL2008003653A1 (es) | 2008-01-17 | 2010-03-05 | Mitsubishi Tanabe Pharma Corp | Uso de un inhibidor de sglt derivado de glucopiranosilo y un inhibidor de dppiv seleccionado para tratar la diabetes; y composicion farmaceutica. |
| CN101503399B (zh) | 2008-02-04 | 2012-06-27 | 白鹭医药技术(上海)有限公司 | C-芳基葡萄糖苷sglt2抑制剂 |
| AU2009210641A1 (en) | 2008-02-05 | 2009-08-13 | Merck Sharp & Dohme Corp. | Pharmaceutical compositions of a combination of metformin and a dipeptidyl peptidase-IV inhibitor |
| US8551524B2 (en) * | 2008-03-14 | 2013-10-08 | Iycus, Llc | Anti-diabetic combinations |
| AR071175A1 (es) | 2008-04-03 | 2010-06-02 | Boehringer Ingelheim Int | Composicion farmaceutica que comprende un inhibidor de la dipeptidil-peptidasa-4 (dpp4) y un farmaco acompanante |
| WO2010045656A2 (en) | 2008-10-17 | 2010-04-22 | Nectid, Inc. | Novel sglt2 inhibitor dosage forms |
| UY32427A (es) * | 2009-02-13 | 2010-09-30 | Boheringer Ingelheim Internat Gmbh | Composicion farmaceutica, forma farmaceutica, procedimiento para su preparacion, metodos de tratamiento y usos de la misma |
| CN102316875A (zh) | 2009-02-13 | 2012-01-11 | 贝林格尔.英格海姆国际有限公司 | 用于治疗i型糖尿病、ii型糖尿病、葡萄糖耐量降低或高血糖症的sglt-2抑制剂 |
| MX2011008416A (es) | 2009-02-13 | 2011-09-08 | Boehringer Ingelheim Int | Medicaciones antidiabeticas que comprenden un inhibidor de dpp-4 (linagliptina) opcionalmente en combinacion con otros antidiabeticos. |
| US20110046076A1 (en) | 2009-02-13 | 2011-02-24 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| EP4327867A3 (en) | 2009-02-13 | 2024-05-29 | Boehringer Ingelheim International GmbH | Pharmaceutical composition comprising glucopyranosyl diphenylmethane derivatives, pharmaceutical dosage form thereof, process for their preparation and uses thereof for improved glycemic control in a patient |
| WO2010119990A1 (en) | 2009-04-16 | 2010-10-21 | Taisho Pharmaceutical Co., Ltd. | Pharmaceutical compositions |
| US8685934B2 (en) * | 2009-05-27 | 2014-04-01 | Bristol-Myers Squibb Company | Methods for treating extreme insulin resistance in patients resistant to previous treatment with other anti-diabetic drugs employing an SGLT2 inhibitor and compositions thereof |
| US20110077212A1 (en) | 2009-09-25 | 2011-03-31 | Theracos, Inc. | Therapeutic uses of sglt2 inhibitors |
| EA022032B1 (ru) | 2009-09-30 | 2015-10-30 | Бёрингер Ингельхайм Интернациональ Гмбх | Способ получения глюкопиранозилзамещенных производных бензилбензола |
| MX2012002942A (es) | 2009-09-30 | 2012-04-11 | Boehringer Ingelheim Int | Metodo para la preparacion de una forma cristalina de 1-cloro-4-(beta-d-glucopiranos-1-il)-2-(4-((s)-teteahidrofuran-3- iloxi)bencil)-benceno. |
| UY32919A (es) | 2009-10-02 | 2011-04-29 | Boehringer Ingelheim Int | Composición farmacéutica, forma de dosificación farmacéutica, procedimiento para su preparación, mé todos para su tratamiento y sus usos |
| ES2693686T3 (es) | 2009-11-13 | 2018-12-13 | Astrazeneca Ab | Formulaciones de comprimidos de liberación inmediata |
| WO2011120923A1 (en) | 2010-03-30 | 2011-10-06 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition comprising an sglt2 inhibitor and a ppar- gamma agonist and uses thereof |
| KR20130137624A (ko) | 2010-09-03 | 2013-12-17 | 브리스톨-마이어스 스큅 컴퍼니 | 수용성 항산화제를 사용한 약물 제제 |
| US20120283169A1 (en) | 2010-11-08 | 2012-11-08 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| JP2014504639A (ja) | 2011-02-01 | 2014-02-24 | ブリストル−マイヤーズ スクイブ カンパニー | アミン化合物を含む医薬製剤 |
| US20130035281A1 (en) | 2011-02-09 | 2013-02-07 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| UY33937A (es) | 2011-03-07 | 2012-09-28 | Boehringer Ingelheim Int | Composiciones farmacéuticas que contienen inhibidores de dpp-4 y/o sglt-2 y metformina |
| BR112013031032A2 (pt) | 2011-06-03 | 2016-11-29 | Boehringer Ingelheim Int | inibidores de sglt-2 para o tratamento de distúrbios metabólicos em pacientes tratados com agentes neurolépticos |
| US20130035298A1 (en) | 2011-07-08 | 2013-02-07 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| US20150119399A1 (en) | 2012-01-10 | 2015-04-30 | President And Fellows Of Harvard College | Beta-cell replication promoting compounds and methods of their use |
| US9555001B2 (en) | 2012-03-07 | 2017-01-31 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition and uses thereof |
| US9192617B2 (en) | 2012-03-20 | 2015-11-24 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| ES2702174T3 (es) | 2013-04-05 | 2019-02-27 | Boehringer Ingelheim Int | Usos terapéuticos de empagliflozina |
| US20140303097A1 (en) | 2013-04-05 | 2014-10-09 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| US20160000816A1 (en) | 2013-04-05 | 2016-01-07 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| MX2021004308A (es) | 2013-04-18 | 2022-10-26 | Boehringer Ingelheim Int | Empagliflozina para usarse en el tratamiento de micro y macroalbuminuria. |
| WO2016174155A1 (en) | 2015-04-30 | 2016-11-03 | Boehringer Ingelheim International Gmbh | Methods and pharmaceutical compositions comprising a sglt2 inhibitor for treating or improving erectile dysfunction |
| US20170106009A1 (en) | 2015-10-15 | 2017-04-20 | Boehringer Ingelheim International Gmbh | Methods of treating diseases |
| WO2017093419A1 (en) | 2015-12-04 | 2017-06-08 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| WO2017157816A1 (en) | 2016-03-16 | 2017-09-21 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition comprising empagliflozin and uses thereof |
| EP3889144A1 (en) | 2016-10-13 | 2021-10-06 | Boehringer Ingelheim International GmbH | Process for preparing glucopyranosyl-substituted benzyl-benzene derivatives |
| BR112019008384A2 (pt) | 2016-11-10 | 2019-07-09 | Boehringer Ingelheim Int | composição farmacêutica, processos para tratamento e seus usos |
-
2010
- 2010-09-30 UY UY0001032919A patent/UY32919A/es not_active Application Discontinuation
- 2010-09-30 US US12/894,385 patent/US10610489B2/en active Active
- 2010-10-01 CA CA2776288A patent/CA2776288C/en active Active
- 2010-10-01 RS RS20240580A patent/RS65542B1/sr unknown
- 2010-10-01 BR BR112012009376A patent/BR112012009376B8/pt active IP Right Grant
- 2010-10-01 AU AU2010302641A patent/AU2010302641B2/en active Active
- 2010-10-01 AR ARP100103599A patent/AR078517A1/es unknown
- 2010-10-01 PL PL10759923T patent/PL2482806T3/pl unknown
- 2010-10-01 AP AP2012006135A patent/AP3438A/xx active
- 2010-10-01 CN CN201510227017.5A patent/CN104873974A/zh active Pending
- 2010-10-01 ES ES16195805T patent/ES2985063T3/es active Active
- 2010-10-01 NZ NZ598323A patent/NZ598323A/en unknown
- 2010-10-01 IN IN2805DEN2012 patent/IN2012DN02805A/en unknown
- 2010-10-01 PL PL16195805.3T patent/PL3150200T3/pl unknown
- 2010-10-01 EA EA201200551A patent/EA027181B1/ru active Protection Beyond IP Right Term
- 2010-10-01 JP JP2012531437A patent/JP5738300B2/ja active Active
- 2010-10-01 KR KR1020127008433A patent/KR101747152B1/ko active IP Right Grant
- 2010-10-01 LT LTEP16195805.3T patent/LT3150200T/lt unknown
- 2010-10-01 RS RS20170029A patent/RS55588B1/sr unknown
- 2010-10-01 HU HUE16195805A patent/HUE067332T2/hu unknown
- 2010-10-01 MX MX2012003102A patent/MX2012003102A/es active IP Right Grant
- 2010-10-01 PT PT161958053T patent/PT3150200T/pt unknown
- 2010-10-01 SI SI201031378A patent/SI2482806T1/sl unknown
- 2010-10-01 PE PE2012000370A patent/PE20120955A1/es not_active Application Discontinuation
- 2010-10-01 DK DK10759923.5T patent/DK2482806T3/en active
- 2010-10-01 EP EP16195805.3A patent/EP3150200B1/en active Active
- 2010-10-01 CN CN2010800440779A patent/CN102573808A/zh active Pending
- 2010-10-01 UA UAA201205028A patent/UA106634C2/uk unknown
- 2010-10-01 TW TW099133631A patent/TWI477509B/zh not_active IP Right Cessation
- 2010-10-01 ES ES10759923.5T patent/ES2616606T3/es active Active
- 2010-10-01 WO PCT/EP2010/064619 patent/WO2011039337A1/en active Application Filing
- 2010-10-01 DK DK16195805.3T patent/DK3150200T3/da active
- 2010-10-01 PT PT107599235T patent/PT2482806T/pt unknown
- 2010-10-01 EP EP24160306.7A patent/EP4371560A3/en active Pending
- 2010-10-01 FI FIEP16195805.3T patent/FI3150200T3/fi active
- 2010-10-01 HU HUE10759923A patent/HUE033021T2/en unknown
- 2010-10-01 SI SI201032144T patent/SI3150200T1/sl unknown
- 2010-10-01 HR HRP20240752TT patent/HRP20240752T1/hr unknown
- 2010-10-01 ME MEP-2016-296A patent/ME02564B/me unknown
- 2010-10-01 EP EP10759923.5A patent/EP2482806B1/en active Active
- 2010-10-01 LT LTEP10759923.5T patent/LT2482806T/lt unknown
-
2012
- 2012-02-22 IL IL218257A patent/IL218257A/en not_active IP Right Cessation
- 2012-03-26 MA MA34721A patent/MA33608B1/fr unknown
- 2012-03-29 TN TNP2012000143A patent/TN2012000143A1/en unknown
- 2012-03-30 CL CL2012000793A patent/CL2012000793A1/es unknown
- 2012-04-26 EC ECSP12011834 patent/ECSP12011834A/es unknown
- 2012-10-11 HK HK16101654.7A patent/HK1213498A1/zh unknown
-
2017
- 2017-02-24 CY CY20171100258T patent/CY1118661T1/el unknown
- 2017-03-09 HR HRP20170400TT patent/HRP20170400T1/hr unknown
-
2020
- 2020-02-21 US US16/797,163 patent/US20200188306A1/en not_active Abandoned
-
2024
- 2024-01-16 US US18/413,822 patent/US20240148656A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101747152B1 (ko) | 약제학적 조성물, 약제학적 용량형, 이들의 제조방법, 치료방법 및 이들의 용도 | |
| US20220193045A1 (en) | Pharmaceutical composition, pharmaceutical dosage form, process for their preparation, methods for treating and uses thereof | |
| US20220313716A1 (en) | Pharmaceutical composition, methods for treating and uses thereof | |
| DK2395984T3 (en) | PHARMACEUTICAL COMPOSITION COMPREHENSIVE linagliptin AND A SGLT2 INHIBITOR AND USE THEREOF | |
| AU2018202278A1 (en) | SGLT-2 inhibitor for treating type 1 diabetes mellitus, type 2 diabetes mellitus, impaired glucose tolerance or hyperglycemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |