본 발명은 활성성분으로서 메트포르민 또는 그의 약제학적으로 허용되는 염과, 서방성 고분자 중합체를 포함하는 약제학적 조성물을 5 ∼ 30 ㎫ 의 압력조건으로 수분을 추가적으로 부가하지 않는 환경에서 건식 슬러그(slug)화시키는 단계, 상기 슬러그를 12 ∼ 30 메쉬 (1.7 ∼ 0.6 mm)의 조건으로 과립화시킨 후 타정하여 정제층을 형성시키는 단계, 및 상기 정제층의 외면에 필름상의 코팅층을 형성시키는 단계를 포함하여 이루어지는 메트포르민 서방정의 제조방법을 특징으로 한다.
또한 본 발명은 상기한 방법으로 제조된 것으로, 활성성분으로서 메트포르민 또는 그의 약제학적으로 허용되는 염 및 서방성 고분자 중합체를 포함하여 구성되는 단일상의 정제층과, 상기 정제층의 외면을 둘러싼 필름상의 코팅층을 포함하여 구성되는 메트포르민 서방정을 포함한다.
이하 본 발명을 상세하게 설명하면 다음과 같다.
본 발명은 인슐린 비의존형 당뇨병 치료제의 유효성분인 메트포르민과 상기한 메트포르민의 방출속도를 조절할 수 있는 서방성 고분자 중합체를 포함하는 조성물을 소정조건의 압력으로 수분을 추가적으로 부가하지 않은 건조된 조건에서 건식 슬러그화한 후 건식 과립법에 따라 타정하여 정제층을 형성시키고, 그 표면에 필름상의 코팅층을 형성시킴으로써, 기존의 제품과 비교하여 체내에서 일정한 속도로 24시간동안 서서히 방출시킬 수 있는 우수한 용출 특성을 나타내어 1일 1회 투여로 24시간 동안 일정한 혈중 농도를 유지하며, 또한 생물학적 동등성을 나타내는 개선된 메트포르민 서방정 및 그의 제조방법에 관한 것이다.
본 발명에 의하면 인슐린 비의존형 당뇨병 치료제이며 수용해성이 높고, 상부 위장관에서 흡수 창을 갖으며, 단위 투여량이 많은 메트포르민의 지속적인 흡수를 유지시킬 수 있는 가장 적합한 투여 형태를 제공할 수 있다.
이하 본 발명을 메트포르민 서방정의 제조방법을 위주로 하여 단계별로 구체적으로 설명한다.
제 1 단계로, 활성성분으로서 메트포르민 또는 그의 약제학적으로 허용되는 염과, 서방성 고분자 중합체를 포함하는 약제학적 조성물을 5 ∼ 30 ㎫ 의 압력조건으로 수분을 추가적으로 부가하지 않는 건조된 환경에서 건식 슬러그화시키는 단계이다.
상기 메트포르민은 약제학적으로 허용되는 염의 형태인 것을 사용할 수 있으며, 가장 바람직하기로는 메트포르민의 염산염을 사용하는 것이 좋다. 이하, 본 발명의 명세서 내에서는 메트포르민의 염산염을 위주로 설명하고 있으나, 본 발명의 범위가 상기 메트포르민의 염산염으로 한정되는 것은 아니다.
이러한 메트포르민은 서방정 총 중량 중 25 ∼ 75 중량%, 바람직하기로는 30 ∼ 70 중량%, 가장 바람직하기로는 35 ∼ 65 중량%를 사용하는 것이 좋다.
서방성 고분자 중합체는 복용하면 팽창하는 특성을 가지므로 상기 메트포르민과 조합되어 위장내 체류 시간을 연장시켜 메트포르민의 흡수를 조절시켜주는 특성을 나타내며, 이러한 특성에 의하여 균일한 방출이 이루어지게 되는 것이다. 상기 서방성 고분자 중합체로는 셀룰로오스 유도체, 덱스트린, 녹말, 탄수화물 중합체, 천연 검, 구아검, 트라가칸타, 아카시아 검, 로커스트빈검, 잔탄검, 알긴산염, 젤라틴, 폴리아크릴산, 폴리비닐 알코올, 폴리비닐 피롤리돈, 폴리비닐아세테이트 및 메타크릴레이트 공중합체 유도체 등 중에서 선택된 1 종 또는 2종 이상의 혼합물을 사용할 수 있다. 상기 서방성 고분자 중합체는 서방정 총 중량 중 25 ∼ 75 중량%, 바람직하기로는 30 ∼ 70 중량%, 가장 바람직하기로는 35 ∼ 65 중량%를 사용하는 것이 좋은데, 상기 서방성 고분자 중합체의 함량이 25 중량% 미만이면 약물의 방출이 너무 빨라서 지속적인 제어방출이 불가능하고, 75 중량%를 초과하면 약물의 방출이 너무 느려서 제어 방출이 불가능 할 뿐만 아니라 정제의 크기가 너무 커져 복용감이 떨어진다.
한편, 슬러그(slug)는 활성성분과 약제학적 첨가제를 강하게 압축하여 만든 응집괴를 의미하는 것으로, 본 발명에서는 상기와 같이 일정정도의 압력을 부가하면서 건조된 조건에서 건식 슬러그화시킴으로 과립의 밀도를 증가시키고 유동성을 개선하여 정제의 부피를 감소시켜주는 특징을 부여하게 된다. 즉, 메트포르민 또는 그의 약제학적으로 허용되는 염과, 서방성 고분자 중합체를 포함하는 약제학적 조성물을 건식 슬러그화시키는데 이때 압력조건을 조절함이 본 발명의 가장 중요한 기술적 특징의 하나이다. 상기 압력조건은 5 ∼ 30 ㎫ 으로 조절하는데, 바람직하기로는 10 ∼ 25 ㎫ , 더욱 바람직하기로는 15 ∼ 20 ㎫으로 슬러그화시킨다. 이때, 상기 압력조건이 5 ㎫미만이면 과립화가 되지 않아 압축성, 유동성 개선 등의 목적을 달성할 수 없을 수 있으며, 30㎫ 를 초과하면 슬러그 강도가 증가하여 슬러그화 및 과립화에 소요되는 시간이 길어져 생산성이 나빠지는 단점이 있다.
제 2 단계로, 상기 슬러그를 12 ∼ 30 메쉬 (1.7 ∼ 0.6 mm)의 정립 조건으로 과립화시킨 후 타정하여 정제층을 형성시키는 단계이다.
상기 제 1 단계에 의하여 슬러그화된 메트포르민과 서방성 고분자 중합체 조성물을 과립화하면 과립의 밀도와 유동성 및 압축성이 우수해진다. 상기 과립화는 12 ∼ 30 메쉬 (1.7 ∼ 0.6 mm)의 정립 조건으로 수행되는데, 상기 과립화에 의하여 과립의 밀도, 유동성, 압축성이 우수해져서 타정성이 좋아진다. 과립은 12 ∼ 30 메쉬 (1.7 ∼ 0.6 mm) 범위로 이루어지는 것이 좋으며, 가장 바람직하기로는 16 ∼ 20 메쉬 (1.18 ∼ 0.85 mm) 범위로 수행되는 것이 좋다. 과립의 크기가 30 메쉬(0.6 mm) 미만이면 원하는 만큼의 과립의 밀도 및 유동성을 얻을 수 없고, 12 메쉬(1.7 mm)를 초과하면 정제의 압축성이 좋지 않다.
상기 제 1 단계와 제 2 단계 과정에 의하여 본 발명의 메트포르민 서방정을 구성하는 단일상의 정제층이 형성된다. 이렇게 형성된 정제층은 메트포르민 염산염과 서방성 고분자 중합체를 강한 압력으로 압착하여 활성 성분과 서방성 고분자 중합체가 강하게 결합되도록 함으로써 기존의 메트포르민이 높은 수용해도로 인하여 압축성과 유동성이 상당히 불량하여 건식 타정이 불가능하던 문제점을 해결하였다.
기존의 경우 메트포르민의 용해도가 높기 때문에 지속적인 제어 방출을 나타내기 위해서 서방성 고분자 중합체의 사용량도 상대적으로 많아 질 수밖에 없으며 이 때문에 정제의 총 중량이 더욱 늘어나게 되어 경구용 서방정 형태를 만드는 것은 가능하겠지만, 복용하기 힘들만큼 거대한 크기의 제형이 되어 복용시 불편하였다.
그러나, 본 발명에 의하여 조절된 압력 조건으로 수분이 부가되지 않은 건조된 환경에서 건식 슬러그화 시킨 후 과립화하여 타정함으로써 제조된 메트포르민 서방정은 그 부피가 기존의 경우보다 10 ∼ 20 부피% 정도 감소하여 상기한 문제점을 개선할 수 있다. 즉, 단위 중량당 부피를 환자가 복용하기 용이한 수준으로 감소시켜 복용의 편의성 및 환자의 순응성을 증대시켜, 지속적인 치료가 가능하다.
상기한 유효성분과 서방성 고분자 중합체 외에 상기 정제층에는 본 발명의 효과를 해치지 않는 범위 안에서 약학적으로 허용 가능한 희석제(전분, 미세결정성 셀룰로오스, 유당, 포도당, 만니톨, 알기네이트, 알칼리토류금속염, 클레이, 폴리에틸렌글리콜 및 디칼슘 포스페이트 등), 결합제(전분, 미세결정성 셀룰로오스, 고분산성 실리카, 만니톨, 락토스, 폴리에틸렌 글리콜, 폴리비닐피롤리돈, 가교성 폴리비닐피롤리돈, 가교된 카르복시메틸셀룰로오스, 히드록시프로필 메틸셀룰로오스, 히드록시프로필셀룰로오스, 천연검, 합성검, 코포비돈 및 젤라틴 등), 붕해제(전분 또는 변성전분, 구체적으로 나트륨 전분 글리콜레이트, 옥수수 전분, 감자 전분 또는 예비 젤라틴화 전분, 클레이, 구체적으로 벤토나이트, 몬모릴로나이트 또는 비검(veegum); 셀룰로오스, 구체적으로 미세결정성 셀룰로오스 히드록시프로필셀룰로오스 또는 카르복시메틸셀룰로오스, 알긴류 구체적으로 알긴산 나트륨 또는 알긴산; 가교 셀룰로오스 구체적으로 크로스카멜로스(croscarmellose) 나트륨, 검류 구체적으로 구아검 또는 잔탄검; 가교 중합체 구체적으로 크로스포비돈(crospovidone); 비등성 제제 구체적으로 중탄산 나트륨 및 시트르산; 또는 그의 혼합물 등), 윤활제(탈크, 스테아린산 마그네슘 및 알칼리토금속 스테아레이트형 칼슘, 아연 등, 라우릴 설페이트, 수소화 식물성 오일, 나트륨 벤조에이트, 나트륨 스테아릴 푸마레이트, 글리세릴 모노스테아레이트 및 폴리에틸렌글리콜 4000 등), 착색제, 향료 중에서 선택된 첨가제를 포함할 수 있다.
이러한 첨가제로서 본 발명의 실시예에서는 미세결정 셀룰로오스, 루디프레스®(바스프사 제품, 독일), 에어로실200(데구사사 제품, 독일), 스테아린산 마그네슘 등을 사용하고 있으나 본 발명의 범위가 상기 첨가제를 사용하는 것으로 한정되는 것은 아니며, 상기한 첨가제는 당업자의 선택에 의하여 통상의 범위의 용량을 함유할 수 있다.
제 3 단계로, 상기 정제층의 외면에 필름상의 코팅층을 형성시키는 단계이다.
본 발명의 메트포르민 서방정은 상기 유효성분을 함유하는 정제층의 표면에 코팅층을 형성하는데, 이러한 코팅층은 셀룰로오스 유도체, 당 유도체, 폴리비닐 유도체, 왁스류, 지방류 및 젤라틴 등의 피막제와 폴리에틸렌글리콜, 에틸셀룰로오스, 산화티탄 및 디에틸프탈레이트 등의 보조제 중에서 선택된 1종 또는 2종 이상의 혼합물을 사용할 수 있다. 이러한 코팅층은 서방정 총 중량 중 0.5 ∼ 15 중량%, 바람직하기로는 1 ∼ 10 중량%, 가장 바람직하기로는 2 ∼ 5 중량% 사용할 수 있으며, 이때 코팅층의 함량이 0.5 중량% 미만이면 인습이 되어 메트포르민의 함량이 저하되기 쉽고, 15 중량%를 초과하면 붕해 시간이 너무 길어져 상부 위장관 흡수에 지장을 초래할 수 있다.
상기 코팅층을 형성하는 방법은 상기한 성분들을 사용하여 정제층의 표면에 필름상의 코팅층을 형성할 수 있는 방법 중에서 당업자의 선택에 의하여 적절히 선택할 수 있으며, 유동층 코팅법, 팬 코팅법 등의 방법을 적용할 수 있다. 바람직하기로는 팬 코팅법을 사용하는 것이 좋다.
상기 코팅층은 필요에 따라 코팅을 수행할 경우 효과적인 코팅으로 활성 성분의 안정성을 확보할 수 있다.
상기와 같이 메트포르민과 서방성 고분자 중합체를 포함하는 조성물을 조절된 압력으로 수분이 추가적으로 부가되지 않은 건조된 환경에서 건식 슬러그화한 후 건식 과립법에 따라 타정하여 정제층을 형성시키고, 그 표면에 필름상의 코팅층을 형성시킴으로써, 기존의 제품과 비교하여 체내에서 일정한 속도로 24시간 동안 서서히 방출시킬 수 있는 우수한 용출특성을 나타내어 1일 1회 투여로 24시간 동안 일정한 혈중 농도를 유지하며, 또한 생물학적 동등성을 나타낼 수 있는 효과가 있다.
이하 본 발명을 실시예에 의거하여 구체적으로 설명하겠는바, 본 발명이 다음 실시예에 의하여 한정되는 것은 아니다.
실시예 1 : 메트포르민 500 ㎎ 함유 정제의 제조
다음 표 1에 나타낸 함량과 같이 염산 메트포르민과 히드록시프로필 메틸셀룰로오스 및 경질 무수 규산을 넣고 혼합하여 16 ∼ 17 ㎫ 의 압력조건으로 롤러 컴팩팅하여 슬러그화 하였다. 이를 14 mesh(1.4 mm) 체로 정립한 뒤 스테아린산 마그네슘을 넣고 혼합한 후, 타정하여 정제층을 제조하였으며, 하이코터(SFC-30N, 세종 기계, 한국)로서 오파드라이 OY-C-7000A를 코팅 기제로 하여 필름 코팅층을 형성하여 메트포르민이 500㎎ 함유된 메트포르민 서방정(Metformin XR tablet 500 mg)을 제조하였다.
실시예 2 : 메트포르민 500 ㎎ 함유 정제의 제조
다음 표 1에 나타낸 함량과 같이 염산 메트포르민과 카르복시메틸셀룰오스 나트륨, 아비셀 PH101 및 경질 무수 규산을 넣고 실시예 1의 제조 방법과 동일한 방법으로 메트포르민이 500㎎ 함유된 메트포르민 서방정(Metformin XR tablet 500 mg)을 제조하였다.
실시예 3 : 메트포르민 500 ㎎ 함유 정제의 제조
다음 표 1에 나타낸 함량과 같이 염산 메트포르민과 구아검 및 경질 무수 규산을 넣고 실시예 1의 제조 방법과 동일한 방법으로 메트포르민이 500㎎ 함유된 메트포르민 서방정(Metformin XR tablet 500 mg)을 제조하였다.
실시예 4 : 메트포르민 750 ㎎ 함유 정제의 제조
다음 표 1에 나타낸 함량과 같이 염산 메트포르민과 히드록시프로필 메틸셀룰로오스 및 경질 무수 규산을 넣고 실시예 1의 제조 방법과 동일한 방법으로 메트포르민이 750㎎ 함유된 메트포르민 서방정(Metformin XR tablet 750 mg)을 제조하였다.
비교예 1 : 메트포르민 500 ㎎ 함유 정제의 제조
다음 표 1의 나타낸 함량과 같이 염산 메트포르민과 히드록시프로필 메틸셀룰로오스 및 경질 무수 규산 및 스테아린산 마그네슘을 넣고 혼합하여, 직타법으로 타정하여 정제 층을 제조하였으며, 하이코터(SFC-30N, 세종 기계, 한국)로서 오파드라이 OY-C-7000A를 코팅 기제로 하여 필름 코팅 층을 형성하여 메트포르민이 500㎎ 함유된 메트포르민 서방정(Metformin XR tablet 500 mg)을 제조하였다.
비교예 2 : 메트포르민 750㎎ 함유 정제의 제조
다음 표 1의 나타낸 함량과 같이 염산 메트포르민과 히드록시프로필 메틸셀룰로오스 및 경질 무수 규산 및 스테아린산 마그네슘을 넣고 혼합하여, 비교예 1의 제조 방법과 동일한 방법으로 메트포르민이 750㎎ 함유된 메트포르민 서방정(Metformin XR tablet 750 mg)을 제조하였다.
| 구성성분 |
조성비(mg/tablet) |
| 실시예1 |
실시예2 |
실시예3 |
실시예4 |
비교예1 |
비교예2 |
| 메트포르민염산염 |
500 |
500 |
500 |
750 |
500 |
750 |
| 히드록시프로필 메틸셀룰로오스1) |
500 |
- |
- |
500 |
500 |
500 |
| 카르복시메틸셀룰로오스 나트륨2) |
- |
450 |
- |
- |
- |
- |
| 구아검 |
- |
- |
500 |
- |
- |
- |
| 아비셀 PH1013) |
- |
41 |
- |
- |
- |
- |
| 에어로실 2004) |
5 |
5 |
5 |
7.5 |
5 |
7.5 |
| 마그네슘 스테아레이트 |
5 |
4 |
4 |
7.5 |
5 |
7.5 |
| 오파드라이 OY-C-7000A5) |
40 |
40 |
40 |
60 |
40 |
60 |
| 합계 |
1050 |
1040 |
1040 |
1325 |
1050 |
1325 |
| 1)다우 케미칼사 제품, 미국 2)보락사 제품, 한국 3)아사히사 제품, 일본 4)데구사사 제품, 독일 5)칼라콘사 제품, 미국 |
실험예 1 : 물성 비교시험
상기 실시예 1, 4의 원료를 혼합한 후 16 ∼ 17 ㎫의 강한 압력으로 슬러그화 한 후 과립화한 반제품인 압축 과립과 이와 동일한 구성성분 및 함량으로 이루어진비교예 1, 2의 제제 설계에 의하여 혼합 과정을 거친 반제품의 압축성과 유동성을 다음과 같은 방법으로 측정하여 서로의 물성을 비교 시험을 하였다.
롤러 컴팩팅을 하기 전 및 후의 반제품의 파우더의 물성 비교를 위해 가비중 (Tapped density), 유동성을 측정하였으며, 타정 후 정제의 부피의 감소 정도를 비교하기 위해 같은 중량의 정제, 동일한 개수의 부피를 측정하였다.
상기 가비중(Tapped density)은 ERWEKA 사의 가비중 측정기(Tapped Volumeter SVM102)를 사용하였으며, 유동성은 ERWEKA사의 과립 유동성 측정기(Granulate Tester GT-L)를 사용하여 측정하였다.
| 조성 |
가비중 (mg/ml) |
유동성 (g/s) |
타정 후 정제의 부피 (ml/20정) |
| 실시예 1 |
0.69 |
10.8 |
15.7 |
| 비교예 1 |
0.61 |
6.1 |
18.0 |
| 실시예 4 |
0.72 |
9.6 |
22.2 |
| 비교예 2 |
0.64 |
6.3 |
25.5 |
상기 표2 에서와 같이 강한 압력을 가하여 슬러그를 만들고 이를 정립하여 건식 과립(실시예 1, 4)의 물성과 슬러그화 단계를 거치지 않은 상태(비교예 1, 2)에서의 물성을 비교한 결과, 유동성 및 압축성이 매우 향상됨을 확인할 수 있으며, 정제의 단위 중량 당 부피도 원하는 수준으로 감소시킬 수 있었다.
이로서 굳이 공정이 복잡하고 추가의 설비를 필요로 하는 제조 방법을 거치지 않더라도 작업 공정이 간단한 건식 과립법으로서 타정이 가능하기 때문에 이는 상업적 규모로 생산하기에 가장 바람직한 형태의 제어 방출제제이다.
또한, 타정 후 형성된 단일상의 정제층으로 이루어진 정제의 부피가 10 ∼ 20부피 % 감소하여 복용시의 편의를 부여한다.
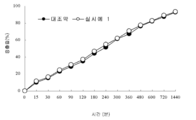
실험예 2 : 비교 용출시험(comparative dissolution profile test)
상기 실시예 1 에 의하여 제조된 본 발명의 메트포르민 서방정과 대조약으로서 시판되는 제품(미국 BMS 사의 Glucophage XL)를 사용하여 대한 약전 일반 시험법 중 용출 시험항에 패들(paddle)법으로 용출 특성을 측정하였으며, 그 결과를 첨부도면 도 1과 같이 나타내었다.
도 1에 의하면 본 발명의 메트포르민 서방정은 상기 조건에서 용출 시험시 대조제제와 비교하여 동등한 용출특성을 나타내는 것으로 확인되었으며, 제시된 대조 제제가 2상 서방형 정제(한국특허출원 제2000-7010280)로 복잡한 공정으로 이루어진 것과는 달리 건식 과립법이라는 간단한 방법을 적용하여 균일한 용출특성을 나타내는 서방정을 제조할 수 있음을 확인하였다.
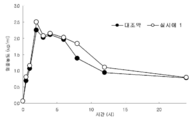
실험예 3 : 생물학적 동등성 시험(bioequivalency)
상기 실시예 1 에 의하여 제조된 본 발명의 메트포르민 서방정과 대조제제로서 시판되는 제품(미국 BMS 사의 Glucophage XL)를 사용하여 생물학적 동등성을 측정하였으며, 그 결과를 첨부도면 도 2와 다음 표 3에 나타내었다.
도 2에 의하면 본 발명의 메트포르민 서방정은 기존의 제품과 비교하여 생물학적 동등성을 나타내는 것으로 확인되었다.
| 구분 |
Cmax(㎍/ml) |
AUC(㎍.hr/ml) |
| 실시예 1 |
2.4078 |
45.1619 |
| 대조약 |
2.2517 |
43.7521 |