JP2014512812A - Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 - Google Patents
Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 Download PDFInfo
- Publication number
- JP2014512812A JP2014512812A JP2014502699A JP2014502699A JP2014512812A JP 2014512812 A JP2014512812 A JP 2014512812A JP 2014502699 A JP2014502699 A JP 2014502699A JP 2014502699 A JP2014502699 A JP 2014502699A JP 2014512812 A JP2014512812 A JP 2014512812A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- seq
- nos
- amino acid
- cdr2
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 175
- 108010074032 HLA-A2 Antigen Proteins 0.000 title claims description 39
- 102000025850 HLA-A2 Antigen Human genes 0.000 title claims description 39
- 102000040856 WT1 Human genes 0.000 title claims description 24
- 108700020467 WT1 Proteins 0.000 title claims description 24
- 210000001744 T-lymphocyte Anatomy 0.000 title description 20
- 230000027455 binding Effects 0.000 claims abstract description 131
- 239000000427 antigen Substances 0.000 claims abstract description 90
- 108091007433 antigens Proteins 0.000 claims abstract description 90
- 102000036639 antigens Human genes 0.000 claims abstract description 90
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 70
- 239000012634 fragment Substances 0.000 claims abstract description 49
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 31
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 24
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 20
- 238000011282 treatment Methods 0.000 claims abstract description 20
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims abstract description 18
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims abstract description 15
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims abstract description 12
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims abstract description 11
- 206010035226 Plasma cell myeloma Diseases 0.000 claims abstract description 11
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims abstract description 11
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims abstract description 10
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims abstract description 6
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims abstract description 6
- 206010006187 Breast cancer Diseases 0.000 claims abstract description 5
- 208000026310 Breast neoplasm Diseases 0.000 claims abstract description 5
- 208000034578 Multiple myelomas Diseases 0.000 claims abstract description 5
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims abstract description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims abstract description 5
- 206010061535 Ovarian neoplasm Diseases 0.000 claims abstract description 5
- 206010060862 Prostate cancer Diseases 0.000 claims abstract description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims abstract description 5
- 208000025113 myeloid leukemia Diseases 0.000 claims abstract description 4
- 238000000034 method Methods 0.000 claims description 56
- 108010088729 HLA-A*02:01 antigen Proteins 0.000 claims description 55
- 150000007523 nucleic acids Chemical class 0.000 claims description 29
- 108020004707 nucleic acids Proteins 0.000 claims description 27
- 102000039446 nucleic acids Human genes 0.000 claims description 27
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 17
- 201000010099 disease Diseases 0.000 claims description 16
- 108010081208 RMFPNAPYL Proteins 0.000 claims description 15
- 210000001519 tissue Anatomy 0.000 claims description 15
- 150000001413 amino acids Chemical class 0.000 claims description 13
- 239000003814 drug Substances 0.000 claims description 13
- 239000013598 vector Substances 0.000 claims description 13
- 231100000433 cytotoxic Toxicity 0.000 claims description 11
- 230000001472 cytotoxic effect Effects 0.000 claims description 11
- 206010027406 Mesothelioma Diseases 0.000 claims description 10
- 229940124597 therapeutic agent Drugs 0.000 claims description 7
- 239000003053 toxin Substances 0.000 claims description 7
- 231100000765 toxin Toxicity 0.000 claims description 7
- 229910052720 vanadium Inorganic materials 0.000 claims description 7
- 229940079593 drug Drugs 0.000 claims description 6
- 201000000050 myeloid neoplasm Diseases 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 5
- 239000008194 pharmaceutical composition Substances 0.000 claims description 5
- 206010000830 Acute leukaemia Diseases 0.000 claims description 4
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 4
- 208000005017 glioblastoma Diseases 0.000 claims description 4
- 208000024207 chronic leukemia Diseases 0.000 claims description 3
- 230000002147 killing effect Effects 0.000 claims description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 claims 7
- 239000002773 nucleotide Substances 0.000 claims 5
- 125000003729 nucleotide group Chemical group 0.000 claims 5
- 108091000831 antigen binding proteins Proteins 0.000 abstract description 37
- 102000025171 antigen binding proteins Human genes 0.000 abstract description 37
- 108020001507 fusion proteins Proteins 0.000 abstract description 13
- 102000037865 fusion proteins Human genes 0.000 abstract description 13
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 abstract description 12
- 238000006467 substitution reaction Methods 0.000 abstract description 8
- 101710127857 Wilms tumor protein Proteins 0.000 abstract description 7
- 102100022748 Wilms tumor protein Human genes 0.000 abstract description 7
- 108010021625 Immunoglobulin Fragments Proteins 0.000 abstract description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 abstract description 3
- 210000004027 cell Anatomy 0.000 description 206
- 102000004196 processed proteins & peptides Human genes 0.000 description 46
- 239000012636 effector Substances 0.000 description 29
- 208000032839 leukemia Diseases 0.000 description 25
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 21
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 17
- 238000000684 flow cytometry Methods 0.000 description 17
- 235000018102 proteins Nutrition 0.000 description 17
- 238000002823 phage display Methods 0.000 description 15
- 210000004881 tumor cell Anatomy 0.000 description 15
- 241000699670 Mus sp. Species 0.000 description 14
- 230000000694 effects Effects 0.000 description 14
- 108091008874 T cell receptors Proteins 0.000 description 12
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 12
- 235000001014 amino acid Nutrition 0.000 description 12
- 230000009870 specific binding Effects 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 230000001404 mediated effect Effects 0.000 description 10
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 10
- 108020004999 messenger RNA Proteins 0.000 description 9
- 101100454807 Caenorhabditis elegans lgg-1 gene Proteins 0.000 description 8
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 8
- 239000002299 complementary DNA Substances 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 238000004091 panning Methods 0.000 description 8
- 238000010186 staining Methods 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 7
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 7
- -1 antibody Proteins 0.000 description 7
- 238000013459 approach Methods 0.000 description 7
- 238000003556 assay Methods 0.000 description 7
- 239000012642 immune effector Substances 0.000 description 7
- 229940121354 immunomodulator Drugs 0.000 description 7
- 238000009169 immunotherapy Methods 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 235000004279 alanine Nutrition 0.000 description 6
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 108700012359 toxins Proteins 0.000 description 6
- 102000043129 MHC class I family Human genes 0.000 description 5
- 108091054437 MHC class I family Proteins 0.000 description 5
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 5
- 239000002246 antineoplastic agent Substances 0.000 description 5
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 5
- 231100000599 cytotoxic agent Toxicity 0.000 description 5
- 231100000135 cytotoxicity Toxicity 0.000 description 5
- 230000003013 cytotoxicity Effects 0.000 description 5
- 239000013604 expression vector Substances 0.000 description 5
- 230000003834 intracellular effect Effects 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000004448 titration Methods 0.000 description 5
- 101100424688 Arabidopsis thaliana ESK1 gene Proteins 0.000 description 4
- 101100454808 Caenorhabditis elegans lgg-2 gene Proteins 0.000 description 4
- 101100217502 Caenorhabditis elegans lgg-3 gene Proteins 0.000 description 4
- 241000283707 Capra Species 0.000 description 4
- 241000699802 Cricetulus griseus Species 0.000 description 4
- 102000011786 HLA-A Antigens Human genes 0.000 description 4
- 108010075704 HLA-A Antigens Proteins 0.000 description 4
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 4
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 4
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 4
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000000259 anti-tumor effect Effects 0.000 description 4
- 230000030741 antigen processing and presentation Effects 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 102000015736 beta 2-Microglobulin Human genes 0.000 description 4
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 4
- 230000002950 deficient Effects 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 210000000987 immune system Anatomy 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 210000001672 ovary Anatomy 0.000 description 4
- 230000001575 pathological effect Effects 0.000 description 4
- 238000010647 peptide synthesis reaction Methods 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 108010032595 Antibody Binding Sites Proteins 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 101100075830 Caenorhabditis elegans mab-5 gene Proteins 0.000 description 3
- 102000014914 Carrier Proteins Human genes 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 3
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 108700020796 Oncogene Proteins 0.000 description 3
- 102000043276 Oncogene Human genes 0.000 description 3
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 3
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- 108010090804 Streptavidin Proteins 0.000 description 3
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 3
- 108091008324 binding proteins Proteins 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000001185 bone marrow Anatomy 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 239000002619 cytotoxin Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 230000036737 immune function Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 210000000822 natural killer cell Anatomy 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 238000003127 radioimmunoassay Methods 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 229940126622 therapeutic monoclonal antibody Drugs 0.000 description 3
- 238000002255 vaccination Methods 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 2
- 101100189167 Capsicum chinense VAMT gene Proteins 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 208000006168 Ewing Sarcoma Diseases 0.000 description 2
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- MVZGYPSXNDCANY-UHFFFAOYSA-N N-[4-[3-chloro-4-[(3-fluorophenyl)methoxy]anilino]-6-quinazolinyl]-2-propenamide Chemical compound FC1=CC=CC(COC=2C(=CC(NC=3C4=CC(NC(=O)C=C)=CC=C4N=CN=3)=CC=2)Cl)=C1 MVZGYPSXNDCANY-UHFFFAOYSA-N 0.000 description 2
- 102000007999 Nuclear Proteins Human genes 0.000 description 2
- 108010089610 Nuclear Proteins Proteins 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 210000003969 blast cell Anatomy 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 230000003915 cell function Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- VDQQXEISLMTGAB-UHFFFAOYSA-N chloramine T Chemical compound [Na+].CC1=CC=C(S(=O)(=O)[N-]Cl)C=C1 VDQQXEISLMTGAB-UHFFFAOYSA-N 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 239000002254 cytotoxic agent Substances 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 230000033581 fucosylation Effects 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 229940127121 immunoconjugate Drugs 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000009851 immunogenic response Effects 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 108091008819 oncoproteins Proteins 0.000 description 2
- 102000027450 oncoproteins Human genes 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 238000003757 reverse transcription PCR Methods 0.000 description 2
- 238000013391 scatchard analysis Methods 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 229960001479 tosylchloramide sodium Drugs 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- VYZAMTAEIAYCRO-BJUDXGSMSA-N Chromium-51 Chemical compound [51Cr] VYZAMTAEIAYCRO-BJUDXGSMSA-N 0.000 description 1
- 101710094648 Coat protein Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 101710112752 Cytotoxin Proteins 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 235000017274 Diospyros sandwicensis Nutrition 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 108700004714 Gelonium multiflorum GEL Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 1
- 102000006354 HLA-DR Antigens Human genes 0.000 description 1
- 108010058597 HLA-DR Antigens Proteins 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 1
- 101000633778 Homo sapiens SLAM family member 5 Proteins 0.000 description 1
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 1
- 101000621309 Homo sapiens Wilms tumor protein Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 241000282838 Lama Species 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 229940110339 Long-acting muscarinic antagonist Drugs 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 1
- 101710141454 Nucleoprotein Proteins 0.000 description 1
- 102000011931 Nucleoproteins Human genes 0.000 description 1
- 108010061100 Nucleoproteins Proteins 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 101710083689 Probable capsid protein Proteins 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 241000084978 Rena Species 0.000 description 1
- 208000007660 Residual Neoplasm Diseases 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 102100029216 SLAM family member 5 Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 108010006886 Vitrogen Proteins 0.000 description 1
- 108700025700 Wilms Tumor Genes Proteins 0.000 description 1
- 108091007916 Zinc finger transcription factors Proteins 0.000 description 1
- 102000038627 Zinc finger transcription factors Human genes 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 230000036783 anaphylactic response Effects 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 238000003975 animal breeding Methods 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 238000011230 antibody-based therapy Methods 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 108010044540 auristatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012867 bioactive agent Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000010370 cell cloning Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 230000005859 cell recognition Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 231100000050 cytotoxic potential Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 229960002743 glutamine Drugs 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000009033 hematopoietic malignancy Effects 0.000 description 1
- 102000046004 human WT1 Human genes 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 239000002596 immunotoxin Substances 0.000 description 1
- 230000002637 immunotoxin Effects 0.000 description 1
- 229940051026 immunotoxin Drugs 0.000 description 1
- 231100000608 immunotoxin Toxicity 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 108091008042 inhibitory receptors Proteins 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000005305 interferometry Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000002843 lactate dehydrogenase assay Methods 0.000 description 1
- 238000011031 large-scale manufacturing process Methods 0.000 description 1
- 238000004989 laser desorption mass spectroscopy Methods 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 238000002625 monoclonal antibody therapy Methods 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 102000044158 nucleic acid binding protein Human genes 0.000 description 1
- 108700020942 nucleic acid binding protein Proteins 0.000 description 1
- 230000030648 nucleus localization Effects 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000005909 tumor killing Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/5748—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving oncogenic proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oncology (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Hospice & Palliative Care (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurology (AREA)
- Reproductive Health (AREA)
- Endocrinology (AREA)
Abstract
Description
以下の発明は、米国国立衛生研究所によって授与された契約番号P01CA23766及びR01CA55349の下で、米国政府支援によりなされたものである。米国政府は、この発明において一定の権利を有する。
本出願は配列表を含む。配列表は、3314013AWO_Sequence_Listing_ST25.txtのファイル名で2112年3月29日に作成されたASCII形式のファイルとして提出される。電子フォーマットでの配列表の情報は、参照によりその全体が本明細書に取り込まれる。
本発明は、一般に細胞質タンパク質に対する抗体に関する。特に、本発明は、ウィルムス腫瘍遺伝子タンパク質(WT1)に対する抗体であって、主要な組織適合抗原と一体となってWT1ペプチドを認識する特異的抗体にも関する。
ウィルムス腫瘍遺伝子タンパク質(WT1)は、大抵の白血病及び広い範囲の癌の免疫療法の魅力的な標的である。WT1は、通常は、胚発生の間の中胚葉性組織において発現されるジンクフィンガー転写因子である。正常な成体組織において、WT1発現は、CD34造血幹細胞内で低レベルに制限されるが、多系統の白血病及び広い範囲の固形腫瘍(1−2)において過剰発現される。最近では、WT1発現は微小残存病変のマーカーになることが報告されている。形態学的寛解にある急性骨髄性白血病(AML)患者における転写レベルの増加は明白な臨床的再発の前兆であった(3、4)。さらに、WT1に対する抗体は、造血性悪性腫瘍及び固形腫瘍を有する患者において検出され、このことは、WT1が高い免疫原性抗原であることを示す(7)。
本出願による開示は、細胞質/細胞内タンパク質、例えばWT1腫瘍タンパク質を標的とすることができる抗体などの抗原結合性タンパク質を、識別し特徴付ける。開示される抗体は、一般的に、細胞による提示及びWT1タンパク質の抗原処理に続いて細胞表面に現れるものとして、ペプチド/MHC複合体を標的とする。この点において、ペプチドがMHC抗原に結合したときに、MHCで拘束される現象において、抗体が特異的に認識する能力を有し、ペプチドに結合する能力を有するということから、T細胞受容体を模倣する。ペプチド/MHC複合体は、一般的に、T細胞へのWT1タンパク質の提示及び抗原処理に続いて細胞表面に現れるものとして、抗原を再現する。
前記免疫結合体は、細胞毒素、検出可能な標識、放射性同位体、治療剤、結合タンパク質、又は第二のアミノ酸配列を有する分子である第二成分を含む。第二成分が結合タンパク質又は二次抗体である場合、結合タンパク質又は二次抗体は、最初に特定されたHLA−ペプチド複合体とは異なる標的に対する結合特異性を有する。
T2細胞が、ペプチドの存在下でインキュベートされた後、フローサイトメトリーを使用して、抗原パルス細胞を選択的に認識するために蛍光標識抗体を使用することができた。
ある実施形態において、本発明は、HLA拘束性ペプチドに特異的に結合する抗体の生成に関し、前記ペプチドは、ペプチド/MHC複合体の一部として提示されたときに、特異的な細胞傷害性T細胞応答を誘発することができる。HLAクラスI分子は、CD8+細胞傷害性Tリンパ球の長さで約8−12のアミノ酸の、内在性誘導ペプチドを示す。本発明の方法において使用されるペプチドは、一般的に約6〜22個の長さのアミノ酸であり、いくつかの実施態様では約9及び20個のアミノ酸の長さであり、対象のタンパク質に由来するアミノ酸配列、例えば、ヒトWT1タンパク質(GenBankアクセッション番号P19544)又はそのアナログを含む。
次のステップは、結合しないか、若しくは弱い親和性で結合するかのどちらかのヒトファージディスプレイライブラリーにおけるファージから高親和性で関心のある標的抗体に結合するファージの選択である。これは、例えば、ビーズ又は哺乳動物細胞に続いて、結合していないファージを除去し、及び特異的に結合したファージを溶出することにより、固体支持体に結合している抗原に対するファージの結合を反復することによって達成される。ある実施形態では、抗原は、例えば、ストレプトアビジン結合ダイナビーズM−280への固定化のためにまず、ビオチン化される。ファージライブラリーを、細胞、ビーズ又は他の固体支持体とともにインキュベートし、結合していないファージは洗浄により除去する。結合するクローンを選択し、試験する。
モノクローナル抗体は、細胞毒、放射性核種、又は免疫調節サイトカインの抗体に基づいた送達を含む、生物活性剤を腫瘍部位へ標的送達する好ましい媒体を表している。本発明の抗体と治療薬の結合体は、薬物(カリケアミシン、オーリスタチン、ドキソルビシンなど)、又は毒素(リシン、ジフテリア、ゲロニンなど)、又はアルファ若しくはベータ粒子を放出する放射性同位体(90Y、131I、225Ac、213Bi、223Ra、及び227Thなど)、炎症性ペプチド(IL2、TNF、IFN−γなど)が本発明に包含されるが、これに限定されるものではない。
細胞サンプル、細胞株、及び抗体
メモリアルスローンケタリングがんセンター治験審査委員会のインフォームドコンセントにプロトコルが承認された後、HLA型の健康ドナー及び患者からの末梢血単核細胞(PBMC)を、フィコール密度遠心分離によって得た。ヒト中皮腫細胞株を得るためのソースは、前述されている(29)。細胞株は、H−Meso1A、JMN、VAMT、H2452、H2373、H28、MSTO、Meso11、Meso34、Meso37、Meso47、及びMeso56を含む。すべての細胞は、メモリアルスローンケタリングがんセンターの細胞免疫学教室によってHLA型とされた。白血病細胞株LAMA81、BV173、及び697、(WT1+、A0201+)は、HJ Stauss博士(ロンドン大学、ロンドン、イギリス)によって,親切にも提供された。メラノーマ細胞株MeWo(WT1−、A201+)、SKLY16(B細胞リンパ腫、WT1‐、A0201+)、K562、RwLeu4、及びHL60、全てのWT1+白血病、及びTAP欠損T2細胞株を、アメリカン・タイプ・カルチャー・コレクションから得た。細胞株を、5%FCS、ペニシリン、ストレプトマイシン、グルタミン2mmol/L、及び2−メルカプトエタノールを補充したRPMI1640中で、37C、5%のCO2で培養した。
すべてのペプチドは、Genemed Synthesis社(サンアントニオ、テキサス州)によって合成され、購入した。ペプチドは、>90%の純度であった(表1)。ペプチドを、DMSOに溶解し、生理食塩水5mg/mLで希釈し、−180℃で凍結させた。ビオチン化された単鎖のWT1ペプチド/HLA−A0201とRHAMM−3/HLA−A0201複合体は、MSKCCのテトラマー施設(Tetramer facility)において、組換えHLA−A2とβ2ミクログロブリン(β2M)とともにペプチドをリフォールディングすることにより合成した。
8−10週齢のNOD scid gamma(NSG)として知られるNOD.Cg−Prkdc scid IL2rgtm1Wjl/SzJマウスを、ジャクソン研究所(バーハーバー、メーン州)から購入し、又はMSKCC動物飼育施設から得た。
フローサイトメトリー分析
細胞表面染色のため、細胞を、適切なモノクローナル抗体とともに氷上で30分間インキュベートし、洗浄し、必要なときは、二次抗体試薬とともにインキュベートした。フローサイトメトリーのデータは、FACS Calibur(Becton Dickinson)上に集め、FlowJo V8.7.1及び9.4.8ソフトウェアで分析した。
ヒトscFv抗体ファージディスプレイライブラリーを、モノクローナル抗体クローンの選択のために使用した。プラスチックの表面に固定化することによるMHC1複合体導入の立体構造変化を低減するために、従来のプレートパニング(plate panning)の代わりに、溶液パニング法(solution panning method)を用いた。手短に言うと、まず、ビオチン化抗原を、ヒトscFvファージライブラリーと混合し、次いで、抗原scFv抗体複合体を、磁気ラックを通してストレプトアビジン結合ダイナビーズM−280によって、プルダウンした。結合したクローンを、その後溶出し、大腸菌XL1−ブルーに感染させるために使用した。細菌中で発現させたscFvファージクローンを、精製した(35,36)。パニングを、HLA−A0201/WT1複合体に特異的に結合したscFvファージクローンを豊富にするために3−4サイクル行った。陽性のクローンを、ビオチン化された単鎖HLA−A0201/WT1ペプチド複合体に対する標準的なELISA法によって決定した。陽性クローンをさらに、TAP欠損、HLA−A0201+細胞株、T2を使用して、フローサイトメトリーによる生細胞表面上のHLA−A2/ペプチド複合体への結合について試験した。T2細胞を、20μg/mLβ2ミクログロブリンの存在下において、無血清RPMI1640培地中のペプチド(50μg/mL)で、一晩パルスした。細胞を洗浄し、染色を、以下の手順で行った。
選択したファージクローンの完全長ヒトIgG1を、前述(37)のように、HEK293及びチャイニーズハムスター卵巣(CHO)細胞株において作製した。手短に言うと、抗体の可変領域を、ヒトラムダ又はカッパ軽鎖定常領域及びヒトIgG1定常領域配列と一致させるとともに、哺乳動物発現ベクターにサブクローニングした。精製した完全長IgG抗体の分子量を、電気泳動によって、還元及び非還元条件下の両方で測定した。
本明細書において同定されている抗体及び抗原結合性タンパク質をコードする核酸は、組換え免疫エフェクター細胞の作製に用いることができる。遺伝子改変したT細胞を発生させる方法及びベクターは、例えば、当技術分野で公知である(Brentjens et al.,Safety and persistence of adoptively transferred autologous CD19−targeted T cells in patients with relapsed or chemotherapy refractory B−cell leukemias in Blood 118(18):4817−4828,November 2011参照)。
初めに、WT1ペプチド/A2複合体の完全ヒトIgG1モノクローナル抗体の特異性を、RMF又はRHANN−R3コントロールペプチドあり、又はなしの状態で、パルスしたT2細胞を染色することにより決定した。続いて、二次ヤギF(ab)2抗ヒトIgGモノクローナル抗体を、PE又はFITCに結合させた。蛍光強度は、フローサイトメトリーにより測定した。同様の方法を、新鮮腫瘍細胞及び細胞株に対するモノクローナル抗体の結合を決定するために用いた。
WT1ab1を、125−I(PerkinElmer)をクロラミン−T法(38)を用いて標識した。抗体100μgを、1mCi−125−I及びクロラミン‐T20μgと反応させ、ピロ亜硫酸ナトリウム200μgとクエンチングし、その後、PBS中の2%ウシ血清アルブミンと平衡させた10DGカラム(company)を用いて、遊離した125−Iと分離した。生成物の比放射能は、7−8mCi/mgの範囲であった。
ADCCに使用される標的細胞は、WT1若しくはRHAAM−3ペプチドあり、又はなしの状態でパルスしたT2細胞、及びペプチドでパルスをしなかった腫瘍細胞株である。WT1ab1又は様々な濃度におけるそのアイソタイプコントロールヒトIgG1を、標的細胞及び新鮮な末梢血単核細胞とともに、異なったエフェクター:標的(E:T)比率で16時間インキュベートした。上清を採取し、それらの操作の後に、細胞傷害性を、Promega社のCytotox 96 non−radioreactiveキットを用いて、LDH放出アッセイにより測定した。細胞傷害性をまた、標準4時間51Cr放出アッセイにより測定した。
luc/GFPをコードしているプラスミドを含むレンチウイルス(39)を用いて、高レベル発現のGFP−ルシフェラーゼ融合タンパク質を作出した。単細胞クローニングを使用して、高レベルのGFPの発現を示す細胞のみを、フローサイトメトリー分析により選択し、維持し、動物実験に使用した。
BV173ヒト白血病細胞200万個を、NSGマウスに静脈内注射した。5日目に、腫瘍の生着を、処置された全てのマウスにおけるホタルルシフェラーゼイメージングによって確認した。次いで、マウスを異なる処置群に無作為に分けた。6日目と10日目に、モノクローナル抗体WT1ab1又はアイソタイプコントロールモノクローナル抗体を静脈内注射した。モノクローナル抗体あり、又はなしの状態で、ヒトエフェクター細胞を受けた動物において、細胞(CD34及びCD3枯渇健康ドナーヒト末梢血単核細胞)を、モノクローナル抗体注入の4時間前にマウス(107細胞/マウス)に静脈内注射した。腫瘍の増殖を、一週間に1回から2回発光イメージングにより評価し、臨床活性は毎日評価した。
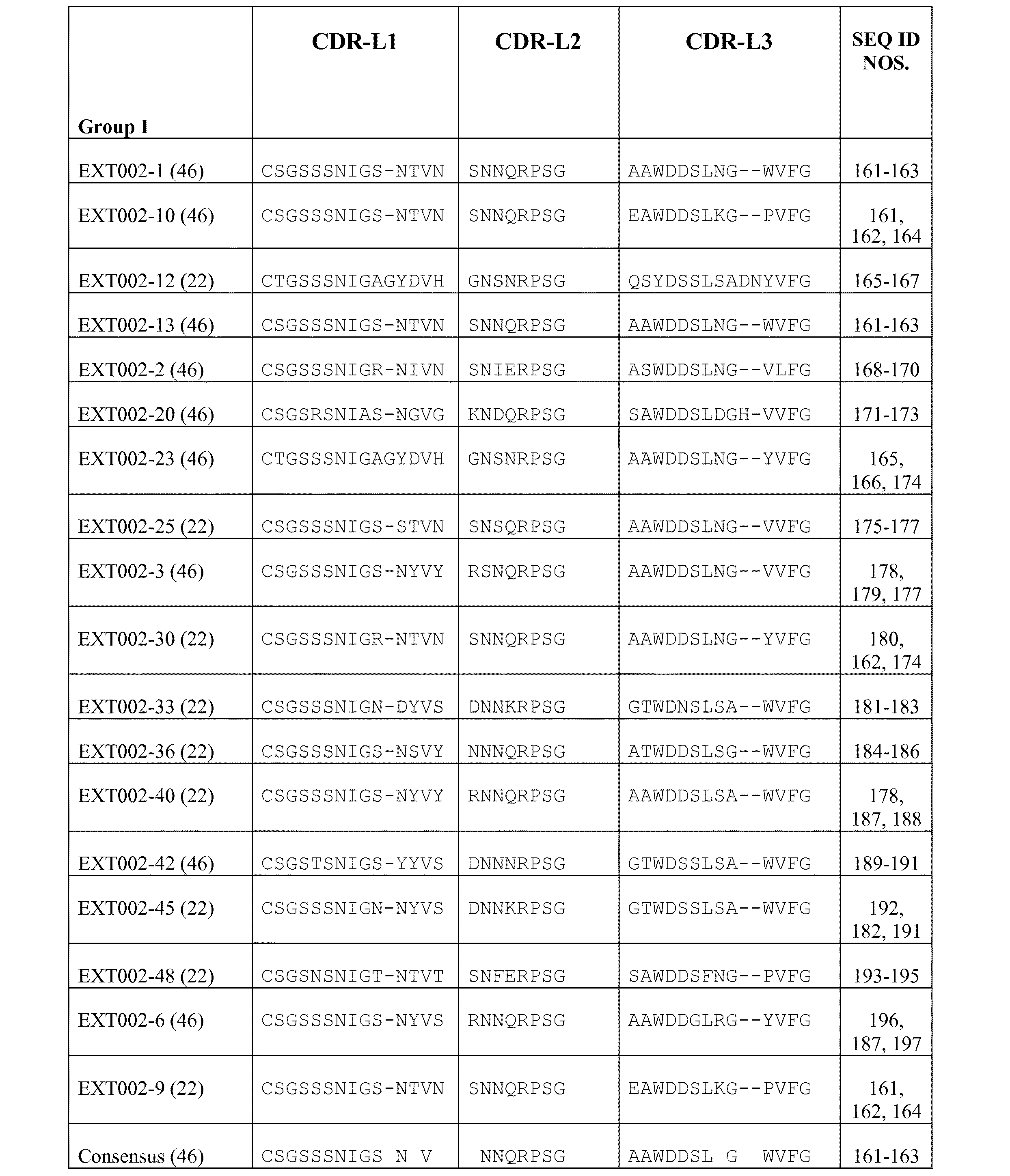
WT1特異的scFVの選択を、WT1の126〜134(配列番号1 RMFPNAPYL)のアミノ酸を含む9merのWT1由来のペプチドを用いて達成した。このペプチドは、WT1陽性腫瘍細胞を死滅させる細胞傷害性CD8+T細胞を誘導するために、HLA−A0201により提示され、処理されることが示されている。
WTI/A2に関するファージパニングの概要
ファージディスプレイ技術により、抗原特異性scFv及びFab断片の迅速な選択及び生産ができるようになり、これ自体が有用であり、又は、完全抗体、抗原結合性タンパク質、又はその抗原結合性断片を提供するためにさらに開発することができる。Fcドメインを有する完全モノクローナル抗体は、scFv及びFab抗体に比べて多くの利点を有している。まず、完全長抗体のみがFcドメインにより媒介されるCDC及びADCCのような免疫学的機能を発揮する。第二に、二価のモノクローナル抗体は、単量体のFab抗体よりも強い抗原結合親和性を提供する。第三に、血漿内半減期と腎クリアランスは、Fab及び二価のモノクローナル抗体とは異なるものになる。各々の特定の特徴および利点は、計画したエフェクター戦略に合わせることができる。第四に、二価のモノクローナル抗体を、scFv及びFabよりも異なった割合で内在化することができ、免疫機能又は担体機能を変更する。アルファ放射体を、例えば、標的を殺すために内在化する必要はない。しかし、多くの薬物や毒素は、免疫複合体の内在化の恩恵を受ける。ある実施態様では、従って、一旦WT1p/A2に特異的なscFvクローンを、ファージディスプレイライブラリーから獲得すれば、scFvフラグメントを用いた完全長IgGモノクローナル抗体が生産される。
完全ヒトファージディスプレイライブラリーを用いたWT1p/A2複合体に特異的なscFvの選択
HLA−A0201/WT1ペプチド複合体に対するファージディスプレイは、HLA−A0201/WT1ペプチド複合体に特異的に結合したscFvファージクローンを豊富にするために3−4パニングラウンドを行った。WT1ペプチド/A2複合体に陽性の個々のscFvファージクローンは、ELISA及びさらなる特徴づけの対象となる独特のDNAをコードする配列を有するクローンにより決定された。scFvが生細胞上のWT1p/A2複合体に結合するかどうかをテストするために、陽性のファージクローンは、TAP欠損株であり、HLA−A0201陽性細胞株であるT2への結合について試験した。T2細胞は、外来性ペプチドを提示することができ、それゆえにHLA−A2分子によって提示される特定のエピトープを検出するために広く使用されている。合計35個のファージクローンは、T2細胞上でスクリーニングされ、15個のクローンは、WT1−RMFペプチドのみでパルスしたT2細胞への特異的結合を示し、T2細胞単独又はコントロールのRHAMM‐3ペプチド(図4)でパルスしたものに対しては特異的結合を示さなかった。scFvのファージクローンは、完全長二価モノクローナル抗体に比べ、scFvの親和性が弱いことを示唆するWT1−及びHLA−A2陽性のいくつかの腫瘍細胞株に結合することができなかった。
完全長ヒトIgG1の生成
CDCやADCCのような免疫機能は二価IgGのFcドメインに依存する。また、二価モノクローナル抗体は、単量体scFv抗体よりも強力な抗原結合親和性を提供する。したがって、HEK293及びチャイニーズハムスター卵巣(CHO)細胞において、15個の陽性のファージクローンのうち、6個のscFvファージクローンを、全長ヒトIgG1のモノクローナルを生成するように選択した。簡潔に言うと、モノクローナル抗体の可変領域を、ヒトλ若しくはκ軽鎖定常領域、及びヒトIgG1定常領域配列が一致する哺乳動物発現ベクターにサブクローニングした。精製した完全長IgG抗体は、還元及び非還元条件下(図8)の両方において、予測された分子量を示した。5個のクローンを首尾よくヒトIgG1に設計した。
《実施例3》
IgG1モノクローナル抗体の特異性及び結合親和性
ヒト細胞株への結合
初めに、RMF又はRHAMM−R3ペプチドあり、又はなしの状態で、パルスしたT2細胞を、モノクローナル抗体の結合特異性を決定するために使用した。WT1ab1を含む5個のヒトIgG1のうち3個では、WT1ペプチドのみでパルスしたT2細胞に対して特異的な結合を示し、T2単独又はコントロールペプチドRHAMM−R3でパルスしたT2に対しては、特異的な結合を示さなかった。モノクローナル抗体の結合親和性は、それらの親のscFvファージクローンに比べて、実質的に強化された(50〜100倍)。結合は、RMFペプチドで細胞をパルスすることによって大幅に強化されたが、5個のうち2個のモノクローナル抗体は、T2細胞単独又はコントロールペプチドRHAMM−R3でパルスしたものへの結合を示した。これは、これらの2個のモノクローナル抗体が、単独でもHLA−A2分子上のエピトープに対する高い親和性を有していたことを示唆しており、それゆえに、さらなる調査から除外された。それは複合体中のMHCクラスI分子のエピトープの優位性を考えると、ペプチド/MHC複合体に対して、このようなモノクローナル抗体を製造するための共通の問題となっているので、これは予想外ではなかった。また、複合体のモノクローナル抗体の正確な特異性は、二価IgG1モノクローナル抗体に比べて低い親和性のために、scFvの段階で容易に決定されることがない可能性を示唆している。
エピトープマッピング
より正確にWT1ab1認識のためのエピトープを調査するために、RMFペプチドの1、3、4、5、6、7及び8位をアラニンで置換し、T2細胞上でパルスし、WT1ab1の結合について試験した。RMFの2位および9位は、これらはHLA−A0201分子に結合するペプチドのアンカー残基として、そのまま残された。1位を除いて、他の位置でのアラニン置換は、ネイティブのRMFペプチド(図19)と比較して、WT1ab1結合に大きく影響しなかった。しかしながら、アラニン(WT1−A1−B)又はチロシン(WT1−A1)のどちらかによる1位の置換は、WT1ab1の結合を完全に排除した。両ペプチドが、HLA−A2分子、クローンBB7(図20)に特異的なモノクローナル抗体を使用してT2安定化アッセイにおける最も強い結合を示したように、結合の喪失は、HLA−A2分子へのペプチド結合親和性の減少によるものではなかった。これらの結果は、RMFペプチドの1位のアルギニンは、WT1ab1認識のための最も重要なものの一つであることを示している。位置における残基の役割は#2と9については、評価することができなかった。
細胞上のWT1ab1結合部位の定量化
125I標識WT1ab1を用いた放射免疫測定を、抗体のWT1+HLA−A0201+細胞株に対する特異性を確認するため、親和定数を決定するため、かつ細胞株のパネル上の細胞当たりの抗体結合部位の数を評価するために、用いた。JMN細胞への結合に基づくスキャッチャード分析は、約0.2nMの親和定数を示した(図23)。この数値は、Forte Bio装置を用いて、干渉分光法により確認した。125I標識WT1ab1を、抗体のWT1+ HLA−A0201+細胞株に対する特異性を確認するため、及び細胞株のパネル上の抗体結合部位の数を評価するために用いた(図24)。二価のモノクローナル抗体が表面上の1又は2の複合体に結合しているかどうかを、我々は判断できないため、細胞当たりのエピトープの合計は、モノクローナル抗体結合部位の数の二倍になることがある。再度、WT1ab1は、HLA−A0201及びWT1mRNAの両方に陽性である、JMN、ALL−3、BA25、BV173に結合したが、HLA−A0201陰性(HL60)又はWT1mRNA陰性(SKLY−16)には結合しなかった。WT1ab1は、HLA−A0201及びWT1の両方に陽性の697細胞には結合しなったが、低レベルのHLA−A0201(表12)を含んでおり、あるレベルのMHC複合体の総数が、WT1ab1結合のための十分なWT1ペプチドが存在するために必要であると確認した。RMFでパルスしたT2は最も多い数のモノクローナル抗体と結合し(50000/細胞)、次いで、細胞辺り〜6×103WT1ab1分子と結合したJMN細胞であり、これは、それぞれが一価又は二価抗体結合だと想定して、1細胞辺り、6×103及び1.2×104RMFペプチド/A2複合体を翻訳したこととなる。3個の白血病陽性細胞株は、1×103及び2×103WT1ab1分子、又は2×103及び4×103の結合部位と結合した(図24)。これらの結果を、定量的フローサイトメトリーによって確認した。
白血病患者サンプルに対するWT1ab1の結合
私たちは次に、一次性AML細胞上のRMFエピトープをWT1ab1分子が探知することができるかどうかを調査した。放射免疫測定は、HLA−A2陽性及びWT1−mRNA+である患者1のAML芽球に対する、WT1AB1の有意な結合を示した。WT1ab1は、細胞集団全体の83%以上の割合を占めるCD33+及びCD34+二重陽性細胞に結合した(図25)。WT1ab1は、HLA−A2陽性だがmRNA陰性、又はHLA−A2陰性のいずれかである他の3人の細胞には結合しなかった。WT1ab1は、HLA−A2陽性又はHLA−A2陰性のいずれかである健康なドナーからの末梢血単核細胞には結合しなかった。結果をフローサイトメトリー分析によって確認した。WT1AB1はA0201陰性の患者からの芽球に有意な結合を示さなかった。結果は、細胞のmRNA発現で得られた結果と一致した。これらのデータにより、白血病細胞の表面上のRMFp/HLA−A0201のレベルは、WT1ab1の反応性のために十分であり、WT1陰性健康細胞のレベルが重要ではないことを確認した。
WT1AB1は、腫瘍細胞に対するADCCを媒介する
ADCCは、ヒトにおける治療用モノクローナル抗体の主要なエフェクター機構の一つであると考えられている。ヒト末梢血単核細胞の存在下で、WT1ab1は、RMFペプチドをロードしたT2細胞に対する、用量依存的な末梢血単核細胞のADCCを媒介したが、T2細胞単独又はコントロールR3ペプチドでパルスしたT2細胞に対しては媒介しなかった(図27)。重要なのは、WT1ab1は、中皮腫細胞株、JMN(図33)、及び白血病細胞株BV173(図34)のような腫瘍細胞上のHLA−A0201によって自然に提示されるRMFエピトープに対するADCCを媒介したが、HLA−A2陰性細胞であるMSTO(図28)又はHL−60(図29)に対しては媒介しなかった。死滅を、複数の健康なドナーからのエフェクター細胞として末梢血単核細胞を用いたWT1ab1の1μg/mL又はそれより低い濃度で、一貫して観察した。重要なことに、WT1ab1も、WT1ab1結合に陽性である一次性A0201陽性AML芽球を死滅させたが、HLA−A0201陰性の芽球を死滅させなかった(図30)。これらの結果は、WT1ab1が、細胞株上と同様に生理学的なレベルで、RMF及びHLA−A201複合体を自然に発現した細胞に対する特異的なADCCを媒介することを実証した。
WT1AB1は、NSGマウスにおけるヒト白血病細胞を排除する
in vivoでのWT1ab1の有効性を、BV173−bcr/abl陽性急性リンパ性白血病で6日以前に静脈内に異種移植されたNOD−SCIDガンマ(NSG)マウスで試験した。治療の際に、マウスはその肝臓、脾臓、及び骨髄(BM)において、ルシフェラーゼイメージングにより認識できる白血病を有していた。NSGマウスは、成熟したB−、T−、及びNK細胞を欠いており、そして、我々は、WT1ab1治療とともに、人間のエフェクター細胞(CD3−、CD34−、末梢血単核細胞)を導入すると、in vitroで観察されたADCCによって媒介された抗腫瘍効果が、生体内においても再現されるという仮説を立てた。WT1ab1の2回の100μg用量とともにされたエフェクターの注入は、コントロールに比べて、腫瘍の増殖を、ほぼ除去した(図31)。この効果は、実験の間持続した(図32)。興味深いことに、実験の初期に、エフェクター細胞単独又はコントロールIgGと結合したエフェクター細胞は、白血病を単独で注入したマウスに対する白血病の迅速な成長をさらに促進するように見え、これは、抗腫瘍効果は、それ自体でエフェクターとは無関係であったことを実証している。エフェクターを与えられたマウスのいくつかは(モノクローナル抗体あり又はなしで)、BV173の広範囲に及ぶ浸潤を伴い、実験の早い段階で死亡した。
細胞傷害性能力を強めた抗体の作製
ヒトIgG1−Fcで述べたように(43、44)、二重特異性抗体を、免疫T細胞のWT1/A2複合体及びCD3の両方を認識するように設計した。二重特異性抗体は、Fcエフェクター機能及びin vivoにおける長半減期を維持する一方で、WT1/A2陽性腫瘍細胞に対する細胞傷害性T細胞を回復させ、そして標的とすると予想されている。i)活性化T細胞による死滅、ii)ADCC活性、iii)CDC活性、の3つのメカニズムが、二重特異性抗体によって媒介される腫瘍細胞の特異的死滅に関与している。二重特異性抗体の他の形式は、タンデム型のscFv分子(taFv)、ダイアボディー(Db)、又は単鎖ダイアボディー(scDb)のように、そしてヒト血清アルブミンとの融合タンパク質のように設計されることができるが(45、46、47、48)、はっきりとした薬物動態の特徴のFcエフェクター機能を欠く。
《参照文献》
1 Mundlos S, et al. Nuclear localization of the protein encoded by the Wilms’ tumor gene WT1 in embryonic and adult tissues. Development 1993;119: 1329-41.
2 Keilholz U, et al. Wilms’ tumor gene 1 (WT1) in human neoplasia. Leukemia 2005; 19: 1318-1323.
3 Inoue K, et al. WT1 as a new prognostic factor and a new marker for the detection of minimal residual disease in acute leukemia. Blood 1994; 84 (9): 3071-3079.
4 Ogawa H, et al. The usefulness of monitoring WT1 gene transcripts for the prediction and management of relapse following allogeneic stem cell transplantation in acute type leukemia. Blood 2003; 101 (5): 1698- 1704.
5 Yarnagarni T, et al. Growth Inhibition of Human Leukemic Cells by WT1(Wilms Tumor Gene) Antisense Oligodeoxynucleotides: Implications for the Involvement of WT1 in Leukemogenesis. Blood 1996; 87: 2878- 2884.
6 Bellantuono I, et al. Two distinct HLA-A0201-presented epitopes of th Wilms tumor antigen 1 can function as targets for leukemia-reactive CTL. Blood 2002; 100 (10): 3835-3837.
7 Gaiger A, et al. WT1- specific serum antibodies in patients with leukemia. Clin. Cancer Res. 2001; 7 (suppl 3): 761-765.
8 Oka Y, et al. WT1 peptide cancer vaccine for patients with hematopoietic malignancies and solid cancers. The Scientific World Journal 2007; 7: 649-665.
9 Kobayashi H, et al. Defining MHC class II T helper epitopes from WT1 antigen. Cancer Immunol.Immunother. 2006; 55 (7): 850-860.
10 Pinilla-Ibarz J, et al. Improved human T-cell responses against synthetic HLA-A0201 analog peptides derived from the WT1 oncoprotein. Leukemia 2006; 20 (11): 2025-2033.
11 May RJ, et al. Peptide epitopes from the Wilms tumor 1 oncoprotein stimulate CD4+ and CD8+ T cells that recognize and kill human malignant mesothelioma tumor cells. Clin Cancer Res. 2007; 13:4547-4555.
12 Keiholz U, et al. A clinical and immunologic phase 2 trial of Wils tumor gene product (WT1) peptide vaccination in patients with AML and MDS. Blood 2009; 113: 6541-6548.
13 Rezwani K, et al. Leukemia-associated antigen-specific T-cell responses following combined PR1 and WT1 peptide vaccination in patients with myeloid malignancies. Blood 2008; 111 (1): 236-242.
14 Maslak P, et al.. Vaccination with synthetic analog peptides derived from WT1 oncoprotein induces T cell responses in patients with complete remission from acute myeloid leukemia. Blood 2010; Accpt Minor rev.
15 Krug LM, et al. WT1 peptide vaccinations induce CD4 and CD8 T cell immune responses in patients with mesothelioma and non-small cell lung cancer. Cancer Immunol Immunother 2010; in revision.
16 Morris E, et al. Generation of tumor-specific T-cell therapies. Blood Reviews 2006; 20: 61-69.
17 Houghton AN et al. Monoclonal antibody therapies- a “constant” threat to cancer. Nat Med 2000; 6:373- 374.
18 Miederer M, et al. Realizing the potential of the Actinium-225 radionuclide generator in targeted alpha particle therapy applications. Adv Drug Deliv Rev 2008; 60 (12): 1371-1382.
19 Noy R, T-cell-receptor-like antibodies: novel reagents for clinical cancer immunology and immunotherapy. Expert Rev Anticancer Ther 2005: 5 (3): 523-536.
20 Chames P, et al. Direct selection of a human antibody fragment directed against the tumor T-cell epitope HLA-A1-MAGE-A1 from a nonimmunized phage-Fab library. Proc Nalt Acad Sci USA 2000; 97: 7969-7974.
21 Held G, et al. Dissecting cytotoxic T cell responses towards the NY-ESO-1 protein by peptide/MHC- specific antibody fragments. Eur J Immunol. 2004: 34:2919-2929.
22 Lev A, et al. Isolation and characterization of human recombinant antibodies endowed with the antigen- specific, major histocompatibility complex-restricted specificity of T cells directed toward the widely expressed tumor T cell-epitopes of the telomerase catalytic subunit. Cancer Res 2002; 62: 3184-3194.
23 Klechevsky E, et al. Antitumor activity of immunotoxins with T-cell receptor-like specificity against human melanoma xenografts. Cancer Res 2008; 68 (15): 6360-6367.
24 Azinovic I, et al. Survival benefit associated with human anti-mouse antibody (HAMA) in patients with B-cell malignancies. Cancer Immunol Immunother 2006; 55(12):1451-8.
25 Tjandra JJ, et al. Development of human anti-murine antibody (HAMA) response in patients. Immunol Cell Biol 1990; 68(6):367-76.
26 Riechmann L, et al. Reshaping human antibodies for therapy. Nature 1988; 332 (6162): 332:323.
27 Queen C, et al. A humanized antibody that binds to the interleukin 2 receptor. Proc Natl Acad Sci USA 1989; 86 (24): 10029-33.
28 Gerd R, et al. Serological Analysis of Human Anti-Human Antibody Responses in Colon Cancer Patients Treated with Repeated Doses of Humanized Monoclonal Antibody A33. Cancer Res 2001; 61, 6851- 6859.
29 Cheever MA, et al. The prioritization of cancer antigens: A national Cancer Institute pilot project for the acceleration of translational research. Clin Cancer Res 2009; 15 (17): 5323-5337.
30 Drakos E, et al. Differentiual expression of WT1 gene product in non-Hodgkin lymphomas. Appl Immunohistochem Mol Morphol 2005; 13 (2): 132-137.
31 Asemissen AM, et al. Identification of a highly immunogenic HLA-A*01-binding T cell epitope of WT1. Clin Cancer Res 2006; 12 (24):7476-7482.
32 Tomimatsu K, et al. Production of human monoclonal antibodies against FceRIa by a method combining in vitro immunization with phage display. Biosci Biotechnol Biochem 2009; 73 (7): 1465-1469.
33 Lidija P, et al. An integrated vector system for the eukaryotic expression of antibodies or their fragments after selection from phage display libraries. Gene 1997; 187(1): 9-18.
34 Lisa JH, et al. Crystallographic structure of an intact IgG1 monoclonal antibody. Journal of Molecular Biology 1998; 275 (5): 861-872.
35 Yasmina NA, et al. Probing the binding mechanism and affinity of tanezumab, a recombinant humanized anti-NGF monoclonal antibody, using a repertoire of biosensors. Protein Science 2008; 17(8): 1326-1335.
36 Roberts WK, et al. Vaccination with CD20 peptides induces a biologically active, specific immune response in mice. Blood 2002: 99 (10): 3748-3755.
37 Caron PC, Class K, Laird W, Co MS, Queen C, Scheinberg DA. Engineered humanized dimeric forms of IgG are more effective antibodies. J Exp Med 176:1191-1195. 1992.
38 McDevitt M, et al. Tumor targeting with antibody-functionalized, radiolabeled carbon nanotubes. J. Nuclear Med 2207; 48 (7))1180-1189.
39 Xue SA, et al. Development of a Wilms’ tumor-specific T-cell receptor for clinical trials: engineered patient’s T cells can eliminate autologous leukemia blasts in NOD/SCID mice. Haematologica 2010; 95 (1): 126-134.
40 McDevitt MR, et al. Tumor therapy with targeted atomic nanogenerators. Science 2001; 294 (5546): 1537-1540.
41 Borchardt PE, et al. Targeted Actinium-225 in vivo generators for therapy of ovarian cancer. Cancer Res 2003; 63: 5084-5090.
42 Singh Jaggi J, et al. Selective alpha-particle mediated depletion of tumor vasculature with vascular normalization. Plos One 2007; 2 (3): e267.
43 Yan W, et al. Enhancing antibody Fc heterodimer formation through electrostatic steering effects. J. Biol. Chem. 2010; 285: 19637-19646.
44 Rossi EA, et al. Stably tethered multi-functional structures of defined composition made by the dock and lock method for use in cancer targeting. Proc Natl Aca Sci USA 2006; 103:6841-6.
45 Ryutaro A, et al. Cytotoxic enhancement of a bispecific diabody by format conversion to tandem single-chain variable fragment (taFv). J Biol Chem 2011; 286: 1812-1818.
46 Anja L, et al. A recombinant bispecific single-chain antibody, CD19 × CD3, induces rapid and high lymphoma-directed cytotoxicity by unstimulated T lymphocytes. Blood 2000; 95(6): 2098-2103.
47 Weiner GJ, et al. The role of T cell activation in anti-CD3 x antitumor bispecific antibody therapy. J. Immunology 1994; 152(5): 2385-2392.
48 Dafne M, et al. Improved pharmacokinetics of recombinant bispecific antibody molecules by fusion to human serum albumin. J Biol Chem 2007; 282: 12650-12660.
49 Liu C, et al. Modified host cells and uses thereof, PCT/US2010/0081195.
50 Francisco J, et al. Neutrophils Contribute to the Biological Antitumor Activity of Rituximab in a Non-Hodgkin’s Lymphoma Severe Combined Immunodeficiency Mouse Model. Clin Cancer Res 2003; 9: 5866.
51 Kavita M, et al. Selective blockade of inhibitory Fc receptor enables human dendritic cell maturation with IL-12p70 production and immunity to antibody-coated tumor cells. Proc natl Aca Sci USA 2005; 102(8): 2910-2915.
52 Raphael A, et al. Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets. Nature Medicine 2000; 6:443-446.
53 Milenic ED. Monoclonal antibody-based therapy strategies: providing options for the cancer patient. Curr Pharm Des. 2002; 8: 1794-1764.
54 Grillo-Lopez AJ. Anti-CD20 mAbs: modifying therapeutic strategies and outcomes in the treatment of lymphoma patients. Expert Rev Anticancer Ther. 2002: 2 (3): 323-329.
55 Jones KL & Buzdar AU. Evolving novel anti-Her2 strategies. Lancet Oncol. 2009: 10 (12): 1179-1187.
56 Reddy MM, Deshpande A & Sattler M. targeting JAK2 in the therapy of myeloproliferative neoplasms. Exper Opin Ther targets 2012: 3: 313-324.
57 Takeuchi K & Ito F. Receptor tyrosine kinases and targeted cancer therapeutics. Biol Pharm Bull. 2011; 34 (12) 1774-1780.
58 Roychowdhury S & Talpaz M. Managing resistance in chronic myeloid leukemia. Blood Rev. 2011; (6): 279- 290.
59 Konnig R. Interactions between MHC molecules and co-receptors of the TCR. Curr Opin Immunol 2002: 14 (1) 75-83.
60 Sergeeva A, Alatrash G, He H, Ruisaard K, Lu S, Wygant J, McIntyre BW, Ma Q, Li D, St John L, Clise-Dwyer K & Molldrem JJ. An anti-PR1/HLA-A2 T-cell receptor-like antibody mediated complement-dependent cytotoxicity against acute myeloid leukemia progenitor cells. Blood2011; 117 (16): 4262-4272).
61 Takigawa N, Kiura K & Kishimoto T. Medical Treatment of Mesothelioma: Anything New? Curr Oncol Rep 2011; DOI 10.1007/s11912-011-0172-1.
62 Raja S, Murthy SC & Mason DP. Malignant Pleural Mesothelioma. Curr Oncol Rep 2011; DOI 10. 1007/s11912-0177-9.
63 Gerber JM, Qin L, Kowalski J, Smith D, Griffin CA, Vala MS, Collector MI, Perkins B, Zahurak M, Matsui W, Gocke CD, Sharkis S, Levitsky H & Jones RJ. Characterization of chronic myeloid leukemia stem cells. 2011; Am J Hematol. 86: 31-37.
64 Rezwani K, Yong AS, Savani BN, Mielke S, Keyvanfar K, Gostick E, Price DA, Douek DC & Barrett AJ. Graft-versus-leukemia effects associated with detectable Wilms tumor-1 specific T lymphocytes after allogeneic stem-cell transplantation for acute lymphoblastic leukemia. Blood 2007: 110 (6): 1924-1932.
65 Persic L, Roberts A, Wilton J et al. An integrated vector system for the eukaryotic expression of antibodies or their fragments after selection from phage display libraries. Gene 1997; 187(1): 9-18.
66 Cheng L, Xiang JY, Yan S et al. Modified host cells and uses thereof. PCT/US2010/0081195.
67 Lindmo T, Boven E, Cuttitta F, Fedorko J & Bunn PA Jr. Determination of the immunoreactive fraction of radiolabeled monoclonal antibodies by linear extrapolation to binding at infinite antigen excess. J Immunol Methods. 1984; 72 (1): 77-89.
68 Feng M, Zhang JL, Anver M, Hassan R & Ho M. In vivoimaging of human malignant mesothelioma growth orthotopically in the peritoneal cavity of nude mice. J Cancer 2011; 2: 123-131.
Claims (41)
- (A)(i)配列番号2、3、及び4のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域、並びに配列番号8、9、及び10のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(ii)配列番号20、21、及び22のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域、並びに配列番号26、27、及び28のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(iii)配列番号38、39、及び40のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域、並びに配列番号44、45、及び46から選択されるアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(iv)配列番号56、57、及び58のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域、並びに配列番号62、63、及び64のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(v)配列番号74、75、及び76のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域、並びに配列番号80、81、及び82のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;若しくは
(vi)配列番号92、93、及び94のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域、並びに配列番号98、99、及び100のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;又は
(B)配列番号14及び16、32及び34、50及び52、68及び70、86及び88、並びに104及び106から選択される第一及び第二アミノ酸配列を含むVH及びVL;又は
(C)配列番号18、36、54、72、90、及び108から選択されるアミノ酸配列
のうちの1を含む単離された抗体、若しくはその抗原結合性断片。 - (A)(i)配列番号2、3、及び4;(ii)20、21、及び22;(iii)38、39、及び40;(iv)56、57、及び58;(v)74、75、及び76;並びに(vi)92、93、及び94から選択されるアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域;及び
(B)(i)配列番号8、9、及び10;(ii)26、27、及び28;(iii)44、45、及び46;(iv)62、63、及び64;(v)80、81、及び82;並びに(vi)98、99、及び100から選択されるアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域
を含む単離された抗体、若しくはその抗原結合性断片。 - (i)配列番号14及び16;(ii)32及び34;(iii)50及び52;(iv)68及び70;(v)86及び88;並びに(vi)104及び106から選択される第一及び第二アミノ酸配列をそれぞれ含むVH及びVL
を含む単離された抗体、若しくはその抗原結合性断片。 - 配列番号18、36、54、72、90、及び108から選択されるアミノ酸配列
を含む単離された抗体、若しくはその抗原結合性断片。 - 抗体が、ヒト可変領域フレームワーク領域を含む、請求項1〜4のいずれか1項に記載の抗体。
- 抗体が、完全ヒト抗体である、請求項1〜4のいずれか1項に記載の抗体。
- 抗体が、HLA−A2に結合したWT1ペプチドに特異的に結合する、請求項1〜4のいずれか1項に記載の抗体。
- WT1が、アミノ酸配列RMFPNAPYLを有する、請求項7に記載の抗体。
- HLA−A2が、HLA−A0201である、請求項7に記載の抗体。
- 抗体の抗原結合性領域が、Fab、Fab’、F(ab’)2、Fv、又は単鎖Fv(scFv)である、請求項1〜9のいずれか1項に記載の抗体。
- 治療薬に結合した、請求項1〜9のいずれか1項に記載の抗体。
- 治療薬が、薬剤、毒素、放射性同位体、タンパク質、又はペプチドである、請求項11に記載の抗体。
- 請求項1〜4のいずれか1項に記載の抗体をコードしている単離された核酸。
- (A)(i)配列番号5、6、及び7;23、24、及び25;41、42、及び43;58、59、及び60;77、78、及び79;並びに95、96、及び97からなる群から選択される第一、第二、及び第三ヌクレオチド配列;及び
(ii)配列番号11、12、及び13;29、30、及び31;47、48、及び49;65、66、及び67;83、84、及び85;並びに101、102、及び103からなる群から選択される第四、第五、及び第六ヌクレオチド配列;又は
(B)配列番号15及び17、33及び35、51及び53、69及び71、87及び89、並びに105及び107からなる群から選択される第一及び第二ヌクレオチド配列;又は
(C)配列番号19、37、55、73、91、及び109からなる群から選択されるヌクレオチド配列
を含む単離された核酸。 - (A)配列番号(i)5、6、及び7;(ii)23、24、及び25;(iii)41、42、及び43;(iv)58、59、及び60;(v)77、78、及び79;並びに(vi)95、96、及び97からなる群から選択される第一、第二、及び第三ヌクレオチド配列;及び
(B)配列番号(vii)11、12、及び13;(viii)29、30、及び31;(ix)47、48、及び49;(x)65、66、及び67;(xi)83、84、及び85;並びに(xii)101、102、及び103からなる群から選択される第四、第五、及び第六ヌクレオチド配列
を含む単離された核酸。 - 第一、第二、及び第三ヌクレオチド配列が、抗体のHC−CDR1、HC−CDR2、及びHC−CDR3をそれぞれコードし、第四、第五、及び第六ヌクレオチド配列が、抗体のLC−CDR1、LC−CDR2、及びLC−CDR3をそれぞれコードする、請求項15に記載の核酸。
- 配列番号(i)15及び17;(ii)33及び35;(iii)51及び53;(iv)69及び71;(v)87及び89;並びに(vi)105及び107からなる群から選択される第一及び第二ヌクレオチド配列をそれぞれ含む単離された核酸。
- 第一ヌクレオチド配列が、抗体のVHをコードし、第二ヌクレオチド配列が抗体のVLをコードする、請求項17に記載の核酸。
- 配列番号19、37、55、73、91、及び109からなる群から選択されるヌクレオチド配列を含む核酸。
- 核酸が、scFvをコードする、請求項19に記載の核酸。
- 請求項13〜20のいずれか1項に記載の核酸を含むベクター。
- 請求項13〜20のいずれか1項に記載の核酸を含む細胞。
- その表面に請求項1〜4に記載の抗体を発現させる、請求項22に記載の細胞。
- 全細胞又は組織中のWT1を探知する方法であって、
(A)細胞又は組織に、HLA−A2に結合するWT1ペプチドに特異的に結合する、探知可能な標識を含む抗体又はその抗原結合性断片と接触させ;
(B)抗体に結合した量が、細胞又は組織中のWT1の量を示し、細胞又は組織に関連した探知可能な標識の量を測定することにより、細胞又は組織に結合した抗体の量を決定すること
を含む方法。 - 抗体が、アミノ酸配列RMFPNAPYL(配列番号1)を有するHLA−A2に結合したWT1ペプチドに特異的に結合する、請求項24に記載の方法。
- WT1ペプチドが、HLA−A0201に結合する、請求項25に記載の方法。
- 請求項24に記載の方法であって、抗体が、
(A)(i)配列番号2、3、及び4のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域;並びに配列番号8、9、及び10のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(ii)配列番号20、21、及び22のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域;並びに配列番号26、27、及び28のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(iii)配列番号38、39、及び40のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域;並びに配列番号44、45、及び46から選択されるアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(iv)配列番号56、57、及び58のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域;並びに配列番号62、63、及び64のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;
(v)配列番号74、75、及び76のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2及びHC−CDR3を含む重鎖可変領域;並びに配列番号80、81、及び82のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;若しくは
(vi)配列番号92、93、及び94のアミノ酸配列をそれぞれ含むHC−CDR1、HC−CDR2、及びHC−CDR3を含む重鎖可変領域;並びに配列番号98、99、及び100のアミノ酸配列をそれぞれ含むLC−CDR1、LC−CDR2、及びLC−CDR3を含む軽鎖可変領域;又は
(B)配列番号14及び16;32及び34;50及び52;68及び70;86及び88;並びに104及び106から選択される第一及び第二アミノ酸配列を含むVH及びVL、又は
(C)配列番号18、36、54、72、90及び108から選択されるアミノ酸配列
のうちの1を含む単離された抗体又はその抗原結合性断片。 - 請求項1〜4のいずれか1項に記載の抗体を含むキット。
- WT1陽性疾患の治療への請求項1〜4のいずれか1項に記載の抗体の使用。
- 請求項1〜4のいずれか1項に記載の抗体及び薬学的に許容可能な担体を含む医薬組成物。
- 治療的に効果のある量の請求項1〜4のいずれか1項に記載の抗体又はその抗原結合性断片を患者に投与することを含むWT1陽性疾患患者の治療方法。
- WT1陽性疾患が、慢性白血病、急性白血病、又はWT1+腫瘍である、請求項31に記載の方法。
- WT1陽性疾患が、慢性骨髄性白血病、多発性骨髄腫(MM)、急性リンパ性白血病(ALL)、急性骨髄/骨髄性白血病(AML)、骨髄異形成症候群(MDS)、中皮腫、卵巣癌、消化管癌、乳癌、前立腺癌、及びグリア芽腫からなる群から選択される、請求項31に記載の方法。
- 抗体が、抗体に結合する細胞傷害性部分を有する結合体である、請求項34に記載の方法。
- 治療的に効果のある量の請求項13〜20のいずれか1項に記載の核酸を患者に投与することを含む、WT1陽性疾患患者の治療方法。
- WT1陽性疾患が、慢性白血病、急性白血病、又はWT1+腫瘍である、請求項35に記載の方法。
- WT1陽性疾患が、慢性骨髄性白血病、多発性骨髄腫(MM)、急性リンパ性白血病(ALL)、急性骨髄/骨髄性白血病(AML)、骨髄異形成症候群(MDS)、中皮腫、卵巣癌、消化管癌、乳癌、前立腺癌、及びグリア芽腫からなる群から選択される、請求項36に記載の方法。
- WT1陽性疾患の治療への、請求項13〜20のいずれか1項に記載の核酸の使用。
- 請求項13〜20のいずれか1項に記載の核酸を含む、医薬組成物。
- WT1+細胞を死滅させる方法であって、細胞に、HLA−A2に結合したWT1ペプチドに特異的に結合する抗体又はその抗原結合性断片を接触させることを含む方法。
- 抗体又はその抗原結合性断片が、それらに結合する細胞傷害性部分を有する、請求項40に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161470635P | 2011-04-01 | 2011-04-01 | |
| US61/470,635 | 2011-04-01 | ||
| US201161491392P | 2011-05-31 | 2011-05-31 | |
| US61/491,392 | 2011-05-31 | ||
| PCT/US2012/031892 WO2012135854A2 (en) | 2011-04-01 | 2012-04-02 | Antibodies to cytosolic peptides |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015213831A Division JP2016026209A (ja) | 2011-04-01 | 2015-10-30 | Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014512812A true JP2014512812A (ja) | 2014-05-29 |
| JP2014512812A5 JP2014512812A5 (ja) | 2014-08-07 |
| JP6082997B2 JP6082997B2 (ja) | 2017-02-22 |
Family
ID=46229910
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014502699A Expired - Fee Related JP6082997B2 (ja) | 2011-04-01 | 2012-04-02 | Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 |
| JP2015213831A Pending JP2016026209A (ja) | 2011-04-01 | 2015-10-30 | Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015213831A Pending JP2016026209A (ja) | 2011-04-01 | 2015-10-30 | Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 |
Country Status (22)
| Country | Link |
|---|---|
| US (5) | US9074000B2 (ja) |
| EP (2) | EP3323833B1 (ja) |
| JP (2) | JP6082997B2 (ja) |
| KR (1) | KR20140033029A (ja) |
| CN (2) | CN103619882B (ja) |
| AP (1) | AP2013007142A0 (ja) |
| AU (2) | AU2012236068A1 (ja) |
| CA (1) | CA2831336C (ja) |
| CL (1) | CL2013002828A1 (ja) |
| CO (1) | CO6900116A2 (ja) |
| CU (1) | CU20130130A7 (ja) |
| DO (1) | DOP2013000219A (ja) |
| EA (1) | EA201391449A1 (ja) |
| ES (2) | ES2785081T3 (ja) |
| GT (1) | GT201300233A (ja) |
| MX (1) | MX2013011363A (ja) |
| MY (1) | MY160662A (ja) |
| NI (1) | NI201300099A (ja) |
| PE (1) | PE20141271A1 (ja) |
| SG (1) | SG193956A1 (ja) |
| WO (1) | WO2012135854A2 (ja) |
| ZA (1) | ZA201306940B (ja) |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016204358A (ja) * | 2014-12-25 | 2016-12-08 | 国立大学法人三重大学 | Wt1由来ペプチド認識抗体 |
| JP2017500057A (ja) * | 2013-11-07 | 2017-01-05 | メモリアル スローン−ケタリング キャンサー センター | 抗wt1/hla二重特異性抗体 |
| JP2018512145A (ja) * | 2015-04-03 | 2018-05-17 | ユーリカ セラピューティックス, インコーポレイテッド | Afpペプチド/mhc複合体を標的化する構築物およびその使用 |
| JP2018520667A (ja) * | 2015-06-09 | 2018-08-02 | メモリアル スローン ケタリング キャンサー センター | ヒトhlaにより提示されるebv潜伏感染膜タンパク質2aペプチドに特異的なt細胞受容体様抗体剤 |
| JP2018526970A (ja) * | 2015-06-08 | 2018-09-20 | アディセット バイオ インク.Adicet Bio Inc. | 微細特異性を有するt細胞受容体様抗体 |
| JP2018536393A (ja) * | 2015-10-09 | 2018-12-13 | イマティクス バイオテクノロジーズ ゲーエムベーハー | 抗wt1/hla特異的抗体 |
| JP2019500848A (ja) * | 2015-10-23 | 2019-01-17 | ユーリカ セラピューティックス, インコーポレイテッド | 抗体/t細胞受容体キメラ構築物およびその使用 |
| US10239952B2 (en) | 2011-04-01 | 2019-03-26 | Memorial Sloan Kettering Cancer Center | Anti-WT1/HLA bi-specific antibody |
| JP2020195393A (ja) * | 2014-07-15 | 2020-12-10 | ジュノー セラピューティクス インコーポレイテッド | 養子細胞療法用の操作された細胞 |
| JP2021507698A (ja) * | 2017-12-21 | 2021-02-25 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Hla−a2/wt1に結合する抗体 |
| US11613573B2 (en) | 2017-04-26 | 2023-03-28 | Eureka Therapeutics, Inc. | Chimeric antibody/T-cell receptor constructs and uses thereof |
Families Citing this family (171)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ612512A (en) | 2010-12-09 | 2015-03-27 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| PE20141271A1 (es) * | 2011-04-01 | 2014-10-08 | Sloan Kettering Inst Cancer | Anticuerpos tipo receptor de celulas t especificos para un peptido wt1 presentado por hla-a2 |
| ES2814962T3 (es) | 2013-02-20 | 2021-03-29 | Novartis Ag | Fijación eficaz como objetivo de la leucemia humana primaria utilizando células T modificadas con receptor de antígeno quimérico anti-CD123 |
| EP2958943B1 (en) | 2013-02-20 | 2019-09-11 | The Trustees Of The University Of Pennsylvania | Treatment of cancer using humanized anti-egfrviii chimeric antigen receptor |
| US20140271644A1 (en) * | 2013-03-15 | 2014-09-18 | Memorial Sloan-Kettering Cancer Center | Combination/adjuvant therapy for wt-1-positive disease |
| WO2014143835A1 (en) * | 2013-03-15 | 2014-09-18 | Memorial Sloan-Kettering Cancer Center | Combination/adjuvant therapy for wt-1-positive disease |
| EP3623380A1 (en) | 2013-03-15 | 2020-03-18 | Michael C. Milone | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| UY35468A (es) | 2013-03-16 | 2014-10-31 | Novartis Ag | Tratamiento de cáncer utilizando un receptor quimérico de antígeno anti-cd19 |
| CN106170297A (zh) * | 2013-09-20 | 2016-11-30 | 纪念斯隆-凯特琳癌症中心 | 用于wt‑1‑阳性疾病的组合/辅助疗法 |
| LT4095130T (lt) | 2013-10-18 | 2024-04-25 | Novartis Ag | Žymėti prostatos specifinio membranos antigeno (psma) inhibitoriai, jų naudojimas kaip vizualizavimo medžiagų ir farmacinių medžiagų prostatos vėžiui gydyti |
| EP3066131A1 (en) * | 2013-11-07 | 2016-09-14 | Memorial Sloan-Kettering Cancer Center | Fc-enhanced anti-wt1/hla antibody |
| RU2714902C2 (ru) | 2013-12-19 | 2020-02-20 | Новартис Аг | Химерные рецепторы антигена против мезотелина человека и их применение |
| JP6793902B2 (ja) | 2013-12-20 | 2020-12-02 | ノバルティス アーゲー | 調節可能キメラ抗原受容体 |
| WO2015112626A1 (en) | 2014-01-21 | 2015-07-30 | June Carl H | Enhanced antigen presenting ability of car t cells by co-introduction of costimulatory molecules |
| US20160152725A1 (en) * | 2014-02-25 | 2016-06-02 | Memorial Sloan-Kettering Cancer Center | Antigen-binding proteins specific for hla-a2-restricted wilms tumor 1 peptide |
| CN106163547A (zh) | 2014-03-15 | 2016-11-23 | 诺华股份有限公司 | 使用嵌合抗原受体治疗癌症 |
| US11390921B2 (en) | 2014-04-01 | 2022-07-19 | Adaptive Biotechnologies Corporation | Determining WT-1 specific T cells and WT-1 specific T cell receptors (TCRs) |
| SI3888674T1 (sl) | 2014-04-07 | 2024-08-30 | Novartis Ag | Zdravljenje raka z uporabo antigenskega himernega receptorja proti-CD19 |
| KR102594343B1 (ko) | 2014-07-21 | 2023-10-26 | 노파르티스 아게 | Cd33 키메라 항원 수용체를 사용한 암의 치료 |
| WO2016014530A1 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Combinations of low, immune enhancing. doses of mtor inhibitors and cars |
| SG11201700476VA (en) | 2014-07-21 | 2017-02-27 | Novartis Ag | Treatment of cancer using humanized anti-bcma chimeric antigen receptor |
| RU2741120C2 (ru) | 2014-07-21 | 2021-01-22 | Новартис Аг | Лечение рака с использованием химерного антигенного рецептора cll-1 |
| US11542488B2 (en) | 2014-07-21 | 2023-01-03 | Novartis Ag | Sortase synthesized chimeric antigen receptors |
| CN107108744B (zh) | 2014-08-19 | 2020-09-25 | 诺华股份有限公司 | 抗cd123嵌合抗原受体(car)用于癌症治疗 |
| US20180010132A1 (en) | 2014-09-11 | 2018-01-11 | Novartis Ag | Inhibition of prmt5 to treat mtap-deficiency-related diseases |
| ES2891332T3 (es) | 2014-09-17 | 2022-01-27 | Novartis Ag | Direccionamiento a células citotóxicas con receptores quiméricos para la inmunoterapia adoptiva |
| WO2016057705A1 (en) | 2014-10-08 | 2016-04-14 | Novartis Ag | Biomarkers predictive of therapeutic responsiveness to chimeric antigen receptor therapy and uses thereof |
| CN107249605A (zh) | 2014-11-17 | 2017-10-13 | 阿迪塞特生物股份有限公司 | 工程化的γδT细胞 |
| WO2016089883A1 (en) | 2014-12-01 | 2016-06-09 | Novartis Ag | Compositions and methods for diagnosis and treatment of prostate cancer |
| US10273300B2 (en) | 2014-12-29 | 2019-04-30 | The Trustees Of The University Of Pennsylvania | Methods of making chimeric antigen receptor-expressing cells |
| US11459390B2 (en) | 2015-01-16 | 2022-10-04 | Novartis Ag | Phosphoglycerate kinase 1 (PGK) promoters and methods of use for expressing chimeric antigen receptor |
| US11161907B2 (en) | 2015-02-02 | 2021-11-02 | Novartis Ag | Car-expressing cells against multiple tumor antigens and uses thereof |
| WO2016154047A2 (en) * | 2015-03-20 | 2016-09-29 | Memorial Sloan-Kettering Cancer Center | Monoclonal antigen-binding proteins to intracellular oncogene products |
| ES2923894T3 (es) | 2015-04-08 | 2022-10-03 | Novartis Ag | Combinación de terapia con receptor de antígeno quimérico y derivados de amino pirimidina |
| CN118726268A (zh) | 2015-04-17 | 2024-10-01 | 诺华股份有限公司 | 改善嵌合抗原受体表达细胞的功效和扩增的方法 |
| US12128069B2 (en) | 2015-04-23 | 2024-10-29 | The Trustees Of The University Of Pennsylvania | Treatment of cancer using chimeric antigen receptor and protein kinase a blocker |
| CN106188274A (zh) * | 2015-05-06 | 2016-12-07 | 广州市香雪制药股份有限公司 | 识别rhamm抗原短肽的t细胞受体 |
| MA42895A (fr) | 2015-07-15 | 2018-05-23 | Juno Therapeutics Inc | Cellules modifiées pour thérapie cellulaire adoptive |
| SG10201912978PA (en) | 2015-07-21 | 2020-02-27 | Novartis Ag | Methods for improving the efficacy and expansion of immune cells |
| FR3039832A1 (fr) * | 2015-08-04 | 2017-02-10 | Univ Francois Rabelais De Tours | Igg1 et leur utilisation therapeutique |
| US11667691B2 (en) | 2015-08-07 | 2023-06-06 | Novartis Ag | Treatment of cancer using chimeric CD3 receptor proteins |
| CA2993432A1 (en) | 2015-09-01 | 2017-03-09 | Agenus Inc. | Anti-pd-1 antibodies and methods of use thereof |
| US11747346B2 (en) | 2015-09-03 | 2023-09-05 | Novartis Ag | Biomarkers predictive of cytokine release syndrome |
| US9862760B2 (en) | 2015-09-16 | 2018-01-09 | Novartis Ag | Polyomavirus neutralizing antibodies |
| MA44314A (fr) | 2015-11-05 | 2018-09-12 | Juno Therapeutics Inc | Récepteurs chimériques contenant des domaines induisant traf, et compositions et méthodes associées |
| US11020429B2 (en) | 2015-11-05 | 2021-06-01 | Juno Therapeutics, Inc. | Vectors and genetically engineered immune cells expressing metabolic pathway modulators and uses in adoptive cell therapy |
| CN116334143A (zh) | 2015-11-23 | 2023-06-27 | 诺华股份有限公司 | 优化的慢病毒转移载体及其用途 |
| EP3708587B1 (en) * | 2015-11-27 | 2024-05-22 | Cartherics Pty. Ltd. | Genetically modified cells and uses thereof |
| CA3007258A1 (en) | 2015-12-03 | 2017-06-08 | Mark L. Bonyhadi | Compositions and methods for reducing immune responses against cell therapies |
| AU2016363025B2 (en) | 2015-12-03 | 2021-04-08 | Juno Therapeutics, Inc. | Modified chimeric receptors and related compositions and methods |
| IL295858A (en) | 2015-12-04 | 2022-10-01 | Novartis Ag | Preparations and methods for immuno-oncology |
| WO2017112741A1 (en) | 2015-12-22 | 2017-06-29 | Novartis Ag | Mesothelin chimeric antigen receptor (car) and antibody against pd-l1 inhibitor for combined use in anticancer therapy |
| ES2944597T3 (es) | 2015-12-30 | 2023-06-22 | Novartis Ag | Terapias con células efectoras inmunitarias de eficacia mejorada |
| US10053515B2 (en) | 2016-01-22 | 2018-08-21 | Merck Sharp & Dohme Corp. | Anti-coagulation factor XI antibodies |
| GB201604492D0 (en) * | 2016-03-16 | 2016-04-27 | Immatics Biotechnologies Gmbh | Transfected t-cells and t-cell receptors for use in immunotherapy against cancers |
| EP3432924A1 (en) | 2016-03-23 | 2019-01-30 | Novartis AG | Cell secreted minibodies and uses thereof |
| CA3018253A1 (en) * | 2016-03-31 | 2017-10-05 | University Of Southern California | A highly sensitive and specific luciferase based reporter assay for antigen detection |
| TW201800418A (zh) | 2016-04-25 | 2018-01-01 | 索倫多醫療公司 | 結合stat3之抗體治療劑 |
| KR102519861B1 (ko) | 2016-05-12 | 2023-04-10 | 아디셋 바이오, 인크. | γδ T-세포 집단의 선택적 확장을 위한 방법 및 그의 조성물 |
| SG10201912563XA (en) | 2016-05-27 | 2020-02-27 | Agenus Inc | Anti-tim-3 antibodies and methods of use thereof |
| MY201852A (en) | 2016-06-14 | 2024-03-20 | Merck Sharp & Dohme Llc | Anti-coagulation factor xi antibodies |
| MA45491A (fr) | 2016-06-27 | 2019-05-01 | Juno Therapeutics Inc | Épitopes à restriction cmh-e, molécules de liaison et procédés et utilisations associés |
| WO2018005559A1 (en) | 2016-06-27 | 2018-01-04 | Juno Therapeutics, Inc. | Method of identifying peptide epitopes, molecules that bind such epitopes and related uses |
| WO2018005775A1 (en) | 2016-06-29 | 2018-01-04 | Memorial Sloan-Kettering Cancer Center | Cd47 blockade enhances therapeutic activity of antibodies to low density cancer epitopes |
| US20190194283A1 (en) | 2016-07-29 | 2019-06-27 | Juno Therapeutics, Inc. | Immunomodulatory polypeptides and related compositions and methods |
| JP7467117B2 (ja) | 2016-10-07 | 2024-04-15 | ノバルティス アーゲー | 癌の治療のためのキメラ抗原受容体 |
| EP3526256A1 (en) | 2016-10-11 | 2019-08-21 | Agenus Inc. | Anti-lag-3 antibodies and methods of use thereof |
| MA46961A (fr) | 2016-12-03 | 2019-10-09 | Juno Therapeutics Inc | Procédés de modulation de lymphocytes t modifiés par car |
| RU2019120398A (ru) | 2016-12-03 | 2021-01-12 | Джуно Терапьютикс, Инк. | Способы определения дозировки cart-клеток |
| AU2017370644A1 (en) | 2016-12-05 | 2019-06-13 | Juno Therapeutics, Inc. | Production of engineered cells for adoptive cell therapy |
| WO2018111340A1 (en) | 2016-12-16 | 2018-06-21 | Novartis Ag | Methods for determining potency and proliferative function of chimeric antigen receptor (car)-t cells |
| CA3048211A1 (en) | 2016-12-23 | 2018-06-28 | Macrogenics, Inc. | Adam9-binding molecules, and methods of use thereof |
| CN107698681B (zh) * | 2016-12-28 | 2020-07-07 | 天津天锐生物科技有限公司 | 一种识别hla-a2/rmfpnapyl的单域抗体 |
| WO2018132518A1 (en) | 2017-01-10 | 2018-07-19 | Juno Therapeutics, Inc. | Epigenetic analysis of cell therapy and related methods |
| MX2019008538A (es) | 2017-01-20 | 2019-11-05 | Juno Therapeutics Gmbh | Conjugados de superficie celular y composiciones y métodos celulares relacionados. |
| WO2018140725A1 (en) | 2017-01-26 | 2018-08-02 | Novartis Ag | Cd28 compositions and methods for chimeric antigen receptor therapy |
| CN110582509A (zh) | 2017-01-31 | 2019-12-17 | 诺华股份有限公司 | 使用具有多特异性的嵌合t细胞受体蛋白治疗癌症 |
| AU2018219226A1 (en) | 2017-02-07 | 2019-08-15 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Phospholipid ether (PLE) CAR T cell tumor targeting (CTCT) agents |
| EP4353818A3 (en) | 2017-02-27 | 2024-06-19 | Juno Therapeutics, Inc. | Compositions, articles of manufacture and methods related to dosing in cell therapy |
| US11850262B2 (en) | 2017-02-28 | 2023-12-26 | Purdue Research Foundation | Compositions and methods for CAR T cell therapy |
| KR20190130608A (ko) | 2017-03-22 | 2019-11-22 | 노파르티스 아게 | 면역종양학을 위한 조성물 및 방법 |
| JP7284707B2 (ja) | 2017-04-07 | 2023-05-31 | ジュノー セラピューティクス インコーポレイテッド | 前立腺特異的膜抗原(psma)またはその改変型を発現する操作された細胞および関連方法 |
| US11242385B2 (en) | 2017-04-13 | 2022-02-08 | Agenus Inc. | Anti-CD137 antibodies and methods of use thereof |
| MX2019012189A (es) | 2017-04-14 | 2020-12-10 | Juno Therapeutics Inc | Metodos para valorar la glucosilacion de la superficie celular. |
| MA50957A (fr) | 2017-05-01 | 2020-10-14 | Agenus Inc | Anticorps anti-tigit et leurs méthodes d'utilisation |
| EP3630846A4 (en) * | 2017-05-31 | 2021-02-24 | Carsgen Therapeutics Co., Ltd. | COMPOSITIONS AND METHODS OF CELLULAR IMMUNOTHERAPY |
| AU2018275891A1 (en) | 2017-06-02 | 2019-12-12 | Juno Therapeutics, Inc. | Articles of manufacture and methods related to toxicity associated with cell therapy |
| WO2018231958A1 (en) * | 2017-06-13 | 2018-12-20 | Adaptive Biotechnologies Corp. | Determining wt-1 specific t cells and wt-1 specific t cell receptors (tcrs) |
| WO2018229530A1 (en) | 2017-06-14 | 2018-12-20 | Adicet Bio Inc. | Antibodies capable of binding hla-a2/tyrd in an hla restricted manner and uses thereof |
| WO2018229715A1 (en) | 2017-06-16 | 2018-12-20 | Novartis Ag | Compositions comprising anti-cd32b antibodies and methods of use thereof |
| CA3067446A1 (en) | 2017-06-20 | 2018-12-27 | Institut Curie | Immune cells defective for suv39h1 |
| US11530413B2 (en) | 2017-07-21 | 2022-12-20 | Novartis Ag | Compositions and methods to treat cancer |
| CA3070573A1 (en) | 2017-07-29 | 2019-02-07 | Juno Therapeutics, Inc. | Reagents for expanding cells expressing recombinant receptors |
| EP3664820B1 (en) | 2017-08-09 | 2023-07-19 | Juno Therapeutics, Inc. | Methods for producing genetically engineered cell compositions and related compositions |
| EP3664835B1 (en) | 2017-08-09 | 2024-10-23 | Juno Therapeutics, Inc. | Methods and compositions for preparing genetically engineered cells |
| US20200292526A1 (en) | 2017-09-07 | 2020-09-17 | Juno Therapeutics, Inc. | Methods of identifying cellular attributes related to outcomes associated with cell therapy |
| AR123115A1 (es) | 2017-10-18 | 2022-11-02 | Novartis Ag | Composiciones y métodos para la degradación selectiva de proteínas |
| CN111566124A (zh) | 2017-10-25 | 2020-08-21 | 诺华股份有限公司 | 制备表达嵌合抗原受体的细胞的方法 |
| EP3700933A1 (en) | 2017-10-25 | 2020-09-02 | Novartis AG | Antibodies targeting cd32b and methods of use thereof |
| WO2019089982A1 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Method of assessing activity of recombinant antigen receptors |
| BR112020008812A2 (pt) | 2017-11-06 | 2020-10-27 | Juno Therapeutics Inc | combinação de terapia celular e um inibidor de gama secretase |
| JP2021502816A (ja) | 2017-11-15 | 2021-02-04 | アディセット バイオ, インコーポレイテッド | δ3γδT細胞集団の選択的増殖方法及びその組成物 |
| MA51210A (fr) | 2017-12-01 | 2020-10-07 | Juno Therapeutics Inc | Procédés de dosage et de modulation de cellules génétiquement modifiées |
| CN112203680A (zh) | 2017-12-08 | 2021-01-08 | 朱诺治疗学股份有限公司 | 用于细胞疗法的表型标记和相关方法 |
| SG11202005228YA (en) | 2017-12-08 | 2020-07-29 | Juno Therapeutics Inc | Serum-free media formulation for culturing cells and methods of use thereof |
| CA3084445A1 (en) | 2017-12-08 | 2019-06-13 | Juno Therapeutics, Inc. | Process for producing a composition of engineered t cells |
| JP7394058B2 (ja) * | 2017-12-21 | 2023-12-07 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | 新規抗原結合部分の特異性試験のためのユニバーサルレポーター細胞アッセイ |
| JP7549303B2 (ja) | 2018-01-22 | 2024-09-11 | エンドサイト・インコーポレイテッド | Car t細胞の使用方法 |
| EP3746117A1 (en) | 2018-01-31 | 2020-12-09 | Celgene Corporation | Combination therapy using adoptive cell therapy and checkpoint inhibitor |
| SG11202007697VA (en) | 2018-02-15 | 2020-09-29 | Memorial Sloan Kettering Cancer Center | Foxp3 targeting agent compositions and methods of use for adoptive cell therapy |
| MA52656A (fr) | 2018-04-05 | 2021-02-17 | Editas Medicine Inc | Procédés de production de cellules exprimant un récepteur recombinant et compositions associées |
| MA52363A (fr) | 2018-04-26 | 2021-03-03 | Agenus Inc | Compositions peptidiques de liaison à une protéine de choc thermique (hsp) et leurs méthodes d'utilisation |
| US20210047405A1 (en) | 2018-04-27 | 2021-02-18 | Novartis Ag | Car t cell therapies with enhanced efficacy |
| EP3788369A1 (en) | 2018-05-01 | 2021-03-10 | Novartis Ag | Biomarkers for evaluating car-t cells to predict clinical outcome |
| WO2019213276A1 (en) | 2018-05-02 | 2019-11-07 | Novartis Ag | Regulators of human pluripotent stem cells and uses thereof |
| WO2019227003A1 (en) | 2018-05-25 | 2019-11-28 | Novartis Ag | Combination therapy with chimeric antigen receptor (car) therapies |
| CN108676098A (zh) * | 2018-05-29 | 2018-10-19 | 段海峰 | 靶向wt1的嵌合抗原受体t细胞及其应用 |
| WO2019237035A1 (en) | 2018-06-08 | 2019-12-12 | Intellia Therapeutics, Inc. | Compositions and methods for immunooncology |
| EP3806962A1 (en) | 2018-06-13 | 2021-04-21 | Novartis AG | Bcma chimeric antigen receptors and uses thereof |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| CA3107383A1 (en) | 2018-07-23 | 2020-01-30 | Magenta Therapeutics, Inc. | Use of anti-cd5 antibody drug conjugate (adc) in allogeneic cell therapy |
| JP7538109B2 (ja) | 2018-08-09 | 2024-08-21 | ジュノー セラピューティクス インコーポレイテッド | 組み込まれた核酸を評価するための方法 |
| IL313701A (en) | 2018-08-09 | 2024-08-01 | Juno Therapeutics Inc | Processes for creating transgenic cells and their compounds |
| CN113167796A (zh) | 2018-09-11 | 2021-07-23 | 朱诺治疗学股份有限公司 | 对工程化细胞组合物进行质谱分析的方法 |
| IT201800009282A1 (it) * | 2018-10-09 | 2020-04-09 | Metis Prec Medicine Sb Srl | Nuovo agente terapeutico per il trattamento di un tumore e/o metastasi |
| KR20210098450A (ko) | 2018-10-31 | 2021-08-10 | 주노 테라퓨틱스 게엠베하 | 세포의 선택 및 자극을 위한 방법 및 이를 위한 장치 |
| GB201817821D0 (en) * | 2018-10-31 | 2018-12-19 | Ospedale San Raffaele Srl | TCR and peptides |
| EP3886875B1 (en) | 2018-11-30 | 2024-05-08 | Juno Therapeutics, Inc. | Methods for treatment using adoptive cell therapy |
| AU2019394877A1 (en) | 2018-12-03 | 2021-06-17 | Adicet Therapeutics, Inc. | Methods for selective in vivo expansion of gamma delta T-cell populations and compositions thereof |
| CN113271945A (zh) | 2018-12-20 | 2021-08-17 | 诺华股份有限公司 | 包含3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物的给药方案和药物组合 |
| EP3924055B1 (en) | 2019-02-15 | 2024-04-03 | Novartis AG | Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| CA3124935A1 (en) | 2019-02-15 | 2020-08-20 | Novartis Ag | 3-(1-oxo-5-(piperidin-4-yl)isoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| BR112021021075A2 (pt) | 2019-05-01 | 2021-12-14 | Editas Medicine Inc | Células que expressam um receptor recombinante de um locus de tgfbr2 modificado, polinucleotídeos relacionados e métodos |
| CN114007640A (zh) | 2019-05-01 | 2022-02-01 | 朱诺治疗学股份有限公司 | 从修饰的cd247基因座表达嵌合受体的细胞、相关多核苷酸和方法 |
| MX2021015317A (es) | 2019-06-12 | 2022-03-11 | Juno Therapeutics Inc | Terapia de combinacion de una terapia citotoxica mediada por celulas y un inhibidor de una proteina de la familia bcl2 de prosupervivencia. |
| JP2022542102A (ja) | 2019-07-23 | 2022-09-29 | ムネモ・セラピューティクス | Suv39h1欠損免疫細胞 |
| CN114555112A (zh) | 2019-08-22 | 2022-05-27 | 朱诺治疗学股份有限公司 | T细胞疗法和zeste增强子同源物2(ezh2)抑制剂的组合疗法及相关方法 |
| CN114585644A (zh) | 2019-08-30 | 2022-06-03 | 艾吉纳斯公司 | 抗cd96抗体及其使用方法 |
| AU2020394441A1 (en) | 2019-11-26 | 2022-06-02 | Novartis Ag | CD19 and CD22 chimeric antigen receptors and uses thereof |
| KR102688094B1 (ko) * | 2019-11-29 | 2024-07-25 | 주식회사 대웅제약 | Cobll1 단백질 특이 항체 또는 이의 항원 결합 단편, 및 이의 용도 |
| KR20220116257A (ko) | 2019-12-20 | 2022-08-22 | 노파르티스 아게 | 골수섬유증 및 골수이형성 증후군을 치료하기 위한, 데시타빈 또는 항 pd-1 항체 스파르탈리주맙을 포함하거나 또는 포함하지 않는, 항 tim-3 항체 mbg453 및 항 tgf-베타 항체 nis793의 조합물 |
| EP4097218A1 (en) | 2020-01-28 | 2022-12-07 | Juno Therapeutics, Inc. | Methods for t cell transduction |
| EP4110389A4 (en) * | 2020-02-28 | 2024-06-26 | The Brigham And Women's Hospital, Inc. | SELECTIVE SIGNALING MODULATION OF THE TRANSFORMING GROWTH FACTOR BETA SUPERFAMILY THROUGH MULTI-SPECIFIC ANTIBODIES |
| KR20230024283A (ko) | 2020-05-13 | 2023-02-20 | 주노 쎄러퓨티크스 인코퍼레이티드 | 임상 반응과 관련된 특징을 식별하는 방법 및 이의 용도 |
| JP2023529211A (ja) | 2020-06-11 | 2023-07-07 | ノバルティス アーゲー | Zbtb32阻害剤及びその使用 |
| MX2022015852A (es) | 2020-06-23 | 2023-01-24 | Novartis Ag | Regimen de dosificacion que comprende derivados de 3-(1-oxoisoindolin-2-il)piperidina-2,6-diona. |
| CN116234558A (zh) | 2020-06-26 | 2023-06-06 | 朱诺治疗学有限公司 | 条件性地表达重组受体的工程化t细胞、相关多核苷酸和方法 |
| US20230303974A1 (en) | 2020-07-30 | 2023-09-28 | Institut Curie | Immune Cells Defective for SOCS1 |
| JP2023536164A (ja) | 2020-08-03 | 2023-08-23 | ノバルティス アーゲー | ヘテロアリール置換3-(1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン誘導体及びその使用 |
| CN116802203A (zh) | 2020-11-04 | 2023-09-22 | 朱诺治疗学股份有限公司 | 从经修饰的恒定cd3免疫球蛋白超家族链基因座表达嵌合受体的细胞、相关多核苷酸和方法 |
| WO2022133030A1 (en) | 2020-12-16 | 2022-06-23 | Juno Therapeutics, Inc. | Combination therapy of a cell therapy and a bcl2 inhibitor |
| TW202227486A (zh) * | 2021-01-04 | 2022-07-16 | 大陸商上海翰森生物醫藥科技有限公司 | 一種抗erbb3受體的抗體或其抗原結合片段及其醫藥用途 |
| WO2022204070A1 (en) | 2021-03-22 | 2022-09-29 | Juno Therapeutics, Inc. | Methods of determining potency of a therapeutic cell composition |
| CN117321200A (zh) | 2021-03-22 | 2023-12-29 | 朱诺治疗学股份有限公司 | 评估病毒载体颗粒效力的方法 |
| JP2024514245A (ja) | 2021-03-29 | 2024-03-29 | ジュノー セラピューティクス インコーポレイテッド | チェックポイント阻害剤療法とcar t細胞療法との組合せを用いた投薬および処置のための方法 |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| TW202309294A (zh) | 2021-04-27 | 2023-03-01 | 瑞士商諾華公司 | 病毒載體生產系統 |
| EP4337763A1 (en) | 2021-05-10 | 2024-03-20 | Institut Curie | Methods for the treatment of cancer, inflammatory diseases and autoimmune diseases |
| WO2022248602A1 (en) | 2021-05-25 | 2022-12-01 | Institut Curie | Myeloid cells overexpressing bcl2 |
| WO2023126458A1 (en) | 2021-12-28 | 2023-07-06 | Mnemo Therapeutics | Immune cells with inactivated suv39h1 and modified tcr |
| AU2023209589A1 (en) | 2022-01-21 | 2024-08-08 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Modulation of suv39h1 expression by rnas |
| KR20240137075A (ko) | 2022-01-28 | 2024-09-19 | 주노 쎄러퓨티크스 인코퍼레이티드 | 세포 조성물의 제조 방법 |
| CN114539412B (zh) * | 2022-02-24 | 2023-09-29 | 广西医科大学 | 抗hla-a2/wt1复合物的单域抗体及其制备方法与应用 |
| WO2023187024A1 (en) | 2022-03-31 | 2023-10-05 | Institut Curie | Modified rela protein for inducing interferon expression and engineered immune cells with improved interferon expression |
| WO2023214325A1 (en) | 2022-05-05 | 2023-11-09 | Novartis Ag | Pyrazolopyrimidine derivatives and uses thereof as tet2 inhibitors |
| EP4279085A1 (en) | 2022-05-20 | 2023-11-22 | Mnemo Therapeutics | Compositions and methods for treating a refractory or relapsed cancer or a chronic infectious disease |
| WO2024062138A1 (en) | 2022-09-23 | 2024-03-28 | Mnemo Therapeutics | Immune cells comprising a modified suv39h1 gene |
| WO2024089639A1 (en) | 2022-10-26 | 2024-05-02 | Novartis Ag | Lentiviral formulations |
| WO2024088383A1 (en) * | 2022-10-28 | 2024-05-02 | Biocytogen Pharmaceuticals (Beijing) Co., Ltd. | Anti-wt1/hla antibodies and uses thereof |
| WO2024167871A1 (en) * | 2023-02-06 | 2024-08-15 | Memorial Sloan-Kettering Cancer Center | Compositions including anti-wt-1 antibodies & antigen binding fragments and uses thereof |
| WO2024220588A1 (en) | 2023-04-18 | 2024-10-24 | Juno Therapeutics, Inc. | Cytotoxicity assay for assessing potency of therapeutic cell compositions |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000018795A2 (en) * | 1998-09-30 | 2000-04-06 | Corixa Corporation | Compositions and methods for wt1 specific immunotherapy |
| WO2003068201A2 (en) * | 2002-02-13 | 2003-08-21 | Technion Research & Development Foundation Ltd. | High affinity antibody having a tcr-like specificity and use in detection and treatment |
| WO2003070752A2 (en) * | 2002-02-20 | 2003-08-28 | Dyax Corporation | Mhc-peptide complex binding ligands |
| WO2005056595A2 (en) * | 2003-12-06 | 2005-06-23 | Imperial Innovations Limited | T cell receptor specific for wilms tumor antigen |
| WO2009108372A2 (en) * | 2008-02-27 | 2009-09-03 | Receptor Logic, Inc. | Antibodies as t cell receptor mimics, methods of production and uses thereof |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4663283A (en) | 1980-03-24 | 1987-05-05 | Genentech, Inc. | Method of altering double-stranded DNA |
| US4456748A (en) | 1981-02-23 | 1984-06-26 | Genentech, Inc. | Hybrid human leukocyte interferons |
| US5726288A (en) * | 1989-11-13 | 1998-03-10 | Massachusetts Institute Of Technology | Localization and characterization of the Wilms' tumor gene |
| WO1997039354A1 (fr) * | 1996-04-16 | 1997-10-23 | Kishimoto, Tadamitsu | Procede de detection de cellules solides cancereuses et d'heterotypie histologique et procede d'examen du tissu dans le but d'effectuer une transplantation de moelle osseuse et une transplantation de cellules souches du sang peripherique |
| US7553494B2 (en) * | 2001-08-24 | 2009-06-30 | Corixa Corporation | WT1 fusion proteins |
| AU2003220079A1 (en) | 2002-03-08 | 2003-09-22 | Sloan-Kettering Institute For Cancer Research | Uses of monoclonal antibody 8h9 |
| EP1548028B1 (en) * | 2002-09-20 | 2009-09-09 | International Institute of Cancer Immunology, Inc. | Substituted type peptides of wt1 |
| US7595379B2 (en) | 2003-05-30 | 2009-09-29 | Agensys, Inc. | Antibodies and related molecules that bind to PSCA proteins |
| MX2008010842A (es) | 2006-02-22 | 2008-09-01 | Int Inst Cancer Immunology Inc | Peptido de tumor de wilms restringido por antigeno leucocitario humano-a*3303 y composicion farmaceutica que comprenden el mismo. |
| US8084022B2 (en) | 2006-06-23 | 2011-12-27 | Aegis Therapeutics, Llc | Stabilizing alkylglycoside compositions and methods thereof |
| EP2341142B8 (en) * | 2006-12-28 | 2015-01-14 | International Institute of Cancer Immunology, Inc. | HLA-A*1101-restricted WT1 peptide and pharmaceutical composition comprising same |
| EP2514766A3 (en) | 2007-03-29 | 2013-06-05 | Technion Research & Development Foundation Ltd. | Antibodies, methods and kits for diagnosing and treating melanoma |
| WO2009091826A2 (en) | 2008-01-14 | 2009-07-23 | The Board Of Regents Of The University Of Texas System | Compositions and methods related to a human cd19-specific chimeric antigen receptor (h-car) |
| CN102124120B (zh) | 2008-07-25 | 2013-11-13 | 电气化学工业株式会社 | 透明质酸的制备方法 |
| US8080415B2 (en) | 2008-09-26 | 2011-12-20 | Eureka Therapeutics, Inc. | Modified host cells and uses thereof |
| CA2826942C (en) | 2011-02-11 | 2021-08-03 | Memorial Sloan-Kettering Cancer Center | Hla-restricted, peptide-specific antigen binding proteins |
| US20160369006A1 (en) * | 2011-04-01 | 2016-12-22 | Memorial Sloan-Kettering Cancer Center | Fc-ENHANCED ANTI-WT1/HLA ANTIBODY |
| US10239952B2 (en) * | 2011-04-01 | 2019-03-26 | Memorial Sloan Kettering Cancer Center | Anti-WT1/HLA bi-specific antibody |
| PE20141271A1 (es) * | 2011-04-01 | 2014-10-08 | Sloan Kettering Inst Cancer | Anticuerpos tipo receptor de celulas t especificos para un peptido wt1 presentado por hla-a2 |
-
2012
- 2012-04-02 PE PE2013002165A patent/PE20141271A1/es not_active Application Discontinuation
- 2012-04-02 AP AP2013007142A patent/AP2013007142A0/xx unknown
- 2012-04-02 EP EP17195724.4A patent/EP3323833B1/en active Active
- 2012-04-02 CN CN201280026656.XA patent/CN103619882B/zh not_active Expired - Fee Related
- 2012-04-02 ES ES17195724T patent/ES2785081T3/es active Active
- 2012-04-02 MX MX2013011363A patent/MX2013011363A/es not_active Application Discontinuation
- 2012-04-02 EA EA201391449A patent/EA201391449A1/ru unknown
- 2012-04-02 MY MYPI2013003545A patent/MY160662A/en unknown
- 2012-04-02 KR KR1020137028479A patent/KR20140033029A/ko not_active Application Discontinuation
- 2012-04-02 US US14/008,447 patent/US9074000B2/en active Active
- 2012-04-02 AU AU2012236068A patent/AU2012236068A1/en not_active Abandoned
- 2012-04-02 EP EP12726511.4A patent/EP2694553B1/en active Active
- 2012-04-02 SG SG2013072277A patent/SG193956A1/en unknown
- 2012-04-02 JP JP2014502699A patent/JP6082997B2/ja not_active Expired - Fee Related
- 2012-04-02 WO PCT/US2012/031892 patent/WO2012135854A2/en active Application Filing
- 2012-04-02 ES ES12726511.4T patent/ES2651510T3/es active Active
- 2012-04-02 CA CA2831336A patent/CA2831336C/en active Active
- 2012-04-02 CN CN201610832132.XA patent/CN106632677B/zh not_active Expired - Fee Related
-
2013
- 2013-09-16 ZA ZA2013/06940A patent/ZA201306940B/en unknown
- 2013-09-30 NI NI201300099A patent/NI201300099A/es unknown
- 2013-10-01 CL CL2013002828A patent/CL2013002828A1/es unknown
- 2013-10-01 CU CUP2013000130A patent/CU20130130A7/es active IP Right Grant
- 2013-10-01 GT GT201300233A patent/GT201300233A/es unknown
- 2013-10-01 DO DO2013000219A patent/DOP2013000219A/es unknown
- 2013-10-24 CO CO13252732A patent/CO6900116A2/es unknown
-
2015
- 2015-05-28 US US14/724,155 patent/US9540448B2/en active Active
- 2015-10-30 JP JP2015213831A patent/JP2016026209A/ja active Pending
-
2016
- 2016-11-30 US US15/364,953 patent/US10040865B2/en active Active
-
2017
- 2017-05-26 AU AU2017203511A patent/AU2017203511B2/en not_active Ceased
-
2018
- 2018-08-06 US US16/055,535 patent/US10858444B2/en active Active
-
2020
- 2020-10-30 US US17/085,234 patent/US20210163624A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000018795A2 (en) * | 1998-09-30 | 2000-04-06 | Corixa Corporation | Compositions and methods for wt1 specific immunotherapy |
| WO2003068201A2 (en) * | 2002-02-13 | 2003-08-21 | Technion Research & Development Foundation Ltd. | High affinity antibody having a tcr-like specificity and use in detection and treatment |
| WO2003070752A2 (en) * | 2002-02-20 | 2003-08-28 | Dyax Corporation | Mhc-peptide complex binding ligands |
| WO2005056595A2 (en) * | 2003-12-06 | 2005-06-23 | Imperial Innovations Limited | T cell receptor specific for wilms tumor antigen |
| WO2009108372A2 (en) * | 2008-02-27 | 2009-09-03 | Receptor Logic, Inc. | Antibodies as t cell receptor mimics, methods of production and uses thereof |
Non-Patent Citations (5)
| Title |
|---|
| JPN5014005619; DENKBERG, G. AND REITER, Y.: 'RECOMBINANT ANTIBODIES WITH T-CELL RECEPTOR-LIKE SPECIFICITY: 以下備考' AUTOIMMUNITY REVIEWS V5 N4, 20060401, P252-257, ELSEVIER * |
| JPN5014005620; KEILHOLZ, U. ET AL.: 'A CLINICAL AND IMMUNOLOGIC PHASE 2 TRIAL OF WILMS TUMOR GENE PRODUCT 1 (WT1) PEPTIDE VACCINATION IN' BLOOD V113 N26, 20090625, P6541-6548 * |
| JPN5014005620; KEILHOLZ, U. ET AL.: 'A CLINICAL AND IMMUNOLOGIC PHASE 2 TRIAL OF WILMS TUMOR GENE PRODUCT 1 (WT1) 以下備考' BLOOD V113 N26, 20090625, P6541-6548 * |
| JPN5014005621; OKA, Y. ET AL.: 'DEVELOPMENT OF WT1 PEPTIDE CANCER VACCINE AGAINST HEMATOPOIETIC MALIGNANCIES AND SOLID CANCERS' CURRENT MEDICINAL CHEMISTRY V13 N20, 20060101, P2345-2352, BENTHAM SCIENCE PUBLISHERS BV * |
| JPN6016009801; WILLEMSEN R. et al.: 'Selection of human antibody fragments directed against tumor T-cell epitopes for adoptive T-cell the' Cytometry A. Vol.73 No.11, 200811, p.1093-1099 * |
Cited By (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10239952B2 (en) | 2011-04-01 | 2019-03-26 | Memorial Sloan Kettering Cancer Center | Anti-WT1/HLA bi-specific antibody |
| JP2017500057A (ja) * | 2013-11-07 | 2017-01-05 | メモリアル スローン−ケタリング キャンサー センター | 抗wt1/hla二重特異性抗体 |
| JP7224318B2 (ja) | 2014-07-15 | 2023-02-17 | ジュノー セラピューティクス インコーポレイテッド | 養子細胞療法用の操作された細胞 |
| JP2020195393A (ja) * | 2014-07-15 | 2020-12-10 | ジュノー セラピューティクス インコーポレイテッド | 養子細胞療法用の操作された細胞 |
| JP2016204358A (ja) * | 2014-12-25 | 2016-12-08 | 国立大学法人三重大学 | Wt1由来ペプチド認識抗体 |
| JP2018512145A (ja) * | 2015-04-03 | 2018-05-17 | ユーリカ セラピューティックス, インコーポレイテッド | Afpペプチド/mhc複合体を標的化する構築物およびその使用 |
| JP2021101723A (ja) * | 2015-04-03 | 2021-07-15 | ユーリカ セラピューティックス, インコーポレイテッド | Afpペプチド/mhc複合体を標的化する構築物およびその使用 |
| JP2018526970A (ja) * | 2015-06-08 | 2018-09-20 | アディセット バイオ インク.Adicet Bio Inc. | 微細特異性を有するt細胞受容体様抗体 |
| JP7013243B2 (ja) | 2015-06-08 | 2022-01-31 | アディセット バイオ インク. | 微細特異性を有する親和性結合体 |
| US11168150B2 (en) | 2015-06-09 | 2021-11-09 | Memorial Sloan Kettering Cancer Center | T cell receptor-like antibody agents specific for EBV latent membrane protein 2A peptide presented by human HLA |
| JP2018520667A (ja) * | 2015-06-09 | 2018-08-02 | メモリアル スローン ケタリング キャンサー センター | ヒトhlaにより提示されるebv潜伏感染膜タンパク質2aペプチドに特異的なt細胞受容体様抗体剤 |
| JP7000162B2 (ja) | 2015-06-09 | 2022-02-10 | メモリアル スローン ケタリング キャンサー センター | ヒトhlaにより提示されるebv潜伏感染膜タンパク質2aペプチドに特異的なt細胞受容体様抗体剤 |
| JP2018536393A (ja) * | 2015-10-09 | 2018-12-13 | イマティクス バイオテクノロジーズ ゲーエムベーハー | 抗wt1/hla特異的抗体 |
| JP2022050431A (ja) * | 2015-10-23 | 2022-03-30 | ユーリカ セラピューティックス, インコーポレイテッド | 抗体/t細胞受容体キメラ構築物およびその使用 |
| US11421013B2 (en) | 2015-10-23 | 2022-08-23 | Eureka Therapeutics, Inc. | Antibody/T-cell receptor chimeric constructs and uses thereof |
| JP2019500848A (ja) * | 2015-10-23 | 2019-01-17 | ユーリカ セラピューティックス, インコーポレイテッド | 抗体/t細胞受容体キメラ構築物およびその使用 |
| JP7316042B2 (ja) | 2015-10-23 | 2023-07-27 | ユーリカ セラピューティックス, インコーポレイテッド | 抗体/t細胞受容体キメラ構築物およびその使用 |
| US11976105B2 (en) | 2015-10-23 | 2024-05-07 | Eureka Therapeutics, Inc. | Antibody/T-cell receptor chimeric constructs and uses thereof |
| US11613573B2 (en) | 2017-04-26 | 2023-03-28 | Eureka Therapeutics, Inc. | Chimeric antibody/T-cell receptor constructs and uses thereof |
| US11965021B2 (en) | 2017-04-26 | 2024-04-23 | Eureka Therapeutics, Inc. | Cells expressing chimeric activating receptors and chimeric stimulating receptors and uses thereof |
| JP2021129561A (ja) * | 2017-12-21 | 2021-09-09 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Hla−a2/wt1に結合する抗体 |
| JP2021507698A (ja) * | 2017-12-21 | 2021-02-25 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Hla−a2/wt1に結合する抗体 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6082997B2 (ja) | Hla−a2により提示されるwt1ペプチドへのt細胞受容体様抗体 | |
| US11384144B2 (en) | T cell receptor-like antibodies specific for a PRAME peptide | |
| US20210277117A1 (en) | Constructs targeting afp peptide/mhc complexes and uses thereof | |
| EP3442567A1 (en) | Anti-psma antibodies and use thereof | |
| JP2019512207A (ja) | Foxp3由来のペプチドに特異的なt細胞受容体様抗体 | |
| JP2019514871A (ja) | 骨髄性白血病の治療方法で使用するための、cd33とcd3に結合する二重特異性構築物の投与の方法 | |
| TW201831517A (zh) | 靶向組織蛋白h3肽/mhc複合體之構築體及其用途 | |
| TW201827453A (zh) | 靶向hiv肽/mhc複合物之構築體及其用途 | |
| CN112771075A (zh) | 结合至cd33和cd3的双特异性抗体构建体的延长施用 | |
| EP4378953A1 (en) | Cd229 targeting moiety for the tratment of cd229 positive cancer | |
| NZ617008B2 (en) | T cell receptor-like antibodies specific for a wt1 peptide presented by hla-a2 | |
| JP2024532167A (ja) | 抗flt3抗体、car、car t細胞、及び使用方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140618 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140618 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20140807 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150120 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150731 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151030 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160315 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160715 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20160728 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160915 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160927 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161107 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20161124 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20161226 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20161226 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20161226 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6082997 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |