KR20140033029A - 에이치엘에이 에이2에 의해 제공된 더블유티1 펩타이드에 특이적인 티 세포 수용체 유사 항체 - Google Patents
에이치엘에이 에이2에 의해 제공된 더블유티1 펩타이드에 특이적인 티 세포 수용체 유사 항체 Download PDFInfo
- Publication number
- KR20140033029A KR20140033029A KR1020137028479A KR20137028479A KR20140033029A KR 20140033029 A KR20140033029 A KR 20140033029A KR 1020137028479 A KR1020137028479 A KR 1020137028479A KR 20137028479 A KR20137028479 A KR 20137028479A KR 20140033029 A KR20140033029 A KR 20140033029A
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- gly
- antibody
- val
- nos
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/5748—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving oncogenic proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oncology (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Hospice & Palliative Care (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurology (AREA)
- Reproductive Health (AREA)
- Endocrinology (AREA)
Abstract
본 발명은 윌름스 종양 단백질(WT1)에 대한 인간화된, 키메릭 및 완전 인간 항체를 포함하여, 상기 WT1에 특이적으로 결합하는 항원 결합 단백질, 그의 항체 단편, 키메릭 항원 수용체(CAR), 융합 단백질, 및 접합체를 제공한다. 상기 항원 결합 단백질 및 항체는 HLA-A0201-제한된 WT1 펩타이드에 결합한다. 상기와 같은 항체, 그의 단편, 융합 단백질 및 접합체는 WT1 관련된 암, 예를 들어 유방암, 난소암, 전립선암, 만성 골수구 백혈병, 다발성 골수종, 급성 림프구성 백혈병(ALL), 급성 골수/골수성 백혈병(AML) 및 골수이형성 증후군(MDS)의 치료에 유용하다. 보다 특정한 실시태양에서, 상기 항-WT1/A 항체는 단백질 안정성, 항체 결합 및/또는 발현 수준을 개선시키도록 설계된 하나 이상의 프레임워크 영역 아미노산 치환을 포함할 수도 있다.
Description
본 발명은 일반적으로 시토솔 단백질에 대한 항체에 관한 것이다. 보다 특히, 본 발명은 윌름스 종양 발암유전자 단백질(WT1)에 대한 항체, 구체적으로 주 조직적합성 항원과 함께 WT1 펩타이드를 인식하는 항체에 관한 것이다.
관련 출원의 상호 참조
본 출원은 2011년 4월 1일자로 출원된 미국 가 출원 제 61/470,635 호 및 2011년 5월 31일자로 출원된 미국 가 출원 제 61/491,392 호로부터 우선권을 주장한다. 이들 가 출원은 내용 전체가 본 명세에 참고로 인용된다.
연방 지원 연구 하의 권리에 대한 진술
본 발명은 미국 국립보건원에 의해 수여된 인가 P01CA23766 및 R01CA55349 하에 정부 지원으로 수행되었다. 정부는 본 발명에 대한 일정한 권리를 갖는다.
서열 목록
본 출원은 2012년 3월 29일자로 생성된 서열 목록을 함유하며; ASCII 포맷의 파일을 3314013AWO_서열 목록_ST25.txt로 나타낸다. 상기 파일은 내용 전체가 본 출원에 참고로 인용된다.
발명의 배경
윌름스 종양 발암유전자 단백질(WT1)은 대부분의 백혈병 및 광범위한 암에 대한 면역요법에 매력적인 표적이다. WT1은 배아형성 중 중배엽 조직에서 통상적으로 발현되는 아연 집게 전사 인자이다. 정상적인 성인 조직에서, WT1 발현은 CD34+ 조혈모세포에서 낮은 수준으로 제한되지만 다중 계통의 백혈병 및 광범위한 고형 종양에서는 과발현된다(1-2). 보다 최근에, WT1 발현은 최소 잔존 질병의 마커인 것으로 보고되었다. 형태학적 관해에 있어서 급성 골수성 백혈병(AML) 환자에서 증가하는 전사물 수준은 명백한 임상적 재발의 전조였다(3,4). 더욱 또한, WT1에 대한 항체가 조혈 악성종양 및 고형 종양 환자에서 검출되며, 이는 WT1이 고도의 면역원성 항원임을 가리킨다(7).
대개, 임상적으로 승인된 치료학적 단클론 항체(mAb)는 세포 표면 단백질의 구조를 인식한다. 그러나, WT1은 핵 단백질이며, 따라서 고전적인 항체 요법으로는 접근할 수 없다. 지금까지, WT1을 표적화하는 면역요법은 세포적 접근법으로 국한되었으며, 오로지, MHC 부류 I 분자에 의해서 세포 표면상에 제공된 펩타이드를 인식하는 WT1-특이적 세포독성 CD8 T 세포(CTL) 반응을 생성시키는 것을 목표로 하였다.
CTL 반응의 유도를 위해서, 세포내 단백질을 대개는 프로테아솜 또는 엔도/리소솜에 의해 분해시키고, 생성되는 펩타이드 단편을 MHC 부류 I 또는 II 분자에 결합시킨다. 이들 펩타이드-MHC 복합체는 상기 세포 표면에서 나타나며 여기에서 이들은 펩타이드-MHC(pMHC)-T 세포 수용체(TCR) 상호작용을 통해 T 세포 인식에 대한 표적을 제공한다(8,9). 상기 WT1 단백질로부터 유래한 펩타이드에 의한 백신화는 HLA-제한된 세포독성 CD8 T 세포를 유도하며, 상기 세포는 종양 세포를 살해할 수 있다.
효능을 개선시키기 위해서, 암 항원을 단클론 항체 요법에 의해 표적화할 수 있다. 단클론 항체(mAb) 요법은 다수의 기전들, 예를 들어 보체-의존적인 세포독성(CDC), 항체-의존적인 세포 세포독성(ADCC) 및 표적 분자를 과-발현하는 종양 세포에 대한 직접적인 세포 억제 또는 세포사멸-유도 효과에 의해 강력한 항종양 효과를 발휘하는 것으로 나타났다. 더욱 또한, mAb를 담체로서 사용하여 방사성핵종, 세포독성 약물 또는 독소와 같은 세포독성 부분을 종양 세포로 특이적으로 전달할 수 있다(18).
세포성 면역요법 접근법 외에, 체액성 면역요법 접근법이 비-세포 표면 종양 항원을 표적화하는데 이용될 수 있다면 굉장한 이점이 존재할 것이다. 따라서, MHC 분자와 함께 세포내 단백질의 단편을 포함하는 표적, 예를 들어 WT1 펩타이드/HLA-A2 복합체에 특이적이라는 점에서 T 세포 수용체를 모방하는 단클론 항체(mAb)는 단독으로 또는 효능있는 항암 시약, 예를 들어 약물, 독소 및 방사성 원소를 전달할 수 있는 비히클로서 신규의 유효한 치료제일 것이다. 상기와 같은 mAb는 또한 진단 또는 예측 도구로서 유용할 것이다.
발명의 요약
본 명세는 시토솔/세포내 단백질, 예를 들어 WT1 종양단백질을 표적화할 수 있는 항원-결합 단백질, 예를 들어 항체를 동정하고 특성화한다. 상기 개시된 항체는 전형적으로 WT1 단백질에 의한 항원 처리 및 세포에 의한 제공에 따라 상기 세포의 표면상에 나타날 것이기 때문에 펩타이드/MHC 복합체를 표적화한다. 이에 관하여, 상기 항체는 상기 항체가 MHC-제한된 방식으로, 즉 펩타이드가 MHC 항원에 결합되는 때에, 상기 펩타이드를 특이적으로 인식하고 이에 결합하는 능력을 갖는다는 점에서 T-세포 수용체를 모방한다. 상기 펩타이드/MHC 복합체는 전형적으로 항원 처리 및 상기 WT1 단백질의 T-세포에의 제공에 따라 세포의 표면상에 나타날 것이기 때문에 상기 항원을 재현한다.
상기 개시된 항체는 펩타이드/HLA-A2 복합체, 특히 WT1/HLA-A0201 복합체의 에피토프를 특이적으로 인식하고 이에 결합한다. HLA-펩타이드 복합체의 부분으로서 본 발명의 항원-결합 단백질에 의해 인식되는 펩타이드의 예는 비제한적으로, 표 7에 나타낸 것들, 예를 들어 아미노산 서열 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드를 포함한다.
따라서, 하나의 태양에서, 본 발명은 아미노산 서열 RMFPNAPYL을 갖는 펩타이드가 MHC 항원, 예를 들어 HLA-A2에 결합할 때, 상기 펩타이드에 결합하는 단리된 항체, 또는 그의 항원-결합 단편에 관한 것이다.
또 다른 태양에서, 본 발명은 (A)(i) 각각 아미노산 서열 서열번호: 2, 3 및 4를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 8, 9 및 10을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; (ii) 각각 아미노산 서열 서열번호: 20, 21 및 22를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 26, 27 및 28을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; (iii) 각각 아미노산 서열 서열번호: 38, 39 및 40을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 44, 45 및 46을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; (iv) 각각 아미노산 서열 서열번호: 56, 57 및 58을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 62, 63 및 64를 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; (v) 각각 아미노산 서열 서열번호: 74, 75 및 76을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 80, 81 및 82를 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; 또는 (vi) 각각 아미노산 서열 서열번호: 92, 93 및 94를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 98, 99 및 100을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역을 포함하는 단리된 항원-결합 단백질, 항체, 또는 그의 항원-결합 단편에 관한 것이다.
또 다른 태양에서, 본 발명은 각각 서열번호: 14 및 16; 32 및 34; 50 및 52; 68 및 70; 86 및 88; 및 104 및 106 중에서 선택된 제 1 및 제 2 아미노산 서열을 포함하는 VH 및 VL을 포함하는 단리된 항원-결합 단백질, 항체, 또는 그의 항원-결합 단편에 관한 것이다.
더욱 또 다른 태양에서, 본 발명은 서열번호: 18, 36, 54, 72, 90 및 108 중에서 선택된 아미노산 서열을 포함하는 단리된 항원-결합 단백질, 항체, 또는 그의 항원-결합 단편에 관한 것이다.
관련된 태양에서, 상기 단리된 항원-결합 단백질은 표 1 내지 8 중 어느 하나에 개시된 바와 같은 항원-결합 영역을 포함한다. 상기 항원-결합 단백질은 융합 단백질일 수도 있다.
또 다른 태양에서, 본 발명은 본 발명에 개시된 바와 같은 항원-결합 단백질, 항체 또는 그의 항원-결합 단편인 제 1 성분을 포함하는 면역접합체 (immunoconjugate)에 관한 것이다. 상기 면역접합체는 세포독소, 검출 가능한 표지, 방사성동위원소, 치료제, 결합 단백질 또는 제 2 아미노산 서열을 갖는 분자인 제 2 성분을 포함한다. 상기 제 2 성분이 결합 단백질 또는 제 2 항체인 경우, 상기 결합 단백질 또는 제 2 항체는 상기 제 1 성분이 특이적인 HLA-펩타이드 복합체와 상이한 표적에 대해 결합 특이성을 갖는다.
따라서, 관련된 태양에서, 본 발명은 본 발명에 개시된 바와 같은 항원-결합 단백질 또는 그의 작용 단편을 포함하는 이중특이성 (bispecific) 항체에 관한 것이다.
더욱 또 다른 태양에서, 본 발명은 WT1 펩타이드/HLA 복합체, 특히 WT1 펩타이드 RMFPNAPYL/HLA-A0201의 복합체에 특이성인 항체 및 키메릭 항원 수용체를 포함한, 항원 결합 단백질을 암호화하는 핵산에 관한 것이다.
또 다른 관련된 태양에서, 본 발명은 재조합 면역 효과기 (effector) 세포, 예를 들어 본 명세에 따라 항원 결합 영역을 포함하는 키메릭 항원 수용체를 발현하도록 유전자 변형된 T-세포를 포함한, 본 발명에 개시된 핵산 또는 항원 결합 단백질을 포함하는 세포에 관한 것이다. 본 명세에 따라 항체를 생산하도록 조작된 세포가 또한 본 발명에 포함된다.
관련된 태양에서, 본 발명은 본 명세에 따라 항체 또는 키메릭 항원 수용체와 같은 항원 결합 단백질의 발현 및/또는 분비를 촉진하는 벡터를 포함한, 본 발명에 개시된 항원 결합 단백질을 암호화하는 핵산을 포함하는 벡터에 관한 것이다.
관련된 태양에서, 본 발명은 약학적으로 허용 가능한 담체와 함께, 본 발명에 개시된 핵산 또는 항원 결합 단백질을 포함하는 항원 결합 단백질, 항체, 핵산, 벡터 또는 세포를 포함하는 약학 조성물에 관한 것이다.
또 다른 태양에서, 본 발명은 본 발명의 WT1 항체를 사용하여 세포 또는 조직의 표면상에서 WT1을 검출하는 방법에 관한 것이다.
더욱 또 다른 태양에서, 본 발명은 WT1-양성 질병을 갖는 환자에게 치료 유효량의 항원 결합 단백질, 항체 또는 그의 항원 결합 단편, 상기 항원 결합 단백질 또는 항체를 암호화하는 핵산 또는 본 발명에 개시된 바와 같은 핵산 또는 단백질을 포함하는 세포를 투여함을 포함하는, 상기 환자의 치료 방법에 관한 것이다. 상기 WT1-양성 질병은 만성 백혈병, 급성 백혈병, 또는 만성 골수구 백혈병, 다발성 골수종(MM), 급성 림프구성 백혈병(ALL), 급성 골수/골수성 백혈병(AML), 골수이형성 증후군(MDS), 중피종, 난소암, 위장암, 유방암, 전립선암 및 교아세포종으로 이루어진 그룹 중에서 선택된 WT1+ 암이다. 일부 실시태양에서, 상기 항원 결합 단백질 또는 항체는 상기 단백질 또는 항체에 결합된 세포독성 부분을 갖는 접합체 (conjugate)이다.
도 1은 굵은선의 일부 HLA-제한된 펩타이드를 갖는 윌름스 종양 단백질의 아미노산 서열(진뱅크(GenBank) 수납 번호 P19544)을 도시한다. 121-140 펩타이드는 그의 유사체 외에, WT1-특이성 세포독성 T-세포 활성을 유도하는 것으로 나타난 9-머(밑줄), RMFPNAPYL(서열번호: 1)을 또한 포함한다.
도 2는 WT1 펩타이드에 의한 백신화가 WT1+ 백혈병 세포에 대해 세포독성인 T 세포를 유도함을 도시하는 그래프이다.
도 3은 WT1/A2(WA) 대 PBS 대조군 또는 R3/HLAA0201(R3)의 특이적인 결합에 대한 파지 ELISA의 결과를 도시한다.
도 4는 WT1A 펩타이드에 의해 펄스화된 T2 세포에 결합하는 WT1 파지 항체의 특이적인 결합만이 선택되었음을 도시한다.
도 5는 다양한 농도에서 WT1 항체의 역가에 의해 시험된 RMF/A0201 복합체에 대한 상기 항체의 완전 길이 IgG1의 결합 친화성을 도시한다. 결과를 50 ug/㎖ RMF에 의해 펄스화된 T2 세포에 대해 도시한다(상부 패널). 대조용 항체를 하부 패널에 도시한다.
도 6은 RMF(상부 패널) 또는 대조용, RHAMM-R3(하부 패널)에 의해 펄스화된 T2 세포 상의 WT1 항체에 의해 인식된 RMF/HLA-A0201 복합체의 밀도에 대한 의존성을 도시한다.
도 7은 인간 항체의 발현을 위한 발현 벡터를 도시한다.
도 8은 환원 및 비-환원 조건 하에서 WT1/A2 항체의 SDS-PAGE 분석의 결과를 도시한다.
도 9는 WT1/A2에 대한 항체의 친화성을 입증하는 WT1/A2 항체의 동역학적 결합 분석의 결과를 도시한다.
도 10은 WT1/A2 복합체에 대한 항체 결합의 친화성(KD)을 도시한다.
도 11은 다양한 농도의 펩타이드, WT1-A, WT1-A1 또는 대조군에 의해 펄스화된 살아있는 T2 세포에 대한 일부 실시태양, mAb 클론 5(상부 패널), 클론 15(중간 패널) 및 대조군(하부 패널)의 결합에 대한 펩타이드 역가의 유식 세포측정에 의한 평균 형광 강도(MFI)를 도시한다.
도 12는 다양한 농도의 WT1A 펩타이드에 의해 펄스화된 살아있는 T2 세포에 대한 WT1 항체, mAb 5(상부 패널), mAb 15(하부 패널)의 결합에 대한 펩타이드 역가의 결과를 도시한다.
도 13은 상이한 농도(50 ㎍/㎖ 상부; 25 ㎍/㎖ 중간; 및 12.5 ㎍/㎖ 하부)의 펩타이드(R3, WT1-A1, WT1-A 또는 펩타이드 부재)에서 하나의 실시태양, mAb 5의 결합 특이성을 도시한다.
도 14는 상이한 농도(50 ㎍/㎖ 상부; 25 ㎍/㎖ 하부)의 펩타이드(R3, WT1-A1, WT1-A 또는 펩타이드 부재)에서 하나의 실시태양, mAb 5의 결합 특이성을 도시한다.
도 15는 WT1-A, WT1-A1 또는 RHAMM-R3 펩타이드에 의해 펄스화된 T2 세포에 대한 mAb 5(상부 패널) 및 15(하부 패널)의 용량-의존적인 결합을 도시한다.
도 16은 U266, 골수종 세포주에 대한 mAb 5 및 15의 결합을 도시한다.
도 17은 (Ph1)-양성 급성 백혈병을 갖는 개인으로부터 유래한 세포 주, BV173에 대한 mAb 15의 결합을 도시한다.
도 18은 WT1 펩타이드에 의해 펄스화된 T2 세포의 표면상의 WT1/A2 복합체에 대한 ESK1(#13)의 결합 특이성을 도시한다.
도 19 및 20은 WT1 항체가, RMF 펩타이드의 상이한 위치들이 알라닌으로 치환된 상기 RMF 펩타이드를 인식할 수 있고 (또한 표 10 참조), 1 번 위치의 알라닌(WT1-A1-B) 또는 타이로신(WT1-A1)에 의한 치환으로 나타난 결합의 상실이, 상기 두 펩타이드가 모두 HLA-A2 분자, 클론 BB7에 대해 특이적인 mAb를 사용하는 T2 안정화 분석에서 가장 강한 결합을 나타내었으므로, 상기 HLA-A2 분자에 대한 펩타이드 결합 친화성의 감소에 기인하지 않았음을 도시한다.
도 21은 인간 중피종 세포주, JMN(WT1+/A0201+)(그러나 MSTO(WT1+/HLA-A0201-)는 아님)의 세포 표면상에 천연으로 제공된 RMF/HLA-A0201 복합체의 WT1 항체에 의한 인식을 도시한다.
도 22는 인간 CML-유래한 세포주 BV173에 대한 WT1 항체의 결합을 도시한다.
도 23은 JMN 세포에 대한 WT1 항체의 결합에 근거한 스캐차드 분석이며 약 0.2 nM의 결합활성 상수를 도시한다.
도 24는 중피종 및 백혈병 세포의 패널에 대한 WT1 항체 결합을 도시한다.
도 25는 HLA-A2 양성 환자로부터의 CD33 및 CD34 이중 양성 AML 아세포 상에서 걸러지는(gated) 유식 세포측정 분석의 결과를 도시한다. ESK1은 백혈병 아세포에 결합한다.
도 26은 HLA-A2 음성 환자로부터의 CD33 및 CD34 이중 양성 AML 아세포 상에서 걸러지는 유식 세포측정 분석의 결과를 도시한다. WT1mAb ESK1은 상기 아세포에 결합하지 않는다.
도 27은 RMF 펩타이드에 의해 펄스화된 T2 세포에 대한 WT1mAb ESK1 매개된 ADCC를 도시한다.
도 28은 JMN 및 백혈병 세포주 BV173(하부 패널)(그러나 MSTO 세포는 아니다)에서 인간 효과기와 함께 ADCC을 매개하는 WT1 항체의 능력을 도시한다.
도 29는 WT1 mAb가 인간 백혈병 세포주 BV173(그러나 HLA-A2+가 아닌 HL60 세포는 아니다)에 대해 유효함을 도시한다.
도 30은 WT1 항체가 HLA-A2 양성 환자로부터의 1차 AML 아세포에 대해 ADCC를 유도함을 도시한다.
도 31은 본 발명의 항체를 사용하는, NSG 마우스에서 인간 BV173의 치료 결과를 도시한다.
도 32는 나중의 시점들에서, WT1 항체에 의해 처리된 마우스는 단지 재발하기 시작한 반면, 효과기를 갖는 항체는 5 마리 중 2 마리의 마우스가 치유됨을 도시한다.
도 33은 WT1 항체가 용량-의존적인 방식으로 종양 부담을 현저하게 감소시킴을 도시한다.
도 34는 Fc(MAGE) 중에 변경된 탄수화물을 갖는 항체가 원래의 항체보다 ADCC에 있어서 보다 활성임을 도시한다.
도 2는 WT1 펩타이드에 의한 백신화가 WT1+ 백혈병 세포에 대해 세포독성인 T 세포를 유도함을 도시하는 그래프이다.
도 3은 WT1/A2(WA) 대 PBS 대조군 또는 R3/HLAA0201(R3)의 특이적인 결합에 대한 파지 ELISA의 결과를 도시한다.
도 4는 WT1A 펩타이드에 의해 펄스화된 T2 세포에 결합하는 WT1 파지 항체의 특이적인 결합만이 선택되었음을 도시한다.
도 5는 다양한 농도에서 WT1 항체의 역가에 의해 시험된 RMF/A0201 복합체에 대한 상기 항체의 완전 길이 IgG1의 결합 친화성을 도시한다. 결과를 50 ug/㎖ RMF에 의해 펄스화된 T2 세포에 대해 도시한다(상부 패널). 대조용 항체를 하부 패널에 도시한다.
도 6은 RMF(상부 패널) 또는 대조용, RHAMM-R3(하부 패널)에 의해 펄스화된 T2 세포 상의 WT1 항체에 의해 인식된 RMF/HLA-A0201 복합체의 밀도에 대한 의존성을 도시한다.
도 7은 인간 항체의 발현을 위한 발현 벡터를 도시한다.
도 8은 환원 및 비-환원 조건 하에서 WT1/A2 항체의 SDS-PAGE 분석의 결과를 도시한다.
도 9는 WT1/A2에 대한 항체의 친화성을 입증하는 WT1/A2 항체의 동역학적 결합 분석의 결과를 도시한다.
도 10은 WT1/A2 복합체에 대한 항체 결합의 친화성(KD)을 도시한다.
도 11은 다양한 농도의 펩타이드, WT1-A, WT1-A1 또는 대조군에 의해 펄스화된 살아있는 T2 세포에 대한 일부 실시태양, mAb 클론 5(상부 패널), 클론 15(중간 패널) 및 대조군(하부 패널)의 결합에 대한 펩타이드 역가의 유식 세포측정에 의한 평균 형광 강도(MFI)를 도시한다.
도 12는 다양한 농도의 WT1A 펩타이드에 의해 펄스화된 살아있는 T2 세포에 대한 WT1 항체, mAb 5(상부 패널), mAb 15(하부 패널)의 결합에 대한 펩타이드 역가의 결과를 도시한다.
도 13은 상이한 농도(50 ㎍/㎖ 상부; 25 ㎍/㎖ 중간; 및 12.5 ㎍/㎖ 하부)의 펩타이드(R3, WT1-A1, WT1-A 또는 펩타이드 부재)에서 하나의 실시태양, mAb 5의 결합 특이성을 도시한다.
도 14는 상이한 농도(50 ㎍/㎖ 상부; 25 ㎍/㎖ 하부)의 펩타이드(R3, WT1-A1, WT1-A 또는 펩타이드 부재)에서 하나의 실시태양, mAb 5의 결합 특이성을 도시한다.
도 15는 WT1-A, WT1-A1 또는 RHAMM-R3 펩타이드에 의해 펄스화된 T2 세포에 대한 mAb 5(상부 패널) 및 15(하부 패널)의 용량-의존적인 결합을 도시한다.
도 16은 U266, 골수종 세포주에 대한 mAb 5 및 15의 결합을 도시한다.
도 17은 (Ph1)-양성 급성 백혈병을 갖는 개인으로부터 유래한 세포 주, BV173에 대한 mAb 15의 결합을 도시한다.
도 18은 WT1 펩타이드에 의해 펄스화된 T2 세포의 표면상의 WT1/A2 복합체에 대한 ESK1(#13)의 결합 특이성을 도시한다.
도 19 및 20은 WT1 항체가, RMF 펩타이드의 상이한 위치들이 알라닌으로 치환된 상기 RMF 펩타이드를 인식할 수 있고 (또한 표 10 참조), 1 번 위치의 알라닌(WT1-A1-B) 또는 타이로신(WT1-A1)에 의한 치환으로 나타난 결합의 상실이, 상기 두 펩타이드가 모두 HLA-A2 분자, 클론 BB7에 대해 특이적인 mAb를 사용하는 T2 안정화 분석에서 가장 강한 결합을 나타내었으므로, 상기 HLA-A2 분자에 대한 펩타이드 결합 친화성의 감소에 기인하지 않았음을 도시한다.
도 21은 인간 중피종 세포주, JMN(WT1+/A0201+)(그러나 MSTO(WT1+/HLA-A0201-)는 아님)의 세포 표면상에 천연으로 제공된 RMF/HLA-A0201 복합체의 WT1 항체에 의한 인식을 도시한다.
도 22는 인간 CML-유래한 세포주 BV173에 대한 WT1 항체의 결합을 도시한다.
도 23은 JMN 세포에 대한 WT1 항체의 결합에 근거한 스캐차드 분석이며 약 0.2 nM의 결합활성 상수를 도시한다.
도 24는 중피종 및 백혈병 세포의 패널에 대한 WT1 항체 결합을 도시한다.
도 25는 HLA-A2 양성 환자로부터의 CD33 및 CD34 이중 양성 AML 아세포 상에서 걸러지는(gated) 유식 세포측정 분석의 결과를 도시한다. ESK1은 백혈병 아세포에 결합한다.
도 26은 HLA-A2 음성 환자로부터의 CD33 및 CD34 이중 양성 AML 아세포 상에서 걸러지는 유식 세포측정 분석의 결과를 도시한다. WT1mAb ESK1은 상기 아세포에 결합하지 않는다.
도 27은 RMF 펩타이드에 의해 펄스화된 T2 세포에 대한 WT1mAb ESK1 매개된 ADCC를 도시한다.
도 28은 JMN 및 백혈병 세포주 BV173(하부 패널)(그러나 MSTO 세포는 아니다)에서 인간 효과기와 함께 ADCC을 매개하는 WT1 항체의 능력을 도시한다.
도 29는 WT1 mAb가 인간 백혈병 세포주 BV173(그러나 HLA-A2+가 아닌 HL60 세포는 아니다)에 대해 유효함을 도시한다.
도 30은 WT1 항체가 HLA-A2 양성 환자로부터의 1차 AML 아세포에 대해 ADCC를 유도함을 도시한다.
도 31은 본 발명의 항체를 사용하는, NSG 마우스에서 인간 BV173의 치료 결과를 도시한다.
도 32는 나중의 시점들에서, WT1 항체에 의해 처리된 마우스는 단지 재발하기 시작한 반면, 효과기를 갖는 항체는 5 마리 중 2 마리의 마우스가 치유됨을 도시한다.
도 33은 WT1 항체가 용량-의존적인 방식으로 종양 부담을 현저하게 감소시킴을 도시한다.
도 34는 Fc(MAGE) 중에 변경된 탄수화물을 갖는 항체가 원래의 항체보다 ADCC에 있어서 보다 활성임을 도시한다.
본 발명에 인용된 모든 공보, 특허 및 다른 참고문헌들은 본 명세에 내용 전체가 참고로 인용된다.
본 발명의 실시에서, 분자 생물학, 미생물학, 세포 생물학, 생화학 및 면역학의 다수의 통상적인 기법들이 사용되며, 이들 기법은 당해 분야의 기술 내에 있다. 이들 기법은 예를 들어 하기 문헌에 보다 상세히 개시되어 있다: Molecular Cloning: a Laboratory Manual 3rd edition, J.F. Sambrook and D.W. Russell, ed. Cold Spring Harbor Laboratory Press 2001; Recombinant Antibodies for Immunotherapy, Melvyn Little, ed. Cambridge University Press 2009; "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R. I. Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Current Protocols in Molecular Biology" (F. M. Ausubel et al., eds., 1987, and periodic updates); "PCR: The Polymerase Chain Reaction", (Mullis et al., ed., 1994); "A Practical Guide to Molecular Cloning" (Perbal Bernard V., 1988); "Phage Display: A Laboratory Manual" (Barbas et al., 2001). 이들 참고문헌, 및 당해 분야의 숙련가들에게 널리 공지되고 이들에 의해 의존되는 표준 프로토콜을 함유하는 다른 참고문헌들의 내용은 본 명세의 일부로서 본 발명에 참고로 인용된다. 하기의 약어들이 출원 전체를 통해 사용된다:
Ab: 항체
ADCC: 항체-의존적인 세포 세포독성
ALL: 급성 림프구성 백혈병
AML: 급성 골수성 백혈병
APC: 항원 제공 세포
β2M: 베타-2-미소글로불린
BiTE: 이중-특이성 T 세포 유인 (engaging) 항체
CAR: 키메릭 항원 수용체
CDC: 보체 의존적인 세포독성
CMC: 보체 매개된 세포독성
CDR: 상보성 결정 영역(또한 하기 HVR 참조)
CL: 경쇄의 불변 도메인
CH1: 중쇄의 제 1 불변 도메인
CH1,2,3: 중쇄의 제 1, 제 2 및 제 3 불변 도메인
CH2,3: 중쇄의 제 2 및 제 3 불변 도메인
CHO: 중국 햄스터 난소
CTL: 세포독성 T 세포
E:T 비: 효과기:표적 비
Fab: 항체 결합 단편
FACS: 흐름 지원된 세포측정 세포 분류
FBS: 소 태아 혈청
FR: 프레임워크 영역
HC: 중쇄
HLA: 인간 백혈구 항원
HVR-H: 고도가변 영역-중쇄(또한 CDR 참조)
HVR-L: 고도가변 영역-경쇄(또한 CDR 참조)
Ig: 면역글로불린
IRES: 내부 리보솜 진입 부위
KD: 해리 상수
koff: 해리 속도
kon: 결합 속도
MHC: 주 조직적합성 복합체
MM: 다발성 골수종
scFv: 단일-쇄 가변 단편
TCR: T 세포 수용체
VH: 가변 중쇄는 중쇄 고도가변 영역 및 중쇄 가변 프레임워크 영역을 포함한다
VL: 가변 경쇄는 경쇄 고도가변 영역 및 경쇄 가변 프레임워크 영역을 포함한다
WT1: 윌름스 종양 단백질 1
하기의 설명에서, 몇몇 규약들은 용어의 용법을 고려하여 따를 것이다. 일반적으로, 본 발명에 사용된 용어들을 이들 용어가 당해 분야의 숙련가들에게 공지된 바와 같은 상기 용어들의 의미와 일치되게 해석하고자 한다.
"항원-결합 단백질"은 항원-결합 영역 또는 항원-결합 부분을 포함하는, 즉 결합하는 또 다른 분자에 대해 강한 친화성을 갖는 단백질 또는 폴리펩타이드이다. 항원-결합 단백질은 항체, 키메릭 항원 수용체(CAR) 및 융합 단백질을 포함한다.
당해 분야에 공지된 바와 같은 "항체" 및 "항체들"이란 용어는 면역계의 항원 결합 단백질을 지칭한다. 본 발명에서 지칭되는 바와 같은 "항체"란 용어는 항원-결합 영역, 및 상기 "항원-결합 부분" 또는 "항원-결합 영역"이 유지되는 그의 임의의 단편을 갖는 전체, 완전 길이 항체, 또는 단일 쇄, 예를 들어 그의 단일 쇄 가변 단편(scFv)을 포함한다. 천연 "항체"는 다이설파이드 결합에 의해 서로 연결된 2 개 이상의 중쇄(H) 및 2 개의 경쇄(L)를 포함하는 당단백질이다. 각각의 중쇄는 중쇄 가변 영역(본 발명에서 VH라 약기한다) 및 중쇄 불변 영역(CH)으로 구성된다. 상기 중쇄 불변 영역은 3 개의 도메인, CH1, CH2 및 CH3으로 구성된다. 각각의 경쇄는 경쇄 가변 영역(본 발명에서 VL이라 약기한다) 및 경쇄 불변 영역 CL로 구성된다. 상기 경쇄 불변 영역은 하나의 도메인 CL로 구성된다. 상기 VH 및 VL 영역을, 프레임워크 영역(FR)이라 지칭되는, 보다 보존된 영역들이 산재된, 상보성 결정 영역(CDR)이라 지칭되는 고도가변성 영역들로 추가로 세분할 수 있다. 각각의 VH 및 VL은 하기의 순서로 아미노-말단에서부터 카복시-말단으로 배열된 3 개의 CDR과 4 개의 FR로 구성된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 상기 중쇄 및 경쇄의 가변 영역들은 항원과 상호작용하는 결합 도메인을 함유한다. 상기 항체의 불변 영역은 면역글로불린의, 숙주 조직 또는 인자에 대한, 예를 들어 면역계의 다양한 세포(예를 들어 효과기 세포) 및 전통적인 보체 시스템의 제 1 성분(C1q)에 대한 결합을 매개할 수 있다.
본 발명에 사용된 바와 같이, 항체의 "항원-결합 부분" 또는 "항원-결합 영역"이란 용어는 항원에 결합하고 항체에 항원 특이성을 부여하는 상기 항체의 영역 또는 부분을 지칭하며; 항원-결합 단백질의 단편들, 예를 들어 항체의 단편들은 항원 (예를 들어 펩타이드/HLA 복합체)에 특이적으로 결합하는 능력을 보유하는 항체의 하나 또는 그 이상의 단편들을 포함한다. 항체의 항원-결합 작용은 완전 길이 항체의 단편들에 의해 수행될 수 있는 것으로 나타났다. 항체의 "항체 단편"이란 용어 내에 포함되는 항원-결합 단편의 예는 Fab 단편, VL, VH, CL 및 CH1 도메인으로 이루어지는 1가 단편; F(ab)2 단편, 힌지 영역에서 다이설파이드 가교에 의해 결합된 2 개의 Fab 단편을 포함하는 2가 단편; VH 및 CH1 도메인으로 이루어지는 Fd 단편; 항체의 단일 가지의 VL 및 VH 도메인으로 이루어지는 Fv 단편; VH 도메인으로 이루어지는 dAb 단편(문헌[Ward et al., 1989 Nature 341:544-546]); 및 단리된 상보성 결정 영역(CDR)을 포함한다.
더욱 또한, 상기 Fv 단편의 2 개의 도메인, VL 및 VH가 별도의 유전자에 의해 암호화되지만, 이들은 재조합 방법을 사용하여, 상기 VL 및 VH 영역들이 짝을 이루어 1가 분자를 형성하는 단일 단백질 쇄로서 만들어질 수 있게 하는 합성 링커에 의해 결합될 수 있다. 이들은 단일 쇄 Fv(scFv)로서 공지되며; 예를 들어 문헌[Bird et al., 1988 Science 242:423-426]; 및 [Huston et al., 1988 Proc. Acad. Sci. 85:5879-5883]을 참조하시오. 이들 항체 단편을 당해 분야의 숙련가들에게 공지된 통상적인 기법을 사용하여 수득하며, 상기 단편을 완전 항체와 동일한 방식으로 유용성을 위해 선별한다.
"단리된 항체" 또는 "단리된 항원-결합 단백질"은 그의 천연 환경의 성분으로부터 동정되고 분리되고/되거나 회수된 것이다. "합성 항체" 또는 "재조합 항체"는 일반적으로 당해 분야의 숙련가들에게 공지된 재조합 기술 또는 펩타이드 합성 기법을 사용하여 생성된다.
전통적으로, MHC-펩타이드 복합체는 오직 T-세포 수용체(TCR)에 의해서만 인식될 수 있었으며, 이는 T 세포-기재 판독 분석을 사용하여 관심 에피토프를 검출하는 우리의 능력을 제한하였다. 본 명세에서, 재조합 HLA-펩타이드 복합체를 사용하여 인간 scFv 파지 디스플레이 라이브러리로부터 선택되는 scFv를 기본으로 하는 항원-결합 영역을 갖는, 항체를 포함한 항원 결합 단백질을 개시한다. 이들 분자는 예를 들어 오직 HLA-A2-RMFPNAPYL 복합체만을 인식하는 항-WT1 항체에 대해 나타나는 바와 같이 정교한 특이성을 나타내었다. 또한, 다른 펩타이드를 함유하는 HLA-복합체에 결합할 수 없음과 함께, 상기 분자는 또한 펩타이드 자신에 결합할 수 없었으며, 이는 그의 TCR-유사 특이성을 입증한다.
파지 디스플레이에 의해 선택된 본 명세의 scFv는 초기에 HLA-양성 세포의 표면상에 제공된 펩타이드에 결합하는 그의 능력에 대해 시험되었다. T2 세포를 펩타이드의 존재 하에서 배양한 후에, 형광 표지된 항체를, 유식 세포측정을 사용하여 상기 항원 펄스화된 세포를 선택적으로 인식하기 위해 사용할 수 있었다.
일부 실시태양에서, 본 발명은 중쇄의 하나 이상의 불변 도메인에 융합하여 인간 면역글로불린의 Fc 영역과 함께 항체를 형성하여 2가 단백질을 제공하는 scFv 서열을 갖는 항체를 포함하며, 이는 상기 항체의 전체 결합 활성 및 안정성을 증가시킨다. 또한, Fc 부분은, 예를 들어 항원 정량분석 연구에 사용하기 위해서, 친화성 측정을 위해 항체를 고정화시키기 위해서, 치료제의 표적화된 전달을 위해서, 면역 효과기 세포를 사용하여 Fc-매개된 세포독성을 시험하기 위해서 및 다수의 다른 용도를 위해서, 다른 분자, 예를 들어 비제한적으로 형광 염료, 세포독소, 방사성 동위원소 등의 항체에의 직접적인 접합을 허용한다.
여기에서 제공된 결과는 MHC-펩타이드 복합체의 표적화에 있어서 본 발명의 항체의 특이성, 감도 및 유용성을 강조한다.
본 발명의 분자는 파지 디스플레이를 사용하는 단일 쇄 가변 단편(scFv)의 확인 및 선택을 기본으로 하며, 상기 분자의 아미노산 서열은 관심 MHC 제한된 펩타이드에 대한 상기 분자의 특이성을 부여하고 본 명세의 모든 항원 결합 단백질들의 토대를 형성한다. 따라서, 상기 scFv를 사용하여, 예를 들어 완전 길이 항체, 그의 단편, 예를 들어 Fab 및 F(ab')2, 미니항체, scFv-Fc 융합물을 포함한 융합 단백질, 다가 항체, 즉 동일한 항원 또는 상이한 항원에 대해 하나보다 많은 특이성을 갖는 항체, 예를 들어 이중특이성 T-세포 유인 항체(BiTe), 트라이바디 등을 포함한 "항체" 분자들의 다양한 배열을 설계할 수 있다(문헌[Cuesta et al., Multivalent antibodies: when design surpasses evolution. Trends in Biotechnology 28:355-362 2010]을 참조하시오).
상기 항원-결합 단백질이 완전 길이 항체인 실시태양에서, 본 발명 항체의 중쇄 및 경쇄는 완전 길이이거나(예를 들어 항체가 하나 이상, 및 바람직하게는 2 개의 완전한 중쇄, 및 하나 이상, 및 바람직하게는 2 개의 완전한 경쇄를 포함할 수 있다), 또는 항원-결합 부분(Fab, F(ab')2, Fv 또는 단일 쇄 Fv 단편("scFv"))을 포함할 수 있다. 다른 실시태양에서, 상기 항체 중쇄 불변 영역을 예를 들어 IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD, 및 IgE로부터 선택한다. 일부 실시태양에서, 상기 면역글로불린 아이소타입은 IgG1, IgG2, IgG3, 및 IgG4, 보다 특히 IgG1(예를 들어 인간 IgG1)으로부터 선택된다. 항체 유형의 선택은 상기 항체를 유도해 내도록 설계된 면역 효과기 작용에 따라 변할 것이다.
재조합 면역글로불린의 제작에 있어서, 다양한 면역글로불린 아이소타입의 불변 영역에 대한 적합한 아미노산 서열 및 광범위한 항체 배열의 생성 방법은 당해 분야의 숙련가들에게 널리 공지되어 있다.
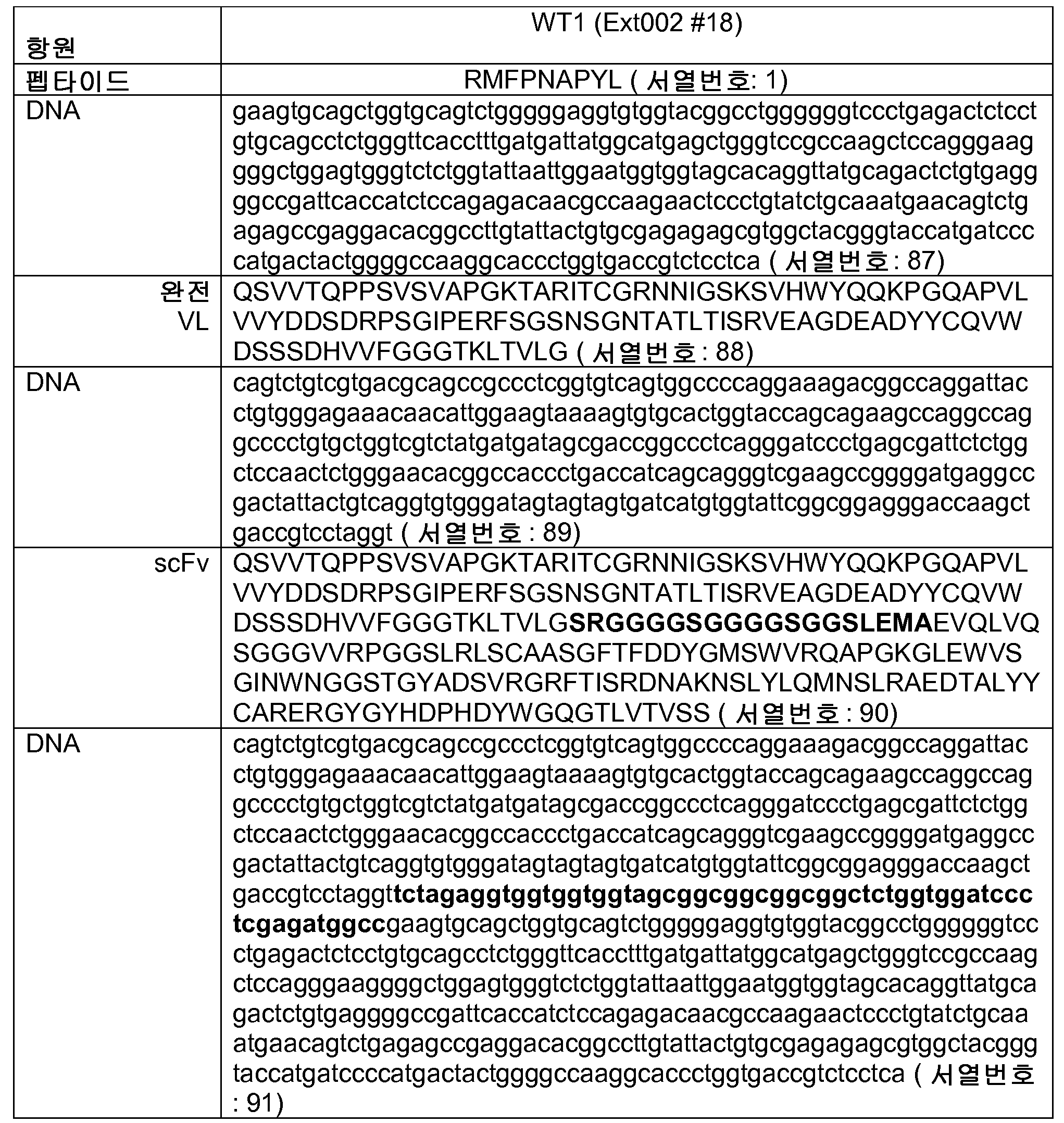
하나의 실시태양에서, 상기 항체 또는 항원 결합 단백질은, 서열번호: 18의 아미노산 서열을 포함하고 HLA-A0201과 함께 아미노산 서열 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드에 특이적으로 결합하는 항원 결합 영역을 갖는 항-WT1/HLA-A2 scFv 또는 그의 항원-결합 단편이다. 다른 실시태양에서, 상기 항-WT1 항체는 표 1 중에서 선택된 VH 및 VL 영역 또는 CDR을 갖는 scFv-Fc 융합 단백질 또는 완전 길이 인간 IgG이다.
또 다른 실시태양에서, 상기 항체 또는 항원 결합 단백질은, 서열번호: 36의 아미노산 서열을 포함하고 HLA-A0201과 함께 아미노산 서열 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드에 특이적으로 결합하는 항원 결합 영역을 갖는 WT1 scFv 또는 그의 항원-결합 단편이다. 다른 실시태양에서, 상기 항-WT-1 항체는 표 2 중에서 선택된 VH 및 VL 영역 또는 CDR을 갖는 scFv-Fc 융합 단백질 또는 완전 길이 인간 IgG이다.
또 다른 실시태양에서, 상기 항체 또는 항원 결합 단백질은, 서열번호: 54의 아미노산 서열을 포함하고 HLA-A0201과 함께 아미노산 서열 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드에 특이적으로 결합하는 항원 결합 영역을 갖는 항-WT1 scFv 또는 그의 항원 결합 단편이다. 다른 실시태양에서, 상기 항-WT-1 항체는 표 3 중에서 선택된 VH 및 VL 영역 또는 CDR을 갖는 scFv-Fc 융합 단백질 또는 완전 길이 인간 IgG이다.
또 다른 실시태양에서, 상기 항체 또는 항원 결합 단백질은, 서열번호: 72의 아미노산 서열을 포함하고 HLA-A0201과 함께 아미노산 서열 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드에 특이적으로 결합하는 항원 결합 영역을 갖는 항-WT1 scFv 항체 또는 그의 항원 결합 단편이다. 다른 실시태양에서, 상기 항-WT-1 항체는 표 4에서 선택된 VH 및 VL 영역 또는 CDR을 갖는 scFv-Fc 융합 단백질 또는 완전 길이 인간 IgG이다.
또 다른 실시태양에서, 상기 항체 또는 항원 결합 단백질은, 서열번호: 90의 아미노산 서열을 포함하고 HLA-A0201과 함께 아미노산 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드에 특이적으로 결합하는 항-WT1 scFv 항체 또는 그의 항원 결합 단편이다. 다른 실시태양에서, 상기 항-WT-1 항체는 표 5 중에서 선택된 VH 및 VL 영역 또는 CDR을 갖는 scFv-Fc 융합 단백질 또는 완전 길이 인간 IgG이다.
또 다른 실시태양에서, 상기 항체 또는 항원 결합 단백질은, 서열번호: 108의 아미노산 서열을 포함하고 HLA-A0201과 함께 아미노산 RMFPNAPYL(서열번호: 1)을 갖는 펩타이드에 특이적으로 결합하는 항-WT1 scFv 항체 또는 그의 항원 결합 단편이다. 다른 실시태양에서, 상기 항-WT-1 항체는 표 6 중에서 선택된 VH 및 VL 영역 또는 CDR을 갖는 scFv-Fc 융합 단백질 또는 완전 길이 인간 IgG이다.
상기 개시된 항체 및 항원 결합 단백질의 다른 실시태양들은, 예를 들어 표 7(중쇄), 8(경쇄) 및 9(불변 영역)에 나타낸 바와 같은 경쇄 및 중쇄 고도가변 영역 및 불변 영역을 포함하는 것들을 포함한다.
본 발명은 세포내 단백질로부터 유래한 펩타이드/단백질 단편 및 MHC 부류 I 분자의 복합체의 에피토프를, 예를 들어 상기 복합체가 항원 제공동안 세포 표면에서 나타날 수도 있기 때문에, 특이적으로 인식하는 재조합 항원-결합 단백질, 항체 및 그의 항원 결합 단편에 관한 것이다. 본 발명 항체의 중쇄 및 경쇄는 완전 길이이거나(예를 들어 항체가 하나 이상, 및 바람직하게는 2 개의 완전한 중쇄, 및 하나 이상, 및 바람직하게는 2 개의 완전한 경쇄를 포함할 수 있다), 또는 항원-결합 부분(Fab, F(ab')2, Fv 또는 단일 쇄 Fv 단편("scFv"))을 포함할 수 있다. 다른 실시태양에서, 상기 항체 중쇄 불변 영역을 예를 들어 IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD, 및 IgE로부터 선택하고, 특히 IgG1, IgG2, IgG3, 및 IgG4, 보다 특히 IgG1(예를 들어 인간 IgG1)으로부터 선택한다. 또 다른 실시태양에서, 상기 항체 경쇄 불변 영역을 예를 들어 카파 (kappa) 및 람다 (lambda), 특히 카파로부터 선택한다.
본 발명의 항체 및 항원 결합 단백질은 이중특이성 항체, 예를 들어 이중특이성 T-세포 유인 항체, 즉 2 개의 별도의 항원과 결합할 수 있는 단일 폴리펩타이드 쇄 상의 2 개의 항체 가변 도메인을 포함하는 항체를 포함하고자 한다. 이중특이성 항체의 제 1 부분이 예를 들어 종양 세포상의 항원에 결합하고 이중특이성 항체의 제 2 부분이 인간 면역 효과기 세포의 표면상의 항원을 인식하는 경우, 상기 항체는 상기 인간 면역 효과기 세포상의 효과기 항원에 특이적으로 결합함으로써 상기 효과기 세포의 활성을 보충할 수 있다. 따라서 일부 실시태양에서, 이중특이성 항체는 효과기 세포들 사이, 예를 들어 T 세포와 종양 세포 사이에 결합을 형성하여 효과기 작용을 증대시킬 수 있다.
하나의 실시태양에서, 상기 불변 영역/프레임워크 영역을 예를 들어 아미노산 치환에 의해 변경시켜 항체의 성질을 변형(예를 들어 하기 중 하나 이상의 증가 또는 감소: 항원 결합 친화성, Fc 수용체 결합, 항체 탄수화물, 예를 들어 글리코실화, 퓨코실화 등, 시스테인 잔기의 수, 효과기 세포 작용, 효과기 세포 작용, 보체 작용 또는 접합 부위의 도입)시킨다. 더욱 또한, 약물, 독소, 방사성동위원소, 사이토카인, 염증성 펩타이드 또는 세포독성제에의 항체의 접합이 또한 고려된다.
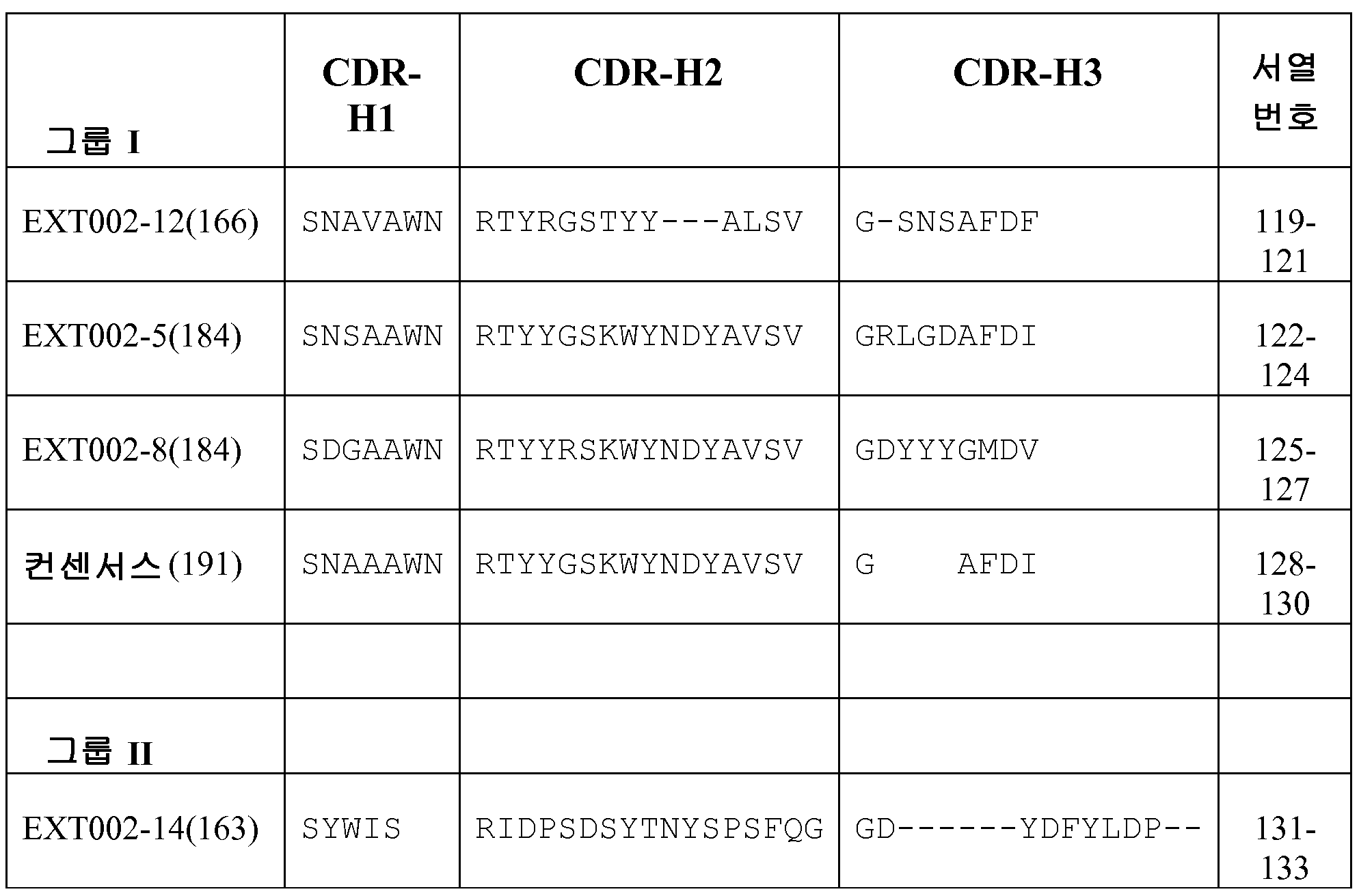
하나의 실시태양에서, 상기 항체는 항-WT1/A2 항체이고 표 9에 나타낸 인간 IgG1 불변 영역과 Fc 도메인을 포함한다. 하나의 실시태양에서, 상기 항-WT1/A2 항체는 표 9에 열거한 서열들을 갖는 인간 카파 서열 또는 인간 람다 서열을 포함한다. 본 발명 항체의 일부 상보성 결정 영역(CDR)에 대한 아미노산 서열을 표 1 내지 8에 나타낸다.
본 발명은 다양한 항원-결합 단백질을 생성시킬 수 있는 항원-특이성 결합 서열의 동정을 기본으로 한다. 항원 처리 및 T-세포에의 상기 단백질의 제공에 따라 T-세포 수용체에 의해 전형적으로 인식되는 것과 유사한 단백질 단편(펩타이드)/HLA 복합체를 나타내는 항원 특이성 항체 이외에, 상기 항체의 제조를 위해 본 발명에 개시된 바와 같은 아미노산 및 핵산 서열의 확인을 또한, 상기 단백질 단편(펩타이드)/HLA 복합체에 대한 특이성과 함께 사용하여 키메릭 항원 수용체(CAR)를 포함한 다른 항원-결합 분자를 생성시킬 수 있다. 이들을 세포에 통합시켜 상기 항원 발현 세포에 특이적으로 세포독성으로 만들 수 있다.
본 발명은, 세포 표면상에서 발현되지 않기 때문에 접근할 수 없는 단백질들을 포함한 임의의 단백질에 대한 치료 항체를 수득하기 위한 신규의 접근법을 사용한다. 거의 모든 세포질내 또는 핵내 단백질(세포 표면 단백질 외에)은 본 발명에 개시된 접근법에 잠재적인 표적이다. 여기에는 비제한적으로 발암성 단백질, 전사 인자, 효소 등이 포함된다.
세포내 또는 핵 단백질로부터 유래한 종양 항원을 표적화하기 위해서, 통상적이지 않은 접근법인 치료 항체의 개발이 필요하였다. 이 접근법은 T-세포 수용체(TCR)와 동일한 특이성을 갖는, 세포 표면상에서 발현된 펩타이드/MHC 복합체를 인식하는 재조합 mAb를 생성시키는 것이다. 상기와 같은 mAb는 표적 인식에 관하여 TCR과 작용성 동족체 (homology)를 공유하지만, 더 높은 친화성, 및 항체가 특징으로 하는 효능 있는 세포독성제로 무장하는 능력을 제공한다. 기술적으로, TCR-유사 mAb는 당해 분야의 숙련가들에게 공지된 통상적인 하이브리도마 기법에 의해 생성되어 인간, 인간화된 또는 키메릭 항체를 생성시킬 수 있다.
더욱 또한, 쥐 항체는 인간에게 투여될 때 HAMA(인간 항-마우스 항체) 반응으로서 공지된(24,25) 면역원성 반응을 야기하여 아나필락시스 및 과민성 반응을 포함한 심한 부작용을 야기하므로 완전-인간 mAb가 인간에 치료학적으로 사용하기에 바람직하다. 이러한 면역원성 반응은 천연 인간 항체와 약간 상이한 아미노산 서열들로 인해 상기 쥐 항체를 외부물질로서 인식하는 인간 면역계에 의해 촉발된다. 당해 분야에 공지된 인간화 방법(26,27)을 사용하여 쥐-유래된 항체의 면역원성을 감소시킬 수 있다(28).
최근에, 파지 디스플레이 라이브러리의 사용은 매우 한정된 에피토프에 대해 독특하고 드문 Ab에 대한 다수의 Ab 레퍼토리를 선택할 수 있게 하였다(파지 디스플레이에 대한 보다 상세한 내용에 대해서 문헌[McCafferty et al., Phage antibodies: filamentous phage displaying antibody variable domains. Nature, 348: 552-554]을 참조하시오). 따라서 종양 항원-유래한 펩타이드-MHC 복합체 분자에 대해 매우 특이적인 인간 Fab 또는 단일 쇄 Fv(ScFv) 단편의 신속한 확인이 가능해졌다(19-22). 보다 최근에, 슈도모나스 내독소의 절두된 형태에, 흑색종 Ag MART-1 26-35/A2 또는 gp100 280-288/A2에 특이적인 TCR-유사 Fab를 융합시킴으로써 생성시킨 면역-독소가 시험관 내 및 생체 내 모두에서 인간 흑색종 성장을 억제하는 것으로 나타났다(23). 또한, 상기 Fab 단편을 사용하여 완전 길이 mAb를 조작함으로써, 치료학적 인간 mAb를 직접 생성시켜, 치료학적 mAb의 개발에 통상적으로 필요한 수 개월의 시간 소모적인 연구를 우회하는 것이 가능하다. 본 발명은 암 치료를 위한, 예를 들어 WT1 펩타이드/HLA-A2 복합체(RMFPNAPYL, 서열번호: 1)를 인식하는 TCR-유사 완전 인간 mAb의 개발을 포함한다.
TCR-유사 특이성을 갖는 재조합 항체는 종양 면역학 및 면역요법에 있어서 신규의 귀중한 연구 도구 및 치료 용도를 나타낸다. WT1은 마커, 예측 인자 및 치료 표적으로서 전 세계적으로 연구된 잘-확립되고 확인된 종양 항원이다. 이는 최근에 NCI 태스크 포스에 의해 최우선 종양 항원으로서 우선 순위 매김되었다(29).
HLA
분자에 고도로 예측 가능한 결합을 갖는
펩타이드의
확인
하나의 실시태양에서, 본 발명은 펩타이드/MHC 복합체의 부분으로서 제공될 때 특이적인 세포독성 T-세포 반응을 이끌어낼 수 있는 HLA-제한된 펩타이드에 특이적으로 결합하는 항체의 생성 방법에 관한 것이다. HLA 부류 I 분자는 약 8 내지 12 아미노산 길이의 내부적으로 유래한 펩타이드를 CD8+ 세포독성 T 림프구에 제공한다. 본 발명의 방법에 사용되는 펩타이드는 일반적으로 약 6 내지 22 아미노산 길이, 및 일부 실시태양에서, 약 9 내지 20개의 아미노산을 가지며, 관심 단백질, 예를 들어 인간 WT1 단백질(진뱅크 수납 번호 P19544) 또는 그의 유사체로부터 유래한 아미노산 서열을 포함한다.
본 발명의 방법에 따라 항체의 생성에 사용하기에 적합한 펩타이드를 당해 분야의 숙련가들에게 공지된 컴퓨터 예측 모델을 사용하여 HLA-A0201-결합 동기 및 프로테아솜 및 면역-프로테아솜에 대한 절단 부위의 존재를 근거로 결정할 수 있다. MHC 부류 I 결합 부위의 예측을 위해서, 상기와 같은 모델은 비제한적으로 ProPred1(문헌[Singh and Raghava, ProPred: prediction of HLA-DR binding sites. BIOINFORMATICS 17(12):1236-1237 2001]에 보다 상세히 개시되어 있다), 및 SYFPEITHI(문헌[Schuler et al. SYFPEITHI, Database for Searching and T-Cell Epitope Prediction. in Immunoinformatics Methods in Molecular Biology, vol 409(1): 75-93 2007]을 참조하시오)을 포함한다.
HLA-A*0201은 전체 백인의 39 내지 46%에서 발현되며, 따라서 본 방법에 사용하기 위한 MHC 항원의 적합한 선택을 나타낸다. WT1 펩타이드 항원의 하나의 실시태양의 제조를 위해서, HLA-A0201 분자에 대한 추정적인 CD84+ 에피토프의 아미노산 서열 및 예측되는 결합을 SYFPEITHI 데이터 베이스의 예측 연산을 사용하여 확인하였다(문헌[Schuler et al. SYFPEITHI, Database for Searching and T-Cell Epitope Prediction. in Immunoinformatics Methods in Molecular Biology, vol 409(1): 75-93 2007]을 참조하시오).
일단 적합한 펩타이드가 확인되었으면, 펩타이드 합성을 당해 분야의 숙련가들에게 널리 공지된 프로토콜에 따라 수행할 수 있다. 본 발명의 펩타이드를 그의 비교적 작은 크기로 인해 통상적인 펩타이드 합성 기법에 따라 용액 중에서 또는 고체 지지체 상에서 직접 합성할 수 있다. 다양한 자동 합성기를 상업적으로 입수할 수 있으며 공지된 프로토콜에 따라 사용할 수 있다. 용액 상 펩타이드 합성은 대규모 합성 펩타이드 생산에 대해 잘-확립된 과정이 되었으며 그 자체가 본 발명의 펩타이드에 적합한 또 다른 제조 방법이다(예를 들어 문헌[Solid Phase Peptide Synthesis by John Morrow Stewart and Martin et al. Application of Almez-mediated Amidation Reactions to Solution Phase Peptide Synthesis, Tetrahedron Letters Vol. 39, pages 1517-1520 1998]을 참조하시오).
본 발명에 개시된 프로토콜에 사용되는 펩타이드들을 각각 구입하고 플루오레닐메톡시카보닐 화학 및 고상 합성을 사용하여 진메드 신세시스 인코포레이티드(Genemed Synthesis, Inc.)(미국 텍사스주 샌안토니오 소재)에 의해 합성하고 고압 액체 크로마토그래피에 의해 정제하였다. 상기 펩타이드의 품질을 고성능 액체 크로마토그래피 분석에 의해 평가하였으며, 예상 분자량을 매트릭스-보조 레이저 탈착 질량 분광측정을 사용하여 관찰하였다. 펩타이드는 멸균성이고 70% 내지 90% 순수하였다. 상기 펩타이드를 DMSO에 용해시키고 PBS(pH 7.4) 또는 염수 중에 5 ㎎/㎖로 희석하고 -80 ℃에서 보관하였다.
펩타이드 선택에 이어서, 선택된 펩타이드의 결합 활성을 항원-처리-결함 T2 세포주(상기는 항원-제공 홈 중에서 펩타이드에 의해 안정화될 때 HLA-A의 발현을 증가시킨다)를 사용하여 시험한다. 간단히, T2 세포를 HLA-A 발현을 유도하기에 충분한 시간 동안 펩타이드로 펄스화한다. 이어서 T2 세포의 HLA-A 발현을 HLA-A에 특이적인 형광 표지된 단클론 항체(예를 들어 BB7.2)에 의한 면역염색 및 유식 세포측정에 의해 측정한다. 형광 지수(FI)를 식 FI = (MFI[펩타이드를 갖는 T2 세포]/MFI[펩타이드가 없는 T2 세포] - 1을 사용하여, 형광-활성화된 세포 분류 분석에 의해 측정된 바와 같은 T2 세포 상의 HLA-A0201의 평균 형광 강도(MFI)로서 계산한다.
윌름스 종양 발암유전자 단백질(WT1)에 대한 완전 인간 T-세포 수용체(TCR)-유사 항체를 본 발명에 개시된 방법을 사용하여 생성시켰다. 파지 디스플레이 기술에 의해 생성된 TCR-유사 항-WT1 항체는 HLA-제한된 세포독성 CD8 T-세포를 유도하는 것과 유사한 WT1 펩타이드/HLA 복합체에 특이성이다.
상기 WT1 단백질 서열을 상기 SYFPEITHI 연산 (algorithm)을 사용하여 선별하고, WT1 펩타이드(예를 들어 428, 328 및 122로 나타낸 펩타이드)가 백인 집단에서 고도로 발현되는 다중 HLA 분자에 대해, 예측된 고-친화성 결합을 갖음을 확인하였다. 펩타이드 428은 WT1 아미노산 428-459에 걸쳐 있고, 펩타이드 328은 WT1 아미노산 328-349에 걸쳐 있으며, 펩타이드 122는 WT1 아미노산 122-140에 걸쳐 있다(도 1 참조).
불규칙한 (heteroclitic) 펩타이드를 또한 상기 예측 연산에 의해 예측되는 바와 같이, MHC 부류 1 대립유전자에 대한 친화성을 증대시키는 것으로 예상되는 MHC-결합 잔기의 보존적인 아미노산 치환에 의해 설계할 수 있다. WT1 펩타이드 122는 내부에 공지된 CD8+ 에피토프를 포함한다(126-134). 따라서, 하나의 실시태양에서, WT1 아미노산 잔기 126-134에 걸쳐 있고 여러 위치에 변형된 아미노산을 함유하는 상기 펩타이드의 변형된 펩타이드를 사용할 수 있다. WT1A(달리 RFM으로 나타낸다)의 알라닌 돌연변이에 사용된 펩타이드를 상기 치환이 이루어진 위치를 근거로 명명하였다. 사용될 수 있는 WT1 펩타이드의 예를 관련 없는 펩타이드, RHAMM-R3 및 EW와 함께 표 10에 나타낸다.
일단 적합한 펩타이드가 확인되었으면, 파지 디스플레이 라이브러리 선별에 사용되는 표적 항원, 즉 펩타이드/HLA 복합체(예를 들어 WT1 펩타이드/HLA-A0201)를, 상기 펩타이드 및 조직적합 항원을 함께 용액 중에 가져가 복합체를 형성시킴으로써 제조한다.
WT1 펩타이드에 대한 고 친화성 ScFv의 선택
다음 단계는 결합하지 않거나 보다 낮은 친화성으로 결합하는 인간 파지 디스플레이 라이브러리 중의 파지로부터, 높은 친화성을 갖는 관심 표적 항원에 결합하는 파지를 선택하는 것이다. 이를 고체 지지체, 예를 들어 비드 또는 포유동물 세포에 결합된 항원에 파지를 반복적으로 결합시킨 다음 결합되지 않은 파지를 제거하고 특이적으로 결합된 파지를 용출시킴으로써 수행한다. 하나의 실시태양에서, 항원을 먼저 예를 들어 스트렙트아비딘-접합된 다이나비즈(Dynabeads) M-280에의 고정화를 위해 비오틴화시킨다. 상기 파지 라이브러리를 세포, 비드 또는 다른 고체 지지체와 함께 배양하고 비 결합 파지를 세척에 의해 제거한다. 결합하는 클론들을 선택하고 시험한다.
일단 선택하였으면, 양성 scFv 클론을 간접 유식 세포측정에 의해 살아있는 T2 세포 표면상의 HLA-A2/펩타이드 복합체에 대한 그의 결합에 대해 시험한다. 간단히, 파지 클론을 Wt1-A 펩타이드 또는 관련없는 펩타이드(대조용)에 의해 펄스화한 T 세포와 함께 배양한다. 상기 세포를 세척하고 이어서 마우스 항-M13으로 단백질 mAb를 코팅한다. 세포를 다시 세척하고 유식 세포측정 전에 FITC-염소(Fab)2 항-마우스 Ig로 표지한다.
다른 실시태양에서, 상기 항-WT1/A 항체는 단백질 안정성, 항체 결합, 발현 수준을 개선하거나 또는 치료제의 접합을 위한 부위를 도입하도록 설계된 하나 이상의 프레임워크 영역 아미노산 치환을 포함할 수 있다. 이어서 이들 scFv를 사용하여 당해 분야의 숙련가들에게 공지된 방법에 따라 재조합 인간 단클론 Ig를 생성시킨다.
백혈병 세포를 본 발명의 WT1 항체와 접촉시킴을 포함하는, 백혈병 세포의 증식을 감소시키기 위한 방법을 또한 포함한다. 관련된 태양에서, 본 발명의 항체를 백혈병의 예방 및 치료에 사용할 수 있다. 치료 항체의 투여는 당해 분야에 공지되어 있다.
항체를 항암제와 접합시킨다
단클론 항체는, 세포독소, 방사성핵종 또는 면역조절 사이토킨의 항체-기재 전달을 포함하여, 생물활성제의 암 부위로의 표적화된 전달에 바람직한 비히클을 나타낸다. 본 발명의 항체와 치료제, 예를 들어 비제한적으로 약물(예를 들어 칼레케아미신, 아우레아스타틴, 독소루비신), 또는 독소(예를 들어 리신, 디프테리아, 젤로닌) 또는 알파 또는 베타 입자를 방출하는 방사성 동위원소(예를 들어 90Y, 131I, 225Ac, 213Bi, 223Ra 및 227Th), 염증성 펩타이드(예를 들어 IL2, TNF, IFN-γ)와의 접합체가 본 발명에 포함된다.
약학 조성물 및 치료 방법
본 발명의 WT1 항체를 치료학적 치료를 위해 종양 또는 WT1-관련된 병리 상태를 앓고 있는 환자에게 상기 종양 또는 병리 상태의 진행을 예방, 억제 또는 감소시키기에 충분한 양으로 투여할 수 있다. 진행은 예를 들어 상기 종양 또는 병리 상태의 성장, 침습, 전이 및/또는 재발을 포함한다. 상기 용도에 유효한 양은 상기 질병의 중증도 및 환자 자신의 면역계의 일반적인 상태에 따라 변할 것이다. 투여 스케줄도 또한 상기 질병 상태 및 환자의 상태에 따라 변할 것이며, 전형적으로는 단일의 일시 주사 투여 또는 연속적인 주입에서부터 하루에 다중 투여(예를 들어 매 4 내지 6 시간마다)의 범위이거나 또는 치료 의사 및 환자의 상태가 가리키는 바에 따를 것이다.
본 발명의 WT1 항체에 의해 치료 가능한 질병의 확인은 당해 분야의 숙련가의 능력 및 지식 내에 있다. 예를 들어, 임상적으로 의미있는 백혈병을 앓거나 또는 임상적으로 의미있는 증후군이 발생할 위험이 있는 인간 개인이 본 발명의 WT1 항체의 투여에 적합하다. 당해 분야의 숙련된 임상의는 예를 들어 임상 시험, 신체 검사 및 병력/가족력에 의해 개인이 상기와 같은 치료의 후보인지를 쉽게 결정할 수 있다.
WT1 발현을 특징으로 하는 병리 상태의 비제한적인 예는 만성 골수구 백혈병, 급성 림프아구성 백혈병(ALL), 급성 골수양성(myeloid)/골수성(myelogenous) 백혈병(AML) 및 골수이형성 증후군(MDS)을 포함한다. 또한, 일반적으로 고형 종양, 및 특히 중피종, 난소암, 위장암, 유방암, 전립선암 및 교아세포종과 관련된 종양이 WT1 항체를 사용하여 치료될 수 있다.
따라서, 또 다른 실시태양에서, 본 발명은 본 발명의 WT1 항체를 하나 이상의 다른 작용제와 함께 투여함으로써 질병을 치료하는 방법을 제공한다. 예를 들어, 본 발명의 하나의 실시태양은 본 발명의 WT1 항체를 항종양제 또는 혈관형성 억제제와 함께 투여함으로써 질병을 치료하는 방법을 제공한다. 상기 WT1 항체를 항종양제 및 혈관형성 억제제 중 하나 이상과 화학적으로 또는 생합성적으로 결합시킬 수 있다.
임의의 적합한 방법 또는 경로를 사용하여 본 발명의 WT1 항체를 투여하고, 임의로 항종양제 및/또는 다른 수용체의 길항물질을 함께 투여할 수 있다. 투여 경로는 예를 들어 경구, 정맥내, 복강내, 피하, 또는 근육내 투여를 포함한다. 그러나, 본 발명을 임의의 특정한 투여 방법 또는 경로로 제한하지 않음을 강조해야 한다.
본 발명의 WT1 항체를, 수용체에 특이적으로 결합하여 리간드-독소 내면화에 따라 독성의 치사 유상하중(payload)을 전달하는 접합체로서 투여할 수 있음이 주목된다.
본 발명의 WT1 항체는 약학적으로 허용 가능한 담체를 추가로 포함하는 조성물의 형태로 투여될 것이라 생각된다. 적합한 약학적으로 허용 가능한 담체는 예를 들어 물, 염수, 포스페이트 완충 염수, 덱스트로스, 글리세롤, 에탄올 등뿐만 아니라 이들의 조합 중 하나 이상을 포함한다. 약학적으로 허용 가능한 담체는 소량의 보조 물질, 예를 들어 상기 결합 단백질의 저장 수명 또는 유효성을 향상시키는 습윤 또는 유화제, 보존제 또는 완충제를 추가로 포함할 수 있다. 상기 주사 조성물을, 당해 분야에 널리 공지된 바와 같이, 포유동물에게 투여 후 활성 성분의 신속한, 지속된 또는 지연된 방출을 제공하도록 제형화할 수도 있다.
본 발명의 다른 태양은 비제한적으로 WT1 관련된 질병의 치료, 진단 및 예측 용도를 위한 항체 및 이를 암호화하는 핵산의 용도 뿐만 아니라 세포 및 조직에서 WT1의 검출을 위한 연구 도구로서의 용도를 포함한다. 상기 개시된 항체 및 핵산을 포함하는 약학 조성물이 본 발명에 포함된다. 벡터 매개된 면역요법에 의한 항체-기재 치료를 위한 본 발명의 핵산을 포함하는 벡터가 또한 본 발명에 의해 고려된다. 벡터는 항체의 발현 및 분비를 가능하게 하는 발현 벡터뿐만 아니라 항원 결합 단백질, 예를 들어 키메릭 항원 수용체의 세포 표면 발현에 관한 벡터를 포함한다.
상기 핵산을 포함하는 세포, 예를 들어 본 발명의 벡터에 의해 형질감염된 세포가 또한 본 명세에 포함된다.
진단 및 연구 용도에 사용하기 위해서, 본 발명의 WT1 항체 또는 핵산, 분석 시약, 완충제 등을 함유하는 키트를 또한 제공한다.
이제 본 발명의 방법을 전형적인 실시태양들에 관하여 보다 상세히 개시할 것이다.
물질
세포 샘플, 세포주 및 항체. 메모리얼 슬로안-케터링(Memorial Sloan-Kettering) 암센터 기관 감사 위원회 승인된 프로토콜에 대한 사전 동의 후, HLA-타입의 건강한 공여자 및 환자로부터 말초 혈액 단핵세포(PBMC)를 피콜(Ficoll) 밀도 원심분리에 의해 수득하였다. 인간 중피종 세포주를 수득하기 위한 공급원은 앞서 개시되어 있다(29). 상기 세포주는 하기를 포함한다: H-Meso1A, JMN , VAMT, H2452 , H2373, H28, MSTO, Meso 11, Meso 34, Meso 37, Meso 47, 및 Meso 56. 모든 세포는 메모리얼 슬로안-케터링 암센터의 세포 면역부에 의해 HLA 분류되었다. 백혈병 세포주 LAMA81, BV173 및 697(WT1+, A0201+)이 친절하게도 에이치 제이 스타우스 박사(Dr. H.J. Stauss)(영국 런던 소재 런던 대학)에 의해 제공되었다. 흑색종 세포주 MeWo(WT1-, A201+), SKLY16(B-세포 림프종; WT1-, A0201+); K562, RwLeu4, 및 HL60, 모든 WT1+ 백혈병 및 TAP-결함 T2 세포주를 아메리칸 타입 컬쳐 콜렉션으로부터 수득하였다. 상기 세포주들을 5% FCS, 페니실린, 스트렙토마이신, 2 밀리몰/ℓ 글루타민, 및 2-머캅토에탄올이 보충된 RPMI 1640에서 37 ℃/5% CO2에서 배양하였다.
FITC 또는 APC, 및 그의 아이소타입 대조용 마우스 IgG2b/FITC 또는 APC, 인간 또는 마우스 CD3, CD19, CD56, CD33, CD34(BD 바이오사이언스, 미국 샌디에고 소재)에 접합된 인간 HLA-A2에 대한 단클론 Ab(클론 BB7.2), PE 또는 FITC와 접합된 염소 F(ab)2 항-인간 IgG 및 형광 접합된 염소 F(ab)2 항-마우스 Ig(인 비트로젠, 시티(In Vitrogen, City))를 구입하였다. HLA-부류 I(W6/32)에 대한 마우스 mAb를 MSKCC 단클론 항체 코어 시설로부터 수득하였다.
펩타이드 . 모든 펩타이드를 구입하고 진메드 신세시스 인코포레이티드(미국 텍사스 샌안토니오 소재)에 의해 합성하였다. 펩타이드는 >90% 순수하였다(표 1). 상기 펩타이드를 DMSO에 용해시키고 염수 중에서 5 ㎎/㎖로 희석하고 180 C에서 동결시켰다. 비오틴화된 단일 쇄 WT1 펩타이드/HLA-A0201 및 RHAMM-3/HLA-A0201 복합체를, MSKCC의 테트라머(Tetramer) 시설에서 상기 펩타이드를 재조합 HLA-A2 및 베타2 마이크로글로불렌(β2M)과 함께 리폴딩함으로써 합성하였다.
동물. NOD scid 감마(NSG)로서 공지된 8 내지 10 주된 NOD.Cg-Prkdc scid IL2rgtm1Wjl/SzJ 마우스를 잭슨(Jackson) 실험실(미국 메인주 바하버 소재)로부터 구입하거나 또는 MSKCC 동물 사육 시설로부터 입수하였다.
방법
유식 세포측정 분석. 세포 표면 염색을 위해서, 세포를 얼음 상에서 30 분간 적합한 mAb와 함께 배양하고, 세척하고, 필요에 따라 2차 항체 시약과 함께 배양하였다. 유식 세포측정 데이터를 FACS Calibur(벡톤 디킨슨(Becton Dickinson)) 상에서 수집하고 플로우조(FlowJo) V8.7.1 및 9.4.8 소프트웨어로 분석하였다.
WT1 펩타이드 / HLA -A0201 복합체에 특이적인 scFv 의 선택 및 특성화. 인간 scFv 항체 파지 디스플레이 라이브러리를 mAb 클론의 선택을 위해 사용하였다. 플라스틱 표면상에서의 고정화에 의해 도입된 MHC1 복합체의 형태적 변화를 감소시키기 위해서, 용액 패닝(panning) 방법을 통상적인 플레이트 패닝 대신에 사용하였다. 간단히, 비오틴화된 항원을 먼저 인간 scFv 파지 라이브러리와 혼합하고, 이어서 상기 항원-scFv 항체 복합체를 자석 랙을 통해 스트렙트아비딘-접합된 다이나비즈 M-280에 의해 허물었다. 이어서 결합된 클론들을 용출시키고 이를 사용하여 이 콜라이 XL1-블루(E.Coli XL1-Blue)를 감염시켰다. 상기 세균에서 발현된 scFv 파지 클론을 정제하였다(35,36). 패닝을 3 내지 4 주기 동안 수행하여 HLA-A0201/WT1 복합체에 특이적으로 결합하는 scFv 파지 클론을 농축시켰다. 비오틴화된 단일 쇄 HLA-A0201/WT1 펩타이드 복합체에 대한 양성 클론을 표준 ELISA 방법에 의해 측정하였다. 양성 클론을 TAP-결함, HLA-A0201+ 세포주, T2를 사용하여, 유식 세포측정에 의해 살아있는 세포 표면상의 HLA-A2/펩타이드 복합체에 대한 그의 결합에 대해 추가로 시험하였다. T2 세포를 20 ㎍/㎖ β2 M ON의 존재 하에 무혈청 RPMI 1640 배지에서 펩타이드(50 ug/㎖)에 의해 펄스화하였다. 상기 세포를 세척하고, 하기의 단계로 염색을 수행하였다.
상기 세포를 먼저 정제된 scFv 파지 클론으로 염색한 다음 마우스 항-M13 mAb로 염색하고, 최종적으로 FITC에 대한 상기 염소 F(ab)2 항-마우스 Ig의 접합물로 염색하였다. 상기 염색의 각 단계를 얼음 상에서 30 내지 60 분간 수행하였으며 상기 세포를 각각의 염색 단계 사이에서 2 회 세척하였다.
상기 선택된 ScFv 단편을 사용하는 완전 길이 mAb 의 조작. 상기 선택된 파지 클론의 완전 길이 인간 IgG1을 개시된 바와 같이(37) HEK293 및 중국 햄스터 난소(CHO) 세포주에서 생성시켰다. 간단히, 항체 가변 영역들을, 합치하는 인간 람다 또는 카파 경쇄 불변 영역 및 인간 IgG1 불변 영역 서열과 함께 포유동물 발현 벡터 내로 서브클로닝하였다. 상기 정제된 완전 길이 IgG 항체의 분자량을 전기영동에 의해 환원 및 비환원 모두의 조건 하에서 측정하였다.
키메릭 항원 수용체 및 면역 효과기 세포의 조작. 본 발명에서 확인된 항체 및 항원 결합 단백질을 암호화하는 핵산을 사용하여 재조합 면역 효과기 세포를 조작할 수 있다. 예를 들어 유전자 변형된 T-세포를 생성시키기 위한 방법 및 벡터가 당해 분야에 공지되어 있다(문헌[Brentjens et al., Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias in Blood 118(18):4817-4828, November 2011]을 참조하시오).
WT1p /A2 복합체에 대한 완전 길이 인간 IgG1 의 특성화. 먼저, 상기 WT1펩타이드/A2 복합체에 대한 완전 길이 IgG1 mAb의 특이성을, RMF 또는 RHAMM-R3 대조용 펩타이드에 의해 펄스화되었거나 펄스화되지 않은 T2 세포를 염색한 다음, PE 또는 FITC에 대한 2차 염소 F(ab)2 항-인간 IgG mAb 접합체를 염색함으로써 측정하였다. 상기 형광 강도를 유식 세포측정에 의해 측정하였다. 같은 방법을 사용하여 상기 mAb의 새로운 종양 세포 및 세포주에 대한 결합을 측정하였다.
방사성면역분석. WT1 ab1을 클로라민-T 방법(38)을 사용하여 125-I(퍼킨엘머)로 표지하였다. 100 ㎍ 항체를 1 mCi 125-I 및 20 ㎍ 클로라민-T와 반응시키고, 200 ㎍ Na 메타바이설파이트로 반응종료 (quench)시키고, 이어서 PBS 중의 2% 소 혈청 알부민으로 평형화시킨 10DG 컬럼(회사)을 사용하여 유리 125-I로부터 분리시켰다. 생성물의 비활성은 7 내지 8 mCi/㎎의 범위였다.
조혈 세포주, 부착성 세포주(비-효소 세포 스트리퍼(명칭)로 수확함), 정상 공여자 및 AML 환자로부터의 PBMC를 개시한 바와 같이 수득하였다. 세포를 PBS로 1 회 세척하고 PBS 중의 2% 인간 혈청 중에 107 세포/㎖로 00에서 재현탁하였다. 세포(중복하여 106 튜브)를 얼음 상에서 45 분간 125-I-표지된 WT1 AB1(1 ㎍/㎖)과 함께 배양하고, 이어서 PBS 중의 1% 소 혈청 알부민으로 00에서 광범위하게 세척하였다. 특이적인 결합을 측정하기 위해서, 한 쌍의 세포를 얼음 상에서 20 분 동안 50배 과잉의 표지되지 않은 WT1 AB1의 존재 하에서 예비-배양 후에 분석하였다. 결합된 방사성을 감마 계수기에 의해 측정하고, 특이적인 결합을 측정하고, 세포당 결합된 항체의 수를 비방사능 (specific activity)으로부터 계산하였다.
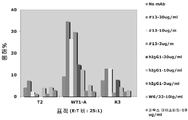
항체-의존적인 세포 세포독성( ADCC ). ADCC에 사용된 표적 세포는 WT1 또는 RHAAM-3 펩타이드에 의해 또는 상기 펩타이드 없이 펄스화된 T2 세포, 및 펩타이드 펄스화가 없는 종양 세포주였다. 다양한 농도의 WT1 ab1 또는 그의 아이소타입 대조용 인간 IgG1을 16 시간 동안 상이한 효과기:표적(E:T) 비에서 표적 세포 및 새로운 PBMC와 함께 배양하였다. 상등액을 수확하고 세포독성을, 사이토톡스(Cytotox) 96 비-방사성 키트(프로메가(Promega))를 설명에 따라 사용하여 LDH 방출 분석에 의해 측정하였다. 세포독성을 또한 표준 4 시간 51Cr-방출 분석에 의해 측정한다.
루시페라제 / GFP 양성 세포의 형질도입 및 선택. BV173 및 JMN 세포를, luc/GFP(39)를 암호화하는 플라스미드를 함유하는 렌티바이러스 벡터를 사용하여, 높은 수준의 GFP-루시페라제 융합 단백질을 발현하도록 조작하였다. 단세포 클로닝을 사용하여, 오직 높은 수준의 GFP 발현을 나타내는 세포만을 유식 세포측정 분석에 의해 선택하고 유지시키고 동물 연구에 사용하였다.
인간 백혈병 이종이식 NSG 모델에서 WT1 ab1 의 치료학적 시험. 200만 개의 BV173 인간 백혈병 세포를 NSG 마우스에 IV 주사하였다. 5일째에, 처리해야 하는 모든 마우스에서 개똥벌레 루시페라제 이미징에 의해 종양 이식을 확인하였으며; 이어서 마우스를 상이한 처리 그룹들로 무작위 분할하였다. 6일 및 10일째에, mAb WT1 ab1 또는 아이소타입 대조용 mAb를 IV 주사하였다. mAb와 함께 또는 mAb 없이 인간 효과기 세포를 또한 수용한 동물들에, 세포(CD34 및 CD3-고갈된 건강한 공여 인간 PBMC)를 mAb 주사 전 4 시간째에 마우스에게 IV 주사하였다(107 세포/마우스). 종양 성장을 1주일에 1 회 내지 2 회 발광 이미징에 의해 평가하고, 임상 활성을 매일 평가하였다.
WT1 펩타이드 / HLA -A0201 복합체에 특이적인 scFv 의 선택 및 특성화. WT1-특이성 scFv의 선택을 WT1의 아미노산 126-134(RMFPNAPYL, 서열번호: 1)를 포함하는 9-머 WT1-유래한 펩타이드를 사용하여 성취한다. 상기 펩타이드는 HLA-A0201에 의해, WT1-양성 종양 세포를 살해할 수 있는 세포독성 CD8+ T 세포를 유도하도록 처리되고 제공되는 것으로 나타났다.
WT1 RMF 펩타이드로 6 회 백신화 후 AML 환자로부터의 전형적인 데이터를, 상기 WT1 펩타이드가 인간에서 면역원성이라는 증거로서 도 2에 도시한다. CD3 T 세포를 WT1-A 펩타이드(아미노산 126-134)로 자극하고, 697(A0201+ WT1+) 또는 SKLY-16(A0201+ WT1-) 세포주에 대한 세포독성을 표준 51Cr 방출 분석을 사용하여 측정하였다. WT1-A 또는 관련없는 펩타이드 EW에 의해 펄스화된 SKLY-16 세포를 상기 살해의 특이성에 대한 양성 및 음성 대조군으로서 사용하였다. 효과기:표적(E:T) 비를 X-축 상에 나타낸다. 데이터는 T 세포가 HLA-A0201-제한된 방식으로 WT1+ 종양 세포를 살해하였음을 입증한다.
당해 분야의 숙련가들에게 공지된 잘 확립된 파지 디스플레이 라이브러리 및 선별 방법을 사용하여 WT1-A 펩타이드/HLA-A2 복합체에 매우 특이적인 scFv 단편을 선택하였다. 하나의 실시태양에서, 인간 scFv 항체 파지 디스플레이 라이브러리(7 x 1010 클론)를 mAb 클론의 선택에 사용하였다. 플라스틱 표면상으로의 고정화에 의해 도입된 MHC1 복합체의 형태 변화를 감소시키기 위해서, 용액 패닝 방법을 통상적인 플레이트 패닝 대신에 사용하였다. 간단히, 비오틴화된 항원을 먼저 인간 scFv 파지 라이브러리와 혼합하고, 이어서 항원-scFv 파지 항체 복합체를 자석 랙을 통해 스트렙트아비딘-접합된 다이나비즈 M-280에 의해 허물었다.
이어서 결합된 클론들을 용출시키고 이를 사용하여 이 콜라이 XL1-블루를 감염시켰다. 상기 세균에서 발현된 scFv 파지 클론을 정제하였다(35,36). 패닝을 3 내지 4 주기 동안 수행하여 HLA-A0201/WT1 복합체에 특이적으로 결합하는 scFv 파지 클론을 농축(enrich) 시켰다. 비오틴화된 단일 쇄 HLA-A0201/WT1 펩타이드 복합체에 대한 양성 클론을 표준 ELISA 방법에 의해 측정하였다(도 3). 양성 클론을 TAP-결함, HLA-A0201+ 세포주, T2를 사용하여, 유식 세포측정에 의해 살아있는 세포 표면상의 HLA-A2/펩타이드 복합체에 대한 그의 결합에 대해 추가로 시험하였다. T2 세포를 20 ㎍/㎖ β2 M의 존재 하에서 밤새 무혈청 RPMI 1640 배지에서 펩타이드(50 ug/㎖)에 의해 펄스화하였다. 상기 세포를 세척하고, 하기의 단계로 염색을 수행하였다.
상기 세포를 먼저 정제된 scFv 파지 클론으로 염색한 다음 마우스 항-M13 mAb로 염색하고, 최종적으로 FITC에 접합된 염소 F(ab)2 항-마우스 Ig로 염색하였다. 상기 염색의 각 단계를 얼음 상에서 30 내지 60 분간 수행하였다. 상기 세포를 각각의 염색 단계 사이에서 2 회 세척하였다. 결과를 도 4에 도시한다. WT1 ab1의 파지 클론은 오직 WT1-A 펩타이드(RMFPNAPYL: 이후부터 RMF로서 약기한다)에 의해 펄스화된 T2 세포에만 결합하였고, T2 세포 단독, 대조용 EW 펩타이드 또는 불규칙한 펩타이드 WT1-A에 의해 펄스화된 T2 세포에는 결합하지 않은 것으로 나타났다.
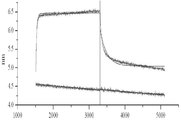
상기 펩타이드/A0201 복합체에 대한 WT1 ab1의 완전 길이 IgG1의 결합 친화성을 지시된 농도들에서의 WT1 ab1의 역가에 의해 시험하였다. T2 세포를 50 ㎍/㎖ 또는 10 ㎍/㎖로 펄스화한 다음, 2차 염소 F(ab) 항-인간 IgG/PE로 펄스화하였다. 결과를 도 5에 도시한다.
도 6은 WT1 ab에 의해 인식된 펩타이드/HLA-A0201 복합체의 밀도를 도시한다. T2 세포를 지시된 농도의 RMF(상부 패널) 또는 RHAMM-R3(하부 패널)에 의해 밤새(ON) 펄스화하고, 1 ㎍/㎖의 농도에서 WT1 ab1, WT1 ab3 및 WT1 ab5의 결합을 유식 세포측정에 의해 분석하였다.
양성 scFv 클론을 하기 상에서 간접 유식 세포측정에 의해 살아있는 세포 표면상의 HLA-A2/펩타이드 복합체에 대한 그의 결합에 대해 시험하였다: (i) WT1 펩타이드 또는 관련없는 펩타이드에 의해 펄스화된 TAP 결함 HLA-A0201+ T2 세포; (ii) 상기 펩타이드에 의한 펄스화 없이, WT1 + HLA-A0201+ 세포 주, 예를 들어 BV173, U266 및 대조용 WT1- HLA-A0201+ 세포주 SKLY-16, 또는 WT1+ HLA-A0201- 세포주, K562. 후자는 종양 세포상의 천연 처리된 WT1p/A2 복합체에 대한 scFv의 인식 및 결합 친화성을 결정한다.
총 28 개의 파지 클론을 WT1-A 펩타이드/A2 복합체에 대한 mAb 특이성을 생성시키는 그의 능력에 대해 선별하였다. 살아있는 세포상의 상기 WT1p/A2 복합체의 인식을 WT1-A 펩타이드 및 다른 HLA-A2-결합 펩타이드(50 ㎍/㎖)에 의해 펄스화된 T2 세포에 대한 파지 scFv의 결합에 의해 측정하였다. 여기에는 T2 세포 단독; WT1-A 펩타이드에 의해 펄스화된 T2 세포; 불규칙한 펩타이드 WT1-A1에 의해 펄스화된 T2 세포; 관련없는 EW 펩타이드(HLA-A0201-결합 9-머 펩타이드, 유잉 육종으로부터 유래함) 또는 RHAMM-R3에 의해 펄스화된 T2 세포가 포함된다(도 4).
선택된 ScFv 단편을 사용하는 완전 길이 mAb 조작.
파지 디스플레이 기술은 항원-특이성 scFv 및 Fab 단편의 신속한 선택 및 생산을 허용하며, 이는 그 자체가 저절로 유용하거나, 또는 완전 항체, 항원 결합 단백질 또는 그의 항원 결합 단편을 제공하도록 추가로 개발될 수 있다. Fc 도메인을 갖는 완전 mAb는 상기 scFv 및 Fab 항체보다 다수의 이점을 갖는다. 먼저, 오직 완전 길이 Ab만이 Fc 도메인을 통해 CDC 및 ADCC와 같은 면역학적 작용을 발휘한다. 두 번째로, 2가 mAb는 단량체성 Fab Ab보다 더 강한 항원-결합 친화성을 제공한다. 세 번째로, 혈장 반감기 및 신장 제거가 상기 Fab 및 2가 mAb와 다를 것이다. 각각의 특정한 특징 및 이점은 상기 계획된 효과기 전략에 부합될 수 있다. 네 번째로, 2가 mAb는 scFv 및 Fab와 상이한 비율로 내면화되어, 면역 작용 또는 담체 작용을 변경시킬 수도 있다. 예를 들어 알파 방출제가 표적 살해를 위해 내면화될 필요가 있는 것이 아니라, 다수의 약물 및 독소가 상기 면역 복합체의 내면화로부터 이로울 것이다. 따라서, 하나의 실시태양에서, 일단 WT1p/A2에 특이성인 scFv 클론이 파지 디스플레이 라이브러리로부터 수득되었으면, 상기 scFv 단편을 사용하여 완전 길이 IgG mAb를 생성시켰다.
중국 햄스터 난소(CHO) 세포에서 재조합 인간 단클론 IgG를 생성시키기 위해서, 완전 길이 IgG mAb를 당해 분야의 숙련가들에게 공지된 방법을 기본으로 조작하였다(문헌[Tomomatsu et al., Production of human monoclonal antibodies against FceRIa by a method combining in vitro immunization with phage display. Biosci Biotechnol Biochem 73(7): 1465-1469 2009]). 간단히, 항체 가변 영역을, 합치하는 람다 또는 카파 경쇄 불변 서열 및 IgG1 하위부류 Fc와 함께, 포유동물 발현 벡터(도 7) 내로 서브클로닝하였다(예를 들어 표 9를 참조하시오)(33,34). 정제된 완전 길이 IgG 항체는 환원 및 비환원 조건 모두 하에서 예상된 분자량을 나타내었다(도 8). 동역학적 결합 분석(35)은 나노몰 범위의 KD와 함께, WT1/A2에 대한 완전 길이 IgG의 특이적인 결합을 입증하였다(도 9 및 10).
실시예 1
완전 인간 파지 디스플레이 라이브러리를 사용하는 WT1p/A2 복합체에 특이적인 ScFv 의 선택.
HLA-A0201/WT1 펩타이드 복합체에 대한 파지 디스플레이를 3-4 회의 패닝 라운드 동안 수행하여 HLA-A0201/WT1 펩타이드 복합체에 특이적으로 결합하는 scFv 파지 클론을 농축시켰다. 상기 WT1 펩타이드/A2 복합체에 대해 양성인 개별적인 scFv 파지 클론을 ELISA에 의해 측정하고 독특한 DNA 암호화 서열을 갖는 클론들을 추가로 특성화하였다. 상기 ScFv가 살아있는 세포상의 WT1p/A2 복합체에 결합되었는지를 시험하기 위해서, 양성 파지 클론을 TAP 결함, HLA-A0201-양성 세포주, T2에 대한 결합에 대해 시험하였다. T2 세포는 오직 외부 펩타이드를 제공할 수 있으며 따라서 HLA-A2 분자에 의해 제공된 특정한 에피토프들의 검출에 광범위하게 사용되었다. 총 35 개의 파지 클론을 T2 세포상에서 선별하였으며 15 개의 클론이 오직 WT1 RMF 펩타이드에 의해 펄스화된 T2 세포에 대해 특이적인 결합을 나타내었으나, T2 세포 단독 또는 대조용 RHAMM-3 펩타이드에 의해 펄스화된 경우에 대해서는 결합을 나타내지 않았다(도 4). 상기 scFv 파지 클론은 WT1- 및 HLA-A2 양성인 몇몇의 종양 세포주들에 대해 결합할 수 없었으며, 이는 상기 ScFv의 친화성이 완전 길이 2가 mAb에 비해 약함을 암시한다.
실시예 2
완전 길이 인간 IgG1 의 생성.
면역학적 작용, 예를 들어 CDC 및 ADCC는 2가 IgG의 Fc 도메인에 좌우된다. 또한, 2가 mAb는 단량체성 scFv Ab보다 더 강한 항원-결합 친화력 (avidity)을 제공한다. 따라서, 15 개의 양성 파지 클론 중 6 개의 ScFv 파지 클론을 선택하여 HEK293 및 중국 햄스터 난소(CHO) 세포 중에 완전 길이 인간 단클론 IgG1을 생성시켰다. 간단히, 상기 mAb의 가변 영역을, 합치하는 람다 또는 카파 경쇄 불변 영역 및 인간 IgG1 불변 영역 서열과 함께, 포유동물 발현 벡터 내로 서브클로닝하였다. 정제된 완전 길이 IgG 항체는 환원 및 비환원 조건 모두 하에서 예상된 분자량을 나타내었다(도 8). 5 개의 클론이 인간 IgG1으로 성공적으로 조작되었다.
실시예 3
IgG1 mAb의 특이성 및 결합 활성
인간 세포주에의 결합.
RMF 또는 RHAMM-3 펩타이드에 의해 또는 상기 펩타이드 없이 펄스화된 T2 세포를 먼저 상기 mAb의 결합 특이성을 측정하기 위해 사용하였다. WT1 ab1을 포함하여 5 개의 인간 IgG1 중 3 개가, 오직 WT1 펩타이드에 의해서만 펄스화된 T2 세포에 대해 특이적인 결합을 나타내었으나, T2 단독 또는 대조용 펩타이드 RHAMM-R3에 의해 펄스화된 T2에 대해서는 그렇지 않았다. 상기 mAb의 결합 활성이 그의 모 scFv 파지 클론에 비해 실질적으로 증대되었다(50 내지 100 배). 상기 5 개 중 2 개의 mAb는 T2 세포 단독 또는 대조용 펩타이드 RHAMM-R3에 의해 펄스화된 T2 세포에 대해 결합을 나타내었지만, 상기 결합은 상기 세포를 RMF 펩타이드에 의해 펄스화함으로써 크게 증대되었다. 이는 이들 2 개의 mAb가 또한 상기 HLA-A2 분자 단독 상의 에피토프에 대해서 높은 결합 활성을 가짐을 암시하였으며 따라서 추가적인 조사로부터 제외하였다. 이는, 상기가 펩타이드/MHC 복합체에 대한 상기와 같은 mAb를 생성시키는데 통상적인 문제였기 때문에, 상기 복합체 내에 MHC 부류 I 분자 에피토프의 우세성이 제공된다면 예기치 못한 것은 아니었다. 상기는 또한 상기 복합체에 대한 mAb의 정확한 특이성을, 상기 2가 IgG1 mAb에 비해 보다 낮은 친화성으로 인해, scFv 단계에서 쉽게 측정하지 못할 수도 있음을 암시한다.
상기 WT1p/A2 복합체에 대해 특이적인 3 개의 나머지 mAb의 결합 친화성을 먼저 상기 mAb의 역가 (titration)에 의해, RMF 및 대조용 RHAMM-R3 펩타이드(50 ug/㎖)에 의해 또는 상기 없이 펄스화된 T2 세포상에서 조사하였다. Mab WT1 ab1은 0.01 ug/㎖의 농도에 이르기까지, 가장 강한 결합을 나타내었다. 아이소타입 대조용 인간 IgG1은 시험된 임의의 농도에서 결합을 나타내지 않았다(도 5). WT1 ab1 이외에, 2 개의 다른 mAb, WT1 ab3 및 WT1 ab5는 사용된 <1 ug/㎖의 mAb 농도의 범위에서 특이적인 결합을 나타내었다. 상기 mAb의 특정한 인식은 또한 상기 세포 표면상의 항원 밀도에 따라 변하였다. T2 세포를 50, 25, 12.5, 6.25, 3.13 및 1.6 ug/㎖에서 RMF 또는 R3 펩타이드에 의해 펄스화하였으며; 상기 시험 mAb를 T2 결합 분석을 위해 1 ug/㎖로 사용하였다. WT1 ab1은 1.6 ug/㎖ 정도로 낮은 농도에서 농도-의존적인 방식으로 T2 세포 상의 RMF 펩타이드/A2 복합체를 검출할 수 있었으며, 다른 두 mAb보다 현저하게 더 높은 형광 강도를 가졌다(도 6). 이러한 결과는 상기 WT1 ab1이 상기 RMFp/A0201 복합체에 대해 가장 높은 결합 활성을 가짐을 추가로 입증하였다.
실시예 4
에피토프 지도화.
상기 에피토프를 WT1 ab1 인식에 대해 더욱 정확하게 조사하기 위해서, RMF 펩타이드를 1, 3, 4, 5, 6, 7 및 8 번 위치에서 알라닌으로 치환시키고 T2 세포 상에서 펄스화하고 WT1 ab1의 결합에 대해 시험하였다. 상기 RMF의 2 및 9 번 위치는, 이들이 상기 HLA-A0201 분자에 대한 펩타이드 결합의 고정 잔기이므로, 완전하게 그대로 두었다. 1 번 위치를 제외하고, 다른 위치들에서의 알라닌 치환은 고유 RMF 펩타이드에 비해, 상기 WT1 ab1의 결합에 그다지 영향을 미치지 않았다(도 19). 그러나, 알라닌(WT1-A1-B) 또는 타이로신(WT1-A1)에 의한 1 번 위치의 치환은 WT1 ab1의 결합을 완전히 없앴다. 상기 결합의 상실은, 상기 두 펩타이드가 모두 HLA-A2 분자, 클론 BB7에 대해 특이적인 mAb를 사용하는 T2 안정화 분석에서 가장 강한 결합을 나타내었으므로, 상기 HLA-A2 분자에 대한 펩타이드 결합 친화성의 감소에 기인하지 않았다(도 20). 이러한 결과는 상기 RMF 펩타이드의 1 번 위치의 아르기닌이 상기 WT1 ab1 인식에 가장 중요한 것들 중 하나임을 나타낸다. 2 번 및 9 번 위치에서의 상기 잔기들의 역할은 평가할 수 없었다.
다음으로 중요한 문제는 WT1 ab1이 세포 표면상의 HLA-A0201 분자에 의해 제공된 천연 처리된 WT1 에피토프 RMF를 인식할 수 있는 지의 여부였다. 하나의 세포주 패널을 WT1 mRNA의 발현 및 HLA 유전형을 기준으로 선택하였다(표 13).
WT1 mRNA 발현 수준을 정량적인 RT-PCR에 의해, 선행 연구(Rena)에 따라 평가하였다.
HLA-A0201과 WT1 mRNA 모두에 대해 양성인 7 개의 인간 중피종 세포주 중에서, WT1 ab1은 7 개의 세포주 중 6 개에 결합하였으나, HLA-A0201 음성(MSTO 및 VAMT) 또는 WT1 mRNA 음성인 세포, 예를 들어 흑색종 세포주, Mewo에 대해서는 결합하지 않았다(도 21).
유사하게, 시험된 9 개의 백혈병 세포주 중에서, WT1 ab1은 WT1 mRNA와 HLA-A0201 모두에 대해 양성인 3 개의 세포주 BV173(도 22), BA25 및 ALL-3에 결합하였으나, 다수의 연구에서 높은 수준의 WT1 전사물을 발현하는 것으로 입증된 HLA-A2-음성 세포주 HL60 및 K562에는 결합하지 않았다.
예상된 바와 같이, 상기 WT1 AB1의 결합 강도가 또한 중피종 세포 H2373, 백혈병 세포주 697 및 LAMA, 및 골수종 세포주 U266에서 입증된 바와 같이, HLA-A0201 분자의 발현 수준과 직접적으로 관련되는 것으로 보였다. 이들 세포주는 WT1 전사물 및 HLA-A2 모두에 대해 양성이었지만, 상기 HLA-A2의 발현 수준은 낮았고(표 13) 상기 mAb는 결합을 나타내지 않았다. 다른 한편으로, T2 세포에 의해 획득된 결과는 T2 세포가 높은 수준의 HLA-A2 분자를 발현하였으므로 WT1 ab1이 HLA-A0201 단독에 결합할 가능성을 반박한다. 현저하게도, WT1 ab1은 T2 세포 단독 또는 R3 및 다른 HLA-A0201-결합 펩타이드에 의해, 예를 들어 상기 RMF 펩타이드에 대한 불규칙한 펩타이드 WT1-A1에 의해 또는 유잉 육종-유래된(EW) 펩타이드에 의해 펄스화된 T2 세포에 결합하지 않았으며; 이들 두 펩타이드는 T2 안정화 분석에서 상기 HLA-A0201 분자에 대해 더 높은 친화성을 나타내었다(28). 이러한 결과는 WT1 ab1 인식이, 상기 RMF 펩타이드 및 A0201 분자가 복합체로 함께 구성된 에피토프에 특이적이라는 강한 증거를 제공하였다. 다른 두 mAb, WT1 ab3 및 WT1 ab5의 BV173 및 JMN 세포에의 결합도 또한 WT1 ab1보다 약하였다.
실시예 5
세포 상의 WT1 ab1 결합 부위의 정량분석.
125I-표지된 WT1 ab1을 사용하는 방사성면역분석을 사용하여 WT1+ HLA-A0201+ 세포주에 대한 항체의 특이성을 확인하고, 친화성 상수를 측정하고, 세포주 패널 상의 세포당 항체 결합 부위의 수를 평가하였다. JMN 세포에 대한 결합에 근거한 스캐차드 분석은 약 0.2 nM의 결합 활성 상수를 나타내었다(도 23). 이 수는 포르테 바이오(Forte Bio) 장치를 사용하는 간섭 측정 (interferometry)에 의해 확인되었다. 125-I-표지된 WT1 ab1을 사용하여 WT1+ HLA-A0201+ 세포주에 대한 항체의 특이성을 확인하고, 세포주 패널 상의 항체 결합 부위의 수를 평가하였다(도 24). 우리는 상기 2가 mAb가 상기 표면상의 1 또는 2 개의 복합체에 결합하는 지의 여부를 측정할 수 없기 때문에, 세포당 전체 에피토프는 mAb 결합 부위 수의 두배 정도로 높을 수 있었다. 다시, WT1 ab1은 HLA-A0201 및 WT1 mRNA 모두에 대해 양성인 JMN, ALL-3, BA25, BV173에 결합하였지만, HLA-A0201 음성(HL60) 또는 WT1 mRNA 음성(SKLY-16) 세포에는 결합하지 않았다. WT1 ab1은, HLA-A0201 및 WT1 모두 양성이나 낮은 수준의 HLA-A0201을 함유하는(표 13) 697 세포에는 결합하지 않았으며, 이는 WT1 ab1 결합에 충분한 WT1 펩타이드를 제공하기 위해서는 일정 수준의 전체 MHC 복합체가 필요함을 입증한다. RMF에 의해 펄스화된 T2는 가장 많은 수의 mAb(50,000/세포)에 결합하였고, 이어서 JMN 세포가 세포당 약 6 x 103의 WT1 ab1 분자에 결합하였으며, 이는 세포당 6 x 103 내지 1.2 x 104 RMF 펩타이드/A2 복합체로 번역되고, 이는 각각 1가 또는 2가 항체 결합으로 추정된다. 3 개의 양성 백혈병 세포주는 1 x 103 내지 2 x 103 WT1 ab1 분자, 또는 2 x 103 내지 4 x 103 결합 부위에 결합하였다(도 24). 이들 결과는 정량적인 유식 세포측정에 의해 확인되었다.
실시예 6
백혈병 환자 샘플에의 WT1 ab1 결합.
이어서 우리는 WT1 ab1이 1차 AML 세포상의 RMF 에피토프를 검출할 수 있는지를 조사하였다. 방사성면역분석은, HLA-A2 양성이고 WT1 mRNA+인 환자 1의 AML 아세포에 대한 WT1 AB1의 현저한 결합을 입증하였다. WT1 ab1은 전체 세포 집단의 83%를 초과하여 차지하는 CD33+ 및 CD34+ 이중 양성 세포에 결합하였다(도 25). WT1 ab1은, HLA-A2 양성이나 mRNA 음성 또는 HLA-A2 음성인 3 명의 다른 환자의 세포에는 결합하지 않았다. WT1 ab1은 HLA-A2 양성 또는 음성의 건강한 공여자로부터의 PBMC에 결합하지 않았다. 상기 결과를 유식 세포측정 분석에 의해 확인하였다. WT1 AB1은 A0201 음성인 환자들로부터의 아세포에는 현저한 결합을 보이지 않았다(도 26). 상기 결과는 상기 세포의 mRNA 발현에 의해 획득한 결과와 일치하였다. 이들 데이터는 백혈병 세포의 표면상의 RMFp/HLA-A0201의 수준이 WT1 ab1과의 반응성을 허용하기에 적합하며 WT1 음성의 건강한 세포상의 수준은 유의수준이 아님을 입증한다.
실시예 7
WT1
AB1
은 종양 세포에 대한
ADCC
를 매개한다.
ADCC는 인간에서 치료학적 mAb의 주요 효과기 기전들 중 하나인 것으로 생각된다. 인간 PBMC의 존재 하에서, WT1 ab1은 RMF 펩타이드가 실린 T2 세포에 대해서 용량-의존적인 PBMC ADCC를 매개하였지만, T2 세포 단독 또는 대조용 R3 펩타이드에 의해 펄스화된 T2 세포는 그렇지 않았다(도 27). 중요하게도, WT1 ab1은 종양 세포, 예를 들어 중피종 세포주, JMN(도 33) 및 백혈병 세포주 BV173(도 34) 상의 HLA-A0201 분자에 의해 천연으로 제공된 RMF 에피토프에 대해서는 ADCC를 매개하였으나, HLA-A2 음성 세포 MSTO(도 28) 또는 HL-60(도 29)의 경우는 그렇지 않았다. 상기 살해는 다수의 건강한 공여자로부터의 효과기 세포로서 PBMC를 사용하여 1 ㎍/㎖ 이하의 WT1 ab1에서 일관되게 관찰되었다. 중요하게도, WT1 ab1은 또한 WT1 ab1 결합에 대해 양성인 1차 A0201-양성 AML 아세포는 살해하였으나, HLA-A0201 음성인 아세포는 그렇지 않았다(도 30). 이들 결과는 WT1 ab1이 세포주뿐만 아니라 생리학적 수준에서 RMF 및 HLA-A0201 복합체를 천연으로 발현하는 세포에 대해 특정한 ADCC를 매개함을 입증하였다.
실시예 8
NSG
마우스에서
WT1
AB1
은 인간 백혈병 세포를 제거한다.
생체 내에서 WT1 ab1의 효능을, 앞서 BV173 bcr/abl 양성 급성 림프구성 백혈병을 6일간 정맥내 이종이식한 NOD SCID 감마(NSG) 마우스에서 시험하였다. 처리 시에, 마우스는 간, 비장 및 BM에서 루시페라제 이미징에 의해 백혈병을 볼 수 있었다. NSG 마우스는 성숙한 B-, T- 및 NK-세포가 없으며, 우리는 WT1 ab1 처리와 함께 인간 효과기 세포(CD3-, CD34-, PBMC)의 도입이 시험관 내에서 관찰된 ADCC-매개된 항-종양 효과를 생체 내에서 재현할 것임을 가정하였다. 2 개의 100 ㎍ 용량의 WT1 ab1과 함께 효과기의 주사는 대조군에 비해 종양 성장을 거의 제거하였다(도 31). 상기 효과는 실험 기간 동안 지속될 수 있었다(도 32). 흥미롭게도, 상기 시험의 초기에, 효과기 세포 단독 또는 대조용 IgG와 결합된 상기 세포는 백혈병만을 주사한 마우스에 비해 백혈병의 보다 빠른 성장을 촉진하는 것으로 나타났으며, 이는 상기 항-종양 효과가 상기 효과기 혼자서는 관련되지 않음을 입증한다. 효과기를 제공한(대조용 mAb와 함께 또는 없이) 마우스 중 여러 마리가 BV173의 대량 침윤으로 상기 실험에서 조기 사망하였다.
놀랍게도, 대략 30일 동안 인간 효과기 없는 WT1 ab1 처리뿐만 아니라 효과기와 결합된 WT1 ab1은, 비록 결국 상기 WT1 ab1 단독 그룹이 효과기 그룹과 결합된 WT1 ab1에 비해 훨신 더 빠르게 종양이 재발하였지만(도 32), 종양 부담을 대단히 감소시켰다(도 32). 우리는 WT1 ab1 단독의 효과를 확인하였으며 효능을 평가하기 위해서 상기 투여량을 적정 (titration)하였다. WT1 ab1은 단독으로, 시험된 모든 용량(25 내지 100 ㎍ x 2 회 용량)에서 초기 시점들에서 종양 부담을 현저하게 감소시켰다. 모든 처리 그룹들에서 종양은 항체 요법 중단 후 서서히 재발하였으며; 23일까지(최종 항체 주사 후 13일째), 100 ㎍ 용량 그룹에 비해 25 ㎍ 그룹에서 현저하게 더 많은 종양 재발이 관찰될 수 있었고, 이는 WT1 ab1 요법에 대한 용량-반응을 가리킨다(도 33). 처리 전에, 마우스는 간에서 가장 큰 종양 부담을 나타내었으며, 이는 WT1 ab1에 의해 빠르게 제거되었다. 재발 시, 가장 높은 용량 그룹의 종양은 주로 골수에서 발생하는 것으로 나타난 반면, 최저 용량으로 처리된 마우스에서는 종양이 간으로 보다 빠르게 재발하였다.
실시예 9
세포독성 능력을 증대시키기 위한 항체 조작.
인간 IgG1 Fc와 함께 개시된 바와 같이(43,44) 면역 T 세포 상의 WT1/A2 복합체 및 CD3 모두를 인식하는 이중특이성 항체를 제작한다. 이중특이성 항체는 생체 내에서 Fc 효과기 작용 및 긴 반감기를 유지하면서 WT1/A2 양성 암세포에 대해 세포독성 T 세포를 보충하고 표적화하는 것으로 여겨진다. 하기 3 가지 기전이 이중특이성 항체에 의해 매개되는 암세포의 특정한 살해에 관여한다: i) 활성화된 T 세포에 의한 살해; ii) ADCC 활성; iii) CDC 활성. 이중특이성 항체의 다른 포맷, 예를 들어 이중 scFv 분자(taFv), 다이아바디(Db), 또는 단일 쇄 다이아바디(scDb), 및 인간 혈청 알부민과의 융합 단백질(45,46,47,48)을 제작할 수 있지만, 이들은 독특한 약동학 프로파일을 갖는 Fc 효과기 작용이 없다.
WT1/A2 표적 특이성-ADCC 활성을 미국 특허 제 8,025,879; 8,080,415; 및 8,084,022 호에 개시된 바와 같이 글리콜-조작된 CHO 세포에서 항체를 재조합에 의해 발현시킴으로써 증대시킨다. Asn297 상의 변형된 올리고사카라이드 N-글리칸은 효과기 작용을 하기와 같이 변경시킨다: 1) 인간 천연 살해 세포에 의해 매개된 개선된 ADCC 활성을 위한 CD16/FcRIIIa에의 보다 높은 친화성 결합; 2) 호중구와 같은 효과기 세포 및 대식세포 및 DC 세포에 의한 항원 제공에 의해 매개된 개선된 ADCC 활성을 위한, 다중 유형의 면역 세포(NK 세포 제외)에서 발현된 억제 수용체 CD32b/FcRIIb에 대한 감소된 결합 친화성(50,51,52). 증대된 항체는 생체 내 암치료에 보다 양호한 효능을 성취하는 것으로 예상된다.
IgG Fc의 글리코실화(구체적으로 퓨코실화) 변체를 미국 특허 제 8,025,879; 8,080,415; 및 8,084,022 호에 개시된 숙주 발현 세포 및 방법을 사용하여 생성시킬 수 있으며, 상기 특허의 내용은 본 발명에 참고로 인용된다. 간단히, 본 발명에 개시된 항체의 중쇄 또는 경쇄를 암호화하는 전령 RNA(mRNA)를 RNA 단리 정제 및 임의로 크기 기준 단리의 표준 기법들을 사용함으로써 수득한다. 이어서 중쇄 또는 경쇄를 암호화하는 mRNA에 상응하는 cDNA를 생성시키고 당해 분야에 공지된 기법, 예를 들어 cDNA 라이브러리 제작, 파지 라이브러리 제작 및 특정한 관련 프라이머를 사용하는 선별 또는 RT-PCR을 사용하여 단리한다. 일부 실시태양에서, 상기 cDNA 서열은 특정한 목적하는 cDNA를 생성시키기 위해서 공지된 시험관 내 DNA 조작 기법을 사용하여 전적으로 또는 부분적으로 제작된 것일 수 있다. 이어서 상기 cDNA 서열을, 상기 유전자를 갖는 판독 프레임 중에 프로모터를 함유하고 낮은 퓨코스-변형된 숙주 세포와 양립할 수 있는 벡터 중에 위치시킬 수 있다.
적합한 프로모터, 대조용 서열, 리보솜 결합 부위, 및 전사 종결 부위, 및 임의로 편리한 마커를 함유하는 다수의 플라스미드가 당해 분야에 공지되어 있으며, 여기에는 비제한적으로 미국 특허 제 4,663,283 호 및 4,456,748 호에 개시된 벡터가 포함된다. 하나의 실시태양에서, 경쇄를 암호화하는 cDNA 및 중쇄를 암호화하는 cDNA를 별도의 발현 플라스미드 내에 삽입할 수도 있다. 또 다른 실시태양에서, 상기 경쇄를 암호화하는 cDNA 및 중쇄를 암호화하는 cDNA를, 각각이 적합한 프로모터 및 번역 조절 하에 있는 한, 동일한 플라스미드 중에 함께 삽입할 수도 있다. 결과를 도 34에 도시한다.
참고문헌
SEQUENCE LISTING
<110> Memorial Sloan-Kettering Cancer Center
SCHEINBERG, David A.
DAO, Tao
LIU, Cheng
YAN, Su
<120> ANTIBODIES TO CYTOSOLIC PEPTIDES
<130> 3314.013AWO
<150> 61/470,635
<151> 2011-04-01
<150> 61/491,392
<151> 2011-05-31
<160> 238
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> PRT
<213> Homo sapiens
<400> 1
Arg Met Phe Pro Asn Ala Pro Tyr Leu
1 5
<210> 2
<211> 10
<212> PRT
<213> Homo sapiens
<400> 2
Gly Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5 10
<210> 3
<211> 17
<212> PRT
<213> Homo sapiens
<400> 3
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 4
<211> 10
<212> PRT
<213> Homo sapiens
<400> 4
Arg Ile Pro Pro Tyr Tyr Gly Met Asp Val
1 5 10
<210> 5
<211> 30
<212> DNA
<213> Homo sapiens
<400> 5
ggaggcacct tcagcagcta tgctatcagc 30
<210> 6
<211> 51
<212> DNA
<213> Homo sapiens
<400> 6
gggatcatcc ctatctttgg tacagcaaac tacgcacaga agttccaggg c 51
<210> 7
<211> 30
<212> DNA
<213> Homo sapiens
<400> 7
cggattcccc cgtactacgg tatggacgtc 30
<210> 8
<211> 13
<212> PRT
<213> Homo sapiens
<400> 8
Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Tyr
1 5 10
<210> 9
<211> 7
<212> PRT
<213> Homo sapiens
<400> 9
Arg Ser Asn Gln Arg Pro Ser
1 5
<210> 10
<211> 11
<212> PRT
<213> Homo sapiens
<400> 10
Ala Ala Trp Asp Asp Ser Leu Asn Gly Val Val
1 5 10
<210> 11
<211> 39
<212> DNA
<213> Homo sapiens
<400> 11
tctggaagca gctccaacat cggaagtaat tatgtatac 39
<210> 12
<211> 21
<212> DNA
<213> Homo sapiens
<400> 12
aggagtaatc agcggccctc a 21
<210> 13
<211> 33
<212> DNA
<213> Homo sapiens
<400> 13
gcagcatggg atgacagcct gaatggtgtg gta 33
<210> 14
<211> 119
<212> PRT
<213> Homo sapiens
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Ile Pro Pro Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 15
<211> 357
<212> DNA
<213> Homo sapiens
<400> 15
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cttctggagg caccttcagc agctatgcta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaggg atcatcccta tctttggtac agcaaactac 180
gcacagaagt tccagggcag agtcacgatt accgcggacg aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gagacggatt 300
cccccgtact acggtatgga cgtctggggc caagggacca cggtcaccgt ctcctca 357
<210> 16
<211> 111
<212> PRT
<213> Homo sapiens
<400> 16
Gln Thr Val Val Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Ser Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Pro Arg
65 70 75 80
Ser Val Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 17
<211> 333
<212> DNA
<213> Homo sapiens
<400> 17
cagactgtgg tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaattatg tatactggta ccaacagctc 120
ccaggaacgg cccccaaact cctcatctat aggagtaatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggccccgg 240
tccgtggatg aggctgatta ttactgtgca gcatgggatg acagcctgaa tggtgtggta 300
ttcggcggag ggaccaagct gaccgtccta ggt 333
<210> 18
<211> 250
<212> PRT
<213> Homo sapiens
<400> 18
Gln Thr Val Val Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Ser Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Pro Arg
65 70 75 80
Ser Val Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Leu
115 120 125
Glu Met Ala Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
130 135 140
Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe
145 150 155 160
Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
165 170 175
Glu Trp Met Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala
180 185 190
Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser
195 200 205
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Arg Arg Ile Pro Pro Tyr Tyr Gly Met Asp Val Trp
225 230 235 240
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
245 250
<210> 19
<211> 750
<212> DNA
<213> Homo sapiens
<400> 19
cagactgtgg tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaattatg tatactggta ccaacagctc 120
ccaggaacgg cccccaaact cctcatctat aggagtaatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggccccgg 240
tccgtggatg aggctgatta ttactgtgca gcatgggatg acagcctgaa tggtgtggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggatc cctcgagatg gcccaggtgc agctggtgca gtctggggct 420
gaggtgaaga agcctgggtc ctcggtgaag gtctcctgca aggcttctgg aggcaccttc 480
agcagctatg ctatcagctg ggtgcgacag gcccctggac aagggcttga gtggatggga 540
gggatcatcc ctatctttgg tacagcaaac tacgcacaga agttccaggg cagagtcacg 600
attaccgcgg acgaatccac gagcacagcc tacatggagc tgagcagcct gagatctgag 660
gacacggccg tgtattactg tgcgagacgg attcccccgt actacggtat ggacgtctgg 720
ggccaaggga ccacggtcac cgtctcctca 750
<210> 20
<211> 12
<212> PRT
<213> Homo sapiens
<400> 20
Gly Asp Ser Val Ser Ser Asn Ser Ala Ala Trp Asn
1 5 10
<210> 21
<211> 18
<212> PRT
<213> Homo sapiens
<400> 21
Arg Thr Tyr Tyr Gly Ser Lys Trp Tyr Asn Asp Tyr Ala Val Ser Val
1 5 10 15
Lys Ser
<210> 22
<211> 9
<212> PRT
<213> Homo sapiens
<400> 22
Gly Arg Leu Gly Asp Ala Phe Asp Ile
1 5
<210> 23
<211> 36
<212> DNA
<213> Homo sapiens
<400> 23
ggggacagtg tctctagcaa cagtgctgct tggaac 36
<210> 24
<211> 54
<212> DNA
<213> Homo sapiens
<400> 24
aggacatact acgggtccaa gtggtataat gattatgcag tatctgtgaa aagt 54
<210> 25
<211> 27
<212> DNA
<213> Homo sapiens
<400> 25
ggtcgcttag gggatgcttt tgatatc 27
<210> 26
<211> 11
<212> PRT
<213> Homo sapiens
<400> 26
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 27
<211> 7
<212> PRT
<213> Homo sapiens
<400> 27
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 28
<211> 9
<212> PRT
<213> Homo sapiens
<400> 28
Gln Gln Ser Tyr Ser Thr Pro Leu Thr
1 5
<210> 29
<211> 33
<212> DNA
<213> Homo sapiens
<400> 29
cgggcaagtc agagcattag cagctattta aat 33
<210> 30
<211> 21
<212> DNA
<213> Homo sapiens
<400> 30
gctgcatcca gtttgcaaag t 21
<210> 31
<211> 27
<212> DNA
<213> Homo sapiens
<400> 31
caacagagtt acagtacccc tctcact 27
<210> 32
<211> 121
<212> PRT
<213> Homo sapiens
<400> 32
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Gly Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Arg Leu Gly Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 33
<211> 363
<212> DNA
<213> Homo sapiens
<400> 33
caggtacagc tgcagcagtc aggtccagga ctggtgaagc cctcgcagac cctctcactc 60
acctgtgcca tctccgggga cagtgtctct agcaacagtg ctgcttggaa ctggatcagg 120
cagtccccat cgagaggcct tgagtggctg ggaaggacat actacgggtc caagtggtat 180
aatgattatg cagtatctgt gaaaagtcga ataaccatca acccagacac atccaagaac 240
cagttctccc tgcagctgaa ctctgtgact cccgaggaca cggctgtgta ttactgtgca 300
agaggtcgct taggggatgc ttttgatatc tggggccaag ggacaatggt caccgtctct 360
tca 363
<210> 34
<211> 108
<212> PRT
<213> Homo sapiens
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Arg
100 105
<210> 35
<211> 324
<212> DNA
<213> Homo sapiens
<400> 35
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaacag agttacagta cccctctcac tttcggcgga 300
gggaccaaag tggatatcaa acgt 324
<210> 36
<211> 250
<212> PRT
<213> Homo sapiens
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Arg Ser Arg Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met
115 120 125
Ala Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser
130 135 140
Gln Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser
145 150 155 160
Asn Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu
165 170 175
Glu Trp Leu Gly Arg Thr Tyr Tyr Gly Ser Lys Trp Tyr Asn Asp Tyr
180 185 190
Ala Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys
195 200 205
Asn Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala
210 215 220
Val Tyr Tyr Cys Ala Arg Gly Arg Leu Gly Asp Ala Phe Asp Ile Trp
225 230 235 240
Gly Gln Gly Thr Met Val Thr Val Ser Ser
245 250
<210> 37
<211> 750
<212> DNA
<213> Homo sapiens
<400> 37
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaacag agttacagta cccctctcac tttcggcgga 300
gggaccaaag tggatatcaa acgttctaga ggtggtggtg gtagcggcgg cggcggctct 360
ggtggtggtg gatccctcga gatggcccag gtacagctgc agcagtcagg tccaggactg 420
gtgaagccct cgcagaccct ctcactcacc tgtgccatct ccggggacag tgtctctagc 480
aacagtgctg cttggaactg gatcaggcag tccccatcga gaggccttga gtggctggga 540
aggacatact acgggtccaa gtggtataat gattatgcag tatctgtgaa aagtcgaata 600
accatcaacc cagacacatc caagaaccag ttctccctgc agctgaactc tgtgactccc 660
gaggacacgg ctgtgtatta ctgtgcaaga ggtcgcttag gggatgcttt tgatatctgg 720
ggccaaggga caatggtcac cgtctcttca 750
<210> 38
<211> 10
<212> PRT
<213> Homo sapiens
<400> 38
Gly Tyr Ser Phe Thr Asn Phe Trp Ile Ser
1 5 10
<210> 39
<211> 17
<212> PRT
<213> Homo sapiens
<400> 39
Arg Val Asp Pro Gly Tyr Ser Tyr Ser Thr Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 40
<211> 12
<212> PRT
<213> Homo sapiens
<400> 40
Val Gln Tyr Ser Gly Tyr Tyr Asp Trp Phe Asp Pro
1 5 10
<210> 41
<211> 30
<212> DNA
<213> Homo sapiens
<400> 41
ggatacagct tcaccaactt ctggatcagc 30
<210> 42
<211> 51
<212> DNA
<213> Homo sapiens
<400> 42
agggttgatc ctggctactc ttatagcacc tacagcccgt ccttccaagg c 51
<210> 43
<211> 36
<212> DNA
<213> Homo sapiens
<400> 43
gtacaatata gtggctacta tgactggttc gacccc 36
<210> 44
<211> 13
<212> PRT
<213> Homo sapiens
<400> 44
Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Thr Val Asn
1 5 10
<210> 45
<211> 7
<212> PRT
<213> Homo sapiens
<400> 45
Ser Asn Asn Gln Arg Pro Ser
1 5
<210> 46
<211> 11
<212> PRT
<213> Homo sapiens
<400> 46
Ala Ala Trp Asp Asp Ser Leu Asn Gly Trp Val
1 5 10
<210> 47
<211> 39
<212> DNA
<213> Homo sapiens
<400> 47
tctggaagca gctccaacat cggaagtaat actgtaaac 39
<210> 48
<211> 21
<212> DNA
<213> Homo sapiens
<400> 48
agtaataatc agcggccctc a 21
<210> 49
<211> 33
<212> DNA
<213> Homo sapiens
<400> 49
gcagcatggg atgacagcct gaatggttgg gtg 33
<210> 50
<211> 121
<212> PRT
<213> Homo sapiens
<400> 50
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Glu Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Phe
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Val Asp Pro Gly Tyr Ser Tyr Ser Thr Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Asn Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Gln Tyr Ser Gly Tyr Tyr Asp Trp Phe Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 51
<211> 363
<212> DNA
<213> Homo sapiens
<400> 51
cagatgcagc tggtgcagtc cggagcagag gtgaaagagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggata cagcttcacc aacttctgga tcagctgggt gcgccagatg 120
cccgggaaag gcctggagtg gatggggagg gttgatcctg gctactctta tagcacctac 180
agcccgtcct tccaaggcca cgtcaccatc tcagctgaca agtctaccag cactgcctac 240
ctgcagtgga acagcctgaa ggcctcggac accgccatgt attactgtgc gagagtacaa 300
tatagtggct actatgactg gttcgacccc tggggccagg gaaccctggt caccgtctcc 360
tca 363
<210> 52
<211> 111
<212> PRT
<213> Homo sapiens
<400> 52
Gln Ala Val Val Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Asn Trp Tyr Gln Gln Val Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 53
<211> 333
<212> DNA
<213> Homo sapiens
<400> 53
caggctgtgg tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaatactg taaactggta ccagcaggtc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgca gcatgggatg acagcctgaa tggttgggtg 300
ttcggcggag ggaccaagct gaccgtccta ggt 333
<210> 54
<211> 253
<212> PRT
<213> Homo sapiens
<400> 54
Gln Ala Val Val Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Asn Trp Tyr Gln Gln Val Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Glu Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Asn Phe Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Arg Val Asp Pro Gly Tyr Ser Tyr Ser Thr Tyr
180 185 190
Ser Pro Ser Phe Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Thr
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Asn Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Val Gln Tyr Ser Gly Tyr Tyr Asp Trp Phe
225 230 235 240
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 55
<211> 759
<212> DNA
<213> Homo sapiens
<400> 55
caggctgtgg tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaatactg taaactggta ccagcaggtc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgca gcatgggatg acagcctgaa tggttgggtg 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggcccaga tgcagctggt gcagtccgga 420
gcagaggtga aagagcccgg ggagtctctg aggatctcct gtaagggttc tggatacagc 480
ttcaccaact tctggatcag ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggagggttg atcctggcta ctcttatagc acctacagcc cgtccttcca aggccacgtc 600
accatctcag ctgacaagtc taccagcact gcctacctgc agtggaacag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgaga gtacaatata gtggctacta tgactggttc 720
gacccctggg gccagggaac cctggtcacc gtctcctca 759
<210> 56
<211> 10
<212> PRT
<213> Homo sapiens
<400> 56
Gly Tyr Asn Phe Ser Asn Lys Trp Ile Gly
1 5 10
<210> 57
<211> 17
<212> PRT
<213> Homo sapiens
<400> 57
Ile Ile Tyr Pro Gly Tyr Ser Asp Ile Thr Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 58
<211> 9
<212> PRT
<213> Homo sapiens
<400> 58
His Thr Ala Leu Ala Gly Phe Asp Tyr
1 5
<210> 59
<211> 30
<212> DNA
<213> Homo sapiens
<400> 59
ggctacaact ttagcaacaa gtggatcggc 30
<210> 60
<211> 51
<212> DNA
<213> Homo sapiens
<400> 60
atcatctatc ccggttactc ggacatcacc tacagcccgt ccttccaagg c 51
<210> 61
<211> 27
<212> DNA
<213> Homo sapiens
<400> 61
cacacagctt tggccggctt tgactac 27
<210> 62
<211> 11
<212> PRT
<213> Homo sapiens
<400> 62
Arg Ala Ser Gln Asn Ile Asn Lys Trp Leu Ala
1 5 10
<210> 63
<211> 7
<212> PRT
<213> Homo sapiens
<400> 63
Lys Ala Ser Ser Leu Glu Ser
1 5
<210> 64
<211> 8
<212> PRT
<213> Homo sapiens
<400> 64
Gln Gln Tyr Asn Ser Tyr Ala Thr
1 5
<210> 65
<211> 33
<212> DNA
<213> Homo sapiens
<400> 65
cgggccagtc agaatatcaa taagtggctg gcc 33
<210> 66
<211> 21
<212> DNA
<213> Homo sapiens
<400> 66
aaggcgtcta gtttagaaag t 21
<210> 67
<211> 24
<212> DNA
<213> Homo sapiens
<400> 67
caacaatata atagttatgc gacg 24
<210> 68
<211> 118
<212> PRT
<213> Homo sapiens
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Asn Phe Ser Asn Lys
20 25 30
Trp Ile Gly Trp Val Arg Gln Leu Pro Gly Arg Gly Leu Glu Trp Ile
35 40 45
Ala Ile Ile Tyr Pro Gly Tyr Ser Asp Ile Thr Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Arg Val Thr Ile Ser Ala Asp Thr Ser Ile Asn Thr Ala Tyr
65 70 75 80
Leu His Trp His Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Val Arg His Thr Ala Leu Ala Gly Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 69
<211> 354
<212> DNA
<213> Homo sapiens
<400> 69
caggtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggagagtc tctgaagatc 60
tcctgtaagg gttctggcta caactttagc aacaagtgga tcggctgggt gcgccaattg 120
cccgggagag gcctggagtg gatagcaatc atctatcccg gttactcgga catcacctac 180
agcccgtcct tccaaggccg cgtcaccatc tccgccgaca cgtccattaa caccgcctac 240
ctgcactggc acagcctgaa ggcctcggac accgccatgt attattgtgt gcgacacaca 300
gctttggccg gctttgacta ctggggcctg ggcaccctgg tcaccgtctc ctca 354
<210> 70
<211> 107
<212> PRT
<213> Homo sapiens
<400> 70
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Lys Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Lys Ala Pro Gln Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Ala Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 71
<211> 321
<212> DNA
<213> Homo sapiens
<400> 71
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcaca 60
atcacttgcc gggccagtca gaatatcaat aagtggctgg cctggtatca gcagagacca 120
gggaaagccc ctcagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatct 180
aggttcagcg gcagtggatc tgggacagaa tacactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacaa tataatagtt atgcgacgtt cggccaaggg 300
accaaggtgg aaatcaaacg t 321
<210> 72
<211> 246
<212> PRT
<213> Homo sapiens
<400> 72
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Lys Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Lys Ala Pro Gln Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Ala Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Ser Arg Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met Ala
115 120 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
130 135 140
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Asn Phe Ser Asn Lys
145 150 155 160
Trp Ile Gly Trp Val Arg Gln Leu Pro Gly Arg Gly Leu Glu Trp Ile
165 170 175
Ala Ile Ile Tyr Pro Gly Tyr Ser Asp Ile Thr Tyr Ser Pro Ser Phe
180 185 190
Gln Gly Arg Val Thr Ile Ser Ala Asp Thr Ser Ile Asn Thr Ala Tyr
195 200 205
Leu His Trp His Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
210 215 220
Val Arg His Thr Ala Leu Ala Gly Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser
245
<210> 73
<211> 738
<212> DNA
<213> Homo sapiens
<400> 73
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcaca 60
atcacttgcc gggccagtca gaatatcaat aagtggctgg cctggtatca gcagagacca 120
gggaaagccc ctcagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatct 180
aggttcagcg gcagtggatc tgggacagaa tacactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacaa tataatagtt atgcgacgtt cggccaaggg 300
accaaggtgg aaatcaaacg ttctagaggt ggtggtggta gcggcggcgg cggctctggt 360
ggtggtggat ccctcgagat ggcccaggtg cagctggtgc agtctggagc agaggtgaaa 420
aagcccggag agtctctgaa gatctcctgt aagggttctg gctacaactt tagcaacaag 480
tggatcggct gggtgcgcca attgcccggg agaggcctgg agtggatagc aatcatctat 540
cccggttact cggacatcac ctacagcccg tccttccaag gccgcgtcac catctccgcc 600
gacacgtcca ttaacaccgc ctacctgcac tggcacagcc tgaaggcctc ggacaccgcc 660
atgtattatt gtgtgcgaca cacagctttg gccggctttg actactgggg cctgggcacc 720
ctggtcaccg tctcctca 738
<210> 74
<211> 10
<212> PRT
<213> Homo sapiens
<400> 74
Gly Phe Thr Phe Asp Asp Tyr Gly Met Ser
1 5 10
<210> 75
<211> 17
<212> PRT
<213> Homo sapiens
<400> 75
Gly Ile Asn Trp Asn Gly Gly Ser Thr Gly Tyr Ala Asp Ser Val Arg
1 5 10 15
Gly
<210> 76
<211> 12
<212> PRT
<213> Homo sapiens
<400> 76
Glu Arg Gly Tyr Gly Tyr His Asp Pro His Asp Tyr
1 5 10
<210> 77
<211> 30
<212> DNA
<213> Homo sapiens
<400> 77
gggttcacct ttgatgatta tggcatgagc 30
<210> 78
<211> 51
<212> DNA
<213> Homo sapiens
<400> 78
ggtattaatt ggaatggtgg tagcacaggt tatgcagact ctgtgagggg c 51
<210> 79
<211> 36
<212> DNA
<213> Homo sapiens
<400> 79
gagcgtggct acgggtacca tgatccccat gactac 36
<210> 80
<211> 11
<212> PRT
<213> Homo sapiens
<400> 80
Gly Arg Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 81
<211> 7
<212> PRT
<213> Homo sapiens
<400> 81
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 82
<211> 11
<212> PRT
<213> Homo sapiens
<400> 82
Gln Val Trp Asp Ser Ser Ser Asp His Val Val
1 5 10
<210> 83
<211> 33
<212> DNA
<213> Homo sapiens
<400> 83
gggagaaaca acattggaag taaaagtgtg cac 33
<210> 84
<211> 21
<212> DNA
<213> Homo sapiens
<400> 84
gatgatagcg accggccctc a 21
<210> 85
<211> 33
<212> DNA
<213> Homo sapiens
<400> 85
caggtgtggg atagtagtag tgatcatgtg gta 33
<210> 86
<211> 121
<212> PRT
<213> Homo sapiens
<400> 86
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asn Trp Asn Gly Gly Ser Thr Gly Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Gly Tyr Gly Tyr His Asp Pro His Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 87
<211> 363
<212> DNA
<213> Homo sapiens
<400> 87
gaagtgcagc tggtgcagtc tgggggaggt gtggtacggc ctggggggtc cctgagactc 60
tcctgtgcag cctctgggtt cacctttgat gattatggca tgagctgggt ccgccaagct 120
ccagggaagg ggctggagtg ggtctctggt attaattgga atggtggtag cacaggttat 180
gcagactctg tgaggggccg attcaccatc tccagagaca acgccaagaa ctccctgtat 240
ctgcaaatga acagtctgag agccgaggac acggccttgt attactgtgc gagagagcgt 300
ggctacgggt accatgatcc ccatgactac tggggccaag gcaccctggt gaccgtctcc 360
tca 363
<210> 88
<211> 109
<212> PRT
<213> Homo sapiens
<400> 88
Gln Ser Val Val Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Arg Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 89
<211> 327
<212> DNA
<213> Homo sapiens
<400> 89
cagtctgtcg tgacgcagcc gccctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtggga gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgatcatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggt 327
<210> 90
<211> 249
<212> PRT
<213> Homo sapiens
<400> 90
Gln Ser Val Val Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Arg Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Ser Leu Glu Met Ala
115 120 125
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Arg Pro Gly Gly
130 135 140
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
145 150 155 160
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
165 170 175
Ser Gly Ile Asn Trp Asn Gly Gly Ser Thr Gly Tyr Ala Asp Ser Val
180 185 190
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
195 200 205
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
210 215 220
Ala Arg Glu Arg Gly Tyr Gly Tyr His Asp Pro His Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 91
<211> 747
<212> DNA
<213> Homo sapiens
<400> 91
cagtctgtcg tgacgcagcc gccctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtggga gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgatcatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggat ccctcgagat ggccgaagtg cagctggtgc agtctggggg aggtgtggta 420
cggcctgggg ggtccctgag actctcctgt gcagcctctg ggttcacctt tgatgattat 480
ggcatgagct gggtccgcca agctccaggg aaggggctgg agtgggtctc tggtattaat 540
tggaatggtg gtagcacagg ttatgcagac tctgtgaggg gccgattcac catctccaga 600
gacaacgcca agaactccct gtatctgcaa atgaacagtc tgagagccga ggacacggcc 660
ttgtattact gtgcgagaga gcgtggctac gggtaccatg atccccatga ctactggggc 720
caaggcaccc tggtgaccgt ctcctca 747
<210> 92
<211> 10
<212> PRT
<213> Homo sapiens
<400> 92
Gly Phe Ser Val Ser Gly Thr Tyr Met Gly
1 5 10
<210> 93
<211> 16
<212> PRT
<213> Homo sapiens
<400> 93
Leu Leu Tyr Ser Gly Gly Gly Thr Tyr His Pro Ala Ser Leu Gln Gly
1 5 10 15
<210> 94
<211> 10
<212> PRT
<213> Homo sapiens
<400> 94
Gly Gly Ala Gly Gly Gly His Phe Asp Ser
1 5 10
<210> 95
<211> 30
<212> DNA
<213> Homo sapiens
<400> 95
gggttctccg tcagtggcac ctacatgggc 30
<210> 96
<211> 48
<212> DNA
<213> Homo sapiens
<400> 96
cttctttata gtggtggcgg cacataccac ccagcgtccc tgcagggc 48
<210> 97
<211> 30
<212> DNA
<213> Homo sapiens
<400> 97
ggaggggcag gaggtggcca ctttgactcc 30
<210> 98
<211> 14
<212> PRT
<213> Homo sapiens
<400> 98
Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His
1 5 10
<210> 99
<211> 7
<212> PRT
<213> Homo sapiens
<400> 99
Gly Asn Ser Asn Arg Pro Ser
1 5
<210> 100
<211> 11
<212> PRT
<213> Homo sapiens
<400> 100
Ala Ala Trp Asp Asp Ser Leu Asn Gly Tyr Val
1 5 10
<210> 101
<211> 42
<212> DNA
<213> Homo sapiens
<400> 101
actgggagca gctccaacat cggggcaggt tatgatgtac ac 42
<210> 102
<211> 21
<212> DNA
<213> Homo sapiens
<400> 102
ggtaacagca atcggccctc a 21
<210> 103
<211> 33
<212> DNA
<213> Homo sapiens
<400> 103
gcagcatggg atgacagcct gaatggttat gtc 33
<210> 104
<211> 118
<212> PRT
<213> Homo sapiens
<400> 104
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Leu Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Val Ser Gly Thr
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Leu Tyr Ser Gly Gly Gly Thr Tyr His Pro Ala Ser Leu Gln
50 55 60
Gly Arg Phe Ile Val Ser Arg Asp Ser Ser Lys Asn Met Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Gly Gly Ala Gly Gly Gly His Phe Asp Ser Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 105
<211> 354
<212> DNA
<213> Homo sapiens
<400> 105
gaggtgcagc tggtggagac cggaggaggc ttgctccagc cgggggggtc cctcagactc 60
tcctgtgcag cctctgggtt ctccgtcagt ggcacctaca tgggctgggt ccgccaggct 120
ccagggaagg gactggagtg ggtcgcactt ctttatagtg gtggcggcac ataccaccca 180
gcgtccctgc agggccgatt catcgtctcc agagacagct ccaagaatat ggtctatctt 240
caaatgaata gcctgaaagc cgaggacacg gccgtctatt actgtgcgaa aggaggggca 300
ggaggtggcc actttgactc ctggggccaa ggcaccctgg tgaccgtctc ctca 354
<210> 106
<211> 112
<212> PRT
<213> Homo sapiens
<400> 106
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu
65 70 75 80
Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser
85 90 95
Leu Asn Gly Tyr Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 107
<211> 336
<212> DNA
<213> Homo sapiens
<400> 107
cagtctgtgt tgacgcagcc gccctcagtg tctggggccc cagggcagag ggtcaccatc 60
tcctgcactg ggagcagctc caacatcggg gcaggttatg atgtacactg gtaccagcag 120
cttccaggaa cagcccccaa actcctcatc tatggtaaca gcaatcggcc ctcaggggtc 180
cctgaccgat tctctggctc caagtctggc acctcagcct ccctggccat cagtgggctc 240
cagtctgagg atgaggctga ttattactgt gcagcatggg atgacagcct gaatggttat 300
gtcttcggaa ctgggaccaa gctgaccgtc ctaggt 336
<210> 108
<211> 251
<212> PRT
<213> Homo sapiens
<400> 108
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu
65 70 75 80
Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser
85 90 95
Leu Asn Gly Tyr Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Ser Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Leu Glu Met Ala Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu
130 135 140
Leu Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
145 150 155 160
Ser Val Ser Gly Thr Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Lys
165 170 175
Gly Leu Glu Trp Val Ala Leu Leu Tyr Ser Gly Gly Gly Thr Tyr His
180 185 190
Pro Ala Ser Leu Gln Gly Arg Phe Ile Val Ser Arg Asp Ser Ser Lys
195 200 205
Asn Met Val Tyr Leu Gln Met Asn Ser Leu Lys Ala Glu Asp Thr Ala
210 215 220
Val Tyr Tyr Cys Ala Lys Gly Gly Ala Gly Gly Gly His Phe Asp Ser
225 230 235 240
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 109
<211> 753
<212> DNA
<213> Homo sapiens
<400> 109
cagtctgtgt tgacgcagcc gccctcagtg tctggggccc cagggcagag ggtcaccatc 60
tcctgcactg ggagcagctc caacatcggg gcaggttatg atgtacactg gtaccagcag 120
cttccaggaa cagcccccaa actcctcatc tatggtaaca gcaatcggcc ctcaggggtc 180
cctgaccgat tctctggctc caagtctggc acctcagcct ccctggccat cagtgggctc 240
cagtctgagg atgaggctga ttattactgt gcagcatggg atgacagcct gaatggttat 300
gtcttcggaa ctgggaccaa gctgaccgtc ctaggttcta gaggtggtgg tggtagcggc 360
ggcggcggct ctggtggtgg tggatccctc gagatggccg aggtgcagct ggtggagacc 420
ggaggaggct tgctccagcc gggggggtcc ctcagactct cctgtgcagc ctctgggttc 480
tccgtcagtg gcacctacat gggctgggtc cgccaggctc cagggaaggg actggagtgg 540
gtcgcacttc tttatagtgg tggcggcaca taccacccag cgtccctgca gggccgattc 600
atcgtctcca gagacagctc caagaatatg gtctatcttc aaatgaatag cctgaaagcc 660
gaggacacgg ccgtctatta ctgtgcgaaa ggaggggcag gaggtggcca ctttgactcc 720
tggggccaag gcaccctggt gaccgtctcc tca 753
<210> 110
<211> 9
<212> PRT
<213> Homo sapiens
<400> 110
Ala Met Phe Pro Asn Ala Pro Tyr Leu
1 5
<210> 111
<211> 9
<212> PRT
<213> Homo sapiens
<400> 111
Arg Met Ala Pro Asn Ala Pro Tyr Leu
1 5
<210> 112
<211> 9
<212> PRT
<213> Homo sapiens
<400> 112
Arg Met Phe Ala Asn Ala Pro Tyr Leu
1 5
<210> 113
<211> 9
<212> PRT
<213> Homo sapiens
<400> 113
Arg Met Phe Pro Ala Ala Pro Tyr Leu
1 5
<210> 114
<211> 9
<212> PRT
<213> Homo sapiens
<400> 114
Arg Met Phe Pro Asn Ala Ala Tyr Leu
1 5
<210> 115
<211> 9
<212> PRT
<213> Homo sapiens
<400> 115
Arg Met Phe Pro Asn Ala Pro Ala Leu
1 5
<210> 116
<211> 9
<212> PRT
<213> Homo sapiens
<400> 116
Ile Leu Ser Leu Glu Leu Met Lys Leu
1 5
<210> 117
<211> 9
<212> PRT
<213> Homo sapiens
<400> 117
Gln Leu Gln Asn Pro Ser Tyr Asp Lys
1 5
<210> 118
<211> 449
<212> PRT
<213> Homo sapiens
<400> 118
Met Gly Ser Asp Val Arg Asp Leu Asn Ala Leu Leu Pro Ala Val Pro
1 5 10 15
Ser Leu Gly Gly Gly Gly Gly Cys Ala Leu Pro Val Ser Gly Ala Ala
20 25 30
Gln Trp Ala Pro Val Leu Asp Phe Ala Pro Pro Gly Ala Ser Ala Tyr
35 40 45
Gly Ser Leu Gly Gly Pro Ala Pro Pro Pro Ala Pro Pro Pro Pro Pro
50 55 60
Pro Pro Pro Pro His Ser Phe Ile Lys Gln Glu Pro Ser Trp Gly Gly
65 70 75 80
Ala Glu Pro His Glu Glu Gln Cys Leu Ser Ala Phe Thr Val His Phe
85 90 95
Ser Gly Gln Phe Thr Gly Thr Ala Gly Ala Cys Arg Tyr Gly Pro Phe
100 105 110
Gly Pro Pro Pro Pro Ser Gln Ala Ser Ser Gly Gln Ala Arg Met Phe
115 120 125
Pro Asn Ala Pro Tyr Leu Pro Ser Cys Leu Glu Ser Gln Pro Ala Ile
130 135 140
Arg Asn Gln Gly Tyr Ser Thr Val Thr Phe Asp Gly Thr Pro Ser Tyr
145 150 155 160
Gly His Thr Pro Ser His His Ala Ala Gln Phe Pro Asn His Ser Phe
165 170 175
Lys His Glu Asp Pro Met Gly Gln Gln Gly Ser Leu Gly Glu Gln Gln
180 185 190
Tyr Ser Val Pro Pro Pro Val Tyr Gly Cys His Thr Pro Thr Asp Ser
195 200 205
Cys Thr Gly Ser Gln Ala Leu Leu Leu Arg Thr Pro Tyr Ser Ser Asp
210 215 220
Asn Leu Tyr Gln Met Thr Ser Gln Leu Glu Cys Met Thr Trp Asn Gln
225 230 235 240
Met Asn Leu Gly Ala Thr Leu Lys Gly Val Ala Ala Gly Ser Ser Ser
245 250 255
Ser Val Lys Trp Thr Glu Gly Gln Ser Asn His Ser Thr Gly Tyr Glu
260 265 270
Ser Asp Asn His Thr Thr Pro Ile Leu Cys Gly Ala Gln Tyr Arg Ile
275 280 285
His Thr His Gly Val Phe Arg Gly Ile Gln Asp Val Arg Arg Val Pro
290 295 300
Gly Val Ala Pro Thr Leu Val Arg Ser Ala Ser Glu Thr Ser Glu Lys
305 310 315 320
Arg Pro Phe Met Cys Ala Tyr Pro Gly Cys Asn Lys Arg Tyr Phe Lys
325 330 335
Leu Ser His Leu Gln Met His Ser Arg Lys His Thr Gly Glu Lys Pro
340 345 350
Tyr Gln Cys Asp Phe Lys Asp Cys Glu Arg Arg Phe Ser Arg Ser Asp
355 360 365
Gln Leu Lys Arg His Gln Arg Arg His Thr Gly Val Lys Pro Phe Gln
370 375 380
Cys Lys Thr Cys Gln Arg Lys Phe Ser Arg Ser Asp His Leu Lys Thr
385 390 395 400
His Thr Arg Thr His Thr Gly Lys Thr Ser Glu Lys Pro Phe Ser Cys
405 410 415
Arg Trp Pro Ser Cys Gln Lys Lys Phe Ala Arg Ser Asp Glu Leu Val
420 425 430
Arg His His Asn Met His Gln Arg Asn Met Thr Lys Leu Gln Leu Ala
435 440 445
Leu
<210> 119
<211> 7
<212> PRT
<213> Homo sapiens
<400> 119
Ser Asn Ala Val Ala Trp Asn
1 5
<210> 120
<211> 13
<212> PRT
<213> Homo sapiens
<400> 120
Arg Thr Tyr Arg Gly Ser Thr Tyr Tyr Ala Leu Ser Val
1 5 10
<210> 121
<211> 8
<212> PRT
<213> Homo sapiens
<400> 121
Gly Ser Asn Ser Ala Phe Asp Phe
1 5
<210> 122
<211> 7
<212> PRT
<213> Homo sapiens
<400> 122
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 123
<211> 16
<212> PRT
<213> Homo sapiens
<400> 123
Arg Thr Tyr Tyr Gly Ser Lys Trp Tyr Asn Asp Tyr Ala Val Ser Val
1 5 10 15
<210> 124
<211> 9
<212> PRT
<213> Homo sapiens
<400> 124
Gly Arg Leu Gly Asp Ala Phe Asp Ile
1 5
<210> 125
<211> 7
<212> PRT
<213> Homo sapiens
<400> 125
Ser Asp Gly Ala Ala Trp Asn
1 5
<210> 126
<211> 16
<212> PRT
<213> Homo sapiens
<400> 126
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Val Ser Val
1 5 10 15
<210> 127
<211> 9
<212> PRT
<213> Homo sapiens
<400> 127
Gly Asp Tyr Tyr Tyr Gly Met Asp Val
1 5
<210> 128
<211> 7
<212> PRT
<213> Homo sapiens
<400> 128
Ser Asn Ala Ala Ala Trp Asn
1 5
<210> 129
<211> 16
<212> PRT
<213> Homo sapiens
<400> 129
Arg Thr Tyr Tyr Gly Ser Lys Trp Tyr Asn Asp Tyr Ala Val Ser Val
1 5 10 15
<210> 130
<211> 5
<212> PRT
<213> Homo sapiens
<400> 130
Gly Ala Phe Asp Ile
1 5
<210> 131
<211> 5
<212> PRT
<213> Homo sapiens
<400> 131
Ser Tyr Trp Ile Ser
1 5
<210> 132
<211> 17
<212> PRT
<213> Homo sapiens
<400> 132
Arg Ile Asp Pro Ser Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 133
<211> 9
<212> PRT
<213> Homo sapiens
<400> 133
Gly Asp Tyr Asp Phe Tyr Leu Asp Pro
1 5
<210> 134
<211> 5
<212> PRT
<213> Homo sapiens
<400> 134
Ser Tyr Gly Ile Ser
1 5
<210> 135
<211> 17
<212> PRT
<213> Homo sapiens
<400> 135
Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 136
<211> 17
<212> PRT
<213> Homo sapiens
<400> 136
Asp Leu Tyr Ser Ser Gly Trp Tyr Glu Ser Tyr Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 137
<211> 5
<212> PRT
<213> Homo sapiens
<400> 137
Ser Tyr Ala Ile Ser
1 5
<210> 138
<211> 17
<212> PRT
<213> Homo sapiens
<400> 138
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 139
<211> 10
<212> PRT
<213> Homo sapiens
<400> 139
Arg Ile Pro Pro Tyr Tyr Gly Met Asp Val
1 5 10
<210> 140
<211> 17
<212> PRT
<213> Homo sapiens
<400> 140
Trp Ile Ser Ala His Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 141
<211> 10
<212> PRT
<213> Homo sapiens
<400> 141
Asp Arg Val Trp Phe Gly Asp Leu Ser Asp
1 5 10
<210> 142
<211> 17
<212> PRT
<213> Homo sapiens
<400> 142
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Glu Gln
1 5 10 15
Gly
<210> 143
<211> 12
<212> PRT
<213> Homo sapiens
<400> 143
Asn Tyr Asp Phe Trp Ser Gly Asp Ala Phe Asp Ile
1 5 10
<210> 144
<211> 12
<212> PRT
<213> Homo sapiens
<400> 144
Ile Pro Gly Thr Asn Tyr Ala Gln Lys Phe Gln Gly
1 5 10
<210> 145
<211> 6
<212> PRT
<213> Homo sapiens
<400> 145
Phe Tyr Gly Met Asp Val
1 5
<210> 146
<211> 5
<212> PRT
<213> Homo sapiens
<400> 146
Asp Tyr Gly Met Ser
1 5
<210> 147
<211> 15
<212> PRT
<213> Homo sapiens
<400> 147
Gly Ile Asn Trp Asn Gly Gly Ser Thr Gly Tyr Ala Asp Ser Val
1 5 10 15
<210> 148
<211> 12
<212> PRT
<213> Homo sapiens
<400> 148
Glu Arg Gly Tyr Gly Tyr His Asp Pro His Asp Tyr
1 5 10
<210> 149
<211> 5
<212> PRT
<213> Homo sapiens
<400> 149
Asn Tyr Thr Met Asn
1 5
<210> 150
<211> 15
<212> PRT
<213> Homo sapiens
<400> 150
Ser Ile Ser Leu Ser Gly Ala Tyr Ile Tyr Tyr Ala Asp Ser Leu
1 5 10 15
<210> 151
<211> 13
<212> PRT
<213> Homo sapiens
<400> 151
Glu Gly Tyr Ser Ser Ser Val Tyr Asp Ala Phe Asp Leu
1 5 10
<210> 152
<211> 5
<212> PRT
<213> Homo sapiens
<400> 152
Ser Tyr Gly Met His
1 5
<210> 153
<211> 15
<212> PRT
<213> Homo sapiens
<400> 153
Gly Ile Leu Ser Asp Gly Gly Lys Asp Tyr Tyr Val Asp Ser Val
1 5 10 15
<210> 154
<211> 12
<212> PRT
<213> Homo sapiens
<400> 154
Cys Ser Ser Asn Tyr Gly Asn Asp Ala Phe Asp Ile
1 5 10
<210> 155
<211> 5
<212> PRT
<213> Homo sapiens
<400> 155
Thr Tyr Ser Met Asn
1 5
<210> 156
<211> 15
<212> PRT
<213> Homo sapiens
<400> 156
Ser Ile Ser Ser Gly Ala Tyr Ser Ile Phe Tyr Ala Asp Ser Val
1 5 10 15
<210> 157
<211> 13
<212> PRT
<213> Homo sapiens
<400> 157
Asp Gln Tyr Tyr Gly Asp Lys Trp Asp Ala Phe Asp Ile
1 5 10
<210> 158
<211> 5
<212> PRT
<213> Homo sapiens
<400> 158
Ser Tyr Gly Met Asn
1 5
<210> 159
<211> 14
<212> PRT
<213> Homo sapiens
<400> 159
Ser Ile Ser Ser Gly Gly Ser Ile Tyr Tyr Ala Asp Ser Val
1 5 10
<210> 160
<211> 9
<212> PRT
<213> Homo sapiens
<400> 160
Glu Tyr Tyr Trp Asp Ala Phe Asp Ile
1 5
<210> 161
<211> 14
<212> PRT
<213> Homo sapiens
<400> 161
Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Thr Val Asn
1 5 10
<210> 162
<211> 8
<212> PRT
<213> Homo sapiens
<400> 162
Ser Asn Asn Gln Arg Pro Ser Gly
1 5
<210> 163
<211> 13
<212> PRT
<213> Homo sapiens
<400> 163
Ala Ala Trp Asp Asp Ser Leu Asn Gly Trp Val Phe Gly
1 5 10
<210> 164
<211> 13
<212> PRT
<213> Homo sapiens
<400> 164
Glu Ala Trp Asp Asp Ser Leu Lys Gly Pro Val Phe Gly
1 5 10
<210> 165
<211> 15
<212> PRT
<213> Homo sapiens
<400> 165
Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His
1 5 10 15
<210> 166
<211> 8
<212> PRT
<213> Homo sapiens
<400> 166
Gly Asn Ser Asn Arg Pro Ser Gly
1 5
<210> 167
<211> 15
<212> PRT
<213> Homo sapiens
<400> 167
Gln Ser Tyr Asp Ser Ser Leu Ser Ala Asp Asn Tyr Val Phe Gly
1 5 10 15
<210> 168
<211> 14
<212> PRT
<213> Homo sapiens
<400> 168
Cys Ser Gly Ser Ser Ser Asn Ile Gly Arg Asn Ile Val Asn
1 5 10
<210> 169
<211> 8
<212> PRT
<213> Homo sapiens
<400> 169
Ser Asn Ile Glu Arg Pro Ser Gly
1 5
<210> 170
<211> 13
<212> PRT
<213> Homo sapiens
<400> 170
Ala Ser Trp Asp Asp Ser Leu Asn Gly Val Leu Phe Gly
1 5 10
<210> 171
<211> 14
<212> PRT
<213> Homo sapiens
<400> 171
Cys Ser Gly Ser Arg Ser Asn Ile Ala Ser Asn Gly Val Gly
1 5 10
<210> 172
<211> 8
<212> PRT
<213> Homo sapiens
<400> 172
Lys Asn Asp Gln Arg Pro Ser Gly
1 5
<210> 173
<211> 14
<212> PRT
<213> Homo sapiens
<400> 173
Ser Ala Trp Asp Asp Ser Leu Asp Gly His Val Val Phe Gly
1 5 10
<210> 174
<211> 13
<212> PRT
<213> Homo sapiens
<400> 174
Ala Ala Trp Asp Asp Ser Leu Asn Gly Tyr Val Phe Gly
1 5 10
<210> 175
<211> 14
<212> PRT
<213> Homo sapiens
<400> 175
Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Ser Thr Val Asn
1 5 10
<210> 176
<211> 8
<212> PRT
<213> Homo sapiens
<400> 176
Ser Asn Ser Gln Arg Pro Ser Gly
1 5
<210> 177
<211> 13
<212> PRT
<213> Homo sapiens
<400> 177
Ala Ala Trp Asp Asp Ser Leu Asn Gly Val Val Phe Gly
1 5 10
<210> 178
<211> 14
<212> PRT
<213> Homo sapiens
<400> 178
Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Tyr
1 5 10
<210> 179
<211> 8
<212> PRT
<213> Homo sapiens
<400> 179
Arg Ser Asn Gln Arg Pro Ser Gly
1 5
<210> 180
<211> 14
<212> PRT
<213> Homo sapiens
<400> 180
Cys Ser Gly Ser Ser Ser Asn Ile Gly Arg Asn Thr Val Asn
1 5 10
<210> 181
<211> 14
<212> PRT
<213> Homo sapiens
<400> 181
Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asp Tyr Val Ser
1 5 10
<210> 182
<211> 8
<212> PRT
<213> Homo sapiens
<400> 182
Asp Asn Asn Lys Arg Pro Ser Gly
1 5
<210> 183
<211> 13
<212> PRT
<213> Homo sapiens
<400> 183
Gly Thr Trp Asp Asn Ser Leu Ser Ala Trp Val Phe Gly
1 5 10
<210> 184
<211> 14
<212> PRT
<213> Homo sapiens
<400> 184
Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Ser Val Tyr
1 5 10
<210> 185
<211> 8
<212> PRT
<213> Homo sapiens
<400> 185
Asn Asn Asn Gln Arg Pro Ser Gly
1 5
<210> 186
<211> 13
<212> PRT
<213> Homo sapiens
<400> 186
Ala Thr Trp Asp Asp Ser Leu Ser Gly Trp Val Phe Gly
1 5 10
<210> 187
<211> 8
<212> PRT
<213> Homo sapiens
<400> 187
Arg Asn Asn Gln Arg Pro Ser Gly
1 5
<210> 188
<211> 13
<212> PRT
<213> Homo sapiens
<400> 188
Ala Ala Trp Asp Asp Ser Leu Ser Ala Trp Val Phe Gly
1 5 10
<210> 189
<211> 14
<212> PRT
<213> Homo sapiens
<400> 189
Cys Ser Gly Ser Thr Ser Asn Ile Gly Ser Tyr Tyr Val Ser
1 5 10
<210> 190
<211> 8
<212> PRT
<213> Homo sapiens
<400> 190
Asp Asn Asn Asn Arg Pro Ser Gly
1 5
<210> 191
<211> 13
<212> PRT
<213> Homo sapiens
<400> 191
Gly Thr Trp Asp Ser Ser Leu Ser Ala Trp Val Phe Gly
1 5 10
<210> 192
<211> 14
<212> PRT
<213> Homo sapiens
<400> 192
Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn Tyr Val Ser
1 5 10
<210> 193
<211> 14
<212> PRT
<213> Homo sapiens
<400> 193
Cys Ser Gly Ser Asn Ser Asn Ile Gly Thr Asn Thr Val Thr
1 5 10
<210> 194
<211> 8
<212> PRT
<213> Homo sapiens
<400> 194
Ser Asn Phe Glu Arg Pro Ser Gly
1 5
<210> 195
<211> 13
<212> PRT
<213> Homo sapiens
<400> 195
Ser Ala Trp Asp Asp Ser Phe Asn Gly Pro Val Phe Gly
1 5 10
<210> 196
<211> 14
<212> PRT
<213> Homo sapiens
<400> 196
Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Ser
1 5 10
<210> 197
<211> 13
<212> PRT
<213> Homo sapiens
<400> 197
Ala Ala Trp Asp Asp Gly Leu Arg Gly Tyr Val Phe Gly
1 5 10
<210> 198
<211> 11
<212> PRT
<213> Homo sapiens
<400> 198
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 199
<211> 7
<212> PRT
<213> Homo sapiens
<400> 199
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 200
<211> 8
<212> PRT
<213> Homo sapiens
<400> 200
Gln Gln Ser Tyr Ser Thr Pro Thr
1 5
<210> 201
<211> 11
<212> PRT
<213> Homo sapiens
<400> 201
Arg Ala Ser Gln Gly Ile Ser Asn Tyr Leu Ala
1 5 10
<210> 202
<211> 7
<212> PRT
<213> Homo sapiens
<400> 202
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 203
<211> 10
<212> PRT
<213> Homo sapiens
<400> 203
Gln Lys Tyr Asn Ser Ala Pro Gly Val Thr
1 5 10
<210> 204
<211> 11
<212> PRT
<213> Homo sapiens
<400> 204
Arg Ala Ser Gln Ser Ile Asn Gly Trp Leu Ala
1 5 10
<210> 205
<211> 7
<212> PRT
<213> Homo sapiens
<400> 205
Arg Ala Ser Thr Leu Gln Ser
1 5
<210> 206
<211> 9
<212> PRT
<213> Homo sapiens
<400> 206
Gln Gln Ser Ser Ser Leu Pro Phe Thr
1 5
<210> 207
<211> 11
<212> PRT
<213> Homo sapiens
<400> 207
Arg Ala Ser Gln Gly Ile Ser Tyr Tyr Leu Ala
1 5 10
<210> 208
<211> 7
<212> PRT
<213> Homo sapiens
<400> 208
Ala Ala Ser Thr Leu Lys Ser
1 5
<210> 209
<211> 9
<212> PRT
<213> Homo sapiens
<400> 209
Gln Gln Leu Asn Ser Tyr Pro Leu Thr
1 5
<210> 210
<211> 11
<212> PRT
<213> Homo sapiens
<400> 210
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 211
<211> 7
<212> PRT
<213> Homo sapiens
<400> 211
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 212
<211> 11
<212> PRT
<213> Homo sapiens
<400> 212
Gln Val Trp Asp Ser Ser Ser Asp His Pro Val
1 5 10
<210> 213
<211> 11
<212> PRT
<213> Homo sapiens
<400> 213
Gln Val Trp Asp Ser Ser Gly Asp His Pro Val
1 5 10
<210> 214
<211> 7
<212> PRT
<213> Homo sapiens
<400> 214
Tyr Asp Ser Asp Arg Pro Ser
1 5
<210> 215
<211> 11
<212> PRT
<213> Homo sapiens
<400> 215
Gly Gly Thr Asn Ile Gly Ser Arg Phe Val His
1 5 10
<210> 216
<211> 11
<212> PRT
<213> Homo sapiens
<400> 216
Gly Gly Asn Asn Val Glu Ser Lys Ser Val His
1 5 10
<210> 217
<211> 7
<212> PRT
<213> Homo sapiens
<400> 217
Tyr Asp Arg Asp Arg Pro Ser
1 5
<210> 218
<211> 11
<212> PRT
<213> Homo sapiens
<400> 218
Glu Val Trp Asp Ser Gly Ser Asp His Pro Val
1 5 10
<210> 219
<211> 11
<212> PRT
<213> Homo sapiens
<400> 219
Gly Gly Lys Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 220
<211> 11
<212> PRT
<213> Homo sapiens
<400> 220
Gln Val Trp Asp Ser Gly Ser Asp His Tyr Val
1 5 10
<210> 221
<211> 11
<212> PRT
<213> Homo sapiens
<400> 221
Gln Val Trp Ile Ser Ser Gly Asp Arg Val Ile
1 5 10
<210> 222
<211> 11
<212> PRT
<213> Homo sapiens
<400> 222
Gly Gly Asp Asn Ile Gly Ser Gln Gly Val His
1 5 10
<210> 223
<211> 7
<212> PRT
<213> Homo sapiens
<400> 223
Tyr Asp Thr Asp Arg Pro Ser
1 5
<210> 224
<211> 11
<212> PRT
<213> Homo sapiens
<400> 224
Gln Val Trp Gly Ala Ser Ser Asp His Pro Val
1 5 10
<210> 225
<211> 14
<212> PRT
<213> Homo sapiens
<400> 225
Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Tyr Val Ser
1 5 10
<210> 226
<211> 7
<212> PRT
<213> Homo sapiens
<400> 226
Asp Val Ser Lys Arg Pro Ser
1 5
<210> 227
<211> 10
<212> PRT
<213> Homo sapiens
<400> 227
Gly Ile Tyr Thr Tyr Ser Asp Ser Trp Val
1 5 10
<210> 228
<211> 7
<212> PRT
<213> Homo sapiens
<400> 228
Asp Val Gly Asn Arg Pro Ser
1 5
<210> 229
<211> 10
<212> PRT
<213> Homo sapiens
<400> 229
Ser Ser Tyr Thr Ser Ser Ser Thr Arg Val
1 5 10
<210> 230
<211> 14
<212> PRT
<213> Homo sapiens
<400> 230
Thr Gly Thr Arg Ser Asp Val Gly Leu Tyr Asn Tyr Val Ala
1 5 10
<210> 231
<211> 7
<212> PRT
<213> Homo sapiens
<400> 231
Asp Val Ile Tyr Arg Pro Gly
1 5
<210> 232
<211> 10
<212> PRT
<213> Homo sapiens
<400> 232
Ser Ser Tyr Thr Asn Thr Gly Thr Val Leu
1 5 10
<210> 233
<211> 14
<212> PRT
<213> Homo sapiens
<400> 233
Thr Gly Thr Ser Ser Asp Phe Gly Asp Tyr Asp Tyr Val Ser
1 5 10
<210> 234
<211> 7
<212> PRT
<213> Homo sapiens
<400> 234
Asp Val Ser Asp Arg Pro Ser
1 5
<210> 235
<211> 12
<212> PRT
<213> Homo sapiens
<400> 235
Gln Ser Tyr Asp Ser Ser Leu Ser Gly Ser Gly Val
1 5 10
<210> 236
<211> 330
<212> PRT
<213> Homo sapiens
<400> 236
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 237
<211> 106
<212> PRT
<213> Homo sapiens
<400> 237
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 238
<211> 105
<212> PRT
<213> Homo sapiens
<400> 238
Gln Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
Claims (41)
- (A)(i) 각각 아미노산 서열 서열번호: 2, 3 및 4를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 8, 9 및 10을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(ii) 각각 아미노산 서열 서열번호: 20, 21 및 22를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 26, 27 및 28을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(iii) 각각 아미노산 서열 서열번호: 38, 39 및 40을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 44, 45 및 46을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(iv) 각각 아미노산 서열 서열번호: 56, 57 및 58을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 62, 63 및 64를 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(v) 각각 아미노산 서열 서열번호: 74, 75 및 76을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 80, 81 및 82를 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; 또는
(vi) 각각 아미노산 서열 서열번호: 92, 93 및 94를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 98, 99 및 100을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; 또는
(B) 각각 서열번호: 14 및 16; 32 및 34; 50 및 52; 68 및 70; 86 및 88; 및 104 및 106 중에서 선택된 제 1 및 제 2 아미노산 서열을 포함하는 VH 및 VL; 또는
(C) 서열번호: 18, 36, 54, 72, 90 및 108 중에서 선택된 아미노산 서열
중 하나를 포함하는 단리된 항체 또는 그의 항원-결합 단편. - (A) 각각 서열번호: (i) 2, 3, 및 4; (ii) 20, 21 및 22; (iii) 38, 39 및 40; (iv) 56, 57 및 58; (v) 74, 75 및 76 ; 및 (vi) 92, 93 및 94 중에서 선택된 아미노산 서열을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및
(B) 각각 서열번호: (i) 8, 9 및 10; (ii) 26, 27 및 28; (iii) 44, 45 및 46; (iv) 62, 63 및 64; (v) 80, 81 및 82; 및 (vi) 98, 99 및 100 중에서 선택된 아미노산 서열을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역
을 포함하는 단리된 항체 또는 그의 항원-결합 단편. - 각각 서열번호: (i) 14 및 16; (ii) 32 및 34; (iii) 50 및 52; (iv) 68 및 70; (v) 86 및 88; 및 (vi) 104 및 106 중에서 선택된 제 1 및 제 2 아미노산 서열을 포함하는 VH 및 VL
을 포함하는 단리된 항체 또는 그의 항원-결합 단편. - 서열번호: 18, 36, 54, 72, 90 및 108 중에서 선택된 아미노산 서열을 포함하는 단리된 항체 또는 그의 항원-결합 단편.
- 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
인간 가변 영역 프레임워크 영역을 포함하는 항체. - 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
완전 인간인 항체. - 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
HLA-A2에 결합된 WT1 펩타이드에 특이적으로 결합하는 항체. - 제 7 항에 있어서,
WT1 펩타이드가 아미노산 서열 RMFPNAPYL을 갖는 항체. - 제 7 항에 있어서,
HLA-A2가 HLA-A0201인 항체. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 항체의 항원-결합 단편이 Fab, Fab', F(ab')2, Fv 또는 단일 쇄 Fv(scFv)인 항체. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
치료제에 접합된 항체. - 제 11 항에 있어서,
치료제가 약물, 독소, 방사성 동위원소, 단백질 또는 펩타이드인 항체. - 제 1 항 내지 제 4 항 중 어느 한 항에 따른 항체를 암호화하는 단리된 핵산.
- (A)(i) 서열번호: 5, 6 및 7; 23, 24 및 25; 41, 42 및 43; 58, 59 및 60; 77, 78 및 79; 및 95, 96 및 97로 이루어진 그룹 중에서 선택된 제 1, 제 2 및 제 3 뉴클레오타이드 서열; 및
(ii) 서열번호: 11, 12 및 13; 29, 30 및 31; 47, 48 및 49; 65, 66 및 67; 83, 84 및 85; 및 101, 102 및 103으로 이루어진 그룹 중에서 선택된 제 4, 제 5 및 제 6 뉴클레오타이드 서열; 또는
(B) 서열번호: 15 및 17; 33 및 35; 51 및 53; 69 및 71; 87 및 89 및 105 및 107로 이루어진 그룹 중에서 선택된 제 1 및 제 2 뉴클레오타이드 서열; 또는
(C) 서열번호: 19, 37, 55, 73, 91 및 109로 이루어진 그룹 중에서 선택된 뉴클레오타이드 서열
을 포함하는 단리된 핵산. - (A) 서열번호: (i) 5, 6 및 7; (ii) 23, 24 및 25; (iii) 41, 42 및 43; (iv) 58, 59 및 60; (v) 77, 78 및 79; 및 (vi) 95, 96 및 97로 이루어진 그룹 중에서 선택된 제 1, 제 2 및 제 3 뉴클레오타이드 서열; 및
(B) 서열번호: (vii) 11, 12 및 13; (viii) 29, 30 및 31; (ix) 47, 48 및 49; (x) 65, 66 및 67; (xi) 83, 84 및 85; 및 (xii) 101, 102 및 103으로 이루어진 그룹 중에서 선택된 제 4, 제 5 및 제 6 뉴클레오타이드 서열
을 포함하는 단리된 핵산. - 제 15 항에 있어서,
상기 제 1, 제 2 및 제 3 뉴클레오타이드 서열이 각각 항체의 HC-CDR1, HC-CDR2 및 HC-CDR3을 암호화하고, 제 4, 제 5 및 제 6 뉴클레오타이드 서열이 각각 상기 항체의 LC-CDR1, LC-CDR2 및 LC-CDR3을 암호화하는 핵산. - 각각 서열번호: (i) 15 및 17; (ii) 33 및 35; (iii) 51 및 53; (iv) 69 및 71; (v) 87 및 89 및 (vi) 105 및 107로 이루어진 그룹 중에서 선택된 제 1 및 제 2 뉴클레오타이드 서열을 포함하는 단리된 핵산.
- 제 17 항에 있어서,
상기 제 1 뉴클레오타이드 서열이 VH를 암호화하고, 상기 제 2 뉴클레오타이드 서열이 항체의 VL을 암호화하는 핵산. - 서열번호: 19, 37, 55, 73, 91 및 109로 이루어진 그룹 중에서 선택된 뉴클레오타이드 서열을 포함하는 단리된 핵산.
- 제 19 항에 있어서,
scFv를 암호화하는 핵산. - 제 13 항 내지 제 20 항 중 어느 한 항의 핵산을 포함하는 벡터.
- 제 13 항 내지 제 20 항 중 어느 한 항의 핵산을 포함하는 세포.
- 제 22 항에 있어서,
표면상에서 제 1 항 내지 제 4 항 중 어느 한 항의 항체를 발현하는 세포. - 전체 세포 또는 조직에서 WT1을 검출하는 방법으로,
(A) 세포 또는 조직을, HLA-A2에 결합하는 WT1 펩타이드에 특이적으로 결합하는 항체 또는 그의 항원-결합 단편과 접촉시키고, 여기에서 상기 항체는 검출 가능한 표지를 포함하며;
(B) 상기 세포 또는 조직과 결합된 검출 가능한 표지의 양을 측정함으로써 상기 세포 또는 조직에 결합된 항체의 양을 결정하고, 여기에서 상기 결합된 항체의 양이 상기 세포 또는 조직 중의 WT1의 양을 가리킴
을 포함하는 방법. - 제 24 항에 있어서,
항체가, HLA-A2에 결합된 아미노산 서열 RMFPNAPYL(서열번호: 1)을 갖는 WT1 펩타이드에 특이적으로 결합하는 방법. - 제 25 항에 있어서,
WT1 펩타이드가 HLA-A0201에 결합하는 방법. - 제 24 항에 있어서,
항체가
(A)(i) 각각 아미노산 서열 서열번호: 2, 3 및 4를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 8, 9 및 10을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(ii) 각각 아미노산 서열 서열번호: 20, 21 및 22를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 26, 27 및 28을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(iii) 각각 아미노산 서열 서열번호: 38, 39 및 40을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 44, 45 및 46을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(iv) 각각 아미노산 서열 서열번호: 56, 57 및 58을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 62, 63 및 64를 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역;
(v) 각각 아미노산 서열 서열번호: 74, 75 및 76을 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 80, 81 및 82를 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; 또는
(vi) 각각 아미노산 서열 서열번호: 92, 93 및 94를 포함하는 HC-CDR1, HC-CDR2 및 HC-CDR3을 포함하는 중쇄(HC) 가변 영역; 및 각각 아미노산 서열 서열번호: 98, 99 및 100을 포함하는 LC-CDR1, LC-CDR2 및 LC-CDR3을 포함하는 경쇄(LC) 가변 영역; 또는
(B) 각각 서열번호: 14 및 16; 32 및 34; 50 및 52; 68 및 70; 86 및 88; 및 104 및 106 중에서 선택된 제 1 및 제 2 아미노산 서열을 포함하는 VH 및 VL; 또는
(C) 서열번호: 18, 36, 54, 72, 90 및 108 중에서 선택된 아미노산 서열
중 하나를 포함하는 단리된 항체 또는 그의 항원-결합 단편인 방법. - 제 1 항 내지 제 4 항 중 어느 한 항의 항체를 포함하는 키트.
- WT1 양성 질병의 치료를 위한 제 1 항 내지 제 4 항 중 어느 한 항의 항체의 용도.
- 제 1 항 내지 제 4 항 중 어느 한 항의 항체 및 약학적으로 허용 가능한 담체를 포함하는 약학 조성물.
- WT1-양성 질병을 갖는 환자에게 치료 유효량의 제 1 항 내지 제 4 항 중 어느 한 항의 항체 또는 그의 항원 결합 단편을 투여함을 포함하는, 상기 환자의 치료 방법.
- 제 31 항에 있어서,
WT1-양성 질병이 만성 백혈병 또는 급성 백혈병 또는 WT1+ 암인 방법. - 제 31 항에 있어서,
WT1-양성 질병이 만성 골수구 백혈병, 다발성 골수종(MM), 급성 림프구성 백혈병(ALL), 급성 골수/골수성 백혈병(AML), 골수이형성 증후군(MDS), 중피종, 난소암, 위장암, 유방암, 전립선암 및 교아세포종으로 이루어진 그룹 중에서 선택되는 방법. - 제 34 항에 있어서,
항체가 상기 항체에 결합된 세포독성 부분을 갖는 접합체인 방법. - WT1-양성 질병을 갖는 환자에게 치료 유효량의 제 13 항 내지 제 20 항 중 어느 한 항의 핵산을 투여함을 포함하는, 상기 환자의 치료 방법.
- 제 35 항에 있어서,
WT1-양성 질병이 만성 백혈병, 급성 백혈병 또는 WT+ 암인 방법. - 제 35 항에 있어서,
WT1-양성 질병이 만성 골수구 백혈병, 다발성 골수종, 급성 림프구성 백혈병(ALL), 급성 골수/골수성 백혈병(AML), 골수이형성 증후군(MDS), 중피종, 난소암, 위장암, 유방암, 전립선암 및 교아세포종으로 이루어진 그룹 중에서 선택되는 방법. - WT1 양성 질병의 치료를 위한 제 13 항 내지 제 20 항 중 어느 한 항의 핵산의 용도.
- 제 13 항 내지 제 20 항 중 어느 한 항의 핵산을 포함하는 약학 조성물.
- WT1+ 세포의 살해 방법으로,
상기 세포를, HLA-A2에 결합된 WT1 펩타이드에 특이적으로 결합하는 항체 또는 그의 항원-결합 단편과 접촉시킴
을 포함하는 방법. - 제 40 항에 있어서,
항체 또는 그의 항원-결합 단편이 상기 항체 또는 그의 항원-결합 단편에 결합된 세포독성 부분을 갖는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161470635P | 2011-04-01 | 2011-04-01 | |
| US61/470,635 | 2011-04-01 | ||
| US201161491392P | 2011-05-31 | 2011-05-31 | |
| US61/491,392 | 2011-05-31 | ||
| PCT/US2012/031892 WO2012135854A2 (en) | 2011-04-01 | 2012-04-02 | Antibodies to cytosolic peptides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140033029A true KR20140033029A (ko) | 2014-03-17 |
Family
ID=46229910
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137028479A KR20140033029A (ko) | 2011-04-01 | 2012-04-02 | 에이치엘에이 에이2에 의해 제공된 더블유티1 펩타이드에 특이적인 티 세포 수용체 유사 항체 |
Country Status (22)
| Country | Link |
|---|---|
| US (5) | US9074000B2 (ko) |
| EP (2) | EP3323833B1 (ko) |
| JP (2) | JP6082997B2 (ko) |
| KR (1) | KR20140033029A (ko) |
| CN (2) | CN103619882B (ko) |
| AP (1) | AP2013007142A0 (ko) |
| AU (2) | AU2012236068A1 (ko) |
| CA (1) | CA2831336C (ko) |
| CL (1) | CL2013002828A1 (ko) |
| CO (1) | CO6900116A2 (ko) |
| CU (1) | CU20130130A7 (ko) |
| DO (1) | DOP2013000219A (ko) |
| EA (1) | EA201391449A1 (ko) |
| ES (2) | ES2785081T3 (ko) |
| GT (1) | GT201300233A (ko) |
| MX (1) | MX2013011363A (ko) |
| MY (1) | MY160662A (ko) |
| NI (1) | NI201300099A (ko) |
| PE (1) | PE20141271A1 (ko) |
| SG (1) | SG193956A1 (ko) |
| WO (1) | WO2012135854A2 (ko) |
| ZA (1) | ZA201306940B (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200104331A (ko) * | 2017-12-21 | 2020-09-03 | 에프. 호프만-라 로슈 아게 | Hla-a2/wt1에 결합하는 항체 |
| WO2021107725A1 (ko) * | 2019-11-29 | 2021-06-03 | 가톨릭대학교 산학협력단 | Cobll1 단백질 특이 항체 또는 이의 항원 결합 단편, 및 이의 용도 |
Families Citing this family (180)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ612512A (en) | 2010-12-09 | 2015-03-27 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| US10239952B2 (en) * | 2011-04-01 | 2019-03-26 | Memorial Sloan Kettering Cancer Center | Anti-WT1/HLA bi-specific antibody |
| PE20141271A1 (es) * | 2011-04-01 | 2014-10-08 | Sloan Kettering Inst Cancer | Anticuerpos tipo receptor de celulas t especificos para un peptido wt1 presentado por hla-a2 |
| ES2814962T3 (es) | 2013-02-20 | 2021-03-29 | Novartis Ag | Fijación eficaz como objetivo de la leucemia humana primaria utilizando células T modificadas con receptor de antígeno quimérico anti-CD123 |
| EP2958943B1 (en) | 2013-02-20 | 2019-09-11 | The Trustees Of The University Of Pennsylvania | Treatment of cancer using humanized anti-egfrviii chimeric antigen receptor |
| US20140271644A1 (en) * | 2013-03-15 | 2014-09-18 | Memorial Sloan-Kettering Cancer Center | Combination/adjuvant therapy for wt-1-positive disease |
| WO2014143835A1 (en) * | 2013-03-15 | 2014-09-18 | Memorial Sloan-Kettering Cancer Center | Combination/adjuvant therapy for wt-1-positive disease |
| EP3623380A1 (en) | 2013-03-15 | 2020-03-18 | Michael C. Milone | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| UY35468A (es) | 2013-03-16 | 2014-10-31 | Novartis Ag | Tratamiento de cáncer utilizando un receptor quimérico de antígeno anti-cd19 |
| CN106170297A (zh) * | 2013-09-20 | 2016-11-30 | 纪念斯隆-凯特琳癌症中心 | 用于wt‑1‑阳性疾病的组合/辅助疗法 |
| LT4095130T (lt) | 2013-10-18 | 2024-04-25 | Novartis Ag | Žymėti prostatos specifinio membranos antigeno (psma) inhibitoriai, jų naudojimas kaip vizualizavimo medžiagų ir farmacinių medžiagų prostatos vėžiui gydyti |
| EP3066131A1 (en) * | 2013-11-07 | 2016-09-14 | Memorial Sloan-Kettering Cancer Center | Fc-enhanced anti-wt1/hla antibody |
| ES2742224T3 (es) * | 2013-11-07 | 2020-02-13 | Memorial Sloan Kettering Cancer Center | Anticuerpos biespecíficos anti-WT1/HLA |
| RU2714902C2 (ru) | 2013-12-19 | 2020-02-20 | Новартис Аг | Химерные рецепторы антигена против мезотелина человека и их применение |
| JP6793902B2 (ja) | 2013-12-20 | 2020-12-02 | ノバルティス アーゲー | 調節可能キメラ抗原受容体 |
| WO2015112626A1 (en) | 2014-01-21 | 2015-07-30 | June Carl H | Enhanced antigen presenting ability of car t cells by co-introduction of costimulatory molecules |
| US20160152725A1 (en) * | 2014-02-25 | 2016-06-02 | Memorial Sloan-Kettering Cancer Center | Antigen-binding proteins specific for hla-a2-restricted wilms tumor 1 peptide |
| CN106163547A (zh) | 2014-03-15 | 2016-11-23 | 诺华股份有限公司 | 使用嵌合抗原受体治疗癌症 |
| US11390921B2 (en) | 2014-04-01 | 2022-07-19 | Adaptive Biotechnologies Corporation | Determining WT-1 specific T cells and WT-1 specific T cell receptors (TCRs) |
| SI3888674T1 (sl) | 2014-04-07 | 2024-08-30 | Novartis Ag | Zdravljenje raka z uporabo antigenskega himernega receptorja proti-CD19 |
| EP3169773B1 (en) | 2014-07-15 | 2023-07-12 | Juno Therapeutics, Inc. | Engineered cells for adoptive cell therapy |
| KR102594343B1 (ko) | 2014-07-21 | 2023-10-26 | 노파르티스 아게 | Cd33 키메라 항원 수용체를 사용한 암의 치료 |
| WO2016014530A1 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Combinations of low, immune enhancing. doses of mtor inhibitors and cars |
| SG11201700476VA (en) | 2014-07-21 | 2017-02-27 | Novartis Ag | Treatment of cancer using humanized anti-bcma chimeric antigen receptor |
| RU2741120C2 (ru) | 2014-07-21 | 2021-01-22 | Новартис Аг | Лечение рака с использованием химерного антигенного рецептора cll-1 |
| US11542488B2 (en) | 2014-07-21 | 2023-01-03 | Novartis Ag | Sortase synthesized chimeric antigen receptors |
| CN107108744B (zh) | 2014-08-19 | 2020-09-25 | 诺华股份有限公司 | 抗cd123嵌合抗原受体(car)用于癌症治疗 |
| US20180010132A1 (en) | 2014-09-11 | 2018-01-11 | Novartis Ag | Inhibition of prmt5 to treat mtap-deficiency-related diseases |
| ES2891332T3 (es) | 2014-09-17 | 2022-01-27 | Novartis Ag | Direccionamiento a células citotóxicas con receptores quiméricos para la inmunoterapia adoptiva |
| WO2016057705A1 (en) | 2014-10-08 | 2016-04-14 | Novartis Ag | Biomarkers predictive of therapeutic responsiveness to chimeric antigen receptor therapy and uses thereof |
| CN107249605A (zh) | 2014-11-17 | 2017-10-13 | 阿迪塞特生物股份有限公司 | 工程化的γδT细胞 |
| WO2016089883A1 (en) | 2014-12-01 | 2016-06-09 | Novartis Ag | Compositions and methods for diagnosis and treatment of prostate cancer |
| JP6699013B2 (ja) * | 2014-12-25 | 2020-05-27 | 国立大学法人三重大学 | Wt1由来ペプチド認識抗体 |
| US10273300B2 (en) | 2014-12-29 | 2019-04-30 | The Trustees Of The University Of Pennsylvania | Methods of making chimeric antigen receptor-expressing cells |
| US11459390B2 (en) | 2015-01-16 | 2022-10-04 | Novartis Ag | Phosphoglycerate kinase 1 (PGK) promoters and methods of use for expressing chimeric antigen receptor |
| US11161907B2 (en) | 2015-02-02 | 2021-11-02 | Novartis Ag | Car-expressing cells against multiple tumor antigens and uses thereof |
| WO2016154047A2 (en) * | 2015-03-20 | 2016-09-29 | Memorial Sloan-Kettering Cancer Center | Monoclonal antigen-binding proteins to intracellular oncogene products |
| CN114478791A (zh) * | 2015-04-03 | 2022-05-13 | 优瑞科生物技术公司 | 靶向afp肽/mhc复合体的构建体及其用途 |
| ES2923894T3 (es) | 2015-04-08 | 2022-10-03 | Novartis Ag | Combinación de terapia con receptor de antígeno quimérico y derivados de amino pirimidina |
| CN118726268A (zh) | 2015-04-17 | 2024-10-01 | 诺华股份有限公司 | 改善嵌合抗原受体表达细胞的功效和扩增的方法 |
| US12128069B2 (en) | 2015-04-23 | 2024-10-29 | The Trustees Of The University Of Pennsylvania | Treatment of cancer using chimeric antigen receptor and protein kinase a blocker |
| CN106188274A (zh) * | 2015-05-06 | 2016-12-07 | 广州市香雪制药股份有限公司 | 识别rhamm抗原短肽的t细胞受体 |
| NL2014935B1 (en) * | 2015-06-08 | 2017-02-03 | Applied Immune Tech Ltd | T cell receptor like antibodies having fine specificity. |
| MX2017015666A (es) * | 2015-06-09 | 2018-07-06 | Memorial Sloan Kettering Cancer Center | Agentes de anticuerpos similares al receptor de celulas t, especificos para peptidos de proteina latente de membrana 2a del virus de epstein-barr (ebv) presentado por antigeno leucocitario humano (hla). |
| MA42895A (fr) | 2015-07-15 | 2018-05-23 | Juno Therapeutics Inc | Cellules modifiées pour thérapie cellulaire adoptive |
| SG10201912978PA (en) | 2015-07-21 | 2020-02-27 | Novartis Ag | Methods for improving the efficacy and expansion of immune cells |
| FR3039832A1 (fr) * | 2015-08-04 | 2017-02-10 | Univ Francois Rabelais De Tours | Igg1 et leur utilisation therapeutique |
| US11667691B2 (en) | 2015-08-07 | 2023-06-06 | Novartis Ag | Treatment of cancer using chimeric CD3 receptor proteins |
| CA2993432A1 (en) | 2015-09-01 | 2017-03-09 | Agenus Inc. | Anti-pd-1 antibodies and methods of use thereof |
| US11747346B2 (en) | 2015-09-03 | 2023-09-05 | Novartis Ag | Biomarkers predictive of cytokine release syndrome |
| US9862760B2 (en) | 2015-09-16 | 2018-01-09 | Novartis Ag | Polyomavirus neutralizing antibodies |
| EP3359565A1 (en) | 2015-10-09 | 2018-08-15 | Immatics Biotechnologies GmbH | Anti-wt1/hla-specific antibodies |
| SG11201802895QA (en) | 2015-10-23 | 2018-05-30 | Eureka Therapeutics Inc | Antibody/t-cell receptor chimeric constructs and uses thereof |
| MA44314A (fr) | 2015-11-05 | 2018-09-12 | Juno Therapeutics Inc | Récepteurs chimériques contenant des domaines induisant traf, et compositions et méthodes associées |
| US11020429B2 (en) | 2015-11-05 | 2021-06-01 | Juno Therapeutics, Inc. | Vectors and genetically engineered immune cells expressing metabolic pathway modulators and uses in adoptive cell therapy |
| CN116334143A (zh) | 2015-11-23 | 2023-06-27 | 诺华股份有限公司 | 优化的慢病毒转移载体及其用途 |
| EP3708587B1 (en) * | 2015-11-27 | 2024-05-22 | Cartherics Pty. Ltd. | Genetically modified cells and uses thereof |
| CA3007258A1 (en) | 2015-12-03 | 2017-06-08 | Mark L. Bonyhadi | Compositions and methods for reducing immune responses against cell therapies |
| AU2016363025B2 (en) | 2015-12-03 | 2021-04-08 | Juno Therapeutics, Inc. | Modified chimeric receptors and related compositions and methods |
| IL295858A (en) | 2015-12-04 | 2022-10-01 | Novartis Ag | Preparations and methods for immuno-oncology |
| WO2017112741A1 (en) | 2015-12-22 | 2017-06-29 | Novartis Ag | Mesothelin chimeric antigen receptor (car) and antibody against pd-l1 inhibitor for combined use in anticancer therapy |
| ES2944597T3 (es) | 2015-12-30 | 2023-06-22 | Novartis Ag | Terapias con células efectoras inmunitarias de eficacia mejorada |
| US10053515B2 (en) | 2016-01-22 | 2018-08-21 | Merck Sharp & Dohme Corp. | Anti-coagulation factor XI antibodies |
| GB201604492D0 (en) * | 2016-03-16 | 2016-04-27 | Immatics Biotechnologies Gmbh | Transfected t-cells and t-cell receptors for use in immunotherapy against cancers |
| EP3432924A1 (en) | 2016-03-23 | 2019-01-30 | Novartis AG | Cell secreted minibodies and uses thereof |
| CA3018253A1 (en) * | 2016-03-31 | 2017-10-05 | University Of Southern California | A highly sensitive and specific luciferase based reporter assay for antigen detection |
| TW201800418A (zh) | 2016-04-25 | 2018-01-01 | 索倫多醫療公司 | 結合stat3之抗體治療劑 |
| KR102519861B1 (ko) | 2016-05-12 | 2023-04-10 | 아디셋 바이오, 인크. | γδ T-세포 집단의 선택적 확장을 위한 방법 및 그의 조성물 |
| SG10201912563XA (en) | 2016-05-27 | 2020-02-27 | Agenus Inc | Anti-tim-3 antibodies and methods of use thereof |
| MY201852A (en) | 2016-06-14 | 2024-03-20 | Merck Sharp & Dohme Llc | Anti-coagulation factor xi antibodies |
| MA45491A (fr) | 2016-06-27 | 2019-05-01 | Juno Therapeutics Inc | Épitopes à restriction cmh-e, molécules de liaison et procédés et utilisations associés |
| WO2018005559A1 (en) | 2016-06-27 | 2018-01-04 | Juno Therapeutics, Inc. | Method of identifying peptide epitopes, molecules that bind such epitopes and related uses |
| WO2018005775A1 (en) | 2016-06-29 | 2018-01-04 | Memorial Sloan-Kettering Cancer Center | Cd47 blockade enhances therapeutic activity of antibodies to low density cancer epitopes |
| US20190194283A1 (en) | 2016-07-29 | 2019-06-27 | Juno Therapeutics, Inc. | Immunomodulatory polypeptides and related compositions and methods |
| JP7467117B2 (ja) | 2016-10-07 | 2024-04-15 | ノバルティス アーゲー | 癌の治療のためのキメラ抗原受容体 |
| EP3526256A1 (en) | 2016-10-11 | 2019-08-21 | Agenus Inc. | Anti-lag-3 antibodies and methods of use thereof |
| MA46961A (fr) | 2016-12-03 | 2019-10-09 | Juno Therapeutics Inc | Procédés de modulation de lymphocytes t modifiés par car |
| RU2019120398A (ru) | 2016-12-03 | 2021-01-12 | Джуно Терапьютикс, Инк. | Способы определения дозировки cart-клеток |
| AU2017370644A1 (en) | 2016-12-05 | 2019-06-13 | Juno Therapeutics, Inc. | Production of engineered cells for adoptive cell therapy |
| WO2018111340A1 (en) | 2016-12-16 | 2018-06-21 | Novartis Ag | Methods for determining potency and proliferative function of chimeric antigen receptor (car)-t cells |
| CA3048211A1 (en) | 2016-12-23 | 2018-06-28 | Macrogenics, Inc. | Adam9-binding molecules, and methods of use thereof |
| CN107698681B (zh) * | 2016-12-28 | 2020-07-07 | 天津天锐生物科技有限公司 | 一种识别hla-a2/rmfpnapyl的单域抗体 |
| WO2018132518A1 (en) | 2017-01-10 | 2018-07-19 | Juno Therapeutics, Inc. | Epigenetic analysis of cell therapy and related methods |
| MX2019008538A (es) | 2017-01-20 | 2019-11-05 | Juno Therapeutics Gmbh | Conjugados de superficie celular y composiciones y métodos celulares relacionados. |
| WO2018140725A1 (en) | 2017-01-26 | 2018-08-02 | Novartis Ag | Cd28 compositions and methods for chimeric antigen receptor therapy |
| CN110582509A (zh) | 2017-01-31 | 2019-12-17 | 诺华股份有限公司 | 使用具有多特异性的嵌合t细胞受体蛋白治疗癌症 |
| AU2018219226A1 (en) | 2017-02-07 | 2019-08-15 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Phospholipid ether (PLE) CAR T cell tumor targeting (CTCT) agents |
| EP4353818A3 (en) | 2017-02-27 | 2024-06-19 | Juno Therapeutics, Inc. | Compositions, articles of manufacture and methods related to dosing in cell therapy |
| US11850262B2 (en) | 2017-02-28 | 2023-12-26 | Purdue Research Foundation | Compositions and methods for CAR T cell therapy |
| KR20190130608A (ko) | 2017-03-22 | 2019-11-22 | 노파르티스 아게 | 면역종양학을 위한 조성물 및 방법 |
| JP7284707B2 (ja) | 2017-04-07 | 2023-05-31 | ジュノー セラピューティクス インコーポレイテッド | 前立腺特異的膜抗原(psma)またはその改変型を発現する操作された細胞および関連方法 |
| US11242385B2 (en) | 2017-04-13 | 2022-02-08 | Agenus Inc. | Anti-CD137 antibodies and methods of use thereof |
| MX2019012189A (es) | 2017-04-14 | 2020-12-10 | Juno Therapeutics Inc | Metodos para valorar la glucosilacion de la superficie celular. |
| CN110741016A (zh) | 2017-04-26 | 2020-01-31 | 优瑞科生物技术公司 | 嵌合抗体/t-细胞受体构筑体及其用途 |
| MA50957A (fr) | 2017-05-01 | 2020-10-14 | Agenus Inc | Anticorps anti-tigit et leurs méthodes d'utilisation |
| EP3630846A4 (en) * | 2017-05-31 | 2021-02-24 | Carsgen Therapeutics Co., Ltd. | COMPOSITIONS AND METHODS OF CELLULAR IMMUNOTHERAPY |
| AU2018275891A1 (en) | 2017-06-02 | 2019-12-12 | Juno Therapeutics, Inc. | Articles of manufacture and methods related to toxicity associated with cell therapy |
| WO2018231958A1 (en) * | 2017-06-13 | 2018-12-20 | Adaptive Biotechnologies Corp. | Determining wt-1 specific t cells and wt-1 specific t cell receptors (tcrs) |
| WO2018229530A1 (en) | 2017-06-14 | 2018-12-20 | Adicet Bio Inc. | Antibodies capable of binding hla-a2/tyrd in an hla restricted manner and uses thereof |
| WO2018229715A1 (en) | 2017-06-16 | 2018-12-20 | Novartis Ag | Compositions comprising anti-cd32b antibodies and methods of use thereof |
| CA3067446A1 (en) | 2017-06-20 | 2018-12-27 | Institut Curie | Immune cells defective for suv39h1 |
| US11530413B2 (en) | 2017-07-21 | 2022-12-20 | Novartis Ag | Compositions and methods to treat cancer |
| CA3070573A1 (en) | 2017-07-29 | 2019-02-07 | Juno Therapeutics, Inc. | Reagents for expanding cells expressing recombinant receptors |
| EP3664820B1 (en) | 2017-08-09 | 2023-07-19 | Juno Therapeutics, Inc. | Methods for producing genetically engineered cell compositions and related compositions |
| EP3664835B1 (en) | 2017-08-09 | 2024-10-23 | Juno Therapeutics, Inc. | Methods and compositions for preparing genetically engineered cells |
| US20200292526A1 (en) | 2017-09-07 | 2020-09-17 | Juno Therapeutics, Inc. | Methods of identifying cellular attributes related to outcomes associated with cell therapy |
| AR123115A1 (es) | 2017-10-18 | 2022-11-02 | Novartis Ag | Composiciones y métodos para la degradación selectiva de proteínas |
| CN111566124A (zh) | 2017-10-25 | 2020-08-21 | 诺华股份有限公司 | 制备表达嵌合抗原受体的细胞的方法 |
| EP3700933A1 (en) | 2017-10-25 | 2020-09-02 | Novartis AG | Antibodies targeting cd32b and methods of use thereof |
| WO2019089982A1 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Method of assessing activity of recombinant antigen receptors |
| BR112020008812A2 (pt) | 2017-11-06 | 2020-10-27 | Juno Therapeutics Inc | combinação de terapia celular e um inibidor de gama secretase |
| JP2021502816A (ja) | 2017-11-15 | 2021-02-04 | アディセット バイオ, インコーポレイテッド | δ3γδT細胞集団の選択的増殖方法及びその組成物 |
| MA51210A (fr) | 2017-12-01 | 2020-10-07 | Juno Therapeutics Inc | Procédés de dosage et de modulation de cellules génétiquement modifiées |
| CN112203680A (zh) | 2017-12-08 | 2021-01-08 | 朱诺治疗学股份有限公司 | 用于细胞疗法的表型标记和相关方法 |
| SG11202005228YA (en) | 2017-12-08 | 2020-07-29 | Juno Therapeutics Inc | Serum-free media formulation for culturing cells and methods of use thereof |
| CA3084445A1 (en) | 2017-12-08 | 2019-06-13 | Juno Therapeutics, Inc. | Process for producing a composition of engineered t cells |
| JP7394058B2 (ja) * | 2017-12-21 | 2023-12-07 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | 新規抗原結合部分の特異性試験のためのユニバーサルレポーター細胞アッセイ |
| JP7549303B2 (ja) | 2018-01-22 | 2024-09-11 | エンドサイト・インコーポレイテッド | Car t細胞の使用方法 |
| EP3746117A1 (en) | 2018-01-31 | 2020-12-09 | Celgene Corporation | Combination therapy using adoptive cell therapy and checkpoint inhibitor |
| SG11202007697VA (en) | 2018-02-15 | 2020-09-29 | Memorial Sloan Kettering Cancer Center | Foxp3 targeting agent compositions and methods of use for adoptive cell therapy |
| MA52656A (fr) | 2018-04-05 | 2021-02-17 | Editas Medicine Inc | Procédés de production de cellules exprimant un récepteur recombinant et compositions associées |
| MA52363A (fr) | 2018-04-26 | 2021-03-03 | Agenus Inc | Compositions peptidiques de liaison à une protéine de choc thermique (hsp) et leurs méthodes d'utilisation |
| US20210047405A1 (en) | 2018-04-27 | 2021-02-18 | Novartis Ag | Car t cell therapies with enhanced efficacy |
| EP3788369A1 (en) | 2018-05-01 | 2021-03-10 | Novartis Ag | Biomarkers for evaluating car-t cells to predict clinical outcome |
| WO2019213276A1 (en) | 2018-05-02 | 2019-11-07 | Novartis Ag | Regulators of human pluripotent stem cells and uses thereof |
| WO2019227003A1 (en) | 2018-05-25 | 2019-11-28 | Novartis Ag | Combination therapy with chimeric antigen receptor (car) therapies |
| CN108676098A (zh) * | 2018-05-29 | 2018-10-19 | 段海峰 | 靶向wt1的嵌合抗原受体t细胞及其应用 |
| WO2019237035A1 (en) | 2018-06-08 | 2019-12-12 | Intellia Therapeutics, Inc. | Compositions and methods for immunooncology |
| EP3806962A1 (en) | 2018-06-13 | 2021-04-21 | Novartis AG | Bcma chimeric antigen receptors and uses thereof |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| CA3107383A1 (en) | 2018-07-23 | 2020-01-30 | Magenta Therapeutics, Inc. | Use of anti-cd5 antibody drug conjugate (adc) in allogeneic cell therapy |
| JP7538109B2 (ja) | 2018-08-09 | 2024-08-21 | ジュノー セラピューティクス インコーポレイテッド | 組み込まれた核酸を評価するための方法 |
| IL313701A (en) | 2018-08-09 | 2024-08-01 | Juno Therapeutics Inc | Processes for creating transgenic cells and their compounds |
| CN113167796A (zh) | 2018-09-11 | 2021-07-23 | 朱诺治疗学股份有限公司 | 对工程化细胞组合物进行质谱分析的方法 |
| IT201800009282A1 (it) * | 2018-10-09 | 2020-04-09 | Metis Prec Medicine Sb Srl | Nuovo agente terapeutico per il trattamento di un tumore e/o metastasi |
| KR20210098450A (ko) | 2018-10-31 | 2021-08-10 | 주노 테라퓨틱스 게엠베하 | 세포의 선택 및 자극을 위한 방법 및 이를 위한 장치 |
| GB201817821D0 (en) * | 2018-10-31 | 2018-12-19 | Ospedale San Raffaele Srl | TCR and peptides |
| EP3886875B1 (en) | 2018-11-30 | 2024-05-08 | Juno Therapeutics, Inc. | Methods for treatment using adoptive cell therapy |
| AU2019394877A1 (en) | 2018-12-03 | 2021-06-17 | Adicet Therapeutics, Inc. | Methods for selective in vivo expansion of gamma delta T-cell populations and compositions thereof |
| CN113271945A (zh) | 2018-12-20 | 2021-08-17 | 诺华股份有限公司 | 包含3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物的给药方案和药物组合 |
| EP3924055B1 (en) | 2019-02-15 | 2024-04-03 | Novartis AG | Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| CA3124935A1 (en) | 2019-02-15 | 2020-08-20 | Novartis Ag | 3-(1-oxo-5-(piperidin-4-yl)isoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| BR112021021075A2 (pt) | 2019-05-01 | 2021-12-14 | Editas Medicine Inc | Células que expressam um receptor recombinante de um locus de tgfbr2 modificado, polinucleotídeos relacionados e métodos |
| CN114007640A (zh) | 2019-05-01 | 2022-02-01 | 朱诺治疗学股份有限公司 | 从修饰的cd247基因座表达嵌合受体的细胞、相关多核苷酸和方法 |
| MX2021015317A (es) | 2019-06-12 | 2022-03-11 | Juno Therapeutics Inc | Terapia de combinacion de una terapia citotoxica mediada por celulas y un inhibidor de una proteina de la familia bcl2 de prosupervivencia. |
| JP2022542102A (ja) | 2019-07-23 | 2022-09-29 | ムネモ・セラピューティクス | Suv39h1欠損免疫細胞 |
| CN114555112A (zh) | 2019-08-22 | 2022-05-27 | 朱诺治疗学股份有限公司 | T细胞疗法和zeste增强子同源物2(ezh2)抑制剂的组合疗法及相关方法 |
| CN114585644A (zh) | 2019-08-30 | 2022-06-03 | 艾吉纳斯公司 | 抗cd96抗体及其使用方法 |
| AU2020394441A1 (en) | 2019-11-26 | 2022-06-02 | Novartis Ag | CD19 and CD22 chimeric antigen receptors and uses thereof |
| KR20220116257A (ko) | 2019-12-20 | 2022-08-22 | 노파르티스 아게 | 골수섬유증 및 골수이형성 증후군을 치료하기 위한, 데시타빈 또는 항 pd-1 항체 스파르탈리주맙을 포함하거나 또는 포함하지 않는, 항 tim-3 항체 mbg453 및 항 tgf-베타 항체 nis793의 조합물 |
| EP4097218A1 (en) | 2020-01-28 | 2022-12-07 | Juno Therapeutics, Inc. | Methods for t cell transduction |
| EP4110389A4 (en) * | 2020-02-28 | 2024-06-26 | The Brigham And Women's Hospital, Inc. | SELECTIVE SIGNALING MODULATION OF THE TRANSFORMING GROWTH FACTOR BETA SUPERFAMILY THROUGH MULTI-SPECIFIC ANTIBODIES |
| KR20230024283A (ko) | 2020-05-13 | 2023-02-20 | 주노 쎄러퓨티크스 인코퍼레이티드 | 임상 반응과 관련된 특징을 식별하는 방법 및 이의 용도 |
| JP2023529211A (ja) | 2020-06-11 | 2023-07-07 | ノバルティス アーゲー | Zbtb32阻害剤及びその使用 |
| MX2022015852A (es) | 2020-06-23 | 2023-01-24 | Novartis Ag | Regimen de dosificacion que comprende derivados de 3-(1-oxoisoindolin-2-il)piperidina-2,6-diona. |
| CN116234558A (zh) | 2020-06-26 | 2023-06-06 | 朱诺治疗学有限公司 | 条件性地表达重组受体的工程化t细胞、相关多核苷酸和方法 |
| US20230303974A1 (en) | 2020-07-30 | 2023-09-28 | Institut Curie | Immune Cells Defective for SOCS1 |
| JP2023536164A (ja) | 2020-08-03 | 2023-08-23 | ノバルティス アーゲー | ヘテロアリール置換3-(1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン誘導体及びその使用 |
| CN116802203A (zh) | 2020-11-04 | 2023-09-22 | 朱诺治疗学股份有限公司 | 从经修饰的恒定cd3免疫球蛋白超家族链基因座表达嵌合受体的细胞、相关多核苷酸和方法 |
| WO2022133030A1 (en) | 2020-12-16 | 2022-06-23 | Juno Therapeutics, Inc. | Combination therapy of a cell therapy and a bcl2 inhibitor |
| TW202227486A (zh) * | 2021-01-04 | 2022-07-16 | 大陸商上海翰森生物醫藥科技有限公司 | 一種抗erbb3受體的抗體或其抗原結合片段及其醫藥用途 |
| WO2022204070A1 (en) | 2021-03-22 | 2022-09-29 | Juno Therapeutics, Inc. | Methods of determining potency of a therapeutic cell composition |
| CN117321200A (zh) | 2021-03-22 | 2023-12-29 | 朱诺治疗学股份有限公司 | 评估病毒载体颗粒效力的方法 |
| JP2024514245A (ja) | 2021-03-29 | 2024-03-29 | ジュノー セラピューティクス インコーポレイテッド | チェックポイント阻害剤療法とcar t細胞療法との組合せを用いた投薬および処置のための方法 |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| TW202309294A (zh) | 2021-04-27 | 2023-03-01 | 瑞士商諾華公司 | 病毒載體生產系統 |
| EP4337763A1 (en) | 2021-05-10 | 2024-03-20 | Institut Curie | Methods for the treatment of cancer, inflammatory diseases and autoimmune diseases |
| WO2022248602A1 (en) | 2021-05-25 | 2022-12-01 | Institut Curie | Myeloid cells overexpressing bcl2 |
| WO2023126458A1 (en) | 2021-12-28 | 2023-07-06 | Mnemo Therapeutics | Immune cells with inactivated suv39h1 and modified tcr |
| AU2023209589A1 (en) | 2022-01-21 | 2024-08-08 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Modulation of suv39h1 expression by rnas |
| KR20240137075A (ko) | 2022-01-28 | 2024-09-19 | 주노 쎄러퓨티크스 인코퍼레이티드 | 세포 조성물의 제조 방법 |
| CN114539412B (zh) * | 2022-02-24 | 2023-09-29 | 广西医科大学 | 抗hla-a2/wt1复合物的单域抗体及其制备方法与应用 |
| WO2023187024A1 (en) | 2022-03-31 | 2023-10-05 | Institut Curie | Modified rela protein for inducing interferon expression and engineered immune cells with improved interferon expression |
| WO2023214325A1 (en) | 2022-05-05 | 2023-11-09 | Novartis Ag | Pyrazolopyrimidine derivatives and uses thereof as tet2 inhibitors |
| EP4279085A1 (en) | 2022-05-20 | 2023-11-22 | Mnemo Therapeutics | Compositions and methods for treating a refractory or relapsed cancer or a chronic infectious disease |
| WO2024062138A1 (en) | 2022-09-23 | 2024-03-28 | Mnemo Therapeutics | Immune cells comprising a modified suv39h1 gene |
| WO2024089639A1 (en) | 2022-10-26 | 2024-05-02 | Novartis Ag | Lentiviral formulations |
| WO2024088383A1 (en) * | 2022-10-28 | 2024-05-02 | Biocytogen Pharmaceuticals (Beijing) Co., Ltd. | Anti-wt1/hla antibodies and uses thereof |
| WO2024167871A1 (en) * | 2023-02-06 | 2024-08-15 | Memorial Sloan-Kettering Cancer Center | Compositions including anti-wt-1 antibodies & antigen binding fragments and uses thereof |
| WO2024220588A1 (en) | 2023-04-18 | 2024-10-24 | Juno Therapeutics, Inc. | Cytotoxicity assay for assessing potency of therapeutic cell compositions |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4663283A (en) | 1980-03-24 | 1987-05-05 | Genentech, Inc. | Method of altering double-stranded DNA |
| US4456748A (en) | 1981-02-23 | 1984-06-26 | Genentech, Inc. | Hybrid human leukocyte interferons |
| US5726288A (en) * | 1989-11-13 | 1998-03-10 | Massachusetts Institute Of Technology | Localization and characterization of the Wilms' tumor gene |
| WO1997039354A1 (fr) * | 1996-04-16 | 1997-10-23 | Kishimoto, Tadamitsu | Procede de detection de cellules solides cancereuses et d'heterotypie histologique et procede d'examen du tissu dans le but d'effectuer une transplantation de moelle osseuse et une transplantation de cellules souches du sang peripherique |
| PL201881B1 (pl) * | 1998-09-30 | 2009-05-29 | Corixa Corp | Izolowany polipeptyd składający się z immunogennej części natywnego WT1, zawierająca go kompozycja farmaceutyczna i szczepionka oraz polinukleotyd kodujący ten polipeptyd |
| US7553494B2 (en) * | 2001-08-24 | 2009-06-30 | Corixa Corporation | WT1 fusion proteins |
| US6992176B2 (en) * | 2002-02-13 | 2006-01-31 | Technion Research & Development Foundation Ltd. | Antibody having a T-cell receptor-like specificity, yet higher affinity, and the use of same in the detection and treatment of cancer, viral infection and autoimmune disease |
| JP2005533486A (ja) * | 2002-02-20 | 2005-11-10 | ダイアックス、コープ | Mhc−ペプチド複合体結合リガンド |
| AU2003220079A1 (en) | 2002-03-08 | 2003-09-22 | Sloan-Kettering Institute For Cancer Research | Uses of monoclonal antibody 8h9 |
| EP1548028B1 (en) * | 2002-09-20 | 2009-09-09 | International Institute of Cancer Immunology, Inc. | Substituted type peptides of wt1 |
| US7595379B2 (en) | 2003-05-30 | 2009-09-29 | Agensys, Inc. | Antibodies and related molecules that bind to PSCA proteins |
| GB0328363D0 (en) | 2003-12-06 | 2004-01-14 | Imp College Innovations Ltd | Therapeutically useful molecules |
| MX2008010842A (es) | 2006-02-22 | 2008-09-01 | Int Inst Cancer Immunology Inc | Peptido de tumor de wilms restringido por antigeno leucocitario humano-a*3303 y composicion farmaceutica que comprenden el mismo. |
| US8084022B2 (en) | 2006-06-23 | 2011-12-27 | Aegis Therapeutics, Llc | Stabilizing alkylglycoside compositions and methods thereof |
| EP2341142B8 (en) * | 2006-12-28 | 2015-01-14 | International Institute of Cancer Immunology, Inc. | HLA-A*1101-restricted WT1 peptide and pharmaceutical composition comprising same |
| EP2514766A3 (en) | 2007-03-29 | 2013-06-05 | Technion Research & Development Foundation Ltd. | Antibodies, methods and kits for diagnosing and treating melanoma |
| WO2009091826A2 (en) | 2008-01-14 | 2009-07-23 | The Board Of Regents Of The University Of Texas System | Compositions and methods related to a human cd19-specific chimeric antigen receptor (h-car) |
| EP2262834A4 (en) | 2008-02-27 | 2011-08-17 | Receptor Logic Inc | ANTIBODIES THAT IMITATE L-CELL RECEPTORS AND METHODS OF MAKING AND USING SAME |
| CN102124120B (zh) | 2008-07-25 | 2013-11-13 | 电气化学工业株式会社 | 透明质酸的制备方法 |
| US8080415B2 (en) | 2008-09-26 | 2011-12-20 | Eureka Therapeutics, Inc. | Modified host cells and uses thereof |
| CA2826942C (en) | 2011-02-11 | 2021-08-03 | Memorial Sloan-Kettering Cancer Center | Hla-restricted, peptide-specific antigen binding proteins |
| US20160369006A1 (en) * | 2011-04-01 | 2016-12-22 | Memorial Sloan-Kettering Cancer Center | Fc-ENHANCED ANTI-WT1/HLA ANTIBODY |
| US10239952B2 (en) * | 2011-04-01 | 2019-03-26 | Memorial Sloan Kettering Cancer Center | Anti-WT1/HLA bi-specific antibody |
| PE20141271A1 (es) * | 2011-04-01 | 2014-10-08 | Sloan Kettering Inst Cancer | Anticuerpos tipo receptor de celulas t especificos para un peptido wt1 presentado por hla-a2 |
-
2012
- 2012-04-02 PE PE2013002165A patent/PE20141271A1/es not_active Application Discontinuation
- 2012-04-02 AP AP2013007142A patent/AP2013007142A0/xx unknown
- 2012-04-02 EP EP17195724.4A patent/EP3323833B1/en active Active
- 2012-04-02 CN CN201280026656.XA patent/CN103619882B/zh not_active Expired - Fee Related
- 2012-04-02 ES ES17195724T patent/ES2785081T3/es active Active
- 2012-04-02 MX MX2013011363A patent/MX2013011363A/es not_active Application Discontinuation
- 2012-04-02 EA EA201391449A patent/EA201391449A1/ru unknown
- 2012-04-02 MY MYPI2013003545A patent/MY160662A/en unknown
- 2012-04-02 KR KR1020137028479A patent/KR20140033029A/ko not_active Application Discontinuation
- 2012-04-02 US US14/008,447 patent/US9074000B2/en active Active
- 2012-04-02 AU AU2012236068A patent/AU2012236068A1/en not_active Abandoned
- 2012-04-02 EP EP12726511.4A patent/EP2694553B1/en active Active
- 2012-04-02 SG SG2013072277A patent/SG193956A1/en unknown
- 2012-04-02 JP JP2014502699A patent/JP6082997B2/ja not_active Expired - Fee Related
- 2012-04-02 WO PCT/US2012/031892 patent/WO2012135854A2/en active Application Filing
- 2012-04-02 ES ES12726511.4T patent/ES2651510T3/es active Active
- 2012-04-02 CA CA2831336A patent/CA2831336C/en active Active
- 2012-04-02 CN CN201610832132.XA patent/CN106632677B/zh not_active Expired - Fee Related
-
2013
- 2013-09-16 ZA ZA2013/06940A patent/ZA201306940B/en unknown
- 2013-09-30 NI NI201300099A patent/NI201300099A/es unknown
- 2013-10-01 CL CL2013002828A patent/CL2013002828A1/es unknown
- 2013-10-01 CU CUP2013000130A patent/CU20130130A7/es active IP Right Grant
- 2013-10-01 GT GT201300233A patent/GT201300233A/es unknown
- 2013-10-01 DO DO2013000219A patent/DOP2013000219A/es unknown
- 2013-10-24 CO CO13252732A patent/CO6900116A2/es unknown
-
2015
- 2015-05-28 US US14/724,155 patent/US9540448B2/en active Active
- 2015-10-30 JP JP2015213831A patent/JP2016026209A/ja active Pending
-
2016
- 2016-11-30 US US15/364,953 patent/US10040865B2/en active Active
-
2017
- 2017-05-26 AU AU2017203511A patent/AU2017203511B2/en not_active Ceased
-
2018
- 2018-08-06 US US16/055,535 patent/US10858444B2/en active Active
-
2020
- 2020-10-30 US US17/085,234 patent/US20210163624A1/en not_active Abandoned
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200104331A (ko) * | 2017-12-21 | 2020-09-03 | 에프. 호프만-라 로슈 아게 | Hla-a2/wt1에 결합하는 항체 |
| WO2021107725A1 (ko) * | 2019-11-29 | 2021-06-03 | 가톨릭대학교 산학협력단 | Cobll1 단백질 특이 항체 또는 이의 항원 결합 단편, 및 이의 용도 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140033029A (ko) | 에이치엘에이 에이2에 의해 제공된 더블유티1 펩타이드에 특이적인 티 세포 수용체 유사 항체 | |
| CN113754768B (zh) | 结合cd39的抗体及其用途 | |
| CN107921127B (zh) | 对于prame肽具有特异性的t细胞受体样抗体 | |
| KR102017070B1 (ko) | 치료 펩티드 | |
| KR101671039B1 (ko) | 항 cxcr4 항체 및 그들의 암의 치료를 위한 용도 | |
| CN112533955B (zh) | 抗b7-h3抗体 | |
| KR20220137032A (ko) | 신규 lilrb2 항체 및 이의 용도 | |
| KR20160090904A (ko) | 치료 펩티드 | |
| KR20150130462A (ko) | 치료 펩티드 | |
| JP2019512207A (ja) | Foxp3由来のペプチドに特異的なt細胞受容体様抗体 | |
| CA3133074A1 (en) | Cd22 antibodies and methods of using the same | |
| CN112839963B (zh) | 新型癌症免疫治疗抗体组合物 | |
| KR20150131219A (ko) | Wt-1-양성 질병 치료용 조합/보조제 요법 | |
| RU2804490C2 (ru) | Новые композиции антител для иммунотерапии рака | |
| KR20220145894A (ko) | 신규 항체 | |
| CN116745325A (zh) | Bcma靶向抗体、嵌合抗原受体及其应用 | |
| CN116018351A (zh) | 靶向cd123的抗体、嵌合抗原受体及其用途 | |
| NZ617008B2 (en) | T cell receptor-like antibodies specific for a wt1 peptide presented by hla-a2 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |