포나티닙
Ponatinib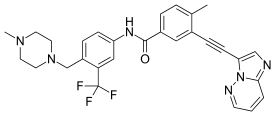 | |
 | |
| 임상자료 | |
|---|---|
| 발음 | /poʊˈnætɪnɪb/ poh-NAT-i-nib |
| 상명 | 일클로시그 |
| 기타 이름 | AP24534 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a613029 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 구강별(테이블록 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 생체이용가능성 | 알 수 없는 |
| 단백질 결합 | >99% (체외) |
| 신진대사 | 간(CYP3A4, 2C8, 2D6, 3A5) |
| 제거 반감기 | 12-66시간 |
| 배설 | 대변(87%), 소변(5%)[1] |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| 화학 및 물리적 데이터 | |
| 공식 | C29H27F3N6O |
| 어금질량 | 532.571 g·1911−1 |
| 3D 모델(JSmol) | |
| |
| |
포나티닙(무역명 Iclusig /aɪˈklulusɪ/eye-KLOO-sig, 이전 AP24534)은 아리아드제약이 만성 골수성 백혈병(CML)과 필라델피아 염색체-양성(Ph+) 급성 림프성 백혈병(ALL)의 치료를 위해 개발한 경구 약물이다.다목적 타이로신키나아제 억제제다.[2]T315I 돌연변이를 가진 CML의 일부 형태는 이마티닙과 같은 현재 치료법에 내성이 있다.포나티닙은 이러한 종류의 종양에 효과적이도록 설계되었다.[3]
미국 식품의약국(FDA)은 2012년 12월 이 약을 후보 약품으로 승인했지만, 2013년 10월 31일 '생명을 위협하는 혈전 및 혈관이 심하게 좁아질 위험'[4][5]을 이유로 판매를 잠정 중단했다.이러한 중단은 2013년 12월 20일에 부분적으로 해제되었고, 포나티닙은 새로운 "블랙박스 경고" 및 "위험 평가 및 완화 전략"을 시행하여 의약품 사용에 따른 위험과 편익을 더 잘 평가할 수 있게 되었다.
미국에서는 1년에 138,000달러의 비용이 들 수 있는데, 이것은 비난을 받아왔다.[6][7]
승인 및 표시
포나티닙은 며칠 전 연례 ASH 회의에서 보고된 PACE 2단계 임상시험 결과에 기초하여 2012년 12월 14일 미국 FDA로부터 내성이 있거나 내성이 없는 CML과 Ph+ ALL 환자에 대한 승인을 받았다.[8]승인이 FDA 가속 승인 프로그램에 따라 이루어졌기 때문에 지원자는 추가 연구를 수행해야 했다.FDA는 이러한 추가 연구를 바탕으로 2016년 만성상, 가속상 또는 발파상 만성 골수성 백혈병 및 다른 티로신 키나제 억제제 치료제가 없는 필라델피아 염색체 양성 급성 림프성 백혈병 환자를 포함하도록 라벨을 전면 승인하고 업데이트했다.T315I 양성 및 T315I 양성 필라델피아 염색체 양성 급성 림프성 백혈병에도 승인이 허가됐다.[9]
역효과
미국 식품의약국은 2013년 10월 9일 포나티닙의 새로운 시험 등록에 대한 부분 임상 보류령을 발표했다.[10]EPIC 재판은 이후 10월 18일에 취소되었다.[11]만성 골수성 백혈병을 위해 4년 동안 포나티닙으로 치료받은 449명의 환자에 대한 후속 연구 결과 다음과 같은 부작용들이 발견되었다.150 심장혈관(21% 환자), 말초혈관(12%), 뇌혈관(9%) 동맥경화 이벤트를 경험했다.정맥 혈전증은 환자의 6%에서 발생했다.The most common all-grade adverse events included hypertension (69%), rash (63%), abdominal pain (48%), fatigue (47%), headache (43%), arterial ischemia (42%), dry skin (42%), constipation (41%), arthralgia (32%), nausea (28%), pyrexia (26%), peripheral neuropathy (24%), myalgia (24%), pain in extremity (23%), back pain (21%), and diarrhea (20%).또 후부역성 뇌병증후군이 발병한 사례도 보고된 바 있다.[12]
임상시험
2010년 ARIAD는 내성과 내화성 만성 골수성 백혈병(CML)과 필라델피아 양성 급성 림프성 백혈병(Ph+ ALL) 환자의 포나티닙 1단계 연구 결과를 발표했다.이 연구는 포나티닙으로 치료된 만성상 CML 환자에서 실험 대상 환자의 66%가 T315I 돌연변이를 가진 환자의 100%를 포함하여 주요 세포유전 반응을 달성했다는 것을 입증했다.[citation needed]
PACE(Ponatinib Ph+ ALL and CML Evaluation) 중추적 단계 II 임상시험은 2010년 9월에 환자 등록을 시작했으며, 이 설정에서 규제 승인을 위한 최종 임상 데이터를 제공하도록 설계되었다.2012년 12월에 좋은 결과가 보고되었다.[8][13]
EPIC(Ponatinib vs Imatinib in CML) 단계 III 재판은 2012년 6월에 시작되어 2013년 10월 18일에 중단되었다[clarification needed][11].
작용기전
Ponatinib의 주요 대상은 BCR-ABL로, CML과 Ph+ ALL의 특징인 비정상적인 티로신 키나아제다.CML은 BCR-ABL 단백질을 생성하는 유전적 이상으로 인해 골수에 의해 백혈구가 과다하고 비규제적으로 생성되는 것이 특징이다.너무 많은 백혈구의 만성적인 생산 단계 후에, CML은 일반적으로 가속 또는 폭발 위기와 같은 보다 공격적인 단계로 진화한다.Ph+ ALL은 BCR-ABL을 생성하는 Ph+ 염색체를 운반하는 급성 림프성 백혈병의 아형이다.CML보다 더 공격적인 코스를 가지고 있으며 화학요법과 티로신키나제 억제제를 병행하여 치료하는 경우가 많다.이 두 질환 모두 BCR-ABL 단백질을 표현하기 때문에, 이것은 포나티닙으로 치료하기 잠재적으로 그들을 취약하게 만들 것이다.BCR-ABL은 CML 환자의 95%에서 검출된다.[citation needed]
만성피로증후군을 앓고 있는 환자들은 현재 일로티닙 및/또는 다사티닙 치료를 받고 있으나 환자의 22-33%가 이상, 치료 실패, 기타 원인으로 인해 2년 동안 치료를 중단한다.[citation needed]
발견 및 출처
Ponatinib은 ARIAD의 연산 및 구조 기반 약물 설계 플랫폼을 사용하여 매우 높은 효소 효소 활성을 억제하고 광범위한 특수성을 가진 BCR-ABL의 효소 활동을 억제하도록 설계되었다.Ponatinib은 토종 BCR-ABL뿐만 아니라, 특히 효과적인 치료법이 존재하지 않는 T315I 돌연변이를 포함하여 기존 Tyrosine kinase 억제제로 치료에 대한 내성을 부여하는 돌연변이를 운반하는 이소폼을 목표로 했다.[15]
발견으로 가는 길은 아리아드의 ATP 경쟁 이중 Src/Abl 억제제 중 첫 번째의 하나인 AP23464와 연결되어 있다.AP23464는 구조 기반 약물 설계와 삼분해성 청색 아날로그의 집중 합성 라이브러리를 사용하여 확인되었다.이 물질은 많은 일반적인 이미티닙 내성 Bcr-Abl 돌연변이를 포함하여 Src와 Bcr-Abl 키나아제를 강력하게 억제한다.그러나 AP23464는 T315I 돌연변이를 억제하지 않는 반면, 포나티닙은 그렇게 한다.
비용, 적용 범위 및 가용성
[US] 종양학자들은 많은 환자들이 연간 13만 8천 달러라는 "비정상적인" 비용을 감당할 수 없다고 불평해 왔는데, 이것은 의학계에서 가장 비싼 약 중 하나이며, [그들의 견해로는] 개발비를 지불하는 데 필요한 것보다 훨씬 더 비싸다고 한다.[6][7]
2015년 포나티닙은 암약기금에 따라 문서화된 T315I 돌연변이가 있는 환자의 CML(만성상, 가속상 또는 폭발상)과 Ph+ ALL 치료를 위해 영국에서 이용 가능하며,[16] 기대 환자 수가 적다는 국립보건의료원(NICE)의 평가를 받지 않았다.[17]NICE는 포나티닙이 연간 약 6만1000파운드의 비용이 들 것으로 추정했지만 암약기금에 따라 지불되는 가격은 기밀이며 다를 수 있다.
참고 항목
참조
- ^ "Iclusig (ponatinib) Tablets, for Oral Use. Full Prescribing Information". ARIAD Pharmaceuticals, Inc. 26 Landsdowne Street, Cambridge, MA 02139-4234. Retrieved 2 October 2016.
- ^ Huang WS, Metcalf CA, Sundaramoorthi R, Wang Y, Zou D, Thomas RM, Zhu X, Cai L, Wen D, Liu S, Romero J, Qi J, Chen I, Banda G, Lentini SP, Das S, Xu Q, Keats J, Wang F, Wardwell S, Ning Y, Snodgrass JT, Broudy MI, Russian K, Zhou T, Commodore L, Narasimhan NI, Mohemmad QK, Iuliucci J, Rivera VM, Dalgarno DC, Sawyer TK, Clackson T, Shakespeare WC (June 2010). "Discovery of 3-[2-(imidazo[1,2-b]pyridazin-3-yl)ethynyl]-4-methyl-N-{4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl}benzamide (AP24534), a potent, orally active pan-inhibitor of breakpoint cluster region-abelson (BCR-ABL) kinase including the T315I gatekeeper mutant". J. Med. Chem. 53 (12): 4701–19. doi:10.1021/jm100395q. PMID 20513156.
- ^ O'Hare T, Shakespeare WC, Zhu X, Eide CA, Rivera VM, Wang F, Adrian LT, Zhou T, Huang WS, Xu Q, Metcalf CA, Tyner JW, Loriaux MM, Corbin AS, Wardwell S, Ning Y, Keats JA, Wang Y, Sundaramoorthi R, Thomas M, Zhou D, Snodgrass J, Commodore L, Sawyer TK, Dalgarno DC, Deininger MW, Druker BJ, Clackson T (November 2009). "AP24534, a pan-BCR-ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance". Cancer Cell. 16 (5): 401–12. doi:10.1016/j.ccr.2009.09.028. PMC 2804470. PMID 19878872.
- ^ "FDA asks manufacturer of the leukemia drug Iclusig (ponatinib) to suspend marketing and sales". FDA Drug Safety Communication. U.S. Food and Drug Administration. 2013-10-31.
- ^ Grady D (2013-10-31). "Serious Danger of Blood Clots Halts Sale of Leukemia Drug". Business. New York Times.
- ^ a b Pollack A (April 25, 2013). "Doctors Denounce Cancer Drug Prices of $100,000 a Year". New York Times.
- ^ a b Experts in Chronic Myeloid Leukemia (May 2013). "The price of drugs for chronic myeloid leukemia (CML) is a reflection of the unsustainable prices of cancer drugs: from the perspective of a large group of CML experts". Blood. 121 (22): 4439–42. doi:10.1182/blood-2013-03-490003. PMC 4190613. PMID 23620577.
- ^ a b Gever J (Dec 14, 2012). "Ponatinib Wins Early FDA Nod". Oncology/Hematology. MedPageToday.com.
- ^ "FDA Grants Ponatinib Full Approval for Rare Leukemias".
- ^ Carroll J. "UPDATED: Ariad hammered on toxicity concerns for leukemia drug Iclusig". FierceBiotech.
- ^ a b "ARIAD Announces Discontinuation of the Phase 3 Epic Trial of Iclusig in Patients with Newly Diagnosed Chronic Myeloid Leukemia".
- ^ "FDA Grants Ponatinib Full Approval for Rare Leukemias".
- ^ Gever J (Dec 10, 2012). "Ponatinib Retains Luster in Leukemia". Oncology/Hematology. MedPageToday.com.
- ^ "Ponatinib in Newly Diagnosed Chronic Myeloid Leukemia". 5 November 2014.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ Zhou T, Commodore L, Huang WS, Wang Y, Thomas M, Keats J, Xu Q, Rivera VM, Shakespeare WC, Clackson T, Dalgarno DC, Zhu X (January 2011). "Structural mechanism of the Pan-BCR-ABL inhibitor ponatinib (AP24534): lessons for overcoming kinase inhibitor resistance". Chemical Biology & Drug Design. 77 (1): 1–11. doi:10.1111/j.1747-0285.2010.01054.x. PMID 21118377. S2CID 22604788.
- ^ NHS 잉글랜드."전국 암약 기금 리스트 Ver4.3". 2015년 6월 5일 (지난 2015년 7월 20일)
- ^ National Institute for Health and Care Excellence."2014년 7월 20일 마지막으로 회수한 2015년 7월 20일, "배치 33 초안 및 초안 범위 협의 및 범위 지정 워크샵의 의견 및 토론 요약"
외부 링크
- "Ponatinib". Drug Information Portal. U.S. National Library of Medicine.

