레스타우티니브
Lestaurtinib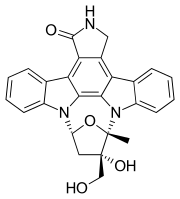 | |
 | |
| 임상 데이터 | |
|---|---|
| 루트 행정부. | 입으로[1] |
| ATC 코드 |
|
| 약동학 데이터 | |
| 단백질 결합 | 특히 α-1산 당단백질에[1] 고단백질 |
| 대사 | 간 P450(CYP34A)효소계[1] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| 화학 및 물리 데이터 | |
| 공식 | C26H21N3O4 |
| 몰 질량 | 439.471 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
레스타우티닙(rINN, 코드네임 CEP-701)은 스타우로스포린과 구조적으로 관련된 티로신 키나제 억제제이다.인도로카르바졸 K252a의 반합성 유도체는 다양한 유형의 [1]암에 대한 치료제로 Cephalon에 의해 연구되었다.키나아제 fms-like tyrosine kinase 3(FLT3),[2] 야누스 kinase 2(JAK2),[3] 트로포미오신 수용체 kinase(trk) A(TrkA), TrkB 및 TrkC의 [4]저해제이다.
사용하다
레스타우티니브는 췌장암과 전립선암, V617F JAK2 양성 다세포증, 필수혈소판증,[1] 난치성 신경아세포종 [5]등 다양한 암 치료에 대한 임상시험을 거쳤다.급성 골수성 백혈병(AML) 치료를 위한 레스타우티닙 개발에 가장 중요한 노력을 기울였다. 성인 AML 감염 인구의 24%는 일반 AML 모집단 이상에서 재발 및 사망률 증가와 관련이 있는 FLT3 돌연변이를 보였다.FLT3 돌연변이는 돌연변이 세포에서 아포토시스를 억제하지만, 레스타우티니브는 FLT3 키나아제 [1]활성을 억제함으로써 이러한 억제를 극복할 수 있는 잠재력을 가지고 있다.
임상 전 연구
레스타우르티닙은 일찍이 trk 수용체 티로신 키나제(RTK) 억제제로 확인되었으며, 티로신 키나제 활성(IC50)의 50%를 억제하는 농도는 25nM이었다.생체내 시험에서 이종 이식 췌장암과 전립선암에 대한 종양 부담이 50-70% 감소하는 것으로 나타났다. 그러나 췌장암과 전립선암에 대한 후속 임상시험에서는 지정된 종말점을 달성하지 못했다.2001년 레스타우르티니브는 FLT3 티로신 키나제에 대하여 IC50이 2~3nM인 것으로 나타났으며, 이러한 농도에서 구조적으로 유사한 티로신 키나아제에는 유의미한 영향이 없었다.백혈병은 전형적으로 여러 생존 경로를 발달시키기 때문에, 레스타우티닙은 전통적인 화학요법과 함께 연구되었다. 화학요법 이전의 레스타우티닙 치료법은 길항제 결과를 낳았지만, 화학요법과 동시 또는 그 이후의 레스타우티닙 치료법은 시너지 결과를 낳는 것으로 결정되었다.가장 최근에 JAK2 억제제로서의 레스타우티닙의 효능이 [1]조사되었다.
임상시험
레스타우티닙을 사용한 초기 1상 연구는 건강한 지원자의 단일 용량에 따른 약물동태학적 매개변수의 결정을 포함했다.다음으로, 진행성 고형 종양 또는 림프종을 가진 30명의 지원자가 참여한 1단계 시험에서 안전성과 내성을 조사했다.주목할 만한 종양 반응은 없었지만, 선량과 부작용 사이에 강한 상관관계가 있었으며, 1차 부작용은 위장 반응으로 보고되었다.췌장암 환자 18명을 대상으로 레스타우티닙과 젬시타빈과의 병용 치료를 위한 II상 연구가 시작되었지만 [1]레스타우티닙의 효과는 관찰되지 않았다.
2004년, 2개 위치에서 17명의 환자가 FLT3 돌연변이와 함께 재발한 난치성 저위험 AML을 포함하였고, 이 연구는 레스타우티닙에 의한 효과적인 FLT3 억제를 보여주었다.60세 이상 29명의 환자를 대상으로 한 다센터 Phase II 연구가 레스타우티니브 단독 치료를 위해 시작되었다. 2006년에 보고된 결과는 어떤 참가자에게도 완화의 주요 종말점이 달성되지 않았음을 보여주었다.이 실패에도 불구하고 42명의 환자가 참여한 또 다른 다센터 단계 II 시험에서 레스타우티닙과 기존 화학요법을 결합하였다. 2005년에 보고된 결과, [1]치료되지 않은 환자보다 레스타우티닙으로 치료했을 때 임상 반응을 보이는 환자가 두 배 더 많았다.따라서 화학요법 후 레스타우티니브에 대한 환자 224명을 대상으로 3상 임상시험이 시작되었으며, 2011년 [7]보고서에 따르면 화학요법만으로 치료한 환자와 레스타우티니브 및 화학요법으로 치료한 환자 간에 암 완화의 유의한 차이가 관찰되지 않았다.
이 단계 III 시험 이후 추가 임상 시험이 시작되었습니다.여기에는 V617F JAK2 양성 다세포증 베라와 필수혈소판증 환자 37명이 참여한 멀티센터 Phase II 시험도 포함됩니다.2014년에 발표된 결과는 환자의 [8]15%에서 V617F JAK2 대립 유전체 부하가 15% 감소하는 최종 결과를 달성하지 못한 것으로 나타났습니다.2010년 47명의 환자를 대상으로 한 1상 연구는 권장 [5]용량에서 난치성 신경아세포종 치료가 잘 내성이 있다고 보고되었으며,[9] 2011년 난치성 신경아세포종 어린이에 대한 1상 연구가 추가로 완료되었다.2015년 V617F JAK2 양성 골수 섬유증 [10]환자가 참여한 레스타우티닙 임상시험에서 1단계 결과가 보고되었다.
사업화 및 지적재산권
레스타우티닙은 미국 펜실베이니아주 [11]프레이저에 본사를 둔 국제 제약회사인 Cephalon에 의해 연구되었다.1987년에 설립된 Cephalon은 2011년까지 [12]Fortune 1000대 기업으로 성장하여 100개국에서 4,000명의 직원과 170개의 제품이 판매되었습니다.
레스타우티닙은 2007년 미국 증권거래위원회(SEC) 보고서에서 세팔론이 개발 중인 두 가지 종양학 약 중 하나로 언급됐다.이 보고서에 따르면 세팔론은 레스타우르티닙의 처리방법, 제제방법, 다형체 등에 관한 특허출원 외에 2008년 만료되는 레스타우르티닙에 대한 물질특허를 미국에서 보유하고 있다.2006년에 미국 FDA와 AML.[13]의 치료법을 무엇보다 임상 실험 Lestaurtinib, 세팔론 설립자이자 CEO인 프랭크 Baldino 박사와 관련한 예비 감퇴하는 결과의 여파로 중요한 필요하지만 최소 시장 200년에 그 다음의 성명을 발표했다 반영하는 AML의 치료를 위해lestaurtinib 희귀 의약품 지위를 부여했다.9시
우리는 예후가 좋지 않고 치료 옵션이 적은 이 분자 표적 환자 모집단을 위해 레스타우티닙을 개발하기 위한 이 선구적인 노력에 상당한 재정 투자를 했다.생명을 위협하는 질병을 앓고 있는 환자들은 우리가 환자의 결과와 전반적인 의료 [14]비용을 개선하려면 투자를 하고 위험을 감수할 Cephalon 같은 회사가 필요합니다.
2011년, Cephalon은 Teva Pharmacical Industries(NASDAQ: TEVA)에 의해 현금 68억달러에 인수되어 Cephalon은 Teva의 완전 출자 자회사가 되었습니다.이번 인수는 Teva가 브랜드 및 전문 의약품 제품을 확대하여 브랜드 의약품 매출을 두 배 이상 늘려 70억달러의 가치를 [11][12]창출하겠다는 비전에 따른 것입니다.Teva는 2011년 연례 SEC 보고서에서 [15]주요 종양학 의약품 목록에 레스타우티닙을 포함시키지 않았다.
상당한 수의 특허가 레스타우티닙과 관련되어 있다.구글의 특허검색에서는 레스타우티닙을 포함한 1,278개의 특허를 얻을 수 있습니다.이 중 6개는 타이틀에 레스타우티닙을 포함하고 8개는 CEP-701을 포함하고 있지 않습니다.2017개의 특허는 타이틀에 CEP-701을 포함하지 않고 8개는 FLT 억제제와 관련된 CEP-701에 할당되어 있습니다.제목과 그 중 3개는 Cephalon에 [16]할당된다.현재 AML 임상시험 중인 FLT3 억제제는 소라페닙,[17] 미도스타우린 및 퀴즈아티닙을 포함한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g h i Shabbir M, Stuart R (2010). "Lestaurtinib, a multitargeted tyrosinse kinase inhibitor: from bench to bedside". Expert Opinion on Investigational Drugs. 19 (3): 427–36. doi:10.1517/13543781003598862. PMID 20141349. S2CID 13558158.
- ^ Knapper S, Burnett AK, Littlewood T, et al. (November 2006). "A phase 2 trial of the FLT3 inhibitor lestaurtinib (CEP701) as first-line treatment for older patients with acute myeloid leukemia not considered fit for intensive chemotherapy". Blood. 108 (10): 3262–70. doi:10.1182/blood-2006-04-015560. PMID 16857985.
- ^ Hexner EO, Serdikoff C, Jan M, et al. (June 2008). "Lestaurtinib (CEP701) is a JAK2 inhibitor that suppresses JAK2/STAT5 signaling and the proliferation of primary erythroid cells from patients with myeloproliferative disorders". Blood. 111 (12): 5663–71. doi:10.1182/blood-2007-04-083402. PMC 2424161. PMID 17984313.
- ^ Revill, P., Serradell, N., Bolos, J., Rosa, E. (2007). "Lestaurtinib". Drugs of the Future. 32 (3): 215. doi:10.1358/dof.2007.032.03.1084137.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b Minturn JE, Villablanca J, Yanik GA, et al. (May 2010). "Phase I trial of lestaurtinib for children with refractory neuroblastoma (NB): A New Approach to Neuroblastoma Therapy (NANT) Consortium study". Journal of Clinical Oncology. 28 (15): 9532. doi:10.1200/jco.2010.28.15_suppl.9532.
- ^ "Lestaurtinib, Cytarabine, and Idarubicin in Treating Younger Patients With Relapsed or Refractory Acute Myeloid Leukemia". ClinicalTrials.gov. U.S. National Institutes of Health. Retrieved 20 November 2016.
- ^ Levis M, Ravandi F, Wang ES, et al. (24 March 2011). "Results from a randomized trial of salvage chemotherapy followed by lestaurtinib for patients with FLT3 mutant AML in first relapse". Blood. 117 (12): 3294–301. doi:10.1182/blood-2010-08-301796. PMC 3069671. PMID 21270442.
- ^ Hexner E, Roboz G, Hoffman R, et al. (January 2014). "Open-label study of oral CEP-701 (lestaurtinib) in patients with polycythaemia vera or essential thrombocythaemia with JAK2-V617F mutation". British Journal of Haematology. 164 (1): 83–93. doi:10.1111/bjh.12607. PMID 24903629. S2CID 2013761.
- ^ Minturn JE, Evans AE, Villablanca JG, et al. (October 2011). "Phase I trial of lestaurtinib for children with refractory neuroblastoma: a new approaches to neuroblastoma therapy consortium study". Cancer Chemotherapy and Pharmacology. 68 (4): 1057–65. doi:10.1007/s00280-011-1581-4. PMC 4238911. PMID 21340605.
- ^ Hexner EO, Mascarenhas J, Prchal J, et al. (2015). "Phase I dose escalation study of lestaurtinib in patients with myelofibrosis". Leukemia & Lymphoma. 56 (9): 2543–51. doi:10.3109/10428194.2014.1001986. PMC 5665563. PMID 25563429.
- ^ a b Nicholson, Chris. "Teva to Buy Cephalon for $6.8 Billion". DealBook. The New York Times. Retrieved 20 November 2016.
- ^ a b "Teva to Acquire Cephalon in $6.8 Billion Transaction". Retrieved 20 November 2016.
- ^ "Cephalon 10-K 2007". wikinvest. Cephalon, Inc. Retrieved 20 November 2016.
- ^ "Cephalon Provides Clinical Update on Lestaurtinib in Relapsed Acute Myelogenous Leukemia". PR Newswire: A CISION Company. Cephalon, Inc. Retrieved 20 November 2016.
- ^ "Form 20-F (2011)". Teva Pharmaceutical Industries Ltd. Retrieved 20 November 2016.
- ^ "Google Patents". Retrieved 20 November 2016.
- ^ Kadia TM, Ravandi F, Cortes J, et al. (22 January 2016). "New drugs in acute myeloid leukemia". Annals of Oncology. 27 (5): 770–8. doi:10.1093/annonc/mdw015. PMC 4843183. PMID 26802152.