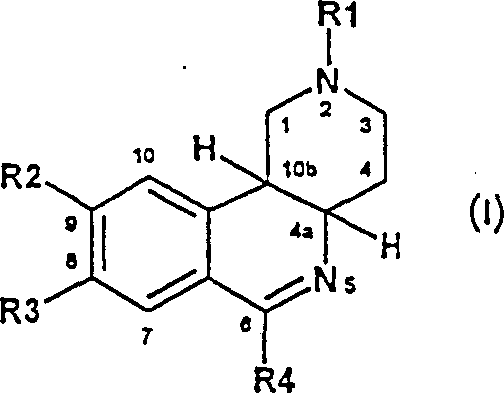
CN1090188C - 新的苯并萘啶类化合物 - Google Patents
新的苯并萘啶类化合物 Download PDFInfo
- Publication number
- CN1090188C CN1090188C CN97199529A CN97199529A CN1090188C CN 1090188 C CN1090188 C CN 1090188C CN 97199529 A CN97199529 A CN 97199529A CN 97199529 A CN97199529 A CN 97199529A CN 1090188 C CN1090188 C CN 1090188C
- Authority
- CN
- China
- Prior art keywords
- phenyl
- compound
- cis
- methyl
- hydrogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurology (AREA)
- Pulmonology (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Cardiology (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- Hematology (AREA)
- Heart & Thoracic Surgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pyrane Compounds (AREA)
- Solid-Sorbent Or Filter-Aiding Compositions (AREA)
- Plural Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
| 化合物 | PDE5 | PDE4 | PDE3 | PDE2 | PDE1 |
| [-log IC50,mol/l] | |||||
| 3 | 6.45 | 7.14 | |||
| 4 | 5.45 | 7.54 | 6.67 | 4.80 | <4 |
| 5 | 7.75 | 7.15 | |||
| 11 | 7.85 | 7.23 | |||
| 16 | 7.96 | 6.73 | |||
| 17 | 7.94 | 6.38 | |||
| 18 | 7.87 | 6.74 | |||
| 19 | 8.18 | 7.56 | |||
| 21 | 7.67 | 6.34 | |||
| 23 | 8.56 | 6.64 | |||
| 24 | 8.51 | 7.64 | |||
Claims (12)
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19646298 | 1996-11-11 | ||
| DE19646298.3 | 1996-11-11 | ||
| EP96118188 | 1996-11-13 | ||
| EP96118188.0 | 1996-11-13 | ||
| DE19739056.0 | 1997-09-05 | ||
| DE19739056 | 1997-09-05 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1236367A CN1236367A (zh) | 1999-11-24 |
| CN1090188C true CN1090188C (zh) | 2002-09-04 |
Family
ID=27216810
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN97199529A Expired - Fee Related CN1090188C (zh) | 1996-11-11 | 1997-11-05 | 新的苯并萘啶类化合物 |
Country Status (31)
| Country | Link |
|---|---|
| US (1) | US6008215A (zh) |
| EP (1) | EP0937074B1 (zh) |
| JP (1) | JP4223075B2 (zh) |
| KR (1) | KR100484045B1 (zh) |
| CN (1) | CN1090188C (zh) |
| AT (1) | ATE234300T1 (zh) |
| AU (1) | AU733129B2 (zh) |
| BG (1) | BG63695B1 (zh) |
| BR (1) | BR9713338B1 (zh) |
| CA (1) | CA2270964C (zh) |
| CY (1) | CY2476B1 (zh) |
| CZ (1) | CZ288752B6 (zh) |
| DE (1) | DE69719778T2 (zh) |
| DK (1) | DK0937074T3 (zh) |
| EA (1) | EA001551B1 (zh) |
| EE (1) | EE03829B1 (zh) |
| ES (1) | ES2195189T3 (zh) |
| GE (1) | GEP20012390B (zh) |
| HK (1) | HK1022151A1 (zh) |
| HU (1) | HU226981B1 (zh) |
| ID (1) | ID22042A (zh) |
| IL (1) | IL129054A (zh) |
| NO (1) | NO312764B1 (zh) |
| NZ (1) | NZ334976A (zh) |
| PL (1) | PL189641B1 (zh) |
| PT (1) | PT937074E (zh) |
| RS (1) | RS49607B (zh) |
| SI (1) | SI0937074T1 (zh) |
| SK (1) | SK283269B6 (zh) |
| TR (1) | TR199900856T2 (zh) |
| WO (1) | WO1998021208A1 (zh) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2195571T3 (es) | 1998-05-05 | 2003-12-01 | Altana Pharma Ag | Nuevos benzonaftiridin-n-oxidos. |
| CA2342245A1 (en) | 1998-08-31 | 2000-03-09 | Byk Gulden Lomberg Chemische Fabrik Gmbh | Benzonaphthyridine-n-oxides comprising a pde3 and pde4 inhibiting activity |
| IT1303272B1 (it) * | 1998-10-29 | 2000-11-06 | Zambon Spa | Derivati triciclici inibitori della fosfodiesterasi 4 |
| PT1147103E (pt) | 1999-01-15 | 2005-08-31 | Altana Pharma Ag | Fenantridina-n-oxidos com actividade inibitoria de pde-iv |
| JP2002534506A (ja) | 1999-01-15 | 2002-10-15 | ビイク グルデン ロンベルク ヒエーミツシエ フアブリーク ゲゼルシヤフト ミツト ベシユレンクテル ハフツング | Pde−iv抑制作用を有する多重に置換された6−フェニルフェナントリジン |
| CA2359404A1 (en) * | 1999-01-15 | 2000-07-20 | Beate Gutterer | Phenanthridine-n-oxides with pde-iv inhibiting activity |
| CA2359440C (en) * | 1999-01-15 | 2009-04-14 | Beate Gutterer | Phenylphenanthridines with pde-iv inhibiting activity |
| EA006685B1 (ru) | 1999-08-21 | 2006-02-24 | Алтана Фарма Аг | Синергетическая композиция |
| NL1017973C2 (nl) * | 2000-05-10 | 2002-11-08 | Tristem Trading Cyprus Ltd | Inrichting. |
| WO2002066476A1 (en) * | 2001-02-21 | 2002-08-29 | Altana Pharma Ag | 6-phenylbenzonaphthyridines |
| US6479493B1 (en) | 2001-08-23 | 2002-11-12 | Cell Pathways, Inc. | Methods for treatment of type I diabetes |
| RS20050117A (en) * | 2002-08-17 | 2007-06-04 | Altana Pharma Ag., | Novel benzonaphthyridines |
| US7470704B2 (en) * | 2002-09-04 | 2008-12-30 | Nycomed Gmbh | Benzonaphthyridines |
| AU2003264132B2 (en) * | 2002-09-04 | 2009-11-19 | Takeda Gmbh | Novel benzonaphthyridines |
| PT2589599E (pt) | 2004-03-03 | 2014-09-02 | Takeda Gmbh | Novas hidroxi-6-heteroarilfenantridinas e sua utilização como inibidores de pde4 |
| AR049419A1 (es) * | 2004-03-03 | 2006-08-02 | Altana Pharma Ag | Hidroxi-6-fenilfenantridinas sustituidas con heterociclilo |
| EP1725534A1 (en) * | 2004-03-10 | 2006-11-29 | Altana Pharma AG | Novel amido-substituted hydroxy-6-phenylphenanthridines and their use as pde4 inhibitors |
| JP2007529471A (ja) * | 2004-03-17 | 2007-10-25 | アルタナ ファルマ アクチエンゲゼルシャフト | 新規のn−(アルコキシアルキル)カルバモイル置換された6−フェニル−ベンゾナフチリジン誘導体及びpde3/4インヒビターとしてのそれらの使用 |
| DE602005027866D1 (de) | 2004-09-08 | 2011-06-16 | Nycomed Gmbh | 3-oxa-10-aza-phenanthrene als pde4- oder pde3/4-inhibitoren |
| JP4960870B2 (ja) * | 2004-09-08 | 2012-06-27 | ニコメッド ゲゼルシャフト ミット ベシュレンクテル ハフツング | 新規の3−チア−10−アザ−フェナントレン誘導体 |
| ME01172B (me) | 2005-03-02 | 2013-03-20 | Takeda Gmbh | (2r,4ar,10br)-6-(2,6-dimetoksipiridin-3-il)-9-etoksi-8-metoksi-1,2,3,4,4a,10b-heksahidrofenantridin-2-ol, hci so |
| WO2007045979A1 (en) | 2005-10-19 | 2007-04-26 | Ranbaxy Laboratories Limited | Pharmaceutical compositions of muscarinic receptor antagonists |
| TW200808695A (en) * | 2006-06-08 | 2008-02-16 | Amgen Inc | Benzamide derivatives and uses related thereto |
| PL2061765T3 (pl) * | 2006-09-01 | 2015-04-30 | Senhwa Biosciences Inc | Modulatory białkowych kinaz serynowo-treoninowych i PARP |
| MX2010011288A (es) | 2008-04-23 | 2010-11-09 | Rigel Pharmaceuticals Inc | Compuestos de carboxamida para el tratamiento de trastornos metabolicos. |
| AR079451A1 (es) | 2009-12-18 | 2012-01-25 | Nycomed Gmbh | Compuestos 3,4,4a,10b-tetrahidro-1h-tiopirano[4,3-c]isoquinolina |
| CN108299429B (zh) * | 2018-04-09 | 2021-10-08 | 中南大学 | 一类八氢苯并萘啶化合物及其制备方法和应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0247971A2 (en) * | 1986-05-29 | 1987-12-02 | Sandoz Ag | Novel pharmaceutical compositions comprising and use of cis-6-(4-acetanilido)-8,9-dimethoxy-2-methyl-1,2,3,4,4a,10b-hexahydrobenzo[c][1,6]naphthyridin |
| CN1056691A (zh) * | 1990-05-16 | 1991-12-04 | 比克·古尔顿·劳姆贝尔格化学公司 | 新的磺酰化合物及其制备方法 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3899494A (en) * | 1970-05-13 | 1975-08-12 | Sandoz Ltd | Substituted 6-phenyl benzo-naphthyridines |
-
1997
- 1997-11-05 CN CN97199529A patent/CN1090188C/zh not_active Expired - Fee Related
- 1997-11-05 EA EA199900421A patent/EA001551B1/ru not_active IP Right Cessation
- 1997-11-05 GE GEAP19974710A patent/GEP20012390B/en unknown
- 1997-11-05 DK DK97950093T patent/DK0937074T3/da active
- 1997-11-05 EP EP97950093A patent/EP0937074B1/en not_active Expired - Lifetime
- 1997-11-05 PL PL97333429A patent/PL189641B1/pl unknown
- 1997-11-05 WO PCT/EP1997/006096 patent/WO1998021208A1/en active IP Right Grant
- 1997-11-05 AU AU53170/98A patent/AU733129B2/en not_active Ceased
- 1997-11-05 SI SI9730535T patent/SI0937074T1/xx unknown
- 1997-11-05 PT PT97950093T patent/PT937074E/pt unknown
- 1997-11-05 US US09/284,458 patent/US6008215A/en not_active Expired - Lifetime
- 1997-11-05 ES ES97950093T patent/ES2195189T3/es not_active Expired - Lifetime
- 1997-11-05 HU HU0000426A patent/HU226981B1/hu not_active IP Right Cessation
- 1997-11-05 BR BRPI9713338-8A patent/BR9713338B1/pt not_active IP Right Cessation
- 1997-11-05 KR KR10-1999-7004024A patent/KR100484045B1/ko not_active IP Right Cessation
- 1997-11-05 CA CA002270964A patent/CA2270964C/en not_active Expired - Fee Related
- 1997-11-05 NZ NZ334976A patent/NZ334976A/xx not_active IP Right Cessation
- 1997-11-05 AT AT97950093T patent/ATE234300T1/de active
- 1997-11-05 CZ CZ19991675A patent/CZ288752B6/cs not_active IP Right Cessation
- 1997-11-05 RS YUP-194/99A patent/RS49607B/sr unknown
- 1997-11-05 DE DE69719778T patent/DE69719778T2/de not_active Expired - Lifetime
- 1997-11-05 ID IDW990180A patent/ID22042A/id unknown
- 1997-11-05 JP JP52212098A patent/JP4223075B2/ja not_active Expired - Fee Related
- 1997-11-05 SK SK623-99A patent/SK283269B6/sk not_active IP Right Cessation
- 1997-11-05 TR TR1999/00856T patent/TR199900856T2/xx unknown
- 1997-11-05 IL IL12905497A patent/IL129054A/en not_active IP Right Cessation
- 1997-11-05 EE EEP199900105A patent/EE03829B1/xx not_active IP Right Cessation
-
1999
- 1999-04-05 BG BG103310A patent/BG63695B1/bg unknown
- 1999-05-11 NO NO19992282A patent/NO312764B1/no not_active IP Right Cessation
-
2000
- 2000-02-24 HK HK00101112A patent/HK1022151A1/xx not_active IP Right Cessation
-
2004
- 2004-09-03 CY CY0400068A patent/CY2476B1/xx unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0247971A2 (en) * | 1986-05-29 | 1987-12-02 | Sandoz Ag | Novel pharmaceutical compositions comprising and use of cis-6-(4-acetanilido)-8,9-dimethoxy-2-methyl-1,2,3,4,4a,10b-hexahydrobenzo[c][1,6]naphthyridin |
| CN1056691A (zh) * | 1990-05-16 | 1991-12-04 | 比克·古尔顿·劳姆贝尔格化学公司 | 新的磺酰化合物及其制备方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1090188C (zh) | 新的苯并萘啶类化合物 | |
| CN1056373C (zh) | 含氮杂环类化合物的氟代烷氧基苄氨基衍生物的制备方法 | |
| CN1025999C (zh) | 咪唑并[4,5-b]喹啉氧烷酰胺的制备方法 | |
| CN1294577A (zh) | 钾通道抑制剂 | |
| CN1336919A (zh) | 具有pde-iv抑制活性的苯基菲啶类化合物 | |
| CN1046514C (zh) | 新型褪黑激素拮抗药、其制备方法及其药品用途 | |
| CN1126468A (zh) | 氟烷氧基取代的苯甲酰胺类及其作为环状核苷酸磷酸二酯酶抑制剂的应用 | |
| CN1141043A (zh) | 非肽类速激肽受体拮抗剂 | |
| CN1113236A (zh) | 非肽基速激肽受体拮抗剂 | |
| CN1426411A (zh) | 3-(二芳基亚甲基)-8-氮杂双环[3.2.1]辛烷衍生物 | |
| CN1671695A (zh) | 用作pde4抑制剂的吡咯烷二酮取代的哌啶-2,3-二氮杂萘酮化合物 | |
| CN1202107A (zh) | 选择性β3肾上腺素兴奋剂 | |
| CN1228087A (zh) | 取代的嘧啶衍生物和它们的药物用途 | |
| CN1524080A (zh) | 作为pde4抑制剂的2,3-二氮杂萘酮哌啶子基衍生物 | |
| CN1200120A (zh) | 作为神经激肽拮抗剂的哌嗪子基衍生物 | |
| CN1092766A (zh) | 药物 | |
| CN1040979C (zh) | 抑制精神活动的方法 | |
| CN1146562C (zh) | 作为pde4抑制剂的四氢噻喃2,3-二氮杂萘酮类衍生物 | |
| CN1019393B (zh) | 制备n-[(4-哌啶基)烷基]取代的双环稠合的唑与噻唑胺之方法 | |
| CN1168716C (zh) | 光学活性四氢苯并吲哚衍生物 | |
| CN1505624A (zh) | 哌嗪子基衍生物及其作为pde4抑制剂的用途 | |
| CN1043990C (zh) | 咪唑啉酮衍生物、其酸的加成盐及老年痴呆症的治疗药物 | |
| CN1266134C (zh) | 稠合多环化合物 | |
| CN1856491A (zh) | 作为可诱导的no合成酶抑制剂的咪唑并吡啶衍生物 | |
| CN1345317A (zh) | (1-苯甲酰甲基-3-苯基-3-哌啶基乙基)哌啶衍生物,制备它们的方法以及包含它们的药物组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C56 | Change in the name or address of the patentee |
Owner name: OTANA MEDICINE AG Free format text: FORMER NAME OR ADDRESS: BYK GULDEN LOMBERG CHEMISCHE FABRIK GMBH |
|
| CP01 | Change in the name or title of a patent holder |
Patentee after: Austana Pharmaceutical GmbH Patentee before: Byk Gulden Lomberg Chemische Fabrik |
|
| C53 | Correction of patent of invention or patent application | ||
| CB03 | Change of inventor or designer information |
Inventor after: B.Guttrell Inventor after: D.Hefner Inventor after: H*-P*Clay Inventor after: K*-J Gobel Inventor after: D.Flocks Inventor after: H.Amsler Inventor after: W -R Ulrich Inventor after: T.Martin Inventor after: T.Bayer Inventor after: A.Hazelman Inventor after: K.Sanders Inventor after: R Boyimei Inventor after: H.Persian Inventor before: B.Guttrell Inventor before: D.Hefner Inventor before: H -P clay Inventor before: K*-J Gobel Inventor before: H.Amsler Inventor before: W -R Ulrich Inventor before: T.Martin Inventor before: T.Bayer Inventor before: A.Hazelman Inventor before: K.Sanders Inventor before: R*Boyimei Inventor before: H.Persian |
|
| COR | Change of bibliographic data |
Free format text: CORRECT: INVENTOR; FROM: B. GUTTERER; H. AMSCHLER; BOER RAINER; BOER RAINER; BAYER THOMAS; A. HATZELMANN; K SANGDEERSI; R. BEUME; H PERSIAN; D HAFNER; H-P KLEIN; K-J GOEBEL TO: B. GUTTERER; H. AMSCHLER; BOER RAINER; BOER RAINER; BAYER THOMAS; A. HATZELMANN; K SANGDEERSI; R. BEUME; H PERSIAN; D HAFNER; H-P KLEIN; K-J GOEBEL; D DOVERLUOKEZI |
|
| C56 | Change in the name or address of the patentee |
Owner name: B. SCHMIDT; H. AMSCHLER; BOER RAINER; BOER RAINER; Free format text: FORMER NAME OR ADDRESS: B. GUTTERER; H. AMSCHLER; BOER RAINER; BOER RAINER; BAYER THOMAS; A. HATZELMANN; K SANGDEERSI; R. BEUME; H PERSIAN; D HAFNER; H-P KLEIN; K-J GOEBEL; D DOVERLUOKEZI |
|
| CP03 | Change of name, title or address |
Inventor after: B.Schmidt Inventor after: D.Hefner Inventor after: H*-P*Clay Inventor after: K*-J Gobel Inventor after: D.Flocks Inventor after: H.Amsler Inventor after: W -R Ulrich Inventor after: T.Martin Inventor after: T.Bayer Inventor after: A.Hazelman Inventor after: K.Sanders Inventor after: R.Boym Inventor after: H.Persian Inventor before: B.Guttrell Inventor before: H -P clay Inventor before: K*-J Gobel Inventor before: D.Flocks Inventor before: H.Amsler Inventor before: W -R Ulrich Inventor before: T.Martin Inventor before: T.Bayer Inventor before: A.Hazelman vK.Sanders Inventor before: R*Boyimei Inventor before: H.Persian Inventor before: D.Hefner |
|
| C56 | Change in the name or address of the patentee |
Owner name: NICOMEDES LIMITED LIABILITY COMPANY Free format text: FORMER NAME OR ADDRESS: OTANA MEDICINE AG |
|
| CP03 | Change of name, title or address |
Address after: Konstanz, Germany Patentee after: Nycomed GmbH Address before: The Federal Republic of Germany Konstanz Patentee before: Austana Pharmaceutical GmbH |
|
| C56 | Change in the name or address of the patentee |
Owner name: NYCOMED INC. Free format text: FORMER NAME: NYCOMED GMBH |
|
| CP01 | Change in the name or title of a patent holder |
Address after: Konstanz, Germany Patentee after: Nycomed GmbH Address before: Konstanz, Germany Patentee before: Nycomed GmbH |
|
| C56 | Change in the name or address of the patentee |
Owner name: TAKEDA GMBH Free format text: FORMER NAME: NYCOMED INC. |
|
| CP01 | Change in the name or title of a patent holder |
Address after: Konstanz, Germany Patentee after: Nycomed GmbH Address before: Konstanz, Germany Patentee before: Nycomed GmbH |
|
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20020904 Termination date: 20151105 |
|
| EXPY | Termination of patent right or utility model |