WO2012039414A1 - 置換された多環性カルバモイルピリドン誘導体のプロドラッグ - Google Patents
置換された多環性カルバモイルピリドン誘導体のプロドラッグ Download PDFInfo
- Publication number
- WO2012039414A1 WO2012039414A1 PCT/JP2011/071446 JP2011071446W WO2012039414A1 WO 2012039414 A1 WO2012039414 A1 WO 2012039414A1 JP 2011071446 W JP2011071446 W JP 2011071446W WO 2012039414 A1 WO2012039414 A1 WO 2012039414A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- substituent group
- optionally substituted
- group
- substituted
- lower alkyl
- Prior art date
Links
- 229940002612 prodrug Drugs 0.000 title claims abstract description 25
- 239000000651 prodrug Substances 0.000 title claims abstract description 25
- -1 polycyclic carbamoyl pyridone derivative Chemical class 0.000 title claims description 439
- 150000001875 compounds Chemical class 0.000 claims abstract description 665
- 108010042407 Endonucleases Proteins 0.000 claims abstract description 23
- 230000001419 dependent effect Effects 0.000 claims abstract description 23
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 23
- 102000004533 Endonucleases Human genes 0.000 claims abstract description 3
- 125000001424 substituent group Chemical group 0.000 claims description 981
- 125000000217 alkyl group Chemical group 0.000 claims description 386
- 125000000623 heterocyclic group Chemical group 0.000 claims description 268
- 125000002837 carbocyclic group Chemical group 0.000 claims description 226
- 229910052739 hydrogen Inorganic materials 0.000 claims description 139
- 239000001257 hydrogen Substances 0.000 claims description 139
- 125000003545 alkoxy group Chemical group 0.000 claims description 94
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 73
- 125000003342 alkenyl group Chemical group 0.000 claims description 61
- 150000003839 salts Chemical class 0.000 claims description 56
- 239000012453 solvate Substances 0.000 claims description 53
- 125000000304 alkynyl group Chemical group 0.000 claims description 50
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 47
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 44
- 229910052736 halogen Inorganic materials 0.000 claims description 43
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 42
- 150000002367 halogens Chemical class 0.000 claims description 41
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 41
- 125000004429 atom Chemical group 0.000 claims description 38
- 125000002947 alkylene group Chemical group 0.000 claims description 27
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 27
- 125000005843 halogen group Chemical group 0.000 claims description 25
- 125000003282 alkyl amino group Chemical group 0.000 claims description 24
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 23
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 claims description 18
- 229910052799 carbon Inorganic materials 0.000 claims description 17
- 206010022000 influenza Diseases 0.000 claims description 17
- 125000003302 alkenyloxy group Chemical group 0.000 claims description 15
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 14
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 13
- 125000004122 cyclic group Chemical group 0.000 claims description 12
- 125000004043 oxo group Chemical group O=* 0.000 claims description 12
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 11
- 125000004414 alkyl thio group Chemical group 0.000 claims description 10
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 10
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 claims description 9
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- 125000004457 alkyl amino carbonyl group Chemical group 0.000 claims description 7
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 7
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 claims description 7
- 125000004450 alkenylene group Chemical group 0.000 claims description 4
- 125000004644 alkyl sulfinyl group Chemical group 0.000 claims description 4
- 230000009471 action Effects 0.000 claims description 3
- 125000005133 alkynyloxy group Chemical group 0.000 claims description 2
- 229910052727 yttrium Inorganic materials 0.000 claims description 2
- 150000002431 hydrogen Chemical class 0.000 claims 27
- 241000712461 unidentified influenza virus Species 0.000 abstract description 6
- 230000000840 anti-viral effect Effects 0.000 abstract description 2
- LQUSVSANJKHVTM-UHFFFAOYSA-N 3-hydroxy-3h-pyridin-4-one Chemical class OC1C=NC=CC1=O LQUSVSANJKHVTM-UHFFFAOYSA-N 0.000 abstract 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 224
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 207
- 239000002904 solvent Substances 0.000 description 169
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 147
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 129
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 128
- 238000005160 1H NMR spectroscopy Methods 0.000 description 115
- 239000000243 solution Substances 0.000 description 95
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 84
- 239000000203 mixture Substances 0.000 description 84
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 79
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 77
- 239000007787 solid Substances 0.000 description 75
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 68
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 61
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 61
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 60
- 230000002829 reductive effect Effects 0.000 description 60
- 239000012046 mixed solvent Substances 0.000 description 51
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 50
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 49
- 229910052938 sodium sulfate Inorganic materials 0.000 description 49
- 235000011152 sodium sulphate Nutrition 0.000 description 49
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 45
- 238000006243 chemical reaction Methods 0.000 description 45
- 238000010898 silica gel chromatography Methods 0.000 description 45
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 42
- 238000003786 synthesis reaction Methods 0.000 description 41
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 40
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 40
- 238000010511 deprotection reaction Methods 0.000 description 38
- 238000001914 filtration Methods 0.000 description 37
- 238000000034 method Methods 0.000 description 37
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 36
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 35
- 230000015572 biosynthetic process Effects 0.000 description 34
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 33
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 32
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 31
- 239000002585 base Substances 0.000 description 31
- 239000012043 crude product Substances 0.000 description 31
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 27
- 239000010410 layer Substances 0.000 description 27
- 238000003756 stirring Methods 0.000 description 27
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 26
- 239000011541 reaction mixture Substances 0.000 description 26
- WORJEOGGNQDSOE-UHFFFAOYSA-N chloroform;methanol Chemical compound OC.ClC(Cl)Cl WORJEOGGNQDSOE-UHFFFAOYSA-N 0.000 description 24
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 22
- 239000000284 extract Substances 0.000 description 22
- 239000003921 oil Substances 0.000 description 22
- 235000019198 oils Nutrition 0.000 description 22
- 102100031780 Endonuclease Human genes 0.000 description 20
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 20
- 229910000027 potassium carbonate Inorganic materials 0.000 description 20
- 229910000029 sodium carbonate Inorganic materials 0.000 description 20
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 20
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 19
- 239000000047 product Substances 0.000 description 18
- 235000017557 sodium bicarbonate Nutrition 0.000 description 18
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 18
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 17
- 125000004432 carbon atom Chemical group C* 0.000 description 17
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 16
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 16
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 16
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 16
- 229910000024 caesium carbonate Inorganic materials 0.000 description 16
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 16
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 15
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 15
- 125000006239 protecting group Chemical group 0.000 description 15
- 125000003118 aryl group Chemical group 0.000 description 14
- 239000003795 chemical substances by application Substances 0.000 description 14
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 14
- 125000000524 functional group Chemical group 0.000 description 14
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 14
- 150000003512 tertiary amines Chemical class 0.000 description 14
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 13
- 239000000706 filtrate Substances 0.000 description 13
- 239000000126 substance Substances 0.000 description 13
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 12
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 11
- 239000007821 HATU Substances 0.000 description 11
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 11
- 238000001816 cooling Methods 0.000 description 11
- 238000010828 elution Methods 0.000 description 11
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 11
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 10
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 10
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 10
- 229910052757 nitrogen Inorganic materials 0.000 description 10
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 10
- 125000004176 4-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1F)C([H])([H])* 0.000 description 9
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 9
- 239000003153 chemical reaction reagent Substances 0.000 description 9
- 239000012044 organic layer Substances 0.000 description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 9
- 229920006395 saturated elastomer Polymers 0.000 description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 8
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 8
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical group C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 8
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 8
- 229910000104 sodium hydride Inorganic materials 0.000 description 8
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 8
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 125000003277 amino group Chemical group 0.000 description 7
- 238000004440 column chromatography Methods 0.000 description 7
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 7
- 238000001035 drying Methods 0.000 description 7
- 229910052731 fluorine Inorganic materials 0.000 description 7
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 7
- 125000002757 morpholinyl group Chemical group 0.000 description 7
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 7
- 125000006173 tetrahydropyranylmethyl group Chemical group 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 6
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 6
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 6
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 239000003054 catalyst Substances 0.000 description 6
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 6
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 6
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- 125000004433 nitrogen atom Chemical group N* 0.000 description 6
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 6
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical compound SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 6
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 5
- 125000006507 2,4-difluorobenzyl group Chemical group [H]C1=C(F)C([H])=C(F)C(=C1[H])C([H])([H])* 0.000 description 5
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 5
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 5
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- 150000001721 carbon Chemical group 0.000 description 5
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 5
- 238000010531 catalytic reduction reaction Methods 0.000 description 5
- 229910052801 chlorine Inorganic materials 0.000 description 5
- 125000001309 chloro group Chemical group Cl* 0.000 description 5
- 125000000753 cycloalkyl group Chemical group 0.000 description 5
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 239000012156 elution solvent Substances 0.000 description 5
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 5
- 235000019253 formic acid Nutrition 0.000 description 5
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 125000006301 indolyl methyl group Chemical group 0.000 description 5
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 5
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 5
- YYTWEEOFRNSTKS-UHFFFAOYSA-N n,n'-dicyclohexylmethanediimine;1-hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1.C1CCCCC1N=C=NC1CCCCC1 YYTWEEOFRNSTKS-UHFFFAOYSA-N 0.000 description 5
- YLACRFYIUQZNIV-UHFFFAOYSA-N o-(2,4-dinitrophenyl)hydroxylamine Chemical compound NOC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O YLACRFYIUQZNIV-UHFFFAOYSA-N 0.000 description 5
- 229910052763 palladium Inorganic materials 0.000 description 5
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 5
- VVWRJUBEIPHGQF-MDZDMXLPSA-N propan-2-yl (ne)-n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)\N=N\C(=O)OC(C)C VVWRJUBEIPHGQF-MDZDMXLPSA-N 0.000 description 5
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 5
- 239000012279 sodium borohydride Substances 0.000 description 5
- 229910000033 sodium borohydride Inorganic materials 0.000 description 5
- 239000012312 sodium hydride Substances 0.000 description 5
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 4
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 150000001412 amines Chemical class 0.000 description 4
- 239000012298 atmosphere Substances 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 230000018044 dehydration Effects 0.000 description 4
- 238000006297 dehydration reaction Methods 0.000 description 4
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 4
- REVROVKRCYLCAT-UHFFFAOYSA-N dimethyl 4-oxo-3-phenylmethoxypyran-2,5-dicarboxylate Chemical compound O1C=C(C(=O)OC)C(=O)C(OCC=2C=CC=CC=2)=C1C(=O)OC REVROVKRCYLCAT-UHFFFAOYSA-N 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 4
- 238000001704 evaporation Methods 0.000 description 4
- 210000004211 gastric acid Anatomy 0.000 description 4
- 239000005457 ice water Substances 0.000 description 4
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 4
- 230000007721 medicinal effect Effects 0.000 description 4
- 229910052751 metal Inorganic materials 0.000 description 4
- 239000002184 metal Substances 0.000 description 4
- 125000001624 naphthyl group Chemical group 0.000 description 4
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 4
- 125000004344 phenylpropyl group Chemical group 0.000 description 4
- 230000036470 plasma concentration Effects 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 4
- 125000004076 pyridyl group Chemical group 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 239000002994 raw material Substances 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- UKLNMMHNWFDKNT-UHFFFAOYSA-M sodium chlorite Chemical compound [Na+].[O-]Cl=O UKLNMMHNWFDKNT-UHFFFAOYSA-M 0.000 description 4
- 229960002218 sodium chlorite Drugs 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- 230000007704 transition Effects 0.000 description 4
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 4
- 125000004776 1-fluoroethyl group Chemical group [H]C([H])([H])C([H])(F)* 0.000 description 3
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 3
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 3
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 3
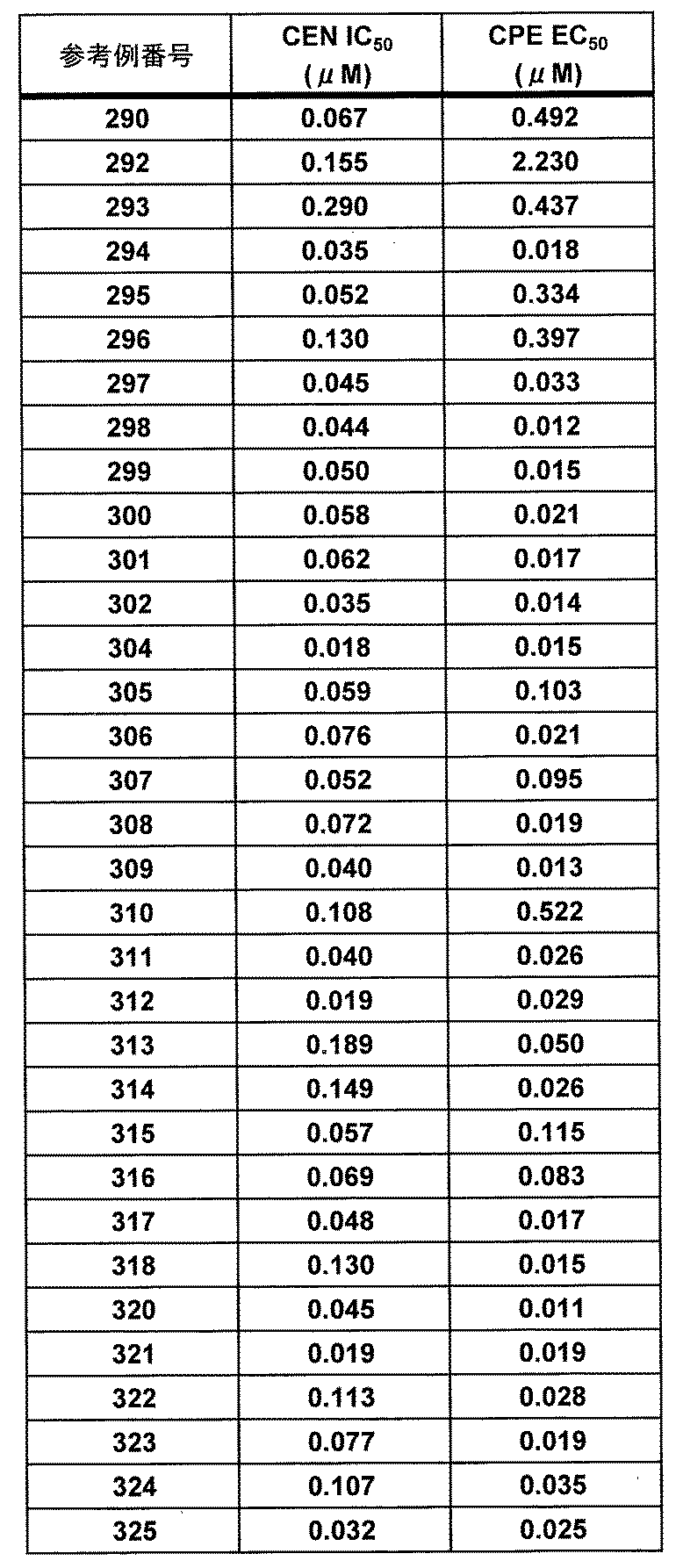
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- AUNNWHUVARSNRE-UHFFFAOYSA-N C(C)OC.C(Cl)(Cl)Cl Chemical compound C(C)OC.C(Cl)(Cl)Cl AUNNWHUVARSNRE-UHFFFAOYSA-N 0.000 description 3
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 3
- 244000166102 Eucalyptus leucoxylon Species 0.000 description 3
- 235000004694 Eucalyptus leucoxylon Nutrition 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 3
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 3
- 235000011114 ammonium hydroxide Nutrition 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- QSKWJTXWJJOJFP-UHFFFAOYSA-N chloroform;ethoxyethane Chemical compound ClC(Cl)Cl.CCOCC QSKWJTXWJJOJFP-UHFFFAOYSA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 125000000392 cycloalkenyl group Chemical group 0.000 description 3
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- 125000003493 decenyl group Chemical group [H]C([*])=C([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 150000001975 deuterium Chemical group 0.000 description 3
- 229910052805 deuterium Inorganic materials 0.000 description 3
- NPOMSUOUAZCMBL-UHFFFAOYSA-N dichloromethane;ethoxyethane Chemical compound ClCCl.CCOCC NPOMSUOUAZCMBL-UHFFFAOYSA-N 0.000 description 3
- 125000006222 dimethylaminomethyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])* 0.000 description 3
- UREBWPXBXRYXRJ-UHFFFAOYSA-N ethyl acetate;methanol Chemical compound OC.CCOC(C)=O UREBWPXBXRYXRJ-UHFFFAOYSA-N 0.000 description 3
- 125000004672 ethylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C(*)=O 0.000 description 3
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 3
- 125000001153 fluoro group Chemical group F* 0.000 description 3
- 125000006419 fluorocyclopropyl group Chemical group 0.000 description 3
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 3
- 238000007429 general method Methods 0.000 description 3
- 125000001072 heteroaryl group Chemical group 0.000 description 3
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 229910052740 iodine Inorganic materials 0.000 description 3
- 239000011630 iodine Substances 0.000 description 3
- XGZVUEUWXADBQD-UHFFFAOYSA-L lithium carbonate Chemical compound [Li+].[Li+].[O-]C([O-])=O XGZVUEUWXADBQD-UHFFFAOYSA-L 0.000 description 3
- 229910052808 lithium carbonate Inorganic materials 0.000 description 3
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 3
- GDOPTJXRTPNYNR-UHFFFAOYSA-N methyl-cyclopentane Natural products CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 3
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 3
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 3
- 230000004962 physiological condition Effects 0.000 description 3
- 125000004673 propylcarbonyl group Chemical group 0.000 description 3
- 125000003226 pyrazolyl group Chemical group 0.000 description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 3
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 3
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 3
- 235000019345 sodium thiosulphate Nutrition 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 3
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 3
- 125000005302 thiazolylmethyl group Chemical group [H]C1=C([H])N=C(S1)C([H])([H])* 0.000 description 3
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 3
- 239000008096 xylene Substances 0.000 description 3
- SDDOXKGXOXANAF-CQSZACIVSA-N (2s)-2-amino-3,3-diphenylpropan-1-ol Chemical compound C=1C=CC=CC=1C([C@@H](CO)N)C1=CC=CC=C1 SDDOXKGXOXANAF-CQSZACIVSA-N 0.000 description 2
- YZBBUYKPTHDZHF-KNVGNIICSA-N (3R)-7,2'-dihydroxy-4'-methoxyisoflavanol Chemical compound OC1=CC(OC)=CC=C1[C@H]1C(O)C2=CC=C(O)C=C2OC1 YZBBUYKPTHDZHF-KNVGNIICSA-N 0.000 description 2
- WOGITNXCNOTRLK-VOTSOKGWSA-N (e)-3-phenylprop-2-enoyl chloride Chemical compound ClC(=O)\C=C\C1=CC=CC=C1 WOGITNXCNOTRLK-VOTSOKGWSA-N 0.000 description 2
- 125000006002 1,1-difluoroethyl group Chemical group 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 2
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 2
- TVSLNRQODQRVJZ-UHFFFAOYSA-N 2-(3,4,5-trifluorophenyl)acetonitrile Chemical group FC1=CC(CC#N)=CC(F)=C1F TVSLNRQODQRVJZ-UHFFFAOYSA-N 0.000 description 2
- SFFSGPCYJCMDJM-UHFFFAOYSA-N 2-[2-(3-oxo-1,2-benzoselenazol-2-yl)ethyl]-1,2-benzoselenazol-3-one Chemical compound [se]1C2=CC=CC=C2C(=O)N1CCN1C(=O)C(C=CC=C2)=C2[se]1 SFFSGPCYJCMDJM-UHFFFAOYSA-N 0.000 description 2
- RHFIAUKMKYHHFA-UHFFFAOYSA-N 2-[[6-(3,3-difluoropyrrolidin-1-yl)-4-[1-(oxetan-3-yl)piperidin-4-yl]pyridin-2-yl]amino]pyridine-4-carbonitrile Chemical compound C1C(F)(F)CCN1C1=CC(C2CCN(CC2)C2COC2)=CC(NC=2N=CC=C(C=2)C#N)=N1 RHFIAUKMKYHHFA-UHFFFAOYSA-N 0.000 description 2
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 2
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 2
- 125000004847 2-fluorobenzyl group Chemical group [H]C1=C([H])C(F)=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- VSCBATMPTLKTOV-UHFFFAOYSA-N 2-tert-butylimino-n,n-diethyl-1,3-dimethyl-1,3,2$l^{5}-diazaphosphinan-2-amine Chemical compound CCN(CC)P1(=NC(C)(C)C)N(C)CCCN1C VSCBATMPTLKTOV-UHFFFAOYSA-N 0.000 description 2
- 125000006494 2-trifluoromethyl benzyl group Chemical group [H]C1=C([H])C([H])=C(C(=C1[H])C([H])([H])*)C(F)(F)F 0.000 description 2
- 125000006512 3,4-dichlorobenzyl group Chemical group [H]C1=C(Cl)C(Cl)=C([H])C(=C1[H])C([H])([H])* 0.000 description 2
- 125000006284 3-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C(F)=C1[H])C([H])([H])* 0.000 description 2
- 125000004208 3-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C([H])C(*)=C1[H] 0.000 description 2
- 125000004207 3-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(OC([H])([H])[H])=C1[H] 0.000 description 2
- 125000006495 3-trifluoromethyl benzyl group Chemical group [H]C1=C([H])C(=C([H])C(=C1[H])C([H])([H])*)C(F)(F)F 0.000 description 2
- 125000003143 4-hydroxybenzyl group Chemical group [H]C([*])([H])C1=C([H])C([H])=C(O[H])C([H])=C1[H] 0.000 description 2
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 2
- 125000006189 4-phenyl benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical compound NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 102000004157 Hydrolases Human genes 0.000 description 2
- 108090000604 Hydrolases Proteins 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- MZVQCMJNVPIDEA-UHFFFAOYSA-N [CH2]CN(CC)CC Chemical group [CH2]CN(CC)CC MZVQCMJNVPIDEA-UHFFFAOYSA-N 0.000 description 2
- BHIIGRBMZRSDRI-UHFFFAOYSA-N [chloro(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(Cl)OC1=CC=CC=C1 BHIIGRBMZRSDRI-UHFFFAOYSA-N 0.000 description 2
- QQIRAVWVGBTHMJ-UHFFFAOYSA-N [dimethyl-(trimethylsilylamino)silyl]methane;lithium Chemical compound [Li].C[Si](C)(C)N[Si](C)(C)C QQIRAVWVGBTHMJ-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical group 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 125000005103 alkyl silyl group Chemical group 0.000 description 2
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 2
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 125000005605 benzo group Chemical group 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 2
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000012267 brine Substances 0.000 description 2
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 2
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- AOGYCOYQMAVAFD-UHFFFAOYSA-N chlorocarbonic acid Chemical compound OC(Cl)=O AOGYCOYQMAVAFD-UHFFFAOYSA-N 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000006255 cyclopropyl carbonyl group Chemical group [H]C1([H])C([H])([H])C1([H])C(*)=O 0.000 description 2
- 125000004859 cyclopropyloxymethyl group Chemical group C1(CC1)OC* 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 2
- 125000006264 diethylaminomethyl group Chemical group [H]C([H])([H])C([H])([H])N(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 2
- 125000006260 ethylaminocarbonyl group Chemical group [H]N(C(*)=O)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000005469 ethylenyl group Chemical group 0.000 description 2
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- CJFGBCWGOQRURQ-UHFFFAOYSA-N ginsenoside Mc Natural products C1CC(C2(CCC3C(C)(C)C(O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC(C(C(O)C1O)O)OC1COC1OC(CO)C(O)C1O CJFGBCWGOQRURQ-UHFFFAOYSA-N 0.000 description 2
- NGAZZOYFWWSOGK-UHFFFAOYSA-N heptan-3-one Chemical compound CCCCC(=O)CC NGAZZOYFWWSOGK-UHFFFAOYSA-N 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 2
- 125000005956 isoquinolyl group Chemical group 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 2
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical compound CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 2
- 125000004458 methylaminocarbonyl group Chemical group [H]N(C(*)=O)C([H])([H])[H] 0.000 description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 2
- 235000020925 non fasting Nutrition 0.000 description 2
- 125000006504 o-cyanobenzyl group Chemical group [H]C1=C([H])C(C#N)=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 2
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 2
- 125000005981 pentynyl group Chemical group 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 2
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 2
- 125000005400 pyridylcarbonyl group Chemical group N1=C(C=CC=C1)C(=O)* 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000005493 quinolyl group Chemical group 0.000 description 2
- YBCAZPLXEGKKFM-UHFFFAOYSA-K ruthenium(iii) chloride Chemical compound [Cl-].[Cl-].[Cl-].[Ru+3] YBCAZPLXEGKKFM-UHFFFAOYSA-K 0.000 description 2
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 2
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 2
- CGRKYEALWSRNJS-UHFFFAOYSA-N sodium;2-methylbutan-2-olate Chemical compound [Na+].CCC(C)(C)[O-] CGRKYEALWSRNJS-UHFFFAOYSA-N 0.000 description 2
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical compound NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 2
- 125000004434 sulfur atom Chemical group 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- ONDSBJMLAHVLMI-UHFFFAOYSA-N trimethylsilyldiazomethane Chemical compound C[Si](C)(C)[CH-][N+]#N ONDSBJMLAHVLMI-UHFFFAOYSA-N 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- ARAIBEBZBOPLMB-UFGQHTETSA-N zanamivir Chemical compound CC(=O)N[C@@H]1[C@@H](N=C(N)N)C=C(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO ARAIBEBZBOPLMB-UFGQHTETSA-N 0.000 description 2
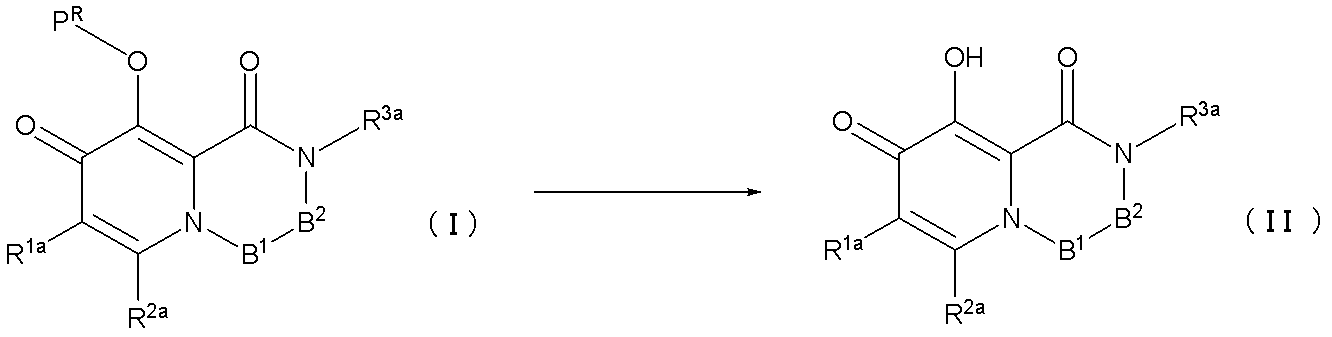
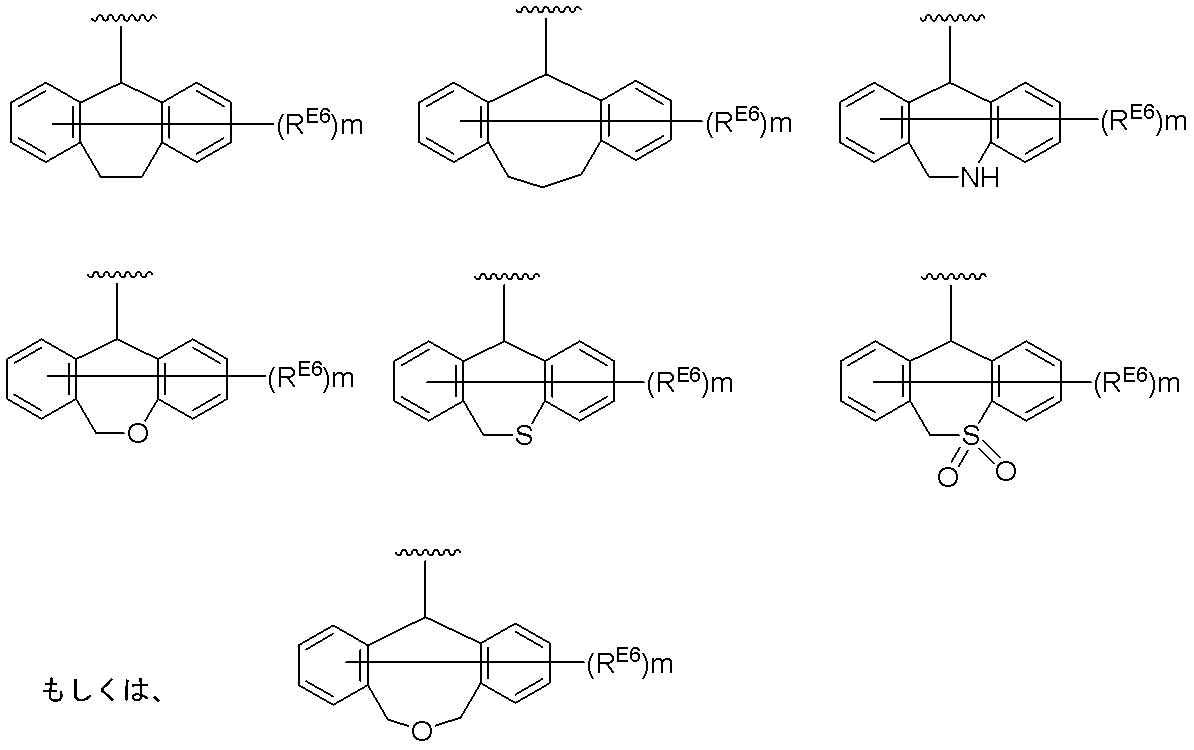
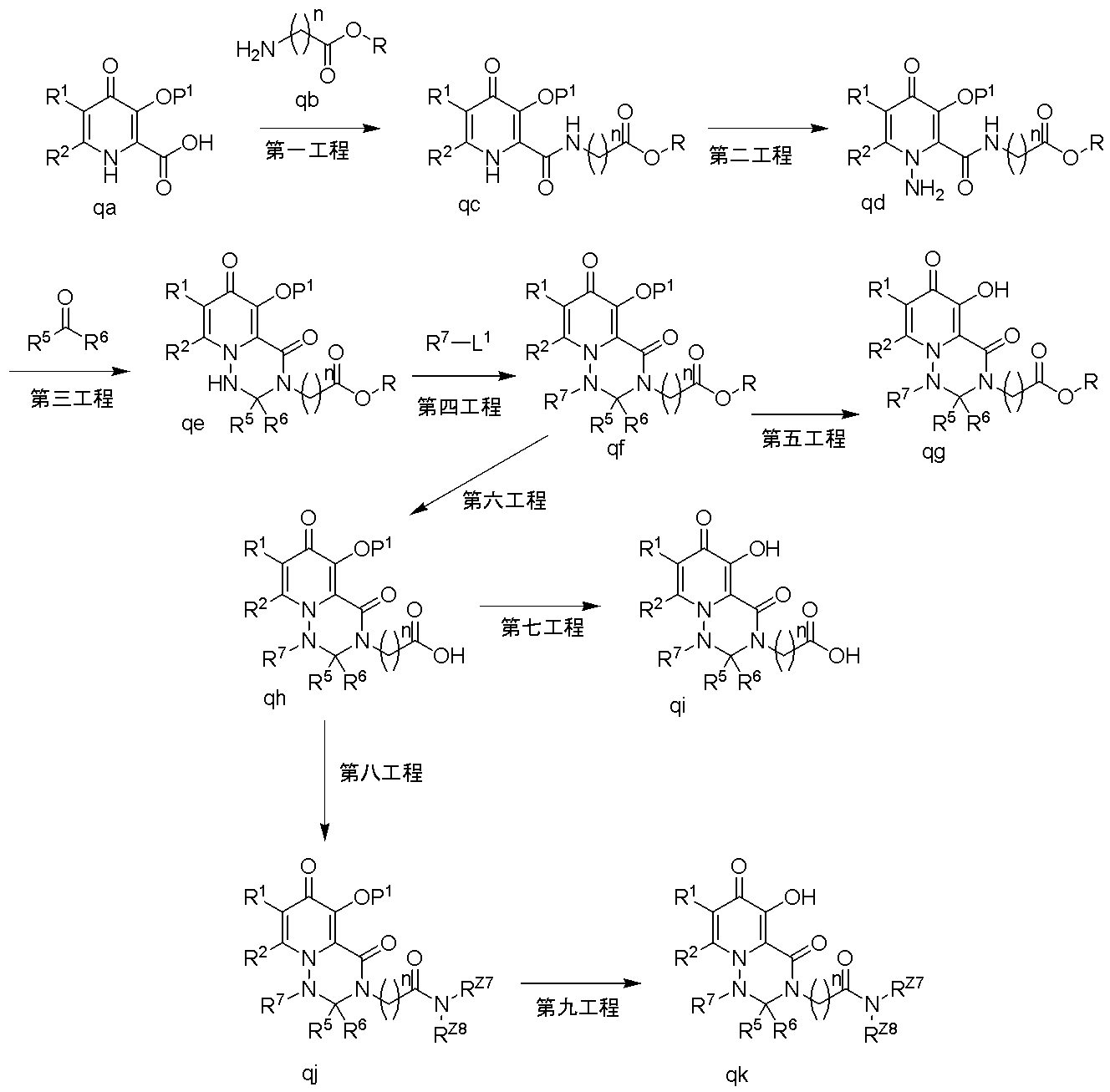
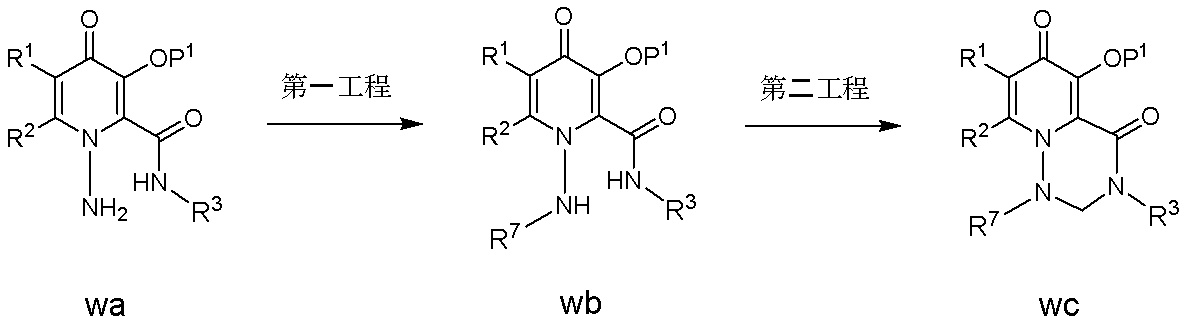
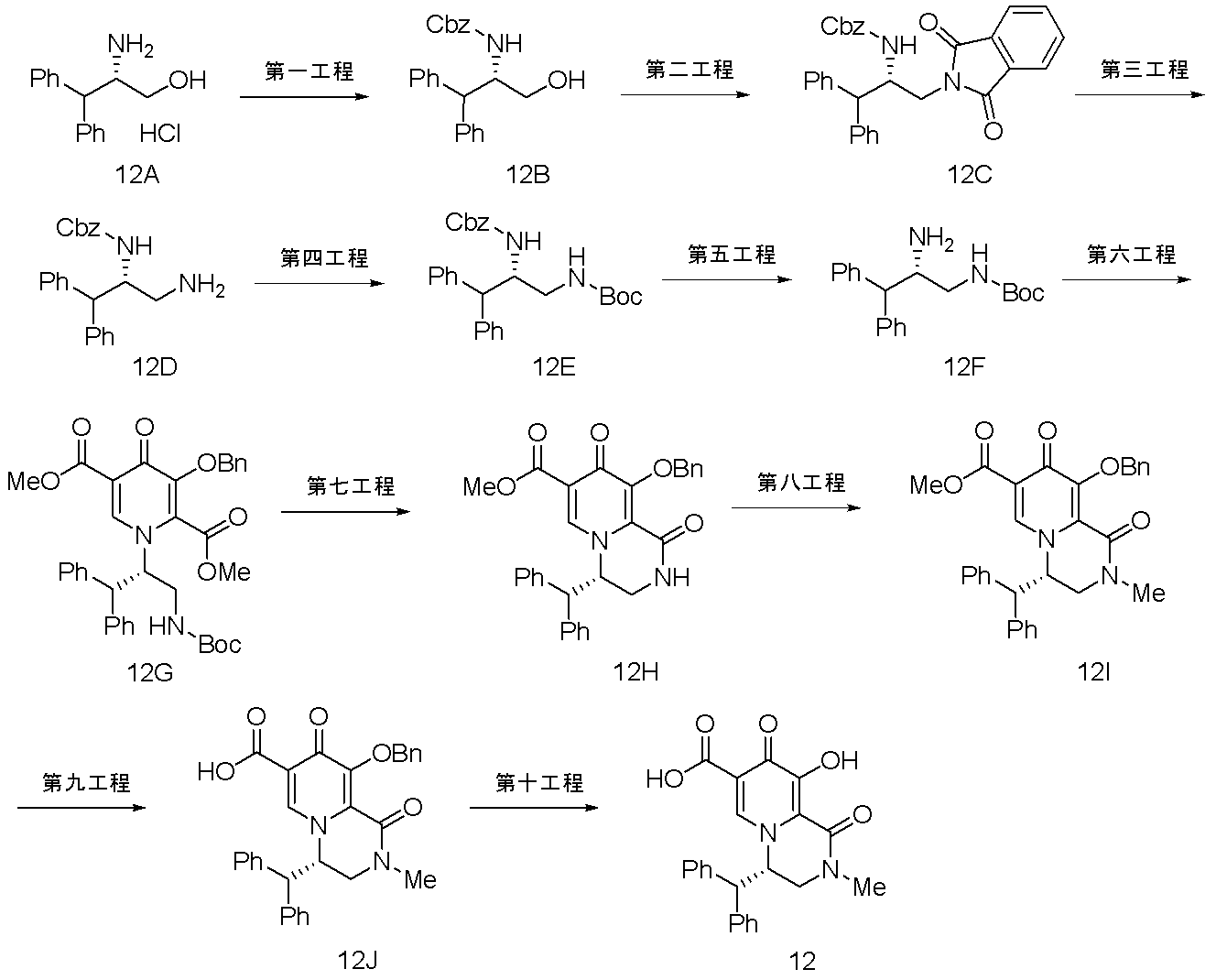
- OHEKQGOBJIKKIF-AWEZNQCLSA-N (12as)-n-[(4-fluorophenyl)methyl]-7-hydroxy-6,8-dioxo-3,4,12,12a-tetrahydro-2h-pyrido[5,6]pyrazino[2,6-b][1,3]oxazine-9-carboxamide Chemical class C([C@@H]1OCCCN1C(=O)C1=C(C2=O)O)N1C=C2C(=O)NCC1=CC=C(F)C=C1 OHEKQGOBJIKKIF-AWEZNQCLSA-N 0.000 description 1
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 1
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- GLGNXYJARSMNGJ-VKTIVEEGSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[(1-ethyl-6-methoxy-2-oxo-4,5-dihydro-3h-1-benzazepin-7-yl)amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound CCN1C(=O)CCCC2=C(OC)C(NC=3N=C(C(=CN=3)Cl)N[C@H]3[C@H]([C@@]4([H])C[C@@]3(C=C4)[H])C(N)=O)=CC=C21 GLGNXYJARSMNGJ-VKTIVEEGSA-N 0.000 description 1
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 1
- YJLIKUSWRSEPSM-WGQQHEPDSA-N (2r,3r,4s,5r)-2-[6-amino-8-[(4-phenylphenyl)methylamino]purin-9-yl]-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound C=1C=C(C=2C=CC=CC=2)C=CC=1CNC1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O YJLIKUSWRSEPSM-WGQQHEPDSA-N 0.000 description 1
- VIJSPAIQWVPKQZ-BLECARSGSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-acetamido-5-(diaminomethylideneamino)pentanoyl]amino]-4-methylpentanoyl]amino]-4,4-dimethylpentanoyl]amino]-4-methylpentanoyl]amino]propanoyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(C)=O VIJSPAIQWVPKQZ-BLECARSGSA-N 0.000 description 1
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 1
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 1
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 1
- MPDDTAJMJCESGV-CTUHWIOQSA-M (3r,5r)-7-[2-(4-fluorophenyl)-5-[methyl-[(1r)-1-phenylethyl]carbamoyl]-4-propan-2-ylpyrazol-3-yl]-3,5-dihydroxyheptanoate Chemical compound C1([C@@H](C)N(C)C(=O)C2=NN(C(CC[C@@H](O)C[C@@H](O)CC([O-])=O)=C2C(C)C)C=2C=CC(F)=CC=2)=CC=CC=C1 MPDDTAJMJCESGV-CTUHWIOQSA-M 0.000 description 1
- IIFVWLUQBAIPMJ-UHFFFAOYSA-N (4-fluorophenyl)methanamine Chemical compound NCC1=CC=C(F)C=C1 IIFVWLUQBAIPMJ-UHFFFAOYSA-N 0.000 description 1
- YQOLEILXOBUDMU-KRWDZBQOSA-N (4R)-5-[(6-bromo-3-methyl-2-pyrrolidin-1-ylquinoline-4-carbonyl)amino]-4-(2-chlorophenyl)pentanoic acid Chemical compound CC1=C(C2=C(C=CC(=C2)Br)N=C1N3CCCC3)C(=O)NC[C@H](CCC(=O)O)C4=CC=CC=C4Cl YQOLEILXOBUDMU-KRWDZBQOSA-N 0.000 description 1
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- AVQQQNCBBIEMEU-UHFFFAOYSA-N 1,1,3,3-tetramethylurea Chemical compound CN(C)C(=O)N(C)C AVQQQNCBBIEMEU-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 description 1
- KKHFRAFPESRGGD-UHFFFAOYSA-N 1,3-dimethyl-7-[3-(n-methylanilino)propyl]purine-2,6-dione Chemical compound C1=NC=2N(C)C(=O)N(C)C(=O)C=2N1CCCN(C)C1=CC=CC=C1 KKHFRAFPESRGGD-UHFFFAOYSA-N 0.000 description 1
- WORJRXHJTUTINR-UHFFFAOYSA-N 1,4-dioxane;hydron;chloride Chemical compound Cl.C1COCCO1 WORJRXHJTUTINR-UHFFFAOYSA-N 0.000 description 1
- UBCHPRBFMUDMNC-UHFFFAOYSA-N 1-(1-adamantyl)ethanamine Chemical compound C1C(C2)CC3CC2CC1(C(N)C)C3 UBCHPRBFMUDMNC-UHFFFAOYSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 1
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 1
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 1
- QXOGPTXQGKQSJT-UHFFFAOYSA-N 1-amino-4-[4-(3,4-dimethylphenyl)sulfanylanilino]-9,10-dioxoanthracene-2-sulfonic acid Chemical compound Cc1ccc(Sc2ccc(Nc3cc(c(N)c4C(=O)c5ccccc5C(=O)c34)S(O)(=O)=O)cc2)cc1C QXOGPTXQGKQSJT-UHFFFAOYSA-N 0.000 description 1
- YZUPZGFPHUVJKC-UHFFFAOYSA-N 1-bromo-2-methoxyethane Chemical compound COCCBr YZUPZGFPHUVJKC-UHFFFAOYSA-N 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000000453 2,2,2-trichloroethyl group Chemical group [H]C([H])(*)C(Cl)(Cl)Cl 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- FQMZXMVHHKXGTM-UHFFFAOYSA-N 2-(1-adamantyl)-n-[2-[2-(2-hydroxyethylamino)ethylamino]quinolin-5-yl]acetamide Chemical compound C1C(C2)CC(C3)CC2CC13CC(=O)NC1=CC=CC2=NC(NCCNCCO)=CC=C21 FQMZXMVHHKXGTM-UHFFFAOYSA-N 0.000 description 1
- PYRKKGOKRMZEIT-UHFFFAOYSA-N 2-[6-(2-cyclopropylethoxy)-9-(2-hydroxy-2-methylpropyl)-1h-phenanthro[9,10-d]imidazol-2-yl]-5-fluorobenzene-1,3-dicarbonitrile Chemical compound C1=C2C3=CC(CC(C)(O)C)=CC=C3C=3NC(C=4C(=CC(F)=CC=4C#N)C#N)=NC=3C2=CC=C1OCCC1CC1 PYRKKGOKRMZEIT-UHFFFAOYSA-N 0.000 description 1
- FMKGJQHNYMWDFJ-CVEARBPZSA-N 2-[[4-(2,2-difluoropropoxy)pyrimidin-5-yl]methylamino]-4-[[(1R,4S)-4-hydroxy-3,3-dimethylcyclohexyl]amino]pyrimidine-5-carbonitrile Chemical compound FC(COC1=NC=NC=C1CNC1=NC=C(C(=N1)N[C@H]1CC([C@H](CC1)O)(C)C)C#N)(C)F FMKGJQHNYMWDFJ-CVEARBPZSA-N 0.000 description 1
- STVVMTBJNDTZBF-UHFFFAOYSA-N 2-amino-3-phenylpropan-1-ol Chemical compound OCC(N)CC1=CC=CC=C1 STVVMTBJNDTZBF-UHFFFAOYSA-N 0.000 description 1
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 1
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 1
- NPRYCHLHHVWLQZ-TURQNECASA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynylpurin-8-one Chemical compound NC1=NC=C2N(C(N(C2=N1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C NPRYCHLHHVWLQZ-TURQNECASA-N 0.000 description 1
- JSBBMMHTNIUVTC-UHFFFAOYSA-N 2-hydroxyethanone Chemical group OC[C]=O JSBBMMHTNIUVTC-UHFFFAOYSA-N 0.000 description 1
- LFOIDLOIBZFWDO-UHFFFAOYSA-N 2-methoxy-6-[6-methoxy-4-[(3-phenylmethoxyphenyl)methoxy]-1-benzofuran-2-yl]imidazo[2,1-b][1,3,4]thiadiazole Chemical compound N1=C2SC(OC)=NN2C=C1C(OC1=CC(OC)=C2)=CC1=C2OCC(C=1)=CC=CC=1OCC1=CC=CC=C1 LFOIDLOIBZFWDO-UHFFFAOYSA-N 0.000 description 1
- ASUDFOJKTJLAIK-UHFFFAOYSA-N 2-methoxyethanamine Chemical compound COCCN ASUDFOJKTJLAIK-UHFFFAOYSA-N 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- QISAUDWTBBNJIR-UHFFFAOYSA-N 2-phenylmethoxyacetyl chloride Chemical compound ClC(=O)COCC1=CC=CC=C1 QISAUDWTBBNJIR-UHFFFAOYSA-N 0.000 description 1
- LYTXXAOHBLJBEA-UHFFFAOYSA-N 2-tert-butylimino-n,n-diethyl-1,3-dimethyl-1,3,2$l^{5}-diazaphosphol-2-amine Chemical compound CCN(CC)P1(=NC(C)(C)C)N(C)C=CN1C LYTXXAOHBLJBEA-UHFFFAOYSA-N 0.000 description 1
- QBWKPGNFQQJGFY-QLFBSQMISA-N 3-[(1r)-1-[(2r,6s)-2,6-dimethylmorpholin-4-yl]ethyl]-n-[6-methyl-3-(1h-pyrazol-4-yl)imidazo[1,2-a]pyrazin-8-yl]-1,2-thiazol-5-amine Chemical compound N1([C@H](C)C2=NSC(NC=3C4=NC=C(N4C=C(C)N=3)C3=CNN=C3)=C2)C[C@H](C)O[C@H](C)C1 QBWKPGNFQQJGFY-QLFBSQMISA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- TVOJIBGZFYMWDT-UHFFFAOYSA-N 4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrazole Chemical compound O1C(C)(C)C(C)(C)OB1C1=CNN=C1 TVOJIBGZFYMWDT-UHFFFAOYSA-N 0.000 description 1
- WYFCZWSWFGJODV-MIANJLSGSA-N 4-[[(1s)-2-[(e)-3-[3-chloro-2-fluoro-6-(tetrazol-1-yl)phenyl]prop-2-enoyl]-5-(4-methyl-2-oxopiperazin-1-yl)-3,4-dihydro-1h-isoquinoline-1-carbonyl]amino]benzoic acid Chemical compound O=C1CN(C)CCN1C1=CC=CC2=C1CCN(C(=O)\C=C\C=1C(=CC=C(Cl)C=1F)N1N=NN=C1)[C@@H]2C(=O)NC1=CC=C(C(O)=O)C=C1 WYFCZWSWFGJODV-MIANJLSGSA-N 0.000 description 1
- 125000004801 4-cyanophenyl group Chemical group [H]C1=C([H])C(C#N)=C([H])C([H])=C1* 0.000 description 1
- HXXOPVULXOEHTK-UHFFFAOYSA-N 4-methyl-1,3-dioxol-2-one Chemical compound CC1=COC(=O)O1 HXXOPVULXOEHTK-UHFFFAOYSA-N 0.000 description 1
- KJSJBKBZMGSIPT-UHFFFAOYSA-N 4-oxo-3-phenylmethoxypyran-2-carboxylic acid Chemical compound O1C=CC(=O)C(OCC=2C=CC=CC=2)=C1C(=O)O KJSJBKBZMGSIPT-UHFFFAOYSA-N 0.000 description 1
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 1
- XFJBGINZIMNZBW-CRAIPNDOSA-N 5-chloro-2-[4-[(1r,2s)-2-[2-(5-methylsulfonylpyridin-2-yl)oxyethyl]cyclopropyl]piperidin-1-yl]pyrimidine Chemical compound N1=CC(S(=O)(=O)C)=CC=C1OCC[C@H]1[C@@H](C2CCN(CC2)C=2N=CC(Cl)=CN=2)C1 XFJBGINZIMNZBW-CRAIPNDOSA-N 0.000 description 1
- HCCNBKFJYUWLEX-UHFFFAOYSA-N 7-(6-methoxypyridin-3-yl)-1-(2-propoxyethyl)-3-(pyrazin-2-ylmethylamino)pyrido[3,4-b]pyrazin-2-one Chemical compound O=C1N(CCOCCC)C2=CC(C=3C=NC(OC)=CC=3)=NC=C2N=C1NCC1=CN=CC=N1 HCCNBKFJYUWLEX-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- JQUCWIWWWKZNCS-LESHARBVSA-N C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F Chemical compound C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F JQUCWIWWWKZNCS-LESHARBVSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
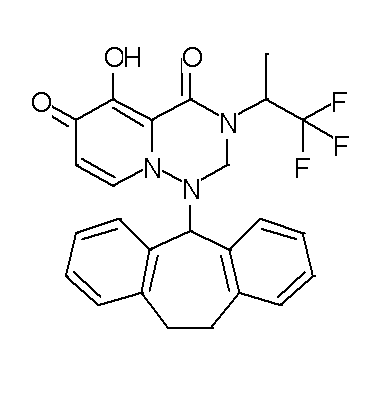
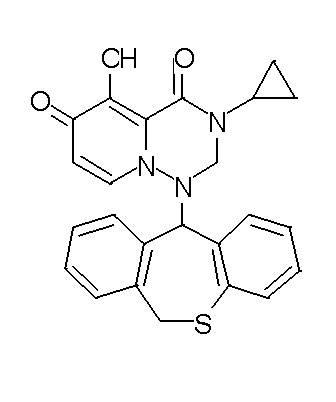
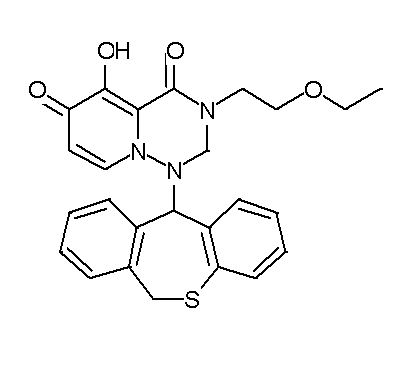
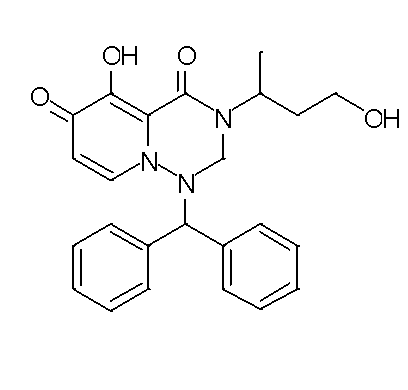
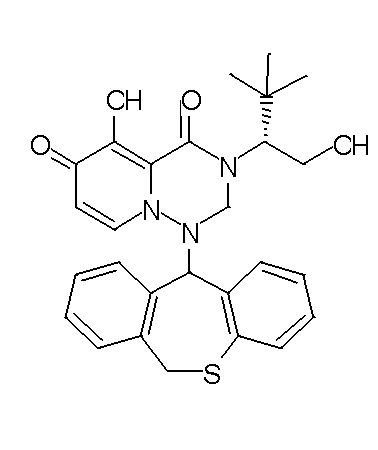
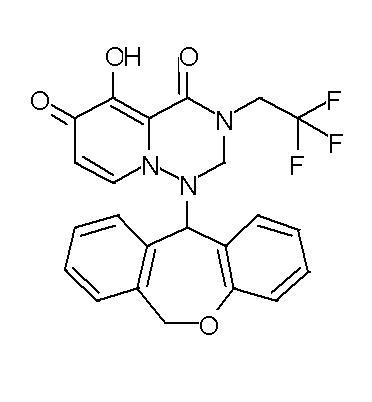
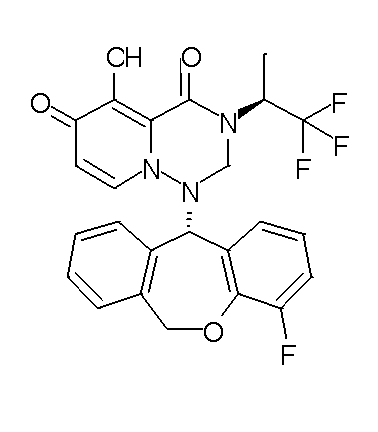
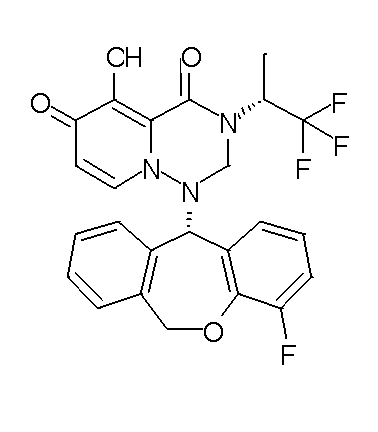
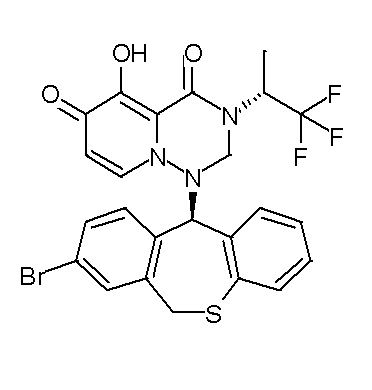
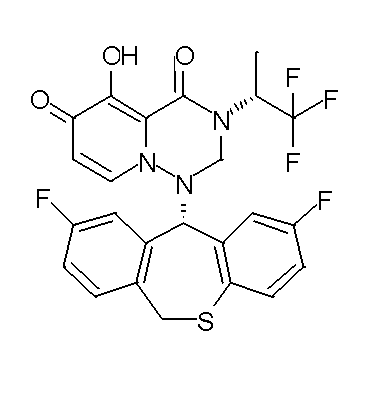
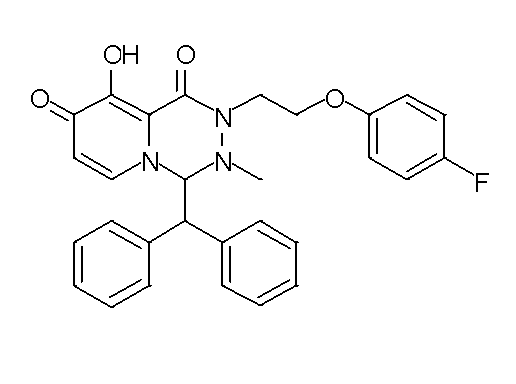
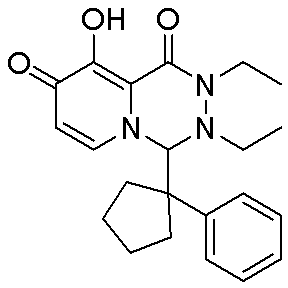
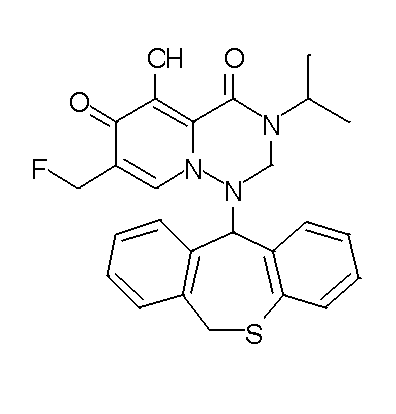
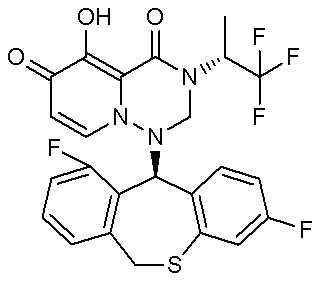
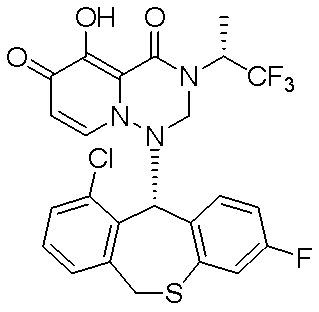
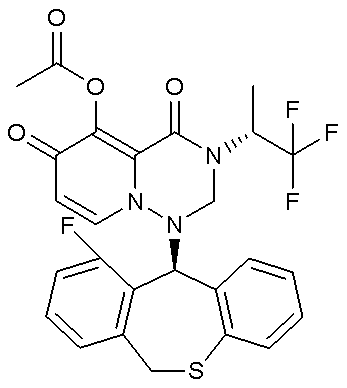
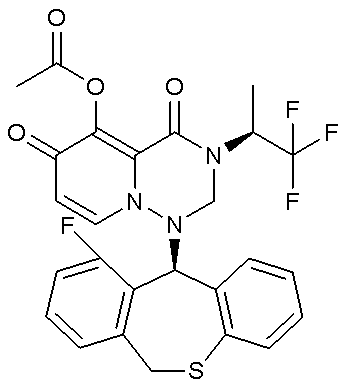
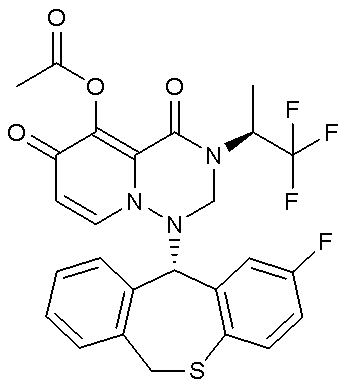
- 229940126657 Compound 17 Drugs 0.000 description 1
- 229940126639 Compound 33 Drugs 0.000 description 1
- 229940127007 Compound 39 Drugs 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 229940123734 Endonuclease inhibitor Drugs 0.000 description 1
- SIXHCCPAJIVTOY-UHFFFAOYSA-N Flutimide Natural products CC(C)CC1=NC(=CC(C)C)C(=O)N(O)C1=O SIXHCCPAJIVTOY-UHFFFAOYSA-N 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- 108010002459 HIV Integrase Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 1
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 1
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 1
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- OZBDFBJXRJWNAV-UHFFFAOYSA-N Rimantadine hydrochloride Chemical compound Cl.C1C(C2)CC3CC2CC1(C(N)C)C3 OZBDFBJXRJWNAV-UHFFFAOYSA-N 0.000 description 1
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 241000227645 Triplaris cumingiana Species 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
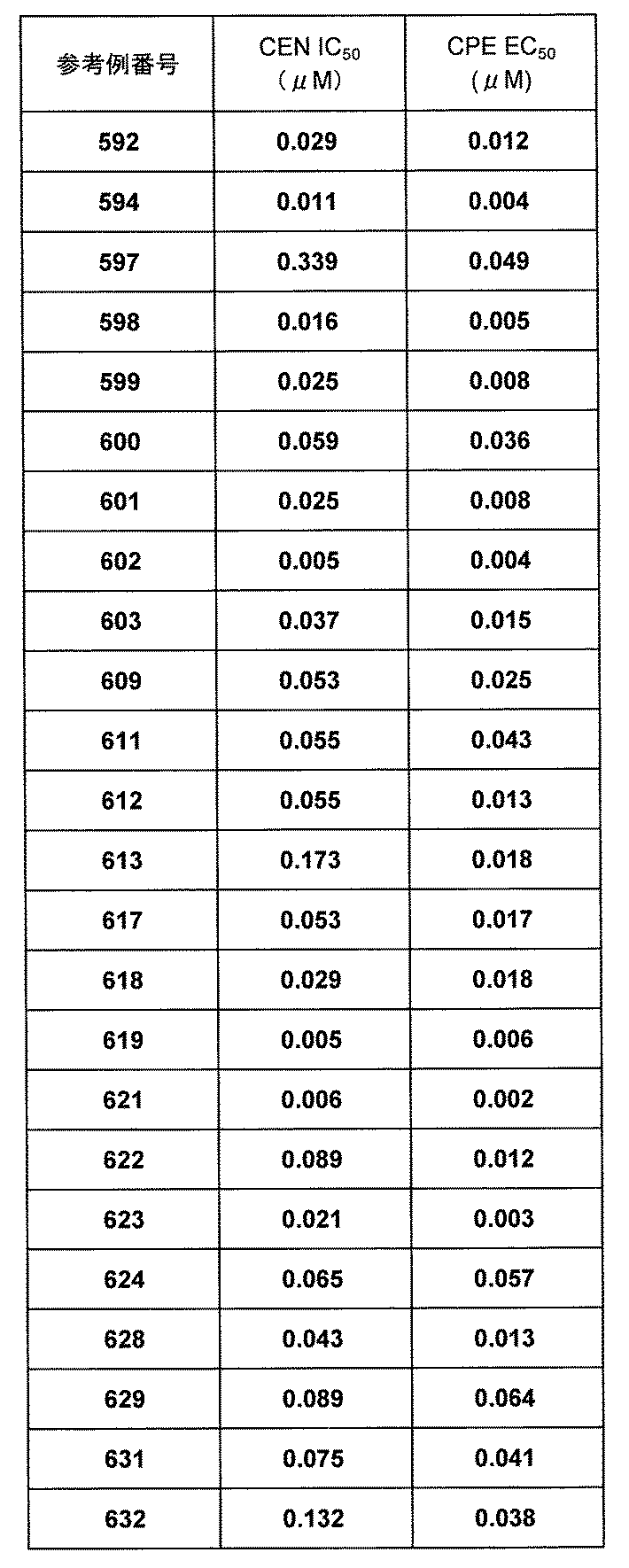
- 108020000999 Viral RNA Proteins 0.000 description 1
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 1
- SPXSEZMVRJLHQG-XMMPIXPASA-N [(2R)-1-[[4-[(3-phenylmethoxyphenoxy)methyl]phenyl]methyl]pyrrolidin-2-yl]methanol Chemical compound C(C1=CC=CC=C1)OC=1C=C(OCC2=CC=C(CN3[C@H](CCC3)CO)C=C2)C=CC=1 SPXSEZMVRJLHQG-XMMPIXPASA-N 0.000 description 1
- IOSLINNLJFQMFF-XMMPIXPASA-N [(2R)-1-[[4-[[3-[(4-fluorophenyl)methylsulfanyl]phenoxy]methyl]phenyl]methyl]pyrrolidin-2-yl]methanol Chemical compound FC1=CC=C(CSC=2C=C(OCC3=CC=C(CN4[C@H](CCC4)CO)C=C3)C=CC=2)C=C1 IOSLINNLJFQMFF-XMMPIXPASA-N 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- WXIONIWNXBAHRU-UHFFFAOYSA-N [dimethylamino(triazolo[4,5-b]pyridin-3-yloxy)methylidene]-dimethylazanium Chemical compound C1=CN=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 WXIONIWNXBAHRU-UHFFFAOYSA-N 0.000 description 1
- DBJUEJCZPKMDPA-UHFFFAOYSA-N acetic acid;zinc Chemical compound [Zn].CC(O)=O DBJUEJCZPKMDPA-UHFFFAOYSA-N 0.000 description 1
- RAFKCLFWELPONH-UHFFFAOYSA-N acetonitrile;dichloromethane Chemical compound CC#N.ClCCl RAFKCLFWELPONH-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960003805 amantadine Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 150000001414 amino alcohols Chemical class 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 1
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- KGNDCEVUMONOKF-UGPLYTSKSA-N benzyl n-[(2r)-1-[(2s,4r)-2-[[(2s)-6-amino-1-(1,3-benzoxazol-2-yl)-1,1-dihydroxyhexan-2-yl]carbamoyl]-4-[(4-methylphenyl)methoxy]pyrrolidin-1-yl]-1-oxo-4-phenylbutan-2-yl]carbamate Chemical compound C1=CC(C)=CC=C1CO[C@H]1CN(C(=O)[C@@H](CCC=2C=CC=CC=2)NC(=O)OCC=2C=CC=CC=2)[C@H](C(=O)N[C@@H](CCCCN)C(O)(O)C=2OC3=CC=CC=C3N=2)C1 KGNDCEVUMONOKF-UGPLYTSKSA-N 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 230000034303 cell budding Effects 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 239000012320 chlorinating reagent Substances 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 125000003016 chromanyl group Chemical group O1C(CCC2=CC=CC=C12)* 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
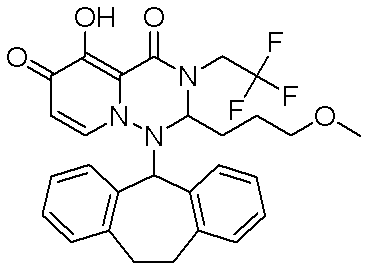
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 229940126543 compound 14 Drugs 0.000 description 1
- 229940125758 compound 15 Drugs 0.000 description 1
- 229940126142 compound 16 Drugs 0.000 description 1
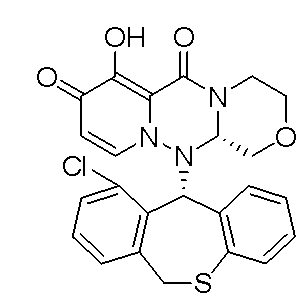
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940125810 compound 20 Drugs 0.000 description 1
- 229940126086 compound 21 Drugs 0.000 description 1
- 229940126208 compound 22 Drugs 0.000 description 1
- 229940125833 compound 23 Drugs 0.000 description 1
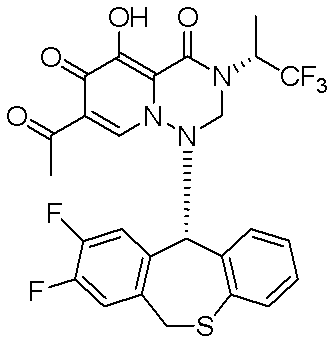
- 229940125961 compound 24 Drugs 0.000 description 1
- 229940125846 compound 25 Drugs 0.000 description 1
- 229940125851 compound 27 Drugs 0.000 description 1
- 229940127204 compound 29 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229940125878 compound 36 Drugs 0.000 description 1
- 229940125807 compound 37 Drugs 0.000 description 1
- 229940127573 compound 38 Drugs 0.000 description 1
- 229940126540 compound 41 Drugs 0.000 description 1
- 229940125936 compound 42 Drugs 0.000 description 1
- 229940125844 compound 46 Drugs 0.000 description 1
- 229940127271 compound 49 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 229940126545 compound 53 Drugs 0.000 description 1
- 229940127113 compound 57 Drugs 0.000 description 1
- 229940125900 compound 59 Drugs 0.000 description 1
- 229940125890 compound Ia Drugs 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000006637 cyclobutyl carbonyl group Chemical group 0.000 description 1
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000006639 cyclohexyl carbonyl group Chemical group 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000006638 cyclopentyl carbonyl group Chemical group 0.000 description 1
- 125000000298 cyclopropenyl group Chemical group [H]C1=C([H])C1([H])* 0.000 description 1
- 230000000120 cytopathologic effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 231100000517 death Toxicity 0.000 description 1
- 125000005070 decynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 125000004987 dibenzofuryl group Chemical group C1(=CC=CC=2OC3=C(C21)C=CC=C3)* 0.000 description 1
- 229960005215 dichloroacetic acid Drugs 0.000 description 1
- PQRPNAHMPIEDRO-UHFFFAOYSA-N dichloromethane;methoxyethane Chemical compound ClCCl.CCOC PQRPNAHMPIEDRO-UHFFFAOYSA-N 0.000 description 1
- 125000004772 dichloromethyl group Chemical group [H]C(Cl)(Cl)* 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- 125000005433 dihydrobenzodioxinyl group Chemical group O1C(COC2=C1C=CC=C2)* 0.000 description 1
- 125000004598 dihydrobenzofuryl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000005434 dihydrobenzoxazinyl group Chemical group O1N(CCC2=C1C=CC=C2)* 0.000 description 1
- 125000004925 dihydropyridyl group Chemical group N1(CC=CC=C1)* 0.000 description 1
- 125000005056 dihydrothiazolyl group Chemical group S1C(NC=C1)* 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- DGODWNOPHMXOTR-UHFFFAOYSA-N dipotassium;dioxido(dioxo)osmium;dihydrate Chemical compound O.O.[K+].[K+].[O-][Os]([O-])(=O)=O DGODWNOPHMXOTR-UHFFFAOYSA-N 0.000 description 1
- 229940042406 direct acting antivirals neuraminidase inhibitors Drugs 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 230000007159 enucleation Effects 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 125000006232 ethoxy propyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- DQYBDCGIPTYXML-UHFFFAOYSA-N ethoxyethane;hydrate Chemical compound O.CCOCC DQYBDCGIPTYXML-UHFFFAOYSA-N 0.000 description 1
- MVEAAGBEUOMFRX-UHFFFAOYSA-N ethyl acetate;hydrochloride Chemical compound Cl.CCOC(C)=O MVEAAGBEUOMFRX-UHFFFAOYSA-N 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 229940028864 flumadine Drugs 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000003784 fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 description 1
- 125000005816 fluoropropyl group Chemical group [H]C([H])(F)C([H])([H])C([H])([H])* 0.000 description 1
- SIXHCCPAJIVTOY-UITAMQMPSA-N flutimide Chemical compound CC(C)CC1=N\C(=C/C(C)C)C(=O)N(O)C1=O SIXHCCPAJIVTOY-UITAMQMPSA-N 0.000 description 1
- 239000008098 formaldehyde solution Substances 0.000 description 1
- 125000004005 formimidoyl group Chemical group [H]\N=C(/[H])* 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 150000004795 grignard reagents Chemical class 0.000 description 1
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 1
- 230000002140 halogenating effect Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000004634 hexahydroazepinyl group Chemical group N1(CCCCCC1)* 0.000 description 1
- MOTRZVVGCFFABN-UHFFFAOYSA-N hexane;2-propan-2-yloxypropane Chemical compound CCCCCC.CC(C)OC(C)C MOTRZVVGCFFABN-UHFFFAOYSA-N 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004871 hexylcarbonyl group Chemical group C(CCCCC)C(=O)* 0.000 description 1
- 125000005935 hexyloxycarbonyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000005945 imidazopyridyl group Chemical group 0.000 description 1
- 125000001841 imino group Chemical group [H]N=* 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 1
- 125000006328 iso-butylcarbonyl group Chemical group [H]C([H])([H])C([H])(C(*)=O)C([H])([H])[H] 0.000 description 1
- 125000005929 isobutyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])OC(*)=O 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005932 isopentyloxycarbonyl group Chemical group 0.000 description 1
- 125000005928 isopropyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- RENRQMCACQEWFC-UGKGYDQZSA-N lnp023 Chemical compound C1([C@H]2N(CC=3C=4C=CNC=4C(C)=CC=3OC)CC[C@@H](C2)OCC)=CC=C(C(O)=O)C=C1 RENRQMCACQEWFC-UGKGYDQZSA-N 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 125000006533 methyl amino methyl group Chemical group [H]N(C([H])([H])[H])C([H])([H])* 0.000 description 1
- QJQYPZZUKLQGGT-UHFFFAOYSA-N methyl hypobromite Chemical group COBr QJQYPZZUKLQGGT-UHFFFAOYSA-N 0.000 description 1
- UCFFGYASXIPWPD-UHFFFAOYSA-N methyl hypochlorite Chemical group COCl UCFFGYASXIPWPD-UHFFFAOYSA-N 0.000 description 1
- BLWYXBNNBYXPPL-UHFFFAOYSA-N methyl pyrrolidine-2-carboxylate Chemical compound COC(=O)C1CCCN1 BLWYXBNNBYXPPL-UHFFFAOYSA-N 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 1
- 125000004092 methylthiomethyl group Chemical group [H]C([H])([H])SC([H])([H])* 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- HDZGCSFEDULWCS-UHFFFAOYSA-N monomethylhydrazine Chemical compound CNN HDZGCSFEDULWCS-UHFFFAOYSA-N 0.000 description 1
- REPVNSJSTLRQEQ-UHFFFAOYSA-N n,n-dimethylacetamide;n,n-dimethylformamide Chemical compound CN(C)C=O.CN(C)C(C)=O REPVNSJSTLRQEQ-UHFFFAOYSA-N 0.000 description 1
- VQSRKMNBWMHJKY-YTEVENLXSA-N n-[3-[(4ar,7as)-2-amino-6-(5-fluoropyrimidin-2-yl)-4,4a,5,7-tetrahydropyrrolo[3,4-d][1,3]thiazin-7a-yl]-4-fluorophenyl]-5-methoxypyrazine-2-carboxamide Chemical compound C1=NC(OC)=CN=C1C(=O)NC1=CC=C(F)C([C@@]23[C@@H](CN(C2)C=2N=CC(F)=CN=2)CSC(N)=N3)=C1 VQSRKMNBWMHJKY-YTEVENLXSA-N 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- DLJPYODODWSDBI-UHFFFAOYSA-N n-methyl-2-nitrobenzenesulfonamide Chemical compound CNS(=O)(=O)C1=CC=CC=C1[N+]([O-])=O DLJPYODODWSDBI-UHFFFAOYSA-N 0.000 description 1
- 125000005185 naphthylcarbonyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- IOMMMLWIABWRKL-WUTDNEBXSA-N nazartinib Chemical compound C1N(C(=O)/C=C/CN(C)C)CCCC[C@H]1N1C2=C(Cl)C=CC=C2N=C1NC(=O)C1=CC=NC(C)=C1 IOMMMLWIABWRKL-WUTDNEBXSA-N 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 125000005071 nonynyl group Chemical group C(#CCCCCCCC)* 0.000 description 1
- 125000005889 octahydrochromenyl group Chemical group 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- FIYYMXYOBLWYQO-UHFFFAOYSA-N ortho-iodylbenzoic acid Chemical compound OC(=O)C1=CC=CC=C1I(=O)=O FIYYMXYOBLWYQO-UHFFFAOYSA-N 0.000 description 1
- 229960003752 oseltamivir Drugs 0.000 description 1
- VSZGPKBBMSAYNT-RRFJBIMHSA-N oseltamivir Chemical compound CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 VSZGPKBBMSAYNT-RRFJBIMHSA-N 0.000 description 1
- PGZUMBJQJWIWGJ-ONAKXNSWSA-N oseltamivir phosphate Chemical compound OP(O)(O)=O.CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 PGZUMBJQJWIWGJ-ONAKXNSWSA-N 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000005880 oxathiolanyl group Chemical group 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000004675 pentylcarbonyl group Chemical group C(CCCC)C(=O)* 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000004932 phenoxathinyl group Chemical group 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000005767 propoxymethyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])[#8]C([H])([H])* 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-O pyridinium Chemical compound C1=CC=[NH+]C=C1 JUJWROOIHBZHMG-UHFFFAOYSA-O 0.000 description 1
- 125000005554 pyridyloxy group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 229940061374 relenza Drugs 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229960000888 rimantadine Drugs 0.000 description 1
- 125000005930 sec-butyloxycarbonyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000002911 sialidase inhibitor Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 125000005750 substituted cyclic group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 125000006253 t-butylcarbonyl group Chemical group [H]C([H])([H])C(C(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229940061367 tamiflu Drugs 0.000 description 1
- 239000013076 target substance Substances 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- OGVCRJDQGBIHAG-QGZVFWFLSA-N tert-butyl n-[(2s)-3-hydroxy-1,1-diphenylpropan-2-yl]carbamate Chemical compound C=1C=CC=CC=1C([C@@H](CO)NC(=O)OC(C)(C)C)C1=CC=CC=C1 OGVCRJDQGBIHAG-QGZVFWFLSA-N 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 125000005063 tetradecenyl group Chemical group C(=CCCCCCCCCCCCC)* 0.000 description 1
- 125000005886 tetrahydrobenzothienyl group Chemical group 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000005942 tetrahydropyridyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000005458 thianyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000004588 thienopyridyl group Chemical group S1C(=CC2=C1C=CC=N2)* 0.000 description 1
- 125000004587 thienothienyl group Chemical group S1C(=CC2=C1C=CS2)* 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 125000005505 thiomorpholino group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000004784 trichloromethoxy group Chemical group ClC(O*)(Cl)Cl 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 150000004684 trihydrates Chemical class 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000005065 undecenyl group Chemical group C(=CCCCCCCCCC)* 0.000 description 1
- 125000005500 uronium group Chemical group 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000006656 viral protein synthesis Effects 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 229960001028 zanamivir Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/53—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with three nitrogens as the only ring hetero atoms, e.g. chlorazanil, melamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/541—Non-condensed thiazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D253/00—Heterocyclic compounds containing six-membered rings having three nitrogen atoms as the only ring hetero atoms, not provided for by group C07D251/00
- C07D253/08—Heterocyclic compounds containing six-membered rings having three nitrogen atoms as the only ring hetero atoms, not provided for by group C07D251/00 condensed with carbocyclic rings or ring systems
- C07D253/10—Condensed 1,2,4-triazines; Hydrogenated condensed 1,2,4-triazines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
- C07F9/65616—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings containing the ring system having three or more than three double bonds between ring members or between ring members and non-ring members, e.g. purine or analogs
Definitions
- the present invention relates to a substituted polycyclic carbamoylpyridone derivative exhibiting cap-dependent endonuclease inhibitory activity, a prodrug thereof, and a pharmaceutical composition containing them.
- Influenza is an acute respiratory infection caused by influenza virus infection. There are millions of influenza-like patients reported every winter in Japan, and influenza is associated with high morbidity and mortality. It is a particularly important disease in high-risk groups such as infants and the elderly. The elderly have a high rate of pneumonia, and many deaths due to influenza account for the elderly.
- Anti-influenza drugs such as symmetrel (trade name: Amantadine) and flumadine (trade name: rimantadine), which inhibit the virus enucleation process, inhibit budding and release of virus from cells.
- the neuraminidase inhibitors Oseltamivir (trade name: Tamiflu) and Zanamivir (trade name: Relenza) are known.
- Oseltamivir trade name: Tamiflu
- Zanamivir trade name: Relenza
- Cap-dependent endonuclease an influenza virus-derived enzyme, is essential for virus growth and is considered to be suitable as a target for anti-influenza drugs because it is a virus-specific enzyme activity that the host does not have .
- the cap-dependent endonuclease is an endonuclease activity that generates a fragment of 9 to 13 bases (including the base of the cap structure in the number) including the cap structure using the host mRNA precursor as a substrate. This fragment functions as a primer for viral RNA polymerase and is used to synthesize mRNA encoding the viral protein. That is, it is considered that a substance that inhibits cap-dependent endonuclease inhibits viral growth as a result of inhibiting viral protein synthesis by inhibiting viral mRNA synthesis.
- Patent Document 1 and Non-Patent Documents 1 and 2 As substances that inhibit the cap-dependent endonuclease, flutimide (Patent Document 1 and Non-Patent Documents 1 and 2), 4-substituted 2,4-dioxobutanoic acid (Non-Patent Documents 3 to 5) and the like have been reported. However, it has not yet been used clinically as an anti-influenza drug.
- Patent Documents 2 to 16 and Non-Patent Document 6 describe compounds having a structure similar to that of the compound of the present invention as compounds having HIV integrase inhibitory activity, but there is no description of cap-dependent endonucleases. .
- Patent Document 17 describes an invention related to a “substituted polycyclic carbamoylpyridone derivative” having a cap-dependent endonuclease inhibitory activity filed by the applicant, and a description of a prodrug related to the present invention. Has not been.
- An object of the present invention is to provide a compound having an antiviral action, particularly an influenza virus growth inhibitory activity. Another object of the present invention is to provide a compound exhibiting a high pharmacological effect that is efficiently absorbed into the body after administration by converting the compound used for administration to a living body (for example, oral administration) into a prodrug. . More preferably, the present invention provides a compound that suppresses the growth of influenza virus by having a cap-dependent endonuclease inhibitory activity after administration to a living body, and a medicament containing the same.
- R 1a is hydrogen, halogen, hydroxy, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituted with substituent group C Lower alkynyl which may be substituted, lower alkyloxy which may be substituted with substituent group C, lower alkenyloxy which may be substituted with substituent group C, and lower which may be substituted with substituent group C Alkylcarbonyl, lower alkyloxycarbonyl optionally substituted with substituent group C, carbocyclic group optionally substituted with substituent group C, carbocyclic lower alkyl optionally substituted with substituent group C A carbocyclic oxy optionally substituted with substituent group C, a carbocyclic oxycarbonyl optionally substituted with substituent group C, and a compound optionally substituted with substituent group C.
- R A4 , R A6 , R A10 , and R A11 are each independently lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituent group C Lower alkynyl optionally substituted with, carbocyclic group optionally substituted with substituent group C, heterocyclic group optionally substituted with substituent group C, substituted with substituent group C Selected from a substituent group consisting of optionally substituted carbocyclic lower alkyl, and heterocyclic lower alkyl optionally substituted with substituent group C; R A1 and R A2 , R A15 and R A16 , and R
- R 2a is hydrogen, halogen, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, or substituted with substituent group C.
- Lower alkynyl which may be substituted, lower alkyloxy which may be substituted with substituent group C, lower alkenyloxy which may be substituted with substituent group C, lower alkylcarbonyl which may be substituted with substituent group C , Lower alkyloxycarbonyl which may be substituted with substituent group C, carbocyclic group which may be substituted with substituent group C, carbocyclic lower alkyl which may be substituted with substituent group C, substituted Carbocyclic carbonyl optionally substituted with group C, carbocyclic oxy optionally substituted with substituent group C, carbocyclic oxycarboni optionally substituted with substituent group C , Heterocyclic group optionally substituted with substituent group C, heterocyclic lower alky
- R B2 and R B11 are each independently a lower alkyl optionally substituted with substituent group C, a lower alkenyl optionally substituted with substituent group C, or optionally substituted with substituent group C.
- R 3a is hydrogen, halogen, hydroxy, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituted with substituent group C Lower alkynyl which may be substituted, lower alkyloxy which may be substituted with substituent group C, lower alkenyloxy which may be substituted with substituent group C, and lower which may be substituted with substituent group C Alkylcarbonyl, lower alkyloxycarbonyl optionally substituted with substituent group C, carbocyclic group optionally substituted with substituent group C, carbocyclic lower alkyl optionally substituted with substituent group C , Carbocyclic oxy-lower alkyl optionally substituted with substituent group C, carbocyclic carbonyl optionally substituted with substituent group C, substituted with substituent group C Good carbocyclic oxy, carbocyclic oxycarbonyl optionally substituted with substituent group C, heterocyclic group
- R C7 and R C8 , and R C9 and R C10 may be combined with adjacent atoms to form a heterocycle, and Z is a single bond or a linear or branched lower alkylene );
- B 1 and B 2 are either CR 5a R 6a and the other is NR 7a , or b) B 1 is CR 8a R 9a and B 2 is CR 10a R 11a ,
- R 5a , R 6a , R 7a , R 8a , R 9a , R 10a and R 11a are each independently hydrogen, carboxy, cyano, lower alkyl optionally substituted with substituent group C, substituent group C Lower alkenyl optionally substituted with substituent group C, lower alkynyl optionally substituted with substituent group C, lower alkylcarbonyl optionally substituted with substituent group C, optionally substituted with substituent group C Lower alkyloxycarbonyl, carbocyclic group optionally substituted with substituent group C, carbocycle optionally substituted with substituent group C, carbocycle optionally substituted with substituent group C Oxy lower alkyl, carbocyclic carbonyl optionally substituted with substituent group C, carbocyclic oxycarbonyl optionally substituted with substituent group C, optionally substituted with substituent group C Heterocyclic group, heterocyclic lower alkyl optionally substituted with substituent group C, heterocyclic oxy lower alkyl optional
- R D2 and R D3 are each independently lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, or optionally substituted with substituent group C.
- R D7 , R D8 , and R D10 are each independently a carbocyclic group that may be substituted with the substituent group C, or a heterocyclic group that may be substituted with the substituent group C;
- R D5 and R D6 may form a heterocyclic ring together with adjacent atoms, Y is straight chain or branched lower alkylene, and Z is a single bond or straight chain or branched lower alkylene).
- R D5 and R D6 may be combined with adjacent atoms to form a carbocycle;
- B 1 is CR 5a R 6a and B 2 is NR 7a R 3a and R 7a together with adjacent atoms may form a heterocyclic ring which may be substituted with substituent group D; 2) When B 1 is NR 7a and B 2 is CR 5a R 6a R 3a and R 6a may form a heterocyclic ring which may be substituted with the substituent group D together with adjacent atoms, or 3) B 1 is CR 8a R 9a and B 2 is In the case of CR 10a R 11a , R 8a and R 10a may form a carbocyclic or heterocyclic ring which may be substituted with the substituent group D together with adjacent atoms, or R 3a and R 11a may be adjacent atoms And may form a heterocyclic ring which may be substituted with substituent group D together with
- R 8a is CR 8a R 9a and B 2 is CR 10a R 11a and R 9a is hydrogen and R 11a is hydrogen
- R 8a or R 10a is -ZC (R E1 ) (R E2 ) (R E3 ) -YS-R E4 , -Z-CH 2 -R E5 or a group shown below:
- R E1 and R E2 each independently comprise a carbocyclic group optionally substituted with substituent group C and a heterocyclic group optionally substituted with substituent group C.
- R E3 is hydrogen, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, lower alkynyl optionally substituted with substituent group C, substituent A carbocyclic group optionally substituted with group C, a heterocyclic group optionally substituted with substituent group C, a carbocyclic lower alkyl optionally substituted with substituent group C, and a substituent group Selected from the group of substituents consisting of heterocyclic lower alkyl optionally substituted with C;
- R E4 is selected from the substituent group consisting of carbocyclic lower alkyl optionally substituted with substituent group C and heterocyclic lower alkyl optionally substituted with substituent group C;
- R E5 is an aromatic heterocyclic group which may be substituted with the substituent group C, R E6 is selected from substituent group C;
- m is 0 or an integer of 1 or more, Provided that m R E6 are groups selected from the substituent group C and
- R 8a or R 10a is Hydrogen, carboxy, cyano, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, lower alkynyl optionally substituted with substituent group C, substituent In lower alkylcarbonyl optionally substituted with group C, lower alkyloxycarbonyl optionally substituted with substituent group C, carbocyclic group optionally substituted with substituent group C, and substituent group C Optionally substituted carbocyclic lower alkyl, optionally substituted carbocyclic oxy-lower alkyl, optionally substituted carbocyclic carbonyl optionally substituted by substituent group C, substituted by substituent group C Optionally substituted carbocyclic oxycarbonyl, optionally substituted heterocyclic group, optionally substituted heterocyclic group optionally substituted with lower alkyl group, optionally substituted with substituent group C.
- heterocyclic-lower alkyl optionally substituted with a substituent group C heterocyclic carbonyl, optionally substituted with a substituent group C heterocyclic oxycarbonyl
- R F1 , R F2 , R F3 , and R F4 are each independently hydrogen, lower alkyl optionally substituted with substituent group C, or lower alkyl optionally substituted with substituent group C.
- Substituent group C halogen, cyano, hydroxy, carboxy, formyl, amino, oxo, nitro, lower alkyl, lower alkenyl, lower alkynyl, halogeno lower alkyl, lower alkyloxy, lower alkynyloxy, lower alkylthio, hydroxy lower alkyl, carbon Cyclic group, heterocyclic group, oxo-substituted heterocyclic group, carbocyclic lower alkyloxy, carbocyclic oxy lower alkyl, carbocyclic lower alkyloxy lower alkyl, heterocyclic lower alkyloxy, heterocyclic oxy lower alkyl, heterocyclic Lower alkyloxy lower alkyl, halogeno lower alkyloxy, lower alkyloxy lower alkyl, lower alkyloxy lower alkyloxy, lower alkylcarbonyl, lower alkylcarbonyloxy, lower alkyloxycarbonyl, lower alkylamino Lower alkylcarbonylamin
- Substituent group D halogen, cyano, hydroxy, carboxy, formyl, amino, oxo, nitro, lower alkyl, halogeno lower alkyl, lower alkyloxy, carbocyclic lower alkyloxy, heterocyclic lower alkyloxy, halogeno lower alkyloxy, lower Alkyloxy lower alkyl, lower alkyloxy lower alkyloxy, lower alkylcarbonyl, lower alkyloxycarbonyl, lower alkylamino, lower alkylcarbonylamino, lower alkylaminocarbonyl, lower alkylsulfonyl, lower alkylsulfonylamino, substituted with substituent group C
- R 1a is substituted with hydrogen, halogen, hydroxy, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, or substituent group C
- Lower alkynyl which may be substituted, lower alkyloxy which may be substituted with substituent group C, lower alkenyloxy which may be substituted with substituent group C, and lower which may be substituted with substituent group C
- R 1a may be substituted with hydrogen, halogen, hydroxy, carboxy, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, or substituted group C Good lower alkyloxy, lower alkylcarbonyl optionally substituted with substituent group C, lower alkyloxycarbonyl optionally substituted with substituent group C, heterocyclic optionally substituted with substituent group C A group, or —ZN (R A1 ) (R A2 ) (Substituent group C, R A1 , R A2 and Z are as defined in item 1) The compound according to item 1, or a pharmaceutically acceptable salt thereof, or a solvate thereof.
- R 2a is hydrogen, lower alkyl which may be substituted with substituent group C, carbocyclic lower alkyl which may be substituted with substituent group C, heterocyclic lower ring which may be substituted with substituent group C Alkyl or -ZN (R B9 ) (R B10 ) (Substituent group C, R B9 , R B10 , and Z are as defined in item 1)
- R 2a is hydrogen or lower alkyl optionally substituted with substituent group C (substituent group C is as defined in item 1)
- substituent group C is as defined in item 1
- R 3a is hydrogen, lower alkyl which may be substituted with substituent group C, carbocyclic group which may be substituted with substituent group C, or heterocyclic which may be substituted with substituent group C
- B 1 is NR 7a and B 2 is CR 5a R 6a and R 5a , R 6a and R 7a are each independently substituted with hydrogen, carboxy, cyano, substituent group C Good lower alkyl, Lower alkenyl optionally substituted with substituent group C, Lower alkynyl optionally substituted with substituent group C, Lower alkylcarbonyl optionally substituted with substituent group C, Substituent group Lower alkyloxycarbonyl optionally substituted with C, carbocyclic group optionally substituted with substituent group C, carbocyclic lower alkyl optionally substituted with substituent group C, substituent group C Optionally substituted carbocyclic oxy-lower alkyl, optionally substituted carbocyclic carbonyl with substituent group C, optionally substituted carbocyclic oxycarbonyl with substituent group C, substituted Heterocyclic group optionally substituted with group C, heterocyclic lower alkyl optionally substituted with substituent group C, heterocycl
- B 1 is NR 7a and B 2 is CR 5a R 6a ;
- R 5a is hydrogen;
- R 6a is hydrogen or lower alkyl optionally substituted with substituent group C, and
- R 7a is optionally substituted with lower alkyl optionally substituted with substituent group C or substituent group C.
- Carbocyclic lower alkyl, heterocyclic lower alkyl optionally substituted with substituent group C, or —ZC (R D7 ) (R D8 ) (R D9 ) (Substituent group C, R D7 , R D8 , R D9 , and Z are as defined in item 1)
- B 1 is CR 5a R 6a and B 2 is NR 7a ;
- R 5a is hydrogen;
- R 6a is hydrogen or lower alkyl optionally substituted with substituent group C, and
- R 7a is optionally substituted with lower alkyl optionally substituted with substituent group C or substituent group C.
- Carbocyclic lower alkyl, heterocyclic lower alkyl optionally substituted with substituent group C, or —ZC (R D7 ) (R D8 ) (R D9 ) (Substituent group C, R D7 , R D8 , R D9 , and Z are as defined in item 1)
- R 7a is a group represented by: (Wherein R E6 and m have the same meanings as item 1) The compound according to any one of items 11 or 12, or a pharmaceutically acceptable salt thereof, or a solvate thereof.
- R 1a is hydrogen or carboxy, R 2a is hydrogen; R 3a is lower alkyl optionally substituted with substituent group C, B 1 is NR 7a and B 2 is CH 2 and R 7a is a group shown below: (Wherein, substituent group C, R E6 , and m have the same meanings as item 1) The compound according to item 1, or a pharmaceutically acceptable salt thereof, or a solvate thereof.
- B 1 is CR 8a R 9a and B 2 is CR 10a R 11a ; R 9a is hydrogen, and R 11a is hydrogen, and
- R 8a or R 10a is The groups shown below: (Wherein R E6 and m have the same meanings as item 1) And; and
- R 8a or R 10a is Hydrogen or lower alkyl optionally substituted by substituent group C (Substituent group C is as defined in item 1); 10.
- substituent group C is as defined in item 1; 10.
- B 1 is CR 5a R 6a and B 2 is NR 7a ;
- R 6a is hydrogen;
- R 3a and R 7a together with adjacent atoms form a heterocyclic ring that may be substituted with substituent group D, and
- R 5a is hydrogen, a carbocyclic group that may be substituted with substituent group C, a carbocyclic lower alkyl that may be substituted with substituent group C, or a heterocycle that may be substituted with substituent group C.
- a heterocyclic group which may be substituted with a cyclic group or substituent group C (wherein substituent group C is as defined in item 1) Item 17.
- B 1 is CR 8a R 9a and B 2 is CR 10a R 11a ;
- R 9a is hydrogen, and
- R 10a is hydrogen, R 3a and R 11a together with the adjacent atoms form a heterocyclic ring that may be substituted with substituent group D, and
- R 8a is hydrogen, a carbocyclic group that may be substituted with substituent group C, a carbocyclic lower alkyl that may be substituted with substituent group C, or a heterocycle that may be substituted with substituent group C.
- a heterocyclic group which may be substituted with a cyclic group or substituent group C (wherein substituent group C is as defined in item 1) Item 19.
- the substituent group D may be a carbocyclic group that may be substituted with the substituent group C, a heterocyclic group that may be substituted with the substituent group C, or a carbon that may be substituted with the substituent group C.
- Ring lower alkyl, or heterocyclic lower alkyl optionally substituted with substituent group C (substituent group C is as defined in item 1)
- PR2 represents lower alkyl optionally substituted with substituent group F, carbocyclic group optionally substituted with substituent group F, or heterocyclic group optionally substituted with substituent group F
- PR3 is a lower alkyl which may be substituted with the substituent group F, a carbocyclic group which may be substituted with the substituent group F, a heterocyclic group which may be substituted with the substituent group F
- Lower alkylamino optionally substituted with substituent group F carbocyclic lower alkyl optionally substituted with substituent group F, heterocyclic lower alkyl optionally substituted with substituent group F, or lower alkyl Cyril
- PR 4 is a carbocyclic group which may be substituted with the substituent group F, a heterocyclic group which may be substituted with the substituent group F
- PR 5 is substituted with the substituent group F.
- Substituent group F oxo, lower alkyl, hydroxy lower alkyl, amino, lower alkylamino, carbocyclic lower alkyl, lower alkylcarbonyl, halogen, hydroxy, carboxy, lower alkylcarbonylamino, lower alkylcarbonyloxy, lower alkyloxycarbonyl, Lower alkyloxy, cyano, nitro) 21.
- (Item 22) 22 A pharmaceutical composition comprising a compound according to any one of items 1 to 21, a pharmaceutically acceptable salt thereof, or a solvate thereof.
- a cap-dependent endonuclease inhibitor comprising the compound according to any one of items 1 to 21, a pharmaceutically acceptable salt thereof, or a solvate thereof.
- the present invention further provides a method for treating or preventing influenza infection using the prodrug compound, and the compound having an anti-influenza action.
- the present invention further provides a parent compound of the above prodrug compound.
- the parent compound is useful as an anti-influenza agent or an intermediate of the prodrug compound.
- the compound according to the present invention has an inhibitory activity against a cap-dependent endonuclease.
- a more preferable compound is a prodrug, which becomes a parent compound having an inhibitory activity against a cap-dependent endonuclease in the body after administration, and thus is useful as a therapeutic and / or prophylactic agent for influenza infection.
- “It may be substituted with substituent group C” means that it may be substituted at any position with one or two or more identical or different substituents selected from substituent group C. The same applies to “may be substituted with substituent group D” and “may be substituted with substituent group F”.
- prodrug refers to the following reaction formula:
- each symbol has the same meaning as item 1
- CEN cap-dependent endonuclease
- AUC area under the blood concentration curve
- the prodrug is preferably absorbed into the body efficiently after being administered to a living body (for example, oral administration) in the stomach and / or intestine, etc., and then converted into a compound represented by the formula (II). Shows a higher influenza treatment and / or prevention effect than the compound represented by the formula (II).
- group that forms a prodrug refers to the following reaction formula:
- each symbol has the same meaning as item 1
- P R groups in formula (I)
- part of the -OP R groups drug-metabolizing enzyme in vivo under physiological conditions, hydrolysis enzyme, gastric acid, the decomposition reaction caused by the intestinal bacteria, etc.
- the “group that forms a prodrug” is more preferably added to the compound represented by the formula (II), thereby allowing the bioavailability and / or AUC (under the blood concentration curve) of the compound represented by the formula (II). It means a group that improves the area.
- the “P R ” group in the —OP R group of formula (I) may be any group that can be converted into an —OH group in vivo, and is preferably a variety of substituted carbonyl groups, substituted oxy lower alkyl groups (eg, Substituted oxymethyl), optionally substituted cyclic group lower alkyl (eg, optionally substituted cyclic group methyl), or optionally substituted imino lower alkyl (eg, optionally substituted).
- PR2 represents lower alkyl optionally substituted with substituent group F, carbocyclic group optionally substituted with substituent group F, or heterocyclic group optionally substituted with substituent group F
- PR3 is a lower alkyl which may be substituted with the substituent group F, a carbocyclic group which may be substituted with the substituent group F, a heterocyclic group which may be substituted with the substituent group F
- Lower alkylamino optionally substituted with substituent group F carbocyclic lower alkyl optionally substituted with substituent group F, heterocyclic lower alkyl optionally substituted with substituent group F, or lower alkyl Cyril
- PR 4 is a carbocyclic group which may be substituted with the substituent group F, a heterocyclic group which may be substituted with the substituent group F
- PR 5 is substituted with the substituent group F.
- Substituent group F oxo, lower alkyl, hydroxy lower alkyl, amino, lower alkylamino, carbocyclic lower alkyl, lower alkylcarbonyl, halogen, hydroxy, carboxy, lower alkylcarbonylamino, lower alkylcarbonyloxy, lower alkyloxycarbonyl, Lower alkyloxy, cyano, nitro)
- the “P R ” group in the —OP R group of formula (I) is preferably a group selected from the following b), k), l) and m).
- b) -C ( O) -P R1 , l) —CH 2 —O—C ( ⁇ O) —P R3 , m) —CH 2 —O—C ( ⁇ O) —O—P R3 , n) —CH (—CH 3 ) —O—C ( ⁇ O) —O—P R3 , (In the formula, each symbol is as defined above.)
- prodrugation refers to the following reaction formula:
- each symbol has the same meaning as item 1
- it means to convert the formula (II) or a pharmaceutically acceptable salt or a hydroxy group solvate thereof, in -OP R group.
- the “parent compound” is a compound that is a raw material before the synthesis of the “prodrug” and / or is released from the “prodrug” by a reaction with an enzyme, gastric acid, or the like under physiological conditions in vivo. Specifically, it means a compound represented by the above formula (II), or a pharmaceutically acceptable salt thereof, or a solvate thereof.
- Halogen includes fluorine, chlorine, bromine and iodine. Preferred are fluorine, chlorine and bromine.
- Lower alkyl includes linear or branched alkyl having 1 to 15 carbon atoms, preferably 1 to 10 carbon atoms, more preferably 1 to 6 carbon atoms, and still more preferably 1 to 4 carbon atoms.
- lower alkyl examples include methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl and n-pentyl. Further preferred examples include methyl, ethyl, n-propyl, isopropyl and tert-butyl.
- Lower alkenyl has 2 to 15 carbon atoms, preferably 2 to 10 carbon atoms, more preferably 2 to 6 carbon atoms, more preferably 2 to 4 carbon atoms, having one or more double bonds at any position. Of linear or branched alkenyl.
- Preferred embodiments of “lower alkenyl” include vinyl, allyl, propenyl, isopropenyl and butenyl.
- “Lower alkynyl” refers to straight or branched alkynyl having 2 to 10, preferably 2 to 8, and more preferably 3 to 6 carbon atoms having one or more triple bonds at any position. Include. Specifically, ethynyl, propynyl, butynyl, pentynyl, hexynyl, heptynyl, octynyl, nonynyl, decynyl and the like are included. These may further have a double bond at an arbitrary position. Preferred embodiments of “lower alkynyl” include ethynyl, propynyl, butynyl and pentynyl.
- the lower alkenyl part of “lower alkenyloxy” is the same as the above “lower alkenyl”.
- the halogen part of “halogeno lower alkyl”, “halogeno lower alkyloxy”, and “halogeno lower alkylcarbonylamino” is the same as the above “halogen”.
- any position on the alkyl group of “lower alkyl”, “lower alkyloxy”, and “lower alkylcarbonylamino” may be substituted with the same or different halogen atoms.
- Carbocyclic group” or “carbocycle” means a carbocyclic group having 3 to 20 carbon atoms, preferably 3 to 16 carbon atoms, more preferably 4 to 12 carbon atoms. , Aryl and non-aromatic fused carbocyclic groups and the like.
- cycloalkyl is a carbocyclic group having 3 to 16 carbon atoms, preferably 3 to 12 carbon atoms, more preferably 4 to 8 carbon atoms, such as cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cyclohexane.
- cycloalkenyl includes those having one or more double bonds at any position in the cycloalkyl ring, for example, cyclopropenyl, cyclobutenyl, cyclopentenyl, cyclohexenyl, cyclo Examples include heptynyl, cyclooctynyl and cyclohexadienyl.
- aryl means an aromatic carbocyclic group, including phenyl, naphthyl, anthryl, phenanthryl and the like, and phenyl is particularly preferred.
- non-aromatic fused carbocyclic group includes a group in which two or more cyclic groups selected from the above “cycloalkyl”, “cycloalkenyl” and “aryl” are condensed, for example, indanyl , Indenyl, tetrahydronaphthyl, fluorenyl, adamantyl, and the groups shown below
- Carbocyclic group or “carbocycle” include cycloalkyl, aryl and non-aromatic fused carbocyclic groups, specifically cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, Cycloheptyl, phenyl, naphthyl, and groups shown below
- heterocyclic group or “heterocycle” means a heteroaryl, non-aromatic heterocyclic group or bicyclic ring having at least one hetero atom selected from O, S and N in the ring.
- a heterocyclic group such as a fused heterocyclic group, a fused heterocyclic group of 3 rings, a fused heterocyclic group of 4 rings, and the like.
- heteroaryl refers to pyrrolyl, imidazolyl, pyrazolyl, pyridyl, pyridazinyl, pyrimidinyl, pyrazinyl, triazolyl, triazinyl, tetrazolyl, furyl, thienyl, isoxazolyl, oxazolyl, oxadiazolyl, isothiazolyl, thiazolyl, thiadiazolyl, etc. Membered aromatic cyclic groups.
- non-aromatic heterocyclic group means dioxanyl, thiylyl, oxiranyl, oxetanyl, oxathiolanyl, azetidinyl, thianyl, thiazolidinyl, pyrrolidinyl, pyrrolinyl, imidazolidinyl, imidazolinyl, pyrazolidinyl, pyrazolinyl, piperidyl, morpholinyl, morpholinyl, morpholinyl, morpholinyl, morpholinyl, morpholinyl , Thiomorpholinyl, thiomorpholino, dihydropyridyl, tetrahydropyridyl, tetrahydrofuryl, tetrahydropyranyl, dihydrothiazolyl, tetrahydrothiazolyl, tetrahydroisothiazolyl, dihydrooxazinyl,
- bicyclic fused heterocyclic group means indolyl, isoindolyl, indazolyl, indolizinyl, indolinyl, isoindolinyl, quinolyl, isoquinolyl, cinnolinyl, phthalazinyl, quinazolinyl, naphthyridinyl, quinoxalinyl, purinyl, pteridinyl, benzopyranyl, benzimidazolyl , Benzotriazolyl, benzisoxazolyl, benzoxazolyl, benzoxadiazolyl, benzoisothiazolyl, benzothiazolyl, benzothiadiazolyl, benzofuryl, isobenzofuryl, benzothienyl, benzotriazolyl, thienopyridyl, Thienopyrrolyl, thienopyrazo
- tricyclic fused heterocyclic group means carbazolyl, acridinyl, xanthenyl, phenothiazinyl, phenoxathinyl, phenoxazinyl, dibenzofuryl, imidazoquinolyl, tetrahydrocarbazolyl, and the groups shown below
- heterocyclic groups containing at least one 4- to 8-membered aromatic or non-aromatic heterocyclic group.
- heterocyclic group include 5- to 6-membered heteroaryl, non-aromatic heterocyclic group, and 3-ring fused heterocyclic group.
- Heterocyclic lower alkyl “heterocyclic lower alkyloxy”, “carbocyclic oxy lower alkyl”, “heterocyclic carbonyl”, “heterocyclic oxy”, “heterocyclic oxycarbonyl”, and “heterocyclic lower alkyloxy lower”
- the heterocyclic moiety of “alkyl” is the same as the above “heterocyclic group” or “heterocycle”.
- oxo-substituted heterocyclic group means that the “heterocyclic group” is substituted with oxo as follows.
- linear or branched lower alkylene is the above-mentioned divalent “lower alkyl”, and includes, for example, methylene, ethylene, propylene, butylene, isobutylene, pentylene, heptylene, dimethylmethylene, ethylmethylmethylene, 1 , 2, -dimethylethylene and the like.
- lower alkyloxy examples include methoxy, ethoxy, propyloxy, isopropyloxy, tert-butyloxy, isobutyloxy, sec-butyloxy, pentyloxy, isopentyloxy, hexyloxy and the like.
- Preferred embodiments include methoxy, ethoxy, propyloxy, isopropyloxy, tert-butyloxy.
- lower alkylcarbonyl examples include methylcarbonyl, ethylcarbonyl, propylcarbonyl, isopropylcarbonyl, tert-butylcarbonyl, isobutylcarbonyl, sec-butylcarbonyl, pentylcarbonyl, isopentylcarbonyl, hexylcarbonyl and the like.
- Preferred embodiments include methylcarbonyl, ethylcarbonyl, and propylcarbonyl.
- lower alkyloxycarbonyl examples include methyloxycarbonyl, ethyloxycarbonyl, propyloxycarbonyl, isopropyloxycarbonyl, tert-butyloxycarbonyl, isobutyloxycarbonyl, sec-butyloxycarbonyl, pentyloxycarbonyl, isopentyloxycarbonyl , Hexyloxycarbonyl and the like.
- Preferred embodiments include methyloxycarbonyl, ethyloxycarbonyl, and propyloxycarbonyl.
- Carbocyclic lower alkyl refers to lower alkyl substituted with one or more carbocyclic groups.
- Carbocyclic lower alkyl examples include benzyl, phenethyl, phenylpropynyl, benzhydryl, trityl, cyclo Propylmethyl, cyclobutylmethyl, cyclopentylmethyl, cyclohexylmethyl, naphthylmethyl, groups shown below
- Heterocyclic lower alkyl refers to lower alkyl substituted with one or more heterocyclic groups, including those where the alkyl moiety is substituted with a carbocyclic group.
- heterocyclic lower alkyl examples include pyridylmethyl, tetrahydropyranylmethyl, furanylmethyl, morpholinylethyl, imidazolylmethyl, indolylmethyl, benzothiophenylmethyl, oxazolylmethyl, isoxazolylmethyl, thiazolylmethyl, Isothiazolylmethyl, pyrazolylmethyl, isopyrazolylmethyl, pyrrolidinylmethyl, benzoxazolylmethyl, piperidinylmethyl, piperazinylmethyl, groups shown below
- Preferable embodiments include pyridylmethyl, tetrahydropyranylmethyl, furanylmethyl, morpholinylethyl.
- Examples of “carbocyclic oxy lower alkyl” include phenyloxymethyl, phenyloxyethyl, cyclopropyloxymethyl, cyclopropyloxyethyl, cyclobutyloxymethyl, cyclobutyloxyethyl, cyclohexyloxymethyl, cyclohexyloxyethyl Etc.
- Preferable embodiments include phenyloxymethyl and phenyloxyethyl.
- heterocyclic oxy-lower alkyl examples include pyridyloxymethyl, pyridyloxyethyl, morpholinyloxymethyl, morpholinyloxyethyl, benzoxazolyloxymethyl and the like. Preferable embodiments include pyridyloxymethyl, morpholinyloxymethyl and the like.
- Carbocyclic lower alkyloxy refers to lower alkyloxy in which the alkyl moiety is substituted with one or more carbocyclic groups.
- Carbocyclic lower alkyloxy examples include phenylmethyloxy, phenylethyl Examples include oxy, cyclopropylmethyloxy, cyclobutylmethyloxy, cyclopentylmethyloxy, cyclohexylmethyloxy and the like. Preferable embodiments include phenylmethyloxy, cyclopropylmethyloxy and the like.
- Heterocyclic lower alkyloxy refers to lower alkyloxy in which the alkyl moiety is substituted with one or more heterocyclic groups, including those in which the alkyl moiety is substituted with a carbocyclic group.
- heterocyclic lower alkyloxy examples include pyridylmethyloxy, pyridylethyloxy, imidazolylmethyloxy, imidazolylethyloxy, benzoxazolylmethyloxy, benzoxazolylethyloxy and the like.
- lower alkyloxy lower alkyl examples include methoxymethyl, methoxyethyl, ethoxymethyl, ethoxyethyl, methoxypropyl, methoxybutyl, ethoxypropyl, ethoxybutyl, isopropyloxymethyl, tert-butyloxymethyl and the like.
- Preferred embodiments include methoxymethyl, methoxyethyl, ethoxymethyl, and ethoxyethyl.
- lower alkyloxy lower alkyloxy include methoxymethoxy, methoxyethoxy, ethoxymethoxy, ethoxyethoxy, methoxypropyloxy, methoxybutyloxy Ethoxypropyloxy, ethoxybutyloxy, isopropyloxymethyloxy, tert-butyloxymethyloxy and the like.
- Preferable embodiments include methoxymethoxy, methoxyethoxy, ethoxymethoxy, and ethoxyethoxy.
- lower alkylamino examples include methylamino, dimethylamino, ethylamino, diethylamino, isopropylamino, N, N-diisopropylamino, N-methyl-N-ethylamino, N-isopropyl-N-ethylamino and the like. It is done. Preferable embodiments include methylamino, dimethylamino, ethylamino, and diethylamino.
- lower alkylcarbonylamino examples include methylcarbonylamino, ethylcarbonylamino, propylcarbonylamino, isopropylcarbonylamino, tert-butylcarbonylamino, isobutylcarbonylamino, sec-butylcarbonylamino and the like.
- Preferable embodiments include methylcarbonylamino and ethylcarbonylamino.
- lower alkylaminocarbonyl examples include methylaminocarbonyl, dimethylaminocarbonyl, ethylaminocarbonyl, diethylaminocarbonyl, isopropylaminocarbonyl, N, N-diisopropylaminocarbonyl, N-methyl-N-ethylaminocarbonyl, N-isopropyl -N-ethylaminocarbonyl and the like.
- Preferable embodiments include methylaminocarbonyl, dimethylaminocarbonyl, ethylaminocarbonyl, and diethylaminocarbonyl.
- lower alkylsulfonyl examples include methylsulfonyl, ethylsulfonyl, propylsulfonyl, isopropylsulfonyl, tert-butylsulfonyl, isobutylsulfonyl, sec-butylsulfonyl and the like.
- Preferable embodiments include methylsulfonyl and ethylsulfonyl.
- lower alkylsulfonylamino examples include methylsulfonylamino, ethylsulfonylamino, propylsulfonylamino, isopropylsulfonylamino, tert-butylsulfonylamino, isobutylsulfonylamino, sec-butylsulfonylamino and the like.
- Preferable embodiments include methylsulfonylamino and ethylsulfonylamino.
- lower alkenyloxy examples include ethylenyloxy, 1-propylenyloxy, 2-propylenyloxy, 1-butylenyloxy, 2-butylenyloxy, 3-butylenyloxy and the like.
- halogeno lower alkyl examples include monofluoromethyl, monofluoroethyl, monofluoropropyl, 2,2,3,3,3-pentafluoropropyl, monochloromethyl, trifluoromethyl, trichloromethyl, 2,2,2 -Trifluoroethyl, 2,2,2-trichloroethyl, 1,2-dibromoethyl, 1,1,1-trifluoropropan-2-yl and the like.
- Preferred examples include trifluoromethyl, trichloromethyl, 1,1,1-trifluoropropan-2-yl.
- halogeno lower alkyloxy examples include monofluoromethoxy, monofluoroethoxy, trifluoromethoxy, trichloromethoxy, trifluoroethoxy, trichloroethoxy and the like. Preferable embodiments include trifluoromethoxy and trichloromethoxy.
- lower alkylthio examples include methylthio, ethylthio, propylthio and the like.
- hydroxy lower alkyl include hydroxymethyl, hydroxyethyl, hydroxypropyl, and the like.
- Examples of “carbocyclic lower alkyloxy lower alkyl” include benzyloxymethyl, benzyloxyethyl, benzhydryloxymethyl and the like.
- Examples of “heterocyclic lower alkyloxy lower alkyl” include pyridylmethyloxymethyl, pyridylmethyloxyethyl and the like.
- Examples of “lower alkylcarbonyloxy” include methylcarbonyloxy, ethylcarbonyloxy and the like.
- Examples of “halogeno lower alkylcarbonylamino” include trifluoromethylcarbonylamino, 2,2,3,3,3-pentafluoropropylcarbonylamino and the like.
- Examples of “lower alkylsulfinyl” include methylsulfinyl, ethylsulfinyl and the like.
- Carbocycle carbonyl examples include phenylcarbonyl, naphthylcarbonyl, cyclopropylcarbonyl, cyclobutylcarbonyl, cyclopentylcarbonyl, cyclohexylcarbonyl and the like.
- Carbocyclic oxy examples include phenyloxy, naphthyloxy, cyclopropyloxy, cyclobutyloxy, cyclopentyloxy, cyclohexyloxy and the like.
- Examples of “carbocyclic oxycarbonyl” include phenyloxycarbonyl, naphthyloxycarbonyl, cyclopropyloxycarbonyl, cyclobutyloxycarbonyl, cyclopentyloxycarbonyl, cyclohexyloxycarbonyl and the like.
- Examples of “heterocyclic carbonyl” include pyridylcarbonyl, benzoxazolylcarbonyl, morpholinylcarbonyl, tetrahydropyranylcarbonyl and the like.
- Examples of “heterocyclicoxy” include pyridyloxy, benzoxazolyloxy, morpholinyloxy, tetrahydropyranyloxy and the like.
- heterocyclic oxycarbonyl examples include pyridyloxycarbonyl, benzoxazolyloxycarbonyl, morpholinyloxycarbonyl, tetrahydropyranyloxycarbonyl and the like.
- R A1 and R A2 , R A15 and R A16 , and R A19 and R A20 may be combined with adjacent atoms to form a heterocyclic ring
- R B7 and R B8 , and R B9 and R B10 may be combined with adjacent atoms to form a heterocycle
- R C7 and R C8 , and R C9 and R C10 may be combined with adjacent atoms to form a heterocycle
- R D5 and R D6 are combined with adjacent atoms.
- May form a heterocyclic ring means a heterocyclic ring having an N atom, for example, a group shown below
- R E6 m in the group means that any carbon atom or nitrogen atom which may have a chemical substituent on the ring is substituted with m same or different R E6. To do.
- R E6 Means that any hydrogen atom of the substituent R E6 on the two benzene rings and the seven-membered ring containing the sulfur atom may be replaced by R E6 , and each R E6 May be the same or different.
- ma is preferably an integer of 0 to 3
- mb is preferably an integer of 0 to 3
- mc is preferably an integer of 0 or 1.
- ma is more preferably an integer of 0 or 1
- mb is more preferably an integer of 0 or 1
- mc is more preferably 0.
- the ring portion is the same selected from one or more substituent groups D Alternatively, it may be substituted at any position with a different substituent.
- the heterocyclic ring is preferably a 5- to 7-membered ring.
- “the heterocyclic ring may form a condensed ring” means that the ring in the formula (I ′) may be further condensed, and the substituent group D is represented by the above formula (I It shows that it may be bonded to either the ring or the condensed ring in ').
- formula (I ′) a compound represented by the following formula
- R x and R y are substituents selected from Substituent Group D, and P R , R 1a , R 2a , R 5a and R 6a are as defined in Item 1). Is mentioned.
- the ring portion is the same selected from one or more substituent groups D Alternatively, it may be substituted at any position with a different substituent.
- the heterocyclic ring is preferably a 5- to 7-membered ring.
- “the heterocyclic ring may form a condensed ring” means that the ring in formula (I ′′) may be further condensed, and one or more substituent groups D are , It may be bonded to either the ring or the condensed ring in the above formula (I ′′).
- formula (I ′′) a compound represented by the following formula
- R x and R y are substituents selected from Substituent Group D, and P R , R 1a , R 2a , R 5a and R 7a have the same meanings as Item 1), etc. Is mentioned.
- R 8a and R 10a may form a carbocyclic or heterocyclic ring which may be substituted with the substituent group D together with adjacent atoms”. “When a carbocyclic or heterocyclic ring is formed” means the following formula (I ′′ ′′):
- R x is a substituent selected from Substituent Group D, and P R , R 1a , R 2a , R 3a , R 9a , and R 11a have the same meanings as Item 1). Can be mentioned.
- R 3a and R 11a may form a heterocyclic ring which may be substituted with the substituent group D together with an adjacent atom, and the heterocyclic ring forms a condensed ring.
- May be means the following formula (I ′ ′′ ′′):
- P R , R 1a , R 2a , R 8a , R 9a , and R 10a are as defined in item 1
- the ring portion may further form a condensed ring, That the same or different substituents selected from the substituent group D may be bonded to any of the rings or condensed rings in the above formula (I ′ ′′ ′′) at any position.
- the heterocyclic ring is preferably a 5- to 7-membered ring.
- formula (I ′ ′′ ′′) a compound represented by the following formula
- R x and R y are substituents selected from Substituent Group D, and P R , R 1a , R 2a , R 8a , R 9a and R 10a have the same meanings as Item 1. Etc.).
- Solvate includes, for example, solvates with organic solvents, hydrates and the like.
- a preferred embodiment is a hydrate or an alcohol solvate, and a more preferred embodiment is a hydrate.
- When forming a hydrate it may be coordinated with an arbitrary number of water molecules. For example, 0.5 hydrate (one water molecule is coordinated with two molecules of the compound of the present invention). Monohydrate (one water molecule is coordinated with one molecule of the compound of the present invention), dihydrate (two water molecules coordinated with one molecule of the compound of the present invention) Trihydrate (three water molecules are coordinated to one molecule of the compound of the present invention) and the like. The same applies to the formation of alcohol hydrates.
- Examples of alcohol in the case of forming an alcohol solvate include methanol, ethanol, isopropanol and the like.
- the compounds of the present invention include pharmaceutically acceptable salts.
- alkali metals lithium, sodium, potassium, etc.
- alkaline earth metals magnesium, calcium, etc.
- ammonium salts with organic bases and amino acids, or inorganic acids (hydrochloric acid, sulfuric acid, nitric acid, hydrobromic acid, phosphorus Acid or hydroiodic acid) and organic acids (acetic acid, trifluoroacetic acid, citric acid, lactic acid, tartaric acid, oxalic acid, maleic acid, fumaric acid, mandelic acid, glutaric acid, malic acid, benzoic acid, phthalic acid, Benzenesulfonic acid, p-toluenesulfonic acid, methanesulfonic acid, ethanesulfonic acid and the like).
- salts can be formed by a commonly performed method.
- preferable salts of the formula (I) in the present invention include hydrochloride, hydrobromide, acetate, sulfate and the like.
- the compounds of the present invention are not limited to specific isomers, and all possible isomers (keto-enol isomers, imine-enamine isomers, diastereoisomers, optical isomers, rotational isomers, etc.) ) And racemates.
- the formula (I) in the present invention is not limited to a specific isomer, but includes all possible isomers and racemates. For example, as shown below, tautomers and stereoisomers are also contained. (In the formula, each symbol is as defined above.)
- one or more hydrogen atoms, carbon atoms or other atoms of the compound of the formula (I) can be substituted with hydrogen atoms, carbon atoms or isotopes of other atoms, respectively.
- the compound of the formula (I) includes all radiolabeled compounds of the compound of the formula (I). Such “radiolabeled”, “radiolabeled” and the like of the compounds of formula (I) are each encompassed by the present invention and are useful as research and / or diagnostic tools in metabolic pharmacokinetic studies and binding assays. .
- Examples of isotopes that can be incorporated into the compounds of formula (I) of the present invention are 2 H, 3 H, 13 C, 14 C, 15 N, 18 O, 17 O, 31 P, 32 P, 35 S, respectively.
- 18 F, and 36 Cl include a hydrogen atom, a carbon atom, a nitrogen atom, an oxygen atom, a phosphorus atom, a sulfur atom, a fluorine atom, and a chlorine atom.
- a particularly preferred example of an isotope that can be incorporated into the compound of formula (I) of the present invention is 2 H (ie, deuterium atom), which is well known in the art or in the methods shown in the Reference Examples herein. It can be prepared by the method.
- a deuterium atom is represented as “D”.
- the compound in which the hydrogen atom of the formula (I) of the present invention is converted to a deuterium atom may be superior in bioavailability, metabolic stability, medicinal effect, and toxicity compared with the unconverted compound, and is useful as a pharmaceutical. It can be.
- lower alkyl optionally substituted with substituent group C examples include methyl, ethyl, propyl, isopropyl, butyl, tert-butyl, sec-butyl, pentan-2-yl, hydroxymethyl, hydroxyethyl, Carboxymethyl, carboxyethyl, carboxypropyl, ethoxycarbonylpropyl, cyanomethyl, cyanoethyl, fluoromethyl, fluoroethyl, fluoropropyl, difluoromethyl, trifluoromethyl, chloromethyl, dichloromethyl, trichloromethyl, ethyloxycarbonylethyl, methoxymethyl, dimethoxymethyl, methoxyethyl, methoxypropyl, ethoxyethyl, 1-methyl-1-methoxymethyl, propoxymethyl, aminopropyl, dimethylaminomethyl, aminomethyl Aminoethyl, dimethylaminoeth
- lower alkyl optionally substituted with substituent group F examples include hydroxyethyl, methyl, ethyl, propyl, isopropyl, butyl, tert-butyl, iso-butyl, sec-butyl, pentan-2-yl , Hydroxymethyl, hydroxyethyl, carboxymethyl, carboxyethyl, carboxypropyl, ethoxycarbonylpropyl, and the groups shown below
- lower alkenyl optionally substituted with substituent group C examples include ethylenyl, 3-methylbuten-2-yl, carboxyethylenyl, hydroxyethylenyl, difluoroethylenyl, 1-propen-2-yl and the like. Is mentioned.
- lower alkynyl optionally substituted with substituent group C examples include 1-propynyl, 1-butynyl, 3,3,3-trifluoromethylpropynyl, 3-hydroxy-propynyl and the like.
- lower alkyloxy optionally substituted with substituent group C examples include methyloxy, ethyloxy, trifluoromethyloxy, trichloromethyloxy, hydroxymethyloxy, hydroxyethyloxy, carboxymethyloxy, carboxyethyloxy Etc.
- lower alkenyloxy optionally substituted with substituent group C examples include 3-fluoro-1-propenyloxy, ethylenyl, carboxyethylenyl, hydroxyethylenyloxy, difluoroethylenyloxy and the like.
- lower alkylcarbonyl optionally substituted with substituent group C examples include methylcarbonyl, ethylcarbonyl, propylcarbonyl, isopropylcarbonyl, hydroxymethylcarbonyl, hydroxyethylcarbonyl, trifluoromethylcarbonyl, 2,2, Examples include 2-trifluoromethylcarbonyl, carboxymethylcarbonyl and the like.
- lower alkyloxycarbonyl optionally substituted with substituent group C examples include methyloxycarbonyl, ethyloxycarbonyl, trifluoromethyloxycarbonyl, trichloromethyloxycarbonyl, hydroxymethyloxycarbonyl, hydroxyethyloxycarbonyl , Carboxymethyloxycarbonyl and the like.
- Examples of “carbocyclic group optionally substituted by substituent group C” include phenyl, naphthyl, anthracenyl, phenanthracenyl, adamantyl, 1-hydroxyadamantyl, 2-hydroxyadamantyl, 3-methylphenyl, 4-methylphenyl, 3-methoxyphenyl, 4-methoxyphenyl, 3-hydroxyphenyl, 4-hydroxyphenyl, 4-chlorophenyl, 4-fluorophenyl, 2-cyanophenyl, 3-cyanophenyl, 4-cyanophenyl, fluoro Cyclopropyl, difluorocyclobutanyl, difluorocyclohexyl, and groups shown below
- R E6 represents a group selected from substituent group C, and m R E6 may be the same or different).
- Examples of “carbocyclic group optionally substituted by substituent group F” include phenyl, naphthyl, 3-methylphenyl, 4-methylphenyl, 3-methoxyphenyl, 4-methoxyphenyl, 3-hydroxyphenyl. 4-hydroxyphenyl, 4-chlorophenyl, 4-fluorophenyl, 1,5-difluorophenyl and the like.
- Examples of “carbocyclic lower alkyl optionally substituted with substituent group C” include cyclopropylmethyl, 4-hydroxybenzyl, cyclopentylmethyl, benzyl, 2-aminobenzyl, 2-cyanobenzyl, 2-fluorobenzyl.
- Examples of “carbocyclic lower alkyl optionally substituted with substituent group F” include cyclopropylmethyl, 4-hydroxybenzyl, cyclopentylmethyl, benzyl, 2-aminobenzyl, 2-cyanobenzyl, 2-fluorobenzyl.
- Examples of “carbocyclic oxy lower alkyl optionally substituted with substituent group C” include 4-hydroxyphenyloxymethyl, 4-hydroxyphenyloxyethyl, cyclopropyloxymethyl, cyclopentyloxymethyl, 4-fluorophenyl Examples include oxymethyl, 4-fluorophenyloxyethyl, 4-trifluoromethylphenyloxymethyl, 4-trifluoromethylphenyloxyethyl, 4-methoxyphenyloxymethyl, 4-methoxyphenyloxyethyl and the like.
- Examples of “carbocyclic carbonyl optionally substituted with substituent group C” include phenylcarbonyl, 4-fluorophenylcarbonyl, 4-trifluoromethylphenylcarbonyl, 4-methoxyphenylcarbonyl, cyclopropylcarbonyl and the like. It is done.
- Examples of “carbocyclic oxy optionally substituted with substituent group C” include phenyloxy, cyclopropyloxy, cyclopentyloxy, 4-fluorophenyloxy, 4-trifluoromethylphenyloxy, 4-methoxyphenyloxy Etc.
- Examples of “carbocyclic oxycarbonyl optionally substituted with substituent group C” include phenyloxycarbonyl, cyclopropyloxycarbonyl, cyclopentyloxycarbonyl, 4-fluorophenyloxycarbonyl, 4-trifluoromethylphenyloxycarbonyl 4-methoxyphenyloxycarbonyl and the like.
- Examples of “heterocyclic group optionally substituted with substituent group C” include pyrimidinyl, pyridyl, benzoxazolyl, morpholinyl, tetrahydropyranyl, furyl, thiophenyl, oxazolyl, thiazolyl, pyrazolyl, methylpyrrolidinyl.
- R E6 represents a group selected from substituent group C, and m R E6 may be the same or different.
- heterocyclic group optionally substituted with substituent group F include morpholinyl, pyridyl, methyl-1,3-dioxol-2-one, trimethyl-2-oxabicyclo [2.2.1 And heptan-3-one, pyrrolidinyl, methyl-pyrrolidine-2-carboxylate, tetrahydropyranyl, hydroxymethylpyrrolidinyl and the like.
- heterocyclic lower alkyl optionally substituted with substituent group C examples include tetrahydropyranylmethyl, pyridylmethyl, isoxazolylmethyl, 5-methyl-isoxazolylmethyl, 3-methyl- Oxadiazolylmethyl, indolylmethyl, benzothiophenylmethyl, 5-chlorobenzothiophenylmethyl, thiazolylmethyl, 2-methylthiazolylmethyl, pyrazolylmethyl, 2-methylpyrazolylmethyl, dithiophenylmethyl, tetrazolylmethyl, Quinazolylmethyl, morpholinylmethyl and groups shown below
- heterocyclic lower alkyl optionally substituted with substituent group F examples include tetrahydropyranylmethyl, pyridylmethyl, isoxazolylmethyl, 5-methyl-isoxazolylmethyl, 3-methyl- Oxadiazolylmethyl, indolylmethyl, benzothiophenylmethyl, 5-chlorobenzothiophenylmethyl, thiazolylmethyl, 2-methylthiazolylmethyl, pyrazolylmethyl, 2-methylpyrazolylmethyl, dithiophenylmethyl, tetrazolylmethyl, Quinazolylmethyl, morpholinylmethyl and the like can be mentioned.
- heterocyclic oxy-lower alkyl optionally substituted with substituent group C examples include tetrahydropyranyloxymethyl, pyridyloxymethyl, isoxazolyloxymethyl, 5-methyl-isoxazolyloxymethyl Indolyloxymethyl, benzothiophenyloxymethyl, 5-chlorobenzothiophenyloxymethyl, thiazolyloxymethyl, 2-methylthiazolyloxymethyl, pyrazolyloxymethyl, 2-methylpyrazolyloxymethyl and the like.
- heterocyclic carbonyl optionally substituted with substituent group C examples include tetrahydropyranylcarbonyl, pyridylcarbonyl, isoxazolylcarbonyl, 5-methyl-isoxazolylcarbonyl, indolylcarbonyl, benzo Examples include thiophenylcarbonyl, 5-chlorobenzothiophenylcarbonyl, thiazolylcarbonyl, 2-methylthiazolylcarbonyl, pyrazolylcarbonyl, 2-methylpyrazolylcarbonyl and the like.
- heterocyclic oxy optionally substituted with substituent group C examples include tetrahydropyranyloxy, pyridyloxy, isoxazolyloxy, 5-methyl-isoxazolyloxy, indolyloxy, benzo Examples thereof include thiophenyloxy, 5-chlorobenzothiophenyloxy, thiazolyloxy, 2-methylthiazolyloxy, pyrazolyloxy, 2-methylpyrazolyloxy and the like.
- heterocyclic oxycarbonyl optionally substituted with substituent group C examples include tetrahydropyranyloxycarbonyl, pyridyloxycarbonyl, isoxazolyloxycarbonyl, 5-methyl-isoxazolyloxycarbonyl, Indolyloxycarbonyl, benzothiophenyloxycarbonyl, 5-chlorobenzothiophenyloxycarbonyl, thiazolyloxycarbonyl, 2-methylthiazolyloxycarbonyl, pyrazolyloxycarbonyl, 2-methylpyrazolyloxycarbonyl and the like can be mentioned.
- lower alkylamino optionally substituted with substituent group F examples include methylamino, dimethylamino, ethylamino, diethylamino and the like.
- lower alkylthio optionally substituted with substituent group F examples include methylthio, ethylthio and the like.
- lower alkylsilyl optionally substituted with substituent group F examples include trimethylsilyl, triethylsilyl, tert-butyldimethylsilyl and the like.
- P R in -OP R groups are administered to a living body (e.g., oral administration) After the drug-metabolizing enzymes, hydrolases, gastric acid, and / or groups that are converted to -OH groups by the action of intestinal bacteria such as preferable.
- PR2 represents lower alkyl optionally substituted with substituent group F, carbocyclic group optionally substituted with substituent group F, or heterocyclic group optionally substituted with substituent group F
- PR3 is a lower alkyl which may be substituted with the substituent group F, a carbocyclic group which may be substituted with the substituent group F, a heterocyclic group which may be substituted with the substituent group F, Lower alkylamino optionally substituted with substituent group F, carbocyclic lower alkyl optionally substituted with substituent group F, heterocyclic lower alkyl optionally substituted with substituent group F, or lower alkyl Cyril
- PR4 is a carbocyclic group that may be substituted with substituent group F, a heterocyclic group that may be substituted with substituent group F, and substituent group F; oxo, lower alkyl, hydroxy Lower alkyl, amino, lower alkylamino, carbocycl
- P R Another embodiment of the preferred substituents of the P R, include groups of P-1 ⁇ P-83 in Tables 1 to 9 below.
- R 1a hydrogen, halogen, hydroxy, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituted Lower alkynyl optionally substituted with group C, lower alkyloxy optionally substituted with substituent group C, lower alkenyloxy optionally substituted with substituent group C, substituted with substituent group C Lower alkylcarbonyl which may be substituted, lower alkyloxycarbonyl which may be substituted with substituent group C, carbocyclic group which may be substituted with substituent group C, and substituent with substituent group C Good carbocyclic lower alkyl, carbocyclic carbonyl optionally substituted with substituent group C, carbocyclic oxy optionally substituted with substituent group C, substituent group C Optionally substituted carbocyclic oxycarbonyl, optionally substituted heterocyclic group optionally substituted with substituent group C, heterocyclic lower alkyl
- R 1a hydrogen, halogen, hydroxy, carboxy, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituent group C Lower alkyloxy optionally substituted with, lower alkylcarbonyl optionally substituted with substituent group C, lower alkyloxycarbonyl optionally substituted with substituent group C, substituted with substituent group C
- R 1a hydrogen, carboxy, hydroxymethyl, methoxy, bromine atom, ethoxymethyl, dimethylamino, hydroxy, —C ( ⁇ O) —NH—S ( ⁇ O) 2 — Me, amino, methylamino, methyl, propenyl, —C ( ⁇ O) —Me, —B (—OH) 2 (Me represents a methyl group) and the like.
- R 1a As another preferred embodiment of the substituent for R 1a , hydrogen, carboxy, and —C ( ⁇ O) —Me can be mentioned.
- the most preferred substituent in R 1a is hydrogen.
- R 2a hydrogen, halogen, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituent group Lower alkynyl optionally substituted with C, lower alkyloxy optionally substituted with substituent group C, lower alkenyloxy optionally substituted with substituent group C, substituted with substituent group C Lower alkylcarbonyl which may be substituted, lower alkyloxycarbonyl which may be substituted with substituent group C, carbocyclic group which may be substituted with substituent group C, carbon which may be substituted with substituent group C Lower alkyl ring, carbocyclic carbonyl optionally substituted with substituent group C, carbocyclic oxy optionally substituted with substituent group C, substituted with substituent group C Carbocyclic oxycarbonyl which may be substituted, heterocyclic group which may be substituted with substituent group C, heterocyclic lower alkyl
- R 2a hydrogen, lower alkyl optionally substituted with substituent group C, carbocyclic lower alkyl optionally substituted with substituent group C, substituted with substituent group C
- substituent group C a heterocyclic lower alkyl, or -ZN (R B9 ) (R B10 )
- R B9 , R B10 , and Z are as defined in item 1).
- R 2a hydrogen, lower alkyl which may be substituted with substituent group C, or heterocyclic lower alkyl which may be substituted with substituent group C (substituent group C is And the same meaning as item 1).
- a preferable substituent in R 2a hydrogen, hydroxymethyl, amino, methoxymethyl, methoxymethylcyclopropylmethyloxymethyl, cyanomethyl, aminomethyl, propyloxymethyl, —CH 2 —NH—C ( ⁇ O ) -Me, methylaminomethyl, imidazolyl, dimethylaminomethyl, pyrrolidinyl, fluoromethyl, —CH 2 —NH—C ( ⁇ O) H (Me represents a methyl group) and the like.
- R 2a As another embodiment of a more preferable substituent in R 2a , hydrogen, hydroxymethyl, methoxymethylcyclopropylmethyloxymethyl, aminomethyl, propyloxymethyl and the like can be mentioned.
- Hydrogen is mentioned as another aspect of the more preferable substituent in R ⁇ 2a> .
- R 3a Hydrogen, halogen, hydroxy, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituted with substituent group C Good lower alkynyl, lower alkyloxy optionally substituted with substituent group C, lower alkenyloxy optionally substituted with substituent group C, lower alkylcarbonyl optionally substituted with substituent group C, substituted Lower alkyloxycarbonyl optionally substituted with group C, carbocyclic group optionally substituted with substituent group C, carbocyclic lower alkyl optionally substituted with substituent group C, substituent group Carbocyclic oxy-lower alkyl optionally substituted with C, carbocyclic carbonyl optionally substituted with substituent group C, carbocycle optionally substituted with substituent group C Xy, carbocyclic oxycarbonyl optionally substituted with substituent group C, heterocyclic group optional
- More preferable substituents in R 3a include hydrogen, lower alkyl optionally substituted with substituent group C, lower alkynyl optionally substituted with substituent group C, and optionally substituted with substituent group C.
- a good carbocyclic group, or carbocyclic lower alkyl optionally substituted with substituent group C is as defined in item 1).
- R 3a hydrogen, ethoxyethyl, methyl, ethyl, propyl, 2,4-difluorobenzyl, methoxyethyl, cyanomethyl, cyanoethyl, 3-chloro-2-fluorobenzyl, 1-methoxy Propyl, pyridylmethyl, isopropyl, tetrahydropyranylmethyl, cyclopropylmethyl, benzyl, methylisoxazolylmethyl, methyloxadiazolyl, isopropyloxyethyl, hydroxyethyl, 4-fluorobenzyl, cyclopropyl, ethoxycarbonylethyl,- CH (Me) CH 2 OMe, carboxyethyl, —CH 2 CH 2 C ( ⁇ O) —N (Me) 2 , —CH 2 CH 2 N (Me) —S ( ⁇ O) 2 —P
- R 3a As another embodiment of the more preferable substituent in R 3a , ethoxyethyl, methyl, ethyl, 2,4-difluorobenzyl, methoxyethyl, cyanomethyl, 3-chloro-2-fluorobenzyl, methoxypropyl, pyridylmethyl, isopropyl, Tetrahydropyranylmethyl, cyclopropylmethyl, benzyl, 4-fluorobenzyl, cyclopropyl, ethoxycarbonylethyl, —CH (Me) CH 2 OMe, carboxyethyl, 1,1,1-trifluoropropan-2-yl, hydroxy And ethyl, 1-fluoroethyl (Me represents a methyl group) and the like.
- Another embodiment of the most preferred substituent in R 3a includes 1,1,1-trifluoropropan-2-yl.
- R 5a , R 6a , R 7a , R 8a , R 9a , R 10a , and R 11a hydrogen, carboxy, cyano, lower alkyl optionally substituted with substituent group C, substituent Lower alkenyl optionally substituted with group C, lower alkynyl optionally substituted with substituent group C, lower alkylcarbonyl optionally substituted with substituent group C, substituted with substituent group C Lower alkyloxycarbonyl which may be substituted, carbocyclic group which may be substituted with substituent group C, carbocyclic lower alkyl which may be substituted with substituent group C, and optionally substituted with substituent group C Carbocyclic oxy-lower alkyl, carbocyclic carbonyl optionally substituted with substituent group C, carbocyclic oxycarbonyl optionally substituted with substituent group C, substituted with substituent group C A heterocyclic group which may be substituted, a heterocyclic lower alkyl, substituent Lower alken
- R 5a , R 6a , R 7a , R 8a , R 9a , R 10a , and R 11a hydrogen, lower alkyl optionally substituted with substituent group C, substituent group C
- substituent group C In the carbocyclic group which may be substituted with, the carbocyclic oxy lower alkyl which may be substituted with the substituent group C, the heterocyclic group which may be substituted with the substituent group C, and the substituent group C
- R 5a , R 6a , R 7a , R 8a , R 9a , R 10a , and R 11a hydrogen, benzhydryl, benzyl, indolylmethyl, cyclohexylmethyl, phenethyl, benzylthio Methyl, 3,5-dimethylisoxazolyl, 5-chloro-3-ethylbenzothiophenyl, 4-fluorobenzyl, methylthiazolylmethyl, cyclopentylmethyl, 4-methoxybenzyl, 3-fluorobenzyl, naphthylmethyl, Methyl, 3-trifluoromethylbenzyl, pyridylmethyl, 4-methylcarbonylaminobenzyl, pyrimidinyl, isobutyl, phenoxyethyl, methoxypropyl, phenylpropyl, and the following groups
- R E6 represents a group selected from Substituent Group C, and m R E6 s may be the same or different), and so on. Or a 4-ring condensed heterocyclic group etc. are mentioned.
- R 5a , R 6a , R 7a , R 8a , R 9a , R 10a , and R 11a hydrogen, benzhydryl, benzyl, indolylmethyl, cyclohexylmethyl, phenethyl, 3 , 5-dimethylisoxazolyl, 5-chloro-3-ethylbenzothiophenyl, biphenylmethyl, 4-fluorobenzyl, methylthiazolylmethyl, cyclopentylmethyl, 4-methoxybenzyl, 3-fluorobenzyl, naphthylmethyl, Methyl, 3-trifluoromethylbenzyl, pyridylmethyl, 4-methylcarbonylaminobenzyl, pyrimidinyl, and the following groups
- R E6 represents a group selected from the substituent group C, and m R E6 may be the same or different).
- B 1 is CR 5a R 6a and B 2 is NR 7a
- R 3a and R 7a together with adjacent atoms form a heterocyclic ring which may be substituted with the substituent group D is mentioned.
- B 1 is NR 7a and B 2 is CR 5a R 6a
- R 3a and R 6a together with adjacent atoms form a heterocyclic ring which may be substituted with the substituent group D is mentioned.
- B 1 is CR 8a R 9a and B 2 is CR 10a R 11a
- R 8a and R 10a together with an adjacent atom form a carbocyclic or heterocyclic ring which may be substituted with the substituent group D
- B 1 is CR 8a R 9a and B 2 is CR 10a R 11a
- R 3a and R 11a together with an adjacent atom form a heterocyclic ring which may be substituted with the substituent group D is mentioned.
- B 1 and B 2 are CR 5a R 6a and the other is NR 7a . More preferably, B 1 is NR 7a and B 2 is CR 5a R 6a .
- R 5a and R 6a are hydrogen and R 5a and R 6a .
- R 5a is hydrogen and R 6a is hydrogen.
- R 7a is not a hydrogen atom.
- B 1 is NR 7a and B 2 is CR 5a R 6a .
- B 1 is NR 7a and B 2 is CH 2 .
- R 7a is a carbocyclic group which may be substituted with the substituent group C, a carbocyclic lower alkyl which may be substituted with the substituent group C, and a substituent group C which may be substituted. Heterocyclic group, heterocyclic lower alkyl optionally substituted with substituent group C.
- R 7a More preferred embodiments of R 7a are cycloalkyl, cycloalkenyl, aryl, non-aromatic fused carbocyclic group, heteroaryl, non-aromatic heterocyclic group, bicyclic fused heterocyclic group, tricyclic fused heterocycle.
- R 7a examples include benzyl, benzhydryl, 4-fluorobenzyl, p-methoxybenzyl, and the following groups
- R 7a are the following groups
- R 7a is the following group:
- R 9a and R 11a are preferably hydrogen. In a preferred embodiment of R 8a and R 10a , one of them is hydrogen. When R 9a and R 11a are hydrogen, and one of R 8a and R 10a is hydrogen, the other preferred embodiment of R 8a and R 10a is the following group —ZC (R E1 ): (R E2 ) (R E3 ) Or
- R 9a and R 11a are hydrogen, and one of R 8a and R 10a is hydrogen, another more preferable embodiment of R 8a and R 10a is the following group:
- R 9a and R 11a are hydrogen and one of R 8a and R 10a is hydrogen
- the other most preferred embodiment of R 8a and R 10a is the following group:
- Preferred substituents in Substituent Group D are carbocyclic groups that may be substituted with Substituent Group C, heterocyclic groups that may be substituted with Substituent Group C, and substituents with Substituent Group C. Carbocyclic lower alkyl which may be substituted, and heterocyclic lower alkyl which may be substituted with substituent group C.
- R E6 represents a group selected from the substituent group C, and m R E6 may be the same or different).
- R E6 examples include halogen, cyano, hydroxy, carboxy, formyl, amino, oxo, nitro, lower alkyl, lower alkynyl, halogeno lower alkyl, lower alkyloxy, lower alkylamino, halogeno lower alkyloxy, carbon And cyclic groups.
- Examples of more preferred substituents for R E6 include fluorine atom, chlorine atom, bromine atom, cyano, hydroxy, methyl, ethyl, ethynyl, hydroxymethyl, isopropyl, methoxy, ethoxy, methoxymethyl, cyclopropyl, dimethylamino, trifluoro Examples include methyl, oxo and carboxy. Examples of particularly preferred substituents for R E6 include a fluorine atom, a chlorine atom, a bromine atom, methyl, methoxy, and trifluoromethyl.
- a preferred embodiment of m is an integer of 0 to 6, more preferably an integer of 0 to 3, and most preferably an integer of 0 to 2.
- One of the characteristics of the compound according to the present invention is a prodrug of a polycyclic carbamoylpyridone derivative in which two or more rings are condensed as shown in the formula (I) in Item 1 and / or a composition containing these
- the product has a high inhibitory activity against the cap-dependent endonuclease and has a therapeutic and / or prophylactic effect against influenza infection.
- the compound according to the present invention is characterized in that cap-dependent endonuclease inhibitory activity is improved by applying a functional group as shown below to R 1a in formula (I).
- Functional group hydrogen, halogen, hydroxy, carboxy, cyano, formyl, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, substituted with substituent group C Lower alkynyl which may be substituted, lower alkyloxy which may be substituted with substituent group C, lower alkenyloxy which may be substituted with substituent group C, lower alkyl which may be substituted with substituent group C Carbonyl, lower alkyloxycarbonyl optionally substituted with substituent group C, carbocyclic group optionally substituted with substituent group C, carbocyclic lower alkyl optionally substituted with substituent group C, Carbocyclic carbonyl optionally substituted with substituent group C, carbocyclic oxy optionally substituted with substituent group C, carb
- a more preferable feature of the compound according to the present invention is that cap-dependent endonuclease inhibitory activity is improved by applying a functional group as shown below to R 1a in formula (I).
- Functional group hydrogen, halogen, hydroxy, carboxy, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, optionally substituted with substituent group C Lower alkyloxy, lower alkylcarbonyl optionally substituted with substituent group C, lower alkyloxycarbonyl optionally substituted with substituent group C, heterocyclic group optionally substituted with substituent group C , -ZN (R A1 ) (R A2 ), —ZN (R A7 ) —C ( ⁇ O) —R A8 , or —ZN (R A12 ) —C ( ⁇ O) —O—R A13 (Substituent group C, R A1 , R A2 , R A7 , R A8 , R A
- a more preferable feature of the compound according to the present invention is that the cap-dependent endonuclease inhibitory activity is improved by applying a functional group as shown below to R 1a in formula (I).
- Functional group hydrogen, halogen, hydroxy, carboxy, lower alkyl optionally substituted with substituent group C, lower alkenyl optionally substituted with substituent group C, optionally substituted with substituent group C Lower alkyloxy, lower alkylcarbonyl optionally substituted with substituent group C, lower alkyloxycarbonyl optionally substituted with substituent group C, heterocyclic group optionally substituted with substituent group C Or -ZN (R A1 ) (R A2 ) (Substituent group C, R A1 , R A2 , and Z are as defined in item 1).
- a particularly preferred compound according to the present invention is characterized in that cap-dependent endonuclease inhibitory activity is improved by applying a functional group as shown below to R 1a in formula (I).
- Functional group hydrogen, acetyl, or carboxy
- Another feature of the compound according to the present invention is that one or more of the following fat-soluble functional groups are introduced on the carbon atom or nitrogen atom of B 1 and / or B 2 in formula (I). By doing so, the cap-dependent endonuclease inhibitory activity is improved.
- Fat-soluble functional group carbocyclic group which may be substituted with substituent group C, carbocyclic lower alkyl which may be substituted with substituent group C, carbocycle which may be substituted with substituent group C Oxy-lower alkyl, carbocyclic oxycarbonyl optionally substituted with substituent group C, heterocyclic group optionally substituted with substituent group C, heterocyclic lower ring optionally substituted with substituent group C Alkyl, heterocyclic oxy-lower alkyl optionally substituted with substituent group C, heterocyclic oxycarbonyl optionally substituted with substituent group C (substituent group C is as defined in item 1)
- Fat-soluble functional group carbocyclic group which may be substituted with substituent group C, carbocyclic lower alkyl which may be substituted with substituent group C, carbocycle which may be substituted with substituent group C Oxy lower alkyl, heterocyclic group optionally substituted with substituent group C, heterocyclic lower alkyl optionally substituted with substituent group C (substituent group C is as defined in item 1)
- Another feature of the particularly preferred compounds according to the invention is that by introducing one fat-soluble functional group as shown below on the carbon atom or nitrogen atom of B 1 or B 2 in formula (I): This is an improvement in cap-dependent endonuclease inhibitory activity.
- Fat-soluble functional group a carbocyclic group that may be substituted with substituent group C, a heterocyclic group that may be substituted with substituent group C (substituent group C is as defined in item 1) ).
- the P R portion in formula (I) by introducing a group forming a prodrug, after administration to a living body (e.g., oral administration) efficiently in the body It is the point which was absorbed and showed the high medicinal effect.
- the P R portion in formula (I), by introducing a group selected from the formulas a) ⁇ v) below, is absorbed efficiently the body after administration, It is the point which showed the high medicinal effect.
- Lower alkylthio optionally substituted with substituent group F, PR2 is a lower alkyl which may be substituted with the substituent group F, a carbocyclic group which may be substituted with the substituent group F, or a heterocyclic group which may be substituted with the substituent group F.
- PR3 is a lower alkyl which may be substituted with the substituent group F, a carbocyclic group which may be substituted with the substituent group F, a heterocyclic group which may be substituted with the substituent group F, Lower alkylamino optionally substituted with substituent group F, carbocyclic lower alkyl optionally substituted with substituent group F, heterocyclic lower alkyl optionally substituted with substituent group F, lower alkylsilyl
- PR 4 is a carbocyclic group that may be substituted with the substituent group F, or a heterocyclic group that may be substituted with the substituent group F.
- Substituent group F oxo, lower alkyl, hydroxy lower alkyl, amino, lower alkylamino, carbocyclic lower alkyl, lower alkylcarbonyl, halogen, hydroxy, carboxy, lower alkylcarbonylamino, lower alkylcarbonyloxy, lower alkyloxycarbonyl, Lower alkyloxy, cyano, nitro)
- R 1a A compound in which R 1a is hydrogen (hereinafter, R 1a is referred to as R1-1), A compound in which R 1a is carboxy (hereinafter, R 1a is represented as R1-2), A compound in which R 1a is halogen (hereinafter, R 1a is R1-3), A compound wherein R 1a is hydroxy (hereinafter, R 1a is R1-4), R 1a is substituted with a substituent group C is also lower alkyl compound (hereinafter, R 1a is as R1-5), R 1a is substituted with a substituent group C is also lower alkyl carbonyl compound (hereinafter, R 1a is as R1-6), R 1a is substituted with a substituent group C is also a good lower alkyloxy carbonyl compound (hereinafter, R 1a is as R1-7), A compound wherein R 1a is amino (hereinafter, R 1a is referred to as R1-8),
- R 2a is hydrogen
- R 2a is substituted with a substituent group C is also lower alkyl compound
- R 2a is as R2-2
- R 3a is substituted with a substituent group C is also lower alkyl compound (hereinafter, R 3a is as R3-1), R 3a is substituted with a substituent group C is also good carbocyclic-lower alkyl compound (hereinafter, R 3a is as R3-2), R 3a is substituted with a substituent group C is also heterocyclic lower alkyl compound (hereinafter, R 3a is as R3-3), R 3a is substituted with a substituent group C is also good carbocyclic group compound (hereinafter, R 3a is as R3-4), A compound wherein R 3a is a heterocyclic group optionally substituted with substituent group C (hereinafter, R 3a is referred to as R 3-5);
- R R is Pr-1
- R R is a compound in which P R is —CH 2 —O—C ( ⁇ O) —O—P R3 (hereinafter R R is Pr-3)
- R 7a is a carbocyclic group optionally substituted by substituent group C, and R 5a and R 6a are hydrogen
- R7-1 A compound in which R 7a is a heterocyclic group which may be substituted with substituent group C, and R 5a and R 6a are hydrogen
- R7-2 A compound wherein R 7a is carbocyclic lower alkyl optionally substituted with substituent group C, and R 5a and R 6a are hydrogen (hereinafter referred to as R7-3),
- R9a A compound in which R 9a is a carbocyclic group optionally substituted by substituent group C, and R 8a , R 10a , and R 11a are hydrogen (hereinafter referred to as R9-1)
- R9-2 A compound in which R 9a is a heterocyclic group optionally substituted by substituent group C, and R 8a , R 10a , and R 11a are hydrogen (hereinafter referred to as R9-2)
- R 9a is carbocyclic lower alkyl optionally substituted with substituent group C, and R 8a , R 10a , and R 11a are hydrogen (hereinafter referred to as R9-3)
- the substituent group C is halogen, cyano, hydroxy, carboxy, formyl, amino, oxo, nitro, lower alkyl, halogeno lower alkyl, lower alkyloxy, carbocyclic group, heterocyclic group, carbocyclic lower alkyl.
- R 1a, R 2a, R 3a, P R and compound combinations (R 5a, R 6a and R 7a,) is as follows.
- R 1a, R 2a, R 3a, P R and compound combinations (R 8a, R 9a, R 10a and R 11a,) is as follows.
- Method for producing the compound of the present invention A general method for producing the compound of the present invention is illustrated below. Extraction, purification, and the like may be performed in a normal organic chemistry experiment. The synthesis of the compound of the present invention can be carried out in consideration of techniques known in the art.
- the present invention includes all possible isomers and mixtures thereof, including these.
- a salt of the compound of the present invention if the compound of the present invention is obtained in the form of a salt, it can be purified as it is, and if it is obtained in a free form, it can be dissolved in an appropriate organic solvent. Alternatively, it may be suspended, and an acid or base is added to form a salt by an ordinary method.
- the compounds of the present invention and pharmaceutically acceptable salts thereof may exist in the form of adducts (hydrates or solvates) with water or various solvents, and these adducts are also included in the present invention. Is included.
- R is a carboxy protecting group
- P 1 is a hydroxyl protecting group
- R 2 , R 3 , R 8 , R 9 , R 10 , and R 11 are R 2a , R 3a in Item 1, respectively.
- R 8a , R 9a , R 10a , and R 11a , and R and P 1 are protected and / or removed by the method described in Protective Groups in Organic Synthesis, Theodora W Green (John Wiley & Sons), etc. Any group can be used as long as it can be protected.
- R is lower alkyl or the like
- P 1 is arylalkyl or the like.
- First Step A compound aa that is commercially available or can be prepared by a known method is mixed with a tertiary amine such as pyridine, trimethylamine, N-methylmorpholine, 4-dimethylaminopyridine, and benzyloxyethyl in a solvent such as dichloromethane, toluene, THF, or a mixed solvent thereof.
- the compound ab can be obtained by dropping the chloride and reacting at ⁇ 20 ° C. to 30 ° C., preferably 0 ° C. to 20 ° C. for 0.1 hour to 24 hours, preferably 0.5 hour to 12 hours. .
- an organic metal base such as lithium hexamethyldisilazane, lithium diisopropylamide, butyllithium, tert-butyllithium in the presence of cinnamoyl chloride in a solvent such as ether, dichloromethane, THF or a mixed solvent thereof.
- the compound ac can be obtained by reacting at ⁇ 80 ° C. to 0 ° C., preferably at ⁇ 80 ° C. to ⁇ 40 ° C. for 1 minute to 2 hours, preferably 10 minutes to 1 hour.
- Third Step A catalytic amount of ruthenium chloride and sodium periodate, TEMPO, manganese dioxide, and an oxidizing agent such as PDC are added to compound ac in a solvent such as ether, dichloromethane, THF, acetonitrile, or a mixed solvent thereof.
- Compound ad can be obtained by reacting at 40 to 80 ° C., preferably 0 to 40 ° C. for 0.1 to 24 hours, preferably 0.2 to 3 hours.
- Fourth Step Concentrated sulfuric acid and acidic acid are added to compound ad in the presence of a solvent such as ether, dichloromethane, THF, acetonitrile, acetone, water or the like in a mixed solvent thereof at 0 ° C.
- Compound af is obtained by reacting for 1 to 24 hours, preferably 1 to 12 hours.
- Door can be.
- Sixth step Compound ag is added to compound af in the presence of a solvent such as toluene, xylene, THF, dioxane or the like, or a mixed solvent thereof, and the mixture is heated under reflux conditions for 0.1 to 12 hours, preferably 0.8.
- Compound ah can be obtained by reacting for 2 to 6 hours.
- a triphenylphosphine and a condensing agent such as DEAD and DIAD are added to the compound ah in the presence of a solvent such as THF, dioxane, ethyl acetate and acetonitrile, or a mixed solvent thereof.
- a solvent such as THF, dioxane, ethyl acetate and acetonitrile, or a mixed solvent thereof.
- Compound ai can be obtained by reacting at 10 to 40 ° C. for 0.1 to 12 hours, preferably 0.2 to 6 hours.
- Compound aj can be obtained by subjecting compound ai to a known general deprotection reaction of a carboxyl protecting group and a hydroxyl protecting group.
- P 2 is an amino protecting group, and P 2 may be any group that can be protected and / or deprotected by the method described in Protective Groups in Organic Synthesis, Theodora W Green (John Wiley & Sons), etc.
- P 2 is aryl alkyloxycarbonyl, lower alkyloxycarbonyl and the like. other symbols are as defined above.
- a base corresponding to potassium carbonate, sodium carbonate, cesium carbonate or the like and a substituent corresponding to the target compound in the presence of a solvent such as DMF, THF, dioxane, acetonitrile, or a mixed solvent thereof.
- Compound P 2 -L (wherein L is a leaving group such as halogen or OMs) and is added at ⁇ 20 ° C. to 80 ° C., preferably 0 ° C. to 50 ° C. for 0.1 hour to 6 hours, preferably Compound bb can be obtained by reacting for 0.2 to 6 hours.
- Second Step To compound bb, triphenylphosphine and phthalimide are added in the presence of a solvent such as DMF, THF, dioxane, acetonitrile and the like, or a mixed solvent thereof, and a dehydration condensation reagent such as DIAD, DEAD is added at ⁇ 10 ° C.
- Compound bc can be obtained by reacting at -60 ° C., preferably 0 ° C.-50 ° C., for 0.1-24 hours, preferably 0.2-12 hours.
- Third Step Hydrazine hydrate or methyl hydrazine is added to compound bc in the presence of a solvent such as methanol, THF, dioxane, acetonitrile or the like in a mixed solvent thereof, and -10 ° C to 80 ° C, preferably 10 ° C to 60 ° C.
- Compound bd can be obtained by reacting at 0.degree. C. for 0.5 to 24 hours, preferably 1 to 12 hours.
- Fourth Step Boc 2 O is added to compound bd in the presence of a solvent such as THF, dioxane, acetonitrile or the like, or a mixed solvent thereof, and is added at ⁇ 10 ° C. to 80 ° C., preferably 10 ° C. to 60 ° C.
- Compound be can be obtained by reacting for a period of time to 24 hours, preferably 1 to 12 hours.
- Fifth Step Compound bf can be obtained by subjecting compound be to a known general deprotection reaction of an amino protecting group.
- Compound bg is added to compound bf in the presence of a solvent such as toluene, THF, dioxane, acetonitrile or the like in a mixed solvent thereof, and the mixture is added at 20 ° C. to 110 ° C., preferably 40 ° C. to heating under reflux.
- Compound bh can be obtained by reacting for 5 hours to 24 hours, preferably 1 hour to 12 hours.
- Seventh step HCl-ethyl acetate, HCl-dioxane, formic acid and the like are added to compound bh, and the mixture is added at 0 ° C. to 40 ° C., preferably 0 ° C.
- Second Step To compound cb, triphenylphosphine and phthalimide are added in the presence of a solvent such as DMF, THF, dioxane, acetonitrile, or a mixed solvent thereof, and a dehydration condensation reagent such as DIAD, DEAD is added to ⁇ 10 ° C.
- Compound cc can be obtained by reacting at -60 ° C., preferably 0 ° C.-50 ° C. for 0.1-24 hours, preferably 0.2-12 hours.
- Third Step Hydrazine hydrate is added to compound cc in the presence of a solvent such as methanol, THF, dioxane, acetonitrile or the like, or a mixed solvent thereof, at ⁇ 10 ° C. to 80 ° C., preferably 10 ° C. to 60 ° C.
- Compound cd can be obtained by reacting for 0.5 to 24 hours, preferably 1 to 12 hours.
- First Step Compound db can be obtained by subjecting compound da obtained by the same method as the synthesis method of bi to a known general carboxyl deprotection reaction.
- Second Step The decarboxylated compound dc can be obtained by reacting the compound db in a solvent such as diphenyl ether under microwave irradiation for 1 minute to 2 hours. Further, decarboxylated compound d can be obtained by adding copper in a quinoline solvent and reacting at 180 ° C. for 2-48 hours.
- Step Compound de can be obtained by the same method as in the first step.
- Fifth Step Compound df can be obtained by the same method as in the second step.
- Sixth Step Compound df can be obtained by the same method as in the third step.
- Seventh Step Compound df can be obtained by subjecting compound df to a known general hydroxyl group deprotection reaction.
- a base such as triethylamine, N-methylmorpholine, diisopropylethylamine and ethyl chloroformate are added in the presence of a solvent such as THF, dioxane, dichloromethane, toluene or the like or a mixed solvent thereof.
- a reducing agent having a low reducing power such as sodium borohydride is added, and the temperature is ⁇ 20 ° C. to 60 ° C., preferably ⁇ 10 ° C. to 20 ° C. for 0.2 hours to 12 hours, preferably 0.5
- Compound eb can be obtained by reacting for a period of time to 6 hours.
- Second Step Compound ec can be obtained by subjecting compound eb to a known general hydroxyl group deprotection reaction.
- R 1 is a group corresponding to R 1a of Item 1 and other symbols are as defined above.
- First Step Compound fb and triphenylphosphine are added to compound fa in the presence of a solvent such as THF, dichloromethane, dioxane, acetonitrile, or a mixed solvent thereof.
- the compound fc can be obtained by adding DIAD and reacting at 0 ° C. to 60 ° C., preferably 10 ° C. to 30 ° C. for 0.5 to 12 hours, preferably 1 to 12 hours. .
- a base such as potassium carbonate, sodium carbonate, lithium carbonate, cesium carbonate and a thiol such as benzenethiol are added in the presence of a solvent such as THF, dioxane, acetonitrile, or a mixed solvent thereof.
- a solvent such as THF, dioxane, acetonitrile, or a mixed solvent thereof.
- Compound fd can be obtained by reacting at 0 ° C. to 60 ° C., preferably 10 ° C. to 30 ° C. for 0.5 to 12 hours, preferably 1 to 12 hours.
- Compound ff can be obtained by reacting for ⁇ 24 hours.
- Fourth Step The compound ff is subjected to a known general deprotection reaction for the P 2 group on the amino group, followed by a solvent such as water, ethanol, methanol, acetonitrile, or a mixed solvent thereof.
- a base such as aqueous sodium carbonate solution or aqueous potassium carbonate solution and reacting at 20 ° C. to 80 ° C., preferably 20 ° C. to 70 ° C. for 0.5 hour to 24 hours, preferably 1 hour to 6 hours
- compound fd Can be obtained.
- Fifth Step Compound fh can be obtained by subjecting compound fg to a known general hydroxyl group deprotection reaction.
- First Step Compound ga can be obtained by subjecting compound dd to a known general hydroxyl group deprotection reaction.
- First Step Compound ha is mixed with dicyclohexylcarbodiimide, carbonyldiimidazole, dicyclohexylcarbodiimide-N-hydroxybenzotriazole, 4- (4,6-dimethoxy-1, 3, 5, ⁇ in a solvent such as DMF, THF, dichloromethane, acetonitrile or the like.
- Triazin-2-yl) -4-methylmorpholinium chloride 2- (7-aza-1H-benzotriazol-1-yl) -1,1,3,3-tetramethyluronium hexafluorophosphate, WSC
- a dehydrating condensing agent such as HCl or HATU
- O N-dimethylhydroxylamine hydrochloride is added, and a tertiary base such as triethylamine, diisopropylethylamine, N-methylmorpholine is added, and 0 ° C. to 60 ° C., preferably 1 to 24 hours at 10 to 40 ° C, preferably By reacting 1 to 12 hours, to give compound hb.
- Second Step Grignard reagent (R-MgBr) is added to compound hb at ⁇ 80 ° C. to ⁇ 40 ° C. in the presence of a solvent such as THF, ether, dichloromethane, dioxane or the like, or a mixed solvent thereof, and ⁇ 80 ° C. to 0 ° C.
- Compound hc can be obtained by reacting preferably at ⁇ 60 ° C. to ⁇ 20 ° C. for 0.5 to 24 hours, preferably 0.5 to 6 hours.
- Third Step mCPBA is added to compound hc in the presence of a solvent of chloroform or dichloromethane, and it is ⁇ 20 ° C. to 30 ° C., preferably 10 ° C.
- Compound hd can be obtained by reacting for a period of time.
- Fourth Step Aqueous sodium hydroxide is added to compound hd in the presence of a solvent such as ethanol, and reacted at 0 ° C. to 120 ° C., preferably 30 ° C. to 90 ° C. for 1 minute to 10 hours, preferably 30 minutes to 120 minutes.
- a solvent such as ethanol
- Fifth Step Compound hf can be obtained by subjecting compound he to a known general hydroxyl group deprotection reaction.
- Compound hg is obtained by adding a metal base such as n-butyllithium and reacting at ⁇ 20 ° C. to 120 ° C., preferably 0 ° C. to 30 ° C. for 0.5 hour to 12 hours, preferably 1 hour to 6 hours. Can do.
- Compound hh can be obtained by subjecting compound hg to a known general hydroxyl group deprotection reaction.
- First Step To compound ia, a tertiary amine such as triethylamine, diisopropylethylamine, N-methylmorpholine, ethyl chlorocarbonate, ethyl chloroformate in the presence of a solvent such as DMF, DMA, NMP, THF, or a mixed solvent thereof. Add a chlorinating reagent such as above, and stir at 0 to 30 ° C. for 0.1 to 1 hour. To this is added a compound R—SO 2 —NH 2 (eg, methanesulfonylamide) and DMAP corresponding to the target product, and 40 ° C.
- a tertiary amine such as triethylamine, diisopropylethylamine, N-methylmorpholine, ethyl chlorocarbonate, ethyl chloroformate in the presence of a solvent such as DMF, DMA, NMP, THF, or a mixed solvent thereof.
- Second Step Compound ic can be obtained by subjecting compound ib to a known general hydroxyl group deprotection reaction.
- First Step To compound ja, a tertiary amine such as triethylamine, N-methylmorpholine, diisopropylethylamine and ethyl chloroformate or chlorocarbonic acid in the presence of a solvent such as THF, dioxane, dichloromethane, toluene, DMF, or a mixed solvent thereof. Add ethyl. To this, a reducing agent having low reactivity such as sodium borohydride is added, and it is ⁇ 20 ° C. to 40 ° C., preferably ⁇ 10 ° C. to 20 ° C.
- a reducing agent having low reactivity such as sodium borohydride
- an alcohol intermediate is obtained.
- This intermediate is dissolved in dichloromethane, chloroform, etc., and an oxidizing agent such as TEMPO, manganese dioxide, PDC, etc. is added, and the temperature is ⁇ 40 ° C. to 30 ° C., preferably 0 ° C. to 30 ° C. for 0.1 hour to 24 hours, preferably Can be reacted for 0.5 to 12 hours to give compound jb.
- Second Step 28% ammonia water and iodine are added to compound jb in the presence of a solvent such as THF, dioxane, dichloromethane and the like, and 0 to 40 ° C., preferably 10 to 30 ° C., for 0.5 to 24 hours.
- the compound jc can be obtained by reacting preferably for 1 to 6 hours.
- Compound jd can be obtained by reacting at -60 ° C., preferably 10 ° C.-40 ° C., for 0.5-24 hours, preferably 1-12 hours.
- Fourth Step Compound je can be obtained by subjecting compound jd to a known general hydroxyl group deprotection reaction.
- First step Compound ka is mixed with tertiary amine such as triethylamine, N-methylmorpholine, diisopropylethylamine and ethyl chloroformate or chlorocarbonic acid in the presence of a solvent such as THF, dioxane, dichloromethane, toluene, DMF or a mixed solvent thereof. Add ethyl. To this, sodium azide is added and reacted at 0 ° C. to 40 ° C., preferably 10 ° C.
- a base such as an aqueous sodium hydroxide solution or an aqueous potassium hydroxide solution is added in a solvent such as ethanol, methanol, water or a mixed solvent thereof, and 20 ° C. to 80 ° C., preferably 40 ° C. to 60 ° C.
- Compound kc can be obtained by reacting at 0.5 ° C. for 0.5 to 24 hours, preferably 1 to 12 hours.
- Third Step Compound kd can be obtained by subjecting compound kc to a known general hydroxyl group deprotection reaction.
- Fourth Step To the compound kc, an acid chloride (R—CO—Cl) or a sulfonyl chloride (R—SO 2 —Cl) corresponding to the target product is added to a solvent such as THF, dioxane, toluene, dichloromethane and the like. Then add a tertiary amine such as pyridine, triethylamine, N-methylmorpholine and the like at ⁇ 20 ° C.
- a solvent such as THF, dioxane, toluene, dichloromethane and the like.
- Compound ke can be obtained by reacting.
- Fifth Step Compound kf can be obtained by subjecting compound ke to a known general hydroxyl group deprotection reaction.
- R is a substituent corresponding to the target compound, and other symbols are as defined above.
- a solvent such as THF, dichloromethane, DMF and the like.
- RL corresponding to the target product (L is a leaving group such as halogen, OMs, etc.) is added thereto, and it is ⁇ 20 ° C. to 40 ° C., preferably 0 ° C. to 30 ° C. for 0.1 hour to 12 hours
- Compound lb can be obtained by reacting preferably for 0.2 to 6 hours.
- compound lb can be obtained by adding formaldehyde to compound la in a formic acid solvent and reacting at 70 ° C. to 110 ° C. for 0.5 to 24 hours, preferably 1 to 12 hours.
- Second Step Compound lc can be obtained by subjecting compound lb to a known general hydroxyl group deprotection reaction.
- First Step Amino protected mb can be obtained by adding Boc 2 O or the like to compound ma in a solvent such as THF, dioxane, acetonitrile, water, or a mixed solvent thereof and subjecting it to an amine protection reaction.
- Second Step Sodium hydride is added to compound mb in a solvent such as THF, dichloromethane, DMF and the like.
- RL corresponding to the target product (L is a leaving group such as halogen, OMs, etc.) is added thereto, and it is ⁇ 20 ° C. to 40 ° C., preferably 0 ° C. to 30 ° C. for 0.1 hour to 12 hours, Compound mc can be obtained by reacting preferably for 0.2 to 6 hours.
- Third Step Compound md can be obtained by subjecting compound mc to a known general amino group and hydroxyl group deprotection reaction.
- First step A halogenating reagent eg, NBS, NCS, bromine, etc.
- a solvent such as dichloromethane, toluene, THF, dioxane, etc.
- Compound nb can be obtained by reacting for 0.2 to 6 hours.
- Second Step Compound nc can be obtained by subjecting compound nb to a known general hydroxyl group deprotection reaction.
- a boronic acid ester (RM) corresponding to the target product is added in a solvent such as toluene, THF, DMF or a mixed solvent thereof, and potassium carbonate, sodium carbonate, sodium hydroxide, etc.
- a zero-valent palladium catalyst eg, Pd (PPh 3 ) 4
- Pd (PPh 3 ) 4 was added thereto under a nitrogen stream, and the temperature was 60 ° C. to 120 ° C., preferably 80 ° C. to 110 ° C. for 1 hour to 48 hours, preferably 2 hours to
- the compound nd can be obtained by reacting for 24 hours.
- Compound ne can be obtained by subjecting compound nd to a known general hydroxyl group deprotection reaction.
- R is a carboxyl protecting group such as lower alkyl
- R 7 has the same meaning as R 7a in Item 1
- L 1 is a leaving group such as halogen, OMs, OTs, etc.
- other symbols are (Same as above)
- First Step Sodium chlorite and amidosulfuric acid are added to compound oa in the presence of a solvent such as THF, dioxane, dichloromethane, acetonitrile and the like, and 0 to 40 ° C., preferably 0 to 30 ° C. for 0.1 hour.
- Compound ob can be obtained by reacting for ⁇ 24 hours, preferably 1 to 12 hours.
- Second Step In the presence of a solvent such as DMF, DMA, NMP, or THF, a condensing agent such as HATU or WSC ⁇ HCl is added to compound ob, and an amine (R 3 —NH 2 ) corresponding to the target product and triethylamine, A compound is obtained by adding a tertiary amine such as N-methylmorpholine and pyridine and reacting at 10 ° C. to 60 ° C., preferably 20 ° C. to 40 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 12 hours. oc can be obtained.
- a tertiary amine such as N-methylmorpholine and pyridine
- Second Step Potassium carbonate, sodium carbonate, O- (2,4-dinitrophenyl) hydroxylamine is added to compound oc in the presence of a solvent such as DMF, DMA, NMP, THF, etc., and 10 ° C. to 60 ° C., preferably Compound od can be obtained by reacting at 20 ° C. to 40 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 12 hours.
- Fourth Step R 5 —C ( ⁇ O) —R 6 and acetic acid are added to compound od in the presence of a solvent such as toluene, DMF, DMA, NMP, THF, and the like, and 60 ° C. to 120 ° C., preferably 80 ° C.
- Compound oe can be obtained by reacting at 110 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 12 hours.
- Fifth Step In the presence of a solvent such as DMF, DMA, NMP, or THF, a compound R 7 -L 1 corresponding to the target product and a base such as sodium carbonate, potassium carbonate, or cesium carbonate are added to compound oe, and 0 ° C.
- the compound of can be obtained by reacting at ⁇ 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 12 hours.
- Sixth Step Compound og can be obtained by subjecting compound of to a known general carboxyl group deprotection reaction.
- Seventh Step Compound oh can be obtained by subjecting compound og to a known general hydroxyl group deprotection reaction.
- First Step Ammonia water is added to compound pa and reacted at 0 ° C. to 30 ° C., preferably 10 ° C. to 30 ° C. for 0.5 hour to 48 hours, preferably 1 hour to 24 hours, to give compound pb.
- Second Step A condensing agent such as HATU, WSC ⁇ HCl or the like is added to compound pb in the presence of a solvent such as DMF, DMA, NMP, or THF, or a mixed solvent thereof, and an amine (R 3 —NH corresponding to the target product) is added.
- a tertiary amine such as triethylamine, N-methylmorpholine, etc.
- a tertiary amine such as triethylamine, N-methylmorpholine, etc.
- a tertiary amine such as triethylamine, N-methylmorpholine, etc.
- Second Step Potassium carbonate, sodium carbonate, O- (2,4-dinitrophenyl) hydroxylamine is added to compound pc in the presence of a solvent such as DMF, DMA, NMP, THF, etc., and 10 ° C. to 60 ° C., preferably Compound pd can be obtained by reacting at 20 ° C. to 40 ° C.
- Step R 5 —C ( ⁇ O) —R 6 and acetic acid are added to compound pd in the presence of a solvent such as toluene, DMF, DMA, NMP, THF and the like, and 60 ° C. to 120 ° C., preferably 80 ° C. to Compound pe can be obtained by reacting at 110 ° C. for 0.1 to 12 hours, preferably 0.2 to 6 hours.
- a solvent such as toluene, DMF, DMA, NMP, THF and the like
- compound R 7 -L 1 corresponding to the target product and a base such as sodium carbonate, potassium carbonate, or cesium carbonate are added to compound pe, and 0 ° C.
- the compound pf can be obtained by reacting at -60 ° C., preferably 10 ° C.-40 ° C., for 0.1 hour-24 hours, preferably 1-12 hours.
- Sixth Step Compound pg can be obtained by subjecting compound pf to a known general hydroxyl group deprotection reaction.
- R represents a carboxyl protecting group
- n represents an integer of 0 to 6
- R Z7 and R Z8 have the same meanings as R C7 and R C8 in Item 1, and the other symbols are the same as above. Is significant
- a condensing agent such as HATU, WSC ⁇ HCl is added in the presence of a solvent such as pyridine, DMF, DMA, NMP, THF, or a mixed solvent thereof, and then compound qb and, if necessary, triethylamine, By adding a tertiary amine such as N-methylmorpholine and reacting at 10 ° C. to 60 ° C., preferably 20 ° C. to 40 ° C.
- compound qc is obtained.
- Second Step To the compound qc, potassium carbonate, sodium carbonate, O- (2,4-dinitrophenyl) hydroxylamine is added in the presence of a solvent such as DMF, DMA, NMP, THF or the like, or a mixed solvent thereof.
- Compound qd can be obtained by reacting at -60 ° C., preferably 20 ° C. to 40 ° C. for 0.1 hour to 48 hours, preferably 1 hour to 24 hours.
- Third Step R 5 —C ( ⁇ O) —R 6 and acetic acid are added to compound qd in the presence of a solvent such as toluene, DMF, DMA, NMP, THF, or a mixed solvent thereof, and 60 ° C. to 120 ° C.
- a solvent such as toluene, DMF, DMA, NMP, THF, or a mixed solvent thereof, and 60 ° C. to 120 ° C.
- the compound pe can be obtained by reacting at 80 to 110 ° C. for 0.1 to 12 hours, preferably 0.2 to 6 hours.
- compound qe can be obtained by reacting in a solvent such as ethanol or isopropyl alcohol at 100 ° C. to 200 ° C. for 5 minutes to 1 hour under microwave irradiation conditions.
- compound R 7 -L 1 corresponding to the target product and a base such as sodium carbonate, potassium carbonate, or cesium carbonate are added.
- compound qf can be obtained by reacting at 0 ° C. to 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 48 hours, preferably 1 hour to 24 hours.
- Fifth Step Compound qg can be obtained by subjecting compound qf to a known general hydroxyl group deprotection reaction.
- Sixth Step Compound qh can be obtained by subjecting compound qf to a known general carboxyl group deprotection reaction.
- Seventh Step Compound qi can be obtained by subjecting compound qh to a known general hydroxyl group deprotection reaction.
- Eighth step A condensing agent such as HATU, WSC ⁇ HCl, etc. is added to compound qh in the presence of a solvent such as pyridine, DMF, DMA, NMP, THF, or a mixed solvent thereof, and compound HNR Z7 R Z8 , and if necessary
- a tertiary amine such as triethylamine, diisopropylethylamine, N-methylmorpholine is added, and the reaction is carried out at 10 to 60 ° C., preferably 20 to 40 ° C. for 0.1 to 24 hours, preferably 1 to 12 hours.
- Compound qj can be obtained.
- Ninth Step Compound qk can be obtained by subjecting compound qj to a known general hydroxyl group deprotection reaction.
- R Z2 , R Z4 , R Z9 , R Z10 , and R Z13 are the same as R C2 , R C4 , R C9 , R C10 , and R C13 in item 1, and the other symbols are (Same as above)
- a condensing agent such as HATU, WSC ⁇ HCl or the like is added in the presence of a solvent such as pyridine, DMF, DMA, NMP or a mixed solvent thereof, and then compound ql and, if necessary, triethylamine, diisopropylethylamine
- a tertiary amine such as N-methylmorpholine
- Second Step To the compound qm, potassium carbonate, sodium carbonate, O- (2,4-dinitrophenyl) hydroxylamine is added in the presence of a solvent such as DMF, DMA, NMP, THF, etc., and 10 ° C. to 60 ° C., preferably Compound qn can be obtained by reacting at 20 to 40 ° C. for 0.1 to 48 hours, preferably 1 to 24 hours.
- a solvent such as DMF, DMA, NMP, THF, etc.
- Third Step R 5 —C ( ⁇ O) —R 6 and acetic acid are added to compound qn in the presence of a solvent such as toluene, DMF, DMA, NMP, THF, or a mixed solvent thereof, and 60 ° C. to 120 ° C.
- a solvent such as toluene, DMF, DMA, NMP, THF, or a mixed solvent thereof, and 60 ° C. to 120 ° C.
- the compound pe can be obtained by reacting at 80 to 110 ° C. for 0.1 to 12 hours, preferably 0.2 to 6 hours.
- compound qo can be obtained by reacting in a solvent such as ethanol under microwave irradiation conditions at 100 ° C. to 200 ° C. for 5 minutes to 1 hour.
- Compound qp can be obtained by adding a base and reacting at 0 ° C. to 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 48 hours, preferably 1 hour to 24 hours.
- Fifth Step Compound qq can be obtained by subjecting compound qp to a known general hydroxyl group deprotection reaction.
- Sixth Step Compound qr can be obtained by subjecting compound qp to a known general amino group deprotection reaction.
- Compound qs can be obtained by subjecting compound qr to a known general hydroxyl group deprotection reaction.
- Eighth Step In compound qr, in the presence of a solvent such as DMF, DMA, NMP, or THF, or in a mixed solvent thereof, compound R Z10 -L 1 corresponding to the target product and sodium carbonate, potassium carbonate, cesium carbonate, etc.
- Compound qt can be obtained by adding 0 ° C. to 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 48 hours, preferably 1 hour to 24 hours.
- Ninth Step Compound qt can be obtained by subjecting compound qt to a known general hydroxyl group deprotection reaction.
- Tenth Step A base such as sodium carbonate, potassium carbonate or cesium carbonate is added to compound qr in the presence of a solvent such as THF, dioxane or dichloromethane acetonitrile.
- a compound corresponding to the target product R Z4 COCl, R Z2 SO 2 Cl, or R Z13 OCOCl
- the temperature is ⁇ 20 ° C. to 60 ° C., preferably 0 ° C. to 30 ° C. for 0.1 hour to Compound qv can be obtained by reacting for 48 hours, preferably 1 to 24 hours.
- Eleventh Step Compound qw can be obtained by subjecting compound qv to a known general hydroxyl group deprotection reaction.
- Compound ra is mixed with dicyclohexylcarbodiimide, carbonyldiimidazole, dicyclohexylcarbodiimide-N-hydroxybenzotriazole, 4- (4,6-dimethoxy-1, 3) in a solvent such as DMF, THF, dichloromethane, acetonitrile or a mixed solvent thereof.
- the compound ra is obtained in the presence of a solvent such as THF, dioxane, dichloromethane, DMF, in the presence or absence of a base such as pyridine, triethylamine, diisopropylethylamine, 1-methylimidazole, diphenylchlorophosphate, thionyl chloride, oxalyl chloride, etc.
- a solvent such as THF, dioxane, dichloromethane, DMF
- a base such as pyridine, triethylamine, diisopropylethylamine, 1-methylimidazole, diphenylchlorophosphate, thionyl chloride, oxalyl chloride, etc.
- An acid chloride is formed by adding an acylating reagent, and a compound R 3 —NH 2 having a substituent corresponding to the target compound is added, and the temperature is ⁇ 20 ° C. to 60 ° C.,
- P 3 is an amino protecting group and may be any group that can be protected and / or deprotected by the method described in Protective Groups in Organic Synthesis, Theodora W Green (John Wiley & Sons)).
- 3 is aryl lower alkyloxycarbonyl, lower alkylcarbonyl, etc.
- B is as defined in Substituent Group D of Item 1 and the other symbols are as defined above.
- An oxidizing reagent such as Dess Martin Periodinane, manganese dioxide, and PDC is added to compound sa in the presence of a solvent such as dichloromethane, THF, dioxane, toluene, and the like, and the temperature is ⁇ 20 ° C.
- the compound sb can be obtained by reacting for 0.1 to 24 hours, preferably 0.5 to 12 hours.
- Second Step Sodium sulfate and amino alcohol sc corresponding to the target compound are added to compound sb in the presence or absence of a solvent such as toluene and THF, and 0 ° C. to 80 ° C., preferably 20 ° C. to 60 ° C.
- the compound sd can be obtained by reacting for 1 to 24 hours, preferably 0.5 to 12 hours.
- Third Step The compound se can be obtained by subjecting the compound sd to a known general amino group deprotection reaction.
- Fourth Step Compound sf is added to compound se in the presence of a solvent such as toluene, THF, dioxane, and the like, and 40 ° C to 110 ° C, preferably 60 ° C to 100 ° C, for 0.5 hour to 24 hours, preferably 1 hour.
- the compound sg can be obtained by reacting for ⁇ 12 hours.
- Fifth Step After subjecting the compound sg to a known general amino group deprotection reaction, the compound is s.p.
- Compound sh can be obtained by reacting for 1 to 12 hours, preferably 0.2 to 6 hours.
- Sixth Step Compound si can be obtained by subjecting compound sh to a known general carboxyl group deprotection reaction.
- Seventh Step Compound sj can be obtained by subjecting compound si to a known general hydroxyl group deprotection reaction.
- Eighth Step The decarboxylated compound sk can be obtained by reacting the compound si in a solvent such as diphenyl ether under microwave irradiation for 1 minute to 2 hours.
- Ninth Step Compound sl can be obtained by subjecting compound sk to a known general hydroxyl group deprotection reaction.
- First Step Compound ub can be obtained by subjecting compound ua to a protection reaction of a secondary amino group.
- Second Step Compound uc can be obtained by subjecting compound ub to a general amino group protection reaction.
- Third Step In the presence of a solvent such as DMF, DMA, NMP and a base such as NaH, compound R 7 -L 1 corresponding to the target compound is added to compound uc, and 0 ° C. to 80 ° C., preferably 20 ° C.
- Compound ue can be obtained by reacting at -60 ° C. for 0.5-12 hours, preferably 1-6 hours.
- Fourth step, fifth step (wherein R 3 and R 7 may be adjacently bonded.
- the fourth step and the fifth step are performed simultaneously)
- Compound ue is reacted with compound ud by sequentially reacting compounds R 3 -L 1 and R 7 -L 1 corresponding to the target compound in the presence of a solvent such as DMF, DMA, NMP and a base such as NaH.
- a solvent such as DMF, DMA, NMP and a base such as NaH.
- Sixth Step Compound ug can be obtained by subjecting compound uf to a secondary amino group protection reaction.
- Seventh Step Compound uh can be obtained by subjecting compound ug to a protection reaction of a secondary amino group.
- a condensing agent such as HATU or WSC ⁇ HCl is added to compound uk to add amine uj corresponding to the target product, pyridine, triethylamine, N-methylmorpholine, etc.
- Compound ul can be obtained by adding a tertiary amine and reacting at 10 ° C. to 60 ° C., preferably 20 ° C. to 40 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 12 hours.
- Eleventh Step Compound um can be obtained by subjecting compound ul to a general amino group protection reaction.
- tertiary amine such as R 5 —C ( ⁇ O) —R 6 , triethylamine, diisopropylethylamine, N-methylmorpholine and acetic acid in the presence of a solvent such as toluene, DMF, DMA, NMP, etc. Is added and reacted at 60 ° C. to 120 ° C., preferably 80 ° C. to 100 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 12 hours, to obtain compound un.
- a solvent such as toluene, DMF, DMA, NMP, etc.
- R ′ may be a group that can be protected and / or deprotected by the method described in Protective Groups in Organic Synthesis, Theodora W Green (John Wiley & Sons), etc., for example, R ′ is a lower alkyl, etc.
- X is halogen, and other symbols are as defined above.
- a solution of the compound ta is added dropwise thereto and reacted at ⁇ 20 ° C. to 40 ° C., preferably 0 ° C. to 30 ° C. for 0.1 hour to 12 hours, preferably 0.5 hour to 6 hours, whereby the compound tb Can be obtained.
- Second Step N N-dimethylformamide dimethyl acetal is added to compound tb in a solvent such as THF, dioxane, toluene, ethyl acetate, or a mixed solvent thereof or without solvent, and 0 ° C. to 80 ° C., preferably 20 ° C.
- Compound tc can be obtained by reacting at -40 ° C to 0.5-24 hours, preferably 1-12 hours.
- Third step Sodium tert-pentoxide, n-butyllithium, tert-butyllithium, sodium methoxide, sodium ethoxide
- an organic metal base such as Sodium tert-butoxide, Potassium tert-butoxide or the like in a solvent such as THF, ether, DMI, methanol, ethanol or a mixed solvent thereof.
- a solution of the compound tc is dropped here and reacted at ⁇ 20 ° C. to 60 ° C., preferably 0 ° C. to 30 ° C. for 0.5 hour to 24 hours, preferably 1 hour to 12 hours, and then hydrochloric acid, sulfuric acid, etc.
- Compound te can be obtained by adding an acid and reacting at ⁇ 20 ° C. to 60 ° C., preferably 0 ° C. to 30 ° C. for 0.5 hour to 24 hours, preferably 1 hour to 12 hours.
- Compound th can be obtained by reacting at -60 ° C for 0.5 hour to 48 hours, preferably 1 hour to 24 hours.
- Second Step Compound tg is added to compound tf in the presence of a solvent such as ethanol, THF, dioxane, acetonitrile or the like, or a mixed solvent thereof, and 0.5 to 0 ° C. to 80 ° C., preferably 20 ° C. to 60 ° C.
- Compound ti can be obtained by reacting for a period of time to 48 hours, preferably 1 hour to 24 hours.
- Second Step Potassium osmate dihydrate, sodium periodate, and water are added to compound th in the presence of a solvent such as THF, ethyl acetate, dioxane or the like in a mixed solvent thereof, and 0 ° C. to 60 ° C., preferably 10 ° C.
- Compound tj can be obtained by reacting at ⁇ 40 ° C. for 0.5 hour and 24 hours, preferably from 1 hour to 12 hours.
- ozone is introduced into compound th in the presence of a solvent such as THF, ethyl acetate, dioxane or the like in a mixed solvent thereof at ⁇ 10 ° C.
- Compound tj can be obtained by adding 3 P or dimethyl sulfide.
- an acid such as formic acid, trifluoroacetic acid, paratoluenesulfonic acid, or the like in a solvent such as acetone, acetonitrile, ethanol, water or a mixed solvent thereof, or sulfuric acid in a formic acid solvent is added,
- Compound tk can be obtained by reacting at 0 ° C. to 90 ° C., preferably 20 ° C. to 80 ° C., for 0.5 hour and 24 hours, preferably 1 hour to 12 hours.
- the compound to can be obtained by reacting preferably for 1 to 12 hours.
- Seventh Step To compound to, compound BL- 1 corresponding to the target compound is added in the presence of a solvent such as DMF, DMA, NMP, THF or the like, or a mixed solvent thereof, and 0 ° C. to 80 ° C., preferably Compound tp can be obtained by reacting at 20 ° C. to 60 ° C. for 0.5 to 12 hours, preferably 1 to 6 hours.
- compound va can be used in the presence of a solvent such as THF, dioxane, dichloromethane, DMF, in the presence or absence of a base such as pyridine, triethylamine, diisopropylethylamine, 1-methylimidazole, diphenylchlorophosphate, thionyl chloride, oxalyl chloride, etc.
- a solvent such as THF, dioxane, dichloromethane, DMF
- a base such as pyridine, triethylamine, diisopropylethylamine, 1-methylimidazole, diphenylchlorophosphate, thionyl chloride, oxalyl chloride, etc.
- An acid chloride is generated by adding an acylating reagent, and a compound vb having a substituent corresponding to the target compound is added, and the temperature is ⁇ 20 ° C. to 60 ° C., preferably ⁇ 10
- Compound vc can be obtained by reacting for 24 hours, preferably 0.5 to 12 hours.
- Second Step Potassium carbonate, sodium carbonate, O- (2,4-dinitrophenyl) hydroxylamine is added to compound vc in the presence of a solvent such as DMF, DMA, NMP, THF or the like, and 10 ° C. to 60 ° C., preferably Compound vd can be obtained by reacting at 20 to 40 ° C. for 0.1 to 48 hours, preferably 1 to 24 hours.
- the deprotection reaction of the acetal protecting group of compound vd can be performed by a general method described in Protective Groups in Organic Synthesis, Theodora W Green (John Wiley & Sons) and the like. Thereafter, the compound ve can be obtained by intramolecular reaction of the generated aldehyde group. For example, acetic acid and / or paratoluenesulfonic acid is added to compound vd in the presence of a solvent such as DMF, toluene, THF and the like at 10 ° C. to 80 ° C., preferably 30 ° C. to 60 ° C. for 0.5 hours to 12 Compound ve can be obtained by reacting for a period of time, preferably 1 to 6 hours.
- a solvent such as DMF, toluene, THF and the like
- compound R 7 -L 1 corresponding to the target product and sodium carbonate, potassium carbonate, cesium carbonate, etc.
- Compound vf can be obtained by adding a base and reacting at 0 ° C. to 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 48 hours, preferably 1 hour to 24 hours.
- First Step A cation-generating reagent eg, dichloroacetic acid
- a solvent such as 1,2-dichloroethane, THF, dioxane, chloroform, etc.
- R 7 -OH which is a reagent corresponding to the target product, is added.
- the compound wb can be obtained by reacting at 10 ° C.
- Second Step A base eg, 2-tert-butylimino2-diethylamino-1,3-dimethylperhydro-1,3,2-diazaphosphorine
- a solvent such as DMF, DMA, NMP, THF, and the like.
- Paraformaldehyde is added and reacted at 0 ° C. to 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 24 hours, preferably 0.5 hour to 12 hours.
- a desorption reagent eg, paratoluenesulfonyl chloride
- the reaction is carried out at 0 ° C. to 60 ° C., preferably 10 ° C. to 40 ° C. for 0.1 hour to 24 hours, preferably 0.5 hour to 12 hours.
- a desorption reagent eg, paratoluenesulfonyl chloride
- Example Compound Prodrug: Formula I
- Parent Compound Parent Compound: Formula II
- Reference Example Compound Parent Compound: Formula II
- Example compounds can be obtained by a general method of converting a hydroxyl group into an ester group or an ether group using the compound shown in the Reference Example as a raw material.
- Protective Groups in Organic Synthesis Theodora W Green (John Wiley & Sons), Prog. Med. 5: 2157-2161 (1985) and Applied by The British Library— “The world's Knowledge” etc. can be used.
- Step 3 Under nitrogen flow, a solution of compound 1C and ruthenium chloride (2.76 mg, 0.0133 mmol) in MeCN (5 ml) at room temperature with sodium periodate (625.8 mg, 2.93 mmol) and 96% sulfuric acid (287.4 mg, 2.93 mmol) aqueous solution (8 ml) was added dropwise over 10 minutes. After stirring the reaction solution at the same temperature for 5 minutes, ethyl acetate was added to separate the organic layer, and the aqueous layer was extracted twice with ethyl acetate. The combined extract was dried over sodium sulfate. The solvent was distilled off, and the resulting oil was purified by silica gel column chromatography.
- Step 5 To a solution of compound 1E (1.00 g, 3.14 mmol) in DMF (10 ml) at room temperature, add WSC HCl (1.20 g, 6.28 mmol) and HOBt (551.6 mg, 4.08 mmol) and stir at the same temperature for 90 minutes. did. The reaction solution was cooled to 0 ° C., and a solution of 2-methoxyethanamine (236.0 mg, 3.14 mmol) in DMF (2 ml) was added dropwise over 3 minutes. The reaction mixture was stirred at the same temperature for 1 hour, water was added, and the mixture was extracted 3 times with ethyl acetate. The extract was washed with water three times and dried over sodium sulfate.
- Step 7 Compound 1G (2.86 g, 5.63 mmol) and triphenylphosphine (2.21 g, 8.45 mmol) in THF (6 ml) at room temperature with DEAD 40 wt% toluene solution (3.68 g, 8.45 mmol) over 3 minutes And dripped. The reaction solution was stirred at the same temperature for 30 minutes, the solvent was distilled off, and the resulting oil was purified by silica gel chromatography. From the fraction eluted with ethyl acetate-MeOH (9: 1, v / v), 1.37 g (yield 50%) of compound 1H was obtained as an oily substance.
- Step 6 Dimethyl 3- (benzyloxy) -4-oxo-4H-pyran-2,5-dicarboxylate (974 mg, 3.06 mmol) and 12F (999 mg, obtained by the method shown in Intermediate Synthesis Example 1 3.06 mmol) was added to toluene (10 ml), and the mixture was stirred at 110 ° C. for 5 hours. After the solvent was distilled off under reduced pressure, the obtained crude product was purified by silica gel column chromatography (chloroform-methanol, 98: 2, v / v) to obtain 1.51 g of compound 12G as a pale yellow solid.
- Step 4 Add dimethyl 3- (benzyloxy) -4-oxo-4H-pyran-2,5-dicarboxylate (313 mg, 0.983 mmol) and 28D (246 mg, 0.983 mmol) to toluene (3 ml) and add to 100 ° C. For 2.5 hours. After distilling off the solvent under reduced pressure, the obtained crude product was purified by silica gel column chromatography (chloroform-methanol, 98: 2, v / v) to obtain 320 mg of compound 28E as a pale yellow gum. .
- Trifluoroacetic acid (1 ml) was added to the compound 28H obtained in the seventh step and stirred at room temperature for 1 hour. After concentration under reduced pressure, the pH was adjusted to 3 with aqueous sodium bicarbonate and 2N hydrochloric acid, extracted with chloroform, and dried over sodium sulfate. After the solvent was distilled off under reduced pressure, chloroform-methanol-ethyl ether was added and the precipitated solid was collected by filtration to obtain 17 mg of compound 28 as a colorless solid.
- Trifluoroacetic acid (1 ml) was added to the compound 36C obtained in the third step, and the mixture was stirred at room temperature for 1 hour. After concentration under reduced pressure, the pH was adjusted to 6 with aqueous sodium bicarbonate and 2N hydrochloric acid, extracted with chloroform, and dried over sodium sulfate. After evaporating the solvent under reduced pressure, chloroform-ethyl ether was added and the precipitated solid was collected by filtration to obtain 24 mg of Compound 36 as a colorless solid.
- Trifluoroacetic acid (2 ml) was added to compound 41B obtained in the first step, and the mixture was stirred at room temperature for 1 hour. After concentration under reduced pressure, the pH was adjusted to 6 with aqueous sodium bicarbonate and 2N hydrochloric acid, extracted with chloroform, and dried over sodium sulfate. After evaporating the solvent under reduced pressure, methylene chloride-ethyl ether was added and the precipitated solid was collected by filtration to obtain 45 mg of Compound 41 as a colorless solid.
- reaction mixture was poured into water, extracted with ethyl acetate, and dried over sodium sulfate. After the solvent was distilled off under reduced pressure, the obtained crude product was purified by silica gel column chromatography (chloroform-methanol, 97: 3, v / v) to obtain 160 mg of a colorless solid as compound 48A.
- Step 6 Compound 49G (214 mg, 0.465 mmol) was dissolved in THF (4 ml), ethanol (2 ml) and methylene chloride (2 ml), and 2N aqueous sodium hydroxide solution (1.16 ml, 2.32 mmol) at room temperature. Was added and stirred for 2.5 hours. 1N Hydrochloric acid was added, and the mixture was extracted with chloroform and dried over sodium sulfate. After the solvent was distilled off under reduced pressure, 158 mg of compound 49H was obtained as a yellow solid.
- Second Step A solution of compound 52A (543 mg, 1.07 mmol) in THF (5 ml) was cooled to ⁇ 78 ° C., methylmagnesium bromide 0.97M THF solution (1.66 ml, 1.61 mmol) was added, and the mixture was heated to ⁇ 20 ° C. for 2 hours. The temperature increased over time. 1N Hydrochloric acid was added to the reaction mixture, and the mixture was extracted 3 times with ethyl acetate. The extract was dried over sodium sulfate, and the solvent was distilled off. The oily substance obtained was purified by silica gel chromatography.
- Sixth Step 5 To a solution of compound 65F in DMF (0.5 mL), 2N aqueous sodium hydroxide solution (0.2 mL) was added, and the mixture was stirred at room temperature for 2 hours.
- Reference Example 65 Reference Example compounds 66 to 92 shown in Tables 10 to 14 below were synthesized in the same manner.
- Step 3 Suspend potassium carbonate (4.20 g, 30.42 mmol) in a DMF (10 ml) solution of the above compound 95C (2.62 g, 10.14 mmol) at room temperature and stir for 5 minutes, then O- (2,4-dinitrophenyl ) hydroxylamine (3.03 g, 15.21 mmol) was added and stirred at the same temperature for 3 hours. Water was added to the reaction solution, extracted with chloroform 5 times, and the extract was dried over sodium sulfate. After the solvent was distilled off, the resulting oil was purified by silica gel chromatography.
- Step 1 Add compound 95B (1.00 g, 3.55 mmol) and cyclopropanamine (0.492 ml, 7.10 mmol) to pyridine (20 ml), add 1-hydroxybenzotriazole (544 mg, 3.55 mmol) and 1- (3-dimethylaminopropyl) -3- Ethylcarbodiimide hydrochloride (1.36 g, 7.10 mmol) was added in order and stirred at room temperature for 18 hours.
- reaction solution was concentrated under reduced pressure, and the resulting crude product was subjected to silica gel column chromatography (chloroform-methanol, 97: 3 ⁇ 95: 5 ⁇ 90: 10, v / v), followed by amino column chromatography (chloroform-methanol). 97: 3, v / v), methylene chloride-ethyl ether was added, and the precipitated solid was collected by filtration to obtain 665 mg of compound 126C as a colorless solid.
- Step 1 Add compound 95B (2.40 g, 8.52 mmol) and ethyl 3-aminopropanoate hydrochloride (2.62 g, 17.0 mmol) to pyridine (30 ml), add 1-hydroxybenzotriazole (1.31 g, 8.52 mmol) and 1- (3- Dimethylaminopropyl) -3-ethylcarbodiimide hydrochloride (3.27 g, 17.0 mmol) was added in order, and the mixture was stirred at room temperature for 2 hours.
- Step 4 Compound 128C (1.00 g, 2.69 mmol) is dissolved in DMF (10 ml), and cesium carbonate (2.63 g, 8.08 mmol) and (bromomethylene) dibenzene (998 mg, 4.04 mmol) are added at 0 ° C to room temperature. For 18 hours. The reaction solution was poured into water and extracted with ethyl acetate, and the organic layer was washed with water and dried over sodium sulfate. The solvent was distilled off under reduced pressure, and the resulting crude product was purified by silica gel column chromatography (chloroform-methanol, 98: 2, v / v) to obtain 500 mg of compound 128D as a colorless gum.
- Trifluoroacetic acid (1 ml) was added to compound 129A (40 mg, 0.079 mmol), and the mixture was stirred at room temperature for 1 hour. After concentration under reduced pressure, the pH was adjusted to 3 with aqueous sodium bicarbonate and 2N hydrochloric acid, extracted with chloroform, and dried over sodium sulfate. After the solvent was distilled off under reduced pressure, chloroform-methanol-ethyl ether was added and the precipitated solid was collected by filtration to obtain 25 mg of Compound 129 as a colorless solid.
- Second Step Trifluoroacetic acid (1 ml) was added to the compound 130A obtained in the first step, and the mixture was stirred at room temperature for 2 hours. After concentration under reduced pressure, the pH was adjusted to 6 with aqueous sodium bicarbonate and aqueous ammonium chloride, extracted with chloroform, and dried over sodium sulfate. After evaporating the solvent under reduced pressure, chloroform-ethyl ether was added and the precipitated solid was collected by filtration to obtain 25 mg of Compound 130 as a colorless solid.
- reaction solution was concentrated under reduced pressure, and the resulting crude product was subjected to silica gel column chromatography (chloroform-methanol, 97: 3 ⁇ 95: 5 ⁇ 90: 10, v / v), followed by amino column chromatography (chloroform-methanol). 97: 3, v / v) to give 721 mg of compound 135C as a colorless solid.
- Trifluoroacetic acid (2 ml) was added to compound 136A obtained in the first step, and the mixture was stirred at room temperature for 1.5 hours. After concentration under reduced pressure, the pH was adjusted to 6 with aqueous sodium bicarbonate and aqueous ammonium chloride, extracted with chloroform, and dried over sodium sulfate. After evaporating the solvent under reduced pressure, methylene chloride-ethyl ether was added and the precipitated solid was collected by filtration to obtain 23 mg of Compound 136 as a colorless solid.
- Trifluoroacetic acid (1 ml) was added to compound 144B obtained in the first step, and the mixture was stirred at room temperature for 1 hour. After concentration under reduced pressure, the pH was adjusted to 6 with aqueous sodium bicarbonate and aqueous ammonium chloride, extracted with chloroform, and dried over sodium sulfate. After evaporating the solvent under reduced pressure, methylene chloride-ethyl ether was added and the precipitated solid was collected by filtration to obtain 13 mg of Compound 144 as a colorless solid.
- Triethylamine (63.2 mg, 0.624 mmol) and benzoyl chloride (31.9 mg, 0.312 mmol) were added to the dichloromethane solution under ice cooling, and the mixture was stirred at room temperature for 1 hour. Water was added to the reaction mixture, and the mixture was extracted 3 times with dichloromethane. The extract was dried over sodium sulfate, the solvent was distilled off, and the resulting residue was washed with diethyl ether to obtain 68 mg (yield 56%) of compound 150B.
- reaction mixture was stirred for 20 minutes under ice-cooling, acetonitrile (50 mL) was added, and the mixture was further stirred for 2 hours.
- an aqueous acetic acid solution (10%, 100 mL) under ice-cooling, and the mixture was extracted with ethyl acetate. The extract was washed successively with water (100 mL), saturated aqueous sodium hydrogen carbonate (150 mL) and saturated brine (100 mL), and dried over sodium sulfate.
- Step 3 Lithium chloride (56.0 mg, 1.32 mmol) was added to a solution of the crude product of Compound 159B obtained in Step 2 in DMF (2 mL) at room temperature, and the mixture was stirred at 150 ° C for 30 minutes under microwave irradiation. . The residue obtained by evaporating the reaction solution under reduced pressure was purified by preparative LCMS to obtain Compound 159 (33.6 mg, 27% for 3 steps) as a white solid.
- Step 4 Bromodiphenylmethane (2.26 g) in a suspension of compound 165D (2.77 g, 7.50 mmol), potassium carbonate (2.23 g, 16.1 mmol) and sodium iodide (102 mg, 0.680 mmol) in acetonitrile (30 mL) at room temperature , 9.14 mmol) and stirred at 90 ° C. for 7 hours.
- the reaction mixture was poured into hydrochloric acid (2 N, 10 mL) and ice (20 g), extracted with chloroform (100 mL ⁇ 2), and dried over sodium sulfate.
- First stepCompound 49B (950 mg, 3.35 mmol), 3-aminopropan-1-ol (277 mg, 3.69 mmol) and sodium sulfate (1.91 g, 13.4 mmol) were added to toluene (25 ml), and 1 hour at room temperature.
- Boc2O (0.856 ml, 3.69 mmol) was added at room temperature and stirred for 18 hours. Further, Boc2O (0.400 ml, 1.72 mmol) was added at room temperature and stirred as it was for 60 hours.
- the reaction solution was filtered, and the filtrate was concentrated under reduced pressure.
- Trifluoroacetic acid (2 ml) was added to compound 171F (50 mg, 0.11 mmol) and stirred at room temperature for 1 hour. After concentration under reduced pressure, the pH was adjusted to 6 with aqueous sodium bicarbonate and 2N hydrochloric acid, extracted with chloroform, and dried over sodium sulfate. After the solvent was distilled off under reduced pressure, chloroform-methanol-ethyl ether was added and the precipitated solid was collected by filtration to obtain 24 mg of compound 171 as a colorless solid.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Pulmonology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
-Z-N(RA1)(RA2)、
-Z-N(RA3)-SO2-(RA4)、
-Z-C(=O)-N(RA5)-SO2-(RA6)、
-Z-N(RA7)-C(=O)-RA8、
-Z-S-RA9、
-Z-SO2-RA10、
-Z-S(=O)-RA11、
-Z-N(RA12)-C(=O)-O-RA13、
-Z-N(RA14)-C(=O)-N(RA15)(RA16)、
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19)、
-Z-N(RA20)-C(=O)-C(=O)-RA21、または
-Z-B(-ORA22)(-ORA23)
(ここで、RA1、RA2、RA3、RA5、RA7、RA8、RA9、RA12、RA13、RA14、RA15、RA16、RA17、RA18、RA19、RA20、およびRA21は、それぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RA4、RA6、RA10、およびRA11はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RA1およびRA2、RA15およびRA16、ならびにRA18およびRA19は、隣接する原子と一緒になって複素環を形成していてもよく、
RA22、およびRA23はそれぞれ独立して、水素原子、置換基群Cで置換されていてもよい低級アルキル、またはRA22、およびRA23が一緒になっては、隣接する原子と一緒になって複素環を形成していてもよく、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;
-Z-N(RB1)-SO2-RB2、
-Z-N(RB3)-C(=O)-RB4、
-Z-N(RB5)-C(=O)-O-RB6、
-Z-C(=O)-N(RB7)(RB8)、
-Z-N(RB9)(RB10)、または
-Z-SO2-RB11
(ここで、RB1、RB3、RB4、RB5、RB6、RB7、RB8、RB9、およびRB10は、それぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RB2およびRB11はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RB7およびRB8、ならびにRB9およびRB10は、隣接する原子と一緒になって複素環を形成していてもよく、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;
-Z-N(RC1)-SO2-RC2、
-Z-N(RC3)-C(=O)-RC4、
-Z-N(RC5)-C(=O)-O-RC6、
-Z-C(=O)-N(RC7)(RC8)、
-Z-N(RC9)(RC10)、
-Z-SO2-RC11、または
-Z-N(RC12)-O-C(=O)-RC13
(ここで、RC1、RC3、RC4、RC5、RC6、RC7、RC8、RC9、RC10、RC12および、RC13は、それぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RC2、およびRC11はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RC7およびRC8、ならびにRC9およびRC10は、隣接する原子と一緒になって複素環を形成していてもよく、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;
b)B1がCR8aR9aおよびB2がCR10aR11aであり、
-Y-S-RD1、
-Z-S(=O)-RD2、
-Z-SO2-RD3、
-C(=O)-C(=O)-RD4、
-C(=O)-N(RD5)(RD6)、
-Z-C(RD7)(RD8)(RD9)、
-Z-CH2-RD10、
-Z-N(RD11)-C(=O)-O-RD12、もしくは
-Z-N(RD13)-C(=O)-RD14、または
R5aおよびR6aは一緒になって置換基群Cで置換されていてもよい複素環式基を形成してもよい
(ここで、RD1、RD4、RD5、RD6、RD9、RD11、RD12、RD13、およびRD14はそれぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RD2、およびRD3はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RD7、RD8、およびRD10はそれぞれ独立して、置換基群Cで置換されていてもよい炭素環式基、または置換基群Cで置換されていてもよい複素環式基であり、
RD5およびRD6は、隣接する原子と一緒になって複素環を形成していてもよく、
Yは、直鎖もしくは分枝状の低級アルキレンであり、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり、
RD5およびRD6は、隣接する原子と一緒になって炭素環を形成していてもよい;
R3aとR7aは隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成していてもよく、
2)B1がNR7a、およびB2がCR5aR6aの場合、
R3aとR6aは隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成していてもよく、または
3)B1がCR8aR9a、およびB2がCR10aR11aの場合、
R8aおよびR10aは、隣接する原子と一緒になって置換基群Dで置換されていてもよい炭素環もしくは複素環を形成していてもよく、もしくは
R3aおよびR11aは、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成していてもよく、
B1がCR8aR9a、およびB2がCR10aR11aであり、ならびにR9aが水素、およびR11aが水素の時、
i)R8aまたはR10aのいずれか一方が、
-Z-C(RE1)(RE2)(RE3)
-Y-S-RE4、
-Z-CH2-RE5、または
以下に示される基:
(式中、RE1、およびRE2はそれぞれ独立して、置換基群Cで置換されていてもよい炭素環式基、および置換基群Cで置換されていてもよい複素環式基からなる置換基群から選ばれ、
RE3は、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RE4は、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RE5は、置換基群Cで置換されていてもよい芳香族複素環式基であり、
RE6は、置換基群Cから選ばれ、
mは0または1以上の整数であり、
但し、m個のRE6は、置換基群Cから選ばれる同一または異なっていてもよい基であり、
Yは、直鎖もしくは分枝状の低級アルキレンであり、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;かつ
水素、カルボキシ、シアノ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Y-S-RF1、
-C(=O)-C(=O)-RF2、または
-C(=O)-N(RF3)(RF4)
(ここで、RF1、RF2、RF3、およびRF4はそれぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、ならびに
Yは、直鎖もしくは分枝状の低級アルキレンである)である;
c)R5a、R6a、およびR7aが、いずれも水素である場合。
d)R8a、R9a、R10a、およびR11aが、いずれも水素である場合。;
で示される化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R1aが、水素、ハロゲン、ヒドロキシ、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RA1)(RA2)、
-Z-N(RA3)-SO2-(RA4)、
-Z-N(RA7)-C(=O)-RA8、
-Z-S-RA9、
-Z-SO2-RA10、
-Z-N(RA12)-C(=O)-O-RA13、
-Z-N(RA20)-C(=O)-C(=O)-RA21、または
-Z-B(-ORA22)(-ORA23)
(置換基群C、RA1、RA2、RA3、RA4、RA7、RA8、RA9、RA10、RA12、RA13、RA20、RA21、RA22、RA23およびZは、項目1と同意義である)
である、項目1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R1aが、水素、ハロゲン、ヒドロキシ、カルボキシ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい複素環式基、
-Z-N(RA1)(RA2)、
-Z-N(RA7)-C(=O)-RA8、
-Z-N(RA12)-C(=O)-O-RA13、または
-Z-B(-ORA22)(-ORA23)
(置換基群C、RA1、RA2、RA7、RA8、RA12、RA13、RA22、RA23およびZは、項目1と同意義である)
である、項目1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R1aが、水素、ハロゲン、ヒドロキシ、カルボキシ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい複素環式基、または
-Z-N(RA1)(RA2)
(置換基群C、RA1、RA2、およびZは、項目1と同意義である)
である、項目1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R1aが、水素、またはカルボキシである、項目1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R2aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい複素環低級アルキル、または
-Z-N(RB9)(RB10)
(置換基群C、RB9、RB10、およびZは、項目1と同意義である)
である、項目1~5のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R2aが、水素、または置換基群Cで置換されていてもよい低級アルキル
(置換基群Cは、項目1と同意義である)
である、項目1~5のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R3aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環低級アルキル、
-Z-N(RC1)-SO2-RC2、
-Z-N(RC3)-C(=O)-RC4、
-Z-N(RC5)-C(=O)-O-RC6、
-Z-C(=O)-N(RC7)(RC8)、または
-Z-N(RC9)(RC10)
(置換基群C、RC1、RC2、RC3、RC4、RC5、RC6、RC7、RC8、RC9、RC10、およびZは、項目1と同意義である)
である、項目1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R3aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、
(置換基群Cは、項目1と同意義である)
である、項目1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
B1がNR7aであり、およびB2がCR5aR6aであり、ならびに
R5a、R6aおよびR7aが、それぞれ独立して水素、カルボキシ、シアノ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Y-S-RD1、
-Z-S(=O)-RD2、
-Z-SO2-RD3、
-C(=O)-C(=O)-RD4、
-C(=O)-N(RD5)(RD6)、
-Z-C(RD7)(RD8)(RD9)
-Z-N(RD11)-C(=O)-O-RD12、または
-Z-N(RD13)-C(=O)-RD14
(置換基群C、RD1、RD2、RD3、RD4、RD5、RD6、RD7、RD8、RD9、RD11、RD12、RD13、RD14、Y、およびZは、項目1と同意義である)
である、項目1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
B1がNR7aであり、およびB2がCR5aR6aであり、
R5aが水素であり、
R6aが水素、または置換基群Cで置換されていてもよい低級アルキルであり、ならびに
R7aが置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、換基群Cで置換されていてもよい炭素環低級アルキル、換基群Cで置換されていてもよい複素環低級アルキル、または
-Z-C(RD7)(RD8)(RD9)
(置換基群C、RD7、RD8、RD9、およびZは、項目1と同意義である)
である、項目1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
B1がCR5aR6aであり、およびB2がNR7aであり、
R5aが水素であり、
R6aが水素、または置換基群Cで置換されていてもよい低級アルキルであり、ならびに
R7aが置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、換基群Cで置換されていてもよい炭素環低級アルキル、換基群Cで置換されていてもよい複素環低級アルキル、または
-Z-C(RD7)(RD8)(RD9)
(置換基群C、RD7、RD8、RD9、およびZは、項目1と同意義である)
である、項目1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R7aが、以下に示される基:
(式中、RE6およびmは、項目1と同意義である)
である、項目11または12のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R1aが、水素、またはカルボキシであり、
R2aが、水素であり、
R3aが、置換基群Cで置換されていてもよい低級アルキルであり、
B1がNR7aであり、およびB2がCH2であり、ならびに
R7aが、以下に示される基:
(式中、置換基群C、RE6、およびmは、項目1と同意義である)
である、項目1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
B1がCR8aR9a、およびB2がCR10aR11aであり、
R9aが水素、およびR11aが水素であり、ならびに
水素、または置換基群Cで置換されていてもよい低級アルキル
(置換基群Cは、項目1と同意義である);
である項目1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
B1がCR5aR6a、およびB2がNR7aであり、
R6aが水素であり、
R3aおよびR7aが、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成し、ならびに
R5aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、
-Y-S-RD1、
-C(=O)-C(=O)-RD2、または
-C(=O)-N(RD3)(RD4)
(ここで、RD1、RD2、RD3、およびRD4、Y、置換基群Cならびに置換基群Dは、項目1と同意義である)
である、項目1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R5aが、水素、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい複素環式基、または置換基群Cで置換されていてもよい複素環低級アルキル
(ここで、置換基群Cは、項目1と同意義である)
である、項目16に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
B1がCR8aR9a、およびB2がCR10aR11aであり、
R9aが水素、およびR10aが水素であり、
R3aおよびR11aが、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成し、ならびに
R8aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、
-Y-S-RD1、
-C(=O)-C(=O)-RD2、または
-C(=O)-N(RD3)(RD4)
(ここで、RD1、RD2、RD3、およびRD4、Y、置換基群Cならびに置換基群Dは、項目1と同意義である)
である、項目1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
R8aが、水素、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい複素環式基、または置換基群Cで置換されていてもよい複素環低級アルキル
(ここで、置換基群Cは、項目1と同意義である)
である、項目18に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
置換基群Dが、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、または置換基群Cで置換されていてもよい複素環低級アルキル
(置換基群Cは、項目1と同意義である)
である、項目16~19のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
PRが、以下の式a)~y)から選ばれる基:
a)-C(=O)-PR0、
b)-C(=O)-PR1、
c)-C(=O)-L-PR1、
d)-C(=O)-L-O-PR1、
e)-C(=O)-L-O-L-O-PR1、
f)-C(=O)-L-O-C(=O)-PR1、
g)-C(=O)-O-PR2、
h)-C(=O)-N(PR2)2、
i)-C(=O)-O-L-O-PR2、
j)-CH2-O-PR3、
k)-CH2-O-L-O-PR3、
l)-CH2-O-C(=O)-PR3、
m)-CH2-O-C(=O)-O-PR3、
n)-CH(-CH3)-O-C(=O)-O-PR3、
o)-CH2-O-C(=O)-N(-K)-PR3、
p)-CH2-O-C(=O)-O-L-O-PR3、
q)-CH2-O-C(=O)-O-L-N(PR3)2、
r)-CH2-O-C(=O)-N(-K)-L-O-PR3、
s)-CH2-O-C(=O)-N(-K)-L-N(PR3)2、
t)-CH2-O-C(=O)-O-L-O-L-O-PR3、
u)-CH2-O-C(=O)-O-L-N(-K)-C(=O)-PR3、
v)-CH2-O-P(=O)(-OH)2、
w)-CH2-O-P(=O)(-OBn)2、
x)-CH2-PR4(ただし、ベンジル基を除く)
y)-C(=N+PR5 2)(-NPR5 2)
(式中、Lは、直鎖もしくは分枝状の低級アルキレン、または直鎖もしくは分枝状の低級アルケニレンであり、
Kは、水素、または直鎖もしくは分枝状の低級アルキレンであり、
PR0は、置換基群Fで置換されていてもよい低級アルキル、または置換基群Fで置換されていてもよい低級アルケニルであり、
PR1は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、または置換基群Fで置換されていてもよい低級アルキルチオであり、
PR2は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、または置換基群Fで置換されていてもよい複素環式基であり、
PR3は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、置換基群Fで置換されていてもよい炭素環低級アルキル、置換基群Fで置換されていてもよい複素環低級アルキル、または低級アルキルシリルであり、
PR4は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基であり、ならびに
PR5は、置換基群Fで置換されていてもよい低級アルキルである。
置換基群F;オキソ、低級アルキル、ヒドロキシ低級アルキル、アミノ、低級アルキルアミノ、炭素環低級アルキル、低級アルキルカルボニル、ハロゲン、ヒドロキシ、カルボキシ、低級アルキルカルボニルアミノ、低級アルキルカルボニルオキシ、低級アルキルオキシカルボニル、低級アルキルオキシ、シアノ、ニトロ)
である、項目1~20に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
項目1~21のいずれかに記載の化合物、その製薬上許容される塩、またはそれらの溶媒和物を含有する医薬組成物。
抗インフルエンザ作用を有する、項目22に記載の医薬組成物。
キャップ依存的エンドヌクレアーゼ阻害作用を有する、項目22に記載の医薬組成物。
インフルエンザ感染症の治療および/または予防のための、項目22に記載の医薬組成物。
項目1~21のいずれかに記載の化合物、その製薬上許容される塩、またはそれらの溶媒和物を含有するキャップ依存的エンドヌクレアーゼ阻害剤。
「置換基群Dで置換されていてもよい」、および「置換基群Fで置換されていてもよい」についても上記と同様である。
における式(I)で示される化合物もしくはその製薬上許容される塩またはそれらの溶媒和物を指し、生体内における生理条件下で薬物代謝酵素、加水分解酵素、胃酸、腸内細菌等によって引き起こされる分解反応によって、式(II)で示される化合物に変換されることにより、キャップ依存的エンドヌクレアーゼ(CEN)阻害活性、および/またはCPE抑制効果を示す化合物を意味する。
該プロドラッグは、より好ましくは、式(II)で示される化合物よりも、生体内投与時におけるバイオアベイラビリティおよび/またはAUC(血中濃度曲線下面積)が向上している化合物を意味する。
したがって、該プロドラッグは、生体への投与(例えば、経口投与)後に、胃および/または腸等で効率よく体内に吸収され、その後、式(II)で示される化合物に変換されるため、好ましくは、式(II)で示される化合物よりも高いインフルエンザ治療および/または予防効果を示す。
の、式(I)における「PR」基を指し、-OPR基の部分が、生体内における生理条件下で薬物代謝酵素、加水分解酵素、胃酸、腸内細菌等によって引き起こされる分解反応によって、式(II)における-OH基に変換される基を示す。
該「プロドラッグを形成する基」は、より好ましくは、式(II)で示される化合物に付加することによって、式(II)で示される化合物のバイオアベイラビリティおよび/またはAUC(血中濃度曲線下面積)を向上させる基を意味する。
式(I)の-OPR基における「PR」基は、生体内で-OH基に変換される基であればよく、好ましくは、種々の置換カルボニル基、置換オキシ低級アルキル基(例:置換オキシメチル)、置換されていてもよい環式基低級アルキル(例:置換されていてもよい環式基メチル)、または置換されていてもよいイミノ低級アルキル(例:置換されていてもよいイミノメチル)等が例示されるがより好ましくは例えば以下の式a)~y)から選ばれる基を包含する。
a)-C(=O)-PR0、
b)-C(=O)-PR1、
c)-C(=O)-L-PR1、
d)-C(=O)-L-O-PR1、
e)-C(=O)-L-O-L-O-PR1、
f)-C(=O)-L-O-C(=O)-PR1、
g)-C(=O)-O-PR2、
h)-C(=O)-N(PR2)2、
i)-C(=O)-O-L-O-PR2、
j)-CH2-O-PR3、
k)-CH2-O-L-O-PR3、
l)-CH2-O-C(=O)-PR3、
m)-CH2-O-C(=O)-O-PR3、
n)-CH(-CH3)-O-C(=O)-O-PR3、
o)-CH2-O-C(=O)-N(-K)-PR3、
p)-CH2-O-C(=O)-O-L-O-PR3、
q)-CH2-O-C(=O)-O-L-N(PR3)2、
r)-CH2-O-C(=O)-N(-K)-L-O-PR3、
s)-CH2-O-C(=O)-N(-K)-L-N(PR3)2、
t)-CH2-O-C(=O)-O-L-O-L-O-PR3、
u)-CH2-O-C(=O)-O-L-N(-K)-C(=O)-PR3、
v)-CH2-O-P(=O)(-OH)2、
w)-CH2-O-P(=O)(-OBn)2、
x)-CH2-PR4
y)-C(=N+PR5 2)(-NPR5 2)
(式中、Lは、直鎖もしくは分枝状の低級アルキレンであり、
Kは、水素、または直鎖もしくは分枝状の低級アルキレン、または直鎖もしくは分枝状の低級アルケニレンであり、
PR0は、置換基群Fで置換されていてもよい低級アルキル、または置換基群Fで置換されていてもよい低級アルケニルであり、
PR1は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、または置換基群Fで置換されていてもよい低級アルキルチオであり、
PR2は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、または置換基群Fで置換されていてもよい複素環式基であり、
PR3は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、置換基群Fで置換されていてもよい炭素環低級アルキル、置換基群Fで置換されていてもよい複素環低級アルキル、または低級アルキルシリルであり、
PR4は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基であり、ならびに
PR5は、置換基群Fで置換されていてもよい低級アルキルである。
置換基群F;オキソ、低級アルキル、ヒドロキシ低級アルキル、アミノ、低級アルキルアミノ、炭素環低級アルキル、低級アルキルカルボニル、ハロゲン、ヒドロキシ、カルボキシ、低級アルキルカルボニルアミノ、低級アルキルカルボニルオキシ、低級アルキルオキシカルボニル、低級アルキルオキシ、シアノ、ニトロ)
b)-C(=O)-PR1、
l)-CH2-O-C(=O)-PR3、
m)-CH2-O-C(=O)-O-PR3、
n)-CH(-CH3)-O-C(=O)-O-PR3、
(式中、各記号は上記と同意義である。)
に示されるように、式(II)もしくはその製薬上許容される塩またはそれらの溶媒和物のヒドロキシ基を、-OPR基に変換することを意味する。
「低級アルキル」とは、炭素数1~15、好ましくは炭素数1~10、より好ましくは炭素数1~6、さらに好ましくは炭素数1~4の直鎖又は分枝状のアルキルを包含し、例えばメチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、tert-ブチル、n-ペンチル、イソペンチル、ネオペンチル、ヘキシル、イソヘキシル、n-へプチル、イソヘプチル、n-オクチル、イソオクチル、n-ノニル及びn-デシル等が挙げられる。「低級アルキル」の好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、tert-ブチル、n-ペンチルが挙げられる。さらに好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、tert-ブチルが挙げられる。
「低級アルケニル」とは、任意の位置に1以上の二重結合を有する炭素数2~15、好ましくは炭素数2~10、より好ましくは炭素数2~6、さらに好ましくは炭素数2~4の直鎖又は分枝状のアルケニルを包含する。具体的にはビニル、アリル、プロペニル、イソプロペニル、ブテニル、イソブテニル、プレニル、ブタジエニル、ペンテニル、イソペンテニル、ペンタジエニル、ヘキセニル、イソヘキセニル、ヘキサジエニル、ヘプテニル、オクテニル、ノネニル、デセニル、ウンデセニル、ドデセニル、トリデセニル、テトラデセニル、ペンタデセニル等を包含する。「低級アルケニル」の好ましい態様として、ビニル、アリル、プロペニル、イソプロペニル、ブテニルが挙げられる。
「低級アルキニル」とは、任意の位置に1以上の三重結合を有する炭素数2~10、好ましくは炭素数2~8、さらに好ましくは炭素数3~6の直鎖又は分枝状のアルキニルを包含する。具体的には、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、オクチニル、ノニニル、デシニル等を包含する。これらはさらに任意の位置に二重結合を有していてもよい。「低級アルキニル」の好ましい態様として、エチニル、プロピニル、ブチニル、ペンチニルが挙げられる。
「低級アルケニルオキシ」の低級アルケニル部分も上記「低級アルケニル」と同様である。
「ハロゲノ低級アルキル」、「ハロゲノ低級アルキルオキシ」、および「ハロゲノ低級アルキルカルボニルアミノ」のハロゲン部分も上記「ハロゲン」と同様である。ここでそれぞれ「低級アルキル」、「低級アルキルオキシ」、および「低級アルキルカルボニルアミノ」のアルキル基上の任意の位置が、同一または異なる1または複数個のハロゲン原子で置換されていてもよい。
具体的に「シクロアルキル」とは炭素数3~16、好ましくは炭素数3~12、より好ましくは炭素数4~8の炭素環式基であり、例えばシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、シクロノニルおよびシクロデシル等を包含する。
具体的に「シクロアルケニル」とは、上記シクロアルキルの環中の任意の位置に1以上の二重結合を有しているものを包含し、例えばシクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロへプチニル、シクロオクチニルおよびシクロヘキサジエニル等が挙げられる。
具体的に「アリール」とは、芳香族炭素環式基を意味し、フェニル、ナフチル、アントリルおよびフェナントリル等を包含し、特にフェニルが好ましい。
具体的に「非芳香族縮合炭素環式基」とは、上記「シクロアルキル」、「シクロアルケニル」および「アリール」から選択される2個以上の環状基が縮合した基を包含し、例えばインダニル、インデニル、テトラヒドロナフチル、フルオレニル、アダマンチル、および以下に示される基
「炭素環式基」または「炭素環」の好ましい態様としては、シクロアルキル、アリールおよび非芳香族縮合炭素環式基が挙げられ、具体的には、シクロプロピル、シクロブチル、シクロペンチル、シクロへキシル、シクロへプチル、フェニル、ナフチル、および以下に示される基
「炭素環低級アルキル」、「炭素環低級アルキルオキシ」、「炭素環オキシ低級アルキル」、「炭素環カルボニル」、「炭素環オキシ」、「炭素環オキシカルボニル」、および「炭素環低級アルキルオキシ低級アルキル」の炭素環部分も上記「炭素環式基」または「炭素環」と同様である。
具体的に「ヘテロアリール」とは、ピロリル、イミダゾリル、ピラゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアゾリル、トリアジニル、テトラゾリル、フリル、チエニル、イソオキサゾリル、オキサゾリル、オキサジアゾリル、イソチアゾリル、チアゾリル、チアジアゾリル等の5~6員の芳香族環式基が挙げられる。
具体的に「非芳香族複素環式基」とは、ジオキサニル、チイラニル、オキシラニル、オキセタニル、オキサチオラニル、アゼチジニル、チアニル、チアゾリジニル、ピロリジニル、ピロリニル、イミダゾリジニル、イミダゾリニル、ピラゾリジニル、ピラゾリニル、ピペリジル、ピペラジニル、モルホリニル、モルホリノ、チオモルホリニル、チオモルホリノ、ジヒドロピリジル、テトラヒドロピリジル、テトラヒドロフリル、テトラヒドロピラニル、ジヒドロチアゾリル、テトラヒドロチアゾリル、テトラヒドロイソチアゾリル、ジヒドロオキサジニル、ヘキサヒドロアゼピニル、テトラヒドロジアゼピニル、テトラヒドロピリダジニル、ヘキサヒドロピリミジニル、ジオキソラニル、ジオキソリル、オキサビシクロヘプタニル等の4~8員の非芳香族複素環式基が挙げられる。
具体的に「2環の縮合複素環式基」とは、インドリル、イソインドリル、インダゾリル、インドリジニル、インドリニル、イソインドリニル、キノリル、イソキノリル、シンノリニル、フタラジニル、キナゾリニル、ナフチリジニル、キノキサリニル、プリニル、プテリジニル、ベンゾピラニル、ベンズイミダゾリル、ベンゾトリアゾリル、ベンズイソオキサゾリル、ベンズオキサゾリル、ベンズオキサジアゾリル、ベンゾイソチアゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾフリル、イソベンゾフリル、ベンゾチエニル、ベンゾトリアゾリル、チエノピリジル、チエノピロリル、チエノピラゾリル、チエノピラジニル、フロピロリル、チエノチエニル、イミダゾピリジル、ピラゾロピリジル、チアゾロピリジル、ピラゾロピリミジニル、ピラゾロトリアニジル、ピリダゾロピリジル、トリアゾロピリジル、イミダゾチアゾリル、ピラジノピリダジニル、キナゾリニル、キノリル、イソキノリル、ナフチリジニル、ジヒドロチアゾロピリミジニル、テトラヒドロキノリル、テトラヒドロイソキノリル、ジヒドロベンゾフリル、ジヒドロベンズオキサジニル、ジヒドロベンズイミダゾリル、テトラヒドロベンゾチエニル、テトラヒドロベンゾフリル、ベンゾジオキソリル、ベンゾジオキソニル、クロマニル、クロメニル、オクタヒドロクロメニル、ジヒドロベンゾジオキシニル、ジヒドロベンゾオキセジニル、ジヒドロベンゾジオキセピニル、ジヒドロチエノジオキシニル等の4~8員の芳香族もしくは非芳香族複素環式基を少なくとも1つ含む環式基が挙げられる。
具体的に「3環の縮合複素環式基」とは、カルバゾリル、アクリジニル、キサンテニル、フェノチアジニル、フェノキサチイニル、フェノキサジニル、ジベンゾフリル、イミダゾキノリル、テトラヒドロカルバゾリル、および以下に示される基
「複素環式基」の好ましい態様としては5~6員のヘテロアリール、または非芳香族複素環式基、3環の縮合複素環式基が挙げられる。
「低級アルキルカルボニル」の例として、メチルカルボニル、エチルカルボニル、プロピルカルボニル、イソプロピルカルボニル、tert-ブチルカルボニル、イソブチルカルボニル、sec-ブチルカルボニル、ペンチルカルボニル、イソペンチルカルボニル、へキシルカルボニル等が挙げられる。好ましい態様としては、メチルカルボニル、エチルカルボニル、プロピルカルボニルが挙げられる。
「低級アルキルオキシカルボニル」の例として、メチルオキシカルボニル、エチルオキシカルボニル、プロピルオキシカルボニル、イソプロピルオキシカルボニル、tert-ブチルオキシカルボニル、イソブチルオキシカルボニル、sec-ブチルオキシカルボニル、ペンチルオキシカルボニル、イソペンチルオキシカルボニル、へキシルオキシカルボニル等が挙げられる。好ましい態様としては、メチルオキシカルボニル、エチルオキシカルボニル、プロピルオキシカルボニルが挙げられる。
「炭素環低級アルキル」とは、1または2以上の炭素環式基で置換されている低級アルキルを示し、「炭素環低級アルキル」の例として、ベンジル、フェネチル、フェニルプロピニル、ベンズヒドリル、トリチル、シクロプロピルメチル、シクロブチルメチル、シクロペンチルメチル、シクロへキシルメチル、ナフチルメチル、以下に示される基
「複素環低級アルキル」とは、1または2以上の複素環式基で置換されている低級アルキルを示し、アルキル部分は炭素環式基で置換されているものも含む。「複素環低級アルキル」の例として、ピリジルメチル、テトラヒドロピラニルメチル、フラニルメチル、モルホリニルエチル、イミダゾリルメチル、インドリルメチル、ベンゾチオフェニルメチル、オキサゾリルメチル、イソキサゾリルメチル、チアゾリルメチル、イソチアゾリルメチル、ピラゾリルメチル、イソピラゾリルメチル、ピロリジニルメチル、ベンズオキサゾリルメチル、ピペリジニルメチル、ピペラジニルメチル、以下に示される基
「炭素環オキシ低級アルキル」の例として、フェニルオキシメチル、フェニルオキシエチル、シクロプロピルオキシメチル、シクロプロピルオキシエチル、シクロブチルオキシメチル、シクロブチルオキシエチル、シクロへキシルオキシメチル、シクロへキシルオキシエチル等が挙げられる。好ましい態様としては、フェニルオキシメチル、フェニルオキシエチルが挙げられる。
「複素環オキシ低級アルキル」の例として、ピリジルオキシメチル、ピリジルオキシエチル、モルホリニルオキシメチル、モルホリニルオキシエチル、ベンズオキサゾリルオキシメチル等が挙げられる。好ましい態様としては、ピリジルオキシメチル、モルホリニルオキシメチル等が挙げられる。
「炭素環低級アルキルオキシ」とは、アルキル部分が1または2以上の炭素環式基で置換されている低級アルキルオキシを示し、「炭素環低級アルキルオキシ」の例として、フェニルメチルオキシ、フェニルエチルオキシ、シクロプロピルメチルオキシ、シクロブチルメチルオキシ、シクロペンチルメチルオキシ、シクロへキシルメチルオキシ等が挙げられる。好ましい態様としては、フェニルメチルオキシ、シクロプロピルメチルオキシ等が挙げられる。
「複素環低級アルキルオキシ」とは、アルキル部分が1または2以上の複素環式基で置換されている低級アルキルオキシを示し、アルキル部分は炭素環式基で置換されているものも含む。「複素環低級アルキルオキシ」の例として、ピリジルメチルオキシ、ピリジルエチルオキシ、イミダゾリルメチルオキシ、イミダゾリルエチルオキシ、ベンズオキサゾリルメチルオキシ、ベンズオキサゾリルエチルオキシ等が挙げられる。
「低級アルキルオキシ低級アルキル」の例として、メトキシメチル、メトキシエチル、エトキシメチル、エトキシエチル、メトキシプロピル、メトキシブチル、エトキシプロピル、エトキシブチル、イソプロピルオキシメチル、tert-ブチルオキシメチル等が挙げられる。好ましい態様としては、メトキシメチル、メトキシエチル、エトキシメチル、エトキシエチルが挙げられる
「低級アルキルオキシ低級アルキルオキシ」の例として、メトキシメトキシ、メトキシエトキシ、エトキシメトキシ、エトキシエトキシ、メトキシプロピルオキシ、メトキシブチルオキシ、エトキシプロピルオキシ、エトキシブチルオキシ、イソプロピルオキシメチルオキシ、tert-ブチルオキシメチルオキシ等が挙げられる。好ましい態様としては、メトキシメトキシ、メトキシエトキシ、エトキシメトキシ、エトキシエトキシが挙げられる。
「低級アルキルアミノ」の例として、メチルアミノ、ジメチルアミノ、エチルアミノ、ジエチルアミノ、イソプロピルアミノ、N,N-ジイソプロピルアミノ、N-メチル-N-エチルアミノ、N-イソプロピル-N-エチルアミノ等が挙げられる。好ましい態様としては、メチルアミノ、ジメチルアミノ、エチルアミノ、ジエチルアミノが挙げられる。
「低級アルキルカルボニルアミノ」の例として、メチルカルボニルアミノ、エチルカルボニルアミノ、プロピルカルボニルアミノ、イソプロピルカルボニルアミノ、tert-ブチルカルボニルアミノ、イソブチルカルボニルアミノ、sec-ブチルカルボニルアミノ等が挙げられる。好ましい態様としては、メチルカルボニルアミノ、エチルカルボニルアミノが挙げられる。
「低級アルキルアミノカルボニル」の例として、メチルアミノカルボニル、ジメチルアミノカルボニル、エチルアミノカルボニル、ジエチルアミノカルボニル、イソプロピルアミノカルボニル、N,N-ジイソプロピルアミノカルボニル、N-メチル-N-エチルアミノカルボニル、N-イソプロピル-N-エチルアミノカルボニル等が挙げられる。好ましい態様としては、メチルアミノカルボニル、ジメチルアミノカルボニル、エチルアミノカルボニル、ジエチルアミノカルボニルが挙げられる。
「低級アルキルスルホニル」の例として、メチルスルホニル、エチルスルホニル、プロピルスルホニル、イソプロピルスルホニル、tert-ブチルスルホニル、イソブチルスルホニル、sec-ブチルスルホニル等が挙げられる。好ましい態様としては、メチルスルホニル、エチルスルホニルが挙げられる。
「低級アルキルスルホニルアミノ」の例として、メチルスルホニルアミノ、エチルスルホニルアミノ、プロピルスルホニルアミノ、イソプロピルスルホニルアミノ、tert-ブチルスルホニルアミノ、イソブチルスルホニルアミノ、sec-ブチルスルホニルアミノ等が挙げられる。好ましい態様としては、メチルスルホニルアミノ、エチルスルホニルアミノが挙げられる。
「低級アルケニルオキシ」の例として、エチレニルオキシ、1-プロピレニルオキシ、2-プロピレニルオキシ、1-ブチレニルオキシ、2-ブチレニルオキシ、3-ブチレニルオキシ等が挙げられる。
「ハロゲノ低級アルキル」の例として、モノフルオロメチル、モノフルオロエチル、モノフルオロプロピル、2,2,3,3,3-ペンタフルオロプロピル、モノクロロメチル、トリフルオロメチル、トリクロロメチル、2,2,2-トリフルオロエチル、2,2,2-トリクロロエチル、1,2-ジブロモエチル、1,1,1-トリフルオロプロパン-2-イル等が挙げられる。好ましい態様としては、トリフルオロメチル、トリクロロメチル、1,1,1-トリフルオロプロパン-2-イルが挙げられる。
「ハロゲノ低級アルキルオキシ」の例として、モノフルオロメトキシ、モノフルオロエトキシ、トリフルオロメトキシ、トリクロロメトキシ、トリフルオロエトキシ、トリクロロエトキシ等が挙げられる。好ましい態様としては、トリフルオロメトキシ、トリクロロメトキシが挙げられる。
「低級アルキルチオ」の例として、メチルチオ、エチルチオ、プロピルチオ等が挙げられる。
「ヒドロキシ低級アルキル」の例として、ヒドロキシメチル、ヒドロキシエチル、ヒドロキシプロピル等が挙げられる。
「炭素環低級アルキルオキシ低級アルキル」の例として、ベンジルオキシメチル、ベンジルオキシエチル、ベンズヒドリルオキシメチル等が挙げられる。
「複素環低級アルキルオキシ低級アルキル」の例として、ピリジルメチルオキシメチル、ピリジルメチルオキシエチル等が挙げられる。
「低級アルキルカルボニルオキシ」の例として、メチルカルボニルオキシ、エチルカルボニルオキシ等が挙げられる。
「ハロゲノ低級アルキルカルボニルアミノ」の例として、トリフルオロメチルカルボニルアミノ、2,2,3,3,3-ペンタフルオロプロピルカルボニルアミノ等が挙げられる。
「低級アルキルスルフィニル」の例として、メチルスルフィニル、エチルスルフィニル等が挙げられる。
「炭素環オキシ」の例として、フェニルオキシ、ナフチルオキシ、シクロプロピルオキシ、シクロブチルオキシ、シクロペンチルオキシ、シクロへキシルオキシ等が挙げられる。
「炭素環オキシカルボニル」の例として、フェニルオキシカルボニル、ナフチルオキシカルボニル、シクロプロピルオキシカルボニル、シクロブチルオキシカルボニル、シクロペンチルオキシカルボニル、シクロへキシルオキシカルボニル等が挙げられる。
「複素環カルボニル」の例として、ピリジルカルボニル、ベンズオキサゾリルカルボニル、モルホリニルカルボニル、テトラヒドロピラニルカルボニル等が挙げられる。
「複素環オキシ」の例として、ピリジルオキシ、ベンズオキサゾリルオキシ、モルホリニルオキシ、テトラヒドロピラニルオキシ等が挙げられる。
「複素環オキシカルボニル」の例として、ピリジルオキシカルボニル、ベンズオキサゾリルオキシカルボニル、モルホリニルオキシカルボニル、テトラヒドロピラニルオキシカルボニル等が挙げられる。
「RA1およびRA2、RA15およびRA16、ならびにRA19およびRA20は、隣接する原子と一緒になって複素環を形成していてもよく」、
「RB7およびRB8、ならびにRB9およびRB10は、隣接する原子と一緒になって複素環を形成していてもよく」、
「RC7およびRC8、ならびにRC9およびRC10は、隣接する原子と一緒になって複素環を形成していてもよく」、および
「RD5およびRD6は、隣接する原子と一緒になって複素環を形成していてもよく」とは、N原子を有する複素環を意味し、例えば、以下に示す基
に示されるように、置換基RE6が2個のベンゼン環上および硫黄原子を含有する7員環が有するいずれの水素原子が、RE6で置き換わってもよいことを意味し、それぞれのRE6は、同一でも異なっていても良い。
maは0~3の整数が好ましく、mbは0~3の整数が好ましく、およびmcは0もしくは1の整数が好ましい。maは0もしくは1の整数がより好ましく、mbは0もしくは1の整数がより好ましく、およびmcは0がより好ましい。
例えば、以下の式
等を包含する。
式(I’)の例として、以下の式に示す化合物
本発明の化合物は製薬上許容される塩を包含する。例えば、アルカリ金属(リチウム、ナトリウム又はカリウム等)、アルカリ土類金属(マグネシウム又はカルシウム等)、アンモニウム、有機塩基及びアミノ酸との塩、又は無機酸(塩酸、硫酸、硝酸、臭化水素酸、リン酸又はヨウ化水素酸等)、及び有機酸(酢酸、トリフルオロ酢酸、クエン酸、乳酸、酒石酸、シュウ酸、マレイン酸、フマル酸、マンデル酸、グルタル酸、リンゴ酸、安息香酸、フタル酸、ベンゼンスルホン酸、p-トルエンスルホン酸、メタンスルホン酸又はエタンスルホン酸等)との塩が挙げられる。これらの塩は、通常行われる方法によって形成させることができる。
本発明における式(I)の好ましい塩の例としては、塩酸塩、臭化水素酸塩、酢酸塩、硫酸塩等が挙げられる。
また、本発明の化合物は特定の異性体に限定するものではなく、全ての可能な異性体(ケト-エノール異性体、イミン-エナミン異性体、ジアステレオ異性体、光学異性体及び回転異性体等)やラセミ体を含むものである。
(式中、各記号は上記と同意義である。)
また、式(I)の化合物は、式(I)の化合物のすべての放射性標識体を包含する。式(I)の化合物のそのような「放射性標識化」、「放射性標識体」などは、それぞれが本発明に包含され、代謝薬物動態研究ならびに結合アッセイにおける研究および/または診断ツールとして有用である。
本発明の式(I)の化合物に組み込まれ得る同位体の例としては、それぞれ2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18F、および36Clのように、水素原子、炭素原子、窒素原子、酸素原子、リン原子、硫黄原子、フッ素原子、および塩素原子が包含される。
本発明の式(I)の化合物に組み込まれ得る同位体の特に好ましい例は、2H(即ち、重水素原子)であり、本明細書の参考例で示される方法、あるいは当該技術分野で周知の方法で調製できる。なお、本明細書の参考例では重水素原子を「D」と表記している。本発明の式(I)の水素原子が重水素原子に変換された化合物は、未変換体に比べてバイオアベイラビリティや、代謝安定性、薬効、毒性面で優れる場合があり、医薬として有用な化合物となりうる。
「置換基群Cで置換されていてもよい低級アルケニル」の例としては、エチレニル、3-メチルブテン-2-イル、カルボキシエチレニル、ヒドロキシエチレニル、ジフルオロエチレニル、1-プロペン-2-イル等が挙げられる。
「置換基群Cで置換されていてもよい低級アルキニル」の例としては、1-プロピニル、1-ブチニル、3,3,3-トリフルオロメチルプロピニル、3-ヒドロキシ-プロピニル等が挙げられる。
「置換基群Cで置換されていてもよい低級アルキルオキシ」の例としては、メチルオキシ、エチルオキシ、トリフルオロメチルオキシ、トリクロロメチルオキシ、ヒドロキシメチルオキシ、ヒドロキシエチルオキシ、カルボキシメチルオキシ、カルボキシエチルオキシ等が挙げられる。
「置換基群Cで置換されていてもよい低級アルケニルオキシ」の例としては、3-フルオロ1-プロペニルオキシ、エチレニル、カルボキシエチレニル、ヒドロキシエチレニルオキシ、ジフルオロエチレニルオキシ等が挙げられる。
「置換基群Cで置換されていてもよい低級アルキルカルボニル」の例としては、メチルカルボニル、エチルカルボニル、プロピルカルボニル、イソプロピルカルボニル、ヒドロキシメチルカルボニル、ヒドロキシエチルカルボニル、トリフルオロメチルカルボニル、2,2,2-トリフルオロメチルカルボニル、カルボキシメチルカルボニル等が挙げられる。
「置換基群Cで置換されていてもよい低級アルキルオキシカルボニル」の例としては、メチルオキシカルボニル、エチルオキシカルボニル、トリフルオロメチルオキシカルボニル、トリクロロメチルオキシカルボニル、ヒドロキシメチルオキシカルボニル、ヒドロキシエチルオキシカルボニル、カルボキシメチルオキシカルボニル等が挙げられる。
「置換基群Cで置換されていてもよい炭素環式基」の例としては、フェニル、ナフチル、アントラセニル、フェナントラセニル、アダマンチル、1-ヒドロキシアダマンチル、2-ヒドロキシアダマンチル、3-メチルフェニル、4-メチルフェニル、3-メトキシフェニル、4-メトキシフェニル、3-ヒドロキシフェニル、4-ヒドロキシフェニル、4-クロロフェニル、4-フルオロフェニル、2-シアノフェニル、3-シアノフェニル、4-シアノフェニル、フルオロシクロプロピル、ジフルオロシクロブタニル、ジフルオロシクロヘキシル、ならびに以下に示される基
「置換基群Fで置換されていてもよい炭素環低級アルキル」の例としては、シクロプロピルメチル、4-ヒドロキシベンジル、シクロペンチルメチル、ベンジル、2-アミノベンジル、2-シアノベンジル、2-フルオロベンジル、4-フルオロベンジル、2-トリフルオロメチルベンジル、1,3,5-トリフルオロベンジル、3,4,5-トリフルオロベンジル、4-メトキシベンジル、2,4-ジフルオロベンジル、2-フルオロ-3-クロロベンジル、ベンズヒドリル、4-フェニルベンジル、フェネチル、フェニルプロピル、4-メチルカルボニルアミノベンジル、3,4-ジクロロベンジル、4-クロロ-2-フルオロベンジル、3,5-ジヒドロキシベンジル等が挙げられる。
「置換基群Cで置換されていてもよい炭素環カルボニル」の例としては、フェニルカルボニル、4-フルオロフェニルカルボニル、4-トリフルオロメチルフェニルカルボニル、4-メトキシフェニルカルボニル、シクロプロピルカルボニル等が挙げられる。
「置換基群Cで置換されていてもよい炭素環オキシ」の例としては、フェニルオキシ、シクロプロピルオキシ、シクロペンチルオキシ、4-フルオロフェニルオキシ、4-トリフルオロメチルフェニルオキシ、4-メトキシフェニルオキシ等が挙げられる。
「置換基群Cで置換されていてもよい炭素環オキシカルボニル」の例としては、フェニルオキシカルボニル、シクロプロピルオキシカルボニル、シクロペンチルオキシカルボニル、4-フルオロフェニルオキシカルボニル、4-トリフルオロメチルフェニルオキシカルボニル、4-メトキシフェニルオキシカルボニル等が挙げられる。
「置換基群Cで置換されていてもよい複素環式基」の例としては、ピリミジニル、ピリジル、ベンズオキサゾリル、モルホリニル、テトラヒドロピラニル、フリル、チオフェニル、オキサゾリル、チアゾリル、ピラゾリル、メチルピロリジニル、イソプロピルピロリジニル、メチルスルホニルピロリジニル、ヒドロキシエチルピロリジニル、メチルピペリジニル、メチルピペラジニル、テトラヒドロフリル、ならびに以下に示す基
「置換基群Fで置換されていてもよい複素環式基」の例としては、モルホリニル、ピリジル、メチル-1,3-ジオキソール-2-オン、トリメチル-2-オキサビシクロ[2.2.1]ヘプタン-3-オン、ピロリジニル、メチル-ピロリジン-2-カルボキシレート、テトラヒドロピラニル、ヒドロキシメチルピロリジニル等が挙げられる。
「置換基群Fで置換されていてもよい複素環低級アルキル」の例としては、テトラヒドロピラニルメチル、ピリジルメチル、イソキサゾリルメチル、5-メチル-イソキサゾリルメチル、3-メチル-オキサジアゾリルメチル、インドリルメチル、ベンゾチオフェニルメチル、5-クロロベンゾチオフェニルメチル、チアゾリルメチル、2-メチルチアゾリルメチル、ピラゾリルメチル、2-メチルピラゾリルメチル、ジチオフェニルメチル、テトラゾリルメチル、キナゾリルメチル、モルホリニルメチル等が挙げられる。
「置換基群Cで置換されていてもよい複素環カルボニル」の例としては、テトラヒドロピラニルカルボニル、ピリジルカルボニル、イソキサゾリルカルボニル、5-メチル-イソキサゾリルカルボニル、インドリルカルボニル、ベンゾチオフェニルカルボニル、5-クロロベンゾチオフェニルカルボニル、チアゾリルカルボニル、2-メチルチアゾリルカルボニル、ピラゾリルカルボニル、2-メチルピラゾリルカルボニル等が挙げられる。
「置換基群Cで置換されていてもよい複素環オキシ」の例としては、テトラヒドロピラニルオキシ、ピリジルオキシ、イソキサゾリルオキシ、5-メチル-イソキサゾリルオキシ、インドリルオキシ、ベンゾチオフェニルオキシ、5-クロロベンゾチオフェニルオキシ、チアゾリルオキシ、2-メチルチアゾリルオキシ、ピラゾリルオキシ、2-メチルピラゾリルオキシ等が挙げられる。
「置換基群Cで置換されていてもよい複素環オキシカルボニル」の例としては、テトラヒドロピラニルオキシカルボニル、ピリジルオキシカルボニル、イソキサゾリルオキシカルボニル、5-メチル-イソキサゾリルオキシカルボニル、インドリルオキシカルボニル、ベンゾチオフェニルオキシカルボニル、5-クロロベンゾチオフェニルオキシカルボニル、チアゾリルオキシカルボニル、2-メチルチアゾリルオキシカルボニル、ピラゾリルオキシカルボニル、2-メチルピラゾリルオキシカルボニル等が挙げられる。
「置換基群Fで置換されていてもよい低級アルキルチオ」の例としては、メチルチオ、エチルチオ等が挙げられる。
「置換基群Fで置換されていてもよい低級アルキルシリル」の例としては、トリメチルシリル、トリエチルシリル、tert-ブチルジメチルシリル等が挙げられる。
b)-C(=O)-PR1、
c)-C(=O)-L-PR1、
d)-C(=O)-L-O-PR1、
e)-C(=O)-L-O-L-O-PR1、
f)-C(=O)-L-O-C(=O)-PR1、
g)-C(=O)-O-PR2、
h)-C(=O)-N(PR2)2、
i)-C(=O)-O-L-O-PR2、
j)-CH2-O-PR3、
k)-CH2-O-L-O-PR3、
l)-CH2-O-C(=O)-PR3、
m)-CH2-O-C(=O)-O-PR3、
n)-CH(-CH3)-O-C(=O)-O-PR3、
o)-CH2-O-C(=O)-N(-K)-PR3、
p)-CH2-O-C(=O)-O-L-O-PR3、
q)-CH2-O-C(=O)-O-L-N(PR3)2、
r)-CH2-O-C(=O)-N(-K)-L-O-PR3、
s)-CH2-O-C(=O)-N(-K)-L-N(PR3)2、
t)-CH2-O-C(=O)-O-L-O-L-O-PR3、
u)-CH2-O-C(=O)-O-L-N(-K)-C(=O)-PR3、
v)-CH2-O-P(=O)(-OH)2、
w)-CH2-O-P(=O)(-OBn)2、
x)-CH2-PR4
(式中、Lは、直鎖もしくは分枝状の低級アルキレンであり、
Kは、水素、または直鎖もしくは分枝状の低級アルキレン、または直鎖もしくは分枝状の低級アルケニレンであり、
PR1は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、または置換基群Fで置換されていてもよい低級アルキルチオであり、
PR2は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、または置換基群Fで置換されていてもよい複素環式基であり、
PR3は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、置換基群Fで置換されていてもよい炭素環低級アルキル、置換基群Fで置換されていてもよい複素環低級アルキル、または低級アルキルシリルであり、
PR4は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基であり、ならびに
置換基群F;オキソ、低級アルキル、ヒドロキシ低級アルキル、アミノ、低級アルキルアミノ、炭素環低級アルキル、低級アルキルカルボニル、ハロゲン、ヒドロキシ、カルボキシ、低級アルキルカルボニルアミノ、低級アルキルカルボニルオキシ、低級アルキルオキシカルボニル、低級アルキルオキシ、シアノ、ニトロ)
b)-C(=O)-PR1、
l)-CH2-O-C(=O)-PR3、
n)-CH2-O-C(=O)-O-PR3、
n)-CH(-CH3)-O-C(=O)-O-PR3、
(式中、各記号は上記と同意義である。)
-Z-N(RA1)(RA2)、
-Z-N(RA3)-SO2-(RA4)、
-Z-C(=O)-N(RA5)-SO2-(RA6)、
-Z-N(RA7)-C(=O)-RA8、
-Z-S-RA9、
-Z-SO2-RA10、
-Z-S(=O)-RA11、
-Z-N(RA12)-C(=O)-O-RA13、
-Z-N(RA14)-C(=O)-N(RA15)(RA16)、
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19)、
-Z-N(RA20)-C(=O)-C(=O)-RA21、または
-Z-B(-ORA22)(-ORA23)
(置換基群C、RA1、RA2、RA3、RA5、RA7、RA8、RA9、RA10、RA11、RA12、RA13、RA14、RA15、RA16、RA17、RA18、RA19、RA20、RA21、RA22、RA23およびZは、項目1と同意義である)が挙げられる。
-Z-N(RA1)(RA2)、
-Z-N(RA7)-C(=O)-RA8、
-Z-N(RA12)-C(=O)-O-RA13、または
-Z-B(-ORA22)(-ORA23)
(置換基群C、RA1、RA2、RA7、RA8、RA12、RA13、RA22、RA23およびZは、項目1同意義である)が挙げられる。
-Z-N(RA1)(RA2)
(置換基群C、RA1、RA2、およびZは、項目1と同意義である)が挙げられる。
(Meはメチル基、Phはフェニル基、Etはエチル基を表わす)等が挙げられる。
(Meはメチル基を表わす)等が挙げられる。
-Z-N(RB1)-SO2-RB2、
-Z-N(RB3)-C(=O)-RB4、
-Z-N(RB5)-C(=O)-O-RB6、
-Z-C(=O)-N(RB7)(RB8)、
-Z-N(RB9)(RB10)、または
-Z-SO2-RB11
(置換基群C、RB1、RB2、RB3、RB4、RB5、RB6、RB7、RB8、RB9、RB10、RB11およびZは、項目1と同意義である)が挙げられる。
-Z-N(RB9)(RB10)
(置換基群C、RB9、RB10、およびZは、項目1と同意義である)が挙げられる。
(置換基群Cは、項目1と同意義である)が挙げられる。
(Meは、メチル基を表わす)等が挙げられる。
水素、ハロゲン、ヒドロキシ、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RC1)-SO2-RC2、
-Z-N(RC3)-C(=O)-RC4、
-Z-N(RC5)-C(=O)-O-RC6、
-Z-C(=O)-N(RC7)(RC8)、
-Z-N(RC9)(RC10)、または
-Z-SO2-RC11
(置換基群C、RC1、RC2、RC3、RC4、RC5、RC6、RC7、RC8、RC9、RC10、RC11、およびZは、項目1と同意義である)が挙げられる。
-Z-N(RC1)-SO2-RC2、
-Z-N(RC3)-C(=O)-RC4、
-Z-N(RC5)-C(=O)-O-RC6、
-Z-C(=O)-N(RC7)(RC8)、または
-Z-N(RC9)(RC10)
(置換基群C、RC1、RC2、RC3、RC4、RC5、RC6、RC7、RC8、RC9、RC10、およびZは、項目1と同意義である)が挙げられる。
(置換基群Cは、項目1と同意義である)が挙げられる。
(Meはメチル基を表わす)等が挙げられる。
-Y-S-RD1、
-Z-S(=O)-RD2、
-Z-SO2-RD3、
-C(=O)-C(=O)-RD4、
-C(=O)-N(RD5)(RD6)、
-Z-C(RD7)(RD8)(RD9)、または
-Z-CH2-RD10
(置換基群C、RD1、RD2、RD3、RD4、RD5、RD6、RD7、RD8、RD9、RD10およびZは項目1と同意義である)が挙げられる。
-Y-S-RD1、または
-Z-C(RD7)(RD8)(RD9)
(置換基群C、RD1、RD7、RD8、RD9、Y、およびZは、項目1と同意義である)が挙げられる。
R3aとR7aが隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成している場合が挙げられる。
2)B1がNR7a、およびB2がCR5aR6aの場合の好ましい態様として、
R3aとR6aが隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成している場合が挙げられる。
3)B1がCR8aR9a、およびB2がCR10aR11aの場合の好ましい態様として、
R8aおよびR10aが、隣接する原子と一緒になって置換基群Dで置換されていてもよい炭素環もしくは複素環を形成している場合が挙げられる。
4)B1がCR8aR9a、およびB2がCR10aR11aの場合の別の好ましい態様として、
R3aおよびR11aが、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成している場合が挙げられる。
B1がNR7aであり、B2がCR5aR6aである場合がより好ましい。
R5aまたはR6aの少なくともいずれか一方が水素であるものが好ましい。より好ましい態様は、R5aが水素、およびR6aが水素である。この場合、R7aは水素原子ではない。
である。
である。
である。
R9aおよびR11aが水素であり、かつR8aおよびR10aのいずれか一方が水素である場合の、R8aおよびR10aの他方の好ましい態様は、以下の基
-Z-C(RE1)(RE2)(RE3)
または
である。
である。
である。
RE6のより好ましい置換基の例として、フッ素原子、塩素原子、臭素原子、シアノ、ヒドロキシ、メチル、エチル、エチニル、ヒドロキシメチル、イソプロピル、メトキシ、エトキシ、メトキシメチル、シクロプロピル、ジメチルアミノ、トリフルオロメチル、オキソ、カルボキシが挙げられる。
RE6の特に好ましい置換基の例として、フッ素原子、塩素原子、臭素原子、メチル、メトキシ、トリフルオロメチルが挙げられる。
mの好ましい態様は、0~6の整数であり、さらに好ましくは0~3の整数であり、最も好ましくは0~2の整数である。
官能基:水素、ハロゲン、ヒドロキシ、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RA1)(RA2)、
-Z-N(RA3)-SO2-(RA4)、
-Z-C(=O)-N(RA5)-SO2-(RA6)、
-Z-N(RA7)-C(=O)-RA8、
-Z-S-RA9、
-Z-SO2-RA10、
-Z-S(=O)-RA11、
-Z-N(RA12)-C(=O)-O-RA13、
-Z-N(RA14)-C(=O)-N(RA15)(RA16)、
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19)、または
-Z-N(RA20)-C(=O)-C(=O)-RA21
(置換基群C、RA1、RA2、RA3、RA5、RA7、RA8、RA9、RA12、RA13、RA14、RA15、RA16、RA17、RA18、RA19、RA20、およびRA21は、項目1と同意義である)
官能基:水素、ハロゲン、ヒドロキシ、カルボキシ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい複素環式基、
-Z-N(RA1)(RA2)、
-Z-N(RA7)-C(=O)-RA8、または
-Z-N(RA12)-C(=O)-O-RA13
(置換基群C、RA1、RA2、RA7、RA8、RA12、RA13、およびZは、項目1と同意義である)である。
官能基:水素、ハロゲン、ヒドロキシ、カルボキシ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい複素環式基、または
-Z-N(RA1)(RA2)
(置換基群C、RA1、RA2、およびZは、項目1と同意義である)である。
官能基:水素、アセチル、またはカルボキシ
脂溶性官能基:置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環オキシカルボニル
(置換基群Cは、項目1と同意義である)
脂溶性官能基:置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル
(置換基群Cは、項目1と同意義である)
脂溶性官能基:置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基
(置換基群Cは、項目1と同意義である)である。
a)-C(=O)-PR0、
b)-C(=O)-PR1、
c)-C(=O)-L-O-PR1、
d)-C(=O)-L-O-L-O-PR1、
e)-C(=O)-L-O-C(=O)-PR1、
f)-C(=O)-O-PR2、
g)-C(=O)-N(PR2)2、
h)-C(=O)-O-L-O-PR2、
i)-CH2-O-PR3、
j)-CH2-O-L-O-PR3、
k)-CH2-O-C(=O)-PR3、
l)-CH2-O-C(=O)-O-PR3、
m)-CH(-CH3)-O-C(=O)-O-PR3、
n)-CH2-O-C(=O)-N(-K)-PR3、
o)-CH2-O-C(=O)-O-L-O-PR3、
p)-CH2-O-C(=O)-O-L-N(PR3)2、
q)-CH2-O-C(=O)-N(-K)-L-O-PR3、
r)-CH2-O-C(=O)-N(-K)-L-N(PR3)2、
s)-CH2-O-C(=O)-O-L-O-L-O-PR3、
t)-CH2-O-P(=O)(-OH)2、
u)-CH2-O-P(=O)(-OBn)2、
v)-CH2-PR4
(式中、Lは、直鎖もしくは分枝状の低級アルキレンであり、
Kは、水素、または直鎖もしくは分枝状の低級アルキレンであり、
PR0は、置換基群Fで置換されていてもよい低級アルキル、
PR1は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、置換基群Fで置換されていてもよい低級アルキルチオであり、
PR2は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基であり、
PR3は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、置換基群Fで置換されていてもよい炭素環低級アルキル、置換基群Fで置換されていてもよい複素環低級アルキル、低級アルキルシリルであり、
PR4は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基である。
置換基群F;オキソ、低級アルキル、ヒドロキシ低級アルキル、アミノ、低級アルキルアミノ、炭素環低級アルキル、低級アルキルカルボニル、ハロゲン、ヒドロキシ、カルボキシ、低級アルキルカルボニルアミノ、低級アルキルカルボニルオキシ、低級アルキルオキシカルボニル、低級アルキルオキシ、シアノ、ニトロ)
R1aが、水素である化合物(以下、R1aがR1-1とする)、
R1aが、カルボキシである化合物(以下、R1aがR1-2とする)、
R1aが、ハロゲンである化合物(以下、R1aがR1-3とする)、
R1aが、ヒドロキシである化合物(以下、R1aがR1-4とする)、
R1aが、置換基群Cで置換されていてもよい低級アルキルである化合物(以下、R1aがR1-5とする)、
R1aが、置換基群Cで置換されていてもよい低級アルキルカルボニルである化合物(以下、R1aがR1-6とする)、
R1aが、置換基群Cで置換されていてもよい低級アルキルオキシカルボニルである化合物(以下、R1aがR1-7とする)、
R1aが、アミノである化合物(以下、R1aがR1-8とする)、
R2aが、水素である化合物(以下、R2aがR2-1とする)、
R2aが、置換基群Cで置換されていてもよい低級アルキルである化合物(以下、R2aがR2-2とする)、
R3aが、置換基群Cで置換されていてもよい低級アルキルである化合物(以下、R3aがR3-1とする)、
R3aが、置換基群Cで置換されていてもよい炭素環低級アルキルである化合物(以下、R3aがR3-2とする)、
R3aが、置換基群Cで置換されていてもよい複素環低級アルキルである化合物(以下、R3aがR3-3とする)、
R3aが、置換基群Cで置換されていてもよい炭素環式基である化合物(以下、R3aがR3-4とする)、
R3aが、置換基群Cで置換されていてもよい複素環式基である化合物(以下、R3aがR3-5とする)、
PRが、-C(=O)-PR1である化合物(以下、RRがPr-1とする)、
PRが、-CH2-O-C(=O)-PR3、である化合物(以下、RRがPr-2とする)、
PRが、-CH2-O-C(=O)-O-PR3、である化合物(以下、RRがPr-3とする)、
PRが、-CH(-CH3)-O-C(=O)-O-PR3、である化合物(以下、RRがPr-4とする)、
(式中、各記号は上記と同意義である。)
R7aが、置換基群Cで置換されていてもよい複素環式基であり、R5a、およびR6aが、水素である化合物(以下、R7-2とする)
R7aが、置換基群Cで置換されていてもよい炭素環低級アルキルであり、R5a、およびR6aが、水素である化合物(以下、R7-3とする)、
R9aが、置換基群Cで置換されていてもよい複素環式基であり、R8a、R10a、およびR11aが、水素である化合物(以下、R9-2とする)
R9aが、置換基群Cで置換されていてもよい炭素環低級アルキルであり、R8a、R10a、およびR11aが、水素である化合物(以下、R9-3とする)
(R1-1, R2-1, R3-1, Pr-1, R7-1)、(R1-1, R2-1, R3-1, Pr-1, R7-2)、(R1-1, R2-1, R3-1, Pr-1, R7-3)、(R1-1, R2-1, R3-1, Pr-2, R7-1)、(R1-1, R2-1, R3-1, Pr-2, R7-2)、(R1-1, R2-1, R3-1, Pr-2, R7-3)、(R1-1, R2-1, R3-1, Pr-3, R7-1)、(R1-1, R2-1, R3-1, Pr-3, R7-2)、(R1-1, R2-1, R3-1, Pr-3, R7-3)、(R1-1, R2-1, R3-1, Pr-4, R7-1)、(R1-1, R2-1, R3-1, Pr-4, R7-2)、(R1-1, R2-1, R3-1, Pr-4, R7-3)、(R1-1, R2-1, R3-2, Pr-1, R7-1)、(R1-1, R2-1, R3-2, Pr-1, R7-2)、(R1-1, R2-1, R3-2, Pr-1, R7-3)、(R1-1, R2-1, R3-2, Pr-2, R7-1)、(R1-1, R2-1, R3-2, Pr-2, R7-2)、(R1-1, R2-1, R3-2, Pr-2, R7-3)、(R1-1, R2-1, R3-2, Pr-3, R7-1)、(R1-1, R2-1, R3-2, Pr-3, R7-2)、(R1-1, R2-1, R3-2, Pr-3, R7-3)、(R1-1, R2-1, R3-2, Pr-4, R7-1)、(R1-1, R2-1, R3-2, Pr-4, R7-2)、(R1-1, R2-1, R3-2, Pr-4, R7-3)、(R1-1, R2-1, R3-3, Pr-1, R7-1)、(R1-1, R2-1, R3-3, Pr-1, R7-2)、(R1-1, R2-1, R3-3, Pr-1, R7-3)、(R1-1, R2-1, R3-3, Pr-2, R7-1)、(R1-1, R2-1, R3-3, Pr-2, R7-2)、(R1-1, R2-1, R3-3, Pr-2, R7-3)、(R1-1, R2-1, R3-3, Pr-3, R7-1)、(R1-1, R2-1, R3-3, Pr-3, R7-2)、(R1-1, R2-1, R3-3, Pr-3, R7-3)、(R1-1, R2-1, R3-3, Pr-4, R7-1)、(R1-1, R2-1, R3-3, Pr-4, R7-2)、(R1-1, R2-1, R3-3, Pr-4, R7-3)、(R1-1, R2-1, R3-4, Pr-1, R7-1)、(R1-1, R2-1, R3-4, Pr-1, R7-2)、(R1-1, R2-1, R3-4, Pr-1, R7-3)、(R1-1, R2-1, R3-4, Pr-2, R7-1)、(R1-1, R2-1, R3-4, Pr-2, R7-2)、(R1-1, R2-1, R3-4, Pr-2, R7-3)、(R1-1, R2-1, R3-4, Pr-3, R7-1)、(R1-1, R2-1, R3-4, Pr-3, R7-2)、(R1-1, R2-1, R3-4, Pr-3, R7-3)、(R1-1, R2-1, R3-4, Pr-4, R7-1)、(R1-1, R2-1, R3-4, Pr-4, R7-2)、(R1-1, R2-1, R3-4, Pr-4, R7-3)、(R1-1, R2-1, R3-5, Pr-1, R7-1)、(R1-1, R2-1, R3-5, Pr-1, R7-2)、(R1-1, R2-1, R3-5, Pr-1, R7-3)、(R1-1, R2-1, R3-5, Pr-2, R7-1)、(R1-1, R2-1, R3-5, Pr-2, R7-2)、(R1-1, R2-1, R3-5, Pr-2, R7-3)、(R1-1, R2-1, R3-5, Pr-3, R7-1)、(R1-1, R2-1, R3-5, Pr-3, R7-2)、(R1-1, R2-1, R3-5, Pr-3, R7-3)、(R1-1, R2-1, R3-5, Pr-4, R7-1)、(R1-1, R2-1, R3-5, Pr-4, R7-2)、(R1-1, R2-1, R3-5, Pr-4, R7-3)、(R1-1, R2-2, R3-1, Pr-1, R7-1)、(R1-1, R2-2, R3-1, Pr-1, R7-2)、(R1-1, R2-2, R3-1, Pr-1, R7-3)、(R1-1, R2-2, R3-1, Pr-2, R7-1)、(R1-1, R2-2, R3-1, Pr-2, R7-2)、(R1-1, R2-2, R3-1, Pr-2, R7-3)、(R1-1, R2-2, R3-1, Pr-3, R7-1)、(R1-1, R2-2, R3-1, Pr-3, R7-2)、(R1-1, R2-2, R3-1, Pr-3, R7-3)、(R1-1, R2-2, R3-1, Pr-4, R7-1)、(R1-1, R2-2, R3-1, Pr-4, R7-2)、(R1-1, R2-2, R3-1, Pr-4, R7-3)、(R1-1, R2-2, R3-2, Pr-1, R7-1)、(R1-1, R2-2, R3-2, Pr-1, R7-2)、(R1-1, R2-2, R3-2, Pr-1, R7-3)、(R1-1, R2-2, R3-2, Pr-2, R7-1)、(R1-1, R2-2, R3-2, Pr-2, R7-2)、(R1-1, R2-2, R3-2, Pr-2, R7-3)、(R1-1, R2-2, R3-2, Pr-3, R7-1)、(R1-1, R2-2, R3-2, Pr-3, R7-2)、(R1-1, R2-2, R3-2, Pr-3, R7-3)、(R1-1, R2-2, R3-2, Pr-4, R7-1)、(R1-1, R2-2, R3-2, Pr-4, R7-2)、(R1-1, R2-2, R3-2, Pr-4, R7-3)、(R1-1, R2-2, R3-3, Pr-1, R7-1)、(R1-1, R2-2, R3-3, Pr-1, R7-2)、(R1-1, R2-2, R3-3, Pr-1, R7-3)、(R1-1, R2-2, R3-3, Pr-2, R7-1)、(R1-1, R2-2, R3-3, Pr-2, R7-2)、(R1-1, R2-2, R3-3, Pr-2, R7-3)、(R1-1, R2-2, R3-3, Pr-3, R7-1)、(R1-1, R2-2, R3-3, Pr-3, R7-2)、(R1-1, R2-2, R3-3, Pr-3, R7-3)、(R1-1, R2-2, R3-3, Pr-4, R7-1)、(R1-1, R2-2, R3-3, Pr-4, R7-2)、(R1-1, R2-2, R3-3, Pr-4, R7-3)、(R1-1, R2-2, R3-4, Pr-1, R7-1)、(R1-1, R2-2, R3-4, Pr-1, R7-2)、(R1-1, R2-2, R3-4, Pr-1, R7-3)、(R1-1, R2-2, R3-4, Pr-2, R7-1)、(R1-1, R2-2, R3-4, Pr-2, R7-2)、(R1-1, R2-2, R3-4, Pr-2, R7-3)、(R1-1, R2-2, R3-4, Pr-3, R7-1)、(R1-1, R2-2, R3-4, Pr-3, R7-2)、(R1-1, R2-2, R3-4, Pr-3, R7-3)、(R1-1, R2-2, R3-4, Pr-4, R7-1)、(R1-1, R2-2, R3-4, Pr-4, R7-2)、(R1-1, R2-2, R3-4, Pr-4, R7-3)、(R1-1, R2-2, R3-5, Pr-1, R7-1)、(R1-1, R2-2, R3-5, Pr-1, R7-2)、(R1-1, R2-2, R3-5, Pr-1, R7-3)、(R1-1, R2-2, R3-5, Pr-2, R7-1)、(R1-1, R2-2, R3-5, Pr-2, R7-2)、(R1-1, R2-2, R3-5, Pr-2, R7-3)、(R1-1, R2-2, R3-5, Pr-3, R7-1)、(R1-1, R2-2, R3-5, Pr-3, R7-2)、(R1-1, R2-2, R3-5, Pr-3, R7-3)、(R1-1, R2-2, R3-5, Pr-4, R7-1)、(R1-1, R2-2, R3-5, Pr-4, R7-2)、(R1-1, R2-2, R3-5, Pr-4, R7-3)、
(R1-1, R2-1, R3-1, Pr-1, R9-1)、(R1-1, R2-1, R3-1, Pr-1, R9-2)、(R1-1, R2-1, R3-1, Pr-1, R9-3)、(R1-1, R2-1, R3-1, Pr-2, R9-1)、(R1-1, R2-1, R3-1, Pr-2, R9-2)、(R1-1, R2-1, R3-1, Pr-2, R9-3)、(R1-1, R2-1, R3-1, Pr-3, R9-1)、(R1-1, R2-1, R3-1, Pr-3, R9-2)、(R1-1, R2-1, R3-1, Pr-3, R9-3)、(R1-1, R2-1, R3-1, Pr-4, R9-1)、(R1-1, R2-1, R3-1, Pr-4, R9-2)、(R1-1, R2-1, R3-1, Pr-4, R9-3)、(R1-1, R2-1, R3-2, Pr-1, R9-1)、(R1-1, R2-1, R3-2, Pr-1, R9-2)、(R1-1, R2-1, R3-2, Pr-1, R9-3)、(R1-1, R2-1, R3-2, Pr-2, R9-1)、(R1-1, R2-1, R3-2, Pr-2, R9-2)、(R1-1, R2-1, R3-2, Pr-2, R9-3)、(R1-1, R2-1, R3-2, Pr-3, R9-1)、(R1-1, R2-1, R3-2, Pr-3, R9-2)、(R1-1, R2-1, R3-2, Pr-3, R9-3)、(R1-1, R2-1, R3-2, Pr-4, R9-1)、(R1-1, R2-1, R3-2, Pr-4, R9-2)、(R1-1, R2-1, R3-2, Pr-4, R9-3)、(R1-1, R2-1, R3-3, Pr-1, R9-1)、(R1-1, R2-1, R3-3, Pr-1, R9-2)、(R1-1, R2-1, R3-3, Pr-1, R9-3)、(R1-1, R2-1, R3-3, Pr-2, R9-1)、(R1-1, R2-1, R3-3, Pr-2, R9-2)、(R1-1, R2-1, R3-3, Pr-2, R9-3)、(R1-1, R2-1, R3-3, Pr-3, R9-1)、(R1-1, R2-1, R3-3, Pr-3, R9-2)、(R1-1, R2-1, R3-3, Pr-3, R9-3)、(R1-1, R2-1, R3-3, Pr-4, R9-1)、(R1-1, R2-1, R3-3, Pr-4, R9-2)、(R1-1, R2-1, R3-3, Pr-4, R9-3)、(R1-1, R2-1, R3-4, Pr-1, R9-1)、(R1-1, R2-1, R3-4, Pr-1, R9-2)、(R1-1, R2-1, R3-4, Pr-1, R9-3)、(R1-1, R2-1, R3-4, Pr-2, R9-1)、(R1-1, R2-1, R3-4, Pr-2, R9-2)、(R1-1, R2-1, R3-4, Pr-2, R9-3)、(R1-1, R2-1, R3-4, Pr-3, R9-1)、(R1-1, R2-1, R3-4, Pr-3, R9-2)、(R1-1, R2-1, R3-4, Pr-3, R9-3)、(R1-1, R2-1, R3-4, Pr-4, R9-1)、(R1-1, R2-1, R3-4, Pr-4, R9-2)、(R1-1, R2-1, R3-4, Pr-4, R9-3)、(R1-1, R2-1, R3-5, Pr-1, R9-1)、(R1-1, R2-1, R3-5, Pr-1, R9-2)、(R1-1, R2-1, R3-5, Pr-1, R9-3)、(R1-1, R2-1, R3-5, Pr-2, R9-1)、(R1-1, R2-1, R3-5, Pr-2, R9-2)、(R1-1, R2-1, R3-5, Pr-2, R9-3)、(R1-1, R2-1, R3-5, Pr-3, R9-1)、(R1-1, R2-1, R3-5, Pr-3, R9-2)、(R1-1, R2-1, R3-5, Pr-3, R9-3)、(R1-1, R2-1, R3-5, Pr-4, R9-1)、(R1-1, R2-1, R3-5, Pr-4, R9-2)、(R1-1, R2-1, R3-5, Pr-4, R9-3)、(R1-1, R2-2, R3-1, Pr-1, R9-1)、(R1-1, R2-2, R3-1, Pr-1, R9-2)、(R1-1, R2-2, R3-1, Pr-1, R9-3)、(R1-1, R2-2, R3-1, Pr-2, R9-1)、(R1-1, R2-2, R3-1, Pr-2, R9-2)、(R1-1, R2-2, R3-1, Pr-2, R9-3)、(R1-1, R2-2, R3-1, Pr-3, R9-1)、(R1-1, R2-2, R3-1, Pr-3, R9-2)、(R1-1, R2-2, R3-1, Pr-3, R9-3)、(R1-1, R2-2, R3-1, Pr-4, R9-1)、(R1-1, R2-2, R3-1, Pr-4, R9-2)、(R1-1, R2-2, R3-1, Pr-4, R9-3)、(R1-1, R2-2, R3-2, Pr-1, R9-1)、(R1-1, R2-2, R3-2, Pr-1, R9-2)、(R1-1, R2-2, R3-2, Pr-1, R9-3)、(R1-1, R2-2, R3-2, Pr-2, R9-1)、(R1-1, R2-2, R3-2, Pr-2, R9-2)、(R1-1, R2-2, R3-2, Pr-2, R9-3)、(R1-1, R2-2, R3-2, Pr-3, R9-1)、(R1-1, R2-2, R3-2, Pr-3, R9-2)、(R1-1, R2-2, R3-2, Pr-3, R9-3)、(R1-1, R2-2, R3-2, Pr-4, R9-1)、(R1-1, R2-2, R3-2, Pr-4, R9-2)、(R1-1, R2-2, R3-2, Pr-4, R9-3)、(R1-1, R2-2, R3-3, Pr-1, R9-1)、(R1-1, R2-2, R3-3, Pr-1, R9-2)、(R1-1, R2-2, R3-3, Pr-1, R9-3)、(R1-1, R2-2, R3-3, Pr-2, R9-1)、(R1-1, R2-2, R3-3, Pr-2, R9-2)、(R1-1, R2-2, R3-3, Pr-2, R9-3)、(R1-1, R2-2, R3-3, Pr-3, R9-1)、(R1-1, R2-2, R3-3, Pr-3, R9-2)、(R1-1, R2-2, R3-3, Pr-3, R9-3)、(R1-1, R2-2, R3-3, Pr-4, R9-1)、(R1-1, R2-2, R3-3, Pr-4, R9-2)、(R1-1, R2-2, R3-3, Pr-4, R9-3)、(R1-1, R2-2, R3-4, Pr-1, R9-1)、(R1-1, R2-2, R3-4, Pr-1, R9-2)、(R1-1, R2-2, R3-4, Pr-1, R9-3)、(R1-1, R2-2, R3-4, Pr-2, R9-1)、(R1-1, R2-2, R3-4, Pr-2, R9-2)、(R1-1, R2-2, R3-4, Pr-2, R9-3)、(R1-1, R2-2, R3-4, Pr-3, R9-1)、(R1-1, R2-2, R3-4, Pr-3, R9-2)、(R1-1, R2-2, R3-4, Pr-3, R9-3)、(R1-1, R2-2, R3-4, Pr-4, R9-1)、(R1-1, R2-2, R3-4, Pr-4, R9-2)、(R1-1, R2-2, R3-4, Pr-4, R9-3)、(R1-1, R2-2, R3-5, Pr-1, R9-1)、(R1-1, R2-2, R3-5, Pr-1, R9-2)、(R1-1, R2-2, R3-5, Pr-1, R9-3)、(R1-1, R2-2, R3-5, Pr-2, R9-1)、(R1-1, R2-2, R3-5, Pr-2, R9-2)、(R1-1, R2-2, R3-5, Pr-2, R9-3)、(R1-1, R2-2, R3-5, Pr-3, R9-1)、(R1-1, R2-2, R3-5, Pr-3, R9-2)、(R1-1, R2-2, R3-5, Pr-3, R9-3)、(R1-1, R2-2, R3-5, Pr-4, R9-1)、(R1-1, R2-2, R3-5, Pr-4, R9-2)、(R1-1, R2-2, R3-5, Pr-4, R9-3)、
(R1-2, R2-1, R3-5, Pr-3, R9-2)、(R1-2, R2-1, R3-5, Pr-3, R9-3)、(R1-2, R2-1, R3-5, Pr-4, R9-1)、(R1-2, R2-1, R3-5, Pr-4, R9-2)、(R1-2, R2-1, R3-5, Pr-4, R9-3)、(R1-2, R2-2, R3-1, Pr-1, R9-1)、(R1-2, R2-2, R3-1, Pr-1, R9-2)、(R1-2, R2-2, R3-1, Pr-1, R9-3)、(R1-2, R2-2, R3-1, Pr-2, R9-1)、(R1-2, R2-2, R3-1, Pr-2, R9-2)、(R1-2, R2-2, R3-1, Pr-2, R9-3)、(R1-2, R2-2, R3-1, Pr-3, R9-1)、(R1-2, R2-2, R3-1, Pr-3, R9-2)、(R1-2, R2-2, R3-1, Pr-3, R9-3)、(R1-2, R2-2, R3-1, Pr-4, R9-1)、(R1-2, R2-2, R3-1, Pr-4, R9-2)、(R1-2, R2-2, R3-1, Pr-4, R9-3)、(R1-2, R2-2, R3-2, Pr-1, R9-1)、(R1-2, R2-2, R3-2, Pr-1, R9-2)、(R1-2, R2-2, R3-2, Pr-1, R9-3)、(R1-2, R2-2, R3-2, Pr-2, R9-1)、(R1-2, R2-2, R3-2, Pr-2, R9-2)、(R1-2, R2-2, R3-2, Pr-2, R9-3)、(R1-2, R2-2, R3-2, Pr-3, R9-1)、(R1-2, R2-2, R3-2, Pr-3, R9-2)、(R1-2, R2-2, R3-2, Pr-3, R9-3)、(R1-2, R2-2, R3-2, Pr-4, R9-1)、(R1-2, R2-2, R3-2, Pr-4, R9-2)、(R1-2, R2-2, R3-2, Pr-4, R9-3)、(R1-2, R2-2, R3-3, Pr-1, R9-1)、(R1-2, R2-2, R3-3, Pr-1, R9-2)、(R1-2, R2-2, R3-3, Pr-1, R9-3)、(R1-2, R2-2, R3-3, Pr-2, R9-1)、(R1-2, R2-2, R3-3, Pr-2, R9-2)、(R1-2, R2-2, R3-3, Pr-2, R9-3)、(R1-2, R2-2, R3-3, Pr-3, R9-1)、(R1-2, R2-2, R3-3, Pr-3, R9-2)、(R1-2, R2-2, R3-3, Pr-3, R9-3)、(R1-2, R2-2, R3-3, Pr-4, R9-1)、(R1-2, R2-2, R3-3, Pr-4, R9-2)、(R1-2, R2-2, R3-3, Pr-4, R9-3)、(R1-2, R2-2, R3-4, Pr-1, R9-1)、(R1-2, R2-2, R3-4, Pr-1, R9-2)、(R1-2, R2-2, R3-4, Pr-1, R9-3)、(R1-2, R2-2, R3-4, Pr-2, R9-1)、(R1-2, R2-2, R3-4, Pr-2, R9-2)、(R1-2, R2-2, R3-4, Pr-2, R9-3)、(R1-2, R2-2, R3-4, Pr-3, R9-1)、(R1-2, R2-2, R3-4, Pr-3, R9-2)、(R1-2, R2-2, R3-4, Pr-3, R9-3)、(R1-2, R2-2, R3-4, Pr-4, R9-1)、(R1-2, R2-2, R3-4, Pr-4, R9-2)、(R1-2, R2-2, R3-4, Pr-4, R9-3)、(R1-2, R2-2, R3-5, Pr-1, R9-1)、(R1-2, R2-2, R3-5, Pr-1, R9-2)、(R1-2, R2-2, R3-5, Pr-1, R9-3)、(R1-2, R2-2, R3-5, Pr-2, R9-1)、(R1-2, R2-2, R3-5, Pr-2, R9-2)、(R1-2, R2-2, R3-5, Pr-2, R9-3)、(R1-2, R2-2, R3-5, Pr-3, R9-1)、(R1-2, R2-2, R3-5, Pr-3, R9-2)、(R1-2, R2-2, R3-5, Pr-3, R9-3)、(R1-2, R2-2, R3-5, Pr-4, R9-1)、(R1-2, R2-2, R3-5, Pr-4, R9-2)、(R1-2, R2-2, R3-5, Pr-4, R9-3)、
本発明の化合物の一般的製造法を以下に例示する。また、抽出、精製などは、通常の有機化学の実験で行う処理を行えばよい。
本発明の化合物の合成は、当該分野において公知の手法を参酌しながら実施することができる。
本発明の化合物の中には、互変異性体が存在し得るものがあるが、本発明は、これらを含め、全ての可能な異性体及びそれらの混合物を包含する。
本発明の化合物の塩を取得したいとき、本発明の化合物が塩の形で得られる場合には、そのまま精製すればよく、また、遊離の形で得られる場合には、適当な有機溶媒に溶解もしくは懸濁させ、酸又は塩基を加えて通常の方法により塩を形成させればよい。
また、本発明の化合物及びその製薬上許容される塩は、水あるいは各種溶媒との付加物(水和物ないし溶媒和物)の形で存在することもあるが、これら付加物も本発明に包含される。
DMF:N,N-ジメチルホルムアミド
DMA:N,N-ジメチルアセトアミド
NMP:N-メチルピロリドン
DMI:ジメチルイミダゾリジノン
THF:テトラヒドロフラン
Ms:メタンスルホニル
Ts:パラトルエンスルホニル
Boc:tert-ブトキシカルボニル
DIBALH:ジイソブチルアルミニウムヒドリド
WSCまたはEDCI:N-エチル-N’-(3-ジメチルアミノプロピル)カルボジイミド
HOBt:1-ヒドロキシベンゾトリアゾール
HATU:O-(7-アザベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウム ヘキサフルオロホスフェイト
NBS;N-ブロモスクシイミド
NCS:N-クロロスクシイミド
TEMPO:2,2,6,6-テトラメチルピペリジン-1-オキシルラジカル
PDC:ピリジニウムジクロロメート
DEAD:ジエチルアゾジカルボキシレート
DIAD:ジイソプロピルアゾジカルボキシレート
DMAP:4-ジメチルアミノピリジン
mCPBA:m-クロロ過安息香酸
DBU:1,8-ジアザビシクロ[5.4.0]-7-ウンデセン
DIPEA:ジイソプロピルエチルアミン
TBAF:フッ化テトラブチルアンモニウム
IBX:2-ヨードキシ安息香酸
DMSO:シメチルスルホキシド
NaHMDS:ナトリウムヘキサメチルジシラジド
TFA:トリフルオロ酢酸
Ac:アセチル
TBS:tert-ブチルジメチルシリル
PEPPSITM-IPr:(1,3-ジイソプロピルイミダゾール-2-イリデン)(3-クロロピリジル)パラジウム(II) ジクロライド
BEMP:2-tert-ブチルイミノ-2-ジエチルアミノ-1,3-ジメチル過ヒドロ-1,3,2-ジアザホスホリン
第一工程
市販または公知の方法により調製できる化合物aaをジクロロメタン、トルエン、THF等の溶媒またはそれらの混合溶媒中、ピリジン、トリメチルアミン、N-メチルモルホリン、4-ジメチルアミノピリジン等の3級アミンおよびBenzyloxyacetyl chlorideを滴下し、-20℃~30℃、好ましくは0℃~20℃にて0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物abを得ることができる。
第二工程
化合物abにエーテル、ジクロロメタン、THF等の溶媒またはそれらの混合溶媒中、シンナモイルクロリドの存在下、リチウムヘキサメチルジシラザン、リチウムジイソプロピルアミド、ブチルリチウム、tert-ブチルリチウム等の有機金属塩基を加え、-80℃~0℃、好ましくは-80℃~-40℃にて1分間~2時間、好ましくは10分間~1時間反応させることにより、化合物acを得ることができる。
第三工程
化合物acに、エーテル、ジクロロメタン、THF、アセトニトリル等の溶媒またはそれらの混合溶媒中、触媒量の塩化ルテニウムおよび過ヨウ素酸ナトリウム、TEMPO、二酸化マンガン、ならびにPDC等の酸化剤を加え、-40℃~80℃、好ましくは0℃~40℃にて0.1時間~24時間、好ましくは0.2時間~3時間反応させることにより、化合物adを得ることができる。
第四工程
化合物adにエーテル、ジクロロメタン、THF、アセトニトリル、アセトン、水等の溶媒の存在下またはそれらの混合溶媒中、0℃~60℃、好ましくは10℃~40℃にて濃硫酸およびamidosululic acidの水溶液を加える。ここに亜塩素酸ナトリウム水溶液を同温度で滴下し、1分間~3時間、好ましくは5分間~1時間反応させることにより、化合物aeを得ることができる。
第五工程
化合物aeに、DMF、THF、ジクロロメタン、アセトニトリル等の溶媒中、ジシクロヘキシルカルボジイミド、カルボニルジイミダゾール、ジシクロヘキシルカルボジイミド-N-ヒドロキシベンゾトリアゾール、4-(4, 6-ジメトキシ-1, 3, 5, -トリアジン-2-イル)-4-メチルモルホリニウムクロリド、ヘキサフルオロリン酸2-(7-アザ-1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウム、WSC・HCl、HATU等の脱水縮合剤存在下、目的とする化合物に対応する置換基を有する化合物R3-NH2を加え、-20℃~60℃、好ましくは-10℃~40℃で0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物afを得ることができる。
第六工程
化合物afに、トルエン、キシレン、THF、ジオキサン等の溶媒の存在下またはそれらの混合溶媒中、化合物agを加え、加熱還流条件下で、0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物ahを得ることができる。
第七工程
化合物ahに、THF、ジオキサン、酢酸エチル、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、トリフェニルホスフィンおよびDEAD、DIAD等の縮合剤を加え、0℃~60℃、好ましくは10℃~40℃で0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物aiを得ることができる。
第八工程
化合物aiを、カルボキシル保護基およびヒドロキシル保護基の公知の一般的な脱保護反応に付すことにより化合物ajを得ることができる。
第一工程
化合物baに、DMF、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、炭酸カリウム、炭酸ナトリウム、炭酸セシウム等の塩基ならびに、目的とする化合物に対応する置換基を有する化合物P2-L(ここで、Lはハロゲン、OMs等の脱離基)を加え、-20℃~80℃、好ましくは0℃~50℃にて0.1時間~6時間、好ましくは0.2時間~6時間反応させることにより、化合物bbを得ることができる。
第二工程
化合物bbに、DMF、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、トリフェニルホスフィンおよびフタルイミドを加え、DIAD、DEAD等の脱水縮合試薬を加えて、-10℃~60℃、好ましくは0℃~50℃にて0.1時間~24時間、好ましくは0.2時間~12時間反応させることにより、化合物bcを得ることができる。
第三工程
化合物bcに、メタノール、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、ヒドラジン水和物またはメチルヒドラジンを加え、-10℃~80℃、好ましくは10℃~60℃にて0.5時間~24時間、好ましくは1~12時間反応させることにより、化合物bdを得ることができる。
第四工程
化合物bdに、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、Boc2Oを加え、-10℃~80℃、好ましくは10℃~60℃にて0.5時間~24時間、好ましくは1~12時間反応させることにより、化合物beを得ることができる。
第五工程
化合物beに、アミノ保護基の公知の一般的な脱保護反応に付すことにより、化合物bfを得ることができる。
第六工程
化合物bfに、トルエン、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、化合物bgを加え、20℃~110℃、好ましくは40℃~加熱還流下にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物bhを得ることができる。
第七工程
化合物bhに、HCl-酢酸エチル、HCl-ジオキサン、ギ酸等を加え、0℃~40℃、好ましくは0℃~20℃にて0.5時間~12時間、好ましくは1時間~6時間反応させる。溶媒を減圧留去した後、飽和炭酸水素ナトリウム水溶液を加え、攪拌することにより、化合物biを得ることができる。
第八工程
化合物biに、DMF、THF、DMA、NMP等の溶媒の存在下またはそれらの混合溶媒中、炭酸カリウム、炭酸ナトリウム、炭酸リチウム、炭酸セシウム等の塩基および化合物R3-L(Lはハロゲン、OMs等の脱離基)を加え、0℃~60℃、好ましくは10℃~30℃にて0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物bjを得ることができる。
第九工程
化合物bjを、カルボキシル保護基およびヒドロキシル保護基の公知の一般的な脱保護反応に付すことにより化合物bkを得ることができる。
第一工程
化合物caに、THF、ジオキサン、アセトニトリル、水等の溶媒の存在下またはそれらの混合溶媒中、トリエチルアミン、DMAP、モルホリン等の3級アミンまたは炭酸ナトリウム、炭酸水素ナトリウム等の塩基を加え、Boc2Oを加え、-10℃~80℃、好ましくは10℃~60℃にて0.5時間~24時間、好ましくは1~12時間反応させることにより、化合物cbを得ることができる。
第二工程
化合物cbに、DMF、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、トリフェニルホスフィンおよびフタルイミドを加え、DIAD、DEAD等の脱水縮合試薬を加えて、-10℃~60℃、好ましくは0℃~50℃にて0.1時間~24時間、好ましくは0.2時間~12時間反応させることにより、化合物ccを得ることができる。
第三工程
化合物ccに、メタノール、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、ヒドラジン水和物を加え、-10℃~80℃、好ましくは10℃~60℃にて0.5時間~24時間、好ましくは1~12時間反応させることにより、化合物cdを得ることができる。
第一工程
biの合成法と同様の方法により得られる化合物daを、公知の一般的なカルボキシル脱保護反応に付すことにより、化合物dbを得ることができる。
第二工程
化合物dbをジフェニルエーテル等の溶媒中、マイクロウェーブ照射下で、1分間~2時間反応させることにより、脱炭酸された化合物dcを得ることができる。また、キノリン溶媒中、銅を加え、180℃で2~48時間反応させることにより、脱炭酸された化合物dを得ることができる。
第三工程
参考例12に記載の方法により得られる化合物daに、DMF、THF、DMA、NMP等の溶媒の存在下またはそれらの混合溶媒中、炭酸カリウム、炭酸ナトリウム、炭酸リチウム、炭酸セシウム等の塩基および化合物R3-L(Lはハロゲン、OMs等の脱離基)を加え、0℃~60℃、好ましくは10℃~30℃にて0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物bdを得ることができる。
第四工程
第一工程と同様の方法により、化合物deを得ることができる。
第五工程
第二工程と同様の方法により、化合物dfを得ることができる。
第六工程
第三工程と同様の方法により、化合物dfを得ることができる。
第七工程
化合物dfを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物dgを得ることができる。
第一工程
化合物eaに、THF、ジオキサン、ジクロロメタン、トルエン等の溶媒の存在下またはそれらの混合溶媒中、トリエチルアミン、N-メチルモルホリン、ジイソプロピルエチルアミン等の塩基およびクロロギ酸エチルを加える。ここに、水素化ほう素ナトリウム等の還元力が低い還元剤を加えて、-20℃~60℃、好ましくは-10℃~20℃にて0.2時間~12時間、好ましくは0.5時間~6時間反応させることにより、化合物ebを得ることができる。
第二工程
化合物ebを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物ecを得ることができる。
第一工程
化合物faに、THF、ジクロロメタン、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、化合物fbおよびトリフェニルホスフィンを加える。ここに、DIADを加えて、0℃~60℃、好ましくは10℃~30℃にて0.5時間~12時間、好ましくは1時間~12時間反応させることにより、化合物fcを得ることができる。
第二工程
化合物fcに、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、炭酸カリウム、炭酸ナトリウム、炭酸リチウム、炭酸セシウム等の塩基
および、ベンゼンチオール等のチオールを加えて、0℃~60℃、好ましくは10℃~30℃にて0.5時間~12時間、好ましくは1時間~12時間反応させることにより、化合物fdを得ることができる。
第三工程
化合物fdにDMF、THF、ジクロロメタン、アセトニトリル等の溶媒中、ジシクロヘキシルカルボジイミド、カルボニルジイミダゾール、ジシクロヘキシルカルボジイミド-N-ヒドロキシベンゾトリアゾール、4-(4, 6-ジメトキシ-1, 3, 5, -トリアジン-2-イル)-4-メチルモルホリニウムクロリド、ヘキサフルオロリン酸2-(7-アザ-1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウム、WSC・HCl等の脱水縮合剤存在下、目的とする化合物に対応する置換基を有する化合物feを加え、0℃~60℃、好ましくは10℃~40℃で1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物ffを得ることができる。
第四工程
化合物ffに対して、アミノ基上のP2基について公知の一般的な脱保護反応に付し、続いて、水、エタノール、メタノール、アセトニトリル等の溶媒中またはそれらの混合溶媒中、炭酸ナトリウム水溶液、炭酸カリウム水溶液等の塩基を加えて20℃~80℃、好ましくは20℃~70℃にて0.5時間~24時間、好ましくは1時間~6時間反応させることにより、化合物fdを得ることができる。
第五工程
化合物fgを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物fhを得ることができる。
第一工程
化合物ddを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物gaを得ることができる。
第一工程
化合物haにDMF、THF、ジクロロメタン、アセトニトリル等の溶媒中、ジシクロヘキシルカルボジイミド、カルボニルジイミダゾール、ジシクロヘキシルカルボジイミド-N-ヒドロキシベンゾトリアゾール、4-(4, 6-ジメトキシ-1, 3, 5, -トリアジン-2-イル)-4-メチルモルホリニウムクロリド、ヘキサフルオロリン酸2-(7-アザ-1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウム、WSC・HCl、HATU等の脱水縮合剤存在下、O,N-ジメチルヒドロキシルアミン塩酸塩を加え、トリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の3級塩基を加えて、0℃~60℃、好ましくは10℃~40℃で1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物hbを得ることができる。
第二工程
化合物hbにTHF、エーテル、ジクロロメタン、ジオキサン等の溶媒の存在下またはそれらの混合溶媒中、-80℃~-40℃でグリニヤール試薬(R-MgBr)を加え、-80℃~0℃好ましくは-60℃~-20℃で0.5時間~24時間、好ましくは0.5時間~6時間反応させることにより、化合物hcを得ることができる。
第三工程
化合物hcに、クロロホルム、ジクロロメタンの溶媒の存在下、mCPBAを加え、-20℃~30℃好ましくは10℃~30℃で0.1時間~12時間、好ましくは0.5時間~6時間反応させることにより、化合物hdを得ることができる。
第四工程
化合物hdに、エタノール等の溶媒の存在下、水酸化ナトリウム水溶液を加え、0℃~120℃好ましくは30℃~90℃で1分間~10時間、好ましくは30分間~120分間反応させることにより、化合物heを得ることができる。
第五工程
化合物heを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物hfを得ることができる。
第六工程
化合物heに、クロロホルム、ジクロロメタン、THF、トルエン等の溶媒の存在下またはそれらの混合溶媒中、目的とする化合物に対応する化合物R-Br等を加え、水素化ナトリウム、ナトリウムメチラート、n-ブチルリチウム等の金属塩基を加え、-20℃~120℃好ましくは0℃~30℃で0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物hgを得ることができる。
第七工程
化合物hgを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物hhを得ることができる。
第一工程
化合物iaに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、トリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の3級アミンおよび、クロロ炭酸エチル、クロロギ酸エチルなどのクロル化試薬を加え、0℃~30℃で0.1時間~1時間攪拌する。ここに、目的物に対応する化合物R-SO2-NH2(例:メタンスルホニルアミド)およびDMAPを加え、40℃~100℃好ましくは40℃~80℃で0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物ibを得ることができる。
第二工程
化合物ibを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物icを得ることができる。
第一工程
化合物jaに、THF、ジオキサン、ジクロロメタン、トルエン、DMF等の溶媒の存在下またはそれらの混合溶媒中、トリエチルアミン、N-メチルモルホリン、ジイソプロピルエチルアミン等の3級アミンおよびクロロギ酸エチルまたはクロロ炭酸エチルを加える。ここに、水素化ほう素ナトリウム等の反応性が低い還元剤を加えて、-20℃~40℃、好ましくは-10℃~20℃にて0.2時間~12時間、好ましくは0.5時間~6時間反応させることにより、アルコール中間体を得る。この中間体をジクロロメタン、クロロホルム等に溶解し、TEMPO、二酸化マンガン、PDC等の酸化剤を加え、-40℃~30℃、好ましくは0℃~30℃にて0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物jbを得ることができる。
第二工程
化合物jbに、THF、ジオキサン、ジクロロメタン等の溶媒の存在下、28%アンモニア水およびヨウ素を加え、0℃~40℃、好ましくは10℃~30℃にて0.5時間~24時間、好ましくは1時間~6時間反応させることにより、化合物jcを得ることができる。
第三工程
化合物jcに、トルエン、キシレン、THF、ジオキサン等の溶媒の存在下またはそれらの混合溶媒中、アジ化ナトリウムおよびトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の3級アミンを加え、0℃~60℃、好ましくは10℃~40℃にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物jdを得ることができる。
第四工程
化合物jdを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物jeを得ることができる。
第一工程
化合物kaに、THF、ジオキサン、ジクロロメタン、トルエン、DMF等の溶媒の存在下またはそれらの混合溶媒中、トリエチルアミン、N-メチルモルホリン、ジイソプロピルエチルアミン等の3級アミンおよびクロロギ酸エチルまたはクロロ炭酸エチルを加える。ここに、アジ化ナトリウムを加え、0℃~40℃、好ましくは10℃~30℃にて0.5時間~24時間、好ましくは1時間~12時間反応させる。その後、アルコール(Rm-OH)を加え、20℃~60℃、好ましくは20℃~50℃にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物kbを得ることができる。
第二工程
化合物kbに、エタノール、メタノール、水等の溶媒中またはそれらの混合溶媒中、水酸化ナトリウム水溶液、水酸化カリウム水溶液等の塩基を加え、20℃~80℃、好ましくは40℃~60℃にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物kcを得ることができる。
第三工程
化合物kcを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物kdを得ることができる。
第四工程
化合物kcに、THF、ジオキサン、トルエン、ジクロロメタン等の溶媒中、目的物に対応する酸クロリド(R-CO-Cl)またはスルホニルクロリド(R-SO2-Cl)を加え、必要に応じてピリジン、トリエチルアミン、N-メチルモルホリン等の3級アミンを加え、-20℃~40℃、好ましくは0℃~30℃にて0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物keを得ることができる。
第五工程
化合物keを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物kfを得ることができる。
第一工程
化合物laに、THF、ジクロロメタン、DMF等の溶媒中、水素化ナトリウムを加える。ここに、目的物に対応するR-L(Lはハロゲン、OMs等の脱離基)を加え、-20℃~40℃、好ましくは0℃~30℃にて0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物lbを得ることができる。
または、化合物laに、ギ酸溶媒中、ホルムアルデヒドを加えて、70℃~110℃にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物lbを得ることができる。
第二工程
化合物lbを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物lcを得ることができる。
第一工程
化合物maに、THF、ジオキサン、アセトニトリル、水等の溶媒中またはそれらの混合溶媒中、Boc2O等を加えてアミン保護反応に付すことにより、アミノ保護体mbを得ることができる。
第二工程
化合物mbに、THF、ジクロロメタン、DMF等の溶媒中、水素化ナトリウムを加える。ここに、目的物に対応するR-L(Lはハロゲン、OMs等の脱離基)を加え、-20℃~40℃、好ましくは0℃~30℃にて0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物mcを得ることができる。
第三工程
化合物mcを公知の一般的なアミノ基およびヒドロキシル基の脱保護反応に付すことにより、化合物mdを得ることができる。
第一工程
化合物naに、ジクロロメタン、トルエン、THF、ジオキサン等の溶媒中、ハロゲン化試薬(例えば、NBS、NCS、臭素等)を加え、過熱還流条件下で0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物nbを得ることができる。
第二工程
化合物nbを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物ncを得ることができる。
第三工程
化合物nbに、トルエン、THF、DMF等の溶媒中またはそれらの混合溶媒中、目的物に対応するボロン酸エステル(R-M)を加え、炭酸カリウム、炭酸ナトリウム、水酸化ナトリウム等の塩基を加える。ここに、窒素気流下、0価パラジウム触媒(例:Pd(PPh3)4)を加え、60℃~120℃、好ましくは80℃~110℃にて1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物ndを得ることができる。
第四工程
化合物ndを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物neを得ることができる。
第一工程
化合物oaに、THF、ジオキサン、ジクロロメタン、アセトニトリル等の溶媒の存在下、亜塩素酸ナトリウムおよびアミド硫酸を加え、0℃~40℃、好ましくは0℃~30℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物obを得ることができる。
第二工程
化合物obに、DMF、DMA、NMP、THF等の溶媒の存在下、HATU、WSC・HCl等の縮合剤を加え、目的物に対応するアミン(R3-NH2)および、トリエチルアミン、N-メチルモルホリン、ピリジン等の3級アミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物ocを得ることができる。
第三工程
化合物ocに、DMF、DMA、NMP、THF等の溶媒の存在下、炭酸カリウム、炭酸ナトリウム、O-(2,4-ジニトロフェニル)ヒドロキシルアミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物odを得ることができる。
第四工程
化合物odに、トルエン、DMF、DMA、NMP、THF等の溶媒の存在下、R5-C(=O)-R6および酢酸を加え、60℃~120℃、好ましくは80℃~110℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物oeを得ることができる。
第五工程
化合物oeに、DMF、DMA、NMP、THF等の溶媒の存在下、目的物に対応する化合物R7-L1および、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物ofを得ることができる。
第六工程
化合物ofを公知の一般的なカルボキシル基の脱保護反応に付すことにより、化合物ogを得ることができる。
第七工程
化合物ogを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物ohを得ることができる。
第一工程
化合物paに、アンモニア水を加え、0℃~30℃、好ましくは10℃~30℃にて0.5時間~48時間、好ましくは1時間~24時間反応させることにより、化合物pbを得ることができる。
第二工程
化合物pbに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、HATU、WSC・HCl等の縮合剤を加え、目的物に対応するアミン(R3-NH2)および、必要に応じてトリエチルアミン、N-メチルモルホリン等の3級アミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物pcを得ることができる。
第三工程
化合物pcに、DMF、DMA、NMP、THF等の溶媒の存在下、炭酸カリウム、炭酸ナトリウム、O-(2,4-ジニトロフェニル)ヒドロキシルアミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物pdを得ることができる。
第四工程
化合物pdに、トルエン、DMF、DMA、NMP、THF等の溶媒の存在下、R5-C(=O)-R6および酢酸を加え、60℃~120℃、好ましくは80℃~110℃にて0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物peを得ることができる。
第五工程
化合物peに、DMF、DMA、NMP、THF等の溶媒の存在下、目的物に対応する化合物R7-L1および、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物pfを得ることができる。
第六工程
化合物pfを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物pgを得ることができる。
第一工程
化合物qaに、ピリジン、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、HATU、WSC・HCl等の縮合剤を加え、化合物qbおよび必要に応じてトリエチルアミン、N-メチルモルホリン等の3級アミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物qcを得ることができる。
第二工程
化合物qcに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、炭酸カリウム、炭酸ナトリウム、O-(2,4-ジニトロフェニル)ヒドロキシルアミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物qdを得ることができる。
第三工程
化合物qdに、トルエン、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、R5-C(=O)-R6および酢酸を加え、60℃~120℃、好ましくは80℃~110℃にて0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物peを得ることができる。
または、エタノール、イソプロピルアルコール等の溶媒中、マイクロウェーブ照射条件下で、100℃~200℃にて5分間~1時間反応させることにより、化合物qeを得ることができる。
第四工程
化合物qeに、DMF、DMA、NMP等の溶媒の存在下またはそれらの混合溶媒中、目的物に対応する化合物R7-L1および、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物qfを得ることができる。
第五工程
化合物qfを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物qgを得ることができる。
第六工程
化合物qfを公知の一般的なカルボキシル基の脱保護反応に付すことにより、化合物qhを得ることができる。
第七工程
化合物qhを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物qiを得ることができる。
第八工程
化合物qhに、ピリジン、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、HATU、WSC・HCl等の縮合剤を加え、化合物HNRZ7RZ8、および必要に応じてトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の3級アミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物qjを得ることができる。
第九工程
化合物qjを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物qkを得ることができる。
第一工程
化合物qaに、ピリジン、DMF、DMA、NMP等の溶媒の存在下またはそれらの混合溶媒中、HATU、WSC・HCl等の縮合剤を加え、化合物qlおよび必要に応じてトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の3級アミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物qmを得ることができる。
第二工程
化合物qmに、DMF、DMA、NMP、THF等の溶媒の存在下、炭酸カリウム、炭酸ナトリウム、O-(2,4-ジニトロフェニル)ヒドロキシルアミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物qnを得ることができる。
第三工程
化合物qnに、トルエン、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、R5-C(=O)-R6および酢酸を加え、60℃~120℃、好ましくは80℃~110℃にて0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物peを得ることができる。
または、エタノール等の溶媒中、マイクロウェーブ照射条件下で、100℃~200℃にて5分間~1時間反応させることにより、化合物qoを得ることができる。
第四工程
化合物qoに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、目的物に対応する化合物R7-L1および、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物qpを得ることができる。
第五工程
化合物qpを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物qqを得ることができる。
第六工程
化合物qpを公知の一般的なアミノ基の脱保護反応に付すことにより、化合物qrを得ることができる。
第七工程
化合物qrを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物qsを得ることができる。
第八工程
化合物qrに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、目的物に対応する化合物RZ10-L1および、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物qtを得ることができる。
第九工程
化合物qtを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物quを得ることができる。
第十工程
化合物qrに、THF、ジオキサン、ジクロロメタンアセトニトリル等の溶媒の存在下、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加える。ここに、目的物に対応する化合物(RZ4COCl、RZ2SO2Cl、またはRZ13OCOCl)をゆっくり加え、-20℃~60℃、好ましくは0℃~30℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物qvを得ることができる。
第十一工程
化合物qvを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物qwを得ることができる。
化合物raに、DMF、THF、ジクロロメタン、アセトニトリル等の溶媒中またはそれらの混合溶媒中、ジシクロヘキシルカルボジイミド、カルボニルジイミダゾール、ジシクロヘキシルカルボジイミド-N-ヒドロキシベンゾトリアゾール、4-(4, 6-ジメトキシ-1, 3, 5, -トリアジン-2-イル)-4-メチルモルホリニウムクロリド、ヘキサフルオロリン酸2-(7-アザ-1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウム、WSC・HCl、HATU等の脱水縮合剤存在下、目的とする化合物に対応する置換基を有する化合物R3NH2を加え、-20℃~60℃、好ましくは-10℃~40℃で0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物rbを得ることができる。
または、化合物raをTHF、ジオキサン、ジクロロメタン、DMF等の溶媒の存在下、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、1-メチルイミダゾール等の塩基の存在下または非存在下、diphenylchlorophosphate、塩化チオニル、塩化オキザリル等のアシル化試薬を加えることにより酸クロライドを生成させ、目的とする化合物に対応する置換基を有する化合物R3-NH2を加え、-20℃~60℃、好ましくは-10℃~40℃で0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物rbを得ることができる。
第一工程
化合物saに、ジクロロメタン、THF、ジオキサン、トルエン等の溶媒の存在下、Dess Martin Periodinane、二酸化マンガン、PDC等の酸化試薬を加え、-20℃~60℃、好ましくは0℃~40℃で0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物sbを得ることができる。
第二工程
化合物sbに、トルエン、THF等の溶媒の存在下もしくは非存在下、硫酸ナトリウムおよび目的物に対応するアミノアルコールscを加え、0℃~80℃、好ましくは20℃~60℃で0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物sdを得ることができる。
第三工程
化合物sdを公知の一般的なアミノ基の脱保護反応に付すことにより、化合物seを得ることができる。
第四工程
化合物seに、トルエン、THF、ジオキサン等の溶媒の存在下、化合物sfを加え、40℃~110℃、好ましくは60℃~100℃で0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物sgを得ることができる。
第五工程
化合物sgを公知の一般的なアミノ基の脱保護反応に付した後、トルエン、THF、ジオキサン等の溶媒の存在下、40℃~110℃、好ましくは60℃~100℃で0.1時間~12時間、好ましくは0.2時間~6時間反応させることにより、化合物shを得ることができる。
第六工程
化合物shを公知の一般的なカルボキシル基の脱保護反応に付すことにより、化合物siを得ることができる。
第七工程
化合物siを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物sjを得ることができる。
第八工程
化合物siをジフェニルエーテル等の溶媒中、マイクロウェーブ照射下で、1分間~2時間反応させることにより、脱炭酸された化合物skを得ることができる。
第九工程
化合物skを公知の一般的なヒドロキシル基の脱保護反応に付すことにより、化合物slを得ることができる。
第一工程
化合物uaに、2級アミノ基の保護反応に付すことにより、化合物ubを得ることができる。
第二工程
化合物ubに、一般的なアミノ基の保護反応に付すことにより、化合物ucを得ることができる。
第三工程
化合物ucに、DMF、DMA、NMP等の溶媒及びNaH等の塩基の存在下、目的とする化合物に対応する化合物R7-L1を加え、0℃~80℃、好ましくは20℃~60℃で0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物ueを得ることができる。
第四工程、第五工程
(式中、R3およびR7は、隣接して結合していてもよく、この場合、第四工程および第五工程は同時に行なう)
化合物udに、DMF、DMA、NMP等の溶媒及びNaH等の塩基の存在下、目的とする化合物に対応する化合物R3-L1、およびR7-L1を順次反応させることで化合物ueを得ることができる。
第六工程
化合物ufに、2級アミノ基の保護反応に付すことにより、化合物ugを得ることができる。
第七工程
化合物ugに、2級アミノ基の保護反応に付すことにより、化合物uhを得ることができる。
第八工程
化合物uhに、DMF、DMA、NMP、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、NaH等の塩基を加え、目的とする化合物に対応する化合物R3-L1を反応させることで化合物ueを得ることができる。
第九工程
化合物ueに、一般的な2級アミンの脱保護反応に付すことにより、化合物ujを得ることができる。
第十工程
化合物ukに、DMF、DMA、THF等の溶媒の存在下、HATU、WSC・HCl等の縮合剤を加え、目的物に対応するアミンujおよび、ピリジン、トリエチルアミン、N-メチルモルホリン等の3級アミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物ulを得ることができる。
第十一工程
化合物ulに、一般的なアミノ基の保護反応に付すことにより、化合物umを得ることができる。
第十二工程
化合物umに、トルエン、DMF、DMA、NMP等の溶媒の存在下、R5-C(=O)-R6、トリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の3級アミンおよび酢酸を加え、60℃~120℃、好ましくは80℃~100℃にて0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物unを得ることができる。
第一工程
Sodium tert-pentoxide、n-ブチルリチウム、tert-ブチルリチウム等の有機金属塩基に、THF、エーテル、ジクロロメタン、DMI、DMF、DMA等の溶媒中、またはそれらの混合溶液中、目的物に対応するアルコール(P1-OH)を加える。ここに化合物taの溶液を滴下し、-20℃~40℃、好ましくは0℃~30℃にて0.1時間~12時間、好ましくは0.5時間~6時間反応させることにより、化合物tbを得ることができる。
第二工程
化合物tbに、THF、ジオキサン、トルエン、酢酸エチル等の溶媒中またはそれらの混合溶媒中、もしくは無溶媒でN,N-ジメチルホルムアミドジメチルアセタールを加え、0℃~80℃、好ましくは20℃~40℃にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物tcを得ることができる。
第三工程
Sodium tert-pentoxide、n-ブチルリチウム、tert-ブチルリチウム、Sodium metoxide、Sodium ethoxide
、Sodium tert-butoxide、Potassium tert-butoxide等の有機金属塩基に、THF、エーテル、DMI、メタノール、エタノール等の溶媒中またはこれらの混合溶媒中、目的物に対応する化合物tdを加える。ここに化合物tcの溶液を滴下し、-20℃~60℃、好ましくは0℃~30℃にて0.5時間~24時間、好ましくは1時間~12時間反応させ、その後塩酸、硫酸等の酸を加え-20℃~60℃、好ましくは0℃~30℃にて0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物teを得ることができる。
第一工程
化合物teと同様の方法で合成できる化合物tfに、エタノール、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、アリルアミンを加え、0℃~80℃、好ましくは20℃~60℃にて0.5時間~48時間、好ましくは1時間~24時間反応させることにより、化合物thを得ることができる。
第二工程
化合物tfに、エタノール、THF、ジオキサン、アセトニトリル等の溶媒の存在下またはそれらの混合溶媒中、化合物tgを加え、0℃~80℃、好ましくは20℃~60℃にて0.5時間~48時間、好ましくは1時間~24時間反応させることにより、化合物tiを得ることができる。
第三工程
化合物thに、THF、酢酸エチル、ジオキサン等の溶媒の存在下またはそれらの混合溶媒中、Potassium osmate dihydrate、過ヨウ素酸ナトリウム、および水を加え、0℃~60℃、好ましくは10℃~40℃にて0.5時間24時間、好ましくは1時間~12時間反応させることにより、化合物tjを得ることができる。
または、化合物thに、THF、酢酸エチル、ジオキサン等の溶媒の存在下またはそれらの混合溶媒中、オゾンを-10℃~20℃にて導入し、反応終了に続いて亜鉛-酢酸、(EtO)3P、またはジメチルスルフィドを加えることにより、化合物tjを得ることができる。
第四工程
化合物tiに、アセトン、アセトニトリル、エタノール、水等の溶媒中もしくはそれらの混合溶媒中、ギ酸、トリフルオロ酢酸、パラトルエンスルホン酸等の酸を加え、またはギ酸溶媒中、硫酸を加え、0℃~90℃、好ましくは20℃~80℃にて0.5時間24時間、好ましくは1時間~12時間反応させることにより、化合物tkを得ることができる。
第五工程
化合物tjまたは化合物tkに、クロロホルム、ジクロロメタン、THF等の溶媒の存在下、化合物tlおよび酢酸を加え、0℃~40℃、好ましくは10℃~30℃にて0.5時間24時間、好ましくは1時間~12時間反応させることにより、化合物tmを得ることができる。
第六工程
化合物tjまたは化合物tkに、クロロホルム、ジクロロメタン、THF等の溶媒の存在下、化合物tnおよび酢酸を加え、0℃~40℃、好ましくは10℃~30℃にて0.5時間24時間、好ましくは1時間~12時間反応させることにより、化合物toを得ることができる。
第七工程
化合物toに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、目的とする化合物に対応する化合物B-L1を加え、0℃~80℃、好ましくは20℃~60℃で0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物tpを得ることができる。
第一工程
化合物vaに、DMF、THF、ジクロロメタン、アセトニトリル等の溶媒中またはそれらの混合溶媒中、ジシクロヘキシルカルボジイミド、カルボニルジイミダゾール、ジシクロヘキシルカルボジイミド-N-ヒドロキシベンゾトリアゾール、4-(4, 6-ジメトキシ-1, 3, 5, -トリアジン-2-イル)-4-メチルモルホリニウムクロリド、ヘキサフルオロリン酸2-(7-アザ-1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウム、WSC・HCl、HATU等の脱水縮合剤存在下、目的とする化合物に対応する置換基を有する化合物vbを加え、-20℃~60℃、好ましくは-10℃~40℃で0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物vcを得ることができる。
または、化合物vaをTHF、ジオキサン、ジクロロメタン、DMF等の溶媒の存在下、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、1-メチルイミダゾール等の塩基の存在下または非存在下、diphenylchlorophosphate、塩化チオニル、塩化オキザリル等のアシル化試薬を加えることにより酸クロライドを生成させ、目的とする化合物に対応する置換基を有する化合物vbを加え、-20℃~60℃、好ましくは-10℃~40℃で0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物vcを得ることができる。
第二工程
化合物vcに、DMF、DMA、NMP、THF等の溶媒の存在下、炭酸カリウム、炭酸ナトリウム、O-(2,4-ジニトロフェニル)ヒドロキシルアミンを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物vdを得ることができる。
第三工程
化合物vdのアセタール保護基の脱保護反応は、Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons)等に記載の一般的な方法で行うことができる。その後、生成したアルデヒド基を分子内反応させることで、化合物veを得ることができる。
例えば、化合物vdに、DMF、トルエン、THF等の溶媒の存在下、酢酸および/またはパラトルエンスルホン酸を加え、10℃~80℃、好ましくは30℃~60℃にて0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物veを得ることができる。
第四工程
化合物veに、DMF、DMA、NMP、THF等の溶媒の存在下またはそれらの混合溶媒中、目的物に対応する化合物R7-L1および、炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~48時間、好ましくは1時間~24時間反応させることにより、化合物vfを得ることができる。
第一工程
化合物waに、1,2-ジクロロエタン、THF、ジオキサン、クロロホルム等の溶媒の存在下、カチオン生成試薬(例;ジクロロ酢酸)を加え、目的物に対応する試薬であるR7-OHを加え、10℃~60℃、好ましくは20℃~40℃にて0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物wbを得ることができる。
第二工程
化合物wbに、DMF、DMA、NMP、THF等の溶媒の存在下、塩基(例;2-tert-butylimino2-diethylamino-1,3-dimethylperhydro-1,3,2-diazaphosphorine)を加え、パラホルムアルデヒドを加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~24時間、好ましくは0.5時間~12時間反応させる。次に、脱離試薬(例;パラトルエンスルホニルクロライド)を加え、0℃~60℃、好ましくは10℃~40℃にて0.1時間~24時間、好ましくは0.5時間~12時間反応させることにより、化合物wcを得ることができる。
参考例に示される化合物を原料として、ヒドロキシル基をエステル基またはエーテル基に変換する一般的な方法によって実施例化合物を得ることができる。
例えば、Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons)、Prog.Med.5:2157-2161(1985)、およびSupplied by The British Library-“The world's Knowledge''等に記載の方法を利用することができる。
化合物1A (12.8 g, 89.4 mmol) とピリジン(8.50 g, 107 mmol) のジクロロメタン (90 mL) 溶液を1-3℃に冷却し、同温度を保ちながら benzyloxyacetyl chloride (19.8 g, 107 mmol) のジクロロメタン (90 mL) 溶液を 50分間かけて滴下した。反応液を同温度で30分間撹拌後、徐々に60分間かけて15℃に上げ、氷水を加えた。ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を3回水洗し、飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに n-ヘキサンで溶出し、次いでn-ヘキサン-酢酸エチル (1:1, v/v) で溶出した。目的の画分を濃縮すると油状物として 22.2 g の化合物1Bを得た。
1H-NMR (CDCl3) δ: 1.25(3H, t, J=7.2Hz), 2.90(3H,brs), 3.24(3H, brs), 4.15(2H, q, J=7.2Hz), 4.45(2H, s), 4.58(2H, s), 7.25-7.38(5H, m), 7.72(1H, s).
第二工程
1規定のリチウムヘキサメチルジシラザンTHF溶液(4.29 ml, 4.29 mmol)を-78℃に冷却し、同温度を保ちながら化合物1B (500 mg, 1.72 mmol) とシンナモイルクロリド (343.2 mg, 2.06 mmol) のTHF溶液 (4 ml) を3分間かけて滴下した。反応液を同温度で 25 分間撹拌後、2規定塩酸(10 ml)を加え、更に 10 分間室温で撹拌した。反応溶液に酢酸エチルを加え有機層を分離し、水層を酢酸エチルで3回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。n-ヘキサン-酢酸エチル (1:1, v/v) で溶出する画分から固体として364.3 mg(収率56%)の化合物1Cを得た。
1H-NMR (CDCl3) δ: 1.40 (3H, t, J = 7.2 Hz), 4.39 (2H, q, J = 7.2 Hz), 5.27 (2H, s), 6.99 (1H, d, J = 16.2 Hz), 7.23 (1H, d, J = 16.2), 7.26-7.48 (10H, m), 8.45 (1H, s).
第三工程
窒素気流下、化合物1Cと塩化ルテニウム(2.76 mg, 0.0133 mmol) のMeCN (5 ml)溶液に、室温下、過ヨウ素酸ナトリウム(625.8 mg, 2.93 mmol)と96% 硫酸 (287.4 mg, 2.93 mmol) の水溶液(8 ml)を10 分間かけて滴下した。反応液を同温度で5分間撹拌後、酢酸エチルを加え有機層を分離し、水層を酢酸エチルで2回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。n-ヘキサン-酢酸エチル (1:1, v/v) で溶出する画分から油状物として303.2 mg (収率75%) の化合物1Dを得た。
1H-NMR (CDCl3) δ: 1.39 (3H, t, J = 6.9 Hz), 4.40 (2H, q, J = 6.9 Hz), 5.54 (2H, s), 7.37 (5H, s), 8.48 (1H, s), 9.85 (1H, s).
第四工程
化合物1D(1.00 g, 3.31 mmol)のMeCN (15 ml) 溶液に室温下、96% 硫酸 (421.7 mg, 4.30 mmol) と amidosululic acid (642.7 mg, 6.62 mmol) の水溶液 (10 ml) を加え撹拌し、同温度を保ちながら亜塩素酸ナトリウム (388.9 mg, 4.30 mmol) の水溶液 (10 ml) 5分間かけて滴下した。反応液を同温度で5分間撹拌後、飽和食塩水を加え、酢酸エチルで3回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-MeOH (7:3, v/v) で溶出した。目的の画分を濃縮すると油状物として 748.8 mg (収率71%) の化合物1Eを得た。
1H-NMR (CDCl3) δ: 1.40 (3H, t, J = 7.2 Hz), 3.93 (1H, br s), 4.40 (2H, q, J = 7.2 Hz), 5.61 (2H, s), 7.38-7.44 (10 H, m), 8.52 (1H, s).
第五工程
化合物1E (1.00 g, 3.14 mmol)のDMF (10 ml)溶液に室温下、WSC HCl(1.20 g, 6.28 mmol) とHOBt (551.6 mg, 4.08 mmol) を加え、同温度で90分間撹拌した。反応液を0℃に冷却し、2-methoxyethanamine (236.0 mg, 3.14 mmol) のDMF (2 ml) 溶液を3分間かけて滴下した。反応液を同温度で1時間撹拌し、水を加え酢酸エチルで3回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめにn-ヘキサン-酢酸エチル (1:1, v/v)で溶出し、次いでn-ヘキサン-酢酸エチル (1:9, v/v)で溶出した。目的の画分を濃縮すると油状物として 928.5 mg (収率79%) の化合物1Fを得た。
1H-NMR (CDCl3) δ: 1.39 (3H, t, J = 7.2 Hz), 3.29 (3H, s), 3.41 (2H, t, J = 5.4 Hz), 3.47-3.53 (2H, m), 4.39 (2H, q, J = 7.2 Hz), 5.44 (2H, s), 7.36 (3H, m), 7.44-7.47 (2H, m), 8.07 (1H, br s), 8.54 (1H, s).
第六工程
化合物1F (500 mg, 1.33 mmol) と (S)-2-アミノ-3-フェニルプロパン-1-オール (604.2 mg, 4.0 mmol) のキシレン (2 ml) 溶液を120℃に加熱し、30分間撹拌した。反応溶液を室温まで冷却し、溶媒を留去後、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-MeOH (9:1, v/v) で溶出した。目的の画分を濃縮すると油状物として 487 mg (収率 72%) の化合物1G を得た。
1H-NMR (CDCl3) δ: 1.41 (3H, t, J = 6.9 Hz), 2.24-2.34 (1H, m), 2.24-3.00 (1H, m), 3.03-3.16 (1H, m), 3.05 (3H, m), 3.25-3.32 (2H, m), 4.13-4.19 (1H, m), 4.17-4.30 (1H, m), 4.36-4.47 (1H, m), 4.51-4.54 (1H, m), 4.55 (1H, d, J = 10.5 Hz), 5.78 (1H, t, J = 6.9 Hz), 7.17-7.26 (4H, m), 7.28-7.35 (5H, m), 7.49 (1H, t, J = 5.4 Hz), 6.32 (1H, s).
第七工程
化合物1G (2.86 g, 5.63 mmol) と トリフェニルホスフィン (2.21 g, 8.45 mmol)のTHF (6ml) 溶液に室温下、DEAD 40 wt% トルエン溶液 (3.68 g, 8.45 mmol) を3分間かけて滴下した。反応液を同温度で30分間撹拌し、溶媒を留去後、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-MeOH (9:1, v/v) で溶出する画分から油状物として 1.37 g (収率 50%) の化合物1H を得た。
1H-NMR (CDCl3) δ: 1.31 (3H, t, J = 7.2 Hz), 3.07 (2H, d, J = 6.9 Hz), 3.33 (3H, s), 3.57-3.80 (4H, m), 3.95 (1H, dd, J = 3.0 Hz, 6.6 Hz), 4.01-4.14 (1H, m), 4.16-4.34 (2H, m), 5.24 (1H, d, J = 9.9 Hz), 5.51 (1H, d, J = 9.9 Hz), 7.01-7.03 (2H, m), 7.21-7.37 (5H, m), 7.41-7.58 (1H, m), 7.64-7.69 (2H, m).
第八工程
化合物1H (1.0 g, 2.04 mmol) のEtOH (6 ml) 溶液に、2規定水酸化ナトリウム水溶液 (6 ml) を加え、室温下、30分間撹拌した。反応液を2規定塩酸で中和し、析出した固体を濾取し、乾燥すると、754 mg (収率 80%) の化合物1I を得た。
1H-NMR (CDCl3) δ: 3.10 (2H, d, J = 7.8 Hz), 3.33 (3H, s), 3.57-3.69 (4H, m), 3.82-3.90 (1H, m), 3.95 (1H, dd, J = 3.3 Hz, 13.8 Hz), 4.36 (1H, dd, J = 6.3 Hz, 7.5 Hz), 5.36 (1H, d, J = 10.2 Hz), 5.45 (1H, d, J = 10.2 Hz), 6.98-7.01 (2H, m), 7.28-7.39 (6H, m), 7.59 (2H, dd, J = 1.8 Hz, 8.1 Hz), 7.87 (1H, s).
第九工程
化合物1I (1.0 g, 2.16 mmol) をTHF (10 ml) に溶解し、10% Pd-C (200 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣をエーテルで洗浄し、512 mg (収率 64%) の化合物1 を得た。
1H-NMR (CDCl3) δ: 6.24 (2H, d, J = 6.3 Hz), 3.36 (3H, s), 3.60-3.86 (5H, m), 4.14 (1H, d, J = 12.9 Hz), 4.47 (1H, s), 7.03-7.05 (2H, m), 7.30-7.35 (3H, m), 7.88 (1H, s), 12.68 (1H, s), 14.83 (1H, s).
(S)-tert-butyl 3-hydroxy-1,1-diphenylpropan-2-ylcarbamate (5.00 g, 15.3 mmol)にトリフルオロ酢酸 (40 ml)を加え、氷冷下1時間攪拌した。トリフルオロ酢酸を留去した後、トルエンを加え、再び減圧留去することで、粗製の(S)-2-amino-3,3-diphenylpropan-1-olを得た。得られた(S)-2-amino-3,3-diphenylpropan-1-olに対し、化合物1F (5.73 g, 15.3 mmol)、トルエン (50 ml)、トリエチルアミン(6.4 ml, 45.8 mmol)を加え、90℃で1時間攪拌し、室温まで冷却した後、溶媒を留去した。得られた残渣にジクロロメタンを加え、2N塩酸水溶液、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄した。有機層を分離後、硫酸マグネシウムを加えた後、セライトろ過し、ろ液を留去することで、アメ状の化合物2A (9.12 g)を得た。
MS: m/z = 585.2 [M+H]+.
第二工程
化合物2A (8.60 g, 14.7 mmol)とトリフェニルフォスフィン (7.72 g, 29.4 mmol) をテトラヒドロフラン (90 ml)に溶解し、氷冷下、ジエチルアゾジカルボキシラート 2.2M トルエン溶液 (10.0 ml, 22.0 mmol)を滴下した。氷冷下2時間、室温下18時間攪拌した後、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し精製を行い、泡状の化合物2B (3.88 g, 6.85 mmol)を得た。
1H-NMR (DMSO-d6) δ: 1.18 (3H, m), 3.11 (3H, s), 3.16 (1H, m), 3.28 (1H, m), 3.76 (1H, m), 3.97-4.13 (3H, m), 4.31 (1H, d, J = 11.3Hz), 5.08 (2H, s), 5.52 (1H, d, J = 12.0Hz), 7.18-7.25 (6H, m), 7.25-7.45 (6H, m), 7.55-7.66 (6H, m).
MS: m/z = 567.7 [M+H]+.
第三工程
化合物2B (3.4 g, 6.0 mmol)にエタノール (36 ml)、水 (12 ml)、2N 水酸化ナトリウム水溶液(4.5 ml, 9.0 mmol)を加え、室温下40分攪拌した後、エタノール (10 ml)、水 (10 ml)を加え、さらに30分間攪拌した。エタノールを留去し、酢酸エチル、水を加え、激しく攪拌した後、分離した。酢酸エチル層を2N 水酸化ナトリウムで3回洗浄し、水層をひとつに合わせた。水層に酢酸エチルを加え、2N塩酸を用いて中和し、激しく攪拌後、酢酸エチル層を分離した。酢酸エチル層に硫酸マグネシウムを加え、セライトろ過し、ろ液を留去した。得られた残渣をMeOHに溶解し留去することで、化合物2C (3.0 g, 5.64 mmol)の固体を得た。
1H-NMR (DMSO-d6) δ: 3.11 (3H, s), 3.16 (1H, m), 3.25 (1H, m), 3.75 (1H, m), 4.11 (1H, m), 4.36 (1H, d, J = 11.6Hz), 5.18 (2H, dd, J = 15.7Hz, 10.4Hz), 5.71 (1H, d, J = 11.6Hz), 7.08-7.20 (5H, m), 7.29-7.45 (6H, m), 7.55 (2H, d, J = 6.7Hz), 7.61 (2H, d, J = 7.5Hz), 7.98 (1H, s).
MS: m/z = 539.4 [M+H]+.
第四工程
化合物2C (1.50 g, 2.79 mmol)にメタノール(22 ml)、10%パラジウム炭素-50% wet (150 mg)を加え、水素雰囲気下、1時間攪拌した。酢酸エチル (44 ml)を加え、セライトろ過し、ろ液を留去した。得られた残渣をメタノール(20 ml)に溶解し、水(10 ml)を加え、メタノールを留去した。析出物を濾取、乾燥し、化合物2 (1.15 g, 2.56 mmol)を得た。
1H-NMR (DMSO-d6) δ: 3.15 (3H, s), 3.50-3.70 (5H, m), 4.19 (1H, dd, J = 13.8Hz, 3.1 Hz), 4.49 (1H, d, J = 11.6Hz), 5.78 (1H, d, J = 9.6Hz), 7.10-7.27 (6H, m), 7.34 (1H, m), 7.46 (2H, t, J = 7.5Hz), 7.63 (2H, t, J = 7.7Hz), 7.94 (1H, s), 12.94 (1H, s), 15.08 (1H, s).
MS: m/z = 449.4 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.15 (1H, m), 3.26 (3H, s), 3.52-3.70 (4H, m), 3.70-3.80 (2H, m),4.10 (1H, d, J = 12.9Hz), 4.92 (1H, brs), 6.98 (1H, t, J = 7.4Hz), 7.03 (1H, brs), 7.08 (1H, t, 7.6Hz), 7.34 (1H, d, J = 7.8Hz), 7.47 (1H, d, J = 7.3Hz), 7.80 (1H, s), 10.94 (1H, brs), 15.38 (1H, brs).
MS: m/z = 412.4 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.13 (3H, s), 3.46-3.72 (5H, m), 4.16 (1H, d, J = 12.6Hz), 4.48 (1H, d, J = 10.9Hz), 5.77 (1H, d, J = 11.6Hz), 7.10-7.27 (6H, m), 7.32 (1H, m), 7.44 (2H, m), 7.61 (2H, m), 7.93 (1H, s), 15.04 (1H, s).
MS: m/z = 449.3 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.28 (3H, s), 3.52-3.68 (4H, m), 4.06 (1H, m), 4.25 (2H, m), 4.41 (1H, brs), 4.56 (1H, d, J = 13.6Hz), 4.82 (1H, d, J = 13.9Hz), 6.74 (2H, d, J = 7.6Hz), 6.92 (1H, t, J = 7.20Hz), 7.25 (2H, t, J = 7.8Hz), 8.58 (1H, s), 12.48 (1H, brs), 15.55 (1H, brs).
MS: m/z = 389.4 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.16 (1H, m), 3.26 (3H, s), 3.50-3.70 (4H, m), 3.70-3.80 (2H, m), 4.10 (1H, d, J = 13.4Hz), 4.92 (1H, brs), 6.98 (1H, t, J = 7.1Hz), 7.03 (1H, brs), 7.08 (1H, t, J =7.3Hz), 7.34 (1H, d, J = 7.8Hz), 7.48 (1H, d, J = 7.3Hz), 7.81 (1H, s), 12.91 (1H, s), 15.36 (1H, s).
MS: m/z = 412.4 [M+H]+.
1H-NMR (DMSO-d6) δ: 0.85-0.95 (2H, m), 1.05-1.25 (5H, m), 1.45-1.80 (8H, m), 3.28 (3H, s), 3.46 (1H, m), 3.58 (1H, m), 3.72 (1H, d, J = 13.9Hz), 3.93 (1H, m), 4.04 (1H, d, J = 13.1Hz), 4.88 (1H, s), 8.56 (1H, s), 12.80 (1H, s), 15.51 (1H, s).
MS: m/z = 379.3 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.07 (2H, m), 2.55 (1H, m), 2.74 (1H, m), 3.17 (1H, s), 3.23 (3H, s), 3.48-3.65 (4H, m), 3.79 (1H, d, J = 13.6Hz), 3.87 (1H, m), 4.09 (1H, d, J = 13.6Hz), 4.80 (1H, s), 7.10-7.29 (5H, m), 8.59 (1H, s), 12.77 (1H, s), 15.49 (1H, s).
MS: m/z = 387.3 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.80 (1H, dd, J = 14.5Hz, J2 = 8.5Hz), 2.93 (1H, dd, J = 14.4Hz, 5.6Hz), 3.21 (3H, s), 3.40-3.55 (4H, m), 3.77 (2H, s), 3.82 (1H, d, J = 13.1Hz), 3.88 (1H, m), 4.13 (1H, d, J = 13.6Hz), 4.85 (1H, s), 7.20-7.35 (5H, m), 8.61 (1H, s), 12.79 (1H, s), 15.43 (1H, s).
MS: m/z = 419.3 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.22 (3H, d, J = 6.2Hz), 3.29 (3H, s), 3.43 (1H, m), 3.58 (2H, m), 3.94 (1H, m), 4.12 (1H, brs), 4.41 (1H, d, J = 13.6Hz), 4.49 (1H, d, J =13.1 Hz), 8.59 (1H, s), 12.65 (1H, s), 15.53 (1H, s).
MS: m/z = 297.2 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.46 (4H, brs), 1.76-1.90 (2H, m), 2.22 (1H, brs), 3.27 (3H, s), 3.57 (1H, d, J = 5.3Hz), 4.07 (1H, m), 4.69 (1H, m), 8.47 (1H, s), 13.04 (1H, s), 15.52 (1H, s).
MS: m/z = 337.2 [M+H]+.
化合物12A (1.53 g, 5.80 mmol) をTHF (6 ml) と水 (6 ml) に溶解し、炭酸カリウム (2.41 g,17.4 mmol) を加えて攪拌しておき、0℃でbenzyl chloroformate (1.09 g, 6.38 mmol) を滴下した。0℃で10分攪拌した後、室温で2時間攪拌した。反応液を重曹水にあけ、酢酸エチルで抽出した。抽出液を1規定塩酸と飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を留去し、無色ガム状物質として 2.32 g の化合物12Bを得た。
1H-NMR (CDCl3) δ: 1.98 (1H, brs), 3.55 (1H, m), 3.75 (1H, m), 4.20 (1H, d, J = 10.5 Hz), 4.58 (1H, m), 4.83 (1H, brs), 5.07 (2H, s), 7.16-7.39 (15H, m).
第二工程
化合物12B (1.94 g, 5.37 mmol) とトリフェニルホスフィン (2.11 g, 8.05 mmol) とフタルイミド (948 mg, 6.44 mmol) をTHF (20 ml) に加え、diisopropyl azodicarboxylate (2.2M in toluene, 3.66 ml, 8.05 mmol) を室温で滴下した。室温で4時間攪拌した後、溶媒を減圧留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色固体として 2.39 g の化合物12Cを得た。
1H-NMR (CDCl3) δ: 3.73 (2H, m), 4.05 (1H, d, J = 10.1Hz), 4.70 (1H, d, J = 9.6Hz), 4.77 (2H, d, J = 7.2 Hz) 5.02 (1H, m), 7.03-7.42 (15H, m), 7.68 (2H, dd, J = 5.7, 2.1 Hz), 7.78 (2H, dd, J = 5.7, 2.1Hz).
第三工程
化合物12C (2.39 g, 4.87 mmol) をTHF (20 ml) とメタノール (20 ml) に加え、hydrazine hydrate (4.88 g, 97.4 mmol) を加えて50℃で4時間攪拌した。白色沈殿物をろ過して除き、メタノールで洗った。ろ液を減圧留去した後、得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1, v/v) で精製し、無色固体として 1.41 g の化合物12Dを得た。
1H-NMR (CDCl3) δ: 2.63 (1H, dd, J = 13.2, 5.8 Hz), 2.86 (1H, d, J = 9.9 Hz), 4.07 (1H, d, J = 10.4 Hz), 4.53 (1H, m), 4.81 (1H, m), 5.00 (2H, d, 8.4Hz), 7.20-7.36 (10H, m).
第四工程
化合物12D (1.41 g, 3.91 mmol) をTHF (15 ml) に溶解し、室温でBoc2O (896 mg, 4.11 mmol)を加えた。1.5時間攪拌の後、溶媒を減圧濃縮した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色固体として 1.77 g の化合物12Eを得た。
1H-NMR (CDCl3) δ: 1.41 (9H, s), 3.23 (2H, brm), 3.97 (1H, d, J = 9.8 Hz), 4.58-4.80 (3H, m), 5.00 (2H, d, J = 9.8 Hz), 7.15-7.29 (10H, m).
第五工程
化合物12E (1.73 g, 3.76 mmol) とパラジウム‐活性炭素 (10%, wet, 200 mg) をメタノール (20ml) に加え、水素雰囲気下、室温で1時間攪拌した。セライトろ過した後、溶媒を減圧濃縮して無色オイル状物質12Fを1.01 g得た。
1H-NMR (CDCl3) δ: 1.44 (9H, s), 2.82 (1H, m), 3.31 (1H, m), 3.73 (2H, d, J = 6.9 Hz), 4.98 (1H, s), 7.18-7.39 (10H, m).
第六工程
中間体合成例1に示される方法で得られた、dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (974 mg, 3.06 mmol) と12F (999 mg,3.06 mmol) をトルエン (10 ml) に加え、110℃で5時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 98:2, v/v) で精製し、淡黄色固体として 1.51 g の化合物12Gを得た。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 3.40 (1H, m), 3.53 (1H, m), 3.82 (3H, s), 3.91 (3H, s), 4.29 (1H, d, J = 11.3 Hz), 4.78 (1H, m), 4.82 (1H, m), 5.11 (1.9H, d, J = 7.5 Hz), 7.10-7.38 (10H, m), 8.27 (1H, s).
第七工程
化合物12G (1.45 g, 2.31 mmol) に4規定 HCl (酢酸エチル溶液, 20 ml) を加え、室温で1.5時間攪拌した。溶媒を減圧留去した後、飽和重曹水を加えて室温で1.5時間攪拌した。クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色固体として1.01 g の化合物12Hを得た。
1H-NMR (CDCl3) δ: 3.40 (1H, dd, J = 13.6, 6.6 Hz), 3.78 (3H, s), 3.80 (1H, m), 4.37 (1H, d, J = 11.6 Hz), 4.59 (1H, d, J = 11.0 Hz), 5.43 (2H, d, J = 10.2 Hz), 5.93 (1H, d, J = 5.8 Hz), 7.03-7.21 (5H, m), 7.37 (9H, m), 7.63 (2H, m).
第八工程
化合物12H (50 mg, 0.10 mmol) をDMF (1 ml) に溶解し、炭酸セシウム (165 mg, 0.50 mmol)を加えた。室温で30分攪拌した後、ヨードメタン (0.032 ml, 0.50 mmol) を加えて室温で3.5時間攪拌した。反応液を水にあけ、酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色固体として49 mg の化合物12Iを得た。
第九工程
化合物12I (49 mg, 0.096 mmol) をTHF (0.5 ml) とメタノール (0.5 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (0.24 ml, 0.48 mmol) を加えてそのまま1.5時間攪拌した。1規定塩酸を加えてから酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、無色固体として54 mg の化合物12Jを得た。
MS: m/z = 481 [M+H]+.
第十工程
第九工程で得られた化合物12Jにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを3に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐メタノール‐エチルエーテルを加えて析出した固体を濾取し、無色固体として26 mg の化合物12を得た。
1H-NMR (DMSO-d6) δ: 3.01 (3H, s), 3.26 (1H, t, J = 14.4 Hz), 4.23 (1H, dd, J = 13.5, 3.8 Hz), 4.57 (1H, d, J = 11.6 Hz), 5.78 (1H, d, J = 11.3 Hz), 7.16-7.70 (10H, m), 8.00 (1H, s), 13.00 (1H, s), 15.10 (1H, s).
MS: m/z = 405 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.05 (3H, t, J = 6.9 Hz), 3.43-3.65 (3H, m), 4.22 (1H, d, J = 10.6 Hz), 4.55 (1H, d, J = 11.6 Hz), 5.81 (1H, d, J = 10.1 Hz), 7.15-7.68 (10H, m), 7.97 (1H, s), 12.96 (1H, s), 15.07 (1H, s).
MS: m/z = 463 [M+H]+.
1H-NMR (DMSO-d6) δ: 0.98 (3H, t, J = 7.17 Hz), 3.44-3.64 (3H, m), 4.15 (1H, dd, J = 13.7, 3.5 Hz), 4.45 (1H, d, J = 11.6 Hz), 5.79 (1H, d, J = 12.2 Hz), 7.08-7.63 (10H, m), 7.89 (1H, s), 13.01 (1H, s), 15.06 (1H, s).
MS: m/z = 419 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.22 (1H, s), 3.47 (1H, d, J = 13.3 Hz), 4.17 (2H, m), 4.44 (2H, dd, J = 16.7, 3.0 Hz), 5.79 (1H, d, J = 12.2 Hz), 7.10-7.64 (10H, m), 7.98 (1H, s), 12.56 (1H, s), 15.05 (1H, brs).
1H-NMR (DMSO-d6) δ: 3.24 (1H, d, J = 13.2 Hz), 4.23 (1H, m), 4.25 (1H, d, J = 14.7 Hz), 4.40 (1H, d, J = 14.8 Hz), 4.92 (1H, d, J = 15.4 Hz), 5.79 (1H, m), 7.03-7.48 (10H, m), 7.93 (1H, s), 12.82 (1H, s), 15.06 (1H, s).
1H-NMR (DMSO-d6) δ: 3.23 (1H, d, J = 13.4 Hz), 4.22 (1H, m), 4.25 (1H, d, J = 12.0 Hz), 4.45 (1H, d, J = 14.9 Hz), 4.93 (1H, d, J = 15.3 Hz), 5.77 (1H, d, J = 11.6 Hz), 7.09-7.56 (10H, m), 7.92 (1H, s), 12.74 (1H, s), 15.06 (1H, s).
1H-NMR (DMSO-d6) δ: 1.63 (2H, m), 3.20 (3H, s), 3.44 (5H, m), 4.19 (1H, d, J = 10.2 Hz), 4.51 (1H, d, J = 11.8 Hz), 5.80 (1H, d, J = 11.0 Hz), 7.13-7.65 (10H, m), 7.93 (1H, s), 13.02 (1H, s).
MS: m/z = 463 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.15 (1H, d, J = 9.5 Hz), 3.95 (1H, dd, J = 13.5, 3.4 Hz), 4.51 (1H, d, J = 11.6 Hz), 5.74 (1H, d, J = 11.1 Hz), 7.11-7.62 (10H, m), 7.93 (1H, s), 9.34 (1H, s), 12.97 (1H, s), 15.07 (1H, brs).
MS: m/z = 391 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.26 (1H, m), 4.24 (1H, m), 4.27 (1H, d, J = 12.0 Hz), 4.41 (1H, d, J = 14.8 Hz), 4.87 (1H, d, J = 14.9 Hz), 5.75 (1H, d, J = 7.6 Hz), 7.09-7.77 (12H, m), 7.93 (1H, s), 8.52 (2H, m), 12.79 (1H, s), 15.07 (1H, brs).
MS: m/z = 482 [M+H]+.
1H-NMR (DMSO-d6) δ: 0.62 (3H, d, J = 6.9 Hz), 0.82 (3H, d, J = 6.6 Hz), 3.18 (1H, m), 3.75 (1H, d, J = 10.2 Hz), 4.25 (1H, d, J = 11.8 Hz), 4.58 (1H, m), 5.65 (1H, d, J = 11.3 Hz), 6.89-7.43 (10H, m), 7.67 (1H, s), 12.94 (1H, s).
MS: m/z = 433 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.07-1.70 (5H, m), 3.04-3.34 (5H, m), 3.82 (2H, dm), 4.18 (1H, d, J = 10.2 Hz), 4.42 (1H, d, J = 12.0 Hz), 5.81 (1H, d, J = 11.7 Hz), 7.11-7.59 (10H, m), 7.86 (1H, s), 12.96 (1H, s), 15.07 (1H, brs).
MS: m/z = 489 [M+H]+.
1H-NMR (DMSO-d6) δ: 0.01-0.79 (5H, m), 3.05 (1H, dd, J = 14.1, 7.5 Hz), 3.49-3.59 (2H, m), 4.16 (1H, dd, J = 14.0, 3.3 Hz), 4.50 (1H, d, J = 11.9 Hz), 5.82 (1H, d, J = 11.1 Hz), 7.11-7.62 (10H, m), 7.89 (1H, s), 12.99 (1H, s), 15.07 (1H, brs).
MS: m/z = 445 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.23 (1H, d, J = 13.7 Hz), 4.16 (1H, dd, J = 13.2, 3.3 Hz), 4.19 (2H, d, J = 12.0 Hz), 4.38 (1H, d, J = 14.6 Hz), 4.84 (1H, d, J = 14.6 Hz), 5.72 (1H, d, J = 11.4 Hz), 7.08-7.33 (15H, m), 7.98 (1H, s), 12.88 (1H, s), 15.07 (1H, s).
MS: m/z = 481 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.39 (3H, s), 3.37 (1H, m), 4.21 (1H, dd, J = 14.4, 3.9 Hz), 4.40 (1H, dd, J = 11.7 Hz), 4.45 (1H, d, J = 15.3 Hz), 4.81 (1H, d, J = 15.4 Hz), 5.78 (1H, d, J = 12.0 Hz), 6.30 (1H, s), 7.09-7.42 (10H, m), 7.95 (1H, s), 12.65 (1H, s), 15.07 (1H, s).
MS: m/z = 486 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.20-1.77 (6H, m), 3.11-3.61 (6H, m), 4.21 (1H, d, J = 9.9 Hz), 4.53 (1H, d, J = 11.7 Hz), 5.80 (1H, d, J = 11.8 Hz), 7.14-7.65 (10H, m), 7.95 (1H, s), 12.95 (1H, brs), 15.06 (1H, brs).
MS: m/z = 489 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.36 (1H, m), 4.28 (1H, d, J = 12.0 Hz), 4.54 (1H, d, J = 11.4 Hz), 4.62 (1H, d, J = 15.3 Hz), 4.79 (1H, d, J = 15.4 Hz), 5.77 (1H, d, J = 9.9 Hz), 7.09-7.79 (13H, m), 7.98 (1H, s), 8.46 (1H, d, J = 4.6 Hz), 12.82 (1H, brs), 15.06 (1H, brs).
MS: m/z = 482 [M+H]+.
化合物28A (3.20 g, 17.1 mmol) をTHF (20 ml) に加え、トリエチルアミン (2.60 ml, 18.8 mmol) を加えて室温で10分攪拌した。Boc2O (4.09 g, 18.8 mmol) を室温で加えた後、そのまま2時間攪拌した。溶媒を減圧留去し、水を加えて酢酸エチルで抽出した。有機層を飽和食塩水で洗い、硫酸ナトリウムで乾燥した。溶媒を減圧留去して無色固体として5.17 g の化合物28Bを得た。
1H-NMR (CDCl3) δ: 1.52 (9H, s), 2.77 (2H, m), 3.03-3.12 (1H, m), 3.38 (1H, m), 3.90-3.98 (1H, m), 4.93 (1H, brs), 7.20-7.35 (5H, m).
第二工程
化合物28B (4.29 g, 17.1 mmol) とトリフェニルホスフィン (5.37 g, 20.5 mmol) とフタルイミド (2.76 g, 18.8 mmol) をTHF (60 ml) に加え、diethyl azodicarboxylate (2.2M in toluene, 11.6 ml, 25.6 mmol) を室温で滴下した。室温で1時間攪拌した後、溶媒を減圧留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 2:1, v/v) で精製し、無色固体として 6.13 g の化合物28Cを得た。
1H-NMR (CDCl3) δ: 1.30 (9H, s), 3.14 (1H, dd, J = 13.8, 6.2 Hz), 3.39 (2H, m), 3.87 (1H, m), 4.67 (1H, m), 4.81 (1H, brs), 7.16-7.19 (5H, m), 7.66 (2H, dd, J = 5.3, 3.1 Hz), 7.75 (2H, dd, J = 5.7, 3.0 Hz).
第三工程
化合物28C (1.00 g, 2.63 mmol) をTHF (7 ml) とメタノール (7 ml) に加え、hydrazine hydrate (2.63 g, 52.6 mmol) を加えて50℃で2時間攪拌した。白色沈殿物をろ過して除き、メタノールで洗った。ろ液を減圧留去した後、得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1, v/v) で精製し、無色固体として 249 mg の化合物28Dを得た。
1H-NMR (CDCl3) δ: 1.44 (9H, s), 1.95 (2H, brs), 2.55-3.31 (5H, m), 5.06 (1H, brs), 7.18-7.33 (5H, m).
第四工程
dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (313 mg, 0.983 mmol) と28D (246 mg, 0.983 mmol) をトルエン (3 ml) に加え、100℃で2.5時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 98:2, v/v) で精製し、淡黄色ガム状物質として 320 mg の化合物28Eを得た。
1H-NMR (CDCl3) δ: 1.42 (9H, s), 3.07 (2H, m), 3.56 (2H, m), 3.68 (3H, s), 3.95 (3H, s), 4.26 (1H, s), 4.86 (1H, s), 5.18 (1H, d, J = 10.8 Hz), 5.22 (1H, d, J = 10.8 Hz), 7.01 (2H, m), 7.24-7.38 (8H, m), 8.22 (1H, s).
MS: m/z = 551 [M+H]+.
第五工程
化合物28E (315 mg, 0.572 mmol) に4規定 HCl (酢酸エチル溶液, 5 ml) を加え、室温で30分攪拌した。溶媒を減圧留去した後、飽和重曹水を加え、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色固体として210 mg の化合物28Fを得た。
1H-NMR (CDCl3) δ: 3.07-3.15 (2H, m), 3.34 (1H, dd, J = 13.2, 6.0 Hz), 3.74 (2H, m), 3.86 (3H, s), 4.12 (1H, m), 5.27 (1H, d, J = 10.1 Hz), 5.47 (1H, d, J = 10.1 Hz), 6.76 (1H, d, J = 6.4 Hz), 7.04 (2H, m), 7.32 (6H, m), 7.62 (2H, dd, J = 7.7, 1.4 Hz), 7.70 (1H, s).
MS: m/z = 419 [M+H]+.
第六工程
化合物28F (50 mg, 0.12 mmol) をDMF (1 ml) に溶解し、炭酸セシウム (195 mg, 0.597 mmol)を加えた。室温で30分攪拌した後、ヨードエタン (0.048 ml, 0.60 mmol) を加えて室温で3.5時間攪拌した。反応液を水にあけ、酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色固体として47 mg の化合物28Gを得た。
1H-NMR (CDCl3) δ: 1.22 (3H, t, J = 7.2 Hz), 3.00-3.15 (2H, m), 3.28 (1H, dd, J = 13.6, 1.6 Hz), 3.48 (1H, m), 3.75 (1H, m), 3.85 (3H, s), 3.88 (1H, dd, J = 13.3, 3.2 Hz), 4.15 (1H, m), 5.25 (1H, d, J = 9.9 Hz), 5.50 (1H, d, J = 9.9 Hz), 7.04 (2H, m), 7.29-7.38 (6H, m), 7.60 (1H, s), 7.68 (2H, m).
MS: m/z = 447 [M+H]+.
第七工程
化合物28G (47 mg, 0.11 mmol) をTHF (0.5 ml) とメタノール (0.5 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (0.26 ml, 0.53 mmol) を加えてそのまま1時間攪拌した。1規定塩酸を加えてから酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、無色固体として40 mg の化合物28Hを得た。
MS: m/z = 433 [M+H]+.
第八工程
第七工程で得られた化合物28Hにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを3に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐メタノール‐エチルエーテルを加えて析出した固体を濾取し、無色固体として17 mg の化合物28を得た。
1H-NMR (DMSO-d6) δ: 1.17 (3H, t, J = 7.2 Hz), 3.08 (2H, m), 3.51-3.63 (3H, m), 4.08 (1H, dd, J = 13.6, 3.9 Hz), 5.03 (1H, brs), 7.21 (5H, m), 8.07 (1H, s), 12.98 (1H, s), 15.07 (1H, brs).
MS: m/z = 343 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.96 (2H, d, J = 7.6 Hz), 3.46 (1H, d, J = 13.3 Hz), 4.06 (1H, dd, J = 13.6, 3.8 Hz), 4.64 (1H, d, J = 14.9 Hz), 4.89 (1H, d, J = 14.6 Hz), 4.98 (1H, m), 6.97 (2H, m), 7.10-7.37 (5H, m), 7.57 (1H, m), 8.12 (1H, s), 12.75 (1H, s), 15.07 (1H, brs).
1H-NMR (DMSO-d6) δ: 2.99 (2H, dd, J = 7.5, 3.6 Hz), 3.48 (1H, d, J = 13.4 Hz), 4.09 (1H, dd, J = 13.4, 4.0 Hz), 4.73 (1H, d, J = 15.1 Hz), 4.92 (1H, d, J = 15.1 Hz), 4.99 (1H, m), 6.97 (2H, m), 7.18-7.29 (4H, m), 7.49 (1H, m), 7.61 (1H, m), 8.15 (1H, s), 12.69 (1H, s), 15.06 (1H, brs).
1H-NMR (DMSO-d6) δ: 2.91 (2H, m), 3.45 (1H, d, J = 13.1 Hz), 4.02 (1H, dd, J = 13.6, 4.0 Hz), 4.57 (1H, d, J = 14.6 Hz), 4.91 (1H, d, J = 14.6 Hz), 4.93 (1H, m), 6.89 (2H, m), 7.18 (3H, m), 7.40 (5H, m), 8.16 (1H, s), 12.86 (1H, brs), 15.06 (1H, brs).
MS: m/z = 405 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.10 (2H, m), 3.39 (1H, d, J = 13.6 Hz), 3.84 (1H, dd, J = 13.6, 4.0 Hz), 4.94 (1H, m), 7.23 (5H, m), 8.19 (1H, s), 9.44 (1H, brs), 12.97 (1H, s), 15.06 (1H, brs).
MS: m/z = 315 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.09 (3H, t, J = 6.9 Hz), 3.10 (2H, m), 3.42-3.50 (2H, m), 3.71 (5H, m), 4.11 (1H, dd, J = 13.6, 3.8 Hz), 4.99 (1H, brs), 7.11-7.29 (5H, m), 7.99 (1H, s), 12.88 (1H, s), 15.06 (1H, brs).
MS: m/z = 387 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.16 (3H, d, J = 6.9 Hz), 1.21 (3H, d, J = 6.9 Hz), 2.98 (1H, dd, J = 13.6, 9.8 Hz), 3.13 (1H, dd, J = 13.7, 5.8 Hz), 3.68 (1H, d, J = 12.8 Hz), 3.87 (1H, dd, J = 13.6, 3.7 Hz), 4.83 (1H, quin, J = 6.8 Hz), 5.07 (1H, brs), 7.19 (5H, m), 7.90 (1H, s), 13.09 (1H, s), 15.08 (1H, brs)..
MS: m/z = 357 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.07 (3H, s), 3.14 (2H, m), 3.49 (1H, d, J = 13.3 Hz), 4.08 (1H, dd, J = 13.7, 4.0 Hz), 4.99 (1H, m), 7.13-7.31 (5H, m), 8.18 (1H, s), 12.95 (1H, s), 15.06 (1H, brs).
MS: m/z = 329 [M+H]+.
化合物12H (460 mg, 0.930 mmol) をTHF (2.5 ml) とメタノール (2.5 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (2.33 ml, 4.65 mmol) を加えてそのまま1.5時間攪拌した。1規定塩酸を加えてから酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、無色固体として405 mg の化合物36Aを得た。
1H-NMR (CDCl3) δ: 3.45 (1H, ddd, J = 13.8, 6.9, 1.3 Hz), 3.80 (1H, dd, J = 13.5, 2.1 Hz), 4.35 (1H, d, J = 11.6 Hz), 4.77 (1H, d, J = 11.3 Hz), 5.46 (1H, d, J = 10.5 Hz), 5.52 (1H, d, J = 10.5 Hz), 6.11 (1H, d, J = 5.8 Hz), 6.94-6.98 (2H, m), 7.17 (3H, m), 7.31-7.46 (8H, m), 7.58 (3H, m).
第二工程
化合物36A (402 mg, 0.837 mmol) をジフェニルエーテル (5 ml) に加え、マイクロウェーブ照射下、245℃で1時間攪拌した。反応液をn-ヘキサンにあけ、析出した固体を濾取した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1, v/v) で精製し、無色固体として 164 mg の化合物36Bを得た。
1H-NMR (CDCl3) δ: 3.36 (1H, dd, J = 13.0, 7.0 Hz), 3.72 (1H, d, J = 11.1 Hz), 4.35 (1H, d, J = 11.4 Hz), 4.49 (1H, d, J = 10.2 Hz), 5.38 (1H, d, J = 10.5 Hz), 5.43 (1H, d, J = 10.4 Hz), 5.94 (1H, d, J = 7.2 Hz), 6.29 (1H, d, J = 6.6 Hz), 6.38 (1H, d, J = 7.5 Hz), 6.99 (2H, m), 7.17 (3H, m), 7.36 (8H, m), 7.60 (2H, m).
第三工程
化合物36B (40 mg, 0.092 mmol) をDMF (1 ml) に溶解し、炭酸セシウム (179 mg, 0.55 mmol)を加えた。室温で30分攪拌した後、ヨードメタン (0.029 ml, 0.46 mmol) を加えて室温で3.5時間攪拌した。反応液を水にあけ、酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色ガム状物質として44 mg の化合物36Cを得た。
第四工程
第三工程で得られた化合物36Cにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐エチルエーテルを加えて析出した固体を濾取し、無色固体として24 mg の化合物36を得た。
1H-NMR (DMSO-d6) δ: 2.93 (3H, s), 3.17 (1H, d, J = 13.0 Hz), 4.13 (1H, dd, J = 13.6, 3.4 Hz), 4.47 (1H, d, J = 11.4 Hz), 5.52 (1H, dd, J = 9.3, 3.4 Hz), 5.99 (1H, d, J = 7.3 Hz), 7.18 (4H, m), 7.30 (3H, m), 7.41 (2H, t, J = 7.5 Hz), 7.60 (2H, d, J = 7.2 Hz).
MS: m/z = 361 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.16 (2H, d, J = 13.3 Hz), 4.05 (1H, d, J = 10.5 Hz), 4.15 (1H, d, J = 11.7 Hz), 4.38 (1H, d, J = 14.9 Hz), 4.74 (1H, d, J = 14.5 Hz), 5.35 (1H, d, J = 11.4 Hz), 5.65 (1H, d, J = 7.3 Hz), 6.99 (1H, d, J = 7.5 Hz), 7.21 (15H, m).
MS: m/z = 437 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.57 (2H, m), 3.17 (3H, s), 3.21-3.31 (5H, m), 4.07 (1H, dd, J = 13.5, 3.7 Hz), 4.36 (1H, d, J = 11.6 Hz), 5.42 (1H, d, J = 9.2 Hz), 5.61 (1H, d, J = 7.3 Hz), 6.89 (1H, d, J = 7.5 Hz), 7.13-7.31 (6H, m), 7.40 (2H, t, J = 6.3 Hz), 7.57 (2H, d, J = 7.3 Hz), 12.31 (1H, brs).
MS: m/z = 419 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.12 (1H, dd, J = 13.6, 5.5 Hz), 3.87 (1H, d, J = 9.5 Hz), 4.44 (1H, d, J = 11.7 Hz), 5.45 (1H, d, J = 10.4 Hz), 5.83 (1H, d, J = 7.5 Hz), 7.04 (1H, d, J = 7.2 Hz), 7.14-7.31 (6H, m), 7.40 (2H, t, J = 7.5 Hz), 7.58 (2H, d, J = 7.5 Hz), 9.09 (1H, d, J = 5.2 Hz).
MS: m/z = 347 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.88-3.15 (2H, m), 3.27 (3H, s), 3.53-3.73 (5H, m), 3.99 (1H, dd, J = 13.27, 3.97 Hz), 4.56-4.60 (1H, m), 5.89 (1H, d, J = 7.32 Hz), 7.08-7.30 (6H, m).
参考例12に準じて合成された化合物41A (290 mg, 0.555 mmol) をジフェニルエーテル (5 ml) に加え、マイクロウェーブ照射下、245℃で1時間攪拌した。反応液をn-ヘキサンにあけ、析出した固体を濾取した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1→97:3, v/v) で精製し、無色固体として 86 mg の化合物41Bを得た。
1H-NMR (CDCl3) δ: 0.76 (3H, d, J = 6.7 Hz), 0.98 (3H, d, J = 6.9 Hz), 3.43-3.52 (2H, m), 3.62 (1H, dd, J = 13.6, 3.5 Hz), 4.22 (1H, d, J = 11.6 Hz), 4.52 (1H, d, J = 11.6 Hz), 4.86-4.95 (1H, m), 5.37 (1H, d, J = 10.2 Hz), 5.45 (1H, d, J = 10.2 Hz), 5.90 (1H, d, J = 7.5 Hz), 6.22 (1H, d, J = 7.5 Hz), 6.89 (2H, m), 7.15 (3H, m), 7.36 (8H, m), 7.67 (2H, m).
第二工程
第一工程で得られた化合物41Bにトリフルオロ酢酸 (2 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として45 mg の化合物41を得た。
1H-NMR (DMSO-d6) δ: 0.82 (3H, d, J = 6.7 Hz), 1.05 (3H, d, J = 6.7 Hz), 3.90 (1H, dd, J = 13.6, 3.4 Hz), 4.39 (1H, d, J = 11.9 Hz), 4.77-4.86 (1H, m), 5.50 (1H, d, J = 8.6 Hz), 5.69 (1H, d, J = 7.4 Hz), 6.92 (1H, d, J = 7.4 Hz), 7.15-7.48 (8H, m), 7.63 (2H, d, J = 7.7 Hz) 12.51 (1H, Brs).
MS: m/z = 389 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.12 (3H, s), 3.51 (5H, m), 4.05 (1H, dd, J = 13.9, 3.5 Hz), 4.37 (1H, d, J = 11.4 Hz), 5.38 (1H, d, J = 11.6 Hz), 5.60 (1H, d, J = 7.3 Hz), 6.90 (1H, d, J = 7.5 Hz), 7.22 (6H, m), 7.40 (2H, t, J = 7.5 Hz), 7.56 (2H, d, J = 7.2 Hz).
MS: m/z = 405 [M+H]+.
化合物43A (2.00 g, 6.11 mmol) とトリフェニルホスフィン (2.40 g, 9.16 mmol) とフタルイミド (1.08 g, 7.33 mmol) をTHF (20 ml) に加え、diethyl azodicarboxylate (2.2M in toluene, 4.16 ml, 9.16 mmol) を室温で滴下した。室温で3時間攪拌した後、溶媒を減圧留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色固体として 2.39 g の化合物43Bを得た。
1H-NMR (DMSO-d6) δ: 1.00 (9H, s), 3.30 (1H, m), 3.61 (1H, dd, J = 13.4, 10.2 Hz), 4.15 (1H, d, J = 12.2 Hz), 4.75 (1H, m), 6.79 (1H, d, J = 9.5 Hz), 7.25 (15H, m), 7.76-7.89 (4H, m).
第二工程
化合物43B (2.06 g, 4.51 mmol) をTHF (20 ml) とメタノール (20 ml) に加え、hydrazine hydrate (4.52 g, 90.2 mmol) を加えて60℃で5時間攪拌した。白色沈殿物をろ過して除き、メタノールで洗った。ろ液を減圧留去した後、得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1, v/v) で精製し、n-ヘキサンを加えて析出した固体を濾取し、無色固体として 1.25 g の化合物43Cを得た。
1H-NMR (CDCl3) δ: 1.32 (9H, s), 2.55 (1H, dd, J = 13.3, 6.0 Hz), 2.80 (1H, dd, J = 13.3, 3.5 Hz), 3.99 (1H, d, J = 10.1 Hz), 4.47 (2H, m), 7.13-7.33 (10H, m).
第三工程
dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (488 mg, 1.53 mmol) と43C (500 mg, 1.53 mmol) をトルエン (8 ml) に加え、110℃で1時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→96:4→94:6, v/v) で精製し、淡黄色ガム状物質として 667 mg の化合物43Dを得た。
1H-NMR (CDCl3) δ: 1.28 (9H, s), 3.63 (3H, s), 3.80 (1H, m), 3.87 (3H, s), 4.02 (1H, dd, J = 14.5, 10.1 Hz), 4.21 (1H, d, J = 10.4 Hz), 4.47 (2H, m), 5.20 (1H, d, J = 10.8 Hz), 5.26 (1H, d, J = 10.7 Hz), 7.30 (15H, m), 8.05 (1H, s).
MS: m/z = 627 [M+H]+.
第四工程
化合物43D (664 mg, 1.06 mmol) に4規定 HCl (酢酸エチル溶液, 10 ml) を加え、室温で1時間攪拌した。溶媒を減圧留去した後、THFと飽和重曹水を加えて2.5時間攪拌した。クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として458 mg の化合物43Eを得た。
1H-NMR (CDCl3) δ: 3.86 (3H, m), 3.92 (3H, s), 4.41-4.48 (1H, m), 5.32 (1H, d, J = 10.8 Hz), 5.42 (1H, d, J = 10.1 Hz), 5.92 (1H, s), 7.21-7.39 (13H, m), 7.59 (2H, m), 7.89 (1H, s).
MS: m/z = 495 [M+H]+.
第五工程
化合物43E (50 mg, 0.10 mmol) をDMF (1 ml) に溶解し、炭酸セシウム (165 mg, 0.51 mmol)を加えた。室温で30分攪拌した後、ヨードメタン (0.025 ml, 0.40 mmol) を加えて室温で1時間攪拌した。反応液を水にあけ、酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) で精製し、無色固体として60 mg の化合物43Fを得た。
1H-NMR (CDCl3) δ: 2.57 (3H, s), 3.75 (2H, d, J = 11.3 Hz), 3.93 (3H, s), 4.20-4.29 (2H, m), 5.25 (1H, d, J = 9.9 Hz), 5.57 (1H, d, J = 9.9 Hz), 7.15-7.41 (13H, m), 7.63 (1H, s), 7.72-7.76 (2H, m).
第六工程
第五工程で得られた化合物43FをTHF (0.5 ml) とメタノール (0.5 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (0.25 ml, 0.50 mmol) を加えてそのまま1時間攪拌した。1規定塩酸を加えてから酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、無色ガム状の化合物43Gを得た。
第七工程
第六工程で得られた化合物43Gにトリフルオロ酢酸 (2 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを3に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム-エチルエーテルを加えて析出した固体を濾取し、無色固体として27 mg の化合物43を得た。
1H-NMR (DMSO-d6) δ: 2.53 (3H, s), 4.26 (1H, d, J = 10.9 Hz), 4.35 (1H, d, J = 13.3 Hz), 4.58 (1H, dd, J = 13.8, 3.5 Hz), 5.06 (1H, d, J = 10.9 Hz), 7.36 (10H,m), 8.36 (1H, s), 12.58 (1H, s), 15.62 (1H, s).
MS: m/z = 405 [M+H]+.
1H-NMR (DMSO-d6) δ: 4.19 (2H, m), 4.42 (1H, dd, J = 13.3, 3.8 Hz), 4.90 (1H, d, J = 9.2 Hz), 7.17-7.41 (10H, m), 8.40 (1H, s), 9.66 (1H, s), 12.70 (1H, s), 15.60 (1H, s).
MS: m/z = 391 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.17-2.26 (1H, m), 3.22 (3H, s), 3.39 (2H, m), 3.58-3.67 (1H, m), 4.19 (1H, d, J = 10.7 Hz), 4.38 (2H, m), 4.95 (1H, d, J = 10.8 Hz), 7.20-7.44 (10H, m), 8.28 (1H, s), 12.40 (1H, s), 15.60 (1H, s).
MS: m/z = 449 [M+H]+.
参考例35で得られた化合物43E (289 mg, 0.584 mmol) をTHF (3 ml) とメタノール (3 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (1.46 ml, 2.92 mmol) を加えてそのまま1.5時間攪拌した。1規定塩酸を加えてから酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、無色固体として342 mg の化合物46Aを得た。
1H-NMR (CDCl3) δ: 3.72-4.04 (3H, m), 4.46 (1H, m), 5.39 (1H, d, J = 10.4 Hz), 5.44 (1H, d, J = 10.4 Hz), 6.04 (1H, brs), 7.19-7.60 (15H, m), 8.10 (1H, s).
第二工程
化合物46A (402 mg, 0.837 mmol) をジフェニルエーテル (5 ml) に加え、マイクロウェーブ照射下、245℃で1時間攪拌した。反応液をn-ヘキサンにあけ、析出した固体を濾取した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5→92:8, v/v) で精製し、無色固体として 85 mg の化合物46Bを得た。
1H-NMR (CDCl3) δ: 3.86 (3H,m), 4.45 (1H, m), 5.35 (1H, d, J = 10.5 Hz), 5.41 (1H, d, J = 10.4 Hz), 5.94 (1H, brs), 6.48 (1H, d, J = 7.4 Hz), 7.00 (1H, d, J = 7.4 Hz), 7.25-7.44 (13H, m), 7.62 (2H, m).
第三工程
化合物46B (39 mg, 0.089 mmol) をDMF (1 ml) に溶解し、炭酸セシウム (145 mg, 0.445 mmol)を加えた。室温で30分攪拌した後、1-bromo-2-methoxyethane (0.033 ml, 0.36 mmol) を加えて室温で3.5時間攪拌した。反応液を水にあけ、酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5→92:8, v/v) で精製し、無色ガム状物質として66 mg の化合物46Cを得た。
第四工程
第三工程で得られた化合物46Cにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン‐エチルエーテルを加えて析出した固体を濾取し、無色固体として21 mg の化合物46を得た。
1H-NMR (DMSO-d6) δ: 2.12-2.21 (1H, m), 3.20 (3H, s), 3.55-3.64 (3H, m), 3.81 (1H, d, J = 13.0 Hz), 3.99 (1H, d, J = 11.0 Hz), 4.22 (1H, dd, J = 13.3, 3.1 Hz), 4.86 (1H, d, J = 11.0 Hz), 6.11 (1H, d, J = 7.2 Hz), 7.18-7.45 (11H, m).
MS: m/z = 405 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.70 (1H, d, J = 12.2 Hz), 4.02 (1H, d, J = 10.7 Hz), 4.17 (1H, dd, J = 13.2, 3.6 Hz), 4.79 (1H, t, J = 3.4 Hz), 6.11 (1H, d, J = 7.3 Hz), 7.18-7.44 (11H, m), 9.23 (1H, d, J = 4.3 Hz).
MS: m/z = 347 [M+H]+.
化合物41A (400 mg, 0.743 mmol) をDMF (5 ml) に溶解し、トリエチルアミン (0.21 ml, 1.5 mmol) とethyl chloroformate (0.143 ml, 1.49 mmol) を0℃で加え、そのまま20分攪拌した。水素化ホウ素ナトリウム (70.2 mg, 1.86 mmol)を0℃で加え、室温で30分攪拌した。さらに水素化ホウ素ナトリウム (70.2 mg, 1.86 mmol)を0℃で加え、室温で2時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3, v/v) で精製し、化合物48Aとして無色固体 160 mgを得た。
1H-NMR (CDCl3) δ: 3.19 (3H, s), 3.37-3.54 (3H, m), 3.65-3.73 (1H, m), 3.87 (1H, m), 4.06 (2H, d, J = 13.9 Hz), 4.31 (1H, d, J = 11.2 Hz), 4.39 (1H, d, J = 13.8 Hz), 4.77 (1H, d, J = 11.2 Hz), 5.36 (1H, d, J = 10.1 Hz), 5.41 (1H, d, J = 10.1 Hz), 6.65 (1H, brs), 7.00 (2H, m), 7.19 (3H, m), 7.33-7.49 (8H, m), 7.70 (2H, m).
第二工程
化合物48A (50 mg, 0.095 mmol) にトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐エチルエーテルを加えて析出した固体を濾取し、無色固体として3.5 mg の化合物48を得た。
1H-NMR (DMSO-d6) δ: 3.12 (3H, s), 3.51 (5H, m), 3.71 (1H, d, J = 13.7 Hz), 4.02 (1H, d, J = 9.9 Hz), 4.09 (1H, d, J = 12.0 Hz), 4.36 (1H, d, J = 11.6 Hz), 4.73 (1H, brs), 5.45 (1H, d, J = 12.5 Hz), 7.00 (1H, s), 7.15 (5H, m), 7.28 (1H, t, J = 7.2 Hz), 7.40 (2H, t, J = 7.5 Hz), 7.59 (2H, d, J = 7.6 Hz).
MS: m/z = 435 [M+H]+.
Dess-Martin Periodinane (0.3M, 塩化メチレン溶液, 52.0 ml, 15.6 mmol) に化合物49A (2.97 g, 10.4 mmol) の塩化メチレン溶液 (20 ml) を0℃で滴下した。室温で3時間攪拌の後、1規定水酸化ナトリウム水溶液にあけ、エチルエーテルで抽出した。有機層を1規定水酸化ナトリウム水溶液と飽和食塩水で洗浄し、硫酸マグネシウムで乾燥した。溶媒を減圧留去した後、白色固体として化合物49Bを2.08 g得た。
1H-NMR (CDCl3) δ: 3.13 (2H, d, J = 6.6 Hz), 4.53 (1H, q, J = 6.7 Hz), 5.12 (2H, s), 5.28 (1H, brs), 7.26 (10H, m), 9.64 (1H, s).
第二工程
化合物49B (700 mg, 2.47 mmol) と2-aminoethanol (166 mg, 2.72 mmol) と硫酸ナトリウム (1.76 g, 12.4 mmol) をトルエン (20 ml) に加え、室温で1時間攪拌した。Boc2O (0.631 ml, 2.72 mmol) を室温で加え、そのまま18時間攪拌した。反応液をろ過し、ろ液を減圧濃縮した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色ガム状物質として49Cを893 mg得た。
第三工程
化合物49C (890 mg, 2.09 mmol) とパラジウム‐活性炭素 (10%, wet, 200 mg) をエタノール (20ml) に加え、水素雰囲気下、室温で2時間攪拌した。セライトろ過した後、溶媒を減圧濃縮して無色オイル状物質49Dを656 mg得た。
1H-NMR (CDCl3) δ: 1.40 (9H, s), 2.65-2.86 (2H, m), 3.32 (2H, m), 3.80 (2H, m), 4.03-4.12 (1H, m), 4.86 (1H, brs), 7.22 (5H, m).
第四工程
dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (610 mg, 2.09 mmol) と49D (664 mg, 2.09 mmol) をトルエン (6 ml) に加え、100℃で4時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、淡黄色ガム状物質として 884 mg の化合物49Eを得た。
MS: m/z = 593 [M+H]+.
第五工程
化合物49E (860 mg, 1.45 mmol) に4規定 HCl (酢酸エチル溶液, 10 ml) を加えた。室温で30分攪拌した後、溶媒を減圧留去した。続いてトルエン (10 ml) と2-aminoethanol (0.175 ml, 2.90 mmol) を加え、80℃で30分攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 99:1→95:5→90:10, v/v) で精製し、無色ガム状物質の化合物49F 157 mgと黄色固体の化合物49G 217 mgを得た。
49F :1H-NMR (CDCl3) δ: 2.48 (1H, dd, J = 14.0, 11.4 Hz), 3.22 (1H, dd, J = 14.1, 3.3 Hz), 3.69 (1H, m), 3.77 (3H, s), 3.83-3.95 (1H, m), 4.08 (1H, m), 4.29 (1H, m), 4.41 (1H, m), 5.34 (2H, m), 5.48 (1H, d, J = 10.1 Hz), 6.86 (2H, m), 7.20-7.39 (7H, m), 7.64 (2H, m)
49G: 1H-NMR (DMSO-d6) δ: 3.70 (2H, t, J = 5.3 Hz), 3.73 (3H, s), 3.86 (2H, t, J = 5.3 Hz), 4.14 (2H, s), 4.98 (1H, t, J = 5.0 Hz), 5.06 (2H, s), 6.98 (1H, s), 7.35 (8H, m), 7.62 (2H, d, J = 7.1 Hz), 8.34 (1H, d, J = 0.8 Hz).
第六工程
化合物49G (214 mg, 0.465 mmol) をTHF (4 ml) とエタノール (2 ml) と塩化メチレン (2 ml)に溶解し、室温で2規定水酸化ナトリウム水溶液 (1.16 ml, 2.32 mmol) を加えてそのまま2.5時間攪拌した。1規定塩酸を加えてからクロロホルムで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、黄色固体として158 mg の化合物49Hを得た。
1H-NMR (DMSO-d6) δ: 3.70 (2H, q, J = 5.2 Hz), 3.89 (2H, t, J = 5.3 Hz), 4.22 (2H, s), 4.97 (1H, t, J = 5.6 Hz), 5.12 (2H, s), 7.23-7.41 (9H, m), 7.60 (2H, m), 8.54 (1H, s).
第七工程
化合物49H (50.0 mg, 0.112 mmol) とパラジウム‐活性炭素 (10%, wet, 12 mg) をメタノール (1 ml) とDMF (3 ml) に加え、水素雰囲気下、室温で5時間攪拌した。セライトろ過した後、溶媒を減圧濃縮し、クロロホルム‐メタノール‐エチルエーテルを加えて析出した固体を濾取し、無色固体として9.0 mg の化合物49を得た。
1H-NMR (DMSO-d6) δ: 3.10 (2H, m), 3.51-3.69 (4H, m), 4.10 (1H, d, J = 10.7 Hz), 4.94 (2H, m), 7.11-7.26 (5H, m), 8.03 (1H, s), 12.94 (1H, brs), 15.30 (1H, brs).
MS: m/z = 359 [M+H]+.
化合物50A (1.00 g, 3.98 mmol) とトリフェニルホスフィン (1.15 g, 4.48 mmol) とN-methyl-2-nitrobenzenesulfonamide (860 mg, 3.98 mmol) をTHF (10 ml) に加え、diethyl azodicarboxylate (2.2M in toluene, 1.99 ml, 4.38 mmol) を室温で滴下した。室温で3時間攪拌した後、溶媒を減圧留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色ガム状物質として 710 mg の化合物50Bを得た。
第二工程
化合物50B (458 mg, 1.02 mmol) をアセトニトリルに溶解し、炭酸カリウム (422 mg, 3.06 mmol)とbenzenethiol (0.126 ml, 1.22 mmol) を加えて室温で5時間攪拌した。反応液を1規定水酸化ナトリウム水溶液にあけ、塩化メチレンで抽出し、硫酸ナトリウムで乾燥した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色オイル状物質として147 mgの化合物50Cを得た。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 2.40 (3H, s), 2.51-2.89 (4H, m), 3.90 (1H, s), 4.69 (1H, s), 7.17-7.31 (5H, m).
第三工程
化合物50C (140 mg, 0.530 mmol) と3-(benzyloxy)-4-oxo-4H-pyran-2-carboxylic acid (WO2006/116764, 119mg, 0.482 mmol) をTHF (3 ml) に加え、1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (111 mg, 0.578 mmol) と1-hydroxybenzotriazole (65.1 mg, 0.482 mmol) を加えて室温で18時間攪拌した。反応液を重曹水にあけ、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3, v/v) で精製し、無色固体として 219 mg の化合物50Dを得た。
MS: m/z = 493 [M+H]+.
第四工程
化合物50D (216 mg, 0.439 mmol) に4規定 HCl (酢酸エチル溶液, 3 ml) を加えた。室温で1時間攪拌した後、溶媒を減圧留去した。続いてエタノール (4 ml) と飽和炭酸ナトリウム水溶液 (3 mll) を加え、60℃で2時間攪拌した。水を加え、酢酸エチルで抽出した後、硫酸ナトリウムで乾燥した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、淡黄色ガム状物質の化合物50E 108 mgを得た。
1H-NMR (CDCl3) δ: 3.00 (2H, m), 3.13 (3H, s), 3.18 (1H, m), 3.88 (1H, dd, J = 13.5, 3.4 Hz), 4.00-4.07 (1H, m), 5.26 (1H, d, J = 10.2 Hz), 5.46 (1H, d, J = 10.1 Hz), 6.25 (1H, d, J = 7.5 Hz), 6.73 (1H, d, J = 7.5 Hz), 6.99-7.02 (2H, m), 7.28-7.37 (6H, m), 7.63-7.67 (2H, m).
第五工程
化合物50E (105 mg, 0.280 mmol) にトリフルオロ酢酸 (2 ml) を加えて、室温で30分攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン‐メタノール‐エチルエーテルを加えて析出した固体を濾取し、無色固体として29 mg の化合物50を得た。
1H-NMR (DMSO-d6) δ: 2.99 (3H, s), 3.26-3.47 (3H, m), 4.07 (1H, d, J = 11.1 Hz), 4.80 (1H, m), 6.43 (1H, d, J = 6.9 Hz), 7.11-7.29 (5H, m), 7.50 (1H, d, J = 6.9 Hz).
MS: m/z = 285 [M+H]+.
化合物1D(60 mg, 0.11 mmol)をトリフルオロ酢酸(1 ml)に溶解し、室温下1時間攪拌した。反応液を留去して得られた残渣をLC/MSにより精製し、化合物51 (43 mg, 0.09 mmol)を得た。
1H-NMR (DMSO-d6) δ: 1.17 (3H, t, J = 6.9Hz), 3.11 (3H, s), 3.48-3.58 (2H, m), 3.95-4.12 (3H, m), 4.40 (1H, d, J = 11.4Hz), 5.59 (1H, d, J = 11.4Hz), 7.11 (1H, d, J = 7.3Hz), 7.17 (2H, t, J = 7.2Hz), 7.26 (2H, d, J = 7.1Hz), 7.30 (1H, t, J = 7.3Hz), 7.42 (2H, t, J = 7.2Hz), 7.60 (3H, m), 12.55 (1H, brs).
MS: m/z = 477.2 [M+H]+.
化合物1I (2.0 g, 4.32 mmol) のDMF (10 ml) 溶液に、室温下、WSC HCl (1.24 g, 6.49 mmol) とHOBt (876.9 mg, 6.49 mmol) を加え、同室度で1時間撹拌した。反応液にO,N-ジメチルヒドロキシルアミン塩酸塩 (842.7 mg, 8.64 mmol) と、トリエチルアミン (2.19 g, 21.6 mmol) を加え、同温度で3時間撹拌後、水を加え、酢酸エチルで3回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに n-ヘキサン-酢酸エチル (7:3, v/v)で溶出し、次いで酢酸エチルのみで溶出した。目的の画分を濃縮すると油状物として543 mg (収率 25%) の化合物52Aを得た。
MS: m/z = 506 [M+H] +.
第二工程
化合物52A (543 mg, 1.07 mmol) のTHF (5 ml) 溶液を-78℃に冷却し、メチルマグネシウムブロミド 0.97M THF溶液 (1.66 ml, 1.61 mmol) を加え、-20℃まで2時間かけて昇温した。反応液に1規定塩酸を加え、酢酸エチルで3回抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに n-ヘキサン-酢酸エチル (7:3, v/v)で溶出し、次いで酢酸エチルのみで溶出した。目的の画分を濃縮すると油状物として256.8 mg (収率 52%) の化合物52Bを得た。
1H-NMR (CDCl3) δ: 2.65 (3H, s), 3.08 (2H, d, J = 7.5 Hz), 3.12 (3H, s), 3.53-3.68 (4H, m), 3.79-3.95 (1H, m), 3.92 (1H, dd, J = 3.3 Hz, 13.5 Hz), 4.10-4.16 (1H, m), 5.30 (1H, d, J = 10.2 hz), 5.45 (1H, d, J = 10.2 Hz), 6.99-7.02 (2H, m), 7.25-7.38 (6H, m), 7.49 (1H, s), 7.63-7.66 (2H, m).
第三工程
化合物52B (256 mg, 0.558 mmol) のジクロロメタン (4 ml) 溶液に、氷冷下、mCPBA (144.3 mg, 0.836 mmol) を加え、室温で2時間撹拌した。反応液にチオ硫酸ナトリウム水溶液を加え、酢酸エチルで3回抽出した。抽出液を飽和重曹水で2回洗浄し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をエタノール (4 ml) に溶解し、2N-水酸化ナトリウム水溶液(1 mL)を加え、1時間還流した。溶媒を留去後、析出した固体をジイソプロピルエーテルで洗浄し、242 mg (収率 100%) の化合物52Cを得た。
1H-NMR (CDCl3) δ: 3.09 (2H, d, J = 6.9 Hz), 3.32 (3H, s), 3.54 (1H, d, J = 14.1 Hz), 3.59-3.71 (2H, m), 3.76-3.85 (1H, m), 3.92 (1H, dd, J = 3.6 Hz, 13.5 Hz), 4.03 (1H, brt), 5.28 (1H, d, J = 10.2 Hz), 5.47 (1H, d, J = 10.2 Hz), 6.68 (1H, s), 7.00-7.04 (2H, m), 7.23-7.37 (6H, m), 7.64 (2H, d, J = 6.3 Hz).
第四工程
化合物52C (242 mg, 0.558 mmol) のTHF (3 ml) 溶液に10% Pd-C (50 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣にジイソプロピルエーテルを加えて析出した固体を濾取し、60 mg (収率 31%) の化合物52を得た。
1H-NMR (CDCl3) δ: 3.05 (2H, brs), 3.36 (3H, s), 3.58 (1H, d, J = 12 Hz), 3.66-3.68 (2H, m), 3.74-3.75 (2H, m), 4.11-4.19 (2H, m), 6.80 (1H, brs), 6.90-7.04 (2H, m), 7.30 (3H, brs).
化合物1I (1.0 mg, 2.23 mmol) のDMF (10 ml) 溶液に、氷冷下、トリエチルアミン (677 mg, 6.69 mmol) とクロロ炭酸エチル (729 mg, 6.69 mmol) を加え、室温で10分間撹拌した。反応液にメタンスルホンアミド (1.06 g, 11.15 mmol) と、DMAP (272.4 mg, 2.23 mmol) を加え、80℃で2時間加熱撹拌した。反応液に、水を加え、酢酸エチルで3回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに クロロホルムのみで溶出し、次いでクロロホルム‐MeOH (9:1, v/v)で溶出した。目的の画分を濃縮すると油状物として535 mg (収率 46%) の化合物53Aを得た。
MS: m/z = 463 [M+H] +.
第二工程
化合物53A (535 mg, 0.991 mmol) のTHF (5 ml) 溶液に10% Pd-C (218 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣にジイソプロピルエーテルを加えて析出した固体を濾取し、235 mg (収率 53%) の化合物53を得た。
1H-NMR (DMSO-d6) δ: 2.99-3.17 (2H, m), 3.27 (3H, s), 3.33 (3H, s), 3.53-3.76 (5H, m), 4.06 (1H, dd, J = 3.6 Hz, 13.8 Hz), 4.98 (1H, brs), 7.14 (2H, d, J = 6.6 Hz), 7.19-7.30 (3H, m), 8.07 (1H, s), 12.84 (1H, s), 13.24 (1H, s).
化合物1I (1.0 mg, 2.23 mmol) のDMF (10 ml) 溶液に、氷冷下、トリエチルアミン (677 mg, 6.69 mmol) とクロロ炭酸エチル (729 mg, 6.69 mmol) を加え、同温度で10分間撹拌した。反応液を、氷冷した水素化ホウ素ナトリウム (441 mg, 11.7 mmol) 水 (5 ml) 溶液に滴下し、同温度で2時間撹拌した。反応液に2規定塩酸を加え反応を停止し、2規定水酸化ナトリウム水溶液で中和後、酢酸エチルで3回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた粗生成物をジクロロメタン (5 ml) に溶解させた。
上記ジクロロメタン溶液に二酸化マンガン (2.1 g, 24.15 mmol) を加え、室温で6時間撹拌した。反応液をろ過し、溶媒を留去後、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-MeOH (9:1, v/v)で溶出し、目的の画分を濃縮すると188 mg (収率 19%) の化合物54Aを得た。
MS: m/z = 447 [M+H] +.
第二工程
化合物54A (188 mg, 0.422 mmol) をTHF (6 ml) に溶解し、室温下、28% アンモニア水とヨウ素 (117.7 mg, 0.464 mmol) を加え、同温度で2時間撹拌した。反応液にチオ硫酸ナトリウム水溶液を加え、酢酸エチルで3回抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-MeOH (9:1, v/v)で溶出し、目的の画分を濃縮すると54.7 mg (収率 29%) の化合物54Bを得た。
1H-NMR (CDCl3) δ: 3.05 (2H, d, J = 7.5 Hz), 3.33 (3H, s), 3.56-3.79 (5H, m), 3.99 (1H, dd, J = 3.6 Hz, 13.8 Hz), 4.08 (1H, brt), 5.33 (1H, d, J = 10.2 Hz), 5.46 (1H, d, J = 10.2 Hz), 6.83 (1H, s), 6.93-6.97 (2H, m), 7.25-7.37 (5H, m), 7.58-7.62 (2H, m).
第三工程
化合物54B (216 mg, 0.487 mmol) のトルエン (2 ml) 溶液に、アジ化ナトリウム (95 mg, 1.46 mmol) と、トリエチルアミン (201 mg, 1.46 mmol) を加え、室温で6時間撹拌した。反応液を2規定水酸化ナトリウム水溶液で2回抽出し、抽出液を2規定塩酸で中和し、酢酸エチルで3回抽出した。有機層を硫酸ナトリウムで乾燥後、溶媒を留去すると、65 mg (収率 27%) の化合物54Cを得た。
1H-NMR (CDCl3) δ: 3.08-3.21 (2H, m), 3.33 (3H, s), 3.55-3.70 (4H, m), 3.81-3.90 (1H, m), 3.96-4,01 (1H, m), 4.51 (1H, brt), 5.31 (1H, d, J = 10.2 Hz), 5.42 (1H, d, J = 10.2 Hz), 7.03-7.05 (2H, m), 7.18-7.37 (6H, m), 7.58-7.61 (2H, m), 8.33 (1H, s).
第四工程
化合物54C (500 mg, 1.03 mmol) のTHF (2 ml)-MeOH (2 ml) 溶液に10% Pd-C (100 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣をジクロロメタン (10 ml) に溶解させ、2規定水酸化ナトリウム水溶液で2回抽出した。抽出液を2規定塩酸で中和後、酢酸エチルで3回抽出した。有機層を硫酸ナトリウムで乾燥し、溶媒を留去して得られた固体をジイソプロピルエーテルで洗浄し、濾取して、55 mg (収率 14%) の化合物54を得た。
1H-NMR (DMSO-d6) δ: 3.01-3.19 (2H, m), 3.28 (3H, s), 3.51-3.79 (5H, m), 4.09 (1H, dd, J = 3.9 Hz, 13.5 Hz), 4.95 (1H, brs), 7.13-7.26 (5H, m), 8.20 (1H, s), 12.23 (1H, s).
化合物1I (500 mg, 1.08 mmol) のTHF (5 ml) 溶液に、室温下、トリメチルシリルジアゾメタン2Mへキサン溶液 (1ml, 2.0 mmol) を加え、50℃に加熱撹拌した。溶媒を留去後、得られた
油状物をシリカゲルクロマトグラフィーに付し、精製した。n-ヘキサン-酢酸エチル (1:1, v/v)で溶出し、目的の画分を濃縮すると115 mg (収率 22%) の化合物55Aを得た。
1H-NMR (CDCl3) δ: 3.06 (2H, d, J = 7.5 Hz), 3.31 (3H, s), 3.51-3.72 (5H, m), 3.81 (3H, s), 3.98 (1H, dd, J = 3.6 Hz), 13.5 Hz), 4.11 (1H, brt), 5.22 (1H, d, J = 9.6 Hz), 5.46 (1H, d, J = 9.6 Hz), 6.99-7.02 (2H, m), 7.26-7.37 (6H, m), 7.46 (1H, s), 7.65-7.69 (2H, m).
第二工程
化合物55A (210 mg, 0.441 mmol) をTHF (2 ml) に溶解し、10% Pd-C (85.7 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣をジイソプロピルエーテルエーテルで洗浄し、50 mg (収率 23%) の化合物55を得た。
1H-NMR (CDCl3) δ: 1.55 (2H, d, J = 7.5 Hz), 3.37 (3H, s), 3.59-3.84 (5H, m), 4.23-4.32 (2H, m), 7.00 (2H, dd, J = 1.5 Hz, 6.9 Hz), 7.23-7.32 (3H, m), 7.39 (1H, s), 12.31 (1H, brs).
化合物2D (424 mg, 0.787 mmol) のDMF (5 mL) 溶液を氷冷し、トリエチルアミン (327 ul, 2.36 mmol) 続いてクロロギ酸エチル (150 ul, 1.57 mmol) を加えた。反応液を室温で10分間撹拌後、再び氷冷し、アジ化ナトリウム (154 mg, 2.36 moml) を加え、1時間攪拌した。反応液にジクロロメタン、水および少量のメタノールを加え、ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を濃縮し、得られた残渣にメタノール (8 ml) を加え、50℃で3 時間攪拌後、溶媒を留去した。得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに n-ヘキサン-酢酸エチル (1:1, v/v) で溶出し、次いで酢酸エチルのみで溶出した。目的の画分を濃縮すると白色固体として 160 mg の化合物56Aを得た。
1H-NMR (CDCl3) δ: 3.08-3.18 (4H, m), 3.35-3.49 (3H, m), 3.68 (3H, s), 3.98 (2H, dt, J = 23.1, 5.6 Hz), 4.32 (1H, d, J = 11.3 Hz), 4.59 (1H, d, J = 11.3 Hz), 5.37 (2H, dd, J = 12.0, 10.4 Hz), 6.98-7.70 (15H, m).
MS: m/z = 568.25 [M+H] +.
第二工程
化合物56A (160 mg, 0.102 mmol) を EtOH (10 mL) に溶解し、2N 水酸化ナトリウム水溶液 (14 ml) を加え、60℃で2時間攪拌した。反応液を減圧下に濃縮後、残留物をジクロロメタン-水に分配した。ジクロロメタン層を分離し、水層をジクロロメタンで3回抽出した。溶媒を留去し、化合物56Bを得た。
1H- NMR (CDCl3) δ: 2.97-3.06 (1H, m), 3.15 (3H, s), 3.38-3.44 (3H, m), 3.71 (2H, s), 3.93-3.99 (2H, m), 4.35 (2H, dd, J = 19.3, 11.1 Hz), 5.37 (2H, dd, J = 31.6, 10.1 Hz), 6.04 (1H, s), 6.98 (2H, dd, J = 6.4, 2.9 Hz), 7.17 (4H, t, J = 3.3 Hz), 7.28-7.69 (12H, m).
MS: m/z = 509.23 [M+H] +.
第三工程
化合物56B (56 mg, 0.11 mmol) を TFA (3 mL) に溶解し、室温で1時間攪拌した。反応混合物をトルエン共沸し、得られた残渣をLCMS分取装置を用いて精製した。 溶出溶媒を留去し、残渣にイソプロピルエーテルを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 7 mgの化合物56を得た。
MS: m/z = 420.07 [M+H]+.
化合物56B (25 mg, 0.049 mmol) の THF (1 mL) 溶液に氷冷下、トリエチルアミン (20 uL, 0.15 mmol) 続いて無水酢酸 (7.0 ul, 0.074 mmol)を加え、 室温で15 分間撹拌した。次いで 4-fluorobenzyl amine (330 mg, 1.75 mmol) を加え、7時間撹拌した。さらに、トリエチルアミン (20 uL, 0.15 mmol) 続いて無水酢酸 (7.0 ul, 0.074 mmol)を加え、終夜攪拌した。反応液に水、酢酸エチル、brineを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、ろ過、濃縮し、白色固体として18 mg の化合物57Aを得た。
1H-NMR (CDCl3) δ: 2.05 (3H, s), 3.09-3.14 (4H, m), 3.41-3.45 (3H, m), 3.95-4.02 (2H, m), 4.31 (1H, d, J = 11.4 Hz), 4.59 (1H, d, J = 12.4 Hz), 5.36 (2H, s), 7.00 (2H, d, J = 4.0 Hz), 7.11-7.16 (3H, m), 7.36 (7H, tt, J = 14.5, 5.1 Hz), 7.62 (2H, t, J = 7.3 Hz), 8.02 (1H, s), 8.18 (1H, s).
MS: m/z = 552.20 [M+H]+.
第二工程
化合物57A (21 mg, 0.038 mmol) を TFA (3 mL) に溶解し、室温で3.5時間攪拌した。反応混合物をトルエン共沸し、得られた残渣にイソプロピルエーテルを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 10 mgの化合物57を得た。
1H-NMR (CDCl3) δ: 2.12 (3H, s), 3.20 (3H, s), 3.39-3.60 (4H, m), 3.76-3.86 (1H, m), 4.08 (1H, dd, J = 13.7, 3.7 Hz), 4.31 (1H, d, J = 11.5 Hz), 4.68 (1H, dd, J = 8.5, 4.3 Hz), 6.96-7.19 (4H, m), 7.30-7.44 (6H, m), 8.11 (1H, s).
MS: m/z =462.20 [M+H]+.
1H-NMR (CDCl3) δ: 3.20 (3H, s), 3.41-3.54 (3H, m), 3.60-3.68 (2H, m), 3.73-3.85 (1H, m), 4.12 (1H, dt, J = 14.0, 3.5 Hz), 4.31 (1H, d, J = 11.4 Hz), 4.68 (1H, dd, J = 11.4, 2.6 Hz), 6.95-7.21 (5H, m), 7.39 (5H, dt, J = 26.9, 7.6 Hz), 7.94 (1H, s), 8.88 (1H, s).
MS: m/z =516.10 [M+H]+.
1H-NMR (CDCl3) δ: 3.21 (3H, s), 3.43-3.63 (4H, m), 3.82 (1H, d, J = 14.0 Hz), 4.12 (1H, dd, J = 8.3, 4.2 Hz), 4.35 (1H, d, J = 11.2 Hz), 4.74 (1H, d, J = 8.3 Hz), 6.90-7.18 (5H, m), 7.34-7.60 (8H, m), 7.82 (2H, d, J = 6.8 Hz), 8.34 (1H, s), 8.89 (1H, s).
MS: m/z =523.21 [M+H]+.
1H-NMR (CDCl3) δ: 2.37 (6H, s), 3.18 (3H, s), 3.29-3.66 (4H, m), 3.82 (1H, d, J = 12.5 Hz), 4.06-4.15 (1H, m), 4.31 (1H, d, J = 11.7 Hz), 4.54 (1H, d, J = 8.1 Hz), 5.97 (1H, s), 7.01 (2H, dd, J = 6.4, 2.8 Hz), 7.17 (3H, t, J = 2.9 Hz), 7.32-7.45 (6H, m).
MS: m/z = 448.15 [M+H]+.
化合物56B (50 mg, 0.098 mmol) をTHF (1 mL) に溶解し、Boc2O (0.068 mL, 0.29 mmol) 続いて DMAP (6.0 mg, 0.049 mmol) を加え、室温で5時間攪拌した。反応液に水、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、ろ過、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、無色透明オイルとして20 mg の化合物61Aを得た。
MS: m/z = 610.50 [M+H]+.
第二工程
化合物61A (20mg, 0.033 mmol) を DMF (1 mL) に溶解し、氷冷下、水素化ナトリウム (2.6 mg, 0.066 mmol) を加え、10分間攪拌した後、ヨウ化メチル (4.1 uL, 0.066 mmol) を加え、室温で1.5時間攪拌した。氷水、酢酸エチル、brineを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、ろ過、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、白色固体として13 mg の化合物61Bを得た。
MS: m/z = 624.25 [M+H]+.
第三工程
化合物61B (13 mg, 0.021 mmol) を TFA (3 mL) に溶解し、室温で3時間攪拌した。反応混合物をトルエン共沸し、得られた残渣をLCMS分取装置を用いて精製した。 溶出溶媒を留去し、残渣にイソプロピルエーテル-ヘキサンを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 7.5 mgの化合物61を得た。
1H-NMR (CDCl3) δ: 2.19 (3H, s), 3.26 (3H, s), 3.46-3.70 (4H, m), 4.23 (1H, d, J = 11.0 Hz), 4.58-4.60 (1H, br m), 5.41-5.44 (1H, br m), 6.28 (1H, br s), 6.99 (2H, br s), 7.13 (3H, br s), 7.31-7.46 (6H, m).
MS: m/z = 434.10 [M+H]+.
化合物2D (112 mg, 0.208 mmol) をDMF (2 mL) に溶解し、氷冷下、トリエチルアミン (0.144 ml, 1.04 mmol) 続いてクロロギ酸エチル (0.040 mL, 0.42 mmol)を加え、室温で10分攪拌した後、N,O-ジメチルヒドロキシアミン塩酸塩 (41 mg, 0.42 mmol)続いてDMAP (3 mg, 0.02 mmol)を加え、室温で1時間攪拌した。反応液に水、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、ろ過、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、黄色オイルとして127 mgの粗精製物62Aを得た。
MS: m/z = 582.20 [M+H]+.
第二工程
化合物62A (137 mg, 0.236 mmol) をTHF (8 mL) に溶解し、窒素気流下、-78℃でメチルマグネシウムブロミドの 2M THF溶液 (0.444 ml, 0.471 mmol)を加え、-50℃まで昇温しながら30分攪拌した。反応液に1M 塩酸 (4 ml) を加え、0℃で20分攪拌した後、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液を飽和炭酸水素ナトリウム水溶液で中和し、有機層に硫酸ナトリウムを加え、ろ過、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、黄色オイルとして67 mg の化合物62Bを得た。
1H-NMR (CDCl3) δ: 2.55 (3H, s), 3.01-3.14 (1H, m), 3.16 (3H, s), 3.37-3.54 (3H, m), 3.91-4.07 (2H, m), 4.28 (1H, d, J = 11.3 Hz), 4.50-4.60 (1H, m), 5.42 (2H, d, J = 1.2 Hz), 6.97-6.99 (2H, m), 7.14-7.17 (4H, m), 7.31-7.45 (8H, m), 7.65 (2H, d, J = 6.5 Hz).
MS: m/z = 537.20 [M+H]+.
第三工程
化合物62B (67 mg, 0.13 mmol) をジクロロメタン (4 mL) に溶解し、窒素気流下、0℃でmCPBA (32 mg, 0.19 mmol)を加え、室温で3時間攪拌した。反応液を氷冷し、チオ硫酸ナトリウム水溶液、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液を飽和炭酸水素ナトリウム水溶液で中和し、有機層に硫酸ナトリウムを加え、ろ過、溶媒を留去することにより、64 mg の化合物62Cを得た。
MS: m/z = 553.23 [M+H]+.
第四工程
化合物62C (64 mg, 0.12 mmol) をエタノール (8 mL) に溶解し、4時間加熱還流した。反応液を濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、42 mg の化合物62Dを得た。
1H-NMR (CDCl3) δ: 2.93-3.09 (1H, m), 3.16 (3H, s), 3.33-3.53 (4H, m), 3.90-4.07 (2H, m), 4.29-4.47 (2H, m), 5.41 (2H, q, J = 10.4 Hz), 6.34 (1H, s), 6.95-6.99 (2H, m), 7.12-7.21 (4H, m), 7.33-7.42 (8H, m), 7.64 (2H, d, J = 6.9 Hz).
MS: m/z = 511.21 [M+H]+.
第五工程
化合物62D (41 mg, 0.080 mmol) をDMF (1 mL) に溶解し、氷冷下、水素化ナトリウム (6.4 mg, 0.16 mmol)を加え、10分攪拌した後、ヨウ化メチル (0.010 ml, 0.16 mmol) を加え、室温で1.5時間攪拌した。反応液に氷水、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、ろ過、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、白色固体として41 mg の化合物62Eを得た。
1H-NMR (CDCl3) δ: 2.99-3.09 (1H, m), 3.16 (3H, s), 3.25 (3H, s), 3.32-3.38 (1H, m), 3.42-3.50 (2H, m), 3.94-4.03 (2H, m), 4.28 (1H, d, J = 11.3 Hz), 4.43 (1H, br s), 5.40 (2H, dd, J = 28.3, 10.2 Hz), 6.01 (1H, s), 6.90-7.19 (5H, m), 7.28-7.44 (8H, m), 7.66 (2H, d, J = 6.4 Hz).
MS: m/z = 525.21 [M+H]+.
第六工程
化合物62E (40 mg, 0.076 mmol) を TFA (3 mL) に溶解し、室温で30分攪拌した。反応混合物をトルエン共沸し、得られた残渣をLCMS分取装置を用いて精製した。 溶出溶媒を留去し、残渣に酢酸エチル-イソプロピルエーテル-ヘキサンを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 桃色固体として7.1 mgの化合物62を得た。
1H-NMR (CDCl3) δ: 3.17 (3H, s), 3.22 (3H, s), 3.40-3.53 (4H, m), 3.63-3.71 (1H, m), 4.24 (1H, d, J = 11.5 Hz), 4.45 (1H, d, J = 13.3 Hz), 4.60 (1H, d, J = 11.2 Hz), 6.08 (1H, d, J = 11.7 Hz), 6.96-6.99 (2H, br m), 7.13-7.17 (3H, m), 7.30-7.43 (5H, m).
MS: m/z = 435.15 [M+H]+.
化合物2D (164 mg, 0.304 mmol) をジフェニルエーテル (1 mL) に溶解し、マイクロウェーブ装置を用いて、245℃で1時間攪拌した後、反応液をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、茶色固体として72 mgの化合物63Aを得た。
1H-NMR (CDCl3) δ: 2.92-3.01 (1H, m), 3.16 (3H, s), 3.32-3.50 (3H, m), 3.90-4.46 (4H, m), 5.42 (2H, dd, J = 26.1, 10.3 Hz), 5.94 (1H, d, J = 7.4 Hz), 6.28 (1H, d, J = 7.5 Hz), 6.96-6.99 (2H, m), 7.15-7.19 (3H, m), 7.28-7.44 (8H, m), 7.62-7.65 (2H, m).
MS: m/z = 495.21 [M+H]+.
第二工程
化合物63A (21 mg, 0.042 mmol) のジクロロメタン (4 mL) 溶液にNBS (11 mg, 0.062 mmol)を加え、1時間加熱還流した。反応液を放冷した後、シリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、白色固体として26 mg の化合物63Bを得た。
1H-NMR (CDCl3) δ: 3.01-3.09 (1H, m), 3.16 (3H, s), 3.35-3.53 (3H, m), 3.92-4.47 (4H, m), 5.41 (2H, dd, J = 32.6, 10.0 Hz), 6.72 (1H, s), 6.97-7.00 (2H, br m), 7.20-7.22 (3H, m), 7.30-7.46 (8H, m), 7.66-7.70 (2H, m).
MS: m/z = 573.20 [M+H]+.
第三工程
化合物63B (10 mg, 0.017 mmol) を TFA (3 mL) に溶解し、室温で50分攪拌した。反応混合物をトルエン共沸し、得られた残渣にイソプロピルエーテルを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 橙色固体として1.4 mgの化合物63を得た。
MS: m/z = 483.15 [M+H]+.
化合物63B (20 mg, 0.035 mmol) のDMF溶液 (2 mL) に、ピラゾール-4-ボロン酸ピナコールエステル (36 mg, 0.19 mmol) 続いて炭酸カリウム (29 mg, 0.21 mmol)を加えた後、窒素雰囲気下、テトラキストリフェニルホスフィンパラジウム (24 mg, 0.021 mmol) を加え、110℃で8.5時間攪拌した。反応液を濃縮した後、酢酸エチル、メタノールを加え、不溶物を除去した。ろ液を濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると、白色固体として18 mgの化合物64Aを得た。
MS: m/z = 561.30 [M+H]+.
第二工程
化合物64A (14 mg, 0.025 mmol) を TFA (2 mL) に溶解し、室温で30分攪拌した。反応混合物をトルエン共沸し、得られた残渣をLCMS分取装置を用いて精製した。 溶出溶媒を留去し、残渣にイソプロピルエーテルを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 橙色固体として1.1 mgの化合物64を得た。
MS: m/z = 471.20 [M+H]+.
化合物65A (WO2006/088173, 20.0 g, 69.6 mmol) のTHF (1.1 L) 溶液を水浴上で25℃に保ち、亜塩素酸ナトリウム (25.2 g, 278 mmol)、 アミド硫酸 (27.0 g, 278 mmol) の水 (378 mL) 溶液を、30分間かけて滴下した。反応液を同温度で1時間撹拌後、減圧濃縮した。残渣に、氷水 (100 mL)、 ジエチルエーテル (100 mL) を加え、析出した固体を濾過した。得られた粗精製物を、水およびジエチルエーテルで洗浄し、白色固体として 20.3 g の化合物65Bを得た。
1H-NMR (DMSO-d6) δ: 3.74 (3H, s), 5.11 (2H, s), 7.31-7.38 (3H,m), 7.48 (2H, d, J = 7.2 Hz), 8.11 (1H, s), 12.07(1H, brs).
第二工程
化合物65B (2.0 g, 6.59 mmol) を DMF (340 mL) に溶解し、HATU (2.76 g, 7.25 mmol)、メチルアミン (2 mol/L THF溶液, 3.63mL, 7.25mmol)、トリエチルアミン (9.89 mmol)を加えて室温で 5時間攪拌した。反応液を酢酸エチル-水に分配した。酢酸エチル層を分離し、水層を酢酸エチルで1回抽出した。合わせた抽出液を水、飽和食塩水で洗浄後、乾燥した。溶媒を留去し、白色固体として、1.66 gの化合物65Cの粗精製物を得た。
1H-NMR (DMSO-d6) δ: 3.38 (3H, brs), 3.75 (3H, s), 5.37 (2H, s), 7.34-7.44 (5H,m), 8.10 (1H, s), 8.38 (1H, s), 11.84(1H, brs).
第三工程
化合物65C (1.2g, 3.79 mmol) の DMF (20 mL) 溶液に、炭酸カリウム (1.04 g, 7.59 mmol)、O-(2,4-dinitrophenyl)hydroxylamine (831mg, 4.17 mmol)を加え、室温で3時間攪拌した。反応液に水を加え、析出した固体を濾取し、水で洗浄することにより、1.0 gの化合物 65Dの粗精製物を得た。
1H-NMR (DMSO-d6) δ: 3.74 (3H,s), 3.83 (3H, brs), 5.05 (2H, s), 6.46 (2H, brs), 7.31-7.38 (5H, m), 8.20 (1H, s), 8.52 (1H, brs).
第四工程
化合物65D (1.0 g, 3.02 mmol) の DMF (10 mL) 溶液に室温下、パラホルムアルデヒド (109 mg, 3.62 mmol)、酢酸 (0.017 ml, 0.302 mmol) を加え、 105℃で2時間撹拌した。反応液を0℃に冷却し、炭酸セシウム (3.44 g, 10.6 mmol) を加え、室温で1時間攪拌した。反応液に水を加え、酢酸エチル-水に分配した。有機層を飽和食塩水で洗浄、乾燥した。溶媒を留去し、120 mg の化合物65E を得た。
MS: m/z = 344 [M+H]+.
第五工程
化合物65E (17.0 mg, 0.05 mmol) の DMF (1 mL) 溶液に 炭酸セシウム (81.4 mg, 0.25 mmol) 、 メチルアミン (2 mol/L THF溶液, 0.125 ml, 0.25 mmol)を加え、室温で5 時間撹拌した。反応液を濾過し、濾液をLCMSで分取精製し、化合物65Fを得た。
MS: m/z = 358 [M+H]+.
第六工程
化合物65Fの DMF (0.5 mL) 溶液に、2N水酸化ナトリウム水溶液 (0.2 mL) を加え、室温で 2時間攪拌した。反応液にイオン交換樹脂DOWEX (50W-X8) を加え、濾過し、DMFで洗浄した。濾液を濃縮後、トリフルオロ酢酸 (0.5 mL) を加え、80℃で4時間攪拌した。反応液を濃縮後、水、クロロホルムを加えて有機層を分離した。有機層を濃縮後、LCMSで分取精製し、6.47 mg の化合物65を得た。
MS: m/z = 254 [M+H]+.
1H-NMR (CDCl3) δ: 3.34 (3H, s), 3.57-3.68 (2H, m), 3.73 (2H, br s), 4.18 (2H, s), 4.75 (2H, br s), 7.06-7.12 (2H, m), 7.21-7.24 (2H, m), 8.10 (1H, s), 11.96 (1H, br s), 14.52 (1H, brs).
化合物94A(WO2007/049675)を用い、参考例65第五工程と同様の手法により化合物94Bを合成した。
1H-NMR (CDCl3) δ: 3.00-3.09 (1H, m), 3.18 (3H, s), 3.44 (2H, dd, J = 7.55, 2.82 Hz), 4.02-4.08 (1H, m), 4.44-4.59 (3H, m), 4.86 (1H, d, J = 13.57 Hz), 5.25 (1H, s), 5.36 (2H, dd, J = 14.87, 9.99 Hz), 6.74-6.84 (2H, m), 7.09-7.60 (16H, m), 7.90 (1H, s), 10.07 (1H, t, J = 5.87 Hz).
第二工程
化合物94B (1.1 g, 1.655 mmol) のMeCN (20 ml) 溶液にDMAP (202 mg, 1.655 mmol)及びBoc2O (20 ml, 86 mmol)を窒素気流下室温で加え、5時間、加熱還流した。更に、Boc2O (20 ml, 86 mmol) を加え、5時間、加熱還流した。減圧濃縮後、その残渣に、エタノール(20.00 ml)及び 水酸化ナトリウ水溶液 (40%, 25 ml) を加え、5時間、室温で攪拌した。反応混合物に酢酸エチル-水を加え、水層を酸性とした。酢酸エチル(2 x 200 mL)で抽出後、有機層を飽和食塩水で洗浄した。硫酸マグネシウムで、乾燥後、溶媒を減圧留去した。粗生成物をシリカゲルカラムクロマトグラフィー(CHCl3/MeOH 20:1)により精製し、化合物94Cを得た。(750 mg、63%)
1H-NMR (DMSO-d6) δ: 3.13 (3H, s), 3.25-3.34 (3H, m), 3.79 (1H, d, J = 13.73 Hz), 4.42 (1H, d, J = 14.03 Hz), 5.11-5.27 (3H, m), 5.48 (1H, s), 7.18-7.21 (5H, m), 7.33-7.49 (6H, m), 7.56-7.58 (2H, m), 7.74 (2H, d, J = 7.32 Hz), 8.01 (1H, s).
第三工程
化合物94Cを用いて、参考例12第十工程と同様の手法により化合物94を合成した。
1H-NMR (DMSO-d6) δ: 3.13 (3H, s), 3.41-3.56 (4H, m), 4.50 (1H, d, J = 13.57 Hz), 5.21 (1H, d, J = 13.42 Hz), 5.58 (1H, s), 7.16-7.50 (8H, m), 7.72 (2H, d, J = 7.32 Hz), 7.93 (1H, s), 12.12 (1H, s).
化合物95A (WO2006/116764, 1g, 4.06 mmol) を28% アンモニア水に溶解させ、室温下、12時間撹拌した。反応液を濃縮後、得られた残渣を2規定塩酸で中和し、析出した固体を酢酸エチルに懸濁させ、濾取、乾燥すると、1.14 g (収率 100%)の化合物95B を得た。
1H-NMR (DMSO-d6) δ: 5.14 (2H, s), 7.31 (1H, d, J = 6.6 Hz), 7.34-7.41 (3H, m), 7.45-7.51 (2H, m), 8.17 (1H, d, J = 6.6 Hz).
第二工程
上記化合物95B (3.00 g, 10.65 mmol) のDMF (10 ml) 溶液に、室温下、WSC HCl (3.06 g, 15.98 mmol) と、HOBt (1.58 g, 11.7 mmol) を加え10分間撹拌し、メチルアミン 33wt.% エタノール溶液 (1.50 g, 15.98 mmol) を滴下した。反応液を同温度で2時間撹拌後、水を加え、クロロホルムで5回抽出した。抽出液を硫酸ナトリウムで乾燥し、溶媒を留去後、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-MeOH (6:4, v/v) で溶出する画分から固体として 2.62 g (収率 95%) の化合物95Cを得た。
1H-NMR (CDCl3) δ: 2.77 (3H, d, J = 4.8 Hz), 5.49 (2H, s), 6.57 (1H, d, J = 6.9 Hz), 7.25-7.43 (5H, m) ,7.48 (1H, t, J = 6.0 Hz), 8.23 (1H, brs), 9.77 (1H, brs).
第三工程
上記化合物95C (2.62 g, 10.14 mmol) のDMF (10 ml) 溶液に室温下、炭酸カリウム (4.20 g, 30.42 mmol)を懸濁させ5分間撹拌後、O-(2,4-dinitrophenyl)hydroxylamine (3.03 g, 15.21 mmol)を加え、同温度で3時間撹拌した。反応液に水を加え、クロロホルムで5回抽出し、抽出液を硫酸ナトリウムで乾燥した。溶媒を留去後、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-MeOH (6:4, v/v) で溶出する画分から固体として 1.41 g (収率 51%) の化合物95Dを得た。
1H-NMR (CDCl3) δ: 2.62 (3H, d, J = 5.1 Hz), 5.06 (2H, s), 5.22 (2H, s), 6.18 (1H, d, J = 7.8 Hz), 7.25-7.36 (5H, m), 5.89 (1H, d, J = 7.8 Hz), 7.57 (1H, q, J = 5.1 Hz).
第四工程
上記化合物95D (1.0 g, 3.66 mmol)のトルエン (10 ml) 溶液にパラホルムアルデヒド (109.9 mg, 3.66 mmol) と、酢酸 (22 mg, 0.37 mmol) を加え、100 ℃で40分間加熱撹拌した。冷却後、溶媒を留去し、残留物を精製することなくDMF (10 ml) に溶解し、氷冷下、炭酸セシウム (3.58 g, 10.98 mmol) を加え、10分間撹拌した。反応液へベンゾヒドリルブロミド (1.36 g, 5.49 mmol) を加え、室温下3時間撹拌後、水を加え酢酸エチルで3回抽出した。抽出液を3回水洗後、硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-MeOH (9:1, v/v) で溶出する画分から固体として 1.26 g (収率 71%) の化合物95Eを得た。
1H-NMR (CDCl3) δ: 2.91 (3H, s), 4.26 (1H, d, J = 13.2 Hz), 4.77 (1H, d, J = 13.2 Hz), 5.12 (1H, s), 5.42 ( 1H, J = 13.2 Hz), 5.45 (1H, d, J = 13.2 Hz), 5.82 (1H, J = 7.5 Hz), 6.71 (1H, d, J = 7.5 Hz), 7.10-7.23 (5H, m), 7.27-7.46 (6H, m), 7.52 (2H, d, J = 6.9 Hz), 7.60-7.64 (2H, m).
第五工程
上記化合物95E (100 mg, 0.221 mmol) をトリフルオロ酢酸 (2 ml) に溶解させ、室温下1時間撹拌した。溶媒を留去し、残渣をジクロロメタン(2 ml) に溶解させ、飽和重曹水で中和した。得られた溶液をクエン酸水溶液で酸性にして、有機層を分離した。水層をジクロロメタンで1回抽出し、合わせた有機層を水洗後、硫酸ナトリウムで乾燥した。溶媒を留去後、得られた固体をジイソプロピルエーテルで洗浄し、50 mg (収率63%) の化合物95を得た。
1H-NMR (CDCl3) δ: 2.95 (3H, s), 4.36 (1H, d, J = 13.2 Hz), 4.95 (1H, d, J = 13.2 Hz), 5.22 (1H, s), 5.71 (1H, d, J = 7.8 Hz), 6.75 (1H, d, J = 7.8 Hz), 7.21 (5H, br s), 7.33-7.47 (4H, m), 7.55 (2H, d, J = 6.6 Hz).
化合物95Dの合成法に準じて合成した化合物107A(3.0 g, 9.96 mmol) のDMF (30 ml) 溶液に、パラホルムアルデヒド (299 mg, 9.96 mmol)と、酢酸 (1 ml) を加え、120℃で4時間、加熱撹拌した。溶媒を留去後、残渣に酢酸エチル‐ジイソプロピルエーテルを加え析出した固体を濾取し、2.85 g (収率 91%) の化合物107Bを得た。
1H-NMR (CDCl3) δ: 1.19 (6H, J = 6.6 Hz), 4.34 (2H, J = 7.5 Hz), 4.72-4.86 (1H, m), 5.30 (2H, s), 5.49 (1H, t, J = 7.5 Hz), 6.36 (1H, d, J = 7.8 Hz), 7.26-7.35 (4H, m), 7.37 (1H, d, J = 7.8 Hz), 7.55-7.58 (2H, m).
第二工程
化合物107B (100 mg, 0.319 mmol) の酢酸 (2 ml) 溶液に室温下、96% 硫酸 (0.5 ml)と、bis(3-chlorophenyl)methanol (242.3 mg, 0.957 mmol) を加え、80℃で2時間撹拌した。反応液を室温まで冷却後、水を加え、酢酸エチルで3回抽出した。有機層を1回水洗後、硫酸ナトリウムで乾燥した。溶媒を留去後、残渣にジイソプロピルエーテルを加え、析出した固体を濾取し、42 mg (収率 29%)の化合物107を得た。
1H-NMR (CDCl3) δ: 0.953 (3H, d, J = 3.9 Hz), 1.12 (3H, d, J = 4.2 Hz), 4.51 (1H, 13.5 Hz), 4.83 (1H, d, J = 13.5 Hz), 4.83-4.92 (1H, m), 5.18 (1H, s), 5.74 (1H, d, J = 7.8 Hz), 6.73 (1H, d, J = 7.8 Hz), 6.90 (1H, d, J = 7.5 Hz), 7.12 (2H, dd, J = 7.2 Hz, 8.1 Hz), 7.19-7.22 (1H, m), 7.37-7.41 (3H, m), 7.55 (1H, s).
1H-NMR (CDCl3) δ: 3.16-3.28 (1H, m), 3.22 (3H, s), 3.46-3.50 (2H, m), 3.86 (1H, ddd, J = 3.6 Hz, 3.6 Hz, 14.4 Hz), 4.47 (1H, d, J = 13.2 Hz), 5.01 (1H, d, J = 13.2 Hz), 5.30 (1H, s), 5.76 (1H, d, J = 7.5 Hz), 6.72 (1H, d, J = 7.5 Hz), 6.90 (2H, t, J = 8.4 Hz), 7.06-7.18 (4H, m), 7.51 (2H, dd, J = 5.4 Hz, 8.7 Hz).
MS: m/z = 446 [M+H]+.
化合物95B (1.00 g, 3.55 mmol) とcyclopropanamine (0.492 ml, 7.10 mmol) をピリジン (20ml)に加え、1-hydroxybenzotriazole (544 mg, 3.55 mmol) と1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (1.36 g, 7.10 mmol) を順に加えて室温で18時間攪拌した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) 、続いてアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1, v/v) で精製し、無色固体として1.19 g の化合物126Aを得た。
1H-NMR (CDCl3) δ: 0.22 (1H, m), 0.70 (2H, m), 2.76-2.83 (1H, m), 5.50 (2H, s), 6.59 (1H, dd, J = 7.0, 1.9 Hz), 7.44 (5H, d, J = 0.7 Hz), 7.53 (1H, dd, J = 6.9, 6.2 Hz), 8.30 (1H, brs), 9.71 (1H, brs).
第二工程
化合物126A (1.19 g, 4.19 mmol) をDMF (15 ml) に溶解し、炭酸カリウム (2.90 g, 20.1 mmol)を加えて室温で30分攪拌した。O-(2,4-dinitrophenyl)hydroxylamine (1.67 g, 8.38 mmol) を加えて室温で18時間攪拌した。反応液にクロロホルムを加えて析出した黄色沈殿物をろ過して除去し、ろ液を減圧濃縮した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) で精製し、黄色固体として851 mg の化合物126Bを得た。
1H-NMR (CDCl3) δ: 0.41-0.46 (2H, m), 0.76 (2H, m), 2.73-2.81 (1H, m), 5.19 (2H, s), 5.61 (2H, s), 6.26 (1H, d, J = 7.2 Hz), 7.38 (5H, s), 7.44 (1H, d, J = 7.8 Hz), 7.70 (1H, s).
第三工程
化合物126B (847 mg, 2.83 mmol) とparaformaldehyde (255 mg, 8.49 mmol) をエタノール (12ml) に加え、マイクロウェーブ照射下、140℃で30分攪拌した。反応液を減圧濃縮し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5→90:10, v/v) 、続いてアミノカラムクロマトグラフィー (クロロホルム-メタノール, 97:3, v/v) で精製し、塩化メチレン‐エチルエーテルを加えて析出した固体を濾取し、無色固体として665 mg の化合物126Cを得た。
1H-NMR (CDCl3) δ: 0.61-0.66 (2H, m), 0.87 (2H, m), 2.68-2.76 (1H, m), 4.32 (2H, d, J = 7.9 Hz), 5.28 (2H, s), 6.33 (1H, d, J = 7.7 Hz), 6.45 (1H, t, J = 7.7 Hz), 7.33 (3H, m), 7.38 (1H, d, J = 7.7 Hz), 7.52 (2H, m).
第四工程
化合物126C (100 mg, 0.321 mmol)をDMF (0.5 ml) に溶解し、炭酸セシウム (314 mg, 0.964 mmol) と(bromomethylene)dibenzene (119 mg, 0.482 mmol) を0℃で加えて室温で2時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、有機層を水で洗浄し、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) で精製し、無色ガム状物質として124 mg の化合物126Dを得た。
1H-NMR (CDCl3) δ: 0.37-0.47 (2H, m), 0.74 (2H, m), 2.63-2.68 (1H, m), 4.35 (1H, d, J = 13.4 Hz), 4.65 (1H, d, J = 13.4 Hz), 5.07 (1H, s), 5.40 (1H, d, J = 10.7 Hz), 5.47 (1H, d, J = 10.5 Hz), 5.79 (1H, d, J = 7.6 Hz), 6.67 (1H, d, J = 7.8 Hz), 7.04-7.62 (15H, m).
第五工程
第四工程で得られた化合物126Dにトリフルオロ酢酸 (2 ml) を加えて、室温で1.5時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン‐エチルエーテルを加えて析出した固体を濾取し、無色固体として52 mg の化合物126を得た。
1H-NMR (DMSO-d6) δ: -0.19--0.06 (1H, m), 0.44-0.54 (1H, m), 0.82 (2H, m), 2.62-2.69 (1H, m), 4.21 (1H, d, J = 13.3 Hz), 5.11 (1H, d, J = 13.1 Hz), 5.32 (1H, s), 5.47 (1H, t, J = 11.1 Hz), 7.13 (1H, d, J = 7.6 Hz), 7.23 (3H, m), 7.28-7.47 (8H, m), 7.69 (2H, t, J = 8.5 Hz).
MS: m/z = 388 [M+H]+.
1H-NMR (DMSO-d6) δ: 0.86 (1.5H, d, J = 7.0 Hz), 1.04 (1.5H, d, J = 7.2 Hz), 3.08 (1.5H, s), 3.16 (1.5H, s), 4.52-5.05 (3H, m), 5.48 (2H, m), 7.31-7.47 (9H, m), 7.66 (2H, t, J = 8.4 Hz).
MS: m/z = 420 [M+H]+.
化合物95B (2.40 g, 8.52 mmol) とethyl 3-aminopropanoate hydrochloride (2.62 g, 17.0 mmol) をピリジン (30 ml)に加え、1-hydroxybenzotriazole (1.31 g, 8.52 mmol) と1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (3.27 g, 17.0 mmol) を順に加えて室温で2時間攪拌した。溶媒を減圧留去し、得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色固体として1.90 g の化合物128Aを得た。
1H-NMR (CDCl3) δ: 1.29 (3H, t, J = 7.1 Hz), 2.48 (2H, t, J = 6.4 Hz), 3.58 (2H, q, J = 6.3 Hz), 4.17 (2H, q, J = 7.1 Hz), 5.59 (2H, s), 6.57 (1H, dd, J = 7.1, 1.6 Hz), 7.37-7.52 (6H, m), 8.73 (1H, brs), 9.72 (1H, brs).
第二工程
化合物128A (2.58 g, 7.49 mmol) をDMF (30 ml) に溶解し、炭酸カリウム (5.18 g, 37.5 mmol)を加えて室温で30分攪拌した。O-(2,4-dinitrophenyl)hydroxylamine (2.98 g, 15.0 mmol) を加えて室温で20時間攪拌した。反応液にクロロホルムを加えて析出した黄色沈殿物をろ過して除去し、ろ液を減圧濃縮した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) 、続いてシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5→92:8, v/v) で精製し、黄色固体として1.67 g の化合物128Bを得た。
1H-NMR (CDCl3) δ: 1.26 (3H, t, J = 7.2 Hz), 2.42 (2H, t, J = 6.6 Hz), 3.43 (2H, q, J = 6.4 Hz), 4.12 (2H, q, J = 7.1 Hz), 5.13 (2H, s), 5.53 (2H, s), 6.21 (1H, d, J = 7.6 Hz), 7.33 (5H, s), 7.39 (1H, d, J = 7.6 Hz), 7.85 (1H, t, J = 5.6 Hz).
第三工程
化合物128B (1.66 g, 4.62 mmol) とparaformaldehyde (416 mg, 13.9 mmol) をエタノール (20 ml) に加え、マイクロウェーブ照射下、140℃で30分攪拌した。反応液を減圧濃縮し、得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 99:1→95:5, v/v) で精製し、無色固体として1.57 g の化合物128Cを得た。
1H-NMR (CDCl3) δ: 1.27 (3H, t, J = 7.2 Hz), 2.70 (2H, t, J = 5.7 Hz), 3.57 (2H, t, J = 5.8 Hz), 4.13 (2H, q, J = 7.1 Hz), 4.50 (2H, d, J = 7.9 Hz), 5.27 (2H, s), 5.87 (1H, t, J = 7.8 Hz), 6.32 (1H, d, J = 7.6 Hz), 7.31 (4H, m), 7.54 (2H, m).
第四工程
化合物128C (1.00 g, 2.69 mmol)をDMF (10 ml) に溶解し、炭酸セシウム (2.63 g, 8.08 mmol) と(bromomethylene)dibenzene (998 mg, 4.04 mmol) を0℃で加えて室温で18時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、有機層を水で洗浄し、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 98:2, v/v) で精製し、無色ガム状物質として500 mg の化合物128Dを得た。
1H-NMR (CDCl3) δ: 1.25 (3H, t, J = 7.3 Hz), 2.46 (1H, m), 2.70-2.80 (1H, m), 2.87-2.96 (1H, m), 4.11 (2H, q, J = 7.3 Hz), 4.12 (1H, m), 4.48 (1H, d, J = 13.7 Hz), 4.85 (1H, d, J = 13.7 Hz), 5.10 (1H, s), 5.47 (2H, s), 5.83 (1H, d, J = 8.0 Hz), 6.73 (1H, d, J = 8.0 Hz), 7.37 (15H, m).
第五工程
化合物128D (40 mg, 0.074 mmol) にトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン‐エチルエーテルを加えて析出した固体を濾取し、無色固体として20 mg の化合物128を得た。
1H-NMR (DMSO-d6) δ: 1.16 (3H, t, J = 7.1 Hz), 2.45-2.58 (3H, m), 3.70 (1H,m), 4.02 (2H, q, J = 7.1 Hz), 4.39 (1H, d, J = 13.4 Hz), 5.09 (1H, d, J = 13.3 Hz), 5.48 (1H, d, J = 3.2 Hz), 5.51 (1H, s), 7.19-7.38 (7H, m), 7.45 (2H, t, J = 7.3 Hz), 7.69 (2H, d, J = 7.2 Hz).
MS: m/z = 448 [M+H]+.
化合物128D (426 mg, 0.792 mmol) をエタノール (3 ml) とTHF (3 ml) に溶解し、2規定水酸化ナトリウム水溶液 (1.19 ml, 2.38 mmol) を加えて室温で1.5時間攪拌した。反応液に2規定塩酸を加えてクロロホルムで抽出し、硫酸ナトリウムで乾燥した。得られた粗生成物を塩化メチレン‐エチルエーテルを加えて析出した固体を濾取し、無色固体として359 mg の化合物129Aを得た。
第二工程
化合物129A (40 mg, 0.079 mmol) にトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを3に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐メタノール‐エチルエーテルを加えて析出した固体を濾取し、無色固体として25 mg の化合物129を得た。
1H-NMR (DMSO-d6) δ: 2.31-2.41 (1H, m), 2.57 (1H, m), 3.63-3.72 (1H, m), 4.37 (1H, d, J = 13.3 Hz), 5.09 (1H, d, J = 13.3 Hz), 5.47 (1H, s), 5.50 (1H, d, J = 7.8 Hz), 7.28 (7H, m), 7.44 (2H, t, J = 7.5 Hz), 7.69 (2H, d, J = 7.2 Hz), 12.40 (1H, brs).
MS: m/z = 420 [M+H]+.
化合物129A (50 mg, 0.098 mmol) をDMF (1 ml) に加え、1-hydroxybenzotriazole (14 mg, 0.098 mmol) 、dimethylamine hydrochloride (24 mg, 0.29 mmol)、トリエチルアミン (0.048 ml, 0.34 mmol)、1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (28 mg, 0.15 mmol) を加えて室温で1.5時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、重曹水で洗い、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、無色ガム状物質として130Aを得た。
第二工程
第一工程で得られた化合物130Aにトリフルオロ酢酸 (1 ml) を加えて、室温で2時間攪拌した。減圧濃縮した後、重曹水と塩化アンモニウム水溶液でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム-エチルエーテルを加えて析出した固体を濾取し、無色固体として25 mg の化合物130を得た。
1H-NMR (DMSO-d6) δ: 2.33-2.43 (1H, m), 2.66 (1H, m), 2.78 (3H, s), 2.89 (3H, s), 3.56 (2H, m), 4.45 (1H, d, J = 13.6 Hz), 5.05 (1H, d, J = 13.6 Hz), 5.47 (s, 1H), 5.49 (1H, d, J = 7.5 Hz), 7.27 (7H, m), 7.44 (2H, t, J = 7.3 Hz), 7.69 (2H, d, J = 7.3 Hz).
1H-NMR (DMSO-d6) δ: 2.60-2.77 (3H, m), 3.94 (1H, m), 4.42 (1H, d, J = 13.4 Hz), 5.15 (1H, d, J = 13.4 Hz), 5.49 (1H, s), 5.55 (1H, d, J = 7.2 Hz), 7.07 (1H, t, J = 7.3 Hz), 7.12-7.49 (13H, m), 7.73 (2H, d, J = 7.2 Hz), 10.01 (1H, s).
MS: m/z = 495 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.14 (3H, s), 3.65 (4H, m), 4.34 (1H, d, J = 13.6 Hz), 5.06 (1H, d, J = 13.6 Hz), 5.42 (1H, s), 5.53 (1H, d, J = 7.5 Hz), 7.42-7.58 (16H, m).
MS: m/z = 509 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.08-1.55 (8H, m), 2.33 (1H, m), 2.68 (1H, m), 4.45 (1H, d, J = 13.6 Hz), 5.05 (1H, d, J = 13.6 Hz), 5.50 (2H, brs), 7.46-7.68 (11H, m).
MS: m/z = 487 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.34-2.40 (1H, m), 2.61-2.77 (1H, m), 3.51-3.69 (10H, m), 4.44 (1H, d, J = 13.4 Hz), 5.03-5.11 (1H, d, J = 13.4 Hz), 5.51 (2H, s), 7.18-7.52 (9H, m), 7.69-7.75 (2H, m).
化合物95B (1.50 g, 5.32 mmol) とtert-butyl 2-aminoethyl(methyl)carbamate (1.86 g, 10.7 mmol) をピリジン (20 ml)に加え、1-hydroxybenzotriazole (815 mg, 5.32 mmol) と1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (2.04 g, 10.7 mmol) を順に加えて室温で2時間攪拌した。反応液を1規定塩酸にあけ、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、続いてシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5, v/v) で精製し、無色ガム状物質として1.63 g の化合物135Aを得た。
1H-NMR (CDCl3) δ: 1.44 (9H, s), 2.82 (3H, s), 3.28 (4H, m), 5.59 (2H, s), 6.57 (1H, d, J = 6.0 Hz), 7.46 (6H, m), 8.46 (1H, m), 9.68 (1H, brs).
第二工程
化合物135A (1.05 g, 2.62 mmol) をDMF (15 ml) に溶解し、炭酸カリウム (1.81 g, 13.1 mmol)を加えて室温で30分攪拌した。O-(2,4-dinitrophenyl)hydroxylamine (1.04 g, 5.23 mmol) を加えて室温で18時間攪拌した。反応液にクロロホルムを加えて析出した黄色沈殿物をろ過して除去し、ろ液を減圧濃縮した。得られた粗生成物をアミノカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) で精製し、淡黄色固体として887 mg の化合物135Bを得た。
1H-NMR (CDCl3) δ: 1.44 (9H, s), 2.84 (3H, s), 3.38 (4H, m), 5.33 (2H, s), 5.68 (1H, brs), 5.80 (1H, brs), 6.35 (1H, d, J = 7.6 Hz), 6.74 (1H, brs), 7.39 (5H, brm), 7.52 (1H, t, J = 9.5 Hz).
第三工程
化合物135B (880 mg, 2.11 mmol) とparaformaldehyde (190 mg, 6.34 mmol) をエタノール (18 ml) に加え、マイクロウェーブ照射下、140℃で30分攪拌した。反応液を減圧濃縮し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5→90:10, v/v) 、続いてアミノカラムクロマトグラフィー (クロロホルム-メタノール, 97:3, v/v) で精製し、無色固体として721 mg の化合物135Cを得た。
1H-NMR (CDCl3) δ: 1.29 (9H, s), 2.95 (3H, s), 4.38 (2H, brs), 5.33 (2H, brs), 6.36 (1H, d, J = 7.6 Hz), 6.85 (1H, t, J = 7.4 Hz), 7.33 (4H, m), 7.55 (2H, m).
MS: m/z = 429 [M+H]+.
第四工程
化合物135C (720 mg, 1.68 mmol)をDMF (3.5 ml) に溶解し、炭酸セシウム (1.64 g, 5.04 mmol) と(bromomethylene)dibenzene (623 mg, 2.52 mmol) を0℃で加えて室温で18時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、有機層を水で洗浄し、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) で精製し、732 mg の化合物135Dを得た。
第五工程
化合物135D (727 mg, 1.22 mmol) に4規定 HCl (酢酸エチル溶液, 10 ml) を加えた。室温で1時間攪拌した後、溶媒を減圧留去した。飽和重曹水を加えてクロロホルムで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物を塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として575 mg の化合物135Eを得た。
第六工程
化合物135E (50 mg, 0.10 mmol) にトリフルオロ酢酸 (2 ml) を加えて、室温で1.5時間攪拌した。減圧濃縮した後、重曹水と塩化アンモニウム水溶液でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として15 mg の化合物135を得た。
1H-NMR (DMSO-d6) δ: 2.40 (3H, s), 2.80 (1H, s), 3.12 (3H, m), 3.87 (1H, m), 4.37 (1H, d, J = 13.6 Hz), 5.10 (1H, d, J = 13.4 Hz), 5.52 (1H, s), 5.53 (1H, d, J = 5.5 Hz), 7.15-7.70 (11H, m).
MS: m/z = 405 [M+H]+.
化合物135E (50 mg, 0.10 mmol) を塩化メチレン (1 ml) に溶解し、トリエチルアミン (0.042 ml, 0.30 mmol) とacetyl chloride (0.011 ml, 0.15 mmol) を加えて室温で1時間攪拌した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) 、続いてアミノカラムクロマトグラフィー (クロロホルム-メタノール, 97:3, v/v) で精製し、無色固体として72 mg の化合物136Aを得た。
第二工程
第一工程で得られた化合物136Aにトリフルオロ酢酸 (2 ml) を加えて、室温で1.5時間攪拌した。減圧濃縮した後、重曹水と塩化アンモニウム水溶液でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として23 mg の化合物136を得た。
1H-NMR (DMSO-d6) δ: 1.89 (2H, s), 1.92 (1H, s), 2.73 (1H, s), 2.95 (2H, s), 3.00-3.06 (1H, m), 3.43 (2H, m), 3.80 (1H, m), 4.34 (0.7H, d, J = 13.3 Hz), 4.45 (0.3H, d, J = 13.1 Hz), 5.11 (1H, m), 5.49 (2H, m), 7.20-7.73 (11H, m).
1H-NMR (DMSO-d6) δ: 2.95 (3H, s), 3.13-4.07 (4H, m), 4.46 (1H, d, J = 13.2 Hz), 5.16 (1H, d, J = 13.0 Hz), 5.51 (1H, d, J = 7.3 Hz), 5.62 (1H, s), 7.17-7.78 (16H, m).
MS: m/z = 509 [M+H]+.
参考例136に従い、化合物138を同様の手法により合成した。
1H-NMR (DMSO-d6) δ: 2.62 (3H, s), 3.03-3.22 (4H, m), 3.72 (2H, d, J = 13.3 Hz), 4.39 (1H, d, J = 13.3 Hz), 5.08 (1H, d, J = 13.3 Hz), 5.53 (1H, d, J = 7.8 Hz), 5.55 (1H, s), 7.19-7.79 (16H, m).
MS: m/z = 545 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.72 (3H, s), 2.88 (3H, s), 3.12-3.24 (3H, m), 3.75-3.80 (1H, m), 4.37 (1H, d, J = 13.0 Hz), 5.10 (1H, d, J = 13.4 Hz), 5.51 (1H, d, J = 7.6 Hz), 5.54 (1H, s), 7.19-7.46 (19H, m), 7.72 (2H, d, J = 7.0 Hz).
MS: m/z = 483 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.88 (3H, s), 2.98-3.12 (3H, m), 3.77 (1H,m), 4.31 (1H, d, J = 13.3 Hz), 5.13 (1H, d, J = 13.3 Hz), 5.51 (1H, s), 5.52 (1H, d, J = 7.6 Hz), 7.13-7.46 (9H, m), 7.71 (2H, d, J = 7.2 Hz).
MS: m/z = 469 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.07 (9H, s), 2.84 (1H, m), 3.19 (2H, d, J = 3.9 Hz), 3.96 (1H, d, m), 4.28 (1H, d, J = 13.1 Hz), 5.21 (1H, d, J = 13.1 Hz), 5.52 (1H, s), 5.56 (1H, t, J = 4.2 Hz), 7.25-7.59 (10H, m), 7.75 (2H, d, J = 7.7 Hz).
MS: m/z = 475 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.10 (6H, m), 2.98 (3H, m), 3.78 (1H, m), 4.27 (1H, d, J = 13.6 Hz), 4.68 (1H, m), 5.11 (1H, d, J = 12.8 Hz), 5.51 (2H,m), 7.07-7.46 (10H, m), 7.70 (2H, d, J = 7.2 Hz).
MS: m/z = 477 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.89 (3H, m), 3.62 (1H, m), 4.17 (1H, d, J = 13.1 Hz), 4.99 (1H, d, J = 13.1 Hz), 5.45 (1H, s), 5.51 (1H, d, J = 7.8 Hz), 7.18-7.77 (17H, m).
MS: m/z = 531 [M+H]+.
参考例135第一~第五工程に準じて合成した化合物144Aにギ酸とホルマリンを加えて、80度で1.5時間攪拌した。溶媒を減圧留去し、飽和重曹水を加え、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧濃縮し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5→92:8, v/v) で精製し、26 mg の化合物144Bを得た。
1H-NMR (CDCl3) δ: 2.06 (6H, s), 2.18-2.26 (1H, m), 2.36-2.45 (1H, m), 2.89-2.98 (1H, m), 3.91 (1H, dt, J = 14.1, 5.9 Hz), 4.43 (1H, d, J = 13.6 Hz), 4.82 (1H, d, J = 13.4 Hz), 5.20 (1H, s), 5.41 (1H, d, J = 10.8 Hz), 5.46 (1H, d, J = 10.7 Hz), 5.80 (1H, d, J = 7.8 Hz), 6.69 (1H, d, J = 7.8 Hz), 7.05-7.64 (15H, m).
第二工程
第一工程で得られた化合物144Bにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と塩化アンモニウム水溶液でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として13 mg の化合物144を得た。
1H-NMR (DMSO-d6) δ: 2.17 (6H, s), 2.38-2.46 (3H, m), 3.59 (1H, m), 4.41 (1H, d, J = 13.1 Hz), 5.09 (1H, d, J = 13.3 Hz), 5.50 (1H, d, J = 6.4 Hz), 5.51 (1H, s), 7.19-7.47 (9H, m), 7.66 (2H, d, J = 7.3 Hz).
MS: m/z = 419 [M+H]+.
化合物95E (300 mg, 0.664 mmol) のジクロロメタン (5 ml) 溶液に、氷冷下、NBS (130 mg, 0.731 mmol) を加え、室温まで昇温後、1時間還流した。溶媒を留去後、得られた残渣をシリカゲルクロマトグラフィーに付し、精製した。はじめに n-ヘキサン-酢酸エチル (1:1, v/v)で溶出し、次いで酢酸エチルで溶出した。目的の画分を濃縮し固体として 326.7 mg (収率93%) の化合物145Aを得た。
1H-NMR (CDCl3) δ: 2.93 (3H, s), 4.27 (1H, d, J = 13.5 Hz), 4.82 (1H, d, J = 13.5 Hz), 5.13 (1H, s), 5.41 (2H, s), 5.41-7.12 (2H, m), 7.15 (1H, s), 7.17-7.28 (3H, m), 7.31-7.47 (6H, m), 7.52 (2H, d, J = 6.6 Hz), 7.63-7.67 (2H, m).
第二工程
化合物145A (100 mg, 0.189 mmol) のDMF (3 ml) 溶液に炭酸カリウム (78.4 mg, 0.567 mmol) 水 (0.5 ml) 溶液と、4,4,5,5-tetramethyl-2-(prop-1-en-2-yl)-1,3,2-dioxaborolane (47.6 mg, 0.284 mmol) と、テトラキストリフェニルホスフィンパラジウム (21.8 mg, 0.0189 mmol) を加え、80℃で4時間加熱撹拌した。反応液を室温まで冷却後、水を加え、酢酸エチルで3回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチルのみで溶出させ、目的の画分を濃縮すると油状物として 42.0 mg (収率45%) の化合物145Bを得た。
1H-NMR (CDCl3) δ: 1.73 (3H, s), 2.92 (3H, s), 4.29 (1H, d, J = 13.5 Hz), 4.83 (1H, d, J = 13.5 Hz), 4.96-4.97 (1H, m), 5.15 (1H, s), 5.21-5.21 (1H, m), 5.37 (1H, d, J = 10.8 Hz), 5.40 (1H, d, J = 10.8 Hz), 6.82 (1H, s), 7.15-7.21 (5H, m), 7.27-7.47 (6H, m), 7.54 (2H, d, J = 6.9 Hz), 7.64-7.69 (2H, m).
第三工程
化合物145B (40 mg, 0.081 mmol) のTHF (2 ml) 溶液に10% Pd-C (8 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣をエーテルで洗浄し、6.8 mg (収率 21%) の化合物145 を得た。
1H-NMR (CDCl3) δ: 0.629 (3H, d, J = 6.9 Hz), 0.900 (3H, d, J = 6.9 Hz), 2.87-3.00 (1H, m), 2.94 (3H, s), 4.37 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.2 Hz), 5.21 (1H, s), 6.69 (1H, s), 7.21 (5H, s), 7.35-7.47 (3H, m), 7.57 (2H, d, J = 7.5 Hz).
1H-NMR (CDCl3) δ: 0.738 (3H, t, J = 7.2 Hz), 1.05-1.18 (2H, m), 2.01-2.18 (2H, m), 2.94 (3H, s), 4.35 (1H. d, J = 13.2 Hz), 4.95 (1H, d, J = 13.2 Hz), 5.22 (1H, s), 6.71 (1H, s), 7.20 (5H, s), 7.35-7.47 (3H, m), 7.55 (2H, d, J = 6.9 Hz).
化合物145A (60 mg, 0.113 mg) をトリフルオロ酢酸 (2 ml) に溶解させ、室温下1時間撹拌した。溶媒を留去し、残渣をジクロロメタン(2 ml) に溶解させ、飽和重曹水で中和した。得られた溶液をクエン酸水溶液で酸性にして、有機層を分離した。水層をジクロロメタンで1回抽出し、合わせた有機層を水洗後、硫酸ナトリウムで乾燥した。溶媒を留去後、得られた固体をジイソプロピルエーテルで洗浄し、30 mg (収率60%) の化合物147を得た。
1H-NMR (CDCl3) δ: 2.97 (3H, s), 4.36 (1H, d, J = 13.2 Hz), 5.01 (1H, d, J = 13.2 Hz), 5.21 (1H, s), 7.14 (1H, s), 7.17-7.25 (5H, m), 7.36-7.48 (3H, m), 7.54 (2H, d, J = 7.2 Hz).
1H-NMR (CDCl3) δ: 1.70 (3H, s), 2.95 (3H, s), 4.36 (1H, d, J = 12.9 Hz), 4.95 (1H, d, J = 12.9 Hz), 4.96-4.98 (1H, m), 5.23 (1H, s), 5.32-5.33 (1H, m), 6.86 (1H, s), 7.21 (5H, s), 7.35-7.48 (3H, m), 7.56 (2H, d, J = 7.2 Hz).
1H-NMR (CDCl3) δ: 1.63 (3H, s), 2.95 (3H, s), 4.34 (1H, d, J = 12.9 Hz), 4.68 (1H, d, J = 12.9 Hz), 5.21 (1H, s), 6.70 (1H, s), 7.18 (5H, s), 7.37-7.47 (3H, m), 7.54 (2H, d, J = 6.9 Hz).
参考例135第一~第四工程に準じて合成した化合物150A (465 mg, 0.801 mmol) を4規定塩酸ジオキサン溶液 (5 ml) に溶解させ、室温下、2時間撹拌した。反応液を飽和重曹水溶液で中和し、ジクロロメタンで3回抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を留去し、得られた油状物のうち100 mg をジクロロメタン (2 ml) に溶解させた。上記ジクロロメタン溶液に、氷冷下、トリエチルアミン (63.2 mg, 0.624 mmol) とベンゾイルクロリド (31.9 mg, 0.312 mmol) を加え、室温で1時間撹拌した。反応液に水を加え、ジクロロメタンで3回抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を留去し、得られた残渣をジエチルエーテルで洗浄すると、68 mg (収率 56%) の化合物150Bを得た。
1H-NMR (CDCl3) δ: 3.05-3.12 (1H, m), 3,38-3.45 (1H, m), 3.64-3.70 (1H, m), 3.93-3.99 (1H, m), 4.22 (1H, d, J = 13.2 Hz), 5.04 (1H, s), 5.07 (1H, d, J = 13.2 Hz), 5.22 (1H, d, J = 10.2 Hz), 5.31 (1H, d, J = 10.2 Hz), 5.70 (1H, d, J = 7.8 Hz), 6.55 (1H, d, J = 7.8 Hz), 6.98 (2H, d, J = 6.6 Hz), 7.08-7.19 (4H, m), 7.29-7.46 (5H, m), 7.49-7.53 (2H, m), 7.87 (2H, d, J = 7.2 Hz), 8.06 (1H, brs).
第二工程
化合物150B (30 mg, 0.051 mg) をトリフルオロ酢酸 (2 ml) に溶解させ、室温下1時間撹拌した。溶媒を留去し、残渣をジクロロメタン(2 ml) に溶解させ、飽和重曹水で中和した。得られた溶液をクエン酸水溶液で酸性にして、有機層を分離した。水層をジクロロメタンで1回抽出し、合わせた有機層を水洗後、硫酸ナトリウムで乾燥した。溶媒を留去後、得られた固体をジイソプロピルエーテルで洗浄し、15 mg (収率59%) の化合物150を得た。
1H-NMR (CDCl3) δ: 2.91-2.98 (1H, m), 3.54-3.66 (1H, m), 3.76-3.84 (1H, m), 4.13-4.18 (1H, m), 4.28 (1H, d, J = 12.9 Hz), 5.11 (1H, s), 5.43 (1H, d, J = 12.9 Hz), 5.45 (1H, d, J = 7.5 Hz), 6.68 (1H, d, J = 7.5 Hz), 7.10-7.18 (4H, m), 7.35-7.47 (8H, m), 7.89 (2H, d, J = 7.2 Hz), 8.41 (1H, s).
1H-NMR (CDCl3) δ: 2.02 (3H, s), 2.69 (1H, br t, J = 10.8 Hz), 3.40-3.49 (1H, m), 3.06-3.74 (1H, m), 4.12-4.22 (1H, m), 4.20 (1H, d, J = 12.9 Hz), 5.08 (1H, s) , 5.47 (1H, d, J = 7.8 Hz), 5.50 (1H, d, J = 12.9 Hz), 6.67 (1H, d, J = 7.8 Hz), 7.12-7.21 (5H, m), 7.28-7.46 (5H, m), 8.31 (1H, brs).
化合物150A (50 mg, 0.801 mmol) を4規定塩酸ジオキサン溶液 (5 ml) に溶解させ、室温下、2時間撹拌した。反応液を飽和重曹水溶液で中和し、ジクロロメタンで3回抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を留去し、得られた油状物のうち50 mg をメタノール (2 ml) に溶解させた。上記メタノール溶液に10% Pd-C (10 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣にジイソプロピルエーテルを加えて析出した固体を濾取し、10 mg (収率 25%) の化合物152を得た。
1H-NMR (DMSO-d6) δ: 2.74-2.78 (2H, m), 3.00-3.07 (1H, m), 3.78-3.85 (1H, m), 4.34 (1H, d, J = 13.5 Hz), 5.13 (1H, d, J = 13.5 Hz), 5.48-5.54 (1H, m), 5.10 (1H, s), 7.20-7.47 (9H, m), 7.63-7.71 (2H, m).
化合物150A (30 mg, 0.052 mmol) のTHF (3 ml) 溶液に10% Pd-C (10 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣にジイソプロピルエーテルを加えて析出した固体を濾取し、20 mg (収率 79%) の化合物153を得た。
1H-NMR (CDCl3) δ: 1.34 (9H, s), 2.84-2.91 (1H, m), 3.18-3.25 (2H, m), 4.03-4.11 (1H, m), 4.35 (1H, d, J- = 13.2 Hz), 5.20 (1H, s), 5.24 (1H, d, J = 13.2 Hz), 5.49 (1H, brs), 5.70 (1H, d, J = 7.8 Hz), 6.73 (1H, d, J = 7.8 Hz), 7.16-7.20 (5H, m), 7.32-7.46 (3H, m), 7.53 (2H, d, J = 7.2 Hz).
参考例65の合成法に準じて合成した化合物154A (539 mg, 1.01 mmol) のDMF (10 ml) 溶液に、氷冷下、トリエチルアミン (615.7 mg, 6.08 mmol) とクロロ炭酸エチル (328.8 mg, 3.03 mmol) を加え、室温で10分間撹拌した。反応液にO,N-ジメチルヒドロキシルアミン塩酸塩 (295.0 mg, 3.03 mmol) と、DMAP (12.3 mg, 0.101 mmol) を加え、同温度で2時間撹拌後、水を加え、酢酸エチルで3回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに n-ヘキサン-酢酸エチル (7:3, v/v)で溶出し、次いで酢酸エチルのみで溶出した。目的の画分を濃縮すると油状物として445.4 mg (収率 76%) の化合物154Bを得た。
1H-NMR (DMSO-d6) δ: 3.09 (3H, s), 3.52 (3H, s), 3.94 (2H, s), 4.40 (1H, brs), 4.64 (2H, s), 4.96 (1H, brs), 5.15 (2H, s), 7.06-7.15 (4H, m), 7.21 (2H, t, J = 8.7 Hz), 7.28-7.38 (3H, m), 7.43 (2H, dd, J = 5.7 Hz, 8.4 Hz), 7.52-7.54 (2H, m), 7.66 (1H, s).
第二工程
化合物154B (250 mg, 0.435 mmol) のTHF (5 ml) 溶液を-78℃に冷却し、メチルマグネシウムブロミド 0.97M THF溶液 (0.673 ml, 0.653 mmol) を加え、-20℃まで2時間かけて昇温した。反応液に1規定塩酸を加え、酢酸エチルで3回抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに クロロホルムのみで溶出し、次いでクロロホルム-メタノール (7:3, v/v)で溶出した。目的の画分を濃縮すると油状物として117.0 mg (収率 51%) の化合物154Cを得た。
1H-NMR (CDCl3) δ: 2.68 (3H, s), 3.80 (2H, brs), 4.29 (2H, brs), 4.71 (2H, brs), 5.45 (2H, brs), 6.83 (2H, m), 6.92-6.98 (2H, m), 7.03-7.10 (2H, m), 7.28-7.39 (5H, m), 7.90 (1H, s).
第三工程
化合物154C (117 mg, 0.221 mmol) のジクロロメタン (2 ml) 溶液に、氷冷下、mCPBA (52.7 mg, 0.332 mmol) を加え、室温で2時間撹拌した。反応液にチオ硫酸ナトリウム水溶液を加え、酢酸エチルで3回抽出した。抽出液を飽和重曹水で2回洗浄し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた油状物をエタノール (2 ml) に溶解し、1時間還流した。溶媒を留去後、析出した固体をジイソプロピルエーテルで洗浄し、54 mg (収率 49%) の化合物154Dを得た。
1H-NMR (CDCl3) δ: 3.74 (1H, brs), 3.85 (1H, brs), 4.20 (2H, brs), 4.61 (1H, brs), 4.93 (1H, brs), 5,41 (2H, brs), 6.79-6.86 (2H, m), 6.91-6.96 (2H, m), 7.02-7.09 (2H, m), 7.15-7.16 (1H, m), 7.26-7.34 (5H, m), 7.56-7.65 (2H, m).
第四工程
化合物154D (54 mg, 0.107 mmol) のTHF (3 ml) 溶液に10% Pd-C (20 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣にジイソプロピルエーテルを加えて析出した固体を濾取し、21 mg (収率 47%) の化合物154を得た。
1H-NMR (DMSO-d6) δ: 3.90 (2H, brs), 3.95 (2H, s), 4,66 (2H, brs), 7.07-7.12 (4H, m), 7.22 (2H, t, J = 8.7 Hz), 7.29 (1H, s), 7.43-7.47 (2H, m).
化合物155A (WO2006/066414, 15.0 g, 38.4 mmol) のトルエン (150 mL) 溶液に氷冷下、 N,N-diisopropylethylamine (16.1 mL, 92.0 mmol)、1-methylimidazole (3.70 mL, 46.4 mmol) および2-methoxyethylamine (4.05 mL, 46.4 mmol) を順次加えた後、さらにdiphenyl chlorophosphate (9.60 mL, 46.1 mmol) を10分間かけて滴下した。反応液を氷冷下、20分間攪拌した後、アセトニトリル (50 mL) を加え、さらに2時間攪拌した。反応液に氷冷下、酢酸水溶液 (10%, 100 mL) を加えた後、酢酸エチルで抽出した。抽出液を水 (100 mL)、飽和重曹水 (150 mL) および飽和食塩水 (100 mL) で順次洗浄した後、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 25% → 50%) で精製し、化合物155B (7.86 g, 46 %) を無色油状物として得た。
1H-NMR (CDCl3) δ: 0.10 (6H, s), 0.93 (9H, s), 3.29 (3H, s), 3.39 (2H, m), 3.47 (2H, m), 4.56 (2H, d, J = 1.2 Hz), 5.41 (2H, s), 6.60 (1H, s), 7.35 - 7.42 (5H, m), 8.11 (1H, brt).
第二工程
化合物155B (7.70 g, 17.2 mmol) の エタノール (80 mL) 溶液に室温でアンモニア水 (40 mL) を加え、18時間攪拌した。溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 75% → 100%) で精製し、化合物155C (7.15 g, 93 %) を無色油状物として得た。
1H-NMR (CDCl3) δ: 0.14 (6H, s), 0.97 (9H, s), 3.28 (3H, s), 3.38 (2H, m), 3.49 (2H, m), 4.64 (2H, s), 5.53 (2H, s), 6.31 (1H, s), 7.34 - 7.49 (5H, m), 8.61 (1H, brs), 9.94 (1H, brs).
第三工程
化合物155C (7.15 g, 16.0 mmol) および炭酸カリウム (6.64 g, 48.0 mmol) のDMF (125 mL) 溶液に室温で、O-(2,4-dinitrophenyl)hydroxylamine (7.97 g, 40.0 mmol) を加え、2日間攪拌した。反応液に氷冷下、水 (250 mL) を加えた後、酢酸エチル (300 mL x 2) で抽出した。抽出液を水 (300 mL)、飽和重曹水 (300 mL x 2) および飽和食塩水 (150 mL) で順次洗浄した後、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (メタノール / クロロホルム = 0% → 10%) で精製し、化合物155D (6.47 g, 88 %) を薄黄色固体として得た。
1H-NMR (CDCl3) δ: 0.11 (6H, s), 0.94 (9H, s), 3.26 (3H, s), 3.35 (4H, m), 4.66 (2H, s), 5.16 (2H, s), 5.24 (2H, s), 6.43 (1H, s), 7.31 - 7.40 (5H, m), 7.59 (1H, brs).
第四工程
化合物155D (6.47 g, 14.0 mmol) および酢酸 (0.080 mL, 1.4 mmol) のトルエン (100 mL) 溶液に室温でparaformaldehyde (0.422 g, 14.1 mmol) を加え、80℃で2時間攪拌した。溶媒を減圧下留去して得られた化合物155Eの粗生成物を精製することなく、次の工程に利用した。
第五工程
第四工程で得た化合物155Eの粗生成物のDMF (100 mL) 溶液に氷冷下、炭酸セシウム (22.7 g, 69.8 mmol) を加え1時間攪拌した。氷冷下、bromodiphenylmethane (5.20 g, 21.0 mmol) を加え、室温で19時間攪拌した。反応液に氷冷下、水 (200 mL) を加えた後、酢酸エチル (200 mL x 3) で抽出した。抽出液を水 (200 mL x 2) および飽和食塩水 (100 mL) で順次洗浄した後、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた化合物155Fの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 640 [M+H]+.
第六工程
第五工程で得た化合物155Fの粗生成物のメタノール (100 mL) 溶液に室温で、塩化水素 (4 N酢酸エチル溶液, 40 mL) を加え、2.5時間攪拌した。反応液に氷冷下、水酸化ナトリウム水溶液 (2 N, 75 mL) を加え中和 (pH = 6) した後、クロロホルム (200 mL x 3) で抽出した。抽出液を硫酸ナトリウムで乾燥し、溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (メタノール / クロロホルム = 5% → 40%) で精製し、化合物155G (5.18 g, 3工程70 %) をオレンジ色油状物として得た。
1H-NMR (CDCl3) δ: 3.16 (3H, s), 3.18 - 3.43 (3H, m), 3.60 - 3.74 (2H, m), 4.06 (1H, d, J = 13.5 Hz), 4.19 (1H, brs), 4.58 (1H, d, J = 14.7 Hz), 5.00 (1H, d, J = 13.5 Hz), 5.24 (1H, s), 5.27 (2H, s), 5.96 (1H, s), 6.78 (2H, m), 6.98 - 7.10 (3H, m), 7.30 - 7.42 (8H, m), 7.72 (2H, m).
第七工程
化合物155G (100 mg, 0.190 mmol)、(bromomethyl)cyclopropane (0.110 mL, 1.12 mmol) およびヨウ化ナトリウム (5.0 mg, 0.033 mmol) のTHF (2 mL) 溶液に室温で、カリウム tert-ブトキシド (78.0 mg, 0.695 mmol) を加え、室温で22時間攪拌した後、マイクロウェーブ照射下、100℃で10分間攪拌した。反応液に水および塩酸 (2 N) を加え (pH = 1)、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた化合物155Hの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 580 [M+H]+.
第八工程
第七工程で得た化合物155Hの粗生成物のDMF (2 mL) 溶液に室温で、lithium chloride (35.0 mg, 0.826 mmol) を加え、マイクロウェーブ照射下、150℃で15分間攪拌した。反応液をpreparative LCMSで精製し、化合物155 (4.3 mg, 2工程5 %) を白色固体として得た。
1H-NMR (CDCl3) δ: 0.16 (2H, m), 0.52 (2H, m), 0.98 (1H, m), 3.08 (3H, m), 3.20 (3H, s), 3.46 (2H, m), 3.68 (1H, dd, J = 0.6, 14.1 Hz), 3.90 (1H, m), 4.52 (1H, d, J = 13.2 Hz), 4.58 (1H, d, J = 14.1 Hz), 4.93 (1H, d, J = 13.2 Hz), 5.38 (1H, s), 6.01 (1H, s), 6.98 (2H, m), 7.11 - 7.48 (8H, m).
MS: m/z = 490 [M+H]+.
1H-NMR (CDCl3) δ: 0.88 (3H, t, J = 7.4 Hz), 1.51 (2H, m), 3.15-3.23 (6H, m), 3.46 (2H, m), 3.69 (1H, dd, J = 0.6, 14.1 Hz), 3.88 (1H, m), 4.54 (2H, d, J = 14.1 Hz), 4.58 (1H, d, J = 14.1 Hz), 4.93 (1H, d, J = 13.5 Hz), 5.39 (1H, s), 6.12 (1H, s), 6.97 (2H, m), 7.12 - 7.47 (8H, m).
MS: m/z = 478 [M+H]+.
1H-NMR (CDCl3) δ: 3.13-3.22 (1H, m), 3.18 (3H, s), 3.20 (3H, s), 3.41-3.51 (2H, m), 3.60 (1H, d, J = 13.8 Hz), 3.89 (1H, ddd, J = 3.3 Hz, 4.2 Hz, 14.4 Hz), 4.52 (1H, d, J = 13.2 Hz), 4.53 (1H, d, J = 13.8 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.38 (1H, s), 5.98 (1H, s), 6.98 (2H, d, J = 8.4 Hz), 7.11-7.22 (3H, m), 7.36-7.48 (5H, m).
化合物155G (960 mg, 1.83 mmol) のTHF (100 mL) 溶液に室温で、 manganese dioxide (2.06 g, 92.0 mmol) を加え、2日間攪拌した。反応液をろ過した後、ろ液を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 60% → 100%) で精製し、化合物158A (554 mg, 58 %) を薄黄色foamとして得た。
1H-NMR (CDCl3) δ: 2.96 (1H, m), 3.18 (3H, s), 3.44 (2H, m), 4.18 (1H, m), 4.56 (1H, d, J = 13.8 Hz), 4.98 (1H, d, J = 13.8 Hz), 5.28 (1H, s), 5.54 (1H, d, J = 10.5 Hz), 5.64 (1H, d, J = 10.5 Hz), 6.35 (1H, s), 6.85 (2H, m), 7.03 (2H, m), 7.18 (1H, m), 7.26 - 7.48 (8H, m), 7.64 (2H, m), 10.10 (1H, s).
第二工程
化合物158A (83.0 mg, 0.159 mmol)、pyrrolidine (0.0400 mL, 0.484 mmol) および酢酸 (0.100mL) の 塩化メチレン (4 mL) 溶液に室温で、sodium triacetoxyborohydride (136 mg, 0.642 mmol) を加え、28時間攪拌した。反応液に水を加え、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた化合物158Bの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 579 [M+H]+.
第三工程
第二工程で得た化合物158Bの粗生成物のDMF (2 mL) 溶液に室温で、lithium chloride (39.2 mg, 0.925 mmol) を加え、マイクロウェーブ照射下、150℃で15分間攪拌した。反応液を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物158 (8.8 mg, 2工程11 %) を黄色油状物として得た。
1H-NMR (CDCl3) δ: 1.84 (4H, m), 2.70-2.85 (5H, m), 3.19 (3H, s), 3.20 - 3.47 (3H, m), 3.80 (1H, m), 4.25 (1H, d, J = 14.7 Hz), 4.57 (1H, d, J = 13.5 Hz), 5.07 (1H, d, J = 13.5 Hz), 5.39 (1H, s), 6.06 (1H, s), 6.97 (2H, m), 7.12 - 7.54 (8H, m), 8.29 (1H, s).
MS: m/z = 489 [M+H]+.
化合物155G (950 mg, 1.81 mmol) およびN,N-diisopropylethylamine (0.380 mL, 2.18 mmol) の塩化メチレン (20 mL) 溶液に氷冷下、methanesulfonyl chloride (0.148 mL, 1.90 mmol) を滴下し、90分間攪拌した。反応液に水 (20 mL) を加え、クロロホルム (50 mL) で抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた化合物159Aの粗生成物 (1.06 g) を精製することなく、次の工程に利用した。
MS: m/z = 604 [M+H]+.
第二工程
第一工程で得た化合物159Aの粗生成物 (161 mg) に室温で、dimethylamine (2 M THF溶液、2.00 mL, 4.00 mmol) を加え、3日間攪拌した。反応液に飽和食塩水 (2 mL) を加え、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた化合物159Bの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 553 [M+H]+.
第三工程
第二工程で得た化合物159Bの粗生成物のDMF (2 mL) 溶液に室温で、lithium chloride (56.0 mg, 1.32 mmol) を加え、マイクロウェーブ照射下、150℃で30分間攪拌した。反応液を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物159 (33.6 mg, 3工程27%) を白色固体として得た。
1H-NMR (CDCl3) δ: 2.37 (6H, s), 2.69 (1H, d, J = 14.4 Hz), 3.19 (3H, s), 3.30 - 3.46 (3H, m), 3.76 (1H, m), 4.00 (1H, d, J = 14.4 Hz), 4.60 (1H, d, J = 13.5 Hz), 5.20 (1H, d, J = 13.5 Hz), 5.40 (1H, s), 6.01 (1H, s), 6.97 (2H, m), 7.11 - 7.42 (8H, m).
MS: m/z = 463 [M+H]+.
化合物159Aの粗生成物 (95.8 mg) に室温で、methylamine (2 M THF溶液、2.00 mL, 4.00 mmol) を加え、3日間攪拌した。反応液をろ過し、溶媒を減圧下留去して得られた化合物160Aの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 539 [M+H]+.
第二工程
化合物160Aの粗生成物およびヨウ化ナトリウム (100 mg, 0.667 mmol) のアセトニトリル(3 mL)懸濁液に室温で、chlorotrimethylsilane (0.0850 mL, 0.665 mmol) を加え、5時間攪拌した。反応液に水 (1 mL) を加え、溶媒を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物160 (59.8 mg, 3工程84%) を白色固体として得た。
1H-NMR (CDCl3) δ: 2.75 (3H, s), 3.08 (1H, d, J = 13.5 Hz), 3.24 (3H, s), 3.30 - 3.40 (3H, m), 3.75 (1H, m), 4.32 (1H, d, J = 13.8 Hz), 4.66 (1H, d, J = 13.8 Hz), 5.33 (1H, s), 5.58 (1H, d, J = 13.5 Hz), 6.40 (1H, s), 6.98 (2H, m), 7.12 - 7.25 (3H, m), 7.40 - 7.51 (2H, m), 7.60 (2H, m).
MS: m/z = 449 [M+H]+.
化合物159Aの粗生成物 (156 mg), imidazole (19.5 mg, 0.286 mmol) および炭酸カリウム (37.7 mg, 0.273 mmol) のDMF (2 mL) 懸濁液を室温で4時間攪拌した後、水素化ナトリウム (60 %, 11.7 mg, 0.293 mmol) を加え、3日間攪拌した。反応液に酢酸水溶液 (10%) を加え、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた化合物161Aの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 576 [M+H]+.
第二工程
化合物161Aの粗生成物に室温で、trifluoroacetic acid (1 mL) を加え、18時間攪拌した後、60℃で3時間攪拌した。反応液を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物161 (19.8 mg, 3工程16%) を薄橙色アモルファスとして得た。
1H-NMR (CDCl3) δ: 3.17 - 3.25 (1H, m), 3.21 (3H, s), 3.38 - 3.47 (2H, m), 3.82 (1H, m), 4.40 (1H, d, J = 16.5 Hz), 4.54 (1H, d, J = 13.5 Hz), 5.02 (1H, d, J = 13.5 Hz), 5.09 (1H, s), 5.32 (1H, d, J = 16.5 Hz), 5.40 (1H, s), 6.65 (1H, brs), 7.03 (2H, m), 7.15 - 7.49 (8H, m), 8.08 (1H, brs).
MS: m/z = 486 [M+H]+.
化合物159Aの粗生成物 (192 mg) のDMF (2 mL) 溶液に室温で、ナトリウムアジド (24.2 mg, 0.372 mmol) を加え、60℃で2時間攪拌した。反応液を減圧下留去して得られた化合物162Aの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 551 [M+H]+.
第二工程
化合物162Aの粗生成物のTHF (4 mL) 溶液に室温で、水 (0.200 mL) およびtriphenylphosphine (83.0 mg, 0.316 mmol) を順次加え、60℃で1時間攪拌した。反応液を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物162B (110 mg, 3工程66 %) を無色油状物として得た。
MS: m/z = 525 [M+H]+.
第三工程
化合物162B (50.0 mg, 0.0950 mmol) およびヨウ化ナトリウム (56.2 mg, 0.375 mmol) のアセトニトリル (1 mL) 懸濁液に室温で、chlorotrimethylsilane (0.0490 mL, 0.381 mmol) を加え、6時間攪拌した。反応液に水 (0.5 mL) を加え、溶媒を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物162 (25.9 mg, 63%) を薄橙色固体として得た。
1H-NMR (CDCl3) δ: 3.12 (1H, d, J = 14.7 Hz), 3.27 (3H, s), 3.35 - 3.48 (3H, m), 3.81 (1H, m), 4.65 (1H, d, J = 13.5 Hz), 5.31 (1H, s), 5.59 (1H, d, J = 13.5 Hz), 6.40 (1H, s), 6.98 (2H, m), 7.19 (3H, m), 7.40 (1H, m), 7.50 (2H, m), 7.62 (2H, m), 8.11 (1H, s).
MS: m/z = 435 [M+H]+.
化合物162B (50.0 mg, 0.0950 mmol) およびN,N-diisopropylethylamine (0.0366 mL, 0.210 mmol) のアセトニトリル (3 mL) 溶液に室温で、acetic anhydride (0.0100 mL, 0.106 mmol) を加え、6時間攪拌した。反応液を減圧下留去して得られた化合物163Aの粗生成物を精製することなく、次の工程に利用した。
MS: m/z = 567 [M+H]+.
第二工程
化合物163Aの粗生成物およびヨウ化ナトリウム (59.2 mg, 0.395 mmol) のアセトニトリル (5 mL)懸濁液に室温で、chlorotrimethylsilane (0.0487 mL, 0.381 mmol) を加え、16時間攪拌した。反応液に水 (0.5 mL) を加え、溶媒を減圧下留去して得られた残さをpreparative LCMSで精製し、化合物163 (28.1 mg, 2工程62%) を薄橙色foamとして得た。
1H-NMR (CDCl3) δ: 2.07 (3H, s), 3.24 (3H, s), 3.27 - 3.52 (4H, m), 3.67 (1H, m), 4.54 (1H, d, J = 13.5 Hz), 4.78 (1H, dd, J = 6.5, 14.9 Hz), 5.17 (1H, d, J = 13.5 Hz), 5.28 (1H, s), 5.61 (1H, s), 7.01 (2H, m), 7.01 - 7.58 (9H, m).
MS: m/z = 477 [M+H]+.
化合物155G (43.3 mg, 0.221 mmol) をトリフルオロ酢酸 (2 ml) に溶解させ、室温下1時間撹拌した。溶媒を留去し、残渣をジクロロメタン(2 ml) に溶解させ、飽和重曹水で中和した。得られた溶液をクエン酸水溶液で酸性にして、有機層を分離した。水層をジクロロメタンで1回抽出し、合わせた有機層を水洗後、硫酸ナトリウムで乾燥した。溶媒を留去後、得られた固体をジイソプロピルエーテルで洗浄し、22 mg (収率61%) の化合物164を得た。
1H-NMR (CDCl3) δ: 1.13 (6H, d, J = 6.0 Hz), 3.18-3.77 (7H, m), 3.26 (3H, s), 4.49 (1H, d, J = 12.3 Hz), 4.76 (1H, d, J = 12.3 Hz), 5.27 (2H, brs), 5.89 (1H, s), 6.90 ( 2H, d, J = 7.2 Hz), 6.98-7.14 (3H, m), 7.315-7.50 (5H, m).
化合物165A (WO2006/088173, 37.0 g, 108 mmol) のDMF (370 mL) 溶液に室温で、炭酸カリウム (17.9 g, 129 mmol) およびヨウ化メチル (8.03 mL, 129 mmol) を順次加えた後、1.5時間攪拌した。反応液を塩化アンモニウム (20.8 g, 390 mmol) の水 (1110 mL) 溶液に氷冷下加え、析出した固体を濾取し、水洗することにより粗生成物 (33 g) を得た。また水層を食塩で塩析した後、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた残さから粗生成物 (9 g) を得た。粗生成物を合わせてシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 50% → 100%) で精製し、化合物165B (36.5 g, 95 %) を白色固体として得た。
第二工程
化合物165B (36.5 g, 102 mmol) の1,4-ジオキサン (548 mL) 溶液に室温で、potassium osmate dihydrate (1.13 g, 3.06 mmol), 過ヨウ素酸ナトリウム (87.3 g, 408 mmol) および水 (365 mmol) を順次加えた後、6時間攪拌した。反応液を塩化メチレンで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 50% → 100%) で精製し、化合物165C (33.0 g, 90 %) を褐色foamとして得た。
第三工程
化合物165C (1.38 g, 3.66 mmol) のトルエン (25 mL) 懸濁液に室温で、ethylenediamine (0.247 mL, 3.66 mmol) および酢酸 (0.0210 mL, 0.366 mmol) を順次加えた後、1時間攪拌し、さらに50℃で17時間攪拌した。析出した固体を濾取した後、エーテルで洗浄し、化合物165D (1.11 g, 100 %) を薄黄色固体として得た。
1HNMR (DMSO-d6) δ: 3.05 (2H, m), 3.26 (1H, m), 3.63 (2H, m), 3.75 (3H, s), 3.87 (1H, m), 4.52 (1H, dd, J = 3.3, 12.6 Hz), 4.69 (1H, m), 4.99 (1H, d, J = 10.4 Hz), 5.15 (1H, d, J = 10.4 Hz), 7.35 (3H, m), 7.54 (2H, m), 8.41 (1H, s).
第四工程
化合物165D (2.77 g, 7.50 mmol), 炭酸カリウム (2.23 g, 16.1 mmol) およびヨウ化ナトリウム (102 mg, 0.680 mmol) のアセトニトリル (30 mL) 懸濁液に室温で、bromodiphenylmethane (2.26 g, 9.14 mmol) を加え、90℃で7時間攪拌した。反応液を塩酸 (2 N, 10 mL) と氷 (20 g) にあけ、クロロホルム (100 mL x 2) で抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (クロロホルム / メタノール = 0% → 5%) で精製し、化合物165E (2.72 g, 68 %) を薄黄色固体として得た。
第五工程
化合物165E (2.72 g, 5.08 mmol) のエタノール (30 mL) 溶液に室温で、水酸化ナトリウム水溶液 (2 N, 10 mL) を加え、3日間攪拌した。反応液に室温で、塩酸 (1 N, 20 mL) を加え (pH = 1)、クロロホルム (100 mL x 2) で抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (クロロホルム / メタノール = 0% → 10%) で精製し、化合物165F (1.77 g, 67 %) を薄黄色固体として得た。
1HNMR (DMSO-d6) δ: 2.63 (1H, m), 3.16 (1H, m), 3.49 (1H, m), 3.73 (1H, m), 4.12 (2H, m), 4.56 (1H, m), 5.04 (1H, s), 5.09 (1H, d, J = 10.7 Hz), 5.19 (1H, d, J = 10.7 Hz), 7.28 - 7.53 (15H, m), 8.32 (1H, s), 8.39 (1H, s).
第六工程
化合物165F (1.77 g, 3.39 mmol) および塩化リチウム (0.515 g, 12.2 mmol) のN,N’-dimethylimidazolidinone (20 mL) 溶液を90℃で1時間攪拌した。反応液に室温で、水 (10 mL)、塩酸 (2 N, 10 mL) および水 (10 mL) を順次加えた。析出した固体を濾取し、エーテルで洗浄した後、DMF-水を加えて析出した固体を濾取し、化合物165 (599 mg, 41 %) を白色固体として得た。
1HNMR (DMSO-d6) δ: 2.60 (1H, m), 3.20 (1H, m), 3.64 (2H, m), 4.00 (2H, m), 4.55 (1H, m), 5.01 (1H, s), 7.28 - 7.47 (10H, m), 8.16 (1H, s), 11.97 (1H, brs).
MS: m/z = 432 [M+H]+.
1HNMR (DMSO-d6) δ: 1.54 (1H, d, J = 12.6 H), 1.66-1.78 (1H, m), 2.60 (1H, t, J = 9.9 Hz), 2.83 (1H, d, J = 11.7 Hz), 3.01 (1H, t, J = 11.7 Hz), 3.34-3.38 (1H, m), 3.94 (1H, d, J = 13.8 Hz), 4.44-4.59 (3H, m), 4.82(1H, d, J = 14.7 Hz), 7.06 (2H, t, J = 8.7 Hz), 7.18-7.23 (2H, m), 8.27 (1H, s), 12.84 (1H, brs).
化合物167A (WO2006/11674, 3.58 g, 7.61 mmol)のキシレン (30 ml)溶液に、(S)-N1-ベンジル-3-フェニルプロパン-1,2-ジアミン (Journal of the American Chemical Society; English; 127; 30; 2005; 10504, 1.83 g, 7.61 mmol) と酢酸 (0.5 ml) を加え、2時間還流した。室温まで冷却後、溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し精製した。はじめにn-ヘキサン-酢酸エチル (9:1, v/v)で溶出し、次いでn-ヘキサン-酢酸エチル (1:1, v/v)で溶出した。目的の画分を濃縮すると油状物として 349 mg (収率7%) の化合物167Bを得た。
1HNMR (CDCl3) δ: 2.54 (1H, t, J = 9.6 Hz), 2.77 (1H, dd, J = 9.0 Hz, 13.2 Hz), 3.31 (1H, dd, J = 6.9 Hz, 9.6 Hz), 3.43-3.78 (5H, m), 4.04-4.15 (1H, m), 4.42-4.48 (1H, m), 4.62 (2H, d, J = 6.0 Hz), 5.29 (1H, d, J = 10.5 Hz), 5.43 (1H, d, J = 10.5 Hz), 6.77-6.85 (2H, m), 7.19-7.39 (14H, m), 7.60 (2H, d, J = 6.3 Hz), 8.05 (1H, s).
第二工程
化合物167B (968 mg, 1.47 mmol) のMeCN (10 ml) 溶液にBoc2O (3 ml) とDMAP (180 mg, 1.47 mmol)を加え、5時間加熱還流させた。反応液に、2規定水酸化ナトリウム水溶液を加えて反応を停止し、2規定塩酸を用いて中和した後に、酢酸エチルで3回抽出した。抽出液を飽和食塩水で洗浄後、溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し精製した。はじめにn-ヘキサン-酢酸エチル (6:4, v/v)で溶出し、次いで酢酸エチルのみで溶出した。目的の画分を濃縮し固体として349 mg (収率 45%) の167Cを得た。
1HNMR (CDCl3) δ: 2.54 (1H, t = 9.0 Hz), 2.76 (1H, dd, J = 9.3 Hz, 16.5 Hz), 3.31 (1H, dd, J = 6.9 Hz, 9.6 Hz), 3.45 (1H, dd, J = 3.3 Hz, 12.6 Hz), 3.51-3.78 (4H, m), 4.04-4.13 (1H, m), 4.42-4.52 (1H, m), 4.61 (2H, d, J = 6.0 Hz), 2.79 (1H, d, J = 10.2 Hz), 5.29 (1H, d, J = 10.2 Hz), 5.43 (1H, d, J = 10.2 Hz), 6.76-7.39 (11H, m), 7.60 (2H, d, J = 6.6 Hz), 8.05 (1H, s), 10.42 (1H, t, J = 5.7 Hz).
第三工程
上記化合物167C (150 mg, 0.280 mmol) をトリフルオロ酢酸 (2 ml) に溶解させ、室温下1時間撹拌した。溶媒を留去し、残渣をジクロロメタン(2 ml) に溶解させ、飽和重曹水で中和した。得られた溶液をクエン酸水溶液で酸性にして、有機層を分離した。水層をジクロロメタンで1回抽出し、合わせた有機層を水洗後、硫酸ナトリウムで乾燥した。溶媒を留去後、得られた固体をジイソプロピルエーテルで洗浄し、71 mg (収率57%) の化合物167を得た。
1HNMR (CDCl3) δ: 2.65 (1H, dd, J = 8.4 Hz, 9.6 Hz), 2.97 (1H, dd, J = 9 Hz, 13.5 Hz), 3.43 (1J, dd, J = 7.2 Hz, 9.6 Hz), 3.55 (1H, dd, J = 3.0 Hz, 13.2 Hz), 3.61-3.80 (4H, m), 4.15 (1H, dd, J = 4.2 Hz, 9.9 Hz), 4.51-4.60 (1H, m), 7.15-7.18 (2H, m), 7.28-7.38 (8H, m), 8.02 (1H, s), 12.04 (1H, s).
化合物168A (WO2006/116764, 400 mg, 0.840 mmol) のDMF (3 mL) 溶液に炭酸セシウム (821 mg, 2.52 mmol) 続いてブロモメチレンジベンゼン (311 mg, 1.26 mmol) を加え、100℃で5時間撹拌した。反応液に2N 塩酸水溶液、水、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで1回、抽出した。合わせた抽出液を飽和炭酸水素ナトリウム水溶液、brineで洗浄、硫酸マグネシウムで乾燥した後、ろ過、濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。目的の画分を濃縮すると黄色オイルとして 100 mg の化合物168Bを得た。
1H-NMR (CDCl3) δ: 1.79-1.84 (2H, m), 2.67-2.77 (1H, m), 2.84-3.05 (2H, m), 4.03 (1H, dd, J = 13.0, 4.2 Hz), 4.28 (1H, dd, J = 13.6, 6.5 Hz), 4.49 (1H, dd, J = 6.4, 3.8 Hz), 4.57 (2H, d, J = 5.7 Hz), 4.78 (1H, dd, J = 13.4, 5.7 Hz), 4.93 (1H, s), 5.27 (2H, s), 7.00 (2H, t, J = 8.8 Hz), 7.15-7.37 (14H, m), 7.57-7.63 (2H, m), 7.76 (1H, s), 10.44 (1H, t, J = 5.9 Hz).
MS: m/z = 643.20 [M+H] +.
第二工程
化合物168B (100 mg, 0.156 mmol) を アセトニトリル (3 mL) に溶解し、Boc2O (4.0 mL, 17.3 mmol) 続いてDMAP (84 mg, 0.69 mmol) を加え、80℃で6時間攪拌した。反応液を放冷し、2N 水酸化ナトリウム水溶液 (8 mL) 続いてエタノール (3 mL)を加え、60℃で2時間攪拌した。反応液に2N 塩酸水溶液、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。溶媒を留去し、得られた残渣をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-メタノールで溶出し、目的の画分を濃縮すると84 mg の化合物168Cを得た。
MS: m/z = 536.25 [M+H] +.
第三工程
化合物168C (80 mg, 0.15 mmol) の DMI (2 mL) 溶液に塩化リチウム (19 mg, 0.45 mmol) を加え、90℃で2時間攪拌した。反応混合物に水、2N 塩酸水溶液を加え、析出した固体を濾取し、得られた固体をLCMS分取装置を用いて精製した。 溶出溶媒を留去し、残渣にイソプロピルエーテルを加え、析出した固体を濾取した。イソプロピルエーテルで洗浄、乾燥することにより、 12 mgの化合物168を得た。
MS: m/z = 446.05 [M+H]+.
化合物95A (WO2006/116764, 500 mg, 2.03 mmol) の エタノール (5 mL) 溶液に2, 2-ジメトキシエタンアミン (0.49 ml, 4.47 mmol) を加え、80℃で3時間撹拌した。反応液を放冷した後、室温で酢酸 (0.27 ml, 4.69 mmol) を加え、減圧下で濃縮した。得られた残渣をDMF (5 mL) に溶解し、窒素雰囲気下、DBU (0.66 mL, 4.4 mmol) 続いてヨウ化メチル (1.02 mL, 16.2 mmol) を加え、室温で3時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、ろ過、濃縮し、得られた残渣をシリカゲルクロマトグラフィーに付し、精製した。クロロホルム-メタノール(9:1)で溶出し、目的の画分を濃縮すると茶色オイルとして258 mg の化合物169Aを得た。
1H-NMR (CDCl3) δ: 3.37 (6H, s), 3.80 (3H, s), 3.87 (2H, d, J = 4.8 Hz), 4.46 (1H, t, J = 4.8 Hz), 5.30 (2H, s), 6.75 (1H, d, J = 6.0 Hz), 7.30-7.41 (6H, m).
第二工程
化合物169A (1.00 g, 2.88 mmol) にギ酸 (31 mL) 続いて水 (5 mL) を加え、70℃で6.5時間攪拌した。反応混合物に水、酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液を飽和炭酸水素ナトリウム水溶液で洗浄した後、硫酸ナトリウムを加え、ろ過、濃縮し、得られた残渣をシリカゲルクロマトグラフィーに付し、精製した。酢酸エチル-メタノールで溶出し、目的の画分を濃縮すると無色透明油状物としてアルデヒド水和物およびメチルアセタールの混合物を得た。得られた油状物をジクロロメタン (5 mL) に溶解し、1,3-ジアミノプロパン二塩酸塩 (354 mg, 2.41 mmol) 続いて酢酸 (0.069 ml, 1.2 mmol) を加え、室温で6時間攪拌した。反応液をジクロロメタンで希釈し、不溶物をろ過した後、減圧下で濃縮し、化合物169Bの粗精製物を得た。
MS: m/z =326.20 [M+H]+.
第三工程
化合物169B (391 mg, 1.20 mmol) のアセトニトリル (4 mL) 溶液に炭酸カリウム (498 mg, 3.61 mmol) 続いてブロモメチレンジベンゼン (890 mg, 3.61 mmol) を加えた。反応液を90℃で2時間撹拌後、反応液に水、酢酸エチル、brineを加え、酢酸エチル層を分離し、水層を酢酸エチルで1回、抽出した。合わせた抽出液を硫酸マグネシウムで乾燥させた後、ろ過、濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィーに付し、精製した。酢酸エチル-メタノールで溶出し、目的の画分を濃縮すると橙色固体として 106 mg の化合物169Cを得た。
MS: m/z = 492.15 [M+H] +.
第四工程
化合物169C (105 mg, 0.214 mmol) の DMI (2 mL) 溶液に塩化リチウム (27.2 mg, 0.641 mmol) を加え、90℃で3時間攪拌した。さらに塩化リチウム (27.2 mg, 0.641 mmol) を加え、90℃で1時間攪拌した。反応液を減圧下で濃縮し、得られた残渣をLCMS分取装置を用いて精製した。 溶出溶媒を留去し、残渣にジエチルエーテルを加え、析出した固体を濾取した。ジエチルエーテルで洗浄、乾燥することにより、 27 mgの化合物169を得た。
1H-NMR (CD3OD) δ: 1.63 (1H, dd, J = 13.4, 2.8 Hz), 1.84 (1H, br s), 2.55-2.64 (1H, m), 2.90-3.10 (2H, m), 4.30 (1H, dd, J = 14.5, 4.0 Hz), 4.52 (4H, dd, J = 14.5, 3.8 Hz), 4.63-4.75 (4H, m), 5.16 (1H, s), 6.16 (1H, d, J = 7.2 Hz), 6.78 (1H, d, J = 7.2 Hz), 7.16-7.32 (10H, m).
MS: m/z = 402.10 [M+H]+.
化合物49F (87 mg, 0.19 mmol) をエタノール (1 ml) とTHF (1 ml) に溶解し、2規定水酸化ナトリウム水溶液 (0.47 ml, 0.95 mmol) を加えて室温で1.5時間攪拌した。反応液に2規定塩酸を加えて酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5→90:10, v/v) で精製し、60 mg の化合物170Aを得た。
1H-NMR (CDCl3) δ: 2.48 (1H, dd, J = 13.8, 11.8 Hz), 3.27 (1H, dd, J = 14.2, 3.4 Hz), 3.73-3.80 (1H, m), 3.92 (1H, m), 4.16 (1H, m), 4.45 (2H, m), 5.34 (1H, d, J = 3.5 Hz), 5.47 (1H, d, J = 10.4 Hz), 5.52 (1H, d, J = 10.7 Hz), 6.73 (2H, d, J = 6.9 Hz), 7.18-7.42 (7H, m), 7.60 (2H, d, J = 6.9 Hz), 14.63 (1H, s).
第二工程
化合物170A (57 mg, 0.13 mmol) にトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを3に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐エチルエーテルを加えて析出した固体を濾取し、無色固体として19 mg の化合物170を得た。
1H-NMR (DMSO-d6) δ: 2.74 (1H, t, J = 12.1 Hz), 3.10-3.22 (1H, m), 3.76 (2H, m), 4.12 (1H, q, J = 8.0 Hz), 4.44 (1H, m), 5.35 (1H, m), 5.49 (1H, d, J = 3.4 Hz), 7.05 (5H, m), 7.77 (1H, s), 12.05 (1H, brs).
化合物49B (950 mg, 3.35 mmol) と3-aminopropan-1-ol (277 mg, 3.69 mmol) と硫酸ナトリウム(1.91 g, 13.4 mmol)をトルエン (25 ml) に加え、室温で1時間攪拌した。Boc2O (0.856 ml, 3.69 mmol) を室温で加え、そのまま18時間攪拌した。さらにBoc2O (0.400 ml, 1.72 mmol) を室温で加え、そのまま60時間時間攪拌した。反応液をろ過し、ろ液を減圧濃縮した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色ガム状物質として171Aを1.02 g得た。
第二工程
化合物171A (1.01 g, 2.29 mmol) とパラジウム‐活性炭素 (10%, wet, 200 mg) をエタノール (20ml) に加え、水素雰囲気下、室温で1.5時間攪拌した。セライトろ過した後、溶媒を減圧濃縮して無色オイル状物質171Bを755 mg得た。
1H-NMR (CDCl3) δ: 1.42 (5H, s), 1.49 (4H, s), 1.56-1.92 (2H, m), 2.49 (0.4H, dd, J = 13.6, 9.8 Hz), 2.62 (0.6H, dd, J = 13.6, 8.5 Hz), 2.81 (0.4H, dd, J = 13.5, 3.6 Hz), 3.16 (1.6H, m), 3.60-4.14 (4H, m), 5.13 (0.6H, d, J = 8.8 Hz), 5.19 (0.4H, d, J = 8.5 Hz), 7.22-7.37 (5H, m).
第三工程
dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (660 mg, 1.99 mmol) と171B (609 mg, 1.99 mmol) をトルエン (8 ml) に加え、100℃で1.5時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 99:1, v/v) で精製し、淡黄色ガム状物質として 1.02 g の化合物171Cを得た。
第四工程
化合物171C (991 mg, 1.60 mmol) に4規定 HCl (酢酸エチル溶液, 12 ml) を加えた。室温で1時間攪拌した後、溶媒を減圧留去した。続いてトルエン (12 ml) と3-aminopropan-1-ol (0.244 ml, 3.19 mmol) を加え、80℃で10分攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 99:1→95:5→90:10, v/v) で精製し、黄色ガム状物質の化合物171D 341 mgと無色固体の化合物171E 338 mgを得た。
171D: 1H-NMR (CDCl3) δ: 1.29 (3H, t, J = 7.1 Hz), 1.51 (1H, d, J = 13.7 Hz), 1.97 (1H, m), 2.91 (1H, dd, J = 13.8, 9.8 Hz), 2.99-3.10 (2H, m), 3.90 (1H, td, J = 12.1, 2.5 Hz), 4.12 (2H, m), 4.25 (2H, m), 4.83 (2H, m), 5.33 (1H, d, J = 10.1 Hz), 5.51 (1H, d, J = 10.1 Hz), 6.88 (2H, m), 7.23-7.40 (7H, m), 7.68 (2H, m)
171E: 1H-NMR (CDCl3) δ: 1.19 (3H, t, J = 7.2 Hz), 1.82-1.99 (2H, m), 2.73 (1H, dd, J = 14.0, 11.3 Hz), 3.13 (1H, m), 3.35 (1H, dd, J = 14.0, 3.4 Hz), 3.63 (1H, m), 3.90-4.26 (4H, m), 4.43 (1H, d, J = 13.6 Hz), 5.27 (1H, t, J = 3.5 Hz), 5.31 (2H, s), 6.78 (2H, dd, J = 6.3, 3.2 Hz), 7.01 (1H, d, J = 7.0 Hz), 7.18 (3H, t, J = 3.1 Hz), 7.28-7.39 (3H, m), 7.67 (2H, m).
第五工程
化合物171D (329 mg, 0.673 mmol) をエタノール (2 ml) とTHF (4 ml) に溶解し、2規定水酸化ナトリウム水溶液 (1.69 ml, 3.38 mmol) を加えて室温で1時間攪拌した。反応液に2規定塩酸を加えて酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧濃縮することにより、無色固体として215 mg の化合物171Fを得た。
MS: m/z = 461 [M+H]+.
第六工程
化合物171F (50 mg, 0.11 mmol) にトリフルオロ酢酸 (2 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム‐メタノール‐エチルエーテルを加えて析出した固体を濾取し、無色固体として24 mg の化合物171を得た。
1H-NMR (DMSO-d6) δ: 1.63 (1H, d, J = 12.6 Hz), 1.83 (1H, m), 2.96-3.29 (3H, m), 4.05 (2H,m), 4.55 (1H, dd, J = 13.2, 4.4 Hz), 5.08 (1H, dd, J = 9.2, 5.4 Hz), 5.30 (1H, s), 7.19 (5H, m), 8.09 (1H, s), 12.84 (1H, brs).
MS: m/z = 371 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.91 (2H, m), 2.94 (1H, dd, J = 14.0, 10.8 Hz), 3.11-3.21 (3H, m), 3.71 (1H, m), 4.19 (1H, m), 4.29-4.35 (1H, m), 5.08-5.14 (1H, m), 5.47 (1H, d, J = 4.0 Hz), 6.92-7.22 (5H, m), 7.71 (1H, s), 12.80 (1H, brs), 15.06 (1H, brs).
MS: m/z = 371 [M+H]+.
化合物171F (159 mg, 0.345 mmol) をジフェニルエーテル (2.5 ml) に加え、マイクロウェーブ照射下、245℃で1時間攪拌した。反応液をn-ヘキサンにあけ、析出した固体を濾取した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 95:5→90:10, v/v) で精製し、化合物173Aを得た。
第二工程
第一工程で得られた化合物173Aにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として10 mg の化合物173を得た。
1H-NMR (DMSO-d6) δ: 1.55-1.86 (2H, m), 2.84-3.26 (3H, m), 3.92-4.09 (2H, m), 4.55 (2H, m), 5.15 (1H, s), 5.89 (1H, d, J = 7.5 Hz), 7.17 (6H, m), 12.11 (1H, brs)
MS: m/z = 327 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.86 (2H, m), 2.87 (1H, t, J = 12.3 Hz), 3.18 (2H, m), 3.68 (1H, t, J = 10.4 Hz), 4.16 (1H, d, J = 10.1 Hz), 4.29 (1H, d, J = 12.4 Hz), 4.71 (1H, d, J = 9.2 Hz), 5.37 (1H, d, J = 3.5 Hz), 5.75 (1H, d, J = 7.5 Hz), 7.00 (6H, m), 12.51 (1H, brs).
MS: m/z = 327 [M+H]+.
Dess-Martin Periodinane (0.3M, 塩化メチレン溶液, 25.0 ml, 7.50 mmol) に化合物2B (1.98 g, 5.48 mmol) の塩化メチレン溶液 (10 ml) を0℃で滴下した。室温で3時間攪拌の後、1規定水酸化ナトリウム水溶液にあけ、エチルエーテルで抽出した。有機層を1規定水酸化ナトリウム水溶液と飽和食塩水で洗浄し、硫酸マグネシウムで乾燥した。溶媒を減圧留去した後、シリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 2:1, v/v) で精製し、白色固体として化合物175Aを1.73 g得た。
1H-NMR (CDCl3) δ: 4.55 (1H, d, J = 7.3 Hz), 5.09 (2H, s), 5.14 (2H, m), 7.22-7.35 (15H, m), 9.62 (1H, s).
第二工程
化合物175A (1.30 g, 4.59 mmol) と3-aminopropan-1-ol (379 mg, 5.05 mmol) と硫酸ナトリウム (3.26 g, 22.4 mmol) をトルエン (40 ml) に加え、室温で1時間攪拌した。Boc2O (1.17 ml, 5.05 mmol) を室温で加え、そのまま18時間攪拌した。Boc2O (1.17 ml, 5.05 mmol) と硫酸ナトリウム (3.26 g, 22.4 mmol) を加え、60時間攪拌した。反応液をろ過し、ろ液を減圧濃縮した。得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、無色固体として175Bを635 mg得た。
第三工程
化合物175B (632 mg, 1.22 mmol) とパラジウム‐活性炭素 (10%, wet, 100 mg) をエタノール (10ml) とTHF (5 ml) に加え、水素雰囲気下、室温で3時間攪拌した。セライトろ過した後、溶媒を減圧濃縮して無色オイル状物質175Cを502 mg得た。
1H-NMR (CDCl3) δ: 1.45 (9H, s), 1.77 (2H, m), 3.18-3.27 (1H, m), 3.43-3.51 (1H, m), 4.04 (4H, m), 4.92 (1H, d, J = 4.7 Hz), 7.28 (10H, m).
第四工程
dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (390 mg, 1.22 mmol) と175C (468 mg, 1.22 mmol) をトルエン (5 ml) に加え、100℃で2時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル, 1:1, v/v) で精製し、淡黄色ガム状物質として 391 mg の化合物175Dを得た。
第五工程
化合物175D (388 mg, 0.568 mmol) に4規定 HCl (酢酸エチル溶液, 4 ml) を加えた。室温で1時間攪拌した後、溶媒を減圧留去した。続いてトルエン (4 ml) と3-aminopropan-1-ol (0.0870 ml, 1.14 mmol) を加え、80℃で5時間攪拌した。溶媒を減圧留去した後、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 98:2, v/v) で精製し、黄色ガム状物質の化合物175E 57 mgと茶色ガム状物質の化合物175F 44 mgを得た。
175E: 1H-NMR (CDCl3) δ: 1.91-2.00 (2H, m), 2.87 (1H, m), 3.78 (3H, s), 3.87 -4.15 (3H, m), 4.61 (1H, d, J = 12.1 Hz), 4.78 (2H, m), 5.33 (1H, d, J = 10.2 Hz), 5.63 (1H, d, J = 10.2 Hz), 6.95 (2H, m), 7.13-7.53 (12H, m), 7.76 (2H, m)
175F: 1H-NMR (CDCl3) δ: 1.83-1.97 (2H, m), 3.12-3.22 (1H, m), 3.50 (1H, m), 3.85 (3H, s), 3.90 (1H, m), 4.34-4.40 (1H, m), 4.74 (1H, d, J = 8.6 Hz), 4.84-4.89 (1H, m), 5.09 (1H, d, J = 3.3 Hz), 5.15 (1H, d, J = 9.9 Hz), 5.26 (1H, d, J = 9.6 Hz), 7.08-7.50 (13H, m), 7.65-7.77 (3H, m).
第六工程
化合物175E (57 mg, 0.10 mmol) をTHF (0.5 ml) とエタノール (0.5 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (0.25 ml, 0.50 mmol) を加えてそのまま1時間攪拌した。1規定塩酸を加えてからクロロホルムで抽出した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 98:2, v/v) で精製し、化合物175Gを得た。
第七工程
第六工程で得られた化合物175Gにトリフルオロ酢酸 (1 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを3に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、クロロホルム-メタノール-エチルエーテルを加えて析出した固体を濾取し、無色固体として11 mg の化合物175を得た。
1H-NMR (DMSO-d6) δ: 1.50 (1H, d, J = 13.1 Hz), 1.79 (1H, m), 3.17 (1H, m), 3.86 (1H, t, J = 11.0 Hz), 4.03 (1H, dd, J = 10.8, 4.1 Hz), 4.46 (1H, d, J = 12.0 Hz), 4.53 (1H, dd, J = 12.7, 4.2 Hz), 4.84 (1H, s), 5.85 (1H, d, J = 11.7 Hz), 7.22 (7H, m), 7.44 (2H, t, J = 7.6 Hz), 7.65 (2H, d, J = 7.3 Hz), 8.14 (1H, s), 12.75 (1H, s), 15.33 (1H, brs).
MS: m/z = 447 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.75 (2H, m), 3.17 (2H, m), 3.43 (1H, m), 3.60 (1H, d, J = 10.7 Hz), 4.31 (1H, d, J = 12.7 Hz), 4.73 (1H, d, J = 9.8 Hz), 5.52 (1H, d, J = 3.4 Hz), 5.87 (1H, dd, J = 9.9, 3.4 Hz), 7.10 (7H, m), 7.29 (2H, t, J = 7.5 Hz), 7.58 (2H, d, J = 7.3 Hz), 8.37 (1H, s), 12.65 (1H, brs).
MS: m/z = 447 [M+H]+.
文献 (Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry (1972-1999), 1975 , p.1712) の方法に従い合成したtert-butyl pyrazolidine-1-carboxylate (275 mg, 1.60 mmol) と化合物95B (409 mg, 1.45 mmol) をピリジン (5 ml) に溶解し、室温でHATU (607 mg, 1.60 mmol) を加えてそのまま18時間攪拌した。反応液を1規定塩酸にあけ、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5, v/v) で精製し、黄色固体として529 mgの化合物177Aを得た。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 1.88-2.10 (2H, m), 3.04 (1H, s), 3.31 (1H, s), 3.86 (2H, m), 4.96 (1H, d, J = 9.3 Hz), 5.45 (1H, d, J = 11.0 Hz), 6.56 (1H, d, J = 6.7 Hz), 7.29-7.43 (6H, m).
第二工程
化合物177A (525 mg, 1.31 mmol) に4規定 HCl (ジオキサン溶液, 6 ml) を加えた。室温で1.5時間攪拌した後、溶媒を減圧留去し、無色固体の化合物177B 413 mgを得た。
1H-NMR (DMSO-d6) δ: 1.95-2.05 (2H, m), 2.78 (2H, t, J = 6.6 Hz), 3.41-3.54 (2H, m), 5.11 (2H, s), 7.38 (5H, m), 7.46 (1H, d, J = 6.6 Hz), 8.36 (1H, d, J = 6.7 Hz).
第三工程
化合物177B (100 mg, 0.298 mmol) をエタノール (2 ml) に加え、2,2-diphenylacetaldehyde (58 mg, 0.30 mmol) とトリエチルアミン (0.083 ml, 0.596 mmol) と酢酸 (0.051 ml, 0.89 mmol) を加えて80℃で3時間攪拌した。反応液を水にあけ、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。媒を減圧留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー (クロロホルム-メタノール, 97:3→95:5→93:7→90:10, v/v) で精製し、黄色ガム状物質として106 mgの化合物177Cを得た。
MS: m/z = 478 [M+H]+.
第四工程
第三工程で得られた化合物177Cにトリフルオロ酢酸 (2 ml) を加えて、室温で1時間攪拌した。減圧濃縮した後、重曹水と2規定塩酸でpHを6に調節し、クロロホルムで抽出して硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、塩化メチレン-エチルエーテルを加えて析出した固体を濾取し、無色固体として7 mg の化合物177を得た。
1H-NMR (DMSO-d6) δ: 1.95 (2H, m), 2.76 (1H, m), 2.96-3.17 (2H, m), 4.04 (1H, m), 4.68 (1H, d, J = 10.4 Hz), 5.66 (1H, d, J = 7.3 Hz), 6.56 (1H, d, J = 10.5 Hz), 7.03 (1H, d, J = 7.2 Hz), 7.17 (6H, m), 7.34 (2H, t, J = 7.3 Hz), 7.55 (2H, d, J = 7.5 Hz).
MS: m/z = 388 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.55 (4H, m), 2.35-7.49 (1H, m), 2.39 (1H, t, J = 12.6 Hz), 2.77 (1H, t, J = 10.0 Hz), 3.09 (1H, d, J = 11.4 Hz), 4.34 (1H, d, J = 12.8 Hz), 4.55 (1H, d, J = 10.8 Hz), 5.71 (1H, d, J = 7.0 Hz), 6.17 (1H, d, J = 10.8 Hz), 6.82 (1H, d, J = 7.3 Hz), 7.13-7.40 (8H, m), 7.48 (2H, d, J = 7.3 Hz).
MS: m/z = 402 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.31 (6H, m), 2.68 (2H, m), 3.21 (1H, m), 4.04 (1H, m), 4.40 (1H, d, J = 10.8 Hz), 5.77 (1H, t, J = 5.2 Hz), 6.26 (1H, d, J = 10.8 Hz), 6.78 (1H, d, J = 7.3 Hz), 7.27 (8H, m), 7.53 (2H, d, J = 7.2 Hz).
MS: m/z = 416 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.78-3.74 (7H, m), 4.17 (1H, m), 4.49 (1H, d, J = 10.8 Hz), 5.79 (1H, d, J = 7.2 Hz), 6.32 (1H, d, J = 10.8 Hz), 6.79 (1H, d, J = 7.2 Hz), 7.28 (8H, m), 7.55 (2H, d, J = 7.6 Hz).
MS: m/z = 418 [M+H]+.
1H-NMR (CDCl3) δ: 1.05 (3H, d, J = 6.9 Hz), 1.04-1.14 (4H, m), 4.49 (1H, d, J = 13.2 Hz), 4.83 (1H, d, J = 13.2 Hz), 4.91-4.99 (1H. m), 5.73 (1H, d, J = 7.8 Hz), 6.50 (1H, s), 6.70 ( 1H, d, J = 7.8 Hz), 7.12-7.30 (4H, m), 7.33-7.43 (2H, m), 7.46-7.54 (1H, m), 8.06 (1H, d, J = 7.5 Hz).
1H-NMR (CDCl3) δ: 1.14 (6H, d, J = 6.9 Hz), 4.59 (1H, d, J = 12.6 Hz), 4.77 (1H, d, J = 12.6 Hz), 4.81-4.91 (1H, m), 5.82 (1H, d, J = 7.5 Hz), 5.82 (1H, s), 6.71 (1H, brs), 6.78 (1H, brs), 6.87 (1H, d, J = 7.5 Hz), 7.05 (1H, brs), 7.16 (1H, brs), 7.25 (1H, brs), 7.41 (1H, brs).
第一工程
化合物246A(5.30 g, 18.76 mmol)と炭酸カリウム(5.19 g, 27.53 mmol)のジメチルホルムアミド(20 ml)溶液にベンジルブロミド(3.21 g, 18.76 mmol)を加え、室温下1時間撹拌した。反応液に酢酸エチル(80 ml)を加え、不溶物をろ去後、1規定塩酸を加えた。有機層を分離し、水槽を酢酸エチルで2回抽出した。合わせた有機層を1回水洗し、さらに重曹水、飽和食塩水で1回ずつ洗浄した。得られた溶液を硫酸ナトリウムで乾燥後、溶媒を留去すると油状物として6.98 gの化合物246Bを得た。
1H-NMR (CDCl3) δ: 5.36 (2H, s), 7.35-7.47 (6H, m), 7.78 (1H, d, J = 8.4 Hz), 8.01 (1H, d, J = 2.1 Hz).
第二工程
化合物246B(3 g, 8.05 mmol)と1-chloro-3-ethynylbenzene(1.32 g, 9.66 mmol)とトリエチルアミン(4.07 g, 40.25 mmol)のジメチルホルムアミド(15 ml)溶液に、窒素雰囲気下、塩化銅(76.6 mg, 0.403 mmol)とdichlorobis(triphenylphosphine)palladium(282.5 mg, 0.403 mmol)を加え、室温で5時間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。合わせた抽出液を3回水洗後、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに ヘキサンで溶出し、次いでヘキサン-酢酸エチル (7:3, v/v) で溶出した。目的の画分を濃縮すると油状物として 3.10 g の化合物246Cを得た。
1H-NMR (CDCl3) δ: 5.39 (2H, s), 7.21-7.46 (9H, m), 7.62 (1H, d, J = 2.1 Hz), 7.98 (1H, d, J = 8.4 Hz).
第三工程
化合物246C(3.10 g, 8.05 mmol)のメタノール(30 ml)溶液に10%パラジウムカーボン(620 mg, 20 wt%)を加え、室温下、1気圧水素雰囲気下で撹拌した。反応液をセライトろ過し、溶媒を留去して得られた粗生成物に酢酸エチル-ジイソプロピルエーテルを加え、析出した残渣をろ過し、固体として618 mg の化合物246Dを得た。
1H-NMR (CDCl3) δ: 2.90 (2H, dd, J = 7.8 Hz, 10.8 Hz), 3.29 (2H, dd, J = 7.5 Hz, 10.5 Hz), 7.06-7.09 (1H, m), 7.18-7.25 (4H, m), 7.31 (1H, dd, J = 2.1 Hz, 8.7 Hz), 8.05 (1H, d, J = 8.4 Hz).
第四工程
化合物246D(2.20 g, 7.45 mmol)にポリリン酸(20 g)を加え、200℃で1時間撹拌した。室温まで放冷後、水を加え、酢酸エチルで3回抽出した。合わせた抽出液を飽和重曹水で1回洗浄し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに ヘキサンで溶出し、次いでヘキサン-酢酸エチル (7:3, v/v) で溶出した。目的の画分を濃縮すると油状物として 1.05 g の化合物246Eを得た。
1H-NMR (CDCl3) δ: 3.17 (4H, s), 7.24 (2H, d, J = 2.1 Hz), 7.32 (2H, dd, J = 2.1 Hz, 8.4 Hz, 8.00 (2H, d, J = 8.4 Hz).
第五工程
水素化ほう素ナトリウム(409 mg, 10.82 mmol)のメタノール(10 ml)懸濁液を1-3℃に冷却し、同温度を保ちながら化合物246E(1.0 g, 3.61 mmol)を加えた。反応液を同温度で30分間撹拌後、水を加えた。析出した固体をろ取すると、968 mgの化合物246Fを得た。
1H-NMR (CDCl3) δ: 2.25 (1H, d, J = 3.0 Hz), 3.05-3.16 (2H, m), 3.27-3.38 (2H, m), 5.95 (1H, d, J = 3.0 Hz), 7.14-7.17 (4H, m), 7.39 (2H, d, J = 8.1 Hz).
第六工程
参考例107に従い、化合物246を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.14 (3H, d, J = 6.9 Hz), 1.20 (3H, d, J = 6.9 Hz), 2.79 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.4 Hz), 2.99-3.11 (1H, m), 3.50 (1H, ddd, J = 4.8 Hz, 4.8 Hz), 17.7 Hz), 4.21-4.33 (1H, m), 4.23 (1H, d, J = 12.9 Hz), 4.62-4.74 (2H, m), 5.04 (1H, s), 5.84 (1H, d, J = 7.8 Hz), 6.57 (1H, d, J = 8.1 Hz), 6.65-6.72 (2H, m), 6.89-6.92 (1H, m), 7.11-7.30 (4H, m).
1H-NMR (DMSO-d6) δ: 2.88 (3H,m), 3.43 (2H, m), 3.69 (1H, dt, J = 16.9, 5.1 Hz), 4.01 (1H, d, J = 13.4 Hz), 4.07-4.17 (2H, m), 4.97 (1H, d, J = 13.4 Hz), 5.24 (1H, s), 5.50 (1H, d, J = 7.6 Hz), 6.73 (1H, d, J = 7.2 Hz), 6.85-6.94 (2H, m), 7.14-7.41 (6H, m), 11.73 (1H, s).
MS: m/z = 432 [M+H] +.
1H-NMR (DMSO-d6) δ: 2.80 (1H, td, J = 9.6, 4.5 Hz), 2.86-2.99 (1H, m), 3.00-3.18 (1H, m), 3.67 (1H, dt, J = 17.1, 5.0 Hz), 4.03-4.19 (2H, m), 4.32-4.52 (1H, m), 5.05 (1H, d, J = 13.3 Hz), 5.26 (1H, s), 5.53 (1H, d, J = 7.6 Hz), 6.17 (1H, tt, J = 55.0, 3.5 Hz), 6.72 (1H, d, J = 7.5 Hz), 6.87-6.94 (2H, m), 7.12-7.27 (3H, m), 7.30-7.43 (3H, m).
MS: m/z = 438 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.80 (1H, dt, J = 14.2, 5.1 Hz), 2.86-2.99 (1H, m), 3.00-3.18 (1H, m), 3.68 (1H, dt, J = 16.9, 5.3 Hz), 4.05 (1H, d, J = 13.3 Hz), 4.07-4.32 (2H, m), 4.37-4.52 (1H, m), 4.53-4.67 (1H, m), 5.02 (1H, d, J = 13.0 Hz), 5.26 (1H, s), 5.50 (1H, d, J = 7.8 Hz), 6.73 (1H, d, J = 7.6 Hz), 6.85-6.94 (2H, m), 7.12-7.27 (3H, m), 7.30-7.43 (3H, m).
MS: m/z = 420 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.76-3.00 (2H, m), 3.46-3.73 (2H, m), 4.06-4.22 (2H, m), 4.77-4.91 (1H, m), 5.15 (1H, d, J = 12.9 Hz), 5.24 (1H, s), 5.56 (1H, d, J = 7.7 Hz), 6.72 (1H, d, J = 7.1 Hz), 6.88-6.95 (1H, m), 6.96 (1H, d, J = 7.7 Hz), 7.09-7.41 (7H, m).
MS: m/z = 456 [M+H]+
1H-NMR (DMSO-d6) δ: 2.74-2.99 (2H, m), 3.62-3.73 (1H, m), 4.01-4.20 (3H, m), 5.12 (1H, d, J = 13.2 Hz), 5.15 (1H, d, J = 15.7 Hz), 5.34 (1H, s), 5.52 (1H, d, J = 7.7 Hz), 6.78 (1H, d, J = 8.0 Hz), 6.89-6.96 (2H, m), 7.10-7.23 (5H, m), 7.27-7.35 (3H, m), 7.43 (1H, d, J = 7.7 Hz), 7.79 (1H, td, J = 7.6, 1.8 Hz), 8.45-8.50 (1H, m).
MS: m/z = 465 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.76-2.86 (1H, m), 2.87-3.01 (1H, m), 3.59-3.70 (1H, m), 4.12-4.25 (1H, m), 4.29 (1H, d, J = 13.5 Hz), 4.90 (1H, d, J = 13.2 Hz), 5.20 (1H, s), 5.49 (1H, d, J = 7.4 Hz), 6.75 (1H, d, J = 8.0 Hz), 6.81 (1H, d, J = 7.4 Hz), 6.91 (1H, t, J = 6.6 Hz), 7.12-7.21 (2H, m), 7.22-7.30 (1H, m), 7.33-7.38 (2H, m), 7.46 (1H, d, J = 7.4 Hz).
MS: m/z = 430 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.05 (3H, t, J = 7.2 Hz), 2.80 (1H, dt, J = 14.4, 5.1 Hz), 2.85-2.99 (2H, m), 3.68 (1H, dt, J = 16.8, 5.0 Hz), 3.74-3.87 (1H, m), 4.02 (1H, d, J = 13.3 Hz), 4.06-4.19 (1H, m), 4.98 (1H, d, J = 13.1 Hz), 5.22 (1H, s), 5.48 (1H, d, J = 7.6 Hz), 6.73 (1H, d, J = 7.5 Hz), 6.83-6.94 (2H, m), 7.12-7.40 (6H, m).
MS: m/z = 402 [M+H]+.
1H-NMR (CDCl3) δ: 1.74-1.86 (2H, m), 2.71-2.82 (1H, m), 2.83-2.93 (1H, m), 2.98-3.11 (1H, m), 3.25 (3H, s), 3.39 (2H, t, J = 5.4 Hz), 3.62-3.74 (1H, m), 4.02-4.14 (2H, m), 4.16-4.28 (1H, m), 4.82 (1H, d, J = 13.2 Hz), 5.03 (1H, s), 5.76 (1H, d, J = 7.7 Hz), 6.58 (1H, d, J = 7.7 Hz), 6.64 (1H, d, J = 7.4 Hz), 6.89-6.97 (1H, m), 7.12-7.39 (6H, m).
MS: m/z = 446 [M+H]+.
1H-NMR (CDCl3) δ: 1.09 (3H, t, J = 7.0 Hz), 2.65-2.77 (1H, m), 2.83-2.94 (1H, m), 2.97-3.10 (1H, m), 3.40 (2H, q, J = 7.0 Hz), 3.45-3.52 (1H, m), 3.55-3.64 (1H, m), 3.65-3.76 (1H, m), 4.00-4.15 (2H, m), 4.36-4.45 (1H, m), 4.90 (1H, d, J = 13.5 Hz), 5.02 (1H, s), 5.79 (1H, d, J = 7.7 Hz), 6.59 (1H, d, J = 7.7 Hz), 6.63 (1H, d, J = 7.4 Hz), 6.90-6.97 (1H, m), 7.13-7.39 (6H, m).
MS: m/z = 446 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.33 (3H, s), 2.85 (2H, m), 3.68 (1H, m), 4.16 (1H, m), 4.29 (1H, d, J = 13.3 Hz), 4.45 (1H, d, J = 17.1 Hz), 5.12 (1H, d, J = 13.1 Hz), 5.26 (1H, d, J = 17.4 Hz), 5.36 (1H, s), 5.55 (1H, d, J = 7.6 Hz), 6.74 (1H, d, J = 7.6 Hz), 6.89-7.38 (8H, m).
MS: m/z = 470 [M+H] +.
1H-NMR (DMSO-d6) δ: 2.87 (2H, m), 3.61-3.69 (1H, m), 4.15 (1H, m), 4.18 (1H, d, J = 13.2 Hz ), 4.51 (1H, d, J = 15.9 Hz), 5.08 (1H, d, J = 13.1 Hz), 5.21 (1H, s), 5.22 (1H, d, J = 15.6 Hz), 5.52 (1H, d, J = 7.6 Hz), 6.72 (1H, d, J = 7.5 Hz), 6.89-7.32 (8H, m), 7.76 (2H, s).
MS: m/z = 471 [M+H] +.
1H-NMR (CDCl3) δ: 2.84-2.93 (1H, m), 2.98 (3H, s), 2.98-3.09 (1H, m), 3.66-3.75 (1H. m), 3.99-4.15 (1H, m), 4.06 (1H, d, J = 12.9 Hz), 4.80 (1H, d, J = 13.2 Hz), 5.03 (1H, s), 5.74 (1H, d, J = 7.5 Hz), 6.56 (1H, d, J = 7.5 Hz), 6.63 (1H, d, J = 6.6 Hz), 6.90-6.96 (1H, m), 7.14-7.37 (6H, m).
1H-NMR (CDCl3) δ: 1.08-1.21 (6H, m), 2.84 (1H, ddd, J = 4.8 Hz, 4.8 Hz, 14.4 Hz), 2.97-3.08 (1H, m), 3.54 (1H, ddd, J = 4.8 Hz, 6.6 Hz, 17.1 Hz), 4.09-4.26 (1H, m), 4.24 (1H, d, J = 13.2 Hz), 4.64-4.74 (m, 1H), 4.70 (1H, d, J = 13.2 Hz), 4.94 (1H, s), 5.81 (1H, d, J = 7.8 Hz), 6.42 (1H, dd, J = 2.7 Hz, 9.0 Hz), 6.67 (1H, d, J = 7.8 Hz), 6.89-7.12 (4H, m), 7.19-7.36 (1H, m).
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 6.9 Hz), 1.20 (3H, d, J = 6.9 Hz), 2.84 (1H, ddd, J = 4.8 Hz, 5.1 Hz, 14.4 Hz), 2.96-3.07 (1H, m), 3.55 (1H, ddd, J = 4.8 Hz, 5.1 Hz, 17.4 Hz), 4.11-4.23 (1H, m), 4.21 (1H, d, J = 12.9 Hz), 4.65-4.74 (1H, m), 4.70 (1H, d, J = 12.9 Hz), 4.95 (1H, s), 5.78 (1H, d, J = 7.8 Hz), 6.63 (1H, d, J = 7.8 Hz), 6.69 (1H, d, J = 2.1 Hz), 7.06 (1H, d, J = 8.4 Hz), 7.18 ( 1H, dd, J = 2.1 Hz, 8.4 Hz), 7.23-7.26 (2H, m), 7.24 (1H, dd, J = 2.1 Hz, 8.1 Hz).
1H-NMR (CDCl3) δ: 1.13 (3H, d, J = 6.6 Hz), 1.20 (3H, d, J = 6.9 Hz), 2.90-3.32 (1H, m), 3.36 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 9.6 Hz), 3.42-3.51 (1H, m), 3.95-4.02 (1H, m), 4.28 (1H, d, J = 12.9 Hz), 4.64-4.75 (1H, m), 1.89 (1H, d, J = 12.9 Hz), 5.15 (1H, s), 5.80 (1H, d, J = 7.5 Hz), 6.46-6.49 (1H, m), 6.70 (1H, d, J = 7.8 Hz), 6.88-7.00 (2H, m), 7.03-7.06 (1H, m), 7.11-7.22 (2H, m).
1H-NMR (CDCl3) δ: 1.09-1.19 (6H, m), 2.80-3.10 (2H, m), 3.40-3.60 (1H, m), 4.16-4.41 (2H, m), 4.61-4.47 (2H, m), 5.06-5.10 (1H, m), 5.71 (0.45 H, d, J = 7.5 Hz), 5.74 (0.55H, d, J = 7.8 Hz), 6.60-6.72 (2H, m), 6.86-6.94 (1H, m), 7.10-7.46 (6H, m).
1H-NMR (CDCl3) δ: 1.10-1.21 (6H, m), 2.75-2,86 (1H, m), 2.99-3.14 (1H, m), 4.23-4.37 (2H, m), 4,59-4.74 (2H, m), 5.04 (1H, s), 5.67-5.80 (1H, m), 6.58-6.67 (2H, m), 6.88-7.08 (1H, m), 7.11-7.38 (5H, m).
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 6.9 Hz), 1.20 (3H, d, J = 6.9 Hz), 2.80 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 9.9 Hz), 3.07 (1H, t, J = 3.9 Hz, 13.2 Hz, 13.2 Hz), 3.50 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 18.0 Hz), 4.24 (1H, 6.9 Hz), 4.34 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 4.63-4.74 (2H, m), 5.06 (1H, s), 5.81 (1H, d, J = 7.8 Hz), 6.57-6.64 (2H, m), 6.65 (1H, d, J = 7.5 Hz), 6.82 (1H, d, J = 9.3 Hz), 6.90 (1H, ddd, J = 2.7 Hz, 8.4 Hz, 8.4 Hz), 7.02 (1H, dd, J = 2.7 Hz, 9.0 Hz), 7.19-7.26 (2H, m).
第一工程
化合物285A (5.00 g, 29.3 mmol) をジメチルホルムアミド (150 ml) に溶解し、炭酸カリウム (14.2 mmol) とヨードエタン (7.11 ml, 88.0mmol) を加えて室温で2時間攪拌した。反応液にヘキサンを加え、水と飽和食塩水で洗った。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去することによって無色オイル状物質285Bを得た。
1H-NMR (CDCl3) δ: 1.40 (3H, t, J = 7.2 Hz), 2.60 (3H, s), 4.37 (2H, q, J = 7.1 Hz), 7.17 (1H, td, J = 7.9, 0.6 Hz), 7.49 (1H, ddd, J = 8.0, 1.4, 0.4 Hz), 7.68 (1H, ddd, J = 7.8, 1.4, 0.3 Hz).
第二工程
第一工程で得られた285B (5.63 g, 28.3 mmol) を四塩化炭素 (150 ml) に溶解し、N-ブロモスクシンイミド (5.55 g, 31.2 mmol) を加えて100℃で18時間攪拌した。反応液を室温まで冷ました後、水と飽和食塩水で洗った。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去して8.08 gの橙色オイル状物質285Cを得た。
1H-NMR (CDCl3) δ: 1.43 (3H, t, J = 7.6 Hz), 4.42 (2H, q, J = 7.1 Hz), 5.10 (2H, s), 7.31 (1H, t, J = 8.6 Hz), 7.57 (1H, d, J = 8.1 Hz), 7.84 (1H, d, J = 8.1 Hz).
第三工程
第二工程で得られた285C (2.17 g, 7.8 mmol) をアセトン (25 ml) に溶解し、4-fluorobenzenethiol (1.00 g, 7.80 mmol) と炭酸カリウム (1.62 g, 11.7 mmol) を加えて80℃で18時間攪拌した。室温まで冷ました後、反応液を水にあけ、酢酸エチルで抽出し、飽和食塩水で洗い、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (4:1, v/v) で溶出することにより精製し、2.20 gの無色オイル状物質285Dを得た。
1H-NMR (CDCl3) δ: 1.35 (3H, t, J = 7.2 Hz), 4.25 (2H, d, J = 7.5 Hz), 4.65 (2H, s), 6.91 (2H, t, J = 8.8 Hz), 7.19-7.31 (3H, m), 7.48 (1H, dd, J = 8.2, 1.4 Hz), 7.70 (1H, dd, J = 7.6, 1.5 Hz).
第四工程
第三工程で得られた285D (2.20 g, 6.77 mmol) をエタノール (20 ml) に溶解し、2規定水酸化ナトリウム水溶液 (16.9 ml, 33.8 mmol) を加えて室温で3時間攪拌した。反応液に水を加え、希塩酸で酸性にし、酢酸エチルで抽出した。有機層を飽和食塩水で洗い、硫酸ナトリウムで乾燥し、溶媒を減圧留去した。得られた化合物にn-ヘキサンを加え析出した残渣をろ過し、1.81 gの白色固体285Eを得た。
1H-NMR (CDCl3) δ: 4.74 (2H, s), 6.95 (2H, t, J = 8.8 Hz), 7.34 (3H, m), 7.59 (1H, dd, J = 7.9, 1.5 Hz), 7.92 (1H, dd, J = 7.9, 1.3 Hz).
第五工程
第四工程で得られた285E (1.81 g, 6.10 mmol) にポリリン酸 (10.0 g) を加えて120℃で5時間攪拌した。室温まで冷ました後、水を加え、酢酸エチルで抽出した。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧濃縮することによって得られた化合物にn-ヘキサン-酢酸エチルを加え、析出した残渣をろ過し、1.18 gの白色固体285Fを得た。
1H-NMR (CDCl3) δ: 4.28 (2H, s), 7.18 (1H, ddd, J = 9.3, 6.6, 2.3 Hz), 7.33 (2H, m), 7.46 (1H, dd, J = 7.7, 1.5 Hz), 7.59 (1H, dd, J = 7.9, 1.3 Hz), 7.91 (1H, dd, J = 10.1, 2.9 Hz).
第六工程
化合物285F (1.17 g, 4.20 mmol) にメタノール (15 ml) を加え、0℃で水素化ホウ素ナトリウム (191 mg, 5.04 mmol) を加えて室温で2時間攪拌した。反応液を水にあけ、ジクロロメタンで抽出し、有機層を硫酸ナトリウムで乾燥して溶媒を留去した。得られた化合物にn-ヘキサン-ジクロロメタンを加え、析出した残渣をろ過し、945 mgの白色固体285Gを得た。
1H-NMR (CDCl3) δ: 2.58 (1H, d, J = 3.2 Hz), 4.46 (1H, d, J = 14.3 Hz), 4.58 (1H, d, J = 14.6 Hz), 6.33 (1H, d, J = 3.7 Hz), 6.82 (1H, td, J = 8.3, 2.9 Hz), 7.07 (1H, dd, J = 8.5, 5.4 Hz), 7.20 (1H, t, J = 7.9 Hz), 7.33 (2H, m), 7.44 (1H, d, J = 6.9 Hz).
第七工程
参考例107と同様の手法により化合物285を合成した。
MS: m/z = 486 [M+H] +
1H-NMR (DMSO-d6) δ: 1.57 (1H, brs), 1.84-1.99 (2H, m), 2.68 (3H, d, J = 4.6 Hz), 3.08-3.17 (2H, m), 3.39 (3H, brs), 3.89 (1H, d, J = 13.4 Hz), 4.16 (1H, d, J = 13.3 Hz), 4.54 (1H, brs), 5.10 (1H, d, J = 12.7 Hz), 5.50 (1H, s), 5.63 (1H, d, J = 13.4 Hz), 5.73 (1H, d, J = 7.8 Hz), 6.82-7.94 (9H, m).
MS: m/z = 489 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.21 (1H, m), 3.85 (1H, d, J = 13.4 Hz), 4.08-4.18 (3H, m), 4.28 (1H, d, J = 13.4 Hz), 5.10 (1H, d, J = 13.7 Hz), 5.45 (1H, s), 5.57-5.64 (2H, m), 6.82-7.50 (10H, m).
MS: m/z = 504 [M+H] +.
1H-NMR (DMSO-d6) δ: 1.00(3H, d, J = 6.9 Hz), 1.06 (3H, d, J = 6.9 Hz), 3.88 (1H, d, J = 13.4 Hz), 4.32 (1H, d, J = 13.3 Hz), 4.67 (1H, m), 4.97 (1H, d, J = 13.4 Hz), 5.43 (1H, s), 5.59 (2H, m), 6.84-7.45 (9H, m), 11.90 (1H, brs).
MS: m/z = 434 [M+H] +.
1H-NMR (DMSO-d6) δ: 0.11 (1H, m), 0.54-0.92 (3H, m), 2.71 (1H, m), 3.85 (1H, d, J = 13.7 Hz), 4.06 (1H, d, J = 13.1 Hz), 5.06 (1H, d, J = 13.1 Hz), 5.35 (1H, s), 5.57 (2H, m), 7.15 (9H, m), 11.66 (1H, brs).
MS: m/z = 432 [M+H] +.
1HNMR (CDCl3) δ: 1.14 (1H, m), 1.54 (2H, m), 1.67 (1H, m), 3.60 (1H, d, J = 13.5 Hz), 4.39 (1H, d, J = 12.6 Hz), 5.02 (1H, s), 5.07 (1H, d, J = 12.6 Hz), 5.60 (1H, d. J = 13.5 Hz), 5.77 (1H, d, J = 7.7 Hz), 6.69 (1H, d, J = 7.7 Hz), 7.07 - 7.13 (3H, m), 7.25 - 7.44 (4H, m).
MS: m/z = 457.10 [M+H] +.
1H-NMR (DMSO-d6) δ: 3.33-3.42 (1H, m), 3.84 (1H, d, J = 13.1 Hz), 3.90-4.10 (1H, m), 4.24 (1H, d, J = 13.4 Hz), 4.35-4.66 (2H, m), 5.13 (1H, d, J = 13.4 Hz), 5.43 (1H, s), 5.54-5.64 (2H, m), 6.80-6.95 (2H, m), 7.04-7.50 (8H, m).
MS: m/z = 438 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.69-3.82 (1H, m), 3.89 (1H, d, J = 13.6 Hz), 4.40 (1H, d, J = 12.9 Hz), 4.60-4.77 (1H, m), 5.27 (1H, d, J = 13.3 Hz), 5.43 (1H, s), 5.60 (1H, d, J = 13.6 Hz), 5.70 (1H, d, J = 7.7 Hz), 6.84-6.95 (1H, m), 7.08-7.55 (9H, m).
MS: m/z = 474 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.81 (1H, d, J = 13.5 Hz), 4.29 (1H, d, J = 13.5 Hz), 4.33 (1H, d, J = 16.2 Hz), 4.96 (1H, d, J = 16.2 Hz), 5.23 (1H, d, J = 13.5 Hz), 5.49 (1H, s), 5.59 (1H, d, J = 13.2 Hz), 5.64 (1H, d, J = 7.7 Hz), 6.82-6.97 (2H, m), 7.05-7.41 (10H, m), 7.80 (1H, td, J = 7.6, 1.7 Hz), 8.47 (1H, d, J = 4.9 Hz).
MS: m/z = 483 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.28 (9H, s), 3.86 (1H, d, J = 13.6 Hz), 4.42 (1H, d, J = 13.3 Hz), 4.99 (1H, d, J = 13.4 Hz), 5.32 (1H, s), 5.53 (1H, d, J = 13.3 Hz), 5.60 (1H, d, J = 7.6 Hz), 6.81-7.63 (10H, m).
MS: m/z = 448 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.03 (3H, t, J = 7.4 Hz), 3.12-3.26 (1H, m), 3.43-3.58 (1H, m), 3.85 (1H, d, J = 13.6 Hz), 4.21 (1H, d, J = 13.4 Hz), 5.07 (1H, d, J = 13.4 Hz), 5.40 (1H, s), 5.57 (1H, d, J = 13.1 Hz), 5.59 (1H, d, J = 7.3 Hz), 6.80-6.88 (1H, m), 6.91 (1H, d, J = 7.9 Hz), 7.03-7.55 (8H, m).
MS: m/z = 420 [M+H]+.
1H-NMR (CDCl3) δ: 1.73-1.85 (2H, m), 2.96-3.07 (1H, m), 3.27 (3H, s), 3.42 (2H, t, J = 5.6 Hz), 3.56 (1H, d, J = 13.5 Hz), 3.93-4.04 (1H, m), 4.25 (1H, d, J = 13.2 Hz), 4.95 (1H, d, J = 12.9 Hz), 5.13 (1H, s), 5.65 (1H, d, J = 13.2 Hz), 5.82 (1H, d, J = 7.7 Hz), 6.69 (1H, d, J = 7.7 Hz), 6.78-6.86 (1H, m), 7.03-7.15 (3H, m), 7.17-7.47 (5H, m).
MS: m/z = 464 [M+H]+.
1H-NMR (CDCl3) δ: 1.10 (3H, t, J = 6.9 Hz), 2.79-2.91 (1H, m), 3.41 (2H, q, J = 7.1 Hz), 3.46-3.69 (3H, m), 4.30 (1H, d, J = 13.5 Hz), 5.01 (1H, d, J = 13.5 Hz), 5.12 (1H, s), 5.65 (1H, d, J = 13.5 Hz), 5.83 (1H, d, J = 7.7 Hz), 6.68 (1H, d, J = 7.7 Hz), 6.77-6.86 (1H, m), 7.03-7.12 (3H, m), 7.16-7.46 (5H, m).
MS: m/z = 464 [M+H]+.
1H-NMR (CDCl3) δ: 1.30-1.47 (1H, m), 1.49-1.67 (1H, m), 1.73-2.02 (4H, m), 2.09-2.23 (2H, m), 3.60 (1H, d, J = 13.5 Hz), 4.39 (1H, d, J = 12.9 Hz), 4.45-4.64 (1H, m), 4.93 (1H, d, J = 12.6 Hz), 5.10 (1H, s), 5.65 (1H, d, J = 13.5 Hz), 5.87 (1H, d, J = 7.4 Hz), 6.67 (1H, d, J = 8.0 Hz), 6.76-6.85 (1H, m), 7.08 (2H, d, J = 3.8 Hz), 7.16 (2H, d, J = 7.7 Hz), 7.23-7.31 (1H, m), 7.34-7.48 (2H, m).
MS: m/z = 510 [M+H]+.
1H-NMR (DMSO-d6) δ: 3.83 (1H, d, J = 13.4 Hz), 4.34 (1H, d, J = 13.1 Hz), 4.67 (1H, d, J = 15.9 Hz), 5.05 (1H, d, J = 15.9 Hz), 5.20 (1H, d, J = 13.4 Hz), 5.33 (1H, s), 5.60 (1H, d, J = 13.8 Hz), 5.64 (1H, d, J = 7.8 Hz), 6.87 (3H, m), 7.05-7.19 (4H, m), 7.35-7.44 (2H, m), 7.74 (1H, d, 3.3 Hz), 7.77 (1H, d, 3.3 Hz).
1H-NMR (CDCl3) δ: 3.18-3.35 (1H, m), 3.60 (1H, d, J = 13.7 Hz), 4.37 (1H, d, J = 13.2 Hz), 4.75-4.95 (1H, m), 5.07-5.15 (2H, m), 5.60 (1H, d, J = 13.7 Hz), 5.85 (1H, d, J = 7.7 Hz), 6.68 (1H, d, J = 7.7 Hz), 6.79-6.88 (1H, m), 7.09-7.14 (3H, m), 7.16 (1H, d, J = 7.7 Hz), 7.29-7.36 (1H, m), 7.36-7.41 (1H, m), 7.42-7.50 (1H, m).
MS: m/z = 524 [M+H]+.
1H-NMR (CDCl3) δ: 0.89 (9H, s), 0.97 (3H, d, J = 7.1 Hz), 3.61 (1H, d, J = 13.2 Hz), 4.43 (1H, d, J = 13.2 Hz), 4.84-4.92 (2H, m), 5.11 (1H, s), 5.70 (1H, d, J = 13.2 Hz), 5.83 (1H, d, J = 7.7 Hz), 6.72 (1H, d, J = 7.4 Hz), 6.79-6.85 (1H, m), 7.03-7.09 (2H, m), 7.16-7.24 (3H, m), 7.29-7.44 (2H, m).
MS: m/z = 476 [M+H]+.
1H-NMR (CDCl3) δ: 2.87 (0.75 H, s), 3.01 (2.25H, s), 3.55 (1.5H, d, J = 10.2 Hz), 3.62 (0.5H, 13.5 Hz), 4.17 (0.5H, d, J = 13.2 Hz), 4.22 (1.5 Hz, J = 12.9 Hz), 4.97 (1H, d, J = 12.9 Hz), 5.02 (0.25H, s), 5.11 (0.75H, s), 5.63 (0.75H, d, J = 13.5 Hz), 5.77-5.83 (1.25H, m), 6.64-6.68 (1H, m), 6.76-6.85 (1H, m), 7.01 (1H, d, J = 7.5 Hz), 7.05-7.13 (2H, m), 7.17-7.45 (3H, m).
1H-NMR (CDCl3) δ: 3.63 (1H, d, J = 13.4 Hz), 4.51-4.59 (2H, m), 4.68-4.98 (4H, m), 5.13 (1H, d, J = 12.9 Hz), 5.28 (1H, s), 5.71 (1H, d, J = 13.3 Hz), 5.85 (1H, d, J = 7.7 Hz), 6.77 (1H, d, J = 7.4 Hz), 6.82-6.89 (1H, m), 7.12 (2H, d, J = 3.5 Hz), 7.24 (1H, d, J = 7.6 Hz), 7.33 (2H, d, J = 4.4 Hz), 7.39 (1H, d, J = 7.1 Hz), 7.42-7.50 (1H, m).
MS: m/z = 470 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.93 (3H, s), 3.13 (1H, m), 3.86 (1H, d, J = 13.6 Hz), 4.06 (3H, m), 4.26 (1H, d, J = 13.3 Hz), 5.14 (1H, d, J = 13.6 Hz), 5.44 (1H, s), 5.60 (2H, m), 6.82-7.49 (10H, m).
MS: m/z = 478 [M+H] +.
1H-NMR (CDCl3) δ: 1.07 (3H, d, J = 6.6 Hz), 1.10 (3H, d, J = 6.9 Hz), 3.70 (1H, d, J = 13.5 Hz), 4.37 (1H, d, J = 12.9 Hz), 4.75-4.85 (2H, m), 5.18 (1H, s), 5.76 (1H, d, J = 13.2 Hz), 5.82 (1H, d, J = 7.8 Hz), 6.67 (1H, dd, J = 1.2 Hz, 7.8 Hz), 6.77 (1H, t, J = 7.8 Hz), 7.07 (1H, d, J = 7.5 Hz), 7.18-7.30 (3H, m), 7.35-7.46 (2H, m).
1H-NMR (CDCl3) δ: 1.06 (3H, d, J = 6.9 Hz), 1.15 (3H, d, J = 7.2 Hz), 3.60 (H, d, J = 13.5 Hz), 4.36 (1H, d, J = 12.9 Hz), 4.75-4.83 (2H, m), 5.10 (1H, s), 5.67 (1H, d, J = 13.2 Hz), 5.86 (1H, d, J = 7.5 Hz), 6.65 ( 1H, d, J = 8,1 Hz), 6.78 (1H, dd, J = 1.8 Hz, 8.1Hz), 7.08-7.18 (2H, m), 7.13 (1H, d, J = 8.1 Hz), 7.24-7.30 (1H, m), 7.33-7.36 (1H, m), 7.39-7.45 (1H, m).
1H-NMR (CDCl3) δ: 0.98 (0.4H, d, J = 7.2 Hz), 1.07 (2.6H, d, J = 6.6 Hz), 1.15 (2.6H, d, J = 6.9 Hz), 1.27 (0.4H, d, J = 0.6 Hz), 3.62 (0.9H, d, J = 13.2 Hz), 3.73 (0.1H, d, J = 13.8 Hz), 4.36 (1H, d, J = 12.9 Hz), 4.77-4.88 (1H, m), 4.83 (1H, d, J = 12.9 Hz), 5.07 (1H, s), 5.62 (1H, d, J = 13.2 Hz), 5.77 (0.1H, d, J = 7.5 Hz), 5.85 (0.9H, d, J = 7.8 Hz), 6.69-6.83 (1H, m), 6.98-7.07 (2H, m), 7.18 (2H, d, J = 7.8 Hz), 7.25-7.35 (2H, m), 7.40-7.45 (1H, m).
1H-NMR (CDCl3) δ: 1.07 (3H, d, J = 6.6 Hz), 1.15 (3H, d, J = 6.9 Hz), 3.63 (1H, d, J = 13.2 Hz), 4.37 (1H, d, J = 12.9 Hz), 4.77-4.8 (1H, m), 4.82 (1H, d, J = 12.6 Hz), 5.06 (1H, s), 5.60 (1H, d, J = 12.9 Hz), 5.85 (1H, d, J = 7.8 Hz), 6.53 (1H, dd, J = 3.0 Hz, 9.0 Hz), 6.80-6.86 (1H, m), 7.03 (1H, dd, J = 4.2 Hz, 9.0 Hz), 7.16-7.30 (3H, m), 7.35 (1H, d, J = 6.3 Hz), 7.40-7.45 (1H, m).
1H-NMR (DMSO-d6) δ: 1.02 (3H, t, J = 7.2 Hz), 3.07-3.22 (1H, m), 3.44-3.59 (1H, m), 4.00 (1H, d, J = 13.4 Hz), 4.21 (1H, d, J = 13.4 Hz), 5.06 (1H, d, J = 13.3 Hz), 5.47-5.76 (3H, m), 6.84-6.92 (1H, m), 6.92-6.99 (1H, m), 7.04 (1H, d, J = 7.6 Hz), 7.10-7.52 (6H, m).
MS: m/z = 454 [M+H]+.
1H-NMR (CDCl3) δ: 2.96 (0.79H, s), 3.00 (2.2H, s), 3.59 (0.75H, d, J = 13.2 Hz), 3.62 (0.25H, d, J = 13.8 Hz), 4.15 (0.25H, d, J = 13.2 Hz), 4.21 (0.75H, d, J = 12.9 Hz), 4.95-5.01 (2H, m), 5.07 (1H, s), 5.56 (1H, d, J = 13.5 Hz), 5.75-5.79 (1H, m), 5.88 (1H, d, J = 7.8 Hz), 6.63 (0.36H, d, J = 7.8 Hz), 6.73 (1H, d, J = 1.8 Hz), 6.83 (0.39H, d, J = 7.2 Hz), 7.01-7.46 (7.25H, m).
1H-NMR (DMSO-d6) δ: 3.01-3.10 (1H, m), 3.16 (3H, s), 3.40 (2H, m), 3.89 (2H, d, J = 13.4 Hz), 4.19 (1H, d, J = 13.4 Hz), 5.06 (1H, d, J = 13.6 Hz), 5.49 (1H, s), 5.58 (1H, d, J = 13.4 Hz), 5.70 (1H, d, J = 7.8 Hz), 6.89-7.48 (8H, m), 11.36 (1H, s).
1H-NMR (DMSO-d6) δ: 3.00-3.09 (1H, m), 3.15 (3H, s), 3.39 (2H, m), 3.94 (1H, m), 4.00 (1H, d, J = 13.2 Hz), 4.20 (1H, d, J = 13.4 Hz), 5.06 (1H, d, J = 13.4 Hz), 5.54 (1H, s), 5.65 (2H, m), 6.86-7.50 (8H, m), 11.54 (1H, brs).
1H-NMR (DMSO-d6) δ: 3.01-3.09 (1H, m), 3.15 (3H, s), 3.40 (2H, m), 3.87-3.94 (1H, m), 3.98 (1H, d, J = 13.6 Hz), 4.20 (1H, d, J = 13.6 Hz), 5.06 (1H, d, J = 13.4 Hz), 5.54 (1H, s), 5.62 (1H, d, J = 13.6 Hz), 5.67 (1H, d, J = 7.6 Hz), 6.78-7.50 (8H, m).
MS: m/z = 468 [M+H] +
1H-NMR (DMSO-d6) δ: 3.07 (1H, m), 3.16 (3H, s), 3.41 (2H, s), 3.89 (1H, d, J = 13.7 Hz), 3.91 (1H, m), 4.19 (1H, d, J = 13.6 Hz), 5.06 (1H, d, J = 13.6 Hz), 5.48 (1H, s), 5.61 (1H, d, J = 13.3 Hz), 5.69 (1H, d, J = 7.6 Hz), 6.70-7.48 (9H, m).
MS: m/z = 468 [M+H] +
1H-NMR (DMSO-d6) δ: 3.14 (3H, s), 3.18 (s, 3H), 3.50 (4H, m), 4.00 (1H, d, J = 13.1 Hz), 4.49 (1H, d, J = 13.3 Hz), 4.77 (1H, m), 4.95 (1H, d, J = 13.3 Hz), 5.56 (1H, s), 5.68 (2H, m), 7.14 (8H, m).
MS: m/z = 512 [M+H] +
1H-NMR (DMSO-d6) δ: 3.12 (3H, s), 3.20 (3H, s), 3.51 (4H, m), 3.96 (1H, d, J = 13.3 Hz), 4.53 (1H, d, J = 13.4 Hz), 4.75 (1H, m), 4.97 (1H, d, J = 13.1 Hz), 5.50 (1H, d, J = 13.3 Hz), 5.54 (1H, s), 5.67 (1H, d, J = 7.8 Hz), 6.87-7.54 (8H, m).
MS: m/z = 530 [M+H] +
1H-NMR (CDCl3) δ: 2.88 (0.60H, s), 2.99 (2.40H, s), 3.67 (0.80H, d, J = 13.8 Hz), 3.73 (0.20H, d, J = 14.1 Hz), 4.16 (0.20H, d, J = 11.1 Hz), 4.20 (0.80H, d, J = 12.9 Hz), 4.97 ( 0.80H, d, J = 12.9 Hz), 4.99 (0.20H, d, J = 15 Hz), 5.10 (0.20H, s), 5.18 (0.80H, s), 5.69 (0.80H, d, J = 13.5 Hz), 5.79 (0.20H, d, J = 7.8 Hz), 5.85 (0.80H, d, J = 7.5 Hz), 5.88 (0.20H, J = 13.5 Hz), 6.62-6.66 (1H, m), 6.75-6.85 (1H, m), 6.98 (1H, d, J = 7.5 Hz), 7.03-7.16 (0.5H, m), 7.19 (1H, d, J = 6.9 Hz), 7.24-7.39 (2.5H, m), 7.43-7.48 (1H, m).
1H-NMR (CDCl3) δ: 2.91 (0.75H, s), 2.99 (2.25H, s), 3.57 (0.75H, d, J = 13.8 Hz), 3.63 (0.25H, d, 13.8 Hz), 4.17 (0.25H, d, J = 12.9 Hz), 4.10 (0.75H, d, J = 12.9 Hz), 4.99 (0.75H, d, J = 12.9 Hz), 5.00 (0.25H, s), 5.01 (0.25H, d, J = 12.3 Hz), 5.10 (0.75H, s), 5.61 (0.75H, d, J = 13.5 Hz), 5.78 (0.25H, J = 7.5 Hz), 5.80 (0.25H, J = 15 Hz), 5.89 (0.75H, d, J = 7.5 Hz), 6.60 (0.75H, d, J = 8.4 Hz), 6.64 (0.25H, d, J = 7.8 Hz), 6.78 (1H, dd, J = 2.1 Hz, 8.1 Hz), 7.03 (1H, d, J = 7.8 Hz), 7.04-7.21 (2H, m), 7.26-7.36 (2H, m), 7.41-7.47 (1H, m).
1H-NMR (CDCl3) δ: 2.94 (0.66H, s), 3.00 (2.34H, s), 3.60 (0.78H, d, J = 13.5 Hz), 3.65 (0.22H, d, J = 3.8 Hz), 4.22 (1H, d, J = 12.9 Hz), 4.94-5.00 (1H, m), 5.06 (1H, s), 5.54 (0.78H, d, J = 13.2 Hz), 5.71 (0.22H, d, J = 13.8 Hz), 5.78 (0.22H, d, J = 7.5 Hz), 5.88 (0.78H, d, J = 7.8 Hz), 6.49 (1H, dd, J = 3.0 Hz, 9.0 Hz), 6.66 (0.22H, d, J = 7.8 Hz), 6.82-6.88 (1H, m), 6.97-7.13 (2H, m), 7.16-7.21 (1H, m), 7.29-7.36 (2H, m), 7.41-7.46 (1H, m).
1H-NMR (CDCl3) δ: 1.08 (3H, d, J = 6.9 Hz), 1.16 (3H, d, J = 6.9 Hz), 3.63 (1H, d, J = 13.2 Hz), 4.37 (1H, d, J = 12.6 Hz), 4.78-4.87 (1H, m), 5.10 (1H, s), 5.67 (1H, d, J = 13.2 Hz), 5.82 (1H, d, J = 7.8 Hz), 6.65 (1H, d, J = 2.1 Hz), 6.96-6.99 (1H, m), 7.08-7.12 (2H, m), 7.17 (1H, d, J = 13.5 Hz), 7.25-7.32 (1H, m), 7.35-7.37 (1H, m), 7.42-7.47 (1H, m).
1H-NMR (CDCl3) δ: 1.08 (3H, d, J = 6.9 Hz), 1.16 (3H, d, J = 6.9 Hz), 3.68 (1H, d, J = 13.2 Hz), 4.37 (1H, d, J = 12.9 Hz), 4.76-4.84 (2H, m), 5.18 (1H,s), 5.72 (1H, d, J = 13.5 Hz), 5.81 (1H, dd, J = 0.9 Hz, 7.5 Hz), 6.56 (1H, d, J = 7.2 Hz), 6.76-6.83 (1H, m), 6.90 (1H, t, J = 9.0 Hz), 7.07-7.11 (1H, m), 7.19 ( 1H, d, J = 7.5 Hz), 7.25-7.30 (1H, m), 7.35-7.45 (2H, m).
1H-NMR (CDCl3) δ: 1.07 (3H, d, J = 6.9 Hz), 1.15 (3H, d, J = 7.1 Hz), 3.59 (1H, d, J = 13.2 Hz), 4.36 (1H, d, J = 9.9 Hz), 4.75-4.85 (2H, m), 5.11 (1H, s), 5.70 (1H, d, J = 13.2 Hz), 5.84 (1H, d, J = 7.8 Hz), 6.48-6.55 (1H, m), 6.71 (1H, dd, J = 5.4 Hz, 8.4 Hz), 6.80 (1H, dd, J = 2.4 Hz, 9.3 Hz), 7.11 (1H, d, J = 7.8 Hz), 7.18 (1H, dd, J = 0.9 Hz), 7.5 Hz), 7.25-7.30 (1H, m), 7.32-7.36 (1H, m), 7.39-7.45 (1H, m).
1H-NMR (CDCl3) δ: 2.92 (0.66H, s), 3.01 (2.34H, s), 3.59 (0.78H, d, J = 13.5 Hz), 3.67 (0.22H, d, J = 13.8 Hz), 4.18 (0.22H, d, J = 13.2 Hz), 4.21 (0.78H, d, J = 12.9 Hz), 5.03 (1H, J = 12.9 Hz), 5.05 (0.22H, s), 5.10 (0.78H, s), 5.62 (0.78H, d, J = 13.5 Hz), 5.76-5.82 (0.44H, m), 5.87 (0.78H, d, J = 7.8 Hz), 6.62 (0.78H, brs), 6.68 (0.22H, d, J = 8.1 Hz), 6.85 (0.22H, d, J = 7.8 Hz), 6.98-7.04 (1.56H, m), 7.11-7.39 (3H, m), 7.44-7.49 (1H, m).
1H-NMR (CDCl3) δ: 2.89 (0.48H, s), 3.00 (2.52H, s), 3.64 (0.84H, d, J = 13.5 Hz), 3.71 (0.16H, d, J = 13.8 Hz), 4.21 (1H, d, J = 12.9 Hz), 4.94 (0.84H, d, J = 12.9 Hz), 4.98 (0.16H, d, J = 12.9 Hz), 5.10 (0.16H, s), 5.19 (0.84H, s), 5.65 (0.84H, d, J = 7.5 Hz), 5.77-5.85 (1.32H, m), 6.52 (0.84H, d, J = 7.8 Hz), 6.64 (0.16H, d, J = 7.8 Hz), 6.77-6.84 (1H, m), 6.89-6.95 (1H, m), 6.99 (1H, d, J = 7.8 Hz), 7.07-7.25 (1H, m), 7.29-7.38 (2H, m), 7.42-7.47 (1H, m).
1H-NMR (CDCl3) δ: 2.91 (0.48H, s), 3.00 (2.52H, s), 3.56 (d, J = 13.8 Hz), 3.62 (0.16H, d, J = 13.8 Hz), 4.18 (0.16H, d, J = 12.9 Hz), 4.20 (0.84H, d, J = 12.9 Hz), 4.96 (0.84H, d, J = 12.9 Hz), 4.98 (0.16H, d, J = 13.8 Hz), 5.03 (0.16H, s), 5.12 (0.84H, s), 5.64 (0.84H, d, J = 13.5 Hz), 5.78-5.87 (0.32H, m), 5.89 (0.84H, d, J = 7.8 Hz), 6.50-6.56 (0.84H, m), 6.63-6.69 (1.16H, m), 6.84 (1H, dd, J = 2.4 Hz, 9.3 Hz),6.94-6.97 (0.16H, m), 7.02 (0.84H, d, J = 7.5 Hz), 7.13-7.23 (1H, m), 7.33-7.38 (2H, m), 7.42-7.47 (1H, m).
1H-NMR (CDCl3) δ: 1.08 (3H, d, J = 6.9 Hz), 1.15 (3H, d, J = 6.9 Hz), 2.24 (3H, s), 3.68 (1H, d, J = 13.2 Hz), 4.38 (1H, d, J = 13.2 Hz), 4.76-4.85 (1H, m), 4.80 (1H, d, J = 12.6 Hz), 5.14 (1H, s), 5.72 (1H, d, J = 12.9 Hz), 5.76 (1H, d, J = 7.8 Hz), 6.59 (1H, d, J = 7.5 Hz), 6.72 (1H, t, J = 7.5 Hz), 6.99 (1H, d, J = 6.9 Hz), 7.07 (1H, d, J = 7.8 Hz), 7.17-7.27 (2H, m), 7.33-7.42 (2H, m).
1H-NMR (CDCl3) δ: 1.10 (3H, d, J = 6.9 Hz), 1.16 (3H, d, J = 6.9 Hz), 3.58 (1H, d, J = 13.2 Hz), 4.37 (1H, d, J = 12.9 Hz), 4.76-4.87 (1H, m), 4.85 (1H, d, J = 12.6 Hz), 5.06 (1H, s), 5.65 (1H, d, J = 13.2 Hz), 5.79 (1H, d, J = 7.5 Hz), 6.54 (1H, s), 6.89 (1H, dd, J = 1.5 Hz, 8.4 Hz), 6.95 (1H, d, J = 7.8 Hz), 7.14-7.19 (1H, m), 7.22-7.28 (1H, m), 7.33-7.43 (2H, m).
1H-NMR (CDCl3) δ: 1.07 (3H, d, J = 6.9 Hz), 1.16 (3H, d, J = 6.9 Hz), 2.20 (3H, s), 2.23 (3H, s), 3.77 (1H, d, J = 12.6 Hz), 4.47 (1H, d, J = 12.9 Hz), 4.78-4.86 (1H, m), 4.88 (1H, 12.9 Hz), 5.49 (1H, d, J = 12.9 Hz), 5.83 (1H, d, J = 11.1 Hz), 5.85 (1H, d, J = 9.0 Hz), 6.64 (1H, d, J = 7.8 Hz), 6.86 (1H, J = 7.8 Hz), 7.16-7.40 (5H, m).
1H-NMR (DMSO-d6) δ: 1.94 (3H, s), 3.07 (1H, m), 3.98-4.12 (4H, m), 4.25 (2H, d, J = 13.4 Hz), 5.13 (2H, d, J = 13.3 Hz), 5.56 (1H, s), 5.66 (1H, d, J = 13.5 Hz), 5.68 (1H, t, J = 7.8 Hz), 6.87-7.51 (8H, m).
化合物325 (46.0 mg, 0.0960 mmol) をメタノール (0.5 ml) とテトラヒドロフラン (0.5 ml) に溶解し、2規定水酸化ナトリウム水溶液 (0.241 ml, 0.482 mmol) を加えて30分攪拌した。反応液に希塩酸を加えて酸性にし、クロロホルムで抽出した。有機層を硫酸ナトリウムで乾燥し、反応液を減圧濃縮した。得られた化合物360にn-ヘキサン-ジエチルエーテルを加え、析出した残渣をろ過し、33 mgの白色固体を得た。
1H-NMR (DMSO-d6) δ: 2.85-2.94 (1H, m), 3.52 (2H, m), 3.89 (1H, d, J = 13.4 Hz), 3.98 (1H, td, J = 9.1, 4.5 Hz), 4.24 (1H, d, J = 13.6 Hz), 4.84 (1H, brs), 5.16 (1H, d, J = 13.6 Hz), 5.48 (1H, s), 5.65 (2H, m), 6.86-7.55 (9H, m).
MS: m/z = 436 [M+H] +
1H-NMR (DMSO-d6) δ: 2.82 (3H, m), 3.49 (1H, brs), 3.71 (1H, dt, J = 16.7, 5.0 Hz), 4.03 (1H, t, J = 7.8 Hz), 4.08-4.15 (2H, m), 4.79 (1H, brs), 5.01 (1H, d, J = 13.4 Hz), 5.25 (1H, s), 5.51 (1H, d, J = 7.6 Hz), 6.72-7.41 (9H, m).
1H-NMR (CDCl3) δ: 1.23 (3H, s), 1.24 (3H, s), 2.43 (1H, d, J = 13.7 Hz), 2.81-2.91 (1H, m), 2.96-3.10 (1H, m), 3.61-3.72 (1H, m), 4.02-4.14 (1H, m), 4.15 (1H, d, J = 13.7 Hz), 4.42 (1H, d, J = 14.0 Hz), 4.95 (1H, s), 5.15 (1H, d, J = 13.5 Hz), 5.74 (1H, d, J = 7.7 Hz), 6.54-6.61 (2H, m), 6.86-6.94 (1H, m), 7.11-7.39 (8H, m).
MS: m/z = 446 [M+H]+.
1H-NMR (CDCl3) δ: 1.24 (3H, s), 1.26 (3H, s), 2.52 (1H, d, J = 14.0 Hz), 3.56 (1H, d, J = 13.7 Hz), 4.34 (1H, d, J = 13.5 Hz), 4.36 (1H, d, J = 13.5 Hz), 5.04 (1H, s), 5.23 (1H, d, J = 13.7 Hz), 5.63 (1H, d, J = 13.5 Hz), 5.84 (1H, d, J = 7.7 Hz), 6.65 (1H, d, J = 7.7 Hz), 6.76-6.84 (1H, m), 7.03-7.18 (5H, m), 7.27-7.47 (4H, m).
MS: m/z = 464 [M+H]+.
1H-NMR (CDCl3) δ: 1.21-1.68 (10H, m), 2.47 (1H, d, J = 13.7 Hz), 3.55 (1H, d, J = 13.5 Hz), 4.34 (1H, d, J = 13.6 Hz), 4.35 (1H, d, J = 13.6 Hz), 5.03 (1H, s), 5.25 (1H, d, J = 13.5 Hz), 5.63 (1H, d, J = 13.5 Hz), 5.79 (1H, d, J = 7.7 Hz), 6.64 (1H, d, J = 7.4 Hz), 6.76-6.84 (1H, m), 7.03 (1H, d, J = 7.7 Hz), 7.06-7.10 (2H, m), 7.15 (1H, d, J = 7.1 Hz), 7.28-7.37 (2H, m), 7.37-7.46 (1H, m).
MS: m/z = 504 [M+H]+.
MS: m/z = 450 [M+H]+.
1H-NMR (DMSO-d6) δ: 2.76-2.85 (1H, m), 3.58 (2H, m), 3.92 (1H, m), 3.98 (1H, d, J = 13.5 Hz), 4.18 (1H, d, J = 13.6 Hz), 4.80 (1H, brs), 5.10 (1H, t, J = 8.8 Hz), 5.50-5.68 (3H, m), 6.87-7.52 (8H, m).
第一工程
化合物383A (1.00 g, 4.42 mmol) をジクロロメタン (50 ml) に溶解し、0℃でmCPBA (2.67 g, 15.5 mmol) を加えて室温で4時間攪拌した。反応液に亜硫酸ナトリウム水溶液を加え、ジクロロメタンで抽出した。有機層を炭酸水素ナトリウム水溶液で洗い、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた化合物にn-ヘキサン-ジクロロメタンを加え、析出した残渣をろ過し、1.06 gの白色固体383Bを得た。
1H-NMR (CDCl3) δ: 4.81 (2H, s), 7.29-8.12 (6H, m).
第二工程
化合物383B (1.05 g, 4.07 mmol) にメタノール (11 ml) を加え、0℃で水素化ホウ素ナトリウム (185 mg, 4.88 mmol) を加えて室温で30分攪拌した。反応液を水にあけ、ジクロロメタンで抽出し、有機層を硫酸ナトリウムで乾燥して溶媒を留去した。得られた化合物にn-ヘキサン-ジクロロメタンを加え、析出した残渣をろ過し、1.01 gの白色固体383Cを得た。
1H-NMR (CDCl3) δ: 2.84 (1H, d, J = 3.7 Hz), 4.76 (1H, d, J = 14.6 Hz), 5.25 (1H, d, J = 14.6 Hz), 6.23 (1H, d, J = 3.7 Hz), 7.28-7.96 (8H, m).
第三工程
参考例107に従い、化合物383を同様の手法により合成した。
MS: m/z = 466 [M+H] +.
1H-NMR (CDCl3) δ: 1.12-1.25 (6H, m), 2.87-3.26 (3H, m), 3.42-3.67 (1H, m), 4.00-4.08 (1H, m), 4.28-4.35 (1H, m), 4.56-4.83 (3H, m), 5.10-5.30 (1H, m), 5.89-6.11 (1H, m), 6.55-6.63 (0.5H, m), 6.71-6.75 (0.5H, m), 6.84-6.94 (1H, m), 7.03-7.47 (4H, m), 8.18-8.20(0.5H, m), 8.48-8.49 (0.5H, m).
1H-NMR (CDCl3) δ: 0.59 (3H, d, J = 6.6 Hz), 1.07-1.14 (4H, m), 1.19-1.28 (1H, m), 2.22-2.32 (1H, m), 2.73-3.12 (3H, m), 4.71-4.81 (1H, m), 4.83 (1H, d, J = 12.9 Hz), 4.96 (1H, d, J = 12.9 Hz), 5.88 (1H, d, J = 7.5 Hz), 5.89 (1H, s), 6.89 (1H, m), 7.00-7.04 (2H, m), 7.08-7.18 (2H, m), 7.22-7.27 (1H, m), 7.38 (1H, d, J = 7.5 Hz), 7.58-7.61 (1H, m), 7.79 (1H, d, J = 7.5 Hz).
1H-NMR (CDCl3) δ: 0.95 (3H, d, J = 6.9 Hz), 1.17 (3H, d, 6.9 Hz), 3.34(2H, d, J = 12.3 Hz), 4.39 (1H, d, J = 12.9 Hz), 4.56-4.65 (1H, m), 4.85 (1H, d, J = 12.9 Hz), 4.93 (1H, m), 5.77 (1H, d, J = 7.5 Hz), 6.77-6.81 (1H, m), 6.79 (1H, d, J = 7.5 Hz), 7.00-7.05 (1H, m), 7.21-7.29 (2H, m), 7.32-7.42 (3H, m).
1H-NMR (CDCl3) δ: 1.06-1.17 (6H, m), 4.02-4.17 (1H, m), 4.61-4.78 (2H, m), 5.16 (1H, d, J = 5.1 Hz), 5.72 (1H, t, J = 8.1 Hz), 6.54 (0.5H, d, J = 7.8 Hz), 6.84 (0.5H, d, J = 7.8 Hz), 6.91-7.08 (2H, m), 7.16-7.47 (4H, m), 7.56-7.59 (1H, m), 8.00 (0.5H, J = 6.3 Hz), 8.09-8.12 (0.5H, m), 8.51 (0.5H, s), 8.68 (0.5H, s).
1H-NMR (CDCl3) δ: 1.19 (3H, d, J = 6.9 Hz), 1.25 (3H, d, J = 6.9 Hz), 2.76-2.91 (2H, m), 3.23-3.31 (1H, m), 4.17-4.33 (2H, m), 4,54-4.84 (2H, m), 5.18 (1H, s), 5.87 (1H, d, J = 7.8 Hz), 6.70 (1H, d, J = 5.1 Hz), 6.86 (1H, d, J = 7.8 Hz), 7.04 (1H, d, J = 5.1 Hz), 7.19-7.25 (2H, m), 7.32-7.38 (2H, m).
1H-NMR (DMSO-d6) δ: 1.04-1.20 (6H, m), 2.83-3.02 (1H, m), 3.46-3.57 (1H, m), 3.75-3.85 (1H, m), 4.13-4.26 (1H, m), 4.32-4.50 (1H, m), 4.56-4.62 (1H, m), 4.89 (1H, d, J = 13.2 Hz), 5.36 (1H, s), 5.44-5.50 (1H, m), 6.73 (1H, d, J = 7.8 Hz), 6.86 (1H, t, J = 7.5 Hz), 6.95-6.98 (1H, m), 7.09-6.54 (5H, m).
第一工程
化合物390A (14.8 g, 115 mmol) をメタノール (200 ml) に加え、室温でナトリウムメトキシド (28%メタノール溶液, 22.2 g, 115 mmol) を加えて室温で1時間攪拌した。溶媒を減圧留去し、17.3 gの白色固体を得た。そのうちの5.61 gにphthalide (5.00 g, 37.3 mmol) を加えて200℃で1時間攪拌した。反応液を水にあけ、塩酸で酸性にし、生じた白色沈殿をろ取した。クロロホルムに溶解し、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた化合物にn-ヘキサン-クロロホルム-ジイソプロピルエーテルを加え、析出した残渣をろ過し、2.44 gの薄茶色固体390Bを得た。
1H-NMR (CDCl3) δ: 5.61 (2H, s), 6.92 (1H, td, J = 7.6, 1.4 Hz), 7.01 (1H, dd, J = 8.3, 1.3 Hz), 7.21 (1H, ddd, J = 8.7, 7.0, 1.2 Hz), 7.32-7.54 (2H, m), 7.66 (1H, td, J = 7.6, 1.4 Hz), 7.92-7.99 (1H, m), 8.17 (1H, dd, J = 7.9, 1.3 Hz).
第二工程
化合物390B (2.44 g, 9.29 mmol) をジクロロメタン (30 ml) に溶解し、trifluoroacetic anhydride (1.44 ml, 10.2 mmol) とboron trifluoride etherate (0.235 ml, 1.86 mmol) を加えて室温で3時間攪拌した。反応液を水にあけ、ジクロロメタンで抽出し、有機層を1規定塩酸と飽和食塩水で洗い、溶媒を留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (4:1, v/v) で溶出することにより精製し、1.76 gの淡黄色固体390Cを得た。
1H-NMR (CDCl3) δ: 5.36 (2H, s), 7.11 (1H, t, J = 8.0 Hz), 7.43-7.66 (4H, m), 7.93 (1H, d, J = 6.5 Hz), 8.19 (1H, dd, J = 8.1, 1.8 Hz).
第三工程
化合物390C (1.76 g, 7.19 mmol) にメタノール (20 ml) を加え、0℃で水素化ホウ素ナトリウム (327 mg, 8.63 mmol) を加えて室温で30分攪拌した。反応液を水にあけ、ジクロロメタンで抽出し、有機層を硫酸ナトリウムで乾燥して溶媒を留去した。得られた化合物にn-ヘキサン-ジクロロメタンを加え、析出した残渣をろ過し、1.44 gの白色固体390Dを得た。
1H-NMR (CDCl3) δ: 2.75 (1H, d, J = 5.0 Hz), 5.18 (1H, d, J = 13.6 Hz), 5.69 (1H, d, J = 5.0 Hz), 5.89 (1H, d, J = 13.6 Hz), 6.93 (1H, t, J = 7.9 Hz), 7.19-7.43 (6H, m).
第四工程
参考例107と同様の手法により化合物390を合成した。
MS: m/z = 452 [M+H] +
1H-NMR (CDCl3) δ: 1.12-1.32 (6H, m), 4.25 (0.52H, d, J = 12.9 Hz), 4.41 (0.48H, d, J = 13.2 Hz), 4.58-4.79 (2H, m), 4.92-5.03 (2H, m), 5.73 (0.48H, d, J = 7.8 Hz), 5.89 (0.52H, d, J = 7.8 Hz), 6.12 (0.48H, d, J = 12 Hz), 6.46-6.58 (1.52H, m), 6.74-6.78 (1H, m), 6.98 (1H, t, J = 7.5 Hz), 7.10-7.14 (1H, m), 7.20-7.50 (4H, m).
1H-NMR (CDCl3) δ: 1.12-1.31 (6H, m), 4.25 (0.75H. d, J = 12.9 Hz), 4.43 (0.25H, d, J = 12.9 Hz), 4.53-4.60 (0.50H, m), 4.67-4.78 (1.5H, m), 4.90-5.05 (2H. m), 5.70 (0.25H, d, J = 7.8 Hz, 5.86 (0.75H, d, J = 7.5 Hz), 6.18 (0.25H, d, J = 13.5 Hz), 6.36-6.42 (0.75H, m), 6.49-6.56 (2H, m), 6.69-6.80 (1H, m), 6.94 (1H, d, J = 7.8 Hz), 7.10-7.19 (0.25H, m), 7.21-7.50 (3.75H, m).
1H-NMR (CDCl3) δ: 1.13-1.31 (12H, m), 3.28-3.37 (0.50H, m), 3.44-3.53 (0.50H, m), 4.29-4.36 (1H, m), 4.65-4.76 (2H, m), 4.98-5.05 (2H, m), 6.37 (0.5H, d, J = 12.9 Hz), 6.45 (0.5H, d, J = 7.5 Hz), 6.67 (0.5H, t, J = 7.8 Hz), 6.81 (0.5H, 7.8 Hz), 6.98-7.08 (2H, m), 7.14 (0.5Hm d, J = 7.8 Hz), 7.22-7.45 (2.5H, m).
第一工程
参考例95と同様の手法で得た化合物413A (200 mg, 0.544 mmol) と6,11-dihydrodibenzo[b,e]thiepin-11-ol (124 mg 0.554 mmol) を酢酸 (8 ml)に溶解し、水冷下で濃硫酸 (2 ml) を滴下した。室温で30分攪拌した後、水を加え酢酸エチルで抽出した。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去して413Bの粗生成物を得た。
第二工程
第一工程で得られた413Bをジクロロメタン (2 ml) に溶解し、無水酢酸 (0.154 ml, 1.63mmol) とトリエチルアミン (0.226 ml, 1.63 mmol) と4-(dimethylamino)pyridine (cat.) を加え、室温で30分攪拌した。溶媒を留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製し、ジアステレオマーを分割した。 それぞれメタノール (1 ml) とテトラヒドロフラン (1 ml) に溶解し、2規定水酸化ナトリウム水溶液 (0.198 ml, 0.397 mmol) を加えて室温で30分攪拌した。反応液を水にあけ、塩酸で酸性にし、酢酸エチルで抽出した。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去した。得られた化合物に酢酸エチル-ジエチルエーテルを加え、分別析出した残渣をろ過し、それぞれ化合物413(22 mg)と化合物414(20 mg)得た。
1H-NMR (DMSO-d6) δ: 1.20 (3H, d, J = 7.4 Hz), 3.92 (1H, d, J = 13.6 Hz), 4.45 (1H, d, J = 13.4 Hz), 5.12 (1H, d, J = 12.8 Hz), 5.60 (4H, m), 6.87-7.60 (9H, m).
MS: m/z = 488 [M+H] +
MS: m/z = 488 [M+H] +
1H-NMR (DMSO-d6) δ: 1.16 (3H, d, J = 7.3 Hz), 3.88 (1H, d, J = 13.3 Hz), 4.41 (1H, d, J = 13.3 Hz), 5.07 (1H, d, J = 13.0 Hz), 5.42-5.52 (1H, m), 5.62 (3H, m), 6.82-7.56 (9H, m).
MS: m/z = 488 [M+H] +
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.3 Hz), 3.88 (1H, d, J = 13.3 Hz), 4.44 (1H, d, J = 12.7 Hz), 5.15 (1H, d, J = 12.5 Hz), 5.16 (1H, m), 5.29 (1H, s), 5.57 (1H, d, J = 13.4 Hz), 5.64 (1H, d, J = 7.8 Hz), 6.81-7.45 (9H, m).
MS: m/z = 488 [M+H] +
1H-NMR (CDCl3) δ: 1.22 (3H, d, J = 7.2 Hz), 4.32 (1H, d, J = 13.9 Hz), 4.49 (1H, d, J = 13.1 Hz), 4.90 (1H, d, J = 13.3 Hz), 5.15 (1H, s), 5.47-5.65 (2H, m), 5.83 (1H, d, J = 8.1 Hz), 6.69 (1H, d, J = 6.5 Hz), 6.80-6.87 (1H, m), 7.07-7.24 (5H, m), 7.54 (1H, d, J = 7.9 Hz).
MS: m/z = 522 [M+H]+.
1H-NMR (CDCl3) δ: 1.48 (3H, d, J = 7.1 Hz), 3.63 (1H, d, J = 13.2 Hz), 4.49 (1H, d, J = 12.6 Hz), 5.03 (1H, s), 5.28-5.45 (2H, m), 5.53 (1H, d, J = 13.5 Hz), 5.73 (1H, d, J = 7.7 Hz), 6.50 (1H, dd, J = 8.7, 2.6 Hz), 6.79-6.86 (1H, m), 6.90 (1H, d, J = 9.1 Hz), 7.02 (1H, dd, J = 8.8, 5.2 Hz), 7.10 (1H, ddd, J = 8.1, 2.5, 1.2 Hz), 7.25 (1H, d, J = 7.7 Hz), 7.30 (1H, dd, J = 8.5, 5.5 Hz).
MS: m/z = 524 [M+H]+.
1H-NMR (CDCl3) δ: 1.50 (3H, d, J = 7.1 Hz), 4.28 (1H, d, J = 13.7 Hz), 4.50 (1H, d, J = 12.4 Hz), 5.17 (1H, s), 5.26-5.44 (2H, m), 5.60-5.69 (2H, m), 6.65 (1H, d, J = 7.4 Hz), 6.73-6.80 (1H, m), 7.01-7.21 (5H, m), 7.48 (1H, d, J = 8.0 Hz).
MS: m/z = 522 [M+H]+.
1H-NMR (CDCl3) δ: 1.49 (3H, d, J = 7.4 Hz), 3.51 (1H, d, J = 13.5 Hz), 4.48 (1H, d, J = 12.6 Hz), 5.12 (1H, s), 5.28-5.44 (2H, m), 5.60-5.70 (2H, m), 6.65 (1H, d, J = 7.4 Hz), 6.73-6.80 (1H, m), 7.00-7.06 (2H, m), 7.10 (1H, d, J = 8.5 Hz), 7.14 (1H, d, J = 8.0 Hz), 7.23 (1H, dd, J = 8.2, 2.2 Hz), 7.31 (1H, d, J = 1.9 Hz).
MS: m/z = 522 [M+H]+.
1H-NMR (CDCl3) δ: 1.53 (3H, d, J = 7.4 Hz), 3.59 (1H, d, J = 13.4 Hz), 4.51 (1H, d, J = 12.6 Hz), 5.12 (1H, s), 5.30-5.48 (2H, m), 5.62-5.70 (2H, m), 6.71 (1H, d, J = 7.7 Hz), 6.80-6.83 (1H, m), 7.07-7.11 (2H, m), 7.18 (1H, d, J = 7.7 Hz), 7.22 (1H, s), 7.28 (1H, d, J = 8.4 Hz), 7.39 (1H, d, J = 8.1 Hz).
MS: m/z = 522 [M+H]+.
1H-NMR (CDCl3) δ: 1.49 (3H, d, J = 7.4 Hz), 3.59 (1H, d, J = 13.5 Hz), 4.48 (1H, d, J = 12.4 Hz), 5.12 (1H, s), 5.29-5.39 (2H, m), 5.66 (1H, d, J = 13.5 Hz), 5.73 (1H, d, J = 7.7 Hz), 6.61 (1H, d, J = 8.2 Hz), 6.73 (1H, dd, J = 8.2, 2.2 Hz), 7.04 (1H, d, J = 2.2 Hz), 7.12-7.20 (2H, m), 7.23-7.27 (1H, m), 7.31 (1H, d, J = 6.3 Hz), 7.36-7.44 (1H, m).
MS: m/z = 522 [M+H]+.
1H-NMR (CDCl3) δ: 1.47 (3H, d, J = 7.1 Hz), 3.69 (1H, d, J = 13.5 Hz), 4.49 (1H, d, J = 12.6 Hz), 5.21 (1H, s), 5.27 (1H, d, J = 12.6 Hz), 5.30-5.40 (1H, m), 5.70 (1H, d, J = 7.7 Hz), 5.75 (1H, d, J = 13.5 Hz), 6.65 (1H, dd, J = 7.8, 1.5 Hz), 6.73 (1H, t, J = 7.7 Hz), 7.13 (1H, d, J = 7.7 Hz), 7.15-7.22 (2H, m), 7.25-7.29 (1H, m),7.32 (1H, d, J = 8.0 Hz), 7.37-7.45 (1H, m).
MS: m/z = 522 [M+H]+.
1HNMR (CDCl3) δ: 1.14 (3H, d, J = 6.9 Hz), 3.64 (1H, d, J = 13.5 Hz), 4.48 (1H, d, J = 12.8 Hz), 4.88 (1H, d, J = 12.8 Hz), 5.08 (1H, s), 5.51 (1H, m), 5.60 (1H, d, J = 13.5 Hz), 5.93 (1H, d, J = 8.1 Hz), 6.58 (1H, d, J = 8.1 Hz), 6.95 (1H, dd, J = 2.0, 8.1 Hz), 7.18 (2H, m), 7.29 (1H, m), 7.37 - 7.45 (2H, m).
1HNMR (CDCl3) δ: 1.41 (3H, d, J = 7.5 Hz), 3.61 (1H, d, J = 13.4 Hz), 4.55 (1H, d, J = 12.5 Hz), 5.06 (1H, d, J = 12.5 Hz), 5.16 (1H, s), 5.34 (1H, m), 5.63 (1H, d, J = 13.4 Hz), 5.87 (1H, d, J = 8.1 Hz), 6.61 (1H, d, J = 8.1 Hz), 6.93 (1H, dd, J = 1.8, 8.1 Hz), 7.16 - 7.41 (5H, m).
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 7.4 Hz), 3.64 (1H, d, J = 13.5 Hz), 4.44 (1H, d, J = 13.2 Hz), 4.87 (1H, d, J = 13.2 Hz), 5.44-5.57 (1H, m), 5.68 (1H, d, J = 13.2 Hz), 5.83 (1H, d, J = 7.7 Hz), 5.94 (1H, s), 6.78-6.91 (2H, m), 7.08-7.18 (3H, m), 7.28-7.38 (3H, m).
MS: m/z = 522 [M+H]+.
1H-NMR (CDCl3) δ: 1.21 (3H, d, J = 7.4 Hz), 3.70 (1H, d, J = 13.5 Hz), 4.43 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.2 Hz), 5.21 (1H, s), 5.46-5.60 (1H, m), 5.70 (1H, d, J = 13.5 Hz), 5.84 (1H, d, J = 7.7 Hz), 6.73 (1H, d, J = 7.1 Hz), 6.82-6.89 (1H, m), 7.08-7.17 (2H, m), 7.22 (1H, d, J = 7.7 Hz), 7.35 (1H, d, J = 8.0 Hz), 7.55 (1H, d, J = 8.0 Hz), 7.67 (1H, s).
MS: m/z = 071 [M+H]+.
1H-NMR (CDCl3) δ: 1.22 (3H, d, J = 7.1 Hz), 3.56 (1H, d, J = 13.5 Hz), 4.48 (1H, d, J = 13.2 Hz), 4.90 (1H, d, J = 13.2 Hz), 5.09 (1H, s), 5.46-5.60 (1H, m), 5.62 (1H, d, J = 13.2 Hz), 5.82 (1H, d, J = 7.7 Hz), 6.69 (1H, d, J = 7.4 Hz), 6.84 (1H, dt, J = 10.0, 3.5 Hz), 7.04-7.14 (3H, m), 7.17 (1H, d, J = 7.7 Hz), 7.42 (1H, dd, J = 8.0, 1.6 Hz), 7.55 (1H, d, J = 1.9 Hz).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.44 (3H, d, J = 7.3 Hz), 3.54 (1H, d, J = 13.4 Hz), 4.54 (1H, d, J = 12.5 Hz), 5.10 (1H, d, J = 12.5 Hz), 5.16 (1H, s), 5.31-5.45 (1H, m), 5.65 (1H, d, J = 13.3 Hz), 5.73 (1H, d, J = 7.8 Hz), 6.71 (1H, d, J = 7.8 Hz), 6.77-6.84 (1H, m), 7.03-7.11 (3H, m), 7.22 (1H, d, J = 7.6 Hz), 7.40 (1H, dd, J = 8.2, 2.0 Hz), 7.48 (1H, d, J = 2.0 Hz).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.14 (3H, d, J = 7.3 Hz), 3.70 (1H, d, J = 13.4 Hz), 4.51 (1H, d, J = 13.1 Hz), 4.90 (1H, d, J = 12.8 Hz), 5.19 (1H, s), 5.44-5.58 (1H, m), 5.62 (1H, d, J = 13.3 Hz), 5.87 (1H, d, J = 7.6 Hz), 6.86 (1H, d, J = 7.9 Hz), 7.07 (1H, dd, J = 8.2, 1.4 Hz), 7.15-7.22 (2H, m), 7.27-7.51 (4H, m).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.48 (3H, d, J = 7.4 Hz), 3.71 (1H, d, J = 13.3 Hz), 4.60 (1H, d, J = 12.6 Hz), 5.21 (1H, d, J = 12.6 Hz), 5.29 (1H, s), 5.32-5.46 (1H, m), 5.70 (1H, d, J = 13.3 Hz), 5.80 (1H, d, J = 7.7 Hz), 6.91 (1H, d, J = 7.9 Hz), 7.08 (1H, d, J = 7.4 Hz), 7.20-7.29 (2H, m), 7.33-7.51 (4H, m).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.21 (3H, d, J = 7.3 Hz), 3.60 (1H, d, J = 13.6 Hz), 4.46 (1H, d, J = 13.1 Hz), 4.90 (1H, d, J = 12.8 Hz), 5.15 (1H, s), 5.47-5.59 (1H, m), 5.68 (1H, d, J = 13.4 Hz), 5.83 (1H, d, J = 7.6 Hz), 6.70 (1H, d, J = 7.3 Hz), 6.80-6.88 (1H, m), 7.07-7.26 (6H, m).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.42 (3H, d, J = 7.3 Hz), 3.57 (1H, d, J = 13.3 Hz), 4.55 (1H, d, J = 12.5 Hz), 5.05 (1H, d, J = 12.5 Hz), 5.23 (1H, s), 5.32-5.47 (1H, m), 5.70 (1H, d, J = 13.4 Hz), 5.77 (1H, d, J = 7.6 Hz), 6.74 (1H, d, J = 7.8 Hz), 6.79-6.87 (1H, m), 7.04-7.26 (6H, m).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.20 (3H, d, J = 7.2 Hz), 2.29 (3H, s), 3.76 (1H, d, J = 13.3 Hz), 4.54 (1H, d, J = 13.1 Hz), 4.92 (1H, d, J = 13.1 Hz), 5.18 (1H, s), 5.50-5.62 (1H, m), 5.71 (1H, d, J = 13.4 Hz), 5.84 (1H, d, J = 7.7 Hz), 6.63 (1H, d, J = 7.4 Hz), 6.78 (1H, t, J = 7.6 Hz), 7.06 (1H, d, J = 7.6 Hz), 7.17 (1H, d, J = 7.7 Hz), 7.23 (1H, d, J = 7.6 Hz), 7.28-7.34 (1H, m), 7.39-7.51 (2H, m).
MS: m/z = 433 [M+H]+.
1H-NMR (CDCl3) δ: 1.45 (3H, d, J = 7.2 Hz), 2.27 (3H, s), 3.74 (1H, d, J = 13.3 Hz), 4.61 (1H, d, J = 12.4 Hz), 5.07 (1H, d, J = 12.4 Hz), 5.27 (1H, s), 5.31-5.44 (1H, m), 5.75 (1H, d, J = 13.3 Hz), 5.80 (1H, d, J = 7.7 Hz), 6.67 (1H, d, J = 7.1 Hz), 6.77 (1H, t, J = 7.6 Hz), 7.04 (1H, d, J = 7.1 Hz), 7.21-7.47 (5H, m).
MS: m/z = 433 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.22 (3H, d, J = 7.2 Hz), 3.94 (1H, d, J = 13.3 Hz), 4.45 (1H, d, J = 13.4 Hz), 5.08 (1H, d, J = 12.8 Hz), 5.56 (4H, dm), 6.84-7.54 (8H, m).
1H-NMR (DMSO-d6) δ: 1.37 (3H, d, J = 7.2 Hz), 3.98 (1H, d, J = 13.4 Hz), 4.48 (1H, d, J = 13.1 Hz), 5.21 (1H, d, J = 12.9 Hz), 5.22 (1H, m), 5.38 (1H, s), 5.52 (1H, d, J = 13.4 Hz), 5.67 (1H, d, J = 7.6 Hz), 6.87-7.57 (8H, m).
1H-NMR (DMSO-d6) δ: 1.19 (3H, d, J = 7.2 Hz), 3.92 (1H, d, J = 13.4 Hz), 4.43 (1H, d, J = 13.1 Hz), 5.05 (1H, d, J = 13.0 Hz), 5.54 (4H, m), 7.29 (8H, m).
MS: m/z = 522 [M+H] +
1H-NMR (DMSO-d6) δ: 1.13 (3H, d, J = 7.0 Hz), 4.00 (1H, d, J = 14.2 Hz), 4.40 (1H, d, J = 13.3 Hz), 5.05 (1H, d, J = 13.3 Hz), 5.44 (1H, m), 5.62-5.71 (3H, m), 6.82-7.56 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.23 (3H, d, J = 7.2 Hz), 4.14 (1H, d, J = 13.8 Hz), 4.60 (1H, d, J = 13.6 Hz), 5.10 (1H, d, J = 13.3 Hz), 5.48 (1H, d, J = 15.6 Hz) 5.49 (1H, m), 5.69 (1H, d, J = 7.9 Hz ), 5.70 (1H, s), 6.89-7.47 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.22 (3H, d, J = 6.9 Hz), 3.93 (1H, d, J = 13.1 Hz), 4.49 (1H, d, J = 13.4 Hz), 5.05 (1H, d, J = 13.7 Hz), 5.57 (4H, m), 6.87-7.61 (8H, m).
MS: m/z = 522 [M+H] +
1H-NMR (DMSO-d6) δ: 1.41 (3H, d, J = 7.2 Hz), 3.98 (1H, d, J = 13.3 Hz), 4.48 (1H, d, J = 12.9 Hz), 5.21 (1H, d, J = 14.4 Hz), 5.22 (1H, m), 5.39 (1H, s), 5.52 (1H, d, J = 13.6 Hz), 5.67 (1H, d, J = 7.6 Hz), 6.88-7.57 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.19 (3H, d, J = 7.2 Hz), 3.94 (1H, d, J = 13.3 Hz), 4.44 (1H, d, J = 13.3 Hz), 5.12 (1H, d, J = 13.1 Hz), 5.46-5.68 (3H, m), 5.76 (1H, d, J = 7.6 Hz), 7.27 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.14 (3H, d, J = 7.2 Hz), 3.93 (1H, d, J = 13.3 Hz), 4.40 (1H, d, J = 13.1 Hz), 5.07 (1H, d, J = 13.0 Hz), 5.46 (1H, m), 5.62 (1H, d, J = 15.6 Hz), 5.64 (1H, s), 5.75 (1H, d, J = 7.6 Hz), 6.94-7.55 (8H, m).
MS: m/z = 522 [M+H] +
1H-NMR (DMSO-d6) δ: 1.14 (3H, d, J = 7.2 Hz), 4.03 (1H, d, J = 13.3 Hz), 4.41 (1H, d, J = 13.3 Hz), 5.06 (1H, d, J = 13.0 Hz), 5.46 (1H, m), 5.69 (3H, m), 6.88-7.57 (8H, m).
MS: m/z = 522 [M+H] +
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.2 Hz), 4.03 (1H, d, J = 13.3 Hz), 4.43 (1H, d, J = 13.0 Hz), 5.14 (1H, t, J = 12.6 Hz), 5.15 (1H, m), 5.42 (1H, s), 5.63 (1H, d, J = 13.5 Hz), 5.65 (1H, d, J = 7.8 Hz) , 6.88-7.44 (8H, m).
MS: m/z = 522 [M+H] +
1H-NMR (DMSO-d6) δ: 1.42 (3H, d, J = 7.2 Hz), 4.14 (1H, d, J = 13.9 Hz), 4.57 (1H, d, J = 13.1 Hz), 5.14 (1H, d, J = 13.0 Hz), 5.15 (1H, m), 5.30 (1H, d, J = 13.0 Hz), 5.40 (1H, s), 5.68 (1H, d, J = 7.7 Hz), 6.89-7.38 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.40 (3H, d, J = 7.4 Hz), 4.05 (1H, d, J = 13.4 Hz), 4.47 (1H, d, J = 13.1 Hz), 5.18 (1H, m), 5.19 (1H, d, J = 13.2 Hz), 5.46 (1H, s), 5.65 (1H, d, J = 13.4 Hz), 5.74 (1H, d, J = 7.6 Hz), 6.89-7.52 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.20 (3H, d, J = 7.2 Hz), 3.89 (1H, d, J = 13.4 Hz), 4.46 (1H, d, J = 13.4 Hz), 5.05 (1H, d, J = 13.4 Hz), 5.44-5.66 (4H, m), 6.83-7.63 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.16 (3H, d, J = 7.3 Hz), 3.92 (1H, d, J = 13.3 Hz), 4.39 (1H, d, J = 13.1 Hz), 5.07 (1H, d, J = 13.3 Hz), 5.47 (1H, m), 5.60 (1H, d, J = 13.3 Hz), 5.68 (1H, s), 5.72 (1H, d, J = 7.6 Hz), 7.07-7.54 (8H, m).
MS: m/z = 522 [M+H] +
1H-NMR (DMSO-d6) δ: 1.13 (5H, d, J = 6.3 Hz), 4.00 (1H, d, J = 13.4 Hz), 4.52 (1H, d, J = 13.6 Hz), 5.09 (1H, d, J = 13.3 Hz), 5.49-5.69 (4H, m), 6.84-7.51 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.40 (3H, d, J = 7.2 Hz), 4.02 (1H, d, J = 13.1 Hz), 4.53 (1H, d, J = 13.3 Hz), 5.20 (1H, d, J = 12.9 Hz), 5.26 (1H, m), 5.67 (3H, m), 7.18 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.15 (3H, d, J = 7.3 Hz), 3.91 (1H, d, J = 13.4 Hz), 4.39 (1H, d, J = 13.3 Hz), 5.06 (1H, d, J = 13.3 Hz), 5.45 (1H, m), 5.62 (1H, s), 5.63 (1H, t, J = 13.5 Hz), 5.74 (1H, d, J = 7.6 Hz), 6.71-7.55 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.39 (3H, d, J = 7.4 Hz), 3.95 (1H, d, J = 13.4 Hz), 4.46 (1H, d, J = 12.9 Hz), 5.19 (1H, d, J = 13.1 Hz), 5.20 (1H, m), 5.41 (1H, s), 5.62 (1H, d, J = 13.4 Hz), 5.76 (1H, d, J = 7.7 Hz), 6.72-7.50 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.42 (3H, d, J = 7.2 Hz), 3.94 (1H, d, J = 13.3 Hz), 4.50 (1H, d, J = 13.1 Hz), 5.17 (1H, d, J = 12.4 Hz), 5.18 (1H, m), 5.39 (1H, s), 5.60-5.69 (2H, m), 6.87-7.42 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.2 Hz), 3.91 (1H, d, J = 13.0 Hz), 4.43 (1H, d, J = 13.1 Hz), 5.15 (1H, d, J = 12.8 Hz), 5.16 (1H, m), 5.41 (1H, s), 5.47 (1H, d, J = 13.0 Hz), 5.69 (1H, d, J = 7.6 Hz), 7.00-7.45 (8H, m).
MS: m/z = 506 [M+H] +
1H-NMR (DMSO-d6) δ: 1.21 (3H, d, J = 7.3 Hz), 3.97 (1H, d, J = 13.3 Hz), 4.46 (1H, d, J = 13.1 Hz), 5.09 (1H, d, J = 13.6 Hz), 5.50 (1H, m), 5.51 (1H, d, J = 12.8 Hz), 5.65 (1H, s), 5.72 (1H, d, J = 7.6 Hz), 6.85-7.55 (7H, m).
MS: m/z = 524 [M+H] +
1HNMR (CDCl3) δ: 1.13 (3H, d, J = 5.8 Hz), 4.20 (1H, d, J = 13.6 Hz), 4.58 (1H, d, J = 12.7 Hz), 4.99 (1H, d, J = 12.7 Hz), 5.29-5.42 (3H, m), 5.84 (1H, d, J = 7.8 Hz), 6.60 (1H, m), 6.79-7.01 (3H, m), 7.19-7.28 (4H, m).
MS: m/z = 524 [M+H]+.
1HNMR (CDCl3) δ: 1.19 (3H, d, J = 7.6 Hz), 4.21 (1H, d, J = 13.9 Hz), 4.48 (1H, d, J = 13.3 Hz), 4.89 (1H, d, J = 13.3 Hz), 5.22 (1H, s), 5.37 (1H, dd, J = 2.1, 13.9 Hz), 5.52 (1H, m), 5.86 (1H, d, J = 7.6), 6.55 (1H, m), 6.83 (1H, m), 6.96 (1H, m), 7.14 (1H, d, J = 7.6 Hz), 7.19-7.30 (4H, m).
MS: m/z = 524 [M+H]+.
1HNMR (CDCl3) δ: 1.19 (3H, d, J = 7.3 Hz), 3.65 (1H, d, J = 13.5 Hz), 4.47 (1H, d, J = 13.0 Hz), 4.87 (1H, d, J = 13.0 Hz), 5.18 (1H, s), 5.50 (1H, m), 5.69 (1H, d, J = 13.5 Hz), 5.85 (1H, d, J = 7.8 Hz), 6.53 (1H, m), 6.83 (1H, m), 6.91-7.01 (2H, m), 7.11 (1H, d, J = 7.6 Hz), 7.10-7.20 (3H, m).
MS: m/z = 524 [M+H]+.
1HNMR (CDCl3) δ: 1.13 (3H, d, J = 6.1 Hz), 3.63 (1H, d, J = 13.5 Hz), 4.56 (1H, d, J = 12.5 Hz), 5.02 (1H, d, J = 12.5 Hz), 5.26 (1H, s), 5.38 (1H, m), 5.71 (1H, d, J = 13.5 Hz), 5.81 (1H, d, J = 7.8 Hz), 6.57 (1H, m), 6.81 (1H, m), 6.91 (1H, m), 6.99 (1H, dd, J = 2.6, 8.2 Hz), 7.05 (1H, dd, J = 2.6, 8.7 Hz), 7.17 (2H, m), 7.19 (1H, d, J = 7.6 Hz).
MS: m/z = 524 [M+H]+.
1HNMR (CDCl3) δ: 1.21 (3H, d, J = 7.4 Hz), 3.66 (1H, d, J = 13.5 Hz), 4.47 (1H, d, J = 13.3 Hz), 4.88 (1H, d, J = 13.3 Hz), 5.17 (1H, s), 5.52 (1H, m), 5.66 (1H, d, J = 13.5 Hz), 5.85 (1H, d, J = 7.7 Hz), 6.54 (1H, m), 6.83 (1H, m), 6.95 (1H, m), 7.11-7.14 (2H, m), 7.23-7.29 (2H, m), 7.41 (1H, d, J = 2.0 Hz).
MS: m/z = 540 [M+H]+.
1HNMR (CDCl3) δ: 1.13 (3H, d, J = 6.2 Hz), 3.63 (1H, d, J = 13.5 Hz), 4.55 (1H, d, J = 12.6 Hz), 5.04 (1H, d, J = 12.6 Hz), 5.25 (1H, s), 5.38 (1H, m), 5.69 (1H, d, J = 13.5 Hz), 5.80 (1H, d, J = 7.7 Hz), 6.58 (1H, m), 6.82 (1H, m), 6.92 (1H, m), 7.13 (1H, m), 7.19 (1H, d, J = 7.7 Hz), 7.24-7.29 (2H, m), 7.34 (1H, d, J = 2.2 Hz).
MS: m/z = 540 [M+H]+.
1HNMR (CDCl3) δ: 1.19 (3H, d, J = 7.3 Hz), 4.40 (1H, d, J = 13.9 Hz), 4.59 (1H, d, J = 13.0 Hz), 5.02 (1H, d, J = 13.0 Hz), 5.31 (1H, s), 5.39 (1H, m), 5.66 (1H, d, J = 13.9 Hz), 5.84 (1H, d, J = 7.8 Hz), 6.58 (1H, m), 6.82 (1H, m), 6.92 (1H, m), 7.10 (1H, m), 7.19 (1H, dd, J = 3.7, 7.9 Hz), 7.20-7.26 (2H, m), 7.51 (1H, m).
MS: m/z = 540 [M+H]+.
第一工程
参考例と同様の手法で合成した476A ( 3.00 g, 9.83 mmol) をジメチルホルムアミド (30 ml) に溶解し、シアン化銅(I) (2.64 g, 29.5 mmol) を加えて150℃で7時間攪拌した。反応液を室温まで冷まし、セライトろ過した。ろ液に水を加え、酢酸エチルで抽出し、有機層を水で洗った。溶媒を減圧留去することによって得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (1:1, v/v) で溶出することにより精製した。得られた化合物にn-ヘキサンを加え、析出した残渣をろ過し、1.81 gの白色固体476Bを得た。
1H-NMR (CDCl3) δ: 4.29 (2H, s), 7.28-7.48 (4H, m), 7.78 (2H, t, J = 7.5 Hz), 8.20 (1H, dd, J = 8.1, 1.5 Hz).
第二工程
参考例107と同様の手法により化合物476を合成した。
1H-NMR (DMSO-d6) δ: 1.16 (3H, d, J = 7.0 Hz), 4.01 (1H, d, J = 14.0 Hz), 4.65 (1H, d, J = 13.7 Hz), 5.04 (1H, d, J = 13.3 Hz), 5.45 (1H, t, J = 8.1 Hz), 5.66 (1H, d, J = 7.6 Hz), 5.74 (1H, s), 5.84 (1H, d, J = 14.0 Hz), 6.87-7.93 (7H, m).
MS: m/z = 513 [M+H] +
第一工程
化合物476B (859 mg, 3.42 mmol) に濃硫酸 (13 ml) を加えて室温で18時間、60℃で2時間攪拌した。反応液を水に加え、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧濃縮することにより、387 mgの淡黄色固体を得た。得られた化合物にメタノール (10 ml) を加え、10規定水酸化ナトリウム水溶液 (6 ml) を加えて90℃で5時間攪拌した。反応液を室温まで冷まし、水を加えてジクロロメタンで洗った。水層に希塩酸を加え、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧濃縮し、296 mgの黄色固体477Aを得た。
第二工程
第一工程で得られた化合物477A (179 mg, 0.662 mmol) をジクロロメタン (4 ml) に溶解し、ジメチルアミン塩酸塩 (108 mg, 1.32 mmol)とEDCI (190 mg, 0.993 mmol) と1H-benzo[d][1,2,3]triazol-1-ol (89.0 mg, 0.662 mmol) とトリエチルアミン (0.3 ml) を加えて室温で2時間攪拌した。反応液に水を加えて酢酸エチルで抽出し、有機層を炭酸水素ナトリウム水溶液で洗って硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (1:1, v/v) で溶出することにより精製し、170 mgの無色ガム状物質477Bを得た。
1H-NMR (CDCl3) δ: 2.99 (3H, s), 3.23 (3H, s), 4.08 (2H, s), 7.28-7.44 (5H, m), 7.58 (1H, t, J = 4.4 Hz), 8.22 (1H, dd, J = 8.1, 1.5 Hz).
第三工程
参考例107と同様の手法により化合物477を合成した。
MS: m/z = 559 [M+H] +
第一工程
化合物277 (971 mg, 2.11 mmol) をジメチルホルムアミド (10 ml)に溶解し、炭酸セシウム (2.75 g, 8.45 mmol) とベンジルブロミド (0.753 ml, 6.34 mmol) を加えて室温で4時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、有機層を水で洗って硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた化合物にジクロロメタン-ジエチルエーテルを加え、析出した残渣をろ過し、740 mgの白色固体478Aを得た。
第二工程
478A (740 mg, 1.35 mmol) をテトラヒドロフラン (7 ml) とメタノール (7 ml) に溶解し、2規定水酸化ナトリウム水溶液 (3.37 ml, 6.73 mmol) を加えて室温で30分攪拌した。反応液に希塩酸を加えて酸性にし、クロロホルムで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧濃縮することにより618 mgの白色固体478Bを得た。
MS: m/z = 508 [M+H] +
第三工程
478B (505 mg, 0.995 mmol) をテトラヒドロフラン (10 ml) に溶解し、triphenylphosphine (391 mg, 1.49 mmol) とphthalimide (220 mg, 1.49 mmol) とazodicarboxylic acid diisopropyl ester (0.290 ml, 1.49 mmol) を加えて室温で1時間攪拌した。反応液を減圧濃縮し、得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製した。得られた化合物にジクロロメタン-ジエチルエーテルを加え、析出した残渣をろ過し、578 mgの白色固体478Cを得た。
MS: m/z = 637 [M+H] +
第四工程
478C (667 mg, 1.05 mmol) にエタノール (10 ml) を加え、hydrazine hydrate (0.254 ml, 5.24 mmol) を加えて90℃で2時間攪拌した。反応液を室温まで冷まし、クロロホルムを加えて不溶物をろ過して除去し、ろ液を減圧濃縮した。得られた粗生成物をアミノカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製した。得られた化合物にジクロロメタン-ジエチルエーテルを加え、析出した残渣をろ過し、462 mgの白色固体478Dを得た。
MS: m/z = 507 [M+H] +
第五工程
478D (100 mg, 0.197 mmol) にギ酸 (1.0 ml) とホルマリン水溶液 (1.0 ml) を加えて80℃で1時間攪拌した。反応液に1規定水酸化ナトリウム水溶液を加え、ジクロロメタンで抽出し、有機層を硫酸ナトリウムで乾燥した。得られた粗生成物をアミノカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製し、56 mgの無色オイル状物質を得た。この化合物を酢酸 (2.0 ml) に溶解し、濃硫酸 (0.5 ml) を滴下して加え、室温で30分攪拌した。反応液を炭酸水素ナトリウム水溶液にあけ、クロロホルムで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた粗成生物にジクロロメタン-酢酸エチル-ジエチルエーテルを加え、析出した残渣をろ過し、12 mgの白色固体478を得た。
MS: m/z = 445 [M+H] +
第一工程
参考例95に準じて合成した化合物479A (5.25 g, 11.8 mmol) 、DIPEA (6.20 mL, 35.5 mmol) およびBoc2O (5.17 g, 23.7 mmol) のジクロロメタン (50 mL) 溶液にDMAP (434 mg, 3.55 mmol) を加え、室温で4時間攪拌した。反応液を減圧下に濃縮後、残留物を酢酸エチルに溶解した。順次、0.5規定塩酸水溶液、飽和食塩水で洗浄後、硫酸ナトリウムにて乾燥した。溶媒を留去し、得られた油状物を シリカゲルクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (97:3, v/v) で溶出した。目的の画分を濃縮すると油状物として 5.22 g の化合物479Bを得た。
MS: m/z = 544 [M+H] +.
第二工程
氷冷下、化合物479B (29.7 g, 102 mmol) と酢酸 (29.7 g, 102 mmol) の THF (340 mL) 溶液にTBAF (1 M THF溶液、23.6 g, 310 mmol) を加え、室温で16時間攪拌した。反応液に酢酸エチルおよび水を加え、酢酸エチル層を分離し、水で洗浄後、硫酸ナトリウムにて乾燥した。溶媒を留去し、得られた油状物にジクロロメタン-エーテルを加えることで固化させ、2.76 g の化合物479Cを得た。
MS: m/z = 430 [M+H] +.
第三工程
化合物479C (500 mg, 1.16 mmol) の酢酸エチル (20 mL) 懸濁液にIBX (652 mg, 2.33 mmol) を加え、3時間加熱、攪拌した。反応液を酢酸エチルで希釈後、不溶物を濾去し、得られた濾液を順次、1規定水酸化ナトリウム水溶液、水で洗浄後、硫酸ナトリウムにて乾燥した。溶媒を留去し、得られた油状物をTHF (5 mL)を溶解させた後、氷冷下ジメチルアミン (2 M THF溶液、0.873 mL, 1.75 mmol) とNaBH(OAc)3 (370 mg, 1.75 mmol) を加え、室温下1.5時間攪拌した。氷冷下、反応液に2規定塩酸水溶液を加えた後、炭酸水素ナトリウム水溶液にて塩基性にした。クロロホルムで抽出し、硫酸ナトリウムにて乾燥した。溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (93:7, v/v) で溶出した。目的の画分を濃縮するとアモルファスとして 437 mg の化合物479Dを得た。
MS: m/z = 457 [M+H]+.
第四工程
化合物479D(430 mg, 0.942 mmol) を酢酸 (10 mL)に溶解し、1時間加熱、攪拌した。溶媒を留去し、得られた油状物をシリカゲルクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (95:5, v/v) で溶出した。目的の画分を濃縮すると油状物として 330 mg の化合物479Eを得た。
MS: m/z = 357 [M+H]+.
第五工程
化合物479E (50 mg, 0.140 mmol) とジベンゾスベロール (29.5 mg, 0.140 mmol) の 酢酸 (2 mL) 溶液に硫酸 (0.5 mL) を滴下し、 30分間撹拌した。反応液に酢酸エチルと水を加えた後、水層を分離し、炭酸水素ナトリウム水溶液にて中和した。酢酸エチル層を用いて抽出し、水で洗浄後、硫酸ナトリウムにて乾燥した。溶媒を留去し、得られた油状物にエーテルを加えることで固化させ、17.0 mg の化合物479を得た。
MS: m/z = 354 [M+H]+.
参考例65及び参考例107に従い、化合物491を同様の手法により合成した。
1H-NMR (DMSO-d6) δ: 1.10 (3H, d, J = 4.0 Hz), 1.12 (3H, d, J = 4.6 Hz), 2.82-3.06 (2H, m), 3.56 (1H, d, J = 17.8 Hz),4.26 (1H, d, J = 13.2 Hz), 4.31 (1H, m), 4.51-4.60 (1H, m), 4.97 (1H, d, J = 13.1 Hz), 5.39 (1H, s), 6.74-7.52 (8H, m).
MS: m/z = 460 [M+H] +
第一工程
化合物493A (258mg, 1.30 mmol) のジクロロメタン (5 mL) 溶液を-50℃に冷却し、同温度を保ちながら DIBAL-H のトルエン溶液(1M, 1.96mL)を5分間かけて滴下した。反応液を同温度で1時間撹拌後、室温に昇温し2.5時間撹拌した。反応液に飽和塩化アンモニウム水溶液を加えた後、室温で1時間撹拌し、不溶物を濾過により除去した。ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を3回水洗し、飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチルで溶出した。目的の画分を濃縮すると油状物として 148mg の化合物493Bを得た。
1HNMR (CDCl3) δ: 1.03-1.44 (5H, m), 1.63-1.83 (5H, m), 2.05-2.13 (1H, m), 3.25 (1H, dd, J = 9.5 Hz, 3.4 Hz), 7.16-7.19 (2H, ms), 7.27-7.38 (3H, m), 9.69 (1H, d, J = 3.5 Hz).
第二工程
参考例177に従い、化合物493を同様の手法により合成した。
MS: m/z = 410 [M+H]+
1H-NMR (CDCl3) δ: 0.94 (3H, t, J = 7.2 Hz), 1.26 (3H, t, J = 7.3 Hz), 2.87-2.94 (2H, m), 3.10-3.22 (1H, m), 3.79-3.89 (1H, m), 3.98 (1H, d, J = 16.9 Hz), 4.17 (1H, d, J = 16.8 Hz), 4.28 (1H, d, J = 9.8 Hz), 6.04 (1H, d, J = 7.2 Hz), 6.54 (2H, t, J = 8.1 Hz), 6.73 (1H, d, J = 9.8 Hz), 6.95-7.33 (6H, m), 7.66 (1H, dd, J = 5.3, 3.6 Hz).
MS: m/z = 448 [M+H]+.
第一工程
参考例491の合成中間体である508A (261 mg, 0.475 mmol) をジメチルホルムアミド (3ml) に溶解し、0℃でトリエチルアミン (0.132 ml, 0.950 mmol) とクロロギ酸エチル (0.0910 ml, 0.950 mmol) を加えて室温で20分攪拌した。水素化ホウ素ナトリウム (71.9 mg, 1.90 mmol) の水溶液 (0.5 ml) を0℃で加え、そのまま30分攪拌した。反応液を水にあけ、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製した。ジエチルエーテルを加え、析出した残渣をろ過し、107 mgの白色固体508Bを得た。
MS: m/z = 536 [M+H] +
第二工程
第一工程で得られた508B (100 mg, 0.187 mmol) をジクロロメタン (1 ml) に溶解し、0℃でDAST (33.1 mg, 0.205 mmol) を加えてそのまま30分攪拌した。反応液を水にあけ、クロロホルムで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製し、28 mgの淡黄色ガム状物質508Cを得た。
MS: m/z = 538 [M+H] +
第三工程
第二工程で得られた508Cに酢酸 (2 ml) と濃硫酸 (0.5 ml) を加え、室温で20分攪拌した。反応液を水にあけ、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。ジエチルエーテルを加え、析出した残渣をろ過し、4.5 mgの白色固体508を得た。
MS: m/z = 448 [M+H] +
第一工程
化合物510A (36.8 g, 259 mmol) をジメチルホルムアミド (380 ml) に溶解し、炭酸カリウム (39.3 g, 285 mmol) とベンジルブロミド (30 7 ml, 259 mmol) を加えて80℃で8時間攪拌した。室温に冷まし、不溶物をろ過して除去し、溶媒を減圧留去した。水を加え析出した残渣をろ過し、減圧下で乾燥し、46.21 gの薄茶色固体510Bを得た。
第二工程
第一工程で得られた化合物510B (4.79 g, 20 6 mmol) にジクロロメタン (70 ml) を加え、トリエチルアミン (4.29 ml, 30.9 mmol) とメタンスルホニルクロリド (1.93 ml, 24.8 mmol) を0℃で加え、そのまま30分攪拌した。反応液を飽和食塩水にあけ、ジクロロメタンで抽出し、硫酸ナトリウムで乾燥して溶媒を減圧留去した。得られた化合物にn-ヘキサン-ジクロロメタンを加え、析出した残渣をろ過し、6.56 gの白色固体を得た。この化合物をアセトニトリル (40 ml) に溶解し、テトラブチルアンモニウムフルオリド (75%水溶液, 21.6 g, 61.9 mmol) を加えて室温で18時間攪拌した。溶媒を減圧留去し、酢酸エチルを加え、炭酸水素ナトリウム水溶液で洗った。有機層を硫酸ナトリウムで乾燥し、減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (1:1, v/v) で溶出することにより精製し、2.51 gの白色固体510Cを得た。
1H-NMR (DMSO-d6) δ: 4.96 (3H, s), 5.30 (3H, d, J = 46.4 Hz), 6.56 (1H, d, J = 1.8 Hz), 7.39 (5H, m), 8.30 (1H, s).
第三工程
第二工程で得られた510C (2.40 g, 10.3 mmol) をジクロロメタン (40 ml) に溶解し、三臭化ホウ素 (1M ジクロロメタン溶液, 10.3 ml, 10.3 mmol) を0℃で滴下して加え、そのまま30分攪拌した。メタノールを加え、溶媒を減圧留去し、酢酸エチルを加えて飽和食塩水で洗った。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去し、得られた固体をジエチルエーテルで洗って940 mgの510Dを得た。
1H-NMR (CDCl3) δ: 5.20 (2H, d, J = 46.3 Hz), 6.40 (1H, s), 6.62 (1H, s), 7.91 (1H, s).
第四工程
第三工程で得られた510D (940 mg, 6.52 mmol) をメタノール (8 ml) に溶解し、0℃で2規定水酸化ナトリウム水溶液 (3.26 ml, 6.52 mmol) と37%ホルムアルデヒド水溶液 (1.46 ml, 19.6 mmol) を加えて室温で20時間攪拌した。反応液に飽和塩化アンモニウム水溶液を加え、溶媒を減圧留去した。塩酸を加えてクロロホルムで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた化合物にn-ヘキサン-ジクロロメタン-酢酸エチルを加え、析出した残渣をろ過し、858 mgの淡黄色固体510Eを得た。
1H-NMR (CDCl3) δ: 4.73 (2H, s), 5.19 (2H, d, J = 46.1 Hz), 6.55 (1H, s).
第五工程
第四工程で得られた510E (855 mg, 4.91 mmol) をジメチルホルムアミド (10 ml) に溶解し、炭酸カリウム (746 mg, 5.40 mmol) とベンジルブロミド (0.583 ml, 4.91 mmol) を加えて80℃で5時間攪拌した。不溶物をろ過して除去し、ろ液を減圧留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製し、887 mgの淡橙色固体510Fを得た。
1H-NMR (CDCl3) δ: 1.39 (1H, t, J = 7.1 Hz), 4.31 (2H, d, J = 7.2 Hz), 5.12 (2H, dd, J = 46.3, 0.7 Hz), 5.23 (2H, s), 6.50 (1H, s), 7.33-7.43 (5H, m).
第六工程
第五工程で得られた510F (887 mg, 3.36 mmol) をクロロホルムに溶解し、二酸化マンガン (2.00 g, 23.0 mmol) を加えて80℃で2時間攪拌した。室温に冷ました後、セライトろ過して溶媒を減圧留去し、812 mgの白色固体510Gを得た。
1H-NMR (CDCl3) δ: 5.18 (2H, dd, J = 45.8, 0.8 Hz), 5.52 (2H, s), 6.60 (1H, d, J = 0.8 Hz), 7.32-7.38 (5H, m), 9.86 (1H, s).
第七工程
第六工程で得られた510G(884 mg, 3.37 mmol) にアセトニトリルと水を加え、リン酸二水素一ナトリウム (809 mg, 6.74 mmol) と次亜塩素酸ナトリウム (1.01 g, 11.1 mmol) を加えて室温で1時間攪拌した。反応液を濃縮し、塩酸でpH=3に調整し、クロロホルムで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去することにより404 mgの白色固体510Hを得た。
1H-NMR (DMSO-d6) δ: 5.17 (2H, s), 5.38 (2H, d, J = 46.2 Hz), 6.73 (1H, d, J = 1.5 Hz), 7.34-7.51 (5H, m).
第八工程
第七工程で得られた510H (402 mg, 1.45 mmol)をジメチルホルムアミドに溶解し、N1-((ethylimino)methylene)-N3,N3-dimethylpropane-1,3-diamine hydrochloride (554 mg, 2.89 mmol) と1H-benzo[d][1,2,3]triazol-1-ol (195 mg, 1.45 mmol) を加えて室温で5分攪拌した。Propan-2-amine (0.149 ml, 1.73 mmol) を加えた後、室温で1時間攪拌した。反応液を減圧濃縮し、水を加えて酢酸エチルで抽出し、有機層を炭酸水素ナトリウム水溶液で洗って硫酸ナトリウムで乾燥した。反応液を減圧留去して得られた化合物にn-ヘキサンを加え、析出した残渣をろ過し、3.56 gの白色固体510Iを得た。
1H-NMR (CDCl3) δ: 0.98 (6H, d, J = 6.6 Hz), 4.05 (1H, m), 5.24 (2H, dd, J = 45.9, 0.9 Hz), 5.41 (2H, s), 6.59 (1H, q, J = 0.9 Hz), 7.40 (5H, m), 7.56 (1H, brs).
第九工程
第八工程で得られた510I (392 mg, 1.23 mmol)をエタノール (6 ml) に溶解し、アンモニア水 (4 ml) を加えて室温で15時間攪拌した。反応液を減圧濃縮し、得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製し、333 mgの白色固体510Jを得た。
MS: m/z = 319 [M+H] +
第十工程
参考例95と同様の手法により化合物510を合成した。
MS: m/z = 422 [M+H] +
第一工程
化合物511A (200 mg, 0.664 mmol) と1,1,3-trimethoxypropane (178.2 mg, 1.33 mmol) のジクロロメタン (90 mL) 溶液を1-3℃に冷却し、同温度を保ちながら 三ふっ化ほう素ジエチルエーテル錯体 (113 mg, 0.797 mmol)を滴下した。反応液を同温度で30分間撹拌後、飽和重曹水を加えた。ジクロロメタン層を分離し、水層をジクロロメタンで3回、抽出した。合わせた抽出液を硫酸ナトリウムで乾燥後、溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに 酢酸エチルで溶出し、次いで酢酸エチル-メタノール (3:2, v/v) で溶出した。目的の画分を濃縮すると油状物として 179.2 mg の化合物511Bを得た。
1H-NMR (CDCl3) δ: 1.14 (6H, d, J = 6.3 Hz), 2.71 (2H, dd, J = 6.0 Hz), 3.34 (3H, s), 3.64 (2H, t, J = 6.0 Hz), 4.06-4.17 (1H, m), 5.23 (2H, s), 6.34 (1H, brs), 6.37 (1H, d, J = 7.8 Hz), 7.26-7.43 (6H, m), 7.90 (1H, t, J = 5.4 Hz).
第二工程
化合物511B (179.2 mg, 0.482 mmol)のジメチルホルムアミド(3 ml)溶液を1-3℃に冷却し、同温度を保ちながら炭酸セシウム(786 mg, 2.41 mmol)を加え、同温度で15分間撹拌した。反応液を水で希釈し、クロロホルムで3回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥後、溶媒を留去すると固体として130 mgの化合物511Cを得た。
1H-NMR (CDCl3) δ: 1.22 (3H, d, J = 6.9 Hz), 1.28 (3H, d, J = 6.9 Hz), 1.59 (2H, brs), 3.22-3.41 (2H, m), 3.12 (3H, s), 4.57-4.70 (2H, m), 5.19 (1H, d, J = 10.5 Hz), 5.38 (1H, brs), 5.54 (1H, d, J = 10.5 Hz), 6.34 (1H, d, J = 7.8 Hz), 7.26-7.32 (4H, m), 7.49-7.52 (2H, m).
第三工程
化合物511C(130 mg, 0.350 mmol)とdibenzosuberol(368 mg, 1.75 mmol)の酢酸(2 ml)溶液に室温下、硫酸(0.4 ml)を滴下し、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去して得られた固体をジイソプロピルエーテルで洗浄すると固体として65 mgの化合物511を得た。
1H-NMR (CDCl3) δ: 1.27 (3H, d, J = 6.9 Hz), 1.49 (3H, d, J = 6.6 Hz), 1.64-1.74 (1H, m), 1.88-1.99 (1H, m), 2.83 (1H, d, J = 4.5 Hz, 4.5 Hz, 9.3 Hz), 3.06 (1H, ddd, J = 5.6 Hz, 13.2 Hz, 13.2 Hz), 3.19 (3H, s), 3.30-3.44 (1H, m), 3.50-3.57 (1H, m), 3.78-3.92 (1H, m), 4.28 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 4.53 (1H, dd, J = 3.3 Hz, 10.8 Hz), 4.96 (1H, s), 5.73 (1H, d, J = 7.5 Hz), 6.61 (1H, d, J = 7.5 Hz), 6.65 (1H, d, J = 7.5 Hz), 6.89-6.93 (1H, m), 7.08-7.36 (6H, m).
1H-NMR (CDCl3) δ: 1.27 (1H, 3H, d, J = 6.9 Hz), 1.48 (3H, d, J = 6.6 Hz), 1.95 (3H, s), 2.63-2.68 (2H, m), 2.84 (1H, ddd, J = 4.8 Hz, 9.3 Hz, 9.3 Hz), 3.05 (1H, ddd, J = 4.2 Hz, 13.2 Hz, 13.2 Hz), 3.60 (1H, ddd, J = 4.8 Hz, 4.8 Hz, 17.4 Hz), 3.87-3.98 (1H, m), 4.42 (1H, dd, J = 6.6 Hz, 8.1 Hz), 4.59 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 4.93 (1H, s), 5.77 (1H, d, J = 7.8 Hz), 6.64 (1H, d, J = 6.9 Hz), 6.69 (1H, d, J = 7.8 Hz), 6.91 (1H, t, J = 6.0 Hz), 7.09-7.38 (6H, m).
1H-NMR (CDCl3) δ: 1.20 (3H, d, J = 6.9 Hz), 1.44 (3H, d, J = 6.9 Hz), 2.80 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 9.3 Hz), 3.07 (1H, ddd, J = 4.5 Hz, 13.5 Hz, 13.5 Hz), 3.25 (3H, s), 3.22-3.43 (2H, m), 3.55 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 8.7 Hz), 3.85-3.94 (1H, m), 4.36 (1H, dd, J = 5.1 Hz, 14.1 Hz), 4.42-4.48 (1H, m), 4.92 (1H, s), 5.78 (1H, d, J = 7.5 Hz), 6.59 (1H, d, J = 7.8 Hz), 6.64 (1H, d, J = 7.5 Hz), 6.91 (1H, t, J = 6.9 Hz), 7.09-7.36 (6H, m).
第一工程
化合物516A (100 mg, 0.332 mmol) と3-(methylthio)propanal (52 mg, 0.498 mmol) のトルエン(3 ml) 溶液に酢酸 (30 mg, 0.500 mmol) を加え、30分間還流した。室温に冷却後、溶媒を留去して得られる粗生成物をジメチルホルムアミド(3 ml) に溶解させた。上記溶液を1-3℃に冷却し、同温度を保ちながら炭酸セシウム (541 mg, 1.66 mmol) を加え、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。合わせた抽出液を3回水洗後、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに 酢酸エチルで溶出し、次いで酢酸エチル-メタノール (7:3, v/v) で溶出した。目的の画分を濃縮すると油状物として 84.7 mg の化合物516Bを得た。
1H-NMR (CDCl3) δ: 1.21 (3H, J = 6.9 Hz), 1.28 (3H, d, J = 6,9 Hz), 1.31-1.56 (2H, m), 2.05 (3H, s), 2.46 (2H, dd, J = 5.4 Hz, 7.8 Hz), 4.57-4.71 (2H, m), 5.18 (1H, d, J = 10.5 Hz), 5.51 (1H, d, J = 10.5 Hz), 5.66 (1H, brs), 6.33 (1H, d, J = 7.8 Hz), 7.19-7.35 (4H, m), 7.46-7.49 (2H, m).
第二工程
参考例511と同様の手法により、化合物516を合成した。
1H-NMR (CDCl3) δ: 1.29 (3H, d, J = 6.9 Hz), 1.49 (3H, d, J = 6.6 Hz), 1.82-1.89 (2H, m), 1.99 (3H, s), 2.41-2.58 (2H, m), 2.86 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.1 Hz), 2.99-3.11 (1H, m), 3.53 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 17.7 Hz), 4.87-3.96 (1H, m), 4.21 (1H, ddd, J = 3.9 Hz, 12.9 Hz, 12.9 Hz), 4.53 (1H, dd, J = 5.1 Hz, 8.7 Hz), 4.96 (1H, s), 5.74 (1H, d, J = 7.5 Hz), 6.62 (1H, d, J = 7.5 Hz), 6.64 (1H, d, J = 9.0 Hz), 6.89-6.94 (1H, m), 7.07-7.37 (6H, m).
1H-NMR (CDCl3) δ: 1.78 (3H, t, J = 6.9 Hz), 1.19-1.30 (1H, m), 1.29 (3H, d, J = 6.9 Hz), 1.43-1.62 (3H, m), 1.50 (3H, d, J = 6.9 Hz), 2.84 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.1 Hz), 3.00-3.11 (1H, ddd, J = 3.9 Hz, 12.9 Hz, 12.9 Hz), 3.52 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 17.4 Hz), 3.79-3.88 (1H, m), 4.23-4.35 (2H, m), 4.96 (1H, s), 5.74 (1H, d, J = 7.8 Hz), 6.61 (1H, d, J = 7.5 Hz), 6.65 (1H, dd, J = 1.2 Hz, 7.8 Hz), 6.91 (1H, ddd, J = 1.5 Hz, 7.5 Hz, 7.5 Hz), 7.08-7.37 (6H, m).
1H-NMR (CDCl3) δ: 1.44 (3H, d, J = 6.9 Hz), 1.54 (3H, d, J = 6.6 Hz), 1.88 (1H, ddd, J = 3.9 Hz, 3.9 Hz, 14.4 Hz), 2.72 (1H, ddd, J = 3.6 Hz, 14.1 Hz, 14.1 Hz), 3.15 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 16.5 Hz), 3.54 (1H, dd, J = 3.0 Hz, 14.4 Hz), 3.66 (1H, ddd, J = 3.9 Hz, 13.8 Hz, 13.8 Hz), 4.03 (1H, dd, J = 10.5 Hz, 14.1 Hz), 4.27-4.26 (1H, m), 4.64 (1H, dd, J = 2.7 Hz, 10.5 Hz), 4.92 (1H, s), 5.80 (1H, d, J = 7.8 Hz), 6.62-6.70 (2H, m), 6.69 (1H, d, J = 7.8 Hz), 6.89 (1H, t, J = 7.5 Hz), 6.96 (1H, d, J = 7.5 Hz), 7.09-7.25 (4H, m), 7.77-7.89 (4H, m).
1H-NMR (CDCl3) δ: 1.30 (3H, d, J = 6.6 Hz), 1.54 (3H, d, J = 6.6 Hz), 2.83 (1H, ddd, J = 4.8 Hz, 4.8Hz, 14.1 Hz), 3.03-3.14 (1H, m), 3.21 (3H, s), 3.30 (3H, s), 3.53 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 17.7 Hz), 3.61-3.70 (1H, m), 4.18 (1H, d, J = 5.4 Hz), 4.26 (1H, d, J = 5.4 Hz), 4.45 (1H, ddd, J = 4.5 Hz, 13.8 Hz, 13.8 Hz), 4.92 (1H, s), 5.72 (1H, d, J = 7.8 Hz), 6.63 (1H, d, J = 7.8 Hz), 6.65 (1H, d, J = 6.6 Hz), 6.91 (1H, t, J = 6.0 Hz), 7.08-7.36 (6H, m).
1H-NMR (CDCl3) δ: 1.30 (2.52H, d, J = 6.9 Hz), 1.36 (0.48H, d, J = 6.9 Hz), 1.42 (0.48H, d, J = 6.9 Hz), 1.50 (2.52H, d, J = 6.9 Hz), 1.74-1.98 (1H, m), 2.00-2.12 (1H, m), 2.16-2.35 (1H, m), 2.89 (1H, ddd, J = 5.1 Hz, 5.1 Hz, 13.5 Hz), 3.06 (1H, ddd, J = 3.9 Hz, 12.9 Hz, 12.9 H), 3.52 (1H, d, J = 4.2 Hz, 4.2 Hz, 17.4 Hz), 3.86-3.96 (1H, m), 4.15 (1H, ddd, J = 3.9 Hz, 13.5 Hz, 13.5 Hz), 4.32 (1H, dd, J = 3.9 Hz, 10.8 Hz), 4.48-4.64 (1H, m), 4.97 (0.84H, s), 5.30 (0.16H, s), 5.73 (0.84H, d, J = 7.8 Hz), 6.20 (0.16H, d, J = 7.5 Hz), 6.45 (0.16H, brs), 6.61 (1H, d, J = 7.5 Hz), 6.64 (0.84H, d, J = 8.7 Hz), 6.92 (1H, t, J = 6.3 Hz), 7.10 (1H, d, J = 7.5 Hz), 7.15-7.39 (3H, m).
1H-NMR (CDCl3) δ: 1.28 (3H, d, J = 6.9 Hz), 1.49 (3H, d, J = 6.9 Hz), 1.54-1.79 (4H, m), 2.84 (1H, ddd, J = 4.8 Hz, 4.8 Hz, 14.1 Hz), 3.05 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 3.17 (3H, s), 3.17-3.21 (2H, m), 3.52 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 17.7 Hz), 3.83-3.92 (1H, m), 4.22-4.32 (2H, m), 4.96 (1H, s), 5.73 (1H, d, J = 7.5 Hz), 6.62 (1H, d, J = 7.8 Hz), 6.65 (1H, d, J = 8.1 Hz), 6.92 (1H, t, J = 7.2 Hz), 7.07-7.37 (6H, m).
1H-NMR (CDCl3) δ: 1.19-1.28 (1H, m), 1.28 (3H, d, J = 6.9 Hz), 1.40-1.82 (4H, m), 1.48 (3H, d, J = 6.6 Hz), 2.89-3.00 z81H, m), 3.17 (3H, s), 3.20-3.27 (2H, m), 3.31-3.40 (1H, m), 3.44-3.53 (1H, m), 3.86-3.98 (2H, m), 4.38 (1H, dd, J = 3.6 Hz, 10.5 Hz), 5.05 (1H, s), 5.84 (1H, d, 7.5 Hz), 6.48-6.50 (1H, m), 6.66-6.69 (1H, m), 6.89-7.00 (2H, m), 7.05 (1H, d, 7.2 Hz), 7.11-7.24 (2H, m).
1H-NMR (CDCl3) δ: 1.29 (3H, d, J = 6.9 Hz), 1.42-1.83 (4H, m), 1.48 (3H, d, J = 6.6 Hz), 2.80 (1H, ddd, J = 4.5 Hz, 4.5 Hz), 14.4 H), 2.94-3.11 (1H, m), 3.18 (3H, s), 3.21-3.26 (2H, m), 3.49 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 18.0 Hz), 3.82-3.91 (1H, m), 4.20-4.33 (2H, m), 5.83 (1H, s), 5.84 (1Hm d, J = 7.8 Hz), 6.58-6.72 (2H, m), 6.91-6.94 (1H, m), 7.11-7.30 (4H, m).
1H-NMR (CDCl3) δ: 1.29 (3H, d, J = 6.9 Hz), 1.47 (3H, d, J = 6.6 Hz), 2.10 (3H, s), 2.78 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 13.8 Hz), 2.97 (3H, s), 3.01-3.13 (2H, m), 3.47 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 17.7 Hz), 3.65 (1H, dd, J = 3.3 Hz, 14.1 Hz), 3.99-4.23 (2H, m), 4.70 (1H, dd, J = 3.3 Hz, 10.2 Hz), 4.95 (1H, s), 5.78 (1H, d, J = 7.8 Hz), 6.61 (1H, d, J = 7.8 Hz), 6.65 (1H, d, J = 7.5 Hz), 6.93 (1H, t, J = 6.6 Hz), 7.09 (1H, d, J = 7.5 Hz), 7.15-7.27 (4H, m), 7.30-7.37 (1H, m).
1H-NMR (CDCl3) δ: 1.57-1.34 (1H, m), 1.29 (3H, d, J = 6.9 Hz), 1.41-1.52 (1H, m), 1.48 (3H, d, J = 6.6 Hz), 1.59-1.81 ( 2H, m), 2.80 (1H, ddd, 4.5 Hz, 4.5 Hz, 14.4 Hz), 3.04 (1H, ddd, J = 4.2 Hz, 13.2 Hz, 13.2 Hz), 3.14-3.26 (2H, m), 3.18 (3H, s), 3.49 (1H, ddd, J = 4.8 Hz, 4.8 Hz, 17.7 Hz), 3.84-3.93 (1H, m), 4.23-4.34 (2H, m), 4.96 (1H, s), 5.81 (1H, d, J = 7.5 Hz), 6.60-6.79 (3H, m), 6.81 (1Hm d, J = 9.3 Hz), 6.92 (1H, ddd, J = 2.7 Hz, 8.4 Hz, 8.4 Hz), 7.19-7.24 (1H, m).
第一工程
化合物516の合成法に準じて合成した化合物527A(36 mg, 0.09 mmol)のDMF (0.2 mL) 溶液1-3℃に冷却し、5-chlorodibenzosuberane(97 mg, 0.43 mmol)と炭酸セシウム (138 mg, 0.43 mmol) を加え、室温で終夜攪拌した。反応液に水を加え、酢酸エチル-水に分配した。有機層を飽和食塩水で洗浄、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノールで溶出した。目的の画分を濃縮すると油状物として 19 mg の化合物 527Bを得た。
MS: m/z = 616 [M+H]+.
第二工程
化合物527B (19 mg, 0.03 mmol) を MeOH (0.6 mL) に溶解し、10% Pd-C (3 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた油状物をジオールシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノールで溶出した。目的の画分を濃縮すると油状物として 7 mg の化合物 527を得た。
MS: m/z = 526 [M+H]+.
第一工程
化合物519 (440 mg, 0.766 mmol)のメタノール(5 ml)溶液に、ヒドラジン水和物 (383 mg, 7.66 mmol) を加え、1時間還流した。室温まで冷却後、析出した不溶物をろ去した。溶媒を留去後、酢酸エチルに懸濁させ不溶物をろ去し、溶媒を留去した。得られた粗生成物を、クロロホルムに懸濁させ不溶物をろ去した。溶媒を留去し得られた粗生成物を、酢酸エチル-ジイソプロピルエーテルで洗浄すると、固体として190 mg の化合物532を得た。
1H-NMR (CDCl3) δ: 1.24 (3H, d, J = 6.9 H), 1.46 (3H, d, J = 6.6 Hz), 2.73-2.90 (3H, m), 3.08 (1H, ddd, J = 4.2 Hz, 12.9 Hz, 12.9 Hz), 3.54 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 17.7 Hz), 3.85-3.94(1H, m ), 4.19 (1H, dd, J = 7.2 Hz, 11.1 Hz), 4.35 (1H, ddd, J = 4.5 Hz, 13.8 Hz, 13.8 Hz), 4.97 (1H, s), 5.74 (1H, d, J = 7.5 Hz), 6.60 (1H, d, J = 7.8 Hz), 6.65 (1H, d, J = 7.2 Hz), 6.92 (1H, t, J = 6.3 Hz), 7.09-7.45 (6H, m).
参考例532と同様の手法により化合物533を合成した。
1H-NMR (DMSO-d6) δ: 1.22 (3H, d, J = 6.6 Hz), 1.40 (3H, d, J = 6.6 Hz), .1.45-1.58 (1H, m), 1.62-1.75 (1H, m), 2.61-2.69 (1H, m), 2.71-2.84 (1H, m), 2.88-2.95 (1H, m), 3.16-3.34 (1H, m), 3.60-3.64 (1H, m), 3.92-4.00 (1H, m), 4.24-4.33 (1H, m), 4.42-4.46 (1H, dd, J = 3.3 Hz, 10.8 Hz), 5.10 (1H, s), 5.47 (1H, d, J = 7.5 Hz), 6.70 (1H, d, J = 7.5 Hz), 6.88 (1H, t, J = 7.5 Hz), 7.02 (1H, d, J = 10.8 Hz), 7.09-7.16 (2H, m), 7.19-7.25 (1H, m), 7.33 (2H, d, 4.2 Hz), 7.42 (1H, d, J = 7.5 Hz).
参考例532と同様の手法により化合物534を合成した。
1H-NMR (DMSO-d6) δ: 1.25 (3H, d, J = 6.9 Hz), 1.44 (3H, d, J = 6.6 Hz), 1.32-1.58 (2H, m), 1.77-1.79 (2H, m), 2.64-2.73 (1H, m), 2.79-3.00 (2H, m), 3.88-3.97 (2H, m), 4.19-4.28 (2H, m), 5.15 (1H, s), 5.67 (1H, d, J = 7.5 Hz), 5.73 (1H, d, J = 7.5 Hz), 6.90 (1H, t, J = 6.6 Hz), 7.03 (1H, d, J = 7.5 Hz), 7.13-7.32 (3H, m), 7.36 (2H, d, J = 4.2 Hz), 7.44 (1H, J = 7.2 Hz), 7.75 (1H, brs).
参考例532と同様の手法により化合物535を合成した。
1H-NMR (DMSO-d6) δ: 1.40-1.52 (1H, m), 1.61-1.72 (1H, m), 2.40-2.49 (1H, m), 2.58-2.62 (1H, m), 2.78-2.86 (1H, m), 2.89-2.95 (1H, m), 2.95 (3H, m), 3.66-3.74 (1H, m), 4.01-4.13 (1H, m), 4.28-4.32 (1H, m), 5.14 (1H, m), 5.51 (1H, d, J = 7.8 Hz), 6.72 (1H, d, J = 7.5 Hz), 6.91-6.94 (2H, m), 7.14-7.40 (6H, m).
第一工程
化合物532 (30 mg, 0.0675 mmol)と38% ホルマリン水溶液(53.5 mg, 0.675 mmol)のジクロロメタン(1 ml)溶液を1-3℃に冷却し、同温度を保ちながらトリアセトキシヒドロほう酸ナトリウム(42.9 mg, 0.293 mmol)と酢酸(10 mg, 0.166 mmol)を加えた。反応液を同温度で30分間撹拌後、飽和重曹水を加え、酢酸エチルで3回抽出した。合わせた抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると固体として20 mg の化合物536を得た。
1H-NMR (CDCl3) δ: 1.22 (3H, d, J = 6.6 Hz), 1.44 (3H, d, J = 6.9 Hz), 2.06 (6H, s), 2.29 (1H, dd, J = 4.5 Hz, 13.2 Hz), 4.23 (1H, dd, J = 8.4 Hz, 13.2 Hz), 2.78 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.1 Hz, 3.06 (1H, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 3.55 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 17.7 Hz), 3.83-3.92 (1H, m), 4.34 (1H, dd, J = 4.5 Hz, 8.4 Hz), 4.54 (1H, ddd, J = 4.5 Hz, 13.8 Hz, 13.8 Hz), 4.91 (1H, s), 5.74 (1H, d, J = 7.5 Hz), 6.63 (1H, d, J = 7.8 Hz), 6.64 (1H, d, J = 7.8 Hz), 6.88-6.93 (1H, m), 7.08-7.45 (6H, m).
参考例536と同様の手法により化合物537を合成した。
1H-NMR (DMSO-d6) δ: 1.25 (3H, d, J = 6.6 Hz), 1.40 (3H, d, J = 6.6 Hz), 1.46-1.57 (1H, m), 1.68-1.79 (1H, m), 1.98 (6H, s), 2.04-2.11 (1H, m), 2.27-2.41 (1H, m), 2.72-2.94 (2H, m), 3.55-3.64 (1H, m), 3.91-4.00 (1H, m), 4.29-4.44 (2H, m), 5.10 (1H, s), 5.48 (1H, d, J = 7.8 Hz), 6.71 (1H, d, J = 7.8 Hz), 6.86-6.90 (1H, m), 7.05-7.24 (4H, m), 7.33 (2H, d, J = 4.2 Hz), 7.40 (1H, d, J = 7.5 Hz).
参考例536と同様の手法により化合物538を合成した。
1H-NMR (DMSO-d6) δ: 0.75 (6H, t, J = 6.6 Hz), 1.28 (3H, d, J = 6.6 Hz), 1.41 (3H, d, J = 6.6 Hz), 1.45-1.56 (1H, m), 1.67-1.78 (1H, m), 2.22-2.49 (4H, m), 2.74-2.97 (2H, m), 3.94-4.03 (1H, m), 4.29-4.41 (2H, m), 5.11 (1H, s), 5.48 (1H, d, J = 7.8 Hz), 6.71 (1H, d, J = 6.9 Hz), 6.87 (1H, t, J = 7.2 Hz), 7.06-7.25 (4H, m), 7.33 (2H, d, J = 7.2 Hz), 7.35 (1H, m).
参考例536と同様の手法により化合物539を合成した。
1H-NMR (DMSO-d6) δ: 1.25 (3H, d, J = 6.6 Hz), 1.44 (3H, d, J = 6.6 Hz), 1.42-1.51 (2H, m), 1.75-1.91 (2H, m), 2.62-2.67 (1H, m), 2.65 (6H, s), 2.74-2.97 (3H, m), 3.57-3.63 (1H, m), 3.91-3.26 (4H, m), 5.16 (1H, s), 5.73 (1H, d, J = 7.5 Hz), 6.71 (1H, d, J = 7.2 Hz), 6.89 (1H, t, J = 6.9 Hz), 7.12-7.28 (4H, m), 7.33-7.45 (3H, m).
参考例536と同様の手法により化合物540を合成した。
1H-NMR (CDCl3) δ: 1.58-1.78 (2H, m), 2.06 (6H, s), 2.15-2.35 (2H, m), 2.84-2.93 (1H, m), 2.96-3.11 (1H, m), 3.00 (3H, s), 3.65-3.74 (1H, m), 3.99-4.14 (1H, m), 4.28-4.33 (1H, m), 4.94 (1H, s), 5.78 (1H, d, J = 7.5 Hz), 6.56 (1H, d, J = 7.8 Hz), 8.66 (1H, d, J = 7.2 Hz), 6.95 (t, J = 7.2 Hz), 7.13-7.38 (6H, m).
参考例536と同様の手法により化合物541を合成した。
1H-NMR (CDCl3) δ: 0.846 (6H, t, J = 7.2 Hz), 1.49-1.75 (2H, m), 2.30-2.41 (5H, m), 2.43-2.53 (1H, m), 2.85-2.93 (1H, m), 2,98-3.08 (1H, m), 3.01 (3H, s), 3.63-3.74 (1H, m), 3.97-4.07 (1H, m), 4.30 (1H, dd, J = 5.1 Hz, 8.1 Hz), 4.95 (1H, s), 5.77 (1H, d, J = 6.0 Hz), 6.56 (1H, d, J = 7.8 Hz), 6.65 (1H, d, J = 7.8 Hz), 6.95 (1H, t, J = 6.3 Hz), 7.13-7.38 (6H, m).
第一工程
化合物 532 (30mg, 0.0675 mmol)とトリエチルアミン(20.5 mg, 0.202 mmol)のジクロロメタン(1 ml)溶液を1-3℃に冷却し、同温度を保ちながら無水酢酸(10.3 mg, 0.101 mmol)を加えた。反応液を同温度で30分間撹拌後、水を加え、酢酸エチルで3回抽出した。合わせた抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると固体として15 mg の化合物542を得た。
1H-NMR (CDCl3) δ: 1.30 (3H, d, J = 6.9 Hz), 1.47 (3H, d, J = 6.6 Hz), 2.00 (3H, s), 2.78-2.94 (2H, m), 3.04 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 3.48-3.60 (1H, m), 3.98-3.07 (1H, m), 4.36 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 4.64 (1H, dd, J = 3.9 Hz, 9.3 Hz), 4.87 (1H, s), 5.43 (1H, d, J = 7.5 Hz), 6.57 (1H, d, J = 7.5 Hz), 6.68 (1H, d, J = 7.5 Hz), 6.85 (1H, t, J = 6.0 Hz), 7.09-7.36 (6H, m), 7.41 (1H, brs).
参考例542と同様の手法により化合物543を合成した。
1H-NMR (CDCl3) δ: 1.32 (3H, d, J = 6.9 Hz), 1.50 (3H, d, J = 6.9 Hz), 2.79 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 14.4 Hz), 3.01 (1H, ddd, J = 3.9 Hz, 13.5 Hz, 13.5 Hz), 3.18-3.28 (1H, m), 3.46-3.59 (2H, m), 4.04-4.18 (1H, m), 4.27 (1H, ddd, J = 3.9 Hz, 13.5 Hz, 13.5 Hz), 4.69 (1H, dd, J = 3.3 Hz, 9.9 Hz), 4.87 (0.9H, s), 5.17 (0.1H, s), 5.37 (0.9H, d, J = 7.8 Hz), 4.50 (0.1H, d, J = 7.8 H), 6.32 (0.1H, d, J = 7.8 Hz), 6.54 (1H, d, J = 7.5 Hz), 6.78 (0.9H, d, J = 7.5 Hz), 6.84 (1H, t, J = 6.6 Hz), 6.91 (0.1H, d, J = 6.0 Hz), 7.06-7.51 (6H, m), 9.29 (1H, brs).
参考例542と同様の手法により化合物544を合成した。
1H-NMR (CDCl3) δ: 1.29 (3H, d, J = 6.9 Hz), 1.46 (3H, d, J = 6.3 Hz), 2.78 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 15.9 Hz), 2.94-3.10 (2H, m), 3.19-3.54 (2H, m), 3.64 (3H, s), 3.96-3.11 (1H, m), 4.28 (1H, ddd, J = 4.2 Hz, 13.5 Hz, 13.5 Hz), 4.57 (1H, dd, J = 3.3 Hz, 9.9 Hz), 4.91 (1H, s), 5.57 (1H, brs), 5.70 (1H, d, J = 7.5 Hz), 6.60 (1H, d, J = 7.5 Hz), 6.66 (1H, d, J = 7.8 Hz), 6.89 (1H, t, J = 7.2 Hz), 7.08-7.47 (6H, m).
第一工程
化合物 532 (30mg, 0.0675 mmol)とピリジン(16 mg, 0.203 mmol)のジクロロメタン(1 ml)溶液を1-3℃に冷却し、同温度を保ちながら2-methoxyacetyl chloride (11 mg, 0.101 mmol)を加えた。反応液を同温度で30分間撹拌後、水を加え、酢酸エチルで3回抽出した。合わせた抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると固体として22 mg の化合物545を得た。
1H-NMR (CDCl3) δ: 1.31 (3H, d, J = 6.9 Hz), 1.49 (3H, d, J = 6.9 Hz), 2.77 (1H, ddd, J = 4.8 Hz, 4.8 Hz, 14.1 Hz), 2.99-3.11 (2H, m), 3.47 (3H, s), 3.47-3.55 (1H, m), 3.64-3.72 (1H, m), 3.77-3.88 (2H, m), 4.02-4.11 (1H, m), 4.23 (1H, ddd, J = 4.2 Hz, 13,8 Hz, 13.8 Hz), 4.47 (1H, dd, J = 3.3 Hz, 9.9 Hz), 4.94 (1H, s), 5.75 (1H, d, J = 7.8 Hz), 6.64 (1H, d, J = 9.0 Hz), 6.67 (1H, 7.8 Hz), 6.80 (1H, brt), 6.91 (1H, t, J = 7.5 Hz), 7.08-7.23 (5H, m), 7.29-7.36 (1H, m).
第一工程
2-(methylthio)acetic acid (15.7 mg, 0.148 mmol)のジメチルホルムアミド(1 ml)溶液に、室温下EDCI (28.5 mg, 0.148 mmol)と1-hydroxy benzotriazole(11.4 mg, 0.0742 mmol)を加え、同温度で5分間撹拌後、化合物532を加えた。反応液を室温下1時間撹拌し、メタノール(3 ml)で希釈した。溶液を1-3℃に冷却し、2規定水酸化ナトリウム水溶液(1 ml)を加え同温度で30分間撹拌後、2規定塩酸(1 ml)で中和した。反応液を酢酸エチルで3回抽出し、合わせた抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると固体として15 mg の化合物546を得た。
1H-NMR (CDCl3) δ: 1.32 (3H, d, J = 6.9 Hz), 1.50 (3H, J = 6.6 Hz), 2.11 (3, s), 2.79 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 14.1 Hz), 2.99-3.16 (4H, m), 3.50 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 12.9 Hz), 3.68 (1H, d, J = 10.2 Hz), 3.97-4.11 (1H,m), 4.26 (1H, ddd, J = 4.5 Hz, 13.8 Hz, 13.8 Hz), 4.94 (3H, s), 5.69 (1H, d, J = 7.5 Hz), 6.63 (1H, d, J = 7.5 Hz), 6.70 (1H, d, J = 7.8 Hz), 6.90 (1H, t, J = 6.0 Hz), 7.09 (1H, d, J = 7.5 Hz), 7.20-7.25 (3H, m), 7.29-7.36 (1H, m), 7.36-7.49 (1H, m).
第一工程
参考例516と同様の手法で合成した化合物547A(367 mg, 0.812 mmol)とdibenzosuberol(205 mg, 0.974 mmol)の酢酸(3 ml)溶液に室温下、硫酸(0.6 ml)を滴下し、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をメタノール(3 ml)に溶解させ、室温下、2規定水酸化ナトリウム水溶液(1 ml)を加え30分間撹拌した。反応液を2規定塩酸水溶液(1 ml)で中和し、酢酸エチルで3回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥し、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると、固体として75 mgの化合物547を得た。
1H-NMR (CDCl3) δ: 1.22 (3H, d, J = 6.9 Hz), 1.45 (3H, d, J = 6.3 Hz), 2.80 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.1 Hz), 2.99-3.11 (1H, m), 3.53 (1H, ddd, J = 3.9 Hz, 3,9 Hz, 17.7 Hz), 3.64 (1H, dd, J = 6.9 Hz), 12.3 Hz), 3.82 (1H, dd, J = 3.3 Hz, 12.3 Hz), 3.86-3.97 (1H, m), 4.34-4.44 (2H, m), 4.88 (1H, s), 5.35 (1H, d, J = 7.5 Hz), 6.52-6.58 (2H, m), 6.82 (1H, dt, J = 1.8 Hz, 7.2 Hz), 7.06-7.35 (6H, m).
参考例547と同様の手法により化合物548を合成した。
1H-NMR (CDCl3) δ: 1.29 (3H, d, J = 6.6 Hz), 1.50 (3H, d, J = 6.6 Hz), 1.70-1.81 (1H, m), 1.88-2.00 (1H, m), 2.85 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.1 Hz), 2.99-3.11 (1H, m), 3.48-3.57 (1H, m), 3.68-3.73 (2H, m), 3.83-3.92 (1H, m), 4.30 (1H, ddd, J = 4.2 Hz, 13.8 Hz, 13.8 Hz), 4.54 (1H, dd, J = 3.6 Hz, 11.1 Hz), 4.67 (1H, s), 5.69 (1H, d, J = 7.8 Hz), 6.62 (1H, d, J = 7.5 Hz), 6.64 (1H, d, J = 5.7 Hz), 6.90 (1H, t, J = 6.9 Hz), 7.07-7.36 (6H, m).
第一工程
参考例516と同様の手法で合成した化合物549A (997 mg, 1.69 mmol)とdibenzosuberol(1.07 g, 5.08 mmol)の酢酸(3 ml)溶液に室温下、硫酸(0.6 ml)を滴下し、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると513 mgの化合物549Bを得た。
1H-NMR (CDCl3) δ: 2.09 (3H, s), 2.71 (1H, ddd, J = 3.6 Hz, 13.5 Hz, 13.5 Hz), 3.18-3.27 (1H, m), 3.42-3.56 (2H, m), 3.80 (1H, dd, J = 2.7 Hz, 14.1 Hz), 4.03 (1H, dd, J = 10.2 Hz, 14.1 Hz), 4.15 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 9.3 Hz), 4.32-4.40 (1H, m), 4.49-4.53 (2H, m), 4.94 (1H, s), 5/83 (1H, d, J = 7.8 Hz), 6.63 (1H, d, J = 7.5 Hz), 6.69 (1H, d, J = 7.8 Hz), 6.76 (1H, d, J = 6.6 Hz), 6.91 (1H, t, J = 7.5 Hz), 7.00 (1H, d, J = 8.1 Hz), 7.12-7.17 (2H, m), 7.20-7.32 (2H, m), 7.82-7.89 (4H, m).
第二工程
化合物549B(513 mg, 0.829 mmol)のメタノール(5 ml)溶液にヒドラジン水和物(124.5 mg, 2.49 mmol)を加え、2時間還流した。室温に冷却後、反応液に2規定塩酸(30 ml)と酢酸エチル(30 ml)を加えた。分液後、有機層を2規定塩酸で2回抽出した。合わせた水層を重曹水で中和後、クロロホルム-メタノールで3回抽出した。合わせた有機層を硫酸ナトリウムで乾燥し、溶媒を留去した。得られた粗生成物を酢酸エチル-ジイソプロピルエーテルで洗浄すると135 mgの化合物549を得た。
1H-NMR (DMSO-d6) δ: 2.40-2.50 (1H, m), 2.72-2.80 (1H, m), 2.83-2.98 (2H, m), 3.03-3.66 (4H, m), 3.79-3.87 (1H, m), 4.11 (1H, 4.2 Hz), 4.32-4.44 (1H, m), 5.12 (1H, s), 5.51 (1H, 7.5 Hz), 6.69 (d, J = 7.5 Hz), 6.84-6.90 (1H, m), 7.07-7.24 (4H, m), 7.30-7.34 (2H, m), 7.39-7.42 (1H, m).
化合物549から参考例536に従い、同様の手法により化合物550を合成した。
1H-NMR (DMSO-d6) δ: 0.77 (6H, t, 6.9 Hz), 1.99-2.36 (3H, m), 2.38-2.56 (1H, m), 2.64 (1H, dd, J = 3.9 Hz, 14.1 Hz), 2.75 z81H, ddd, J = 4.5 Hz, 4.5 Hz, 14.4 Hz), 2.89-3.00 (1H, m), 3.09-3.68 (4H, m), 3.74-3.82 (1H, m), 4.09 (1H, brs), 4.17 (1H, dd, J = 3.6 Hz, 8.4 Hz), 5.03 (1H, brs), 5.17 (1H, s), 5.53 (1H, d, J = 7.5 Hz), 6.73 (1H, d, J = 7.5 Hz), 6.84 (1H, d, J = 7.8 Hz), 6.91 (1H, t, J = 7.2 Hz), 7.12-7.26 (4H, m), 7.31-7.44 (4H, m), 7.45 (1H, d, J = 7.2 Hz).
化合物549から参考例536に従い、同様の手法により化合物551を合成した。
1H-NMR (DMSO-d6) δ: 1.99 (6H, s), 2.27 (1H, brs), 2.51-2.27 (3H, m), 3.56-3.70 (4H, m), 4.03 (2H, brs), 4.36 (1H, brs), 4.94 (2H, brs), 5.29 (1H, brs), 6.54-6.83 (3H, m), 7.11-7.33 (6H, m).
第一工程
参考例516と同様の手法で合成した化合物552A (137 mg, 0.367 mmol)とdibenzosuberol(386 mg, 1.83 mmol)の酢酸(2 ml)溶液に室温下、硫酸(0.4 ml)を滴下し、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をメタノール(5 ml)に溶解させ、室温下、2規定水酸化ナトリウム水溶液(2 ml)を加え30分間撹拌した。反応液を2規定塩酸水溶液(2 ml)で中和し、酢酸エチルで2回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥し、溶媒を留去した。得られた粗生成物を酢酸エチルで洗浄し、62 mgの化合物552を得た。
1H-NMR (CDCl3) δ: 1.71-1.82 (1H, m), 2.09-2.21 (1H, m), 2.82-2.90 (1H, m), 3.06 (1H, ddd, J = 4.2 Hz, 13.2 Hz, 13.2 Hz), 3.19 (3H, s), 3.22-3.43 (3H, m), 3.60 (1H, ddd, J = 10.5 Hz, 10.5 Hz, 17.4 Hz), 3.79-3.96 (3H, m), 4.12-4.21 (1H, m), 4.46 (1H, dd, J = 3.3 Hz, 10.2 Hz), 4.98 (1H, s), 5.89 (1H, d, J = 7.5 Hz), 6.62 (1H, d, J = 6.9 Hz), 6.64 (1H, d, J = 7.5 Hz), 6.88-6.93 (1H, m), 7.11-7.37 (6H, m).
参考例552と同様の手法により化合物553を合成した。
1H-NMR (CDCl3) δ: 0.80 (3H, d, J = 6.6 Hz), 0.94 (3H, d, J = 6.9 Hz), 1.94-2.00 (1H, m), 2.82-2.90 (1H, m), 3.00-3.11 (1H, m), 5.31-3.59 (2H, m), 3.64-3.74 (1H, m), 3.94-4.04 (3H, m), 4.25-4.36 (1H, m), 5.04 (1H, s), 5.87 (1H, d, J = 7.2 Hz), 6.65 (1H, d, J = 7.2 Hz), 7.12 (1H, d, J = 7.5 Hz), 6.92 (1H, t, J = 8.1 Hz), 7.10 (1H, d, J = 7.2 Hz), 7.15-7.38 (5H, m).
第一工程
参考例516と同様の手法で合成した化合物554A (100 mg, 0.177 mmol)とdibenzosuberol(186 mg, 0.885 mmol)の酢酸(2 ml)溶液に室温下、硫酸(0.4 ml)を滴下し、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をメタノール(5 ml)に溶解させ、室温下、2規定水酸化ナトリウム水溶液(2 ml)を加え30分間撹拌した。反応液をクエン酸水溶液で中和し、酢酸エチルで2回抽出した。合わせた抽出液を重曹水で洗浄後、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた粗生成物を酢酸エチルで洗浄し、24 mgの化合物554を得た。
1H-NMR (CDCl3) δ: 2.81-2.91 (2H, m), 2.98-3.09 (1H, m), 3.60-3.75 (2H, m), 3.91-4.04 (2H, m), 4.08-4.17 (2H, m), 4.22-4.33 (2H, m), 4.80 (1H, s), 5.69 (1H, d, J = 7.8 Hz), 6.48 (1H, d, J = 7.5 Hz), 6.59 (1H, d, J = 7.5 Hz), 6.80-6.85 (1H, m), 7.13-7.35 (6H, m).
参考例516に従い合成した化合物555A (380 mg, 1.11 mmol)と dibenzosuberol(1.16 g, 5.52 mmol)の酢酸(4 ml)溶液に室温下、硫酸(0.8 ml)を滴下し、同温度で30分間撹拌した。反応液を水で希釈し、酢酸エチルで3回抽出した。抽出液を1回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をメタノール(5 ml)に溶解させ、室温下、2規定水酸化ナトリウム水溶液(2 ml)を加え30分間撹拌した。反応液をクエン酸水溶液で中和し、酢酸エチルで3回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥し、溶媒を留去した。得られた粗生成物に酢酸エチル-ジイソプロピルエーテルを加え、析出した残渣をろ過し、22 mgの化合物555を得た。
1H-NMR (CDCl3) δ: 1.62 (3H, d, J = 6.9 Hz), 2.81 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 14.4 Hz), 3.09 (1H, ddd, J = 4.5 Hz, 13.8 Hz, 13.8 Hz), 3.37 (3H, s), 3.37-3.53 (2H, m), 3.70 (1H, d, J = 5.4 Hz), 4.23-4.30 (2H, m), 4.33-4.44 (1H, m), 4.94 (1H, s), 5.70 (1H, d, J = 7.8 Hz), 6.59 (1H, d, J = 7.5 Hz), 6.64 (1H, d, J = 7.8 Hz), 6.88-6.92 (1H, m), 7.08-7.37 (6H, m).
参考例65及び参考例516と同様の手法により化合物556を合成した。
1H-NMR (CDCl3) δ: 1.66-1.78 (2H, m), 1.97 (3H, s), 2.19-2.31 (1H, m), 2.35-2.44 (1H, m), 2.49-2.57 (1H, m), 2.85-2.93 (1H, m), 3.06 (1H, J = 3.9 Hz, 12.9 Hz, 12.9 Hz), 3.27-3.39 (2H, m), 3.34 (3H, s), 3.58-3.73 (3H, m), 3.96-4.04 (1H, m), 4.08-4.18 (1H, m), 4.60 (1H, dd, J = 3.0 Hz, 11.1 Hz), 4.96 (1H, s), 6.52 (1H, d, J = 7.5 Hz), 6.87-6.92 (1H, m), 7.18-7.28 (4H, m), 7.31-7.40 (2H, m), 7.65 (1H, s), 12.04 (1H, s), 14.33 (1H, s).
化合物63B (68.8 mg, 0.120 mmol) のDMSO (2 mL) 溶液に塩化銅 (39.2 mg, 0.396 mmol) を加え、110度で2時間、さらに120度で1時間攪拌した。その後、塩化銅 (50.0 mg, 0.505 mmol)を加え、200度で1時間攪拌した。反応液をLCMS分取装置を用いて精製し、溶出溶媒を留去し、濃縮残渣にジエチルエーテルを加え、析出した白色固体をろ取した。ジエチルエーテルで洗浄、乾燥することにより、 20.9 mgの化合物558を得た。
MS: m/z = 439 [M+H]+.
第一工程
化合物48A (43 mg, 0.083 mmol) を ジクロロメタン (6.0 mL) に溶解し、二酸化マンガン (120 mg, 1.38 mmol) を加えて室温で3時間攪拌した。反応液をセライトでろ過した後、ろ液を濃縮し、薄黄色固体として 22.3 mg の化合物559Bを得た。
1HNMR (CDCl3) δ: 3.17 (3H, s), 3.41-3.55 (4H, m), 3.95-4.07 (2H,m), 4.28 (1H, d, J = 16.1 Hz), 4.53 (1H, d, J = 11.8 Hz), 5.49 (2H, d, J = 2.0 Hz), 6.97-7.66 (16H, m), 10.07 (1H, s).
第二工程
化合物559B (22 mg, 0.043 mmol) を THF (6.0 mL) に溶解し、40% methanamine メタノール溶液 (6.5 ul, 0.064 mmol) および酢酸 (3.7 ul, 0.064 mmol) を加えて室温で5分間攪拌した。反応液を氷冷し、NaBH(OAc)3 (14 mg, 0.064 mmol) を加え、室温で終夜攪拌した。反応液に水、クロロホルムを加え、クロロホルム層を分離した。水層をクロロホルムで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去すると、薄黄色固体として 24 mg の化合物559Cを得た。
MS: m/z = 538 [M+H] +.
第三工程
参考例1と同様の手法により化合物559を合成した。
MS: m/z = 448 [M+H]+.
第一工程
(methoxymethyl)triphenylphosphonium chloride (6.73 g, 19.0 mmol) のジオキサン (20 mL) 混合液を0℃に冷却し、同温度を保ちながら 1.06 M NaHMDS トルエン溶液 (18.0 ml, 19.0 mmol) を滴下した。反応液を室温で30分間撹拌後、化合物383Aを加え、1時間半還流した。反応液を室温に戻し、水、酢酸エチルを加えた。酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (95:5, v/v) で溶出し、精製した。目的の画分を濃縮すると油状物として 2.22 g の化合物560Bを得た。
1H-NMR (CDCl3) δ: 3.68 (3H, s), 3.73 (3H, s), 4.20 (4H, brs), 6.17 (1H, s), 6.39 (1H, s), 6.96-7.07 (6H, m), 7.18-7.32 (9H, m), 7.32-7.46 (1H, m).
第二工程
化合物560B (1.98 g, 7.78 mmol) を ジクロロメタン (30 mL) に溶解し、70% perchloric acid 水溶液 (8.0 ml, 93 mmol) を加えて室温で終夜攪拌した。反応液に飽和炭酸ナトリウム水溶液を加え、ジクロロメタン層を分離した。水層をジクロロメタンで抽出し、合わせた抽出液に硫酸マグネシウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (90:10, v/v) で溶出し、精製した。目的の画分を濃縮すると油状物として 1.80 g の化合物560Cを得た。
1H-NMR (CDCl3) δ: 3.93 (1H, d, J = 16.1 Hz), 4.06 (1H, d, J = 16.1 Hz), 4.53 (1H, s), 7.11-7.50 (8H, m), 9.89 (1H, s).
MS: m/z = 241 [M+H] +.
第三工程
化合物560C (2.87 g, 11.9 mmol) の ジクロロメタン (30 mL) 溶液に室温下、 tetraisopropoxytitanium (17.5 mL, 59.7 mmol)、(S)-4-methylbenzenesulfinamide (2.27 g, 14.3 mmol) を加え、 3 時間半還流した。反応液を氷冷し、氷水 (30 ml) を加え、同温度のまま1時間攪拌した後、析出した固体をセライトを用いてろ過した。得られたろ液をジクロロメタンで抽出し、合わせた抽出液に硫酸マグネシウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (70:30, v/v) で溶出し、精製した。目的の画分を濃縮すると黄色固体として 3.16 g の化合物560Dを得た。
1H-NMR (CDCl3) δ: 2.39 (6H, s), 3.60 (1H, d, J = 15.2 Hz), 3.68 (1H, d, J = 14.9 Hz), 3.97 (1H, d, J = 15.0 Hz), 4.07 (1H, d, J = 15.0 Hz), 4.90 (1H, d, J = 2.7 Hz), 4.92 (1H, d, J = 2.9 Hz), 7.08-7.26 (20H, m), 7.46-7.51 (4H, m), 8.62 (1H, d, J = 2.8 Hz), 8.65 (1H, d, J = 2.7 Hz).
MS: m/z = 378 [M+H]+.
第四工程
1M cyanodiethylaluminum トルエン溶液 (16.7 mL, 16.7 mmol) の THF (30 mL) 懸濁液を0度に冷却し、2-propanol (1.29 mL, 16.7 mmol) を加えた後、同温度に保ったまま、1時間攪拌した。その後、反応液を -60度に冷却し、化合物560D (3.16 g, 8.37 mmol) のTHF (12 mL) 溶液を滴下し、同温度に保ったまま15 分攪拌した後、室温まで昇温させ、終夜攪拌した。反応液を氷冷し、飽和塩化アンモニウム水溶液を加え、室温で1時間半攪拌した後、析出した固体をセライトを用いてろ過し、ジクロロメタンで洗浄した。ろ液のジクロロメタン層を分離し、水層をジクロロメタンで抽出した後、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出し、精製した。目的の画分を濃縮すると白色固体として 1.88 g の化合物560Eを得た。
MS: m/z = 427 [M+Na]+.
第五工程
化合物560E (235 mg, 0.581 mmol) の メタノール (4 mL) 溶液を0度に冷却し、cobalt(II) chloride hexahydrate (55.3 mg, 0.232 mmol) を加え、室温で30分攪拌した。その後、反応液を氷冷し、水素化ホウ素ナトリウム (88 mg, 2.3 mmol) の DMF (4 mL) 溶液を滴下し、そのままの温度で5分間攪拌した後、室温で1時間攪拌した。次いで、Boc2O (0.674 mL, 2.90 mmol) を加え、30分攪拌した。反応液に水を加え、酢酸エチルで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (98:2, v/v) で溶出した。目的の画分を濃縮すると、化合物560Fの粗生成物 (211 mg) を得た。
MS: m/z = 509 [M+Na]+.
第六工程
化合物560Fの粗生成物 (211 mg) の メタノール (6 mL) 溶液に TFA (0.128 mL, 1.66 mmol) を加え、 2.5 時間室温で撹拌した。反応液にトリエチルアミン (0.230 mL, 1.66 mmol) を加え、溶媒を留去し、得られた化合物560Gの粗生成物を精製することなく次の反応に用いた。
MS: m/z = 371 [M+H]+.
第七工程
化合物560Gの粗生成物のトルエン (4 mL) 溶液に dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (132 mg, 0.416 mmol) を加え、 1時間半還流した。反応液をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→90:10, v/v) で溶出した。目的の画分を濃縮すると、化合物560Hの粗生成物 (287 mg) を得た。
MS: m/z = 671 [M+H]+.
第八工程
第七工程で得られた化合物560Hの粗生成物に4N 塩酸 酢酸エチル溶液 (3 mL) を加え、室温で30分間攪拌した。溶媒を留去し、得られた濃縮残渣にTHF (2 mL) および飽和炭酸水素ナトリウム水溶液 (2 mL) を加え、室温で45分間攪拌した。反応液に水を加え、クロロホルムで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、黄色固体として、27mgの化合物560Iを得た。
MS: m/z = 539 [M+H]+.
第九工程
化合物560I (27 mg, 0.050 mmol) を DMF (2 mL) に溶解し、炭酸セシウム (82 mg, 0.25 mmol) および ヨウ化メチル (0.010 mL, 0.16 mmol)を加え、室温で1時間半攪拌した。反応液に水を加え、酢酸エチルで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、化合物560Jの粗生成物を得た。
MS: m/z = 553 [M+H]+.
第十工程
第九工程で得られた化合物560Jの粗生成物のEtOH (2 mL) 溶液に 2N NaOH (1 mL) を加え、 室温で40分間撹拌した。反応液に2N HCl水溶液を加え、酢酸エチルで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去すると、白色オイルとして、17 mg の化合物560Kを得た。
MS: m/z = 539 [M+H]+.
第十一工程
化合物560K (17 mg, 0.032 mmol)に TFA (2.0 mL) を加え、 35分間室温で撹拌した。反応液をトルエン共沸し、得られた濃縮残渣にイソプロピルエーテルを加え、析出した固体をろ取、洗浄したところ、桃色固体として、7.1 mgの化合物560を得た。
MS: m/z = 449 [M+H]+.
第一工程
化合物560Hの粗生成物 (433mg) に4N 塩酸 酢酸エチル溶液 (3 mL) を加え、室温で1時間攪拌した。溶媒を留去し、得られた残渣 のTHF (2 mL) 溶液にアセトン (2 mL) を加え、室温で20分間攪拌した後、NaBH(OAc)3 (70 mg, 0.32 mmol) を加え、室温で1時間半攪拌した。その後、反応液に飽和炭酸水素ナトリウム水溶液 (3 mL) を加え、室温で終夜攪拌した。反応液に水を加え、クロロホルムで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、化合物561Aの粗生成物 (79 mg) を得た。
MS: m/z = 581 [M+H]+.
第二工程
化合物561Aの粗生成物 (79 mg) のEtOH (4 mL) 溶液に 2N NaOH (2 mL) を加え、 室温で1時間撹拌した。反応液に2N HCl水溶液を加え、酢酸エチルで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、化合物561B (53 mg) を得た。
MS: m/z = 567 [M+H]+.
第三工程
化合物 561B (53 mg, 0.093 mmol) の DMF (2 mL) 溶液を0度に冷却し、トリエチルアミン(0.039 mL, 0.28 mmol) およびクロロギ酸エチル (0.018 mL, 0.187 mmol) を加えた後、室温で10分間攪拌した。その後、反応液を 0度に冷却し、アジ化ナトリウム (18 mg, 0.28 mmol) を加え、同温度に保ったまま50分攪拌した。反応液に水を加え、ジクロロメタンで抽出した後、合わせた抽出液を濃縮し、化合物561Cの粗生成物を得た。
MS: m/z = 592 [M+H]+.
第四工程
化合物561Cの粗生成物 (55 mg) をメタノール (2 mL) に溶解し、50℃で1時間攪拌した。反応液をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、化合物561Dの粗生成物 (43 mg) を得た。
MS: m/z = 596 [M+H]+.
第五工程
化合物561Dの粗生成物 (43 mg) のEtOH (2 mL) 溶液に 2N NaOH (4 mL) を加え、 60度で1時間撹拌した。溶媒を留去し、水を加え、酢酸エチルで抽出した後、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をアミノカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→80:20, v/v) で溶出した。目的の画分を濃縮すると、薄黄色固体として、16 mgの化合物561E を得た。
MS: m/z = 538 [M+H]+.
第六工程
化合物 561E (16 mg, 0.029 mmol) を EtOH (1 mL) および48% tetrafluoroboric acid水溶液(1 mL) に溶解し、反応液を0度に冷却し、亜硝酸ナトリウム (15 mg, 0.22 mmol) を加えた後、同温度に保ったまま1時間半、さらに室温で2時間半攪拌した。反応液に水を加え、クロロホルムで抽出した後、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた濃縮残渣に酢酸エチルおよびイソプロピルエーテルを加え、析出した固体をろ取、洗浄したところ、白色固体として、5 mgの化合物561を得た。
1H-NMR (CDCl3) δ: 0.96 (3H, d, J = 6.9 Hz), 1.17 (3H, d, J = 6.8 Hz), 3.37 (1H, d, J = 13.3 Hz), 3.88 (1H, dd, J = 13.4, 4.3 Hz), 3.99 (1H, d, J = 14.9 Hz), 4.08 (1H, d, J = 11.3 Hz), 4.52 (1H, d, J = 14.9 Hz), 4.81-4.90 (1H, m), 5.67 (1H, dd, J = 11.3, 3.1 Hz), 5.94 (1H, d, J = 7.4 Hz), 6.59 (1H, d, J = 6.4 Hz), 6.72 (1H, d, J = 7.3 Hz), 6.86 (1H, t, J = 7.1 Hz), 7.09 (1H, t, J = 7.6 Hz), 7.16-7.31 (5H, m).
参考例561と同様の手法により化合物562を合成した。
1H-NMR (CDCl3) δ: 3.07 (3H, s), 3.21 (1H, d, J = 12.3 Hz), 4.00-4.31 (4H, m), 5.78 (1H, d, J = 10.5 Hz), 5.94 (1H, d, J = 7.4 Hz), 6.54 (1H, d, J = 7.3 Hz), 6.69 (1H, d, J = 7.5 Hz), 6.98 (1H, t, J = 7.6 Hz), 7.14-7.41 (6H, m).
MS: m/z = 405 [M+H]+.
第一工程
化合物563A (Tetrahedron Letters, 34, 953-956, 1993, 41.1 g, 154 mmol) をTHF (300 mL) に溶解し、1 M BH3-THF (770 mL) を室温でゆっくりと加え、18時間攪拌した。3規定塩酸水溶液(513 mL)をゆっくりと加え1時間還流し、精製することなく次の工程に進んだ。
LC-MS: m/z = 254 [M+H] +.
第二工程
化合物563Bを含む溶液を用いて、参考例12に準じて化合物563Cを合成した。
LC-MS: m/z = 353 [M+H] +.
1H-NMR (DMSO-d6): 1.40 (9H, s), 2.65-2.72 (1H, m), 2.86-2.92 (3H, m), 3.47-3.56 (3H, m), 3.56-3.69 (1H, m), 6.63 (1H, s), 7.11-7.26 (8H, m).
第三工程
化合物563C(2.16 g, 6.79 mmol) およびdimethyl 3-(benzyloxy)-4-oxo-4H-pyran- 2,5-dicarboxylate (2.38 g, 6.75 mmol) のトルエン (30 mL) 溶液を100 ℃で4時間攪拌した.反応液を減圧下留去して得られる化合物563Dの粗生成物を精製することなく次の反応に用いた.
MS: m/z = 653.05 [M+H] +.
第四工程
化合物563D の粗生成物の酢酸エチル (20 mL) 溶液に,室温で塩化水素 (4 N酢酸エチル溶液, 20 mL) を加え,30分間攪拌した.反応液を減圧下留去して得られる化合物563Eの粗生成物を精製することなく次の反応に用いた.
MS: m/z = 553.05 [M+H] +.
第五工程
化合物563E の粗生成物のテトラヒドロフラン (40 mL) 溶液に,室温で飽和重曹水 (5 mL) を加え,16時間攪拌した.反応液に水 (50 mL) を加え,クロロホルムで3回抽出した.抽出液を合わせて硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られる残さにジエチルエーテルおよびクロロホルムを加えて粉末化させ,化合物563F (2.90 g, 70.2 %) を白色固体として得た.
MS: m/z = 521.05 [M+H] +.
第六工程
化合物563F (523 mg, 1.01 mmol) のメタノール (7.5 mL) 懸濁液に,室温で水酸化ナトリウム水溶液 (2 M, 1.5 mL) を加え,3時間攪拌した.反応液に室温で塩酸 (2N, 1.5 mL) および水 (3 mL) を加えた後,0 ℃で15分間攪拌した.析出した固体をろ取した後,水およびジエチルエーテルで洗浄し,化合物563G (418 mg, 82.0 %) を白色固体として得た.
MS: m/z = 507.00 [M+H] +.
第七工程
化合物563G (107 mg, 0.211 mmol) のジフェニルエーテル (5 mL) 懸濁液をマイクロウェーブ照射下,240 ℃で1時間攪拌した.反応液をシリカゲルカラムクロマトグラフィー (メタノール/クロロホルム = 0 % → 5 %) で精製し,化合物563H (64.4 mg, 65.9 %) を白色固体として得た.
MS: m/z = 463.05 [M+H] +.
第八工程
化合物563H (64.4 mg, 0.139 mmol) のメタノール (30 mL) 溶液を,10%Pd-C CatCart (H-cube, Full-H2 mode, 25 ℃) に3時間通じて水素化を行った.反応液を減圧下留去して得られる残さに酢酸エチルおよびメタノールを加えて粉末化させ,化合物563 (31.1 mg, 60.0 %) を灰白色固体として得た.
1HNMR (DMSO-d6) δ: 2.50 - 3.03 (3H, m), 3.50 - 3.72 (3H, m), 4.29 (1H, d, J = 11.4 Hz), 5.12 (1H, m), 5.69 (1H, d, J = 7.2 Hz), 6.50 (1H, d, J = 7.7Hz), 6.75 (1H, d, J = 7.7 Hz), 6.84 (1H, m), 7.14 - 7.30 (6H, m), 9.16 (1H, d, J = 4.8 Hz).
MS: m/z = 372.90 [M+H] +.
第一工程
化合物563H (64.2 mg, 0.139 mmol) および炭酸セシウム (220 mg, 0.675 mmol) のジメチルホルムアミド (2 mL) 懸濁液に,室温でヨウ化メチル (0.0430 mL, 0.688 mmol) を加え,3時間攪拌した.反応液に室温で水 (10 mL) を加え,酢酸エチル (30 mL) で抽出した.有機層を水 (10 mL) および飽和食塩水 (10 mL) で洗浄した後,硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られる残さをシリカゲルカラムクロマトグラフィー (メタノール/クロロホルム = 2.5 % → 10 %)で精製し,化合物564A (56.0 mg, 85.0 %) を無色ガム状物として得た.
MS: m/z = 477.00 [M+H] +.
第二工程
化合物564A (56.0 mg, 0.118 mmol) のメタノール (10 mL) ,酢酸エチル (5 mL) , テトラヒドロフラン (5 mL) 溶液を,10%Pd-C CatCart (H-cube, Full-H2 mode, 25 ℃) に75分間通じて水素化を行った.反応液を減圧下留去して得られる残さに酢酸エチルおよびメタノールを加えて粉末化させ,化合物564 (22.0 mg, 48.4 %) を灰白色固体として得た.
1HNMR (DMSO-d6) δ: 2.86 - 2.98 (6H, m), 3.51 - 3.58 (2H, m), 3.94 (1H, m), 4.30 (1H, d, J = 11.1 Hz), 5.19 (1H, d, J = 10.2 Hz), 5.79 (1H, d, J = 6.9 Hz), 6.49 (1H, d, J = 7.4 Hz), 6.74 (1H, d, J = 7.4 Hz), 6.85 (1H, m), 7.14 (2H, m), 7.25 (4H, m), 12.50 (1H, brs).
MS: m/z = 387.05 [M+H] +.
第一工程
化合物563H (75.4 mg, 0.163 mmol) ,3-ヨードベンゾニトリル (124 mg, 0.541 mmol) ,ヨウ化銅 (I) (33.2 mg, 0.174 mmol) ,炭酸カリウム (74.7 mg, 0.540 mmol) およびN,N’-ジメチルエチレンジアミン (0.0200 ml, 0.186 mmol) のジメチルホルムアミド (2 mL) 懸濁液をマイクロウェーブ照射下,140 ℃で2時間攪拌した.反応液に室温で水 (10 mL) および塩酸 (2 M, 2 mL) を加え,酢酸エチルで抽出した.抽出液をセライトでろ過し,ろ液を水 (10 mL x 2) および飽和食塩水 (10 mL) で洗浄した後,硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られる化合物566Aの粗生成物を精製することなく次の反応に用いた.
MS: m/z = 564.05 [M+H] +.
第二工程
第一工程で得られた化合物566Aの粗生成物の塩化メチレン (10 mL) 溶液に,室温でトリフルオロ酢酸 (2 mL) を加え,1時間攪拌した.反応液を減圧下で濃縮して得られる残さをpreparative LCMSにて精製し,化合物566 (30.3 mg, 39.3 %) を黄色固体として得た.
1HNMR (DMSO-d6) δ: 2.81 - 2.94 (2H, m), 3.38 - 3.58 (2H, m), 4.54 (1H, d, J = 10.5 Hz), 4.64 (1H, d, J = 10.5 Hz), 5.35 (1H, d, J = 10.5 Hz), 5.76 (1H, m), 6.66 - 6.71 (3H, m), 6.90 (1H, m), 7.06 - 7.15 (6H, m), 7.76 (2H, m), 7.90 (2H, m).
MS: m/z = 473.90 [M+H] +.
参考例566と同様の手法により化合物567を合成した。
1HNMR (DMSO-d6) δ: 2.80 - 3.00 (2H, m), 3.40 - 3.70 (2H, m), 4.52 (1H, m), 4.64 (1H, m), 5.38 (1H, m), 5.76 (1H, m), 6.60 - 7.20 (10H, m), 7.60 - 7.90 (3H, m), 8.11 (1H, m).
MS: m/z = 474.00 [M+H] +.
参考例566と同様の手法により化合物568を合成した。
1HNMR (DMSO-d6) δ: 2.87 - 2.96 (2H, m), 3.34 - 3.73 (2H, m), 4.64 (2H, m), 5.33 (1H, m), 5.71 (1H, d, J = 7.2 Hz), 6.61 (1H, d, J = 7.8 Hz), 6.87 - 6.95 (3H, m), 7.00 - 7.27 (6H, m), 7.62 (2H, m), 7.86 (1H, m), 8.07 (1H, m).
MS: m/z = 474.00 [M+H] +.
参考例566と同様の手法により化合物570を合成した。
1HNMR (DMSO-d6) δ: 2.83 - 2.97 (3H, m), 3.16 - 3.62 (2H, m), 3.56 (1H, m), 3.66 (1H, d, J = 11.1 Hz), 5.35 (1H, d, J = 11.1 Hz), 5.73 (1H, d, J = 7.4 Hz), 6.68 (1H, d, J = 7.4 Hz), 6.92 (1H, m), 7.06 - 7.21 (5H, m), 7.49 (1H, m), 7.97 (1H, d, J = 8.4 Hz), 8.14 (1H, s), 8.50 (1H, d, J = 3.6 Hz), 8.81 (1H, d, J = 2.1 Hz).
MS: m/z = 449.95 [M+H] +.
第一工程
化合物563H (50.0 mg, 0.108 mmol) のDMF (1 mL) 溶液に炭酸セシウム (176 mg, 0.540 mmol) を加え、室温下、10分間攪拌した。反応液にO-(2,4-dinitrophenyl)hydroxylamine (64.6 mg, 0.324 mmol) を加え、室温下、9時間攪拌した。反応液にクロロホルムを加え、水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (98:2, v/v) で溶出した。目的の画分を濃縮するとアモルファスとして 28.3 mg の化合物571Aを得た。
MS: m/z = 478 [M+H] +.
第二工程
化合物571A (27.0 g, 0.057 mmol) を THF-メタノール (1 mL, 1:1, v/v) 溶液に溶解し、10%パラジウム炭素 (15.0 mg) を加えて室温水素雰囲気下で2時間攪拌した。クロロホルムで希釈した後、セライト濾過にて不溶物を除去した。濾液を減圧下に濃縮後、残留物をジクロロメタン-エーテルにて固化することにより12.0 mg の化合物571を得た。
MS: m/z = 388 [M+H]+.
第一工程
化合物563H (83.2 mg, 0.160 mmol) のジメチルホルムアミド (1.5 mL) 溶液に氷冷下,水素化ナトリウム (60 %, 13.2 mg, 0.330 mmol) を加え,30分間攪拌した後,ブロモアセトニトリル (0.0190 mL, 0.270 mmol) を加え,室温で1時間攪拌した.反応液に塩化アンモニア水溶液 (10 %, 3 mL) を加え,酢酸エチルで抽出した.有機層を水 (10 mL) および飽和食塩水 (10 mL) で洗浄した後,硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られる化合物573Aの粗生成物を精製することなく次の反応に用いた.
MS: m/z = 502.00 [M+H] +.
第二工程
第一工程で得られた化合物573Aの粗生成物およびヨウ化ナトリウム (111 mg, 0.741 mmol) のアセトニトリル (4 mL) 懸濁液に,室温でクロロトリメチルシラン (0.0920 mL, 0.720 mmol) を加え,24時間攪拌した.反応液に亜硫酸水素ナトリウム水溶液 (10%, 10 mL) を加えた後,クロロホルムで抽出した.抽出液を合わせて硫酸ナトリウムで乾燥した後,溶媒を減圧下で濃縮して得られる残さをpreparative LCMSにて精製し,化合物573 (22.0 mg, 29.7 %) を灰白色固体として得た.
1H-NMR (DMSO-d6) δ: 2.86 - 2.95 (2H, m), 3.45 - 3.63 (2H, m), 4.01 (1H, m), 4.30 (1H, d, J = 10.8 Hz), 4.35 (1H, d, J = 17.4 Hz), 4.74 (1H, d, J = 17.4 Hz), 5.20 (1H, m), 5.66 (1H, d, J = 7.5 Hz), 6.52 (1H, d, J = 7.8 Hz), 6.73 (1H, d, J = 7.5 Hz), 6.83 (1H, m), 7.11 - 7.28 (6H, m).
MS: m/z = 502.00 [M+H] +.
参考例573と同様の手法により化合物574を合成した。
1H-NMR (DMSO-d6) δ: 4.16 (1H, dd, J = 13.26, 3.53 Hz), 4.36 (1H, d, J = 11.58 Hz), 4.52 (2H, dd, J = 20.73, 17.54 Hz), 5.44 (1H, d, J = 11.41 Hz), 5.65 (1H, d, J = 7.39 Hz), 6.99 (1H, d, J = 7.55 Hz), 7.11-7.32 (6H, m), 7.36-7.45 (2H, m), 7.58 (2H, d, J = 7.39 Hz).
第一工程
化合物576A (Bioorg. Med. Chem., 2003, 11, 197-206) (2.26 g, 10.2 mmol) の ジクロロメタン (30 mL) 溶液に室温下、tetraisopropoxytitanium (10.0 mL, 33.1 mmol)、(S)-4-methylbenzenesulfinamide (1.29 g, 8.13 mmol) を加え、 2 時間還流した。反応液を氷冷し、氷水 (40 ml) を加え、同温度のまま1時間攪拌した後、析出した固体をセライトを用いてろ過した。得られたろ液をジクロロメタンで抽出し、合わせた抽出液に硫酸マグネシウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (100:0→70:30, v/v) で溶出し、精製した。目的の画分を濃縮すると黄色固体として 1.35 g の化合物576Bを得た。
1H-NMR (CDCl3) δ: 2.32 (3H, s), 2.72-2.85 (2H, m), 3.03-3.16 (2H, m), 4.89 (1H, d, J = 3.5 Hz), 7.09-7.25 (10H, m), 7.39-7.42 (2H, m), 8.49 (1H, d, J = 3.6Hz).
MS: m/z = 360 [M+H]+.
第二工程
1M cyanodiethylaluminum トルエン溶液 (7.51 mL, 7.51 mmol) の THF (20 mL) 溶液を0度に冷却し、2-propanol (0.579 mL, 7.51 mmol) を加えた後、同温度に保ったまま、1時間攪拌した。その後、反応液を -60度に冷却し、化合物576BのTHF (14 mL) 溶液を滴下し、同温度に保ったまま15 分攪拌した後、室温まで昇温させ、終夜攪拌した。反応液を氷冷し、飽和塩化アンモニウム水溶液を加え、室温で1時間半攪拌した後、析出した固体をセライトを用いてろ過し、ジクロロメタンで洗浄した。ろ液のジクロロメタン層を分離し、水層をジクロロメタンで抽出した後、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物に酢酸エチルおよびヘキサンを加え、析出した固体をろ取、洗浄したところ、白色固体として 976 mg の化合物576Cを得た。
1H-NMR (CDCl3) δ: 2.38 (3H, s), 2.92-3.055 (2H, m), 3.41-3.52 (2H, m), 4.25 (1H, d, J = 10.8 Hz), 4.28 (1H, d, J = 5.6 Hz), 4.94 (1H, dd, J = 10.6, 5.7 Hz), 7.14-7.41 (12H, m).
第三工程
化合物576 C(500 mg, 1.29 mmol) の メタノール (8 mL) 懸濁液を0度に冷却し、cobalt(II) chloride hexahydrate (123 mg, 0.517 mmol) を加え、室温で30分攪拌した。反応液にクロロホルム (5 mL) を加えた後、氷冷し、水素化ホウ素ナトリウム (196 mg, 5.17 mmol) の DMF (4 mL) 溶液を滴下し、そのままの温度で5分間攪拌した後、室温で2時間攪拌した。次いで、Boc2O (1.0 mL, 4.3 mmol) を加え、室温で終夜攪拌した。反応液に水を加え、酢酸エチルで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→98:2, v/v) で溶出した。目的の画分を濃縮すると、化合物576Dの粗生成物 (200 mg) を得た。
MS: m/z = 491 [M+Na]+.
第四工程
第三工程で得られた化合物576Dの粗生成物 (200 mg) の メタノール (6 mL) 溶液に TFA (0.188 mL, 2.45 mmol) を加え、 2.5 時間室温で撹拌した。反応液にトリエチルアミン (0.399 mL, 2.45 mmol) を加え、溶媒を留去し、得られた化合物576Eの粗生成物を精製することなく次の反応に用いた。
MS: m/z = 353 [M+H]+.
第五工程
第四工程で得られた化合物576Eの粗生成物のトルエン (4 mL) 溶液に dimethyl 3-(benzyloxy)-4-oxo-4H-pyran-2,5-dicarboxylate (130 mg, 0.409 mmol) を加え、 2時間還流した。反応液をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→90:10, v/v) で溶出した。目的の画分を濃縮すると、化合物576Fの粗生成物 (268 mg) を得た。
MS: m/z = 653 [M+H]+.
第六工程
第五工程で得られた化合物576Fの粗生成物 (263 mg) に4N 塩酸 酢酸エチル溶液 (3 mL) を加え、室温で1時間半攪拌した。溶媒を留去し、得られた濃縮残渣のTHF (4 mL) 溶液にアセトン (1 mL) を加え、室温で25分間攪拌した後、NaBH(OAc)3 (180 mg, 0.807 mmol) を加え、室温で1時間15分攪拌した。その後、反応液に飽和炭酸水素ナトリウム水溶液 (7 mL) を加え、室温で終夜攪拌した。反応液に水を加え、クロロホルムで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、化合物576Gの粗生成物 (160 mg) を得た。
MS: m/z = 563 [M+H]+.
第七工程
第六工程で得られた化合物576Gの粗生成物 (160 mg) のEtOH (4 mL) 溶液に 2N NaOH (2 mL) を加え、 室温で3時間撹拌した。反応液に2N HCl水溶液を加え、酢酸エチルで抽出し、合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→94:6, v/v) で溶出した。目的の画分を濃縮すると、黄色固体として、78 mgの化合物576Hを得た。
MS: m/z = 549 [M+H]+.
第八工程
化合物576H (78 mg, 0.14 mmol) にジフェニルエーテル (3 mL) を加え、マイクロウェーブ照射下、245度で1時間攪拌した。 反応液をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (100:0→90:10, v/v) で溶出した。目的の画分を濃縮すると、褐色オイルとして、43 mgの化合物576Iを得た。
MS: m/z = 505 [M+H]+.
第九工程
化合物576I (42 mg, 0.083 mmol)に TFA (1.0 mL) を加え、 35分間室温で撹拌した。反応液をトルエン共沸し、得られた濃縮残渣に飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出した。合わせた抽出液に硫酸ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物に酢酸エチルおよびイソプロピルエーテルを加え、析出した固体をろ取、洗浄したところ、薄茶色固体として、14 mgの化合物576を得た。
1H-NMR (CDCl3) δ: 1.13 (3H, d, J = 6.7 Hz), 1.20 (3H, d, J = 6.7 Hz), 2.95-3.13 (2H, m), 3.28 (1H, d, J = 13.1 Hz), 3.37-3.59 (2H, m), 3.75 (1H, d, J = 10.3 Hz), 4.10 (1H, d, J = 10.8 Hz), 4.80-4.87 (2H, m), 5.91 (1H, d, J = 5.8 Hz), 6.41 (2H, t, J = 6.5 Hz), 6.85 (1H, t, J = 6.4 Hz), 7.05-7.35 (6H, m).
MS: m/z = 415 [M+H]+.
第一工程
化合物159Aの粗生成物 (140 mg) のジメチルホルムアミド (3 mL) 溶液に,室温でシアン化カリウム (21.0 mg, 0.323 mmol) を加え,80 ℃で30分間,100 ℃で30分間攪拌した.反応液を減圧下で濃縮して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 80 % → 100 %) で精製し,化合物577B (41.5 mg, 33.5 %) を薄オレンジ色泡状物として得た.
MS: m/z = 535.25 [M+H] +.
第二工程
化合物577B (41.5 mg, 0.078 mmol) およびヨウ化ナトリウム (45.5 mg, 0.304 mmol) のアセトニトリル (4 mL) 溶液に,室温でクロロトリメチルシラン (0.0400 mL, 0.313 mmol) を加え,2時間攪拌した.反応液に水 (1 mL) を加えた後,反応液を減圧下で濃縮して得られる残さをpreparative LCMSにて精製した.得られた残さにジエチルエーテルを加えて粉末化し,化合物577 (20.7 mg, 60.0 %) を灰白色固体として得た.
1HNMR (DMSO-d6) δ: 3.10 (3H, s), 3.51 (2H, m), 3.70 (1H, d, J = 18.9 Hz), 4.03 (1H, d, J = 18.9 Hz), 4.46 (1H, d, J = 13.4 Hz), 5.04 (1H, d, J = 13.4 Hz), 5.56 (1H, s), 5.69 (1H, s), 7.09 - 7.21 (5H, m), 7.39 - 7.63 (3H, m), 7.64 (2H, m).
MS: m/z = 445.20 [M+H] +.
参考例157と同様の手法により化合物578を合成した。
1HNMR (CDCl3) δ: 0.97 (3H, d, J = 6.6 Hz), 1.19 (3H, d, J = 6.9 Hz), 3.29 (3H, s), 3.97 (1H, d, J = 16.1 Hz), 4.56 (1H, d, J = 13.7 Hz), 4.82 (1H, m), 4.96 (1H, d, J = 16.1 Hz), 5.34 (1H, s), 5.97 (1H, d ,J = 13.7 Hz), 6.78 (2H, m), 7.12 (2H, m), 7.44 - 7.51 (6H, m).
MS: m/z = 434.10 [M+H] +.
第一工程
化合物155A (10.5 g, 26.9 mmol) ,ジイソプロピルエチルアミン (11.0 mL, 63.0 mmol) ,1-メチルイミダゾール (2.60 mL, 32.6 mmol) およびイソプロピルアミン (2.80 mL, 32.7 mmol) のトルエン (100 mL) およびアセトニトリル (20 mL) 溶液に,氷冷下,ジフェニルリン酸クロリド (6.80 mL, 32.7 mmol) を5分間かけて滴下し,氷冷下,90分間,室温で90分間攪拌した.反応液に氷冷下,tert-ブチルジメチルシリルクロリド (4.05 g, 26.9 mmol) およびトリエチルアミン (4.10 mL, 29.6 mmol) を加え,室温で80分間攪拌した後,室温で4-ジメチルアミノピリジン (164 mg, 1.35 mmol) および塩化メチレン (100 mL) を加え,15.5時間攪拌した.反応液に室温でtert-ブチルジメチルシリルクロリド (2.04 g, 26.9 mmol) を加え,24時間攪拌した.反応液に室温で10 %酢酸水溶液 (100 mL) を加え,クロロホルムで抽出した.抽出液を合わせて飽和重曹水 (100 mL) で洗浄した後,硫酸ナトリウムで乾燥した.溶媒を減圧下で濃縮して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 15 % → 40 %) で精製し,化合物580B (6.96 g, 59.9 %) を薄黄色油状物として得た.
MS: m/z = 432.25 [M+H] +.
第二工程
化合物580B (6.96 g, 16.1 mmol) のエタノール (50 mL) 溶液に,室温でアンモニア水 (35 mL) を加え,4日間攪拌した.反応液を減圧下で濃縮して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 75 % → 100 %,メタノール/クロロホルム = 0 % → 15 %) で精製し,化合物580C (4.50 g, 64.8 %) を薄オレンジ色ガム状物として得た.
MS: m/z = 431.25 [M+H] +.
第三工程
化合物580C (4.50 g, 10.5 mmol) および炭酸カリウム (7.27 g, 52.6 mmol) のジメチルホルムアミド (90 mL) 溶液に室温で,O-(2,4-ジニトロフェニル)ヒドロキシルアミン (6.29 g, 31.6 mmol) を加え,2日間攪拌した.反応液に室温でクロロホルム (180 mL) を加え,析出した不溶物をろ去し,ろ液を減圧下で濃縮して得られる残さをシリカゲルカラムクロマトグラフィー (メタノール/クロロホルム = 0 % → 10 %) で精製し,化合物580D (5.28 g, quant) を黄色固体として得た.
MS: m/z = 446.25 [M+H] +.
第四工程
化合物580D (1.29 g, 2.89 mmol) のエタノール (15 mL) 溶液に,室温でパラホルムアルデヒド(261 mg, 8.68 mmol) を加え,マイクロウェーブ照射下,140 ℃で3時間攪拌した.反応液を減圧下で濃縮して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 50 % → 100 %) で精製し,化合物580E (2.47 g, 93.0 %) を薄オレンジ色固体として得た.
MS: m/z = 458.20 [M+H] +.
第五工程
化合物580E (2.47 g, 5.40 mmol) のDMF (25 mL) 溶液に氷冷下,炭酸セシウム (5.28 g, 16.2 mmol) およびブロモジフェニルメタン (4.02 g, 16.3 mmol) を加え,室温で2日間攪拌した.反応液に氷冷下,水 (50 mL) を加えた後,酢酸エチル (150 mL x 2) で抽出した.抽出液を合わせて水 (50 mL x 2) および飽和食塩水 (50 mL) で順次洗浄した後,硫酸ナトリウムで乾燥した.溶媒を減圧下で濃縮して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 50 % → 100 %,メタノール/クロロホルム = 10 % → 20 %)で精製し,化合物580F (1.60 g, 47.5 %) を黄色泡状物として得た.
MS: m/z = 624.30 [M+H] +.
第六工程
化合物580F (1.60 g, 2.56 mmol) のメタノール (40 mL) 溶液に,室温で塩化水素 (4 N酢酸エチル溶液, 20 mL) を加え,2時間攪拌した.反応液を減圧下で濃縮して得られる残さに,室温で飽和重曹水 (20 mL) を加えた後,クロロホルムで3回抽出した.抽出液を合わせて硫酸ナトリウムで乾燥し,溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル) で精製し,化合物580G (920 mg, 70.4 %) を白色泡状物として得た.
MS: m/z = 510.25 [M+H] +.
第七工程
化合物580G (816 mg, 1.60 mmol) のTHF (80 mL) 溶液に,室温で二酸化マンガン (2.39 g, 27.5 mmol) を加え,19時間攪拌した.反応液をろ過した後,ろ液を減圧下留去して得られる化合物580Hの粗生成物 (785 mg) を精製することなく次の反応に用いた.
MS: m/z = 508.20 [M+H] +.
第八工程
第七工程で得られた化合物580Hの粗生成物 (635 mg, 1.25 mmol) およびアミド硫酸 (425 mg, 4.38 mmol) のメタノール (30 mL) および水 (10 mL) 溶液に氷冷下,亜塩素酸ナトリウム (396 mg, 4.38 mmol) の水 (4 mL) 溶液を10分間かけて滴下し,室温で30分間攪拌した後, 5 %亜硫酸水素ナトリウム水溶液 (10 mL) を加えた.メタノールを減圧下留去して得られた残さを酢酸エチルで2回抽出した,抽出液を合わせて飽和食塩水 (10 mL) で洗浄した後,硫酸ナトリウムで乾燥した.ろ液を減圧下留去して得られる化合物580Iの粗生成物を精製することなく次の反応に用いた.
MS: m/z = 524.25 [M+H] +.
第九工程
第八工程で得られた化合物580Iの粗生成物 (164 mg, 0.313 mmol),ジイソプロピルエチルアミン (0.131 mL, 0.751 mmol) ,1-メチルイミダゾール (0.0300 mL, 0.376 mmol) およびメチルアミン (2.0 Mテトラヒドロフラン溶液,0.188 mL, 0.376 mmol) の塩化メチレン (20 mL) 溶液に,室温でジフェニルリン酸クロリド (0.0780 mL, 0.375 mmol) を加え,3.5時間攪拌した後,メチルアミン塩酸塩 (25.0 mg, 0.370 mmol) を加え,6日間攪拌した.反応液を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 75 % → 100 %) で精製し,化合物580J (45.7 mg, 27.2 %) を白色泡状物として得た.
MS: m/z = 537.30 [M+H] +.
第十工程
化合物580J (45.7 mg, 0.0850 mmol) およびヨウ化ナトリウム (103 mg, 0.687 mmol) のアセトニトリル (4 mL) 溶液に,室温でクロロトリメチルシラン (0.0870 mL, 0.681 mmol) を加え,20時間攪拌した.反応液に5 %亜硫酸水素ナトリウム水溶液 (4 mL) を加え,クロロホルムで2回抽出した.抽出液を合わせて硫酸ナトリウムで乾燥した後,減圧下で濃縮して得られる残さをpreparative LCMSにて精製した.得られた残さにジエチルエーテルおよびn-ヘキサンを加えて粉末化し,化合物580 (17.1 mg, 45.0 %) を白色固体として得た.
1HNMR (CDCl3) δ: 0.93 (3H, d, J = 6.9 Hz), 1.11 (3H, d, J = 6.9 Hz), 2.83 (3H, d, J = 4.8 Hz), 4.53 (1H, d, J = 13.4 Hz), 4.85 (1H, m), 4.97 (1H, d, J = 13.4 Hz), 5.07 (1H, brd), 5.25 (1H, s), 5.86 (1H, s), 6.97 (2H, m), 7.15 - 7.24 (2H, m), 7.38 - 7.46 (6H, m).
MS: m/z = 447.20 [M+H] +.
第一工程
化合物580I (398 mg, 0.760 mmol) のtert-ブタノール (4 mL) 溶液に,室温でトリエチルアミン (0.158 mL, 1.14 mmol) およびジフェニルリン酸アジド (0.196 mL, 0.912 mmol) を加え,20時間加熱還流した.反応液に室温で水 (20 mL) を加え,クロロホルムで3回抽出した.抽出液を合わせて硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られる残さをシリカゲルカラムクロマトグラフィー (メタノール/クロロホルム = 0 % → 10 %) で精製し,化合物581A (167 mg, 36.9 %) を灰白色固体として得た.
MS: m/z = 595.10 [M+H] +.
第二工程
化合物581A (167 mg, 0.281 mmol) の塩化メチレン (2 mL) 溶液に,室温でトリフルオロ酢酸 (2 mL) を加え,1.5時間攪拌した.反応液を減圧下で濃縮して得られる残さをpreparative LCMSにて精製した.得られた残さに酢酸エチル,ジエチルエーテルおよびメタノールを加えて粉末化し,化合物581 (29.4 mg, 25.9 %) を白色固体として得た.
1HNMR (DMSO-d6) δ: 0.81 (3H, d, J = 6.5 Hz), 0.98 (3H, d, J = 6.5 Hz), 4.35 (1H, d, J = 12.6 Hz), 4.63 (1H, m), 4.68 (1H, d, J = 12.6 Hz), 4.80 (1H, s), 5.28 (1H, s), 6.34 (2H, s), 7.10 - 7.43 (8H, m), 7.81 - 7.83 (2H, m).
MS: m/z = 404.95 [M+H] +.
第一工程
参考例65の合成法に準じて合成した化合物582A (200 mg, 0.470 mmol) のエタノール (4 mL) 溶液に,室温でパラホルムアルデヒド(14.8 mg, 0.493 mmol) を加え,マイクロウェーブ照射下,140 ℃で45分間攪拌した.反応液を減圧下留去して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 90 % → 100 %)で精製し,化合物582B (173 mg, 84.0 %) を白色固体として得た.
MS: m/z = 438.15 [M+H] +.
第二工程
化合物582B (173 mg, 0.396 mmol) ,4-ジメチルアミノピリジン (5.6 mg, 0.046 mmol) およびトリエチルアミン (0.164 mL, 1.18 mmol) の塩化メチレン (4 mL) 溶液に室温で2-フルオロベンゼンスルホニルクロリド (0.0790 mL, 0.597 mmol) を加え,3日間攪拌した.反応液を減圧下留去して得られる残さをシリカゲルカラムクロマトグラフィー (酢酸エチル/n-ヘキサン = 60 % → 80 %)で精製し,化合物582C (199 mg, 84.0 %) を白色固体として得た.
MS: m/z = 596.15 [M+H] +.
第三工程
化合物582C (162 mg, 0.272 mmol) の酢酸 (2 mL) 溶液に,室温で48 %臭化水素水 (2 ml) を加え,マイクロウェーブ照射下,100 ℃で20分間攪拌した.溶媒を減圧下留去して得られる残さにジエチルエーテルおよびメタノールを加えて粉末化させ,化合物582 (160 mg, quant) を黄色固体として得た.
1HNMR (DMSO-d6) δ: 4.34 (1H, d, J = 14.7 Hz), 4.59 (1H, d, J = 14.7 Hz), 5.50 (1H, d, J = 14.3 Hz), 5.81 (1H, d, J = 14.3 Hz), 7.15 - 7.21 (2H, m), 7.35 - 7.40 (2H, m), 7.45 - 7.61 (2H, m), 7.78 (1H, m), 7.93 (1H, m), 8.42 (1H, s).
MS: m/z = 492.10 [M+H] +.
第一工程
参考例95に準じて合成した化合物583A (3.0g, .99 mmol)をトルエン(300 ml)と酢酸 (30.0 ml) に加えて溶かしTsOH H2O (0.1 g, 0.526 mmol)を室温で加えた。反応混合物を加熱還流下3時間攪拌した。減圧濃縮後、残渣をアミノシリカゲルカラムクロマトグラフィー(CHCl3/MeOH 50:1)により精製し、化合物583Bを得た(1.8 g,72.4 %)
MS: m/z = 312 [M+H] +.
第二工程
化合物583B (233 mg, 0.748 mmol) と化合物403C (197 mg, 0.8 mmol) をTHF (7.5 ml)に懸濁させ、室温でNaHMDS (1.123 ml, 1.123 mmol, 1M-THF溶液) を窒素気流下加えた。3時間室温で攪拌後、水を加え、酢酸エチル(2 x 30 mL)で抽出した。酢酸エチル層を飽和食塩水で洗浄し、硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(CHCl3/MeOH 20:1)により精製し、化合物583Dを得た(90 mg,23.1 %)。
MS: m/z = 522 [M+H] +.
第三工程
化合物583D (90 mg, 0.173 mmol)をMeOH (3 ml)とTHF (3.00 ml)の混合溶媒に溶かし、10%パラジウム-炭素(90 mg, 0.846 mmol)を加えた。水素(2 atm)気流下で24時間攪拌し、不要物をろ過した。残渣をHPLC (MeCN-H2O) を用いて精製し、ジアステレオマーを分割した。
第一分画(化合物583)
(15 mg, 20.1 %)
MS: m/z = 432 [M+H] +.
第二分画(化合物584)
(45 mg, 60.4 %)
MS: m/z = 432 [M+H] +.
参考例403と同様の手法により化合物585を合成した。
1H-NMR (DMSO-d6) δ: 1.87-2.28 (4H, m), 3.40-3.80 (3H, m), 4.32 (1H, d, J = 12.96 Hz), 5.34 (1H, t, J = 7.32 Hz), 5.65 (1H, d, J = 7.63 Hz), 6.90 (1H, d, J = 7.78 Hz), 7.10-7.35 (5H, m).
MS: m/z = 312 [M+H] +.
第一工程
化合物95B (2.29 g, 8.12 mmol) をピリジン (10 ml) に溶解し、iso-propyl-D7-amine hydrochloride (1.00 g, 9.75 mmol)と1H-benzo[d][1,2,3]triazol-1-ol (1.10 g, 8.12 mmol) とN1-((ethylimino)methylene)-N3,N3-dimethylpropane-1,3-diamine hydrochloride (3.11 g, 16.2 mmol)を加えて室温で20時間攪拌した。反応液を水にあけ、酢酸エチルで抽出し、硫酸ナトリウムで乾燥した。溶媒を減圧留去することによって得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製した。得られた化合物にジエチルエーテルを加え、析出した残渣をろ過し、1.36 gの白色固体586Bを得た。
第二工程
第一工程で得られた586B (1.36 g, 4.64 mmol) をジメチルホルムアミド (20 ml) に溶解し、炭酸カリウム (3.20 g, 23.2 mmol) を加えて室温で50分攪拌した。O-(2,4-dinitrophenyl)hydroxylamine (1.85 g, 9.27 mmol) を加えて室温で18時間攪拌した。反応液にクロロホルムを加え、生じた沈殿物をろ過して除去し、ろ液を減圧濃縮した。得られた粗生成物をアミノカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製し、835 mgの無色固体586Cを得た。
1H-NMR (CDCl3) δ: 5.28 (2H, s), 5.63 (2H, s), 6.32 (1H, d, J = 7.7 Hz), 7.10 (1H, brs), 7.42 (6H, m).
第三工程
第二工程で得られた586C (581 mg, 1.88 mmol) とパラホルムアルデヒド-D2 (181 mg, 5.65mmol) をエタノール (12 ml) に加え、マイクロウエーブ照射下140℃で30分攪拌した。反応液を減圧濃縮し、得られた粗生成物をアミノカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することにより精製した。得られた化合物にジエチルエーテルを加え、析出した残渣をろ過し、140 mgの白色固体586Dを得た。
1H-NMR (CDCl3) δ: 4.39 (2H, d, J = 8.1 Hz), 5.36 (2H, s), 5.42 (1H, t, J = 8.0 Hz), 6.37 (1H, d, J = 7.6 Hz), 7.48 (6H, m).
第四工程
化合物586E (972 mg, 5.78 mmol) をテトラヒドロフラン (10 ml) に溶解し、0℃で水素化ナトリウム (60%, 231 mg, 5.78 mmol) とベンジルブロミド-D2 (1.00 g, 5.78 mmol) を加えて60℃で30分攪拌した。反応液を希塩酸に加え、酢酸エチルで抽出し、有機層を炭酸水素ナトリウム水溶液であらった。溶媒を減圧留去することにより、1.48 gの白色固体586Fを得た。
1H-NMR (CDCl3) δ: 3.95 (3H, s), 7.17-7.48 (8H, m), 8.00 (1H, dd, J = 7.8, 1.3 Hz).
第五工程
第四工程で得られた586F (1.50 g, 5.76 mmol) をメタノール (20 ml) とテトラヒドロフラン (20ml) に溶解し、2規定水酸化ナトリウム水溶液 (14.4 ml, 28.8 mmol) を加えて室温で3時間攪拌した。反応液に希塩酸を加えて酸性にし、酢酸エチルで抽出し、有機層を飽和食塩水で洗って硫酸ナトリウムで乾燥した。溶媒を減圧留去することによって得られた化合物にn-ヘキサン-酢酸エチルを加え、析出した残渣をろ過し、1.17 gの白色固体586Gを得た。
1H-NMR (CDCl3) δ: 7.18-7.48 (8H, m), 8.11 (1H, dd, J = 7.9, 1.6 Hz).
第六工程
第五工程で得られた586G (1.15 g, 4.67 mmol) にトルエン (10 ml) を加え、ジメチルホルムアミド (0.100 ml, 1.29 mmol) と塩化チオニル (0.410 ml, 5.60 mmol) を加えて、130℃で1.5時間攪拌した。室温に冷ました後、反応液を減圧濃縮した。得られた化合物にn-ヘキサンを加え、析出した残渣をろ過し、1.16 gの白色固体を得た。塩化アルミニウム (718 mg, 5.38 mmol) にジクロロメタン (10 ml) とニトロメタン (0.5 ml) を加え、先ほど得られた化合物500 mgのジクロロメタン溶液 (5 ml) を0℃で加え、室温で5時間攪拌した。反応液を水酸化ナトリウム水溶液を加え、塩化メチレンで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧濃縮し、得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (4:1, v/v) で溶出することにより精製した。得られた化合物にn-ヘキサンを加え、析出した残渣をろ過し、155 mgの淡黄色固体586Hを得た。
1H-NMR (CDCl3) δ: 7.21-7.39 (6H, m), 7.46 (1H, td, J = 7.5, 1.4 Hz), 7.59 (1H, dd, J = 7.5, 1.4 Hz), 8.21 (1H, dd, J = 8.0, 1.0 Hz).
第七工程
第六工程で得られた586H (150 mg, 0.657 mmol) をテトラヒドロフラン (3 ml) に溶解し、0℃で水素化リチウムアルミニウム-D4 (13.8 mg, 0.329 mmol) を加えて室温で2時間攪拌した。反応液に希塩酸を加え、酢酸エチルで抽出し、硫酸ナトリウムで乾燥して溶媒を減圧留去した。得られた化合物をにn-ヘキサン-ジクロロメタンを加え、析出した残渣をろ過し、114 mgの白色固体586Iを得た。
1H-NMR (CDCl3) δ: 7.17 (6H, m), 7.40-7.52 (2H, m).
第八工程
化合物586D (76.0 mg, 0.236 mmol) と586I (54.5 mg, 0.236 mmol) を酢酸 (3.2 ml) に溶解し、水冷下で濃硫酸 (0.8 ml) を滴下した。室温で30分攪拌した後、水にあけて酢酸エチルで抽出した。有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去して得られた粗生成物に酢酸エチル-ジエチルエーテルを加え、析出した残渣をろ過し、32 mgの白色固体586を得た。
1H-NMR (DMSO-d6) δ: 5.57 (1H, d, J = 7.3 Hz), 6.82-7.44 (9H, m).
MS: m/z = 446 [M+H] +
1H-NMR (DMSO-d6) δ: 3.87 (1H, d, J = 13.4 Hz), 5.58 (1H, d, J = 7.8 Hz), 5.60 (1H, d, J = 12.6 Hz), 6.81-7.48 (9H, m).
第一工程
化合物592A (22.8 g, 64.1 mmol) と7-(trifluoromethyl)-6,11-dihydrodibenzo [b,e]thiepin- 11-ol (19 g, 64.1 mmol) を1,2-ジクロロエタンに懸濁し、ジクロロ酢酸 (13.2 mL, 160 mmol) を加え、加熱還流下2.5時間攪拌した。 室温まで冷まし、ジクロロメタンで希釈した後、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、乾燥した。溶媒を留去して得られた固体に、酢酸エチル-ジイソプロピルエーテルを加えて固化させ、32g (10%の592Aを含む) の化合物592B を得た。
MS: m/z = 634 [M+H] +.
Rf: 0.56 (AcOEt only).
第二工程
化合物592B (6.0 g, 9.47 mmol) のN,N-dimethylacetoamide (120 mL) 溶液に、2-tert-butylimino2-diethylamino-1,3-dimethylperhydro-1,3,2-diazaphosphorine (16.5 mL, 56.8 mmol) およびparaformaldehyde (569 mg, 18.9 mmol) を加え、室温で3時間攪拌した。続いてTsCl (3.61 g, 18.9 mmol) をゆっくり加え、さらに2時間攪拌した。反応液に1N HCl水溶液を加え、酢酸エチルで2回抽出した。有機層を水、飽和食塩水で洗浄し、乾燥した。溶媒を留去した後、得られた固体をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめヘキサン‐酢酸エチル (2:3, v/v) で溶出し、次いでヘキサン‐酢酸エチル (1:9, v/v)で溶出した。目的の画分を濃縮し、1.74 gの淡黄色固体として化合物592Cを得た。
1H-NMR (CDCl3) δ:1.14 (3H, d, J = 7.2 Hz), 3.96 (1H, d, J = 14.6 Hz), 4.34 (1H, d, J = 13.2 Hz), 4.81 (1H, d, J = 13.2 Hz), 5.17 (1H, s), 5.46 (1H, d, J = 10.8 Hz), 5.56 (1H, d, J = 10.8 Hz), 5.60 (1H, m), 5.82 (1H, d, J = 14.6 Hz), 5.87 (1H, d, J = 7.7 Hz), 6.56 (1H, d, J = 7.2 Hz), 6.73 (1H, m), 7.04-7.11 (2H, m), 7.09 (1H, d, J = 7.7 Hz), 7.29-7.38 (5H, m), 7.56 (2H, m), 7.78 (1H, m).
MS: m/z = 646 [M+H] +.
Rf: 0.65 (AcOEt only).
第三工程
化合物592C (1.7 g, 2.63 mmol) のN,N-dimethylformamide (34 mL) 溶液に、無水LiCl (1.3 g, 31.6 mmol) およびparaformaldehyde (569 mg, 18.9 mmol) を加え、100℃で3時間攪拌した。反応液に1N HCl水溶液を加え、酢酸エチルで2回抽出した。有機層を水、飽和食塩水で洗浄し、乾燥した。溶媒を留去した後、得られた固体をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめクロロホルム‐メタノール (99:1, v/v) で溶出し、次いでクロロホルム‐メタノール (96:4, v/v)で溶出した。目的の画分を濃縮して得られた固体に、酢酸エチル-ジイソプロピルエーテルを加えて固化させ、無色固体の化合物592を1.33 g得た。
1H-NMR (CDCl3) δ:1.21 (3H, d, J = 7.2 Hz), 2.90 (1H, brs), 3.99 (1H, d, J = 14.5 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.24 (1H, s), 5.54 (1H, m), 5.83 (1H, d, J = 7.72 Hz), 5.87 (1H, d, J = 14.5 Hz), 6.70 (1H, d, J = 7.1 Hz), 6.84 (1H, m), 7.07-7.16 (2H, m), 7.13 (1H, d, J = 7.7 Hz), 7.36-7.42 (2H, m), 7.80 (1H, m).
MS: m/z = 556 [M+H] +.
Rf: 0.46 (CHCl3:MeOH=9:1).
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.0 Hz), 4.12 (1H, d, J = 13.7 Hz), 4.49 (1H, d, J = 13.1 Hz), 5.14 (1H, d, J = 13.0 Hz), 5.20 (1H,m), 5.68 (3H, m), 6.74 (1H, d, J = 7.5 Hz), 6.93 (1H, m), 7.12-7.46 (5H, m).
1H-NMR (DMSO-d6) δ: 1.21 (3H, d, J = 7.2 Hz), 4.27 (1H, d, J = 14.1 Hz), 4.61 (1H, d, J = 13.4 Hz), 5.08 (1H, d, J = 13.4 Hz), 5.47 (1H, m), 5.55 (1H, d, J = 15.8 Hz), 5.75 (1H, d, J = 7.6 Hz), 5.83 (1H, s), 6.97 (1H, t, J = 7.8 Hz), 7.06 (1H, dd, J = 7.8, 1.6 Hz), 7.21 (1H, d, J = 7.7 Hz), 7.41 (4H, m).
MS: m/z = 540 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.42 (3H, d, J = 7.2 Hz), 4.08 (1H, d, J = 13.3 Hz), 4.49 (1H, d, J = 13.1 Hz), 5.12 (1H, m), 5.16 (1H, d, J = 13.1 Hz), 5.51 (1H, s), 5.70 (2H, m), 6.93 (1H, t, J = 7.8 Hz), 7.05 (1H, dd, J = 7.9, 1.3 Hz), 7.18 (2H, m), 7.37-7.43 (3H, m).
MS: m/z = 540 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.2 Hz), 3.90 (1H, d, J = 12.8 Hz), 4.42 (1H, d, J = 13.1 Hz), 5.12 (1H, m), 5.14 (1H, d, J = 12.5 Hz), 5.36 (1H, s), 5.58 (1H, d, J = 13.4 Hz), 5.71 (1H, d, J = 7.5 Hz), 6.70 (1H, td, J = 8.3, 2.6 Hz), 6.96-7.06 (2H, m), 7.21 (1H, d, J = 7.6 Hz), 7.26 (2H, d, J = 3.5 Hz), 7.42 (2H, m).
MS: m/z = 506 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.38 (3H, d, J = 7.2 Hz), 4.23 (1H, d, J = 13.9 Hz), 4.52 (1H, d, J = 13.1 Hz), 5.10 (1H, m), 5.12 (1H, d, J = 12.8 Hz), 5.44 (1H, d, J = 14.2 Hz), 5.52 (1H, s), 5.69 (1H, d, J = 7.6 Hz), 6.91 (1H, t, J = 7.8 Hz), 7.04 (1H, d, J = 7.2 Hz), 7.15 (2H, m), 7.28-7.40 (3H, m).
MS: m/z = 540 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.12 (3H, d, J = 7.3 Hz), 4.02 (1H, d, J = 13.1 Hz), 4.50 (1H, d, J = 13.4 Hz), 5.07 (1H, d, J = 13.4 Hz), 5.50 (1H, m), 5.64 (1H, d, J = 13.4 Hz), 5.69 (1H, s), 5.75 (1H, d, J = 7.5 Hz), 6.73 (1H, td, J = 8.5, 2.6 Hz), 7.02 (2H, m), 7.21 (2H,m), 7.35 (1H, d, J = 7.0 Hz), 7.47 (1H, t, J = 6.8 Hz).
MS: m/z = 524 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.10 (3H, d, J = 7.5 Hz), 4.11 (1H, d, J = 13.6 Hz), 4.51 (1H, d, J = 13.4 Hz), 5.05 (1H, d, J = 13.3 Hz), 5.49 (1H, m), 5.67 (3H, m), 6.80 (1H, d, J = 7.8 Hz), 6.92 (1H, dd, J = 13.6, 7.7 Hz), 7.11-7.24 (3H, m), 7.36 (1H, d, J = 7.5 Hz), 7.47 (1H, t, J = 6.9 Hz).
MS: m/z = 524 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.19 (3H, d, J = 7.2 Hz), 3.86 (3H, s), 4.22 (1H, d, J = 13.3 Hz), 4.49 (1H, d, J = 13.1 Hz), 5.06 (1H, d, J = 13.3 Hz), 5.34 (1H, d, J = 13.3 Hz), 5.46 (1H, m), 5.55 (1H, s), 5.65 (1H, d, J = 7.8 Hz), 6.84 (1H, t, J = 7.2 Hz), 6.94 (1H, d, J = 7.8 Hz), 7.14 (6H, m).
MS: m/z = 518 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.09 (3H, d, J = 7.1 Hz), 4.15 (1H, d, J = 13.6 Hz), 4.53 (1H, d, J = 13.6 Hz), 5.07 (1H, d, J = 14.0 Hz), 5.48 (1H, m), 5.70 (3H, m), 6.93 (2H, m), 7.14-7.26 (2H, m), 7.35-7.51 (3H, m).
MS: m/z = 540 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.18 (3H, d, J = 7.0 Hz), 4.03 (1H, d, J = 14.5 Hz), 4.47 (1H, d, J = 13.6 Hz), 5.03 (1H, d, J = 13.1 Hz), 5.46 (1H,m), 5.68-5.74 (3H, m), 6.94 (2H, m), 7.10-7.17 (2H, m), 7.34-7.40 (2H, m), 7.63 (1H, m).
MS: m/z = 540 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.14 (3H, t, J = 6.3 Hz), 3.90 (1H, d, J = 13.6 Hz), 4.39 (1H, d, J = 13.4 Hz), 5.06 (1H, d, J = 13.0 Hz), 5.46 (1H, m), 5.63 (1H, s), 5.64 (1H, d, J = 13.2 Hz), 5.73 (1H, d, J = 7.6 Hz), 6.73 (1H, td, J = 8.3, 2.7 Hz), 6.96-7.04 (2H, m), 7.21 (1H, d, J = 7.6 Hz), 7.27 (1H, dt, J = 10.3, 3.7 Hz), 7.43 (2H, m), 7.53 (1H, d, J = 7.3 Hz).
MS: m/z = 506 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.2 Hz), 4.01 (1H, d, J = 13.4 Hz), 4.47 (1H, d, J = 13.1 Hz), 5.17 (1H, d, J = 12.7 Hz), 5.20 (1H, m), 5.63 (1H, d, J = 13.7 Hz), 5.66 (1H, s), 5.72 (1H, d, J = 7.6 Hz), 6.72 (1H, td, J = 8.3, 2.8 Hz), 6.92 (1H, dd, J = 8.6, 6.0 Hz), 7.04 (1H, dd, J = 10.0, 2.5 Hz), 7.19 (2H, m), 7.30 (1H, d, J = 7.0 Hz), 7.43 (1H, m).
MS: m/z = 524 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.37 (3H, d, J = 7.3 Hz), 3.85 (3H, s), 4.23 (1H, d, J = 13.6 Hz), 4.50 (1H, d, J = 12.8 Hz), 5.13 (1H, d, J = 12.8 Hz), 5.14 (1H, m), 5.28 (1H, s), 5.30 (1H, d, J = 12.4 Hz), 5.63 (1H, d, J = 7.8 Hz), 6.80-7.25 (8H, m).
MS: m/z = 518 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.35 (3H, d, J = 7.5 Hz), 4.13 (1H, d, J = 13.9 Hz), 4.48 (1H, d, J = 13.1 Hz), 5.14 (1H, d, J = 12.5 Hz), 5.20 (1H, m), 5.69 (3H, m), 6.90 (2H, m), 7.18 (2H, m), 7.32 (1H, d, J = 8.1 Hz), 7.43 (2H, m).
MS: m/z = 540 [M+H]+.
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 7.5 Hz), 3.82 (1H, d, J = 13.7 Hz), 4.49 (1H, d, J = 13.1 Hz), 4.91 (1H, d, J = 13.7 Hz), 5.18 (1H, s), 5.51 (1H, m), 5.71 (1H, d, J = 13.1 Hz), 5.88 (1H, d, J = 7.5 Hz), 6.94 (2H, m), 7.14 - 7.52 (6H, m).
MS: m/z = 513.20 [M+H] +.
1H-NMR (CDCl3) δ:1.19 (3H, d, J = 7.3 Hz), 2.00 (1H, brs), 3.65 (1H, d, J = 13.6 Hz), 4.46 (1H, d, J = 13.3 Hz), 4.87 (1H, d, J = 13.3 Hz), 5.17 (1H, s), 5.51 (1H, m), 5.74 (1H, d, J = 13.6 Hz), 5.86 (1H, d, J = 7.7 Hz), 6.68-6.75 (2H, m), 6.98 (1H, dt, J = 2.6, 8.3 Hz), 7.10 (1H, d, J = 7.7 Hz), 7.11 (1H, dd, J = 2.6, 8.3 Hz), 7.17 (1H, dd, J = 5.3, 8.3 Hz), 7.45 (1H, dd, J = 2.6, 6.9 Hz).
MS: m/z = 585 [M+H]+.
1H-NMR (CDCl3) δ: 1.42 (3H, d, J = 7.3 Hz), 2.00 (1H, brs), 3.63 (1H, d, J = 13.6 Hz), 4.54 (1H, d, J = 12.6 Hz), 5.05 (1H, d, J = 12.6 Hz), 5.24 (1H, s), 5.37 (1H, m), 5.77 (1H, d, J = 13.6 Hz), 5.79 (1H, d, J = 7.6 Hz), 6.68 (1H, d, J = 7.3 Hz), 6.73 (1H, dd, J = 2.1, 7.3 Hz), 6.97 (1H, dt, J = 2.6, 8.4 Hz), 7.04 (1H, dd, J = 2.6, 8.4 Hz), 7.16 (1H, d, J = 7.6 Hz), 7.16 (1H, m), 7.42 (1H, dd, J = 2.1, 7.3 Hz).
MS: m/z = 585 [M+H]+.
1H-NMR (CDCl3) δ: 1.19 (3H, d, J = 7.3 Hz), 2.10 (1H, brs), 2.25 (3H, s), 4.21 (1H, d, J = 13.6 Hz), 4.48 (1H, d, 13.3 Hz), 4.89 (1H, d, J = 13.3 Hz), 5.18 (1H, s), 5.37 (1H, dd, J = 2.0, 13.6 Hz), 5.52 (1H, s), 5.80 (1H, d, J = 7.8 Hz), 6.57 (1H, d, J = 7.2 Hz), 6.75 (1H, t, J = 7.6 Hz), 6.97-7.04 (2H, m), 7.12 (1H, d, J = 7.8 Hz), 7.17-7.24 (2H, m).
MS: m/z = 520 [M+H]+.
第一工程
化合物624A (14.7g, 87.0 mmol) とmethyl 2-(bromomethyl)benzoate (20.0 g, 87.0 mmol) をDMF (200 ml) に溶解し、炭酸セシウム (42.7 g, 131 mmol) を加えて室温で2時間攪拌した。反応液をろ過し、ろ液に酢酸エチルを加え、水と飽和炭酸水素ナトリウム水溶液で洗った。有機層を硫酸ナトリウムで乾燥した後、溶媒を減圧留去した。得られた固体にヘキサンを加えて粉砕し、ろ取することによって26.2 gの白色固体624Bを得た。
1H-NMR (CDCl3) δ: 3.89 (6H, s), 4.64 (2H, s), 7.14-7.52 (6H, m), 7.94 (2H, t, J = 7.1 Hz).
第二工程
化合物624B (26.2 g, 83.0 mmol) をメタノール (200 ml) とTHF (200 ml) に溶解し、室温で2規定水酸化ナトリウム水溶液 (207 ml, 414 mmol) を加えて室温で3日間攪拌した。反応液に希塩酸を加えて酸性にし、生じた白色沈殿をろ取して乾燥することによって23.1 gの白色固体624Cを得た。
1H-NMR (DMSO-d6) δ: 4.58 (2H, s), 7.20 (1H, td, J = 7.2, 1.3 Hz), 7.35-7.54 (5H, m), 7.85 (2H, t, J = 6.9 Hz).
第三工程
化合物624C (2.66 g, 9.23 mmol) にポリリン酸 (30 g) を加えて120℃で3時間攪拌した。反応液を室温まで冷却した後に水を加え、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留居することによって2.37 gの薄茶色固体624Dを得た。
1H-NMR (CDCl3) δ: 4.05 (2H, s), 7.27 (1H, d, J = 7.4 Hz), 7.36-7.42 (2H, m), 7.52 (1H, td, J = 7.6, 1.3 Hz), 7.62 (1H, dd, J = 7.5, 1.1 Hz), 8.23 (1H, dd, J = 7.6, 1.7 Hz), 8.52 (1H, dd, J = 8.1, 1.7 Hz).
第四工程
化合物624D (96.0 mg, 0.355 mmol) にトルエン (2 ml) を加え、DMF (0.028 ml) と塩化チオニル (0.131ml, 1.80 mmol) を加えてから130℃で1時間攪拌した。溶媒を減圧留去した後、メタノール (1 ml) とTHF (1 ml) に溶解し、水素化ホウ素ナトリウム (100 mg, 2.64 mmol) を加えて室温で1時間攪拌した。反応液に塩化アンモニウム水溶液を加え、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (1:1, v/v) で溶出することによって精製し、41 mgの白色固体624Eを得た。
1H-NMR (CDCl3) δ: 2.09 (1H, t, J = 6.3 Hz), 2.79 (1H, d, J = 3.7 Hz), 4.43 (2H, d, J = 1.3 Hz), 4.76 (2H, m), 6.33 (1H, d, J = 3.0 Hz), 7.18-7.34 (5H, m), 7.52-7.56 (2H, m).
第五工程
化合物624E (40.0 mg, 0.155 mmol) をジクロロメタン (2 ml) に溶解し、ピリジン (61.2 mg, 0.774 mmol) と塩化ベンゾイル (21.8 mg, 0.155 mmol) を加えて室温で2時間攪拌した。反応液に水を加え、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、n-ヘキサン-酢酸エチル (1:1, v/v) で溶出することによって精製し、30 mgの白色固体624Fを得た。
1H-NMR (CDCl3) δ: 2.83 (1H, d, J = 3.4 Hz), 4.27 (1H, d, J = 13.9 Hz), 4.41 (1H, d, J = 14.0 Hz), 5.42 (2H, s), 6.35 (1H, d, J = 2.9 Hz), 7.12-7.58 (5H, m), 8.06 (2H, dd, J = 8.2, 1.4 Hz).
MS: m/z = 518 [M+H]+.
第一工程
窒素気流下、化合物625A (700 mg, 2.29 mmol) のトルエン (3.3 mL) 溶液に2-ピロリドン (264 μL, 3.44 mmol)、N,N'-dimethylethylene diamine (49μL, 0.46 mmol)、ヨウ化銅 (87 mg, 0.46 mmol)、炭酸カリウム (634 mg, 4.59 mmol)を加え、110℃で8時間攪拌した。室温まで冷ました後、反応溶液をそのままシリカゲルカラムクロマトグラフィーに付し、精製した。クロロホルム‐メタノール (19:1, v/v) で溶出し、目的の画分を濃縮すると灰白色固体として620mgの化合物625Bを得た。
MS: m/z = 310 [M+H] +.
Rf: 0.50 (CHCl3:MeOH=19:1).
第二工程
氷冷したNaBH4 (227 mg, 6.0 mmol) のMeOH (4 mL) 溶液に化合物625B (620 mg, 2.0 mmol) のTHF (8 mL) 溶液を加え、1時間攪拌した。水を加え、酢酸エチルで2回抽出した後、有機層を飽和食塩水で洗浄し、乾燥した。溶媒を留去して得られた固体をシリカゲルカラムクロマトグラフィーに付し、精製した。クロロホルム‐メタノール (19:1, v/v) で溶出し、目的の画分を濃縮すると無色固体として621mgの化合物625Cを得た。
1H-NMR (CDCl3) δ: 2.26 (2H, m, J = 6.9, 7.2, 8.0 Hz), 2.61 (2H, t, J = 8.0 Hz), 2.89 (1H, d, J = 2.9 Hz), 3.77 (2H, m, J = 6.9, 7.2, 9.7 Hz), 4.24 (1H, brs), 6.13 (1H, s), 7.02-7.14 (4H, m), 7.29 (1H, t, J = 7.8 Hz), 7.46 (1H, d, J = 7.2 Hz), 7.56 (1H, d, J = 6.0 Hz).
Rf: 0.30 (CHCl3:MeOH=19:1).
1H-NMR (CDCl3) δ:1.18 (3H, d, J = 7.32), 2.33 (2H, m), 2.65 (2H, t, J = 8.1 Hz), 3.65 (1H, d, J = 14.2 Hz), 3.77-3.95 (2H, m), 4.60 (1H, d, J = 13.4 Hz), 4.87 (1H, d, J = 13.4 Hz), 5.16 (1H, s), 5.48 (1H, m), 5.50 (1H, d, J = 14.2 Hz), 5.82 (1H, d, J = 7.7 Hz), 6.70 (1H, dd, J = 1.2, 7.6 Hz), 6.83 (1H, dt, J = 7.6, 10.2 Hz), 7.04-7.17 (4H, m), 7.13 (1H, d, J = 7.7 Hz), 7.31 (1H, d, J = 5.3 Hz), 7.31 (1H, d, J = 3.7 Hz).
MS: m/z = 571 [M+H] +.
第一工程
化合物626A (20.0 g, 114 mmol) とphenylmethanethiol (14.19 g, 114 mmol) のN.N-ジメチルホルムアミド (200 mL) 溶液を1-3℃に冷却し、同温度を保ちながら t-ブトキシカリウム (14.11 g, 126 mmol)を 20分間かけて投入した。反応液を同温度で30分間撹拌後、徐々に室温まで昇温し同温度で2時間攪拌した。氷水を加え、酢酸エチルで抽出した。抽出液を3回水洗し、飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物にジイソプロピルエーテルを加えて固化させ、 15.0 g の化合物626Bを得た。
1H-NMR (CDCl3) δ: 4.16 (2H, s), 7.19-7.41 (8H, m), 10.61 (1H, s).
MS: m/z = 263 [M+H] +.
第二工程
化合物626B (6.9 g, 26.3 mmol) を 1.4-ジオキサン (60 mL) に懸濁し、SULFAMIC ACID (5.61 g, 57.8 mmol) を加えて1-3℃に冷却した。反応液に次亜塩素酸ナトリウム(5.23 g, 57.8 mmol)の水溶液(20ml)を同温度に保ちながら10分かけて滴下した。反応液を同温度で30分間撹拌後、徐々に室温まで昇温し同温度で2時間攪拌した。反応液に氷水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物にジイソプロピルエーテルを加えて固化させ、 7.1 g の化合物626Cを得た。
1H-NMR (DMSO-d6) δ: 3.99 (1H, d, J = 11.2Hz ), 4.41 (1H, d, J = 11.2Hz ), 7.11 (2H, brs), 7.33 (3H, brs), 7.49 (1H, d, J = 7.2Hz ), 7.60 (1H, t, J = 7.2Hz ), 7.73 (1H, d, J = 7.2Hz ), 10.4 (1H, brs ).
MS: m/z = 295 [M+H] +.
第三工程
化合物626C (8.0 g, 27.1 mmol) を アセトニトリル (40 mL) に懸濁し、ヨウ化ナトリウム (12.1 g, 81.0 mmol) を加えた。反応液にBF3 エーテレート(5.16 ml, 40.7 mmol)を一気に投入し、同温度で30分間撹拌した。反応液に氷水、10%亜硫酸ナトリウム水溶液を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物にジイソプロピルエーテルを加えて固化させ、 5.0 g の化合物626Dを得た。
1H-NMR (CDCl3) δ: 4.11 (2H, s), 7.22-7.34 (8H, m).
MS: m/z = 277 [M-H] +.
第四工程
120℃に熱したポリリン酸20gに、化合物626D (2.5 g, 9.0 mmol) を 60分かけて投入した。その後、同温度で6時間撹拌した。反応液を室温まで冷却後、氷水に空けて酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに n-ヘキサンで溶出し、次いでn-ヘキサン-酢酸エチル (1:1, v/v) で溶出した。目的の画分を濃縮し、ヘキサンを加えて固化させ、白色固体として 710mg の化合物626Eを得た。
1H-NMR (CDCl3) δ: 4.05 (2H, s), 7.20-7.25 (2H, m), 7.32-7.37 (2H, m), 7.46 (1H, d, J = 7.2Hz ), 7.59 (1H, d, J = 7.2Hz ), 8.16 (1H, d, J = 7.2Hz ).
MS: m/z = 261 [M-H] +.
第五工程
化合物626E (730 mg, 2.80 mmol) のテトラヒドロフラン (10 mL)溶液を1-3℃に冷却し、同温度を保ちながら リチウムボロハイドライド (61 mg, 2.80 mmol)を投入した。同温度で30分間撹拌した。反応液に氷水、10%塩化アンモニウム水溶液を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物にジイソプロピルエーテルを加えて固化させ、 530 mg の化合物626Fを得た。
1H-NMR (CDCl3) δ: 2.48 (1H, d, J = 5.3Hz ), 4.31 (1H, d, J = 11.2Hz ), 4.48 (1H, d, J = 11.2Hz ), 6.14 (1H, d, J = 5.3Hz ), 7.03-7.46 (7H, m).
1H-NMR (CDCl3) δ: 1.14 (3H, d, J = 6.9Hz ), 3.92 (1H, d, J = 7.8Hz ), 4.40 (1H, d, J = 7.8Hz ), 5.08 (1H, d, J = 7.8Hz ), 5.39-5.52 (1H, m), 5.60-5.65 (2H, m), 5.76 (1H, d, J = 6.9Hz ), 6.96-7.01 (1H, m), 7.17-7.55 (7H, m), 8.31 (1H, s).
1H-NMR (CDCl3) δ:1.47-1.58 (1H, m), 1.62-1.75 (2H, m), 1.82-1.92 (1H, m), 2.83-2.91 (1H, m), 3.00-3.11 (1H, m), 3.15 (3H, s), 3.18-3,24 (1H, m), 3.47-3.72 (2H, m), 4.08-4.23 (2H, m), 4.36-4.54 (2H, m), 4.92 (1H, s), 5.79 (1H, d, J = 7.5 Hz), 6.60-6.68 (2H, m), 6.93 (1H, t, J = 7.2 Hz), 7.10-7.39 (6H, m).
1H-NMR (CDCl3) δ:1.47-1.56 (1H, m), 1.59-1.72 (2H, m), 1.81-1.91 (1H, m), 2.83 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 14.7 Hz), 3.00-3.11 (1H, m), 3.16 (3H, s), 3.19-3.26 (2H, m), 3.47-3.57 (1H, m), 3.77-3.91 (1H, m), 4.16-4.34 (2H, m), 4.40-4.45 (1H, m), 4.96 (1H, s), 5.86 (1H, d, J = 7.8 Hz), 6.63-6.71 (2H, m), 6.82-6.85 (1H, m), 6.91-6.98 (1H, m), 7.00-7.04 (1H, m), 7.11-7.15 (1H, m).
第一工程
化合物646A (100 mg, 0.33 mmol) をアセトン (1 mL) - トルエン (1 mL) に溶解し、酢酸 (0.02mL, 0.33 mmol)を加えて2時間,加熱還流した。反応液を減圧下に濃縮後、残留物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (10:1, v/v) で溶出した。目的の画分を濃縮すると油状物として 117 mg の化合物646Bを得た。
1H-NMR (CDCl3) δ: 1.10 (6H, d, J = 6.6 Hz), 1.95 (3H, s), 2.17 (3H, s), 4.01 (1H, q, J = 14.3 Hz), 5.30 (2H, s), 6.36 (1H, br s), 6.45 (1H, d, J = 7.6 Hz), 6.92 (1H, d, J = 7.6 Hz), 7.29-7.40 (5H, m).
第二工程
化合物646BのDMF (170 mL) 溶液を1-3℃に氷冷し、臭化ベンジル (0.11 mL, 0.92 mmol) および炭酸セシウム( 301 mg,0.92 mmol) を加えた。 反応液を室温で3時間撹拌後、酢酸エチル-水に分配した。酢酸エチル層を分離し、水層を酢酸エチルで1回抽出した。合わせた抽出液を順次、水2回、飽和食塩水で洗浄後、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (10:1, v/v) で溶出した。目的の画分を濃縮すると油状物として 10 mg の化合物646Cを得た。
MS: m/z = 432 [M+H] +
第三工程
化合物646C (10 mg, 0.023 mmol) を MeOH (0.5 mL) に溶解し、10% Pd-C (2.5 mg) を加え、水素気流下、接触還元反応に付した。触媒を濾過により除去し、濾液を濃縮した。得られた残渣をジオールシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (10:1, v/v) で溶出した。目的の画分を濃縮すると油状物として 3.4 mg の化合物646を得た。
MS: m/z = 342 [M+H] +.
1H-NMR (DMSO-d6) δ: 1.03-1.30 (3H, m), 4.51 (1H, t, J = 14.41 Hz), 5.12-5.55 (4H, m), 7.18-7.46 (9H, m), 7.58-7.69 (2H, m).
MS: m/z = 444.15 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.12-1.35 (2H, m), 4.46-4.55 (1H, m), 5.24-5.61 (3H, m), 6.33-6.42 (1H, m), 7.23-7.67 (8H, m), 8.22-8.29 (1H, m).
MS: m/z = 512.15 [M+H]+.
カラム:ACQUITY UPLC登録商標BEH C18 (1.7μm i.d. 2.1x50mm) (Waters)
流速:0.8 mL/分
UV検出波長:254nm
移動相:[A]は0.1%ギ酸含有水溶液、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジェント:3.5分間で10%-100%溶媒[B]のリニアグラジエントを行い、0.5分間、100%溶媒[B]を維持した。
1H-NMR (CDCl3) δ: 1.45 (3H, d, J = 7.4 Hz), 3.69 (1H, d, J = 13.7 Hz), 4.52 (1H, d, J = 12.6 Hz), 5.14-5.20 (2H, m), 5.32-5.45 (1H, m), 5.64 (1H, d, J = 13.5 Hz), 5.74 (1H, d, J = 7.7 Hz), 6.56 (1H, d, J = 7.7 Hz), 6.81 (1H, ddd, J = 7.8, 7.8, 3.9 Hz), 6.87-6.96 (2H, m), 7.11 (1H, ddd, J = 8.2, 8.2, 2.6 Hz), 7.17 (1H, d, J = 7.7 Hz), 7.32 (1H, dd, J = 8.4, 5.4 Hz).
MS: m/z = 524 [M+H]+.
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 7.4 Hz), 3.62 (1H, d, J = 13.5 Hz), 4.44 (1H, d, J = 12.9 Hz), 4.86 (1H, d, J = 13.2 Hz), 5.43-5.56 (1H, m), 5.68 (1H, d, J = 13.5 Hz), 5.83 (1H, d, J = 7.7 Hz), 5.94 (1H, s), 6.81-6.91 (2H, m), 7.07-7.18 (3H, m), 7.26 (1H, t, J = 7.7 Hz), 7.34 (1H, d, J = 7.4 Hz), 7.55 (1H, d, J = 8.0 Hz).
MS: m/z = 566, 568 [M+H]+.
1H-NMR (CDCl3) δ: 1.44 (3H, d, J = 7.4 Hz), 4.07 (1H, d, J = 14.6 Hz), 4.52 (1H, d, J = 12.6 Hz), 5.13 (1H, d, J = 12.6 Hz), 5.34-5.47 (2H, m), 5.79 (1H, d, J = 7.7 Hz), 5.93 (1H, d, J = 14.6 Hz), 6.58 (1H, d, J = 7.7 Hz), 6.82 (1H, ddd, J = 7.9, 7.9, 5.6 Hz), 6.89-6.97 (1H, m), 7.14 (1H, d, J = 7.7 Hz), 7.40 (2H, d, J = 5.2 Hz), 7.76-7.83 (1H, m).
MS: m/z = 573 [M+H]+.
1H-NMR (CDCl3) δ: 1.22 (3H, d, J = 7.4 Hz), 3.72 (1H, d, J = 13.7 Hz), 4.48 (1H, d, J = 13.2 Hz), 4.90 (1H, d, J = 13.2 Hz), 5.13 (1H, s), 5.50-5.58 (1H, m), 5.61 (1H, d, J = 14.0 Hz), 5.86 (1H, d, J = 7.7 Hz), 6.56 (1H, d, J = 7.7 Hz), 6.84 (1H, ddd, J = 7.9, 7.9, 5.6 Hz), 6.91-7.00 (2H, m), 7.11-7.19 (2H, m), 7.40 (1H, dd, J = 8.4, 5.4 Hz).
MS: m/z = 524 [M+H]+.
1H-NMR (CDCl3) δ: 1.45 (3H, d, J = 7.3 Hz), 3.97 (1H, d, J = 14.5 Hz), 4.53 (1H, d, J = 12.7 Hz), 5.12 (1H, d, J = 12.7 Hz), 5.32 (1H, s), 5.35-5.49 (1H, m), 5.76 (1H, d, J = 7.6 Hz), 5.90 (1H, d, J = 14.5 Hz), 6.73 (1H, d, J = 7.6 Hz), 6.78-6.86 (1H, m), 7.03-7.14 (2H, m), 7.19 (1H, dd, J = 7.7, 0.8 Hz), 7.36-7.43 (2H, m), 7.77 (1H, dd, J = 6.3, 2.9 Hz).
MS: m/z = 556 [M+H]+.
1H-NMR (CDCl3) δ: 1.21 (3H, d, J = 7.1 Hz), 3.74 (1H, d, J = 13.7 Hz), 4.47 (1H, d, J = 12.9 Hz), 4.90 (1H, d, J = 13.2 Hz), 5.13 (1H, s), 5.47-5.60 (1H, m), 5.65 (1H, d, J = 13.7 Hz), 5.86 (1H, d, J = 7.7 Hz), 6.68 (1H, d, J = 7.7 Hz), 6.81 (1H, dd, J = 7.8, 7.8 Hz), 6.94 (1H, dd, J = 8.5, 2.5 Hz), 7.10-7.20 (2H, m), 7.27-7.31 (1H, m), 7.39 (1H, dd, J = 8.4, 5.4 Hz).
MS: m/z = 540 [M+H]+.
1H-NMR (CDCl3) δ: 1.45 (3H, d, J = 7.1 Hz), 4.31 (1H, d, J = 14.0 Hz), 4.53 (1H, d, J = 12.6 Hz), 5.15 (1H, d, J = 12.6 Hz), 5.21 (1H, s), 5.31-5.45 (1H, m), 5.64 (1H, d, J = 14.0 Hz), 5.80 (1H, d, J = 7.7 Hz), 6.51 (1H, ddd, J = 8.0, 8.0, 2.6 Hz), 6.70 (1H, dd, J = 8.4, 5.6 Hz), 6.80 (1H, dd, J = 9.3, 2.5 Hz), 7.10 (1H, d, J = 7.7 Hz), 7.15-7.25 (2H, m), 7.51 (1H, d, J = 8.0 Hz).
MS: m/z = 540 [M+H]+.
1H-NMR (CDCl3) δ: 1.20 (3H, d, J = 7.4 Hz), 4.09 (1H, d, J = 14.6 Hz), 4.44 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.5 Hz), 5.32 (1H, s), 5.48-5.60 (1H, m), 5.85-5.95 (2H, m), 6.56 (1H, d, J = 7.7 Hz), 6.85 (1H, ddd, J = 8.0, 8.0, 5.6 Hz), 6.92-7.00 (1H, m), 7.11 (1H, d, J = 7.7 Hz), 7.39-7.44 (2H, m), 7.80-7.87 (1H, m).
MS: m/z = 574 [M+H]+.
1H-NMR (CDCl3) δ: 1.21 (3H, d, J = 7.1 Hz), 4.33 (1H, d, J = 14.0 Hz), 4.48 (1H, d, J = 13.2 Hz), 4.90 (1H, d, J = 12.6 Hz), 5.16 (1H, s), 5.46-5.59 (1H, m), 5.62 (1H, d, J = 13.7 Hz), 5.90 (1H, d, J = 7.7 Hz), 6.54 (1H, ddd, J = 7.7, 7.7, 2.5 Hz), 6.69 (1H, dd, J = 8.7, 5.6 Hz), 6.84 (1H, dd, J = 9.3, 2.5 Hz), 7.11 (1H, d, J = 7.7 Hz), 7.15 (1H, d, J = 7.7 Hz), 7.23 (1H, dd, J = 7.8, 7.8 Hz), 7.55 (1H, d, J = 8.0 Hz).
MS: m/z = 540 [M+H]+.
1H-NMR (CDCl3) δ: 1.45 (3H, d, J = 7.1 Hz), 3.71 (1H, d, J = 13.7 Hz), 4.52 (1H, d, J = 12.6 Hz), 5.13-5.19 (2H, m), 5.32-5.45 (1H, m), 5.68 (1H, d, J = 13.7 Hz), 5.74 (1H, d, J = 7.7 Hz), 6.68 (1H, dd, J = 7.7, 1.4 Hz), 6.78 (1H, dd, J = 7.8, 7.8 Hz), 6.92 (1H, d, J = 9.1 Hz), 7.07-7.18 (2H, m), 7.24 (1H, dd, J = 8.0, 1.4 Hz), 7.32 (1H, dd, J = 8.2, 5.5 Hz).
MS: m/z = 540 [M+H]+.
1H-NMR (CDCl3) δ: 0.92 (3H, d, J = 7.1 Hz), 2.35 (3H, s), 3.60 (1H, d, J = 13.5 Hz), 4.49 (1H, d, J = 12.9 Hz), 4.82 (1H, d, J = 12.4 Hz), 5.39-5.51 (2H, m), 5.60 (1H, d, J = 13.5 Hz), 5.85 (1H, d, J = 7.7 Hz), 6.69 (1H, d, J = 7.4 Hz), 6.79-6.87 (1H, m), 7.05 (1H, d, J = 7.7 Hz), 7.10-7.15 (3H, m), 7.22 (1H, d, J = 7.1 Hz), 7.27-7.33 (1H, m).
MS: m/z = 502 [M+H]+.
工程1
化合物i-1(50.0g、136mmol)をジクロロメタン(500mL)に溶解し、Boc2O(34.8mL、150mmol)、DMAP(831mg、6.81mmol)、を加え、室温で2時間撹拌した。その後、NBS(29.1g、163mmol)を加えてさらに室温で終夜撹拌した。
有機層を水と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-2(64.0g、収率86%)を得た。
1H-NMR (DMSO-d6) δ: 8.62 (s, 1H), 7.58 (t, J = 8.6 Hz, 2H), 7.38 (br s, 3H), 5.44 (br s, 1H), 5.23 (d, J = 10.6 Hz, 2H), 5.14 (d, J = 11.9 Hz, 1H), 3.40 (s, 1H), 1.47-1.43 (m, 12H).
工程2
化合物i-2(64.0g、117mmol)のメタノール(600mL)溶液を氷水で0℃に冷却した。これに2mol/L水酸化ナトリウム水溶液(76mL、152mmol)を加え、0℃で1時間撹拌した。氷浴下、2mol/L塩酸で中和した後、析出した固体を濾別した。水で洗浄後、乾燥させ化合物i-3(40.5g、収率78%)を得た。
1H-NMR (DMSO-d6) δ: 8.38 (s, 1H), 7.62 (t, J = 6.6 Hz, 1H), 7.53 (d, J = 7.1 Hz, 2H), 7.35-7.33 (m, 3H), 5.29 (br s, 1H), 5.11 (q, J = 12.5 Hz, 2H), 4.75 (t, J = 6.9 Hz, 1H), 4.65 (t, J = 11.1 Hz, 1H), 1.45 (d, J = 7.1 Hz, 3H).
工程1
窒素雰囲気下、化合物i-4(6.60g、9.55mmol)にジオキサン(66mL)、Pd2(PPh3)2(670mg、0.955mmol)、トリブチル(1―エトキシ―ビニル)チン(4.84mL、14.3mmol)を加えて、2時間半加熱還流した。室温まで冷却した後、1mol/L塩酸(20mL)を加えて室温で20分撹拌した。水を加え、酢酸エチルで抽出した。有機層を水と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-5(5.50g、収率88%)を得た。
1H-NMR (DMSO-d6) δ: 7.75 (s, 1H), 7.59 (d, J = 6.6 Hz, 2H), 7.50 (s, 1H), 7.42-7.39 (m, 5H), 7.11 (s, 2H), 6.80 (s, 1H), 6.54 (d, J = 7.1 Hz, 1H), 5.74 (s, 1H), 5.64 (d, J = 13.4 Hz, 1H), 5.57 (br s, 1H), 5.45 (d, J = 10.6 Hz, 1H), 5.25 (d, J = 10.6 Hz, 1H), 5.12 (d, J = 13.6 Hz, 1H), 4.52 (d, J = 13.6 Hz, 1H), 3.96 (d, J = 13.6 Hz, 1H), 2.37 (s, 3H), 1.02 (d, J = 6.3 Hz, 3H).
工程1
化合物i-6(40mg、0.058mmol)にジメチルアセトアミド(0.5mL)、シアン化銅(I)(52mg、0.579mmol)を加え、封管にて26時間140℃で加熱撹拌した。1mol/L塩酸(20mL)を加え、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣を分取型LCMS(メソッド14)により精製して化合物i-7(8.0mg、収率25%)を得た。
1H-NMR (DMSO-d6) δ: 7.58 (s, 1H), 7.51 (s, 1H), 7.46 (s, 2H), 7.21 (br s, 2H), 6.92-6.88 (m, 2H), 5.86 (s, 1H), 5.65 (d, J = 12.6 Hz, 1H), 5.48 (br s, 1H), 4.95 (br s, 1H), 4.49 (br s, 1H), 3.97 (d, J = 13.4 Hz, 2H), 1.02 (s, 3H).
工程1
化合物i-8(110mg、0.164mmol)にメタノール(1mL)、テトラヒドロフラン(1mL)、2mol/L水酸化ナトリウム水溶液(0.246mL、0.492mmol)を加えて60℃で3時間撹拌した後、さらに2mol/L水酸化ナトリウム水溶液(0.164mL、0.328mmol)を加えて60℃で4時間攪拌した。2mol/L塩酸で中和した後、クロロホルムで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し化合物i-9(91mg、98%)を得た。
MS: m/z = 566 [M+H]+. RT=2.30 min.
工程2
化合物i-9(20mg、0.035mmol)にジメチルホルムアミド(0.5mL)、2mol/Lアンモニア-メタノール溶液(0.053mL、0.106mmol)、[4-(4、6-ジメトキシ-1、3、5-トリアジン-2-イル)-4-メチルモルホリニウムクロライド](29.3mg、0.106mmol)を加えて室温で終夜撹拌した。その後、28%ナトリウムメトキシド-メタノール溶液(34.1mg、0.177mmol)を加えてさらに室温で1時間撹拌した。0.5mol/L塩酸を加えた後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣を分取型LCMS(メソッド14)により精製して化合物i-10(4.0mg、収率20%)を得た。
MS: m/z = 565 [M+H]+. RT=2.03 min.
工程1
窒素雰囲気下、化合物i-11(1.00g、3.28mmol)にテトラヒドロフラン(25mL)、[1、1´-ビス(ジ-tert-ブチルホスフィノ)フェロセン]パラジウム(II)ジクロリド(214mg、4.91mmol)、ポタシウムシクロプロピルトリフルオロボレート(727mg、4.91mmol)、2mol/L炭酸ナトリウム水溶液(4.91mL、9.83mmol)を加えて、20時間加熱還流した。水を加えた後、酢酸エチルで抽出した。有機層を水と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-クロロホルム)により精製して化合物i-12(350mg、収率24%)を得た。
MS: m/z = 267 [M+H]+. RT=2.46 min.
工程1
化合物i-13(200mg、0.305mmol)にテトラヒドロフラン(3mL)、ビスピナコレートジボラン(232mg、0.914mmol)、PdCl2(dppf)・CH2Cl2(24.9mg、0.030mmol)、酢酸カリウム(90mg、0.914mmol)を加え、80℃で3時間半撹拌した。室温まで冷却後、セライトろ過を行い、溶媒を減圧留去した。1mol/L塩酸を加えた後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。得られた茶色個体にジメチルアセトアミド(2mL)、リチウムクロライド(64.5mg、1.53mmol)を加えて100℃で4時間撹拌した。室温まで冷却後、1mol/L塩酸を加え酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣を分取型LCMS(メソッド14)により精製して化合物i-14(59mg、収率37%)を得た。
MS: m/z = 532 [M+H]+. RT=2.02 min.
工程1
化合物i-15(20mg、0.030mmol)にテトラヒドロフラン(0.5mL)、PEPPSI-IPr(2.07mg、3.05μmol)、2mol/Lメチルジンククロライド-テトラヒドロフラン溶液(0.076mL、0.152mmol)を加えて窒素気流下、封管で100℃で3時間撹拌した。室温まで冷却した後、2mol/L塩酸を加え酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(DIOL、ヘキサン-酢酸エチル)により精製して化合物i-16(4.0mg、収率26%)を得た。
1H-NMR (DMSO-d6) δ: 7.54 (s, 1H), 7.46 (s, 1H), 7.41 (s, 1H), 7.25 (s, 2H), 7.08 (s, 2H), 6.91 (s, 1H), 6.81 (s, 1H), 5.68 (d, J = 13.1 Hz, 1H), 5.56 (s, 1H), 5.48 (s, 1H), 5.05 (d, J = 13.6 Hz, 1H), 4.41 (d, J = 12.6 Hz, 1H), 3.87 (d, J = 12.9 Hz, 1H), 1.52 (s, 3H), 1.18 (d, J = 6.3 Hz, 3H).
工程1
化合物i-17(50mg、0.076mmol)をテトラヒドロフラン(1mL)に溶解させ、ドライアイス-アセトン下、-78℃に冷却した。これに1.06mol/L水素化ジイソブチルアルミニウム-ヘキサン溶液(0.108mL、0.115mmol)を加え、-78℃で1時間撹拌した。飽和ロッシェル塩水溶液を加え、室温で20分間撹拌した後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-18(35mg、収率70%)を得た。
1H-NMR (DMSO-d6) δ: 7.53 (s, 3H), 7.46 (s, 2H), 7.36 (d, J = 7.3 Hz, 3H), 7.29 (s, 1H), 7.15 (s, 2H), 6.80 (br s, 1H), 6.47 (d, J = 7.1 Hz, 1H), 5.70 (s, 1H), 5.61 (d, J = 14.4 Hz, 1H), 5.53 (br s, 1H), 5.33 (d, J = 11.1 Hz, 1H), 5.13 (d, J = 11.4 Hz, 1H), 5.01 (d, J = 12.9 Hz, 1H), 4.92 (s, 1H), 4.57 (s, 1H), 4.47 (d, J = 13.9 Hz, 1H), 3.98 (d, J = 13.9 Hz, 1H), 0.98 (d, J = 6.8 Hz, 3H), 0.71 (d, J = 5.3 Hz, 3H).
工程1
化合物i-19(560mg、1.43mmol)にトルエン(250mL)、酢酸(25mL)、トシル酸1水和物(54.4mg、0.286mmol)を加えて16時間加熱還流した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-20(210mg、収率45%)を得た。
1H-NMR (DMSO-d6) δ: 7.56 (d, J = 6.8 Hz, 2H), 7.36-7.27 (m, 5H), 6.23 (d, J = 7.3 Hz, 1H), 5.06 (s, 2H), 4.79 (t, J = 11.7 Hz, 1H), 4.14 (d, J = 13.4 Hz, 1H), 4.02 (br s, 2H), 3.43 (t, J = 13.0 Hz, 1H), 3.13 (t, J = 10.5 Hz, 1H), 2.95 (t, J = 11.1 Hz, 1H).
工程1
化合物i-21(30.0g、104mmol)をメタノール(450mL)に懸濁して、65℃に加熱して溶解した。二酸化マンガン(75g、863mmol)を加え、65℃で2時間攪拌した。固体をろ過除去し、濾液を減圧留去した。得られた残渣にテトラヒドロフラン-ジイソプロピルエーテルを加えて固体を析出させた後、ろ取することにより化合物i-22(27.55g、収率93%)を得た。
1H-NMR (CDCl3) δ: 3.99 (s, 3H), 5.43 (s, 2H), 7.27-7.45 (m, 6H), 8.62 (s, 1H), 10.05 (s, 1H).
工程2
亜塩素酸ナトリウム(34.6g、383mmol)を水(150mL)に溶解し、氷水で0℃に冷却した。これにアミド硫酸(37.2g、383mmol)を加え40分攪拌した。別のフラスコにて化合物i-22(27.5g、96mmol)をテトラヒドロフラン(450mL)とDMF(45mL)に溶解し、氷水で0℃に冷却した。これに上記調整した水溶液を滴下し、0℃で1時間攪拌した。溶媒を減圧濃縮し、水とジイソプロピルエーテルを加えて固体をろ取することにより化合物i-23(19.49g、収率67%)を得た。
1H-NMR (DMSO-d6) δ: 3.74 (s, 3H), 5.11 (s, 2H), 7.27-7.40 (m, 4H), 7.44-7.50 (m, 2H), 8.11 (s, 1H).
工程3
化合物i-23(14.0g、46.2mmol)をDMF(140mL)に溶解し、氷冷した。(R)-1,1,1-トリフルオロイソプロピルアミン塩酸塩(10.36g、69.2mmol)、EDC(11.50g、60.0mmol)、HOBt(8.11g、60.0mmol)、トリエチルアミン(19.2mL、138mmol)を加え、室温で4時間攪拌した。反応液に水を加えて反応を停止した。酢酸エチルで抽出し、有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物i-24(12.87g、収率70%)を得た。
MS: m/z = 399.1 [M+H] +.
工程4
化合物i-24(12.55g、31.5mmol)をDMF(130mL)に溶解した。炭酸カリウム(21.77g、158mmol)を加えて15分攪拌した。2,4-ジニトリフェニルヒドロキシルアミン(9.41g、47.3mmol)を加えて3時間攪拌した。反応液にクロロホルムを加えて析出した固体をろ過除去し、濾液を減圧留去した。得られたDMF溶液にパラホルムアルデヒド(851mg、28.3mmol)、酢酸(0.09mL、1.58mmol)を加え、110℃で3時間半攪拌した。放冷して溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物i-25(8.15g、収率61%)を得た。
1H-NMR (CDCl3) δ: 1.32 (d, J = 7.2Hz, 3H), 3.79 (s, 3H), 4.39-4.54 (m, 2H), 5.14 (d, J = 10.2Hz, 1H), 5.24 (m, 1H), 5.28 (d, J = 10.2Hz, 1H), 6.54 (m, 1H), 7.25-7.33 (m, 3H), 7.45-7.52 (m, 2H), 8.18 (s, 1H).
工程1
化合物i-25(1.5g、3.5mmol)をジクロロメタンに懸濁した。Boc2O(0.86mL、3.7mmol)、DMAP(43mg、0.35mmol)を加えて、室温で1時間攪拌した。水を加えてクロロホルムで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-26(1.59g、収率86%)を得た。
1H-NMR (CDCl3) δ: 1.33-1.50 (m, 12H), 3.91 (s, 3H), 4.71 (m, 0.6H), 4.88 (m, 0.4H), 5.13-5.60 (m, 4H), 7.27-7.37 (m, 3H), 7.49-7.66 (m, 2H), 8.16 (s, 1H).
工程2
窒素雰囲気下、化合物i-26(1.5g、2.9mmol)をトルエン(30mL)に懸濁し、ドライアイス-アセトンで-78℃に冷却した。これにDIBAL-ヘキサン溶液(3.0mL、3.1mmol)を滴下し、-78℃で1時間攪拌した。反応液に酢酸エチルを加えて反応を停止し室温に昇温した。酒石酸ナトリウムカリウム水溶液を加えて室温で激しく1時間攪拌した。二層を分離して、有機層を水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-27(568mg、収率40%)を得た。
1H-NMR (CDCl3) δ: 1.38-1.49 (m, 12H), 4.58-4.81 (m, 1H), 5.23-5.70 (m, 4H), 7.27-7.40 (m, 3H), 7.47-7.65 (m, 2H), 7.95 (s, 1H), 10.32 (s, 1H).
工程3
化合物i-27(550mg、1.1mmol)をジクロロメタン(11mL)に溶解した。氷冷してビス(2-メトキシエチル)アミノサルファートリフルオリド(0.72mL、3.9mmol)を加え、室温に昇温して2時間攪拌した。反応液に水を加えて反応を停止し、酢酸エチルで抽出した。有機層を飽和重曹水、水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-28(408mg、収率71%)を得た。
1H-NMR (CDCl3) δ: 1.36-1.52 (m, 12H), 4.68 (m, 0.7H), 4.78 (m, 0.3H), 5.18-5.59 (m, 4H), 6.89 (t, J = 54.9Hz, 1H), 7.27-7.38 (m, 3H), 7.47-7.63 (m, 2H), 7.64 (s, 1H).
工程4
化合物i-28(400mg、0.77mmol)をメタノール(6mL)に溶解した。氷冷して2mol/L水酸化ナトリウム水溶液(0.5mL、1.0mmol)を加え、0℃で1時間攪拌した。反応液に水を加えて希釈し、クロロホルムで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去することにより化合物i-29(286mg、収率89%)を得た。
1H-NMR (CDCl3) δ: 1.38 (d, J = 7.2Hz, 3H), 4.47 (d, J = 7.8Hz, 2H), 5.22 (d, J = 10.2Hz, 1H), 5.29 (m, 1H), 5.34 (d, J = 10.2 Hz, 1H), 5.82 (m, 1H), 6.80 (t, J = 55.2Hz, 1H), 7.28-7.37 (m, 3H), 7.48-7.55 (m, 2H), 7.71 (s, 1H).
工程1
化合物i-30(13.3g、69.9mmol)をDMF(60mL)に溶解した。氷冷して水素化ナトリウム(3.3g、83mmol)を加え、0℃で15分攪拌した。ここにブロモアセトアルデヒドジメチルアセタール(12.3mL、104mmol)、ヨウ化カリウム(1.16g、7.0mmol)を加え、室温にて3時間攪拌した。反応液に水を加えて反応を停止し、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-31(8.8g、収率45%)を得た。
1H-NMR (CDCl3) δ: 3.34 (s, 6H), 3.53 (d, J = 5.1Hz, 2H), 3.76 (t, J = 5,7Hz, 2H), 3.91 (t, J = 5.7 Hz, 2H), 4.44 (t, J = 5.1Hz, 1H), 7.72 (m, 2H), 7.85 (m, 2H).
工程2
化合物i-31(8.79g、31.5mmol)をエタノール(100mL)に溶解した。ヒドラジン一水和物(3.0mL、62.9mmol)を加え、60℃で2時間攪拌した。放冷後、析出した固体をろ過除去し、濾液を減圧留去した。再び析出してきた固体をろ過除去し、濾液を減圧留去することにより化合物i-32(4.37g、収率93%)を得た。
1H-NMR (CDCl3) δ: 2.87 (m, 2H), 3.40 (s, 6H), 3.49-3.57 (m, 4H), 4.53 (m, 1H).
工程1
化合物i-33(1.00g、4.09mmol)をDMF(5mL)に溶解し、ジメチルアミン塩酸塩(384mg、4.71mmol)、炭酸カリウム(651mg、4.71mmol)、トリエチルアミン(0.653mL、4.71mmol)を加え、封緘にて160℃で17.5時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-34(587mg、収率53%)を得た。
1H-NMR (CDCl3) δ: 2.71 (s, 6H), 3.96 (s, 2H), 6.68 (d, J = 7.3 Hz, 1H), 6.84 (d, J = 8.5 Hz, 1H), 7.18-7.36 (m, 4H), 7.99 (dd, J = 7.9, 1.5 Hz, 1H).
工程2
化合物i-34(587mg、2.18mmol)をテトラヒドロフラン(20mL)に溶解し、氷冷下、ナトリウム水素化ビス(2-メトキシエトキシ)アルミニウム-トルエン溶液(3.39mL、10.9mmol)を滴下し、室温で3.5時間攪拌した。氷冷下、ロッシェル塩(7.06g、25.0mmol)の水溶液(50mL)を加え、室温に昇温した。酢酸エチルで抽出し、有機層を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-35(460mg、収率78%)を得た。
1H-NMR (CDCl3) δ: 2.61 (s, 6H), 3.67 (d, J = 13.7 Hz, 1H), 4.95 (d, J = 13.7 Hz, 1H), 6.61 (d, J = 7.1 Hz, 1H), 6.96-7.18 (m, 4H), 7.24-7.28 (m, 2H), 7.79 (d, J = 7.7 Hz, 1H), 9.88 (d, J = 6.6 Hz, 1H).
工程3
化合物i-35(100mg、0.368mmol)を酢酸エチル(3mL)に溶解し、化合物i-A(222mg、0.553mmol)、クロロ酢酸(104mg、1.11mmol)を加え、封緘にて120℃で4時間攪拌した。酢酸エチルで希釈し、飽和炭酸水素ナトリウム水溶液、水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-36(107mg、収率44%)および化合物i-37(42.7mg、収率18%)を得た。
4: 1H-NMR (CDCl3) δ: 0.96 (d, J = 7.1 Hz, 3H), 2.48 (s, 6H), 3.49 (d, J = 14.0 Hz, 1H), 4.18 (d, J = 13.2 Hz, 1H), 4.66 (d, J = 13.2 Hz, 1H), 5.35-5.52 (m, 2H), 5.59 (d, J = 10.4 Hz, 1H), 5.79 (d, J = 14.0 Hz, 1H), 5.99 (s, 1H), 6.57 (d, J = 7.7 Hz, 1H), 6.72 (t, J = 7.1 Hz, 1H), 7.03-7.15 (m, 4H), 7.26-7.38 (m, 5H), 7.58-7.64 (m, 2H).
5: MS: m/z = 655.15 [M+H] +.
工程1
化合物i-38(12.0g、49.1mmol)をテトラヒドロフラン(20mL)に溶解し、ナトリウムメトキシド-メタノール溶液(60.0mL、311mmol)を加え、4時間還流した。塩酸水溶液を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣にジクロロメタン-ヘキサンを加え固体を析出させた後、ろ取することにより化合物i-39(10.5g、収率84%)を得た。
1H-NMR (CDCl3) δ: 3.79 (s, 3H), 3.99 (s, 2H), 6.85 (dd, J = 7.8, 6.2 Hz, 2H), 7.19-7.26 (m, 2H), 7.30-7.39 (m, 2H), 7.95 (dd, J = 8.2, 1.4 Hz, 1H).
工程2
窒素雰囲気下、化合物i-39をジクロロメタン(100mL)に懸濁し、氷冷下、1mol/L トリブロモボラン-ジクロロメタン溶液(82.0mL、82.0mmol)を滴下した後、室温で2時間攪拌した。氷冷下、炭酸水素ナトリウム水溶液を加えた後、室温に昇温した。飽和塩化ナトリウム水溶液を加え、ジクロロメタンで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣にジクロロメタン-ヘキサンを加え固体を析出させた後、ろ取することにより化合物i-40(8.42g、収率85%)を得た。
1H-NMR (CDCl3) δ: 4.05 (s, 2H), 6.72 (d, J = 6.9 Hz, 1H), 6.98 (dd, J = 8.2, 1.1 Hz, 1H), 7.32-7.48 (m, 4H), 8.29 (dd, J = 7.6, 2.1 Hz, 1H), 12.35 (s, 1H).
工程3
化合物i-40(500mg、2.06mmol)をテトラヒドロフラン(10mL)に溶解し、氷冷下、ナトリウム水素化ビス(2-メトキシエトキシ)アルミニウム-トルエン溶液(3.21mL、10.3mmol)を滴下し、氷冷下で1時間攪拌した。氷冷下、ロッシェル塩(2.82g、10.0mmol)の水溶液(20mL)を加え、室温に昇温した。酢酸エチルで抽出し、有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣にジクロロメタン-ヘキサンを加え固体を析出させた後、ろ取することにより化合物i-41(389mg、収率77%)を得た。
1H-NMR (CDCl3) δ: 3.28 (s, 1H), 3.77 (d, J = 13.2 Hz, 1H), 4.73 (d, J = 13.2 Hz, 1H), 6.69 (s, 1H), 6.73-6.78 (m, 2H), 7.06-7.17 (m, 4H), 7.60-7.65 (m, 1H), 8.45 (s, 1H).
工程4
化合物i-41(150mg、0.614mmol)をアセトニトリル(1.5mL)に懸濁し、トリエチルアミン(0.426mL、3.07mmol)、無水酢酸(0.290mL、3.07mmol)およびDMAP(37.5mg、0.307mmol)を加え、室温で1.5時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-42(171mg、収率85%)を得た。
1H-NMR (CDCl3) δ: 2.03 (s, 3H), 2.41 (s, 3H), 3.55 (d, J = 14.0 Hz, 1H), 5.38 (d, J = 13.9 Hz, 1H), 6.97-7.16 (m, 5H), 7.24 (s, 1H), 7.29 (t, J = 7.9 Hz, 1H), 7.40 (d, J = 7.8 Hz, 1H).
工程1
化合物i-43(4.06g、16.7mmol)をDMSO(40mL)に溶解し、リン酸カリウム(7.11g、33.5mmol)および臭化アリル(2.18mL、25.1mmol)を加え、室温で6時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣にヘキサンを加え固体を析出させた後、ろ取することにより化合物i-44(4.28g、収率91%)を得た。
1H-NMR (CDCl3) δ: 4.00 (s, 2H), 4.50-4.55 (m, 2H), 5.20-5.26 (m, 1H), 5.32-5.41 (m, 1H), 5.89-6.03 (m, 1H), 6.84 (d, J = 8.0 Hz, 2H), 7.19-7.26 (m, 2H), 7.29-7.37 (m, 2H), 7.92 (dd, J = 8.2, 1.4 Hz, 1H).
工程2
化合物i-44(50.0mg、0.177mmol)をDMA(1mL)に溶解し、封緘にて230℃で6時間攪拌した。塩酸水溶液を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-45(37.1mg、収率74%)を得た。
1H-NMR (CDCl3) δ: 3.43 (d, J = 6.6 Hz, 2H), 4.01 (s, 2H), 5.05-5.15 (m, 2H), 6.01 (ddt, J = 17.3, 10.1, 6.8 Hz, 1H), 6.65 (d, J = 7.4 Hz, 1H), 7.24 (d, J = 7.7 Hz, 1H), 7.29-7.46 (m, 3H), 8.27 (dd, J = 8.0, 1.6 Hz, 1H), 12.69 (s, 1H).
工程3
化合物i-45(600mg、2.13mmol)をDMSO(6mL)に溶解し、リン酸カリウム(902mg、4.25mmol)および臭化アリル(0.276mL、3.19mmol)を加え、室温で2時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-46(642mg、収率88%)を得た。
1H-NMR (CDCl3) δ: 3.40 (d, J = 6.3 Hz, 2H), 3.99 (s, 2H), 4.27-4.32 (m, 2H), 5.03-5.07 (m, 1H), 5.08-5.12 (m, 1H), 5.15-5.21 (m, 1H), 5.25-5.33 (m, 1H), 5.85-6.04 (m, 2H), 6.95 (d, J = 8.0 Hz, 1H), 7.18-7.27 (m, 4H), 7.30-7.37 (m, 1H), 7.88-7.94 (m, 1H).
工程4
窒素雰囲気下、化合物i-46(560mg、1.74mmol)をジクロロメタン(56mL)に溶解し、第二世代グラブス触媒(147mg、0.174mmol)を加え、室温で14時間攪拌した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-47(366mg、収率72%)を得た。
1H-NMR (CDCl3) δ: 3.22-3.28 (m, 2H), 3.82 (s, 2H), 4.42-4.47 (m, 2H), 5.23-5.31 (m, 1H), 5.57-5.67 (m, 1H), 6.72 (d, J = 7.7 Hz, 1H), 6.95 (d, J = 7.7 Hz, 1H), 7.00-7.07 (m, 2H), 7.11-7.19 (m, 1H), 7.74-7.79 (m, 1H).
工程5
化合物i-47(362mg、1.23mmol)をテトラヒドロフラン(7mL)に溶解し、氷冷下、ナトリウム水素化ビス(2-メトキシエトキシ)アルミニウム-トルエン溶液(1.15mL、3.69mmol)を滴下し、氷冷下で45分間攪拌した。氷冷下、ロッシェル塩(2.11g、7.50mmol)の水溶液(30mL)を加え、室温に昇温した。酢酸エチルで抽出し、有機層を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-48(352mg、収率97%)を得た。
1H-NMR (CDCl3) δ: 3.29-3.40 (m, 1H), 3.43-3.55 (m, 1H), 3.95 (d, J = 5.5 Hz, 1H), 4.06 (d, J = 13.7 Hz, 1H), 4.47-4.52 (m, 2H), 4.82 (d, J = 13.7 Hz, 1H), 5.33-5.41 (m, 1H), 5.74-5.84 (m, 1H), 6.43 (d, J = 5.8 Hz, 1H), 6.92 (d, J = 7.7 Hz, 1H), 6.99 (d, J = 7.7 Hz, 1H), 7.06-7.14 (m, 3H), 7.46-7.52 (m, 1H).
工程6
化合物i-48(215mg、0.725mmol)のテトラヒドロフラン-メタノール(1:1、3mL)溶液に10%パラジウム炭素(77.0mg、0.073mmol)を加え、水素雰囲気下、室温で1.5時間攪拌した。固体をろ過除去し、濾液を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-49(139mg、収率64%)を得た。
1H-NMR (CDCl3) δ: 1.45-1.55 (m, 1H), 1.67-1.80 (m, 1H), 1.85-2.01 (m, 2H), 2.65-2.85 (m, 2H), 3.63-3.74 (m, 1H), 4.06-4.16 (m, 1H), 4.29 (d, J = 13.5 Hz, 1H), 4.49 (d, J = 13.5 Hz, 1H), 4.58-4.70 (m, 1H), 6.44 (d, J = 6.9 Hz, 1H), 6.88 (d, J = 7.4 Hz, 1H), 7.02 (d, J = 7.7 Hz, 1H), 7.07-7.11 (m, 3H), 7.49-7.55 (m, 1H).
工程1
化合物i-51(676mg、2.39mmol)をジオキサン(10mL)に溶解し、ジクロロビスアセトニトリルパラジウム(155mg、0.599mmol)、炭酸ナトリウム(254mg、2.39mmol)およびベンゾキノン(259mg、2.39mmol)を加え、封緘にて100℃で27時間攪拌した。酢酸エチルで希釈し、固体をろ過除去した。ろ液を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-51(166mg、収率25%)および化合物i-52(280mg、収率41%)を得た。
16: MS: m/z = 280.95 [M+H] +.
17: 1H-NMR (CDCl3) δ: 1.92 (dd, J = 6.6, 1.6 Hz, 3H), 4.01 (s, 2H), 6.25 (dq, J = 15.8, 6.6 Hz, 1H), 6.66 (d, J = 7.7 Hz, 1H), 6.77 (d, J = 15.8 Hz, 1H), 7.30-7.51 (m, 4H), 8.26-8.31 (m, 1H), 12.67 (s, 1H).
工程2
化合物i-52(250mg、0.885mmol)をDMSO(2.5mL)に溶解し、リン酸カリウム(376mg、1.77mmol)および臭化アリル(0.115mL、1.33mmol)を加え、室温で2時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-53(285mg、収率100%)を得た。
1H-NMR (CDCl3) δ: 1.88 (dd, J = 6.6, 1.5 Hz, 3H), 3.98 (s, 2H), 4.31 (dt, J = 5.5, 1.3 Hz, 2H), 5.17 (dd, J = 10.5, 1.2 Hz, 1H), 5.29 (dq, J = 17.9, 1.5 Hz, 1H), 5.90-6.02 (m, 1H), 6.21 (dq, J = 17.9, 6.6 Hz, 1H), 6.57 (dd, J = 15.9, 1.2 Hz, 1H), 6.94 (d, J = 7.9 Hz, 1H), 7.17-7.24 (m, 2H), 7.28-7.36 (m, 1H), 7.45 (d, J = 7.9 Hz, 1H), 7.88 (dd, J = 8.2, 1.4 Hz, 1H).
工程3
窒素雰囲気下、化合物i-53(310mg、0.961mmol)をジクロロメタン(31mL)に溶解し、第二世代グラブス触媒(82.0mg、0.096mmol)を加え、室温で14時間攪拌した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-54(170mg、収率63%)を得た。
1H-NMR (CDCl3) δ: 3.95 (s, 2H), 4.82 (dd, J = 3.4, 1.8 Hz, 2H), 5.75 (dt, J = 9.9, 3.4 Hz, 1H), 6.38 (d, J = 9.9 Hz, 1H), 6.72 (d, J = 7.4 Hz, 1H), 6.97 (d, J = 7.4 Hz, 1H), 7.19-7.26 (m, 2H), 7.30-7.38 (m, 1H), 7.95-8.00 (m, 1H).
工程1
化合物i-55(100mg、0.328mmol)をDMF(1mL)に懸濁し、2,2-ジフルオロ-2-(フルオロスルホニル)酢酸メチル(0.124mL、0.983mmol)およびヨウ化銅(68.6mg、0.360mmol)を加え、130℃で4時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去して化合物i-56(96mg、収率100%)を得た。
1H-NMR (CDCl3) δ: 4.04 (s, 2H), 7.17-7.26 (m, 2H), 7.29-7.36 (m, 1H), 7.41-7.53 (m, 2H), 7.57-7.62 (m, 1H), 7.78 (d, J = 7.8 Hz, 1H).
工程1
化合物i-55(3.00g、9.83mmol)をDMF(30mL)に懸濁し、シアン化銅(2.64g、29.5mmol)を加え、8時間還流した。水を加え、クロロホルムで抽出した。有機層を水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣にジクロロメタン-ジエチルエーテル-ヘキサンを加え固体を析出させた後、ろ取することにより化合物i-57(1.72g、収率70%)を得た。
1H-NMR (CDCl3) δ: 4.06 (s, 2H), 7.27-7.35 (m, 2H), 7.40-7.57 (m, 3H), 7.68 (dd, J = 7.4, 1.4 Hz, 1H), 8.16-8.21 (m, 1H).
工程2
化合物i-57(25.0mg、0.099mmol)をメタノール(0.5mL)に懸濁し、塩化トリメチルシリル(0.051mL、0.398mmol)を加え、50℃で4.5時間攪拌した。炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-58(11.4mg、収率40%)を得た。
1H-NMR (CDCl3) δ: 3.87 (s, 3H), 4.09 (s, 2H), 7.25-7.53 (m, 5H), 7.86-7.91 (m, 1H), 7.98 (dd, J = 7.8, 1.6 Hz, 1H).
工程3
窒素雰囲気下、化合物i-58(600mg、2.11mmol)をテトラヒドロフラン(8mL)に溶解し、氷冷下、水素化リチウムアルミニウム(481mg、12.66mmol)を加え、氷冷下で45分間攪拌した。氷冷下、飽和塩化アンモニウム水溶液(1.5mL)を滴下し、室温に昇温した。酢酸エチルで抽出し、有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-59(415mg、収率76%)を得た。
1H-NMR (DMSO-d6) δ: 3.48-3.70 (m, 1H), 4.34-4.49 (m, 2H), 4.95 (t, J = 5.4 Hz, 1H), 5.18-5.47 (m, 1H), 5.79-5.88 (m, 2H), 6.78-6.95 (m, 3H), 6.99-7.11 (m, 3H), 7.22 (d, J = 6.0 Hz, 1H).
工程4
化合物i-59(70.0mg、0.271mmol)をアセトニトリル(1mL)に懸濁し、トリエチルアミン(0.188mL、1.36mmol)、無水酢酸(0.128mL、1.36mmol)およびDMAP(16.6mg、0.135mmol)を加え、室温で30分間攪拌した。水を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して化合物i-60(93.0mg、収率100%)を得た。
1H-NMR (CDCl3) δ: 1.92 (s, 3H), 2.08 (s, 3H), 3.53 (d, J = 14.0 Hz, 1H), 5.38 (d, J = 1.4 Hz, 2H), 5.47 (d, J = 14.0 Hz, 1H), 7.03-7.20 (m, 4H), 7.24-7.31 (m, 2H), 7.48 (dd, J = 7.6, 1.2 Hz, 1H).
工程1
窒素雰囲気下、化合物i-59(100mg、0.387mmol)をテトラヒドロフランに溶解し、氷冷下、水素化ナトリウム(37.2mg、0.929mmol)を加え、氷冷下で5分攪拌した後、ヨウ化メチル(0.145mL、2.32mmol)を加え、室温で2時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-61(106mg、収率96%)を得た。
1H-NMR (CDCl3) δ: 3.29 (s, 3H), 3.34 (s, 3H), 3.40 (d, J = 13.1 Hz, 1H), 4.45-4.58 (m, 2H), 5.63 (s, 1H), 5.70 (d, J = 13.1 Hz, 1H), 7.00-7.24 (m, 6H), 7.35 (d, J = 7.4 Hz, 1H).
工程1
化合物i-55(2.10g、6.88mmol)をDMF(10.5mL)に懸濁し、ヨウ化銅(262mg、1.38mmol)、ジクロロビストリフェニルホスフィンパラジウム(966mg、1.38mmol)、トリメチルシリルアセチレン(4.86mL、34.4mmol)およびトリエチルアミン(14.0mL、101mmol)を加え、封緘にて140℃で11時間攪拌した。酢酸エチルで希釈し、固体をろ過除去した。ろ液を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-62(1.34g、収率60%)を得た。
MS: m/z = 323.05 [M+H] +.
工程2
化合物i-62(1.34g、4.16mmol)をメタノール(40mL)に溶解し、炭酸カリウム(1.72g、12.5mmol)を加え、室温で1.5時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-63(967mg、収率93%)を得た。
1H-NMR (CDCl3) δ: 3.20 (s, 1H), 4.05 (s, 2H), 7.14-7.30 (m, 4H), 7.40 (t, J = 7.8 Hz, 1H), 7.51 (d, J = 7.6 Hz, 1H), 7.79 (dt, J = 7.7, 0.8 Hz, 1H).
工程3
窒素雰囲気下、化合物i-63(619mg、2.47mmol)をテトラヒドロフラン(12mL)に溶解し、氷冷下、水素化リチウムアルミニウム(282mg、7.42mmol)を加え、氷冷下で1時間攪拌した。氷冷下、飽和塩化アンモニウム水溶液(15mL)を滴下し、室温に昇温した。酢酸エチルで抽出し、有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-64(554mg、収率89%)を得た。
1H-NMR (CDCl3) δ: 2.73 (d, J = 3.4 Hz, 1H), 3.41 (s, 1H), 3.57 (d, J = 13.6 Hz, 1H), 5.63 (d, J = 13.6 Hz, 1H), 6.55 (d, J = 3.4 Hz, 1H), 7.04-7.26 (m, 5H), 7.37-7.44 (m, 2H).
工程4
窒素雰囲気下、化合物i-64(50.0mg、0.198mmol)のテトラヒドロフラン(2mL)溶液をドライアイス-アセトンで-78℃に冷却した。これに1.65mol/L n-ブチルリチウム-ヘキサン溶液(0.312mL、0.515mmol)を滴下し、室温で20分攪拌した。再度ドライアイス-アセトンで-78℃に冷却した後、ヨウ化メチル(0.248mL、3.96mmol)を滴下し、室温まで昇温しながら1.5時間攪拌した。飽和塩化アンモニウム水溶液(1.5mL)を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-65(44.9mg、収率81%)を得た。
1H-NMR (CDCl3) δ: 2.14 (s, 3H), 3.34 (s, 3H), 3.38 (d, J = 13.5 Hz, 1H), 5.62 (d, J = 13.5 Hz, 1H), 5.97 (s, 1H), 7.01-7.23 (m, 5H), 7.29 (dd, J = 7.3, 1.8 Hz, 1H), 7.36 (d, J = 7.4 Hz, 1H).
工程1
化合物i-66(520mg、1.92mmol)のテトラヒドロフラン-メタノール(1:1、6mL)溶液に10%パラジウム炭素(205mg、0.192mmol)を加え、水素雰囲気下、室温で1時間攪拌した。固体をろ過除去し、濾液を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-67(370mg、収率70%)を得た。
1H-NMR (CDCl3) δ: 1.25 (t, J = 7.5 Hz, 3H), 2.48 (d, J = 1.7 Hz, 1H), 2.82 (dq, J = 2.7, 7.5 Hz, 2H), 3.63 (d, J = 13.6 Hz, 1H), 5.79 (d, J = 13.6 Hz, 1H), 6.25 (s, 1H), 6.97-7.32 (m, 7H).
工程1
窒素雰囲気下、化合物i-68(1.00g、3.81mmol)のテトラヒドロフラン(40mL)溶液をドライアイス-アセトンで-78℃に冷却した。これに1.65mol/L n-ブチルリチウム-ヘキサン溶液(6.92mL、11.4mmol)を滴下し、室温で30分攪拌した。再度ドライアイス-アセトンで-78℃に冷却した後、ヨウ化メチル(2.38mL、38.1mmol)を滴下し、室温まで昇温しながら2.5時間攪拌した。反応液を濃縮した後、水を加え、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物i-69(522mg、収率50%)を得た。
1H-NMR (CDCl3) δ: 1.74 (d, J = 6.9 Hz, 3H), 4.96-5.09 (m, 2H), 6.65 (d, J = 10.7 Hz, 1H), 7.10-7.28 (m, 6H), 7.49-7.52 (m, 1H).
工程1
化合物i-70(500mg、1.36mmol)をジクロロメタン(10mL)に溶解し、Boc2O(0.348mL、1.50mmol)、DMAP(16mg、0.136mmol)、を加え、室温で1時間撹拌した。その後、NCS(273mg、2.04mmol)を加えて7時間加熱還流し、その後4日間室温で撹拌した。
反応液を濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール)により精製して化合物i-71(670mg、収率98%)を得た。
MS: m/z = 502.12 [M+H] +
工程2
化合物i-71(670mg、1.34mmol)のエタノール-水溶液をに2M塩酸水溶液(3.34mL、6.67mmol)を加え60℃で3時間攪拌した。飽和重曹水を加えクロロホルムで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、化合物i-72(452mg、1.13mmol)を得た。
MS: m/z = 402.08 [M+H] +
参考例666の合成
第一工程
化合物666A(1.0g、2.4mmol)、10-クロロ-6,11-ジヒドロジベンゾ[b,e]チエピン-11-オール(741mg、2.8mmol)、ホスホン酸無水プロパン-50%酢酸エチル溶液(10mL、16.8mmol)を混合し、100℃で5時間攪拌した。反応液に酢酸エチルを加えて希釈し、水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物666B(451mg、収率29%)を得た。
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.5Hz, 3H), 3.62 (d, J = 13.5Hz, 1H), 3.76 (s, 3H), 4.37 (d, J = 13.2Hz, 1H), 4.80 (d, J = 13.2Hz, 1H), 5.43 (d, 10.5Hz, 1H), 5.53-5.66 (m, 3H), 5.86 (s, 1H), 6.58 (m, 1H), 6.76 (m, 1H), 7.04-7.13 (m, 2H), 7.26-7.38 (m, 6H), 7.58-7.63 (m, 2H), 7.99 (s, 1H).
第二工程
化合物666B(570mg、0.85mmol)をテトラヒドロフラン(6mL)とメタノール(1.5mL)に溶解した。氷冷して、2mol/L水酸化ナトリウム水溶液(0.64mL、1.28mmol)を加え、0℃で30分攪拌した。反応液に塩酸を加えて反応を停止し、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物666C(433mg、収率78%)を得た。
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.2Hz, 3H), 3.62 (d, J = 13.8Hz, 1H), 4.42 (d, J = 13.2Hz, 1H), 4.82 (d, J = 13.2Hz, 1H), 5.50-5.62 (m, 3H), 5.66 (d, J = 10.8Hz, 1H), 5.82 (s, 1H), 6.38 (m, 1H), 6.70 (m, 1H), 7.05-7.16 (m, 2H), 7.26-7.39 (m, 6H), 7.51-7.56 (m, 2H), 8.12 (s, 1H), 14.31 (s, 1H).
第三工程
化合物666C(289mg、0.44mmol)をテトラヒドロフラン(5mL)に溶解した。氷冷し、トリエチルアミン(0.18mL、1.3mmol)、クロロギ酸エチル(0.11mL、1.1mmol)を加えて15分攪拌した。ドライアイス-アセトンで-78℃に冷却して、DIBAL-ヘキサン溶液(2.1mL、2.2mmol)を加え、-78℃で40分攪拌した。反応液に酢酸エチルを加えて反応を停止し室温に昇温した。酒石酸ナトリウムカリウム水溶液を加えて室温で激しく2時間攪拌した。有機層を無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をDMF(2ml)に溶解した。塩化リチウム(70mg、1.7mmol)を加え、100℃で2時間攪拌した。放冷して酢酸エチルで希釈し、2mol/L塩酸、水、飽和食塩水で洗浄した。溶媒を減圧留去し、得られた残渣に酢酸エチル-ジイソプロピルエーテルを加えて固体を析出させた後、ろ取することにより化合物666(40.5mg、収率17%)を得た。
1H-NMR (CDCl3) δ: 1.16 (d, J = 7.2Hz, 3H), 3.63 (d, J = 13.5Hz, 1H), 4.06 (d, J = 13.2Hz, 1H), 4.24 (d, J = 13.2Hz, 1H), 4.44 (d, J = 12.9Hz, 1H), 4.87 (d, J = 12.9Hz, 1H), 5.50 (m, 1H), 5.72 (d, J = 13.5Hz, 1H), 5.93 (s, 1H), 6.75 (m, 1H), 6.83 (m, 1H), 7.09-7.14 (m, 2H), 7.22 (s, 1H), 7.27-7.39 (m, 1H).
MS: m/z = 552.2 [M+H] +.
1H-NMR (CDCl3) δ: 1.23 (d, J = 7.5Hz, 3H), 4.11 (d, J = 13.8Hz, 1H), 4.48 (d, J = 12.9Hz, 1H), 4.90 (d, J = 12.9Hz, 1H), 5.13 (s, 1H), 5.41 (dd, J = 13.8, 3.0 Hz, 1H), 5.54 (m, 1H), 5.82 (d, J = 7.8 Hz, 1H), 6.69 (d, J = 7.2Hz, 1H), 6.85 (m, 1H), 6.96 (m, 1H), 7.03-7.14 (m, 3H), 7.16 (d, J = 7.2Hz, 1H).
1H-NMR (CDCl3) δ: 1.19 (d, J = 6.9Hz, 3H), 3.61 (d, J = 13.5Hz, 1H), 4.07 (d, J = 13.2Hz, 1H), 4.24 (d, J = 13.2Hz, 1H), 4.50 (d, J = 13.2Hz, 1H), 4.88 (d, J = 13.2Hz, 1H), 5.09 (s, 1H), 5.51 (m, 1H), 5.67 (d, J = 13.5 Hz, 1H), 6.66 (m, 1H), 6.79 (m, 1H), 7.04-7.12 (m, 2H), 7.18 (m, 1H), 7.24-7.30 (m, 2H), 7.35-7.46 (m, 2H).
MS: m/z = 518.3 [M+H] +.
1H-NMR (CDCl3) δ: 1.25 (d, J = 7.2Hz, 3H), 4.07 (d, J = 13.2Hz, 1H), 4.10 (d, J = 13.8Hz, 1H), 4.29 (d, J = 13.2Hz, 1H), 4.48 (d, J = 13.2Hz, 1H), 4.90 (d, J = 13.2Hz, 1H), 5.12 (s, 1H), 5.44 (dd, J = 13.8, 3.0 Hz, 1H), 5.52 (m, 1H), 6.64 (m, 1H), 6.82 (m, 1H), 6.95 (m, 1H), 7.02-7.13 (m, 3H), 7.25 (s, 1H).
MS: m/z = 554.2 [M+H] +.
1H-NMR (CDCl3) δ: 2.98 (m, 1H), 3.46 (m, 1H), 3.57 (t, J = 10.5 Hz, 1H), 3.58 (d, J = 13.5Hz, 1H), 3.79 (dd, J = 12.3, 3.0 Hz, 1H), 3.96 (dd, J = 11.4, 3.0 Hz, 1H), 4.63 (m, 2H), 5.25 (s, 1H), 5.52 (d, J = 13.5Hz, 1H), 5.75 (d, J = 7.8 Hz, 1H), 6.70 (m, 1H), 6.81 (m, 1H), 7.04-7.10 (m, 3H), 7.19-7.37 (m, 3H), 7.43 (m, 1H).
MS: m/z = 448.1 [M+H] +.
1H-NMR (CDCl3) δ: 2.83 (m, 1H), 3.43 (m, 1H), 3.55 (t, J = 10.5 Hz, 1H), 3.61 (d, J = 13.8Hz, 1H), 3.78 (dd, J = 12.0, 3.0 Hz, 1H), 4.04 (dd, J = 11.1, 3.0 Hz, 1H), 4.50 (m, 1H), 4.60 (m, 1H), 5.13 (s, 1H), 5.64 (d, J = 13.8Hz, 1H), 5.73 (d, J = 7.8 Hz, 1H), 6.59 (d, J = 7.8 Hz, 1H), 6.81 (m, 1H), 7.07-7.15 (m, 2H), 7.20-7.37 (m, 5H).
MS: m/z = 448.1 [M+H] +.
1H-NMR (CDCl3) δ: 1.26 (d, J = 7.2Hz, 3H), 4.13 (d, J = 13.8Hz, 1H), 4.49 (d, J = 13.2Hz, 1H), 4.94 (d, J = 13.2Hz, 1H), 5.13 (s, 1H), 5.38 (dd, J = 13.8, 2.4 Hz, 1H), 5.52 (m, 1H), 6.68 (m, 1H), 6.86 (m, 1H), 6.97 (m, 1H), 7.03-7.20 (m, 3H), 7.50 (s, 1H).
MS: m/z = 558.0 [M+H] +.
1H-NMR (CDCl3) δ: 1.18 (d, J = 7.2Hz, 3H), 3.65 (d, J = 13.5Hz, 1H), 4.47 (d, J = 12.9Hz, 1H), 4.90 (d, J = 12.9Hz, 1H), 5.49 (m, 1H), 5.66 (d, J = 13.5Hz, 1H), 5.93 (s, 1H), 6.60 (t, J = 54.9Hz, 1H), 6.77 (m, 1H), 6.86 (m, 1H), 7.11-7.16 (m, 2H), 7.28-7.37 (m, 3H), 7.49 (s, 1H).
1H-NMR (CDCl3) δ: 1.25 (d, J = 7.2Hz, 3H), 4.11 (d, J = 13.8Hz, 1H), 4.51 (d, J = 13.2Hz, 1H), 4.93 (d, J = 13.2Hz, 1H), 5.11 (s, 1H), 5.38 (dd, J = 13.8, 3.0Hz, 1H), 5.52 (m, 1H), 6.58 (t, J = 54.6Hz, 1H), 6.65 (m, 1H), 6.84 (m, 1H), 6.95 (m, 1H), 7.02-7.15 (m, 3H), 7.52 (s, 1H).
1H-NMR (CDCl3) δ: 1.23 (d, J = 7.2Hz, 3H), 4.08 (d, J = 12.9Hz, 1H), 4.24 (d, J = 13.5Hz, 1H), 4.32 (d, J = 14.1Hz, 1H), 4.50 (d, J = 12.9Hz, 1H), 4.90 (d, J = 13.5Hz, 1H), 5.13 (s, 1H), 5.53 (m, 1H), 5.64 (d, J = 14.1Hz, 1H), 6.64 (m, 1H), 6.80 (m, 1H), 7.06-7.12 (m, 3H), 7.20 (m, 1H), 7.24 (s, 1H), 7.53 (m, 1H).
MS: m/z = 552.2 [M+H] +.
1H-NMR (CDCl3) δ: 0.90 (d, J = 7.4 Hz, 3H), 2.25 (s, 3H), 2.34 (s, 3H), 3.70 (d, J = 13.5 Hz, 1H), 4.49 (d, J = 12.9 Hz, 1H), 4.81 (d, J = 12.9 Hz, 1H), 5.38-5.50 (m, 2H), 5.62 (d, J = 13.5 Hz, 1H), 5.84 (d, J = 7.7 Hz, 1H), 6.56 (d, J = 7.7 Hz, 1H), 6.75 (t, J = 7.6 Hz, 1H), 6.98 (d, J = 7.7 Hz, 1H), 7.05 (d, J = 7.7 Hz, 1H), 7.12 (d, J = 7.1 Hz, 1H), 7.21 (d, J = 6.6 Hz, 1H), 7.26-7.32 (m, 1H).
1H-NMR (CDCl3) δ: 0.93 (d, J = 7.2 Hz, 3H), 2.38 (s, 3H), 3.75 (d, J = 13.6 Hz, 1H), 4.52 (d, J = 12.9 Hz, 1H), 4.85 (d, J = 12.9 Hz, 1H), 5.41-5.54 (m, 2H), 5.69 (d, J = 13.6 Hz, 1H), 5.93 (d, J = 7.7 Hz, 1H), 6.68 (d, J = 7.6 Hz, 1H), 6.84 (t, J = 7.8 Hz, 1H), 7.04 (d, J = 7.7 Hz, 1H), 7.18 (d, J = 7.6 Hz, 1H), 7.25-7.40 (m, 3H).
1H-NMR (CDCl3) δ: 0.90 (d, J = 7.4 Hz, 3H), 2.34 (s, 3H), 3.69 (d, J = 13.5 Hz, 1H), 4.48 (d, J = 12.6 Hz, 1H), 4.82 (d, J = 12.6 Hz, 1H), 5.38-5.50 (m, 2H), 5.62 (d, J = 13.5 Hz, 1H), 5.88 (d, J = 7.7 Hz, 1H), 6.53 (d, J = 7.7 Hz, 1H), 6.83 (td, J = 8.0, 5.5 Hz, 1H), 6.92-7.00 (m, 1H), 7.03 (d, J = 7.7 Hz, 1H), 7.15 (d, J = 7.4 Hz, 1H), 7.23 (d, J = 7.1 Hz, 1H), 7.32 (t, J = 7.6 Hz, 1H).
1H-NMR (CDCl3) δ: 1.19 (d, J = 7.4 Hz, 3H), 2.24 (s, 3H), 4.09 (d, J = 14.3 Hz, 1H), 4.44 (d, J = 12.9 Hz, 1H), 4.91 (d, J = 12.9 Hz, 1H), 5.27 (s, 1H), 5.49-5.59 (m, 1H), 5.81 (d, J = 7.7 Hz, 1H), 5.91 (d, J = 14.3 Hz, 1H), 6.58 (d, J = 7.7 Hz, 1H), 6.76 (t, J = 7.6 Hz, 1H), 7.02-7.10 (m, 2H), 7.34-7.43 (m, 2H), 7.70-7.83 (m, 1H).
1H-NMR (CDCl3) δ: 0.89 (d, J = 7.2 Hz, 3H), 1.08 (t, J = 7.5 Hz, 3H), 2.62-2.77 (m, 2H), 3.68 (d, J = 13.6 Hz, 1H), 4.44 (d, J = 12.7 Hz, 1H), 4.79 (d, J = 12.7 Hz, 1H), 5.37-5.47 (m, 1H), 5.58 (s, 1H), 5.69 (d, J = 13.6 Hz, 1H), 5.87 (d, J = 7.6 Hz, 1H), 6.53 (d, J = 7.3 Hz, 1H), 6.82 (td, J = 7.8, 5.8 Hz, 1H), 6.90-6.98 (m, 1H), 7.00 (d, J = 7.6 Hz, 1H), 7.17-7.23 (m, 2H), 7.36 (t, J = 7.5 Hz, 1H).
1H-NMR (CDCl3) δ: 1.15 (d, J = 7.4 Hz, 3H), 3.55 (s, 1H), 3.71 (d, J = 13.5 Hz, 1H), 4.44 (d, J = 12.9 Hz, 1H), 4.87 (d, J = 12.9 Hz, 1H), 5.43-5.54 (m, 1H), 5.65 (d, J = 13.5 Hz, 1H), 5.87 (d, J = 7.7 Hz, 1H), 6.14 (s, 1H), 6.63 (d, J = 7.4 Hz, 1H), 6.84 (td, J = 8.0, 5.7 Hz, 1H), 6.91-7.00 (m, 1H), 7.10 (d, J = 7.7 Hz, 1H), 7.37-7.42 (m, 2H), 7.46-7.52 (m, 1H).
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.1 Hz, 3H), 3.59 (d, J = 13.5 Hz, 1H), 3.79 (s, 3H), 4.51 (d, J = 12.9 Hz, 1H), 4.84 (d, J = 12.9 Hz, 1H), 5.43-5.56 (m, 1H), 5.67 (d, J = 13.5 Hz, 1H), 5.83 (d, J = 7.7 Hz, 1H), 5.92 (s, 1H), 6.74 (d, J = 7.7 Hz, 1H), 6.77-6.86 (m, 2H), 6.95 (d, J = 7.7 Hz, 1H), 7.05-7.10 (m, 2H), 7.19 (d, J = 7.7 Hz, 1H), 7.35 (t, J = 8.1 Hz, 1H).
1H-NMR (CDCl3) δ: 1.18 (d, J = 7.1 Hz, 3H), 3.55 (s, 1H), 3.63 (d, J = 13.2 Hz, 1H), 4.46 (d, J = 11.5 Hz, 1H), 4.94 (d, J = 11.5 Hz, 1H), 5.44-5.54 (m, 1H), 5.63 (d, J = 13.2 Hz, 1H), 6.01 (d, J = 4.4 Hz, 1H), 6.07 (s, 1H), 6.77 (d, J = 7.4 Hz, 1H), 6.83-6.85 (m, 1H), 7.07-7.16 (m, 2H), 7.17-7.24 (m, 1H), 7.36-7.40 (m, 2H), 7.44-7.50 (m, 1H).
1H-NMR (CDCl3) δ: 0.91 (d, J = 7.4 Hz, 3H), 1.08 (t, J = 7.4 Hz, 3H), 2.62-2.79 (m, 2H), 3.59 (d, J = 13.2 Hz, 1H), 4.46 (d, J = 12.6 Hz, 1H), 4.82 (d, J = 12.6 Hz, 1H), 5.38-5.48 (m, 1H), 5.51 (s, 1H), 5.68 (d, J = 13.2 Hz, 1H), 5.92 (d, J = 6.9 Hz, 1H), 6.68 (d, J = 8.0 Hz, 1H), 6.78-6.87 (m, 1H), 7.05 (d, J = 7.1 Hz, 1H), 7.09-7.14 (m, 2H), 7.19 (d, J = 7.7 Hz, 1H), 7.23 (d, J = 7.4 Hz, 1H), 7.36 (t, J = 7.7 Hz, 1H).
1H-NMR (CDCl3) δ: 0.23 (d, J = 7.1 Hz, 3H), 3.75 (d, J = 13.5 Hz, 1H), 4.47 (d, J = 12.9 Hz, 1H), 4.84 (d, J = 12.9 Hz, 1H), 5.23-5.33 (m, 1H), 5.91 (d, J = 7.7 Hz, 1H), 5.97 (d, J = 13.5 Hz, 1H), 6.19 (s, 1H), 6.81-6.93 (m, 2H), 7.07-7.12 (m, 2H), 7.21 (d, J = 7.7 Hz, 1H), 7.48 (d, J = 8.2 Hz, 1H), 7.52 (d, J = 7.4 Hz, 1H), 7.57-7.64 (m, 1H), 7.87 (d, J = 8.2 Hz, 1H), 7.92 (d, J = 8.5 Hz, 1H), 8.07 (d, J = 8.8 Hz, 1H).
1H-NMR (CDCl3) δ: 1.12 (d, J = 5.8 Hz, 6H), 1.43 (d, J = 6.0 Hz, 3H), 3.58 (d, J = 13.5 Hz, 1H), 4.43-4.57 (m, 2H), 4.84 (d, J = 12.9 Hz, 1H), 5.41-5.52 (m, 1H), 5.61 (d, J = 13.5 Hz, 1H), 5.88 (d, J = 7.7 Hz, 1H), 5.94 (s, 1H), 6.67 (d, J = 7.7 Hz, 1H), 6.77-6.87 (m, 2H), 6.91 (d, J = 7.1 Hz, 1H), 7.09 (d, J = 3.6 Hz, 2H), 7.16 (d, J = 7.7 Hz, 1H), 7.31 (t, J = 8.0 Hz, 1H).
1H-NMR (DMSO-d6) δ: 0.93 (d, J = 7.4 Hz, 3H), 3.59 (d, J = 13.5 Hz, 1H), 4.27 (d, J = 12.9 Hz, 1H), 4.84 (d, J = 12.9 Hz, 1H), 5.24-5.35 (m, 1H), 5.38 (d, J = 13.5 Hz, 1H), 5.48 (d, J = 7.4 Hz, 1H), 5.59 (s, 1H), 6.50 (d, J = 7.4 Hz, 1H), 6.57-6.71 (m, 4H), 6.86-7.03 (m, 5H), 9.98 (s, 1H).
1H-NMR (CDCl3) δ: 1.00-1.10 (m, 6H), 1.74-1.87 (m, 2H), 3.59 (d, J = 13.2 Hz, 1H), 3.78-3.95 (m, 2H), 4.55 (d, J = 12.4 Hz, 1H), 4.92 (d, J = 12.4 Hz, 1H), 5.39-5.52 (m, 1H), 5.65 (d, J = 13.2 Hz, 1H), 5.97 (s, 1H), 6.01-6.11 (m, 1H), 6.66 (d, J = 7.4 Hz, 1H), 6.81 (d, J = 8.2 Hz, 2H), 6.93 (d, J = 7.4 Hz, 1H), 7.07-7.11 (m, 2H), 7.21-7.25 (m, 1H), 7.32 (t, J = 8.0 Hz, 1H).
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.1 Hz, 3H), 1.40 (t, J = 6.9 Hz, 3H), 3.59 (d, J = 13.2 Hz, 1H), 3.87-4.07 (m, 2H), 4.53 (d, J = 13.2 Hz, 1H), 4.86 (d, J = 13.2 Hz, 1H), 5.43-5.53 (m, 1H), 5.64 (d, J = 13.2 Hz, 1H), 5.91 (d, J = 7.4 Hz, 1H), 5.96 (s, 1H), 6.70 (d, J = 7.7 Hz, 1H), 6.78-6.84 (m, 2H), 6.93 (d, J = 7.4 Hz, 1H), 7.06-7.10 (m, 2H), 7.20 (d, J = 7.7 Hz, 1H), 7.32 (t, J = 8.0 Hz, 1H).
1H-NMR (CDCl3) δ: 0.93 (d, J = 6.9 Hz, 3H), 3.73 (d, J = 13.7 Hz, 1H), 4.58 (d, J = 12.9 Hz, 1H), 4.64 (d, J = 11.8 Hz, 1H), 4.82-4.90 (m, 2H), 5.31-5.43 (m, 1H), 5.62 (d, J = 13.7 Hz, 1H), 5.90 (d, J = 7.7 Hz, 1H), 6.09 (s, 1H), 6.65 (d, J = 6.6 Hz, 1H), 6.69-6.78 (m, 1H), 6.90-6.98 (m, 1H), 7.00 (d, J = 7.7 Hz, 1H), 7.27-7.41 (m, 3H).
1H-NMR (CDCl3) δ: 1.16 (d, J = 7.1 Hz, 3H), 3.49 (s, 1H), 3.60 (d, J = 13.2 Hz, 1H), 4.49-4.62 (m, 2H), 4.74 (dd, J = 15.9, 2.2 Hz, 1H), 4.85 (d, J = 13.5 Hz, 1H), 5.44-5.57 (m, 1H), 5.67 (d, J = 13.2 Hz, 1H), 5.82 (d, J = 7.7 Hz, 1H), 5.89 (s, 1H), 6.74 (d, J = 8.0 Hz, 1H), 6.78-6.85 (m, 1H), 7.01 (dd, J = 8.1, 3.7 Hz, 2H), 7.05-7.12 (m, 2H), 7.20 (d, J = 7.7 Hz, 1H), 7.36 (t, J = 8.1 Hz, 1H).
1H-NMR (CDCl3) δ: 1.15 (d, J = 7.4 Hz, 3H), 2.14 (s, 3H), 3.59 (d, J = 13.5 Hz, 1H), 4.45 (d, J = 12.9 Hz, 1H), 4.85 (d, J = 12.9 Hz, 1H), 5.43-5.53 (m, 1H), 5.58 (d, J = 13.5 Hz, 1H), 5.83 (d, J = 7.7 Hz, 1H), 6.08 (s, 1H), 6.71 (d, J = 7.4 Hz, 1H), 6.80-6.87 (m, 1H), 7.07-7.14 (m, 3H), 7.26-7.38 (m, 3H).
1H-NMR (CDCl3) δ: 1.16 (d, J = 7.1 Hz, 3H), 1.78 (d, J = 6.9 Hz, 3H), 2.14 (s, 3H), 4.43 (d, J = 12.9 Hz, 1H), 4.83 (d, J = 12.9 Hz, 1H), 5.42-5.54 (m, 1H), 5.84 (d, J = 7.7 Hz, 1H), 5.99 (q, J = 7.1 Hz, 1H), 6.22 (s, 1H), 6.69 (d, J = 7.1 Hz, 1H), 6.79-6.86 (m, 1H), 7.03-7.14 (m, 3H), 7.31-7.42 (m, 3H).
1H-NMR (CDCl3) δ: 1.03 (d, J = 6.7 Hz, 3H), 1.21 (d, J = 6.4 Hz, 3H), 1.78 (d, J = 6.4 Hz, 3H), 4.34 (d, J = 12.3 Hz, 1H), 4.70-4.84 (m, 1H), 5.03 (d, J = 12.3 Hz, 1H), 6.08-6.27 (m, 3H), 6.70-6.86 (m, 2H), 7.01-7.22 (m, 3H), 7.30-7.42 (m, 3H).
1H-NMR (CDCl3) δ: 0.88 (d, J = 7.1 Hz, 3H), 3.43 (s, 3H), 3.62 (d, J = 13.5 Hz, 1H), 4.27 (d, J = 11.0 Hz, 1H), 4.38 (d, J = 11.0 Hz, 1H), 4.52 (d, J = 13.2 Hz, 1H), 4.84 (d, J = 13.2 Hz, 1H), 5.25-5.35 (m, 1H), 5.60 (d, J = 13.5 Hz, 1H), 5.70 (s, 1H), 5.91 (d, J = 7.1 Hz, 1H), 6.64 (d, J = 7.4 Hz, 1H), 6.80-6.88 (m, 1H), 6.96 (d, J = 7.7 Hz, 1H), 7.10-7.16 (m, 2H), 7.22 (dd, J = 6.3, 2.5 Hz, 1H), 7.32-7.39 (m, 2H).
1H-NMR (CDCl3) δ: 1.15 (d, J = 7.4 Hz, 3H), 1.80 (d, J = 6.9 Hz, 3H), 4.42 (d, J = 13.2 Hz, 1H), 4.86 (d, J = 13.2 Hz, 1H), 5.46-5.57 (m, 1H), 5.83 (d, J = 7.7 Hz, 1H), 6.07 (s, 1H), 6.12 (q, J = 7.1 Hz, 1H), 6.77-6.89 (m, 2H), 7.04-7.17 (m, 3H), 7.33-7.45 (m, 3H).
1H-NMR (CDCl3) δ: 0.96 (d, J = 7.4 Hz, 3H), 3.64 (d, J = 13.7 Hz, 1H), 4.58 (d, J = 13.2 Hz, 1H), 4.64 (d, J = 11.8 Hz, 1H), 4.82-4.91 (m, 2H), 5.33-5.43 (m, 1H), 5.60 (d, J = 13.7 Hz, 1H), 5.86 (d, J = 7.4 Hz, 1H), 6.01 (s, 1H), 6.71-6.83 (m, 2H), 7.02 (d, J = 7.7 Hz, 1H), 7.11 (d, J = 3.6 Hz, 2H), 7.27-7.39 (m, 3H).
1H-NMR (CDCl3) δ: 1.05 (d, J = 7.1 Hz, 3H), 2.49 (s, 6H), 3.50 (d, J = 13.7 Hz, 1H), 4.24 (d, J = 13.2 Hz, 1H), 4.72 (d, J = 13.2 Hz, 1H), 5.35-5.48 (m, 1H), 5.80 (d, J = 8.0 Hz, 1H), 5.91 (d, J = 13.7 Hz, 1H), 6.05 (s, 1H), 6.75-6.86 (m, 2H), 7.02-7.15 (m, 5H), 7.36 (t, J = 7.8 Hz, 1H).
1H-NMR (CDCl3) δ: 1.14 (d, J = 7.4 Hz, 3H), 1.24-1.34 (m, 1H), 1.80 (d, J = 14.8 Hz, 1H), 1.88-2.04 (m, 2H), 2.60-2.70 (m, 1H), 2.70-2.82 (m, 1H), 3.09 (t, J = 11.8 Hz, 1H), 3.59 (d, J = 13.5 Hz, 1H), 4.37 (d, J = 11.5 Hz, 1H), 4.45 (d, J = 13.2 Hz, 1H), 4.81 (d, J = 13.2 Hz, 1H), 5.44-5.54 (m, 1H), 5.58 (d, J = 13.5 Hz, 1H), 5.83 (d, J = 7.7 Hz, 1H), 6.00 (s, 1H), 6.73 (d, J = 7.7 Hz, 1H), 6.78-6.85 (m, 1H), 6.95 (d, J = 7.7 Hz, 1H), 7.07-7.21 (m, 4H).
1H-NMR (CDCl3) δ: 1.08 (d, J = 7.4 Hz, 3H), 2.50 (s, 6H), 3.53 (d, J = 14.0 Hz, 1H), 4.26 (d, J = 13.2 Hz, 1H), 4.74 (d, J = 13.2 Hz, 1H), 5.35-5.45 (m, 1H), 5.87 (d, J = 14.0 Hz, 1H), 6.05 (s, 1H), 6.75 (d, J = 7.7 Hz, 1H), 6.84 (t, J = 6.5 Hz, 1H), 7.07-7.18 (m, 4H), 7.33-7.40 (m, 2H).
1H-NMR (CDCl3) δ: 1.22 (d, J = 6.7 Hz, 3H), 3.49-3.60 (m, 1H), 4.50-4.61 (m, 1H), 4.71 (d, J = 14.8 Hz, 1H), 4.90 (d, J = 11.6 Hz, 1H), 5.40-5.65 (m, 2H), 5.75-5.82 (m, 2H), 6.03-6.16 (m, 1H), 6.37 (d, J = 9.8 Hz, 1H), 6.69 (d, J = 7.3 Hz, 1H), 6.78-6.87 (m, 2H), 6.97 (d, J = 7.3 Hz, 1H), 7.07-7.14 (m, 2H).
1H-NMR (CDCl3) δ: 0.70 (d, J = 7.1 Hz, 3H), 2.46 (s, 3H), 3.73 (d, J = 13.5 Hz, 1H), 4.51 (d, J = 13.2 Hz, 1H), 4.87 (d, J = 13.2 Hz, 1H), 5.41-5.52 (m, 1H), 5.70 (d, J = 13.5 Hz, 1H), 5.85 (d, J = 7.7 Hz, 1H), 5.92 (s, 1H), 6.38 (s, 1H), 6.79-6.90 (m, 2H), 7.07-7.11 (m, 2H), 7.17 (d, J = 8.0 Hz, 1H), 7.22 (d, J = 7.7 Hz, 1H), 7.45 (d, J = 8.0 Hz, 1H).
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.1 Hz, 3H), 2.50 (s, 6H), 2.52 (s, 3H), 3.51 (d, J = 13.7 Hz, 1H), 4.27 (d, J = 13.2 Hz, 1H), 4.73 (d, J = 13.2 Hz, 1H), 5.35-5.48 (m, 1H), 5.93 (d, J = 13.7 Hz, 1H), 6.04 (s, 1H), 6.70-6.83 (m, 2H), 7.00-7.16 (m, 4H), 7.36 (t, J = 7.7 Hz, 1H), 7.84 (s, 1H).
第一工程
化合物759A(124mg、0.35mmol)をジクロロメタンに懸濁した。4,9-ジヒドロベンゾ[e]チエノ[2,3-b]チエピン-オール(82mg、0.35mmol),ジクロロ酢酸(87μL,1.05mmol)を加えて、室温で1時間攪拌した。水を加えてクロロホルムで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物759B(180mg、収率90%)を得た。
MS: m/z = 572.29 [M+H] +.
第二工程
化合物759B(108mg、0.18mmol)をDMAに懸濁した。パラホルムアルデヒド (113mg、0.38mmol),BEMP(0.33mL,1.13mmol)を加えて、氷冷で5分攪拌した後、室温で2日間攪拌した。その後トシルクロライド(72mg、0.38mmol)を加え、3日間攪拌した。飽和塩化アンモニア水を加えて、析出した固体をろ取した。得られた固体をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物759C(16mg、収率15%)を得た。
MS: m/z = 584.25 [M+H] +
第三工程
化合物759C(16mg、0.03mmol)をDMFに懸濁した。塩化リチウム(17mg、0.41mmol)を加えて、90℃で7時間攪拌した。1M塩酸水溶液を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をジオールシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物759(9mg、0.02mmol)を得た。
MS: m/z = 494.18 [M+H] +
第一工程
化合物765A(722mg、2.43mmol)をDMFに懸濁した。N-Bocアゼチジノン(1.25g、7.30mmol),炭酸セシウム(2.96g、12.16mmol)を加えて、氷冷下で30分攪拌した後、室温で30分攪拌した。その後、5-クロロジベンゾスベラン(1.67g、7.30mmol)を加え3時間攪拌した。不溶物をろ別した後、0.5M塩酸水溶液を加え酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物765B(176mg、収率11%)を得た。
MS: m/z = 663.33 [M+H] +.
第二工程
化合物765B(176mg、0.27mmol)をDMAに懸濁した。塩化リチウム(113mg、2.66mmol)を加えて、100℃で2時間攪拌した。0.5M 塩酸水溶液を加え、析出した固体をろ取し、化合物765C(92mg、0.16mmol)を得た。
MS: m/z = 573.29 [M+H] +
第三工程
化合物765C(45mg、0.08mmol)に4N HCl/ジオキサン(0.68mL,2.75mmol)を加えて、氷冷下3時間攪拌した。反応溶液をジイソプロピルエーテルで希釈し、生じた固体をろ取し、化合物765D(29mg、0.057mmol)を得た。
MS: m/z = 474.19 [M+H] +
第四工程
化合物765D(31mg、0.06mmol)をジクロロメタンに懸濁した。37%ホルムアルデヒド(25μL,0.91mmol),トリエチルアミン(10μL、0.07mmol),酢酸(5μL,0.09mmol),NaBH(OAc)3(25mg,0.12mmol)を加えて、室温で1時間攪拌した。飽和重曹水を加えクロロホルムで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去したのち、残渣をヘキサンで固体化し、化合物765(15mg、0.03mmol)を得た。
MS: m/z = 487.25[M+H] +
第一工程
化合物767A(87mg、0.37mmol)をジクロロメタンに懸濁した。塩化チオニル(54μL、0.75mmol)を加えて、2時間加熱還流した。反応液濃縮後、得られた残渣をヘキサンで固体化し、化合物767B(48mg、収率51%)を得た。
第二工程
化合物767B(70mg、0.19mmol)をDMFに懸濁した。化合物12(48mg、0.19mmol)、炭酸セシウム(186mg、0.57mmol)を加えて、室温で2時間攪拌した。不溶物をろ別後、ろ液に水を加え酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物767C(32mg、0.06mmol)を得た。
MS: m/z = 583.16[M+H] +
第三工程
化合物767C(31mg、0.05mmol)をTHF-メタノールに懸濁した。10%パラジウム炭素(15mg)を加えて、水素雰囲気下、室温で24時間攪拌した。不溶物をろ別後、ろ液を濃縮し得られた残渣をジオールシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物767(6mg、0.01mmol)を得た。
MS: m/z = 493.16[M+H]+
第一工程
化合物774A(111mg、0.20mmol)をDMAに懸濁した。パラホルムアルデヒド (11mg、0.39mmol),BEMP(0.34mL,1.17mmol)を加えて、室温で1.5時間攪拌した。その後トシルクロライド(74mg、0.39mmol)を加え、2時間攪拌した。飽和塩化アンモニア水を加えて、析出した固体をろ取した。得られた固体をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物774B(16mg、収率14%)を得た。
MS: m/z = 595.18 [M+H] +
第二工程
化合物774B(16mg、0.03mmol)をDMAに懸濁した。塩化リチウム(11mg、0.27mmol)を加えて、100℃で3時間攪拌した。0.5M 塩酸水溶液を加え、生じた固体をろ取し、化合物774(3mg、0.006mmol)を得た。
MS: m/z = 505.11 [M+H] +
第三工程
化合物774B(21mg、0.04mmol)をメタノールに懸濁した。10%パラジウム炭素(15mg)を加えて、水素雰囲気下、室温で20時間攪拌した。不溶物をろ別後、ろ液を濃縮し得られた残渣をDMAに懸濁した。塩化リチウム(12mg、0.28mmol)を加えて、100℃で3時間攪拌した。0.5M塩酸水溶液を加え、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をジイロプロピルエーテルで固体化することで、化合物775(9mg、0.02mmol)を得た。
MS: m/z = 507.13[M+H]+
第一工程
化合物1-a (50 mg, 0.0900 mmol)とトリエチルアミン(46 mg, 0.45 mmol)のジクロロメタン (1 ml)溶液に、室温下、無水酢酸(28 mg, 0.27 mmol)とDMAP(11 mg, 0.0090 mmol)を加え。同温を保ちながら3時間撹拌した。反応液をジクロロメタン(10 ml)で希釈した後、水を加えた。ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を硫酸ナトリウムで乾燥後、溶媒を留去し、得られた固体を酢酸エチル-ジイソプロピルエーテルで洗浄すると、27 mgの実施例化合物1を得た。
1H-NMR (CDCl3) δ:1.18 (3H, d, J = 7.5 Hz), 2.44 (3H, s), 3.98 (1H, d, J = 14.7 Hz), 4.41 (1H, d, J = 13.5 Hz), 4.95 (1H, d, J = 13.2 Hz), 5.25 (1H, s), 5.46-5.57 (1H, m), 5.86 (1H, d, J = 14.7 Hz), 5.97 (1H, d, J = 7.8 Hz), 6.89-6.94 (2H, m), 7.06-7.21 (3H, m), 7.39 (2H, d, J = 3.9 Hz), 7.78-7.82 (1H, m).
1H-NMR (CDCl3) δ:1.02 (3H, d, J = 6.6 Hz), 1.06 (3H, d, J = 6.9 Hz), 3.58-3.62 (1H, m), 4.36 (1H, d, J = 13.2 Hz), 4.70 (1H, brs), 4.82-4.91 (1H, m), 5.19 (1H, d, J = 8.4 Hz), 5.67-5.75 (1H, m), 6.02 (1H, brs), 6.86 (1H, brs), 7.00-7.08 (3H, m), 7.13-7.51 (4H, m), 7.55-7.63 (2H, m), 8.07 (1H, d, J = 7.5 Hz), 8.26 (2H, d, J = 7.5 Hz).
1H-NMR (CDCl3) δ:1.03 (3H, d, J = 6.6 Hz), 1.08 (3H, d, J = 8.4 Hz), 1.45 (9H, s), 3.56-3.60 (1H, m), 4.33 (1H, d, J = 13.2 Hz), 4.79 (2H, brs), 5.15 (1H, brs), 5.68 (1H, brs), 5.90 (1H, brs), 6.84 (1H, brs), 6.94 (1H, brs), 7.05-7.06 (2H, m), 7.15-7.27 (3H, m), 7.33-7.43 (2H, m).
1H-NMR (CDCl3) δ: 1.16 (3H, d, J = 7.3 Hz), 2.43 (3H, s), 3.64 (1H, d, J = 13.6 Hz), 4.42 (1H, d, J = 12.9 Hz), 4.91 (1H, d, J = 12.9 Hz), 5.18 (1H, s), 5.49 (1H, m), 5.74 (1H, d, J = 13.6 Hz), 6.00 (1H, d, J = 7.7 Hz), 6.79 (1H, t, J = 7.7 Hz), 6.87 (1H, m), 6.97 (1H, dt, J = 2.6, 8.0 Hz), 7.08-7.18 (3H, m), 7.45 (1H, dd, J = 1.5, 8.0 Hz).
MS: m/z = 627 [M+H]+.
Rf: 0.53 (CHCl3:MeOH=9:1) .
1H-NMR (CDCl3) δ: 1.14 (3H, d, J = 7.2 Hz), 2.32 (2H, m), 2.43 (3H, s), 2.65 (2H, t, J = 8.1 Hz), 3.64 (1H, d, J = 14.2 Hz), 3.86 (2H, m), 4.56 (1H, d, J = 13.5 Hz), 4.91 (1H, d, J = 13.5 Hz), 5.17 (1H, s), 5.44 (1H, m), 5.50 (1H, d, J = 14.2 Hz), 5.96 (1H, d, J = 7.8 Hz), 6.88 (1H, m), 7.03-7.16 (3H, m), 7.20 (1H, d, J = 7.8 Hz), 7.30 (3H, m).
MS: m/z = 613 [M+H]+.
Rf: 0.5 (CHCl3:MeOH=9:1).
1H-NMR (CDCl3) δ: 1.13 (3H, d, J = 6.1 Hz), 2.42 (3H, s), 4.31 (1H, d, J = 13.9 Hz), 4.57 (1H, d, J = 12.6 Hz), 4.97 (1H, d, J = 12.6 Hz), 5.26 (1H, s), 5.28 (1H, m), 5.62 (1H, d, J = 13.9 Hz), 5.96 (1H, d, J = 7.8 Hz), 6.87 (1H, m), 7.04-7.12 (3H, m), 7.19 (1H, t, J = 7.9 Hz), 7.32 (1H, d, J = 7.5 Hz), 7.49 (1H, dd, J = 1.2, 7.9 Hz).
MS: m/z = 564 [M+H]+ .
1H-NMR (DMSO-d6) δ: 0.97-1.09 (9H, m), 1.68 (2H, m), 2.55 (2H, t, J = 7.2 Hz), 3.88 (1H, d, J = 13.3 Hz), 4.27 (1H, d, J = 13.7 Hz), 4.59 (1H, m), 4.99 (1H, d, J = 13.6 Hz), 5.33 (1H, s), 5.73 (2H, dd, J = 53.9, 10.8 Hz), 6.83-7.48 (9H, m).
MS: m/z = 504 [M+H]+.
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 7.3 Hz), 2.44 (3H, s), 3.61 (1H, d, J = 13.4 Hz), 4.46 (1H, d, J = 13.1 Hz), 4.91 (1H, d, J = 13.3 Hz), 5.12 (1H, s), 5.42-5.57 (1H, m), 5.64 (1H, d, J = 13.4 Hz), 5.98 (1H, d, J = 7.8 Hz), 6.87 (2H, s), 6.99-7.61 (7H, m).
MS: m/z = 530 [M+H]+.
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 7.3 Hz), 2.44 (3H, s), 3.61 (1H, d, J = 13.4 Hz), 4.46 (1H, d, J = 13.1 Hz), 4.91 (1H, d, J = 13.3 Hz), 5.12 (1H, s), 5.42-5.57 (1H, m), 5.64 (1H, d, J = 13.4 Hz), 5.98 (1H, d, J = 7.8 Hz), 6.87 (2H, s), 6.99-7.61 (7H, m).
1H-NMR (CDCl3) δ: 1.34 (3H, d, J = 7.3 Hz), 2.43 (3H, s), 3.60 (1H, d, J = 13.3 Hz), 4.57 (1H, d, J = 12.5 Hz), 4.97 (1H, d, J = 12.5 Hz), 5.23 (1H, s), 5.29 (1H,m), 5.66 (1H, d, J = 13.1 Hz), 5.97 (1H, d, J = 7.9 Hz), 6.87 (2H, s), 7.05-7.42 (8H, m).
1H-NMR (CDCl3) δ: 1.16 (3H, d, J = 7.4 Hz), 2.46 (3H, s), 3.63 (1H, d, J = 13.5 Hz), 4.46 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.2 Hz), 5.14 (1H, s), 5.51 (1H, m), 5.68 (1H, d, J = 13.5 Hz), 6.07 (1H, d, J = 8.0 Hz), 6.63 (1H, t, J = 8.0 Hz), 6.84 (2H, m), 7.18-7.49 (6H, m).
MS: m/z = 541 [M+H]+.
1H-NMR (CDCl3) δ: 1.21 (3H, d, J = 7.2 Hz), 2.41 (3H, d, J = 15.1 Hz), 3.62 (1H, d, J = 13.6 Hz), 4.44 (1H, d, J = 13.3 Hz), 4.93 (1H, d, J = 13.1 Hz), 5.06 (1H, s), 5.50 (1H, m), 5.58 (1H, d, J = 13.4 Hz), 5.98 (1H, d, J = 7.8 Hz), 6.88-7.39 (8H, m).
1H-NMR (CDCl3) δ: 1.35 (3H, d, J = 7.5 Hz), 2.42 (3H, s), 3.61 (1H, d, J = 13.4 Hz), 4.56 (1H, d, J = 12.8 Hz), 4.99 (1H, d, J = 12.8 Hz), 5.16 (1H, s), 5.23-5.38 (1H, m), 5.59 (1H, d, J = 13.6 Hz), 5.97 (1H, d, J = 7.8 Hz), 6.91-7.38 (8H, m).
1H-NMR (CDCl3) δ: 1.35 (3H, d, J = 7.5 Hz), 2.42 (3H, s), 3.61 (1H, d, J = 13.4 Hz), 4.56 (1H, d, J = 12.8 Hz), 4.99 (1H, d, J = 12.8 Hz), 5.16 (1H, s), 5.23-5.38 (1H, m), 5.59 (1H, d, J = 13.6 Hz), 5.97 (1H, d, J = 7.8 Hz), 6.91-7.38 (8H, m).
1H-NMR (DMSO-d6) δ: 1.07 (4H, m), 1.17 (3H, d, J = 6.9 Hz), 1.88 (1H, m), 3.88 (1H, d, J = 13.6 Hz), 4.38 (1H, d, J = 13.6 Hz), 5.11 (1H, d, J = 13.4 Hz), 5.46 (1H, m), 5.51 (1H, s), 5.63 (1H, d, J = 13.3 Hz), 5.87 (1H, d, J = 7.8 Hz), 6.84-7.60 (9H, m).
MS: m/z = 556 [M+H]+.
1H-NMR (CDCl3) δ: 1.17 (3H, d, J = 7.2 Hz), 2.44 (3H, s), 4.22 (1H, d, J = 13.7 Hz), 4.44 (1H, d, J = 13.3 Hz), 4.93 (1H, d, J = 13.6 Hz), 5.23 (1H, s), 5.42 (1H, d, J = 15.7 Hz), 5.50 (1H, m), 6.00 (1H, d, J = 7.9 Hz), 6.85-7.29 (7H, m).
MS: m/z = 582 [M+H]+.
1H-NMR (CDCl3) δ: 1.34 (3H, d, J = 7.4 Hz), 2.42 (3H, s), 3.60 (1H, d, J = 13.3 Hz), 4.56 (1H, d, J = 12.7 Hz), 4.96 (1H, d, J = 12.4 Hz), 5.20-5.34 (2H, m), 5.65 (1H, d, J = 13.5 Hz), 5.97 (1H, d, J = 7.9 Hz), 6.76-7.41 (9H, m).
MS: m/z = 530 [M+H]+.
1H-NMR (CDCl3) δ: 1.34 (3H, d, J = 7.5 Hz), 1.39 (6H, d, J = 6.8 Hz), 2.92-3.00 (1H, m), 3.59 (1H, d, J = 13.1 Hz), 4.56 (1H, d, J = 12.7 Hz), 4.97 (1H, d, J = 12.2 Hz),5.22-5.30 (2H, m), 5.65 (1H, d, J = 13.7 Hz), 6.00 (1H, d, 7.9 Hz), 6.90-7.39 (9H, m).
MS: m/z = 558 [M+H]+.
1H-NMR (CDCl3) δ: 1.26-1.35 (6H, m), 2.76 (2H, q, J = 7.3 Hz), 3.59 (1H, d, J = 13.2 Hz), 4.56 (1H, d, J = 12.6 Hz), 4.96 (1H, d, J = 12.8 Hz), 5.22-5.30 (2H, m), 5.66 (1H, d, J = 13.4 Hz), 5.95 (1H, d, J = 7.7 Hz), 6.89-7.42 (9H, m).
MS: m/z = 544 [M+H]+.
1H-NMR (CDCl3) δ: 1.12 (3H, d, J = 7.2 Hz), 1.40 (6H, d, J = 6.9 Hz), 2.93-3.02 (1H, m), 3.60 (1H, d, J = 13.1 Hz), 4.44 (1H, d, J = 13.1 Hz), 4.90 (1H, d, J = 12.9 Hz), 5.12 (1H, s), 5.46-5.66 (2H, m), 5.93 (1H, d, J = 7.7 Hz), 6.89 (2H, brs), 7.06-7.28 (5H, m), 7.35-7.44 (2H, m).
MS: m/z = 558 [M+H]+.
1H-NMR (CDCl3) δ: 1.13 (3H, d, J = 6.1 Hz), 1.31 (3H, t, J = 7.5 Hz), 2.77 (2H, q, J = 7.6 Hz), 3.60 (1H, d, J = 13.4 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.90 (1H, d, J = 13.3 Hz), 5.12 (1H, s), 5.44-5.66 (2H, m), 5.95 (1H, d, J = 7.9 Hz), 6.89 (2H, brs), 7.06-7.45 (7H, m).
MS: m/z = 544 [M+H]+.
1H-NMR (CDCl3) δ: 1.09-1.14 (9H, m), 2.26-2.35 (1H, m), 2.60 (2H, d, J = 6.6 Hz), 3.60 (1H, d, J = 13.5 Hz), 4.44 (1H, d, J = 13.0 Hz), 4.90 (1H, d, J = 12.7 Hz), 5.11 (1H, s), 5.46-5.65 (2H, m), 5.94 (1H, d, J = 8.1 Hz), 6.88 (2H, brs), 7.07-7.44 (7H, m).
MS: m/z = 572 [M+H]+.
1H-NMR (CDCl3) δ: 1.05-1.14 (6H, m), 1.81-1.88 (2H, m), 2.71 (2H, t, J = 7.4 Hz), 3.61 (1H, d, J = 13.4 Hz), 4.45 (1H, d, J = 13.4 Hz), 4.91 (1H, d, J = 13.3 Hz), 5.12 (1H, s), 5.47-5.66 (2H, m), 5.95 (1H, d, J = 8.0 Hz), 6.89 (2H, brs), 7.07-7.45 (7H, m).
MS: m/z = 558 [M+H]+.
1H-NMR (DMSO-d6) δ: 1.03 (3H, d, J = 8.0 Hz), 2.29 (3H, s), 3.98 (1H, d, J = 12.0 Hz), 4.53 (1H, d, 12.0 Hz), 5.13 (1H, d, 12.0 Hz), 5.47 (1H, m) , 5.66 (1H, d, J = 12.0 Hz), 5.79 (1H, s), 5.92 (1H, d, J = 8.0 Hz), 6.81 (1H, d, 8.0 Hz), 6.91 (1H, m), 7.13-7.22 (2H, m), 7.27 (1H, d, J = 8.0 Hz), 7.45 (2H, m), 7.51 (1H, m) .
MS: m/z = 564 [M+H]+. RT=2.10 min.
1H-NMR (DMSO-d6) δ: 1.40 (3H, d, J = 8.0 Hz), 2.42 (3H, s), 3.62 (1H, d, J = 12.0 Hz), 4.48 (1H, d, 12.0 Hz), 5.02 (2H, m) , 5.64 (1H, m), 5.97 (1H, d, J = 8.0 Hz), 6.05 (1H, s), 6.91 (1H, m), 7.05-7.15 (2H, m), 7.20-7.35 (5H, m)
MS: m/z = 564 [M+H]+. RT=2.11 min.
1H-NMR (DMSO-d6) δ: 0.94-1.02 (6H, m), 3.89 (1H, d, J = 13.42 Hz), 4.29 (1H, d, J = 13.57 Hz), 4.54 (1H, t, J = 6.79 Hz), 5.04 (1H, d, J = 13.42 Hz), 5.50 (2H, t, J = 51.02 Hz), 5.91 (1H, d, J = 7.78 Hz), 6.87-7.26 (5H, m), 7.42 (4H, dt, J = 21.66, 7.66 Hz), 7.64-7.68 (1H, m), 8.40-8.43 (1H, m), 8.90 (1H, dd, J = 4.73, 1.68 Hz), 9.20 (1H, d, J = 1.68 Hz).
MS: m/z = 539.00 [M+H] +.
Tetrahydro-2H-pyran-4-carboxylic acid (125 mg, 0.958 mmol)とトリエチルアミン(194 mg, 1.92 mmol)のDMF(1 ml)溶液に、室温下、クロロギ酸エチル(94 mg, 0.862 mmol)を滴下した。反応液を同温度で5分間撹拌後、化合物98-a (50 mg, 0.0958 mmol)を加え、さらに5時間撹拌した。反応液を酢酸エチル(10 ml)で希釈し、水を加えた。有機層を分離し、水槽を酢酸エチルで1回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた固体を酢酸エチル-ジイソプロピルエーテルで洗浄すると、30mgの実施例化合物98を得た。
1H-NMR (CDCl3) δ:1.18 (3H, d, J = 7.5 Hz), 1.98-2.13 (4H, m), 2.95-3.03 (1H, m), 3.40-3.57 (2H, m), 3.95-4.14 (2H, m), 4.31 (1H, d, J = 14.1 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.5 Hz), 5.16 (1H, s), 5.45-5.57 (1H, m), 5.60 (1H, d, J = 14.1 Hz), 5.95 (1H, d, J = 7.8 Hz), 6.91 (2H, brs), 7.09-7.26 (5H, m), 7.53 (1H, d, J = 8.1 hz).
1H-NMR (CDCl3) δ:1.16 (3H, d, J = 7.2 Hz), 1.98-2.14 (4H, m), 2.95-3.05 (1H, m), 3.49-3.57 (3H, m), 4.03-4.09 (2H, m), 4.44 (1H, d, J = 13.2 Hz), 4.91 (1H, d, J = 12.9 Hz), 5.13 (1H, s), 5.44-5.54 (1H, m), 5.66 (1H, d, J = 13.5 Hz), 5.94 (1H, d, J = 8.1 Hz), 6.91-6.99 (3H, m), 7.07-7.22 (5H, m).
1H-NMR (CDCl3) δ:1.16 (3H, d, J = 7.2 Hz), 2.01-2.13 (4H, m), 2.95-3.04 (1H, m), 3.49-3.57 (2H, m), 3.96-4.08 (3H, m), 4.41 (1H, d, J = 13.5 Hz), 4.94 (1H, d, J = 13.5 Hz), 5.26 (1H, s), 5.45-5.55 (1H, m), 5.86 (1H, d, J = 14.7 Hz), 5.95 (1H, d, J = 7.5 Hz), 6.91-6.93 (2H, m), 7.07-7.19 (3H, m), 7.38-7.39 (2H, m), 7.79-7.82 (1H, m).
1H-NMR (CDCl3) δ:1.15 (3H, d, J = 7.2 Hz), 1.98-2.12 (4H, m), 2.94-3.04 (1H, m), 3.48-3.56 (2H, m), 4.04-4.07 (2H, m), 4.21 (1H, d, J = 13.8 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.20 (1H, s), 5.37 (1H, d, J = 13.5 Hz), 5.43-5.54 (1H, m), 5.93 (1H, d, J = 7.8 Hz), 6.77 (1H, brs), 6.82-6.86 (1H, m), 6.97-6.99 (1H, m), 7.04 (2H, d, J = 7.5 Hz), 7.17-7.25 (3H, m).
1H-NMR (CDCl3) δ:1.19 (3H, d, J = 7.2 Hz), 2.50 (6H, s), 3.55-3.68 (2H, m), 4.31 (1H, d, J = 13.8 Hz), 4.44 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.45-5.58 (1H, m), 5.61 (1H, d, J = 13.8 Hz), 5.95 (1H, d, J = 7.8 Hz), 6.90 (2H, brs), 7.07-7.11 (3H, m), 7.16-7.25 (2H, m), 7.52 (2H, d, J = 6.9 Hz).
1H-NMR (CDCl3) δ:1.18 (3H, d, J = 7.2 Hz), 2.17 (2H, s), 3.32 (3H, s), 3.63-3.66 (2H, m), 3.87-3.90 (2H, m), 4.31 (1H, d, J = 13.8 Hz), 4.45 (1H, d, J = 13.5 Hz), 6.60 (2H, d, J = 2.1 Hz), 4.92 (1H, d, J = 12.6 Hz), 5.15 (1H, s), 5.44-5.54 (1H, m),
5.60 (1H, d, J = 13.8 Hz), 5.95 (1H, d, J = 7.8 Hz), 6.89-6.90 (2H, m), 7.07-7.14 (3H, m), 7.16-7.25 (2H, m), 7.52 (1H, d, J = 6.9 Hz).
1H-NMR (CDCl3) δ: 1.19 (3H, d, J = 7.2 Hz), 2.09 (4H, m), 3.03 (1H, dm), 3.55 (2H, m), 4.10 (2H, m), 4.26 (1H, d, J = 13.6 Hz), 4.48 (1H, d, J = 13.1 Hz), 4.96 (1H, d, J = 12.8 Hz), 5.28 (1H, s), 5.46 (1H, d, J = 13.4 Hz), 5.54 (1H, d, J = 8.1 Hz), 6.03 (1H, d, J = 7.9 Hz), 6.94-7.34 (7H, m).
MS: m/z = 652 [M+H]+.
Bioorganic & Medicinal Chemistry Letters; English; 14; 12; 2004; 3231 - 3234に示される方法に従い、2-(tert-butyldimethylsilyloxy)acetic acid (82 mg, 0.958 mmol)と、トリエチルアミン(194 mg, 1.92 mmol)のDMF(1 ml)溶液に室温下、クロロギ酸エチル(93 mg, 0.862 mmol)を加え、同温度で3分間撹拌した。反応液に化合物98-a (50 mg, 0.0958 mmol)を加え、さらに1時間撹拌した。反応液を酢酸エチル(10 ml)で希釈し、水を加えた。有機層を分離し、水槽を酢酸エチルで1回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をTHF (2 ml)に溶解させ、室温下、TBAF 1M THF溶液 (0.287 ml, 0.287 mmol)を加え、同温度で30分撹拌した。反応液に水を加え、酢酸エチルで2回抽出した。抽出液を硫酸ナトリウムで乾燥し溶媒を留去後、得られた固体を酢酸エチル-ジイソプロピルエーテルで洗浄すると、30mgの実施例化合物105を得た。
1H-NMR (CDCl3) δ:1.24 (3H, d, J = 7.2 Hz), 4.36 (1H, d, J = 14.1 Hz), 4.52 (1H, d, J = 13.2 Hz), 4.62 (1H, d, J = 16.5 Hz), 4.90-4.97 (2H, m), 5.14 (1H, s), 5.51-5.62 (2H, m), 6.12 (1H, d, J = 7.8 Hz), 6.68 (1H, d, J = 7.2 Hz), 6.84-6.90 (1H, m), 7.10-7.18 (3H, m), 7.20-7.24 (1H, m), 7.37 (1H, d, J = 7.8 Hz), 7.55 (1H, d, J = 6.9 Hz).
(S)-2-(tert-butoxycarbonylamino)propanoic acid (301 mg, 1.59 mmol) をTHF (2 ml) に溶解し、N-メチルモルホリン (0.175 ml, 1.59 mmol) とisobutyl chloroformate (0.209 ml, 1.59 mmol) を0℃で加えてそのまま15分攪拌した。実施例に従い合成した106-a (69.0 mg, 0.159 mmol) のジクロロメタン溶液 (1 ml) を0℃で加えて室温で4時間攪拌した。反応液に水を加え、酢酸エチルで抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することによって精製した。ジクロロメタン‐ジイソプロピルエーテル‐ジエチルエーテルを加え固化させることにより、40 mgの白色固体として実施例化合物106を得た。
第一工程
(R)-Methyl 2,2-dimethyl-1,3-dioxolane-4-carboxylate (107-a, 11.22 g, 70.1 mmol) のメタノール (80 mL) 溶液に室温で水酸化ナトリウム1水和物 (2.94 g, 70.1 mmol) を加え,3時間攪拌した.溶媒を減圧下留去して得られた残さに氷冷下,2N塩酸 (35 mL) を加え,クロロメタン (100 mL x 2) で抽出した.有機層を水 (50 mL) で洗浄し,硫酸マグネシウムで乾燥した.溶媒を減圧下留去して得られる化合物107-bの粗生成物を生成することなく,次の反応に用いた.
第二工程
化合物98-a (41.7 mg, 0.285 mmol) ,トリエチルアミン (0.106 mL, 0.765 mmol) および4-ジメチルアミノピリジン (5.7 mg, 0.047 mmol) のジクロロメタン (2 mL) 溶液に,室温で2-methyl-6-nitrobenzoic anhydride (100 mg, 0.290 mmol) を加え,10分間攪拌した.反応液に化合物5C (51.7 mg, 0.099 mmol) を加え,1.5時間攪拌した.反応液に水 (2 mL) を加えた後,字クロロメタンで抽出し,有機層を硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 60% → 100%) で精製し,実施例化合物107 (40.4 mg, 63 %) を白色固体として得た.
MS: m/z = 650.35 [M+H] +.
第一工程
化合物98-a (50.0 mg, 0.096 mmol) ,トリエチルアミン (0.0660 mL, 0.476 mmol) およびN-メチルイミダゾール (0.0038 mL, 0.048 mmol) のジクロロメタン (1 mL) 溶液に室温で,3-Methoxypropionyl chloride (33.0 mg, 0.269 mmol) を加え,16時間攪拌した.反応液に水 (1 mL) および塩酸 (2M, 1 mL) を加え,ジクロロメタンで抽出し,有機層を硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 60% → 100%) で精製して得られた生成物を酢酸エチル-イソプロピルエーテルで粉末化し,実施例化合物108 (47.0 mg, 81 %) を白色固体として得た.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.2 Hz), 3.03 (2H, t, J = 6.9 Hz), 3.43 (3H, s), 3.85 (2H, m), 4.31 (1H, d, J = 13.7 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.16 (1H, s), 5.52 (1H, m), 5.60 (1H, d, J = 13.7 Hz), 5.96 (1H, d, J = 8.1 Hz), 6.90 (2H, m), 7.10 - 7.23 (5H, m), 7.53 (1H, d, J = 8.1 Hz).
MS: m/z = 608.20 [M]+.
実施例108に従い,実施例化合物109を同様の手法により合成した.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.5 Hz), 2.83 (2H, t, J = 7.4 Hz), 3.10 (2H, t, J = 7.4 Hz), 3.74 (3H, s), 4.31 (1H, d, J = 13.8 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.15 (1H, s), 5.50 (1H, m), 5.60 (1H, d, J = 13.8 Hz), 5.96 (1H, d, J = 8.1 Hz), 6.91 (2H, m), 7.10 - 7.23 (5H, m), 7.53 (1H, d, J = 8.1 Hz).
MS: m/z = 636.15 [M]+.
実施例108に従い,実施例化合物110を同様の手法により合成した.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.2 Hz), 2.22 (3H, s), 4.31 (1H, d, J = 13.8 Hz), 4.46 (1H, d, J = 13.4 Hz), 4.92 (1H, d, J = 13.4 Hz), 5.05 (1H, d, J = 16.5Hz), 5.15 (1H, d, J = 16.5Hz), 5.15 (1H, s), 5.54 (1H, m), 5.60 (1H, d, J = 13.8 Hz), 5.97 (1H, d, J = 8.1 Hz), 6.82 - 6.94 (2H, m), 7.09 - 7.23 (5H, m), 7.54 (1H, d, J = 8.1 Hz).
MS: m/z = 622.15 [M]+.
化合物98-a (50 mg, 0.10 mmol) のジクロロメタン (1.0 mL) 溶液を氷冷し、トリエチルアミン (0.040 ml, 0.29 mmol) および2-methoxyacetyl chloride (11 mg, 0.11 mmol) を加え、氷冷下で1時間攪拌した後、室温で2時間攪拌した。その後、反応液に酢酸エチルを加え、水で洗浄後、硫化ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物を酢酸エチルを用いて固体を析出させ、白色固体として31 mg の実施例化合物111を得た。
1H-NMR (CDCl3) δ: 1.19 (3H, d, 7.1 Hz), 3.59 (3H, s), 4.31 (1H, d, J = 13.9 Hz), 4.41-4.54 (3H, m), 4.93 (1H, d, J = 13.3 Hz), 5.16 (1H, s), 5.46-5.63 (2H, m), 5.97 (1H, d, J = 7.9 Hz), 6.90 (2H, brs), 7.09-7.24 (5H, m), 7.53 (1H, d, J = 7.4 Hz).
MS: m/z = 594 [M+H]+.
第一工程
化合物106-a (100 mg, 0.231 mmol) とchloromethyl pivalate (482 mg, 3.20 mmol) とヨウ化ナトリウム (480 mg, 3.20 mmol) のアセトニトリル (2 ml)溶液を80℃で6時間撹拌した。室温まで放冷した後、水を加え酢酸エチルで3回抽出した。合わせた抽出液を硫酸ナトリウムで乾燥し、溶媒を留去した。得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに酢酸エチルで溶出し、次いで酢酸エチル-メタノール(7:3, v/v)で溶出した。目的の画分を濃縮すると固体として35 mgの実施例化合物112を得た。
1H-NMR (CDCl3) δ:1.06 (3H, d, J = 16.2 Hz), 10.9 (3H, d, J = 9.3 Hz), 1.26 (9H, s), 3.58 (1H, d, J = 13.2 Hz), 4.29 (1H, d, J = 13.2 Hz), 4.73-4.82 (1H, m), 4.77 (1H, d, J = 12.9 Hz), 5.10 (1H, s), 5.68 (2H, d, J = 13.2 Hz), 5.88-5.93 (3H, m), 6.86-6.88 (2H, m), 7.04-7.10 (2H, m), 7.15-7.27 (3H, m), 7.32-7.42 (2H, m).
化合物113-a (50 mg, 0.10 mmol) と炭酸カリウム (40 mg, 0.29 mmol) の水 (0.5 mL)懸濁液に、tetrabutylammonium hydrogen sulfate (33 mg, 0.10 mmol) およびジクロロメタン (1.0 ml) を加え、室温で10分間攪拌した。反応液にiodomethyl acetate (56 mg, 0.19 mmol) のジクロロメタン (1.0 ml) 溶液を加え、さらに2時間攪拌した。その後、反応液に水を加え、ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を飽和食塩水およびbrineで洗浄後、硫化ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (94:6, v/v) で溶出した。目的の画分を濃縮し、ジイソプロピルエーテルを加えて固化させることにより、白色固体として41 mg の実施例化合物113を得た。
1H-NMR (DMSO-d6) δ: 0.98 (3H, d, J = 7.2 Hz), 2.02 (3H, s), 3.98 (1H, d, J = 7.2 Hz), 4.48 (1H, d, J = 7.2 Hz), 5.05 (1H, d, J = 7.2 Hz), 5.42-5.49 (1H, m), 5.61 (1H, d, J = 7.2 Hz), 5.66-5.77 (3H, m), 5.87 (1H, d, J = 7.2 Hz), 6.86-6.95 (2H, m), 7.16-7.20 (3H, m), 7.45-7.52 (3H, m).
MS: m/z = 594 [M+H]+.
1H-NMR (CDCl3) δ: 1.07 (3H, d, J = 6.6 Hz), 1.09 (3H, d, J = 6.6 Hz), 2.15 (3H, s), 7.58 (1H, d, J = 13.5 Hz), 4.30 (1H, d, J = 12.9 Hz), 4.75-4.83 (1H, m), 4.77 (1H, d, J = 12.9 Hz), 5.12 (1H, s), 5.69 (d, J = 13.5 Hz), 5.82-5.92 (3H, m), 6.84-6.91 (2H, m), 7.04-7.08 (2H, m), 7.20-7.28 (3H, m), 7.32-7.42 (2H, m).
1H-NMR (CDCl3) δ: 1.17 (3H, d, J = 7.3 Hz), 2.12 (3H, s), 3.90 (1H, d, J = 14.7 Hz), 4.38 (1H, d, J = 13.3 Hz), 4.91 (1H, d, J = 13.3 Hz), 5.23 (1H, s), 5.57 (1H, m), 5.86 (1H, d, J = 6.4 Hz), 5.86 (1H, d, J = 14.7 Hz), 5.94 (1H, d, J = 7.8 Hz), 6.84 (1H, dd, J = 1.2, 7.9 Hz), 6.91 (1H, dt, J = 1.7, 6.8 Hz), 7.09 (1H, dd, J = 1.4, 7.6 Hz), 7.12 (1H, dd, J = 1.4, 6.6 Hz), 7.16 (1H, d, J = 7.8 Hz), 7.6-7.42 (2H, m), 7.81 (1H, dd, J = 2.1, 6.8 Hz).
MS: m/z = 628 [M+H]+ .
1H-NMR (CDCl3) δ: 1.19 (3H, d, J = 7.2 Hz), 2.15 (3H, s), 4.26 (1H, d, J = 13.9 Hz), 4.45 (1H, d, J = 12.9 Hz), 4.92 (1H, d, J = 13.3 Hz), 5.24 (1H, s), 5.45 (1H, dd, J = 13.8, 1.9 Hz), 5.53-5.63 (1H, m), 5.89 (1H, d, J = 6.4 Hz), 5.95 (1H, d, J = 6.4 Hz), 6.01 (1H, d, J = 7.7 Hz), 6.84-7.34 (7H, m).
MS: m/z = 612 [M+H]+.
1H-NMR (CDCl3) δ: 1.17 (3H, d, J = 7.2 Hz), 2.10 (3H, s), 4.11 (1H, d, J = 13.6 Hz), 4.42 (1H, d, J = 13.1 Hz), 4.89 (1H, d, J = 13.0 Hz), 5.13 (1H, s), 5.33 (1H, dd, J = 13.6, 2.2 Hz), 5.55 (1H, m), 5.84-5.94 (3H, m), 6.81-7.25 (8H, m).
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.3 Hz), 2.11 (3H, s), 3.56 (1H, d, J = 13.6 Hz), 4.42 (1H, d, J = 13.0 Hz), 4.88 (1H, d, J = 13.4 Hz), 5.10 (1H, s), 5.55 (1H, m), 5.67 (1H, d, J = 13.4 Hz), 5.85-5.94 (3H, m), 6.81-7.26 (8H, m).
MS: m/z = 578 [M+H]+.
1H-NMR (CDCl3) δ: 1.13 (3H, d, 6.1 Hz), 2.10 (3H, s), 3.60 (1H, d, 13.4 Hz), 4.42 (1H, d, J = 13.0 Hz), 4.87 (1H, d, J = 13.1 Hz), 5.07 (1H, s), 5.48-5.64 (2H, m), 5.85-5.97 (3H, m), 6.80-6.89 (2H, m), 7.05-7.44 (7H, m).
MS: m/z = 560 [M+H]+.
1H-NMR (CDCl3) δ: 1.18 (3H, d, 7.3 Hz), 2.10 (3H,s), 4.31 (1H, d, 13.9 Hz), 4.42 (1H, d, J = 13.3 Hz), 4.88 (1H, d, J = 12.8 Hz), 5.12 (1H, s), 5.50-5.62 (2H, m), 5.84-5.94 (3H, m), 6.80-6.91 (2H, m), 7.07-7.22 (5H, m), 7.52 (1H, d, J = 7.6 Hz).
MS: m/z = 594 [M+H]+.
化合物122-a (50 mg, 0.10 mmol) と炭酸カリウム (138 mg, 0.22 mmol) の水 (1.0 mL)懸濁液に、tetrabutylammonium hydrogen sulfate (34 mg, 0.10 mmol) およびジクロロメタン (0.5 ml) を加え、室温で10分間攪拌した。反応液にiodomethyl 2-methoxyethyl carbonate (57 mg, 0.22 mmol) のジクロロメタン (0.5 ml) 溶液を加え、さらに2時間攪拌した。その後、反応液に水を加え、ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を飽和食塩水およびbrineで洗浄後、硫化ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (94:6, v/v) で溶出した。目的の画分を濃縮し、ヘキサン-ジエチルエーテルを用いて洗浄することにより、白色固体として39 mg の実施例化合物122を得た。
1H-NMR (CDCl3) δ: 1.15 (3H, d, J = 7.2 Hz), 3.38 (3H, s), 3.58-3.69 (3H, m), 4.28-4.44 (3H, m), 4.87 (1H, d, J = 13.0 Hz), 5.09 (1H, s), 5.51-5.66 (2H, m), 5.90-5.96 (3H, m), 6.84-7.44 (9H, m).
MS: m/z = 620 [M+H]+.
実施例122に従い、実施例化合物123を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.32 (3H, d, J = 7.3 Hz), 3.39 (3H, s), 3.59 (1H, d, J = 13.3 Hz), 3.68-3.71 (2H, m), 4.39 (2H, dt, J = 7.22, 2.14 Hz), 4.53 (1H, d, J = 12.7 Hz), 4.92 (1H, d, J = 12.7 Hz), 5.23-5.36 (2H, m), 5.67 (1H, d, J = 13.2 Hz), 5.84 (1H, d, J = 6.4 Hz), 5.92 (1H, d, J = 6.5 Hz), 5.95 (1H, d, J = 7.8 Hz), 6.83-7.41 (9H, m).
MS: m/z = 620 [M+H]+.
実施例122に従い、実施例化合物124を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.10 (3H, d, J = 7.3 Hz), 3.60 (1H, d, J = 13.4 Hz), 3.75 (2H, t, J = 4.4 Hz), 4.33-4.42 (3H, m), 4.57 (2H, s), 4.85 (1H, d, J = 13.6 Hz), 5.07 (1H, s), 5.46-5.64 (2H, m), 5.90-5.96 (3H, m), 6.82-6.88 (2H, m), 7.06-7.43 (12H, m).
MS: m/z = 696 [M+H]+.
実施例122に従い、実施例化合物125を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.14 (3H, d, J = 7.2 Hz), 3.61 (1H, d, J = 13.4 Hz), 3.83 (3H, s), 4.42 (1H, d, J = 13.2 Hz), 4.87 (1H, d, J = 13.0 Hz), 5.08 (1H, s), 5.48-5.65 (2H, m), 5.87 (1H, d, J = 6.5 Hz), 5.94 (1H, d, J = 6.2 Hz), 5.96 (1H, d, J = 4.8 Hz), 6.79-6.85 (2H, m), 7.05-7.44 (7H, m).
MS: m/z = 576 [M+H]+.
実施例122に従い、実施例化合物126を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.13 (3H, d, 6.0 Hz), 3.36 (3H, s), 3.52-3.79 (7H, m), 4.31-4.44 (3H, m), 4.87 (1H, d, J = 13.0 Hz), 5.09 (1H, s), 5.50-5.73 (2H, m), 5.89-5.98 (3H, m), 6.81-6.88 (2H, m), 7.05-7.45 (7H, m).
MS: m/z = 664 [M+H]+.
実施例122に従い、実施例化合物127を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.19 (3H, d, 7.2 Hz), 3.37 (1H, s), 3.62-3.69 (2H, m), 4.29-4.43 (4H, m), 4.88 (1H, d, J = 13.6 Hz), 5.14 (1H, s), 5.50-5.63 (2H, m), 5.90-5.96 (3H, m), 6.82-6.89 (2H, m), 7.05-7.24 (5H, m), 7.52 (1H, d, J = 7.9 Hz).
MS: m/z = 654 [M+H]+.
実施例122に従い、実施例化合物128を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.19 (3H, d, 7.2 Hz), 3.83 (3H, s), 4.31 (1H, d, J = 13.9 Hz), 4.42 (1H, d, J = 13.1 Hz), 4.89 (1H, d, J = 13.4 Hz), 5.12 (1H, s), 5.49-5.61 (2H, m), 5.87 (1H, d, J = 6.5 Hz), 5.93-5.97 (2H, m), 6.77-6.89 (2H, m), 7.09-7.24 (5H, m), 7.52 (1H, d, J = 8.2 Hz).
MS: m/z = 610 [M+H]+.
実施例122に従い、実施例化合物129を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.21 (3H, d, 7.3 Hz), 3.77 (3H, s), 4.31 (1H, d, J = 14.0 Hz), 4.43 (1H, d, J = 13.3 Hz), 4.60-4.70 (2H, m), 4.85-4.93 (2H, m), 5.31 (1H, s), 5.56-5.66 (2H, m), 5.93-6.01 (3H, m), 6.86-6.92 (2H, m), 7.08-7.51 (5H, m), 7.52 (1H, d, J = 7.8 Hz).
MS: m/z = 668 [M+H]+.
実施例122に従い、実施例化合物130を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.16-1.37 (3H, m), 2.77-2.87 (1H, m), 3.04-3.15 (1H, m), 3.41-3.53 (1H, m), 3.83-3.89 (3H, m), 4.24-4.42 (2H, m), 4.70-4.82 (1H, m), 5.02-5.45 (2H, m), 5.82-5.99 (3H, m), 6.72-7.35 (9H, m).
MS: m/z = 558 [M+H]+.
実施例122に従い、実施例化合物131を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.17 (3H, d, 7.2 Hz), 3.65 (1H, d, J = 13.4 Hz), 3.83 (3H,s), 4.41 (1H, d, 13.3 Hz), 4.88 (1H, d, J = 13.4 Hz), 5.17 (1H, s), 5.47-5.57 (1H, m), 5.68 (1H, d, J = 13.4 Hz), 5.87 (1H, d, J = 6.6 Hz), 5.95-6.00 (2H, m), 6.65 (1H, d, J = 7.3 Hz), 6.83-6.99 (3H, m), 7.01-7.20 (3H, m).
MS: m/z = 612 [M+H]+.
実施例122に従い、実施例化合物132を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12 (3H, d, 7.2 Hz), 3.62 (1H, d, J = 13.3 Hz), 3.83 (3H,s), 4.40 (1H, d, 12.9 Hz), 4.86 (1H, d, J = 12.7 Hz), 5.06 (1H, s), 5.48-5.62 (2H, m), 5.88 (1H, d, J = 6.5 Hz), 5.97 (1H, d, J = 6.6 Hz), 6.02 (1H, d, J = 7.8 Hz), 6.75-6.85 (2H, m), 7.08-7.43 (6H, m).
MS: m/z = 610 [M+H]+.
実施例122に従い、実施例化合物133を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.11 (3H, d, 7.1 Hz), 3.68 (1H, d, J = 13.4 Hz), 3.84 (3H,s), 4.43 (1H, d, 13.5 Hz), 4.88 (1H, d, J = 12.8 Hz), 5.16 (1H, s), 5.47-5.64 (2H, m), 5.90 (1H, d, J = 6.4 Hz), 5.95-5.99 (2H, m), 7.00 (1H, d, J = 7.7 Hz), 7.11-7.49 (8H, m).
MS: m/z = 644 [M+H]+.
実施例122に従い、実施例化合物134を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.19-1.35 (3H, m), 2.77-2.89 (1H, m), 3.04-3.14 (1H, m), 3.37-3.51 (1H, m), 3.83-3.89 (3H, m), 4.27-4.41 (2H, m), 4.71-4.82 (1H, m), 5.03-5.52 (2H, m), 5.89-6.00 (3H, m), 6.68-7.19 (7H, m).
MS: m/z = 594 [M+H]+.
実施例122に従い、実施例化合物135を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.18 (3H, d, 7.4 Hz), 3.83 (3H,s), 4.37-4.43 (2H, m), 4.89 (1H, d, J = 12.9 Hz), 5.19 (1H, s), 5.49-5.64 (2H, m), 5.87 (1H, d, J = 6.5 Hz), 5.95-6.00 (2H, m), 6.65 (1H, d, J = 7.3 Hz), 7.07-7.25 (4H, m), 7.54 (1H, d, J = 7.0 Hz).
MS: m/z = 628 [M+H]+.
実施例122に従い、実施例化合物136を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.13 (3H, d, 7.0 Hz), 3.61 (1H, d, J = 13.7 Hz), 3.83 (3H,s), 4.40 (1H, d, J = 13.0 Hz), 4.86 (1H, d, J = 13.5 Hz), 5.08 (1H, s), 5.49-5.65 (2H, m), 5.88 (1H, d, J = 6.5 Hz), 5.95-6.02 (2H, m), 6.53-6.60 (1H, m), 6.79-6.84 (2H, m), 7.14-7.43 (5H, m).
MS: m/z = 594 [M+H]+.
実施例122に従い、実施例化合物137を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.08 (3H, d, 7.2 Hz), 3.38 (3H,s), 3.60-3.68 (3H, m), 4.28-4.39 (3H, m), 4.85 (1H, d, J = 13.0 Hz), 5.48-5.57 (1H, m), 5.65 (1H, d, J = 13.6 Hz), 5.87-5.98 (4H, m), 6.87-6.96 (2H, m), 7.07-7.17 (3H, m), 7.25-7.34 (3H, m).
MS: m/z = 654 [M+H]+.
実施例122に従い、実施例化合物138を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.18 (3H, d, 7.4 Hz), 1.81 (2H,brs), 2.02 (2H,brs), 3.54-3.62 (2H, m), 3.91-3.99 (3H, m), 4.31 (1H, d, J = 13.7 Hz), 4.42 (1H, d, J = 12.9 Hz), 4.86-4.92 (2H, m), 5.11 (1H, s), 5.45-5.61 (2H, m), 5.90-5.95 (3H, m), 6.71-6.87 (2H, m), 7.03-7.25 (5H, m), 7.52 (1H, d, J = 6.9 Hz).
MS: m/z = 680 [M+H]+.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.2Hz), 3.84 (3H, s), 3.99 (1H, d, J = 14.7Hz), 4.39 (1H, d, J = 13.2Hz), 4.92 (1H, d, J = 13.2 Hz), 5.23 (1H, s) , 5.55 (1H, m), 5.8-6.0 (4H, m), 6.7-7.0 (2H, m), 7.0-7.3 (3H, m), 7.3-7.5 (2H, m), 7.81 (1H, dd, J = 6.3 Hz, J = 2.7 Hz)
MS: m/z = 644 [M+H]+.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.5Hz), 3.85 (3H, s), 4.24 (1H, d, J = 13.8Hz), 4.43 (1H, d, J = 13.2Hz), 4.91 (1H, d, J = 13.2 Hz), 5.23 (1H, s), 5.43 (1H, d, J = 13.8 Hz), 5.54 (1H, m), 5.8-6.1 (3H, m), 6.7-7.1 (3H, m), 7.1-7.4 (4H, m)
MS: m/z = 628 [M+H]+.
1H-NMR (CDCl3) δ: 1.17 (3H, d, J = 7.5Hz), 2.25 (3H, s), 3.83 (3H, s), 4.21 (1H, d, J = 13.8Hz), 4.43 (1H, d, J = 13.5Hz), 4.90 (1H, d, J = 13.5 Hz), 5.17 (1H, s), 5.37 (1H, d, J = 15.6 Hz), 5.53 (1H, m), 5.8-6.0 (3H, m), 6.6-6.8 (2H, m), 6.9-7.1 (2H, m) , 7.1-7.3 (3H, m)
MS: m/z = 608 [M+H]+.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 6.9Hz), 3.84 (3H, s), 4.12 (1H, d, J = 13.8Hz), 4.42 (1H, d, J = 13.2Hz), 4.90 (1H, d, J = 13.2 Hz), 5.14 (1H, s), 5.34 (1H, d, J = 13.8 Hz), 5.54 (1H, m), 5.8-6.0 (3H, m), 6.7-6.9 (2H, m), 6.9-7.1 (3H, m) , 7.1-7.3 (3H, m)
MS: m/z = 594 [M+H]+.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.5Hz), 3.56 (1H, d, J = 13.5Hz), 3.84 (3H, s), 4.42 (1H, d, J = 13.2Hz), 4.89 (1H, d, J = 13.2 Hz), 5.10 (1H, s), 5.53 (1H, m), 5.66 (1H, d, J = 13.5 Hz), 5.8-6.0 (3H, m), 6.7-7.0 (3H, m), 7.0-7.3 (5H, m)
MS: m/z = 594 [M+H]+.
1H-NMR (CDCl3) δ: 1.08 (3H, d, J = 7.2Hz), 3.63 (1H, d, J = 12.6Hz), 3.83 (3H, s), 4.39 (1H, d, J = 13.2Hz), 4.86 (1H, d, J = 13.2 Hz), 5.23 (1H, m), 5.65 (1H, d, J = 13.5 Hz), 5.8-6.0 (4H, m), 6.8-7.0 (2H, m), 7.0-7.2 (3H, m) , 7.2-7.4 (3H, m)
MS: m/z = 610 [M+H]+.
1H-NMR (CDCl3) δ: 1.13 (3H, d, J = 6.0 Hz), 1.34 (3H, t, J = 7.1 Hz), 3.65 (1H, m), 4.29 (3H, m), 4.42 (1H, d, J = 13.5 Hz), 4.90 (1H, d, J = 13.5 Hz), 5.13 (1H, s), 5.58 (2H, m), 5.92 (3H, m), 6.82 (2H, m), 7.00 - 7.26 (5H, m), 7.53 (1H, d, J = 8.4 Hz).
MS: m/z = 624.15 [M]+.
1H-NMR (CDCl3) δ: 1.18 (3H, d, J = 7.2 Hz), 1.34 (3H, t, J = 6.3 Hz), 1.35 (3H, t, J = 6.3 Hz), 4.32 (1H, d, J = 13.7 Hz), 4.42 (1H, d, J = 13.1 Hz), 4.89 (1H, d, J = 13.1 Hz), 4.96 (1H, m), 5.13 (1H, s), 5.54 (1H, m), 5.60 (1H, d, J = 13.7 Hz), 5.87 (1H, d, J = 6.8 Hz), 5.95 (2H, d, J = 6.9 Hz), 6.85 (2H, m), 7.06 - 7.26 (5H, m), 7.53 (1H, d, J = 6.8 Hz).
MS: m/z = 638.15 [M]+.
実施例122に従い、化合物151-aを同様の手法により合成した。
化合物151-a (67 mg, 0.093 mmol) の酢酸エチル (2.0 mL) 溶液に、4N HCl 酢酸エチル溶液(2.0 ml) を加え、室温で終夜攪拌した。その後、反応液に酢酸エチルおよび水を加え、酢酸エチル層を分離し、水層を酢酸エチルで2回抽出した。合わせた抽出液に硫化ナトリウムを加え、乾燥した後、溶媒を留去した。得られた油状物にジイソプロピルエーテルを加え、析出した固体をろ取することにより、白色固体として12 mg の実施例化合物151を得た。
1H-NMR (CDCl3) δ: 1.24 (3H, d, 6.8 Hz), 2.80 (2H, brs), 4.31 (1H, d, J = 13.7 Hz), 4.40-4.51 (3H, m), 4.86 (2H, m), 4.86 (1H, d, 13.1 Hz), 5.21 (1H, s), 5.53-5.62 (2H, m), 5.83-5.93 (3H, m), 6.75-6.86 (2H, m), 7.09-7.25 (5H, m), 7.48 (1H, d, J = 9.0 Hz).
MS: m/z = 668 [M+H]+.
1-chloroethyl methyl carbonate (166 mg, 0.96 mmol) のアセトニトリル (1.5 mL) 溶液に化合物98-a (43 mg, 0.29 mmol) および酸化銀(I) (44 mg, 0.10 mmol)を加え、50℃で4時間攪拌した後、室温で終夜静置した。その後、反応液をセライトでろ過し、溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (95:5, v/v) で溶出した。目的の画分を濃縮し、ヘキサン-ジイソプロピルエーテルを用いて洗浄することにより、白色固体として54 mg の実施例化合物152を得た。
1H-NMR (CDCl3) δ: 1.14-1.16 (3H, m), 1.82-1.85 (3H, m), 3.66-3.83 (3H, m), 4.27-4.43 (2H, m), 4.82-4.91 (1H, m), 5.10-5.12 (1H, m), 5.54-5.62 (2H, m), 5.89-5.93 (1H, m), 6.52-6.56 (1H, m), 6.75-6.98 (2H, m), 7.07-7.21 (5H, m), 7.52 (1H, d, J = 8.1 Hz).
MS: m/z = 624 [M+H]+.
実施例152に従い、実施例化合物153を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.14-1.16 (3H, m), 1.21-1.41 (3H, m), 1.84 (3H, d, J = 5.1 Hz), 4.02-4.43 (4H, m), 4.83-4.89 (1H, m), 5.09-5.11 (1H, m), 5.54-5.61 (2H, m), 5.88-5.92 (1H, m), 6.48-6.55 (1H, m), 6.75-7.21 (7H, m), 7.51 (1H, d, J = 8.2 Hz).
MS: m/z = 638 [M+H]+.
実施例152に従い、実施例化合物154を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.10-1.43 (9H, m), 1.83 (3H, d, J = 5.3 Hz), 4.27-4.43 (2H, m), 4.67-4.90 (2H, m), 5.08-5.12 (1H, m), 5.54-5.60 (2H, m), 5.86-5.91 (1H, m), 6.43-6.57 (1H, m), 6.71-7.20 (7H, m), 7.51 (1H, d, J = 8.1 Hz).
MS: m/z = 652 [M+H]+.
実施例152に従い、実施例化合物155を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12-1.15 (3H, m), 1.82-1.85 (3H, m), 3.66-3.84 (3H, m), 4.08-4.14 (1H, m), 4.37-4.44 (1H, m), 4.82-4.92 (1H, m), 5.12-5.14 (1H, m), 5.28-5.32 (1H, m), 5.52-5.60 (1H, m), 5.89-5.93 (1H, m), 6.51-6.55 (1H, m), 6.77-7.24 (8H, m).
MS: m/z = 608 [M+H]+.
実施例152に従い、実施例化合物156を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.10-1.14 (3H, m), 1.82-1.84 (3H, m), 3.65-3.83 (3H, m), 4.17-4.23 (1H, m), 4.36-4.42 (1H, m), 4.82-4.90 (1H, m), 5.17-5.19 (1H, m), 5.35-5.58 (2H, m), 5.92-5.96 (1H, m), 6.49-6.53 (1H, m), 6.71-7.14 (4H, m), 7.21-7.29 (3H, m).
MS: m/z = 642 [M+H]+.
実施例152に従い、実施例化合物157を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12-1.15 (3H, m), 1.82-1.85 (3H, m), 3.51-3.55 (1H, m), 3.66-3.83 (3H, m), 4.37-4.43 (1H, m), 4.81-4.89 (1H, m), 5.07-5.09 (1H, m), 5.53-5.68 (2H, m), 5.88-5.91 (1H, m), 6.51-6.56 (1H, m), 6.76-7.00 (3H, m), 7.06-7.18 (5H, m).
MS: m/z = 608 [M+H]+.
実施例152に従い、実施例化合物158を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.10-1.14 (3H, m), 1.81-1.84 (3H, m), 2.24-2.25 (3H, m), 3.65-3.83 (3H, m), 4.17-4.23 (1H, m), 4.38-4.43 (1H, m), 4.82-4.90 (1H, m), 5.14-5.16 (1H, m), 5.31-5.38 (1H, m), 5.51-5.60 (1H, m), 5.86-5.90 (1H, m), 6.51-6.56 (1H, m), 6.65-7.23 (7H, m).
MS: m/z = 622 [M+H]+.
実施例152に従い、実施例化合物159を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.10-1.16 (3H, m), 1.63-2.02 (7H, m), 3.44-4.04 (4H, m), 4.27-4.44 (2H, m), 4.62-4.90 (2H, m), 5.05-5.13 (1H, m), 5.49-5.61 (2H, m), 5.87-5.91 (1H, m), 6.44-6.58 (1H, m), 6.78-7.26 (7H, m), 7.53 (1H, d, J = 7.8 Hz).
MS: m/z = 694 [M+H]+.
実施例152に従い、実施例化合物160を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12-1.15 (3H, m), 1.82-1.85 (3H, m), 3.66-3.84 (3H, m), 3.94-4.00 (1H, m), 4.33-4.39 (1H, m), 4.84-4.92 (1H, m), 5.20-5.21 (1H, m), 5.52-5.62 (1H, m), 5.80-5.93 (2H, m), 6.51-6.56 (1H, m), 6.71-7.14 (5H, m), 7.36-7.38 (2H, m), 7.78-7.81 (1H, m).
MS: m/z = 658 [M+H]+.
1H-NMR (CDCl3) δ:1.05 (6H, m), 1.19-1.27 (3H, m), 1.34-1.45 (3H, m), 1.82-1.87 (3H, m), 2.80 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 13.8 Hz), 4.02-3.14 (1H, m), 3.43-3.52 (1H, m), 4.15-4.21 (1H, m), 4.25-4.38 (1H, m), 4.59-4.77 (2H, m), 5.05 (1H, d, J = 11.7 Hz), 5.76-5.81 (1H, m), 6.45-6.51 (1H, m), 6.64-6.67 (1H, m), 6.79 (0.5H, d, J = 7.5 Hz), 6.90-7.35 (6.5H, m).
実施例152に従い、実施例化合物162を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.10 (3H, d, 7.3 Hz), 1.84 (3H, d, 5.2 Hz), 3.60 (1H, d, 13.5 Hz), 3.65 (3H, s), 4.41 (1H, d, J = 13.0 Hz), 4.87 (1H, d, J = 12.7 Hz), 5.06 (1H, s), 5.52-5.62 (2H, m), 5.91 (1H, d, J = 7.8 Hz), 6.53 (1H, q, J = 5.3), 6.76-6.84 (2H, m), 7.06-7.43 (7H, m).
MS: m/z = 590 [M+H]+.
実施例122に従い、化合物163-aを同様の手法により合成した。
化合物163-a (70 mg, 0.10 mmol) と炭酸カリウム (138 mg, 0.22 mmol) のアセトニトリル (1.0 mL) 溶液に、2-morpholinoethanamine (31 mg, 0.24 mmol) 、DMAP (13 mg, 0.10 mmol) およびトリエチルアミン (0.042 ml, 0.30 mmol) を加え、室温で終夜攪拌した。その後、反応液に水を加え、ジクロロメタン層を分離し、水層をジクロロメタンで1回、抽出した。合わせた抽出液を飽和食塩水およびbrineで洗浄後、硫化ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (94:6, v/v) で溶出した。目的の画分を濃縮し、ジイソプロピルエーテルを用いて洗浄することにより、黄白色固体として26 mg の実施例化合物163を得た。
MS: m/z = 674 [M+H]+.
実施例163に従い、実施例化合物164を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.13 (3H, d, 7.0 Hz), 1.33-1.36 (6H, m), 3.61 (1H, d, J = 13.4 Hz), 4.42 (1H, d, J = 13.3 Hz), 4.85-4.99 (2H, m), 5.08 (1H, s), 5.49-5.64 (2H, m), 5.86 (1H, d, J = 6.4 Hz), 5.93-5.97 (2H, m), 6.82-6.88 (2H, m), 7.05-7.44 (7H, m).
MS: m/z = 604 [M+H]+.
実施例163に従い、実施例化合物166を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12 (3H, d, 7.3 Hz), 2.78 (3H, d, J = 5.0), 3.60 (1H, d, J = 13.1 Hz), 4.42 (1H, d, J = 13.3 Hz), 4.78 (1H, brs), 4.87 (1H, d, J = 12.9 Hz), 5.09 (1H, s), 5.54-5.64 (2H, m), 5.84-5.94 (3H, m), 6.83-6.89 (2H, m), 7.07-7.44 (7H, m).
MS: m/z = 575 [M+H]+.
実施例163に従い、実施例化合物168を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12 (3H, d, 7.4 Hz), 3.35-3.38 (5H,m), 3.46 (2H, t, J = 5.1 Hz), 3.60 (1H, d, J = 13.4 Hz), 4.42 (1H, d, J = 13.1), 4.87 (1H, d, J = 12.4 Hz), 5.09-5.16 (2H, m), 5.87-5.94 (3H, m), 6.81-6.89 (2H, m), 7.05-7.45 (7H, m).
MS: m/z = 619 [M+H]+.
実施例163に従い、実施例化合物170を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.12 (3H, d, 7.3 Hz), 3.48-3.77 (9H, m), 4.42 (1H, d, J = 13.4 Hz), 4.87 (1H, d, J = 13.4), 5.07 (1H, s), 5.49-5.63 (2H, m), 5.91-5.94 (3H, m), 6.84-6.86 (2H, m), 7.06-7.45 (7H, m).
MS: m/z = 631 [M+H]+.
実施例163に従い、実施例化合物171を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.17 (3H, d, 7.3 Hz), 4.31 (1H, d, J = 13.9 Hz), 4.42 (1H, d, J = 13.2 Hz), 4.72 (2H, brs), 4.89 (1H, d, J = 12.8 Hz), 5.14 (1H, s), 5.55-5.62 (2H, m), 5.87 (2H, s), 5.94 (1H, d, J = 7.8 Hz), 6.81-6.89 (2H, m), 7.07-7.21 (5H, m), 7.52 (1H, d, J = 7.1 Hz).
MS: m/z = 595 [M+H]+.
実施例163に従い、実施例化合物172を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.16 (3H, d, 7.8 Hz), 2.89 (3H, s), 2.95 (3H, s), 4.31 (1H, d, J = 14.0 Hz), 4.41 (1H, d, J = 13.5 Hz), 4.89 (1H, d, J = 13.3 Hz), 5.13 (1H, s), 5.52-5.61 (2H, m), 5.85-5.96 (3H, m), 6.83-6.88 (2H, m), 7.07-7.22 (5H, m), 7.52 (1H, d, J = 7.0 Hz).
MS: m/z = 623 [M+H]+.
実施例163に従い、実施例化合物173を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.33 (3H, d, 7.4 Hz), 3.37-3.62 (8H, m), 4.52 (1H, d, J = 12.4 Hz), 4.92 (1H, d, J = 12.4 Hz), 5.23-5.30 (3H, m), 5.65 (1H, d, 13.0 Hz), 5.80-5.95 (3H, m), 6.84-6.91 (2H, m), 7.03-7.09 (2H, m), 7.18-7.41 (5H, m).
MS: m/z = 619 [M+H]+.
実施例163に従い、実施例化合物174を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.38 (3H, d, 7.2 Hz), 2.92 (1H, d, 4.5 Hz), 3.10 (1H, d, 4.5 Hz), 3.45 (2H, brs), 4.34 (1H, d, J = 14.3 Hz), 4.52-4.57 (2H, m), 4.90 (1H, d, J = 13.8 Hz), 5.10 (1H, brs), 5.52-5.60 (3H, m), 5.75 (1H, d, J = 6.9 Hz), 6.02 (1H, d, J = 6.8 Hz), 6.85-6.96 (3H, m), 7.07-7.28 (3H, m), 7.50-7.57 (2H, m), 7.73 (1H, d, J = 7.4 Hz).
MS: m/z = 667 [M+H]+.
実施例163に従い、実施例化合物175を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.16 (3H, d, 7.3 Hz), 2.01 (3H,s), 3.19-3.45 (4H, m), 4.32 (1H, d, 14.0 Hz), 4.46 (1H, d, J = 13.2 Hz), 4.90 (1H, d, J = 13.1 Hz), 5.17-5.19 (2H, m), 5.53-5.68 (3H, m), 5.89-5.97 (2H, m), 6.87-6.95 (2H, m), 7.08-7.26 (5H, m), 7.54 (1H, d, J = 7.8 Hz).
MS: m/z = 680 [M+H]+.
実施例163に従い、化合物177-aを同様の手法により合成した。
化合物177-a (129 mg, 0.17 mmol) の酢酸エチル (2.0 mL) 溶液に、4N HCl 酢酸エチル溶液(2.0 ml) を加え、室温で30分間攪拌した。その後、反応液に水を加え、酢酸エチル層を分離し、水層を酢酸エチルで2回、抽出した。合わせた抽出液を飽和食塩水およびbrineで洗浄後、硫化ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (94:6, v/v) で溶出した。目的の画分を濃縮し、ジイソプロピルエーテルを用いて洗浄することにより、薄桃色固体として10 mg の実施例化合物177を得た。
1H-NMR (CDCl3) δ: 1.15 (3H, d, 7.2 Hz), 3.61 (1H, d, 13.4 Hz), 3.92 (2H, brs), 4.30-4.51 (3H, m), 4.86 (1H, d, J = 12.8), 5.09 (1H, s), 5.44-5.62 (2H, m), 5.86 (1H, d, J = 6.6Hz), 5.94-5.97 (2H, m), 6.88-6.90 (2H, m), 7.08-7.44 (7H, m).
MS: m/z = 606 [M+H]+.
実施例163に従い、化合物178-aを同様の手法により合成した。
化合物178-a (81 mg, 0.11 mmol) の酢酸エチル (1.0 mL) 溶液に、4N HCl 酢酸エチル溶液(1.0 ml) を加え、室温で1時間半攪拌した。反応液から析出した固体をろ取し、ジイソプロピルエーテルで洗浄することにより、白色固体として54 mg の実施例化合物178を得た。
MS: m/z = 638 [M+H]+.
化合物179-a (50 mg, 0.120 mmol)とトリエチルアミン(61 mg, 0.60 mmol)のDMF(1 ml)溶液を1-3℃に冷却し、同温度を保ちながらクロロギ酸エチル(26 mg, 0.24 mmol)を滴下した。反応液を室温で30分撹拌後、水を加え、酢酸エチルで3回抽出した。抽出液を3回水洗後、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた固体をエチル-ジイソプロピルエーテルで洗浄すると、24 mgの実施例化合物179を得た。
1H-NMR (CDCl3) δ:1.11 (3H, d, J = 6.9 Hz), 1.12 (3H, d, J = 6.9 Hz), 1.44 (3H, t, J = 6.9 Hz), 2.82 (1H, ddd, J = 4.5 Hz, 4.5 Hz, 14.1 Hz), 3.09 (1H, ddd, J = 3.9 H, 13.5 Hz, 13.5 Hz), 3.49 (1H, ddd, J = 4.2 Hz, 4.2 Hz, 17.4 Hz), 4.24 (1H, d, 13.2 Hz), 4.29-4.43 (2H, m), 4.40 (1H, d, J = 7.2 Hz), 4.66-4.77 (1H, m), 4.69 (1H, d, J = 12.9 Hz), 5.10 (1H, s), 5.87 (1H, d, J = 8.1 Hz), 6.77 (1H, d, J = 7.8 Hz), 6.79-6.82 (1H, m), 6.98 (1H, t, J = 7.2 Hz), 7.07-7.37 (6H, m).
1H-NMR (CDCl3) δ:1.20 (3H, d, J = 7.2 Hz), 3.98 (3H, s), 4.31 (1H, d, J = 13.8 Hz), 4.46 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.2 Hz), 5.16 (1H, s), 5.48-5.57 (1H, m), 5.60 (1H, d, J = 14.1 Hz), 5.99 (1H, d, J = 7.8 Hz), 6.23-6.93 (2H, m), 7.07-7.25 (6H, m), 7.51-7.54 (1H, m).
1H-NMR (CDCl3) δ:1.20 (3H, d, J = 7.2 Hz), 3.45 (3H, s), 3.74 (2H, t, J = 5.1 Hz), 4.31 (1H, d, J = 13.8 Hz), 4.43-4.48 (3H, m), 4.93 (1H, d, J = 13.2 Hz), 5.16 (1H, s), 5.48-5.57 (1H, m), 5.60 (1H, d, J = 14.1 Hz), 5.98 (1H, d, J = 7.8 Hz), 6.82-6.92 (2H, m), 7.06-7.12 (3H, m), 7.14-7.25 (2H, m), 7.52 (1H, d, J = 8.1 Hz).
1H-NMR (CDCl3) δ:1.22 (3H, d, J = 7.2 Hz), 4.31 (1H, d, J = 13.8 Hz), 4.48 (1H, d, J = 13.2 Hz), 4.95 (1H, d, J = 13.2 Hz), 5.17 (1H, s), 5.53-5.63 (2H, m), 6.02 (1H, d, J = 7.8 Hz), 6.83-6.88 (2H, m), 7.06-7.13 (3H, m), 7.17-7.39 (3H, m), 7.41-7.51 (4H, m), 7.51-7.55 (1H, m).
1H-NMR (CDCl3) δ:1.04 (6H, d, J = 6.6 Hz), 1.19 (3H, d, J = 7.2 Hz), 2.08-2.17 (1H, m), 4.11 (2H, d, J = 6.6 Hz), 4.31 (1H, d, J = 13.8 Hz), 4.46 (1H, d, J = 13.5 Hz), 4.93 (1H, d, J = 12.9 Hz), 5.16 (1H, s), 5.48-5.62 (2H, m), 5.98 (1H, d, J = 8.1 Hz), 6.82-6.92 (2H, m), 7.07-7.26 (5H, m), 7.51-7.55 (1H, m).
1H-NMR (CDCl3) δ:1.19 (3H, d, J = 7.2 Hz), 1.60 (9 H, s), 4.31 (1H, d, J = 13.8 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 13.2 Hz), 5.17 (1H, s), 5.48-5.63 (2H, m), 5.97 (1H, d, J = 7.5 Hz), 6.81-6.92 (2H, m), 7.07-7.14 (3H, m), 7.17-7.22 (2H, m), 7.12-7.54 (1H, m).
1H-NMR (DMSO-d6) δ: 1.01 (6H, t, J = 7.17 Hz), 1.31 (3H, t, J = 7.09 Hz), 3.88 (1H, d, J = 13.27 Hz), 4.20-4.30 (3H, m), 4.61 (1H, t, J = 6.71 Hz), 5.00 (1H, d, J = 13.42 Hz), 5.32 (1H, s), 5.65 (1H, d, J = 13.27 Hz), 5.87 (1H, d, J = 7.78 Hz), 6.82-6.93 (2H, m), 7.06-7.15 (2H, m), 7.22-7.50 (5H, m).
MS: m/z = 505.95 [M+H] +.
Journal of Medicinal Chemistry; English; 39; 2; 1996; 480 - 486に示される方法に従い、化合物98-a (50 mg, 0.0958 mmol)と、トリエチルアミン(48 mg, 0.48 mmol)のDMF(1 ml)溶液に室温下、(5-methyl-2-oxo-1,3-dioxol-4-yl)methyl 4-nitrophenyl carbonate (85 mg, 0.29 mmol)とDMAP (1.2 mg, 0.096 mmol)を加え、同温度で6時間撹拌した。反応液を酢酸エチル(10 ml)で希釈し、水を加えた。有機層を分離し、水槽を酢酸エチルで1回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに酢酸エチルで溶出し、次いで酢酸エチル-メタノール(4:1, v/v) で溶出した。目的の画分を濃縮すると固体として31 mgの実施例化合物186を得た。
1H-NMR (CDCl3) δ:1.21 (3H, d, J = 7.2 Hz), 2.27 (3H, s), 4.33 (1H, d, J = 14.1 Hz), 4.47 (1H, d, J = 13.5 Hz), 4.91 (2H, d, J = 13.2 Hz), 5.18 (1H, d, J = 17.7 Hz), 5.21 (1H, s), 5.38-5.49 (1H, m), 5.58 (1H, d, J = 13.8 Hz), 6.01 (1H, d, J = 7.8 Hz), 6.83-6.89 (2H, m), 7.08-7.15 (2H, m), 7.18-7.27 (3H, m), 7.51-7.54 (1H, m).
1H-NMR (CDCl3) δ:1.20 (3H, d, J = 7.2 Hz), 1.87-2.01 (2H, m), 2.06-2.17 (2H, m), 3.57-3.64 (2H, m), 3.98-4.04 (2H, m), 4.32 (1H, d, J = 14.1 Hz), 4.46 (1H, d, J = 13.2 Hz), 4.92-5.02 (2H, m), 5.16 (1H, s), 5.46-5.58 (1H, m), 6.60 (1H, d, J = 14.1 Hz), 5.99 (1H, d, J = 8.1 Hz), 6.81-6.93 (2H, m), 7.08-7.28 (4H, m), 7.54 (1H, d, J = 6.6 Hz).
1H-NMR (CDCl3) δ:1.12-1.27 (12H, m), 3.55-3.66 (5H, m), 3.73-3.79 (4H, m), 4.31 (1H, d, J = 13.8 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.2 Hz), 5.03-5.06 (1H, m), 5.16 (1H, s), 5.46-5.62 (2H, m), 5.95-6.00 (1H, m), 6.85-6.92 (2H, m), 7.07-7.26 (5H, m), 7.53 (1H, d, J = 7.8 Hz).
1H-NMR (CDCl3) δ:1.19 (3H, d, J = 7.2 Hz), 2.94 (3H, s), 4.32 (1H, d, J = 13.8 Hz), 4.46 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.8 Hz), 5.16 (1H, s), 5.51-5.62 (2H, m), 5.98 (1H, d, J = 7.8 Hz), 6.82-6.84 (1H, m), 6.88-6.93 (1H, m), 7.07-7.12 (3H, m), 7.14-7.26 (3H, m), 7.51-7.54 (1H, m).
化合物106-a (80.0 mg, 0.185 mmol) をジクロロメタン (1 ml) に溶解し、トリエチルアミン (0.051 ml, 0.37 mmol) 、dimethylcarbamic chloride (39.7 mg, 0.369 mmol) 、DMAP (cat.) を加えて50℃で3時間攪拌した。反応液に水を加え、酢酸エチルで抽出し、有機層を水で洗って硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (97:3, v/v) で溶出することによって精製した。ジクロロメタン‐酢酸エチル‐ジエチルエーテルを加え、固化させることにより、47 mgの白色固体として実施例化合物190 を得た。
MS: m/z = 505 [M+H]+.
1H-NMR (CDCl3) δ:1.17 (3H, d, J = 7.2 Hz), 2.96 (3H, d, J = 5.1 Hz), 4.30 (1H, d, J = 13.8 Hz), 4.45 (1H, d, J = 13.2 Hz), 4.92 (1H, d, J = 12.9 Hz), 5.20 (1H s), 5.29-5.30 (1H, m), 5.48-5.58 (1H, m), 5.60 (1H, d, J = 13.8 Hz), 5.96 (1H, d, J = 13.8 Hz), 6.91-6.92 (2H, m), 7.06-7.21 (5H, m), 7.50-7.53 (1H, m).
第一工程
Chem. Pharm. Bull. 55, 328-333 (2007) に記載の方法に従って,化合物192-bを合成した.
第二工程
化合物192-b (78.0 mg, 0.273 mmol) のピリジン (1 mL) 溶液に,室温で化合物98-a (51.0 mg, 0.098 mmol) を加え,室温で1.5時間,50℃で3時間,70℃で7時間攪拌した.反応液を酢酸エチル (10 mL) で希釈し,水 (5 mL) および塩酸 (2M, 5 mL) で洗浄した後,有機層を硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られた化合物192-c の粗生成物を精製することなく,次の反応に用いた.
第三工程
第二工程で得た化合物192-c の粗生成物のエタノール (0.5 mL) 溶液に,室温で濃塩酸 (0.050 mL) を加え,2時間攪拌した.反応液に水 (20 mL) を加え,クロロホルムで抽出した後,有機層を硫酸ナトリウムで乾燥した.溶媒を減圧下留去して得られた残さをシリカゲルカラムクロマトグラフィー (酢酸エチル / n-ヘキサン = 80% → 100%) で精製して得られた生成物を酢酸エチル-エチルエーテルで粉末化し,実施例化合物192 (39.7 mg, 65 %) を白色固体として得た.
1H-NMR (CDCl3) δ: 1.17 (3H, d, J = 6.9 Hz), 3.02 - 3.70 (5H, m), 3.80 - 4.25 (4H, m), 4.32 (1H, m), 4.47 (1H, d, J = 13.2 Hz), 4.94 (1H, m), 5.18 (1H, m), 5.30 (1H, m), 5.60 (1H, d, J = 13.8 Hz), 5.97 (1H, m), 6.75 - 7.25 (5H, m), 7.52 (1H, d, J = 7.8 Hz).
MS: m/z = 623.15 [M]+.
実施例192に従い,実施例化合物193を同様の手法により合成した.
1H-NMR (CDCl3) δ: 1.17 (3H, d, J = 8.1 Hz), 1.80 - 2.20 (4H, m), 3.50 - 4.20 (6H, m), 4.20 - 4.80 (3H, m), 4.92 (1H, m), 5.19 (1H, m), 5.56 (1H, m), 5.61 (1H, d, J = 14.1 Hz), 5.97 (1H, d, J = 8.4 Hz), 6.60 - 7.26 (5H, m), 7.53 (1H, d, J = 8.4 Hz).
MS: m/z = 649.20 [M]+.
化合物98-a (50 mg, 0.10 mmol) のピリジン (1.0 mL) 溶液にmorpholine-4-carbonyl chloride (43 mg, 0.29 mmol) を加え、50℃で10時間攪拌した。その後、反応液に2N HCl水溶液および酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液に硫化ナトリウムを加え、乾燥した後、溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (97:3, v/v) で溶出した。目的の画分を濃縮し、ジイソプロピルエーテルを用いて洗浄することにより、白色固体として49 mg の実施例化合物194を得た。
1H-NMR (CDCl3) δ: 1.19 (3H, d, 7.1 Hz), 3.60-3.81 (8H, m), 4.30 (1H, d, J = 14.3 Hz), 4.44 (1H, d, J = 13.3 Hz), 4.89 (1H, d, J = 14.8 Hz), 5.19 (1H, s), 5.48-5.62 (2H, m), 5.93 (1H, d, J = 7.4 Hz), 6.95-7.24 (7H, m), 7.52 (1H, d, J = 7.5 Hz).
MS: m/z = 635 [M+H]+.
実施例194に従い、実施例化合物195を同様の手法により合成した。
1H-NMR (CDCl3) δ: 1.15 (3H, d, 6.5 Hz), 2.97-3.18 (6H, m), 4.29 (1H, d, J = 13.73 Hz), 4.44 (1H, d, J = 13.3 Hz), 4.89 (1H, d, J = 13.5 Hz), 5.21 (1H, brs), 5.47-5.62 (2H, m), 5.94 (1H, brs), 6.97-7.24 (7H, m), 7.51 (1H, d, J = 7.9 Hz).
MS: m/z = 593 [M+H]+.
第一工程
化合物106-a (140 mg, 0.323 mmol) をDMF(2 mL)に溶解させ、炭酸カリウム(89 mg, 0.646 mmol)及びdibenzyl chloromethyl phosphate (158 mg, 0.484 mmol) のDMF (1.0 ml) 溶液を0度、窒素気流下で加えた。反応混合液を1週間室温で攪拌し、水を加えた。酢酸エチル(2 x 20 mL)を用いて抽出し、併せた有機層を水・飽和食塩水で洗浄し、硫酸ナトリウムで乾燥後、ろ過、減圧濃縮した。残渣をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール=50:1)で精製し、実施例化合物196-bを得た。
1H-NMR (CDCl3) δ: 1.01 (6H, dd, J = 8.90, 6.88 Hz), 3.58 (1H, d, J = 13.09 Hz), 4.21 (1H, d, J = 13.09 Hz), 4.61-4.73 (2H, m), 5.01-5.10 (5H, m), 5.63 (1H, d, J = 13.26 Hz), 5.77 (1H, dd, J = 13.26, 5.37 Hz), 5.87-5.95 (2H, m), 6.81-6.85 (2H, m), 7.02-7.08 (2H, m), 7.13-7.42 (15H, m).
第二工程
化合物196-b (60 mg, 0.083 mmol) をTHF (2 mL)とメタノール(2 mL)の混合溶媒に溶解させ、10%-パラジウム-炭素(10 mg)を加えた。水素気流下、室温で2時間攪拌し、セライトろ過した。ろ液を分取用HPLCで精製することにより目的とする実施例化合物196を得た。(18mg, 40%)
1H-NMR (DMSO-d6) δ: 1.01 (6H, dd, J = 14.64, 6.86 Hz), 3.90 (1H, d, J = 13.27 Hz), 4.32 (1H, d, J = 13.57 Hz), 4.59-4.71 (1H, m), 5.01 (1H, d, J = 13.42 Hz), 5.43-5.62 (4H, m), 6.17 (1H, d, J = 7.63 Hz), 6.80-6.89 (1H, m), 6.91-6.99 (1H, m), 7.07-7.14 (2H, m), 7.27 (1H, t, J = 6.63 Hz), 7.38-7.52 (4H, m).
第一工程
(S)-chloromethyl 2-(tert-butoxycarbonylamino)-3-methylbutanoate (138 mg, 0.519 mmol) のアセトン(3 ml) 溶液に、ヨウ化ナトリウム(390 mg, 2.6 mmol) を窒素気流下室温で加え、20時間攪拌した。ろ過後、ろ液を減圧濃縮し、残渣に10%-チオ硫酸ナトリウム水溶液を加え、酢酸エチル(30 mL)で抽出した。有機層を水洗し、硫酸ナトリウムで乾燥・ろ過後、減圧濃縮した。残渣をアセトン(0.5 mL)に溶解させ、化合物106-a (100 mg, 0.231 mmol) 及び炭酸セシウム(169 mg, 0.52 mmol)をアセトン(2.5 ml)中、窒素気流下、氷冷下、30分攪拌させた混合物に加えた。この反応混合物を室温で4時間攪拌し、減圧濃縮後、水を加えた。酢酸エチル(2 x 30 mL)を用いて抽出し、併せた有機層を水・飽和食塩水で洗浄し、硫酸ナトリウムで乾燥後、ろ過、減圧濃縮した。残渣をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール=50:1)で精製し、実施例化合物197-bを得た。 (130 mg, 85 %)
1H-NMR (CDCl3) δ: 0.90-1.11 (12H, m), 1.44 (9H, d, J = 9.00 Hz), 2.20-2.41 (1H, m), 3.59 (1H, d, J = 13.27 Hz), 4.27-4.43 (2H, m), 4.76-4.86 (2H, m), 5.10-5.29 (2H, m), 5.68 (1H, dd, J = 13.27, 2.44 Hz), 5.81-6.17 (3H, m), 6.80-6.94 (2H, m), 7.03-7.15 (2H, m), 7.20-7.44 (5H, m).
MS: m/z = 668.05 [M+H] +.
第二工程
化合物197-b (130 mg, 0.196 mmol) を酢酸エチル(4 ml)に溶解させ、4規定塩酸酢酸エチル溶液(4 mL, 16.00 mmol)を室温で加え、3時間攪拌した。減圧濃縮後、残渣をエーテルで希釈し、固体をろ取することで、実施例化合物197の塩酸塩を得た。(85 mg、72.3 %)
1H-NMR (DMSO-d6) δ: 0.96-1.05 (11H, m), 2.22-2.28 (1H, m), 3.90 (2H, d, J = 12.36 Hz), 4.28 (1H, d, J = 13.73 Hz), 4.55-4.65 (1H, m), 4.90-4.99 (1H, m), 5.30 (1H, d, J = 7.42 Hz), 5.63 (1H, d, J = 13.46 Hz), 5.86-5.89 (4H, m), 6.87-6.96 (2H, m), 7.07-7.16 (2H, m), 7.27-7.32 (2H, m), 7.44-7.49 (3H, m), 8.42 (3H, s).
MS: m/z =563.25 [M+H] +.
化合物106-a (33 mg, 0.076 mmol)とトリエチルアミン(24 mg, 0.235 mmol)のDMF(1 ml)溶液を1-3℃に冷却し、同温度を保ちながらクロロメチルメチルエーテル(12.6 mg, 0.157 mmol)を滴下した。反応液を同温度で30分間撹拌後、水を加え、酢酸エチルで3回抽出した。抽出液を3回水洗後、硫酸ナトリウムで乾燥し、溶媒を留去した。得られた固体をエチル-ジイソプロピルエーテルで洗浄すると、22mgの実施例化合物199を得た。
1H-NMR (CDCl3) δ:1.08 (3H, d, J = 7.2 Hz), 1.11 (3H, d, J = 7.2 Hz), 3.59 (1H, d, J = 13.2 Hz), 3.64 (3H, s), 4.32 (1H, d, J = 12.9 Hz), 4.77-4.85 (2H, m), 5.14 (1H, s), 5.32 (1H, d, J = 6.0 Hz), 5.50 (1H, d, J = 6.0 Hz), 5.70 (1H, d, J = 13.2 Hz), 5.90 (1H, d, J = 6.9 Hz), 6.77-6.84 (2H, m), 7.05-7.07 (2H, m), 7.18-7.28 (3H, m), 7.33-7.43 (2H, m).
4-(hydroxymethyl)phenyl acetate(53 mg, 0.287 mmol)とヨウ化ナトリウム(72 mg, 0.48 mmol)のDMF(1 ml)溶液を室温下、30分撹拌した。反応液に、炭酸カリウム(66 mg, 0.48 mmol)と化合物98-a (50 mg, 0.0958 mmol)を加え、さらに同温度で5時間撹拌した。反応液を酢酸エチル(10 ml)で希釈し、水を加えた。有機層を分離し、水槽を酢酸エチルで1回抽出した。抽出液を3回水洗し、硫酸ナトリウムで乾燥後、溶媒を留去した。得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに酢酸エチルで溶出し、次いで酢酸エチル-メタノール(7:3, v/v) で溶出した。目的の画分を濃縮すると固体として34 mgの実施例化合物200を得た。
1H-NMR (CDCl3) δ:1.16 (3H, d, J = 7.2 Hz), 2.28 (3H, s), 4.29 (1H, d, J = 13.8 Hz), 4.38 (1H, d, J = 13.2 Hz), 4.81 (1H, d, J = 12.9 Hz), 5.08 (1H, s), 5.45 (1H, d, J = 10.8 Hz), 5.52-5.61 (2H, m), 5.87 (1H, d, J = 7.5 Hz), 6.57 (1H, d, J = 7.5 Hz), 6.73-6.79 (1H, m), 7.04-7.20 (7H, m), 7.51 (1H, d, J = 7.2 Hz), 7.57 (2H, d, J = 8.4 Hz).
第一工程
実施例に従い合成した106-a (80.0 mg, 0.185 mmol) と4-(chloromethyl)-5-methyl-1,3-dioxol-2-one (41.1 mg, 0.277 mmol) をDMF (1 ml) に溶解し、炭酸カリウム (93.0 mg, 0.673 mmol) を加えて50℃で2時間攪拌した。反応液に水を加え、酢酸エチルで抽出し、有機層を水で洗って硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィーに付し、クロロホルム-メタノール (95:5, v/v) で溶出することによって精製した。ジクロロメタン‐ジエチルエーテルを加え固化させることにより、60 mgの白色固体として実施例化合物201を得た。
1H-NMR (DMSO-d6) δ: 1.00 (6H, s), 2.10 (3H, s), 3.89 (1H, d, J = 13.1 Hz), 4.25 (1H, d, J = 12.7 Hz), 4.59 (1H, m), 4.90-5.04 (3H, m), 5.27 (1H, s), 5.62 (1H, d, J = 13.3 Hz), 5.83 (1H, d, J = 4.9 Hz), 6.91-7.44 (9H, m).
MS: m/z = 546 [M+H]+.
1H-NMR (CDCl3) δ:1.18 (3H, d, J = 7.2 Hz), 2.18 (3H, s), 4.33 (1H, d, J = 13.8 Hz), 4.43 (1H, d, J = 13.2 Hz), 4.86 (1H, d, J = 13.5 Hz), 5.15 (1H, d, J = 13.5 Hz), 5.17 (1H, s), 5.35 (1H, d, J = 13.8 Hz), 5.48-5.59 (2H, m), 5.94 (1H, d, J = 13.8 Hz), 6.77 (1H, d, J = 7.5 Hz), 6.86-6.91 (1H, m), 7.07-7.26 (5H, m), 7.50-7.53 (1H, m).
化合物98-a (50 mg, 0.10 mmol) のDMF (1.0 mL) 溶液を氷冷し、トリエチルアミン (0.040 ml, 0.29 mmol) および1-(chloromethoxy)-2-methoxyethane (24 mg, 0.19 mmol) を加え、氷冷下で1時間攪拌した後、室温で終夜攪拌した。その後、反応液に水および酢酸エチルを加え、酢酸エチル層を分離し、水層を酢酸エチルで抽出した。合わせた抽出液を水およびbrineで洗浄後、硫化ナトリウムを加え、乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィーに付し、精製した。はじめに クロロホルムで溶出し、次いでクロロホルム-メタノール (97:3, v/v) で溶出した。目的の画分を濃縮し、ジイソプロピルエーテルを用いて洗浄することにより、白色固体として18 mg の実施例化合物203を得た。
1H-NMR (CDCl3) δ: 1.19 (3H, d, 7.6 Hz), 3.36 (3H, s), 3.51-3.55 (2H, m), 3.93-4.00 (2H, m), 4.32 (1H, d, 14.2 Hz), 4.43 (1H, d, J = 13.3 Hz), 4.88 (1H, d, J = 12.8 Hz), 5.14 (1H, s), 5.55-5.66 (3H, m), 5.90 (1H, d, J = 7.8 Hz), 6.73-6.85 (2H, m), 7.09-7.22 (5H, m), 7.53 (1H, d, J = 8.9 Hz).
MS: m/z = 610 [M+H]+.
1H-NMR (CDCl3) δ: 1.06 (3H, d, J = 7.1 Hz), 1.09 (3H, d, J = 7.1 Hz), 2.43 (3H, s), 3.59 (1H, d, J = 13.5 Hz), 4.34 (1H, d, J = 13.2 Hz), 4.70-4.86 (2H, m), 5.14 (1H, s), 5.70 (1H, d, J = 13.5 Hz), 5.94 (1H, d, J = 7.7 Hz), 6.81-6.92 (2H, m), 7.03-7.08 (2H, m), 7.15-7.26 (3H, m), 7.32-7.44 (2H, m).
MS: m/z = 476 [M+H]+.
1H-NMR (CDCl3) δ: 1.02-1.15 (9H, m), 1.39 (3H, d, J = 6.9 Hz), 1.58-1.72 (1H, m), 1.90-2.05 (1H, m), 2.71-2.84 (1H, m), 3.59 (1H, d, J = 13.2 Hz), 4.34 (1H, d, J = 12.9 Hz), 4.69-4.90 (2H, m), 5.15 (1H, s), 5.70 (1H, d, J = 12.9 Hz), 5.86-5.98 (1H, m), 6.76-6.99 (2H, m), 7.04-7.10 (2H, m), 7.15-7.29 (3H, m), 7.32-7.44 (2H, m).
MS: m/z = 518 [M+H]+.
1H-NMR (CDCl3) δ: 2.41 (3H, s), 3.58 (1H, d, J = 13.5 Hz), 4.41-4.87 (6H, m), 5.07 (1H, d, J = 13.2 Hz), 5.26 (1H, s), 5.65 (1H, d, J = 13.5 Hz), 5.97 (1H, d, J = 7.7 Hz), 6.80-6.92 (2H, m), 7.04-7.10 (2H, m), 7.25-7.45 (5H, m).
MS: m/z = 512 [M+H]+.
1H-NMR (CDCl3) δ: 1.20 (3H, d, J = 7.3 Hz), 2.44 (3H, s), 4.32 (1H, d, J = 13.9 Hz), 4.46 (1H, d, J = 13.3 Hz), 4.93 (1H, d, J = 13.3 Hz), 5.16 (1H, s), 5.45-5.58 (1H, m), 5.61 (1H, d, J = 13.9 Hz), 5.97 (1H, d, J = 7.9 Hz), 6.80-6.94 (2H, m), 7.05-7.13 (3H, m), 7.15-7.24 (2H, m), 7.53 (1H, d, J = 7.8 Hz).
MS: m/z = 564 [M+H]+.
1H-NMR (CDCl3) δ: 1.13 (3H, d, J = 7.3 Hz), 3.63 (1H, d, J = 13.4 Hz), 4.48 (1H, d, J = 13.1 Hz), 4.95 (1H, d, J = 13.0 Hz), 5.17 (1H, s), 5.44-5.58 (1H, m), 5.65 (1H, d, J = 13.0 Hz), 6.02 (1H, d, J = 7.9 Hz), 6.90-7.61 (12H, m).
MS: m/z = 628 [M+H]+.
1H-NMR (CDCl3) δ: 1.16 (3H, d, J = 7.4 Hz), 1.99-2.15 (4H, m), 2.93-3.06 (1H, m), 3.47-3.58 (2H, m), 4.01-4.16 (3H, m), 4.45 (1H, d, J = 13.2 Hz), 4.93 (1H, d, J = 13.5 Hz), 5.18 (1H, s), 5.35 (1H, d, J = 14.0 Hz), 5.43-5.56 (1H, m), 5.95 (1H, d, J = 7.7 Hz), 6.82-7.02 (3H, m), 7.06-7.15 (2H, m), 7.19-7.26 (3H, m).
MS: m/z = 618 [M+H]+.
工程
化合物210-a(101mg、0.193mmol)にジメチルホルムアミド(1mL)、HATU(50mg、0.148mmol)、N-メチルモルホリン(0.041mL、0.370mmol)を加えて室温で6時間撹拌した。反応溶液を分取型LCMS(メソッド14)により精製して実施例化合物210(50mg、収率51%)を得た。
1H-NMR (DMSO-d6) δ: 7.53 (s, 1H), 7.47 (s, 3H), 7.20 (s, 2H), 6.99 (s, 1H), 6.87 (s, 1H), 6.17 (s, 1H), 5.83 (s, 1H), 5.61 (d, J = 13.0 Hz, 1H), 5.50 (s, 1H), 5.24 (d, J = 13.0 Hz, 1H), 4.67 (d, J = 13.0 Hz, 1H), 4.04 (d, J = 11.0 Hz, 1H), 3.10 (s, 6H), 3.05 (s, 6H), 1.09 (s, 3H).
MS: m/z = 620 [M+H]+. RT=1.73 min.
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.2Hz, 3H), 3.65 (d, J = 13.8Hz, 1H), 3.82 (s, 3H), 4.39 (d, J = 13.2Hz, 1H), 4.87 (d, J = 13.2Hz, 1H), 5.52 (m, 1H), 5.63 (d, J = 13.8Hz, 1H), 5.88 (d, J = 6.6Hz, 1H), 5.94 (s, 1H), 6.00 (d, J = 6.6Hz, 1H), 6.88-6.98 (m, 2H), 7.14-7.19 (m, 2H), 7.27-7.38 (m, 3H), 7.52 (s, 1H).
MS: m/z = 644.2 [M+H] +.
MS: m/z = 564.15 [M+H] +.
1H-NMR (CDCl3) δ: 1.09 (d, J = 7.1 Hz, 3H), 3.55 (s, 3H), 3.63 (d, J = 13.5 Hz, 1H), 4.40 (d, J = 13.2 Hz, 1H), 4.87 (d, J = 13.2 Hz, 1H), 5.26 (d, J = 6.0 Hz, 1H), 5.51-5.70 (m, 3H), 5.89-5.95 (m, 2H), 6.84-6.89 (m, 2H), 7.07-7.20 (m, 3H), 7.26-7.37 (m, 3H).
1H-NMR (CDCl3) δ: 1.10 (d, J = 7.1 Hz, 3H), 2.48 (s, 3H), 3.63 (d, J = 13.5 Hz, 1H), 3.83 (s, 3H), 4.41 (d, J = 13.2 Hz, 1H), 4.87 (d, J = 13.2 Hz, 1H), 5.47-5.58 (m, 1H), 5.68 (d, J = 13.5 Hz, 1H), 5.87 (d, J = 6.6 Hz, 1H), 5.93 (s, 1H), 6.01 (d, J = 6.6 Hz, 1H), 6.84-6.91 (m, 1H), 6.95 (d, J = 7.4 Hz, 1H), 7.05-7.15 (m, 2H), 7.25-7.38 (m, 3H), 7.93 (s, 1H).
1H-NMR (CDCl3) δ: 1.21 (d, J = 7.1 Hz, 3H), 3.83 (s, 3H), 4.11 (d, J = 13.7 Hz, 1H), 4.42 (d, J = 13.2 Hz, 1H), 4.91 (d, J = 13.2 Hz, 1H), 5.13 (s, 1H), 5.40 (dd, J = 13.7, 2.6 Hz, 1H), 5.49-5.59 (m, 1H), 5.87 (d, J = 6.6 Hz, 1H), 5.93-5.96 (m, 2H), 6.79 (d, J = 7.4 Hz, 1H), 6.84-6.91 (m, 1H), 6.97 (dd, J = 8.7, 4.3 Hz, 1H), 7.04-7.15 (m, 3H), 7.26 (d, J = 4.7 Hz, 1H).
1)特に記載のない場合の条件;
カラム:ACQUITY UPLC(r)BEH C18 (1.7μm i.d.2.1x50mm) (Waters)
流速:0.8 mL/分
UV検出波長:254nm
移動相:[A]は0.1%ギ酸含有水溶液、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジェント:3.5分間で10%-100%溶媒[B]のリニアグラジエントを行い、0.5分間、100%溶媒[B]を維持した。
2)メソッド6;
カラム:Gemini-NX (5μm、i.d.4.6x50mm)(Phenomenex)
流速:3 mL/分
UV検出波長:254nm
移動相:[A]は0.1%ギ酸含有水溶液、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジェント:3.5分間で5%-100%溶媒[B]のリニアグラジエントを行い、0.5分間、100%溶媒[B]を維持した。
3)メソッド14;
カラム::Gemini-NX(C18, 5μm AXIA Packed , i.d.21.2 x 50mm)(Phenomenex)
流速:25 mL/分
UV検出波長:254nm
移動相:[A]は0.1%ギ酸含有水溶液、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジェント:
Narrow Gradient(6min):4分間でX%-Y%溶媒[B]のリニアグラジエントを行い、1分間、100%溶媒[B]を維持した。
中間体化合物i-7:X=35, Y=55 中間体化合物i-10:X=30, Y=50
中間体化合物i-14:X=30, Y=50
実施例210:X=20, Y=40
Standard Gradient(7min): 5分間で10%-100%溶媒[B]のリニアグラジエントを行い、1分間、100%溶媒[B]を維持した。
のR3aならびにR7aの組合せが、それぞれ以下の表15~20から選択される化合物。
(R3-1, R7-1)、(R3-1, R7-2)、(R3-1, R7-3)、(R3-1, R7-4)、(R3-1, R7-5)、(R3-1, R7-6)、(R3-1, R7-7)、(R3-1, R7-8)、(R3-1, R7-9)、(R3-1, R7-10)、(R3-1, R7-11)、(R3-1, R7-12)、(R3-1, R7-13)、(R3-1, R7-14)、(R3-1, R7-15)、(R3-1, R7-16)、(R3-1, R7-17)、(R3-1, R7-18)、(R3-1, R7-19)、(R3-1, R7-20)、(R3-1, R7-21)、(R3-1, R7-22)、(R3-1, R7-23)、(R3-1, R7-24)、(R3-1, R7-25)、(R3-1, R7-26)、(R3-1, R7-27)、(R3-1, R7-28)、(R3-1, R7-29)、(R3-1, R7-30)、(R3-1, R7-31)、(R3-1, R7-32)、(R3-1, R7-33)、(R3-1, R7-34)、(R3-1, R7-35)、(R3-1, R7-36)、(R3-1, R7-37)、(R3-1, R7-38)、(R3-1, R7-39)、(R3-1, R7-40)、(R3-1, R7-41)、(R3-1, R7-42)、(R3-1, R7-43)、(R3-1, R7-44)、(R3-1, R7-45)、(R3-1, R7-46)、(R3-1, R7-47)、(R3-1, R7-48)、(R3-1, R7-49)、(R3-1, R7-50)、(R3-1, R7-51)、(R3-1, R7-52)、(R3-1, R7-53)、(R3-1, R7-54)、(R3-1, R7-55)、(R3-1, R7-56)、(R3-1, R7-57)、(R3-1, R7-58)、(R3-1, R7-59)、(R3-1, R7-60)、(R3-1, R7-61)、(R3-1, R7-62)、(R3-1, R7-63)、(R3-1, R7-64)、(R3-1, R7-65)、(R3-1, R7-66)、(R3-1, R7-67)、(R3-1, R7-68)、(R3-1, R7-69)、(R3-1, R7-70)、(R3-1, R7-71)、(R3-1, R7-72)、(R3-1, R7-73)、(R3-1, R7-74)、(R3-1, R7-75)、(R3-1, R7-76)、(R3-1, R7-77)、
(PR,R7a)の組合せ=
(PR-1, R7-1)、(PR-1, R7-2)、(PR-1, R7-3)、(PR-1, R7-4)、(PR-1, R7-5)、(PR-1, R7-6)、(PR-1, R7-7)、(PR-1, R7-8)、(PR-1, R7-9)、(PR-1, R7-10)、(PR-1, R7-11)、(PR-1, R7-12)、(PR-1, R7-13)、(PR-1, R7-14)、(PR-1, R7-15)、(PR-1, R7-16)、(PR-1, R7-17)、(PR-1, R7-18)、(PR-1, R7-19)、(PR-1, R7-20)、(PR-1, R7-21)、(PR-1, R7-22)、(PR-1, R7-23)、(PR-1, R7-24)、(PR-1, R7-25)、(PR-1, R7-26)、(PR-1, R7-27)、(PR-1, R7-28)、(PR-1, R7-29)、(PR-1, R7-30)、(PR-1, R7-31)、(PR-1, R7-32)、(PR-1, R7-33)、(PR-1, R7-34)、(PR-1, R7-35)、(PR-1, R7-36)、(PR-1, R7-37)、(PR-1, R7-38)、(PR-1, R7-39)、(PR-1, R7-40)、(PR-1, R7-41)、(PR-1, R7-42)、(PR-1, R7-43)、(PR-1, R7-44)、(PR-1, R7-45)、(PR-1, R7-46)、(PR-1, R7-47)、(PR-1, R7-48)、(PR-1, R7-49)、(PR-1, R7-50)、(PR-1, R7-51)、(PR-1, R7-52)、(PR-1, R7-53)、(PR-1, R7-54)、(PR-1, R7-55)、(PR-1, R7-56)、(PR-1, R7-57)、(PR-1, R7-58)、(PR-1, R7-59)、(PR-1, R7-60)、(PR-1, R7-61)、(PR-1, R7-62)、(PR-1, R7-63)、(PR-1, R7-64)、(PR-1, R7-65)、(PR-1, R7-66)、(PR-1, R7-67)、(PR-1, R7-68)、(PR-1, R7-69)、(PR-1, R7-70)、(PR-1, R7-71)、(PR-1, R7-72)、(PR-1, R7-73)、(PR-1, R7-74)、(PR-1, R7-75)、(PR-1, R7-76)、(PR-1, R7-77)、
の-OH基に対応する部分を、上記表21のPR-1~PR-5でプロドラッグ化した以下の組合せも、本発明の好ましい実施態様である。これらの化合物も、上記参考例化合物を原料として、当業者に知られた一般的な方法または実施例に記載の方法と同様に合成可能である。
(参考例1, PR-1)、(参考例1, PR-2)、(参考例1, PR-3)、(参考例1, PR-4)、(参考例1, PR-5)、(参考例2, PR-1)、(参考例2, PR-2)、(参考例2, PR-3)、(参考例2, PR-4)、(参考例2, PR-5)、(参考例3, PR-1)、(参考例3, PR-2)、(参考例3, PR-3)、(参考例3, PR-4)、(参考例3, PR-5)、(参考例4, PR-1)、(参考例4, PR-2)、(参考例4, PR-3)、(参考例4, PR-4)、(参考例4, PR-5)、(参考例5, PR-1)、(参考例5, PR-2)、(参考例5, PR-3)、(参考例5, PR-4)、(参考例5, PR-5)、(参考例6, PR-1)、(参考例6, PR-2)、(参考例6, PR-3)、(参考例6, PR-4)、(参考例6, PR-5)、(参考例7, PR-1)、(参考例7, PR-2)、(参考例7, PR-3)、(参考例7, PR-4)、(参考例7, PR-5)、(参考例8, PR-1)、(参考例8, PR-2)、(参考例8, PR-3)、(参考例8, PR-4)、(参考例8, PR-5)、(参考例9, PR-1)、(参考例9, PR-2)、(参考例9, PR-3)、(参考例9, PR-4)、(参考例9, PR-5)、(参考例10, PR-1)、(参考例10, PR-2)、(参考例10, PR-3)、(参考例10, PR-4)、(参考例10, PR-5)、(参考例11, PR-1)、(参考例11, PR-2)、(参考例11, PR-3)、(参考例11, PR-4)、(参考例11, PR-5)、(参考例12, PR-1)、(参考例12, PR-2)、(参考例12, PR-3)、(参考例12, PR-4)、(参考例12, PR-5)、(参考例13, PR-1)、(参考例13, PR-2)、(参考例13, PR-3)、(参考例13, PR-4)、(参考例13, PR-5)、(参考例14, PR-1)、(参考例14, PR-2)、(参考例14, PR-3)、(参考例14, PR-4)、(参考例14, PR-5)、(参考例15, PR-1)、(参考例15, PR-2)、(参考例15, PR-3)、(参考例15, PR-4)、(参考例15, PR-5)、(参考例16, PR-1)、(参考例16, PR-2)、(参考例16, PR-3)、(参考例16, PR-4)、(参考例16, PR-5)、(参考例17, PR-1)、(参考例17, PR-2)、(参考例17, PR-3)、(参考例17, PR-4)、(参考例17, PR-5)、(参考例18, PR-1)、(参考例18, PR-2)、(参考例18, PR-3)、(参考例18, PR-4)、(参考例18, PR-5)、(参考例19, PR-1)、(参考例19, PR-2)、(参考例19, PR-3)、(参考例19, PR-4)、(参考例19, PR-5)、(参考例20, PR-1)、(参考例20, PR-2)、(参考例20, PR-3)、(参考例20, PR-4)、(参考例20, PR-5)、(参考例21, PR-1)、(参考例21, PR-2)、(参考例21, PR-3)、(参考例21, PR-4)、(参考例21, PR-5)、(参考例22, PR-1)、(参考例22, PR-2)、(参考例22, PR-3)、(参考例22, PR-4)、(参考例22, PR-5)、(参考例23, PR-1)、(参考例23, PR-2)、(参考例23, PR-3)、(参考例23, PR-4)、(参考例23, PR-5)、(参考例24, PR-1)、(参考例24, PR-2)、(参考例24, PR-3)、(参考例24, PR-4)、(参考例24, PR-5)、(参考例25, PR-1)、(参考例25, PR-2)、(参考例25, PR-3)、(参考例25, PR-4)、(参考例25, PR-5)、(参考例26, PR-1)、(参考例26, PR-2)、(参考例26, PR-3)、(参考例26, PR-4)、(参考例26, PR-5)、(参考例27, PR-1)、(参考例27, PR-2)、(参考例27, PR-3)、(参考例27, PR-4)、(参考例27, PR-5)、(参考例28, PR-1)、(参考例28, PR-2)、(参考例28, PR-3)、(参考例28, PR-4)、(参考例28, PR-5)、(参考例29, PR-1)、(参考例29, PR-2)、(参考例29, PR-3)、(参考例29, PR-4)、(参考例29, PR-5)、(参考例30, PR-1)、(参考例30, PR-2)、(参考例30, PR-3)、(参考例30, PR-4)、(参考例30, PR-5)、(参考例31, PR-1)、(参考例31, PR-2)、(参考例31, PR-3)、(参考例31, PR-4)、(参考例31, PR-5)、(参考例32, PR-1)、(参考例32, PR-2)、(参考例32, PR-3)、(参考例32, PR-4)、(参考例32, PR-5)、(参考例33, PR-1)、(参考例33, PR-2)、(参考例33, PR-3)、(参考例33, PR-4)、(参考例33, PR-5)、(参考例34, PR-1)、(参考例34, PR-2)、(参考例34, PR-3)、(参考例34, PR-4)、(参考例34, PR-5)、(参考例35, PR-1)、(参考例35, PR-2)、(参考例35, PR-3)、(参考例35, PR-4)、(参考例35, PR-5)、(参考例36, PR-1)、(参考例36, PR-2)、(参考例36, PR-3)、(参考例36, PR-4)、(参考例36, PR-5)、(参考例37, PR-1)、(参考例37, PR-2)、(参考例37, PR-3)、(参考例37, PR-4)、(参考例37, PR-5)、(参考例38, PR-1)、(参考例38, PR-2)、(参考例38, PR-3)、(参考例38, PR-4)、(参考例38, PR-5)、(参考例39, PR-1)、(参考例39, PR-2)、(参考例39, PR-3)、(参考例39, PR-4)、(参考例39, PR-5)、(参考例40, PR-1)、(参考例40, PR-2)、(参考例40, PR-3)、(参考例40, PR-4)、(参考例40, PR-5)、(参考例41, PR-1)、(参考例41, PR-2)、(参考例41, PR-3)、(参考例41, PR-4)、(参考例41, PR-5)、(参考例42, PR-1)、(参考例42, PR-2)、(参考例42, PR-3)、(参考例42, PR-4)、(参考例42, PR-5)、(参考例43, PR-1)、(参考例43, PR-2)、(参考例43, PR-3)、(参考例43, PR-4)、(参考例43, PR-5)、(参考例44, PR-1)、(参考例44, PR-2)、(参考例44, PR-3)、(参考例44, PR-4)、(参考例44, PR-5)、(参考例45, PR-1)、(参考例45, PR-2)、(参考例45, PR-3)、(参考例45, PR-4)、(参考例45, PR-5)、(参考例46, PR-1)、(参考例46, PR-2)、(参考例46, PR-3)、(参考例46, PR-4)、(参考例46, PR-5)、(参考例47, PR-1)、(参考例47, PR-2)、(参考例47, PR-3)、(参考例47, PR-4)、(参考例47, PR-5)、(参考例48, PR-1)、(参考例48, PR-2)、(参考例48, PR-3)、(参考例48, PR-4)、(参考例48, PR-5)、(参考例49, PR-1)、(参考例49, PR-2)、(参考例49, PR-3)、(参考例49, PR-4)、(参考例49, PR-5)、(参考例50, PR-1)、(参考例50, PR-2)、(参考例50, PR-3)、(参考例50, PR-4)、(参考例50, PR-5)、(参考例51, PR-1)、(参考例51, PR-2)、(参考例51, PR-3)、(参考例51, PR-4)、(参考例51, PR-5)、(参考例52, PR-1)、(参考例52, PR-2)、(参考例52, PR-3)、(参考例52, PR-4)、(参考例52, PR-5)、(参考例53, PR-1)、(参考例53, PR-2)、(参考例53, PR-3)、(参考例53, PR-4)、(参考例53, PR-5)、(参考例54, PR-1)、(参考例54, PR-2)、(参考例54, PR-3)、(参考例54, PR-4)、(参考例54, PR-5)、(参考例55, PR-1)、(参考例55, PR-2)、(参考例55, PR-3)、(参考例55, PR-4)、(参考例55, PR-5)、(参考例56, PR-1)、(参考例56, PR-2)、(参考例56, PR-3)、(参考例56, PR-4)、(参考例56, PR-5)、(参考例57, PR-1)、(参考例57, PR-2)、(参考例57, PR-3)、(参考例57, PR-4)、(参考例57, PR-5)、(参考例58, PR-1)、(参考例58, PR-2)、(参考例58, PR-3)、(参考例58, PR-4)、(参考例58, PR-5)、(参考例59, PR-1)、(参考例59, PR-2)、(参考例59, PR-3)、(参考例59, PR-4)、(参考例59, PR-5)、(参考例60, PR-1)、(参考例60, PR-2)、(参考例60, PR-3)、(参考例60, PR-4)、(参考例60, PR-5)、(参考例61, PR-1)、(参考例61, PR-2)、(参考例61, PR-3)、(参考例61, PR-4)、(参考例61, PR-5)、(参考例62, PR-1)、(参考例62, PR-2)、(参考例62, PR-3)、(参考例62, PR-4)、(参考例62, PR-5)、(参考例63, PR-1)、(参考例63, PR-2)、(参考例63, PR-3)、(参考例63, PR-4)、(参考例63, PR-5)、(参考例64, PR-1)、(参考例64, PR-2)、(参考例64, PR-3)、(参考例64, PR-4)、(参考例64, PR-5)、(参考例65, PR-1)、(参考例65, PR-2)、(参考例65, PR-3)、(参考例65, PR-4)、(参考例65, PR-5)、(参考例66, PR-1)、(参考例66, PR-2)、(参考例66, PR-3)、(参考例66, PR-4)、(参考例66, PR-5)、(参考例67, PR-1)、(参考例67, PR-2)、(参考例67, PR-3)、(参考例67, PR-4)、(参考例67, PR-5)、(参考例68, PR-1)、(参考例68, PR-2)、(参考例68, PR-3)、(参考例68, PR-4)、(参考例68, PR-5)、(参考例69, PR-1)、(参考例69, PR-2)、(参考例69, PR-3)、(参考例69, PR-4)、(参考例69, PR-5)、(参考例70, PR-1)、(参考例70, PR-2)、(参考例70, PR-3)、(参考例70, PR-4)、(参考例70, PR-5)、(参考例71, PR-1)、(参考例71, PR-2)、(参考例71, PR-3)、(参考例71, PR-4)、(参考例71, PR-5)、(参考例72, PR-1)、(参考例72, PR-2)、(参考例72, PR-3)、(参考例72, PR-4)、(参考例72, PR-5)、(参考例73, PR-1)、(参考例73, PR-2)、(参考例73, PR-3)、(参考例73, PR-4)、(参考例73, PR-5)、(参考例74, PR-1)、(参考例74, PR-2)、(参考例74, PR-3)、(参考例74, PR-4)、(参考例74, PR-5)、(参考例75, PR-1)、(参考例75, PR-2)、(参考例75, PR-3)、(参考例75, PR-4)、(参考例75, PR-5)、(参考例76, PR-1)、(参考例76, PR-2)、(参考例76, PR-3)、(参考例76, PR-4)、(参考例76, PR-5)、(参考例77, PR-1)、(参考例77, PR-2)、(参考例77, PR-3)、(参考例77, PR-4)、(参考例77, PR-5)、(参考例78, PR-1)、(参考例78, PR-2)、(参考例78, PR-3)、(参考例78, PR-4)、(参考例78, PR-5)、(参考例79, PR-1)、(参考例79, PR-2)、(参考例79, PR-3)、(参考例79, PR-4)、(参考例79, PR-5)、(参考例80, PR-1)、(参考例80, PR-2)、(参考例80, PR-3)、(参考例80, PR-4)、(参考例80, PR-5)、(参考例81, PR-1)、(参考例81, PR-2)、(参考例81, PR-3)、(参考例81, PR-4)、(参考例81, PR-5)、(参考例82, PR-1)、(参考例82, PR-2)、(参考例82, PR-3)、(参考例82, PR-4)、(参考例82, PR-5)、(参考例83, PR-1)、(参考例83, PR-2)、(参考例83, PR-3)、(参考例83, PR-4)、(参考例83, PR-5)、(参考例84, PR-1)、(参考例84, PR-2)、(参考例84, PR-3)、(参考例84, PR-4)、(参考例84, PR-5)、(参考例85, PR-1)、(参考例85, PR-2)、(参考例85, PR-3)、(参考例85, PR-4)、(参考例85, PR-5)、(参考例86, PR-1)、(参考例86, PR-2)、(参考例86, PR-3)、(参考例86, PR-4)、(参考例86, PR-5)、(参考例87, PR-1)、(参考例87, PR-2)、(参考例87, PR-3)、(参考例87, PR-4)、(参考例87, PR-5)、(参考例88, PR-1)、(参考例88, PR-2)、(参考例88, PR-3)、(参考例88, PR-4)、(参考例88, PR-5)、(参考例89, PR-1)、(参考例89, PR-2)、(参考例89, PR-3)、(参考例89, PR-4)、(参考例89, PR-5)、(参考例90, PR-1)、(参考例90, PR-2)、(参考例90, PR-3)、(参考例90, PR-4)、(参考例90, PR-5)、(参考例91, PR-1)、(参考例91, PR-2)、(参考例91, PR-3)、(参考例91, PR-4)、(参考例91, PR-5)、(参考例92, PR-1)、(参考例92, PR-2)、(参考例92, PR-3)、(参考例92, PR-4)、(参考例92, PR-5)、(参考例93, PR-1)、(参考例93, PR-2)、(参考例93, PR-3)、(参考例93, PR-4)、(参考例93, PR-5)、(参考例94, PR-1)、(参考例94, PR-2)、(参考例94, PR-3)、(参考例94, PR-4)、(参考例94, PR-5)、(参考例95, PR-1)、(参考例95, PR-2)、(参考例95, PR-3)、(参考例95, PR-4)、(参考例95, PR-5)、(参考例96, PR-1)、(参考例96, PR-2)、(参考例96, PR-3)、(参考例96, PR-4)、(参考例96, PR-5)、(参考例97, PR-1)、(参考例97, PR-2)、(参考例97, PR-3)、(参考例97, PR-4)、(参考例97, PR-5)、(参考例98, PR-1)、(参考例98, PR-2)、(参考例98, PR-3)、(参考例98, PR-4)、(参考例98, PR-5)、(参考例99, PR-1)、(参考例99, PR-2)、(参考例99, PR-3)、(参考例99, PR-4)、(参考例99, PR-5)、(参考例100, PR-1)、(参考例100, PR-2)、(参考例100, PR-3)、(参考例100, PR-4)、(参考例100, PR-5)、
Sodium tert-pentoxide (2.55 g, 23.2 mmol) のTHF (4 ml) 懸濁液にベンジルアルコール (1.00 g, 9.25 mmol) のTHF (3 ml) 溶液を窒素雰囲気下室温で加え、40℃で2時間撹拌した。この反応液を氷浴で冷却し、化合物1a (1.53 g, 10.2 mmol) のTHF (3 ml) 溶液を0-10℃で滴下した。反応液を室温で2時間撹拌後、2N塩酸 (15 ml)を加え、酢酸エチルで2回抽出した。合わせた抽出液を水、飽和重曹水、水、飽和食塩水で順次洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 4:1, v/v) で精製し、化合物1b 1.89 g (収率92 %) を油状物として得た。
1H-NMR (CDCl3) δ: 3.56 (2H, s), 3.71 (3H, s), 4.14 (2H, s), 4.59 (2H, s), 7.27-7.42 (5H, m).
第二工程
化合物1b (1.80 g, 8.1 mmol) を 1,4-ジオキサン (18 mL) に溶解し、N,N-ジメチルホルムアミドジメチルアセタール (1.45 g, 12.2 mmol) を加えて室温で6 時間撹拌した。反応液を減圧下に濃縮後、残留物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 1:4, v/v) で精製し、化合物1c 1.77 g (収率79 %) を油状物として得た。
1H-NMR (CDCl3) δ: 2.90 (3H, br), 3.25 (3H, br), 3.69 (3H, s), 4.45 (2H, s), 4.59 (2H, s), 7.24-7.40 (5H, m), 7.73 (s, 1H).
第三工程
3頸フラスコに窒素雰囲気下Sodium tert-butoxide (2.55 g, 23.2 mmol)、シュウ酸ジメチル (639 mg, 5.41 mmol)、DMI (3 ml) を加え、これに化合物1c (0.50 g, 1.80 mmol) のDMI (2 ml) 溶液を25-30℃で滴下した。室温で7時間撹拌した後、2N塩酸 (10 ml)を加え、室温で15時間撹拌した。酢酸エチルで2回抽出し、合わせた抽出液を水、飽和重曹水、水、飽和食塩水で順次洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 2:1から1:1, v/v) で精製し、化合物1d 488 mg (収率85 %) を白色固体として得た。
1H-NMR (CDCl3) δ: 3.89 (3H, s), 3.93 (3H, s), 5.34 (2H, s), 7.32-7.40 (3H, m), 7.45-7.49 (2H, m), 8.50 (1H, s).
Sodium tert-pentoxide (1.67 g, 15.2 mmol) のDMI (4 ml) 懸濁液にベンジルアルコール (0.66 g, 6.1 mmol) のDMI (3 ml) 溶液を窒素雰囲気下室温で加え、40℃で2時間撹拌した。この反応液を氷浴で冷却し、化合物2a (1.10 g, 6.68 mmol) のDMI (3 ml) 溶液を0-10℃で滴下した。反応液を0-5℃で2時間、室温で3時間撹拌後、2N塩酸 (15 ml)を加え、酢酸エチルで2回抽出した。合わせた抽出液を水、飽和重曹水、水、飽和食塩水で順次洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 4:1, v/v) で精製し、化合物2b 1.29 g (収率90 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.25 (3H, t, J = 7.2 Hz), 3.54 (2H, s), 4.14 (2H, s), 4.17 (2H, q, J = 7.2Hz), 4.59 (2H, s), 7.28-7.40 (5H, m).
第二工程
化合物2b (9.73 g, 41.2 mmol) を トルエン (45 mL) に溶解し、N,N-ジメチルホルムアミドジメチルアセタール (7.36 g, 61.8 mmol) を加えて室温で5 時間撹拌した。反応液に水を加え、酢酸エチルで2回抽出した。合わせた抽出液を水、飽和食塩水で順次洗浄後、無水硫酸マグネシウムで乾燥した。溶媒を留去し、得られた油状物をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 1:1から3:7, v/v) で精製し、化合物2c 7.90 g (収率66 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.25 (3H, t, J = 7.2 Hz), 2.95 (3H, br), 3.22 (3H, br), 4.15 (2H, q, J = 7.2Hz), 4.45 (2H, s), 4.59 (2H, s), 7.22-7.40 (5H, m), 7.73 (1H, s).
第三工程
3頸フラスコに窒素雰囲気下Sodium tert-butoxide (495 mg, 5.15 mmol)、DMI (2 ml) を加え、これにシュウ酸ジメチル (608 mg, 5.15 mmol)、化合物2c (0.50 g, 1.72 mmol) のDMI (3 ml) 溶液を25-30℃で滴下した。室温で4時間撹拌した後、2N塩酸 (10 ml)を加え、室温で15時間撹拌した。トルエンで2回抽出し、合わせた抽出液を水、飽和重曹水、水、飽和食塩水で順次洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 2:1, v/v) で精製し、化合物2d 420 mg (収率74 %) を白色固体として得た。
1H-NMR (CDCl3) δ: 1.39 (3H, t, J = 7.2 Hz), 3.88 (3H, s), 4.39 (2H, q, J = 7.2Hz), 5.34 (2H, s), 7.30-7.41 (3H, m), 7.45-7.50 (2H, m), 8.48 (1H, s).
化合物3a (5.0 g, 30.4 mmol) にN,N-dimethylformamide dimethyl acetal (4.9 ml, 36.5 mmol) を0℃にて冷却下滴下した。0℃で1時間攪拌したのち、反応液に酢酸エチル100mlを加え、0.5N塩酸水(50 ml)で洗浄した。水層を分液し酢酸エチル(50ml)で抽出した。有機層を合わせ、飽和重曹水、飽和食塩水で順次洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 1:1 (v/v) → 酢酸エチル) で精製し、化合物3b 4.49 g (収率67 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.32 (3H, t, J = 7.1 Hz), 2.90 (3H, br s), 3.29 (3H, br s), 4.23 (2H, q, J = 7.1 Hz), 4.54 (2H, s), 7.81 (1H, s).
第二工程
リチウムヘキサメチルジシラジド(1.0M トルエン溶液, 49 ml, 49.0 mmol)をTHF (44 ml) で希釈し、これに-78℃にて冷却下、化合物3b (4.49 g, 20.4 mmol) のTHF (10 ml) 溶液を滴下したのち、ethyl oxalyl chloride (3.35 g, 24.5 mmol) のTHF (10 ml) 溶液を滴下した。-78℃で2時間攪拌後、0℃まで昇温した。反応液に2N塩酸を加えて20分間攪拌後、酢酸エチルで抽出し (200 ml x 2)、有機層を飽和重曹水、飽和食塩水で洗浄したのち、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 7:3→5:5→0:10 (v/v)) で精製し、化合物3c 1.77 g (収率31 %) を白色固体として得た。
1H-NMR (CDCl3) δ:1.36-1.46 (6H, m), 4.35-4.52 (8H, m), 8.53 (1H, s).
第三工程
化合物3c (300 mg, 1.09 mmol) のエタノール (6 ml) 溶液に aminoacetaldehyde dimethyl acetal (0.13 ml, 1.20 mmol) を0℃で加え、0℃にて1時間30分、室温にて18時間、次いで60℃にて4時間攪拌した。反応液を減圧下溶媒留去したのち、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 5:5→0:10 (v/v)) で精製し、化合物3d 252 mg (収率64 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.36-1.47 (6H, m), 3.42 (6H, s), 3.90 (2H, d, J = 5.2 Hz), 4.37 (3H, q, J = 7.2 Hz), 4.50 (2H, q, J = 7.2 Hz), 8.16 (1H, s).
化合物4a (10.0 g, 76.8 mmol) にN,N-dimethylformamide dimethyl acetal (12.2 ml, 92.2 mmol) を0℃にて冷却下滴下した。0℃で1時間30分、次いで室温で2時間30分攪拌したのち、反応液に酢酸エチル100mlを加え、溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 5:5→0:10 (v/v)) で精製し、化合物4b 12.45 g (収率88 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.32 (3H, t, J = 7.1 Hz), 2.33 (3H, s), 3.04 (6H, br s), 4.23 (2H, q, J = 7.2 Hz), 7.68 (1H, s).
第二工程
リチウムヘキサメチルジシラジド(1.0M トルエン溶液, 24 ml, 24.0 mmol)をTHF (20 ml) で希釈し、これに-78℃にて冷却下、化合物4b (1.85 g, 10.0 mmol) のTHF (5 ml) 溶液を滴下したのち、ethyl oxalyl chloride (1.34 ml, 12.0 mmol) のTHF (5 ml) 溶液を滴下した。-78℃で2時間攪拌後、反応液に2N-塩酸を加えて室温にて20分間攪拌した。酢酸エチルで抽出し有機層を飽和重曹水、飽和食塩水で順次洗浄したのち、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 75:25→455:5 (v/v)) で精製し、化合物4c1.03 g (収率43 %) を褐色油状物として得た。
1H-NMR (CDCl3) δ: 1.38 (3H, t, J = 7.1 Hz), 1.42 (3H, t, J = 7.4 Hz), 4.33-4.47 (4H, m), 7.19 (1H, s), 8.54 (1H, s).
第三工程
化合物4c (680 mg, 2.83 mmol) のエタノール (6.8 ml) 溶液に aminoacetaldehyde dimethyl acetal (0.34 ml, 3.11 mmol) を0℃で加え、室温にて16時間静置した。反応液を減圧下溶媒留去したのち、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 90:10 (v/v)) で精製し、化合物4d 875 mg (収率94 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.38 (3H, t, J = 7.1 Hz), 1.39 (3H, t, J = 7.1 Hz), 3.40 (6H, s), 4.33 (2H, d, J = 4.7 Hz), 4.37 (4H, q, J = 7.1 Hz), 4.49 (1H, t, J = 4.7 Hz), 7.06 (1H, s), 8.17 (1H, s).
第四工程
化合物4d (2.68 g, 8.18 mmol) のDMF (10 ml) 溶液に N-bromosuccinimide (1.46 g, 8.18 mmol) を加え、室温にて48時間攪拌した。反応液に飽和重曹水を加えたのち酢酸エチルで抽出し、有機層を水、飽和食塩水で順次洗浄後無水硫酸ナトリウムで乾燥した。溶媒を留去したのち、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 90:10 (v/v)) で精製し、化合物4e 2.83 g (収率85 %) を油状物として得た。
1H-NMR (CDCl3) δ: 1.38 (3H, t, J = 7.1 Hz), 1.46 (3H, t, J = 7.1 Hz), 3.42 (6H, s), 3.88 (3H, d, J = 5.0 Hz), 4.37 (3H, q, J = 7.1 Hz), 4.51 (2H, q, J = 7.1 Hz), 4.54 (2H, t, J = 5.2 Hz), 8.17 (1H, s).
化合物5a (598 mg, 4.09 mmol) と N,N-dimethylformamide dimethyl acetal (488 mg, 4.09 mmol) をトルエン (1 ml) に溶解し、室温で11時間攪拌した。反応液を減圧下溶媒留去し、得られた残渣(化合物5bを含む)は精製することなく、第二工程に使用した。
第二工程
Sodium tert-butoxide (400 mg, 4.16 mmol) をDMI (5 ml) に懸濁させ、これに第一工程で得られた粗生成物のDMI (5 ml) 溶液を加えたのち、dimethyl oxalate (983 mg, 8.32 mmol) のTHF (10 ml) 溶液を滴下し、室温で45分攪拌した。反応液を2N 塩酸-メタノール (20 ml) にあけ、0℃で20分攪拌した。水を加えたのち酢酸エチルで抽出し、有機層を水、飽和重曹水、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。溶媒を留去したのち、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、化合物3C 222 mg (収率:5aから22 %) を得た。
1H-NMR (CDCl3) δ: 3.91 (3H, s), 3.97 (3H, s), 4.05 (3H, s), 8.50 (1H, s).
リチウムヘキサメチルジシラジド(1.0M トルエン溶液, 12 ml, 12.0 mmol)をTHF (11 ml) で希釈し、これに-78℃にて冷却下、化合物6a (1.46 g, 5.0 mmol) のTHF (2 ml) 溶液を滴下したのち、ethyl oxalyl chloride (0.67 ml, 6.0 mmol) のTHF (2 ml) 溶液を滴下した。-78℃で2時間攪拌後、反応液に酢酸アンモニウム (500 mg) と酢酸 (10 ml) を加え、65℃にて1時間30分攪拌した。反応液に水を加え酢酸エチルで抽出し、有機層を水、飽和重曹水で順次洗浄後無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 55:45→45:55 (v/v)) で精製し、化合物6b 505.1 mg を黄色固体として得た。これをイソプロピルエーテル-ヘキサン (1:2) で洗い、減圧下乾燥することで、化合物6b 416.8 mg (収率24 %) を黄色結晶として得た。
1H-NMR (CDCl3) δ: 1.35 (3H, t, J = 7.1 Hz), 1.46 (3H, t, J = 7.1 Hz), 4.40 (2H, q, J = 7.2 Hz), 4.50 (2H, q, J = 7.1 Hz), 5.20 (2H, s), 7.33-7.41 (3H, m), 7.49-7.52 (2H, m), 8.76 (1H, s), 11.61 (1H, br s).
第二工程
化合物6b (51.8 mg, 0.15 mmol) のDMF (1 ml) 溶液に炭酸セシウム (73.3 mg, 0.23 mmol) とbromoacetaldehyde dimethyl acetal (38.0 mg, 0.23 mmol) を加え、室温で終夜攪拌した。炭酸セシウム (73.3 mg, 0.23 mmol) およびbromoacrtaldehyde dimethyl acetal (38.0 mg, 0.23 mmol) を追加し、さらに100℃にて20分間攪拌した。反応液に水を加えたのち酢酸エチルにて抽出し、有機層を水、飽和食塩水で順次洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 50:50→30:70 (v/v)) で精製し、化合物6c 35.3 mg (収率54 %) を無色油状物として得た。
1H-NMR (CDCl3) δ: 1.26 (3H, t, J = 7.1 Hz), 1.40 (3H, t, J = 7.1 Hz), 3.39 (6H, s), 3.91 (2H, d, J = 5.0 Hz), 4.29 (2H, q, J = 7.1 Hz), 4.40 (2H, q, J = 7.2 Hz), 4.50 (1H, t, J = 5.0 Hz), 5.30 (2H, s), 7.31-7.37 (3H, m), 7.43-7.46 (2H, m), 8.12 (1H, s).
化合物7a (900 mg, 2.60 mmol) のエタノール (5 ml) 溶液に aminoacetaldehyde dimethyl acetal (7.80 mmol) を加え、室温にて22時間攪拌した。反応液に酢酸エチル (5 ml) と水 (5 ml)を加え、酢酸エチル (5ml) で抽出した。有機層を水 (10ml) で洗浄後溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー (n-ヘキサン-酢酸エチル 2:1) で精製し、化合物7b 0.37g (収率33 %) を無色油状物として得た。
1H-NMR (CDCl3) δ: 7.90 (1H, s), 7.45-7.43 (5H, m), 5.30 (2H, s), 4.51 (1H, t, J = 5.1 Hz), 4.40 (2H, q, J = 7.1 Hz), 4.30 (2H, q, J = 7.1 Hz), 3.91 (2H, d, J = 5.1 Hz), 3.46 (6H, s), 1.40 (3H, t, J = 7.1 Hz), 1.26 (3H, t, J = 7.1 Hz).
本発明に係る化合物はプロドラッグであるため、経口吸収性が高い、良好なバイオアベイラビリティーを示す、良好なクリアランスを示す、肺移行性が高いなどの利点を有するため、優れた医薬品となりうる。
本発明に係る化合物の親化合物は、キャップ構造依存的エンドヌクレアーゼに対する阻害活性が高い、ウイルス特異的な酵素であるため選択性が高いなどの効果を有するため、副作用が軽減された医薬品となりうる。
さらに、本発明に係る化合物及び/又は本発明に係る化合物の親化合物は、代謝安定性が高い、溶解度が高い、経口吸収性が高い、良好なバイオアベイラビリティーを示す、良好なクリアランスを示す、肺移行性が高い、半減期が長い、非タンパク結合率が高い、hERGチャネル阻害が低い、CYP阻害が低い、CPE(CytoPathic Effect、細胞変性効果)抑制効果が認められ、及び/又は光毒性試験、Ames試験、遺伝毒性試験で陰性を示す、もしくは肝障害などの毒性を有さない等の利点も有する。したがって、本発明に係る化合物は、優れた医薬品となりうる。
本発明に係る化合物の投与量は、投与方法、患者の年齢、体重、状態及び疾患の種類によっても異なるが、通常、経口投与の場合、成人1日あたり約0.05mg~3000mg、好ましくは、約0.1mg~1000mgを、要すれば分割して投与すればよい。また、非経口投与の場合、成人1日あたり約0.01mg~1000mg、好ましくは、約0.05mg~500mgを投与する。
1)基質の調製
5’末端のGを2リン酸化修飾、且つ2’位の水酸基をメトキシル化修飾し、5’末端から6番目のUをCy3標識、3’末端をBHQ2標識した30merRNA(5’-pp-[m2’-O]GAA UAU(-Cy3) GCA UCA CUA GUA AGC UUU GCU CUA-BHQ2-3’:日本バイオサービス社製)を購入し、EPICENTRE社製のスクリプトキャップ(ScriptCap)システムを使ってcap構造を付加した(産物はm7G [5’]-ppp-[5’] [m2’-O]GAA UAU(-Cy3) GCA UCA CUA GUA AGC UUU GCU CUA(-BHQ2)-3’)。これを変性ポリアクリルアミドゲル電気泳動法にて分離・精製し、基質として使用した。
2)酵素の調製
RNPは定法に従いウイルス粒子から調製した(参考文献:VIROLOGY(1976) 73, p327-338 OLGA M. ROCHOVANSKY)。具体的にはA/WSN/33ウイルス1x103 PFU/mL、200μLを10日齢発育鶏卵に接種し、37℃で2日間培養後、鶏卵のしょう尿液を回収した。20%スクロースを用いた超遠心分離によりウイルス粒子を精製し、TritonX-100とリソレシチンを用いてウイルス粒子を可溶化後、30-70%グリセロール密度勾配を用いた超遠心分離によりRNP画分(50~70%グリセロール画分)を採取し、酵素液(約1nMのPB1・PB2・PA複合体を含む)として使用した。
3)酵素反応
ポリプロピレン製の384穴プレートに酵素反応液(組成: 53 mM Tris-塩酸塩 (pH7.8)、1mM MgCl2、1.25 mM ジチオスレイトール、80mM NaCl、12.5%グリセロール、酵素液0.15μL)を2.5μL分注した。次にジメチルスルホキシド(DMSO)で段階的に希釈した被検化合物溶液0.5μL、ポジティブコントロール(PC)及びネガティブコントロール(NC)には、DMSO 0.5μLを加え、よく混合した。次に基質溶液(1.4nM基質RNA、0.05%Tween20)2μLを加えて反応を開始し、室温で60分間インキュベートした後、反応液1μLを10μL のHi-Di Formamide溶液(サイジングマーカーとしてGeneScan 120 Liz Size Standardを含む:アプライドバイオシステム(ABI)社製。)に加え、反応を停止した。NCは反応開始前にEDTA(4.5mM)を加えることで予め反応を停止させた(表記濃度は全て終濃度である)。
3)阻害率(IC50値)の測定
反応停止させた溶液を85 ℃で5分間加熱し、氷上で2分間急冷後、ABI PRIZM 3730ジェネティックアナライザで分析した。解析ソフトABI Genemapperによりキャップ依存的エンドヌクレアーゼ産物のピークを定量し、PC、NCの蛍光強度をそれぞれ0%阻害、100%阻害として被検化合物のCEN反応阻害率(%)を求めた後、カーブフィッティング ソフトウェア (XLfit2.0:Model 205(IDBS社製)など)を使ってIC50値を求めた。親化合物である被検物質のIC50値を表22~34に示す。
市販のプールドヒト肝ミクロソームを用いて、ヒト主要CYP5分子種(CYP1A2、2C9、2C19、2D6、3A4)の典型的基質代謝反応として7-エトキシレゾルフィンのO-脱エチル化(CYP1A2)、トルブタミドのメチル-水酸化(CYP2C9)、メフェニトインの4’-水酸化(CYP2C19)、 デキストロメトルファンのO脱メチル化(CYP2D6)、テルフェナジンの水酸化(CYP3A4)を指標とし、それぞれの代謝物生成量が被検化合物によって阻害される程度を評価した。
反応条件は以下のとおり:基質、0.5 μmol/L エトキシレゾルフィン(CYP1A2)、100 μmol/L トルブタミド(CYP2C9)、50 μmol/L S-メフェニトイン(CYP2C19)、5μmol/L デキストロメトルファン(CYP2D6)、1 μmol/L テルフェナジン(CYP3A4);反応時間、15分;反応温度、37℃;酵素、プールドヒト肝ミクロソーム 0.2mg タンパク質/mL;被検薬物濃度、1、5、10、20 μmol/L(4点)。
96穴プレートに反応溶液として、50mM Hepes 緩衝液中に各5種の基質、ヒト肝ミクロソーム、被検薬物を上記組成で加え、補酵素であるNADPHを添加して、指標とする代謝反応を開始し、37℃、15分間反応した後、メタノール/アセトニトリル=1/1(v/v)溶液を添加することで反応を停止した。3000rpm、15分間の遠心操作後、遠心上清中のレゾルフィン(CYP1A2代謝物)を蛍光マルチラベルカウンタで、トルブタミド水酸化体 (CYP2C9代謝物)、メフェニトイン4’水酸化体(CYP2C19代謝物)、デキストロルファン(CYP2D6代謝物)、テルフェナジンアルコール体(CYP3A4代謝物)をLC/MS/MSで定量した。
薬物を溶解した溶媒であるDMSOのみを反応系に添加したものをコントロール(100%)とし、被検薬物溶液を加えたそれぞれの濃度での残存活性(%)を算出し、濃度と抑制率を用いて、ロジスティックモデルによる逆推定によりIC50を算出した。
化合物の溶解度は、1%DMSO添加条件下で決定した。DMSOにて10mM化合物溶液を調製し、化合物溶液6 μLをpH 6.8 人工腸液(0.2 mol/L リン酸二水素カリウム試液 250 mL に 0.2 mol/L NaOH 試液 118 mL、水を加えて 1000 mL とした) 594 μLに添加した。25℃で16時間静置させた後、混液を吸引濾過した。濾液をメタノール/水= 1/1にて2倍希釈し、絶対検量線法によりHPLCまたはLC/MS/MSを用いてろ液中濃度を測定した。
ヒト肝ミクロソーム0.5mg タンパク質/mLを含む0.2 mLの緩衝液(50mmol/L tris-HCl pH7.4、 150mmol/L 塩化カリウム、 10 mmol/L 塩化マグネシウム)中で、1mmol/L NADPH存在下で37℃、0分あるいは30分間反応させた(酸化的反応)。反応後、メタノール/アセトニトリル=1/1(v/v)溶液の100μLに反応液50 μLを添加、混合し、3000rpmで15分間遠心した。その遠心上清中の試験化合物をLC/MS/MSにて定量し、反応後の試験化合物の残存量を0分反応時の化合物量を100%として計算した。なお、加水分解反応はNADPH非存在下で、グルクロン酸抱合反応はNADPHに換えて5mM UDP-グルクロン酸の存在下で反応を行い、以後同じ操作を実施した。
心電図QT間隔延長のリスク評価を目的として、human ether-a-go-go related gene (hERG) チャンネルを発現させたHEK293細胞を用いて、心室再分極過程に重要な役割を果たす遅延整流K+電流 (IKr) への作用を検討した。
全自動パッチクランプシステム (PatchXpress 7000A, Axon Instruments Inc.) を用い、ホールセルパッチクランプ法により、細胞を-80 mVの膜電位に保持した後、+50 mVの脱分極刺激を2秒間、さらに-50 mVの再分極刺激を2秒間与えた際に誘発されるIKrを記録した。発生する電流が安定した後、被検物質を目的の濃度で溶解させた細胞外液 (NaCl: 137 mmol/L、 KCl: 4 mmol/L、 CaCl2・2H2O: 1.8 mmol/L、 MgCl2・6H2O: 1 mmol/L、 グルコース: 10 mmol/L、 HEPES(4-(2-hydroxyethyl)-1-piperazine ethanesulfonic acid、4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸): 10 mmol/L、 pH = 7.4) を室温条件下で、10分間細胞に適用させた。得られたIKrから、解析ソフト (DataXpress ver. 1、 Molecular Devices Corporation) を使用して、保持膜電位における電流値を基準に最大テール電流の絶対値を計測した。さらに、被検物質適用前の最大テール電流に対する阻害率を算出し、媒体適用群 (0.1 % ジメチルスルホキシド溶液) と比較して、被検物質のIKrへの影響を評価した。
・2% FCS E-MEM(MEM(Minimum Essential Medium)(Invitrogen)にカナマイシン及びFCSを添加して調整)
・0.5% BSA E-MEM(MEM(Minimum Essential Medium)(Invitrogen)にカナマイシン及びBSAを添加して調整)
・HBSS(hanks' Balanced Salt Solution)
・MDBK細胞
2% FCS E-MEMにて適当細胞数(3×105 /mL)に調整した。
・MDCK細胞
HBSSにて2回洗った後、0.5% BSA E-MEMにて適当細胞数(5×105 /mL)に調整した。
・Trypsin溶液
Trypsin from porcine pancreas(SIGMA)をPBS(-)にて溶解し、0.45umのフィルターにてフィルトレーションした。
・EnVision(PerkinElmer)
・WST-8 Kit(キシダ化学)
・10% SDS溶液
・被験試料の希釈、分注
培養液として、MDBK細胞使用時には2% FCS E-MEMを使用し、MDCK細胞使用時には0.5% BSA E-MEMを用いた。以下、ウイルス・細胞・被験試料の希釈に対し、同様の培養液を使用した。
予め被験試料を培養液で適度な濃度に希釈し、96 wellプレートに2~5倍段階希釈系列を作製した(50μL/well)。抗Flu活性測定用、細胞毒性測定用の2枚作製した。各薬剤について3重測定を実施した。
MDCK細胞使用時には、抗Flu活性測定用にのみ、細胞にTrypsinを最終濃度3ug/mLとなるように添加した。
・インフルエンザウイルスの希釈、分注
予め、インフルエンザウイルスを培養液で適当な濃度に希釈し、被験試料が入った96 wellプレートに50μL/wellずつ分注した。細胞毒性測定用のプレートには、培養液を50μL/wellずつ分注した。
・細胞の希釈、分注
適当細胞数に調整した細胞を、被験試料が入った96 wellプレートに100μL/wellずつ分注した。
プレートミキサーで混和し、CO2インキュベーターで培養した。抗Flu活性測定用、細胞毒性測定用共に、3日間培養した。
・WST-8の分注
3日間培養した96 wellプレートを肉眼、顕微鏡下で観察し、細胞の形態・結晶の有無等を確認した。プレートから細胞を吸わないように上清を除いた。
WST-8 Kitを、培養液にて10倍希釈し、このWST-8溶液を各wellに100μLずつ分注した。プレートミキサーにて混和の後、CO2インキュベーターで1~3時間培養した。
抗Flu活性測定用プレートについては、培養後、各wellに10% SDS溶液を10uLずつ分注し、ウイルスを不活化した。
・吸光度の測定
混和した96wellプレートを、EnVisionで450 nm/620 nmの2波長で吸光度を測定した。
次の様な計算式に基づきMicrosoft Excelまたは同等の計算処理能力を有するプログラムを使用し算出した。
・50% インフルエンザ感染細胞死阻害濃度 (EC50)算出
EC50 = 10^ Z
Z = (50% - High %) / (High % -Low %) x {log(High conc.) - log(Low conc.)} + log(High conc.)
試験例6の測定結果を表22~34に示す。
以上の結果から、親化合物は高いキャップ依存的エンドヌクレアーゼ(CEN)阻害活性、および/または高いCPE抑制効果を示すため、インフルエンザウイルスに感染することより誘発される症状及び/又は疾患の治療及び/又は予防剤として有用な医薬となり得る。
BALB/cAnNCrlCrlj(雌,5週齢;日本チャールス・リバー株式会社)を購入し、6~7週齢のマウスを試験に使用した。
<ウイルス溶液の調整>
A/WS/33, A/Victoria/3/75またはB/Maryland/1/59(ATCC)をマウス肺内で継代し、マウス馴化ウイルスを作成した。凍結保存したマウス馴化ウイルス溶液をすみやかに融解し、用いる感染価 (A/WS/33の場合:800-4000TCID50/mouse, A/Victoria/3/75の場合:750 TCID50/mouse, B/Maryland/1/59の場合:100 TCID50/mouse)になるようにDPBSで希釈した。
<感染>
ケタミン・キシラジン混合液の麻酔下にて、調整したウイルス溶液100ulを経鼻接種し、マウス肺内へ直接感染させた。
<被験試料の調整>
被験試料を0.5%メチルセルロース溶液で適当な濃度に懸濁した。
<感染マウスへの被験試料の投与>
ウイルス感染直後または一定時間経過後のマウスに適当に希釈された被験試料を200ul経口投与した。
<薬効評価>
ウイルス感染後14日間飼育し、50%致死抑制に必要な一日あたりの投与量ED50(mg/kg/day)、最高投与量における致死抑制率(%survival)、あるいは最高投与量においてコントロールに比して50%生存する日数(50%延命日数(days))を算出した。またはウイルス感染後数日間の肺内ウイルス量を測定し,コントロールのウイルス量と比較してウイルス抑制効果を評価した。
<安楽死>
実験終了後のマウスは二酸化炭素やハロタン過剰投与で安楽死させた。
<結果>
単回投与のED50値を示す。
参考例化合物番号413:12.3
実施例化合物番号20:4.4
以上の結果から、親化合物である参考例化合物413をプロドラッグ化した実施例化合物20は、より低濃度で致死抑制効果を示すことが判明した。
経口吸収性の検討実験材料と方法
(1)使用動物:マウスあるいはラットを使用した。
(2)飼育条件:マウス及びラットは、固形飼料および滅菌水道水を自由摂取させた。
(3)投与量、群分けの設定:経口投与、静脈内投与を所定の投与量により投与した。以下のように群を設定した。(化合物ごとで投与量は変更有)
経口投与 1~30mg/kg(n=2~3)
静脈内投与 0.5~10mg/kg(n=2~3)
(4)投与液の調製:経口投与は溶液または懸濁液として投与した。静脈内投与は可溶化して投与した。
(5)投与方法:経口投与は、経口ゾンデにより強制的に胃内に投与した。静脈内投与は、注射針を付けたシリンジにより尾静脈から投与した。
(6)評価項目:経時的に採血し、血漿中薬物濃度をLC/MS/MSを用いて測定した。
(7)統計解析:血漿中濃度推移について、非線形最小二乗法プログラムWinNonlin(登録商標)を用いて血漿中濃度‐時間曲線下面積(AUC)を算出し、経口投与群と静脈内投与群のAUCからバイオアベイラビリティ(BA)を算出した。
<結果>
ラットを使用して測定した測定結果を下記の表35に示す。
以上の結果から、プロドラッグは、親化合物よりもバイオアベイラビリティが向上した。
したがって、本発明化合物は、経口吸収性に優れ、インフルエンザウイルスに感染することより誘発される症状及び/又は疾患の治療及び/又は予防剤として有用な医薬となり得る。
実施例114および204を経口投与した後のBAはそれぞれ、6.8%、および13.0%であり、親化合物である参考例化合物301を経口投与したとき(BA=2.3%)と比べて、バイオアベイラビリティの向上が認められた。いずれの化合物もTmaxの値は、1hr以下であり,経口吸収性が高いことが示された。また、実施例化合物114および204は、全血漿サンプル中の濃度は定量下限以下であった。
以下の成分を含有する顆粒剤を製造する。
成分 式(I)で表わされる化合物 10mg
乳糖 700mg
コーンスターチ 274mg
HPC-L 16mg
1000mg
式(I)で表わされる化合物と乳糖を60メッシュのふるいに通す。コーンスターチを120メッシュのふるいに通す。これらをV型混合機にて混合する。混合末にHPC-L(低粘度ヒドロキシプロピルセルロース)水溶液を添加し、練合、造粒(押し出し造粒 孔径0.5~1mm)、乾燥工程する。得られた乾燥顆粒を振動ふるい(12/60メッシュ)で櫛過し顆粒剤を得る。
以下の成分を含有するカプセル充填用顆粒剤を製造する。
成分 式(I)で表わされる化合物 15mg
乳糖 90mg
コーンスターチ 42mg
HPC-L 3mg
150mg
式(I)で表わされる化合物、乳糖を60メッシュのふるいに通す。コーンスターチを120メッシュのふるいに通す。これらを混合し、混合末にHPC-L溶液を添加して練合、造粒、乾燥する。得られた乾燥顆粒を整粒後、その150mgを4号硬ゼラチンカプセルに充填する。
以下の成分を含有する錠剤を製造する。
成分 式(I)で表わされる化合物 10mg
乳糖 90mg
微結晶セルロース 30mg
CMC-Na 15mg
ステアリン酸マグネシウム 5mg
150mg
式(I)で表わされる化合物、乳糖、微結晶セルロース、CMC-Na(カルボキシメチルセルロース ナトリウム塩)を60メッシュのふるいに通し、混合する。混合末にステアリン酸マグネシウム混合し、製錠用混合末を得る。本混合末を直打し、150mgの錠剤を得る。
以下の成分を加温混合後、滅菌して注射剤とした。
成分 式(I)で示される化合物 3 mg
非イオン界面活性剤 15 mg
注射用精製水 1 ml
Claims (24)
- 式(I):
(式中、
PRは、プロドラッグを形成する基であり;
R1aは、水素、ハロゲン、ヒドロキシ、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RA1)(RA2)、
-Z-N(RA3)-SO2-(RA4)、
-Z-C(=O)-N(RA5)-SO2-(RA6)、
-Z-N(RA7)-C(=O)-RA8、
-Z-S-RA9、
-Z-SO2-RA10、
-Z-S(=O)-RA11、
-Z-N(RA12)-C(=O)-O-RA13、
-Z-N(RA14)-C(=O)-N(RA15)(RA16)、
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19)、
-Z-N(RA20)-C(=O)-C(=O)-RA21、または
-Z-B(-ORA22)(-ORA23)
(ここで、RA1、RA2、RA3、RA5、RA7、RA8、RA9、RA12、RA13、RA14、RA15、RA16、RA17、RA18、RA19、RA20、およびRA21は、それぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RA4、RA6、RA10、およびRA11はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RA1およびRA2、RA15およびRA16、ならびにRA18およびRA19は、隣接する原子と一緒になって複素環を形成していてもよく、
RA22、およびRA23はそれぞれ独立して、水素原子、置換基群Cで置換されていてもよい低級アルキル、またはRA22、およびRA23が一緒になっては、隣接する原子と一緒になって複素環を形成していてもよく、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;
R2aは、水素、ハロゲン、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RB1)-SO2-RB2、
-Z-N(RB3)-C(=O)-RB4、
-Z-N(RB5)-C(=O)-O-RB6、
-Z-C(=O)-N(RB7)(RB8)、
-Z-N(RB9)(RB10)、または
-Z-SO2-RB11
(ここで、RB1、RB3、RB4、RB5、RB6、RB7、RB8、RB9、およびRB10は、それぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RB2およびRB11はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RB7およびRB8、ならびにRB9およびRB10は、隣接する原子と一緒になって複素環を形成していてもよく、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;
R3aは、水素、ハロゲン、ヒドロキシ、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RC1)-SO2-RC2、
-Z-N(RC3)-C(=O)-RC4、
-Z-N(RC5)-C(=O)-O-RC6、
-Z-C(=O)-N(RC7)(RC8)、
-Z-N(RC9)(RC10)、
-Z-SO2-RC11、または
-Z-N(RC12)-O-C(=O)-RC13
(ここで、RC1、RC3、RC4、RC5、RC6、RC7、RC8、RC9、RC10、RC12および、RC13は、それぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RC2、およびRC11はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RC7およびRC8、ならびにRC9およびRC10は、隣接する原子と一緒になって複素環を形成していてもよく、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;
a)B1およびB2は、いずれか一方がCR5aR6a、ならびに他方がNR7aであるか、または
b)B1がCR8aR9aおよびB2がCR10aR11aであり、
R5a、R6a、R7a、R8a、R9a、R10aおよびR11aは、それぞれ独立して水素、カルボキシ、シアノ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Y-S-RD1、
-Z-S(=O)-RD2、
-Z-SO2-RD3、
-C(=O)-C(=O)-RD4、
-C(=O)-N(RD5)(RD6)、
-Z-C(RD7)(RD8)(RD9)、
-Z-CH2-RD10、
-Z-N(RD11)-C(=O)-O-RD12、もしくは
-Z-N(RD13)-C(=O)-RD14、または
R5aおよびR6aは一緒になって置換基群Cで置換されていてもよい複素環式基を形成してもよい
(ここで、RD1、RD4、RD5、RD6、RD9、RD11、RD12、RD13、およびRD14はそれぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RD2、およびRD3はそれぞれ独立して、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RD7、RD8、およびRD10はそれぞれ独立して、置換基群Cで置換されていてもよい炭素環式基、または置換基群Cで置換されていてもよい複素環式基であり、
RD5およびRD6は、隣接する原子と一緒になって複素環を形成していてもよく、
Yは、直鎖もしくは分枝状の低級アルキレンであり、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり、
RD5およびRD6は、隣接する原子と一緒になって炭素環を形成していてもよい;
1)B1がCR5aR6a、およびB2がNR7aの場合、
R3aとR7aは隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成していてもよく、
2)B1がNR7a、およびB2がCR5aR6aの場合、
R3aとR6aは隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成していてもよく、または
3)B1がCR8aR9a、およびB2がCR10aR11aの場合、
R8aおよびR10aは、隣接する原子と一緒になって置換基群Dで置換されていてもよい炭素環もしくは複素環を形成していてもよく、もしくは
R3aおよびR11aは、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成していてもよく、
ここで、
B1がCR8aR9a、およびB2がCR10aR11aであり、ならびにR9aが水素、およびR11aが水素の時、
i)R8aまたはR10aのいずれか一方が、
-Z-C(RE1)(RE2)(RE3)
-Y-S-RE4、
-Z-CH2-RE5、または
以下に示される基:
(式中、RE1、およびRE2はそれぞれ独立して、置換基群Cで置換されていてもよい炭素環式基、および置換基群Cで置換されていてもよい複素環式基からなる置換基群から選ばれ、
RE3は、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RE4は、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、
RE5は、置換基群Cで置換されていてもよい芳香族複素環式基であり、
RE6は、置換基群Cから選ばれ、
mは0または1以上の整数であり、
但し、m個のRE6は、置換基群Cから選ばれる同一または異なっていてもよい基であり、
Yは、直鎖もしくは分枝状の低級アルキレンであり、ならびに
Zは、単結合または直鎖もしくは分枝状の低級アルキレンである)であり;かつ
ii)R8aまたはR10aの他方が、
水素、カルボキシ、シアノ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Y-S-RF1、
-C(=O)-C(=O)-RF2、または
-C(=O)-N(RF3)(RF4)
(ここで、RF1、RF2、RF3、およびRF4はそれぞれ独立して、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキルからなる置換基群から選ばれ、ならびに
Yは、直鎖もしくは分枝状の低級アルキレンである)である;
但し、以下のc)ならびにd)である場合を除く
c)R5a、R6a、およびR7aが、いずれも水素である場合。
d)R8a、R9a、R10a、およびR11aが、いずれも水素である場合。;
置換基群C:ハロゲン、シアノ、ヒドロキシ、カルボキシ、ホルミル、アミノ、オキソ、ニトロ、低級アルキル、低級アルケニル、低級アルキニル、ハロゲノ低級アルキル、低級アルキルオキシ、低級アルキニルオキシ、低級アルキルチオ、ヒドロキシ低級アルキル、炭素環式基、複素環式基、オキソ置換複素環式基、炭素環低級アルキルオキシ、炭素環オキシ低級アルキル、炭素環低級アルキルオキシ低級アルキル、複素環低級アルキルオキシ、複素環オキシ低級アルキル、複素環低級アルキルオキシ低級アルキル、ハロゲノ低級アルキルオキシ、低級アルキルオキシ低級アルキル、低級アルキルオキシ低級アルキルオキシ、低級アルキルカルボニル、低級アルキルカルボニルオキシ、低級アルキルオキシカルボニル、低級アルキルアミノ、低級アルキルカルボニルアミノ、ハロゲノ低級アルキルカルボニルアミノ、低級アルキルアミノカルボニル、低級アルキルスルホニル、低級アルキルスルフィニル、および低級アルキルスルホニルアミノ;
置換基群D:ハロゲン、シアノ、ヒドロキシ、カルボキシ、ホルミル、アミノ、オキソ、ニトロ、低級アルキル、ハロゲノ低級アルキル、低級アルキルオキシ、炭素環低級アルキルオキシ、複素環低級アルキルオキシ、ハロゲノ低級アルキルオキシ、低級アルキルオキシ低級アルキル、低級アルキルオキシ低級アルキルオキシ、低級アルキルカルボニル、低級アルキルオキシカルボニル、低級アルキルアミノ、低級アルキルカルボニルアミノ、低級アルキルアミノカルボニル、低級アルキルスルホニル、低級アルキルスルホニルアミノ、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、および置換基群Cで置換されていてもよい複素環低級アルキル)
で示される化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R1aが、水素、ハロゲン、ヒドロキシ、カルボキシ、シアノ、ホルミル、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルケニルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Z-N(RA1)(RA2)、
-Z-N(RA3)-SO2-(RA4)、
-Z-N(RA7)-C(=O)-RA8、
-Z-S-RA9、
-Z-SO2-RA10、
-Z-N(RA12)-C(=O)-O-RA13、
-Z-N(RA20)-C(=O)-C(=O)-RA21、または
-Z-B(-ORA22)(-ORA23)
(置換基群C、RA1、RA2、RA3、RA4、RA7、RA8、RA9、RA10、RA12、RA13、RA20、RA21、RA22、RA23およびZは、請求項1と同意義である)
である、請求項1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R1aが、水素、ハロゲン、ヒドロキシ、カルボキシ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい複素環式基、
-Z-N(RA1)(RA2)、
-Z-N(RA7)-C(=O)-RA8、
-Z-N(RA12)-C(=O)-O-RA13、または
-Z-B(-ORA22)(-ORA23)
(置換基群C、RA1、RA2、RA7、RA8、RA12、RA13、RA22、RA23およびZは、請求項1と同意義である)
である、請求項1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R1aが、水素、ハロゲン、ヒドロキシ、カルボキシ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキルオキシ、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい複素環式基、または
-Z-N(RA1)(RA2)
(置換基群C、RA1、RA2、およびZは、請求項1と同意義である)
である、請求項1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R1aが、水素、またはカルボキシである、請求項1に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R2aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい複素環低級アルキル、または
-Z-N(RB9)(RB10)
(置換基群C、RB9、RB10、およびZは、請求項1と同意義である)
である、請求項1~5のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R2aが、水素、または置換基群Cで置換されていてもよい低級アルキル
(置換基群Cは、請求項1と同意義である)
である、請求項1~5のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R3aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環低級アルキル、
-Z-N(RC1)-SO2-RC2、
-Z-N(RC3)-C(=O)-RC4、
-Z-N(RC5)-C(=O)-O-RC6、
-Z-C(=O)-N(RC7)(RC8)、または
-Z-N(RC9)(RC10)
(置換基群C、RC1、RC2、RC3、RC4、RC5、RC6、RC7、RC8、RC9、RC10、およびZは、請求項1と同意義である)
である、請求項1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R3aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、
(置換基群Cは、請求項1と同意義である)
である、請求項1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- B1がNR7aであり、およびB2がCR5aR6aであり、ならびに
R5a、R6aおよびR7aが、それぞれ独立して水素、カルボキシ、シアノ、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい低級アルケニル、置換基群Cで置換されていてもよい低級アルキニル、置換基群Cで置換されていてもよい低級アルキルカルボニル、置換基群Cで置換されていてもよい低級アルキルオキシカルボニル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい炭素環カルボニル、置換基群Cで置換されていてもよい炭素環オキシカルボニル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環カルボニル、置換基群Cで置換されていてもよい複素環オキシカルボニル、
-Y-S-RD1、
-Z-S(=O)-RD2、
-Z-SO2-RD3、
-C(=O)-C(=O)-RD4、
-C(=O)-N(RD5)(RD6)、
-Z-C(RD7)(RD8)(RD9)
-Z-N(RD11)-C(=O)-O-RD12、または
-Z-N(RD13)-C(=O)-RD14
(置換基群C、RD1、RD2、RD3、RD4、RD5、RD6、RD7、RD8、RD9、RD11、RD12、RD13、RD14、Y、およびZは、請求項1と同意義である)
である、請求項1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- B1がNR7aであり、およびB2がCR5aR6aであり、
R5aが水素であり、
R6aが水素、または置換基群Cで置換されていてもよい低級アルキルであり、ならびに
R7aが置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、換基群Cで置換されていてもよい炭素環低級アルキル、換基群Cで置換されていてもよい複素環低級アルキル、または
-Z-C(RD7)(RD8)(RD9)
(置換基群C、RD7、RD8、RD9、およびZは、請求項1と同意義である)
である、請求項1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- B1がCR5aR6aであり、およびB2がNR7aであり、
R5aが水素であり、
R6aが水素、または置換基群Cで置換されていてもよい低級アルキルであり、ならびに
R7aが置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、換基群Cで置換されていてもよい炭素環低級アルキル、換基群Cで置換されていてもよい複素環低級アルキル、または
-Z-C(RD7)(RD8)(RD9)
(置換基群C、RD7、RD8、RD9、およびZは、請求項1と同意義である)
である、請求項1~9のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- B1がCR5aR6a、およびB2がNR7aであり、
R6aが水素であり、
R3aおよびR7aが、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成し、ならびに
R5aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、
-Y-S-RD1、
-C(=O)-C(=O)-RD2、または
-C(=O)-N(RD3)(RD4)
(ここで、RD1、RD2、RD3、およびRD4、Y、置換基群Cならびに置換基群Dは、請求項1と同意義である)
である、請求項1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R5aが、水素、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい複素環式基、または置換基群Cで置換されていてもよい複素環低級アルキル
(ここで、置換基群Cは、請求項1と同意義である)
である、請求項16に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- B1がCR8aR9a、およびB2がCR10aR11aであり、
R9aが水素、およびR10aが水素であり、
R3aおよびR11aが、隣接する原子と一緒になって置換基群Dで置換されていてもよい複素環を形成し、ならびに
R8aが、水素、置換基群Cで置換されていてもよい低級アルキル、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい炭素環オキシ低級アルキル、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい複素環低級アルキル、置換基群Cで置換されていてもよい複素環オキシ低級アルキル、
-Y-S-RD1、
-C(=O)-C(=O)-RD2、または
-C(=O)-N(RD3)(RD4)
(ここで、RD1、RD2、RD3、およびRD4、Y、置換基群Cならびに置換基群Dは、請求項1と同意義である)
である、請求項1~7のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- R8aが、水素、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、置換基群Cで置換されていてもよい複素環式基、または置換基群Cで置換されていてもよい複素環低級アルキル
(ここで、置換基群Cは、請求項1と同意義である)
である、請求項18に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- 置換基群Dが、置換基群Cで置換されていてもよい炭素環式基、置換基群Cで置換されていてもよい複素環式基、置換基群Cで置換されていてもよい炭素環低級アルキル、または置換基群Cで置換されていてもよい複素環低級アルキル
(置換基群Cは、請求項1と同意義である)
である、請求項16~19のいずれかに記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- PRが、以下の式a)~x)から選ばれる基:
a)-C(=O)-PR0、
b)-C(=O)-PR1、
c)-C(=O)-L-PR1、
d)-C(=O)-L-O-PR1、
e)-C(=O)-L-O-L-O-PR1、
f)-C(=O)-L-O-C(=O)-PR1、
g)-C(=O)-O-PR2、
h)-C(=O)-N(PR2)2、
i)-C(=O)-O-L-O-PR2、
j)-CH2-O-PR3、
k)-CH2-O-L-O-PR3、
l)-CH2-O-C(=O)-PR3、
m)-CH2-O-C(=O)-O-PR3、
n)-CH2(-CH3)-O-C(=O)-O-PR3、
o)-CH2-O-C(=O)-N(-K)-PR3、
p)-CH2-O-C(=O)-O-L-O-PR3、
q)-CH2-O-C(=O)-O-L-N(PR3)2、
r)-CH2-O-C(=O)-N(-K)-L-O-PR3、
s)-CH2-O-C(=O)-N(-K)-L-N(PR3)2、
t)-CH2-O-C(=O)-O-L-O-L-O-PR3、
u)-CH2-O-C(=O)-O-L-N(-K)-C(=O)-PR3、
v)-CH2-O-P(=O)(-OH)2、
w)-CH2-O-P(=O)(-OBn)2、
x)-C(=N+PR5 2)(-NPR5 2)
(式中、Lは、直鎖もしくは分枝状の低級アルキレン、または直鎖もしくは分枝状の低級アルケニレンであり、
Kは、水素、または直鎖もしくは分枝状の低級アルキレンであり、
PR0は、置換基群Fで置換されていてもよい低級アルキル、または置換基群Fで置換されていてもよい低級アルケニルであり、
PR1は、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、または置換基群Fで置換されていてもよい低級アルキルチオであり、
PR2は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、または置換基群Fで置換されていてもよい複素環式基であり、
PR3は、置換基群Fで置換されていてもよい低級アルキル、置換基群Fで置換されていてもよい炭素環式基、置換基群Fで置換されていてもよい複素環式基、置換基群Fで置換されていてもよい低級アルキルアミノ、置換基群Fで置換されていてもよい炭素環低級アルキル、置換基群Fで置換されていてもよい複素環低級アルキル、または低級アルキルシリルであり、ならびに
PR5は、置換基群Fで置換されていてもよい低級アルキルである。
置換基群F;オキソ、低級アルキル、ヒドロキシ低級アルキル、アミノ、低級アルキルアミノ、炭素環低級アルキル、低級アルキルカルボニル、ハロゲン、ヒドロキシ、カルボキシ、低級アルキルカルボニルアミノ、低級アルキルカルボニルオキシ、低級アルキルオキシカルボニル、低級アルキルオキシ、シアノ、ニトロ)
である、請求項1~20に記載の化合物、もしくはその製薬上許容される塩またはそれらの溶媒和物。
- 請求項1~21のいずれかに記載の化合物、その製薬上許容される塩、またはそれらの溶媒和物を含有する医薬組成物。
- 抗インフルエンザ作用を有する、請求項22に記載の医薬組成物。
- キャップ依存的エンドヌクレアーゼ阻害作用を有する、請求項22に記載の医薬組成物。
Priority Applications (25)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/824,723 US8987441B2 (en) | 2010-09-24 | 2011-09-21 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| MX2013003139A MX2013003139A (es) | 2010-09-24 | 2011-09-21 | Profarmaco de derivado de carbamoilpiridona policiclica substituida. |
| BR112013006722-5A BR112013006722B1 (pt) | 2010-09-24 | 2011-09-21 | profármaco de derivado de carbamoilpiridona policíclica substituída |
| EP11826859.8A EP2620436B1 (en) | 2010-09-24 | 2011-09-21 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| ES11826859.8T ES2683153T3 (es) | 2010-09-24 | 2011-09-21 | Profármaco derivado de carbamoil piridona policíclica sustituida |
| DK11826859.8T DK2620436T3 (en) | 2010-09-24 | 2011-09-21 | Substituted polycyclic carbamoylpyridone derivative prodrug |
| AU2011307087A AU2011307087B2 (en) | 2010-09-24 | 2011-09-21 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| SI201131528T SI2620436T1 (en) | 2010-09-24 | 2011-09-21 | A prodrug substituted polycyclic carbamoyl pyridone derivative |
| KR1020137010331A KR101773226B1 (ko) | 2010-09-24 | 2011-09-21 | 치환된 다환성 카르바모일 피리돈 유도체의 프로드러그 |
| CA2812363A CA2812363C (en) | 2010-09-24 | 2011-09-21 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| CN201180056716.8A CN103228653B (zh) | 2010-09-24 | 2011-09-21 | 被取代的多环性氨基甲酰基吡啶酮衍生物的前药 |
| RS20180908A RS57490B1 (sr) | 2010-09-24 | 2011-09-21 | Supstituisani prolek derivata policikličnog karbamoil piridona |
| LTEP11826859.8T LT2620436T (lt) | 2010-09-24 | 2011-09-21 | Pakeistojo policiklinio karbamoilpiridono darinio provaistas |
| JP2012535048A JP5553393B2 (ja) | 2010-09-24 | 2011-09-21 | 置換された多環性カルバモイルピリドン誘導体のプロドラッグ |
| RU2013114189A RU2608519C2 (ru) | 2010-09-24 | 2011-09-21 | Пролекарственная форма замещенного полициклического производного карбамоилпиридона |
| PL11826859T PL2620436T3 (pl) | 2010-09-24 | 2011-09-21 | Prolek podstawionej policyklicznej pochodnej karbamoilopirydonowej |
| US14/562,117 US9758515B2 (en) | 2010-09-24 | 2014-12-05 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| US15/676,540 US10202379B2 (en) | 2010-09-24 | 2017-08-14 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| HRP20181250TT HRP20181250T1 (hr) | 2010-09-24 | 2018-08-02 | Predlijek iz supstituiranog policikličkog derivata karbamoilpiridona |
| US16/194,504 US20190248785A1 (en) | 2010-09-24 | 2018-11-19 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| US16/684,870 US20200339565A1 (en) | 2010-09-24 | 2019-11-15 | Prodrug substituted polycyclic carbamoyl pyridone derivative |
| NO2021011C NO2021011I1 (no) | 2010-09-24 | 2021-03-08 | baloksavirmarboksil |
| FR21C1012C FR21C1012I2 (fr) | 2010-09-24 | 2021-03-15 | Promedicament derive de carbamoylpyridone polycyclique substituee |
| LTPA2021505C LTC2620436I2 (lt) | 2010-09-24 | 2021-03-19 | Pakeistojo policiklinio karbamoilpiridono darinio provaistas |
| US18/230,392 US20240182463A1 (en) | 2010-09-24 | 2023-08-04 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010-213012 | 2010-09-24 | ||
| JP2010213012 | 2010-09-24 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US13/824,723 A-371-Of-International US8987441B2 (en) | 2010-09-24 | 2011-09-21 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
| US14/562,117 Division US9758515B2 (en) | 2010-09-24 | 2014-12-05 | Substituted polycyclic carbamoyl pyridone derivative prodrug |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2012039414A1 true WO2012039414A1 (ja) | 2012-03-29 |
Family
ID=45873898
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2011/071446 WO2012039414A1 (ja) | 2010-09-24 | 2011-09-21 | 置換された多環性カルバモイルピリドン誘導体のプロドラッグ |
Country Status (24)
| Country | Link |
|---|---|
| US (6) | US8987441B2 (ja) |
| EP (1) | EP2620436B1 (ja) |
| JP (2) | JP5553393B2 (ja) |
| KR (1) | KR101773226B1 (ja) |
| CN (1) | CN103228653B (ja) |
| AU (1) | AU2011307087B2 (ja) |
| BR (1) | BR112013006722B1 (ja) |
| CA (1) | CA2812363C (ja) |
| DK (1) | DK2620436T3 (ja) |
| ES (1) | ES2683153T3 (ja) |
| FR (1) | FR21C1012I2 (ja) |
| HR (1) | HRP20181250T1 (ja) |
| HU (2) | HUE039859T2 (ja) |
| LT (2) | LT2620436T (ja) |
| MX (1) | MX2013003139A (ja) |
| NO (1) | NO2021011I1 (ja) |
| PL (1) | PL2620436T3 (ja) |
| PT (1) | PT2620436T (ja) |
| RS (1) | RS57490B1 (ja) |
| RU (1) | RU2608519C2 (ja) |
| SI (1) | SI2620436T1 (ja) |
| TR (1) | TR201810736T4 (ja) |
| TW (1) | TWI518085B (ja) |
| WO (1) | WO2012039414A1 (ja) |
Cited By (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014108406A1 (en) | 2013-01-08 | 2014-07-17 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| WO2015038660A1 (en) | 2013-09-12 | 2015-03-19 | Alios Biopharma, Inc. | Pyridazinone compounds and uses thereof |
| WO2016027879A1 (ja) * | 2014-08-22 | 2016-02-25 | 塩野義製薬株式会社 | インテグラーゼ阻害活性を有する多環性ピリドン誘導体 |
| US9328119B2 (en) | 2013-09-12 | 2016-05-03 | Alios Biopharma, Inc. | AZA-pyridone compounds and uses thereof |
| JP5971830B1 (ja) * | 2015-04-28 | 2016-08-17 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグ |
| WO2016175224A1 (ja) * | 2015-04-28 | 2016-11-03 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグ |
| WO2017072341A1 (en) | 2015-10-30 | 2017-05-04 | F. Hoffmann-La Roche Ag | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| US9682084B2 (en) | 2014-06-20 | 2017-06-20 | Gilead Sciences, Inc. | Crystalline forms of (2R,5S,13AR)-8-hydroxy-7,9,-dioxo-N-(2,4,6-trifluorobenzyl)-2,3,4,5,7,9,13,13a-octahydro-2,5-methanopyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]oxazepine-10-carboxamide |
| WO2017104691A1 (ja) * | 2015-12-15 | 2017-06-22 | 塩野義製薬株式会社 | キャップ依存的エンドヌクレアーゼ阻害剤及び抗インフルエンザ薬を組み合わせることを特徴とするインフルエンザ治療用医薬 |
| WO2017109088A1 (en) | 2015-12-23 | 2017-06-29 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| JP2017137291A (ja) * | 2016-02-03 | 2017-08-10 | 塩野義製薬株式会社 | 多環性ピリドン誘導体およびそのプロドラッグ |
| US9732092B2 (en) | 2012-12-21 | 2017-08-15 | Gilead Sciences, Inc. | Substituted 2,3,4,5,7,9,13,13a-octahydropyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]OXAZEPINES and methods for treating viral infections |
| WO2017158147A1 (en) | 2016-03-18 | 2017-09-21 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| WO2017158151A1 (en) | 2016-03-18 | 2017-09-21 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| JP6212678B1 (ja) * | 2016-06-20 | 2017-10-11 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体の製造方法およびその結晶 |
| JP6249434B1 (ja) * | 2016-08-10 | 2017-12-20 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグを含有する医薬組成物 |
| CN107531717A (zh) * | 2015-03-11 | 2018-01-02 | 艾丽奥斯生物制药有限公司 | 氮杂‑吡啶酮化合物及其用途 |
| JP2018172437A (ja) * | 2014-12-23 | 2018-11-08 | ギリアード サイエンシーズ, インコーポレイテッド | 多環式カルバモイルピリドン化合物およびそれらの薬学的使用 |
| WO2019070059A1 (ja) | 2017-10-06 | 2019-04-11 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体の立体選択的な製造方法 |
| WO2019144089A1 (en) * | 2018-01-22 | 2019-07-25 | Taigen Biotechnology Co., Ltd. | Cap-dependent endonuclease inhibitors |
| US10456395B2 (en) | 2013-07-12 | 2019-10-29 | Gilead Sciences, Inc. | Substituted dipyrido[1,2-a:1′,2′-d]pyrazines for treating viral infections |
| JP2019532033A (ja) * | 2016-08-29 | 2019-11-07 | ノバルティス アーゲー | オルトミクソウイルス感染症を治療するのに有用な縮合三環式ピリダジノン化合物 |
| US10519168B2 (en) | 2014-06-20 | 2019-12-31 | Gilead Sciences, Inc. | Synthesis of polycyclic-carbamoylpyridone compounds |
| WO2020004443A1 (ja) | 2018-06-27 | 2020-01-02 | 国立大学法人北海道大学 | 多環性カルバモイルピリドン誘導体を含有するアレナウイルス増殖阻害剤 |
| JP2020526521A (ja) * | 2017-07-06 | 2020-08-31 | プロメガ コーポレイションPromega Corporation | 血清中で安定なプロセレンテラジン類似体 |
| CN111670191A (zh) * | 2019-05-08 | 2020-09-15 | 江西彩石医药科技有限公司 | 吡啶酮衍生物的晶型及制备方法和应用 |
| KR20200118062A (ko) * | 2018-01-17 | 2020-10-14 | 장시 카이시 파마슈티컬 테크놀로지 컴퍼니 리미티드 | 피리돈 유도체, 이의 입체 이성질체 및 항인플루엔자 바이러스 약물로서의 응용 |
| US11104689B2 (en) | 2017-09-18 | 2021-08-31 | Sunshine Lake Pharma Co., Ltd. | Influenza virus replication inhibitor and use thereof |
| KR20210137140A (ko) | 2019-03-12 | 2021-11-17 | 시오노기 앤드 컴파니, 리미티드 | 인플루엔자 및 합병증 위험 인자를 갖는 대상체에서 치환된 폴리사이클릭 피리돈 유도체 및 그의 전구약물을 사용한 인플루엔자 치료 |
| WO2021239126A1 (en) * | 2020-05-28 | 2021-12-02 | Taigen Biotechnology Co., Ltd. | Stereoselective synthesis of intermediate for preparation of heterocyclic compound |
| US11389457B2 (en) | 2019-03-29 | 2022-07-19 | Hoffmann-La Roche Inc. | Compound and method for the prevention of transmission of influenza virus |
| US11629149B2 (en) | 2018-02-28 | 2023-04-18 | Novartis Ag | 10-(di(phenyl)methyl)-4-hydroxy-8,9,9A,10-tetrahydro-7H-pyrrolo[1′,2′:4,5]pyrazino[1,2-b]pyridazine-3,5-dione derivatives and related compounds as inhibitors of the orthomyxovirus replication for treating influenza |
| WO2023088370A1 (zh) * | 2021-11-17 | 2023-05-25 | 辰欣药业股份有限公司 | 一种稠环衍生物的晶型及其制备方法 |
| JP2023529295A (ja) * | 2020-05-21 | 2023-07-10 | シーセン ファーマシューティカル カンパニー リミテッド | 縮合環誘導体及びその薬学的用途 |
| WO2024190907A1 (ja) * | 2023-03-15 | 2024-09-19 | 日産化学株式会社 | 2'-o-修飾アデノシンホスホロアミダイト及びその中間体の製造方法 |
Families Citing this family (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010147068A1 (ja) * | 2009-06-15 | 2010-12-23 | 塩野義製薬株式会社 | 置換された多環性カルバモイルピリドン誘導体 |
| WO2013054862A1 (ja) * | 2011-10-12 | 2013-04-18 | 塩野義製薬株式会社 | インテグラーゼ阻害活性を有する多環性ピリドン誘導体 |
| CA2916993C (en) | 2013-07-12 | 2019-01-15 | Gilead Sciences, Inc. | Polycyclic-carbamoylpyridone compounds and their pharmaceutical use |
| NO2717902T3 (ja) | 2014-06-20 | 2018-06-23 | ||
| EP3166943A1 (en) * | 2014-07-07 | 2017-05-17 | Savira Pharmaceuticals GmbH | Pyridopyrazine compounds and their use in the treatment, amelioration or prevention of influenza |
| CA2975398C (en) | 2015-01-30 | 2023-02-21 | Lieber Institute For Brain Development | Comt inhibiting methods and compositions |
| US10730888B2 (en) * | 2015-02-06 | 2020-08-04 | Mylan Laboratories Limited | Process for the preparation of dolutegravir |
| BR112017020837A2 (pt) | 2015-04-02 | 2018-07-03 | Gilead Sciences, Inc. | compostos de carbamoilpiridona policíclicos e seu uso farmacêutico |
| CN105030819B (zh) * | 2015-07-06 | 2019-04-05 | 中国科学技术大学 | 一种3-羟基-4-吡啶酮类高分子铁螯合剂的用途 |
| US10934283B2 (en) | 2015-11-25 | 2021-03-02 | Lieber Institute, Inc. | COMT inhibiting methods and compositions |
| EP3426656B1 (en) * | 2016-03-08 | 2021-05-12 | Novartis AG | Tricyclic compounds useful to treat orthomyxovirus infections |
| CN111303147B (zh) * | 2018-12-12 | 2024-07-02 | 江西彩石医药科技有限公司 | 吡啶酮衍生物、其组合物及作为抗流感病毒药物的应用 |
| CN110041327B (zh) * | 2018-01-17 | 2022-01-21 | 江西彩石医药科技有限公司 | 吡啶酮衍生物、其组合物及作为抗流感病毒药物的应用 |
| CN109503625A (zh) * | 2018-01-19 | 2019-03-22 | 赵蕾 | 一种多环吡啶酮化合物及其药物组合和用途 |
| CN108440564B (zh) * | 2018-04-11 | 2019-08-06 | 安帝康(无锡)生物科技有限公司 | 被取代的多环氨基甲酰基吡啶酮衍生物及其前药 |
| WO2020015669A1 (zh) * | 2018-07-17 | 2020-01-23 | 南京明德新药研发有限公司 | 抗流感病毒三并环衍生物 |
| WO2020020267A1 (zh) * | 2018-07-27 | 2020-01-30 | 深圳市塔吉瑞生物医药有限公司 | 一种取代的多环性吡啶酮化合物及其前药 |
| MX2021004182A (es) * | 2018-10-10 | 2021-09-08 | Janssen Biopharma Inc | Inhibidores macrocíclicos de endonucleasa de la gripe. |
| SG11202104117WA (en) * | 2018-10-22 | 2021-05-28 | Univ Nebraska | Antiviral prodrugs and nanoformulations thereof |
| CN109134428A (zh) * | 2018-10-25 | 2019-01-04 | 南京科技职业学院 | 一种巴洛沙韦中间体的制备方法 |
| US20220048897A1 (en) * | 2018-11-26 | 2022-02-17 | Cocrystal Pharma, Inc. | Inhibitors of influenza virus replication |
| WO2020177715A1 (zh) * | 2019-03-05 | 2020-09-10 | 广东东阳光药业有限公司 | 流感病毒复制抑制剂及其用途 |
| CN112118891B (zh) * | 2019-04-01 | 2023-10-31 | 尼坎医疗公司 | 作为流感病毒复制抑制剂的稠和多环吡啶酮化合物 |
| RU2720305C1 (ru) | 2019-05-07 | 2020-04-28 | Андрей Александрович Иващенко | Замещенный 3,4,12,12а-тетрагидро-1Н-[1,4]оксазино[3,4-c]пиридо[2,1-f] [1,2,4]триазин-6,8-дион, фармацевтическая композиция, способы их получения и применения |
| CN112174956B (zh) * | 2019-07-05 | 2023-01-13 | 广州南鑫药业有限公司 | 一种2-取代-5-六氢哒嗪酮-4-羧酸酯衍生物及其用途 |
| CN112174955B (zh) * | 2019-07-05 | 2023-01-13 | 广州南鑫药业有限公司 | 一种2-取代-5-六氢哒嗪酮-4-羧酸胺衍生物及其用途 |
| KR20220074869A (ko) * | 2019-08-27 | 2022-06-03 | 아트리바 테라퓨틱스 게엠베하 | Mek 억제제와 캡-의존성 엔도뉴클레아제 억제제의 조합 |
| CN112521386B (zh) * | 2019-09-19 | 2023-05-26 | 周雨恬 | 具有抗病毒作用的多环吡啶酮化合物及其药物组合和用途 |
| CN112574170A (zh) * | 2019-09-29 | 2021-03-30 | 江西东邦药业有限公司 | 一种二苯并七元环衍生物及其制备方法和应用 |
| CN115135646B (zh) * | 2019-12-23 | 2024-05-17 | 石家庄迪斯凯威医药科技有限公司 | 取代的多环化合物及其药物组合物和用途 |
| CN111233891B (zh) * | 2020-03-04 | 2021-05-04 | 江苏柯菲平医药股份有限公司 | 一种稠环吡啶酮衍生物及其制备方法和用途 |
| WO2021191872A1 (en) * | 2020-03-26 | 2021-09-30 | Janssen Biopharma, Inc. | Heteroaryl-substituted macrocyclic flu endonuclease inhibitors |
| CN113620948B (zh) * | 2020-05-06 | 2022-11-25 | 太景医药研发(北京)有限公司 | 帽依赖性核酸内切酶抑制剂 |
| RU2745985C1 (ru) * | 2020-05-07 | 2021-04-05 | Андрей Александрович Иващенко | Антикоронавирусный терапевтический агент - замещенный 7-гидрокси-3,4,12,12а-тетрагидро-1H-[1,4]оксазино[3,4-c]пиридо[2,1-f][1,2,4]триазин-6,8-дион для профилактики и лечения COVID-19 |
| CN115667269B (zh) * | 2020-06-12 | 2024-09-17 | 上海翰森生物医药科技有限公司 | 含吡啶酮稠环类衍生物抑制剂、其制备方法和应用 |
| US12129265B2 (en) | 2020-07-21 | 2024-10-29 | Ankh Life Sciences Limited | Therapeutic agents and uses thereof |
| KR20230044252A (ko) * | 2020-07-27 | 2023-04-03 | 머크 샤프 앤드 돔 엘엘씨 | 인플루엔자를 치료 또는 예방하기 위한 폴리시클릭 캡-의존성 엔도뉴클레아제 억제제 |
| CN112062763B (zh) * | 2020-09-10 | 2021-11-05 | 浙江大学 | 羟基吡啶酮并[1,2-b][1,2,5]三氮卓平衍生物及制备和应用 |
| CN112047945B (zh) * | 2020-09-10 | 2021-11-12 | 浙江大学 | 螺环吡啶酮衍生物及应用 |
| WO2022105669A1 (zh) * | 2020-11-17 | 2022-05-27 | 南京明德新药研发有限公司 | 含Se大环类化合物 |
| CN112480007B (zh) * | 2020-12-08 | 2022-11-18 | 宿迁市科莱博生物化学有限公司 | 一种1,3-二甲基-1h-吡唑-4-羧酸的合成方法 |
| CN112724156B (zh) * | 2020-12-30 | 2022-05-10 | 深圳市坤健创新药物研究院 | 一种多环吡啶酮衍生物和药物组合物及其应用 |
| CN114907365B (zh) * | 2021-02-09 | 2023-12-01 | 扬子江药业集团有限公司 | 一种流感病毒抑制剂及其用途 |
| CN116829153A (zh) * | 2021-05-10 | 2023-09-29 | 南京征祥医药有限公司 | 治疗流感化合物的晶型及应用 |
| CN117924325A (zh) * | 2022-11-09 | 2024-04-26 | 石家庄迪斯凯威医药科技有限公司 | 一种抗流感病毒衍生物及其用途 |
| WO2024109707A1 (zh) * | 2022-11-21 | 2024-05-30 | 合肥医工医药股份有限公司 | 稠环吡啶酮衍生物及其制备方法和用途 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006088173A1 (ja) * | 2005-02-21 | 2006-08-24 | Shionogi & Co., Ltd. | Hivインテグラーゼ阻害活性を有する2環性カルバモイルピリドン誘導体 |
| WO2006116764A1 (en) * | 2005-04-28 | 2006-11-02 | Smithkline Beecham Corporation | Polycyclic carbamoylpyridone derivative having hiv integrase inhibitory activity |
| WO2007049675A1 (ja) * | 2005-10-27 | 2007-05-03 | Shionogi & Co., Ltd. | Hivインテグラーゼ阻害活性を有する多環性カルバモイルピリドン誘導体 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2280435A (en) | 1993-07-29 | 1995-02-01 | Merck & Co Inc | Anti-viral agent |
| NZ534712A (en) * | 2002-02-19 | 2006-11-30 | Ono Pharmaceutical Co | Fused pyridazine derivative compounds and drugs containing these compounds as the active ingredient |
| EP1549315A4 (en) | 2002-09-11 | 2007-05-23 | Merck & Co Inc | DIHYDROXYPYRIDOPYRAZINE-1,6-DION COMPOUNDS AS HIV INTEGRASE INHIBITORS |
| JP3879729B2 (ja) * | 2003-06-04 | 2007-02-14 | 株式会社ノーリツ | ガス燃焼装置 |
| TW200510425A (en) * | 2003-08-13 | 2005-03-16 | Japan Tobacco Inc | Nitrogen-containing fused ring compound and use thereof as HIV integrase inhibitor |
| US7820680B2 (en) | 2004-03-09 | 2010-10-26 | Merck & Co., Inc. | HIV integrase inhibitors |
| JP2007528379A (ja) * | 2004-03-09 | 2007-10-11 | イステイチユート・デイ・リチエルケ・デイ・ビオロジア・モレコラーレ・ピ・アンジエレツテイ・エツセ・ピー・アー | Hivインテグラーゼ阻害薬 |
| JP2006088173A (ja) * | 2004-09-21 | 2006-04-06 | Sumitomo Light Metal Ind Ltd | ダブルスキン形材の摩擦撹拌接合方法 |
| EP1973906A1 (en) | 2004-12-23 | 2008-10-01 | Virochem Pharma Inc. | Hydroxydihydropyridopy razine-1,8-diones and methods for inhibiting hiv integrase |
| CN101212903B (zh) * | 2005-04-28 | 2013-07-24 | 史密丝克莱恩比彻姆公司 | 具有hiv整合酶抑制活性的多环氨基甲酰基吡啶酮衍生物 |
| JP4675828B2 (ja) * | 2005-07-15 | 2011-04-27 | 株式会社リコー | デジタルカメラ |
| CN101346376A (zh) * | 2005-10-27 | 2009-01-14 | 盐野义制药株式会社 | 具有hiv整合酶抑制活性的多环性氨基甲酰基吡啶酮衍生物 |
| SG192550A1 (en) * | 2008-07-25 | 2013-08-30 | Viiv Healthcare Co | Chemical compounds |
| WO2010011815A1 (en) * | 2008-07-25 | 2010-01-28 | Smithkline Beecham Corporation | Chemical compounds |
| PT2320908E (pt) * | 2008-07-25 | 2014-03-06 | Shionogi & Co | Pró-fármacos de dolutegravir |
| WO2010011818A1 (en) | 2008-07-25 | 2010-01-28 | Smithkline Beecham Corporation | Chemical compounds |
| WO2010011819A1 (en) * | 2008-07-25 | 2010-01-28 | Smithkline Beecham Corporation | Chemical compounds |
| EP2330902B1 (en) * | 2008-07-25 | 2012-11-14 | GlaxoSmithKline LLC | Chemical compounds |
| WO2010147068A1 (ja) * | 2009-06-15 | 2010-12-23 | 塩野義製薬株式会社 | 置換された多環性カルバモイルピリドン誘導体 |
| WO2011011483A1 (en) | 2009-07-22 | 2011-01-27 | Glaxosmithkline Llc | Chemical compounds |
-
2011
- 2011-09-21 SI SI201131528T patent/SI2620436T1/en unknown
- 2011-09-21 MX MX2013003139A patent/MX2013003139A/es active IP Right Grant
- 2011-09-21 WO PCT/JP2011/071446 patent/WO2012039414A1/ja active Application Filing
- 2011-09-21 RU RU2013114189A patent/RU2608519C2/ru active
- 2011-09-21 ES ES11826859.8T patent/ES2683153T3/es active Active
- 2011-09-21 DK DK11826859.8T patent/DK2620436T3/en active
- 2011-09-21 CN CN201180056716.8A patent/CN103228653B/zh active Active
- 2011-09-21 TR TR2018/10736T patent/TR201810736T4/tr unknown
- 2011-09-21 PT PT118268598T patent/PT2620436T/pt unknown
- 2011-09-21 US US13/824,723 patent/US8987441B2/en active Active
- 2011-09-21 HU HUE11826859A patent/HUE039859T2/hu unknown
- 2011-09-21 PL PL11826859T patent/PL2620436T3/pl unknown
- 2011-09-21 AU AU2011307087A patent/AU2011307087B2/en active Active
- 2011-09-21 KR KR1020137010331A patent/KR101773226B1/ko active IP Right Grant
- 2011-09-21 EP EP11826859.8A patent/EP2620436B1/en active Active
- 2011-09-21 JP JP2012535048A patent/JP5553393B2/ja active Active
- 2011-09-21 CA CA2812363A patent/CA2812363C/en active Active
- 2011-09-21 RS RS20180908A patent/RS57490B1/sr unknown
- 2011-09-21 BR BR112013006722-5A patent/BR112013006722B1/pt active IP Right Grant
- 2011-09-21 LT LTEP11826859.8T patent/LT2620436T/lt unknown
- 2011-09-23 TW TW100134256A patent/TWI518085B/zh active
-
2014
- 2014-05-20 JP JP2014104465A patent/JP5777077B2/ja active Active
- 2014-12-05 US US14/562,117 patent/US9758515B2/en active Active
-
2017
- 2017-08-14 US US15/676,540 patent/US10202379B2/en active Active
-
2018
- 2018-08-02 HR HRP20181250TT patent/HRP20181250T1/hr unknown
- 2018-11-19 US US16/194,504 patent/US20190248785A1/en not_active Abandoned
-
2019
- 2019-11-15 US US16/684,870 patent/US20200339565A1/en not_active Abandoned
-
2021
- 2021-03-08 NO NO2021011C patent/NO2021011I1/no unknown
- 2021-03-15 FR FR21C1012C patent/FR21C1012I2/fr active Active
- 2021-03-19 LT LTPA2021505C patent/LTC2620436I2/lt unknown
- 2021-03-23 HU HUS2100010C patent/HUS2100010I1/hu unknown
-
2023
- 2023-08-04 US US18/230,392 patent/US20240182463A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006088173A1 (ja) * | 2005-02-21 | 2006-08-24 | Shionogi & Co., Ltd. | Hivインテグラーゼ阻害活性を有する2環性カルバモイルピリドン誘導体 |
| WO2006116764A1 (en) * | 2005-04-28 | 2006-11-02 | Smithkline Beecham Corporation | Polycyclic carbamoylpyridone derivative having hiv integrase inhibitory activity |
| WO2007049675A1 (ja) * | 2005-10-27 | 2007-05-03 | Shionogi & Co., Ltd. | Hivインテグラーゼ阻害活性を有する多環性カルバモイルピリドン誘導体 |
Cited By (105)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10689399B2 (en) | 2012-12-21 | 2020-06-23 | Gilead Sciences, Inc. | Substituted 3,4,5,6,8,10,14,14a-octahydro-2h-2,6-methanopyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]oxazocines and methods for treating viral infections |
| US9732092B2 (en) | 2012-12-21 | 2017-08-15 | Gilead Sciences, Inc. | Substituted 2,3,4,5,7,9,13,13a-octahydropyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]OXAZEPINES and methods for treating viral infections |
| US11548901B2 (en) | 2012-12-21 | 2023-01-10 | Gilead Sciences, Inc. | Substituted 1,4-methanopyrido[1′,2′:4,5]pyrazino[1,2-a]pyrimidines for treating viral infections |
| US10035809B2 (en) | 2012-12-21 | 2018-07-31 | Gilead Sciences, Inc. | Substituted 2,3,4,5,7,9,13,13a-octahydro-1,5-methanopyrido[1′,2′:4,5]pyrazino[1,2-a][1,3]diazepines and methods for treating viral infections |
| JP2016518305A (ja) * | 2013-01-08 | 2016-06-23 | ザヴィラ ファーマシューティカルズ ゲーエムベーハー | ピリミドン誘導体及びウイルス性疾患の治療、改善又は予防におけるそれらの使用 |
| WO2014108406A1 (en) | 2013-01-08 | 2014-07-17 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| US11883397B2 (en) | 2013-07-12 | 2024-01-30 | Gilead Sciences, Inc. | Substituted pyrido[1,2-a]pyrrolo[1,2-d]pyrazines for treating viral infections |
| US11213523B2 (en) | 2013-07-12 | 2022-01-04 | Gilead Sciences, Inc. | Substituted pyrido[1,2-a]pyrrolo[1,2-d]pyrazines for treating viral infections |
| US10456395B2 (en) | 2013-07-12 | 2019-10-29 | Gilead Sciences, Inc. | Substituted dipyrido[1,2-a:1′,2′-d]pyrazines for treating viral infections |
| US10364226B2 (en) | 2013-09-12 | 2019-07-30 | Alios Biopharma, Inc. | Pyridazinone compounds and uses thereof |
| JP2016530314A (ja) * | 2013-09-12 | 2016-09-29 | アリオス バイオファーマ インク. | アザ−ピリドン化合物およびその用途 |
| US10251882B2 (en) | 2013-09-12 | 2019-04-09 | Alios Biopharma, Inc. | Aza-pyridone compounds and uses thereof |
| US10702523B2 (en) | 2013-09-12 | 2020-07-07 | Janssen Biopharma, Inc. | AZA-pyridone compounds and uses thereof |
| US9328119B2 (en) | 2013-09-12 | 2016-05-03 | Alios Biopharma, Inc. | AZA-pyridone compounds and uses thereof |
| US10980805B2 (en) | 2013-09-12 | 2021-04-20 | Janssen Biopharma, Inc. | Aza-pyridone compounds and uses thereof |
| WO2015038660A1 (en) | 2013-09-12 | 2015-03-19 | Alios Biopharma, Inc. | Pyridazinone compounds and uses thereof |
| US10975096B2 (en) | 2014-06-20 | 2021-04-13 | Gilead Sciences, Inc. | Synthesis of polycyclic-carbamoylpyridone compounds |
| US10098886B2 (en) | 2014-06-20 | 2018-10-16 | Gilead Sciences, Inc. | Crystalline forms of (2R,5S,13AR)-8-hydroxy-7,9-dioxo-N-(2,4,6-trifluorobenzyl)-2,3,4,5,7,9,13,13A- octahydro-2,5-methanopyrido[1′,2′:4,5]pyrazino[2,1-B] [1,3] oxazepine-10-carboxamide |
| US10519168B2 (en) | 2014-06-20 | 2019-12-31 | Gilead Sciences, Inc. | Synthesis of polycyclic-carbamoylpyridone compounds |
| US11202780B2 (en) | 2014-06-20 | 2021-12-21 | Gilead Sciences, Inc. | Crystalline forms of (2R,5S,13aR)-8-hydroxy-7,9-dioxo-N-(2,4,6-trifluorobenzyl)-2,3,4,5,7,9,13,13a-octahydro-2,5-methanopyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]oxazepine-10-carboxamide |
| US9682084B2 (en) | 2014-06-20 | 2017-06-20 | Gilead Sciences, Inc. | Crystalline forms of (2R,5S,13AR)-8-hydroxy-7,9,-dioxo-N-(2,4,6-trifluorobenzyl)-2,3,4,5,7,9,13,13a-octahydro-2,5-methanopyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]oxazepine-10-carboxamide |
| WO2016027879A1 (ja) * | 2014-08-22 | 2016-02-25 | 塩野義製薬株式会社 | インテグラーゼ阻害活性を有する多環性ピリドン誘導体 |
| JPWO2016027879A1 (ja) * | 2014-08-22 | 2017-06-01 | 塩野義製薬株式会社 | インテグラーゼ阻害活性を有する多環性ピリドン誘導体 |
| JP2018172437A (ja) * | 2014-12-23 | 2018-11-08 | ギリアード サイエンシーズ, インコーポレイテッド | 多環式カルバモイルピリドン化合物およびそれらの薬学的使用 |
| US10208045B2 (en) | 2015-03-11 | 2019-02-19 | Alios Biopharma, Inc. | Aza-pyridone compounds and uses thereof |
| CN107531717A (zh) * | 2015-03-11 | 2018-01-02 | 艾丽奥斯生物制药有限公司 | 氮杂‑吡啶酮化合物及其用途 |
| CN107531717B (zh) * | 2015-03-11 | 2021-07-27 | 詹森生物制药有限公司 | 氮杂-吡啶酮化合物及其用途 |
| KR20190002742A (ko) | 2015-04-28 | 2019-01-08 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR101981880B1 (ko) | 2015-04-28 | 2019-05-23 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| EP4424314A2 (en) | 2015-04-28 | 2024-09-04 | Shionogi & Co., Ltd | Substituted polycyclic pyridone derivative and prodrug thereof |
| JP5971830B1 (ja) * | 2015-04-28 | 2016-08-17 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグ |
| EP4219508A1 (en) | 2015-04-28 | 2023-08-02 | Shionogi & Co., Ltd | Substituted polycyclic pyridone derivative and prodrug thereof |
| EP3428170A1 (en) | 2015-04-28 | 2019-01-16 | Shionogi & Co., Ltd | Anti-influenza polycyclic pyridone derivative and prodrug thereof |
| KR102409779B1 (ko) | 2015-04-28 | 2022-06-16 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| AU2016256125B2 (en) * | 2015-04-28 | 2020-01-30 | Shionogi And Co., Ltd. | Substituted polycyclic pyridone derivative and prodrug thereof |
| KR20170131651A (ko) | 2015-04-28 | 2017-11-29 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR101981912B1 (ko) | 2015-04-28 | 2019-05-23 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| WO2016175224A1 (ja) * | 2015-04-28 | 2016-11-03 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグ |
| AU2016256125B9 (en) * | 2015-04-28 | 2020-02-20 | Shionogi And Co., Ltd. | Substituted polycyclic pyridone derivative and prodrug thereof |
| KR20190049916A (ko) | 2015-04-28 | 2019-05-09 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| JP2017105750A (ja) * | 2015-04-28 | 2017-06-15 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグ |
| WO2017072341A1 (en) | 2015-10-30 | 2017-05-04 | F. Hoffmann-La Roche Ag | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| WO2017104691A1 (ja) * | 2015-12-15 | 2017-06-22 | 塩野義製薬株式会社 | キャップ依存的エンドヌクレアーゼ阻害剤及び抗インフルエンザ薬を組み合わせることを特徴とするインフルエンザ治療用医薬 |
| KR20180080320A (ko) | 2015-12-15 | 2018-07-11 | 시오노기세야쿠 가부시키가이샤 | 캡 의존적 엔도뉴클레아제 저해제 및 항인플루엔자 약을 조합하는 것을 특징으로 하는 인플루엔자 치료용 의약 |
| WO2017109088A1 (en) | 2015-12-23 | 2017-06-29 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| JP7095945B2 (ja) | 2016-02-03 | 2022-07-05 | 塩野義製薬株式会社 | 多環性ピリドン誘導体およびそのプロドラッグ |
| JP2017137291A (ja) * | 2016-02-03 | 2017-08-10 | 塩野義製薬株式会社 | 多環性ピリドン誘導体およびそのプロドラッグ |
| JP2021046425A (ja) * | 2016-02-03 | 2021-03-25 | 塩野義製薬株式会社 | 多環性ピリドン誘導体およびそのプロドラッグ |
| WO2017158151A1 (en) | 2016-03-18 | 2017-09-21 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| WO2017158147A1 (en) | 2016-03-18 | 2017-09-21 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| AU2017282305B2 (en) * | 2016-06-20 | 2021-06-10 | Shionogi & Co., Ltd. | Method for producing substituted polycyclic pyridone derivative and crystal of same |
| WO2017221869A1 (ja) * | 2016-06-20 | 2017-12-28 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体の製造方法およびその結晶 |
| KR102586854B1 (ko) | 2016-06-20 | 2023-10-11 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체의 제조 방법 및 그의 결정 |
| KR20190017991A (ko) | 2016-06-20 | 2019-02-20 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체의 제조 방법 및 그의 결정 |
| EP4194459A1 (en) | 2016-06-20 | 2023-06-14 | Shionogi & Co., Ltd | Process for preparing substituted polycyclic pyridone derivative and crystal thereof |
| KR20220084425A (ko) | 2016-06-20 | 2022-06-21 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체의 제조 방법 및 그의 결정 |
| US11261198B2 (en) | 2016-06-20 | 2022-03-01 | Shionogi & Co., Ltd. | Process for preparing substituted polycyclic pyridone derivative and crystal thereof |
| KR102447711B1 (ko) | 2016-06-20 | 2022-09-28 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체의 제조 방법 및 그의 결정 |
| JP6212678B1 (ja) * | 2016-06-20 | 2017-10-11 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体の製造方法およびその結晶 |
| JP2018024682A (ja) * | 2016-06-20 | 2018-02-15 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体の製造方法およびその結晶 |
| US11807648B2 (en) | 2016-06-20 | 2023-11-07 | Shionogi & Co., Ltd. | Process for preparing substituted polycyclic pyridone derivative and crystal thereof |
| CN113717198A (zh) * | 2016-06-20 | 2021-11-30 | 盐野义制药株式会社 | 用于制备取代多环吡啶酮衍生物及其晶体的方法 |
| RU2727962C1 (ru) * | 2016-08-10 | 2020-07-28 | Сионоги Энд Ко., Лтд. | Фармацевтические композиции, содержащие замещенные полициклические пиридоновые производные и их пролекарство |
| JP6249434B1 (ja) * | 2016-08-10 | 2017-12-20 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグを含有する医薬組成物 |
| JP2018048172A (ja) * | 2016-08-10 | 2018-03-29 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグを含有する医薬組成物 |
| JP6267397B1 (ja) * | 2016-08-10 | 2018-01-24 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグを含有する医薬組成物 |
| WO2018030463A1 (ja) | 2016-08-10 | 2018-02-15 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体およびそのプロドラッグを含有する医薬組成物 |
| EP4458348A2 (en) | 2016-08-10 | 2024-11-06 | Shionogi & Co., Ltd | Pharmaceutical compositions containing substituted polycyclic pyridone derivatives and prodrug thereof |
| KR20190007517A (ko) | 2016-08-10 | 2019-01-22 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그를 함유하는 의약 조성물 |
| KR20190018469A (ko) | 2016-08-10 | 2019-02-22 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그를 함유하는 의약 조성물 |
| US11912715B2 (en) | 2016-08-29 | 2024-02-27 | Novartis Ag | Fused tricyclic pyridazinone compounds useful to treat orthomyxovirus infections |
| JP7221861B2 (ja) | 2016-08-29 | 2023-02-14 | ノバルティス アーゲー | オルトミクソウイルス感染症を治療するのに有用な縮合三環式ピリダジノン化合物 |
| JP2019532033A (ja) * | 2016-08-29 | 2019-11-07 | ノバルティス アーゲー | オルトミクソウイルス感染症を治療するのに有用な縮合三環式ピリダジノン化合物 |
| JP7204728B2 (ja) | 2017-07-06 | 2023-01-16 | プロメガ コーポレイション | 血清中で安定なプロセレンテラジン類似体 |
| JP2020526521A (ja) * | 2017-07-06 | 2020-08-31 | プロメガ コーポレイションPromega Corporation | 血清中で安定なプロセレンテラジン類似体 |
| US11104689B2 (en) | 2017-09-18 | 2021-08-31 | Sunshine Lake Pharma Co., Ltd. | Influenza virus replication inhibitor and use thereof |
| WO2019070059A1 (ja) | 2017-10-06 | 2019-04-11 | 塩野義製薬株式会社 | 置換された多環性ピリドン誘導体の立体選択的な製造方法 |
| KR20200066644A (ko) | 2017-10-06 | 2020-06-10 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체의 입체 선택적인 제조 방법 |
| US11247993B2 (en) | 2018-01-17 | 2022-02-15 | Jiangxi Caishi Pharmaceutical Technology Co., Ltd. | Pyridone derivative, composition and use as antiviral drug thereof |
| JP7352297B2 (ja) | 2018-01-17 | 2023-09-28 | 江西彩石医薬科技有限公司 | ピリドン誘導体と、その組成物、並びにそれらが抗ウイルス薬物としての応用 |
| KR20200118062A (ko) * | 2018-01-17 | 2020-10-14 | 장시 카이시 파마슈티컬 테크놀로지 컴퍼니 리미티드 | 피리돈 유도체, 이의 입체 이성질체 및 항인플루엔자 바이러스 약물로서의 응용 |
| JP2021511374A (ja) * | 2018-01-17 | 2021-05-06 | 江西彩石医薬科技有限公司Jiangxi Caishi Pharmaceutical Technology Co., Limited | ピリドン誘導体と、その組成物、並びにそれらが抗ウイルス薬物としての応用 |
| KR102477187B1 (ko) | 2018-01-17 | 2022-12-12 | 장시 카이시 파마슈티컬 테크놀로지 컴퍼니 리미티드 | 피리돈 유도체, 이의 입체 이성질체 및 항인플루엔자 바이러스 약물로서의 응용 |
| JP6994121B2 (ja) | 2018-01-22 | 2022-01-14 | タイゲン バイオテクノロジー カンパニー リミテッド | キャップ依存性エンドヌクレアーゼ阻害剤 |
| KR20200086385A (ko) * | 2018-01-22 | 2020-07-16 | 타이젠 바이오테크놀러지 컴퍼니 리미티드 | 캡 의존성 엔도뉴클레아제 억제제 |
| KR102432975B1 (ko) | 2018-01-22 | 2022-08-16 | 타이젠 바이오테크놀러지 컴퍼니 리미티드 | 캡 의존성 엔도뉴클레아제 억제제 |
| US10596171B2 (en) | 2018-01-22 | 2020-03-24 | Taigen Biotechnology Co., Ltd. | Cap-dependent endonuclease inhibitors |
| WO2019144089A1 (en) * | 2018-01-22 | 2019-07-25 | Taigen Biotechnology Co., Ltd. | Cap-dependent endonuclease inhibitors |
| JP2021512146A (ja) * | 2018-01-22 | 2021-05-13 | タイゲン バイオテクノロジー カンパニー リミテッド | キャップ依存性エンドヌクレアーゼ阻害剤 |
| US12071441B2 (en) | 2018-02-28 | 2024-08-27 | Novartis Ag | 10-(di(phenyl)methyl)-4-hydroxy-8,9,9A,10-tetrahydro-7H-pyrrolo[1′,2′:4,5]pyrazino[1,2-b]pyridazine-3,5-dione derivatives and related compounds as inhibitors of the orthomyxovirus replication for treating influenza |
| US11629149B2 (en) | 2018-02-28 | 2023-04-18 | Novartis Ag | 10-(di(phenyl)methyl)-4-hydroxy-8,9,9A,10-tetrahydro-7H-pyrrolo[1′,2′:4,5]pyrazino[1,2-b]pyridazine-3,5-dione derivatives and related compounds as inhibitors of the orthomyxovirus replication for treating influenza |
| US12098151B2 (en) | 2018-06-27 | 2024-09-24 | National University Coporation Hokkaido University | Arenavirus growth inhibitor comprising polycyclic carbamoyl pyridone derivative |
| JP7307412B2 (ja) | 2018-06-27 | 2023-07-12 | 国立大学法人北海道大学 | 多環性カルバモイルピリドン誘導体を含有するアレナウイルス増殖阻害剤 |
| JPWO2020004443A1 (ja) * | 2018-06-27 | 2021-08-05 | 国立大学法人北海道大学 | 多環性カルバモイルピリドン誘導体を含有するアレナウイルス増殖阻害剤 |
| US11492352B2 (en) | 2018-06-27 | 2022-11-08 | National University Corporation Hokkaido University | Arenavirus growth inhibitor comprising polycyclic carbamoylpyridone derivative |
| WO2020004443A1 (ja) | 2018-06-27 | 2020-01-02 | 国立大学法人北海道大学 | 多環性カルバモイルピリドン誘導体を含有するアレナウイルス増殖阻害剤 |
| KR20210137140A (ko) | 2019-03-12 | 2021-11-17 | 시오노기 앤드 컴파니, 리미티드 | 인플루엔자 및 합병증 위험 인자를 갖는 대상체에서 치환된 폴리사이클릭 피리돈 유도체 및 그의 전구약물을 사용한 인플루엔자 치료 |
| US11389457B2 (en) | 2019-03-29 | 2022-07-19 | Hoffmann-La Roche Inc. | Compound and method for the prevention of transmission of influenza virus |
| CN111670191A (zh) * | 2019-05-08 | 2020-09-15 | 江西彩石医药科技有限公司 | 吡啶酮衍生物的晶型及制备方法和应用 |
| CN111670191B (zh) * | 2019-05-08 | 2021-07-13 | 江西彩石医药科技有限公司 | 吡啶酮衍生物的晶型及制备方法和应用 |
| JP2023529295A (ja) * | 2020-05-21 | 2023-07-10 | シーセン ファーマシューティカル カンパニー リミテッド | 縮合環誘導体及びその薬学的用途 |
| JP7407976B2 (ja) | 2020-05-21 | 2024-01-04 | シーセン ファーマシューティカル カンパニー リミテッド | 縮合環誘導体及びその薬学的用途 |
| WO2021239126A1 (en) * | 2020-05-28 | 2021-12-02 | Taigen Biotechnology Co., Ltd. | Stereoselective synthesis of intermediate for preparation of heterocyclic compound |
| WO2023088370A1 (zh) * | 2021-11-17 | 2023-05-25 | 辰欣药业股份有限公司 | 一种稠环衍生物的晶型及其制备方法 |
| WO2024190907A1 (ja) * | 2023-03-15 | 2024-09-19 | 日産化学株式会社 | 2'-o-修飾アデノシンホスホロアミダイト及びその中間体の製造方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5777077B2 (ja) | 置換された多環性カルバモイルピリドン誘導体のプロドラッグ | |
| JP6004552B2 (ja) | 置換された多環性カルバモイルピリドン誘導体 | |
| WO2023131333A1 (zh) | 苯并咪唑类化合物及其医药用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 201180056716.8 Country of ref document: CN |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 11826859 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2012535048 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 13824723 Country of ref document: US |
|
| WWE | Wipo information: entry into national phase |
Ref document number: MX/A/2013/003139 Country of ref document: MX |
|
| ENP | Entry into the national phase |
Ref document number: 2812363 Country of ref document: CA |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2011826859 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: 2011307087 Country of ref document: AU Date of ref document: 20110921 Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 20137010331 Country of ref document: KR Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 2013114189 Country of ref document: RU Kind code of ref document: A |
|
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: 112013006722 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: 112013006722 Country of ref document: BR Kind code of ref document: A2 Effective date: 20130322 |