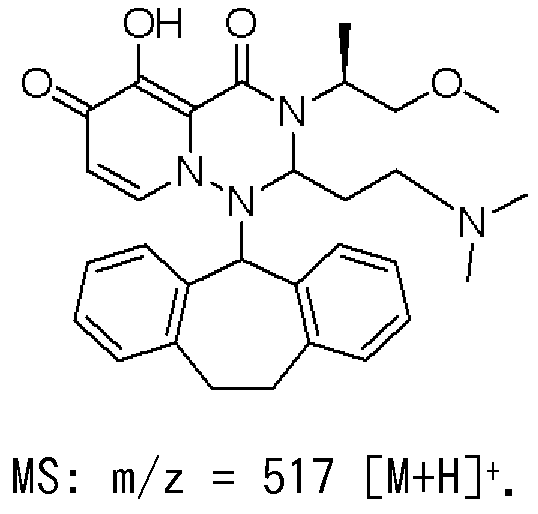
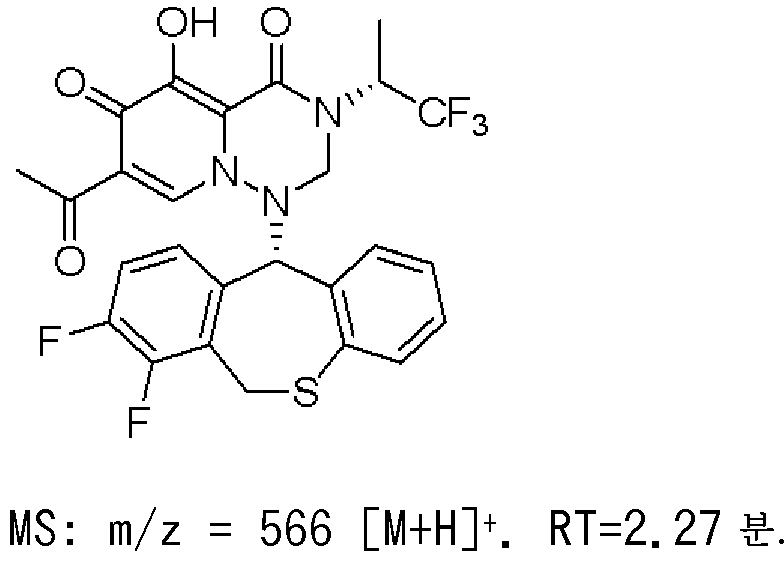
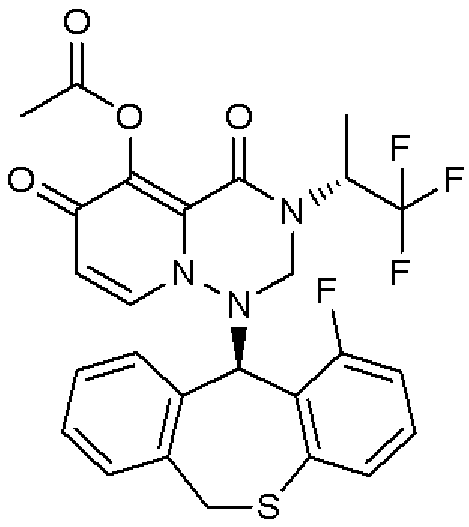
KR20140032934A - 치환된 다환성 카르바모일 피리돈 유도체의 프로드러그 - Google Patents
치환된 다환성 카르바모일 피리돈 유도체의 프로드러그 Download PDFInfo
- Publication number
- KR20140032934A KR20140032934A KR20137010331A KR20137010331A KR20140032934A KR 20140032934 A KR20140032934 A KR 20140032934A KR 20137010331 A KR20137010331 A KR 20137010331A KR 20137010331 A KR20137010331 A KR 20137010331A KR 20140032934 A KR20140032934 A KR 20140032934A
- Authority
- KR
- South Korea
- Prior art keywords
- substituted
- substituent group
- group
- lower alkyl
- carbocyclic
- Prior art date
Links
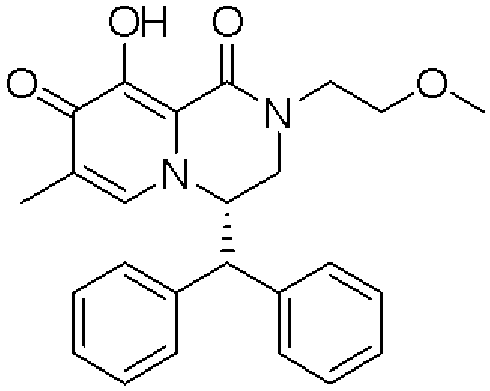
- 229940002612 prodrug Drugs 0.000 title claims abstract description 23
- 239000000651 prodrug Substances 0.000 title claims abstract description 23
- -1 polycyclic carbamoyl pyridone derivative Chemical class 0.000 title claims description 432
- 150000001875 compounds Chemical class 0.000 claims abstract description 657
- 230000001419 dependent effect Effects 0.000 claims abstract description 23
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 22
- 108010042407 Endonucleases Proteins 0.000 claims abstract description 21
- 102000004533 Endonucleases Human genes 0.000 claims abstract description 7
- 125000001424 substituent group Chemical group 0.000 claims description 995
- 125000000217 alkyl group Chemical group 0.000 claims description 382
- 125000000623 heterocyclic group Chemical group 0.000 claims description 265
- 125000002837 carbocyclic group Chemical group 0.000 claims description 231
- 229910052739 hydrogen Inorganic materials 0.000 claims description 140
- 239000001257 hydrogen Substances 0.000 claims description 140
- 238000000034 method Methods 0.000 claims description 121
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 102
- 125000003545 alkoxy group Chemical group 0.000 claims description 95
- 125000003342 alkenyl group Chemical group 0.000 claims description 61
- 150000003839 salts Chemical class 0.000 claims description 56
- 239000012453 solvate Substances 0.000 claims description 51
- 125000000304 alkynyl group Chemical group 0.000 claims description 50
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 46
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 44
- 229910052736 halogen Inorganic materials 0.000 claims description 43
- 150000002367 halogens Chemical class 0.000 claims description 42
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 41
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 40
- 125000004429 atom Chemical group 0.000 claims description 38
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 28
- 125000002947 alkylene group Chemical group 0.000 claims description 27
- 125000005843 halogen group Chemical group 0.000 claims description 26
- 125000003282 alkyl amino group Chemical group 0.000 claims description 24
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 23
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 claims description 19
- 206010022000 influenza Diseases 0.000 claims description 16
- 125000003302 alkenyloxy group Chemical group 0.000 claims description 15
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 13
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 12
- 125000004414 alkyl thio group Chemical group 0.000 claims description 10
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 claims description 9
- 125000004043 oxo group Chemical group O=* 0.000 claims description 9
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- 125000004457 alkyl amino carbonyl group Chemical group 0.000 claims description 7
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 7
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 claims description 7
- 125000005103 alkyl silyl group Chemical group 0.000 claims description 6
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 6
- 230000009471 action Effects 0.000 claims description 4
- 125000004450 alkenylene group Chemical group 0.000 claims description 4
- 125000004644 alkyl sulfinyl group Chemical group 0.000 claims description 4
- 125000004744 butyloxycarbonyl group Chemical group 0.000 claims description 4
- 125000005133 alkynyloxy group Chemical group 0.000 claims description 2
- 125000005740 oxycarbonyl group Chemical group [*:1]OC([*:2])=O 0.000 claims description 2
- 150000003018 phosphorus compounds Chemical class 0.000 claims 19
- 241000712461 unidentified influenza virus Species 0.000 abstract description 6
- 230000000840 anti-viral effect Effects 0.000 abstract description 2
- 230000002062 proliferating effect Effects 0.000 abstract description 2
- LQUSVSANJKHVTM-UHFFFAOYSA-N 3-hydroxy-3h-pyridin-4-one Chemical class OC1C=NC=CC1=O LQUSVSANJKHVTM-UHFFFAOYSA-N 0.000 abstract 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 234
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 216
- 239000002904 solvent Substances 0.000 description 177
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 147
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 145
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 129
- 239000000243 solution Substances 0.000 description 123
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 84
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 81
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 79
- 239000007787 solid Substances 0.000 description 78
- 238000006243 chemical reaction Methods 0.000 description 70
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 64
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 62
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 61
- 230000002829 reductive effect Effects 0.000 description 60
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 52
- 239000012046 mixed solvent Substances 0.000 description 51
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 50
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 49
- 239000000203 mixture Substances 0.000 description 49
- 229910052938 sodium sulfate Inorganic materials 0.000 description 49
- 235000011152 sodium sulphate Nutrition 0.000 description 49
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 48
- 238000010898 silica gel chromatography Methods 0.000 description 45
- 238000003786 synthesis reaction Methods 0.000 description 43
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 42
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 40
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 38
- 238000010511 deprotection reaction Methods 0.000 description 38
- 230000008569 process Effects 0.000 description 38
- 238000003756 stirring Methods 0.000 description 38
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 37
- 230000015572 biosynthetic process Effects 0.000 description 36
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 34
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 33
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 32
- 239000000126 substance Substances 0.000 description 32
- 239000012043 crude product Substances 0.000 description 31
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 30
- 239000010410 layer Substances 0.000 description 29
- 239000002585 base Substances 0.000 description 28
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 25
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 24
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 24
- WORJEOGGNQDSOE-UHFFFAOYSA-N chloroform;methanol Chemical compound OC.ClC(Cl)Cl WORJEOGGNQDSOE-UHFFFAOYSA-N 0.000 description 24
- 239000000284 extract Substances 0.000 description 23
- 229910000027 potassium carbonate Inorganic materials 0.000 description 21
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 20
- 125000004432 carbon atom Chemical group C* 0.000 description 20
- 229910000029 sodium carbonate Inorganic materials 0.000 description 20
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 20
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 19
- 229910052698 phosphorus Inorganic materials 0.000 description 19
- 239000011574 phosphorus Substances 0.000 description 19
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 18
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 18
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 18
- 229910000024 caesium carbonate Inorganic materials 0.000 description 18
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 18
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 17
- 239000000047 product Substances 0.000 description 17
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 16
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 16
- 239000000706 filtrate Substances 0.000 description 15
- 102100031780 Endonuclease Human genes 0.000 description 14
- 239000007864 aqueous solution Substances 0.000 description 14
- 239000003795 chemical substances by application Substances 0.000 description 14
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 14
- 125000000524 functional group Chemical group 0.000 description 14
- 125000006239 protecting group Chemical group 0.000 description 14
- 125000003118 aryl group Chemical group 0.000 description 13
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 13
- 239000007821 HATU Substances 0.000 description 12
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 12
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 12
- 238000001914 filtration Methods 0.000 description 12
- 239000012044 organic layer Substances 0.000 description 12
- 235000017557 sodium bicarbonate Nutrition 0.000 description 12
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 12
- 150000003512 tertiary amines Chemical class 0.000 description 12
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 11
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 11
- 238000001816 cooling Methods 0.000 description 11
- 239000003814 drug Substances 0.000 description 11
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 11
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 11
- 239000003921 oil Substances 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 10
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 10
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 10
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 10
- 239000011541 reaction mixture Substances 0.000 description 10
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 10
- 125000004176 4-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1F)C([H])([H])* 0.000 description 9
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 9
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 229910052757 nitrogen Inorganic materials 0.000 description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 9
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 8
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical group C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 8
- 238000001035 drying Methods 0.000 description 8
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 8
- 229910000104 sodium hydride Inorganic materials 0.000 description 8
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 7
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 150000001412 amines Chemical class 0.000 description 7
- 125000003277 amino group Chemical group 0.000 description 7
- 238000004440 column chromatography Methods 0.000 description 7
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 7
- 238000000605 extraction Methods 0.000 description 7
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 7
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 7
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 7
- 125000006173 tetrahydropyranylmethyl group Chemical group 0.000 description 7
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 6
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 6
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 239000003054 catalyst Substances 0.000 description 6
- 125000000753 cycloalkyl group Chemical group 0.000 description 6
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 6
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 6
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- 125000004433 nitrogen atom Chemical group N* 0.000 description 6
- YLACRFYIUQZNIV-UHFFFAOYSA-N o-(2,4-dinitrophenyl)hydroxylamine Chemical compound NOC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O YLACRFYIUQZNIV-UHFFFAOYSA-N 0.000 description 6
- 229910052763 palladium Inorganic materials 0.000 description 6
- XHFLOLLMZOTPSM-UHFFFAOYSA-M sodium;hydrogen carbonate;hydrate Chemical compound [OH-].[Na+].OC(O)=O XHFLOLLMZOTPSM-UHFFFAOYSA-M 0.000 description 6
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical compound SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 6
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 5
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 5
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 5
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 5
- 238000010531 catalytic reduction reaction Methods 0.000 description 5
- 125000001309 chloro group Chemical group Cl* 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 5
- 235000019253 formic acid Nutrition 0.000 description 5
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 125000006301 indolyl methyl group Chemical group 0.000 description 5
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 5
- VVWRJUBEIPHGQF-MDZDMXLPSA-N propan-2-yl (ne)-n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)\N=N\C(=O)OC(C)C VVWRJUBEIPHGQF-MDZDMXLPSA-N 0.000 description 5
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 238000010992 reflux Methods 0.000 description 5
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 5
- 239000012279 sodium borohydride Substances 0.000 description 5
- 229910000033 sodium borohydride Inorganic materials 0.000 description 5
- 239000012312 sodium hydride Substances 0.000 description 5
- PNGLEYLFMHGIQO-UHFFFAOYSA-M sodium;3-(n-ethyl-3-methoxyanilino)-2-hydroxypropane-1-sulfonate;dihydrate Chemical compound O.O.[Na+].[O-]S(=O)(=O)CC(O)CN(CC)C1=CC=CC(OC)=C1 PNGLEYLFMHGIQO-UHFFFAOYSA-M 0.000 description 5
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 4
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 239000012298 atmosphere Substances 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 125000000392 cycloalkenyl group Chemical group 0.000 description 4
- REVROVKRCYLCAT-UHFFFAOYSA-N dimethyl 4-oxo-3-phenylmethoxypyran-2,5-dicarboxylate Chemical compound O1C=C(C(=O)OC)C(=O)C(OCC=2C=CC=CC=2)=C1C(=O)OC REVROVKRCYLCAT-UHFFFAOYSA-N 0.000 description 4
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 4
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 4
- 229910052731 fluorine Inorganic materials 0.000 description 4
- 210000004211 gastric acid Anatomy 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 4
- 239000005457 ice water Substances 0.000 description 4
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 4
- 125000001624 naphthyl group Chemical group 0.000 description 4
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 4
- 125000004344 phenylpropyl group Chemical group 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 4
- 125000004076 pyridyl group Chemical group 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 239000002994 raw material Substances 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- UKLNMMHNWFDKNT-UHFFFAOYSA-M sodium chlorite Chemical compound [Na+].[O-]Cl=O UKLNMMHNWFDKNT-UHFFFAOYSA-M 0.000 description 4
- 229960002218 sodium chlorite Drugs 0.000 description 4
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- 125000004776 1-fluoroethyl group Chemical group [H]C([H])([H])C([H])(F)* 0.000 description 3
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 3
- 125000006507 2,4-difluorobenzyl group Chemical group [H]C1=C(F)C([H])=C(F)C(=C1[H])C([H])([H])* 0.000 description 3
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 3
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- AUNNWHUVARSNRE-UHFFFAOYSA-N C(C)OC.C(Cl)(Cl)Cl Chemical compound C(C)OC.C(Cl)(Cl)Cl AUNNWHUVARSNRE-UHFFFAOYSA-N 0.000 description 3
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 3
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 3
- 235000011114 ammonium hydroxide Nutrition 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- 239000012267 brine Substances 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- QSKWJTXWJJOJFP-UHFFFAOYSA-N chloroform;ethoxyethane Chemical compound ClC(Cl)Cl.CCOCC QSKWJTXWJJOJFP-UHFFFAOYSA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- 238000000354 decomposition reaction Methods 0.000 description 3
- NPOMSUOUAZCMBL-UHFFFAOYSA-N dichloromethane;ethoxyethane Chemical compound ClCCl.CCOCC NPOMSUOUAZCMBL-UHFFFAOYSA-N 0.000 description 3
- 125000006222 dimethylaminomethyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])* 0.000 description 3
- UREBWPXBXRYXRJ-UHFFFAOYSA-N ethyl acetate;methanol Chemical compound OC.CCOC(C)=O UREBWPXBXRYXRJ-UHFFFAOYSA-N 0.000 description 3
- 125000004672 ethylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C(*)=O 0.000 description 3
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 3
- 125000001153 fluoro group Chemical group F* 0.000 description 3
- 125000006419 fluorocyclopropyl group Chemical group 0.000 description 3
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 3
- 125000001072 heteroaryl group Chemical group 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 229910052740 iodine Inorganic materials 0.000 description 3
- 239000011630 iodine Substances 0.000 description 3
- XGZVUEUWXADBQD-UHFFFAOYSA-L lithium carbonate Chemical compound [Li+].[Li+].[O-]C([O-])=O XGZVUEUWXADBQD-UHFFFAOYSA-L 0.000 description 3
- 229910052808 lithium carbonate Inorganic materials 0.000 description 3
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- PKAUVIXBZJUYRV-UHFFFAOYSA-N methane;hydroiodide Chemical compound C.I PKAUVIXBZJUYRV-UHFFFAOYSA-N 0.000 description 3
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 3
- GDOPTJXRTPNYNR-UHFFFAOYSA-N methyl-cyclopentane Natural products CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 3
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 3
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 3
- 125000002757 morpholinyl group Chemical group 0.000 description 3
- YYTWEEOFRNSTKS-UHFFFAOYSA-N n,n'-dicyclohexylmethanediimine;1-hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1.C1CCCCC1N=C=NC1CCCCC1 YYTWEEOFRNSTKS-UHFFFAOYSA-N 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 3
- 230000004962 physiological condition Effects 0.000 description 3
- 230000036470 plasma concentration Effects 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 125000004673 propylcarbonyl group Chemical group 0.000 description 3
- 125000003226 pyrazolyl group Chemical group 0.000 description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 3
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 3
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 3
- 235000019345 sodium thiosulphate Nutrition 0.000 description 3
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical compound NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 3
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 3
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 3
- 125000005302 thiazolylmethyl group Chemical group [H]C1=C([H])N=C(S1)C([H])([H])* 0.000 description 3
- 239000008096 xylene Substances 0.000 description 3
- SDDOXKGXOXANAF-CQSZACIVSA-N (2s)-2-amino-3,3-diphenylpropan-1-ol Chemical compound C=1C=CC=CC=1C([C@@H](CO)N)C1=CC=CC=C1 SDDOXKGXOXANAF-CQSZACIVSA-N 0.000 description 2
- YZBBUYKPTHDZHF-KNVGNIICSA-N (3R)-7,2'-dihydroxy-4'-methoxyisoflavanol Chemical compound OC1=CC(OC)=CC=C1[C@H]1C(O)C2=CC=C(O)C=C2OC1 YZBBUYKPTHDZHF-KNVGNIICSA-N 0.000 description 2
- WOGITNXCNOTRLK-VOTSOKGWSA-N (e)-3-phenylprop-2-enoyl chloride Chemical compound ClC(=O)\C=C\C1=CC=CC=C1 WOGITNXCNOTRLK-VOTSOKGWSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 2
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 2
- TVSLNRQODQRVJZ-UHFFFAOYSA-N 2-(3,4,5-trifluorophenyl)acetonitrile Chemical group FC1=CC(CC#N)=CC(F)=C1F TVSLNRQODQRVJZ-UHFFFAOYSA-N 0.000 description 2
- SFFSGPCYJCMDJM-UHFFFAOYSA-N 2-[2-(3-oxo-1,2-benzoselenazol-2-yl)ethyl]-1,2-benzoselenazol-3-one Chemical compound [se]1C2=CC=CC=C2C(=O)N1CCN1C(=O)C(C=CC=C2)=C2[se]1 SFFSGPCYJCMDJM-UHFFFAOYSA-N 0.000 description 2
- RHFIAUKMKYHHFA-UHFFFAOYSA-N 2-[[6-(3,3-difluoropyrrolidin-1-yl)-4-[1-(oxetan-3-yl)piperidin-4-yl]pyridin-2-yl]amino]pyridine-4-carbonitrile Chemical compound C1C(F)(F)CCN1C1=CC(C2CCN(CC2)C2COC2)=CC(NC=2N=CC=C(C=2)C#N)=N1 RHFIAUKMKYHHFA-UHFFFAOYSA-N 0.000 description 2
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 2
- 125000004847 2-fluorobenzyl group Chemical group [H]C1=C([H])C(F)=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- QISAUDWTBBNJIR-UHFFFAOYSA-N 2-phenylmethoxyacetyl chloride Chemical compound ClC(=O)COCC1=CC=CC=C1 QISAUDWTBBNJIR-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- 125000006494 2-trifluoromethyl benzyl group Chemical group [H]C1=C([H])C([H])=C(C(=C1[H])C([H])([H])*)C(F)(F)F 0.000 description 2
- VQNDBXJTIJKJPV-UHFFFAOYSA-N 2h-triazolo[4,5-b]pyridine Chemical compound C1=CC=NC2=NNN=C21 VQNDBXJTIJKJPV-UHFFFAOYSA-N 0.000 description 2
- 125000006512 3,4-dichlorobenzyl group Chemical group [H]C1=C(Cl)C(Cl)=C([H])C(=C1[H])C([H])([H])* 0.000 description 2
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 2
- 125000006284 3-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C(F)=C1[H])C([H])([H])* 0.000 description 2
- 125000004208 3-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C([H])C(*)=C1[H] 0.000 description 2
- 125000004207 3-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(OC([H])([H])[H])=C1[H] 0.000 description 2
- 125000006495 3-trifluoromethyl benzyl group Chemical group [H]C1=C([H])C(=C([H])C(=C1[H])C([H])([H])*)C(F)(F)F 0.000 description 2
- BMTZEAOGFDXDAD-UHFFFAOYSA-M 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholin-4-ium;chloride Chemical compound [Cl-].COC1=NC(OC)=NC([N+]2(C)CCOCC2)=N1 BMTZEAOGFDXDAD-UHFFFAOYSA-M 0.000 description 2
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 2
- 125000003143 4-hydroxybenzyl group Chemical group [H]C([*])([H])C1=C([H])C([H])=C(O[H])C([H])=C1[H] 0.000 description 2
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 2
- 125000006189 4-phenyl benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical compound NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 229930040373 Paraformaldehyde Natural products 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- MZVQCMJNVPIDEA-UHFFFAOYSA-N [CH2]CN(CC)CC Chemical group [CH2]CN(CC)CC MZVQCMJNVPIDEA-UHFFFAOYSA-N 0.000 description 2
- BHIIGRBMZRSDRI-UHFFFAOYSA-N [chloro(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(Cl)OC1=CC=CC=C1 BHIIGRBMZRSDRI-UHFFFAOYSA-N 0.000 description 2
- QQIRAVWVGBTHMJ-UHFFFAOYSA-N [dimethyl-(trimethylsilylamino)silyl]methane;lithium Chemical compound [Li].C[Si](C)(C)N[Si](C)(C)C QQIRAVWVGBTHMJ-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical group 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 230000010933 acylation Effects 0.000 description 2
- 238000005917 acylation reaction Methods 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 2
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 2
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 150000001805 chlorine compounds Chemical class 0.000 description 2
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000006255 cyclopropyl carbonyl group Chemical group [H]C1([H])C([H])([H])C1([H])C(*)=O 0.000 description 2
- 125000004859 cyclopropyloxymethyl group Chemical group C1(CC1)OC* 0.000 description 2
- 230000018044 dehydration Effects 0.000 description 2
- 238000006297 dehydration reaction Methods 0.000 description 2
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 2
- 150000001975 deuterium Chemical group 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 2
- 125000006264 diethylaminomethyl group Chemical group [H]C([H])([H])C([H])([H])N(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 2
- 150000004683 dihydrates Chemical class 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 125000006260 ethylaminocarbonyl group Chemical group [H]N(C(*)=O)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000005469 ethylenyl group Chemical group 0.000 description 2
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 238000007429 general method Methods 0.000 description 2
- CJFGBCWGOQRURQ-UHFFFAOYSA-N ginsenoside Mc Natural products C1CC(C2(CCC3C(C)(C)C(O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC(C(C(O)C1O)O)OC1COC1OC(CO)C(O)C1O CJFGBCWGOQRURQ-UHFFFAOYSA-N 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 2
- 125000005956 isoquinolyl group Chemical group 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 2
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical compound CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 2
- 125000004458 methylaminocarbonyl group Chemical group [H]N(C(*)=O)C([H])([H])[H] 0.000 description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 2
- 235000020925 non fasting Nutrition 0.000 description 2
- 125000006504 o-cyanobenzyl group Chemical group [H]C1=C([H])C(C#N)=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 2
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 2
- 229920002866 paraformaldehyde Polymers 0.000 description 2
- 125000005981 pentynyl group Chemical group 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 2
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 2
- 125000005400 pyridylcarbonyl group Chemical group N1=C(C=CC=C1)C(=O)* 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000005493 quinolyl group Chemical group 0.000 description 2
- 238000000163 radioactive labelling Methods 0.000 description 2
- YBCAZPLXEGKKFM-UHFFFAOYSA-K ruthenium(iii) chloride Chemical compound [Cl-].[Cl-].[Cl-].[Ru+3] YBCAZPLXEGKKFM-UHFFFAOYSA-K 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 2
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 2
- CGRKYEALWSRNJS-UHFFFAOYSA-N sodium;2-methylbutan-2-olate Chemical compound [Na+].CCC(C)(C)[O-] CGRKYEALWSRNJS-UHFFFAOYSA-N 0.000 description 2
- 239000008279 sol Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 125000004434 sulfur atom Chemical group 0.000 description 2
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- ONDSBJMLAHVLMI-UHFFFAOYSA-N trimethylsilyldiazomethane Chemical compound C[Si](C)(C)[CH-][N+]#N ONDSBJMLAHVLMI-UHFFFAOYSA-N 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- OHEKQGOBJIKKIF-AWEZNQCLSA-N (12as)-n-[(4-fluorophenyl)methyl]-7-hydroxy-6,8-dioxo-3,4,12,12a-tetrahydro-2h-pyrido[5,6]pyrazino[2,6-b][1,3]oxazine-9-carboxamide Chemical class C([C@@H]1OCCCN1C(=O)C1=C(C2=O)O)N1C=C2C(=O)NCC1=CC=C(F)C=C1 OHEKQGOBJIKKIF-AWEZNQCLSA-N 0.000 description 1
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 1
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- GLGNXYJARSMNGJ-VKTIVEEGSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[(1-ethyl-6-methoxy-2-oxo-4,5-dihydro-3h-1-benzazepin-7-yl)amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound CCN1C(=O)CCCC2=C(OC)C(NC=3N=C(C(=CN=3)Cl)N[C@H]3[C@H]([C@@]4([H])C[C@@]3(C=C4)[H])C(N)=O)=CC=C21 GLGNXYJARSMNGJ-VKTIVEEGSA-N 0.000 description 1
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 1
- YJLIKUSWRSEPSM-WGQQHEPDSA-N (2r,3r,4s,5r)-2-[6-amino-8-[(4-phenylphenyl)methylamino]purin-9-yl]-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound C=1C=C(C=2C=CC=CC=2)C=CC=1CNC1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O YJLIKUSWRSEPSM-WGQQHEPDSA-N 0.000 description 1
- VIJSPAIQWVPKQZ-BLECARSGSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-acetamido-5-(diaminomethylideneamino)pentanoyl]amino]-4-methylpentanoyl]amino]-4,4-dimethylpentanoyl]amino]-4-methylpentanoyl]amino]propanoyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(C)=O VIJSPAIQWVPKQZ-BLECARSGSA-N 0.000 description 1
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 1
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 1
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 1
- MPDDTAJMJCESGV-CTUHWIOQSA-M (3r,5r)-7-[2-(4-fluorophenyl)-5-[methyl-[(1r)-1-phenylethyl]carbamoyl]-4-propan-2-ylpyrazol-3-yl]-3,5-dihydroxyheptanoate Chemical compound C1([C@@H](C)N(C)C(=O)C2=NN(C(CC[C@@H](O)C[C@@H](O)CC([O-])=O)=C2C(C)C)C=2C=CC(F)=CC=2)=CC=CC=C1 MPDDTAJMJCESGV-CTUHWIOQSA-M 0.000 description 1
- IIFVWLUQBAIPMJ-UHFFFAOYSA-N (4-fluorophenyl)methanamine Chemical compound NCC1=CC=C(F)C=C1 IIFVWLUQBAIPMJ-UHFFFAOYSA-N 0.000 description 1
- YQOLEILXOBUDMU-KRWDZBQOSA-N (4R)-5-[(6-bromo-3-methyl-2-pyrrolidin-1-ylquinoline-4-carbonyl)amino]-4-(2-chlorophenyl)pentanoic acid Chemical compound CC1=C(C2=C(C=CC(=C2)Br)N=C1N3CCCC3)C(=O)NC[C@H](CCC(=O)O)C4=CC=CC=C4Cl YQOLEILXOBUDMU-KRWDZBQOSA-N 0.000 description 1
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- AVQQQNCBBIEMEU-UHFFFAOYSA-N 1,1,3,3-tetramethylurea Chemical compound CN(C)C(=O)N(C)C AVQQQNCBBIEMEU-UHFFFAOYSA-N 0.000 description 1
- 125000006002 1,1-difluoroethyl group Chemical group 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 description 1
- KKHFRAFPESRGGD-UHFFFAOYSA-N 1,3-dimethyl-7-[3-(n-methylanilino)propyl]purine-2,6-dione Chemical compound C1=NC=2N(C)C(=O)N(C)C(=O)C=2N1CCCN(C)C1=CC=CC=C1 KKHFRAFPESRGGD-UHFFFAOYSA-N 0.000 description 1
- WORJRXHJTUTINR-UHFFFAOYSA-N 1,4-dioxane;hydron;chloride Chemical compound Cl.C1COCCO1 WORJRXHJTUTINR-UHFFFAOYSA-N 0.000 description 1
- UBCHPRBFMUDMNC-UHFFFAOYSA-N 1-(1-adamantyl)ethanamine Chemical compound C1C(C2)CC3CC2CC1(C(N)C)C3 UBCHPRBFMUDMNC-UHFFFAOYSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 1
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 1
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 1
- QXOGPTXQGKQSJT-UHFFFAOYSA-N 1-amino-4-[4-(3,4-dimethylphenyl)sulfanylanilino]-9,10-dioxoanthracene-2-sulfonic acid Chemical compound Cc1ccc(Sc2ccc(Nc3cc(c(N)c4C(=O)c5ccccc5C(=O)c34)S(O)(=O)=O)cc2)cc1C QXOGPTXQGKQSJT-UHFFFAOYSA-N 0.000 description 1
- YZUPZGFPHUVJKC-UHFFFAOYSA-N 1-bromo-2-methoxyethane Chemical compound COCCBr YZUPZGFPHUVJKC-UHFFFAOYSA-N 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000000453 2,2,2-trichloroethyl group Chemical group [H]C([H])(*)C(Cl)(Cl)Cl 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- FQMZXMVHHKXGTM-UHFFFAOYSA-N 2-(1-adamantyl)-n-[2-[2-(2-hydroxyethylamino)ethylamino]quinolin-5-yl]acetamide Chemical compound C1C(C2)CC(C3)CC2CC13CC(=O)NC1=CC=CC2=NC(NCCNCCO)=CC=C21 FQMZXMVHHKXGTM-UHFFFAOYSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- PYRKKGOKRMZEIT-UHFFFAOYSA-N 2-[6-(2-cyclopropylethoxy)-9-(2-hydroxy-2-methylpropyl)-1h-phenanthro[9,10-d]imidazol-2-yl]-5-fluorobenzene-1,3-dicarbonitrile Chemical compound C1=C2C3=CC(CC(C)(O)C)=CC=C3C=3NC(C=4C(=CC(F)=CC=4C#N)C#N)=NC=3C2=CC=C1OCCC1CC1 PYRKKGOKRMZEIT-UHFFFAOYSA-N 0.000 description 1
- FMKGJQHNYMWDFJ-CVEARBPZSA-N 2-[[4-(2,2-difluoropropoxy)pyrimidin-5-yl]methylamino]-4-[[(1R,4S)-4-hydroxy-3,3-dimethylcyclohexyl]amino]pyrimidine-5-carbonitrile Chemical compound FC(COC1=NC=NC=C1CNC1=NC=C(C(=N1)N[C@H]1CC([C@H](CC1)O)(C)C)C#N)(C)F FMKGJQHNYMWDFJ-CVEARBPZSA-N 0.000 description 1
- VVCMGAUPZIKYTH-VGHSCWAPSA-N 2-acetyloxybenzoic acid;[(2s,3r)-4-(dimethylamino)-3-methyl-1,2-diphenylbutan-2-yl] propanoate;1,3,7-trimethylpurine-2,6-dione Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O.CN1C(=O)N(C)C(=O)C2=C1N=CN2C.C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 VVCMGAUPZIKYTH-VGHSCWAPSA-N 0.000 description 1
- STVVMTBJNDTZBF-UHFFFAOYSA-N 2-amino-3-phenylpropan-1-ol Chemical compound OCC(N)CC1=CC=CC=C1 STVVMTBJNDTZBF-UHFFFAOYSA-N 0.000 description 1
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 1
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 1
- NPRYCHLHHVWLQZ-TURQNECASA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynylpurin-8-one Chemical compound NC1=NC=C2N(C(N(C2=N1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C NPRYCHLHHVWLQZ-TURQNECASA-N 0.000 description 1
- JSBBMMHTNIUVTC-UHFFFAOYSA-N 2-hydroxyethanone Chemical group OC[C]=O JSBBMMHTNIUVTC-UHFFFAOYSA-N 0.000 description 1
- LFOIDLOIBZFWDO-UHFFFAOYSA-N 2-methoxy-6-[6-methoxy-4-[(3-phenylmethoxyphenyl)methoxy]-1-benzofuran-2-yl]imidazo[2,1-b][1,3,4]thiadiazole Chemical compound N1=C2SC(OC)=NN2C=C1C(OC1=CC(OC)=C2)=CC1=C2OCC(C=1)=CC=CC=1OCC1=CC=CC=C1 LFOIDLOIBZFWDO-UHFFFAOYSA-N 0.000 description 1
- ASUDFOJKTJLAIK-UHFFFAOYSA-N 2-methoxyethanamine Chemical compound COCCN ASUDFOJKTJLAIK-UHFFFAOYSA-N 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- VSCBATMPTLKTOV-UHFFFAOYSA-N 2-tert-butylimino-n,n-diethyl-1,3-dimethyl-1,3,2$l^{5}-diazaphosphinan-2-amine Chemical compound CCN(CC)P1(=NC(C)(C)C)N(C)CCCN1C VSCBATMPTLKTOV-UHFFFAOYSA-N 0.000 description 1
- QBWKPGNFQQJGFY-QLFBSQMISA-N 3-[(1r)-1-[(2r,6s)-2,6-dimethylmorpholin-4-yl]ethyl]-n-[6-methyl-3-(1h-pyrazol-4-yl)imidazo[1,2-a]pyrazin-8-yl]-1,2-thiazol-5-amine Chemical compound N1([C@H](C)C2=NSC(NC=3C4=NC=C(N4C=C(C)N=3)C3=CNN=C3)=C2)C[C@H](C)O[C@H](C)C1 QBWKPGNFQQJGFY-QLFBSQMISA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- TVOJIBGZFYMWDT-UHFFFAOYSA-N 4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrazole Chemical compound O1C(C)(C)C(C)(C)OB1C1=CNN=C1 TVOJIBGZFYMWDT-UHFFFAOYSA-N 0.000 description 1
- WYFCZWSWFGJODV-MIANJLSGSA-N 4-[[(1s)-2-[(e)-3-[3-chloro-2-fluoro-6-(tetrazol-1-yl)phenyl]prop-2-enoyl]-5-(4-methyl-2-oxopiperazin-1-yl)-3,4-dihydro-1h-isoquinoline-1-carbonyl]amino]benzoic acid Chemical compound O=C1CN(C)CCN1C1=CC=CC2=C1CCN(C(=O)\C=C\C=1C(=CC=C(Cl)C=1F)N1N=NN=C1)[C@@H]2C(=O)NC1=CC=C(C(O)=O)C=C1 WYFCZWSWFGJODV-MIANJLSGSA-N 0.000 description 1
- 125000004801 4-cyanophenyl group Chemical group [H]C1=C([H])C(C#N)=C([H])C([H])=C1* 0.000 description 1
- HXXOPVULXOEHTK-UHFFFAOYSA-N 4-methyl-1,3-dioxol-2-one Chemical compound CC1=COC(=O)O1 HXXOPVULXOEHTK-UHFFFAOYSA-N 0.000 description 1
- KJSJBKBZMGSIPT-UHFFFAOYSA-N 4-oxo-3-phenylmethoxypyran-2-carboxylic acid Chemical compound O1C=CC(=O)C(OCC=2C=CC=CC=2)=C1C(=O)O KJSJBKBZMGSIPT-UHFFFAOYSA-N 0.000 description 1
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 1
- XFJBGINZIMNZBW-CRAIPNDOSA-N 5-chloro-2-[4-[(1r,2s)-2-[2-(5-methylsulfonylpyridin-2-yl)oxyethyl]cyclopropyl]piperidin-1-yl]pyrimidine Chemical compound N1=CC(S(=O)(=O)C)=CC=C1OCC[C@H]1[C@@H](C2CCN(CC2)C=2N=CC(Cl)=CN=2)C1 XFJBGINZIMNZBW-CRAIPNDOSA-N 0.000 description 1
- HCCNBKFJYUWLEX-UHFFFAOYSA-N 7-(6-methoxypyridin-3-yl)-1-(2-propoxyethyl)-3-(pyrazin-2-ylmethylamino)pyrido[3,4-b]pyrazin-2-one Chemical compound O=C1N(CCOCCC)C2=CC(C=3C=NC(OC)=CC=3)=NC=C2N=C1NCC1=CN=CC=N1 HCCNBKFJYUWLEX-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- ZBJJDYGJCNTNTH-UHFFFAOYSA-N Betahistine mesilate Chemical group CS(O)(=O)=O.CS(O)(=O)=O.CNCCC1=CC=CC=N1 ZBJJDYGJCNTNTH-UHFFFAOYSA-N 0.000 description 1
- JQUCWIWWWKZNCS-LESHARBVSA-N C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F Chemical compound C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F JQUCWIWWWKZNCS-LESHARBVSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229940126657 Compound 17 Drugs 0.000 description 1
- 229940126639 Compound 33 Drugs 0.000 description 1
- 229940127007 Compound 39 Drugs 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 229940123734 Endonuclease inhibitor Drugs 0.000 description 1
- SIXHCCPAJIVTOY-UHFFFAOYSA-N Flutimide Natural products CC(C)CC1=NC(=CC(C)C)C(=O)N(O)C1=O SIXHCCPAJIVTOY-UHFFFAOYSA-N 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- 108010002459 HIV Integrase Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 1
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 1
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 1
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- OZBDFBJXRJWNAV-UHFFFAOYSA-N Rimantadine hydrochloride Chemical compound Cl.C1C(C2)CC3CC2CC1(C(N)C)C3 OZBDFBJXRJWNAV-UHFFFAOYSA-N 0.000 description 1
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 108020000999 Viral RNA Proteins 0.000 description 1
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 1
- SPXSEZMVRJLHQG-XMMPIXPASA-N [(2R)-1-[[4-[(3-phenylmethoxyphenoxy)methyl]phenyl]methyl]pyrrolidin-2-yl]methanol Chemical compound C(C1=CC=CC=C1)OC=1C=C(OCC2=CC=C(CN3[C@H](CCC3)CO)C=C2)C=CC=1 SPXSEZMVRJLHQG-XMMPIXPASA-N 0.000 description 1
- IOSLINNLJFQMFF-XMMPIXPASA-N [(2R)-1-[[4-[[3-[(4-fluorophenyl)methylsulfanyl]phenoxy]methyl]phenyl]methyl]pyrrolidin-2-yl]methanol Chemical compound FC1=CC=C(CSC=2C=C(OCC3=CC=C(CN4[C@H](CCC4)CO)C=C3)C=CC=2)C=C1 IOSLINNLJFQMFF-XMMPIXPASA-N 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 1
- IZVPWPOCGVNQRM-UHFFFAOYSA-N [I].CC Chemical compound [I].CC IZVPWPOCGVNQRM-UHFFFAOYSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- DBJUEJCZPKMDPA-UHFFFAOYSA-N acetic acid;zinc Chemical compound [Zn].CC(O)=O DBJUEJCZPKMDPA-UHFFFAOYSA-N 0.000 description 1
- RAFKCLFWELPONH-UHFFFAOYSA-N acetonitrile;dichloromethane Chemical compound CC#N.ClCCl RAFKCLFWELPONH-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 1
- 229960003805 amantadine Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 1
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- KGNDCEVUMONOKF-UGPLYTSKSA-N benzyl n-[(2r)-1-[(2s,4r)-2-[[(2s)-6-amino-1-(1,3-benzoxazol-2-yl)-1,1-dihydroxyhexan-2-yl]carbamoyl]-4-[(4-methylphenyl)methoxy]pyrrolidin-1-yl]-1-oxo-4-phenylbutan-2-yl]carbamate Chemical compound C1=CC(C)=CC=C1CO[C@H]1CN(C(=O)[C@@H](CCC=2C=CC=CC=2)NC(=O)OCC=2C=CC=CC=2)[C@H](C(=O)N[C@@H](CCCCN)C(O)(O)C=2OC3=CC=CC=C3N=2)C1 KGNDCEVUMONOKF-UGPLYTSKSA-N 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- 125000003016 chromanyl group Chemical group O1C(CCC2=CC=CC=C12)* 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 229940126543 compound 14 Drugs 0.000 description 1
- 229940125758 compound 15 Drugs 0.000 description 1
- 229940126142 compound 16 Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940125810 compound 20 Drugs 0.000 description 1
- 229940126086 compound 21 Drugs 0.000 description 1
- 229940126208 compound 22 Drugs 0.000 description 1
- 229940125833 compound 23 Drugs 0.000 description 1
- 229940125961 compound 24 Drugs 0.000 description 1
- 229940125846 compound 25 Drugs 0.000 description 1
- 229940125851 compound 27 Drugs 0.000 description 1
- 229940127204 compound 29 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229940125878 compound 36 Drugs 0.000 description 1
- 229940125807 compound 37 Drugs 0.000 description 1
- 229940127573 compound 38 Drugs 0.000 description 1
- 229940126540 compound 41 Drugs 0.000 description 1
- 229940125936 compound 42 Drugs 0.000 description 1
- 229940125844 compound 46 Drugs 0.000 description 1
- 229940127271 compound 49 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 229940126545 compound 53 Drugs 0.000 description 1
- 229940127113 compound 57 Drugs 0.000 description 1
- 229940125900 compound 59 Drugs 0.000 description 1
- 229940125890 compound Ia Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 125000004802 cyanophenyl group Chemical group 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000006637 cyclobutyl carbonyl group Chemical group 0.000 description 1
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000006639 cyclohexyl carbonyl group Chemical group 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000006638 cyclopentyl carbonyl group Chemical group 0.000 description 1
- 125000000298 cyclopropenyl group Chemical group [H]C1=C([H])C1([H])* 0.000 description 1
- 230000000120 cytopathologic effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 231100000517 death Toxicity 0.000 description 1
- 125000003493 decenyl group Chemical group [H]C([*])=C([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005070 decynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 125000004431 deuterium atom Chemical group 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 125000004987 dibenzofuryl group Chemical group C1(=CC=CC=2OC3=C(C21)C=CC=C3)* 0.000 description 1
- 229960005215 dichloroacetic acid Drugs 0.000 description 1
- YDVNLQGCLLPHAH-UHFFFAOYSA-N dichloromethane;hydrate Chemical compound O.ClCCl YDVNLQGCLLPHAH-UHFFFAOYSA-N 0.000 description 1
- PQRPNAHMPIEDRO-UHFFFAOYSA-N dichloromethane;methoxyethane Chemical compound ClCCl.CCOC PQRPNAHMPIEDRO-UHFFFAOYSA-N 0.000 description 1
- 125000004772 dichloromethyl group Chemical group [H]C(Cl)(Cl)* 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004598 dihydrobenzofuryl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000005434 dihydrobenzoxazinyl group Chemical group O1N(CCC2=C1C=CC=C2)* 0.000 description 1
- 125000004925 dihydropyridyl group Chemical group N1(CC=CC=C1)* 0.000 description 1
- 125000005056 dihydrothiazolyl group Chemical group S1C(NC=C1)* 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 229940042406 direct acting antivirals neuraminidase inhibitors Drugs 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 125000005066 dodecenyl group Chemical group C(=CCCCCCCCCCC)* 0.000 description 1
- 239000012156 elution solvent Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 125000006232 ethoxy propyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- DQYBDCGIPTYXML-UHFFFAOYSA-N ethoxyethane;hydrate Chemical compound O.CCOCC DQYBDCGIPTYXML-UHFFFAOYSA-N 0.000 description 1
- MHYCRLGKOZWVEF-UHFFFAOYSA-N ethyl acetate;hydrate Chemical compound O.CCOC(C)=O MHYCRLGKOZWVEF-UHFFFAOYSA-N 0.000 description 1
- MVEAAGBEUOMFRX-UHFFFAOYSA-N ethyl acetate;hydrochloride Chemical compound Cl.CCOC(C)=O MVEAAGBEUOMFRX-UHFFFAOYSA-N 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 229940028864 flumadine Drugs 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000003784 fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 description 1
- 125000005816 fluoropropyl group Chemical group [H]C([H])(F)C([H])([H])C([H])([H])* 0.000 description 1
- SIXHCCPAJIVTOY-UITAMQMPSA-N flutimide Chemical compound CC(C)CC1=N\C(=C/C(C)C)C(=O)N(O)C1=O SIXHCCPAJIVTOY-UITAMQMPSA-N 0.000 description 1
- 239000008098 formaldehyde solution Substances 0.000 description 1
- 125000004005 formimidoyl group Chemical group [H]\N=C(/[H])* 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 150000004795 grignard reagents Chemical class 0.000 description 1
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 1
- NGAZZOYFWWSOGK-UHFFFAOYSA-N heptan-3-one Chemical compound CCCCC(=O)CC NGAZZOYFWWSOGK-UHFFFAOYSA-N 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- MOTRZVVGCFFABN-UHFFFAOYSA-N hexane;2-propan-2-yloxypropane Chemical compound CCCCCC.CC(C)OC(C)C MOTRZVVGCFFABN-UHFFFAOYSA-N 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004871 hexylcarbonyl group Chemical group C(CCCCC)C(=O)* 0.000 description 1
- 125000005935 hexyloxycarbonyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000005945 imidazopyridyl group Chemical group 0.000 description 1
- 125000001841 imino group Chemical group [H]N=* 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 125000006328 iso-butylcarbonyl group Chemical group [H]C([H])([H])C([H])(C(*)=O)C([H])([H])[H] 0.000 description 1
- 125000005929 isobutyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])OC(*)=O 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005932 isopentyloxycarbonyl group Chemical group 0.000 description 1
- 125000005928 isopropyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 238000010983 kinetics study Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- RENRQMCACQEWFC-UGKGYDQZSA-N lnp023 Chemical compound C1([C@H]2N(CC=3C=4C=CNC=4C(C)=CC=3OC)CC[C@@H](C2)OCC)=CC=C(C(O)=O)C=C1 RENRQMCACQEWFC-UGKGYDQZSA-N 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 125000006533 methyl amino methyl group Chemical group [H]N(C([H])([H])[H])C([H])([H])* 0.000 description 1
- QJQYPZZUKLQGGT-UHFFFAOYSA-N methyl hypobromite Chemical group COBr QJQYPZZUKLQGGT-UHFFFAOYSA-N 0.000 description 1
- UCFFGYASXIPWPD-UHFFFAOYSA-N methyl hypochlorite Chemical group COCl UCFFGYASXIPWPD-UHFFFAOYSA-N 0.000 description 1
- BLWYXBNNBYXPPL-UHFFFAOYSA-N methyl pyrrolidine-2-carboxylate Chemical compound COC(=O)C1CCCN1 BLWYXBNNBYXPPL-UHFFFAOYSA-N 0.000 description 1
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 1
- 125000004092 methylthiomethyl group Chemical group [H]C([H])([H])SC([H])([H])* 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- HDZGCSFEDULWCS-UHFFFAOYSA-N monomethylhydrazine Chemical compound CNN HDZGCSFEDULWCS-UHFFFAOYSA-N 0.000 description 1
- VQSRKMNBWMHJKY-YTEVENLXSA-N n-[3-[(4ar,7as)-2-amino-6-(5-fluoropyrimidin-2-yl)-4,4a,5,7-tetrahydropyrrolo[3,4-d][1,3]thiazin-7a-yl]-4-fluorophenyl]-5-methoxypyrazine-2-carboxamide Chemical compound C1=NC(OC)=CN=C1C(=O)NC1=CC=C(F)C([C@@]23[C@@H](CN(C2)C=2N=CC(F)=CN=2)CSC(N)=N3)=C1 VQSRKMNBWMHJKY-YTEVENLXSA-N 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- DLJPYODODWSDBI-UHFFFAOYSA-N n-methyl-2-nitrobenzenesulfonamide Chemical compound CNS(=O)(=O)C1=CC=CC=C1[N+]([O-])=O DLJPYODODWSDBI-UHFFFAOYSA-N 0.000 description 1
- 125000005185 naphthylcarbonyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- IOMMMLWIABWRKL-WUTDNEBXSA-N nazartinib Chemical compound C1N(C(=O)/C=C/CN(C)C)CCCC[C@H]1N1C2=C(Cl)C=CC=C2N=C1NC(=O)C1=CC=NC(C)=C1 IOMMMLWIABWRKL-WUTDNEBXSA-N 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 125000005071 nonynyl group Chemical group C(#CCCCCCCC)* 0.000 description 1
- 125000005889 octahydrochromenyl group Chemical group 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229960003752 oseltamivir Drugs 0.000 description 1
- VSZGPKBBMSAYNT-RRFJBIMHSA-N oseltamivir Chemical compound CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 VSZGPKBBMSAYNT-RRFJBIMHSA-N 0.000 description 1
- PGZUMBJQJWIWGJ-ONAKXNSWSA-N oseltamivir phosphate Chemical compound OP(O)(O)=O.CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 PGZUMBJQJWIWGJ-ONAKXNSWSA-N 0.000 description 1
- MOBKGIYZCYKWHZ-UHFFFAOYSA-N osmium;potassium;dihydrate Chemical compound O.O.[K].[Os] MOBKGIYZCYKWHZ-UHFFFAOYSA-N 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000005880 oxathiolanyl group Chemical group 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 230000007918 pathogenicity Effects 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000004675 pentylcarbonyl group Chemical group C(CCCC)C(=O)* 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002633 protecting effect Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000001012 protector Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-O pyridinium Chemical compound C1=CC=[NH+]C=C1 JUJWROOIHBZHMG-UHFFFAOYSA-O 0.000 description 1
- 125000005554 pyridyloxy group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229960000888 rimantadine Drugs 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000002911 sialidase inhibitor Substances 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 125000005750 substituted cyclic group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 125000006253 t-butylcarbonyl group Chemical group [H]C([H])([H])C(C(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229940061367 tamiflu Drugs 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- OGVCRJDQGBIHAG-QGZVFWFLSA-N tert-butyl n-[(2s)-3-hydroxy-1,1-diphenylpropan-2-yl]carbamate Chemical compound C=1C=CC=CC=1C([C@@H](CO)NC(=O)OC(C)(C)C)C1=CC=CC=C1 OGVCRJDQGBIHAG-QGZVFWFLSA-N 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 125000005063 tetradecenyl group Chemical group C(=CCCCCCCCCCCCC)* 0.000 description 1
- 125000005886 tetrahydrobenzothienyl group Chemical group 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000005942 tetrahydropyridyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000005458 thianyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000004588 thienopyridyl group Chemical group S1C(=CC2=C1C=CC=N2)* 0.000 description 1
- 125000004587 thienothienyl group Chemical group S1C(=CC2=C1C=CS2)* 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 125000005505 thiomorpholino group Chemical group 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000004784 trichloromethoxy group Chemical group ClC(O*)(Cl)Cl 0.000 description 1
- 125000005040 tridecenyl group Chemical group C(=CCCCCCCCCCCC)* 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 150000004684 trihydrates Chemical class 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000005065 undecenyl group Chemical group C(=CCCCCCCCCC)* 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000005727 virus proliferation Effects 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- ARAIBEBZBOPLMB-UFGQHTETSA-N zanamivir Chemical compound CC(=O)N[C@@H]1[C@@H](N=C(N)N)C=C(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO ARAIBEBZBOPLMB-UFGQHTETSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/53—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with three nitrogens as the only ring hetero atoms, e.g. chlorazanil, melamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/541—Non-condensed thiazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D253/00—Heterocyclic compounds containing six-membered rings having three nitrogen atoms as the only ring hetero atoms, not provided for by group C07D251/00
- C07D253/08—Heterocyclic compounds containing six-membered rings having three nitrogen atoms as the only ring hetero atoms, not provided for by group C07D251/00 condensed with carbocyclic rings or ring systems
- C07D253/10—Condensed 1,2,4-triazines; Hydrogenated condensed 1,2,4-triazines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
- C07F9/65616—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings containing the ring system having three or more than three double bonds between ring members or between ring members and non-ring members, e.g. purine or analogs
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Pulmonology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
본 발명은 항바이러스 작용, 특히 인플루엔자 바이러스의 증식 억제 활성을 갖는 화합물, 보다 바람직하게는 캡 의존적 엔도뉴클레아제 저해 활성을 나타내는 치환된 3-히드록시-4-피리돈 유도체의 프로드러그를 제공한다.
Description
본 발명은 캡(cap) 의존적 엔도뉴클레아제 저해 활성을 나타내는 치환된 다환성 카르바모일 피리돈 유도체, 그의 프로드러그, 및 이들을 함유하는 의약 조성물에 관한 것이다.
인플루엔자는, 인플루엔자 바이러스의 감염에 기인하는 급성 호흡기 감염증이다. 일본에서는 겨울마다 수백만명의 인플루엔자성 환자가 발생한다는 보고가 있으며, 인플루엔자는 높은 이환율과 사망율을 수반한다. 유아, 고령자 등 고위험 집단에서는 특히 중요한 질환으로, 고령자에게는 폐렴의 합병율이 높아, 인플루엔자에 의한 사망의 대부분을 고령자가 차지하고 있다.
항인플루엔자 약으로는, 바이러스의 탈핵 과정을 저해하는 심메트렐(Symmetrel; 상품명: 아만타딘(Amantadine))이나 플루마딘(Flumadine; 상품명: 리만타딘(Rimantadine)), 바이러스 세포로부터의 출아·방출을 억제하는 뉴라미니다아제 저해제인 오셀타미비르(Oseltamivir; 상품명: 타미플루(Tamiflu))나 자나미비르(Zanamivir; 상품명: 리렌자(Relenza))가 공지된 것이다. 그러나, 내성주의 출현이나 부작용의 문제, 및 병원성이나 치사성이 높은 신형 인플루엔자 바이러스의 세계적인 대유행 등이 우려되고 있어 신규 메카니즘의 항인플루엔자 약의 개발이 요망되고 있다.
인플루엔자 바이러스 유래 효소인 캡 의존적 엔도뉴클레아제는 바이러스 증식에 필수적이며, 숙주가 갖지 않는 바이러스 특이적인 효소 활성을 갖기 때문에, 항인플루엔자 약의 타겟에 적합한 것으로 생각되고 있다. 캡 의존적 엔도뉴클레아제는 숙주 mRNA 전구체를 기질로 하고, 캡 구조를 포함한 9 내지 13염기(캡 구조의 염기는 수에 포함시키지 않음)의 단편을 생성하는 엔도뉴클레아제 활성을 갖는다. 이 단편은 바이러스 RNA 폴리메라아제의 프라이머로서 기능하여 바이러스 단백질을 코드하는 mRNA의 합성에 사용된다. 즉, 캡 의존적 엔도뉴클레아제를 저해하는 물질은 바이러스 mRNA의 합성을 저해함으로써 바이러스 단백질의 합성을 저해한 결과, 바이러스 증식을 저해하는 것으로 생각된다.
캡 의존적 엔도뉴클레아제를 저해하는 물질로는, 플루티미드(flutimide; 특허문헌 1 및 비특허문헌 1 및 2)나 4-치환 2,4-디옥소부탄산(비특허문헌 3 내지 5) 등이 보고되어 있지만, 아직 임상에서 항인플루엔자 약으로서 사용되지 못하고 있다. 또한, 특허문헌 2 내지 16 및 비특허문헌 6에는, HIV 인테그라아제 저해 활성을 갖는 화합물로서, 본 발명 화합물과 유사한 구조를 갖는 화합물이 기재되어 있지만, 캡 의존적 엔도뉴클레아제에 관한 기재는 없다. 또한, 특허문헌 17에는, 본 출원인에 의해 출원된, 캡 의존적 엔도뉴클레아제 저해 활성을 갖는 "치환된 다환성 카르바모일 피리돈 유도체"에 관한 발명이 기재되어 있지만, 본 발명에 따른 프로드러그는 기재되어 있지 않다.
Tetrahedron Lett 1995, 36(12), 2005
Tetrahedron Lett 1995, 36(12), 2009
Antimicrobial Agents And Chemotherapy, Dec. 1994, p.2827-2837
Antimicrobial Agents And Chemotherapy, May 1996, p.1304-1307
J. Med. Chem. 2003, 46, 1153-1164
Bioorganic & Medicinal Chemistry Letters 17(2007) 5595-5599
본 발명의 목적은, 항바이러스 작용, 특히 인플루엔자 바이러스의 증식 억제 활성을 갖는 화합물을 제공하는 것이다. 본 발명의 다른 목적은, 생체에 대한 투여(예를 들면, 경구 투여)에 이용하는 화합물을 프로드러그화함으로써, 투여 후에 효율적으로 체내에 흡수되어 높은 약리 효과를 나타내는 화합물을 제공하는 데에 있다. 본 발명은 보다 바람직하게는, 생체에 대한 투여 후에, 캡 의존적 엔도뉴클레아제 저해 활성을 가짐으로써 인플루엔자 바이러스의 증식을 억제하는 화합물 및 그것을 함유하는 의약을 제공한다.
본 발명은 이하에 나타내어지는 발명을 제공한다.
(항목 1)
식 (I):
[식에서, PR은 프로드러그를 형성하는 기이고(다만, 바람직하게는 벤질기 및 메톡시기를 제외함);
R1a는 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RA1)(RA2),
-Z-N(RA3)-SO2-(RA4),
-Z-C(=O)-N(RA5)-SO2-(RA6),
-Z-N(RA7)-C(=O)-RA8,
-Z-S-RA9,
-Z-SO2-RA10,
-Z-S(=O)-RA11,
-Z-N(RA12)-C(=O)-O-RA13,
-Z-N(RA14)-C(=O)-N(RA15)(RA16),
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19),
-Z-N(RA20)-C(=O)-C(=O)-RA21, 또는
-Z-B(-ORA22)(-ORA23)
(여기서, RA1, RA2, RA3, RA5, RA7, RA8, RA9, RA12, RA13, RA14, RA15, RA16, RA17, RA18, RA19, RA20 및 RA21은 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RA4, RA6, RA10 및 RA11은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RA1 및 RA2, RA15 및 RA16, 및 RA18 및 RA19는 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
RA22 및 RA23은 각각 독립적으로, 수소 원자, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이거나, 또는 RA22 및 RA23은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
R2a는 수소, 할로겐, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RB1)-SO2-RB2,
-Z-N(RB3)-C(=O)-RB4,
-Z-N(RB5)-C(=O)-O-RB6,
-Z-C(=O)-N(RB7)(RB8),
-Z-N(RB9)(RB10), 또는
-Z-SO2-RB11
(여기서, RB1, RB3, RB4, RB5, RB6, RB7, RB8, RB9 및 RB10은 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RB2 및 RB11은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RB7 및 RB8, 및 RB9 및 RB10은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
R3a는 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RC1)-SO2-RC2,
-Z-N(RC3)-C(=O)-RC4,
-Z-N(RC5)-C(=O)-O-RC6,
-Z-C(=O)-N(RC7)(RC8),
-Z-N(RC9)(RC10),
-Z-SO2-RC11, 또는
-Z-N(RC12)-O-C(=O)-RC13
(여기서, RC1, RC3, RC4, RC5, RC6, RC7, RC8, RC9, RC10, RC12 및 RC13은 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RC2 및 RC11은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RC7 및 RC8, 및 RC9 및 RC10은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
a) B1 및 B2는 어느 한쪽이 CR5aR6a이고, 다른 쪽이 NR7a이거나, 또는
b) B1이 CR8aR9a이고, B2가 CR10aR11a이고,
R5a, R6a, R7a, R8a, R9a, R10a 및 R11a는 각각 독립적으로 수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RD1,
-Z-S(=O)-RD2,
-Z-SO2-RD3,
-C(=O)-C(=O)-RD4,
-C(=O)-N(RD5)(RD6),
-Z-C(RD7)(RD8)(RD9),
-Z-CH2-RD10,
-Z-N(RD11)-C(=O)-O-RD12, 또는
-Z-N(RD13)-C(=O)-RD14
(여기서, RD1, RD4, RD5, RD6, RD9, RD11, RD12, RD13 및 RD14는 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RD2 및 RD3은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RD7, RD8 및 RD10은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환식기이고,
RD5 및 RD6은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Y는 직쇄 또는 분지상의 저급 알킬렌이고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이거나, 또는
R5a 및 R6a는 일체가 되어 치환기군 C로 치환되어 있을 수도 있는 복소환식기를 형성할 수도 있고;
RD5 및 RD6은 인접하는 원자와 일체가 되어 탄소환을 형성하고 있을 수도 있고;
1) B1이 CR5aR6a이고, B2가 NR7a인 경우,
R3a와 R7a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고,
2) B1이 NR7a이고, B2가 CR5aR6a인 경우,
R3a와 R6a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고,
3) B1이 CR8aR9a이고, B2가 CR10aR11a인 경우,
R8a 및 R10a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 탄소환 또는 복소환을 형성하고 있을 수도 있거나 또는
R3a 및 R11a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고,
여기서,
B1이 CR8aR9a이고, B2가 CR10aR11a이고, R9a가 수소이고, R11a가 수소일 때,
i) R8a 또는 R10a 중 어느 한쪽이
-Z-C(RE1)(RE2)(RE3),
-Y-S-RE4,
-Z-CH2-RE5, 또는
이하에 나타내어지는 기:
(식에서, RE1 및 RE2는 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 및 치환기군 C로 치환되어 있을 수도 있는 복소환식기로 이루어지는 치환기군에서 선택되고,
RE3은 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RE4는 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RE5는 치환기군 C로 치환되어 있을 수도 있는 방향족 복소환식기이고,
RE6은 치환기군 C에서 선택되고,
m은 0 또는 1 이상의 정수이되,
단, m개의 RE6은 치환기군 C에서 선택되는 동일 또는 상이할 수도 있는 기이고,
Y는 직쇄 또는 분지상의 저급 알킬렌이고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
ii) R8a 또는 R10a 중 다른 쪽이
수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RF1,
-C(=O)-C(=O)-RF2, 또는
-C(=O)-N(RF3)(RF4)
(여기서, RF1, RF2, RF3 및 RF4는 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
Y는 직쇄 또는 분지상의 저급 알킬렌임)이되,
단, 이하의 c) 및 d)인 경우를 제외한다:
c) R5a, R6a 및 R7a가 모두 수소인 경우
d) R8a, R9a, R10a 및 R11a가 모두 수소인 경우;
치환기군 C: 할로겐, 시아노, 히드록시, 카르복시, 포르밀, 아미노, 옥소, 니트로, 저급 알킬, 저급 알케닐, 저급 알키닐, 할로게노 저급 알킬, 저급 알킬옥시, 저급 알키닐옥시, 저급 알킬티오, 히드록시 저급 알킬, 탄소환식기, 복소환식기, 옥소 치환 복소환식기, 탄소환 저급 알킬옥시, 탄소환 옥시 저급 알킬, 탄소환 저급 알킬옥시 저급 알킬, 복소환 저급 알킬옥시, 복소환 옥시 저급 알킬, 복소환 저급 알킬옥시 저급 알킬, 할로게노 저급 알킬옥시, 저급 알킬옥시 저급 알킬, 저급 알킬옥시 저급 알킬옥시, 저급 알킬카르보닐, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬아미노, 저급 알킬카르보닐아미노, 할로게노 저급 알킬카르보닐아미노, 저급 알킬아미노카르보닐, 저급 알킬술포닐, 저급 알킬술피닐 및 저급 알킬술포닐아미노;
치환기군 D: 할로겐, 시아노, 히드록시, 카르복시, 포르밀, 아미노, 옥소, 니트로, 저급 알킬, 할로게노 저급 알킬, 저급 알킬옥시, 탄소환 저급 알킬옥시, 복소환 저급 알킬옥시, 할로게노 저급 알킬옥시, 저급 알킬옥시 저급 알킬, 저급 알킬옥시 저급 알킬옥시, 저급 알킬카르보닐, 저급 알킬옥시카르보닐, 저급 알킬아미노, 저급 알킬카르보닐아미노, 저급 알킬아미노카르보닐, 저급 알킬술포닐, 저급 알킬술포닐아미노, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬]
로 표시되는 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 2)
R1a가 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RA1)(RA2),
-Z-N(RA3)-SO2-(RA4),
-Z-N(RA7)-C(=O)-RA8,
-Z-S-RA9,
-Z-SO2-RA10,
-Z-N(RA12)-C(=O)-O-RA13,
-Z-N(RA20)-C(=O)-C(=O)-RA21, 또는
-Z-B(-ORA22)(-ORA23)
(치환기군 C, RA1, RA2, RA3, RA4, RA7, RA8, RA9, RA10, RA12, RA13, RA20, RA21, RA22, RA23 및 Z는 항목 1과 동일한 의미임)
인, 항목 1에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 3)
R1a가 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기,
-Z-N(RA1)(RA2),
-Z-N(RA7)-C(=O)-RA8,
-Z-N(RA12)-C(=O)-O-RA13, 또는
-Z-B(-ORA22)(-ORA23)
(치환기군 C, RA1, RA2, RA7, RA8, RA12, RA13, RA22, RA23 및 Z는 항목 1과 동일한 의미임)
인, 항목 1에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 4)
R1a가 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는
-Z-N(RA1)(RA2)
(치환기군 C, RA1, RA2 및 Z는 항목 1과 동일한 의미임)
인, 항목 1에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 5)
R1a가 수소 또는 카르복시인, 항목 1에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 6)
R2a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-N(RB9)(RB10)
(치환기군 C, RB9, RB10 및 Z는 항목 1과 동일한 의미임)
인, 항목 1 내지 5 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 7)
R2a가 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬
(치환기군 C는 항목 1과 동일한 의미임)
인, 항목 1 내지 5 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 8)
R3a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬,
-Z-N(RC1)-SO2-RC2,
-Z-N(RC3)-C(=O)-RC4,
-Z-N(RC5)-C(=O)-O-RC6,
-Z-C(=O)-N(RC7)(RC8), 또는
-Z-N(RC9)(RC10)
(치환기군 C, RC1, RC2, RC3, RC4, RC5, RC6, RC7, RC8, RC9, RC10 및 Z는 항목 1과 동일한 의미임)
인, 항목 1 내지 7 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 9)
R3a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬
(치환기군 C는 항목 1과 동일한 의미임)
인, 항목 1 내지 7 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 10)
B1이 NR7a이고, B2가 CR5aR6a이고,
R5a, R6a 및 R7a가 각각 독립적으로 수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RD1,
-Z-S(=O)-RD2,
-Z-SO2-RD3,
-C(=O)-C(=O)-RD4,
-C(=O)-N(RD5)(RD6),
-Z-C(RD7)(RD8)(RD9)
-Z-N(RD11)-C(=O)-O-RD12, 또는
-Z-N(RD13)-C(=O)-RD14
(치환기군 C, RD1, RD2, RD3, RD4, RD5, RD6, RD7, RD8, RD9, RD11, RD12, RD13, RD14, Y 및 Z는 항목 1과 동일한 의미임)
인, 항목 1 내지 9 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 11)
B1이 NR7a이고, B2가 CR5aR6a이고,
R5a가 수소이고,
R6a가 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이고,
R7a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-C(RD7)(RD8)(RD9)
(치환기군 C, RD7, RD8, RD9 및 Z는 항목 1과 동일한 의미임)
인, 항목 1 내지 9 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 12)
B1이 CR5aR6a이고, B2가 NR7a이고,
R5a가 수소이고,
R6a가 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이고,
R7a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-C(RD7)(RD8)(RD9)
(치환기군 C, RD7, RD8, RD9 및 Z는 항목 1과 동일한 의미임)
인, 항목 1 내지 9 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 13)
R7a가 이하에 나타내어지는 기:
(식에서, RE6 및 m은 항목 1과 동일한 의미임)
인, 항목 11 또는 12 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 14)
R1a가 수소 또는 카르복시이고,
R2a가 수소이고,
R3a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이고,
B1이 NR7a이고, B2가 CH2이고,
R7a가 이하에 나타내어지는 기:
(치환기군 C, RE6 및 m은 항목 1과 동일한 의미임)
인, 항목 1에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 15)
B1이 CR8aR9a이고, B2가 CR10aR11a이고,
R9a가 수소이고, R11a가 수소이고,
i) R8a 또는 R10a 중 어느 한쪽이 이하에 나타내어지는 기:
(식에서, RE6, m은 항목 1과 동일한 의미임)이고;
ii) R8a 또는 R10a 중 다른 쪽이
수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬
(치환기군 C는 항목 1과 동일한 의미임)
인, 항목 1 내지 9 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 16)
B1이 CR5aR6a이고, B2가 NR7a이고,
R6a가 수소이고,
R3a 및 R7a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고,
R5a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬,
-Y-S-RD1,
-C(=O)-C(=O)-RD2, 또는
-C(=O)-N(RD3)(RD4)
(여기서, RD1, RD2, RD3 및 RD4, Y, 치환기군 C 및 치환기군 D는 항목 1과 동일한 의미임)
인, 항목 1 내지 7 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 17)
R5a가 수소, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬
(여기서, 치환기군 C는 항목 1과 동일한 의미임)
인, 항목 16에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 18)
B1이 CR8aR9a이고, B2가 CR10aR11a이고,
R9a가 수소이고, R10a가 수소이고,
R3a 및 R11a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고,
R8a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬,
-Y-S-RD1,
-C(=O)-C(=O)-RD2, 또는
-C(=O)-N(RD3)(RD4)
(여기서, RD1, RD2, RD3 및 RD4, Y, 치환기군 C 및 치환기군 D는 항목 1과 동일한 의미임)
인, 항목 1 내지 7 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 19)
R8a가 수소, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬
(여기서, 치환기군 C는 항목 1과 동일한 의미임)
인, 항목 18에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 20)
치환기군 D가 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬
(치환기군 C는 항목 1과 동일한 의미임)
인, 항목 16 내지 19 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 21)
PR이 이하의 식 a) 내지 y)에서 선택되는 기:
(식에서, L은 직쇄 또는 분지상의 저급 알킬렌, 또는 직쇄 또는 분지상의 저급 알케닐렌이고,
K는 수소, 또는 직쇄 또는 분지상의 저급 알킬렌이고,
PR0는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알케닐이고,
PR1은 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬티오이고,
PR2는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR3은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 치환기군 F로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는 저급 알킬실릴이고,
PR4는 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR5는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬이고,
치환기군 F는 옥소, 저급 알킬, 히드록시 저급 알킬, 아미노, 저급 알킬아미노, 탄소환 저급 알킬, 저급 알킬카르보닐, 할로겐, 히드록시, 카르복시, 저급 알킬카르보닐아미노, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬옥시, 시아노, 니트로임)
인, 항목 1 내지 20에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물.
(항목 22)
항목 1 내지 21 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물을 함유하는 의약 조성물.
(항목 23)
항인플루엔자 작용을 갖는, 항목 22에 기재된 의약 조성물.
(항목 24)
캡 의존적 엔도뉴클레아제 저해 작용을 갖는, 항목 22에 기재된 의약 조성물.
(항목 25)
인플루엔자 감염증의 치료 및/또는 예방을 위한, 항목 22에 기재된 의약 조성물.
(항목 26)
항목 1 내지 21 중 어느 한 항에 기재된 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물을 함유하는 캡 의존적 엔도뉴클레아제 저해제.
본 발명은 또한 상기 프로드러그 화합물을 이용한 인플루엔자 감염증의 치료법 또는 예방법, 및 항인플루엔자 작용을 갖는 상기 화합물을 제공한다. 본 발명은 또한 상기 프로드러그 화합물의 친(親) 화합물을 제공한다. 상기 친 화합물은 항인플루엔자제 또는 상기 프로드러그 화합물의 중간체로서 유용하다.
본 발명에 따른 화합물은 캡 의존적 엔도뉴클레아제에 관한 저해 활성을 갖는다. 보다 바람직한 화합물은 프로드러그이고, 투여 후 체내에서 캡 의존적 엔도뉴클레아제에 관한 저해 활성을 갖는 친 화합물이 되기 때문에, 인플루엔자 감염증의 치료제 및/또는 예방제로서 유용하다.
도 1은 친 화합물인 참고예 화합물 301을 프로드러그화한 실시예 화합물 114에 대해, 비절식하에서 래트에 경구 투여한 후의 참고예 301의 혈장중 농도 추이를 측정한 결과이다.
도 2는, 도 1에서 나타내어지는 측정을 3회 행한 혈장중 농도 추이의 평균치를 나타내는 그래프이다.
도 3은 친 화합물인 참고예 화합물 301을 프로드러그화한 실시예 화합물 204에 대해, 비절식하에서 래트에 경구 투여한 후의 참고예 301의 혈장중 농도 추이를 측정한 결과이다.
도 4는, 도 3에서 나타내어지는 측정을 3회 행한 혈장중 농도 추이의 평균치를 나타내는 그래프이다.
도 2는, 도 1에서 나타내어지는 측정을 3회 행한 혈장중 농도 추이의 평균치를 나타내는 그래프이다.
도 3은 친 화합물인 참고예 화합물 301을 프로드러그화한 실시예 화합물 204에 대해, 비절식하에서 래트에 경구 투여한 후의 참고예 301의 혈장중 농도 추이를 측정한 결과이다.
도 4는, 도 3에서 나타내어지는 측정을 3회 행한 혈장중 농도 추이의 평균치를 나타내는 그래프이다.
이하에 본 명세서에서 이용되는 각 용어의 의미를 설명한다. 각 용어는 통일된 의미로 사용하고, 단독으로 이용되는 경우나 또는 다른 용어와 조합해서 이용되는 경우도 동일한 의미로 이용된다.
"치환기군 C로 치환되어 있을 수도 있다"란, 치환기군 C에서 선택되는 1 또는 2 이상의 동일 또는 상이한 치환기로 임의의 위치에서 치환되어 있을 수도 있는 것을 의미한다.
"치환기군 D로 치환되어 있을 수도 있다" 및 "치환기군 F로 치환되어 있을 수도 있다"에 대해서도 상기와 마찬가지이다.
본 명세서에서의 "프로드러그"란, 이하의 반응식에서의 식 (I)로 표시되는 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물을 가리키며, 생체 내에서의 생리 조건하에서 약물 대사 효소, 가수분해 효소, 위산, 장내 세균 등에 의해 야기되는 분해 반응에 의해 식 (II)로 표시되는 화합물로 변환됨으로써, 캡 의존적 엔도뉴클레아제(CEN) 저해 활성, 및/또는 CPE 억제 효과를 나타내는 화합물을 의미한다.
(식에서, 각 기호는 항목 1과 동일한 의미임)
상기 프로드러그는, 보다 바람직하게는 식 (II)로 표시되는 화합물보다 생체내 투여시에 있어서의 생체 이용률 및/또는 AUC(혈중 농도 곡선하 면적)가 향상되어 있는 화합물을 의미한다.
따라서, 상기 프로드러그는 생체에 대한 투여(예를 들면, 경구 투여) 후에 위 및/또는 장 등에서 효율적으로 체내에 흡수되고, 그 후, 식 (II)로 표시되는 화합물로 변환되기 때문에, 바람직하게는, 식 (II)로 표시되는 화합물보다 높은 인플루엔자 치료 및/또는 예방 효과를 나타낸다.
본 명세서에서의 "프로드러그를 형성하는 기"란, 이하의 반응식의 식 (I)에서의 "PR"기를 가리키고, -OPR기의 부분이 생체 내에서의 생리 조건하에서 약물 대사 효소, 가수분해 효소, 위산, 장내 세균 등에 의해 야기되는 분해 반응에 의해 식 (II)에서의 -OH기로 변환되는 기를 나타낸다.
(식에서, 각 기호는 항목 1과 동일한 의미임)
상기 "프로드러그를 형성하는 기"는, 보다 바람직하게는 식 (II)로 표시되는 화합물에 부가함으로써, 식 (II)로 표시되는 화합물의 생체 이용률 및/또는 AUC(혈중 농도 곡선하 면적)를 향상시키는 기를 의미한다.
프로드러그를 형성하는 기로는, 예를 들면, Prog. Med. 5: 2157-2161(1985), 및 Supplied by The British Library-"The world's Knowledge"에 기재되어 있는 기를 들 수 있다.
식 (I)의 -OPR기에서의 "PR"기는 생체 내에서 -OH기로 변환되는 기이면 되고, 바람직하게는, 다양한 치환 카르보닐기, 치환 옥시 저급 알킬기(예: 치환 옥시메틸), 치환되어 있을 수도 있는 환식기 저급 알킬(예: 치환되어 있을 수도 있는 환식기 메틸), 또는 치환되어 있을 수도 있는 이미노 저급 알킬(예: 치환되어 있을 수도 있는 이미노메틸) 등이 예시되지만, 보다 바람직하게는 예를 들면 이하의 식 a) 내지 y)에서 선택되는 기를 포함한다.
(식에서, L은 직쇄 또는 분지상의 저급 알킬렌이고,
K는 수소, 또는 직쇄 또는 분지상의 저급 알킬렌, 또는 직쇄 또는 분지상의 저급 알케닐렌이고,
PR0은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알케닐이고,
PR1은 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬티오이고,
PR2는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR3은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 치환기군 F로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는 저급 알킬실릴이고,
PR4는 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR5는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬이고,
치환기군 F는 옥소, 저급 알킬, 히드록시 저급 알킬, 아미노, 저급 알킬아미노, 탄소환 저급 알킬, 저급 알킬카르보닐, 할로겐, 히드록시, 카르복시, 저급 알킬카르보닐아미노, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬옥시, 시아노, 니트로임)
프로드러그를 형성하는 기로서, 식 (I)의 -OPR기에서의 "PR"기는, 바람직하게는 이하의 b), k), l) 및 m)에서 선택되는 기이다.
b) -C(=O)-PR1,
l) -CH2-O-C(=O)-PR3,
m) -CH2-O-C(=O)-O-PR3,
n) -CH(-CH3)-O-C(=O)-O-PR3
(식에서, 각 기호는 상기와 동일한 의미임)
본 명세서에서의 "프로드러그화"란, 이하의 반응식에 나타낸 바와 같이, 식 (II) 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물의 히드록시기를 -OPR기로 변환하는 것을 의미한다.
(식에서, 각 기호는 항목 1과 동일한 의미임)
본 명세서에서의 "친 화합물"이란, 상기 "프로드러그"를 합성하기 전의 원료가 되는 화합물, 및/또는 상기 "프로드러그"로부터 생체 내에서의 생리 조건하에서 효소나 위산 등에 의한 반응에 의해 방출되는 화합물을 의미하여, 구체적으로는, 상기 식 (II)로 표시되는 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물을 의미한다.
"할로겐"이란, 불소, 염소, 브롬 및 요오드를 포함한다. 바람직하게는 불소, 염소, 브롬이다.
"저급 알킬"이란, 탄소수 1 내지 15, 바람직하게는 탄소수 1 내지 10, 보다 바람직하게는 탄소수 1 내지 6, 더욱 바람직하게는 탄소수 1 내지 4의 직쇄 또는 분지상의 알킬을 포함하고, 예를 들면 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸, n-펜틸, 이소펜틸, 네오펜틸, 헥실, 이소헥실, n-헵틸, 이소헵틸, n-옥틸, 이소옥틸, n-노닐 및 n-데실 등을 들 수 있다. "저급 알킬"의 바람직한 양태로서, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸, n-펜틸을 들 수 있다. 더욱 바람직한 양태로서, 메틸, 에틸, n-프로필, 이소프로필, tert-부틸을 들 수 있다.
"저급 알케닐"이란, 임의의 위치에 1 이상의 이중 결합을 갖는 탄소수 2 내지 15, 바람직하게는 탄소수 2 내지 10, 보다 바람직하게는 탄소수 2 내지 6, 더욱 바람직하게는 탄소수 2 내지 4의 직쇄 또는 분지상의 알케닐을 포함한다. 구체적으로는 비닐, 알릴, 프로페닐, 이소프로페닐, 부테닐, 이소부테닐, 프레닐, 부타디에닐, 펜테닐, 이소펜테닐, 펜타디에닐, 헥세닐, 이소헥세닐, 헥사디에닐, 헵테닐, 옥테닐, 노네닐, 데세닐, 운데세닐, 도데세닐, 트리데세닐, 테트라데세닐, 펜타데세닐 등을 포함한다. "저급 알케닐"의 바람직한 양태로서, 비닐, 알릴, 프로페닐, 이소프로페닐, 부테닐을 들 수 있다.
"저급 알키닐"이란, 임의의 위치에 1 이상의 삼중 결합을 갖는 탄소수 2 내지 10, 바람직하게는 탄소수 2 내지 8, 더욱 바람직하게는 탄소수 3 내지 6의 직쇄 또는 분지상의 알키닐을 포함한다. 구체적으로는, 에티닐, 프로피닐, 부티닐, 펜티닐, 헥시닐, 헵티닐, 옥티닐, 노니닐, 데시닐 등을 포함한다. 이들은 또한 임의의 위치에 이중 결합을 가질 수도 있다. "저급 알키닐"의 바람직한 양태로서, 에티닐, 프로피닐, 부티닐, 펜티닐을 들 수 있다.
"저급 알킬옥시", "저급 알킬카르보닐", "저급 알킬옥시카르보닐", "탄소환 저급 알킬", "복소환 저급 알킬", "탄소환 옥시 저급 알킬", "복소환 옥시 저급 알킬", "할로게노 저급 알킬", "탄소환 저급 알킬옥시", "복소환 저급 알킬옥시", "할로게노 저급 알킬옥시", "저급 알킬옥시 저급 알킬", "저급 알킬옥시 저급 알킬옥시", "저급 알킬카르보닐", "저급 알킬옥시카르보닐", "저급 알킬아미노", "저급 알킬카르보닐아미노", "저급 알킬아미노카르보닐", "저급 알킬술포닐", "저급 알킬술포닐아미노", "저급 알킬티오", "히드록시 저급 알킬", "탄소환 저급 알킬옥시 저급 알킬", "복소환 저급 알킬옥시 저급 알킬", "저급 알킬카르보닐옥시", "할로게노 저급 알킬카르보닐아미노" 및 "저급 알킬술피닐"의 저급 알킬 부분도 상기 "저급 알킬"과 마찬가지이다.
"저급 알케닐옥시"의 저급 알케닐 부분도 상기 "저급 알케닐"과 마찬가지이다.
"할로게노 저급 알킬", "할로게노 저급 알킬옥시" 및 "할로게노 저급 알킬카르보닐아미노"의 할로겐 부분도 상기 "할로겐"과 마찬가지이다. 여기서 각각 "저급 알킬", "저급 알킬옥시" 및 "저급 알킬카르보닐아미노"의 알킬기 상의 임의의 위치가, 동일 또는 상이한 1 또는 복수개의 할로겐 원자로 치환되어 있을 수도 있다.
"탄소환식기" 또는 "탄소환"이란, 탄소수 3 내지 20, 바람직하게는 탄소수 3 내지 16, 보다 바람직하게는 탄소수 4 내지 12의 탄소환식기를 의미하며, 시클로알킬, 시클로알케닐, 아릴 및 비방향족 축합 탄소환식기 등을 포함한다.
구체적으로 "시클로알킬"이란, 탄소수 3 내지 16, 바람직하게는 탄소수 3 내지 12, 보다 바람직하게는 탄소수 4 내지 8의 탄소환식기이고, 예를 들면 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸, 시클로옥틸, 시클로노닐 및 시클로데실 등을 포함한다.
구체적으로 "시클로알케닐"이란, 상기 시클로알킬의 환 중의 임의의 위치에 1 이상의 이중 결합을 갖고 있는 것을 포함하며, 예를 들면 시클로프로페닐, 시클로부테닐, 시클로펜테닐, 시클로헥세닐, 시클로헵티닐, 시클로옥티닐 및 시클로헥사디에닐 등을 들 수 있다.
구체적으로 "아릴"이란, 방향족 탄소환식기를 의미하며, 페닐, 나프틸, 안트릴 및 페난트릴 등을 포함하고, 특히 페닐이 바람직하다.
구체적으로 "비방향족 축합 탄소환식기"란, 상기 "시클로알킬", "시클로알케닐" 및 "아릴"에서 선택되는 2개 이상의 환상기가 축합된 기를 포함하며, 예를 들면 인다닐, 인데닐, 테트라히드로나프틸, 플루오레닐, 아다만틸, 및 이하에 나타내어지는 기:
등을 들 수 있다.
"탄소환식기" 또는 "탄소환"의 바람직한 양태로는, 시클로알킬, 아릴 및 비방향족 축합 탄소환식기를 들 수 있고, 구체적으로는, 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸, 페닐, 나프틸, 및 이하에 나타내어지는 기:
등을 들 수 있다.
"탄소환 저급 알킬", "탄소환 저급 알킬옥시", "탄소환 옥시 저급 알킬", "탄소환 카르보닐", "탄소환 옥시", "탄소환 옥시카르보닐" 및 "탄소환 저급 알킬옥시 저급 알킬"의 탄소환 부분도 상기 "탄소환식기" 또는 "탄소환"과 마찬가지이다.
"복소환식기" 또는 "복소환"으로는, O, S 및 N에서 임의로 선택되는 동일 또는 상이한 헤테로 원자를 환 내에 1 이상 갖는 헤테로아릴, 비방향족 복소환식기, 2환의 축합 복소환식기, 3환의 축합 복소환식기, 4환의 축합 복소환식기 등의 복소환식기를 포함한다.
구체적으로 "헤테로아릴"이란, 피롤릴, 이미다졸릴, 피라졸릴, 피리딜, 피리다지닐, 피리미디닐, 피라지닐, 트리아졸릴, 트리아지닐, 테트라졸릴, 푸릴, 티에닐, 이소옥사졸릴, 옥사졸릴, 옥사디아졸릴, 이소티아졸릴, 티아졸릴, 티아디아졸릴 등의 5 내지 6원의 방향족 환식기를 들 수 있다.
구체적으로 "비방향족 복소환식기"란, 디옥사닐, 티이라닐, 옥시라닐, 옥세타닐, 옥사티올라닐, 아제티디닐, 티아닐, 티아졸리디닐, 피롤리디닐, 피롤리닐, 이미다졸리디닐, 이미다졸리닐, 피라졸리디닐, 피라졸리닐, 피페리딜, 피페라지닐, 모르폴리닐, 모르폴리노, 티오모르폴리닐, 티오모르폴리노, 디히드로피리딜, 테트라히드로피리딜, 테트라히드로푸릴, 테트라히드로피라닐, 디히드로티아졸릴, 테트라히드로티아졸릴, 테트라히드로이소티아졸릴, 디히드로옥사지닐, 헥사히드로아제피닐, 테트라히드로디아제피닐, 테트라히드로피리다지닐, 헥사히드로피리미디닐, 디옥솔라닐, 디옥솔릴, 옥사비시클로헵타닐 등의 4 내지 8원의 비방향족 복소환식기를 들 수 있다.
구체적으로 "2환의 축합 복소환식기"란, 인돌릴, 이소인돌릴, 인다졸릴, 인돌리디닐, 인돌리닐, 이소인돌리닐, 퀴놀릴, 이소퀴놀릴, 신놀리닐, 프탈라지닐, 퀴나졸리닐, 나프티리디닐, 퀴녹살리닐, 푸리닐, 프테리디닐, 벤조피라닐, 벤즈이미다졸릴, 벤조트리아졸릴, 벤즈이소옥사졸릴, 벤즈옥사졸릴, 벤즈옥사디아졸릴, 벤조이소티아졸릴, 벤조티아졸릴, 벤조티아디아졸릴, 벤조푸릴, 이소벤조푸릴, 벤조티에닐, 벤조트리아졸릴, 티에노피리딜, 티에노피롤릴, 티에노피라졸릴, 티에노피라지닐, 프로피롤릴, 티에노티에닐, 이미다조피리딜, 피라졸로피리딜, 티아졸로피리딜, 피라졸로피리미디닐, 피라졸로트리아니딜, 피리다졸로피리딜, 트리아졸로피리딜, 이미다조티아졸릴, 피라지노피리다지닐, 퀴나졸리닐, 퀴놀릴, 이소퀴놀릴, 나프티리디닐, 디히드로티아졸로피리미디닐, 테트라히드로퀴놀릴, 테트라히드로이소퀴놀릴, 디히드로벤조푸릴, 디히드로벤즈옥사지닐, 디히드로벤즈이미다졸릴, 테트라히드로벤조티에닐, 테트라히드로벤조푸릴, 벤조디옥솔릴, 벤조디옥소닐, 크로마닐, 크로메닐, 옥타히드로크로메닐, 디히드로벤조디옥시닐, 디히드로벤조옥세디닐, 디히드로벤조디옥세피닐, 디히드로티에노디옥시닐 등의 4 내지 8원의 방향족 또는 비방향족 복소환식기를 적어도 1개 포함하는 환식기를 들 수 있다.
구체적으로 "3환의 축합 복소환식기"란, 카르바졸릴, 아크리디닐, 크산테닐, 페노티아지닐, 페녹사티이닐, 페녹사지닐, 디벤조푸릴, 이미다조퀴놀릴, 테트라히드로카르바졸릴, 및 이하에 나타내어지는 기:
등의 4 내지 8원의 방향족 또는 비방향족 복소환식기를 적어도 1개 포함하는 환식기를 들 수 있다.
"복소환식기"의 바람직한 양태로는 5 내지 6원의 헤테로아릴, 또는 비방향족 복소환식기, 3환의 축합 복소환식기를 들 수 있다.
"복소환 저급 알킬", "복소환 저급 알킬옥시", "탄소환 옥시 저급 알킬", "복소환 카르보닐", "복소환 옥시", "복소환 옥시카르보닐" 및 "복소환 저급 알킬옥시 저급 알킬"의 복소환 부분도 상기 "복소환식기" 또는 "복소환"과 마찬가지이다.
"옥소 치환 복소환식기"란, 이하와 같이, 상기 "복소환식기"가 옥소로 치환되어 있는 것을 의미한다. 이하에 나타내어지는 기가 예시된다.
"직쇄 또는 분지상의 저급 알킬렌"이란, 2가의 상기 "저급 알킬"이고, 예를 들면, 메틸렌, 에틸렌, 프로필렌, 부틸렌, 이소부틸렌, 펜틸렌, 헵틸렌, 디메틸메틸렌, 에틸메틸메틸렌, 1,2-디메틸에틸렌 등을 포함한다.
"저급 알킬옥시"의 예로서, 메톡시, 에톡시, 프로필옥시, 이소프로필옥시, tert-부틸옥시, 이소부틸옥시, sec-부틸옥시, 펜틸옥시, 이소펜틸옥시, 헥실옥시 등을 들 수 있다. 바람직한 양태로는, 메톡시, 에톡시, 프로필옥시, 이소프로필옥시, tert-부틸옥시를 들 수 있다.
"저급 알킬카르보닐"의 예로서, 메틸카르보닐, 에틸카르보닐, 프로필카르보닐, 이소프로필카르보닐, tert-부틸카르보닐, 이소부틸카르보닐, sec-부틸카르보닐, 펜틸카르보닐, 이소펜틸카르보닐, 헥실카르보닐 등을 들 수 있다. 바람직한 양태로는, 메틸카르보닐, 에틸카르보닐, 프로필카르보닐을 들 수 있다.
"저급 알킬옥시카르보닐"의 예로서, 메틸옥시카르보닐, 에틸옥시카르보닐, 프로필옥시카르보닐, 이소프로필옥시카르보닐, tert-부틸옥시카르보닐, 이소부틸옥시카르보닐, sec-부틸옥시카르보닐, 펜틸옥시카르보닐, 이소펜틸옥시카르보닐, 헥실옥시카르보닐 등을 들 수 있다. 바람직한 양태로는, 메틸옥시카르보닐, 에틸옥시카르보닐, 프로필옥시카르보닐을 들 수 있다.
"탄소환 저급 알킬"이란, 1 또는 2 이상의 탄소환식기로 치환되어 있는 저급 알킬을 나타내고, "탄소환 저급 알킬"의 예로서, 벤질, 페네틸, 페닐프로피닐, 벤즈히드릴, 트리틸, 시클로프로필메틸, 시클로부틸메틸, 시클로펜틸메틸, 시클로헥실메틸, 나프틸메틸, 등을 들 수 있다. 바람직한 양태로는, 벤질, 페네틸, 벤즈히드릴을 들 수 있다.
"복소환 저급 알킬"이란, 1 또는 2 이상의 복소환식기로 치환되어 있는 저급 알킬을 나타내고, 알킬 부분은 탄소환식기로 치환되어 있는 것도 포함한다. "복소환 저급 알킬"의 예로서, 피리딜메틸, 테트라히드로피라닐메틸, 푸라닐메틸, 모르폴리닐에틸, 이미다졸릴메틸, 인돌릴메틸, 벤조티오페닐메틸, 옥사졸릴메틸, 이속사졸릴메틸, 티아졸릴메틸, 이소티아졸릴메틸, 피라졸릴메틸, 이소피라졸릴메틸, 피롤리디닐메틸, 벤즈옥사졸릴메틸, 피페리디닐메틸, 피페라지닐메틸, 이하에 나타내어지는 기:
등을 들 수 있다. 바람직한 양태로는, 피리딜메틸, 테트라히드로피라닐메틸, 푸라닐메틸, 모르폴리닐에틸을 들 수 있다.
"탄소환 옥시 저급 알킬"의 예로서, 페닐옥시메틸, 페닐옥시에틸, 시클로프로필옥시메틸, 시클로프로필옥시에틸, 시클로부틸옥시메틸, 시클로부틸옥시에틸, 시클로헥실옥시메틸, 시클로헥실옥시에틸 등을 들 수 있다. 바람직한 양태로는, 페닐옥시메틸, 페닐옥시에틸을 들 수 있다.
"복소환 옥시 저급 알킬"의 예로서, 피리딜옥시메틸, 피리딜옥시에틸, 모르폴리닐옥시메틸, 모르폴리닐옥시에틸, 벤즈옥사졸릴옥시메틸 등을 들 수 있다. 바람직한 양태로는, 피리딜옥시메틸, 모르폴리닐옥시메틸 등을 들 수 있다.
"탄소환 저급 알킬옥시"란, 알킬 부분이 1 또는 2 이상의 탄소환식기로 치환되어 있는 저급 알킬옥시를 나타내고, "탄소환 저급 알킬옥시"의 예로서, 페닐메틸옥시, 페닐에틸옥시, 시클로프로필메틸옥시, 시클로부틸메틸옥시, 시클로펜틸메틸옥시, 시클로헥실메틸옥시 등을 들 수 있다. 바람직한 양태로는, 페닐메틸옥시, 시클로프로필메틸옥시 등을 들 수 있다.
"복소환 저급 알킬옥시"란, 알킬 부분이 1 또는 2 이상의 복소환식기로 치환되어 있는 저급 알킬옥시를 나타내고, 알킬 부분은 탄소환식기로 치환되어 있는 것도 포함한다. "복소환 저급 알킬옥시"의 예로서, 피리딜메틸옥시, 피리딜에틸옥시, 이미다졸릴메틸옥시, 이미다졸릴에틸옥시, 벤즈옥사졸릴메틸옥시, 벤즈옥사졸릴에틸옥시 등을 들 수 있다.
"저급 알킬옥시 저급 알킬"의 예로서, 메톡시메틸, 메톡시에틸, 에톡시메틸, 에톡시에틸, 메톡시프로필, 메톡시부틸, 에톡시프로필, 에톡시부틸, 이소프로필옥시메틸, tert-부틸옥시메틸 등을 들 수 있다. 바람직한 양태로는, 메톡시메틸, 메톡시에틸, 에톡시메틸, 에톡시에틸을 들 수 있다.
"저급 알킬옥시 저급 알킬옥시"의 예로서, 메톡시메톡시, 메톡시에톡시, 에톡시메톡시, 에톡시에톡시, 메톡시프로필옥시, 메톡시부틸옥시, 에톡시프로필옥시, 에톡시부틸옥시, 이소프로필옥시메틸옥시, tert-부틸옥시메틸옥시 등을 들 수 있다. 바람직한 양태로는, 메톡시메톡시, 메톡시에톡시, 에톡시메톡시, 에톡시에톡시를 들 수 있다.
"저급 알킬아미노"의 예로서, 메틸아미노, 디메틸아미노, 에틸아미노, 디에틸아미노, 이소프로필아미노, N,N-디이소프로필아미노, N-메틸-N-에틸아미노, N-이소프로필-N-에틸아미노 등을 들 수 있다. 바람직한 양태로는, 메틸아미노, 디메틸아미노, 에틸아미노, 디에틸아미노를 들 수 있다.
"저급 알킬카르보닐아미노"의 예로서, 메틸카르보닐아미노, 에틸카르보닐아미노, 프로필카르보닐아미노, 이소프로필카르보닐아미노, tert-부틸카르보닐아미노, 이소부틸카르보닐아미노, sec-부틸카르보닐아미노 등을 들 수 있다. 바람직한 양태로는, 메틸카르보닐아미노, 에틸카르보닐아미노를 들 수 있다.
"저급 알킬아미노카르보닐"의 예로서, 메틸아미노카르보닐, 디메틸아미노카르보닐, 에틸아미노카르보닐, 디에틸아미노카르보닐, 이소프로필아미노카르보닐, N,N-디이소프로필아미노카르보닐, N-메틸-N-에틸아미노카르보닐, N-이소프로필-N-에틸아미노카르보닐 등을 들 수 있다. 바람직한 양태로는, 메틸아미노카르보닐, 디메틸아미노카르보닐, 에틸아미노카르보닐, 디에틸아미노카르보닐을 들 수 있다.
"저급 알킬술포닐"의 예로서, 메틸술포닐, 에틸술포닐, 프로필술포닐, 이소프로필술포닐, tert-부틸술포닐, 이소부틸술포닐, sec-부틸술포닐 등을 들 수 있다. 바람직한 양태로는, 메틸술포닐, 에틸술포닐을 들 수 있다.
"저급 알킬술포닐아미노"의 예로서, 메틸술포닐아미노, 에틸술포닐아미노, 프로필술포닐아미노, 이소프로필술포닐아미노, tert-부틸술포닐아미노, 이소부틸술포닐아미노, sec-부틸술포닐아미노 등을 들 수 있다. 바람직한 양태로는, 메틸술포닐아미노, 에틸술포닐아미노를 들 수 있다.
"저급 알케닐옥시"의 예로서, 에틸레닐옥시, 1-프로피레닐옥시, 2-프로피레닐옥시, 1-부티레닐옥시, 2-부티레닐옥시, 3-부티레닐옥시 등을 들 수 있다.
"할로게노 저급 알킬"의 예로서, 모노플루오로메틸, 모노플루오로에틸, 모노플루오로프로필, 2,2,3,3,3-펜타플루오로프로필, 모노클로로메틸, 트리플루오로메틸, 트리클로로메틸, 2,2,2-트리플루오로에틸, 2,2,2-트리클로로에틸, 1,2-디브로모에틸, 1,1,1-트리플루오로프로판-2-일 등을 들 수 있다. 바람직한 양태로는, 트리플루오로메틸, 트리클로로메틸, 1,1,1-트리플루오로프로판-2-일을 들 수 있다.
"할로게노 저급 알킬옥시"의 예로서, 모노플루오로메톡시, 모노플루오로에톡시, 트리플루오로메톡시, 트리클로로메톡시, 트리플루오로에톡시, 트리클로로에톡시 등을 들 수 있다. 바람직한 양태로는, 트리플루오로메톡시, 트리클로로메톡시를 들 수 있다.
"저급 알킬티오"의 예로서, 메틸티오, 에틸티오, 프로필티오 등을 들 수 있다.
"히드록시 저급 알킬"의 예로서, 히드록시메틸, 히드록시에틸, 히드록시프로필 등을 들 수 있다.
"탄소환 저급 알킬옥시 저급 알킬"의 예로서, 벤질옥시메틸, 벤질옥시에틸, 벤즈히드릴옥시메틸 등을 들 수 있다.
"복소환 저급 알킬옥시 저급 알킬"의 예로서, 피리딜메틸옥시메틸, 피리딜메틸옥시에틸 등을 들 수 있다.
"저급 알킬카르보닐옥시"의 예로서, 메틸카르보닐옥시, 에틸카르보닐옥시 등을 들 수 있다.
"할로게노 저급 알킬카르보닐아미노"의 예로서, 트리플루오로메틸카르보닐아미노, 2,2,3,3,3-펜타플루오로프로필카르보닐아미노 등을 들 수 있다.
"저급 알킬술피닐"의 예로서, 메틸술피닐, 에틸술피닐 등을 들 수 있다.
"탄소환 카르보닐"의 예로서, 페닐카르보닐, 나프틸카르보닐, 시클로프로필카르보닐, 시클로부틸카르보닐, 시클로펜틸카르보닐, 시클로헥실카르보닐 등을 들 수 있다.
"탄소환 옥시"의 예로서, 페닐옥시, 나프틸옥시, 시클로프로필옥시, 시클로부틸옥시, 시클로펜틸옥시, 시클로헥실옥시 등을 들 수 있다.
"탄소환 옥시카르보닐"의 예로서, 페닐옥시카르보닐, 나프틸옥시카르보닐, 시클로프로필옥시카르보닐, 시클로부틸옥시카르보닐, 시클로펜틸옥시카르보닐, 시클로헥실옥시카르보닐 등을 들 수 있다.
"복소환 카르보닐"의 예로서, 피리딜카르보닐, 벤즈옥사졸릴카르보닐, 모르폴리닐카르보닐, 테트라히드로피라닐카르보닐 등을 들 수 있다.
"복소환 옥시"의 예로서, 피리딜옥시, 벤즈옥사졸릴옥시, 모르폴리닐옥시, 테트라히드로피라닐옥시 등을 들 수 있다.
"복소환 옥시카르보닐"의 예로서, 피리딜옥시카르보닐, 벤즈옥사졸릴옥시카르보닐, 모르폴리닐옥시카르보닐, 테트라히드로피라닐옥시카르보닐 등을 들 수 있다.
항목 1에서의 "RA1 및 RA2, RA15 및 RA16, 및 RA19 및 RA20은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고", "RB7 및 RB8, 및 RB9 및 RB10은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고", "RC7 및 RC8, 및 RC9 및 RC10은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고" 및 "RD5 및 RD6은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고"란, N 원자를 갖는 복소환을 의미하며, 예를 들면, 이하에 나타내어지는 기:
본 명세서 중, 이하에 나타내어지는 식:
에서의 (RE6)m은, 환상의 화학적으로 치환기를 가질 수 있는 임의의 탄소 원자 또는 질소 원자 상에 m개의 동일 또는 상이할 수도 있는 RE6으로 치환되어 있는 것을 의미한다.
예를 들면, 이하의 식:
에서, 이하에 나타내어지는 치환기:
(식에서, ma+mb+mc=m이고, RE6은 상기와 동일한 의미임)
에 나타낸 바와 같이, 치환기 RE6이 2개의 벤젠환 상 및 황 원자를 함유하는 7원환이 갖는 어느 하나의 수소 원자가 RE6으로 치환되어 있을 수도 있는 것을 의미하고, 각각의 RE6은 동일하거나 상이해도 좋다.
ma는 0 내지 3의 정수가 바람직하고, mb는 0 내지 3의 정수가 바람직하고, mc는 0 또는 1의 정수가 바람직하다. ma는 0 또는 1의 정수가 보다 바람직하고, mb는 0 또는 1의 정수가 보다 바람직하고, mc는 0이 보다 바람직하다.
예를 들면, 이하의 식:
에서, 이하에 나타내어지는 치환기:
(식에서, RE6, m은 항목 1과 동일한 의미임) 등을 포함한다.
항목 1의 식 (I)에서의 "B1이 CR5aR6a이고, B2가 NR7a인 경우, R3a와 R7a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고"란, 이하에 나타내는 식 (I'):
(식에서, PR, R1a, R2a, R5a 및 R6a는 항목 1과 동일한 의미임)를 나타내고, 환의 부분이 1 또는 2 이상의 치환기군 D에서 선택되는 동일 또는 상이한 치환기로 임의의 위치에서 치환되어 있을 수도 있는 것을 나타낸다. 상기 복소환은 바람직하게는 5 내지 7원환이다. 또한, "상기 복소환은 축합환을 형성하고 있을 수도 있고"란, 식 (I')에서의 환이 더 축환하고 있어도 되는 것을 나타내고, 치환기군 D는 상기 식 (I')에서의 환 또는 축환하고 있는 환 중 어디에 결합하고 있더라도 되는 것을 나타낸다.
식 (I')의 예로서, 이하의 식에 나타내는 화합물 등을 들 수 있다.
(식에서, Rx 및 Ry는 치환기군 D에서 선택되는 치환기이고, PR, R1a, R2a, R5a, R6a는 항목 1과 동일한 의미임)
항목 1의 식 (I)에서의 "B1이 NR7a이고, B2가 CR5aR6a인 경우, R3a와 R6a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고"의 "복소환을 형성하고 있는 경우"란, 이하에 나타내는 식 (I"):
(식에서, PR, R1a, R2a, R5a 및 R7a는 항목 1과 동일한 의미임)를 나타내고, 환의 부분이 1 또는 2 이상의 치환기군 D에서 선택되는 동일 또는 상이한 치환기로 임의의 위치에서 치환되어 있을 수도 있는 것을 나타낸다. 상기 복소환은 바람직하게는 5 내지 7원환이다. 또한, "상기 복소환은 축합환을 형성할 수도 있고"란, 식 (I")에서의 환이 더 축환하고 있어도 되는 것을 나타내고, 1 또는 2 이상의 치환기군 D는 상기 식 (I")에서의 환 또는 축환하고 있는 환 중 어디에 결합하고 있더라도 되는 것을 나타낸다. 식 (I")의 예로서, 이하의 식에 나타내는 화합물 등을 들 수 있다.
(식에서, Rx 및 Ry는 치환기군 D에서 선택되는 치환기이고, PR, R1a, R2a, R5a, R7a는 항목 1과 동일한 의미임)
항목 1의 식 (I)에서의 "R8a 및 R10a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 탄소환 또는 복소환을 형성하고 있을 수도 있고"의 "탄소환 또는 복소환을 형성하고 있는 경우"란, 이하에 나타내는 식 (I""):
(식에서, PR, R1a, R2a, R3a, R9a 및 R11a는 항목 1과 동일한 의미임)를 나타내고, 환의 부분이 1 또는 2 이상의 치환기군 D에서 선택되는 동일 또는 상이한 치환기로 임의의 위치에서 치환되어 있을 수도 있는 것을 나타낸다. 상기 탄소환 또는 복소환은 바람직하게는 5 내지 7원환이다. 식 (I"")의 예로서, 이하의 식에 나타내는 화합물 등을 들 수 있다.
(식에서, Rx는 치환기군 D에서 선택되는 치환기이고, PR, R1a, R2a, R3a, R9a, R11a는 항목 1과 동일한 의미임)
또한, "R3a 및 R11a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고, 상기 복소환은 축합환을 형성하고 있을 수도 있다"란, 이하에 나타내는 식 (I""'):
(식에서, PR, R1a, R2a, R8a, R9a 및 R10a는 항목 1과 동일한 의미임)를 나타내고, 환의 부분이 축합환을 더 형성하고 있을 수도 있고, 치환기군 D에서 선택되는 동일 또는 상이한 치환기가 상기 식 (I""')에서의 환 또는 축환하고 있는 환의 어디에든 임의의 위치에서 결합하고 있어도 되는 것을 나타낸다. 상기 복소환은 바람직하게는 5 내지 7원환이다. 식 (I""')의 예로서, 이하의 식에 나타내는 화합물 등을 들 수 있다.
(식에서, Rx 및 Ry는 치환기군 D에서 선택되는 치환기이고, PR, R1a, R2a, R8a, R9a, R10a는 항목 1과 동일한 의미임)
"용매화물"이란, 예를 들면 유기용매와의 용매화물, 수화물 등을 포함한다. 바람직한 양태는 수화물 또는 알코올화물이고, 보다 바람직한 양태는 수화물이다. 수화물을 형성할 때는 임의의 수의 물 분자와 배위하고 있을 수도 있고, 예를 들면, 0.5수화물(본 발명 화합물 2분자에 대하여 1분자의 물 분자가 배위하고 있음), 1수화물(본 발명 화합물 1분자에 대하여 1분자의 물 분자가 배위하고 있음), 2수화물(본 발명 화합물 1분자에 대하여 2분자의 물 분자가 배위하고 있음), 3수화물(본 발명 화합물 1분자에 대하여 3분자의 물 분자가 배위하고 있음) 등을 들 수 있다. 알코올화물을 형성할 때도 동일하다. 알코올화물을 형성하는 경우의 알코올의 예로는, 메탄올, 에탄올, 이소프로판올 등을 들 수 있다.
본 발명의 화합물은 제약상 허용되는 염을 포함한다. 예를 들면, 알칼리 금속(리튬, 나트륨 또는 칼륨 등), 알칼리토류 금속(마그네슘 또는 칼슘 등), 암모늄, 유기 염기 및 아미노산과의 염, 또는 무기산(염산, 황산, 질산, 브롬화수소산, 인산 또는 요오드화수소산 등), 및 유기산(아세트산, 트리플루오로아세트산, 시트르산, 락트산, 타르타르산, 옥살산, 말레산, 푸마르산, 만델산, 글루타르산, 말산, 벤조산, 프탈산, 벤젠술폰산, p-톨루엔술폰산, 메탄술폰산 또는 에탄술폰산 등)과의 염을 들 수 있다. 이들 염은 통상 행해지는 방법에 의해 형성시킬 수 있다.
본 발명에서의 식 (I)의 바람직한 염의 예로는, 염산염, 브롬화수소산염, 아세트산염, 황산염 등을 들 수 있다.
또한, 본 발명의 화합물은 특정한 이성체에 한정하는 것이 아니라, 모든 가능한 이성체(케토-엔올 이성체, 이민-엔아민 이성체, 부분입체 이성체, 광학 이성체 및 회전 이성체 등)나 라세미체를 포함하는 것이다.
본 발명에서의 식 (I)은 특정한 이성체에 한정하는 것이 아니라, 모든 가능한 이성체나 라세미체를 포함하는 것이다. 예를 들면, 하기에 나타낸 바와 같이, 호변 이성체나 입체 이성체도 함유한다.
(식에서, 각 기호는 상기와 동일한 의미임)
(식에서, 각 기호는 상기와 동일한 의미임)
또한, 본 발명에서의 식 (I)은, 식 (I)의 화합물의 하나 이상의 수소 원자, 탄소 원자 또는 다른 원자가 각각 수소 원자, 탄소 원자 또는 다른 원자의 동위체로 치환될 수 있다.
또한, 식 (I)의 화합물은 식 (I)의 화합물의 모든 방사성 표지체를 포함한다. 식 (I)의 화합물의 그와 같은 "방사성 표지화", "방사성 표지체" 등은 각각이 본 발명에 포함되어, 대사 약물 동태 연구 및 결합 어세이에서의 연구 및/또는 진단 툴로서 유용하다.
본 발명의 식 (I)의 화합물에 포함될 수 있는 동위체의 예로는, 각각 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F 및 36Cl과 같은, 수소 원자, 탄소 원자, 질소 원자, 산소 원자, 인 원자, 황 원자, 불소 원자 및 염소 원자가 포함된다.
본 발명의 식 (I)의 화합물에 포함될 수 있는 동위체의 특히 바람직한 예는 2H(즉, 중수소 원자)이고, 본 명세서의 참고예에서 나타내어지는 방법, 또는 해당 기술 분야에서 주지의 방법으로 제조할 수 있다. 또한, 본 명세서의 참고예에서는 중수소 원자를 "D"라고 표기하고 있다. 본 발명의 식 (I)의 수소 원자가 중수소 원자로 변환된 화합물은, 미변환체에 비해 생체 이용률이나, 대사 안정성, 약효, 독성면에서 우수한 경우가 있어 의약으로서 유용한 화합물이 될 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알킬"의 예로는, 메틸, 에틸, 프로필, 이소프로필, 부틸, tert-부틸, sec-부틸, 펜탄-2-일, 히드록시메틸, 히드록시에틸, 카르복시메틸, 카르복시에틸, 카르복시프로필, 에톡시카르보닐프로필, 시아노메틸, 시아노에틸, 플루오로메틸, 플루오로에틸, 플루오로프로필, 디플루오로메틸, 트리플루오로메틸, 클로로메틸, 디클로로메틸, 트리클로로메틸, 에틸옥시카르보닐에틸, 메톡시메틸, 디메톡시메틸, 메톡시에틸, 메톡시프로필, 에톡시에틸, 1-메틸-1-메톡시메틸, 프로필옥시메틸, 아미노프로필, 디메틸아미노메틸, 아미노메틸, 아미노에틸, 디메틸아미노에틸, 디에틸아미노메틸, 디에틸아미노에틸, 디메틸아미노프로필, 시클로프로필메틸옥시메틸, 메틸술포닐아미노메틸, 메틸아미노카르보닐에틸, 1,1,1-트리플루오로프로판-2-일, 1,1-디플루오로에틸, 1,1,1-트리플루오로에틸, 1,1,1-트리플루오로프로필, 트리플루오로메틸옥시에틸, 트리플루오로메틸카르보닐아미노메틸, 메틸술포닐에틸, 메틸카르보닐옥시에틸, 및 이하에 나타내어지는 기:
등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 저급 알킬"의 예로는, 히드록시에틸, 메틸, 에틸, 프로필, 이소프로필, 부틸, tert-부틸, iso-부틸, sec-부틸, 펜탄-2-일, 히드록시메틸, 히드록시에틸, 카르복시메틸, 카르복시에틸, 카르복시프로필, 에톡시카르보닐프로필, 및 이하에 나타내어지는 기:
등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알케닐"의 예로는, 에틸레닐, 3-메틸부텐-2-일, 카르복시에틸레닐, 히드록시에틸레닐, 디플루오로에틸레닐, 1-프로펜-2-일 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알키닐"의 예로는, 1-프로피닐, 1-부티닐, 3,3,3-트리플루오로메틸프로피닐, 3-히드록시-프로피닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시"의 예로는, 메틸옥시, 에틸옥시, 트리플루오로메틸옥시, 트리클로로메틸옥시, 히드록시메틸옥시, 히드록시에틸옥시, 카르복시메틸옥시, 카르복시에틸옥시 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시"의 예로는, 3-플루오로 1-프로페닐옥시, 에틸레닐, 카르복시에틸레닐, 히드록시에틸레닐옥시, 디플루오로에틸레닐옥시 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐"의 예로는, 메틸카르보닐, 에틸카르보닐, 프로필카르보닐, 이소프로필카르보닐, 히드록시메틸카르보닐, 히드록시에틸카르보닐, 트리플루오로메틸카르보닐, 2,2,2-트리플루오로메틸카르보닐, 카르복시메틸카르보닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐"의 예로는, 메틸옥시카르보닐, 에틸옥시카르보닐, 트리플루오로메틸옥시카르보닐, 트리클로로메틸옥시카르보닐, 히드록시메틸옥시카르보닐, 히드록시에틸옥시카르보닐, 카르복시메틸옥시카르보닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 탄소환식기"의 예로는, 페닐, 나프틸, 안트라세닐, 페난트라세닐, 아다만틸, 1-히드록시아다만틸, 2-히드록시아다만틸, 3-메틸페닐, 4-메틸페닐, 3-메톡시페닐, 4-메톡시페닐, 3-히드록시페닐, 4-히드록시페닐, 4-클로로페닐, 4-플루오로페닐, 2-시아노페닐, 3-시아노페닐, 4-시아노페닐, 플루오로시클로프로필, 디플루오로시클로부타닐, 디플루오로시클로헥실, 및 이하에 나타내어지는 기:
(식에서, RE6은 치환기군 C에서 선택되는 기를 나타내고, m개의 RE6은 동일하거나 상이할 수도 있음) 등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 탄소환식기"의 예로는, 페닐, 나프틸, 3-메틸페닐, 4-메틸페닐, 3-메톡시페닐, 4-메톡시페닐, 3-히드록시페닐, 4-히드록시페닐, 4-클로로페닐, 4-플루오로페닐, 1,5-디플루오로페닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬"의 예로는, 시클로프로필메틸, 4-히드록시벤질, 시클로펜틸메틸, 벤질, 2-아미노벤질, 2-시아노벤질, 2-플루오로벤질, 4-플루오로벤질, 2-트리플루오로메틸벤질, 1,3,5-트리플루오로벤질, 3,4,5-트리플루오로벤질, 4-메톡시벤질, 2,4-디플루오로벤질, 2-플루오로-3-클로로벤질, 벤즈히드릴, 4-페닐벤질, 페네틸, 페닐프로필, 4-메틸카르보닐아미노벤질, 3,4-디클로로벤질, 4-클로로-2-플루오로벤질, 3,5-디히드록시벤질, 및 이하에 나타내어지는 기:
등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 탄소환 저급 알킬"의 예로는, 시클로프로필메틸, 4-히드록시벤질, 시클로펜틸메틸, 벤질, 2-아미노벤질, 2-시아노벤질, 2-플루오로벤질, 4-플루오로벤질, 2-트리플루오로메틸벤질, 1,3,5-트리플루오로벤질, 3,4,5-트리플루오로벤질, 4-메톡시벤질, 2,4-디플루오로벤질, 2-플루오로-3-클로로벤질, 벤즈히드릴, 4-페닐벤질, 페네틸, 페닐프로필, 4-메틸카르보닐아미노벤질, 3,4-디클로로벤질, 4-클로로-2-플루오로벤질, 3,5-디히드록시벤질 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬"의 예로는, 4-히드록시페닐옥시메틸, 4-히드록시페닐옥시에틸, 시클로프로필옥시메틸, 시클로펜틸옥시메틸, 4-플루오로페닐옥시메틸, 4-플루오로페닐옥시에틸, 4-트리플루오로메틸페닐옥시메틸, 4-트리플루오로메틸페닐옥시에틸, 4-메톡시페닐옥시메틸, 4-메톡시페닐옥시에틸 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐"의 예로는, 페닐카르보닐, 4-플루오로페닐카르보닐, 4-트리플루오로메틸페닐카르보닐, 4-메톡시페닐카르보닐, 시클로프로필카르보닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시"의 예로는, 페닐옥시, 시클로프로필옥시, 시클로펜틸옥시, 4-플루오로페닐옥시, 4-트리플루오로메틸페닐옥시, 4-메톡시페닐옥시 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐"의 예로는, 페닐옥시카르보닐, 시클로프로필옥시카르보닐, 시클로펜틸옥시카르보닐, 4-플루오로페닐옥시카르보닐, 4-트리플루오로메틸페닐옥시카르보닐, 4-메톡시페닐옥시카르보닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 복소환식기"의 예로는, 피리미디닐, 피리딜, 벤즈옥사졸릴, 모르폴리닐, 테트라히드로피라닐, 푸릴, 티오페닐, 옥사졸릴, 티아졸릴, 피라졸릴, 메틸피롤리디닐, 이소프로필피롤리디닐, 메틸술포닐피롤리디닐, 히드록시에틸피롤리디닐, 메틸피페리디닐, 메틸피페라지닐, 테트라히드로푸릴, 및 이하에 나타내어지는 기:
(식에서, RE6은 치환기군 C에서 선택되는 기를 나타내고, m개의 RE6은 동일하거나 상이할 수도 있음) 등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 복소환식기"의 예로는, 모르폴리닐, 피리딜, 메틸-1,3-디옥솔-2-온, 트리메틸-2-옥사비시클로[2.2.1]헵탄-3-온, 피롤리디닐, 메틸-피롤리딘-2-카르복실레이트, 테트라히드로피라닐, 히드록시메틸피롤리디닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬"의 예로는, 테트라히드로피라닐메틸, 피리딜메틸, 이속사졸릴메틸, 5-메틸-이속사졸릴메틸, 3-메틸-옥사디아졸릴메틸, 인돌릴메틸, 벤조티오페닐메틸, 5-클로로벤조티오페닐메틸, 티아졸릴메틸, 2-메틸티아졸릴메틸, 피라졸릴메틸, 2-메틸피라졸릴메틸, 디티오페닐메틸, 테트라졸릴메틸, 퀴나졸릴메틸, 모르폴리닐메틸 및 이하에 나타내어지는 기:
등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 복소환 저급 알킬"의 예로는, 테트라히드로피라닐메틸, 피리딜메틸, 이속사졸릴메틸, 5-메틸-이속사졸릴메틸, 3-메틸-옥사디아졸릴메틸, 인돌릴메틸, 벤조티오페닐메틸, 5-클로로벤조티오페닐메틸, 티아졸릴메틸, 2-메틸티아졸릴메틸, 피라졸릴메틸, 2-메틸피라졸릴메틸, 디티오페닐메틸, 테트라졸릴메틸, 퀴나졸릴메틸, 모르폴리닐메틸 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬"의 예로는, 테트라히드로피라닐옥시메틸, 피리딜옥시메틸, 이속사졸릴옥시메틸, 5-메틸-이속사졸릴옥시메틸, 인돌릴옥시메틸, 벤조티오페닐옥시메틸, 5-클로로벤조티오페닐옥시메틸, 티아졸릴옥시메틸, 2-메틸티아졸릴옥시메틸, 피라졸릴옥시메틸, 2-메틸피라졸릴옥시메틸 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐"의 예로는, 테트라히드로피라닐카르보닐, 피리딜카르보닐, 이속사졸릴카르보닐, 5-메틸-이속사졸릴카르보닐, 인돌릴카르보닐, 벤조티오페닐카르보닐, 5-클로로벤조티오페닐카르보닐, 티아졸릴카르보닐, 2-메틸티아졸릴카르보닐, 피라졸릴카르보닐, 2-메틸피라졸릴카르보닐 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 복소환 옥시"의 예로는, 테트라히드로피라닐옥시, 피리딜옥시, 이속사졸릴옥시, 5-메틸-이속사졸릴옥시, 인돌릴옥시, 벤조티오페닐옥시, 5-클로로벤조티오페닐옥시, 티아졸릴옥시, 2-메틸티아졸릴옥시, 피라졸릴옥시, 2-메틸피라졸릴옥시 등을 들 수 있다.
"치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐"의 예로는, 테트라히드로피라닐옥시카르보닐, 피리딜옥시카르보닐, 이속사졸릴옥시카르보닐, 5-메틸-이속사졸릴옥시카르보닐, 인돌릴옥시카르보닐, 벤조티오페닐옥시카르보닐, 5-클로로벤조티오페닐옥시카르보닐, 티아졸릴옥시카르보닐, 2-메틸 티아졸릴옥시카르보닐, 피라졸릴옥시카르보닐, 2-메틸피라졸릴옥시카르보닐 등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노"의 예로는, 메틸아미노, 디메틸아미노, 에틸아미노, 디에틸아미노 등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 저급 알킬티오"의 예로는, 메틸티오, 에틸티오 등을 들 수 있다.
"치환기군 F로 치환되어 있을 수도 있는 저급 알킬실릴"의 예로는, 트리메틸실릴, 트리에틸실릴, tert-부틸디메틸실릴 등을 들 수 있다.
-OPR기에서의 PR은, 생체에 대한 투여(예를 들면, 경구 투여) 후에 약물 대사 효소, 가수분해 효소, 위산 및/또는 장내 세균 등의 작용에 의해서 -OH기로 변환되는 기가 바람직하다.
PR의 보다 바람직한 양태로서, 이하의 식 b) 내지 x)에서 선택되는 기를 들 수 있다.
(식에서, L은 직쇄 또는 분지상의 저급 알킬렌이고,
K는 수소, 또는 직쇄 또는 분지상의 저급 알킬렌, 또는 직쇄 또는 분지상의 저급 알케닐렌이고,
PR1은 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬티오이고,
PR2는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR3은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 치환기군 F로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는 저급 알킬실릴이고,
PR4는 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
치환기군 F는 옥소, 저급 알킬, 히드록시 저급 알킬, 아미노, 저급 알킬아미노, 탄소환 저급 알킬, 저급 알킬카르보닐, 할로겐, 히드록시, 카르복시, 저급 알킬카르보닐아미노, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬옥시, 시아노, 니트로임)
PR의 더욱 바람직한 양태로서, 이하의 b), k), l) 및 m)을 들 수 있다.
b) -C(=O)-PR1,
l) -CH2-O-C(=O)-PR3,
n) -CH2-O-C(=O)-O-PR3,
n) -CH(-CH3)-O-C(=O)-O-PR3
(식에서, 각 기호는 상기와 동일한 의미임)
PR의 바람직한 치환기의 별도의 양태로서, 이하의 표 1 내지 9에서의 P-1 내지 P-83의 기를 들 수 있다.
PR의 특히 바람직한 치환기의 별도의 양태로서, 이하에 나타내어지는 기를 들 수 있다.
R1a에서의 바람직한 치환기로서, 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RA1)(RA2),
-Z-N(RA3)-SO2-(RA4),
-Z-C(=O)-N(RA5)-SO2-(RA6),
-Z-N(RA7)-C(=O)-RA8,
-Z-S-RA9,
-Z-SO2-RA10,
-Z-S(=O)-RA11,
-Z-N(RA12)-C(=O)-O-RA13,
-Z-N(RA14)-C(=O)-N(RA15)(RA16),
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19),
-Z-N(RA20)-C(=O)-C(=O)-RA21, 또는
-Z-B(-ORA22)(-ORA23)
(치환기군 C, RA1, RA2, RA3, RA5, RA7, RA8, RA9, RA10, RA11, RA12, RA13, RA14, RA15, RA16, RA17, RA18, RA19, RA20, RA21, RA22, RA23 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R1a에서의 보다 바람직한 치환기로서, 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기,
-Z-N(RA1)(RA2),
-Z-N(RA7)-C(=O)-RA8,
-Z-N(RA12)-C(=O)-O-RA13, 또는
-Z-B(-ORA22)(-ORA23)
(치환기군 C, RA1, RA2, RA7, RA8, RA12, RA13, RA22, RA23 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R1a에서의 더욱 바람직한 치환기로서, 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는
-Z-N(RA1)(RA2)
(치환기군 C, RA1, RA2 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R1a에서의 바람직한 치환기의 별도의 양태로서, 수소, 카르복시, 히드록시메틸, 메톡시, 염소 원자, 브롬 원자, 에톡시메틸, 디메틸아미노, 히드록시, -C(=O)-NH-S(=O)2-Me, 아미노, 메틸아미노, 메틸아미노메틸, -NH-C(=O)-CF3, 피라졸릴, -NH-C(=O)-Me, -C(=O)N-Me2, 테트라졸릴, -NH-C(=O)-Ph, -C(=O)NH-Me, -C(=O)NH-Et, -C(=O)NH-시클로프로필, 메톡시카르보닐, 메틸, 프로페닐, 프로필, 이소프로필, 플루오로메틸, 디플루오로메틸, 시아노, -C(=O)-Me, -CH(-OH)-Me, -B(-OH)2, (Me는 메틸기, Ph는 페닐기, Et는 에틸기를 나타냄) 등을 들 수 있다.
R1a에서의 보다 바람직한 치환기의 별도의 양태로서, 수소, 카르복시, 히드록시메틸, 메톡시, 브롬 원자, 에톡시메틸, 디메틸아미노, 히드록시, -C(=O)-NH-S(=O)2-Me, 아미노, 메틸아미노, 메틸, 프로페닐, -C(=O)-Me, -B(-OH)2 (Me는 메틸기를 나타냄) 등을 들 수 있다.
R1a에서의 더욱 바람직한 치환기의 별도의 양태로서, 수소, 카르복시, -C(=O)-Me를 들 수 있다.
R1a에서의 가장 바람직한 치환기는 수소이다.
R2a에서의 바람직한 치환기로서, 수소, 할로겐, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RB1)-SO2-RB2,
-Z-N(RB3)-C(=O)-RB4,
-Z-N(RB5)-C(=O)-O-RB6,
-Z-C(=O)-N(RB7)(RB8),
-Z-N(RB9)(RB10), 또는
-Z-SO2-RB11
(치환기군 C, RB1, RB2, RB3, RB4, RB5, RB6, RB7, RB8, RB9, RB10, RB11 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R2a에서의 보다 바람직한 치환기로서, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-N(RB9)(RB10)
(치환기군 C, RB9, RB10 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R2a에서의 더욱 바람직한 치환기로서, 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬 (치환기군 C는 항목 1과 동일한 의미임)를 들 수 있다.
R2a에서의 바람직한 치환기의 별도의 양태로서, 수소, 히드록시메틸, 아미노, 메톡시메틸, 메톡시메틸시클로프로필메틸옥시메틸, 시아노메틸, 아미노메틸, 프로필옥시메틸, -CH2-NH-C(=O)-Me, 메틸아미노메틸, 이미다졸릴, 디메틸아미노메틸, 피롤리디닐, 플루오로메틸, -CH2-NH-C(=O)H (Me는 메틸기를 나타냄) 등을 들 수 있다.
R2a에서의 보다 바람직한 치환기의 별도의 양태로서, 수소, 히드록시메틸, 메톡시메틸시클로프로필메틸옥시메틸, 아미노메틸, 프로필옥시메틸 등을 들 수 있다.
R2a에서의 더욱 바람직한 치환기의 별도의 양태로서, 수소를 들 수 있다.
R3a에서의 바람직한 치환기로서,
수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RC1)-SO2-RC2,
-Z-N(RC3)-C(=O)-RC4,
-Z-N(RC5)-C(=O)-O-RC6,
-Z-C(=O)-N(RC7)(RC8),
-Z-N(RC9)(RC10), 또는
-Z-SO2-RC11
(치환기군 C, RC1, RC2, RC3, RC4, RC5, RC6, RC7, RC8, RC9, RC10, RC11 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R3a에서의 보다 바람직한 치환기로서, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬,
-Z-N(RC1)-SO2-RC2,
-Z-N(RC3)-C(=O)-RC4,
-Z-N(RC5)-C(=O)-O-RC6,
-Z-C(=O)-N(RC7)(RC8), 또는
-Z-N(RC9)(RC10)
(치환기군 C, RC1, RC2, RC3, RC4, RC5, RC6, RC7, RC8, RC9, RC10 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R3a에서의 더욱 바람직한 치환기로서, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬 (치환기군 C는 항목 1과 동일한 의미임)를 들 수 있다.
R3a에서의 바람직한 치환기의 별도의 양태로서, 수소, 에톡시에틸, 메틸, 에틸, 프로필, 2,4-디플루오로벤질, 메톡시에틸, 시아노메틸, 시아노에틸, 3-클로로-2-플루오로벤질, 1-메톡시프로필, 피리딜메틸, 이소프로필, 테트라히드로피라닐메틸, 시클로프로필메틸, 벤질, 메틸이속사졸릴메틸, 메틸옥사디아졸릴, 이소프로필옥시에틸, 히드록시에틸, 4-플루오로벤질, 시클로프로필, 에톡시카르보닐에틸, -CH(Me)CH2OMe, 카르복시에틸, -CH2CH2C(=O)-N(Me)2, -CH2CH2N(Me)-S(=O)2-Ph, -CH2CH2-N(Me)-S(=O)2-Me, -CH2CH2-NHC(=O)-Ph, -CH(Me)-CH2-OMe, -CH2CH2-NH-S(=O)2-Ph, -CH2CH2-NH-C(=O)-O-CH(Me)2, -CH2CH2-C(=O)-NH-Ph, -CH2CH2-N(Me)C(=O)-Ph, -CH2CH2-NH-C(=O)-Me, -CH2CH2-NH-S(=O)2-Me, 아미노에틸, -CH2CH2-N(Me)-C(=O)-Me, -CH2CH2-C(=O)-N(Me)-Ph, -CH2CH2-NH-C(=O)-O-tBu, 피페리디닐카르보닐에틸, 디메틸아미노에틸, 시클로프로필메틸, 메틸아미노에틸, 푸라닐메틸, 모르폴리닐카르보닐에틸, sec-부틸, 펜탄-2-일, 카르복시프로필, 에톡시카르보닐프로필, 페닐프로필, 프로필옥시에틸, 아미노프로필, 디메틸아미노메틸, 디메틸아미노에틸, 디에틸아미노메틸, 디에틸아미노에틸, 디메틸아미노프로필, 메틸아미노카르보닐에틸, 1,1,1-트리플루오로프로판-2-일, 1,1-디플루오로에틸, 1,1,1-트리플루오로에틸, 1,1,1-트리플루오로프로필, 트리플루오로메틸옥시에틸, 트리플루오로메틸카르보닐아미노메틸, 메틸술포닐에틸, 메틸카르보닐옥시에틸, 메틸카르보닐옥시프로필, 1-플루오로프로필, 플루오로시클로프로필, 디플루오로시클로프로필, 3,3-디메틸부탄-2-일, 1-플루오로에틸, 1-메톡시프로판-2-일, 아미노, 티아졸릴메틸, 메틸술포닐에틸, 4-플루오로페닐옥시에틸, 피리딜, 펜탄-2-일, 부탄-2-일, 3-메틸부텐-2-일, 및 이하에 나타내어지는 기:
(Me는 메틸기, Ph는 페닐기, 및 tBu는 tert-부틸기를 나타냄) 등을 들 수 있다.
R3a에서의 보다 바람직한 치환기의 별도의 양태로서, 에톡시에틸, 메틸, 에틸, 2,4-디플루오로벤질, 메톡시에틸, 시아노메틸, 3-클로로-2-플루오로벤질, 메톡시프로필, 피리딜메틸, 이소프로필, 테트라히드로피라닐메틸, 시클로프로필메틸, 벤질, 메틸이속사졸릴메틸, 4-플루오로벤질, 시클로프로필, 에톡시카르보닐에틸, -CH(Me)CH2OMe, 카르복시에틸, -CH2CH2C(=O)-N(Me)2, -CH2CH2N(Me)-S(=O)2-Ph, -CH2CH2-N(Me)-S(=O)2-Me, -CH2CH2-NHC(=O)-Ph, -CH(Me)-CH2-OMe, -CH2CH2-NH-S(=O)2-Ph, -CH2CH2-NH-C(=O)-O-CH(Me)2, -CH2CH2-C(=O)-NH-Ph, -CH2CH2-N(Me)C(=O)-Ph, -CH2CH2-NH-C(=O)-Me, -CH2CH2-NH-S(=O)2-Me, 아미노에틸, 1,1,1-트리플루오로프로판-2-일, 프로필, 메틸티오메틸, 수소, 플루오로시클로프로필, 트리플루오로메톡시에틸, 1-플루오로프로필, 1-플루오로에틸, 메틸카르보닐옥시메틸, 1,1-디플루오로메틸, 및 이하에 나타내어지는 기:
(Me는 메틸기, 및 Ph는 페닐기를 나타냄) 등을 들 수 있다.
R3a에서의 더욱 바람직한 치환기의 별도의 양태로서, 에톡시에틸, 메틸, 에틸, 2,4-디플루오로벤질, 메톡시에틸, 시아노메틸, 3-클로로-2-플루오로벤질, 메톡시프로필, 피리딜메틸, 이소프로필, 테트라히드로피라닐메틸, 시클로프로필메틸, 벤질, 4-플루오로벤질, 시클로프로필, 에톡시카르보닐에틸, -CH(Me)CH2OMe, 카르복시에틸, 1,1,1-트리플루오로프로판-2-일, 히드록시에틸, 1-플루오로에틸 (Me는 메틸기를 나타냄) 등을 들 수 있다.
R3a에서의 가장 바람직한 치환기의 별도의 양태로서, 1,1,1-트리플루오로프로판-2-일을 들 수 있다.
R5a, R6a, R7a, R8a, R9a, R10a 및 R11a에서의 바람직한 치환기로서, 수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RD1,
-Z-S(=O)-RD2,
-Z-SO2-RD3,
-C(=O)-C(=O)-RD4,
-C(=O)-N(RD5)(RD6),
-Z-C(RD7)(RD8)(RD9), 또는
-Z-CH2-RD10
(치환기군 C, RD1, RD2, RD3, RD4, RD5, RD6, RD7, RD8, RD9, RD10 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
또한, R5a, R6a, R7a, R8a, R9a, R10a 및 R11a에서의 보다 바람직한 치환기로서, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 3환의 축합 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬,
-Y-S-RD1, 또는
-Z-C(RD7)(RD8)(RD9)
(치환기군 C, RD1, RD7, RD8, RD9, Y 및 Z는 항목 1과 동일한 의미임)를 들 수 있다.
R5a, R6a, R7a, R8a, R9a, R10a 및 R11a에서의 바람직한 치환기의 별도의 양태로서, 수소, 벤즈히드릴, 벤질, 인돌릴메틸, 시클로헥실메틸, 페네틸, 벤질티오메틸, 3,5-디메틸이속사졸릴, 5-클로로-3-에틸벤조티오페닐, 4-플루오로벤질, 메틸티아졸릴메틸, 시클로펜틸메틸, 4-메톡시벤질, 3-플루오로벤질, 나프틸메틸, 메틸, 3-트리플루오로메틸벤질, 피리딜메틸, 4-메틸카르보닐아미노벤질, 피리미디닐, 이소부틸, 페녹시에틸, 메톡시프로필, 페닐프로필, 및 이하의 기:
(식에서, RE6은 치환기군 C에서 선택되는 기를 나타내고, m개의 RE6은 동일하거나 상이할 수도 있음) 등의 치환기군 C로 치환되어 있을 수도 있는 3환 또는 4환의 축합 복소환식기 등을 들 수 있다.
R5a, R6a, R7a, R8a, R9a, R10a 및 R11a에서의 보다 바람직한 치환기의 별도의 양태로서, 수소, 벤즈히드릴, 벤질, 인돌릴메틸, 시클로헥실메틸, 페네틸, 3,5-디메틸이속사졸릴, 5-클로로-3-에틸벤조티오페닐, 비페닐메틸, 4-플루오로벤질, 메틸 티아졸릴메틸, 시클로펜틸메틸, 4-메톡시벤질, 3-플루오로벤질, 나프틸메틸, 메틸, 3-트리플루오로메틸벤질, 피리딜메틸, 4-메틸카르보닐아미노벤질, 피리미디닐, 및 이하의 기:
(식에서, RE6은 치환기군 C에서 선택되는 기를 나타내고, m개의 RE6은 동일하거나 상이할 수도 있음) 등을 들 수 있다.
1) B1이 CR5aR6a이고, B2가 NR7a인 경우의 바람직한 양태로서,
R3a와 R7a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있는 경우를 들 수 있다.
2) B1이 NR7a이고, B2가 CR5aR6a인 경우의 바람직한 양태로서,
R3a와 R6a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있는 경우를 들 수 있다.
3) B1이 CR8aR9a이고, B2가 CR10aR11a인 경우의 바람직한 양태로서,
R8a 및 R10a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 탄소환 또는 복소환을 형성하고 있는 경우를 들 수 있다.
4) B1이 CR8aR9a이고, B2가 CR10aR11a인 경우의 별도의 바람직한 양태로서,
R3a 및 R11a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있는 경우를 들 수 있다.
B1 및 B2 중 어느 한쪽이 CR5aR6a이고, 다른 쪽이 NR7a인 경우, B1이 NR7a이고, B2가 CR5aR6a인 경우가 보다 바람직하다.
B1 및 B2 중 어느 한쪽이 CR5aR6a이고, 다른 쪽이 NR7a인 경우, R5a 또는 R6a의 적어도 어느 한쪽이 수소인 것이 바람직하다. 보다 바람직한 양태는, R5a가 수소이고, R6a가 수소이다. 이 경우, R7a는 수소 원자가 아니다.
B1 및 B2의 특히 바람직한 양태는, B1이 NR7a이고, B2가 CR5aR6a이다.
B1 및 B2의 가장 바람직한 양태는, B1이 NR7a이고, B2가 CH2이다.
R7a의 바람직한 양태는 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬이다.
R7a의 보다 바람직한 양태는 시클로알킬, 시클로알케닐, 아릴, 비방향족 축합 탄소환식기, 헤테로아릴, 비방향족 복소환식기, 2환의 축합 복소환식기, 3환의 축합 복소환식기, 1 또는 2의 탄소환식기로 치환되어 있는 저급 알킬, 1 또는 2의 복소환식기로 치환되어 있는 저급 알킬이다.
R7a의 더욱 바람직한 양태는 벤질, 벤즈히드릴, 4-플루오로벤질, p-메톡시벤질, 및 이하의 기:
(식에서, RE6 및 m은 항목 1과 동일한 의미임)이다.
R7a의 특히 바람직한 양태는 이하의 기:
(식에서, RE6 및 m은 항목 1과 동일한 의미임)이다.
R7a의 가장 바람직한 양태는 이하의 기:
(식에서, RE6 및 m은 항목 1과 동일한 의미임)이다.
B1이 CR8aR9a이고, B2가 CR10aR11a인 경우, R9a 및 R11a는 수소가 바람직하다. R8a 및 R10a의 바람직한 양태는, 어느 한쪽이 수소이다.
R9a 및 R11a가 수소이고, R8a 및 R10a 중 어느 한쪽이 수소인 경우, R8a 및 R10a 중 다른 쪽의 바람직한 양태는
-Z-C(RE1)(RE2)(RE3) 또는
(식에서, Z, RE1, RE2, RE3, RE6 및 m은 항목 1과 동일한 의미임)이다.
R9a 및 R11a가 수소이고, R8a 및 R10a 중 어느 한쪽이 수소인 경우, R8a 및 R10a 중 다른 쪽의 더욱 바람직한 양태는 이하의 기:
(식에서, RE6, m은 항목 1과 동일한 의미임)이다.
R9a 및 R11a가 수소이고, R8a 및 R10a 중 어느 한쪽이 수소인 경우, R8a 및 R10a 중 다른 쪽의 가장 바람직한 양태는 이하의 기:
(식에서, RE6, m은 항목 1과 동일한 의미임)이다.
치환기군 D에서의 바람직한 치환기로서, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬을 들 수 있다.
치환기군 D에서의 바람직한 치환기의 별도의 양태로서, 벤질, 벤즈히드릴, 4-플루오로벤질, p-메톡시벤질,
(식에서, RE6은 치환기군 C에서 선택되는 기를 나타내고, m개의 RE6은 동일하거나 상이할 수도 있음) 등을 들 수 있다.
RE6의 바람직한 치환기의 예로서, 할로겐, 시아노, 히드록시, 카르복시, 포르밀, 아미노, 옥소, 니트로, 저급 알킬, 저급 알키닐, 할로게노 저급 알킬, 저급 알킬옥시, 저급 알킬아미노, 할로게노 저급 알킬옥시, 탄소환식기 등을 들 수 있다.
RE6의 보다 바람직한 치환기의 예로서, 불소 원자, 염소 원자, 브롬 원자, 시아노, 히드록시, 메틸, 에틸, 에티닐, 히드록시메틸, 이소프로필, 메톡시, 에톡시, 메톡시메틸, 시클로프로필, 디메틸아미노, 트리플루오로메틸, 옥소, 카르복시를 들 수 있다.
RE6의 특히 바람직한 치환기의 예로서, 불소 원자, 염소 원자, 브롬 원자, 메틸, 메톡시, 트리플루오로메틸을 들 수 있다.
m의 바람직한 양태는 0 내지 6의 정수이고, 더욱 바람직하게는 0 내지 3의 정수이고, 가장 바람직하게는 0 내지 2의 정수이다.
본 발명에 따른 화합물의 특징의 하나는, 항목 1에서의 식 (I)에 나타낸 바와 같은 2개 이상의 환이 축환된 다환성 카르바모일 피리돈 유도체의 프로드러그 및/또는 이들을 포함하는 조성물이 캡 의존적 엔도뉴클레아제에 대하여 높은 저해 활성을 가져 인플루엔자 감염증에 관한 치료 및/또는 예방 효과를 갖는 점이다.
본 발명에 따른 화합물의 특징은, 식 (I)에서의 R1a에 대하여 하기에 나타낸 바와 같은 관능기를 적용함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
관능기: 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RA1)(RA2),
-Z-N(RA3)-SO2-(RA4),
-Z-C(=O)-N(RA5)-SO2-(RA6),
-Z-N(RA7)-C(=O)-RA8,
-Z-S-RA9,
-Z-SO2-RA10,
-Z-S(=O)-RA11,
-Z-N(RA12)-C(=O)-O-RA13,
-Z-N(RA14)-C(=O)-N(RA15)(RA16),
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19), 또는
-Z-N(RA20)-C(=O)-C(=O)-RA21
(치환기군 C, RA1, RA2, RA3, RA5, RA7, RA8, RA9, RA12, RA13, RA14, RA15, RA16, RA17, RA18, RA19, RA20 및 RA21은 항목 1과 동일한 의미임)
본 발명에 따른 보다 바람직한 화합물의 특징은, 식 (I)에서의 R1a에 대하여 하기에 나타낸 바와 같은 관능기를 적용함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
관능기: 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기,
-Z-N(RA1)(RA2),
-Z-N(RA7)-C(=O)-RA8, 또는
-Z-N(RA12)-C(=O)-O-RA13
(치환기군 C, RA1, RA2, RA7, RA8, RA12, RA13 및 Z는 항목 1과 동일한 의미임)
본 발명에 따른 더욱 바람직한 화합물의 특징은, 식 (I)에서의 R1a에 대하여 하기에 나타낸 바와 같은 관능기를 적용함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
관능기: 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는
-Z-N(RA1)(RA2)
(치환기군 C, RA1, RA2 및 Z는 항목 1과 동일한 의미임)
본 발명에 따른 특히 바람직한 화합물의 특징은, 식 (I)에서의 R1a에 대하여 하기에 나타낸 바와 같은 관능기를 적용함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
관능기: 수소, 아세틸, 또는 카르복시
본 발명에 따른 화합물의 다른 특징은, 식 (I)에서의 B1 및/또는 B2의 탄소 원자상 또는 질소 원자상에 하기에 나타낸 바와 같은 지용성 관능기를 1개 또는 2개 이상 도입함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
지용성 관능기: 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐 (치환기군 C는 항목 1과 동일한 의미임)
본 발명에 따른 보다 바람직한 화합물의 다른 특징은, 식 (I)에서의 B1 또는 B2의 탄소 원자상 또는 질소 원자상에 하기에 나타낸 바와 같은 지용성 관능기를 1개 도입함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
지용성 관능기: 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬 (치환기군 C는 항목 1과 동일한 의미임)
본 발명에 따른 특히 바람직한 화합물의 다른 특징은, 식 (I)에서의 B1 또는 B2의 탄소 원자상 또는 질소 원자상에 하기에 나타낸 바와 같은 지용성 관능기를 1개 도입함으로써, 캡 의존적 엔도뉴클레아제 저해 활성을 향상시킨 점이다.
지용성 관능기: 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기 (치환기군 C는 항목 1과 동일한 의미임)
본 발명에 따른 바람직한 화합물의 그 밖의 특징은, 식 (I)에서의 PR부에 프로드러그를 형성하는 기를 도입함으로써, 생체에 대한 투여(예를 들면, 경구 투여) 후에 효율적으로 체내에 흡수되어 높은 약효를 나타내도록 한 점이다.
본 발명에 따른 보다 바람직한 화합물의 그 밖의 특징은, 식 (I)에서의 PR부에 이하의 식 a) 내지 v)에서 선택되는 기를 도입함으로써, 투여 후에 효율적으로 체내에 흡수되어 높은 약효를 나타내도록 한 점이다.
(식에서, L은 직쇄 또는 분지상의 저급 알킬렌이고,
K는 수소, 또는 직쇄 또는 분지상의 저급 알킬렌이고,
PR0은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬이고,
PR1은 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬티오이고,
PR2는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR3은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 치환기군 F로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 복소환 저급 알킬, 저급 알킬실릴이고,
PR4는 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
치환기군 F는 옥소, 저급 알킬, 히드록시 저급 알킬, 아미노, 저급 알킬아미노, 탄소환 저급 알킬, 저급 알킬카르보닐, 할로겐, 히드록시, 카르복시, 저급 알킬카르보닐아미노, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬옥시, 시아노, 니트로임)
본 발명에 따른 보다 바람직한 화합물의 그 밖의 특징은, 식 (I)에서의 PR부에 표 1 내지 8에서의 P-1 내지 P-77의 기를 도입함으로써, 투여 후에 효율적으로 체내에 흡수되어 높은 약효를 나타내도록 한 점이다.
본 발명의 바람직한 실시 양태를 이하에 예시한다.
식 (III), 식 (III'), 식 (III"), 식 (III"'), 식 (III""), 식 (III""'):
1) R1a가 수소인 화합물(이하, R1a가 R1-1로 함),
R1a가 카르복시인 화합물(이하, R1a가 R1-2로 함),
R1a가 할로겐인 화합물(이하, R1a가 R1-3으로 함),
R1a가 히드록시인 화합물(이하, R1a가 R1-4로 함),
R1a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬인 화합물(이하, R1a가 R1-5로 함),
R1a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐인 화합물(이하, R1a가 R1-6으로 함),
R1a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐인 화합물(이하, R1a가 R1-7로 함),
R1a가 아미노인 화합물(이하, R1a가 R1-8로 함),
2) R2a가 수소인 화합물(이하, R2a가 R2-1로 함),
R2a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬인 화합물(이하, R2a가 R2-2로 함),
3) R3a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬인 화합물(이하, R3a가 R3-1로 함),
R3a가 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬인 화합물(이하, R3a가 R3-2로 함),
R3a가 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬인 화합물(이하, R3a가 R3-3으로 함),
R3a가 치환기군 C로 치환되어 있을 수도 있는 탄소환식기인 화합물(이하, R3a가 R3-4로 함),
R3a가 치환기군 C로 치환되어 있을 수도 있는 복소환식기인 화합물(이하, R3a가 R3-5로 함),
4) PR이 -C(=O)-PR1인 화합물(이하, RR이 Pr-1로 함),
PR이 -CH2-O-C(=O)-PR3인 화합물(이하, RR이 Pr-2로 함),
PR이 -CH2-O-C(=O)-O-PR3인 화합물(이하, RR이 Pr-3으로 함),
PR이 -CH(-CH3)-O-C(=O)-O-PR3인 화합물(이하, RR이 Pr-4로 함)
(식에서, 각 기호는 상기와 동일한 의미임);
상기 식 (III')에서,
R7a가 치환기군 C로 치환되어 있을 수도 있는 탄소환식기이고, R5a 및 R6a가 수소인 화합물(이하, R7-1로 함)
R7a가 치환기군 C로 치환되어 있을 수도 있는 복소환식기이고, R5a 및 R6a가 수소인 화합물(이하, R7-2로 함)
R7a가 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬이고, R5a 및 R6a가 수소인 화합물(이하, R7-3으로 함);
상기 식 (III)에서,
R9a가 치환기군 C로 치환되어 있을 수도 있는 탄소환식기이고, R8a, R10a 및 R11a가 수소인 화합물(이하, R9-1로 함)
R9a가 치환기군 C로 치환되어 있을 수도 있는 복소환식기이고, R8a, R10a 및 R11a가 수소인 화합물(이하, R9-2로 함)
R9a가 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬이고, R8a, R10a 및 R11a가 수소인 화합물(이하, R9-3으로 함)
(여기서, 치환기군 C란, 할로겐, 시아노, 히드록시, 카르복시, 포르밀, 아미노, 옥소, 니트로, 저급 알킬, 할로게노 저급 알킬, 저급 알킬옥시, 탄소환식기, 복소환식기, 탄소환 저급 알킬옥시, 복소환 저급 알킬옥시, 할로게노 저급 알킬옥시, 저급 알킬옥시 저급 알킬, 저급 알킬옥시 저급 알킬옥시, 저급 알킬카르보닐, 저급 알킬옥시카르보닐, 저급 알킬아미노, 저급 알킬카르보닐아미노, 저급 알킬아미노카르보닐, 저급 알킬술포닐 및 저급 알킬술포닐아미노로 이루어지는 치환기군에서 선택되는 적어도 1개임);
상기 식 (III')에서, R1a, R2a, R3a, PR 및 (R5a, R6a 및 R7a)의 조합이 이하의 것인 화합물.
상기 식 (III)에서, R1a, R2a, R3a, PR 및 (R8a, R9a, R10a 및 R11a)의 조합이 이하의 것인 화합물.
(본 발명의 화합물의 제조법)
본 발명의 화합물의 일반적 제조법을 이하에 예시한다. 또한, 추출, 정제 등은 통상의 유기 화학의 실험에서 행하는 처리를 행하면 된다.
본 발명의 화합물의 합성은 해당 분야에서 공지된 수법을 참작하면서 실시할 수 있다.
원료 화합물은 시판되고 있는 화합물, 본 명세서에 기재된 것, 본 명세서에서 인용된 문헌에 기재된 것, 및 그 밖의 공지 화합물을 이용할 수 있다.
본 발명의 화합물 중에는 호변 이성체가 존재할 수 있는 것이 있지만, 본 발명은 이것들을 포함해서 모든 가능한 이성체 및 이들의 혼합물을 포함한다.
본 발명의 화합물의 염을 취득하고자 할 때, 본 발명의 화합물이 염의 형태로 얻어지는 경우에는 그대로 정제하면 되고, 유리 형태로 얻어지는 경우에는 적당한 유기 용매에 용해 또는 현탁시키고, 산 또는 염기를 가하여 통상의 방법에 의해 염을 형성시키면 된다.
또한, 본 발명의 화합물 및 그의 제약상 허용되는 염은 물 또는 각종 용매와의 부가물(수화물 내지 용매화물)의 형태로 존재하기도 하는데, 이들 부가물도 본 발명에 포함된다.
일반적 합성법 및 참고예, 실시예, 및 중간체 합성예 중, 각 약어의 의미는 이하와 같다.
DMF: N,N-디메틸포름아미드
DMA: N,N-디메틸아세트아미드
NMP: N-메틸피롤리돈
DMI: 디메틸이미다졸리디논
THF: 테트라히드로푸란
Ms: 메탄술포닐
Ts: 파라톨루엔술포닐
Boc: tert-부톡시카르보닐
DIBALH: 디이소부틸알루미늄히드리드
WSC 또는 EDCI: N-에틸-N'-(3-디메틸아미노프로필)카르보디이미드
HOBt: 1-히드록시벤조트리아졸
HATU: O-(7-아자벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트
NBS: N-브로모숙시이미드
NCS: N-클로로숙시이미드
TEMPO: 2,2,6,6-테트라메틸피페리딘-1-옥실 래디컬
PDC: 피리디늄디클로로메이트
DEAD: 디에틸아조디카르복실레이트
DIAD: 디이소프로필아조디카르복실레이트
DMAP: 4-디메틸아미노피리딘
mCPBA: m-클로로과벤조산
DBU: 1,8-디아자비시클로[5.4.0]-7-운데센
DIPEA: 디이소프로필에틸아민
TBAF: 불화테트라부틸암모늄
IBX: 2-요오독시벤조산
DMSO: 디메틸술폭시드
NaHMDS: 나트륨헥사메틸디실라지드
TFA: 트리플루오로아세트산
Ac: 아세틸
TBS: tert-부틸디메틸실릴
PEPPSITM-IPr: (1,3-디이소프로필이미다졸-2-일리덴)(3-클로로피리딜)팔라듐(II) 디클로라이드
BEMP: 2-tert-부틸이미노-2-디에틸아미노-1,3-디메틸과히드로-1,3,2-디아자포스포린
참고예 화합물 aj의 합성(참조: 참고예 1)
(식에서, R은 카르복시 보호기이고, P1은 히드록실 보호기이고, R2, R3, R8, R9, R10 및 R11은 각각 항목 1의 R2a, R3a, R8a, R9a, R10a 및 R11a와 동일한 의미이고, R 및 P1은 Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 방법으로 보호 및/또는 탈보호할 수 있는 기이면 되고, 예를 들면 R은 저급 알킬 등이고, P1은 아릴알킬 등임)
제1 공정
시판 또는 공지된 방법에 의해 제조할 수 있는 화합물 aa를 디클로로메탄, 톨루엔, THF 등의 용매 또는 이들의 혼합 용매 중, 피리딘, 트리메틸아민, N-메틸모르폴린, 4-디메틸아미노피리딘 등의 3급 아민 및 벤질옥시아세틸클로라이드를 적하하고, -20℃ 내지 30℃, 바람직하게는 0℃ 내지 20℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 ab를 얻을 수 있다.
제2 공정
화합물 ab에 에테르, 디클로로메탄, THF 등의 용매 또는 이들의 혼합 용매 중, 신나모일클로라이드의 존재하에, 리튬헥사메틸디실라잔, 리튬디이소프로필아미드, 부틸리튬, tert-부틸리튬 등의 유기 금속 염기를 가하고, -80℃ 내지 0℃, 바람직하게는 -80℃ 내지 -40℃에서 1분간 내지 2시간, 바람직하게는 10분간 내지 1시간 반응시킴으로써, 화합물 ac를 얻을 수 있다.
제3 공정
화합물 ac에, 에테르, 디클로로메탄, THF, 아세토니트릴 등의 용매 또는 이들의 혼합 용매 중, 촉매량의 염화루테늄 및 과요오드산나트륨, TEMPO, 이산화망간 및 PDC 등의 산화제를 가하고, -40℃ 내지 80℃, 바람직하게는 0℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.2시간 내지 3시간 반응시킴으로써, 화합물 ad를 얻을 수 있다.
제4 공정
화합물 ad에 에테르, 디클로로메탄, THF, 아세토니트릴, 아세톤, 물 등의 용매의 존재하 또는 이들의 혼합 용매 중, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 농황산 및 아미도황산의 수용액을 가한다. 여기에 아염소산나트륨 수용액을 동일 온도에서 적하하여, 1분간 내지 3시간, 바람직하게는 5분간 내지 1시간 반응시킴으로써, 화합물 ae를 얻을 수 있다.
제5 공정
화합물 ae에, DMF, THF, 디클로로메탄, 아세토니트릴 등의 용매 중, 디시클로헥실카르보디이미드, 카르보닐디이미다졸, 디시클로헥실카르보디이미드-N-히드록시벤조트리아졸, 4-(4,6-디메톡시-1,3,5-트리아진-2-일)-4-메틸모르폴리늄클로라이드, 헥사플루오로인산 2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄, WSC·HCl, HATU 등의 탈수 축합제 존재하에, 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 R3-NH2를 가하고, -20℃ 내지 60℃, 바람직하게는 -10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 af를 얻을 수 있다.
제6 공정
화합물 af에, 톨루엔, 크실렌, THF, 디옥산 등의 용매의 존재하 또는 이들의 혼합 용매 중, 화합물 ag를 가하고, 가열 환류 조건하에서, 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 ah를 얻을 수 있다.
제7 공정
화합물 ah에, THF, 디옥산, 아세트산에틸, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리페닐포스핀 및 DEAD, DIAD 등의 축합제를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 ai를 얻을 수 있다.
제8 공정
화합물 ai를 카르복실 보호기 및 히드록실 보호기의 공지된 일반적인 탈보호 반응을 시킴으로써 화합물 aj를 얻을 수 있다.
참고예 화합물 bk의 합성(참조: 참고예 12)
(식에서, P2는 아미노 보호기이고, P2는 Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 방법으로 보호 및/또는 탈보호할 수 있는 기이면 되고, 예를 들면 P2는 아릴알킬옥시카르보닐, 저급 알킬옥시카르보닐 등이다. 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ba에, DMF, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 탄산칼륨, 탄산나트륨, 탄산세슘 등의 염기, 및 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 P2-L(여기서, L은 할로겐, OMs 등의 탈리기)을 가하고, -20℃ 내지 80℃, 바람직하게는 0℃ 내지 50℃에서 0.1시간 내지 6시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 bb를 얻을 수 있다.
제2 공정
화합물 bb에, DMF, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리페닐포스핀 및 프탈이미드를 가하고, DIAD, DEAD 등의 탈수 축합 시약을 가하고, -10℃ 내지 60℃, 바람직하게는 0℃ 내지 50℃에서 0.1시간 내지 24시간, 바람직하게는 0.2시간 내지 12시간 반응시킴으로써, 화합물 bc를 얻을 수 있다.
제3 공정
화합물 bc에, 메탄올, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 히드라진 수화물 또는 메틸히드라진을 가하고, -10℃ 내지 80℃, 바람직하게는 10℃ 내지 60℃에서 0.5시간 내지 24시간, 바람직하게는 1 내지 12시간 반응시킴으로써, 화합물 bd를 얻을 수 있다.
제4 공정
화합물 bd에, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, Boc2O를 가하고, -10℃ 내지 80℃, 바람직하게는 10℃ 내지 60℃에서 0.5시간 내지 24시간, 바람직하게는 1 내지 12시간 반응시킴으로써, 화합물 be를 얻을 수 있다.
제5 공정
화합물 be에, 아미노 보호기의 공지된 일반적인 탈보호 반응을 시킴으로써, 화합물 bf를 얻을 수 있다.
제6 공정
화합물 bf에, 톨루엔, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 화합물 bg를 가하고, 20℃ 내지 110℃, 바람직하게는 40℃ 내지 가열 환류하에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 bh를 얻을 수 있다.
제7 공정
화합물 bh에, HCl-아세트산에틸, HCl-디옥산, 포름산 등을 가하고, 0℃ 내지 40℃, 바람직하게는 0℃ 내지 20℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킨다. 용매를 감압증류 제거한 후, 포화 탄산수소나트륨 수용액을 가하여 교반함으로써, 화합물 bi를 얻을 수 있다.
제8 공정
화합물 bi에, DMF, THF, DMA, NMP 등의 용매의 존재하 또는 이들의 혼합 용매 중, 탄산칼륨, 탄산나트륨, 탄산리튬, 탄산세슘 등의 염기 및 화합물 R3-L(L은 할로겐, OMs 등의 탈리기)을 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 bj를 얻을 수 있다.
제9 공정
화합물 bj를 카르복실 보호기 및 히드록실 보호기의 공지된 일반적인 탈보호 반응을 시킴으로써 화합물 bk를 얻을 수 있다.
참고예 화합물 cd의 합성(참조: 참고예 28 및 43)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ca에, THF, 디옥산, 아세토니트릴, 물 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리에틸아민, DMAP, 모르폴린 등의 3급 아민 또는 탄산나트륨, 탄산수소나트륨 등의 염기를 가하고, Boc2O를 가하고, -10℃ 내지 80℃, 바람직하게는 10℃ 내지 60℃에서 0.5시간 내지 24시간, 바람직하게는 1 내지 12시간 반응시킴으로써, 화합물 cb를 얻을 수 있다.
제2 공정
화합물 cb에, DMF, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리페닐포스핀 및 프탈이미드를 가하고, DIAD, DEAD 등의 탈수 축합 시약을 가하고, -10℃ 내지 60℃, 바람직하게는 0℃ 내지 50℃에서 0.1시간 내지 24시간, 바람직하게는 0.2시간 내지 12시간 반응시킴으로써, 화합물 cc를 얻을 수 있다.
제3 공정
화합물 cc에, 메탄올, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 히드라진 수화물을 가하고, -10℃ 내지 80℃, 바람직하게는 10℃ 내지 60℃에서 0.5시간 내지 24시간, 바람직하게는 1 내지 12시간 반응시킴으로써, 화합물 cd를 얻을 수 있다.
참고예 화합물 dg의 합성(참조: 참고예 36, 41 및 46)
(식에서, B1 및 B2는 항목 1과 동일한 의미이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
bi의 합성법과 마찬가지의 방법에 의해 얻어진 화합물 da를 공지된 일반적인 카르복실 탈보호 반응을 시킴으로써, 화합물 db를 얻을 수 있다.
제2 공정
화합물 db를 디페닐에테르 등의 용매 중, 마이크로웨이브 조사하에서, 1분간 내지 2시간 반응시킴으로써, 탈탄산된 화합물 dc를 얻을 수 있다. 또한, 퀴놀린 용매 중, 구리를 가하고, 180℃에서 2 내지 48시간 반응시킴으로써, 탈탄산된 화합물 d를 얻을 수 있다.
제3 공정
참고예 12에 기재된 방법에 의해 얻어지는 화합물 da에, DMF, THF, DMA, NMP 등의 용매의 존재하 또는 이들의 혼합 용매 중, 탄산칼륨, 탄산나트륨, 탄산리튬, 탄산세슘 등의 염기 및 화합물 R3-L(L은 할로겐, OMs 등의 탈리기)을 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 bd를 얻을 수 있다.
제4 공정
제1 공정과 마찬가지의 방법에 의해, 화합물 de를 얻을 수 있다.
제5 공정
제2 공정과 마찬가지의 방법에 의해, 화합물 df를 얻을 수 있다.
제6 공정
제3 공정과 마찬가지의 방법에 의해, 화합물 df를 얻을 수 있다.
제7 공정
화합물 df를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 dg를 얻을 수 있다.
참고예 화합물 ec의 합성(참조: 참고예 48)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ea에, THF, 디옥산, 디클로로메탄, 톨루엔 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리에틸아민, N-메틸모르폴린, 디이소프로필에틸아민 등의 염기 및 클로로포름산에틸을 가한다. 여기에 수소화붕소나트륨 등의 환원력이 낮은 환원제를 가하고, -20℃ 내지 60℃, 바람직하게는 -10℃ 내지 20℃에서 0.2시간 내지 12시간, 바람직하게는 0.5시간 내지 6시간 반응시킴으로써, 화합물 eb를 얻을 수 있다.
제2 공정
화합물 eb를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 ec를 얻을 수 있다.
참고예 화합물 fh의 합성(참조: 참고예 50)
(식에서, R1은 항목 1의 R1a에 대응하는 기이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 fa에, THF, 디클로로메탄, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 화합물 fb 및 트리페닐포스핀을 가한다. 여기에 DIAD를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 fc를 얻을 수 있다.
제2 공정
화합물 fc에, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 탄산칼륨, 탄산나트륨, 탄산리튬, 탄산세슘 등의 염기, 및 벤젠티올 등의 티올을 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 fd를 얻을 수 있다.
제3 공정
화합물 fd에 DMF, THF, 디클로로메탄, 아세토니트릴 등의 용매 중, 디시클로헥실카르보디이미드, 카르보닐디이미다졸, 디시클로헥실카르보디이미드-N-히드록시벤조트리아졸, 4-(4,6-디메톡시-1,3,5-트리아진-2-일)-4-메틸모르폴리늄클로라이드, 헥사플루오로인산 2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄, WSC·HCl 등의 탈수 축합제 존재하에, 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 fe를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 1시간 내지 48시간, 바람직하게는 2시간 내지 24시간 반응시킴으로써, 화합물 ff를 얻을 수 있다.
제4 공정
화합물 ff에 대하여, 아미노기 상의 P2기에 대해 공지된 일반적인 탈보호 반응을 시키고, 계속해서, 물, 에탄올, 메탄올, 아세토니트릴 등의 용매 중 또는 이들의 혼합 용매 중, 탄산나트륨 수용액, 탄산칼륨 수용액 등의 염기를 가하고 20℃ 내지 80℃, 바람직하게는 20℃ 내지 70℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 fd를 얻을 수 있다.
제5 공정
화합물 fg를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 fh를 얻을 수 있다.
참고예 화합물 ga의 합성(참조: 참고예 51)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 dd를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 ga를 얻을 수 있다.
참고예 화합물 hh의 합성(참조: 참고예 52)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ha에 DMF, THF, 디클로로메탄, 아세토니트릴 등의 용매 중, 디시클로헥실카르보디이미드, 카르보닐디이미다졸, 디시클로헥실카르보디이미드-N-히드록시벤조트리아졸, 4-(4,6-디메톡시-1,3,5-트리아진-2-일)-4-메틸모르폴리늄클로라이드, 헥사플루오로인산 2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄, WSC·HCl, HATU 등의 탈수 축합제 존재하에, O,N-디메틸히드록실아민염산염을 가하고, 트리에틸아민, 디이소프로필에틸아민, N-메틸모르폴린 등의 3급 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 hb를 얻을 수 있다.
제2 공정
화합물 hb에 THF, 에테르, 디클로로메탄, 디옥산 등의 용매의 존재하 또는 이들의 혼합 용매 중, -80℃ 내지 -40℃에서 그리냐르시약(R-MgBr)을 가하고, -80℃ 내지 0℃, 바람직하게는 -60℃ 내지 -20℃에서 0.5시간 내지 24시간, 바람직하게는 0.5시간 내지 6시간 반응시킴으로써, 화합물 hc를 얻을 수 있다.
제3 공정
화합물 hc에, 클로로포름, 디클로로메탄 용매의 존재하에 mCPBA를 가하고, -20℃ 내지 30℃, 바람직하게는 10℃ 내지 30℃에서 0.1시간 내지 12시간, 바람직하게는 0.5시간 내지 6시간 반응시킴으로써, 화합물 hd를 얻을 수 있다.
제4 공정
화합물 hd에, 에탄올 등의 용매의 존재하에 수산화나트륨 수용액을 가하고, 0℃ 내지 120℃, 바람직하게는 30℃ 내지 90℃에서 1분간 내지 10시간, 바람직하게는 30분간 내지 120분간 반응시킴으로써, 화합물 he를 얻을 수 있다.
제5 공정
화합물 he를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 hf를 얻을 수 있다.
제6 공정
화합물 he에, 클로로포름, 디클로로메탄, THF, 톨루엔 등의 용매의 존재하 또는 이들의 혼합 용매 중, 목적으로 하는 화합물에 대응하는 화합물 R-Br 등을 가하고, 수소화나트륨, 나트륨메틸레이트, n-부틸리튬 등의 금속 염기를 가하고, -20℃ 내지 120℃, 바람직하게는 0℃ 내지 30℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 hg를 얻을 수 있다.
제7 공정
화합물 hg를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 hh를 얻을 수 있다.
참고예 화합물 ic의 합성(참조: 참고예 53)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ia에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리에틸아민, 디이소프로필에틸아민, N-메틸모르폴린 등의 3급 아민, 및 클로로탄산에틸, 클로로포름산에틸 등의 클로르화 시약을 가하고, 0℃ 내지 30℃에서 0.1시간 내지 1시간 교반한다. 여기에, 목적물에 대응하는 화합물 R-SO2-NH2(예: 메탄술포닐아미드) 및 DMAP를 가하고, 40℃ 내지 100℃, 바람직하게는 40℃ 내지 80℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 ib를 얻을 수 있다.
제2 공정
화합물 ib를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 ic를 얻을 수 있다.
참고예 화합물 je의 합성(참조: 참고예 54)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ja에, THF, 디옥산, 디클로로메탄, 톨루엔, DMF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리에틸아민, N-메틸모르폴린, 디이소프로필에틸아민 등의 3급 아민 및 클로로포름산에틸 또는 클로로탄산에틸을 가한다. 여기에 수소화붕소나트륨 등의 반응성이 낮은 환원제를 가하고, -20℃ 내지 40℃, 바람직하게는 -10℃ 내지 20℃에서 0.2시간 내지 12시간, 바람직하게는 0.5시간 내지 6시간 반응시킴으로써, 알코올 중간체를 얻는다. 이 중간체를 디클로로메탄, 클로로포름 등에 용해하고, TEMPO, 이산화망간, PDC 등의 산화제를 가하고, -40℃ 내지 30℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 jb를 얻을 수 있다.
제2 공정
화합물 jb에, THF, 디옥산, 디클로로메탄 등의 용매의 존재하에 28% 암모니아수 및 요오드를 가하고, 0℃ 내지 40℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 jc를 얻을 수 있다.
제3 공정
화합물 jc에, 톨루엔, 크실렌, THF, 디옥산 등의 용매의 존재하 또는 이들의 혼합 용매 중, 아지드화나트륨 및 트리에틸아민, 디이소프로필에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 jd를 얻을 수 있다.
제4 공정
화합물 jd를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 je를 얻을 수 있다.
참고예 화합물 kd 및 kf의 합성(참조: 참고예 56 및 그의 유도체)
(식에서, Rm은 저급 알킬이고, R은 목적 화합물에 대응하는 치환기이고, W는 -C(=O)- 또는 -SO2-이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ka에, THF, 디옥산, 디클로로메탄, 톨루엔, DMF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 트리에틸아민, N-메틸모르폴린, 디이소프로필에틸아민 등의 3급 아민 및 클로로포름산에틸 또는 클로로탄산에틸을 가한다. 여기에 아지드화나트륨을 가하고, 0℃ 내지 40℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킨다. 그 후, 알코올(Rm-OH)을 가하고, 20℃ 내지 60℃, 바람직하게는 20℃ 내지 50℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 kb를 얻을 수 있다.
제2 공정
화합물 kb에, 에탄올, 메탄올, 물 등의 용매 중 또는 이들의 혼합 용매 중, 수산화나트륨 수용액, 수산화칼륨 수용액 등의 염기를 가하고, 20℃ 내지 80℃, 바람직하게는 40℃ 내지 60℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 kc를 얻을 수 있다.
제3 공정
화합물 kc를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 kd를 얻을 수 있다.
제4 공정
화합물 kc에, THF, 디옥산, 톨루엔, 디클로로메탄 등의 용매 중, 목적물에 대응하는 산클로라이드(R-CO-Cl) 또는 술포닐클로라이드(R-SO2-Cl)를 가하고, 필요에 따라서 피리딘, 트리에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, -20℃ 내지 40℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 ke를 얻을 수 있다.
제5 공정
화합물 ke를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 kf를 얻을 수 있다.
참고예 화합물 lc의 합성(참조: 참고예 60)
(식에서, R은 목적 화합물에 대응하는 치환기이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 la에, THF, 디클로로메탄, DMF 등의 용매 중, 수소화나트륨을 가한다. 여기에 목적물에 대응하는 R-L(L은 할로겐, OMs 등의 탈리기)을 가하고, -20℃ 내지 40℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 lb를 얻을 수 있다.
또는, 화합물 la에, 포름산 용매 중, 포름알데히드를 가하고, 70℃ 내지 110℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 lb를 얻을 수 있다.
제2 공정
화합물 lb를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 lc를 얻을 수 있다.
참고예 화합물 md의 합성(참조: 참고예 61)
(식에서, R은 목적 화합물에 대응하는 치환기이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ma에, THF, 디옥산, 아세토니트릴, 물 등의 용매 중 또는 이들의 혼합 용매 중, Boc2O 등을 가하여 아민 보호 반응을 시킴으로써, 아미노 보호체 mb를 얻을 수 있다.
제2 공정
화합물 mb에, THF, 디클로로메탄, DMF 등의 용매 중, 수소화나트륨을 가한다. 여기에 목적물에 대응하는 R-L(L은 할로겐, OMs 등의 탈리기)을 가하고, -20℃ 내지 40℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 mc를 얻을 수 있다.
제3 공정
화합물 mc를 공지된 일반적인 아미노기 및 히드록실기의 탈보호 반응을 시킴으로써, 화합물 md를 얻을 수 있다.
참고예 화합물 nc 및 화합물 ne의 합성(참조: 참고예 63 및 64)
(식에서, X는 할로겐이고, M은 B(O-페닐)3 등의 보론산에스테르이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 na에, 디클로로메탄, 톨루엔, THF, 디옥산 등의 용매 중, 할로겐화시약(예를 들면, NBS, NCS, 브롬 등)을 가하고, 과열 환류 조건하에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 nb를 얻을 수 있다.
제2 공정
화합물 nb를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 nc를 얻을 수 있다.
제3 공정
화합물 nb에, 톨루엔, THF, DMF 등의 용매 중 또는 이들의 혼합 용매 중, 목적물에 대응하는 보론산에스테르(R-M)를 가하고, 탄산칼륨, 탄산나트륨, 수산화나트륨 등의 염기를 가한다. 여기에 질소 기류하에, 0가 팔라듐 촉매(예: Pd(PPh3)4)를 가하고, 60℃ 내지 120℃, 바람직하게는 80℃ 내지 110℃에서 1시간 내지 48시간, 바람직하게는 2시간 내지 24시간 반응시킴으로써, 화합물 nd를 얻을 수 있다.
제4 공정
화합물 nd를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 ne를 얻을 수 있다.
참고예 화합물 oh의 합성(참조: 참고예 65)
(식에서, R은 저급 알킬 등의 카르복실 보호기이고, R7은 항목 1의 R7a와 동일한 의미이고, L1은 할로겐, OMs, OTs 등의 탈리기이고, 그 밖의 기호는 상기와 동일한 의미임)
제1 공정
화합물 oa에, THF, 디옥산, 디클로로메탄, 아세토니트릴 등의 용매의 존재하에, 아염소산나트륨 및 아미도황산을 가하고, 0℃ 내지 40℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 ob를 얻을 수 있다.
제2 공정
화합물 ob에, DMF, DMA, NMP, THF 등의 용매의 존재하에, HATU, WSC·HCl 등의 축합제를 가하고, 목적물에 대응하는 아민(R3-NH2), 및 트리에틸아민, N-메틸모르폴린, 피리딘 등의 3급 아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 oc를 얻을 수 있다.
제3 공정
화합물 oc에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 탄산칼륨, 탄산나트륨, O-(2,4-디니트로페닐)히드록실아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 od를 얻을 수 있다.
제4 공정
화합물 od에, 톨루엔, DMF, DMA, NMP, THF 등의 용매의 존재하에, R5-C(=O)-R6 및 아세트산을 가하고, 60℃ 내지 120℃, 바람직하게는 80℃ 내지 110℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 oe를 얻을 수 있다.
제5 공정
화합물 oe에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 목적물에 대응하는 화합물 R7-L1, 및 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 of를 얻을 수 있다.
제6 공정
화합물 of를 공지된 일반적인 카르복실기의 탈보호 반응을 시킴으로써, 화합물 og를 얻을 수 있다.
제7 공정
화합물 og를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 oh를 얻을 수 있다.
참고예 화합물 pg의 합성(참조: 참고예 95)
(식에서, 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 pa에 암모니아수를 가하고, 0℃ 내지 30℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 pb를 얻을 수 있다.
제2 공정
화합물 pb에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, HATU, WSC·HCl 등의 축합제를 가하고, 목적물에 대응하는 아민(R3-NH2), 및 필요에 따라서 트리에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 pc를 얻을 수 있다.
제3 공정
화합물 pc에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 탄산칼륨, 탄산나트륨, O-(2,4-디니트로페닐)히드록실아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 pd를 얻을 수 있다.
제4 공정
화합물 pd에, 톨루엔, DMF, DMA, NMP, THF 등의 용매의 존재하에, R5-C(=O)-R6 및 아세트산을 가하고, 60℃ 내지 120℃, 바람직하게는 80℃ 내지 110℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 pe를 얻을 수 있다.
제5 공정
화합물 pe에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 목적물에 대응하는 화합물 R7-L1, 및 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 pf를 얻을 수 있다.
제6 공정
화합물 pf를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 pg를 얻을 수 있다.
참고예 화합물 qg, 화합물 qi 및 화합물 qk의 합성(참조: 참고예 128)
(식에서, R은 카르복실 보호기를 나타내고, n은 0 내지 6의 정수를 나타내고, RZ7 및 RZ8은 항목 1의 RC7 및 RC8과 동일한 의미이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 qa에, 피리딘, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, HATU, WSC·HCl 등의 축합제를 가하고, 화합물 qb 및 필요에 따라서 트리에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 qc를 얻을 수 있다.
제2 공정
화합물 qc에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 탄산칼륨, 탄산나트륨, O-(2,4-디니트로페닐)히드록실아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 qd를 얻을 수 있다.
제3 공정
화합물 qd에, 톨루엔, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, R5-C(=O)-R6 및 아세트산을 가하고, 60℃ 내지 120℃, 바람직하게는 80℃ 내지 110℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 pe를 얻을 수 있다.
또는, 에탄올, 이소프로필알코올 등의 용매 중, 마이크로웨이브 조사 조건하에서, 100℃ 내지 200℃에서 5분간 내지 1시간 반응시킴으로써, 화합물 qe를 얻을 수 있다.
제4 공정
화합물 qe에, DMF, DMA, NMP 등의 용매의 존재하 또는 이들의 혼합 용매 중, 목적물에 대응하는 화합물 R7-L1, 및 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 qf를 얻을 수 있다.
제5 공정
화합물 qf를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qg를 얻을 수 있다.
제6 공정
화합물 qf를 공지된 일반적인 카르복실기의 탈보호 반응을 시킴으로써, 화합물 qh를 얻을 수 있다.
제7 공정
화합물 qh를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qi를 얻을 수 있다.
제8 공정
화합물 qh에, 피리딘, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, HATU, WSC·HCl 등의 축합제를 가하고, 화합물 HNRZ7RZ8, 및 필요에 따라서 트리에틸아민, 디이소프로필에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 qj를 얻을 수 있다.
제9 공정
화합물 qj를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qk를 얻을 수 있다.
참고예 화합물 qq, 참고예 화합물 qs, 참고예 화합물 qu 및 참고예 화합물 qw의 합성(참조: 참고예 128)
(식에서, RZ2, RZ4, RZ9, RZ10 및 RZ13은 항목 1의 RC2, RC4, RC9, RC10 및 RC13과 동일한 의미이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 qa에, 피리딘, DMF, DMA, NMP 등의 용매의 존재하 또는 이들의 혼합 용매 중, HATU, WSC·HCl 등의 축합제를 가하고, 화합물 ql 및 필요에 따라서 트리에틸아민, 디이소프로필에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 qm을 얻을 수 있다.
제2 공정
화합물 qm에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 탄산칼륨, 탄산나트륨, O-(2,4-디니트로페닐)히드록실아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 qn을 얻을 수 있다.
제3 공정
화합물 qn에, 톨루엔, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, R5-C(=O)-R6 및 아세트산을 가하고, 60℃ 내지 120℃, 바람직하게는 80℃ 내지 110℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 pe를 얻을 수 있다.
또는, 에탄올 등의 용매 중, 마이크로웨이브 조사 조건하에서, 100℃ 내지 200℃에서 5분간 내지 1시간 반응시킴으로써, 화합물 qo를 얻을 수 있다.
제4 공정
화합물 qo에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 목적물에 대응하는 화합물 R7-L1, 및 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 qp를 얻을 수 있다.
제5 공정
화합물 qp를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qq를 얻을 수 있다.
제6 공정
화합물 qp를 공지된 일반적인 아미노기의 탈보호 반응을 시킴으로써, 화합물 qr을 얻을 수 있다.
제7 공정
화합물 qr을 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qs를 얻을 수 있다.
제8 공정
화합물 qr에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 목적물에 대응하는 화합물 RZ10-L1, 및 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 qt를 얻을 수 있다.
제9 공정
화합물 qt를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qu를 얻을 수 있다.
제10 공정
화합물 qr에, THF, 디옥산, 디클로로메탄아세토니트릴 등의 용매의 존재하에, 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가한다. 여기에 목적물에 대응하는 화합물(RZ4COCl, RZ2SO2Cl 또는 RZ13OCOCl)을 천천히 가하고, -20℃ 내지 60℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 qv를 얻을 수 있다.
제11 공정
화합물 qv를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 qw를 얻을 수 있다.
참고예 화합물 rb의 합성(참조: 참고예 155)
(식에서, 각 기호는 상기와 동일한 의미임)
화합물 ra에, DMF, THF, 디클로로메탄, 아세토니트릴 등의 용매 중 또는 이들의 혼합 용매 중, 디시클로헥실카르보디이미드, 카르보닐디이미다졸, 디시클로헥실카르보디이미드-N-히드록시벤조트리아졸, 4-(4,6-디메톡시-1,3,5-트리아진-2-일)-4-메틸모르폴리늄클로라이드, 헥사플루오로인산 2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄, WSC·HCl, HATU 등의 탈수 축합제 존재하에, 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 R3NH2를 가하고, -20℃ 내지 60℃, 바람직하게는 -10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 rb를 얻을 수 있다.
또는, 화합물 ra를 THF, 디옥산, 디클로로메탄, DMF 등의 용매의 존재하에, 피리딘, 트리에틸아민, 디이소프로필에틸아민, 1-메틸이미다졸 등의 염기의 존재하 또는 비존재하에, 디페닐클로로포스페이트, 염화티오닐, 염화옥살릴 등의 아실화 시약을 가함으로써 산클로라이드를 생성시키고, 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 R3-NH2를 가하고, -20℃ 내지 60℃, 바람직하게는 -10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 rb를 얻을 수 있다.
참고예 화합물 sl의 합성(참조: 참고예 49)
(식에서, P3은 아미노 보호기이고, Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 방법으로 보호 및/또는 탈보호할 수 있는 기이면 되고, 예를 들면 P3은 아릴 저급 알킬옥시카르보닐, 저급 알킬카르보닐 등이다. B는 항목 1의 치환기군 D와 동일한 의미이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 sa에, 디클로로메탄, THF, 디옥산, 톨루엔 등의 용매의 존재하에, 데스 마틴(Dess Martin) 퍼아이오디난, 이산화망간, PDC 등의 산화 시약을 가하고, -20℃ 내지 60℃, 바람직하게는 0℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 sb를 얻을 수 있다.
제2 공정
화합물 sb에, 톨루엔, THF 등의 용매의 존재하 또는 비존재하에, 황산나트륨 및 목적물에 대응하는 아미노알코올 sc를 가하고, 0℃ 내지 80℃, 바람직하게는 20℃ 내지 60℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 sd를 얻을 수 있다.
제3 공정
화합물 sd를 공지된 일반적인 아미노기의 탈보호 반응을 시킴으로써, 화합물 se를 얻을 수 있다.
제4 공정
화합물 se에, 톨루엔, THF, 디옥산 등의 용매의 존재하에 화합물 sf를 가하고, 40℃ 내지 110℃, 바람직하게는 60℃ 내지 100℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 sg를 얻을 수 있다.
제5 공정
화합물 sg를 공지된 일반적인 아미노기의 탈보호 반응을 시킨 후, 톨루엔, THF, 디옥산 등의 용매의 존재하에, 40℃ 내지 110℃, 바람직하게는 60℃ 내지 100℃에서 0.1시간 내지 12시간, 바람직하게는 0.2시간 내지 6시간 반응시킴으로써, 화합물 sh를 얻을 수 있다.
제6 공정
화합물 sh를 공지된 일반적인 카르복실기의 탈보호 반응을 시킴으로써, 화합물 si를 얻을 수 있다.
제7 공정
화합물 si를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 sj를 얻을 수 있다.
제8 공정
화합물 si를 디페닐에테르 등의 용매 중, 마이크로웨이브 조사하에서 1분간 내지 2시간 반응시킴으로써, 탈탄산된 화합물 sk를 얻을 수 있다.
제9 공정
화합물 sk를 공지된 일반적인 히드록실기의 탈보호 반응을 시킴으로써, 화합물 sl을 얻을 수 있다.
참고예 화합물 un의 합성(참조: 참고예 177)
(식에서, L1은 할로겐, OMs, OTs 등의 탈리기를 나타내고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 ua에 2급 아미노기의 보호 반응을 시킴으로써, 화합물 ub를 얻을 수 있다.
제2 공정
화합물 ub에 일반적인 아미노기의 보호 반응을 시킴으로써, 화합물 uc를 얻을 수 있다.
제3 공정
화합물 uc에, DMF, DMA, NMP 등의 용매 및 NaH 등의 염기의 존재하에, 목적으로 하는 화합물에 대응하는 화합물 R7-L1을 가하고, 0℃ 내지 80℃, 바람직하게는 20℃ 내지 60℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 ue를 얻을 수 있다.
제4 공정, 제5 공정
(식에서, R3 및 R7은 인접해서 결합하고 있을 수도 있고, 이 경우, 제4 공정 및 제5 공정은 동시에 행함)
화합물 ud에, DMF, DMA, NMP 등의 용매 및 NaH 등의 염기의 존재하에, 목적으로 하는 화합물에 대응하는 화합물 R3-L1 및 R7-L1을 순차 반응시킴으로써 화합물 ue를 얻을 수 있다.
제6 공정
화합물 uf에 2급 아미노기의 보호 반응을 시킴으로써, 화합물 ug를 얻을 수 있다.
제7 공정
화합물 ug에 2급 아미노기의 보호 반응을 시킴으로써, 화합물 uh를 얻을 수 있다.
제8 공정
화합물 uh에, DMF, DMA, NMP, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, NaH 등의 염기를 가하고, 목적으로 하는 화합물에 대응하는 화합물 R3-L1을 반응시킴으로써 화합물 ue를 얻을 수 있다.
제9 공정
화합물 ue에 일반적인 2급 아민의 탈보호 반응을 시킴으로써, 화합물 uj를 얻을 수 있다.
제10 공정
화합물 uk에, DMF, DMA, THF 등의 용매의 존재하에, HATU, WSC·HCl 등의 축합제를 가하고, 목적물에 대응하는 아민 uj, 및 피리딘, 트리에틸아민, N-메틸모르폴린 등의 3급 아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 ul을 얻을 수 있다.
제11 공정
화합물 ul에 일반적인 아미노기의 보호 반응을 시킴으로써, 화합물 um을 얻을 수 있다.
제12 공정
화합물 um에, 톨루엔, DMF, DMA, NMP 등의 용매의 존재하에, R5-C(=O)-R6, 트리에틸아민, 디이소프로필에틸아민, N-메틸모르폴린 등의 3급 아민 및 아세트산을 가하고, 60℃ 내지 120℃, 바람직하게는 80℃ 내지 100℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 un을 얻을 수 있다.
참고예 화합물 te의 합성
(식에서, R'는 Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 방법으로 보호 및/또는 탈보호할 수 있는 기이면 되고, 예를 들면 R'는 저급 알킬 등이다. X는 할로겐이고, 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
나트륨 tert-펜톡시드, n-부틸리튬, tert-부틸리튬 등의 유기 금속 염기에, THF, 에테르, 디클로로메탄, DMI, DMF, DMA 등의 용매 중 또는 이들의 혼합 용액 중, 목적물에 대응하는 알코올(P1-OH)을 가한다. 여기에 화합물 ta의 용액을 적하하고, -20℃ 내지 40℃, 바람직하게는 0℃ 내지 30℃에서 0.1시간 내지 12시간, 바람직하게는 0.5시간 내지 6시간 반응시킴으로써, 화합물 tb를 얻을 수 있다.
제2 공정
화합물 tb에, THF, 디옥산, 톨루엔, 아세트산에틸 등의 용매 중 또는 이들의 혼합 용매 중, 또는 무용매에서 N,N-디메틸포름아미드디메틸아세탈을 가하고, 0℃ 내지 80℃, 바람직하게는 20℃ 내지 40℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 tc를 얻을 수 있다.
제3 공정
나트륨 tert-펜톡시드, n-부틸리튬, tert-부틸리튬, 나트륨 메톡시드, 나트륨 에톡시드, 나트륨 tert-부톡시드, 칼륨 tert-부톡시드 등의 유기 금속 염기에, THF, 에테르, DMI, 메탄올, 에탄올 등의 용매 중 또는 이들 혼합 용매 중, 목적물에 대응하는 화합물 td를 가한다. 여기에 화합물 tc의 용액을 적하하여, -20℃ 내지 60℃, 바람직하게는 0℃ 내지 30℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시키고, 그 후 염산, 황산 등의 산을 가하고 -20℃ 내지 60℃, 바람직하게는 0℃ 내지 30℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 te를 얻을 수 있다.
참고예 화합물 tm 및 참고예 화합물 tp의 합성(참조: 참고예 165 및 169)
(식에서, RP는 Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 방법으로 보호 및/또는 탈보호할 수 있는 아세탈 보호기이면 되고, 예를 들면 RP는 저급 알킬 등이다. 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 te와 마찬가지의 방법으로 합성할 수 있는 화합물 tf에, 에탄올, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 알릴아민을 가하고, 0℃ 내지 80℃, 바람직하게는 20℃ 내지 60℃에서 0.5시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 th를 얻을 수 있다.
제2 공정
화합물 tf에, 에탄올, THF, 디옥산, 아세토니트릴 등의 용매의 존재하 또는 이들의 혼합 용매 중, 화합물 tg를 가하고, 0℃ 내지 80℃, 바람직하게는 20℃ 내지 60℃에서 0.5시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 ti를 얻을 수 있다.
제3 공정
화합물 th에, THF, 아세트산에틸, 디옥산 등의 용매의 존재하 또는 이들의 혼합 용매 중, 오스뮴산칼륨 2수화물, 과요오드산나트륨 및 물을 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 tj를 얻을 수 있다.
또는, 화합물 th에, THF, 아세트산에틸, 디옥산 등의 용매의 존재하 또는 이들의 혼합 용매 중, 오존을 -10℃ 내지 20℃에서 도입하고, 반응 종료 후 계속해서 아연-아세트산, (EtO)3P, 또는 디메틸술피드를 가함으로써, 화합물 tj를 얻을 수 있다.
제4 공정
화합물 ti에, 아세톤, 아세토니트릴, 에탄올, 물 등의 용매 중 또는 이들의 혼합 용매 중, 포름산, 트리플루오로아세트산, 파라톨루엔술폰산 등의 산을 가하거나 또는 포름산 용매 중 황산을 가하고, 0℃ 내지 90℃, 바람직하게는 20℃ 내지 80℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 tk를 얻을 수 있다.
제5 공정
화합물 tj 또는 화합물 tk에, 클로로포름, 디클로로메탄, THF 등의 용매의 존재하에, 화합물 tl 및 아세트산을 가하고, 0℃ 내지 40℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 tm을 얻을 수 있다.
제6 공정
화합물 tj 또는 화합물 tk에, 클로로포름, 디클로로메탄, THF 등의 용매의 존재하에, 화합물 tn 및 아세트산을 가하고, 0℃ 내지 40℃, 바람직하게는 10℃ 내지 30℃에서 0.5시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 to를 얻을 수 있다.
제7 공정
화합물 to에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 목적으로 하는 화합물에 대응하는 화합물 B-L1을 가하고, 0℃ 내지 80℃, 바람직하게는 20℃ 내지 60℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 tp를 얻을 수 있다.
참고예 화합물 vf의 합성(참조: 참고예 583 및 584)
(식에서, Y1은 R3a에 대응하는 치환기이고, Y2는 R11a에 대응하는 치환기이다. 그 밖의 각 기호는 상기와 동일한 의미임)
제1 공정
화합물 va에, DMF, THF, 디클로로메탄, 아세토니트릴 등의 용매 중 또는 이들의 혼합 용매 중, 디시클로헥실카르보디이미드, 카르보닐디이미다졸, 디시클로헥실카르보디이미드-N-히드록시벤조트리아졸, 4-(4,6-디메톡시-1,3,5-트리아진-2-일)-4-메틸모르폴리늄클로라이드, 헥사플루오로인산 2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄, WSC·HCl, HATU 등의 탈수 축합제 존재하에, 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 vb를 가하고, -20℃ 내지 60℃, 바람직하게는 -10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 1시간 내지 12시간 반응시킴으로써, 화합물 vc를 얻을 수 있다.
또는, 화합물 va를 THF, 디옥산, 디클로로메탄, DMF 등의 용매의 존재하에, 피리딘, 트리에틸아민, 디이소프로필에틸아민, 1-메틸이미다졸 등의 염기의 존재하 또는 비존재하에, 디페닐클로로포스페이트, 염화티오닐, 염화옥살릴 등의 아실화 시약을 가함으로써 산클로라이드를 생성시키고, 목적으로 하는 화합물에 대응하는 치환기를 갖는 화합물 vb를 가하고, -20℃ 내지 60℃, 바람직하게는 -10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 vc를 얻을 수 있다.
제2 공정
화합물 vc에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 탄산칼륨, 탄산나트륨, O-(2,4-디니트로페닐)히드록실아민을 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 vd를 얻을 수 있다.
제3 공정
화합물 vd의 아세탈 보호기의 탈보호 반응은 Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 일반적인 방법으로 행할 수 있다. 그 후, 생성된 알데히드기를 분자내 반응시킴으로써, 화합물 ve를 얻을 수 있다.
예를 들면, 화합물 vd에, DMF, 톨루엔, THF 등의 용매의 존재하에, 아세트산 및/또는 파라톨루엔술폰산을 가하고, 10℃ 내지 80℃, 바람직하게는 30℃ 내지 60℃에서 0.5시간 내지 12시간, 바람직하게는 1시간 내지 6시간 반응시킴으로써, 화합물 ve를 얻을 수 있다.
제4 공정
화합물 ve에, DMF, DMA, NMP, THF 등의 용매의 존재하 또는 이들의 혼합 용매 중, 목적물에 대응하는 화합물 R7-L1, 및 탄산나트륨, 탄산칼륨, 탄산세슘 등의 염기를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 48시간, 바람직하게는 1시간 내지 24시간 반응시킴으로써, 화합물 vf를 얻을 수 있다.
참고예 화합물 wd의 합성(참조: 참고예 592 등)
(식에서, 각 기호는 상기와 동일한 의미이고, P1은 Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons) 등에 기재된 방법으로 보호 및/또는 탈보호할 수 있는 기이면 되고, 예를 들면 P1은 아릴알킬 등임)
제1 공정
화합물 wa에, 1,2-디클로로에탄, THF, 디옥산, 클로로포름 등의 용매의 존재하에, 양이온 생성 시약(예; 디클로로아세트산)을 가하고, 목적물에 대응하는 시약인 R7-OH를 가하고, 10℃ 내지 60℃, 바람직하게는 20℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 wb를 얻을 수 있다.
제2 공정
화합물 wb에, DMF, DMA, NMP, THF 등의 용매의 존재하에, 염기(예; 2-tert-부틸이미노 2-디에틸아미노-1,3-디메틸퍼히드로-1,3,2-디아자포스포린)를 가하고, 파라포름알데히드를 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킨다. 다음으로, 탈리 시약(예; 파라톨루엔술포닐클로라이드)을 가하고, 0℃ 내지 60℃, 바람직하게는 10℃ 내지 40℃에서 0.1시간 내지 24시간, 바람직하게는 0.5시간 내지 12시간 반응시킴으로써, 화합물 wc를 얻을 수 있다.
참고예 화합물(친 화합물: 식 II)로부터 실시예 화합물(프로드러그: 식 I)의 합성(참조: 실시예 1, 98, 105, 106, 106, 107, 108, 111, 112, 113, 122, 151, 152, 163, 177, 178, 186, 190, 192, 194, 196, 197, 199, 200, 201 및 203)
(식에서, 각 치환기는 항목 1과 동일한 의미임)
참고예에 나타내어지는 화합물을 원료로 하여, 히드록실기를 에스테르기 또는 에테르기로 변환하는 일반적인 방법에 의해서 실시예 화합물을 얻을 수 있다.
예를 들면, Protective Groups in Organic Synthesis, Theodora W Green(John Wiley & Sons), Prog. Med. 5: 2157-2161(1985), 및 Supplied by The British Library-"The world's Knowledge" 등에 기재된 방법을 이용할 수 있다.
이하에 본 발명의 실시예, 참고예 및 중간체 합성예, 및 시험예를 들어 본 발명을 더 자세히 설명하지만, 본 발명은 이들에 의해 한정되는 것은 아니다.
이하에, 친 화합물인 참고예 화합물 1 내지 775의 구조식 및 합성예를 나타낸다.
참고예 1
제1 공정
화합물 1A(12.8g, 89.4mmol)와 피리딘(8.50g, 107mmol)의 디클로로메탄(90mL) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 벤질옥시아세틸클로라이드(19.8g, 107mmol)의 디클로로메탄(90mL) 용액을 50분에 걸쳐서 적하하였다. 반응액을 동일 온도에서 30분간 교반한 후, 서서히 60분에 걸쳐 15℃로 높이고, 얼음물을 가하였다. 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 3회 수세하고, 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 n-헥산으로 용출하고, 이어서 n-헥산-아세트산에틸(1:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 22.2g의 화합물 1B를 얻었다.
제2 공정
1규정의 리튬헥사메틸디실라잔 THF 용액(4.29ml, 4.29mmol)을 -78℃로 냉각하고, 동일 온도를 유지하면서 화합물 1B(500mg, 1.72mmol)와 신나모일클로라이드(343.2mg, 2.06mmol)의 THF 용액(4ml)을 3분에 걸쳐 적하하였다. 반응액을 동일 온도에서 25분간 교반한 후, 2규정 염산(10ml)을 가하고, 10분간 실온에서 더 교반하였다. 반응 용액에 아세트산에틸을 가하여 유기층을 분리하고, 수층을 아세트산에틸로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. n-헥산-아세트산에틸(1:1, v/v)로 용출하는 분획으로부터 고체로서 364.3mg(수율 56%)의 화합물 1C를 얻었다.
제3 공정
질소 기류하의 화합물 1C와 염화루테늄(2.76mg, 0.0133mmol)의 MeCN(5ml) 용액에 실온하에 과요오드산나트륨(625.8mg, 2.93mmol)과 96% 황산(287.4mg, 2.93mmol)의 수용액(8ml)을 10분에 걸쳐 적하하였다. 반응액을 동일 온도에서 5분간 교반한 후, 아세트산에틸을 가하여 유기층을 분리하고, 수층을 아세트산에틸로 2회 추출하였다. 합친 추출액을 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. n-헥산-아세트산에틸(1:1, v/v)로 용출하는 분획으로부터 유상물로서 303.2mg(수율 75%)의 화합물 1D를 얻었다.
제4 공정
화합물 1D(1.00g, 3.31mmol)의 MeCN(15ml) 용액에 실온하에 96% 황산(421.7mg, 4.30mmol)과 아미도황산(642.7mg, 6.62mmol)의 수용액(10ml)을 가하여 교반하고, 동일 온도를 유지하면서 아염소산나트륨(388.9mg, 4.30mmol)의 수용액(10ml)을 5분에 걸쳐 적하하였다. 반응액을 동일 온도에서 5분간 교반한 후, 포화 식염수를 가하고 아세트산에틸로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-MeOH(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 748.8mg(수율 71%)의 화합물 1E를 얻었다.
제5 공정
화합물 1E(1.00g, 3.14mmol)의 DMF(10ml) 용액에 실온하에 WSC HCl(1.20g, 6.28mmol)과 HOBt(551.6mg, 4.08mmol)를 가하고, 동일 온도에서 90분간 교반하였다. 반응액을 0℃로 냉각하고, 2-메톡시에탄아민(236.0mg, 3.14mmol)의 DMF(2ml) 용액을 3분에 걸쳐 적하하였다. 반응액을 동일 온도에서 1시간 교반하고, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(1:1, v/v)로 용출하고, 이어서 n-헥산-아세트산에틸(1:9, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 928.5mg(수율 79%)의 화합물 1F를 얻었다.
제6 공정
화합물 1F(500mg, 1.33mmol)와 (S)-2-아미노-3-페닐프로판-1-올(604.2mg, 4.0mmol)의 크실렌(2ml) 용액을 120℃로 가열하여 30분간 교반하였다. 반응 용액을 실온까지 냉각하고, 용매를 증류 제거한 후, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-MeOH(9:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 487mg(수율 72%)의 화합물 1G를 얻었다.
제7 공정
화합물 1G(2.86g, 5.63mmol)와 트리페닐포스핀(2.21g, 8.45mmol)의 THF(6ml) 용액에 실온하에 DEAD 40중량% 톨루엔 용액(3.68g, 8.45mmol)을 3분에 걸쳐 적하하였다. 반응액을 동일 온도에서 30분간 교반하고, 용매를 증류 제거한 후, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-MeOH(9:1, v/v)로 용출하는 분획으로부터 유상물로서 1.37g(수율 50%)의 화합물 1H를 얻었다.
제8 공정
화합물 1H(1.0g, 2.04mmol)의 EtOH(6ml) 용액에 2규정 수산화나트륨 수용액(6ml)을 가하고, 실온하에 30분간 교반하였다. 반응액을 2규정 염산으로 중화하고, 석출된 고체를 여과 취출하고 건조하여 754mg(수율 80%)의 화합물 1I를 얻었다.
제9 공정
화합물 1I(1.0g, 2.16mmol)를 THF(10ml)에 용해하고, 10% Pd-C(200mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사를 에테르로 세정하여 512mg(수율 64%)의 화합물 1을 얻었다.
참고예 2
제1 공정
(S)-tert-부틸 3-히드록시-1,1-디페닐프로판-2-일카바메이트(5.00g, 15.3mmol)에 트리플루오로아세트산(40ml)을 가하고, 빙냉하에 1시간 교반하였다. 트리플루오로아세트산을 증류 제거한 후 톨루엔을 가하여 다시 감압증류 제거함으로써 조제의 (S)-2-아미노-3,3-디페닐프로판-1-올을 얻었다. 얻어진 (S)-2-아미노-3,3-디페닐프로판-1-올에 대하여 화합물 1F(5.73g, 15.3mmol), 톨루엔(50ml), 트리에틸아민(6.4ml, 45.8mmol)을 가하여 90℃에서 1시간 교반하고, 실온까지 냉각한 후, 용매를 증류 제거하였다. 얻어진 잔사에 디클로로메탄을 가하고, 2N 염산 수용액, 포화 탄산수소나트륨 수용액, 포화 식염수로 세정하였다. 유기층을 분리한 후, 황산마그네슘을 가한 후 셀라이트 여과하고, 여액을 증류 제거함으로써 물엿 형상의 화합물 2A(9.12g)를 얻었다.
MS: m/z=585.2 [M+H]+.
제2 공정
화합물 2A(8.60g, 14.7mmol)와 트리페닐포스핀(7.72g, 29.4mmol)을 테트라히드로푸란(90ml)에 용해하고, 빙냉하에 디에틸아조디카르복실레이트 2.2M 톨루엔 용액(10.0ml, 22.0mmol)을 적하하였다. 빙냉하에 2시간, 실온하에 18시간 교반한 후, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제를 행하여 거품상의 화합물 2B(3.88g, 6.85mmol)를 얻었다.
제3 공정
화합물 2B(3.4g, 6.0mmol)에 에탄올(36ml), 물(12ml), 2N 수산화나트륨 수용액(4.5ml, 9.0mmol)을 가하고, 실온하에 40분 교반한 후, 에탄올(10ml), 물(10ml)을 가하여 30분간 더 교반하였다. 에탄올을 증류 제거하고, 아세트산에틸, 물을 가하여 격렬하게 교반한 후, 분리하였다. 아세트산에틸층을 2N 수산화나트륨으로 3회 세정하고, 수층을 하나로 합쳤다. 수층에 아세트산에틸을 가하고, 2N 염산을 이용하여 중화하고, 격렬하게 교반한 후, 아세트산에틸층을 분리하였다. 아세트산에틸층에 황산마그네슘을 가하고, 셀라이트 여과하고, 여액을 증류 제거하였다. 얻어진 잔사를 MeOH에 용해하여 증류 제거함으로써 화합물 2C(3.0g, 5.64mmol)의 고체를 얻었다.
제4 공정
화합물 2C(1.50g, 2.79mmol)에 메탄올(22ml), 10% 팔라듐탄소-50% 습윤(150mg)를 가하고, 수소 분위기하에 1시간 교반하였다. 아세트산에틸(44ml)을 가하고, 셀라이트 여과하고, 여액을 증류 제거하였다. 얻어진 잔사를 메탄올(20ml)에 용해하고, 물(10ml)을 가하여 메탄올을 증류 제거하였다. 석출물을 여과 취출, 건조하여 화합물 2(1.15g, 2.56mmol)를 얻었다.
참고예 3
참고예 2에 따라서, 화합물 3을 마찬가지의 수법에 의해 합성하였다.
참고예 4
참고예 2에 따라서, 화합물 4를 마찬가지의 수법에 의해 합성하였다.
참고예 5
참고예 2에 따라서, 화합물 5를 마찬가지의 수법에 의해 합성하였다.
참고예 6
참고예 2에 따라서, 화합물 6을 마찬가지의 수법에 의해 합성하였다.
참고예 7
참고예 2에 따라서, 화합물 7을 마찬가지의 수법에 의해 합성하였다.
참고예 8
참고예 2에 따라서, 화합물 8을 마찬가지의 수법에 의해 합성하였다.
참고예 9
참고예 2에 따라서, 화합물 9를 마찬가지의 수법에 의해 합성하였다.
참고예 10
참고예 2에 따라서, 화합물 10을 마찬가지의 수법에 의해 합성하였다.
참고예 11
참고예 2에 따라서, 화합물 11을 마찬가지의 수법에 의해 합성하였다.
참고예 12
제1 공정
화합물 12A(1.53g, 5.80mmol)를 THF(6ml)와 물(6ml)에 용해하고, 탄산칼륨(2.41g, 17.4mmol)을 가해서 교반해 두고, 0℃에서 벤질클로로포르메이트(1.09g, 6.38mmol)를 적하하였다. 0℃에서 10분 교반한 후, 실온에서 2시간 교반하였다. 반응액을 중조수에 옮기고, 아세트산에틸로 추출하였다. 추출액을 1규정 염산과 포화 식염수로 세정한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하여 무색 고무상 물질로서 2.32g의 화합물 12B를 얻었다.
제2 공정
화합물 12B(1.94g, 5.37mmol)와 트리페닐포스핀(2.11g, 8.05mmol)과 프탈이미드(948mg, 6.44mmol)를 THF(20ml)에 가하고, 디이소프로필 아조디카르복실레이트(톨루엔 중의 2.2M, 3.66ml, 8.05mmol)를 실온에서 적하하였다. 실온에서 4시간 교반한 후, 용매를 감압증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고체로서 2.39g의 화합물 12C를 얻었다.
제3 공정
화합물 12C(2.39g, 4.87mmol)를 THF(20ml)와 메탄올(20ml)에 가하고, 히드라진 수화물(4.88g, 97.4mmol)을 가하고, 50℃에서 4시간 교반하였다. 백색 침전물을 여과해서 제거하고, 메탄올로 세정하였다. 여액을 감압증류 제거한 후, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1, v/v)로 정제하여 무색 고체로서 1.41g의 화합물 12D를 얻었다.
제4 공정
화합물 12D(1.41g, 3.91mmol)를 THF(15ml)에 용해하고, 실온에서 Boc2O(896mg, 4.11mmol)를 가하였다. 1.5시간 교반한 후, 용매를 감압 농축하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고체로서 1.77g의 화합물 12E를 얻었다.
제5 공정
화합물 12E(1.73g, 3.76mmol)와 팔라듐-활성 탄소(10%, 습윤, 200mg)를 메탄올(20ml)에 가하고, 수소 분위기하에 실온에서 1시간 교반하였다. 셀라이트 여과한 후, 용매를 감압 농축하여 무색 오일상 물질 12F를 1.01g 얻었다.
제6 공정
중간체 합성예 1에 나타내어지는 방법으로 얻어진 디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(974mg, 3.06mmol)와 12F(999mg, 3.06mmol)를 톨루엔(10ml)에 가하고, 110℃에서 5시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 98:2, v/v)로 정제하여 담황색 고체로서 1.51g의 화합물 12G를 얻었다.
제7 공정
화합물 12G(1.45g, 2.31mmol)에 4규정 HCl(아세트산에틸 용액, 20ml)을 가하고, 실온에서 1.5시간 교반하였다. 용매를 감압증류 제거한 후, 포화 중조수를 가하고, 실온에서 1.5시간 교반하였다. 클로로포름으로 추출하고 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고체로서 1.01g의 화합물 12H를 얻었다.
제8 공정
화합물 12H(50mg, 0.10mmol)를 DMF(1ml)에 용해하고, 탄산세슘(165mg, 0.50mmol)을 가하였다. 실온에서 30분 교반한 후, 요오드메탄(0.032ml, 0.50mmol)을 가하고 실온에서 3.5시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고체로서 49mg의 화합물 12I를 얻었다.
제9 공정
화합물 12I(49mg, 0.096mmol)를 THF(0.5ml)와 메탄올(0.5ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(0.24ml, 0.48mmol)을 가하고, 그대로 1.5시간 교반하였다. 1규정 염산을 가하고 나서 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 무색 고체로서 54mg의 화합물 12J를 얻었다.
MS: m/z=481 [M+H]+.
제10 공정
제9 공정에서 얻어진 화합물 12J에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 3으로 조절하고, 클로로포름으로 추출하고 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 26mg의 화합물 12를 얻었다.
참고예 13
참고예 12에 따라서, 화합물 13을 마찬가지의 수법에 의해 합성하였다.
참고예 14
참고예 12에 따라서, 화합물 14를 마찬가지의 수법에 의해 합성하였다.
참고예 15
참고예 12에 따라서, 화합물 15를 마찬가지의 수법에 의해 합성하였다.
참고예 16
참고예 12에 따라서, 화합물 16을 마찬가지의 수법에 의해 합성하였다.
참고예 17
참고예 12에 따라서, 화합물 17을 마찬가지의 수법에 의해 합성하였다.
참고예 18
참고예 12에 따라서, 화합물 18을 마찬가지의 수법에 의해 합성하였다.
참고예 19
참고예 12에 따라서, 화합물 19를 마찬가지의 수법에 의해 합성하였다.
참고예 20
참고예 12에 따라서, 화합물 20을 마찬가지의 수법에 의해 합성하였다.
참고예 21
참고예 12에 따라서, 화합물 21을 마찬가지의 수법에 의해 합성하였다.
참고예 22
참고예 12에 따라서, 화합물 22를 마찬가지의 수법에 의해 합성하였다.
참고예 23
참고예 12에 따라서, 화합물 23을 마찬가지의 수법에 의해 합성하였다.
참고예 24
참고예 12에 따라서, 화합물 24를 마찬가지의 수법에 의해 합성하였다.
참고예 25
참고예 12에 따라서, 화합물 25를 마찬가지의 수법에 의해 합성하였다.
참고예 26
참고예 12에 따라서, 화합물 26을 마찬가지의 수법에 의해 합성하였다.
참고예 27
참고예 12에 따라서, 화합물 27을 마찬가지의 수법에 의해 합성하였다.
참고예 28
제1 공정
화합물 28A(3.20g, 17.1mmol)를 THF(20ml)에 가하고, 트리에틸아민(2.60ml, 18.8mmol)을 가하고 실온에서 10분 교반하였다. Boc2O(4.09g, 18.8mmol)를 실온에서 가한 후, 그대로 2시간 교반하였다. 용매를 감압증류 제거하고, 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하여 무색 고체로서 5.17g의 화합물 28B를 얻었다.
제2 공정
화합물 28B(4.29g, 17.1mmol)와 트리페닐포스핀(5.37g, 20.5mmol)과 프탈이미드(2.76g, 18.8mmol)를 THF(60ml)에 가하고, 디에틸아조디카르복실레이트(톨루엔 중의 2.2M, 11.6ml, 25.6mmol)를 실온에서 적하하였다. 실온에서 1시간 교반한 후, 용매를 감압증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 2:1, v/v)로 정제하여 무색 고체로서 6.13g의 화합물 28C를 얻었다.
제3 공정
화합물 28C(1.00g, 2.63mmol)를 THF(7ml)와 메탄올(7ml)에 가하고, 히드라진 수화물(2.63g, 52.6mmol)을 가하고, 50℃에서 2시간 교반하였다. 백색 침전물을 여과해서 제거하고, 메탄올로 세정하였다. 여과액을 감압증류 제거한 후, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1, v/v)로 정제하여 무색 고체로서 249mg의 화합물 28D를 얻었다.
제4 공정
디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(313mg, 0.983mmol)와 28D(246mg, 0.983mmol)를 톨루엔(3ml)에 가하고, 100℃에서 2.5시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 98:2, v/v)로 정제하여 담황색 고무상 물질로서 320mg의 화합물 28E를 얻었다.
제5 공정
화합물 28E(315mg, 0.572mmol)에 4규정 HCl(아세트산에틸 용액, 5ml)을 가하고, 실온에서 30분 교반하였다. 용매를 감압증류 제거한 후, 포화 중조수를 가하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고체로서 210mg의 화합물 28F를 얻었다.
제6 공정
화합물 28F(50mg, 0.12mmol)를 DMF(1ml)에 용해하고, 탄산세슘(195mg, 0.597mmol)을 가하였다. 실온에서 30분 교반한 후, 요오드에탄(0.048ml, 0.60mmol)을 가하고 실온에서 3.5시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고체로서 47mg의 화합물 28G를 얻었다.
제7 공정
화합물 28G(47mg, 0.11mmol)를 THF(0.5ml)와 메탄올(0.5ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(0.26ml, 0.53mmol)을 가하고, 그대로 1시간 교반하였다. 1규정 염산을 가하고 나서 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 무색 고체로서 40mg의 화합물 28H를 얻었다.
MS: m/z=433 [M+H]+.
제8 공정
제7 공정에서 얻어진 화합물 28H에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 3으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 17mg의 화합물 28을 얻었다.
참고예 29
참고예 28에 따라서, 화합물 29를 마찬가지의 수법에 의해 합성하였다.
참고예 30
참고예 28에 따라서, 화합물 30을 마찬가지의 수법에 의해 합성하였다.
참고예 31
참고예 28에 따라서, 화합물 31을 마찬가지의 수법에 의해 합성하였다.
참고예 32
참고예 28에 따라서, 화합물 32를 마찬가지의 수법에 의해 합성하였다.
참고예 33
참고예 28에 따라서, 화합물 33을 마찬가지의 수법에 의해 합성하였다.
참고예 34
참고예 28에 따라서, 화합물 34를 마찬가지의 수법에 의해 합성하였다.
참고예 35
참고예 28에 따라서, 화합물 35를 마찬가지의 수법에 의해 합성하였다.
참고예 36
제1 공정
화합물 12H(460mg, 0.930mmol)를 THF(2.5ml)와 메탄올(2.5ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(2.33ml, 4.65mmol)을 가하고, 그대로 1.5시간 교반하였다. 1규정 염산을 가하고 나서 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 무색 고체로서 405mg의 화합물 36A를 얻었다.
제2 공정
화합물 36A(402mg, 0.837mmol)를 디페닐에테르(5ml)에 가하고, 마이크로웨이브 조사하에 245℃에서 1시간 교반하였다. 반응액을 n-헥산에 옮기고, 석출된 고체를 여과 취출하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1, v/v)로 정제하여 무색 고체로서 164mg의 화합물 36B를 얻었다.
제3 공정
화합물 36B(40mg, 0.092mmol)를 DMF(1ml)에 용해하고, 탄산세슘(179mg, 0.55mmol)을 가하였다. 실온에서 30분 교반한 후, 요오드메탄(0.029ml, 0.46mmol)을 가하고 실온에서 3.5시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고무상 물질로서 44mg의 화합물 36C를 얻었다.
제4 공정
제3 공정에서 얻어진 화합물 36C에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 24mg의 화합물 36을 얻었다.
참고예 37
참고예 36에 따라서, 화합물 37을 마찬가지의 수법에 의해 합성하였다.
참고예 38
참고예 36에 따라서, 화합물 38을 마찬가지의 수법에 의해 합성하였다.
참고예 39
참고예 36에 따라서, 화합물 39를 마찬가지의 수법에 의해 합성하였다.
참고예 40
참고예 36에 따라서, 화합물 40을 마찬가지의 수법에 의해 합성하였다.
참고예 41
제1 공정
참고예 12에 준하여 합성된 화합물 41A(290mg, 0.555mmol)를 디페닐에테르(5ml)에 가하고, 마이크로웨이브 조사하에 245℃에서 1시간 교반하였다. 반응액을 n-헥산에 옮기고, 석출된 고체를 여과 취출하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1→97:3, v/v)로 정제하여 무색 고체로서 86mg의 화합물 41B를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 41B에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 45mg의 화합물 41을 얻었다.
참고예 42
참고예 41에 따라서, 화합물 42를 마찬가지의 수법에 의해 합성하였다.
참고예 43
제1 공정
화합물 43A(2.00g, 6.11mmol)와 트리페닐포스핀(2.40g, 9.16mmol)과 프탈이미드(1.08g, 7.33mmol)를 THF(20ml)에 가하고, 디에틸아조디카르복실레이트(톨루엔 중의 2.2M, 4.16ml, 9.16mmol)를 실온에서 적하하였다. 실온에서 3시간 교반한 후, 용매를 감압증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고체로서 2.39g의 화합물 43B를 얻었다.
제2 공정
화합물 43B(2.06g, 4.51mmol)를 THF(20ml)와 메탄올(20ml)에 가하고, 히드라진 수화물(4.52g, 90.2mmol)을 가하고, 60℃에서 5시간 교반하였다. 백색 침전물을 여과해서 제거하고, 메탄올로 세정하였다. 여액을 감압증류 제거한 후, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1, v/v)로 정제하고, n-헥산을 가해서 석출된 고체를 여과 취출하여 무색 고체로서 1.25g의 화합물 43C를 얻었다.
제3 공정
디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(488mg, 1.53mmol)와 43C(500mg, 1.53mmol)를 톨루엔(8ml)에 가하고, 110℃에서 1시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→96:4→94:6, v/v)로 정제하여 담황색 고무상 물질로서 667mg의 화합물 43D를 얻었다.
제4 공정
화합물 43D(664mg, 1.06mmol)에 4규정 HCl(아세트산에틸 용액, 10ml)을 가하고, 실온에서 1시간 교반하였다. 용매를 감압증류 제거한 후, THF와 포화 중조수를 가하고 2.5시간 교반하였다. 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 458mg의 화합물 43E를 얻었다.
제5 공정
화합물 43E(50mg, 0.10mmol)를 DMF(1ml)에 용해하고, 탄산세슘(165mg, 0.51mmol)을 가하였다. 실온에서 30분 교반한 후, 요오드메탄(0.025ml, 0.40mmol)을 가하고, 실온에서 1시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v)로 정제하여 무색 고체로서 60mg의 화합물 43F를 얻었다.
제6 공정
제5 공정에서 얻어진 화합물 43F를 THF(0.5ml)와 메탄올(0.5ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(0.25ml, 0.50mmol)을 가하고, 그대로 1시간 교반하였다. 1규정 염산을 가하고 나서 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 무색 고무상의 화합물 43G를 얻었다.
제7 공정
제6 공정에서 얻어진 화합물 43G에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 3으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 27mg의 화합물 43을 얻었다.
참고예 44
참고예 43에 따라서, 화합물 44를 마찬가지의 수법에 의해 합성하였다.
참고예 45
참고예 43에 따라서, 화합물 45를 마찬가지의 수법에 의해 합성하였다.
참고예 46
제1 공정
참고예 35에서 얻어진 화합물 43E(289mg, 0.584mmol)를 THF(3ml)와 메탄올(3ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(1.46ml, 2.92mmol)을 가하고, 그대로 1.5시간 교반하였다. 1규정 염산을 가하고 나서 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 무색 고체로서 342mg의 화합물 46A를 얻었다.
제2 공정
화합물 46A(402mg, 0.837mmol)를 디페닐에테르(5ml)에 가하고, 마이크로웨이브 조사하에 245℃에서 1시간 교반하였다. 반응액을 n-헥산에 옮기고, 석출된 고체를 여과 취출하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5→92:8, v/v)로 정제하여 무색 고체로서 85mg의 화합물 46B를 얻었다.
제3 공정
화합물 46B(39mg, 0.089mmol)를 DMF(1ml)에 용해하고, 탄산세슘(145mg, 0.445mmol)을 가하였다. 실온에서 30분 교반한 후, 1-브로모-2-메톡시에탄(0.033ml, 0.36mmol)을 가하고 실온에서 3.5시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5→92:8, v/v)로 정제하여 무색 고무상 물질로서 66mg의 화합물 46C를 얻었다.
제4 공정
제3 공정에서 얻어진 화합물 46C에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 21mg의 화합물 46을 얻었다.
참고예 47
참고예 46에 따라서, 화합물 47을 마찬가지의 수법에 의해 합성하였다.
참고예 48
제1 공정
화합물 41A(400mg, 0.743mmol)를 DMF(5ml)에 용해하고, 트리에틸아민(0.21ml, 1.5mmol)과 에틸클로로포르메이트(0.143ml, 1.49mmol)를 0℃에서 가하고, 그대로 20분 교반하였다. 수소화붕소나트륨(70.2mg, 1.86mmol)을 0℃에서 가하고, 실온에서 30분 교반하였다. 수소화붕소나트륨(70.2mg, 1.86mmol)을 0℃에서 더 가하고, 실온에서 2시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3, v/v)로 정제하여 화합물 48A로서 무색 고체 160mg을 얻었다.
제2 공정
화합물 48A(50mg, 0.095mmol)에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 3.5mg의 화합물 48을 얻었다.
참고예 49
제1 공정
데스-마틴 퍼아이오디난(0.3M, 염화메틸렌 용액, 52.0ml, 15.6mmol)에 화합물 49A(2.97g, 10.4mmol)의 염화메틸렌 용액(20ml)을 0℃에서 적하하였다. 실온에서 3시간 교반한 후, 1규정 수산화나트륨 수용액에 옮기고, 에틸에테르로 추출하였다. 유기층을 1규정 수산화나트륨 수용액과 포화 식염수로 세정하고, 황산마그네슘으로 건조하였다. 용매를 감압증류 제거한 후, 백색 고체로서 화합물 49B를 2.08g 얻었다.
제2 공정
화합물 49B(700mg, 2.47mmol)와 2-아미노에탄올(166mg, 2.72mmol)과 황산나트륨(1.76g, 12.4mmol)을 톨루엔(20ml)에 가하고, 실온에서 1시간 교반하였다. Boc2O(0.631ml, 2.72mmol)를 실온에서 가하고, 그대로 18시간 교반하였다. 반응액을 여과하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고무상 물질로서 49C를 893mg 얻었다.
제3 공정
화합물 49C(890mg, 2.09mmol)와 팔라듐-활성탄소(10%, 습윤, 200mg)를 에탄올(20ml)에 가하고, 수소 분위기하에 실온에서 2시간 교반하였다. 셀라이트 여과한 후, 용매를 감압 농축하여 무색 오일상 물질 49D를 656mg 얻었다.
제4 공정
디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(610mg, 2.09mmol)와 49D(664mg, 2.09mmol)를 톨루엔(6ml)에 가하고, 100℃에서 4시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 담황색 고무상 물질로서 884mg의 화합물 49E를 얻었다.
MS: m/z=593 [M+H]+.
제5 공정
화합물 49E(860mg, 1.45mmol)에 4규정 HCl(아세트산에틸 용액, 10ml)을 가하였다. 실온에서 30분 교반한 후, 용매를 감압증류 제거하였다. 계속해서 톨루엔(10ml)과 2-아미노에탄올(0.175ml, 2.90mmol)을 가하고, 80℃에서 30분 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 99:1→95:5→90:10, v/v)로 정제하여 무색 고무상 물질의 화합물 49F 157mg과 황색 고체의 화합물 49G 217mg을 얻었다.
제6 공정
화합물 49G(214mg, 0.465mmol)를 THF(4ml)와 에탄올(2ml)과 염화메틸렌(2ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(1.16ml, 2.32mmol)을 가하고 그대로 2.5시간 교반하였다. 1규정 염산을 가하고 나서 클로로포름으로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 황색 고체로서 158mg의 화합물 49H를 얻었다.
제7 공정
화합물 49H(50.0mg, 0.112mmol)와 팔라듐-활성탄소(10%, 습윤, 12mg)를 메탄올(1ml)과 DMF(3ml)에 가하고, 수소 분위기하에 실온에서 5시간 교반하였다. 셀라이트 여과한 후, 용매를 감압 농축하고, 클로로포름-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 9.0mg의 화합물 49를 얻었다.
참고예 50
제1 공정
화합물 50A(1.00g, 3.98mmol)와 트리페닐포스핀(1.15g, 4.48mmol)과 N-메틸-2-니트로벤젠술폰아미드(860mg, 3.98mmol)를 THF(10ml)에 가하고, 디에틸아조디카르복실레이트(톨루엔 중의 2.2M, 1.99ml, 4.38mmol)를 실온에서 적하하였다. 실온에서 3시간 교반한 후, 용매를 감압증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고무상 물질로서 710mg의 화합물 50B를 얻었다.
제2 공정
화합물 50B(458mg, 1.02mmol)를 아세토니트릴에 용해하고, 탄산칼륨(422mg, 3.06mmol)과 벤젠티올(0.126ml, 1.22mmol)을 가하고, 실온에서 5시간 교반하였다. 반응액을 1규정 수산화나트륨 수용액에 옮기고, 염화메틸렌으로 추출하고, 황산나트륨으로 건조하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여, 무색 오일상 물질로서 147mg의 화합물 50C를 얻었다.
제3 공정
화합물 50C(140mg, 0.530mmol)와 3-(벤질옥시)-4-옥소-4H-피란-2-카르복실산(WO2006/116764, 119mg, 0.482mmol)을 THF(3ml)에 가하고, 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 하이드로클로라이드(111mg, 0.578mmol)와 1-히드록시벤조트리아졸(65.1mg, 0.482mmol)을 가하고, 실온에서 18시간 교반하였다. 반응액을 중조수에 옮기고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3, v/v)로 정제하여 무색 고체로서 219mg의 화합물 50D를 얻었다.
MS: m/z=493 [M+H]+.
제4 공정
화합물 50D(216mg, 0.439mmol)에 4규정 HCl(아세트산에틸 용액, 3ml)을 가하였다. 실온에서 1시간 교반한 후, 용매를 감압증류 제거하였다. 계속해서 에탄올(4ml)과 포화 탄산나트륨 수용액(3ml)을 가하고, 60℃에서 2시간 교반하였다. 물을 가하고, 아세트산에틸로 추출한 후, 황산나트륨으로 건조하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 담황색 고무상 물질의 화합물 50E 108mg을 얻었다.
제5 공정
화합물 50E(105mg, 0.280mmol)에 트리플루오로아세트산(2ml)을 가하고, 실온에서 30분 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 29mg의 화합물 50을 얻었다.
참고예 51
제1 공정
화합물 1D(60mg, 0.11mmol)를 트리플루오로아세트산(1ml)에 용해하여 실온하에 1시간 교반하였다. 반응액을 증류 제거해서 얻어진 잔사를 LC/MS에 의해 정제하여 화합물 51(43mg, 0.09mmol)을 얻었다.
참고예 52
제1 공정
화합물 1I(2.0g, 4.32mmol)의 DMF(10ml) 용액에 실온하에 WSC HCl(1.24g, 6.49mmol)과 HOBt(876.9mg, 6.49mmol)를 가하고, 동일 온도에서 1시간 교반하였다. 반응액에 O,N-디메틸히드록실아민염산염(842.7mg, 8.64mmol)과 트리에틸아민(2.19g, 21.6mmol)을 가하고, 동일 온도에서 3시간 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(7:3, v/v)로 용출하고, 이어서 아세트산에틸만으로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 543mg(수율 25%)의 화합물 52A를 얻었다.
MS: m/z=506 [M+H]+.
제2 공정
화합물 52A(543mg, 1.07mmol)의 THF(5ml) 용액을 -78℃로 냉각하고, 메틸마그네슘브로마이드 0.97M THF 용액(1.66ml, 1.61mmol)를 가하고, -20℃까지 2시간에 걸쳐서 승온하였다. 반응액에 1규정 염산을 가하고 아세트산에틸로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(7:3, v/v)로 용출하고, 이어서 아세트산에틸만으로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 256.8mg(수율 52%)의 화합물 52B를 얻었다.
제3 공정
화합물 52B(256mg, 0.558mmol)의 디클로로메탄(4ml) 용액에 빙냉하에 mCPBA(144.3mg, 0.836mmol)를 가하고, 실온에서 2시간 교반하였다. 반응액에 티오황산나트륨 수용액을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 포화 중조수로 2회 세정하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 에탄올(4ml)에 용해하고, 2N-수산화나트륨 수용액(1mL)을 가하여 1시간 환류하였다. 용매를 증류 제거한 후, 석출된 고체를 디이소프로필에테르로 세정하여 242mg(수율 100%)의 화합물 52C를 얻었다.
제4 공정
화합물 52C(242mg, 0.558mmol)의 THF(3ml) 용액에 10% Pd-C(50mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 60mg(수율 31%)의 화합물 52를 얻었다.
참고예 53
제1 공정
화합물 1I(1.0mg, 2.23mmol)의 DMF(10ml) 용액에 빙냉하에 트리에틸아민(677mg, 6.69mmol)과 클로로탄산에틸(729mg, 6.69mmol)을 가하고, 실온에서 10분간 교반하였다. 반응액에 메탄술폰아미드(1.06g, 11.15mmol)와 DMAP(272.4mg, 2.23mmol)를 가하고, 80℃에서 2시간 가열 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 클로로포름만으로 용출하고, 이어서 클로로포름-MeOH(9:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 535mg(수율 46%)의 화합물 53A를 얻었다.
MS: m/z=463 [M+H]+.
제2 공정
화합물 53A(535mg, 0.991mmol)의 THF(5ml) 용액에 10% Pd-C(218mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 235mg(수율 53%)의 화합물 53을 얻었다.
참고예 54
제1 공정
화합물 1I(1.0mg, 2.23mmol)의 DMF(10ml) 용액에 빙냉하에 트리에틸아민(677mg, 6.69mmol)과 클로로탄산에틸(729mg, 6.69mmol)을 가하고, 동일 온도에서 10분간 교반하였다. 반응액을 빙냉한 수소화붕소나트륨(441mg, 11.7mmol), 물(5ml) 용액에 적하하고, 동일 온도에서 2시간 교반하였다. 반응액에 2규정 염산을 가하여 반응을 정지시키고, 2규정 수산화나트륨 수용액으로 중화한 후, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하여 얻어진 조 생성물을 디클로로메탄(5ml)에 용해시켰다.
상기 디클로로메탄 용액에 이산화망간(2.1g, 24.15mmol)을 가하고, 실온에서 6시간 교반하였다. 반응액을 여과하고, 용매를 증류 제거한 후, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-MeOH(9:1, v/v)로 용출하고, 목적으로 하는 분획을 농축하여 188mg(수율 19%)의 화합물 54A를 얻었다.
MS: m/z=447 [M+H]+.
제2 공정
화합물 54A(188mg, 0.422mmol)를 THF(6ml)에 용해하고, 실온하에 28% 암모니아수와 요오드(117.7mg, 0.464mmol)를 가하고, 동일 온도에서 2시간 교반하였다. 반응액에 티오황산나트륨 수용액을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-MeOH(9:1, v/v)로 용출하고, 목적으로 하는 분획을 농축하여 54.7mg(수율 29%)의 화합물 54B를 얻었다.
제3 공정
화합물 54B(216mg, 0.487mmol)의 톨루엔(2ml) 용액에 아지드화나트륨(95mg, 1.46mmol)과 트리에틸아민(201mg, 1.46mmol)을 가하고, 실온에서 6시간 교반하였다. 반응액을 2규정 수산화나트륨 수용액으로 2회 추출하고, 추출액을 2규정 염산으로 중화하고, 아세트산에틸로 3회 추출하였다. 유기층을 황산나트륨으로 건조한 후, 용매를 증류 제거하여 65mg(수율 27%)의 화합물 54C를 얻었다.
제4 공정
화합물 54C(500mg, 1.03mmol)의 THF(2ml)-MeOH(2ml) 용액에 10% Pd-C(100mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사를 디클로로메탄(10ml)에 용해시키고, 2규정 수산화나트륨 수용액으로 2회 추출하였다. 추출액을 2규정 염산으로 중화한 후, 아세트산에틸로 3회 추출하였다. 유기층을 황산나트륨으로 건조하고, 용매를 증류 제거해서 얻어진 고체를 디이소프로필에테르로 세정하고, 여과 취출하여 55mg(수율 14%)의 화합물 54를 얻었다.
참고예 55
제1 공정
화합물 1I(500mg, 1.08mmol)의 THF(5ml) 용액에 실온하에 트리메틸실릴디아조메탄 2M 헥산 용액(1ml, 2.0mmol)을 가하고, 50℃로 가열 교반하였다. 용매를 증류 제거한 후 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. n-헥산-아세트산에틸(1:1, v/v)로 용출하고, 목적으로 하는 분획을 농축하여 115mg(수율 22%)의 화합물 55A를 얻었다.
제2 공정
화합물 55A(210mg, 0.441mmol)를 THF(2ml)에 용해하고, 10% Pd-C(85.7mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사를 디이소프로필에테르에테르로 세정하여 50mg(수율 23%)의 화합물 55를 얻었다.
참고예 56
제1 공정
화합물 2D(424mg, 0.787mmol)의 DMF(5mL) 용액을 빙냉하고, 트리에틸아민(327ul, 2.36mmol), 계속해서 클로로포름산에틸(150ul, 1.57mmol)을 가하였다. 반응액을 실온에서 10분간 교반한 후 다시 빙냉하고, 아지드화나트륨(154mg, 2.36mmol)을 가하여 1시간 교반하였다. 반응액에 디클로로메탄, 물 및 소량의 메탄올을 가하여 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 농축하고, 얻어진 잔사에 메탄올(8ml)을 가하고, 50℃에서 3시간 교반한 후, 용매를 증류 제거하였다. 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(1:1, v/v)로 용출하고, 이어서 아세트산에틸만으로 용출하였다. 목적으로 하는 분획을 농축하여 백색 고체로서 160mg의 화합물 56A를 얻었다.
제2 공정
화합물 56A(160mg, 0.102mmol)를 EtOH(10mL)에 용해하고, 2N 수산화나트륨 수용액(14ml)을 가하고, 60℃에서 2시간 교반하였다. 반응액을 감압하에서 농축한 후, 잔류물을 디클로로메탄-물로 분배하였다. 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 3회 추출하였다. 용매를 증류 제거하여 화합물 56B를 얻었다.
제3 공정
화합물 56B(56mg, 0.11mmol)를 TFA(3mL)에 용해하고, 실온에서 1시간 교반하였다. 반응 혼합물을 톨루엔 공비하고, 얻어진 잔사를 LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 이소프로필에테르를 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 7mg의 화합물 56을 얻었다.
MS: m/z=420.07 [M+H]+.
참고예 57
제1 공정
화합물 56B(25mg, 0.049mmol)의 THF(1mL) 용액에 빙냉하에 트리에틸아민(20uL, 0.15mmol), 계속해서 무수아세트산(7.0ul, 0.074mmol)을 가하고, 실온에서 15분간 교반하였다. 이어서 4-플루오로벤질아민(330mg, 1.75mmol)을 가하고, 7시간 교반하였다. 트리에틸아민(20uL, 0.15mmol), 계속해서 무수 아세트산(7.0ul, 0.074mmol)을 더 가하고 철야 교반하였다. 반응액에 물, 아세트산에틸, 염수를 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 여과, 농축하여 백색 고체로서 18mg의 화합물 57A를 얻었다.
제2 공정
화합물 57A(21mg, 0.038mmol)를 TFA(3mL)에 용해하고, 실온에서 3.5시간 교반하였다. 반응 혼합물을 톨루엔 공비하고, 얻어진 잔사에 이소프로필에테르를 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 10mg의 화합물 57을 얻었다.
참고예 58
참고예 57에 따라서, 화합물 58을 마찬가지의 수법에 의해 합성하였다.
참고예 59
참고예 57에 따라서, 화합물 59를 마찬가지의 수법에 의해 합성하였다.
참고예 60
화합물 56B(30mg, 0.059mmol)에 포름산(1.0mL, 26mmol), 계속해서 37% 포름알데히드 용액(0.5mL, 6.7mmol)을 가하고, 100℃에서 7시간 교반하였다. 반응액을 톨루엔 공비하고, DMSO를 가하여 불용물을 여과한 후, LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 이소프로필에테르를 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 3mg의 화합물 60을 얻었다.
참고예 61
제1 공정
화합물 56B(50mg, 0.098mmol)를 THF(1mL)에 용해하고, Boc2O(0.068mL, 0.29mmol), 계속해서 DMAP(6.0mg, 0.049mmol)를 가하고, 실온에서 5시간 교반하였다. 반응액에 물, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 여과하고, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 무색 투명 오일로서 20mg의 화합물 61A를 얻었다.
MS: m/z=610.50 [M+H]+.
제2 공정
화합물 61A(20mg, 0.033mmol)를 DMF(1mL)에 용해하고, 빙냉하에 수소화나트륨(2.6mg, 0.066mmol)을 가하여 10분간 교반한 후, 요오드화메틸(4.1uL, 0.066mmol)을 가하고, 실온에서 1.5시간 교반하였다. 얼음물, 아세트산에틸, 염수를 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 여과하고, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 백색 고체로서 13mg의 화합물 61B를 얻었다.
MS: m/z=624.25 [M+H]+.
제3 공정
화합물 61B(13mg, 0.021mmol)를 TFA(3mL)에 용해하고, 실온에서 3시간 교반하였다. 반응 혼합물을 톨루엔 공비하고, 얻어진 잔사를 LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 이소프로필에테르-헥산을 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 7.5mg의 화합물 61을 얻었다.
참고예 62
제1 공정
화합물 2D(112mg, 0.208mmol)를 DMF(2mL)에 용해하고, 빙냉하에 트리에틸아민(0.144ml, 1.04mmol), 계속해서 클로로포름산에틸(0.040mL, 0.42mmol)을 가하고, 실온에서 10분 교반한 후, N,O-디메틸히드록시아민염산염(41mg, 0.42mmol), 계속해서 DMAP(3mg, 0.02mmol)를 가하고, 실온에서 1시간 교반하였다. 반응액에 물, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 여과하고, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 황색 오일로서 127mg의 조 정제물 62A를 얻었다.
MS: m/z=582.20 [M+H]+.
제2 공정
화합물 62A(137mg, 0.236mmol)를 THF(8mL)에 용해하고, 질소 기류하에 -78℃에서 메틸마그네슘브로마이드의 2M THF 용액(0.444ml, 0.471mmol)을 가하고, -50℃까지 승온하면서 30분 교반하였다. 반응액에 1M 염산(4ml)을 가하고, 0℃에서 20분 교반한 후 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액을 포화 탄산수소나트륨 수용액으로 중화하고, 유기층에 황산나트륨을 가하여 여과하고, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 황색 오일로서 67mg의 화합물 62B를 얻었다.
제3 공정
화합물 62B(67mg, 0.13mmol)를 디클로로메탄(4mL)에 용해하고, 질소 기류하, 0℃에서 mCPBA(32mg, 0.19mmol)를 가하고, 실온에서 3시간 교반하였다. 반응액을 빙냉하고, 티오황산나트륨 수용액, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액을 포화 탄산수소나트륨 수용액으로 중화하고, 유기층에 황산나트륨을 가하여 여과하고, 용매를 증류 제거함으로써, 64mg의 화합물 62C를 얻었다.
MS: m/z=553.23 [M+H]+.
제4 공정
화합물 62C(64mg, 0.12mmol)를 에탄올(8mL)에 용해하여, 4시간 가열 환류하였다. 반응액을 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 42mg의 화합물 62D를 얻었다.
제5 공정
화합물 62D(41mg, 0.080mmol)를 DMF(1mL)에 용해하고, 빙냉하에 수소화나트륨(6.4mg, 0.16mmol)을 가하여 10분 교반한 후, 요오드화메틸(0.010ml, 0.16mmol)을 가하고 실온에서 1.5시간 교반하였다. 반응액에 얼음물, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 여과하고, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 백색 고체로서 41mg의 화합물 62E를 얻었다.
제6 공정
화합물 62E(40mg, 0.076mmol)를 TFA(3mL)에 용해하고, 실온에서 30분 교반하였다. 반응 혼합물을 톨루엔 공비하고, 얻어진 잔사를 LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 아세트산에틸-이소프로필에테르-헥산을 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 분홍색 고체로서 7.1mg의 화합물 62를 얻었다.
참고예 63
제1 공정
화합물 2D(164mg, 0.304mmol)를 디페닐에테르(1mL)에 용해하고, 마이크로웨이브 장치를 이용하여, 245℃에서 1시간 교반한 후, 반응액을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 차색 고체로서 72mg의 화합물 63A를 얻었다.
제2 공정
화합물 63A(21mg, 0.042mmol)의 디클로로메탄(4mL) 용액에 NBS(11mg, 0.062mmol)를 가하고, 1시간 가열 환류하였다. 반응액을 방냉한 후, 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 백색 고체로서 26mg의 화합물 63B를 얻었다.
제3 공정
화합물 63B(10mg, 0.017mmol)를 TFA(3mL)에 용해하고, 실온에서 50분 교반하였다. 반응 혼합물을 톨루엔 공비하고, 얻어진 잔사에 이소프로필에테르를 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 오렌지색 고체로서 1.4mg의 화합물 63을 얻었다.
MS: m/z=483.15 [M+H]+.
참고예 64
제1 공정
화합물 63B(20mg, 0.035mmol)의 DMF 용액(2mL)에 피라졸-4-보론산피나콜에스테르(36mg, 0.19mmol), 계속해서 탄산칼륨(29mg, 0.21mmol)을 가한 후, 질소 분위기하에 테트라키스트리페닐포스핀팔라듐(24mg, 0.021mmol)을 가하고, 110℃에서 8.5시간 교반하였다. 반응액을 농축한 후, 아세트산에틸, 메탄올을 가하여 불용물을 제거하였다. 여액을 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 백색 고체로서 18mg의 화합물 64A를 얻었다.
MS: m/z=561.30 [M+H]+.
제2 공정
화합물 64A(14mg, 0.025mmol)를 TFA(2mL)에 용해하고, 실온에서 30분 교반하였다. 반응 혼합물을 톨루엔 공비하고, 얻어진 잔사를 LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 이소프로필에테르를 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 오렌지색 고체로서 1.1mg의 화합물 64를 얻었다.
MS: m/z=471.20 [M+H]+.
참고예 65
제1 공정
화합물 65A(WO2006/088173, 20.0g, 69.6mmol)의 THF(1.1L) 용액을 수욕 상에서 25℃로 유지하고, 아염소산나트륨(25.2g, 278mmol), 아미도황산(27.0g, 278mmol)의 물(378mL) 용액을 30분에 걸쳐 적하하였다. 반응액을 동일 온도에서 1시간 교반한 후, 감압 농축하였다. 잔사에 얼음물(100mL), 디에틸에테르(100mL)를 가해서 석출된 고체를 여과하였다. 얻어진 조 정제물을 물 및 디에틸에테르로 세정하여 백색 고체로서 20.3g의 화합물 65B를 얻었다.
제2 공정
화합물 65B(2.0g, 6.59mmol)를 DMF(340mL)에 용해하고, HATU(2.76g, 7.25mmol), 메틸아민(2mol/L THF 용액, 3.63mL, 7.25mmol), 트리에틸아민(9.89mmol)을 가하고, 실온에서 5시간 교반하였다. 반응액을 아세트산에틸-물로 분배하였다. 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 1회 추출하였다. 합친 추출액을 물, 포화 식염수로 세정한 후, 건조하였다. 용매를 증류 제거하여 백색 고체로서 1.66g의 화합물 65C의 조 정제물을 얻었다.
제3 공정
화합물 65C(1.2g, 3.79mmol)의 DMF(20mL) 용액에 탄산칼륨(1.04g, 7.59mmol), O-(2,4-디니트로페닐)히드록실아민(831mg, 4.17mmol)을 가하고, 실온에서 3시간 교반하였다. 반응액에 물을 가해서 석출된 고체를 여과 취출하여 물로 세정함으로써, 1.0g의 화합물 65D의 조 정제물을 얻었다.
제4 공정
화합물 65D(1.0g, 3.02mmol)의 DMF(10mL) 용액에 실온하에 파라포름알데히드(109mg, 3.62mmol), 아세트산(0.017ml, 0.302mmol)을 가하고, 105℃에서 2시간 교반하였다. 반응액을 0℃로 냉각하고, 탄산세슘(3.44g, 10.6mmol)을 가하고, 실온에서 1시간 교반하였다. 반응액에 물을 가하여 아세트산에틸-물로 분배하였다. 유기층을 포화 식염수로 세정, 건조하였다. 용매를 증류 제거하여 120mg의 화합물 65E를 얻었다.
MS: m/z=344 [M+H]+.
제5 공정
화합물 65E(17.0mg, 0.05mmol)의 DMF(1mL) 용액에 탄산세슘(81.4mg, 0.25mmol), 메틸아민(2mol/L THF 용액, 0.125ml, 0.25mmol)을 가하고, 실온에서 5시간 교반하였다. 반응액을 여과하고, 여액을 LCMS로 분취 정제하여 화합물 65F를 얻었다.
MS: m/z=358 [M+H]+.
제6 공정
화합물 65F의 DMF(0.5mL) 용액에 2N 수산화나트륨 수용액(0.2mL)을 가하고, 실온에서 2시간 교반하였다. 반응액에 이온 교환 수지 도웩스(DOWEX)(50W-X8)를 가하여 여과하고, DMF로 세정하였다. 여액을 농축한 후, 트리플루오로아세트산(0.5mL)을 가하고, 80℃에서 4시간 교반하였다. 반응액을 농축한 후, 물, 클로로포름을 가하여 유기층을 분리하였다. 유기층을 농축한 후, LCMS로 분취 정제하여 6.47mg의 화합물 65를 얻었다.
MS: m/z=254 [M+H]+.
참고예 65에 따라서, 이하의 표 10 내지 14에 나타내어지는 참고예 화합물 66 내지 92를 마찬가지의 수법에 의해 합성하였다.
참고예 93
참고예 65에 따라서, 화합물 93을 마찬가지의 수법에 의해 합성하였다.
참고예 94
제1 공정
화합물 94A(WO2007/049675)를 이용하여, 참고예 65의 제5 공정과 마찬가지의 수법에 의해 화합물 94B를 합성하였다.
제2 공정
화합물 94B(1.1g, 1.655mmol)의 MeCN(20ml) 용액에 DMAP(202mg, 1.655mmol) 및 Boc2O(20ml, 86mmol)를 질소 기류하에 실온에서 가하고, 5시간 가열 환류하였다. Boc2O(20ml, 86mmol)를 더 가하고, 5시간 가열 환류하였다. 감압 농축한 후, 그 잔사에 에탄올(20.00ml) 및 수산화나트륨 수용액(40%, 25ml)을 가하고, 5시간 실온에서 교반하였다. 반응 혼합물에 아세트산에틸-물을 가해서 수층을 산성으로 하였다. 아세트산에틸(2×200mL)로 추출한 후, 유기층을 포화 식염수로 세정하였다. 황산마그네슘으로 건조한 후, 용매를 감압증류 제거하였다. 조 생성물을 실리카 겔 컬럼 크로마토그래피(CHCl3/MeOH 20:1)에 의해 정제하여 화합물 94C를 얻었다(750mg, 63%).
제3 공정
화합물 94C를 이용하여, 참고예 12의 제10 공정과 마찬가지의 수법에 의해 화합물 94를 합성하였다.
참고예 95
제1 공정
화합물 95A(WO2006/116764, 1g, 4.06mmol)를 28% 암모니아수에 용해시켜, 실온하에 12시간 교반하였다. 반응액을 농축한 후, 얻어진 잔사를 2규정 염산으로 중화하고, 석출된 고체를 아세트산에틸에 현탁시키고, 여과 취출하고, 건조하여 1.14g(수율 100%)의 화합물 95B를 얻었다.
제2 공정
상기 화합물 95B(3.00g, 10.65mmol)의 DMF(10ml) 용액에 실온하에 WSC HCl(3.06g, 15.98mmol)과 HOBt(1.58g, 11.7mmol)를 가하여 10분간 교반하고, 메틸아민 33중량% 에탄올 용액(1.50g, 15.98mmol)을 적하하였다. 반응액을 동일 온도에서 2시간 교반한 후, 물을 가하고, 클로로포름으로 5회 추출하였다. 추출액을 황산나트륨으로 건조하고, 용매를 증류 제거한 후, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-MeOH(6:4, v/v)로 용출하는 분획으로부터 고체로서 2.62g(수율 95%)의 화합물 95C를 얻었다.
제3 공정
상기 화합물 95C(2.62g, 10.14mmol)의 DMF(10ml) 용액에 실온하에 탄산칼륨(4.20g, 30.42mmol)을 현탁시키고 5분간 교반한 후, O-(2,4-디니트로페닐)히드록실아민(3.03g, 15.21mmol)을 가하고, 동일 온도에서 3시간 교반하였다. 반응액에 물을 가하고, 클로로포름으로 5회 추출하고, 추출액을 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-MeOH(6:4, v/v)로 용출하는 분획으로부터 고체로서 1.41g(수율 51%)의 화합물 95D를 얻었다.
제4 공정
상기 화합물 95D(1.0g, 3.66mmol)의 톨루엔(10ml) 용액에 파라포름알데히드(109.9mg, 3.66mmol)와 아세트산(22mg, 0.37mmol)을 가하고, 100℃에서 40분간 가열 교반하였다. 냉각 후, 용매를 증류 제거하고, 잔류물을 정제하지 않고 DMF(10ml)에 용해하고, 빙냉하에 탄산세슘(3.58g, 10.98mmol)을 가하여 10분간 교반하였다. 반응액에 벤조히드릴 브로마이드(1.36g, 5.49mmol)를 가하고, 실온하에 3시간 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-MeOH(9:1, v/v)로 용출하는 분획으로부터 고체로서 1.26g(수율 71%)의 화합물 95E를 얻었다.
제5 공정
상기 화합물 95E(100mg, 0.221mmol)를 트리플루오로아세트산(2ml)에 용해시켜 실온하에 1시간 교반하였다. 용매를 증류 제거하고, 잔사를 디클로로메탄(2ml)에 용해시키고, 포화 중조수로 중화하였다. 얻어진 용액을 시트르산 수용액으로 산성으로 하고, 유기층을 분리하였다. 수층을 디클로로메탄으로 1회 추출하고, 합친 유기층을 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 디이소프로필에테르로 세정하여 50mg(수율 63%)의 화합물 95를 얻었다.
참고예 95에 따라서, 이하의 화합물을 마찬가지의 수법에 의해 합성하였다.
참고예 96
참고예 97
참고예 98
참고예 99
참고예 100
참고예 101
참고예 102
참고예 103
참고예 104
참고예 105
참고예 106
참고예 107
제1 공정
화합물 95D의 합성법에 준하여 합성한 화합물 107A(3.0g, 9.96mmol)의 DMF(30ml) 용액에 파라포름알데히드(299mg, 9.96mmol)와 아세트산(1ml)을 가하고, 120℃에서 4시간 가열 교반하였다. 용매를 증류 제거한 후, 잔사에 아세트산에틸-디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 2.85g(수율 91%)의 화합물 107B를 얻었다.
제2 공정
화합물 107B(100mg, 0.319mmol)의 아세트산(2ml) 용액에 실온하에 96% 황산(0.5ml)과 비스(3-클로로페닐)메탄올(242.3mg, 0.957mmol)을 가하고, 80℃에서 2시간 교반하였다. 반응액을 실온까지 냉각한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 유기층을 1회 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 잔사에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 42mg(수율 29%)의 화합물 107을 얻었다.
참고예 107에 따라서, 이하의 화합물을 마찬가지의 수법에 의해 합성하였다.
참고예 108
참고예 109
참고예 110
참고예 111
참고예 112
참고예 113
참고예 114
참고예 115
참고예 116
참고예 117
참고예 118
참고예 119
참고예 120
참고예 121
참고예 122
참고예 123
참고예 124
참고예 125
참고예 126
제1 공정
화합물 95B(1.00g, 3.55mmol)와 시클로프로판아민(0.492ml, 7.10mmol)을 피리딘(20ml)에 가하고, 1-히드록시벤조트리아졸(544mg, 3.55mmol)과 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 하이드로클로라이드(1.36g, 7.10mmol)를 순서대로 가하고, 실온에서 18시간 교반하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v), 계속해서 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1, v/v)로 정제하여 무색 고체로서 1.19g의 화합물 126A를 얻었다.
제2 공정
화합물 126A(1.19g, 4.19mmol)를 DMF(15ml)에 용해하고, 탄산칼륨(2.90g, 20.1mmol)을 가하고, 실온에서 30분 교반하였다. O-(2,4-디니트로페닐)히드록실아민(1.67g, 8.38mmol)을 가하고, 실온에서 18시간 교반하였다. 반응액에 클로로포름을 가해서 석출된 황색 침전물을 여과해서 제거하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v)로 정제하여 황색 고체로서 851mg의 화합물 126B를 얻었다.
제3 공정
화합물 126B(847mg, 2.83mmol)와 파라포름알데히드(255mg, 8.49mmol)를 에탄올(12ml)에 가하고, 마이크로웨이브 조사하에 140℃에서 30분 교반하였다. 반응액을 감압 농축하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5→90:10, v/v), 계속해서 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 97:3, v/v)로 정제하고, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 665mg의 화합물 126C를 얻었다.
제4 공정
화합물 126C(100mg, 0.321mmol)를 DMF(0.5ml)에 용해하고, 탄산세슘(314mg, 0.964mmol)과 (브로모메틸렌)디벤젠(119mg, 0.482mmol)을 0℃에서 가하고, 실온에서 2시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 유기층을 물로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v)로 정제하여 무색 고무상 물질로서 124mg의 화합물 126D를 얻었다.
제5 공정
제4 공정에서 얻어진 화합물 126D에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1.5시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 52mg의 화합물 126을 얻었다.
참고예 127
참고예 126에 따라서, 화합물 127을 마찬가지의 수법에 의해 합성하였다.
참고예 128
제1 공정
화합물 95B(2.40g, 8.52mmol)와 에틸 3-아미노프로파노에이트 하이드로클로라이드(2.62g, 17.0mmol)를 피리딘(30ml)에 가하고, 1-히드록시벤조트리아졸(1.31g, 8.52mmol)과 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 하이드로클로라이드(3.27g, 17.0mmol)를 순서대로 가하고, 실온에서 2시간 교반하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고체로서 1.90g의 화합물 128A를 얻었다.
제2 공정
화합물 128A(2.58g, 7.49mmol)를 DMF(30ml)에 용해하고, 탄산칼륨(5.18g, 37.5mmol)을 가하고, 실온에서 30분 교반하였다. O-(2,4-디니트로페닐)히드록실아민(2.98g, 15.0mmol)을 가하고, 실온에서 20시간 교반하였다. 반응액에 클로로포름을 가해서 석출된 황색 침전물을 여과해서 제거하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v), 계속해서 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5→92:8, v/v)로 정제하여 황색 고체로서 1.67g의 화합물 128B를 얻었다.
제3 공정
화합물 128B(1.66g, 4.62mmol)와 파라포름알데히드(416mg, 13.9mmol)를 에탄올(20ml)에 가하고, 마이크로웨이브 조사하에 140℃에서 30분 교반하였다. 반응액을 감압 농축하고, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 99:1→95:5, v/v)로 정제하여 무색 고체로서 1.57g의 화합물 128C를 얻었다.
제4 공정
화합물 128C(1.00g, 2.69mmol)를 DMF(10ml)에 용해하고, 탄산세슘(2.63g, 8.08mmol)과 (브로모메틸렌)디벤젠(998mg, 4.04mmol)을 0℃에서 가하고, 실온에서 18시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 유기층을 물로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 98:2, v/v)로 정제하여 무색 고무상 물질로서 500mg의 화합물 128D를 얻었다.
제5 공정
화합물 128D(40mg, 0.074mmol)에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 20mg의 화합물 128을 얻었다.
참고예 129
제1 공정
화합물 128D(426mg, 0.792mmol)를 에탄올(3ml)과 THF(3ml)에 용해하고, 2규정 수산화나트륨 수용액(1.19ml, 2.38mmol)을 가하고, 실온에서 1.5시간 교반하였다. 반응액에 2규정 염산을 가하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 얻어진 조 생성물에 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 359mg의 화합물 129A를 얻었다.
제2 공정
화합물 129A(40mg, 0.079mmol)에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 3으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 25mg의 화합물 129를 얻었다.
참고예 130
제1 공정
화합물 129A(50mg, 0.098mmol)를 DMF(1ml)에 가하고, 1-히드록시벤조트리아졸(14mg, 0.098mmol), 디메틸아민 하이드로클로라이드(24mg, 0.29mmol), 트리에틸아민(0.048ml, 0.34mmol), 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 하이드로클로라이드(28mg, 0.15mmol)를 가하고 실온에서 1.5시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 중조수로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하여 무색 고무상 물질로서 130A를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 130A에 트리플루오로아세트산(1ml)을 가하고, 실온에서 2시간 교반하였다. 감압 농축한 후, 중조수와 염화암모늄 수용액으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 25mg의 화합물 130을 얻었다.
참고예 131
참고예 130에 따라서, 화합물 131을 마찬가지의 수법에 의해 합성하였다.
참고예 132
참고예 130에 따라서, 화합물 132를 마찬가지의 수법에 의해 합성하였다.
참고예 133
참고예 130에 따라서, 화합물 133을 마찬가지의 수법에 의해 합성하였다.
참고예 134
참고예 130에 따라서, 화합물 134를 마찬가지의 수법에 의해 합성하였다.
참고예 135
제1 공정
화합물 95B(1.50g, 5.32mmol)와 tert-부틸 2-아미노에틸(메틸)카바메이트(1.86g, 10.7mmol)를 피리딘(20ml)에 가하고, 1-히드록시벤조트리아졸(815mg, 5.32mmol)과 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 하이드로클로라이드(2.04g, 10.7mmol)를 순서대로 가하고, 실온에서 2시간 교반하였다. 반응액을 1규정 염산에 옮기고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하고, 계속해서 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5, v/v)로 정제하여 무색 고무상 물질로서 1.63g의 화합물 135A를 얻었다.
제2 공정
화합물 135A(1.05g, 2.62mmol)를 DMF(15ml)에 용해하고, 탄산칼륨(1.81g, 13.1mmol)을 가하고, 실온에서 30분 교반하였다. O-(2,4-디니트로페닐)히드록실아민(1.04g, 5.23mmol)을 가하고, 실온에서 18시간 교반하였다. 반응액에 클로로포름을 가해서 석출된 황색 침전물을 여과해서 제거하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v)로 정제하여 담황색 고체로서 887mg의 화합물 135B를 얻었다.
제3 공정
화합물 135B(880mg, 2.11mmol)와 파라포름알데히드(190mg, 6.34mmol)를 에탄올(18ml)에 가하고, 마이크로웨이브 조사하에 140℃에서 30분 교반하였다. 반응액을 감압 농축하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5→90:10, v/v), 계속해서 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 97:3, v/v)로 정제하여 무색 고체로서 721mg의 화합물 135C를 얻었다.
제4 공정
화합물 135C(720mg, 1.68mmol)를 DMF(3.5ml)에 용해하고, 탄산세슘(1.64g, 5.04mmol)과 (브로모메틸렌)디벤젠(623mg, 2.52mmol)을 0℃에서 가하고, 실온에서 18시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 유기층을 물로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v)로 정제하여 732mg의 화합물 135D를 얻었다.
제5 공정
화합물 135D(727mg, 1.22mmol)에 4규정 HCl(아세트산에틸 용액, 10ml)을 가하였다. 실온에서 1시간 교반한 후, 용매를 감압증류 제거하였다. 포화 중조수를 가하고, 클로로포름으로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물에 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 575mg의 화합물 135E를 얻었다.
제6 공정
화합물 135E(50mg, 0.10mmol)에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1.5시간 교반하였다. 감압 농축한 후, 중조수와 염화암모늄 수용액으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 15mg의 화합물 135를 얻었다.
참고예 136
제1 공정
화합물 135E(50mg, 0.10mmol)를 염화메틸렌(1ml)에 용해하고, 트리에틸아민(0.042ml, 0.30mmol)과 아세틸클로라이드(0.011ml, 0.15mmol)를 가하고, 실온에서 1시간 교반하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v), 계속해서 아미노 컬럼 크로마토그래피(클로로포름-메탄올, 97:3, v/v)로 정제하여 무색 고체로서 72mg의 화합물 136A를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 136A에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1.5시간 교반하였다. 감압 농축한 후, 중조수와 염화암모늄 수용액으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 23mg의 화합물 136을 얻었다.
참고예 137
참고예 136에 따라서, 화합물 137을 마찬가지의 수법에 의해 합성하였다.
참고예 138
참고예 136에 따라서, 화합물 138을 마찬가지의 수법에 의해 합성하였다.
참고예 139
참고예 136에 따라서, 화합물 139를 마찬가지의 수법에 의해 합성하였다.
참고예 140
참고예 136에 따라서, 화합물 140을 마찬가지의 수법에 의해 합성하였다.
참고예 141
참고예 136에 따라서, 화합물 141을 마찬가지의 수법에 의해 합성하였다.
참고예 142
참고예 136에 따라서, 화합물 142를 마찬가지의 수법에 의해 합성하였다.
참고예 143
참고예 136에 따라서, 화합물 143을 마찬가지의 수법에 의해 합성하였다.
참고예 144
제1 공정
참고예 135의 제1 내지 제5 공정에 준하여 합성한 화합물 144A에 포름산과 포르말린을 가하고, 80℃에서 1.5시간 교반하였다. 용매를 감압증류 제거하고, 포화 중조수를 가하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압 농축하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5→92:8, v/v)로 정제하여 26mg의 화합물 144B를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 144B에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 염화암모늄 수용액으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 13mg의 화합물 144를 얻었다.
참고예 145
제1 공정
화합물 95E(300mg, 0.664mmol)의 디클로로메탄(5ml) 용액에 빙냉하에 NBS(130mg, 0.731mmol)를 가하고, 실온까지 승온한 후 1시간 환류하였다. 용매를 증류 제거한 후, 얻어진 잔사를 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(1:1, v/v)로 용출하고, 이어서 아세트산에틸로 용출하였다. 목적으로 하는 분획을 농축하여 고체로서 326.7mg(수율 93%)의 화합물 145A를 얻었다.
제2 공정
화합물 145A(100mg, 0.189mmol)의 DMF(3ml) 용액에 탄산칼륨(78.4mg, 0.567mmol), 물(0.5ml) 용액과 4,4,5,5-테트라메틸-2-(프로프-1-엔-2-일)-1,3,2-디옥사보롤란(47.6mg, 0.284mmol)과 테트라키스트리페닐포스핀팔라듐(21.8mg, 0.0189mmol)을 가하고, 80℃에서 4시간 가열 교반하였다. 반응액을 실온까지 냉각한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸만으로 용출시키고, 목적으로 하는 분획을 농축하여 유상물로서 42.0mg(수율 45%)의 화합물 145B를 얻었다.
제3 공정
화합물 145B(40mg, 0.081mmol)의 THF(2ml) 용액에 10% Pd-C(8mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사를 에테르로 세정하여 6.8mg(수율 21%)의 화합물 145를 얻었다.
참고예 146
참고예 145에 따라서, 화합물 146을 마찬가지의 수법에 의해 합성하였다.
참고예 147
제1 공정
화합물 145A(60mg, 0.113mg)를 트리플루오로아세트산(2ml)에 용해시키고, 실온하에 1시간 교반하였다. 용매를 증류 제거하고, 잔사를 디클로로메탄(2ml)에 용해시키고, 포화 중조수로 중화하였다. 얻어진 용액을 시트르산 수용액으로 산성으로 하고, 유기층을 분리하였다. 수층을 디클로로메탄으로 1회 추출하고, 합친 유기층을 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 디이소프로필에테르로 세정하여 30mg(수율 60%)의 화합물 147을 얻었다.
참고예 148
화합물 145B(41mg, 0.083mg)를 트리플루오로아세트산(2ml)에 용해시키고, 실온하에 1시간 교반하였다. 용매를 증류 제거하고, 잔사를 디클로로메탄(2ml)에 용해시키고, 포화 중조수로 중화하였다. 얻어진 용액을 시트르산 수용액으로 산성으로 하고, 유기층을 분리하였다. 수층을 디클로로메탄으로 1회 추출하고, 합친 유기층을 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 디이소프로필에테르로 세정하여 12mg(수율 36%)의 화합물 148을 얻었다.
참고예 149
화합물 145A(100mg, 0.189mg)의 THF(2ml) 용액에 실온하에 2규정 메틸아연클로라이드 THF 용액(0.377ml, 0.754mmol)과 테트라키스트리페닐포스핀팔라듐(10.9mg, 0.0945mmol)을 가하고, 60℃에서 4시간 가열 교반하였다. 반응액을 실온까지 냉각한 후, 물을 가하고, 클로로포름으로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 MS 트리거(trigger) 역층 컬럼으로 정제하여 9.6mg(수율 14%)의 화합물 149를 얻었다.
참고예 150
제1 공정
참고예 135의 제1 내지 제4 공정에 준하여 합성한 화합물 150A(465mg, 0.801mmol)를 4규정 염산디옥산 용액(5ml)에 용해시키고, 실온하에 2시간 교반하였다. 반응액을 포화 중조수 용액으로 중화하고, 디클로로메탄으로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후 용매를 증류 제거하고, 얻어진 유상물 중 100mg을 디클로로메탄(2ml)에 용해시켰다. 상기 디클로로메탄 용액에 빙냉하에 트리에틸아민(63.2mg, 0.624mmol)과 벤조일클로라이드(31.9mg, 0.312mmol)를 가하고, 실온에서 1시간 교반하였다. 반응액에 물을 가하고, 디클로로메탄으로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 잔사를 디에틸에테르로 세정하여 68mg(수율 56%)의 화합물 150B를 얻었다.
제2 공정
화합물 150B(30mg, 0.051mg)를 트리플루오로아세트산(2ml)에 용해시키고, 실온하에 1시간 교반하였다. 용매를 증류 제거하고, 잔사를 디클로로메탄(2ml)에 용해시키고, 포화 중조수로 중화하였다. 얻어진 용액을 시트르산 수용액으로 산성으로 하고, 유기층을 분리하였다. 수층을 디클로로메탄으로 1회 추출하고, 합친 유기층을 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 디이소프로필에테르로 세정하여 15mg(수율 59%)의 화합물 150을 얻었다.
참고예 151
참고예 150에 따라서, 화합물 151을 마찬가지의 수법에 의해 합성하였다.
참고예 152
제1 공정
화합물 150A(50mg, 0.801mmol)를 4규정 염산디옥산 용액(5ml)에 용해시키고, 실온하에 2시간 교반하였다. 반응액을 포화 중조수 용액으로 중화하고, 디클로로메탄으로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후 용매를 증류 제거하고, 얻어진 유상물 중 50mg을 메탄올(2ml)에 용해시켰다. 상기 메탄올 용액에 10% Pd-C(10mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 10mg(수율 25%)의 화합물 152를 얻었다.
참고예 153
제1 공정
화합물 150A(30mg, 0.052mmol)의 THF(3ml) 용액에 10% Pd-C(10mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 20mg(수율 79%)의 화합물 153을 얻었다.
참고예 154
제1 공정
참고예 65의 합성법에 준하여 합성한 화합물 154A(539mg, 1.01mmol)의 DMF(10ml) 용액에 빙냉하에 트리에틸아민(615.7mg, 6.08mmol)과 클로로탄산에틸(328.8mg, 3.03mmol)을 가하고, 실온에서 10분간 교반하였다. 반응액에 O,N-디메틸히드록실아민염산염(295.0mg, 3.03mmol)과 DMAP(12.3mg, 0.101mmol)를 가하고, 동일 온도에서 2시간 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(7:3, v/v)로 용출하고, 이어서 아세트산에틸만으로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 445.4mg(수율 76%)의 화합물 154B를 얻었다.
제2 공정
화합물 154B(250mg, 0.435mmol)의 THF(5ml) 용액을 -78℃로 냉각하고, 메틸마그네슘브로마이드 0.97M THF 용액(0.673ml, 0.653mmol)을 가하고, -20℃까지 2시간에 걸쳐서 승온하였다. 반응액에 1규정 염산을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 클로로포름만으로 용출하고, 이어서 클로로포름-메탄올(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 117.0mg(수율 51%)의 화합물 154C를 얻었다.
제3 공정
화합물 154C(117mg, 0.221mmol)의 디클로로메탄(2ml) 용액에 빙냉하에 mCPBA(52.7mg, 0.332mmol)를 가하고, 실온에서 2시간 교반하였다. 반응액에 티오황산나트륨 수용액을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 포화 중조수로 2회 세정하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 유상물을 에탄올(2ml)에 용해하고, 1시간 환류하였다. 용매를 증류 제거한 후, 석출된 고체를 디이소프로필에테르로 세정하여 54mg(수율 49%)의 화합물 154D를 얻었다.
제4 공정
화합물 154D(54mg, 0.107mmol)의 THF(3ml) 용액에 10% Pd-C(20mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출하여 21mg(수율 47%)의 화합물 154를 얻었다.
참고예 155
제1 공정
화합물 155A(WO2006/066414, 15.0g, 38.4mmol)의 톨루엔(150mL) 용액에 빙냉하에 N,N-디이소프로필에틸아민(16.1mL, 92.0mmol), 1-메틸이미다졸 (3.70mL, 46.4mmol) 및 2-메톡시에틸아민(4.05mL, 46.4mmol)을 순차 가한 후, 추가로 디페닐클로로포스페이트(9.60mL, 46.1mmol)를 10분에 걸쳐 적하하였다. 반응액을 빙냉하에 20분간 교반한 후, 아세토니트릴(50mL)을 가하여 2시간 더 교반하였다. 반응액에 빙냉하에 아세트산 수용액(10%, 100mL)을 가한 후, 아세트산에틸로 추출하였다. 추출액을 물(100mL), 포화 중조수(150mL) 및 포화 식염수(100mL)로 순차 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=25%→50%)로 정제하여 화합물 155B(7.86g, 46%)를 무색 유상물로서 얻었다.
제2 공정
화합물 155B(7.70g, 17.2mmol)의 에탄올(80mL) 용액에 실온에서 암모니아수(40mL)를 가하고 18시간 교반하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=75%→100%)로 정제하여 화합물 155C(7.15g, 93%)를 무색 유상물로서 얻었다.
제3 공정
화합물 155C(7.15g, 16.0mmol) 및 탄산칼륨(6.64g, 48.0mmol)의 DMF(125mL) 용액에 실온에서 O-(2,4-디니트로페닐)히드록실아민(7.97g, 40.0mmol)을 가하고, 2일간 교반하였다. 반응액에 빙냉하에 물(250mL)을 가한 후, 아세트산에틸(300mL×2)로 추출하였다. 추출액을 물(300mL), 포화 중조수(300mL×2) 및 포화 식염수(150mL)로 순차 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(메탄올/클로로포름=0%→10%)로 정제하여 화합물 155D(6.47g, 88%)를 박황색 고체로서 얻었다.
제4 공정
화합물 155D(6.47g, 14.0mmol) 및 아세트산(0.080mL, 1.4mmol)의 톨루엔(100mL) 용액에 실온에서 파라포름알데히드(0.422g, 14.1mmol)를 가하고, 80℃에서 2시간 교반하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 155E의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
제5 공정
제4 공정에서 얻은 화합물 155E의 조 생성물의 DMF(100mL) 용액에 빙냉하에 탄산세슘(22.7g, 69.8mmol)을 가하고 1시간 교반하였다. 빙냉하에 브로모디페닐메탄(5.20g, 21.0mmol)을 가하고, 실온에서 19시간 교반하였다. 반응액에 빙냉하에 물(200mL)을 가한 후, 아세트산에틸(200mL×3)로 추출하였다. 추출액을 물(200mL×2) 및 포화 식염수(100mL)로 순차 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 155F의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=640 [M+H]+.
제6 공정
제5 공정에서 얻은 화합물 155F의 조 생성물의 메탄올(100mL) 용액에 실온에서 염화수소(4N 아세트산에틸 용액, 40mL)를 가하고 2.5시간 교반하였다. 반응액에 빙냉하에 수산화나트륨 수용액(2N, 75mL)을 가하여 중화(pH=6)한 후, 클로로포름(200mL×3)으로 추출하였다. 추출액을 황산나트륨으로 건조하고, 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(메탄올/클로로포름=5%→40%)로 정제하여 화합물 155G(5.18g, 3공정 70%)를 오렌지색 유상물로서 얻었다.
제7 공정
화합물 155G(100mg, 0.190mmol), (브로모메틸)시클로프로판(0.110mL, 1.12mmol) 및 요오드화나트륨(5.0mg, 0.033mmol)의 THF(2mL) 용액에 실온에서 칼륨 tert-부톡시드(78.0mg, 0.695mmol)를 가하고, 실온에서 22시간 교반한 후, 마이크로웨이브 조사하에 100℃에서 10분간 교반하였다. 반응액에 물 및 염산(2N)을 가하고(pH=1), 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 155H의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=580 [M+H]+.
제8 공정
제7 공정에서 얻은 화합물 155H의 조 생성물의 DMF(2mL) 용액에 실온에서 염화리튬(35.0mg, 0.826mmol)을 가하고, 마이크로웨이브 조사하에 150℃에서 15분간 교반하였다. 반응액을 분취용 LCMS로 정제하여 화합물 155(4.3mg, 2공정 5%)를 백색 고체로서 얻었다.
참고예 156
참고예 155에 따라서, 화합물 156을 마찬가지의 수법에 의해 합성하였다.
참고예 157
참고예 155에 따라서, 화합물 157을 마찬가지의 수법에 의해 합성하였다.
참고예 158
제1 공정
화합물 155G(960mg, 1.83mmol)의 THF(100mL) 용액에 실온에서, 이산화망간(2.06g, 92.0mmol)을 가하고 2일간 교반하였다. 반응액을 여과한 후 여액을 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=60%→100%)로 정제하여 화합물 158A(554mg, 58%)를 박황색 폼으로 얻었다.
제2 공정
화합물 158A(83.0mg, 0.159mmol), 피롤리딘(0.0400mL, 0.484mmol) 및 아세트산(0.100mL)의 염화메틸렌(4mL) 용액에 실온에서, 나트륨트리아세톡시보로하이드라이드(136mg, 0.642mmol)를 가하고 28시간 교반하였다. 반응액에 물을 가하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 158B의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=579 [M+H]+.
제3 공정
제2 공정에서 얻은 화합물 158B의 조 생성물의 DMF(2mL) 용액에 실온에서 염화리튬(39.2mg, 0.925mmol)을 가하고, 마이크로웨이브 조사하에 150℃에서 15분간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 158(8.8mg, 2공정 11%)을 황색 유상물로서 얻었다.
참고예 159
제1 공정
화합물 155G(950mg, 1.81mmol) 및 N,N-디이소프로필에틸아민(0.380mL, 2.18mmol)의 염화메틸렌(20mL) 용액에 빙냉하에 메탄술포닐클로라이드(0.148mL, 1.90mmol)를 적하하고, 90분간 교반하였다. 반응액에 물(20mL)을 가하고, 클로로포름(50mL)으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 159A의 조 생성물(1.06g)을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=604 [M+H]+.
제2 공정
제1 공정에서 얻은 화합물 159A의 조 생성물(161mg)에 실온에서, 디메틸아민(2M THF 용액, 2.00mL, 4.00mmol)을 가하고, 3일간 교반하였다. 반응액에 포화 식염수(2mL)를 가하고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 159B의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=553 [M+H]+.
제3 공정
제2 공정에서 얻은 화합물 159B의 조 생성물의 DMF(2mL) 용액에 실온에서 염화리튬(56.0mg, 1.32mmol)을 가하고, 마이크로웨이브 조사하에 150℃에서 30분간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 159(33.6mg, 3공정 27%)를 백색 고체로서 얻었다.
참고예 160
제1 공정
화합물 159A의 조 생성물(95.8mg)에 실온에서 메틸아민(2M THF 용액, 2.00mL, 4.00mmol)을 가하고, 3일간 교반하였다. 반응액을 여과하고, 용매를 감압하에 증류 제거하여 얻어진 화합물 160A의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=539 [M+H]+.
제2 공정
화합물 160A의 조 생성물 및 요오드화나트륨(100mg, 0.667mmol)의 아세토니트릴(3mL) 현탁액에 실온에서 클로로트리메틸실란(0.0850mL, 0.665mmol)을 가하고, 5시간 교반하였다. 반응액에 물(1mL)을 가하고, 용매를 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 160(59.8mg, 3공정 84%)을 백색 고체로서 얻었다.
참고예 161
제1 공정
화합물 159A의 조 생성물(156mg), 이미다졸(19.5mg, 0.286mmol) 및 탄산칼륨(37.7mg, 0.273mmol)의 DMF(2mL) 현탁액을 실온에서 4시간 교반한 후, 수소화나트륨(60%, 11.7mg, 0.293mmol)을 가하고 3일간 교반하였다. 반응액에 아세트산 수용액(10%)을 가하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 161A의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=576 [M+H]+.
제2 공정
화합물 161A의 조 생성물에 실온에서 트리플루오로아세트산(1mL)을 가하여 18시간 교반한 후, 60℃에서 3시간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 161(19.8mg, 3공정 16%)을 옅은 오렌지색 비정질로서 얻었다.
참고예 162
제1 공정
화합물 159A의 조 생성물(192mg)의 DMF(2mL) 용액에 실온에서 나트륨아지드(24.2mg, 0.372mmol)를 가하고, 60℃에서 2시간 교반하였다. 반응액을 감압하에 증류 제거하여 얻어진 화합물 162A의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=551 [M+H]+.
제2 공정
화합물 162A의 조 생성물의 THF(4mL) 용액에 실온에서 물(0.200mL) 및 트리페닐포스핀(83.0mg, 0.316mmol)을 순차 가하고, 60℃에서 1시간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 162B(110mg, 3공정 66%)를 무색 유상물로서 얻었다.
MS: m/z=525 [M+H]+.
제3 공정
화합물 162B(50.0mg, 0.0950mmol) 및 요오드화나트륨(56.2mg, 0.375mmol)의 아세토니트릴(1mL) 현탁액에 실온에서 클로로트리메틸실란(0.0490mL, 0.381mmol)을 가하고, 6시간 교반하였다. 반응액에 물(0.5mL)을 가하고, 용매를 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 162(25.9mg, 63%)를 옅은 오렌지색 고체로서 얻었다.
참고예 163
제1 공정
화합물 162B(50.0mg, 0.0950mmol) 및 N,N-디이소프로필에틸아민(0.0366mL, 0.210mmol)의 아세토니트릴(3mL) 용액에 실온에서 아세트산 무수물(0.0100mL, 0.106mmol)을 가하고, 6시간 교반하였다. 반응액을 감압하에 증류 제거하여 얻어진 화합물 163A의 조 생성물을 정제하지 않고, 다음 공정에 이용하였다.
MS: m/z=567 [M+H]+.
제2 공정
화합물 163A의 조 생성물 및 요오드화나트륨(59.2mg, 0.395mmol)의 아세토니트릴(5mL) 현탁액에 실온에서 클로로트리메틸실란(0.0487mL, 0.381mmol)을 가하고, 16시간 교반하였다. 반응액에 물(0.5mL)을 가하고, 용매를 감압하에 증류 제거하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 163(28.1mg, 2공정 62%)을 옅은 오렌지색 폼으로서 얻었다.
참고예 164
제1 공정
화합물 155G(43.3mg, 0.221mmol)를 트리플루오로아세트산(2ml)에 용해시키고, 실온하에 1시간 교반하였다. 용매를 증류 제거하고, 잔사를 디클로로메탄(2ml)에 용해시키고, 포화 중조수로 중화하였다. 얻어진 용액을 시트르산 수용액으로 산성으로 하고, 유기층을 분리하였다. 수층을 디클로로메탄으로 1회 추출하고, 합친 유기층을 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 디이소프로필에테르로 세정하여 22mg(수율 61%)의 화합물 164를 얻었다.
참고예 165
제1 공정
화합물 165A(WO2006/088173, 37.0g, 108mmol)의 DMF(370mL) 용액에 실온에서, 탄산칼륨(17.9g, 129mmol) 및 요오드화메틸(8.03mL, 129mmol)을 순차 가한 후, 1.5시간 교반하였다. 반응액을 염화암모늄(20.8g, 390mmol)의 물(1110mL) 용액에 빙냉하에 가해서 석출된 고체를 여과 취출하고, 수세함으로써 조 생성물(33g)을 얻었다. 또한, 수층을 식염으로 염석한 후, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 잔사로부터 조 생성물(9g)을 얻었다. 조 생성물을 합쳐서 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=50%→100%)로 정제하여 화합물 165B(36.5g, 95%)를 백색 고체로서 얻었다.
제2 공정
화합물 165B(36.5g, 102mmol)의 1,4-디옥산(548mL) 용액에 실온에서, 오스뮴산칼륨 2수화물(1.13g, 3.06mmol), 과요오드산나트륨(87.3g, 408mmol) 및 물(365mmol)을 순차 가한 후, 6시간 교반하였다. 반응액을 염화메틸렌으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=50%→100%)로 정제하여 화합물 165C(33.0g, 90%)를 갈색 폼으로 얻었다.
제3 공정
화합물 165C(1.38g, 3.66mmol)의 톨루엔(25mL) 현탁액에 실온에서, 에틸렌디아민(0.247mL, 3.66mmol) 및 아세트산(0.0210mL, 0.366mmol)을 순차 가한 후, 1시간 교반하고, 50℃에서 17시간 더 교반하였다. 석출된 고체를 여과 취출한 후, 에테르로 세정하여 화합물 165D(1.11g, 100%)를 옅은 황색 고체로서 얻었다.
제4 공정
화합물 165D(2.77g, 7.50mmol), 탄산칼륨(2.23g, 16.1mmol) 및 요오드화나트륨(102mg, 0.680mmol)의 아세토니트릴(30mL) 현탁액에 실온에서, 브로모디페닐메탄(2.26g, 9.14mmol)을 가하고, 90℃에서 7시간 교반하였다. 반응액을 염산(2N, 10mL)과 얼음(20g)에 옮기고, 클로로포름(100mL×2)으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(클로로포름/메탄올=0%→5%)로 정제하여 화합물 165E(2.72g, 68%)를 옅은 황색 고체로서 얻었다.
제5 공정
화합물 165E(2.72g, 5.08mmol)의 에탄올(30mL) 용액에 실온에서, 수산화나트륨 수용액(2N, 10mL)을 가하고, 3일간 교반하였다. 반응액에 실온에서, 염산(1N, 20mL)을 가하고(pH=1), 클로로포름(100mL×2)으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(클로로포름/메탄올=0%→10%)로 정제하여 화합물 165F(1.77g, 67%)를 옅은 황색 고체로서 얻었다.
제6 공정
화합물 165F(1.77g, 3.39mmol) 및 염화리튬(0.515g, 12.2mmol)의 N,N'-디메틸이미다졸리디논(20mL) 용액을 90℃에서 1시간 교반하였다. 반응액에 실온에서, 물(10mL), 염산(2N, 10mL) 및 물(10mL)을 순차 가하였다. 석출된 고체를 여과 취출하고, 에테르로 세정한 후, DMF-물을 가해서 석출된 고체를 여과 취출하여 화합물 165(599mg, 41%)를 백색 고체로서 얻었다.
참고예 166
참고예 165에 따라서, 이하의 화합물 166을 마찬가지의 수법에 의해 합성하였다.
참고예 167
제1 공정
화합물 167A(WO2006/11674, 3.58g, 7.61mmol)의 크실렌(30ml) 용액에 (S)-N1-벤질-3-페닐프로판-1,2-디아민(Journal of the American Chemical Society; English; 127; 30; 2005; 10504, 1.83g, 7.61mmol)과 아세트산(0.5ml)을 가하고, 2시간 환류하였다. 실온까지 냉각한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(9:1, v/v)로 용출하고, 이어서 n-헥산-아세트산에틸(1:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 349mg(수율 7%)의 화합물 167B를 얻었다.
제2 공정
화합물 167B(968mg, 1.47mmol)의 MeCN (10ml) 용액에 Boc2O(3ml)와 DMAP(180mg, 1.47mmol)를 가하고, 5시간 가열 환류시켰다. 반응액에 2규정 수산화나트륨 수용액을 가하여 반응을 정지시키고, 2규정 염산을 이용하여 중화한 후에, 아세트산에틸로 3회 추출하였다. 추출액을 포화 식염수로 세정한 후, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 n-헥산-아세트산에틸(6:4, v/v)로 용출하고, 이어서 아세트산에틸만으로 용출하였다. 목적으로 하는 분획을 농축하여 고체로서 349mg(수율 45%)의 167C를 얻었다.
제3 공정
상기 화합물 167C(150mg, 0.280mmol)를 트리플루오로아세트산(2ml)에 용해시키고, 실온하에 1시간 교반하였다. 용매를 증류 제거하고, 잔사를 디클로로메탄(2ml)에 용해시키고, 포화 중조수로 중화하였다. 얻어진 용액을 시트르산 수용액으로 산성으로 하고, 유기층을 분리하였다. 수층을 디클로로메탄으로 1회 추출하고, 합친 유기층을 수세한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 디이소프로필에테르로 세정하여 71mg(수율 57%)의 화합물 167을 얻었다.
참고예 168
제1 공정
화합물 168A(WO2006/116764, 400mg, 0.840mmol)의 DMF(3mL) 용액에 탄산세슘(821mg, 2.52mmol), 계속해서 브로모메틸렌디벤젠(311mg, 1.26mmol)을 가하고, 100℃에서 5시간 교반하였다. 반응액에 2N 염산 수용액, 물, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 1회 추출하였다. 합친 추출액을 포화 탄산수소나트륨 수용액, 염수로 세정하고, 황산마그네슘으로 건조한 후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 목적으로 하는 분획을 농축하여 황색 오일로서 100mg의 화합물 168B를 얻었다.
제2 공정
화합물 168B(100mg, 0.156mmol)를 아세토니트릴(3mL)에 용해하고, Boc2O(4.0mL, 17.3mmol), 계속해서 DMAP(84mg, 0.69mmol)를 가하고, 80℃에서 6시간 교반하였다. 반응액을 방냉하고, 2N 수산화나트륨 수용액(8mL), 계속해서 에탄올(3mL)을 가하고, 60℃에서 2시간 교반하였다. 반응액에 2N 염산 수용액, 아세트산에틸을 가하여 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-메탄올로 용출하고, 목적으로 하는 분획을 농축하여 84mg의 화합물 168C를 얻었다.
MS: m/z=536.25 [M+H]+.
제3 공정
화합물 168C(80mg, 0.15mmol)의 DMI(2mL) 용액에 염화리튬(19mg, 0.45mmol)을 가하고, 90℃에서 2시간 교반하였다. 반응 혼합물에 물, 2N 염산 수용액을 가해서 석출된 고체를 여과 취출하고, 얻어진 고체를 LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 이소프로필에테르를 가해서 석출된 고체를 여과 취출하였다. 이소프로필에테르로 세정, 건조함으로써, 12mg의 화합물 168을 얻었다.
MS: m/z=446.05 [M+H]+.
참고예 169
제1 공정
화합물 95A(WO2006/116764, 500mg, 2.03mmol)의 에탄올(5mL) 용액에 2,2-디메톡시에탄아민(0.49ml, 4.47mmol)을 가하고, 80℃에서 3시간 교반하였다. 반응액을 방냉한 후, 실온에서 아세트산(0.27ml, 4.69mmol)을 가하고, 감압하에서 농축하였다. 얻어진 잔사를 DMF(5mL)에 용해하고, 질소 분위기하에 DBU(0.66mL, 4.4mmol), 계속해서 요오드화메틸(1.02mL, 16.2mmol)을 가하고, 실온에서 3시간 교반하였다. 반응액에 포화 탄산수소나트륨 수용액, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 여과, 농축하고, 얻어진 잔사를 실리카 겔 크로마토그래피에 의해 정제하였다. 클로로포름-메탄올(9:1)로 용출하고, 목적으로 하는 분획을 농축하여 차색 오일로서 258mg의 화합물 169A를 얻었다.
제2 공정
화합물 169A(1.00g, 2.88mmol)에 포름산(31mL), 계속해서 물(5mL)을 가하고, 70℃에서 6.5시간 교반하였다. 반응 혼합물에 물, 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액을 포화 탄산수소나트륨 수용액으로 세정한 후, 황산나트륨을 가하여 여과, 농축하고, 얻어진 잔사를 실리카 겔 크로마토그래피에 의해 정제하였다. 아세트산에틸-메탄올로 용출하고, 목적으로 하는 분획을 농축하여 무색 투명 유상물로서 알데히드 수화물 및 메틸아세탈의 혼합물을 얻었다. 얻어진 유상물을 디클로로메탄(5mL)에 용해하고, 1,3-디아미노프로판이염산염(354mg, 2.41mmol), 계속해서 아세트산(0.069ml, 1.2mmol)을 가하고, 실온에서 6시간 교반하였다. 반응액을 디클로로메탄으로 희석하고, 불용물을 여과한 후, 감압하에서 농축하여 화합물 169B의 조 정제물을 얻었다.
MS: m/z=326.20 [M+H]+.
제3 공정
화합물 169B(391mg, 1.20mmol)의 아세토니트릴(4mL) 용액에 탄산칼륨(498mg, 3.61mmol), 계속해서 브로모메틸렌디벤젠(890mg, 3.61mmol)을 가하였다. 반응액을 90℃에서 2시간 교반한 후, 반응액에 물, 아세트산에틸, 염수를 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 1회 추출하였다. 합친 추출액을 황산마그네슘으로 건조시킨 후, 여과, 농축하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 아세트산에틸-메탄올로 용출하고, 목적으로 하는 분획을 농축하여 오렌지색 고체로서 106mg의 화합물 169C를 얻었다.
MS: m/z=492.15 [M+H]+.
제4 공정
화합물 169C(105mg, 0.214mmol)의 DMI(2mL) 용액에 염화리튬(27.2mg, 0.641mmol)을 가하고, 90℃에서 3시간 교반하였다. 염화리튬(27.2mg, 0.641mmol)을 더 가하고, 90℃에서 1시간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사를 LCMS 분취 장치를 이용하여 정제하였다. 용출 용매를 증류 제거하고, 잔사에 디에틸에테르를 가해서 석출된 고체를 여과 취출하였다. 디에틸에테르로 세정, 건조함으로써, 27mg의 화합물 169를 얻었다.
참고예 170
제1 공정
화합물 49F(87mg, 0.19mmol)를 에탄올(1ml)과 THF(1ml)에 용해하고, 2규정 수산화나트륨 수용액(0.47ml, 0.95mmol)을 가하고, 실온에서 1.5시간 교반하였다. 반응액에 2규정 염산을 가하고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5→90:10, v/v)로 정제하여 60mg의 화합물 170A를 얻었다.
제2 공정
화합물 170A(57mg, 0.13mmol)에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 3으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 19mg의 화합물 170을 얻었다.
참고예 171
제1 공정
화합물 49B(950mg, 3.35mmol)와 3-아미노프로판-1-올(277mg, 3.69mmol)과 황산나트륨(1.91g, 13.4mmol)을 톨루엔(25ml)에 가하고, 실온에서 1시간 교반하였다. Boc2O(0.856ml, 3.69mmol)를 실온에서 가하고, 그대로 18시간 교반하였다. Boc2O(0.400ml, 1.72mmol)를 실온에서 더 가하고, 그대로 60시간 교반하였다. 반응액을 여과하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고무상 물질로서 171A를 1.02g 얻었다.
제2 공정
화합물 171A(1.01g, 2.29mmol)와 팔라듐-활성탄소(10%, 습윤, 200mg)를 에탄올(20ml)에 가하고, 수소 분위기하에 실온에서 1.5시간 교반하였다. 셀라이트 여과한 후, 용매를 감압 농축하여 무색 오일상 물질 171B를 755mg 얻었다.
제3 공정
디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(660mg, 1.99mmol)와 171B(609mg, 1.99mmol)를 톨루엔(8ml)에 가하고, 100℃에서 1.5시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 99:1, v/v)로 정제하여 담황색 고무상 물질로서 1.02g의 화합물 171C를 얻었다.
제4 공정
화합물 171C(991mg, 1.60mmol)에 4규정 HCl(아세트산에틸 용액, 12ml)을 가하였다. 실온에서 1시간 교반한 후, 용매를 감압증류 제거하였다. 계속해서 톨루엔(12ml)과 3-아미노프로판-1-올(0.244ml, 3.19mmol)을 가하고, 80℃에서 10분 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 99:1→95:5→90:10, v/v)로 정제하여, 황색 고무상 물질의 화합물 171D 341mg과 무색 고체의 화합물 171E 338mg을 얻었다.
제5 공정
화합물 171D(329mg, 0.673mmol)를 에탄올(2ml)과 THF(4ml)에 용해하고, 2규정 수산화나트륨 수용액(1.69ml, 3.38mmol)을 가하고, 실온에서 1시간 교반하였다. 반응액에 2규정 염산을 가하고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압 농축함으로써, 무색 고체로서 215mg의 화합물 171F를 얻었다.
MS: m/z=461 [M+H]+.
제6 공정
화합물 171F(50mg, 0.11mmol)에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 24mg의 화합물 171을 얻었다.
참고예 172
참고예 171에 따라서, 화합물 171E를 이용하여 화합물 172를 마찬가지의 수법에 의해 합성하였다.
참고예 173
제1 공정
화합물 171F(159mg, 0.345mmol)를 디페닐에테르(2.5ml)에 가하고, 마이크로웨이브 조사하에 245℃에서 1시간 교반하였다. 반응액을 n-헥산에 옮기고, 석출된 고체를 여과 취출하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 95:5→90:10, v/v)로 정제하여 화합물 173A를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 173A에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 10mg의 화합물 173을 얻었다.
참고예 174
참고예 173에 따라서, 화합물 174를 마찬가지의 수법에 의해 합성하였다.
참고예 175
제1 공정
데스-마틴 퍼아이오디난(0.3M, 염화메틸렌 용액, 25.0ml, 7.50mmol)에 화합물 2B(1.98g, 5.48mmol)의 염화메틸렌 용액(10ml)을 0℃에서 적하하였다. 실온에서 3시간 교반한 후, 1규정 수산화나트륨 수용액에 옮기고, 에틸에테르로 추출하였다. 유기층을 1규정 수산화나트륨 수용액과 포화 식염수로 세정하고, 황산마그네슘으로 건조하였다. 용매를 감압증류 제거한 후, 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 2:1, v/v)로 정제하여 백색 고체로서 화합물 175A를 1.73g 얻었다.
제2 공정
화합물 175A(1.30g, 4.59mmol)와 3-아미노프로판-1-올(379mg, 5.05mmol)과 황산나트륨(3.26g, 22.4mmol)을 톨루엔(40ml)에 가하고, 실온에서 1시간 교반하였다. Boc2O(1.17ml, 5.05mmol)를 실온에서 가하고, 그대로 18시간 교반하였다. Boc2O(1.17ml, 5.05mmol)와 황산나트륨(3.26g, 22.4mmol)을 가하고, 60시간 교반하였다. 반응액을 여과하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 무색 고체로서 175B를 635mg 얻었다.
제3 공정
화합물 175B(632mg, 1.22mmol)와 팔라듐-활성탄소(10%, 습윤, 100mg)를 에탄올(10ml)과 THF(5ml)에 가하고, 수소 분위기하에 실온에서 3시간 교반하였다. 셀라이트 여과한 후, 용매를 감압 농축하여 무색 오일상 물질 175C를 502mg 얻었다.
제4 공정
디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(390mg, 1.22mmol)와 175C(468mg, 1.22mmol)를 톨루엔(5ml)에 가하고, 100℃에서 2시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸, 1:1, v/v)로 정제하여 담황색 고무상 물질로서 391mg의 화합물 175D를 얻었다.
제5 공정
화합물 175D(388mg, 0.568mmol)에 4규정 HCl(아세트산에틸 용액, 4ml)을 가하였다. 실온에서 1시간 교반한 후, 용매를 감압증류 제거하였다. 계속해서 톨루엔(4ml)과 3-아미노프로판-1-올(0.0870ml, 1.14mmol)을 가하고, 80℃에서 5시간 교반하였다. 용매를 감압증류 제거한 후, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 98:2, v/v)로 정제하여, 황색 고무상 물질의 화합물 175E 57mg과 차색 고무상 물질의 화합물 175F 44mg을 얻었다.
제6 공정
화합물 175E(57mg, 0.10mmol)를 THF(0.5ml)와 에탄올(0.5ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(0.25ml, 0.50mmol)을 가하고, 그대로 1시간 교반하였다. 1규정 염산을 가하고 나서 클로로포름으로 추출한 후, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 98:2, v/v)로 정제하여 화합물 175G를 얻었다.
제7 공정
제6 공정에서 얻어진 화합물 175G에 트리플루오로아세트산(1ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 3으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 클로로포름-메탄올-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 11mg의 화합물 175를 얻었다.
참고예 176
참고예 175에 따라서, 화합물 175F를 이용하여 화합물 176을 마찬가지의 수법에 의해 합성하였다.
참고예 177
제1 공정
문헌(Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry(1972-1999), 1975, p.1712)의 방법에 따라서 합성한 tert-부틸 피라졸리딘-1-카르복실레이트(275mg, 1.60mmol)와 화합물 95B(409mg, 1.45mmol)를 피리딘(5ml)에 용해하고, 실온에서 HATU(607mg, 1.60mmol)를 가하고, 그대로 18시간 교반하였다. 반응액을 1규정 염산에 옮기고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5, v/v)로 정제하여 황색 고체로서 529mg의 화합물 177A를 얻었다.
제2 공정
화합물 177A(525mg, 1.31mmol)에 4규정 HCl(디옥산 용액, 6ml)을 가하였다. 실온에서 1.5시간 교반한 후, 용매를 감압증류 제거하여 무색 고체의 화합물 177B 413mg을 얻었다.
제3 공정
화합물 177B(100mg, 0.298mmol)를 에탄올(2ml)에 가하고, 2,2-디페닐아세트알데히드(58mg, 0.30mmol)와 트리에틸아민(0.083ml, 0.596mmol)과 아세트산(0.051ml, 0.89mmol)을 가하고, 80℃에서 3시간 교반하였다. 반응액을 물에 옮기고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올, 97:3→95:5→93:7→90:10, v/v)로 정제하여 황색 고무상 물질로서 106mg의 화합물 177C를 얻었다.
MS: m/z=478 [M+H]+.
제4 공정
제3 공정에서 얻어진 화합물 177C에 트리플루오로아세트산(2ml)을 가하고, 실온에서 1시간 교반하였다. 감압 농축한 후, 중조수와 2규정 염산으로 pH를 6으로 조절하고, 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거한 후, 염화메틸렌-에틸에테르를 가해서 석출된 고체를 여과 취출하여 무색 고체로서 7mg의 화합물 177을 얻었다.
참고예 178
참고예 177에 따라서, 화합물 178을 마찬가지의 수법에 의해 합성하였다.
참고예 179
참고예 177에 따라서, 화합물 179를 마찬가지의 수법에 의해 합성하였다.
참고예 180
참고예 177에 따라서, 화합물 180을 마찬가지의 수법에 의해 합성하였다.
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 할라이드를 이용하여 참고예 12의 방법에 준해서 참고예 181 내지 187을 합성하였다.
참고예 181
참고예 182
참고예 183
참고예 184
참고예 185
참고예 186
참고예 187
참고예 188
참고예 12 및 참고예 129에 따라서, 화합물 188을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=449 [M+H]+.
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 할라이드를 이용하여 참고예 95의 방법에 준해서 참고예 189 내지 229를 합성하였다.
참고예 189
참고예 190
참고예 191
참고예 192
참고예 193
참고예 194
참고예 195
참고예 196
참고예 197
참고예 198
참고예 199
참고예 200
참고예 201
참고예 202
참고예 203
참고예 204
참고예 205
참고예 206
참고예 207
참고예 208
참고예 209
참고예 210
참고예 211
참고예 212
참고예 213
참고예 214
참고예 215
참고예 216
참고예 217
참고예 218
참고예 219
참고예 220
참고예 221
참고예 222
참고예 223
참고예 224
참고예 225
참고예 226
참고예 227
참고예 228
참고예 229
참고예 230
참고예 128에 따라서, 화합물 230을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=461 [M+H]+.
참고예 231
참고예 129에 따라서, 화합물 231을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=420 [M+H]+.
참고예 232
참고예 129에 따라서, 화합물 232를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=434 [M+H]+.
참고예 233
참고예 130에 따라서, 화합물 233을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=433 [M+H]+.
참고예 234
참고예 130에 따라서, 화합물 234를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=447 [M+H]+.
참고예 235
참고예 130에 따라서, 화합물 235를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=473 [M+H]+.
참고예 236
참고예 130에 따라서, 화합물 236을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=447 [M+H]+.
참고예 237
참고예 130에 따라서, 화합물 237을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=487 [M+H]+.
참고예 238
참고예 130에 따라서, 화합물 238을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=509 [M+H]+.
참고예 239
참고예 157에 따라서, 화합물 239를 마찬가지의 수법에 의해 합성하였다.
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 알코올을 이용하여 참고예 107의 방법에 준해서 참고예 240 내지 245를 합성하였다.
참고예 240
참고예 241
참고예 242
참고예 243
참고예 244
참고예 245
참고예 246
제1 공정
화합물 246A(5.30g, 18.76mmol)와 탄산칼륨(5.19g, 27.53mmol)의 디메틸포름아미드(20ml) 용액에 벤질 브로마이드(3.21g, 18.76mmol)를 가하고, 실온하에 1시간 교반하였다. 반응액에 아세트산에틸(80ml)을 가하고, 불용물을 여과 제거한 후, 1규정 염산을 가하였다. 유기층을 분리하고, 수조를 아세트산에틸로 2회 추출하였다. 합친 유기층을 1회 수세하고, 중조수, 포화 식염수로 1회씩 더 세정하였다. 얻어진 용액을 황산나트륨으로 건조한 후, 용매를 증류 제거하여 유상물로서 6.98g의 화합물 246B를 얻었다.
제2 공정
화합물 246B(3g, 8.05mmol)와 1-클로로-3-에티닐벤젠(1.32g, 9.66mmol)과 트리에틸아민(4.07g, 40.25mmol)의 디메틸포름아미드(15ml) 용액에 질소 분위기하에서 염화구리(76.6mg, 0.403mmol)와 디클로로비스(트리페닐포스핀)팔라듐(282.5mg, 0.403mmol)을 가하고, 실온에서 5시간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 3회 수세한 후, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 헥산으로 용출하고, 이어서 헥산-아세트산에틸(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 3.10g의 화합물 246C를 얻었다.
제3 공정
화합물 246C(3.10g, 8.05mmol)의 메탄올(30ml) 용액에 10% 팔라듐카본(620mg, 20중량%)을 가하고, 실온하에 1기압 수소 분위기하에서 교반하였다. 반응액을 셀라이트 여과하고, 용매를 증류 제거하고, 얻어진 조 생성물에 아세트산에틸-디이소프로필에테르를 가해서 석출된 잔사를 여과하여, 고체로서 618mg의 화합물 246D를 얻었다.
제4 공정
화합물 246D(2.20g, 7.45mmol)에 폴리인산(20g)을 가하고, 200℃에서 1시간 교반하였다. 실온까지 방냉한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 포화 중조수로 1회 세정하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 헥산으로 용출하고, 이어서 헥산-아세트산에틸(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 1.05g의 화합물 246E를 얻었다.
제5 공정
수소화붕소나트륨(409mg, 10.82mmol)의 메탄올(10ml) 현탁액을 1 내지 3℃로 냉각하고, 상기 온도를 유지하면서 화합물 246E(1.0g, 3.61mmol)를 가하였다. 반응액을 동일 온도에서 30분간 교반한 후, 물을 가하였다. 석출된 고체를 여과 취출하여 968mg의 화합물 246F를 얻었다.
제6 공정
참고예 107에 따라서, 화합물 246을 마찬가지의 수법에 의해 합성하였다.
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 246A-F에 상당하는 중간체를 이용하여 참고예 246의 방법에 준해서 화합물 247 내지 284를 합성하였다.
참고예 247
참고예 248
참고예 249
참고예 250
참고예 251
참고예 252
참고예 253
참고예 254
참고예 255
참고예 256
참고예 257
참고예 258
참고예 259
참고예 260
참고예 261
참고예 262
참고예 263
참고예 264
참고예 265
참고예 266
참고예 267
참고예 268
참고예 269
참고예 270
참고예 271
참고예 272
참고예 273
참고예 274
참고예 275
참고예 276
참고예 277
참고예 278
참고예 279
참고예 280
참고예 281
참고예 282
참고예 283
참고예 284
참고예 285
제1 공정
화합물 285A(5.00g, 29.3mmol)를 디메틸포름아미드(150ml)에 용해하고, 탄산칼륨(14.2mmol)과 요오드에탄(7.11ml, 88.0mmol)을 가하고, 실온에서 2시간 교반하였다. 반응액에 헥산을 가하고, 물과 포화 식염수로 세정하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압증류 제거함으로써 무색 오일상 물질 285B를 얻었다.
제2 공정
제1 공정에서 얻어진 285B(5.63g, 28.3mmol)를 사염화탄소(150ml)에 용해하고, N-브로모숙신이미드(5.55g, 31.2mmol)를 가하고, 100℃에서 18시간 교반하였다. 반응액을 실온까지 식힌 후, 물과 포화 식염수로 세정하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압증류 제거하여 8.08g의 오렌지색 오일상 물질 285C를 얻었다.
제3 공정
제2 공정에서 얻어진 285C(2.17g, 7.8mmol)를 아세톤(25ml)에 용해하고, 4-플루오로벤젠티올(1.00g, 7.80mmol)과 탄산칼륨(1.62g, 11.7mmol)을 가하고, 80℃에서 18시간 교반하였다. 실온까지 식힌 후, 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 포화 식염수로 세정하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(4:1, v/v)로 용출함으로써 정제하여 2.20g의 무색 오일상 물질 285D를 얻었다.
제4 공정
제3 공정에서 얻어진 285D(2.20g, 6.77mmol)를 에탄올(20ml)에 용해하고, 2규정 수산화나트륨 수용액(16.9ml, 33.8mmol)을 가하고, 실온에서 3시간 교반하였다. 반응액에 물을 가하고, 희염산으로 산성으로 하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정하고, 황산나트륨으로 건조하고, 용매를 감압증류 제거하였다. 얻어진 화합물에 n-헥산을 가해서 석출된 잔사를 여과하여 1.81g의 백색 고체 285E를 얻었다.
제5 공정
제4 공정에서 얻어진 285E(1.81g, 6.10mmol)에 폴리인산(10.0g)을 가하고, 120℃에서 5시간 교반하였다. 실온까지 식힌 후, 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압 농축함으로써 얻어진 화합물에 n-헥산-아세트산에틸을 가해서 석출된 잔사를 여과하여 1.18g의 백색 고체 285F를 얻었다.
제6 공정
화합물 285F(1.17g, 4.20mmol)에 메탄올(15ml)을 가하고, 0℃에서 수소화붕소나트륨(191mg, 5.04mmol)을 가하고, 실온에서 2시간 교반하였다. 반응액을 물에 옮기고, 디클로로메탄으로 추출하고, 유기층을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 화합물에 n-헥산-디클로로메탄을 가해서 석출된 잔사를 여과하여 945mg의 백색 고체 285G를 얻었다.
제7 공정
참고예 107과 마찬가지의 수법에 의해 화합물 285를 합성하였다.
MS: m/z=486 [M+H]+
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 285A 내지 285G에 상당하는 중간체를 이용하여 참고예 285의 방법에 준해서 화합물 286 내지 359를 합성하였다.
참고예 286
참고예 287
참고예 288
참고예 289
참고예 290
참고예 291
참고예 292
참고예 293
참고예 294
참고예 295
참고예 296
참고예 297
참고예 298
참고예 107에 따라서, 화합물 298을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=452 [M+H]+.
참고예 299
참고예 300
참고예 301
참고예 302
참고예 303
참고예 304
참고예 305
참고예 306
참고예 307
참고예 308
참고예 309
참고예 310
참고예 311
참고예 312
참고예 313
참고예 314
참고예 315
참고예 316
참고예 317
참고예 318
참고예 319
참고예 320
참고예 321
참고예 322
참고예 323
참고예 324
참고예 325
참고예 326
참고예 327
참고예 328
참고예 329
참고예 330
참고예 331
참고예 332
참고예 333
참고예 334
참고예 335
참고예 336
참고예 337
참고예 338
참고예 339
참고예 340
참고예 341
참고예 342
참고예 343
참고예 344
참고예 345
참고예 346
참고예 347
참고예 348
참고예 349
참고예 350
참고예 351
참고예 352
참고예 353
참고예 354
참고예 355
참고예 356
참고예 357
참고예 358
참고예 359
참고예 360
화합물 325(46.0mg, 0.0960mmol)를 메탄올(0.5ml)과 테트라히드로푸란(0.5ml)에 용해하고, 2규정 수산화나트륨 수용액(0.241ml, 0.482mmol)을 가하고, 30분 교반하였다. 반응액에 희염산을 가하여 산성으로 하고, 클로로포름으로 추출하였다. 유기층을 황산나트륨으로 건조하고, 반응액을 감압 농축하였다. 얻어진 화합물 360에 n-헥산-디에틸에테르를 가해서 석출된 잔사를 여과하여 33mg의 백색 고체를 얻었다.
참고예 107, 246, 285에 준하여 합성한 에스테르체를 참고예 320의 방법에 준해서 화합물 361 내지 382를 합성하였다.
참고예 361
참고예 362
참고예 363
참고예 364
참고예 365
참고예 366
참고예 367
참고예 368
참고예 369
참고예 370
참고예 371
참고예 372
참고예 373
참고예 374
참고예 375
참고예 376
참고예 377
참고예 378
참고예 379
참고예 380
참고예 381
참고예 382
참고예 383
제1 공정
화합물 383A(1.00g, 4.42mmol)를 디클로로메탄(50ml)에 용해하고, 0℃에서 mCPBA(2.67g, 15.5mmol)를 가하고, 실온에서 4시간 교반하였다. 반응액에 아황산나트륨 수용액을 가하고, 디클로로메탄으로 추출하였다. 유기층을 탄산수소나트륨 수용액으로 세정하고, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 화합물에 n-헥산-디클로로메탄을 가해서 석출된 잔사를 여과하여 1.06g의 백색 고체 383B를 얻었다.
제2 공정
화합물 383B(1.05g, 4.07mmol)에 메탄올(11ml)을 가하고, 0℃에서 수소화붕소나트륨(185mg, 4.88mmol)을 가하고, 실온에서 30분 교반하였다. 반응액을 물에 옮기고, 디클로로메탄으로 추출하고, 유기층을 황산나트륨으로 건조하고 용매를 증류 제거하였다. 얻어진 화합물에 n-헥산-디클로로메탄을 가해서 석출된 잔사를 여과하여 1.01g의 백색 고체 383C를 얻었다.
제3 공정
참고예 107에 따라서, 화합물 383을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=466 [M+H]+.
시판 또는 문헌 기지의 383A-C에 상당하는 중간체를 이용하여 참고예 383의 방법에 준해서 화합물 384 내지 389를 합성하였다.
참고예 384
참고예 385
참고예 386
참고예 387
참고예 388
참고예 389
참고예 390
제1 공정
화합물 390A(14.8g, 115mmol)을 메탄올(200ml)에 가하고, 실온에서 나트륨메톡시드(28% 메탄올 용액, 22.2g, 115mmol)를 가하고, 실온에서 1시간 교반하였다. 용매를 감압증류 제거하여 17.3g의 백색 고체를 얻었다. 그 중의 5.61g에 프탈라이드(5.00g, 37.3mmol)를 가하고, 200℃에서 1시간 교반하였다. 반응액을 물에 옮기고, 염산으로 산성으로 하고, 생긴 백색 침전을 여과 취출하였다. 클로로포름에 용해하고, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 화합물에 n-헥산-클로로포름-디이소프로필에테르를 가해서 석출된 잔사를 여과하여 2.44g의 묽은 차색 고체 390B를 얻었다.
제2 공정
화합물 390B(2.44g, 9.29mmol)를 디클로로메탄(30ml)에 용해하고, 트리플루오로아세트산 무수물(1.44ml, 10.2mmol)과 보론트리플루오리드에테레이트(0.235ml, 1.86mmol)를 가하고, 실온에서 3시간 교반하였다. 반응액을 물에 옮기고, 디클로로메탄으로 추출하고, 유기층을 1규정 염산과 포화 식염수로 세정하고, 용매를 증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(4:1, v/v)로 용출함으로써 정제하여 1.76g의 담황색 고체 390C를 얻었다.
제3 공정
화합물 390C(1.76g, 7.19mmol)에 메탄올(20ml)을 가하고, 0℃에서 수소화붕소나트륨(327mg, 8.63mmol)을 가하고, 실온에서 30분 교반하였다. 반응액을 물에 옮기고, 디클로로메탄으로 추출하고, 유기층을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 화합물에 n-헥산-디클로로메탄을 가해서 석출된 잔사를 여과하여 1.44g의 백색 고체 390D를 얻었다.
제4 공정
참고예 107과 마찬가지의 수법에 의해 화합물 390을 합성하였다.
MS: m/z=452 [M+H]+
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 390A 내지 D에 상당하는 중간체를 이용하여 참고예 390의 방법에 준해서 화합물 391 내지 412를 합성하였다.
참고예 391
참고예 392
참고예 393
참고예 394
참고예 395
참고예 396
참고예 397
참고예 398
참고예 399
참고예 400
참고예 401
참고예 402
참고예 403
참고예 404
참고예 405
참고예 406
참고예 407
참고예 408
참고예 409
참고예 410
참고예 411
참고예 412
참고예 413, 참고예 414
제1 공정
참고예 95와 마찬가지의 수법으로 얻은 화합물 413A(200mg, 0.544mmol)와 6,11-디히드로디벤조[b,e]티에핀-11-올(124mg, 0.554mmol)을 아세트산(8ml)에 용해하고, 수냉하에서 농황산(2ml)을 적하하였다. 실온에서 30분 교반한 후, 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압증류 제거하여 413B의 조 생성물을 얻었다.
제2 공정
제1 공정에서 얻어진 413B를 디클로로메탄(2ml)에 용해하고, 무수 아세트산(0.154ml, 1.63mmol)과 트리에틸아민(0.226ml, 1.63mmol)과 4-(디메틸아미노)피리딘(cat.)을 가하고, 실온에서 30분 교반하였다. 용매를 증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하여 부분입체이성체를 분할하였다. 각각 메탄올(1ml)과 테트라히드로푸란(1ml)에 용해하고, 2규정 수산화나트륨 수용액(0.198ml, 0.397mmol)을 가하고, 실온에서 30분 교반하였다. 반응액을 물에 옮기고, 염산으로 산성으로 하고, 아세트산에틸로 추출하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압증류 제거하였다. 얻어진 화합물에 아세트산에틸-디에틸에테르를 가하고, 분별 석출된 잔사를 여과하여 각각 화합물 413(22mg)과 화합물 414(20mg)를 얻었다.
참고예 413
참고예 414
MS: m/z=488 [M+H]+
참고예 413에 따라서, 마찬가지의 수법을 이용하여 화합물 414 내지 475를 합성하였다.
참고예 415
참고예 416
참고예 417
참고예 418
참고예 419
참고예 420
참고예 421
참고예 422
참고예 423
참고예 424
참고예 425
참고예 426
참고예 427
참고예 428
참고예 429
참고예 430
참고예 431
참고예 432
참고예 433
참고예 434
참고예 435
참고예 436
참고예 437
참고예 438
참고예 439
참고예 440
참고예 441
참고예 442
참고예 443
참고예 444
참고예 445
참고예 446
참고예 447
참고예 448
참고예 449
참고예 450
참고예 451
참고예 452
참고예 453
참고예 454
참고예 455
참고예 456
참고예 457
참고예 458
참고예 459
참고예 460
참고예 461
참고예 462
참고예 463
참고예 464
참고예 465
참고예 466
참고예 467
참고예 468
참고예 469
참고예 470
참고예 471
참고예 472
참고예 473
참고예 474
참고예 475
참고예 476
제1 공정
참고예와 마찬가지의 수법으로 합성한 476A(3.00g, 9.83mmol)를 디메틸포름아미드(30ml)에 용해하고, 시안화구리(I)(2.64g, 29.5mmol)를 가하고, 150℃에서 7시간 교반하였다. 반응액을 실온까지 식히고, 셀라이트 여과하였다. 여액에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 물로 세정하였다. 용매를 감압증류 제거함으로써 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(1:1, v/v)로 용출함으로써 정제하였다. 얻어진 화합물에 n-헥산을 가해서 석출된 잔사를 여과하여 1.81g의 백색 고체 476B를 얻었다.
제2 공정
참고예 107과 마찬가지의 수법에 의해 화합물 476을 합성하였다.
참고예 477
제1 공정
화합물 476B(859mg, 3.42mmol)에 농황산(13ml)을 가하고, 실온에서 18시간, 60℃에서 2시간 교반하였다. 반응액을 물에 가하고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압 농축함으로써, 387mg의 담황색 고체를 얻었다. 얻어진 화합물에 메탄올(10ml)을 가하고, 10규정 수산화나트륨 수용액(6ml)을 가하고 90℃에서 5시간 교반하였다. 반응액을 실온까지 식히고, 물을 가하고 디클로로메탄으로 세정하였다. 수층에 희염산을 가하고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압 농축하여 296mg의 황색 고체 477A를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 477A(179mg, 0.662mmol)를 디클로로메탄(4ml)에 용해하고, 디메틸아민염산염(108mg, 1.32mmol)과 EDCI(190mg, 0.993mmol)와 1H-벤조[d][1,2,3]트리아졸-1-올(89.0mg, 0.662mmol)과 트리에틸아민(0.3ml)을 가하고, 실온에서 2시간 교반하였다. 반응액에 물을 가하고 아세트산에틸로 추출하고, 유기층을 탄산수소나트륨 수용액으로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(1:1, v/v)로 용출함으로써 정제하여 170mg의 무색 고무상 물질 477B를 얻었다.
제3 공정
참고예 107과 마찬가지의 수법에 의해 화합물 477을 합성하였다.
MS: m/z=559 [M+H]+
참고예 478
제1 공정
화합물 277(971mg, 2.11mmol)을 디메틸포름아미드(10ml)에 용해하고, 탄산세슘(2.75g, 8.45mmol)과 벤질 브로마이드(0.753ml, 6.34mmol)를 가하고, 실온에서 4시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 유기층을 물로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 화합물에 디클로로메탄-디에틸에테르를 가해서 석출된 잔사를 여과하여 740mg의 백색 고체 478A를 얻었다.
제2 공정
478A(740mg, 1.35mmol)를 테트라히드로푸란(7ml)과 메탄올(7ml)에 용해하고, 2규정 수산화나트륨 수용액(3.37ml, 6.73mmol)을 가하고, 실온에서 30분 교반하였다. 반응액에 희염산을 가하여 산성으로 하고, 클로로포름으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압 농축함으로써 618mg의 백색 고체 478B를 얻었다.
MS: m/z=508 [M+H]+
제3 공정
478B(505mg, 0.995mmol)를 테트라히드로푸란(10ml)에 용해하고, 트리페닐포스핀(391mg, 1.49mmol)과 프탈이미드(220mg, 1.49mmol)와 아조디카르복실산 디이소프로필에스테르(0.290ml, 1.49mmol)를 가하고, 실온에서 1시간 교반하였다. 반응액을 감압 농축하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 얻어진 화합물에 디클로로메탄-디에틸에테르를 가해서 석출된 잔사를 여과하여 578mg의 백색 고체 478C를 얻었다.
MS: m/z=637 [M+H]+
제4 공정
478C(667mg, 1.05mmol)에 에탄올(10ml)을 가하고, 히드라진 수화물(0.254ml, 5.24mmol)을 가하고, 90℃에서 2시간 교반하였다. 반응액을 실온까지 식히고, 클로로포름을 가하여 불용물을 여과해서 제거하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 얻어진 화합물에 디클로로메탄-디에틸에테르를 가해서 석출된 잔사를 여과하여 462mg의 백색 고체 478D를 얻었다.
MS: m/z=507 [M+H]+
제5 공정
478D(100mg, 0.197mmol)에 포름산(1.0ml)과 포르말린 수용액(1.0ml)을 가하고, 80℃에서 1시간 교반하였다. 반응액에 1규정 수산화나트륨 수용액을 가하고, 디클로로메탄으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하여 56mg의 무색 오일상 물질을 얻었다. 이 화합물을 아세트산(2.0ml)에 용해하고, 농황산(0.5ml)을 적하해서 가하고, 실온에서 30분 교반하였다. 반응액을 탄산수소나트륨 수용액에 옮기고, 클로로포름으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물에 디클로로메탄-아세트산에틸-디에틸에테르를 가해서 석출된 잔사를 여과하여 12mg의 백색 고체 478을 얻었다.
MS: m/z=445 [M+H]+
참고예 479
제1 공정
참고예 95에 준하여 합성한 화합물 479A(5.25g, 11.8mmol), DIPEA(6.20mL, 35.5mmol) 및 Boc2O(5.17g, 23.7mmol)의 디클로로메탄(50mL) 용액에 DMAP(434mg, 3.55mmol)를 가하고, 실온에서 4시간 교반하였다. 반응액을 감압하에서 농축한 후, 잔류물을 아세트산에틸에 용해하였다. 순차적으로, 0.5규정 염산 수용액, 포화 식염수로 세정한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(97:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 5.22g의 화합물 479B를 얻었다.
MS: m/z=544 [M+H]+.
제2 공정
빙냉하의 화합물 479B(29.7g, 102mmol)와 아세트산(29.7g, 102mmol)의 THF(340mL) 용액에 TBAF(1M THF 용액, 23.6g, 310mmol)를 가하고, 실온에서 16시간 교반하였다. 반응액에 아세트산에틸 및 물을 가하여 아세트산에틸층을 분리하고, 물로 세정한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 디클로로메탄-에테르를 가함으로써 고화시켜, 2.76g의 화합물 479C를 얻었다.
MS: m/z=430 [M+H]+.
제3 공정
화합물 479C(500mg, 1.16mmol)의 아세트산에틸(20mL) 현탁액에 IBX(652mg, 2.33mmol)를 가하고, 3시간 가열, 교반하였다. 반응액을 아세트산에틸로 희석한 후, 불용물을 여과 제거하여 얻어진 여액을 순차적으로 1규정 수산화나트륨 수용액, 물로 세정한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하여 얻어진 유상물을 THF(5mL)에 용해시킨 후, 빙냉하에 디메틸아민(2M THF 용액, 0.873mL, 1.75mmol)과 NaBH(OAc)3(370mg, 1.75mmol)을 가하고, 실온하에 1.5시간 교반하였다. 빙냉하에 반응액에 2규정 염산 수용액을 가한 후, 탄산수소나트륨 수용액으로 염기성으로 하였다. 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(93:7, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 비정질로서 437mg의 화합물 479D를 얻었다.
MS: m/z=457 [M+H]+.
제4 공정
화합물 479D(430mg, 0.942mmol)를 아세트산(10mL)에 용해하여 1시간 가열, 교반하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(95:5, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 330mg의 화합물 479E를 얻었다.
MS: m/z=357 [M+H]+.
제5 공정
화합물 479E(50mg, 0.140mmol)와 디벤조수베롤(29.5mg, 0.140mmol)의 아세트산(2mL) 용액에 황산(0.5mL)을 적하하고, 30분간 교반하였다. 반응액에 아세트산에틸과 물을 가한 후, 수층을 분리하고, 탄산수소나트륨 수용액으로 중화하였다. 아세트산에틸층을 이용하여 추출하고, 물로 세정한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 에테르를 가함으로써 고화시켜, 17.0mg의 화합물 479를 얻었다.
MS: m/z=354 [M+H]+.
참고예 478 또는 참고예 479에 따라서, 마찬가지의 수법을 이용하여 참고예 480 내지 490을 합성하였다.
참고예 480
참고예 481
참고예 482
참고예 483
참고예 484
참고예 485
참고예 486
참고예 487
참고예 488
참고예 489
참고예 490
참고예 491
참고예 65 및 참고예 107에 따라서, 화합물 491을 마찬가지의 수법에 의해 합성하였다.
참고예 492
참고예 65 및 참고예 107에 따라서, 화합물 492를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=478 [M+H]+
참고예 493
제1 공정
화합물 493A(258mg, 1.30mmol)의 디클로로메탄(5mL) 용액을 -50℃로 냉각하고, 동일 온도를 유지하면서 DIBAL-H의 톨루엔 용액(1M, 1.96mL)을 5분에 걸쳐 적하하였다. 반응액을 동일 온도에서 1시간 교반한 후, 실온으로 승온하여 2.5시간 교반하였다. 반응액에 포화 염화암모늄 수용액을 가한 후, 실온에서 1시간 교반하고, 불용물을 여과에 의해 제거하였다. 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 3회 수세하고, 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 148mg의 화합물 493B를 얻었다.
제2 공정
참고예 177에 따라서, 화합물 493을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=410 [M+H]+
시판 또는 문헌 기지의 알데히드 및 시판 또는 문헌 기지의 히드라진을 이용해서 참고예 493에 따라 화합물 494 내지 505를 합성하였다.
참고예 494
참고예 495
참고예 496
참고예 497
참고예 498
참고예 499
참고예 500
참고예 501
참고예 502
참고예 503
참고예 504
참고예 505
참고예 506
화합물 65B를 이용하여 참고예 177에 따라서, 화합물 506을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=470 [M+H]+.
참고예 507
화합물 506을 이용하여 참고예 65에 따라서, 화합물 507을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=446 [M+H]+.
참고예 508
제1 공정
참고예 491의 합성 중간체인 508A(261mg, 0.475mmol)를 디메틸포름아미드(3ml)에 용해하고, 0℃에서 트리에틸아민(0.132ml, 0.950mmol)과 클로로포름산에틸(0.0910ml, 0.950mmol)을 가하고, 실온에서 20분 교반하였다. 수소화붕소나트륨(71.9mg, 1.90mmol)의 수용액(0.5ml)을 0℃에서 가하고 그대로 30분 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 디에틸에테르를 가해서 석출된 잔사를 여과하여 107mg의 백색 고체 508B를 얻었다.
MS: m/z=536 [M+H]+
제2 공정
제1 공정에서 얻어진 508B(100mg, 0.187mmol)를 디클로로메탄(1ml)에 용해하고, 0℃에서 DAST(33.1mg, 0.205mmol)를 가하고, 그대로 30분 교반하였다. 반응액을 물에 옮기고, 클로로포름으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하여, 28mg의 담황색 고무상 물질 508C를 얻었다.
MS: m/z=538 [M+H]+
제3 공정
제2 공정에서 얻어진 508C에 아세트산(2ml)과 농황산(0.5ml)을 가하고, 실온에서 20분 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 디에틸에테르를 가해서 석출된 잔사를 여과하여 4.5mg의 백색 고체 508을 얻었다.
MS: m/z=448 [M+H]+
참고예 509
참고예 508에 따라서, 화합물 509를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=466 [M+H]+
참고예 510
제1 공정
화합물 510A(36.8g, 259mmol)를 디메틸포름아미드(380ml)에 용해하고, 탄산칼륨(39.3g, 285mmol)과 벤질브로마이드(30.7ml, 259mmol)를 가하고, 80℃에서 8시간 교반하였다. 실온으로 식히고, 불용물을 여과해서 제거하고, 용매를 감압증류 제거하였다. 물을 가해서 석출된 잔사를 여과하고, 감압하에서 건조하여 46.21g의 묽은 차색 고체 510B를 얻었다.
제2 공정
제1 공정에서 얻어진 화합물 510B(4.79g, 20.6mmol)에 디클로로메탄(70ml)을 가하고, 트리에틸아민(4.29ml, 30.9mmol)과 메탄술포닐클로라이드(1.93ml, 24.8mmol)를 0℃에서 가하고, 그대로 30분 교반하였다. 반응액을 포화 식염수에 옮기고, 디클로로메탄으로 추출하고, 황산나트륨으로 건조하고, 용매를 감압증류 제거하였다. 얻어진 화합물에 n-헥산-디클로로메탄을 가해서 석출된 잔사를 여과하여 6.56g의 백색 고체를 얻었다. 이 화합물을 아세토니트릴(40ml)에 용해하고, 테트라부틸암모늄플루오라이드(75% 수용액, 21.6g, 61.9mmol)를 가하고, 실온에서 18시간 교반하였다. 용매를 감압증류 제거하고, 아세트산에틸을 가하고, 탄산수소나트륨 수용액으로 세정하였다. 유기층을 황산나트륨으로 건조하고, 감압증류 제거하여 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(1:1, v/v)로 용출함으로써 정제하여, 2.51g의 백색 고체 510C를 얻었다.
제3 공정
제2 공정에서 얻어진 510C(2.40g, 10.3mmol)를 디클로로메탄(40ml)에 용해하고, 삼브롬화붕소(1M 디클로로메탄 용액, 10.3ml, 10.3mmol)를 0℃에서 적하해서 가하고, 그대로 30분 교반하였다. 메탄올을 가해서 용매를 감압증류 제거하고, 아세트산에틸을 가하고, 포화 식염수로 세정하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압증류 제거하고, 얻어진 고체를 디에틸에테르로 세정하여 940mg의 510D를 얻었다.
제4 공정
제3 공정에서 얻어진 510D(940mg, 6.52mmol)를 메탄올(8ml)에 용해하고, 0℃에서 2규정 수산화나트륨 수용액(3.26ml, 6.52mmol)과 37% 포름알데히드 수용액(1.46ml, 19.6mmol)을 가하고, 실온에서 20시간 교반하였다. 반응액에 포화 염화암모늄 수용액을 가해서 용매를 감압증류 제거하였다. 염산을 가하고, 클로로포름으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 화합물에 n-헥산-디클로로메탄-아세트산에틸을 가해서 석출된 잔사를 여과하여 858mg의 담황색 고체 510E를 얻었다.
제5 공정
제4 공정에서 얻어진 510E(855mg, 4.91mmol)를 디메틸포름아미드(10ml)에 용해하고, 탄산칼륨(746mg, 5.40mmol)과 벤질브로마이드(0.583ml, 4.91mmol)를 가하고, 80℃에서 5시간 교반하였다. 불용물을 여과하여 제거하고, 여액을 감압증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하여 887mg의 옅은 오렌지색 고체 510F를 얻었다.
제6 공정
제5 공정에서 얻어진 510F(887mg, 3.36mmol)를 클로로포름에 용해하고, 이산화망간(2.00g, 23.0mmol)을 가하고, 80℃에서 2시간 교반하였다. 실온으로 식힌 후, 셀라이트 여과하고 용매를 감압증류 제거하여 812mg의 백색 고체 510G를 얻었다.
제7 공정
제6 공정에서 얻어진 510G(884mg, 3.37mmol)에 아세토니트릴과 물을 가하고, 인산이수소일나트륨(809mg, 6.74mmol)과 차아염소산나트륨(1.01g, 11.1mmol)을 가하고, 실온에서 1시간 교반하였다. 반응액을 농축하고, 염산으로 pH=3으로 조정하여 클로로포름으로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거함으로써 404mg의 백색 고체 510H를 얻었다.
제8 공정
제7 공정에서 얻어진 510H(402mg, 1.45mmol)를 디메틸포름아미드에 용해하고, N1-((에틸이미노)메틸렌)-N3,N3-디메틸프로판-1,3-디아민하이드로클로라이드(554mg, 2.89mmol)와 1H-벤조[d][1,2,3]트리아졸-1-올(195mg, 1.45mmol)을 가하고, 실온에서 5분 교반하였다. 프로판-2-아민(0.149ml, 1.73mmol)을 가한 후, 실온에서 1시간 교반하였다. 반응액을 감압 농축하여 물을 가하고, 아세트산에틸로 추출하고, 유기층을 탄산수소나트륨 수용액으로 세정하고, 황산나트륨으로 건조하였다. 반응액을 감압증류 제거하고, 얻어진 화합물에 n-헥산을 가해서 석출된 잔사를 여과하여 3.56g의 백색 고체 510I를 얻었다.
제9 공정
제8 공정에서 얻어진 510I(392mg, 1.23mmol)를 에탄올(6ml)에 용해하고, 암모니아수(4ml)를 가하고, 실온에서 15시간 교반하였다. 반응액을 감압 농축하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하여, 333mg의 백색 고체 510J를 얻었다.
MS: m/z=319 [M+H]+
제10 공정
참고예 95와 마찬가지의 수법에 의해 화합물 510을 합성하였다.
MS: m/z=422 [M+H]+
참고예 511
제1 공정
화합물 511A(200mg, 0.664mmol)와 1,1,3-트리메톡시프로판(178.2mg, 1.33mmol)의 디클로로메탄(90mL) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 삼불화붕소디에틸에테르 착체(113mg, 0.797mmol)를 적하하였다. 반응액을 동일 온도에서 30분간 교반한 후, 포화 중조수를 가하였다. 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조한 후 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 아세트산에틸로 용출하고, 이어서 아세트산에틸-메탄올(3:2, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 179.2mg의 화합물 511B를 얻었다.
제2 공정
화합물 511B(179.2mg, 0.482mmol)의 디메틸포름아미드(3ml) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 탄산세슘(786mg, 2.41mmol)을 가하고, 동일 온도에서 15분간 교반하였다. 반응액을 물로 희석하고, 클로로포름으로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하여 고체로서 130mg의 화합물 511C를 얻었다.
제3 공정
화합물 511C(130mg, 0.350mmol)와 디벤조수베롤(368mg, 1.75mmol)의 아세트산(2ml) 용액에 실온하에 황산(0.4ml)을 적하하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 추출액을 1회 수세하고, 황산나트륨으로 건조한 후 용매를 증류 제거하고, 얻어진 고체를 디이소프로필에테르로 세정하여 고체로서 65mg의 화합물 511을 얻었다.
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 아세탈을 이용하여 참고예 511에 따라서 화합물 512 내지 515를 합성하였다.
참고예 512
참고예 513
참고예 514
참고예 515
참고예 516
제1 공정
화합물 516A(100mg, 0.332mmol)와 3-(메틸티오)프로판알(52mg, 0.498mmol)의 톨루엔(3ml) 용액에 아세트산(30mg, 0.500mmol)을 가하고 30분간 환류하였다. 실온으로 냉각한 후, 용매를 증류 제거하여 얻어진 조 생성물을 디메틸포름아미드(3ml)에 용해시켰다. 상기 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 탄산세슘(541mg, 1.66mmol)을 가하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 3회 수세한 후, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 아세트산에틸로 용출하고, 이어서 아세트산에틸-메탄올(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 84.7mg의 화합물 516B를 얻었다.
제2 공정
참고예 511과 마찬가지의 수법에 의해, 화합물 516을 합성하였다.
시판 또는 문헌 기지의 아민 및 시판 또는 문헌 기지의 알데히드를 이용하여 참고예 516에 따라서 화합물 517 내지 526을 합성하였다.
참고예 517
참고예 518
참고예 519
참고예 520
참고예 521
참고예 522
참고예 523
참고예 524
참고예 525
참고예 526
참고예 527
제1 공정
화합물 516의 합성법에 준하여 합성한 화합물 527A(36mg, 0.09mmol)의 DMF(0.2mL) 용액을 1 내지 3℃로 냉각하고, 5-클로로디벤조수베란(97mg, 0.43mmol)과 탄산세슘(138mg, 0.43mmol)을 가하고, 실온에서 철야 교반하였다. 반응액에 물을 가하여 아세트산에틸-물로 분배하였다. 유기층을 포화 식염수로 세정, 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 19mg의 화합물 527B를 얻었다.
MS: m/z=616 [M+H]+.
제2 공정
화합물 527B(19mg, 0.03mmol)를 MeOH(0.6mL)에 용해하고, 10% Pd-C(3mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 유상물을 디올 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 7mg의 화합물 527을 얻었다.
MS: m/z=526 [M+H]+.
시판 또는 문헌 기지의 할라이드 및 시판 또는 문헌 기지의 알데히드를 이용하여 참고예 527의 방법에 준해서 화합물 528 내지 531을 합성하였다.
참고예 528
참고예 529
참고예 530
참고예 531
참고예 532
제1 공정
화합물 519(440mg, 0.766mmol)의 메탄올(5ml) 용액에 히드라진수화물(383mg, 7.66mmol)을 가하고 1시간 환류하였다. 실온까지 냉각한 후, 석출된 불용물을 여과 제거하였다. 용매를 증류 제거한 후, 아세트산에틸에 현탁시켜 불용물을 여과 제거하고, 용매를 증류 제거하였다. 얻어진 조 생성물을 클로로포름에 현탁시켜 불용물을 여과 제거하였다. 용매를 증류 제거하고, 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 고체로서 190mg의 화합물 532를 얻었다.
참고예 533
참고예 532와 마찬가지의 수법에 의해 화합물 533을 합성하였다.
참고예 534
참고예 532와 마찬가지의 수법에 의해 화합물 534를 합성하였다.
참고예 535
참고예 532와 마찬가지의 수법에 의해 화합물 535를 합성하였다.
참고예 536
제1 공정
화합물 532(30mg, 0.0675mmol)와 38% 포르말린 수용액(53.5mg, 0.675mmol)의 디클로로메탄(1ml) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 트리아세톡시히드로붕산나트륨(42.9mg, 0.293mmol)과 아세트산(10mg, 0.166mmol)을 가하였다. 반응액을 동일 온도에서 30분간 교반한 후, 포화 중조수를 가하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 고체로서 20mg의 화합물 536을 얻었다.
참고예 537
참고예 536과 마찬가지의 수법에 의해 화합물 537을 합성하였다.
참고예 538
참고예 536과 마찬가지의 수법에 의해 화합물 538을 합성하였다.
참고예 539
참고예 536과 마찬가지의 수법에 의해 화합물 539를 합성하였다.
참고예 540
참고예 536과 마찬가지의 수법에 의해 화합물 540을 합성하였다.
참고예 541
참고예 536과 마찬가지의 수법에 의해 화합물 541을 합성하였다.
참고예 542
제1 공정
화합물 532(30mg, 0.0675mmol)와 트리에틸아민(20.5mg, 0.202mmol)의 디클로로메탄(1ml) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 무수아세트산(10.3mg, 0.101mmol)을 가하였다. 반응액을 동일 온도에서 30분간 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 고체로서 15mg의 화합물 542를 얻었다.
참고예 543
참고예 542와 마찬가지의 수법에 의해 화합물 543을 합성하였다.
참고예 544
참고예 542와 마찬가지의 수법에 의해 화합물 544를 합성하였다.
참고예 545
제1 공정
화합물 532(30mg, 0.0675mmol)와 피리딘(16mg, 0.203mmol)의 디클로로메탄(1ml) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 2-메톡시아세틸클로라이드(11mg, 0.101mmol)를 가하였다. 반응액을 동일 온도에서 30분간 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 고체로서 22mg의 화합물 545를 얻었다.
참고예 546
제1 공정
2-(메틸티오)아세트산(15.7mg, 0.148mmol)의 디메틸포름아미드(1ml) 용액에 실온하에 EDCI(28.5mg, 0.148mmol)와 1-히드록시벤조트리아졸(11.4mg, 0.0742mmol)을 가하고, 동일 온도에서 5분간 교반한 후, 화합물 532를 가하였다. 반응액을 실온하에 1시간 교반하고, 메탄올(3ml)로 희석하였다. 용액을 1 내지 3℃로 냉각하고, 2규정 수산화나트륨 수용액(1ml)을 가하여 동일 온도에서 30분간 교반한 후 2규정 염산(1ml)으로 중화하였다. 반응액을 아세트산에틸로 3회 추출하고, 합친 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 고체로서 15mg의 화합물 546을 얻었다.
참고예 547
제1 공정
참고예 516과 마찬가지의 수법으로 합성한 화합물 547A(367mg, 0.812mmol)와 디벤조수베롤(205mg, 0.974mmol)의 아세트산(3ml) 용액에 실온하에 황산(0.6ml)을 적하하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 메탄올(3ml)에 용해시키고, 실온하에 2규정 수산화나트륨 수용액(1ml)을 가하여 30분간 교반하였다. 반응액을 2규정 염산 수용액(1ml)으로 중화하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 고체로서 75mg의 화합물 547을 얻었다.
참고예 548
참고예 547과 마찬가지의 수법에 의해 화합물 548을 합성하였다.
참고예 549
제1 공정
참고예 516과 마찬가지의 수법으로 합성한 화합물 549A(997mg, 1.69mmol)와 디벤조수베롤(1.07g, 5.08mmol)의 아세트산(3ml) 용액에 실온하에 황산(0.6ml)을 적하하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 513mg의 화합물 549B를 얻었다.
제2 공정
화합물 549B(513mg, 0.829mmol)의 메탄올(5ml) 용액에 히드라진수화물(124.5mg, 2.49mmol)을 가하고, 2시간 환류하였다. 실온으로 냉각한 후, 반응액에 2규정 염산(30ml)과 아세트산에틸(30ml)을 가하였다. 분액 후, 유기층을 2규정 염산으로 2회 추출하였다. 합친 수층을 중조수로 중화한 후, 클로로포름-메탄올로 3회 추출하였다. 합친 유기층을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸-디이소프로필에테르로 세정하여 135mg의 화합물 549를 얻었다.
참고예 550
화합물 549로부터 참고예 536에 따라서 마찬가지의 수법에 의해 화합물 550을 합성하였다.
참고예 551
화합물 549로부터 참고예 536에 따라서 마찬가지의 수법에 의해 화합물 551을 합성하였다.
참고예 552
제1 공정
참고예 516과 마찬가지의 수법으로 합성한 화합물 552A(137mg, 0.367mmol)와 디벤조수베롤(386mg, 1.83mmol)의 아세트산(2ml) 용액에 실온하에 황산(0.4ml)을 적하하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 메탄올(5ml)에 용해시키고, 실온하에 2규정 수산화나트륨 수용액(2ml)을 가하여 30분간 교반하였다. 반응액을 2규정 염산 수용액(2ml)으로 중화하고, 아세트산에틸로 2회 추출하였다. 합친 추출액을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸로 세정하여 62mg의 화합물 552를 얻었다.
참고예 553
참고예 552와 마찬가지의 수법에 의해 화합물 553을 합성하였다.
참고예 554
제1 공정
참고예 516과 마찬가지의 수법으로 합성한 화합물 554A(100mg, 0.177mmol)와 디벤조수베롤(186mg, 0.885mmol)의 아세트산(2ml) 용액에 실온하에 황산(0.4ml)을 적하하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 메탄올(5ml)에 용해시키고, 실온하에 2규정 수산화나트륨 수용액(2ml)을 가하고 30분간 교반하였다. 반응액을 시트르산 수용액으로 중화하고, 아세트산에틸로 2회 추출하였다. 합친 추출액을 중조수로 세정한 후, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 조 생성물을 아세트산에틸로 세정하여 24mg의 화합물 554를 얻었다.
참고예 555
참고예 516에 따라서 합성한 화합물 555A(380mg, 1.11mmol)와 디벤조수베롤(1.16g, 5.52mmol)의 아세트산(4ml) 용액에 실온하에 황산(0.8ml)을 적하하고, 동일 온도에서 30분간 교반하였다. 반응액을 물로 희석하고, 아세트산에틸로 3회 추출하였다. 추출액을 1회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 메탄올(5ml)에 용해시키고, 실온하에 2규정 수산화나트륨 수용액(2ml)을 가하여 30분간 교반하였다. 반응액을 시트르산 수용액으로 중화하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 조 생성물에 아세트산에틸-디이소프로필에테르를 가해서 석출된 잔사를 여과하여 22mg의 화합물 555를 얻었다.
참고예 556
참고예 65 및 참고예 516과 마찬가지의 수법에 의해 화합물 556을 합성하였다.
참고예 557
참고예 149와 마찬가지의 수법에 의해 화합물 557을 합성하였다.
MS: m/z=419 [M+H]+.
참고예 558
화합물 63B(68.8mg, 0.120mmol)의 DMSO(2mL) 용액에 염화구리(39.2mg, 0.396mmol)를 가하고, 110℃에서 2시간, 120℃에서 1시간 더 교반하였다. 그 후, 염화구리(50.0mg, 0.505mmol)를 가하고, 200℃에서 1시간 교반하였다. 반응액을 LCMS 분취 장치를 이용하여 정제하고, 용출 용매를 증류 제거하고, 농축 잔사에 디에틸에테르를 가해서 석출된 백색 고체를 여과 취출하였다. 디에틸에테르로 세정, 건조함으로써, 20.9mg의 화합물 558을 얻었다.
MS: m/z=439 [M+H]+.
참고예 559
제1 공정
화합물 48A(43mg, 0.083mmol)를 디클로로메탄(6.0mL)에 용해하고, 이산화망간(120mg, 1.38mmol)을 가하고 실온에서 3시간 교반하였다. 반응액을 셀라이트로 여과한 후, 여액을 농축하여 옅은 황색 고체로서 22.3mg의 화합물 559B를 얻었다.
제2 공정
화합물 559B(22mg, 0.043mmol)를 THF(6.0mL)에 용해하고, 40% 메탄아민 메탄올 용액(6.5ul, 0.064mmol) 및 아세트산(3.7ul, 0.064mmol)을 가하고, 실온에서 5분간 교반하였다. 반응액을 빙냉하고, NaBH(OAc)3(14mg, 0.064mmol)을 가하여 실온에서 철야 교반하였다. 반응액에 물, 클로로포름을 가하여 클로로포름층을 분리하였다. 수층을 클로로포름으로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하여 옅은 황색 고체로서 24mg의 화합물 559C를 얻었다.
MS: m/z=538 [M+H]+.
제3 공정
참고예 1과 마찬가지의 수법에 의해 화합물 559를 합성하였다.
MS: m/z=448 [M+H]+.
참고예 560
제1 공정
(메톡시메틸)트리페닐포스포늄클로라이드(6.73g, 19.0mmol)의 디옥산(20mL) 혼합액을 0℃로 냉각하고, 동일 온도를 유지하면서 1.06M NaHMDS 톨루엔 용액(18.0ml, 19.0mmol)을 적하하였다. 반응액을 실온에서 30분간 교반한 후, 화합물 383A를 가하고 1시간 반 환류하였다. 반응액을 실온으로 복귀시키고, 물, 아세트산에틸을 가하였다. 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(95:5, v/v)로 용출하여 정제하였다. 목적으로 하는 분획을 농축하여 유상물로서 2.22g의 화합물 560B를 얻었다.
제2 공정
화합물 560B(1.98g, 7.78mmol)를 디클로로메탄(30mL)에 용해하고, 70% 과염소산 수용액(8.0ml, 93mmol)을 가하고, 실온에서 철야 교반하였다. 반응액에 포화 탄산나트륨 수용액을 가하고, 디클로로메탄층을 분리하였다. 수층을 디클로로메탄으로 추출하고, 합친 추출액에 황산마그네슘을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(90:10, v/v)로 용출하여 정제하였다. 목적으로 하는 분획을 농축하여 유상물로서 1.80g의 화합물 560C를 얻었다.
제3 공정
화합물 560C(2.87g, 11.9mmol)의 디클로로메탄(30mL) 용액에 실온하에 테트라이소프로폭시티타늄(17.5mL, 59.7mmol), (S)-4-메틸벤젠술핀아미드(2.27g, 14.3mmol)를 가하고, 3시간 반 환류하였다. 반응액을 빙냉하고, 얼음물(30ml)을 가하여 동일 온도 그대로 1시간 교반한 후, 석출된 고체를 셀라이트를 이용하여 여과하였다. 얻어진 여액을 디클로로메탄으로 추출하고, 합친 추출액에 황산마그네슘을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(70:30, v/v)로 용출하여 정제하였다. 목적으로 하는 분획을 농축하여 황색 고체로서 3.16g의 화합물 560D를 얻었다.
제4 공정
1M 시아노디에틸알루미늄 톨루엔 용액(16.7mL, 16.7mmol)의 THF(30mL) 현탁액을 0℃로 냉각하고, 2-프로판올(1.29mL, 16.7mmol)을 가한 후, 동일 온도로 유지한 채 1시간 교반하였다. 그 후, 반응액을 -60℃로 냉각하고, 화합물 560D(3.16g, 8.37mmol)의 THF(12mL) 용액을 적하하고, 동일 온도로 유지한 채 15분 교반한 후, 실온까지 승온시켜 철야 교반하였다. 반응액을 빙냉하고, 포화 염화암모늄 수용액을 가하여 실온에서 1시간 반 교반한 후, 석출된 고체를 셀라이트를 이용하여 여과하고, 디클로로메탄으로 세정하였다. 여액의 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 추출한 후, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출하여 정제하였다. 목적으로 하는 분획을 농축하여 백색 고체로서 1.88g의 화합물 560E를 얻었다.
MS: m/z=427 [M+Na]+.
제5 공정
화합물 560E(235mg, 0.581mmol)의 메탄올(4mL) 용액을 0℃로 냉각하고, 코발트(II)클로라이드 6수화물(55.3mg, 0.232mmol)을 가하고, 실온에서 30분 교반하였다. 그 후, 반응액을 빙냉하고, 수소화붕소나트륨(88mg, 2.3mmol)의 DMF(4mL) 용액을 적하하고, 그대로의 온도에서 5분간 교반한 후, 실온에서 1시간 교반하였다. 이어서, Boc2O(0.674mL, 2.90mmol)를 가하여 30분 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(98:2, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 560F의 조 생성물(211mg)을 얻었다.
MS: m/z=509 [M+Na]+.
제6 공정
화합물 560F의 조 생성물(211mg)의 메탄올(6mL) 용액에 TFA(0.128mL, 1.66mmol)를 가하고, 2.5시간 실온에서 교반하였다. 반응액에 트리에틸아민(0.230mL, 1.66mmol)을 가하고, 용매를 증류 제거하여 얻어진 화합물 560G의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=371 [M+H]+.
제7 공정
화합물 560G의 조 생성물의 톨루엔(4mL) 용액에 디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(132mg, 0.416mmol)를 가하고, 1시간 반 환류하였다. 반응액을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→90:10, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 560H의 조 생성물(287mg)을 얻었다.
MS: m/z=671 [M+H]+.
제8 공정
제7 공정에서 얻어진 화합물 560H의 조 생성물에 4N 염산 아세트산에틸 용액(3mL)을 가하고, 실온에서 30분간 교반하였다. 용매를 증류 제거하고, 얻어진 농축 잔사에 THF(2mL) 및 포화 탄산수소나트륨 수용액(2mL)을 가하여 실온에서 45분간 교반하였다. 반응액에 물을 가하고, 클로로포름으로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 황색 고체로서 27mg의 화합물 560I를 얻었다.
MS: m/z=539 [M+H]+.
제9 공정
화합물 560I(27mg, 0.050mmol)를 DMF(2mL)에 용해하고, 탄산세슘(82mg, 0.25mmol) 및 요오드화메틸(0.010mL, 0.16mmol)을 가하고, 실온에서 1시간 반 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 560J의 조 생성물을 얻었다.
MS: m/z=553 [M+H]+.
제10 공정
제9 공정에서 얻어진 화합물 560J의 조 생성물의 EtOH(2mL) 용액에 2N NaOH(1mL)를 가하고, 실온에서 40분간 교반하였다. 반응액에 2N HCl 수용액을 가하고, 아세트산에틸로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하여 백색 오일로서 17mg의 화합물 560K를 얻었다.
MS: m/z=539 [M+H]+.
제11 공정
화합물 560K(17mg, 0.032mmol)에 TFA(2.0mL)를 가하고, 35분간 실온에서 교반하였다. 반응액을 톨루엔 공비하고, 얻어진 농축 잔사에 이소프로필에테르를 가해서 석출된 고체를 여취, 세정한 결과, 분홍색 고체로서 7.1mg의 화합물 560을 얻었다.
MS: m/z=449 [M+H]+.
참고예 561
제1 공정
화합물 560H의 조 생성물(433mg)에 4N 염산 아세트산에틸 용액(3mL)을 가하고, 실온에서 1시간 교반하였다. 용매를 증류 제거하고, 얻어진 잔사의 THF(2mL) 용액에 아세톤(2mL)을 가하여 실온에서 20분간 교반한 후, NaBH(OAc)3(70mg, 0.32mmol)을 가하여 실온에서 1시간 반 교반하였다. 그 후, 반응액에 포화 탄산수소나트륨 수용액(3mL)을 가하고, 실온에서 철야 교반하였다. 반응액에 물을 가하고, 클로로포름으로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 561A의 조 생성물(79mg)을 얻었다.
MS: m/z=581 [M+H]+.
제2 공정
화합물 561A의 조 생성물(79mg)의 EtOH(4mL) 용액에 2N NaOH(2mL)를 가하고, 실온에서 1시간 교반하였다. 반응액에 2N HCl 수용액을 가하고, 아세트산에틸로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 561B(53mg)를 얻었다.
MS: m/z=567 [M+H]+.
제3 공정
화합물 561B(53mg, 0.093mmol)의 DMF(2mL) 용액을 0℃로 냉각하고, 트리에틸아민(0.039mL, 0.28mmol) 및 클로로포름산에틸(0.018mL, 0.187mmol)을 가한 후, 실온에서 10분간 교반하였다. 그 후, 반응액을 0℃로 냉각하여 아지드화나트륨(18mg, 0.28mmol)을 가하고, 동일 온도로 유지한 채 50분 교반하였다. 반응액에 물을 가하고, 디클로로메탄으로 추출한 후, 합친 추출액을 농축하여 화합물 561C의 조 생성물을 얻었다.
MS: m/z=592 [M+H]+.
제4 공정
화합물 561C의 조 생성물(55mg)을 메탄올(2mL)에 용해하고, 50℃에서 1시간 교반하였다. 반응액을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 561D의 조 생성물(43mg)을 얻었다.
MS: m/z=596 [M+H]+.
제5 공정
화합물 561D의 조 생성물(43mg)의 EtOH(2mL) 용액에 2N NaOH(4mL)를 가하고, 60℃에서 1시간 교반하였다. 용매를 증류 제거하고, 물을 가하고, 아세트산에틸로 추출한 후, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 아미노 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→80:20, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 옅은 황색 고체로서 16mg의 화합물 561E를 얻었다.
MS: m/z=538 [M+H]+.
제6 공정
화합물 561E(16mg, 0.029mmol)를 EtOH(1mL) 및 48% 테트라플루오로붕산 수용액(1mL)에 용해하고, 반응액을 0℃로 냉각하여 아질산나트륨(15mg, 0.22mmol)을 가한 후, 동일 온도로 유지한 채 1시간 반, 실온에서 2시간 반 더 교반하였다. 반응액에 물을 가하고, 클로로포름으로 추출한 후, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 농축 잔사에 아세트산에틸 및 이소프로필에테르를 가해서 석출된 고체를 여취, 세정한 결과, 백색 고체로서 5mg의 화합물 561을 얻었다.
참고예 562
참고예 561과 마찬가지의 수법에 의해 화합물 562를 합성하였다.
참고예 563
제1 공정
화합물 563A(Tetrahedron Letters, 34, 953-956, 1993, 41.1g, 154mmol)를 THF(300mL)에 용해하고, 1M BH3-THF(770mL)를 실온에서 천천히 가하고, 18시간 교반하였다. 3규정 염산 수용액(513mL)을 천천히 가해서 1시간 환류하여, 정제하지 않고 다음 공정으로 진행하였다.
LC-MS: m/z=254 [M+H]+.
제2 공정
화합물 563B를 포함하는 용액을 이용하여, 참고예 12에 준해서 화합물 563C를 합성하였다.
제3 공정
화합물 563C(2.16g, 6.79mmol) 및 디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(2.38g, 6.75mmol)의 톨루엔(30mL) 용액을 100℃에서 4시간 교반하였다. 반응액을 감압하에 증류 제거하여 얻어진 화합물 563D의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=653.05 [M+H]+.
제4 공정
화합물 563D의 조 생성물의 아세트산에틸(20mL) 용액에 실온에서 염화수소(4N 아세트산에틸 용액, 20mL)를 가하고, 30분간 교반하였다. 반응액을 감압하에 증류 제거하여 얻어진 화합물 563E의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=553.05 [M+H]+.
제5 공정
화합물 563E의 조 생성물의 테트라히드로푸란(40mL) 용액에 실온에서 포화 중조수(5mL)를 가하고 16시간 교반하였다. 반응액에 물(50mL)을 가하고, 클로로포름으로 3회 추출하였다. 추출액을 합쳐서 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사에 디에틸에테르 및 클로로포름을 가하여 분말화시켜서, 화합물 563F(2.90g, 70.2%)를 백색 고체로서 얻었다.
MS: m/z=521.05 [M+H]+.
제6 공정
화합물 563F(523mg, 1.01mmol)의 메탄올(7.5mL) 현탁액에 실온에서 수산화나트륨 수용액(2M, 1.5mL)을 가하고 3시간 교반하였다. 반응액에 실온에서 염산(2N, 1.5mL) 및 물(3mL)을 가한 후, 0℃에서 15분간 교반하였다. 석출된 고체를 여과 취출한 후, 물 및 디에틸에테르로 세정하여 화합물 563G(418mg, 82.0%)를 백색 고체로서 얻었다.
MS: m/z=507.00 [M+H]+.
제7 공정
화합물 563G(107mg, 0.211mmol)의 디페닐에테르(5mL) 현탁액을 마이크로웨이브 조사하에 240℃에서 1시간 교반하였다. 반응액을 실리카 겔 컬럼 크로마토그래피(메탄올/클로로포름=0%→5%)로 정제하여 화합물 563H(64.4mg, 65.9%)를 백색 고체로서 얻었다.
MS: m/z=463.05 [M+H]+.
제8 공정
화합물 563H(64.4mg, 0.139mmol)의 메탄올(30mL) 용액을 10% Pd-C 캣카트(CatCart)(H-큐브(H-cube), 풀-H2 모드, 25℃)에 3시간 통과시켜 수소화를 행하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사에 아세트산에틸 및 메탄올을 가하여 분말화시켜서, 화합물 563(31.1mg, 60.0%)을 회백색 고체로서 얻었다.
참고예 564
제1 공정
화합물 563H(64.2mg, 0.139mmol) 및 탄산세슘(220mg, 0.675mmol)의 디메틸포름아미드(2mL) 현탁액에 실온에서 요오드화메틸(0.0430mL, 0.688mmol)을 가하고 3시간 교반하였다. 반응액에 실온에서 물(10mL)을 가하고, 아세트산에틸(30mL)로 추출하였다. 유기층을 물(10mL) 및 포화 식염수(10mL)로 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(메탄올/클로로포름=2.5%→10%)로 정제하여 화합물 564A(56.0mg, 85.0%)를 무색 고무상 물질로서 얻었다.
MS: m/z=477.00 [M+H]+.
제2 공정
화합물 564A(56.0mg, 0.118mmol)의 메탄올(10mL), 아세트산에틸(5mL), 테트라히드로푸란(5mL) 용액을 10% Pd-C 캣카트(H-큐브, 풀-H2 모드, 25℃)에 75분간 통과시켜 수소화를 행하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사에 아세트산에틸 및 메탄올을 가하여 분말화시켜서, 화합물 564(22.0mg, 48.4%)를 회백색 고체로서 얻었다.
참고예 565
참고예 564와 마찬가지의 수법에 의해 화합물 565를 합성하였다.
MS: m/z=443.95 [M+H]+.
참고예 566
제1 공정
화합물 563H(75.4mg, 0.163mmol), 3-요오드벤조니트릴(124mg, 0.541mmol), 요오드화구리(I)(33.2mg, 0.174mmol), 탄산칼륨(74.7mg, 0.540mmol) 및 N,N'-디메틸에틸렌디아민(0.0200ml, 0.186mmol)의 디메틸포름아미드(2mL) 현탁액을 마이크로웨이브 조사하에 140℃에서 2시간 교반하였다. 반응액에 실온에서 물(10mL) 및 염산(2M, 2mL)을 가하고, 아세트산에틸로 추출하였다. 추출액을 셀라이트로 여과하고, 여액을 물(10mL×2) 및 포화 식염수(10mL)로 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 566A의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=564.05 [M+H]+.
제2 공정
제1 공정에서 얻어진 화합물 566A의 조 생성물의 염화메틸렌(10mL) 용액에 실온에서 트리플루오로아세트산(2mL)을 가하고 1시간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 566(30.3mg, 39.3%)을 황색 고체로서 얻었다.
참고예 567
참고예 566과 마찬가지의 수법에 의해 화합물 567을 합성하였다.
참고예 568
참고예 566과 마찬가지의 수법에 의해 화합물 568을 합성하였다.
참고예 569
참고예 566과 마찬가지의 수법에 의해 화합물 569를 합성하였다.
MS: m/z=449.95 [M+H]+.
참고예 570
참고예 566과 마찬가지의 수법에 의해 화합물 570을 합성하였다.
참고예 571
제1 공정
화합물 563H(50.0mg, 0.108mmol)의 DMF(1mL) 용액에 탄산세슘(176mg, 0.540mmol)을 가하고, 실온하에 10분간 교반하였다. 반응액에 O-(2,4-디니트로페닐)히드록실아민(64.6mg, 0.324mmol)을 가하고, 실온하에 9시간 교반하였다. 반응액에 클로로포름을 가하고, 물로 세정한 후, 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(98:2, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 비정질로서 28.3mg의 화합물 571A를 얻었다.
MS: m/z=478 [M+H]+.
제2 공정
화합물 571A(27.0g, 0.057mmol)를 THF-메탄올(1mL, 1:1, v/v) 용액에 용해하고, 10% 팔라듐탄소(15.0mg)를 가하고, 실온 수소 분위기하에서 2시간 교반하였다. 클로로포름으로 희석한 후, 셀라이트 여과로 불용물을 제거하였다. 여액을 감압하에서 농축한 후, 잔류물을 디클로로메탄-에테르로 고화함으로써 12.0mg의 화합물 571을 얻었다.
MS: m/z=388 [M+H]+.
참고예 572
화합물 12H를 이용하여 참고예 571에 따라서 화합물 572를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=420 [M+H]+.
참고예 573
제1 공정
화합물 563H(83.2mg, 0.160mmol)의 디메틸포름아미드(1.5mL) 용액에 빙냉하에 수소화나트륨(60%, 13.2mg, 0.330mmol)을 가하여 30분간 교반한 후, 브로모아세토니트릴(0.0190mL, 0.270mmol)을 가하여 실온에서 1시간 교반하였다. 반응액에 염화암모니아 수용액(10%, 3mL)을 가하고, 아세트산에틸로 추출하였다. 유기층을 물(10mL) 및 포화 식염수(10mL)로 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 573A의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=502.00 [M+H]+.
제2 공정
제1 공정에서 얻어진 화합물 573A의 조 생성물 및 요오드화나트륨(111mg, 0.741mmol)의 아세토니트릴(4mL) 현탁액에 실온에서 클로로트리메틸실란(0.0920mL, 0.720mmol)을 가하고, 24시간 교반하였다. 반응액에 아황산수소나트륨 수용액(10%, 10mL)을 가한 후, 클로로포름으로 추출하였다. 추출액을 합쳐서 황산나트륨으로 건조한 후, 용매를 감압하에서 농축하고, 얻어진 잔사를 분취용 LCMS로 정제하여 화합물 573(22.0mg, 29.7%)을 회백색 고체로서 얻었다.
참고예 574
참고예 573과 마찬가지의 수법에 의해 화합물 574를 합성하였다.
참고예 575
참고예 573과 마찬가지의 수법에 의해 화합물 575를 합성하였다.
MS: m/z=425.95 [M+H]+.
참고예 576
제1 공정
화합물 576A(Bioorg. Med. Chem., 2003, 11, 197-206)(2.26g, 10.2mmol)의 디클로로메탄(30mL) 용액에 실온하에 테트라이소프로폭시티타늄(10.0mL, 33.1mmol), (S)-4-메틸벤젠술핀아미드(1.29g, 8.13mmol)를 가하고, 2시간 환류하였다. 반응액을 빙냉하고, 얼음물(40ml)을 가하여 동일 온도에서 1시간 교반한 후, 석출된 고체를 셀라이트를 이용하여 여과하였다. 얻어진 여액을 디클로로메탄으로 추출하고, 합친 추출액에 황산마그네슘을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(100:0→70:30, v/v)로 용출하여 정제하였다. 목적으로 하는 분획을 농축하여 황색 고체로서 1.35g의 화합물 576B를 얻었다.
제2 공정
1M 시아노디에틸알루미늄 톨루엔 용액(7.51mL, 7.51mmol)의 THF(20mL) 용액을 0℃로 냉각하고, 2-프로판올(0.579mL, 7.51mmol)을 가한 후, 동일 온도로 유지한 채 1시간 교반하였다. 그 후, 반응액을 -60℃로 냉각하여 화합물 576B의 THF(14mL) 용액을 적하하고, 동일 온도로 유지한 채 15분 교반한 후, 실온까지 승온시켜 철야 교반하였다. 반응액을 빙냉하고, 포화 염화암모늄 수용액을 가하고, 실온에서 1시간 반 교반한 후, 석출된 고체를 셀라이트를 이용하여 여과하고, 디클로로메탄으로 세정하였다. 여액의 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 추출한 후, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 아세트산에틸 및 헥산을 가해서 석출된 고체를 여취, 세정한 결과, 백색 고체로서 976mg의 화합물 576C를 얻었다.
제3 공정
화합물 576C(500mg, 1.29mmol)의 메탄올(8mL) 현탁액을 0℃로 냉각하고, 코발트(II)클로라이드 6수화물(123mg, 0.517mmol)을 가하고, 실온에서 30분 교반하였다. 반응액에 클로로포름(5mL)을 가한 후 빙냉하고, 수소화붕소나트륨(196mg, 5.17mmol)의 DMF(4mL) 용액을 적하하고, 그대로의 온도에서 5분간 교반한 후, 실온에서 2시간 교반하였다. 이어서, Boc2O(1.0mL, 4.3mmol)를 가하고, 실온에서 철야 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→98:2, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 576D의 조 생성물(200mg)을 얻었다.
MS: m/z=491 [M+Na]+.
제4 공정
제3 공정에서 얻어진 화합물 576D의 조 생성물(200mg)의 메탄올(6mL) 용액에 TFA(0.188mL, 2.45mmol)를 가하고, 2.5시간 실온에서 교반하였다. 반응액에 트리에틸아민(0.399mL, 2.45mmol)을 가하고, 용매를 증류 제거하여 얻어진 화합물 576E의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=353 [M+H]+.
제5 공정
제4 공정에서 얻어진 화합물 576E의 조 생성물의 톨루엔(4mL) 용액에 디메틸 3-(벤질옥시)-4-옥소-4H-피란-2,5-디카르복실레이트(130mg, 0.409mmol)를 가하고, 2시간 환류하였다. 반응액을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→90:10, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 576F의 조 생성물(268mg)을 얻었다.
MS: m/z=653 [M+H]+.
제6 공정
제5 공정에서 얻어진 화합물 576F의 조 생성물(263mg)에 4N 염산 아세트산에틸 용액(3mL)을 가하고, 실온에서 1시간 반 교반하였다. 용매를 증류 제거하고, 얻어진 농축 잔사의 THF(4mL) 용액에 아세톤(1mL)을 가하여 실온에서 25분간 교반한 후, NaBH(OAc)3(180mg, 0.807mmol)을 가하여 실온에서 1시간 15분 교반하였다. 그 후, 반응액에 포화 탄산수소나트륨 수용액(7mL)을 가하고, 실온에서 철야 교반하였다. 반응액에 물을 가하고, 클로로포름으로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 화합물 576G의 조 생성물(160mg)을 얻었다.
MS: m/z=563 [M+H]+.
제7 공정
제6 공정에서 얻어진 화합물 576G의 조 생성물(160mg)의 EtOH(4mL) 용액에 2N NaOH(2mL)를 가하고, 실온에서 3시간 교반하였다. 반응액에 2N HCl 수용액을 가하고, 아세트산에틸로 추출하고, 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 황색 고체로서 78mg의 화합물 576H를 얻었다.
MS: m/z=549 [M+H]+.
제8 공정
화합물 576H(78mg, 0.14mmol)에 디페닐에테르(3mL)를 가하고, 마이크로웨이브 조사하에 245℃에서 1시간 교반하였다. 반응액을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(100:0→90:10, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 갈색 오일로서 43mg의 화합물 576I를 얻었다.
MS: m/z=505 [M+H]+.
제9 공정
화합물 576I(42mg, 0.083mmol)에 TFA(1.0mL)를 가하고, 35분간 실온에서 교반하였다. 반응액을 톨루엔 공비하고, 얻어진 농축 잔사에 포화 탄산수소나트륨 수용액을 가하고, 아세트산에틸로 추출하였다. 합친 추출액에 황산나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 아세트산에틸 및 이소프로필에테르를 가해서 석출된 고체를 여취, 세정한 결과, 묽은 차색 고체로서 14mg의 화합물 576을 얻었다.
참고예 577
제1 공정
화합물 159A의 조 생성물(140mg)의 디메틸포름아미드(3mL) 용액에 실온에서 시안화칼륨(21.0mg, 0.323mmol)을 가하고, 80℃에서 30분간, 100℃에서 30분간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=80%→100%)로 정제하여 화합물 577B(41.5mg, 33.5%)를 옅은 오렌지색 거품상 물질로서 얻었다.
MS: m/z=535.25 [M+H]+.
제2 공정
화합물 577B(41.5mg, 0.078mmol) 및 요오드화나트륨(45.5mg, 0.304mmol)의 아세토니트릴(4mL) 용액에 실온에서 클로로트리메틸실란(0.0400mL, 0.313mmol)을 가하고 2시간 교반하였다. 반응액에 물(1mL)을 가한 후 반응액을 감압하에서 농축하고, 얻어진 잔사를 분취용 LCMS로 정제하였다. 얻어진 잔사에 디에틸에테르를 가하여 분말화하여, 화합물 577(20.7mg, 60.0%)을 회백색 고체로서 얻었다.
참고예 578
참고예 157과 마찬가지의 수법에 의해 화합물 578을 합성하였다.
참고예 579
참고예 163과 마찬가지의 수법에 의해 화합물 579를 합성하였다.
MS: m/z=477.25 [M+H]+.
참고예 580
제1 공정
화합물 155A(10.5g, 26.9mmol), 디이소프로필에틸아민(11.0mL, 63.0mmol), 1-메틸이미다졸(2.60mL, 32.6mmol) 및 이소프로필아민(2.80mL, 32.7mmol)의 톨루엔(100mL) 및 아세토니트릴(20mL) 용액에 빙냉하에 디페닐인산클로라이드(6.80mL, 32.7mmol)를 5분에 걸쳐 적하하고, 빙냉하에 90분간, 실온에서 90분간 교반하였다. 반응액에 빙냉하에 tert-부틸디메틸실릴클로라이드(4.05g, 26.9mmol) 및 트리에틸아민(4.10mL, 29.6mmol)을 가하여 실온에서 80분간 교반한 후, 실온에서 4-디메틸아미노피리딘(164mg, 1.35mmol) 및 염화메틸렌(100mL)을 가하여 15.5시간 교반하였다. 반응액에 실온에서 tert-부틸디메틸실릴클로라이드(2.04g, 26.9mmol)를 가하고 24시간 교반하였다. 반응액에 실온에서 10% 아세트산 수용액(100mL)을 가하고, 클로로포름으로 추출하였다. 추출액을 합쳐서 포화 중조수(100mL)로 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에서 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=15%→40%)로 정제하여 화합물 580B(6.96g, 59.9%)를 옅은 황색 유상물로서 얻었다.
MS: m/z=432.25 [M+H]+.
제2 공정
화합물 580B(6.96g, 16.1mmol)의 에탄올(50mL) 용액에 실온에서 암모니아수(35mL)를 가하고, 4일간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=75%→100%, 메탄올/클로로포름=0%→15%)로 정제하여 화합물 580C(4.50g, 64.8%)를 옅은 오렌지색 고무상 물질로서 얻었다.
MS: m/z=431.25 [M+H]+.
제3 공정
화합물 580C(4.50g, 10.5mmol) 및 탄산칼륨(7.27g, 52.6mmol)의 디메틸포름아미드(90mL) 용액에 실온에서 O-(2,4-디니트로페닐)히드록실아민(6.29g, 31.6mmol)을 가하고 2일간 교반하였다. 반응액에 실온에서 클로로포름(180mL)을 가해서 석출된 불용물을 여과 제거하고, 여액을 감압하에서 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(메탄올/클로로포름=0%→10%)로 정제하여 화합물 580D(5.28g, 정량적)를 황색 고체로서 얻었다.
MS: m/z=446.25 [M+H]+.
제4 공정
화합물 580D(1.29g, 2.89mmol)의 에탄올(15mL) 용액에 실온에서 파라포름알데히드(261mg, 8.68mmol)를 가하고, 마이크로웨이브 조사하에 140℃에서 3시간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=50%→100%)로 정제하여 화합물 580E(2.47g, 93.0%)를 옅은 오렌지색 고체로서 얻었다.
MS: m/z=458.20 [M+H]+.
제5 공정
화합물 580E(2.47g, 5.40mmol)의 DMF(25mL) 용액에 빙냉하에 탄산세슘(5.28g, 16.2mmol) 및 브로모디페닐메탄(4.02g, 16.3mmol)을 가하고, 실온에서 2일간 교반하였다. 반응액에 빙냉하에 물(50mL)을 가한 후, 아세트산에틸(150mL×2)로 추출하였다. 추출액을 합쳐서 물(50mL×2) 및 포화 식염수(50mL)로 순차 세정한 후, 황산나트륨으로 건조하였다. 용매를 감압하에서 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=50%→100%, 메탄올/클로로포름=10%→20%)로 정제하여 화합물 580F(1.60g, 47.5%)를 황색 거품상 물질로서 얻었다.
MS: m/z=624.30 [M+H]+.
제6 공정
화합물 580F(1.60g, 2.56mmol)의 메탄올(40mL) 용액에 실온에서 염화수소(4N 아세트산에틸 용액, 20mL)를 가하고 2시간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사에 실온에서 포화 중조수(20mL)를 가한 후, 클로로포름으로 3회 추출하였다. 추출액을 합쳐서 황산나트륨으로 건조하고, 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸)로 정제하여 화합물 580G(920mg, 70.4%)를 백색 거품상 물질로서 얻었다.
MS: m/z=510.25 [M+H]+.
제7 공정
화합물 580G(816mg, 1.60mmol)의 THF(80mL) 용액에 실온에서 이산화망간(2.39g, 27.5mmol)을 가하고 19시간 교반하였다. 반응액을 여과한 후, 여액을 감압하에 증류 제거하여 얻어진 화합물 580H의 조 생성물(785mg)을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=508.20 [M+H]+.
제8 공정
제7 공정에서 얻어진 화합물 580H의 조 생성물(635mg, 1.25mmol) 및 아미도황산(425mg, 4.38mmol)의 메탄올(30mL) 및 물(10mL) 용액에 빙냉하에 아염소산나트륨(396mg, 4.38mmol)의 물(4mL) 용액을 10분에 걸쳐 적하하고, 실온에서 30분간 교반한 후, 5% 아황산수소나트륨 수용액(10mL)을 가하였다. 메탄올을 감압하에 증류 제거하고, 얻어진 잔사를 아세트산에틸로 2회 추출하고, 추출액을 합쳐서 포화 식염수(10mL)로 세정한 후, 황산나트륨으로 건조하였다. 여액을 감압하에 증류 제거하여 얻어진 화합물 580I의 조 생성물을 정제하지 않고 다음 반응에 이용하였다.
MS: m/z=524.25 [M+H]+.
제9 공정
제8 공정에서 얻어진 화합물 580I의 조 생성물(164mg, 0.313mmol), 디이소프로필에틸아민(0.131mL, 0.751mmol), 1-메틸이미다졸(0.0300mL, 0.376mmol) 및 메틸아민(2.0M 테트라히드로푸란 용액, 0.188mL, 0.376mmol)의 염화메틸렌(20mL) 용액에 실온에서 디페닐인산클로라이드(0.0780mL, 0.375mmol)를 가하여 3.5시간 교반한 후, 메틸아민염산염(25.0mg, 0.370mmol)을 가하여 6일간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=75%→100%)로 정제하여 화합물 580J(45.7mg, 27.2%)를 백색 거품상 물질로서 얻었다.
MS: m/z=537.30 [M+H]+.
제10 공정
화합물 580J(45.7mg, 0.0850mmol) 및 요오드화나트륨(103mg, 0.687mmol)의 아세토니트릴(4mL) 용액에 실온에서 클로로트리메틸실란(0.0870mL, 0.681mmol)을 가하고 20시간 교반하였다. 반응액에 5% 아황산수소나트륨 수용액(4mL)을 가하고, 클로로포름으로 2회 추출하였다. 추출액을 합쳐서 황산나트륨으로 건조한 후, 감압하에서 농축하고, 얻어진 잔사를 분취용 LCMS로 정제하였다. 얻어진 잔사에 디에틸에테르 및 n-헥산을 가해서 분말화하여, 화합물 580(17.1mg, 45.0%)을 백색 고체로서 얻었다.
참고예 581
제1 공정
화합물 580I(398mg, 0.760mmol)의 tert-부탄올(4mL) 용액에 실온에서 트리에틸아민(0.158mL, 1.14mmol) 및 디페닐인산아지드(0.196mL, 0.912mmol)를 가하고, 20시간 가열 환류하였다. 반응액에 실온에서 물(20mL)을 가하고, 클로로포름으로 3회 추출하였다. 추출액을 합쳐서 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(메탄올/클로로포름=0%→10%)로 정제하여 화합물 581A(167mg, 36.9%)를 회백색 고체로서 얻었다.
MS: m/z=595.10 [M+H]+.
제2 공정
화합물 581A(167mg, 0.281mmol)의 염화메틸렌(2mL) 용액에 실온에서 트리플루오로아세트산(2mL)을 가하고 1.5시간 교반하였다. 반응액을 감압하에서 농축하고, 얻어진 잔사를 분취용 LCMS로 정제하였다. 얻어진 잔사에 아세트산에틸, 디에틸에테르 및 메탄올을 가해서 분말화하여, 화합물 581(29.4mg, 25.9%)을 백색 고체로서 얻었다.
참고예 582
제1 공정
참고예 65의 합성법에 준하여 합성한 화합물 582A(200mg, 0.470mmol)의 에탄올(4mL) 용액에 실온에서 파라포름알데히드(14.8mg, 0.493mmol)를 가하고, 마이크로웨이브 조사하에 140℃에서 45분간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=90%→100%)로 정제하여 화합물 582B(173mg, 84.0%)를 백색 고체로서 얻었다.
MS: m/z=438.15 [M+H]+.
제2 공정
화합물 582B(173mg, 0.396mmol), 4-디메틸아미노피리딘(5.6mg, 0.046mmol) 및 트리에틸아민(0.164mL, 1.18mmol)의 염화메틸렌(4mL) 용액에 실온에서 2-플루오로벤젠술포닐클로라이드(0.0790mL, 0.597mmol)를 가하고 3일간 교반하였다. 반응액을 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=60%→80%)로 정제하여 화합물 582C(199mg, 84.0%)를 백색 고체로서 얻었다.
MS: m/z=596.15 [M+H]+.
제3 공정
화합물 582C(162mg, 0.272mmol)의 아세트산(2mL) 용액에 실온에서 48% 브롬화수소수(2ml)를 가하고, 마이크로웨이브 조사하에 100℃에서 20분간 교반하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사에 디에틸에테르 및 메탄올을 가해서 분말화시켜, 화합물 582(160mg, 정량적)를 황색 고체로서 얻었다.
참고예 583, 참고예 584
제1 공정
참고예 95에 준하여 합성한 화합물 583A(3.0g, .99mmol)를 톨루엔(300ml)과 아세트산(30.0ml)에 가하여 녹이고, TsOH H2O(0.1g, 0.526mmol)를 실온에서 가하였다. 반응 혼합물을 가열 환류하에 3시간 교반하였다. 감압 농축한 후, 잔사를 아미노 실리카 겔 컬럼 크로마토그래피(CHCl3/MeOH 50:1)에 의해 정제하여 화합물 583B를 얻었다(1.8g, 72.4%).
MS: m/z=312 [M+H]+.
제2 공정
화합물 583B(233mg, 0.748mmol)와 화합물 403C(197mg, 0.8mmol)를 THF(7.5ml)에 현탁시키고, 실온에서 NaHMDS(1.123ml, 1.123mmol, 1M-THF 용액)를 질소 기류하에 가하였다. 3시간 실온에서 교반한 후, 물을 가하고, 아세트산에틸(2×30mL)로 추출하였다. 아세트산에틸층을 포화 식염수로 세정하고, 황산나트륨으로 건조한 후, 용매를 감압증류 제거하였다. 잔사를 실리카 겔 컬럼 크로마토그래피(CHCl3/MeOH 20:1)에 의해 정제하여 화합물 583D를 얻었다(90mg, 23.1%).
MS: m/z=522 [M+H]+.
제3 공정
화합물 583D(90mg, 0.173mmol)를 MeOH(3ml)와 THF(3.00ml)의 혼합 용매에 녹이고, 10% 팔라듐-탄소(90mg, 0.846mmol)를 가하였다. 수소(2atm) 기류하에서 24시간 교반하여 불필요물을 여과하였다. 잔사를 HPLC(MeCN-H2O)를 이용해서 정제하여 부분입체이성체를 분할하였다.
제1 분획(화합물 583)
(15mg, 20.1%)
MS: m/z=432 [M+H]+.
제2 분획(화합물 584)
(45mg, 60.4%)
MS: m/z=432 [M+H]+.
참고예 585
참고예 403과 마찬가지의 수법에 의해 화합물 585를 합성하였다.
참고예 586
제1 공정
화합물 95B(2.29g, 8.12mmol)를 피리딘(10ml)에 용해하고, 이소-프로필-D7-아민 하이드로클로라이드(1.00g, 9.75mmol)와 1H-벤조[d][1,2,3]트리아졸-1-올(1.10g, 8.12mmol)과 N1-((에틸이미노)메틸렌)-N3,N3-디메틸프로판-1,3-디아민 하이드로클로라이드(3.11g, 16.2mmol)를 가하고, 실온에서 20시간 교반하였다. 반응액을 물에 옮기고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거함으로써 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 얻어진 화합물에 디에틸에테르를 가해서 석출된 잔사를 여과하여 1.36g의 백색 고체 586B를 얻었다.
제2 공정
제1 공정에서 얻어진 586B(1.36g, 4.64mmol)를 디메틸포름아미드(20ml)에 용해하고, 탄산칼륨(3.20g, 23.2mmol)을 가하고, 실온에서 50분 교반하였다. O-(2,4-디니트로페닐)히드록실아민(1.85g, 9.27mmol)을 가하고, 실온에서 18시간 교반하였다. 반응액에 클로로포름을 가하고, 생긴 침전물을 여과해서 제거하고, 여액을 감압 농축하였다. 얻어진 조 생성물을 아미노 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하여 835mg의 무색 고체 586C를 얻었다.
제3 공정
제2 공정에서 얻어진 586C(581mg, 1.88mmol)와 파라포름알데히드-D2(181mg, 5.65mmol)를 에탄올(12ml)에 가하고, 마이크로웨이브 조사하에 140℃에서 30분 교반하였다. 반응액을 감압 농축하고, 얻어진 조 생성물을 아미노 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 얻어진 화합물에 디에틸에테르를 가해서 석출된 잔사를 여과하여 140mg의 백색 고체 586D를 얻었다.
제4 공정
화합물 586E(972mg, 5.78mmol)를 테트라히드로푸란(10ml)에 용해하고, 0℃에서 수소화나트륨(60%, 231mg, 5.78mmol)과 벤질브로마이드-D2(1.00g, 5.78mmol)를 가하고, 60℃에서 30분 교반하였다. 반응액을 희염산에 가하고, 아세트산에틸로 추출하고, 유기층을 탄산수소나트륨 수용액으로 세정하였다. 용매를 감압증류 제거함으로써, 1.48g의 백색 고체 586F를 얻었다.
제5 공정
제4 공정에서 얻어진 586F(1.50g, 5.76mmol)를 메탄올(20ml)과 테트라히드로푸란(20ml)에 용해하고, 2규정 수산화나트륨 수용액(14.4ml, 28.8mmol)을 가하고, 실온에서 3시간 교반하였다. 반응액에 희염산을 가해서 산성으로 하고, 아세트산에틸로 추출하고, 유기층을 포화 식염수로 세정하고 황산나트륨으로 건조하였다. 용매를 감압증류 제거함으로써 얻어진 화합물에 n-헥산-아세트산에틸을 가해서 석출된 잔사를 여과하여 1.17g의 백색 고체 586G를 얻었다.
제6 공정
제5 공정에서 얻어진 586G(1.15g, 4.67mmol)에 톨루엔(10ml)을 가하고, 디메틸포름아미드(0.100ml, 1.29mmol)와 염화티오닐(0.410ml, 5.60mmol)을 가하고, 130℃에서 1.5시간 교반하였다. 실온으로 식힌 후, 반응액을 감압 농축하였다. 얻어진 화합물에 n-헥산을 가해서 석출된 잔사를 여과하여 1.16g의 백색 고체를 얻었다. 염화알루미늄(718mg, 5.38mmol)에 디클로로메탄(10ml)과 니트로메탄(0.5ml)을 가하고, 조금전에 얻어진 화합물 500mg의 디클로로메탄 용액(5ml)을 0℃에서 가하고, 실온에서 5시간 교반하였다. 반응액에 수산화나트륨 수용액을 가하고, 염화메틸렌으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압 농축하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(4:1, v/v)로 용출함으로써 정제하였다. 얻어진 화합물에 n-헥산을 가해서 석출된 잔사를 여과하여 155mg의 담황색 고체 586H를 얻었다.
제7 공정
제6 공정에서 얻어진 586H(150mg, 0.657mmol)를 테트라히드로푸란(3ml)에 용해하고, 0℃에서 수소화리튬알루미늄-D4(13.8mg, 0.329mmol)를 가하고, 실온에서 2시간 교반하였다. 반응액에 희염산을 가하고, 아세트산에틸로 추출하고, 황산나트륨으로 건조하여 용매를 감압증류 제거하였다. 얻어진 화합물에 n-헥산-디클로로메탄을 가해서 석출된 잔사를 여과하여 114mg의 백색 고체 586I를 얻었다.
제8 공정
화합물 586D(76.0mg, 0.236mmol)와 586I(54.5mg, 0.236mmol)를 아세트산(3.2ml)에 용해하고, 수냉하에서 농황산(0.8ml)을 적하하였다. 실온에서 30분 교반한 후, 물에 옮기고 아세트산에틸로 추출하였다. 유기층을 황산나트륨으로 건조하고, 용매를 감압증류 제거하고, 얻어진 조 생성물에 아세트산에틸-디에틸에테르를 가해서 석출된 잔사를 여과하여 32mg의 백색 고체 586을 얻었다.
시판되고 있는 중수소 시약을 이용하여 참고예 586에 따라서 화합물 587 내지 591을 합성하였다.
참고예 587
참고예 588
참고예 589
참고예 590
참고예 591
참고예 592
제1 공정
화합물 592A(22.8g, 64.1mmol)와 7-(트리플루오로메틸)-6,11-디히드로디벤조[b,e]티에핀-11-올(19g, 64.1mmol)을 1,2-디클로로에탄에 현탁하고, 디클로로아세트산(13.2mL, 160mmol)을 가하고, 가열 환류하에 2.5시간 교반하였다. 실온까지 식히고, 디클로로메탄으로 희석한 후, 포화 탄산수소나트륨 수용액, 포화 식염수로 세정하여 건조하였다. 용매를 증류 제거하고, 얻어진 고체에 아세트산에틸-디이소프로필에테르를 가해서 고화시켜, 32g(10%의 592A를 포함함)의 화합물 592B를 얻었다.
MS: m/z=634 [M+H]+.
Rf: 0.56(오로지 AcOEt).
제2 공정
화합물 592B(6.0g, 9.47mmol)의 N,N-디메틸아세토아미드(120mL) 용액에 2-tert-부틸이미노 2-디에틸아미노-1,3-디메틸퍼히드로-1,3,2-디아자포스포린(16.5mL, 56.8mmol) 및 파라포름알데히드(569mg, 18.9mmol)를 가하고, 실온에서 3시간 교반하였다. 계속해서 TsCl(3.61g, 18.9mmol)를 천천히 가하고, 2시간 더 교반하였다. 반응액에 1N HCl 수용액을 가하고, 아세트산에틸로 2회 추출하였다. 유기층을 물, 포화 식염수로 세정하고 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 헥산-아세트산에틸(2:3, v/v)로 용출하고, 이어서 헥산-아세트산에틸(1:9, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 1.74g의 담황색 고체로서 화합물 592C를 얻었다.
제3 공정
화합물 592C(1.7g, 2.63mmol)의 N,N-디메틸포름아미드(34mL) 용액에 무수 LiCl(1.3g, 31.6mmol) 및 파라포름알데히드(569mg, 18.9mmol)를 가하고, 100℃에서 3시간 교반하였다. 반응액에 1N HCl 수용액을 가하고, 아세트산에틸로 2회 추출하였다. 유기층을 물, 포화 식염수로 세정하고 건조하였다. 용매를 증류 제거한 후, 얻어진 고체를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름-메탄올(99:1, v/v)로 용출하고, 이어서 클로로포름-메탄올(96:4, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 얻어진 고체에 아세트산에틸-디이소프로필에테르를 가해서 고화시켜, 무색 고체의 화합물 592를 1.33g 얻었다.
참고예 593
참고예 594
참고예 595
참고예 596
참고예 597
참고예 598
참고예 599
참고예 600
참고예 601
참고예 602
참고예 603
참고예 604
참고예 605
참고예 606
참고예 607
참고예 608
참고예 609
참고예 610
참고예 611
참고예 612
참고예 613
참고예 614
참고예 615
참고예 616
참고예 617
참고예 618
참고예 619
참고예 620
참고예 621
참고예 622
참고예 623
참고예 624
제1 공정
화합물 624A(14.7g, 87.0mmol)와 메틸 2-(브로모메틸)벤조에이트(20.0g, 87.0mmol)를 DMF(200ml)에 용해하고, 탄산세슘(42.7g, 131mmol)을 가하고, 실온에서 2시간 교반하였다. 반응액을 여과하고, 여액에 아세트산에틸을 가하고, 물과 포화 탄산수소나트륨 수용액으로 세정하였다. 유기층을 황산나트륨으로 건조한 후, 용매를 감압증류 제거하였다. 얻어진 고체에 헥산을 가해서 분쇄하고, 여과 취출함으로써 26.2g의 백색 고체 624B를 얻었다.
제2 공정
화합물 624B(26.2g, 83.0mmol)를 메탄올(200ml)과 THF(200ml)에 용해하고, 실온에서 2규정 수산화나트륨 수용액(207ml, 414mmol)을 가하고, 실온에서 3일간 교반하였다. 반응액에 희염산을 가하여 산성으로 하고, 생긴 백색 침전을 여과 취출하여 건조함으로써 23.1g의 백색 고체 624C를 얻었다.
제3 공정
화합물 624C(2.66g, 9.23mmol)에 폴리인산(30g)을 가하고, 120℃에서 3시간 교반하였다. 반응액을 실온까지 냉각한 후에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거함으로써 2.37g의 옅은 차색 고체 624D를 얻었다.
제4 공정
화합물 624D(96.0mg, 0.355mmol)에 톨루엔(2ml)을 가하고, DMF(0.028ml)와 염화티오닐(0.131ml, 1.80mmol)을 가하고 나서 130℃에서 1시간 교반하였다. 용매를 감압증류 제거한 후, 메탄올(1ml)과 THF(1ml)에 용해하고, 수소화붕소나트륨(100mg, 2.64mmol)을 가하고, 실온에서 1시간 교반하였다. 반응액에 염화암모늄 수용액을 가하고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(1:1, v/v)로 용출함으로써 정제하여 41mg의 백색 고체 624E를 얻었다.
제5 공정
화합물 624E(40.0mg, 0.155mmol)를 디클로로메탄(2ml)에 용해하고, 피리딘(61.2mg, 0.774mmol)과 염화벤조일(21.8mg, 0.155mmol)을 가하고, 실온에서 2시간 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 n-헥산-아세트산에틸(1:1, v/v)로 용출함으로써 정제하여 30mg의 백색 고체 624F를 얻었다.
이하, 참고예 592에 따라서, 화합물 624를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=518 [M+H]+.
참고예 625
제1 공정
질소 기류하에, 화합물 625A(700mg, 2.29mmol)의 톨루엔(3.3mL) 용액에 2-피롤리돈(264μL, 3.44mmol), N,N'-디메틸에틸렌디아민(49μL, 0.46mmol), 요오드화구리(87mg, 0.46mmol), 탄산칼륨(634mg, 4.59mmol)을 가하고, 110℃에서 8시간 교반하였다. 실온까지 식힌 후, 반응 용액을 그대로 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 클로로포름-메탄올(19:1, v/v)로 용출하고, 목적으로 하는 분획을 농축하여 회백색 고체로서 620mg의 화합물 625B를 얻었다.
MS: m/z=310 [M+H]+.
Rf: 0.50(CHCl3:MeOH=19:1).
제2 공정
빙냉한 NaBH4(227mg, 6.0mmol)의 MeOH(4mL) 용액에 화합물 625B(620mg, 2.0mmol)의 THF(8mL) 용액을 가하고 1시간 교반하였다. 물을 가하고, 아세트산에틸로 2회 추출한 후, 유기층을 포화 식염수로 세정하고 건조하였다. 용매를 증류 제거하고, 얻어진 고체를 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 클로로포름-메탄올(19:1, v/v)로 용출하고, 목적으로 하는 분획을 농축하여 무색 고체로서 621mg의 화합물 625C를 얻었다.
이하, 참고예 592에 따라서, 화합물 625를 마찬가지의 수법에 의해 합성하였다.
참고예 626
제1 공정
화합물 626A(20.0g, 114mmol)와 페닐메탄티올(14.19g, 114mmol)의 N,N-디메틸포름아미드(200mL) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 t-부톡시칼륨(14.11g, 126mmol)을 20분에 걸쳐 투입하였다. 반응액을 동일 온도에서 30분간 교반한 후, 서서히 실온까지 승온시켜 동일 온도에서 2시간 교반하였다. 얼음물을 가하고, 아세트산에틸로 추출하였다. 추출액을 3회 수세하고, 포화 식염수로 세정한 후, 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 디이소프로필에테르를 가해서 고화시켜, 15.0g의 화합물 626B를 얻었다.
제2 공정
화합물 626B(6.9g, 26.3mmol)를 1,4-디옥산(60mL)에 현탁하고, 술팜산(5.61g, 57.8mmol)을 가하고 1 내지 3℃로 냉각하였다. 반응액에 차아염소산나트륨(5.23g, 57.8mmol)의 수용액(20ml)을 동일 온도로 유지하면서 10분에 걸쳐 적하하였다. 반응액을 동일 온도에서 30분간 교반한 후, 서서히 실온까지 승온시켜 동일 온도에서 2시간 교반하였다. 반응액에 얼음물을 가하고, 아세트산에틸로 추출하였다. 추출액을 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 디이소프로필에테르를 가해서 고화시켜, 7.1g의 화합물 626C를 얻었다.
제3 공정
화합물 626C(8.0g, 27.1mmol)를 아세토니트릴(40mL)에 현탁하고, 요오드화나트륨(12.1g, 81.0mmol)을 가하였다. 반응액에 BF3 에테레이트(5.16ml, 40.7mmol)를 한번에 투입하고, 동일 온도에서 30분간 교반하였다. 반응액에 얼음물, 10% 아황산나트륨 수용액을 가하고, 아세트산에틸로 추출하였다. 추출액을 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 디이소프로필에테르를 가해서 고화시켜, 5.0g의 화합물 626D를 얻었다.
제4 공정
120℃로 가열한 폴리인산 20g에 화합물 626D(2.5g, 9.0mmol)를 60분에 걸쳐 투입하였다. 그 후, 동일 온도에서 6시간 교반하였다. 반응액을 실온까지 냉각한 후, 얼음물에 옮겨 아세트산에틸로 추출하였다. 추출액을 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 n-헥산으로 용출하고, 이어서 n-헥산-아세트산에틸(1:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 헥산을 가하여 고화시켜, 백색 고체로서 710mg의 화합물 626E를 얻었다.
제5 공정
화합물 626E(730mg, 2.80mmol)의 테트라히드로푸란(10mL) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 리튬보로하이드라이드(61mg, 2.80mmol)를 투입하였다. 동일 온도에서 30분간 교반하였다. 반응액에 얼음물, 10% 염화암모늄 수용액을 가하고, 아세트산에틸로 추출하였다. 추출액을 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물에 디이소프로필에테르를 가해서 고화시켜, 530mg의 화합물 626F를 얻었다.
이하, 참고예 592에 따라서, 화합물 626을 마찬가지의 수법에 의해 합성하였다.
참고예 627
참고예 628
참고예 629
참고예 630
참고예 631
참고예 632
참고예 633
참고예 634
참고예 635
참고예 636
참고예 637
참고예 638
참고예 639
참고예 640
참고예 641
참고예 642
참고예 643
참고예 644
참고예 645
참고예 646
제1 공정
화합물 646A(100mg, 0.33mmol)를 아세톤(1mL)-톨루엔(1mL)에 용해하고, 아세트산(0.02mL, 0.33mmol)을 가하고 2시간 가열 환류하였다. 반응액을 감압하에 농축한 후, 잔류물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(10:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 117mg의 화합물 646B를 얻었다.
제2 공정
화합물 646B의 DMF(170mL) 용액을 1 내지 3℃로 빙냉하고, 브롬화벤질(0.11mL, 0.92mmol) 및 탄산세슘(301mg, 0.92mmol)을 가하였다. 반응액을 실온에서 3시간 교반한 후, 아세트산에틸-물로 분배하였다. 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 1회 추출하였다. 합친 추출액을 순차적으로 물 2회, 포화 식염수로 세정한 후 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(10:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 10mg의 화합물 646C를 얻었다.
MS: m/z=432 [M+H]+
제3 공정
화합물 646C(10mg, 0.023mmol)를 MeOH(0.5mL)에 용해하고, 10% Pd-C(2.5mg)를 가하고, 수소 기류하에 접촉 환원 반응을 시켰다. 촉매를 여과에 의해 제거하고, 여액을 농축하였다. 얻어진 잔사를 디올 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(10:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 유상물로서 3.4mg의 화합물 646을 얻었다.
MS: m/z=342 [M+H]+.
참고예 647
참고예 648
참고예 649
참고예 650
참고예 651
참고예 652
LCMS 방법
컬럼: 액퀴티(ACQUITY) UPLC 등록상표 BEH C18(1.7㎛ i.d. 2.1×50mm)(워터스(Waters)사)
유속: 0.8mL/분
UV 검출 파장: 254nm
이동상: [A]는 0.1% 포름산 함유 수용액, [B]는 0.1% 포름산 함유 아세토니트릴 용액
구배: 3.5분간 10% 내지 100% 용매 [B]의 선형 구배를 행하고, 0.5분간 100% 용매 [B]를 유지하였다.
참고예 653
참고예 654
참고예 655
참고예 656
참고예 657
참고예 658
참고예 659
참고예 660
참고예 661
참고예 662
참고예 663
참고예 664
참고예 665
이하에, 친 화합물을 합성하기 위한 중간체 화합물 i-1 내지 i-72의 합성법을 나타낸다.
중간체 화합물 i-3의 합성
공정 1
화합물 i-1(50.0g, 136mmol)을 디클로로메탄(500mL)에 용해하고, Boc2O(34.8mL, 150mmol), DMAP(831mg, 6.81mmol)를 가하고, 실온에서 2시간 교반하였다. 그 후, NBS(29.1g, 163mmol)를 가하고 실온에서 철야 더 교반하였다.
유기층을 물과 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-2(64.0g, 수율 86%)를 얻었다.
공정 2
화합물 i-2(64.0g, 117mmol)의 메탄올(600mL) 용액을 얼음물로 0℃로 냉각하였다. 이것에 2mol/L 수산화나트륨 수용액(76mL, 152mmol)을 가하고, 0℃에서 1시간 교반하였다. 빙욕하에 2mol/L 염산으로 중화한 후, 석출된 고체를 여과 분별하였다. 물로 세정한 후, 건조시켜서 화합물 i-3(40.5g, 수율 78%)을 얻었다.
중간체 화합물 i-5의 합성
공정 1
질소 분위기하에, 화합물 i-4(6.60g, 9.55mmol)에 디옥산(66mL), Pd2(PPh3)2(670mg, 0.955mmol), 트리부틸(1-에톡시-비닐)주석(4.84mL, 14.3mmol)을 가하고, 2시간 반 가열 환류하였다. 실온까지 냉각한 후, 1mol/L 염산(20mL)을 가하고 실온에서 20분 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 물과 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-5(5.50g, 수율 88%)를 얻었다.
중간체 화합물 i-7의 합성
공정 1
화합물 i-6(40mg, 0.058mmol)에 디메틸아세트아미드(0.5mL), 시안화구리(I)(52mg, 0.579mmol)를 가하고, 봉관에서 26시간 140℃에서 가열 교반하였다. 1mol/L 염산(20mL)을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 분취형 LCMS(방법 14)에 의해 정제하여 화합물 i-7(8.0mg, 수율 25%)을 얻었다.
중간체 화합물 i-10의 합성
공정 1
화합물 i-8(110mg, 0.164mmol)에 메탄올(1mL), 테트라히드로푸란(1mL), 2mol/L 수산화나트륨 수용액(0.246mL, 0.492mmol)을 가하고 60℃에서 3시간 교반한 후, 2mol/L 수산화나트륨 수용액(0.164mL, 0.328mmol)을 더 가하고 60℃에서 4시간 교반하였다. 2mol/L 염산으로 중화한 후, 클로로포름으로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하여 화합물 i-9(91mg, 98%)를 얻었다.
MS: m/z=566 [M+H]+. RT=2.30분.
공정 2
화합물 i-9(20mg, 0.035mmol)에 디메틸포름아미드(0.5mL), 2mol/L 암모니아-메탄올 용액(0.053mL, 0.106mmol), [4-(4,6-디메톡시-1,3,5-트리아진-2-일)-4-메틸모르폴리늄클로라이드](29.3mg, 0.106mmol)를 가하고, 실온에서 철야 교반하였다. 그 후, 28% 나트륨메톡시드-메탄올 용액(34.1mg, 0.177mmol)을 가하고 실온에서 1시간 더 교반하였다. 0.5mol/L 염산을 가한 후, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 분취형 LCMS(방법 14)에 의해 정제하여 화합물 i-10(4.0mg, 수율 20%)을 얻었다.
MS: m/z=565 [M+H]+. RT=2.03분.
중간체 화합물 i-12의 합성
공정 1
질소 분위기하에, 화합물 i-11(1.00g, 3.28mmol)에 테트라히드로푸란(25mL), [1,1'-비스(디-tert-부틸포스피노)페로센]팔라듐(II)디클로라이드(214mg, 4.91mmol), 칼륨시클로프로필트리플루오로보레이트(727mg, 4.91mmol), 2mol/L 탄산나트륨 수용액(4.91mL, 9.83mmol)을 가하고, 20시간 가열 환류하였다. 물을 가한 후, 아세트산에틸로 추출하였다. 유기층을 물과 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-클로로포름)에 의해 정제하여 화합물 i-12(350mg, 수율 24%)를 얻었다.
MS: m/z=267 [M+H]+. RT=2.46분.
중간체 화합물 i-14의 합성
공정 1
화합물 i-13(200mg, 0.305mmol)에 테트라히드로푸란(3mL), 비스피나콜레이트디보란(232mg, 0.914mmol), PdCl2(dppf)·CH2Cl2(24.9mg, 0.030mmol), 아세트산칼륨(90mg, 0.914mmol)을 가하고, 80℃에서 3시간 반 교반하였다. 실온까지 냉각한 후, 셀라이트 여과를 행하고, 용매를 감압증류 제거하였다. 1mol/L 염산을 가한 후, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 얻어진 차색 개체에 디메틸아세트아미드(2mL), 염화리튬(64.5mg, 1.53mmol)을 가하고, 100℃에서 4시간 교반하였다. 실온까지 냉각한 후, 1mol/L 염산을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 분취형 LCMS(방법 14)에 의해 정제하여 화합물 i-14(59mg, 수율 37%)를 얻었다.
MS: m/z=532 [M+H]+. RT=2.02분.
중간체 화합물 i-16의 합성
공정 1
화합물 i-15(20mg, 0.030mmol)에 테트라히드로푸란(0.5mL), PEPPSI-IPr(2.07mg, 3.05μmol), 2mol/L 메틸아연클로라이드 테트라히드로푸란 용액(0.076mL, 0.152mmol)을 가하고, 질소 기류하에 봉관에서 100℃에서 3시간 교반하였다. 실온까지 냉각한 후, 2mol/L 염산을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(DIOL, 헥산-아세트산에틸)에 의해 정제하여 화합물 i-16(4.0mg, 수율 26%)을 얻었다.
중간체 화합물 i-18의 합성
공정 1
화합물 i-17(50mg, 0.076mmol)을 테트라히드로푸란(1mL)에 용해시키고, 드라이아이스-아세톤하에 -78℃로 냉각하였다. 이것에 1.06mol/L 수소화디이소부틸알루미늄-헥산 용액(0.108mL, 0.115mmol)을 가하고, -78℃에서 1시간 교반하였다. 포화 로셸(Rochelle)염 수용액을 가하고, 실온에서 20분간 교반한 후, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-18(35mg, 수율 70%)을 얻었다.
중간체 화합물 i-20의 합성
공정 1
화합물 i-19(560mg, 1.43mmol)에 톨루엔(250mL), 아세트산(25mL), 토실산1수화물(54.4mg, 0.286mmol)을 가하고 16시간 가열 환류하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-20(210mg, 수율 45%)을 얻었다.
중간체 화합물 i-25의 합성
공정 1
화합물 i-21(30.0g, 104mmol)을 메탄올(450mL)에 현탁해서, 65℃로 가열하여 용해하였다. 이산화망간(75g, 863mmol)을 가하고, 65℃에서 2시간 교반하였다. 고체를 여과 제거하고, 여액을 감압증류 제거하였다. 얻어진 잔사에 테트라히드로푸란-디이소프로필에테르를 가해서 고체를 석출시킨 후, 여과 취출함으로써 화합물 i-22(27.55g, 수율 93%)를 얻었다.
공정 2
아염소산나트륨(34.6g, 383mmol)을 물(150mL)에 용해하고, 얼음물로 0℃로 냉각하였다. 이것에 아미도황산(37.2g, 383mmol)을 가하고 40분 교반하였다. 별도의 플라스크에서 화합물 i-22(27.5g, 96mmol)를 테트라히드로푸란(450mL)과 DMF(45mL)에 용해하여, 얼음물로 0℃로 냉각하였다. 이것에 상기 조정한 수용액을 적하하고, 0℃에서 1시간 교반하였다. 용매를 감압 농축하고, 물과 디이소프로필에테르를 가하여 고체를 여과 취출함으로써 화합물 i-23(19.49g, 수율 67%)을 얻었다.
공정 3
화합물 i-23(14.0g, 46.2mmol)을 DMF(140mL)에 용해하고 빙냉하였다. (R)-1,1,1-트리플루오로이소프로필아민염산염(10.36g, 69.2mmol), EDC(11.50g, 60.0mmol), HOBt(8.11g, 60.0mmol), 트리에틸아민(19.2mL, 138mmol)을 가하고, 실온에서 4시간 교반하였다. 반응액에 물을 가하여 반응을 정지시켰다. 아세트산에틸로 추출하고, 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 i-24(12.87g, 수율 70%)를 얻었다.
MS: m/z=399.1 [M+H]+.
공정 4
화합물 i-24(12.55g, 31.5mmol)를 DMF(130mL)에 용해하였다. 탄산칼륨(21.77g, 158mmol)을 가하고 15분 교반하였다. 2,4-디니트로페닐히드록실아민(9.41g, 47.3mmol)을 가하고 3시간 교반하였다. 반응액에 클로로포름을 가해서 석출된 고체를 여과 제거하고, 여액을 감압증류 제거하였다. 얻어진 DMF 용액에 파라포름알데히드(851mg, 28.3mmol), 아세트산(0.09mL, 1.58mmol)을 가하고, 110℃에서 3시간 반 교반하였다. 방냉하여 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 i-25(8.15g, 수율 61%)를 얻었다.
중간체 화합물 i-29의 합성
공정 1
화합물 i-25(1.5g, 3.5mmol)를 디클로로메탄에 현탁하였다. Boc2O(0.86mL, 3.7mmol), DMAP(43mg, 0.35mmol)를 가하고, 실온에서 1시간 교반하였다. 물을 가하고, 클로로포름으로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-26(1.59g, 수율 86%)을 얻었다.
공정 2
질소 분위기하에, 화합물 i-26(1.5g, 2.9mmol)을 톨루엔(30mL)에 현탁하고, 드라이아이스-아세톤으로 -78℃로 냉각하였다. 이것에 DIBAL-헥산 용액(3.0mL, 3.1mmol)을 적하하여, -78℃에서 1시간 교반하였다. 반응액에 아세트산에틸을 가하여 반응을 정지시키고 실온으로 승온시켰다. 타르타르산나트륨칼륨 수용액을 가하고, 실온에서 격렬하게 1시간 교반하였다. 2층을 분리하고, 유기층을 물, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-27(568mg, 수율 40%)을 얻었다.
공정 3
화합물 i-27(550mg, 1.1mmol)을 디클로로메탄(11mL)에 용해하였다. 빙냉하고 비스(2-메톡시에틸)아미노설퍼트리플루오라이드(0.72mL, 3.9mmol)를 가하고, 실온으로 승온시켜 2시간 교반하였다. 반응액에 물을 가하여 반응을 정지시키고, 아세트산에틸로 추출하였다. 유기층을 포화 중조수, 물, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-28(408mg, 수율 71%)을 얻었다.
공정 4
화합물 i-28(400mg, 0.77mmol)을 메탄올(6mL)에 용해하였다. 빙냉하고 2mol/L 수산화나트륨 수용액(0.5mL, 1.0mmol)을 가하고, 0℃에서 1시간 교반하였다. 반응액에 물을 가하여 희석하고, 클로로포름으로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거함으로써 화합물 i-29(286mg, 수율 89%)를 얻었다.
중간체 화합물 i-32의 합성
공정 1
화합물 i-30(13.3g, 69.9mmol)을 DMF(60mL)에 용해하였다. 빙냉하고 수소화나트륨(3.3g, 83mmol)을 가하고, 0℃에서 15분 교반하였다. 여기에 브로모아세트알데히드디메틸아세탈(12.3mL, 104mmol), 요오드화칼륨(1.16g, 7.0mmol)을 가하고, 실온에서 3시간 교반하였다. 반응액에 물을 가하여 반응을 정지시키고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-31(8.8g, 수율 45%)을 얻었다.
공정 2
화합물 i-31(8.79g, 31.5mmol)을 에탄올(100mL)에 용해하였다. 히드라진일수화물(3.0mL, 62.9mmol)을 가하고, 60℃에서 2시간 교반하였다. 방냉한 후, 석출된 고체를 여과 제거하고, 여액을 감압증류 제거하였다. 다시 석출된 고체를 여과 제거하고, 여액을 감압증류 제거함으로써 화합물 i-32(4.37g, 수율 93%)를 얻었다.
중간체 화합물 i-36, i-37의 합성
공정 1
화합물 i-33(1.00g, 4.09mmol)을 DMF(5mL)에 용해하고, 디메틸아민염산염(384mg, 4.71mmol), 탄산칼륨(651mg, 4.71mmol), 트리에틸아민(0.653mL, 4.71mmol)을 가하고, 봉함(封緘)하에 160℃에서 17.5시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-34(587mg, 수율 53%)를 얻었다.
공정 2
화합물 i-34(587mg, 2.18mmol)를 테트라히드로푸란(20mL)에 용해하고, 빙냉하에 나트륨수소화비스(2-메톡시에톡시)알루미늄-톨루엔 용액(3.39mL, 10.9mmol)을 적하하고, 실온에서 3.5시간 교반하였다. 빙냉하에 로셸염(7.06g, 25.0mmol)의 수용액(50mL)을 가하고, 실온으로 승온시켰다. 아세트산에틸로 추출하고, 유기층을 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-35(460mg, 수율 78%)를 얻었다.
공정 3
화합물 i-35(100mg, 0.368mmol)를 아세트산에틸(3mL)에 용해하고, 화합물 i-A(222mg, 0.553mmol), 클로로아세트산(104mg, 1.11mmol)을 가하고, 봉함하에 120℃에서 4시간 교반하였다. 아세트산에틸로 희석하고, 포화 탄산수소나트륨 수용액, 물로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-36(107mg, 수율 44%) 및 화합물 i-37(42.7mg, 수율 18%)을 얻었다.
중간체 화합물 i-42의 합성
공정 1
화합물 i-38(12.0g, 49.1mmol)을 테트라히드로푸란(20mL)에 용해하고, 나트륨메톡시드-메탄올 용액(60.0mL, 311mmol)을 가하고 4시간 환류하였다. 염산 수용액을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사에 디클로로메탄-헥산을 가하여 고체를 석출시킨 후, 여과 취출함으로써 화합물 i-39(10.5g, 수율 84%)를 얻었다.
공정 2
질소 분위기하에, 화합물 i-39를 디클로로메탄(100mL)에 현탁하고, 빙냉하에 1mol/L 트리브로모보란-디클로로메탄 용액(82.0mL, 82.0mmol)을 적하한 후, 실온에서 2시간 교반하였다. 빙냉하에 탄산수소나트륨 수용액을 가한 후, 실온으로 승온시켰다. 포화 염화나트륨 수용액을 가하고, 디클로로메탄으로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사에 디클로로메탄-헥산을 가하여 고체를 석출시킨 후, 여과 취출함으로써 화합물 i-40(8.42g, 수율 85%)을 얻었다.
공정 3
화합물 i-40(500mg, 2.06mmol)을 테트라히드로푸란(10mL)에 용해하고, 빙냉하에 나트륨수소화비스(2-메톡시에톡시)알루미늄-톨루엔 용액(3.21mL, 10.3mmol)을 적하하여, 빙냉하에서 1시간 교반하였다. 빙냉하에 로셸염(2.82g, 10.0mmol)의 수용액(20mL)을 가하고, 실온으로 승온시켰다. 아세트산에틸로 추출하고, 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사에 디클로로메탄-헥산을 가하여 고체를 석출시킨 후, 여과 취출함으로써 화합물 i-41(389mg, 수율 77%)을 얻었다.
공정 4
화합물 i-41(150mg, 0.614mmol)을 아세토니트릴(1.5mL)에 현탁하고, 트리에틸아민(0.426mL, 3.07mmol), 무수아세트산(0.290mL, 3.07mmol) 및 DMAP(37.5mg, 0.307mmol)를 가하고, 실온에서 1.5시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-42(171mg, 수율 85%)를 얻었다.
중간체 화합물 i-49의 합성
공정 1
화합물 i-43(4.06g, 16.7mmol)을 DMSO(40mL)에 용해하고, 인산칼륨(7.11g, 33.5mmol) 및 브롬화알릴(2.18mL, 25.1mmol)을 가하고, 실온에서 6시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사에 헥산을 가하여 고체를 석출시킨 후, 여과 취출함으로써 화합물 i-44(4.28g, 수율 91%)를 얻었다.
공정 2
화합물 i-44(50.0mg, 0.177mmol)를 DMA(1mL)에 용해하여, 봉함하에 230℃에서 6시간 교반하였다. 염산 수용액을 가하고, 아세트산에틸로 추출하였다. 유기층을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-45(37.1mg, 수율 74%)를 얻었다.
공정 3
화합물 i-45(600mg, 2.13mmol)를 DMSO(6mL)에 용해하고, 인산칼륨(902mg, 4.25mmol) 및 브롬화알릴(0.276mL, 3.19mmol)을 가하고, 실온에서 2시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-46(642mg, 수율 88%)을 얻었다.
공정 4
질소 분위기하에, 화합물 i-46(560mg, 1.74mmol)을 디클로로메탄(56mL)에 용해하고, 제2세대 그럽스(Grubbs) 촉매(147mg, 0.174mmol)를 가하고, 실온에서 14시간 교반하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-47(366mg, 수율 72%)을 얻었다.
공정 5
화합물 i-47(362mg, 1.23mmol)을 테트라히드로푸란(7mL)에 용해하고, 빙냉하에 나트륨수소화비스(2-메톡시에톡시)알루미늄-톨루엔 용액(1.15mL, 3.69mmol)을 적하하여, 빙냉하에서 45분간 교반하였다. 빙냉하에 로셸염(2.11g, 7.50mmol)의 수용액(30mL)을 가하고, 실온으로 승온시켰다. 아세트산에틸로 추출하고, 유기층을 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-48(352mg, 수율 97%)을 얻었다.
공정 6
화합물 i-48(215mg, 0.725mmol)의 테트라히드로푸란-메탄올(1:1, 3mL) 용액에 10% 팔라듐탄소(77.0mg, 0.073mmol)를 가하고, 수소 분위기하에 실온에서 1.5시간 교반하였다. 고체를 여과 제거하고, 여액을 감압증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-49(139mg, 수율 64%)를 얻었다.
중간체 화합물 i-51, i-54의 합성
공정 1
화합물 i-51(676mg, 2.39mmol)을 디옥산(10mL)에 용해하고, 디클로로비스아세토니트릴팔라듐(155mg, 0.599mmol), 탄산나트륨(254mg, 2.39mmol) 및 벤조퀴논(259mg, 2.39mmol)을 가하고, 봉함하에 100℃에서 27시간 교반하였다. 아세트산에틸로 희석하고, 고체를 여과 제거하였다. 여액을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-51(166mg, 수율 25%) 및 화합물 i-52(280mg, 수율 41%)를 얻었다.
공정 2
화합물 i-52(250mg, 0.885mmol)를 DMSO(2.5mL)에 용해하고, 인산칼륨(376mg, 1.77mmol) 및 브롬화알릴(0.115mL, 1.33mmol)을 가하고, 실온에서 2시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-53(285mg, 수율 100%)을 얻었다.
공정 3
질소 분위기하에, 화합물 i-53(310mg, 0.961mmol)을 디클로로메탄(31mL)에 용해하고, 제2세대 그럽스 촉매(82.0mg, 0.096mmol)를 가하고, 실온에서 14시간 교반하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-54(170mg, 수율 63%)를 얻었다.
중간체 화합물 i-56의 합성
공정 1
화합물 i-55(100mg, 0.328mmol)를 DMF(1mL)에 현탁하고, 2,2-디플루오로-2-(플루오로술포닐)아세트산메틸(0.124mL, 0.983mmol) 및 요오드화구리(68.6mg, 0.360mmol)를 가하고, 130℃에서 4시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하여 화합물 i-56(96mg, 수율 100%)을 얻었다.
중간체 화합물 i-60의 합성
공정 1
화합물 i-55(3.00g, 9.83mmol)를 DMF(30mL)에 현탁하고, 시안화구리(2.64g, 29.5mmol)를 가하고 8시간 환류하였다. 물을 가하고, 클로로포름으로 추출하였다. 유기층을 물로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사에 디클로로메탄-디에틸에테르-헥산을 가하여 고체를 석출시킨 후, 여과 취출함으로써 화합물 i-57(1.72g, 수율 70%)을 얻었다.
공정 2
화합물 i-57(25.0mg, 0.099mmol)을 메탄올(0.5mL)에 현탁하고, 염화트리메틸실릴(0.051mL, 0.398mmol)을 가하고, 50℃에서 4.5시간 교반하였다. 탄산수소나트륨 수용액을 가하고, 클로로포름으로 추출하고, 유기층을 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-58(11.4mg, 수율 40%)을 얻었다.
공정 3
질소 분위기하에, 화합물 i-58(600mg, 2.11mmol)을 테트라히드로푸란(8mL)에 용해하고, 빙냉하에 수소화리튬알루미늄(481mg, 12.66mmol)을 가하고, 빙냉하에서 45분간 교반하였다. 빙냉하에 포화 염화암모늄 수용액(1.5mL)을 적하하고, 실온으로 승온시켰다. 아세트산에틸로 추출하고, 유기층을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-59(415mg, 수율 76%)를 얻었다.
공정 4
화합물 i-59(70.0mg, 0.271mmol)을 아세토니트릴(1mL)에 현탁하고, 트리에틸아민(0.188mL, 1.36mmol), 무수아세트산(0.128mL, 1.36mmol) 및 DMAP(16.6mg, 0.135mmol)을 가하고, 실온에서 30분간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하여 화합물 i-60(93.0mg, 수율 100%)을 얻었다.
중간체 화합물 i-61의 합성
공정 1
질소 분위기하에, 화합물 i-59(100mg, 0.387mmol)를 테트라히드로푸란에 용해하고, 빙냉하에 수소화나트륨(37.2mg, 0.929mmol)을 가하여 빙냉하에서 5분 교반한 후, 요오드화메틸(0.145mL, 2.32mmol)을 가하여 실온에서 2시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-61(106mg, 수율 96%)을 얻었다.
중간체 화합물 i-65의 합성
공정 1
화합물 i-55(2.10g, 6.88mmol)를 DMF(10.5mL)에 현탁하고, 요오드화구리(262mg, 1.38mmol), 디클로로비스트리페닐포스핀팔라듐(966mg, 1.38mmol), 트리메틸실릴아세틸렌(4.86mL, 34.4mmol) 및 트리에틸아민(14.0mL, 101mmol)을 가하고, 봉함하에 140℃에서 11시간 교반하였다. 아세트산에틸로 희석하고, 고체를 여과 제거하였다. 여액을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-62(1.34g, 수율 60%)를 얻었다.
MS: m/z=323.05 [M+H]+.
공정 2
화합물 i-62(1.34g, 4.16mmol)를 메탄올(40mL)에 용해하고, 탄산칼륨(1.72g, 12.5mmol)을 가하고, 실온에서 1.5시간 교반하였다. 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-63(967mg, 수율 93%)을 얻었다.
공정 3
질소 분위기하에, 화합물 i-63(619mg, 2.47mmol)을 테트라히드로푸란(12mL)에 용해하고, 빙냉하에 수소화리튬알루미늄(282mg, 7.42mmol)을 가하고, 빙냉하에서 1시간 교반하였다. 빙냉하에 포화 염화암모늄 수용액(15mL)을 적하하여 실온으로 승온시켰다. 아세트산에틸로 추출하고, 유기층을 염산 수용액, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-64(554mg, 수율 89%)를 얻었다.
공정 4
질소 분위기하의 화합물 i-64(50.0mg, 0.198mmol)의 테트라히드로푸란(2mL) 용액을 드라이아이스-아세톤으로 -78℃로 냉각하였다. 이것에 1.65mol/L n-부틸리튬-헥산 용액(0.312mL, 0.515mmol)을 적하하고, 실온에서 20분 교반하였다. 재차 드라이아이스-아세톤으로 -78℃로 냉각한 후, 요오드화메틸(0.248mL, 3.96mmol)을 적하하고, 실온까지 승온시키면서 1.5시간 교반하였다. 포화 염화암모늄 수용액(1.5mL)을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-65(44.9mg, 수율 81%)를 얻었다.
중간체 화합물 i-67의 합성
공정 1
화합물 i-66(520mg, 1.92mmol)의 테트라히드로푸란-메탄올(1:1, 6mL) 용액에 10% 팔라듐탄소(205mg, 0.192mmol)를 가하고, 수소 분위기하에 실온에서 1시간 교반하였다. 고체를 여과 제거하고, 여액을 감압증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-67(370mg, 수율 70%)을 얻었다.
중간체 화합물 i-69의 합성
공정 1
질소 분위기하의 화합물 i-68(1.00g, 3.81mmol)의 테트라히드로푸란(40mL) 용액을 드라이아이스-아세톤으로 -78℃로 냉각하였다. 이것에 1.65mol/L n-부틸리튬-헥산 용액(6.92mL, 11.4mmol)을 적하하고, 실온에서 30분 교반하였다. 재차 드라이아이스-아세톤으로 -78℃로 냉각한 후, 요오드화메틸(2.38mL, 38.1mmol)을 적하하여 실온까지 승온시키면서 2.5시간 교반하였다. 반응액을 농축한 후, 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 i-69(522mg, 수율 50%)를 얻었다.
중간체 화합물 i-72의 합성
공정 1
화합물 i-70(500mg, 1.36mmol)을 디클로로메탄(10mL)에 용해하고, Boc2O(0.348mL, 1.50mmol), DMAP(16mg, 0.136mmol)를 가하고, 실온에서 1시간 교반하였다. 그 후, NCS(273mg, 2.04mmol)를 가하여 7시간 가열 환류하고, 그 후 4일간 실온에서 교반하였다.
반응액을 농축하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 i-71(670mg, 수율 98%)을 얻었다.
MS: m/z=502.12 [M+H]+
공정 2
화합물 i-71(670mg, 1.34mmol)의 에탄올-수용액에 2M 염산 수용액(3.34mL, 6.67mmol)을 가하고, 60℃에서 3시간 교반하였다. 포화 중조수를 가하고 클로로포름으로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하여 화합물 i-72(452mg, 1.13mmol)를 얻었다.
MS: m/z=402.08 [M+H]+
이하, 상기한 중간체 화합물을 이용하여, 참고예 666 내지 775를 합성하였다.
참고예 666의 합성
제1 공정
화합물 666A(1.0g, 2.4mmol), 10-클로로-6,11-디히드로디벤조[b,e]티에핀-11-올(741mg, 2.8mmol), 포스폰산무수프로판-50% 아세트산에틸 용액(10mL, 16.8mmol)을 혼합하고, 100℃에서 5시간 교반하였다. 반응액에 아세트산에틸을 가해서 희석하고, 물, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 666B(451mg, 수율 29%)를 얻었다.
제2 공정
화합물 666B(570mg, 0.85mmol)를 테트라히드로푸란(6mL)과 메탄올(1.5mL)에 용해하였다. 빙냉하고, 2mol/L 수산화나트륨 수용액(0.64mL, 1.28mmol)을 가하고, 0℃에서 30분 교반하였다. 반응액에 염산을 가하여 반응을 정지시키고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 666C(433mg, 수율 78%)를 얻었다.
제3 공정
화합물 666C(289mg, 0.44mmol)를 테트라히드로푸란(5mL)에 용해하였다. 빙냉하고, 트리에틸아민(0.18mL, 1.3mmol), 클로로포름산에틸(0.11mL, 1.1mmol)을 가하고 15분 교반하였다. 드라이아이스-아세톤으로 -78℃로 냉각하고, DIBAL-헥산 용액(2.1mL, 2.2mmol)을 가하고, -78℃에서 40분 교반하였다. 반응액에 아세트산에틸을 가하여 반응을 정지시키고 실온으로 승온시켰다. 타르타르산나트륨칼륨 수용액을 가하고, 실온에서 격렬하게 2시간 교반하였다. 유기층을 무수 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 DMF(2ml)에 용해하였다. 염화리튬(70mg, 1.7mmol)을 가하고, 100℃에서 2시간 교반하였다. 방냉하여 아세트산에틸로 희석하고, 2mol/L 염산, 물, 포화 식염수로 세정하였다. 용매를 감압증류 제거하고, 얻어진 잔사에 아세트산에틸-디이소프로필에테르를 가하여 고체를 석출시킨 후, 여과 취출함으로써 화합물 666(40.5mg, 수율 17%)을 얻었다.
참고예 667
참고예 668
참고예 669
참고예 670
참고예 671
참고예 672
참고예 673
참고예 674
참고예 675
참고예 676
참고예 677
참고예 678
참고예 679
참고예 680
참고예 681
참고예 682
참고예 683
참고예 684
참고예 685
참고예 686
참고예 687
참고예 688
참고예 689
참고예 690
참고예 691
참고예 692
참고예 693
참고예 694
참고예 695
참고예 696
참고예 697
참고예 698
참고예 699
참고예 700
참고예 701
참고예 702
참고예 703
참고예 704
참고예 705
참고예 706
참고예 707
참고예 708
참고예 709
참고예 710
참고예 711
참고예 712
참고예 713
참고예 714
참고예 715
참고예 716
참고예 717
참고예 718
참고예 719
참고예 720
참고예 721
참고예 722
참고예 723
참고예 724
참고예 725
참고예 726
참고예 727
참고예 728
참고예 729
참고예 730
참고예 731
참고예 732
참고예 733
참고예 734
참고예 735
참고예 736
참고예 737
참고예 738
참고예 739
참고예 740
참고예 741
참고예 742
참고예 743
참고예 744
참고예 745
참고예 746
참고예 747
참고예 748
참고예 749
참고예 750
참고예 751
참고예 752
참고예 753
참고예 754
참고예 755
참고예 756
참고예 757
참고예 758
참고예 759
제1 공정
화합물 759A(124mg, 0.35mmol)를 디클로로메탄에 현탁하였다. 4,9-디히드로벤조[e]티에노[2,3-b]티에핀올(82mg, 0.35mmol), 디클로로아세트산(87μL, 1.05mmol)을 가하고, 실온에서 1시간 교반하였다. 물을 가하고 클로로포름으로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 759B(180mg, 수율 90%)를 얻었다.
MS: m/z=572.29 [M+H]+.
제2 공정
화합물 759B(108mg, 0.18mmol)를 DMA에 현탁하였다. 파라포름알데히드(113mg, 0.38mmol), BEMP(0.33mL, 1.13mmol)를 가하고, 빙냉에서 5분 교반한 후, 실온에서 2일간 교반하였다. 그 후 토실클로라이드(72mg, 0.38mmol)를 가하고 3일간 교반하였다. 포화 염화암모니아수를 가해서 석출된 고체를 여과 취출하였다. 얻어진 고체를 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 759C(16mg, 수율 15%)를 얻었다.
MS: m/z=584.25 [M+H]+
제3 공정
화합물 759C(16mg, 0.03mmol)를 DMF에 현탁하였다. 염화리튬(17mg, 0.41mmol)을 가하고, 90℃에서 7시간 교반하였다. 1M 염산 수용액을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 디올 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 759(9mg, 0.02mmol)를 얻었다.
MS: m/z=494.18 [M+H]+
참고예 760
참고예 761
참고예 762
참고예 763
참고예 764
참고예 765
제1 공정
화합물 765A(722mg, 2.43mmol)를 DMF에 현탁하였다. N-Boc 아제티디논(1.25g, 7.30mmol), 탄산세슘(2.96g, 12.16mmol)을 가하고, 빙냉하에서 30분 교반한 후, 실온에서 30분 교반하였다. 그 후, 5-클로로디벤조수베란(1.67g, 7.30mmol)을 가하고 3시간 교반하였다. 불용물을 여과 분별한 후, 0.5M 염산 수용액을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 765B(176mg, 수율 11%)를 얻었다.
MS: m/z=663.33 [M+H]+.
제2 공정
화합물 765B(176mg, 0.27mmol)를 DMA에 현탁하였다. 염화리튬(113mg, 2.66mmol)을 가하고, 100℃에서 2시간 교반하였다. 0.5M 염산 수용액을 가해서 석출된 고체를 여과 취출하여 화합물 765C(92mg, 0.16mmol)를 얻었다.
MS: m/z=573.29 [M+H]+
제3 공정
화합물 765C(45mg, 0.08mmol)에 4N HCl/디옥산(0.68mL, 2.75mmol)을 가하고, 빙냉하에 3시간 교반하였다. 반응 용액을 디이소프로필에테르로 희석해서 생긴 고체를 여과 취출하여 화합물 765D(29mg, 0.057mmol)를 얻었다.
MS: m/z=474.19 [M+H]+
제4 공정
화합물 765D(31mg, 0.06mmol)를 디클로로메탄에 현탁하였다. 37% 포름알데히드(25μL, 0.91mmol), 트리에틸아민(10μL, 0.07mmol), 아세트산(5μL, 0.09mmol), NaBH(OAc)3(25mg, 0.12mmol)을 가하고, 실온에서 1시간 교반하였다. 포화 중조수를 가하고 클로로포름으로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거한 후, 잔사를 헥산으로 고체화하여 화합물 765(15mg, 0.03mmol)를 얻었다.
MS: m/z=487.25[M+H]+
참고예 766
참고예 767
제1 공정
화합물 767A(87mg, 0.37mmol)를 디클로로메탄에 현탁하였다. 염화티오닐(54μL, 0.75mmol)을 가하고 2시간 가열 환류하였다. 반응액을 농축한 후, 얻어진 잔사를 헥산으로 고체화하여 화합물 767B(48mg, 수율 51%)를 얻었다.
제2 공정
화합물 767B(70mg, 0.19mmol)를 DMF에 현탁하였다. 화합물 12(48mg, 0.19mmol), 탄산세슘(186mg, 0.57mmol)을 가하고, 실온에서 2시간 교반하였다. 불용물을 여과 분별한 후, 여액에 물을 가하고, 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 767C(32mg, 0.06mmol)를 얻었다.
MS: m/z=583.16[M+H]+
제3 공정
화합물 767C(31mg, 0.05mmol)를 THF-메탄올에 현탁하였다. 10% 팔라듐탄소(15mg)를 가하고, 수소 분위기하에 실온에서 24시간 교반하였다. 불용물을 여과 분별한 후, 여액을 농축해서 얻어진 잔사를 디올 실리카 겔 크로마토그래피(클로로포름-메탄올)에 의해 정제하여 화합물 767(6mg, 0.01mmol)을 얻었다.
MS: m/z=493.16[M+H]+
참고예 768
참고예 769
참고예 770
참고예 771
참고예 772
참고예 773
참고예 774, 775
제1 공정
화합물 774A(111mg, 0.20mmol)를 DMA에 현탁하였다. 파라포름알데히드(11mg, 0.39mmol), BEMP(0.34mL, 1.17mmol)를 가하고, 실온에서 1.5시간 교반하였다. 그 후 토실클로라이드(74mg, 0.39mmol)를 가하고 2시간 교반하였다. 포화 염화암모니아수를 가해서 석출된 고체를 여과 취출하였다. 얻어진 고체를 실리카 겔 크로마토그래피(헥산-아세트산에틸)에 의해 정제하여 화합물 774B(16mg, 수율 14%)를 얻었다.
MS: m/z=595.18 [M+H]+
제2 공정
화합물 774B(16mg, 0.03mmol)를 DMA에 현탁하였다. 염화리튬(11mg, 0.27mmol)을 가하고, 100℃에서 3시간 교반하였다. 0.5M 염산 수용액을 가하고, 생긴 고체를 여과 취출하여 화합물 774(3mg, 0.006mmol)를 얻었다.
MS: m/z=505.11 [M+H]+
제3 공정
화합물 774B(21mg, 0.04mmol)를 메탄올에 현탁하였다. 10% 팔라듐탄소(15mg)를 가하고, 수소 분위기하에 실온에서 20시간 교반하였다. 불용물을 여과 분별한 후, 여액을 농축해서 얻어진 잔사를 DMA에 현탁하였다. 염화리튬(12mg, 0.28mmol)을 가하고, 100℃에서 3시간 교반하였다. 0.5M 염산 수용액을 가하고 아세트산에틸로 추출하였다. 유기층을 물, 포화 식염수로 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 잔사를 디이소프로필에테르로 고체화함으로써, 화합물 775(9mg, 0.02mmol)를 얻었다.
MS: m/z=507.13[M+H]+
이하에 나타내어진 EX-1 내지 EX-29도 상기 참고예와 마찬가지로 합성 가능하며, 친 화합물의 바람직한 실시 양태이다.
이하에, 본 발명에 따른 실시예 화합물 1 내지 241의 구조식을 나타낸다.
실시예 1
제1 공정
화합물 1-a(50mg, 0.0900mmol)와 트리에틸아민(46mg, 0.45mmol)의 디클로로메탄(1ml) 용액에 실온하에 무수아세트산(28mg, 0.27mmol)과 DMAP(11mg, 0.0090mmol)를 가하고, 동일 온도를 유지하면서 3시간 교반하였다. 반응액을 디클로로메탄(10ml)으로 희석한 후, 물을 가하였다. 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 황산나트륨으로 건조한 후, 용매를 증류 제거하고, 얻어진 고체를 아세트산에틸-디이소프로필에테르로 세정하여 27mg의 실시예 화합물 1을 얻었다.
실시예 2
실시예 3
실시예 4
실시예 5
실시예 6
실시예 7
실시예 8
실시예 9
실시예 10
실시예 11
실시예 12
실시예 13
실시예 14
실시예 15
실시예 16
실시예 17
실시예 18
실시예 19
실시예 20
실시예 21
실시예 22
실시예 23
실시예 24
실시예 25
실시예 26
실시예 27
실시예 28
실시예 29
실시예 30
실시예 31
실시예 32
실시예 33
실시예 34
실시예 35
실시예 36
실시예 37
실시예 38
실시예 39
실시예 40
실시예 41
실시예 42
실시예 43
실시예 44
실시예 45
실시예 46
실시예 47
실시예 48
실시예 49
실시예 50
실시예 51
실시예 52
실시예 53
실시예 54
실시예 55
실시예 56
실시예 57
실시예 58
실시예 59
실시예 60
실시예 61
실시예 62
실시예 63
실시예 64
실시예 65
실시예 66
실시예 67
실시예 68
실시예 69
실시예 70
실시예 71
실시예 72
실시예 73
실시예 74
실시예 75
실시예 76
실시예 77
실시예 78
실시예 79
실시예 80
실시예 81
실시예 82
실시예 83
실시예 84
실시예 85
실시예 86
실시예 87
실시예 88
실시예 89
실시예 90
실시예 91
실시예 92
실시예 93
실시예 94
실시예 95
실시예 96
실시예 97
실시예 98
테트라히드로-2H-피란-4-카르복실산(125mg, 0.958mmol)과 트리에틸아민(194mg, 1.92mmol)의 DMF(1ml) 용액에 실온하에 클로로포름산에틸(94mg, 0.862mmol)을 적하하였다. 반응액을 동일 온도에서 5분간 교반한 후, 화합물 98-a(50mg, 0.0958mmol)을 가하고 5시간 더 교반하였다. 반응액을 아세트산에틸(10ml)로 희석하고, 물을 가하였다. 유기층을 분리하고, 수조를 아세트산에틸로 1회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 고체를 아세트산에틸-디이소프로필에테르로 세정하여 30mg의 실시예 화합물 98을 얻었다.
실시예 99
실시예 100
실시예 101
실시예 102
실시예 103
실시예 104
실시예 105
Bioorganic & Medicinal Chemistry Letters; English; 14; 12; 2004; 3231 -3234에 나타내어지는 방법에 따라서, 2-(tert-부틸디메틸실릴옥시)아세트산(82mg, 0.958mmol)과 트리에틸아민(194mg, 1.92mmol)의 DMF(1ml) 용액에 실온하에 클로로포름산에틸(93mg, 0.862mmol)을 가하고, 동일 온도에서 3분간 교반하였다. 반응액에 화합물 98-a(50mg, 0.0958mmol)를 가하고 1시간 더 교반하였다. 반응액을 아세트산에틸(10ml)로 희석하고, 물을 가하였다. 유기층을 분리하고, 수조를 아세트산에틸로 1회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 THF(2ml)에 용해시키고, 실온하에 TBAF 1M THF 용액(0.287ml, 0.287mmol)을 가하고, 동일 온도에서 30분 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 2회 추출하였다. 추출액을 황산나트륨으로 건조하고 용매를 증류 제거한 후, 얻어진 고체를 아세트산에틸-디이소프로필에테르로 세정하여 30mg의 실시예 화합물 105를 얻었다.
실시예 106
(S)-2-(tert-부톡시카르보닐아미노)프로판산(301mg, 1.59mmol)을 THF(2ml)에 용해하고, N-메틸모르폴린(0.175ml, 1.59mmol)과 이소부틸클로로포르메이트(0.209ml, 1.59mmol)를 0℃에서 가하고, 그대로 15분 교반하였다. 실시예에 따라서 합성한 106-a(69.0mg, 0.159mmol)의 디클로로메탄 용액(1ml)을 0℃에서 가하고, 실온에서 4시간 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 디클로로메탄-디이소프로필에테르-디에틸에테르를 가하여 고화시킴으로써, 40mg의 백색 고체로서 실시예 화합물 106을 얻었다.
실시예 107
제1 공정
(R)-메틸 2,2-디메틸-1,3-디옥솔란-4-카르복실레이트(107-a, 11.22g, 70.1mmol)의 메탄올(80mL) 용액에 실온에서 수산화나트륨1수화물(2.94g, 70.1mmol)을 가하고, 3시간 교반하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사에 빙냉하에 2N 염산(35mL)을 가하고, 클로로메탄(100mL×2)으로 추출하였다. 유기층을 물(50mL)로 세정하고, 황산마그네슘으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 107-b의 조 생성물을 생성하지 않고, 다음 반응에 이용하였다.
제2 공정
화합물 98-a(41.7mg, 0.285mmol), 트리에틸아민(0.106mL, 0.765mmol) 및 4-디메틸아미노피리딘(5.7mg, 0.047mmol)의 디클로로메탄(2mL) 용액에 실온에서 2-메틸-6-니트로벤조산 무수물(100mg, 0.290mmol)을 가하고, 10분간 교반하였다. 반응액에 화합물 5C(51.7mg, 0.099mmol)를 가하고, 1.5시간 교반하였다. 반응액에 물(2mL)을 가한 후, 디클로로메탄으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=60%→100%)로 정제하여 실시예 화합물 107(40.4mg, 63%)을 백색 고체로서 얻었다.
MS: m/z=650.35 [M+H]+.
실시예 108
제1 공정
화합물 98-a(50.0mg, 0.096mmol), 트리에틸아민(0.0660mL, 0.476mmol) 및 N-메틸이미다졸(0.0038mL, 0.048mmol)의 디클로로메탄(1mL) 용액에 실온에서, 3-메톡시프로피오닐클로라이드(33.0mg, 0.269mmol)를 가하고, 16시간 교반하였다. 반응액에 물(1mL) 및 염산(2M, 1mL)을 가하고, 디클로로메탄으로 추출하고, 유기층을 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=60%→100%)로 정제해서 얻어진 생성물을 아세트산에틸-이소프로필에테르로 분말화하여, 실시예 화합물 108(47.0mg, 81%)을 백색 고체로서 얻었다.
실시예 109
실시예 108에 따라서, 실시예 화합물 109를 마찬가지의 수법에 의해 합성하였다.
실시예 110
실시예 108에 따라서, 실시예 화합물 110을 마찬가지의 수법에 의해 합성하였다.
실시예 111
화합물 98-a(50mg, 0.10mmol)의 디클로로메탄(1.0mL) 용액을 빙냉하고, 트리에틸아민(0.040ml, 0.29mmol) 및 2-메톡시아세틸클로라이드(11mg, 0.11mmol)를 가하고, 빙냉하에서 1시간 교반한 후, 실온에서 2시간 교반하였다. 그 후, 반응액에 아세트산에틸을 가하고 물로 세정한 후, 황화나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 아세트산에틸을 이용하여 고체를 석출시켜, 백색 고체로서 31mg의 실시예 화합물 111을 얻었다.
실시예 112
제1 공정
화합물 106-a(100mg, 0.231mmol)와 클로로메틸피발레이트(482mg, 3.20mmol)와 요오드화나트륨(480mg, 3.20mmol)의 아세토니트릴(2ml) 용액을 80℃에서 6시간 교반하였다. 실온까지 방냉한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 합친 추출액을 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 아세트산에틸로 용출하고, 이어서 아세트산에틸-메탄올(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 고체로서 35mg의 실시예 화합물 112를 얻었다.
실시예 113
화합물 113-a(50mg, 0.10mmol)와 탄산칼륨(40mg, 0.29mmol)의 물(0.5mL) 현탁액에 테트라부틸암모늄하이드로겐술페이트(33mg, 0.10mmol) 및 디클로로메탄(1.0ml)을 가하고, 실온에서 10분간 교반하였다. 반응액에 아이오도메틸아세테이트(56mg, 0.19mmol)의 디클로로메탄(1.0ml) 용액을 가하고, 2시간 더 교반하였다. 그 후, 반응액에 물을 가하고, 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 포화 식염수 및 염수로 세정한 후, 황화나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 처음에 클로로포름으로 용출하고, 이어서클로로포름-메탄올(94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 디이소프로필에테르를 가하여 고화시킴으로써, 백색 고체로서 41mg의 실시예 화합물 113을 얻었다.
실시예 113에 따라서, 이하의 화합물을 마찬가지의 수법에 의해 합성하였다.
실시예 114
실시예 115
실시예 116
실시예 117
실시예 118
실시예 119
실시예 120
실시예 121
실시예 122
화합물 122-a(50mg, 0.10mmol)와 탄산칼륨(138mg, 0.22mmol)의 물(1.0mL) 현탁액에 테트라부틸암모늄하이드로겐술페이트(34mg, 0.10mmol) 및 디클로로메탄(0.5ml)을 가하고, 실온에서 10분간 교반하였다. 반응액에 아이오도메틸 2-메톡시에틸카르보네이트(57mg, 0.22mmol)의 디클로로메탄(0.5ml) 용액을 가하고, 2시간 더 교반하였다. 그 후, 반응액에 물을 가하고, 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 포화 식염수 및 염수로 세정한 후, 황화나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 헥산-디에틸에테르를 이용하여 세정함으로써, 백색 고체로서 39mg의 실시예 화합물 122를 얻었다.
실시예 123
실시예 122에 따라서, 실시예 화합물 123을 마찬가지의 수법에 의해 합성하였다.
실시예 124
실시예 122에 따라서, 실시예 화합물 124를 마찬가지의 수법에 의해 합성하였다.
실시예 125
실시예 122에 따라서, 실시예 화합물 125를 마찬가지의 수법에 의해 합성하였다.
실시예 126
실시예 122에 따라서, 실시예 화합물 126을 마찬가지의 수법에 의해 합성하였다.
실시예 127
실시예 122에 따라서, 실시예 화합물 127을 마찬가지의 수법에 의해 합성하였다.
실시예 128
실시예 122에 따라서, 실시예 화합물 128을 마찬가지의 수법에 의해 합성하였다.
실시예 129
실시예 122에 따라서, 실시예 화합물 129를 마찬가지의 수법에 의해 합성하였다.
실시예 130
실시예 122에 따라서, 실시예 화합물 130을 마찬가지의 수법에 의해 합성하였다.
실시예 131
실시예 122에 따라서, 실시예 화합물 131을 마찬가지의 수법에 의해 합성하였다.
실시예 132
실시예 122에 따라서, 실시예 화합물 132를 마찬가지의 수법에 의해 합성하였다.
실시예 133
실시예 122에 따라서, 실시예 화합물 133을 마찬가지의 수법에 의해 합성하였다.
실시예 134
실시예 122에 따라서, 실시예 화합물 134를 마찬가지의 수법에 의해 합성하였다.
실시예 135
실시예 122에 따라서, 실시예 화합물 135를 마찬가지의 수법에 의해 합성하였다.
실시예 136
실시예 122에 따라서, 실시예 화합물 136을 마찬가지의 수법에 의해 합성하였다.
실시예 137
실시예 122에 따라서, 실시예 화합물 137을 마찬가지의 수법에 의해 합성하였다.
실시예 138
실시예 122에 따라서, 실시예 화합물 138을 마찬가지의 수법에 의해 합성하였다.
실시예 139
실시예 122에 따라서, 실시예 화합물 139를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=720 [M+H]+.
실시예 140
실시예 139의 부 생성물로서, 실시예 화합물 140을 얻었다.
MS: m/z=606 [M+H]+.
실시예 141
실시예 142
실시예 143
실시예 144
실시예 145
실시예 146
실시예 147
실시예 148
실시예 149
실시예 150
실시예 151
실시예 122에 따라서, 화합물 151-a를 마찬가지의 수법에 의해 합성하였다.
화합물 151-a(67mg, 0.093mmol)의 아세트산에틸(2.0mL) 용액에 4N HCl 아세트산에틸 용액(2.0ml)을 가하고, 실온에서 철야 교반하였다. 그 후, 반응액에 아세트산에틸 및 물을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 2회 추출하였다. 합친 추출액에 황화나트륨을 가하여 건조한 후, 용매를 증류 제거하였다. 얻어진 유상물에 디이소프로필에테르를 가해서 석출된 고체를 여과 취출함으로써, 백색 고체로서 12mg의 실시예 화합물 151을 얻었다.
실시예 152
1-클로로에틸메틸카르보네이트(166mg, 0.96mmol)의 아세토니트릴(1.5mL) 용액에 화합물 98-a(43mg, 0.29mmol) 및 산화은(I)(44mg, 0.10mmol)을 가하고, 50℃에서 4시간 교반한 후, 실온에서 철야 정치하였다. 그 후, 반응액을 셀라이트로 여과하고, 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(95:5, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 헥산-디이소프로필에테르를 이용하여 세정함으로써, 백색 고체로서 54mg의 실시예 화합물 152를 얻었다.
실시예 153
실시예 152에 따라서, 실시예 화합물 153을 마찬가지의 수법에 의해 합성하였다.
실시예 154
실시예 152에 따라서, 실시예 화합물 154를 마찬가지의 수법에 의해 합성하였다.
실시예 155
실시예 152에 따라서, 실시예 화합물 155를 마찬가지의 수법에 의해 합성하였다.
실시예 156
실시예 152에 따라서, 실시예 화합물 156을 마찬가지의 수법에 의해 합성하였다.
실시예 157
실시예 152에 따라서, 실시예 화합물 157을 마찬가지의 수법에 의해 합성하였다.
실시예 158
실시예 152에 따라서, 실시예 화합물 158을 마찬가지의 수법에 의해 합성하였다.
실시예 159
실시예 152에 따라서, 실시예 화합물 159를 마찬가지의 수법에 의해 합성하였다.
실시예 160
실시예 152에 따라서, 실시예 화합물 160을 마찬가지의 수법에 의해 합성하였다.
실시예 161
실시예 162
실시예 152에 따라서, 실시예 화합물 162를 마찬가지의 수법에 의해 합성하였다.
실시예 163
실시예 122에 따라서, 화합물 163-a를 마찬가지의 수법에 의해 합성하였다.
화합물 163-a(70mg, 0.10mmol)와 탄산칼륨(138mg, 0.22mmol)의 아세토니트릴(1.0mL) 용액에 2-모르폴리노에탄아민(31mg, 0.24mmol), DMAP(13mg, 0.10mmol) 및 트리에틸아민(0.042ml, 0.30mmol)을 가하고, 실온에서 철야 교반하였다. 그 후, 반응액에 물을 가하고, 디클로로메탄층을 분리하고, 수층을 디클로로메탄으로 1회 추출하였다. 합친 추출액을 포화 식염수 및 염수로 세정한 후, 황화나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 디이소프로필에테르를 이용하여 세정함으로써, 황백색 고체로서 26mg의 실시예 화합물 163을 얻었다.
MS: m/z=674 [M+H]+.
실시예 164
실시예 163에 따라서, 실시예 화합물 164를 마찬가지의 수법에 의해 합성하였다.
실시예 165
실시예 163에 따라서, 실시예 화합물 165를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=675 [M+H]+.
실시예 166
실시예 163에 따라서, 실시예 화합물 166을 마찬가지의 수법에 의해 합성하였다.
실시예 167
실시예 163에 따라서, 실시예 화합물 167을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=675 [M+H]+.
실시예 168
실시예 163에 따라서, 실시예 화합물 168을 마찬가지의 수법에 의해 합성하였다.
실시예 169
실시예 163에 따라서, 실시예 화합물 169를 마찬가지의 수법에 의해 합성하였다.
MS: m/z=673 [M+H]+.
실시예 170
실시예 163에 따라서, 실시예 화합물 170을 마찬가지의 수법에 의해 합성하였다.
실시예 171
실시예 163에 따라서, 실시예 화합물 171을 마찬가지의 수법에 의해 합성하였다.
실시예 172
실시예 163에 따라서, 실시예 화합물 172를 마찬가지의 수법에 의해 합성하였다.
실시예 173
실시예 163에 따라서, 실시예 화합물 173을 마찬가지의 수법에 의해 합성하였다.
실시예 174
실시예 163에 따라서, 실시예 화합물 174를 마찬가지의 수법에 의해 합성하였다.
실시예 175
실시예 163에 따라서, 실시예 화합물 175를 마찬가지의 수법에 의해 합성하였다.
실시예 176
실시예 163에 따라서, 실시예 화합물 176을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=666 [M+H]+.
실시예 177
실시예 163에 따라서, 화합물 177-a를 마찬가지의 수법에 의해 합성하였다.
화합물 177-a(129mg, 0.17mmol)의 아세트산에틸(2.0mL) 용액에 4N HCl 아세트산에틸 용액(2.0ml)을 가하고, 실온에서 30분간 교반하였다. 그 후, 반응액에 물을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 2회 추출하였다. 합친 추출액을 포화 식염수 및 염수로 세정한 후, 황화나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(94:6, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 디이소프로필에테르를 이용하여 세정함으로써, 옅은 분홍색 고체로서 10mg의 실시예 화합물 177을 얻었다.
실시예 178
실시예 163에 따라서, 화합물 178-a를 마찬가지의 수법에 의해 합성하였다.
화합물 178-a(81mg, 0.11mmol)의 아세트산에틸(1.0mL) 용액에 4N HCl 아세트산에틸 용액(1.0ml)을 가하고, 실온에서 1시간 반 교반하였다. 반응액으로부터 석출된 고체를 여과 취출하여 디이소프로필에테르로 세정함으로써, 백색 고체로서 54mg의 실시예 화합물 178을 얻었다.
MS: m/z=638 [M+H]+.
실시예 179
화합물 179-a(50mg, 0.120mmol)와 트리에틸아민(61mg, 0.60mmol)의 DMF(1ml) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 클로로포름산에틸(26mg, 0.24mmol)을 적하하였다. 반응액을 실온에서 30분 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세한 후, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 고체를 에틸-디이소프로필에테르로 세정하여 24mg의 실시예 화합물 179를 얻었다.
실시예 179에 따라서, 이하의 실시예 화합물을 마찬가지의 수법에 의해 합성하였다.
실시예 180
실시예 181
실시예 182
실시예 183
실시예 184
실시예 185
실시예 186
Journal of Medicinal Chemistry; English; 39; 2; 1996; 480-486에 나타내어지는 방법에 따라서, 화합물 98-a(50mg, 0.0958mmol)와 트리에틸아민(48mg, 0.48mmol)의 DMF(1ml) 용액에 실온하에 (5-메틸-2-옥소-1,3-디옥솔-4-일)메틸 4-니트로페닐카르보네이트(85mg, 0.29mmol)와 DMAP(1.2mg, 0.096mmol)를 가하고, 동일 온도에서 6시간 교반하였다. 반응액을 아세트산에틸(10ml)로 희석하고, 물을 가하였다. 유기층을 분리하여, 수조를 아세트산에틸로 1회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 아세트산에틸로 용출하고, 이어서 아세트산에틸-메탄올(4:1, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 고체로서 31mg의 실시예 화합물 186을 얻었다.
실시예 186에 따라서, 이하의 화합물을 마찬가지의 수법에 의해 합성하였다.
실시예 187
실시예 188
실시예 189
실시예 190
화합물 106-a(80.0mg, 0.185mmol)를 디클로로메탄(1ml)에 용해하고, 트리에틸아민(0.051ml, 0.37mmol), 디메틸카르밤산클로라이드(39.7mg, 0.369mmol), DMAP(cat.)를 가하고, 50℃에서 3시간 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 물로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(97:3, v/v)로 용출함으로써 정제하였다. 디클로로메탄-아세트산에틸-디에틸에테르를 가하여 고화시킴으로써, 47mg의 백색 고체로서 실시예 화합물 190을 얻었다.
MS: m/z=505 [M+H]+.
실시예 191
실시예 192
제1 공정
Chem. Pharm. Bull. 55, 328-333(2007)에 기재된 방법에 따라서, 화합물 192-b를 합성하였다.
제2 공정
화합물 192-b(78.0mg, 0.273mmol)의 피리딘(1mL) 용액에 실온에서 화합물 98-a(51.0mg, 0.098mmol)를 가하고, 실온에서 1.5시간, 50℃에서 3시간, 70℃에서 7시간 교반하였다. 반응액을 아세트산에틸(10mL)로 희석하고, 물(5mL) 및 염산(2M, 5mL)으로 세정한 후, 유기층을 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하여 얻어진 화합물 192-c의 조 생성물을 정제하지 않고, 다음 반응에 이용하였다.
제3 공정
제2 공정에서 얻은 화합물 192-c의 조 생성물의 에탄올(0.5mL) 용액에 실온에서 농염산(0.050mL)을 가하고 2시간 교반하였다. 반응액에 물(20mL)을 가하고, 클로로포름으로 추출한 후, 유기층을 황산나트륨으로 건조하였다. 용매를 감압하에 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(아세트산에틸/n-헥산=80%→100%)로 정제하여 얻어진 생성물을 아세트산에틸-에틸에테르로 분말화하여, 실시예 화합물 192(39.7mg, 65%)를 백색 고체로서 얻었다.
실시예 193
실시예 192에 따라서, 실시예 화합물 193을 마찬가지의 수법에 의해 합성하였다.
실시예 194
화합물 98-a(50mg, 0.10mmol)의 피리딘(1.0mL) 용액에 모르폴린-4-카르보닐클로라이드(43mg, 0.29mmol)를 가하고, 50℃에서 10시간 교반하였다. 그 후, 반응액에 2N HCl 수용액 및 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액에 황화나트륨을 가하여 건조한 후 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(97:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 디이소프로필에테르를 이용하여 세정함으로써, 백색 고체로서 49mg의 실시예 화합물 194를 얻었다.
실시예 195
실시예 194에 따라서, 실시예 화합물 195를 마찬가지의 수법에 의해 합성하였다.
실시예 196, 실시예 196-b
제1 공정
화합물 106-a(140mg, 0.323mmol)를 DMF(2mL)에 용해시키고, 탄산칼륨(89mg, 0.646mmol) 및 디벤질클로로메틸포스페이트(158mg, 0.484mmol)의 DMF(1.0ml) 용액을 0℃, 질소 기류하에서 가하였다. 반응 혼합액을 1주간 실온에서 교반하고 물을 가하였다. 아세트산에틸(2×20mL)을 이용해서 추출하고, 합친 유기층을 물·포화 식염수로 세정하고, 황산나트륨으로 건조한 후 여과하고, 감압 농축하였다. 잔사를 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올=50:1)로 정제하여 실시예 화합물 196-b를 얻었다.
제2 공정
화합물 196-b(60mg, 0.083mmol)를 THF(2mL)와 메탄올(2mL)의 혼합 용매에 용해시키고, 10%-팔라듐-탄소(10mg)를 가하였다. 수소 기류하에 실온에서 2시간 교반하고, 셀라이트 여과하였다. 여액을 분취용 HPLC로 정제함으로써, 목적으로 하는 실시예 화합물 196을 얻었다(18mg, 40%).
실시예 197, 실시예 197-b
제1 공정
(S)-클로로메틸 2-(tert-부톡시카르보닐아미노)-3-메틸부타노에이트 (138mg, 0.519mmol)의 아세톤(3ml) 용액에 요오드화나트륨(390mg, 2.6mmol)을 질소 기류하에 실온에서 가하고 20시간 교반하였다. 여과 후 여액을 감압 농축하고, 잔사에 10%-티오황산나트륨 수용액을 가해서 아세트산에틸(30mL)로 추출하였다. 유기층을 수세하고, 황산나트륨으로 건조·여과한 후 감압 농축하였다. 잔사를 아세톤(0.5mL)에 용해시키고, 화합물 106-a(100mg, 0.231mmol) 및 탄산세슘(169mg, 0.52mmol)을 아세톤(2.5ml) 중 질소 기류하에서 빙냉하에 30분 교반시킨 혼합물에 가하였다. 이 반응 혼합물을 실온에서 4시간 교반하고, 감압 농축한 후 물을 가하였다. 아세트산에틸(2×30mL)을 이용해서 추출하고, 합친 유기층을 물·포화 식염수로 세정하고, 황산나트륨으로 건조한 후 여과하고, 감압 농축하였다. 잔사를 실리카 겔 컬럼 크로마토그래피(클로로포름-메탄올=50:1)로 정제하여 실시예 화합물 197-b를 얻었다(130mg, 85%).
제2 공정
화합물 197-b(130mg, 0.196mmol)를 아세트산에틸(4ml)에 용해시키고, 4규정 염산아세트산에틸 용액(4mL, 16.00mmol)을 실온에서 가하고 3시간 교반하였다. 감압 농축한 후, 잔사를 에테르로 희석하여 고체를 여과 취출함으로써 실시예 화합물 197의 염산염을 얻었다(85mg, 72.3%).
실시예 198
실시예 197에 따라서, 실시예 화합물 198을 마찬가지의 수법에 의해 합성하였다.
MS: m/z=651 [M+H]+.
실시예 199
화합물 106-a(33mg, 0.076mmol)와 트리에틸아민(24mg, 0.235mmol)의 DMF(1ml) 용액을 1 내지 3℃로 냉각하고, 동일 온도를 유지하면서 클로로메틸메틸에테르(12.6mg, 0.157mmol)를 적하하였다. 반응액을 동일 온도에서 30분간 교반한 후, 물을 가하고, 아세트산에틸로 3회 추출하였다. 추출액을 3회 수세한 후, 황산나트륨으로 건조하고, 용매를 증류 제거하였다. 얻어진 고체를 에틸-디이소프로필에테르로 세정하여 22mg의 실시예 화합물 199를 얻었다.
실시예 200
4-(히드록시메틸)페닐아세테이트(53mg, 0.287mmol)와 요오드화나트륨(72mg, 0.48mmol)의 DMF(1ml) 용액을 실온하에 30분 교반하였다. 반응액에 탄산칼륨(66mg, 0.48mmol)과 화합물 98-a(50mg, 0.0958mmol)를 가하고, 동일 온도에서 5시간 더 교반하였다. 반응액을 아세트산에틸(10ml)로 희석하고, 물을 가하였다. 유기층을 분리하고, 수조를 아세트산에틸로 1회 추출하였다. 추출액을 3회 수세하고, 황산나트륨으로 건조한 후, 용매를 증류 제거하였다. 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 아세트산에틸로 용출하고, 이어서 아세트산에틸-메탄올(7:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하여 고체로서 34mg의 실시예 화합물 200을 얻었다.
실시예 201
제1 공정
실시예에 따라서 합성한 106-a(80.0mg, 0.185mmol)와 4-(클로로메틸)-5-메틸-1,3-디옥솔-2-온(41.1mg, 0.277mmol)을 DMF(1ml)에 용해하고, 탄산칼륨(93.0mg, 0.673mmol)을 가하고, 50℃에서 2시간 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 물로 세정하고, 황산나트륨으로 건조하였다. 용매를 감압증류 제거하고, 얻어진 조 생성물을 실리카 겔 컬럼 크로마토그래피를 통해 클로로포름-메탄올(95:5, v/v)로 용출함으로써 정제하였다. 디클로로메탄-디에틸에테르를 가하여 고화시킴으로써, 60mg의 백색 고체로서 실시예 화합물 201을 얻었다.
실시예 202
실시예 203
화합물 98-a(50mg, 0.10mmol)의 DMF(1.0mL) 용액을 빙냉하고, 트리에틸아민(0.040ml, 0.29mmol) 및 1-(클로로메톡시)-2-메톡시에탄(24mg, 0.19mmol)을 가하고, 빙냉하에서 1시간 교반한 후, 실온에서 철야 교반하였다. 그 후, 반응액에 물 및 아세트산에틸을 가하고, 아세트산에틸층을 분리하고, 수층을 아세트산에틸로 추출하였다. 합친 추출액을 물 및 염수로 세정한 후, 황화나트륨을 가하여 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 먼저 클로로포름으로 용출하고, 이어서 클로로포름-메탄올(97:3, v/v)로 용출하였다. 목적으로 하는 분획을 농축하고, 디이소프로필에테르를 이용해서 세정함으로써, 백색 고체로서 18mg의 실시예 화합물 203을 얻었다.
실시예 204
실시예 205
실시예 206
실시예 207
실시예 208
실시예 209
실시예 210
공정
화합물 210-a(101mg, 0.193mmol)에 디메틸포름아미드(1mL), HATU(50mg, 0.148mmol), N-메틸모르폴린(0.041mL, 0.370mmol)을 가하고, 실온에서 6시간 교반하였다. 반응 용액을 분취형 LCMS(방법 14)에 의해 정제하여 실시예 화합물 210(50mg, 수율 51%)을 얻었다.
실시예 211
실시예 212
실시예 213
실시예 214
실시예 215
실시예 216
실시예 217
실시예 218
실시예 219
실시예 220
실시예 221
실시예 222
실시예 223
실시예 224
실시예 225
실시예 226
실시예 227
실시예 228
실시예 229
실시예 230
실시예 231
실시예 232
실시예 233
실시예 234
실시예 235
실시예 236
실시예 237
실시예 238
실시예 239
실시예 240
실시예 241
참고예 및 실시예 화합물의 LCMS 측정 조건을 이하에 기재한다.
1) 특별히 기재가 없는 경우의 조건;
컬럼: 액퀴티 UPLC(r) BEH C18(1.7㎛ i.d. 2.1×50mm)(워터스사)
유속: 0.8mL/분
UV 검출 파장: 254nm
이동상: [A]는 0.1% 포름산 함유 수용액, [B]는 0.1% 포름산 함유 아세토니트릴 용액
구배: 3.5분간 10% 내지 100% 용매 [B]의 선형 구배를 행하고, 0.5분간 100% 용매 [B]를 유지하였다.
2) 방법 6;
컬럼: 게미니(Gemini)-NX(5㎛, i.d. 4.6×50mm)(페노메넥스(Phenomenex)사)
유속: 3mL/분
UV 검출 파장: 254nm
이동상: [A]는 0.1% 포름산 함유 수용액, [B]는 0.1% 포름산 함유 아세토니트릴 용액
구배: 3.5분간 5% 내지 100% 용매 [B]의 선형 구배를 행하고, 0.5분간 100% 용매 [B]를 유지하였다.
3) 방법 14;
컬럼: 게미니-NX(C18, 5㎛ 액시아 팩키드(AXIA Packed), i.d. 21.2×50mm)(페노메넥스사)
유속: 25mL/분
UV 검출 파장: 254nm
이동상: [A]는 0.1% 포름산 함유 수용액, [B]는 0.1% 포름산 함유 아세토니트릴 용액
구배:
정밀 구배(6분): 4분간 X% 내지 Y% 용매 [B]의 선형 구배를 행하고, 1분간 100% 용매 [B]를 유지하였다.
중간체 화합물 i-7: X=35, Y=55
중간체 화합물 i-10: X=30, Y=50
중간체 화합물 i-14: X=30, Y=50
실시예 210: X=20, Y=40
표준 구배(7분): 5분간 10% 내지 100% 용매 [B]의 선형 구배를 행하고, 1분간 100% 용매 [B]를 유지하였다.
또한, 이하에 나타내어지는 치환기의 조합도 상기 참고예 및 실시예에 기재된 방법과 마찬가지로 합성 가능하며, 본 발명의 바람직한 실시 양태이다.
이하의 식 (I):
에서, 이하의 식 (I-A) 및 (I-B):
(식에서, PR은 항목 1과 동일한 의미임)
의 R3a 및 R7a의 조합이 각각 이하의 표 15 내지 20에서 선택되는 화합물.
(R3a, R7a)의 조합=
또한, 이하에 나타내어지는 치환기의 조합도 상기 참고예 및 실시예에 기재된 방법과 마찬가지로 합성 가능하며, 본 발명의 바람직한 실시 양태이다.
이하의 식 (I-C):
의 PR 및 R7a의 조합이 각각 이하의 표 21, 및 상기한 표 15 내지 20에서 선택되는 화합물.
(PR, R7a)의 조합=
또한, 상기한 참고예 화합물 1 내지 775에서, 하기의 식 (II):
(식에서, 각 치환기는 항목 1과 동일한 의미임)
의 -OH기에 대응하는 부분을 상기 표 21의 PR-1 내지 PR-5로 프로드러그화한 이하의 조합도, 본 발명의 바람직한 실시 양태이다. 이들 화합물도 상기 참고예 화합물을 원료로 해서, 당업자에게 알려진 일반적인 방법 또는 실시예에 기재된 방법과 마찬가지로 합성 가능하다.
(참고예 화합물 번호, PR)의 조합=
(참고예 1, PR-1), (참고예 1, PR-2), (참고예 1, PR-3), (참고예 1, PR-4), (참고예 1, PR-5), (참고예 2, PR-1), (참고예 2, PR-2), (참고예 2, PR-3), (참고예 2, PR-4), (참고예 2, PR-5), (참고예 3, PR-1), (참고예 3, PR-2), (참고예 3, PR-3), (참고예 3, PR-4), (참고예 3, PR-5), (참고예 4, PR-1), (참고예 4, PR-2), (참고예 4, PR-3), (참고예 4, PR-4), (참고예 4, PR-5), (참고예 5, PR-1), (참고예 5, PR-2), (참고예 5, PR-3), (참고예 5, PR-4), (참고예 5, PR-5), (참고예 6, PR-1), (참고예 6, PR-2), (참고예 6, PR-3), (참고예 6, PR-4), (참고예 6, PR-5), (참고예 7, PR-1), (참고예 7, PR-2), (참고예 7, PR-3), (참고예 7, PR-4), (참고예 7, PR-5), (참고예 8, PR-1), (참고예 8, PR-2), (참고예 8, PR-3), (참고예 8, PR-4), (참고예 8, PR-5), (참고예 9, PR-1), (참고예 9, PR-2), (참고예 9, PR-3), (참고예 9, PR-4), (참고예 9, PR-5), (참고예 10, PR-1), (참고예 10, PR-2), (참고예 10, PR-3), (참고예 10, PR-4), (참고예 10, PR-5), (참고예 11, PR-1), (참고예 11, PR-2), (참고예 11, PR-3), (참고예 11, PR-4), (참고예 11, PR-5), (참고예 12, PR-1), (참고예 12, PR-2), (참고예 12, PR-3), (참고예 12, PR-4), (참고예 12, PR-5), (참고예 13, PR-1), (참고예 13, PR-2), (참고예 13, PR-3), (참고예 13, PR-4), (참고예 13, PR-5), (참고예 14, PR-1), (참고예 14, PR-2), (참고예 14, PR-3), (참고예 14, PR-4), (참고예 14, PR-5), (참고예 15, PR-1), (참고예 15, PR-2), (참고예 15, PR-3), (참고예 15, PR-4), (참고예 15, PR-5), (참고예 16, PR-1), (참고예 16, PR-2), (참고예 16, PR-3), (참고예 16, PR-4), (참고예 16, PR-5), (참고예 17, PR-1), (참고예 17, PR-2), (참고예 17, PR-3), (참고예 17, PR-4), (참고예 17, PR-5), (참고예 18, PR-1), (참고예 18, PR-2), (참고예 18, PR-3), (참고예 18, PR-4), (참고예 18, PR-5), (참고예 19, PR-1), (참고예 19, PR-2), (참고예 19, PR-3), (참고예 19, PR-4), (참고예 19, PR-5), (참고예 20, PR-1), (참고예 20, PR-2), (참고예 20, PR-3), (참고예 20, PR-4), (참고예 20, PR-5), (참고예 21, PR-1), (참고예 21, PR-2), (참고예 21, PR-3), (참고예 21, PR-4), (참고예 21, PR-5), (참고예 22, PR-1), (참고예 22, PR-2), (참고예 22, PR-3), (참고예 22, PR-4), (참고예 22, PR-5), (참고예 23, PR-1), (참고예 23, PR-2), (참고예 23, PR-3), (참고예 23, PR-4), (참고예 23, PR-5), (참고예 24, PR-1), (참고예 24, PR-2), (참고예 24, PR-3), (참고예 24, PR-4), (참고예 24, PR-5), (참고예 25, PR-1), (참고예 25, PR-2), (참고예 25, PR-3), (참고예 25, PR-4), (참고예 25, PR-5), (참고예 26, PR-1), (참고예 26, PR-2), (참고예 26, PR-3), (참고예 26, PR-4), (참고예 26, PR-5), (참고예 27, PR-1), (참고예 27, PR-2), (참고예 27, PR-3), (참고예 27, PR-4), (참고예 27, PR-5), (참고예 28, PR-1), (참고예 28, PR-2), (참고예 28, PR-3), (참고예 28, PR-4), (참고예 28, PR-5), (참고예 29, PR-1), (참고예 29, PR-2), (참고예 29, PR-3), (참고예 29, PR-4), (참고예 29, PR-5), (참고예 30, PR-1), (참고예 30, PR-2), (참고예 30, PR-3), (참고예 30, PR-4), (참고예 30, PR-5), (참고예 31, PR-1), (참고예 31, PR-2), (참고예 31, PR-3), (참고예 31, PR-4), (참고예 31, PR-5), (참고예 32, PR-1), (참고예 32, PR-2), (참고예 32, PR-3), (참고예 32, PR-4), (참고예 32, PR-5), (참고예 33, PR-1), (참고예 33, PR-2), (참고예 33, PR-3), (참고예 33, PR-4), (참고예 33, PR-5), (참고예 34, PR-1), (참고예 34, PR-2), (참고예 34, PR-3), (참고예 34, PR-4), (참고예 34, PR-5), (참고예 35, PR-1), (참고예 35, PR-2), (참고예 35, PR-3), (참고예 35, PR-4), (참고예 35, PR-5), (참고예 36, PR-1), (참고예 36, PR-2), (참고예 36, PR-3), (참고예 36, PR-4), (참고예 36, PR-5), (참고예 37, PR-1), (참고예 37, PR-2), (참고예 37, PR-3), (참고예 37, PR-4), (참고예 37, PR-5), (참고예 38, PR-1), (참고예 38, PR-2), (참고예 38, PR-3), (참고예 38, PR-4), (참고예 38, PR-5), (참고예 39, PR-1), (참고예 39, PR-2), (참고예 39, PR-3), (참고예 39, PR-4), (참고예 39, PR-5), (참고예 40, PR-1), (참고예 40, PR-2), (참고예 40, PR-3), (참고예 40, PR-4), (참고예 40, PR-5), (참고예 41, PR-1), (참고예 41, PR-2), (참고예 41, PR-3), (참고예 41, PR-4), (참고예 41, PR-5), (참고예 42, PR-1), (참고예 42, PR-2), (참고예 42, PR-3), (참고예 42, PR-4), (참고예 42, PR-5), (참고예 43, PR-1), (참고예 43, PR-2), (참고예 43, PR-3), (참고예 43, PR-4), (참고예 43, PR-5), (참고예 44, PR-1), (참고예 44, PR-2), (참고예 44, PR-3), (참고예 44, PR-4), (참고예 44, PR-5), (참고예 45, PR-1), (참고예 45, PR-2), (참고예 45, PR-3), (참고예 45, PR-4), (참고예 45, PR-5), (참고예 46, PR-1), (참고예 46, PR-2), (참고예 46, PR-3), (참고예 46, PR-4), (참고예 46, PR-5), (참고예 47, PR-1), (참고예 47, PR-2), (참고예 47, PR-3), (참고예 47, PR-4), (참고예 47, PR-5), (참고예 48, PR-1), (참고예 48, PR-2), (참고예 48, PR-3), (참고예 48, PR-4), (참고예 48, PR-5), (참고예 49, PR-1), (참고예 49, PR-2), (참고예 49, PR-3), (참고예 49, PR-4), (참고예 49, PR-5), (참고예 50, PR-1), (참고예 50, PR-2), (참고예 50, PR-3), (참고예 50, PR-4), (참고예 50, PR-5), (참고예 51, PR-1), (참고예 51, PR-2), (참고예 51, PR-3), (참고예 51, PR-4), (참고예 51, PR-5), (참고예 52, PR-1), (참고예 52, PR-2), (참고예 52, PR-3), (참고예 52, PR-4), (참고예 52, PR-5), (참고예 53, PR-1), (참고예 53, PR-2), (참고예 53, PR-3), (참고예 53, PR-4), (참고예 53, PR-5), (참고예 54, PR-1), (참고예 54, PR-2), (참고예 54, PR-3), (참고예 54, PR-4), (참고예 54, PR-5), (참고예 55, PR-1), (참고예 55, PR-2), (참고예 55, PR-3), (참고예 55, PR-4), (참고예 55, PR-5), (참고예 56, PR-1), (참고예 56, PR-2), (참고예 56, PR-3), (참고예 56, PR-4), (참고예 56, PR-5), (참고예 57, PR-1), (참고예 57, PR-2), (참고예 57, PR-3), (참고예 57, PR-4), (참고예 57, PR-5), (참고예 58, PR-1), (참고예 58, PR-2), (참고예 58, PR-3), (참고예 58, PR-4), (참고예 58, PR-5), (참고예 59, PR-1), (참고예 59, PR-2), (참고예 59, PR-3), (참고예 59, PR-4), (참고예 59, PR-5), (참고예 60, PR-1), (참고예 60, PR-2), (참고예 60, PR-3), (참고예 60, PR-4), (참고예 60, PR-5), (참고예 61, PR-1), (참고예 61, PR-2), (참고예 61, PR-3), (참고예 61, PR-4), (참고예 61, PR-5), (참고예 62, PR-1), (참고예 62, PR-2), (참고예 62, PR-3), (참고예 62, PR-4), (참고예 62, PR-5), (참고예 63, PR-1), (참고예 63, PR-2), (참고예 63, PR-3), (참고예 63, PR-4), (참고예 63, PR-5), (참고예 64, PR-1), (참고예 64, PR-2), (참고예 64, PR-3), (참고예 64, PR-4), (참고예 64, PR-5), (참고예 65, PR-1), (참고예 65, PR-2), (참고예 65, PR-3), (참고예 65, PR-4), (참고예 65, PR-5), (참고예 66, PR-1), (참고예 66, PR-2), (참고예 66, PR-3), (참고예 66, PR-4), (참고예 66, PR-5), (참고예 67, PR-1), (참고예 67, PR-2), (참고예 67, PR-3), (참고예 67, PR-4), (참고예 67, PR-5), (참고예 68, PR-1), (참고예 68, PR-2), (참고예 68, PR-3), (참고예 68, PR-4), (참고예 68, PR-5), (참고예 69, PR-1), (참고예 69, PR-2), (참고예 69, PR-3), (참고예 69, PR-4), (참고예 69, PR-5), (참고예 70, PR-1), (참고예 70, PR-2), (참고예 70, PR-3), (참고예 70, PR-4), (참고예 70, PR-5), (참고예 71, PR-1), (참고예 71, PR-2), (참고예 71, PR-3), (참고예 71, PR-4), (참고예 71, PR-5), (참고예 72, PR-1), (참고예 72, PR-2), (참고예 72, PR-3), (참고예 72, PR-4), (참고예 72, PR-5), (참고예 73, PR-1), (참고예 73, PR-2), (참고예 73, PR-3), (참고예 73, PR-4), (참고예 73, PR-5), (참고예 74, PR-1), (참고예 74, PR-2), (참고예 74, PR-3), (참고예 74, PR-4), (참고예 74, PR-5), (참고예 75, PR-1), (참고예 75, PR-2), (참고예 75, PR-3), (참고예 75, PR-4), (참고예 75, PR-5), (참고예 76, PR-1), (참고예 76, PR-2), (참고예 76, PR-3), (참고예 76, PR-4), (참고예 76, PR-5), (참고예 77, PR-1), (참고예 77, PR-2), (참고예 77, PR-3), (참고예 77, PR-4), (참고예 77, PR-5), (참고예 78, PR-1), (참고예 78, PR-2), (참고예 78, PR-3), (참고예 78, PR-4), (참고예 78, PR-5), (참고예 79, PR-1), (참고예 79, PR-2), (참고예 79, PR-3), (참고예 79, PR-4), (참고예 79, PR-5), (참고예 80, PR-1), (참고예 80, PR-2), (참고예 80, PR-3), (참고예 80, PR-4), (참고예 80, PR-5), (참고예 81, PR-1), (참고예 81, PR-2), (참고예 81, PR-3), (참고예 81, PR-4), (참고예 81, PR-5), (참고예 82, PR-1), (참고예 82, PR-2), (참고예 82, PR-3), (참고예 82, PR-4), (참고예 82, PR-5), (참고예 83, PR-1), (참고예 83, PR-2), (참고예 83, PR-3), (참고예 83, PR-4), (참고예 83, PR-5), (참고예 84, PR-1), (참고예 84, PR-2), (참고예 84, PR-3), (참고예 84, PR-4), (참고예 84, PR-5), (참고예 85, PR-1), (참고예 85, PR-2), (참고예 85, PR-3), (참고예 85, PR-4), (참고예 85, PR-5), (참고예 86, PR-1), (참고예 86, PR-2), (참고예 86, PR-3), (참고예 86, PR-4), (참고예 86, PR-5), (참고예 87, PR-1), (참고예 87, PR-2), (참고예 87, PR-3), (참고예 87, PR-4), (참고예 87, PR-5), (참고예 88, PR-1), (참고예 88, PR-2), (참고예 88, PR-3), (참고예 88, PR-4), (참고예 88, PR-5), (참고예 89, PR-1), (참고예 89, PR-2), (참고예 89, PR-3), (참고예 89, PR-4), (참고예 89, PR-5), (참고예 90, PR-1), (참고예 90, PR-2), (참고예 90, PR-3), (참고예 90, PR-4), (참고예 90, PR-5), (참고예 91, PR-1), (참고예 91, PR-2), (참고예 91, PR-3), (참고예 91, PR-4), (참고예 91, PR-5), (참고예 92, PR-1), (참고예 92, PR-2), (참고예 92, PR-3), (참고예 92, PR-4), (참고예 92, PR-5), (참고예 93, PR-1), (참고예 93, PR-2), (참고예 93, PR-3), (참고예 93, PR-4), (참고예 93, PR-5), (참고예 94, PR-1), (참고예 94, PR-2), (참고예 94, PR-3), (참고예 94, PR-4), (참고예 94, PR-5), (참고예 95, PR-1), (참고예 95, PR-2), (참고예 95, PR-3), (참고예 95, PR-4), (참고예 95, PR-5), (참고예 96, PR-1), (참고예 96, PR-2), (참고예 96, PR-3), (참고예 96, PR-4), (참고예 96, PR-5), (참고예 97, PR-1), (참고예 97, PR-2), (참고예 97, PR-3), (참고예 97, PR-4), (참고예 97, PR-5), (참고예 98, PR-1), (참고예 98, PR-2), (참고예 98, PR-3), (참고예 98, PR-4), (참고예 98, PR-5), (참고예 99, PR-1), (참고예 99, PR-2), (참고예 99, PR-3), (참고예 99, PR-4), (참고예 99, PR-5), (참고예 100, PR-1), (참고예 100, PR-2), (참고예 100, PR-3), (참고예 100, PR-4), (참고예 100, PR-5),
(참고예 101, PR-1), (참고예 101, PR-2), (참고예 101, PR-3), (참고예 101, PR-4), (참고예 101, PR-5), (참고예 102, PR-1), (참고예 102, PR-2), (참고예 102, PR-3), (참고예 102, PR-4), (참고예 102, PR-5), (참고예 103, PR-1), (참고예 103, PR-2), (참고예 103, PR-3), (참고예 103, PR-4), (참고예 103, PR-5), (참고예 104, PR-1), (참고예 104, PR-2), (참고예 104, PR-3), (참고예 104, PR-4), (참고예 104, PR-5), (참고예 105, PR-1), (참고예 105, PR-2), (참고예 105, PR-3), (참고예 105, PR-4), (참고예 105, PR-5), (참고예 106, PR-1), (참고예 106, PR-2), (참고예 106, PR-3), (참고예 106, PR-4), (참고예 106, PR-5), (참고예 107, PR-1), (참고예 107, PR-2), (참고예 107, PR-3), (참고예 107, PR-4), (참고예 107, PR-5), (참고예 108, PR-1), (참고예 108, PR-2), (참고예 108, PR-3), (참고예 108, PR-4), (참고예 108, PR-5), (참고예 109, PR-1), (참고예 109, PR-2), (참고예 109, PR-3), (참고예 109, PR-4), (참고예 109, PR-5), (참고예 110, PR-1), (참고예 110, PR-2), (참고예 110, PR-3), (참고예 110, PR-4), (참고예 110, PR-5), (참고예 111, PR-1), (참고예 111, PR-2), (참고예 111, PR-3), (참고예 111, PR-4), (참고예 111, PR-5), (참고예 112, PR-1), (참고예 112, PR-2), (참고예 112, PR-3), (참고예 112, PR-4), (참고예 112, PR-5), (참고예 113, PR-1), (참고예 113, PR-2), (참고예 113, PR-3), (참고예 113, PR-4), (참고예 113, PR-5), (참고예 114, PR-1), (참고예 114, PR-2), (참고예 114, PR-3), (참고예 114, PR-4), (참고예 114, PR-5), (참고예 115, PR-1), (참고예 115, PR-2), (참고예 115, PR-3), (참고예 115, PR-4), (참고예 115, PR-5), (참고예 116, PR-1), (참고예 116, PR-2), (참고예 116, PR-3), (참고예 116, PR-4), (참고예 116, PR-5), (참고예 117, PR-1), (참고예 117, PR-2), (참고예 117, PR-3), (참고예 117, PR-4), (참고예 117, PR-5), (참고예 118, PR-1), (참고예 118, PR-2), (참고예 118, PR-3), (참고예 118, PR-4), (참고예 118, PR-5), (참고예 119, PR-1), (참고예 119, PR-2), (참고예 119, PR-3), (참고예 119, PR-4), (참고예 119, PR-5), (참고예 120, PR-1), (참고예 120, PR-2), (참고예 120, PR-3), (참고예 120, PR-4), (참고예 120, PR-5), (참고예 121, PR-1), (참고예 121, PR-2), (참고예 121, PR-3), (참고예 121, PR-4), (참고예 121, PR-5), (참고예 122, PR-1), (참고예 122, PR-2), (참고예 122, PR-3), (참고예 122, PR-4), (참고예 122, PR-5), (참고예 123, PR-1), (참고예 123, PR-2), (참고예 123, PR-3), (참고예 123, PR-4), (참고예 123, PR-5), (참고예 124, PR-1), (참고예 124, PR-2), (참고예 124, PR-3), (참고예 124, PR-4), (참고예 124, PR-5), (참고예 125, PR-1), (참고예 125, PR-2), (참고예 125, PR-3), (참고예 125, PR-4), (참고예 125, PR-5), (참고예 126, PR-1), (참고예 126, PR-2), (참고예 126, PR-3), (참고예 126, PR-4), (참고예 126, PR-5), (참고예 127, PR-1), (참고예 127, PR-2), (참고예 127, PR-3), (참고예 127, PR-4), (참고예 127, PR-5), (참고예 128, PR-1), (참고예 128, PR-2), (참고예 128, PR-3), (참고예 128, PR-4), (참고예 128, PR-5), (참고예 129, PR-1), (참고예 129, PR-2), (참고예 129, PR-3), (참고예 129, PR-4), (참고예 129, PR-5), (참고예 130, PR-1), (참고예 130, PR-2), (참고예 130, PR-3), (참고예 130, PR-4), (참고예 130, PR-5), (참고예 131, PR-1), (참고예 131, PR-2), (참고예 131, PR-3), (참고예 131, PR-4), (참고예 131, PR-5), (참고예 132, PR-1), (참고예 132, PR-2), (참고예 132, PR-3), (참고예 132, PR-4), (참고예 132, PR-5), (참고예 133, PR-1), (참고예 133, PR-2), (참고예 133, PR-3), (참고예 133, PR-4), (참고예 133, PR-5), (참고예 134, PR-1), (참고예 134, PR-2), (참고예 134, PR-3), (참고예 134, PR-4), (참고예 134, PR-5), (참고예 135, PR-1), (참고예 135, PR-2), (참고예 135, PR-3), (참고예 135, PR-4), (참고예 135, PR-5), (참고예 136, PR-1), (참고예 136, PR-2), (참고예 136, PR-3), (참고예 136, PR-4), (참고예 136, PR-5), (참고예 137, PR-1), (참고예 137, PR-2), (참고예 137, PR-3), (참고예 137, PR-4), (참고예 137, PR-5), (참고예 138, PR-1), (참고예 138, PR-2), (참고예 138, PR-3), (참고예 138, PR-4), (참고예 138, PR-5), (참고예 139, PR-1), (참고예 139, PR-2), (참고예 139, PR-3), (참고예 139, PR-4), (참고예 139, PR-5), (참고예 140, PR-1), (참고예 140, PR-2), (참고예 140, PR-3), (참고예 140, PR-4), (참고예 140, PR-5), (참고예 141, PR-1), (참고예 141, PR-2), (참고예 141, PR-3), (참고예 141, PR-4), (참고예 141, PR-5), (참고예 142, PR-1), (참고예 142, PR-2), (참고예 142, PR-3), (참고예 142, PR-4), (참고예 142, PR-5), (참고예 143, PR-1), (참고예 143, PR-2), (참고예 143, PR-3), (참고예 143, PR-4), (참고예 143, PR-5), (참고예 144, PR-1), (참고예 144, PR-2), (참고예 144, PR-3), (참고예 144, PR-4), (참고예 144, PR-5), (참고예 145, PR-1), (참고예 145, PR-2), (참고예 145, PR-3), (참고예 145, PR-4), (참고예 145, PR-5), (참고예 146, PR-1), (참고예 146, PR-2), (참고예 146, PR-3), (참고예 146, PR-4), (참고예 146, PR-5), (참고예 147, PR-1), (참고예 147, PR-2), (참고예 147, PR-3), (참고예 147, PR-4), (참고예 147, PR-5), (참고예 148, PR-1), (참고예 148, PR-2), (참고예 148, PR-3), (참고예 148, PR-4), (참고예 148, PR-5), (참고예 149, PR-1), (참고예 149, PR-2), (참고예 149, PR-3), (참고예 149, PR-4), (참고예 149, PR-5), (참고예 150, PR-1), (참고예 150, PR-2), (참고예 150, PR-3), (참고예 150, PR-4), (참고예 150, PR-5), (참고예 151, PR-1), (참고예 151, PR-2), (참고예 151, PR-3), (참고예 151, PR-4), (참고예 151, PR-5), (참고예 152, PR-1), (참고예 152, PR-2), (참고예 152, PR-3), (참고예 152, PR-4), (참고예 152, PR-5), (참고예 153, PR-1), (참고예 153, PR-2), (참고예 153, PR-3), (참고예 153, PR-4), (참고예 153, PR-5), (참고예 154, PR-1), (참고예 154, PR-2), (참고예 154, PR-3), (참고예 154, PR-4), (참고예 154, PR-5), (참고예 155, PR-1), (참고예 155, PR-2), (참고예 155, PR-3), (참고예 155, PR-4), (참고예 155, PR-5), (참고예 156, PR-1), (참고예 156, PR-2), (참고예 156, PR-3), (참고예 156, PR-4), (참고예 156, PR-5), (참고예 157, PR-1), (참고예 157, PR-2), (참고예 157, PR-3), (참고예 157, PR-4), (참고예 157, PR-5), (참고예 158, PR-1), (참고예 158, PR-2), (참고예 158, PR-3), (참고예 158, PR-4), (참고예 158, PR-5), (참고예 159, PR-1), (참고예 159, PR-2), (참고예 159, PR-3), (참고예 159, PR-4), (참고예 159, PR-5), (참고예 160, PR-1), (참고예 160, PR-2), (참고예 160, PR-3), (참고예 160, PR-4), (참고예 160, PR-5), (참고예 161, PR-1), (참고예 161, PR-2), (참고예 161, PR-3), (참고예 161, PR-4), (참고예 161, PR-5), (참고예 162, PR-1), (참고예 162, PR-2), (참고예 162, PR-3), (참고예 162, PR-4), (참고예 162, PR-5), (참고예 163, PR-1), (참고예 163, PR-2), (참고예 163, PR-3), (참고예 163, PR-4), (참고예 163, PR-5), (참고예 164, PR-1), (참고예 164, PR-2), (참고예 164, PR-3), (참고예 164, PR-4), (참고예 164, PR-5), (참고예 165, PR-1), (참고예 165, PR-2), (참고예 165, PR-3), (참고예 165, PR-4), (참고예 165, PR-5), (참고예 166, PR-1), (참고예 166, PR-2), (참고예 166, PR-3), (참고예 166, PR-4), (참고예 166, PR-5), (참고예 167, PR-1), (참고예 167, PR-2), (참고예 167, PR-3), (참고예 167, PR-4), (참고예 167, PR-5), (참고예 168, PR-1), (참고예 168, PR-2), (참고예 168, PR-3), (참고예 168, PR-4), (참고예 168, PR-5), (참고예 169, PR-1), (참고예 169, PR-2), (참고예 169, PR-3), (참고예 169, PR-4), (참고예 169, PR-5), (참고예 170, PR-1), (참고예 170, PR-2), (참고예 170, PR-3), (참고예 170, PR-4), (참고예 170, PR-5), (참고예 171, PR-1), (참고예 171, PR-2), (참고예 171, PR-3), (참고예 171, PR-4), (참고예 171, PR-5), (참고예 172, PR-1), (참고예 172, PR-2), (참고예 172, PR-3), (참고예 172, PR-4), (참고예 172, PR-5), (참고예 173, PR-1), (참고예 173, PR-2), (참고예 173, PR-3), (참고예 173, PR-4), (참고예 173, PR-5), (참고예 174, PR-1), (참고예 174, PR-2), (참고예 174, PR-3), (참고예 174, PR-4), (참고예 174, PR-5), (참고예 175, PR-1), (참고예 175, PR-2), (참고예 175, PR-3), (참고예 175, PR-4), (참고예 175, PR-5), (참고예 176, PR-1), (참고예 176, PR-2), (참고예 176, PR-3), (참고예 176, PR-4), (참고예 176, PR-5), (참고예 177, PR-1), (참고예 177, PR-2), (참고예 177, PR-3), (참고예 177, PR-4), (참고예 177, PR-5), (참고예 178, PR-1), (참고예 178, PR-2), (참고예 178, PR-3), (참고예 178, PR-4), (참고예 178, PR-5), (참고예 179, PR-1), (참고예 179, PR-2), (참고예 179, PR-3), (참고예 179, PR-4), (참고예 179, PR-5), (참고예 180, PR-1), (참고예 180, PR-2), (참고예 180, PR-3), (참고예 180, PR-4), (참고예 180, PR-5), (참고예 181, PR-1), (참고예 181, PR-2), (참고예 181, PR-3), (참고예 181, PR-4), (참고예 181, PR-5), (참고예 182, PR-1), (참고예 182, PR-2), (참고예 182, PR-3), (참고예 182, PR-4), (참고예 182, PR-5), (참고예 183, PR-1), (참고예 183, PR-2), (참고예 183, PR-3), (참고예 183, PR-4), (참고예 183, PR-5), (참고예 184, PR-1), (참고예 184, PR-2), (참고예 184, PR-3), (참고예 184, PR-4), (참고예 184, PR-5), (참고예 185, PR-1), (참고예 185, PR-2), (참고예 185, PR-3), (참고예 185, PR-4), (참고예 185, PR-5), (참고예 186, PR-1), (참고예 186, PR-2), (참고예 186, PR-3), (참고예 186, PR-4), (참고예 186, PR-5), (참고예 187, PR-1), (참고예 187, PR-2), (참고예 187, PR-3), (참고예 187, PR-4), (참고예 187, PR-5), (참고예 188, PR-1), (참고예 188, PR-2), (참고예 188, PR-3), (참고예 188, PR-4), (참고예 188, PR-5), (참고예 189, PR-1), (참고예 189, PR-2), (참고예 189, PR-3), (참고예 189, PR-4), (참고예 189, PR-5), (참고예 190, PR-1), (참고예 190, PR-2), (참고예 190, PR-3), (참고예 190, PR-4), (참고예 190, PR-5), (참고예 191, PR-1), (참고예 191, PR-2), (참고예 191, PR-3), (참고예 191, PR-4), (참고예 191, PR-5), (참고예 192, PR-1), (참고예 192, PR-2), (참고예 192, PR-3), (참고예 192, PR-4), (참고예 192, PR-5), (참고예 193, PR-1), (참고예 193, PR-2), (참고예 193, PR-3), (참고예 193, PR-4), (참고예 193, PR-5), (참고예 194, PR-1), (참고예 194, PR-2), (참고예 194, PR-3), (참고예 194, PR-4), (참고예 194, PR-5), (참고예 195, PR-1), (참고예 195, PR-2), (참고예 195, PR-3), (참고예 195, PR-4), (참고예 195, PR-5), (참고예 196, PR-1), (참고예 196, PR-2), (참고예 196, PR-3), (참고예 196, PR-4), (참고예 196, PR-5), (참고예 197, PR-1), (참고예 197, PR-2), (참고예 197, PR-3), (참고예 197, PR-4), (참고예 197, PR-5), (참고예 198, PR-1), (참고예 198, PR-2), (참고예 198, PR-3), (참고예 198, PR-4), (참고예 198, PR-5), (참고예 199, PR-1), (참고예 199, PR-2), (참고예 199, PR-3), (참고예 199, PR-4), (참고예 199, PR-5), (참고예 200, PR-1), (참고예 200, PR-2), (참고예 200, PR-3), (참고예 200, PR-4), (참고예 200, PR-5),
(참고예 201, PR-1), (참고예 201, PR-2), (참고예 201, PR-3), (참고예 201, PR-4), (참고예 201, PR-5), (참고예 202, PR-1), (참고예 202, PR-2), (참고예 202, PR-3), (참고예 202, PR-4), (참고예 202, PR-5), (참고예 203, PR-1), (참고예 203, PR-2), (참고예 203, PR-3), (참고예 203, PR-4), (참고예 203, PR-5), (참고예 204, PR-1), (참고예 204, PR-2), (참고예 204, PR-3), (참고예 204, PR-4), (참고예 204, PR-5), (참고예 205, PR-1), (참고예 205, PR-2), (참고예 205, PR-3), (참고예 205, PR-4), (참고예 205, PR-5), (참고예 206, PR-1), (참고예 206, PR-2), (참고예 206, PR-3), (참고예 206, PR-4), (참고예 206, PR-5), (참고예 207, PR-1), (참고예 207, PR-2), (참고예 207, PR-3), (참고예 207, PR-4), (참고예 207, PR-5), (참고예 208, PR-1), (참고예 208, PR-2), (참고예 208, PR-3), (참고예 208, PR-4), (참고예 208, PR-5), (참고예 209, PR-1), (참고예 209, PR-2), (참고예 209, PR-3), (참고예 209, PR-4), (참고예 209, PR-5), (참고예 210, PR-1), (참고예 210, PR-2), (참고예 210, PR-3), (참고예 210, PR-4), (참고예 210, PR-5), (참고예 211, PR-1), (참고예 211, PR-2), (참고예 211, PR-3), (참고예 211, PR-4), (참고예 211, PR-5), (참고예 212, PR-1), (참고예 212, PR-2), (참고예 212, PR-3), (참고예 212, PR-4), (참고예 212, PR-5), (참고예 213, PR-1), (참고예 213, PR-2), (참고예 213, PR-3), (참고예 213, PR-4), (참고예 213, PR-5), (참고예 214, PR-1), (참고예 214, PR-2), (참고예 214, PR-3), (참고예 214, PR-4), (참고예 214, PR-5), (참고예 215, PR-1), (참고예 215, PR-2), (참고예 215, PR-3), (참고예 215, PR-4), (참고예 215, PR-5), (참고예 216, PR-1), (참고예 216, PR-2), (참고예 216, PR-3), (참고예 216, PR-4), (참고예 216, PR-5), (참고예 217, PR-1), (참고예 217, PR-2), (참고예 217, PR-3), (참고예 217, PR-4), (참고예 217, PR-5), (참고예 218, PR-1), (참고예 218, PR-2), (참고예 218, PR-3), (참고예 218, PR-4), (참고예 218, PR-5), (참고예 219, PR-1), (참고예 219, PR-2), (참고예 219, PR-3), (참고예 219, PR-4), (참고예 219, PR-5), (참고예 220, PR-1), (참고예 220, PR-2), (참고예 220, PR-3), (참고예 220, PR-4), (참고예 220, PR-5), (참고예 221, PR-1), (참고예 221, PR-2), (참고예 221, PR-3), (참고예 221, PR-4), (참고예 221, PR-5), (참고예 222, PR-1), (참고예 222, PR-2), (참고예 222, PR-3), (참고예 222, PR-4), (참고예 222, PR-5), (참고예 223, PR-1), (참고예 223, PR-2), (참고예 223, PR-3), (참고예 223, PR-4), (참고예 223, PR-5), (참고예 224, PR-1), (참고예 224, PR-2), (참고예 224, PR-3), (참고예 224, PR-4), (참고예 224, PR-5), (참고예 225, PR-1), (참고예 225, PR-2), (참고예 225, PR-3), (참고예 225, PR-4), (참고예 225, PR-5), (참고예 226, PR-1), (참고예 226, PR-2), (참고예 226, PR-3), (참고예 226, PR-4), (참고예 226, PR-5), (참고예 227, PR-1), (참고예 227, PR-2), (참고예 227, PR-3), (참고예 227, PR-4), (참고예 227, PR-5), (참고예 228, PR-1), (참고예 228, PR-2), (참고예 228, PR-3), (참고예 228, PR-4), (참고예 228, PR-5), (참고예 229, PR-1), (참고예 229, PR-2), (참고예 229, PR-3), (참고예 229, PR-4), (참고예 229, PR-5), (참고예 230, PR-1), (참고예 230, PR-2), (참고예 230, PR-3), (참고예 230, PR-4), (참고예 230, PR-5), (참고예 231, PR-1), (참고예 231, PR-2), (참고예 231, PR-3), (참고예 231, PR-4), (참고예 231, PR-5), (참고예 232, PR-1), (참고예 232, PR-2), (참고예 232, PR-3), (참고예 232, PR-4), (참고예 232, PR-5), (참고예 233, PR-1), (참고예 233, PR-2), (참고예 233, PR-3), (참고예 233, PR-4), (참고예 233, PR-5), (참고예 234, PR-1), (참고예 234, PR-2), (참고예 234, PR-3), (참고예 234, PR-4), (참고예 234, PR-5), (참고예 235, PR-1), (참고예 235, PR-2), (참고예 235, PR-3), (참고예 235, PR-4), (참고예 235, PR-5), (참고예 236, PR-1), (참고예 236, PR-2), (참고예 236, PR-3), (참고예 236, PR-4), (참고예 236, PR-5), (참고예 237, PR-1), (참고예 237, PR-2), (참고예 237, PR-3), (참고예 237, PR-4), (참고예 237, PR-5), (참고예 238, PR-1), (참고예 238, PR-2), (참고예 238, PR-3), (참고예 238, PR-4), (참고예 238, PR-5), (참고예 239, PR-1), (참고예 239, PR-2), (참고예 239, PR-3), (참고예 239, PR-4), (참고예 239, PR-5), (참고예 240, PR-1), (참고예 240, PR-2), (참고예 240, PR-3), (참고예 240, PR-4), (참고예 240, PR-5), (참고예 241, PR-1), (참고예 241, PR-2), (참고예 241, PR-3), (참고예 241, PR-4), (참고예 241, PR-5), (참고예 242, PR-1), (참고예 242, PR-2), (참고예 242, PR-3), (참고예 242, PR-4), (참고예 242, PR-5), (참고예 243, PR-1), (참고예 243, PR-2), (참고예 243, PR-3), (참고예 243, PR-4), (참고예 243, PR-5), (참고예 244, PR-1), (참고예 244, PR-2), (참고예 244, PR-3), (참고예 244, PR-4), (참고예 244, PR-5), (참고예 245, PR-1), (참고예 245, PR-2), (참고예 245, PR-3), (참고예 245, PR-4), (참고예 245, PR-5), (참고예 246, PR-1), (참고예 246, PR-2), (참고예 246, PR-3), (참고예 246, PR-4), (참고예 246, PR-5), (참고예 247, PR-1), (참고예 247, PR-2), (참고예 247, PR-3), (참고예 247, PR-4), (참고예 247, PR-5), (참고예 248, PR-1), (참고예 248, PR-2), (참고예 248, PR-3), (참고예 248, PR-4), (참고예 248, PR-5), (참고예 249, PR-1), (참고예 249, PR-2), (참고예 249, PR-3), (참고예 249, PR-4), (참고예 249, PR-5), (참고예 250, PR-1), (참고예 250, PR-2), (참고예 250, PR-3), (참고예 250, PR-4), (참고예 250, PR-5), (참고예 251, PR-1), (참고예 251, PR-2), (참고예 251, PR-3), (참고예 251, PR-4), (참고예 251, PR-5), (참고예 252, PR-1), (참고예 252, PR-2), (참고예 252, PR-3), (참고예 252, PR-4), (참고예 252, PR-5), (참고예 253, PR-1), (참고예 253, PR-2), (참고예 253, PR-3), (참고예 253, PR-4), (참고예 253, PR-5), (참고예 254, PR-1), (참고예 254, PR-2), (참고예 254, PR-3), (참고예 254, PR-4), (참고예 254, PR-5), (참고예 255, PR-1), (참고예 255, PR-2), (참고예 255, PR-3), (참고예 255, PR-4), (참고예 255, PR-5), (참고예 256, PR-1), (참고예 256, PR-2), (참고예 256, PR-3), (참고예 256, PR-4), (참고예 256, PR-5), (참고예 257, PR-1), (참고예 257, PR-2), (참고예 257, PR-3), (참고예 257, PR-4), (참고예 257, PR-5), (참고예 258, PR-1), (참고예 258, PR-2), (참고예 258, PR-3), (참고예 258, PR-4), (참고예 258, PR-5), (참고예 259, PR-1), (참고예 259, PR-2), (참고예 259, PR-3), (참고예 259, PR-4), (참고예 259, PR-5), (참고예 260, PR-1), (참고예 260, PR-2), (참고예 260, PR-3), (참고예 260, PR-4), (참고예 260, PR-5), (참고예 261, PR-1), (참고예 261, PR-2), (참고예 261, PR-3), (참고예 261, PR-4), (참고예 261, PR-5), (참고예 262, PR-1), (참고예 262, PR-2), (참고예 262, PR-3), (참고예 262, PR-4), (참고예 262, PR-5), (참고예 263, PR-1), (참고예 263, PR-2), (참고예 263, PR-3), (참고예 263, PR-4), (참고예 263, PR-5), (참고예 264, PR-1), (참고예 264, PR-2), (참고예 264, PR-3), (참고예 264, PR-4), (참고예 264, PR-5), (참고예 265, PR-1), (참고예 265, PR-2), (참고예 265, PR-3), (참고예 265, PR-4), (참고예 265, PR-5), (참고예 266, PR-1), (참고예 266, PR-2), (참고예 266, PR-3), (참고예 266, PR-4), (참고예 266, PR-5), (참고예 267, PR-1), (참고예 267, PR-2), (참고예 267, PR-3), (참고예 267, PR-4), (참고예 267, PR-5), (참고예 268, PR-1), (참고예 268, PR-2), (참고예 268, PR-3), (참고예 268, PR-4), (참고예 268, PR-5), (참고예 269, PR-1), (참고예 269, PR-2), (참고예 269, PR-3), (참고예 269, PR-4), (참고예 269, PR-5), (참고예 270, PR-1), (참고예 270, PR-2), (참고예 270, PR-3), (참고예 270, PR-4), (참고예 270, PR-5), (참고예 271, PR-1), (참고예 271, PR-2), (참고예 271, PR-3), (참고예 271, PR-4), (참고예 271, PR-5), (참고예 272, PR-1), (참고예 272, PR-2), (참고예 272, PR-3), (참고예 272, PR-4), (참고예 272, PR-5), (참고예 273, PR-1), (참고예 273, PR-2), (참고예 273, PR-3), (참고예 273, PR-4), (참고예 273, PR-5), (참고예 274, PR-1), (참고예 274, PR-2), (참고예 274, PR-3), (참고예 274, PR-4), (참고예 274, PR-5), (참고예 275, PR-1), (참고예 275, PR-2), (참고예 275, PR-3), (참고예 275, PR-4), (참고예 275, PR-5), (참고예 276, PR-1), (참고예 276, PR-2), (참고예 276, PR-3), (참고예 276, PR-4), (참고예 276, PR-5), (참고예 277, PR-1), (참고예 277, PR-2), (참고예 277, PR-3), (참고예 277, PR-4), (참고예 277, PR-5), (참고예 278, PR-1), (참고예 278, PR-2), (참고예 278, PR-3), (참고예 278, PR-4), (참고예 278, PR-5), (참고예 279, PR-1), (참고예 279, PR-2), (참고예 279, PR-3), (참고예 279, PR-4), (참고예 279, PR-5), (참고예 280, PR-1), (참고예 280, PR-2), (참고예 280, PR-3), (참고예 280, PR-4), (참고예 280, PR-5), (참고예 281, PR-1), (참고예 281, PR-2), (참고예 281, PR-3), (참고예 281, PR-4), (참고예 281, PR-5), (참고예 282, PR-1), (참고예 282, PR-2), (참고예 282, PR-3), (참고예 282, PR-4), (참고예 282, PR-5), (참고예 283, PR-1), (참고예 283, PR-2), (참고예 283, PR-3), (참고예 283, PR-4), (참고예 283, PR-5), (참고예 284, PR-1), (참고예 284, PR-2), (참고예 284, PR-3), (참고예 284, PR-4), (참고예 284, PR-5), (참고예 285, PR-1), (참고예 285, PR-2), (참고예 285, PR-3), (참고예 285, PR-4), (참고예 285, PR-5), (참고예 286, PR-1), (참고예 286, PR-2), (참고예 286, PR-3), (참고예 286, PR-4), (참고예 286, PR-5), (참고예 287, PR-1), (참고예 287, PR-2), (참고예 287, PR-3), (참고예 287, PR-4), (참고예 287, PR-5), (참고예 288, PR-1), (참고예 288, PR-2), (참고예 288, PR-3), (참고예 288, PR-4), (참고예 288, PR-5), (참고예 289, PR-1), (참고예 289, PR-2), (참고예 289, PR-3), (참고예 289, PR-4), (참고예 289, PR-5), (참고예 290, PR-1), (참고예 290, PR-2), (참고예 290, PR-3), (참고예 290, PR-4), (참고예 290, PR-5), (참고예 291, PR-1), (참고예 291, PR-2), (참고예 291, PR-3), (참고예 291, PR-4), (참고예 291, PR-5), (참고예 292, PR-1), (참고예 292, PR-2), (참고예 292, PR-3), (참고예 292, PR-4), (참고예 292, PR-5), (참고예 293, PR-1), (참고예 293, PR-2), (참고예 293, PR-3), (참고예 293, PR-4), (참고예 293, PR-5), (참고예 294, PR-1), (참고예 294, PR-2), (참고예 294, PR-3), (참고예 294, PR-4), (참고예 294, PR-5), (참고예 295, PR-1), (참고예 295, PR-2), (참고예 295, PR-3), (참고예 295, PR-4), (참고예 295, PR-5), (참고예 296, PR-1), (참고예 296, PR-2), (참고예 296, PR-3), (참고예 296, PR-4), (참고예 296, PR-5), (참고예 297, PR-1), (참고예 297, PR-2), (참고예 297, PR-3), (참고예 297, PR-4), (참고예 297, PR-5), (참고예 298, PR-1), (참고예 298, PR-2), (참고예 298, PR-3), (참고예 298, PR-4), (참고예 298, PR-5), (참고예 299, PR-1), (참고예 299, PR-2), (참고예 299, PR-3), (참고예 299, PR-4), (참고예 299, PR-5), (참고예 300, PR-1), (참고예 300, PR-2), (참고예 300, PR-3), (참고예 300, PR-4), (참고예 300, PR-5),
(참고예 301, PR-1), (참고예 301, PR-2), (참고예 301, PR-3), (참고예 301, PR-4), (참고예 301, PR-5), (참고예 302, PR-1), (참고예 302, PR-2), (참고예 302, PR-3), (참고예 302, PR-4), (참고예 302, PR-5), (참고예 303, PR-1), (참고예 303, PR-2), (참고예 303, PR-3), (참고예 303, PR-4), (참고예 303, PR-5), (참고예 304, PR-1), (참고예 304, PR-2), (참고예 304, PR-3), (참고예 304, PR-4), (참고예 304, PR-5), (참고예 305, PR-1), (참고예 305, PR-2), (참고예 305, PR-3), (참고예 305, PR-4), (참고예 305, PR-5), (참고예 306, PR-1), (참고예 306, PR-2), (참고예 306, PR-3), (참고예 306, PR-4), (참고예 306, PR-5), (참고예 307, PR-1), (참고예 307, PR-2), (참고예 307, PR-3), (참고예 307, PR-4), (참고예 307, PR-5), (참고예 308, PR-1), (참고예 308, PR-2), (참고예 308, PR-3), (참고예 308, PR-4), (참고예 308, PR-5), (참고예 309, PR-1), (참고예 309, PR-2), (참고예 309, PR-3), (참고예 309, PR-4), (참고예 309, PR-5), (참고예 310, PR-1), (참고예 310, PR-2), (참고예 310, PR-3), (참고예 310, PR-4), (참고예 310, PR-5), (참고예 311, PR-1), (참고예 311, PR-2), (참고예 311, PR-3), (참고예 311, PR-4), (참고예 311, PR-5), (참고예 312, PR-1), (참고예 312, PR-2), (참고예 312, PR-3), (참고예 312, PR-4), (참고예 312, PR-5), (참고예 313, PR-1), (참고예 313, PR-2), (참고예 313, PR-3), (참고예 313, PR-4), (참고예 313, PR-5), (참고예 314, PR-1), (참고예 314, PR-2), (참고예 314, PR-3), (참고예 314, PR-4), (참고예 314, PR-5), (참고예 315, PR-1), (참고예 315, PR-2), (참고예 315, PR-3), (참고예 315, PR-4), (참고예 315, PR-5), (참고예 316, PR-1), (참고예 316, PR-2), (참고예 316, PR-3), (참고예 316, PR-4), (참고예 316, PR-5), (참고예 317, PR-1), (참고예 317, PR-2), (참고예 317, PR-3), (참고예 317, PR-4), (참고예 317, PR-5), (참고예 318, PR-1), (참고예 318, PR-2), (참고예 318, PR-3), (참고예 318, PR-4), (참고예 318, PR-5), (참고예 319, PR-1), (참고예 319, PR-2), (참고예 319, PR-3), (참고예 319, PR-4), (참고예 319, PR-5), (참고예 320, PR-1), (참고예 320, PR-2), (참고예 320, PR-3), (참고예 320, PR-4), (참고예 320, PR-5), (참고예 321, PR-1), (참고예 321, PR-2), (참고예 321, PR-3), (참고예 321, PR-4), (참고예 321, PR-5), (참고예 322, PR-1), (참고예 322, PR-2), (참고예 322, PR-3), (참고예 322, PR-4), (참고예 322, PR-5), (참고예 323, PR-1), (참고예 323, PR-2), (참고예 323, PR-3), (참고예 323, PR-4), (참고예 323, PR-5), (참고예 324, PR-1), (참고예 324, PR-2), (참고예 324, PR-3), (참고예 324, PR-4), (참고예 324, PR-5), (참고예 325, PR-1), (참고예 325, PR-2), (참고예 325, PR-3), (참고예 325, PR-4), (참고예 325, PR-5), (참고예 326, PR-1), (참고예 326, PR-2), (참고예 326, PR-3), (참고예 326, PR-4), (참고예 326, PR-5), (참고예 327, PR-1), (참고예 327, PR-2), (참고예 327, PR-3), (참고예 327, PR-4), (참고예 327, PR-5), (참고예 328, PR-1), (참고예 328, PR-2), (참고예 328, PR-3), (참고예 328, PR-4), (참고예 328, PR-5), (참고예 329, PR-1), (참고예 329, PR-2), (참고예 329, PR-3), (참고예 329, PR-4), (참고예 329, PR-5), (참고예 330, PR-1), (참고예 330, PR-2), (참고예 330, PR-3), (참고예 330, PR-4), (참고예 330, PR-5), (참고예 331, PR-1), (참고예 331, PR-2), (참고예 331, PR-3), (참고예 331, PR-4), (참고예 331, PR-5), (참고예 332, PR-1), (참고예 332, PR-2), (참고예 332, PR-3), (참고예 332, PR-4), (참고예 332, PR-5), (참고예 333, PR-1), (참고예 333, PR-2), (참고예 333, PR-3), (참고예 333, PR-4), (참고예 333, PR-5), (참고예 334, PR-1), (참고예 334, PR-2), (참고예 334, PR-3), (참고예 334, PR-4), (참고예 334, PR-5), (참고예 335, PR-1), (참고예 335, PR-2), (참고예 335, PR-3), (참고예 335, PR-4), (참고예 335, PR-5), (참고예 336, PR-1), (참고예 336, PR-2), (참고예 336, PR-3), (참고예 336, PR-4), (참고예 336, PR-5), (참고예 337, PR-1), (참고예 337, PR-2), (참고예 337, PR-3), (참고예 337, PR-4), (참고예 337, PR-5), (참고예 338, PR-1), (참고예 338, PR-2), (참고예 338, PR-3), (참고예 338, PR-4), (참고예 338, PR-5), (참고예 339, PR-1), (참고예 339, PR-2), (참고예 339, PR-3), (참고예 339, PR-4), (참고예 339, PR-5), (참고예 340, PR-1), (참고예 340, PR-2), (참고예 340, PR-3), (참고예 340, PR-4), (참고예 340, PR-5), (참고예 341, PR-1), (참고예 341, PR-2), (참고예 341, PR-3), (참고예 341, PR-4), (참고예 341, PR-5), (참고예 342, PR-1), (참고예 342, PR-2), (참고예 342, PR-3), (참고예 342, PR-4), (참고예 342, PR-5), (참고예 343, PR-1), (참고예 343, PR-2), (참고예 343, PR-3), (참고예 343, PR-4), (참고예 343, PR-5), (참고예 344, PR-1), (참고예 344, PR-2), (참고예 344, PR-3), (참고예 344, PR-4), (참고예 344, PR-5), (참고예 345, PR-1), (참고예 345, PR-2), (참고예 345, PR-3), (참고예 345, PR-4), (참고예 345, PR-5), (참고예 346, PR-1), (참고예 346, PR-2), (참고예 346, PR-3), (참고예 346, PR-4), (참고예 346, PR-5), (참고예 347, PR-1), (참고예 347, PR-2), (참고예 347, PR-3), (참고예 347, PR-4), (참고예 347, PR-5), (참고예 348, PR-1), (참고예 348, PR-2), (참고예 348, PR-3), (참고예 348, PR-4), (참고예 348, PR-5), (참고예 349, PR-1), (참고예 349, PR-2), (참고예 349, PR-3), (참고예 349, PR-4), (참고예 349, PR-5), (참고예 350, PR-1), (참고예 350, PR-2), (참고예 350, PR-3), (참고예 350, PR-4), (참고예 350, PR-5), (참고예 351, PR-1), (참고예 351, PR-2), (참고예 351, PR-3), (참고예 351, PR-4), (참고예 351, PR-5), (참고예 352, PR-1), (참고예 352, PR-2), (참고예 352, PR-3), (참고예 352, PR-4), (참고예 352, PR-5), (참고예 353, PR-1), (참고예 353, PR-2), (참고예 353, PR-3), (참고예 353, PR-4), (참고예 353, PR-5), (참고예 354, PR-1), (참고예 354, PR-2), (참고예 354, PR-3), (참고예 354, PR-4), (참고예 354, PR-5), (참고예 355, PR-1), (참고예 355, PR-2), (참고예 355, PR-3), (참고예 355, PR-4), (참고예 355, PR-5), (참고예 356, PR-1), (참고예 356, PR-2), (참고예 356, PR-3), (참고예 356, PR-4), (참고예 356, PR-5), (참고예 357, PR-1), (참고예 357, PR-2), (참고예 357, PR-3), (참고예 357, PR-4), (참고예 357, PR-5), (참고예 358, PR-1), (참고예 358, PR-2), (참고예 358, PR-3), (참고예 358, PR-4), (참고예 358, PR-5), (참고예 359, PR-1), (참고예 359, PR-2), (참고예 359, PR-3), (참고예 359, PR-4), (참고예 359, PR-5), (참고예 360, PR-1), (참고예 360, PR-2), (참고예 360, PR-3), (참고예 360, PR-4), (참고예 360, PR-5), (참고예 361, PR-1), (참고예 361, PR-2), (참고예 361, PR-3), (참고예 361, PR-4), (참고예 361, PR-5), (참고예 362, PR-1), (참고예 362, PR-2), (참고예 362, PR-3), (참고예 362, PR-4), (참고예 362, PR-5), (참고예 363, PR-1), (참고예 363, PR-2), (참고예 363, PR-3), (참고예 363, PR-4), (참고예 363, PR-5), (참고예 364, PR-1), (참고예 364, PR-2), (참고예 364, PR-3), (참고예 364, PR-4), (참고예 364, PR-5), (참고예 365, PR-1), (참고예 365, PR-2), (참고예 365, PR-3), (참고예 365, PR-4), (참고예 365, PR-5), (참고예 366, PR-1), (참고예 366, PR-2), (참고예 366, PR-3), (참고예 366, PR-4), (참고예 366, PR-5), (참고예 367, PR-1), (참고예 367, PR-2), (참고예 367, PR-3), (참고예 367, PR-4), (참고예 367, PR-5), (참고예 368, PR-1), (참고예 368, PR-2), (참고예 368, PR-3), (참고예 368, PR-4), (참고예 368, PR-5), (참고예 369, PR-1), (참고예 369, PR-2), (참고예 369, PR-3), (참고예 369, PR-4), (참고예 369, PR-5), (참고예 370, PR-1), (참고예 370, PR-2), (참고예 370, PR-3), (참고예 370, PR-4), (참고예 370, PR-5), (참고예 371, PR-1), (참고예 371, PR-2), (참고예 371, PR-3), (참고예 371, PR-4), (참고예 371, PR-5), (참고예 372, PR-1), (참고예 372, PR-2), (참고예 372, PR-3), (참고예 372, PR-4), (참고예 372, PR-5), (참고예 373, PR-1), (참고예 373, PR-2), (참고예 373, PR-3), (참고예 373, PR-4), (참고예 373, PR-5), (참고예 374, PR-1), (참고예 374, PR-2), (참고예 374, PR-3), (참고예 374, PR-4), (참고예 374, PR-5), (참고예 375, PR-1), (참고예 375, PR-2), (참고예 375, PR-3), (참고예 375, PR-4), (참고예 375, PR-5), (참고예 376, PR-1), (참고예 376, PR-2), (참고예 376, PR-3), (참고예 376, PR-4), (참고예 376, PR-5), (참고예 377, PR-1), (참고예 377, PR-2), (참고예 377, PR-3), (참고예 377, PR-4), (참고예 377, PR-5), (참고예 378, PR-1), (참고예 378, PR-2), (참고예 378, PR-3), (참고예 378, PR-4), (참고예 378, PR-5), (참고예 379, PR-1), (참고예 379, PR-2), (참고예 379, PR-3), (참고예 379, PR-4), (참고예 379, PR-5), (참고예 380, PR-1), (참고예 380, PR-2), (참고예 380, PR-3), (참고예 380, PR-4), (참고예 380, PR-5), (참고예 381, PR-1), (참고예 381, PR-2), (참고예 381, PR-3), (참고예 381, PR-4), (참고예 381, PR-5), (참고예 382, PR-1), (참고예 382, PR-2), (참고예 382, PR-3), (참고예 382, PR-4), (참고예 382, PR-5), (참고예 383, PR-1), (참고예 383, PR-2), (참고예 383, PR-3), (참고예 383, PR-4), (참고예 383, PR-5), (참고예 384, PR-1), (참고예 384, PR-2), (참고예 384, PR-3), (참고예 384, PR-4), (참고예 384, PR-5), (참고예 385, PR-1), (참고예 385, PR-2), (참고예 385, PR-3), (참고예 385, PR-4), (참고예 385, PR-5), (참고예 386, PR-1), (참고예 386, PR-2), (참고예 386, PR-3), (참고예 386, PR-4), (참고예 386, PR-5), (참고예 387, PR-1), (참고예 387, PR-2), (참고예 387, PR-3), (참고예 387, PR-4), (참고예 387, PR-5), (참고예 388, PR-1), (참고예 388, PR-2), (참고예 388, PR-3), (참고예 388, PR-4), (참고예 388, PR-5), (참고예 389, PR-1), (참고예 389, PR-2), (참고예 389, PR-3), (참고예 389, PR-4), (참고예 389, PR-5), (참고예 390, PR-1), (참고예 390, PR-2), (참고예 390, PR-3), (참고예 390, PR-4), (참고예 390, PR-5), (참고예 391, PR-1), (참고예 391, PR-2), (참고예 391, PR-3), (참고예 391, PR-4), (참고예 391, PR-5), (참고예 392, PR-1), (참고예 392, PR-2), (참고예 392, PR-3), (참고예 392, PR-4), (참고예 392, PR-5), (참고예 393, PR-1), (참고예 393, PR-2), (참고예 393, PR-3), (참고예 393, PR-4), (참고예 393, PR-5), (참고예 394, PR-1), (참고예 394, PR-2), (참고예 394, PR-3), (참고예 394, PR-4), (참고예 394, PR-5), (참고예 395, PR-1), (참고예 395, PR-2), (참고예 395, PR-3), (참고예 395, PR-4), (참고예 395, PR-5), (참고예 396, PR-1), (참고예 396, PR-2), (참고예 396, PR-3), (참고예 396, PR-4), (참고예 396, PR-5), (참고예 397, PR-1), (참고예 397, PR-2), (참고예 397, PR-3), (참고예 397, PR-4), (참고예 397, PR-5), (참고예 398, PR-1), (참고예 398, PR-2), (참고예 398, PR-3), (참고예 398, PR-4), (참고예 398, PR-5), (참고예 399, PR-1), (참고예 399, PR-2), (참고예 399, PR-3), (참고예 399, PR-4), (참고예 399, PR-5), (참고예 400, PR-1), (참고예 400, PR-2), (참고예 400, PR-3), (참고예 400, PR-4), (참고예 400, PR-5),
(참고예 401, PR-1), (참고예 401, PR-2), (참고예 401, PR-3), (참고예 401, PR-4), (참고예 401, PR-5), (참고예 402, PR-1), (참고예 402, PR-2), (참고예 402, PR-3), (참고예 402, PR-4), (참고예 402, PR-5), (참고예 403, PR-1), (참고예 403, PR-2), (참고예 403, PR-3), (참고예 403, PR-4), (참고예 403, PR-5), (참고예 404, PR-1), (참고예 404, PR-2), (참고예 404, PR-3), (참고예 404, PR-4), (참고예 404, PR-5), (참고예 405, PR-1), (참고예 405, PR-2), (참고예 405, PR-3), (참고예 405, PR-4), (참고예 405, PR-5), (참고예 406, PR-1), (참고예 406, PR-2), (참고예 406, PR-3), (참고예 406, PR-4), (참고예 406, PR-5), (참고예 407, PR-1), (참고예 407, PR-2), (참고예 407, PR-3), (참고예 407, PR-4), (참고예 407, PR-5), (참고예 408, PR-1), (참고예 408, PR-2), (참고예 408, PR-3), (참고예 408, PR-4), (참고예 408, PR-5), (참고예 409, PR-1), (참고예 409, PR-2), (참고예 409, PR-3), (참고예 409, PR-4), (참고예 409, PR-5), (참고예 410, PR-1), (참고예 410, PR-2), (참고예 410, PR-3), (참고예 410, PR-4), (참고예 410, PR-5), (참고예 411, PR-1), (참고예 411, PR-2), (참고예 411, PR-3), (참고예 411, PR-4), (참고예 411, PR-5), (참고예 412, PR-1), (참고예 412, PR-2), (참고예 412, PR-3), (참고예 412, PR-4), (참고예 412, PR-5), (참고예 413, PR-1), (참고예 413, PR-2), (참고예 413, PR-3), (참고예 413, PR-4), (참고예 413, PR-5), (참고예 414, PR-1), (참고예 414, PR-2), (참고예 414, PR-3), (참고예 414, PR-4), (참고예 414, PR-5), (참고예 415, PR-1), (참고예 415, PR-2), (참고예 415, PR-3), (참고예 415, PR-4), (참고예 415, PR-5), (참고예 416, PR-1), (참고예 416, PR-2), (참고예 416, PR-3), (참고예 416, PR-4), (참고예 416, PR-5), (참고예 417, PR-1), (참고예 417, PR-2), (참고예 417, PR-3), (참고예 417, PR-4), (참고예 417, PR-5), (참고예 418, PR-1), (참고예 418, PR-2), (참고예 418, PR-3), (참고예 418, PR-4), (참고예 418, PR-5), (참고예 419, PR-1), (참고예 419, PR-2), (참고예 419, PR-3), (참고예 419, PR-4), (참고예 419, PR-5), (참고예 420, PR-1), (참고예 420, PR-2), (참고예 420, PR-3), (참고예 420, PR-4), (참고예 420, PR-5), (참고예 421, PR-1), (참고예 421, PR-2), (참고예 421, PR-3), (참고예 421, PR-4), (참고예 421, PR-5), (참고예 422, PR-1), (참고예 422, PR-2), (참고예 422, PR-3), (참고예 422, PR-4), (참고예 422, PR-5), (참고예 423, PR-1), (참고예 423, PR-2), (참고예 423, PR-3), (참고예 423, PR-4), (참고예 423, PR-5), (참고예 424, PR-1), (참고예 424, PR-2), (참고예 424, PR-3), (참고예 424, PR-4), (참고예 424, PR-5), (참고예 425, PR-1), (참고예 425, PR-2), (참고예 425, PR-3), (참고예 425, PR-4), (참고예 425, PR-5), (참고예 426, PR-1), (참고예 426, PR-2), (참고예 426, PR-3), (참고예 426, PR-4), (참고예 426, PR-5), (참고예 427, PR-1), (참고예 427, PR-2), (참고예 427, PR-3), (참고예 427, PR-4), (참고예 427, PR-5), (참고예 428, PR-1), (참고예 428, PR-2), (참고예 428, PR-3), (참고예 428, PR-4), (참고예 428, PR-5), (참고예 429, PR-1), (참고예 429, PR-2), (참고예 429, PR-3), (참고예 429, PR-4), (참고예 429, PR-5), (참고예 430, PR-1), (참고예 430, PR-2), (참고예 430, PR-3), (참고예 430, PR-4), (참고예 430, PR-5), (참고예 431, PR-1), (참고예 431, PR-2), (참고예 431, PR-3), (참고예 431, PR-4), (참고예 431, PR-5), (참고예 432, PR-1), (참고예 432, PR-2), (참고예 432, PR-3), (참고예 432, PR-4), (참고예 432, PR-5), (참고예 433, PR-1), (참고예 433, PR-2), (참고예 433, PR-3), (참고예 433, PR-4), (참고예 433, PR-5), (참고예 434, PR-1), (참고예 434, PR-2), (참고예 434, PR-3), (참고예 434, PR-4), (참고예 434, PR-5), (참고예 435, PR-1), (참고예 435, PR-2), (참고예 435, PR-3), (참고예 435, PR-4), (참고예 435, PR-5), (참고예 436, PR-1), (참고예 436, PR-2), (참고예 436, PR-3), (참고예 436, PR-4), (참고예 436, PR-5), (참고예 437, PR-1), (참고예 437, PR-2), (참고예 437, PR-3), (참고예 437, PR-4), (참고예 437, PR-5), (참고예 438, PR-1), (참고예 438, PR-2), (참고예 438, PR-3), (참고예 438, PR-4), (참고예 438, PR-5), (참고예 439, PR-1), (참고예 439, PR-2), (참고예 439, PR-3), (참고예 439, PR-4), (참고예 439, PR-5), (참고예 440, PR-1), (참고예 440, PR-2), (참고예 440, PR-3), (참고예 440, PR-4), (참고예 440, PR-5), (참고예 441, PR-1), (참고예 441, PR-2), (참고예 441, PR-3), (참고예 441, PR-4), (참고예 441, PR-5), (참고예 442, PR-1), (참고예 442, PR-2), (참고예 442, PR-3), (참고예 442, PR-4), (참고예 442, PR-5), (참고예 443, PR-1), (참고예 443, PR-2), (참고예 443, PR-3), (참고예 443, PR-4), (참고예 443, PR-5), (참고예 444, PR-1), (참고예 444, PR-2), (참고예 444, PR-3), (참고예 444, PR-4), (참고예 444, PR-5), (참고예 445, PR-1), (참고예 445, PR-2), (참고예 445, PR-3), (참고예 445, PR-4), (참고예 445, PR-5), (참고예 446, PR-1), (참고예 446, PR-2), (참고예 446, PR-3), (참고예 446, PR-4), (참고예 446, PR-5), (참고예 447, PR-1), (참고예 447, PR-2), (참고예 447, PR-3), (참고예 447, PR-4), (참고예 447, PR-5), (참고예 448, PR-1), (참고예 448, PR-2), (참고예 448, PR-3), (참고예 448, PR-4), (참고예 448, PR-5), (참고예 449, PR-1), (참고예 449, PR-2), (참고예 449, PR-3), (참고예 449, PR-4), (참고예 449, PR-5), (참고예 450, PR-1), (참고예 450, PR-2), (참고예 450, PR-3), (참고예 450, PR-4), (참고예 450, PR-5), (참고예 451, PR-1), (참고예 451, PR-2), (참고예 451, PR-3), (참고예 451, PR-4), (참고예 451, PR-5), (참고예 452, PR-1), (참고예 452, PR-2), (참고예 452, PR-3), (참고예 452, PR-4), (참고예 452, PR-5), (참고예 453, PR-1), (참고예 453, PR-2), (참고예 453, PR-3), (참고예 453, PR-4), (참고예 453, PR-5), (참고예 454, PR-1), (참고예 454, PR-2), (참고예 454, PR-3), (참고예 454, PR-4), (참고예 454, PR-5), (참고예 455, PR-1), (참고예 455, PR-2), (참고예 455, PR-3), (참고예 455, PR-4), (참고예 455, PR-5), (참고예 456, PR-1), (참고예 456, PR-2), (참고예 456, PR-3), (참고예 456, PR-4), (참고예 456, PR-5), (참고예 457, PR-1), (참고예 457, PR-2), (참고예 457, PR-3), (참고예 457, PR-4), (참고예 457, PR-5), (참고예 458, PR-1), (참고예 458, PR-2), (참고예 458, PR-3), (참고예 458, PR-4), (참고예 458, PR-5), (참고예 459, PR-1), (참고예 459, PR-2), (참고예 459, PR-3), (참고예 459, PR-4), (참고예 459, PR-5), (참고예 460, PR-1), (참고예 460, PR-2), (참고예 460, PR-3), (참고예 460, PR-4), (참고예 460, PR-5), (참고예 461, PR-1), (참고예 461, PR-2), (참고예 461, PR-3), (참고예 461, PR-4), (참고예 461, PR-5), (참고예 462, PR-1), (참고예 462, PR-2), (참고예 462, PR-3), (참고예 462, PR-4), (참고예 462, PR-5), (참고예 463, PR-1), (참고예 463, PR-2), (참고예 463, PR-3), (참고예 463, PR-4), (참고예 463, PR-5), (참고예 464, PR-1), (참고예 464, PR-2), (참고예 464, PR-3), (참고예 464, PR-4), (참고예 464, PR-5), (참고예 465, PR-1), (참고예 465, PR-2), (참고예 465, PR-3), (참고예 465, PR-4), (참고예 465, PR-5), (참고예 466, PR-1), (참고예 466, PR-2), (참고예 466, PR-3), (참고예 466, PR-4), (참고예 466, PR-5), (참고예 467, PR-1), (참고예 467, PR-2), (참고예 467, PR-3), (참고예 467, PR-4), (참고예 467, PR-5), (참고예 468, PR-1), (참고예 468, PR-2), (참고예 468, PR-3), (참고예 468, PR-4), (참고예 468, PR-5), (참고예 469, PR-1), (참고예 469, PR-2), (참고예 469, PR-3), (참고예 469, PR-4), (참고예 469, PR-5), (참고예 470, PR-1), (참고예 470, PR-2), (참고예 470, PR-3), (참고예 470, PR-4), (참고예 470, PR-5), (참고예 471, PR-1), (참고예 471, PR-2), (참고예 471, PR-3), (참고예 471, PR-4), (참고예 471, PR-5), (참고예 472, PR-1), (참고예 472, PR-2), (참고예 472, PR-3), (참고예 472, PR-4), (참고예 472, PR-5), (참고예 473, PR-1), (참고예 473, PR-2), (참고예 473, PR-3), (참고예 473, PR-4), (참고예 473, PR-5), (참고예 474, PR-1), (참고예 474, PR-2), (참고예 474, PR-3), (참고예 474, PR-4), (참고예 474, PR-5), (참고예 475, PR-1), (참고예 475, PR-2), (참고예 475, PR-3), (참고예 475, PR-4), (참고예 475, PR-5), (참고예 476, PR-1), (참고예 476, PR-2), (참고예 476, PR-3), (참고예 476, PR-4), (참고예 476, PR-5), (참고예 477, PR-1), (참고예 477, PR-2), (참고예 477, PR-3), (참고예 477, PR-4), (참고예 477, PR-5), (참고예 478, PR-1), (참고예 478, PR-2), (참고예 478, PR-3), (참고예 478, PR-4), (참고예 478, PR-5), (참고예 479, PR-1), (참고예 479, PR-2), (참고예 479, PR-3), (참고예 479, PR-4), (참고예 479, PR-5), (참고예 480, PR-1), (참고예 480, PR-2), (참고예 480, PR-3), (참고예 480, PR-4), (참고예 480, PR-5), (참고예 481, PR-1), (참고예 481, PR-2), (참고예 481, PR-3), (참고예 481, PR-4), (참고예 481, PR-5), (참고예 482, PR-1), (참고예 482, PR-2), (참고예 482, PR-3), (참고예 482, PR-4), (참고예 482, PR-5), (참고예 483, PR-1), (참고예 483, PR-2), (참고예 483, PR-3), (참고예 483, PR-4), (참고예 483, PR-5), (참고예 484, PR-1), (참고예 484, PR-2), (참고예 484, PR-3), (참고예 484, PR-4), (참고예 484, PR-5), (참고예 485, PR-1), (참고예 485, PR-2), (참고예 485, PR-3), (참고예 485, PR-4), (참고예 485, PR-5), (참고예 486, PR-1), (참고예 486, PR-2), (참고예 486, PR-3), (참고예 486, PR-4), (참고예 486, PR-5), (참고예 487, PR-1), (참고예 487, PR-2), (참고예 487, PR-3), (참고예 487, PR-4), (참고예 487, PR-5), (참고예 488, PR-1), (참고예 488, PR-2), (참고예 488, PR-3), (참고예 488, PR-4), (참고예 488, PR-5), (참고예 489, PR-1), (참고예 489, PR-2), (참고예 489, PR-3), (참고예 489, PR-4), (참고예 489, PR-5), (참고예 490, PR-1), (참고예 490, PR-2), (참고예 490, PR-3), (참고예 490, PR-4), (참고예 490, PR-5), (참고예 491, PR-1), (참고예 491, PR-2), (참고예 491, PR-3), (참고예 491, PR-4), (참고예 491, PR-5), (참고예 492, PR-1), (참고예 492, PR-2), (참고예 492, PR-3), (참고예 492, PR-4), (참고예 492, PR-5), (참고예 493, PR-1), (참고예 493, PR-2), (참고예 493, PR-3), (참고예 493, PR-4), (참고예 493, PR-5), (참고예 494, PR-1), (참고예 494, PR-2), (참고예 494, PR-3), (참고예 494, PR-4), (참고예 494, PR-5), (참고예 495, PR-1), (참고예 495, PR-2), (참고예 495, PR-3), (참고예 495, PR-4), (참고예 495, PR-5), (참고예 496, PR-1), (참고예 496, PR-2), (참고예 496, PR-3), (참고예 496, PR-4), (참고예 496, PR-5), (참고예 497, PR-1), (참고예 497, PR-2), (참고예 497, PR-3), (참고예 497, PR-4), (참고예 497, PR-5), (참고예 498, PR-1), (참고예 498, PR-2), (참고예 498, PR-3), (참고예 498, PR-4), (참고예 498, PR-5), (참고예 499, PR-1), (참고예 499, PR-2), (참고예 499, PR-3), (참고예 499, PR-4), (참고예 499, PR-5), (참고예 500, PR-1), (참고예 500, PR-2), (참고예 500, PR-3), (참고예 500, PR-4), (참고예 500, PR-5),
(참고예 501, PR-1), (참고예 501, PR-2), (참고예 501, PR-3), (참고예 501, PR-4), (참고예 501, PR-5), (참고예 502, PR-1), (참고예 502, PR-2), (참고예 502, PR-3), (참고예 502, PR-4), (참고예 502, PR-5), (참고예 503, PR-1), (참고예 503, PR-2), (참고예 503, PR-3), (참고예 503, PR-4), (참고예 503, PR-5), (참고예 504, PR-1), (참고예 504, PR-2), (참고예 504, PR-3), (참고예 504, PR-4), (참고예 504, PR-5), (참고예 505, PR-1), (참고예 505, PR-2), (참고예 505, PR-3), (참고예 505, PR-4), (참고예 505, PR-5), (참고예 506, PR-1), (참고예 506, PR-2), (참고예 506, PR-3), (참고예 506, PR-4), (참고예 506, PR-5), (참고예 507, PR-1), (참고예 507, PR-2), (참고예 507, PR-3), (참고예 507, PR-4), (참고예 507, PR-5), (참고예 508, PR-1), (참고예 508, PR-2), (참고예 508, PR-3), (참고예 508, PR-4), (참고예 508, PR-5), (참고예 509, PR-1), (참고예 509, PR-2), (참고예 509, PR-3), (참고예 509, PR-4), (참고예 509, PR-5), (참고예 510, PR-1), (참고예 510, PR-2), (참고예 510, PR-3), (참고예 510, PR-4), (참고예 510, PR-5), (참고예 511, PR-1), (참고예 511, PR-2), (참고예 511, PR-3), (참고예 511, PR-4), (참고예 511, PR-5), (참고예 512, PR-1), (참고예 512, PR-2), (참고예 512, PR-3), (참고예 512, PR-4), (참고예 512, PR-5), (참고예 513, PR-1), (참고예 513, PR-2), (참고예 513, PR-3), (참고예 513, PR-4), (참고예 513, PR-5), (참고예 514, PR-1), (참고예 514, PR-2), (참고예 514, PR-3), (참고예 514, PR-4), (참고예 514, PR-5), (참고예 515, PR-1), (참고예 515, PR-2), (참고예 515, PR-3), (참고예 515, PR-4), (참고예 515, PR-5), (참고예 516, PR-1), (참고예 516, PR-2), (참고예 516, PR-3), (참고예 516, PR-4), (참고예 516, PR-5), (참고예 517, PR-1), (참고예 517, PR-2), (참고예 517, PR-3), (참고예 517, PR-4), (참고예 517, PR-5), (참고예 518, PR-1), (참고예 518, PR-2), (참고예 518, PR-3), (참고예 518, PR-4), (참고예 518, PR-5), (참고예 519, PR-1), (참고예 519, PR-2), (참고예 519, PR-3), (참고예 519, PR-4), (참고예 519, PR-5), (참고예 520, PR-1), (참고예 520, PR-2), (참고예 520, PR-3), (참고예 520, PR-4), (참고예 520, PR-5), (참고예 521, PR-1), (참고예 521, PR-2), (참고예 521, PR-3), (참고예 521, PR-4), (참고예 521, PR-5), (참고예 522, PR-1), (참고예 522, PR-2), (참고예 522, PR-3), (참고예 522, PR-4), (참고예 522, PR-5), (참고예 523, PR-1), (참고예 523, PR-2), (참고예 523, PR-3), (참고예 523, PR-4), (참고예 523, PR-5), (참고예 524, PR-1), (참고예 524, PR-2), (참고예 524, PR-3), (참고예 524, PR-4), (참고예 524, PR-5), (참고예 525, PR-1), (참고예 525, PR-2), (참고예 525, PR-3), (참고예 525, PR-4), (참고예 525, PR-5), (참고예 526, PR-1), (참고예 526, PR-2), (참고예 526, PR-3), (참고예 526, PR-4), (참고예 526, PR-5), (참고예 527, PR-1), (참고예 527, PR-2), (참고예 527, PR-3), (참고예 527, PR-4), (참고예 527, PR-5), (참고예 528, PR-1), (참고예 528, PR-2), (참고예 528, PR-3), (참고예 528, PR-4), (참고예 528, PR-5), (참고예 529, PR-1), (참고예 529, PR-2), (참고예 529, PR-3), (참고예 529, PR-4), (참고예 529, PR-5), (참고예 530, PR-1), (참고예 530, PR-2), (참고예 530, PR-3), (참고예 530, PR-4), (참고예 530, PR-5), (참고예 531, PR-1), (참고예 531, PR-2), (참고예 531, PR-3), (참고예 531, PR-4), (참고예 531, PR-5), (참고예 532, PR-1), (참고예 532, PR-2), (참고예 532, PR-3), (참고예 532, PR-4), (참고예 532, PR-5), (참고예 533, PR-1), (참고예 533, PR-2), (참고예 533, PR-3), (참고예 533, PR-4), (참고예 533, PR-5), (참고예 534, PR-1), (참고예 534, PR-2), (참고예 534, PR-3), (참고예 534, PR-4), (참고예 534, PR-5), (참고예 535, PR-1), (참고예 535, PR-2), (참고예 535, PR-3), (참고예 535, PR-4), (참고예 535, PR-5), (참고예 536, PR-1), (참고예 536, PR-2), (참고예 536, PR-3), (참고예 536, PR-4), (참고예 536, PR-5), (참고예 537, PR-1), (참고예 537, PR-2), (참고예 537, PR-3), (참고예 537, PR-4), (참고예 537, PR-5), (참고예 538, PR-1), (참고예 538, PR-2), (참고예 538, PR-3), (참고예 538, PR-4), (참고예 538, PR-5), (참고예 539, PR-1), (참고예 539, PR-2), (참고예 539, PR-3), (참고예 539, PR-4), (참고예 539, PR-5), (참고예 540, PR-1), (참고예 540, PR-2), (참고예 540, PR-3), (참고예 540, PR-4), (참고예 540, PR-5), (참고예 541, PR-1), (참고예 541, PR-2), (참고예 541, PR-3), (참고예 541, PR-4), (참고예 541, PR-5), (참고예 542, PR-1), (참고예 542, PR-2), (참고예 542, PR-3), (참고예 542, PR-4), (참고예 542, PR-5), (참고예 543, PR-1), (참고예 543, PR-2), (참고예 543, PR-3), (참고예 543, PR-4), (참고예 543, PR-5), (참고예 544, PR-1), (참고예 544, PR-2), (참고예 544, PR-3), (참고예 544, PR-4), (참고예 544, PR-5), (참고예 545, PR-1), (참고예 545, PR-2), (참고예 545, PR-3), (참고예 545, PR-4), (참고예 545, PR-5), (참고예 546, PR-1), (참고예 546, PR-2), (참고예 546, PR-3), (참고예 546, PR-4), (참고예 546, PR-5), (참고예 547, PR-1), (참고예 547, PR-2), (참고예 547, PR-3), (참고예 547, PR-4), (참고예 547, PR-5), (참고예 548, PR-1), (참고예 548, PR-2), (참고예 548, PR-3), (참고예 548, PR-4), (참고예 548, PR-5), (참고예 549, PR-1), (참고예 549, PR-2), (참고예 549, PR-3), (참고예 549, PR-4), (참고예 549, PR-5), (참고예 550, PR-1), (참고예 550, PR-2), (참고예 550, PR-3), (참고예 550, PR-4), (참고예 550, PR-5), (참고예 551, PR-1), (참고예 551, PR-2), (참고예 551, PR-3), (참고예 551, PR-4), (참고예 551, PR-5), (참고예 552, PR-1), (참고예 552, PR-2), (참고예 552, PR-3), (참고예 552, PR-4), (참고예 552, PR-5), (참고예 553, PR-1), (참고예 553, PR-2), (참고예 553, PR-3), (참고예 553, PR-4), (참고예 553, PR-5), (참고예 554, PR-1), (참고예 554, PR-2), (참고예 554, PR-3), (참고예 554, PR-4), (참고예 554, PR-5), (참고예 555, PR-1), (참고예 555, PR-2), (참고예 555, PR-3), (참고예 555, PR-4), (참고예 555, PR-5), (참고예 556, PR-1), (참고예 556, PR-2), (참고예 556, PR-3), (참고예 556, PR-4), (참고예 556, PR-5), (참고예 557, PR-1), (참고예 557, PR-2), (참고예 557, PR-3), (참고예 557, PR-4), (참고예 557, PR-5), (참고예 558, PR-1), (참고예 558, PR-2), (참고예 558, PR-3), (참고예 558, PR-4), (참고예 558, PR-5), (참고예 559, PR-1), (참고예 559, PR-2), (참고예 559, PR-3), (참고예 559, PR-4), (참고예 559, PR-5), (참고예 560, PR-1), (참고예 560, PR-2), (참고예 560, PR-3), (참고예 560, PR-4), (참고예 560, PR-5), (참고예 561, PR-1), (참고예 561, PR-2), (참고예 561, PR-3), (참고예 561, PR-4), (참고예 561, PR-5), (참고예 562, PR-1), (참고예 562, PR-2), (참고예 562, PR-3), (참고예 562, PR-4), (참고예 562, PR-5), (참고예 563, PR-1), (참고예 563, PR-2), (참고예 563, PR-3), (참고예 563, PR-4), (참고예 563, PR-5), (참고예 564, PR-1), (참고예 564, PR-2), (참고예 564, PR-3), (참고예 564, PR-4), (참고예 564, PR-5), (참고예 565, PR-1), (참고예 565, PR-2), (참고예 565, PR-3), (참고예 565, PR-4), (참고예 565, PR-5), (참고예 566, PR-1), (참고예 566, PR-2), (참고예 566, PR-3), (참고예 566, PR-4), (참고예 566, PR-5), (참고예 567, PR-1), (참고예 567, PR-2), (참고예 567, PR-3), (참고예 567, PR-4), (참고예 567, PR-5), (참고예 568, PR-1), (참고예 568, PR-2), (참고예 568, PR-3), (참고예 568, PR-4), (참고예 568, PR-5), (참고예 569, PR-1), (참고예 569, PR-2), (참고예 569, PR-3), (참고예 569, PR-4), (참고예 569, PR-5), (참고예 570, PR-1), (참고예 570, PR-2), (참고예 570, PR-3), (참고예 570, PR-4), (참고예 570, PR-5), (참고예 571, PR-1), (참고예 571, PR-2), (참고예 571, PR-3), (참고예 571, PR-4), (참고예 571, PR-5), (참고예 572, PR-1), (참고예 572, PR-2), (참고예 572, PR-3), (참고예 572, PR-4), (참고예 572, PR-5), (참고예 573, PR-1), (참고예 573, PR-2), (참고예 573, PR-3), (참고예 573, PR-4), (참고예 573, PR-5), (참고예 574, PR-1), (참고예 574, PR-2), (참고예 574, PR-3), (참고예 574, PR-4), (참고예 574, PR-5), (참고예 575, PR-1), (참고예 575, PR-2), (참고예 575, PR-3), (참고예 575, PR-4), (참고예 575, PR-5), (참고예 576, PR-1), (참고예 576, PR-2), (참고예 576, PR-3), (참고예 576, PR-4), (참고예 576, PR-5), (참고예 577, PR-1), (참고예 577, PR-2), (참고예 577, PR-3), (참고예 577, PR-4), (참고예 577, PR-5), (참고예 578, PR-1), (참고예 578, PR-2), (참고예 578, PR-3), (참고예 578, PR-4), (참고예 578, PR-5), (참고예 579, PR-1), (참고예 579, PR-2), (참고예 579, PR-3), (참고예 579, PR-4), (참고예 579, PR-5), (참고예 580, PR-1), (참고예 580, PR-2), (참고예 580, PR-3), (참고예 580, PR-4), (참고예 580, PR-5), (참고예 581, PR-1), (참고예 581, PR-2), (참고예 581, PR-3), (참고예 581, PR-4), (참고예 581, PR-5), (참고예 582, PR-1), (참고예 582, PR-2), (참고예 582, PR-3), (참고예 582, PR-4), (참고예 582, PR-5), (참고예 583, PR-1), (참고예 583, PR-2), (참고예 583, PR-3), (참고예 583, PR-4), (참고예 583, PR-5), (참고예 584, PR-1), (참고예 584, PR-2), (참고예 584, PR-3), (참고예 584, PR-4), (참고예 584, PR-5), (참고예 585, PR-1), (참고예 585, PR-2), (참고예 585, PR-3), (참고예 585, PR-4), (참고예 585, PR-5), (참고예 586, PR-1), (참고예 586, PR-2), (참고예 586, PR-3), (참고예 586, PR-4), (참고예 586, PR-5), (참고예 587, PR-1), (참고예 587, PR-2), (참고예 587, PR-3), (참고예 587, PR-4), (참고예 587, PR-5), (참고예 588, PR-1), (참고예 588, PR-2), (참고예 588, PR-3), (참고예 588, PR-4), (참고예 588, PR-5), (참고예 589, PR-1), (참고예 589, PR-2), (참고예 589, PR-3), (참고예 589, PR-4), (참고예 589, PR-5), (참고예 590, PR-1), (참고예 590, PR-2), (참고예 590, PR-3), (참고예 590, PR-4), (참고예 590, PR-5), (참고예 591, PR-1), (참고예 591, PR-2), (참고예 591, PR-3), (참고예 591, PR-4), (참고예 591, PR-5), (참고예 592, PR-1), (참고예 592, PR-2), (참고예 592, PR-3), (참고예 592, PR-4), (참고예 592, PR-5), (참고예 593, PR-1), (참고예 593, PR-2), (참고예 593, PR-3), (참고예 593, PR-4), (참고예 593, PR-5), (참고예 594, PR-1), (참고예 594, PR-2), (참고예 594, PR-3), (참고예 594, PR-4), (참고예 594, PR-5), (참고예 595, PR-1), (참고예 595, PR-2), (참고예 595, PR-3), (참고예 595, PR-4), (참고예 595, PR-5), (참고예 596, PR-1), (참고예 596, PR-2), (참고예 596, PR-3), (참고예 596, PR-4), (참고예 596, PR-5), (참고예 597, PR-1), (참고예 597, PR-2), (참고예 597, PR-3), (참고예 597, PR-4), (참고예 597, PR-5), (참고예 598, PR-1), (참고예 598, PR-2), (참고예 598, PR-3), (참고예 598, PR-4), (참고예 598, PR-5), (참고예 599, PR-1), (참고예 599, PR-2), (참고예 599, PR-3), (참고예 599, PR-4), (참고예 599, PR-5), (참고예 600, PR-1), (참고예 600, PR-2), (참고예 600, PR-3), (참고예 600, PR-4), (참고예 600, PR-5),
(참고예 601, PR-1), (참고예 601, PR-2), (참고예 601, PR-3), (참고예 601, PR-4), (참고예 601, PR-5), (참고예 602, PR-1), (참고예 602, PR-2), (참고예 602, PR-3), (참고예 602, PR-4), (참고예 602, PR-5), (참고예 603, PR-1), (참고예 603, PR-2), (참고예 603, PR-3), (참고예 603, PR-4), (참고예 603, PR-5), (참고예 604, PR-1), (참고예 604, PR-2), (참고예 604, PR-3), (참고예 604, PR-4), (참고예 604, PR-5), (참고예 605, PR-1), (참고예 605, PR-2), (참고예 605, PR-3), (참고예 605, PR-4), (참고예 605, PR-5), (참고예 606, PR-1), (참고예 606, PR-2), (참고예 606, PR-3), (참고예 606, PR-4), (참고예 606, PR-5), (참고예 607, PR-1), (참고예 607, PR-2), (참고예 607, PR-3), (참고예 607, PR-4), (참고예 607, PR-5), (참고예 608, PR-1), (참고예 608, PR-2), (참고예 608, PR-3), (참고예 608, PR-4), (참고예 608, PR-5), (참고예 609, PR-1), (참고예 609, PR-2), (참고예 609, PR-3), (참고예 609, PR-4), (참고예 609, PR-5), (참고예 610, PR-1), (참고예 610, PR-2), (참고예 610, PR-3), (참고예 610, PR-4), (참고예 610, PR-5), (참고예 611, PR-1), (참고예 611, PR-2), (참고예 611, PR-3), (참고예 611, PR-4), (참고예 611, PR-5), (참고예 612, PR-1), (참고예 612, PR-2), (참고예 612, PR-3), (참고예 612, PR-4), (참고예 612, PR-5), (참고예 613, PR-1), (참고예 613, PR-2), (참고예 613, PR-3), (참고예 613, PR-4), (참고예 613, PR-5), (참고예 614, PR-1), (참고예 614, PR-2), (참고예 614, PR-3), (참고예 614, PR-4), (참고예 614, PR-5), (참고예 615, PR-1), (참고예 615, PR-2), (참고예 615, PR-3), (참고예 615, PR-4), (참고예 615, PR-5), (참고예 616, PR-1), (참고예 616, PR-2), (참고예 616, PR-3), (참고예 616, PR-4), (참고예 616, PR-5), (참고예 617, PR-1), (참고예 617, PR-2), (참고예 617, PR-3), (참고예 617, PR-4), (참고예 617, PR-5), (참고예 618, PR-1), (참고예 618, PR-2), (참고예 618, PR-3), (참고예 618, PR-4), (참고예 618, PR-5), (참고예 619, PR-1), (참고예 619, PR-2), (참고예 619, PR-3), (참고예 619, PR-4), (참고예 619, PR-5), (참고예 620, PR-1), (참고예 620, PR-2), (참고예 620, PR-3), (참고예 620, PR-4), (참고예 620, PR-5), (참고예 621, PR-1), (참고예 621, PR-2), (참고예 621, PR-3), (참고예 621, PR-4), (참고예 621, PR-5), (참고예 622, PR-1), (참고예 622, PR-2), (참고예 622, PR-3), (참고예 622, PR-4), (참고예 622, PR-5), (참고예 623, PR-1), (참고예 623, PR-2), (참고예 623, PR-3), (참고예 623, PR-4), (참고예 623, PR-5), (참고예 624, PR-1), (참고예 624, PR-2), (참고예 624, PR-3), (참고예 624, PR-4), (참고예 624, PR-5), (참고예 625, PR-1), (참고예 625, PR-2), (참고예 625, PR-3), (참고예 625, PR-4), (참고예 625, PR-5), (참고예 626, PR-1), (참고예 626, PR-2), (참고예 626, PR-3), (참고예 626, PR-4), (참고예 626, PR-5), (참고예 627, PR-1), (참고예 627, PR-2), (참고예 627, PR-3), (참고예 627, PR-4), (참고예 627, PR-5), (참고예 628, PR-1), (참고예 628, PR-2), (참고예 628, PR-3), (참고예 628, PR-4), (참고예 628, PR-5), (참고예 629, PR-1), (참고예 629, PR-2), (참고예 629, PR-3), (참고예 629, PR-4), (참고예 629, PR-5), (참고예 630, PR-1), (참고예 630, PR-2), (참고예 630, PR-3), (참고예 630, PR-4), (참고예 630, PR-5), (참고예 631, PR-1), (참고예 631, PR-2), (참고예 631, PR-3), (참고예 631, PR-4), (참고예 631, PR-5), (참고예 632, PR-1), (참고예 632, PR-2), (참고예 632, PR-3), (참고예 632, PR-4), (참고예 632, PR-5), (참고예 633, PR-1), (참고예 633, PR-2), (참고예 633, PR-3), (참고예 633, PR-4), (참고예 633, PR-5), (참고예 634, PR-1), (참고예 634, PR-2), (참고예 634, PR-3), (참고예 634, PR-4), (참고예 634, PR-5), (참고예 635, PR-1), (참고예 635, PR-2), (참고예 635, PR-3), (참고예 635, PR-4), (참고예 635, PR-5), (참고예 636, PR-1), (참고예 636, PR-2), (참고예 636, PR-3), (참고예 636, PR-4), (참고예 636, PR-5), (참고예 637, PR-1), (참고예 637, PR-2), (참고예 637, PR-3), (참고예 637, PR-4), (참고예 637, PR-5), (참고예 638, PR-1), (참고예 638, PR-2), (참고예 638, PR-3), (참고예 638, PR-4), (참고예 638, PR-5), (참고예 639, PR-1), (참고예 639, PR-2), (참고예 639, PR-3), (참고예 639, PR-4), (참고예 639, PR-5), (참고예 640, PR-1), (참고예 640, PR-2), (참고예 640, PR-3), (참고예 640, PR-4), (참고예 640, PR-5), (참고예 641, PR-1), (참고예 641, PR-2), (참고예 641, PR-3), (참고예 641, PR-4), (참고예 641, PR-5), (참고예 642, PR-1), (참고예 642, PR-2), (참고예 642, PR-3), (참고예 642, PR-4), (참고예 642, PR-5), (참고예 643, PR-1), (참고예 643, PR-2), (참고예 643, PR-3), (참고예 643, PR-4), (참고예 643, PR-5), (참고예 644, PR-1), (참고예 644, PR-2), (참고예 644, PR-3), (참고예 644, PR-4), (참고예 644, PR-5), (참고예 645, PR-1), (참고예 645, PR-2), (참고예 645, PR-3), (참고예 645, PR-4), (참고예 645, PR-5), (참고예 646, PR-1), (참고예 646, PR-2), (참고예 646, PR-3), (참고예 646, PR-4), (참고예 646, PR-5), (참고예 647, PR-1), (참고예 647, PR-2), (참고예 647, PR-3), (참고예 647, PR-4), (참고예 647, PR-5), (참고예 648, PR-1), (참고예 648, PR-2), (참고예 648, PR-3), (참고예 648, PR-4), (참고예 648, PR-5), (참고예 649, PR-1), (참고예 649, PR-2), (참고예 649, PR-3), (참고예 649, PR-4), (참고예 649, PR-5), (참고예 650, PR-1), (참고예 650, PR-2), (참고예 650, PR-3), (참고예 650, PR-4), (참고예 650, PR-5), (참고예 651, PR-1), (참고예 651, PR-2), (참고예 651, PR-3), (참고예 651, PR-4), (참고예 651, PR-5), (참고예 652, PR-1), (참고예 652, PR-2), (참고예 652, PR-3), (참고예 652, PR-4), (참고예 652, PR-5), (참고예 653, PR-1), (참고예 653, PR-2), (참고예 653, PR-3), (참고예 653, PR-4), (참고예 653, PR-5), (참고예 654, PR-1), (참고예 654, PR-2), (참고예 654, PR-3), (참고예 654, PR-4), (참고예 654, PR-5), (참고예 655, PR-1), (참고예 655, PR-2), (참고예 655, PR-3), (참고예 655, PR-4), (참고예 655, PR-5), (참고예 656, PR-1), (참고예 656, PR-2), (참고예 656, PR-3), (참고예 656, PR-4), (참고예 656, PR-5), (참고예 657, PR-1), (참고예 657, PR-2), (참고예 657, PR-3), (참고예 657, PR-4), (참고예 657, PR-5), (참고예 658, PR-1), (참고예 658, PR-2), (참고예 658, PR-3), (참고예 658, PR-4), (참고예 658, PR-5), (참고예 659, PR-1), (참고예 659, PR-2), (참고예 659, PR-3), (참고예 659, PR-4), (참고예 659, PR-5), (참고예 660, PR-1), (참고예 660, PR-2), (참고예 660, PR-3), (참고예 660, PR-4), (참고예 660, PR-5), (참고예 661, PR-1), (참고예 661, PR-2), (참고예 661, PR-3), (참고예 661, PR-4), (참고예 661, PR-5), (참고예 662, PR-1), (참고예 662, PR-2), (참고예 662, PR-3), (참고예 662, PR-4), (참고예 662, PR-5), (참고예 663, PR-1), (참고예 663, PR-2), (참고예 663, PR-3), (참고예 663, PR-4), (참고예 663, PR-5), (참고예 664, PR-1), (참고예 664, PR-2), (참고예 664, PR-3), (참고예 664, PR-4), (참고예 664, PR-5), (참고예 665, PR-1), (참고예 665, PR-2), (참고예 665, PR-3), (참고예 665, PR-4), (참고예 665, PR-5).
예를 들면 상기 (참고예 1, PR-1)은 이하의 구조식으로 표시되는 화합물을 의미한다.
이하, 중간체 합성예로서, 본원을 실시하기 위해 유용한 중간체의 합성법을 나타낸다.
중간체 합성예 1
제1 공정
나트륨 tert-펜톡시드(2.55g, 23.2mmol)의 THF(4ml) 현탁액에 벤질알코올(1.00g, 9.25mmol)의 THF(3ml) 용액을 질소 분위기하에 실온에서 가하고, 40℃에서 2시간 교반하였다. 이 반응액을 빙욕으로 냉각하고, 화합물 1a(1.53g, 10.2mmol)의 THF(3ml) 용액을 0 내지 10℃에서 적하하였다. 반응액을 실온에서 2시간 교반한 후, 2N 염산(15ml)을 가하고, 아세트산에틸로 2회 추출하였다. 합친 추출액을 물, 포화 중조수, 물, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 4:1, v/v)로 정제하여 화합물 1b 1.89g(수율 92%)을 유상물로서 얻었다.
제2 공정
화합물 1b(1.80g, 8.1mmol)를 1,4-디옥산(18mL)에 용해하고, N,N-디메틸포름아미드디메틸아세탈(1.45g, 12.2mmol)을 가하고, 실온에서 6시간 교반하였다. 반응액을 감압하에서 농축한 후, 잔류물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 1:4, v/v)로 정제하여 화합물 1c 1.77g(수율 79%)을 유상물로서 얻었다.
제3 공정
3목 플라스크에 질소 분위기하에서 나트륨 tert-부톡시드(2.55g, 23.2mmol), 옥살산디메틸(639mg, 5.41mmol), DMI(3ml)를 가하고, 이것에 화합물 1c(0.50g, 1.80mmol)의 DMI(2ml) 용액을 25 내지 30℃에서 적하하였다. 실온에서 7시간 교반한 후, 2N 염산(10ml)을 가하여 실온에서 15시간 교반하였다. 아세트산에틸로 2회 추출하고, 합친 추출액을 물, 포화 중조수, 물, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 2:1→1:1, v/v)로 정제하여 화합물 1d 488mg(수율 85%)을 백색 고체로서 얻었다.
중간체 합성예 2
제1 공정
나트륨 tert-펜톡시드(1.67g, 15.2mmol)의 DMI(4ml) 현탁액에 벤질알코올(0.66g, 6.1mmol)의 DMI(3ml) 용액을 질소 분위기하에 실온에서 가하고, 40℃에서 2시간 교반하였다. 이 반응액을 빙욕으로 냉각하고, 화합물 2a(1.10g, 6.68mmol)의 DMI(3ml) 용액을 0 내지 10℃에서 적하하였다. 반응액을 0 내지 5℃에서 2시간, 실온에서 3시간 교반한 후, 2N 염산(15ml)을 가하고, 아세트산에틸로 2회 추출하였다. 합친 추출액을 물, 포화 중조수, 물, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 4:1, v/v)로 정제하여 화합물 2b 1.29g(수율 90%)을 유상물로서 얻었다.
제2 공정
화합물 2b(9.73g, 41.2mmol)를 톨루엔(45mL)에 용해하고, N,N-디메틸포름아미드디메틸아세탈(7.36g, 61.8mmol)을 가하고, 실온에서 5시간 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 2회 추출하였다. 합친 추출액을 물, 포화 식염수로 순차 세정한 후, 무수 황산마그네슘으로 건조하였다. 용매를 증류 제거하고, 얻어진 유상물을 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 1:1→3:7, v/v)로 정제하여 화합물 2c 7.90g(수율 66%)을 유상물로서 얻었다.
제3 공정
3목 플라스크에 질소 분위기하에서 나트륨 tert-부톡시드(495mg, 5.15mmol), DMI(2ml)를 가하고, 이것에 옥살산디메틸(608mg, 5.15mmol), 화합물 2c(0.50g, 1.72mmol)의 DMI(3ml) 용액을 25 내지 30℃에서 적하하였다. 실온에서 4시간 교반한 후, 2N 염산(10ml)을 가하여 실온에서 15시간 교반하였다. 톨루엔으로 2회 추출하고, 합친 추출액을 물, 포화 중조수, 물, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 2:1, v/v)로 정제하여 화합물 2d 420mg(수율 74%)을 백색 고체로서 얻었다.
중간체 합성예 3
제1 공정
화합물 3a(5.0g, 30.4mmol)에 N,N-디메틸포름아미드디메틸아세탈(4.9ml, 36.5mmol)을 0℃에서 냉각하에 적하하였다. 0℃에서 1시간 교반한 후, 반응액에 아세트산에틸 100ml를 가하고, 0.5N 염산물(50ml)로 세정하였다. 수층을 분액하여 아세트산에틸(50ml)로 추출하였다. 유기층을 합쳐서 포화 중조수, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 1:1(v/v)→아세트산에틸)로 정제하여 화합물 3b 4.49g(수율 67%)을 유상물로서 얻었다.
제2 공정
리튬헥사메틸디실라지드(1.0M 톨루엔 용액, 49ml, 49.0mmol)를 THF(44ml)로 희석하고, 이것에 -78℃에서 냉각하에 화합물 3b(4.49g, 20.4mmol)의 THF(10ml) 용액을 적하한 후, 에틸옥살릴클로라이드(3.35g, 24.5mmol)의 THF(10ml) 용액을 적하하였다. -78℃에서 2시간 교반한 후, 0℃까지 승온하였다. 반응액에 2N 염산을 가하여 20분간 교반한 후, 아세트산에틸로 추출하고(200ml×2), 유기층을 포화 중조수, 포화 식염수로 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 7:3→5:5→0:10(v/v))로 정제하여 화합물 3c 1.77g(수율 31%)을 백색 고체로서 얻었다.
제3 공정
화합물 3c(300mg, 1.09mmol)의 에탄올(6ml) 용액에 아미노아세트알데히드디메틸아세탈(0.13ml, 1.20mmol)을 0℃에서 가하고, 0℃에서 1시간 30분, 실온에서 18시간, 이어서 60℃에서 4시간 교반하였다. 반응액을 감압하에 용매증류 제거한 후, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 5:5→0:10(v/v))로 정제하여 화합물 3d 252mg(수율 64%)을 유상물로서 얻었다.
중간체 합성예 4
제1 공정
화합물 4a(10.0g, 76.8mmol)에 N,N-디메틸포름아미드디메틸아세탈(12.2ml, 92.2mmol)을 0℃에서 냉각하에 적하하였다. 0℃에서 1시간 30분, 이어서 실온에서 2시간 30분 교반한 후, 반응액에 아세트산에틸 100ml를 가하고, 용매를 증류 제거하였다. 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 5:5→0:10(v/v))로 정제하여 화합물 4b 12.45g(수율 88%)을 유상물로서 얻었다.
제2 공정
리튬헥사메틸디실라지드(1.0M 톨루엔 용액, 24ml, 24.0mmol)를 THF(20ml)로 희석하고, 이것에 -78℃에서 냉각하에 화합물 4b(1.85g, 10.0mmol)의 THF(5ml) 용액을 적하한 후, 에틸옥살릴클로라이드(1.34ml, 12.0mmol)의 THF(5ml) 용액을 적하하였다. -78℃에서 2시간 교반한 후, 반응액에 2N-염산을 가하고, 실온에서 20분간 교반하였다. 아세트산에틸로 추출하고, 유기층을 포화 중조수, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 75:25→455:5(v/v))로 정제하여 화합물 4c 1.03g(수율 43%)을 갈색 유상물로서 얻었다.
제3 공정
화합물 4c(680mg, 2.83mmol)의 에탄올(6.8ml) 용액에 아미노아세트알데히드디메틸아세탈(0.34ml, 3.11mmol)을 0℃에서 가하고, 실온에서 16시간 정치하였다. 반응액을 감압하에 용매증류 제거한 후, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 90:10(v/v))로 정제하여 화합물 4d 875mg(수율 94%)을 유상물로서 얻었다.
제4 공정
화합물 4d(2.68g, 8.18mmol)의 DMF(10ml) 용액에 N-브로모숙신이미드(1.46g, 8.18mmol)를 가하고, 실온에서 48시간 교반하였다. 반응액에 포화 중조수를 가한 후 아세트산에틸로 추출하고, 유기층을 물, 포화 식염수로 순차 세정한 후 무수 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 90:10(v/v))로 정제하여 화합물 4e 2.83g(수율 85%)을 유상물로서 얻었다.
중간체 합성예 5
제1 공정
화합물 5a(598mg, 4.09mmol)와 N,N-디메틸포름아미드디메틸아세탈(488mg, 4.09mmol)을 톨루엔(1ml)에 용해하고, 실온에서 11시간 교반하였다. 반응액을 감압하에 용매증류 제거하여 얻어진 잔사(화합물 5b를 포함함)를 정제하지 않고 제2 공정에 사용하였다.
제2 공정
나트륨 tert-부톡시드(400mg, 4.16mmol)를 DMI(5ml)에 현탁시키고, 이것에 제1 공정에서 얻어진 조 생성물의 DMI(5ml) 용액을 가한 후, 디메틸옥살레이트(983mg, 8.32mmol)의 THF(10ml) 용액을 적하하고, 실온에서 45분 교반하였다. 반응액을 2N 염산-메탄올(20ml)에 옮기고, 0℃에서 20분 교반하였다. 물을 가한 후 아세트산에틸로 추출하고, 유기층을 물, 포화 중조수, 포화 식염수로 순차 세정하고, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거한 후, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피로 정제하여 화합물 3C 222mg(수율: 5a로부터 22%)을 얻었다.
중간체 합성예 6
제1 공정
리튬헥사메틸디실라지드(1.0M 톨루엔 용액, 12ml, 12.0mmol)를 THF(11ml)로 희석하고, 이것에 -78℃에서 냉각하에 화합물 6a(1.46g, 5.0mmol)의 THF(2ml) 용액을 적하한 후, 에틸옥살릴클로라이드(0.67ml, 6.0mmol)의 THF(2ml) 용액을 적하하였다. -78℃에서 2시간 교반한 후, 반응액에 아세트산암모늄(500mg)과 아세트산(10ml)을 가하고, 65℃에서 1시간 30분 교반하였다. 반응액에 물을 가하고, 아세트산에틸로 추출하고, 유기층을 물, 포화 중조수로 순차 세정한 후 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 55:45→45:55(v/v))로 정제하여 화합물 6b 505.1mg을 황색 고체로서 얻었다. 이것을 이소프로필에테르-헥산(1:2)으로 세정하고, 감압하에 건조함으로써 화합물 6b 416.8mg(수율 24%)을 황색 결정으로서 얻었다.
제2 공정
화합물 6b(51.8mg, 0.15mmol)의 DMF(1ml) 용액에 탄산세슘(73.3mg, 0.23mmol)과 브로모아세트알데히드디메틸아세탈(38.0mg, 0.23mmol)을 가하고, 실온에서 철야 교반하였다. 탄산세슘(73.3mg, 0.23mmol) 및 브로모아세트알데히드디메틸아세탈(38.0mg, 0.23mmol)을 추가하여 100℃에서 20분간 더 교반하였다. 반응액에 물을 가한 후 아세트산에틸로 추출하고, 유기층을 물, 포화 식염수로 순차 세정한 후, 무수 황산나트륨으로 건조하였다. 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 50:50→30:70(v/v))로 정제하여 화합물 6c 35.3mg(수율 54%)을 무색 유상물로서 얻었다.
중간체 합성예 7
제1 공정
화합물 7a(900mg, 2.60mmol)의 에탄올(5ml) 용액에 아미노아세트알데히드디메틸아세탈(7.80mmol)을 가하고, 실온에서 22시간 교반하였다. 반응액에 아세트산에틸(5ml)과 물(5ml)을 가하고, 아세트산에틸(5ml)로 추출하였다. 유기층을 물(10ml)로 세정한 후 용매를 증류 제거하고, 얻어진 잔사를 실리카 겔 컬럼 크로마토그래피(n-헥산-아세트산에틸 2:1)로 정제하여 화합물 7b 0.37g(수율 33%)을 무색 유상물로서 얻었다.
본 발명에 따른 화합물 및/또는 본 발명에 따른 화합물의 친 화합물은 인플루엔자 바이러스에 의해 유발되는 증상 및/또는 질환에 유용하다. 예를 들면, 발열, 오한, 두통, 근육통, 전신 권태감 등을 수반하는 감기와 같은 증상이나, 후두통, 콧물, 코막힘, 기침, 담 등의 기도염 증상, 복통, 구토, 설사와 같은 위장 증상, 또한 급성 뇌증, 폐렴 등의 이차 감염을 수반하는 합병증의 치료 및/또는 예방, 증상 개선에 유효하다.
본 발명에 따른 화합물은 프로드러그이기 때문에 경구 흡수성이 높고, 양호한 생물학적 이용 가능성을 나타내고, 양호한 클리어런스를 나타내고, 폐 이행성이 높은 등의 이점을 갖기 때문에, 우수한 의약품이 될 수 있다.
본 발명에 따른 화합물의 친 화합물은 캡 구조 의존적 엔도뉴클레아제에 관한 저해 활성이 높고, 바이러스 특이적인 효소이므로 선택성이 높은 등의 효과를 갖기 때문에, 부작용이 경감된 의약품이 될 수 있다.
또한, 본 발명에 따른 화합물 및/또는 본 발명에 따른 화합물의 친 화합물은 대사 안정성이 높고, 용해도가 높고, 경구 흡수성이 높고, 양호한 생물학적 이용 가능성을 나타내고, 양호한 클리어런스를 나타내고, 폐 이행성이 높고, 반감기가 길고, 비단백질 결합율이 높고, hERG 채널 저해가 낮고, CYP 저해가 낮고, CPE(CytoPathic Effect, 세포 변성 효과) 억제 효과가 인정되고/거나 광독성 시험, Ames 시험, 유전 독성 시험에서 음성을 나타내거나 또는 간장 장애 등의 독성을 갖지 않는 등의 이점도 갖는다. 따라서, 본 발명에 따른 화합물은 우수한 의약품이 될 수 있다.
본 발명에 따른 화합물 및/또는 본 발명에 따른 화합물의 친 화합물은 경구적 또는 비경구적으로 투여할 수 있다. 경구 투여에 의한 경우, 본 발명 화합물은 통상의 제제, 예를 들면, 정제, 산제, 과립제, 캡슐제 등의 고형제; 물제; 유성 현탁제; 또는 시럽제 또는 엘릭시르제 등의 액제 중 어느 제형으로서도 사용할 수 있다. 비경구 투여에 의한 경우, 본 발명에 따른 화합물은, 수성 또는 유성 현탁 주사제, 점비액으로서 사용할 수 있다. 그의 제조에 있어서는, 관용의 부형제, 결합제, 활택제, 수성 용제, 유성 용제, 유화제, 현탁화제, 보존제, 안정제 등을 임의로 사용할 수 있다. 본 발명의 의약 조성물은, 치료 유효량의 본 발명 화합물을 제약상 허용되는 담체 또는 희석제와 동시에 조합함으로써(예를 들면 혼합함으로써) 제조된다.
본 발명에 따른 화합물의 투여량은 투여 방법, 환자의 연령, 체중, 상태 및 질환의 종류에 따라서 다르지만, 통상, 경구 투여의 경우, 성인 1일당 약 0.05mg 내지 3000mg, 바람직하게는 약 0.1mg 내지 1000mg을, 필요하다면 분할해서 투여하면 된다. 또한, 비경구 투여의 경우, 성인 1일당 약 0.01mg 내지 1000mg, 바람직하게는 약 0.05mg 내지 500mg을 투여한다.
시험예 1: 캡 의존적 엔도뉴클레아제(CEN) 저해 활성의 측정
1) 기질의 제조
5' 말단의 G를 2인산화 수식 및 2'-자리의 수산기를 메톡실화 수식하고, 5' 말단에서 6번째의 U를 Cy3 표지, 3' 말단을 BHQ2 표지한 30merRNA(5'-pp-[m2'-O]GAA UAU(-Cy3) GCA UCA CUA GUA AGC UUU GCU CUA-BHQ2-3': 닛본바이오서비스사 제조)를 구입하여, 에피센터(EPICENTRE)사 제조의 스크립트캡(ScriptCap) 시스템을 사용해서 캡 구조를 부가하였다(산물은 m7G[5']-ppp-[5'][m2'-O]GAA UAU(-Cy3) GCA UCA CUA GUA AGC UUU GCU CUA(-BHQ2)-3'). 이것을 변성 폴리아크릴아미드 겔 전기 영동법으로 분리·정제하여, 기질로서 사용하였다.
2) 효소의 제조
RNP는 정법에 따라서 바이러스 입자로부터 제조하였다(참고 문헌: VIROLOGY(1976) 73, p327-338 OLGA M. ROCHOVANSKY). 구체적으로는 A/WSN/33 바이러스 1×103 PFU/mL, 200μL를 10일령 발육 계란에 접종하여, 37℃에서 2일간 배양한 후, 계란의 장뇨액을 회수하였다. 20% 수크로오스를 이용한 초 원심 분리에 의해 바이러스 입자를 정제하고, 트리톤(Triton)X-100과 리소레시틴을 이용해서 바이러스 입자를 가용화한 후, 30 내지 70% 글리세롤 밀도 경사를 이용한 초 원심 분리에 의해 RNP 분획(50 내지 70% 글리세롤 분획)을 채취하여, 효소액(약 1nM의 PB1·PB2·PA 복합체를 포함함)으로서 사용하였다.
3) 효소 반응
폴리프로필렌제의 384구멍 플레이트에 효소 반응액(조성: 53mM 트리스-염산염(pH7.8), 1mM MgCl2, 1.25mM 디티오트레이톨, 80mM NaCl, 12.5% 글리세롤, 효소액 0.15μL)을 2.5μL 분주하였다. 다음으로 디메틸술폭시드(DMSO)로 단계적으로 희석한 피검 화합물 용액 0.5μL를, 양성 대조군(PC) 및 음성 대조군(NC)에는 DMSO 0.5μL를 가하여 충분히 혼합하였다. 다음으로 기질 용액(1.4nM 기질 RNA, 0.05% 트윈(Tween)20) 2μL를 가해서 반응을 개시하고, 실온에서 60분간 인큐베이트한 후, 반응액 1μL를 10μL의 Hi-Di 포름아미드 용액(사이징 마커로서 젠스캔(GeneScan) 120 리즈(Liz) 규격 표준물질을 포함함: 어플라이드 바이오 시스템(ABI)사 제조)에 가하여 반응을 정지시켰다. NC는 반응 개시 전에 EDTA(4.5mM)를 가함으로써 미리 반응을 정지시켰다(표기 농도는 모두 최종 농도임).
4) 저해율(IC50치)의 측정
반응 정지시킨 용액을 85℃에서 5분간 가열하고, 빙상에서 2분간 급냉한 후, ABI 프리즘(PRIZM) 3730 제네틱 애널라이저로 분석하였다. 해석 소프트 ABI 젠매퍼(Genemapper)에 의해 캡 의존적 엔도뉴클레아제 산물의 피크를 정량하여, PC, NC의 형광 강도를 각각 0% 저해, 100% 저해로 하여 피검 화합물의 CEN 반응 저해율(%)을 구한 후, 커브 피팅 소프트웨어(XLfit2.0: 모델 205(IDBS사 제조) 등)를 사용하여 IC50치를 구하였다. 친 화합물인 피검 물질의 IC50치를 표 22 내지 34에 나타내었다.
시험예 2: CYP 저해 시험
시판되고 있는 풀드 인간 간 마이크로솜을 이용하여, 인간 주요 CYP5 분자종(CYP1A2, 2C9, 2C19, 2D6, 3A4)의 전형적 기질 대사 반응으로서 7-에톡시레소루핀의 O-탈에틸화(CYP1A2), 톨부타미드의 메틸-수산화(CYP2C9), 메페니토인의 4'-수산화(CYP2C19), 덱스트로메토르판의 O탈메틸화(CYP2D6), 테르페나딘의 수산화(CYP3A4)를 지표로 하여, 각각의 대사물 생성량이 피검 화합물에 의해서 저해되는 정도를 평가하였다.
반응 조건은 이하의 같다: 기질, 0.5μmol/L 에톡시레소루핀(CYP1A2), 100μmol/L 톨부타미드(CYP2C9), 50μmol/L S-메페니토인(CYP2C19), 5μmol/L 덱스트로메토르판(CYP2D6), 1μmol/L 테르페나딘(CYP3A4); 반응 시간, 15분; 반응 온도, 37℃; 효소, 풀드 인간 간 마이크로솜 0.2mg 단백질/mL; 피검 약물 농도, 1, 5, 10, 20μmol/L(4점).
96구멍 플레이트에 반응 용액으로서, 50mM 헤페스(Hepes) 완충액 내에 각 5종의 기질, 인간 간 마이크로솜, 피검 약물을 상기 조성으로 가하고, 보효소인 NADPH를 첨가하여 지표로 하는 대사 반응을 개시하고, 37℃, 15분간 반응한 후, 메탄올/아세토니트릴=1/1(v/v) 용액을 첨가함으로써 반응을 정지시켰다. 3000rpm, 15분간의 원심 조작 후, 원심 상청 중의 레소루핀(CYP1A2 대사물)을 형광 멀티 라벨 카운터로, 톨부타미드 수산화체(CYP2C9 대사물), 메페니토인 4' 수산화체(CYP2C19 대사물), 덱스트로르판(CYP2D6 대사물), 테르페나딘 알코올체(CYP3A4 대사물)를 LC/MS/MS로 정량하였다.
약물을 용해하는 용매인 DMSO만을 반응계에 첨가한 것을 대조군(100%)으로 하여, 피검 약물 용액을 가한 각각의 농도에서의 잔존 활성(%)을 산출하고, 농도와 억제율을 이용하여, 로지스틱 모델에 의한 역 추정에 의해 IC50을 산출하였다.
시험예 3: 용해성 시험
화합물의 용해도는 1% DMSO 첨가 조건하에서 결정하였다. DMSO로 10mM 화합물 용액을 제조하고, 화합물 용액 6μL를 pH6.8 인공 장액(0.2mol/L 인산이수소칼륨 시액 250mL에 0.2mol/L NaOH 시액 118mL, 물을 가하여 1000mL로 함) 594μL에 첨가하였다. 25℃에서 16시간 정치시킨 후, 혼합액을 흡인 여과하였다. 여액을 메탄올/물=1/1로 2배 희석하고, 절대 검량선법에 의해 HPLC 또는 LC/MS/MS를 이용하여 여액 내 농도를 측정하였다.
시험예 4: 대사 안정성 시험
인간 간 마이크로솜 0.5mg 단백질/mL를 포함하는 0.2mL의 완충액(50mmol/L 트리스-HCl pH7.4, 150mmol/L 염화칼륨, 10mmol/L 염화마그네슘) 중에서, 1mmol/L NADPH 존재하에서 37℃, 0분 또는 30분간 반응시켰다(산화적 반응). 반응 후, 메탄올/아세토니트릴=1/1(v/v) 용액의 100μL에 반응액 50μL를 첨가, 혼합하여, 3000rpm으로 15분간 원심하였다. 그 원심 상청 중의 시험 화합물을 LC/MS/MS로 정량하여, 반응 후의 시험 화합물의 잔존량을 0분 반응시의 화합물량을 100%로 해서 계산하였다. 또한, 가수분해 반응은 NADPH 비존재하에서, 글루쿠론산 포합 반응은 NADPH 대신에 5mM UDP-글루쿠론산의 존재하에서 반응을 행하고, 이후 동일한 조작을 실시하였다.
시험예 5: hERG 시험
심전도 QT 간격 연장의 리스크 평가를 목적으로, human ether-a-go-go related gene(hERG) 채널을 발현시킨 HEK293 세포를 이용하여, 심실 재분극 과정에 중요한 역할을 하는 지연 정류 K+ 전류(IKr)에 대한 작용을 검토하였다.
전자동 패치 클램프 시스템(패치엑스프레스(PatchXpress) 7000A, 액손 인스트루먼츠 인크.(Axon Instruments Inc.)사)을 이용하여, 홀 셀 패치 클램프법에 의해 세포를 -80mV의 막전위로 유지한 후, +50mV의 탈분극 자극을 2초간, -50mV의 재분극 자극을 2초간 제공했을 때에 유발되는 IKr을 기록하였다. 발생하는 전류가 안정된 후, 피검 물질을 목적으로 하는 농도로 용해시킨 세포외액(NaCl: 137mmol/L, KCl: 4mmol/L, CaCl2·2H2O: 1.8mmol/L, MgCl2·6H2O: 1mmol/L, 글루코오스: 10mmol/L, 헤페스(4-(2-히드록시에틸)-1-피페라진에탄술폰산): 10mmol/L, pH=7.4)을 실온 조건하에서 10분간 세포에 적용시켰다. 얻어진 IKr로부터, 해석 소프트(데이터엑스프레스(DataXpress) ver.1, 몰레큘러 디바이시즈 코포레이션(Molecular Devices Corporation)사)를 사용하여, 유지막 전위에서의 전류치를 기준으로 최대 테일 전류의 절대치를 계측하였다. 또한, 피검 물질 적용 전의 최대 테일 전류에 관한 저해율을 산출해서, 매체 적용군(0.1% 디메틸술폭시드 용액)과 비교하여 피검 물질의 IKr에 대한 영향을 평가하였다.
시험예 6: CPE 억제 효과 확인 시험
<재료>
·2% FCS E-MEM(MEM(최소 필수 배지)(인비트로젠(Invitrogen)사)에 카나마이신 및 FCS를 첨가하여 조정)
·0.5% BSA E-MEM(MEM(최소 필수 배지)(인비트로젠사)에 카나마이신 및 BSA를 첨가하여 조정)
·HBSS(행크스 평형염액)
·MDBK 세포
2% FCS E-MEM으로 적당 세포수(3×105/mL)로 조정하였다.
·MDCK 세포
HBSS로 2회 세정한 후, 0.5% BSA E-MEM으로 적당 세포수(5×105/mL)로 조정하였다.
·트립신 용액
돼지 췌장으로부터의 트립신(시그마(SIGMA)사)를 PBS(-)로 용해하고, 0.45um의 필터로 여과하였다.
·인비젼(EnVision)(퍼킨엘머(PerkinElmer)사)
·WST-8 Kit(키시다 가가꾸)
·10% SDS 용액
<조작 절차>
·피검 시료의 희석, 분주
배양액으로서, MDBK 세포 사용시에는 2% FCS E-MEM을 사용하고, MDCK 세포 사용시에는 0.5% BSA E-MEM을 이용하였다. 이하, 바이러스·세포·피검 시료의 희석에 대하여 마찬가지의 배양액을 사용하였다.
미리 피검 시료를 배양액으로 적절한 농도로 희석하여, 96웰 플레이트에 2 내지 5배 단계 희석 계열을 제작하였다(50μL/웰). 항 Flu 활성 측정용, 세포 독성 측정용의 2장을 제작하였다. 각 약제에 대해서 3중 측정을 실시하였다.
MDCK 세포 사용시에는, 항 Flu 활성 측정용에만, 세포에 트립신을 최종 농도 3ug/mL가 되도록 첨가하였다.
·인플루엔자 바이러스의 희석, 분주
미리, 인플루엔자 바이러스를 배양액으로 적당한 농도로 희석하여, 피검 시료가 들어간 96웰 플레이트에 50μL/웰씩 분주하였다. 세포 독성 측정용의 플레이트에는 배양액을 50μL/웰씩 분주하였다.
·세포의 희석, 분주
적당 세포수로 조정한 세포를 피검 시료가 들어간 96웰 플레이트에 100μL/웰씩 분주하였다.
플레이트 믹서로 혼화하고, CO2 인큐베이터에서 배양하였다. 항 Flu 활성 측정용, 세포 독성 측정용 모두 3일간 배양하였다.
·WST-8의 분주
3일간 배양한 96웰 플레이트를 육안, 현미경하에서 관찰하여 세포의 형태·결정의 유무 등을 확인하였다. 플레이트로부터 세포를 빨아들이지 않도록 상청을 제거하였다.
WST-8 Kit를 배양액으로 10배 희석하여, 이 WST-8 용액을 각 웰에 100μL씩 분주하였다. 플레이트 믹서로 혼화한 후, CO2 인큐베이터에서 1 내지 3시간 배양하였다.
항 Flu 활성 측정용 플레이트에 대해서는, 배양 후 각 웰에 10% SDS 용액을 10uL씩 분주하여, 바이러스를 불활성화하였다.
·흡광도의 측정
혼화한 96웰 플레이트를 인비젼으로 450nm/620nm의 2파장에서 흡광도를 측정하였다.
<각 측정 항목치의 산출>
다음과 같은 계산식에 기초하여 마이크로소프트 엑셀 또는 동등한 계산 처리 능력을 갖는 프로그램을 사용하여 산출하였다.
·50% 인플루엔자 감염 세포사 저해 농도(EC50) 산출
EC50=10^ Z
Z=(50%-High%)/(High%-Low%)×{log(high conc.)-log(low conc.)}+log(high conc.)
친 화합물인 피검 물질(참고예 화합물)에 대해서, 시험예 1 및 시험예 6의 측정 결과를 표 22 내지 34에 나타내었다.
이상의 결과로부터, 친 화합물은 높은 캡 의존적 엔도뉴클레아제(CEN) 저해 활성 및/또는 높은 CPE 억제 효과를 나타내기 때문에, 인플루엔자 바이러스에 감염됨으로써 유발되는 증상 및/또는 질환의 치료제 및/또는 예방제로서 유용한 의약이 될 수 있다.
시험예 7: 인플루엔자 바이러스 감염 마우스 치사 억제 시험
<마우스>
BALB/cAnNCrlCrlj(암컷, 5주령; 닛본 찰스·리버 가부시끼가이샤)를 구입하여, 6 내지 7주령의 마우스를 시험에 사용하였다.
<바이러스 용액의 조정>
A/WS/33, A/빅토리아/3/75 또는 B/메릴랜드/1/59(ATCC)를 마우스 폐 내에서 계대하여, 마우스 순화 바이러스를 제조하였다. 동결 보존한 마우스 순화 바이러스 용액을 신속하게 융해하여, 이용하는 감염가(A/WS/33인 경우: 800-4000TCID50/마우스, A/빅토리아/3/75인 경우: 750TCID50/마우스, B/메릴랜드/1/59인 경우: 100TCID50/마우스)가 되도록 DPBS로 희석하였다.
<감염>
케타민·자일라진 혼합액의 마취하에서, 조정한 바이러스 용액 100ul를 경비 접종하여, 마우스 폐 내로 직접 감염시켰다.
<피검 시료의 조정>
피검 시료를 0.5% 메틸셀룰로오스 용액으로 적당한 농도로 현탁하였다.
<감염 마우스에 대한 피검 시료의 투여>
바이러스 감염 직후 또는 일정 시간 경과 후의 마우스에게 적당히 희석된 피검 시료를 200ul 경구 투여하였다.
<약효 평가>
바이러스 감염 후 14일간 사육하여, 50% 치사 억제에 필요한 1일당 투여량 ED50(mg/kg/day), 최고 투여량에서의 치사 억제율(%생존율), 또는 최고 투여량에 있어서 대조군에 비해 50% 생존하는 일수(50% 연명 일수(일))를 산출하였다. 또는, 바이러스 감염 후 수일간 폐내 바이러스량을 측정해서, 대조군의 바이러스량과 비교하여 바이러스 억제 효과를 평가하였다.
<안락사>
실험 종료 후의 마우스는 이산화탄소나 할로탄 과잉 투여로 안락사시켰다.
<결과>
단회 투여의 ED50치를 나타낸다.
참고예 화합물 번호 413: 12.3
실시예 화합물 번호 20: 4.4
이상의 결과로부터, 친 화합물인 참고예 화합물 413을 프로드러그화한 실시예 화합물 20은, 보다 저농도로 치사 억제 효과를 나타내는 것으로 판명되었다.
시험예 8: BA 시험
경구 흡수성의 검토 실험 재료와 방법
(1) 사용 동물: 마우스 또는 래트를 사용하였다.
(2) 사육 조건: 마우스 및 래트는, 고형 사료 및 멸균 수돗물을 자유 섭취시켰다.
(3) 투여량, 군나눔의 설정: 경구 투여, 정맥내 투여를 소정의 투여량에 의해 투여하였다. 이하와 같이 군을 설정하였다 (화합물마다 투여량은 변경됨).
경구 투여 1 내지 30mg/kg(n=2 내지 3)
정맥내 투여 0.5 내지 10mg/kg(n=2 내지 3)
(4) 투여액의 제조: 경구 투여는 용액 또는 현탁액으로서 투여하였다. 정맥내 투여는 가용화하여 투여하였다.
(5) 투여 방법: 경구 투여는, 경구 존데(sonde)에 의해 강제적으로 위 내에 투여하였다. 정맥내 투여는, 주사 바늘이 달린 시린지에 의해 꼬리 정맥으로 투여하였다.
(6) 평가 항목: 경시적으로 채혈하여, 혈장중 약물 농도를 LC/MS/MS를 이용하여 측정하였다.
(7) 통계 해석: 혈장중 농도 추이에 대해, 비선형 최소 제곱법 프로그램 윈논린(WinNonlin)(등록상표)을 이용해서 혈장중 농도-시간 곡선하 면적(AUC)을 산출하여, 경구 투여군과 정맥내 투여군의 AUC로부터 생체 이용률(BA)을 산출하였다.
<결과>
래트를 사용하여 측정한 측정 결과를 하기의 표 35에 나타내었다.
이상의 결과로부터, 프로드러그는 친 화합물보다 생체 이용률을 향상시켰다.
따라서, 본 발명 화합물은 경구 흡수성이 우수하고, 인플루엔자 바이러스에 감염됨으로써 유발되는 증상 및/또는 질환의 치료제 및/또는 예방제로서 유용한 의약이 될 수 있다.
도 1 내지 4는, 친 화합물인 참고예 화합물 301을 프로드러그화한 실시예 화합물 114 및 204에 대해서, 비절식하에서 래트에 경구 투여한 후의 참고예 화합물 301의 혈장중 농도 추이를 측정한 결과를 나타내고 있다.
실시예 114 및 204를 경구 투여한 후의 BA는 각각 6.8% 및 13.0%이고, 친 화합물인 참고예 화합물 301을 경구 투여했을 때(BA=2.3%)와 비교하여, 생체 이용률의 향상이 인정되었다. 어느 화합물이든 Tmax 값은 1hr 이하로서, 경구 흡수성이 높은 것으로 나타났다. 또한, 실시예 화합물 114 및 204는 전체 혈장 샘플 중의 농도가 정량 하한 이하였다.
이들 시험 결과로부터, 프로드러그화된 실시예 화합물은 경구 투여 후에 체내에 흡수되어 혈중에서 빠르게 친 화합물로 변환되는 것으로 판명되었다. 따라서, 본 발명에 따른 화합물은, 인플루엔자 바이러스에 감염됨으로써 유발되는 증상 및/또는 질환의 치료제 및/또는 예방제로서 유용한 의약이 될 수 있다.
제제예 1
이하의 성분을 함유하는 과립제를 제조하였다.
성분 식 (I)로 나타내어지는 화합물 10mg
젖당 700mg
옥수수 전분 274mg
HPC-L 16mg
1000mg
식 (I)로 나타내어지는 화합물과 젖당을 60메쉬의 체에 통과시킨다. 옥수수 전분을 120메쉬의 체에 통과시킨다. 이들을 V형 혼합기로 혼합한다. 혼합 분말에 HPC-L(저점도 히드록시프로필셀룰로오스) 수용액을 첨가하여, 반죽, 조립(압출 조립 공경 0.5 내지 1mm), 건조 공정을 한다. 얻어진 건조 과립을 진동체(12/60메쉬)로 걸러 과립제를 얻는다.
제제예 2
이하의 성분을 함유하는 캡슐 충전용 과립제를 제조하였다.
성분 식 (I)로 나타내어지는 화합물 15mg
젖당 90mg
옥수수 전분 42mg
HPC-L 3mg
150mg
식 (I)로 나타내어지는 화합물, 젖당을 60메쉬의 체에 통과시킨다. 옥수수 전분을 120메쉬의 체에 통과시킨다. 이들을 혼합하고, 혼합 분말에 HPC-L 용액을 첨가하여 반죽, 조립, 건조한다. 얻어진 건조 과립을 정립한 후, 그 150mg을 4호경 젤라틴 캡슐에 충전한다.
제제예 3
이하의 성분을 함유하는 정제를 제조하였다.
성분 식 (I)로 나타내어지는 화합물 10mg
젖당 90mg
미결정 셀룰로오스 30mg
CMC-Na 15mg
스테아르산마그네슘 5mg
150mg
식 (I)로 나타내어지는 화합물, 젖당, 미결정 셀룰로오스, CMC-Na(카르복시메틸셀룰로오스나트륨염)를 60메쉬의 체에 통과시켜 혼합한다. 혼합 분말에 스테아르산마그네슘을 혼합하여, 제정용 혼합 분말을 얻는다. 본 혼합 분말을 직타(直打)하여, 150mg의 정제를 얻는다.
제제예 4
이하의 성분을 가온 혼합한 후, 멸균하여 주사제로 하였다.
성분 식 (I)로 표시되는 화합물 3mg
비이온 계면 활성제 15mg
주사용 정제수 1ml
본 발명에 따른 화합물은 체내에 대한 흡수 후에 캡 의존적 엔도뉴클레아제(CEN) 저해 활성을 갖는다. 본 발명에 따른 화합물은, 인플루엔자 바이러스에 감염됨으로써 유발되는 증상 및/또는 질환의 치료제 및/또는 예방제로서 유용한 의약이 될 수 있다.
Claims (24)
- 식 (I):
[식에서,
PR은 프로드러그를 형성하는 기이고;
R1a는 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RA1)(RA2),
-Z-N(RA3)-SO2-(RA4),
-Z-C(=O)-N(RA5)-SO2-(RA6),
-Z-N(RA7)-C(=O)-RA8,
-Z-S-RA9,
-Z-SO2-RA10,
-Z-S(=O)-RA11,
-Z-N(RA12)-C(=O)-O-RA13,
-Z-N(RA14)-C(=O)-N(RA15)(RA16),
-Z-C(=O)-N(RA17)-C(=O)-N(RA18)(RA19),
-Z-N(RA20)-C(=O)-C(=O)-RA21, 또는
-Z-B(-ORA22)(-ORA23)
(여기서, RA1, RA2, RA3, RA5, RA7, RA8, RA9, RA12, RA13, RA14, RA15, RA16, RA17, RA18, RA19, RA20 및 RA21은 각각 독립적으로 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RA4, RA6, RA10 및 RA11은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RA1 및 RA2, RA15 및 RA16, 및 RA18 및 RA19는 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
RA22 및 RA23은 각각 독립적으로, 수소 원자, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이거나, 또는 RA22 및 RA23은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
R2a는 수소, 할로겐, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RB1)-SO2-RB2,
-Z-N(RB3)-C(=O)-RB4,
-Z-N(RB5)-C(=O)-O-RB6,
-Z-C(=O)-N(RB7)(RB8),
-Z-N(RB9)(RB10), 또는
-Z-SO2-RB11
(여기서, RB1, RB3, RB4, RB5, RB6, RB7, RB8, RB9 및 RB10은 각각 독립적으로 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RB2 및 RB11은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RB7 및 RB8, 및 RB9 및 RB10은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
R3a는 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RC1)-SO2-RC2,
-Z-N(RC3)-C(=O)-RC4,
-Z-N(RC5)-C(=O)-O-RC6,
-Z-C(=O)-N(RC7)(RC8),
-Z-N(RC9)(RC10),
-Z-SO2-RC11, 또는
-Z-N(RC12)-O-C(=O)-RC13
(여기서, RC1, RC3, RC4, RC5, RC6, RC7, RC8, RC9, RC10, RC12 및 RC13은 각각 독립적으로 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RC2 및 RC11은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RC7 및 RC8, 및 RC9 및 RC10은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
a) B1 및 B2는 어느 한쪽이 CR5aR6a이고, 다른 쪽이 NR7a이거나, 또는
b) B1이 CR8aR9a이고, B2가 CR10aR11a이고,
R5a, R6a, R7a, R8a, R9a, R10a 및 R11a는 각각 독립적으로 수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RD1,
-Z-S(=O)-RD2,
-Z-SO2-RD3,
-C(=O)-C(=O)-RD4,
-C(=O)-N(RD5)(RD6),
-Z-C(RD7)(RD8)(RD9),
-Z-CH2-RD10,
-Z-N(RD11)-C(=O)-O-RD12, 또는
-Z-N(RD13)-C(=O)-RD14
(여기서, RD1, RD4, RD5, RD6, RD9, RD11, RD12, RD13 및 RD14는 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RD2 및 RD3은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RD7, RD8 및 RD10은 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환식기이고,
RD5 및 RD6은 인접하는 원자와 일체가 되어 복소환을 형성하고 있을 수도 있고,
Y는 직쇄 또는 분지상의 저급 알킬렌이고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이거나, 또는
R5a 및 R6a는 일체가 되어 치환기군 C로 치환되어 있을 수도 있는 복소환식기를 형성할 수도 있고,
RD5 및 RD6은 인접하는 원자와 일체가 되어 탄소환을 형성하고 있을 수도 있고;
1) B1이 CR5aR6a이고, B2가 NR7a인 경우,
R3a와 R7a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고,
2) B1이 NR7a이고, B2가 CR5aR6a인 경우,
R3a와 R6a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고,
3) B1이 CR8aR9a이고, B2가 CR10aR11a인 경우,
R8a 및 R10a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 탄소환 또는 복소환을 형성하고 있을 수도 있거나 또는
R3a 및 R11a는 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고 있을 수도 있고,
여기서,
B1이 CR8aR9a이고, B2가 CR10aR11a이고, R9a가 수소이고, R11a가 수소일 때,
i) R8a 또는 R10a 중 어느 한쪽이
-Z-C(RE1)(RE2)(RE3),
-Y-S-RE4,
-Z-CH2-RE5, 또는
이하에 나타내어지는 기:
(식에서, RE1 및 RE2는 각각 독립적으로, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 및 치환기군 C로 치환되어 있을 수도 있는 복소환식기로 이루어지는 치환기군에서 선택되고,
RE3은 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RE4는 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
RE5는 치환기군 C로 치환되어 있을 수도 있는 방향족 복소환식기이고,
RE6은 치환기군 C에서 선택되고,
m은 0 또는 1 이상의 정수이되,
단, m개의 RE6은 치환기군 C에서 선택되는 동일 또는 상이할 수도 있는 기이고,
Y는 직쇄 또는 분지상의 저급 알킬렌이고,
Z는 단결합, 또는 직쇄 또는 분지상의 저급 알킬렌임)이고;
ii) R8a 또는 R10a 중 다른 쪽이
수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RF1,
-C(=O)-C(=O)-RF2, 또는
-C(=O)-N(RF3)(RF4)
(여기서, RF1, RF2, RF3 및 RF4는 각각 독립적으로, 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬로 이루어지는 치환기군에서 선택되고,
Y는 직쇄 또는 분지상의 저급 알킬렌임)이되,
단, 이하의 c) 및 d)인 경우를 제외한다:
c) R5a, R6a 및 R7a가 모두 수소인 경우
d) R8a, R9a, R10a 및 R11a가 모두 수소인 경우;
치환기군 C: 할로겐, 시아노, 히드록시, 카르복시, 포르밀, 아미노, 옥소, 니트로, 저급 알킬, 저급 알케닐, 저급 알키닐, 할로게노 저급 알킬, 저급 알킬옥시, 저급 알키닐옥시, 저급 알킬티오, 히드록시 저급 알킬, 탄소환식기, 복소환식기, 옥소 치환 복소환식기, 탄소환 저급 알킬옥시, 탄소환 옥시 저급 알킬, 탄소환 저급 알킬옥시 저급 알킬, 복소환 저급 알킬옥시, 복소환 옥시 저급 알킬, 복소환 저급 알킬옥시 저급 알킬, 할로게노 저급 알킬옥시, 저급 알킬옥시 저급 알킬, 저급 알킬옥시 저급 알킬옥시, 저급 알킬카르보닐, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬아미노, 저급 알킬카르보닐아미노, 할로게노 저급 알킬카르보닐아미노, 저급 알킬아미노카르보닐, 저급 알킬술포닐, 저급 알킬술피닐 및 저급 알킬술포닐아미노;
치환기군 D: 할로겐, 시아노, 히드록시, 카르복시, 포르밀, 아미노, 옥소, 니트로, 저급 알킬, 할로게노 저급 알킬, 저급 알킬옥시, 탄소환 저급 알킬옥시, 복소환 저급 알킬옥시, 할로게노 저급 알킬옥시, 저급 알킬옥시 저급 알킬, 저급 알킬옥시 저급 알킬옥시, 저급 알킬카르보닐, 저급 알킬옥시카르보닐, 저급 알킬아미노, 저급 알킬카르보닐아미노, 저급 알킬아미노카르보닐, 저급 알킬술포닐, 저급 알킬술포닐아미노, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 및 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬]
로 표시되는 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항에 있어서,
R1a가 수소, 할로겐, 히드록시, 카르복시, 시아노, 포르밀, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Z-N(RA1)(RA2),
-Z-N(RA3)-SO2-(RA4),
-Z-N(RA7)-C(=O)-RA8,
-Z-S-RA9,
-Z-SO2-RA10,
-Z-N(RA12)-C(=O)-O-RA13,
-Z-N(RA20)-C(=O)-C(=O)-RA21, 또는
-Z-B(-ORA22)(-ORA23)
(치환기군 C, RA1, RA2, RA3, RA4, RA7, RA8, RA9, RA10, RA12, RA13, RA20, RA21, RA22, RA23 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항에 있어서,
R1a가 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기,
-Z-N(RA1)(RA2),
-Z-N(RA7)-C(=O)-RA8,
-Z-N(RA12)-C(=O)-O-RA13, 또는
-Z-B(-ORA22)(-ORA23)
(치환기군 C, RA1, RA2, RA7, RA8, RA12, RA13, RA22, RA23 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항에 있어서,
R1a가 수소, 할로겐, 히드록시, 카르복시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는
-Z-N(RA1)(RA2)
(치환기군 C, RA1, RA2 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항에 있어서,
R1a가 수소 또는 카르복시인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제5항 중 어느 한 항에 있어서,
R2a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-N(RB9)(RB10)
(치환기군 C, RB9, RB10 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제5항 중 어느 한 항에 있어서,
R2a가 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬
(치환기군 C는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제7항 중 어느 한 항에 있어서,
R3a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬,
-Z-N(RC1)-SO2-RC2,
-Z-N(RC3)-C(=O)-RC4,
-Z-N(RC5)-C(=O)-O-RC6,
-Z-C(=O)-N(RC7)(RC8), 또는
-Z-N(RC9)(RC10)
(치환기군 C, RC1, RC2, RC3, RC4, RC5, RC6, RC7, RC8, RC9, RC10 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제7항 중 어느 한 항에 있어서,
R3a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬
(치환기군 C는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제9항 중 어느 한 항에 있어서,
B1이 NR7a이고, B2가 CR5aR6a이고,
R5a, R6a 및 R7a가 각각 독립적으로 수소, 카르복시, 시아노, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 저급 알케닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알키닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬카르보닐, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 카르보닐, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시카르보닐,
-Y-S-RD1,
-Z-S(=O)-RD2,
-Z-SO2-RD3,
-C(=O)-C(=O)-RD4,
-C(=O)-N(RD5)(RD6),
-Z-C(RD7)(RD8)(RD9)
-Z-N(RD11)-C(=O)-O-RD12, 또는
-Z-N(RD13)-C(=O)-RD14
(치환기군 C, RD1, RD2, RD3, RD4, RD5, RD6, RD7, RD8, RD9, RD11, RD12, RD13, RD14, Y 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제9항 중 어느 한 항에 있어서,
B1이 NR7a이고, B2가 CR5aR6a이고,
R5a가 수소이고,
R6a가 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이고,
R7a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-C(RD7)(RD8)(RD9)
(치환기군 C, RD7, RD8, RD9 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제9항 중 어느 한 항에 있어서,
B1이 CR5aR6a이고, B2가 NR7a이고,
R5a가 수소이고,
R6a가 수소, 또는 치환기군 C로 치환되어 있을 수도 있는 저급 알킬이고,
R7a가 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는
-Z-C(RD7)(RD8)(RD9)
(치환기군 C, RD7, RD8, RD9 및 Z는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제7항 중 어느 한 항에 있어서,
B1이 CR5aR6a이고, B2가 NR7a이고,
R6a가 수소이고,
R3a 및 R7a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고,
R5a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬,
-Y-S-RD1,
-C(=O)-C(=O)-RD2, 또는
-C(=O)-N(RD3)(RD4)
(여기서, RD1, RD2, RD3 및 RD4, Y, 치환기군 C 및 치환기군 D는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제16항에 있어서,
R5a가 수소, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬
(여기서, 치환기군 C는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제7항 중 어느 한 항에 있어서,
B1이 CR8aR9a이고, B2가 CR10aR11a이고,
R9a가 수소이고, R10a가 수소이고,
R3a 및 R11a가 인접하는 원자와 일체가 되어 치환기군 D로 치환되어 있을 수도 있는 복소환을 형성하고,
R8a가 수소, 치환기군 C로 치환되어 있을 수도 있는 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 탄소환 옥시 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환 옥시 저급 알킬,
-Y-S-RD1,
-C(=O)-C(=O)-RD2, 또는
-C(=O)-N(RD3)(RD4)
(여기서, RD1, RD2, RD3 및 RD4, Y, 치환기군 C 및 치환기군 D는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제18항에 있어서,
R8a가 수소, 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬
(여기서, 치환기군 C는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제16항 내지 제19항 중 어느 한 항에 있어서,
치환기군 D가 치환기군 C로 치환되어 있을 수도 있는 탄소환식기, 치환기군 C로 치환되어 있을 수도 있는 복소환식기, 치환기군 C로 치환되어 있을 수도 있는 탄소환 저급 알킬, 또는 치환기군 C로 치환되어 있을 수도 있는 복소환 저급 알킬
(치환기군 C는 제1항과 동일한 의미임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제20항 중 어느 한 항에 있어서,
PR이 이하의 식 a) 내지 x)에서 선택되는 기:
(식에서, L은 직쇄 또는 분지상의 저급 알킬렌, 또는 직쇄 또는 분지상의 저급 알케닐렌이고,
K는 수소, 또는 직쇄 또는 분지상의 저급 알킬렌이고,
PR0은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알케닐이고,
PR1은 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 또는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬티오이고,
PR2는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 또는 치환기군 F로 치환되어 있을 수도 있는 복소환식기이고,
PR3은 치환기군 F로 치환되어 있을 수도 있는 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 탄소환식기, 치환기군 F로 치환되어 있을 수도 있는 복소환식기, 치환기군 F로 치환되어 있을 수도 있는 저급 알킬아미노, 치환기군 F로 치환되어 있을 수도 있는 탄소환 저급 알킬, 치환기군 F로 치환되어 있을 수도 있는 복소환 저급 알킬, 또는 저급 알킬실릴이고,
PR5는 치환기군 F로 치환되어 있을 수도 있는 저급 알킬이고,
치환기군 F는 옥소, 저급 알킬, 히드록시 저급 알킬, 아미노, 저급 알킬아미노, 탄소환 저급 알킬, 저급 알킬카르보닐, 할로겐, 히드록시, 카르복시, 저급 알킬카르보닐아미노, 저급 알킬카르보닐옥시, 저급 알킬옥시카르보닐, 저급 알킬옥시, 시아노, 니트로임)
인 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물. - 제1항 내지 제21항 중 어느 한 항의 화합물 또는 그의 제약상 허용되는 염, 또는 그들의 용매화물을 함유하는 의약 조성물.
- 제22항에 있어서, 항인플루엔자 작용을 갖는 의약 조성물.
- 제22항에 있어서, 캡(cap) 의존적 엔도뉴클레아제 저해 작용을 갖는 의약 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2010-213012 | 2010-09-24 | ||
| JP2010213012 | 2010-09-24 | ||
| PCT/JP2011/071446 WO2012039414A1 (ja) | 2010-09-24 | 2011-09-21 | 置換された多環性カルバモイルピリドン誘導体のプロドラッグ |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140032934A true KR20140032934A (ko) | 2014-03-17 |
| KR101773226B1 KR101773226B1 (ko) | 2017-09-12 |
Family
ID=45873898
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137010331A KR101773226B1 (ko) | 2010-09-24 | 2011-09-21 | 치환된 다환성 카르바모일 피리돈 유도체의 프로드러그 |
Country Status (24)
| Country | Link |
|---|---|
| US (6) | US8987441B2 (ko) |
| EP (1) | EP2620436B1 (ko) |
| JP (2) | JP5553393B2 (ko) |
| KR (1) | KR101773226B1 (ko) |
| CN (1) | CN103228653B (ko) |
| AU (1) | AU2011307087B2 (ko) |
| BR (1) | BR112013006722B1 (ko) |
| CA (1) | CA2812363C (ko) |
| DK (1) | DK2620436T3 (ko) |
| ES (1) | ES2683153T3 (ko) |
| FR (1) | FR21C1012I2 (ko) |
| HR (1) | HRP20181250T1 (ko) |
| HU (2) | HUE039859T2 (ko) |
| LT (2) | LT2620436T (ko) |
| MX (1) | MX2013003139A (ko) |
| NO (1) | NO2021011I1 (ko) |
| PL (1) | PL2620436T3 (ko) |
| PT (1) | PT2620436T (ko) |
| RS (1) | RS57490B1 (ko) |
| RU (1) | RU2608519C2 (ko) |
| SI (1) | SI2620436T1 (ko) |
| TR (1) | TR201810736T4 (ko) |
| TW (1) | TWI518085B (ko) |
| WO (1) | WO2012039414A1 (ko) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170131651A (ko) * | 2015-04-28 | 2017-11-29 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR20180080320A (ko) * | 2015-12-15 | 2018-07-11 | 시오노기세야쿠 가부시키가이샤 | 캡 의존적 엔도뉴클레아제 저해제 및 항인플루엔자 약을 조합하는 것을 특징으로 하는 인플루엔자 치료용 의약 |
| KR20190049916A (ko) * | 2015-04-28 | 2019-05-09 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR20200086385A (ko) * | 2018-01-22 | 2020-07-16 | 타이젠 바이오테크놀러지 컴퍼니 리미티드 | 캡 의존성 엔도뉴클레아제 억제제 |
Families Citing this family (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010147068A1 (ja) * | 2009-06-15 | 2010-12-23 | 塩野義製薬株式会社 | 置換された多環性カルバモイルピリドン誘導体 |
| WO2013054862A1 (ja) * | 2011-10-12 | 2013-04-18 | 塩野義製薬株式会社 | インテグラーゼ阻害活性を有する多環性ピリドン誘導体 |
| EA037633B1 (ru) | 2012-12-21 | 2021-04-23 | Джилид Сайэнс, Инк. | Полициклические карбамоилпиридоновые соединения, их фармацевтические композиции и применение |
| US9045486B2 (en) | 2013-01-08 | 2015-06-02 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| CA2916993C (en) | 2013-07-12 | 2019-01-15 | Gilead Sciences, Inc. | Polycyclic-carbamoylpyridone compounds and their pharmaceutical use |
| NO2865735T3 (ko) | 2013-07-12 | 2018-07-21 | ||
| AU2014318832B2 (en) | 2013-09-12 | 2018-11-29 | Janssen Biopharma, Inc. | Aza-pyridone compounds and uses thereof |
| AU2014318837B2 (en) | 2013-09-12 | 2019-05-30 | Janssen Biopharma, Inc. | Pyridazinone compounds and uses thereof |
| TW201613936A (en) | 2014-06-20 | 2016-04-16 | Gilead Sciences Inc | Crystalline forms of(2R,5S,13aR)-8-hydroxy-7,9-dioxo-n-(2,4,6-trifluorobenzyl)-2,3,4,5,7,9,13,13a-octahydro-2,5-methanopyrido[1',2':4,5]pyrazino[2,1-b][1,3]oxazepine-10-carboxamide |
| TWI677489B (zh) | 2014-06-20 | 2019-11-21 | 美商基利科學股份有限公司 | 多環型胺甲醯基吡啶酮化合物之合成 |
| NO2717902T3 (ko) | 2014-06-20 | 2018-06-23 | ||
| EP3166943A1 (en) * | 2014-07-07 | 2017-05-17 | Savira Pharmaceuticals GmbH | Pyridopyrazine compounds and their use in the treatment, amelioration or prevention of influenza |
| EP3196201B1 (en) * | 2014-08-22 | 2021-04-28 | Shionogi & Co., Ltd. | Polycyclic pyridone derivative having integrase-inhibiting activity |
| TWI738321B (zh) * | 2014-12-23 | 2021-09-01 | 美商基利科學股份有限公司 | 多環胺甲醯基吡啶酮化合物及其醫藥用途 |
| CA2975398C (en) | 2015-01-30 | 2023-02-21 | Lieber Institute For Brain Development | Comt inhibiting methods and compositions |
| US10730888B2 (en) * | 2015-02-06 | 2020-08-04 | Mylan Laboratories Limited | Process for the preparation of dolutegravir |
| US10208045B2 (en) | 2015-03-11 | 2019-02-19 | Alios Biopharma, Inc. | Aza-pyridone compounds and uses thereof |
| BR112017020837A2 (pt) | 2015-04-02 | 2018-07-03 | Gilead Sciences, Inc. | compostos de carbamoilpiridona policíclicos e seu uso farmacêutico |
| CN105030819B (zh) * | 2015-07-06 | 2019-04-05 | 中国科学技术大学 | 一种3-羟基-4-吡啶酮类高分子铁螯合剂的用途 |
| TW201726678A (zh) | 2015-10-30 | 2017-08-01 | 赫孚孟拉羅股份公司 | 嘧啶酮衍生物及其於治療、改善或預防病毒性疾病之用途 |
| US10934283B2 (en) | 2015-11-25 | 2021-03-02 | Lieber Institute, Inc. | COMT inhibiting methods and compositions |
| WO2017109088A1 (en) | 2015-12-23 | 2017-06-29 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| JP6806413B2 (ja) * | 2016-02-03 | 2021-01-06 | 塩野義製薬株式会社 | 多環性ピリドン誘導体およびそのプロドラッグ |
| EP3426656B1 (en) * | 2016-03-08 | 2021-05-12 | Novartis AG | Tricyclic compounds useful to treat orthomyxovirus infections |
| WO2017158151A1 (en) | 2016-03-18 | 2017-09-21 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| WO2017158147A1 (en) | 2016-03-18 | 2017-09-21 | Savira Pharmaceuticals Gmbh | Pyrimidone derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| MX2018016267A (es) * | 2016-06-20 | 2019-05-20 | Shionogi & Co | Metodo para producir derivado de piridona policiclica sustituida y cristal del mismo. |
| RU2727962C1 (ru) | 2016-08-10 | 2020-07-28 | Сионоги Энд Ко., Лтд. | Фармацевтические композиции, содержащие замещенные полициклические пиридоновые производные и их пролекарство |
| JOP20170169A1 (ar) * | 2016-08-29 | 2019-01-30 | Novartis Ag | مركبات بيريدازين ثلاثية الحلقة مندمجة تفيد في علاج العدوى بفيروس أورثوميكسو |
| US10836767B2 (en) * | 2017-07-06 | 2020-11-17 | Promega Corporation | Serum stable pro-coelenterazine analogues |
| AU2018331172B2 (en) * | 2017-09-18 | 2022-12-01 | Sunshine Lake Pharma Co., Ltd. | Influenza virus replication inhibitor and use thereof |
| KR102714478B1 (ko) * | 2017-10-06 | 2024-10-10 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체의 입체 선택적인 제조 방법 |
| CN111303147B (zh) * | 2018-12-12 | 2024-07-02 | 江西彩石医药科技有限公司 | 吡啶酮衍生物、其组合物及作为抗流感病毒药物的应用 |
| US11247993B2 (en) * | 2018-01-17 | 2022-02-15 | Jiangxi Caishi Pharmaceutical Technology Co., Ltd. | Pyridone derivative, composition and use as antiviral drug thereof |
| CN110041327B (zh) * | 2018-01-17 | 2022-01-21 | 江西彩石医药科技有限公司 | 吡啶酮衍生物、其组合物及作为抗流感病毒药物的应用 |
| CN109503625A (zh) * | 2018-01-19 | 2019-03-22 | 赵蕾 | 一种多环吡啶酮化合物及其药物组合和用途 |
| UA126253C2 (uk) | 2018-02-28 | 2022-09-07 | Новартіс Аг | ПОХІДНІ 10-(ДИ(ФЕНІЛ)МЕТИЛ)-4-ГІДРОКСИ-8,9,9а,10-ТЕТРАГІДРО-7H-ПІРОЛО[1',2':4,5]ПІРАЗИНО[1,2-b]ПІРИДАЗИН-3,5-ДІОНУ ЯК ІНГІБІТОРИ РЕПЛІКАЦІЇ ОРТОМІКСОВІРУСУ ДЛЯ ЛІКУВАННЯ ГРИПУ |
| CN108440564B (zh) * | 2018-04-11 | 2019-08-06 | 安帝康(无锡)生物科技有限公司 | 被取代的多环氨基甲酰基吡啶酮衍生物及其前药 |
| EP3815689A4 (en) | 2018-06-27 | 2022-04-20 | National University Corporation Hokkaido University | ARENAVIRUS GROWTH INHIBITOR COMPRISING A POLYCYCLIC CARBAMOYLPYRIDONE DERIVATIVE |
| WO2020015669A1 (zh) * | 2018-07-17 | 2020-01-23 | 南京明德新药研发有限公司 | 抗流感病毒三并环衍生物 |
| WO2020020267A1 (zh) * | 2018-07-27 | 2020-01-30 | 深圳市塔吉瑞生物医药有限公司 | 一种取代的多环性吡啶酮化合物及其前药 |
| MX2021004182A (es) * | 2018-10-10 | 2021-09-08 | Janssen Biopharma Inc | Inhibidores macrocíclicos de endonucleasa de la gripe. |
| SG11202104117WA (en) * | 2018-10-22 | 2021-05-28 | Univ Nebraska | Antiviral prodrugs and nanoformulations thereof |
| CN109134428A (zh) * | 2018-10-25 | 2019-01-04 | 南京科技职业学院 | 一种巴洛沙韦中间体的制备方法 |
| US20220048897A1 (en) * | 2018-11-26 | 2022-02-17 | Cocrystal Pharma, Inc. | Inhibitors of influenza virus replication |
| WO2020177715A1 (zh) * | 2019-03-05 | 2020-09-10 | 广东东阳光药业有限公司 | 流感病毒复制抑制剂及其用途 |
| CA3133189A1 (en) | 2019-03-12 | 2020-09-17 | Shionogi & Co., Ltd. | Methods of treating influenza in subjects with influenza and a complication risk factor |
| EP3714889A1 (en) | 2019-03-29 | 2020-09-30 | F. Hoffmann-La Roche AG | Baloxavir for the prevention of transmission of influenza virus |
| CN112118891B (zh) * | 2019-04-01 | 2023-10-31 | 尼坎医疗公司 | 作为流感病毒复制抑制剂的稠和多环吡啶酮化合物 |
| RU2720305C1 (ru) | 2019-05-07 | 2020-04-28 | Андрей Александрович Иващенко | Замещенный 3,4,12,12а-тетрагидро-1Н-[1,4]оксазино[3,4-c]пиридо[2,1-f] [1,2,4]триазин-6,8-дион, фармацевтическая композиция, способы их получения и применения |
| CN111909174B (zh) * | 2019-05-08 | 2022-01-21 | 江西彩石医药科技有限公司 | 吡啶酮衍生物的晶型及制备方法和应用 |
| CN112174956B (zh) * | 2019-07-05 | 2023-01-13 | 广州南鑫药业有限公司 | 一种2-取代-5-六氢哒嗪酮-4-羧酸酯衍生物及其用途 |
| CN112174955B (zh) * | 2019-07-05 | 2023-01-13 | 广州南鑫药业有限公司 | 一种2-取代-5-六氢哒嗪酮-4-羧酸胺衍生物及其用途 |
| KR20220074869A (ko) * | 2019-08-27 | 2022-06-03 | 아트리바 테라퓨틱스 게엠베하 | Mek 억제제와 캡-의존성 엔도뉴클레아제 억제제의 조합 |
| CN112521386B (zh) * | 2019-09-19 | 2023-05-26 | 周雨恬 | 具有抗病毒作用的多环吡啶酮化合物及其药物组合和用途 |
| CN112574170A (zh) * | 2019-09-29 | 2021-03-30 | 江西东邦药业有限公司 | 一种二苯并七元环衍生物及其制备方法和应用 |
| CN115135646B (zh) * | 2019-12-23 | 2024-05-17 | 石家庄迪斯凯威医药科技有限公司 | 取代的多环化合物及其药物组合物和用途 |
| CN111233891B (zh) * | 2020-03-04 | 2021-05-04 | 江苏柯菲平医药股份有限公司 | 一种稠环吡啶酮衍生物及其制备方法和用途 |
| WO2021191872A1 (en) * | 2020-03-26 | 2021-09-30 | Janssen Biopharma, Inc. | Heteroaryl-substituted macrocyclic flu endonuclease inhibitors |
| CN113620948B (zh) * | 2020-05-06 | 2022-11-25 | 太景医药研发(北京)有限公司 | 帽依赖性核酸内切酶抑制剂 |
| RU2745985C1 (ru) * | 2020-05-07 | 2021-04-05 | Андрей Александрович Иващенко | Антикоронавирусный терапевтический агент - замещенный 7-гидрокси-3,4,12,12а-тетрагидро-1H-[1,4]оксазино[3,4-c]пиридо[2,1-f][1,2,4]триазин-6,8-дион для профилактики и лечения COVID-19 |
| US20230212187A1 (en) * | 2020-05-21 | 2023-07-06 | Cisen Pharmaceutical Co., Ltd | Fused ring derivatives and use thereof in pharmacy |
| TWI796701B (zh) * | 2020-05-28 | 2023-03-21 | 太景生物科技股份有限公司 | 用於製備雜環化合物的中間體立體選擇性合成 |
| CN115667269B (zh) * | 2020-06-12 | 2024-09-17 | 上海翰森生物医药科技有限公司 | 含吡啶酮稠环类衍生物抑制剂、其制备方法和应用 |
| US12129265B2 (en) | 2020-07-21 | 2024-10-29 | Ankh Life Sciences Limited | Therapeutic agents and uses thereof |
| KR20230044252A (ko) * | 2020-07-27 | 2023-04-03 | 머크 샤프 앤드 돔 엘엘씨 | 인플루엔자를 치료 또는 예방하기 위한 폴리시클릭 캡-의존성 엔도뉴클레아제 억제제 |
| CN112062763B (zh) * | 2020-09-10 | 2021-11-05 | 浙江大学 | 羟基吡啶酮并[1,2-b][1,2,5]三氮卓平衍生物及制备和应用 |
| CN112047945B (zh) * | 2020-09-10 | 2021-11-12 | 浙江大学 | 螺环吡啶酮衍生物及应用 |
| WO2022105669A1 (zh) * | 2020-11-17 | 2022-05-27 | 南京明德新药研发有限公司 | 含Se大环类化合物 |
| CN112480007B (zh) * | 2020-12-08 | 2022-11-18 | 宿迁市科莱博生物化学有限公司 | 一种1,3-二甲基-1h-吡唑-4-羧酸的合成方法 |
| CN112724156B (zh) * | 2020-12-30 | 2022-05-10 | 深圳市坤健创新药物研究院 | 一种多环吡啶酮衍生物和药物组合物及其应用 |
| CN114907365B (zh) * | 2021-02-09 | 2023-12-01 | 扬子江药业集团有限公司 | 一种流感病毒抑制剂及其用途 |
| CN116829153A (zh) * | 2021-05-10 | 2023-09-29 | 南京征祥医药有限公司 | 治疗流感化合物的晶型及应用 |
| CN118317964A (zh) * | 2021-11-17 | 2024-07-09 | 辰欣药业股份有限公司 | 一种稠环衍生物的晶型及其制备方法 |
| CN117924325A (zh) * | 2022-11-09 | 2024-04-26 | 石家庄迪斯凯威医药科技有限公司 | 一种抗流感病毒衍生物及其用途 |
| WO2024109707A1 (zh) * | 2022-11-21 | 2024-05-30 | 合肥医工医药股份有限公司 | 稠环吡啶酮衍生物及其制备方法和用途 |
| WO2024190907A1 (ja) * | 2023-03-15 | 2024-09-19 | 日産化学株式会社 | 2'-o-修飾アデノシンホスホロアミダイト及びその中間体の製造方法 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2280435A (en) | 1993-07-29 | 1995-02-01 | Merck & Co Inc | Anti-viral agent |
| NZ534712A (en) * | 2002-02-19 | 2006-11-30 | Ono Pharmaceutical Co | Fused pyridazine derivative compounds and drugs containing these compounds as the active ingredient |
| EP1549315A4 (en) | 2002-09-11 | 2007-05-23 | Merck & Co Inc | DIHYDROXYPYRIDOPYRAZINE-1,6-DION COMPOUNDS AS HIV INTEGRASE INHIBITORS |
| JP3879729B2 (ja) * | 2003-06-04 | 2007-02-14 | 株式会社ノーリツ | ガス燃焼装置 |
| TW200510425A (en) * | 2003-08-13 | 2005-03-16 | Japan Tobacco Inc | Nitrogen-containing fused ring compound and use thereof as HIV integrase inhibitor |
| US7820680B2 (en) | 2004-03-09 | 2010-10-26 | Merck & Co., Inc. | HIV integrase inhibitors |
| JP2007528379A (ja) * | 2004-03-09 | 2007-10-11 | イステイチユート・デイ・リチエルケ・デイ・ビオロジア・モレコラーレ・ピ・アンジエレツテイ・エツセ・ピー・アー | Hivインテグラーゼ阻害薬 |
| JP2006088173A (ja) * | 2004-09-21 | 2006-04-06 | Sumitomo Light Metal Ind Ltd | ダブルスキン形材の摩擦撹拌接合方法 |
| EP1973906A1 (en) | 2004-12-23 | 2008-10-01 | Virochem Pharma Inc. | Hydroxydihydropyridopy razine-1,8-diones and methods for inhibiting hiv integrase |
| WO2006088173A1 (ja) * | 2005-02-21 | 2006-08-24 | Shionogi & Co., Ltd. | Hivインテグラーゼ阻害活性を有する2環性カルバモイルピリドン誘導体 |
| CN101212903B (zh) * | 2005-04-28 | 2013-07-24 | 史密丝克莱恩比彻姆公司 | 具有hiv整合酶抑制活性的多环氨基甲酰基吡啶酮衍生物 |
| EP3284520B1 (en) * | 2005-04-28 | 2019-06-05 | VIIV Healthcare Company | Polycyclic carbamoylpyridone derivative having hiv integrase inhibitory activity |
| JP4675828B2 (ja) * | 2005-07-15 | 2011-04-27 | 株式会社リコー | デジタルカメラ |
| CA2626956A1 (en) | 2005-10-27 | 2007-05-03 | Shionogi & Co., Ltd. | Polycyclic carbamoylpyridone derivative having hiv integrase inhibitory activity |
| CN101346376A (zh) * | 2005-10-27 | 2009-01-14 | 盐野义制药株式会社 | 具有hiv整合酶抑制活性的多环性氨基甲酰基吡啶酮衍生物 |
| SG192550A1 (en) * | 2008-07-25 | 2013-08-30 | Viiv Healthcare Co | Chemical compounds |
| WO2010011815A1 (en) * | 2008-07-25 | 2010-01-28 | Smithkline Beecham Corporation | Chemical compounds |
| PT2320908E (pt) * | 2008-07-25 | 2014-03-06 | Shionogi & Co | Pró-fármacos de dolutegravir |
| WO2010011818A1 (en) | 2008-07-25 | 2010-01-28 | Smithkline Beecham Corporation | Chemical compounds |
| WO2010011819A1 (en) * | 2008-07-25 | 2010-01-28 | Smithkline Beecham Corporation | Chemical compounds |
| EP2330902B1 (en) * | 2008-07-25 | 2012-11-14 | GlaxoSmithKline LLC | Chemical compounds |
| WO2010147068A1 (ja) * | 2009-06-15 | 2010-12-23 | 塩野義製薬株式会社 | 置換された多環性カルバモイルピリドン誘導体 |
| WO2011011483A1 (en) | 2009-07-22 | 2011-01-27 | Glaxosmithkline Llc | Chemical compounds |
-
2011
- 2011-09-21 SI SI201131528T patent/SI2620436T1/en unknown
- 2011-09-21 MX MX2013003139A patent/MX2013003139A/es active IP Right Grant
- 2011-09-21 WO PCT/JP2011/071446 patent/WO2012039414A1/ja active Application Filing
- 2011-09-21 RU RU2013114189A patent/RU2608519C2/ru active
- 2011-09-21 ES ES11826859.8T patent/ES2683153T3/es active Active
- 2011-09-21 DK DK11826859.8T patent/DK2620436T3/en active
- 2011-09-21 CN CN201180056716.8A patent/CN103228653B/zh active Active
- 2011-09-21 TR TR2018/10736T patent/TR201810736T4/tr unknown
- 2011-09-21 PT PT118268598T patent/PT2620436T/pt unknown
- 2011-09-21 US US13/824,723 patent/US8987441B2/en active Active
- 2011-09-21 HU HUE11826859A patent/HUE039859T2/hu unknown
- 2011-09-21 PL PL11826859T patent/PL2620436T3/pl unknown
- 2011-09-21 AU AU2011307087A patent/AU2011307087B2/en active Active
- 2011-09-21 KR KR1020137010331A patent/KR101773226B1/ko active IP Right Grant
- 2011-09-21 EP EP11826859.8A patent/EP2620436B1/en active Active
- 2011-09-21 JP JP2012535048A patent/JP5553393B2/ja active Active
- 2011-09-21 CA CA2812363A patent/CA2812363C/en active Active
- 2011-09-21 RS RS20180908A patent/RS57490B1/sr unknown
- 2011-09-21 BR BR112013006722-5A patent/BR112013006722B1/pt active IP Right Grant
- 2011-09-21 LT LTEP11826859.8T patent/LT2620436T/lt unknown
- 2011-09-23 TW TW100134256A patent/TWI518085B/zh active
-
2014
- 2014-05-20 JP JP2014104465A patent/JP5777077B2/ja active Active
- 2014-12-05 US US14/562,117 patent/US9758515B2/en active Active
-
2017
- 2017-08-14 US US15/676,540 patent/US10202379B2/en active Active
-
2018
- 2018-08-02 HR HRP20181250TT patent/HRP20181250T1/hr unknown
- 2018-11-19 US US16/194,504 patent/US20190248785A1/en not_active Abandoned
-
2019
- 2019-11-15 US US16/684,870 patent/US20200339565A1/en not_active Abandoned
-
2021
- 2021-03-08 NO NO2021011C patent/NO2021011I1/no unknown
- 2021-03-15 FR FR21C1012C patent/FR21C1012I2/fr active Active
- 2021-03-19 LT LTPA2021505C patent/LTC2620436I2/lt unknown
- 2021-03-23 HU HUS2100010C patent/HUS2100010I1/hu unknown
-
2023
- 2023-08-04 US US18/230,392 patent/US20240182463A1/en active Pending
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170131651A (ko) * | 2015-04-28 | 2017-11-29 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR20190002742A (ko) * | 2015-04-28 | 2019-01-08 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR20190049916A (ko) * | 2015-04-28 | 2019-05-09 | 시오노기세야쿠 가부시키가이샤 | 치환된 다환성 피리돈 유도체 및 그의 프로드러그 |
| KR20180080320A (ko) * | 2015-12-15 | 2018-07-11 | 시오노기세야쿠 가부시키가이샤 | 캡 의존적 엔도뉴클레아제 저해제 및 항인플루엔자 약을 조합하는 것을 특징으로 하는 인플루엔자 치료용 의약 |
| KR20200086385A (ko) * | 2018-01-22 | 2020-07-16 | 타이젠 바이오테크놀러지 컴퍼니 리미티드 | 캡 의존성 엔도뉴클레아제 억제제 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101773226B1 (ko) | 치환된 다환성 카르바모일 피리돈 유도체의 프로드러그 | |
| CN102803260B (zh) | 被取代的多环性氨基甲酰基吡啶酮衍生物 | |
| CN102482219B (zh) | 吡喃酮和吡啶酮衍生物的制备方法 | |
| US12098151B2 (en) | Arenavirus growth inhibitor comprising polycyclic carbamoyl pyridone derivative | |
| AU2016271762A1 (en) | Nitrogen-containing tricyclic derivative having HIV replication inhibitory activity | |
| CN107001316A (zh) | 作为抗菌剂的喹诺酮衍生物 | |
| KR20170016957A (ko) | 폴리엔 마크로라이드 유도체 | |
| WO2023220225A1 (en) | Inhibitors of human respiratory syncytial virus and metapneumovirus | |
| AU2023268460A1 (en) | Inhibitors of human respiratory syncytial virus and metapneumovirus |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |