JP6903790B2 - Fgfr抑制剤としての二環式複素環 - Google Patents
Fgfr抑制剤としての二環式複素環 Download PDFInfo
- Publication number
- JP6903790B2 JP6903790B2 JP2020079472A JP2020079472A JP6903790B2 JP 6903790 B2 JP6903790 B2 JP 6903790B2 JP 2020079472 A JP2020079472 A JP 2020079472A JP 2020079472 A JP2020079472 A JP 2020079472A JP 6903790 B2 JP6903790 B2 JP 6903790B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- cancer
- combination drug
- drug according
- cycloalkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 125000002618 bicyclic heterocycle group Chemical group 0.000 title description 3
- 229940125829 fibroblast growth factor receptor inhibitor Drugs 0.000 title description 3
- 150000001875 compounds Chemical class 0.000 claims description 329
- -1 2-morpholin-4-ylethyl Chemical group 0.000 claims description 320
- 150000003839 salts Chemical class 0.000 claims description 114
- 206010028980 Neoplasm Diseases 0.000 claims description 58
- 239000003814 drug Substances 0.000 claims description 40
- 201000011510 cancer Diseases 0.000 claims description 34
- 239000003112 inhibitor Substances 0.000 claims description 29
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 23
- 238000011282 treatment Methods 0.000 claims description 22
- 229940124597 therapeutic agent Drugs 0.000 claims description 18
- 229940079593 drug Drugs 0.000 claims description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 12
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 12
- 229960004316 cisplatin Drugs 0.000 claims description 12
- 239000002552 dosage form Substances 0.000 claims description 11
- 239000000126 substance Substances 0.000 claims description 11
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 10
- 229930012538 Paclitaxel Natural products 0.000 claims description 9
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 claims description 9
- 229960004562 carboplatin Drugs 0.000 claims description 9
- 229960001592 paclitaxel Drugs 0.000 claims description 9
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims description 9
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 8
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims description 8
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 claims description 6
- 208000034578 Multiple myelomas Diseases 0.000 claims description 6
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 claims description 6
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 6
- 108091008605 VEGF receptors Proteins 0.000 claims description 6
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 claims description 6
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 claims description 6
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 claims description 6
- 206010017758 gastric cancer Diseases 0.000 claims description 6
- 229960005277 gemcitabine Drugs 0.000 claims description 6
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 claims description 6
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 claims description 6
- 201000011549 stomach cancer Diseases 0.000 claims description 6
- 206010005003 Bladder cancer Diseases 0.000 claims description 5
- 206010006187 Breast cancer Diseases 0.000 claims description 5
- 208000026310 Breast neoplasm Diseases 0.000 claims description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 5
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 5
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 5
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 claims description 5
- 208000005017 glioblastoma Diseases 0.000 claims description 5
- 201000005202 lung cancer Diseases 0.000 claims description 5
- 208000020816 lung neoplasm Diseases 0.000 claims description 5
- 239000002245 particle Substances 0.000 claims description 5
- 229910052697 platinum Inorganic materials 0.000 claims description 5
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 5
- 229960003048 vinblastine Drugs 0.000 claims description 5
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 claims description 5
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 claims description 4
- 101150029707 ERBB2 gene Proteins 0.000 claims description 4
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 4
- 102000000588 Interleukin-2 Human genes 0.000 claims description 4
- 108010002350 Interleukin-2 Proteins 0.000 claims description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 206010038389 Renal cancer Diseases 0.000 claims description 4
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 4
- 239000013059 antihormonal agent Substances 0.000 claims description 4
- 231100000433 cytotoxic Toxicity 0.000 claims description 4
- 230000001472 cytotoxic effect Effects 0.000 claims description 4
- 239000002955 immunomodulating agent Substances 0.000 claims description 4
- 201000010982 kidney cancer Diseases 0.000 claims description 4
- 201000007270 liver cancer Diseases 0.000 claims description 4
- 208000014018 liver neoplasm Diseases 0.000 claims description 4
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 claims description 4
- 229960002340 pentostatin Drugs 0.000 claims description 4
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 claims description 4
- 102000003390 tumor necrosis factor Human genes 0.000 claims description 4
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 claims description 3
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 claims description 3
- 108010024976 Asparaginase Proteins 0.000 claims description 3
- 108010006654 Bleomycin Proteins 0.000 claims description 3
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 3
- 108010092160 Dactinomycin Proteins 0.000 claims description 3
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 claims description 3
- 208000032027 Essential Thrombocythemia Diseases 0.000 claims description 3
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 claims description 3
- 101100066427 Homo sapiens FCGR1A gene Proteins 0.000 claims description 3
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 claims description 3
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 claims description 3
- 102000014150 Interferons Human genes 0.000 claims description 3
- 108010050904 Interferons Proteins 0.000 claims description 3
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 claims description 3
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 3
- 206010033128 Ovarian cancer Diseases 0.000 claims description 3
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 claims description 3
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 claims description 3
- 108091000080 Phosphotransferase Proteins 0.000 claims description 3
- 206010060862 Prostate cancer Diseases 0.000 claims description 3
- 101150077555 Ret gene Proteins 0.000 claims description 3
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 3
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 claims description 3
- 229940100198 alkylating agent Drugs 0.000 claims description 3
- 239000002168 alkylating agent Substances 0.000 claims description 3
- 230000000340 anti-metabolite Effects 0.000 claims description 3
- 229940100197 antimetabolite Drugs 0.000 claims description 3
- 239000002256 antimetabolite Substances 0.000 claims description 3
- 229960001561 bleomycin Drugs 0.000 claims description 3
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 claims description 3
- 229940022399 cancer vaccine Drugs 0.000 claims description 3
- 201000010881 cervical cancer Diseases 0.000 claims description 3
- 229960000640 dactinomycin Drugs 0.000 claims description 3
- 229960004679 doxorubicin Drugs 0.000 claims description 3
- 229960001904 epirubicin Drugs 0.000 claims description 3
- 201000004101 esophageal cancer Diseases 0.000 claims description 3
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 claims description 3
- 229960005420 etoposide Drugs 0.000 claims description 3
- 108020001507 fusion proteins Proteins 0.000 claims description 3
- 102000037865 fusion proteins Human genes 0.000 claims description 3
- 201000010536 head and neck cancer Diseases 0.000 claims description 3
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 3
- 229960000908 idarubicin Drugs 0.000 claims description 3
- 229940079322 interferon Drugs 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 claims description 3
- 229960004857 mitomycin Drugs 0.000 claims description 3
- 206010028537 myelofibrosis Diseases 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 102000020233 phosphotransferase Human genes 0.000 claims description 3
- 229960003171 plicamycin Drugs 0.000 claims description 3
- 208000003476 primary myelofibrosis Diseases 0.000 claims description 3
- 229960001278 teniposide Drugs 0.000 claims description 3
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 claims description 3
- 229960004528 vincristine Drugs 0.000 claims description 3
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 claims description 3
- 102000006992 Interferon-alpha Human genes 0.000 claims description 2
- 108010047761 Interferon-alpha Proteins 0.000 claims description 2
- 208000008601 Polycythemia Diseases 0.000 claims description 2
- 102000001253 Protein Kinase Human genes 0.000 claims description 2
- 208000017733 acquired polycythemia vera Diseases 0.000 claims description 2
- 229940124302 mTOR inhibitor Drugs 0.000 claims description 2
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 claims description 2
- 208000037244 polycythemia vera Diseases 0.000 claims description 2
- 108060006633 protein kinase Proteins 0.000 claims description 2
- 229940000425 combination drug Drugs 0.000 claims 33
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 claims 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 claims 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 claims 2
- 229960000975 daunorubicin Drugs 0.000 claims 2
- 229960003668 docetaxel Drugs 0.000 claims 2
- 229960005079 pemetrexed Drugs 0.000 claims 2
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 claims 2
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 claims 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 claims 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 claims 1
- 125000000217 alkyl group Chemical group 0.000 description 501
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 256
- 125000003118 aryl group Chemical group 0.000 description 165
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 160
- 125000001424 substituent group Chemical group 0.000 description 157
- 125000005843 halogen group Chemical group 0.000 description 147
- 125000001072 heteroaryl group Chemical group 0.000 description 135
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 132
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 96
- 239000000203 mixture Substances 0.000 description 95
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 description 93
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 description 86
- 238000000034 method Methods 0.000 description 83
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 description 82
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 70
- 229910052799 carbon Inorganic materials 0.000 description 66
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 62
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 60
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 54
- 125000000753 cycloalkyl group Chemical group 0.000 description 54
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 53
- 108091008794 FGF receptors Proteins 0.000 description 53
- 102000044168 Fibroblast Growth Factor Receptor Human genes 0.000 description 53
- 239000000243 solution Substances 0.000 description 52
- 210000004027 cell Anatomy 0.000 description 50
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 46
- 229910052739 hydrogen Inorganic materials 0.000 description 43
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 42
- 239000000047 product Substances 0.000 description 35
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 30
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 30
- 201000010099 disease Diseases 0.000 description 30
- 125000004433 nitrogen atom Chemical group N* 0.000 description 30
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 30
- 238000006243 chemical reaction Methods 0.000 description 29
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 description 28
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 28
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- 239000011734 sodium Substances 0.000 description 25
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 25
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 24
- 125000005842 heteroatom Chemical group 0.000 description 24
- 239000012044 organic layer Substances 0.000 description 24
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 23
- 150000001721 carbon Chemical group 0.000 description 23
- 238000000746 purification Methods 0.000 description 23
- 235000019439 ethyl acetate Nutrition 0.000 description 22
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical group C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 19
- 125000004432 carbon atom Chemical group C* 0.000 description 19
- VTGOHKSTWXHQJK-UHFFFAOYSA-N pyrimidin-2-ol Chemical compound OC1=NC=CC=N1 VTGOHKSTWXHQJK-UHFFFAOYSA-N 0.000 description 19
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 18
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 18
- 125000003545 alkoxy group Chemical group 0.000 description 18
- 239000011541 reaction mixture Substances 0.000 description 18
- 239000000741 silica gel Substances 0.000 description 18
- 229910002027 silica gel Inorganic materials 0.000 description 18
- 238000006467 substitution reaction Methods 0.000 description 18
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 17
- 125000002950 monocyclic group Chemical group 0.000 description 17
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 17
- 238000004007 reversed phase HPLC Methods 0.000 description 17
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 16
- 208000035475 disorder Diseases 0.000 description 16
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 15
- 125000001153 fluoro group Chemical group F* 0.000 description 15
- 229910052757 nitrogen Inorganic materials 0.000 description 15
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 14
- 125000000304 alkynyl group Chemical group 0.000 description 14
- 238000003556 assay Methods 0.000 description 14
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 14
- 229920006395 saturated elastomer Polymers 0.000 description 14
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 12
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 12
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 11
- 239000002253 acid Substances 0.000 description 11
- 125000003282 alkyl amino group Chemical group 0.000 description 11
- 125000004429 atom Chemical group 0.000 description 11
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 11
- 239000012267 brine Substances 0.000 description 11
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 10
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 10
- 150000001299 aldehydes Chemical class 0.000 description 10
- 125000003342 alkenyl group Chemical group 0.000 description 10
- 239000012043 crude product Substances 0.000 description 10
- 238000003818 flash chromatography Methods 0.000 description 10
- 239000008194 pharmaceutical composition Substances 0.000 description 10
- 230000002829 reductive effect Effects 0.000 description 10
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 9
- 125000004414 alkyl thio group Chemical group 0.000 description 9
- 239000002246 antineoplastic agent Substances 0.000 description 9
- 125000002619 bicyclic group Chemical group 0.000 description 9
- 239000003153 chemical reaction reagent Substances 0.000 description 9
- 229940088598 enzyme Drugs 0.000 description 9
- 238000009472 formulation Methods 0.000 description 9
- 239000003446 ligand Substances 0.000 description 9
- 229910052760 oxygen Inorganic materials 0.000 description 9
- 239000000546 pharmaceutical excipient Substances 0.000 description 9
- 238000003786 synthesis reaction Methods 0.000 description 9
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 9
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 8
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 8
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 8
- 238000005481 NMR spectroscopy Methods 0.000 description 8
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 8
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 8
- 229940127089 cytotoxic agent Drugs 0.000 description 8
- 125000004438 haloalkoxy group Chemical group 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 description 7
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 7
- 230000004913 activation Effects 0.000 description 7
- 239000007864 aqueous solution Substances 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 7
- 229910000024 caesium carbonate Inorganic materials 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 239000012071 phase Substances 0.000 description 7
- 230000005855 radiation Effects 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 210000001519 tissue Anatomy 0.000 description 7
- 125000006582 (C5-C6) heterocycloalkyl group Chemical group 0.000 description 6
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 6
- SUXITUVUFUOAGT-UHFFFAOYSA-N 2,6-difluoro-3,5-dimethoxyaniline Chemical compound COC1=CC(OC)=C(F)C(N)=C1F SUXITUVUFUOAGT-UHFFFAOYSA-N 0.000 description 6
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 6
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 6
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 6
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 6
- 206010025323 Lymphomas Diseases 0.000 description 6
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 125000006193 alkinyl group Chemical group 0.000 description 6
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 6
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 6
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000010828 elution Methods 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 239000000284 extract Substances 0.000 description 6
- 229940126864 fibroblast growth factor Drugs 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 229940127084 other anti-cancer agent Drugs 0.000 description 6
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 6
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 108090000623 proteins and genes Proteins 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 5
- 206010008723 Chondrodystrophy Diseases 0.000 description 5
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 5
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 5
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 5
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 5
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 5
- 238000006069 Suzuki reaction reaction Methods 0.000 description 5
- 239000007983 Tris buffer Substances 0.000 description 5
- 208000008919 achondroplasia Diseases 0.000 description 5
- 239000003443 antiviral agent Substances 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 239000011324 bead Substances 0.000 description 5
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 5
- 231100000673 dose–response relationship Toxicity 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 229960002897 heparin Drugs 0.000 description 5
- 229920000669 heparin Polymers 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 239000013067 intermediate product Substances 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 238000005457 optimization Methods 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 229910052763 palladium Inorganic materials 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- 230000026731 phosphorylation Effects 0.000 description 5
- 238000006366 phosphorylation reaction Methods 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 5
- 229910052717 sulfur Inorganic materials 0.000 description 5
- 239000011593 sulfur Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 208000011580 syndromic disease Diseases 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- 125000006584 (C3-C10) heterocycloalkyl group Chemical group 0.000 description 4
- 125000004343 1-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 description 4
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 4
- HNGHJAMSLIQBLE-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1,8-dimethyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C)C(N)=NC=C3C2)=O)=C1F HNGHJAMSLIQBLE-UHFFFAOYSA-N 0.000 description 4
- 201000010028 Acrocephalosyndactylia Diseases 0.000 description 4
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 4
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 description 4
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 239000008346 aqueous phase Substances 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 4
- 125000003636 chemical group Chemical group 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- IGSKHXTUVXSOMB-UHFFFAOYSA-N cyclopropylmethanamine Chemical compound NCC1CC1 IGSKHXTUVXSOMB-UHFFFAOYSA-N 0.000 description 4
- 230000014509 gene expression Effects 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 4
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 4
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 150000003951 lactams Chemical class 0.000 description 4
- 239000012280 lithium aluminium hydride Substances 0.000 description 4
- 238000004949 mass spectrometry Methods 0.000 description 4
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- NQDJXKOVJZTUJA-UHFFFAOYSA-N nevirapine Chemical compound C12=NC=CC=C2C(=O)NC=2C(C)=CC=NC=2N1C1CC1 NQDJXKOVJZTUJA-UHFFFAOYSA-N 0.000 description 4
- 238000007911 parenteral administration Methods 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 4
- 239000006187 pill Substances 0.000 description 4
- 125000003367 polycyclic group Chemical group 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 125000003226 pyrazolyl group Chemical group 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 239000003039 volatile agent Substances 0.000 description 4
- 239000003643 water by type Substances 0.000 description 4
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 4
- FTZQXOJYPFINKJ-UHFFFAOYSA-N 2-fluoroaniline Chemical compound NC1=CC=CC=C1F FTZQXOJYPFINKJ-UHFFFAOYSA-N 0.000 description 3
- JTQSRKPTVSUIQB-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F JTQSRKPTVSUIQB-UHFFFAOYSA-N 0.000 description 3
- AKJNNGNMKVTDQG-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-[2-(4-methylpiperazin-1-yl)ethoxy]-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(OCCN4CCN(C)CC4)C(N)=NC=C3C2)=O)=C1F AKJNNGNMKVTDQG-UHFFFAOYSA-N 0.000 description 3
- LTNBGNHAYQWWAD-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-phenyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F LTNBGNHAYQWWAD-UHFFFAOYSA-N 0.000 description 3
- WORXVHLKINLMRW-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-ethyl-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound O=C1N(C)C=2C(CC)=C(N)N=CC=2CN1C1=C(F)C(OC)=CC(OC)=C1F WORXVHLKINLMRW-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
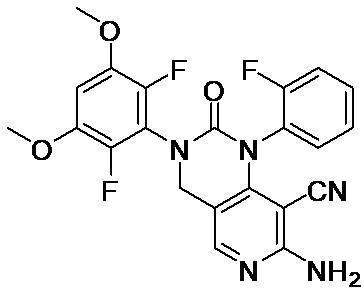
- 0 COc(c(F)c1N(Cc2c(*3)c(*)c(N)nc2)C3=O)cc(OC)c1F Chemical compound COc(c(F)c1N(Cc2c(*3)c(*)c(N)nc2)C3=O)cc(OC)c1F 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 230000004544 DNA amplification Effects 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 206010016654 Fibrosis Diseases 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 3
- 206010052178 Lymphocytic lymphoma Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 3
- HVEPTSRENPYXJA-UHFFFAOYSA-N N-[(4,6-dichloro-5-methylpyridin-3-yl)methyl]-2,6-difluoro-3,5-dimethoxyaniline Chemical compound COc1cc(OC)c(F)c(NCc2cnc(Cl)c(C)c2Cl)c1F HVEPTSRENPYXJA-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 208000000453 Skin Neoplasms Diseases 0.000 description 3
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 3
- 230000001594 aberrant effect Effects 0.000 description 3
- 150000003927 aminopyridines Chemical class 0.000 description 3
- 239000012131 assay buffer Substances 0.000 description 3
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 238000001516 cell proliferation assay Methods 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 208000029742 colonic neoplasm Diseases 0.000 description 3
- 229960003901 dacarbazine Drugs 0.000 description 3
- 238000010511 deprotection reaction Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- WDVGNXKCFBOKDF-UHFFFAOYSA-N dicyclohexyl-[3,6-dimethoxy-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C1CCCCC1)C1CCCCC1 WDVGNXKCFBOKDF-UHFFFAOYSA-N 0.000 description 3
- SXZIXHOMFPUIRK-UHFFFAOYSA-N diphenylmethanimine Chemical compound C=1C=CC=CC=1C(=N)C1=CC=CC=C1 SXZIXHOMFPUIRK-UHFFFAOYSA-N 0.000 description 3
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 3
- 238000004090 dissolution Methods 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 125000001188 haloalkyl group Chemical group 0.000 description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 3
- 238000005984 hydrogenation reaction Methods 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 201000001441 melanoma Diseases 0.000 description 3
- 239000002480 mineral oil Substances 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 230000001590 oxidative effect Effects 0.000 description 3
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 3
- 238000010926 purge Methods 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 125000004076 pyridyl group Chemical group 0.000 description 3
- 238000006268 reductive amination reaction Methods 0.000 description 3
- 238000007363 ring formation reaction Methods 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 201000000849 skin cancer Diseases 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 3
- 125000003003 spiro group Chemical group 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- KFTRXTSNTQSGNE-UHFFFAOYSA-N (1-methylpyrazol-4-yl)methanamine Chemical compound CN1C=C(CN)C=N1 KFTRXTSNTQSGNE-UHFFFAOYSA-N 0.000 description 2
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 2
- FAXGJDIKJMMSPL-UHFFFAOYSA-N (4,6-dichloro-5-methylpyridin-3-yl)methanol Chemical compound Cc1c(Cl)ncc(CO)c1Cl FAXGJDIKJMMSPL-UHFFFAOYSA-N 0.000 description 2
- 125000004767 (C1-C4) haloalkoxy group Chemical group 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 2
- IDPURXSQCKYKIJ-UHFFFAOYSA-N 1-(4-methoxyphenyl)methanamine Chemical group COC1=CC=C(CN)C=C1 IDPURXSQCKYKIJ-UHFFFAOYSA-N 0.000 description 2
- IBYHHJPAARCAIE-UHFFFAOYSA-N 1-bromo-2-chloroethane Chemical compound ClCCBr IBYHHJPAARCAIE-UHFFFAOYSA-N 0.000 description 2
- ZIXOMENEVHICNV-UHFFFAOYSA-N 2,4-dichloro-5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]pyridine-3-carbonitrile Chemical compound COc1cc(OC)c(F)c(NCc2cnc(Cl)c(C#N)c2Cl)c1F ZIXOMENEVHICNV-UHFFFAOYSA-N 0.000 description 2
- HWUQKELWCYCAFU-UHFFFAOYSA-N 2,4-dichloro-5-formylpyridine-3-carbonitrile Chemical compound ClC1=NC=C(C=O)C(Cl)=C1C#N HWUQKELWCYCAFU-UHFFFAOYSA-N 0.000 description 2
- LBTQCPWBQJYQLI-UHFFFAOYSA-N 2-(1-methoxyethylidene)propanedinitrile Chemical compound COC(C)=C(C#N)C#N LBTQCPWBQJYQLI-UHFFFAOYSA-N 0.000 description 2
- KCTAFCBIIMHTHL-UHFFFAOYSA-N 2-(2,6-difluoro-3,5-dimethoxyphenyl)-6-(2-morpholin-4-ylethylamino)spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(NCCN4CCOCC4)=NC=C3C2)=O)=C1F KCTAFCBIIMHTHL-UHFFFAOYSA-N 0.000 description 2
- BFUHISFXTSUKRS-UHFFFAOYSA-N 2-(2,6-difluoro-3,5-dimethoxyphenyl)-6-(pyridin-3-ylamino)spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(NC=4C=NC=CC=4)=NC=C3C2)=O)=C1F BFUHISFXTSUKRS-UHFFFAOYSA-N 0.000 description 2
- VVIZKMACHQLJHX-OAHLLOKOSA-N 2-(2,6-difluoro-3,5-dimethoxyphenyl)-6-[[(1r)-1-phenylethyl]amino]spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(N[C@H](C)C=4C=CC=CC=4)=NC=C3C2)=O)=C1F VVIZKMACHQLJHX-OAHLLOKOSA-N 0.000 description 2
- VPBADHFSKMXWLX-NSHDSACASA-N 2-(2,6-difluoro-3,5-dimethoxyphenyl)-6-[[(2s)-2-hydroxypropyl]amino]spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(NC[C@H](C)O)=NC=C3C2)=O)=C1F VPBADHFSKMXWLX-NSHDSACASA-N 0.000 description 2
- QQYBCRVKCIIDMI-ZDUSSCGKSA-N 2-(2,6-difluoro-3,5-dimethoxyphenyl)-6-[[(3s)-oxolan-3-yl]amino]spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(N[C@@H]4COCC4)=NC=C3C2)=O)=C1F QQYBCRVKCIIDMI-ZDUSSCGKSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- 125000006288 3,5-difluorobenzyl group Chemical group [H]C1=C(F)C([H])=C(C([H])=C1F)C([H])([H])* 0.000 description 2
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 2
- CUYKNJBYIJFRCU-UHFFFAOYSA-N 3-aminopyridine Chemical compound NC1=CC=CN=C1 CUYKNJBYIJFRCU-UHFFFAOYSA-N 0.000 description 2
- AKYJFAHYRMPRDS-UHFFFAOYSA-N 4,6-dichloropyridine-3-carbaldehyde Chemical compound ClC1=CC(Cl)=C(C=O)C=N1 AKYJFAHYRMPRDS-UHFFFAOYSA-N 0.000 description 2
- OPTQIQIKSBUZNX-UHFFFAOYSA-N 6-(cyclohexylamino)-2-(2,6-difluoro-3,5-dimethoxyphenyl)spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(NC4CCCCC4)=NC=C3C2)=O)=C1F OPTQIQIKSBUZNX-UHFFFAOYSA-N 0.000 description 2
- ACTNQZUIPPOEKZ-UHFFFAOYSA-N 6-chloro-2-(2,6-difluoro-3,5-dimethoxyphenyl)spiro[1H-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)cc3C3(CC3)C2=O)c1F ACTNQZUIPPOEKZ-UHFFFAOYSA-N 0.000 description 2
- KBFYJXMMAXTGQP-UHFFFAOYSA-N 6-chloro-4-(methylamino)pyridine-3-carbaldehyde Chemical compound CNC1=CC(Cl)=NC=C1C=O KBFYJXMMAXTGQP-UHFFFAOYSA-N 0.000 description 2
- LOSYYRGUVIXECN-UHFFFAOYSA-N 7-amino-1-cyclopentyl-3-(2,6-difluoro-3,5-dimethoxyphenyl)-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C3CCCC3)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F LOSYYRGUVIXECN-UHFFFAOYSA-N 0.000 description 2
- BMLFFNDARUKPKT-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(1-piperidin-4-ylpyrazol-4-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CN(N=C4)C4CCNCC4)C(N)=NC=C3C2)=O)=C1F BMLFFNDARUKPKT-UHFFFAOYSA-N 0.000 description 2
- AHDQQWCKEPPDPT-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(1h-pyrazol-4-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CNN=C4)C(N)=NC=C3C2)=O)=C1F AHDQQWCKEPPDPT-UHFFFAOYSA-N 0.000 description 2
- MWCZXXCQXJJXIT-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(2-phenylethyl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(CCC=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F MWCZXXCQXJJXIT-UHFFFAOYSA-N 0.000 description 2
- OJRQWIXOMOZDRF-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-phenoxy-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(OC=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F OJRQWIXOMOZDRF-UHFFFAOYSA-N 0.000 description 2
- ICANASFWDUXFMJ-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-(3,6-dihydro-2h-pyran-4-yl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4CCOCC=4)C(N)=NC=C3C2)=O)=C1F ICANASFWDUXFMJ-UHFFFAOYSA-N 0.000 description 2
- WMBAQRVNANHKCB-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-[1-(2-hydroxyethyl)pyrazol-4-yl]-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CN(CCO)N=C4)C(N)=NC=C3C2)=O)=C1F WMBAQRVNANHKCB-UHFFFAOYSA-N 0.000 description 2
- RMNVKLPMFWVUID-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-ethoxy-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound O=C1N(C)C=2C(OCC)=C(N)N=CC=2CN1C1=C(F)C(OC)=CC(OC)=C1F RMNVKLPMFWVUID-UHFFFAOYSA-N 0.000 description 2
- MRZKEVZACCCOPD-UHFFFAOYSA-N 7-amino-8-benzyl-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(CC=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F MRZKEVZACCCOPD-UHFFFAOYSA-N 0.000 description 2
- FFCOKBVTTUGESE-UHFFFAOYSA-N 7-amino-8-bromo-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(N)c(Br)c3N(C)C2=O)c1F FFCOKBVTTUGESE-UHFFFAOYSA-N 0.000 description 2
- AVXXXQCONUHJLB-UHFFFAOYSA-N 7-amino-8-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(Cl)C(N)=NC=C3C2)=O)=C1F AVXXXQCONUHJLB-UHFFFAOYSA-N 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 description 2
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 208000025490 Apert syndrome Diseases 0.000 description 2
- 208000003950 B-cell lymphoma Diseases 0.000 description 2
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 2
- TWLKUJMSMOHVMB-UHFFFAOYSA-N COC1=CC(=C(C(=C1F)N2CC3=CN=C(C=C3C4(C2)CC4)N)F)OC Chemical compound COC1=CC(=C(C(=C1F)N2CC3=CN=C(C=C3C4(C2)CC4)N)F)OC TWLKUJMSMOHVMB-UHFFFAOYSA-N 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 206010066946 Craniofacial dysostosis Diseases 0.000 description 2
- 201000006526 Crouzon syndrome Diseases 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- XQSPYNMVSIKCOC-NTSWFWBYSA-N Emtricitabine Chemical compound C1=C(F)C(N)=NC(=O)N1[C@H]1O[C@@H](CO)SC1 XQSPYNMVSIKCOC-NTSWFWBYSA-N 0.000 description 2
- 206010014733 Endometrial cancer Diseases 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 208000005050 Familial Hypophosphatemic Rickets Diseases 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000917148 Homo sapiens Fibroblast growth factor receptor 3 Proteins 0.000 description 2
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 208000009289 Jackson-Weiss syndrome Diseases 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- 208000003445 Mouth Neoplasms Diseases 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- 208000014767 Myeloproliferative disease Diseases 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- JVTRDABZZDRPEY-UHFFFAOYSA-N N-[(4,6-dichloro-5-cyanopyridin-3-yl)methyl]-N-(2,6-difluoro-3,5-dimethoxyphenyl)carbamoyl chloride Chemical compound COc1cc(OC)c(F)c(N(Cc2cnc(Cl)c(C#N)c2Cl)C(Cl)=O)c1F JVTRDABZZDRPEY-UHFFFAOYSA-N 0.000 description 2
- UVELVDKYAKYQPF-UHFFFAOYSA-N N-[(4,6-dichloro-5-methylpyridin-3-yl)methyl]-N-(2,6-difluoro-3,5-dimethoxyphenyl)carbamoyl chloride Chemical compound ClC1=C(C=NC(=C1C)Cl)CN(C(=O)Cl)C1=C(C(=CC(=C1F)OC)OC)F UVELVDKYAKYQPF-UHFFFAOYSA-N 0.000 description 2
- XEXMHFAYNZWPMJ-UHFFFAOYSA-N N-[(4,6-dichloropyridin-3-yl)methyl]-2,6-difluoro-3,5-dimethoxyaniline Chemical compound COc1cc(OC)c(F)c(NCc2cnc(Cl)cc2Cl)c1F XEXMHFAYNZWPMJ-UHFFFAOYSA-N 0.000 description 2
- 150000001204 N-oxides Chemical class 0.000 description 2
- DWCJGOCXHPXTQO-UHFFFAOYSA-N NC1=C(C=2N(CN(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)C)Br Chemical compound NC1=C(C=2N(CN(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)C)Br DWCJGOCXHPXTQO-UHFFFAOYSA-N 0.000 description 2
- 238000006411 Negishi coupling reaction Methods 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 201000004014 Pfeiffer syndrome Diseases 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 208000020221 Short stature Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 238000003477 Sonogashira cross-coupling reaction Methods 0.000 description 2
- 238000006859 Swern oxidation reaction Methods 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 238000006887 Ullmann reaction Methods 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 208000031878 X-linked hypophosphatemia Diseases 0.000 description 2
- 208000035724 X-linked hypophosphatemic rickets Diseases 0.000 description 2
- WREGKURFCTUGRC-POYBYMJQSA-N Zalcitabine Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)CC1 WREGKURFCTUGRC-POYBYMJQSA-N 0.000 description 2
- 229960004748 abacavir Drugs 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- WOZSCQDILHKSGG-UHFFFAOYSA-N adefovir depivoxil Chemical compound N1=CN=C2N(CCOCP(=O)(OCOC(=O)C(C)(C)C)OCOC(=O)C(C)(C)C)C=NC2=C1N WOZSCQDILHKSGG-UHFFFAOYSA-N 0.000 description 2
- 201000006966 adult T-cell leukemia Diseases 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 206010064930 age-related macular degeneration Diseases 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- YMARZQAQMVYCKC-OEMFJLHTSA-N amprenavir Chemical compound C([C@@H]([C@H](O)CN(CC(C)C)S(=O)(=O)C=1C=CC(N)=CC=1)NC(=O)O[C@@H]1COCC1)C1=CC=CC=C1 YMARZQAQMVYCKC-OEMFJLHTSA-N 0.000 description 2
- 229960002932 anastrozole Drugs 0.000 description 2
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 2
- 150000001448 anilines Chemical class 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 201000003674 autosomal dominant hypophosphatemic rickets Diseases 0.000 description 2
- 201000003672 autosomal recessive hypophosphatemic rickets Diseases 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- AFYNADDZULBEJA-UHFFFAOYSA-N bicinchoninic acid Chemical compound C1=CC=CC2=NC(C=3C=C(C4=CC=CC=C4N=3)C(=O)O)=CC(C(O)=O)=C21 AFYNADDZULBEJA-UHFFFAOYSA-N 0.000 description 2
- 210000000941 bile Anatomy 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 210000005252 bulbus oculi Anatomy 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 210000001612 chondrocyte Anatomy 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 229940125797 compound 12 Drugs 0.000 description 2
- 229940125961 compound 24 Drugs 0.000 description 2
- 229940125898 compound 5 Drugs 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- PAFZNILMFXTMIY-UHFFFAOYSA-N cyclohexylamine Chemical compound NC1CCCCC1 PAFZNILMFXTMIY-UHFFFAOYSA-N 0.000 description 2
- NISGSNTVMOOSJQ-UHFFFAOYSA-N cyclopentanamine Chemical compound NC1CCCC1 NISGSNTVMOOSJQ-UHFFFAOYSA-N 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 238000006114 decarboxylation reaction Methods 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 208000033679 diabetic kidney disease Diseases 0.000 description 2
- 125000004663 dialkyl amino group Chemical group 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- HCUYBXPSSCRKRF-UHFFFAOYSA-N diphosgene Chemical compound ClC(=O)OC(Cl)(Cl)Cl HCUYBXPSSCRKRF-UHFFFAOYSA-N 0.000 description 2
- XPOQHMRABVBWPR-ZDUSSCGKSA-N efavirenz Chemical compound C([C@]1(C2=CC(Cl)=CC=C2NC(=O)O1)C(F)(F)F)#CC1CC1 XPOQHMRABVBWPR-ZDUSSCGKSA-N 0.000 description 2
- 238000007824 enzymatic assay Methods 0.000 description 2
- DEAFVBVKIMXSND-UHFFFAOYSA-N ethyl 6-chloro-4-(methylamino)pyridine-3-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)C=C1NC DEAFVBVKIMXSND-UHFFFAOYSA-N 0.000 description 2
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 238000010575 fractional recrystallization Methods 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000009033 hematopoietic malignancy Effects 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 238000002868 homogeneous time resolved fluorescence Methods 0.000 description 2
- 102000055709 human FGFR3 Human genes 0.000 description 2
- 230000003553 hypophosphatemic effect Effects 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 230000000091 immunopotentiator Effects 0.000 description 2
- 229960003444 immunosuppressant agent Drugs 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- CBVCZFGXHXORBI-PXQQMZJSSA-N indinavir Chemical compound C([C@H](N(CC1)C[C@@H](O)C[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H]2C3=CC=CC=C3C[C@H]2O)C(=O)NC(C)(C)C)N1CC1=CC=CN=C1 CBVCZFGXHXORBI-PXQQMZJSSA-N 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 230000031146 intracellular signal transduction Effects 0.000 description 2
- 229940043355 kinase inhibitor Drugs 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- JTEGQNOMFQHVDC-NKWVEPMBSA-N lamivudine Chemical compound O=C1N=C(N)C=CN1[C@H]1O[C@@H](CO)SC1 JTEGQNOMFQHVDC-NKWVEPMBSA-N 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 231100000518 lethal Toxicity 0.000 description 2
- 230000001665 lethal effect Effects 0.000 description 2
- 229960003881 letrozole Drugs 0.000 description 2
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 2
- GTCAXTIRRLKXRU-UHFFFAOYSA-N methyl carbamate Chemical compound COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 125000006578 monocyclic heterocycloalkyl group Chemical group 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 125000004957 naphthylene group Chemical group 0.000 description 2
- 150000005054 naphthyridines Chemical class 0.000 description 2
- 230000001613 neoplastic effect Effects 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 208000005368 osteomalacia Diseases 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 2
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 2
- 125000003386 piperidinyl group Chemical group 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- VZOPRCCTKLAGPN-ZFJVMAEJSA-L potassium;sodium;(2r,3r)-2,3-dihydroxybutanedioate;tetrahydrate Chemical compound O.O.O.O.[Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O VZOPRCCTKLAGPN-ZFJVMAEJSA-L 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 125000006514 pyridin-2-ylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 239000003419 rna directed dna polymerase inhibitor Substances 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 210000003625 skull Anatomy 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- PUZPDOWCWNUUKD-UHFFFAOYSA-M sodium fluoride Chemical compound [F-].[Na+] PUZPDOWCWNUUKD-UHFFFAOYSA-M 0.000 description 2
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 229960004964 temozolomide Drugs 0.000 description 2
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 201000002510 thyroid cancer Diseases 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 231100000588 tumorigenic Toxicity 0.000 description 2
- 230000000381 tumorigenic effect Effects 0.000 description 2
- 229910052721 tungsten Inorganic materials 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 231100000747 viability assay Toxicity 0.000 description 2
- 238000003026 viability measurement method Methods 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- NIDRYBLTWYFCFV-FMTVUPSXSA-N (+)-calanolide A Chemical compound C1=CC(C)(C)OC2=C1C(O[C@H](C)[C@@H](C)[C@@H]1O)=C1C1=C2C(CCC)=CC(=O)O1 NIDRYBLTWYFCFV-FMTVUPSXSA-N 0.000 description 1
- IPJABYVHNXMKEV-UHFFFAOYSA-N (1-methylpyrazol-4-yl)methanamine;hydrochloride Chemical compound Cl.CN1C=C(CN)C=N1 IPJABYVHNXMKEV-UHFFFAOYSA-N 0.000 description 1
- RQEUFEKYXDPUSK-SSDOTTSWSA-N (1R)-1-phenylethanamine Chemical compound C[C@@H](N)C1=CC=CC=C1 RQEUFEKYXDPUSK-SSDOTTSWSA-N 0.000 description 1
- FMCGSUUBYTWNDP-ONGXEEELSA-N (1R,2S)-2-(dimethylamino)-1-phenyl-1-propanol Chemical compound CN(C)[C@@H](C)[C@H](O)C1=CC=CC=C1 FMCGSUUBYTWNDP-ONGXEEELSA-N 0.000 description 1
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 1
- JRHPOFJADXHYBR-HTQZYQBOSA-N (1r,2r)-1-n,2-n-dimethylcyclohexane-1,2-diamine Chemical compound CN[C@@H]1CCCC[C@H]1NC JRHPOFJADXHYBR-HTQZYQBOSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- WCWUXEGQKLTGDX-LLVKDONJSA-N (2R)-1-[[4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-5-methyl-6-pyrrolo[2,1-f][1,2,4]triazinyl]oxy]-2-propanol Chemical compound C1=C2NC(C)=CC2=C(F)C(OC2=NC=NN3C=C(C(=C32)C)OC[C@H](O)C)=C1 WCWUXEGQKLTGDX-LLVKDONJSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- DNISEZBAYYIQFB-PHDIDXHHSA-N (2r,3r)-2,3-diacetyloxybutanedioic acid Chemical compound CC(=O)O[C@@H](C(O)=O)[C@H](C(O)=O)OC(C)=O DNISEZBAYYIQFB-PHDIDXHHSA-N 0.000 description 1
- HXKKHQJGJAFBHI-VKHMYHEASA-N (2s)-1-aminopropan-2-ol Chemical compound C[C@H](O)CN HXKKHQJGJAFBHI-VKHMYHEASA-N 0.000 description 1
- VJNGGOMRUHYAMC-UHFFFAOYSA-N (3,5-difluorophenyl)methanamine Chemical compound NCC1=CC(F)=CC(F)=C1 VJNGGOMRUHYAMC-UHFFFAOYSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- MIPHRQMEIYLZFZ-BYPYZUCNSA-N (3s)-oxolan-3-amine Chemical compound N[C@H]1CCOC1 MIPHRQMEIYLZFZ-BYPYZUCNSA-N 0.000 description 1
- HINZVVDZPLARRP-YSVIXOAZSA-N (4r,5s,6s,7r)-1,3-bis[(3-aminophenyl)methyl]-4,7-dibenzyl-5,6-dihydroxy-1,3-diazepan-2-one;methanesulfonic acid Chemical compound CS(O)(=O)=O.CS(O)(=O)=O.NC1=CC=CC(CN2C(N(CC=3C=C(N)C=CC=3)[C@H](CC=3C=CC=CC=3)[C@H](O)[C@@H](O)[C@H]2CC=2C=CC=CC=2)=O)=C1 HINZVVDZPLARRP-YSVIXOAZSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- HDPNBNXLBDFELL-UHFFFAOYSA-N 1,1,1-trimethoxyethane Chemical compound COC(C)(OC)OC HDPNBNXLBDFELL-UHFFFAOYSA-N 0.000 description 1
- 125000005919 1,2,2-trimethylpropyl group Chemical group 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- GUFUXKNDIHDAII-UHFFFAOYSA-N 1-[(4,6-dichloro-5-methylpyridin-3-yl)methyl]-1-(2,6-difluoro-3,5-dimethoxyphenyl)-3-methylurea Chemical compound CNC(=O)N(Cc1cnc(Cl)c(C)c1Cl)c1c(F)c(OC)cc(OC)c1F GUFUXKNDIHDAII-UHFFFAOYSA-N 0.000 description 1
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 1
- KRWRFIMBWRVMKE-UHFFFAOYSA-N 1-bromo-3,5-dimethoxybenzene Chemical compound COC1=CC(Br)=CC(OC)=C1 KRWRFIMBWRVMKE-UHFFFAOYSA-N 0.000 description 1
- ALOCUZOKRULSAA-UHFFFAOYSA-N 1-methylpiperidin-4-amine Chemical compound CN1CCC(N)CC1 ALOCUZOKRULSAA-UHFFFAOYSA-N 0.000 description 1
- LBGSWBJURUFGLR-UHFFFAOYSA-N 1-methylpyrazol-4-amine Chemical compound CN1C=C(N)C=N1 LBGSWBJURUFGLR-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- ASOMNDIOOKDVDC-UHFFFAOYSA-N 1h-indol-2-yl-[4-[3-(propan-2-ylamino)pyridin-2-yl]piperazin-1-yl]methanone Chemical compound CC(C)NC1=CC=CN=C1N1CCN(C(=O)C=2NC3=CC=CC=C3C=2)CC1 ASOMNDIOOKDVDC-UHFFFAOYSA-N 0.000 description 1
- XXMFJKNOJSDQBM-UHFFFAOYSA-N 2,2,2-trifluoroacetic acid;hydrate Chemical compound [OH3+].[O-]C(=O)C(F)(F)F XXMFJKNOJSDQBM-UHFFFAOYSA-N 0.000 description 1
- GOWUDHPKGOIDIX-UHFFFAOYSA-N 2-(4-methyl-1-piperazinyl)ethanamine Chemical compound CN1CCN(CCN)CC1 GOWUDHPKGOIDIX-UHFFFAOYSA-N 0.000 description 1
- QHTUMQYGZQYEOZ-UHFFFAOYSA-N 2-(4-methylpiperazin-1-yl)ethanol Chemical compound CN1CCN(CCO)CC1 QHTUMQYGZQYEOZ-UHFFFAOYSA-N 0.000 description 1
- UZYQSNQJLWTICD-UHFFFAOYSA-N 2-(n-benzoylanilino)-2,2-dinitroacetic acid Chemical compound C=1C=CC=CC=1N(C(C(=O)O)([N+]([O-])=O)[N+]([O-])=O)C(=O)C1=CC=CC=C1 UZYQSNQJLWTICD-UHFFFAOYSA-N 0.000 description 1
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 1
- WOXFMYVTSLAQMO-UHFFFAOYSA-N 2-Pyridinemethanamine Chemical compound NCC1=CC=CC=N1 WOXFMYVTSLAQMO-UHFFFAOYSA-N 0.000 description 1
- IJXJGQCXFSSHNL-UHFFFAOYSA-N 2-amino-2-phenylethanol Chemical compound OCC(N)C1=CC=CC=C1 IJXJGQCXFSSHNL-UHFFFAOYSA-N 0.000 description 1
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 1
- GWFOVSGRNGAGDL-FSDSQADBSA-N 2-amino-9-[(1r,2r,3s)-2,3-bis(hydroxymethyl)cyclobutyl]-3h-purin-6-one Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1C[C@H](CO)[C@H]1CO GWFOVSGRNGAGDL-FSDSQADBSA-N 0.000 description 1
- KMGUEILFFWDGFV-UHFFFAOYSA-N 2-benzoyl-2-benzoyloxy-3-hydroxybutanedioic acid Chemical compound C=1C=CC=CC=1C(=O)C(C(C(O)=O)O)(C(O)=O)OC(=O)C1=CC=CC=C1 KMGUEILFFWDGFV-UHFFFAOYSA-N 0.000 description 1
- YCNQPAVKQPLZRS-UHFFFAOYSA-N 2-benzyl-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1CC1=CC=CC=C1 YCNQPAVKQPLZRS-UHFFFAOYSA-N 0.000 description 1
- UCYCGRXWQDKTCX-UHFFFAOYSA-N 2-chloro-5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]-N-methylpyridin-4-amine Chemical compound ClC1=NC=C(C(=C1)NC)CNC1=C(C(=CC(=C1F)OC)OC)F UCYCGRXWQDKTCX-UHFFFAOYSA-N 0.000 description 1
- IPOVOSHRRIJKBR-UHFFFAOYSA-N 2-ethylpropanedioyl dichloride Chemical compound CCC(C(Cl)=O)C(Cl)=O IPOVOSHRRIJKBR-UHFFFAOYSA-N 0.000 description 1
- LIOLIMKSCNQPLV-UHFFFAOYSA-N 2-fluoro-n-methyl-4-[7-(quinolin-6-ylmethyl)imidazo[1,2-b][1,2,4]triazin-2-yl]benzamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1C1=NN2C(CC=3C=C4C=CC=NC4=CC=3)=CN=C2N=C1 LIOLIMKSCNQPLV-UHFFFAOYSA-N 0.000 description 1
- AUVALWUPUHHNQV-UHFFFAOYSA-N 2-hydroxy-3-propylbenzoic acid Chemical class CCCC1=CC=CC(C(O)=O)=C1O AUVALWUPUHHNQV-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- AZUKLCJYWVMPML-UHFFFAOYSA-N 2-methyltetrazol-5-amine Chemical compound CN1N=NC(N)=N1 AZUKLCJYWVMPML-UHFFFAOYSA-N 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- VSWICNJIUPRZIK-UHFFFAOYSA-N 2-piperideine Chemical compound C1CNC=CC1 VSWICNJIUPRZIK-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical class C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- RKATWUBDSJHPEV-UHFFFAOYSA-N 3,3-difluorocyclobutan-1-amine Chemical compound NC1CC(F)(F)C1 RKATWUBDSJHPEV-UHFFFAOYSA-N 0.000 description 1
- QHLIBTVVMOSOIP-UHFFFAOYSA-N 3-(2,6-difluoro-3,5-dimethoxyphenyl)-7-[(4-methoxyphenyl)methylamino]-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1ccc(CNc2cc3N(C)C(=O)N(Cc3cn2)c2c(F)c(OC)cc(OC)c2F)cc1 QHLIBTVVMOSOIP-UHFFFAOYSA-N 0.000 description 1
- GBAMCAABJWBZEH-UHFFFAOYSA-N 3-(cyclopropylmethyl)-1-[(4,6-dichloro-5-cyanopyridin-3-yl)methyl]-1-(2,6-difluoro-3,5-dimethoxyphenyl)urea Chemical compound C1(CC1)CNC(N(C1=C(C(=CC(=C1F)OC)OC)F)CC=1C=NC(=C(C1Cl)C#N)Cl)=O GBAMCAABJWBZEH-UHFFFAOYSA-N 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- QZVQQUVWFIZUBQ-UHFFFAOYSA-N 3-fluoroaniline Chemical compound NC1=CC=CC(F)=C1 QZVQQUVWFIZUBQ-UHFFFAOYSA-N 0.000 description 1
- RGDQRXPEZUNWHX-UHFFFAOYSA-N 3-methylpyridin-2-amine Chemical compound CC1=CC=CN=C1N RGDQRXPEZUNWHX-UHFFFAOYSA-N 0.000 description 1
- XXJWYDDUDKYVKI-UHFFFAOYSA-N 4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-6-methoxy-7-[3-(1-pyrrolidinyl)propoxy]quinazoline Chemical compound COC1=CC2=C(OC=3C(=C4C=C(C)NC4=CC=3)F)N=CN=C2C=C1OCCCN1CCCC1 XXJWYDDUDKYVKI-UHFFFAOYSA-N 0.000 description 1
- APRZHQXAAWPYHS-UHFFFAOYSA-N 4-[5-[3-(carboxymethoxy)phenyl]-3-(4,5-dimethyl-1,3-thiazol-2-yl)tetrazol-3-ium-2-yl]benzenesulfonate Chemical compound S1C(C)=C(C)N=C1[N+]1=NC(C=2C=C(OCC(O)=O)C=CC=2)=NN1C1=CC=C(S([O-])(=O)=O)C=C1 APRZHQXAAWPYHS-UHFFFAOYSA-N 0.000 description 1
- QGMGHALXLXKCBD-UHFFFAOYSA-N 4-amino-n-(2-aminophenyl)benzamide Chemical compound C1=CC(N)=CC=C1C(=O)NC1=CC=CC=C1N QGMGHALXLXKCBD-UHFFFAOYSA-N 0.000 description 1
- IMLXLGZJLAOKJN-UHFFFAOYSA-N 4-aminocyclohexan-1-ol Chemical compound NC1CCC(O)CC1 IMLXLGZJLAOKJN-UHFFFAOYSA-N 0.000 description 1
- SBGSWYLEUDJCDG-UHFFFAOYSA-N 4-chloro-5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]-N-[(4-methoxyphenyl)methyl]-3-methylpyridin-2-amine Chemical compound COc1ccc(CNc2ncc(CNc3c(F)c(OC)cc(OC)c3F)c(Cl)c2C)cc1 SBGSWYLEUDJCDG-UHFFFAOYSA-N 0.000 description 1
- WGNPNAOPVBYTKD-UHFFFAOYSA-N 4-pyrazol-1-ylpiperidine Chemical compound C1CNCCC1N1N=CC=C1 WGNPNAOPVBYTKD-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical class C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- LVFXMTSBFVPLHT-UHFFFAOYSA-N 5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]-4-N-(2-fluorophenyl)-2-N-[(4-methoxyphenyl)methyl]-3-methylpyridine-2,4-diamine Chemical compound COc1ccc(CNc2ncc(CNc3c(F)c(OC)cc(OC)c3F)c(Nc3ccccc3F)c2C)cc1 LVFXMTSBFVPLHT-UHFFFAOYSA-N 0.000 description 1
- 125000006163 5-membered heteroaryl group Chemical group 0.000 description 1
- KRNSYSYRLQDHDK-UHFFFAOYSA-N 6,7-dihydro-5h-cyclopenta[b]pyridine Chemical class C1=CN=C2CCCC2=C1 KRNSYSYRLQDHDK-UHFFFAOYSA-N 0.000 description 1
- ATCRIOJPQXDFNY-ZETCQYMHSA-N 6-chloro-2-(1-furo[2,3-c]pyridin-5-yl-ethylsulfanyl)-pyrimidin-4-ylamine Chemical compound S([C@@H](C)C=1N=CC=2OC=CC=2C=1)C1=NC(N)=CC(Cl)=N1 ATCRIOJPQXDFNY-ZETCQYMHSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- WNNPQYABVNLQNH-UHFFFAOYSA-N 7-(benzhydrylideneamino)-1-(cyclopropylmethyl)-3-(2,6-difluoro-3,5-dimethoxyphenyl)-2-oxo-4H-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound C1(CC1)CN1C(N(CC2=C1C(=C(N=C2)N=C(C2=CC=CC=C2)C2=CC=CC=C2)C#N)C2=C(C(=CC(=C2F)OC)OC)F)=O WNNPQYABVNLQNH-UHFFFAOYSA-N 0.000 description 1
- MXOUFDHUYKNWSG-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(N)cc3N(C)C2=O)c1F MXOUFDHUYKNWSG-UHFFFAOYSA-N 0.000 description 1
- YPRVJEJUEVHEKY-UHFFFAOYSA-N 7-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1,8-dimethyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)c(C)c3N(C)C2=O)c1F YPRVJEJUEVHEKY-UHFFFAOYSA-N 0.000 description 1
- CUKFRTLSJAZTOY-UHFFFAOYSA-N 7-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)cc3N(C)C2=O)c1F CUKFRTLSJAZTOY-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 108010039627 Aprotinin Proteins 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical class C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 210000003771 C cell Anatomy 0.000 description 1
- 102100031151 C-C chemokine receptor type 2 Human genes 0.000 description 1
- 101710149815 C-C chemokine receptor type 2 Proteins 0.000 description 1
- 101710149863 C-C chemokine receptor type 4 Proteins 0.000 description 1
- OJRUSAPKCPIVBY-KQYNXXCUSA-N C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N Chemical compound C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N OJRUSAPKCPIVBY-KQYNXXCUSA-N 0.000 description 1
- MEOTZTCJOBNZPG-CAIRWLTDSA-N CC/C(/C)=C\C(CN1c(c(F)c(cc2OC)OC)c2F)=C(/C(/c(cc2)ccc2F)=C(\C)/N)N(C)C1=O Chemical compound CC/C(/C)=C\C(CN1c(c(F)c(cc2OC)OC)c2F)=C(/C(/c(cc2)ccc2F)=C(\C)/N)N(C)C1=O MEOTZTCJOBNZPG-CAIRWLTDSA-N 0.000 description 1
- 102100032976 CCR4-NOT transcription complex subunit 6 Human genes 0.000 description 1
- 108091007914 CDKs Proteins 0.000 description 1
- ZXZYUVSUMVHXPF-UHFFFAOYSA-N CN(c1c(CN2c(c(F)c(cc3OC)OC)c3F)cnc(N)c1OCCOC)C2=O Chemical compound CN(c1c(CN2c(c(F)c(cc3OC)OC)c3F)cnc(N)c1OCCOC)C2=O ZXZYUVSUMVHXPF-UHFFFAOYSA-N 0.000 description 1
- JLLPQMNQJBQSRY-UHFFFAOYSA-N CN1CCN(CCNc2ncc(CN(C(C34CC3)=O)c(c(F)c(cc3OC)OC)c3F)c4c2)CC1 Chemical compound CN1CCN(CCNc2ncc(CN(C(C34CC3)=O)c(c(F)c(cc3OC)OC)c3F)c4c2)CC1 JLLPQMNQJBQSRY-UHFFFAOYSA-N 0.000 description 1
- XNPFFUMEQYIEGJ-UHFFFAOYSA-N COC(Nc1ncc(CN(C(C23CC2)=O)c(c(F)c(cc2OC)OC)c2F)c3c1)=O Chemical compound COC(Nc1ncc(CN(C(C23CC2)=O)c(c(F)c(cc2OC)OC)c2F)c3c1)=O XNPFFUMEQYIEGJ-UHFFFAOYSA-N 0.000 description 1
- VNXKNBMRJYHPDM-UHFFFAOYSA-N COc(cc(c(F)c1N(Cc2c(C34CC3)cc(NC3CCC3)nc2)C4=O)OC)c1F Chemical compound COc(cc(c(F)c1N(Cc2c(C34CC3)cc(NC3CCC3)nc2)C4=O)OC)c1F VNXKNBMRJYHPDM-UHFFFAOYSA-N 0.000 description 1
- QQYBCRVKCIIDMI-UHFFFAOYSA-N COc(cc(c(F)c1N(Cc2c(C34CC3)cc(NC3COCC3)nc2)C4=O)OC)c1F Chemical compound COc(cc(c(F)c1N(Cc2c(C34CC3)cc(NC3COCC3)nc2)C4=O)OC)c1F QQYBCRVKCIIDMI-UHFFFAOYSA-N 0.000 description 1
- YAKXQTYYTVPRSB-SHTZXODSSA-N COc1cc(OC)c(F)c(N2Cc3cnc(N[C@H]4CC[C@H](O)CC4)cc3C3(CC3)C2=O)c1F Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(N[C@H]4CC[C@H](O)CC4)cc3C3(CC3)C2=O)c1F YAKXQTYYTVPRSB-SHTZXODSSA-N 0.000 description 1
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- MPIBAVKEXCASBT-UHFFFAOYSA-N C[n]1ncc(CNc2ncc(CN(C(C34CC3)=O)c(c(F)c(cc3OC)OC)c3F)c4c2)c1 Chemical compound C[n]1ncc(CNc2ncc(CN(C(C34CC3)=O)c(c(F)c(cc3OC)OC)c3F)c4c2)c1 MPIBAVKEXCASBT-UHFFFAOYSA-N 0.000 description 1
- XUUXVWVJQMMRGG-UHFFFAOYSA-N C[n]1nccc1-c(c(N)ncc1CN2c(c(F)c(cc3OC)OC)c3F)c1N(C)C2=O Chemical compound C[n]1nccc1-c(c(N)ncc1CN2c(c(F)c(cc3OC)OC)c3F)c1N(C)C2=O XUUXVWVJQMMRGG-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 235000002566 Capsicum Nutrition 0.000 description 1
- 240000008574 Capsicum frutescens Species 0.000 description 1
- CKDWPUIZGOQOOM-UHFFFAOYSA-N Carbamyl chloride Chemical compound NC(Cl)=O CKDWPUIZGOQOOM-UHFFFAOYSA-N 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 229940122444 Chemokine receptor antagonist Drugs 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 1
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 1
- HTJDQJBWANPRPF-UHFFFAOYSA-N Cyclopropylamine Chemical compound NC1CC1 HTJDQJBWANPRPF-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 108010041986 DNA Vaccines Proteins 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 229940021995 DNA vaccine Drugs 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012688 Diabetic retinal oedema Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- BXZVVICBKDXVGW-NKWVEPMBSA-N Didanosine Chemical compound O1[C@H](CO)CC[C@@H]1N1C(NC=NC2=O)=C2N=C1 BXZVVICBKDXVGW-NKWVEPMBSA-N 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical group C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- XPOQHMRABVBWPR-UHFFFAOYSA-N Efavirenz Natural products O1C(=O)NC2=CC=C(Cl)C=C2C1(C(F)(F)F)C#CC1CC1 XPOQHMRABVBWPR-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 229940102550 Estrogen receptor antagonist Drugs 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- 208000008069 Geographic Atrophy Diseases 0.000 description 1
- 208000022461 Glomerular disease Diseases 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 108090000353 Histone deacetylase Proteins 0.000 description 1
- 102100038720 Histone deacetylase 9 Human genes 0.000 description 1
- 101100120051 Homo sapiens FGF1 gene Proteins 0.000 description 1
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 1
- 101001016865 Homo sapiens Heat shock protein HSP 90-alpha Proteins 0.000 description 1
- 101000904173 Homo sapiens Progonadoliberin-1 Proteins 0.000 description 1
- 101000997835 Homo sapiens Tyrosine-protein kinase JAK1 Proteins 0.000 description 1
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 description 1
- 101000934996 Homo sapiens Tyrosine-protein kinase JAK3 Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010056305 Hypopharyngeal neoplasm Diseases 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- 102000042838 JAK family Human genes 0.000 description 1
- 108091082332 JAK family Proteins 0.000 description 1
- 230000004163 JAK-STAT signaling pathway Effects 0.000 description 1
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 1
- KJHKTHWMRKYKJE-SUGCFTRWSA-N Kaletra Chemical compound N1([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=2C=CC=CC=2)NC(=O)COC=2C(=CC=CC=2C)C)CC=2C=CC=CC=2)CCCNC1=O KJHKTHWMRKYKJE-SUGCFTRWSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 1
- 239000003798 L01XE11 - Pazopanib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 1
- 239000002138 L01XE21 - Regorafenib Substances 0.000 description 1
- 239000002137 L01XE24 - Ponatinib Substances 0.000 description 1
- UCEQXRCJXIVODC-PMACEKPBSA-N LSM-1131 Chemical compound C1CCC2=CC=CC3=C2N1C=C3[C@@H]1C(=O)NC(=O)[C@H]1C1=CNC2=CC=CC=C12 UCEQXRCJXIVODC-PMACEKPBSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 1
- GDBQQVLCIARPGH-UHFFFAOYSA-N Leupeptin Natural products CC(C)CC(NC(C)=O)C(=O)NC(CC(C)C)C(=O)NC(C=O)CCCN=C(N)N GDBQQVLCIARPGH-UHFFFAOYSA-N 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- 206010062038 Lip neoplasm Diseases 0.000 description 1
- 229940124041 Luteinizing hormone releasing hormone (LHRH) antagonist Drugs 0.000 description 1
- 206010025312 Lymphoma AIDS related Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 108010006519 Molecular Chaperones Proteins 0.000 description 1
- 102000005431 Molecular Chaperones Human genes 0.000 description 1
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical group C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- FMCGSUUBYTWNDP-UHFFFAOYSA-N N-Methylephedrine Natural products CN(C)C(C)C(O)C1=CC=CC=C1 FMCGSUUBYTWNDP-UHFFFAOYSA-N 0.000 description 1
- IXOJTOIFKBSNIF-UHFFFAOYSA-N NC1=C(C=2N(CN(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)C1=C(C=CC=C1)F)C Chemical compound NC1=C(C=2N(CN(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)C1=C(C=CC=C1)F)C IXOJTOIFKBSNIF-UHFFFAOYSA-N 0.000 description 1
- 229940124821 NNRTIs Drugs 0.000 description 1
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 description 1
- 208000009277 Neuroectodermal Tumors Diseases 0.000 description 1
- 229940122313 Nucleoside reverse transcriptase inhibitor Drugs 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 description 1
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 235000008331 Pinus X rigitaeda Nutrition 0.000 description 1
- 235000011613 Pinus brutia Nutrition 0.000 description 1
- 241000018646 Pinus brutia Species 0.000 description 1
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical class C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 1
- 102100024028 Progonadoliberin-1 Human genes 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical group C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 1
- NCDNCNXCDXHOMX-UHFFFAOYSA-N Ritonavir Natural products C=1C=CC=CC=1CC(NC(=O)OCC=1SC=NC=1)C(O)CC(CC=1C=CC=CC=1)NC(=O)C(C(C)C)NC(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-UHFFFAOYSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 206010072610 Skeletal dysplasia Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- XNKLLVCARDGLGL-JGVFFNPUSA-N Stavudine Chemical compound O=C1NC(=O)C(C)=CN1[C@H]1C=C[C@@H](CO)O1 XNKLLVCARDGLGL-JGVFFNPUSA-N 0.000 description 1
- 238000006619 Stille reaction Methods 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 101000930762 Sulfolobus acidocaldarius (strain ATCC 33909 / DSM 639 / JCM 8929 / NBRC 15157 / NCIMB 11770) Signal recognition particle receptor FtsY Proteins 0.000 description 1
- 101000996723 Sus scrofa Gonadotropin-releasing hormone receptor Proteins 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- 206010042971 T-cell lymphoma Diseases 0.000 description 1
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 239000004012 Tofacitinib Substances 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 102000014384 Type C Phospholipases Human genes 0.000 description 1
- 108010079194 Type C Phospholipases Proteins 0.000 description 1
- 102100033438 Tyrosine-protein kinase JAK1 Human genes 0.000 description 1
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 description 1
- 102100025387 Tyrosine-protein kinase JAK3 Human genes 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- RLAHNGKRJJEIJL-RFZPGFLSSA-N [(2r,4r)-4-(2,6-diaminopurin-9-yl)-1,3-dioxolan-2-yl]methanol Chemical compound C12=NC(N)=NC(N)=C2N=CN1[C@H]1CO[C@@H](CO)O1 RLAHNGKRJJEIJL-RFZPGFLSSA-N 0.000 description 1
- YNOGYQAEJGADFJ-YFKPBYRVSA-N [(2s)-oxolan-2-yl]methanamine Chemical compound NC[C@@H]1CCCO1 YNOGYQAEJGADFJ-YFKPBYRVSA-N 0.000 description 1
- VKIJXFIYBAYHOE-VOTSOKGWSA-N [(e)-2-phenylethenyl]boronic acid Chemical compound OB(O)\C=C\C1=CC=CC=C1 VKIJXFIYBAYHOE-VOTSOKGWSA-N 0.000 description 1
- HEVHZBOMHKOOHT-UHFFFAOYSA-N [2-[1-[(2-methylpropan-2-yl)oxycarbonyl]piperidin-4-yl]-3,4-dihydropyrazol-4-yl]boronic acid Chemical compound CC(C)(C)OC(=O)N1CCC(CC1)N1CC(C=N1)B(O)O HEVHZBOMHKOOHT-UHFFFAOYSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- MCGSCOLBFJQGHM-SCZZXKLOSA-N abacavir Chemical compound C=12N=CN([C@H]3C=C[C@@H](CO)C3)C2=NC(N)=NC=1NC1CC1 MCGSCOLBFJQGHM-SCZZXKLOSA-N 0.000 description 1
- 229940028652 abraxane Drugs 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 229960003205 adefovir dipivoxil Drugs 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 239000002487 adenosine deaminase inhibitor Substances 0.000 description 1
- 229960001686 afatinib Drugs 0.000 description 1
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 1
- 229960002833 aflibercept Drugs 0.000 description 1
- 108010081667 aflibercept Proteins 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 238000005937 allylation reaction Methods 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- ANBBXQWFNXMHLD-UHFFFAOYSA-N aluminum;sodium;oxygen(2-) Chemical compound [O-2].[O-2].[Na+].[Al+3] ANBBXQWFNXMHLD-UHFFFAOYSA-N 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 229960001830 amprenavir Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 239000003936 androgen receptor antagonist Substances 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000003527 anti-angiogenesis Effects 0.000 description 1
- 230000003092 anti-cytokine Effects 0.000 description 1
- 230000003388 anti-hormonal effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940124691 antibody therapeutics Drugs 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- RYMCFYKJDVMSIR-RNFRBKRXSA-N apricitabine Chemical compound O=C1N=C(N)C=CN1[C@@H]1S[C@H](CO)OC1 RYMCFYKJDVMSIR-RNFRBKRXSA-N 0.000 description 1
- 229960004405 aprotinin Drugs 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000003943 azolyl group Chemical group 0.000 description 1
- 229950000971 baricitinib Drugs 0.000 description 1
- XUZMWHLSFXCVMG-UHFFFAOYSA-N baricitinib Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2C=3C=CNC=3N=CN=2)=C1 XUZMWHLSFXCVMG-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- ZDZHCHYQNPQSGG-UHFFFAOYSA-N binaphthyl group Chemical group C1(=CC=CC2=CC=CC=C12)C1=CC=CC2=CC=CC=C12 ZDZHCHYQNPQSGG-UHFFFAOYSA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 201000002143 bronchus adenoma Diseases 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000001390 capsicum minimum Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 1
- 229960002438 carfilzomib Drugs 0.000 description 1
- 108010021331 carfilzomib Proteins 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 210000003321 cartilage cell Anatomy 0.000 description 1
- 229960002412 cediranib Drugs 0.000 description 1
- 230000006369 cell cycle progression Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 238000009172 cell transfer therapy Methods 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- 239000002559 chemokine receptor antagonist Substances 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 230000007882 cirrhosis Effects 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- BSMCAPRUBJMWDF-KRWDZBQOSA-N cobimetinib Chemical compound C1C(O)([C@H]2NCCCC2)CN1C(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F BSMCAPRUBJMWDF-KRWDZBQOSA-N 0.000 description 1
- 229960002271 cobimetinib Drugs 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125758 compound 15 Drugs 0.000 description 1
- 229940125810 compound 20 Drugs 0.000 description 1
- 229940127204 compound 29 Drugs 0.000 description 1
- 239000012059 conventional drug carrier Substances 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229960005061 crizotinib Drugs 0.000 description 1
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- KZZKOVLJUKWSKX-UHFFFAOYSA-N cyclobutanamine Chemical compound NC1CCC1 KZZKOVLJUKWSKX-UHFFFAOYSA-N 0.000 description 1
- 125000002188 cycloheptatrienyl group Chemical group C1(=CC=CC=CC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- SSJXIUAHEKJCMH-UHFFFAOYSA-N cyclohexane-1,2-diamine Chemical compound NC1CCCCC1N SSJXIUAHEKJCMH-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- LVXJQMNHJWSHET-AATRIKPKSA-N dacomitinib Chemical compound C=12C=C(NC(=O)\C=C\CN3CCCCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 LVXJQMNHJWSHET-AATRIKPKSA-N 0.000 description 1
- 229950002205 dacomitinib Drugs 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- WHBIGIKBNXZKFE-UHFFFAOYSA-N delavirdine Chemical compound CC(C)NC1=CC=CN=C1N1CCN(C(=O)C=2NC3=CC=C(NS(C)(=O)=O)C=C3C=2)CC1 WHBIGIKBNXZKFE-UHFFFAOYSA-N 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 201000011190 diabetic macular edema Diseases 0.000 description 1
- 229960002656 didanosine Drugs 0.000 description 1
- HQWPLXHWEZZGKY-UHFFFAOYSA-N diethylzinc Chemical compound CC[Zn]CC HQWPLXHWEZZGKY-UHFFFAOYSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 125000005805 dimethoxy phenyl group Chemical group 0.000 description 1
- AXAZMDOAUQTMOW-UHFFFAOYSA-N dimethylzinc Chemical compound C[Zn]C AXAZMDOAUQTMOW-UHFFFAOYSA-N 0.000 description 1
- GPAYUJZHTULNBE-UHFFFAOYSA-N diphenylphosphine Chemical compound C=1C=CC=CC=1PC1=CC=CC=C1 GPAYUJZHTULNBE-UHFFFAOYSA-N 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- DLNKOYKMWOXYQA-UHFFFAOYSA-N dl-pseudophenylpropanolamine Natural products CC(N)C(O)C1=CC=CC=C1 DLNKOYKMWOXYQA-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 239000013583 drug formulation Substances 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 229960003804 efavirenz Drugs 0.000 description 1
- 239000012156 elution solvent Substances 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- MLILORUFDVLTSP-UHFFFAOYSA-N emivirine Chemical compound O=C1NC(=O)N(COCC)C(CC=2C=CC=CC=2)=C1C(C)C MLILORUFDVLTSP-UHFFFAOYSA-N 0.000 description 1
- 229960000366 emtricitabine Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 238000001952 enzyme assay Methods 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 208000010932 epithelial neoplasm Diseases 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- AJTAPTZHMLWGOA-UHFFFAOYSA-N ethyl 3-[N-[(4,6-dichloropyridin-3-yl)methyl]-2,6-difluoro-3,5-dimethoxyanilino]-3-oxopropanoate Chemical compound CCOC(=O)CC(=O)N(Cc1cnc(Cl)cc1Cl)c1c(F)c(OC)cc(OC)c1F AJTAPTZHMLWGOA-UHFFFAOYSA-N 0.000 description 1
- KWFADUNOPOSMIJ-UHFFFAOYSA-N ethyl 3-chloro-3-oxopropanoate Chemical compound CCOC(=O)CC(Cl)=O KWFADUNOPOSMIJ-UHFFFAOYSA-N 0.000 description 1
- KLDOYPGZOWJLPL-UHFFFAOYSA-N ethyl 4,6-dichloro-5-methylpyridine-3-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)C(C)=C1Cl KLDOYPGZOWJLPL-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 239000011536 extraction buffer Substances 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 101150016624 fgfr1 gene Proteins 0.000 description 1
- 101150088071 fgfr2 gene Proteins 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- XLXSAKCOAKORKW-UHFFFAOYSA-N gonadorelin Chemical compound C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 XLXSAKCOAKORKW-UHFFFAOYSA-N 0.000 description 1
- 229940035638 gonadotropin-releasing hormone Drugs 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000003966 growth inhibitor Substances 0.000 description 1
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 210000002768 hair cell Anatomy 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229960003445 idelalisib Drugs 0.000 description 1
- YKLIKGKUANLGSB-HNNXBMFYSA-N idelalisib Chemical compound C1([C@@H](NC=2[C]3N=CN=C3N=CN=2)CC)=NC2=CC=CC(F)=C2C(=O)N1C1=CC=CC=C1 YKLIKGKUANLGSB-HNNXBMFYSA-N 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000001571 immunoadjuvant effect Effects 0.000 description 1
- 239000000568 immunological adjuvant Substances 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 229960001936 indinavir Drugs 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- KLEAIHJJLUAXIQ-JDRGBKBRSA-N irinotecan hydrochloride hydrate Chemical compound O.O.O.Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 KLEAIHJJLUAXIQ-JDRGBKBRSA-N 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 229960004592 isopropanol Drugs 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 238000000021 kinase assay Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001627 lamivudine Drugs 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- GDBQQVLCIARPGH-ULQDDVLXSA-N leupeptin Chemical compound CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C=O)CCCN=C(N)N GDBQQVLCIARPGH-ULQDDVLXSA-N 0.000 description 1
- 108010052968 leupeptin Proteins 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- KBEMFSMODRNJHE-JFWOZONXSA-N lodenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)C[C@@H]1F KBEMFSMODRNJHE-JFWOZONXSA-N 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 201000011649 lymphoblastic lymphoma Diseases 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 description 1
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- 210000003584 mesangial cell Anatomy 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- RWIVICVCHVMHMU-UHFFFAOYSA-N n-aminoethylmorpholine Chemical compound NCCN1CCOCC1 RWIVICVCHVMHMU-UHFFFAOYSA-N 0.000 description 1
- 125000004370 n-butenyl group Chemical group [H]\C([H])=C(/[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- AGVKXDPPPSLISR-UHFFFAOYSA-N n-ethylcyclohexanamine Chemical compound CCNC1CCCCC1 AGVKXDPPPSLISR-UHFFFAOYSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- RIWRFSMVIUAEBX-UHFFFAOYSA-N n-methyl-1-phenylmethanamine Chemical compound CNCC1=CC=CC=C1 RIWRFSMVIUAEBX-UHFFFAOYSA-N 0.000 description 1
- 229940073569 n-methylephedrine Drugs 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003506 n-propoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004888 n-propyl amino group Chemical group [H]N(*)C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 229960000513 necitumumab Drugs 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 229950008835 neratinib Drugs 0.000 description 1
- JWNPDZNEKVCWMY-VQHVLOKHSA-N neratinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 JWNPDZNEKVCWMY-VQHVLOKHSA-N 0.000 description 1
- 229960000689 nevirapine Drugs 0.000 description 1
- 229960001346 nilotinib Drugs 0.000 description 1
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 229940042402 non-nucleoside reverse transcriptase inhibitor Drugs 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000002726 nonnucleoside reverse transcriptase inhibitor Substances 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 125000005482 norpinyl group Chemical group 0.000 description 1
- 229940042404 nucleoside and nucleotide reverse transcriptase inhibitor Drugs 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 229960000572 olaparib Drugs 0.000 description 1
- FDLYAMZZIXQODN-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC=2C3=CC=CC=C3C(=O)NN=2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FDLYAMZZIXQODN-UHFFFAOYSA-N 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- AHVQYHFYQWKUKB-UHFFFAOYSA-N oxan-4-amine Chemical compound NC1CCOCC1 AHVQYHFYQWKUKB-UHFFFAOYSA-N 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 229960004390 palbociclib Drugs 0.000 description 1
- AHJRHEGDXFFMBM-UHFFFAOYSA-N palbociclib Chemical compound N1=C2N(C3CCCC3)C(=O)C(C(=O)C)=C(C)C2=CN=C1NC(N=C1)=CC=C1N1CCNCC1 AHJRHEGDXFFMBM-UHFFFAOYSA-N 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 229960005184 panobinostat Drugs 0.000 description 1
- FWZRWHZDXBDTFK-ZHACJKMWSA-N panobinostat Chemical compound CC1=NC2=CC=C[CH]C2=C1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FWZRWHZDXBDTFK-ZHACJKMWSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 229960000639 pazopanib Drugs 0.000 description 1
- CUIHSIWYWATEQL-UHFFFAOYSA-N pazopanib Chemical compound C1=CC2=C(C)N(C)N=C2C=C1N(C)C(N=1)=CC=NC=1NC1=CC=C(C)C(S(N)(=O)=O)=C1 CUIHSIWYWATEQL-UHFFFAOYSA-N 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 108010091212 pepstatin Proteins 0.000 description 1
- FAXGPCHRFPCXOO-LXTPJMTPSA-N pepstatin A Chemical compound OC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)CC(C)C FAXGPCHRFPCXOO-LXTPJMTPSA-N 0.000 description 1
- DLNKOYKMWOXYQA-APPZFPTMSA-N phenylpropanolamine Chemical compound C[C@@H](N)[C@H](O)C1=CC=CC=C1 DLNKOYKMWOXYQA-APPZFPTMSA-N 0.000 description 1
- 229960000395 phenylpropanolamine Drugs 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 238000003566 phosphorylation assay Methods 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 229960001131 ponatinib Drugs 0.000 description 1
- PHXJVRSECIGDHY-UHFFFAOYSA-N ponatinib Chemical compound C1CN(C)CCN1CC(C(=C1)C(F)(F)F)=CC=C1NC(=O)C1=CC=C(C)C(C#CC=2N3N=CC=CC3=NC=2)=C1 PHXJVRSECIGDHY-UHFFFAOYSA-N 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- SSOLNOMRVKKSON-UHFFFAOYSA-N proguanil Chemical compound CC(C)\N=C(/N)N=C(N)NC1=CC=C(Cl)C=C1 SSOLNOMRVKKSON-UHFFFAOYSA-N 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- VVWRJUBEIPHGQF-MDZDMXLPSA-N propan-2-yl (ne)-n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)\N=N\C(=O)OC(C)C VVWRJUBEIPHGQF-MDZDMXLPSA-N 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- ABMYEXAYWZJVOV-UHFFFAOYSA-N pyridin-3-ylboronic acid Chemical compound OB(O)C1=CC=CN=C1 ABMYEXAYWZJVOV-UHFFFAOYSA-N 0.000 description 1
- QLULGIRFKAWHOJ-UHFFFAOYSA-N pyridin-4-ylboronic acid Chemical compound OB(O)C1=CC=NC=C1 QLULGIRFKAWHOJ-UHFFFAOYSA-N 0.000 description 1
- 239000003790 pyrimidine antagonist Substances 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 229960004836 regorafenib Drugs 0.000 description 1
- FNHKPVJBJVTLMP-UHFFFAOYSA-N regorafenib Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 FNHKPVJBJVTLMP-UHFFFAOYSA-N 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 208000004644 retinal vein occlusion Diseases 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- 229960000311 ritonavir Drugs 0.000 description 1
- NCDNCNXCDXHOMX-XGKFQTDJSA-N ritonavir Chemical compound N([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1SC=NC=1)CC=1C=CC=CC=1)C(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-XGKFQTDJSA-N 0.000 description 1
- 229960000215 ruxolitinib Drugs 0.000 description 1
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 208000014190 scalp syndrome Diseases 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 208000000649 small cell carcinoma Diseases 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 229910001388 sodium aluminate Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011775 sodium fluoride Substances 0.000 description 1
- 235000013024 sodium fluoride Nutrition 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- FOEYMRPOKBCNCR-UHFFFAOYSA-N spiro[2.5]octane Chemical compound C1CC11CCCCC1 FOEYMRPOKBCNCR-UHFFFAOYSA-N 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000004500 stellate cell Anatomy 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 239000012258 stirred mixture Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- DHHKPEUQJIEKOA-UHFFFAOYSA-N tert-butyl 2-[6-(nitromethyl)-6-bicyclo[3.2.0]hept-3-enyl]acetate Chemical compound C1C=CC2C(CC(=O)OC(C)(C)C)(C[N+]([O-])=O)CC21 DHHKPEUQJIEKOA-UHFFFAOYSA-N 0.000 description 1
- BEUUJDAEPJZWHM-COROXYKFSA-N tert-butyl n-[(2s,3s,5r)-3-hydroxy-6-[[(2s)-1-(2-methoxyethylamino)-3-methyl-1-oxobutan-2-yl]amino]-6-oxo-1-phenyl-5-[(2,3,4-trimethoxyphenyl)methyl]hexan-2-yl]carbamate Chemical compound C([C@@H]([C@@H](O)C[C@H](C(=O)N[C@H](C(=O)NCCOC)C(C)C)CC=1C(=C(OC)C(OC)=CC=1)OC)NC(=O)OC(C)(C)C)C1=CC=CC=C1 BEUUJDAEPJZWHM-COROXYKFSA-N 0.000 description 1
- JHLVEBNWCCKSGY-UHFFFAOYSA-N tert-butyl n-methylcarbamate Chemical compound CNC(=O)OC(C)(C)C JHLVEBNWCCKSGY-UHFFFAOYSA-N 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical compound C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- XBXCNNQPRYLIDE-UHFFFAOYSA-N tert-butylcarbamic acid Chemical compound CC(C)(C)NC(O)=O XBXCNNQPRYLIDE-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003527 tetrahydropyrans Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 230000025366 tissue development Effects 0.000 description 1
- 229950005976 tivantinib Drugs 0.000 description 1
- 229960001350 tofacitinib Drugs 0.000 description 1
- UJLAWZDWDVHWOW-YPMHNXCESA-N tofacitinib Chemical compound C[C@@H]1CCN(C(=O)CC#N)C[C@@H]1N(C)C1=NC=NC2=C1C=CN2 UJLAWZDWDVHWOW-YPMHNXCESA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 210000003437 trachea Anatomy 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- AYNNSCRYTDRFCP-UHFFFAOYSA-N triazene Chemical compound NN=N AYNNSCRYTDRFCP-UHFFFAOYSA-N 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- IHIXIJGXTJIKRB-UHFFFAOYSA-N trisodium vanadate Chemical compound [Na+].[Na+].[Na+].[O-][V]([O-])([O-])=O IHIXIJGXTJIKRB-UHFFFAOYSA-N 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 125000005500 uronium group Chemical group 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 229960003862 vemurafenib Drugs 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229960004854 viral vaccine Drugs 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 229960000523 zalcitabine Drugs 0.000 description 1
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4375—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having nitrogen as a ring heteroatom, e.g. quinolizines, naphthyridines, berberine, vincamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Enzymes And Modification Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Description
WはNR9、O、またはCR10R11である;
R1はC1−6アルキル、C1−6ハロアルキル、またはC3−7シクロアルキルである;
R2、R3、及びR5はそれぞれH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、シクロプロピル、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)ORa、NRcC(O)NRcRd、C(=NRe)Rb、C(=NRe)NRcRd、NRcC(=NRe)NRcRd、NRcS(O)Rb、NRcS(O)2Rb、NRcS(O)2NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、及びS(O)2NRcRdから独立して選択される;
R4はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、CN、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、C(=NRe1)Rb1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C3−7シクロアルキル、及び4〜7員ヘテロシクロアルキルがそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1から独立して選択される1、2または3個の置換基で置換されていてもよい;
R6はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、C(=NRe2)Rb2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、またはS(O)2NRc2Rd2である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
ここで、WがNR9である場合、R6はH以外である;
R6aはそれぞれCy1、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy1、ハロ、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択される1、2または3個の置換基で置換されていてもよい;
R7及びR8はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、−C(O)RA、S(O)RA、S(O)2RA、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R7aはそれぞれCy2、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy2、ハロ、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択される1、2または3個の置換基で置換されていてもよい;
R9はH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルであり、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR9aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R9aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy3、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
R10及びR11はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、C(=NRe4)Rb4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR10aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R10aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy2、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
またはR10及びR11はそれらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基または4、5、6または7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルがCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい;
RAはそれぞれH、C1−6アルキル、C1−6アルコキシ、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C1−6アルコキシ、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2または3個の置換基で置換されていてもよい;
Cy1、Cy2、及びCy3はそれぞれC6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルから独立して選択され、それぞれがハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、3〜10員ヘテロシクロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、C(=NRe5)Rb5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基によって置換されていてもよい;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
Ra、Rb、Rc、及びRdはそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルがC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよい;
Ra1、Rb1、Rc1、Rd1、Ra2、Rb2、Rc2、Rd2、Ra3、Rb3、Rc3、Rd3、Ra4、Rb4、Rc4、及びRd4、Ra5、Rb5、Rc5、及びRd5はそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択される、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
またはいずれのRc及びRdもそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc1及びRd1もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc2及びRd2もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc3及びRd3もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc4及びRd4もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc5及びRd5もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
Re、Re1、Re2、Re3、Re4、及びRe5はそれぞれH、C1−4アルキル、CN、ORa6、SRb6、S(O)2Rb6、C(O)Rb6、S(O)2NRc6Rd6、及びC(O)NRc6Rd6から独立して選択される;
Ra6、Rb6、Rc6、及びRd6はそれぞれH、C1−4アルキル、C1−4ハロアルキル、C2−4アルケニル、及びC2−4アルキニルから独立して選択され、ここで、前記C1−4アルキル、C2−4アルケニル、及びC2−4アルキニルがOH、CN、アミノ、ハロ、C1−4アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;
またはいずれのRc6及びRd6もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、OH、CN、アミノ、ハロ、C1−6アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;及び
Re6はそれぞれH、C1−4アルキル、及びCNから独立して選択される。
WはNR9、O、またはCR10R11である;
R1はC1−6アルキル、C1−6ハロアルキル、またはC3−7シクロアルキルである;
R2、R3、及びR5はそれぞれH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、シクロプロピル、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)ORa、NRcC(O)NRcRd、C(=NRe)Rb、C(=NRe)NRcRd、NRcC(=NRe)NRcRd、NRcS(O)Rb、NRcS(O)2Rb、NRcS(O)2NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、及びS(O)2NRcRdから独立して選択される;
R4はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、CN、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、C(=NRe1)Rb1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C3−7シクロアルキル、及び4〜7員ヘテロシクロアルキルがそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1から独立して選択される1、2または3個の置換基で置換されていてもよい;
R6はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、C(=NRe2)Rb2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、またはS(O)2NRc2Rd2である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
ここで、WがNR9である場合、R6はH以外である;
R6aはそれぞれCy1、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy1、ハロ、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択される1、2または3個の置換基で置換されていてもよい;
R7及びR8はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、−C(O)RA、S(O)RA、S(O)2RA、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R7aはそれぞれCy2、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy2、ハロ、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択される1、2または3個の置換基で置換されていてもよい;
R9はH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルであり、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR9aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R9aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy3、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
R10及びR11はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、C(=NRe4)Rb4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR10aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R10aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy2、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
またはR10及びR11はそれらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基または4、5、6または7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルがCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい;
RAはそれぞれH、C1−6アルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2または3個の置換基で置換されていてもよい;
Cy1、Cy2、及びCy3はそれぞれC6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルから独立して選択され、それぞれがハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、3〜10員ヘテロシクロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、C(=NRe5)Rb5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基によって置換されていてもよい;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
Ra、Rb、Rc、及びRdはそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルがC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよい;
Ra1、Rb1、Rc1、Rd1、Ra2、Rb2、Rc2、Rd2、Ra3、Rb3、Rc3、Rd3、Ra4、Rb4、Rc4、及びRd4、Ra5、Rb5、Rc5、及びRd5はそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択される、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
またはいずれのRc及びRdもそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc1及びRd1もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc2及びRd2もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc3及びRd3もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc4及びRd4もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc5及びRd5もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールがハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
Re、Re1、Re2、Re3、Re4、及びRe5はそれぞれH、C1−4アルキル、CN、ORa6、SRb6、S(O)2Rb6、C(O)Rb6、S(O)2NRc6Rd6、及びC(O)NRc6Rd6から独立して選択される;
Ra6、Rb6、Rc6、及びRd6はそれぞれH、C1−4アルキル、C1−4ハロアルキル、C2−4アルケニル、及びC2−4アルキニルから独立して選択され、ここで、前記C1−4アルキル、C2−4アルケニル、及びC2−4アルキニルがOH、CN、アミノ、ハロ、C1−4アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;
またはいずれのRc6及びRd6もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、OH、CN、アミノ、ハロ、C1−6アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;及び
Re6はそれぞれH、C1−4アルキル、及びCNから独立して選択される。
スキーム1
スキーム2
スキーム3
スキーム4
スキーム5
スキーム6
スキーム7
本発明の化合物は1つ以上のFGFR酵素の活性を抑制することができる。例えば、本発明の化合物を用いて、細胞、個体、または患者に抑制する量の本発明の化合物を投与することによって酵素の抑制の必要な細胞または個体もしくは患者のFGFR酵素の活性を抑制することができる。
FGFR−関連疾患、障害または病態の治療のために、本発明の化合物と組み合わせて、1つ以上の追加の薬剤または治療方法、例えば、抗−ウイルス剤、化学療法剤または他の抗癌剤、免疫増強剤、免疫抑制剤、放射線、抗−腫瘍及び抗−ウイルスワクチン、サイトカイン治療法(例えば、IL2、GM−CSF等)、及び/またはチロシンキナーゼ抑制剤を用いることができる。単一の投与形態で本化合物とこの薬剤を混合することができる、または分離投与形態として同時にまたは連続的にこの薬剤を投与することができる。
本発明のもう1つの態様は、本発明の蛍光染料、スピンラベル、重金属または放射線−標識化合物に関する。これは、ヒトを含む組織試料中のFGFR酵素を局所にとどめる及びFGFR酵素の量を計るために、及びFGFR酵素配位子標識化合物の抑制結合によって識別するために、画像化だけではなく、in vivo及びin vivoともにアッセイに有用である。したがって、本発明には、このような標識化合物を含有するFGFR酵素アッセイが含まれる。
このほか、本発明には、例えば、治療有効量の本発明の化合物を含む医薬組成物を含有する1つ以上の容器を含む、FGFR−関連疾患または障害、肥満、糖尿病及び本明細書に記載した他の疾患の治療または予防に有用な薬剤キットが含まれる。このようなキットはさらに、必要な場合、当業者に容易に明らかであるように、1つ以上のさまざまな従来の薬剤キットコンポーネント、例えば、1つ以上の医薬上許容される担体を有する容器、追加の容器、等を含むことができる。このほか、挿入物またはラベルとして、投与する成分の量、投与のガイドライン、及び/または成分を混合するガイドラインを示す指示書をキットに含めることができる。
以下に本発明の化合物の実験手順を提供する。Waters質量指向分留システムでいくつかの調製した化合物の予備的LC−MS精製を実施した。これらのシステムの操作のための基本的な装置セットアップ、プロトコル、及び制御ソフトウエアは、文献に詳細に記載されている。例えば、「Two−Pump At Column Dilution Configuration for Preparative LC−MS」,K.Blom,J.Combi.Chem.,4,295(2002);「Optimizing Preparative LC−MS Configurations and Methods for Parallel Synthesis Purification」,K.Blom,R.Sparks,J.Doughty,G.Everlof,T.Haque,A.Combs,J.Combi.Chem.,5,670(2003);and 「Preparative LC−MS Purification:Improved Compound Specific Method Optimization」,K.Blom,B.Glass,R.Sparks,A.Combs,J.Combi.Chem.,6,874−883(2004)を参照。典型的には純度チェックのために以下の条件下で分離した化合物を分析的液体クロマトグラフィー質量分析(LCMS)にかけた。:測定器;Agilent1100シリーズ、LC/MSD、カラム:Waters Sunfire(商標)C185μm、2.1x5.0mm、緩衝液:移動相A:水に0.025%TFA及び移動相B:アセトニトリルに0.025%TFA;3分間に流量率1.5mL/分で勾配2%〜80%のB。
1,4−ジオキサン(0.8mL)中の7−アミノ−8−ブロモ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン(34.0mg、0.080mmol)の溶液にPd(dppf)Cl2(8.0mg、0.01mmol)及びZnMe2(トルエン、0.11mL、0.22mmol中の2.0M溶液、)を添加した。1時間、110℃で、得られた混合物を撹拌し、その後、MeOH(4mL)で希釈し、RP−HPLC(pH2)によって精製し、そのTFA塩として生成物が生じた。LC−MSによってC17H19F2N4O3[M+H]+m/z:365.1が計算され;365.1が判明した。1H NMR(500MHz、DMSO)δ7.73(s、3H)、7.04(t、J=7.5Hz、1H)、4.59(s、2H)、3.88(s、6H)、3.39(s、3H)、2.80ppm(s、3H)。
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−[2−(4−メチルピペラジン−1−イル)エトキシ]−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−メチル−1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−エチル−1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−[1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル]−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−メチル−1H−ピラゾール−5−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−(3,6−ジヒドロ−2H−ピラン−4−イル)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
0℃でアセトニトリル(1.5mL)中のtert−ブチル[7−(3,5−ジメトキシフェニル)−5,5−ジメチル−6−オキソ−5,6,7,8−テトラヒドロ−2,7−ナフチリジン−3−イル]カルバメート(22.0mg、0.0515mmol)の撹拌した溶液に、1−(クロロメチル)−4−フルオロ−1,4−ジアゾニアビシクロ[2.2.2]オクタンジテトラフルオロボレート(54.7mg、0.154mmol)を添加した。その後、室温まで得られた混合物を温めた。3時間後、飽和水性NaHCO3で反応を停止し、塩化メチレンで抽出した。MgSO4上で混合した有機層を乾燥させ、乾燥状態まで濃縮し、その後、トリフルオロ酢酸(1.0mL)/メチレンクロリド(1.0mL、16mmol)に溶解した。1時間後に、減圧下で揮発物を除去し、RP−HPLC(XBridgeC18カラム、0.05%TFAを含有するアセトニトリル/水の勾配で溶離する、30mL/分の流量率で)で残留物を精製し、そのTFA塩として所望の生成物(2.0mg)が生じた。LC−MSによってC18H20F2N3O3[M+H]+m/z:364.1が計算され;364.2が判明した。
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−[(2−モルホリン−4−イルエチル)アミノ]−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オン
室温で、1,4−ジオキサン(6.0mL)中の6’−クロロ−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オン(250mg、0.657mmol)及び2−モルホリノエタンアミン(214mg、1.64mmol)の撹拌した溶液に連続的にジシクロヘキシル(2’,4’,6’−トリイソプロピル−3,6−ジメトキシビフェニル−2−イル)ホスフィン(BrettPhos、Aldrich、cat#718742:70.5mg、0.131mmol)、ナトリウムtert−ブトキシド(126mg、1.31mmol)及び酢酸パラジウム(29.5mg、0.131mmol)を添加した。N2で得られた混合物をパージし、その後、110℃まで加熱した。110℃で45分間撹拌後、周囲温度まで反応混合物を冷却し、RP−HPLC(XBridgeC18カラム、0.05%TFAを含有するアセトニトリル/水の勾配で溶離する、60mL/分の流量率で)で精製し、そのTFA塩として所望の生成物(150mg)が得られた。LC−MSによってC24H29F2N4O4[M+H]+m/z:475.2が計算され;475.2が判明した。1H NMR(500MHz、DMSO−d6):δ7.96(s、1H)、7.06(t、J=10.0Hz、1H)、6.22(s、1H)、4.77(s、2H)、3.88(s、6H)、3.82(br、4H)、3.65(br、2H)、3.27−3.33(m、6H)、1.71(dd、J=7.0Hz、4.0Hz、2H)、1.43(dd、J=7.0Hz、4.0Hz、2H)ppm。
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(テトラヒドロ−2H−ピラン−4−イルアミノ)−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(ピリジン−2−イルメチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(2−(4−メチルピペラジン−1−イル)エチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
メチル2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−3’−オキソ−2’,3’−ジヒドロ−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−6’−イルカルバメート
(S)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−((テトラヒドロフラン−2−イル)メチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(1−メチル−1H−ピラゾール−4−イルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−((1−メチル−1H−ピラゾール−4−イル)メチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(トランス−4−ヒドロキシシクロヘキシルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(3,3−ジフルオロシクロブチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(1−メチルピペリジン−4−イルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン
1mLのTFAにステップ5からの粗生成物を溶解し、85℃で3時間反応混合物を撹拌した。室温まで混合物を冷却し、真空で濃縮した。アセトニトリルに残留物を溶解し、その後、RP−HPLC(pH=2)によって精製し、TFA塩として所望の生成物が生じた。LCMSによってC22H20F3N4O3(M+H)+:m/z=445.1が計算され;445.2が判明した。
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−メチル−1−(2−メチル−2H−テトラゾール−5−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−メチル−1−[(1−メチル−1H−ピラゾール−4−イル)メチル]−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
塩化メチレン(5mL)中に7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1,8−ジメチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン(120mg、0.33mmol)の溶液にクロロ蟻酸メチル(38μL、0.49mmol)及びトリエチルアミン(230μL、1.6mmol)を添加した。室温で一晩、得られた混合物を撹拌し、その後、濃縮した。逆相HPLC(pH=2、アセトニトリル/水+TFA)によって残留物を精製し、TFA塩として所望の生成物が得られた。LCMSによってC19H21F2N4O5(M+H)+:m/z=423.1が計算され;423.1が判明した。1HNMR(500MHz、DMSO−d6)δ9.80(s、1H)、8.03(s、1H)、7.02(t、J=8.2Hz、1H)、4.67(s、2H)、3.88(s、6H)、3.68(s、3H)、3.34(s、3H)、2.21(s、3H)ppm。
7−アミノ−1−(シクロプロピルメチル)−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル
テトラヒドロフラン(3mL)にステップ6からの生成物を溶解し、その後、水中1.0M塩化水素(0.16mL、0.16mmol)を添加した。室温で2時間、得られた混合物を撹拌し、その後、アセトニトリルで希釈し、分取HPLC(pH=2、アセトニトリル/水+TFA)によって精製し、TFA塩として所望の生成物が得られた。LCMSによってC20H20F2N5O3(M+H)+:m/z=416.2が計算され;416.2が判明した。
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−[(1−メチル−1H−ピラゾール−4−イル)メチル]−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル
7−アミノ−1−(3,5−ジフルオロベンジル)−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−(2−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル
実施例49、ステップ6〜7に記載したものとほぼ同じ条件を用いて7−クロロ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−(2−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリルからこの化合物を調製した。LCMSによってC22H17F3N5O3(M+H)+:m/z=456.1が計算され;455.9が判明した。
FGFR酵素的アッセイ
生成物形を検知するためにFRET測定を用いてペプチドリン酸化を測定する酵素アッセイで、例示した化合物の抑制剤効力を測定した。連続的にDMSO中に抑制剤を希釈し、384−ウェルプレートのウェルに容量0.5μLを移動した。FGFR3については、プレートにアッセイ緩衝液(50mMのHEPES、10mMのMgCl2、1mMのEGTA、0.01%Tween−20、5mMのDTT、pH7.5)中に希釈した容量10μLのFGFR3酵素(Millipore)を添加し、5〜10分間、プレインキュベートした。プレート上にしかるべき対照(酵素なし、及び抑制剤を有しない酵素)を含めた。ウェルにアッセイ緩衝液中にビオチン化EQEDEPEGDYFEWLEペプチド基質(配列番号:1)及びATP(それぞれの最終濃度500nM及び140μM)を含有する10μL溶液を添加することによってアッセイを開始した。25℃で1時間、プレートをインキュベートした。10μL/ウェルのクエンチ溶液(50mMトリス、150mMNaCl、0.5mg/mLBSA、pH7.8;3.75nM Eu−抗体PY20及び180nM APC−StreptavidinのPerkin Elmer Lance試薬を有する30mMEDTA)の添加で反応を終わらせた。約1時間プレートを平衡させ、その後、PheraStarプレートリーダー(BMG Labtech)上でウェルを走査した。
FGFR細胞増殖/生存アッセイ
生存率アッセイを用いて、実施例の化合物の、生存を示しているFGFRに依存する細胞の、成長を抑制する能力を測定することができる。完全長ヒトFGFR3をコードするプラスミドを有するマウス プロB Ba/F3細胞(Deutsche Sammlung von Mikroorganismen und Zellkulturenから得た)の安定したトランスフェクションによってヒトFGFR3を過剰発現する組換え細胞系統を開発した。ヘパリン及びFGF1の存在下でプロマイシン抵抗及び増殖のために連続的に細胞を選択した。単一の細胞クローンが単離され、FGFR3の機能的発現に特徴づけられる。このBa/F3−FGFR3クローンが細胞増殖アッセイに用いられ、化合物が細胞増殖/生存を抑制する能力について検査される。Ba/F3−FGFR3細胞は、2%FBS、20ug/mLのヘパリン及び5ng/mLのFGF1を含有するRPMI1640媒質の3500細胞/ウェルで96ウェル、黒色細胞培養プレートに接種される。細胞は10μLの10X濃度を(5mMのDSMOドットからの血清を欠く媒質で希釈した)最終容量100μL/ウェルに連続的に希釈した化合物で処理された。72時間のインキュベーション後、細胞のATP濃度を測定するCell Titer Glo(登録商標)試薬(Promega Corporation)100μLをそれぞれのウェルに添加する。振り混ぜしながら20分のインキュベーション後、プレートリーダー上で発光を読む。発光表示はDMSOによって処理される対照ウェルに比例するパーセント抑制に変換され、可変勾配のシグモイド用量反応方程式にデータを合わせることによってGraphPad Prismソフトウエアを用いてIC50値を計算する。IC50が10μM以下の化合物は活性と考えられる。KMS−11(多発性骨髄腫、FGFR3転座)、RT112(膀胱癌、FGFR3過剰発現)、KatoIII(胃癌、FGFR2遺伝子増幅)、及びH−1581(肺、FGFR1遺伝子増幅)を含む種々の腫瘍型を示す細胞系統がほぼ同じ増殖アッセイに用いられる。いくつかの実験では、MTS試薬、Cell Titer96(登録商標)AQueous OneSolution試薬(Promega Corporation)が最終濃度333μg/mLのCell Titer Gloの場所に添加され、プレートリーダー上で490/650nmで読まれる。IC50が5μM以下の化合物は活性と考えられる。
細胞系FGFRリン酸化アッセイ
FGFRリン酸化に特定の免疫アッセイを用いて、関連がある細胞系統(Ba/F3−FGFR3、KMS−11、RT112、KatoIII、H−1581癌細胞系統及びHUVEC細胞系統)のFGFRリン酸化に基づく化合物の抑制効果を評価することができる。細胞系統に応じて4〜18時間還元血清(0.5%)及びFGF1がない培地で細胞を飢餓におき、その後、1〜4時間さまざまな濃度の個々の抑制剤で処理する。いくつかの細胞系統、例えば、Ba/F3−FGFR3及びKMS−11では、10分間、ヘパリン(20μg/mL)及びFGF1(10ng/mL)で細胞を刺激する。4℃で、プロテアーゼ及びホスファターゼ抑制剤[50mM HEPES(pH7.5)、150mM NaCl、1.5mM MgCl2、10%グリセロール、1%Triton X−100、1mM オルトバナジン酸ナトリウム、1mM フッ化ナトリウム、アプロチニン(2μg/mL)、ロイペプチン(2μg/mL)、ペプスタチンA(2μg/mL)、及びフッ化フェニルメチルスルホニル(1mM)]を有する溶解緩衝液にインキュベートすることによって全細胞タンパク質抽出物を調製する。10分間、14,000xgで遠心分離することによってタンパク質抽出物から細胞破片を取り除き、BCA(ビシンコニン酸)マイクロプレートアッセイ試薬(Thermo Scientific)を用いて量を計る。
FGFR細胞系シグナリングアッセイ
FGFRの活性化によりErkタンパク質がリン酸化される。Cellu’Erk HTRF(均一時間分解蛍光)アッセイ(CisBio)を用いて製造者のプロトコルに従ってpErkの検出をモニターする。KMS−11細胞が0.25%FBSを有するRPMI培地の40,000細胞/ウェルで96−ウェルプレートに接種され、2日間、飢餓におかれる。培地を吸引し、細胞を30μLの1X濃度を(5mMのDSMOドットからの血清を欠く媒質で希釈した)最終容量30μL/ウェルに連続的に希釈した化合物で治療し、室温で45分間インキュベートする。10μLのヘパリン(100μg/mL)及びFGF1(50ng/mL)をそれぞれのウェルに添加することによって細胞を刺激し、室温で10分間インキュベートする。溶解後、384−ウェルローボリュームプレートに細胞抽出物のアリコートを移動し、4μLの検出試薬を添加し、続いて室温で3時間、インキュベートする。HTRFのために設定してあるPheraStar測定器上でプレートを読む。標準化蛍光表示は、DMSOによって治療される対照ウェルに比例するパーセント抑制に変換され、IC50値はGraphPad Prismソフトウエアを用いて計算される。IC50が1μM以下の化合物は活性と考えられる。
VEGFR2キナーゼアッセイ
25℃で1時間、黒色384ウェルポリスチレンプレートで40μL酵素の反応が起こる。ウェルにDMSO中の0.8μLの試験化合物を点在させる。アッセイ緩衝液は、50mMトリス、pH7.5、0.01%Tween−20、10mM MgCl2、1mM EGTA、5mM DTT、0.5μMビオチン−標識EQEDEPEGDYFEWLEペプチド基質(配列番号:1)、1mM ATP、及び0.1nM酵素(Milliporeカタログ番号14−630)を含有する。225nM LANCE Streptavidin Surelight(登録商標) APC(PerkinElmerカタログ番号CR130−100)及び4.5nM LANCE Eu−W1024抗ホスホチロシン(PY20)抗体(PerkinElmerカタログ番号AD0067)と20μL停止緩衝液(50mMトリス、pH=7.8、150mM NaCl、0.5mg/mL BSA、45mM EDTA)を添加することによって反応を停止する。室温で20分のインキュベーション後、PheraStar FSプレートリーダー(BMG Labtech)上でプレートを読む。GraphPad Prismを用いて変勾配のシグモイド用量反応方程式にデータを合わせることによってIC50値を計算することができる。IC50が1μM以下の化合物は活性と考えられる。
また、本願は、以下の発明も包含する。
[発明1]
式I:
WはNR9、O、またはCR10R11である;
R1はC1−6アルキル、C1−6ハロアルキル、またはC3−7シクロアルキルである;
R2、R3、及びR5はそれぞれ独立してH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、シクロプロピル、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)ORa、NRcC(O)NRcRd、C(=NRe)Rb、C(=NRe)NRcRd、NRcC(=NRe)NRcRd、NRcS(O)Rb、NRcS(O)2Rb、NRcS(O)2NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、及びS(O)2NRcRdから選択される;
R4はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、CN、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、C(=NRe1)Rb1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C3−7シクロアルキル、及び4〜7員ヘテロシクロアルキルがそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1から独立して選択される1、2または3個の置換基で置換されていてもよい;
R6はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、C(=NRe2)Rb2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、またはS(O)2NRc2Rd2である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
ここで、WがNR9である場合、R6はH以外である;
R6aはそれぞれCy1、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy1、ハロ、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択される1、2または3個の置換基で置換されていてもよい;
R7及びR8はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、−C(O)RA、S(O)RA、S(O)2RA、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R7aはそれぞれCy2、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy2、ハロ、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択される1、2または3個の置換基で置換されていてもよい;
R9はH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルであり、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR9aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R9aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルがそれぞれCy3、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
R10及びR11はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、C(=NRe4)Rb4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR10aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R10aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルはそれぞれCy2、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
またはR10及びR11はそれらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基または4、5、6または7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルはCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい;
RAはそれぞれH、C1−6アルキル、C1−6アルコキシ、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C1−6アルコキシ、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルはそれぞれR7aから独立して選択される1、2または3個の置換基で置換されていてもよい;
Cy1、Cy2、及びCy3はそれぞれC6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルから独立して選択され、それぞれがハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、3〜10員ヘテロシクロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、C(=NRe5)Rb5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基によって置換されていてもよい;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルはそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
Ra、Rb、Rc、及びRdはそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルはC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよい;
Ra1、Rb1、Rc1、Rd1、Ra2、Rb2、Rc2、Rd2、Ra3、Rb3、Rc3、Rd3、Ra4、Rb4、Rc4、及びRd4、Ra5、Rb5、Rc5、及びRd5はそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルはC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
またはいずれのRc及びRdもそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc1及びRd1もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc2及びRd2もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc3及びRd3もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc4及びRd4もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc5及びRd5もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
Re、Re1、Re2、Re3、Re4、及びRe5はそれぞれH、C1−4アルキル、CN、ORa6、SRb6、S(O)2Rb6、C(O)Rb6、S(O)2NRc6Rd6、及びC(O)NRc6Rd6から独立して選択される;
Ra6、Rb6、Rc6、及びRd6はそれぞれH、C1−4アルキル、C1−4ハロアルキル、C2−4アルケニル、及びC2−4アルキニルから独立して選択され、ここで、前記C1−4アルキル、C2−4アルケニル、及びC2−4アルキニルはOH、CN、アミノ、ハロ、C1−4アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;
またはいずれのRc6及びRd6もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、OH、CN、アミノ、ハロ、C1−6アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換:基で置換されていてもよい;
Re6はそれぞれH、C1−4アルキル、及びCNから独立して選択される]
で示される化合物またはその医薬上許容される塩。
[発明2]
式I:
WはNR9、O、またはCR10R11である;
R1はC1−6アルキル、C1−6ハロアルキル、またはC3−7シクロアルキルである;
R2、R3、及びR5はそれぞれH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、シクロプロピル、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)ORa、NRcC(O)NRcRd、C(=NRe)Rb、C(=NRe)NRcRd、NRcC(=NRe)NRcRd、NRcS(O)Rb、NRcS(O)2Rb、NRcS(O)2NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、及びS(O)2NRcRdから独立して選択される;
R4はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、CN、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、C(=NRe1)Rb1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C3−7シクロアルキル、及び4〜7員ヘテロシクロアルキルはそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、C(=NRe1)NRc1Rd1、NRc1C(=NRe1)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)ORa1、NRc1C(O)NRc1Rd1、NRc1S(O)Rb1、NRc1S(O)2Rb1、NRc1S(O)2NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、及びS(O)2NRc1Rd1から独立して選択される1、2または3個の置換基で置換されていてもよい;
R6はH、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、C(=NRe2)Rb2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、またはS(O)2NRc2Rd2である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルはそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
ここで、WがNR9である場合、R6はH以外である;
R6aはそれぞれCy1、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルはそれぞれCy1、ハロ、CN、NO2、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、C(=NRe2)NRc2Rd2、NRc2C(=NRe2)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)ORa2、NRc2C(O)NRc2Rd2、NRc2S(O)Rb2、NRc2S(O)2Rb2、NRc2S(O)2NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、及びS(O)2NRc2Rd2から独立して選択される1、2または3個の置換基で置換されていてもよい;
R7及びR8はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、−C(O)RA、S(O)RA、S(O)2RA、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルはそれぞれR7aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R7aはそれぞれCy2、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルはそれぞれCy2、ハロ、CN、NO2、ORa3、SRa3、C(O)Rb3、C(O)NRc3Rd3、C(O)ORa3、OC(O)Rb3、OC(O)NRc3Rd3、C(=NRe3)NRc3Rd3、NRc3C(=NRe3)NRc3Rd3、NRc3Rd3、NRc3C(O)Rb3、NRc3C(O)ORa3、NRc3C(O)NRc3Rd3、NRc3S(O)Rb3、NRc3S(O)2Rb3、NRc3S(O)2NRc3Rd3、S(O)Rb3、S(O)NRc3Rd3、S(O)2Rb3、及びS(O)2NRc3Rd3から独立して選択される1、2または3個の置換基で置換されていてもよい;
R9はH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルであり、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルはそれぞれR9aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R9aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルはそれぞれCy3、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
R10及びR11はそれぞれH、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、C(=NRe4)Rb4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルはそれぞれR10aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
R10aはそれぞれCy3、ハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、及びC2−6アルキニルはそれぞれCy2、ハロ、CN、NO2、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)ORa4、NRc4C(O)NRc4Rd4、NRc4S(O)Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよい;
またはR10及びR11はそれらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基または4、5、6または7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルはCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい;
RAはそれぞれH、C1−6アルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルはそれぞれR7aから独立して選択される1、2または3個の置換基で置換されていてもよい;
Cy1、Cy2、及びCy3はそれぞれC6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルから独立して選択され、それぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、3〜10員ヘテロシクロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、C(=NRe5)Rb5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基によって置換されていてもよい;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルはそれぞれハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6ハロアルキル、CN、NO2、ORa5、SRa5、C(O)Rb5、C(O)NRc5Rd5、C(O)ORa5、OC(O)Rb5、OC(O)NRc5Rd5、C(=NRe5)NRc5Rd5、NRc5C(=NRe5)NRc5Rd5、NRc5Rd5、NRc5C(O)Rb5、NRc5C(O)ORa5、NRc5C(O)NRc5Rd5、NRc5S(O)Rb5、NRc5S(O)2Rb5、NRc5S(O)2NRc5Rd5、S(O)Rb5、S(O)NRc5Rd5、S(O)2Rb5、及びS(O)2NRc5Rd5から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
Ra、Rb、Rc、及びRdはそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、及びシクロプロピルはC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよい;
Ra1、Rb1、Rc1、Rd1、Ra2、Rb2、Rc2、Rd2、Ra3、Rb3、Rc3、Rd3、Ra4、Rb4、Rc4、及びRd4、Ra5、Rb5、Rc5、及びRd5はそれぞれH、C1−6アルキル、C1−4ハロアルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルはC1−4アルキル、C1−4ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2、3、4または5個の置換基で置換されていてもよい;
またはいずれのRc及びRdもそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc1及びRd1もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc2及びRd2もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc3及びRd3もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc4及びRd4もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
またはいずれのRc5及びRd5もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはC1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、5〜6員ヘテロアリール、C1−6ハロアルキル、ハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキル、C3−7シクロアルキル、4〜7員ヘテロシクロアルキル、C6−10アリール、及び5〜6員ヘテロアリールはハロ、CN、ORa6、SRa6、C(O)Rb6、C(O)NRc6Rd6、C(O)ORa6、OC(O)Rb6、OC(O)NRc6Rd6、NRc6Rd6、NRc6C(O)Rb6、NRc6C(O)NRc6Rd6、NRc6C(O)ORa6、C(=NRe6)NRc6Rd6、NRc6C(=NRe6)NRc6Rd6、S(O)Rb6、S(O)NRc6Rd6、S(O)2Rb6、NRc6S(O)2Rb6、NRc6S(O)2NRc6Rd6、及びS(O)2NRc6Rd6から独立して選択される1、2または3個の置換基によって置換されていてもよい;
Re、Re1、Re2、Re3、Re4、及びRe5はそれぞれH、C1−4アルキル、CN、ORa6、SRb6、S(O)2Rb6、C(O)Rb6、S(O)2NRc6Rd6、及びC(O)NRc6Rd6から独立して選択される;
Ra6、Rb6、Rc6、及びRd6はそれぞれH、C1−4アルキル、C1−4ハロアルキル、C2−4アルケニル、及びC2−4アルキニルから独立して選択され、ここで、前記C1−4アルキル、C2−4アルケニル、及びC2−4アルキニルはOH、CN、アミノ、ハロ、C1−4アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;
またはいずれのRc6及びRd6もそれらが結合するN原子とともに4、5、6または7員ヘテロシクロアルキル基を形成し、これはOH、CN、アミノ、ハロ、C1−6アルキル、C1−4アルコキシ、C1−4アルキルチオ、C1−4アルキルアミノ、ジ(C1−4アルキル)アミノ、C1−4ハロアルキル、及びC1−4ハロアルコキシから独立して選択される1、2または3個の置換基で置換されていてもよい;
Re6はそれぞれH、C1−4アルキル、及びCNから独立して選択される]
で示される化合物またはその医薬上許容される塩。
[発明3]
WがNR9またはCR10R11である、発明1または2に記載の化合物またはその医薬上許容される塩。
[発明4]
WがNR9である、発明1または2に記載の化合物またはその医薬上許容される塩。
[発明5]
R9がC1−6アルキルである、発明1〜4のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明6]
R9がメチルである、発明1〜4のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明7]
R9がC6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルであり、ここで、前記C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR9aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜4のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明8]
R9がC6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、または(5〜10員ヘテロアリール)−C1−4アルキルであり、ここで、前記C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、C6−10アリール−C1−4アルキル、C3−10シクロアルキル−C1−4アルキル、及び(5〜10員ヘテロアリール)−C1−4アルキルがそれぞれハロ及びC1−4アルキルから独立して選択される1または2個の置換基で置換されていてもよい、発明1〜4のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明9]
R9がフェニル、2H−テトラゾール−5−イル、ベンジル、1H−ピラゾール−4−イルメチル、シクロペンチル、またはシクロプロピルメチルであり、それぞれがF及びメチルから独立して選択される1または2個の置換基で置換されていてもよい、発明1〜4のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明10]
WがCR10R11である、発明1または2に記載の化合物またはその医薬上許容される塩。
[発明11]
R10及びR11がそれぞれC1−6アルキルである、発明1〜3及び10のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明12]
R10及びR11がそれぞれメチルである、発明1〜3及び10のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明13]
R10及びR11が、それらが結合する炭素原子とともに3、4、5、6もしくは7員シクロアルキル基または4、5、6もしくは7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルがCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい、発明1〜3及び10のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明14]
R10及びR11が、それらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基を形成する、発明1〜3及び10のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明15]
R10及びR11が、それらが結合する炭素原子とともにシクロプロピル基を形成する、発明1〜3及び10のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明16]
R1がメチルである、発明1〜15のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明17]
R2がハロである、発明1〜16のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明18]
R2がフルオロである、発明1〜16のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明19]
R3がHである、発明1〜18のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明20]
R4がORa1である、発明1〜19のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明21]
R4がメトキシである、発明1〜19のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明22]
R5がハロである、発明1〜21のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明23]
R5がフルオロである、発明1〜21のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明24]
R6がHであり、WがCR10R11である、発明1〜3及び10〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明25]
R6がH、ハロ、C1−6アルキル、C2−6アルケニル、C6−10アリール、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、C6−10アリール、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明26]
R6がハロ、C1−6アルキル、C2−6アルケニル、C6−10アリール、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、C6−10アリール、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明27]
R6がC1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明28]
R6がハロ、C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、6員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、及び6員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明29]
R6がC1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、6員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、及び6員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明30]
R6がクロロ、メチル、エチル、CN、エトキシ、メトキシエトキシ、フェノキシ、2−(4−メチルピペラジン−1−イル)エトキシ、フェニル、4−フルオロフェニル、ベンジル、フェニルエチル、2−フェニルビニル、3,6−ジヒドロ−2H−ピラン−4−イル、3−ピリジル、4−ピリジル、1H−ピラゾール−4−イル、1−メチル−1H−ピラゾール−5−イル、1−メチル−1H−ピラゾール−4−イル、1−エチル−1H−ピラゾール−4−イル、1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル、または1−(ピペリジン−4−イル)−1H−ピラゾール−4−イルである、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明31]
R6がメチル、エチル、CN、エトキシ、メトキシエトキシ、フェノキシ、2−(4−メチルピペラジン−1−イル)エトキシ、フェニル、4−フルオロフェニル、ベンジル、フェネチル、2−フェニルビニル、3,6−ジヒドロ−2H−ピラン−4−イル、3−ピリジル、4−ピリジル、1H−ピラゾール−4−イル、1−メチル−1H−ピラゾール−5−イル、1−メチル−1H−ピラゾール−4−イル、1−エチル−1H−ピラゾール−4−イル、1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル、または1−(ピペリジン−4−イル)−1H−ピラゾール−4−イルである、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明32]
R6がメチルである、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明33]
R6が、R6aから独立して選択される1または2個の置換基で置換されていてもよいピラゾリルである、発明1〜23のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明34]
R7及びR8がそれぞれH、C1−6アルキル、−C(O)RA、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明1〜33のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明35]
R7及びR8がそれぞれH、2−ヒドロキシプロピル、−C(O)OCH3、3−フルオロフェニル、シクロプロピル、シクロブチル、3,3−ジフルオロシクロブチル、シクロペンチル、シクロヘキシル、4−ヒドロキシシクロヘキシル、メチル、1−メチル−1H−ピラゾール−4−イル、ピリジン−3−イル、N−メチルピペリジン−4−イル、テトラヒドロ−2H−ピラン−4−イル、テトラヒドロフラン−3−イル、1−フェニルエチル、(1−メチル−1H−ピラゾール−4−イル)メチル、2−モルホリノ−4−イルエチル、ピリジン−2−イルメチル、N−メチルピペラジン−1−イルエチル、及びテトラヒドロフラン−2−イルメチルから独立して選択される、発明1〜33のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明36]
R7及びR8のうちの1つがHである、発明1〜33のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明37
R7及びR8がそれぞれHである、発明1〜33のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明38]
式IIa:
[発明39]
R2がハロである、発明38に記載の化合物またはその医薬上許容される塩。
[発明40]
R2がフルオロである、発明38に記載の化合物またはその医薬上許容される塩。
[発明41]
R5がハロである、発明38〜40のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明42]
R5がフルオロである、発明38〜40のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明43]
R6がハロ、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明38〜42のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明44]
R6がC1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明38〜42のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明45]
R6がハロ、C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、6員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、及び6員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明38〜42のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明46]
R6がC1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、6員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、及び6員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明38〜42のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明47]
R6がクロロ、メチル、エチル、CN、エトキシ、メトキシエトキシ、フェノキシ、2−(4−メチルピペラジン−1−イル)エトキシ、フェニル、4−フルオロフェニル、ベンジル、フェニルエチル、2−フェニルビニル、3,6−ジヒドロ−2H−ピラン−4−イル、3−ピリジル、4−ピリジル、1H−ピラゾール−4−イル、1−メチル−1H−ピラゾール−5−イル、1−メチル−1H−ピラゾール−4−イル、1−エチル−1H−ピラゾール−4−イル、1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル、または1−(ピペリジン−4−イル)−1H−ピラゾール−4−イルである、発明38〜42のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明48]
R6がメチル、エチル、CN、エトキシ、メトキシエトキシ、フェノキシ、2−(4−メチルピペラジン−1−イル)エトキシ、フェニル、4−フルオロフェニル、ベンジル、フェネチル、2−フェニルビニル、3,6−ジヒドロ−2H−ピラン−4−イル、3−ピリジル、4−ピリジル、1H−ピラゾール−4−イル、1−メチル−1H−ピラゾール−5−イル、1−メチル−1H−ピラゾール−4−イル、1−エチル−1H−ピラゾール−4−イル、1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル、または1−(ピペリジン−4−イル)−1H−ピラゾール−4−イルである、発明38〜42のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明49]
R9がC1−6アルキルである、発明38〜48のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明50]
R9がメチルである、発明38〜48のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明51]
式IIb:
[発明52]
R6がハロ、C1−6アルキル、C2−6アルケニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明51に記載の化合物またはその医薬上許容される塩。
[発明53]
R6がC1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、CN、またはORa2である;ここで、前記C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、及び4〜10員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明51に記載の化合物またはその医薬上許容される塩。
[発明54]
R6がハロ、C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、6員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、及び6員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明51に記載の化合物またはその医薬上許容される塩。
[発明55]
R6がC1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、6員ヘテロシクロアルキル、CN、またはORa2であり;ここで、前記C1−6アルキル、C2−6アルケニル、フェニル、5〜6員ヘテロアリール、及び6員ヘテロシクロアルキルがそれぞれR6aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明51に記載の化合物またはその医薬上許容される塩。
[発明56]
R6がクロロ、メチル、エチル、CN、エトキシ、メトキシエトキシ、フェノキシ、2−(4−メチルピペラジン−1−イル)エトキシ、フェニル、4−フルオロフェニル、ベンジル、フェニルエチル、2−フェニルビニル、3,6−ジヒドロ−2H−ピラン−4−イル、3−ピリジル、4−ピリジル、1H−ピラゾール−4−イル、1−メチル−1H−ピラゾール−5−イル、1−メチル−1H−ピラゾール−4−イル、1−エチル−1H−ピラゾール−4−イル、1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル、または1−(ピペリジン−4−イル)−1H−ピラゾール−4−イルである、発明51に記載の化合物またはその医薬上許容される塩。
[発明57]
R6がメチル、エチル、CN、エトキシ、メトキシエトキシ、フェノキシ、2−(4−メチルピペラジン−1−イル)エトキシ、フェニル、4−フルオロフェニル、ベンジル、フェネチル、2−フェニルビニル、3,6−ジヒドロ−2H−ピラン−4−イル、3−ピリジル、4−ピリジル、1H−ピラゾール−4−イル、1−メチル−1H−ピラゾール−5−イル、1−メチル−1H−ピラゾール−4−イル、1−エチル−1H−ピラゾール−4−イル、1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル、または1−(ピペリジン−4−イル)−1H−ピラゾール−4−イルである、発明51に記載の化合物またはその医薬上許容される塩。
[発明58]
R9がC1−6アルキルである、発明51〜57のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明59]
R9がメチルである、発明51〜57のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明60]
式IIIa:
[発明61]
R2がハロである、発明60に記載の化合物またはその医薬上許容される塩。
[発明62]
R2がフルオロである、発明60に記載の化合物またはその医薬上許容される塩。
[発明63]
R5がハロである、発明60〜62のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明64]
R5がフルオロである、発明60〜62のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明65]
R6がHである、発明60〜64のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明66]
R10及びR11がともにC1−6アルキルである、発明60〜65のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明67]
R10及びR11がともにメチルである、発明60〜65のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明68]
R10及びR11がそれらが結合する炭素原子とともに3、4、5、6もしくは7員シクロアルキル基または4、5、6もしくは7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルがCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい、発明60〜65のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明69]
R10及びR11がそれらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基を形成する、発明60〜65のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明70]
R10及びR11がそれらが結合する炭素原子とともにシクロプロピル基を形成する、発明60〜65のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明71]
R7及びR8がそれぞれH、C1−6アルキル、−C(O)RA、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、C6−10アリール−C1−4アルキル、(5〜10員ヘテロアリール)−C1−4アルキル、または(4〜10員ヘテロシクロアルキル)−C1−4アルキルから独立して選択され、ここで、前記C1−6アルキル、C6−10アリール、C3−10シクロアルキル、5〜10員ヘテロアリール、4〜10員ヘテロシクロアルキル、(5〜10員ヘテロアリール)−C1−4アルキル、及び(4〜10員ヘテロシクロアルキル)−C1−4アルキルがそれぞれR7aから独立して選択される1、2、3、4または5個の置換基で置換されていてもよい、発明60〜70のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明72]
R7及びR8がそれぞれH、2−ヒドロキシプロピル、−C(O)OCH3、3−フルオロフェニル、シクロプロピル、シクロブチル、3,3−ジフルオロシクロブチル、シクロペンチル、シクロヘキシル、4−ヒドロキシシクロヘキシル、メチル、1−メチル−1H−ピラゾール−4−イル、ピリジン−3−イル、N−メチルピペリジン−4−イル、テトラヒドロ−2H−ピラン−4−イル、テトラヒドロフラン−3−イル、1−フェニルエチル、(1−メチル−1H−ピラゾール−4−イル)メチル、2−モルホリノ−4−イルエチル、ピリジン−2−イルメチル、N−メチルピペラジン−1−イルエチル、及びテトラヒドロフラン−2−イルメチルから独立して選択される、発明60〜70のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明73]
R7及びR8のうちの1つがHである、発明60〜70のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明74]
R7及びR8がそれぞれHである、発明60〜70のいずれか1つに記載の化合物またはその医薬上許容される塩。
[発明75]
式IIIb:
[発明76]
R6がHである、発明75に記載の化合物またはその医薬上許容される塩。
[発明77]
R10及びR11がともにC1−6アルキルである、発明75または76に記載の化合物またはその医薬上許容される塩。
[発明78]
R10及びR11がともにメチルである、発明75または76に記載の化合物またはその医薬上許容される塩。
[発明79]
R10及びR11が、それらが結合する炭素原子とともに3、4、5、6もしくは7員シクロアルキル基または4、5、6もしくは7員ヘテロシクロアルキル基を形成し、それぞれCy3、C1−6アルキル、C1−6ハロアルキル、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基で置換されていてもよく、ここで、前記C1−6アルキルがCy3、ハロ、CN、ORa4、SRa4、C(O)Rb4、C(O)NRc4Rd4、C(O)ORa4、OC(O)Rb4、OC(O)NRc4Rd4、NRc4Rd4、NRc4C(O)Rb4、NRc4C(O)NRc4Rd4、NRc4C(O)ORa4、C(=NRe4)NRc4Rd4、NRc4C(=NRe4)NRc4Rd4、S(O)Rb4、S(O)NRc4Rd4、S(O)2Rb4、NRc4S(O)2Rb4、NRc4S(O)2NRc4Rd4、及びS(O)2NRc4Rd4から独立して選択される1、2または3個の置換基によって置換されていてもよい、発明75または76に記載の化合物またはその医薬上許容される塩。
[発明80]
R10及びR11がそれらが結合する炭素原子とともに3、4、5、6または7員シクロアルキル基を形成する、発明75または76に記載の化合物またはその医薬上許容される塩。
[発明81]
R10及びR11がそれらが結合する炭素原子とともにシクロプロピル基を形成する、発明75または76に記載の化合物またはその医薬上許容される塩。
[発明82]
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1,8−ジメチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−エチル−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−エトキシ−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−(2−メトキシエトキシ)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−[2−(4−メチルピペラジン−1−イル)エトキシ]−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−フェノキシ−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−メチル−1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−エチル−1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−[1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル]−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1H−ピラゾール−4−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−(1−メチル−1H−ピラゾール−5−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−フェニル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−(4−フルオロフェニル)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−ピリジン−3−イル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−ピリジン−4−イル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−[(E)−2−フェニルビニル]−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−8−フェニルエチル−3,4−ジヒドロピリド−[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−8−ベンジル−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−(3,6−ジヒドロ−2H−ピラン−4−イル)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;及び
6−アミノ−2−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−4,4−ジメチル−1,2−ジヒドロ−2,7−ナフチリジン−3(4H)−オン
から選択される、発明1に記載の化合物または前記のいずれかの化合物の医薬上許容される塩。
[発明83]
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−[(2−モルホリン−4−イルエチル)アミノ]−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オン;
6’−アミノ−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(メチルアミノ)−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(テトラヒドロ−2H−ピラン−4−イルアミノ)−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オン;
(S)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(2−ヒドロキシプロピルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(ピリジン−2−イルメチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
(S)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(テトラヒドロフラン−3−イルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(2−(4−メチルピペラジン−1−イル)エチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
メチル2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−3’−オキソ−2’,3’−ジヒドロ−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−6’−イルカルバメート;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(ピリジン−3−イルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(3−フルオロフェニルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
6’−(シクロペンチルアミノ)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
(S)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−((テトラヒドロフラン−2−イル)メチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(1−メチル−1H−ピラゾール−4−イルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−((1−メチル−1H−ピラゾール−4−イル)メチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
(R)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(1−フェニルエチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
6’−(シクロヘキシルアミノ)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(トランス−4−ヒドロキシシクロヘキシルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
6’−(シクロプロピルアミノ)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
6’−(シクロブチルアミノ)−2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(3,3−ジフルオロシクロブチルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−(1−メチルピペリジン−4−イルアミノ)−1’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’(2’H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−(2−フルオロフェニル)−8−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−メチル−1−(2−メチル−2H−テトラゾール−5−イル)−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−8−メチル−1−[(1−メチル−1H−ピラゾール−4−イル)メチル]−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン;
メチル[3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1,8−ジメチル−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−7−イル]カルバメート;
7−アミノ−1−(シクロプロピルメチル)−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル;
7−アミノ−1−シクロペンチル−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−[(1−メチル−1H−ピラゾール−4−イル)メチル]−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル;
7−アミノ−1−(3,5−ジフルオロベンジル)−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル;
7−アミノ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−(2−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロピリド[4,3−d]ピリミジン−8−カルボニトリル;及び
7−アミノ−8−クロロ−3−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−1−メチル−3,4−ジヒドロピリド[4,3−d]ピリミジン−2(1H)−オン
から選択される、発明1に記載の化合物または前記のいずれかの化合物の医薬上許容される塩。
[発明84]
発明1〜83のいずれか1つに記載の化合物またはその医薬上許容される塩、及び少なくとも1つの医薬上許容される担体を含む医薬組成物。
[発明85]
FGFR酵素を発明1〜83のいずれか1つに記載の化合物またはその医薬上許容される塩と接触させることを含む、前記FGFR酵素を抑制する方法。
[発明86]
発明1〜83のいずれか1つに記載の化合物またはその医薬上許容される塩の治療有効量を患者に投与することを含む、患者の癌を治療する方法。
[発明87]
前記癌が膀胱癌、乳癌、子宮頸癌、大腸癌、子宮内膜癌、胃癌、頭頚部癌、腎臓癌、肝臓癌、肺癌、卵巣癌、前立腺癌、食道癌、胆嚢癌、膵癌、甲状腺癌、皮膚癌.白血病、多発性骨髄腫、慢性リンパ球性リンパ腫、成人T細胞白血病、B−細胞リンパ腫、急性骨髄性白血病、ホジキンまたは非ホジキンリンパ腫、ワルデンシュトレームマクログロブリン血症、有毛細胞リンパ腫、バーキットリンパ腫、膠芽腫、黒色腫、及び横紋筋肉腫から選択される、発明86に記載の方法。
[発明88]
発明1〜83のいずれか1つに記載の化合物またはその医薬上許容される塩の治療有効量を患者に投与することを含む、患者の骨髄増殖性疾患を治療する方法。
[発明89]
前記骨髄増殖性疾患が真性赤血球増加症、本態性血小板血症、及び原発性骨髄線維症から選択される、発明88に記載の方法。
[発明90]
発明1〜83のいずれか1つに記載の化合物またはその医薬上許容される塩の治療有効量を患者に投与することを含む、患者の骨格または軟骨細胞障害を治療する方法。
[発明91]
前記骨格または軟骨細胞障害が軟骨無形成症、軟骨低形成症、低身長症、致死性骨異形成症(TD)、アペール症候群、クルーゾン症候群、ジャクソン・ワイス症候群、ベーレ・スティーブンソン脳回状頭皮症候群、ファイファー症候群、及び頭蓋骨癒合症候群から選択される、発明90に記載の方法。
[発明92]
発明1〜83のいずれか1つに記載の化合物またはその医薬上許容される塩の治療有効量を患者に投与することを含む、患者の低リン血性障害を治療する方法。
[発明93]
前記低リン血性障害がX連鎖性低リン血性くる病、常染色体劣性低リン血性くる病、常染色体優性低リン血性くる病、または腫瘍性骨軟化症である、発明92に記載の方法。
Claims (32)
- 2’−(2,6−ジフルオロ−3,5−ジメトキシフェニル)−6’−[(2−モルホリン−4−イルエチル)アミノ]−1’,2’−ジヒドロ−3’H−スピロ[シクロプロパン−1,4’−[2,7]ナフチリジン]−3’−オンである化合物またはその医薬上許容される塩とさらなる治療薬剤とを含む組合せ医薬であって、癌の治療を必要とする患者に、該化合物またはその医薬上許容される塩と該さらなる治療薬剤とを、単一の投与形態で投与するかまたは分離投与形態として同時にもしくは連続的に投与することによる癌治療に用いるための組合せ医薬であり、
該さらなる治療薬剤が、
i)抗−ホルモン剤;
ii)EGFR、Her2、VEGFR、c−Met、Ret、IGFR1またはFlt−3に対する抑制剤または抗体、及び癌−関連融合タンパク質キナーゼに対する抑制剤または抗体;
iii)PI3キナーゼに対する薬剤;
iv)mTORの抑制剤;
v)アルキル化剤;
vi)白金系ダブレット;
vii)代謝拮抗剤;
viii)細胞毒性物質;
ix)免疫療法薬剤;
x)共刺激分子に対する抗体治療薬;
ix)抗癌ワクチン;ならびに
xii)ビンブラスチン、ビンクリスチン、ビンデシン、ブレオマイシン、ダクチノマイシン、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、ara−C、パクリタキセル、ミトラマイシン、デオキシコホルマイシン、マイトマイシン−C、L−アスパラギナーゼ、インターフェロン、エトポシド、及びテニポシド
から選択される、組合せ医薬。 - 癌が、腎臓癌、胃癌、食道癌、多発性骨髄腫、膵臓癌、肺癌、前立腺癌、乳癌、膀胱癌、肝臓癌、真性赤血球増加症、本態性血小板血症、原発性骨髄線維症、頭頚部癌、卵巣癌、および膠芽腫から選択される、請求項1に記載の組合せ医薬。
- 癌が、腎臓癌である、請求項1または2に記載の組合せ医薬。
- 癌が、胃癌である、請求項1または2に記載の組合せ医薬。
- 癌が、食道癌である、請求項1または2に記載の組合せ医薬。
- 癌が、多発性骨髄腫である、請求項1または2に記載の組合せ医薬。
- 癌が、膵臓癌である、請求項1または2に記載の組合せ医薬。
- 癌が、肺癌である、請求項1または2に記載の組合せ医薬。
- 癌が、前立腺癌である、請求項1または2に記載の組合せ医薬。
- 癌が、乳癌である、請求項1または2に記載の組合せ医薬。
- 癌が、膀胱癌である、請求項1または2に記載の組合せ医薬。
- 癌が、肝臓癌である、請求項1または2に記載の組合せ医薬。
- 癌が、真性赤血球増加症である、請求項1または2に記載の組合せ医薬。
- 癌が、本態性血小板血症である、請求項1または2に記載の組合せ医薬。
- 癌が、原発性骨髄線維症である、請求項1または2に記載の組合せ医薬。
- 癌が、頭頚部癌である、請求項1または2に記載の組合せ医薬。
- 癌が、卵巣癌である、請求項1または2に記載の組合せ医薬。
- 癌が、膠芽腫である、請求項1または2に記載の組合せ医薬。
- さらなる治療薬剤が、抗−ホルモン剤である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、EGFR、Her2、VEGFR、c−Met、Ret、IGFR1またはFlt−3に対する抑制剤または抗体、及び癌−関連融合タンパク質キナーゼに対する抑制剤または抗体から選択される、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、PI3キナーゼに対する薬剤である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、mTORの抑制剤である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、アルキル化剤である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が白金系ダブレットである、請求項1〜18のいずれか1項に記載の組合せ医薬。
- 白金系ダブレットが、シスプラチンとゲムシタビンとの、カルボプラチンとゲムシタビンとの、シスプラチンとドセタキセルとの、カルボプラチンとドセタキセルとの、シスプラチンとパクリタキセルとの、カルボプラチンとパクリタキセルとの、シスプラチンとペメトレキセドとの、カルボプラチンとペメトレキセドとの、およびゲムシタビンとパクリタキセルとの結合粒子から選択される、請求項24に記載の組合せ医薬。
- さらなる治療薬剤が、代謝拮抗剤である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、細胞毒性物質である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、免疫療法薬剤である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- 免疫療法薬剤が、インターフェロンα、インターロイキン2、及び腫瘍壊死因子(TNF)から選択される、請求項28に記載の組合せ医薬。
- さらなる治療薬剤が、共刺激分子に対する抗体治療薬である、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、抗癌ワクチンである、請求項1〜18のいずれか1項に記載の組合せ医薬。
- さらなる治療薬剤が、ビンブラスチン、ビンクリスチン、ビンデシン、ブレオマイシン、ダクチノマイシン、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、ara−C、パクリタキセル、ミトラマイシン、デオキシコホルマイシン、マイトマイシン−C、L−アスパラギナーゼ、インターフェロン、エトポシド、及びテニポシドから選択される、請求項1〜18のいずれか1項に記載の組合せ医薬。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361813782P | 2013-04-19 | 2013-04-19 | |
| US61/813,782 | 2013-04-19 | ||
| JP2018228352A JP6698799B2 (ja) | 2013-04-19 | 2018-12-05 | Fgfr抑制剤としての二環式複素環 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018228352A Division JP6698799B2 (ja) | 2013-04-19 | 2018-12-05 | Fgfr抑制剤としての二環式複素環 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020128396A JP2020128396A (ja) | 2020-08-27 |
| JP6903790B2 true JP6903790B2 (ja) | 2021-07-14 |
Family
ID=50983108
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016509131A Active JP6449244B2 (ja) | 2013-04-19 | 2014-04-18 | Fgfr抑制剤としての二環式複素環 |
| JP2018228352A Active JP6698799B2 (ja) | 2013-04-19 | 2018-12-05 | Fgfr抑制剤としての二環式複素環 |
| JP2020079472A Active JP6903790B2 (ja) | 2013-04-19 | 2020-04-28 | Fgfr抑制剤としての二環式複素環 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016509131A Active JP6449244B2 (ja) | 2013-04-19 | 2014-04-18 | Fgfr抑制剤としての二環式複素環 |
| JP2018228352A Active JP6698799B2 (ja) | 2013-04-19 | 2018-12-05 | Fgfr抑制剤としての二環式複素環 |
Country Status (35)
| Country | Link |
|---|---|
| US (5) | US9533984B2 (ja) |
| EP (2) | EP2986610B9 (ja) |
| JP (3) | JP6449244B2 (ja) |
| KR (2) | KR102469849B1 (ja) |
| CN (3) | CN109912594A (ja) |
| AR (1) | AR096097A1 (ja) |
| AU (3) | AU2014253798C1 (ja) |
| BR (1) | BR112015026307B1 (ja) |
| CA (2) | CA3130452C (ja) |
| CL (1) | CL2015003089A1 (ja) |
| CR (1) | CR20150578A (ja) |
| CY (1) | CY1120556T1 (ja) |
| DK (1) | DK2986610T5 (ja) |
| EA (2) | EA202090516A3 (ja) |
| EC (1) | ECSP15048555A (ja) |
| ES (2) | ES2893725T3 (ja) |
| HK (2) | HK1255159A1 (ja) |
| HR (1) | HRP20180365T2 (ja) |
| HU (1) | HUE036571T2 (ja) |
| IL (2) | IL241982B (ja) |
| LT (1) | LT2986610T (ja) |
| ME (1) | ME03015B (ja) |
| MX (2) | MX367878B (ja) |
| MY (1) | MY181497A (ja) |
| NO (1) | NO3087075T3 (ja) |
| PE (1) | PE20152033A1 (ja) |
| PH (2) | PH12015502383A1 (ja) |
| PL (1) | PL2986610T4 (ja) |
| PT (1) | PT2986610T (ja) |
| RS (1) | RS56924B9 (ja) |
| SG (2) | SG11201508328PA (ja) |
| SI (1) | SI2986610T1 (ja) |
| TW (2) | TWI649318B (ja) |
| UA (1) | UA120087C2 (ja) |
| WO (1) | WO2014172644A2 (ja) |
Families Citing this family (49)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| NZ702747A (en) | 2012-06-13 | 2017-03-31 | Incyte Holdings Corp | Substituted tricyclic compounds as fgfr inhibitors |
| WO2014026125A1 (en) | 2012-08-10 | 2014-02-13 | Incyte Corporation | Pyrazine derivatives as fgfr inhibitors |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| EP2986610B9 (en) | 2013-04-19 | 2018-10-17 | Incyte Holdings Corporation | Bicyclic heterocycles as fgfr inhibitors |
| WO2015008839A1 (ja) | 2013-07-18 | 2015-01-22 | 大鵬薬品工業株式会社 | Fgfr阻害剤の間歇投与用抗腫瘍剤 |
| US10124003B2 (en) | 2013-07-18 | 2018-11-13 | Taiho Pharmaceutical Co., Ltd. | Therapeutic agent for FGFR inhibitor-resistant cancer |
| AU2014338549B2 (en) | 2013-10-25 | 2017-05-25 | Novartis Ag | Ring-fused bicyclic pyridyl derivatives as FGFR4 inhibitors |
| US20180185341A1 (en) | 2014-10-03 | 2018-07-05 | Novartis Ag | Use of ring-fused bicyclic pyridyl derivatives as fgfr4 inhibitors |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US20160115164A1 (en) * | 2014-10-22 | 2016-04-28 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| US9694084B2 (en) | 2014-12-23 | 2017-07-04 | Dana-Farber Cancer Institute, Inc. | Methods to induce targeted protein degradation through bifunctional molecules |
| WO2016134294A1 (en) | 2015-02-20 | 2016-08-25 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| US9708318B2 (en) * | 2015-02-20 | 2017-07-18 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| US9802917B2 (en) | 2015-03-25 | 2017-10-31 | Novartis Ag | Particles of N-(5-cyano-4-((2-methoxyethyl)amino)pyridin-2-yl)-7-formyl-6-((4-methyl-2-oxopiperazin-1-yl)methyl)-3,4-dihydro-1,8-naphthyridine-1(2H)-carboxamide |
| AU2016240841C1 (en) | 2015-03-31 | 2018-05-17 | Taiho Pharmaceutical Co., Ltd. | Crystal of 3,5-disubstituted benzene alkynyl compound |
| US11883404B2 (en) | 2016-03-04 | 2024-01-30 | Taiho Pharmaceuticals Co., Ltd. | Preparation and composition for treatment of malignant tumors |
| EP3424505A4 (en) * | 2016-03-04 | 2019-10-16 | Taiho Pharmaceutical Co., Ltd. | PREPARATION AND COMPOSITION FOR TREATING MALIGNANT TUMORS |
| JP7008064B2 (ja) * | 2016-05-27 | 2022-01-25 | 杭州英創医薬科技有限公司 | Fgfr4阻害剤としてのヘテロ環式化合物 |
| CN107459519A (zh) * | 2016-06-06 | 2017-12-12 | 上海艾力斯医药科技有限公司 | 稠合嘧啶哌啶环衍生物及其制备方法和应用 |
| US11192890B2 (en) * | 2017-03-03 | 2021-12-07 | Auckland Uniservices Limited | FGFR kinase inhibitors and pharmaceutical uses |
| WO2018218197A2 (en) * | 2017-05-26 | 2018-11-29 | Board Of Regents, The University Of Texas System | Tetrahydropyrido[4,3-d]pyrimidine inhibitors of atr kinase |
| AR111960A1 (es) * | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| FI3651768T3 (fi) | 2017-07-13 | 2024-03-14 | Univ Texas | Heterosyklisiä ATR-kinaasin inhibiittoreita |
| JP7341156B2 (ja) | 2018-03-16 | 2023-09-08 | ボード オブ レジェンツ,ザ ユニバーシティ オブ テキサス システム | Atrキナーゼの複素環式阻害剤 |
| WO2019181876A1 (ja) | 2018-03-19 | 2019-09-26 | 大鵬薬品工業株式会社 | アルキル硫酸ナトリウムを含む医薬組成物 |
| CR20200591A (es) | 2018-05-04 | 2021-03-31 | Incyte Corp | Sales de un inhibidor de fgfr |
| IL312465A (en) | 2018-05-04 | 2024-06-01 | Incyte Corp | FGFR inhibitor solid forms and processes for their preparation |
| WO2020185532A1 (en) | 2019-03-08 | 2020-09-17 | Incyte Corporation | Methods of treating cancer with an fgfr inhibitor |
| BR112021018168B1 (pt) | 2019-03-21 | 2023-11-28 | Onxeo | Composição farmacêutica, combinação e kit compreendendo uma molécula dbait e um inibidor de quinase para o tratamento de câncer |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| TW202128685A (zh) | 2019-10-14 | 2021-08-01 | 美商英塞特公司 | 作為fgfr抑制劑之雙環雜環 |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| GB201915828D0 (en) * | 2019-10-31 | 2019-12-18 | Cancer Research Tech Ltd | Compounds, compositions and therapeutic uses thereof |
| US20220401436A1 (en) | 2019-11-08 | 2022-12-22 | INSERM (Institute National de la Santé et de la Recherche Médicale) | Methods for the treatment of cancers that have acquired resistance to kinase inhibitors |
| EP4069696A1 (en) | 2019-12-04 | 2022-10-12 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| US11407750B2 (en) | 2019-12-04 | 2022-08-09 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| WO2021146424A1 (en) | 2020-01-15 | 2021-07-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| CN115715201A (zh) * | 2020-03-02 | 2023-02-24 | 约翰霍普金斯大学 | 葡萄糖雷公藤甲素缀合物及其用途 |
| CN111960932B (zh) * | 2020-09-16 | 2022-11-08 | 沈阳药科大学 | 二氯雷琐酚类化合物及其制备方法和医药用途 |
| JP2024513575A (ja) | 2021-04-12 | 2024-03-26 | インサイト・コーポレイション | Fgfr阻害剤及びネクチン-4標的化剤を含む併用療法 |
| JP2024522189A (ja) | 2021-06-09 | 2024-06-11 | インサイト・コーポレイション | Fgfr阻害剤としての三環式ヘテロ環 |
| CN113527311B (zh) * | 2021-08-23 | 2022-05-06 | 中南大学湘雅医院 | Fgfr4抑制剂、组合物及其在药物制备中的用途 |
| WO2023039828A1 (en) * | 2021-09-17 | 2023-03-23 | Nutshell Biotech (Shanghai) Co., Ltd. | Fused ring compounds as inhibitors of fgfr4 tyrosine kinases |
| WO2023091746A1 (en) | 2021-11-22 | 2023-05-25 | Incyte Corporation | Combination therapy comprising an fgfr inhibitor and a kras inhibitor |
| WO2024206858A1 (en) | 2023-03-30 | 2024-10-03 | Revolution Medicines, Inc. | Compositions for inducing ras gtp hydrolysis and uses thereof |
Family Cites Families (811)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE280853C (ja) | ||||
| US850370A (en) | 1906-06-05 | 1907-04-16 | William L Hynes | Water-automobile. |
| DE2156720A1 (de) | 1971-11-16 | 1973-05-24 | Bayer Ag | Pyrimido eckige klammer auf 4,5-d eckige klammer zu pyrimidine |
| US3894021A (en) | 1974-01-28 | 1975-07-08 | Squibb & Sons Inc | Derivatives of 1,7-dihydro-2H-pyrazolo{8 4{40 ,3{40 :5,6{9 pyrido{8 4,3-D{9 pyrimidine-2,4-(3H)-diones |
| JPS5120580B2 (ja) | 1974-06-19 | 1976-06-25 | ||
| JPS5120580A (en) | 1974-08-08 | 1976-02-18 | Nitto Electric Ind Co | 4 futsukaechirenjugotaihifukudensenno seizohoho |
| US4347348A (en) | 1978-06-05 | 1982-08-31 | Chernikhov Alexei Y | Heat-resistant heterocyclic polymers and methods for producing same |
| FR2428654A1 (fr) | 1978-06-13 | 1980-01-11 | Chernikhov Alexei | Polymeres heterocycliques thermostables et leurs procedes de preparation |
| CH641470A5 (de) | 1978-08-30 | 1984-02-29 | Ciba Geigy Ag | Imidgruppen enthaltende silane. |
| CH635828A5 (de) | 1978-08-30 | 1983-04-29 | Ciba Geigy Ag | N-substituierte imide und bisimide. |
| US4339267A (en) | 1980-01-18 | 1982-07-13 | E. I. Du Pont De Nemours And Company | Herbicidal sulfonamides |
| US4405519A (en) | 1980-10-22 | 1983-09-20 | Plastics Engineering Company | Di-Acetylene-terminated polyimide derivatives |
| US4402878A (en) | 1980-10-22 | 1983-09-06 | Plastics Engineering Company | Addition products of di-acetylene-terminated polyimide derivatives with a polyimide having terminal non-conjugated acetylene groups |
| US4405786A (en) | 1980-10-22 | 1983-09-20 | Plastics Engineering Company | Addition products of di-acetylene-terminated polyimide derivatives and an dienophile having ethylene groups |
| US4405520A (en) | 1980-10-22 | 1983-09-20 | Plastics Engineering Company | Addition products of di-acetylene-terminated polymide derivatives and dienophiles having terminal maleimide grops |
| JPS5857170A (ja) | 1981-09-30 | 1983-04-05 | シャープ株式会社 | 学習機 |
| JPS5873576U (ja) | 1981-11-12 | 1983-05-18 | 沖電気工業株式会社 | コネクタのロツク構造 |
| US4460773A (en) | 1982-02-05 | 1984-07-17 | Lion Corporation | 1-Phenyl-1H-pyrazolo [3,4-b]pyrazine derivatives and process for preparing same |
| JPS5926040U (ja) | 1982-08-12 | 1984-02-17 | 井出 正一 | ロ−プ掛締付け器 |
| DE3432983A1 (de) | 1983-09-07 | 1985-04-18 | Lion Corp., Tokio/Tokyo | 1,5-disubstituierte 1h-pyrazolo(3,4-b)-pyrazin-derivate und antitumormittel, die diese enthalten |
| JPH029895Y2 (ja) | 1984-11-08 | 1990-03-12 | ||
| JPH0348656Y2 (ja) | 1985-05-10 | 1991-10-17 | ||
| JPS62273979A (ja) | 1986-05-21 | 1987-11-28 | Lion Corp | 1,5−置換−1H−ピラゾロ〔3,4−b〕ピラジン誘導体及び該化合物を含有する抗腫瘍剤 |
| JPS6310630A (ja) | 1986-06-23 | 1988-01-18 | Teijin Ltd | 芳香族ポリアミドイミドエ−テルの製造法 |
| JPS6317882A (ja) | 1986-07-09 | 1988-01-25 | Lion Corp | 5−置換−1H−ピラゾロ〔3,4−b〕ピラジン誘導体及び該化合物を含有する抗腫瘍剤 |
| US4859672A (en) | 1986-10-29 | 1989-08-22 | Rorer Pharmaceutical Corporation | Pyrido[2,3-d]pyrimidinone and imidazo[4,5-b]pyrimidinone |
| US4874803A (en) | 1987-09-21 | 1989-10-17 | Pennwalt Corporation | Dianhydride coupled polymer stabilizers |
| DE3814549A1 (de) | 1987-10-30 | 1989-05-18 | Bayer Ag | N-substituierte derivate von 1-desoxynojirimycin und 1-desoxymannonojirimycin, verfahren zu deren herstellung und deren verwendung in arzneimitteln |
| JPH029895A (ja) | 1988-06-28 | 1990-01-12 | Lion Corp | ヌクレオシド類似化合物及び抗腫瘍剤 |
| DD280853A1 (de) | 1989-03-21 | 1990-07-18 | Akad Nauk Sssr | Bindemittel fuer elektroden, vorzugsweise fuer polymerelektroden |
| US5159054A (en) | 1989-05-16 | 1992-10-27 | The United States Of America As Represented By The Secretary Of The Navy | Synthesis of phthalonitrile resins containing ether and imide linkages |
| JP2845957B2 (ja) | 1989-07-17 | 1999-01-13 | 三井化学株式会社 | イミド環を有する新規ジフェノール類およびその製造方法 |
| US5726302A (en) | 1989-09-15 | 1998-03-10 | Gensia Inc. | Water soluble adenosine kinase inhibitors |
| DE3937633A1 (de) | 1989-11-11 | 1991-05-16 | Bayer Ag | Heterocyclische verbindungen und deren verwendung als pigmente und farbstoffe |
| WO1991009835A1 (de) | 1989-12-28 | 1991-07-11 | Hoechst Aktiengesellschaft | Biskationische säureamid- und -imidderivative und verfahren zu ihrer herstellung |
| DE59009701D1 (de) | 1989-12-28 | 1995-10-26 | Hoechst Ag | Biskationische säureamid- und -imidderivate als ladungssteuermittel. |
| JP2883670B2 (ja) | 1990-03-23 | 1999-04-19 | 三井化学株式会社 | イミド環を有する新規ビスフェノール類およびその製造方法 |
| GB9113137D0 (en) | 1990-07-13 | 1991-08-07 | Ici Plc | Thioxo heterocycles |
| CA2093322C (en) | 1990-10-03 | 2002-01-29 | Jonathan H. Hodgkin | Epoxy resins based on diaminobisimide compounds |
| JPH04158084A (ja) | 1990-10-22 | 1992-06-01 | Fuji Photo Film Co Ltd | 記録材料 |
| JPH04179576A (ja) | 1990-11-14 | 1992-06-26 | Fuji Photo Film Co Ltd | 記録材料 |
| JPH04328121A (ja) | 1991-04-26 | 1992-11-17 | Sumitomo Bakelite Co Ltd | 半導体封止用エポキシ樹脂組成物 |
| JP3147902B2 (ja) | 1991-06-14 | 2001-03-19 | ファルマシア・アンド・アップジョン・カンパニー | イミダゾ〔1,5−a〕キノキサリン |
| DE4119767A1 (de) | 1991-06-15 | 1992-12-17 | Dresden Arzneimittel | Verfahren zur herstellung von (pyrimid-2-yl-thio- bzw. seleno)-essigsaeurederivaten |
| US5521184A (en) | 1992-04-03 | 1996-05-28 | Ciba-Geigy Corporation | Pyrimidine derivatives and processes for the preparation thereof |
| JP3279635B2 (ja) | 1992-05-18 | 2002-04-30 | 鐘淵化学工業株式会社 | ヒドロシリル基含有イミド化合物 |
| JP3232123B2 (ja) | 1992-05-20 | 2001-11-26 | 鐘淵化学工業株式会社 | 硬化性組成物 |
| WO1993024488A1 (en) | 1992-05-28 | 1993-12-09 | Commonwealth Scientific And Industrial Research Organisation | Bismaleimide compounds |
| NZ258488A (en) | 1992-12-07 | 1997-02-24 | Commw Scient Ind Res Org | Preparation of bisnadimides (n,n'-bis(aryl)aryl diimides) from an n,n'-bis (aminoaryl)aryldiimide and nadic acid; curable compositions and fibre reinforced cured composites |
| JPH08506189A (ja) | 1993-01-11 | 1996-07-02 | ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア | 非線形光学的性質を有する多環式芳香族化合物 |
| WO1994025438A1 (en) | 1993-04-28 | 1994-11-10 | The Du Pont Merck Pharmaceutical Company | Novel trisubstituted aromatic amines useful for the treatment of cognitive deficits |
| US5536725A (en) | 1993-08-25 | 1996-07-16 | Fmc Corporation | Insecticidal substituted-2,4-diamino-5,6,7,8-tetrahydroquinazolines |
| DK0731795T3 (da) | 1993-11-30 | 2000-05-15 | Searle & Co | Substituerede pyrazolylbenzensulfonamider til behandling af inflammation |
| WO1995020965A1 (en) | 1994-02-02 | 1995-08-10 | Eli Lilly And Company | Hiv protease inhibitors and intermediates |
| US5480887A (en) | 1994-02-02 | 1996-01-02 | Eli Lilly And Company | Protease inhibitors |
| PL181893B1 (pl) | 1994-11-14 | 2001-10-31 | Warner Lambert Co | Zwiazki bedace pochodnymi pirymidyny i naftyrydyny oraz preparat farmaceutyczny zawierajacy je PL PL PL |
| US7067664B1 (en) | 1995-06-06 | 2006-06-27 | Pfizer Inc. | Corticotropin releasing factor antagonists |
| US5783577A (en) | 1995-09-15 | 1998-07-21 | Trega Biosciences, Inc. | Synthesis of quinazolinone libraries and derivatives thereof |
| JPH09188812A (ja) | 1996-01-11 | 1997-07-22 | Mitsui Toatsu Chem Inc | 結晶化促進剤 |
| WO1997047601A1 (fr) | 1996-06-11 | 1997-12-18 | Yoshitomi Pharmaceutical Industries, Ltd. | Composes heterocycliques fusionnes et leurs utilisations medicinales |
| CN1093130C (zh) | 1996-08-06 | 2002-10-23 | 辉瑞大药厂 | 被取代的吡啶并6,6-二环衍生物 |
| JP2000516611A (ja) | 1996-08-14 | 2000-12-12 | ワーナー―ランバート・コンパニー | Mcp―1アンタゴニストとしての2―フェニルベンズイミダゾール誘導体 |
| JP3669783B2 (ja) | 1996-08-21 | 2005-07-13 | 三井化学株式会社 | 有機電界発光素子 |
| US5994364A (en) | 1996-09-13 | 1999-11-30 | Schering Corporation | Tricyclic antitumor farnesyl protein transferase inhibitors |
| WO1998018781A2 (en) | 1996-10-28 | 1998-05-07 | Versicor, Inc. | Fused 2,4-pyrimidinedione combinatorial libraries, their preparation and the use of fused 2,4-pyrimidinediones derivatives as antimicrobial agents |
| JP2001507349A (ja) | 1996-12-23 | 2001-06-05 | セルテック セラピューティックス リミテッド | 縮合多環式2−アミノピリミジン誘導体、それらの製造およびたんぱく質チロシンキナーゼ抑制因子としてのそれらの使用 |
| ATE391719T1 (de) | 1997-02-05 | 2008-04-15 | Warner Lambert Co | Pyrido (2,3-d) pyrimidine und 4-amino-primidine als inhibitoren der zellulären proliferation |
| EP0973777A1 (en) | 1997-04-11 | 2000-01-26 | Abbott Laboratories | Furopyridine, thienopyridine, pyrrolopyridine and related pyrimidine, pyridazine and triazine compounds useful in controlling chemical synaptic transmission |
| SK158199A3 (en) | 1997-05-28 | 2000-06-12 | Rhone Poulenc Rorer Pharma | QUINOLINE AND QUINOXALINE COMPOUNDS WHICH INHIBIT PLATELET-DERIVED GROWTH FACTOR AND/OR p56lck TYROSINE KINASES |
| GB9716231D0 (en) | 1997-07-31 | 1997-10-08 | Amersham Int Ltd | Base analogues |
| NZ502877A (en) | 1997-08-11 | 2001-11-30 | Cor Therapeutics Inc | Bicyclic aryl azepinone selective factor Xa inhibitors for treating thrombosis related diseases |
| JP4965021B2 (ja) | 1997-08-20 | 2012-07-04 | ワーナー−ランバート カンパニー リミテッド ライアビリティー カンパニー | プロテインチロシンキナーゼおよび細胞周期キナーゼ仲介細胞増殖を阻害するためのナフチリジノン |
| US6465484B1 (en) | 1997-09-26 | 2002-10-15 | Merck & Co., Inc. | Angiogenesis inhibitors |
| JPH11171865A (ja) | 1997-12-04 | 1999-06-29 | Yoshitomi Pharmaceut Ind Ltd | 縮合ヘテロ環化合物 |
| AU4481899A (en) | 1998-02-20 | 1999-09-06 | Takeda Chemical Industries Ltd. | Aminoguanidine hydrazone derivatives, process for producing the same and drugs thereof |
| JP2002515490A (ja) | 1998-05-15 | 2002-05-28 | ギルフォード ファーマシューティカルズ インコーポレイテッド | Parp活性を抑制する縮合三環化合物 |
| EP1080092B1 (en) * | 1998-05-26 | 2008-07-23 | Warner-Lambert Company LLC | Bicyclic pyrimidines and bicyclic 3,4-dihydropyrimidines as inhibitors of cellular proliferation |
| US20040044012A1 (en) * | 1998-05-26 | 2004-03-04 | Dobrusin Ellen Myra | Bicyclic pyrimidines and bicyclic 3,4-dihydropyrimidines as inhibitors of cellular proliferation |
| EP1086085A1 (en) | 1998-06-12 | 2001-03-28 | Vertex Pharmaceuticals Incorporated | INHIBITORS OF p38 |
| DE69942097D1 (de) | 1998-08-11 | 2010-04-15 | Novartis Ag | Isochinoline derivate mit angiogenesis-hemmender wirkung |
| JP2000123973A (ja) | 1998-10-09 | 2000-04-28 | Canon Inc | 有機発光素子 |
| GB9823103D0 (en) | 1998-10-23 | 1998-12-16 | Pfizer Ltd | Pharmaceutically active compounds |
| AU769989B2 (en) | 1998-10-23 | 2004-02-12 | F. Hoffmann-La Roche Ag | Bicyclic nitrogen heterocycles |
| US6133031A (en) | 1999-08-19 | 2000-10-17 | Isis Pharmaceuticals Inc. | Antisense inhibition of focal adhesion kinase expression |
| GB9905075D0 (en) | 1999-03-06 | 1999-04-28 | Zeneca Ltd | Chemical compounds |
| DE19912638A1 (de) | 1999-03-20 | 2000-09-21 | Bayer Ag | Naphthylcarbonsäureamid-substituierte Sulfonamide |
| DE19920790A1 (de) | 1999-05-06 | 2000-11-09 | Bayer Ag | Bis-Sulfonamide mit anti-HCMV-Wirkung |
| PE20010306A1 (es) | 1999-07-02 | 2001-03-29 | Agouron Pharma | Compuestos de indazol y composiciones farmaceuticas que los contienen utiles para la inhibicion de proteina kinasa |
| JP4041624B2 (ja) | 1999-07-21 | 2008-01-30 | 三井化学株式会社 | 有機電界発光素子 |
| ATE316781T1 (de) | 1999-09-24 | 2006-02-15 | Janssen Pharmaceutica Nv | Antivirale feste dispersionen |
| DE19946289A1 (de) | 1999-09-28 | 2001-03-29 | Basf Ag | Benzodiazepin-Derivate, deren Herstellung und Anwendung |
| CN1171889C (zh) | 1999-10-21 | 2004-10-20 | 霍夫曼-拉罗奇有限公司 | 作为p38蛋白激酶的抑制剂的杂烷基氨基-取代的双环氮杂环类化合物 |
| BR0014973A (pt) | 1999-10-21 | 2002-07-16 | Hoffmann La Roche Ag G | Heterociclos de nitrogênio bicìclico de alquilamino substituìdo como inibidores de proteìna quinase p38 |
| TWI271406B (en) | 1999-12-13 | 2007-01-21 | Eisai Co Ltd | Tricyclic condensed heterocyclic compounds, preparation method of the same and pharmaceuticals comprising the same |
| DE60033316T2 (de) | 1999-12-29 | 2007-11-22 | Wyeth | Tricyclische proteinkinasehemmer |
| EA005585B1 (ru) | 2000-01-24 | 2005-04-28 | Уорнер-Ламберт Компани | 3-аминохиназолин-2,4-дионовые антибактериальные агенты |
| IL150742A0 (en) | 2000-01-27 | 2003-02-12 | Warner Lambert Co | Pyridopyrimidinone derivatives for the treatment of neurodegenerative disease |
| DE50112961D1 (de) | 2000-02-01 | 2007-10-18 | Abbott Gmbh & Co Kg | Heterozyklische verbindungen und deren anwendung als parp-inhibitoren |
| ATE309999T1 (de) | 2000-02-04 | 2005-12-15 | Portola Pharm Inc | Blutplättchen-adp-rezeptor-inhibitoren |
| EP1254138B1 (en) | 2000-02-09 | 2005-05-11 | Novartis AG | Pyridine derivatives inhibiting angiogenesis and/or vegf receptor tyrosine kinase |
| GB0004890D0 (en) | 2000-03-01 | 2000-04-19 | Astrazeneca Uk Ltd | Chemical compounds |
| JP2003525897A (ja) | 2000-03-06 | 2003-09-02 | アストラゼネカ アクチボラグ | 治 療 |
| JP2001265031A (ja) | 2000-03-15 | 2001-09-28 | Fuji Xerox Co Ltd | 電子写真感光体、プロセスカートリッジ、及び、電子写真装置 |
| DE10012549A1 (de) | 2000-03-15 | 2001-09-20 | Bayer Ag | Arzneimittel gegen virale Erkrankungen |
| JP4119126B2 (ja) | 2000-04-28 | 2008-07-16 | アカディア ファーマシューティカルズ,インコーポレーテッド | ムスカリン性アゴニスト |
| EP1278744A1 (en) | 2000-05-05 | 2003-01-29 | Millenium Pharmaceuticals, Inc. | Heterobicyclic sulfonamides and their use as platelet adp receptor inhibitors |
| IL152916A0 (en) | 2000-06-23 | 2003-06-24 | Bristol Myers Squibb Co | Heteroaryl-phenyl heterobicyclic factor xa inhibitors |
| PL202623B1 (pl) | 2000-06-28 | 2009-07-31 | Smithkline Beecham Plc | Sposób wytwarzania drobno zmielonego preparatu substancji leczniczej, drobno zmielona substancja lecznicza wytworzona tym sposobem i zawierająca ją kompozycja farmaceutyczna |
| US20050009876A1 (en) | 2000-07-31 | 2005-01-13 | Bhagwat Shripad S. | Indazole compounds, compositions thereof and methods of treatment therewith |
| KR20030036678A (ko) | 2000-08-07 | 2003-05-09 | 뉴로젠 코포레이션 | Gabaa 수용체의 리간드로서의 헤테로사이클릭 화합물 |
| MXPA03001422A (es) | 2000-08-14 | 2004-01-26 | Johnson & Johnson | Pirazoles substituidos. |
| AU2001288706B2 (en) | 2000-09-06 | 2006-01-19 | Ortho-Mcneil Pharmaceutical, Inc. | A method for treating allergies using substituted pyrazoles |
| GB0025782D0 (en) | 2000-10-20 | 2000-12-06 | Pfizer Ltd | Use of inhibitors |
| EP1217000A1 (en) | 2000-12-23 | 2002-06-26 | Aventis Pharma Deutschland GmbH | Inhibitors of factor Xa and factor VIIa |
| GB0100621D0 (en) | 2001-01-10 | 2001-02-21 | Vernalis Res Ltd | Chemical compounds VI |
| GB0103926D0 (en) | 2001-02-17 | 2001-04-04 | Astrazeneca Ab | Chemical compounds |
| AP1699A (en) | 2001-03-21 | 2006-12-26 | Warner Lambert Co | New spirotricyclic derivatives and their use as phosphodiesterase-7 inhibitors |
| US6998408B2 (en) | 2001-03-23 | 2006-02-14 | Bristol-Myers Squibb Pharma Company | 6-5, 6-6, or 6-7 Heterobicycles as factor Xa inhibitors |
| JP2002296731A (ja) | 2001-03-30 | 2002-10-09 | Fuji Photo Film Co Ltd | 熱現像カラー画像記録材料 |
| CA2440842A1 (en) | 2001-04-16 | 2002-10-24 | Eisai Co., Ltd. | Novel 1h-indazole compounds |
| EP2048142A3 (en) | 2001-04-26 | 2009-04-22 | Eisai R&D Management Co., Ltd. | Nitrogen-containing condensed cyclic compound having a pyrazolyl group as a substituent group and pharmaceutical composition thereof |
| CZ20032946A3 (en) | 2001-04-30 | 2004-05-12 | Glaxoágroupálimited | Fused pyrimidines as antagonists of the corticotropin releasing factor (crf) |
| WO2002094825A1 (fr) | 2001-05-22 | 2002-11-28 | Banyu Pharmaceutical Co., Ltd. | Nouveau derive de spiropiperidine |
| US20030114448A1 (en) | 2001-05-31 | 2003-06-19 | Millennium Pharmaceuticals, Inc. | Inhibitors of factor Xa |
| EP1401830A2 (en) | 2001-06-19 | 2004-03-31 | Warner-Lambert Company LLC | Quinazolinediones as antibacterial agents |
| US20030114467A1 (en) | 2001-06-21 | 2003-06-19 | Shakespeare William C. | Novel pyrazolo- and pyrrolo-pyrimidines and uses thereof |
| GB0115109D0 (en) | 2001-06-21 | 2001-08-15 | Aventis Pharma Ltd | Chemical compounds |
| WO2003000690A1 (en) | 2001-06-25 | 2003-01-03 | Aventis Pharmaceuticals Inc. | Synthesis of heterocyclic compounds employing microwave technology |
| US20040235867A1 (en) | 2001-07-24 | 2004-11-25 | Bilodeau Mark T. | Tyrosine kinase inhibitors |
| CN1538956A (zh) | 2001-08-07 | 2004-10-20 | ������ҩ��ʽ���� | 螺环化合物 |
| EP1436291B1 (en) | 2001-09-19 | 2009-01-14 | Aventis Pharma S.A. | Indolizines as kinase protein inhibitors |
| NZ532136A (en) | 2001-10-30 | 2006-08-31 | Novartis Ag | Staurosporine derivatives as inhibitors of FLT3 receptor tyrosine kinase activity |
| IL161662A0 (en) | 2001-11-01 | 2004-09-27 | Janssen Pharmaceutica Nv | Heteroaryl amines as glycogen synthase kinase 3 beta inhibitors (gsk3 inhibitors) |
| PL370480A1 (en) | 2001-11-07 | 2005-05-30 | F.Hoffmann-La Roche Ag | Aminopyrimidines and pyridines |
| WO2003042402A2 (en) | 2001-11-13 | 2003-05-22 | Dana-Farber Cancer Institute, Inc. | Agents that modulate immune cell activation and methods of use thereof |
| GB0129476D0 (en) | 2001-12-10 | 2002-01-30 | Syngenta Participations Ag | Organic compounds |
| GEP20063909B (en) | 2002-01-22 | 2006-08-25 | Warner Lambert Co | 2-(PYRIDIN-2-YLAMINO)-PYRIDO[2,3d] PYRIMIDIN-7-ONES |
| PT1482924E (pt) | 2002-03-05 | 2008-08-27 | Axys Pharm Inc | Inibidores de proteases da cisteína catepsina |
| US6815519B2 (en) | 2002-03-22 | 2004-11-09 | Chung-Shan Institute Of Science & Technology | Acidic fluorine-containing poly (siloxane amideimide) silica hybrids |
| CA2479644A1 (en) | 2002-04-03 | 2003-10-09 | F. Hoffmann-La Roche Ag | Imidazo fused compounds |
| AU2003234567A1 (en) | 2002-05-15 | 2003-12-02 | Janssen Pharmaceutica N.V. | N-substituted tricyclic 3-aminopyrazoles as pdfg receptor inhibitors |
| JP4499342B2 (ja) | 2002-05-16 | 2010-07-07 | 株式会社カネカ | SiH基を含有する含窒素有機系化合物の製造方法 |
| AU2003245325A1 (en) | 2002-05-23 | 2003-12-12 | Chiron Corporation | Substituted quinazolinone compounds |
| PE20040522A1 (es) | 2002-05-29 | 2004-09-28 | Novartis Ag | Derivados de diarilurea dependientes de la cinasa de proteina |
| US7119111B2 (en) | 2002-05-29 | 2006-10-10 | Amgen, Inc. | 2-oxo-1,3,4-trihydroquinazolinyl derivatives and methods of use |
| US7105526B2 (en) | 2002-06-28 | 2006-09-12 | Banyu Pharmaceuticals Co., Ltd. | Benzimidazole derivatives |
| GB0215676D0 (en) | 2002-07-05 | 2002-08-14 | Novartis Ag | Organic compounds |
| PA8577501A1 (es) | 2002-07-25 | 2004-02-07 | Warner Lambert Co | Inhibidores de quinasas |
| IL166241A0 (en) | 2002-07-29 | 2006-01-15 | Rigel Pharmaceuticals Inc | Method of treating or preventing autoimmune diseases with 2,4-pyrimidinedinediamine compounds |
| BR0313297A (pt) | 2002-08-06 | 2005-06-21 | Hoffmann La Roche | 6-alcóxi-pirido-pirimidinas como inibidores de p-38 map cinase |
| EP1388541A1 (en) | 2002-08-09 | 2004-02-11 | Centre National De La Recherche Scientifique (Cnrs) | Pyrrolopyrazines as kinase inhibitors |
| US7084270B2 (en) | 2002-08-14 | 2006-08-01 | Hoffman-La Roche Inc. | Pyrimido compounds having antiproliferative activity |
| GB0220187D0 (en) | 2002-08-30 | 2002-10-09 | Novartis Ag | Organic compounds |
| GB0223349D0 (en) | 2002-10-08 | 2002-11-13 | Merck Sharp & Dohme | Therapeutic agents |
| TW200413381A (en) | 2002-11-04 | 2004-08-01 | Hoffmann La Roche | Novel amino-substituted dihydropyrimido [4,5-d]pyrimidinone derivatives, their manufacture and use as pharmaceutical agents |
| US7129351B2 (en) | 2002-11-04 | 2006-10-31 | Hoffmann-La Roche Inc. | Pyrimido compounds having antiproliferative activity |
| US7384937B2 (en) | 2002-11-06 | 2008-06-10 | Bristol-Myers Squibb Co. | Fused heterocyclic compounds and use thereof |
| TWI335913B (en) | 2002-11-15 | 2011-01-11 | Vertex Pharma | Diaminotriazoles useful as inhibitors of protein kinases |
| PL377620A1 (pl) * | 2002-11-18 | 2006-02-06 | F. Hoffmann-La Roche Ag | Diazynopirymidyny |
| AU2003288198A1 (en) | 2002-11-28 | 2004-06-18 | Schering Aktiengesellschaft | CHK-,PDK- and AKT-inhibitory pyrimidines, their production and use as pharmaceutical agents |
| JP4903385B2 (ja) | 2002-12-06 | 2012-03-28 | パーデュー・リサーチ・ファウンデーション | 損傷した哺乳類神経組織を治療するためのピリジン類 |
| AU2003288994A1 (en) | 2002-12-10 | 2004-06-30 | Ono Pharmaceutical Co., Ltd. | Nitrogen-containing heterocyclic compounds and medicinal use thereof |
| UA80171C2 (en) | 2002-12-19 | 2007-08-27 | Pfizer Prod Inc | Pyrrolopyrimidine derivatives |
| UA80767C2 (en) | 2002-12-20 | 2007-10-25 | Pfizer Prod Inc | Pyrimidine derivatives for the treatment of abnormal cell growth |
| US7098332B2 (en) | 2002-12-20 | 2006-08-29 | Hoffmann-La Roche Inc. | 5,8-Dihydro-6H-pyrido[2,3-d]pyrimidin-7-ones |
| US7521051B2 (en) | 2002-12-23 | 2009-04-21 | Medimmune Limited | Methods of upmodulating adaptive immune response using anti-PD-1 antibodies |
| JP2004203749A (ja) | 2002-12-24 | 2004-07-22 | Kanegafuchi Chem Ind Co Ltd | SiH基を含有する含窒素有機系化合物の製造方法 |
| DE602004021558D1 (de) | 2003-01-17 | 2009-07-30 | Warner Lambert Co | 2-aminopyridin-substituierteheterocyclen als inhibitoren der zellulären proliferation |
| GB0305929D0 (en) | 2003-03-14 | 2003-04-23 | Novartis Ag | Organic compounds |
| US7135469B2 (en) | 2003-03-18 | 2006-11-14 | Bristol Myers Squibb, Co. | Linear chain substituted monocyclic and bicyclic derivatives as factor Xa inhibitors |
| US7550590B2 (en) | 2003-03-25 | 2009-06-23 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| GB0308208D0 (en) | 2003-04-09 | 2003-05-14 | Glaxo Group Ltd | Chemical compounds |
| AU2004228155A1 (en) * | 2003-04-10 | 2004-10-21 | F.Hoffman-La Roche Ag | Pyrimido compounds |
| EP1622910A1 (en) | 2003-05-05 | 2006-02-08 | F. Hoffmann-La Roche Ag | Fused pyrimidine derivatives with crf activity |
| JP2004346145A (ja) | 2003-05-21 | 2004-12-09 | Teijin Ltd | イミド組成物およびそれからなる樹脂組成物、及びその製造方法 |
| US7625909B2 (en) | 2003-05-23 | 2009-12-01 | Novartis Vaccines And Diagnostics, Inc. | Substituted quinazolinone compounds |
| ATE459359T1 (de) | 2003-06-06 | 2010-03-15 | Arexis Ab | Verwendung von kondensierten heterozyklischen verbindungen als scce-hemmern zur behandlung von hautzuständen |
| IL156495A0 (en) | 2003-06-17 | 2004-01-04 | Prochon Biotech Ltd | Use of fgfr3 antagonists for treating t cell mediated diseases |
| EP1637523A4 (en) | 2003-06-18 | 2009-01-07 | Ube Industries | PROCESS FOR PRODUCING A PYRIMIDIN-4-ONE COMPOUND |
| JP2005015395A (ja) | 2003-06-26 | 2005-01-20 | Japan Science & Technology Agency | 新規ピリミドピリミジンヌクレオシドとその構造類縁体 |
| CA2531327A1 (en) | 2003-07-03 | 2005-01-13 | Myriad Genetics, Inc. | Compounds and therapeutical use thereof |
| AR045037A1 (es) | 2003-07-10 | 2005-10-12 | Aventis Pharma Sa | Tetrahidro-1h-pirazolo [3,4-c] piridinas sustituidas, composiciones que las contienen y su utilizacion. |
| US7371750B2 (en) | 2003-07-29 | 2008-05-13 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| US7390820B2 (en) | 2003-08-25 | 2008-06-24 | Amgen Inc. | Substituted quinolinone derivatives and methods of use |
| WO2005028480A2 (en) | 2003-09-03 | 2005-03-31 | Neurogen Corporation | 5-aryl-pyrazolo[4,3-d]pyrimidines, pyridines, and pyrazines and related compounds |
| US7148228B2 (en) | 2003-09-18 | 2006-12-12 | Conforma Therapeutics Corporation | Pyrazolopyrimidines and related analogs as HSP90-inhibitors |
| CA2537325A1 (en) | 2003-09-19 | 2005-03-31 | Gilead Sciences, Inc. | Aza-quinolinol phosphonate integrase inhibitor compounds |
| AR045944A1 (es) | 2003-09-24 | 2005-11-16 | Novartis Ag | Derivados de isoquinolina 1.4-disustituidas |
| JP4833069B2 (ja) | 2003-10-01 | 2011-12-07 | ゼンション・リミテッド | テトラヒドロ−ナフタレンおよび尿素誘導体 |
| JP4758349B2 (ja) | 2003-10-08 | 2011-08-24 | アイアールエム・リミテッド・ライアビリティ・カンパニー | タンパク質キナーゼ阻害剤としての化合物および組成物 |
| CN1897950A (zh) | 2003-10-14 | 2007-01-17 | 惠氏公司 | 稠合芳基和杂芳基衍生物及其使用方法 |
| US20090099165A1 (en) | 2003-10-14 | 2009-04-16 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Protein Kinase Inhibitors |
| WO2005047289A1 (en) | 2003-11-17 | 2005-05-26 | Pfizer Products Inc. | Pyrrolopyrimidine compounds useful in treatment of cancer |
| WO2005056524A2 (en) | 2003-12-09 | 2005-06-23 | Euro-Celtique S.A. | Therapeutic agents useful for treating pain |
| US20080188527A1 (en) | 2003-12-23 | 2008-08-07 | Cashman John R | Synthetic Compounds and Derivatives as Modulators of Smoking or Nicotine Ingestion and Lung Cancer |
| KR100703068B1 (ko) | 2003-12-30 | 2007-04-05 | 에스케이케미칼주식회사 | 피리딘 유도체와 이의 제조방법, 및 이를 포함하는약제조성물 |
| US20050222171A1 (en) | 2004-01-22 | 2005-10-06 | Guido Bold | Organic compounds |
| KR101160182B1 (ko) | 2004-01-23 | 2012-06-26 | 얀센 파마슈티카 엔.브이. | 퀴놀린 유도체 및 마이코박테리아 저해제로서의 용도 |
| AU2005206562A1 (en) | 2004-01-23 | 2005-08-04 | Amgen Inc. | Vanilloid receptor ligands and their use in treatments |
| AU2005208938A1 (en) | 2004-01-29 | 2005-08-11 | Elixir Pharmaceuticals, Inc | Anti-viral therapeutics |
| GB0402137D0 (en) | 2004-01-30 | 2004-03-03 | Smithkline Beecham Corp | Novel compounds |
| AU2005214352B2 (en) | 2004-02-14 | 2009-11-12 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| BRPI0507852A (pt) | 2004-02-18 | 2007-07-10 | Warner Lambert Co | 2-(piridin-3-ilamino)-pirido[2,3-d]pirimidin-7-onas |
| AU2005219517A1 (en) | 2004-02-27 | 2005-09-15 | F.Hoffmann-La Roche Ag | Heteroaryl-fused pyrazolo derivatives |
| BRPI0508036A (pt) | 2004-02-27 | 2007-07-17 | Hoffmann La Roche | derivados fundidos de pirazola |
| US20080004263A1 (en) | 2004-03-04 | 2008-01-03 | Santora Vincent J | Ligands of Follicle Stimulating Hormone Receptor and Methods of Use Thereof |
| US20070197510A1 (en) | 2004-03-10 | 2007-08-23 | Kazuyuki Ohmoto | Nitriles and medicinal compositions containing the same as the active ingredient |
| EP1736476A4 (en) | 2004-03-29 | 2010-04-07 | Mitsui Chemicals Inc | NOVEL COMPOUND AND ORGANIC ELECTRONIC DEVICE USING THE SAME |
| WO2005105097A2 (en) | 2004-04-28 | 2005-11-10 | Gpc Biotech Ag | Pyridopyrimidines for treating inflammatory and other diseases |
| JP2005320288A (ja) | 2004-05-10 | 2005-11-17 | Mitsui Chemicals Inc | テトラカルボン酸誘導体、および該化合物を用いた電子写真感光体、電子写真装置 |
| US20050256309A1 (en) | 2004-05-12 | 2005-11-17 | Altenbach Robert J | Tri-and bi-cyclic heteroaryl histamine-3 receptor ligands |
| BRPI0511512A (pt) | 2004-05-27 | 2007-12-26 | Pfizer Prod Inc | derivados pirrolpirimidina úteis no tratamento do cáncer |
| PE20060426A1 (es) | 2004-06-02 | 2006-06-28 | Schering Corp | DERIVADOS DE ACIDO TARTARICO COMO INHIBIDORES DE MMPs, ADAMs, TACE Y TNF-alfa |
| WO2005123719A1 (en) | 2004-06-10 | 2005-12-29 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| MXPA06014478A (es) | 2004-06-11 | 2007-03-21 | Japan Tobacco Inc | Derivados de 5-amino-2, 4, 7-trioxo-3, 4, 7, 8-tetrahidro -2h-pirido[2, 3-d]pirimidina y compuestos relacionados para el tratamiento del cancer. |
| GB0512324D0 (en) | 2005-06-16 | 2005-07-27 | Novartis Ag | Organic compounds |
| JP2006028027A (ja) | 2004-07-12 | 2006-02-02 | Mitsui Chemicals Inc | テトラカルボン酸誘導体、および該化合物を用いた電子写真感光体、電子写真装置 |
| EP1789417A1 (en) | 2004-08-31 | 2007-05-30 | F.Hoffmann-La Roche Ag | AMIDE DERIVATIVES OF 7-AMINO-3-PHENYL-DIHYDROPYRIMIDO [4,5-d]PYRIMIDINONES, THEIR MANUFACTURE AND USE AS PHARMACEUTICAL AGENTS |
| KR20070048798A (ko) | 2004-08-31 | 2007-05-09 | 아스트라제네카 아베 | 퀴나졸리논 유도체 및 이것의 b-raf 억제제로서의 용도 |
| DE602005013248D1 (de) | 2004-08-31 | 2009-04-23 | Hoffmann La Roche | Amidderivate von 3-phenyldihydropyrimidoä4,5-düpyrimidinonen, deren herstellung und verwendung als pharmazeutische mittel |
| DE102004042667A1 (de) | 2004-09-01 | 2006-03-30 | Ewald Dörken Ag | Mehrschichtige Gebäudewand |
| CN1980970B (zh) | 2004-09-10 | 2010-05-26 | 宇部兴产株式会社 | 改性聚酰亚胺树脂和可固化的树脂组合物 |
| CA2584412C (en) | 2004-09-14 | 2017-05-09 | Minerva Biotechnologies Corporation | Methods for diagnosis and treatment of cancer |
| GB0420719D0 (en) | 2004-09-17 | 2004-10-20 | Addex Pharmaceuticals Sa | Novel allosteric modulators |
| WO2006038112A1 (en) | 2004-10-01 | 2006-04-13 | Warner-Lambert Company Llc | Use of kinase inhibitors to promote neochondrogenesis |
| FR2876582B1 (fr) | 2004-10-15 | 2007-01-05 | Centre Nat Rech Scient Cnrse | Utilisation de derives de pyrrolo-pyrazines pour la fabrication de medicaments pour le traitement de la mucoviscidose et de maladies liees a un defaut d'adressage des proteines dans les cellules |
| US20060135553A1 (en) | 2004-10-28 | 2006-06-22 | Campbell David A | Imidazole derivatives |
| US7855205B2 (en) | 2004-10-29 | 2010-12-21 | Janssen Pharmaceutica Nv | Pyrimidinyl substituted fused-pyrrolyl compounds useful in treating kinase disorders |
| KR20070074610A (ko) | 2004-11-08 | 2007-07-12 | 백스터 인터내셔널 인코포레이티드 | 튜불린 억제제의 나노미립자 조성물 |
| WO2006055752A2 (en) | 2004-11-18 | 2006-05-26 | Incyte Corporation | INHIBITORS OF 11-β HYDROXYL STEROID DEHYDROGENASE TYPE 1 AND METHODS OF USING THE SAME |
| KR20070089201A (ko) | 2004-11-22 | 2007-08-30 | 버텍스 파마슈티칼스 인코포레이티드 | 단백질 키나제 억제제로서 유용한 피롤로피라진 및피라졸로피라진 |
| KR20070085433A (ko) | 2004-11-24 | 2007-08-27 | 노파르티스 아게 | Jak 저해제들과 bcr-abl, flt-3, fak 또는raf 키나제 저해제들 중 하나 이상의 조합물 |
| MY140748A (en) | 2004-12-06 | 2010-01-15 | Astrazeneca Ab | Novel pyrrolo [3,2-d] pyrimidin-4-one derivatives and their use in therapy |
| CA2590294A1 (en) | 2004-12-13 | 2006-06-22 | Sunesis Pharmaceuticals, Inc. | Pyrido pyrimidinones, dihydro pyrimido pyrimidinones and pteridinones useful as raf kinase inhibitors |
| US20100152206A1 (en) | 2005-01-07 | 2010-06-17 | Ralph Mazitschek | Bicyclic Dihydropyrimidines and Uses Thereof |
| DE102005008310A1 (de) | 2005-02-17 | 2006-08-24 | Schering Ag | Verwendung von CDKII Inhibitoren zur Fertilitätskontrolle |
| WO2006092691A1 (en) | 2005-03-01 | 2006-09-08 | Pfizer Limited | Use of pde7 inhibitors for the treatment of neuropathic pain |
| US7402596B2 (en) | 2005-03-24 | 2008-07-22 | Renovis, Inc. | Bicycloheteroaryl compounds as P2X7 modulators and uses thereof |
| EP2527365A3 (en) | 2005-03-30 | 2013-02-20 | Minerva Biotechnologies Corporation | Proliferation of MUC1 expressing cells |
| JP2006284843A (ja) | 2005-03-31 | 2006-10-19 | Mitsui Chemicals Inc | テトラカルボン酸誘導体を用いた電子写真感光体、電子写真装置 |
| US20060223993A1 (en) | 2005-04-01 | 2006-10-05 | Connor Daniel M | Colorant compounds, intermediates, and compositions |
| JP2006316054A (ja) | 2005-04-15 | 2006-11-24 | Tanabe Seiyaku Co Ltd | 高コンダクタンス型カルシウム感受性kチャネル開口薬 |
| KR100781704B1 (ko) | 2005-04-20 | 2007-12-03 | 에스케이케미칼주식회사 | 피리딘 유도체와 이의 제조방법, 및 이를 포함하는약제조성물 |
| ES2552804T3 (es) | 2005-05-04 | 2015-12-02 | Evotec Ag | Compuestos heterocíclicos condensados, y sus composiciones y usos |
| LT2439273T (lt) | 2005-05-09 | 2019-05-10 | Ono Pharmaceutical Co., Ltd. | Žmogaus monokloniniai antikūnai prieš programuotos mirties 1(pd-1) baltymą, ir vėžio gydymo būdai, naudojant vien tik anti-pd-1 antikūnus arba derinyje su kitais imunoterapiniais vaistais |
| WO2006124731A2 (en) | 2005-05-12 | 2006-11-23 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| US8183248B2 (en) | 2005-05-13 | 2012-05-22 | Irm Llc | Substituted pyrrolo[2,3-d]pyrimidines and compositions as protein kinase inhibitors |
| WO2006135821A2 (en) | 2005-06-09 | 2006-12-21 | Achille Carlisle Tisdelle | Vehicular head and neck safety system and method |
| GB0512844D0 (en) | 2005-06-23 | 2005-08-03 | Novartis Ag | Organic compounds |
| BRPI0613361A2 (pt) | 2005-07-01 | 2011-01-04 | Medarex Inc | anticorpo monoclonal humano isolado, composição, imunoconjugado, molécula biespecìfica, molécula de ácido nucleico isolada, vetor de expressão, célula hospedeira, camundongo transgênico, método para modular uma resposta imune num indivìduo, método para inibir crescimento de células tumorais num indivìduo, método para tratar uma doença infecciosa num indivìduo, método para aumentar uma resposta imune a um antìgeno num indivìduo, método para tratar ou prevenir uma doença inflamatória num indivìduo e método para preparar o anticorpo anti-pd-l1 |
| AU2006272876A1 (en) | 2005-07-22 | 2007-02-01 | Sunesis Pharmaceuticals, Inc. | Pyrazolo pyrimidines useful as aurora kinase inhibitors |
| ES2270715B1 (es) | 2005-07-29 | 2008-04-01 | Laboratorios Almirall S.A. | Nuevos derivados de pirazina. |
| EP1910369A1 (en) | 2005-07-29 | 2008-04-16 | Astellas Pharma Inc. | Fused heterocycles as lck inhibitors |
| ATE482958T1 (de) | 2005-08-09 | 2010-10-15 | Irm Llc | Verbindungen und zusammensetzungen als proteinkinaseinhibitoren |
| KR20080035698A (ko) | 2005-08-16 | 2008-04-23 | 아이알엠 엘엘씨 | 단백질 키나제 억제제로서의 화합물 및 조성물 |
| KR101011958B1 (ko) | 2005-08-25 | 2011-01-31 | 에프. 호프만-라 로슈 아게 | p38 MAP 키나아제 저해제로서의 융합형 피라졸 |
| US7678917B2 (en) | 2005-09-01 | 2010-03-16 | Hoffman-La Roche Inc. | Factor Xa inhibitors |
| AU2006287771A1 (en) | 2005-09-06 | 2007-03-15 | Smithkline Beecham Corporation | Regioselective process for preparing benzimidazole thiophenes |
| KR20080046728A (ko) | 2005-09-15 | 2008-05-27 | 아스카 세이야쿠 가부시키가이샤 | 복소환 화합물, 그의 제조 방법 및 용도 |
| US20070116984A1 (en) | 2005-09-21 | 2007-05-24 | Doosan Corporation | Spiro-compound for electroluminescent display device and electroluminescent display device comprising the same |
| WO2007038209A2 (en) | 2005-09-23 | 2007-04-05 | Schering Corporation | Fused tetracyclic mglur1 antagonists as therapeutic agents |
| DE102005048072A1 (de) | 2005-09-24 | 2007-04-05 | Bayer Cropscience Ag | Thiazole als Fungizide |
| CA2624965A1 (en) | 2005-10-07 | 2007-04-19 | Exelixis, Inc. | Pyridopyrimidinone inhibitors of pi3k.alpha. |
| RS53627B1 (en) | 2005-10-07 | 2015-04-30 | Exelixis Inc. | N- (3-Amino-quinoxalin-2-yl) -sulfonamide derivatives and their use as phosphatidylinositol 3-kinase inhibitors |
| WO2007061554A2 (en) | 2005-10-21 | 2007-05-31 | Purdue Research Foundation | Dosage of 4-aminopyridine derivatives for treatment of central nervous system injuries |
| CA2626747A1 (en) | 2005-10-26 | 2007-05-03 | Boehringer Ingelheim International Gmbh | (hetero)aryl compounds with mch antagonistic activity and medicaments comprising these compounds |
| NZ567851A (en) | 2005-11-01 | 2011-09-30 | Targegen Inc | Bi-aryl meta-pyrimidine inhibitors of kinases |
| US8604042B2 (en) | 2005-11-01 | 2013-12-10 | Targegen, Inc. | Bi-aryl meta-pyrimidine inhibitors of kinases |
| WO2007053498A1 (en) | 2005-11-01 | 2007-05-10 | Millennium Pharmaceuticals, Inc. | Compounds useful as antagonists of ccr2 |
| EP1945222B1 (en) | 2005-11-02 | 2012-12-26 | Bayer Pharma Aktiengesellschaft | Pyrrolo[2,1-f] [1,2,4]-triazin-4-ylamines as igf-1r kinase inhibitors for the treatment of cancer and other hyperproliferative diseases |
| US20070149508A1 (en) | 2005-11-02 | 2007-06-28 | Targegen, Inc. | Six membered heteroaromatic inhibitors targeting resistant kinase mutations |
| CA2629461C (en) | 2005-11-10 | 2016-01-12 | Anita Melikian | Substituted quinolones and methods of use |
| EP1953165B1 (en) | 2005-11-10 | 2012-02-01 | Msd K.K. | Aza-substituted spiro derivative |
| WO2007058626A1 (en) | 2005-11-16 | 2007-05-24 | S*Bio Pte Ltd | Indazole compounds |
| WO2007058392A1 (ja) | 2005-11-21 | 2007-05-24 | Japan Tobacco Inc. | ヘテロ環化合物およびその医薬用途 |
| PE20070855A1 (es) | 2005-12-02 | 2007-10-14 | Bayer Pharmaceuticals Corp | Derivados de 4-amino-pirrolotriazina sustituida como inhibidores de quinasas |
| BRPI0619146A2 (pt) | 2005-12-02 | 2011-09-13 | Bayer Pharmaceuticals Corp | derivados de 4-amino-pirroltriazina substituìda úteis no tratamento de disordens e doenças hiperproliferativas associadas com angiogênesis |
| ZA200804679B (en) | 2005-12-08 | 2010-02-24 | Millenium Pharmaceuticals Inc | Bicyclic compounds with kinase inhibitory activity |
| WO2007066189A2 (en) | 2005-12-09 | 2007-06-14 | Pfizer Products Inc. | Salts, prodrugs and formulations of 1-[5-(4-amino-7-isopropyl-7h-pyrrolo[2,3-d]pyrimidine-5-carbonyl)-2-methoxy-phenyl]-3-(2,4-dichloro-phenyl)-urea |
| US20080318989A1 (en) | 2005-12-19 | 2008-12-25 | Burdick Daniel J | Pyrimidine Kinase Inhibitors |
| MEP3808A (xx) | 2005-12-21 | 2010-02-10 | Novartis Ag | Derivati pirimidinil aril uree kao fgf inhibitori |
| US7998959B2 (en) | 2006-01-12 | 2011-08-16 | Incyte Corporation | Modulators of 11-β hydroxyl steroid dehydrogenase type 1, pharmaceutical compositions thereof, and methods of using the same |
| PE20071025A1 (es) | 2006-01-31 | 2007-10-17 | Mitsubishi Tanabe Pharma Corp | Compuesto amina trisustituido |
| WO2007092879A2 (en) | 2006-02-08 | 2007-08-16 | Janssen Pharmaceutica, N.V. | Substituted thiatriazaacenaphthylene-6-carbonitrile kinase inhibitors |
| KR20080085232A (ko) | 2006-02-17 | 2008-09-23 | 화이자 리미티드 | Tlr7 조절제로서 3-데아자퓨린 유도체 |
| WO2007112347A1 (en) | 2006-03-28 | 2007-10-04 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| EP2233472B1 (en) | 2006-03-28 | 2014-01-15 | Atir Holding S.A. | Heterocyclic compounds and uses thereof in the treatment of sexual disorders |
| EP2007373A4 (en) | 2006-03-29 | 2012-12-19 | Foldrx Pharmaceuticals Inc | INHIBITION OF ALPHA SYNUCLEINE TOXICITY |
| MX2008012912A (es) | 2006-04-06 | 2008-11-26 | Wisconsin Alumni Res Found | Analogos de 2-metilen-1a,25-dihidroxi-19,21-dinorvitamina d3 y sus usos. |
| WO2007120097A1 (en) | 2006-04-13 | 2007-10-25 | Astrazeneca Ab | Thioxanthine derivatives and their use as inhibitors of mpo |
| GB0608386D0 (en) | 2006-04-27 | 2006-06-07 | Senexis Ltd | Compounds |
| US7998978B2 (en) | 2006-05-01 | 2011-08-16 | Pfizer Inc. | Substituted 2-amino-fused heterocyclic compounds |
| PT2027123E (pt) | 2006-05-11 | 2011-05-30 | Irm Llc | Compostos e composi??es como inibidores da prote?na quinase |
| BRPI0711628A2 (pt) | 2006-05-15 | 2011-12-06 | Irm Llc | composto, composição farmacêutica, uso e processo para preparação do composto |
| US7910108B2 (en) | 2006-06-05 | 2011-03-22 | Incyte Corporation | Sheddase inhibitors combined with CD30-binding immunotherapeutics for the treatment of CD30 positive diseases |
| DE102006027156A1 (de) | 2006-06-08 | 2007-12-13 | Bayer Schering Pharma Ag | Sulfimide als Proteinkinaseinhibitoren |
| CN101460165B (zh) | 2006-06-16 | 2011-03-23 | 雅宝公司 | 减少或消除爬行动物和/或它们蛋中的沙门氏菌的方法 |
| CA2656825C (en) | 2006-06-22 | 2013-12-10 | Prana Biotechnology Limited | Method of treatment and agents useful for same |
| EP2044063A1 (en) | 2006-06-30 | 2009-04-08 | Astra Zeneca AB | Pyrimidine derivatives useful in the treatment of cancer |
| WO2008005877A2 (en) | 2006-06-30 | 2008-01-10 | Board Of Regents, The University Of Texas System | Inhibitors of c-kit and uses thereof |
| JP2009542604A (ja) | 2006-07-06 | 2009-12-03 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 4−ヘテロシクロアルキルピリミジン、それらの調製方法及び医薬としての使用 |
| WO2008008234A1 (en) | 2006-07-07 | 2008-01-17 | Targegen, Inc. | 2-amino-5-substituted pyrimidine inhibitors |
| TW200811134A (en) | 2006-07-12 | 2008-03-01 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| WO2008012635A2 (en) | 2006-07-26 | 2008-01-31 | Pfizer Products Inc. | Amine derivatives useful as anticancer agents |
| EP2049481A2 (en) | 2006-08-09 | 2009-04-22 | SmithKline Beecham Corporation | Novel compounds as antagonists or inverse agonists for opioid receptors |
| EP2056829B9 (en) | 2006-08-16 | 2012-09-26 | Exelixis, Inc. | Using pi3k and mek modulators in treatments of cancer |
| DE102006041382A1 (de) | 2006-08-29 | 2008-03-20 | Bayer Schering Pharma Ag | Carbamoyl-Sulfoximide als Proteinkinaseinhibitoren |
| MX2009002298A (es) | 2006-09-01 | 2009-06-04 | Cylene Pharmaceuticals Inc | Moduladores de serina-treonina proteina quinasa y de parp. |
| WO2008079460A2 (en) | 2006-09-05 | 2008-07-03 | Emory University | Tyrosine kinase inhibitors for prevention or treatment of infection |
| WO2008033858A2 (en) | 2006-09-11 | 2008-03-20 | Cgi Pharmaceuticals, Inc. | Kinase inhibitors, and methods of using and identifying kinase inhibitors |
| US7897762B2 (en) | 2006-09-14 | 2011-03-01 | Deciphera Pharmaceuticals, Llc | Kinase inhibitors useful for the treatment of proliferative diseases |
| WO2008034859A1 (en) | 2006-09-21 | 2008-03-27 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted difluorobenzyl-benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| US20080176891A1 (en) | 2006-09-22 | 2008-07-24 | Paul Bamborough | Novel compounds |
| KR20090073120A (ko) | 2006-09-28 | 2009-07-02 | 노파르티스 아게 | 피라졸로[1,5-a]피리미딘 유도체 및 이들의 치료 용도 |
| US8202876B2 (en) | 2006-10-02 | 2012-06-19 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| EP2077841A1 (en) | 2006-10-30 | 2009-07-15 | Glaxo Group Limited | Novel substituted pyrimidines as cysteine protease inhibitors |
| US7858645B2 (en) | 2006-11-01 | 2010-12-28 | Hoffmann-La Roche Inc. | Indazole derivatives |
| EP2081928B1 (en) | 2006-11-10 | 2014-02-26 | Bristol-Myers Squibb Company | Pyrrolo-pyridine kinase inhibitors |
| US7902363B2 (en) | 2006-11-17 | 2011-03-08 | Polyera Corporation | Diimide-based semiconductor materials and methods of preparing and using the same |
| WO2008063583A1 (en) | 2006-11-17 | 2008-05-29 | Polyera Corporation | Acene-based organic semiconductor materials and methods of preparing and using the same |
| KR20080045536A (ko) | 2006-11-20 | 2008-05-23 | 에스케이케미칼주식회사 | 피리딘 화합물을 포함하는 간염 치료 및 예방 또는 간 보호효능을 갖는 약제 조성물 |
| MX2009006466A (es) | 2006-12-13 | 2009-06-26 | Schering Corp | Metodos de tratamiento de cancer con inhibidores del receptor del factor 1 de crecimiento similar a la insulina. |
| WO2008071455A1 (en) | 2006-12-15 | 2008-06-19 | Bayer Schering Pharma Aktiengesellschaft | Bicyclic acyltryptophanols |
| WO2008074068A1 (en) | 2006-12-20 | 2008-06-26 | Prana Biotechnology Limited | Substituted quinoline derivatives as antiamyloidogeneic agents |
| US7737149B2 (en) | 2006-12-21 | 2010-06-15 | Astrazeneca Ab | N-[5-[2-(3,5-dimethoxyphenyl)ethyl]-2H-pyrazol-3-yl]-4-(3,5-dimethylpiperazin-1-yl)benzamide and salts thereof |
| CA2672172C (en) * | 2006-12-22 | 2016-05-03 | Astex Therapeutics Limited | Bicyclic heterocyclic compounds as fgfr inhibitors |
| CN101568529A (zh) | 2006-12-22 | 2009-10-28 | 诺瓦提斯公司 | 作为cdk抑制剂、用于治疗癌症、炎症和病毒感染的杂芳基-杂芳基化合物 |
| JP5442449B2 (ja) | 2006-12-22 | 2014-03-12 | アステックス、セラピューティックス、リミテッド | 新規化合物 |
| FR2911140B1 (fr) | 2007-01-05 | 2009-02-20 | Sanofi Aventis Sa | Nouveaux derives de 2-anilino 4-heteroaryle pyrimides, leur preparation a titre de medicaments, compositions pharmaceutiques et notamment comme inhibiteurs de ikk |
| EP2104676A2 (en) | 2007-01-08 | 2009-09-30 | Polyera Corporation | Methods for preparing arene-bis(dicarboximide)-based semiconducting materials and related intermediates for preparing same |
| CN101007778A (zh) | 2007-01-10 | 2007-08-01 | 复旦大学 | 一种链延长型芴基双马来酰亚胺及其制备方法 |
| EP2123651A4 (en) | 2007-01-12 | 2011-05-04 | Astellas Pharma Inc | CONDENSED PYRIDINE COMPOUND |
| CA2674589A1 (en) | 2007-01-12 | 2008-07-24 | Biocryst Pharmaceuticals, Inc. | Antiviral nucleoside analogs |
| FR2911604B1 (fr) | 2007-01-19 | 2009-04-17 | Sanofi Aventis Sa | Derives de n-(heteroaryl-1h-indole-2-carboxamides, leur preparation et leur application en therapeutique |
| JP5358962B2 (ja) | 2007-02-06 | 2013-12-04 | 住友化学株式会社 | 組成物及び該組成物を用いてなる発光素子 |
| JP2008198769A (ja) | 2007-02-13 | 2008-08-28 | Nippon Steel Chem Co Ltd | 有機エレクトロルミネッセント素子 |
| BRPI0808422A2 (pt) | 2007-03-06 | 2015-06-23 | Novartis Ag | Compostos orgânicos bicíclicos adequados para o tratamento de condições inflamatórias ou alérgicas |
| CA2680312A1 (en) | 2007-03-07 | 2008-09-12 | Alantos Pharmaceuticals Holding, Inc. | Metalloprotease inhibitors containing a heterocyclic moiety |
| KR101737753B1 (ko) | 2007-03-12 | 2017-05-18 | 와이엠 바이오사이언시즈 오스트레일리아 피티와이 엘티디 | 페닐 아미노 피리미딘 화합물 및 이의 용도 |
| US20080234262A1 (en) | 2007-03-21 | 2008-09-25 | Wyeth | Pyrazolopyrimidine analogs and their use as mtor kinase and pi3 kinase inhibitors |
| AU2007227278B2 (en) | 2007-03-21 | 2014-09-11 | Epix Pharmaceuticals, Inc. | SIP receptor modulating compounds and use thereof |
| JP2010522177A (ja) | 2007-03-23 | 2010-07-01 | アムジエン・インコーポレーテツド | 複素環化合物およびその使用 |
| EP2896624B1 (en) | 2007-03-28 | 2016-07-13 | Atir Holding S.A. | Heterotricyclic compounds as serotonergic and/or dopaminergic agents and uses thereof |
| KR20080091948A (ko) | 2007-04-10 | 2008-10-15 | 에스케이케미칼주식회사 | 락탐형 피리딘 화합물을 포함하는 허혈성 질환의 예방 및치료용 약학조성물 |
| KR20100016477A (ko) | 2007-04-12 | 2010-02-12 | 어드밴스드 테크놀러지 머티리얼즈, 인코포레이티드 | Ald/cvd용의 지르코늄, 하프늄, 티타늄 및 규소 전구체 |
| JP2010524941A (ja) | 2007-04-20 | 2010-07-22 | シェーリング コーポレイション | ピリミジノン誘導体およびそれらの使用方法 |
| EP1985612A1 (en) | 2007-04-26 | 2008-10-29 | Bayer Schering Pharma Aktiengesellschaft | Arymethylen substituted N-Acyl-gamma-aminoalcohols |
| PE20090288A1 (es) | 2007-05-10 | 2009-04-03 | Smithkline Beecham Corp | Derivados de quinoxalina como inhibidores de la pi3 quinasa |
| EP1990342A1 (en) * | 2007-05-10 | 2008-11-12 | AEterna Zentaris GmbH | Pyridopyrazine Derivatives, Process of Manufacturing and Uses thereof |
| WO2008144253A1 (en) | 2007-05-14 | 2008-11-27 | Irm Llc | Protein kinase inhibitors and methods for using thereof |
| GB2449293A (en) | 2007-05-17 | 2008-11-19 | Evotec | Compounds having Hsp90 inhibitory activity |
| CA2689282A1 (en) | 2007-06-03 | 2008-12-11 | Vanderbilt University | Benzamide mglur5 positive allosteric modulators and methods of making and using same |
| WO2008153852A1 (en) | 2007-06-07 | 2008-12-18 | Merck & Co., Inc. | Tricyclic anilide heterocyclic cgrp receptor antagonists |
| US7928111B2 (en) | 2007-06-08 | 2011-04-19 | Senomyx, Inc. | Compounds including substituted thienopyrimidinone derivatives as ligands for modulating chemosensory receptors |
| US8633186B2 (en) | 2007-06-08 | 2014-01-21 | Senomyx Inc. | Modulation of chemosensory receptors and ligands associated therewith |
| PL2168966T3 (pl) | 2007-06-15 | 2017-06-30 | Msd K.K. | Pochodna bicykloaniliny |
| BR122017025062B8 (pt) | 2007-06-18 | 2021-07-27 | Merck Sharp & Dohme | anticorpo monoclonal ou fragmento de anticorpo para o receptor de morte programada humano pd-1, polinucleotídeo e composição compreendendo o referido anticorpo ou fragmento |
| EP2018859A1 (en) | 2007-07-26 | 2009-01-28 | Bayer Schering Pharma Aktiengesellschaft | Arylmethylene substituted N-acyl-beta-amino alcohols |
| EA201000123A1 (ru) | 2007-07-26 | 2010-08-30 | Новартис Аг | Органические соединения |
| EP2020404A1 (en) | 2007-08-01 | 2009-02-04 | Bayer Schering Pharma Aktiengesellschaft | Cyanomethyl substituted N-Acyl Tryptamines |
| EP2173354A4 (en) | 2007-08-09 | 2011-10-05 | Glaxosmithkline Llc | CHINOXALIN DERIVATIVES AS PI3 KINASE INHIBITORS |
| WO2009019518A1 (en) | 2007-08-09 | 2009-02-12 | Astrazeneca Ab | Pyrimidine compounds having a fgfr inhibitory effect |
| US7960400B2 (en) | 2007-08-27 | 2011-06-14 | Duquesne University Of The Holy Ghost | Tricyclic compounds having cytostatic and/or cytotoxic activity and methods of use thereof |
| WO2009029625A1 (en) | 2007-08-27 | 2009-03-05 | Kalypsys, Inc. | 4- [heterocyclyl-methyl] -8-fluoro-quinolin-2-ones useful as nitric oxide synthase inhibitors |
| ES2535166T3 (es) | 2007-09-04 | 2015-05-06 | The Scripps Research Institute | Pirimidinil-aminas sustituidas como inhibidores de proteína-quinasas |
| WO2009030871A1 (en) | 2007-09-07 | 2009-03-12 | Vernalis R & D Ltd | Pyrrolopyrimidine derivatives having hsp90 inhibitory activity |
| TW200920357A (en) | 2007-09-10 | 2009-05-16 | Curis Inc | HSP90 inhibitors containing a zinc binding moiety |
| KR101660989B1 (ko) | 2007-10-01 | 2016-09-28 | 아이오니스 파마수티컬즈, 인코포레이티드 | 섬유아세포 성장 인자 수용체 4 발현의 안티센스 조절 |
| CA2701406C (en) | 2007-10-05 | 2016-01-26 | Banyu Pharmaceutical Co., Ltd. | Benzoxazinone derivative |
| WO2009047255A1 (en) | 2007-10-09 | 2009-04-16 | Ucb Pharma, S.A. | Heterobicyclic compounds as histamine h4-receptor antagonists |
| WO2009049018A1 (en) | 2007-10-10 | 2009-04-16 | Syndax Pharmaceuticals, Inc. | Novel compounds and methods of using them |
| US8513233B2 (en) | 2007-10-11 | 2013-08-20 | Shanghai Institute Of Materia Medica, Cas | Pyrimidinyl-propionic acid derivatives and their use as PPAR agonists |
| GB0720038D0 (en) | 2007-10-12 | 2007-11-21 | Astex Therapeutics Ltd | New compounds |
| GB0720041D0 (en) | 2007-10-12 | 2007-11-21 | Astex Therapeutics Ltd | New Compounds |
| WO2009047993A1 (ja) | 2007-10-13 | 2009-04-16 | Konica Minolta Holdings, Inc. | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| MX2010004260A (es) | 2007-10-16 | 2010-04-30 | Wyeth Llc | Compuestos de tienopirimidina y pirazolopirimidina y su uso como inhibidores de mtor cinasa y pi3 cinasa. |
| MX2010004244A (es) | 2007-10-17 | 2010-04-30 | Novartis Ag | Derivados de imidazo [i,2-a]-piridina utiles como inhibidores de cinasa tipo activina (alk). |
| CN101910158A (zh) | 2007-10-25 | 2010-12-08 | 阿斯利康(瑞典)有限公司 | 可用于治疗细胞增殖性病症的吡啶衍生物和吡嗪衍生物 |
| RU2007139634A (ru) | 2007-10-25 | 2009-04-27 | Сергей Олегович Бачурин (RU) | Новые тиазол-, триазол- или оксадиазол-содержащие тетрациклические соединения |
| WO2009056886A1 (en) | 2007-11-01 | 2009-05-07 | Astrazeneca Ab | Pyrimidine derivatives and their use as modulators of fgfr activity |
| EA019869B1 (ru) | 2007-11-28 | 2014-06-30 | Дана Фарбер Кансер Инститьют, Инк. | Низкомолекулярные миристатные ингибиторы тирозинкиназы bcr-abl и способы их применения |
| JP2011505407A (ja) | 2007-12-03 | 2011-02-24 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 過剰な又は異常な細胞増殖を特徴とする疾患を治療するためのジアミノピリジン |
| AU2008343932B2 (en) | 2007-12-19 | 2013-08-15 | Amgen Inc. | Fused pyridine, pyrimidine and triazine compounds as cell cycle inhibitors |
| AU2008345225A1 (en) | 2007-12-21 | 2009-07-09 | University Of Rochester | Method for altering the lifespan of eukaryotic organisms |
| AU2008345688A1 (en) | 2007-12-21 | 2009-07-09 | Wyeth Llc | Imidazo [1,2-b] pyridazine compounds as modulators of liver X receptors |
| WO2009086509A2 (en) | 2007-12-27 | 2009-07-09 | Purdue Research Foundation | Reagents for biomolecular labeling, detection and quantification employing raman spectroscopy |
| FR2926297B1 (fr) | 2008-01-10 | 2013-03-08 | Centre Nat Rech Scient | Molecules chimiques inhibitrices du mecanisme d'epissage pour traiter des maladies resultant d'anomalies d'epissage. |
| EP2248814A4 (en) | 2008-01-24 | 2011-01-12 | Alla Chem Llc | SUBSTITUTED CYCLOALKAN [E AND D] PYRAZOLO [1,5-A] PYRIMIDINES / ANTAGONISTS OF SEROTONIN 5-HT6 RECEPTORS AND PROCESS FOR THEIR PREPARATION AND THEIR USE |
| JP2011510044A (ja) | 2008-01-24 | 2011-03-31 | ユセベ ファルマ ソシエテ アノニム | シクロブトキシ基を含む化合物 |
| KR20100119776A (ko) | 2008-01-24 | 2010-11-10 | 알라 캠, 엘엘씨 | 2-알킬아미노-3-아릴설포닐-사이클로알카노[e 또는 d]피라졸로[1,5-A]피리미딘/세로토닌 5-HT6 수용체의 길항제, 이의 제조방법 및 이의 용도 |
| EA018462B1 (ru) | 2008-01-25 | 2013-08-30 | ХАЙ ПОЙНТ ФАРМАСЬЮТИКАЛЗ, ЭлЭлСи | ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК МОДУЛЯТОРЫ СИНТЕЗА TNF-α И КАК ИНГИБИТОРЫ PDE4 |
| WO2009097446A1 (en) | 2008-01-30 | 2009-08-06 | Genentech, Inc. | Pyrazolopyrimidine pi3k inhibitor compounds and methods of use |
| EP2265270A1 (en) | 2008-02-04 | 2010-12-29 | OSI Pharmaceuticals, Inc. | 2-aminopyridine kinase inhibitors |
| RU2010137300A (ru) | 2008-02-22 | 2012-03-27 | Ф. Хоффманн-Ля Рош Аг (Ch) | Модуляторы бета-амилоида |
| JP2011513233A (ja) | 2008-02-22 | 2011-04-28 | アイアールエム・リミテッド・ライアビリティ・カンパニー | Gpr119活性モジュレーターとしての化合物および組成物 |
| JP5451646B2 (ja) | 2008-02-27 | 2014-03-26 | ヴァイティー ファーマシューティカルズ,インコーポレイテッド | 11β−ヒドロキシステロイドデヒドロゲナーゼ1型の阻害剤 |
| WO2009108827A1 (en) | 2008-02-29 | 2009-09-03 | Wyeth | Fused tricyclic pyrazolo[1, 5-a]pyrimidines, methods for preparation and uses thereof |
| EP2262837A4 (en) | 2008-03-12 | 2011-04-06 | Merck Sharp & Dohme | PD-1 BINDING PROTEINS |
| GB0804701D0 (en) | 2008-03-13 | 2008-04-16 | Amura Therapeutics Ltd | Compounds |
| JP5547099B2 (ja) | 2008-03-14 | 2014-07-09 | インテリカイン, エルエルシー | キナーゼ阻害剤および使用方法 |
| WO2009114874A2 (en) | 2008-03-14 | 2009-09-17 | Intellikine, Inc. | Benzothiazole kinase inhibitors and methods of use |
| US20090246198A1 (en) | 2008-03-31 | 2009-10-01 | Takeda Pharmaceutical Company Limited | Mapk/erk kinase inhibitors and methods of use thereof |
| WO2009122180A1 (en) | 2008-04-02 | 2009-10-08 | Medical Research Council | Pyrimidine derivatives capable of inhibiting one or more kinases |
| US8436005B2 (en) | 2008-04-03 | 2013-05-07 | Abbott Laboratories | Macrocyclic pyrimidine derivatives |
| WO2009126584A1 (en) | 2008-04-07 | 2009-10-15 | Amgen Inc. | Gem-disubstituted and spirocyclic amino pyridines/pyrimidines as cell cycle inhibitors |
| WO2009124755A1 (en) | 2008-04-08 | 2009-10-15 | European Molecular Biology Laboratory (Embl) | Compounds with novel medical uses and method of identifying such compounds |
| WO2009125809A1 (ja) | 2008-04-11 | 2009-10-15 | 第一三共株式会社 | ピペリジン誘導体 |
| WO2009125808A1 (ja) | 2008-04-11 | 2009-10-15 | 第一三共株式会社 | アミノシクロヘキシル誘導体 |
| WO2009128520A1 (ja) | 2008-04-18 | 2009-10-22 | 塩野義製薬株式会社 | P13k阻害活性を有する複素環化合物 |
| NZ588830A (en) | 2008-04-22 | 2012-11-30 | Portola Pharm Inc | Inhibitors of protein kinases |
| US8309577B2 (en) | 2008-04-23 | 2012-11-13 | Bristol-Myers Squibb Company | Quinuclidine compounds as α-7 nicotinic acetylcholine receptor ligands |
| US7863291B2 (en) | 2008-04-23 | 2011-01-04 | Bristol-Myers Squibb Company | Quinuclidine compounds as alpha-7 nicotinic acetylcholine receptor ligands |
| CN102015704A (zh) | 2008-04-29 | 2011-04-13 | 霍夫曼-拉罗奇有限公司 | Jnk的嘧啶基吡啶酮抑制剂 |
| MX342553B (es) | 2008-04-29 | 2016-10-04 | Novartis Ag | Metodos para monitorear la modulacion de la actividad de cinasa del receptor del factor de crecimiento de fibroblastos y uso de dichos metodos. |
| AR071523A1 (es) | 2008-04-30 | 2010-06-23 | Merck Serono Sa | Compuestos biciclicos fusionados, un proceso para su preparacion, el compuesto para ser utilizado como medicamento en el tratamiento y profilaxis de enfermedades, una composicion farmaceutica y un conjunto que comprende paquetes separados del compuesto y de un ingrediente activo del medicamento |
| US9315449B2 (en) | 2008-05-15 | 2016-04-19 | Duke University | Substituted pyrazoles as heat shock transcription factor activators |
| MY155535A (en) | 2008-05-23 | 2015-10-30 | Novartis Ag | Derivatives of quinolines and quinoxalines as protien tyrosine kinase inhibitors |
| WO2009144205A1 (en) | 2008-05-30 | 2009-12-03 | Basf Se | Rylene-based semiconductor materials and methods of preparation and use thereof |
| CA2726317A1 (en) | 2008-06-03 | 2009-12-10 | Merck Sharp & Dohme Corp. | Inhibitors of akt activity |
| CN102089403A (zh) | 2008-06-10 | 2011-06-08 | 巴斯夫欧洲公司 | 新型过渡金属配合物及其在有机发光二极管中的用途-ⅲ |
| WO2009151997A1 (en) | 2008-06-12 | 2009-12-17 | Merck & Co., Inc. | Process for producing bicycloaniline derivatives |
| GB0810902D0 (en) | 2008-06-13 | 2008-07-23 | Astex Therapeutics Ltd | New compounds |
| CN102123989A (zh) | 2008-06-19 | 2011-07-13 | 阿斯利康(瑞典)有限公司 | 吡唑化合物436 |
| WO2009157423A1 (ja) | 2008-06-24 | 2009-12-30 | 財団法人乙卯研究所 | 縮合環を有するオキサゾリジノン誘導体 |
| US8338439B2 (en) | 2008-06-27 | 2012-12-25 | Celgene Avilomics Research, Inc. | 2,4-disubstituted pyrimidines useful as kinase inhibitors |
| EP2303881A2 (en) | 2008-07-14 | 2011-04-06 | Gilead Sciences, Inc. | Fused heterocyclyc inhibitors of histone deacetylase and/or cyclin-dependent kinases |
| CA2726460C (en) | 2008-07-15 | 2017-02-21 | F. Hoffmann-La Roche Ag | Novel phenyl-imidazopyridines and pyridazines |
| WO2010007099A1 (en) | 2008-07-15 | 2010-01-21 | Cellzome Limited | 2-aminoimidazo[1,2-b]pyridazine derivatives as pi3k inhibitors |
| EP2328897A1 (en) | 2008-07-16 | 2011-06-08 | Schering Corporation | Bicyclic heterocycle derivatives and their use as gpcr modulators |
| CA2730593A1 (en) | 2008-07-16 | 2010-01-21 | Schering Corporation | Bicyclic heterocycle derivatives and use thereof as gpr119 modulators |
| UY31982A (es) | 2008-07-16 | 2010-02-26 | Boehringer Ingelheim Int | Derivados de 1,2-dihidropiridin-3-carboxamidas n-sustituidas |
| US10722562B2 (en) | 2008-07-23 | 2020-07-28 | Immudex Aps | Combinatorial analysis and repair |
| WO2010017047A1 (en) | 2008-08-05 | 2010-02-11 | Merck & Co., Inc. | Therapeutic compounds |
| WO2010015643A1 (en) | 2008-08-06 | 2010-02-11 | Novartis Ag | New antiviral modified nucleosides |
| US9284297B2 (en) | 2008-08-11 | 2016-03-15 | President And Fellows Of Harvard College | Halofuginone analogs for inhibition of tRNA synthetases and uses thereof |
| UY32049A (es) | 2008-08-14 | 2010-03-26 | Takeda Pharmaceutical | Inhibidores de cmet |
| WO2010030027A1 (en) | 2008-09-10 | 2010-03-18 | Mitsubishi Tanabe Pharma Corporation | Aromatic nitrogen-containing 6-membered ring compounds and their use |
| CA2738252C (en) | 2008-09-26 | 2018-05-01 | Dana-Farber Cancer Institute, Inc. | Human anti-pd-1, pd-l1, and pd-l2 antibodies and uses therefor |
| UY32158A (es) | 2008-10-03 | 2010-04-30 | Astrazeneca Ab | Derivados heterociclicos y metodos de uso de los mismos |
| US20100267748A1 (en) | 2008-10-15 | 2010-10-21 | Gilead Palo Alto, Inc. | HETEROCYCLIC COMPOUNDS USEFUL AS STEAROYL CoA DESATURASE INHIBITORS |
| US8110578B2 (en) | 2008-10-27 | 2012-02-07 | Signal Pharmaceuticals, Llc | Pyrazino[2,3-b]pyrazine mTOR kinase inhibitors for oncology indications and diseases associated with the mTOR/PI3K/Akt pathway |
| UY32203A (es) | 2008-10-29 | 2010-05-31 | Astrazeneca Ab | Amino pirimidinas y su uso en terapia |
| US8476431B2 (en) | 2008-11-03 | 2013-07-02 | Itellikine LLC | Benzoxazole kinase inhibitors and methods of use |
| WO2010052448A2 (en) | 2008-11-05 | 2010-05-14 | Ucb Pharma S.A. | Fused pyrazine derivatives as kinase inhibitors |
| WO2010059552A1 (en) | 2008-11-18 | 2010-05-27 | Glaxosmithkline Llc | Prolyl hydroxylase inhibitors |
| ES2548141T3 (es) | 2008-11-20 | 2015-10-14 | Glaxosmithkline Llc | Compuestos químicos |
| JP5522053B2 (ja) | 2008-12-03 | 2014-06-18 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料、表示装置及び照明装置 |
| KR101061599B1 (ko) | 2008-12-05 | 2011-09-02 | 한국과학기술연구원 | 비정상 세포 성장 질환의 치료를 위한 단백질 키나아제 저해제인 신규 인다졸 유도체, 이의 약학적으로 허용가능한염 및 이를 유효성분으로 함유하는 약학적 조성물 |
| MX2011006108A (es) | 2008-12-08 | 2011-11-18 | Vm Pharma Llc | Composiciones de inhibidores de los receptores tirosina quinasa. |
| US8110265B2 (en) | 2008-12-09 | 2012-02-07 | The Coca-Cola Company | Pet container and compositions having enhanced mechanical properties and gas barrier properties |
| SI4209510T1 (sl) | 2008-12-09 | 2024-04-30 | F. Hoffmann-La Roche Ag | Protitelesa anti-PD-L1 in njihova uporaba za izboljšanje funkcije celic T |
| US8575179B2 (en) | 2008-12-12 | 2013-11-05 | Msd K.K. | Dihydropyrazolopyrimidinone derivatives |
| WO2010067886A1 (en) | 2008-12-12 | 2010-06-17 | Banyu Pharmaceutical Co.,Ltd. | Dihydropyrimidopyrimidine derivative |
| BRPI0918360A8 (pt) | 2008-12-19 | 2017-12-05 | Genentech Inc | Composto, composição farmacêutica e usos de um composto |
| JO2885B1 (en) | 2008-12-22 | 2015-03-15 | ايلي ليلي اند كومباني | Protein kinase inhibitors |
| MX2011006959A (es) | 2008-12-30 | 2011-12-06 | Arqule Inc | Compuestos substituidos de 5,6-dihidro-6-fenilbenzo [f] isoquinolina-2-amina. |
| WO2010078427A1 (en) | 2008-12-30 | 2010-07-08 | Arqule, Inc. | Substituted pyrazolo [3, 4-b] pyridine compounds |
| EP3828185A3 (en) | 2009-01-06 | 2021-09-01 | Dana Farber Cancer Institute, Inc. | Pyrimido-diazepinone kinase scaffold compounds and methods of treating disorders |
| JOP20190230A1 (ar) | 2009-01-15 | 2017-06-16 | Incyte Corp | طرق لاصلاح مثبطات انزيم jak و المركبات الوسيطة المتعلقة به |
| WO2010083145A1 (en) | 2009-01-16 | 2010-07-22 | Merck Sharp & Dohme Corp. | IMIDAZO[1,2-a]PYRIDINES AND IMIDAZO[1,2-b]PYRIDAZINES AS MARK INHIBITORS |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| JP2010180147A (ja) | 2009-02-04 | 2010-08-19 | Mitsubishi Gas Chemical Co Inc | シアン酸エステル化合物、およびその硬化物 |
| WO2010089411A2 (en) | 2009-02-09 | 2010-08-12 | Universite De La Mediterranee | Pd-1 antibodies and pd-l1 antibodies and uses thereof |
| TW201038569A (en) | 2009-02-16 | 2010-11-01 | Abbott Gmbh & Co Kg | Heterocyclic compounds, pharmaceutical compositions containing them, and their use in therapy |
| TW201035102A (en) | 2009-03-04 | 2010-10-01 | Gruenethal Gmbh | Sulfonylated tetrahydroazolopyrazines and their use as medicinal products |
| WO2010103306A1 (en) | 2009-03-10 | 2010-09-16 | Astrazeneca Uk Limited | Benzimidazole derivatives and their use as antivaral agents |
| JP5615261B2 (ja) | 2009-03-11 | 2014-10-29 | 学校法人関西学院 | 多環芳香族化合物 |
| WO2010107768A1 (en) | 2009-03-18 | 2010-09-23 | Schering Corporation | Bicyclic compounds as inhibitors of diacylglycerol acyltransferase |
| JP2012521988A (ja) | 2009-03-23 | 2012-09-20 | シーメンス メディカル ソリューションズ ユーエスエー インコーポレイテッド | 神経学的障害を検知するためのイメージング剤 |
| WO2010111573A1 (en) | 2009-03-27 | 2010-09-30 | Abbott Laboratories | Compounds as cannabinoid receptor ligands |
| TW201102391A (en) | 2009-03-31 | 2011-01-16 | Biogen Idec Inc | Certain substituted pyrimidines, pharmaceutical compositions thereof, and methods for their use |
| JP5629752B2 (ja) | 2009-04-06 | 2014-11-26 | ユニバーシティ・ヘルス・ネットワークUniversity Health Network | キナーゼインヒビターおよびこれを用いた癌の治療方法 |
| EA020825B1 (ru) | 2009-04-07 | 2015-02-27 | Эмерити Фарма Аб | Аналоги изоксазол-3(2h)-она в качестве терапевтических агентов |
| GB0906472D0 (en) | 2009-04-15 | 2009-05-20 | Astex Therapeutics Ltd | New compounds |
| GB0906470D0 (en) | 2009-04-15 | 2009-05-20 | Astex Therapeutics Ltd | New compounds |
| JP5531446B2 (ja) | 2009-04-20 | 2014-06-25 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料、表示装置および照明装置 |
| ES2347630B1 (es) | 2009-04-29 | 2011-09-08 | Universitat Ramon Llull | Sintesis y usos de 4-cianopentanoatos y 4-cianopentenoatos sustituidos. |
| US8765754B2 (en) | 2009-04-29 | 2014-07-01 | Locus Pharmaceuticals, Inc. | Pyrrolotriazine compounds |
| US20100280067A1 (en) | 2009-04-30 | 2010-11-04 | Pakala Kumara Savithru Sarma | Inhibitors of acetyl-coa carboxylase |
| US9616244B2 (en) | 2009-05-01 | 2017-04-11 | Heartsine Technologies Limited | External defibrillator |
| AR078411A1 (es) | 2009-05-07 | 2011-11-09 | Lilly Co Eli | Compuesto de vinil imidazolilo y composicion farmaceutica que lo comprende |
| JP5600891B2 (ja) | 2009-05-15 | 2014-10-08 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置および照明装置 |
| JP5604808B2 (ja) | 2009-05-20 | 2014-10-15 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP5568889B2 (ja) | 2009-05-22 | 2014-08-13 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置及び有機エレクトロルミネッセンス素子材料 |
| JP5629980B2 (ja) | 2009-05-22 | 2014-11-26 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP2012528083A (ja) | 2009-05-27 | 2012-11-12 | コーベンハブンス ウニベルシテト | Ncamに結合する線維芽細胞増殖因子レセプター由来ペプチド |
| JP5499519B2 (ja) | 2009-05-27 | 2014-05-21 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| GB0910003D0 (en) | 2009-06-11 | 2009-07-22 | Univ Leuven Kath | Novel compounds for the treatment of neurodegenerative diseases |
| JP5600894B2 (ja) | 2009-06-24 | 2014-10-08 | コニカミノルタ株式会社 | 白色有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| EP2445502B2 (en) | 2009-06-25 | 2022-09-28 | Alkermes Pharma Ireland Limited | Heterocyclic compounds for the treatment of neurological and psychological disorders |
| CN102471261B (zh) | 2009-06-30 | 2014-10-29 | 日本瑞翁株式会社 | 二芳基胺化合物、以及抗老化剂、聚合物组合物、橡胶交联物及其成型品、以及二芳基胺化合物的制备方法 |
| US20120135997A1 (en) | 2009-07-17 | 2012-05-31 | Shionogi & Co., Ltd. | Pharmaceutical composition comprising a lactam or benzenesulfonamide compound |
| WO2011011597A1 (en) | 2009-07-24 | 2011-01-27 | Duke University | Prochelators useful for inhibiting metal-associated toxicity |
| FR2948568B1 (fr) | 2009-07-30 | 2012-08-24 | Sanofi Aventis | Formulation pharmaceutique |
| TWI468402B (zh) | 2009-07-31 | 2015-01-11 | 必治妥美雅史谷比公司 | 降低β-類澱粉生成之化合物 |
| CA2770140A1 (en) | 2009-08-05 | 2011-02-10 | Yitsun Richard Kao | Antiviral compounds and methods of making and using thereof cross reference to related applications |
| JP2012197231A (ja) | 2009-08-06 | 2012-10-18 | Oncotherapy Science Ltd | Ttk阻害作用を有するピリジンおよびピリミジン誘導体 |
| BR112012008094A2 (pt) | 2009-08-07 | 2020-08-18 | Chugai Seiyaku Kabushiki Kaisha | derivado de aminopirazol, seu uso, composição farmacêutica que o compreende, agentes para inibir a atividade de fgfr e para prevenir ou tratar câncer |
| WO2011018894A1 (en) | 2009-08-10 | 2011-02-17 | Raqualia Pharma Inc. | Pyrrolopyrimidine derivatives as potassium channel modulators |
| NZ620020A (en) | 2009-08-17 | 2015-06-26 | Intellikine Llc | Heterocyclic compounds and uses thereof |
| JP5577650B2 (ja) | 2009-08-24 | 2014-08-27 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料、表示装置及び照明装置 |
| KR101184115B1 (ko) | 2009-08-31 | 2012-09-18 | 일동제약주식회사 | 신규 펩티드 데포르밀라제 저해제 화합물 및 그 제조방법 |
| WO2011028947A2 (en) | 2009-09-03 | 2011-03-10 | Bioenergenix | Heterocyclic compounds for the inhibition of pask |
| EP2473498A1 (en) | 2009-09-04 | 2012-07-11 | Bayer Pharma Aktiengesellschaft | Substituted aminoquinoxalines as tyrosine threonine kinase inhibitors |
| WO2011031740A1 (en) | 2009-09-09 | 2011-03-17 | Achaogen, Inc. | Antibacterial fluoroquinolone analogs |
| WO2011032050A2 (en) | 2009-09-11 | 2011-03-17 | Trius Therapeutics, Inc. | Gyrase inhibitors |
| WO2011041143A1 (en) | 2009-10-01 | 2011-04-07 | Merck Sharp & Dohme Corp. | HETEROCYCLIC-FUSED PYRAZOLO[4,3-c]PYRIDIN-3-ONE M1 RECEPTOR POSITIVE ALLOSTERIC MODULATORS |
| US8466155B2 (en) | 2009-10-02 | 2013-06-18 | Boehringer Ingelheim International Gmbh | Pyrimidines |
| GB0917571D0 (en) | 2009-10-07 | 2009-11-25 | Karobio Ab | Novel estrogen receptor ligands |
| EP2308866A1 (de) | 2009-10-09 | 2011-04-13 | Bayer CropScience AG | Phenylpyri(mi)dinylpyrazole und ihre Verwendung als Fungizide |
| FR2951172B1 (fr) | 2009-10-13 | 2014-09-26 | Pf Medicament | Derives pyrazolopyridines en tant qu'agent anticancereux |
| WO2011049988A2 (en) | 2009-10-20 | 2011-04-28 | Eiger Biopharmaceuticals, Inc. | Indazoles to treat flaviviridae virus infection |
| KR20110043270A (ko) | 2009-10-21 | 2011-04-27 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 구비한 유기발광소자 |
| SG10201406813RA (en) | 2009-10-22 | 2014-11-27 | Gilead Sciences Inc | Derivatives of purine or deazapurine useful for the treatment of (inter alia) viral infections |
| WO2011050245A1 (en) | 2009-10-23 | 2011-04-28 | Yangbo Feng | Bicyclic heteroaryls as kinase inhibitors |
| CN102686225A (zh) | 2009-10-26 | 2012-09-19 | 西格诺药品有限公司 | 杂芳基化合物的合成和纯化方法 |
| ES2524548T3 (es) | 2009-10-30 | 2014-12-10 | Novartis Ag | N-óxido de 3-(2,6-dicloro-3,5-dimetoxi-fenil)-1-{6-[4-(4-etil-piperacin-1-il)-fenilamino]-pirimidin-4-il}-1-metil-urea |
| KR20110049217A (ko) | 2009-11-04 | 2011-05-12 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 전계 발광 소자 |
| GB0919432D0 (en) | 2009-11-05 | 2009-12-23 | Glaxosmithkline Llc | Use |
| NZ599866A (en) | 2009-11-06 | 2014-09-26 | Plexxikon Inc | Compounds and methods for kinase modulation, and indications therefor |
| JP5740409B2 (ja) | 2009-11-13 | 2015-06-24 | ジェノスコ | キナーゼ阻害剤 |
| MX2012005827A (es) | 2009-11-18 | 2012-06-19 | Plexxikon Inc | Compuestos y metodos para la modulacion de cinasas, e indicaciones para ello. |
| JP2013032290A (ja) | 2009-11-20 | 2013-02-14 | Dainippon Sumitomo Pharma Co Ltd | 新規縮合ピリミジン誘導体 |
| WO2011062885A1 (en) | 2009-11-23 | 2011-05-26 | Schering Corporation | Fused bicyclic pyrimidine derivatives and methods of use thereof |
| WO2011066342A2 (en) | 2009-11-24 | 2011-06-03 | Amplimmune, Inc. | Simultaneous inhibition of pd-l1/pd-l2 |
| EP2332939A1 (en) * | 2009-11-26 | 2011-06-15 | Æterna Zentaris GmbH | Novel Naphthyridine derivatives and the use thereof as kinase inhibitors |
| MX2012006381A (es) | 2009-12-01 | 2012-06-19 | Abbott Lab | Nuevos compuestos triciclicos. |
| JP2011116840A (ja) | 2009-12-02 | 2011-06-16 | Fujifilm Corp | 顔料微粒子分散体、これを用いた光硬化性組成物及びカラーフィルタ |
| AR079257A1 (es) | 2009-12-07 | 2012-01-04 | Novartis Ag | Formas cristalinas de 3-(2,6-dicloro-3-5-dimetoxi-fenil)-1-{6-[4-(4-etil-piperazin-1-il)-fenil-amino]-pirimidin-4-il}-1-metil-urea y sales de las mismas |
| EP2513098B1 (en) | 2009-12-17 | 2016-11-09 | Merck Sharp & Dohme Corp. | Aminopyrimidines as syk inhibitors |
| US20120258940A1 (en) | 2009-12-18 | 2012-10-11 | Giordano Caponigro | Method for treating haematological cancers |
| RU2573569C2 (ru) | 2009-12-22 | 2016-01-20 | Вертекс Фармасьютикалз Инкорпорейтед | Ингибиторы фосфатидилинозитол-3-киназы на основе изоиндолинона |
| FR2954317B1 (fr) | 2009-12-23 | 2012-01-27 | Galderma Res & Dev | Nouveaux derives phenoliques, et leur utilisation pharmaceutique ou cosmetique |
| FR2954315B1 (fr) | 2009-12-23 | 2012-02-24 | Galderma Res & Dev | Nouveaux derives phenoliques, et leur utilisation pharmaceutique ou cosmetique |
| US20110207736A1 (en) | 2009-12-23 | 2011-08-25 | Gatekeeper Pharmaceuticals, Inc. | Compounds that modulate egfr activity and methods for treating or preventing conditions therewith |
| WO2011090666A2 (en) | 2009-12-28 | 2011-07-28 | Afraxis, Inc. | Methods for treating autism |
| EP2519523A1 (en) | 2009-12-29 | 2012-11-07 | Polyera Corporation | Thionated aromatic bisimides as organic semiconductors and devices incorporating them |
| WO2011080755A1 (en) | 2009-12-29 | 2011-07-07 | Advinus Therapeutics Private Limited | Fused nitrogen heterocyclic compounds, process of preparation and uses thereof |
| CA2784807C (en) | 2009-12-29 | 2021-12-14 | Dana-Farber Cancer Institute, Inc. | Type ii raf kinase inhibitors |
| US8563567B2 (en) | 2009-12-30 | 2013-10-22 | Arqule, Inc. | Substituted heterocyclic compounds |
| AU2010339444A1 (en) | 2009-12-30 | 2012-07-19 | Arqule, Inc. | Substituted pyrrolo-aminopyrimidine compounds |
| WO2011082267A2 (en) | 2009-12-30 | 2011-07-07 | Arqule, Inc. | Substituted triazolo-pyrazine compounds |
| CN102115026A (zh) | 2009-12-31 | 2011-07-06 | 清华大学 | 一维纳米结构、其制备方法及一维纳米结构作标记的方法 |
| US20130022629A1 (en) | 2010-01-04 | 2013-01-24 | Sharpe Arlene H | Modulators of Immunoinhibitory Receptor PD-1, and Methods of Use Thereof |
| WO2011082488A1 (en) | 2010-01-06 | 2011-07-14 | British Columbia Cancer Agency Branch | Bisphenol derivative therapeutics and methods for their use |
| KR101483215B1 (ko) | 2010-01-29 | 2015-01-16 | 한미약품 주식회사 | 단백질 키나아제 저해활성을 갖는 비시클릭 헤테로아릴 유도체 |
| WO2011094890A1 (en) | 2010-02-02 | 2011-08-11 | Argusina Inc. | Phenylalanine derivatives and their use as non-peptide glp-1 receptor modulators |
| WO2011097717A1 (en) | 2010-02-15 | 2011-08-18 | University Of Victoria Innovation And Development Corporation | Synthesis of bicyclic compounds and method for their use as therapeutic agents |
| SA111320200B1 (ar) | 2010-02-17 | 2014-02-16 | ديبيوفارم اس ايه | مركبات ثنائية الحلقة واستخداماتها كمثبطات c-src/jak مزدوجة |
| MX2012009561A (es) | 2010-02-17 | 2012-11-23 | Amgen Inc | Carboxamidas como inhibidores de canales de sodio dependientes del voltaje. |
| WO2011103441A1 (en) | 2010-02-18 | 2011-08-25 | Schering Corporation | Substituted pyridine and pyrimidine derivatives and their use in treating viral infections |
| DE112011100604T5 (de) | 2010-02-18 | 2013-01-31 | Ntn Corporation | Verdicker, Schmierfett, Verfahren zur Herstellung derselben und fettgeschmiertes Lager |
| US9193728B2 (en) | 2010-02-18 | 2015-11-24 | Medivation Technologies, Inc. | Fused tetracyclic pyrido [4,3-B] indole and pyrido [3,4-B] indole derivatives and methods of use |
| UY33227A (es) | 2010-02-19 | 2011-09-30 | Novartis Ag | Compuestos de pirrolopirimidina como inhibidores de la cdk4/6 |
| WO2011103557A1 (en) | 2010-02-22 | 2011-08-25 | Advanced Cancer Therapeutics, Llc | Small molecule inhibitors of pfkfb3 and glycolytic flux and their methods of use as anti-cancer therapeutics |
| JP5662994B2 (ja) | 2010-02-26 | 2015-02-04 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| US20130045203A1 (en) | 2010-03-02 | 2013-02-21 | Emory University | Uses of Noscapine and Derivatives in Subjects Diagnosed with FAP |
| WO2011111880A1 (ko) | 2010-03-08 | 2011-09-15 | 주식회사 메디젠텍 | 세포핵에서 세포질로의 gsk3의 이동을 억제하는 화합물을 함유하는 세포핵에서 세포질로의 gsk3 이동에 의해 발생되는 질환의 치료 또는 예방용 약학적 조성물 |
| WO2011112687A2 (en) | 2010-03-10 | 2011-09-15 | Kalypsys, Inc. | Heterocyclic inhibitors of histamine receptors for the treatment of disease |
| WO2011112995A1 (en) | 2010-03-11 | 2011-09-15 | Gilead Sciences, Inc. | Imidazopyridines syk inhibitors |
| WO2011115725A2 (en) | 2010-03-16 | 2011-09-22 | Dana-Farber Cancer Institute, Inc. | Indazole compounds and their uses |
| KR20180032686A (ko) | 2010-03-24 | 2018-03-30 | 아미텍 테러퓨틱 솔루션즈 인크 | 인산화효소 억제에 유용한 헤테로환 화합물 |
| JP5752232B2 (ja) | 2010-03-31 | 2015-07-22 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | プロテインキナーゼ阻害剤としての置換ピロロトリアジン化合物 |
| CN102153551B (zh) | 2010-04-02 | 2012-04-25 | 济南海乐医药技术开发有限公司 | 基于吲唑或氮杂吲唑的双芳基脲或硫脲类结构抗肿瘤药物 |
| JP5724204B2 (ja) | 2010-04-07 | 2015-05-27 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、及び照明装置 |
| WO2011130390A1 (en) | 2010-04-13 | 2011-10-20 | Rigel Pharmaceuticals, Inc. | 2, 4-pyrimidinediamine compounds and prodrugs thereof and their uses |
| WO2011128403A1 (en) | 2010-04-16 | 2011-10-20 | Novartis Ag | Organic compound for use in the treatment of liver cancer |
| US8822447B2 (en) | 2010-04-22 | 2014-09-02 | Janssen Pharmaceutica Nv | Indazole compounds useful as ketohexokinase inhibitors |
| CN102939088A (zh) | 2010-04-23 | 2013-02-20 | 奇尼塔公司 | 抗病毒化合物 |
| AR081331A1 (es) | 2010-04-23 | 2012-08-08 | Cytokinetics Inc | Amino- pirimidinas composiciones de las mismas y metodos para el uso de los mismos |
| WO2011137313A1 (en) | 2010-04-30 | 2011-11-03 | Bristol-Myers Squibb Company | Aza-bicyclic amine n-oxide compounds as alpha-7 nicotinic acetylcholine receptor ligand pro-drugs |
| GB201007286D0 (en) | 2010-04-30 | 2010-06-16 | Astex Therapeutics Ltd | New compounds |
| US8759398B2 (en) | 2010-05-03 | 2014-06-24 | Biolink Life Sciences, Inc. | Phosphorus binder composition for treatment of hyperphosphatemia |
| WO2011140338A1 (en) | 2010-05-05 | 2011-11-10 | Gatekeeper Pharmaceuticals, Inc. | Compounds that modulate egfr activity and methods for treating or preventing conditions therewith |
| AU2011253101A1 (en) | 2010-05-11 | 2013-01-10 | Aveo Pharmaceuticals, Inc. | Anti-FGFR2 antibodies |
| WO2011141848A1 (en) | 2010-05-11 | 2011-11-17 | Pfizer Inc. | Morpholine compounds as mineralocorticoid receptor antagonists |
| TWI513694B (zh) | 2010-05-11 | 2015-12-21 | Amgen Inc | 抑制間變性淋巴瘤激酶的嘧啶化合物 |
| MX2012013197A (es) | 2010-05-12 | 2013-04-03 | Abbvie Inc | Inhibidores de indazol de cinasa. |
| TWI446916B (zh) | 2010-05-12 | 2014-08-01 | Spectrum Pharmaceuticals Inc | 鹼式碳酸鑭、碳酸氧鑭及其製備方法及用途 |
| GB201008134D0 (en) | 2010-05-14 | 2010-06-30 | Medical Res Council Technology | Compounds |
| WO2011147199A1 (en) | 2010-05-28 | 2011-12-01 | Versitech Limited | Compounds and methods for treating viral infections |
| WO2011147198A1 (en) | 2010-05-28 | 2011-12-01 | Versitech Limited | Compounds and methods for treatment of proliferative diseases |
| CA2797947C (en) | 2010-06-04 | 2019-07-09 | Charles Baker-Glenn | Aminopyrimidine derivatives as lrrk2 modulators |
| WO2011153553A2 (en) | 2010-06-04 | 2011-12-08 | The Regents Of The University Of California | Methods and compositions for kinase inhibition |
| WO2011155983A1 (en) | 2010-06-07 | 2011-12-15 | Bikam Pharmaceuticals Inc. | Opsin-binding ligands, compositions and methods of use |
| TW201210597A (en) | 2010-06-09 | 2012-03-16 | Gilead Sciences Inc | Inhibitors of hepatitis C virus |
| US8299117B2 (en) | 2010-06-16 | 2012-10-30 | Metabolex Inc. | GPR120 receptor agonists and uses thereof |
| WO2011159877A2 (en) | 2010-06-18 | 2011-12-22 | The Brigham And Women's Hospital, Inc. | Bi-specific antibodies against tim-3 and pd-1 for immunotherapy in chronic immune conditions |
| WO2011163330A1 (en) | 2010-06-24 | 2011-12-29 | Merck Sharp & Dohme Corp. | Novel heterocyclic compounds as erk inhibitors |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| KR101486782B1 (ko) | 2010-06-27 | 2015-01-28 | 킹 사우드 유니버시티 | 무한 중첩된 해시 체인들에 의한 1회용 패스워드 인증 |
| ES2706066T3 (es) | 2010-07-02 | 2019-03-27 | Univ Health Network | Procedimiento dirigido a enfermedades mutantes con PTEN y composiciones para las mismas |
| FR2962438B1 (fr) | 2010-07-06 | 2012-08-17 | Sanofi Aventis | Derives d'indolizines, procedes de preparation et application en therapeutique |
| FR2962437B1 (fr) | 2010-07-06 | 2012-08-17 | Sanofi Aventis | Derives d'imidazopyridine, leur procede de preparation et leur application en therapeutique |
| CN103080106A (zh) | 2010-07-06 | 2013-05-01 | 诺瓦提斯公司 | 用作激酶抑制剂的环醚化合物 |
| CA2804648C (en) | 2010-07-09 | 2019-01-22 | The Walter And Eliza Hall Institute Of Medical Research | Protein kinase inhibitors and methods of treatment |
| WO2012009258A2 (en) | 2010-07-13 | 2012-01-19 | Edward Roberts | Peptidomimetic galanin receptor modulators |
| WO2012008999A2 (en) | 2010-07-14 | 2012-01-19 | Merck Sharp & Dohme Corp. | Tricyclic compounds as allosteric modulators of metabotropic glutamate receptors |
| TW201206946A (en) | 2010-07-15 | 2012-02-16 | Bristol Myers Squibb Co | Compounds for the reduction of beta-amyloid production |
| WO2012008564A1 (ja) | 2010-07-16 | 2012-01-19 | 協和発酵キリン株式会社 | 含窒素芳香族複素環誘導体 |
| US20130225581A1 (en) | 2010-07-16 | 2013-08-29 | Kyowa Hakko Kirin Co., Ltd | Nitrogen-containing aromatic heterocyclic derivative |
| US8987273B2 (en) | 2010-07-28 | 2015-03-24 | Bayer Intellectual Property Gmbh | Substituted imidazo[1,2-B]pyridazines |
| EP2413140A1 (en) | 2010-07-29 | 2012-02-01 | Sanofi | Method for identifying a compound having an antiarrhythmic effect as well as uses relating thereto |
| KR20120012431A (ko) | 2010-07-30 | 2012-02-09 | 롬엔드하스전자재료코리아유한회사 | 유기발광화합물을 발광재료로서 채용하고 있는 유기 전계 발광 소자 |
| US8906943B2 (en) | 2010-08-05 | 2014-12-09 | John R. Cashman | Synthetic compounds and methods to decrease nicotine self-administration |
| US9051280B2 (en) | 2010-08-13 | 2015-06-09 | AbbVie Deutschland GmbH & Co. KG | Tetraline and indane derivatives, pharmaceutical compositions containing them, and their use in therapy |
| US8883839B2 (en) | 2010-08-13 | 2014-11-11 | Abbott Laboratories | Tetraline and indane derivatives, pharmaceutical compositions containing them, and their use in therapy |
| WO2012027239A1 (en) | 2010-08-23 | 2012-03-01 | Schering Corporation | NOVEL PYRAZOLO[1,5-a]PYRROLO[3,2-e]PYRIMIDINE DERIVATIVES AS mTOR INHIBITORS |
| EP2608669B1 (en) | 2010-08-23 | 2016-06-22 | Merck Sharp & Dohme Corp. | NOVEL PYRAZOLO[1,5-a]PYRIMIDINE DERIVATIVES AS mTOR INHIBITORS |
| EP2611798B1 (en) | 2010-09-01 | 2015-04-08 | Gilead Connecticut, Inc. | Pyridazinones, method of making, and method of use thereof |
| KR101837223B1 (ko) | 2010-09-01 | 2018-03-09 | 질레드 코네티컷 인코포레이티드 | 피리디논/피라지논, 그의 제조 방법 및 사용 방법 |
| EP2614058B1 (en) | 2010-09-08 | 2015-07-08 | GlaxoSmithKline Intellectual Property Development Limited | POLYMORPHS AND SALTS OF N-[5-[4-(5-{[(2R,6S)-2,6-DIMETHYL-4-MORPHOLINYL]METHYL}-& xA;1,3-OXAZOL-2-YL)-1H-INDAZOL-6-YL]-2-(METHYLOXY)-3-PYRIDINYL]METHANESULFONAMIDE |
| AR082799A1 (es) | 2010-09-08 | 2013-01-09 | Ucb Pharma Sa | Derivados de quinolina y quinoxalina como inhibidores de quinasa |
| EP2613781B1 (en) | 2010-09-08 | 2016-08-24 | GlaxoSmithKline Intellectual Property Development Limited | Indazole derivatives for use in the treatment of influenza virus infection |
| TWI541243B (zh) | 2010-09-10 | 2016-07-11 | 拜耳知識產權公司 | 經取代咪唑并嗒 |
| KR20130103503A (ko) | 2010-09-14 | 2013-09-23 | 호도가야 가가쿠 고교 가부시키가이샤 | 전하 제어제 및 그것을 사용한 토너 |
| CN102399220A (zh) | 2010-09-15 | 2012-04-04 | 黄振华 | 三并环类PI3K和mTOR双重抑制剂 |
| CN102399233B (zh) | 2010-09-15 | 2014-08-13 | 山东轩竹医药科技有限公司 | PI3K和mTOR双重抑制剂类化合物 |
| WO2012036233A1 (ja) | 2010-09-17 | 2012-03-22 | 塩野義製薬株式会社 | メラニン凝集ホルモン受容体アンタゴニスト活性を有する縮合へテロ環誘導体 |
| GB201015949D0 (en) | 2010-09-22 | 2010-11-03 | Medical Res Council Technology | Compounds |
| JO3062B1 (ar) | 2010-10-05 | 2017-03-15 | Lilly Co Eli | R)-(e)-2-(4-(2-(5-(1-(3، 5-داي كلورو بيريدين-4-يل)إيثوكسي)-1h-إندازول-3-يل)?ينيل)-1h-بيرازول-1-يل)إيثانول بلوري |
| WO2012054364A2 (en) | 2010-10-22 | 2012-04-26 | Merck Sharp & Dohme Corp. | Bicyclic diamines as janus kinase inhibitors |
| EP3567042B1 (en) | 2010-10-25 | 2021-07-07 | G1 Therapeutics, Inc. | Cdk inhibitors |
| JP2012092049A (ja) | 2010-10-27 | 2012-05-17 | Sumitomo Chemical Co Ltd | 有害動物防除組成物及び有害動物の防除方法 |
| WO2012058211A2 (en) | 2010-10-29 | 2012-05-03 | Emory University | Quinazoline derivatives, compositions, and uses related thereto |
| WO2012061337A1 (en) | 2010-11-02 | 2012-05-10 | Exelixis, Inc. | Fgfr2 modulators |
| TW201305139A (zh) | 2010-11-10 | 2013-02-01 | Gruenenthal Gmbh | 作為類香草素受體配體之經取代雜芳基甲醯胺及尿素衍生物 |
| EP2638008B1 (en) | 2010-11-10 | 2015-07-01 | Actelion Pharmaceuticals Ltd | Lactam derivatives useful as orexin receptor antagonists |
| JP2012116825A (ja) | 2010-11-11 | 2012-06-21 | Ehime Univ | アセンジイミド化合物の製造方法 |
| KR101171232B1 (ko) | 2010-11-15 | 2012-08-06 | 단국대학교 산학협력단 | 스파이로 화합물 및 이를 포함하는 유기전계 발광소자 |
| WO2012065297A1 (en) | 2010-11-16 | 2012-05-24 | Impact Therapeutics, Inc. | 3-ARYL-6-ARYL-[1,2,4]TRIAZOLO[4,3-a]PYRIDINES AS INHIBITORS OF CELL PROLIFERATION AND THE USE THEREOF |
| MX2013005567A (es) | 2010-11-17 | 2013-10-30 | Amgen Inc | Derivados de quinolina como inhibidores de pik3. |
| JP5898687B2 (ja) | 2010-11-18 | 2016-04-06 | カシナ ライラ イノバ ファーマシューティカルズ プライベート リミテッド | 置換4−(セレノフェン−2(または3)−イルアミノ)ピリミジン化合物およびその使用方法 |
| GB201020179D0 (en) | 2010-11-29 | 2011-01-12 | Astex Therapeutics Ltd | New compounds |
| US9090593B2 (en) | 2010-12-09 | 2015-07-28 | Amgen Inc. | Bicyclic compounds as Pim inhibitors |
| EP2651405A2 (en) | 2010-12-14 | 2013-10-23 | Electrophoretics Limited | Casein kinase 1 (ck1 ) inhibitors |
| JP6007189B2 (ja) | 2010-12-20 | 2016-10-12 | メルク セローノ ソシエテ アノニム | Irak阻害剤としてのインダゾリルトリアゾール誘導体 |
| BR112013015859A2 (pt) | 2010-12-22 | 2018-11-21 | Leo Laboratories Ltd | composto, uso de um composto, métodos de prevenção, tratamento, melhora ou profilaxia de distúrbios fisiológicos ou doenças, e de tratamento ou melhora de indicações cosméticas, e, composição farmacêutica |
| CN102603628B (zh) | 2010-12-22 | 2016-08-17 | 香港理工大学 | 作为抗癌试剂的喹啉衍生物 |
| CN104529827B (zh) | 2010-12-22 | 2016-08-24 | 利奥实验室有限公司 | 巨大戟二萜醇-3-酰化物iii和巨大戟二萜醇-3-氨基甲酸酯 |
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| EP2468258A1 (en) | 2010-12-22 | 2012-06-27 | LEK Pharmaceuticals d.d. | Process for the preparation of a pharmaceutical composition comprising a low soluble pharmaceutically active ingredient |
| US20130267526A1 (en) | 2010-12-23 | 2013-10-10 | Amgen, Inc. | Heterocyclic compounds and their uses |
| JP5691508B2 (ja) | 2010-12-27 | 2015-04-01 | Jnc株式会社 | ジイミド化合物ならびにインクジェット用インクおよびその用途 |
| KR101466150B1 (ko) | 2010-12-31 | 2014-11-27 | 제일모직 주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| WO2012093731A1 (ja) | 2011-01-06 | 2012-07-12 | Jx日鉱日石エネルギー株式会社 | イミド化合物及びその製造方法、グリース用増ちょう剤並びにグリース組成物 |
| US8362023B2 (en) | 2011-01-19 | 2013-01-29 | Hoffmann-La Roche Inc. | Pyrazolo pyrimidines |
| FR2970967B1 (fr) | 2011-01-27 | 2013-02-15 | Pf Medicament | Derives de type azaindazole ou diazaindazole comme medicament |
| EP2487159A1 (en) | 2011-02-11 | 2012-08-15 | MSD Oss B.V. | RorgammaT inhibitors |
| US9434747B2 (en) | 2011-02-18 | 2016-09-06 | Medivation Technologies, Inc. | Methods of treating diabetes |
| WO2012116237A2 (en) | 2011-02-23 | 2012-08-30 | Intellikine, Llc | Heterocyclic compounds and uses thereof |
| TWI532742B (zh) | 2011-02-28 | 2016-05-11 | 艾伯維有限公司 | 激酶之三環抑制劑 |
| CN103429759A (zh) | 2011-03-17 | 2013-12-04 | 诺华股份有限公司 | Fgfr及其配体作为hr阳性对象中乳腺癌的生物标记 |
| EP2937349B1 (en) | 2011-03-23 | 2016-12-28 | Amgen Inc. | Fused tricyclic dual inhibitors of cdk 4/6 and flt3 |
| ITPD20110091A1 (it) | 2011-03-24 | 2012-09-25 | Univ Padova | Inibitori multitirosinchinasi utili per le patologie correlate: modelli farmacoforici, composti identificati tramite questi modelli, metodi per la loro preparazione, la loro formulazione e il loro impiego terapeutico. |
| UY33966A (es) | 2011-03-25 | 2012-10-31 | Abbott Lab | Antagonistas del receptor transitorio potencial de vanilloides 1 (trpv1) |
| CN103596983B (zh) | 2011-04-07 | 2016-10-26 | 霍夫曼-拉罗奇有限公司 | 抗fgfr4抗体及使用方法 |
| FR2974088A1 (fr) | 2011-04-12 | 2012-10-19 | Pf Medicament | Composes pyrazolo[3,4-b]pyridines tri- et tetracycliques comme agent anticancereux |
| SG194917A1 (en) | 2011-05-16 | 2013-12-30 | Genentech Inc | Fgfr1 agonists and methods of use |
| US20140288069A1 (en) | 2011-05-17 | 2014-09-25 | Bayer Intellectual Property Gmbh | Amino-substituted imidazopyridazines as mknk1 kinase inhibitors |
| WO2012158795A1 (en) | 2011-05-17 | 2012-11-22 | Principia Biopharma Inc. | Pyrazolopyrimidine derivatives as tyrosine kinase inhibitors |
| US20150182525A1 (en) | 2011-05-19 | 2015-07-02 | Novartis Ag | 4-Amino-5-Fluoro-3-[6-(4-Methylpiperazin-1-YL)-1H-Benzimidazol-2-YL]-1H-Quinolin-2-one for use in the Treatment of Adenoid Cystic Carcinoma |
| CN103717604B (zh) | 2011-06-01 | 2016-06-01 | 拜耳知识产权有限责任公司 | 取代的氨基咪唑并哒嗪 |
| UY34114A (es) | 2011-06-03 | 2013-01-03 | Millennium Pharm Inc | Combinación de inhibidores de mek e inhibidores selectivos de la quiinasa aurora a |
| US8999530B2 (en) | 2011-06-13 | 2015-04-07 | Lg Chem, Ltd. | Compounds and organic electronic device using same |
| ES2610366T3 (es) | 2011-06-22 | 2017-04-27 | Bayer Intellectual Property Gmbh | Heterociclil-aminoimidazopiridazinas |
| US8846656B2 (en) | 2011-07-22 | 2014-09-30 | Novartis Ag | Tetrahydropyrido-pyridine and tetrahydropyrido-pyrimidine compounds and use thereof as C5a receptor modulators |
| MX355852B (es) | 2011-08-12 | 2018-05-02 | Hoffmann La Roche | Compuestos de pirazolo [3,4-c] piridina y métodos de uso. |
| AU2012295802B2 (en) | 2011-08-12 | 2017-03-30 | Nissan Chemical Industries, Ltd. | Tricyclic heterocyclic compounds and JAK inhibitors |
| JP2013049251A (ja) | 2011-08-31 | 2013-03-14 | Fujifilm Corp | レーザー彫刻用レリーフ印刷版原版、並びに、レリーフ印刷版及びその製版方法 |
| WO2013033981A1 (zh) | 2011-09-06 | 2013-03-14 | 江苏先声药物研究有限公司 | 一类2,7-萘啶衍生物及其制备方法和应用 |
| US9345705B2 (en) | 2011-09-15 | 2016-05-24 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| US9376435B2 (en) | 2011-09-23 | 2016-06-28 | Jawaharlal Nehru Centre For Advanced Scientific Research | Chromophores for the detection of volatile organic compounds |
| US9320737B2 (en) | 2011-09-23 | 2016-04-26 | Bayer Intellectual Property Gmbh | Substituted imidazopyridazines |
| US20140227321A1 (en) | 2011-09-30 | 2014-08-14 | Kineta, Inc. | Anti-viral compounds |
| UA111382C2 (uk) | 2011-10-10 | 2016-04-25 | Оріон Корпорейшн | Інгібітори протеїнкінази |
| US9580390B2 (en) | 2011-10-12 | 2017-02-28 | University Health Network | Indazole compounds as kinase inhibitors and method of treating cancer with same |
| KR101897044B1 (ko) | 2011-10-20 | 2018-10-23 | 에스에프씨 주식회사 | 유기금속 화합물 및 이를 포함하는 유기전계발광소자 |
| WO2013063003A1 (en) | 2011-10-28 | 2013-05-02 | Novartis Ag | Method of treating gastrointestinal stromal tumors |
| EP2770999A1 (en) | 2011-10-28 | 2014-09-03 | Novartis AG | Method of treating gastrointestinal stromal tumors |
| WO2013088191A1 (en) | 2011-12-12 | 2013-06-20 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Antagonist of the fibroblast growth factor receptor 3 (fgfr3) for use in the treatment or the prevention of skeletal disorders linked with abnormal activation of fgfr3 |
| FR2985257B1 (fr) | 2011-12-28 | 2014-02-14 | Sanofi Sa | Composes dimeres agonistes des recepteurs des fgfs (fgfrs), leur procede de preparation et leur application en therapeutique |
| FR2985258A1 (fr) | 2011-12-28 | 2013-07-05 | Sanofi Sa | Composes dimeres agonistes des recepteurs des fgfs (fgfrs), leur procede de preparation et leur application en therapeutique |
| WO2013109027A1 (ko) | 2012-01-18 | 2013-07-25 | 덕산하이메탈(주) | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US10026905B2 (en) | 2012-01-18 | 2018-07-17 | Duk San Neolux Co., Ltd. | Compound, organic electric element using the same, and an electronic device thereof |
| CA2854093C (en) | 2012-01-19 | 2016-07-05 | Taiho Pharmaceutical Co., Ltd. | 3,5-disubstituted alkynylbenzene compound and salt thereof |
| EP2817311B1 (en) | 2012-02-23 | 2016-04-06 | Bayer Intellectual Property GmbH | Substituted benzothienyl-pyrrolotriazines and uses thereof |
| JP2013179181A (ja) | 2012-02-28 | 2013-09-09 | Sumitomo Chemical Co Ltd | 有機光電変換素子 |
| MX355474B (es) | 2012-03-14 | 2018-04-16 | Lupin Ltd | Compuestos de heterociclilo como inhibidores de mek. |
| MX354783B (es) | 2012-03-30 | 2018-03-21 | Novartis Ag | Inhibidor de fgfr para su uso en el tratamiento de trastornos hipofosfatemicos. |
| JP5120580B1 (ja) | 2012-05-14 | 2013-01-16 | Jsr株式会社 | 液晶配向剤 |
| DK2852354T3 (da) | 2012-05-20 | 2020-08-24 | Tel Hashomer Medical Res Infrastructure & Services Ltd | Kunstig mitralklap |
| NZ702747A (en) | 2012-06-13 | 2017-03-31 | Incyte Holdings Corp | Substituted tricyclic compounds as fgfr inhibitors |
| KR102163776B1 (ko) | 2012-07-11 | 2020-10-12 | 블루프린트 메디신즈 코포레이션 | 섬유아세포 성장인자 수용체의 저해제 |
| US20150202203A1 (en) | 2012-07-11 | 2015-07-23 | Novartis Ag | Method of Treating Gastrointestinal Stromal Tumors |
| CA2880901A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| WO2014019186A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| KR101985259B1 (ko) | 2012-08-10 | 2019-06-03 | 제이에스알 가부시끼가이샤 | 액정 배향제 및 화합물 |
| WO2014026125A1 (en) | 2012-08-10 | 2014-02-13 | Incyte Corporation | Pyrazine derivatives as fgfr inhibitors |
| WO2014044846A1 (en) | 2012-09-24 | 2014-03-27 | Evotec (Uk) Ltd. | 3-(aryl- or heteroaryl-amino)-7-(3,5-dimethoxyphenyl)isoquinoline derivatives as fgfr inhibitors useful for the treatment of proliferative disorders or dysplasia |
| WO2014048878A1 (en) | 2012-09-26 | 2014-04-03 | Evotec (Uk) Ltd. | Phenyl- or pyridyl- pyrrolo[2,3b]pyrazine derivatives useful in the treatment or prevention of proliferative disorders or dysplasia |
| WO2014062454A1 (en) | 2012-10-15 | 2014-04-24 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| KR102000211B1 (ko) | 2012-10-29 | 2019-09-30 | 삼성디스플레이 주식회사 | 유기금속 화합물 및 이를 포함한 유기 발광 소자 |
| WO2014085216A1 (en) | 2012-11-28 | 2014-06-05 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| US20140148548A1 (en) | 2012-11-28 | 2014-05-29 | Central Glass Company, Limited | Fluorine-Containing Polymerizable Monomer And Polymer Compound Using Same |
| CN104968664A (zh) | 2012-12-12 | 2015-10-07 | 山东亨利医药科技有限责任公司 | 作为酪氨酸激酶抑制剂的并环化合物 |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| WO2014105849A1 (en) | 2012-12-28 | 2014-07-03 | Xoma (Us) Llc | Antibodies specific for fgfr4 and methods of use |
| TWI629266B (zh) | 2012-12-28 | 2018-07-11 | 藍印藥品公司 | 纖維母細胞生長因子受體之抑制劑 |
| KR102030587B1 (ko) | 2013-01-09 | 2019-10-10 | 에스에프씨주식회사 | 두 개의 나프틸기를 포함하는 비대칭 안트라센 유도체 및 이를 포함하는 유기 발광 소자 |
| WO2014113191A1 (en) | 2013-01-15 | 2014-07-24 | Xiaohu Zhang | Hedgehog pathway signaling inhibitors and therapeutic applications thereof |
| CN103694236B (zh) | 2013-01-15 | 2017-05-31 | 苏州开拓药业股份有限公司 | 一种嘧啶骨架具有刺猬通路拮抗剂活性的抗肿瘤化合物 |
| KR101456626B1 (ko) | 2013-02-01 | 2014-11-03 | 대영이앤비 주식회사 | 냉장고 부압 방지 장치 |
| WO2014136972A1 (ja) | 2013-03-07 | 2014-09-12 | 国立大学法人九州大学 | 超分子複合体、発光体、および有機化合物検出用のセンサー素子 |
| WO2014138485A1 (en) | 2013-03-08 | 2014-09-12 | Irm Llc | Ex vivo production of platelets from hematopoietic stem cells and the product thereof |
| US9498532B2 (en) | 2013-03-13 | 2016-11-22 | Novartis Ag | Antibody drug conjugates |
| EP2968285A4 (en) | 2013-03-13 | 2016-12-21 | Flatley Discovery Lab | COMPOUNDS AND METHODS FOR THE TREATMENT OF CYSTIC FIBROSIS |
| EP2970258B1 (en) | 2013-03-14 | 2018-04-18 | AbbVie Deutschland GmbH & Co KG | Novel inhibitor compounds of phosphodiesterase type 10a |
| EA036160B1 (ru) | 2013-03-15 | 2020-10-08 | Селджен Кар Ллс | Гетероарильные соединения и их применение |
| US9499522B2 (en) | 2013-03-15 | 2016-11-22 | Blueprint Medicines Corporation | Compositions useful for treating disorders related to kit |
| US9321786B2 (en) | 2013-03-15 | 2016-04-26 | Celgene Avilomics Research, Inc. | Heteroaryl compounds and uses thereof |
| KR102350704B1 (ko) | 2013-03-15 | 2022-01-13 | 셀젠 카르 엘엘씨 | 헤테로아릴 화합물 및 이의 용도 |
| TWI628176B (zh) | 2013-04-04 | 2018-07-01 | 奧利安公司 | 蛋白質激酶抑制劑 |
| KR101573611B1 (ko) | 2013-04-17 | 2015-12-01 | 주식회사 엘지화학 | 플러렌 유도체, 이를 이용한 유기 태양 전지 및 이의 제조 방법 |
| EP2986610B9 (en) | 2013-04-19 | 2018-10-17 | Incyte Holdings Corporation | Bicyclic heterocycles as fgfr inhibitors |
| CA2908988A1 (en) | 2013-04-19 | 2014-10-23 | Covagen Ag | Novel bispecific binding molecules with antitumoral activity |
| GB201307577D0 (en) | 2013-04-26 | 2013-06-12 | Astex Therapeutics Ltd | New compounds |
| US9630963B2 (en) | 2013-05-09 | 2017-04-25 | Principia Biopharma, Inc. | Quinolone derivatives as fibroblast growth factor inhibitors |
| TR201815333T4 (tr) | 2013-06-14 | 2018-11-21 | Sanofi Sa | Mesane kanserinin tedavisinde kullanıma yönelik pirazolopiridin türevleri. |
| MX362582B (es) | 2013-06-28 | 2019-01-24 | Beigene Ltd | Compuestos triciclicos fusionados de urea como inhibidores de raf quinasa y/o dimero de raf quinasa. |
| JP6380862B2 (ja) | 2013-06-28 | 2018-08-29 | ベイジーン リミテッド | 複数種類のキナーゼの阻害剤としての縮合三環式アミド系化合物 |
| EP3016949B1 (en) | 2013-07-02 | 2020-05-13 | Syngenta Participations AG | Pesticidally active bi- or tricyclic heterocycles with sulfur containing substituents |
| AU2014287209B2 (en) | 2013-07-09 | 2019-01-24 | Dana-Farber Cancer Institute, Inc. | Kinase inhibitors for the treatment of disease |
| JP6018547B2 (ja) | 2013-07-09 | 2016-11-02 | 大成ロテック株式会社 | 舗装機械 |
| WO2015006754A2 (en) | 2013-07-11 | 2015-01-15 | Acea Biosciences Inc. | Heterocyclic compounds and uses thereof |
| TW201605452A (zh) | 2013-08-28 | 2016-02-16 | 安斯泰來製藥股份有限公司 | 以嘧啶化合物作爲有效成分之醫藥組成物 |
| MX2016004933A (es) | 2013-10-18 | 2016-12-20 | Eisai R&D Man Co Ltd | Inhibidores de pirimidina del fgfr4. |
| US9434700B2 (en) | 2013-10-25 | 2016-09-06 | Neil Bifulco, JR. | Inhibitors of the fibroblast growth factor receptor |
| AU2014338549B2 (en) | 2013-10-25 | 2017-05-25 | Novartis Ag | Ring-fused bicyclic pyridyl derivatives as FGFR4 inhibitors |
| FR3012330B1 (fr) | 2013-10-29 | 2015-10-23 | Oreal | Composition biphase comprenant un ester d'acide gras et de sucre ou un alkylpolyglucoside liquide, de hlb < 8, et un alcane ramifie en c8-c18 |
| WO2015066452A2 (en) | 2013-11-01 | 2015-05-07 | Foundation Medicine, Inc. | Methods of treating pediatric cancers |
| WO2015108992A1 (en) | 2014-01-15 | 2015-07-23 | Blueprint Medicines Corporation | Heterobicyclic compounds and their use as fgfr4 receptor inhibitors |
| AU2015306561B2 (en) | 2014-08-19 | 2018-03-15 | Shanghai Haihe Pharmaceutical Co., Ltd. | Indazole compounds as FGFR kinase inhibitor, preparation and use thereof |
| CN104262330B (zh) | 2014-08-27 | 2016-09-14 | 广东东阳光药业有限公司 | 一种脲取代联苯类化合物及其组合物及用途 |
| MA39484A (fr) | 2014-09-19 | 2016-03-24 | Bayer Pharma AG | Indazoles à substituants benzyle utilisés comme inhibiteurs de bub1 |
| US20160115164A1 (en) | 2014-10-22 | 2016-04-28 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9708318B2 (en) | 2015-02-20 | 2017-07-18 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| WO2016134294A1 (en) | 2015-02-20 | 2016-08-25 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| PE20180021A1 (es) | 2015-02-20 | 2018-01-09 | Univ Oregon Health & Science | Derivados de sobetiroma |
| EP3302442B1 (en) | 2015-06-03 | 2024-10-16 | Triastek, Inc. | Dosage forms and use thereof |
| MY189596A (en) | 2015-07-15 | 2022-02-18 | Immatics Biotechnologies Gmbh | A novel peptides for use in immunotherapy against epithelial ovarian cancer and other cancers |
| CR20180029A (es) | 2015-07-15 | 2018-06-05 | Protagonist Therapeutics Inc | Inhibidores peotídicos del receptor de interleucina 23 y su uso para tratar enfermedades inflamatorias |
| JP6717927B2 (ja) | 2015-07-15 | 2020-07-08 | キャボット コーポレイションCabot Corporation | シリカで補強されたエラストマー複合材の製造方法およびそれを含む製品 |
| DK3322701T3 (da) | 2015-07-15 | 2019-07-08 | H Hoffmann La Roche Ag | Ethynylderivater som metabotropiske glutamatreceptormodulatorer |
| MD3456346T2 (ro) | 2015-07-30 | 2021-11-30 | Macrogenics Inc | Molecule de legare la PD-1 și LAG-3 și metode de utilizare a acestora |
| US10519169B2 (en) | 2015-08-03 | 2019-12-31 | Samumed, Llc | 3-(1H-pyrrolo[2,3-C]pyridin-2-yl)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10329309B2 (en) | 2015-08-03 | 2019-06-25 | Samumed, Llc | 3-(3H-imidazo[4,5-B]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10206909B2 (en) | 2015-08-03 | 2019-02-19 | Samumed, Llc | 3-(1H-pyrrolo[2,3-B]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017023988A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10195185B2 (en) | 2015-08-03 | 2019-02-05 | Samumed, Llc | 3-(1H-imidazo[4,5-C]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10231956B2 (en) | 2015-08-03 | 2019-03-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10392383B2 (en) | 2015-08-03 | 2019-08-27 | Samumed, Llc | 3-(1H-benzo[d]imidazol-2-yl)-1H-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| CN108368057B (zh) | 2015-08-20 | 2022-03-15 | 捷思英达医药技术(上海)有限公司 | 作为erk抑制剂的吡唑并稠合的杂环化合物 |
| US10975071B2 (en) | 2015-09-28 | 2021-04-13 | Araxes Pharma Llc | Inhibitors of KRAS G12C mutant proteins |
| WO2017070089A1 (en) | 2015-10-19 | 2017-04-27 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CA3002560A1 (en) | 2015-10-23 | 2017-04-27 | Array Biopharma, Inc. | 2-aryl- and 2-heteroaryl-substituted 2-pyridazin-3(2h)-one compounds as inhibitors of fgfr tyrosine kinases |
| SI3377488T1 (sl) | 2015-11-19 | 2022-11-30 | Incyte Corporation | Heterociklične spojine kot imunomodulatorji |
| EP3390361B1 (en) | 2015-12-17 | 2022-03-16 | Incyte Corporation | N-phenyl-pyridine-2-carboxamide derivatives and their use as pd-1/pd-l1 protein/protein interaction modulators |
| EP3828171A1 (en) | 2015-12-22 | 2021-06-02 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2017192961A1 (en) | 2016-05-06 | 2017-11-09 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2017205464A1 (en) | 2016-05-26 | 2017-11-30 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CA3028685A1 (en) | 2016-06-20 | 2017-12-28 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| US10138248B2 (en) | 2016-06-24 | 2018-11-27 | Incyte Corporation | Substituted imidazo[2,1-f][1,2,4]triazines, substituted imidazo[1,2-a]pyridines, substituted imidazo[1,2-b]pyridazines and substituted imidazo[1,2-a]pyrazines as PI3K-γ inhibitors |
| US20180016260A1 (en) | 2016-07-14 | 2018-01-18 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| US20180057486A1 (en) | 2016-08-29 | 2018-03-01 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CN109641868B (zh) | 2016-08-30 | 2021-12-03 | 广东东阳光药业有限公司 | 流感病毒复制抑制剂及其使用方法和用途 |
| US20180072718A1 (en) | 2016-09-09 | 2018-03-15 | Incyte Corporation | Pyrazolopyridine compounds and uses thereof |
| US10934304B2 (en) | 2016-10-05 | 2021-03-02 | Recurium Ip Holdings, Llc | Spirocyclic compounds |
| KR101755556B1 (ko) | 2016-11-18 | 2017-07-07 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 뇌암 예방 또는 치료용 약학 조성물 및 이의 제조방법 |
| KR101834366B1 (ko) | 2016-11-21 | 2018-03-05 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 유방암 예방 또는 치료용 약학 조성물 및 이의 제조방법 |
| KR101844049B1 (ko) | 2016-12-05 | 2018-03-30 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 간암 예방 또는 치료용 약학 조성물 |
| KR101844050B1 (ko) | 2016-12-09 | 2018-05-14 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 암 예방 또는 치료용 약학 조성물 |
| EP3558963B1 (en) | 2016-12-22 | 2022-03-23 | Incyte Corporation | Bicyclic heteroaromatic compounds as immunomodulators |
| DK3558990T3 (da) | 2016-12-22 | 2022-09-12 | Incyte Corp | Tetrahydroimidazo[4,5-c]pyridinderivater som pd-l1 internaliseringsinducere |
| US20180177784A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| ES2874756T3 (es) | 2016-12-22 | 2021-11-05 | Incyte Corp | Derivados de triazolo[1,5-A]piridina como inmunomoduladores |
| US20180179179A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| IL295660A (en) | 2016-12-22 | 2022-10-01 | Incyte Corp | Benzoxazole derivatives as immunomodulators |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| WO2018234354A1 (en) | 2017-06-20 | 2018-12-27 | Grünenthal GmbH | NOVEL SUBSTITUTED 3-INDOLE AND 3-INDAZOLE COMPOUNDS AS PHOSPHODIESTERASE INHIBITORS |
| EP3672973A4 (en) | 2017-08-22 | 2021-05-26 | JS Innopharm (Shanghai) Ltd. | HETEROCYCLIC COMPOUNDS USED AS KINASE INHIBITORS, COMPOSITIONS INCLUDING THE HETEROCYCLIC COMPOUND, AND METHODS OF USE THEREOF |
| AU2018352695A1 (en) | 2017-10-19 | 2020-05-28 | Effector Therapeutics, Inc. | Benzimidazole-indole inhibitors of Mnk1 and Mnk2 |
| ES2908283T3 (es) | 2017-12-02 | 2022-04-28 | Galapagos Nv | Nuevos compuestos y composiciones farmacéuticas de los mismos para el tratamiento de enfermedades |
| FI3774791T3 (fi) | 2018-03-30 | 2023-03-21 | Incyte Corp | Heterosyklisiä yhdisteitä immunomodulaattoreina |
| CR20200591A (es) | 2018-05-04 | 2021-03-31 | Incyte Corp | Sales de un inhibidor de fgfr |
| IL312465A (en) | 2018-05-04 | 2024-06-01 | Incyte Corp | FGFR inhibitor solid forms and processes for their preparation |
| HUE061503T2 (hu) | 2018-05-11 | 2023-07-28 | Incyte Corp | Tetrahidro-imidazo[4,5-C]piridin-származékok mint PD-L1 immunmodulátorok |
| SG11202101151SA (en) | 2018-08-14 | 2021-03-30 | Osteoqc Inc | Pyrrolo - dipyridine compounds |
| US20210355123A1 (en) | 2018-09-07 | 2021-11-18 | Merck Patent Gmbh | 5-Morpholin-4-yl-pyrazolo[4,3-b]pyridine derivatives |
| JP2022515198A (ja) | 2018-12-19 | 2022-02-17 | アレイ バイオファーマ インコーポレイテッド | FGFRチロシンキナーゼの阻害剤としての置換ピラゾロ[1,5-a]ピリジン化合物 |
| EP3898615A1 (en) | 2018-12-19 | 2021-10-27 | Array Biopharma, Inc. | 7-((3,5-dimethoxyphenyl)amino)quinoxaline derivatives as fgfr inhibitors for treating cancer |
| JP7148802B2 (ja) | 2019-01-25 | 2022-10-06 | 富士通株式会社 | 解析プログラム、解析方法および解析装置 |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| TW202128685A (zh) | 2019-10-14 | 2021-08-01 | 美商英塞特公司 | 作為fgfr抑制劑之雙環雜環 |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| EP4069696A1 (en) | 2019-12-04 | 2022-10-12 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| US11407750B2 (en) | 2019-12-04 | 2022-08-09 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| WO2021146424A1 (en) | 2020-01-15 | 2021-07-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
-
2014
- 2014-04-18 EP EP14732662.3A patent/EP2986610B9/en active Active
- 2014-04-18 AU AU2014253798A patent/AU2014253798C1/en active Active
- 2014-04-18 EA EA202090516A patent/EA202090516A3/ru unknown
- 2014-04-18 US US14/256,438 patent/US9533984B2/en active Active
- 2014-04-18 KR KR1020217018897A patent/KR102469849B1/ko active IP Right Grant
- 2014-04-18 EA EA201592005A patent/EA035095B1/ru unknown
- 2014-04-18 JP JP2016509131A patent/JP6449244B2/ja active Active
- 2014-04-18 CA CA3130452A patent/CA3130452C/en active Active
- 2014-04-18 SG SG11201508328PA patent/SG11201508328PA/en unknown
- 2014-04-18 PE PE2015002236A patent/PE20152033A1/es unknown
- 2014-04-18 MX MX2015014683A patent/MX367878B/es active IP Right Grant
- 2014-04-18 ME MEP-2018-53A patent/ME03015B/me unknown
- 2014-04-18 LT LTEP14732662.3T patent/LT2986610T/lt unknown
- 2014-04-18 TW TW103114284A patent/TWI649318B/zh active
- 2014-04-18 BR BR112015026307-0A patent/BR112015026307B1/pt active IP Right Grant
- 2014-04-18 PT PT147326623T patent/PT2986610T/pt unknown
- 2014-04-18 ES ES17199421T patent/ES2893725T3/es active Active
- 2014-04-18 CN CN201910023729.3A patent/CN109912594A/zh active Pending
- 2014-04-18 RS RS20180225A patent/RS56924B9/sr unknown
- 2014-04-18 SI SI201430543T patent/SI2986610T1/en unknown
- 2014-04-18 EP EP17199421.3A patent/EP3318564B1/en active Active
- 2014-04-18 UA UAA201511370A patent/UA120087C2/uk unknown
- 2014-04-18 PL PL14732662T patent/PL2986610T4/pl unknown
- 2014-04-18 HU HUE14732662A patent/HUE036571T2/hu unknown
- 2014-04-18 DK DK14732662.3T patent/DK2986610T5/en active
- 2014-04-18 CA CA2909207A patent/CA2909207C/en active Active
- 2014-04-18 ES ES14732662.3T patent/ES2657451T3/es active Active
- 2014-04-18 MY MYPI2015002540A patent/MY181497A/en unknown
- 2014-04-18 KR KR1020157032502A patent/KR102269032B1/ko active IP Right Grant
- 2014-04-18 WO PCT/US2014/034662 patent/WO2014172644A2/en active Application Filing
- 2014-04-18 TW TW107146498A patent/TWI715901B/zh active
- 2014-04-18 CN CN201910023251.4A patent/CN109776525B/zh active Active
- 2014-04-18 SG SG10201708520YA patent/SG10201708520YA/en unknown
- 2014-04-18 CN CN201480028858.7A patent/CN105263931B/zh active Active
- 2014-04-21 AR ARP140101651 patent/AR096097A1/es active IP Right Grant
- 2014-12-22 NO NO14827669A patent/NO3087075T3/no unknown
-
2015
- 2015-10-08 IL IL241982A patent/IL241982B/en active IP Right Grant
- 2015-10-14 PH PH12015502383A patent/PH12015502383A1/en unknown
- 2015-10-16 CR CR20150578A patent/CR20150578A/es not_active Application Discontinuation
- 2015-10-19 MX MX2019010709A patent/MX2019010709A/es unknown
- 2015-10-19 CL CL2015003089A patent/CL2015003089A1/es unknown
- 2015-11-19 EC ECIEPI201548555A patent/ECSP15048555A/es unknown
-
2016
- 2016-08-10 HK HK18114275.7A patent/HK1255159A1/zh unknown
- 2016-08-10 HK HK16109534.6A patent/HK1221462A1/zh unknown
- 2016-11-22 US US15/358,371 patent/US10040790B2/en active Active
-
2018
- 2018-02-28 HR HRP20180365TT patent/HRP20180365T2/hr unknown
- 2018-03-09 CY CY20181100286T patent/CY1120556T1/el unknown
- 2018-07-02 US US16/025,519 patent/US10450313B2/en active Active
- 2018-07-30 AU AU2018208772A patent/AU2018208772B2/en active Active
- 2018-10-02 IL IL262038A patent/IL262038B/en unknown
- 2018-12-05 JP JP2018228352A patent/JP6698799B2/ja active Active
-
2019
- 2019-09-10 US US16/566,509 patent/US10947230B2/en active Active
- 2019-12-12 PH PH12019502810A patent/PH12019502810A1/en unknown
-
2020
- 2020-04-28 JP JP2020079472A patent/JP6903790B2/ja active Active
- 2020-10-07 AU AU2020250201A patent/AU2020250201B2/en active Active
-
2021
- 2021-01-28 US US17/160,628 patent/US11530214B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6903790B2 (ja) | Fgfr抑制剤としての二環式複素環 | |
| NZ752422B2 (en) | Bicyclic heterocycles as fgfr inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200428 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210525 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210623 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6903790 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |