ES2893725T3 - Heterocíclicos bicíclicos como inhibidores del FGFR - Google Patents
Heterocíclicos bicíclicos como inhibidores del FGFR Download PDFInfo
- Publication number
- ES2893725T3 ES2893725T3 ES17199421T ES17199421T ES2893725T3 ES 2893725 T3 ES2893725 T3 ES 2893725T3 ES 17199421 T ES17199421 T ES 17199421T ES 17199421 T ES17199421 T ES 17199421T ES 2893725 T3 ES2893725 T3 ES 2893725T3
- Authority
- ES
- Spain
- Prior art keywords
- alkyl
- nrc6rd6
- cycloalkyl
- nrc6c
- aryl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108091008794 FGF receptors Proteins 0.000 title claims description 56
- 102000052178 fibroblast growth factor receptor activity proteins Human genes 0.000 title claims description 51
- 239000003112 inhibitor Substances 0.000 title description 27
- 125000002618 bicyclic heterocycle group Chemical group 0.000 title description 5
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 367
- 150000001875 compounds Chemical class 0.000 claims abstract description 248
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims abstract description 213
- -1 -C(O)RA Chemical group 0.000 claims abstract description 180
- 125000005843 halogen group Chemical group 0.000 claims abstract description 151
- 125000001424 substituent group Chemical group 0.000 claims abstract description 148
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims abstract description 143
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 claims abstract description 133
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims abstract description 119
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 claims abstract description 109
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims abstract description 67
- 150000003839 salts Chemical class 0.000 claims abstract description 67
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims abstract description 66
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims abstract description 63
- 101100310928 Caenorhabditis elegans sra-6 gene Proteins 0.000 claims abstract description 55
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 claims abstract description 48
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract description 46
- 125000006568 (C4-C7) heterocycloalkyl group Chemical group 0.000 claims abstract description 46
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 31
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 31
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims abstract description 28
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 claims abstract description 27
- 125000000041 C6-C10 aryl group Chemical group 0.000 claims abstract description 25
- 101100310927 Caenorhabditis elegans sra-4 gene Proteins 0.000 claims abstract description 20
- 101100310920 Caenorhabditis elegans sra-2 gene Proteins 0.000 claims abstract description 15
- 125000003282 alkyl amino group Chemical group 0.000 claims abstract description 13
- 125000004414 alkyl thio group Chemical group 0.000 claims abstract description 11
- 101100310926 Caenorhabditis elegans sra-3 gene Proteins 0.000 claims abstract description 10
- 125000003342 alkenyl group Chemical group 0.000 claims abstract description 10
- 125000004767 (C1-C4) haloalkoxy group Chemical group 0.000 claims abstract description 9
- 125000006584 (C3-C10) heterocycloalkyl group Chemical group 0.000 claims abstract description 5
- 125000003118 aryl group Chemical group 0.000 claims description 155
- 238000000034 method Methods 0.000 claims description 79
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 51
- 210000004027 cell Anatomy 0.000 claims description 42
- 206010028980 Neoplasm Diseases 0.000 claims description 33
- 229910052799 carbon Inorganic materials 0.000 claims description 32
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 30
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 29
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 26
- 208000035475 disorder Diseases 0.000 claims description 22
- 201000011510 cancer Diseases 0.000 claims description 19
- 229910052739 hydrogen Inorganic materials 0.000 claims description 17
- 125000003545 alkoxy group Chemical group 0.000 claims description 16
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 14
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 13
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 claims description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims description 11
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 claims description 10
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 claims description 10
- 102000004190 Enzymes Human genes 0.000 claims description 10
- 108090000790 Enzymes Proteins 0.000 claims description 10
- 239000000460 chlorine Substances 0.000 claims description 10
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 10
- 239000003937 drug carrier Substances 0.000 claims description 8
- 125000001153 fluoro group Chemical group F* 0.000 claims description 8
- 125000000304 alkynyl group Chemical group 0.000 claims description 7
- 238000000338 in vitro Methods 0.000 claims description 7
- 229910052801 chlorine Inorganic materials 0.000 claims description 6
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 6
- 125000001188 haloalkyl group Chemical group 0.000 claims description 6
- 230000002401 inhibitory effect Effects 0.000 claims description 6
- 201000003896 thanatophoric dysplasia Diseases 0.000 claims description 6
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 claims description 5
- 206010025323 Lymphomas Diseases 0.000 claims description 5
- 210000001612 chondrocyte Anatomy 0.000 claims description 5
- 230000001684 chronic effect Effects 0.000 claims description 5
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 claims description 5
- 208000011580 syndromic disease Diseases 0.000 claims description 5
- 201000010028 Acrocephalosyndactylia Diseases 0.000 claims description 4
- 208000017604 Hodgkin disease Diseases 0.000 claims description 4
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 4
- 208000034578 Multiple myelomas Diseases 0.000 claims description 4
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 claims description 4
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 4
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 4
- 229910052731 fluorine Inorganic materials 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- 230000003553 hypophosphatemic effect Effects 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- HNGHJAMSLIQBLE-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1,8-dimethyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C)C(N)=NC=C3C2)=O)=C1F HNGHJAMSLIQBLE-UHFFFAOYSA-N 0.000 claims description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 3
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 claims description 3
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 claims description 3
- 206010005003 Bladder cancer Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 206010049889 Craniosynostosis Diseases 0.000 claims description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 3
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 3
- 206010052178 Lymphocytic lymphoma Diseases 0.000 claims description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 3
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 3
- 201000006966 adult T-cell leukemia Diseases 0.000 claims description 3
- 239000011737 fluorine Substances 0.000 claims description 3
- 208000005017 glioblastoma Diseases 0.000 claims description 3
- 201000005202 lung cancer Diseases 0.000 claims description 3
- 208000020816 lung neoplasm Diseases 0.000 claims description 3
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 3
- 125000004343 1-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C([H])([H])[H] 0.000 claims description 2
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 claims description 2
- MIAXKQPVRWDVFI-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-(2-fluorophenyl)-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C3=C(C#N)C(N)=NC=C3C2)C=2C(=CC=CC=2)F)=O)=C1F MIAXKQPVRWDVFI-UHFFFAOYSA-N 0.000 claims description 2
- HYJHWTKYITXECK-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-(2-fluorophenyl)-8-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C3=C(C)C(N)=NC=C3C2)C=2C(=CC=CC=2)F)=O)=C1F HYJHWTKYITXECK-UHFFFAOYSA-N 0.000 claims description 2
- BMLFFNDARUKPKT-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(1-piperidin-4-ylpyrazol-4-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CN(N=C4)C4CCNCC4)C(N)=NC=C3C2)=O)=C1F BMLFFNDARUKPKT-UHFFFAOYSA-N 0.000 claims description 2
- YKBROVXUBANFCS-MDZDMXLPSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-[(e)-2-phenylethenyl]-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(\C=C\C=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F YKBROVXUBANFCS-MDZDMXLPSA-N 0.000 claims description 2
- ZXZYUVSUMVHXPF-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-(2-methoxyethoxy)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound O=C1N(C)C=2C(OCCOC)=C(N)N=CC=2CN1C1=C(F)C(OC)=CC(OC)=C1F ZXZYUVSUMVHXPF-UHFFFAOYSA-N 0.000 claims description 2
- WORXVHLKINLMRW-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-ethyl-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound O=C1N(C)C=2C(CC)=C(N)N=CC=2CN1C1=C(F)C(OC)=CC(OC)=C1F WORXVHLKINLMRW-UHFFFAOYSA-N 0.000 claims description 2
- XJDWLJXIEVLSPK-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-methyl-1-[(1-methylpyrazol-4-yl)methyl]-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(CC3=CN(C)N=C3)C3=C(C)C(N)=NC=C3C2)=O)=C1F XJDWLJXIEVLSPK-UHFFFAOYSA-N 0.000 claims description 2
- 208000025490 Apert syndrome Diseases 0.000 claims description 2
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 2
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 2
- 206010066946 Craniofacial dysostosis Diseases 0.000 claims description 2
- 201000006526 Crouzon syndrome Diseases 0.000 claims description 2
- 206010013883 Dwarfism Diseases 0.000 claims description 2
- 206010014733 Endometrial cancer Diseases 0.000 claims description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 2
- 208000032027 Essential Thrombocythemia Diseases 0.000 claims description 2
- 208000005050 Familial Hypophosphatemic Rickets Diseases 0.000 claims description 2
- 208000022072 Gallbladder Neoplasms Diseases 0.000 claims description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 2
- 208000009289 Jackson-Weiss syndrome Diseases 0.000 claims description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 2
- 208000005072 Oncogenic osteomalacia Diseases 0.000 claims description 2
- 206010033128 Ovarian cancer Diseases 0.000 claims description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 2
- 201000004014 Pfeiffer syndrome Diseases 0.000 claims description 2
- 206010060862 Prostate cancer Diseases 0.000 claims description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 2
- 206010038389 Renal cancer Diseases 0.000 claims description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 2
- 208000031878 X-linked hypophosphatemia Diseases 0.000 claims description 2
- 208000035724 X-linked hypophosphatemic rickets Diseases 0.000 claims description 2
- 208000017733 acquired polycythemia vera Diseases 0.000 claims description 2
- 201000003674 autosomal dominant hypophosphatemic rickets Diseases 0.000 claims description 2
- 201000003672 autosomal recessive hypophosphatemic rickets Diseases 0.000 claims description 2
- 201000010881 cervical cancer Diseases 0.000 claims description 2
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 claims description 2
- 201000004101 esophageal cancer Diseases 0.000 claims description 2
- 201000010175 gallbladder cancer Diseases 0.000 claims description 2
- 201000010536 head and neck cancer Diseases 0.000 claims description 2
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 2
- 201000010072 hypochondroplasia Diseases 0.000 claims description 2
- 201000010982 kidney cancer Diseases 0.000 claims description 2
- 208000032839 leukemia Diseases 0.000 claims description 2
- 201000007270 liver cancer Diseases 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- 206010028537 myelofibrosis Diseases 0.000 claims description 2
- 208000037244 polycythemia vera Diseases 0.000 claims description 2
- 208000003476 primary myelofibrosis Diseases 0.000 claims description 2
- 201000002510 thyroid cancer Diseases 0.000 claims description 2
- 208000014767 Myeloproliferative disease Diseases 0.000 claims 3
- ZMJGAIFFPHDKIE-UHFFFAOYSA-N 7-amino-1-(cyclopropylmethyl)-3-(2,6-difluoro-3,5-dimethoxyphenyl)-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(CC3CC3)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F ZMJGAIFFPHDKIE-UHFFFAOYSA-N 0.000 claims 1
- LOSYYRGUVIXECN-UHFFFAOYSA-N 7-amino-1-cyclopentyl-3-(2,6-difluoro-3,5-dimethoxyphenyl)-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C3CCCC3)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F LOSYYRGUVIXECN-UHFFFAOYSA-N 0.000 claims 1
- FVXGOKYKUWTBTE-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-[(1-methylpyrazol-4-yl)methyl]-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(CC3=CN(C)N=C3)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F FVXGOKYKUWTBTE-UHFFFAOYSA-N 0.000 claims 1
- QEJZKOMOTNWHRN-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-[(3,5-difluorophenyl)methyl]-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(CC=3C=C(F)C=C(F)C=3)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F QEJZKOMOTNWHRN-UHFFFAOYSA-N 0.000 claims 1
- JTQSRKPTVSUIQB-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-2-oxo-4h-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C#N)C(N)=NC=C3C2)=O)=C1F JTQSRKPTVSUIQB-UHFFFAOYSA-N 0.000 claims 1
- PAXUHUCWTQNTSC-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(1-methylpyrazol-4-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CN(C)N=C4)C(N)=NC=C3C2)=O)=C1F PAXUHUCWTQNTSC-UHFFFAOYSA-N 0.000 claims 1
- AHDQQWCKEPPDPT-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(1h-pyrazol-4-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CNN=C4)C(N)=NC=C3C2)=O)=C1F AHDQQWCKEPPDPT-UHFFFAOYSA-N 0.000 claims 1
- XUUXVWVJQMMRGG-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(2-methylpyrazol-3-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4N(N=CC=4)C)C(N)=NC=C3C2)=O)=C1F XUUXVWVJQMMRGG-UHFFFAOYSA-N 0.000 claims 1
- MWCZXXCQXJJXIT-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-(2-phenylethyl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(CCC=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F MWCZXXCQXJJXIT-UHFFFAOYSA-N 0.000 claims 1
- AKJNNGNMKVTDQG-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-[2-(4-methylpiperazin-1-yl)ethoxy]-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(OCCN4CCN(C)CC4)C(N)=NC=C3C2)=O)=C1F AKJNNGNMKVTDQG-UHFFFAOYSA-N 0.000 claims 1
- OJRQWIXOMOZDRF-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-phenoxy-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(OC=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F OJRQWIXOMOZDRF-UHFFFAOYSA-N 0.000 claims 1
- LTNBGNHAYQWWAD-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-phenyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F LTNBGNHAYQWWAD-UHFFFAOYSA-N 0.000 claims 1
- DZMWVLAGFIMXPL-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-pyridin-3-yl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4C=NC=CC=4)C(N)=NC=C3C2)=O)=C1F DZMWVLAGFIMXPL-UHFFFAOYSA-N 0.000 claims 1
- QSTJOTIIUALGOO-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-8-pyridin-4-yl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4C=CN=CC=4)C(N)=NC=C3C2)=O)=C1F QSTJOTIIUALGOO-UHFFFAOYSA-N 0.000 claims 1
- OYKZXTUASRSYSR-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-(1-ethylpyrazol-4-yl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound C1=NN(CC)C=C1C1=C(N)N=CC2=C1N(C)C(=O)N(C=1C(=C(OC)C=C(OC)C=1F)F)C2 OYKZXTUASRSYSR-UHFFFAOYSA-N 0.000 claims 1
- ICANASFWDUXFMJ-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-(3,6-dihydro-2h-pyran-4-yl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4CCOCC=4)C(N)=NC=C3C2)=O)=C1F ICANASFWDUXFMJ-UHFFFAOYSA-N 0.000 claims 1
- WSHPHXSKUFJZEO-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-(4-fluorophenyl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C=4C=CC(F)=CC=4)C(N)=NC=C3C2)=O)=C1F WSHPHXSKUFJZEO-UHFFFAOYSA-N 0.000 claims 1
- WMBAQRVNANHKCB-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-[1-(2-hydroxyethyl)pyrazol-4-yl]-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(C4=CN(CCO)N=C4)C(N)=NC=C3C2)=O)=C1F WMBAQRVNANHKCB-UHFFFAOYSA-N 0.000 claims 1
- RMNVKLPMFWVUID-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-ethoxy-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound O=C1N(C)C=2C(OCC)=C(N)N=CC=2CN1C1=C(F)C(OC)=CC(OC)=C1F RMNVKLPMFWVUID-UHFFFAOYSA-N 0.000 claims 1
- BCKHPUUCWIEEGJ-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-8-methyl-1-(2-methyltetrazol-5-yl)-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C3=NN(C)N=N3)C3=C(C)C(N)=NC=C3C2)=O)=C1F BCKHPUUCWIEEGJ-UHFFFAOYSA-N 0.000 claims 1
- MRZKEVZACCCOPD-UHFFFAOYSA-N 7-amino-8-benzyl-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(CC=4C=CC=CC=4)C(N)=NC=C3C2)=O)=C1F MRZKEVZACCCOPD-UHFFFAOYSA-N 0.000 claims 1
- AVXXXQCONUHJLB-UHFFFAOYSA-N 7-amino-8-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4h-pyrido[4,3-d]pyrimidin-2-one Chemical compound COC1=CC(OC)=C(F)C(N2C(N(C)C3=C(Cl)C(N)=NC=C3C2)=O)=C1F AVXXXQCONUHJLB-UHFFFAOYSA-N 0.000 claims 1
- NVLGODDPGOVSKJ-UHFFFAOYSA-N methyl n-[3-(2,6-difluoro-3,5-dimethoxyphenyl)-1,8-dimethyl-2-oxo-4h-pyrido[4,3-d]pyrimidin-7-yl]carbamate Chemical compound O=C1N(C)C2=C(C)C(NC(=O)OC)=NC=C2CN1C1=C(F)C(OC)=CC(OC)=C1F NVLGODDPGOVSKJ-UHFFFAOYSA-N 0.000 claims 1
- 101100150279 Caenorhabditis elegans srb-6 gene Proteins 0.000 abstract description 4
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 abstract 2
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 abstract 2
- 125000006656 (C2-C4) alkenyl group Chemical group 0.000 abstract 2
- 125000006650 (C2-C4) alkynyl group Chemical group 0.000 abstract 2
- PECYZEOJVXMISF-UWTATZPHSA-N 3-amino-D-alanine Chemical compound NC[C@@H](N)C(O)=O PECYZEOJVXMISF-UWTATZPHSA-N 0.000 abstract 1
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 129
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 95
- 239000000203 mixture Substances 0.000 description 91
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 61
- 239000000243 solution Substances 0.000 description 56
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 53
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 49
- 239000000047 product Substances 0.000 description 35
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 30
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 30
- 201000010099 disease Diseases 0.000 description 29
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 24
- 239000012044 organic layer Substances 0.000 description 24
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 23
- 235000019439 ethyl acetate Nutrition 0.000 description 22
- 238000006243 chemical reaction Methods 0.000 description 21
- 239000006196 drop Substances 0.000 description 21
- 238000011282 treatment Methods 0.000 description 21
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 20
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical group C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- 229910052938 sodium sulfate Inorganic materials 0.000 description 20
- 235000011152 sodium sulphate Nutrition 0.000 description 20
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 19
- 239000007832 Na2SO4 Substances 0.000 description 19
- RWIVICVCHVMHMU-UHFFFAOYSA-N n-aminoethylmorpholine Chemical group NCCN1CCOCC1 RWIVICVCHVMHMU-UHFFFAOYSA-N 0.000 description 19
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 18
- 238000000746 purification Methods 0.000 description 18
- 239000011541 reaction mixture Substances 0.000 description 18
- 239000000741 silica gel Substances 0.000 description 18
- 229910002027 silica gel Inorganic materials 0.000 description 18
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 17
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 17
- 125000004432 carbon atom Chemical group C* 0.000 description 17
- 239000003795 chemical substances by application Substances 0.000 description 17
- 125000002950 monocyclic group Chemical group 0.000 description 17
- 238000004007 reversed phase HPLC Methods 0.000 description 17
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 15
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 15
- 0 *c1c(*)c(N(Cc2c(*C3)c(*)c(N(*)*)nc2)C3=O)c(*)c(O*)c1* Chemical compound *c1c(*)c(N(Cc2c(*C3)c(*)c(N(*)*)nc2)C3=O)c(*)c(O*)c1* 0.000 description 14
- 125000004429 atom Chemical group 0.000 description 13
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 12
- 239000003153 chemical reaction reagent Substances 0.000 description 12
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 229910052757 nitrogen Inorganic materials 0.000 description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 11
- 239000002253 acid Substances 0.000 description 11
- 238000003556 assay Methods 0.000 description 11
- 239000012267 brine Substances 0.000 description 11
- 229910000024 caesium carbonate Inorganic materials 0.000 description 11
- 239000012043 crude product Substances 0.000 description 11
- 125000005842 heteroatom Chemical group 0.000 description 11
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 11
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 11
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 10
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- SUYCBXMLYVFILH-UHFFFAOYSA-N 2-methyl-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-3,4-dihydropyrazole Chemical compound C1=NN(C)CC1B1OC(C)(C)C(C)(C)O1 SUYCBXMLYVFILH-UHFFFAOYSA-N 0.000 description 10
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 10
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 10
- 241000282414 Homo sapiens Species 0.000 description 10
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 10
- 150000001299 aldehydes Chemical class 0.000 description 10
- 230000002829 reductive effect Effects 0.000 description 10
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 9
- 229940127089 cytotoxic agent Drugs 0.000 description 9
- 239000002552 dosage form Substances 0.000 description 9
- 229940088598 enzyme Drugs 0.000 description 9
- 238000003818 flash chromatography Methods 0.000 description 9
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 9
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 9
- 239000003446 ligand Substances 0.000 description 9
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 9
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 8
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 8
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 8
- 125000002619 bicyclic group Chemical group 0.000 description 8
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 229910052701 rubidium Inorganic materials 0.000 description 8
- 229920006395 saturated elastomer Polymers 0.000 description 8
- 235000017557 sodium bicarbonate Nutrition 0.000 description 8
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 7
- 230000004913 activation Effects 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 150000001721 carbon Chemical group 0.000 description 7
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 7
- 229960004316 cisplatin Drugs 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000010168 coupling process Methods 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 239000000543 intermediate Substances 0.000 description 7
- 229940127084 other anti-cancer agent Drugs 0.000 description 7
- SUXITUVUFUOAGT-UHFFFAOYSA-N 2,6-difluoro-3,5-dimethoxyaniline Chemical compound COC1=CC(OC)=C(F)C(N)=C1F SUXITUVUFUOAGT-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 6
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 6
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 6
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 6
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 6
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 239000011324 bead Substances 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 239000000284 extract Substances 0.000 description 6
- 229940126864 fibroblast growth factor Drugs 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 239000012071 phase Substances 0.000 description 6
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 6
- 230000026731 phosphorylation Effects 0.000 description 6
- 238000006366 phosphorylation reaction Methods 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 239000011734 sodium Substances 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 5
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 5
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 5
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 description 5
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 5
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 5
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 5
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 5
- 238000006069 Suzuki reaction reaction Methods 0.000 description 5
- 235000019270 ammonium chloride Nutrition 0.000 description 5
- 239000002246 antineoplastic agent Substances 0.000 description 5
- 239000003443 antiviral agent Substances 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 5
- WDVGNXKCFBOKDF-UHFFFAOYSA-N dicyclohexyl-[3,6-dimethoxy-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C1CCCCC1)C1CCCCC1 WDVGNXKCFBOKDF-UHFFFAOYSA-N 0.000 description 5
- 231100000673 dose–response relationship Toxicity 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 230000014509 gene expression Effects 0.000 description 5
- 229960002897 heparin Drugs 0.000 description 5
- 229920000669 heparin Polymers 0.000 description 5
- 238000011534 incubation Methods 0.000 description 5
- 150000003951 lactams Chemical class 0.000 description 5
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 5
- 235000019341 magnesium sulphate Nutrition 0.000 description 5
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 5
- 238000005457 optimization Methods 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 230000007170 pathology Effects 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 229910052717 sulfur Inorganic materials 0.000 description 5
- 239000011593 sulfur Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 5
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 5
- KFTRXTSNTQSGNE-UHFFFAOYSA-N (1-methylpyrazol-4-yl)methanamine Chemical compound CN1C=C(CN)C=N1 KFTRXTSNTQSGNE-UHFFFAOYSA-N 0.000 description 4
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 4
- FTZQXOJYPFINKJ-UHFFFAOYSA-N 2-fluoroaniline Chemical compound NC1=CC=CC=C1F FTZQXOJYPFINKJ-UHFFFAOYSA-N 0.000 description 4
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 4
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 4
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 102100038417 Cytoplasmic FMR1-interacting protein 1 Human genes 0.000 description 4
- 101710181791 Cytoplasmic FMR1-interacting protein 1 Proteins 0.000 description 4
- 102000044168 Fibroblast Growth Factor Receptor Human genes 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 4
- JVTRDABZZDRPEY-UHFFFAOYSA-N N-[(4,6-dichloro-5-cyanopyridin-3-yl)methyl]-N-(2,6-difluoro-3,5-dimethoxyphenyl)carbamoyl chloride Chemical compound COc1cc(OC)c(F)c(N(Cc2cnc(Cl)c(C#N)c2Cl)C(Cl)=O)c1F JVTRDABZZDRPEY-UHFFFAOYSA-N 0.000 description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 4
- 108091008605 VEGF receptors Proteins 0.000 description 4
- 230000002159 abnormal effect Effects 0.000 description 4
- 239000008346 aqueous phase Substances 0.000 description 4
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 4
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 4
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 4
- 229960004562 carboplatin Drugs 0.000 description 4
- 125000003636 chemical group Chemical group 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- IGSKHXTUVXSOMB-UHFFFAOYSA-N cyclopropylmethanamine Chemical compound NCC1CC1 IGSKHXTUVXSOMB-UHFFFAOYSA-N 0.000 description 4
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 238000006073 displacement reaction Methods 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000012280 lithium aluminium hydride Substances 0.000 description 4
- 238000004949 mass spectrometry Methods 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- NQDJXKOVJZTUJA-UHFFFAOYSA-N nevirapine Chemical compound C12=NC=CC=C2C(=O)NC=2C(C)=CC=NC=2N1C1CC1 NQDJXKOVJZTUJA-UHFFFAOYSA-N 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- 239000006187 pill Substances 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 238000010791 quenching Methods 0.000 description 4
- 238000006268 reductive amination reaction Methods 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 239000003039 volatile agent Substances 0.000 description 4
- 239000003643 water by type Substances 0.000 description 4
- FAXGJDIKJMMSPL-UHFFFAOYSA-N (4,6-dichloro-5-methylpyridin-3-yl)methanol Chemical compound Cc1c(Cl)ncc(CO)c1Cl FAXGJDIKJMMSPL-UHFFFAOYSA-N 0.000 description 3
- XXMFJKNOJSDQBM-UHFFFAOYSA-N 2,2,2-trifluoroacetic acid;hydrate Chemical compound [OH3+].[O-]C(=O)C(F)(F)F XXMFJKNOJSDQBM-UHFFFAOYSA-N 0.000 description 3
- ACTNQZUIPPOEKZ-UHFFFAOYSA-N 6-chloro-2-(2,6-difluoro-3,5-dimethoxyphenyl)spiro[1H-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)cc3C3(CC3)C2=O)c1F ACTNQZUIPPOEKZ-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- 230000004544 DNA amplification Effects 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- HVEPTSRENPYXJA-UHFFFAOYSA-N N-[(4,6-dichloro-5-methylpyridin-3-yl)methyl]-2,6-difluoro-3,5-dimethoxyaniline Chemical compound COc1cc(OC)c(F)c(NCc2cnc(Cl)c(C)c2Cl)c1F HVEPTSRENPYXJA-UHFFFAOYSA-N 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- 229930012538 Paclitaxel Natural products 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 150000003927 aminopyridines Chemical class 0.000 description 3
- 239000012131 assay buffer Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 238000001516 cell proliferation assay Methods 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- 238000010511 deprotection reaction Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- SXZIXHOMFPUIRK-UHFFFAOYSA-N diphenylmethanimine Chemical compound C=1C=CC=CC=1C(=N)C1=CC=CC=C1 SXZIXHOMFPUIRK-UHFFFAOYSA-N 0.000 description 3
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 3
- 238000001952 enzyme assay Methods 0.000 description 3
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 3
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 3
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 3
- 229960005277 gemcitabine Drugs 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 238000002868 homogeneous time resolved fluorescence Methods 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 239000002480 mineral oil Substances 0.000 description 3
- 235000010446 mineral oil Nutrition 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 3
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 229960001592 paclitaxel Drugs 0.000 description 3
- 229910052763 palladium Inorganic materials 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 239000008177 pharmaceutical agent Substances 0.000 description 3
- DCWXELXMIBXGTH-UHFFFAOYSA-N phosphotyrosine Chemical compound OC(=O)C(N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-UHFFFAOYSA-N 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 125000003226 pyrazolyl group Chemical group 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 125000004076 pyridyl group Chemical group 0.000 description 3
- 230000000171 quenching effect Effects 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000003419 rna directed dna polymerase inhibitor Substances 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- NIDRYBLTWYFCFV-FMTVUPSXSA-N (+)-calanolide A Chemical compound C1=CC(C)(C)OC2=C1C(O[C@H](C)[C@@H](C)[C@@H]1O)=C1C1=C2C(CCC)=CC(=O)O1 NIDRYBLTWYFCFV-FMTVUPSXSA-N 0.000 description 2
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 2
- IDPURXSQCKYKIJ-UHFFFAOYSA-N 1-(4-methoxyphenyl)methanamine Chemical compound COC1=CC=C(CN)C=C1 IDPURXSQCKYKIJ-UHFFFAOYSA-N 0.000 description 2
- GUFUXKNDIHDAII-UHFFFAOYSA-N 1-[(4,6-dichloro-5-methylpyridin-3-yl)methyl]-1-(2,6-difluoro-3,5-dimethoxyphenyl)-3-methylurea Chemical compound CNC(=O)N(Cc1cnc(Cl)c(C)c1Cl)c1c(F)c(OC)cc(OC)c1F GUFUXKNDIHDAII-UHFFFAOYSA-N 0.000 description 2
- IBYHHJPAARCAIE-UHFFFAOYSA-N 1-bromo-2-chloroethane Chemical compound ClCCBr IBYHHJPAARCAIE-UHFFFAOYSA-N 0.000 description 2
- HWUQKELWCYCAFU-UHFFFAOYSA-N 2,4-dichloro-5-formylpyridine-3-carbonitrile Chemical compound ClC1=NC=C(C=O)C(Cl)=C1C#N HWUQKELWCYCAFU-UHFFFAOYSA-N 0.000 description 2
- GWFOVSGRNGAGDL-FSDSQADBSA-N 2-amino-9-[(1r,2r,3s)-2,3-bis(hydroxymethyl)cyclobutyl]-3h-purin-6-one Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1C[C@H](CO)[C@H]1CO GWFOVSGRNGAGDL-FSDSQADBSA-N 0.000 description 2
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 2
- QTQXCAYAPQHWIN-UHFFFAOYSA-N 3-[N-[(4,6-dichloropyridin-3-yl)methyl]-2,6-difluoro-3,5-dimethoxyanilino]-3-oxopropanoic acid Chemical compound COC1=CC(=C(C(=C1F)N(CC2=CN=C(C=C2Cl)Cl)C(=O)CC(=O)O)F)OC QTQXCAYAPQHWIN-UHFFFAOYSA-N 0.000 description 2
- CUYKNJBYIJFRCU-UHFFFAOYSA-N 3-aminopyridine Chemical compound NC1=CC=CN=C1 CUYKNJBYIJFRCU-UHFFFAOYSA-N 0.000 description 2
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 2
- VONLAIRZOJPNHY-UHFFFAOYSA-N 6-chloro-2-(2,6-difluoro-3,5-dimethoxyphenyl)-3-oxo-1,4-dihydro-2,7-naphthyridine-4-carboxylic acid Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)cc3C(C(O)=O)C2=O)c1F VONLAIRZOJPNHY-UHFFFAOYSA-N 0.000 description 2
- KBFYJXMMAXTGQP-UHFFFAOYSA-N 6-chloro-4-(methylamino)pyridine-3-carbaldehyde Chemical compound CNC1=CC(Cl)=NC=C1C=O KBFYJXMMAXTGQP-UHFFFAOYSA-N 0.000 description 2
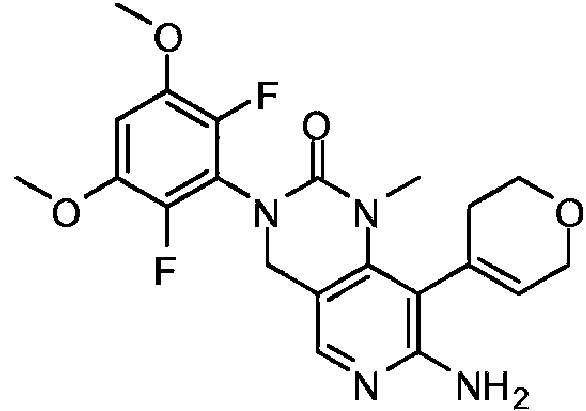
- MXOUFDHUYKNWSG-UHFFFAOYSA-N 7-amino-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(N)cc3N(C)C2=O)c1F MXOUFDHUYKNWSG-UHFFFAOYSA-N 0.000 description 2
- FFCOKBVTTUGESE-UHFFFAOYSA-N 7-amino-8-bromo-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(N)c(Br)c3N(C)C2=O)c1F FFCOKBVTTUGESE-UHFFFAOYSA-N 0.000 description 2
- ABJMOVGWFQOWNR-UHFFFAOYSA-N 7-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-(2-fluorophenyl)-2-oxo-4H-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)c(C#N)c3N(C2=O)c2ccccc2F)c1F ABJMOVGWFQOWNR-UHFFFAOYSA-N 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 2
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- 108700012941 GNRH1 Proteins 0.000 description 2
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 101000917148 Homo sapiens Fibroblast growth factor receptor 3 Proteins 0.000 description 2
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- UVELVDKYAKYQPF-UHFFFAOYSA-N N-[(4,6-dichloro-5-methylpyridin-3-yl)methyl]-N-(2,6-difluoro-3,5-dimethoxyphenyl)carbamoyl chloride Chemical compound ClC1=C(C=NC(=C1C)Cl)CN(C(=O)Cl)C1=C(C(=CC(=C1F)OC)OC)F UVELVDKYAKYQPF-UHFFFAOYSA-N 0.000 description 2
- 150000001204 N-oxides Chemical class 0.000 description 2
- 229940122313 Nucleoside reverse transcriptase inhibitor Drugs 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 2
- 108091000080 Phosphotransferase Proteins 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 102000001253 Protein Kinase Human genes 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 238000003477 Sonogashira cross-coupling reaction Methods 0.000 description 2
- 238000006619 Stille reaction Methods 0.000 description 2
- 238000006859 Swern oxidation reaction Methods 0.000 description 2
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 238000006887 Ullmann reaction Methods 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- WREGKURFCTUGRC-POYBYMJQSA-N Zalcitabine Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)CC1 WREGKURFCTUGRC-POYBYMJQSA-N 0.000 description 2
- 229960004748 abacavir Drugs 0.000 description 2
- 230000001594 aberrant effect Effects 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- WOZSCQDILHKSGG-UHFFFAOYSA-N adefovir depivoxil Chemical compound N1=CN=C2N(CCOCP(=O)(OCOC(=O)C(C)(C)C)OCOC(=O)C(C)(C)C)C=NC2=C1N WOZSCQDILHKSGG-UHFFFAOYSA-N 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 206010064930 age-related macular degeneration Diseases 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- YMARZQAQMVYCKC-OEMFJLHTSA-N amprenavir Chemical compound C([C@@H]([C@H](O)CN(CC(C)C)S(=O)(=O)C=1C=CC(N)=CC=1)NC(=O)O[C@@H]1COCC1)C1=CC=CC=C1 YMARZQAQMVYCKC-OEMFJLHTSA-N 0.000 description 2
- 229960002932 anastrozole Drugs 0.000 description 2
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 2
- 150000001448 anilines Chemical class 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 239000013059 antihormonal agent Substances 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- AFYNADDZULBEJA-UHFFFAOYSA-N bicinchoninic acid Chemical compound C1=CC=CC2=NC(C=3C=C(C4=CC=CC=C4N=3)C(=O)O)=CC(C(O)=O)=C21 AFYNADDZULBEJA-UHFFFAOYSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 238000012054 celltiter-glo Methods 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 230000000973 chemotherapeutic effect Effects 0.000 description 2
- 229940125797 compound 12 Drugs 0.000 description 2
- 229940125961 compound 24 Drugs 0.000 description 2
- 229940125898 compound 5 Drugs 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- NISGSNTVMOOSJQ-UHFFFAOYSA-N cyclopentanamine Chemical group NC1CCCC1 NISGSNTVMOOSJQ-UHFFFAOYSA-N 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 239000002254 cytotoxic agent Substances 0.000 description 2
- 231100000599 cytotoxic agent Toxicity 0.000 description 2
- 229960003901 dacarbazine Drugs 0.000 description 2
- 238000006114 decarboxylation reaction Methods 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 125000004663 dialkyl amino group Chemical group 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- HCUYBXPSSCRKRF-UHFFFAOYSA-N diphosgene Chemical compound ClC(=O)OC(Cl)(Cl)Cl HCUYBXPSSCRKRF-UHFFFAOYSA-N 0.000 description 2
- XPOQHMRABVBWPR-ZDUSSCGKSA-N efavirenz Chemical compound C([C@]1(C2=CC(Cl)=CC=C2NC(=O)O1)C(F)(F)F)#CC1CC1 XPOQHMRABVBWPR-ZDUSSCGKSA-N 0.000 description 2
- 229940121647 egfr inhibitor Drugs 0.000 description 2
- MLILORUFDVLTSP-UHFFFAOYSA-N emivirine Chemical compound O=C1NC(=O)N(COCC)C(CC=2C=CC=CC=2)=C1C(C)C MLILORUFDVLTSP-UHFFFAOYSA-N 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 239000002702 enteric coating Substances 0.000 description 2
- DEAFVBVKIMXSND-UHFFFAOYSA-N ethyl 6-chloro-4-(methylamino)pyridine-3-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)C=C1NC DEAFVBVKIMXSND-UHFFFAOYSA-N 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 230000003176 fibrotic effect Effects 0.000 description 2
- 239000013022 formulation composition Substances 0.000 description 2
- 238000010575 fractional recrystallization Methods 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 125000004438 haloalkoxy group Chemical group 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 230000026030 halogenation Effects 0.000 description 2
- 238000005658 halogenation reaction Methods 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 102000055709 human FGFR3 Human genes 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 229960003444 immunosuppressant agent Drugs 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- CBVCZFGXHXORBI-PXQQMZJSSA-N indinavir Chemical compound C([C@H](N(CC1)C[C@@H](O)C[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H]2C3=CC=CC=C3C[C@H]2O)C(=O)NC(C)(C)C)N1CC1=CC=CN=C1 CBVCZFGXHXORBI-PXQQMZJSSA-N 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 230000031146 intracellular signal transduction Effects 0.000 description 2
- 229940043355 kinase inhibitor Drugs 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- JTEGQNOMFQHVDC-NKWVEPMBSA-N lamivudine Chemical compound O=C1N=C(N)C=CN1[C@H]1O[C@@H](CO)SC1 JTEGQNOMFQHVDC-NKWVEPMBSA-N 0.000 description 2
- KBEMFSMODRNJHE-JFWOZONXSA-N lodenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)C[C@@H]1F KBEMFSMODRNJHE-JFWOZONXSA-N 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- GTCAXTIRRLKXRU-UHFFFAOYSA-N methyl carbamate Chemical compound COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 description 2
- 125000006578 monocyclic heterocycloalkyl group Chemical group 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 231100000590 oncogenic Toxicity 0.000 description 2
- 230000002246 oncogenic effect Effects 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 2
- 229960002340 pentostatin Drugs 0.000 description 2
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 2
- 102000020233 phosphotransferase Human genes 0.000 description 2
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 2
- 125000003386 piperidinyl group Chemical group 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- VZOPRCCTKLAGPN-ZFJVMAEJSA-L potassium;sodium;(2r,3r)-2,3-dihydroxybutanedioate;tetrahydrate Chemical compound O.O.O.O.[Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O VZOPRCCTKLAGPN-ZFJVMAEJSA-L 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 108060006633 protein kinase Proteins 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 208000037803 restenosis Diseases 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 238000007363 ring formation reaction Methods 0.000 description 2
- NCDNCNXCDXHOMX-XGKFQTDJSA-N ritonavir Chemical compound N([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1SC=NC=1)CC=1C=CC=CC=1)C(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-XGKFQTDJSA-N 0.000 description 2
- 229960000311 ritonavir Drugs 0.000 description 2
- 239000012266 salt solution Substances 0.000 description 2
- QWAXKHKRTORLEM-UGJKXSETSA-N saquinavir Chemical compound C([C@@H]([C@H](O)CN1C[C@H]2CCCC[C@H]2C[C@H]1C(=O)NC(C)(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)C=1N=C2C=CC=CC2=CC=1)C1=CC=CC=C1 QWAXKHKRTORLEM-UGJKXSETSA-N 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 125000003003 spiro group Chemical group 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 229960001603 tamoxifen Drugs 0.000 description 2
- 229960004964 temozolomide Drugs 0.000 description 2
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 2
- PSDZTXHGHZEYHT-UHFFFAOYSA-N tert-butyl N-[7-(3,5-dimethoxyphenyl)-5,5-dimethyl-6-oxo-8H-2,7-naphthyridin-3-yl]carbamate Chemical compound COc1cc(OC)cc(c1)N1Cc2cnc(NC(=O)OC(C)(C)C)cc2C(C)(C)C1=O PSDZTXHGHZEYHT-UHFFFAOYSA-N 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- BEUUJDAEPJZWHM-COROXYKFSA-N tert-butyl n-[(2s,3s,5r)-3-hydroxy-6-[[(2s)-1-(2-methoxyethylamino)-3-methyl-1-oxobutan-2-yl]amino]-6-oxo-1-phenyl-5-[(2,3,4-trimethoxyphenyl)methyl]hexan-2-yl]carbamate Chemical compound C([C@@H]([C@@H](O)C[C@H](C(=O)N[C@H](C(=O)NCCOC)C(C)C)CC=1C(=C(OC)C(OC)=CC=1)OC)NC(=O)OC(C)(C)C)C1=CC=CC=C1 BEUUJDAEPJZWHM-COROXYKFSA-N 0.000 description 2
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 102000003390 tumor necrosis factor Human genes 0.000 description 2
- 229910052721 tungsten Inorganic materials 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- 229960002555 zidovudine Drugs 0.000 description 2
- HBOMLICNUCNMMY-XLPZGREQSA-N zidovudine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](N=[N+]=[N-])C1 HBOMLICNUCNMMY-XLPZGREQSA-N 0.000 description 2
- RQEUFEKYXDPUSK-SSDOTTSWSA-N (1R)-1-phenylethanamine Chemical compound C[C@@H](N)C1=CC=CC=C1 RQEUFEKYXDPUSK-SSDOTTSWSA-N 0.000 description 1
- FMCGSUUBYTWNDP-ONGXEEELSA-N (1R,2S)-2-(dimethylamino)-1-phenyl-1-propanol Chemical compound CN(C)[C@@H](C)[C@H](O)C1=CC=CC=C1 FMCGSUUBYTWNDP-ONGXEEELSA-N 0.000 description 1
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 1
- JRHPOFJADXHYBR-HTQZYQBOSA-N (1r,2r)-1-n,2-n-dimethylcyclohexane-1,2-diamine Chemical compound CN[C@@H]1CCCC[C@H]1NC JRHPOFJADXHYBR-HTQZYQBOSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- WCWUXEGQKLTGDX-LLVKDONJSA-N (2R)-1-[[4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-5-methyl-6-pyrrolo[2,1-f][1,2,4]triazinyl]oxy]-2-propanol Chemical compound C1=C2NC(C)=CC2=C(F)C(OC2=NC=NN3C=C(C(=C32)C)OC[C@H](O)C)=C1 WCWUXEGQKLTGDX-LLVKDONJSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- DNISEZBAYYIQFB-PHDIDXHHSA-N (2r,3r)-2,3-diacetyloxybutanedioic acid Chemical compound CC(=O)O[C@@H](C(O)=O)[C@H](C(O)=O)OC(C)=O DNISEZBAYYIQFB-PHDIDXHHSA-N 0.000 description 1
- HXKKHQJGJAFBHI-VKHMYHEASA-N (2s)-1-aminopropan-2-ol Chemical compound C[C@H](O)CN HXKKHQJGJAFBHI-VKHMYHEASA-N 0.000 description 1
- VJNGGOMRUHYAMC-UHFFFAOYSA-N (3,5-difluorophenyl)methanamine Chemical group NCC1=CC(F)=CC(F)=C1 VJNGGOMRUHYAMC-UHFFFAOYSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- MIPHRQMEIYLZFZ-BYPYZUCNSA-N (3s)-oxolan-3-amine Chemical group N[C@H]1CCOC1 MIPHRQMEIYLZFZ-BYPYZUCNSA-N 0.000 description 1
- HINZVVDZPLARRP-YSVIXOAZSA-N (4r,5s,6s,7r)-1,3-bis[(3-aminophenyl)methyl]-4,7-dibenzyl-5,6-dihydroxy-1,3-diazepan-2-one;methanesulfonic acid Chemical compound CS(O)(=O)=O.CS(O)(=O)=O.NC1=CC=CC(CN2C(N(CC=3C=C(N)C=CC=3)[C@H](CC=3C=CC=CC=3)[C@H](O)[C@@H](O)[C@H]2CC=2C=CC=CC=2)=O)=C1 HINZVVDZPLARRP-YSVIXOAZSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical class C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- HDPNBNXLBDFELL-UHFFFAOYSA-N 1,1,1-trimethoxyethane Chemical compound COC(C)(OC)OC HDPNBNXLBDFELL-UHFFFAOYSA-N 0.000 description 1
- 125000005919 1,2,2-trimethylpropyl group Chemical group 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- KGLYUHXSJFMUDI-UHFFFAOYSA-N 1,3-dioxolane;7h-purine-2,8-diamine Chemical compound C1COCO1.NC1=NC=C2NC(N)=NC2=N1 KGLYUHXSJFMUDI-UHFFFAOYSA-N 0.000 description 1
- ZQGDSZPGKPJABN-UHFFFAOYSA-N 1-(chloromethyl)-4-fluoro-1,4-diazoniabicyclo[2.2.2]octane Chemical compound C1C[N+]2(CCl)CC[N+]1(F)CC2 ZQGDSZPGKPJABN-UHFFFAOYSA-N 0.000 description 1
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- KRWRFIMBWRVMKE-UHFFFAOYSA-N 1-bromo-3,5-dimethoxybenzene Chemical compound COC1=CC(Br)=CC(OC)=C1 KRWRFIMBWRVMKE-UHFFFAOYSA-N 0.000 description 1
- HLXOVAMYQUFLPE-UHFFFAOYSA-N 1-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyrazole Chemical compound CN1N=CC=C1B1OC(C)(C)C(C)(C)O1 HLXOVAMYQUFLPE-UHFFFAOYSA-N 0.000 description 1
- ALOCUZOKRULSAA-UHFFFAOYSA-N 1-methylpiperidin-4-amine Chemical group CN1CCC(N)CC1 ALOCUZOKRULSAA-UHFFFAOYSA-N 0.000 description 1
- LBGSWBJURUFGLR-UHFFFAOYSA-N 1-methylpyrazol-4-amine Chemical group CN1C=C(N)C=N1 LBGSWBJURUFGLR-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-N 1H-imidazole Chemical compound C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 1
- LFHLEABTNIQIQO-UHFFFAOYSA-N 1H-isoindole Chemical compound C1=CC=C2CN=CC2=C1 LFHLEABTNIQIQO-UHFFFAOYSA-N 0.000 description 1
- ASOMNDIOOKDVDC-UHFFFAOYSA-N 1h-indol-2-yl-[4-[3-(propan-2-ylamino)pyridin-2-yl]piperazin-1-yl]methanone Chemical compound CC(C)NC1=CC=CN=C1N1CCN(C(=O)C=2NC3=CC=CC=C3C=2)CC1 ASOMNDIOOKDVDC-UHFFFAOYSA-N 0.000 description 1
- ZIXOMENEVHICNV-UHFFFAOYSA-N 2,4-dichloro-5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]pyridine-3-carbonitrile Chemical compound COc1cc(OC)c(F)c(NCc2cnc(Cl)c(C#N)c2Cl)c1F ZIXOMENEVHICNV-UHFFFAOYSA-N 0.000 description 1
- LBTQCPWBQJYQLI-UHFFFAOYSA-N 2-(1-methoxyethylidene)propanedinitrile Chemical compound COC(C)=C(C#N)C#N LBTQCPWBQJYQLI-UHFFFAOYSA-N 0.000 description 1
- KCTAFCBIIMHTHL-UHFFFAOYSA-N 2-(2,6-difluoro-3,5-dimethoxyphenyl)-6-(2-morpholin-4-ylethylamino)spiro[1h-2,7-naphthyridine-4,1'-cyclopropane]-3-one Chemical compound COC1=CC(OC)=C(F)C(N2C(C3(CC3)C3=CC(NCCN4CCOCC4)=NC=C3C2)=O)=C1F KCTAFCBIIMHTHL-UHFFFAOYSA-N 0.000 description 1
- DOSGEBYQRMBTGS-UHFFFAOYSA-N 2-(3,6-dihydro-2h-pyran-4-yl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1C1=CCOCC1 DOSGEBYQRMBTGS-UHFFFAOYSA-N 0.000 description 1
- YNTJKQDWYXUTLZ-UHFFFAOYSA-N 2-(3-chlorophenoxy)propanoic acid Chemical compound OC(=O)C(C)OC1=CC=CC(Cl)=C1 YNTJKQDWYXUTLZ-UHFFFAOYSA-N 0.000 description 1
- GOWUDHPKGOIDIX-UHFFFAOYSA-N 2-(4-methyl-1-piperazinyl)ethanamine Chemical compound CN1CCN(CCN)CC1 GOWUDHPKGOIDIX-UHFFFAOYSA-N 0.000 description 1
- QHTUMQYGZQYEOZ-UHFFFAOYSA-N 2-(4-methylpiperazin-1-yl)ethanol Chemical compound CN1CCN(CCO)CC1 QHTUMQYGZQYEOZ-UHFFFAOYSA-N 0.000 description 1
- UZYQSNQJLWTICD-UHFFFAOYSA-N 2-(n-benzoylanilino)-2,2-dinitroacetic acid Chemical compound C=1C=CC=CC=1N(C(C(=O)O)([N+]([O-])=O)[N+]([O-])=O)C(=O)C1=CC=CC=C1 UZYQSNQJLWTICD-UHFFFAOYSA-N 0.000 description 1
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 1
- WOXFMYVTSLAQMO-UHFFFAOYSA-N 2-Pyridinemethanamine Chemical compound NCC1=CC=CC=N1 WOXFMYVTSLAQMO-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- ROKKNRBDRLURJW-UHFFFAOYSA-N 2-[4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-3,4-dihydropyrazol-2-yl]ethanol Chemical compound CC1(C)OB(OC1(C)C)C1CN(CCO)N=C1 ROKKNRBDRLURJW-UHFFFAOYSA-N 0.000 description 1
- IJXJGQCXFSSHNL-UHFFFAOYSA-N 2-amino-2-phenylethanol Chemical compound OCC(N)C1=CC=CC=C1 IJXJGQCXFSSHNL-UHFFFAOYSA-N 0.000 description 1
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 1
- KMGUEILFFWDGFV-UHFFFAOYSA-N 2-benzoyl-2-benzoyloxy-3-hydroxybutanedioic acid Chemical compound C=1C=CC=CC=1C(=O)C(C(C(O)=O)O)(C(O)=O)OC(=O)C1=CC=CC=C1 KMGUEILFFWDGFV-UHFFFAOYSA-N 0.000 description 1
- YCNQPAVKQPLZRS-UHFFFAOYSA-N 2-benzyl-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1CC1=CC=CC=C1 YCNQPAVKQPLZRS-UHFFFAOYSA-N 0.000 description 1
- UCYCGRXWQDKTCX-UHFFFAOYSA-N 2-chloro-5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]-N-methylpyridin-4-amine Chemical compound ClC1=NC=C(C(=C1)NC)CNC1=C(C(=CC(=C1F)OC)OC)F UCYCGRXWQDKTCX-UHFFFAOYSA-N 0.000 description 1
- REPWWGFJKZSJDA-UHFFFAOYSA-N 2-ethyl-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-3,4-dihydropyrazole Chemical compound C1=NN(CC)CC1B1OC(C)(C)C(C)(C)O1 REPWWGFJKZSJDA-UHFFFAOYSA-N 0.000 description 1
- IPOVOSHRRIJKBR-UHFFFAOYSA-N 2-ethylpropanedioyl dichloride Chemical compound CCC(C(Cl)=O)C(Cl)=O IPOVOSHRRIJKBR-UHFFFAOYSA-N 0.000 description 1
- LIOLIMKSCNQPLV-UHFFFAOYSA-N 2-fluoro-n-methyl-4-[7-(quinolin-6-ylmethyl)imidazo[1,2-b][1,2,4]triazin-2-yl]benzamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1C1=NN2C(CC=3C=C4C=CC=NC4=CC=3)=CN=C2N=C1 LIOLIMKSCNQPLV-UHFFFAOYSA-N 0.000 description 1
- AUVALWUPUHHNQV-UHFFFAOYSA-N 2-hydroxy-3-propylbenzoic acid Chemical class CCCC1=CC=CC(C(O)=O)=C1O AUVALWUPUHHNQV-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- AZUKLCJYWVMPML-UHFFFAOYSA-N 2-methyltetrazol-5-amine Chemical compound CN1N=NC(N)=N1 AZUKLCJYWVMPML-UHFFFAOYSA-N 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- VSWICNJIUPRZIK-UHFFFAOYSA-N 2-piperideine Chemical compound C1CNC=CC1 VSWICNJIUPRZIK-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- RKATWUBDSJHPEV-UHFFFAOYSA-N 3,3-difluorocyclobutan-1-amine Chemical compound NC1CC(F)(F)C1 RKATWUBDSJHPEV-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- GBAMCAABJWBZEH-UHFFFAOYSA-N 3-(cyclopropylmethyl)-1-[(4,6-dichloro-5-cyanopyridin-3-yl)methyl]-1-(2,6-difluoro-3,5-dimethoxyphenyl)urea Chemical compound C1(CC1)CNC(N(C1=C(C(=CC(=C1F)OC)OC)F)CC=1C=NC(=C(C1Cl)C#N)Cl)=O GBAMCAABJWBZEH-UHFFFAOYSA-N 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- QZVQQUVWFIZUBQ-UHFFFAOYSA-N 3-fluoroaniline Chemical compound NC1=CC=CC(F)=C1 QZVQQUVWFIZUBQ-UHFFFAOYSA-N 0.000 description 1
- OAKURXIZZOAYBC-UHFFFAOYSA-M 3-oxopropanoate Chemical compound [O-]C(=O)CC=O OAKURXIZZOAYBC-UHFFFAOYSA-M 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- AKYJFAHYRMPRDS-UHFFFAOYSA-N 4,6-dichloropyridine-3-carbaldehyde Chemical compound ClC1=CC(Cl)=C(C=O)C=N1 AKYJFAHYRMPRDS-UHFFFAOYSA-N 0.000 description 1
- TVOJIBGZFYMWDT-UHFFFAOYSA-N 4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrazole Chemical compound O1C(C)(C)C(C)(C)OB1C1=CNN=C1 TVOJIBGZFYMWDT-UHFFFAOYSA-N 0.000 description 1
- XXJWYDDUDKYVKI-UHFFFAOYSA-N 4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-6-methoxy-7-[3-(1-pyrrolidinyl)propoxy]quinazoline Chemical compound COC1=CC2=C(OC=3C(=C4C=C(C)NC4=CC=3)F)N=CN=C2C=C1OCCCN1CCCC1 XXJWYDDUDKYVKI-UHFFFAOYSA-N 0.000 description 1
- APRZHQXAAWPYHS-UHFFFAOYSA-N 4-[5-[3-(carboxymethoxy)phenyl]-3-(4,5-dimethyl-1,3-thiazol-2-yl)tetrazol-3-ium-2-yl]benzenesulfonate Chemical compound S1C(C)=C(C)N=C1[N+]1=NC(C=2C=C(OCC(O)=O)C=CC=2)=NN1C1=CC=C(S([O-])(=O)=O)C=C1 APRZHQXAAWPYHS-UHFFFAOYSA-N 0.000 description 1
- QGMGHALXLXKCBD-UHFFFAOYSA-N 4-amino-n-(2-aminophenyl)benzamide Chemical compound C1=CC(N)=CC=C1C(=O)NC1=CC=CC=C1N QGMGHALXLXKCBD-UHFFFAOYSA-N 0.000 description 1
- IMLXLGZJLAOKJN-UHFFFAOYSA-N 4-aminocyclohexan-1-ol Chemical compound NC1CCC(O)CC1 IMLXLGZJLAOKJN-UHFFFAOYSA-N 0.000 description 1
- SBGSWYLEUDJCDG-UHFFFAOYSA-N 4-chloro-5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]-N-[(4-methoxyphenyl)methyl]-3-methylpyridin-2-amine Chemical compound COc1ccc(CNc2ncc(CNc3c(F)c(OC)cc(OC)c3F)c(Cl)c2C)cc1 SBGSWYLEUDJCDG-UHFFFAOYSA-N 0.000 description 1
- LBUNNMJLXWQQBY-UHFFFAOYSA-N 4-fluorophenylboronic acid Chemical compound OB(O)C1=CC=C(F)C=C1 LBUNNMJLXWQQBY-UHFFFAOYSA-N 0.000 description 1
- LVFXMTSBFVPLHT-UHFFFAOYSA-N 5-[(2,6-difluoro-3,5-dimethoxyanilino)methyl]-4-N-(2-fluorophenyl)-2-N-[(4-methoxyphenyl)methyl]-3-methylpyridine-2,4-diamine Chemical compound COc1ccc(CNc2ncc(CNc3c(F)c(OC)cc(OC)c3F)c(Nc3ccccc3F)c2C)cc1 LVFXMTSBFVPLHT-UHFFFAOYSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- 125000006163 5-membered heteroaryl group Chemical group 0.000 description 1
- QLMYDUMKXXBULG-UHFFFAOYSA-N 6-chloro-2,4-dihydro-1h-2,7-naphthyridin-3-one Chemical compound C1C(=O)NCC2=C1C=C(Cl)N=C2 QLMYDUMKXXBULG-UHFFFAOYSA-N 0.000 description 1
- ATCRIOJPQXDFNY-ZETCQYMHSA-N 6-chloro-2-(1-furo[2,3-c]pyridin-5-yl-ethylsulfanyl)-pyrimidin-4-ylamine Chemical compound S([C@@H](C)C=1N=CC=2OC=CC=2C=1)C1=NC(N)=CC(Cl)=N1 ATCRIOJPQXDFNY-ZETCQYMHSA-N 0.000 description 1
- FKZNZEWNXBWJJV-UHFFFAOYSA-N 6-chloro-2-(2,6-difluoro-3,5-dimethoxyphenyl)-1,4-dihydro-2,7-naphthyridin-3-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)cc3CC2=O)c1F FKZNZEWNXBWJJV-UHFFFAOYSA-N 0.000 description 1
- JEVUSGBFJWDNOZ-UHFFFAOYSA-N 6-chloro-2-(3,5-dimethoxyphenyl)-1,4-dihydro-2,7-naphthyridin-3-one Chemical compound COc1cc(OC)cc(c1)N1Cc2cnc(Cl)cc2CC1=O JEVUSGBFJWDNOZ-UHFFFAOYSA-N 0.000 description 1
- AQFGZQZYECSLOX-UHFFFAOYSA-N 6-chloro-2-(3,5-dimethoxyphenyl)-4,4-dimethyl-1H-2,7-naphthyridin-3-one Chemical compound COc1cc(OC)cc(c1)N1Cc2cnc(Cl)cc2C(C)(C)C1=O AQFGZQZYECSLOX-UHFFFAOYSA-N 0.000 description 1
- KQVQQSLYBUVFRU-UHFFFAOYSA-N 6-chloro-4-(methylamino)pyridine-3-carboxylic acid Chemical compound CNC1=CC(Cl)=NC=C1C(O)=O KQVQQSLYBUVFRU-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- AEOITJSGEMDFKH-UHFFFAOYSA-N 7-chloro-1-(cyclopropylmethyl)-3-(2,6-difluoro-3,5-dimethoxyphenyl)-2-oxo-4H-pyrido[4,3-d]pyrimidine-8-carbonitrile Chemical compound ClC1=C(C=2N(C(N(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)=O)CC1CC1)C#N AEOITJSGEMDFKH-UHFFFAOYSA-N 0.000 description 1
- YPRVJEJUEVHEKY-UHFFFAOYSA-N 7-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1,8-dimethyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)c(C)c3N(C)C2=O)c1F YPRVJEJUEVHEKY-UHFFFAOYSA-N 0.000 description 1
- CUKFRTLSJAZTOY-UHFFFAOYSA-N 7-chloro-3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-methyl-4H-pyrido[4,3-d]pyrimidin-2-one Chemical compound COc1cc(OC)c(F)c(N2Cc3cnc(Cl)cc3N(C)C2=O)c1F CUKFRTLSJAZTOY-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 108010039627 Aprotinin Proteins 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical class C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- CWHUFRVAEUJCEF-UHFFFAOYSA-N BKM120 Chemical compound C1=NC(N)=CC(C(F)(F)F)=C1C1=CC(N2CCOCC2)=NC(N2CCOCC2)=N1 CWHUFRVAEUJCEF-UHFFFAOYSA-N 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006417 Bronchial carcinoma Diseases 0.000 description 1
- 208000011691 Burkitt lymphomas Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 102100031151 C-C chemokine receptor type 2 Human genes 0.000 description 1
- 101710149815 C-C chemokine receptor type 2 Proteins 0.000 description 1
- 101710149863 C-C chemokine receptor type 4 Proteins 0.000 description 1
- OJRUSAPKCPIVBY-KQYNXXCUSA-N C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N Chemical compound C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N OJRUSAPKCPIVBY-KQYNXXCUSA-N 0.000 description 1
- 102100032976 CCR4-NOT transcription complex subunit 6 Human genes 0.000 description 1
- 108091007914 CDKs Proteins 0.000 description 1
- GIHPAUDRUFAIKE-UHFFFAOYSA-N CN(c1c(CN2c(c(F)c(cc3OC)OC)c3F)cnc(N)c1C1=CN=C[I]=C1)C2=O Chemical compound CN(c1c(CN2c(c(F)c(cc3OC)OC)c3F)cnc(N)c1C1=CN=C[I]=C1)C2=O GIHPAUDRUFAIKE-UHFFFAOYSA-N 0.000 description 1
- QTJCYMITXQIAGR-UHFFFAOYSA-N COc(c(F)c1N(Cc(c(C23CC2)c2)ccc2Cl)C3=O)cc(OC)c1F Chemical compound COc(c(F)c1N(Cc(c(C23CC2)c2)ccc2Cl)C3=O)cc(OC)c1F QTJCYMITXQIAGR-UHFFFAOYSA-N 0.000 description 1
- BFUHISFXTSUKRS-UHFFFAOYSA-N COc(c(F)c1N(Cc2c(C34CC3)cc(Nc3cccnc3)nc2)C4=O)cc(OC)c1F Chemical compound COc(c(F)c1N(Cc2c(C34CC3)cc(Nc3cccnc3)nc2)C4=O)cc(OC)c1F BFUHISFXTSUKRS-UHFFFAOYSA-N 0.000 description 1
- GRURLFLJFSWKIE-UHFFFAOYSA-N COc(cc(c(F)c1N(CC(CNC(N)=C2C#N)=C2N2CC(C=C(C3)F)=CC3F)C2=O)OC)c1F Chemical compound COc(cc(c(F)c1N(CC(CNC(N)=C2C#N)=C2N2CC(C=C(C3)F)=CC3F)C2=O)OC)c1F GRURLFLJFSWKIE-UHFFFAOYSA-N 0.000 description 1
- GUPHIFOHCAAWAV-UHFFFAOYSA-N COc(cc(c(F)c1N(Cc(c(C23CC2)c2)cnc2NC2CC2)C3=O)OC)c1F Chemical compound COc(cc(c(F)c1N(Cc(c(C23CC2)c2)cnc2NC2CC2)C3=O)OC)c1F GUPHIFOHCAAWAV-UHFFFAOYSA-N 0.000 description 1
- VNXKNBMRJYHPDM-UHFFFAOYSA-N COc(cc(c(F)c1N(Cc(c(C23CC2)c2)cnc2NC2CCC2)C3=O)OC)c1F Chemical compound COc(cc(c(F)c1N(Cc(c(C23CC2)c2)cnc2NC2CCC2)C3=O)OC)c1F VNXKNBMRJYHPDM-UHFFFAOYSA-N 0.000 description 1
- UNVZGXGIFYPFHJ-UHFFFAOYSA-N COc(cc(c(F)c1N(Cc2c(C34CC3)cc(Nc3cccc(F)c3)nc2)C4=O)OC)c1F Chemical compound COc(cc(c(F)c1N(Cc2c(C34CC3)cc(Nc3cccc(F)c3)nc2)C4=O)OC)c1F UNVZGXGIFYPFHJ-UHFFFAOYSA-N 0.000 description 1
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- VVIZKMACHQLJHX-OAHLLOKOSA-N C[C@H](c1ccccc1)Nc1cc(C2(CC2)C(N(C2)c(c(F)c(cc3OC)OC)c3F)=O)c2cn1 Chemical compound C[C@H](c1ccccc1)Nc1cc(C2(CC2)C(N(C2)c(c(F)c(cc3OC)OC)c3F)=O)c2cn1 VVIZKMACHQLJHX-OAHLLOKOSA-N 0.000 description 1
- GWOVKSBYWNYSMO-UHFFFAOYSA-N C[n]1ncc(Nc2cc(C3(CC3)C(N(C3)c(c([F-])c(cc4OC)OC)c4F)=O)c3cn2)c1 Chemical compound C[n]1ncc(Nc2cc(C3(CC3)C(N(C3)c(c([F-])c(cc4OC)OC)c4F)=O)c3cn2)c1 GWOVKSBYWNYSMO-UHFFFAOYSA-N 0.000 description 1
- 101100080643 Caenorhabditis elegans ran-4 gene Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 238000006964 Chan-Lam coupling reaction Methods 0.000 description 1
- 102000009410 Chemokine receptor Human genes 0.000 description 1
- 108050000299 Chemokine receptor Proteins 0.000 description 1
- 206010008723 Chondrodystrophy Diseases 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 208000009283 Craniosynostoses Diseases 0.000 description 1
- HTJDQJBWANPRPF-UHFFFAOYSA-N Cyclopropylamine Chemical compound NC1CC1 HTJDQJBWANPRPF-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 108010041986 DNA Vaccines Proteins 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 229940021995 DNA vaccine Drugs 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012688 Diabetic retinal oedema Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- BXZVVICBKDXVGW-NKWVEPMBSA-N Didanosine Chemical compound O1[C@H](CO)CC[C@@H]1N1C(NC=NC2=O)=C2N=C1 BXZVVICBKDXVGW-NKWVEPMBSA-N 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical group C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- XPOQHMRABVBWPR-UHFFFAOYSA-N Efavirenz Natural products O1C(=O)NC2=CC=C(Cl)C=C2C1(C(F)(F)F)C#CC1CC1 XPOQHMRABVBWPR-UHFFFAOYSA-N 0.000 description 1
- XQSPYNMVSIKCOC-NTSWFWBYSA-N Emtricitabine Chemical compound C1=C(F)C(N)=NC(=O)N1[C@H]1O[C@@H](CO)SC1 XQSPYNMVSIKCOC-NTSWFWBYSA-N 0.000 description 1
- 108010032976 Enfuvirtide Proteins 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 229940102550 Estrogen receptor antagonist Drugs 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- JNCMHMUGTWEVOZ-UHFFFAOYSA-N F[CH]F Chemical compound F[CH]F JNCMHMUGTWEVOZ-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- 208000008069 Geographic Atrophy Diseases 0.000 description 1
- 208000022461 Glomerular disease Diseases 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 229940125497 HER2 kinase inhibitor Drugs 0.000 description 1
- 108010081348 HRT1 protein Hairy Proteins 0.000 description 1
- 102100021881 Hairy/enhancer-of-split related with YRPW motif protein 1 Human genes 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 108090000353 Histone deacetylase Proteins 0.000 description 1
- 102100038720 Histone deacetylase 9 Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101100066427 Homo sapiens FCGR1A gene Proteins 0.000 description 1
- 101100120051 Homo sapiens FGF1 gene Proteins 0.000 description 1
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 1
- 101001016865 Homo sapiens Heat shock protein HSP 90-alpha Proteins 0.000 description 1
- 101000997835 Homo sapiens Tyrosine-protein kinase JAK1 Proteins 0.000 description 1
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 description 1
- 101000934996 Homo sapiens Tyrosine-protein kinase JAK3 Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 102000042838 JAK family Human genes 0.000 description 1
- 108091082332 JAK family Proteins 0.000 description 1
- 230000004163 JAK-STAT signaling pathway Effects 0.000 description 1
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 1
- KJHKTHWMRKYKJE-SUGCFTRWSA-N Kaletra Chemical compound N1([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=2C=CC=CC=2)NC(=O)COC=2C(=CC=CC=2C)C)CC=2C=CC=CC=2)CCCNC1=O KJHKTHWMRKYKJE-SUGCFTRWSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 208000002260 Keloid Diseases 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 1
- 239000003798 L01XE11 - Pazopanib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 1
- 239000002138 L01XE21 - Regorafenib Substances 0.000 description 1
- 239000002137 L01XE24 - Ponatinib Substances 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 1
- GDBQQVLCIARPGH-UHFFFAOYSA-N Leupeptin Natural products CC(C)CC(NC(C)=O)C(=O)NC(CC(C)C)C(=O)NC(C=O)CCCN=C(N)N GDBQQVLCIARPGH-UHFFFAOYSA-N 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 229940124041 Luteinizing hormone releasing hormone (LHRH) antagonist Drugs 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 108010006519 Molecular Chaperones Proteins 0.000 description 1
- 102000005431 Molecular Chaperones Human genes 0.000 description 1
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical group C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 1
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 1
- FMCGSUUBYTWNDP-UHFFFAOYSA-N N-Methylephedrine Natural products CN(C)C(C)C(O)C1=CC=CC=C1 FMCGSUUBYTWNDP-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- VGWNQMYFXRJRRR-UHFFFAOYSA-N N1=C(N)N=C(N)N=C1N.C(COCCOCCO)O Chemical compound N1=C(N)N=C(N)N=C1N.C(COCCOCCO)O VGWNQMYFXRJRRR-UHFFFAOYSA-N 0.000 description 1
- IXOJTOIFKBSNIF-UHFFFAOYSA-N NC1=C(C=2N(CN(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)C1=C(C=CC=C1)F)C Chemical compound NC1=C(C=2N(CN(CC2C=N1)C1=C(C(=CC(=C1F)OC)OC)F)C1=C(C=CC=C1)F)C IXOJTOIFKBSNIF-UHFFFAOYSA-N 0.000 description 1
- 208000009277 Neuroectodermal Tumors Diseases 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 208000022873 Ocular disease Diseases 0.000 description 1
- 229910019213 POCl3 Inorganic materials 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 201000008199 Pleuropulmonary blastoma Diseases 0.000 description 1
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 206010036590 Premature baby Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical group C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 101150077555 Ret gene Proteins 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 1
- NCDNCNXCDXHOMX-UHFFFAOYSA-N Ritonavir Natural products C=1C=CC=CC=1CC(NC(=O)OCC=1SC=NC=1)C(O)CC(CC=1C=CC=CC=1)NC(=O)C(C(C)C)NC(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-UHFFFAOYSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 206010072610 Skeletal dysplasia Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- XNKLLVCARDGLGL-JGVFFNPUSA-N Stavudine Chemical compound O=C1NC(=O)C(C)=CN1[C@H]1C=C[C@@H](CO)O1 XNKLLVCARDGLGL-JGVFFNPUSA-N 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 101000930762 Sulfolobus acidocaldarius (strain ATCC 33909 / DSM 639 / JCM 8929 / NBRC 15157 / NCIMB 11770) Signal recognition particle receptor FtsY Proteins 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 239000004012 Tofacitinib Substances 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 102000014384 Type C Phospholipases Human genes 0.000 description 1
- 108010079194 Type C Phospholipases Proteins 0.000 description 1
- 102100033438 Tyrosine-protein kinase JAK1 Human genes 0.000 description 1
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 description 1
- 102100025387 Tyrosine-protein kinase JAK3 Human genes 0.000 description 1
- 238000010751 Ullmann type reaction Methods 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 229940122803 Vinca alkaloid Drugs 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- RLAHNGKRJJEIJL-RFZPGFLSSA-N [(2r,4r)-4-(2,6-diaminopurin-9-yl)-1,3-dioxolan-2-yl]methanol Chemical compound C12=NC(N)=NC(N)=C2N=CN1[C@H]1CO[C@@H](CO)O1 RLAHNGKRJJEIJL-RFZPGFLSSA-N 0.000 description 1
- YNOGYQAEJGADFJ-YFKPBYRVSA-N [(2s)-oxolan-2-yl]methanamine Chemical compound NC[C@@H]1CCCO1 YNOGYQAEJGADFJ-YFKPBYRVSA-N 0.000 description 1
- VKIJXFIYBAYHOE-VOTSOKGWSA-N [(e)-2-phenylethenyl]boronic acid Chemical compound OB(O)\C=C\C1=CC=CC=C1 VKIJXFIYBAYHOE-VOTSOKGWSA-N 0.000 description 1
- HEVHZBOMHKOOHT-UHFFFAOYSA-N [2-[1-[(2-methylpropan-2-yl)oxycarbonyl]piperidin-4-yl]-3,4-dihydropyrazol-4-yl]boronic acid Chemical compound CC(C)(C)OC(=O)N1CCC(CC1)N1CC(C=N1)B(O)O HEVHZBOMHKOOHT-UHFFFAOYSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- MCGSCOLBFJQGHM-SCZZXKLOSA-N abacavir Chemical compound C=12N=CN([C@H]3C=C[C@@H](CO)C3)C2=NC(N)=NC=1NC1CC1 MCGSCOLBFJQGHM-SCZZXKLOSA-N 0.000 description 1
- WMHSRBZIJNQHKT-FFKFEZPRSA-N abacavir sulfate Chemical compound OS(O)(=O)=O.C=12N=CN([C@H]3C=C[C@@H](CO)C3)C2=NC(N)=NC=1NC1CC1.C=12N=CN([C@H]3C=C[C@@H](CO)C3)C2=NC(N)=NC=1NC1CC1 WMHSRBZIJNQHKT-FFKFEZPRSA-N 0.000 description 1
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 1
- 229960000853 abiraterone Drugs 0.000 description 1
- 229940028652 abraxane Drugs 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 108010052004 acetyl-2-naphthylalanyl-3-chlorophenylalanyl-1-oxohexadecyl-seryl-4-aminophenylalanyl(hydroorotyl)-4-aminophenylalanyl(carbamoyl)-leucyl-ILys-prolyl-alaninamide Proteins 0.000 description 1
- 229940081735 acetylcellulose Drugs 0.000 description 1
- 208000008919 achondroplasia Diseases 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 229960003205 adefovir dipivoxil Drugs 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 239000002487 adenosine deaminase inhibitor Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 229960001686 afatinib Drugs 0.000 description 1
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 1
- 229960002833 aflibercept Drugs 0.000 description 1
- 108010081667 aflibercept Proteins 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 229960001830 amprenavir Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 239000003936 androgen receptor antagonist Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000003527 anti-angiogenesis Effects 0.000 description 1
- 229940124650 anti-cancer therapies Drugs 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000003388 anti-hormonal effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940045719 antineoplastic alkylating agent nitrosoureas Drugs 0.000 description 1
- RYMCFYKJDVMSIR-RNFRBKRXSA-N apricitabine Chemical compound O=C1N=C(N)C=CN1[C@@H]1S[C@H](CO)OC1 RYMCFYKJDVMSIR-RNFRBKRXSA-N 0.000 description 1
- 229960004405 aprotinin Drugs 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 238000006254 arylation reaction Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000003943 azolyl group Chemical group 0.000 description 1
- 229950000971 baricitinib Drugs 0.000 description 1
- XUZMWHLSFXCVMG-UHFFFAOYSA-N baricitinib Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2C=3C=CNC=3N=CN=2)=C1 XUZMWHLSFXCVMG-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 208000002352 blister Diseases 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 208000003362 bronchogenic carcinoma Diseases 0.000 description 1
- 201000002143 bronchus adenoma Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 229950003628 buparlisib Drugs 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- NIDRYBLTWYFCFV-UHFFFAOYSA-N calanolide F Natural products C1=CC(C)(C)OC2=C1C(OC(C)C(C)C1O)=C1C1=C2C(CCC)=CC(=O)O1 NIDRYBLTWYFCFV-UHFFFAOYSA-N 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 229960003340 calcium silicate Drugs 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical class C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001735 carboxylic acids Chemical group 0.000 description 1
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 1
- 108010021331 carfilzomib Proteins 0.000 description 1
- 229960002438 carfilzomib Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 229960002412 cediranib Drugs 0.000 description 1
- 230000006369 cell cycle progression Effects 0.000 description 1
- 239000008004 cell lysis buffer Substances 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- 229940089960 chloroacetate Drugs 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- BSMCAPRUBJMWDF-KRWDZBQOSA-N cobimetinib Chemical compound C1C(O)([C@H]2NCCCC2)CN1C(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F BSMCAPRUBJMWDF-KRWDZBQOSA-N 0.000 description 1
- 229960002271 cobimetinib Drugs 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125758 compound 15 Drugs 0.000 description 1
- 229940125810 compound 20 Drugs 0.000 description 1
- 229940127204 compound 29 Drugs 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 239000012059 conventional drug carrier Substances 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229960005061 crizotinib Drugs 0.000 description 1
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- KZZKOVLJUKWSKX-UHFFFAOYSA-N cyclobutanamine Chemical compound NC1CCC1 KZZKOVLJUKWSKX-UHFFFAOYSA-N 0.000 description 1
- 125000002188 cycloheptatrienyl group Chemical group C1(=CC=CC=CC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- SSJXIUAHEKJCMH-UHFFFAOYSA-N cyclohexane-1,2-diamine Chemical compound NC1CCCCC1N SSJXIUAHEKJCMH-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- PAFZNILMFXTMIY-UHFFFAOYSA-N cyclohexylamine Chemical compound NC1CCCCC1 PAFZNILMFXTMIY-UHFFFAOYSA-N 0.000 description 1
- 150000001940 cyclopentanes Chemical class 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- LVXJQMNHJWSHET-AATRIKPKSA-N dacomitinib Chemical compound C=12C=C(NC(=O)\C=C\CN3CCCCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 LVXJQMNHJWSHET-AATRIKPKSA-N 0.000 description 1
- 229950002205 dacomitinib Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 229960002272 degarelix Drugs 0.000 description 1
- MEUCPCLKGZSHTA-XYAYPHGZSA-N degarelix Chemical compound C([C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CC=1C=CC(NC(=O)[C@H]2NC(=O)NC(=O)C2)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(NC(N)=O)C=C1 MEUCPCLKGZSHTA-XYAYPHGZSA-N 0.000 description 1
- WHBIGIKBNXZKFE-UHFFFAOYSA-N delavirdine Chemical compound CC(C)NC1=CC=CN=C1N1CCN(C(=O)C=2NC3=CC=C(NS(C)(=O)=O)C=C3C=2)CC1 WHBIGIKBNXZKFE-UHFFFAOYSA-N 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- CFCUWKMKBJTWLW-UHFFFAOYSA-N deoliosyl-3C-alpha-L-digitoxosyl-MTM Natural products CC=1C(O)=C2C(O)=C3C(=O)C(OC4OC(C)C(O)C(OC5OC(C)C(O)C(OC6OC(C)C(O)C(C)(O)C6)C5)C4)C(C(OC)C(=O)C(O)C(C)O)CC3=CC2=CC=1OC(OC(C)C1O)CC1OC1CC(O)C(O)C(C)O1 CFCUWKMKBJTWLW-UHFFFAOYSA-N 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 208000033679 diabetic kidney disease Diseases 0.000 description 1
- 201000011190 diabetic macular edema Diseases 0.000 description 1
- 229960002656 didanosine Drugs 0.000 description 1
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 1
- HQWPLXHWEZZGKY-UHFFFAOYSA-N diethylzinc Chemical compound CC[Zn]CC HQWPLXHWEZZGKY-UHFFFAOYSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- AXAZMDOAUQTMOW-UHFFFAOYSA-N dimethylzinc Chemical compound C[Zn]C AXAZMDOAUQTMOW-UHFFFAOYSA-N 0.000 description 1
- FYAABNCYNWGSQX-UHFFFAOYSA-L disodium;difluoride Chemical compound [F-].[F-].[Na+].[Na+] FYAABNCYNWGSQX-UHFFFAOYSA-L 0.000 description 1
- DLNKOYKMWOXYQA-UHFFFAOYSA-N dl-pseudophenylpropanolamine Natural products CC(N)C(O)C1=CC=CC=C1 DLNKOYKMWOXYQA-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 229960003804 efavirenz Drugs 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 150000002081 enamines Chemical class 0.000 description 1
- 230000002357 endometrial effect Effects 0.000 description 1
- 229960002062 enfuvirtide Drugs 0.000 description 1
- PEASPLKKXBYDKL-FXEVSJAOSA-N enfuvirtide Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(C)=O)[C@@H](C)O)[C@@H](C)CC)C1=CN=CN1 PEASPLKKXBYDKL-FXEVSJAOSA-N 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 239000012055 enteric layer Substances 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- AAUBVINEXCCXOK-UHFFFAOYSA-N ethyl 4,6-dichloropyridine-3-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)C=C1Cl AAUBVINEXCCXOK-UHFFFAOYSA-N 0.000 description 1
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 1
- 239000011536 extraction buffer Substances 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 101150016624 fgfr1 gene Proteins 0.000 description 1
- 101150088071 fgfr2 gene Proteins 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000020375 flavoured syrup Nutrition 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical class CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000004077 genetic alteration Effects 0.000 description 1
- 231100000118 genetic alteration Toxicity 0.000 description 1
- 238000009650 gentamicin protection assay Methods 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 239000003966 growth inhibitor Substances 0.000 description 1
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 230000009033 hematopoietic malignancy Effects 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 108700020746 histrelin Proteins 0.000 description 1
- HHXHVIJIIXKSOE-QILQGKCVSA-N histrelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC(N=C1)=CN1CC1=CC=CC=C1 HHXHVIJIIXKSOE-QILQGKCVSA-N 0.000 description 1
- 229960002193 histrelin Drugs 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical compound [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 210000003026 hypopharynx Anatomy 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- IFSDAJWBUCMOAH-HNNXBMFYSA-N idelalisib Chemical compound C1([C@@H](NC=2C=3N=CNC=3N=CN=2)CC)=NC2=CC=CC(F)=C2C(=O)N1C1=CC=CC=C1 IFSDAJWBUCMOAH-HNNXBMFYSA-N 0.000 description 1
- 229960003445 idelalisib Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 239000000367 immunologic factor Substances 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 229960001936 indinavir Drugs 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- KLEAIHJJLUAXIQ-JDRGBKBRSA-N irinotecan hydrochloride hydrate Chemical compound O.O.O.Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 KLEAIHJJLUAXIQ-JDRGBKBRSA-N 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 229960004592 isopropanol Drugs 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 210000001117 keloid Anatomy 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 238000000021 kinase assay Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001627 lamivudine Drugs 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- 210000000867 larynx Anatomy 0.000 description 1
- 229950004697 lasinavir Drugs 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- GDBQQVLCIARPGH-ULQDDVLXSA-N leupeptin Chemical compound CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C=O)CCCN=C(N)N GDBQQVLCIARPGH-ULQDDVLXSA-N 0.000 description 1
- 108010052968 leupeptin Proteins 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 210000000088 lip Anatomy 0.000 description 1
- 239000011344 liquid material Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 229950005339 lobucavir Drugs 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 229950003557 lodenosine Drugs 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 201000011649 lymphoblastic lymphoma Diseases 0.000 description 1
- 208000025036 lymphosarcoma Diseases 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- 210000003584 mesangial cell Anatomy 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 230000002071 myeloproliferative effect Effects 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- 125000004370 n-butenyl group Chemical group [H]\C([H])=C(/[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- AGVKXDPPPSLISR-UHFFFAOYSA-N n-ethylcyclohexanamine Chemical compound CCNC1CCCCC1 AGVKXDPPPSLISR-UHFFFAOYSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- RIWRFSMVIUAEBX-UHFFFAOYSA-N n-methyl-1-phenylmethanamine Chemical compound CNCC1=CC=CC=C1 RIWRFSMVIUAEBX-UHFFFAOYSA-N 0.000 description 1
- 229940073569 n-methylephedrine Drugs 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003506 n-propoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 210000001989 nasopharynx Anatomy 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 229960000513 necitumumab Drugs 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- NQHXCOAXSHGTIA-SKXNDZRYSA-N nelfinavir mesylate Chemical compound CS(O)(=O)=O.CC1=C(O)C=CC=C1C(=O)N[C@H]([C@H](O)CN1[C@@H](C[C@@H]2CCCC[C@@H]2C1)C(=O)NC(C)(C)C)CSC1=CC=CC=C1 NQHXCOAXSHGTIA-SKXNDZRYSA-N 0.000 description 1
- 229950008835 neratinib Drugs 0.000 description 1
- JWNPDZNEKVCWMY-VQHVLOKHSA-N neratinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 JWNPDZNEKVCWMY-VQHVLOKHSA-N 0.000 description 1
- 229960000689 nevirapine Drugs 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229960001346 nilotinib Drugs 0.000 description 1
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical class O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 229940042402 non-nucleoside reverse transcriptase inhibitor Drugs 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000002726 nonnucleoside reverse transcriptase inhibitor Substances 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 125000005482 norpinyl group Chemical group 0.000 description 1
- 229940042404 nucleoside and nucleotide reverse transcriptase inhibitor Drugs 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 229960000572 olaparib Drugs 0.000 description 1
- FAQDUNYVKQKNLD-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC2=C3[CH]C=CC=C3C(=O)N=N2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FAQDUNYVKQKNLD-UHFFFAOYSA-N 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 210000003300 oropharynx Anatomy 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- AHVQYHFYQWKUKB-UHFFFAOYSA-N oxan-4-amine Chemical group NC1CCOCC1 AHVQYHFYQWKUKB-UHFFFAOYSA-N 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 230000033116 oxidation-reduction process Effects 0.000 description 1
- 229960004390 palbociclib Drugs 0.000 description 1
- AHJRHEGDXFFMBM-UHFFFAOYSA-N palbociclib Chemical compound N1=C2N(C3CCCC3)C(=O)C(C(=O)C)=C(C)C2=CN=C1NC(N=C1)=CC=C1N1CCNCC1 AHJRHEGDXFFMBM-UHFFFAOYSA-N 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- FWZRWHZDXBDTFK-ZHACJKMWSA-N panobinostat Chemical compound CC1=NC2=CC=C[CH]C2=C1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FWZRWHZDXBDTFK-ZHACJKMWSA-N 0.000 description 1
- 229960005184 panobinostat Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 229960000639 pazopanib Drugs 0.000 description 1
- CUIHSIWYWATEQL-UHFFFAOYSA-N pazopanib Chemical compound C1=CC2=C(C)N(C)N=C2C=C1N(C)C(N=1)=CC=NC=1NC1=CC=C(C)C(S(N)(=O)=O)=C1 CUIHSIWYWATEQL-UHFFFAOYSA-N 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- FAXGPCHRFPCXOO-LXTPJMTPSA-N pepstatin A Chemical compound OC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)CC(C)C FAXGPCHRFPCXOO-LXTPJMTPSA-N 0.000 description 1
- 125000005004 perfluoroethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- XMGMFRIEKMMMSU-UHFFFAOYSA-N phenylmethylbenzene Chemical group C=1C=CC=CC=1[C]C1=CC=CC=C1 XMGMFRIEKMMMSU-UHFFFAOYSA-N 0.000 description 1
- DLNKOYKMWOXYQA-APPZFPTMSA-N phenylpropanolamine Chemical compound C[C@@H](N)[C@H](O)C1=CC=CC=C1 DLNKOYKMWOXYQA-APPZFPTMSA-N 0.000 description 1
- 229960000395 phenylpropanolamine Drugs 0.000 description 1
- 238000003566 phosphorylation assay Methods 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- PHXJVRSECIGDHY-UHFFFAOYSA-N ponatinib Chemical compound C1CN(C)CCN1CC(C(=C1)C(F)(F)F)=CC=C1NC(=O)C1=CC=C(C)C(C#CC=2N3N=CC=CC3=NC=2)=C1 PHXJVRSECIGDHY-UHFFFAOYSA-N 0.000 description 1
- 229960001131 ponatinib Drugs 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 210000001948 pro-b lymphocyte Anatomy 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- VVWRJUBEIPHGQF-MDZDMXLPSA-N propan-2-yl (ne)-n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)\N=N\C(=O)OC(C)C VVWRJUBEIPHGQF-MDZDMXLPSA-N 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000005588 protonation Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- ABMYEXAYWZJVOV-UHFFFAOYSA-N pyridin-3-ylboronic acid Chemical compound OB(O)C1=CC=CN=C1 ABMYEXAYWZJVOV-UHFFFAOYSA-N 0.000 description 1
- QLULGIRFKAWHOJ-UHFFFAOYSA-N pyridin-4-ylboronic acid Chemical compound OB(O)C1=CC=NC=C1 QLULGIRFKAWHOJ-UHFFFAOYSA-N 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 229960004836 regorafenib Drugs 0.000 description 1
- FNHKPVJBJVTLMP-UHFFFAOYSA-N regorafenib Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 FNHKPVJBJVTLMP-UHFFFAOYSA-N 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 208000004644 retinal vein occlusion Diseases 0.000 description 1
- 238000010567 reverse phase preparative liquid chromatography Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 1
- 229960000215 ruxolitinib Drugs 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 229960001852 saquinavir Drugs 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 1
- 229950010746 selumetinib Drugs 0.000 description 1
- 239000012056 semi-solid material Substances 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- FOEYMRPOKBCNCR-UHFFFAOYSA-N spiro[2.5]octane Chemical compound C1CC11CCCCC1 FOEYMRPOKBCNCR-UHFFFAOYSA-N 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 239000012258 stirred mixture Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000007755 survival signaling Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 1
- 229950007866 tanespimycin Drugs 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- JHLVEBNWCCKSGY-UHFFFAOYSA-N tert-butyl n-methylcarbamate Chemical compound CNC(=O)OC(C)(C)C JHLVEBNWCCKSGY-UHFFFAOYSA-N 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical compound C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 150000003527 tetrahydropyrans Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 230000025366 tissue development Effects 0.000 description 1
- 229960001350 tofacitinib Drugs 0.000 description 1
- UJLAWZDWDVHWOW-YPMHNXCESA-N tofacitinib Chemical compound C[C@@H]1CCN(C(=O)CC#N)C[C@@H]1N(C)C1=NC=NC2=C1C=CN2 UJLAWZDWDVHWOW-YPMHNXCESA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 150000004654 triazenes Chemical class 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- ZBZJXHCVGLJWFG-UHFFFAOYSA-N trichloromethyl(.) Chemical compound Cl[C](Cl)Cl ZBZJXHCVGLJWFG-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- IHIXIJGXTJIKRB-UHFFFAOYSA-N trisodium vanadate Chemical compound [Na+].[Na+].[Na+].[O-][V]([O-])([O-])=O IHIXIJGXTJIKRB-UHFFFAOYSA-N 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 125000005500 uronium group Chemical group 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229960003862 vemurafenib Drugs 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 231100000747 viability assay Toxicity 0.000 description 1
- 238000003026 viability measurement method Methods 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229960004854 viral vaccine Drugs 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229960000523 zalcitabine Drugs 0.000 description 1
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4375—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having nitrogen as a ring heteroatom, e.g. quinolizines, naphthyridines, berberine, vincamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Enzymes And Modification Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
Un compuesto de Fórmula IIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: R2 es halo; R5 es halo R6 es H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, C(=NRe2)Rb2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 o S(O)2NRc2Rd2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a; cada R6a se selecciona independientemente de Cy1, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1- 6, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, y S(O)2 NRc2Rd2, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy1, halo, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2 NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 y S(O)2NRc2Rd2; R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, -C(O)RA, S(O)RA, S(O)2RA, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y heterocicloalquilo de 4-10 miembros)- alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R7a; cada R7a se selecciona independientemente de Cy2, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1- 6, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, y S(O)2NRc3Rd3, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3 y S(O)2NRc3Rd3; R9 es H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10- alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a; cada R9a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1- 6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6 y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2 o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4; cada RA se selecciona independientemente de H, alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de R7a; Cy1, Cy2, y Cy3 se seleccionan cada uno independientemente de arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros, cada uno de los cuales está opcionalmente sustituido por 1, 2, 3, 4, o 5 sustituyentes de forma independiente seleccionados de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 3-10 miembros, CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, C(=NRe5)Rb5, C(=NRe5)NRc5Rd5, NRc5C(=NRe5)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5 y S(O)2NRc5Rd5; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4- miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, C(=NRe5)NRc5Rd5NRc5C(=NRe5)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5, y S(O)2NRc5Rd5; cada Ra2, Rb2, Rc2, Rd2, Ra3, Rb3, Rc3, Rd3, Ra4, Rb4, Rc4, Rd4, Ra5, Rb5, Rc5 y Rd5 se selecciona independientemente de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de -10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 está opcionalmente sustituido con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6; o cualquier Rc2 y Rd2 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de alquilo C1- 6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6; o cualquier Rc3 y Rd3 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de alquilo C1- 6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6 Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6; o cualquier Rc4 y Rd4 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de alquilo C1- 6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros y están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6; o cualquier Rc5y Rd5 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, donde dicha alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos con 1, 2 o 3 sustituyentes seleccionados independientemente entre halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2 NRc6Rd6; cada Re, Re2, Re3, Re4, y Re5 se selecciona independientemente de H, alquilo C1-4, CN, ORa6, SRb6, S(O)2Rb6, C(O)Rb6, S(O)2NRc6Rd6, y C(O)NRc6Rd6; cada Ra6, Rb6, Rc6, y Rd6 se selecciona independientemente de H, alquilo C1-4, haloalquilo C1-4, alquenilo C2-4, y alquinilo C2-4, en donde dicho C1-4 alquilo, alquenilo C2-4, y alquinilo C2-4 están opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de OH, CN, amino, halo, alquilo C1-4, alcoxi C1-4, alquiltio C1- 4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4 y haloalcoxi C1-4; o cualquier Rc6y Rd6 junto con el átomo de N al que están unidos forman un heterocicloalquilo de 4, 5, 6, o 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de OH, CN, amino, halo, alquilo C1-6, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4 y haloalcoxi C1-4; y cada Re6 se selecciona independientemente de H, alquilo C1-4, y CN.
Description
DESCRIPCIÓN
Heterocíclicos bicíclicos como inhibidores del FGFR
CAMPO DE LA INVENCIÓN
La presente invención se refiere a heterociclos bicíclicos, y composiciones farmacéuticas de los mismos, que son inhibidores de una o más enzimas de FGFR y son útiles en el tratamiento de enfermedades asociadas a FGFR, tal como el cáncer.
ANTECEDENTES DE LA INVENCIÓN
Los receptores de factor de crecimiento fibroblástico (FGFR) son quinasas de tirosina receptoras que se unen a ligandos del factor de crecimiento de fibroblastos (FGF). Hay cuatro proteínas FGFR (FGFR1-4) que son capaces de unirse a ligandos y están implicadas en la regulación de muchos procesos fisiológicos, incluyendo el desarrollo de tejidos, la angiogénesis, la curación de heridas y la regulación metógena. Tras la unión del ligando, los receptores experimentan dimerización y fosforilación que conducen a la estimulación de la actividad de quinasa de proteína y al reclutamiento de muchas proteínas de acoplamiento intracelulares. Estas interacciones facilitan la activación de un conjunto de vías de señalización intracelular que incluyen Ras-MAPK, AKT-PI3K y fosfolipasa C que son importantes para el crecimiento celular, la proliferación y la supervivencia (revisada en Eswarakumar y col., Cytokine & Growth Factor Reviews, 2005). La activación aberrante de esta vía a través de la sobreexpresión de ligandos de FGF o FGFR o mutaciones activadoras en los FGFR pueden conducir al desarrollo, progresión y resistencia del tumor a terapias contra el cáncer convencionales. En el cáncer humano, se han descrito alteraciones genéticas que incluyen la amplificación génica, las translocaciones cromosómicas y las mutaciones somáticas que conducen a la activación del receptor independiente del ligando. La secuenciación de ADN a gran escala de miles de muestras tumorales ha revelado que los componentes de la vía del FGFR están entre los más mutados en el cáncer humano. Muchas de estas mutaciones activadoras son idénticas a las mutaciones de la línea germinal que conducen a síndromes de displasia esquelética. Los mecanismos que conducen a la señalización dependiente de ligando aberrante en la enfermedad humana incluyen sobreexpresión de FGF y cambios en el empalme de FGFR que conducen a receptores con capacidades de unión de ligando más promiscuas (revisadas en Knights and Cook Pharmacology & Therapeutics, 2010; Turner y Grose, Nature Reviews Cancer, 2010). Por lo tanto, el desarrollo de inhibidores dirigidos a FGFR puede ser útil en el tratamiento clínico de enfermedades que tienen una actividad elevada de FGF o FGFR.
Los tipos de cáncer en los que están implicados FGF/FGFR incluyen, pero no se limitan a: carcinomas (por ejemplo, de vejiga, de mama, cervical, colorectal, endometrial, gástrico, de cabeza y cuello, riñón, hígado, pulmón, ovario, próstata); neoplasias hematopoyéticas (p. ej., mieloma múltiple, linfoma linfocítico crónico, leucemia de células T adultas, leucemia mieloide aguda, linfoma no Hodgkin, neoplasias mieloproliferativas y macroglubulinemia de Waldenstrom); y otros neoplasmas (p. ej., glioblastoma, melanoma y rabdosarcoma). Además de un papel en los neoplasmas oncogénicos, la activación del FGFR también se ha visto implicada en trastornos esqueléticos y condrocitos que incluyen, entre otros, síndromes de craneosinostosis y acrondroplasia.
La US 2004/044012 describe algunos heterociclos bicíclicos que inhiben las enzimas quinasa y tirosina quinasa dependientes de ciclina y, como tales, son útiles para tratar trastornos proliferativos celulares como angiogénesis, aterosclerosis, reestenosis y cáncer. La WO2007/136465 describe algunos compuestos heterocíclicos bicíclicos para su uso en el tratamiento de enfermedades o trastornos que implican una activación anormal de la quinasa FGFR.
Existe una necesidad continua para el desarrollo de nuevos fármacos para el tratamiento de cáncer y otras enfermedades, y los inhibidores de FGFR descritos en la presente memoria ayudan a satisfacer esta necesidad.
RESUMEN DE LA INVENCIÓN
La presente invención se dirige a inhibidores de FGFR que tienen la Fórmula IIa:
o una sal farmacéuticamente aceptable de los mismos, en donde las variables constituyentes se definen en la presente y en las reivindicaciones.
La presente invención se dirige además a composiciones farmacéuticas que comprenden un compuesto de fórmula IIa, o una sal farmacéuticamente aceptable del mismo, y al menos un vehículo farmacéuticamente aceptable.
La presente invención se dirige además a métodos de inhibición de una enzima FGFR comprendiendo poner en contacto la enzima in vitro con un compuesto de fórmula IIIa, o una sal farmacéuticamente aceptable del mismo.
La presente invención se dirige además a compuestos de fórmula IIa, o sales farmacéuticamente aceptables de los mismos, para uso en un método de tratamiento de una enfermedad asociada con la actividad anormal o la expresión de una enzima FGFR.
La presente invención se dirige además a compuestos de fórmula IIa, o sales farmacéuticamente aceptables de los mismos, para uso en el tratamiento de una enfermedad asociada con la actividad anormal o la expresión de una enzima FGFR.
La presente invención se dirige además al uso de compuestos de fórmula IIa, o sales farmacéuticamente aceptables de los mismos, en la preparación de un medicamento para uso en terapia.
DESCRIPCIÓN DETALLADA
La presente invención se refiere a inhibidores de FGFR que tiene la Fórmula IIa:
o una sal farmacéuticamente aceptable del mismo, en donde:
R2 es halo;
R5 es halo
R6 es H, halo, alquilo Ci-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, C(=NRe2)Rb2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 o S(O)2NRc2Rd2; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituido con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a;
cada R6a se selecciona independientemente de Cy1, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, y S(O)2 NRc2Rd2, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy1, halo, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, N Rc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2 NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 y S(O)2NRc2Rd2;
R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, -C(O)RA, S(O)RA, S(O)2Ra, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y heterocicloalquilo de 4-10 miembros)-alquilo C1-4 (están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R7a;
cada R7a se selecciona independientemente de Cy2, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, y S(O)2NRc3Rd3, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, N Rc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3 y S(O)2NRc3Rd3;
R9 es H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10- alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituido con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a;
cada R9a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6 y alquinilo C2-6 están cada uno opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, N Rc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4;
cada RA se selecciona independientemente de H, alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de R7a;
Cy1, Cy2, y Cy3 se seleccionan cada uno independientemente de arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros, cada uno de los cuales está opcionalmente sustituido por 1, 2, 3, 4, o 5 sustituyentes de forma independiente seleccionados de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 3-10 miembros, CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, C(=NRe5)Rb5, C(=NRe5)NRc5Rd5, NRc5C(=NRe5)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5 y S(O)2NRc5Rd5; en el que dicho alquilo C1-6,
alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4 10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2 , ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, C(=NRe5)NRc5Rd5NRc5C(=NRe5)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5, y S(O)2NRc5Rd5;
cada Ra2, Rb2, Rc2, Rd2, Ra3, Rb3, Rc3, Rd3, Ra4, Rb4, Rc4, Rd4, Ra5, Rb5, Rc5 y Rd5 se selecciona independientemente de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 está opcionalmente sustituido con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc2 y Rd2 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1,2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc3 y Rd3 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1,2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6 Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2 Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc4 y Rd4 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1,2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros y están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc5y Rd5 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, donde dicha alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos con 1, 2 o 3 sustituyentes seleccionados independientemente entre halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2 NRc6Rd6; cada Re, Re2, Re3, Re4, y Re5 se selecciona independientemente de H, alquilo C1-4, CN, ORa6, SRb6, S(O)2Rb6, C(O)Rb6, S(O)2NRc6Rd6, y C(O)NRc6Rd6;
cada Ra6, Rb6, Rc6, y Rd6 se selecciona independientemente de H, alquilo C1-4, haloalquilo C1-4, alquenilo C2-4, y alquinilo C2-4, en donde dicho C1-4 alquilo, alquenilo C2-4, y alquinilo C2-4 están opcionalmente sustituidos con 1,2, o 3 sustituyentes seleccionados independientemente de Oh , CN, amino, halo, alquilo C1-4, alcoxi C1-4, alquiltio C14, alquilamino C1-4, di(alquilo Ci-4)amino, haloalquilo C1-4 y haloalcoxi C1-4;
o cualquier Rc6y Rd6 junto con el átomo de N al que están unidos forman un heterocicloalquilo de 4, 5, 6, o 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de OH, CN, amino, halo, alquilo C1-6, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4 y haloalcoxi C1-4; y
cada Re6 se selecciona independientemente de H, alquilo C1-4, y CN.
También se describen inhibidores de FGFR que tiene la Fórmula I:
a sal farmacéuticamente aceptable del mismo, en donde:
W es NR9, O o CR10R11.
R1 es alquilo C1-6, haloalquilo C1-6, o cicloalquilo C3-7;
R2, R3, y R5 se seleccionan cada uno independientemente de H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, ciclopropilo, CN, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)ORa, NRcC(O)NRcRd, C(=NRe)Rb, C(=NRe)NcCd, NRcC(=NRe)NRcRd, NRcS(O)b, NRcS(O)2Rb, NRcS(O)2NRcRd, S(O)Rb, S(O)NRcRd, S(O)2Rb, y S(O)2NRcRd;
R4 es H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, CN, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, NRc1 Rd1, NRc1C(O)Rb1, NRc1C(O)ORa1, NRc1C(O)NRc1Rd1, C(=NRe1)Rb1, C(=NRe1)NRc1 Rd1, NRc1C(=NRe1)NRc1Rd1, NRc1S(O)Rb1, NRc1S(O)2Rb1, NRc1S(O)2NRc1Rd1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, y S(O)2NRc1Rd1; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, y heterocicloalquilo de 4-7 miembros están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, C(=NRe1)NRc1 Rd1, NRc1C(=NRe1)NRc1Rd1, NRc1Rd1, NRc1C(O)Rb1, NRc1C(O)ORa1, NRc1C(O)NRc1 Rd1, NRc1S(O)Rb1, NRc1S(O)2Rb1, NRc1S(O)2NRc1 Rd1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, y S(O)2NRc1Rd1;
R6 es H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)Oa2, NRc2C(O)NRc2Rd2, C(=NRe2) Rb2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 o S(O)2NRc2Rd2; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a;
en la que R6 es distinto de H cuando W es NR9;
cada R6a se selecciona independientemente de Cy1, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)Oa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2 NRc2C(O)Oa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 y S(O)2NRc2Rd2, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy1, halo, CN, NO2, Oa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)Oa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)Oa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, y S(O)2NRc2Rd2;
R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, -C(O)RA, S(O)RA, S(O)2Ra, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros) alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y heterocicloalquilo de 4-10 miembros)alquilo C1-4 (están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R7a;
cada R7a se selecciona independientemente de Cy2, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, y S(O)2NRc3Rd3, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, Oa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, N Rc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3 y S(O)2NRc3Rd3;
R9 es H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros) alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a;
cada R9a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6 y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, N Rc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4C(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4 y S(O)2NRc4Rd4;
R10 y R11 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, C(=NRe4)Rb4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4 y S(O)2NRc4Rd4; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4 10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R10a;
cada R10a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, N Rc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4 y S(O)2NRc4Rd4;
o R10 y R11 junto con el átomo de carbono al que están unidos forman un grupo cicloalquilo de 3, 4, 5, 6 o 7 miembros o un grupo heterocicloalquilo de 4, 5, 6, o 7 miembros, cada uno opcionalmente sustituido con 1,2, o 3 sustituyentes seleccionados independientemente de Cy3, alquilo C1-6, haloalquilo C1-6, halo, CN, Oa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)NRc4Rd4, NRc4C(O)ORa4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6 está opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)NRc4Rd4, NRc4C(O)ORa4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, y S(O)2NRc4Rd4;
cada RA se selecciona independientemente de H, alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dicho alquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 y cada uno opcionalmente sustituido con 1, 2, or 3 sustituyentes independientemente seleccionados de R7a;
Cy1 Cy2, y Cy3 se seleccionan cada uno independientemente de arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros, cada uno de los cuales está opcionalmente sustituido por 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 3-10 miembros,
CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, C(=NRe5) Rb5, C(=NRe5)NRc5Rd5, N Rc5C(=NRe5)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5, y S(O)2NRc5Rd5; en el que dichos alquilo Ci-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes de forma independiente seleccionados de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, C(=NRe5)NRc5Rd5, NRc5C(=NRe5)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5, y S(O)2NRc5Rd5;
cada Ra, Rb, Rc y Rd se selecciona independientemente de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, y ciclopropilo, en donde dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, y ciclopropilo está opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, N Rc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6 y S(O)2NRc6Rd6;
cada Ra1, Rb1, R c1, Rd1, Ra2, Rb2, Rc2, Rd2, Ra3, Rb3, Rc3, Rd3, Ra4, Rb4, Rc4, y Rd4, Ra5, Rb5, Rc5, y Rd5 se selecciona independientemente de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, C 3- 10 cicloalquilo, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 está opcionalmente sustituido con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, N Rc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc y Rd junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc1 y Rd1 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes independientemente seleccionado de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc2 y Rd2 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc3 y Rd3 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en
donde dicho alquilo Ci-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc4 y Rd4 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6 ,
o cualquier Rc5 y Rd5 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
cada Re, Re1, Re2, Re3, Re4, y Re5 se selecciona independientemente de H, alquilo C1-4, CN, ORa6, SRb6, S(O)2Rb6, C(O)Rb6, S(O)2NRc6Rd6, y C(O)NRc6Rd6;
cada Ra6, Rb6, Rc6, y Rd6 se selecciona independientemente de H, alquilo C1-4, haloalquilo C1-4, alquenilo C2-4 y C2-4 alquinilo, en el que dicho alquilo C1-4, alquenilo C2-4 y alquinilo C2-4, está opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de Oh , CN, amino, halo, alquilo C1-4, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4, y haloalcoxi C1-4;
o cualquier Rc6 y Rd6 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de OH, CN, amino, halo, alquilo C1-6, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4, y haloalcoxi C1-4; y cada Re6 se selecciona independientemente de H, alquilo C1-4, y CN.
También se describen inhibidores de FGFR que tiene la Fórmula I:
a sal farmacéuticamente aceptable de los mismos, en donde:
W es NR9, O o CR10R11.
R1 es alquilo C1-6, haloalquilo C1-6, o cicloalquilo C3-7;
R2, R3, y R5 se seleccionan cada uno independientemente de H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, ciclopropilo, CN, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)ORa, NRcC(O)NRcRd, C(=NRe)Rb, C(=NRe)NcCd, NRcC(=NRe)NRcRd, NRcS(O)b, NRcS(O)2Rb, NRcS(O)2NRcRd, S(O)Rb, S(O)NRcRd, S(O)2Rb, y S(O)2NRcRd;
R4 es H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7
miembros, CN, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, NRc1 Rd1, NRc1C(O)Rb1, NRc1C(O)ORa1, NRc1C(O)NRc1 Rd1, C(=NRe1)Rb1, C(=NRe1)NRc1 Rd1, NRc1C(=NRe1)NRc1Rd1, NRc1S(O)Rb1, NRc1S(O)2Rb1, NRc1S(O)2NRc1Rd1, S(O)Rb1, S(O)NRc1 Rd1, S(O)2Rb1, y S(O)2NRc1Rd1; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, y heterocicloalquilo de 4-7 miembros están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, C(=NRe1)NRc1 Rd1, NRc1C(=NRe1)NRc1Rd1, NRc1Rd1, NRc1C(O)Rb1, NRc1C(O)ORa1, NRc1C(O)NRc1 Rd1, NRc1S(O)Rb1, NRc1S(O)2Rb1, NRc1S(O)2NRc1 Rd1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, y S(O)2NRc1Rd1;
R6 es H, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)Oa2, NRc2C(O)NRc2Rd2, C(=NRe2) Rb2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 o S(O)2NRc2Rd2; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a;
en donde R6 es distinto de H cuando W es NR9;
cada R6a se selecciona independientemente de Cy1, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)Oa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2 NRc2C(O)Oa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 y S(O)2NRc2Rd2, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy1, halo, CN, NO2, Oa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)Oa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)Oa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, y S(O)2NRc2Rd2;
R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, -C(O)RA, S(O)RA, S(O)2Ra, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros) alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y heterocicloalquilo de 4-10 miembros)-alquilo C1-4 (están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R7a;
cada R7a se selecciona independientemente de Cy2, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, y S(O)2NRc3Rd3, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, Oa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, N Rc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3 y S(O)2NRc3Rd3;
R9 es H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros) alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a;
cada R9a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6 y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, N Rc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4C(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4 y S(O)2NRc4Rd4;
R10 y R11 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, C(=NRe4)Rb4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4 y S(O)2NRc4Rd4; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 410 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R10a;
cada R10a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, N Rc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4 y S(O)2NRc4Rd4;
o R10 y R11 junto con el átomo de carbono al que están unidos forman un grupo cicloalquilo de 3, 4, 5, 6 o 7 miembros o un grupo heterocicloalquilo de 4, 5, 6, o 7 miembros, cada uno opcionalmente sustituido con 1,2, o 3 sustituyentes seleccionados independientemente de Cy3, alquilo C1-6, haloalquilo C1-6, halo, CN, Oa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)NRc4Rd4, NRc4C(O)ORa4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6 está opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)NRc4Rd4, NRc4C(O)ORa4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, y S(O)2NRc4Rd4;
cada RA se selecciona independientemente de H, alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dicho alquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 y cada uno opcionalmente sustituido con 1, 2, or 3 sustituyentes independientemente seleccionados de R7a;
Cy1 Cy2, y Cy3 se seleccionan cada uno independientemente de arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros, cada uno de los cuales está opcionalmente sustituido por 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 3-10 miembros, CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, C(=NRe5) Rb5, C(=NRe5)NRc5Rd5, N Rc5C(=NRe5)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5, y S(O)2NRc5Rd5; en el que dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes de forma independiente seleccionados de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, C(=NRe5)NRc5Rd5, NRc5C(=NRe5)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5, y S(O)2NRc5Rd5;
cada Ra, Rb, Rc y Rd se selecciona independientemente de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, y ciclopropilo, en donde dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, y ciclopropilo está opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, N Rc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6 y S(O)2NRc6Rd6;
cada Ra1, Rb1, R c1, Rd1, Ra2, Rb2, Rc2, Rd2, Ra3, Rb3, Rc3, Rd3, Ra4, Rb4, Rc4, y Rd4, Ra5, Rb5, Rc5, y Rd5 se selecciona independientemente de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, C 3- 10 cicloalquilo, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 está opcionalmente sustituido con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, N Rc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc y Rd junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6
miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc1 y Rd1 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes independientemente seleccionado de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc2 y Rd2 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc3 y Rd3 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc4 y Rd4 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6 ,
o cualquier Rc5 y Rd5 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10 y heteroarilo de 5-6 miembros están opcionalmente sustituidos por 1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
cada Re, Re1, Re2, Re3, Re4, y Re5 se selecciona independientemente de H, alquilo C1-4, CN, ORa6, SRb6, S(O)2Rb6, C(O)Rb6, S(O)2NRc6Rd6, y C(O)NRc6Rd6;
cada Ra6, Rb6, Rc6, y Rd6 se selecciona independientemente de H, alquilo C1-4, haloalquilo C1-4, alquenilo C2-4 y C2-4 alquinilo, en el que dicho alquilo C1-4, alquenilo C2-4 y alquinilo C2-4, está opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de Oh , CN, amino, halo, alquilo C1-4, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4, y haloalcoxi C1-4;
o cualquier Rc6 y Rd6 junto con el átomo de N al que están unidos forman un heterociclo de 4, 5, 6, o grupo heterocicloalquilo de 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de OH, CN, amino, halo, alquilo C1-6, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4, y haloalcoxi C1-4; y cada Re6 se selecciona independientemente de H, alquilo C1-4, y CN.
En algunas realizaciones, W es NR9.
En algunas realizaciones, R9 es alquilo C1-6.
En algunas realizaciones, R9 es metilo.
En algunas realizaciones, R9 es arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dicho arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 está cada uno opcionalmente sustituido con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a.
En algunas realizaciones, R9 es arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, o (heteroarilo de 5-10 miembros)-alquilo C1-4, en donde dichos arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4 y (heteroarilo de 5 10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1 o 2 sustituyentes seleccionados independientemente de halo y alquilo C1-4.
En algunas realizaciones, R9 es fenilo, 2H-tetrazol-5-ilo, bencilo, 1 H-pirazol-4-ilmetilo, ciclopentilo, o ciclopropilmetilo, cada uno opcionalmente sustituido con 1 o 2 sustituyentes independientemente seleccionados de F y metilo.
En algunas realizaciones, R1 es metilo.
En algunas realizaciones, R2 es halo.
En algunas realizaciones, R2 es fluoro.
En algunas realizaciones, R3 es H.
En algunas realizaciones, R4 es ORa1 .
En algunas realizaciones, R4 es metoxi.
En algunas realizaciones, R5 es halo.
En algunas realizaciones, R5 es fluoro.
En algunas realizaciones, R6 es halo, alquilo C1-6, alquenilo C2-6, arilo C6-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, o ORa2; en el que dicho alquilo C1-6, alquenilo C2-6, arilo C6-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente a partir de R6a.
En algunas realizaciones, R6 es alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, o ORa2; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente entre R6a.
En algunas realizaciones, R6 es halo, alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, o ORa2; en el que dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, R6 es alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, o ORa2; en el que dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, R6 es cloro, metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazina-1-ilo)etoxi, fenilo, 4-fluorofenilo, bencilo, feniletilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1H-pirazol-4-ilo, 1 -metilo-1 H-pirazol-5-ilo, 1 -metilo-1 H-pirazol-4-ilo, 1 -etilo-1 H-pirazol-4-ilo, 1 -(2-hidroxietilo)-1 H-pirazol-4-ilo, o 1 -(piperidina-4-ilo)-1 H-pirazol-4-ilo.
En algunas realizaciones, R6 es metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazina-1-ilo)etoxi, fenilo, 4-fluorofenilo, bencilo, fenetilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1H- pirazol-4-ilo, 1-metilo-1 H-pirazol-5-ilo, 1 -metilo-1 H-pirazol-4-ilo, 1 -etilo-1 H-pirazol-4-ilo, 1 -(2-hidroxietilo)-1 H-pirazol-4-ilo, o 1-(piperidina-4-ilo)-1 H-pirazol-4-ilo.
En algunas realizaciones, R6 es metilo.
En algunas realizaciones, R6 es pirazolilo opcionalmente sustituido con 1 ó 2 sustituyentes seleccionados independientemente a partir de R6a.
En algunas realizaciones, R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, -C(O)RA, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R7a.
En algunas realizaciones, R7 y R8 se seleccionan cada uno independientemente de H, 2-hidroxipropilo, -C(O)OCH3, 3-fluorofenilo, ciclopropilo, ciclobutilo, 3,3-difluorociclobutilo, ciclopentilo, ciclohexilo, 4-hidroxyciclohexilo, metilo, 1 -metilo-1 H-pirazol-4-ilo, piridina-3-ilo, N-metilpiperidina-4-ilo, tetrahidro-2H-piran-4-ilo, tetrahidrofuran-3-ilo, 1 -feniletilo, (1 -metilo-1 H-pirazol-4-ilo)metilo, 2-morfolino-4-iletilo, piridina-2-ilmetilo, N-metilpiperazina-1-iletilo, y tetrahidrofuran-2-ilmetilo.
En algunas realizaciones, uno de R7 y R8 es H.
En algunas realizaciones, R7 y R8 son cada uno H.
Los compuestos de la invención tienen la Fórmula IIa:
En algunas realizaciones, en las que el compuesto tiene la fórmula IIa, R2 es halo.
En algunas realizaciones, en las que el compuesto tiene la fórmula IIa, R2 es fluoro.
En algunas realizaciones, en las que el compuesto tiene la fórmula IIa, R5 es halo.
En algunas realizaciones, en las que el compuesto tiene la fórmula IIa, R5 es fluoro.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R6 es halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4 a 10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5 10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5
sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R6 es alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4 a 10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R6 es halo, alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, o ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R6 es alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, o ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R 6 es cloro, metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, feniletilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R6 es metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, fenetilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R9 es alquilo C1-6.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIa, R9 es metilo.
En algunas realizaciones, los compuestos de la invención tienen la Fórmula I Ib:
En algunas realizaciones, en las que el compuesto tiene la Fórmula I Ib, R6 es halo, alquilo C1-6, alquenilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula I Ib, R6 es alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4 a 10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIb, R6 es halo, alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno
opcionalmente sustituidos con 1,2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIb, R6 es alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, u ORa2; en donde dicho alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1,2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIb, R6 es cloro, metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, feniletilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIb, R6 es metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, fenetilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIb, R9 es alquilo C1-6.
En algunas realizaciones, en las que el compuesto tiene la Fórmula IIb, R9 es metilo.
Se aprecia además que ciertas características de la invención, que están, para mayor claridad, descritas en el contexto de realizaciones separadas, también pueden proporcionarse en combinación en una única realización. A la inversa, diversas características de la invención que, por brevedad, se describen en el contexto de una única realización, también pueden proporcionarse por separado o en cualquier subcombinación adecuada.
En varios lugares de la presente memoria descriptiva, los sustituyentes de los compuestos de la invención se describen en grupos o en gamas. Se pretende específicamente que la invención incluya todas y cada subcombinación individual de los miembros de tales grupos y gamas. Por ejemplo, el término "alquilo C1-6" se pretende específicamente dar a conocer individualmente metilo, etilo, alquilo C3, alquilo C4, alquilo C5, y alquilo C6.
En varios lugares de la presente memoria descriptiva se describen varios anillos de arilo, heteroarilo, cicloalquilo y heterocicloalquilo. A menos que se especifique lo contrario, estos anillos pueden estar unidos al resto de la molécula en cualquier miembro de anillo según lo permita la valencia. Por ejemplo, el término "un anillo de piridina" o "piridinilo" puede referirse a un anillo de piridina-2-ilo, piridina-3-ilo, o piridina-4-ilo.
El término "de miembros n", donde n es un número entero típicamente describe el número de átomos que forman el anillo en un resto en el que el número de átomos que forman el anillo es n. Por ejemplo, piperidinilo es un ejemplo de un anillo heterocicloalquilo de 6 miembros, pirazolilo es un ejemplo de un anillo heteroarilo de 5 miembros, piridilo es un ejemplo de un anillo heteroarilo de 6 miembros, y 1,2,3,4-tetrahidro-naftaleno es un ejemplo de un grupo cicloalquilo de 10 miembros.
Para los compuestos de la invención en la que una variable aparece más de una vez, cada variable puede ser un resto diferente seleccionado independientemente del grupo que define la variable. Por ejemplo, donde se describe una estructura que tiene dos grupos R que están presentes simultáneamente en el mismo compuesto, los dos grupos R pueden representar diferentes restos seleccionados independientemente entre el grupo definido para R.
Tal como se utiliza aquí, la frase "opcionalmente sustituido" significa no sustituido o sustituido.
Tal como se utiliza aquí, el término "sustituido" significa que un átomo de hidrógeno se sustituye por un grupo no hidrógeno. Debe entenderse que la sustitución en un átomo dado está limitado por la valencia.
Como se usa en este documento, el término "Ci-j", donde i y j son números enteros, empleados en combinación con un grupo químico, designa un rango del número de átomos de carbono en el grupo químico definiendo i-j el intervalo. Por ejemplo, alquilo C1-6 se refiere a un grupo alquilo que tiene 1, 2, 3, 4, 5, o 6 átomos de carbono.
Tal como se utiliza aquí, el término "alquilo", usado sólo o en combinación con otros términos, se refiere a un grupo hidrocarburo saturado que puede ser de cadena lineal o ramificada. En algunas realizaciones, el grupo alquilo contiene 1 a 6, 1 a 4, o de 1 a 3 átomos de carbono. Los ejemplos de restos alquilo incluyen, pero no se limitan a, grupos químicos tales como metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, sec-butilo, terc-butilo, npentilo, 2-metilo-1-butilo, 3-pentilo, n-hexilo, 1,2,2-trimetilpropilo, y similares. En algunas realizaciones, el grupo alquilo es metilo, etilo, o propilo.
Como se usa en el presente documento, "alquenilo", empleado solo o en combinación con otros términos, se refiere a un grupo alquilo que tiene uno o más dobles enlaces carbono-carbono. En algunas realizaciones, el resto alquenilo contiene de 2 a 6 o de 2 a 4 átomos de carbono. Grupos alquenilo ejemplares incluyen, pero no se limitan a, etenilo, n-propenilo, isopropenilo, n-butenilo, sec-butenilo, y similares.
Como se usa en el presente documento, "alquinilo", empleado solo o en combinación con otros términos, se refiere a un grupo alquilo que tiene uno o más enlaces triples carbono-carbono. Los ejemplos de grupos alquinilo incluyen, pero no se limitan a, etinilo, propin-1-ilo, propin-2-ilo, y similares. En algunas realizaciones, el resto alquinilo contiene de 2 a 6 o de 2 a 4 átomos de carbono.
Como se usa en el presente documento, "halo" o "halógeno", empleado solo o en combinación con otros términos, incluye fluoro, cloro, bromo, y yodo. En algunas realizaciones, halo es F o Cl. En algunas realizaciones, halo es F.
Tal como se utiliza aquí, el término "haloalquilo", empleado solo o en combinación con otros términos, se refiere a un grupo alquilo que tiene hasta la valencia completa de los sustituyentes de átomos de halógeno, que puede ser o bien el mismo o diferente. En algunas realizaciones, los átomos de halógeno son átomos de flúor. En algunas realizaciones, el grupo alquilo tiene 1 a 6 o de 1 a 4 átomos de carbono. Grupos haloalquilo ejemplares incluyen CF3, C2F5, CHF2, CCl3, CHCh, C2Cl5, y similares.
Tal como se utiliza aquí, el término "alcoxi", usado sólo o en combinación con otros términos, se refiere a un grupo de fórmula -O-alquilo. Ejemplo grupos alcoxi incluyen metoxi, etoxi, propoxi (por ejemplo, n-propoxi e isopropoxi), t-butoxi, y similares. En algunas realizaciones, el grupo alquilo tiene 1 a 6 o de 1 a 4 átomos de carbono.
Como se usa en este documento, "haloalcoxi", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula -O- (haloalquilo). En algunas realizaciones, el grupo alquilo tiene 1 a 6 o de 1 a 4 átomos de carbono. Un grupo de ejemplo haloalcoxi es -OCF3.
Como se usa en este documento, "amino", empleado solo o en combinación con otros términos, se refiere a NH2.
Tal como se utiliza aquí, el término "alquilamino", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula -NH (alquilo). En algunas realizaciones, el grupo alquilamino tiene de 1 a 6 o de 1 a 4 átomos de carbono. Ejemplo grupos alquilamino incluyen metilamino, etilamino, propilamino (por ejemplo, N-propilamino y isopropilamino), y similares.
Tal como se utiliza aquí, el término "dialquilamino", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula -N(alquilo)2. Ejemplo grupos dialquilamino incluyen dimetilamino, dietilamino, dipropilamino (por ejemplo, di(n-propilo-)amino y di(isopropilo)amino), y similares. En algunas realizaciones, cada grupo alquilo tiene independientemente de 1 a 6 o de 1 a 4 átomos de carbono.
Tal como se utiliza aquí, el término "alquiltio", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula -S-alquilo. En algunas realizaciones, el grupo alquilo tiene 1 a 6 o de 1 a 4 átomos de carbono.
Tal como se utiliza aquí, el término "cicloalquilo", empleado solo o en combinación con otros términos, se refiere a un hidrocarburo cíclico no aromático que incluye grupos alquilo y alquenilo ciclados. Los grupos cicloalquilo pueden incluir sistemas de anillos mono- o policíclicos (por ejemplo, que tienen 2, 3, o 4 anillos condensados, puenteados, o de espiro). También se incluyen en la definición de cicloalquilo restos que tienen uno o más anillos aromáticos (por ejemplo, anillos arilo o heteroarilo) fusionados (es decir, que tiene un enlace en común con) al anillo cicloalquilo, por ejemplo, derivados benzo de ciclopentano, ciclohexeno, ciclohexano, y similares, o derivados pirido de ciclopentano o ciclohexano. Átomos de carbono formadores de anillo de un grupo cicloalquilo pueden estar opcionalmente sustituidos con oxo. Los grupos cicloalquilo también incluyen cicloalquiloidenos. El término "cicloalquilo" también incluye grupos de cabeza de puente cicloalquilo (por ejemplo, restos hidrocarbonados cíclicos no aromáticos que contienen al menos un carbono de cabeza de puente, tales como admantan-1-ilo) y grupos espirocicloalquilo (por ejemplo, restos de hidrocarburos no aromáticos que contienen al menos dos anillos fusionados a un solo átomo de carbono, como por ejemplo espiro[2.5]octano y similares). En algunas realizaciones, el grupo cicloalquilo tiene 3 a 10 miembros en el anillo, o de 3 a 7 miembros en el anillo, o de 3 a 6 miembros de anillo. En algunas realizaciones, el grupo cicloalquilo es monocíclico o bicíclico. En algunas realizaciones, el grupo cicloalquilo es monocíclico. En algunas realizaciones, el grupo cicloalquilo es un grupo cicloalquilo monocíclico C3-7. Grupos cicloalquilo ejemplares incluyen ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, cicloheptilo, ciclopentenilo, ciclohexenilo, ciclohexadienilo, cicloheptatrienilo, norbornilo, norpinilo, norcarnilo, tetrahidronaftalenilo, octahidronaftalenilo, indanilo, y similares. En algunas realizaciones, el grupo cicloalquilo es ciclopropilo, ciclobutilo, ciclopentilo, o ciclohexilo.
Tal como se utiliza aquí, el término "cicloalquilalquilo", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula cicloalquilo-alquilo-. En algunas realizaciones, la porción alquilo tiene de 1 a 4, 1 a 3, 1 a 2, o 1 átomo(s) de carbono. En algunas realizaciones, la porción alquilo es metileno. En algunas realizaciones, la parte cicloalquilo tiene de 3 a 10 miembros en el anillo o de 3 a 7 miembros del anillo. En algunas realizaciones, el grupo cicloalquilo es monocíclico o bicíclico. En algunas realizaciones, la porción cicloalquilo es monocíclica. En algunas realizaciones, la porción cicloalquilo es un grupo cicloalquilo monocíclico C3-7.
Tal como se utiliza aquí, el término "heterocicloalquilo", empleado solo o en combinación con otros términos, se refiere a un anillo o sistema de anillos no aromático, que puede contener opcionalmente uno o más alquenileno o alquinileno como parte de la estructura de anillo, que tiene al menos un miembro del anillo de heteroátomo seleccionado independientemente de nitrógeno, azufre, oxígeno y fósforo. Los grupos heterocicloalquilo pueden incluir sistemas de anillos mono- o policíclicos (por ejemplo, que tienen 2, 3 o 4 anillos condensados, puenteados, o espiro). En algunas realizaciones, el grupo heterocicloalquilo es un grupo monocíclico o bicíclico que tiene 1, 2, 3, ó 4 heteroátomos seleccionados independientemente de nitrógeno, azufre y oxígeno. También se incluye en la definición de heterocicloalquilo restos que tienen uno o más anillos aromáticos (por ejemplo, anillos arilo o heteroarilo) fusionados (es decir, que tiene un enlace en común con) al anillo heterocicloalquilo no aromático, por ejemplo, 1,2,3,4-tetrahidro-quinolina y similares. Grupos heterocicloalquilo también pueden incluir grupos heterocicloalquilo de cabeza de puente (por ejemplo, un resto heterocicloalquilo que contiene al menos un átomo de cabeza de puente, tales como azaadmantan-1-ilo y similares) y grupos spiroheterocicloalquilo (por ejemplo, un resto heterocicloalquilo que contiene al menos dos anillos fusionado en un único átomo, tal como [1,4-dioxa-8-aza-espiro [4.5] decan-N-ilo] y similares). En algunas realizaciones, el grupo heterocicloalquilo tiene 3 a 10 átomos que forman el anillo, de 4 a 10 átomos formadores de anillo, o 3 a 8 átomos formadores de anillo. En algunas realizaciones, el grupo heterocicloalquilo tiene de 1 a 5 heteroátomos, de 1 a 4 heteroátomos, de 1 a 3 heteroátomos, o de 1 a 2 heteroátomos. Los átomos de carbono o heteroátomos en el anillo del grupo heterocicloalquilo pueden ser oxidados para formar un carbonilo, un N-óxido, o un grupo sulfonilo (u otro enlace oxidado) o un átomo de nitrógeno puede estar cuaternizado. En algunas realizaciones, la porción de heterocicloalquilo es un grupo heterocicloalquilo monocíclico C2-7. En algunas realizaciones, el grupo heterocicloalquilo es un anillo de morfolina, anillo de pirrolidina, anillo de piperazina, anillo de piperidina, anillo de dihidropirano, anillo tetrahidropirano, tetrahidropiridina, anillo de azetidina, o anillo de tetrahidrofurano.
Tal como se utiliza aquí, el término "heterocicloalquilalquilo", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula heterocicloalquilo-alquilo-. En algunas realizaciones, la porción alquilo tiene de 1 a 4, 1 a 3, 1 a 2, o 1 átomo(s) de carbono. En algunas realizaciones, la porción alquilo es metileno. En algunas realizaciones, la parte heterocicloalquilo tiene de 3 a 10 miembros de anillo, de 4 a 10 miembros en el anillo, 0 de 3 a 7 miembros del anillo. En algunas realizaciones, el grupo heterocicloalquilo es monocíclico o bicíclico. En algunas realizaciones, la porción de heterocicloalquilo es monocíclica. En algunas realizaciones, la porción de heterocicloalquilo es un grupo heterocicloalquilo monocíclico C2-7.
Tal como se utiliza aquí, el término "arilo", usado sólo o en combinación con otros términos, se refiere a un resto aromático de hidrocarburo monocíclico o policíclico (por ejemplo, que tiene 2 anillos fusionados), tal como, pero no limitados a, fenilo, 1 -naftilo, 2- naftilo, y similares. En algunas realizaciones, los grupos arilo tienen de 6 a 10 átomos de carbono o 6 átomos de carbono. En algunas realizaciones, el grupo arilo es un grupo monocíclico o bicíclico. En algunas realizaciones, el grupo arilo es fenilo o naftilo.
Tal como se utiliza aquí, el término "arilalquilo", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula arilo-alquilo-. En algunas realizaciones, la porción alquilo tiene de 1 a 4, 1 a 3, 1 a 2, o 1 átomo(s) de carbono. En algunas realizaciones, la porción alquilo es metileno. En algunas realizaciones, la porción arilo es fenilo. En algunas realizaciones, el grupo arilo es un grupo monocíclico o bicíclico. En algunas realizaciones, el grupo arilalquilo es bencilo.
Tal como se utiliza aquí, el término "heteroarilo", usado sólo o en combinación con otros términos, se refiere a un resto de hidrocarburo aromático monocíclico o policíclico (por ejemplo, que tienen 2 o 3 anillos fusionados), que tiene uno o más miembros del anillo heteroátomo independientemente seleccionado de nitrógeno, azufre y oxígeno. En algunas realizaciones, el grupo heteroarilo es un grupo monocíclico o bicíclico que tiene 1,2, 3, o 4 heteroátomos seleccionados independientemente de nitrógeno, azufre y oxígeno. Los ejemplos de grupos heteroarilo incluyen, pero no se limitan a, piridilo, pirimidinilo, pirazinilo, piridazinilo, triazinilo, furilo, tienilo, imidazolilo, tiazolilo, indolilo, pirrilo, oxazolilo, benzofurilo, benzotienilo, benzotiazolilo, isoxazolilo, pirazolilo, triazolilo, tetrazolilo, indazolilo, 1,2,4-tiadiazolilo, isotiazolilo, purinilo, carbazolilo, bencimidazolilo, indolinilo, pirrolilo, azolilo, quinolinilo, isoquinolinilo, benzisoxazolilo, imidazo[1,2-b]tiazolilo o similares. Los átomos de carbono o heteroátomos en el anillo (s) del grupo heteroarilo pueden ser oxidados para formar un carbonilo, un N-óxido, o un grupo sulfonilo (u otro enlace oxidado) o un átomo de nitrógeno se pueden cuaternizar, siempre que la naturaleza aromática del anillo se conserva. En una realización, el grupo heteroarilo es un grupo heteroarilo de 3 a 10 miembros. En otra realización, el grupo heteroarilo es un grupo heteroarilo de 4 a 10 miembros. En otra realización, el grupo heteroarilo es un grupo heteroarilo de 3 a 7 miembros. En otra realización, el grupo heteroarilo es un grupo heteroarilo de 5 a 6 miembros.
Tal como se utiliza aquí, el término "heteroarilalquilo", empleado solo o en combinación con otros términos, se refiere a un grupo de fórmula heteroarilo-alquilo-. En algunas realizaciones, la porción alquilo tiene de 1 a 4, 1 a 3, 1 a 2, o 1 átomo(s) de carbono. En algunas realizaciones, la porción alquilo es metileno. En algunas realizaciones, la porción heteroarilo es un grupo monocíclico o bicíclico que tiene 1, 2, 3, o 4 heteroátomos seleccionados independientemente de nitrógeno, azufre y oxígeno.
Los compuestos descritos en este documento pueden ser asimétricos (por ejemplo, que tienen uno o más estereocentros). Todos los estereoisómeros, tales como enantiómeros y diastereómeros, están previstos a no ser que se indique lo contrario. Los compuestos de la presente invención que contienen átomos de carbono sustituidos asimétricamente pueden aislarse en formas ópticamente activas o racémicas. Métodos sobre cómo preparar formas ópticamente activas a partir de materiales de partida ópticamente inactivos son conocidos en la técnica, tal como por resolución de mezclas racémicas o por síntesis estereoselectiva. Muchos isómeros geométricos de olefinas, C = N dobles enlaces, y similares también pueden estar presentes en los compuestos descritos en el presente documento, y todos estos isómeros estables se contemplan en la presente invención. Isómeros geométricos cis y trans de los compuestos de la presente invención se describen y pueden aislarse como una mezcla de isómeros o como formas isoméricas separadas.
La resolución de mezclas racémicas de compuestos puede realizarse por cualquiera de numerosos métodos conocidos en la técnica. Un método de ejemplo incluye recristalización fraccional utilizando un ácido de resolución quiral, que es un ácido orgánico ópticamente activo, formador de sal. Agentes de resolución adecuados para los métodos de recristalización fraccionada son, por ejemplo, ácidos ópticamente activos, tales como las formas D y L del ácido tartárico, ácido diacetiltartárico, ácido dibenzoiltartárico, ácido mandélico, ácido málico, ácido láctico o los diversos ácidos alcanforsulfónicos ópticamente activos. Otros agentes de resolución adecuados para los métodos de cristalización fraccionada incluyen formas estereoisoméricamente puras de metilbencilamina (por ejemplo, formas S y R, o formas diastereoméricamente puras), 2-fenilglicinol, norefedrina, efedrina, N-metilefedrina, ciclohexiletilamina, 1,2-diaminociclohexano, y similares.
Resolución de mezclas racémicas también puede llevarse a cabo por elución en una columna rellena con un agente de resolución ópticamente activo (por ejemplo, dinitrobenzoilfenilglicina). Composición de disolvente de elución adecuada puede ser determinada por un experto en la técnica.
Los compuestos de la invención también incluyen formas tautoméricas. Las formas tautoméricas resultan de la permutación de un enlace sencillo con un doble enlace adyacentes junto con la migración concomitante de un protón. Las formas tautoméricas incluyen tautómeros prototrópicos que son estados de protonación isoméricos que tienen la misma fórmula empírica y la carga total. Tautómeros prototrópicos ejemplares incluyen cetona - pares de enol, amida - pares de ácidos imídicos, lactama - pares de lactima, enamina - pares de imina, y formas anulares donde un protón puede ocupar dos o más posiciones de un sistema heterocíclico, por ejemplo, 1H- y 3H-imidazol, 1H-, 2H- y 4H-1,2,4-triazol, 1H- y 2H-isoindol, y 1H- y 2H-pirazol. Las formas tautoméricas pueden estar en equilibrio o estéricamente bloqueadas en una forma por sustitución apropiada.
Los compuestos de la invención también incluyen todos los isótopos de átomos que aparecen en los intermedios o compuestos finales. Los isótopos incluyen aquellos átomos que tienen el mismo número atómico pero diferentes números de masa. Por ejemplo, los isótopos de hidrógeno incluyen tritio y deuterio.
Se entiende que el término "compuesto", como se usa aquí incluye todos los estereoisómeros, iosomers geométricos, tautómeros, y los isótopos de las estructuras representadas.
Todos los compuestos, y sales farmacéuticamente aceptables de los mismos, se pueden encontrar, junto con otras sustancias tales como agua y disolventes (por ejemplo, en forma de hidratos y solvatos) o se pueden aislar.
En algunas realizaciones, los compuestos de la invención, o sales de los mismos, están sustancialmente aislados. Por "sustancialmente aislado" se entiende que el compuesto es al menos parcialmente o sustancialmente separado del entorno en el que se formó o detectó. La separación parcial puede incluir, por ejemplo, una composición enriquecida en los compuestos de la invención. Separación sustancial puede incluir composiciones que contienen al menos aproximadamente 50%, al menos aproximadamente 60%, al menos aproximadamente 70%, al menos aproximadamente 80%, al menos aproximadamente 90%, al menos aproximadamente 95%, al menos aproximadamente 97%, o al menos aproximadamente 99% en peso de los compuestos de la invención, o sal de los mismos. Los métodos para aislar los compuestos y sus sales son de rutina en la técnica.
La frase "farmacéuticamente aceptable" se emplea en el presente documento para referirse a aquellos compuestos, materiales, composiciones, y/o formas de dosificación que son, dentro del alcance del juicio médico, adecuadas para uso en contacto con los tejidos de humanos seres y animales sin excesiva toxicidad, irritación, respuesta alérgica, u otro problema o complicación, acorde con una relación beneficio/riesgo razonable.
La presente invención también incluye sales farmacéuticamente aceptables de los compuestos descritos en
este documento. Como se usa en el presente documento, "sales farmacéuticamente aceptables" se refiere a derivados de los compuestos descritos en los que el compuesto parental se modifica mediante la conversión de un ácido existente o resto de base a su forma de sal. Ejemplos de sales farmacéuticamente aceptables incluyen, pero no se limitan a sales de ácidos orgánicos de residuos básicos tales como aminas, sales alcalinas u orgánicas de restos ácidos tales como ácidos carboxílicos; y similares. Las sales farmacéuticamente aceptables de la presente invención incluyen las sales no tóxicas del compuesto original formadas, por ejemplo, de ácidos inorgánicos u orgánicos no tóxicos. Las sales farmacéuticamente aceptables de la presente invención se pueden sintetizar a partir del compuesto original que contiene un resto básico o ácido mediante procedimientos químicos convencionales. Generalmente, tales sales se pueden preparar por reacción de las formas de ácido o base libre de estos compuestos con una cantidad estequiométrica de la base o ácido apropiado en agua o en un disolvente orgánico, o en una mezcla de los dos; generalmente, se prefieren medios no acuosos como éter, acetato de etilo, alcoholes (por ejemplo, metanol, etanol, iso-propanol, o butanol) o acetonitrilo (ACN). Listas de sales adecuadas se encuentran en Remington's Pharmaceutical Sciences, 17a ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418 y Journal of Pharmaceutical Science, 66, 2 (1977).
Las siguientes abreviaturas se pueden usar en la presente memoria: AcOH (ácido acético); AC2O (anhídrido acético); ac. (acuoso); atm. (atmósfera(s)); Boc (f-butoxicarbonilo); br (ancho); Cbz (carboxibencilo); calc. (calculado); d (doblete); dd (doblete de dobletes); DCM (diclorometano); DEAd (azodicarboxilato de dietilo); DIAD (azidodicarboxilato de W,W'-diisopropilo); DIPEA (W,A/-diisopropiletilamina); DMF (W,W-dimetilformamida); Et (etilo); EtOAc (acetato de etilo); g (gramo(s)); h (hora(s)); HATU (N,N,N,’N'-tetrametilo-0-(7-azabenzotriazol-1-ilo)hexafluorofosfato de uronio); HCl (ácido clorhídrico); HPLC (cromatografía líquida de alto rendimiento); Hz (hertz); J (constante de acoplamiento); LCMS (cromatografía líquida - espectrometría de masas); m (multiplete); M (molar); mCPBA (ácido 3-cloroperoxibenzoico); MgSO4 (sulfato de magnesio); MS (espectrometría de masas); Me (metilo); MeCN (acetonitrilo); MeOH (metanol); mg (miligramo(s)); min. (minuto(s)); ml (mililitro(s)); mmol (milimol(s)); N (normal); NaHCO3 (bicarbonato de sodio); NaOH (hidróxido de sodio); Na2SO4 (sulfato de sodio); NH4Cl (cloruro de amonio); NH4OH (hidróxido de amonio); nM (nanomolar); RMN (espectroscopia de resonancia magnética nuclear); OTf (trifluorometanosulfonato); Pd (paladio); Ph (fenilo); pM (picomolar); PMB (para-metoxibencilo), POCl3 (cloruro de fosforilo); RP-HPLC (cromatografía líquida de alto rendimiento en fase inversa); s (singlete); t (triplete o terciario); TBS (terc-butildimetilsililo); tert (terciario); tt (triplete de tripletes); f-Bu (ferc-butilo); t Fa (ácido trifluoroacético); THF (tetrahidrofurano); pg (microgramo(s)); pL (microlitro(s)); pM (micromolar); % en peso (por ciento en peso).
Sínfesis
Los compuestos de la invención, incluyendo sales de los mismos, se pueden preparar usando técnicas de síntesis orgánica conocidas y pueden ser sintetizadas de acuerdo con cualquiera de las numerosas rutas sintéticas posibles.
Las reacciones para preparar compuestos de la invención pueden llevarse a cabo en disolventes adecuados que pueden seleccionarse fácilmente por un experto en la técnica de la síntesis orgánica. Los disolventes adecuados pueden ser sustancialmente no reactivos con los materiales de partida (reactivos), los intermedios o los productos a las temperaturas a las que las reacciones se llevan a cabo, por ejemplo, temperaturas que pueden oscilar desde la temperatura de congelación del disolvente a la temperatura de ebullición del disolvente. Una reacción dada puede llevarse a cabo en un disolvente o una mezcla de más de un disolvente. Dependiendo de la etapa de reacción particular, los disolventes adecuados para una etapa de reacción particular pueden ser seleccionados por el experto en la materia.
Preparación de compuestos de la invención puede implicar la protección y desprotección de diversos grupos químicos. La necesidad de protección y desprotección, y la selección de grupos protectores apropiados, se puede determinar fácilmente por un experto en la técnica. La química de los grupos protectores se puede encontrar, por ejemplo, en T.W. Greene y P.G.M. Wuts, Protective Groups in Organic Synthesis, tercera. Ed., Wiley & Sons, Inc., Nueva York (1999).
Las reacciones pueden ser controladas de acuerdo con cualquier método adecuado conocido en la técnica. Por ejemplo, la formación de producto puede controlarse por medios espectroscópicos, tales como espectroscopia de resonancia magnética nuclear (por ejemplo, 1H o 13C), espectroscopia infrarroja, espectrofotometría (por ejemplo, UV-visible), o espectrometría de masas, o por cromatografía tal como cromatografía líquida de alto rendimiento (HPLC) o cromatografía en capa fina.
Las expresiones, "temperatura ambiente", "temperatura de habitación", y "t.a.", como se usa aquí, se entiende en la técnica, y se refieren en general a una temperatura, por ejemplo una temperatura de reacción, es decir sobre la temperatura de la habitación en la que la reacción se lleva a cabo, por ejemplo, una temperatura de aproximadamente 20°C a aproximadamente 30°C.
Los compuestos de la invención se pueden preparar de acuerdo con numerosas rutas de preparación conocidas en la literatura. Métodos sintéticos ejemplares para la preparación de compuestos de la invención se
proporcionan en los esquemas a continuación.
Una serie de derivados de urea bicíclicos de fórmula 10 se pueden preparar por los métodos esbozados en el Esquema 1. Éster de amino 2 puede prepararse mediante el tratamiento de aminas adecuadas R9NH2 con el éster 1. El éster resultante 2 se somete a una secuencia de reducción-oxidación para dar aldehído 3. Reactivos reductores ejemplares incluyen DIBAL-H (hidruro de diisobutilaluminio), LAH (hidruro de litio y aluminio), Super-H (trietilborohidruro de litio), etc; y oxidantes ejemplares incluyen Dess-Martin, MnO2, oxidación de Swern, etc. El compuesto de anilina 5 se sintetiza por acoplamiento de aldehído 3 y anilina 4 a través de aminación reductora. Entonces la ciclación del compuesto diamino 5 puede llevarse a cabo con trifosgeno o el equivalente tal como carbonildiimidazol (CDI), fosgeno, difosgeno, etc. proporcionando los derivados de urea bicíclicos de fórmula 6. El desplazamiento del cloruro con 4-metoxibencilamina (PMB-NH2) con la ayuda de un catalizador de paladio y después desprotección del PMB (grupo 4-metoxibencilo) con ácido trifluoroacético (TFA) puede proporcionar el compuesto de aminopiridina 8. La halogenación del anillo de piridina con un reactivo de halogenación apropiado tal como, por ejemplo, NBS (N- bromosuccinimida), NCS (N-clorosuccinimida) NIS (N-yodosuccinimida), etc., se puede introducir un halógeno para obtener preparación adicional. Una variedad de grupos se puede unir a través de acoplamiento catalizado por paladio incluyendo, pero no limitado a, acoplamiento de Suzuki, acoplamiento de Stille, acoplamiento de Neigishi, acoplamiento de Sonogashira, etc. y cobre acoplamiento de Ullmann catalizado para proporcionar el compuesto 10.
Esquema 1
Una serie de derivados de anilina de fórmula 13 se pueden preparar por los métodos esbozados en el Esquema 2. El desplazamiento del cloruro 6 con R8-NH2 en presencia de catalizador de paladio puede proporcionar el compuesto de aminopiridina 11. Halogenación del anillo de piridina con un reactivo de halogenación apropiado, tal como NBS, NCS, NIS, etc. puede proporcionar el compuesto 12 para su posterior elaboración. Acoplamiento catalizado por paladio del compuesto 12 mediante, por ejemplo, acoplamiento de Suzuki, acoplamiento de Stille, acoplamiento de Neigishi, acoplamiento de Sonogashira, etc. o cobre acoplamiento de Ullmann catalizado puede proporcionar el compuesto 13.
Esquema 2
Una serie de derivados de anilina 14 puede prepararse de acuerdo con los procedimientos esbozados en el Esquema 3. El desplazamiento de flúor en el compuesto 15 con bencilamina (BnNH2) proporciona la anilina 16 que se puede convertir a bis-éter por reacción con un alcóxido de sodio adecuado (NaOR donde R es alquilo), seguido de saponificación para proporcionar el ácido 17. El compuesto 18 puede obtenerse por descarboxilación de ácido benzoico 17, seguido por hidrogenación para eliminar el grupo protector para dar la anilina 14.
Esquema 3
Una síntesis alternativa del compuesto 8 se esboza en el Esquema 4 . Ester 1 se reduce y se oxida al aldehído correspondiente 19. La aminación reductora en este aldehído con anilina 4 proporciona la anilina 20, que puede someterse a aminación catalizada por paladio para proporcionar la anilina intermedia 5. La síntesis del compuesto 8 a partir de anilina 5 sigue el mismo procedimiento descrito en el Esquema 1.
Esquema 4
Los compuestos de fórmula 26 se puede preparar por los métodos esbozados en el Esquema 5. Lactama 24 se puede preparar a partir de compuestos 22 y 23 usando reacciones de tipo Hartwig Buchwald catalizadas por paladio o reacciones de tipo Ullmann mediadas por cobre y de N-arilación de tipo Chan-Lam. Lactama a-sustituida 25 se puede obtener por tratamiento del compuesto 24 con una base tal como, por ejemplo, K2CO3 o Cs2CO3 en DMF o acetonitrilo, y seguidas por la adición de haluros de R10X y/o R11X (X es halo tal como Cl o Br). Cloruro 25 se puede convertir en la aminopiridina 26 correspondiente en condiciones de aminación Buchwald-Hartwig usando reactivos tales como, por ejemplo, Pd(OAc)2/Xantphos/Cs2CO3 o Pd2(dba)3/BINAP/NaOtBu, etc.
Los compuestos de fórmula 34 se pueden preparar por los métodos esbozados en el Esquema 6. Éster 27 se puede preparar por el desplazamiento selectivo de cloruro con alilóxido sódico. El éster 27 resultante se somete a una secuencia de oxidación-reducción para dar aldehído 28. Reactivos reductores ejemplares incluyen DIBAL-H
(hidruro de diisobutilaluminio), LAH (hidruro de litio y aluminio), Super-H (trietilborohidruro de litio), etc; y oxidantes ejemplares incluyen Dess-Martin, MnO2, oxidación de Swern, etc. El compuesto de anilina 29 se sintetiza por acoplamiento de aldehído 28 y anilina 4 a través de aminación reductora. Después de la eliminación del grupo alilo por dicloruro de paladio, a continuación, la ciclación del intermedio de hidroxilo de amino puede llevarse a cabo con trifosgeno o el equivalente tal como carbonildiimidazol (CDI), fosgeno, difosgeno, etc. proporcionando los derivados de carbamato bicíclicos de fórmula 30. La síntesis del compuesto 34 a partir del carbamato 30 sigue el mismo procedimiento como se describe en el Esquema 1.
Esquema 6
Una síntesis alternativa del compuesto 26 se esboza en el Esquema 7. Ester 1 se reduce al correspondiente aldehído 19. A continuación, la aminación reductora de aldehído 19 con anilina 4 proporciona el compuesto 20, que puede ser tratada con acetato de 3-cloro-3-oxopropanoato en presencia de NaH en THF para proporcionar la anilina intermedia 35. Lactama 24 se puede preparar por tratamiento o compuesto 35 con una base fuerte tal como, pero no limitado a, NaH o Cs2CO3 en DMF, a continuación, seguido por un ácido, por ejemplo, descarboxilación mediada por HCl. Lactama a-sustituida 25 se puede obtener por tratamiento del compuesto 24 con una base adecuada tal como, NaH o Cs2CO3 en DMF y seguido por la adición de haluros de R10X y/o R11X (X es halo tal como Cl o Br). Cloruro 25 se puede convertir en la aminopiridina correspondiente 26 en condiciones de aminación Buchwald-Hartwig usando reactivos tales como, pero no limitado a, Pd(OAc)2/Xantphos/Cs2CO3 o Pd(OAc)2/BrettPhos/NaOíBu.
Esquema 7
Métodos de uso
Los compuestos de la invención pueden inhibir la actividad de una o más enzimas de FGFR. Por ejemplo, los compuestos de la invención pueden usarse para inhibir la actividad de una enzima FGFR en una célula o en un individuo o paciente en necesidad de inhibición de la enzima mediante la administración de una cantidad inhibidora de un compuesto de la invención a la célula, individuo, o paciente.
En algunas realizaciones, los compuestos de la invención son inhibidores de una o más de FGFR1, FGFR2, FGFR3 y FGFR4. En algunas realizaciones, los compuestos de la invención inhiben cada uno de FGFR1, FGFR2, y FGFR3. En algunas realizaciones, los compuestos de la invención son selectivos para una o más enzimas de FGFR. En algunas realizaciones, los compuestos de la invención son selectivos para una o más enzimas de FGFR más de VEGFR2. En algunas realizaciones, la selectividad es 2 veces o más, 3 veces o más, 5 veces o más, 10 veces o más, 50 veces o más, o 100 veces o más.
Como inhibidores de FGFR, los compuestos de la invención son útiles en el tratamiento de diversas enfermedades asociadas con la expresión o actividad de las enzimas de FGFR o ligandos de FGFR anormal.
Por ejemplo, los compuestos de la invención son útiles en el tratamiento del cáncer. Cánceres ejemplares incluyen cáncer de vejiga, cáncer de mama, cáncer cervical, cáncer colorrectal, cáncer del intestino delgado, cáncer de colon, cáncer rectal, cacncer del ano, cáncer endometrial, cáncer gástrico, cáncer de cabeza y cuello (por ejemplo, cánceres de laringe, hipofaringe, nasofaringe, orofaringe, los labios y la boca), cáncer de riñón, cáncer de hígado (por ejemplo, carcinoma hepatocelular, carcinoma colangiocelular), cáncer de pulmón (por ejemplo, adenocarcinoma, cáncer de pulmón de células pequeñas y no pequeñas de pulmón de células carcinomas, parvicelular y carcinoma no parvicelular, carcinoma bronquial, adenoma bronquial, blastoma pleuropulmonar),
cáncer de ovario, cáncer de próstata, cáncer testicular, cáncer de útero, cáncer de esófago, cáncer de vesícula biliar, cáncer pancreático (por ejemplo exocrina carcinoma de páncreas), cáncer de estómago, cáncer de tiroides, cáncer de paratiroides, cáncer de piel (por ejemplo, carcinoma de células escamosas, sarcoma de Kaposi, cáncer de piel de células Merkel), y el cáncer de cerebro (por ejemplo, astrocitoma, meduloblastoma, ependimoma, tumores neuroectodérmicos, tumores pineales).
Otros tipos de cáncer de ejemplo incluyen tumores malignos hematopoyéticos, tales como leucemia o linfoma, mieloma múltiple, linfoma linfocítica crónica, leucemia de células T adultas, linfoma de células B, linfoma cutáneo de células T, leucemia mielógena aguda, enfermedad de Hodgkin o no linfoma de Hodgkin, síndrome mieloproliferativo crónico (por ejemplo, policitemia vera, trombocitemia esencial y mielofibrosis primaria), Macroglubulinemia de Waldenstrom, linfoma de células pilosas, linfoma mielogénico crónico, linfoma linfoblástico agudo, linfomas relacionados con el SIDA y linfoma de Burkitt.
Otros tipos de cáncer que pueden tratarse con los compuestos de la invención incluyen tumores del ojo, glioblastoma, melanoma, rabdosarcoma, linfosarcoma, y osteosarcoma.
Además de los tumores oncogénicos, los compuestos de la invención pueden ser útiles en el tratamiento de trastornos del esqueleto y los condrocitos, incluyendo, pero no limitado a, achrondroplasia, hipocondroplasia, enanismo, displasia tanatofórica (TD) (formas clínicas TD I y TD II), síndrome de Apert, síndrome de Crouzon, síndrome de Jackson-Weiss, síndrome de giro de cutis Beare-Stevenson, síndrome de Pfeiffer, y síndromes de craneosinostosis.
Los compuestos de la invención también pueden ser útiles en el tratamiento de trastornos de hipofosfatemia incluyendo, por ejemplo, el raquitismo hipofosfatémico ligado al cromosoma X, raquitismo hipofosfatémico recesivo autosómico, raquitismo hipofosfatémico autosómico dominante, y osteromalacia inducida por tumores.
Los compuestos de la invención pueden ser útiles además en el tratamiento de enfermedades fibróticas, tales como donde un síntoma de enfermedad o trastorno se caracteriza por la fibrosis. Enfermedades fibróticas ejemplares incluyen cirrosis hepática, glomerulonafritis, fibrosis pulmonar, fibrosis sistémico, artritis reumatoide, y cicatrización de heridas.
Los compuestos de la invención también pueden ser útiles en el tratamiento de la psoriasis, queloides, enfermedades de la piel ampollosas, aterosclerosis, restenosis, trastornos proliferativos de células mesangiales, glomerulopatía, nefropatía diabética, enfermedades de riñón, y la hiperplasia benigna de la próstata.
Los compuestos de la invención también pueden ser útiles en el tratamiento de diversas enfermedades oculares incluyendo, por ejemplo, la degeneración relacionada con la edad macular, degeneración macular seca, oclusión isquémica de la vena retiniana, edema macular diabético, retinopatía diabética, y retinopatía de la prematuridad.
Los compuestos de la invención también pueden ser útiles en la inhibición de la metastisis de tumor.
Tal como se utiliza aquí, el término "célula" pretende referirse a una célula que es in vitro, ex vivo o in vivo. En algunas realizaciones, una célula ex vivo puede ser parte de una muestra de tejido extirpado de un organismo tal como un mamífero. En algunas realizaciones, una célula in vitro puede ser una célula en un cultivo celular. En algunas realizaciones, una célula in vivo es una célula viva en un organismo tal como un mamífero.
Tal como se utiliza aquí, el término "poner en contacto" se refiere a la interposición de restos indicadas en un sistema in vitro o un sistema in vivo. Por ejemplo, "poner en contacto" la enzima FGFR con un compuesto de la invención incluye la administración de un compuesto de la presente invención a un individuo o paciente, tal como un humano, que tiene FGFR, así como, por ejemplo, introducir un compuesto de la invención en una muestra que contiene una preparación celular o purificada que contiene la enzima FGFR.
Tal como se utiliza aquí, el término "individuo" o "paciente" se usa de forma intercambiable, se refiere a cualquier animal, incluyendo mamíferos, preferentemente ratones, ratas, otros roedores, conejos, perros, gatos, cerdos, ganado vacuno, ovejas, caballos, o primates, y lo más preferiblemente seres humanos.
Tal como se utiliza aquí, la frase "cantidad terapéuticamente eficaz" se refiere a la cantidad de compuesto activo o agente farmacéutico que provoca la respuesta biológica o medicinal en un tejido, sistema, animal, individuo o humano que está siendo buscada por un investigador, veterinario, doctor en medicina u otro médico.
Tal como se utiliza aquí, el término "tratar" o "tratamiento" se refiere a 1) prevenir la enfermedad; por ejemplo, la prevención de una enfermedad, condición o trastorno en un individuo que puede estar predispuesto a la enfermedad, afección o trastorno pero que aún no experimenta o presenta la patología o sintomatología de la enfermedad; 2) inhibir la enfermedad; por ejemplo, inhibir una enfermedad, afección o trastorno en un individuo que
está experimentando o mostrando la patología o sintomatología de la enfermedad, condición o trastorno (es decir, la detención de un mayor desarrollo de la patología y/o sintomatología), o 3) mejorando la enfermedad; por ejemplo, mejorando una enfermedad, condición o trastorno en un individuo que está experimentando o presentando la patología o sintomatología de la enfermedad, afección o trastorno (es decir, revirtiendo la patología y/o sintomatología).
Terapia de combinación
Uno o más agentes farmacéuticos o métodos de tratamiento adicionales, tal como, por ejemplo, agentes anti-virales, quimioterapéuticos u otros agentes anti-cáncer, potenciadores inmunes, inmunosupresores, radiación, anti-tumor y vacunas anti-virales, la terapia con citocinas (por ejemplo, IL2, GM-CSF, etc.), y/o inhibidores de quinasa de tirosina se pueden utilizar en combinación con los compuestos de la presente invención para el tratamiento de enfermedades asociadas con FGFR, trastornos o condiciones. Los agentes se pueden combinar con los presentes compuestos en una forma de dosificación única, o los agentes pueden administrarse simultáneamente o secuencialmente como formas de dosificación separadas.
Los agentes adecuados antivirales contemplados para uso en combinación con los compuestos de la presente invención pueden comprender nucleósidos y nucleótidos inhibidores de transcriptasa inversa (NRTI), inhibidores de la transcriptasa inversa no nucleósidos (NNRTI), inhibidores de proteasa y otros fármacos antivirales.
Un ejemplo adecuado NRTI incluye zidovudina (AZT); didanosina (ddl); zalcitabina (ddC); estavudina (d4T); lamivudina (3TC); abacavir (1592U89); dipivoxilo de adefovir [bis (POM)-PMEA]; lobucavir (BMS-180194); BCH-10652; emitricitabina [(-)-FTC]; beta-L-FD4 (también llamado beta-L-D4C y nombrado beta-L-2', 3'-dicleoxi-5-fluorocitideno); DAPD, ((-)-beta-D-2,6, dioxolano diamino-purina); y lodenosina (FddA). NNRTI adecuados típicos incluyen nevirapina (BI-RG-587); delaviradina (BHAP, U-90152); efavirenz (DMP-266); PNU-142721; AG-1549; MKC-442 (1-(etoxi-metilo)-5-(1-metiíetilo)-6-(fenilmetilo)-(2,4(1H, 3H) pirimidindiona); y (+)-calanolida A (NSC-675451) y B. Inhibidores de proteasa adecuados típicos incluyen saquinavir (Ro 31-8959); ritonavir (ABT-538); indinavir (MK-639); nelfnavir (AG-1343); amprenavir (141W94); lasinavir (BMS-234475); DMP-450; BMS-2322623; ABT-378, AG-1 549. Otros agentes antivirales incluyen hidroxiurea, ribavirina, IL-2, IL-12, pentafusida y Yissum Project N° 11607.
Los agentes adecuados para uso en combinación con los compuestos de la presente invención para el tratamiento del cáncer incluyen agentes quimioterapéuticos, terapias contra el cáncer dirigidas, inmunoterapias o terapia de radiación. Los compuestos de esta invención pueden ser eficaces en combinación con agentes anti hormonales para el tratamiento de cáncer de cáncer de mama y otros tumores. Ejemplos adecuados son los agentes antiestrógenos incluyendo pero no limitados al tamoxifeno y toremifeno, inhibidores de la aromatasa, que incluyen pero no se limitan a letrozol, anastrozol, y exemestano, adrenocorticosteroides (por ejemplo, prednisona), progestinas (por ejemplo acetato de megastrol), y antagonistas del receptor de estrógenos (por ejemplo fulvestrant). Agentes anti-hormonales adecuados usados para el tratamiento de próstata y otros cánceres también se pueden combinar con los compuestos de la presente invención. Estos incluyen anti-andrógenos incluyendo pero no limitado a la flutamida, bicalutamida, y nilutamida, hormona liberadora de hormona de análogos de luteinizante (LHRH), incluyendo leuprolida, goserelina, triptorelina, y histrelina, antagonistas de LHRH (por ejemplo, degarelix), bloqueadores de los receptores de andrógeno (por ejemplo, enzalutamida) y agentes que inhiben la producción de andrógenos (por ejemplo abiraterona).
Los compuestos de la presente invención se pueden combinar con o en secuencia con otros agentes contra quinasas del receptor de membrana, especialmente para pacientes que han desarrollado resistencia primaria o adquirida a la terapia dirigida. Estos agentes terapéuticos incluyen inhibidores o anticuerpos contra EGFR, Her2, VEGFR, c-Met, Ret, IGFR1, o Flt-3 y en contra de quinasas de proteínas de fusión asociadas con el cáncer tales como Bcr-Abl y EML4-Alq. Inhibidores contra EGFR incluyen gefitinib y erlotinib, y los inhibidores contra EGFR/Her2 incluyen, pero no se limitan a dacomitinib, afatinib, lapatinib y neratinib. Los anticuerpos contra el EGFR incluyen, pero no se limitan a cetuximab, panitumumab y necitumumab. Los inhibidores de c-Met se pueden usar en combinación con inhibidores de FGFR. Estos incluyen onartumzumab, tivantnib, e INC-280. Agentes contra Abl (o Bcr-Abl) incluyen imatinib, dasatinib, nilotinib, y ponatinib y aquellos contra Alq (o EML4-ALK) incluyen crizotinib.
Inhibidores de la angiogénesis pueden ser eficaces en algunos tumores en combinación con inhibidores de FGFR. Estos incluyen anticuerpos contra VEGF o VEGFR o inhibidores de la quinasa de VEGFR. Los anticuerpos u otras proteínas terapéuticas contra VEGF incluyen bevacizumab y aflibercept. Los inhibidores de quinasas de VEGFR y otros inhibidores de la anti-angiogénesis incluyen, pero no se limitan a sunitinib, sorafenib, axitinib, cediranib, pazopanib, regorafenib, brivanib, y vandetanib
La activación de vías de señalización intracelular es frecuente en el cáncer, y agentes que se dirigen a componentes de estas vías se han combinado con agentes receptores de la orientación para mejorar la eficacia y reducir la resistencia. Los ejemplos de agentes que pueden combinarse con compuestos de la presente invención incluyen inhibidores de la ruta PI3K-AKT-mTOR, inhibidores de la vía Raf-MAPK, inhibidores de la vía de JAK-STAT, y los inhibidores de las chaperonas de proteínas y la progresión del ciclo celular.
Agentes contra la quinasa de PI3 incluyen pero no se limitan a topilaralisib, idelalisib, buparlisib. Los inhibidores de mTOR, tales como rapamicina, sirolimus, temsirolimus, y everolimus pueden combinarse con inhibidores de FGFR. Otros ejemplos adecuados incluyen, pero no se limitan al vemurafenib y dabrafenib (inhibidores de Raf) y trametinib, selumetinib y GDC-0973 (inhibidores de MEK). Los inhibidores de una o más JAK (por ejemplo, ruxolitinib, baricitinib, tofacitinib), Hsp90 (por ejemplo, tanespimicina), quinasas dependientes de ciclina (por ejemplo, palbociclib), HDAC (por ejemplo, panobinostat), PARP (por ejemplo, olaparib), y proteasomas (por ejemplo, bortezomib, carfilzomib) también se puede combinar con los compuestos de la presente invención. En algunas realizaciones, el inhibidor de JAK es selectivo para JAK1 sobre JAK2 y JAK3.
Otros agentes adecuados para uso en combinación con los compuestos de la presente invención incluyen combinaciones de quimioterapia tales como dobletes a base de platino usados en el cáncer de pulmón y otros tumores sólidos (cisplatino o carboplatino y gemcitabina; cisplatino o carboplatino más docetaxel; cisplatino o carboplatino más paclitaxel; cisplatino o carboplatino más pemetrexed) o gemcitabina más partículas unidas a paclitaxel (Abraxane®).
Agentes quimioterapéuticos adecuados u otros agentes anti-cáncer incluyen, por ejemplo, los agentes (incluyendo, sin limitación, mostazas de nitrógeno, derivados de etilenimina, sulfonatos de alquilo, nitrosoureas y triazenos) tales como mostaza de uracilo alquilante, clormetina, ciclofosfamida (Cytoxan™), ifosfamida, melfalán, clorambucilo, pipobromán, trietilenglicol-melamina, trietilentiofosforamina, busulfán, carmustina, lomustina, estreptozocina, dacarbazina, y temozolomida.
Otros agentes adecuados para uso en combinación con los compuestos de la presente invención incluyen: dacarbazina (DTIC), opcionalmente, junto con otros fármacos de quimioterapia tales como carmustina (BCNU) y cisplatino; la "el régimen de Dartmouth", que consiste de DTIC, BCNU, cisplatino y tamoxifeno; una combinación de cisplatino, vinblastina y DTIC;. o temozolomida. Los compuestos según la invención también se pueden combinar con medicamentos de inmunoterapia, incluyendo citoquinas tales como interferón alfa, interleucina 2, y el factor de necrosis tumoral (TNF) in.
Agentes quimioterapéuticos adecuados u otros agentes anti-cáncer incluyen, por ejemplo, antimetabolitos (incluyendo, sin limitación, antagonistas de ácido fólico, análogos de pirimidina, análogos de purina e inhibidores de desaminasa de adenosina), tales como metotrexato, 5-fluorouracilo, floxuridina, citarabina, 6-mercaptopurina, 6-tioguanina, fosfato de fludarabina, pentostatina, y gemcitabina.
Agentes quimioterapéuticos adecuados u otros agentes anti-cáncer incluyen además, por ejemplo, ciertos productos naturales y sus derivados (por ejemplo, alcaloides de la vinca, antibióticos antitumorales, enzimas, linfoquinas y epipodofilotoxinas) tales como vinblastina, vincristina, vindesina, bleomicina, dactinomicina, daunorubicina, doxorubicina, epirubicina, idarubicina, ara-C, paclitaxel (TAXOLTM), mitramicina, desoxicoformicina, mitomicina-C, L-asparaginasa, interferones (especialmente IFN-a), etopósido, y tenipósido.
Otros agentes citotóxicos incluyen navelbeno, CPT-11, anastrazol, letrazol, capecitabina, reloxafina, ciclofosfamida, ifosamida, y droloxafina.
También son adecuados los agentes citotóxicos tales como epidofilotoxina; una enzima antineoplásica; un inhibidor de topoisomerasa; procarbazina; mitoxantrona; complejos de coordinación de platino tales como cis-platino y carboplatino; modificadores de respuesta biológica; inhibidores de crecimiento; agentes terapéuticos antihormonales; leucovorina; tegafur; y factores de crecimiento hematopoyéticos.
Otro(s) agente(s) anti-cáncer incluyen anticuerpos terapéuticos, tales como trastuzumab (Herceptina), anticuerpos a moléculas coestimuladoras tales como CTLA-4, 41BB y PD-1, o anticuerpos a las citoquinas (IL-10, TGF-p, etc.).
Otros agentes anti-cáncer también incluyen los que bloquean la migración de células inmunes, tales como antagonistas a receptores de quimioquinas, incluyendo CCR2 y CCR4.
Otros agentes anti-cáncer también incluyen aquellos que aumentan el sistema inmune tales como adyuvantes o transferencia adoptiva de células T.
Las vacunas contra el cáncer incluyen células dendríticas, péptidos sintéticos, las vacunas de ADN y los virus recombinantes.
Los métodos para la administración segura y eficaz de la mayoría de estos agentes quimioterapéuticos son conocidos por los expertos en la técnica. Además, su administración se describe en la literatura estándar. Por ejemplo, la administración de muchos de los agentes quimioterapéuticos se describe en el "Physicians' Desk Reference" (PDR, por ejemplo, edición de 1996, Medical Economics Company, Montvale, NJ).
Formulaciones farmacéuticas y formas de dosificación
Cuando se emplean como productos farmacéuticos, los compuestos de la invención se pueden administrar en forma de composiciones farmacéuticas que se refieren a una combinación de un compuesto de la invención, o su sal farmacéuticamente aceptable, y al menos un vehículo farmacéuticamente aceptable. Estas composiciones se pueden preparar de una manera bien conocida en la técnica farmacéutica, y se pueden administrar por una variedad de rutas, dependiendo de si se desea tratamiento local o sistémico y del área a ser tratada. La administración puede ser tópica (incluyendo oftálmica y a las membranas mucosas incluyendo intranasal, vaginal y rectal), pulmonar (por ejemplo, por inhalación o insuflación de polvos o aerosoles, incluyendo mediante nebulizador; intratraqueal, intranasal, epidérmica y transdérmica), ocular, oral o parenteral. Los métodos para suministro ocular pueden incluir la administración tópica (gotas para los ojos), subconjuntival, inyección periocular o intravítrea o introducción por catéter de balón o insertos oftálmicos colocado quirúrgicamente en el saco conjuntival. La administración parenteral incluye la administración intravenosa, intraarterial, subcutánea, intraperitoneal, o intramuscular o infusión; o administración intracraneal, por ejemplo, intratecal o intraventricular,. La administración parenteral puede ser en forma de una sola dosis de bolo, o puede ser, por ejemplo, por una bomba de perfusión continua. Las composiciones farmacéuticas y formulaciones para administración tópica pueden incluir parches transdérmicos, pomadas, lociones, cremas, geles, gotas, supositorios, pulverizaciones, líquidos y polvos. Los vehículos farmacéuticos convencionales, bases acuosas, en polvo u oleosas, espesantes y similares pueden ser necesarios o deseables.
Esta invención también incluye composiciones farmacéuticas que contienen, como ingrediente activo, uno o más de los compuestos de la invención anteriormente en combinación con uno o más portadores farmacéuticamente aceptables. Al hacer las composiciones de la invención, el ingrediente activo se mezcla típicamente con un excipiente, se diluye mediante un excipiente o se encierra dentro de un vehículo tal como en la forma de, por ejemplo, una cápsula, bolsita, papel, u otro recipiente. Cuando el excipiente sirve como diluyente, puede ser un material sólido, semi-sólido, o líquido, que actúa como un vehículo, excipiente o medio para el ingrediente activo. Por lo tanto, las composiciones pueden estar en forma de comprimidos, píldoras, polvos, pastillas, sobres, sellos, elixires, suspensiones, emulsiones, soluciones, jarabes, aerosoles (como un sólido o en un medio líquido), ungüentos que contienen, por ejemplo, hasta un 10% en peso del compuesto activo, cápsulas de gelatina blandas y duras, supositorios, soluciones inyectables estériles, y polvos envasados estériles.
En la preparación de una formulación, el compuesto activo puede molerse para proporcionar el tamaño de partícula apropiado antes de combinarlo con los otros ingredientes. Si el compuesto activo es sustancialmente insoluble, puede molerse hasta un tamaño de partícula de malla inferior a 200. Si el compuesto activo es sustancialmente soluble en agua, el tamaño de partícula puede ajustarse por molienda para proporcionar una distribución sustancialmente uniforme en la formulación, por ejemplo aproximadamente 40 de malla.
Algunos ejemplos de excipientes adecuados incluyen lactosa, dextrosa, sacarosa, sorbitol, manitol, almidones, goma arábiga, fosfato de calcio, alginatos, tragacanto, gelatina, silicato de calcio, celulosa microcristalina, polivinilpirrolidona, celulosa, agua, jarabe, y metilcelulosa. Las formulaciones pueden incluir adicionalmente: agentes lubricantes tales como talco, estearato de magnesio, y aceite mineral; agentes humectantes; emulsionantes y agentes de suspensión; agentes tales como metilo y propilhidroxi-benzoatos; agentes edulcorantes; y agentes aromatizantes. Las composiciones de la intervención pueden formularse de manera que proporcionen una liberación rápida, sostenida o retardada del ingrediente activo tras la administración al paciente empleando procedimientos conocidos en la técnica.
Las composiciones se pueden formular en una forma de dosificación unitaria, conteniendo cada dosis de aproximadamente 5 a aproximadamente 100 mg, más habitualmente de aproximadamente 10 a aproximadamente 30 mg, del ingrediente activo. El término "formas de dosificación unitaria" se refiere a unidades físicamente discretas adecuadas como dosificaciones unitarias para sujetos humanos y otros mamíferos, conteniendo cada unidad una cantidad predeterminada de material activo calculada para producir el efecto terapéutico deseado, en asociación con un excipiente farmaceútico adecuado.
El compuesto activo puede ser eficaz en un amplio intervalo de dosificación y se administra generalmente en una cantidad farmaceúticamente eficaz. Se entenderá, sin embargo, que la cantidad de compuesto realmente administrada será normalmente determinada por un médico, según las circunstancias relevantes, incluyendo la afección a tratar, la vía de administración elegida, el compuesto real administrado, la edad, peso y respuesta del paciente individual, la gravedad de los síntomas del paciente, y similares.
Para preparar composiciones sólidas tales como comprimidos, el ingrediente activo principal se mezcla con un excipiente farmacéutico para formar una composición de pre-formulación sólida que contiene una mezcla homogénea de un compuesto de la presente invención. Cuando se hace referencia a estas composiciones de pre formulación como homogéneas, el ingrediente activo se dispersa típicamente de manera uniforme por toda la composición de modo que la composición puede subdividirse fácilmente en formas de dosificación unitarias
igualmente eficaces tales como comprimidos, píldoras y cápsulas. Esta pre-formulación sólida se subdivide después en formas de dosificación unitarias del tipo descrito anteriormente que contienen de, por ejemplo, 0,1 a aproximadamente 500 mg del ingrediente activo de la presente invención.
Los comprimidos o píldoras de la presente invención pueden recubrirse o componerse de otra manera para proporcionar una forma de dosificación que proporcione la ventaja de una acción prolongada. Por ejemplo, el comprimido o píldora puede comprender una dosificación interna y un componente de dosificación externo, estando este último en forma de una envoltura sobre el primero. Los dos componentes pueden estar separados por una capa entérica que sirve para resistir la desintegración en el estómago y permitir que el componente interno pase intacto al duodeno o que se retrase su liberación. Una variedad de materiales puede ser utilizada para tales capas entéricas o recubrimientos, incluyendo dichos materiales una serie de ácidos poliméricos y mezclas de ácidos poliméricos con materiales tales como goma laca, alcohol cetílico y acetato de celulosa.
Las formas líquidas en las que los compuestos y composiciones de la presente invención pueden incorporarse para administración oral o por inyección incluyen soluciones acuosas, jarabes adecuadamente aromatizados, suspensiones acuosas u oleosas, y emulsiones aromatizadas con aceites comestibles tales como aceite de semilla de algodón, sésamo aceite, aceite de coco, o aceite de cacahuete, así como elixires y vehículos farmacéuticos similares.
Las composiciones para inhalación o insuflación incluyen soluciones y suspensiones en disolventes farmacéuticamente aceptables, acuosos o orgánicos, o mezclas de los mismos, y polvos. Las composiciones líquidas o sólidas pueden contener excipientes farmacéuticamente aceptables adecuados como se describió anteriormente. En algunas realizaciones, las composiciones se administran por vía respiratoria oral o nasal para un efecto local o sistémico. Las composiciones se pueden nebulizar mediante el uso de gases inertes. Las soluciones nebulizadas pueden respirarse directamente desde el dispositivo de nebulización o el dispositivo de nebulización se puede unir a una tienda de máscara fascial, o máquina de respiración de presión positiva intermitente. Solución, suspensión, o composiciones en polvo se pueden administrar por vía oral o nasal desde dispositivos que suministran la formulación de una manera apropiada.
La cantidad de compuesto o composición administrada a un paciente variará dependiendo de lo que se está administrando, el propósito de la administración, tal como profilaxis o terapia, el estado del paciente, la manera de administración, y similares. En aplicaciones terapéuticas, las composiciones se pueden administrar a un paciente que ya padece una enfermedad en una cantidad suficiente para curar o al menos detener parcialmente los síntomas de la enfermedad y sus complicaciones. Las dosis eficaces dependerán de la condición de la enfermedad que se está tratando, así como por el juicio del médico a cargo dependiendo de factores tales como la gravedad de la enfermedad, la edad, peso y estado general del paciente, y similares.
Las composiciones administradas a un paciente pueden estar en la forma de composiciones farmacéuticas descritas anteriormente. Estas composiciones se pueden esterilizar mediante técnicas de esterilización convencionales, o pueden filtrarse de forma estéril. Las soluciones acuosas pueden envasarse para uso como tales, o liofilizadas, la preparación liofilizada siendo combinada con un vehículo acuoso estéril antes de la administración. El pH de las preparaciones de compuesto típicamente estará entre 3 y 11, más preferiblemente de 5 a 9 y lo más preferiblemente de 7 a 8. Se entenderá que el uso de ciertos de los excipientes, vehículos o estabilizantes anteriores dará como resultado la formación de sales farmacéuticas.
La dosificación terapéutica de los compuestos de la presente invención puede variar de acuerdo con, por ejemplo, el uso particular para el que se hace el tratamiento, la manera de administración del compuesto, la salud y condición del paciente, y el juicio del médico que prescribe. La proporción o concentración de un compuesto de la invención en una composición farmacéutica puede variar dependiendo de una serie de factores que incluyen la dosificación, características químicas (por ejemplo, hidrofobicidad) y la vía de administración. Por ejemplo, los compuestos de la invención pueden proporcionarse en una solución de tampón fisiológica acuosa que contiene aproximadamente 0,1 a aproximadamente 10% p/v del compuesto para administración parenteral. Algunos intervalos de dosis típicos son de aproximadamente 1 pg/kg a aproximadamente 1 g/kg de peso corporal por día. En algunas realizaciones, el intervalo de dosis es de aproximadamente 0,01 mg/kg a aproximadamente 100 mg/kg de peso corporal por día. La dosis es probable que dependa de variables tales como el tipo y grado de progresión de la enfermedad o trastorno, el estado de salud general del paciente particular, la eficacia biológica relativa del compuesto seleccionado, la formulación del excipiente, y su vía de administración. Las dosis eficaces pueden extrapolarse a partir de curvas de dosis-respuesta derivadas de sistemas de prueba de modelo in vitro o de animales.
Los compuestos de la invención también pueden formularse en combinación con uno o más ingredientes activos adicionales que pueden incluir cualquier agente farmacéutico tales como agentes anti-virales, vacunas, anticuerpos, potenciadores inmunes, inmunosupresores, agentes antiinflamatorios y similares.
Compuestos marcados y métodos de ensayo
Otro aspecto de la presente invención se refiere a un colorante fluorescente, marcador de espín, compuestos de metales pesados o radiomarcados de la invención que serían útiles no sólo en formación de imágenes sino también en ensayos, tanto in vitro como in vivo, para localización y cuantificación de la enzima FGFR en muestras de tejido, incluyendo humanos, y para identificar ligandos de enzima FGFR mediante la unión de inhibición de un compuesto marcado. Por consiguiente, la presente invención incluye ensayos enzimáticos FGFR que contienen dichos compuestos marcados.
La presente invención incluye además compuestos de la invención marcados isotópicamente. Un compuesto "marcado isotópicamente" o "radio-marcado" es un compuesto de la invención en que uno o más átomos están reemplazados o sustituidos por un átomo que tiene una masa atómica o número másico diferente de la masa atómica o número másico normalmente encontrado en la naturaleza (es decir, de forma natural). Los radionúclidos adecuados que pueden incorporarse en compuestos de la presente invención incluyen, pero no están limitados a 2H (también escrito como D para deuterio), 3H (también escrito como T para tritio), 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 18F, 35S, 36Cl, 82Br, 75Br, 76Br, 77Br, 123I, 124I, 125I y 131I. El radionúclido que se incorpora en los compuestos marcados radioactivamente dependerá de la aplicación específica de ese compuesto radiomarcado. Por ejemplo, para etiquetado de enzima FGFR in vitro y ensayos de competición, los compuestos que incorporan 3H, 14C, 82Br, 125I, 131I, o 35S generalmente serán más útiles. Para aplicaciones de radio-formación de imágenes 11C, 18F, 125I, 123I, 124I, 131I, 75Br, 76Br o 77Br generalmente serán más útiles.
Se entiende que un "compuesto marcado" "radio-marcado" es un compuesto que ha incorporado al menos un radionúclido. En algunas realizaciones el radionúclido se selecciona entre el grupo que consiste en 3H, 14C, 125I, 35S y 82Br. Los métodos sintéticos para incorporar radioisótopos en compuestos orgánicos son aplicables a compuestos de la invención y son bien conocidos en la técnica.
Un compuesto radiomarcado de la invención puede usarse en un ensayo de cribado para identificar/evaluar compuestos. En términos generales, un compuesto recién sintetizado o identificado (es decir, compuesto de ensayo) puede evaluarse por su capacidad para reducir la unión del compuesto radiomarcado de la invención a la enzima FGFR. Por consiguiente, la capacidad de un compuesto de ensayo para competir con el compuesto radiomarcado por la unión a la enzima FGFR se correlaciona directamente con su afinidad de unión.
Kits
La presente invención también incluye kits farmacéuticos útiles, por ejemplo, en el tratamiento o prevención de enfermedades asociadas a FGFR o trastornos, la obesidad, la diabetes y otras enfermedades mencionadas en la presente memoria, que incluyen uno o más recipientes que contienen una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un compuesto de la invención. Tales kits pueden incluir además, si se desea, uno o más de varios componentes de kit farmacéuticos convencionales, tales como, por ejemplo, recipientes con portadores aceptables farmacéuticamente de uno o más recipientes adicionales, etc., como será fácilmente evidente para los expertos en la técnica. Instrucciones, ya sea como insertos o como etiquetas, que indican cantidades de los componentes a administrar, directrices para la administración y/o directrices para mezclar los componentes, pueden también incluirse en el kit.
La invención se describirá con mayor detalle por medio de ejemplos específicos. Los siguientes ejemplos se ofrecen con fines ilustrativos, y no pretenden limitar la invención de ninguna manera. Los expertos en la técnica reconocerán fácilmente una variedad de parámetros no críticos que pueden cambiarse o modificarse para producir esencialmente los mismos resultados. Se encontró que los compuestos de los Ejemplos eran inhibidores de una o más de FGFR como se describe a continuación.
EJEMPLOS
Los procedimientos experimentales para los compuestos de la invención se proporcionan a continuación. Se realizaron purificaciones preparativas de LC-MS de algunos de los compuestos preparados en sistemas de fraccionamiento dirigidos por masa de Waters. La configuración del equipo básico, los protocolos y el software de control para el funcionamiento de estos sistemas se han descrito en detalle en la literatura. Véase, por ejemplo, "Two-Pump At Column Dilution Configuration for Preparative LC-MS", K. Blom, J. Combi. Chem., 4, 295 (2002); "Optimizing Preparative LC-MS Configurations and Methods for Parallel Synthesis Purification", K. Blom, R. Sparks, J. Doughty, G. Everlof, T. Haque, A. Combs, J. Combi. Chem., 5, 670 (2003); y "Preparative LC-MS Purification: Improved Compound Specific Method Optimization", K. Blom, B. Glass, R. Sparks, A. Combs, J. Combi. Chem., 6, 874 - 893 (2004). Los compuestos separados se sometieron típicamente a espectrometría de masas de cromatografía líquida analítica (LCMS) para la verificación de pureza en las siguientes condiciones: instrumento; serie Agilent 1100, LC/MSD, Columna: Waters Sunfire™ C185 pm, 2,1 x 5,0 mm, tampones: fase móvil A: 0,025% de TFA en agua y fase móvil B: 0,025% de TFA en acetonitrilo; gradiente del 2% al 80% de B en 3 minutos con una tasa de flujo de 1,5 ml/minuto.
Algunos de los compuestos preparados también fueron separados en una escala preparativa por cromatografía líquida de fase inversa de alto rendimiento (RP-HPLC) con detector de MS o cromatografía flash (gel de sílice) como se indica en los ejemplos. Las condiciones típicas de la columna de cromatografía líquida preparativa de fase inversa (RP-HPLC) son las siguientes:
pH = 2 purificaciones: Waters Sunfire™ Cis 5 pm, columna de 19 x 100 mm, eluyendo con la fase móvil A: TFA al 0,1% (ácido trifluoroacético) en agua y fase móvil B: TFA al 0,1% en acetonitrilo; la velocidad de flujo fue de 30 mL/minuto, el gradiente de separación se optimizó para cada compuesto utilizando el protocolo de Optimización del Método Específico del Compuesto como se describe en la literatura [véase " Preparative LCMS Purification: Improved Compound Specific Method Optimization", K. Blom, B. Glass, R. Sparks, A. Combs, J. Comb. Chem., 6, 874 - 893 (2004)]. Típicamente, la velocidad de flujo utilizada con la columna de 30 x 100 mm era de 60 mL/minuto.
pH = 10 purificaciones: Waters XBridge C185 Tm, columna de 19 x 100 mm, eluyendo con la fase móvil A: 0,15% de NH4OH en agua y fase móvil B: 0,15% de NH4OH en acetonitrilo; la velocidad de flujo fue de 30 mL/minuto, el gradiente de separación se optimizó para cada compuesto utilizando el protocolo de Optimización del Método Específico del Compuesto como se describe en la literatura [Véase "Preparative LCMS Purification: Improved Compound Specific Method Optimization", K. Blom, B. Glass, R. Sparks, A. Combs, J. Comb. Chem., 6, 874 -893 (2004)]. Típicamente, la velocidad de flujo utilizada con una columna de 30 x 100 mm era de 60 mL/minuto.
Los compuestos de los Ejemplos 1 a 22, y 45 a 54, no están dentro del alcance de las reivindicaciones. 2
Ejemplo 1
7-amino-3-(2,6-d¡fluoro-3,5-d¡metox¡fenilo) -1,8-d¡metIL-3,4-d¡h¡dropir¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Paso 1: etilo 6-cloro-4-(metilamino)nicotinato
A una solución de 2, 4-dicloro-5-carbetoxipiridina (10,0 g, 45,4 mmol, adquirida en Ark, catálogo N° AK-25933) en acetonitrilo (40 ml) se añadió metilamina (8,52 ml, 8,0 M en EtOH, 68,2 mmol) gota a gota a 0°C. La solución resultante se agitó a temperatura ambiente durante 6 h antes de concentrarse al vacío. El residuo bruto se llevó al siguiente paso directamente sin purificación adicional. LC-MS calculado para C9H12ClN2O2 [M+H]+ m/z: 215,1; encontrado 215.1.
Paso 2: 6-cloro-4-(metilamino)nicotinaldehído
A una solución de 6-cloro-4-(metilamino)nicotinato (11,0 g, 50,2 mmol) en cloruro de metileno (400 mL) se añadió hidruro de diisobutilaluminio 1,0 M en THF (150 ml, 150 mmol). La mezcla resultante se agitó a temperatura ambiente durante 6 h antes de enfriarse con una solución de sal de Rochelle. Después de agitarse durante 12H, la solución acuosa se extrajo con EtOAc (3 X 150 ml) y la capa orgánica se secó sobre Na2SO4 y se concentró al vacío para proporcionar el alcohol en bruto. LC-MS calculado para C7H1üCIN2O [M+H]+ m/z: 173,0; encontrado 173.0.
A la solución de alcohol bruto en cloruro de metileno (300 mL) se añadieron bicarbonato de sodio (42 g, 500 mmol) y periodinano de Dess-Martin (42 g, 100 mmol). La mezcla resultante se agitó durante 1 h antes de inactivarse con Na2S2O3 (sat. ac, 100 mL) y NaHCO3 (sat. ac, 100 mL). La fase acuosa se extrajo con EtOAc (3 X 100 mL) y la capa orgánica se secó sobre Na2SO4 y se concentró a vacío. Se purificó por cromatografía en columna ultrarrápida para proporcionar el aldehído (6,2 g, 80% de rendimiento en dos etapas). LC-MS calculado para C7H8CIN2O [M+H]+ m/z: 171,0; encontrado 171,0.
Paso 3 :2-cloro-5-{[(2,6-difluoro-3,5-dimetoxifenilo)amino]metilo}-N-metilpiridina-4-amina
A una mezcla de 2,6-difluoro-3,5-dimetoxianilina (CAS N° 651734-54-2, LakeStar Tech, LSP-210C, lote: 132-110-05: 1,07 g, 5,68 mmol) en ácido trifluoroacético (7,9 mL, 0,1 mol) se añadió triacetoxiborohidruro sódico (3,6 g, 17,0 mmol). La mezcla se agitó a 0°C durante 2 minutos antes de añadir gota a gota una solución de 6-cloro-4-(metilamino)-nicotinaldehído (0,97 g, 5,7 mmol) en cloruro de metileno (8,0 mL). La mezcla de reacción se agitó a temperatura ambiente durante la noche antes de que se concentrara a vacío para eliminar el exceso de ácido trifluoroacético. El residuo se neutralizó con una solución de NaHCO3. La fase acuosa se extrajo con EtOAc (3 X 10 mL) y la capa orgánica se secó sobre Na2SO4 y se concentró a vacío. El producto bruto se purificó mediante cromatografía en columna de desarrollo rápido para proporcionar la anilina (1,36 g, 68 %). LC-MS calculado para C15H17CIF2N3O2 [M+H]+ m/z: 344,1; encontrado 344,1.
Paso 4: 7-cloro-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
A una mezcla de dianilina (206 mg, 0,60 mmol) en THF (6,0 mL) se añadieron trietilamina (0,41 ml, 2,9
mmol) y trifosgeno (70,0 mg, 0,23 mmol) a 02C. La mezcla resultante se agitó durante 1 h a 0°C antes de enfriarse rápidamente con carbonato de sodio. La fase acuosa se extrajo con EtOAc (3 X 10 mL) y la capa orgánica se secó sobre Na2SO4 y se concentró a vacío. El producto bruto se purificó mediante cromatografía en columna ultrarrápida para proporcionar la urea (190 mg, 90%). LC-MS calculado para C16H15C F 2N3O3 [M+H]+ m/z: 370,1; encontrado 370,1.
Paso 5: 3-(2,6-difiuoro-3,5-dimetoxifeniio)-7-[(4-metoxibenciio)amino]-1-metiio-3,4-dihidropirído[4,3-d]pirímidina-2(1H)-ona
A una mezcla de 4-metoxibencilamina (2,65 mL, 20,3 mmol), 7-cloro-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (1,5 g, 4,0 mmol), acetato de paladio (90 mg, 0,4 mmol), (R)-(+)-2,2'-bis (difenilfosfino)-1, Se calentó 1 '-binaftilo (200 mg, 0,4 mmol) y carbonato de cesio (2,6 g, 8,1 mmol) en 1,4-dioxano (30 mL, 400 mmol) a 100°C durante 12 h. La mezcla se filtró y se concentró al vacío. El producto bruto se purificó mediante cromatografía en columna de desarrollo rápido para proporcionar la anilina. LC-MS calculado para C24H25F2N4O4 [M+H]+ m/z: 471,2; encontrado 471,2.
Paso 6: 7-amino-3-(2,6-difiuoro-3,5-dimetoxifeniio)-1-metiio-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
Una solución de 3-(2,6-difluoro-3,5-dimetoxifenilo)-7-[(4-metoxibencilo)amino]-1-metilo-3,4-dihidropiridinio[4,3-d]pirimidina-2(1H)-ona (1,1 g, 2,3 mmol) en TFA (10,0 mL) se calentó a 85°C durante 3 h antes de que se concentrara in vacuo y neutralizado con solución de bicarbonato de sodio. La fase acuosa se extrajo con EtOAc (3 3 20 mL) y la capa orgánica se secó sobre Na2SO4 y se concentró a vacío. El producto bruto se purificó mediante cromatografía en columna ultrarrápida para proporcionar la anilina (0,55 g, 67%). LC-MS calculado para C16H17F2N4O3 [M+H]+ m/z: 351,1; encontrado 351,1.
Paso 7: 7-amino-8-bromo-3-(2, 6-difluoro-3, 5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
A una solución de 7-amino-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (37 mg, 0,106 mmol) en acetonitrilo (2,0 mL) se añadió NBS (23 mg, 0,13 mmol). La mezcla resultante se agitó durante 1 h antes de concentrarse al vacío. El producto bruto se purificó por cromatografía en columna
ultrarrápida para proporcionar el bromuro. LC-MS calculado para Ci6Hi6BrF2N4Ü3 [M+H]+ m/z: 429,1; encontrado 429,1.
Paso 8: 7-amino-3-(2,6-difluoro-3,5-dimetoxifenilo)- 1,8-dimetilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
A una solución de 7-amino-8-bromo-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]piridinina-2(1H)-ona (34,0 mg, 0,080 mmol) en 1,4-dioxano (0,8 mL) se añadieron Pd(dppf)Cl2 (8,0 mg, 0,01 mmol) y ZnMe2 (solución de 2,0 M en tolueno, 0,11 mL, 0,22 mmol). La mezcla resultante se agitó durante 1 h a 110°C antes de diluirse con MeOH (4 mL) y se purificó mediante RP-HPLC (pH2) para proporcionar el producto como su sal de TFA. LC-MS calculado para C17H19F2N4O3 [M+H]+ m/z: 365,1; encontrado 365.1. 1H RMN (500 MHz, DMSO) 5 7,73 (s, 3H), 7,04 (t, J = 7,5 Hz, 1H), 4,59 (s, 2H), 3,88 (s, 6H), 3,39 (s, 3H), 2,80 ppm (s, 3H).
Ejemplo 2
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-8-et¡lo-1-met¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó por el mismo método descrito en el Ejemplo 1 mediante el uso de dietilzinc (adquirido de Sigma-Aldrich, n° de catálogo 220809) en lugar de dimetilzinc. LC-MS calculado para C18H21F2N4O3 [M+H]+ m/z: 379,1; encontrado 379,1.
Ejemplo 3
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-2-oxo-1,2,3,4-tetrah¡drop¡r¡do-[4,3-d]p¡r¡m¡d¡na-8-carbon¡tr¡lo
A una solución de 7-amino-8-bromo-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]piridinina-2(1H)-ona (10,0 mg, 0,0233 mmol) en DMF (1,0 mL) se añadió Pd(dppf)Cl2 (4,0 mg, 0,005 mmol) y cianuro de zinc (8,2 mg, 0,070 mmol). La mezcla resultante se agitó durante 1 h a 180°C antes de diluirse con MeOH (4 mL) y se purificó mediante RP-HPLC (pH2) para proporcionar el producto. LC-MS calculado para C17H16F2N5O3 [M+H]+ m/z: 376,1; encontrado 376,1. 1H RMN (500 MHz, DMSO) 5 7,90 (s, 1H), 7,15 (s, 2H), 7,05 (t, J = 7,5 Hz, 1H), 4,55 (s, 2H), 3,89 (s, 6H), 3,53 ppm (s, 3H).
Ejemplo 4
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-8-etox¡-1-met¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
A una solución de 7-amino-8-bromo-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (10,0 mg, 0,0233 mmol) en etanol (1,0 mL) se añadieron cobre (10,0 mg, 0,157 mmol) e hidróxido de potasio (10,0 mg, 0,178 mmol). La mezcla resultante se calentó a 150°C durante 3 h y luego se diluyó con MeOH (4 mL) y se purificó mediante RP-HPLC (pH2). LC-MS calculado para C18H21F2N4O4 [M+H]+ m/z: 395,1; encontrado 395,1. 1H RMN (500 MHz, DMSO) 57,57 (s, 1H), 7,03 (t, J = 7,5 Hz, 1H), 6,48 (s, 2H), 4,58 (s, 2H), 3,88 (s, 6H), 3,82 (q, J = 7,5 Hz, 2H), 3,42 (s, 3H), 1,34 ppm (t, J = 7,5 Hz, 3H).
Ejemplo 5
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-8-(2-metox¡etox¡)-1-met¡lo-3,4-d¡h¡dro-pir¡do[4,3-d]p¡r¡m¡d¡n-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 4 mediante el uso de 2-metoxietanol en lugar de etanol. LC-MS calculado para C19H23F2N4O5 [M+H]+ m/z: 424,2; encontrado 424.1.
Ejemplo 6
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-[2-(4-met¡lp¡peraz¡na-1-¡lo)etox¡]-3,4-d¡h¡drop¡r¡d¡n¡o[4,3-d]p¡r¡m¡d¡na-2(1 H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 4 usando 2-(4-metilpiperazina-1-ilo)etanol (adquirido de Oakwood, N° de Catálogo 021290) en lugar de etanol. LC-MS calculado para C23H31F2N6O4 [M+H]+ m/z: 493,2; encontrado 493,2.
Ejemplo 7
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-fenox¡-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 4 usando fenol en lugar de etanol. LC-MS calculado para C22H21F2N4O4 [M+H]+ m/z: 443,1; encontrado 443,1.
Ejemplo 8
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-(1-met¡lo-1H-p¡razol-4-¡lo)-3,4-d¡h¡drop¡r¡do[4,3-d]pirimidina-2(1 H)-ona
A una solución de 7-amino-8-bromo-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-3,4-dihidropirido[4,3-d]piridinina-2(1H)-ona (Ejemplo 1, Etapa 7 : 9,0 mg, 0,021 mmol) y 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1 H-pirazol (6,5 mg, 0,031 mmol, adquirido de Sigma-Aldrich, n.° de catálogo 595314) en 1, 4-dioxano (0,6 mL) /agua (0,15 ml) se añadieron carbonato de potasio (8.6 mg, 0,062 mmol) y tetrakis(trifenilfosfina)paladio(0) (3,6 mg, 0,0031 mmol). La mezcla resultante se agitó durante 2 h a 110°C antes de diluirse con MeOH (4 mL) y se purificó por RP-HPLC (pH 2) para dar el producto como su sal de TFA. LC-MS calculado para C20H21F2N6O3 [M+H]+ m/z: 431,2; encontrado 431,1. 1H RMN (500 MHz, DMSO) 5 7,87 (s, 1H), 7,81 (s, 1H), 7,49 (s, 1H), 7,20 (s, 2H), 7,04 (t, J = 7,5 Hz, 1H), 4.61 (s, 2H), 3.90 (s, 3H), 3,88 (s, 6H), 2,67 ppm (s, 3H).
Ejemplo 9
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fenilo)-1-met¡lo-8-(1-et¡lo-1H-p¡razol-4-¡lo)-3,4-d¡h¡drop¡r¡do[4,3-d]pirimidina-2(1 H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 utilizando 1 -etilo-4-(4,4,5,5- tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol (comprado en Combi-Blocks, número de catálogo BB-8817) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. LC-MS calculado para C21H23F2N6O3 [M+H]+ m/z: 443,2; encontrado 443,1.
Ejemplo 10
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-8-[1-(2-h¡drox¡et¡lo)-1H-p¡razol-4-¡lo]-1-met¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]pirimidina-2(1 H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando 2-[4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol-1-ilo]etanol en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-di-oxaborolan-2-ilo)-4,5-dihidro-1H-pirazol (comprado a Syntech Solution, número de catálogo BH-3012) _. LC-MS calculado para C21H23F2N6O3 [M+H]+ m/z: 461,2; encontrado 461,2.
Ejemplo 11
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-(1-p¡perid¡na-4-¡lo-1H-p¡razol-4-¡lo)-3,4-d¡h¡drop¡r¡do[4,3-d]pirimidina-2(1 H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando ácido {1-[1-(tercbutoxicarbonilo)piperidina-4-ilo]-4,5-dihidro-1H-pirazol-4-ilo}borónico (comprado en Combi-Blocks, N° de catálogo BB-6007) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. Después de completarse la reacción, se diluyó con TFA (4 mL) y se purificó por RP-HPLC para proporcionar el producto. LC-MS calculado para C24H28F2N7O3 [M+H]+ m/z: 500,2; encontrado 500,1.
Ejemplo 12
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-(1H-p¡razol-4-ilo)-3,4-d¡h¡dro-p¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando ácido 4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-1H-pirazol (adquirido de Sigma-Aldrich, n° de catálogo 525057) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. LC-MS calculado para C19H19F2N6O3 [M+H]+ m/z: 417,1; encontrado 417,1.
Ejemplo 13
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-(1-met¡lo-1H-p¡razol-5-¡lo)-3,4-d¡h¡drop¡r¡do[4,3-d]pirimidina-2(1 H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 utilizando 1-metilo-5-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-1H-pirazol (comprado en ChemBridge Corp., n° de catálogo 4003213) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. LC-MS calculado para C20H21F2N6O3 [M+H]+ m/z: 431,2; encontrado 431.1.
Ejemplo 14
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-fenil-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando ácido fenilborónico (adquirido de Sigma-Aldrich, n° de catálogo 20009) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo- 1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1 H-pirazol. LC-MS calculado para C22H21F2N4O3 [M+H]+ m/z: 427,2; encontrado 427,1.
Ejemplo 15
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-8-(4-fluorofen¡lo)-1-metilo-3,4-d¡h¡dro-p¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando ácido 4-fluorofenilborónico (adquirido de Sigma-Aldrich, n° de catálogo 417556) en lugar de 1-metilo-4-(4,4,5, 5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. LC-MS calculado para C22H20F3N4O3 [M+H]+ m/z : 445,1; encontrado 445,1.
Ejemplo 16
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-p¡r¡d¡na-3-¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando ácido 3-piridilborónico (adquirido de Sigma-Aldrich, n° de catálogo 512125) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. LC-MS calculada para C21H20F2N5O3 [M+H]+ m/z : 428,1; encontrado 428,1.
Ejemplo 17
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-p¡r¡d¡na-4-¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó mediante el mismo método descrito en el Ejemplo 8 usando ácido 4-piridilborónico (adquirido de Sigma-Aldrich, n° de catálogo 634492) en lugar de 1-metilo-4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-4,5-dihidro-1H-pirazol. LC-MS calculada para C21H20F2N5O3 [M+H]+ m/z: 428,1; encontrado 428,1.
Ejemplo 18
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-[(E)-2-fen¡lv¡n¡lo]-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó a partir de acoplamiento de Suzuki del bromuro (Ejemplo 1, Etapa 7) con ácido borónico (E)-2-fenilvinilo (adquirido de Sigma-Aldrich, n° de catálogo 473790) por el mismo método descrito en el Ejemplo 2. Lc -MS calculada para C24H23F2N4O3 [M+H]+ m/z: 453,2; encontrado 453,1.
Ejemplo 19
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-8-fen¡let¡lo-3,4-d¡h¡drop¡r¡do-[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
A una solución de 7-amino-3-(2,6-difluoro-3,5-dimetoxifenilo)-1-metilo-8-[(E)-2-fenilvinilo]-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (10,0 mg) en MeOH (1 mL) se añadió paladio sobre carbón vegetal (10,0 mg). La reacción se mantuvo bajo atmósfera de H2 durante 2 h antes de que se filtró y se purificó por RP-HPLC (p H2). LC-MS calculado para C24H25F2N4O3 [M+H]+ m/z: 455,2; encontrado 455.1.
Ejemplo 20
7-am¡no-8-benc¡lo-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1-met¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
Este compuesto se sintetizó a partir de acoplamiento de Suzuki del bromuro (Ejemplo 1, Etapa 7) con 2-bencilo-4,4,5,5-tetrametilo-1,3,2-dioxaborolano (adquirido de Ark, n° de catálogo AK-23881) por el mismo método descrito en el Ejemplo 2. LC-MS calculado para C23H23F2N4O3 [M+H]+ m/z: 441,1; encontrado 441,1.
Ejemplo 21
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-8-(3,6-d¡h¡dro-2H-p¡ran-4-¡lo)-1-met¡lo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1 H)-ona
Este compuesto se sintetizó a partir de acoplamiento de Suzuki del bromuro (Ejemplo 1, Etapa 7) con 4-(4,4,5,5-tetrametilo-1,3,2-dioxaborolan-2-ilo)-3,6-dihidro-2H-pirano (adquirido de Sigma-Aldrich, n° de catálogo 721352) por el mismo método descrito en el Ejemplo 2. LC-MS calculado para C21H23F2N4O4 [M+H]+ m/z: 433,2; encontrado 433,1.
Ejemplo 22 6-am¡no-2-(2,6-difluoro-3,5-d¡metox¡fen¡lo)-4,4-d¡met¡lo-1,2-dih¡dro-2,7-naftir¡d¡na-3 (4H)-ona
Paso 1. 6-doro-2-(3,5-dimetoxifenilo)-1,4-dihidro-2,7-naftirídina-3(2H)-ona
A una suspensión agitada de 6-cloro-1,4-dihidro-2,7-naftiridina-3(2H)-ona (de Anichem, n.° de catálogo NC1485, 250,0 mg, 1,37 mmol) en 1,4- dioxano (3,8 ml), carbonato de potasio (568 mg, 4,11 mmol), (1 R, 2 R)-N,N’-dimetilciclohexano-1,2-diamina (77,9 mg, 0,548 mmol), cobre (I) yoduro (52,1 mg, 0,274 mmol) y 3,5-dimetoxibromobenceno (446 mg, 2,05 mmol) se añadieron secuencialmente a temperatura ambiente. Se calentó entonces la mezcla resultante a 90°C bajo atmósfera de N2. Después de 15 h, la reacción se inactivó con NH4Cl ac., y se extrajo con cloruro de metileno. Las capas orgánicas combinadas se secaron sobre MgSO4 , y después se concentró. El residuo se purificó sobre gel de sílice (eluyendo con 0 a 0-40% de EtOAc en DCM) para proporcionar el producto deseado (120 mg). LC-MS calculado para C16H16ClN2O3 [M+H]+ m/z: 319,1; encontrado 319,1.
Paso 2. 6-cloro-2-(2,6-difluoro-3,5-dimetoxifenilo)-4,4-dimetilo-1,4-dihidro-2,7-naftiridina-3(2H)-ona
A una solución agitada de 6-cloro-2-(3,5-dimetoxifenilo)-1,4-dihidro-2,7-naftiridina-3(2H)-ona (109,0 mg, 0,342 mmol) en W,W-dimetilformamida (3,6 mL), carbonato de cesio (330 mg, 1,0 mmol) y yoduro de metilo (53 pL, 0,85 mmol) se añadieron secuencialmente a temperatura ambiente. Después de 5 horas, la mezcla de reacción se inactivó con NH4Cl ac., y se extrajo con cloruro de metileno. Las capas orgánicas combinadas se secaron sobre MgSO4, y después se concentraron para proporcionar el producto bruto (110 mg), que se usó directamente en la siguiente etapa sin purificación. LC-MS calculado para C18H2üClN2O3 [M+H]+ m/z: 347,1; encontrado 347,1.
Paso 3. Terc-butilo [7-(3,5-dimetoxifenilo)-5,5-dimetilo-6-oxo-5,6,7,8-tetrahidro-2,7-naftiridina-3-ilo]carbamato
Una mezcla agitada de 6-cloro-2-(3,5-dimetoxifenilo)-4,4-dimetilo-1,4-dihidro-2,7-naftiridina-3(2H)-ona (100,0 mg, 0,288 mmol), carbamato de f-butilo (40,5 mg, 0,346 mmol), (9,9-dimetilo-9H-xanteno-4,5-diilo)bis(difenilfosfina) (33 mg, 0,058 mmol), acetato de paladio (6,5 mg, 0,029 mmol), y carbonato de cesio (93,9 mg, 0,288 mmol) en 1,4-dioxano (5 mL) se calentó a 90°C bajo atmósfera de N2. Después de 12H, la reacción se inactivó con NH4Cl ac., y se extrajo con cloruro de metileno. Las capas orgánicas combinadas se secaron sobre MgSO4, y después se concentraron. El residuo se purificó sobre gel de sílice (eluyendo con 0 a 0-40% de EtOAc en DCM) para proporcionar el producto deseado (22 mg). LC-MS calculado para C23H30N3O5 [M+H]+ m/z: 428,2; encontrado 428,2.
Paso 4. 6-amino-2-(2,6-difluoro-3,5-dimefoxifenilo)-4,4-dimefilo-1,4-dihidro-2,7-naffiridina-3(2H)-ona
A una solución agitada de ferc-butilo [7-(3,5-dimetoxifenilo)-5,5-dimetilo-6-oxo-5,6,7,8-tetrahidro-2,7-naftiridina-3-ilo]carbamato (22,0 mg, 0,0515 mmol) en acetonitrilo (1,5 mL), 1-(clorometilo)-4-fluoro-1,4-diazoniabiciclo[2,2,2]octano ditetrafluoroborato (54,7 mg, 0,154 mmol) se añadió a 0°C. La mezcla resultante se calentó luego a temperatura ambiente. Después de 3 horas, la reacción se inactivó con NaHCO3 ac., y se extrajo con cloruro de metileno. Las capas orgánicas combinadas se secaron sobre MgSO4, se concentraron hasta sequedad, y después se disolvieron en ácido trifluoroacético (1,0 ml)/cloruro de metileno (1,0 mL, 16 mmol). Después de 1 hora, los volátiles se eliminaron a presión reducida y el residuo se purificó en RP-HPLC (columna XBridge C18, eluyendo con un gradiente de acetonitrilo/agua que contenía TFA al 0,05%, a una tasa de flujo de 30 mL/min) para proporcionar el producto deseado (2,0 mg) como su sal de TFA. LC-MS calculado para C18H20F2N3O3 [M+H]+ m/z: 364,1; encontrado 364,2.
Ejemplo de Referencia 23
2’-(2,6-difluoro-3,5-dimetoxifenilo)-6'-[(2-morfolina-4-ileetilo)amino]-1’,2'-dihidro-3'H-espiro[ciclopropano-1,4’-[2,7]naftiridina]-3'-ona
Paso 1:4, 6-dicloronicofinaldehído
A una solución agitada de 2,4-dicloro-5-carbetoxipiridina (Ark Pharm, n° de cat. AK-25933: 10,0 g, 45,4 mmol) en cloruro de metileno (100,0 mL) a -78°C se añadió una solución de hidruro de diisobutilaluminio en cloruro de metileno (50,0 mL, 1,0 M, 50,0 mmol) gota a gota. Después de 2 horas, la reacción se inactivó con una solución saturada de sal de Rochelle. Después de agitarse durante 12 h, la solución acuosa se extrajo con DCM (3 X 150
mL). Las capas orgánicas combinadas se secaron sobre Na2SÜ4 y se concentraron a vacío para proporcionar el aldehido bruto (7,51 g, 42,9 mmol), que se usó en la siguiente etapa sin purificación adicional. LC-MS calculado para C6H4Cl2NO [M+H]+ m/z: 176,0; encontrado 176,0.
Paso 2: n-[(4,6-dicloropiridina-3-ilo)metilo]-2,6-difluoro-3,5-dimetoxianilina
A una solución agitada de 2,6-difluoro-3,5-dimetoxianilina (CAS N° 651734-54-2, LakeStar Tech, LSP-210C, lote: 132-110-05: 9,03 g, 47,7 mmol) y triacetoxiborohidruro sódico (38,0 g, 180 mmol) en cloruro de metileno (60 mL)/ácido trifluoroacético (30 mL) se añadió 4,6-dicloronicotinaldehído (8,00 g, 45,5 mmol) en pequeñas porciones a temperatura ambiente. Después de 1 hora, los volátiles se retiraron al vacío y NaHCO3 acuoso saturado se añadió (200 mL). La mezcla resultante se extrajo con DCM (3 x 150 mL). Las capas orgánicas se combinaron, se secaron sobre Na2SO4, y se concentraron. El residuo se purificó en gel de sílice (eluyendo con 0 a 40% de EtOAc en hexanos) para proporcionar el producto deseado (15,0 g). LC-MS calculado para C14H13Cl2F2N2O2 [M+H]+ m/z: 349,0; encontrado 349,1.
Paso 3 :3-[[(4,6-dicloropiridina-3-ilo)metilo](2,6-difluoro-3,5-dimetoxifenilo)amino]-3-oxopropanoato
A una solución agitada de n-[(4,6-dicloropiridina-3-ilo)metilo]-2,6-difluoro-3,5-dimetoxianilina (3,50 g, 10,0 mmol) en tetrahidrofurano (20 mL) se añadió NaH (60% p/p en aceite mineral, 421 mg, 10,5 mmol) a temperatura ambiente. Después de 10 minutos, se añadió cloruro de etilmalonilo (1,92 mL, 15,0 mmol) gota a gota. Después de otra 1 hora, la reacción se inactivó con solución acuosa saturada de NH4Cl, y se extrajo con DCM (3 X 100 mL). Las capas orgánicas se combinaron, se secaron sobre Na2SO4, y se concentraron. El residuo se purificó en gel de sílice (eluyendo con 0 a 35% de EtOAc en hexanos) para proporcionar el producto deseado (4,20 g, 9,1 mmol). LC-MS calculado para C1gH1gCl2F2N2O5 [M+H]+ m/z: 463,1; encontrado 463,1.
Paso 4: 6-cloro-2-(2,6-difluoro-3,5-dimetoxifenilo)-3-oxo-1,2,3,4-tetrahidro-2,7-naftiridina-4-carboxilato
A una solución agitada de 3-[[(4,6-dicloropiridina-3-ilo)metilo](2,6-difluoro-3,5-dimetoxifenilo)amino]-3-oxopropanoato (1,50 g, 3,24 mmol) en DMF (15 mL) se añadió NaH (60% p/p en aceite mineral, 337 mg, 8,42 mmol) a temperatura ambiente. La mezcla resultante se calentó luego a 110°C. Después de 5 horas, la mezcla de reacción
se enfrió a temperatura ambiente y luego se añadió NH4CI acuoso saturado (50 mL) formando precipitado. Después de la filtración, el sólido se secó a vacío para dar un producto bruto ciclado (0,95 g, 2,23 mmol) que se usó en la siguiente etapa sin purificación adicional. LC-MS calculado para C1gH18ClF2N2O5 [M+H]+ m/z: 427,1; encontrado 427,0.
Paso 5: 6-cloro-2-(2,6-difluoro-3,5-dimetoxifenilo)-1,2-dihidro-2,7-naftiridina-3(4H)-ona
A una solución agitada de 6-cloro-2-(2,6-difluoro-3,5-dimetoxifenilo)-3-oxo-1,2,3,4-tetrahidro-2,7-naftiridina-4-carboxilato (0,95 g, 2,23 mmol) en 1,4-dioxano (5 mL) se añadió cloruro de hidrógeno (4,0 M en dioxano, 2 mL, 8 mmol) a temperatura ambiente. La mezcla resultante se calentó a 100°C. Después de agitarse a 100°C durante 4 horas, la mezcla de reacción se enfrió a temperatura ambiente, se inactivó con NaHCO3 acuoso saturado, y se extrajo con DCM (3 X 100 mL). Las capas orgánicas se combinaron, se secaron sobre Na2SO4, y se concentraron. El residuo se purificó sobre gel de sílice (eluyendo con 0 a 30% de EtOAc en DCM) para proporcionar el producto deseado (0,75 g, 2,12 mmol). LC-MS calculado para C16H14C F 2N2O3 [M+H]+ m/z: 355,1; encontrado 355,1.
Paso 6: 6'-cloro-2'-(2,6-difluoro-3,5-dimetoxifenilo)-1',2'-dihidro-3'H-espiro[ciclopropano-1,4'-[2,7]naftiridina]-3'-ona
A una solución agitada de 6-cloro-2-(2,6-difluoro-3,5-dimetoxifenilo)-1,4-dihidro-2,7-naftiridina-3(2H)-ona (1,50 g, 4,23 mmol) en DMF (10 mL) se añadió secuencialmente carbonato de cesio (3,03 g, 9,30 mmol) y 1-bromo-2-cloroetano (701 mL, 8,46 mmol) a temperatura ambiente. Después de agitarse a temperatura ambiente durante 5 horas, la mezcla de reacción se inactivó con solución acuosa saturada de NH4Cl, y se extrajo con DCM (3 X 75 mL). Las capas orgánicas se combinaron, se secaron sobre Na2SO4, y se concentraron. El residuo se purificó sobre gel de sílice (eluyendo con 0 a 50% de EtOAc en hexanos) para proporcionar el producto deseado (1,20 g, 3,15 mmol). LC-MS calculado para C18H16C F 2N2O3 [M+H]+ m/z: 381,1; encontrado 381,1.
Paso 7: 2'-(2,6-difluoro-3,5-dimetoxifenilo)-6'-[(2-morfolina-4-iletilo)amino]-1'-2'-dihidro-3'H-espiro[ciclopropano-1,4'-[2,7]naftiridina]-3 ’-ona
A una solución agitada de 6'-cloro-2’-(2,6-difluoro-3,5-dimetoxifenilo)-1',2'-dihidro-3’H-espiro[ciclopropano-1,4'-[2,7]naftiridina]-3'-ona (250 mg, 0,657 mmol) y 2-morfolinoetanamina (214 mg, 1,64 mmol) en 1,4-dioxano (6,0 mL) se añadieron secuencialmente diciclohexilo (2’,4’,6'-triisopropilo-3,6-dimetoxibifenilo-2-ilo)fosfina (BrettPhos, Aldrich, n° de cat. 718742: 70,5 mg, 0,131 mmol), terc-butóxido sódico (126 mg, 1,31 mmol) y acetato de paladio (29,5 mg, 0,131 mmol) a temperatura ambiente. La mezcla resultante se purgó con N2 después se calentó a 110°C. Después de agitarse a 110°C durante 45 minutos, la mezcla de reacción se enfrió a temperatura ambiente y se purificó en RP-HPLC (columna XBridge C18, eluyendo con un gradiente de acetonitrilo/agua que contenía TFA al 0,05%, con un caudal de 60 mL/min) para dar el producto deseado (150 mg) como su sal de TFA. LC-MS calculado para C24H29F2N4O4 [M+H]+ m/z: 475,2; encontrado 475,2. 1H RMN (500 MHz, DMSO-d6): 5 7,96 (s, 1 H), 7,06 (t, J = 10.0 Hz, 1 H), 6,22 (s, 1 H), 4,77 (s, 2 H), 3,88 (s, 6 H), 3,82 (br, 4 H), 3,65 (br, 2H), 3,27-3,33 (m, 6 H), 1,71 (dd, J = 7.0 Hz, 4,0 Hz, 2H), 1,43 (dd, J = 7,0 Hz, 4,0 Hz, 2H) ppm.
Ejemplo de Referencia 24
6'-am¡no-2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1'H-espiro[c¡clopropano-1,4’-[2,7]naft¡r¡d¡na]-3'(2'H)-ona
A una solución agitada de 6'-cloro-2’-(2,6-difluoro-3,5-dimetoxifenilo)-1’,2'-dihidro-3’H-espiro[ciclopropano-1,4'-[2,7]naftiridina]-3'-ona (Ejemplo 23, Etapa 6: 248 mg, 0,651 mmol) y benzofenona imina (164 mL, 0,977 mmol) en tolueno (5 mL) se añadieron secuencialmente (R)-(+)-2,2'-bis(difenilfosfino)-1,1'-binaftilo (40,6 mg, 0,0651 mmol), terc-butóxido de sodio (125 mg, 1,30 mmol) y tris(dibencilidenacetona)dipaladio(0) (23,9 mg, 0,0260 mmol) a temperatura ambiente. La mezcla resultante se purgó con N2 y se calentó a 90°C. Después de agitarse durante 2 horas a 90°C, la mezcla de reacción se enfrió a temperatura ambiente y los volátiles se eliminaron al vacío. El residuo se disolvió en tetrahidrofurano (5 mL), a continuación se añadió una solución de cloruro de hidrógeno en agua (1,0 M, 650 mL, 0,65 mmol). Después de agitarse a temperatura ambiente durante 1 hora, la mezcla de reacción se concentró y el residuo se purificó sobre RP-HPLC (columna XBridge C18, eluyendo con un gradiente de acetonitrilo/agua que contiene 0,05% de TFA, a una tasa de flujo de 60 mL/min) para dar el producto deseado (202 mg) como su sal de TFA. LC-MS calculado para C18H18F2N3O3 [M+H]+ m/z: 362,1; encontrado 362,1. 1H RMN (500 MHz, DMSO- d 6): 5 7,90 (s, 1 H), 7,77 (br, 2H), 7,07 (t, J = 10,0 Hz, 1 H), 6,49 (s, 1 H), 4,79 (s, 2H), 3,89 (s, 6 H), 1,82 (dd, J = 10,0 Hz, 5,0 Hz, 2H), 1,51 (dd, J = 10,0 Hz, 5,0 Hz, 2H) ppm.
Ejemplo de Referencia 25
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(met¡lam¡no)-1’,2’d¡h¡dro-3'H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3'-ona
A una solución agitada de 6'-cloro-2’-(2,6-difluoro-3,5-dimetoxi-fenilo)-1’,2'-dihidro-3’H-espiro[ciclopropano-1,4'-[2,7]naftiridina]-3'-ona (Ejemplo 23, Etapa 6: 90,0 mg, 0,236 mmol) y metilcarbamato de ferc-butilo (89,5 mg, 0,682 mmol) en 1,4-dioxano (3 mL) se añadieron diciclohexilo secuencialmente (2’,4’,6'-triisopropilo-3,6-dimetoxibifenilo-2-ilo)fosfina (BrettPhos, Aldrich, n° de cat 718742: 24,4 mg, 0,0455 mmol), terc-butóxido de sodio (52,4 mg, 0,546 mmol), y acetato de paladio (10,2 mg, 0,0455 mmol) a temperatura ambiente. La mezcla resultante se purgó con N2 y se calentó a 90°C. Después de agitarse durante 45 minutos a 90°C, la mezcla de reacción se enfrió a temperatura ambiente y los volátiles se eliminaron a vacío. El residuo se disolvió en DCM (1 mL), después TFA (1 mL) se añadió. Después de agitarse a temperatura ambiente durante 1 hora, la mezcla de reacción se concentró y el producto bruto se purificó sobre RP-HPLC (columna XBridge C18, eluyendo con un gradiente de acetonitrilo/agua que contiene 0,05% de TFA, a una tasa de flujo de 60 mL/min) para dar el producto deseado (32 mg) como su sal de TFA. LC-MS calculado para C19H20F2N3O3 [m H]+ m/z: 376,1; encontrado 376,2. 1H RMN (500 MHz, DMSO- d 6): 5 7,90 (s, 1 H), 7,07 (t, J = 10,0 Hz, 1 H), 6,46 (s, 1 H), 4,80 (s, 2H), 3,89 (s, 6 H),), 2,90 (s, 3H) 1,79 (dd, J = 10,0 Hz, 5,0 Hz, 2H), 1,56 (dd, J = 10,0 Hz, 5,0 Hz, 2H) ppm.
Ejemplo de Referenc¡a 26
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(tetrah¡dro-2H-p¡ran-4-¡lam¡no)-1’,2'-d¡h¡dro-3’H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7 con tetrahidro-2H-piran-4-amina sustituyendo 2-morfolinoetanamina. LCMS calculada para C23H26F2N3O4 (M+H)+: m/z = 446,2; Encontrado: 446,2.
Ejemplo de Referencia 27
(S)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(2-h¡drox¡prop¡lam¡no)-1'H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’(2' H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con (S)-1-amino-propan-2-ol reemplazando 2-morfolinoetanamina. LCMS calculada para C21H24F2N3O4 (M+H)+: m/z = 420,2; Encontrado: 420,2.
Ejemplo de Referenc¡a 28
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(p¡r¡d¡na-2-¡lmet¡lam¡no)-1’H-esp¡ro[c¡clopropano-1,4'-[2,7] naft¡r¡d¡na]-3’(2' H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con piridina-2-ilmetanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C24H23F2N4O3 (M+H)+: m/z = 453,2; Encontrado: 453,2.
Ejemplo de Referenc¡a 29
(S)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(tetrah¡drofurano-3-¡lam¡no)-1’H-Esp¡ro[c¡clopropano-1,4’-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con (S)-tetrahidrofuran-3-amina sustituyendo 2-morfolinoetanamina. LCMS calculada para C22H24F2N3O4 (M+H)+: m/z = 432,2; Encontrado: 432,2.
Ejemplo de Referencia 30
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(2-(4-met¡lp¡peraz¡na-1-¡lo)et¡lam¡no)-1’H-esp¡ro[c¡clopropano-1,4’-[2,7]naftiridina]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con 2-(4-metilo-piperazina-1-ilo)etanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C25H32F2N5O4 (m H)+: m/z = 488,2; Encontrado: 488,2.
Ejemplo de Referenc¡a 31
Metilo 2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-3'-oxo-2’,3’-dih¡dro-1’H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-6'-ilcarbamato
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejemplo 23, Etapa 7, con carbamato de metilo reemplazando 2-morfolinoetanamina. LCMS calculada para C20H20F2N3O5 (M+H)+: m/z = 420,1; Encontrado: 420,1.
Ejemplo de Referenc¡a 32
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(p¡rid¡na-3-¡lam¡no)-1’H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con piridina-3-amina reemplazando 2-morfolinoetanamina. LCMS calculada para C23H21F2N4O3 (M+H)+: m/z = 439,2; Encontrado: 439,2.
Ejemplo de Referencia 33
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(3-fluoro-fen¡lam¡no)-1’H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con 3-fluoroanilina reemplazando 2-morfolinoetanamina. LCMS calculada para C24H21F3N3O3 (M+H)+: m/z = 456,2; Encontrado: 456,2.
Ejemplo de Referenc¡a 34
6’-(c¡clopent¡lam¡no)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1'H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con ciclopentanamina sustituyendo 2-morfolinoetanamina. LCMS calculada para C23H26F2N3O3 (M+H)+: m/z = 430,2; Encontrado: 430,2.
Ejemplo de Referenc¡a 35
(S)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-((tetrah¡drofuran-2-¡lo)met¡lam¡no)-1’H-esp¡ro[c¡clopropano-1,4’-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con (S)-(tetrahidrofuran-2-ilo)metanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C23H26F2N3O4 (m H)+: m/z = 446,2; Encontrado: 446,2.
Ejemplo de Referencia 36
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(1-met¡lo-1H-p¡razol-4-¡lam¡no)-1'H-esp¡ro[c¡clopropano-1,4’-[2,7]naftiridina]-3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con 1-metilo-1H-pirazol-4-amina sustituyendo 2-morfolinoetanamina. LCMS calculada para C22H22F2N5O3 (M+H)+: m/z = 442,2; Encontrado: 442,2.
Ejemplo de Referenc¡a 37
2’-(2,6-d¡fluoro-3,5-d¡metoxifen¡lo)-6’-((1-met¡lo-1H-p¡razol-4-¡lo)met¡lam¡no)-1'H-esp¡ro[c¡clopropano-1,4'-[2,7]naftiridina]-3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con (1-metilo-1H-pirazol-4-ilo)metanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C23H24F2N5O3 (m H)+: m/z = 456,2; Encontrado: 456,2.
Ejemplo de Referencia 38
(R)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fenilo)-6’-(1-fen¡let¡lam¡no)-1'H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]
3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con (R)-l-feniletanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C26H26F2N3O3 (M+H)+: m/z = 466,2; Encontrado: 466,2.
Ejemplo de Referencia 39
6’-(c¡clohex¡lam¡no)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fenilo)-1'H-esp¡ro[c¡clopropano-1,4’-[2,7]naft¡r¡d¡na]-3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con ciclohexanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C24H28F2N3O3 (M+H)+: m/z = 444,2; Encontrado: 444,2.
Ejemplo de Referenc¡a 40
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(trans-4-h¡drox¡c¡clohex¡lam¡no)-1'H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con trans-4-aminociclohexanol reemplazando 2-morfolinoetanamina. LCMS calculada para C24H28F2N3O4 (M+H)+: m/z = 460,2; Encontrado: 460,2.
Ejemplo de Referenc¡a 41
6’-(c¡cloprop¡lam¡no)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-1'H-esp¡ro[c¡clopropano-1,4’-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con ciclopropanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C21H22F2N3O3 (M+H)+: m/z = 402,2; Encontrado: 402,2.
Ejemplo de Referencia 42
6’-(c¡clobut¡lam¡no)-2’-(2,6-d¡fluoro-3,5-d¡metox¡fenilo)-1'H-esp¡ro[c¡clopropano-1,4’-[2,7]naft¡r¡d¡na]-3’(2’H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con ciclobutilamina reemplazando 2-morfolinoetanamina. LCMS calculada para C22H24F2N3O3 (M+H)+: m/z = 416,2; Encontrado: 416,2.
Ejemplo de Referenc¡a 43
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(3,3-d¡fluoroc¡clobutylam¡no)-1'H-esp¡ro[c¡clopropano-1,4'-[2,7]naft¡r¡d¡na]-3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejem plo 23, E tapa 7, con 3,3-difluorociclobutanamina reemplazando 2-morfolinoetanamina. LCMS calculada para C22H22F4N3O3 (M+H)+: m/z = 452,2; Encontrado: 452,2.
Ejemplo de Referenc¡a 44
2’-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-6’-(1-met¡lp¡per¡d¡na-4-¡lam¡no)-1'H-esp¡ro[c¡clopropano-1,4'
[2,7]naftiridina]-3’(2'H)-ona
Este compuesto se preparó usando procedimientos análogos a aquellos para el Ejemplo 23, Etapa 7, con 1-metilpiperidina-4-amina sustituyendo 2 -morfolinoetanamina. LCMS calculada para C24H29F2N4O3 (M+H)+: m/z = 459,2; Encontrado: 459,2.
Ejemplo 45
7-amino-3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1-(2-fluorofenilo)-8-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
Paso 1: (4,6-dicloro-5-metilpiridina-3-ilo)metanol
A una solución agitada de acetato de 4,6-dicloro-5-metilnicotinato (1,75 g, 7,48 mmol, Ark Pharm, n° de cat AK121795) se añadió en cloruro de metileno (30 mL) a -78°C hidruro de diisobutilaluminio (1,0 M en tolueno, 18,0 mL, 18,0 mmol) gota a gota. La mezcla resultante se agitó a -78°C durante 2 h después se inactivó con solución acuosa saturada de NH4CL La mezcla se calentó a temperatura ambiente y después se extrajo con DCM (3 x 20 mL). Las capas orgánicas combinadas se lavaron con salmuera, se secaron sobre Na2SO4, se filtraron y se concentraron a presión reducida. El residuo se purificó por cromatografía ultrarrápida en una columna de gel de sílice eluyendo con MeOH en DCM (0-5%) para proporcionar el producto deseado (0,80 g, 56%). LCMS calculada para C7HsCl2NO (M+H)+: m/z = 192,0; Encontrado: 192,0.
Paso 2: N-[(4,6-dicloro-5-metilpiridina-3-ilo)metilo]-2,6-difluoro-3,5-dimetoxianilina
A una solución agitada de (4,6-dicloro-5-metilpiridina-3-ilo)metanol (0,80 g, 4,2 mmol) en cloruro de metileno (20 mL) a 0°C se añadió N,N-diisopropiletilamina (1,45 mL, 8,33 mmol), seguido de cloruro de metanosulfonilo (0,42 mL, 5,4 mmol). La mezcla resultante se calentó a temperatura ambiente y se agitó durante 2 h y después se inactivó con una solución acuosa saturada de NaHCO3. La mezcla se extrajo con DCM (3x 50 mL). Las capas orgánicas combinadas se lavaron con salmuera, se secaron sobre Na2SO4, se filtraron y se concentraron a presión reducida. El residuo se disolvió en N,N-diisopropiletilamina (3,5 mL), después 2,6-difluoro-3,5-dimetoxianilina (0,79 g, 4,2 mmol) se añadió. La mezcla se agitó a 100°C durante la noche. La mezcla de reacción se enfrió a temperatura ambiente y después se inactivó con NaHCO3 acuosa saturada, y se extrajo con acetato de etilo (3 x 20 mL). Las capas orgánicas combinadas se lavaron con salmuera, se secaron sobre Na2SO4, se filtraron y se concentraron a presión reducida. El residuo se purificó por cromatografía ultrarrápida en una columna de gel de sílice eluyendo con acetato de etilo en hexanos (0-25%) para proporcionar el producto deseado (1,5 g, 99%). LCMS calculada para C15H15Cl2 F2N2O2 (M+H)+: m/z = 363,0; Encontrado: 363,0.
Paso 3 :4-cloro-5-{[(2,6-difluoro-3,5-dimetoxi-fenilo)amino]metilo}-N-(4-metoxibencilo)-3-metilpiridina-2-amina
Una mezcla de N-[(4,6-dicloro-5-metilpiridina-3-ilo)metilo]-2,6-difluoro-3,5-dimetoxianilina (1,5 g, 4,1 mmol), bencenometanamina, 4-metoxi- (1,1 mL, 8,3 mmol), (R)-(+)-2,2'-bis(difenilfosfino)-1,1 '-binaftilo (0,26 g, 0,42 mmol), acetato de paladio (0,093 g, 0,41 mmol) y carbonato de cesio (2,7 g, 8,3 mmol) en 1,4-dioxano (10 mL) se purgó con nitrógeno, después se calentó a 150°C y se agitó durante la noche. Después de enfriarse a temperatura ambiente, la mezcla de reacción se diluyó con acetato de etilo, se filtró y se concentró bajo presión reducida. El residuo se purificó por cromatografía ultrarrápida en una columna de gel de sílice eluyendo con acetato de etilo en hexanos (0-25%) para proporcionar el producto deseado (1,0 g, 52%). LCMS calculada para C23H25C F 2N3O3 (M+H)+: m/z = 464,2; Encontrado: 464,1.
Paso 4: 5-{[(2,6-difluoro-3,5-dimetoxi-fenilo)amino]metilo}-N4-(2-fluorofenilo)-N2-(4-metoxibencilo)-3-metilpiridina-2,4 diamina
A una mezcla de 4-cloro-5-{[(2,6-difluoro-3,5-dimetoxi-fenilo)amino]metilo}-N-(4-metoxibencilo)-3-metilopiridina-2-amina (32 mg, 0,070 mmol), acetato de paladio (1,6 mg, 0,0070 mmol), (R)-(+)-2,2'-bis(difenilfosfino)-1,1’-binaftilo (4,4 mg, 0,0070 mmol), y carbonato de cesio (69 mg, 0,21 mmol) en 1,4-dioxano (1,0 mL) se añadió 2-fluoroanilina (11 mg, 0,098 mmol). La mezcla resultante se purgó con nitrógeno y después se calentó a 150°C y se agitó durante la noche. Después de enfriarse a temperatura ambiente, la mezcla de reacción se diluyó con acetato de etilo, se filtró y se concentró bajo presión reducida. El residuo se usó en la siguiente etapa sin purificación adicional. LCMS calculada para C29H30F3N4O3 (M+H)+: m/z = 539,2; Encontrado: 539,2.
Paso 5: 3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1-(2-fluorofenilo)-7-[(4-metoxibencilo)amino]-8-metilo-3,4-dihidropiridina[4,3-d]pirimidina-2( 1 H)-ona
Trifosgeno (21 mg, 0,070 mmol) se añadió a una solución del producto bruto de la Etapa 4 y N,N-diisopropiletilamina (73 pL, 0,42 mmol) en tetrahidrofurano (2,0 mL). La mezcla resultante se agitó a temperatura ambiente durante 30 min y después se añadió 2N NaOH2 (2 mL). La mezcla se agitó a 30°C durante 1 h, después se enfrió a temperatura ambiente y se extrajo con acetato de etilo (3 x 20 mL). Las capas orgánicas combinadas se lavaron con salmuera, se secaron sobre Na2SO4, se filtraron y se concentraron a presión reducida. El residuo se usó en la siguiente etapa sin purificación adicional. LCMS calculada para C30H28F3N4O4 (M+H)+: m/z = 565,2; Encontrado: 565,2.
Paso 6: 7-amino-3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1 -(2-fluorofenilo)-8-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
El producto bruto de la Etapa 5 se disolvió en 1 mL de TFA y la mezcla de reacción se agitó a 85°C durante 3 h. La mezcla se enfrió a temperatura ambiente y se concentró a vacío. El residuo se disolvió en acetonitrilo y después se purificó por RP-HPLC (pH = 2) para proporcionar el producto deseado como sal de TFA. LCMS calculada para C22H20F3N4O3 (M+H)+: m/z = 445,1; Encontrado: 445,2.
Ejemplo 46
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡-fenilo)-8-met¡lo-1-(2-met¡lo-2H-tetrazol-5-¡lo)-3,4-dihidropirido[4,3d]pirim idina-2(1H)-ona
Este compuesto se preparó usando procedimientos análogos a los descritos para el Ejemplo 45 con 2-metilo-2H-tetrazol-5-amina (Combi-Blocks, n° de Cat O-5103) reemplazando 2-fluoroanilina en el Paso 4. LCMS calculada para C18H19F2N8O3 (M+H)+: m/z = 433,2; Encontrado: 433,2.
Ejemplo 47
7-am¡no-3-(2,6-difluoro-3,5-d¡metox¡-fen¡lo)-8-met¡lo-1-[(1-met¡lo-1H-p¡razol-4-¡lo)met¡lo]-3,4
dihidropiridina[4,3-d]pirim idina-2(1H)-ona
Este compuesto se preparó usando procedimientos análogos a los descritos para el Ejemplo 45 con 1-(1-metilo-1H-pirazol-4-ilo)metanamina (J & W PharmLab, n° de Cat 68R0166) reemplazando 2-fluoroanilina en Paso 4. LCMS calculada para C21H23F2N6O3 (M+H)+: m/z = 445,2; Encontrado: 445,1.
Ejemplo 48
metilo [3-(2,6-difluoro-3,5-dimetoxifenilo)-1,8-dimetilo-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-7-ilo]carbamato
Paso 1: [(4,6-dicloro-5-metilpirídina-3-ilo)metilo](2,6-difluoro-3,5-dimetoxifenilo) cloruro de carbámico
A una solución de N-[(4,6-dicloro-5-metilpiridina-3-ilo)metilo]-2,6-difluoro-3,5-dimetoxianilina (Ejemplo 45, Etapa 2: 1,25 g, 3,44 mmol) en cloruro de metileno (30 mL) a 0°C se añadió trifosgeno (0,61 g, 2,1 mmol), seguido de piridina (840 pL, 10. mmol). La mezcla de reacción se agitó a 0°C durante 1 hora y después se diluyó con cloruro de metileno y se lavó con solución de 1N HCl. Después, la solución acuosa se extrajo con cloruro de metileno. Las capas orgánicas combinadas se lavaron con agua, salmuera, se secaron sobre Na2SO4, después se concentró para dar el producto deseado (1,45 g, 99%) que se usó en la siguiente etapa sin purificación adicional. LCMS calculada para C16HuCl3F2N2O3 (M+H)+: m/z = 425,0; Encontrado: 425,0.
Paso 2: N-[(4,6-dicloro-5-metilpirídina-3-ilo)metilo]-N-(2,6-difluoro-3,5-dimetoxi-fenilo)-N'-metilurea
A una solución de [(4,6-dicloro-5-metilpiridina-3-ilo)metilo](2,6-difluoro-3,5-dimetoxifenilo) cloruro carbámico (1,45 g, 3,41 mmol) en cloruro de metileno (6 mL) se añadió metilamina (2 M en THF, 3,4 mL, 6,8 mmol) y N,N-diisopropiletilamina (3,0 mL, 17 mmol). La mezcla resultante se agitó a temperatura ambiente durante 30 min y después se concentró. El residuo se purificó en una columna de gel de sílice para dar el producto deseado (1,35 g, 94%). LCMS calculada para C17H18C F 2N3O3 (M+H)+: m/z = 420,1; Encontrado: 420,0.
Paso 3: 7-cloro-3-(2,6-difluoro-3,5-dimetoxifenilo)- 1,8-dimetilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
Una mezcla de N-[(4,6-dicloro-5-metilpiridina-3-ilo)metilo]-N-(2,6-difluoro-3,5-dimetoxi-fenilo)-N'-metilurea (0,80 g, 1,9 mmol), carbonato de cesio (1,9 g, 5,7 mmol) en N,N-dimetilformamida (7 mL) en un vial de reacción se agitó a 110°C durante la noche. Después de enfriarse a temperatura ambiente, la mezcla se inactivó con solución saturada de NH4Cl, y se extrajo con acetato de etilo. Los extractos combinados se lavaron con agua y salmuera después se secaron sobre Na2SO4 y se concentraron. El residuo se purificó en una columna de gel de sílice para dar el producto deseado (0,58 g, 79%). LCMS calculada para C17H17C F 2N3O3 (M+H)+: m/z = 384,1; Encontrado: 384,1.
Paso 4: 7-amino-3-(2,6-difluoro-3,5-dimetoxifenilo)-1,8-dimetilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona
Una mezcla de 7-cloro-3-(2,6-difluoro-3,5-dimetoxifenilo)-1,8-dimetilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (200 mg, 0,5 mmol), imina de benzofenona (110 pL, 0,68 mmol), 2,2'-bis(difenilfosfino)-1,1'-binaftilo (32 mg, 0,052 mmol) y tris(dibencilidenacetona)dipaladio (0) (20 mg, 0,02 mmol) en tolueno (4 mL) se purgó con nitrógeno durante 5 min. La mezcla se agitó a 90°C durante 2 horas después se enfrió a temperatura ambiente y se concentró. El residuo se purificó en una columna de gel de sílice para dar el intermedio (210 mg). El intermedio se disolvió en tetrahidrofurano (3 mL) y después se añadió cloruro de hidrógeno (1 M en agua, 0,3 mL, 0,3 mmol). La mezcla se agitó a temperatura ambiente durante 3 horas, después se concentró y el residuo se purificó en una columna de gel de sílice para dar el producto deseado (150 mg). LCMS calculada para C17H19F2N4O3 (M+H)+: m/z =
365,1; Encontrado: 365,1.
Paso 5: [3-(2,6-difluoro-3,5-dimetoxifenilo)-1,8-dimetilo-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-7-ilo]carbamato
A una solución de 7-amino-3-(2,6-difluoro-3,5-dimetoxifenilo)-1,8-dimetilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (120 mg, 0,33 mmol) en cloruro de metileno (5 mL) se añadió cloroformato de metilo (38 pL, 0,49 mmol) y trietilamina (230 pL, 1,6 mmol). La mezcla resultante se agitó a temperatura ambiente durante la noche y después se concentró. El residuo se purificó por HPLC de fase inversa (pH = 2, acetonitrilo/agua TFA) para dar el producto deseado como la sal T fA. LCMS calculada para C19H21F2N4O5 (M+H)+: m/z = 423,1; Encontrado: 423,1. 1H RMN (500 MHz, DMSO-afe) 59,80 (s, 1H), 8,03 (s, 1H), 7,02 (t, J = 8,2Hz, 1H), 4,67 (s, 2H), 3,88 (s, 6H), 3,68 (s, 3H), 3,34 (s, 3H), 2,21 (s, 3H) ppm.
Ejemplo 49
7-am¡no-1-(c¡cloprop¡lmet¡lo)-3-(2,6-d¡fluoro-3,5-dimetox¡fen¡lo)-2-oxo-1,2,3,4-tetrah¡drop¡r¡do[4,3-d]pirim idina-8-carbonitrilo
Paso 1:2,4-dicloro-5-formilnicotinonitrilo
Una mezcla de malononitrilo (2,0 g, 30. mmol) y ortoacetato de trimetilo (4,0 g, 33 mmol) se calentó a reflujo durante 3 horas y después se enfrió a temperatura ambiente y malononitrilo se concentró para dar (1-metoxietilideno) (3,7 g) que se usó en la siguiente etapa sin purificación adicional. Una solución de (1-metoxietilideno)malononitrilo (2,0 g, 16 mmol) en N,N-dimetilformamida (4,8 g, 66 mmol) gota a gota a cloruro de fosforilo (10 g, 66 mmol) a 95°C. La mezcla resultante se agitó a 95°C durante 3 días, después se enfrió a temperatura ambiente y se diluyó con cloruro de metileno (50 mL). La mezcla se agitó a temperatura ambiente durante 1 h, después se añadió agua (50 mL) y la mezcla se agitó a temperatura ambiente durante 1 h adicional. La mezcla se extrajo con cloruro de metileno. Las capas orgánicas combinadas se lavaron con agua y salmuera después se secaron sobre Na2SO4 y se concentraron. El residuo se purificó en una columna de gel de sílice para dar el producto deseado (1,46 g, 44%). 1H RMN (400 MHz, CDCh): 5 10,44 (s, 1 H), 8,99 (s, 1 H) ppm.
Paso 2 :2,4-dicloro-5-{[(2,6-difluoro-3,5-dimetoxi-fenilo)amino]metilo}nicotinonitrilo
A una mezcla de sodio triacetoxiborohidruro (1,0 g, 5,0 mmol) en ácido trifluoroacético (2 mL, 20 mmol) a temperatura ambiente se le añadió una solución de 2,6-difluoro-3,5-dimetoxianilina (0,52 g, 2,7 mmol) en cloruro de metileno (20 mL). La mezcla resultante se agitó durante 5 min a temperatura ambiente después se añadió una solución de 2,4-dicloro-5-formilnicotinonitrilo (0,50 g, 2,5 mmol) en cloruro de metileno (20 mL).
La mezcla se agitó a temperatura ambiente durante 1 h, después se neutralizó con solución saturada de NaHCO3 y se extrajo con cloruro de metileno. Las capas orgánicas combinadas se lavaron con agua y salmuera, después se secaron sobre Na2SO4 y se concentraron. El residuo se purificó en una columna de gel de sílice para dar el producto deseado (0,87 g, 93%). LCMS calculada para C15H12Cl2F2N3O2 (M+H)+: m/z = 374,0; Encontrado: 373,9.
Paso 3: [(4,6-dicloro-5-cianopiridina-3-ilo)metilo](2,6-difluoro-3,5-dimetoxifenilo) cloruro carbámico
A una solución de 2,4-dicloro-5-{[(2,6-difluoro-3,5-dimetoxi-fenilo)amino]metilo}nicotinonitrilo (810 mg, 2,2 mmol) en cloruro de metileno (30 mL) a 0°C se le añadió trifosgen (0,38 g, 1,3 mmol), seguido de piridina (520 pL, 6,5 mmol). La mezcla se agitó a 0°C durante 1 hora y después se diluyó con cloruro de metileno y se lavó con solución de 1 N HCl. Después, la mezcla se extrajo con cloruro de metileno. Las capas orgánicas combinadas se lavaron con agua y salmuera después se secaron sobre Na2SO4 y se concentraron para dar el producto deseado (0,84 g, 89%) que se usó en la siguiente etapa sin purificación adicional. LCMS calculada para C16HnCl3F2N3O3 (m H)+: m/z = 436,0; Encontrado: 435,8.
Paso 4: N'-(ciclopropilmetilo)-N-[(4,6-dicloro-5-cianopiridina-3-ilo)metilo]-N-(2,6-difluoro-3,5-dimetoxi-fenilo)urea
A una solución de [(4,6-dicloro-5-cianopiridina-3-ilo)metilo] (2,6-difluoro-3,5-dimetoxifenilo) cloruro carbámico (35 mg, 0,080 mmol) en cloruro de metileno (1 mL) se añadió ciclopropilmetilamina (8,9 pL, 0,10 mmol) y N,N-diisopropiletilamina (70 pL, 0,40 mmol). La solución resultante se agitó a temperatura ambiente durante 30 min después se diluyó con DCM y se lavó con solución acuosa 1 N HCl. La capa orgánica se lavó con salmuera y después se secó sobre Na2SO4 y se concentró. El residuo se usó en la siguiente etapa sin purificación adicional. LCMS calculada para C2üH19Cl2F2NaO3 (M+H)+: m/z = 471,1; Encontrado: 471,1.
Paso 5: 7-cloro-1 -(ciclopropilmetilo)-3-(2,6-difluoro-3,5-dimetoxifenilo)-2-oxo- 1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo
Una mezcla del producto bruto de la Etapa 4 y carbonato de potasio (22 mg, 0,16 mmol) en acetonitrilo (3 mL) se calentó a reflujo y se agitó durante la noche. La mezcla de reacción se enfrió a temperatura ambiente después se diluyó con DCM y se lavó con agua y salmuera. La capa orgánica se secó sobre Na2SO4 después se concentró. El residuo se usó en la siguiente etapa sin purificación adicional. LCMS calculada para C20H18C F 2N4O3 (M+H)+: m/z = 435,1; Encontrado: 434,7.
Paso 6: 1-(ciclopropilmetilo)-3-(2,6-difluoro-3,5-dimeloxifenilo)-7-[(difenilmetileno) - amino]-2-oxo-1,2,3,4-tetrahidropirido-[4,3-d]pirimidina-8-carbonitrilo
Una mezcla del producto bruto de la Etapa 5, bis(dibencilidenacetona) paladio (0) (5 mg, 0,008 mmol), (R)-(+)-2,2'-bis(difenilfosfino)-1,1'-binaftilo (5 mg, 0,008 mmol), terc-butóxido sódico (15 mg, 0,16 mmol) e imina benzofenona (20. pL, 0,12 mmol) en tolueno (5 mL) fue evacuado y llenado entonces con nitrógeno. La mezcla resultante se calentó a 90°C y se agitó durante 3 h. La mezcla de reacción se enfrió a temperatura ambiente después se diluyó con agua y se extrajo con DCM. Los extractos combinados se secaron sobre Na2SO4 y después se concentraron. El residuo se purificó en una columna de gel de sílice eluyendo con EtOAc del 0 al 100%/hexanos para dar el producto deseado (13 mg) como un sólido amarillo. LCMS calculada para C33H28F2N5O3 (M+H)+: m/z = 580,2; Encontrado: 580,0.
Paso 7: 7-amino-1-(ciclopropilmetilo)-3-(3,5-dimetoxifenilo2,6-difluoro)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo
El producto de la Etapa 6 se disolvió en tetrahidrofurano (3 mL), y después se añadió 1,0 M de cloruro de hidrógeno en agua (0,16 mL, 0,16 mmol). La mezcla resultante se agitó a temperatura ambiente durante 2 h, después se diluyó con acetonitrilo y se purificó por HPLC preparativa (pH = 2, acetonitrilo/agua TFA) para dar el producto deseado como la sal TFA. LCMS calculada para C20H20F2N5O3 (M+H)+: m/z = 416,2; Encontrado: 416,2.
Ejemplo 50
7-am¡no-1-c¡clopent¡lo-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-2-oxo-1,2,3,4-tetrah¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-8-carbonitrilo
Este compuesto se preparó usando procedimientos análogos a los descritos para el Ejem plo 49 con ciclopentanamina sustituyendo ciclopropilmetilamina en la Etapa 4. LCMS calculada para C21H22F2N5O3 (M+H)+: m/z = 430,2; Encontrado: 430,2.
Ejemplo 51
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡-fen¡lo)-1-[(1-met¡lo-1H-p¡razol-4-¡lo)met¡lo]-2-oxo-1,2,3,4-tetrah¡drop¡r¡do-[4,3-d]pirim idina-8-carbonitrilo
Este compuesto se preparó usando procedimientos análogos a los descritos para el Ejem plo 49 con 1-(1-metilo-1H-pirazol-4-ilo)metanamina (AstaTech, n° de cat BL009313) sustituyendo ciclopropilmetilamina en la Etapa 4. LCMS calculada para C21H20F2N7O3 (M+H)+: m/z = 456,2; Encontrado: 456,0.
Ejemplo 52
7-am¡no-1-(3,5-difluorobenc¡lo)-3-(2,6-d¡fluoro-3,5-d¡metox¡fen¡lo)-2-oxo-1,2,3,4-tetrah¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-8-carbon¡tr¡lo
Este compuesto se preparó usando procedimientos análogos a los descritos para el Ejemplo 49 con 1 -(3,5-difluorofenilo)metanamina sustituyendo ciclopropilmetilamina en la Etapa 4. LCMS calculada para C23H18F4N5O3 (M+H)+: m/z = 488,1; Encontrado: 488,1.
Ejemplo 53
7-am¡no-3-(2,6-d¡fluoro-3,5-d¡metox¡-fenilo)-1-(2-fluorofen¡lo)-2-oxo-1,2,3,4-tetrah¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-8-carbon¡tr¡lo
Paso 1: 7-cloro-3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1-(2-fluorofenilo)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo
Una mezcla de [(4,6-dicloro-5-cianopiridina-3-ilo)metilo](2,6-difluoro-3,5-dimetoxifenilo) cloruro carbámico (35 mg, 0,080 mmol), 2-fluoro-bencenamina (9,8 mg, 0,088 mmol) y N,N-diisopropiletilamina (42 pL, 0,24 mmol) en 1,2-dicloroetano (0,4 mL) se agitó a 90°C durante la noche. La mezcla de reacción se enfrió a temperatura ambiente y después carbonato de potasio (25 mg, 0,18 mmol) y se añadieron acetonitrilo (1 mL). La mezcla se agitó a 90°C durante 4 horas. Después de enfriarse a temperatura ambiente, la mezcla se concentró y el residuo se purificó en una columna de gel de sílice para dar el producto deseado (30 mg, 80%). LCMS calculada para C22H15ClF3N4Ü3 (M+H)+: m/z = 475,1; Encontrado: 474,9.
Paso 2: 7-amino-3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1-(2-fluorofenilo)-2-oxo-1,2,3,4-tetrahidropirído[4,3-d]pirímidina-8-carbonitrilo
Este compuesto se preparó a partir de 7-cloro-3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1-(2-fluorofenilo)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo usando condiciones similares como se describe para el Ejemplo 49, Etapa 6-7. LCMS calculada para C22H17F3N5O3 (M+H)+: m/z = 456,1; Encontrado: 455,9.
Ejemplo 54
7-amino-8-cloro-3-(2,6-d¡fluoro-3,5-d¡metox¡-fenilo)-1 -metilo-3,4-d¡h¡drop¡r¡do[4,3-d]p¡r¡m¡d¡na-2(1H)-ona
A una solución de 7-amino-3-(2,6-difluoro-3,5-dimetoxi-fenilo)-1-metilo-3,4-dihidropirido[4,3-d]pirimidina-2(1H)-ona (Ejemplo 1, Etapa 6: 15 mg, 0,043 mmol) se añadió en DMF (1,0 mL) de N-clorosuccinimida (17 mg, 0,13 mmol). La mezcla resultante se agitó a temperatura ambiente durante 1 h, después se purificó por HPLC prep (pH 2, acetonitrilo/agua TFA) para proporcionar el producto deseado como la sal TFA. LC-MS calculado para C16H1sClF2N4O3 [M+H]+ m/z: 385,1; encontrado 385,1. 1H RMN (500 MHz, DMSO) 5 7,75 (s, 1H), 7,15 (s, 2H), 7,02
(t, J = 7,5 Hz, 1H), 4,57 (s, 2H), 3,88 (s, 6H), 3,45 (s, 3H) ppm.
Ejemplo A
Ensayo enzimático FGFR
La potencia del inhibidor de los compuestos ejemplificados se midió en un ensayo enzimático que mide la fosforilación de péptido usando mediciones FRET para detectar la formación de producto. Los inhibidores se diluyeron en serie en DMSO y un volumen de 0,5 pL se transfirió a los pocillos de una placa de 384 pocillos. Para FGFR3, a 10 pL de volumen de enzima FGFR3 (Millipore) diluido en tampón de ensayo (50 mM de h Ep ES, 10 mM de MgCl2, 1 mM de EGTA, 0,01% de Tween-20, 5 mM de DTT, pH 7,5) se añadió a la placa y se pre-incubó durante 5-10 minutos. Controles apropiados (blanco de enzima y enzima sin inhibidor) se incluyeron en la placa. El ensayo se inició por la adición de un 10 pL de solución que contenía sustrato peptídico EQEDEPEGDYFEWLE biotinilado (SEQ ID NO: 1) y ATP (concentraciones finales de 500 nM y 140 pM respectivamente) en tampón de ensayo a los pocillos. La placa se incubó a 25°C durante 1 h. Las reacciones se terminaron con la adición de 10 pL/pocillo de solución de enfriamiento rápido (50 mM de Tris, 150 mM de NaCl, 0,5 mg/ml de BSA, pH 7,8; 30 mM de EdTA con Reactivos de Perkin Elmer Lanza en 3,75 nM de anticuerpo Eu PY20 y 180 nM APC-estreptavidina). La placa se dejó equilibrar durante ~ 1 h antes de escanear los pocillos en un lector de placas PheraStar (BMG Labtech).
FGFR1 y FGFR2 se midieron en condiciones equivalentes con los siguientes cambios en enzima y concentraciones At P: FGFR1, 0,02 nM y 210 pM, respectivamente, y FGFR2, 0,01 nM y 100 pM, respectivamente. Las enzimas se adquirieron de Millipore o Invitrogen.
GraphPad prism3 se utilizó para analizar los datos. Los valores CI50 se obtuvieron ajustando los datos a la ecuación para una respuesta a la dosis sigmoidal de pendiente variable. Y = Abajo (Arriba-Abajo)/(1+10A((LogCl5ü-X)*HillSlope)) donde X es el logaritmo de la concentración y Y es la respuesta. Los compuestos que tienen una CI50 de 1 pM o menos se consideran activos.
Se encontró que los compuestos de la invención son inhibidores de una o más de FGFR1, FGFR2, y FGFR3 de acuerdo con el ensayo descrito anteriormente. Datos de CI50 se proporcionan a continuación en la Tabla 1. El símbolo "+" indica un CI50 de menos de 100 nM.
Tabla 1
(continuación)
Ejemplo B
Proliferación celular FGFR/Ensayos de supervivencia
La capacidad de los compuestos ejemplares para inhibir el crecimiento de células dependiente de la señalización para la supervivencia FGFR puede medirse usando ensayos de viabilidad. Una línea de células recombinantes que sobreexpresan FGFR3 humana fue desarrollada por transfección estable de células pro-B Ba/F3 de ratón (obtenidas de Deutsche Sammlung von Mikroorganismen und Zellkulturen) con un plásmido que codifica la FGFR3 humana de longitud completa. Las células se seleccionaron secuencialmente para resistencia a puromicina y la proliferación en presencia de heparina y FGF1. Un clon de células individuales se aisló y se caracterizó para la expresión funcional de FGFR3. Este clon Ba/F3-FGFR3 se utiliza en ensayos de proliferación celular, y los compuestos se criban para su capacidad de inhibir la proliferación de células/supervivencia. Las células Ba/F3-FGFR3 se siembran en 96 pocillos, placas de cultivo celular negro a 3500 células/pocillo en medio RPMI1640 que contiene 2% de FBS, 20 ug/ml de heparina y 5 ng/ml FGF1. Las células fueron tratadas con 10 pL de 10X concentraciones de los compuestos diluidos en serie (diluidos con medio de suero carente de puntos de 5 mM DSMO) a un volumen final de 100 pL/pocillo. Después de incubación de 72 horas, 100 pL de reactivo Cell Titer Glo® (Promega Corporation) que mide los niveles celulares de ATP se añade a cada pocillo. Después de incubación de 20 minutos con agitación, la luminiscencia se lee en un lector de placas. Las lecturas luminiscentes se convierten en porcentaje de inhibición con respecto a los pocillos de control tratados con DMSO, y los valores CI50 se calcularon utilizando software GraphPad Prism ajustando los datos a la ecuación para una respuesta a la dosis sigmoidal de pendiente variable. Los compuestos que tienen una CI50 de 10 pM o menos se consideran activos. Las líneas celulares que representan una variedad de tipos de tumores incluyendo KMS-11 (mieloma múltiple, translocación de FGFR3), Rt 112 (cáncer de vejiga, sobreexpresión de FGFR3), KatolII (cáncer gástrico, amplificación génica de FGFR2), y H-1581 (pulmón, amplificación génica de FGFR1) se utilizan en ensayos de proliferación similares. En algunos experimentos, el reactivo MTS, reactivo Cell Titer 96® Aqueous One Solution (Promega Corporation) se añade a una concentración final de 333 pg/ml en lugar de Cell Titer Glo y se leyó a 490/650 nm en un lector de placas. Los compuestos que tienen una CI50 de 5 pM o menos se consideran activos.
Ejemplo C
Ensayos de fosforilación de FGFR a base celular
El efecto inhibidor de los compuestos sobre la fosforilación de FGFR en líneas celulares relevantes (Ba/F3-FGFR3, KMS-11, RT112, KATOIII, líneas celulares de cáncer H-1581 y la línea celular HUVEC) puede evaluarse usando inmunoensayos específicos para la fosforilación del FGFR. Las células se mueren de inanición en medio con suero reducido (0,5%) y no FGF1 para 4 a 18 h, dependiendo de la línea celular tratándose con diversas concentraciones de inhibidores individuales durante 1-4 horas. Para algunas líneas celulares, tales como Ba/F3-FGFR3 y KMS-11, las células se estimularon con heparina (20 pg/mL) y FGF1 (10 ng/mL) durante 10 min. Extractos de proteínas de células enteras se prepararon por incubación en tampón de lisis con inhibidores de proteasa y
fosfatasa [50 mM de HEPES (pH 7,5), 150 mM de NaCI, 1,5 mM de MgCÍ2, 10% de glicerol, 1% Tritón X-100, 1 mM de ortovanadato de sodio, 1 mM de fluoruro de sodio, aprotinina (2 pg/mL), leupeptina (2 pg/mL), pepstatina a (2 pg/mL), y fluoruro de fenilmetilsulfonilo (1 mM)] a 4°C. Se elimina los restos celulares de los extractos de proteína por centrifugación a 14.000 x g durante 10 minutos y se cuantifican usando el reactivo de ensayo de microplaca de BCA (ácido bicinconínico) (Thermo Scientific).
La fosforilación de receptor FGFR en extractos de proteínas se determinó utilizando inmunoensayos incluyendo transferencia Western, inmunoensayo ligado a enzimas (ELISA) o perla a base de (Luminex). Para la detección de FGFR2 fosforilado, se puede utilizar un ensayo ELISA fosfo-FGF R2a humano de kit ELISA comercial DuoSet IC (R&D Systems, Minneapolis, MN). Para el ensayo de células KatolII se siembran en 0,2% de medio de Iscove FBS suplementado (50.000 células/pocillo/por 100 pL) en placas de 96 pocillos de fondo plano tratadas de cultivo tisular (Corning, Corning, NY), en presencia o ausencia de un intervalo de concentraciones de compuestos de ensayo y se incubaron durante 4 horas a 37°C, 5% de CO2. El ensayo se detuvo con la adición de 200 pL de PBS frío y centrifugación. Las células lavadas se lisaron en Tampón de Lisis Celular (Cell Signaling, n° 9803) con inhibidor de proteasa (Calbiochem, n° 535140) y PMSF (Sigma, n° P7626) durante 30 min en hielo húmedo. Los lisados celulares se congelaron a -80°C antes de la prueba de una alícuota con el kit de ensayo ELISA R2a fosfo-FGF humano DuoSet IC. GraphPad prism3 se utilizó para analizar los datos. Los valores CI50 se obtuvieron ajustando los datos a la ecuación para una dosis-respuesta sigmoidal con una pendiente variable.
Para la detección de FGFR3 fosforilado, se desarrolló un inmunoensayo basado en perlas. Un FGFR3 mAb de ratón anti-humano (R&D Systems, n° de cat MAB7661) se conjugó con microesferas Luminex MAGplex, región de perla 20 y se utilizó como anticuerpo de captura. Células TA-112 se sembraron en placas de cultivo de tejidos de múltiples pocillos y se cultivaron hasta 70% de confluencia. Las células se lavaron con PBS y se privaron de inanición en medio RPMI 0,5% de FBS durante 18 h. Las células fueron tratadas con 10 pL de 10X concentraciones de los compuestos diluidos en serie durante 1 h a 37°C, 5% de CO2 antes de la estimulación con 10 ng/ml FGF1 humano y 20 pg/ml de heparina durante 10 min. Las células se lavaron con PBS frío y se lisaron con tampón de extracción de células (Invitrogen) y se centrifugaron. Sobrenadantes clarificados se congelaron a -80°C hasta su análisis.
Para el ensayo, los lisados celulares se diluyen 1:10 en diluyente de ensayo y se incuban con perlas unidas a anticuerpo de captura en una placa de filtro de 96 pocillos durante 2 horas a temperatura ambiente en un agitador de placas. Las placas se lavan tres veces usando un colector de vacío y se incubaron con anticuerpo policlonal de conejo de anti-fosfo-FGF R1-4 (Y653/Y654) (R&D Systems cat n° AF3285) durante 1 hora a TA con agitación. Las placas se lavan tres veces. El anticuerpo informador diluido, anticuerpo conjugado anti-conejo-RPE de cabra (Invitrogen Cat. n° LHB0002) se añade y se incuba durante 30 minutos con agitación. Las placas se lavan tres veces. Las perlas se suspendieron en tampón de lavado con agitación a temperatura ambiente durante 5 minutos y después se leyeron en un instrumento Luminex 200 establecido para contar 50 eventos por muestra, ajustes de compuerta 7500-13500. Los datos se expresan como intensidad de fluorescencia media (MFI). MFI de las muestras tratadas con el compuesto se dividen por valores de MFI de controles DMSO para determinar el porcentaje de inhibición, y los valores CI50 se calculan usando el software GraphPad Prism. Los compuestos que tienen una CI50 de 1 pM o menos se consideran activos.
Ejemplo D
Ensayos de señalización basados en células FGFR
La activación de FGFR conduce a la fosforilación de proteínas Erk. La detección de Perk se monitoriza utilizando el Ensayo de Cellu'Erk HTRF (Flurorescencia Homogénea Resuelta en el Tiempo) (CisBio) de acuerdo con el protocolo del fabricante. Células KMS-11 se siembran en placas de 96 pocillos a 40.000 células/pocillo en medio RPMI con 0,25% de FBS y en ayunas durante 2 días. El medio se aspiró y las células se tratan con 30 pL de concentraciones 1X de compuestos diluidos en serie (diluidos con medio de suero carente de puntos de 5 mM de DSMO) a un volumen final de 30 pL/pocillo y se incubaron durante 45 min a temperatura ambiente. Las células se estimulan mediante la adición de 10 pL de heparina (100 pg/mL) y FGF1 (50 ng/mL) a cada pocillo y se incubaron durante 10 min a temperatura ambiente. Después de la lisis, una alícuota de extracto de células se transfiere a placas de 384 pocillos de bajo volumen, y 4 pL de reactivos de detección se añaden seguido por incubación durante 3 horas a temperatura ambiente. Las placas se leyeron en un instrumento Pherastar con ajustes de HTRF. Las lecturas de fluorescencia normalizada se convierten en porcentaje de inhibición con respecto a los pocillos de control tratados con DMSO, y los valores CI50 se calcularon utilizando el software GraphPad Prism. Los compuestos que tienen una CI50 de 1 pM o menos se consideran activos.
Ejemplo E
Ensayo de quinasa VEGFR2
Reacciones enzimáticas de 40 pL se ejecutan en placas negras de 384 pocillos de poliestireno durante 1
hora a 25°C. Los pocilios están salpicados de 0,8 pL de compuesto de ensayo en DMSO. El tampón de ensayo contiene 50 mM de Tris, pH 7,5, 0,01% de Tween-20, 10 mM de MgCÍ2 mM, 1 mM de EGTA, 5 mM de DTT, 0,5 pM de sustrato peptídico EQEDEPEGDYFEWLE marcado con biotina (SEQ ID NO: 1), 1 mM de ATP, y 0,1 nM de enzima (catálogo de Millipore número 14 a 630). Las reacciones se detuvieron mediante la adición de 20 pL de tope (50 mM de Tris, pH = 7,8, 150 mM de NaCl, 0,5 mg/ml de BSA, EDTA 45 mM) con 225 nM de estreptavidina LAn Ce Surelight® APC (catálogo PerkinElmer número CR130-100) y 4,5 nM de anticuerpos de LANCE Eu-W1024 contra fosfotirosina (PY20) (PerkinElmer número de catálogo AD0067). Después de 20 minutos de incubación a temperatura ambiente, las placas se leyeron en un lector de placas Pherastar FS (BMG Labtech). Los valores CI50 se pueden calcular utilizando GraphPad Prism ajustando los datos a la ecuación para una respuesta a la dosis sigmoidal de pendiente variable. Los compuestos que tienen una CI50 de 1 pM o menos se consideran activos.
Claims (39)
1. Un compuesto de Fórmula lia:
o una sal farmacéuticamente aceptable del mismo, en donde:
R2 es halo;
R5 es halo
R6 es H, halo, alquilo Ci-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, C(=NRe2)Rb2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 o S(O)2NRc2Rd2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1,2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a;
cada R6a se selecciona independientemente de Cy1, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, y S(O)2 NRc2Rd2, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy1, halo, CN, NO2, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, C(=NRe2)NRc2Rd2, NRc2C(=NRe2)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)ORa2, NRc2C(O)NRc2Rd2, NRc2S(O)Rb2, NRc2S(O)2Rb2, NRc2S(O)2 NRc2Rd2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2 y S(O)2NRc2Rd2;
R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, -C(O)RA, S(O)RA, S(O)2Ra, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R7a;
cada R7a se selecciona independientemente de Cy2, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, y S(O)2NRc3Rd3, en donde dicho alquilo C1-6, alquenilo C2-6, y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de Cy2, halo, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, C(=NRe3)NRc3Rd3, NRc3C(=NRe3)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)ORa3, NRc3C(O)NRc3Rd3, NRc3S(O)Rb3, NRc3S(O)2Rb3, NRc3S(O)2NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3 y S(O)2NRc3Rd3;
R9 es H, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10- alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y
(heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a;
cada R9a se selecciona independientemente de Cy3, halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, NRc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4, en donde dicho alquilo C1-6, alquenilo C2-6 y alquinilo C2-6 están cada uno opcionalmente sustituidos con 1, 2 o 3 sustituyentes seleccionados independientemente de Cy3, halo, CN, NO2 , ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, C(=NRe4)NRc4Rd4, N Rc4C(=NRe4)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)ORa4, NRc4C(O)NRc4Rd4, NRc4S(O)Rb4, NRc4S(O)2Rb4, NRc4S(O)2NRc4Rd4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, y S(O)2NRc4Rd4;
cada RA se selecciona independientemente de H, alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en el que dicho alquilo C1-6, alcoxi C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, arilo C6-10-alquilo C1-4, cicloalquilo C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, o 3 sustituyentes seleccionados independientemente de R7a;
Cy1, Cy2, y Cy3 se seleccionan cada uno independientemente de arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros, cada uno de los cuales está opcionalmente sustituido por 1, 2,
3, 4, o 5 sustituyentes de forma independiente seleccionados de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 3-10 miembros,
CN, NO2, ORa5, SRa5, C(O)Rb5, C(O)NRc5Rd5, C(O)ORa5, OC(O)Rb5, OC(O)NRc5Rd5, NRc5Rd5, NRc5C(O)Rb5, NRc5C(O)ORa5, NRc5C(O)NRc5Rd5, C(=NRe5)Rb5, C(=NRe5)NRc5Rd5, NRc5C(=NRe5)NRc5Rd5, NRc5S(O)Rb5, NRc5S(O)2Rb5, NRc5S(O)2NRc5Rd5, S(O)Rb5, S(O)NRc5Rd5, S(O)2Rb5 y S(O)2NRc5Rd5; en el que dicho alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4
10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, CN, NO2, ORa5, SRa5, C(O)Rb5, C O NRc5Rd5, C O ORa5, OC O Rb5, OC O NRc5Rd5, C =NRe5NRc5Rd5NRc5C =NRe5NRc5Rd5, NRc5Rd5, NRc5C(O)
S(O)NRc cada Ra2, Rb5, Rc5 y de H, alquilo C1-6, haloalquilo C1-4, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, h miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de
5-10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 está opcionalmente sustituido con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de alquilo C1-4, haloalquilo C1-4, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc2 y Rd2 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o
7 miembros opcionalmente sustituido con 1,2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en el que dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por
1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc3 y Rd3 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o
7 miembros opcionalmente sustituido con 1,2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6 Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos por
1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc4 y Rd4 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o
7 miembros opcionalmente sustituido con 1,2 o 3 sustituyentes seleccionados independientemente de alquilo Ci-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, en donde dicho alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros y están opcionalmente sustituidos por
1, 2, o 3 sustituyentes seleccionados independientemente de halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6;
o cualquier Rc5y Rd5 junto con el átomo de N al que están unidos forman un grupo heterocicloalquilo de 4, 5, 6 o 7 miembros opcionalmente sustituido con 1, 2 o 3 sustituyentes seleccionados independientemente de alquilo C1-6, cicloalquilo C3-7 , heterocicloalquilo de 4-7 miembros, arilo C6-10, heteroarilo de 5-6 miembros, haloalquilo C1-6, halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2NRc6Rd6, donde dicha alquilo C1-6, cicloalquilo C3-7, heterocicloalquilo
de 4-7 miembros, arilo C6-10, y heteroarilo de 5-6 miembros están opcionalmente sustituidos con 1, 2 o 3 sustituyentes seleccionados independientemente entre halo, CN, ORa6, SRa6, C(O)Rb6, C(O)NRc6Rd6, C(O)ORa6, OC(O)Rb6, OC(O)NRc6Rd6, NRc6Rd6, NRc6C(O)Rb6, NRc6C(O)NRc6Rd6, NRc6C(O)ORa6, C(=NRe6)NRc6Rd6, NRc6C(=NRe6)NRc6Rd6, S(O)Rb6, S(O)NRc6Rd6, S(O)2Rb6, NRc6S(O)2Rb6, NRc6S(O)2NRc6Rd6, y S(O)2 NRc6Rd6;
cada Re, Re2, Re3, Re4, y Re5 se selecciona independientemente de H, alquilo C1-4 , CN, ORa6, C(O)Rb6, S(O)2NRc6Rd6, y C(O)NRc6Rd6;
cada Ra6, Rb6, Rc6, y Rd6 se selecciona independientemente de H, alquilo C1-4, haloalquilo C1-4, alquenilo C2-4, y alquinilo C2-4 , en donde dicho C1-4 alquilo, alquenilo C2-4, y alquinilo C2-4 están opcionalmente sustituidos con 1,2, o 3 sustituyentes seleccionados independientemente de Oh , CN, amino, halo, alquilo C1-4, alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4 y haloalcoxi C1-4 ;
o cualquier Rc6y Rd6 junto con el átomo de N al que están unidos forman un heterocicloalquilo de 4, 5, 6, o 7 miembros opcionalmente sustituido con 1, 2, o 3 sustituyentes seleccionados independientemente de OH, CN, amino, halo, alquilo C1-6 , alcoxi C1-4, alquiltio C1-4, alquilamino C1-4, di(alquilo C1-4)amino, haloalquilo C1-4 y haloalcoxi C1-4 ; y
cada Re6 se selecciona independientemente de H, alquilo C1-4, y CN.
2. El compuesto de la reivindicación 1, o una sal farmacéuticamente aceptable del mismo, en el que R9 es alquilo C1-6.
3. El compuesto de la reivindicación 1, o una sal farmacéuticamente aceptable del mismo, en el que R9 es metilo.
4. El compuesto de la reivindicación 1, o una sal farmacéuticamente aceptable del mismo, en el que R9 es arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4. cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4 o (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10-alquilo C1-4, (heteroarilo de 5 a 10 miembros)-alquilo C1-4 y (heterocicloalquilo de 4 a 10 miembros)-alquilo de C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R9a.
5. El compuesto de la reivindicación 1, o una sal farmacéuticamente aceptable del mismo, en el que R 9 es arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10 -alquilo C1-4, o (heteroarilo
de 5-10 miembros)-alquilo C1-4, en donde dichos arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, aril C6-10-alquilo C1-4, cicloalquil C3-10 -alquilo C1-4, o (heteroarilo de 5-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1 o 2 sustituyentes seleccionados independientemente de halo y alquilo C1-4.
6. El compuesto de la reivindicación 1, o una sal farmacéuticamente aceptable del mismo, en el que R9 es fenilo, 2H-tetrazol-5-ilo, bencilo, 1 H-pirazol-4-ilmetilo, ciclopentilo, o ciclopropilmetilo, cada uno opcionalmente sustituido con 1
o 2 sustituyentes independientemente seleccionados de F y metilo.
7. El compuesto de cualquiera de las reivindicaciones 1-6, o una sal farmacéuticamente aceptable del mismo, en el que R7 y R8 se seleccionan cada uno independientemente de H, alquilo C1-6, -C(O)RA, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, aril C6-10-alquilo C1-4, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4, en donde dichos alquilo C1-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, (heteroarilo de 5-10 miembros)-alquilo C1-4, y (heterocicloalquilo de 4-10 miembros)-alquilo C1-4 están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R7a.
8. El compuesto de cualquiera de las reivindicaciones 1-6, o una sal farmacéuticamente aceptable del mismo, en el que R7 y R8 se seleccionan cada uno independientemente de H, 2-hidroxipropilo, -C(O)OCH3, 3-fluorofenilo,
ciclopropilo, ciclobutilo, 3,3-difluorociclobutilo, ciclopentilo, ciclohexilo, 4-hidroxiciclohexilo, metilo, 1-metilo-1H-pirazol-4-ilo, piridin-3-ilo, N-metilpiperidin-4-ilo, tetrahidro-2H-piran-4-ilo, tetrahidrofuran-3-ilo, 1-feniletilo, (1 -metil-1 H-pirazol-4-il)metilo, 2-morfolino-4-iletilo, piridina-2-ilmetilo, N-metilpiperazina-1-iletilo, y tetrahidrofuran-2-ilmetilo.
9. El compuesto de cualquiera de las reivindicaciones 1 a 6, o una sal farmacéuticamente aceptable del mismo, en el que uno de R7 y R8 es H.
10. El compuesto de cualquiera de las reivindicaciones 1 a 6, o una sal farmacéuticamente aceptable del mismo, en el que R7 y R8 son cada uno H.
11. El compuesto de cualquiera de las reivindicaciones 1 a 10, o una sal farmacéuticamente aceptable del mismo, en el que R2 es flúor.
12. El compuesto de cualquiera de las reivindicaciones 1 a 11, o una sal farmacéuticamente aceptable del mismo, en el que R5 es flúor.
13. El compuesto de cualquiera de las reivindicaciones 1 a 12, o una sal farmacéuticamente aceptable del mismo, en el que R6 es halo, alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN u ORa2; en el que dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
14. El compuesto de cualquiera de las reivindicaciones 1 a 12, o una sal farmacéuticamente aceptable del mismo, en el que R6 es alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5 a 10 miembros, heterocicloalquilo de 4 a 10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5 a 10 miembros, heterocicloalquilo de 4 a 10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
15. El compuesto de cualquiera de las reivindicaciones 1 a 12, o una sal farmacéuticamente aceptable del mismo, en el que R6 es halo, alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, u ORa2; en donde dicho alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
16. El compuesto de cualquiera de las reivindicaciones 1 a 12, o una sal farmacéuticamente aceptable del mismo, en donde R6 es alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, CN, u ORa2 ; en donde dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
17. El compuesto de cualquiera de las reivindicaciones 1 a 12, o una sal farmacéuticamente aceptable del mismo, en el que R6 es cloro, metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo , 4-fluorofenilo, bencilo, feniletilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1-metil-1H-pirazol -5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
18. El compuesto de cualquiera de las reivindicaciones 1 a 12, o una sal farmacéuticamente aceptable del mismo, en el que R6 es metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, fenetilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1-metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
20. El compuesto de la reivindicación 19, o una sal farmacéuticamente aceptable del mismo, en el que R6 es halo, alquilo C1-6, alquenilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4-10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1, 2, 3, 4, o 5 sustituyentes seleccionados independientemente de R6a.
21. El compuesto de la reivindicación 19, o una sal farmacéuticamente aceptable del mismo, en el que R6 es alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, heterocicloalquilo de 4 10 miembros, CN u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, alquinilo C2-6, arilo C6-10, cicloalquilo C3-10, heteroarilo de 5-10 miembros, y heterocicloalquilo de 4-10 miembros están cada uno opcionalmente sustituidos con 1,2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
22. El compuesto de la reivindicación 19, o una sal farmacéuticamente aceptable del mismo, en el que R6 es halo, alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, Cn , u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1,2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
23. El compuesto de la reivindicación 19, o una sal farmacéuticamente aceptable del mismo, en el que R6 es halo, alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros, heterocicloalquilo de 6 miembros, Cn , u ORa2; en donde dichos alquilo C1-6, alquenilo C2-6, fenilo, heteroarilo de 5-6 miembros y heterocicloalquilo de 6 miembros están cada uno opcionalmente sustituidos con 1,2, 3, 4 o 5 sustituyentes seleccionados independientemente de R6a.
24. El compuesto de la reivindicación 19, o una sal farmacéuticamente aceptable del mismo, en el que R6 es cloro, metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, feniletilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1 -etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-ilo)-1 H-pirazol-4-ilo.
25. El compuesto de la reivindicación 19, o una sal farmacéuticamente aceptable del mismo, en el que R6 es metilo, etilo, CN, etoxi, metoxietoxi, fenoxi, 2-(4-metilpiperazin-1-il)etoxi, fenilo, 4-fluorofenilo, bencilo, fenetilo, 2-fenilvinilo, 3,6-dihidro-2H-piran-4-ilo, 3-piridilo, 4-piridilo, 1 H-pirazol-4-ilo, 1 -metil-1 H-pirazol-5-ilo, 1 -metil-1 H-pirazol-4-ilo, 1-etil-1 H-pirazol-4-ilo, 1 -(2-hidroxietil)-1 H-pirazol-4-ilo o 1 -(piperidin-4-il)-1 H-pirazol-4-ilo.
26. El compuesto de cualquiera de las reivindicaciones 19 a 25, o una sal farmacéuticamente aceptable del mismo, en el que R9 es alquilo C1-6.
27. El compuesto de cualquiera de las reivindicaciones 19 a 25, o una sal farmacéuticamente aceptable del mismo, en el que R9 es metilo.
28. El compuesto de la reivindicación 1 seleccionado de:
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1,8-dimetil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-etil-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-2-oxo-1,2,3,4-tetrahidropirido-[4,3-d]pirimidin-8-carbonitrilo; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-etoxi-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-(2-metoxietoxi)-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-8-[2-(4-metilpiperazin-1-il)etoxi]-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-8-fenoxi-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-8-(1 -metil-1 H-pirazol-4-il)-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-8-(1 -etil-1 H-pirazol-4-il)-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-[1-(2-hidroxietil)-1 H-pirazol-4-il]-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-8-(1-piperidin-4-il-1 H-pirazol-4-il)-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-8-(1 H-pirazol-4-il)-3,4-dihidro-pirido[4,3-d]pirimidin-2(1 H)-ona; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-8-(1 -metil-1 H-pirazol-5-il)-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-8-fenil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-(4-fluorofenil)-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-l-metil-8-piridin-3-il-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -metil-8-piridin-4-il-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-8-[(E)-2-fenilvinil]-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-8-feniletil-3,4-dihidropirido-[4,3-d]pirimidin-2(1 H)-ona;
7-amino-8-bencil-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona; y
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-(3,6-dihidro-2H-piran-4-il)-1 -metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
o una sal farmacéuticamente aceptable de cualquiera de los mencionados anteriormente; o
29. El compuesto de la reivindicación 1 seleccionado de:
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-(2-fluorofenil)-8-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-metil-1-(2-metil-2H-tetrazol-5-il)-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-8-metil-1-[(1-metil-1 H-pirazol-4-il)metil]-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona;
metil[3-(2,6-difluoro-3,5-dimetoxifenil)-1,8-dimetil-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidin-7-il]carbamato; 7-amino-1-(ciclopropilmetil)-3-(2,6-difluoro-3,5-dimetoxifenil)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo;
7-amino-1-ciclopentil-3-(2,6-difluoro-3,5-dimetoxifenil)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidin-8-carbonitrilo; 7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1 -[(1 -metil-1 H-pirazol-4-il)metil]-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidin-8-carbonitrilo;
7-amino-1-(3,5-difluorobencil)-3-(2,6-difluoro-3,5-dimetoxifenil)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo;
7-amino-3-(2,6-difluoro-3,5-dimetoxifenil)-1-(2-fluorofenil)-2-oxo-1,2,3,4-tetrahidropirido[4,3-d]pirimidina-8-carbonitrilo; y
7-amino-8-cloro-3-(2,6-difluoro-3,5-dimetoxifenil)-1-metil-3,4-dihidropirido[4,3-d]pirimidin-2(1 H)-ona,
o una sal farmacéuticamente aceptable de cualquiera de los mencionados anteriormente.
30. Una composición farmacéutica que comprende un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, y por lo menos un vehículo farmacéuticamente aceptable.
31. Un método para inhibir una enzima de FGFR que comprende poner en contacto dicha enzima in vitro con un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo.
32. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento del cáncer en un paciente.
33. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento del cáncer en un paciente en donde dicho cáncer se selecciona de cáncer de vejiga, cáncer de mama, cáncer de cuello uterino, cáncer colorrectal, cáncer de endometrio, cáncer gástrico, cáncer de cabeza y cuello, cáncer de riñón, cáncer de hígado, cáncer de pulmón, cáncer de ovario, cáncer de próstata, cáncer de esófago, cáncer de vesícula biliar, cáncer de páncreas, cáncer de tiroides, cáncer de piel, leucemia, mieloma múltiple, linfoma linfocítico crónico, leucemia de células T adultas, linfoma de células B, leucemia mielógena aguda, linfoma de Hodgkin o no Hodgkin, macroglubulinemia de Waldenstrom, linfoma de células pilosas, linfoma de Burkett, glioblastoma, melanosaroma y raboma.
34. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento de un trastorno mieloproliferativo en un paciente.
35. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento de un trastorno mieloproliferativo en un paciente en donde dicho trastorno mieloproliferativo se selecciona de policitemia vera, trombocitemia esencial y mielofibrosis primaria.
36. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento de un trastorno del esqueleto o de condrocitos en un paciente.
37. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento de un trastorno del esqueleto o de condrocitos en un paciente en donde dicho trastorno del esqueleto o de condrocitos se selecciona de acronroplasia, hipocondroplasia, enanismo, displasia tanatofórica (TD), síndrome de Apert, síndrome de Crouzon, síndrome de Jackson-Weiss, síndrome de la cutis girada de Beare-Stevenson, síndrome de Pfeiffer y síndrome de craneosinostosis.
38. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento de un trastorno de hipofosfatemia en un paciente.
39. Un compuesto de cualquiera de las reivindicaciones 1 a 29, o una sal farmacéuticamente aceptable del mismo, para su uso en un método de tratamiento de un trastorno de hipofosfatemia en un paciente en donde dicho trastorno de hipofosfatemia es raquitismo hipofosfatémico ligado a X, raquitismo hipofosfatémico autosómico recesivo, raquitismo hipofosfatémico autosómico dominante u osteromalacia inducida por tumores.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361813782P | 2013-04-19 | 2013-04-19 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2893725T3 true ES2893725T3 (es) | 2022-02-09 |
Family
ID=50983108
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES17199421T Active ES2893725T3 (es) | 2013-04-19 | 2014-04-18 | Heterocíclicos bicíclicos como inhibidores del FGFR |
| ES14732662.3T Active ES2657451T3 (es) | 2013-04-19 | 2014-04-18 | Heterocíclicos bicíclicos como inhibidores del FGFR |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES14732662.3T Active ES2657451T3 (es) | 2013-04-19 | 2014-04-18 | Heterocíclicos bicíclicos como inhibidores del FGFR |
Country Status (35)
| Country | Link |
|---|---|
| US (5) | US9533984B2 (es) |
| EP (2) | EP2986610B9 (es) |
| JP (3) | JP6449244B2 (es) |
| KR (2) | KR102469849B1 (es) |
| CN (3) | CN109912594A (es) |
| AR (1) | AR096097A1 (es) |
| AU (3) | AU2014253798C1 (es) |
| BR (1) | BR112015026307B1 (es) |
| CA (2) | CA3130452C (es) |
| CL (1) | CL2015003089A1 (es) |
| CR (1) | CR20150578A (es) |
| CY (1) | CY1120556T1 (es) |
| DK (1) | DK2986610T5 (es) |
| EA (2) | EA202090516A3 (es) |
| EC (1) | ECSP15048555A (es) |
| ES (2) | ES2893725T3 (es) |
| HK (2) | HK1255159A1 (es) |
| HR (1) | HRP20180365T2 (es) |
| HU (1) | HUE036571T2 (es) |
| IL (2) | IL241982B (es) |
| LT (1) | LT2986610T (es) |
| ME (1) | ME03015B (es) |
| MX (2) | MX367878B (es) |
| MY (1) | MY181497A (es) |
| NO (1) | NO3087075T3 (es) |
| PE (1) | PE20152033A1 (es) |
| PH (2) | PH12015502383A1 (es) |
| PL (1) | PL2986610T4 (es) |
| PT (1) | PT2986610T (es) |
| RS (1) | RS56924B9 (es) |
| SG (2) | SG11201508328PA (es) |
| SI (1) | SI2986610T1 (es) |
| TW (2) | TWI649318B (es) |
| UA (1) | UA120087C2 (es) |
| WO (1) | WO2014172644A2 (es) |
Families Citing this family (49)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| NZ702747A (en) | 2012-06-13 | 2017-03-31 | Incyte Holdings Corp | Substituted tricyclic compounds as fgfr inhibitors |
| WO2014026125A1 (en) | 2012-08-10 | 2014-02-13 | Incyte Corporation | Pyrazine derivatives as fgfr inhibitors |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| EP2986610B9 (en) | 2013-04-19 | 2018-10-17 | Incyte Holdings Corporation | Bicyclic heterocycles as fgfr inhibitors |
| WO2015008839A1 (ja) | 2013-07-18 | 2015-01-22 | 大鵬薬品工業株式会社 | Fgfr阻害剤の間歇投与用抗腫瘍剤 |
| US10124003B2 (en) | 2013-07-18 | 2018-11-13 | Taiho Pharmaceutical Co., Ltd. | Therapeutic agent for FGFR inhibitor-resistant cancer |
| AU2014338549B2 (en) | 2013-10-25 | 2017-05-25 | Novartis Ag | Ring-fused bicyclic pyridyl derivatives as FGFR4 inhibitors |
| US20180185341A1 (en) | 2014-10-03 | 2018-07-05 | Novartis Ag | Use of ring-fused bicyclic pyridyl derivatives as fgfr4 inhibitors |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US20160115164A1 (en) * | 2014-10-22 | 2016-04-28 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| US9694084B2 (en) | 2014-12-23 | 2017-07-04 | Dana-Farber Cancer Institute, Inc. | Methods to induce targeted protein degradation through bifunctional molecules |
| WO2016134294A1 (en) | 2015-02-20 | 2016-08-25 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| US9708318B2 (en) * | 2015-02-20 | 2017-07-18 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| US9802917B2 (en) | 2015-03-25 | 2017-10-31 | Novartis Ag | Particles of N-(5-cyano-4-((2-methoxyethyl)amino)pyridin-2-yl)-7-formyl-6-((4-methyl-2-oxopiperazin-1-yl)methyl)-3,4-dihydro-1,8-naphthyridine-1(2H)-carboxamide |
| AU2016240841C1 (en) | 2015-03-31 | 2018-05-17 | Taiho Pharmaceutical Co., Ltd. | Crystal of 3,5-disubstituted benzene alkynyl compound |
| US11883404B2 (en) | 2016-03-04 | 2024-01-30 | Taiho Pharmaceuticals Co., Ltd. | Preparation and composition for treatment of malignant tumors |
| EP3424505A4 (en) * | 2016-03-04 | 2019-10-16 | Taiho Pharmaceutical Co., Ltd. | PREPARATION AND COMPOSITION FOR TREATING MALIGNANT TUMORS |
| JP7008064B2 (ja) * | 2016-05-27 | 2022-01-25 | 杭州英創医薬科技有限公司 | Fgfr4阻害剤としてのヘテロ環式化合物 |
| CN107459519A (zh) * | 2016-06-06 | 2017-12-12 | 上海艾力斯医药科技有限公司 | 稠合嘧啶哌啶环衍生物及其制备方法和应用 |
| US11192890B2 (en) * | 2017-03-03 | 2021-12-07 | Auckland Uniservices Limited | FGFR kinase inhibitors and pharmaceutical uses |
| WO2018218197A2 (en) * | 2017-05-26 | 2018-11-29 | Board Of Regents, The University Of Texas System | Tetrahydropyrido[4,3-d]pyrimidine inhibitors of atr kinase |
| AR111960A1 (es) * | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| FI3651768T3 (fi) | 2017-07-13 | 2024-03-14 | Univ Texas | Heterosyklisiä ATR-kinaasin inhibiittoreita |
| JP7341156B2 (ja) | 2018-03-16 | 2023-09-08 | ボード オブ レジェンツ,ザ ユニバーシティ オブ テキサス システム | Atrキナーゼの複素環式阻害剤 |
| WO2019181876A1 (ja) | 2018-03-19 | 2019-09-26 | 大鵬薬品工業株式会社 | アルキル硫酸ナトリウムを含む医薬組成物 |
| CR20200591A (es) | 2018-05-04 | 2021-03-31 | Incyte Corp | Sales de un inhibidor de fgfr |
| IL312465A (en) | 2018-05-04 | 2024-06-01 | Incyte Corp | FGFR inhibitor solid forms and processes for their preparation |
| WO2020185532A1 (en) | 2019-03-08 | 2020-09-17 | Incyte Corporation | Methods of treating cancer with an fgfr inhibitor |
| BR112021018168B1 (pt) | 2019-03-21 | 2023-11-28 | Onxeo | Composição farmacêutica, combinação e kit compreendendo uma molécula dbait e um inibidor de quinase para o tratamento de câncer |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| TW202128685A (zh) | 2019-10-14 | 2021-08-01 | 美商英塞特公司 | 作為fgfr抑制劑之雙環雜環 |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| GB201915828D0 (en) * | 2019-10-31 | 2019-12-18 | Cancer Research Tech Ltd | Compounds, compositions and therapeutic uses thereof |
| US20220401436A1 (en) | 2019-11-08 | 2022-12-22 | INSERM (Institute National de la Santé et de la Recherche Médicale) | Methods for the treatment of cancers that have acquired resistance to kinase inhibitors |
| EP4069696A1 (en) | 2019-12-04 | 2022-10-12 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| US11407750B2 (en) | 2019-12-04 | 2022-08-09 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| WO2021146424A1 (en) | 2020-01-15 | 2021-07-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| CN115715201A (zh) * | 2020-03-02 | 2023-02-24 | 约翰霍普金斯大学 | 葡萄糖雷公藤甲素缀合物及其用途 |
| CN111960932B (zh) * | 2020-09-16 | 2022-11-08 | 沈阳药科大学 | 二氯雷琐酚类化合物及其制备方法和医药用途 |
| JP2024513575A (ja) | 2021-04-12 | 2024-03-26 | インサイト・コーポレイション | Fgfr阻害剤及びネクチン-4標的化剤を含む併用療法 |
| JP2024522189A (ja) | 2021-06-09 | 2024-06-11 | インサイト・コーポレイション | Fgfr阻害剤としての三環式ヘテロ環 |
| CN113527311B (zh) * | 2021-08-23 | 2022-05-06 | 中南大学湘雅医院 | Fgfr4抑制剂、组合物及其在药物制备中的用途 |
| WO2023039828A1 (en) * | 2021-09-17 | 2023-03-23 | Nutshell Biotech (Shanghai) Co., Ltd. | Fused ring compounds as inhibitors of fgfr4 tyrosine kinases |
| WO2023091746A1 (en) | 2021-11-22 | 2023-05-25 | Incyte Corporation | Combination therapy comprising an fgfr inhibitor and a kras inhibitor |
| WO2024206858A1 (en) | 2023-03-30 | 2024-10-03 | Revolution Medicines, Inc. | Compositions for inducing ras gtp hydrolysis and uses thereof |
Family Cites Families (811)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE280853C (es) | ||||
| US850370A (en) | 1906-06-05 | 1907-04-16 | William L Hynes | Water-automobile. |
| DE2156720A1 (de) | 1971-11-16 | 1973-05-24 | Bayer Ag | Pyrimido eckige klammer auf 4,5-d eckige klammer zu pyrimidine |
| US3894021A (en) | 1974-01-28 | 1975-07-08 | Squibb & Sons Inc | Derivatives of 1,7-dihydro-2H-pyrazolo{8 4{40 ,3{40 :5,6{9 pyrido{8 4,3-D{9 pyrimidine-2,4-(3H)-diones |
| JPS5120580B2 (es) | 1974-06-19 | 1976-06-25 | ||
| JPS5120580A (en) | 1974-08-08 | 1976-02-18 | Nitto Electric Ind Co | 4 futsukaechirenjugotaihifukudensenno seizohoho |
| US4347348A (en) | 1978-06-05 | 1982-08-31 | Chernikhov Alexei Y | Heat-resistant heterocyclic polymers and methods for producing same |
| FR2428654A1 (fr) | 1978-06-13 | 1980-01-11 | Chernikhov Alexei | Polymeres heterocycliques thermostables et leurs procedes de preparation |
| CH641470A5 (de) | 1978-08-30 | 1984-02-29 | Ciba Geigy Ag | Imidgruppen enthaltende silane. |
| CH635828A5 (de) | 1978-08-30 | 1983-04-29 | Ciba Geigy Ag | N-substituierte imide und bisimide. |
| US4339267A (en) | 1980-01-18 | 1982-07-13 | E. I. Du Pont De Nemours And Company | Herbicidal sulfonamides |
| US4405519A (en) | 1980-10-22 | 1983-09-20 | Plastics Engineering Company | Di-Acetylene-terminated polyimide derivatives |
| US4402878A (en) | 1980-10-22 | 1983-09-06 | Plastics Engineering Company | Addition products of di-acetylene-terminated polyimide derivatives with a polyimide having terminal non-conjugated acetylene groups |
| US4405786A (en) | 1980-10-22 | 1983-09-20 | Plastics Engineering Company | Addition products of di-acetylene-terminated polyimide derivatives and an dienophile having ethylene groups |
| US4405520A (en) | 1980-10-22 | 1983-09-20 | Plastics Engineering Company | Addition products of di-acetylene-terminated polymide derivatives and dienophiles having terminal maleimide grops |
| JPS5857170A (ja) | 1981-09-30 | 1983-04-05 | シャープ株式会社 | 学習機 |
| JPS5873576U (ja) | 1981-11-12 | 1983-05-18 | 沖電気工業株式会社 | コネクタのロツク構造 |
| US4460773A (en) | 1982-02-05 | 1984-07-17 | Lion Corporation | 1-Phenyl-1H-pyrazolo [3,4-b]pyrazine derivatives and process for preparing same |
| JPS5926040U (ja) | 1982-08-12 | 1984-02-17 | 井出 正一 | ロ−プ掛締付け器 |
| DE3432983A1 (de) | 1983-09-07 | 1985-04-18 | Lion Corp., Tokio/Tokyo | 1,5-disubstituierte 1h-pyrazolo(3,4-b)-pyrazin-derivate und antitumormittel, die diese enthalten |
| JPH029895Y2 (es) | 1984-11-08 | 1990-03-12 | ||
| JPH0348656Y2 (es) | 1985-05-10 | 1991-10-17 | ||
| JPS62273979A (ja) | 1986-05-21 | 1987-11-28 | Lion Corp | 1,5−置換−1H−ピラゾロ〔3,4−b〕ピラジン誘導体及び該化合物を含有する抗腫瘍剤 |
| JPS6310630A (ja) | 1986-06-23 | 1988-01-18 | Teijin Ltd | 芳香族ポリアミドイミドエ−テルの製造法 |
| JPS6317882A (ja) | 1986-07-09 | 1988-01-25 | Lion Corp | 5−置換−1H−ピラゾロ〔3,4−b〕ピラジン誘導体及び該化合物を含有する抗腫瘍剤 |
| US4859672A (en) | 1986-10-29 | 1989-08-22 | Rorer Pharmaceutical Corporation | Pyrido[2,3-d]pyrimidinone and imidazo[4,5-b]pyrimidinone |
| US4874803A (en) | 1987-09-21 | 1989-10-17 | Pennwalt Corporation | Dianhydride coupled polymer stabilizers |
| DE3814549A1 (de) | 1987-10-30 | 1989-05-18 | Bayer Ag | N-substituierte derivate von 1-desoxynojirimycin und 1-desoxymannonojirimycin, verfahren zu deren herstellung und deren verwendung in arzneimitteln |
| JPH029895A (ja) | 1988-06-28 | 1990-01-12 | Lion Corp | ヌクレオシド類似化合物及び抗腫瘍剤 |
| DD280853A1 (de) | 1989-03-21 | 1990-07-18 | Akad Nauk Sssr | Bindemittel fuer elektroden, vorzugsweise fuer polymerelektroden |
| US5159054A (en) | 1989-05-16 | 1992-10-27 | The United States Of America As Represented By The Secretary Of The Navy | Synthesis of phthalonitrile resins containing ether and imide linkages |
| JP2845957B2 (ja) | 1989-07-17 | 1999-01-13 | 三井化学株式会社 | イミド環を有する新規ジフェノール類およびその製造方法 |
| US5726302A (en) | 1989-09-15 | 1998-03-10 | Gensia Inc. | Water soluble adenosine kinase inhibitors |
| DE3937633A1 (de) | 1989-11-11 | 1991-05-16 | Bayer Ag | Heterocyclische verbindungen und deren verwendung als pigmente und farbstoffe |
| WO1991009835A1 (de) | 1989-12-28 | 1991-07-11 | Hoechst Aktiengesellschaft | Biskationische säureamid- und -imidderivative und verfahren zu ihrer herstellung |
| DE59009701D1 (de) | 1989-12-28 | 1995-10-26 | Hoechst Ag | Biskationische säureamid- und -imidderivate als ladungssteuermittel. |
| JP2883670B2 (ja) | 1990-03-23 | 1999-04-19 | 三井化学株式会社 | イミド環を有する新規ビスフェノール類およびその製造方法 |
| GB9113137D0 (en) | 1990-07-13 | 1991-08-07 | Ici Plc | Thioxo heterocycles |
| CA2093322C (en) | 1990-10-03 | 2002-01-29 | Jonathan H. Hodgkin | Epoxy resins based on diaminobisimide compounds |
| JPH04158084A (ja) | 1990-10-22 | 1992-06-01 | Fuji Photo Film Co Ltd | 記録材料 |
| JPH04179576A (ja) | 1990-11-14 | 1992-06-26 | Fuji Photo Film Co Ltd | 記録材料 |
| JPH04328121A (ja) | 1991-04-26 | 1992-11-17 | Sumitomo Bakelite Co Ltd | 半導体封止用エポキシ樹脂組成物 |
| JP3147902B2 (ja) | 1991-06-14 | 2001-03-19 | ファルマシア・アンド・アップジョン・カンパニー | イミダゾ〔1,5−a〕キノキサリン |
| DE4119767A1 (de) | 1991-06-15 | 1992-12-17 | Dresden Arzneimittel | Verfahren zur herstellung von (pyrimid-2-yl-thio- bzw. seleno)-essigsaeurederivaten |
| US5521184A (en) | 1992-04-03 | 1996-05-28 | Ciba-Geigy Corporation | Pyrimidine derivatives and processes for the preparation thereof |
| JP3279635B2 (ja) | 1992-05-18 | 2002-04-30 | 鐘淵化学工業株式会社 | ヒドロシリル基含有イミド化合物 |
| JP3232123B2 (ja) | 1992-05-20 | 2001-11-26 | 鐘淵化学工業株式会社 | 硬化性組成物 |
| WO1993024488A1 (en) | 1992-05-28 | 1993-12-09 | Commonwealth Scientific And Industrial Research Organisation | Bismaleimide compounds |
| NZ258488A (en) | 1992-12-07 | 1997-02-24 | Commw Scient Ind Res Org | Preparation of bisnadimides (n,n'-bis(aryl)aryl diimides) from an n,n'-bis (aminoaryl)aryldiimide and nadic acid; curable compositions and fibre reinforced cured composites |
| JPH08506189A (ja) | 1993-01-11 | 1996-07-02 | ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア | 非線形光学的性質を有する多環式芳香族化合物 |
| WO1994025438A1 (en) | 1993-04-28 | 1994-11-10 | The Du Pont Merck Pharmaceutical Company | Novel trisubstituted aromatic amines useful for the treatment of cognitive deficits |
| US5536725A (en) | 1993-08-25 | 1996-07-16 | Fmc Corporation | Insecticidal substituted-2,4-diamino-5,6,7,8-tetrahydroquinazolines |
| DK0731795T3 (da) | 1993-11-30 | 2000-05-15 | Searle & Co | Substituerede pyrazolylbenzensulfonamider til behandling af inflammation |
| WO1995020965A1 (en) | 1994-02-02 | 1995-08-10 | Eli Lilly And Company | Hiv protease inhibitors and intermediates |
| US5480887A (en) | 1994-02-02 | 1996-01-02 | Eli Lilly And Company | Protease inhibitors |
| PL181893B1 (pl) | 1994-11-14 | 2001-10-31 | Warner Lambert Co | Zwiazki bedace pochodnymi pirymidyny i naftyrydyny oraz preparat farmaceutyczny zawierajacy je PL PL PL |
| US7067664B1 (en) | 1995-06-06 | 2006-06-27 | Pfizer Inc. | Corticotropin releasing factor antagonists |
| US5783577A (en) | 1995-09-15 | 1998-07-21 | Trega Biosciences, Inc. | Synthesis of quinazolinone libraries and derivatives thereof |
| JPH09188812A (ja) | 1996-01-11 | 1997-07-22 | Mitsui Toatsu Chem Inc | 結晶化促進剤 |
| WO1997047601A1 (fr) | 1996-06-11 | 1997-12-18 | Yoshitomi Pharmaceutical Industries, Ltd. | Composes heterocycliques fusionnes et leurs utilisations medicinales |
| CN1093130C (zh) | 1996-08-06 | 2002-10-23 | 辉瑞大药厂 | 被取代的吡啶并6,6-二环衍生物 |
| JP2000516611A (ja) | 1996-08-14 | 2000-12-12 | ワーナー―ランバート・コンパニー | Mcp―1アンタゴニストとしての2―フェニルベンズイミダゾール誘導体 |
| JP3669783B2 (ja) | 1996-08-21 | 2005-07-13 | 三井化学株式会社 | 有機電界発光素子 |
| US5994364A (en) | 1996-09-13 | 1999-11-30 | Schering Corporation | Tricyclic antitumor farnesyl protein transferase inhibitors |
| WO1998018781A2 (en) | 1996-10-28 | 1998-05-07 | Versicor, Inc. | Fused 2,4-pyrimidinedione combinatorial libraries, their preparation and the use of fused 2,4-pyrimidinediones derivatives as antimicrobial agents |
| JP2001507349A (ja) | 1996-12-23 | 2001-06-05 | セルテック セラピューティックス リミテッド | 縮合多環式2−アミノピリミジン誘導体、それらの製造およびたんぱく質チロシンキナーゼ抑制因子としてのそれらの使用 |
| ATE391719T1 (de) | 1997-02-05 | 2008-04-15 | Warner Lambert Co | Pyrido (2,3-d) pyrimidine und 4-amino-primidine als inhibitoren der zellulären proliferation |
| EP0973777A1 (en) | 1997-04-11 | 2000-01-26 | Abbott Laboratories | Furopyridine, thienopyridine, pyrrolopyridine and related pyrimidine, pyridazine and triazine compounds useful in controlling chemical synaptic transmission |
| SK158199A3 (en) | 1997-05-28 | 2000-06-12 | Rhone Poulenc Rorer Pharma | QUINOLINE AND QUINOXALINE COMPOUNDS WHICH INHIBIT PLATELET-DERIVED GROWTH FACTOR AND/OR p56lck TYROSINE KINASES |
| GB9716231D0 (en) | 1997-07-31 | 1997-10-08 | Amersham Int Ltd | Base analogues |
| NZ502877A (en) | 1997-08-11 | 2001-11-30 | Cor Therapeutics Inc | Bicyclic aryl azepinone selective factor Xa inhibitors for treating thrombosis related diseases |
| JP4965021B2 (ja) | 1997-08-20 | 2012-07-04 | ワーナー−ランバート カンパニー リミテッド ライアビリティー カンパニー | プロテインチロシンキナーゼおよび細胞周期キナーゼ仲介細胞増殖を阻害するためのナフチリジノン |
| US6465484B1 (en) | 1997-09-26 | 2002-10-15 | Merck & Co., Inc. | Angiogenesis inhibitors |
| JPH11171865A (ja) | 1997-12-04 | 1999-06-29 | Yoshitomi Pharmaceut Ind Ltd | 縮合ヘテロ環化合物 |
| AU4481899A (en) | 1998-02-20 | 1999-09-06 | Takeda Chemical Industries Ltd. | Aminoguanidine hydrazone derivatives, process for producing the same and drugs thereof |
| JP2002515490A (ja) | 1998-05-15 | 2002-05-28 | ギルフォード ファーマシューティカルズ インコーポレイテッド | Parp活性を抑制する縮合三環化合物 |
| EP1080092B1 (en) * | 1998-05-26 | 2008-07-23 | Warner-Lambert Company LLC | Bicyclic pyrimidines and bicyclic 3,4-dihydropyrimidines as inhibitors of cellular proliferation |
| US20040044012A1 (en) * | 1998-05-26 | 2004-03-04 | Dobrusin Ellen Myra | Bicyclic pyrimidines and bicyclic 3,4-dihydropyrimidines as inhibitors of cellular proliferation |
| EP1086085A1 (en) | 1998-06-12 | 2001-03-28 | Vertex Pharmaceuticals Incorporated | INHIBITORS OF p38 |
| DE69942097D1 (de) | 1998-08-11 | 2010-04-15 | Novartis Ag | Isochinoline derivate mit angiogenesis-hemmender wirkung |
| JP2000123973A (ja) | 1998-10-09 | 2000-04-28 | Canon Inc | 有機発光素子 |
| GB9823103D0 (en) | 1998-10-23 | 1998-12-16 | Pfizer Ltd | Pharmaceutically active compounds |
| AU769989B2 (en) | 1998-10-23 | 2004-02-12 | F. Hoffmann-La Roche Ag | Bicyclic nitrogen heterocycles |
| US6133031A (en) | 1999-08-19 | 2000-10-17 | Isis Pharmaceuticals Inc. | Antisense inhibition of focal adhesion kinase expression |
| GB9905075D0 (en) | 1999-03-06 | 1999-04-28 | Zeneca Ltd | Chemical compounds |
| DE19912638A1 (de) | 1999-03-20 | 2000-09-21 | Bayer Ag | Naphthylcarbonsäureamid-substituierte Sulfonamide |
| DE19920790A1 (de) | 1999-05-06 | 2000-11-09 | Bayer Ag | Bis-Sulfonamide mit anti-HCMV-Wirkung |
| PE20010306A1 (es) | 1999-07-02 | 2001-03-29 | Agouron Pharma | Compuestos de indazol y composiciones farmaceuticas que los contienen utiles para la inhibicion de proteina kinasa |
| JP4041624B2 (ja) | 1999-07-21 | 2008-01-30 | 三井化学株式会社 | 有機電界発光素子 |
| ATE316781T1 (de) | 1999-09-24 | 2006-02-15 | Janssen Pharmaceutica Nv | Antivirale feste dispersionen |
| DE19946289A1 (de) | 1999-09-28 | 2001-03-29 | Basf Ag | Benzodiazepin-Derivate, deren Herstellung und Anwendung |
| CN1171889C (zh) | 1999-10-21 | 2004-10-20 | 霍夫曼-拉罗奇有限公司 | 作为p38蛋白激酶的抑制剂的杂烷基氨基-取代的双环氮杂环类化合物 |
| BR0014973A (pt) | 1999-10-21 | 2002-07-16 | Hoffmann La Roche Ag G | Heterociclos de nitrogênio bicìclico de alquilamino substituìdo como inibidores de proteìna quinase p38 |
| TWI271406B (en) | 1999-12-13 | 2007-01-21 | Eisai Co Ltd | Tricyclic condensed heterocyclic compounds, preparation method of the same and pharmaceuticals comprising the same |
| DE60033316T2 (de) | 1999-12-29 | 2007-11-22 | Wyeth | Tricyclische proteinkinasehemmer |
| EA005585B1 (ru) | 2000-01-24 | 2005-04-28 | Уорнер-Ламберт Компани | 3-аминохиназолин-2,4-дионовые антибактериальные агенты |
| IL150742A0 (en) | 2000-01-27 | 2003-02-12 | Warner Lambert Co | Pyridopyrimidinone derivatives for the treatment of neurodegenerative disease |
| DE50112961D1 (de) | 2000-02-01 | 2007-10-18 | Abbott Gmbh & Co Kg | Heterozyklische verbindungen und deren anwendung als parp-inhibitoren |
| ATE309999T1 (de) | 2000-02-04 | 2005-12-15 | Portola Pharm Inc | Blutplättchen-adp-rezeptor-inhibitoren |
| EP1254138B1 (en) | 2000-02-09 | 2005-05-11 | Novartis AG | Pyridine derivatives inhibiting angiogenesis and/or vegf receptor tyrosine kinase |
| GB0004890D0 (en) | 2000-03-01 | 2000-04-19 | Astrazeneca Uk Ltd | Chemical compounds |
| JP2003525897A (ja) | 2000-03-06 | 2003-09-02 | アストラゼネカ アクチボラグ | 治 療 |
| JP2001265031A (ja) | 2000-03-15 | 2001-09-28 | Fuji Xerox Co Ltd | 電子写真感光体、プロセスカートリッジ、及び、電子写真装置 |
| DE10012549A1 (de) | 2000-03-15 | 2001-09-20 | Bayer Ag | Arzneimittel gegen virale Erkrankungen |
| JP4119126B2 (ja) | 2000-04-28 | 2008-07-16 | アカディア ファーマシューティカルズ,インコーポレーテッド | ムスカリン性アゴニスト |
| EP1278744A1 (en) | 2000-05-05 | 2003-01-29 | Millenium Pharmaceuticals, Inc. | Heterobicyclic sulfonamides and their use as platelet adp receptor inhibitors |
| IL152916A0 (en) | 2000-06-23 | 2003-06-24 | Bristol Myers Squibb Co | Heteroaryl-phenyl heterobicyclic factor xa inhibitors |
| PL202623B1 (pl) | 2000-06-28 | 2009-07-31 | Smithkline Beecham Plc | Sposób wytwarzania drobno zmielonego preparatu substancji leczniczej, drobno zmielona substancja lecznicza wytworzona tym sposobem i zawierająca ją kompozycja farmaceutyczna |
| US20050009876A1 (en) | 2000-07-31 | 2005-01-13 | Bhagwat Shripad S. | Indazole compounds, compositions thereof and methods of treatment therewith |
| KR20030036678A (ko) | 2000-08-07 | 2003-05-09 | 뉴로젠 코포레이션 | Gabaa 수용체의 리간드로서의 헤테로사이클릭 화합물 |
| MXPA03001422A (es) | 2000-08-14 | 2004-01-26 | Johnson & Johnson | Pirazoles substituidos. |
| AU2001288706B2 (en) | 2000-09-06 | 2006-01-19 | Ortho-Mcneil Pharmaceutical, Inc. | A method for treating allergies using substituted pyrazoles |
| GB0025782D0 (en) | 2000-10-20 | 2000-12-06 | Pfizer Ltd | Use of inhibitors |
| EP1217000A1 (en) | 2000-12-23 | 2002-06-26 | Aventis Pharma Deutschland GmbH | Inhibitors of factor Xa and factor VIIa |
| GB0100621D0 (en) | 2001-01-10 | 2001-02-21 | Vernalis Res Ltd | Chemical compounds VI |
| GB0103926D0 (en) | 2001-02-17 | 2001-04-04 | Astrazeneca Ab | Chemical compounds |
| AP1699A (en) | 2001-03-21 | 2006-12-26 | Warner Lambert Co | New spirotricyclic derivatives and their use as phosphodiesterase-7 inhibitors |
| US6998408B2 (en) | 2001-03-23 | 2006-02-14 | Bristol-Myers Squibb Pharma Company | 6-5, 6-6, or 6-7 Heterobicycles as factor Xa inhibitors |
| JP2002296731A (ja) | 2001-03-30 | 2002-10-09 | Fuji Photo Film Co Ltd | 熱現像カラー画像記録材料 |
| CA2440842A1 (en) | 2001-04-16 | 2002-10-24 | Eisai Co., Ltd. | Novel 1h-indazole compounds |
| EP2048142A3 (en) | 2001-04-26 | 2009-04-22 | Eisai R&D Management Co., Ltd. | Nitrogen-containing condensed cyclic compound having a pyrazolyl group as a substituent group and pharmaceutical composition thereof |
| CZ20032946A3 (en) | 2001-04-30 | 2004-05-12 | Glaxoágroupálimited | Fused pyrimidines as antagonists of the corticotropin releasing factor (crf) |
| WO2002094825A1 (fr) | 2001-05-22 | 2002-11-28 | Banyu Pharmaceutical Co., Ltd. | Nouveau derive de spiropiperidine |
| US20030114448A1 (en) | 2001-05-31 | 2003-06-19 | Millennium Pharmaceuticals, Inc. | Inhibitors of factor Xa |
| EP1401830A2 (en) | 2001-06-19 | 2004-03-31 | Warner-Lambert Company LLC | Quinazolinediones as antibacterial agents |
| US20030114467A1 (en) | 2001-06-21 | 2003-06-19 | Shakespeare William C. | Novel pyrazolo- and pyrrolo-pyrimidines and uses thereof |
| GB0115109D0 (en) | 2001-06-21 | 2001-08-15 | Aventis Pharma Ltd | Chemical compounds |
| WO2003000690A1 (en) | 2001-06-25 | 2003-01-03 | Aventis Pharmaceuticals Inc. | Synthesis of heterocyclic compounds employing microwave technology |
| US20040235867A1 (en) | 2001-07-24 | 2004-11-25 | Bilodeau Mark T. | Tyrosine kinase inhibitors |
| CN1538956A (zh) | 2001-08-07 | 2004-10-20 | ������ҩ��ʽ���� | 螺环化合物 |
| EP1436291B1 (en) | 2001-09-19 | 2009-01-14 | Aventis Pharma S.A. | Indolizines as kinase protein inhibitors |
| NZ532136A (en) | 2001-10-30 | 2006-08-31 | Novartis Ag | Staurosporine derivatives as inhibitors of FLT3 receptor tyrosine kinase activity |
| IL161662A0 (en) | 2001-11-01 | 2004-09-27 | Janssen Pharmaceutica Nv | Heteroaryl amines as glycogen synthase kinase 3 beta inhibitors (gsk3 inhibitors) |
| PL370480A1 (en) | 2001-11-07 | 2005-05-30 | F.Hoffmann-La Roche Ag | Aminopyrimidines and pyridines |
| WO2003042402A2 (en) | 2001-11-13 | 2003-05-22 | Dana-Farber Cancer Institute, Inc. | Agents that modulate immune cell activation and methods of use thereof |
| GB0129476D0 (en) | 2001-12-10 | 2002-01-30 | Syngenta Participations Ag | Organic compounds |
| GEP20063909B (en) | 2002-01-22 | 2006-08-25 | Warner Lambert Co | 2-(PYRIDIN-2-YLAMINO)-PYRIDO[2,3d] PYRIMIDIN-7-ONES |
| PT1482924E (pt) | 2002-03-05 | 2008-08-27 | Axys Pharm Inc | Inibidores de proteases da cisteína catepsina |
| US6815519B2 (en) | 2002-03-22 | 2004-11-09 | Chung-Shan Institute Of Science & Technology | Acidic fluorine-containing poly (siloxane amideimide) silica hybrids |
| CA2479644A1 (en) | 2002-04-03 | 2003-10-09 | F. Hoffmann-La Roche Ag | Imidazo fused compounds |
| AU2003234567A1 (en) | 2002-05-15 | 2003-12-02 | Janssen Pharmaceutica N.V. | N-substituted tricyclic 3-aminopyrazoles as pdfg receptor inhibitors |
| JP4499342B2 (ja) | 2002-05-16 | 2010-07-07 | 株式会社カネカ | SiH基を含有する含窒素有機系化合物の製造方法 |
| AU2003245325A1 (en) | 2002-05-23 | 2003-12-12 | Chiron Corporation | Substituted quinazolinone compounds |
| PE20040522A1 (es) | 2002-05-29 | 2004-09-28 | Novartis Ag | Derivados de diarilurea dependientes de la cinasa de proteina |
| US7119111B2 (en) | 2002-05-29 | 2006-10-10 | Amgen, Inc. | 2-oxo-1,3,4-trihydroquinazolinyl derivatives and methods of use |
| US7105526B2 (en) | 2002-06-28 | 2006-09-12 | Banyu Pharmaceuticals Co., Ltd. | Benzimidazole derivatives |
| GB0215676D0 (en) | 2002-07-05 | 2002-08-14 | Novartis Ag | Organic compounds |
| PA8577501A1 (es) | 2002-07-25 | 2004-02-07 | Warner Lambert Co | Inhibidores de quinasas |
| IL166241A0 (en) | 2002-07-29 | 2006-01-15 | Rigel Pharmaceuticals Inc | Method of treating or preventing autoimmune diseases with 2,4-pyrimidinedinediamine compounds |
| BR0313297A (pt) | 2002-08-06 | 2005-06-21 | Hoffmann La Roche | 6-alcóxi-pirido-pirimidinas como inibidores de p-38 map cinase |
| EP1388541A1 (en) | 2002-08-09 | 2004-02-11 | Centre National De La Recherche Scientifique (Cnrs) | Pyrrolopyrazines as kinase inhibitors |
| US7084270B2 (en) | 2002-08-14 | 2006-08-01 | Hoffman-La Roche Inc. | Pyrimido compounds having antiproliferative activity |
| GB0220187D0 (en) | 2002-08-30 | 2002-10-09 | Novartis Ag | Organic compounds |
| GB0223349D0 (en) | 2002-10-08 | 2002-11-13 | Merck Sharp & Dohme | Therapeutic agents |
| TW200413381A (en) | 2002-11-04 | 2004-08-01 | Hoffmann La Roche | Novel amino-substituted dihydropyrimido [4,5-d]pyrimidinone derivatives, their manufacture and use as pharmaceutical agents |
| US7129351B2 (en) | 2002-11-04 | 2006-10-31 | Hoffmann-La Roche Inc. | Pyrimido compounds having antiproliferative activity |
| US7384937B2 (en) | 2002-11-06 | 2008-06-10 | Bristol-Myers Squibb Co. | Fused heterocyclic compounds and use thereof |
| TWI335913B (en) | 2002-11-15 | 2011-01-11 | Vertex Pharma | Diaminotriazoles useful as inhibitors of protein kinases |
| PL377620A1 (pl) * | 2002-11-18 | 2006-02-06 | F. Hoffmann-La Roche Ag | Diazynopirymidyny |
| AU2003288198A1 (en) | 2002-11-28 | 2004-06-18 | Schering Aktiengesellschaft | CHK-,PDK- and AKT-inhibitory pyrimidines, their production and use as pharmaceutical agents |
| JP4903385B2 (ja) | 2002-12-06 | 2012-03-28 | パーデュー・リサーチ・ファウンデーション | 損傷した哺乳類神経組織を治療するためのピリジン類 |
| AU2003288994A1 (en) | 2002-12-10 | 2004-06-30 | Ono Pharmaceutical Co., Ltd. | Nitrogen-containing heterocyclic compounds and medicinal use thereof |
| UA80171C2 (en) | 2002-12-19 | 2007-08-27 | Pfizer Prod Inc | Pyrrolopyrimidine derivatives |
| UA80767C2 (en) | 2002-12-20 | 2007-10-25 | Pfizer Prod Inc | Pyrimidine derivatives for the treatment of abnormal cell growth |
| US7098332B2 (en) | 2002-12-20 | 2006-08-29 | Hoffmann-La Roche Inc. | 5,8-Dihydro-6H-pyrido[2,3-d]pyrimidin-7-ones |
| US7521051B2 (en) | 2002-12-23 | 2009-04-21 | Medimmune Limited | Methods of upmodulating adaptive immune response using anti-PD-1 antibodies |
| JP2004203749A (ja) | 2002-12-24 | 2004-07-22 | Kanegafuchi Chem Ind Co Ltd | SiH基を含有する含窒素有機系化合物の製造方法 |
| DE602004021558D1 (de) | 2003-01-17 | 2009-07-30 | Warner Lambert Co | 2-aminopyridin-substituierteheterocyclen als inhibitoren der zellulären proliferation |
| GB0305929D0 (en) | 2003-03-14 | 2003-04-23 | Novartis Ag | Organic compounds |
| US7135469B2 (en) | 2003-03-18 | 2006-11-14 | Bristol Myers Squibb, Co. | Linear chain substituted monocyclic and bicyclic derivatives as factor Xa inhibitors |
| US7550590B2 (en) | 2003-03-25 | 2009-06-23 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| GB0308208D0 (en) | 2003-04-09 | 2003-05-14 | Glaxo Group Ltd | Chemical compounds |
| AU2004228155A1 (en) * | 2003-04-10 | 2004-10-21 | F.Hoffman-La Roche Ag | Pyrimido compounds |
| EP1622910A1 (en) | 2003-05-05 | 2006-02-08 | F. Hoffmann-La Roche Ag | Fused pyrimidine derivatives with crf activity |
| JP2004346145A (ja) | 2003-05-21 | 2004-12-09 | Teijin Ltd | イミド組成物およびそれからなる樹脂組成物、及びその製造方法 |
| US7625909B2 (en) | 2003-05-23 | 2009-12-01 | Novartis Vaccines And Diagnostics, Inc. | Substituted quinazolinone compounds |
| ATE459359T1 (de) | 2003-06-06 | 2010-03-15 | Arexis Ab | Verwendung von kondensierten heterozyklischen verbindungen als scce-hemmern zur behandlung von hautzuständen |
| IL156495A0 (en) | 2003-06-17 | 2004-01-04 | Prochon Biotech Ltd | Use of fgfr3 antagonists for treating t cell mediated diseases |
| EP1637523A4 (en) | 2003-06-18 | 2009-01-07 | Ube Industries | PROCESS FOR PRODUCING A PYRIMIDIN-4-ONE COMPOUND |
| JP2005015395A (ja) | 2003-06-26 | 2005-01-20 | Japan Science & Technology Agency | 新規ピリミドピリミジンヌクレオシドとその構造類縁体 |
| CA2531327A1 (en) | 2003-07-03 | 2005-01-13 | Myriad Genetics, Inc. | Compounds and therapeutical use thereof |
| AR045037A1 (es) | 2003-07-10 | 2005-10-12 | Aventis Pharma Sa | Tetrahidro-1h-pirazolo [3,4-c] piridinas sustituidas, composiciones que las contienen y su utilizacion. |
| US7371750B2 (en) | 2003-07-29 | 2008-05-13 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| US7390820B2 (en) | 2003-08-25 | 2008-06-24 | Amgen Inc. | Substituted quinolinone derivatives and methods of use |
| WO2005028480A2 (en) | 2003-09-03 | 2005-03-31 | Neurogen Corporation | 5-aryl-pyrazolo[4,3-d]pyrimidines, pyridines, and pyrazines and related compounds |
| US7148228B2 (en) | 2003-09-18 | 2006-12-12 | Conforma Therapeutics Corporation | Pyrazolopyrimidines and related analogs as HSP90-inhibitors |
| CA2537325A1 (en) | 2003-09-19 | 2005-03-31 | Gilead Sciences, Inc. | Aza-quinolinol phosphonate integrase inhibitor compounds |
| AR045944A1 (es) | 2003-09-24 | 2005-11-16 | Novartis Ag | Derivados de isoquinolina 1.4-disustituidas |
| JP4833069B2 (ja) | 2003-10-01 | 2011-12-07 | ゼンション・リミテッド | テトラヒドロ−ナフタレンおよび尿素誘導体 |
| JP4758349B2 (ja) | 2003-10-08 | 2011-08-24 | アイアールエム・リミテッド・ライアビリティ・カンパニー | タンパク質キナーゼ阻害剤としての化合物および組成物 |
| CN1897950A (zh) | 2003-10-14 | 2007-01-17 | 惠氏公司 | 稠合芳基和杂芳基衍生物及其使用方法 |
| US20090099165A1 (en) | 2003-10-14 | 2009-04-16 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Protein Kinase Inhibitors |
| WO2005047289A1 (en) | 2003-11-17 | 2005-05-26 | Pfizer Products Inc. | Pyrrolopyrimidine compounds useful in treatment of cancer |
| WO2005056524A2 (en) | 2003-12-09 | 2005-06-23 | Euro-Celtique S.A. | Therapeutic agents useful for treating pain |
| US20080188527A1 (en) | 2003-12-23 | 2008-08-07 | Cashman John R | Synthetic Compounds and Derivatives as Modulators of Smoking or Nicotine Ingestion and Lung Cancer |
| KR100703068B1 (ko) | 2003-12-30 | 2007-04-05 | 에스케이케미칼주식회사 | 피리딘 유도체와 이의 제조방법, 및 이를 포함하는약제조성물 |
| US20050222171A1 (en) | 2004-01-22 | 2005-10-06 | Guido Bold | Organic compounds |
| KR101160182B1 (ko) | 2004-01-23 | 2012-06-26 | 얀센 파마슈티카 엔.브이. | 퀴놀린 유도체 및 마이코박테리아 저해제로서의 용도 |
| AU2005206562A1 (en) | 2004-01-23 | 2005-08-04 | Amgen Inc. | Vanilloid receptor ligands and their use in treatments |
| AU2005208938A1 (en) | 2004-01-29 | 2005-08-11 | Elixir Pharmaceuticals, Inc | Anti-viral therapeutics |
| GB0402137D0 (en) | 2004-01-30 | 2004-03-03 | Smithkline Beecham Corp | Novel compounds |
| AU2005214352B2 (en) | 2004-02-14 | 2009-11-12 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| BRPI0507852A (pt) | 2004-02-18 | 2007-07-10 | Warner Lambert Co | 2-(piridin-3-ilamino)-pirido[2,3-d]pirimidin-7-onas |
| AU2005219517A1 (en) | 2004-02-27 | 2005-09-15 | F.Hoffmann-La Roche Ag | Heteroaryl-fused pyrazolo derivatives |
| BRPI0508036A (pt) | 2004-02-27 | 2007-07-17 | Hoffmann La Roche | derivados fundidos de pirazola |
| US20080004263A1 (en) | 2004-03-04 | 2008-01-03 | Santora Vincent J | Ligands of Follicle Stimulating Hormone Receptor and Methods of Use Thereof |
| US20070197510A1 (en) | 2004-03-10 | 2007-08-23 | Kazuyuki Ohmoto | Nitriles and medicinal compositions containing the same as the active ingredient |
| EP1736476A4 (en) | 2004-03-29 | 2010-04-07 | Mitsui Chemicals Inc | NOVEL COMPOUND AND ORGANIC ELECTRONIC DEVICE USING THE SAME |
| WO2005105097A2 (en) | 2004-04-28 | 2005-11-10 | Gpc Biotech Ag | Pyridopyrimidines for treating inflammatory and other diseases |
| JP2005320288A (ja) | 2004-05-10 | 2005-11-17 | Mitsui Chemicals Inc | テトラカルボン酸誘導体、および該化合物を用いた電子写真感光体、電子写真装置 |
| US20050256309A1 (en) | 2004-05-12 | 2005-11-17 | Altenbach Robert J | Tri-and bi-cyclic heteroaryl histamine-3 receptor ligands |
| BRPI0511512A (pt) | 2004-05-27 | 2007-12-26 | Pfizer Prod Inc | derivados pirrolpirimidina úteis no tratamento do cáncer |
| PE20060426A1 (es) | 2004-06-02 | 2006-06-28 | Schering Corp | DERIVADOS DE ACIDO TARTARICO COMO INHIBIDORES DE MMPs, ADAMs, TACE Y TNF-alfa |
| WO2005123719A1 (en) | 2004-06-10 | 2005-12-29 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| MXPA06014478A (es) | 2004-06-11 | 2007-03-21 | Japan Tobacco Inc | Derivados de 5-amino-2, 4, 7-trioxo-3, 4, 7, 8-tetrahidro -2h-pirido[2, 3-d]pirimidina y compuestos relacionados para el tratamiento del cancer. |
| GB0512324D0 (en) | 2005-06-16 | 2005-07-27 | Novartis Ag | Organic compounds |
| JP2006028027A (ja) | 2004-07-12 | 2006-02-02 | Mitsui Chemicals Inc | テトラカルボン酸誘導体、および該化合物を用いた電子写真感光体、電子写真装置 |
| EP1789417A1 (en) | 2004-08-31 | 2007-05-30 | F.Hoffmann-La Roche Ag | AMIDE DERIVATIVES OF 7-AMINO-3-PHENYL-DIHYDROPYRIMIDO [4,5-d]PYRIMIDINONES, THEIR MANUFACTURE AND USE AS PHARMACEUTICAL AGENTS |
| KR20070048798A (ko) | 2004-08-31 | 2007-05-09 | 아스트라제네카 아베 | 퀴나졸리논 유도체 및 이것의 b-raf 억제제로서의 용도 |
| DE602005013248D1 (de) | 2004-08-31 | 2009-04-23 | Hoffmann La Roche | Amidderivate von 3-phenyldihydropyrimidoä4,5-düpyrimidinonen, deren herstellung und verwendung als pharmazeutische mittel |
| DE102004042667A1 (de) | 2004-09-01 | 2006-03-30 | Ewald Dörken Ag | Mehrschichtige Gebäudewand |
| CN1980970B (zh) | 2004-09-10 | 2010-05-26 | 宇部兴产株式会社 | 改性聚酰亚胺树脂和可固化的树脂组合物 |
| CA2584412C (en) | 2004-09-14 | 2017-05-09 | Minerva Biotechnologies Corporation | Methods for diagnosis and treatment of cancer |
| GB0420719D0 (en) | 2004-09-17 | 2004-10-20 | Addex Pharmaceuticals Sa | Novel allosteric modulators |
| WO2006038112A1 (en) | 2004-10-01 | 2006-04-13 | Warner-Lambert Company Llc | Use of kinase inhibitors to promote neochondrogenesis |
| FR2876582B1 (fr) | 2004-10-15 | 2007-01-05 | Centre Nat Rech Scient Cnrse | Utilisation de derives de pyrrolo-pyrazines pour la fabrication de medicaments pour le traitement de la mucoviscidose et de maladies liees a un defaut d'adressage des proteines dans les cellules |
| US20060135553A1 (en) | 2004-10-28 | 2006-06-22 | Campbell David A | Imidazole derivatives |
| US7855205B2 (en) | 2004-10-29 | 2010-12-21 | Janssen Pharmaceutica Nv | Pyrimidinyl substituted fused-pyrrolyl compounds useful in treating kinase disorders |
| KR20070074610A (ko) | 2004-11-08 | 2007-07-12 | 백스터 인터내셔널 인코포레이티드 | 튜불린 억제제의 나노미립자 조성물 |
| WO2006055752A2 (en) | 2004-11-18 | 2006-05-26 | Incyte Corporation | INHIBITORS OF 11-β HYDROXYL STEROID DEHYDROGENASE TYPE 1 AND METHODS OF USING THE SAME |
| KR20070089201A (ko) | 2004-11-22 | 2007-08-30 | 버텍스 파마슈티칼스 인코포레이티드 | 단백질 키나제 억제제로서 유용한 피롤로피라진 및피라졸로피라진 |
| KR20070085433A (ko) | 2004-11-24 | 2007-08-27 | 노파르티스 아게 | Jak 저해제들과 bcr-abl, flt-3, fak 또는raf 키나제 저해제들 중 하나 이상의 조합물 |
| MY140748A (en) | 2004-12-06 | 2010-01-15 | Astrazeneca Ab | Novel pyrrolo [3,2-d] pyrimidin-4-one derivatives and their use in therapy |
| CA2590294A1 (en) | 2004-12-13 | 2006-06-22 | Sunesis Pharmaceuticals, Inc. | Pyrido pyrimidinones, dihydro pyrimido pyrimidinones and pteridinones useful as raf kinase inhibitors |
| US20100152206A1 (en) | 2005-01-07 | 2010-06-17 | Ralph Mazitschek | Bicyclic Dihydropyrimidines and Uses Thereof |
| DE102005008310A1 (de) | 2005-02-17 | 2006-08-24 | Schering Ag | Verwendung von CDKII Inhibitoren zur Fertilitätskontrolle |
| WO2006092691A1 (en) | 2005-03-01 | 2006-09-08 | Pfizer Limited | Use of pde7 inhibitors for the treatment of neuropathic pain |
| US7402596B2 (en) | 2005-03-24 | 2008-07-22 | Renovis, Inc. | Bicycloheteroaryl compounds as P2X7 modulators and uses thereof |
| EP2527365A3 (en) | 2005-03-30 | 2013-02-20 | Minerva Biotechnologies Corporation | Proliferation of MUC1 expressing cells |
| JP2006284843A (ja) | 2005-03-31 | 2006-10-19 | Mitsui Chemicals Inc | テトラカルボン酸誘導体を用いた電子写真感光体、電子写真装置 |
| US20060223993A1 (en) | 2005-04-01 | 2006-10-05 | Connor Daniel M | Colorant compounds, intermediates, and compositions |
| JP2006316054A (ja) | 2005-04-15 | 2006-11-24 | Tanabe Seiyaku Co Ltd | 高コンダクタンス型カルシウム感受性kチャネル開口薬 |
| KR100781704B1 (ko) | 2005-04-20 | 2007-12-03 | 에스케이케미칼주식회사 | 피리딘 유도체와 이의 제조방법, 및 이를 포함하는약제조성물 |
| ES2552804T3 (es) | 2005-05-04 | 2015-12-02 | Evotec Ag | Compuestos heterocíclicos condensados, y sus composiciones y usos |
| LT2439273T (lt) | 2005-05-09 | 2019-05-10 | Ono Pharmaceutical Co., Ltd. | Žmogaus monokloniniai antikūnai prieš programuotos mirties 1(pd-1) baltymą, ir vėžio gydymo būdai, naudojant vien tik anti-pd-1 antikūnus arba derinyje su kitais imunoterapiniais vaistais |
| WO2006124731A2 (en) | 2005-05-12 | 2006-11-23 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| US8183248B2 (en) | 2005-05-13 | 2012-05-22 | Irm Llc | Substituted pyrrolo[2,3-d]pyrimidines and compositions as protein kinase inhibitors |
| WO2006135821A2 (en) | 2005-06-09 | 2006-12-21 | Achille Carlisle Tisdelle | Vehicular head and neck safety system and method |
| GB0512844D0 (en) | 2005-06-23 | 2005-08-03 | Novartis Ag | Organic compounds |
| BRPI0613361A2 (pt) | 2005-07-01 | 2011-01-04 | Medarex Inc | anticorpo monoclonal humano isolado, composição, imunoconjugado, molécula biespecìfica, molécula de ácido nucleico isolada, vetor de expressão, célula hospedeira, camundongo transgênico, método para modular uma resposta imune num indivìduo, método para inibir crescimento de células tumorais num indivìduo, método para tratar uma doença infecciosa num indivìduo, método para aumentar uma resposta imune a um antìgeno num indivìduo, método para tratar ou prevenir uma doença inflamatória num indivìduo e método para preparar o anticorpo anti-pd-l1 |
| AU2006272876A1 (en) | 2005-07-22 | 2007-02-01 | Sunesis Pharmaceuticals, Inc. | Pyrazolo pyrimidines useful as aurora kinase inhibitors |
| ES2270715B1 (es) | 2005-07-29 | 2008-04-01 | Laboratorios Almirall S.A. | Nuevos derivados de pirazina. |
| EP1910369A1 (en) | 2005-07-29 | 2008-04-16 | Astellas Pharma Inc. | Fused heterocycles as lck inhibitors |
| ATE482958T1 (de) | 2005-08-09 | 2010-10-15 | Irm Llc | Verbindungen und zusammensetzungen als proteinkinaseinhibitoren |
| KR20080035698A (ko) | 2005-08-16 | 2008-04-23 | 아이알엠 엘엘씨 | 단백질 키나제 억제제로서의 화합물 및 조성물 |
| KR101011958B1 (ko) | 2005-08-25 | 2011-01-31 | 에프. 호프만-라 로슈 아게 | p38 MAP 키나아제 저해제로서의 융합형 피라졸 |
| US7678917B2 (en) | 2005-09-01 | 2010-03-16 | Hoffman-La Roche Inc. | Factor Xa inhibitors |
| AU2006287771A1 (en) | 2005-09-06 | 2007-03-15 | Smithkline Beecham Corporation | Regioselective process for preparing benzimidazole thiophenes |
| KR20080046728A (ko) | 2005-09-15 | 2008-05-27 | 아스카 세이야쿠 가부시키가이샤 | 복소환 화합물, 그의 제조 방법 및 용도 |
| US20070116984A1 (en) | 2005-09-21 | 2007-05-24 | Doosan Corporation | Spiro-compound for electroluminescent display device and electroluminescent display device comprising the same |
| WO2007038209A2 (en) | 2005-09-23 | 2007-04-05 | Schering Corporation | Fused tetracyclic mglur1 antagonists as therapeutic agents |
| DE102005048072A1 (de) | 2005-09-24 | 2007-04-05 | Bayer Cropscience Ag | Thiazole als Fungizide |
| CA2624965A1 (en) | 2005-10-07 | 2007-04-19 | Exelixis, Inc. | Pyridopyrimidinone inhibitors of pi3k.alpha. |
| RS53627B1 (en) | 2005-10-07 | 2015-04-30 | Exelixis Inc. | N- (3-Amino-quinoxalin-2-yl) -sulfonamide derivatives and their use as phosphatidylinositol 3-kinase inhibitors |
| WO2007061554A2 (en) | 2005-10-21 | 2007-05-31 | Purdue Research Foundation | Dosage of 4-aminopyridine derivatives for treatment of central nervous system injuries |
| CA2626747A1 (en) | 2005-10-26 | 2007-05-03 | Boehringer Ingelheim International Gmbh | (hetero)aryl compounds with mch antagonistic activity and medicaments comprising these compounds |
| NZ567851A (en) | 2005-11-01 | 2011-09-30 | Targegen Inc | Bi-aryl meta-pyrimidine inhibitors of kinases |
| US8604042B2 (en) | 2005-11-01 | 2013-12-10 | Targegen, Inc. | Bi-aryl meta-pyrimidine inhibitors of kinases |
| WO2007053498A1 (en) | 2005-11-01 | 2007-05-10 | Millennium Pharmaceuticals, Inc. | Compounds useful as antagonists of ccr2 |
| EP1945222B1 (en) | 2005-11-02 | 2012-12-26 | Bayer Pharma Aktiengesellschaft | Pyrrolo[2,1-f] [1,2,4]-triazin-4-ylamines as igf-1r kinase inhibitors for the treatment of cancer and other hyperproliferative diseases |
| US20070149508A1 (en) | 2005-11-02 | 2007-06-28 | Targegen, Inc. | Six membered heteroaromatic inhibitors targeting resistant kinase mutations |
| CA2629461C (en) | 2005-11-10 | 2016-01-12 | Anita Melikian | Substituted quinolones and methods of use |
| EP1953165B1 (en) | 2005-11-10 | 2012-02-01 | Msd K.K. | Aza-substituted spiro derivative |
| WO2007058626A1 (en) | 2005-11-16 | 2007-05-24 | S*Bio Pte Ltd | Indazole compounds |
| WO2007058392A1 (ja) | 2005-11-21 | 2007-05-24 | Japan Tobacco Inc. | ヘテロ環化合物およびその医薬用途 |
| PE20070855A1 (es) | 2005-12-02 | 2007-10-14 | Bayer Pharmaceuticals Corp | Derivados de 4-amino-pirrolotriazina sustituida como inhibidores de quinasas |
| BRPI0619146A2 (pt) | 2005-12-02 | 2011-09-13 | Bayer Pharmaceuticals Corp | derivados de 4-amino-pirroltriazina substituìda úteis no tratamento de disordens e doenças hiperproliferativas associadas com angiogênesis |
| ZA200804679B (en) | 2005-12-08 | 2010-02-24 | Millenium Pharmaceuticals Inc | Bicyclic compounds with kinase inhibitory activity |
| WO2007066189A2 (en) | 2005-12-09 | 2007-06-14 | Pfizer Products Inc. | Salts, prodrugs and formulations of 1-[5-(4-amino-7-isopropyl-7h-pyrrolo[2,3-d]pyrimidine-5-carbonyl)-2-methoxy-phenyl]-3-(2,4-dichloro-phenyl)-urea |
| US20080318989A1 (en) | 2005-12-19 | 2008-12-25 | Burdick Daniel J | Pyrimidine Kinase Inhibitors |
| MEP3808A (xx) | 2005-12-21 | 2010-02-10 | Novartis Ag | Derivati pirimidinil aril uree kao fgf inhibitori |
| US7998959B2 (en) | 2006-01-12 | 2011-08-16 | Incyte Corporation | Modulators of 11-β hydroxyl steroid dehydrogenase type 1, pharmaceutical compositions thereof, and methods of using the same |
| PE20071025A1 (es) | 2006-01-31 | 2007-10-17 | Mitsubishi Tanabe Pharma Corp | Compuesto amina trisustituido |
| WO2007092879A2 (en) | 2006-02-08 | 2007-08-16 | Janssen Pharmaceutica, N.V. | Substituted thiatriazaacenaphthylene-6-carbonitrile kinase inhibitors |
| KR20080085232A (ko) | 2006-02-17 | 2008-09-23 | 화이자 리미티드 | Tlr7 조절제로서 3-데아자퓨린 유도체 |
| WO2007112347A1 (en) | 2006-03-28 | 2007-10-04 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| EP2233472B1 (en) | 2006-03-28 | 2014-01-15 | Atir Holding S.A. | Heterocyclic compounds and uses thereof in the treatment of sexual disorders |
| EP2007373A4 (en) | 2006-03-29 | 2012-12-19 | Foldrx Pharmaceuticals Inc | INHIBITION OF ALPHA SYNUCLEINE TOXICITY |
| MX2008012912A (es) | 2006-04-06 | 2008-11-26 | Wisconsin Alumni Res Found | Analogos de 2-metilen-1a,25-dihidroxi-19,21-dinorvitamina d3 y sus usos. |
| WO2007120097A1 (en) | 2006-04-13 | 2007-10-25 | Astrazeneca Ab | Thioxanthine derivatives and their use as inhibitors of mpo |
| GB0608386D0 (en) | 2006-04-27 | 2006-06-07 | Senexis Ltd | Compounds |
| US7998978B2 (en) | 2006-05-01 | 2011-08-16 | Pfizer Inc. | Substituted 2-amino-fused heterocyclic compounds |
| PT2027123E (pt) | 2006-05-11 | 2011-05-30 | Irm Llc | Compostos e composi??es como inibidores da prote?na quinase |
| BRPI0711628A2 (pt) | 2006-05-15 | 2011-12-06 | Irm Llc | composto, composição farmacêutica, uso e processo para preparação do composto |
| US7910108B2 (en) | 2006-06-05 | 2011-03-22 | Incyte Corporation | Sheddase inhibitors combined with CD30-binding immunotherapeutics for the treatment of CD30 positive diseases |
| DE102006027156A1 (de) | 2006-06-08 | 2007-12-13 | Bayer Schering Pharma Ag | Sulfimide als Proteinkinaseinhibitoren |
| CN101460165B (zh) | 2006-06-16 | 2011-03-23 | 雅宝公司 | 减少或消除爬行动物和/或它们蛋中的沙门氏菌的方法 |
| CA2656825C (en) | 2006-06-22 | 2013-12-10 | Prana Biotechnology Limited | Method of treatment and agents useful for same |
| EP2044063A1 (en) | 2006-06-30 | 2009-04-08 | Astra Zeneca AB | Pyrimidine derivatives useful in the treatment of cancer |
| WO2008005877A2 (en) | 2006-06-30 | 2008-01-10 | Board Of Regents, The University Of Texas System | Inhibitors of c-kit and uses thereof |
| JP2009542604A (ja) | 2006-07-06 | 2009-12-03 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 4−ヘテロシクロアルキルピリミジン、それらの調製方法及び医薬としての使用 |
| WO2008008234A1 (en) | 2006-07-07 | 2008-01-17 | Targegen, Inc. | 2-amino-5-substituted pyrimidine inhibitors |
| TW200811134A (en) | 2006-07-12 | 2008-03-01 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| WO2008012635A2 (en) | 2006-07-26 | 2008-01-31 | Pfizer Products Inc. | Amine derivatives useful as anticancer agents |
| EP2049481A2 (en) | 2006-08-09 | 2009-04-22 | SmithKline Beecham Corporation | Novel compounds as antagonists or inverse agonists for opioid receptors |
| EP2056829B9 (en) | 2006-08-16 | 2012-09-26 | Exelixis, Inc. | Using pi3k and mek modulators in treatments of cancer |
| DE102006041382A1 (de) | 2006-08-29 | 2008-03-20 | Bayer Schering Pharma Ag | Carbamoyl-Sulfoximide als Proteinkinaseinhibitoren |
| MX2009002298A (es) | 2006-09-01 | 2009-06-04 | Cylene Pharmaceuticals Inc | Moduladores de serina-treonina proteina quinasa y de parp. |
| WO2008079460A2 (en) | 2006-09-05 | 2008-07-03 | Emory University | Tyrosine kinase inhibitors for prevention or treatment of infection |
| WO2008033858A2 (en) | 2006-09-11 | 2008-03-20 | Cgi Pharmaceuticals, Inc. | Kinase inhibitors, and methods of using and identifying kinase inhibitors |
| US7897762B2 (en) | 2006-09-14 | 2011-03-01 | Deciphera Pharmaceuticals, Llc | Kinase inhibitors useful for the treatment of proliferative diseases |
| WO2008034859A1 (en) | 2006-09-21 | 2008-03-27 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted difluorobenzyl-benzene derivatives, medicaments containing such compounds, their use and process for their manufacture |
| US20080176891A1 (en) | 2006-09-22 | 2008-07-24 | Paul Bamborough | Novel compounds |
| KR20090073120A (ko) | 2006-09-28 | 2009-07-02 | 노파르티스 아게 | 피라졸로[1,5-a]피리미딘 유도체 및 이들의 치료 용도 |
| US8202876B2 (en) | 2006-10-02 | 2012-06-19 | Irm Llc | Compounds and compositions as protein kinase inhibitors |
| EP2077841A1 (en) | 2006-10-30 | 2009-07-15 | Glaxo Group Limited | Novel substituted pyrimidines as cysteine protease inhibitors |
| US7858645B2 (en) | 2006-11-01 | 2010-12-28 | Hoffmann-La Roche Inc. | Indazole derivatives |
| EP2081928B1 (en) | 2006-11-10 | 2014-02-26 | Bristol-Myers Squibb Company | Pyrrolo-pyridine kinase inhibitors |
| US7902363B2 (en) | 2006-11-17 | 2011-03-08 | Polyera Corporation | Diimide-based semiconductor materials and methods of preparing and using the same |
| WO2008063583A1 (en) | 2006-11-17 | 2008-05-29 | Polyera Corporation | Acene-based organic semiconductor materials and methods of preparing and using the same |
| KR20080045536A (ko) | 2006-11-20 | 2008-05-23 | 에스케이케미칼주식회사 | 피리딘 화합물을 포함하는 간염 치료 및 예방 또는 간 보호효능을 갖는 약제 조성물 |
| MX2009006466A (es) | 2006-12-13 | 2009-06-26 | Schering Corp | Metodos de tratamiento de cancer con inhibidores del receptor del factor 1 de crecimiento similar a la insulina. |
| WO2008071455A1 (en) | 2006-12-15 | 2008-06-19 | Bayer Schering Pharma Aktiengesellschaft | Bicyclic acyltryptophanols |
| WO2008074068A1 (en) | 2006-12-20 | 2008-06-26 | Prana Biotechnology Limited | Substituted quinoline derivatives as antiamyloidogeneic agents |
| US7737149B2 (en) | 2006-12-21 | 2010-06-15 | Astrazeneca Ab | N-[5-[2-(3,5-dimethoxyphenyl)ethyl]-2H-pyrazol-3-yl]-4-(3,5-dimethylpiperazin-1-yl)benzamide and salts thereof |
| CA2672172C (en) * | 2006-12-22 | 2016-05-03 | Astex Therapeutics Limited | Bicyclic heterocyclic compounds as fgfr inhibitors |
| CN101568529A (zh) | 2006-12-22 | 2009-10-28 | 诺瓦提斯公司 | 作为cdk抑制剂、用于治疗癌症、炎症和病毒感染的杂芳基-杂芳基化合物 |
| JP5442449B2 (ja) | 2006-12-22 | 2014-03-12 | アステックス、セラピューティックス、リミテッド | 新規化合物 |
| FR2911140B1 (fr) | 2007-01-05 | 2009-02-20 | Sanofi Aventis Sa | Nouveaux derives de 2-anilino 4-heteroaryle pyrimides, leur preparation a titre de medicaments, compositions pharmaceutiques et notamment comme inhibiteurs de ikk |
| EP2104676A2 (en) | 2007-01-08 | 2009-09-30 | Polyera Corporation | Methods for preparing arene-bis(dicarboximide)-based semiconducting materials and related intermediates for preparing same |
| CN101007778A (zh) | 2007-01-10 | 2007-08-01 | 复旦大学 | 一种链延长型芴基双马来酰亚胺及其制备方法 |
| EP2123651A4 (en) | 2007-01-12 | 2011-05-04 | Astellas Pharma Inc | CONDENSED PYRIDINE COMPOUND |
| CA2674589A1 (en) | 2007-01-12 | 2008-07-24 | Biocryst Pharmaceuticals, Inc. | Antiviral nucleoside analogs |
| FR2911604B1 (fr) | 2007-01-19 | 2009-04-17 | Sanofi Aventis Sa | Derives de n-(heteroaryl-1h-indole-2-carboxamides, leur preparation et leur application en therapeutique |
| JP5358962B2 (ja) | 2007-02-06 | 2013-12-04 | 住友化学株式会社 | 組成物及び該組成物を用いてなる発光素子 |
| JP2008198769A (ja) | 2007-02-13 | 2008-08-28 | Nippon Steel Chem Co Ltd | 有機エレクトロルミネッセント素子 |
| BRPI0808422A2 (pt) | 2007-03-06 | 2015-06-23 | Novartis Ag | Compostos orgânicos bicíclicos adequados para o tratamento de condições inflamatórias ou alérgicas |
| CA2680312A1 (en) | 2007-03-07 | 2008-09-12 | Alantos Pharmaceuticals Holding, Inc. | Metalloprotease inhibitors containing a heterocyclic moiety |
| KR101737753B1 (ko) | 2007-03-12 | 2017-05-18 | 와이엠 바이오사이언시즈 오스트레일리아 피티와이 엘티디 | 페닐 아미노 피리미딘 화합물 및 이의 용도 |
| US20080234262A1 (en) | 2007-03-21 | 2008-09-25 | Wyeth | Pyrazolopyrimidine analogs and their use as mtor kinase and pi3 kinase inhibitors |
| AU2007227278B2 (en) | 2007-03-21 | 2014-09-11 | Epix Pharmaceuticals, Inc. | SIP receptor modulating compounds and use thereof |
| JP2010522177A (ja) | 2007-03-23 | 2010-07-01 | アムジエン・インコーポレーテツド | 複素環化合物およびその使用 |
| EP2896624B1 (en) | 2007-03-28 | 2016-07-13 | Atir Holding S.A. | Heterotricyclic compounds as serotonergic and/or dopaminergic agents and uses thereof |
| KR20080091948A (ko) | 2007-04-10 | 2008-10-15 | 에스케이케미칼주식회사 | 락탐형 피리딘 화합물을 포함하는 허혈성 질환의 예방 및치료용 약학조성물 |
| KR20100016477A (ko) | 2007-04-12 | 2010-02-12 | 어드밴스드 테크놀러지 머티리얼즈, 인코포레이티드 | Ald/cvd용의 지르코늄, 하프늄, 티타늄 및 규소 전구체 |
| JP2010524941A (ja) | 2007-04-20 | 2010-07-22 | シェーリング コーポレイション | ピリミジノン誘導体およびそれらの使用方法 |
| EP1985612A1 (en) | 2007-04-26 | 2008-10-29 | Bayer Schering Pharma Aktiengesellschaft | Arymethylen substituted N-Acyl-gamma-aminoalcohols |
| PE20090288A1 (es) | 2007-05-10 | 2009-04-03 | Smithkline Beecham Corp | Derivados de quinoxalina como inhibidores de la pi3 quinasa |
| EP1990342A1 (en) * | 2007-05-10 | 2008-11-12 | AEterna Zentaris GmbH | Pyridopyrazine Derivatives, Process of Manufacturing and Uses thereof |
| WO2008144253A1 (en) | 2007-05-14 | 2008-11-27 | Irm Llc | Protein kinase inhibitors and methods for using thereof |
| GB2449293A (en) | 2007-05-17 | 2008-11-19 | Evotec | Compounds having Hsp90 inhibitory activity |
| CA2689282A1 (en) | 2007-06-03 | 2008-12-11 | Vanderbilt University | Benzamide mglur5 positive allosteric modulators and methods of making and using same |
| WO2008153852A1 (en) | 2007-06-07 | 2008-12-18 | Merck & Co., Inc. | Tricyclic anilide heterocyclic cgrp receptor antagonists |
| US7928111B2 (en) | 2007-06-08 | 2011-04-19 | Senomyx, Inc. | Compounds including substituted thienopyrimidinone derivatives as ligands for modulating chemosensory receptors |
| US8633186B2 (en) | 2007-06-08 | 2014-01-21 | Senomyx Inc. | Modulation of chemosensory receptors and ligands associated therewith |
| PL2168966T3 (pl) | 2007-06-15 | 2017-06-30 | Msd K.K. | Pochodna bicykloaniliny |
| BR122017025062B8 (pt) | 2007-06-18 | 2021-07-27 | Merck Sharp & Dohme | anticorpo monoclonal ou fragmento de anticorpo para o receptor de morte programada humano pd-1, polinucleotídeo e composição compreendendo o referido anticorpo ou fragmento |
| EP2018859A1 (en) | 2007-07-26 | 2009-01-28 | Bayer Schering Pharma Aktiengesellschaft | Arylmethylene substituted N-acyl-beta-amino alcohols |
| EA201000123A1 (ru) | 2007-07-26 | 2010-08-30 | Новартис Аг | Органические соединения |
| EP2020404A1 (en) | 2007-08-01 | 2009-02-04 | Bayer Schering Pharma Aktiengesellschaft | Cyanomethyl substituted N-Acyl Tryptamines |
| EP2173354A4 (en) | 2007-08-09 | 2011-10-05 | Glaxosmithkline Llc | CHINOXALIN DERIVATIVES AS PI3 KINASE INHIBITORS |
| WO2009019518A1 (en) | 2007-08-09 | 2009-02-12 | Astrazeneca Ab | Pyrimidine compounds having a fgfr inhibitory effect |
| US7960400B2 (en) | 2007-08-27 | 2011-06-14 | Duquesne University Of The Holy Ghost | Tricyclic compounds having cytostatic and/or cytotoxic activity and methods of use thereof |
| WO2009029625A1 (en) | 2007-08-27 | 2009-03-05 | Kalypsys, Inc. | 4- [heterocyclyl-methyl] -8-fluoro-quinolin-2-ones useful as nitric oxide synthase inhibitors |
| ES2535166T3 (es) | 2007-09-04 | 2015-05-06 | The Scripps Research Institute | Pirimidinil-aminas sustituidas como inhibidores de proteína-quinasas |
| WO2009030871A1 (en) | 2007-09-07 | 2009-03-12 | Vernalis R & D Ltd | Pyrrolopyrimidine derivatives having hsp90 inhibitory activity |
| TW200920357A (en) | 2007-09-10 | 2009-05-16 | Curis Inc | HSP90 inhibitors containing a zinc binding moiety |
| KR101660989B1 (ko) | 2007-10-01 | 2016-09-28 | 아이오니스 파마수티컬즈, 인코포레이티드 | 섬유아세포 성장 인자 수용체 4 발현의 안티센스 조절 |
| CA2701406C (en) | 2007-10-05 | 2016-01-26 | Banyu Pharmaceutical Co., Ltd. | Benzoxazinone derivative |
| WO2009047255A1 (en) | 2007-10-09 | 2009-04-16 | Ucb Pharma, S.A. | Heterobicyclic compounds as histamine h4-receptor antagonists |
| WO2009049018A1 (en) | 2007-10-10 | 2009-04-16 | Syndax Pharmaceuticals, Inc. | Novel compounds and methods of using them |
| US8513233B2 (en) | 2007-10-11 | 2013-08-20 | Shanghai Institute Of Materia Medica, Cas | Pyrimidinyl-propionic acid derivatives and their use as PPAR agonists |
| GB0720038D0 (en) | 2007-10-12 | 2007-11-21 | Astex Therapeutics Ltd | New compounds |
| GB0720041D0 (en) | 2007-10-12 | 2007-11-21 | Astex Therapeutics Ltd | New Compounds |
| WO2009047993A1 (ja) | 2007-10-13 | 2009-04-16 | Konica Minolta Holdings, Inc. | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| MX2010004260A (es) | 2007-10-16 | 2010-04-30 | Wyeth Llc | Compuestos de tienopirimidina y pirazolopirimidina y su uso como inhibidores de mtor cinasa y pi3 cinasa. |
| MX2010004244A (es) | 2007-10-17 | 2010-04-30 | Novartis Ag | Derivados de imidazo [i,2-a]-piridina utiles como inhibidores de cinasa tipo activina (alk). |
| CN101910158A (zh) | 2007-10-25 | 2010-12-08 | 阿斯利康(瑞典)有限公司 | 可用于治疗细胞增殖性病症的吡啶衍生物和吡嗪衍生物 |
| RU2007139634A (ru) | 2007-10-25 | 2009-04-27 | Сергей Олегович Бачурин (RU) | Новые тиазол-, триазол- или оксадиазол-содержащие тетрациклические соединения |
| WO2009056886A1 (en) | 2007-11-01 | 2009-05-07 | Astrazeneca Ab | Pyrimidine derivatives and their use as modulators of fgfr activity |
| EA019869B1 (ru) | 2007-11-28 | 2014-06-30 | Дана Фарбер Кансер Инститьют, Инк. | Низкомолекулярные миристатные ингибиторы тирозинкиназы bcr-abl и способы их применения |
| JP2011505407A (ja) | 2007-12-03 | 2011-02-24 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 過剰な又は異常な細胞増殖を特徴とする疾患を治療するためのジアミノピリジン |
| AU2008343932B2 (en) | 2007-12-19 | 2013-08-15 | Amgen Inc. | Fused pyridine, pyrimidine and triazine compounds as cell cycle inhibitors |
| AU2008345225A1 (en) | 2007-12-21 | 2009-07-09 | University Of Rochester | Method for altering the lifespan of eukaryotic organisms |
| AU2008345688A1 (en) | 2007-12-21 | 2009-07-09 | Wyeth Llc | Imidazo [1,2-b] pyridazine compounds as modulators of liver X receptors |
| WO2009086509A2 (en) | 2007-12-27 | 2009-07-09 | Purdue Research Foundation | Reagents for biomolecular labeling, detection and quantification employing raman spectroscopy |
| FR2926297B1 (fr) | 2008-01-10 | 2013-03-08 | Centre Nat Rech Scient | Molecules chimiques inhibitrices du mecanisme d'epissage pour traiter des maladies resultant d'anomalies d'epissage. |
| EP2248814A4 (en) | 2008-01-24 | 2011-01-12 | Alla Chem Llc | SUBSTITUTED CYCLOALKAN [E AND D] PYRAZOLO [1,5-A] PYRIMIDINES / ANTAGONISTS OF SEROTONIN 5-HT6 RECEPTORS AND PROCESS FOR THEIR PREPARATION AND THEIR USE |
| JP2011510044A (ja) | 2008-01-24 | 2011-03-31 | ユセベ ファルマ ソシエテ アノニム | シクロブトキシ基を含む化合物 |
| KR20100119776A (ko) | 2008-01-24 | 2010-11-10 | 알라 캠, 엘엘씨 | 2-알킬아미노-3-아릴설포닐-사이클로알카노[e 또는 d]피라졸로[1,5-A]피리미딘/세로토닌 5-HT6 수용체의 길항제, 이의 제조방법 및 이의 용도 |
| EA018462B1 (ru) | 2008-01-25 | 2013-08-30 | ХАЙ ПОЙНТ ФАРМАСЬЮТИКАЛЗ, ЭлЭлСи | ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК МОДУЛЯТОРЫ СИНТЕЗА TNF-α И КАК ИНГИБИТОРЫ PDE4 |
| WO2009097446A1 (en) | 2008-01-30 | 2009-08-06 | Genentech, Inc. | Pyrazolopyrimidine pi3k inhibitor compounds and methods of use |
| EP2265270A1 (en) | 2008-02-04 | 2010-12-29 | OSI Pharmaceuticals, Inc. | 2-aminopyridine kinase inhibitors |
| RU2010137300A (ru) | 2008-02-22 | 2012-03-27 | Ф. Хоффманн-Ля Рош Аг (Ch) | Модуляторы бета-амилоида |
| JP2011513233A (ja) | 2008-02-22 | 2011-04-28 | アイアールエム・リミテッド・ライアビリティ・カンパニー | Gpr119活性モジュレーターとしての化合物および組成物 |
| JP5451646B2 (ja) | 2008-02-27 | 2014-03-26 | ヴァイティー ファーマシューティカルズ,インコーポレイテッド | 11β−ヒドロキシステロイドデヒドロゲナーゼ1型の阻害剤 |
| WO2009108827A1 (en) | 2008-02-29 | 2009-09-03 | Wyeth | Fused tricyclic pyrazolo[1, 5-a]pyrimidines, methods for preparation and uses thereof |
| EP2262837A4 (en) | 2008-03-12 | 2011-04-06 | Merck Sharp & Dohme | PD-1 BINDING PROTEINS |
| GB0804701D0 (en) | 2008-03-13 | 2008-04-16 | Amura Therapeutics Ltd | Compounds |
| JP5547099B2 (ja) | 2008-03-14 | 2014-07-09 | インテリカイン, エルエルシー | キナーゼ阻害剤および使用方法 |
| WO2009114874A2 (en) | 2008-03-14 | 2009-09-17 | Intellikine, Inc. | Benzothiazole kinase inhibitors and methods of use |
| US20090246198A1 (en) | 2008-03-31 | 2009-10-01 | Takeda Pharmaceutical Company Limited | Mapk/erk kinase inhibitors and methods of use thereof |
| WO2009122180A1 (en) | 2008-04-02 | 2009-10-08 | Medical Research Council | Pyrimidine derivatives capable of inhibiting one or more kinases |
| US8436005B2 (en) | 2008-04-03 | 2013-05-07 | Abbott Laboratories | Macrocyclic pyrimidine derivatives |
| WO2009126584A1 (en) | 2008-04-07 | 2009-10-15 | Amgen Inc. | Gem-disubstituted and spirocyclic amino pyridines/pyrimidines as cell cycle inhibitors |
| WO2009124755A1 (en) | 2008-04-08 | 2009-10-15 | European Molecular Biology Laboratory (Embl) | Compounds with novel medical uses and method of identifying such compounds |
| WO2009125809A1 (ja) | 2008-04-11 | 2009-10-15 | 第一三共株式会社 | ピペリジン誘導体 |
| WO2009125808A1 (ja) | 2008-04-11 | 2009-10-15 | 第一三共株式会社 | アミノシクロヘキシル誘導体 |
| WO2009128520A1 (ja) | 2008-04-18 | 2009-10-22 | 塩野義製薬株式会社 | P13k阻害活性を有する複素環化合物 |
| NZ588830A (en) | 2008-04-22 | 2012-11-30 | Portola Pharm Inc | Inhibitors of protein kinases |
| US8309577B2 (en) | 2008-04-23 | 2012-11-13 | Bristol-Myers Squibb Company | Quinuclidine compounds as α-7 nicotinic acetylcholine receptor ligands |
| US7863291B2 (en) | 2008-04-23 | 2011-01-04 | Bristol-Myers Squibb Company | Quinuclidine compounds as alpha-7 nicotinic acetylcholine receptor ligands |
| CN102015704A (zh) | 2008-04-29 | 2011-04-13 | 霍夫曼-拉罗奇有限公司 | Jnk的嘧啶基吡啶酮抑制剂 |
| MX342553B (es) | 2008-04-29 | 2016-10-04 | Novartis Ag | Metodos para monitorear la modulacion de la actividad de cinasa del receptor del factor de crecimiento de fibroblastos y uso de dichos metodos. |
| AR071523A1 (es) | 2008-04-30 | 2010-06-23 | Merck Serono Sa | Compuestos biciclicos fusionados, un proceso para su preparacion, el compuesto para ser utilizado como medicamento en el tratamiento y profilaxis de enfermedades, una composicion farmaceutica y un conjunto que comprende paquetes separados del compuesto y de un ingrediente activo del medicamento |
| US9315449B2 (en) | 2008-05-15 | 2016-04-19 | Duke University | Substituted pyrazoles as heat shock transcription factor activators |
| MY155535A (en) | 2008-05-23 | 2015-10-30 | Novartis Ag | Derivatives of quinolines and quinoxalines as protien tyrosine kinase inhibitors |
| WO2009144205A1 (en) | 2008-05-30 | 2009-12-03 | Basf Se | Rylene-based semiconductor materials and methods of preparation and use thereof |
| CA2726317A1 (en) | 2008-06-03 | 2009-12-10 | Merck Sharp & Dohme Corp. | Inhibitors of akt activity |
| CN102089403A (zh) | 2008-06-10 | 2011-06-08 | 巴斯夫欧洲公司 | 新型过渡金属配合物及其在有机发光二极管中的用途-ⅲ |
| WO2009151997A1 (en) | 2008-06-12 | 2009-12-17 | Merck & Co., Inc. | Process for producing bicycloaniline derivatives |
| GB0810902D0 (en) | 2008-06-13 | 2008-07-23 | Astex Therapeutics Ltd | New compounds |
| CN102123989A (zh) | 2008-06-19 | 2011-07-13 | 阿斯利康(瑞典)有限公司 | 吡唑化合物436 |
| WO2009157423A1 (ja) | 2008-06-24 | 2009-12-30 | 財団法人乙卯研究所 | 縮合環を有するオキサゾリジノン誘導体 |
| US8338439B2 (en) | 2008-06-27 | 2012-12-25 | Celgene Avilomics Research, Inc. | 2,4-disubstituted pyrimidines useful as kinase inhibitors |
| EP2303881A2 (en) | 2008-07-14 | 2011-04-06 | Gilead Sciences, Inc. | Fused heterocyclyc inhibitors of histone deacetylase and/or cyclin-dependent kinases |
| CA2726460C (en) | 2008-07-15 | 2017-02-21 | F. Hoffmann-La Roche Ag | Novel phenyl-imidazopyridines and pyridazines |
| WO2010007099A1 (en) | 2008-07-15 | 2010-01-21 | Cellzome Limited | 2-aminoimidazo[1,2-b]pyridazine derivatives as pi3k inhibitors |
| EP2328897A1 (en) | 2008-07-16 | 2011-06-08 | Schering Corporation | Bicyclic heterocycle derivatives and their use as gpcr modulators |
| CA2730593A1 (en) | 2008-07-16 | 2010-01-21 | Schering Corporation | Bicyclic heterocycle derivatives and use thereof as gpr119 modulators |
| UY31982A (es) | 2008-07-16 | 2010-02-26 | Boehringer Ingelheim Int | Derivados de 1,2-dihidropiridin-3-carboxamidas n-sustituidas |
| US10722562B2 (en) | 2008-07-23 | 2020-07-28 | Immudex Aps | Combinatorial analysis and repair |
| WO2010017047A1 (en) | 2008-08-05 | 2010-02-11 | Merck & Co., Inc. | Therapeutic compounds |
| WO2010015643A1 (en) | 2008-08-06 | 2010-02-11 | Novartis Ag | New antiviral modified nucleosides |
| US9284297B2 (en) | 2008-08-11 | 2016-03-15 | President And Fellows Of Harvard College | Halofuginone analogs for inhibition of tRNA synthetases and uses thereof |
| UY32049A (es) | 2008-08-14 | 2010-03-26 | Takeda Pharmaceutical | Inhibidores de cmet |
| WO2010030027A1 (en) | 2008-09-10 | 2010-03-18 | Mitsubishi Tanabe Pharma Corporation | Aromatic nitrogen-containing 6-membered ring compounds and their use |
| CA2738252C (en) | 2008-09-26 | 2018-05-01 | Dana-Farber Cancer Institute, Inc. | Human anti-pd-1, pd-l1, and pd-l2 antibodies and uses therefor |
| UY32158A (es) | 2008-10-03 | 2010-04-30 | Astrazeneca Ab | Derivados heterociclicos y metodos de uso de los mismos |
| US20100267748A1 (en) | 2008-10-15 | 2010-10-21 | Gilead Palo Alto, Inc. | HETEROCYCLIC COMPOUNDS USEFUL AS STEAROYL CoA DESATURASE INHIBITORS |
| US8110578B2 (en) | 2008-10-27 | 2012-02-07 | Signal Pharmaceuticals, Llc | Pyrazino[2,3-b]pyrazine mTOR kinase inhibitors for oncology indications and diseases associated with the mTOR/PI3K/Akt pathway |
| UY32203A (es) | 2008-10-29 | 2010-05-31 | Astrazeneca Ab | Amino pirimidinas y su uso en terapia |
| US8476431B2 (en) | 2008-11-03 | 2013-07-02 | Itellikine LLC | Benzoxazole kinase inhibitors and methods of use |
| WO2010052448A2 (en) | 2008-11-05 | 2010-05-14 | Ucb Pharma S.A. | Fused pyrazine derivatives as kinase inhibitors |
| WO2010059552A1 (en) | 2008-11-18 | 2010-05-27 | Glaxosmithkline Llc | Prolyl hydroxylase inhibitors |
| ES2548141T3 (es) | 2008-11-20 | 2015-10-14 | Glaxosmithkline Llc | Compuestos químicos |
| JP5522053B2 (ja) | 2008-12-03 | 2014-06-18 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料、表示装置及び照明装置 |
| KR101061599B1 (ko) | 2008-12-05 | 2011-09-02 | 한국과학기술연구원 | 비정상 세포 성장 질환의 치료를 위한 단백질 키나아제 저해제인 신규 인다졸 유도체, 이의 약학적으로 허용가능한염 및 이를 유효성분으로 함유하는 약학적 조성물 |
| MX2011006108A (es) | 2008-12-08 | 2011-11-18 | Vm Pharma Llc | Composiciones de inhibidores de los receptores tirosina quinasa. |
| US8110265B2 (en) | 2008-12-09 | 2012-02-07 | The Coca-Cola Company | Pet container and compositions having enhanced mechanical properties and gas barrier properties |
| SI4209510T1 (sl) | 2008-12-09 | 2024-04-30 | F. Hoffmann-La Roche Ag | Protitelesa anti-PD-L1 in njihova uporaba za izboljšanje funkcije celic T |
| US8575179B2 (en) | 2008-12-12 | 2013-11-05 | Msd K.K. | Dihydropyrazolopyrimidinone derivatives |
| WO2010067886A1 (en) | 2008-12-12 | 2010-06-17 | Banyu Pharmaceutical Co.,Ltd. | Dihydropyrimidopyrimidine derivative |
| BRPI0918360A8 (pt) | 2008-12-19 | 2017-12-05 | Genentech Inc | Composto, composição farmacêutica e usos de um composto |
| JO2885B1 (en) | 2008-12-22 | 2015-03-15 | ايلي ليلي اند كومباني | Protein kinase inhibitors |
| MX2011006959A (es) | 2008-12-30 | 2011-12-06 | Arqule Inc | Compuestos substituidos de 5,6-dihidro-6-fenilbenzo [f] isoquinolina-2-amina. |
| WO2010078427A1 (en) | 2008-12-30 | 2010-07-08 | Arqule, Inc. | Substituted pyrazolo [3, 4-b] pyridine compounds |
| EP3828185A3 (en) | 2009-01-06 | 2021-09-01 | Dana Farber Cancer Institute, Inc. | Pyrimido-diazepinone kinase scaffold compounds and methods of treating disorders |
| JOP20190230A1 (ar) | 2009-01-15 | 2017-06-16 | Incyte Corp | طرق لاصلاح مثبطات انزيم jak و المركبات الوسيطة المتعلقة به |
| WO2010083145A1 (en) | 2009-01-16 | 2010-07-22 | Merck Sharp & Dohme Corp. | IMIDAZO[1,2-a]PYRIDINES AND IMIDAZO[1,2-b]PYRIDAZINES AS MARK INHIBITORS |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| JP2010180147A (ja) | 2009-02-04 | 2010-08-19 | Mitsubishi Gas Chemical Co Inc | シアン酸エステル化合物、およびその硬化物 |
| WO2010089411A2 (en) | 2009-02-09 | 2010-08-12 | Universite De La Mediterranee | Pd-1 antibodies and pd-l1 antibodies and uses thereof |
| TW201038569A (en) | 2009-02-16 | 2010-11-01 | Abbott Gmbh & Co Kg | Heterocyclic compounds, pharmaceutical compositions containing them, and their use in therapy |
| TW201035102A (en) | 2009-03-04 | 2010-10-01 | Gruenethal Gmbh | Sulfonylated tetrahydroazolopyrazines and their use as medicinal products |
| WO2010103306A1 (en) | 2009-03-10 | 2010-09-16 | Astrazeneca Uk Limited | Benzimidazole derivatives and their use as antivaral agents |
| JP5615261B2 (ja) | 2009-03-11 | 2014-10-29 | 学校法人関西学院 | 多環芳香族化合物 |
| WO2010107768A1 (en) | 2009-03-18 | 2010-09-23 | Schering Corporation | Bicyclic compounds as inhibitors of diacylglycerol acyltransferase |
| JP2012521988A (ja) | 2009-03-23 | 2012-09-20 | シーメンス メディカル ソリューションズ ユーエスエー インコーポレイテッド | 神経学的障害を検知するためのイメージング剤 |
| WO2010111573A1 (en) | 2009-03-27 | 2010-09-30 | Abbott Laboratories | Compounds as cannabinoid receptor ligands |
| TW201102391A (en) | 2009-03-31 | 2011-01-16 | Biogen Idec Inc | Certain substituted pyrimidines, pharmaceutical compositions thereof, and methods for their use |
| JP5629752B2 (ja) | 2009-04-06 | 2014-11-26 | ユニバーシティ・ヘルス・ネットワークUniversity Health Network | キナーゼインヒビターおよびこれを用いた癌の治療方法 |
| EA020825B1 (ru) | 2009-04-07 | 2015-02-27 | Эмерити Фарма Аб | Аналоги изоксазол-3(2h)-она в качестве терапевтических агентов |
| GB0906472D0 (en) | 2009-04-15 | 2009-05-20 | Astex Therapeutics Ltd | New compounds |
| GB0906470D0 (en) | 2009-04-15 | 2009-05-20 | Astex Therapeutics Ltd | New compounds |
| JP5531446B2 (ja) | 2009-04-20 | 2014-06-25 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料、表示装置および照明装置 |
| ES2347630B1 (es) | 2009-04-29 | 2011-09-08 | Universitat Ramon Llull | Sintesis y usos de 4-cianopentanoatos y 4-cianopentenoatos sustituidos. |
| US8765754B2 (en) | 2009-04-29 | 2014-07-01 | Locus Pharmaceuticals, Inc. | Pyrrolotriazine compounds |
| US20100280067A1 (en) | 2009-04-30 | 2010-11-04 | Pakala Kumara Savithru Sarma | Inhibitors of acetyl-coa carboxylase |
| US9616244B2 (en) | 2009-05-01 | 2017-04-11 | Heartsine Technologies Limited | External defibrillator |
| AR078411A1 (es) | 2009-05-07 | 2011-11-09 | Lilly Co Eli | Compuesto de vinil imidazolilo y composicion farmaceutica que lo comprende |
| JP5600891B2 (ja) | 2009-05-15 | 2014-10-08 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置および照明装置 |
| JP5604808B2 (ja) | 2009-05-20 | 2014-10-15 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP5568889B2 (ja) | 2009-05-22 | 2014-08-13 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置及び有機エレクトロルミネッセンス素子材料 |
| JP5629980B2 (ja) | 2009-05-22 | 2014-11-26 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP2012528083A (ja) | 2009-05-27 | 2012-11-12 | コーベンハブンス ウニベルシテト | Ncamに結合する線維芽細胞増殖因子レセプター由来ペプチド |
| JP5499519B2 (ja) | 2009-05-27 | 2014-05-21 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| GB0910003D0 (en) | 2009-06-11 | 2009-07-22 | Univ Leuven Kath | Novel compounds for the treatment of neurodegenerative diseases |
| JP5600894B2 (ja) | 2009-06-24 | 2014-10-08 | コニカミノルタ株式会社 | 白色有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| EP2445502B2 (en) | 2009-06-25 | 2022-09-28 | Alkermes Pharma Ireland Limited | Heterocyclic compounds for the treatment of neurological and psychological disorders |
| CN102471261B (zh) | 2009-06-30 | 2014-10-29 | 日本瑞翁株式会社 | 二芳基胺化合物、以及抗老化剂、聚合物组合物、橡胶交联物及其成型品、以及二芳基胺化合物的制备方法 |
| US20120135997A1 (en) | 2009-07-17 | 2012-05-31 | Shionogi & Co., Ltd. | Pharmaceutical composition comprising a lactam or benzenesulfonamide compound |
| WO2011011597A1 (en) | 2009-07-24 | 2011-01-27 | Duke University | Prochelators useful for inhibiting metal-associated toxicity |
| FR2948568B1 (fr) | 2009-07-30 | 2012-08-24 | Sanofi Aventis | Formulation pharmaceutique |
| TWI468402B (zh) | 2009-07-31 | 2015-01-11 | 必治妥美雅史谷比公司 | 降低β-類澱粉生成之化合物 |
| CA2770140A1 (en) | 2009-08-05 | 2011-02-10 | Yitsun Richard Kao | Antiviral compounds and methods of making and using thereof cross reference to related applications |
| JP2012197231A (ja) | 2009-08-06 | 2012-10-18 | Oncotherapy Science Ltd | Ttk阻害作用を有するピリジンおよびピリミジン誘導体 |
| BR112012008094A2 (pt) | 2009-08-07 | 2020-08-18 | Chugai Seiyaku Kabushiki Kaisha | derivado de aminopirazol, seu uso, composição farmacêutica que o compreende, agentes para inibir a atividade de fgfr e para prevenir ou tratar câncer |
| WO2011018894A1 (en) | 2009-08-10 | 2011-02-17 | Raqualia Pharma Inc. | Pyrrolopyrimidine derivatives as potassium channel modulators |
| NZ620020A (en) | 2009-08-17 | 2015-06-26 | Intellikine Llc | Heterocyclic compounds and uses thereof |
| JP5577650B2 (ja) | 2009-08-24 | 2014-08-27 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料、表示装置及び照明装置 |
| KR101184115B1 (ko) | 2009-08-31 | 2012-09-18 | 일동제약주식회사 | 신규 펩티드 데포르밀라제 저해제 화합물 및 그 제조방법 |
| WO2011028947A2 (en) | 2009-09-03 | 2011-03-10 | Bioenergenix | Heterocyclic compounds for the inhibition of pask |
| EP2473498A1 (en) | 2009-09-04 | 2012-07-11 | Bayer Pharma Aktiengesellschaft | Substituted aminoquinoxalines as tyrosine threonine kinase inhibitors |
| WO2011031740A1 (en) | 2009-09-09 | 2011-03-17 | Achaogen, Inc. | Antibacterial fluoroquinolone analogs |
| WO2011032050A2 (en) | 2009-09-11 | 2011-03-17 | Trius Therapeutics, Inc. | Gyrase inhibitors |
| WO2011041143A1 (en) | 2009-10-01 | 2011-04-07 | Merck Sharp & Dohme Corp. | HETEROCYCLIC-FUSED PYRAZOLO[4,3-c]PYRIDIN-3-ONE M1 RECEPTOR POSITIVE ALLOSTERIC MODULATORS |
| US8466155B2 (en) | 2009-10-02 | 2013-06-18 | Boehringer Ingelheim International Gmbh | Pyrimidines |
| GB0917571D0 (en) | 2009-10-07 | 2009-11-25 | Karobio Ab | Novel estrogen receptor ligands |
| EP2308866A1 (de) | 2009-10-09 | 2011-04-13 | Bayer CropScience AG | Phenylpyri(mi)dinylpyrazole und ihre Verwendung als Fungizide |
| FR2951172B1 (fr) | 2009-10-13 | 2014-09-26 | Pf Medicament | Derives pyrazolopyridines en tant qu'agent anticancereux |
| WO2011049988A2 (en) | 2009-10-20 | 2011-04-28 | Eiger Biopharmaceuticals, Inc. | Indazoles to treat flaviviridae virus infection |
| KR20110043270A (ko) | 2009-10-21 | 2011-04-27 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 구비한 유기발광소자 |
| SG10201406813RA (en) | 2009-10-22 | 2014-11-27 | Gilead Sciences Inc | Derivatives of purine or deazapurine useful for the treatment of (inter alia) viral infections |
| WO2011050245A1 (en) | 2009-10-23 | 2011-04-28 | Yangbo Feng | Bicyclic heteroaryls as kinase inhibitors |
| CN102686225A (zh) | 2009-10-26 | 2012-09-19 | 西格诺药品有限公司 | 杂芳基化合物的合成和纯化方法 |
| ES2524548T3 (es) | 2009-10-30 | 2014-12-10 | Novartis Ag | N-óxido de 3-(2,6-dicloro-3,5-dimetoxi-fenil)-1-{6-[4-(4-etil-piperacin-1-il)-fenilamino]-pirimidin-4-il}-1-metil-urea |
| KR20110049217A (ko) | 2009-11-04 | 2011-05-12 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 전계 발광 소자 |
| GB0919432D0 (en) | 2009-11-05 | 2009-12-23 | Glaxosmithkline Llc | Use |
| NZ599866A (en) | 2009-11-06 | 2014-09-26 | Plexxikon Inc | Compounds and methods for kinase modulation, and indications therefor |
| JP5740409B2 (ja) | 2009-11-13 | 2015-06-24 | ジェノスコ | キナーゼ阻害剤 |
| MX2012005827A (es) | 2009-11-18 | 2012-06-19 | Plexxikon Inc | Compuestos y metodos para la modulacion de cinasas, e indicaciones para ello. |
| JP2013032290A (ja) | 2009-11-20 | 2013-02-14 | Dainippon Sumitomo Pharma Co Ltd | 新規縮合ピリミジン誘導体 |
| WO2011062885A1 (en) | 2009-11-23 | 2011-05-26 | Schering Corporation | Fused bicyclic pyrimidine derivatives and methods of use thereof |
| WO2011066342A2 (en) | 2009-11-24 | 2011-06-03 | Amplimmune, Inc. | Simultaneous inhibition of pd-l1/pd-l2 |
| EP2332939A1 (en) * | 2009-11-26 | 2011-06-15 | Æterna Zentaris GmbH | Novel Naphthyridine derivatives and the use thereof as kinase inhibitors |
| MX2012006381A (es) | 2009-12-01 | 2012-06-19 | Abbott Lab | Nuevos compuestos triciclicos. |
| JP2011116840A (ja) | 2009-12-02 | 2011-06-16 | Fujifilm Corp | 顔料微粒子分散体、これを用いた光硬化性組成物及びカラーフィルタ |
| AR079257A1 (es) | 2009-12-07 | 2012-01-04 | Novartis Ag | Formas cristalinas de 3-(2,6-dicloro-3-5-dimetoxi-fenil)-1-{6-[4-(4-etil-piperazin-1-il)-fenil-amino]-pirimidin-4-il}-1-metil-urea y sales de las mismas |
| EP2513098B1 (en) | 2009-12-17 | 2016-11-09 | Merck Sharp & Dohme Corp. | Aminopyrimidines as syk inhibitors |
| US20120258940A1 (en) | 2009-12-18 | 2012-10-11 | Giordano Caponigro | Method for treating haematological cancers |
| RU2573569C2 (ru) | 2009-12-22 | 2016-01-20 | Вертекс Фармасьютикалз Инкорпорейтед | Ингибиторы фосфатидилинозитол-3-киназы на основе изоиндолинона |
| FR2954317B1 (fr) | 2009-12-23 | 2012-01-27 | Galderma Res & Dev | Nouveaux derives phenoliques, et leur utilisation pharmaceutique ou cosmetique |
| FR2954315B1 (fr) | 2009-12-23 | 2012-02-24 | Galderma Res & Dev | Nouveaux derives phenoliques, et leur utilisation pharmaceutique ou cosmetique |
| US20110207736A1 (en) | 2009-12-23 | 2011-08-25 | Gatekeeper Pharmaceuticals, Inc. | Compounds that modulate egfr activity and methods for treating or preventing conditions therewith |
| WO2011090666A2 (en) | 2009-12-28 | 2011-07-28 | Afraxis, Inc. | Methods for treating autism |
| EP2519523A1 (en) | 2009-12-29 | 2012-11-07 | Polyera Corporation | Thionated aromatic bisimides as organic semiconductors and devices incorporating them |
| WO2011080755A1 (en) | 2009-12-29 | 2011-07-07 | Advinus Therapeutics Private Limited | Fused nitrogen heterocyclic compounds, process of preparation and uses thereof |
| CA2784807C (en) | 2009-12-29 | 2021-12-14 | Dana-Farber Cancer Institute, Inc. | Type ii raf kinase inhibitors |
| US8563567B2 (en) | 2009-12-30 | 2013-10-22 | Arqule, Inc. | Substituted heterocyclic compounds |
| AU2010339444A1 (en) | 2009-12-30 | 2012-07-19 | Arqule, Inc. | Substituted pyrrolo-aminopyrimidine compounds |
| WO2011082267A2 (en) | 2009-12-30 | 2011-07-07 | Arqule, Inc. | Substituted triazolo-pyrazine compounds |
| CN102115026A (zh) | 2009-12-31 | 2011-07-06 | 清华大学 | 一维纳米结构、其制备方法及一维纳米结构作标记的方法 |
| US20130022629A1 (en) | 2010-01-04 | 2013-01-24 | Sharpe Arlene H | Modulators of Immunoinhibitory Receptor PD-1, and Methods of Use Thereof |
| WO2011082488A1 (en) | 2010-01-06 | 2011-07-14 | British Columbia Cancer Agency Branch | Bisphenol derivative therapeutics and methods for their use |
| KR101483215B1 (ko) | 2010-01-29 | 2015-01-16 | 한미약품 주식회사 | 단백질 키나아제 저해활성을 갖는 비시클릭 헤테로아릴 유도체 |
| WO2011094890A1 (en) | 2010-02-02 | 2011-08-11 | Argusina Inc. | Phenylalanine derivatives and their use as non-peptide glp-1 receptor modulators |
| WO2011097717A1 (en) | 2010-02-15 | 2011-08-18 | University Of Victoria Innovation And Development Corporation | Synthesis of bicyclic compounds and method for their use as therapeutic agents |
| SA111320200B1 (ar) | 2010-02-17 | 2014-02-16 | ديبيوفارم اس ايه | مركبات ثنائية الحلقة واستخداماتها كمثبطات c-src/jak مزدوجة |
| MX2012009561A (es) | 2010-02-17 | 2012-11-23 | Amgen Inc | Carboxamidas como inhibidores de canales de sodio dependientes del voltaje. |
| WO2011103441A1 (en) | 2010-02-18 | 2011-08-25 | Schering Corporation | Substituted pyridine and pyrimidine derivatives and their use in treating viral infections |
| DE112011100604T5 (de) | 2010-02-18 | 2013-01-31 | Ntn Corporation | Verdicker, Schmierfett, Verfahren zur Herstellung derselben und fettgeschmiertes Lager |
| US9193728B2 (en) | 2010-02-18 | 2015-11-24 | Medivation Technologies, Inc. | Fused tetracyclic pyrido [4,3-B] indole and pyrido [3,4-B] indole derivatives and methods of use |
| UY33227A (es) | 2010-02-19 | 2011-09-30 | Novartis Ag | Compuestos de pirrolopirimidina como inhibidores de la cdk4/6 |
| WO2011103557A1 (en) | 2010-02-22 | 2011-08-25 | Advanced Cancer Therapeutics, Llc | Small molecule inhibitors of pfkfb3 and glycolytic flux and their methods of use as anti-cancer therapeutics |
| JP5662994B2 (ja) | 2010-02-26 | 2015-02-04 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| US20130045203A1 (en) | 2010-03-02 | 2013-02-21 | Emory University | Uses of Noscapine and Derivatives in Subjects Diagnosed with FAP |
| WO2011111880A1 (ko) | 2010-03-08 | 2011-09-15 | 주식회사 메디젠텍 | 세포핵에서 세포질로의 gsk3의 이동을 억제하는 화합물을 함유하는 세포핵에서 세포질로의 gsk3 이동에 의해 발생되는 질환의 치료 또는 예방용 약학적 조성물 |
| WO2011112687A2 (en) | 2010-03-10 | 2011-09-15 | Kalypsys, Inc. | Heterocyclic inhibitors of histamine receptors for the treatment of disease |
| WO2011112995A1 (en) | 2010-03-11 | 2011-09-15 | Gilead Sciences, Inc. | Imidazopyridines syk inhibitors |
| WO2011115725A2 (en) | 2010-03-16 | 2011-09-22 | Dana-Farber Cancer Institute, Inc. | Indazole compounds and their uses |
| KR20180032686A (ko) | 2010-03-24 | 2018-03-30 | 아미텍 테러퓨틱 솔루션즈 인크 | 인산화효소 억제에 유용한 헤테로환 화합물 |
| JP5752232B2 (ja) | 2010-03-31 | 2015-07-22 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | プロテインキナーゼ阻害剤としての置換ピロロトリアジン化合物 |
| CN102153551B (zh) | 2010-04-02 | 2012-04-25 | 济南海乐医药技术开发有限公司 | 基于吲唑或氮杂吲唑的双芳基脲或硫脲类结构抗肿瘤药物 |
| JP5724204B2 (ja) | 2010-04-07 | 2015-05-27 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、及び照明装置 |
| WO2011130390A1 (en) | 2010-04-13 | 2011-10-20 | Rigel Pharmaceuticals, Inc. | 2, 4-pyrimidinediamine compounds and prodrugs thereof and their uses |
| WO2011128403A1 (en) | 2010-04-16 | 2011-10-20 | Novartis Ag | Organic compound for use in the treatment of liver cancer |
| US8822447B2 (en) | 2010-04-22 | 2014-09-02 | Janssen Pharmaceutica Nv | Indazole compounds useful as ketohexokinase inhibitors |
| CN102939088A (zh) | 2010-04-23 | 2013-02-20 | 奇尼塔公司 | 抗病毒化合物 |
| AR081331A1 (es) | 2010-04-23 | 2012-08-08 | Cytokinetics Inc | Amino- pirimidinas composiciones de las mismas y metodos para el uso de los mismos |
| WO2011137313A1 (en) | 2010-04-30 | 2011-11-03 | Bristol-Myers Squibb Company | Aza-bicyclic amine n-oxide compounds as alpha-7 nicotinic acetylcholine receptor ligand pro-drugs |
| GB201007286D0 (en) | 2010-04-30 | 2010-06-16 | Astex Therapeutics Ltd | New compounds |
| US8759398B2 (en) | 2010-05-03 | 2014-06-24 | Biolink Life Sciences, Inc. | Phosphorus binder composition for treatment of hyperphosphatemia |
| WO2011140338A1 (en) | 2010-05-05 | 2011-11-10 | Gatekeeper Pharmaceuticals, Inc. | Compounds that modulate egfr activity and methods for treating or preventing conditions therewith |
| AU2011253101A1 (en) | 2010-05-11 | 2013-01-10 | Aveo Pharmaceuticals, Inc. | Anti-FGFR2 antibodies |
| WO2011141848A1 (en) | 2010-05-11 | 2011-11-17 | Pfizer Inc. | Morpholine compounds as mineralocorticoid receptor antagonists |
| TWI513694B (zh) | 2010-05-11 | 2015-12-21 | Amgen Inc | 抑制間變性淋巴瘤激酶的嘧啶化合物 |
| MX2012013197A (es) | 2010-05-12 | 2013-04-03 | Abbvie Inc | Inhibidores de indazol de cinasa. |
| TWI446916B (zh) | 2010-05-12 | 2014-08-01 | Spectrum Pharmaceuticals Inc | 鹼式碳酸鑭、碳酸氧鑭及其製備方法及用途 |
| GB201008134D0 (en) | 2010-05-14 | 2010-06-30 | Medical Res Council Technology | Compounds |
| WO2011147199A1 (en) | 2010-05-28 | 2011-12-01 | Versitech Limited | Compounds and methods for treating viral infections |
| WO2011147198A1 (en) | 2010-05-28 | 2011-12-01 | Versitech Limited | Compounds and methods for treatment of proliferative diseases |
| CA2797947C (en) | 2010-06-04 | 2019-07-09 | Charles Baker-Glenn | Aminopyrimidine derivatives as lrrk2 modulators |
| WO2011153553A2 (en) | 2010-06-04 | 2011-12-08 | The Regents Of The University Of California | Methods and compositions for kinase inhibition |
| WO2011155983A1 (en) | 2010-06-07 | 2011-12-15 | Bikam Pharmaceuticals Inc. | Opsin-binding ligands, compositions and methods of use |
| TW201210597A (en) | 2010-06-09 | 2012-03-16 | Gilead Sciences Inc | Inhibitors of hepatitis C virus |
| US8299117B2 (en) | 2010-06-16 | 2012-10-30 | Metabolex Inc. | GPR120 receptor agonists and uses thereof |
| WO2011159877A2 (en) | 2010-06-18 | 2011-12-22 | The Brigham And Women's Hospital, Inc. | Bi-specific antibodies against tim-3 and pd-1 for immunotherapy in chronic immune conditions |
| WO2011163330A1 (en) | 2010-06-24 | 2011-12-29 | Merck Sharp & Dohme Corp. | Novel heterocyclic compounds as erk inhibitors |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| KR101486782B1 (ko) | 2010-06-27 | 2015-01-28 | 킹 사우드 유니버시티 | 무한 중첩된 해시 체인들에 의한 1회용 패스워드 인증 |
| ES2706066T3 (es) | 2010-07-02 | 2019-03-27 | Univ Health Network | Procedimiento dirigido a enfermedades mutantes con PTEN y composiciones para las mismas |
| FR2962438B1 (fr) | 2010-07-06 | 2012-08-17 | Sanofi Aventis | Derives d'indolizines, procedes de preparation et application en therapeutique |
| FR2962437B1 (fr) | 2010-07-06 | 2012-08-17 | Sanofi Aventis | Derives d'imidazopyridine, leur procede de preparation et leur application en therapeutique |
| CN103080106A (zh) | 2010-07-06 | 2013-05-01 | 诺瓦提斯公司 | 用作激酶抑制剂的环醚化合物 |
| CA2804648C (en) | 2010-07-09 | 2019-01-22 | The Walter And Eliza Hall Institute Of Medical Research | Protein kinase inhibitors and methods of treatment |
| WO2012009258A2 (en) | 2010-07-13 | 2012-01-19 | Edward Roberts | Peptidomimetic galanin receptor modulators |
| WO2012008999A2 (en) | 2010-07-14 | 2012-01-19 | Merck Sharp & Dohme Corp. | Tricyclic compounds as allosteric modulators of metabotropic glutamate receptors |
| TW201206946A (en) | 2010-07-15 | 2012-02-16 | Bristol Myers Squibb Co | Compounds for the reduction of beta-amyloid production |
| WO2012008564A1 (ja) | 2010-07-16 | 2012-01-19 | 協和発酵キリン株式会社 | 含窒素芳香族複素環誘導体 |
| US20130225581A1 (en) | 2010-07-16 | 2013-08-29 | Kyowa Hakko Kirin Co., Ltd | Nitrogen-containing aromatic heterocyclic derivative |
| US8987273B2 (en) | 2010-07-28 | 2015-03-24 | Bayer Intellectual Property Gmbh | Substituted imidazo[1,2-B]pyridazines |
| EP2413140A1 (en) | 2010-07-29 | 2012-02-01 | Sanofi | Method for identifying a compound having an antiarrhythmic effect as well as uses relating thereto |
| KR20120012431A (ko) | 2010-07-30 | 2012-02-09 | 롬엔드하스전자재료코리아유한회사 | 유기발광화합물을 발광재료로서 채용하고 있는 유기 전계 발광 소자 |
| US8906943B2 (en) | 2010-08-05 | 2014-12-09 | John R. Cashman | Synthetic compounds and methods to decrease nicotine self-administration |
| US9051280B2 (en) | 2010-08-13 | 2015-06-09 | AbbVie Deutschland GmbH & Co. KG | Tetraline and indane derivatives, pharmaceutical compositions containing them, and their use in therapy |
| US8883839B2 (en) | 2010-08-13 | 2014-11-11 | Abbott Laboratories | Tetraline and indane derivatives, pharmaceutical compositions containing them, and their use in therapy |
| WO2012027239A1 (en) | 2010-08-23 | 2012-03-01 | Schering Corporation | NOVEL PYRAZOLO[1,5-a]PYRROLO[3,2-e]PYRIMIDINE DERIVATIVES AS mTOR INHIBITORS |
| EP2608669B1 (en) | 2010-08-23 | 2016-06-22 | Merck Sharp & Dohme Corp. | NOVEL PYRAZOLO[1,5-a]PYRIMIDINE DERIVATIVES AS mTOR INHIBITORS |
| EP2611798B1 (en) | 2010-09-01 | 2015-04-08 | Gilead Connecticut, Inc. | Pyridazinones, method of making, and method of use thereof |
| KR101837223B1 (ko) | 2010-09-01 | 2018-03-09 | 질레드 코네티컷 인코포레이티드 | 피리디논/피라지논, 그의 제조 방법 및 사용 방법 |
| EP2614058B1 (en) | 2010-09-08 | 2015-07-08 | GlaxoSmithKline Intellectual Property Development Limited | POLYMORPHS AND SALTS OF N-[5-[4-(5-{[(2R,6S)-2,6-DIMETHYL-4-MORPHOLINYL]METHYL}-& xA;1,3-OXAZOL-2-YL)-1H-INDAZOL-6-YL]-2-(METHYLOXY)-3-PYRIDINYL]METHANESULFONAMIDE |
| AR082799A1 (es) | 2010-09-08 | 2013-01-09 | Ucb Pharma Sa | Derivados de quinolina y quinoxalina como inhibidores de quinasa |
| EP2613781B1 (en) | 2010-09-08 | 2016-08-24 | GlaxoSmithKline Intellectual Property Development Limited | Indazole derivatives for use in the treatment of influenza virus infection |
| TWI541243B (zh) | 2010-09-10 | 2016-07-11 | 拜耳知識產權公司 | 經取代咪唑并嗒 |
| KR20130103503A (ko) | 2010-09-14 | 2013-09-23 | 호도가야 가가쿠 고교 가부시키가이샤 | 전하 제어제 및 그것을 사용한 토너 |
| CN102399220A (zh) | 2010-09-15 | 2012-04-04 | 黄振华 | 三并环类PI3K和mTOR双重抑制剂 |
| CN102399233B (zh) | 2010-09-15 | 2014-08-13 | 山东轩竹医药科技有限公司 | PI3K和mTOR双重抑制剂类化合物 |
| WO2012036233A1 (ja) | 2010-09-17 | 2012-03-22 | 塩野義製薬株式会社 | メラニン凝集ホルモン受容体アンタゴニスト活性を有する縮合へテロ環誘導体 |
| GB201015949D0 (en) | 2010-09-22 | 2010-11-03 | Medical Res Council Technology | Compounds |
| JO3062B1 (ar) | 2010-10-05 | 2017-03-15 | Lilly Co Eli | R)-(e)-2-(4-(2-(5-(1-(3، 5-داي كلورو بيريدين-4-يل)إيثوكسي)-1h-إندازول-3-يل)?ينيل)-1h-بيرازول-1-يل)إيثانول بلوري |
| WO2012054364A2 (en) | 2010-10-22 | 2012-04-26 | Merck Sharp & Dohme Corp. | Bicyclic diamines as janus kinase inhibitors |
| EP3567042B1 (en) | 2010-10-25 | 2021-07-07 | G1 Therapeutics, Inc. | Cdk inhibitors |
| JP2012092049A (ja) | 2010-10-27 | 2012-05-17 | Sumitomo Chemical Co Ltd | 有害動物防除組成物及び有害動物の防除方法 |
| WO2012058211A2 (en) | 2010-10-29 | 2012-05-03 | Emory University | Quinazoline derivatives, compositions, and uses related thereto |
| WO2012061337A1 (en) | 2010-11-02 | 2012-05-10 | Exelixis, Inc. | Fgfr2 modulators |
| TW201305139A (zh) | 2010-11-10 | 2013-02-01 | Gruenenthal Gmbh | 作為類香草素受體配體之經取代雜芳基甲醯胺及尿素衍生物 |
| EP2638008B1 (en) | 2010-11-10 | 2015-07-01 | Actelion Pharmaceuticals Ltd | Lactam derivatives useful as orexin receptor antagonists |
| JP2012116825A (ja) | 2010-11-11 | 2012-06-21 | Ehime Univ | アセンジイミド化合物の製造方法 |
| KR101171232B1 (ko) | 2010-11-15 | 2012-08-06 | 단국대학교 산학협력단 | 스파이로 화합물 및 이를 포함하는 유기전계 발광소자 |
| WO2012065297A1 (en) | 2010-11-16 | 2012-05-24 | Impact Therapeutics, Inc. | 3-ARYL-6-ARYL-[1,2,4]TRIAZOLO[4,3-a]PYRIDINES AS INHIBITORS OF CELL PROLIFERATION AND THE USE THEREOF |
| MX2013005567A (es) | 2010-11-17 | 2013-10-30 | Amgen Inc | Derivados de quinolina como inhibidores de pik3. |
| JP5898687B2 (ja) | 2010-11-18 | 2016-04-06 | カシナ ライラ イノバ ファーマシューティカルズ プライベート リミテッド | 置換4−(セレノフェン−2(または3)−イルアミノ)ピリミジン化合物およびその使用方法 |
| GB201020179D0 (en) | 2010-11-29 | 2011-01-12 | Astex Therapeutics Ltd | New compounds |
| US9090593B2 (en) | 2010-12-09 | 2015-07-28 | Amgen Inc. | Bicyclic compounds as Pim inhibitors |
| EP2651405A2 (en) | 2010-12-14 | 2013-10-23 | Electrophoretics Limited | Casein kinase 1 (ck1 ) inhibitors |
| JP6007189B2 (ja) | 2010-12-20 | 2016-10-12 | メルク セローノ ソシエテ アノニム | Irak阻害剤としてのインダゾリルトリアゾール誘導体 |
| BR112013015859A2 (pt) | 2010-12-22 | 2018-11-21 | Leo Laboratories Ltd | composto, uso de um composto, métodos de prevenção, tratamento, melhora ou profilaxia de distúrbios fisiológicos ou doenças, e de tratamento ou melhora de indicações cosméticas, e, composição farmacêutica |
| CN102603628B (zh) | 2010-12-22 | 2016-08-17 | 香港理工大学 | 作为抗癌试剂的喹啉衍生物 |
| CN104529827B (zh) | 2010-12-22 | 2016-08-24 | 利奥实验室有限公司 | 巨大戟二萜醇-3-酰化物iii和巨大戟二萜醇-3-氨基甲酸酯 |
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| EP2468258A1 (en) | 2010-12-22 | 2012-06-27 | LEK Pharmaceuticals d.d. | Process for the preparation of a pharmaceutical composition comprising a low soluble pharmaceutically active ingredient |
| US20130267526A1 (en) | 2010-12-23 | 2013-10-10 | Amgen, Inc. | Heterocyclic compounds and their uses |
| JP5691508B2 (ja) | 2010-12-27 | 2015-04-01 | Jnc株式会社 | ジイミド化合物ならびにインクジェット用インクおよびその用途 |
| KR101466150B1 (ko) | 2010-12-31 | 2014-11-27 | 제일모직 주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| WO2012093731A1 (ja) | 2011-01-06 | 2012-07-12 | Jx日鉱日石エネルギー株式会社 | イミド化合物及びその製造方法、グリース用増ちょう剤並びにグリース組成物 |
| US8362023B2 (en) | 2011-01-19 | 2013-01-29 | Hoffmann-La Roche Inc. | Pyrazolo pyrimidines |
| FR2970967B1 (fr) | 2011-01-27 | 2013-02-15 | Pf Medicament | Derives de type azaindazole ou diazaindazole comme medicament |
| EP2487159A1 (en) | 2011-02-11 | 2012-08-15 | MSD Oss B.V. | RorgammaT inhibitors |
| US9434747B2 (en) | 2011-02-18 | 2016-09-06 | Medivation Technologies, Inc. | Methods of treating diabetes |
| WO2012116237A2 (en) | 2011-02-23 | 2012-08-30 | Intellikine, Llc | Heterocyclic compounds and uses thereof |
| TWI532742B (zh) | 2011-02-28 | 2016-05-11 | 艾伯維有限公司 | 激酶之三環抑制劑 |
| CN103429759A (zh) | 2011-03-17 | 2013-12-04 | 诺华股份有限公司 | Fgfr及其配体作为hr阳性对象中乳腺癌的生物标记 |
| EP2937349B1 (en) | 2011-03-23 | 2016-12-28 | Amgen Inc. | Fused tricyclic dual inhibitors of cdk 4/6 and flt3 |
| ITPD20110091A1 (it) | 2011-03-24 | 2012-09-25 | Univ Padova | Inibitori multitirosinchinasi utili per le patologie correlate: modelli farmacoforici, composti identificati tramite questi modelli, metodi per la loro preparazione, la loro formulazione e il loro impiego terapeutico. |
| UY33966A (es) | 2011-03-25 | 2012-10-31 | Abbott Lab | Antagonistas del receptor transitorio potencial de vanilloides 1 (trpv1) |
| CN103596983B (zh) | 2011-04-07 | 2016-10-26 | 霍夫曼-拉罗奇有限公司 | 抗fgfr4抗体及使用方法 |
| FR2974088A1 (fr) | 2011-04-12 | 2012-10-19 | Pf Medicament | Composes pyrazolo[3,4-b]pyridines tri- et tetracycliques comme agent anticancereux |
| SG194917A1 (en) | 2011-05-16 | 2013-12-30 | Genentech Inc | Fgfr1 agonists and methods of use |
| US20140288069A1 (en) | 2011-05-17 | 2014-09-25 | Bayer Intellectual Property Gmbh | Amino-substituted imidazopyridazines as mknk1 kinase inhibitors |
| WO2012158795A1 (en) | 2011-05-17 | 2012-11-22 | Principia Biopharma Inc. | Pyrazolopyrimidine derivatives as tyrosine kinase inhibitors |
| US20150182525A1 (en) | 2011-05-19 | 2015-07-02 | Novartis Ag | 4-Amino-5-Fluoro-3-[6-(4-Methylpiperazin-1-YL)-1H-Benzimidazol-2-YL]-1H-Quinolin-2-one for use in the Treatment of Adenoid Cystic Carcinoma |
| CN103717604B (zh) | 2011-06-01 | 2016-06-01 | 拜耳知识产权有限责任公司 | 取代的氨基咪唑并哒嗪 |
| UY34114A (es) | 2011-06-03 | 2013-01-03 | Millennium Pharm Inc | Combinación de inhibidores de mek e inhibidores selectivos de la quiinasa aurora a |
| US8999530B2 (en) | 2011-06-13 | 2015-04-07 | Lg Chem, Ltd. | Compounds and organic electronic device using same |
| ES2610366T3 (es) | 2011-06-22 | 2017-04-27 | Bayer Intellectual Property Gmbh | Heterociclil-aminoimidazopiridazinas |
| US8846656B2 (en) | 2011-07-22 | 2014-09-30 | Novartis Ag | Tetrahydropyrido-pyridine and tetrahydropyrido-pyrimidine compounds and use thereof as C5a receptor modulators |
| MX355852B (es) | 2011-08-12 | 2018-05-02 | Hoffmann La Roche | Compuestos de pirazolo [3,4-c] piridina y métodos de uso. |
| AU2012295802B2 (en) | 2011-08-12 | 2017-03-30 | Nissan Chemical Industries, Ltd. | Tricyclic heterocyclic compounds and JAK inhibitors |
| JP2013049251A (ja) | 2011-08-31 | 2013-03-14 | Fujifilm Corp | レーザー彫刻用レリーフ印刷版原版、並びに、レリーフ印刷版及びその製版方法 |
| WO2013033981A1 (zh) | 2011-09-06 | 2013-03-14 | 江苏先声药物研究有限公司 | 一类2,7-萘啶衍生物及其制备方法和应用 |
| US9345705B2 (en) | 2011-09-15 | 2016-05-24 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| US9376435B2 (en) | 2011-09-23 | 2016-06-28 | Jawaharlal Nehru Centre For Advanced Scientific Research | Chromophores for the detection of volatile organic compounds |
| US9320737B2 (en) | 2011-09-23 | 2016-04-26 | Bayer Intellectual Property Gmbh | Substituted imidazopyridazines |
| US20140227321A1 (en) | 2011-09-30 | 2014-08-14 | Kineta, Inc. | Anti-viral compounds |
| UA111382C2 (uk) | 2011-10-10 | 2016-04-25 | Оріон Корпорейшн | Інгібітори протеїнкінази |
| US9580390B2 (en) | 2011-10-12 | 2017-02-28 | University Health Network | Indazole compounds as kinase inhibitors and method of treating cancer with same |
| KR101897044B1 (ko) | 2011-10-20 | 2018-10-23 | 에스에프씨 주식회사 | 유기금속 화합물 및 이를 포함하는 유기전계발광소자 |
| WO2013063003A1 (en) | 2011-10-28 | 2013-05-02 | Novartis Ag | Method of treating gastrointestinal stromal tumors |
| EP2770999A1 (en) | 2011-10-28 | 2014-09-03 | Novartis AG | Method of treating gastrointestinal stromal tumors |
| WO2013088191A1 (en) | 2011-12-12 | 2013-06-20 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Antagonist of the fibroblast growth factor receptor 3 (fgfr3) for use in the treatment or the prevention of skeletal disorders linked with abnormal activation of fgfr3 |
| FR2985257B1 (fr) | 2011-12-28 | 2014-02-14 | Sanofi Sa | Composes dimeres agonistes des recepteurs des fgfs (fgfrs), leur procede de preparation et leur application en therapeutique |
| FR2985258A1 (fr) | 2011-12-28 | 2013-07-05 | Sanofi Sa | Composes dimeres agonistes des recepteurs des fgfs (fgfrs), leur procede de preparation et leur application en therapeutique |
| WO2013109027A1 (ko) | 2012-01-18 | 2013-07-25 | 덕산하이메탈(주) | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US10026905B2 (en) | 2012-01-18 | 2018-07-17 | Duk San Neolux Co., Ltd. | Compound, organic electric element using the same, and an electronic device thereof |
| CA2854093C (en) | 2012-01-19 | 2016-07-05 | Taiho Pharmaceutical Co., Ltd. | 3,5-disubstituted alkynylbenzene compound and salt thereof |
| EP2817311B1 (en) | 2012-02-23 | 2016-04-06 | Bayer Intellectual Property GmbH | Substituted benzothienyl-pyrrolotriazines and uses thereof |
| JP2013179181A (ja) | 2012-02-28 | 2013-09-09 | Sumitomo Chemical Co Ltd | 有機光電変換素子 |
| MX355474B (es) | 2012-03-14 | 2018-04-16 | Lupin Ltd | Compuestos de heterociclilo como inhibidores de mek. |
| MX354783B (es) | 2012-03-30 | 2018-03-21 | Novartis Ag | Inhibidor de fgfr para su uso en el tratamiento de trastornos hipofosfatemicos. |
| JP5120580B1 (ja) | 2012-05-14 | 2013-01-16 | Jsr株式会社 | 液晶配向剤 |
| DK2852354T3 (da) | 2012-05-20 | 2020-08-24 | Tel Hashomer Medical Res Infrastructure & Services Ltd | Kunstig mitralklap |
| NZ702747A (en) | 2012-06-13 | 2017-03-31 | Incyte Holdings Corp | Substituted tricyclic compounds as fgfr inhibitors |
| KR102163776B1 (ko) | 2012-07-11 | 2020-10-12 | 블루프린트 메디신즈 코포레이션 | 섬유아세포 성장인자 수용체의 저해제 |
| US20150202203A1 (en) | 2012-07-11 | 2015-07-23 | Novartis Ag | Method of Treating Gastrointestinal Stromal Tumors |
| CA2880901A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| WO2014019186A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| KR101985259B1 (ko) | 2012-08-10 | 2019-06-03 | 제이에스알 가부시끼가이샤 | 액정 배향제 및 화합물 |
| WO2014026125A1 (en) | 2012-08-10 | 2014-02-13 | Incyte Corporation | Pyrazine derivatives as fgfr inhibitors |
| WO2014044846A1 (en) | 2012-09-24 | 2014-03-27 | Evotec (Uk) Ltd. | 3-(aryl- or heteroaryl-amino)-7-(3,5-dimethoxyphenyl)isoquinoline derivatives as fgfr inhibitors useful for the treatment of proliferative disorders or dysplasia |
| WO2014048878A1 (en) | 2012-09-26 | 2014-04-03 | Evotec (Uk) Ltd. | Phenyl- or pyridyl- pyrrolo[2,3b]pyrazine derivatives useful in the treatment or prevention of proliferative disorders or dysplasia |
| WO2014062454A1 (en) | 2012-10-15 | 2014-04-24 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| KR102000211B1 (ko) | 2012-10-29 | 2019-09-30 | 삼성디스플레이 주식회사 | 유기금속 화합물 및 이를 포함한 유기 발광 소자 |
| WO2014085216A1 (en) | 2012-11-28 | 2014-06-05 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| US20140148548A1 (en) | 2012-11-28 | 2014-05-29 | Central Glass Company, Limited | Fluorine-Containing Polymerizable Monomer And Polymer Compound Using Same |
| CN104968664A (zh) | 2012-12-12 | 2015-10-07 | 山东亨利医药科技有限责任公司 | 作为酪氨酸激酶抑制剂的并环化合物 |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| WO2014105849A1 (en) | 2012-12-28 | 2014-07-03 | Xoma (Us) Llc | Antibodies specific for fgfr4 and methods of use |
| TWI629266B (zh) | 2012-12-28 | 2018-07-11 | 藍印藥品公司 | 纖維母細胞生長因子受體之抑制劑 |
| KR102030587B1 (ko) | 2013-01-09 | 2019-10-10 | 에스에프씨주식회사 | 두 개의 나프틸기를 포함하는 비대칭 안트라센 유도체 및 이를 포함하는 유기 발광 소자 |
| WO2014113191A1 (en) | 2013-01-15 | 2014-07-24 | Xiaohu Zhang | Hedgehog pathway signaling inhibitors and therapeutic applications thereof |
| CN103694236B (zh) | 2013-01-15 | 2017-05-31 | 苏州开拓药业股份有限公司 | 一种嘧啶骨架具有刺猬通路拮抗剂活性的抗肿瘤化合物 |
| KR101456626B1 (ko) | 2013-02-01 | 2014-11-03 | 대영이앤비 주식회사 | 냉장고 부압 방지 장치 |
| WO2014136972A1 (ja) | 2013-03-07 | 2014-09-12 | 国立大学法人九州大学 | 超分子複合体、発光体、および有機化合物検出用のセンサー素子 |
| WO2014138485A1 (en) | 2013-03-08 | 2014-09-12 | Irm Llc | Ex vivo production of platelets from hematopoietic stem cells and the product thereof |
| US9498532B2 (en) | 2013-03-13 | 2016-11-22 | Novartis Ag | Antibody drug conjugates |
| EP2968285A4 (en) | 2013-03-13 | 2016-12-21 | Flatley Discovery Lab | COMPOUNDS AND METHODS FOR THE TREATMENT OF CYSTIC FIBROSIS |
| EP2970258B1 (en) | 2013-03-14 | 2018-04-18 | AbbVie Deutschland GmbH & Co KG | Novel inhibitor compounds of phosphodiesterase type 10a |
| EA036160B1 (ru) | 2013-03-15 | 2020-10-08 | Селджен Кар Ллс | Гетероарильные соединения и их применение |
| US9499522B2 (en) | 2013-03-15 | 2016-11-22 | Blueprint Medicines Corporation | Compositions useful for treating disorders related to kit |
| US9321786B2 (en) | 2013-03-15 | 2016-04-26 | Celgene Avilomics Research, Inc. | Heteroaryl compounds and uses thereof |
| KR102350704B1 (ko) | 2013-03-15 | 2022-01-13 | 셀젠 카르 엘엘씨 | 헤테로아릴 화합물 및 이의 용도 |
| TWI628176B (zh) | 2013-04-04 | 2018-07-01 | 奧利安公司 | 蛋白質激酶抑制劑 |
| KR101573611B1 (ko) | 2013-04-17 | 2015-12-01 | 주식회사 엘지화학 | 플러렌 유도체, 이를 이용한 유기 태양 전지 및 이의 제조 방법 |
| EP2986610B9 (en) | 2013-04-19 | 2018-10-17 | Incyte Holdings Corporation | Bicyclic heterocycles as fgfr inhibitors |
| CA2908988A1 (en) | 2013-04-19 | 2014-10-23 | Covagen Ag | Novel bispecific binding molecules with antitumoral activity |
| GB201307577D0 (en) | 2013-04-26 | 2013-06-12 | Astex Therapeutics Ltd | New compounds |
| US9630963B2 (en) | 2013-05-09 | 2017-04-25 | Principia Biopharma, Inc. | Quinolone derivatives as fibroblast growth factor inhibitors |
| TR201815333T4 (tr) | 2013-06-14 | 2018-11-21 | Sanofi Sa | Mesane kanserinin tedavisinde kullanıma yönelik pirazolopiridin türevleri. |
| MX362582B (es) | 2013-06-28 | 2019-01-24 | Beigene Ltd | Compuestos triciclicos fusionados de urea como inhibidores de raf quinasa y/o dimero de raf quinasa. |
| JP6380862B2 (ja) | 2013-06-28 | 2018-08-29 | ベイジーン リミテッド | 複数種類のキナーゼの阻害剤としての縮合三環式アミド系化合物 |
| EP3016949B1 (en) | 2013-07-02 | 2020-05-13 | Syngenta Participations AG | Pesticidally active bi- or tricyclic heterocycles with sulfur containing substituents |
| AU2014287209B2 (en) | 2013-07-09 | 2019-01-24 | Dana-Farber Cancer Institute, Inc. | Kinase inhibitors for the treatment of disease |
| JP6018547B2 (ja) | 2013-07-09 | 2016-11-02 | 大成ロテック株式会社 | 舗装機械 |
| WO2015006754A2 (en) | 2013-07-11 | 2015-01-15 | Acea Biosciences Inc. | Heterocyclic compounds and uses thereof |
| TW201605452A (zh) | 2013-08-28 | 2016-02-16 | 安斯泰來製藥股份有限公司 | 以嘧啶化合物作爲有效成分之醫藥組成物 |
| MX2016004933A (es) | 2013-10-18 | 2016-12-20 | Eisai R&D Man Co Ltd | Inhibidores de pirimidina del fgfr4. |
| US9434700B2 (en) | 2013-10-25 | 2016-09-06 | Neil Bifulco, JR. | Inhibitors of the fibroblast growth factor receptor |
| AU2014338549B2 (en) | 2013-10-25 | 2017-05-25 | Novartis Ag | Ring-fused bicyclic pyridyl derivatives as FGFR4 inhibitors |
| FR3012330B1 (fr) | 2013-10-29 | 2015-10-23 | Oreal | Composition biphase comprenant un ester d'acide gras et de sucre ou un alkylpolyglucoside liquide, de hlb < 8, et un alcane ramifie en c8-c18 |
| WO2015066452A2 (en) | 2013-11-01 | 2015-05-07 | Foundation Medicine, Inc. | Methods of treating pediatric cancers |
| WO2015108992A1 (en) | 2014-01-15 | 2015-07-23 | Blueprint Medicines Corporation | Heterobicyclic compounds and their use as fgfr4 receptor inhibitors |
| AU2015306561B2 (en) | 2014-08-19 | 2018-03-15 | Shanghai Haihe Pharmaceutical Co., Ltd. | Indazole compounds as FGFR kinase inhibitor, preparation and use thereof |
| CN104262330B (zh) | 2014-08-27 | 2016-09-14 | 广东东阳光药业有限公司 | 一种脲取代联苯类化合物及其组合物及用途 |
| MA39484A (fr) | 2014-09-19 | 2016-03-24 | Bayer Pharma AG | Indazoles à substituants benzyle utilisés comme inhibiteurs de bub1 |
| US20160115164A1 (en) | 2014-10-22 | 2016-04-28 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9708318B2 (en) | 2015-02-20 | 2017-07-18 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| WO2016134294A1 (en) | 2015-02-20 | 2016-08-25 | Incyte Corporation | Bicyclic heterocycles as fgfr4 inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| PE20180021A1 (es) | 2015-02-20 | 2018-01-09 | Univ Oregon Health & Science | Derivados de sobetiroma |
| EP3302442B1 (en) | 2015-06-03 | 2024-10-16 | Triastek, Inc. | Dosage forms and use thereof |
| MY189596A (en) | 2015-07-15 | 2022-02-18 | Immatics Biotechnologies Gmbh | A novel peptides for use in immunotherapy against epithelial ovarian cancer and other cancers |
| CR20180029A (es) | 2015-07-15 | 2018-06-05 | Protagonist Therapeutics Inc | Inhibidores peotídicos del receptor de interleucina 23 y su uso para tratar enfermedades inflamatorias |
| JP6717927B2 (ja) | 2015-07-15 | 2020-07-08 | キャボット コーポレイションCabot Corporation | シリカで補強されたエラストマー複合材の製造方法およびそれを含む製品 |
| DK3322701T3 (da) | 2015-07-15 | 2019-07-08 | H Hoffmann La Roche Ag | Ethynylderivater som metabotropiske glutamatreceptormodulatorer |
| MD3456346T2 (ro) | 2015-07-30 | 2021-11-30 | Macrogenics Inc | Molecule de legare la PD-1 și LAG-3 și metode de utilizare a acestora |
| US10519169B2 (en) | 2015-08-03 | 2019-12-31 | Samumed, Llc | 3-(1H-pyrrolo[2,3-C]pyridin-2-yl)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10329309B2 (en) | 2015-08-03 | 2019-06-25 | Samumed, Llc | 3-(3H-imidazo[4,5-B]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10206909B2 (en) | 2015-08-03 | 2019-02-19 | Samumed, Llc | 3-(1H-pyrrolo[2,3-B]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017023988A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10195185B2 (en) | 2015-08-03 | 2019-02-05 | Samumed, Llc | 3-(1H-imidazo[4,5-C]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10231956B2 (en) | 2015-08-03 | 2019-03-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10392383B2 (en) | 2015-08-03 | 2019-08-27 | Samumed, Llc | 3-(1H-benzo[d]imidazol-2-yl)-1H-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| CN108368057B (zh) | 2015-08-20 | 2022-03-15 | 捷思英达医药技术(上海)有限公司 | 作为erk抑制剂的吡唑并稠合的杂环化合物 |
| US10975071B2 (en) | 2015-09-28 | 2021-04-13 | Araxes Pharma Llc | Inhibitors of KRAS G12C mutant proteins |
| WO2017070089A1 (en) | 2015-10-19 | 2017-04-27 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CA3002560A1 (en) | 2015-10-23 | 2017-04-27 | Array Biopharma, Inc. | 2-aryl- and 2-heteroaryl-substituted 2-pyridazin-3(2h)-one compounds as inhibitors of fgfr tyrosine kinases |
| SI3377488T1 (sl) | 2015-11-19 | 2022-11-30 | Incyte Corporation | Heterociklične spojine kot imunomodulatorji |
| EP3390361B1 (en) | 2015-12-17 | 2022-03-16 | Incyte Corporation | N-phenyl-pyridine-2-carboxamide derivatives and their use as pd-1/pd-l1 protein/protein interaction modulators |
| EP3828171A1 (en) | 2015-12-22 | 2021-06-02 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2017192961A1 (en) | 2016-05-06 | 2017-11-09 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2017205464A1 (en) | 2016-05-26 | 2017-11-30 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CA3028685A1 (en) | 2016-06-20 | 2017-12-28 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| US10138248B2 (en) | 2016-06-24 | 2018-11-27 | Incyte Corporation | Substituted imidazo[2,1-f][1,2,4]triazines, substituted imidazo[1,2-a]pyridines, substituted imidazo[1,2-b]pyridazines and substituted imidazo[1,2-a]pyrazines as PI3K-γ inhibitors |
| US20180016260A1 (en) | 2016-07-14 | 2018-01-18 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| US20180057486A1 (en) | 2016-08-29 | 2018-03-01 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CN109641868B (zh) | 2016-08-30 | 2021-12-03 | 广东东阳光药业有限公司 | 流感病毒复制抑制剂及其使用方法和用途 |
| US20180072718A1 (en) | 2016-09-09 | 2018-03-15 | Incyte Corporation | Pyrazolopyridine compounds and uses thereof |
| US10934304B2 (en) | 2016-10-05 | 2021-03-02 | Recurium Ip Holdings, Llc | Spirocyclic compounds |
| KR101755556B1 (ko) | 2016-11-18 | 2017-07-07 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 뇌암 예방 또는 치료용 약학 조성물 및 이의 제조방법 |
| KR101834366B1 (ko) | 2016-11-21 | 2018-03-05 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 유방암 예방 또는 치료용 약학 조성물 및 이의 제조방법 |
| KR101844049B1 (ko) | 2016-12-05 | 2018-03-30 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 간암 예방 또는 치료용 약학 조성물 |
| KR101844050B1 (ko) | 2016-12-09 | 2018-05-14 | 주식회사 케마스 | 육산화사비소의 결정다형을 포함하는 암 예방 또는 치료용 약학 조성물 |
| EP3558963B1 (en) | 2016-12-22 | 2022-03-23 | Incyte Corporation | Bicyclic heteroaromatic compounds as immunomodulators |
| DK3558990T3 (da) | 2016-12-22 | 2022-09-12 | Incyte Corp | Tetrahydroimidazo[4,5-c]pyridinderivater som pd-l1 internaliseringsinducere |
| US20180177784A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| ES2874756T3 (es) | 2016-12-22 | 2021-11-05 | Incyte Corp | Derivados de triazolo[1,5-A]piridina como inmunomoduladores |
| US20180179179A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| IL295660A (en) | 2016-12-22 | 2022-10-01 | Incyte Corp | Benzoxazole derivatives as immunomodulators |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| WO2018234354A1 (en) | 2017-06-20 | 2018-12-27 | Grünenthal GmbH | NOVEL SUBSTITUTED 3-INDOLE AND 3-INDAZOLE COMPOUNDS AS PHOSPHODIESTERASE INHIBITORS |
| EP3672973A4 (en) | 2017-08-22 | 2021-05-26 | JS Innopharm (Shanghai) Ltd. | HETEROCYCLIC COMPOUNDS USED AS KINASE INHIBITORS, COMPOSITIONS INCLUDING THE HETEROCYCLIC COMPOUND, AND METHODS OF USE THEREOF |
| AU2018352695A1 (en) | 2017-10-19 | 2020-05-28 | Effector Therapeutics, Inc. | Benzimidazole-indole inhibitors of Mnk1 and Mnk2 |
| ES2908283T3 (es) | 2017-12-02 | 2022-04-28 | Galapagos Nv | Nuevos compuestos y composiciones farmacéuticas de los mismos para el tratamiento de enfermedades |
| FI3774791T3 (fi) | 2018-03-30 | 2023-03-21 | Incyte Corp | Heterosyklisiä yhdisteitä immunomodulaattoreina |
| CR20200591A (es) | 2018-05-04 | 2021-03-31 | Incyte Corp | Sales de un inhibidor de fgfr |
| IL312465A (en) | 2018-05-04 | 2024-06-01 | Incyte Corp | FGFR inhibitor solid forms and processes for their preparation |
| HUE061503T2 (hu) | 2018-05-11 | 2023-07-28 | Incyte Corp | Tetrahidro-imidazo[4,5-C]piridin-származékok mint PD-L1 immunmodulátorok |
| SG11202101151SA (en) | 2018-08-14 | 2021-03-30 | Osteoqc Inc | Pyrrolo - dipyridine compounds |
| US20210355123A1 (en) | 2018-09-07 | 2021-11-18 | Merck Patent Gmbh | 5-Morpholin-4-yl-pyrazolo[4,3-b]pyridine derivatives |
| JP2022515198A (ja) | 2018-12-19 | 2022-02-17 | アレイ バイオファーマ インコーポレイテッド | FGFRチロシンキナーゼの阻害剤としての置換ピラゾロ[1,5-a]ピリジン化合物 |
| EP3898615A1 (en) | 2018-12-19 | 2021-10-27 | Array Biopharma, Inc. | 7-((3,5-dimethoxyphenyl)amino)quinoxaline derivatives as fgfr inhibitors for treating cancer |
| JP7148802B2 (ja) | 2019-01-25 | 2022-10-06 | 富士通株式会社 | 解析プログラム、解析方法および解析装置 |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| TW202128685A (zh) | 2019-10-14 | 2021-08-01 | 美商英塞特公司 | 作為fgfr抑制劑之雙環雜環 |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| EP4069696A1 (en) | 2019-12-04 | 2022-10-12 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| US11407750B2 (en) | 2019-12-04 | 2022-08-09 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| WO2021146424A1 (en) | 2020-01-15 | 2021-07-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
-
2014
- 2014-04-18 EP EP14732662.3A patent/EP2986610B9/en active Active
- 2014-04-18 AU AU2014253798A patent/AU2014253798C1/en active Active
- 2014-04-18 EA EA202090516A patent/EA202090516A3/ru unknown
- 2014-04-18 US US14/256,438 patent/US9533984B2/en active Active
- 2014-04-18 KR KR1020217018897A patent/KR102469849B1/ko active IP Right Grant
- 2014-04-18 EA EA201592005A patent/EA035095B1/ru unknown
- 2014-04-18 JP JP2016509131A patent/JP6449244B2/ja active Active
- 2014-04-18 CA CA3130452A patent/CA3130452C/en active Active
- 2014-04-18 SG SG11201508328PA patent/SG11201508328PA/en unknown
- 2014-04-18 PE PE2015002236A patent/PE20152033A1/es unknown
- 2014-04-18 MX MX2015014683A patent/MX367878B/es active IP Right Grant
- 2014-04-18 ME MEP-2018-53A patent/ME03015B/me unknown
- 2014-04-18 LT LTEP14732662.3T patent/LT2986610T/lt unknown
- 2014-04-18 TW TW103114284A patent/TWI649318B/zh active
- 2014-04-18 BR BR112015026307-0A patent/BR112015026307B1/pt active IP Right Grant
- 2014-04-18 PT PT147326623T patent/PT2986610T/pt unknown
- 2014-04-18 ES ES17199421T patent/ES2893725T3/es active Active
- 2014-04-18 CN CN201910023729.3A patent/CN109912594A/zh active Pending
- 2014-04-18 RS RS20180225A patent/RS56924B9/sr unknown
- 2014-04-18 SI SI201430543T patent/SI2986610T1/en unknown
- 2014-04-18 EP EP17199421.3A patent/EP3318564B1/en active Active
- 2014-04-18 UA UAA201511370A patent/UA120087C2/uk unknown
- 2014-04-18 PL PL14732662T patent/PL2986610T4/pl unknown
- 2014-04-18 HU HUE14732662A patent/HUE036571T2/hu unknown
- 2014-04-18 DK DK14732662.3T patent/DK2986610T5/en active
- 2014-04-18 CA CA2909207A patent/CA2909207C/en active Active
- 2014-04-18 ES ES14732662.3T patent/ES2657451T3/es active Active
- 2014-04-18 MY MYPI2015002540A patent/MY181497A/en unknown
- 2014-04-18 KR KR1020157032502A patent/KR102269032B1/ko active IP Right Grant
- 2014-04-18 WO PCT/US2014/034662 patent/WO2014172644A2/en active Application Filing
- 2014-04-18 TW TW107146498A patent/TWI715901B/zh active
- 2014-04-18 CN CN201910023251.4A patent/CN109776525B/zh active Active
- 2014-04-18 SG SG10201708520YA patent/SG10201708520YA/en unknown
- 2014-04-18 CN CN201480028858.7A patent/CN105263931B/zh active Active
- 2014-04-21 AR ARP140101651 patent/AR096097A1/es active IP Right Grant
- 2014-12-22 NO NO14827669A patent/NO3087075T3/no unknown
-
2015
- 2015-10-08 IL IL241982A patent/IL241982B/en active IP Right Grant
- 2015-10-14 PH PH12015502383A patent/PH12015502383A1/en unknown
- 2015-10-16 CR CR20150578A patent/CR20150578A/es not_active Application Discontinuation
- 2015-10-19 MX MX2019010709A patent/MX2019010709A/es unknown
- 2015-10-19 CL CL2015003089A patent/CL2015003089A1/es unknown
- 2015-11-19 EC ECIEPI201548555A patent/ECSP15048555A/es unknown
-
2016
- 2016-08-10 HK HK18114275.7A patent/HK1255159A1/zh unknown
- 2016-08-10 HK HK16109534.6A patent/HK1221462A1/zh unknown
- 2016-11-22 US US15/358,371 patent/US10040790B2/en active Active
-
2018
- 2018-02-28 HR HRP20180365TT patent/HRP20180365T2/hr unknown
- 2018-03-09 CY CY20181100286T patent/CY1120556T1/el unknown
- 2018-07-02 US US16/025,519 patent/US10450313B2/en active Active
- 2018-07-30 AU AU2018208772A patent/AU2018208772B2/en active Active
- 2018-10-02 IL IL262038A patent/IL262038B/en unknown
- 2018-12-05 JP JP2018228352A patent/JP6698799B2/ja active Active
-
2019
- 2019-09-10 US US16/566,509 patent/US10947230B2/en active Active
- 2019-12-12 PH PH12019502810A patent/PH12019502810A1/en unknown
-
2020
- 2020-04-28 JP JP2020079472A patent/JP6903790B2/ja active Active
- 2020-10-07 AU AU2020250201A patent/AU2020250201B2/en active Active
-
2021
- 2021-01-28 US US17/160,628 patent/US11530214B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11530214B2 (en) | Bicyclic heterocycles as FGFR inhibitors | |
| US10738048B2 (en) | Bicyclic heterocycles as FGFR4 inhibitors | |
| NZ752422B2 (en) | Bicyclic heterocycles as fgfr inhibitors | |
| NZ713074B2 (en) | Bicyclic heterocycles as fgfr inhibitors |