카테핀 B
Cathepsin B| CTSB | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | CTSB, APP, CPSB, 카테터 B, REEEBUP | ||||||||||||||||||||||||
| 외부 ID | OMIM: 116810 MGI: 88561 HomoloGene: 37550 GeneCard: CTSB | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) |
| ||||||||||||||||||||||||
| RefSeq(단백질) |
| ||||||||||||||||||||||||
| 위치(UCSC) | Chr 8: 11.84 – 11.87Mb | Cr 14: 63.36 – 63.38Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
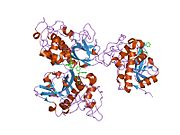
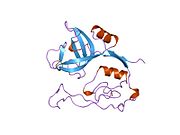
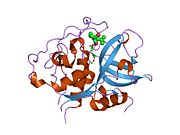
카테핀 B는 시스테인 카테핀으로 알려진 리소솜탈 시스테인 프로테아제군에 속하며 세포내 프로테아 분해에 중요한 역할을 한다.[5]인간에서 카테핀 B는 CTSB 유전자에 의해 암호화된다.[6][7]카테신 B는 특정 암, 악성 전 병변 및 기타 다양한 병리학적 조건에서 조절된다.[8][9][10][11]
구조
유전자
CTSB 유전자는 13개의 exon으로 구성된 8p22 염색체에 위치한다.CTSB 유전자의 발기인은 많은 SP1 사이트를 포함하여 GC가 풍부한 지역을 포함하고 있는데, 이는 하우스키핑 유전자와 유사하다.[12]이 유전자에 대해 동일한 단백질을 인코딩하는 최소 5개의 대본변형이 발견되었다.[13]
단백질
카테신 B는 339개의 아미노산의 프리프로겐자임(preproenzyme)과 17개의 아미노산 신호 펩타이드의 프리프로겐자임(preproenzyme)으로 거친 내소성 망막에서 합성된다.[14][15]그런 다음 43/46 kDa의 프로카테프신 B를 골기 기구로 운반하고, 여기서 카테핀 B가 형성된다.성숙한 카테핀 B는 25-26kDa의 무거운 체인과 5kDa의 가벼운 체인으로 구성되어 있으며, 이황화 조광기로 연결되어 있다.
함수
Cathepsin B, 매트릭스 metalloproteinase, urokinase(세린 프로테아제 우로키나아제 플라스미노겐 활성화 인자), 그리고 cathepsin D,[16][17], 그리고 또한 그것은 세포외 기질 요소들, 세포 내의 소통 단절될 단백질 가수 분해에 필수적인 원칙을 가지고 있으며, 줄인 것을 분해 효소 억제제 expres을 포함한 다른 proteases의 활동을 향상시킬 수 있다.sion.[11]종양 악성종양에 유리한 자가포혈증, 카타볼리즘에도 관여하고 있으며, 특정 면역 저항성에도 관여할 가능성이 있다.[18]또한 최근에는 아미드 결합을 통해 펩타이드 파편을 부착할 수 있는 능력으로 경미한 리가아제 활동을 하는 것으로 결정되었다.[19]
임상적 유의성
카테신 B는 다양한 암에 잠재적으로 효과적인 바이오마커로 제안되었다.[16][20][21][22][23][24]카테핀 B의 과도한 압박은 침습성 암과 전이성 암과 상관관계가 있다.[25]카테핀 B는 신진대사를 하는 동안 근육 조직에서 생성된다.[26]그것은 혈액-뇌 장벽을[27] 넘을 수 있고 신경 유전, 특히 쥐의 틀니트 회에 연관되어 있다.광범위한 질병은 카테핀 B의 높은 수치를 초래하며, 이것은 세포사멸, 염증, 독성 펩타이드의 생산을 포함한 수많은 병리학적 과정을 유발한다.신경학적 질병에 초점을 맞추어 간질적 설치류 모델에서 카테신 B 유전자 결핍 연구는 카테신 B가 간질을 유도한 결과 발생하는 상당한 양의 세포 사멸을 유발한다는 것을 보여주었다.[28]
발작이 유도된 쥐에 대한 카테신 B 억제제 치료는 신경학적 점수와 학습 능력이 향상되고 신경세포 사망 및 세포사멸 펩타이드 투여를 크게 감소시켰다.[29]마찬가지로 외상성 뇌손상 마우스 모델에서 카테신 B 유전자 녹아웃과 카테신 B 억제제 치료 연구는 카테신 B가 신경근육 기능장애, 기억상실, 신경세포 사망 및 친핵 및 친중독성 세포 데스 펩타이드의 생산 증가의 핵심이 된다는 것을 보여주었다.[30][31]허혈성 비인간 영장류 및 설치류 모델에서 카테핀 B 억제제 치료는 특히 해마에서 뇌 뉴런의 상당한 손실을 방지했다.[32][33][34]스트렙토코커스 진폐막염 설치제 모델에서 카테핀 B 억제제 치료는 감염의 임상 과정을 크게 개선하고 뇌 염증 및 염증성 인터루킨-1β(IL1-β)와 종양 괴사 인자-α(TNF-α)[35]를 감소시켰다.
대부분의 AD 환자 또는 인간의 야생형 APP 처리의 자연 모델인 기니피그에서 발견된 야생형 베타-시크레타아제 사이트 시퀀스를 포함하는 인간 아밀로이드 전구 단백질(APP)을 표현하는 유전자 변형 알츠하이머(AD) 동물 모델에서는 카테틴 B 유전자를 유전적으로 삭제하거나 화학적으로 카테핀 B 뇌 ac를 억제한다.이러한 생쥐에서 발병하고 신경독성 전신인 아베타(1-40/42)의 수치를 감소시키는 기억력 결핍이 현저하게 개선되었으며, 특히 병을 유발한다고 생각되는 유해성 피로글루타메이트 아베타(3-40/42)의 수치를 감소시켰다.[36][37][38][39][40][41][42]야생형 베타-시크레타아제 사이트 염기서열을 담은 APP도 함유한 비전환성 노화촉진 마우스 변형에서 칭코 빌로바 잎의 추출물인 빌로발라이드를 이용한 치료도 카테핀 B를 억제해 뇌 아베타를 낮췄다.[43]더욱이 인간의 야생형 베타-시크레타아제 활동을 하는 일차 설치류 해마세포나 소 크로마핀세포에서 siRNA가 카테핀 B를 침묵시키거나 화학적으로 억제하면 규제된 분비 경로에 의해 아베타의 분비를 감소시킨다.[44][45]CTSB 유전자의 돌연변이는 만성 췌장염의 일종인 열대 췌장염과 연관되어 있다.[46]
상호작용
카테핀 B는 다음과 상호 작용하는 것으로 나타났다.
Cathetpsin B는 다음에 의해 억제된다.
참고 항목
참조
- ^ a b c ENSG00000285132 GRCh38: 앙상블 릴리스 89: ENSG00000164733, ENSG00000285132 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000021939 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Sloane BF (April 1990). "Cathepsin B and cystatins: evidence for a role in cancer progression". Seminars in Cancer Biology. 1 (2): 137–52. PMID 2103490.
- ^ Chan SJ, San Segundo B, McCormick MB, Steiner DF (October 1986). "Nucleotide and predicted amino acid sequences of cloned human and mouse preprocathepsin B cDNAs". Proceedings of the National Academy of Sciences of the United States of America. 83 (20): 7721–5. Bibcode:1986PNAS...83.7721C. doi:10.1073/pnas.83.20.7721. PMC 386793. PMID 3463996.
- ^ Cao L, Taggart RT, Berquin IM, Moin K, Fong D, Sloane BF (February 1994). "Human gastric adenocarcinoma cathepsin B: isolation and sequencing of full-length cDNAs and polymorphisms of the gene". Gene. 139 (2): 163–9. doi:10.1016/0378-1119(94)90750-1. PMID 8112600.
- ^ Tong B, Wan B, Wei Z, Wang T, Zhao P, Dou Y, Lv Z, Xia Y, Dai Y (September 2014). "Role of cathepsin B in regulating migration and invasion of fibroblast-like synoviocytes into inflamed tissue from patients with rheumatoid arthritis". Clinical and Experimental Immunology. 177 (3): 586–97. doi:10.1111/cei.12357. PMC 4137842. PMID 24749816.
- ^ Lai WF, Chang CH, Tang Y, Bronson R, Tung CH (March 2004). "Early diagnosis of osteoarthritis using cathepsin B sensitive near-infrared fluorescent probes". Osteoarthritis and Cartilage. 12 (3): 239–44. doi:10.1016/j.joca.2003.11.005. PMID 14972341.
- ^ Ha SD, Ham B, Mogridge J, Saftig P, Lin S, Kim SO (January 2010). "Cathepsin B-mediated autophagy flux facilitates the anthrax toxin receptor 2-mediated delivery of anthrax lethal factor into the cytoplasm". The Journal of Biological Chemistry. 285 (3): 2120–9. doi:10.1074/jbc.M109.065813. PMC 2804368. PMID 19858192.
- ^ a b Yang WE, Ho CC, Yang SF, Lin SH, Yeh KT, Lin CW, Chen MK (2016). "Cathepsin B Expression and the Correlation with Clinical Aspects of Oral Squamous Cell Carcinoma". PLOS ONE. 11 (3): e0152165. Bibcode:2016PLoSO..1152165Y. doi:10.1371/journal.pone.0152165. PMC 4816521. PMID 27031837.
- ^ Qian F, Frankfater A, Chan SJ, Steiner DF (April 1991). "The structure of the mouse cathepsin B gene and its putative promoter". DNA and Cell Biology. 10 (3): 159–68. doi:10.1089/dna.1991.10.159. PMID 2012677.
- ^ "Entrez Gene: CTSB cathepsin B".
- ^ Kirschke H, Barrett AJ, Rawlings ND (1995). "Proteinases 1: lysosomal cysteine proteinases". Protein Profile. 2 (14): 1581–643. PMID 8771190.
- ^ Mort JS, Buttle DJ (May 1997). "Cathepsin B". The International Journal of Biochemistry & Cell Biology. 29 (5): 715–20. doi:10.1016/s1357-2725(96)00152-5. PMID 9251238.
- ^ a b Alapati K, Kesanakurti D, Rao JS, Dasari VR (May 2014). "uPAR and cathepsin B-mediated compartmentalization of JNK regulates the migration of glioma-initiating cells". Stem Cell Research. 12 (3): 716–29. doi:10.1016/j.scr.2014.02.008. PMC 4061617. PMID 24699410.
- ^ Vigneswaran N, Zhao W, Dassanayake A, Muller S, Miller DM, Zacharias W (August 2000). "Variable expression of cathepsin B and D correlates with highly invasive and metastatic phenotype of oral cancer". Human Pathology. 31 (8): 931–7. doi:10.1053/hupa.2000.9035. PMID 10987253.
- ^ Fais S (December 2007). "Cannibalism: a way to feed on metastatic tumors". Cancer Letters. 258 (2): 155–64. doi:10.1016/j.canlet.2007.09.014. PMID 17977647.
- ^ Lambeth, Tyler R.; Dai, Zhefu; Zhang, Yong; Julian, Ryan R. (2021). "A two-trick pony: lysosomal protease cathepsin B possesses surprising ligase activity". RSC Chemical Biology. 2 (2): 606–611. doi:10.1039/D0CB00224K. ISSN 2633-0679. PMC 8291735. PMID 34291207.
- ^ Mirković B, Markelc B, Butinar M, Mitrović A, Sosič I, Gobec S, Vasiljeva O, Turk B, Čemažar M, Serša G, Kos J (August 2015). "Nitroxoline impairs tumor progression in vitro and in vivo by regulating cathepsin B activity". Oncotarget. 6 (22): 19027–42. doi:10.18632/oncotarget.3699. PMC 4662473. PMID 25848918.
- ^ Bian B, Mongrain S, Cagnol S, Langlois MJ, Boulanger J, Bernatchez G, Carrier JC, Boudreau F, Rivard N (May 2016). "Cathepsin B promotes colorectal tumorigenesis, cell invasion, and metastasis". Molecular Carcinogenesis. 55 (5): 671–87. doi:10.1002/mc.22312. PMC 4832390. PMID 25808857.
- ^ Bengsch F, Buck A, Günther SC, Seiz JR, Tacke M, Pfeifer D, von Elverfeldt D, Sevenich L, Hillebrand LE, Kern U, Sameni M, Peters C, Sloane BF, Reinheckel T (September 2014). "Cell type-dependent pathogenic functions of overexpressed human cathepsin B in murine breast cancer progression". Oncogene. 33 (36): 4474–84. doi:10.1038/onc.2013.395. PMC 4139469. PMID 24077280.
- ^ Bao W, Fan Q, Luo X, Cheng WW, Wang YD, Li ZN, Chen XL, Wu D (August 2013). "Silencing of Cathepsin B suppresses the proliferation and invasion of endometrial cancer". Oncology Reports. 30 (2): 723–30. doi:10.3892/or.2013.2496. PMID 23708264.
- ^ Yin M, Soikkeli J, Jahkola T, Virolainen S, Saksela O, Hölttä E (December 2012). "TGF-β signaling, activated stromal fibroblasts, and cysteine cathepsins B and L drive the invasive growth of human melanoma cells". The American Journal of Pathology. 181 (6): 2202–16. doi:10.1016/j.ajpath.2012.08.027. PMID 23063511.
- ^ Ruan J, Zheng H, Rong X, Rong X, Zhang J, Fang W, Zhao P, Luo R (20 February 2016). "Over-expression of cathepsin B in hepatocellular carcinomas predicts poor prognosis of HCC patients". Molecular Cancer. 15: 17. doi:10.1186/s12943-016-0503-9. PMC 4761221. PMID 26896959.
- ^ Vivar C, Potter MC, van Praag H (2012). "All about running: synaptic plasticity, growth factors and adult hippocampal neurogenesis". Neurogenesis and Neural Plasticity. Current Topics in Behavioral Neurosciences. Vol. 15. pp. 189–210. doi:10.1007/7854_2012_220. ISBN 978-3-642-36231-6. PMC 4565722. PMID 22847651.
- ^ Moon HY, Becke A, Berron D, Becker B, Sah N, Benoni G, Janke E, Lubejko ST, Greig NH, Mattison JA, Duzel E, van Praag H (June 2016). "Running-Induced Systemic Cathepsin B Secretion Is Associated with Memory Function". Cell Metabolism. 24 (2): 332–40. doi:10.1016/j.cmet.2016.05.025. PMC 6029441. PMID 27345423.
- ^ Houseweart MK, Pennacchio LA, Vilaythong A, Peters C, Noebels JL, Myers RM (September 2003). "Cathepsin B but not cathepsins L or S contributes to the pathogenesis of Unverricht-Lundborg progressive myoclonus epilepsy (EPM1)". Journal of Neurobiology. 56 (4): 315–27. doi:10.1002/neu.10253. PMID 12918016.
- ^ Ni H, Ren SY, Zhang LL, Sun Q, Tian T, Feng X (February 2013). "Expression profiles of hippocampal regenerative sprouting-related genes and their regulation by E-64d in a developmental rat model of penicillin-induced recurrent epilepticus". Toxicology Letters. 217 (2): 162–9. doi:10.1016/j.toxlet.2012.12.010. PMID 23266720.
- ^ Hook GR, Yu J, Sipes N, Pierschbacher MD, Hook V, Kindy MS (March 2014). "The cysteine protease cathepsin B is a key drug target and cysteine protease inhibitors are potential therapeutics for traumatic brain injury". Journal of Neurotrauma. 31 (5): 515–29. doi:10.1089/neu.2013.2944. PMC 3934599. PMID 24083575.
- ^ Luo CL, Chen XP, Yang R, Sun YX, Li QQ, Bao HJ, Cao QQ, Ni H, Qin ZH, Tao LY (October 2010). "Cathepsin B contributes to traumatic brain injury-induced cell death through a mitochondria-mediated apoptotic pathway". Journal of Neuroscience Research. 88 (13): 2847–58. doi:10.1002/jnr.22453. PMID 20653046. S2CID 2977933.
- ^ Yoshida M, Yamashima T, Zhao L, Tsuchiya K, Kohda Y, Tonchev AB, Matsuda M, Kominami E (September 2002). "Primate neurons show different vulnerability to transient ischemia and response to cathepsin inhibition". Acta Neuropathologica. 104 (3): 267–72. doi:10.1007/s00401-002-0554-4. PMID 12172912. S2CID 10913622.
- ^ Tsuchiya K, Kohda Y, Yoshida M, Zhao L, Ueno T, Yamashita J, Yoshioka T, Kominami E, Yamashima T (February 1999). "Postictal blockade of ischemic hippocampal neuronal death in primates using selective cathepsin inhibitors". Experimental Neurology. 155 (2): 187–94. doi:10.1006/exnr.1998.6988. PMID 10072294. S2CID 22548769.
- ^ Tsubokawa T, Yamaguchi-Okada M, Calvert JW, Solaroglu I, Shimamura N, Yata K, Zhang JH (September 2006). "Neurovascular and neuronal protection by E64d after focal cerebral ischemia in rats". Journal of Neuroscience Research. 84 (4): 832–40. doi:10.1002/jnr.20977. PMID 16802320. S2CID 24194809.
- ^ Hoegen T, Tremel N, Klein M, Angele B, Wagner H, Kirschning C, Pfister HW, Fontana A, Hammerschmidt S, Koedel U (November 2011). "The NLRP3 inflammasome contributes to brain injury in pneumococcal meningitis and is activated through ATP-dependent lysosomal cathepsin B release". Journal of Immunology. 187 (10): 5440–51. doi:10.4049/jimmunol.1100790. PMID 22003197.
- ^ Hook VY, Kindy M, Hook G (March 2008). "Inhibitors of cathepsin B improve memory and reduce beta-amyloid in transgenic Alzheimer disease mice expressing the wild-type, but not the Swedish mutant, beta-secretase site of the amyloid precursor protein". The Journal of Biological Chemistry. 283 (12): 7745–53. doi:10.1074/jbc.m708362200. PMID 18184658.
- ^ Hook V, Kindy M, Hook G (February 2007). "Cysteine protease inhibitors effectively reduce in vivo levels of brain beta-amyloid related to Alzheimer's disease". Biological Chemistry. 388 (2): 247–52. doi:10.1515/bc.2007.027. PMID 17261088. S2CID 34617103.
- ^ Hook G, Hook VY, Kindy M (September 2007). "Cysteine protease inhibitors reduce brain beta-amyloid and beta-secretase activity in vivo and are potential Alzheimer's disease therapeutics". Biological Chemistry. 388 (9): 979–83. doi:10.1515/BC.2007.117. PMID 17696783. S2CID 84162059.
- ^ Hook VY, Kindy M, Reinheckel T, Peters C, Hook G (August 2009). "Genetic cathepsin B deficiency reduces beta-amyloid in transgenic mice expressing human wild-type amyloid precursor protein". Biochemical and Biophysical Research Communications. 386 (2): 284–8. doi:10.1016/j.bbrc.2009.05.131. PMC 2753505. PMID 19501042.
- ^ Hook G, Hook V, Kindy M (2011). "The cysteine protease inhibitor, E64d, reduces brain amyloid-β and improves memory deficits in Alzheimer's disease animal models by inhibiting cathepsin B, but not BACE1, β-secretase activity". Journal of Alzheimer's Disease. 26 (2): 387–408. doi:10.3233/JAD-2011-110101. PMC 4317342. PMID 21613740.
- ^ Kindy MS, Yu J, Zhu H, El-Amouri SS, Hook V, Hook GR (2012). "Deletion of the cathepsin B gene improves memory deficits in a transgenic ALZHeimer's disease mouse model expressing AβPP containing the wild-type β-secretase site sequence". Journal of Alzheimer's Disease. 29 (4): 827–40. doi:10.3233/JAD-2012-111604. PMC 4309289. PMID 22337825.
- ^ Hook G, Yu J, Toneff T, Kindy M, Hook V (2014). "Brain pyroglutamate amyloid-β is produced by cathepsin B and is reduced by the cysteine protease inhibitor E64d, representing a potential Alzheimer's disease therapeutic". Journal of Alzheimer's Disease. 41 (1): 129–49. doi:10.3233/JAD-131370. PMC 4059604. PMID 24595198.
- ^ Shi C, Zheng DD, Wu FM, Liu J, Xu J (February 2012). "The phosphatidyl inositol 3 kinase-glycogen synthase kinase 3β pathway mediates bilobalide-induced reduction in amyloid β-peptide". Neurochemical Research. 37 (2): 298–306. doi:10.1007/s11064-011-0612-1. PMID 21952928. S2CID 5744771.
- ^ Hook V, Toneff T, Bogyo M, Greenbaum D, Medzihradszky KF, Neveu J, Lane W, Hook G, Reisine T (September 2005). "Inhibition of cathepsin B reduces beta-amyloid production in regulated secretory vesicles of neuronal chromaffin cells: evidence for cathepsin B as a candidate beta-secretase of Alzheimer's disease". Biological Chemistry. 386 (9): 931–40. doi:10.1515/BC.2005.108. PMID 16164418. S2CID 9038695.
- ^ Klein DM, Felsenstein KM, Brenneman DE (March 2009). "Cathepsins B and L differentially regulate amyloid precursor protein processing". The Journal of Pharmacology and Experimental Therapeutics. 328 (3): 813–21. doi:10.1124/jpet.108.147082. PMID 19064719. S2CID 7798381.
- ^ Tandon RK (January 2007). "Tropical pancreatitis". Journal of Gastroenterology. 42 Suppl 17 (Suppl 17): 141–7. doi:10.1007/s00535-006-1930-y. PMID 17238044. S2CID 2796833.
- ^ van der Stappen JW, Williams AC, Maciewicz RA, Paraskeva C (August 1996). "Activation of cathepsin B, secreted by a colorectal cancer cell line requires low pH and is mediated by cathepsin D". International Journal of Cancer. 67 (4): 547–54. doi:10.1002/(SICI)1097-0215(19960807)67:4<547::AID-IJC14>3.0.CO;2-4. PMID 8759615.
- ^ a b Pavlova A, Björk I (September 2003). "Grafting of features of cystatins C or B into the N-terminal region or second binding loop of cystatin A (stefin A) substantially enhances inhibition of cysteine proteinases". Biochemistry. 42 (38): 11326–33. doi:10.1021/bi030119v. PMID 14503883.
- ^ Estrada S, Nycander M, Hill NJ, Craven CJ, Waltho JP, Björk I (May 1998). "The role of Gly-4 of human cystatin A (stefin A) in the binding of target proteinases. Characterization by kinetic and equilibrium methods of the interactions of cystatin A Gly-4 mutants with papain, cathepsin B, and cathepsin L". Biochemistry. 37 (20): 7551–60. doi:10.1021/bi980026r. PMID 9585570.
- ^ Pol E, Björk I (September 2001). "Role of the single cysteine residue, Cys 3, of human and bovine cystatin B (stefin B) in the inhibition of cysteine proteinases". Protein Science. 10 (9): 1729–38. doi:10.1110/ps.11901. PMC 2253190. PMID 11514663.
- ^ Mai J, Finley RL, Waisman DM, Sloane BF (April 2000). "Human procathepsin B interacts with the annexin II tetramer on the surface of tumor cells". The Journal of Biological Chemistry. 275 (17): 12806–12. doi:10.1074/jbc.275.17.12806. PMID 10777578.
- ^ Hurley EA, Thorley-Lawson DA (December 1988). "B cell activation and the establishment of Epstein-Barr virus latency". The Journal of Experimental Medicine. 168 (6): 2059–75. doi:10.1084/jem.168.6.2059. PMC 2189139. PMID 2848918.
- ^ Murata M, Miyashita S, Yokoo C, Tamai M, Hanada K, Hatayama K, Towatari T, Nikawa T, Katunuma N (March 1991). "Novel epoxysuccinyl peptides. Selective inhibitors of cathepsin B, in vitro". FEBS Letters. 280 (2): 311–15. doi:10.1016/0014-5793(91)80318-w. PMID 2013328. S2CID 46523390.