CN1809789A - 用于远紫外光刻的光致抗蚀剂组合物 - Google Patents
用于远紫外光刻的光致抗蚀剂组合物 Download PDFInfo
- Publication number
- CN1809789A CN1809789A CN200480004743.0A CN200480004743A CN1809789A CN 1809789 A CN1809789 A CN 1809789A CN 200480004743 A CN200480004743 A CN 200480004743A CN 1809789 A CN1809789 A CN 1809789A
- Authority
- CN
- China
- Prior art keywords
- polymkeric substance
- alkyl
- group
- composition
- unit
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0046—Photosensitive materials with perfluoro compounds, e.g. for dry lithography
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
- G03F7/0395—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition the macromolecular compound having a backbone with alicyclic moieties
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S430/00—Radiation imagery chemistry: process, composition, or product thereof
- Y10S430/1053—Imaging affecting physical property or radiation sensitive material, or producing nonplanar or printing surface - process, composition, or product: radiation sensitive composition or product or process of making binder containing
- Y10S430/1055—Radiation sensitive composition or product or process of making
- Y10S430/106—Binder containing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S430/00—Radiation imagery chemistry: process, composition, or product thereof
- Y10S430/1053—Imaging affecting physical property or radiation sensitive material, or producing nonplanar or printing surface - process, composition, or product: radiation sensitive composition or product or process of making binder containing
- Y10S430/1055—Radiation sensitive composition or product or process of making
- Y10S430/106—Binder containing
- Y10S430/108—Polyolefin or halogen containing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S430/00—Radiation imagery chemistry: process, composition, or product thereof
- Y10S430/1053—Imaging affecting physical property or radiation sensitive material, or producing nonplanar or printing surface - process, composition, or product: radiation sensitive composition or product or process of making binder containing
- Y10S430/1055—Radiation sensitive composition or product or process of making
- Y10S430/106—Binder containing
- Y10S430/111—Polymer of unsaturated acid or ester
Landscapes
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- General Physics & Mathematics (AREA)
- Materials For Photolithography (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本发明涉及一种光致抗蚀剂组合物,包括一种光酸生成剂和至少一种包含至少一种由结构1描述的单元的聚合物。本发明还涉及本发明的光致抗蚀剂组合物的成像方法,和涉及在有机碱存在条件下制备该聚合物的方法。
Description
本申请是于2003年2月21日提交的序列号10/371,262的部分继续,其内容在此引入作为参考。
技术领域
本发明涉及一种新的光致抗蚀剂组合物,它特别地可用于微光刻术领域,和尤其可用于在半导体器件制造中成像正性图案。这种光致抗蚀剂树脂组合物包括一种聚合物或聚合物混合物、一种光活性组分和任选地一种碱添加剂,在该聚合物中在脂肪族环状氟化聚合物上的氟代醇部分全部或部分地被烷基羰基烷基(AOCA)保护基所保护。这种新的光致抗蚀剂的树脂在远紫外(UV)区域有高透明性,和这种组合物特别地用于在193纳米(nm)和157nm处曝光。本发明进一步涉及成像这种新的光致抗蚀剂的方法。本发明还涉及制备本发明的聚合物的方法。
发明背景
光致抗蚀剂组合物在微光刻工艺中用于制造小型化电子部件,例如制造计算机芯片和集成电路。通常,在这些工艺中,光致抗蚀剂组合物的薄膜涂层首先施涂于一个基体材料上,例如用于制造集成电路的硅片。涂覆的基体接着焙烧以蒸发光致抗蚀剂组合物中的任何溶剂和将涂层固定到基体上。涂覆在基体上的光致抗蚀剂随后图像式曝光于辐射。
辐射曝光引起涂覆表面的曝光区域中的化学转换。可见光、紫外(UV)光、电子束和X射线辐射能是今天在微光刻工艺中常见的辐射类型。在这种图像式曝光之后,涂覆的基体用显影剂溶液处理以溶解和去除光致抗蚀剂的辐射曝光区域或未曝光的区域。
半导体器件小型化的趋势已经导致使用在越来越低波长的辐射下敏感的新的光致抗蚀剂和还导致使用高级的多级系统以克服和这种小型化有关的困难。
本光致抗蚀剂组合物是正性工作的光致抗蚀剂,即,当它们图像式曝光于辐射时,光致抗蚀剂组合物的曝光于辐射的那些区域变得对显影剂溶液更可溶(例如发生重排反应),而没有曝光的那些区域保持对显影剂溶液相对不可溶。因此,用显影剂处理曝光的正性工作光致抗蚀剂引起涂层的曝光区域的去除和在光致抗蚀剂涂层中形成正像。再次地,底层表面的所希望的部分露出来。
光致抗蚀剂分辨率定义为光致抗蚀剂组合物能够在曝光和显影后以高度图像边缘精度从光掩模转移到基体的最小特征。在今天的许多前沿制造应用中,需要小于100nm数量级的光致抗蚀剂组合物。此外,几乎总是希望显影的光致抗蚀剂壁轮廓是相对于基体接近垂直。在光致抗蚀剂涂层的显影区域和未显影区域之间的这种分界线翻译为掩模图像向基体上的精确图案转移。当向小型化的推进降低了器件上的临界尺寸时,这变得甚至更加重要。
对约100nm-约300nm之间的短波长敏感的光致抗蚀剂经常用在要求亚半微米几何尺寸的场合。特别优选的是包含非芳族聚合物、光酸生成剂、任选地溶解抑制剂和溶剂的光致抗蚀剂。
高分辩率的、化学放大的、远紫外(100-300nm)的正性和负性色调光致抗蚀剂可获得用于构图具有小于四分之一微米几何尺寸的图像。直到今天,有三种主要的远紫外(uv)曝光技术已经提供了在小型化中的显著进步,和这些使用了在248nm,193nm和157nm处发射辐射的激光器。用于248nm的光致抗蚀剂典型地基于取代的聚羟基苯乙烯和其共聚物,例如描述于US 4,491,628和US 5,350,660的那些。另一方面,用于在200nm以下曝光的光致抗蚀剂要求非芳族聚合物,因为芳族化合物在此波长下是不透明的。US 5,843,624和GB 2320718公开了可用于193nm曝光的光致抗蚀剂。通常,含有脂环族烃的聚合物用于在200nm以下曝光的光致抗蚀剂。脂环族烃由于许多原因而引入到聚合物中,主要是因为它们具有相对高的改善耐刻蚀性的碳氢比,它们也提供了在低波长处的透明性和它们具有较高的玻璃化转变温度。US 5,843,624公开了用于光致抗蚀剂的聚合物,通过马来酸酐和不饱和环状单体的自由基聚合得到,但马来酸酐的存在使得这些聚合物在157nm处的透明性不足。
在157nm处敏感的和基于含有侧挂氟代醇基团的氟化聚合物的两种基本种类的光致抗蚀剂已知是在该波长处基本透明的。一类157nm氟代醇光致抗蚀剂来自含有基团例如氟代降冰片烯的聚合物,并使用金属催化的或自由基聚合反应进行均聚或与其他透明单体例如四氟乙烯共聚(Hoang V.Tran等Macromolecules 35,6539,2002,WO00/67072,WO 00/17712)。通常,这些材料由于它们的高脂环族含量而产生较高的吸收性,但具有好的耐等离子刻蚀性。近来,描述了一类157nm氟代醇聚合物,其中聚合物主链来自不对称二烯例如1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯的环聚反应(Shun-ichi Kodama等Advances in Resist Technology andProcessing XIX,Proceedings of SPIE Vol.4690 p76 2002;WO02/065212)或氟代二烯与烯烃的共聚合反应(WO 01/98834-A1)。这些材料在157nm出产生可接受的吸收性,但由于它们相比于氟代降冰片烯较低的脂环族含量而具有较低的耐等离子刻蚀性。这两类聚合物经常可共混以提供在第一种聚合物类型的高耐刻蚀性和第二种聚合物类型在157nm处的高透明性之间的平衡。
然而,任何这些途径的重要限制是用于氟代醇的合适保护基的获得性。在几乎所有的这些途径中,用于氟代醇部分的酸不稳定保护基团在范围上已经主要地限制到缩醛型(例如MOM(甲氧基甲基)),或四烷氧基羰基(例如t-BOC(叔丁氧基羰基)或叔烷基保护基。在该全氟代醇部分上的这些保护基团相对不稳定和在聚合反应期间经常发生部分或完全的脱保护。
保护氟代醇官能度的困难和产生的未曝光光致抗蚀剂膜损失已经意味着酸不稳定官能度经常仅仅可以连接到甲基丙烯酸酯、丙烯酸酯、或降冰片烯羧酸重复单元(它们对157nm处的透明性是有害的)或溶解抑制剂添加剂(WO 00/67072,WO 00/17712 Hoang V.Tran等Macromolecules 35,6539,2002)。本发明的目的是提供一种保护基,它将给予在157nm处的良好透明性和将会具有对合成条件和光致抗蚀剂加工条件两者的高热稳定性。
该申请的发明人已经发现,令人意外地,脂肪族环状聚合物可具有容易用烷氧基羰基烷基(AOCA)基团官能化的氟代醇部分,和该基团提供给这些类型的树脂意外的用于光致抗蚀剂用途的优点。
AOC基团,特别是叔丁氧基羰基甲基(BOCME)基团,已经在制药用途中有一些作为取代基的在先使用(WO9533753,DE 2460537)。它也已经用在光致抗蚀剂应用中,其中BOCME基团连接到树脂中的酚部分或作为小分子溶解抑制剂,并与辐射在i-线(JP09211865),248nm(JP 20011312065,US 6333436B1,US 6369276,JP08193055)或电子束和X射线(JP2000-376059)使用。此外,在248nm处它还用于保护酚醛树脂(JP 08176051)。此外,BOCME基团还已经用于保护一些用于157nm光致抗蚀剂的具体单体。US 2002/090572 A1和US2002/0081520 A1讨论了在倍半硅氧烷基聚合物和共聚物中使用BOCME保护的六氟双酚-A,然而它们在157nm处有非常的吸收性。另外,使用BOCME基团保护连接到环状或脂环族聚合物重复单元的氟代醇部分公开于WO 02/44811 A2和EP 1,275,666。在WO 01/74916 A1中其摘要披露了具有一个含酸可分解的基团的片段、一个来自氟代丙烯酸酯的片段和另一个来自其他可共聚单体的片段的聚合物,和该专利申请公开了各种的可能聚合物。在WO 02/44811 A2中,BOCME基团用于保护降冰片烯氟代醇基团,然而该聚合物以与四氟乙烯共聚物的共混物使用。
BOCME的氟化同系物(例如-FC(CH3)CO2t-Bu)已经被描述为在应用例如除草剂中作为苯酚部分的取代基(EP0044979)。US2002/0061466披露了BOCME的氟化同系物的官能化,但是是在丙烯酸酯单体上。
本申请的发明人已经发现,当AOCA基团用于保护氟代醇部分时,意想不到地发现具有比t-BOC基团或MOM保护基高的对热裂解的稳定性。通常,从光致抗蚀剂的观点看,通过使用AOCA基团,特别BOCME基团赋予的受保护氟代醇这种热稳定性的增加是所希望的,因为它增加了热加工范围和贮存寿命。还有,从合成的观点看,热稳定性的这种增加是所希望的,因为它有助于增加受保护氟代醇聚合物的收率,无论它们是通过保护预形成的氟代醇聚合物制成的还是通过含有被AOCA基团保护的带氟代醇聚合物的单体进行聚合反应制成的。令人意外地,尽管其有高热稳定性,特别是BOCME保护基可以被曝光的光致抗蚀剂区域中的光释放酸而容易地去除,要求标准的后曝光焙烧温度进行裂解(110℃-130℃)。申请人还发现全氟醇用AOCA基团的官能化导致比使用含有降冰片烯-5-羧酸重复单元的光致抗蚀剂树脂的羧酸叔丁基酯高对比度的光致抗蚀剂系统。
AOCA基团官能化到聚合物的方法包括将一种含羟基的聚合物与一种能够提供AOCA基团的反应物反应,和反应在碱存在下进行。典型地,金属碱,特别是碱金属和碱土金属,已经被用于这种反应,这种碱的例子是氢化纳、叔丁醇锂、叔丁醇钾等。US 6,210,859披露了聚羟基苯乙烯与溴乙酸叔丁酯和溴乙酸吗啉代酯在25%的四甲基氢氧化铵水溶液存在下的反应。
本申请的发明人发现,对于本发明的脂肪族聚合物的合成,有机碱,特别是铵碱,比金属碱有优势。来自金属碱的金属比有机碱更难于从最终的光致抗蚀剂中去除,和金属碱可能留下痕量的金属,对于最终产物有害。
发明概述
本发明涉及一种光致抗蚀剂组合物,包括一种光酸生成剂和至少一种包含至少一种由结构1描述的单元的新的聚合物,
其中:
(i)R1是聚合物的脂肪族环状单元,R2选自H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基,和(CR3R4)p(CO)OR5,Rf选自F,H,(C1-C8)烷基,或全部或部分氟化的烷基,和环氟烷基,或
(ii)R1和R2结合形成聚合物的脂肪族环状单元,Rf选自F,H,(C1-C8)烷基和全部或部分氟化的烷基,和环氟烷基,或
(ii)R1和Rf结x合形成聚合物的脂肪族环状单元,和R2选自H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基和(CR3R4)p(CO)OR5;和
R3和R4独立地是H,F,(C1-C8)烷基,(C1-C8氟烷基,环烷基,环氟烷基,(CR3R4)p(CO)OR5,R3和R4可以结合形成烷基螺环或氟烷基螺环基团,
X选自(C1-C8)亚烷基,(C1-C8)氟亚烷基,O(C1-C8)亚烷基,O(C1-C8)氟亚烷基,环烷基和氟化环烷基,
R5是H或一个酸不稳定基团,m=0-1,和p=1-4。
本发明还涉及本发明的光致抗蚀剂组合物的成像方法,尤其在157nm处。
本发明进一步涉及使用有机碱,特别是铵碱,制备本发明的聚合物的方法。
发明详述
本发明涉及一种新的光致抗蚀剂组合物,包括一种光酸生成剂和至少一种包含至少一种由结构1描述的、用烷氧基羰基烷基官能化的脂肪族环状氟代醇基团的单元的新的聚合物,
其中:
(i)R1是聚合物的脂肪族环状单元,R2选自H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基,和(CR3R4)p(CO)OR5,Rf选自F,H,(C1-C8)烷基,或全部或部分氟化的烷基,和环氟烷基,或
(ii)R1和R2结合形成聚合物的脂肪族环状单元,Rf选自F,H,(C1-C8)烷基和全部或部分氟化的烷基,和环氟烷基,或
(ii)R1和Rf结合形成聚合物的脂肪族环状单元,和R2选自H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基和(CR3R4)p(CO)OR5;和
R3和R4独立地是H,F,(C1-C8)烷基,(C1-C8氟烷基,环烷基,环氟烷基,(CR3R4)p(CO)OR5,R3和R4可以结合形成烷基螺环或氟烷基螺环基团,
X选自(C1-C8)亚烷基,(C1-C8)氟亚烷基,O(C1-C8)亚烷基,O(C1-C8)氟亚烷基,环烷基和氟化环烷基,
R5是H或一个酸不稳定基团,m=0-1,和p=1-4。
该组合物特别地可用于在100-300nm范围内成像,和更特别地用于157nm和193nm,和甚至更特别用于157nm成像。本发明进一步涉及成像新的光致抗蚀剂的方法,特别是在100nm-200nm范围内的波长,和更特别用于在193nm和157nm成像的方法。
在本申请中,官能度烷氧基羰基烷基(AOCA)以-(CR3R4)p(CO)OR5表示,指代脂肪族环状氟代醇的官能度以R1(X)mC(RfR2)O-H表示,如结构1中所示。典型地,脂肪族环状氟代醇与能够提供AOCA基团的化合物反应,形成包括至少一种结构1的单元的新的聚合物。
本发明的聚合物可以是碱不溶性的或实质上碱不溶性的,即当R5是酸不稳定基团时。或者,本发明的聚合物可以是碱溶性的,即当R5是氢时。当聚合物碱溶性的时,要求一种溶解抑制剂以使未曝光的区域对显影剂是不溶性的。然而,当聚合物具有一个酸不稳定基团时,则在曝光期间光酸生成剂形成酸,它通过酸解或水解进一步裂解R5基团得到现在是实质上碱不溶性的聚合物。酸不稳定基团的例子没有限制地是具有至少一个β氢的仲和叔烷基(最高到20个碳原子),缩醛和缩酮,三甲基甲硅烷基,和β-三烷基甲硅烷基取代的烷基。酸不稳定基团的代表性例子是叔丁基、叔戊基、异冰片基、1-烷基环己基、1-烷基环戊基、环己基、2-烷基-2-金刚烷基、2-烷基-2-降冰片基。酸不稳定基团的其他例子是四氢呋喃基、四氢吡喃基、取代或未取代的甲氧基羰基,β-三烷基甲硅烷基烷基(例如CH2-CH2Si(CH3)3,CH(-CH2Si(CH3)3)2,CH2-CH(Si(CH3)3)2等。
本发明的聚合物包括至少一种结构1的单元,其中该单元包含至少一种非芳族脂肪族环状基团,它是聚合物主链的一部分和可以是单环或多环的。脂肪族环状基团是重要的,因为它们对光致抗蚀剂提供了必要的耐干刻蚀性。AOCA基团从可以是多环或单环的脂肪族环状基团上侧挂。在本发明的一个实施方案中,R1是作为聚合物主链一部分的多环或单环单元。在另一个实施方案中,R1和R2或R1和Rf结合形成作为聚合物主链一部分的多环或单环单元。
典型地,多环基团是来自基于降冰片烯的单体的那些,和可以用于形成本发明聚合物的这种多环单体的例子由图1表示。
其中,在图1中,R1-R7独立地是H,F,(C1-C8)烷基,(C1-C8氟烷基等,但R1-R6的至少一个具有在结构1中描述的侧挂的氧AOCA官能度,或可被封端得到结构1的单元的醇官能度。
图1:基于降冰片烯的单体的一般性结构
图1的多环单体是多环单体的一般性结构,它们单独聚合或与其他单体聚合,直接得到本发明的聚合物或聚合得到带有自由氟代醇的多环聚合物,该聚合物接着可以用AOCA基团封端。
典型地,这种多环单体用一种活性金属催化剂,钯或镍配合物,例如在Hoang V.Tran等Macromolecules 35 6539,2002中描述的那些聚合,其在此作为参考引用。对于氟代醇基团的封端,可提供AOCA基团的化合物的例子没有限制地是溴乙酸叔丁酯、氯乙酸叔丁酯、甲磺酰氧基乙酸叔丁酯、溴乙酸叔戊酯、溴乙酸2-甲基-2-金刚烷基酯、溴乙酸2-甲基-2-降冰片基酯、3-溴丙酸叔丁酯、2-溴-2,2-二氟丁酸叔丁酯。
图1的多环单元被取代使得在聚合物内至少一个单元具有结构1,但环状基团也可以具有其他取代基。典型的取代基是H、F、烷基、氟烷基、环烷基、氟环烷基和氰基。此外,如在图1中所示的,R1和R2或R5和R4或R6和R7取代基可以一起是螺烷基或氟螺烷基取代基的一部分。
在上述定义和整个说明书中,烷基是指具有所需数目的碳原子和化合价的直链或支链烷基。合适的直链烷基包括甲基、乙基、丙基、丁基、戊基等;支链烷基包括异丙基、异丁基、仲丁基或叔丁基、支链戊基等。氟烷基是指全部或部分被氟取代的烷基,其例子是三氟甲基、五氟乙基、全氟异丙基、2,2,2-三氟乙基和1,1-二氟丙基。亚烷基是指亚甲基、亚乙基、亚丙基等。烷基螺环或氟烷基螺环是连接到同一碳原子上的环状亚烷基结构,优选其中环含有4-8个碳原子,和进一步地其中环可以具有取代基,例如F、烷基、和氟烷基。环烷基或环氟烷基定义为含有碳原子并连接到一个碳原子上的脂肪族单或多环,优选是环丁基、环戊基、环己基、环庚基、环辛基、降冰片基、金刚烷基等,其中环可以进一步被氟、烷基取代基或氟烷基取代基取代。
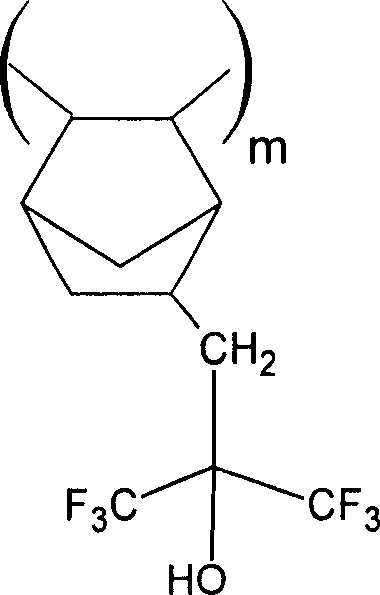
更具体地,含有叔丁氧基羰基甲基(BOCME)保护基与叔丁基酸不稳定基团的优选的降冰片烯单体的例子示于下面的图2中,尽管也可以使用其他酸不稳定基团或其中来自结构1的R5是氢。
图2:BOCME保护的降冰片烯单体的例子
除了其中在聚合物主链中R1是多环单元外,也可以使用单环重复单元,尽管在一些情况下优选多环单元。单环单元可以具有一个环结构,其中环中的原子数目范围是约4-约10,优选5-约8,和更优选约5-约7。
在另一实施方案中,结构1中的取代基R1和R2,或R1和Rf也可以结合得到脂肪族环状聚合物,其中m=0或1,即X可以作为环结构的一部分存在或可以不作为环结构的一部分存在。聚合物环状主链可以是烃,或可以另外含有氟化的取代基。单环单元可以另外在环状结构中含有氧。通常,具有单环重复单元的聚合物可以通过使用自由基引发基在本体中或在溶剂中由合适的单体制得,例如通过非共轭二烯均聚或通过非共轭二烯与烯烃共聚合(这种聚合方法的例子可参见“Cyclopolymerization and Polymers with Chain Ring Structures,ACS Symposium Series 195,George Butle和Jiri E.Kresta编辑,第2,3和4章)。这种技术可用于形成带有具有连接到主链或作为侧挂基团一部分的醇官能度的单环主链的聚合物,如图3所示。环状结构上的可能的取代基可以选自氟、烷基、氟烷基、环烷基、环氟烷基、脂环族或氟化脂环族基团。
更具体地,本发明的单环聚合物可以通过非共轭非对称的部分氟化二烯的自由基均聚合反应或通过氟化非共轭二烯与烯烃的共聚合反应,使用自由基引发基在本体中或在溶液中制得。(这种聚合方法的例子可参见Shun-ichi Kodama et al Advances in Resist Technologyand Processing XIX,Proceedings of SPIE Vol.4690第76页2002;WO 02/065212,或W0 01/98834-A1)。以这种方式,所希望的材料可以直接或通过带有氟代醇的聚合物的中间体制得,该聚合物接着可用AOCA基团封端。
Rf=氧烷基C1-C8 Y=烷基或氟烷基间隔基团(C1-C8)
Ra,Rb,Rc,Rd,Re,Rg,Rh=烷基,X=CF2,O
氟烷基或氟环烷基
Ra-Re和Rg还可用烷基、氟烷基、
环烷基、氟环烷基或用螺氟烷基
或螺烷基取代基取代。
图3:具有侧挂羟基的一般性单环聚合物
醇或氟代醇取代基或含有从环状部分侧挂并被AOCA基团保护的部分的取代基例如没有限制地是:R1OH,R1OCH2(CF2)nOH(n=1-8),R1O(CF2)nOH(n=1-8),R1C(CnF2n+1)2OH (n=1-8),R1OCH2(CnF2n+1)2OH(n=1-8),R1CH2(CnF2n+1)2OH(n=1-8)。
具有侧醇基团的脂肪族部分氟化的单环单体的例子描述于图4,其中醇基团进一步与能够提供AOCA基团的反应物,优选含有BOCME官能度的反应物反应,得到本发明的聚合物。
Rf=氟烷基C1-C8 Y=烷基或氟烷基间隔基C0-C8
Z=CF2,C(CnF2n+1)2,C(CnF2n+1)(CnH2n+1), X=CF2,O
n=1-12
图4:具有侧醇基团的部分氟化的单环聚合物
本发明的聚合物包括至少一种结构1的单元。聚合物的合成优选通过聚合含有单环或多环氟代醇官能度的单体和将形成的聚合物与含有AOCA基团的化合物进一步反应,尽管在本发明的范围内AOCA封端的单体可以聚合得到本发明的聚合物。
在本发明范围内并优选的是,含有氟代醇基团的聚合物(含有多环或单环重复单元的均聚物或共聚物)仅仅部分被AOCA基团封端,从而留下一些醇基团是自由的和/或一些羟基被不是酸不稳定的基团封端,例如直链或支链烷基、氟烷基、部分氟化的烷基、酰基、尤其是含有高达20个碳原子的基团或烷基磺酸酯(三氟甲磺酸酯、甲磺酸酯或它们的高级同系物)。具体地,羟基可以用基团例如甲基或高级烷基(C1-C12),部分或全部氟化的烷基(C1-C20),烷基磺酰基(SO2CnH2n+1,n=1-20),和氟烷基磺酰基(高达C20)封端。更具体地,羟基可以用基团例如CF3-CH2-,(CF3)2-CH-,CF3-CF2-CH2-,CF3-SO2-,CH3-SO2-,和CH3-CO-封端。
聚合物可以是均聚物或也可以是共聚物,其中其他单体也可以引入聚合物中。具有多环重复单元的其他单体的例子是降冰片烯、用叔丁氧基羧基或烷氧基羰基封端的降冰片烯衍生物、其他非芳族脂肪族环状单体和它们的衍生物、环状氟代醇等。另外,对于具有多环重复单元的聚合物,也可以存在来自氟化或部分氟化烯烃的其他单元。包括至少一种结构1的单元的单环聚合物也可以含有来自取代的非共轭二烯和/或全部或部分氟化的取代烯烃的其他重复单元。
在另一个实施方案中,共聚物包括结构1的单元、来自其中羟基被一个非酸不稳定基团封端的不饱和单环醇的单元和/或来自其中羟基被一个除AOCA基团外的酸不稳定基团封端的不饱和单环醇的单元。不受限制地,除AOCA基团外的酸不稳定基团的例子是t-BOC、亚烷基氧基烷基、三烷基甲硅烷基、2-(三烷基甲硅烷基)乙基。这些酸不稳定基团的具体例子是甲氧基甲基、金刚烷基甲氧基甲基、双环己基氧基甲基、乙氧基甲基、基氧基甲基和环戊氧基甲基。
优选的多环聚合物是来自在图1的结构I或II中说明的类型的单体的那些,其中氟代醇部分被2-100% AOCA基团所保护。优选的单环聚合物是如图4描述的聚合物,和更优选地被2-100% AOCA基团保护的聚(1,1,2,3,3-五氟-4-氟烷基-4-羟基-1,6-庚二烯)(如图4(I))。光致抗蚀剂组合物可以包括本发明的各种实施方案的聚合物的混合物。
还在本发明范围内的是本发明的聚合物以与其他次要聚合物的共混物存在。含有封端基团,包括AOCA基团,和/或自由羟基的混合物的共聚物也可以与次要聚合物共混。这些次要聚合物可以是不含酸不稳定基团的聚合物、含其他酸不稳定基团的聚合物,其中这种其他酸不稳定基团不是AOCA但可以含有缩醛保护基例如MOM或酸可裂解的烷氧基羰基(例如叔丁氧基羧基,t-BOC),亚烷基氧基烷基,三烷基甲硅烷基,2-(三烷基甲硅烷基)乙基,这些酸不稳定基团的具体例子是甲氧基甲基、金刚烷基甲氧基甲基、双环己基氧基甲基、乙氧基甲基、基氧基甲基和环戊基氧基甲基,或者其他聚合物或共聚物。次要聚合物可以包括一种仅仅含有侧羟基的单环聚合物。另外,次要聚合物可以包括一种含有侧羟基、带有除AOCA外的封端的酸不稳定基团的侧羟基和/或部分氟化C1-C12烷基的单环聚合物。优选的次要聚合物的例子是具有用非酸不稳定基团和/或除AOCA外的酸不稳定基团部分封端的图4结构的聚合物。在某些情况下,可能优选的是,本发明的聚合物在没有次要聚合物的情况下使用。
优选的多环聚合物共混物是由在图1的结构I或II中所示的类型的单体制成的那些聚合物,其中聚合物共混物之一的氟代醇部分以2-98%的量存在和含有高达40%的AOCA总保护,和其他组分以2-98%的量存在和由高达40%的AOCA基团构成,但两种聚合物有不同百分比的AOCA封端和/或AOCA基团的不同同系物。优选的单环聚合物共混物是如在图4中描述的那些聚合物,和更优选聚(1,1,2,3,3-五氟-4-氟烷基-4-羟基-1,6-庚二烯)(如在图4(I)中),其中聚合物共混物之一以2-98%的量存在和含有高达40%的AOCA总保护的氟代醇基团,和其他组分以2-98%的量存在和具有高达40%的AOCA基团保护,但两种聚合物有不同百分比的AOCA封端和/或AOCA基团的不同同系物。含有两种以上组分的共混物也是被预期的。
在一个优选的实施方案中,本发明的组合物包括一种光酸生成剂和一种本发明的脂肪族单环聚合物与本发明的脂肪族多环聚合物的聚合物混合物,优选地用AOCA基团保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)和用AOCA基团保护的聚(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)的共混物,和更优选其中聚合物用AOCA基团的封端在2-40%范围内,和甚至更优选其中AOCA基团是BOCME基团。
在另一优选的实施方案,聚合物混合物仅仅包含本发明的多环聚合物或单环聚合物。
在本发明范围内一种以上的AOCA基团能够存在于相同脂肪族环状单元上,或AOCA和另一种酸不稳定基团的混合物存在于相同脂肪族环状单元上。可想到的是两个BOCME或AOCA基团能够存在于相同碳原子上(即C(OC(R’)2CO2-t-Bu)2)。
树脂组合物的优选实施方案如下:用5-100%BOCME基团保护的聚(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇),用5-100% BOCME基团保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)和5-100% BOCME基团保护的(5-95重量%)聚(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)与用5-100% BOCME基团保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)的混合物。更优选地,聚合物被BOCME基团保护的程度是在约9%-约40%的范围。
带有AOCA基团的聚合物的官能化程度或与其他聚合物共混的程度由光致抗蚀剂的光刻性能,特别是显影剂中未曝光光致抗蚀剂膜可接受的损失水平(暗膜损失)、相的相容性等决定。典型地官能化度可在约1mol%-约100mol%范围内,优选约9mol%-约40%mol。
本发明的聚合物包含一种或多种含有AOCA保护基团的单元。曝光时AOCA保护基团经受酸解或水解形成游离羧酸,从而使得聚合物可溶解于正性光致抗蚀剂的碱显影剂中。在聚合反应之后聚合物可以用保护基封端或单体可以用保护基封端和然后聚合。聚合物也可以用溶解抑制剂抑止,和当曝光时光致抗蚀剂接着变得可溶于显影剂中。典型地溶解抑制剂加入到光致抗蚀剂以降低未曝光光致抗蚀剂在显影剂中的溶解率。当与溶解抑制剂和光酸生成剂混合时,本发明的聚合物,其中R5是氢,如结构1所示,将是碱可溶的和有用的。可以使用的已知溶解抑制剂的例子是单体的或低聚的氯酸盐、也可以用作溶解抑制剂的光活性化合物,例如强酸的二芳基碘鎓或三苯基硫鎓盐,其中一个或多个芳基具有用对通过释放光酸酸解敏感的基团保护的羟基取代基、羧酸取代基或全氟异丙醇取代基。
光致抗蚀剂中聚合物的透明性是重要的要求。因此,树脂膜的吸收系数在曝光波长,典型地157nm下小于4/微米,优选3/微米和更优选地小于2/微米和甚至更优选地1/微米。
优选的是在这种配方中使用的聚合物具有重均分子为约1,000-约200,000,优选约4,000-约20,000,更优选约6,000约14,000。
本发明的聚合物可以通过含有脂肪族环状氟代醇基团的聚合物与含有AOCA官能度的化合物反应合成,作为例子,含有羟基的环状单体被聚合,如图1所示,或如图3和4所示的聚合物可以与溴乙酸叔丁酯或溴乙酸2-甲基-2-金刚烷基酯反应。该反应在碱存在下进行。在本发明中,已经发现有机碱,特别是铵碱、磷鎓碱和硫鎓碱,提供了优异的结果。优选地,碱被烷基化。典型地,优选(R1’)(R2’)(R3’)(R4’)NOH,其中R1’,R2’,R3’和R4’独立地是(C1-C20)烷基;这种烷基的例子是直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基等。优选的碱是四甲基氢氧化铵和四丁基氢氧化铵。碱可以作为水合物、水溶液或甲醇溶液存在,尽管优选的是水溶液。可以使用有机碱的混合物。反应混合物可以另外包括铵盐、磷鎓盐或硫鎓盐,它们可以用作反应的相转移催化剂。该类盐的例子是烷基化的铵盐,如(R1’R2’R3’R4’)NX,和烷基化的磷鎓盐如(R1’)(R2’)(R3’)(R4’)PX,其中R1’,R2’,R3’和R4’独立地为(C1-C20)烷基和X是任意的阴离子,如氯,溴和硫酸氢根(hydrogensulfate)。尽管讨论的是烷基化的碱,但是芳族的或混合芳族和烷基化的碱和盐也可以使用。反应组分在适当的溶剂中混合,典型地是乙腈,二氯甲烷,二噁烷,丙酮/水,四氢呋喃等。反应使用合适的反应时间和温度条件进行。典型地,反应在约-30℃-约80℃,和更典型地在约0℃-约25℃之间的范围内进行。反应时间在约30分钟-约72小时范围内,优选约5小时-约24小时,更优选约10小时-约18小时。聚合物用标准技术沉淀出来并纯化。得到高纯度和良好收率的聚合物,典型地具有收率超过80%,优选大于85%和更优选大于90%。通过酸如乙酸,甲酸,盐酸等除去有机碱。
另外,使用具有至少一个C4烷基(或更高)部分的四烷基铵盐得到更平和的反应,反应需要的反应时间更少和/或使用更少过量的AOCA试剂(如溴乙酸叔丁酯)。具有至少一个C4烷基(或更高可达C20)部分的四烷基铵碱可作为纯的氢氧化物碱使用或者与另一种氢氧化物碱如四丁基氢氧化铵或氢氧化钠一起使用。具有至少一个C4烷基(或更高可达C20)部分的四烷基铵盐也可加入与一种氢氧化物碱例如四甲基铵盐一起使用以提高反应速度和/或收率。当用作辅助氢氧化物碱或用作盐添加剂时,具有至少一个C4烷基(或更高可达C20)的四烷基铵衍生物的用量可以在起始氢氧化物碱量的5%重量-50%重量范围内。可以想到碱和盐的烷基可被芳基部分(如苄基等)取代。还可进一步想到其他鎓盐可用作添加剂以提高反应性(如磷鎓,硫鎓等)。
新组合物的光酸生成剂(PAG)选自在所希望的曝光波长下,优选193nm和157nm吸收的那些。酸生成光敏化合物适合的例子包括,并非限制,离子光酸生成剂(PAG),如重氮盐,碘鎓盐,硫鎓盐,或非离子PAG如重氮磺酰基化合物,磺酰氧基酰亚胺和硝基苄基磺酸酯,但是受到辐射产生酸的任何光敏化合物都可以使用。鎓盐通常以溶于有机溶剂中的形式使用,多数是作为碘鎓或硫鎓盐,其例子是二苯基碘鎓三氟甲烷磺酸盐,二苯基碘鎓九氟丁烷磺酸盐,三苯基硫鎓三氟甲烷磺酸盐,三苯基硫鎓九氟丁烷磺酸盐等。可以使用的受到辐射形成酸的其他化合物是三嗪,噁唑,噁二唑,噻唑,取代的2-吡喃酮,酚磺酸酯,双-磺酰基甲烷,双-磺酰基甲烷或双磺酰基重氮甲烷,三苯基硫鎓三(三氟甲基磺酰基)甲基化物,三苯基硫鎓双(三氟甲基磺酰基)酰亚胺,二苯基碘鎓三(三氟甲基磺酰基)甲基化物,二苯基碘鎓双(三氟甲基磺酰基)酰亚胺和它们的同系物也可作为可能的选择。也可以使用光活性化合物的混合物。
图5显示了PAG结构的例子,如有用的鎓盐和羟基酰胺(hydroxyamic)衍生物。
R1,R2,R3独立地是烷基、氟烷基、F、 OCnH2n+1,OCnF2n+1,
CO2-tert-Bu,OCH2-CO2-tert-Bu n=1-4,OCH2OCH3
X-=非亲核强酸的阴离子如 -OSO2CnF2n+1;AsF6 -,SbF6 -,
-N(SO2CnF2n+1)2;-C(SO2CnF2n+1)3
图5光活性化合物的例子
本发明的光致抗蚀剂包含所述新的聚合物,光酸生成剂和任选地一种碱添加剂。在一些情况下,碱或光活性碱加入到光致抗蚀剂中以控制成像的光致抗蚀剂的轮廓和防止表面抑制效应,例如T形顶。优选含氮的碱,其具体例子有胺,例如三乙胺、三乙醇胺、苯胺、乙二胺、吡啶、四烷基氢氧化铵或其盐。光敏性碱的例子有二苯基碘鎓氢氧化物、二烷基碘鎓氢氧化物、三烷基硫鎓氢氧化物等。碱可以以相对于光酸生成剂最高到100mol%的水平加入。尽管使用了术语碱添加剂,但去除酸的其他机理也是可能的,例如使用挥发性酸的四烷基铵盐(例如CF3CO2 -)或亲核酸(例如Br-),它们分别在后曝光焙烧期间通过从膜中挥发或通过亲核部分与酸前体碳阳离子反应(例如叔丁基碳阳离子与溴化物反应形成叔丁基溴)而去除酸。
图5显示了可用作碱的铵衍生物的结构。
图5合适的铵碱的例子
也可以使用非挥发的胺添加剂。优选的胺具有空间位阻结构以阻碍亲核反应性同时保持碱性,低挥发性和在光致抗蚀剂配方中的溶解性,如质子海绵,1,5-二氮杂双环[4.3.0]-5-壬烯,1,8-二氮杂双环[5,4,0]-7-十一碳烯,环状烷基胺或带有胺的聚醚,如US 6,274,286所述。
另外,在本发明范围内的是光致抗蚀剂进一步包含溶解抑制剂。这样,BOCME或AOCA基团可以在没有其中R5是氢的保护性酸不稳定部分(如CH2CO2H)的情况下使用。在一个实施方案中,羧酸可以与另一带有AOCA保护基团的单元共同存在和用于调节光致抗蚀剂的溶解速率。在此概念上含有AOCA的单元的量由保持低的暗蚀同时提高曝光区域的溶解速率的需要来决定。典型地,向光致抗蚀剂中加入溶解抑制剂以降低未曝光的光致抗蚀剂在显影剂中的溶解速率。
光致抗蚀剂组合物通过在适合的光致抗蚀剂溶剂中混合各成分而形成。在优选的实施方案中,光致抗蚀剂中聚合物的量优选在90%-约99.5%范围,和更优选约95%-约99%,以固体即非溶剂光致抗蚀剂组分的重量为基础。在优选的实施方案中,光致抗蚀剂中存在的光活性化合物的量约0.5%-约10%,优选约4%-约6%,以固体光致抗蚀剂组分的重量为基础。在制备光致抗蚀剂组合物时,光致抗蚀剂的固体组分与溶剂或溶剂混合物混合,溶剂例如丙二醇单烷基醚、丙二醇烷基醚乙酸酯、乙酸丁酯、二甲苯、1,3-二(三氟甲基)苯、乙二醇单乙基醚乙酸酯、丙二醇单甲基醚乙酸酯、2-庚酮、乳酸乙酯、3-乙氧基丙酸乙酯、和乳酸乙酯与3-乙氧基丙酸乙酯的混合物。
制备的光致抗蚀剂组合物溶液可以通过光致抗蚀剂领域中使用的任何常规方法施涂到基体上,包括浸涂、喷涂、涡旋(whirling)和旋涂。例如当旋涂时,光致抗蚀剂溶液可以对固体含量的百分比进行调整,以便提供所希望厚度的涂层,只要使用的旋涂设备类型和时间量允许用于旋涂方法。合适的基体包括硅、铝、聚合物树脂、二氧化硅、掺杂的二氧化硅、氮化硅、钽、铜、多硅、陶瓷、铝/铜混合物;砷化镓和其他该族III/V化合物。光致抗蚀剂也可以涂覆在抗反射涂层上。
光致抗蚀剂组合物接着涂覆在基体上,和基体在约70℃-约150℃的温度在热板上处理约30秒-约180秒或在对流炉中处理约15-约90分钟。选择该温度处理以便降低光致抗蚀剂中残余溶剂的浓度,同时不引起固体组分的显著热降解。通常,人们希望使溶剂浓度最小化和该第一温度处理进行到基本上所有的溶剂已经蒸发和厚度为半微米数量级的光致抗蚀剂组合物薄涂层保留在基体上。在优选的实施方案中,温度为约95℃-约160℃,和更优选约95℃-约135℃。进行处理直到溶剂去除的变化速率变得相对不明显。温度和时间选择取决于用户所希望的光致抗蚀剂性质以及使用的设备和商业上所需的涂覆时间。涂覆基体可以接着图像式曝光于光化辐射,例如紫外线辐射、在波长约100nm(纳米)-约300nm下、x-射线、电子束、粒子束或激光辐射,以通过使用合适掩模、底片(negatives)、镂花模板、样板等产生的任何所希望的图案。
光致抗蚀剂接着在显影之前进行后曝光第二次焙烧或热处理。加热温度可以在约90℃-约160℃,更优选约100℃-约130℃的范围内。加热可以在热板上进行约30秒-约5分钟,更优选约60秒-约90秒,或通过对流炉进行约15-45分钟。
曝光的光致抗蚀剂涂覆的基体通过浸入显影溶液中显影以去除图像式曝光的区域或通过喷涂、搅炼(puddle)或喷涂-搅炼显影方法而显影。溶液优选被搅拌,例如通过氮爆裂搅拌。使基体保持在显影剂中直到所有或基本上所有的光致抗蚀剂涂层已经从曝光区域溶解。显影剂包括氢氧化铵或碱金属氢氧化物或超临界二氧化碳的水溶液。一种优选的显影剂是四甲基氢氧化铵的水溶液。表面活性剂也可加到显影剂组合物中。从显影溶液中去除涂覆的晶片后,人们可以进行任选的后显影热处理或焙烧以增加涂层的粘结性和对刻蚀条件和其他物质的耐化学性。后显影热处理可以包括在涂层的软化点以下焙烧涂层和基体或UV硬化过程。在工业应用中,特别是在硅/二氧化硅型基体上的微电路单元的制造中,显影的基体可以用缓冲的、氢氟酸刻蚀溶液或优选干刻蚀处理。在一些情况下,金属沉积在成像的光致抗蚀剂上。
在此每一个上述参考文献在所有的场合都全部引入参考。下面的具体实施例将提供详细的本发明组合物生产和利用的方法的说明。但是这些实施例并非要以任何方式限制或限定本发明的范围并不被认为是提供为了实践本发明必须唯一地使用的条件,参数或数值。
实施例
术语表
TGA 热重分析
UV 紫外
MOM 甲氧基甲基
MeOH 甲醇
mmol 毫摩尔即10-3mol
BOCME (叔-丁氧基羰基)甲基
t-BOC 叔-丁氧基羰基
THP 氢吡喃
PAG 光酸生成剂
I PA 异丙醇
THF 四氢呋喃
TMAH 甲基氢氧化铵
t-BuOK 叔丁醇钾
BHTTP 3-(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇,
CMAdOM 碳-2-甲基-2-金刚烷基氧基甲基,
BCHOM 双环己基氧基甲基,
AdMOM 金刚烷基甲氧基甲基,
PBHTTP 聚(3-(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇),购自Promerus LLC,9921 Brecksville Road,Bldg B,Brecksville OH 44141
PTHH 1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯PPTHH聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)是5元和6元环的混合物,购自Asahi Glass Co,LTD,2-1-2Marunouchi,Chiyoda-ku Tokyo 100-8305 Japan,
实施例1
表1显示了在属于前述的两类带有环氟代醇的聚合物的聚合物(图6)的代表性例子上进行的与用BOCEM基团脱保护所发现的相比MOM和t-boc脱保护的TGA开始(onset)。
图6由脂环族部分(I)或氟化二烯(II)聚合制备的氟代醇聚合
物
表1带有不同保护基团的聚合物I和II的脱保护开始*
| 保护基团 | 聚合物(保护%) | 脱保护开始(℃) |
| BOCME | II(30%) | 174 |
| BOCME | I(30%) | 206 |
| T-BOC | I(30%) | 120 |
| MOM | II(20%) | <100 |
*在20℃/min加热速率下采集的数据
表1清楚地显示带有BOCME基团的聚合物比带有t-boc和MOM基团的相同聚合物在较高的温度热脱保护。
实施例2
测定光致抗蚀剂的对比度,是通过将其以1350A(埃)的厚度涂覆,并在用开口框架光罩(reticle)曝光后烘烤和将膜显影,然后测定作为剂量的函数的标准化厚度。对比度取自标准化厚度对log(剂量)作图的斜率。处理条件如下:
在Austin的International SEMATECH用开口框架曝光光罩对Exitech 157nm小场(1.5mm×1.5mm)迷你步进仪(0.6NA)进行曝光。FSI Polaris 2000轨道用于涂覆,烘烤和显影光致抗蚀剂膜。Prometrix干涉仪用于测量光致抗蚀剂厚度。
光致抗蚀剂配方制备和所得对比度如下:
用不同的后涂覆烘烤(PAB)(135-150℃)或PEB(115-150℃)和用0.26N的四甲基氢氧化铵显影30秒时间,将下面的干燥成分混合为10%的丙二醇甲基醚乙酸酯溶液:聚(双环[2.2.1]庚-5-烯-2-羧酸叔丁基酯-共-1,1,1-三氟-2-(三氟甲基)戊-4-烯-2-3-(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)(75.3%)聚(3-(三氟甲基)三环[4.2.1.02,5]壬-7-烯-3-羧酸叔丁基酯-共-一氧化碳(18.8%),三苯基硫鎓九氟丁磺酸盐(nonaflate)(5.6%)和四甲基乙酸铵(0.3%),得到6-7的对比度,而含有下面干燥成分的类似的配方:用BOCME官能化的93%聚(1,1,1-三氟-2-(三氟甲基)戊-4-烯-2-3-(双环[2.2.1]庚-5-烯-2-基)(20%保护)(93%固体),三苯基硫鎓九氟丁磺酸盐(5.6%)和四丁基乙酸铵(0.5%),典型地得到~12-25的对比度。
实施例3
用t-BuOK合成BOCME保护的聚(3-(双环[2.2.1]庚-5-烯-2-
基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)
聚(3-(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)(PBHTTP)(4.0g,14.59mmol)溶解于15ml四氢呋喃(THF),和搅拌同时加入固体t-BuOK(0.491g,4.38mmol)。30分钟后,向此反应溶液中加入溴乙酸叔丁酯(1.71g,8.76mmol),该溶液在25℃搅拌16小时。用旋转蒸发器除去溶剂后,所得残余物溶解在含1.0g浓HCl的20ml甲醇(MeOH)中。然后此溶液在180ml水-甲醇(8∶1)中沉淀。过滤分离聚合物并通过将其溶解在MeOH中和在水-甲醇混合物中再沉淀而进一步纯化。然后将最终的沉淀过滤、用水冲洗并在55℃真空干燥过夜(25”Hg)。聚合物的分离收率为91%。叔丁基和亚甲基的存在通过1H-NMR(ppm,丙酮-d6)δ1.48(9H,叔丁基)和δ4.27(2H,-CH2-COO-)被确定。发现用BOCME基团的保护程度是24mol%。
实施例4
用TMAH.5H2O合成BOCME保护的聚(3-(双环[2.2.1]庚-5-烯-2-
基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)
PBHTTP(4.0g,14.59mmol)溶解于15ml THF和搅拌同时加入固体TMAH.5H2O(0.793g,4.38mmol)。30分钟后,向此反应溶液中加入溴乙酸叔丁酯(1.71g,8.76mmol),该溶液在25℃另外搅拌16小时。反应混合物中形成的沉淀过滤除去。所得滤液在旋转蒸发器中汽提出溶剂。所得残余物再溶解在含1.0g浓HCl的20ml甲醇(MeOH)中。此溶液在180ml水-甲醇(8∶1)混合物中沉淀。过滤分离聚合物并通过将其溶解在MeOH中和在水-甲醇混合物中再沉淀而进一步纯化。然后将最终的沉淀过滤、用水冲洗并在55℃真空干燥过夜(25”Hg)。聚合物的分离收率为91%。叔丁基(1.48ppm)和亚甲基(4.27ppm)的存在通过1H-NMR被确定。发现用BOCME基团的保护程度是28mol%。
实施例5
用25% TMAH水溶液合成BOCME保护的PBHTTP
PBHTTP(4.0g,14.59mmol)溶解于15ml THF和搅拌同时加入25%四甲基氢氧化铵水溶液(TMAH)(1.6g,4.38mmol)。30分钟后,向此反应溶液中加入溴乙酸叔丁酯(1.71g,8.76mmol),该溶液在25℃搅拌16小时。用旋转蒸发器除去溶剂后,所得残余物溶解在含1.0g浓HCl的20ml甲醇(MeOH)中。此溶液在180ml水-甲醇(8∶1)混合物中沉淀。过滤分离聚合物并通过将其溶解在MeOH中和在水-甲醇混合物中再沉淀而进一步纯化。然后将最终的沉淀过滤、用水冲洗并在55℃真空干燥过夜(25”Hg)。聚合物的分离收率为92%。叔丁基(1.48ppm)和亚甲基基团(4.27ppm)的存在通过1H-NMR被确定。发现用BOCME基团的保护程度是21mol%。
实施例6
用MeOH中的25%TMAH合成BOCME保护的PBHTTP
PBHTTP(4.0g,14.59mmol)溶解于15ml THF和搅拌同时加入在甲醇中的25%的TMAH(1.6g,4.38mmol)。30分钟后,向此反应溶液中加入溴乙酸叔丁酯(1.71g,8.76mmol),该溶液在25℃搅拌16小时。用旋转蒸发器除去溶剂后,所得残余物溶解在含1.0g浓HCl的20ml甲醇(MeOH)中。此溶液在180ml水-甲醇(8∶1)中沉淀。过滤分离聚合物并通过将其溶解在MeOH中和在水-甲醇混合物中再沉淀而进一步纯化。然后将最终的沉淀过滤、用水冲洗并在55℃真空干燥过夜(25”Hg)。聚合物的分离收率为90%。叔丁基(1.48ppm)和亚甲基基团(4.27ppm)的存在通过1H-NMR被确定。发现用BOCME基团的保护程度是22mol%。
实施例7
用K2CO3和18-冠-6醚合成BOCME保护的PBHTTP
在配有回流柱、磁力搅拌棒和加热套的小圆底烧瓶中在氮气下制备由PBHTTP(2.0g,7.29mmol)、溴乙酸叔丁酯(1.42g,7.29mmol)和溶解在6ml干燥的THF中的18-冠-6醚(0.19g,0.73mmol)构成的溶液。向此溶液中加入无水K2CO3(1.26g)和溶液在回流下剧烈搅拌过夜。之后,过滤反应混合物并将滤液在旋转蒸发器中汽提出溶剂。然后滤液再溶解到40ml乙酸乙酯中并用几份10ml等分的蒸馏水冲洗直到水洗涤物中检测到中性pH。冲洗的乙酸乙酯溶液在旋转蒸发器中汽提出溶剂并在35℃在1乇(torr)真空下进一步干燥1小时制得硬泡沫。此泡沫再溶解到30ml THF中和在300ml蒸馏水中沉淀。将此材料过滤,用蒸馏水冲洗和空气干燥1小时。回收的材料以同样的方式再沉淀两次。最终的沉淀然后在55℃真空干燥过夜。聚合物的分离收率为62%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H NMR确定。发现聚合物用BOCME基团的保护程度是100mol%。
实施例8
由其甲氧基甲基衍生物合成聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基
-1,6-庚二烯)
10g用20% MOM基团保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)溶解于30ml THF并与10ml三氟乙酸和7.5ml水混合。此均匀的溶液在室温搅拌过夜。反应后在旋转蒸发器中在50℃汽提出溶剂。残余物溶解于30ml IPA并在750ml冷水中沉淀。将沉淀过滤,冲洗并在55℃真空干燥(25”Hg)。聚合物的分离收率为98%。NMR分析确定了不存在MOM基团。
实施例9
用t-BuOK合成BOCME保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基
-1,6-庚二烯)
实施例8的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)(4.0g,14.81mmol)(PPTHH)溶解于15ml THF并向此溶液加入固体t-BuOK(0.5g,4.44mmol)同时搅拌。在25℃搅拌30分钟后,向此反应溶液中加入溴乙酸叔丁酯1.74g,8.88mmol),并在25℃另外搅拌16小时。之后,反应过程中形成的沉淀过滤除去。所得滤液然后在旋转蒸发器中汽提出溶剂。残余物再溶解于含1.0g浓HCl的20ml MeOH。然后此溶液在200ml 15% MeOH水溶液中沉淀。将沉淀过滤,用蒸馏水冲洗并干燥。通过将聚合物再溶解在MeOH中并在水中再沉淀而进一步纯化。在55℃真空干燥(25”Hg)之后,聚合物的收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)的存在通过1H-NMR被确定。发现用BOCME基团的保护程度是22mol%。
实施例10
用TMAH.5H2O合成BOCME保护的PPTHH
实施例8的PPTHH(4.0g,14.81mmol)溶解于15ml THF并向此溶液中加入固体TMAH.5H2O(0.81g,4.44mmol)同时搅拌。在25℃搅拌30分钟后,向此反应溶液中加入溴乙酸叔丁酯(1.74g,8.88mmol),并在25℃另外搅拌16小时。之后,反应过程中形成的沉淀过滤除去。所得滤液然后在旋转蒸发器中汽提出溶剂。残余物再溶解于含1.0g浓HCl的20ml MeOH。然后此溶液在200ml 15% MeOH水溶液中沉淀。将沉淀过滤,用蒸馏水冲洗并干燥。通过将聚合物再溶解在MeOH中并在水中再沉淀而进一步纯化。在55℃真空干燥(25”Hg)之后,聚合物的收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)的存在通过1H-NMR被确定。发现用BOCMR基团的保护程度是23mol%。
实施例11
用溴乙酸2-甲基-2-金刚烷基酯合成CMAdOM保护的聚(1,1,2,3,3-
五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
实施例8的聚合物(2.0g,7.4mmol)溶解于12ml THF并加入TMAH.5H2O(0.4g,2.22mmol)同时搅拌。30分钟后,向此反应溶液中加入溴乙酸2-甲基-2-金刚烷基酯(1.28g,4.44mmol),并在25℃搅拌16小时。反应混合物中形成的固体过滤分离。然后在旋转蒸发器中汽提出滤液中的溶剂并将残余物溶解于20ml含1.0g浓HCl的MeOH。此溶液在200ml 15%的MeOH水溶液中沉淀。将沉淀过滤,用水冲洗并干燥。通过将聚合物溶解在MeOH中并在水中再沉淀而进一步纯化。聚合物在55℃真空干燥(25”Hg),聚合物的收率为90%。2-甲基-2-金刚烷基(1.5-2.0ppm)和亚甲基(4.27ppm)的存在通过1H-NMR被确定。发现保护程度是25mol%。
制备光致抗蚀剂溶液并在157nm成像
在Tx.的Austin在International SEMATECH用Exitech 157nm小场(1.5-1.5mm2)迷你步进仪(0.6NA)用相移掩模(σ0.3)完成成像工作。JEOL JWS-7550用于得到扫描电子显微图片。Hitachi4500显微镜用于得到横截面数据。FSI Polaris 2000轨道用于涂覆,烘烤和显影光致抗蚀剂膜。Prometrix干涉仪用于测定光致抗蚀剂厚度。
实施例12
含PBTTP的光致抗蚀剂溶液
由实施例4制备的6.58%重量的PBTTP,0.39%重量的三苯基硫鎓九氟丁磺酸盐,0.03%重量的四丁基乙酸铵和93%重量的丙二醇氮甲基醚乙酸酯(PGMEA)制备溶液。此溶液通过0.2微米的PTFE过滤器过滤。
实施例13
含PPTHH的光致抗蚀剂溶液
由实施例10制备的6.58%重量的PPTHH,0.39%重量的三苯基硫鎓九氟丁磺酸盐,0.03%重量的四丁基乙酸铵和93%重量的PGMEA制备溶液。此溶液通过0.2微米的PTFE过滤器过滤。
实施例14
含PBTTP和PPTHH的50/50混合物的光致抗蚀剂溶液
由实施例4制备的3.29%重量的PBTTP,实施例10制备的3.29%重量的PPTHH,0.39%重量的三苯基硫鎓九氟丁磺酸盐,0.03%重量四丁基乙酸铵和93%重量的PGMEA制备溶液。此溶液通过0.2微米的PTFE过滤器过滤。
实施例15
成像含PBTTP的光致抗蚀剂溶液
实施例12制备的光致抗蚀剂溶液以1658rpm分别旋涂于裸露的硅片和用有机抗反射涂层涂覆的晶片上。130℃/60秒后涂覆烘烤后,得到1350A的厚度。在157nm用开口框架光罩曝光后,进行115C/90秒的后曝光烘烤,并在0.26N TMAH中显影30秒。这样得到曝光响应曲线,由它得到清晰的7.2mJ/cm2的剂量和12的对比度。涂覆在抗反射涂层涂覆的硅片上的晶片用相移掩模和同样的处理条件曝光,得到对于1∶1.5线为100nm的分辨率和108nm线宽的间隔和曝光剂量是51mJ/cm2。
实施例16
成像含PPTHH的光致抗蚀剂溶液
实施例13制备的光致抗蚀剂溶液以2220rpm分别旋涂于裸露的硅片和用有机抗反射涂层涂覆的晶片上。150℃/60秒的后涂覆烘烤后,得到1350A的厚度。在157nm用开口框架光罩曝光后,进行135C/90秒的后曝光烘烤,并在0.26N TMAH中显影30秒。这样得到曝光响应曲线,由它得到清晰的8.1mJ/cm2的曝光剂量和12的对比度。涂覆在抗反射涂层涂覆的硅片上的晶片用相移掩模和同样的处理条件曝光,得到对于1∶1.5线为100nm的分辨率和73nm线宽的间隔和曝光剂量是69mJ/cm2。
实施例17
成像含PBTTP和PPTHH的50/50混合物的光致抗蚀剂溶液
实施例14制备的光致抗蚀剂溶液以1801rpm分别旋涂于裸露的硅片和用有机抗反射涂层涂覆的晶片上。150℃/60秒的后涂覆烘烤后,得到1350A的厚度。在157nm用开口框架光罩曝光后,进行135C/90秒的后曝光烘烤,并在0.26N的TMAH中显影30秒。这样得到曝光响应曲线,由它得到10.2mJ/cm2的曝光剂量和10.2的对比度。涂覆在抗反射涂层涂覆的硅片上的晶片用相移掩模和同样的处理条件曝光,得到对于1∶1.5线为100nm的分辨率和80nm线宽的间隔和曝光剂量是81mJ/cm2。
实施例18
由其甲氧基甲基(MOM)衍生物合成聚(1,1,2,3,3-五氟-4-三氟甲基
-4-羟基-1,6-庚二烯)
100g用20% MOM基团保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)溶解于200ml THF中并与30ml三氟乙酸和25ml水混合。此均匀的溶液在80℃搅拌4小时。反应混合物的溶剂在50℃真空下除去。残余物溶解在200ml甲醇中并在1L水中沉淀。将沉淀过滤,冲洗和在70℃真空下干燥。干燥的产物聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)的收率为96%。NMR分析确定了聚合物中不存在甲氧基甲基基团。
实施例19
用25%TMAH水溶液合成BOCME保护的聚(1,1,2,3,3-五氟-4-三氟甲
基-4-羟基-1,6-庚二烯)
实施例18的聚合物(20g,74mmol)溶解于120ml THF并向此溶液中加入25%的TMAH(13.5g,37mmol)水溶液同时搅拌。30分钟后,向此反应溶液中加入溴乙酸叔丁酯(3.4g,17.4mmol)并在室温搅拌3天。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在110mlMeOH中。溶液在室温用20ml冰醋酸处理并在水-甲醇-乙酸(280+10+10ml)混合物中沉淀。将沉淀过滤,用水-甲醇(140+60ml),水(2L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入BOCME基团的程度是20mol%。
实施例20
用25%TMAH水溶液合成BOCME保护的聚(1,1,2,3,3-五氟-4-三氟甲
基-4-羟基-1,6-庚二烯)
实施例18的聚合物(20g,74mmol)溶解于120ml THF并向此溶液中加入25%的TMAH(13.5g,37mmol)水溶液同时搅拌。30分钟后,向此反应溶液中加入溴乙酸叔丁酯(3.4g,17.4mmol)并在10℃搅拌16小时。用旋转蒸发器(rotavap)在40℃真空除去溶剂并将残余物溶解在110ml MeOH中。溶液在室温用20ml冰醋酸处理并在水-甲醇-乙酸(280+10+10ml)的混合物中沉淀。将沉淀过滤,用水-甲醇(140+60ml),水(2L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为91%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是23.5mol%。
实施例21
用40%四丁基氢氧化铵(TBAH)水溶液合成BOCME保护的聚
(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
实施例18的聚合物(5g,18.5mmol)溶解于30ml THF并加入40%的TBAH(6g,9.26mmol)水溶液同时搅拌。向此反应溶液中加入溴乙酸叔丁酯(0.98g,5mmol)并在室温搅拌16小时。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在50ml MeOH中。溶液在室温用10ml冰醋酸处理并在水-甲醇-乙酸(140+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(7+30ml),水(1L)冲洗并干燥。通过溶解在MeOH中和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为90%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是27mol%。
实施例22
用25%TMAH水溶液和40%TBAH水溶液合成BOCME保护的聚
(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
实施例18的聚合物(20g,74mmol)溶解于120ml THF并向此溶液中加入25%的TMAH(10.8g,29.62mmol)的水溶液和40%的TBAH(4.8g,7.4mmol)的水溶液同时搅拌。然后向此反应溶液中加入溴乙酸叔丁酯(2.96g,15.2mmol)并在室温搅拌16小时。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在110ml MeOH中。溶液在室温用20ml冰醋酸处理并在水-甲醇-乙酸(280+10+10ml)混合物中沉淀。将沉淀过滤,用水-甲醇(140+60ml),水(2L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为93%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是18mol%。
实施例23
用25%的TMAH水溶液由MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)起始合成MOM和BOCME保护的聚(1,1,2,3,3-五
氟-4-三氟甲基-4-羟基-1,6-庚二烯)
15% MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)(10g,31.5mmol)溶解于60ml THF和加入25% TMAH(5.74g,15.73mmol)的水溶液同时搅拌。然后向此反应溶液中加入溴乙酸叔丁酯(0.8g,4.1mmol)并在室温搅拌3天。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在80ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(210+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(105+45ml),水(1.5L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是11mol%。
实施例24
用25%的TMAH水溶液由MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基
-4-羟基-1,6-庚二烯)起始合成MOM和BOCME保护的聚(1,1,2,3,3-
五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
20% MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)(10g,29.6mmol)溶解于60ml THF和加入25% TMAH(5.4g,14.8mmol)的水溶液同时搅拌。然后向此反应溶液中加入溴乙酸叔丁酯(1.04g,5.33mmol)并在室温搅拌3天。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在80ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(210+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(105+45ml),水(1.5L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为91%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是14mol%。
实施例25
用25% TMAH水溶液由MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-
羟基-1,6-庚二烯)起始合成MOM和BOCME保护的聚(1,1,2,3,3-五
氟-4-三氟甲基-4-羟基-1,6-庚二烯)
20% MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)(10g,30mmol)溶解于60ml THF和加入25% TMAH(5.47g,15mmol)的水溶液同时搅拌。然后向此反应溶液中加入溴乙酸叔丁酯(0.71g,3.6mmol)并在10℃搅拌16小时。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在80ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(210+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(105+45ml),水(1.5L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是12mol%。
实施例26
用25% TMAH水溶液由BCHOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基
-4-羟基-1,6-庚二烯)起始合成双环己氧基甲基(BCHOM)和BOCME保护
的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
8% BCHOM保护的聚合物(5g,16mmol)溶解于30ml THF和加入25% TMAH(2.91g,8mmol)的水溶液同时搅拌。向此反应溶液中加入溴乙酸叔丁酯(0.56g,2.9mmol)并在室温搅拌3天。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在50ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(140+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(70+30ml),水(1L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为93%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的BOCME基团的程度是13mol%。
实施例27
用25%TMAH水溶液由聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚
二烯)起始合成金刚烷基甲氧基甲基(AdMOM)和BOCME保护的聚
(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
实施例18的聚合物(5g,18.5mmol)溶解于30ml THF并加入25%的TMAH(3.37g,9.26mmol)的水溶液同时搅拌。然后向此反应溶液中加入金刚烷基甲氧基甲基氯化物(0.32g,1.48mmol)和溴乙酸叔丁酯(0.65g,3.33mmol)并在室温搅拌3天。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在50ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(140+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(70+30ml),水(1L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的AdMOM和BOCME基团的程度分别是6和14mol%。
实施例28
用25%TMAH水溶液由MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)起始合成MOM和CMAdOM保护的聚(1,1,2,3,3-五氟
-4-三氟甲基-4-羟基-1,6-庚二烯)
15% MOM保护的聚合物(5g,15.73mmol)溶解于30ml THF和加入25%TMAH(2.87g,7.87mmol)的水溶液同时搅拌。然后向此反应溶液中加入溴乙酸2-甲基-2-金刚烷基酯(0.5g,1.73mmol)并在室温搅拌3天。用旋转蒸发器在40℃真空除去溶剂并将残余物溶解在50ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(140+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(70+30ml),水(1L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为93%。亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入聚合物中的CMAdOM基团的程度是7mol%。
实施例29
用25% TMAH水溶液由MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-
羟基-1,6-庚二烯)起始合成MOM和BOCME保护的聚(1,1,2,3,3-五氟
-4-三氟甲基-4-羟基-1,6-庚二烯)
19% MOM保护的聚合物(10g,30mmol)溶解于60ml THF和加入25% TMAH(5.47g,15mmol)的水溶液同时搅拌。然后向此反应溶液中加入溴乙酸叔丁酯(0.71g,3.6mmol)并在室温搅拌3天。用旋转蒸发器(rotavap)在40℃真空除去溶剂并将残余物溶解在80ml MeOH中。溶液在室温用15ml冰醋酸处理并在水-甲醇-乙酸(210+10+5ml)混合物中沉淀。将沉淀过滤,用水-甲醇(105+45ml),水(1.5L)冲洗并干燥。通过溶解在MeOH和在水中沉淀将聚合物进一步纯化并在70℃真空干燥16小时。聚合物收率为92%。叔丁基(1.48ppm)和亚甲基(4.27ppm)基团的存在通过1H-NMR被确定。引入的BOCME基团的程度是9mol%。
实施例30
评价含有聚合物混合物的光致抗蚀剂溶液的光刻性能。用1.02g树脂,30.5mg三苯基硫鎓九氟丁磺酸盐,2.5mg四丁基乙酸铵和13.95g PGMEA制备7%重量的光致抗蚀剂溶液。通过0.2微米的过滤器过滤光致抗蚀剂。树脂含有MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)和20% BOCME保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)的混合物。表1显示了所用的各种不同的树脂共混物和其混合比。不同保护程度的MOM保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)用来比较。
用大约2,200rpm的旋涂速度将光致抗蚀剂膜以1350A的厚度涂覆在用带有有机底部抗反射涂层(900A)的硅片涂覆的晶片上,接着在135℃烘烤60秒。用157nm的Excitech 0.85 NA曝光工具进行曝光。曝光后在115℃烘烤90秒接着在0.26N的TMAH显影剂中显影30秒。得到70nm 1∶1.5 L/S的曝光是用强的相移掩模以0.3的sigma设置进行的。
表1
由聚合物的共混物制备的光致抗蚀剂的光刻性能表
| 光致抗蚀剂实施例 | 聚合物1 | 分辩剂量mJ/cm270nm 1∶1.5 L/S | EomJ/cm2 | 对比度 | 暗膜损失% | 在157nm的吸收率 |
| 1 | 20F3MOM,20F3BOCME 30/70 | 70.0 | 11.8 | 8.5 | 1.6 | 0.87 |
| 2 | 25F3MOM,20F3BOCME 30/70 | 83.1 | 15.0 | 5.6 | 1.9 | 0.89 |
| 3 | 30F3MOM,20F3BOCME 30/70 | 86.0 | 14.4 | 4.2 | 2.1 | 0.91 |
| 4 | 35F3MOM,20F3BOCME 30/70 | 80.5 | 14.8 | 5.2 | 2.6 | 0.89 |
| 5 | 40F3MOM,20F3BOCME 30/70 | 85.2 | 14.6 | 5.9 | 3.3 | 0.92 |
| 6 | 25F3MOM,20F3BOCME 50/50 | 83.0 | 14.6 | 6.2 | 2.6 | 0.83 |
| 7 | 30F3MOM,20F3BOCME 50/50 | 84.6 | 14.8 | 6.5 | 2.7 | 0.86 |
| 8 | 35F3MOM,20F3BOCME 50/50 | 91.0 | 15.0 | 9.7 | 3.0 | 0.87 |
| 9 | 40F3MOM,20F3BOCME 50/50 | 93.2 | 15.2 | 20 | 2.7 | 0.89 |
| 10 | 25F3MOM,20F3BOCME 70/30 | 83.7 | 14.6 | 6.2 | 4.3 | 0.78 |
| 11 | 30F3MOM,20F3BOCME 70/30 | 88.2 | 14.8 | 6.0 | 4.1 | 0.80 |
| 12 | 35F3MOM,20F3BOCME 70/30 | 94.9 | 15.4 | 25 | 2.9 | 0.83 |
| 13 | 40F3MOM,20F3BOCME 70/30 | 104.5 | 16.8 | 19.5 | 2.0 | 0.83 |
| 14 | 35F3MOM | 不分辨 | 16.8 | 16 | 2.1 | 0.74 |
| 15 | 40F3MOM | 不分辨 | 19.0 | 15 | 2.4 | 0.76 |
1聚合物组合物的备注如下:例如20F3MOM,20F3BOCME(30/70)意思是分别由20%保护的F3-MOM聚合物与20%保护的F3BOCME以30/70%重量的比率组成的混合物。对于纯的聚合物而言,25MOMF3表示用25%的MOM基团保护的F 3制成的树脂。F3是聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)
Eo是对开口大空间的曝光能量。
暗膜损失是在0.26N TMAH显影剂中30秒显影时间内膜损失的百分数。
吸收率是光致抗蚀剂膜的吸收率。
发现与带有单种仅仅用甲氧基甲基基团封端的聚合物的光致抗蚀剂相比,含有聚合物物理共混物的光致抗蚀剂组合物给出了优越的光刻性能。
实施例31
评价含有各种不同的共聚物的光致抗蚀剂溶液。用1.02g树脂,30.5mg三苯基硫鎓九氟丁磺酸盐,2.5mg四丁基乙酸铵和13.95gPGMEA制备7%重量的光致抗蚀剂溶液。光致抗蚀剂用0.2微米过滤器过滤。每种溶液的树脂是用BOCME和如表2所示的其他酸不稳定基团保护的聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)的不同共聚物。
用大约2,200rpm的旋涂速度将光致抗蚀剂膜以1350A的厚度涂覆在用带有有机底部抗反射涂层(900A)的硅片涂覆的晶片上,接着在135℃烘烤60秒。用157nm的Excitech 0.85 NA曝光工具进行曝光。曝光后在115℃烘烤90秒接着在0.26N的TMAH显影剂中显影30秒。得到70nm 1∶1.5 L/S的曝光是用强的相移掩模以0.3的sigma设置进行的。
表2
由共聚物制备的光致抗蚀剂的光刻性能表
| 光致抗蚀剂实施例 | 聚合物1 | EomJ/cm2 | 分辩剂量1∶1.5 L/SmJ/cm2 | 对比度 | 暗膜损失% | 157nm的吸收率 |
| 1 | 28(19MOM,9BOCME)实施例29的聚合物 | 18.6 | 106.4 | 7.0 | 1.4 | 0.85 |
| 2 | 32(20MOM,12BOCME)实施例25的聚合物 | 15.6 | 102.2 | 18 | 1.4 | 0.94 |
| 3 | 20.5(7BCHOM,13.5BOCME)实施例26的聚合物 | 11.2 | 60.8 | 15.2 | 1.7 | 1.11 |
| 4 | 20.4(6ADMOM,14.4BOCME)实施例27的聚合物 | 15.2 | 75.5 | 7.5 | 1.9 | 1.12 |
1聚合物所指示如下:圆括号前的第一个数即28(19MOM,9BOCME)中的28表示材料的总的保护水平。圆括号中的备注表示聚合物中每一类型的重复单元的%含量。
Eo是对开口大空间的曝光能量。
暗膜损失是在0.26N TMAH显影剂中30秒显影时间的膜损失百分数。
吸收率是光致抗蚀剂膜的吸收率。
Claims (28)
1.一种光致抗蚀剂组合物,包括一种光酸生成剂和至少一种包含至少一种由结构1描述的单元的新的聚合物,
其中,
(i)R1是聚合物的脂肪族环状单元,R2选自H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基,和(CR3R4)p(CO)OR5,Rf选自F,H,(C1-C8)烷基,或全部或部分氟化的烷基,和环氟烷基,或
(ii)R1和R2结合形成聚合物的脂肪族环状单元,Rf选自F,H,(C1-C8)烷基和全部或部分氟化的烷基,和环氟烷基,或
(ii)R1和Rf结合形成聚合物的脂肪族环状单元,和R2选自H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基和(CR3R4)p(CO)OR5;和
R3和R4独立地是H,F,(C1-C8)烷基,(C1-C8)氟烷基,环烷基,环氟烷基,(CR3R4)p(CO)OR5,R3和R4可以结合形成烷基螺环或氟烷基螺环基团,
X选自(C1-C8)亚烷基,(C1-C8)氟亚烷基,O(C1-C8)亚烷基,O(C1-C8)氟亚烷基,环烷基和氟化环烷基,
R5是H或一个酸不稳定基团,m=0-1,和p=1-4。
2.权利要求1的组合物,其中含有结构1的单元的聚合物是含脂肪族环状氟代醇单元的聚合物与能够用烷氧基羰基烷基基团官能化氟代醇单元的化合物的反应产物。
3.权利要求1的组合物,其中环状单元是脂肪族多环单元或脂肪族单环单元。
5.权利要求1的组合物,其中结构1的单元选自由下面的单体衍生的基团:
6.权利要求1的组合物,其中脂肪族环状单元是单环单元。
8.权利要求2的组合物,其中烷氧基羰基烷基选自叔丁氧基羰基甲基,甲基-金刚烷基氧基羰基甲基,叔戊基氧基羰基甲基,甲基-降冰片基氧基羰基甲基,叔丁氧基羰基丙基和叔丁氧基羰基二氟丁基。
9.权利要求1的组合物,其中酸不稳定基团选自仲和叔烷基,缩醛和缩酮,三甲基甲硅烷基,β-三烷基甲硅烷基取代的烷基,四氢呋喃基,四氢吡喃基,取代或未取代的甲氧基甲氧基羰基和β-三烷基甲硅烷基烷基。
10.权利要求1的组合物,其中聚合物包含另外的含有非酸不稳定基团和/或酸不稳定基团的单元。
11.权利要求1的组合物,其中聚合物选自聚(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇),聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯和聚(1,1,2,3,3-五氟-4-三氟烷基-4-羟基-1,6-庚二烯)。
12.权利要求1的组合物,其中聚合物包含一种含有单环单元的聚合物和含有多环单元的聚合物的混合物。
13.权利要求12的组合物,其中聚合物混合物是聚(双环[2.2.1]庚-5-烯-2-基)-1,1,1-三氟-2-(三氟甲基)丙烷-2-醇)与聚(1,1,2,3,3-五氟-4-三氟甲基-4-羟基-1,6-庚二烯)。
14.权利要求1的组合物,其中组合物进一步包含溶解抑制剂。
15.权利要求1的组合物,其中组合物进一步包含一种碱或一种光碱。
16.权利要求1的组合物,进一步包含第二种聚合物。
17.权利要求1的组合物,其中光酸生成剂选自重氮盐,碘鎓盐,硫鎓盐,三嗪,噁唑,噁二唑,噻唑,取代的2-吡喃酮,酚磺酸酯和它们的混合物。
18.光致抗蚀剂组合物成像的方法,包括如下步骤:
a)由权利要求1的光致抗蚀剂组合物在基体上形成光致抗蚀剂涂层;
b)图像式曝光光致抗蚀剂涂层;
c)后曝光烘烤光致抗蚀剂涂层;和
d)用碱的水溶液显影光致抗蚀剂涂层。
19.权利要求18的方法,其中图像式曝光波长在200nm以下。
20.权利要求18的方法,其中碱的水溶液包含四甲基氢氧化铵。
21.权利要求18的方法,其中碱的水溶液进一步包含一种表面活性剂。
22.一种制备权利要求1的聚合物的方法,其中含有脂肪族环状氟代醇单元的聚合物在含有至少一种有机碱的混合物存在的条件下与能够用烷氧基羰基烷基基团官能化氟代醇单元的化合物反应。
23.权利要求22的方法,其中有机碱选自铵碱,磷鎓碱和硫鎓碱。
24.权利要求22的方法,其中有机碱是(R1’)(R2’)(R3’)(R’4)NOH,和其中R1’,R2’,R3’和R4’独立地是(C1-C20)烷基。
25.权利要求22的方法,其中混合物进一步含有选自铵盐,磷鎓盐和硫鎓盐的一种盐。
26.权利要求22的方法,其中有机碱选自四甲基氢氧化铵,四丁基氢氧化铵和它们的混合物。
26.权利要求22的方法,其中环状单元是脂肪族多环单元或脂肪族单环单元。
27.权利要求22的方法,其中烷氧基羰基烷基选自叔丁氧基羰基甲基,甲基-金刚烷基氧基羰基甲基,叔戊基氧基羰基甲基,甲基-降冰片基氧基羰基甲基,叔丁氧基羰基丙基和叔丁氧基羰基二氟丁基。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/371,262 | 2003-02-21 | ||
| US10/371,262 US20040166434A1 (en) | 2003-02-21 | 2003-02-21 | Photoresist composition for deep ultraviolet lithography |
| US10/658,840 | 2003-09-09 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1809789A true CN1809789A (zh) | 2006-07-26 |
Family
ID=32868306
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200480004743.0A Pending CN1809789A (zh) | 2003-02-21 | 2004-02-10 | 用于远紫外光刻的光致抗蚀剂组合物 |
Country Status (3)
| Country | Link |
|---|---|
| US (2) | US20040166434A1 (zh) |
| CN (1) | CN1809789A (zh) |
| SG (1) | SG155061A1 (zh) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102023479A (zh) * | 2009-09-09 | 2011-04-20 | 住友化学株式会社 | 光刻胶组合物 |
| CN102329403A (zh) * | 2010-06-30 | 2012-01-25 | 株式会社东进世美肯 | 用于形成抗蚀剂保护膜的聚合物、组合物以及使用所述组合物形成半导体装置图案的方法 |
| CN114874384A (zh) * | 2022-01-21 | 2022-08-09 | 南通林格橡塑制品有限公司 | 一种193nm光刻胶成膜树脂及其制备方法和正型光刻胶组合物 |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004088428A1 (ja) * | 2003-03-28 | 2004-10-14 | Tokyo Ohka Kogyo Co. Ltd. | ホトレジスト組成物及びそれを用いたレジストパターン形成方法 |
| JP4360844B2 (ja) * | 2003-06-16 | 2009-11-11 | 富士フイルム株式会社 | ポジ型レジスト組成物 |
| DE10350685B4 (de) * | 2003-10-30 | 2010-05-27 | Az Electronic Materials Usa Corp. | Fotoresist geeignet zur Verwendung in der 157 nm-Fotolithografie, enthaltend ein Polymer auf Basis von fluorierten Norbornen-Derivaten |
| US8053159B2 (en) * | 2003-11-18 | 2011-11-08 | Honeywell International Inc. | Antireflective coatings for via fill and photolithography applications and methods of preparation thereof |
| DE602005021212D1 (de) * | 2004-04-27 | 2010-06-24 | Tokyo Ohka Kogyo Co Ltd | Material zur bildung eines resistschutzfilms für das eintauchbelichtungsverfahren und verfahren zur bildung eines resistmusters unter verwendung des schutzfilms |
| JP4368267B2 (ja) * | 2004-07-30 | 2009-11-18 | 東京応化工業株式会社 | レジスト保護膜形成用材料、およびこれを用いたレジストパターン形成方法 |
| US7473749B2 (en) * | 2005-06-23 | 2009-01-06 | International Business Machines Corporation | Preparation of topcoat compositions and methods of use thereof |
| US8642246B2 (en) | 2007-02-26 | 2014-02-04 | Honeywell International Inc. | Compositions, coatings and films for tri-layer patterning applications and methods of preparation thereof |
| JP2010085921A (ja) * | 2008-10-02 | 2010-04-15 | Panasonic Corp | レジスト材料及びそれを用いたパターン形成方法 |
| US8557877B2 (en) | 2009-06-10 | 2013-10-15 | Honeywell International Inc. | Anti-reflective coatings for optically transparent substrates |
| US8541523B2 (en) * | 2010-04-05 | 2013-09-24 | Promerus, Llc | Norbornene-type polymers, compositions thereof and lithographic process using such compositions |
| US8864898B2 (en) | 2011-05-31 | 2014-10-21 | Honeywell International Inc. | Coating formulations for optical elements |
| US20130108956A1 (en) | 2011-11-01 | 2013-05-02 | Az Electronic Materials Usa Corp. | Nanocomposite positive photosensitive composition and use thereof |
| TWI617629B (zh) * | 2013-05-01 | 2018-03-11 | Jsr股份有限公司 | 具有凹圖案的基材的製造方法、組成物、導電膜的形成方法、電子電路及電子元件 |
| WO2016167892A1 (en) | 2015-04-13 | 2016-10-20 | Honeywell International Inc. | Polysiloxane formulations and coatings for optoelectronic applications |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1496757A (en) | 1973-12-21 | 1978-01-05 | Glaxo Lab Ltd | Cephalosporin derivatives |
| NO744621L (zh) | 1973-12-21 | 1975-07-21 | Glaxo Lab Ltd | |
| DE3028627A1 (de) | 1980-07-29 | 1982-03-04 | Basf Ag, 6700 Ludwigshafen | 2-fluoralkancarbonsaeureverbindungen, verfahren zu ihrer herstellung, diese enthaltende herbizide und ihre anwendung |
| US4491628A (en) * | 1982-08-23 | 1985-01-01 | International Business Machines Corporation | Positive- and negative-working resist compositions with acid generating photoinitiator and polymer with acid labile groups pendant from polymer backbone |
| JP2622402B2 (ja) | 1988-06-13 | 1997-06-18 | 株式会社日立製作所 | 磁性膜形成装置 |
| EP0440374B1 (en) * | 1990-01-30 | 1997-04-16 | Wako Pure Chemical Industries Ltd | Chemical amplified resist material |
| CH688319A5 (fr) | 1994-06-03 | 1997-07-31 | Marcham Trading & Investment L | Procédé pour la préparation du céfixime trihydraté. |
| JPH08176051A (ja) | 1994-12-27 | 1996-07-09 | Mitsui Toatsu Chem Inc | スピロビインダン誘導体およびそれを含有するレジスト材料 |
| JPH08193055A (ja) | 1995-01-13 | 1996-07-30 | Shin Etsu Chem Co Ltd | 2,6−ビス(2−t−ブトキシカルボニルメチロキシフェニルメチル)−1−t−ブトキシカルボニルメチロキシ−4−メチルベンゼン及びその誘導体 |
| JPH09211865A (ja) | 1996-02-05 | 1997-08-15 | Fuji Photo Film Co Ltd | ポジ型感光性組成物 |
| JP3804138B2 (ja) * | 1996-02-09 | 2006-08-02 | Jsr株式会社 | ArFエキシマレーザー照射用感放射線性樹脂組成物 |
| RU2194295C2 (ru) * | 1996-03-07 | 2002-12-10 | З Би. Эф. Гудрич Кампэни | Фоторезистная композиция и полимер |
| US5843624A (en) * | 1996-03-08 | 1998-12-01 | Lucent Technologies Inc. | Energy-sensitive resist material and a process for device fabrication using an energy-sensitive resist material |
| KR100265597B1 (ko) | 1996-12-30 | 2000-09-15 | 김영환 | Arf 감광막 수지 및 그 제조방법 |
| US6048661A (en) * | 1997-03-05 | 2000-04-11 | Shin-Etsu Chemical Co., Ltd. | Polymeric compounds, chemically amplified positive type resist materials and process for pattern formation |
| TW526390B (en) | 1997-06-26 | 2003-04-01 | Shinetsu Chemical Co | Resist compositions |
| US6849377B2 (en) * | 1998-09-23 | 2005-02-01 | E. I. Du Pont De Nemours And Company | Photoresists, polymers and processes for microlithography |
| EP1131677B1 (en) | 1998-09-23 | 2005-08-03 | E.I. Dupont De Nemours And Company | Photoresists, polymers and processes for microlithography |
| JP2000098614A (ja) | 1998-09-28 | 2000-04-07 | Fuji Photo Film Co Ltd | ポジ型感光性組成物 |
| US6369276B1 (en) * | 1998-11-19 | 2002-04-09 | Eagleview Technologies, Inc. | Catalyst structure for ketone production and method of making and using the same |
| US6790587B1 (en) * | 1999-05-04 | 2004-09-14 | E. I. Du Pont De Nemours And Company | Fluorinated polymers, photoresists and processes for microlithography |
| KR20020012206A (ko) | 1999-05-04 | 2002-02-15 | 메리 이. 보울러 | 플루오르화 중합체, 포토레지스트 및 마이크로리소그래피방법 |
| TW487698B (en) * | 1999-10-13 | 2002-05-21 | Shinetsu Chemical Co | Styrene derivatives |
| US6210859B1 (en) | 1999-10-15 | 2001-04-03 | Korea Kumho Petrochemical Co., Ltd. | Copolymer for the manufacture of chemical amplified photoresist and a positive photoresist composition using the same |
| WO2001037047A2 (en) | 1999-11-17 | 2001-05-25 | E.I. Du Pont De Nemours And Company | Nitrile/fluoroalcohol polymer-containing photoresists and associated processes for microlithography |
| US6468712B1 (en) * | 2000-02-25 | 2002-10-22 | Massachusetts Institute Of Technology | Resist materials for 157-nm lithography |
| EP1275666A4 (en) | 2000-04-04 | 2007-10-24 | Daikin Ind Ltd | FLUOROPOLYMER COMPRISING A GROUP THAT REACTS TO ACIDS AND PHOTORESIST COMPOSITION WITH CHEMICAL AMPLIFICATION CONTAINING SAID FLUOROPOLYMER |
| JP4838437B2 (ja) * | 2000-06-16 | 2011-12-14 | Jsr株式会社 | 感放射線性樹脂組成物 |
| KR20030076228A (ko) | 2000-06-21 | 2003-09-26 | 아사히 가라스 가부시키가이샤 | 레지스트 조성물 |
| JP4190167B2 (ja) * | 2000-09-26 | 2008-12-03 | 富士フイルム株式会社 | ポジ型レジスト組成物 |
| KR20020038283A (ko) * | 2000-11-17 | 2002-05-23 | 박종섭 | 포토레지스트 단량체, 그의 중합체 및 이를 함유하는포토레지스트 조성물 |
| JP2004536327A (ja) | 2000-11-29 | 2004-12-02 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | ポリマーブレンド及びマイクロリソグラフィ用フォトレジスト組成物中でのそれらの使用 |
| US7261992B2 (en) * | 2000-12-21 | 2007-08-28 | International Business Machines Corporation | Fluorinated silsesquioxane polymers and use thereof in lithographic photoresist compositions |
| US20020081520A1 (en) * | 2000-12-21 | 2002-06-27 | Ratnam Sooriyakumaran | Substantially transparent aqueous base soluble polymer system for use in 157 nm resist applications |
| US6548219B2 (en) * | 2001-01-26 | 2003-04-15 | International Business Machines Corporation | Substituted norbornene fluoroacrylate copolymers and use thereof in lithographic photoresist compositions |
| WO2002065212A1 (fr) * | 2001-02-09 | 2002-08-22 | Asahi Glass Company, Limited | Composition de reserve |
| EP1376230A1 (en) * | 2001-03-09 | 2004-01-02 | Semiconductor Leading Edge Technologies, Inc. | Fine pattern forming method |
-
2003
- 2003-02-21 US US10/371,262 patent/US20040166434A1/en not_active Abandoned
- 2003-12-17 US US10/658,840 patent/US7211366B2/en not_active Expired - Fee Related
-
2004
- 2004-02-10 CN CN200480004743.0A patent/CN1809789A/zh active Pending
- 2004-02-10 SG SG200705091-7A patent/SG155061A1/en unknown
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102023479A (zh) * | 2009-09-09 | 2011-04-20 | 住友化学株式会社 | 光刻胶组合物 |
| CN102329403A (zh) * | 2010-06-30 | 2012-01-25 | 株式会社东进世美肯 | 用于形成抗蚀剂保护膜的聚合物、组合物以及使用所述组合物形成半导体装置图案的方法 |
| CN102329403B (zh) * | 2010-06-30 | 2016-01-13 | 株式会社东进世美肯 | 用于形成抗蚀剂保护膜的聚合物、组合物以及使用所述组合物形成半导体装置图案的方法 |
| CN114874384A (zh) * | 2022-01-21 | 2022-08-09 | 南通林格橡塑制品有限公司 | 一种193nm光刻胶成膜树脂及其制备方法和正型光刻胶组合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG155061A1 (en) | 2009-09-30 |
| US20040166434A1 (en) | 2004-08-26 |
| US20040166433A1 (en) | 2004-08-26 |
| US7211366B2 (en) | 2007-05-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1253759C (zh) | 微石印用光致抗蚀剂、聚合物和工艺 | |
| CN1809789A (zh) | 用于远紫外光刻的光致抗蚀剂组合物 | |
| CN1659477A (zh) | 包含光活性化合物混合物的用于深紫外平版印刷的光刻胶组合物 | |
| CN1225486C (zh) | 具有酸反应性基团的新颖含氟聚合物以及使用这些材料的化学增幅型光刻胶组合物 | |
| CN1227569C (zh) | 氟化聚合物,光刻胶和用于显微光刻的方法 | |
| CN1210622C (zh) | 用于短波长光的负型光致抗蚀组合物及其形成图像的方法 | |
| CN1550896A (zh) | 光致抗蚀剂组合物及其制备方法 | |
| CN1167982C (zh) | 光刻胶组合物 | |
| CN1592870A (zh) | 正型抗蚀剂组合物及使用其形成抗蚀图形的方法 | |
| CN1791573A (zh) | 光活性化合物 | |
| CN1918217A (zh) | 高分子化合物、含有该高分子化合物的光致抗蚀剂组合物以及抗蚀图案形成方法 | |
| CN1413992A (zh) | 5-亚甲-1,3-二恶茂烷-4-酮诱导体、重合体、化学增幅型抗蚀组成物及形成方法 | |
| CN1678646A (zh) | 氟化聚合物、光致抗蚀剂和显微平版印刷法 | |
| CN1818782A (zh) | 深紫外正性光刻胶及其成膜树脂 | |
| CN1240666C (zh) | 光致抗蚀剂单体,其共聚物和使用该共聚物的组合物 | |
| CN1605938A (zh) | 光致抗蚀剂聚合物及包含其的光致抗蚀剂组合物 | |
| CN1498360A (zh) | 聚合物掺混物及其在用于微细光刻的光刻胶组合物中的应用 | |
| CN1620633A (zh) | 碱和表面活性剂,以及它们在用于微型平板印刷的光致抗蚀剂组合物中的用途 | |
| CN1311298C (zh) | 光刻胶组合物、层压材料、图案形成方法和制造半导体器件的方法 | |
| CN1214054C (zh) | 微刻用组合物 | |
| CN1856741A (zh) | 低多分散性可光成像的聚合物、光致抗蚀剂和微版印刷术 | |
| CN100351309C (zh) | 含有具有被保护的羧基的化合物的形成光刻用下层膜的组合物 | |
| CN1834785A (zh) | 含硅193nm负性光刻胶及其成膜树脂 | |
| CN1991581A (zh) | 抗蚀底膜的硬掩模层组合物及半导体集成电路装置的制造方法 | |
| CN1847274A (zh) | 含硅偶联剂共聚物成膜树脂及其有机防反射涂膜 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Open date: 20060726 |