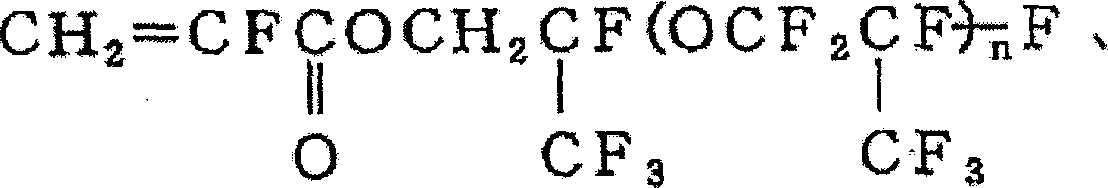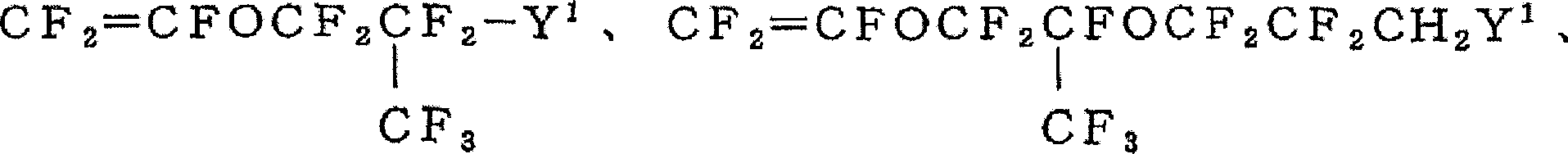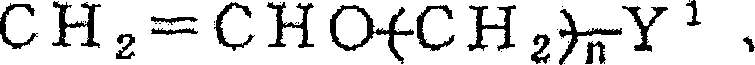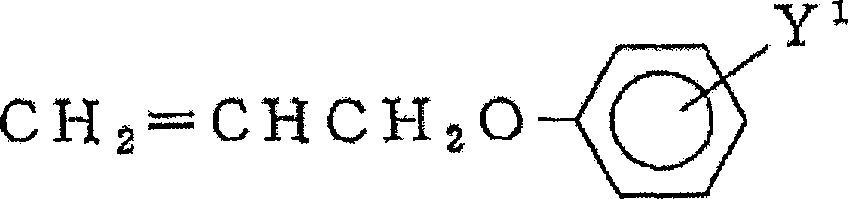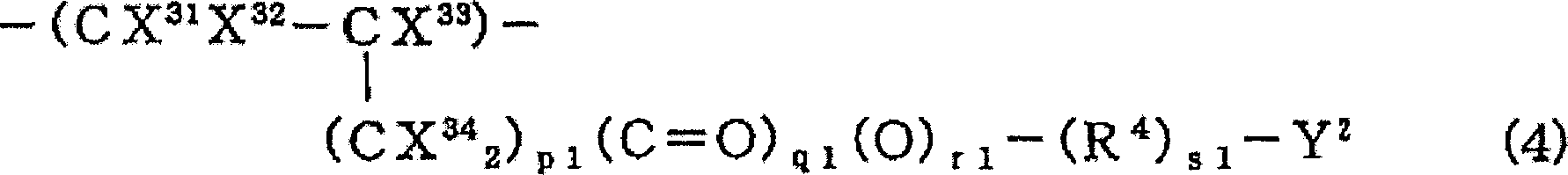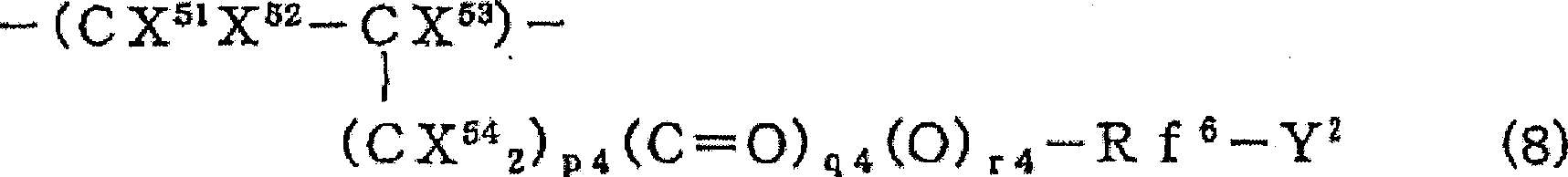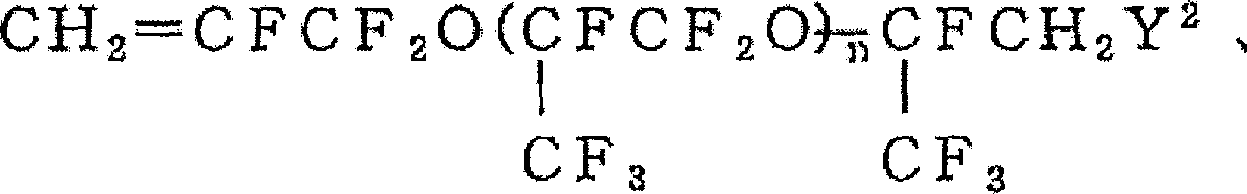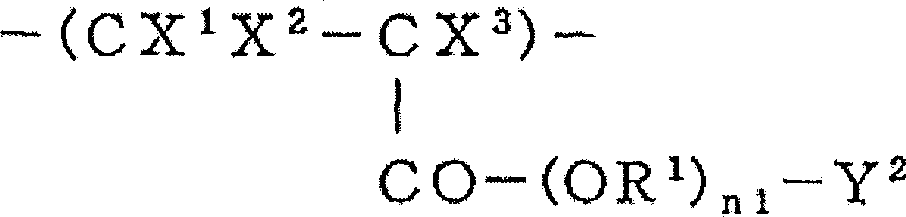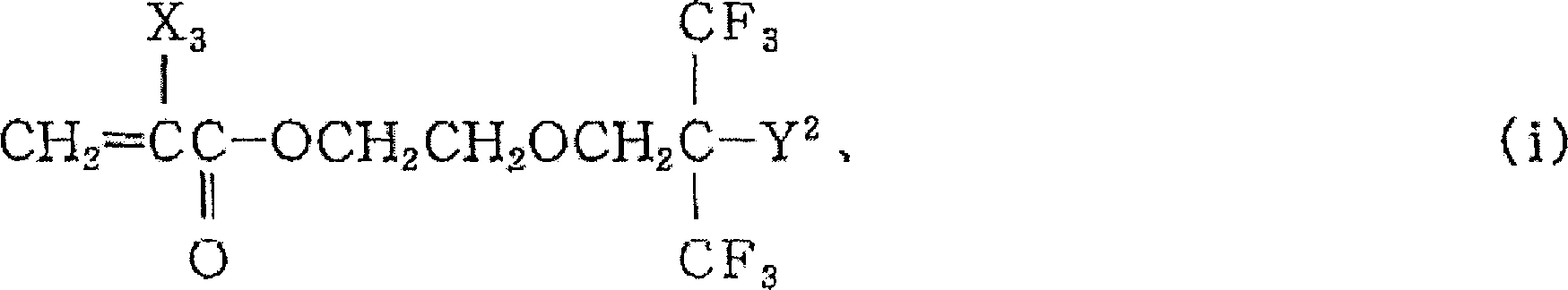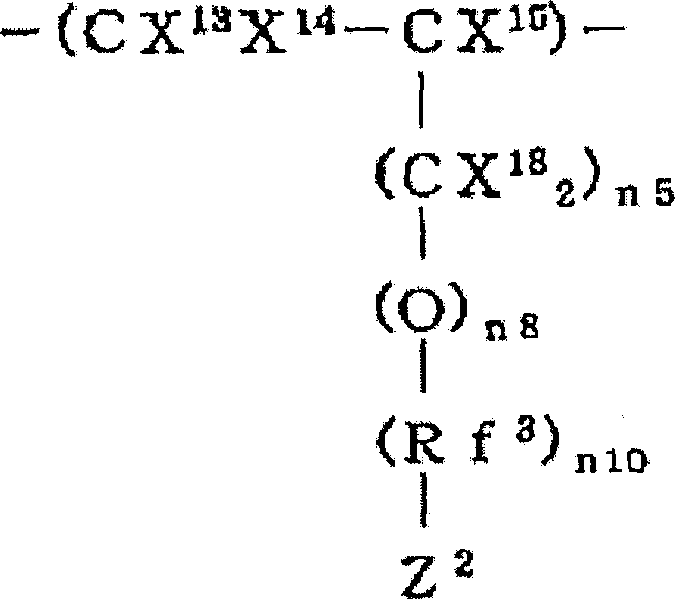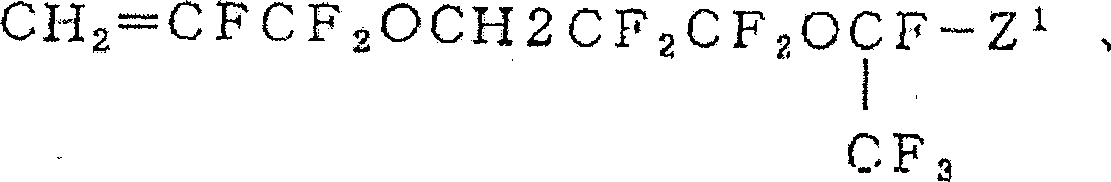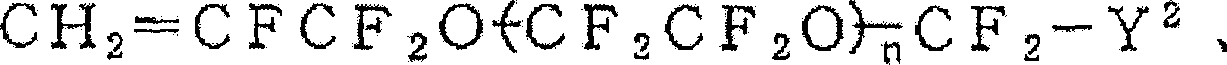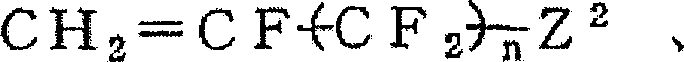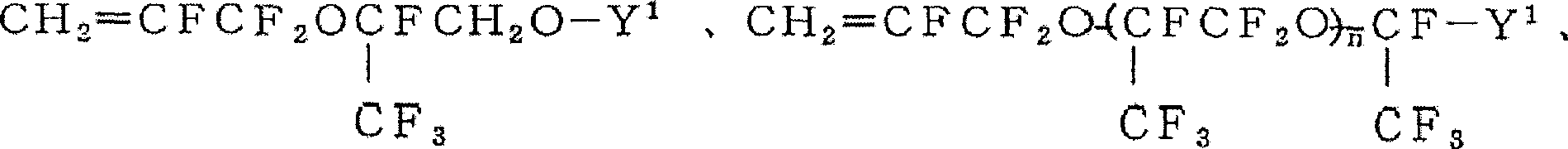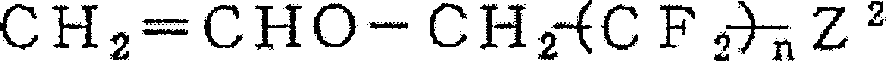CN1225486C - 具有酸反应性基团的新颖含氟聚合物以及使用这些材料的化学增幅型光刻胶组合物 - Google Patents
具有酸反应性基团的新颖含氟聚合物以及使用这些材料的化学增幅型光刻胶组合物 Download PDFInfo
- Publication number
- CN1225486C CN1225486C CNB018047963A CN01804796A CN1225486C CN 1225486 C CN1225486 C CN 1225486C CN B018047963 A CNB018047963 A CN B018047963A CN 01804796 A CN01804796 A CN 01804796A CN 1225486 C CN1225486 C CN 1225486C
- Authority
- CN
- China
- Prior art keywords
- acid
- formula
- structural unit
- fluorine
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F20/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride, ester, amide, imide or nitrile thereof
- C08F20/02—Monocarboxylic acids having less than ten carbon atoms, Derivatives thereof
- C08F20/10—Esters
- C08F20/22—Esters containing halogen
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0045—Photosensitive materials with organic non-macromolecular light-sensitive compounds not otherwise provided for, e.g. dissolution inhibitors
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0046—Photosensitive materials with perfluoro compounds, e.g. for dry lithography
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/038—Macromolecular compounds which are rendered insoluble or differentially wettable
- G03F7/0382—Macromolecular compounds which are rendered insoluble or differentially wettable the macromolecular compound being present in a chemically amplified negative photoresist composition
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
- G03F7/0395—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition the macromolecular compound having a backbone with alicyclic moieties
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
- G03F7/0397—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition the macromolecular compound having an alicyclic moiety in a side chain
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/075—Silicon-containing compounds
- G03F7/0757—Macromolecular compounds containing Si-O, Si-C or Si-N bonds
- G03F7/0758—Macromolecular compounds containing Si-O, Si-C or Si-N bonds with silicon- containing groups in the side chains
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S430/00—Radiation imagery chemistry: process, composition, or product thereof
- Y10S430/1053—Imaging affecting physical property or radiation sensitive material, or producing nonplanar or printing surface - process, composition, or product: radiation sensitive composition or product or process of making binder containing
- Y10S430/1055—Radiation sensitive composition or product or process of making
- Y10S430/106—Binder containing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S430/00—Radiation imagery chemistry: process, composition, or product thereof
- Y10S430/1053—Imaging affecting physical property or radiation sensitive material, or producing nonplanar or printing surface - process, composition, or product: radiation sensitive composition or product or process of making binder containing
- Y10S430/1055—Radiation sensitive composition or product or process of making
- Y10S430/106—Binder containing
- Y10S430/108—Polyolefin or halogen containing
Landscapes
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- General Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Materials For Photolithography (AREA)
Abstract
提供一种对真空紫外区(157nm)能量射线(射线)透明性高、具有酸反应性基团的新颖含氟聚合物,以及使用它作光刻胶用的含氟基础聚合物,使用这些材料的化学增幅型光刻胶组合物。由式:-(M1)-(M2)-(A)(式中,M1是具有酸解离性或酸分解性官能团的结构单元,M2是含氟丙烯酸酯结构单元,A是来源于其他能共聚单体的结构单元)表示的,其中含有1~99摩尔%结构单元M1,1~99摩尔%结构单元M2及0~98摩尔%结构单元A,M1/M2为1~99/99~1摩尔%且数均分子量为1,000~1,000,000的含氟聚合物,或者含有该聚合物等带酸反应性基团的含氟聚合物的、适于光刻胶用含氟基础聚合物用材料,使用这些材料的化学增幅型光刻胶组合物。
Description
技术领域
本发明涉及含有酸反应性基团的新颖含氟聚合物,进一步涉及对真空紫外区能量射线(放射线)透明性高、适于光刻胶用的含氟基础聚合物用材料,以及使用这些材料的化学增幅型光刻胶组合物。
背景技术
随着大规模集成电路(LSI)高集成化必要性的提高,光刻技术需要一种微细加工技术。针对此要求,人们试验采用比以往的g线(波长436nm)、i线(波长365nm)波长更短的远紫外线、KrF受激准分子激光(波长248nm)、ArF受激准分子激光(波长193nm)作为曝光用光源,并陆续实用化。
作为进一步超微细加工技术,最近正在研究采用真空紫外区F2激光(波长157nm)的方法,作为目标曝光技术今后有望看到0.1微米的技术焦点。
在图形形成过程中,从有利于各波长能量射线下的透明性、分辨率、灵敏度、耐干蚀性等观点出发人们研究了化学增幅型光刻胶。所谓“化学增幅型光刻胶”是指这样一种感能量射线组合物,例如在正像型场合下,其中含有导入有由酸作用脱保护之类取代基而对碱显影液溶解性树脂产生溶解抑制效果的树脂,以及在光线、电子射线等能量射线照射下产生酸的化合物(以下称为光酸发生剂)。这种组合物一经光和电子射线照射就从光酸发生剂中产生酸,通过曝光后的加热(postexposure bake,以下也叫作“PEB”),酸使赋予溶解抑制效果的取代基脱保护。其结果曝光部分变成碱溶性的,经碱显影液处理后,可以得到正像型光刻胶图形。此时酸起催化作用,微量下就能发挥效果。而且酸的作用因PEB而变得活泼,以连锁反应方式促进化学反应,使灵敏度提高。
这种化学增幅型光刻胶中使用的已有树脂实例,可以举出酚醛系树脂中部分或全部羟基被乙缩醛和酮缩醇等保护基保护的树脂(KrF光刻胶)、甲基丙烯酸系树脂的羧基上导入酸解离性酯基的树脂(ArF光刻胶)等。
然而,这些已有的光刻胶用聚合物的基本问题是,真空紫外光的波长区域有强吸收,对更超微细化法研究利用的那种波长157nm下的F2激光透明性差(分子消光系数大)。因此,F2激光曝光必须将光刻胶膜的厚度做得极薄,实际上很难以单层F2光刻胶使用。
然而,R.R.Kunz和T.M.Bloomstein等人在《Jounal of PhotopolymerScience and Technology》(12卷4期561-569页,1999年)上比较了各种材料在157nm下的透明性,记载说氟代碳类有良好的透明性,暗示了作F2光刻胶使用的可能性。
但是该文章仅记载了现有氟代碳类聚合物在157nm下有高透明性,而未记载优选含氟聚合物的具体结构。其中不用说有关于正像型和负像型化学增幅型光刻胶中导入必要官能团后含氟聚合物透明性的评价,就连合成也未提及。因此根本没有对化学增幅型光刻胶用优选的含氟基础聚合物和使用其的优选光刻胶组合物作出任何暗示,此外也未发现使用含氟聚合物形成F2光刻胶图形的可能性。
其后,杜邦公司的A.E.Feiring等人在PCT专利公开公报WO00/17712(2000年3月30日公开)上公开了特定的含氟聚合物作为F2光刻胶使用的用途。
在这份公开的专利中,虽然记载了使用具有氟代烯烃结构单元和杂环结构结构单元的含氟聚合物,但是没有记载有关不具有杂环结构的含氟聚合物,例如链状含氟乙烯类聚合物。
有关在含氟聚合物中导入正像型光刻胶所需的酸解离性(或酸分解性)官能团,仅仅研究在已有的丙烯酸系、甲基丙烯酸系、降冰片烯系、乙烯基酯系单体中导入酸解离性(或酸分解性)官能团后单体的共聚,其中没有例示使用带有含氟原子或氟代烷基,同时还含有酸解离性(或酸分解性)官能团的单体。
作为构成光刻胶用含氟聚合物稠环结构实例之一记载的降冰片烯衍生物,虽然有被卤素取代的降冰片烯的记载,但是却没有具体记载被氟原子取代的实例,一分子同时被氟原子和酸反应性基团取代的实例,进而在特定位置取代的实例等。
其后,杜邦公司的A.E.Feiring等人在PCT专利公开公报WO00/67072(2000年11月9日公开)上公开了一些含有-C(Rf)(Rf’)OH或-C(Rf)(Rf’)O-Rb的含氟聚合物作为F2光刻胶使用的用途。
该公开专利中记载的有关-C(Rf)(Rf’)OH或-C(Rf)(Rf’)O-Rb在含氟聚合物中的导入,是由具有-C(Rf)(Rf’)OH或-C(Rf)(Rf’)O-Rb的乙烯性单体与降冰片烯衍生物共聚而成的,但是没有举出其中含有与酸反应后能变成羧基的官能团的含氟单体结构单元的实例。
此外,作为光刻胶用含氟聚合物实例之一,记载了含有-C(Rf)(Rf’)OH或-C(Rf)(Rf’)O-Rb的降冰片烯衍生物,其中虽然有被卤素取代的降冰片烯的记载,但是却没有记载具体被氟原子取代的实例,一个分子被氟原子和酸反应性基团(特别是与酸反应能变成羧基的官能团)同时取代的实例,进而在特定位置上被取代的等具体实例。
本发明第I目的在于提供一种具有酸反应性基团,适于光刻胶用聚合物的新颖含氟聚合物及其覆膜。
第II目的在于提供一种对真空紫外区(例如157nm)透明性高、可以作为化学增幅型光刻胶基础聚合物用、导入有酸反应性基团的含氟基础聚合物。
此外第III目的在于提供一种含有带酸反应性基团的含氟聚合物和光酸发生剂,可以在采用F2激光作光源的形成图形工艺中利用的化学增幅型光刻胶组合物,以及以其涂覆得到的覆膜。
此外,松下电气产业株式会社的胜山等人,提出了使用含有卤原子等的光刻胶材料用1~180nm波长范围的光线曝光形成图形的方法(特开2000-321774号公报,2000年11月24日公开)。但是仅记载了以侧链有-CH2CF3基、-CH(CF3)2基的甲基丙烯酸酯结构单元的甲基丙烯酸树脂,作为含有卤原子的光刻胶用树脂,既没有记载主链上有氟原子的树脂,也没有具体记载同时含有能起化学增幅型光刻胶(正像或负像型)作用的官能团和氟原子的含氟单体结构单元的聚合物。此外,更没有记载主链有环结构的聚合物。
发明的公开
本发明人等为达成此目的深入研究后,发现了具有酸反应性基团的新颖含氟聚合物,可以作光刻胶用聚合物使用。
而且还发现,作为光刻胶用基础聚合物,具有特定的酸反应性基团的含氟聚合物是有效的,其真空紫外区内透明性高。
此外又发现,含有这些光刻胶用基础聚合物,和光酸发生剂的组合物可以用作为光刻胶组合物,用涂布法可以得到真空紫外区内透明性高的覆膜,具有正像型和负像型化学增幅型光刻胶作用。
本发明的第I(以下也叫作发明I)涉及以酸解离性或酸分解性官能团作为酸反应性基团的新颖含氟聚合物。
本发明第I类新颖的含氟聚合物之一,是式I-(1)表示的第1含氟丙烯酸系聚合物。
式I-(1)
-(M1)-(M2)-(A1)- I-(1)
(式中,M1是
M2是
(式中,X1、X2、X4、X5相同或不同,是H或F;X3、X6相同或不同,是H、Cl、CH3、F或CF3;Y1是酸解离性或酸分解性官能团;R1表示碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;Rf表示碳原子数1~20的含氟烷基、碳原子数的2~100的具有醚键的含氟烷基或碳原子数3~20的含氟芳基;n1为0或1)
A1是来源于能与结构单元M1、M2共聚单体的结构单元)
当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,其中含有1~99摩尔%结构单元M1、1~99摩尔%结构单元M2和0~98摩尔%结构单元A1、其数均分子量为1,000~1,000,000。
其他还涉及由后述式I-(2)和式I-(3)表示的第2和第3含氟聚合物。
此外,也涉及由这些含氟聚合物形成的基础聚合物用材料、以及由含酸反应性基团的含氟聚合物、光酸发生剂和溶剂组成的化学增幅型光刻胶组合物。
本发明的第II(以下也叫作发明II)涉及一种化学增幅型光刻胶组合物,是由:
(A)具有酸反应性基团的含氟聚合物,
(B)光酸发生剂和
(C)溶剂
组成的组合物,其中带酸反应性基团的含氟聚合物(A),是由式II-1表示的聚合物:
式II-1
-(M1)-(M2)-(N)- II-(1)
①结构单元M1是来源于具有酸反应性基团的乙烯类单体的结构单元,
②结构单元M2是来源于含氟乙烯类单体的结构单元,
③结构单元N是来源于能与M1、M2共聚的乙烯类单体的结构单元
当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,其中含有1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N,侧链中不含稠环结构部位。
本发明的第III(以下也叫作发明III)涉及一种化学增幅型光刻胶组合物,是由:
(A)具有酸反应性基团的含氟聚合物,
(B)光酸发生剂,和
(C)溶剂组成的组合物,
而具有酸反应性基团的含氟聚合物(A),是由式III-1:
-(M1)-(M2)-(N)- III-(1)
①结构单元M1是源于具有酸反应性基团的乙烯类单体的结构单元,
②结构单元M2是源于聚合物主链上具有含氟脂肪族环状结构的结构单元,
③结构单元N是源于能与M1、M2共聚的乙烯类单体的结构单元
表示的聚合物,当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,其中含有1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N,是主链和侧链中不含稠环结构部位的含氟聚合物。
本发明的第IV(以下也叫作发明IV)涉及一种化学增幅型光刻胶组合物,是由:
(A)具有酸解离性或酸分解性基团的含氟聚合物,
(B)光酸发生剂,和
(C)溶剂组成的组合物,
而具有酸反应性基团的含氟聚合物(A),是式IV-1表示的聚合物:
-(M1)-(M2)-(M3)-(N)- IV-(1)
①结构单元M1是来源于其中含有本身是酸解离性或酸分解性基团,与酸反应能变成羧基官能团的含氟乙烯类单体的结构单元,
②结构单元M2是来源于脂环式单体的结构单元,
③结构单元M3是来源于含氟乙烯类单体的结构单元,
④结构单元N是来源于能与M1、M2、M3共聚的乙烯类单体的结构单元当M1+M2+M3=100摩尔%时,M1/M2/M3(摩尔%)为1~98/1~98/1~98,其中含有1~98摩尔%M1、1~98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N。
本发明的第V(以下也叫作发明V)涉及一种化学增幅型光刻胶组合物,是由:
(A)具有酸反应性基团的含氟聚合物,
(B)光酸发生剂,和
(C)溶剂组成的组合物,
而具有酸反应性基团的含氟聚合物(A),是含有来源于式V-1所示酸反应性基团的含氟脂环式单体的结构单元M1的含氟聚合物:
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性官能团。当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基)。
实施发明的最佳方式
本发明的第I(发明I)涉及作为酸反应性基团含有酸解离性或酸分解性官能团的新颖含氟聚合物。
首先说明式I-(1)所示的第I新颖含氟丙烯酸系聚合物。
在式I-(1)含氟聚合物中,具有Y1的结构单元M1中作为必要成分X1、X2和X3均为氟原子以外成分,而且在n1=0或者R1不含氟原子的场合下,以含氟丙烯酸结构单元M2作为必要成分,当M1+M2=100摩尔%时,是M1/M2(摩尔%)=1~99/1~99的共聚物。
不过在M1中含氟原子的场合下,可以是从M1结构体中选出的一种以上的聚合物(当M1+M2=100摩尔%时,M1/M2(摩尔%)=1~100/0~99)。
式I-(1)表示的含氟聚合物,优选式I-(1)-1表示的:
-(M1a)-(M2a)-(A1)
(式中,M1a是
M2a是
(式中Y1、X1、X2、X4、X5、R1、Rf1、n1与式I-(1)中的相同)A1是来源于能与结构单元M1a、M2a共聚的单体的结构单元),当M1a+M2a=100摩尔%时,M1a/M2a(摩尔%)为1~100/0~99,其中含有1~100摩尔%结构单元M1a、0~99摩尔%结构单元M2a和0~99摩尔%结构单元A1、数均分子量为1,000~1,000,000的含氟聚合物。
更优选的具体实例是式I-(1)-2表示的:
-(M1b)-(M2b)-(A1)
(式中,M1b是
M2b是
(式中Y1、R1、Rf1、n1与式I-(1)相同)
A1是来源于能与结构单元M1b、M2b共聚的单体的结构单元)
当M1b+M2b=100摩尔%时,M1b/M2b(摩尔%)为1~100/0~99,其中含有1~100摩尔%结构单元M1b、0~99摩尔%结构单元M2b和0~99摩尔%结构单元A1、数均分子量为1,000~1,000,000的含氟聚合物。
如式I-(1)-1和式I-(1)-2所示,具有酸反应性基团且在α位上有氟原子的含氟丙烯酸系聚合物,不仅耐热性和机械特性优良,而且因折射率低而光学特性也优良,此外直到真空紫外区的透明性均高,可以在各种光学用途中和光刻胶等半导体用途中使用,因而特别优选。
在式I-(1)、式I-(1)-1和式I-(1)-2中,可以有、也可以没有-OR1,在含有该基团的场合下,R1可以从上述的二价烃基和含氟亚烷基中选择,优选二价烃基,可以具体举出:
-(CH2)n-(其中n=1~10的整数)
(n为0-5的整数)
等。
在式I-(1)、式I-(1)-1和式I-(1)-2中,Rf1选自上述含氟烷基,具体优选的可以举出:
-(CH2)m(CF2)n-F、-(CH2)m(CF2)n-H、-(CH2)m(CF2)n-Cl(式中m为1~5,n为1~10的整数)、
-CH2CF2CFHCF3、
(m=1~5、n=1~30) (n=1~30)
(n=1~30)
(m+n=2~30)
本发明的I-(1)、式I-(1)-1和式I-(1)-2的聚合物,可以利用使分别与结构单元M1和M2相当的乙烯类不饱和单体,和必要时与A1相当的单体聚合的方法,即将M1、M2和A1;M1a、M2a和A1(都是相应的单体);M1b、M2b和A1(都是相应的单体)聚合的方法得到。
具有酸解离性或酸分解性官能团Y1的结构单元M1~M1b(只要不特别说明就用M1表示)用单体的具体实例,可以举出:
(X3:H、F、CH3、CF3)
在构成上述M1单体的具体实例中,式(i)和式(ii)的化合物是文献和专利均未记载的化合物,使用它们的聚合物也是文献和专利均未记载的化合物。
构成聚合物的另一种结构单元M2~M2b(以下只要不特别说明就用M2表示)用单体的具体实例,可以举出:
(Z4:H、F、Cl、n:1~10)
(Z5:H、F、Cl、n:1~10)
(n:1~5)
(n:1~30)
(m:1或2,Z4:H,F,Cl,n:1-10)
(m:1或2,Z4:H,F,Cl,n:1-10)
(Z4、Z5:H、F、Cl、n:1~10)
本发明的I-(1)、式I-(1)-1和式I-(1)-2中,酸解离性或酸分解性官能团Y1,是指在酸或阳离子作用下能产生解离反应或分解反应的官能团。
这些反应既可以在低温下开始,也可以利用加热在高温下才开始。
其中优选Y1是在酸作用下能变成亲水性基团的官能团。更优选能够变成具有使含氟聚合物在碱水溶液中可以溶解能力的官能团。
具体优选在酸作用下能变成羟基、羧基、磺基等的官能团。
Y1的具体实例可以举出:
(式中,R7、R8、R9、R10、R11、R12、R14、R15、R18、R19、R20、R21、R22、R24、R25、R26、R27、R28、R29相同或不同,是碳原子数1~10的烃基,R13、R16是H或碳原子数1~10的烃基,R17、R23是碳原子数2~10的二价烃基)。
更优选的具体实例有:
-OC(CH3)3、-OCH2COOC(CH3)3、
(R30是碳原子数1-30的烷基)
由于这些官能团的作用,可以用于各种酸敏感材料、感光性材料和光刻胶材料等之中。
源于能与M1、M2共聚的单体的结构单元A1是任意成分,没有特别限制,可以根据目的含氟聚合物的用途、性能要求等适当选择。能形成结构单元A1的单体,例如可以举出以下化合物。
丙烯酸系单体(但是能形成M1、M2的单体除外):
CH2=CXCOOH、
(X:从H,CH3,F,CF3选出的)
苯乙烯系单体:
(n:0-2的整数)
乙烯系单体:
CH2=CH2、CH2=CHCH3、CH2=CHCl等
马来酸系单体:
(R是碳原子数1-20的烃基)
烯丙基系单体:
CH2=CHCH2Cl、CH2=CHCH2OH、CH2=CHCH2COOH、CH2=CHCH2Br等烯丙基醚系单体:
CH2=CHCH2OR(R:1~20个碳原子的烃基)、
CH2=CHCH2OCH2(CF2)nX(n:1~10,X:H、Cl、F)、
CH2=CHCH2OCH2CH2COOH、
还带官能团的脂环式单体:
(m:0-3的整数)
(Y1是酸解离性或酸分解性的官能团,Z1是酸不解离的官能团)含氟脂环式单体:
式(9)
(式中,A、B、C和D是H、F、1~10个碳原子的烷基或1~10个碳原子的含氟烷基;m是0~3的整数。但是A~D中有一个含有氟原子)
可以具体举出:
等。
此外还可以举出:
(A,B,C,D是H,F碳原子数1~10的烷基或含氟烷基)
等。
具有官能团的含氟脂环式单体可以举出:
由式(10)表示的新颖的含氟单体:
式(10)
(式中,A、B和C是H、F、1~10个碳原子的烷基或1~10个碳原子的含氟烷基;R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团。当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基。)
其中优选A、B和C均是氟原子,或者当A~C中均不含氟原子的场合下优选R的含氟量大于60%的,从赋予聚合物以透明性的观点来看更优选全氟亚烷基。
可以具体举出:
(n:0-10,X,F或CF3)
等。
或者式(11)表示的新颖的含氟单体:
式(11)
(式中,A、B和C是H、F、1~10个碳原子的烷基或1~10个碳原子的含氟烷基;R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团。)
可以具体举出优选有以下降冰片烯骨架的:
(n:0~10)
(n:0~10)
(X:F或CF3)
等。
此外还可以举出:
等。
这些脂环式单体所含的酸反应性基团,详细讲是酸解离性或酸分解性的官能团和酸缩合性的官能团。
①酸解离性或酸分解性官能团可以优选举出在酸或阳离子作用下,具有变成羟基、羧基、磺基等能力的,上面有关式I-(1)中M1列举的Y1基团。
②酸缩合性官能团
酸缩合性官能团,具体指在酸或阳离子作用下产生自缩合、缩聚的官能团,或者在交联剂存在下,因酸的作用引起与交联剂的缩合反应或缩聚反应的官能团,或者因酸或阳离子的转位重排反应(例如片那醇重排、卡必醇重排)等中引起极性变化的官能团,优选的实例例如有从羟基、羧基、氰基、磺基、环氧基等中选出的基团。
本发明的式I-(1)、式I-(1)-1和式I-(1)-2聚合物中,M1与M2之比(M1/M2、M1a/M2a、M1b/M2b)虽然可以根据用途、所需的功能和官能团Y1的种类在上述范围内作各种选择,但是例如在与酸反应后为了获得碱溶性,各结构单元M1(M1a、M1b)应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2(M2a、M2b)与A1的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
本发明的式I-(1)、式I-(1)-1和式I-(1)-2聚合物的分子量,可以根据用途、目的、使用状态等在1,000~1,000,000数均分子量范围内选择,但是优选3,000~700,000,更优选5,000~500,000左右。分子量过低,得到的聚合物覆膜耐热性和机械特性容易变得不足,反之分子量过高,对加工特性不利。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以数均分子量优选300,000以下,特别优选200,000以下。
本发明的式I-(1)聚合物中具体M1和M2的组合,可以根据预期用途、物性(特别是玻璃化转变点、熔点等)、功能(透明性和折射率等)从上面列示的单体中作各种选择,但是通常由M1带来官能团Y1的功能,而上记的其他功能则可以通过选择M2的种类(特别是Rf1基团)、存在比例、A1的种类和存在比例调整。例如,为提高机械特性而使用高Tg或高熔点聚合物的场合下,M2用单体优选从体积大的侧链物质中选择,例如可以优选:
反之,希望赋予柔软性和弹性(弹体性)的场合下,M2优选从具有低温下移动性高侧链的物质中选择,例如可以优选:
(n:1~5)
(n:1~30)
(m:1或2,n:1-10,Z4:H,F,Cl)
此外,为光学用途(塑料光纤,POF等)、半导体相关用途(光刻胶、层间绝缘膜等)而使用透明、低折射率聚合物的场合下,优选包括M1、M2、A1的聚合物整体氟原子含量尽可能高的聚合物,即氟原子含量应当在30重量%以上,优选在50重量%以上,更优选在60重量%以上;从这一点来看,在式I-(1)中优选X3、X6为氟原子或者为CF3,而且M2优选具有较高含氟量的,例如在M2用单体中优选:
(n:1~30)
(n:1~30)
(m:1或2,n:3-10)
这样得到的式I-(1)含氟聚合物耐热性良好,非晶态下在包括真空紫外区在内的宽广波长范围内透明性高,可以用于需要低折射率的塑料光纤等光学用途之中,以及光刻胶和层间绝缘膜等半导体相关用途等之中。
属于本发明第I类的其他新颖含氟聚合物,是式I-(2)和I-(2a)表示的含氟丙烯酸系聚合物或含氟乙烯基系聚合物。
新颖的含氟聚合物中的第2种,是式I-(2)表示的含氟聚合物:
式I-(2)
-(M3)-(M4)-(M5)-(A2)-
(式中,
M3是
M4是
M5是
(式中,X7、X8、X9、X10、X11、X12、X13、X14、X16、X17、X18相同或不同,是H或F;X15是H、F或CF3;Y1是酸解离性或酸分解性官能团;Z1是与酸不发生解离或分解反应的官能团;Z2是H、F或Cl;R2、Rf2、Rf3相同或不同,表示碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n3、n4、n5相同或不同,为0~2的整数;n6、n7、n8、n10相同或不同,为0或1;n9为1),A2是来源于能与结构单元M3~M5共聚的单体的结构单元)当M3+M4+M5=100摩尔%时,M3/M4/M5(摩尔%)为1~100/0~99/0~99,其中含有1~100摩尔%结构单元M3、0~99摩尔%结构单元M4、0~99摩尔%结构单元M5和0~99摩尔%结构单元A2,其数均分子量为1,000~1,000,000。
新颖的含氟聚合物的第3种,是式I-(2a)表示的含氟聚合物:
式I-(2a)
-(M3a)-(M4a)-(M5a)-(A2)-
(式中,M3a是
M4a是
M5a是
(式中,R2a表示碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n9为0或1;X7、X8、X9、X10、X11、X12、X13、X14、X15、X16、X17、X18、Y1、Z1、Z2、Rf2、Rf3、n3、n4、n5、n6、n7、n8和n10与上记式(2)相同(但是X13、X14、Z2中至少一个是F,或者X15是F或CF3),A2是来源于能与结构单元M3~M5共聚的单体的结构单元)
当M3a+M4a+M5a=100摩尔%时,M3a/(M4a+M5a)(摩尔%)为1~90/10~99,其中含有1~90摩尔%结构单元M3a、0~99摩尔%结构单元M4a、0~99摩尔%结构单元M5a和0~99摩尔%结构单元A2,其数均分子量为1,000~1,000,000。
以下若无特别说明,将结构单元M3和M3a,M4和M4a,M5和M5a,分别用结构单元M3,M4和M5为代表说明。
结构单元M3是具有酸解离性或酸分解性官能团的单体的结构单元,作为必要成分存在时能赋予含氟聚合物以新的功能。
结构单元M4虽然不与酸产生解离或分解反应,但是由于其中具有能够赋予和调整含氟聚合物的溶解性和交联性,以及与基材的附着性的官能团,所以优选用作含氟单体的结构单元。
结构单元M5虽然是没有官能团的含氟单体的结构单元,但是从可以根据要求来调整聚合物的机械特性和耐热性(玻璃化转变点或熔点),所以也优选。此外,还可以用M4和M5调整聚合物整体的含氟量,能使聚合物具有透明性和低折射率化等,因而也是优选成分。
结构单元A2与上记式I-(1)中所述的相同,也是选择性成分,必要时能赋予所需的性能,所以也是共聚成分之一。
本发明的式I-(2)和I-(2a)表示的含氟聚合物,在M3含氟的场合下,可以仅由M3的结构单元中选出一种或两种以上结构单元组成,而不含M4、M5和A2。
也就是说,M3的结构单元中具有氟原子,该场合下式I-(2)也可以是仅由从M3的结构组中选出的结构单元组成的聚合物。
另一方面,当式I-(2a)中的M3a是既有酸解离基团Y1又不含氟原子的结构单元的场合下,式I-(2a)是以M4a或M5a中任何一种结构单元为必要成分而组成的聚合物。
在式I-(2)的聚合物中,可以举出含有式I-(2)-1表示的结构单元M3的聚合物:
(式中,Y1、R2与式I-(2)的相同)。
在式I-(2)-1表示的聚合物中,优选的结构单元M4还可以举出式I-(2)-2表示的其中M3/M4/M5(摩尔%)=1~99/1~99/0~98的聚合物:
(式中,Rf2、Z1与式I-(2)的相同)。
在本发明的式I-(2)-1和式I-(2)-2表示的聚合物中,构成M3的单体,优选以下具体实例:
(a1+b1+c1:0~30;d1为0或1;e1:0~5;X55:F或CF3;X58:H或F;X57:H、F或CF3。但是X58为H的场合下,a1+b1+c1+d1不为0)
更具体优选以下具体实例:
(n:1-30的整数)
(n:1-30的整数)
此外在本发明的式I-(2)-2表示的聚合物中,构成M4的单体的优选具体实例可以举出:
(a2+b2+c2:0~30;d2为0或1;e2:0~5;X59:F或CF3;X60、X62:H或F;X61:H、F或CF3。但是X61、X62为H的场合下,a2+b2+c2+d2+e2不为0)
更具体可以举出
CH2=CFCF2O-CH2CF2-Z1、
CH2=CFCF2OCF2CF2O-CF2-Z1、
式I-(2)中另一优选的聚合物,是含有由式I-(2)-3表示的结构单元M3的聚合物:
I-(2)-3
(式中,Y1、R2与式I-(2)相同)。
在式I-(2)-3的聚合物中,还优选结构单元M4为式I-(2)-4表示的、其中M3/M4/M5(摩尔%)=1~99/1~99/0~98的聚合物:
(式中,Rf2、Z1与式I-(2)相同)。
在本发明的式I-(2)-3和式I-(2)-4表示的聚合物中,构成M3的单体优选以下具体实例:
(a3+b3+c3:0~30;d3:0~2;e3:0~5;X63、X65:F或CF3;X64:H或F。)
可以进一步具体举出:
CF2=CFOCF2CF2OCF2Y1、CF2=CFOCF2CF2OCF2CH2Y1、
CF2=CFOCF2CF2CH2OCF2CF2-Y1、
CF2=CFOCF2CF2CH2OCF2CF2CH2Y1、
本发明的式I-(2)-4聚合物中,构成M4的单体优选以下具体实例:
(a4+b4+c4:0~30;d4:0~2;e4:0~5;X66、X68:F或CF3;X67:H或F。)
可以进一步具体举出:
CF2=CFOCF2CF2-Z1、CF2=CFOCF2CF2CH2-Z1、
CF2=CFOCF2CF2OCF2-Z1、CF2=CFOCF2CF2OCF2CH2Z1、
CF2=CFOCF2CF2CH2OCF2CF2-Z1、
CF2=CFOCF2CF2CH2OCF2CF2CH2Z1
在式I-(2)的含氟聚合物中,作为构成M3的单体,除了由上述式I-(2)-1和式I-(2)-3表示的优选具体实例之外,其他优选实例可以举出例如:
CF2=CFCF2-O-Rf-Y1、CF2=CF-Rf-Y1、
CH2=CH-Rf-Y1、CH2=CHO-Rf-Y1
(Rf与式I-(2)中的Rf2相同)
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Y1、CF2=CFCF2OCF2CF2CF2CH2Y1、
CF2=CFCF2-Y1、CF2=CFCF2-CH2Y1、
CH2=CHCF2CF2CH2CH2-Y1、CH2=CHCF2CF2-Y1、
CH2=CHCF2CF2CH2Y1、CH2=CHCF2CF2CF2CF2-Y1、
CH2=CHCF2CF2CF2CF2CH2Y1、CH2=CHO-CH2CF2CF2-Y1、
CH2=CHOCH2CF2CF2CH2Y1
在式I-(2)的含氟聚合物中,作为构成M4的单体,除了由上述式I-(2)-1和式I-(2)-3表示的优选具体实例之外,其他优选实例可以举出例如:
CF2=CFCF2-O-Rf-Z1、CF2=CF-Rf-Z1、
CH2=CH-Rf-Z1、CH2=CHO-Rf-Z1
(Rf与式I-(2)中的Rf2相同)
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Z1、CF2=CFCF2OCF2CF2CF2CH2Z1、
CF2=CFCF2-Z1、CF2=CFCF2-CH2Z1、
CH2=CHCF2CF2CH2CH2-Z1、CH2=CHCF2CF2-Z1、
CH2=CHCF2CF2CH2Z1、CH2=CHCF2CF2CF2CF2-Z1、
CH2=CHCF2CF2CF2CF2CH2Z1、CH2=CHO-CH2CF2CF2-Z1、
CH2=CHOCH2CF2CF2CH2Z1
在本发明的式I-(2)、式I-(2)-1和式I-(2)-2聚合物中,M3、M4和M5间的比例可以根据用途、所需的功能和官能团Y1的种类在上述范围内作各种选择,但是为使例如与酸反应后含氟聚合物变成碱溶性的,结构单元M3应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M4、M5与A2的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
而且在式I-(2a)的聚合物中,优选结构单元为式I-(2a)-5表示的,其中M3/(M4+M5)比(摩尔%)为1~90/99~10,而且M3/M4/M5比(摩尔%)为1~90/0~98/1~99的聚合物:
(式中,X13、X14、X15、X18、Z2和n5与式(2a)相同)。
在式I-(2a)-5的聚合物中,优选的还可以举出结构单元M3a由式(2a)-6表示的聚合物:
(式中,R2b是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或者碳原子数3~20的含氟亚芳基;Y1与式I-(2a)-5中的相同),或者式I-(2a)-7表示的聚合物:
(式中,R2b和Y1与式I-(2a)-5中的相同)。
在本发明的式I-(2a)-5、式I-(2a)-6和式I-(2a)-7的聚合物中,作为构成M3的单体的优选具体实例,可以方便地举出与上述结构单元M1相当的含氟单体相同的那些,此外也可以是不含氟原子的单体。作为不含氟原子的单体的实例,可以举出:
CH2=CHO-R30-Y1、
CH2=CHCH2O-R32-Y1、CH2=CH-R33-Y1
(R30~R33是二价烃基,例如二价亚烷基、二价脂环式烃基、二价芳香族烃基以及含有氧、氮、硫等杂原子的烃基等)
更具体可以举出:
(X:H或CH3,n为1-10)
(n为1-10)
在本发明的式I-(2a)-5、式I-(2a)-6和式I-(2a)-7的聚合物中,作为构成M4的单体的优选具体实例,可以举出与上述式I-(2)-2和式I-(2)-4中例示的结构单元M4用单体相同的单体。
在本发明的式I-(2a)-5、式I-(2a)-6和式I-(2a)-7的聚合物中,作为构成M5的单体的优选具体实例,可以举出:
CF2=CF2、CF2=CH2、CF2=CFCl、CF2=CFCF3、
CF2=CFO(CF2)nF、CH2=C(CF3)2、
(n:1~5)
(Z2与式I-(2)相同,n:1-10)
本发明的式I-(2a)、式I-(2a)-5、式I-(2a)-6和式I-(2a)-7的聚合物中,M3a、M4a与M5a之比可以根据用途、所需的功能和官能团Y1的种类在上述范围内作各种选择,但是例如在与酸反应后,为了使含氟聚合物成为碱溶性的,结构单元M3a应存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M4a、M5a与A2的合量应存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
在本发明的式I-(2)、式I-(2)-1~式I-(2)-4、式I-(2a)、式I-(2a)-5~式I-(2a)-7的聚合物中,酸解离性或酸分解性官能团Y1,可以优选与上述式I-(1)的官能团Y1同样的。
在本发明的式I-(2)、式I-(2)-1~式I-(2)-4、式I-(2a)、式I-(2a)-5~式I-(2a)-7的聚合物中,所谓酸不分解的官能团Z1,是指在酸或阳离子作用下不分解或不解离的官能团。但是,产生自缩合和缩聚反应、交联剂存在、缩合和缩聚等也没关系。其中在不含交联剂等的体系中,优选那些仅靠官能团Z1与酸(或阳离子)接触,该官能团本身不发生变化的。
酸不分解的官能团Z1的优选实例,可以举出-CH2OH、-COOH、-SO3H、-CN等。
使含氟聚合物中共存酸解离性或酸分解性的官能团Y1和酸不分解的官能团Z1,通过调整各官能团的种类和存在比例,可以获得以下优选效果:例如能调整与酸反应前后含氟聚合物对碱或溶剂的溶解性能,能调整酸反应前后对碱和溶剂的溶解度差异,在酸反应前赋予含氟聚合物在基体材料上的附着性等功能。
按照这些官能团的功能,可以用于各种酸敏感性材料、感光性材料和光刻胶材料等之中。
结构单元A2是选择性成分,只要是能与结构单元M3、M4、M5共聚的单体就无特别限制,可以根据目的含氟聚合物的用途、要求的特性适当选择。
能形成结构单元A2的单体可以列举出由以下结构式表示的单体:
脂环式单体:
(m:0-3的整数)
(Y1是酸解离性、酸分解性官能团,Y1是酸反应性官能团,Z1是酸不分解的官能团)
含氟脂环式单体:
(式中,A、B、C和D是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,m为0~3的整数。但是A~D中有一个含有氟原子。)
具体可以举出:
(n:1~10、X:H、F、Cl)
此外,还可以举出:
具有官能团的含氟脂环式单体:
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基;R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基;a是0或1~3的整数;b是0或1;Y2是酸反应性官能团。但是当b为0或R不含氟原子的场合下,A~C中之一是氟原子或含氟烷基。)
这些单体中优选A、B和C都是氟原子的,或者在A~C均不含氟原子的场合下优选R的含氟量处于60重量%以上的,而且由于全氟亚烷基能赋予聚合物以透明性所以更优选。
可以具体举出的有:
(n:0-10,X:F或CF3)
或者由式(11)表示的新颖的含氟单体:
式(11)
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基;R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基;a是0或1~3的整数;b是0或1;Y2是酸反应性官能团。)
优选有以下各式等表示的降冰片烯骨架的单体,具体举出的有:
(n:0~10)
(n:0~10)
(n:0~10)
(X:F或CF3)
此外还可以举出:
(式中,n:0~10;X:F或CF3)
这些脂环式单体所含的酸反应性基团Y2,详细讲是酸解离性或酸分解性官能团和酸缩合性官能团。
①酸解离性或酸分解性官能团
酸解离性或酸分解性官能团,是在酸或阳离子作用下,具有转变成羟基、羧基、磺基等转变能力的官能团。
酸解离性或酸分解性官能团,可以具体举出关于上记式I-(1)中M所列举的Y1。
②酸缩合性官能团
酸缩合性官能团,具体指在酸或阳离子作用下产生自缩合、缩聚的官能团,或者在交联剂存在下,因酸的作用引起与交联剂的缩合反应或缩聚反应的官能团,或者因酸或阳离子引起的转位重排反应(例如片那醇重排、卡必醇重排)等而产生极性变化的官能团,优选实例例如有从羟基、羧基、氰基、磺基、环氧基等中选出的基团。
乙烯系单体:
乙烯、丙烯、丁烯、氯乙烯、偏氯乙烯等。
乙烯基醚系或乙烯基酯系单体:
CH2=CHOR、CH2=CHOCOR(R:碳原子数1~20的烃基)等。
烯丙基系单体:
CH2=CHCH2Cl、CH2=CHCH2OH、CH2=CHCH2COOH、CH2=CHCH2Br等烯丙基醚系单体:
CH2=CHCH2OR(R:1~20个碳原子的烃基)、
CH2=CHCH2OCH2CH2COOH、
本发明的式I-(2)、式I-(2)-1~式I-(2)-4、式I-(2a)、式I-(2a)-5~式I-(2a)-7聚合物的分子量,可以根据用途、目的和使用形态在1,000~1,000,000数均分子量范围内选择,但是优选3,000~700,000,更优选5,000~500,000左右。分子量过低,得到的聚合物覆膜的耐热性和机械特性容易变得不足,反之分子量过高,对加工特性不利。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以数均分子量优选300,000以下,特别优选200,000以下。
本发明的式I-(2)和式I-(2a)聚合物中具体结构单元M3、M4、M5和A2之间的组合,可以根据预期用途、物理特性(特别是玻璃化转变点和熔点等)和功能(透明性和折射率等)从上述列举的之中作出各种选择。
通常在M3侧能产生酸解离性和酸分解性的功能(即分解前后使功能和性状产生变化的功能),由M3分解后的官能团和M4的官能团将功能赋予分解后的聚合物,而M5以及必要时由A2来控制其他功能和性状。这些功能和性状的综合指标,可以通过选择M3、M4、M5和A2各自的种类和存在比例调整。
例如,欲满足光学用途(POF等)、半导体(光刻胶、层间绝缘膜等)用途要求而制成透明和低折射率的聚合物时,优选使含有M3、M4、M5和A2的聚合物全体的氟原子含量尽可能高,氟原子含量应当处于30重量%以上,优选50重量%以上,更优选60重量%以上,即使从这一点来看也优选式I-(2)-2、式I-(2)-4、式I-(2a)-6~式I-(2a)-7等聚合物。这样得到的含氟聚合物耐热性优良,非晶形下包括真空紫外区在内的宽广波长范围内透明性高,折射率低,所以能够用于塑料光纤等光学用途,
特别是式I-(2)-2和式I-(2a)的聚合物,一般说来发现了在真空紫外区具有高透明性。因此,可以用于光刻胶、表膜等半导体·液晶用途,以及防反射剂等光学材料用途等之中。
此外由于还发现具有良好的气体(特别是氧气)的选择透过性,所以也可以用于氧富化膜等之中。
本发明第4种的新颖的含氟聚合物,是由式I-(3)表示的脂环状含氟聚合物。
式I-(3)表示的含氟聚合物为:
-(M6)-(M7)-(A3)-
(式中,M6:
M7:
(式中,X19、X20、X23、X24、X25、X26相同或不同,是H或F;X21、X22相同或不同,是H、F、Cl或CF3;Rf4表示碳原子数1~10的含氟亚烷基或碳原子数2~10的具有醚键的含氟亚烷基;n12为0~3的整数;n11、n13、n14和n15相同或不同,为0或1的整数;X27、X28、X29、X30相同或不同,是H或F;Y1是酸解离性或酸分解性官能团;R3是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、或碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n16为0~2的整数,n17为0或1)
A3是来源于能与结构单元M6、M7共聚的单体的结构单元),
当M6+M7=100摩尔%时,M6/M7(摩尔%)为1~99/1~99,其中含有1~99摩尔%结构单元M6、1~99摩尔%结构单元M7和0~98摩尔%结构单元A3,其数均分子量为1,000~1,000,000。
本发明的式I-(3)的含氟聚合物,是由含氟的脂环族结构单元M6、来源于具有酸解离性或酸分解性官能团的乙烯类单体的结构单元M7、和能与这些结构单元M6、M7共聚的任意结构单元A3组成的。
在本发明的式I-(3)聚合物中,优选含有由式I-(3)-1表示的结构单元M6的聚合物。
式I-(3)-1:
(式中,Rf4是碳原子数1~10的含氟亚烷基)
构成此式I-(3)-1聚合物的结构单元M6用的单体,可以具体举出:
等,可以通过与构成结构单元M7的单体共聚得到。
另一方面,优选使用上述式I-(2)和式I-(2a)中作为结构单元M3用单体,形成本发明式I-(3)-1聚合物的结构单元M7。尤其是与式I-(2)-1和式I-(2)-2中所示的具有官能团Y1的含氟烯丙基醚类、CH2=CFCF2-O-R2-Y1(式中,R2、Y1与式I-(2)-1中的相同)、式I-(2)-3和式I-(2)-4所示的具有官能团Y1的含氟乙烯基醚类、CF2=CF-O-R2-Y1(式中,R2、Y1与式I-(2)-3中的相同)同样的单体,共聚性能良好,从能够使得到的聚合物具有官能团Y1的酸反应性功能以及透明性、低折射率、非粘结性、防污性等优良性能的观点来看而优选,与式I-(2)-1、式I-(2)-2、I-(2)-3和式I-(2)-4所示有关M3用单体实例同样的单体,也可以同样用作式I-(3)-1聚合物的M7用。
在本发明的式I-(3)的聚合物中,结构单元M6优选由式I-(3)-2或式I-(3)-3表示的结构单元。
式I-(3)-2:
式I-(3)-3:
构成这些式I-(3)-2、式I-(3)-3聚合物的单体成分,具体是用CF2=CFOCF2CF2CF=CF2的二烯化合物作共聚成分经环化聚合得到的。
本发明人等发现,即使在使上述二烯化合物与上述通式I-(3)-1中记载的具有酸解离性或酸分解性的官能团Y1的化合物的结构单元M7用单体共聚时,上述二烯化合物也能产生环化聚合,而且与具有酸解离性或酸分解性官能团Y1的单体(M7)的共聚性能良好。
也就是说,可以优选使用作为式I-(3)-1聚合物结构单元M7用单体所列示的单体。尤其是与式I-(2)-1和式I-(2)-2中所示的具有官能团Y1的含氟烯丙基醚类、CH2=CFCF2-O-R2-Y1(式中,R2、Y1与式I-(2)-1中的相同)、式I-(2)-3和式I-(2)-4所示的具有官能团Y1的含氟乙烯基醚类、CF2=CF-O-R2-Y1(式中,R2、Y1与式I-(2)-3中的相同)同样的单体,共聚性能良好,能使得到的聚合物具有官能团Y1的酸反应性功能以及透明性、低折射率、非粘结性、防污性等优良性能,因而优选。与式I-(2)-1、式I-(2)-2、I-(2)-3和式I-(2)-4所示有关M3用单体实例同样的单体,也可以同样用作式I-(3)-1的聚合物的M7用。
在本发明的式I-(3)的聚合物中,结构单元M6优选是式I-(3)-4、式I-(3)-5或式I-(3)-6表示结构单元的聚合物。
式I-(3)-4:
式I-(3)-5:
式I-(3)-6:
(式中,X19、X20、X23、X24表示H或F)。
本发明的式I-(3)-4、式I-(3)-5、式I-(3)-6聚合物的结构单元M6,可以具体使用CF2=CFOCF2CF=CX19X20(式中,X19、X20表示H或F)表示的二烯化合物,经环化聚合得到。更具体讲,是使用CF2=CFOCF2CF=CF2、CF2=CFOCF2CF=CH2等二烯化合物,环化聚合得到的。
本发明人等发现,即使在使上述二烯化合物与上述通式I-(3)-1中记载的具有酸解离性或酸分解性的官能团Y1的化合物的结构单元M7用单体共聚时,上述二烯化合物也能产生环化聚合,而且与具有酸解离性或酸分解性官能团Y1的单体(M7)的共聚性能良好。
也就是说,可以优选使用作为式I-(3)-1聚合物的结构单元M7用单体所列示的单体。尤其是与式I-(2)-1和式I-(2)-2中所示的具有官能团Y1的含氟烯丙基醚类、CH2=CFCF2-O-R2-Y1(式中,R2、Y1与式I-(2)-1中的相同)、式I-(2)-3和式I-(2)-4所示的具有官能团Y1的含氟乙烯基醚类、CF2=CF-O-R2-Y1(式中,R2、Y1与式I-(2)-3中的相同)同样的单体,共聚性能良好,能使得到的聚合物具有官能团Y1的酸反应性功能以及透明性、低折射率、非粘结性、防污性等优良性能,因而优选。与式I-(2)-1、式I-(2)-2、I-(2)-3和式I-(2)-4所示有关M3用单体实例同样的单体,也可以同样用作式I-(3)-1的聚合物的M7用。
在本发明的式I-(3)、式I-(3)-1~式I-(3)-6的聚合物中,酸解离性或酸分解性官能团Y1,优选使用与上述I-(1)、式I-(2)中记载的同样的基团,同样的基团可以作为优选实例。
作为选择成分的A3,只要是能与结构单元M6、M7共聚的就无特别限制,例如可以使用与上述有关式I-(2)式I-(2a)等说明的结构单元M4、M5,以及上述有关式I-(2)式I-(2a)等说明的结构单元A2同样的结构单元。
本发明的式I-(3)、式I-(3)-1~式I-(3)-6的聚合物的分子量,可以根据用途、目的、使用状态等在1,000~1,000,000数均分子量范围内选择,优选3,000~700,000,更优选5,000~500,000左右。分子量过低,得到的聚合物覆膜耐热性和机械特性容易变得不足,反之分子量过高对加工特性不利。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以优选300,000以下,特别优选200,000以下。
本发明的式I-(3)聚合物中具体结构单元M6、M7和A3的组合,可以根据上面列示的预期用途、物理性质(特别是玻璃化转变点、熔点等)、功能(透明性和折射率等)作各种选择。
通常由M7侧带来酸解离性或酸分解性的功能(即在分解前后功能和性状发生变化的功能),由M7分解后的官能团和M6官能团将功能赋予分解后的聚合物,而M6以及必要时的A3则将控制其他功能和性状。这些功能和性状的平衡,将通过选择M6、M7、A3各自的种类、存在比例等调整。
这些式I-(3)、式I-(3)-1~式I-(3)-6的环状含氟聚合物,结构体积大、自由体积大、含氟量也高,具有:
·玻璃化转变点高且机械物性良好
·耐热性好
·在宽广波长范围内透明性好
·折射率低
·疏水性、非粘接性和防污性优良等特征,因而优选。此外,官能团Y1赋予与酸反应功能及与酸反应后,含氟聚合物能够获得:
·与碱水溶液的亲和性、溶解性
·溶剂溶解性、亲水性
·与基材的附着性、粘接性
·交联性
等功能,因而优选。可以用作防反射剂和光纤等光学材料,光刻胶和表膜、层间绝缘膜材料等半导体相关材料,涂布材料,气体(特别是氧气)选择性透过材料,电子、电气部件(成形材料)、防湿处理材料等。
例如为光学用途(POF等)、半导体相关用途(光刻胶、层间绝缘膜等)而以透明性和低折射率聚合物为目的物的场合下,优选尽可能提高包括M6、M7、A3的聚合物整体中的含氟量,使氟原子含量大于30重量%,优选大于50重量%,更优选大于60重量%。这样得到的含氟聚合物耐热性优良,非晶形下在包括真空紫外区在内的宽广波长范围内透明性高,折射率低,所以能够用于塑料光纤等光学用途,以及光刻胶和层间绝缘膜等半导体相关用途之中。一般来说特别发现了本发明的式I-(3)聚合物,在真空紫外区的透明性强。因此,可以用于光刻胶、表膜等半导体、液晶用途,防反射剂等光学材料用途等之中。
本发明的式I-(3)、式I-(3)-1~式I-(3)-6聚合物中,M6、M7与A3之比可以根据用途、所需的功能和官能团Y1的种类等在上述范围内作各种选择,但是例如为了获得在与酸反应后碱溶性,结构单元M7应当存在5~99摩尔%,优选10~99摩尔%,更优选20~99摩尔%,结构单元M6与A3的合量应当存在1~95摩尔%,优选1~90摩尔%,更优选1~80摩尔%。
而且为使发挥上述环状结构的优良特性,结构单元M6应当存在30~99摩尔%,优选40~99摩尔%,更优选60~99摩尔%,结构单元M7与A3的合量应当存在1~70摩尔%,优选1~60摩尔%,更优选1~40摩尔%。
本发明的式I-(1)、式I-(2)和式I-(3)聚合物,特征在于均具有酸解离性或酸分解性的官能团Y1。在含氟聚合物中导入这些官能团的方法,虽然可以采用一切方法,但是一般可以采用:
①可以预先合成具有官能团Y1的单体后聚合的方法,
②一旦合成了具有其他官能团的聚合物,通过高分子反应使该聚合物的官能团改变,导入官能团Y1的方法。
例如作为方法②,可以采用:一旦制成具有羟基的含氟聚合物(例如由M4和M5组成的聚合物)后,在甲苯磺酸之类酸存在下,使乙基乙烯基醚、二氢吡喃等乙烯基醚类反应导入酸分解性官能团(酮缩醇类)的方法;使酮类与具有1,2-二醇的含氟聚合物反应,得到酸分解性官能团(环状缩醛化合物)的方法等。
在本发明的式I-(1)、式I-(2)、式I-(3)中分别记载的新颖的含氟聚合物,可以采用各种公知的方法,使分别相当于各结构单元的具有官能团Y1的乙烯类单体(M1、M3、M7)、乙烯类单体(M2、M4、M5)和形成环状结构的环状单体或二烯化合物(M6)聚合(共聚)得到。聚合方法可以采用游离基聚合法、阴离子聚合法、阳离子聚合法等,其中从使本发明聚合物用各种单体,具有良好的游离基聚合特性,进而容易控制组成和分子量等质量指标,以及容易工业化等角度出发,优选采用游离基聚合法。也就是说,为了引发聚合并以游离基方式进行,虽然并不限制手段,但是例如可以采用有机或无机游离基聚合引发剂、热、光或电离射线等来引发聚合。聚合的种类,可以采用溶液聚合、本体聚合、悬浮聚合、乳液聚合等。而且分子量可以通过聚合用的单体浓度、聚合引发剂浓度、链转移剂浓度和温度加以控制。生成的聚合物组成可以由加入的单体组成来控制。
本发明I的第2,涉及适合于化学增幅型光刻胶用的含氟基础聚合物。
本发明的光刻胶用含氟基础聚合物用材料,由具有酸反应性基团Y2的含氟聚合物组成。所谓酸反应性基团Y2,详细讲是指酸解离性或酸分解性官能团和酸缩合性官能团。
①酸解离性或酸分解性官能团
酸解离性或酸分解性官能团,是一些与酸反应前虽然不溶或难溶于碱,但是在酸作用下,能够使其在碱类显影液中溶解的官能团。
具体讲,是一些在酸或阳离子作用下,具有转变成羟基、羧基、磺基等能力,其结果使含氟聚合物本身在碱中溶解的官能团。
基于该性质,可以作为正像型光刻胶基础聚合物使用。酸解离性或酸分解性官能团,可以优选利用上记式I-(1)中关于M1所列举的Y1:
更优选的具体实例可以举出:
-OC(CH3)3、-OCH2COOC(CH3)3、
(式中,R30表示碳原子数1~10的烷基)
③酸缩合性官能团
酸缩合性官能团,是指与酸反应前溶于碱或溶剂中,但是在酸作用下能使聚合物本身不溶于碱系显影液(或与后述相同的溶剂)中的官能团。
具体讲,在酸或阳离子作用下引起自缩合或缩聚的官能团,或者在交联剂存在下,因酸的作用与交联剂引起缩合反应或缩聚反应的官能团,或者在酸或阳离子引起的转位重排反应(例如片那醇重排、卡必醇重排)等中能引起极性变化的官能团;无论哪种情况其结果均使聚合物本身变成不溶于碱(或溶剂)的。
借助于这些可以用作负像型光刻胶母料聚合物。
酸缩合性官能团的具体优选实例,是选自羟基、羧基、氰基、磺基、环氧基等中选出的基团。
在要使用的场合下对交联剂没有特别限制,可以从过去常用的负像型光刻胶的交联剂中任意选取。
优选的具体实例例如有N-羟甲基化三聚氰胺、N-烷氧基甲基化三聚氰胺、尿素化合物、环氧化合物、异氰酸酯化合物等。
本发明的光刻胶用含氟基础聚合物,优选具有上述酸反应性基团的乙烯类单体结构单元的。
作为具体实例可以是:
(I)由具有酸反应性基团Y2的含氟乙烯类单体衍生的、式(4):
(式中,X31、X32和X34相同或不同,表示H或F;X33表示H、CH3、Cl、F或CF3;Y2是酸反应性官能团;R4是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100并具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;p1为0~2;q1为0或1;r1为0或1;s1为0或1的整数;当s1为0或者当R4不含氟原子的场合下,X31、X32和X34中至少一个是氟原子或者X33是F或CF3)表示的结构单元的聚合物
组成的含氟基础聚合物用材料(I)。
本发明的含氟基础聚合物用材料(I),从能将含氟量设得很高的方面讲优选,此时真空紫外区内的透明性也好,所以优选用于光刻胶用途之中。
此外本发明的含氟基础聚合物用材料(I)中,q1为0时真空紫外区光线的透过性特别高,优选用在采用F2激光的图形化方法之中。
(II)含有由具有酸反应性基团Y2的乙烯类单体衍生的式(5):
(式中,X35、X36和X38相同或不同,表示H或F;X37表示H、CH3、Cl、F或CF3;Y2是酸反应性官能团;R5是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100并具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;p2为0~2;q2为0或1;r2为0或1的整数;s2为0或1的整数)表示的结构单元(a),和
式(6):
(式中,X39、X40和X42相同或不同,表示H或F;X41表示H、CH3、Cl、F或CF3;Z3是H、F或Cl;R6是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100并具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;p3为0~2;q3为0或1;r3为0或1的整数;s3为0或1的整数;当s3为0或者当R6不含氟原子的场合下,X39、X40、X42和Z3中至少一个是氟原子或者X41是F或CF3)表示的含氟乙烯类单体衍生的结构单元(b)的聚合物
组成的含氟基础聚合物用材料(II)。
式(5)的具有官能团Y2的结构单元(a),可以含或不含氟原子。
这种含氟基础聚合物用材料(II),由于通过选择式(6)的结构单元(b)可以获得能够控制含氟基础聚合物的物性(Tg和机械性质),控制含氟量,以及控制在显影液中的溶解性能和溶胀性而应当优选,从真空紫外区内的透明性强,分辨率高,灵敏度也高等观点来看,优选作为光刻胶使用,而且还能作到低成本化。
此外,本发明的含氟基础聚合物用材料(II)中,q2=0和/或q3=0的那些,对真空紫外区光线的透过性特别高,可以优选用在采用F2激光的图形化法中。
(III)含有式(5)所示具有酸反应性官能团Y2的乙烯类单体的结构单元(a)和式(7)所示具有含氟脂肪族环状结构单元(b)的含氟聚合物。
也可以是由
式(5):
(式中,X35、X36和X38相同或不同,表示H或F;X37表示H、CH3、Cl、F或CF3;Y2是酸反应性官能团;R5是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;p2为0~2;q2为0或1;r2为0或1的整数;s2为0或1的整数)表示的含氟乙烯类单体衍生的结构单元(a),和
式(7):
(式中,X43、X44、X47、X48、X49和X50相同或不同,表示H或F;X45、X46相同或不同,表示H、F、Cl或CF3;Rf5是碳原子数1~10的含氟亚烷基或碳原子数1~10具有醚键的含氟亚烷基;n19为0~3的整数;n18、n20、n21和n22相同或不同,为0或1的整数)表示的具有含氟脂肪族环状结构单元(b)的聚合物
组成的含氟基础聚合物用材料(III)。
在这种含氟基础聚合物用材料(III)中,具有式(5)的官能团Y2的结构单元,可以有或没有氟原子。
这种含氟基础聚合物用材料(III),因脂肪族环状结构单元而体积大,自由体积也大,能将Tg设得很高,机械性能良好,因而优选。而且即使含氟量相同,由于能够提高包括真空紫外区在内的透明性,因而优选。其结果,作为光刻胶使用的场合下,由于真空紫外区的透明性高,分辨率好,能够实现高灵敏度化,因而优选。
本发明的含氟基础聚合物用材料(III)中,q2=0的那些在真空紫外区的透明性特别高,可以优先用在采用F2激光的图形化法中。
在这些光刻胶用含氟基础聚合物用材料(II)和(III)中,其中具有酸反应性基团Y2的结构单元(a)优选含氟乙烯类单体的结构单元,具体优选由式(8):
(式中,X51、X52和X54相同或不同,表示H或F;X53表示H、CH3、Cl、F或CF3;Y2是酸反应性官能团;Rf6是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;p4为0~2;q4为0或1;r4为0或1的整数)表示的含氟乙烯类单体衍生的结构单元。
利用这些可以进一步提高含氟基础聚合物用材料的含氟量,能够将真空紫外区光线的透过性提高得更高,因而优选。
此外,其中q4=0的那些,在真空紫外区的透明性特别高,可以优先用在采用F2激光的图形化法中。
作为酸反应性基团,可以举出上述Y1或上述酸缩合性基团。
在本发明的光刻胶用含氟基础聚合物用材料(I)、(II)和(III)中,具有酸反应性基团Y2的式(4)、式(5)结构单元内含有氟原子的优选实例,可以列举如下。
①含氟丙烯酸系单体的结构单元
具体有:
(Y2,R1,n1与式(1)相同)
更具体有:
(X3:H、CH3,F、CF3)
②含氟烯丙基醚类单体的结构单元
可以列出的具体有:
CH2=CFCF2-O-R4-Y2(R4,Y2与式(4)相同)
CF2=CFCF2-O-R4-Y2(R4,Y2与式(4)相同)
更具体有:
(a5+b5+c5:0-30,d5:0-2,e5:0-5,X69:F或CF3,X70,X72:H或F,X71:H,F或CF3.但是,X71,X72为H的场合下,a5+b5+c5+d5+e5不为0)
(a6+b6+c6:0-30,d6:0-2,e6:0-5,X72,X74:F或CF3,X73:H或F)进一步有:
CF2=CFCF2OCF2CF2CF2Y2、
CF2=CFCF2OCF2CF2CF2-CH2Y2、
(n:1-30的整数)
③含氟乙烯基醚类单体的结构单元
可以列出的具体有:
CF2=CFO-R4-Y2(R4和Y2与式(4)相同)
(a6+b6+c6:0-30,d6:0-2,e6:0-5,X75,X77:F或CF3,X76:H或F)
更具体有:
CF2=CFOCF2CF2-Y2、CF2=CFOCF2CF2CH2Y2、
CF2=CFOCF2CF2OCF2Y2、CF2=CFOCF2CF2OCF2CH2Y2、
CF2=CFOCF2CF2CH2OCF2CF2-Y2、
CF2=CFOCF2CF2CH2OCF2CF2CH2Y2、
(n:0~10)
上记具体实例中,结构式(v)和(vi)是文献和专利所没有记载过的化合物,使用这些化合物的聚合物也同样是文献和专利所没有记载过的化合物。
④其他化合物,可以举出含氟乙烯基化合物:
CF2=CFCF2-Y2、CF2=CFCF2CH2Y2、
(n:1~10)
CH2=CFCF2-Y2、CH2=CFCF2CH2Y2、
(n:1~10)
CH2=CHCF2-Y2、CH2=CHCF2CH2Y2、
(n:1~10、n’:1~5)、
(X78,X79,X80与H或F)
等。
(式中,X78、X79和X80是H或F)
在本发明的光刻胶用含氟基础聚合物(II)、(III)中,形成具有酸反应性基团Y2的结构单元式(4)、(5)的单体,也可以不含氟原子,可以具体举出的有:
CH2=CHO-R-Y2、CH2=CH-R-Y2
CH2=CHCH2-O-R-Y2、
(式中R是碳原子数1~20的二价烃基)
更具体举出的有:
CH2=CHCH2OCH2CH2-Y2、CH2=CHCH2-Y2、
(n为1~10)
在本发明的光刻胶用含氟基础聚合物用材料中,欲得到具有酸反应性基团Y2的单体与其外的单体共聚形成的含氟基础聚合物用材料的场合下,作为共聚成分只要是能与上述具有酸反应性基团Y2的单体共聚的就无特别限制,但是优选与式(6)相当的乙烯类单体,以及能形成式(7)记载的环状结构单元的单体(环状单体或二烯单体等),具体讲,
①优选利用与上述式I-(1)、式I-(1)-1、式I-(1)-2所示的丙烯酸系含氟聚合物的结构单元M2相当的单体,而且同样可以优选利用与在上述的M2具体实例中所示的同样的含氟丙烯酸系单体。
②优选利用与上述式I-(2)、式I-(2a)、式I-(2)-1、式I-(2)-2、式I-(2)-3、式I-(2)-4、式I-(2a)-5、
式I-(2a)-6、式I-(2a)-7所示的结构单元M4、M5相当的单体,而且可以同样优选利用与上述在M4、M5具体实例中所示的同样乙烯类单体。
③优选利用与上述式I-(3)、式I-(3)-1~式I-(3)-6所示的结构单元M6相当的单体,特别优选能形成M6结构单元的环状单体和二烯类单体,与上述M6的具体实例中所示的同样单体同样能优选使用。
④在与式I-(1)中结构单元A1相当的单体的具体实例,
以及在与式I-(2)中结构单元A2相当的单体具体实例所示的同样单体,同样能优选利用。
在本发明的光刻胶用含氟基础聚合物用材料中,当含有具有酸反应性基团Y2的单体是含氟乙烯类单体的情况下,作为共聚成分可以在不使真空紫外区的透明性降低的范围内与不含氟的单体共聚。
可以具体举出的有:乙烯、丙烯、1-丁烯、异丁烯、乙烯基醚类、乙烯基酯类、丙烯酸酯类、甲基丙烯酸酯类、马来酸类、苯乙烯类、烯丙基醚类、氯乙烯、偏氯乙烯等。
此外,这些不含氟的单体可以作为含氟基础聚合物用具有酸反应性基团的聚合物第三成分使用,例如当然可以作为光刻胶用含氟基础聚合物用材料(II)、(III)第三成分的结构单元使用。
至此列出的含氟聚合物材料,通过酸反应性官能团Y2的效果而能有效地用作光刻胶用材料,此外由于对200nm以下真空紫外区光线的透明性良好(即无吸收),对今后进行微细加工和图形化法中可以使用的157nm波长的F2激光的透明性高,作为生产率高的图形化法用光刻胶材料,可以利用作为技术焦点的0.1微米,因而优选。为了用作F2光刻胶的基础聚合物,本发明的含氟基础聚合物用材料,在157nm波长下的分子消光系数优选处于3.0微米-1以下,更优选处于1.0微米-1以下。
换句话说,要求0.1微米光路长(膜厚)下157nm波长的透过率达到50%以上,优选70%以上,更优选80%以上,而采用本发明的含氟聚合物材料能够满足这些性能要求。
使用这些透过性材料,使F2激光下单层光刻胶法成为可能。
本发明I的第3涉及一种作为粘结剂含有具有酸反应官能团的含氟聚合物的化学增幅型光刻胶组合物。
化学增幅型光刻胶,含有树脂(聚合物)成分和光酸发生剂,在能量射线照射部分使酸发生剂发生酸,是利用其催化作用。而化学增幅型正像型光刻胶,虽然在能量射线照射部分发生酸,但是经其后的热处理(postexposure bake:PEB)而扩散,在使树脂等酸解离性或酸分解性官能团脱离的同时再次发生酸,从而能使该能量射线照射部分变成碱溶性。
对于化学增幅型正像型光刻胶而言,树脂成分是碱溶性的,除这样的树脂成分和酸发生剂之外,其中还含有酸作用下能解离或分解的官能团(保护基),其本身对碱溶性树脂具有抑制溶解的能力,而且还含有对于酸作用下上述官能团(保护基)解离后变成碱溶性的溶解抑制剂,树脂成分有酸作用下能够解离或分解的官能团,其本身虽然不溶或难溶于碱,但是在酸作用下上述官能团(保护基)解离后却变成碱溶性的。
化学增幅型负像型光刻胶,树脂成分一般有能被酸产生缩合反应的官能团,而且是碱溶性的,除这种树脂成分和酸发生剂之外,还含有交联剂。
在这样的负像型光刻胶中,在能量射线照射部分发生的酸因PEB而扩散,作用在树脂成分中的酸缩合性官能团和交联剂上,使该能量射线照射部分的粘结剂固化,从而实现碱不溶或难溶化。
本发明的化学增幅型光刻胶组合物,是能与上记的正像型和负像型对应的组合物,是由:
(A)具有酸反应性官能团的含氟聚合物、
(B)光酸发生剂,和
(C)溶剂组成的。
以下就本发明的化学增幅型光刻胶组合物用的、具有酸反应性官能团的含氟聚合物(A)进行说明。
具有酸反应性官能团的含氟聚合物(A)中的酸反应性官能团,与上记酸解离性或酸分解性官能团同样,是指能由酸引起缩合反应(缩合反应性)的官能团,作为含氟聚合物(A)优选利用以下三种。
①具有酸解离性或酸分解性官能团的含氟聚合物,可以用于上述的正像型光刻胶之中。酸解离性或酸分解性官能团,也叫作上述的保护基,反应前含氟聚合物(A)本身虽然不溶或难溶于碱,但是在能量射线作用下因光酸发生剂(B)发生的酸而解离或分解,具有使含氟聚合物(A)变成碱溶性的作用,进而从含氟聚合物(A)中官能团分解产生的离去基团中也发生酸,因而具有进一步促进分解反应的效果。
酸解离性或酸分解性官能团的具体实例,同样可以优选利用在上述光刻胶用含氟聚合物部分说明的那些。
②具有酸致缩合反应性官能团的含氟聚合物,可以用于负像型光刻胶之中。酸致缩合反应性的官能团,是在能量射线照射下,因光酸发生剂(B)发生的酸而能引起缩合·缩聚反应或转位重排反应的基团,由其产生自身交联反应、分子内转位重排反应、或含有交联剂的组合物与交联剂间的交联反应等,反应前含氟聚合物(A)本身虽然是溶于显影液(碱或溶剂)中的,但是却具有使之转变成不溶或难溶性的功能。酸致缩合反应性官能团的具体实例,最好从羟基、羧基、氰基、磺基和环氧基团等之中选出。
此外,本发明的缩合反应性的官能团,优选与酸反应前本身能赋予在碱和溶剂等显影液中溶解性功能的基团(例如羧基、磺基、羟基等),但是也可以是仅有因酸致缩合反应(交联反应)而在显影液中不溶化功能(氰基环氧基等)的官能团。这种场合下,可以与在显影液中具有可溶性功能的其他官能团组合使用,使含氟聚合物骨架本身形成能在显影液中可溶的结构,作为负像型光刻胶使用。
其中具有酸缩合性官能团的含氟聚合物,特别优选与酸反应前是碱溶性的聚合物,使得显影液不用溶剂(特别是可燃性溶剂)而用水性的显影过程(溶解过程)成为可能,有利于安全性和环境。
本发明的化学增幅型光刻胶组合物中具有酸反应性官能团的含氟聚合物(A),是具有上记的酸解离性或酸分解性或酸缩合性官能团的聚合物,可以从含有氟原子的,特别是从具有碳-氟键的聚合物中广泛选择。一般最好从:
(IV)具有酸反应性官能团的乙烯类含氟聚合物,和
(V)具有酸反应性官能团,主链具有环状结构的含氟聚合物中选择。
在(V)的主链具有环状结构的含氟聚合物中,从透明性考虑优选(V-1)具有酸反应性官能团而且主链具有含氟脂肪族环状结构的含氟聚合物。
另一方面,向含氟聚合物中导入酸反应性官能团时,优选以具有酸反应性官能团的乙烯类单体结构单元的形式导入。一般可以采用使具有酸反应性官能团的乙烯类单体聚合(均聚或共聚)的方法,或者通过使具有其他官能团的具有乙烯类单体结构单元的含氟聚合物等进行高分子反应等转变成酸反应性官能团的方法导入。
从透明性角度来看,其中优选具有酸反应性官能团的乙烯类单体的结构单元,是含氟乙烯类单体的结构单元的那些。
本发明的化学增幅型光刻胶组合物中的具有酸反应性官能团的含氟聚合物(A),可以分别优选使用与上述的新颖的含氟聚合物以及光刻胶用含氟聚合物材料同样的材料。具体讲,优选使用上述的(I)、(II)、(III)的含氟基础聚合物,而构成含氟聚合物(A)结构单元的单体也可以优选使用与为上述的含氟基础聚合物所列示的同样单体。
在本发明的化学增幅型光刻胶组合物中,作为含氟聚合物(A),也可以是具有酸反应性官能团Y2并具有下式(10)或(11)所示新颖的含氟脂环式单体重复单元的含氟聚合物,使用这些不仅可以得到能够与正像型或负像型光刻胶对应具有优良透明性的光刻胶组合物,而且还能得到耐腐蚀性也优良的光刻胶组合物,所以优选。
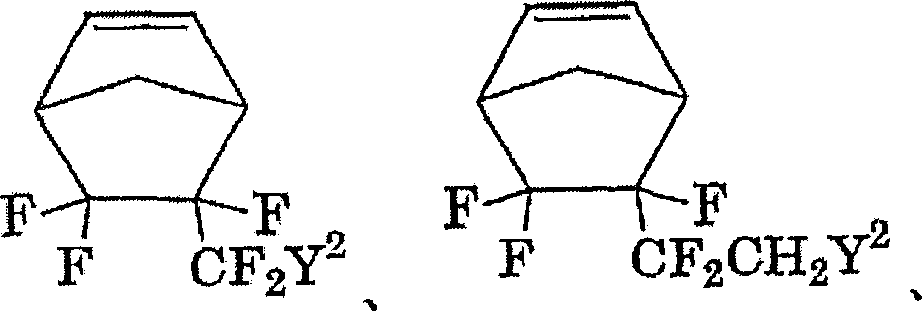
作为式(10)的新颖含氟脂环式单体,可以举出由式(10)表示的含氟单体:
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团,当b为0或R不含氟原子的场合下,A~C中一个为氟原子或含氟烷基)。
这些单体中优选A、B和C中一个为氟原子的,或者当A~C不含氟原子的场合下,R的含氟量在60%以上的,从能够赋予聚合物以透明性的角度来看,R更优选全氟亚烷基。
具体讲,可以举出:
(n:0~10)、
(X:H,F或Cl,n:1-10)
(n:0-10,X:F或CF3)
等。
或者作为式(11)的新颖含氟脂环式单体,可以举出由式(11)表示的含氟单体:
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团)。
具体讲,可以优选举出以下等具有降冰片烯骨架的单体:
(n:0~10)
(X:F或CF3)
具有带这些酸反应性基团的含氟脂环式单体重复单元的含氟聚合物,可以举出以下那些聚合物。
①由式(10)的含氟脂环式单体与乙烯类单体共聚而成的聚合物。
作为共聚成分的乙烯类单体,例如可以举出乙烯、丙烯、丁烯、氯乙烯等乙烯类单体;丙烯酸系单体;甲基丙烯酸系单体;烯丙基系单体;烯丙基醚系单体;苯乙烯系单体等。
②由式(10)的含氟脂环式单体与含氟乙烯类单体共聚而成的聚合物。
作为共聚成分的含氟乙烯类单体,例如可以优选举出四氟乙烯、一氯三氟乙烯、六氟丙烯、CF2=CFRf(Rf是碳原子数1~5的全氟烷基)、偏氟乙烯、氟乙烯、三氟乙烯等,从能够赋予透明性观点来看特别优选这些。
③式(10)和/或式(11)的含氟脂环式单体的开环聚合物和/或其开环聚合物加氢后的聚合物。
④式(10)和/或式(11)的含氟脂环式单体,与式(12)表示的脂环式单体的开环共聚物和/或其开环共聚的加氢的共聚物。
(式中,A、B、C和D是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,a是0或者1~3的整数)。
作为本发明的光刻胶组合物中使用的含氟聚合物(A),除上述含有含氟脂环式单体重复单元的含氟聚合物之外,也可以是由不含酸反应性官能团含氟脂环式单体与具有酸反应性官能团的单体,例如可共聚的含酸反应性基团的脂环式单体或具有酸反应性基团的乙烯类单体,形成的共聚物。
不含酸反应性基团的含氟脂环式单体,可以举出由式(9)表示的单体:
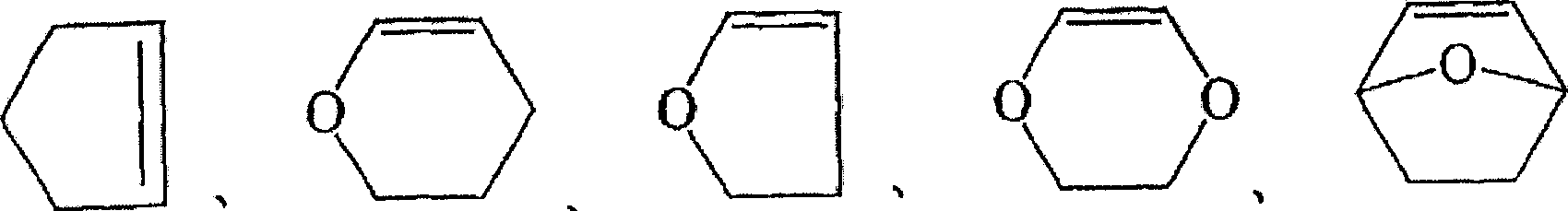
(式中,A、B、C和D是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,m是0~3的整数,A~D中一个含有氟原子),
具体讲可以举出:
(A、B、C、D是 (n:1~10;
碳原子数1~10的 X:H、F、Cl)
烷基或含氟烷基)
等。
具有酸反应性基团的脂环式单体,既可以是上述式(10)和式(11)的单体,也可以是不含氟原子的单体:
等。
这些脂环式单体的混合物开环聚合后的共聚物和/或其开环共聚物加氢后的共聚物等,优选列示出的含氟聚合物。
作为能共聚的具有酸反应性基团的乙烯类单体,优选举出具有酸反应性官能团Y2的丙烯酸系单体、甲基丙烯酸系单体和苯乙烯系单体等。
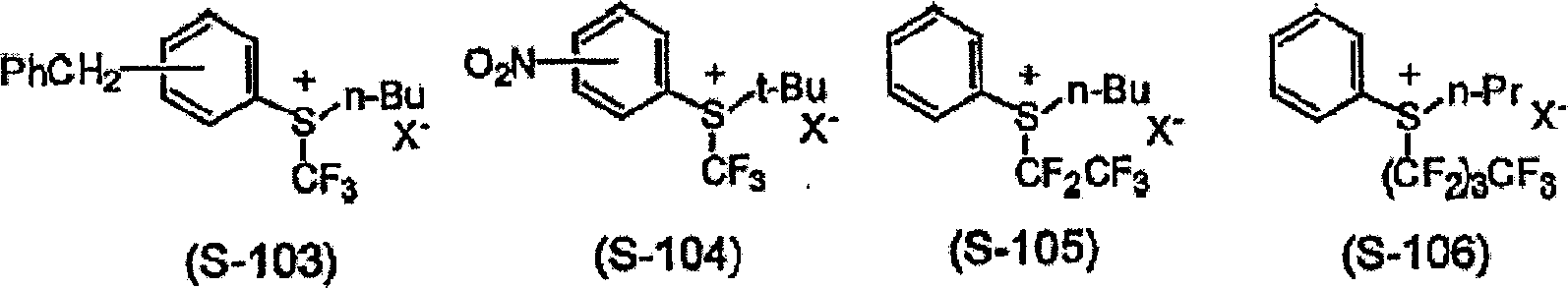
在本发明I的化学增幅型光刻胶组合物中,光酸发生剂(B)是通过对该物质本身或含有该物质的光刻胶组合物照射放射线,将会发生酸或阳离子的化合物。也可以使用两种以上的混合物。例如可以举出有机卤化物、磺酸酯、鎓盐、重氮盐、二砜化合物等公知化合物。具体可以举出例如三(三氯甲基)-s-三嗪、三(三溴甲基)-s-三嗪、三(二溴甲基)-s-三嗪、2,4-双(三溴甲基)-6-对甲氧基苯基-s-三嗪等含有卤代烷基的s-三嗪衍生物,1,2,3,4-四溴丁烷、1,1,2,2-四溴乙烷、四溴化碳、碘仿等卤代链烷烃类,六溴环己烷、六氯环己烷、六溴环十二碳烷等卤代环烷烃,双(三氯甲基)苯、双(三溴甲基)苯等含有卤代烷基的苯衍生物,三溴甲基苯基砜、三氯甲基苯基砜等含有卤代烷基的砜化合物,2,3-二溴环丁砜等含有卤素的环丁砜化合物,三(2,3-二溴代丙基)三聚异氰酸酯等含有卤代烷基的三聚异氰酸酯类,三苯锍氯化物、三苯锍甲磺酸盐、三苯锍三氟甲磺酸盐、三苯锍对甲苯磺酸盐、三苯锍四氟硼酸盐、三苯锍六氟砷酸盐、三苯锍六氟磷酸盐等锍盐,二苯基碘鎓三氟甲磺酸盐-二苯基碘鎓对甲苯磺酸盐、二苯基碘鎓四氟硼酸盐、二苯基碘鎓六氟砷酸盐、二苯基碘鎓六氟磷酸盐等碘鎓盐,对甲苯磺酸甲酯、对甲苯磺酸乙酯、对甲苯磺酸丁酯、对甲苯磺酸苯酯、1,2,3-三(对甲苯磺酰氧基)苯、对甲苯磺酸苯酰苯基甲醇酯、甲磺酸甲酯、甲磺酸乙酯、甲磺酸丁酯、1,2,3-三(甲磺酰氧基)苯、甲磺酸苯酯、甲磺酸苯酰苯基甲醇酯、三氟甲磺酸甲酯、三氟甲磺酸乙酯、三氟甲磺酸丁酯、1,2,3-三(三氟甲磺酰氧基)苯、三氟甲磺酸苯酯、三氟甲磺酸苯酰苯基甲醇酯等磺酸酯类,二苯基二砜等二砜类,双(苯基磺酰基)重氮甲烷、双(2,4-二甲基苯基磺酰基)重氮甲烷、双(环己基磺酰基)重氮甲烷、环己基磺酰基-(2-甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(3-甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(4-甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(2-氟代苯基磺酰基)重氮甲烷、环己基磺酰基-(3-氟代苯基磺酰基)重氮甲烷、环己基磺酰基-(4-氟代苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-氟代苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-氟代苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-氟代苯基磺酰基)重氮甲烷、环己基磺酰基-(2-氯代苯基磺酰基)重氮甲烷、环己基磺酰基-(3-氯代苯基磺酰基)重氮甲烷、环己基磺酰基-(4-氯代苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-氯代苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-氯代苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-氯代苯基磺酰基)重氮甲烷、环己基磺酰基-(2-三氟苯基磺酰基)重氮甲烷、环己基磺酰基-(3-三氟苯基磺酰基)重氮甲烷、环己基磺酰基-(4-三氟苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-三氟苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-三氟苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-三氟苯基磺酰基)重氮甲烷、环己基磺酰基-(2-三氟甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(3-三氟甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(4-三氟甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-三氟甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-三氟甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-三氟甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,4,6-三乙基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,3,4-三乙基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,4,6-三乙基苯基磺酰基)重氮甲烷、重氮甲烷、环戊基磺酰基-(2,3,4-三乙基苯基磺酰基)重氮甲烷、苯基磺酰基-(2-甲氧基苯基磺酰基)重氮甲烷、苯基磺酰基-(3-甲氧基苯基磺酰基)重氮甲烷、苯基磺酰基-(4-甲氧基苯基磺酰基)重氮甲烷、双(2-甲氧基苯基磺酰基)重氮甲烷、双(3-甲氧基苯基磺酰基)重氮甲烷、双(4-甲氧基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,3,4,-三甲基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,4,6-三乙基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,3,4,-三乙基苯基磺酰基)重氮甲烷、2,4-二甲基苯基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、2,4-二甲基苯基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、、苯基磺酰基-(2-氟代苯基磺酰基)重氮甲烷、苯基磺酰基-(3-氟代苯基磺酰基)重氮甲烷、苯基磺酰基-(4-氟代苯基磺酰基)重氮甲烷等磺酰重氮化合物类,对-甲苯磺酸邻硝基苄基酯等邻硝基苄基酯类,N,N’-二(苯磺酰基)酰肼等磺酰肼类等。
作为光酸发生剂,优选发生酸是磺酸、亚磺酸或次磺酸的化合物。可以具体举出的有:三苯基锍对甲苯磺酸盐、二苯基碘鎓对甲苯磺酸盐等鎓的磺酸盐,对甲苯磺酸苯酯、1,2,3-三(对甲苯磺酰氧基)苯等磺酸酯类,二苯基二砜等二砜类,双(苯基磺酰基)重氮甲烷、双(2,4-二甲基苯基磺酰基)重氮甲烷、双(环己基磺酰基)重氮甲烷、环己基磺酰基-(2-甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(3-甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(4-甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(2-氟代苯基磺酰基)重氮甲烷、环己基磺酰基-(3-氟代苯基磺酰基)重氮甲烷、环己基磺酰基-(4-氟代苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-氟代苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-氟代苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-氟代苯基磺酰基)重氮甲烷、环己基磺酰基-(2-氯代苯基磺酰基)重氮甲烷、环基磺酰基-(3-氯代苯基磺酰基)重氮甲烷、环己基磺酰基-(4-氯代苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-氯代苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-氯代苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-氯代苯基磺酰基)重氮甲烷、环己基磺酰基-(2-三氟甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(3-三氟甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(4-三氟甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-三氟甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-三氟甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-三氟甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(2-三氟甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(3-三氟甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(4-三氟甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2-三氟甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(3-三氟甲氧基苯基磺酰基)重氮甲烷、环戊基磺酰基-(4-三氟甲氧基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,4,6-三乙基苯基磺酰基)重氮甲烷、环己基磺酰基-(2,3,4-三乙基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,4,6-三乙基苯基磺酰基)重氮甲烷、环戊基磺酰基-(2,3,4-三乙基苯基磺酰基)重氮甲烷、苯基磺酰基-(2-甲氧基苯基磺酰基)重氮甲烷、苯基磺酰基-(3-甲氧基苯基磺酰基)重氮甲烷、苯基磺酰基-(4-甲氧基苯基磺酰基)重氮甲烷、双(2-甲氧基苯基磺酰基)重氮甲烷、双(3-甲氧基苯基磺酰基)重氮甲烷、双(4-甲氧基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,4,6-三乙基苯基磺酰基)重氮甲烷、苯基磺酰基-(2,3,4-三乙基苯基磺酰基)重氮甲烷、2,4-二甲基苯基磺酰基-(2,4,6-三甲基苯基磺酰基)重氮甲烷、2,4-二甲基苯基磺酰基-(2,3,4-三甲基苯基磺酰基)重氮甲烷、苯基磺酰基-(2-氟代苯基磺酰基)重氮甲烷、苯基磺酰基-(3-氟代苯基磺酰基)重氮甲烷、苯基磺酰基-(4-氟代苯基磺酰基)重氮甲烷等磺酰重氮化合物类,对-甲苯磺酸邻硝基苄基酯等邻硝基苄基酯类,特别优选磺酰叠氮化合物类。
除上面列示的以外,还可以利用含有氟原子的鎓盐型光酸发生剂,例如可以优选由下示表示的氟代烷基鎓盐:
(式中,A1是从碘、硫、硒、碲、氮或磷中选出的元素;
A1是碘的情况下,R2-1和R3-1不存在,R1-1是碳原子数1~15的烷基或碳原子数6~15的芳基;
A1是硫、硒或碲的场合下,R3-1不存在,R1-1和R2-1各自独立,是碳原子数1~15的烷基、碳原子数6~20的芳基、碳原子数2~30的二烷基氨基、碳原子数7~35的烷基芳基氨基或碳原子数12~40的二芳基氨基;R1-1和R2-1也可以互相结合成环;
A1是氮或磷的场合下,R1-1、R2-1和R3-1各自独立,,是碳原子数1~15的烷基、碳原子数6~20的芳基、碳原子数2~30的二烷基氨基、碳原子数7~35的烷基芳基氨基或碳原子数12~40的二芳基氨基;R1-1、R2-1和R3-1也可以互相结合形成一个以上的环;或者当R3-1不存在时,;R1-1和R2-1也可以互相结合形成含有A1的芳环;
上记的烷基、二烷基氨基的烷基和烷基芳基氨基的烷基,可以被芳基、卤原子、氧原子、氮原子、硫原子或硅原子取代,可以形成支链也可以形成环;上记芳基、烷基芳基氨基的芳基和二芳基氨基的芳基,也可以被烷基、卤代烷基、卤原子、烷氧基、芳氧基、硝基、酰胺基、氰基、烷酰基、芳酰基、烷氧羰基、芳氧羰基或酰氧基取代;
Rf是可以形成支链或环的碳原子数1~15的全氟烷基或者该全氟烷基中部分氟原子被氢取代的基团;
X-是布朗斯台德酸的共轭碱);
或者由下式表示的氟代烷基鎓盐等:
(式中,A2和A3相同或不同,均是从碘、硫、硒、碲、氮或磷中选出的元素;
A2或A3碘的情况下,R4-1、R5-1、R7-1和R8-1不存在;
A2或A3是硫、硒或碲的场合下,R5-1和R8-1不存在,R4-1和R7-1各自独立,是碳原子数1~15的烷基、碳原子数6~20的芳基、碳原子数2~30的二烷基氨基、碳原子数7~35的烷基芳基氨基或碳原子数12~40的二芳基氨基;
A2或A3是氮或磷的场合下,R4-1、R5-1、R7-1和R8-1各自独立,是碳原子数1~15的烷基、碳原子数6~20的芳基、碳原子数2~30的二烷基氨基、碳原子数7~35的烷基芳基氨基或碳原子数12~40的二芳基氨基;R4-1和R5-1,或者R7-1和R8-1也可以分别互相结合形成环;
上记的烷基、二烷基氨基的烷基和烷基芳基氨基的烷基,可以被芳基、卤原子、氧原子、氮原子、硫原子或硅原子取代,可以形成支链也可以形成环;上记芳基、烷基芳基氨基的芳基和二芳基氨基的芳基,也可以被烷基、卤代烷基、卤原子、烷氧基、芳氧基、硝基、酰胺基、氰基、烷酰基、芳酰基、烷氧羰基、芳氧羰基或酰氧基取代;
R6-1可以是被芳基、卤原子、氧原子、氮原子、硫原子或硅原子取代形成支链或环的碳原子数1~15的亚烷基;
Rf是可以形成支链或环的碳原子数1~15的全氟烷基或者该全氟烷基中部分氟原子被氢取代的基团;
X-是布朗斯台德酸的共轭碱)
等。
具体实例有:
中心元素为碘的氟代烷基鎓盐:
中心元素为硫的氟代烷基鎓盐:
中心元素为硒的氟代烷基鎓盐:
中心元素为碲的氟代烷基鎓盐:
中心元素为氮的氟代烷基鎓盐:
中心元素为磷的氟代烷基鎓盐:
例示的这些氟代烷基鎓盐中的X-,是布朗斯台德酸的共轭碱。作为布朗斯台德酸,除三氟甲磺酸、四氟乙磺酸、全氟丁磺酸、全氟戊磺酸、全氟己磺酸、全氟辛磺酸、二氟甲磺酸等氟代烷基磺酸之外,还可以举出甲磺酸、三氯甲磺酸、苯磺酸、甲苯磺酸、硫酸、氟代磺酸、氯代磺酸、HBF4、HSbF6、HPF6、HSbCl5F、HSbCl6、HAsF6、HBCl3F、HAlCl4等,但是并不限于这些。特别是强酸,从不发生氟化氢和氯化氢的观点来看,更优选氟代烷基磺酸。
这些具有含氟烷基的鎓盐因其自身在真空紫外区的透明性高而优选,而且与本发明的化学增幅型光刻胶组合物中具有酸反应性基团的含氟聚合物(A)的相容性良好而优选。
本发明I的化学增幅型光刻胶组合物中光酸发生剂的含量,相对于100重量份具有酸反应性基团的含氟聚合物(A)优选0.1~30重量份,更优选0.2~20重量份,最好0.5~10重量份。
光酸发生剂的含量一旦低于0.1重量份,灵敏度会降低,而使用的高于30重量份,则光酸发生剂吸收的光量增加,光线不能充分抵达基板,容易使分辨率降低。
在本发明I的光刻胶组合物中,可以添加对上述光酸发生剂产生的酸能起碱作用的有机碱。
之所以要添加有机碱,目的在于防止因曝光至PEB之间从光酸发生剂中产生的酸迁移而导致光刻胶图形尺寸上的波动。因此,虽然只要是能中和如上所述光酸发生剂产生酸的化合物就没有特殊限制,但是作为碱若使用无机化合物,就会在图形形成后除去光刻胶后产生微量残渣,具有不利影响,所以优选有机碱。所说的有机碱是一些从含氮化合物中选出的有机胺化合物,可以具体举出例如嘧啶、2-氨基嘧啶、4-氨基嘧啶、5-氨基嘧啶、2,4-二氨基嘧啶、2,5-二氨基嘧啶、4,5-二氨基嘧啶、4,6-二氨基嘧啶、2,4,5-三氨基嘧啶、2,4,6-三氨基嘧啶、4,5,6-三氨基嘧啶、2,4,5,6-四氨基嘧啶、2-羟基嘧啶、4-羟基嘧啶、5-羟基嘧啶、2,4-二羟基嘧啶、2,5-二羟基嘧啶、4,5-二羟基嘧啶、4,6-二羟基嘧啶、2,4,5-三羟基嘧啶、2,4,6-三羟基嘧啶、4,5,6-三羟基嘧啶、2,4,5,6-四羟基嘧啶、2-氨基-4-羟基嘧啶、2-氨基-5-羟基嘧啶、2-氨基-4,5-二羟基嘧啶、2-氨基-4,6-二羟基嘧啶、4-氨基-2,5-二羟基嘧啶、4-氨基-2,6-二羟基嘧啶、2-氨基-4-甲基嘧啶、2-氨基-5-甲基嘧啶、2-氨基-4,5-二甲基嘧啶、2-氨基-4,6-二甲基嘧啶、4-氨基-2,5-二甲基嘧啶、4-氨基-2,6-二甲基嘧啶、2-氨基-4-甲氧基嘧啶、2-氨基-5-甲氧基嘧啶、2-氨基-4,5-二甲氧基嘧啶、2-氨基-4,6-二甲氧基嘧啶、4-氨基-2,5-二甲氧基嘧啶、4-氨基-2,6-二甲氧基嘧啶、2-羟基-4-甲基嘧啶、2-羟基-5-甲基嘧啶、2-羟基-4,5-二甲基嘧啶、2-羟基-2,6-二甲基嘧啶、4-羟基-2,5-二甲基嘧啶、4-羟基-2,6-二甲基嘧啶、2-羟基-4-甲氧基嘧啶、2-羟基-5-甲氧基嘧啶、2-羟基-4,5-二甲氧基嘧啶、2-羟基-4,6-二甲氧基嘧啶、4-羟基-2,5-二甲氧基嘧啶、4-羟基-2,6-二甲氧基嘧啶等嘧啶化合物类;吡啶、4-二甲氨基吡啶、2,6-二甲基吡啶等吡啶化合物类;二乙醇胺、三乙醇胺、三异丙基胺、三(羟基甲基)氨基甲烷、双(2-羟基乙基)亚氨基三(羟基甲基)甲烷等碳原子数1以上4以下的羟基烷基取代的胺类;2-氨基苯酚、3-氨基苯酚、4-氨基苯酚等氨基酚类等。有机碱优选嘧啶类、吡啶类或羟基胺类,特别优选具有羟基的胺类。这些化合物可以单独使用或两种以上混合使用。本发明的光刻胶组合物中有机碱的含量,相对于光酸发生剂含量优选0.1~100摩尔%,更优选1~50摩尔%。低于0.1摩尔%的场合下,分辨率低,而高于100摩尔%时灵敏度有降低的趋势。
在本发明I的化学增幅型光刻胶组合物中,使用具有酸缩合性官能团的含氟聚合物(A)作为负像型光刻胶组合物的场合下,必要时也可以使用交联剂。
关于使用的交联并无特别限制,可以从过去作为负像型交联剂惯用的那些中任意选择使用。
例如,N-羟甲基化的蜜胺、N-烷氧基羟甲基化的蜜胺化合物、尿素化合物、环氧化合物、异氰酸酯化合物等是一些优选的具体实例。
这些物质可以单独使用或者两种以上组合物使用。其中组合使用该蜜胺树脂和尿素树脂是有利的。
本发明I的光刻胶(特别是负像型)组合物中所含交联剂的比例,相对于100重量份含有酸反应性基团的含氟聚合物(A)可以从3~70重量份,优选5~50重量份,更优选10~40重量份范围内选择。低于3重量份时,难于形成光刻胶图形,而超过70重量份的场合下光线透过性低,同时分辨率也容易降低,使显影特性劣化,不好。
本发明I的光刻胶组合物,必要时还可以含有溶解抑制剂、增感剂、染料、粘结性改进剂、保水剂等本领域惯用的各种添加剂。为了使化学增幅型光刻胶中发生酸,水存在虽然是必要的,但是利用存在少量聚丙二醇等保水剂的方法也能有效地发生酸。
使用这些添加剂的场合下,其量合计占组合物全部固形分重量的20重量%左右。
本发明I的化学增幅型光刻胶组合物中,溶剂(C)是能够溶解具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)和上述各种添加剂的物质,只要是能获得良好的涂装特性(表面平滑性、膜厚均一性等)者就无特别限制,可以使用。
优选的溶剂可以举出:例如甲基纤溶剂、乙基纤溶剂、甲基纤溶剂、乙基纤溶剂乙酸酯等纤溶剂类溶剂,乙二酸二乙酯、丙酮酸乙酯、2-羟基丁酸乙酯、乙酰乙酸乙酯、乙酸丁酯、乙酸戊酯、丁酸乙酯、丁酸丁酯、乳酸甲酯、乳酸乙酯、3-甲氧基丙酸甲酯、3-甲氧基丙酸乙酯、2-羟基异丁酸甲酯、2-羟基异丁酸乙酯等酯类溶剂,丙二醇单甲醚、丙二醇单乙醚、丙二醇单丁醚、丙二醇单甲醚乙酸酯、丙二醇单乙醚乙酸酯、丙二醇单丁醚乙酸酯、丙二醇二甲醚等丙二醇类溶剂,2-己酮、环己酮、甲基氨基甲酮、2-庚酮等酮类溶剂,甲苯、二甲苯、氯苯、氯甲苯等芳族烃类溶剂或其两种以上的混合溶剂等。
此外,为了提高含氟聚合物(A)的溶解性,必要时也可以使用含氟溶剂。
例如除CH3CCl2F(HCFC-141b)、CF3CF2CHCl2/CClF2CF2CHClF混合物(HCFC-225)、全氟己烷、全氟(2-丁基四氢呋喃)、甲氧基九氟丁烷、1,3-双三氟甲基苯等之外,还可以举出:
H(CF2CF2)n-CH2OH(n:1~3的整数)、F(CF2)n-CH2OH(n:1~5的整数)、(CH3)2-CHOH等含氟醇类;以及
三氟甲苯(benzo triflunide)、全氟代苯、全氟(三丁胺)、ClCF2CFClCF2CFCl2等。
这些含氟溶剂可以单独使用,或者将两种以上含氟溶剂或两种以上无氟溶剂和含氟溶剂以混合溶剂形式使用。
这些溶剂(C)量可以根据被溶剂固形成分的种类和涂布基材的目的膜厚等适当选择,但是从容易涂布的观点来看,其使用量应当使光刻胶组合物中总固形分浓度为0.5~70重量%,优选占1~50重量%,更优选为5~30重量%。
作为本发明I的化学增幅型光刻胶组合物的使用方法,可以采用过去光刻胶技术中的光刻胶图形形成方法,但是为了适当进行,首先用旋涂器等在硅晶片等支持体上涂布该光刻胶组合物溶液,干燥后形成感光层,利用缩小曝光装置等,通过所需的掩模图形在其上照射紫外线、超短波长紫外线、受激准分子激光或X-射线,或者用电子射线扫描,并加热。然后用显影液,例如1~10重量%的四甲基氢氧化铵水溶液之类碱性水溶液对其进行显影处理。这种形成方法能够得到与掩模图形一致的图像。
其中发现,采用本发明I的化学增幅型光刻胶组合物,能够形成即使在真空紫外区透明性也高的光刻胶覆膜(感光层)。由此可知,特别是今后可以很好地用于为0.1微米技术目标而使用F2激光(157nm)的光刻法之中。
本发明I的第4,涉及在基材上包覆具有酸反应性官能团的含氟聚合物而成的覆膜。
本发明I的覆膜,是由具有酸反应性官能团的含氟聚合物形成的,该含氟聚合物对真空紫外区内光线透明性高,是包覆了这种聚合物的覆膜。
可以用于本发明I的覆膜的具有酸反应性官能团的含氟聚合物,是在157nm处的分子消光系数处于3.0微米-1以下的,优选处于1.5微米-1以下,更优选处于1.0微米-1以下。
基材上包覆了这些在真空紫外区内光线透明性高的含氟聚合物覆膜,在采用F2激光的光刻法之中,当然可以用作光刻胶覆膜(感光层),但是除此之外,由于还能用于采用F2光刻法的表膜用途中,棱镜等周边光学部件或硅晶片的防反射膜以及棱镜或周边光学部件的非粘着性防污膜等用途之中,因而优选。
本发明I的覆膜用含氟聚合物中的酸反应性官能团,可以举出上述光刻胶用含氟基础聚合物中说明的那些,即显示酸解离性或酸分解性官能团、酸缩合性官能团,具体讲与上述含氟基础聚合物用材料同样的。酸解离性或酸分解性官能团,因与酸反应后官能团的效果而使与基材的附着性和粘着性提高,能够形成牢固附着的覆膜。另一方面,酸致缩合性官能团,在也可以不含交联剂等的体系中与酸产生缩合反应(交联反应),所以具有提高覆膜的机械特性、耐药品性、耐溶剂性等的效果,因而是优选的。
本发明I的覆膜用含氟聚合物的具体实例,最好从上述光刻胶用基础聚合物中说明的(I)、(II)和(III)结构的物质中,选择对真空紫外区光线透明性高的。
其中,优选(I)中示出的含氟聚合物的式(4)结构单元中q1=0的、(II)中示出的含氟聚合物的式(5)、(6)的结构单元中q2=0、q3=0的和(III)中示出的含氟聚合物的式(5)结构单元中q2=0的聚合物,更优选聚合物中含氟量在30%的,尤其是50%以上的,最好是60%以上的含氟聚合物。
本发明I的覆膜可以按照目的、目标和用途施于各种基材上。在特别要求透明性的用途和光学用途中,也可以施于硅晶片、玻璃、LiF、CaF2、MgF2等无机基材上,以及丙烯酸树脂、三乙酰纤维素树脂、聚碳酸酯树脂等透明性树脂和其他金属类材料等之上。
膜厚虽然可以根据目的和用途作广泛选择,但是在以透明性为目标用途使用的场合下,膜厚优选1.0微米以下,更优选0.5微米以下,最好处于0.3微米以下。
以光刻胶的光刻胶覆膜使用本发明I覆膜的场合下,优选涂布上述化学增幅型光刻胶组合物后成膜的覆膜。
本发明I的光刻胶覆膜,采用旋涂法等涂装方法将上述化学增幅型光刻胶组合物涂布在硅晶片等支持体上,经干燥成形,覆膜中含有具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)和其他添加物等固形分成分。
本发明I光刻胶覆膜的膜厚,通常是1.0微米以下薄层覆膜,优选0.5~0.1微米的薄膜。
本发明I的光刻胶覆膜,优选真空紫外区的透明性高的,具体讲是157nm波长的分子消光系数处于3.0微米-1以下的,优选处于1.5微米-1以下,更优选处于1.0微米-1以下的。从能够在采用F2激光(157nm)的光线的光刻法中有效利用的观点来看优选。
其中,施有本发明的光刻胶覆膜的基材,可以同样利用过去适用光刻胶的各种材料。例如,硅晶片、设有有机或无机防放射膜的硅晶片、玻璃基板等都可以使用。特别是设有有机防放射膜的硅晶片上的灵敏度和剖面性状均良好。
本发明I得到合成例1~10以及实施例1~117和对照例1、2的总体支持。
发明II的公开(发明II)涉及含有具有酸反应性官能团、作为粘结剂的特定含氟聚合物的化学增幅型光刻胶组合物。
化学增幅型光刻胶组合物,是含有树脂(聚合物)成分和光酸发生剂,在能量射线照射部分从酸发生剂中发生酸,利用其催化作用的组合物。化学增幅型中的正像型光刻胶,由能量射线照射部分发生的酸,通过其后的热处理(postexposure bake:PEB)而扩散,使树脂等酸解离性或酸分解性官能团脱离,同时再次发生酸,通过这种作用使其能量射线照射部分碱可溶性化。
对于化学增幅型正像型光刻胶而言,树脂成分是碱溶性的,除这样的树脂成分和酸发生剂之外,还含有能够在酸作用下解离或分解的官能团(保护基),其本身对碱溶性树脂具有抑制溶解的作用,在酸作用下上述官能团(保护基)解离后,存在变成碱溶性的溶解抑制剂的物质,而且树脂成分具有在酸作用下能解离或分解的官能团(保护基),其本身虽然是不溶或难溶于碱的,但是在酸作用下上述官能团(保护基)解离后,也存在变成碱溶性的物质。
而且化学增幅型负像型光刻胶中,树脂成分一般含有酸致缩合反应的官能团,而且是碱溶性的,除这种树脂成分和酸发生剂之外,还含有交联剂。
在这样的负像型光刻胶中,能量射线照射部分发生的酸因PEB而扩散,作用在树脂成分中的酸缩合性官能团和交联剂上,使该能量射线照射部分的粘结剂树脂固化,变成不溶或难溶于碱中的。
第II发明(发明II)的化学增幅型光刻胶组合物能够与上记的正像型和负像型对应,是由:
(A)具有酸反应性官能团的含氟聚合物、
(B)光酸发生剂和
(C)溶剂
组成的组合物。
本发明人等发现,不含稠环结构但含有特定的酸反应性官能团的含氟聚合物(A),对真空紫外区内光线的透明性特别高,具有优良的耐腐蚀性、与酸的反应性、显影液溶解性等优良的光刻胶特性。
可以在第II发明的化学增幅型光刻胶组合物中使用的、具有酸反应性基团的第一种含氟聚合物(A),是由式II-(1)表示的聚合物:
式II-(1):
-(M1)-(M2)-(N)- II-(1)
①结构单元M1是源于带酸反应性基团的乙烯类单体的结构单元,
②结构单元M2是源于含氟乙烯类单体的结构单元,
③结构单元N是源于能与M1、M2共聚的乙烯类单体的结构单元
当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,其中含有1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N,是侧链不含稠环结构部位的含氟聚合物。由于存在源于构成结构单元M2的含氟乙烯类单体的结构单元而能赋予透明性和耐干蚀性,因而优选。
另一方面,具有酸反应性基团的含氟聚合物,优选是由式II-(1)表示的聚合物:
式II-(1):
-(M1)-(M2)-(N)- II-(1)
①结构单元M1是源于带酸反应性基团的含氟乙烯类单体的结构单元,
②结构单元M2是源于含氟乙烯类单体的结构单元,
③结构单元N是源于能与M1、M2共聚的乙烯类单体的结构单元
当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~100/0~99,其中含有1~100摩尔%M1、0~99摩尔%M2和0~99摩尔%结构单元N,是侧链不含稠环结构部位的含氟聚合物。即结构单元M1中在含有酸反应性基团的同时还含有氟原子,或者还含有含氟烷基,能够赋予光刻胶覆膜更优良的透明性和耐干蚀性,因而优选。
优选的第2种具有酸反应性基团的含氟聚合物(A),是含氟丙烯酸系聚合物,具体讲是由式II-(2)表示的聚合物:
式II-(2):
-(M1-1)-(M2-1)-(N)- II-(2)
结构单元M1是下记的M1-1,
M1-1:
结构单元M2是下记的,
M2-1:
(式中,式中,X1、X2、X4、X5相同或不同,是H或F;X3、X6相同或不同,是H、Cl、CH3、F或CF3;Y2是酸反应性基团;R1表示碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;Rf1表示碳原子数1~20的含氟烷基、碳原子数2~100的具有醚键的含氟烷基或碳原子数3~20的含氟芳基;n1为0或1)
当单元M1-1+单元M2-1=100摩尔%时,是单元M1-1/单元M2-1=1~99/1~99摩尔%的含氟聚合物。
当M1-1中含有氟原子的场合下,从M1-1结构体中选出一种以上的聚合物也可,单元M1-1+M2-1=100摩尔%时单元M1-1/单元M2-1比(摩尔%)=1~100/0~99,则优选其中结构单元M1-1含有氟原子的或含有含氟烷基的,其中特别优选式M1-1a表示的:
M1-1a:
(式中,X1和X2相同或不同,是H或F;R1表示碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n1为0或1)
从聚合性优良,与已有的丙烯酸系聚合物相比特别能够改善透明性和耐干蚀性的观点来看,而且即使从耐热性和机械特性来看均优选。
更优选的具体实例可以举出:
M1-1b:
(式中,Y2是酸反应性官能团;R1表示碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n1为0或1)
在M1-1、M1-1a和M1-1b中,可以含有或不含-OR1-,含有的场合下,R1可以从上述二价烃基和含氟亚烷基中选择,但是优选除稠环结构之外的二价烃基,具体可以举出:
-(CH2)n- (n=1-10的整数)
等。
结构单元M2-1中的-Rf可以从上记的含氟亚烷基中选择,具体可以举出:-(CH2)m(CF2)n-F、(CH2)m(CF2)n-H、-(CH2)m(CF2)n-Cl(其中m为1~5的整数,n为1~10的整数)、
-CH2CF2CFHCF3、
(m=1~5、n=1~30) (n=1~30)
(n=1~30)
(m+n=2~30)
等。
本发明的含氟聚合物(A)可以通过使与各自结构单元M1-1和M2-1相当的乙烯类单体,与必要时与N相当的单体,例如M1、M2和N,或者M1-1(或M1-1a、M1-1b)、M2-1和N(均指相当的单体)共聚得到。
作为具有酸反应性基团Y2的结构单元M1、M1-1、M1-1a、M1-1b(以下若无特别说明均以M1代表)用单体的具体实例,可以举出:
(X3:H、F、CH3、CF3) (ii)
等。
上述具体实例中的(i)和(ii)是文献和专利中所没有记载的化合物,使用这些化合物的聚合物同样也是文献和专利中所没有记载的化合物。
作为构成聚合物另一方的结构单元M2-1(以下若无特别说明,则以M2表示)用单体的具体实例,可以举出:
(Z4:H、F、Cl、n:1~10)
(Z5:H、F、Cl、n:1~10)
(n:1~5)
(n:1~30)
(m:1或2,Z4:H,F,Cl,n:1-10)
m:1或2,Z4:H,F,Cl,n:1~10
(Z4、Z5:H、F、Cl、n:1~10)等。
源于能与M1、M2共聚的结构单元N是选择性成分,没有特别限制,可以根据目的含氟聚合物的用途和性能要求等适当选择。能形成结构单元N的单体,例如可以举出以下化合物。
丙烯酸系单体(能形成M1、M2的单体除外):
CH2=CXCOO-
(X选自H、CH3、F、CF3)
苯乙烯系单体:
(n为0~2的整数)
乙烯类单体:
CH2=CH、CH2=CHCH3、CH2=CHCl等。
马来酸系单体:
(R为1~20个碳原子的烃基)
烯丙基系单体:
CH2=CHCH2Cl、CH2=CHCH2OH、CH2=CHCH2COOH、CH2=CHCH2Br等。
烯丙基醚系单体:
(R:碳原子数1-20的烃基) (n:1-10,X:H,Cl,F)
CH2=CHCH2OCH2CH2COOH、
在具有M1-1、M2-1结构单元的聚合物中,M1-1(或者M1-1a、M1-1b)与M2-1之比可以根据用途、目的功能和官能团Y2的种类作各种选择,例如使之与酸反应后变成碱溶性的,结构单元M1-1(M1-1a、M1-1b)应存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2-1与N合计存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%的聚合物。
上记含氟聚合物(A)的分子量,可以根据用途、目的和使用形态在1,000~1,000,000数均分子量范围内选择,优选在3,000~700,000,更优选在5,000~500,000范围内选择。分子量过低容易使得到聚合物覆膜的耐热性和机械特性不充分,反之若分子量过高,则不利于加工特性。特别是以涂料用材料形态目的在于形成薄层覆膜的场合下,分子量过高不利于成膜性,所以优选300,000以下,特别优选200,000以下。
具有M1-1、M2-1结构单元的含氟聚合物中,M1-1和M2-1的具体组合可以根据目的用途、物理性能(特别是玻璃化转变点和熔点等)、功能(透明性、折射率等)从上面例示的单体中适当选择,通常M1-1侧能赋予官能团Y2的功能,而上述其他功能则可以通过选择M2-1的种类(特别是Rf基团)、存在比例、N的种类和存在比例等加以调整。例如,目的在于提高耐热性和机械特性,以高Tg或高熔点的聚合物为目的物的场合下,M2-1用单体优选从侧链体积大的单体中选择,最好例如从:
等之中选择。
光刻胶,特别是以F2光刻胶用途作为目标,目的在于使用在真空紫外区的透明性高的聚合物的场合下,优选包括M1-1、M2-1和N的聚合物整体的含氟量尽可能高的聚合物。含氟量应当在30重量%以上,优选50重量%以上,更优选60重量%以上的。从这一点出发优选M1-1和M2-1中的X3、X6为氟原子或CF3的,更优选含氟量比M2-1高的,例如在M2-1单体中优选:
(n:1~30)
(n:1~30)
(m:1或2,n:3-10)
等。
这样得到的含氟聚合物为非晶性,在包括真空紫外区在内的广泛波长范围内透明性高,可以用于光刻胶,特别是F2光刻胶用基础聚合物之中。
优选的第3和第4种具有酸反应性基团的含氟聚合物(A),是含氟烯丙基系或含氟乙烯系聚合物。
该第3种是式II-(3)的含氟聚合物:
-(M1-2)-(M2-2)-(M2-3)-(N)- II-(3)
(式中,M1-2:
M2-2:
M2-3:
(式中,X7、X8、X9、X10、X11、X12、X13、X14、X16、X17和X18相同或不同,表示H或F;X15表示H、F或CF3;Y2是酸反应性官能团;Z1是酸不引起解离或分解反应的官能团;Z2是H、F或Cl;R2、Rf2、Rf3相同或不同,是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n3、n4和n5相同或不同,为0~2的整数;n6、n7、n8和n10相同或不同,为0或1的整数;n9为1)N是源于能与结构单元M1-2、M2-2和M2-3共聚单体的结构单元),当M1-2+M2-2+M2-3=100摩尔%时,单元M1-2/单元M2-2/单元M2-3(摩尔%)为1~100/0~99/0~99摩尔%,其中含有1~100摩尔%M1-2、0~99摩尔%M2-2和0~99摩尔%M2-3以及0~99摩尔%结构单元N,其数均分子量为1,000~1,000,000。
该第4种是式II-(4)的含氟聚合物:
-(M1-3)-(M2-2)-(M2-3)-(N)- II-(4)
(式中,M1-3:
M2-2:
M2-3:
(式中,R2a是碳原子数1~20二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n9为0或1;X7、X8、X9、X10、X11、X12、X13、X14、X15、X16、X17、X18、Y2、Z1、Z2、Rf2、Rf3、n3、n4、n5、n6、n7、n8和n10与上述式(3)中相同;但是X13、X14、Z2中至少一个是氟原子,或者X15是F或CF3)N是源于能与结构单元M1-3、M2-2和M2-3共聚单体的结构单元),当M1-3+M2-2+M2-3=100摩尔%时,单元M1-2/(单元M2-2+单元M2-3)(摩尔%)为1~90/10~99摩尔%,其中含有1~90摩尔%M1-2、0~99摩尔%M2-2和0~99摩尔%M2-3以及0~99摩尔%结构单元N,其数均分子量为1,000~1,000,000。
以下若无特别说明,则结构单元M1-2和M1-3均用M1-2表示。
结构单元M1-2是含有酸解离性或酸分解性官能团的单体的结构单元,以必要成分形式存在,能够赋予含氟聚合物以新的功能。
结构单元M2-2与酸不产生解离或分解反应,但是由于具有能够赋予或者调整含氟聚合物的溶解性和交联性、与基材附着性的官能团,所以作为含氟聚合物的结构单元是优选的。
结构单元M2-3是不含官能团的含氟聚合物的结构单元,但是从能根据要求调节聚合物的机械特性和耐热性(玻璃化转变点或熔点)来看优选。此外,能用M2-2与M2-3调节聚合物全体的含氟量,赋予聚合物以透明性,使之变成低折射率化的,从这些方面来看是优选成分。
结构单元N与上记式II-(1)中所述的同样是选择性成分,是必要时赋予所需性能用的共聚成分。
本发明的式II-(3)和II-(4)的含氟聚合物,在M1-2中含有氟原子的场合下,也可以仅从M1-2的结构单元中选出一种或两种以上结构单元,而不含M2-2、M2-3和N。
也就是说,在式II-(3)中M1-2的结构单元具有氟原子的场合下,也可以仅从M1-2结构单元组中选出的结构单元构成聚合物。
另一方面,当式II-(4)中的M1-3包含具有酸解离性基团Y1而不含氟原子结构单元的场合下,式II-(4)是以M2-2和M2-3中一种结构单元为必要成分形成的聚合物。
在式II-(3)的聚合物中,优选具有以下结构单元的式II-(3a)聚合物:
-(M1-2a)-(M2-2a)-(M2-3)-(N)- II-(3a)
结构单元M1-2a优选由下式表示的结构单元:
(式中,Y2、R2与式II-(3)相同)。
结构单元M2-2a优选由下式表示的结构单元:
(式中,Rf2、Z1与式II-(2)中的相同),可以优选举出单元M1-2/单元M2-2/单元M2-3(摩尔%)为1~99/1~99/1~98摩尔%的聚合物。
在本发明的II-(3)、II-(3a)聚合物中,作为构成M1-2和M2-2a单体的优选实例有:
(a1+b1+c1:0~30;d1:0或1;e1:0~5;X55:H或F;X58:H或FX57:H、F或CF3。当X58为H的场合下,a1+b1+c1+d1不为0。)
更具体有:
(n:1-30的整数)
(n:1-30的整数)
此外,在本发明的II-(3a)聚合物中,作为构成M2-2、M2-2a的单体的优选实例有:
(a2+b2+c2:0~30;d2:0或1;e2:0~5;X59:F或CF3;X60、X62:H或F;X61:H、F或CF3。当X61、X62为H的场合下,a2+b2+c2+d2+e2不为0。)
更具体可以举出:
CH3=CFCF2O-CH2CF2-Z1
CH2=CFCF2OCF2CF2O-CF2-Z1、
作为式II-(3)中的另一优选聚合物,由式II-(3b)表示:
(M1-2b)-(M2-2b)-(M2-3)-(N)- II-(3b)
M1-2b是下式表示的结构单元:
(式中,Y2、R2与式(3)相同)
M2-2b是下式表示的结构单元:
(式中,Rf2、Z1与式II-(2)相同)。
式II-(3b)聚合物中,可以优选举出单元M1-2/单元M2-2/单元M2-3(摩尔%)比为1~99/1~99/0~98摩尔%的聚合物。
在本发明II的式II-(3b)聚合物中,作为构成M1-2的单体的优选具体实例有:
(a3+b3+c3:0~30;d3:0~2;e3:0~5;X63、X65:F或CF3;X64:H或F。)
更具体可以举出:
CF2=CFOCF2CF2-Y2、CF2=CFOCF2CF2CH2Y2、
CF2=CFOCF2CF2OCF2Y2、CF2=CFOCF2CF2OCF2CH2Y2、
CF2=CFOCF2CF2CH2OCF2CF2-Y2、
CF2=CFOCF2CF2CH2OCF2CF2CH2Y2
等。
这些具体实例中,结构式(v)和(vi)是文献和专利所没有记载过的化合物,使用这些化合物的聚合物也同样是文献和专利所没有记载过的化合物。
在本发明II的式II-(3b)聚合物中,作为构成M2-2的单体的优选具体实例有:
(a4+b4+c4:0~30;d4:0~2;e4:0~5;X66、X68:F或CF3;X67:H或F。)
更具体可以举出:
CF2=CFOCF2CF2-Z1、CF2=CFOCF2CF2CH2-Z1、
CF2=CFOCF2CF2OCF2-Z1、CF2=CFOCF2CF2OC2CH2Z1、
CF2=CFOCF2CF2CH2OCF2CF2-Z1、
CF2=CFOCF2CF2CH2OCF2CF2CH2Z1
等。
在式的II-(2)的含氟聚合物中,构成M1-2的单体除上述的M1-2a、M1-2b所示的优选实例之外,其他优选的单体例如可以举出:
CF2=CFCF2-O-Rf-Y2、CF2=CF-Rf-Y2、CH2=CH-Rf-Y2、CH2=CHO-Rf-Y2等。(Rf与式(2)的Rf2相同)
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Y2、CF2=CFCF2OCF2CF2CF2CH2Y2、
CF2=CFCF2-Y2、CF2=CFCF2-CH2Y2、
CH2=CHCF2CF2CH2CH2-Y2、CH3=CHCF2CF2-Y2、
CH2=CHCF2CF2CH2Y2、CH2=CHCF2CF2CF2CF2-Y2、
CH2=CHCF2CF2CF2CF2CH2Y2、CH2=CH2O-CH2CF2CF2-Y2、
CH2=CH2OCH2CF2CF2CH2Y2
等:
在式的II-(3)的含氟聚合物中,构成M2-2的单体除上述的M2-2a、M2-2b所示的优选实例之外,其他优选的单体例如可以举出:
CF2=CFCF2-O-Rf-Z1、CF2=CF-Rf-Z1、CH2=CH-Rf-Z1、CH2=CHO-Rf-Z1等。(Rf与式II-(2)的Rf2相同)
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Z1、CF2=CFCF2OCF2CF2CF2CH2Z1、
CF2=CFCF2-Z1、CF2=CFCF2-CH2Z1、
CH2=CHCF2CF2CH2CH2-Z1、CH2=CHCF2CF2-Z1、
CH2=CHCF2CF2CH2Z1、CH2=CHCF2CF2CF2CF2-Z1、
CH2=CHCF2CF2CF2CF2CH2Z1、CH2=CH2O-CH2CF2CF2-Z1、
CH2=CH2OCH2CF2CF2CH2Z1
等。
本发明的式II-(3)、式II-(3a)和式II-(3b)聚合物中,M1-2(M1-2a、M1-2b)、M2-2(M2-2a、M2-2b)和M2-3间的比例可以根据用途、所需的功能和官能团Y2的种类在上述范围内作各种选择,但是例如与酸反应后为了使含氟聚合物变成碱溶性的,结构单元M3应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2-2、M1-3与N的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
而且在式II-(4)的聚合物中,优选式II-(4a)表示的,
-(M1-3)-(M2-2)-(M2-3a)- II-(4a)
其中,M1-3a:
(式中,X13、X14、X15、X18、Z2和n5与式(2a)相同)
而且其中M1-3/(单元M2-2+单元M2-3a)之比(摩尔%)为1~99/99~10,而且单元M1-3/单元M2-2/单元M2-3a之比(摩尔%)为1~90/0~98/1~99摩尔%的聚合物。
在式II-(4a)的聚合物中,进一步优选结构单元M1-3为M1-3a的聚合物,而结构单元M1-3a:
(式中,R2b是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;Y2为酸反应性基团),以及
在式II-(4a)的聚合物中,进一步优选结构单元M1-3为M1-3b的聚合物,而结构单元M1-3b:
(式中,R2b和Y2与式II-(M1-3a)中的相同)。
本发明II的式II-(4)、式II-(4a)的聚合物中,作为构成M1-3单体的优选实例,可以举出与上述的结构单元M1-2相当的含氟单体相同的那些,此外也可以是不含氟的单体。不含氟单体的优选实例有:
CH2=CHO-R30-Y3、
CH2=CHCH2O-R32-Y2、
CH2=CH-R33-Y2
(R30~R33是二价烃基,例如二价亚烷基,除二价稠环结构的脂环式烃基、二价芳族烃基、除含有氧、氮、硫等原子的稠环结构之外的烃基等)更具体可以举出:
(X:H或CH3)
等。
本发明II的式II-(4)、式II-(4a)的聚合物中,作为构成M2-2单体的优选实例,最好是与上述的式II-(3)、式II-(3a)例示的M2-2用单体相同的那些。
本发明II的式II-(3)、式II-(4)、式II-(4a)的聚合物中,作为构成M2-3单体的优选实例,可以举出:
CF2=CF2、CF2=CH、CF2=CFCl、CF2=CFCF3、
(n:1~5)
CF2=CFH、CF3=CCl2、
(Z2与式(2)相同,n:1-10)
(Z2与式(2)相同,n:1-10)
等。
本发明的式II-(3)、式II-(3a)、式II-(3b)、式II-(4)、式II-(4a)的聚合物中,酸不分解的官能团Z1,是在酸或阳离子作用下不会分解或解离的官能团。但是,不管是否引起自缩合和缩聚反应、以及是否在交联剂存在下发生缩合和缩聚反应均可。其中在不含交联剂等的体系中,优选仅靠Z1与酸(或阳离子)接触该官能团本身不变的那些。
酸不分解的官能团Z1的优选实例可以举出-CH2OH、-COOH、-SO3H、-CN等。
例如在酸反应性基团Y2是酸解离性或酸分解性的场合下,使含氟聚合物中共存酸解离性或酸分解性官能团Y2和酸不分解的官能团Z1,通过调整各官能团的种类和存在比例,可以获得以下优选效果:例如能够调整与酸反应前后含氟聚合物在碱或溶剂中的溶解性,能够调整酸反应前后在碱和溶剂中溶解度差,以及在酸反应前能够赋予含氟聚合物在基材上的附着性等。
借助于这些官能团的功能,可以用于各种酸敏感材料、感光性材料和光刻胶材料等中。
结构单元N是选择性成分,只要是能与结构单元M1-2、M2-2、M2-3共聚的单体就无特别限制,可以根据目的含氟聚合物的用途、特性要求适当选择。可以举出:
乙烯类单体:
乙烯、丙烯、丁烯、氯乙烯、偏氯乙烯等
乙烯基醚类单体:
CH2=CHOR、CH2=CHOCOR(R:碳原子数1~20的烃基)等
烯丙基系单体:
CH2=CHCH2Cl、CH2=CHCH2OH、CH2=CHCH2COOH、CH2=CHCH2Br等
烯丙基醚系单体:
CH2=CHCH2OR(R:1~20个碳原子的烃基)、
CH2=CHCH2OCH2CH2COOH、
等。
本发明的式II-(3)、式II-(3a)、式II-(3b)、式II-(4)、式II-(4a)聚合物的分子量,可以根据用途、目的、使用形式等在1,000~1,000,000数均分子量范围内选择,优选3,000~700,000,更优选5,000~500,000左右。分子量过低,得到的聚合物覆膜耐热性和机械特性容易变得不足,反之分子量过高,对加工特性容易有不利影响。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以数均分子量优选3,000~200,000,特别优选3,000~100,000。000。
发明的式II-(3)、式II-(4)聚合物的具体结构单元M1-2(或M1-3)、M2-2、M2-3和N的组合,可以根据预期用途、物理性质(特别是玻璃化转变点等)、功能(透明性和折射率等)从上记例示的单体中作各种选择。
通常结构单元M1-2侧具有酸反应性功能(即酸作用前后功能和性状发生变化的功能),将功能赋予M1-2分解后的官能团和M2-2的官能团分解后的聚合物,而M2-3以及必要时的N能控制其他功能。这些功能和性状的综合平衡则通过选择M1-2、M2-2、M2-3、N的各自种类、存在比例等进行调整。
例如,以光刻胶、特别是以F2光刻胶用途为目标,目的在于获得真空紫外区透明性的场合下,应当使含有M1-2、M2-2、M2-3和N的聚合物整体氟原子含量尽可能高,使氟原子含量处于30重量%以上,优选50重量%以上,更优选60重量%以上,从这一点来看优选含有M1-2a、M1-2b、M2-2a、M2-3b的聚合物。这样得到的含氟聚合物耐热性优良,非晶形下包括真空紫外区在内的宽广波长范围内透明性高,可以作为光刻胶,特别是F2光刻胶用基础聚合物使用。
尤其是发现本发明II的式II-(3)、式II-(4)的聚合物在真空紫外区的透明性高。因此可以用于F2光刻胶和F2表膜等半导体材料用途等中。
在本发明的化学增幅型光刻胶组合物中,具有酸反应性基团的含氟聚合物(A)由具有酸反应性基团Y2的含氟聚合物组成。酸反应性基团Y2详细讲是酸解离性或酸分解性官能团和酸缩合性官能团。
①酸解离性或酸分解性官能团
酸解离性或酸分解性官能团,是与酸反应前虽然不溶或难溶于碱,但是在酸作用下能够使转变成在碱系显影液中可溶性的官能团。
具体讲是在酸或阳离子作用下,具有转变成羟基、羧基、磺基等的能力,其结果使含氟聚合物本身在碱中溶解的官能团。
基于该性质,可以作为正像型光刻胶基础聚合物使用。
酸解离性或酸分解性官能团,具体优选利用:
(式中,R7、R8、R9、R10、R11、R12、R14、R15、R18、R19、R20、R21、R22、R24、R25、R26、R27、R28和R29相同或不同,是碳原子数1~10的烃基;R13和R16是H或碳原子数1~10的烃基;R17和R23是碳原子数2~10的二价烃基);
更具体优选的实例有:
-OC(CH3)3、-OCH2COOC(CH3)3、
-COOC(CH3)3、-OSi(CH3)3
(R30是碳原子数1~10的烷基)。
含有这些酸解离性或酸分解性官能团的含氟聚合物,可以用于上述的正像型光刻胶中。酸解离性或酸分解性官能团上述也叫作保护基,反应前含氟聚合物(A)本身虽然不溶或难溶于碱,但是因能量射线照射下从光酸发生剂(B)中产生的酸而能解离或分解,含氟聚合物(A)转变成碱溶性的,而且含氟聚合物(A)中官能团分解产生的离去基团也会产生酸,因而具有进一步促进分解反应的效果。
在含有这些酸解离性或酸分解性官能团的含氟聚合物中,结构单元M1、M2和N之间的比例,可以根据组合物种类、目标功能和官能团Y2种类等在上述范围内作各种选择,例如为了使之与酸反应后变成碱溶性的,结构单元M1应当以5~100摩尔%,优选以10~100摩尔%,更优选以20~100摩尔%存在,结构单元M2和N合计应以0~95摩尔%,优选以0~90摩尔%,更优选以0~80摩尔%存在。
②酸缩合反应性官能团
酸缩合反应性官能团,是酸反应前虽然是碱溶性的,但是在酸作用下,能够使聚合物本身在碱系显影液(或者与上述相同的溶剂)中不溶化的官能团。
具体讲是指在酸或阳离子作用下产生自缩合、缩聚反应的官能团,或者在交联剂存在下因酸的作用引起与交联剂的缩合反应或缩聚反应的官能团,或者因酸或阳离子引起的转位重排反应(例如片哪醇重排、甲醇重排)等而产生极性变化的官能团,无论哪种情况其结果均是使聚合物本身变成在碱(或溶剂)中不溶的。
作为酸缩合性官能团,其具体优选实例有选自羟基、羧基、氰基、磺基、环氧基等中的基团。
具有因这些酸而产生缩合反应性官能团的含氟聚合物,可以用于负像型光刻胶中。酸致缩合反应性的官能团,是光酸发生剂(B)在能量射线照射下产生酸的作用下,能够引起缩合·缩聚反应或分子重排反应的官能团,在其作用下引起自接连反应、分子内重排反应、或因含交联剂的组合物而与交联剂产生交联反应,反应前含氟聚合物(A)本身是可溶于显影液(碱或溶剂)中的,具有使之不溶或难溶的功能。
此外,本发明的缩合反应性的官能团,虽然优选与酸反应前能赋予其本身在碱或溶剂等显影液中溶解性功能的(例如羧基、磺基、羟基等),但是也可以是仅仅具有因酸致缩合反应(交联反应)而在显影液中不溶化功能的(氰基、环氧基等)。这种场合下,也可以与在显影液中具有溶解性能的其他官能团组合使用,将含氟聚合物骨架本身改造成能在显影液中溶解的结构之后,可以作为负像型光刻胶使用。
具有酸缩合性官能团的含氟聚合物中,特别优选与酸反应前是碱水溶液可溶性的聚合物,能够用于显影液不用溶剂(特别是可燃性溶剂)的水系显影方法(溶解方法)中,对安全性和环境有利。
为了赋予在碱水溶液中的可溶性,结构单元M1应当以5~100摩尔%,优选以10~100摩尔%,更优选以20~100摩尔%存在,结构单元M2和N合计应以0~95摩尔%,优选以0~90摩尔%,更优选以0~80摩尔%存在。
对交联剂并无特别限制,可以使用从以往作为负像型光刻胶的交联剂惯用的那些中选出的。
本发明II的式(1)、(2)、(3)和(4)的聚合物,均以具有酸反应性官能团Y2为特征。向含氟聚合物中导入这些官能团的方法,可以利用一切方法。一般可以采用:
①预先合成具有官能团Y2的单体后聚合的方法,
②一旦合成具有其他官能团的聚合物,利用高分子反应使该聚合物官能团转变导入官能团Y2的方法等。
例如作为用方法②导入酸解离性或酸分解性官能团的实例,可以采用:先制成具有羟基的含氟聚合物后,在甲苯磺酸等酸的存在下,使之与乙基乙烯基醚、二氢吡喃等乙烯基醚类反应,导入酸分解性官能团(酮缩醇)的方法;以及使酮类与具有1,2-二醇的含氟聚合物反应,得到酸分解性官能团(环状缩醛化合物)的方法等。
本发明的组合物用含氟聚合物(A),可以采用各种公知的方法,使分别相当于各结构单元具有官能团Y2的乙烯类单体(M1)、含氟乙烯类单体(M2)和必要时相当于选择性成分N的含氟乙烯类单体(共)聚合得到。聚合方法可以采用游离基聚合法、阴离子聚合法、阳离子聚合法等,其中从使本发明的聚合物用各种单体,具有良好的游离基聚合特性,进而容易控制组成和分子量等质量指标,以及容易工业化等角度出发,优选游离基聚合法。也就是说,为了使聚合开始并以游离基方式进行并不限制手段,例如可以采用有机或无机游离基聚合引发剂、热、光或电离射线等引发聚合。聚合的种类,可以采用溶液聚合、本体聚合、悬浮聚合、乳液聚合等。而且分子量可以通过聚合用单体浓度、聚合引发剂浓度、链转移剂浓度和温度来控制。生成的聚合物组成可由加入单体的组成来控制。
在本发明II的化学增幅型光刻胶组合物中,光酸发生剂(B)是该物质本身或含有该物质的光刻胶组合物经放射线照射,能够发生酸或阳离子的化合物。也可以使用两种以上的混合物。
在本发明II的化学增幅型光刻胶组合物中,作为光酸发生剂(B)的实例,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的物质同样的物质。
本发明II的化学增幅型光刻胶组合物中光酸发生剂(B)含量,优选采用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的比例同样的比例。
而且在发明II的化学增幅型光刻胶组合物中,还可以添加有机碱,与上述光酸发生剂发生的酸起作用。
添加的有机碱,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的有机碱。
有机碱的添加量,优选与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的添加比例相同。
通过添加这些有机碱,可以使本发明的光刻胶组合物具有与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的效果。
本发明II的化学增幅型光刻胶组合物中,使用具有酸缩合性官能团的含氟聚合物(A)作为负像型光刻胶组合物的场合下,必要时也可以用交联剂。
使用的交联剂并无特别限制,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的交联剂。
本发明II的化学增幅型光刻胶(特别是负像型)组合物中,所含交联剂的比例优选与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的使用量相同。
本发明II的光刻胶组合物,必要时还可以含有溶解抑制剂、增感剂、染料、粘结性改进剂和保水剂等本领域惯用的各种添加剂。
这些添加剂的具体实例,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的添加剂。
使用这些添加剂的场合下,其添加量优选与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的使用比例相同。
本发明II的化学增幅型光刻胶(特别是负像型)组合物中,溶剂(C)是能够溶解具有酸反应性基团的含氟聚合物(A)、光酸发生剂(B)和上述各种添加剂的溶剂,只要能够获得良好的涂装性能(表面平滑性和厚度均一性等)就没有特别限制,都可以使用。
作为优选的溶剂(C),优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的溶剂。这些溶剂的存在比例,优选采用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示比例同样的比例。
本发明II的化学增幅型光刻胶组合物的使用方法,可以采用过去光刻胶技术中光刻胶图形的形成方法,这种图形的形成方法可以优选采用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的方法。
其中发现,通过采用本发明II的化学增幅型光刻胶组合物,可以形成即使在真空紫外区内透明性也高的光刻胶覆膜。利用这一点尤其可以方便地用在今后作为技术焦点目标而采用0.1微米的光刻法技术开发中。
本发明的第II公开(发明II)涉及基材上覆盖由具有酸反应性官能团的上述含氟聚合物(A)所形成组合物的覆膜。
可以用在本发明II覆膜的具有酸反应性官能团的含氟聚合物,在157nm下的分子消光系数处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下。
基材上包覆有这些真空紫外区透明性高的含氟聚合物的覆膜,在采用F2激光的光刻法之中,当然可以用作光刻胶覆膜(感光层),除此之外,由于还能用于采用F2光刻法的表膜用途中,棱镜等周边光学部件和硅晶片的防反射膜以及棱镜和周边光学部件的非粘着性防污膜等用途之中,因而优选。
本发明II的覆膜,可以根据目的、目标和用途施于一切基材上。在特别要求透明性的用途和光学用途中,也可以施于硅晶片、玻璃、LiF、CaF2、MgF2等无机基材上,以及丙烯酸树脂、三乙酰纤维素树脂、聚碳酸酯树脂等透明性树脂和其他金属类材料等之上。
膜厚可以根据目的和用途作广泛选择,但是在以透明性为目标的场合下,膜厚优选1.0微米以下,更优选0.5微米以下,最好处于0.3微米以下。
作为光刻胶的光刻胶覆膜使用本发明II覆膜(感光层)的场合下,优选涂布上述化学增幅型光刻胶组合物后形成的覆膜。
本发明II的光刻胶覆膜,利用旋涂法等涂装方法将上述的化学增幅型光刻胶组合物涂布在硅晶片之类支持体上,干燥成形;覆膜中可以含有具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)以及其他添加物等固形成分。
本发明II光刻胶覆膜的膜厚,通常是1.0微米以下的薄层覆膜,优选0.5~0.1微米厚度的薄膜。
此外,本发明II的光刻胶覆膜,优选真空紫外区透明性高的,具体讲是在157nm波长下的分子消光系数处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下的,从能有效利用采用F2激光(157nm)光线的光刻法来看,应当这样优选。
其中包覆有本发明II光刻胶覆膜的基材,可以同样利用过去使用光刻胶的各种基材。例如可以是硅晶片、设有有机或无机防反射膜的硅晶片以及玻璃基板等。特别是设有有机防反射膜的硅晶片,其灵敏度和剖面形状均良好。
应予说明,与此第II发明直接相关的合成例是合成例1~6,实施例是实施例1~9,12~22,25~35,47,62~75,88~93,112~117。
发明第III的公开(发明III),与发明II同样,涉及作为粘结剂用其中含有带酸反应性官能团的特定含氟聚合物的化学增幅型光刻胶组合物。
化学增幅型光刻胶,是含有树脂(聚合物)成分和光酸发生剂,在能量射线照射部分使酸发生剂发生酸,利用其催化作用的物质。化学增幅型正像型光刻胶,在能量射线照射部分发生的酸经其后的热处理(postexposure bake:PEB)而扩散,在使树脂等的酸解离性或酸分解性官能团脱离的同时再次发生酸,这样将使该能量射线照射部分变成碱溶性的。
对于化学增幅型正像型光刻胶而言,树脂成分是碱溶性的,除这样的树脂成分和酸发生剂之外,还有在酸作用下能够解离或分解的官能团(保护基),其本身对碱溶性树脂具有溶解抑制能力,其中含有对于酸作用下上述官能团(保护基)解离后转变成碱溶性的溶解抑制剂,树脂成分中有能在酸作用下解离或分解的官能团(保护基),其本身虽然是不溶或难溶于碱的,但是却具有在酸作用下上述官能团(保护基)解离后变成碱溶性的物质。
而且化学增幅型负像型光刻胶,树脂成分一般有能够产生酸致缩合反应的官能团,而且是碱溶性的,除这种树脂成分和酸发生剂之外,还含有交联剂。
在这样的负像型光刻胶中,能量射线照射部分产生的酸因PEB而扩散,作用在树脂成分中的酸缩合性官能团和交联剂上,使该能量射线照射部分固化,从而变成不溶或难溶于碱的。
第III发明(发明III)的化学增幅型光刻胶组合物,是能够与上记的正像型和负像型对应的物质,是由以下成分组成的组合物:
(A)具有酸反应性官能团的含氟聚合物,
(B)光酸发生剂,和
(C)溶剂。
本发明人等发现,不含稠环结构的具有特定的酸反应性基团的含氟聚合物(A),对真空紫外区的光线透明性特别高,耐腐蚀性、与酸反应性、显影液溶解性等光刻胶特性均优良。
可以用于第III发明的化学增幅型光刻胶组合物、具有酸反应性基团的含氟聚合物(A),是由式III-(1)表示的聚合物:
式III-(1):
-(M1)-(M2)-(N)-
①结构单元M1是源于具有酸反应性基团的乙烯类单体的结构单元,
②结构单元M2是源于聚合物主链有含氟脂肪族环状结构的结构单元,
③结构单元N是源于能与M1、M2共聚的含氟乙烯类单体的结构单元当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,其中含有1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N,其主链和侧链不含稠环结构部位的含氟聚合物。从能够赋予透明性和耐干蚀性的观点来看,优选在构成结构单元M2的聚合物主链中具有含氟脂肪族环状结构的结构单元的。
具有酸反应性基团的含氟聚合物(A)的结构单元M1,优选M1-1:
(式中,X7、X8、X9、X16相同或不同,表示H或F;Y2是酸反应性官能团;R2a是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n6、和n9为0或1;n3为0~2的整数)。
上记的结构单元M1-1无论是否含有氟原子或氟代烷基都可以。
其中从透明性和耐干蚀性方面来看,优选X7、X8、X9、X16都是氟原子或者R2a是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基。
其中优选的结构单元M1-1,是M1-1a:
(式中,Y2是酸反应性官能团;R2b是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基)。
构成上述结构单元M1-1a单体的优选实例有,
(a1+b1+c1:0~30;d1:0或1;e1:0~5;X55:H或F;X58:H或F;X57:H、F或CF3。当X58为H的场合下,a1+b1+c1+d1不为0。)
更具体有:
(n:1-30的整数)
(n:1-30的整数)
另一个优选的结构单元M1-1是M1-1b:
(式中,Y2是酸反应性官能团;R2b是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基)。
作为构成上记结构单元M1-1b的单体,优选的具体实例可以举出:
(a3+b3+c3:0~30;d3:0~2;e3:0~5;X63、X65:F或CF3;X64:H或F。)
更具体可以举出:
CF2=CFOCF2CF2-Y2、CF2=CFOCF2CF2CH2Y2、
CF2=CFOCF2CF2OCF2Y3、CF2=CFOCF2CF2OCF2CH2Y3、
CF2=CFOCF2CF2CH2OCF2CF2-Y2、
CF2=CFOCF2CF2CH2OCF2CF2CH2Y2
等。
除上面所示的结构单元M1-1a和M1-1B之外,作为优选的结构单元M1-1的单体例如可以举出:
CF2=CFCF2-O-Rf-Y2、、CH2=CH-Rf-Y2、CH2=CHO-Rf-Y2等。(Rf与式(2)的Rf2相同)
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Y2、CF2=CFCF2OCF2CF2CF2CH2Y2、
CF2=CFCF2-Y2、CF2=CFCF2-CH2Y2、
CH2=CHCF2CF2CH2CH2-Y2、CH2=CHCF2CF2-Y2、
CH2=CHCF2CF2CH2Y2、CH2=CHCF2CF2CF2CF2-Y2、
CH2=CHCF2CF2CF2CF2CH2Y2、CH2=CH2O-CH2CF2CF2-Y2、
CH2=CH2OCH2CF2CF2CH2Y2
等。
而且结构单元M1也可以是不含氟原子的乙烯类单体,该场合下构成M1的乙烯类单体优选:
CH2=CHO-R30-Y2、
CH2=CHCH2O-R32-Y2、CH2=CH-R33-Y2
(R30~R33是二价烃基,例如二价亚烷基,除二价稠环结构外的脂环式烃基、二价芳族烃基、除含有氧、氮、硫等原子等稠环结构之外的烃基等)
更具体可以举出:
(X:H或CH3)
等。
构成具有酸反应性基团的含氟聚合物(A)的结构单元M2,是主链上具有脂肪族含氟环状结构的结构单元,其优选实例可以举出由结构单元M2-1表示的结构单元:
(式中,X19、X20、X23、X24、X25和X26相同或不同,表示H或F;X21和X22相同或不同,表示H、F、Cl或CF3;Rf4是碳原子数1~10的含氟亚烷基或碳原子数2~10的具有醚键的含氟亚烷基;n12是0~3的整数;n11、n13、n14和n15相同或不同,表示0或1的整数)
而结构单元M2-1的优选实例可以举出结构单元M2-1a:
(式中Rf4表示碳原子数1~10的含氟亚烷基),
构成这些结构单元M2-1a的单体,具体可以举出:
等,通过与构成结构单元M1的单体共聚可以得到。
作为结构单元M2-1的另一种具体实例,优选由结构单元M2-1b或M2-1c表示的结构单元:
作为构成这些结构单元M2-1b、结构单元M2-1C的单体,具体是用CF2=CFOCF2CF2CF=CF2等二烯化合物作共聚成分,经环化聚合得到的。
此外,作为结构单元M2-1的优选实例,可以举出由结构单元M2-1d、M2-1e或M2-1f表示的结构单元:
结构单元M2-1d:式III-(3)-4
结构单元M2-1e:
结构单元M2-1f:
(式中,X19、X20、X23和X24表示H或F)。
结构单元M2-1d、结构单元M2-1e、结构单元M2-1f,具体是用由式CF2=CFOCF2CF=CX19X20(式中,X19、X20表示H或F)表示的二烯化合物环化聚合得到的。更具体讲是使用CF2=CFOCF2CF=CF2、CF2=CFOCF2CF=CH2等二烯化合物环化聚合得到的。
此外,作为构成其他含氟脂肪族环状结构单元的单体,还可以举出:
(Y2是酸反应性基团)
等。
在具有酸反应性的含氟聚合物(A)中,结构单元N是选择性成分,可以从能与M1、M2共聚的含氟乙烯类单体中选择。
结构单元N优选N-1:
(式中,X13、X14和X18相同或不同,表示H或F;X15表示H、F或CF3;Z2表示H、F或Cl;Rf3相同或不同,表示碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n5相同或不同,是0~2的整数;n10相同或不同,为0或1;当n10为0的场合下,X13、X14、X18和Z2中至少一个是氟原子或者X15是F或CF3)。
结构单元N-1为不具有官能团的含氟单体构成的单元,优选用于调整聚合物的机械特性、玻璃化转变点。另外也可用于调整聚合物整体的含氟量、赋予聚合物透明性等方面。
结构单元N-1更优选结构单元N-1a
(式中,X13、X14和X18相同或不同,表示H或F;X15表示H、F或CF3;Z2表示H、F或Cl;n5相同或不同,是0~2的整数;X13、X14、X18和Z2中至少一个是氟原子或者X15是F或CF3)。
作为构成结构单元N-1、N-1a优选单体的具体实例,可以举出:
CF2=CF2、CF2=CH2、CF2=CFCl、CF2=CFCF3、
CF2=CFO(CF2)n、CH2=C(CF3)2、
(n:1~5)
CF2=CFH、CF2=CCl2、
等。
而且结构单元N,也可以是源于结构单元M1用具有官能团Y2以外的官能团的含氟乙烯类单体,结构单元N-2。
结构单元N-2虽然不与酸发生解离或分解反应,但是由于具有能够赋予和调整含氟聚合物溶解性和交联性以及与基材的附着性的官能团,所以是含氟单体的优选结构单元。
作为构成结构单元N-2的单体,其优选实例可以举出:
(a2+b2+c2:0~30;d2:0或1;e2:0~5;X59:H或CF3;X60、X62:H或F;X61:H、F或CF3。当X61、X62为H的场合下,a2+b2+c2+d2+e2不为0)
具体可以举出:
CH2=CFCF2O-CH2CF2-Z1
CH2=CFCF2OCF2CF2O-CF2-Z1、
(Z1是Y2以外的官能团)
进一步可以举出:
(a4+b4+c4:0~30;d4:0~2;e4:0~5;X66、X68:F或CF3;X67:H或F)
更具体可以举出:
CF2=CFOCF2CF2-Z1、CF2=CFOCF2CF2CH2-Z1、
CF2=CFOCF2CF2OCF2-Z1、CF2=CFOCF2CF2OCF2CH2Z1、
CF2=CFOCF2CF2CH2OCF2CF2-Z1、
CF2=CFOCF2CF2CH2OCF2CF2CH2Z1
等。
此外还可以举出:
CF2=CFCF2-O-Rf-Z1、CF2=CF-Rf-Z1、CH2=CH-Rf-Z1、CH2=CHO-Rf-Z1(Rf是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基)等。
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Z1、CF2=CFCF2OCF2CF2CF2CH2Z1、
CF2=CFCF2-Z1、CF2=CFCF2-CH2Z1、
CH2=CHCF2CF2CH2CH2-Z1、CH2=CHCF2CF2-Z1、
CH2=CHCF2CF2CH2Z1、CH2=CHCF2CF2CF2CF2-Z1、
CH2=CHCF2CF2CF2CF2CH2Z1、CH2=CH2O-CH2CF2CF2-Z1、
CH2=CH2OCH2CF2CF2CH2Z1
(Z1是不与酸产生解离或分解反应的官能团)等。
本发明的光刻胶用含氟基础聚合物,由具有酸反应性基团Y2的含氟聚合物组成。所谓酸反应性基团Y2,详细讲是酸解离性或酸分解性官能团和酸缩合性官能团。
①酸解离性或酸分解性官能团
酸解离性或酸分解性官能团,是酸反应前不溶或难溶于碱,但是在酸作用下,能够使其在碱类显影液中溶解的官能团。
具体讲,是在酸或阳离子作用下,具有转变成羟基、羧基、磺基等转变能力,其结果使含氟聚合物本身在碱中溶解的官能团。
基于该性质,可以作为正像型光刻胶基础聚合物使用。酸解离性或酸分解性官能团,可以优选利用:
(式中,R7、R8、R9、R10、R11、R12、R14、R15、R18、R19、R20、R21、R22、R24、R25、R26、R27、R28和R29相同或不同,是碳原子数1~10的烃基;R13、R16是H或碳原子数1~10的烃基;R17、R23是碳原子数2~10的二价烃基)
更具体的优选实例可以举出:
-OC(CH3)3、-OCH2COOC(CH3)3、
(式中,R30表示碳原子数1~10的烷基)等。
有这些酸解离性或酸分解性官能团的含氟聚合物,可以用于上述正像型光刻胶中。酸解离性或酸分解性官能团也叫作上述的保护基,反应前含氟聚合物本身虽然不溶或难溶于碱,但是因能量射线照射下从光酸发生剂(B)中产生的酸而能解离或分解,是具有使含氟聚合物(A)转变成碱溶性作用的基团,而且含氟聚合物(A)中官能团分解产生的脱离基团也会产生酸,因而具有进一步促进分解反应的作用。
在具有这些酸解离性或酸分解性官能团的含氟聚合物中,结构单元M1、M2和N之间的比例,可以根据组合物的种类、目标功能和官能团Y2的种类等在上记范围内作各种选择,例如为了使与酸反应后的含氟聚合物变成碱溶性的,结构单元M1应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2与N的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
②酸缩合反应性官能团
酸缩合反应性官能团,是指与酸反应前虽然溶于碱或溶剂中,但是在酸作用下能使聚合物本身不溶于碱系显影液(或与前述相同的溶剂)中的官能团。
具体讲,在酸或阳离子作用下产生自缩合或缩聚,或者在交联剂存在下,因酸的作用与交联剂产生缩合反应或缩聚反应的官能团,或者在酸或阳离子引起的转位重排反应(例如片哪醇重排、甲醇重排)等中能引起极性变化的官能团;无论哪种情况其结果均使聚合物本身变成不溶于碱(或溶剂)的。
酸缩合性官能团的具体优选实例,是从羟基、羧基、氰基、磺基、环氧基等中选出的基团。
使用的场合下对交联剂并无特别限制,可以使用从过去作负像型光刻胶的交联剂惯用的那些中选出使用。
具有这些酸致缩合反应性官能团的含氟聚合物,可以用作负像型光刻胶。酸致缩合反应性的官能团,是因在能量射线照射下从光酸发生剂(B)中产生的酸而产生缩合·缩聚反应或重排反应的官能团,借助于它产生自交联反应、分子重排反应和由含有交联剂的组合物引起的与交联剂的交联反应,反应前含氟聚合物(A)本身在显影液(碱或溶剂)中是溶解性的,但是却有使之不溶或难溶的功能。
此外,本发明的缩合反应性的官能团,优选与酸反应前本身能赋予在碱和溶剂等显影液中溶解性功能的基团(例如羧基、磺基、羟基等),但是也可以是仅有因酸致缩合反应(交联反应)而在显影液中不溶化功能(氰基、环氧基等)的官能团。这种场合下,可以与在显影液中具有可溶性功能的其他官能团组合使用,使含氟聚合物骨架本身形成能在显影液中可溶的结构,作为负像型光刻胶使用。
其中具有酸缩合性官能团的含氟聚合物,特别优选与酸反应前是碱溶性的聚合物,使得显影液不用溶剂(特别是可燃性溶剂)而用水的显影过程(溶解过程)成为可能,对安全性和环境有利。
为了赋予在碱水溶液中的可溶性,结构单元M1应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2与N的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
具有这些酸缩合性官能团的含氟聚合物中,结构单元M1、M2和N之间的比例,可以根据组合物的种类、目标功能和官能团Y2的种类等在上记范围内作各种选择,例如为了使与酸反应前的含氟聚合物变成碱溶性的,结构单元M1应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2与N的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
具有这些酸反应性基团的含氟聚合物(A)的分子量,可以根据用途、目的、使用状态等在1,000~1,000,000数均分子量范围内选择,但是优选3,000~700,000,更优选5,000~500,000左右。分子量过低,得到的聚合物覆膜耐热性和机械特性容易变得不足,反之分子量过高,对加工特性不利。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以优选200,000以下,特别优选100,000以下。
具有这些酸反应性基团的含氟聚合物(A)中具体结构单元M1、M2和N的组合,可以根据预期用途、物理性质(特别是玻璃化转变点、熔点等)、功能(透明性和耐干蚀等)从上记例示的那些中作各种选择。
通常结构单元M1具有酸解离性或酸分解性功能和交联性(即分解前后功能和性状发生变化的功能),而由结构单元M2以及必要时的N来控制其他功能和性状。这些功能和性状的综合平衡则通过选择M1、M2、N的各自种类、存在比例等加以调整。
这些主链为脂肪族环状含氟聚合物,由于结构膨松、自由体积大、含氟量也高,具有:
·玻璃化转变点高且机械物性良好
·耐热性好
·在宽广波长范围内透明性好
·折射率低
·耐干蚀性优良等
特征而被优选。此外,官能团Y2赋予与酸反应的功能以及与酸反应后,含氟聚合物能够获得:
·对碱水溶液的亲和性、溶解性等
·溶剂溶解性、亲水性
·与基材的附着性、粘接性
·交联性
等功能而优选。可以用作光刻胶用聚合物,特别适于作为F2光刻胶用聚合物使用。
例如已经发现,以光刻胶,特别是以F2光刻胶为目标,目的在于获得真空紫外区透明性的场合下,优选使含M1、M2和N的聚合物全体中的含氟量尽可能高的,氟原子含量应当在30重量%以上,优选在50重量%以上,更优选在60重量%以上。这样得到的含氟聚合物耐热性优良,非晶形下包括真空紫外区在内的宽广波长范围内透明性高,这些主链有脂肪族环状的含氟聚合物在真空紫外区的透明性特别高。因此,可以用于光刻胶,特别是F2光刻胶相关用途等之中。
另一方面,为了发挥上述环状结构的优良特征,结构单元M2应当存在30~99摩尔%,优选40~99摩尔%,更优选60~99摩尔%,结构单元M1与N的合量应当存在1~70摩尔%,优选1~60摩尔%,更优选1~40摩尔%。
本发明III的化学增幅型光刻胶组合物用含氟聚合物,特征在于均有酸反应性官能团Y2。作为在含氟聚合物中导入这些官能团的方法可以采用各种方法,但是一般可以采用:
①预先合成具有官能团Y2的单体后聚合的方法,
②先合成具有其他官能团的聚合物后,利用高分子反应使该聚合物的官能团改变,导入官能团Y2的方法。
例如以采用方法②导入酸解离性或酸分解性官能团为例,可以采用的有:先制成具有羟基的含氟聚合物后,在甲苯磺酸之类酸存在下,使乙基乙烯基醚、二氢吡喃等乙烯基醚类反应,导入酸分解性官能团(酮缩醇类)的方法;以及使酮类与具有1,2-二醇的含氟聚合物反应,得到酸分解性官能团(环状缩醛化合物)的方法等。
在本发明的组合物用含氟聚合物(A),可以采用公知方法,通过使相当于各结构单元的具有官能团Y2的乙烯类单体(M1)、形成环结构的环状单体或二烯化合物(M2)、以及必要时相当于选择性成分(N)的含氟乙烯类单体(共)聚合得到。聚合方法可以采用游离基聚合法、阴离子聚合法、阳离子聚合法等,其中从获得本发明聚合物用各种单体具有良好的游离基聚合特性,进而容易控制组成和分子量等质量指标,以及容易工业化等角度出发,优选游离基聚合法。也就是说,为了引发聚合并以游离基方式进行,虽然并不限制手段,但是例如可以采用有机或无机游离基聚合引发剂,或者利用热、光或电离射线等引发聚合。聚合的种类,可以采用溶液聚合、本体聚合、悬浮聚合、乳液聚合等。而且分子量可以通过控制聚合用的单体浓度、聚合引发剂浓度、链转移剂浓度和温度加以调节。生成的聚合物组成可以由加入的单体组成来控制。
在本发明III的化学增幅型光刻胶组合物中,光酸发生剂(B)是通过对该物质本身或含有该物质的光刻胶组合物照射放射线发生酸或阳离子的化合物。也可以以两种以上混合物的形式使用。
在本发明III的化学增幅型光刻胶组合物中,作为光酸发生剂(B)的实例,优选采用在第I发明公开(发明I)的化学增幅型光刻胶组合物中所示同样的物质。
在本发明III的化学增幅型光刻胶组合物中,光酸发生剂(B)的含量,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的比例相同的比例。
在本发明III的光刻胶组合物中,作为能与上记光酸发生剂产生的酸起作用的碱,可以添加有机碱。
作为添加的有机碱,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的相同的碱。
有机碱的添加量,优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的添加比例相同的比例。
通过添加这些有机碱,可以将第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的同样效果赋予本发明的光刻胶组合物。
而且本发明的化学增幅型光刻胶组合物中,使用具有酸缩合性官能团的含氟聚合物(A)作为负像型光刻胶组合物的场合下,必要时还可以用交联剂。
对于使用的交联剂并无特别限制,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的交联剂。
本发明的光刻胶(特别是负像型)组合物中,所含交联剂的比例优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的使用量相同。
本发明的光刻胶组合物,必要时也可以含有溶解抑制剂、增感剂、染料、粘结性改进剂、保水剂等本领域惯用的各种添加剂。
这种添加剂的具体实例,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的添加剂。
使用这些添加剂的场合下,其添加量优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的相同。
在本发明III的化学增幅型光刻胶组合物中,溶剂(C)是能够溶解具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)以及上面列示的各种添加剂的物质,只要能获得良好的涂装性(表面平滑性和厚度均一性等)就无特别限制,都可以使用。
优选的溶剂(C),最好采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的溶剂。
这些溶剂(C)的存在比例,优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的相同。
作为本发明III的化学增幅型光刻胶组合物的使用方法,可以采用过去在光刻胶技术中光刻胶图形的形成方法,该图形形成方法可以优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的方法。
其中发现,采用本发明的化学增幅型光刻胶组合物,能够形成一种真空紫外区透明性也高的光刻胶覆膜。借助于它能够方便地用在特别作为今后目标为0.1微米技术焦点而开发的F2激光(157nm)光刻法中。
本发明涉及在基材上包覆由具有酸反应性官能团的含氟聚合物组成的覆膜。
本发明III的覆膜,由具有酸反应性官能团的含氟聚合物组成,是包覆了对真空紫外区光线透明性高的该含氟聚合物的覆膜。
可以用在本发明III覆膜上的具有酸反应性官能团的含氟聚合物,157nm下的分子消光系数处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下。
基材上包覆有这些真空紫外区透明性高的含氟聚合物的覆膜,当然可以在采用F2激光的光刻法之中用作光刻胶覆膜(感光层),除此之外,由于还能用于采用F2光刻法的表膜用途中,棱镜等周边光学部件和硅晶片的防反射膜以及棱镜和周边光学部件的非粘着性防污膜等用途之中而优选。
本发明III的覆膜,可以根据目的、目标和用途施于一切基材上。在特别要求透明性的用途和光学用途中,也可以施于硅晶片、玻璃、LiF、CaF2、MgF2等无机基材上,以及丙烯酸树脂、三乙酰纤维素树脂、聚碳酸酯树脂等透明性树脂和其他金属类材料等之上。
膜厚可以根据目的和用途作广泛选择,但是用在以透明性为目标的用途的场合下,膜厚优选1.0微米以下,更优选0.5微米以下,最好处于0.3微米以下。
作为光刻胶的光刻胶覆膜使用本发明III覆膜(感光层)的场合下,优选涂布上述化学增幅型光刻胶组合物后形成的覆膜。
本发明III的光刻胶覆膜,可以利用旋涂法等涂装方法将上述化学增幅型光刻胶组合物涂布在硅晶片之类支持体上,干燥成形;覆膜中可以含有具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)以及其他添加物等固形分。
本发明III光刻胶覆膜的膜厚,通常是1.0微米以下的薄层覆膜,优选0.5~0.1微米厚度的薄膜。
此外,本发明III的光刻胶覆膜,从能有效用在采用F2激光(157nm)光线的光刻法的观点来看,应当优选真空紫外区透明性高的,具体讲157nm波长下的分子消光系数应处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下的。
其中包覆有本发明的光刻胶覆膜的基材,可以同样利用过去使用光刻胶的各种基材。例如可以是硅晶片、设有有机或无机防反射膜的硅晶片以及玻璃基板等。特别是设有有机防反射膜的硅晶片,其灵敏度和剖面形状均良好。
其中与此第III发明直接相关的实施例是实施例10、11、23和24。
发明的第IV公开(发明IV),涉及作为粘结剂用其中含有具有酸反应性官能团的特定含氟聚合物的化学增幅型光刻胶组合物。
化学增幅型光刻胶,是含有树脂(聚合物)成分和光酸发生剂,在能量射线照射部分使酸发生剂发生酸,利用其催化作用的物质。化学增幅型正像型光刻胶,在能量射线照射部分发生的酸经其后的热处理(postexposure bake:PEB)而扩散,在使树脂等的酸解离性或酸分解性官能团脱离的同时再次发生酸,利用这种方法将使该能量射线照射部分变成碱溶性的。
对于化学增幅型正像型光刻胶而言,树脂成分是碱溶性的,除这样的树脂成分和酸发生剂之外,还有在酸作用下能够解离或分解的官能团(保护基),其本身对碱溶性树脂具有溶解抑制能力,其中含有在酸作用下上述官能团(保护基)解离后转变成碱溶性的溶解抑制剂,树脂成分有能在酸作用下解离或分解的官能团(保护基),其本身虽然是不溶或难溶于碱的,但是却在酸作用下上述官能团(保护基)解离后变成碱溶性的。
第IV发明(发明IV)的化学增幅型光刻胶组合物,是能够与上记的正像型对应的物质,是由:
(A)具有酸解离性或酸分解性基团的含氟聚合物,
(B)光酸发生剂,和
(D)溶剂组成的组合物。
本发明人等发现,由具有特定酸解离性或酸分解性基团的含氟乙烯类单体和脂环式单体组成的含氟聚合物(A),对真空紫外区光线的透明性特别高,耐腐蚀性、与酸反应性、显影液溶解性等光刻胶特性均优良。
可以用于第IV发明(发明IV)的化学增幅型光刻胶组合物中的、具有酸反应性基团的含氟聚合物(A),是由式IV-(1)表示的含氟聚合物:
式IV-(1):
-(M1)-(M2)-(M3)-(N)- IV-(1)
①结构单元M1是源于本身是酸解离性或酸分解性官能团,具有与酸反应后变成羧基的官能团的含氟乙烯类单体的结构单元,
②结构单元M2是源于脂环式单体的结构单元,
③结构单元M3是源于含氟乙烯类单体的结构单元,
④结构单元N是源于能与M1、M2、M3共聚的乙烯类单体的结构单元
当M1+M2+M3=100摩尔%时,M1/M2/M3(摩尔%)为1~98/1~98/1~98,其中含有1~98摩尔%M1、1~98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N。
进而发现,聚合物的特征是具有源于特定乙烯类单体的结构单元M1,而结构单元M1中同时含有在酸解离性或酸分解性官能团中、在酸作用下分解变成羧基的官能团和氟原子以及氟代烷基,因此可以利用羧基在碱水溶液(显影液)中的良好溶解性,得到高灵敏度正像型光刻胶,同时由于氟原子和氟代烷基具有的效果,导致与以往的丙烯酸系单体的结构单元相比,真空紫外区内的透明性更高,因而还可用作F2光刻胶。
而且由于脂环式单体还具有结构单元(M2),因而将成为耐干蚀性良好的光刻胶覆膜。
此外也发现,由于作为必要成分含有含氟乙烯类单体的结构单元(M3),所以能够赋予透明性和改善耐干蚀性等。
也就是说,含氟聚合物由于同时含有带有上述酸解离性或酸分解性官能团的含氟乙烯类单体的结构单元M1、脂环式单体的结构单元M2和含氟乙烯类单体的结构单元M3,所以能够获得真空紫外区光线的透明性特别高,耐腐蚀性、曝光灵敏度和显影液溶解性等作为光刻胶特性所需的必要功能。
以下具体说明各结构单元。
具有酸解离性或酸分解性官能团的含氟聚合物(A)的第1优选的聚合物,是含氟丙烯酸系聚合物,
结构单元M1是M1-1,而M1-1:
(式中,X1和X2相同或不同,表示H或F;X3相同或不同,是H、Cl、CH3、F或CF3;Y1是酸解离性或酸分解性官能团,与酸反应后变成羧基的官能团;R1是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n1为0或1;当n1为0,或者当R1中不含氟原子的场合下,X1和X2中至少有一个是氟原子或者X3氟原子或CF3)。
即是主链和/或侧链上是具有氟原子、氟代烷基的含氟丙烯酸系单体,具有与酸反应后变成羧基的官能团的结构单元。
其中从聚合性好,与已有的丙烯酸系聚合物相比能够特别改善透明性和耐干蚀性等观点来看,进而从耐热性和机械特性来看,特别优选下记的M1-1a:
(式中,X1和X2相同或不同,表示H或F;Y1是酸解离性或酸分解性官能团,与酸反应后变成羧基的官能团;R1是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n1为0或1)。
作为进一步优选的具体实例有:
M1-1b:
(式中,R1是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n1为0或1)。
在M1-1、M1-1a和M1-1b中可以含有、也可以不含-OR1-,但是在包含的场合下,R1可以从上述的烃基和含氟亚烷基中选择,优选二价烃基,具体优选的实例可以举出:
-(CH2)n- (n=1-10的整数)
等。
但是在没有-OR1-或者R1上不含氟原子的场合下,上述结构单元M1-1中的X1、X2和X3均是具有氟原子或含氟基团的。
具有酸解离性或酸分解性官能团Y1的丙烯酸系结构单元M1-1、M1-1a和M1-1b(以下若无特别说明,均用M1表示)用单体的具体实例,可以举出:
等。
上述具体实例中,式(i)和式(ii)均是文献和专利中所没有记载过的化合物,使用这些单体的聚合物同样也是文献和专利中所没有记载过的化合物。
在具有酸解离性或酸分解性官能团的含氟聚合物(A)中,第2种优选的结构单元M1是源于含氟烯丙基系或含氟乙烯类单体的结构单元。
具体讲M1是M1-2,而M1-2是:
(式中,X7、X8、X9、X16相同或不同,表示H或F;Y1是酸解离性或酸分解性官能团、与酸反应可转变为羧基;R2a是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n6、和n9为0或1;n3为0~2的整数;当n9为0或R2a不含氟原子的场合下,X7、X8、X9、X16均含氟原子)表示的结构单元。
即是从主链或侧链具有氟原子、氟代烷基的烯丙基系、烯丙基醚系、乙烯基系、乙烯基醚系单体衍生出来的、具有与酸反应变成羧基的官能团的结构单元,从能提高真空紫外区透明性的观点,以及能提高耐干蚀性的观点来看,特别优选这种结构单元。
上记的M1-2结构单元中,从透明性方面考虑,应当特别优选R2a是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基(n9=1)。
在结构单元M1-2中,更具体优选下记M1-2a:
(式中,R2b是碳原子数1~20的烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;Y1是酸解离性或酸分解性官能团,与酸反应后变成羧基的官能团),从与含氟乙烯类单体等各种其他单体的共聚性能也良好,而且能够改善聚合物的透明性,特别是真空紫外区透明性的观点来看优选。此外,从透明性方面考虑,优选R2b是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基的。
构成结构单元M1-2a单体的优选实例有:
(a1+b1+c1:0~30;d1:0或1;e1:0~5;X55:F或CF3;X56、X58:H或F;X57:H、F或CF3。当X58为H的场合下,a1+b1+c1+d1不为0。)
更具体有:
(n:1-30的整数)
(n:1-30的整数)
结构单元M1-2的另一个优选实例是下记结构单元M1-2b,而结构单元M1-2b优选:
(式中,R2b是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;Y1是酸解离性或酸分解性官能团,与酸反应后变成羧基的官能团),从与含氟乙烯类单体等各种其他单体的共聚性能也良好,而且能够改善聚合物的透明性,特别是真空紫外区透明性的观点来看优选。此外,从透明性方面考虑,优选R2b是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基者。
作为构成结构单元M1-2b单体的优选实例可以举出:
(a3+b3+c3:0~30;d3:0~2;e3:0~5;X63、X65:F或CF3;X64:H或F。)
更具体可以举出:
CF2=CFOCF2CF2-Y1、CF2=CFOCF3CF2CH2Y1、
CF2=CFOCF2CF2OCF2Y1、CF2=CFOCF2CF2OCF2CH2Y1、
CF2=CFOCF2CF2CH2OCF2CF2-Y1、
CF2=CFOCF2CF2CH2OCF2CF2CH2Y1、
等。
这些具体实例中,式(iii)和式(iv)均是文献和专利中所没有记载过的化合物,使用这些单体的聚合物同样也是文献和专利中所没有记载过的化合物。
除作为构成M1-2的单体,上面M1-2a和M1-2b所示的优选具体实例外,优选的单体例如可以举出:
CF2=CFCF2-O-Rf-Y1、CF2=CF-Rf-Y1、CH2=CH-Rf-Y1、CH2=CHO-Rf-Y1等。
(Rf与M1-2b的R2b相同)
更具体可以举出:
CF2=CF-CF2OCF2CF2CF2Y1、CF2=CFCF2OCF2CF2CF2CH3Y1、
CF2=CFCF2-Y1、CF2=CFCF2-CH2Y1、
CH2=CHCF2CF2CH2CH2-Y1、CH2=CHCF2CF2-Y1、
CH2=CHCF2CF2CH2Y1、CH2=CHCF2CF2CF2CF2-Y1、
CH2=CHCF2CF2CF2CF2CH2Y1、CH2=CHO-CH2CF2CF2-Y1、
CH2=CHOCH2CF2CF2CH2Y1
等。
在具有酸解离性或酸分解性官能团的含氟聚合物(A)中,结构单元M2是具有脂肪族环状结构的结构单元,即是主链中具有环结构,或者侧链具有环结构的结构单元。
优选那些因这些环结构而能赋予具有酸解离性或酸分解性官能团的含氟聚合物(A)以良好耐干蚀性的。
其中从耐干蚀性角度来看,特别优选那些能使具有环结构的结构单元具有高玻璃化转变点温度的。
主链形成环状结构的单体的具体实例,可以举出:
脂环式烃类
(m:0-3的整
数)
(Z1:结构单元M1中的官能团之外的官能团)
含氟脂环式单体,式(9):
(式中,A、B、C和D是H、F、1-10个碳原子的烷基或1~10个碳原子的含氟烷基;m是0~3的整数。A~D中一个含有氟原子)
可以具体举出:
等。
此外还可以举出:
基或含氟烷基)
等。
具有官能团的含氟脂环式单体可以举出:
由下式表示的新颖的含氟单体:
(式中,A、B和C是H、F、1~10个碳原子的烷基或1~l0个碳原子的含氟烷基;R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性官能团。当b为0或R不含氟原子的场合下,A~C中一个为氟原子或含氟烷基。)
其中优选A、B和C均是氟原子,或者当A~C中均不含氟原子的场合下优选R的含氟量在60重量%以上的,从赋予聚合物以透明性的观点来看更优选全氟亚烷基。
可以具体举出:
(n:0-10,X:F或CF3)
等。
或者式(11)表示的新颖的含氟单体:
(式中,A、B和C是H、F、1~10个碳原子的烷基或1~10个碳原子的含氟烷基;R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性官能团。)
可以具体举出优选有以下降冰片烯骨架的:
(n:0~10)、
(n:0~10)
(n:0~10)
(以上的X是F或CF3)
等。
此外还可以举出:
(X:H、F、CF3、CH3)、
等。
这些脂环式单体所含的酸反应性基团Y2,详细讲是酸解离性或酸分解性的官能团和酸缩合性的官能团。
①酸解离性或酸分解性官能团
酸解离性或酸分解性官能团,是一些与酸反应前不溶或难溶于碱,但是在酸作用下,能够使其在碱类显影液中溶解的官能团。
具体讲,是一些在酸或阳离子作用下,具有转变成羟基、羧基、磺基等能力,其结果使含氟聚合物本身在碱中溶解的官能团。
基于该性质,可以作为正像型光刻胶基础聚合物使用。酸解离性或酸分解性官能团,具体可以举出上记式I-(1)中关于M1所列举的Y1。
②酸缩合性官能团
酸缩合性官能团,是指在酸反应前可溶于或碱(或溶剂),但是在酸作用下能使聚合物本身在碱类显影液(或与上述相同的溶剂)中不溶化的官能团。
具体讲,是在酸或阳离子作用下产生自缩合、缩聚的官能团,或者在交联剂存在下,因酸的作用与交联剂产生缩合反应或缩聚反应的官能团,或者在酸或阳离子引起的转位重排反应(例如片哪醇重排、甲醇重排)等中产生极性变化的官能团,无论那种情况下,其结果使聚合物本身变成不溶于碱(或溶剂)的。
基于该性质,可以作为负像型光刻胶基础聚合物使用。
作为酸缩合性官能团的具体优选实例,可以举出例如从羟基、羧基、氰基、磺基、环氧基等中选出的基团。
从能够提高耐腐蚀性的观点考虑,其中优选具有稠环结构的结构单元的。
其中作为主链具有稠环结构的结构单元,在源于降冰片烯和降冰片烯衍生物的结构单元中,优选降冰片烯和降冰片烯衍生物本身与含氟乙烯类单体的共聚性好,而且能使得到的聚合物具有高玻璃化转变点并能提高耐干蚀性的那些。
而且从透明性,特别是真空紫外区透明性优良的角度来看,优选环状烃类单体中部分或全部氢原子被氟原子取代的单体。
作为一方侧链有脂肪族环状结构的单体,可以举出:
等。
构成具有酸解离性或酸分解性官能团的含氟聚合物(A)的结构单元M3,是含氟乙烯类单体的结构单元,能够改善含氟聚合物的透明性,特别是真空紫外区的透明性。
详细讲结构单元M3是由下式结构单元M3-1表示的源于含氟乙烯类单体的结构单元:
M3-1:
(式中X13、X14和X18相同或不同,表示H或F;X15、表示H、F或CF3;Z2是H、F或Cl;Rf3相同或不同,是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n5为0~2的整数;n10为0或1;但是n10为0的场合下,X13、X14、X15、X18、Z2均含氟原子)。
作为构成结构单元M3单体的优选实例,可以举出:
CF2=CF2、CF2=CH2、CF2=CFCl、CF2=CFCF3、
CF2=CFO(CF2)nF、CH2=C(CF3)2、
(n:1~5)
(Z2与M3-1中的Rf3相同,n:1-10)
等。
从单体共聚性能方面考虑,其中优选本身是2或3个碳原子的乙烯类单体,而且至少含有一个以上氟原子的。
具体实例可以举出四氟乙烯、一氯三氟乙烯、偏氟乙烯、六氟丙烯、氟乙烯等,特别优选四氟乙烯和一氯三氟乙烯。
另外,结构单元M3也可以是源于含氟乙烯类单体的结构单元,含有除结构单元M1所含的官能团之外的官能团Z1(定为结构单元M3-2),例如优选酸不分解的官能团。在不含交联剂等的体系中,优选官能团Z1与酸接触其官能团自身不发生变化的。
作为酸不分解的官能团Z1的优选实例,可以举出-CH2OH、-COOH、-SO3H、-CN等。
例如,使含氟聚合物中共存酸解离性或酸分解性的官能团Y1和酸不分解的官能团Z1,通过调整各官能团的种类和存在比例,可以获得赋予以下功能的良好效果:例如能调整与酸反应前后含氟聚合物对碱和溶剂的溶解性,能调整酸反应前后对碱和溶剂的溶解度差,赋予在酸反应前的含氟聚合物在基体材料上的附着性等。
能形成含有这些酸不分解官能团Z1结构单元的、含有官能团Z1的乙烯类单体的实例,可以优选利用的是:在结构单元M1中所示的具有酸解离性或酸分解性官能团Y1所列举的含氟乙烯类单体中,各自的官能团Y1被置换为上记Z1的那些。
基于这些官能团的功能,可以用于各种酸敏感材料、感光性材料和光刻胶材料等之中。
而且,还可以是结构单元M3-1、M3-2以外的含氟乙烯类单体,例如可以是含氟丙烯酸类(但是包括在结构单元M1-1中的除外)。
具体讲,结构单元M3-3优选由下式M3-3表示的结构单元。
M3-3:
(式中,式中,X4、X5相同或不同,是H或F;X6可是H、Cl、CH3、F或CF3;Rf1表示碳原子数1~20的含氟烷基、碳原子数2~100的具有醚键的含氟烷基或碳原子数3~20的含氟芳基)
结构单元M3-3中,-Rf1选自上述含氟烷基,具体优选的可以举出:-(CH2)m(CF2)n-F、-(CH2)m(CF2)n-H、-(CH2)m(CF2)n-Cl(式中m为1~5,n为1~10的整数)、
(m=1~5、n=1~30) (n=1~30)
(n=1~30)
(m+n=2~30)
等。
能形成结构单元M3-3的单体的实例有:
(Z4:H、F、Cl、n:1~10)
(Z5:H、F、Cl、n:1~10)
(n:1~5)
(n:1~30)
(m:1或2,Z4:H,F,Cl,n:1-10)
(m:1或2,Z4:H,F,Cl,n:1-10)
(Z4、Z5:H、F、Cl、n:1~10)
结构单元N是选择性成分,只要是能与结构单元M1、M1-1、M1-2、M2、M3-1、M3-2共聚的单体就无特别限制,可以根据目的含氟聚合物的用途、特性要求适当选择。
可以举出的有:
乙烯类单体:
乙烯、丙烯、丁烯、氯乙烯、偏氯乙烯等
乙烯基醚类或乙烯基酯类单体:
CH2=CHOR、CH2=CHOCOR(R:碳原子数1~20的烃基)等
烯丙基系单体:
CH2=CHCH2Cl、CH2=CHCH2OH、CH2=CHCH2COOH、CH2=CHCH2Br等
烯丙基醚系单体:
CH2=CHCH2OR(R:1~20个碳原子的烃基)、
CH2=CHCH2OCH2CH2COOH、
此外还有丙烯酸、甲基丙烯酸系(其中不含氟原子)单体等。
具有这些酸解离性或酸分解性官能团的聚合物(A)的分子量,可以根据用途、目的、使用状态等在1,000~1,000,000数均分子量范围内选择,优选3,000~700,000,更优选5,000~500,000左右范围内选择。分子量过低,得到的聚合物覆膜耐热性和机械特性容易变得不足,反之分子量过高,对加工特性不利。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以数均分子量优选3,000~200,000,特别优选3,000~100,000。
含氟聚合物(A)的具体结构单元M1、M1-1、M1-2、M2、M3、M3-1和N间的组合,可以根据预期用途、物理性质(特别是玻璃化转变点、熔点等)、功能(透明性和折射率等)从上记例示的单体中作各种选择。
通常使结构单元M1具有酸反应性功能(即酸作用前后功能和性状发生变化的功能),对分解后的聚合物,将功能赋予由M1分解后的官能团和根据情况M3-2的官能团,而M2赋予耐干蚀性并进行Tg控制,M3-1以及必要时的N则控制其他功能和性状。这些功能和性状的综合平衡则通过选择M1、M2、M3-1、M3-2和N各自的种类、存在比例等加以调整。
例如,以光刻胶、特别是以F2光刻胶用途为目标,目的在于获得真空紫外区透明性的场合下,应当使包括M1、M2、M3和N的聚合物整体中氟原子含量尽可能高,使氟原子含量处于30重量%以上,优选处于50重量%以上,更优选处于60重量%以上,即使从这一点来看也应当优选含有M1-1、M1-2a、M1-2b、M3-1、M3-2的聚合物等。这样得到的含氟聚合物耐热性优良,非晶形下包括真空紫外区在内的宽广波长范围内透明性高,可以作为光刻胶,特别是F2光刻胶基础聚合物使用。
尤其是发现本发明列示的聚合物,真空紫外区透明性极高。因此可以用于F2光刻胶和F2表膜等半导体材料用途等中。
在本发明的化学增幅型光刻胶组合物中,具有酸解离性或酸分解性官能团的含氟聚合物(A)的特征是:具有与酸反应转变成羧基的官能团。
由于这些官能团的效果,含氟聚合物(A)与酸反应前虽然是不溶或难溶于碱的,但是在酸作用下能够使之在碱系显影液中可溶化。
由于此原因,可以将其作为正像型光刻胶的基础聚合物使用。酸解离性或酸分解性基团可以举出:
(R24、R25、R26、R10、R11、R12、R18、R19和R20相同或不同,表示1~10个碳原子的烃基,R’表示H或1~10个碳原子的烃基)等。其中优选-COOC(CH3)3、-OCH2COOC(CH3)3等。
具有这些酸解离性或酸分解性官能团的含氟聚合物,可以用于上述的正像型光刻胶之中。酸解离性或酸分解性官能团,也叫作上述的保护基,反应前含氟聚合物(A)本身虽然不溶或难溶于碱,但是在能量射线作用下因光酸发生剂(B)发生的酸而解离或分解,具有使含氟聚合物(A)变成碱溶性的功能,进而由于含氟聚合物(A)中官能团的分解而产生的离去基团也发生酸,所以具有进一步促进分解反应的效果。
采用导入在本发明的在酸的作用下能转变成羧基的官能团的含氟聚合物的化学增幅型光刻胶,感光灵敏度高,酸反应后(脱保护后)在显影液中溶解性良好,能够获得分辨率高的图形,因而优选。
此外,本发明的化学增幅型光刻胶组合物中使用的含氟聚合物(A),尽管导入了羧酸系官能团,但是却能获得透明性,特别是真空紫外区的透明性高,即使F2激光曝光后也有高灵敏度,分辨率高的微细光刻胶图形,进而能获得微细电路图形。
在具有这些酸解离性或酸分解性官能团的含氟聚合物(A)中,M1、M2、M3和N之间的比例可以根据组合物种类、目标功能和官能团Y1的种类在上述范围内作各种选择,但是例如为了使与酸反应后的含氟聚合物成为碱溶性的,结构单元M1应当存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2与N的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
向本发明的化学增幅型光刻胶组合物用聚合物中导入官能团的方法,虽然可以采用一切方法,但是一般可以采用:
①预先合成具有官能团Y1的单体后聚合的方法,
②一旦合成有其他官能团的聚合物后,通过高分子反应使该聚合物的官能团改变,导入官能团Y1的方法等。
本发明的组合物用含氟聚合物(A),可以采用各种公知的方法,使分别相当于各结构单元具有官能团Y1的乙烯类单体(M1)、脂环式单体(M2)、含氟乙烯性单体(M3)和必要时相当于选择性成分N的含氟乙烯类单体(共)聚合得到。聚合方法可以采用游离基聚合法、阴离子聚合法、阳离子聚合法等,其中从本发明的聚合物用各种单体具有良好的游离基聚合特性,进而容易控制组成和分子量等质量指标,以及容易工业化等角度出发,优选游离基聚合法。也就是说,为了使聚合开始并以游离基方式进行并不限制手段,例如可以采用有机或无机游离基聚合引发剂、热、光或电离射线等引发聚合。聚合的种类,可以采用溶液聚合、本体聚合、悬浮聚合、乳液聚合等。而且分子量可以通过聚合用单体浓度、聚合引发剂浓度、链转移剂浓度和温度来控制。生成的聚合物组成可由加入单体的组成控制。
在本发明的化学增幅型光刻胶组合物中,光酸发生剂(B)是该物质本身或含有该物质的光刻胶组合物经放射线照射,能够发生酸或阳离子的化合物。也可以使用两种以上的混合物。
在本发明的化学增幅型光刻胶组合物中,作为光酸发生剂(B)的实例,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的物质。
本发明的化学增幅型光刻胶组合物中光酸发生剂(B)的含量,优选采用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的比例。
而且在发明的光刻胶组合物中还可以添加能够与上述光酸发生剂发生的酸起碱作用的有机碱。
添加的有机碱,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的有机碱。
有机碱的添加量,优选与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的添加比例相同。
通过添加这些有机碱,可以使本发明的光刻胶组合物具有与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示同样的效果。
本发明IV的光刻胶组合物,必要时还可以含有溶解抑制剂、增感剂、染料、粘结性改进剂和保水剂等本领域惯用的各种添加剂。
这些添加剂的具体实例,优选使用与第I发明的公开(发明I)中在化学增幅型光刻胶组合物中所示的相同。
使用这些添加剂的场合下,其添加量优选与第I发明的公开(发明I)中关于化学增幅型光刻胶组合物中所示的使用比例相同。
本发明IV的化学增幅型光刻胶组合物中,溶剂(C)是能够溶解具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)和上面列示的各种添加剂的溶剂,只要能够获得良好的涂装性能(表面平滑性和厚度均一性等)就没有特别限制,都可以使用。
作为优选的溶剂(C),与第I发明的公开(发明I)中关于化学增幅型光刻胶组合物中所示的溶剂相同。
这些溶剂的存在比例,优选采用与第I发明公开(发明I)中关于化学增幅型光刻胶组合物中所示同样的比例。
本发明IV的化学增幅型光刻胶组合物的使用方法,可以采用过去光刻胶技术中光刻胶图形的形成方法,这种图形的形成方法优选采用与第I发明公开(发明I)中关于化学增幅型光刻胶组合物中所示同样的方法。
其中发现,通过采用本发明IV的化学增幅型光刻胶组合物,可以形成真空紫外区内透明性也高的光刻胶覆膜(感光层)。借助于它尤其可以方便地用在今后作为目标为0.1微米的技术焦点而开发的光刻法中。
本发明IV也涉及基材上覆盖具有酸反应性官能团的含氟聚合物而形成的覆膜。
本发明IV的覆膜是由具有酸反应性官能团的含氟聚合物形成的,是覆盖了对真空紫外区光线透明性高的该含氟聚合物的覆膜。
本发明IV的覆膜用具有酸反应性官能团的含氟聚合物,在157nm下的分子消光系数处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下。
基材上包覆有这些真空紫外区透明性高的含氟聚合物的覆膜,在采用F2激光的光刻法中当然可以作光刻胶覆膜(感光层)使用,除此之外,由于还能用于采用F2光刻法的表膜用途,以及棱镜等周边光学部件和硅晶片的防反射膜及棱镜和周边光学部件的非粘着性防污膜等用途之中,因而优选。
本发明IV的覆膜,可以根据目的、目标和用途施于一切基材上。在特别要求透明性的用途和光学用途中,也可以施于硅晶片、玻璃、LiF、CaF2、MgF2等无机基材上,以及丙烯酸树脂、三乙酰纤维素树脂、聚碳酸酯树脂等透明性树脂和其他金属类材料等之上。
膜厚可以根据目的和用途作广泛选择,但是在以透明性为目标的场合下,膜厚优选1.0微米以下,更优选0.5微米以下,最好处于0.3微米以下。
此外使用本发明IV的覆膜作为光刻胶的光刻胶覆膜(感光层)的场合下,优选涂布上述化学增幅型光刻胶组合物后形成的覆膜。
本发明IV的光刻胶覆膜,可以用旋涂法等涂装方法将上述化学增幅型光刻胶组合物涂布在硅晶片之类支持体上,干燥后形成;覆膜中可以含有具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)以及其他添加物等固形成分。
本发明IV光刻胶覆膜的膜厚,通常是1.0微米以下的薄层覆膜,优选0.5~0.1微米的薄膜。
本发明IV的光刻胶覆膜,进一步优选真空紫外区透明性高的,具体讲是157nm波长下分子消光系数处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下的,从能有效利用采用F2激光(157nm)光线的光刻法来看,应当这样优选。
其中包覆有本发明IV光刻胶覆膜的基材,可以同样利用过去使用光刻胶的各种基材。例如可以是硅晶片、设有有机或无机防反射膜的硅晶片以及玻璃基板等。特别是设有有机防反射膜的硅晶片,其灵敏度和剖面形状均良好。
本发明IV(发明IV)第2涉及新颖的含氟聚合物。
本发明IV的含氟聚合物是具有本身是酸解离性或酸分解性官能团,在酸作用下将转变成羧基的官能团。
该新颖的含氟聚合物的第1是由
式IV-(1):
-(M1)-(M2)-(M3)-(N)- IV-(1)
①结构单元M1是源于其中有本身是酸解离性或酸分解性基团,与酸反应将变成羧基的官能团的含氟乙烯类单体的结构单元,
②结构单元M2是源于脂环式单体的结构单元,
③结构单元M3是源于含氟乙烯类单体的结构单元
④结构单元N是源于能与M1、M2、M3共聚的乙烯类单体的结构单元表示的聚合物,当M1+M2+M3=100摩尔%时,M1/M2/M3(摩尔%)为1~98/1~98/1~98,是由1~98摩尔%M1、1~98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N组成的含氟聚合物,
结构单元M1是由下记M1-1,
M1-1:
(式中,X1、X2相同或不同,是H或F;X3是H、Cl、CH3、F或CF3;Y1是酸解离性或酸分解性官能团,与酸反应转变成羧基的官能团;R1表示碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n1为0或1;但是当n1为0或者R1中不含氟原子的场合下,X1或X2中至少一个为氟原子,或者X3是氟原子或CF3)表示的、数均分子量为1,000~1000,000的含氟聚合物。
该新颖的含氟聚合物的第2是由
式IV-(1):
-(M1)-(M2)-(M3)-(N)- IV-(1)
②结构单元M1是源于其中有本身是酸解离性或酸分解性基团,与酸反应将变成羧基的官能团的含氟乙烯类单体的结构单元,
②结构单元M2是源于脂环式单体的结构单元,
③结构单元M3是源于含氟乙烯类单体的结构单元
④结构单元N是源于能与M1、M2、M3共聚的乙烯类单体的结构单元表示的聚合物,当M1+M2+M3=100摩尔%时,M1/M2/M3(摩尔%)为1~98/1~98/1~98,是由1~98摩尔%M1、1~98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N组成的含氟聚合物,
结构单元M1是下记M1-2,
M1-2:
(式中,X7、X8、X9、X16相同或不同,表示H或F;Y1是酸解离性或酸分解性官能团,与酸反应能转变成羧基的官能团;R2a是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n6和n9为0或1;n3为0~2的整数;但是当R2a不含氟原子的场合下,X7、X8、X9、X16均含氟原子)表示的、数均分子量为1,000~1000,000的含氟聚合物。
在这些新颖的含氟聚合物中,结构单元M1的具体优选实例,同样优选与本发明的化学增幅型光刻胶组合物使用的、具有酸解离性或酸分解性官能团的含氟聚合物(A)中记载的那些具体实例。
在新颖的含氟聚合物中,结构单元M2的具体优选实例,同样优选与本发明的化学增幅型光刻胶组合物使用的、具有酸解离性或酸分解性官能团的含氟聚合物(A)中记载的那些具体实例。
在新颖的含氟聚合物中,结构单元M3的具体优选实例,同样优选与本发明的化学增幅型光刻胶组合物使用的、具有酸解离性或酸分解性官能团的含氟聚合物(A)中记载的那些具体实例。
在新颖的含氟聚合物中,结构单元N的具体优选实例,同样优选与本发明的化学增幅型光刻胶组合物使用的、具有酸解离性或酸分解性官能团的含氟聚合物(A)中记载的那些具体实例。
在新颖的含氟聚合物中,结构单元M1、M2、M3和N的优选组成例,同样优选与本发明的化学增幅型光刻胶组合物使用的、具有酸解离性或酸分解性官能团的含氟聚合物(A)中记载的那些具体实例。
而且关于新颖含氟聚合物制造方法的优选实例,同样优选与本发明的化学增幅型光刻胶组合物使用的、具有酸解离性或酸分解性官能团的含氟聚合物(A)中记载的那些具体实例。
这些含氟聚合物具有透明性高、折射率低和Tg高的性质,布可以用作光刻胶聚合物,而且还可以很好地用于放反射膜、表膜、光纤和光波导等光学用途之中。
与此第IV发明直接相关的合成例是合成例1、2、6、7、9和10,实施例是实施例37~40、45、46、48~57、59~61、76、77、80~87、94~96、100~101、102~104、108~111,对照例是对照例1和2。
本发明第V(发明V)的公开,涉及含有带酸反应性官能团的特定含氟聚合物作为粘结剂的、化学增幅型光刻胶组合物。
化学增幅型光刻胶是一种含有树脂(聚合物)成分和光酸发生剂成分,在能量射线照射部分使酸发生剂产生酸,利用其催化作用的物质。化学增幅型正像型光刻胶,能量射线照射部分产生的酸因其后的热处理(postexposure bake:PEB)而扩散,通过使树脂等酸解离性或酸分解性官能团脱离的同时再次发生酸,该能量射线照射部分将变成碱溶性的。
对于化学增幅型正像型光刻胶而言,树脂成分是碱溶性的,除这样的树脂成分和酸发生剂之外,其中还有在酸作用下能解离或分解的官能团(保护基),其本身对碱溶性树脂具有抑制溶解的能力,而且其中含有对于在酸作用下上述官能团(保护基)解离后变成碱溶性的溶解抑制剂,而且树脂成分具有在酸作用下能够解离或分解的官能团,其本身虽然不溶或难溶于碱,但是在酸作用下上述官能团(保护基)解离后却变成碱溶性的。
此外化学增幅型负像型光刻胶是这样一种物质,其中的树脂成分一般含有能被酸引发缩合反应性的官能团,而且是碱溶性的,除这种树脂成分和酸发生剂之外,还含有交联剂。
在这样的负像型光刻胶中,被能量射线照射部分产生的酸因PEB而扩散,作用在树脂成分中的酸缩合性官能团和交联剂上,使该能量射线照射部分的粘结剂固化而变成不溶或难溶于碱的。
第V发明(发明V)的化学增幅型光刻胶组合物,是能与上记的正像型和负像型对应的,由:
(A)具有酸反应性基团的含氟聚合物,
(B)光酸发生剂,和
(C)溶剂组成的组合物。
本发明人等发现,具有由一个分子中含酸反应性基团和氟原子或氟代烷基的特定降冰片烯衍生物衍生出来的结构单元的含氟聚合物(A),对真空紫外区光线的透明性特别高,耐腐蚀性、与酸反应性、显影液溶解性等光刻胶特性均优良。
第V发明的化学增幅型光刻胶组合物用、具有酸反应性基团的含氟聚合物(A),是含有结构单元M1的含氟聚合物,而结构单元M1源于式IV-(1)表示的、具有酸反应性基团的含氟脂环式单体:
式V-(1):
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团。当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基)。
以往人们知道,在聚合物中导入降冰片烯骨架后能提高耐干蚀性,但是已有的降冰片烯衍生物就透明性,尤其是真空紫外区的透明性而言尚不充分。本次发现,在降冰片烯衍生物的特定位置上导入氟原子、氟代烷基后,特别能提高真空紫外区的透明性。
此外,过去利用其他乙烯类单体(例如丙烯酸系单体等)的聚合法等虽然能导入光刻胶用聚合物所必须的酸反应性基团,但是那种方法的透明性(特别是真空紫外区的透明性)和耐干蚀性低下。现在发现,在一个降冰片烯衍生物分子中同时导入氟原子和氟代烷基与作为光刻胶所必须的酸反应性基团后,能够使由其聚合得到的含氟聚合物兼备良好的透明性(特别是真空紫外区的透明性)和耐干蚀性。
在形成本发明的含氟聚合物(A)、上式具有酸反应性基团的含氟降冰片烯中,优选A、B、C任意为氟原子的,而且当A~C不含氟原子的场合下,优选R中含氟量60%以上的,从能够赋予聚合物以透明性的观点来看,更优选R为全氟亚烷基的。
具体可以举出:
(n:0~10)、
(n:0-10,X:F或CF3)
等。
本发明的化学增幅型光刻胶组合物用具有酸反应性基团的含氟聚合物(A),是以这些含氟脂环式单体结构单元为必要成分的聚合物。
其中作为具有这些酸反应性基团的含氟脂环式单体重复单元的聚合物,可以优选举出以下一些聚合物:
①由具有式V-(1)酸反应性基团的含氟脂环式单体与乙烯类单体形成的共聚物。
作共聚成分使用的乙烯类单体,例如可以举出乙烯、丙烯、丁烯、氯乙烯等乙烯类单体,丙烯酸类单体,甲基丙烯酸类单体,烯丙基类单体,烯丙基醚类单体,苯乙烯类单体等。
②由具有式V-(1)酸反应性基团的含氟脂环式单体与含氟乙烯类单体形成的共聚物。
作为共聚成分的含氟脂环式单体,例如可以举出四氟乙烯、一氯三氟乙烯、六氟丙烯、CF2=CFRf(Rf是碳原子数1~5的全氟烷基)、偏氟乙烯、氟乙烯、三氟乙烯等,从特别能够赋予透明性观点来看特别优选这些。
③具有式V-(1)的酸反应性基团的含氟脂环式单体的开环聚合物和/或其开环聚合物加氢后的聚合物。
④具有式V-(1)的酸反应性基团的含氟脂环式单体,与下式表示的脂环式单体的开环共聚物和/或该开环共聚物加氢后的共聚物。
(式中,A、B、C和D是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,a是0或者1~3的整数)等。
其中,具有酸反应性基团的含氟聚合物(A),是式V-(2)表示的聚合物:
式V-(2):
-(M1)-(M2)-(N)- V-(2)
①结构单元M1是源于具有式(1)的酸反应性基团的含氟脂环式单体的结构单元,
②结构单元M2是源于含氟乙烯类单体的结构单元,
③结构单元N是源于能与M1、M2共聚的单体的结构单元
当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,优选由1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N组成的聚合物。
这些含氟聚合物由于是使结构单元M1与含氟乙烯类单体同时共聚的,所以从能提高透明性,特别是真空紫外区透明性的角度来看优选。
作为具有酸反应性基团的含氟聚合物(A)的另一种优选的聚合物,是由式V-(3)表示的含氟聚合物,
式V-(3):
-(M1)-(M2)-(M3)-(N)- V-(3)
结构单元M1是源于上记的具有式V-(1)的酸反应性基团的含氟脂环式单体的结构单元,
结构单元M2是源于含氟乙烯类单体的结构单元,
结构单元M3是源于式(4)表示的脂环式单体的结构单元
式(4)
(式中,A1、B1、C1和D1是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基、M1的酸反应性基团之外的官能团,a是0或者1~3的整数)
结构单元N是源于能与M1、M2、M3共聚的单体的结构单元,
其中当M1+M2+M3=100摩尔%时,M1+M3/M2(摩尔%)为30/70~70/30,是由1~98摩尔%M1、1~98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N组成的聚合物。
导入这些结构单元M3后,从能进一步提高耐干蚀性特性来看,而且可以说,从能够在不降低耐干蚀性特性的条件下控制含氟聚合物(A)中酸反应性官能团浓度的观点来看,应当优选。
形成结构单元M3的式(4)的降冰片烯衍生物,可以含有或不含氟原子,可以从公知的降冰片烯或取代的降冰片烯类物质中选择。
构成式V-(2)、V-(3)所示的含氟聚合物(A)的结构单元M2用含氟乙烯类单体,是由下示的结构单元M2-1表示的含氟乙烯类单体衍生出来的结构单元:
结构单元M2-1:
(式中,X13、X14和X18相同或不同,表示H或F;X16表示H、F或CF3;Z2是H、F或Cl;Rf3相同或不同,是碳原子数1~20的含氟亚烷基、碳原子数2~100的具有醚键的含氟亚烷基或碳原子数3~20的含氟亚芳基;n5为0~2的整数;n10为0或1;但是当n10为0的场合下,X13、X14、X18和Z2中至少一个是氟原子或者X15;是氟原子或CF3)。
构成结构单元M2单体的优选实例,可以举出:
CF2=CF2、CF2=CH2、CF2=CFCl、CF2=CFCF3、
CF2=CFO(CF2)nF、CH2=C(CF3)2、
(n:1~5)
CF2=CFH、CF2=CCl2、
(Z2与M2-1中的Rf3相同,n:1-10)
等。
从共聚性能上考虑,其中优选的是碳原子数2或3的乙烯类单体,而且是至少含有一个以上氟原子的单体。
具体实例可以举出四氟乙烯、一氯三氟乙烯、偏氟乙烯、六氟丙烯、氟乙烯等,特别优选四氟乙烯和一氯三氟乙烯。
结构单元N是选择性成分,只要是能与结构单元M1、M2共聚的单体就无特别限制,可以根据目的含氟聚合物的特性要求适当选择。
上述的本发明的化学增幅型光刻胶用含氟聚合物(A)的分子量,可以根据用途、目的、使用状态等在1,000~1,000,000数均分子量范围内选择,优选3,000~700,000,更优选5,000~500,000左右。分子量过低,得到的聚合物覆膜耐热性和机械特性容易变得不足,反之分子量过高,对加工特性不利。特别是目的在于以涂布用材料形态形成薄层覆膜的场合下,分子量过高成膜性不良,所以数均分子量优选200,000以下,特别优选100,000以下。
有关含氟聚合物(A)的具体结构单元M1、M2、M3和N的组合,可以根据预期用途、物理性质(特别是玻璃化转变点等)、功能(透明性和折射率等)从上记例示的单体中作各种选择。
通常结构单元M1具有酸反应性功能(即酸作用前后功能和性状发生变化的功能)和耐干蚀性特性,而M2以及必要时的N能控制其他功能。这些功能和性状的综合平衡则通过选择M1、M2、M3、N的各自种类和存在比例等进行调整。
例如,以光刻胶、特别是以F2光刻胶用途为目标,目的在于获得真空紫外区透明性的场合下,应当使含有M1、M2、M3和N的聚合物全体氟原子含量尽可能高,使氟原子含量处于30重量%以上,优选50重量%以上,更优选60重量%以上,即使从这一点来看也应当优选式V-(2)、V-(3)的聚合物。这样得到的含氟聚合物耐热性优良,非晶形下包括真空紫外区在内的宽广波长范围内透明性高,可以作为光刻胶,特别是F2光刻胶用基础聚合物使用。
特别发现,本发明的式V-(2)、V-(3)的聚合物一般来说真空紫外区的透明性高,因而可以用在F2光刻胶、F2表膜等半导体材料用途等之中。
本发明的化学增幅型光刻胶组合物中,具有酸反应性基团的含氟聚合物(A),由具有酸反应性基团Y2的含氟聚合物组成。酸反应性基团Y2,详细讲是酸解离性或酸分解性的官能团和酸缩合性的官能团。
①酸解离性或酸分解性的官能团:
酸解离性或酸分解性的官能团,是一些与酸反应前不溶或难溶于碱,但是在酸作用下能使其在碱类显影液中溶解的官能团。
具体讲,是一些在酸或阳离子作用下,具有转变成羟基、羧基、磺基等能力,其结果使含氟聚合物本身在碱中溶解的官能团。
基于该性质,可以作为正像型光刻胶基础聚合物使用。
酸解离性或酸分解性官能团,具体优选利用:
(式中,酸解离性或酸分解性官能团Y1可以优选利用
(式中,R7、R8、R9、R10、R11、R12、R14、R15、R18、R19、R20、R21、R22、R24、R25、R26、R27、R28、R29相同或不同,表示碳原子数1~10的烃基;R13、R16是H或碳原子数1~10的烃基;R17、R23是碳原子数2~10的二价烃基))
进一步具体优选的可以举出:
-OC(CH3)3、-OCH2COOC(CH3)3、
-COOC(CH3)3、-OSi(CH3)3
(R30是碳原子数1~10的烷基)
等。
从碱水溶液(显影液)中溶解性优良的观点来看,这些当中优选与酸反应转变成羧基的。具体可以举出:
(式中,R24、R25、R26、R10、R11、R12、R18、R19、R20相同或不同,表示碳原子数1~10的烃基;R’是H或碳原子数1~10的烃基;)等。
其中优选-COOC(CH3)3、-OCH2COOC(CH3)3等。
含有这些酸解离性或酸分解性官能团的含氟聚合物,可以用于上述的正像型光刻胶中。酸解离性或酸分解性官能团也叫作上述的保护基,反应前含氟聚合物(A)本身虽然不溶或难溶于碱,但是能在能量射线照射下因从光酸发生剂(B)中产生的酸而解离或分解,是具有使含氟聚合物(A)转变成碱溶性作用的基团,而且含氟聚合物(A)中官能团分解产生的离去基团也会产生酸,因而具有进一步促进分解反应的效果。
在有这些酸解离性或酸分解性官能团的含氟聚合物中,结构单元M1、M2、M3和N之间的比例,可以根据组合物种类、目标功能和官能团Y2的种类等在上述范围内作各种选择,例如为了与酸反应后的含氟聚合物变成碱溶性的,结构单元M1应当以5~100摩尔%,优选以10~100摩尔%,更优选以20~100摩尔%存在,结构单元M2、M3和N合计应以0~95摩尔%,优选以0~90摩尔%,更优选以0~80摩尔%存在。
②酸缩合反应性官能团
酸缩合反应性官能团,是指在酸反应前溶于或碱(或溶剂),但是在酸作用下能使聚合物本身在碱类显影液(或与上述相同的溶剂)中不溶化的官能团。
具体讲,在酸或阳离子作用下产生自缩合、缩聚的官能团,或者在交联剂存在下,因酸的作用与交联剂产生缩合反应或缩聚反应的官能团,或者在酸或阳离子引起的转位重排反应(例如片哪醇重排、甲醇重排)等中产生极性变化的官能团,无论那种情况其结果使聚合物本身变成不溶于碱(或溶剂)的。
酸缩合性官能团的具体优选实例,可以举出例如从羟基、羧基、氰基、磺基、环氧基等中选出的基团。
具有这些酸致缩合反应性官能团的含氟聚合物,可以用在负像型光刻胶中。酸致缩合反应性的官能团,是一种因能量射线照射从光酸发生剂(B)中产生的酸而产生缩合·缩聚反应或重排反应的官能团,借助于它产生自交联反应、分子内重排反应和由含有交联剂的组合物引发的与交联剂的交联反应等,反应前含氟聚合物(A)本身在显影液(碱或溶剂)中是可溶性的,有使之不溶或难溶的功能。
此外,本发明的缩合反应性的官能团,优选那些与酸反应前其本身能赋予在碱和溶剂等显影液中可溶性功能的基团(例如羧基、磺基、羟基等),但是也可以是仅具有因酸致缩合反应(交联反应)而在显影液中不溶化功能(氰基、环氧基等)的官能团。这种场合下,可以与在显影液中具有可溶性功能的其他官能团组合使用,使含氟聚合物骨架本身形成能在显影液中可溶的结构,作为负像型光刻胶使用。
具有酸致缩合性官能团的含氟聚合物中,特别优选与酸反应前是碱溶性的聚合物,使得显影液不用溶剂(特别是可燃性溶剂)而在水系中的显影过程(溶解过程)成为可能,对安全性和环境有利。
当酸反应性基团Y2是酸致缩合性基团场合下的比例,应使结构单元M1存在5~100摩尔%,优选10~100摩尔%,更优选20~100摩尔%,结构单元M2、M3与N的合量应当存在0~95摩尔%,优选0~90摩尔%,更优选0~80摩尔%。
关于交联剂并无特别限制,可以从过去作为负像型交联剂惯用的那些中任意选择使用。
本发明式V-(1)、式V-(2)和式V-(3)聚合物的特征在于均具有酸反应性官能团Y2。在含氟聚合物中导入这些官能团的方法可以采用一切方法,但是一般可以采用:
①预先合成具有官能团Y2的单体后聚合的方法,
②一旦合成具有其他官能团的聚合物,通过高分子反应使该聚合物的官能团改变导入官能团Y2的方法。
例如作为用方法②导入酸解离性或酸分解性官能团的实例,可以采用:先制成具有羟基的含氟聚合物后,在甲苯磺酸之类酸存在下,使乙基乙烯基醚、二氢吡喃等乙烯基醚类反应导入酸分解性官能团(酮缩醇类)的方法;和使酮类与具有1,2-二醇的含氟聚合物反应,得到酸分解性官能团(环状缩醛化合物)的方法等。
本发明的组合物用含氟聚合物(A),可以采用各种公知的方法,通过使分别相当于各结构单元的具有官能团Y2的含氟降冰片烯单体(M1)、含氟乙烯类单体(M2)以及必要时相当于选择性成分(N)的单体(共)聚合得到。聚合方法可以采用游离基聚合法、阴离子聚合法、阳离子聚合法等,其中从本发明聚合物用各种单体具有良好的游离基聚合特性,进而容易控制组成和分子量等质量指标,以及容易工业化等角度出发,优选采用游离基聚合法。也就是说,为了使聚合引发并以游离基方式进行并不限制手段,但是例如可以采用有机或无机游离基聚合引发剂、热、光或电离射线等来引发聚合。聚合的种类,可以采用溶液聚合、本体聚合、悬浮聚合、乳液聚合等。而且分子量可以通过聚合用的单体浓度、聚合引发剂浓度、链转移剂浓度和温度加以控制。生成的聚合物组成可以由加入的单体组成来控制。
本发明的化学增幅型光刻胶组合物中,光酸发生剂(B)是通过对该物质本身或对含有该物质的光刻胶组合物照射放射线后发生酸或阳离子的化合物。也能以两种以上混合物的形式使用。
本发明的化学增幅型光刻胶组合物中,光酸发生剂(B)的实例,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示同样的物质。
本发明的化学增幅型光刻胶组合物中,光酸发生剂(B)的含量,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的比例。
本发明的光刻胶组合物中,作为能与上记光酸发生剂产生的酸起作用的碱,可以添加有机碱。
添加的有机碱,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的碱。
有机碱的添加量,优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的添加比例相同。
通过添加这些有机碱,可以将与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的同样效果赋予本发明的光刻胶组合物。
而且本发明的化学增幅型光刻胶组合物中,使用具有酸缩合性官能团的含氟聚合物(A)作为负像型光刻胶组合物的场合下,必要时还可以用交联剂。
对于使用的交联剂并无特别限制,优选采用与第I发明所公开(发明I)的化学增幅型光刻胶组合物中所示相同的交联剂。
本发明的光刻胶(特别是负像型)组合物中,所含交联剂的比例优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的使用量相同。
本发明的光刻胶组合物,必要时也可以含有溶解抑制剂、增感剂、染料、粘结性改进剂、保水剂等本领域惯用的各种添加剂。
这种添加剂的具体实例,优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的添加剂。
使用这些添加剂的场合下,其添加量优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的比例相同。
在本发明的化学增幅型光刻胶组合物中,溶剂(C)是能溶解具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)以及上面列示的各种添加剂的物质,只要能获得良好的涂装性(表面平滑性和厚度均一性等)就无特别限制,都可以使用。
优选的溶剂(C),最好采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示相同的溶剂。
这些溶剂(C)的存在比例,优选与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的相同。
本发明的化学增幅型光刻胶组合物的使用方法,可以采用过去在光刻胶技术中光刻胶图形的形成方法,该图形形成方法优选采用与第I发明公开(发明I)的化学增幅型光刻胶组合物中所示的相同方法。
其中发现,采用本发明的化学增幅型光刻胶组合物,能够形成一种真空紫外区透明性也高的光刻胶覆膜(感光层)。借助于它能够很好地用在特别作为今后以0.1微米技术焦点为目标而开发的F2激光(157nm波长)光刻法中。
本发明还涉及基材上包覆由具有酸反应性官能团的含氟聚合物组成的覆膜。
本发明的覆膜,由具有酸反应性官能团的含氟聚合物组成,是包覆了对真空紫外区光线透明性高的该含氟聚合物的覆膜。
可以在本发明覆膜中用的具有酸反应性官能团的含氟聚合物,157nm下的分子消光系数处于3.0微米-1以下,优选1.5微米-1以下,更优选1.0微米-1以下。
基材上包覆有这些真空紫外区透明性高的含氟聚合物的覆膜,由于当然可以在采用F2激光的光刻法中用作光刻胶覆膜(感光层),除此之外,由于还能用于采用F2光刻法的表膜用途中,棱镜等周边光学部件和硅晶片的防反射膜以及棱镜和周边光学部件的非粘着性防污膜等用途之中,所以是优选的。
本发明的覆膜,可以根据目的、目标和用途施于一切基材上。在特别要求透明性的用途和光学用途中,也可以施于硅晶片、玻璃、LiF、CaF2、MgF2等无机基材上,以及丙烯酸树脂、三乙酰纤维素树脂、聚碳酸酯树脂等透明性树脂和其他金属类材料等之上。
膜厚可以根据目的和用途作广泛选择,但是用在以透明性为目标的用途的场合下,膜厚优选1.0微米以下,更优选0.5微米以下,最好处于0.3微米以下。
作为光刻胶的光刻胶覆膜使用本发明覆膜(感光层)的场合下,优选涂布上述化学增幅型光刻胶组合物后形成的覆膜。
本发明的光刻胶覆膜,可以利用旋涂法等涂装方法将上述化学增幅型光刻胶组合物涂布在硅晶片之类支持体上,干燥成形;覆膜中可以含有具有酸反应性官能团的含氟聚合物(A)、光酸发生剂(B)以及其他添加物等固形成分。
本发明光刻胶覆膜的膜厚,通常是1.0微米以下的薄层覆膜,优选0.5~0.1微米厚的薄膜。
此外本发明的光刻胶覆膜,优选真空紫外区透明性高的,从能有效用在采用F2激光(157nm)光线的光刻法的观点来看应当具体优选157nm波长下分子消光系数处于3.0微米-1以下,更优选1.5微米-1以下,特别优选1.0微米-1以下的。
包覆有本发明光刻胶覆膜的基材,可以同样利用过去使用光刻胶的各种基材。例如可以是硅晶片、设有有机或无机防反射膜的硅晶片以及玻璃基板等。特别是设有有机防反射膜的硅晶片,其灵敏度和剖面形状均良好。
本发明(发明V)的第2涉及新颖的含氟聚合物。
本发明V含氟聚合物的第1,是源于具有酸反应性官能团的新颖含氟降冰片烯衍生物的结构单元的聚合物,详细讲是源于式V-(1)表示的含有带酸反应性基团含氟脂环式单体的结构单元而且数均分子量为1,000~1,000,000的含氟聚合物
式V-(1):
(式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性官能团。b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基)。
本发明V的新颖含氟聚合物的第2,是式V-(2)表示的含氟聚合物,
式V-(2):
-(M1)-(M2)-(N)- V-(2)
①结构单元M1是源于具有式(1)的酸反应性基团的含氟脂环式单体的结构单元,
②结构单元M2是源于含氟乙烯类单体的结构单元,
③结构单元N是源于能与M1、M2共聚单体的结构单元,
其中当M1+M2=100摩尔%时,M1/M2(摩尔%)为1~99/1~99,是由1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N组成的、数均分子量为1,000~1,000,000的含氟聚合物。
本发明V的新颖含氟聚合物的第3是由式V-(3)表示的含氟聚合物,
式V-(3):
-(M1)-(M2)-(M3)-(N)- V-(3)
结构单元M1是源于上记的具有式V-(1)的酸反应性基团的含氟脂环式单体的结构单元,
结构单元M2是源于含氟乙烯类单体的结构单元,
结构单元M3是源于式(4)表示的脂环式单体的结构单元
式(4)
(式中,A1、B1、C1和D1是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基;a是0或者1~3的整数)
结构单元N是源于能与M1、M2、M3共聚的单体的结构单元,
其中当M1+M2+M3=100摩尔%时,M1+M3/M2(摩尔%)为30/70~70/30,是由1-98摩尔%M1、1-98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N组成的、数均分子量为1,000~1,000,000的含氟聚合物。
这些新颖的含氟聚合物中具体优选的结构单元M1,同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
这些新颖的含氟聚合物中具体优选的结构单元M2,同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
这些新颖的含氟聚合物中具体优选的结构单元M3,同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
这些新颖的含氟聚合物中具体优选的结构单元N,同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
而且构成新颖的含氟聚合物的结构单元M1、M2、M3和N的优选组成实例(组成比等),同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
此外有关构成新颖的含氟聚合物的结构单元M1中酸反应性基团的优选实例,同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
有关新颖的含氟聚合物制造方法的优选实例,同样可以例示出与本发明的化学增幅型光刻胶组合物用并于具有酸反应性基团的含氟聚合物(A)中记载的实例。
这三种新颖的含氟聚合物特征是具有源于式V-(1)表示的新颖降冰片烯衍生物的结构单元,这些新颖的降冰片烯衍生物可以采用各种方法制得,但是一般能够利用具有酸反应性基团Y2的含氟乙烯类单体与环戊二烯之间的Diers-Alder反应得到。
这些含氟聚合物,具有透明性高、折射率低、Tg高的性质,其中从具有酸反应性、酸缩合性(交联性)的官能团的角度出发,不仅在光刻胶用途中,而且在防反射膜、表膜光线和光波导等光学用途中也能充分利用。
其中,与此第V发明直接相关的合成例是合成例8~10,实施例是实施例36、41~44、58、78、79、97~99、105~107,对照例是对照例1和2。
实施例
以下通过实施例等说明本发明,但是本发明不受这些实施例等丝毫限制。
合成例1(具有-OC-(CH3)3基团的含氟丙烯酸酯的合成)
向具有回流冷凝器、温度计、搅拌机和滴液漏斗的1升玻璃四口烧瓶中,加入400克二氯甲烷、103.6克叔丁醇和111克三乙胺,用冰保持在5℃。
氮气流下边搅拌,边在大约60分钟内滴入92克α-氟代丙烯酰氟(CH2=CFCOF)。
滴加终止后将温度提高至室温,继续搅拌1.5小时。
反应终止后的混合物经水洗后,有机层用无水硫酸镁干燥后,蒸馏得到105克α-氟代丙烯酸叔丁酯(CH2=CFCOOC(CH3)3)。经气相色谱-质谱、19F-NMR、1H-NMR和IR分析,鉴定确定了结构。
实施例1(具有-OC-(CH3)3基团的含氟丙烯酸酯共聚物的合成)
在备有回流冷凝器、温度计、搅拌机和滴液漏斗的200毫升玻璃四口烧瓶中,将12克CH2=CFCOOC(CF3)2、2.5克合成例1得到的CH2=CFCOOC(CH3)3溶解在50克乙酸乙酯中,边搅拌边通氮气泡大约30分钟。
接着加入0.207克巯基乙酸异辛酯和0.052克2,2-偶氮双异丁腈(AIBN),65℃下加热搅拌5小时。得到了粘度高的聚合物溶液。
将聚合物溶液注入大量正己烷中,使聚合物析出。取出析出的聚合物干燥后,分离出10.5克聚合物。聚合物的组成,经19F-NMR分析为具有CH2=CFCOOC(CH3)3∶CH2=CFCOOC(CF3)2=23∶77摩尔%结构单元的聚合物。元素分析结果:氟原子45.48重量%,经GPC分析得出数均分子量(Mn)为160,000,经DSC分析得出的玻璃化转变点(Tg)为123℃。
实施例2(具有-OC-(CH3)3基的含氟丙烯酸酯共聚物的合成)
在与实施例1同样的装置中,除了使用8.9克CH2=CFCOOC(CF3)2、5.3克合成例1得到的CH2=CFCOOC(CH3)3、0.047克巯基乙酸异辛酯和0.014克AIBN、在70℃下反应5小时之外,与实施例1同样进行聚合和聚合物精制,得到了8.5克聚合物。
聚合物的组成,经19F-NMR分析是具有CH2=CFCOOC(CH3)3∶CH2=CFCOOC(CF3)2=47∶53摩尔%结构单元的聚合物。元素分析结果:氟原子38.64重量%,GPC分析得出Mn为50,000,DSC分析得出的Tg为130℃。
实施例3(具有羟基的含氟烯丙基醚均聚物的合成)
在备有搅拌装置的100毫升玻璃烧瓶中,加入20.4克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂壬烯醇)
和8.6克8.0重量%[H(CF2CF2)3-COO-]2的全氟己烷溶液,用氮气充分置换后,在氮气流和20℃下搅拌24小时。生成了高粘度的固体。
将得到的固体溶解在二乙醚中后注入全氟己烷中,经分离和干燥得到了18.6克无色透明的聚合物。经19F-NMR分析和IR分析,是一种仅由上记含氟烯丙基醚结构单元组成、侧链末端具有羟基的含氟聚合物。以四氢呋喃(THF)作溶剂进行GPC分析得出,数均分子量为21,000。
实施例4(具有羟基的含氟烯丙基醚均聚物的合成)
除使用12克全氟-(1,1,6,6-四氢-2-三氟甲基-3-氧杂己醇)
代替全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂壬烯醇)之外,与实施例3同样进行聚合物和精制,得到了10.5克无色透明的聚合物。
经19F-NMR分析和IR分析,是一种仅由上记含氟烯丙基醚结构单元组成、侧链末端具有羟基的含氟聚合物。GPC分析得出数均分子量为7,300。
合成例2(具有-OCH2COOC(CH3)3基的含氟烯丙基醚的合成)
在与合成例1同样的200毫升玻璃四口烧瓶中,加入50毫升四氢呋喃、氮气流下加入预先用己烷洗净的7.8克氢化钠(60%)后,冷却到5℃,缓缓滴加80克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇),
再于室温下搅拌1小时。接着在30分钟内滴加30克氯代乙酸叔丁酯:ClCH2COOC(CH3)3,室温下搅拌2小时。
将混合物置于500毫升中,分离有机层后经水洗、干燥和蒸馏,得到了58.0克下式:
所示具有酸解离性基团的含氟烯丙基醚,沸点为75~77℃/7mmHg。
经19F-NMR、1H-NMR和IR分析,鉴定和确认为上记单体。
实施例5(带-OCH2COOC-(CH3)3基的含氟烯丙基醚聚合物的合成)
除了使用6.7克合成例2得到的具有酸解离性基团含氟烯丙基醚:
和15.3克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇):
代替全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)之外,与实施例3同样进行聚合和聚合物精制,得到了19.3克无色透明的聚合物。
经19F-NMR和1H-NMR分析,聚合物是上记各单体的结构单元-OCH2COOC-(CH3)3基含氟烯丙基醚∶-CH2OH基含氟烯丙基醚=26∶74摩尔%的共聚物。
经GPC分析,数均分子量为14400。
实施例6(带-OCH2COOC-(CH3)3基的含氟烯丙基醚聚合物的合成)
除了使用13.45克合成例2得到的具有酸解离性基团的含氟烯丙基醚:
和10.2克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇):
之外,与实施例5同样进行聚合和聚合物精制,得到了20.1克无色透明的聚合物。
经19F-NMR和1H-NMR分析,此聚合物是上记各单体的结构单元-OCH2COOC-(CH3)3基含氟烯丙基醚∶-CH2OH基含氟烯丙基醚=43∶57摩尔%的共聚物。
经GPC分析,数均分子量为13200。
实施例7(带羟基的含氟烯丙基醚聚合物的1-乙氧基乙基化)
在备有回流冷凝器、温度计、搅拌机和滴液漏斗的100毫升玻璃四口烧瓶中,将10.0克实施例3得到的具有羟基的烯丙基醚均聚物加入50毫升二乙醚中完全溶解后,使0.23克对甲苯磺酸一水合物溶解。氮气流和室温下边搅拌,边在30分钟内滴加10毫升二乙醚中溶解有0.44克乙基乙烯基醚的溶液。
将反应后的混合物注入500毫升正己烷中使聚合物析出,经分离、干燥后得到了9.1克无色透明的聚合物。经19F-NMR和1H-NMR分析,此聚合物的1-乙氧基乙基化率(1-乙氧基乙基在羟基和1-乙氧基乙基合量中的比例)为15摩尔%。
此物质是结构单元组成为带基团:
GPC分析得出的数均分子量为20200。
实施例8(带羟基的含氟烯丙基醚聚合物的1-乙氧基乙基化)
除使用0.88克乙基乙烯基醚以外,与实施例7同样进行1-乙氧基乙基化反应和聚合物精制,得到了9.5克无色透明的聚合物。
经19F-NMR和1H-NMR分析,此聚合物的1-乙氧基乙基化率为38摩尔%。
此物质是结构单元组成为带基团:
基的含氟烯丙基醚/带基团-CH2OH含氟烯丙基醚=38/62摩尔%的共聚物。
GPC分析得出的数均分子量为19200。
合成例3(带
基的含氟烯丙基醚的合成)
在与合成例1同样的玻璃四口烧瓶中,使50毫升二氯甲烷、80克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)和0.02克对甲苯磺酸一水合物溶解。边搅拌边在室温下于30分钟内滴加17.6克二氢吡喃后,
于室温下继续搅拌6小时。蒸馏反应后的混合物,得到了63.4克具有:
基的含氟烯丙基醚:
沸点为74~76℃/4mmHg。
经19F-NMR、1H-NMR和IR分析,确认了结构。
实施例9(带
除了使用12.3克合成例3得到的具有酸解离性基团:
的含氟烯丙基醚和10.2克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇):
代替全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬醇)之外,与实施例3同样进行聚合和聚合物精制,得到了19.1克无色透明的聚合物。
经19F-NMR和1H-NMR分析,此聚合物由上记各单体的结构单元组成,是带
GPC分析得出的数均分子量为10200。
实施例10(带羟基的含氟环状聚合物的合成)
向备有搅拌装置的200毫升玻璃烧瓶中,加入6.1克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)、
6.7克全氟(5,5-二氢烯丙基乙烯基醚)[CH2=CFCF2OCF=CF2]、160克HFC-225(CF3CF2CHCl2/CClF3CF2CHClF的混合物)和6.9克[H(CF2CF2)3-COO]2-的8.0重量%的全氟己烷溶液,用氮气充分置换后,在氮气流和20℃下搅拌24小时。用蒸发器将反应混合物中溶剂蒸馏除去浓缩后,注入己烷中析出聚合物,经过分离和干燥后,得到了10.2克无色透明的聚合物。
所得到的聚合物对丙酮、乙酸乙酯、乙酸丁酯、THF等的溶解性良好。
聚合物经IR分析,可以看到羟基的吸收,但是没有发现双键的吸收(1400~1700埃范围)。
而且经19F-NMR和1H-NMR分析,聚合物为显示有以下任意环状结构:
结构单元的比例(a/b)为65/35摩尔%的共聚物。
GPC分析得出的数均分子量为18300。
或
或
实施例11(带羟基的环状聚合物的1-乙氧基乙基化)
在与实施例7同样的100毫升玻璃四口烧瓶中,加入10.0克实施例10得到的具有羟基的环状聚合物和50毫升二乙醚,使之完全溶解后,再使0.012克对甲苯磺酸一水合物溶解。氮气流和室温下边搅拌,边在30分钟内滴加10毫升二乙醚中溶解有1.1克乙基乙烯基醚溶液。
与实施例7同样从反应后的溶液中分离聚合物,得到了9.6克无色透明的聚合物。
IR分析证明羟基消失,经19F-NMR和1H-NMR分析,此聚合物的1-乙氧基乙基化率为100摩尔%。
即为实施例10记载的环状结构单元/带
基的烯丙基醚结构单元比为65/35摩尔%的共聚物。
GPC分析得出的数均分子量为17500。
实施例12(带羟基和磺基的含氟聚合物的合成)
除使用2.2克带-SO2F基的全氟乙烯基醚
和18.4克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)
代替全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)之外,与实施例3同样进行聚合和聚合物精制,得到了17.8克无色透明的聚合物。
将得到的聚合物浸入10%氢氧化钠水溶液中使之水解,再浸入1N盐酸水溶液中中和,水洗后干燥,得到了16.1克聚合物。
经19F-NMR、1H-NMR和IR分析,上记各单体的结构单元为含磺基的全氟乙烯基醚/含羟基的含氟烯丙基醚=8.7∶91.3摩尔%的共聚物。
实施例13(带羟基和羧基的含氟烯丙基醚聚合物的合成)
除使用10.7克全氟(9,9-二氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯酸)
和10.2克全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)
代替全氟-(1,1,9,9-四氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯醇)之外,与实施例3同样进行聚合和聚合物精制,得到了16.5克无色透明的聚合物。
经19F-NMR和1H-NMR分析,上记各单体的结构单元:含羧基的含氟烯丙基醚/含羟基的含氟烯丙基醚=53∶47(摩尔%)的共聚物。
实施例14~24(涂布用组合物的制备和真空紫外区157nm透明性的测定)
(1)涂布用组合物的制备
将具有表1所示官能团的含氟聚合物(A)、光酸发生剂(B)和溶剂(C)按照表1所示比例混合、溶解,然后用0.5微米PTEE制的膜过滤器过滤。
作为光酸发生剂使用了S-(三氟甲基)-硫鎓三氟甲磺酸盐:
(2)涂布
①在透明性测定用基材(MgF2)上的涂布
用旋涂器在室温下和1000转条件下将各涂布用组合物涂布在MgF2基板上。涂布后在100℃烧成15分钟,制成透明性覆膜。
②厚度测定
除了用硅晶片代替MgF2基板之外,在上述同样条件下用各种涂布用组合物在硅晶片上形成覆膜。
用AFM装置(精工电子株式会社制,SPI3800)测定了覆膜的厚度。结果示于表1之中。
(3)真空紫外区透明性的测定
①测定装置
·濑谷—波冈型分光装置(高能研究机构:BL-7B)
·狭缝7/8-7/8
·检出器PMT
·衍射光栅(GII:闪耀波长160nm,1200条/mm)
·光学系统 参照H.Namba等著Rev.Sic.Instrum.60卷第7期1917页(1989年)。
②透过光谱的测定
用各种涂布用组合物和(2)①方法在MgF2基板上形成覆膜,使用上述装置测定该覆膜在200~100nm波长下的透过光谱。
157nm下从中透过的透过率(%)示于表1之中。进而由透过率和覆膜厚度计算出分子消光系数,也示于表1之中。
表1
1)光酸发生剂:S-(三氟甲基)-硫鎓三氟甲磺酸盐
实施例25(酸反应性的确认)
将实施例6得到的1.0克具有-OCH2COOC-(CH3)3基的含氟烯丙基醚聚合物,50℃下在0.1N盐酸水溶液中浸渍1小时。然后将未浸渍在上记盐酸水溶液中的实施例6得到的1.0克聚合物分别于50℃下在2.38%四甲基氢氧化铵水溶液中浸渍1小时。
在实施例6的聚合物本身在上记碱水溶液中不溶,而实施例6的聚合物经盐酸水溶液浸渍过的却完全溶解在碱水溶液之中。
实施例26(带羧基的含氟烯丙基醚和偏氟乙烯共聚物的合成)
向备有阀门、压力计和温度计的100毫升不锈钢制高压釜中,加入3.52克全氟-(9,9-二氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯酸):
50毫升全氟己烷及0.1克二正丙基过碳酸酯(NPP),边用干冰/甲醇液冷却,边用氮气充分置换系统内气体。然后经阀门加入8.9克偏氟乙烯(VdF),在40℃下振动反应20小时。反应进行过程中,表压从反应前的12.8千克力/平方厘米,降低到9.8千克力/平方厘米。
放出未反应的单体后,取出析出的固形物,将其溶解在二乙醚中,用己烷和甲苯混合溶剂(50/50)再沉淀,分离共聚物。真空干燥至恒重后,得到了4.8克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物组成比:VdF/带羧基的含氟烯丙基醚为81/19摩尔%的共聚物。
实施例27(带羟基的乙烯基醚和四氟乙烯共聚物的合成)
向与实施例26同样的高压釜中,加入12克2-羟基乙基乙烯基醚、40毫升HFC-225(与实施例10相同者)和0.95克二正丙基过碳酸酯(NPP),边用干冰/甲醇液冷却,边用氮气充分置换系统内气体。然后经阀门加入13.8克四氟乙烯(TFE),在40℃下振动反应12小时。反应进行过程中,表压从反应前的12.8千克力/平方厘米,降低到9.0千克力/平方厘米。
放出未反应的单体后,取出析出的固形物,将其溶解在丙酮中,用己烷和苯混合溶剂(50/50)再沉淀,分离共聚物。真空干燥至恒重后,得到了6.5克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物组成比:TFE/2-羟基乙基乙烯基醚为52/48摩尔%的共聚物。
合成例4(带
基的含氟丙烯酸酯的合成)
在备有回流冷凝器、温度计、搅拌机和滴液漏斗的500毫升玻璃四口烧瓶中,加入150毫升二氯甲烷、40.4克全氟苯酚:
和30.1克三甲胺,用冰冷却并保持在5℃。
氮气流下边搅拌边于30分钟内滴加25克α-氟代丙烯酰氟(CF2=CFCOF)。
滴加终止后,将温度升至室温,继续搅拌2.5小时。
反应终止后的反应混合物经水洗后,有机层用无水硫酸镁干燥,然后蒸馏,得到了47克(56~57℃/7.0mmHg)全氟苯基-α-氟代丙烯酸酯:
经气相色谱-质谱、19F-NMR、1H-NMR和IR分析鉴定,确定了其结构。
合成例5(带
基的含氟丙烯酸酯的合成)
除了用21克苯酚代替合成例4中的全氟苯酚之外,与合成例4同样进行反应后,得到了28克苯基-α-氟代丙烯酸酯:
经气相色谱-质谱、19F-NMR、1H-NMR和IR分析鉴定,确定了其结构。
实施例28(全氟苯基-α-氟代丙烯酸酯单聚物的合成)
在与实施例3同样的100毫升玻璃烧瓶中加入合成例4得到的7克全氟苯基-α-氟代丙烯酸酯和20毫升乙酸乙酯,边搅拌边用氮气鼓泡大约30分钟。然后加入0.06克2,2-偶氮双异丁腈(AIBN),60℃下加热搅拌3小时。得到了粘度高的聚合物溶液。
将此聚合物溶液加入到乙酸乙酯和甲醇混合液(50/50)中,使聚合物析出后取出,再将其溶解在N-甲基吡咯烷酮中,用乙酸乙酯和甲醇混合液(50/50)再沉淀,进行干燥后,得到了4.5克单聚物。
实施例29(苯基-α-氟代丙烯酸酯单独聚合物的合成)
除使用4.5克合成例5得到的苯基-α-氟代丙烯酸酯,代替实施例28中的全氟苯基-α-氟代丙烯酸酯之外,与实施例28同样进行单独聚合物的合成后,得到了3.2克单独聚合物。
实施例30~35(真空紫外区157nm透明性的测定)
在以下工序中进行了真空紫外区157nm透明性的测定。
(1)涂布用组合物的制备
将表2所示的含氟聚合物和溶剂,按照表2记载的比例混合溶解,然后用0.5微米的PTEE膜过滤器过滤。
(2)涂布
与实施例14同样在MgF2基材上进行涂布和膜厚测定,结果示于表2之中。
(3)真空紫外区157nm透明性的测定
与实施例14同样测定透过光谱,计算出157nm下的透过率和分子消光系数。结果示于表2之中。
表2
实施例36(含氟降冰片烯的合成)
在备有回流冷凝器、温度计、搅拌机和滴液漏斗的300毫升玻璃四口烧瓶中,加入61克环戊二烯、26克合成例1得到的叔丁基-α-氟代丙烯酸酯、50毫升四氢呋喃和0.1克氢醌,保温在25℃。
在氮气流下边搅拌边滴入4.0克三氟化硼·二乙醚配合物,滴加终止后室温下搅拌反应48小时。
反应终止后,蒸馏除去四氢呋喃,取出残余物,加水,用二氯甲烷萃取。二氯甲烷层用5%碳酸氢钠水溶液洗涤后,有机层用无水硫酸镁干燥。
干燥后分离有机层,用蒸发器蒸发除去二氯甲烷后,蒸馏得到14克带酸反应性基团的含氟降冰片烯(70~72℃/2mmHg):
经气相色谱-质谱、19F-NMR和1H-NMR分析鉴定,确定了其结构。
实施例37(降冰片烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入10.5克双环[2.2.1]庚-2-烯(2-降冰片烯)、16.2克合成例1得到的叔丁基-α-氟代丙烯酸酯、140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入22.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的7.5千克力/平方厘米降低到4.2千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了36.5克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2-降冰片烯/叔丁基-α-氟代丙烯酸酯=11/20/69(摩尔%)的共聚物。
GPC分析结果得出数均分子量为23000。
实施例38(降冰片烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入10.5克2-降冰片烯、16.2克合成例1得到的叔丁基-α-氟代丙烯酸酯、140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边用氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.8千克力/平方厘米降低到8.5千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了24.5克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2-降冰片烯/叔丁基-α-氟代丙烯酸酯=19/22/59(摩尔%)的共聚物。
GPC分析结果得出数均分子量为17000。
实施例39(降冰片烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入10.5克2-降冰片烯、9.8克合成例1得到的叔丁基-α-氟代丙烯酸酯、140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.8千克力/平方厘米降低到9.0千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了20.9克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/2-降冰片烯/叔丁基-α-氟代丙烯酸酯=31/30/39(摩尔%)的共聚物。
GPC分析结果得出数均分子量为9800。
实施例40(降冰片烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入11.8克2-降冰片烯、9.8克合成例1得到的叔丁基-α-氟代丙烯酸酯、140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.2千克力/平方厘米降低到9.1千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了18.0克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/2-降冰片烯/叔丁基-α-氟代丙烯酸酯=45/35/20(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4300。
实施例41(四氟乙烯和含氟降冰片烯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入15.9克实施例36中得到的含氟降冰片烯、140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入30.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.2千克力/平方厘米降低到9.6千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了8.5克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/含氟降冰片烯=50/50(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4600。
实施例42(降冰片烯、四氟乙烯和含氟降冰片烯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入7.0克2-降冰片烯、47.5克实施例36中得到的含氟降冰片烯、140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入30.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.1千克力/平方厘米降低到9.3千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了13.5克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/2-降冰片烯/含氟降冰片烯=50/14/36(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4600。
实施例43(降冰片烯、四氟乙烯和含氟降冰片烯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入14克2-降冰片烯、31克实施例36中得到的含氟降冰片烯、140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用于冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入30.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.2千克力/平方厘米降低到8.9千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了17.5克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/2-降冰片烯/含氟降冰片烯=53/25/22(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4000。
实施例44(降冰片烯、四氟乙烯和含氟降冰片烯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入27.3克2-降冰片烯、47.4克实施例36中得到的含氟降冰片烯、140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入30.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.1千克力/平方厘米降低到9.5千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了16.5克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/2-降冰片烯/含氟降冰片烯=56/29/15(摩尔%)的共聚物。
GPC分析结果得出数均分子量为5300。
实施例45(降冰片烯、四氟乙烯和含氟烯丙基醚共聚物的合成)
向与实施例26同样的300毫升高压釜中加入17.0克2-降冰片烯、39.1克合成例2得到的含氟烯丙基醚、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.0千克力/平方厘米降低到9.5千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了9.0克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/2-降冰片烯/含氟烯丙基醚=50/34/16(摩尔%)的共聚物。
GPC分析结果得出数均分子量为3900。
合成例6(带-COO(CH3)3的含氟烯丙基醚的合成)
向与合成例1同样的300毫升四口玻璃烧瓶中加入50毫升吡啶,氮气流下加入50克二氯亚砜后,冷却到5℃,缓缓滴加84克全氟-(9,9-二氢-2,5-双三氟甲基-3,6-二氧杂-8-壬烯酸):
进而在冰冷却下搅拌3小时后,减压蒸馏除去过量的二氯亚砜和溶剂,得到了反应混合物。预先向与合成例1同样的200毫升四口玻璃烧瓶中加入50毫升三乙胺、50毫升二氯甲烷和20克叔丁醇,冷却到5℃后,缓缓滴加此反应混合物,滴加终止并恢复至室温后再搅拌12小时。将混合物放入500毫升1N盐酸中,分离有机层后水洗、干燥和蒸馏,得到了76.0克具有下示所示的酸解离性基团的含氟烯丙基醚,沸点42~46/0.2mmHg:
利用19F-NMR、1H-NMR和IR分析,鉴定了上述单体,确认了结构。
实施例46(降冰片烯、四氟乙烯和含氟烯丙基醚共聚物的合成)
向与实施例26同样的300毫升高压釜中加入17.0克2-降冰片烯、33.2克合成例6得到的含氟烯丙基醚、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.3千克力/平方厘米降低到9.4千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了12.0克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2-降冰片烯/含氟烯丙基醚=47/40/13(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4400。
实施例47(四氟乙烯和含氟乙烯基醚共聚物的合成)
向与实施例26同样的100毫升高压釜中加入24.5克含氟乙烯基醚:CH2=CHOCH2CH2(CF2)7CF3
40毫升HCFC-141b和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.0千克力/平方厘米降低到3.4千克力/平方厘米。
放出未反应的单体后,取出聚合物后用HCFC-141b、甲醇、己烷洗涤,分离共聚物。真空干燥至恒重,得到了16.5克共聚物。
经19F-NMR和1H-NMR分析得出,TFE/含氟乙烯基醚=51/49(摩尔%)。
实施例48~57(降冰片烯、四氟乙烯和叔丁基-α-丙烯酸酯共聚物的脱保护以及在碱显影液中的溶解性)
(1)脱保护
在100毫升茄形烧瓶中,将5克各种降冰片烯、四氟乙烯和叔丁基-α-丙烯酸酯共聚物溶解在80克二氯甲烷中,加入表3所示的三氟乙酸,室温下搅拌12小时。反应后,减压蒸馏除去过量的三氟乙酸和二氯甲烷。残留的固体成分用蒸馏水洗涤数次,溶解在四氢呋喃中用己烷再沉淀,分离共聚物。由19F-NMR和1H-NMR分析结果计算出脱保护率。结果示于表3之中。
(2)涂布
与实施例14同样将得到的共聚物溶解在丙二醇单乙基醚乙酸酯(PGMEA)中后,涂布在硅基片上。
(3)在碱显影液中的溶解性
将2.38%四甲基氢氧化铵水溶液低聚物在涂布了共聚物的硅基片上,评价溶解性能。结果示于表3之中。
表3
| 实施例号 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 |
| 含氟聚合物 | 实施例37 | 实施例37 | 实施例37 | 实施例38 | 实施例38 | 实施例38 | 实施例39 | 实施例39 | 实施例39 | 实施例40 |
| 三氟乙酸(g) | 4 | 8 | 16 | 4 | 8 | 16 | 4 | 8 | 16 | 16 |
| 脱保护率(%) | 5 | 44 | 68 | 10 | 58 | 75 | 32 | 55 | 84 | 90 |
| COOH含量(%) | 4 | 30 | 46 | 6 | 34 | 44 | 13 | 21 | 33 | 18 |
| 碱性显影液中的溶解性 | 不溶 | 溶解 | 溶解 | 不溶 | 溶解 | 溶解 | 不溶 | 有部分残渣 | 溶解 | 有部分残渣 |
实施例58(四氟乙烯和含氟降冰片烯共聚物的脱保护及在碱显影液中的溶解性)
与实施例48同样方式评价了实施例41得到的含氟聚合物的脱保护和在碱显影液中的溶解性。将用16克三氟乙酸脱保护的样品溶解在2.38%的四甲基氢氧化铵水溶液中。
实施例59(环戊烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入3.4克环戊烯、1.5克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的8.0千克力/平方厘米降低到7.7千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了1.7克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/环戊烯/叔丁基-α-氟代丙烯酸酯=18/41/41(摩尔%)的共聚物。
GPC分析结果得出数均分子量为15000。
实施例60(环戊烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入1.7克环戊烯、1.5克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的8.0千克力/平方厘米降低到7.7千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.9克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/环戊烯/叔丁基-α-氟代丙烯酸酯=29/36/36(摩尔%)的共聚物。
GPC分析结果得出数均分子量为14000。
实施例61(环戊烯、四氟乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入3.4克环戊烯、3.6克叔丁基甲基丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的8.0千克力/平方厘米降低到7.9千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了3.8克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/环戊烯/叔丁基甲基丙烯酸酯=13/17/70(摩尔%)的共聚物。
GPC分析结果得出数均分子量为5800。
实施例62(环戊烯、四氟乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入1.7克环戊烯、1.5克叔丁基甲基丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的9.0千克力/平方厘米降低到8.9千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.8克共聚物。
经19F-NMR和1H-NMR分析,此共聚物是组成比为TFE/环戊烯/叔丁基甲基丙烯酸酯=34/37/29(摩尔%)的共聚物。
GPC分析结果得出数均分子量为5600。
实施例63((全氟辛基)乙烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入17.8克(全氟辛基)乙烯(CH2=CH(CF2)7CF3)、5.9克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入8.0克四氟乙烯(TFE),40℃下使之振动反应18小时。随着反应的进行,表压由反应前的7.8千克力/平方厘米降低到7.5千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了7.8克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/(全氟辛基)乙烯/叔丁基-α-氟代丙烯酸酯=9/9/82(摩尔%)的共聚物。
GPC分析结果得出数均分子量为170000。
实施例64((全氟辛基)乙烯、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入22.3克(全氟辛基)乙烯、1.5克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下使之振动反应18小时。随着反应的进行,表压由反应前的7.0千克力/平方厘米降低到5.0千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了3.0克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/(全氟辛基)乙烯/叔丁基-α-氟代丙烯酸酯=15/19/66(摩尔%)的共聚物。
GPC分析结果得出数均分子量为89000。
实施例65((全氟辛基)乙烯、四氟乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入22.3克(全氟辛基)乙烯、1.5克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下使之振动反应18小时。随着反应的进行,表压由反应前的6.5千克力/平方厘米降低到5.5千克力/平方厘米。
放出未反应的单体后,取出聚合溶液浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.0克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/(全氟辛基)乙烯/叔丁基甲基丙烯酸酯=37/30/33(摩尔%)的共聚物。
GPC分析结果得出数均分子量为8100。
实施例66((全氟辛基)乙烯、四氟乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入22.3克(全氟辛基)乙烯、0.71克合成例1得到的叔丁基甲基丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下使之振动反应18小时。随着反应的进行,表压由反应前的6.5千克力/平方厘米降低到6.2千克力/平方厘米。
放出未反应的单体后,取出聚合溶液后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了1.5克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/(全氟辛基)乙烯/叔丁基甲基丙烯酸酯=34/36/30(摩尔%)的共聚物。
GPC分析结果得出数均分子量为13000。
实施例67(烯丙醇、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入2.4克烯丙醇(CH2=CHCH2OH)、5.8克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入8.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的6.2千克力/平方厘米降低到6.0千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了7.0克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/烯丙醇/叔丁基-α-氟代丙烯酸酯=8/39/53(摩尔%)的共聚物。
GPC分析结果得出数均分子量为12000。
实施例68(烯丙醇、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入2.9克烯丙醇、1.5克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的9.2千克力/平方厘米降低到8.2千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.4克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/烯丙醇/叔丁基-α-氟代丙烯酸酯=20/55/25(摩尔%)的共聚物。
GPC分析结果得出数均分子量为12000。
实施例69(4,4-二-三氟甲基-1-丁烯-4-醇、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入11.2克4,4-二-三氟甲基-1-丁烯-4-醇THF加成物(CH2=CHCH2C(CF3)2OH·THF)、2.9克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入8.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的6.5千克力/平方厘米降低到6.2千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了5.9克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/4,4-二-三氟甲基-1-丁烯-4-醇/叔丁基-α-氟代丙烯酸酯=19/33/48(摩尔%)的共聚物。
GPC分析结果得出数均分子量为28000。
实施例70(4,4-二-三氟甲基-1-丁烯-4-醇、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入14.0克4,4-二-三氟甲基-1-丁烯-4-醇THF加成物、0.73克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入8.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的8.0千克力/平方厘米降低到7.0千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.6克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/4,4-二三氟甲基-1-丁烯-4-醇/叔丁基-α-氟代丙烯酸酯=23/46/31(摩尔%)的共聚物。
GPC分析结果得出数均分子量为17000。
实施例71(4,4-二-三氟甲基-1-丁烯-4-醇、四氟乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入14.0克4,4-二-三氟甲基-1-丁烯-4-醇THF加成物、3.6克合成例1得到的叔丁基甲基丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的8.0千克力/平方厘米降低到7.9千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了3.3克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/4,4-二-三氟甲基-1-丁烯-4-醇/叔丁基甲基丙烯酸酯=10/35/55(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4900。
实施例72(4,4-二-三氟甲基-1-丁烯-4-醇、四氟乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入14.0克4,4-二三氟甲基-1-丁烯-4-醇THF加成物、0.72克合成例1得到的叔丁基甲基丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.3克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的8.0千克力/平方厘米降低到7.9千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.3克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/4,4-二三氟甲基-1-丁烯-4-醇/叔丁基甲基丙烯酸酯=44/16/40(摩尔%)的共聚物。
GPC分析结果得出数均分子量为6100。
实施例73((全氟辛基)乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向备有温度计、滴液漏斗、回流管和三通塞的100毫升四口烧瓶中,加入30毫升乙酸丁酯和0.5克AIBN。系统内用氮气充分置换后,在氮气气氛下利用油浴迅速升温至95℃。然后在3小时内滴加22.3克(全氟辛基)乙烯、3.7克叔丁基-α-氟代丙烯酸酯和乙酸丁酯的混合溶液,滴加后继续搅拌3小时。
反应终止后取出聚合溶液,用蒸发器浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.7克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为(全氟辛基)乙烯/叔丁基-α-氟代丙烯酸酯=19/81(摩尔%)的共聚物。
GPC分析结果得出数均分子量为7700。
实施例74((全氟辛基)乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向备有温度计、滴液漏斗、回流管和三通塞的100毫升四口烧瓶中,加入30毫升乙酸丁酯和0.5克AIBN。系统内用氮气充分置换后,在氮气气氛下利用油浴迅速升温至95℃。然后在3小时内滴加17.9克(全氟辛基)乙烯、2.9克叔丁基-α-氟代丙烯酸酯和乙酸丁酯的混合溶液,滴加后继续搅拌3小时。
反应终止后取出聚合溶液,用蒸发器浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了3.3克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为(全氟辛基)乙烯/叔丁基-α-氟代丙烯酸酯=37/63(摩尔%)的共聚物。
GPC分析结果得出数均分子量为1800。
实施例75((全氟辛基)乙烯和叔丁基甲基丙烯酸酯共聚物的合成)
向备有温度计、滴液漏斗、回流管和三通塞的100毫升四口烧瓶中,加入30毫升乙酸丁酯和0,5克AIBN。系统内用氮气充分置换后,在氮气气氛下利用油浴迅速升温至95℃。然后在3小时内滴加22.3克(全氟辛基)乙烯、7.1克叔丁基甲基丙烯酸酯和乙酸丁酯的混合溶液,滴加后继续搅拌3小时。
反应终止后取出聚合溶液,用蒸发器浓缩后用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了3.3克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为(全氟辛基)乙烯/叔丁基甲基丙烯酸酯=40/60(摩尔%)的共聚物。
GPC分析结果得出数均分子量为7000。
合成例7(环戊烯衍生物的合成)
向备有隔板、回流管的二口茄形烧瓶中加入2-环戊烯-1-乙酸
(25克,0.198毫摩尔)和二氯亚砜(50克),从开始回流的温度加热(浴温110℃)至80℃温度。反应3小时后,用吸气器减压蒸馏除去过剩的二氯亚砜后,蒸馏得到酰氯(沸点44~47℃,4mmHg)。接着向备有回流管、滴液漏斗和温度计的三口烧瓶中加入50毫升叔丁醇和50毫升乙醚,一边用冰浴冷却一边在1小时内滴加正丁基锂(173毫升,0.277摩尔)。滴加终止搅拌一段时间后,一边用冰浴冷却一边在1小时内滴加上述酰氯。滴加终止后室温下搅拌24小时。反应终止后加入R225,先后用2N盐酸和饱和食盐水洗涤有机相数次,有机相用无水硫酸镁干燥。干燥后过滤除去硫酸镁,浓缩溶剂。蒸馏浓缩物得到所需酯(沸点52~55℃,1mmHg)32克。
同样合成了环戊烯衍生物(沸点57~60℃,5mmHg)。
实施例76(环戊烯衍生物与四氟乙烯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入4.6克合成例7中得到的环己烯衍生物、
140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的10.0千克力/平方厘米降低到9.8千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了0.9克共聚物。
经元素分析得出,此共聚物是组成比为TFE/环己烯衍生物=50/50(摩尔%)的共聚物。
GPC分析结果得出数均分子量为1500。
实施例77(环己烯衍生物与四氟乙烯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入4.2克合成例7得到的环己烯衍生物、
140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的10.0千克力/平方厘米降低到9.8千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了1.3克共聚物。
经元素分析得出,此共聚物是组成比为TFE/环己烯衍生物=50/50(摩尔%)的共聚物。
GPC分析结果得出数均分子量为2100。
合成例8(降冰片烯衍生物的合成)
除了用α-三氟甲基丙烯酸
CH2=C(CF3)COOH
代替2-环戊烯-1-乙酸之外,与合成例7同样合成了α-三氟甲基丙烯酸叔丁酯
CH2=C(CF3)COOC(CH3)3
接着用它进行与环戊二烯的Diels-Alder反应,得到了目的降冰片烯衍生物
除使用α-三氟甲基丙烯酸叔丁酯代替α-氟代丙烯酸叔丁酯之外,合成是与实施例36同样进行的。
实施例78(降冰片烯衍生物与四氟乙烯共聚物的合成)
向与实施例26同样的100毫升高压釜中加入6.6克合成例8得到的降冰片烯衍生物、
140毫升HCFC-141b和0.5克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入10.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的10.0千克力/平方厘米降低到9.8千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了2.2克共聚物。
经元素分析得出,此共聚物是组成比为TFE/降冰片烯衍生物=50/50(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4200。
实施例79(降冰片烯衍生物与四氟乙烯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入7.0克2-降冰片烯、58.7克合成例8得到的降冰片烯衍生物、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入30.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.7千克力/平方厘米降低到9.8千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了14.5克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2-降冰片烯/含氟降冰片烯=49/19/32(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4800。
实施例80(2,3-二氢呋喃、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的500毫升高压釜中加入7.0克2,3-二氢呋喃、5.8克合成例1得到的叔丁基-α-氟代丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.8克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入40.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的9.0千克力/平方厘米降低到8.8千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了10.9克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2,3-二氢呋喃/叔丁基-α-氟代丙烯酸酯=23/33/44(摩尔%)的共聚物。
GPC分析结果得出数均分子量为16000。
实施例81(2,3-二氢呋喃、四氟乙烯和叔丁基-α-氟代丙烯酸酯共聚物的合成)
向与实施例26同样的500毫升高压釜中加入7.0克2,3-二氢呋喃、5.6克叔丁基甲基丙烯酸酯、40毫升与实施例10同样的HCFC-225和0.8克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入40.0克四氟乙烯(TFE),40℃下振动反应18小时。随着反应的进行,表压由反应前的9.0千克力/平方厘米降低到8.8千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用己烷再沉淀,分离共聚物。真空干燥至恒重,得到了10.8克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2,3-二氢呋喃/叔丁基甲基丙烯酸酯=33/25/32(摩尔%)的共聚物。
GPC分析结果得出数均分子量为9800。
实施例82(环戊烯、四氟乙烯和含氟烯丙基醚共聚物的合成)
向与实施例26同样的300毫升高压釜中加入13.0克环戊烯、33.2克合成例6得到的含氟烯丙基醚、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.3千克力/平方厘米降低到9.4千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了9.0克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/环戊烯/含氟烯丙基醚=47/39/14(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4400。
实施例83(环戊烯、四氟乙烯和含氟烯丙基醚共聚物的合成)
向与实施例26同样的300毫升高压釜中加入13.0克环戊烯、39.1克合成例2得到的含氟烯丙基醚、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.1千克力/平方厘米降低到9.7千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了7.8克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/环戊烯/含氟烯丙基醚=50/33/17(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4200。
实施例84(2,3-二氢呋喃、四氟乙烯和含氟烯丙基醚共聚物的合成)
向与实施例26同样的300毫升高压釜中加入13.4克二氢呋喃、33.2克合成例6得到的含氟烯丙基醚、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用干冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.3千克力/平方厘米降低到9.4千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了9.5克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2,3-二氢呋喃/含氟烯丙基醚=47/35/18(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4100。
实施例85(2,3-二氢呋喃、四氟乙烯和含氟烯丙基醚共聚物的合成)
向与实施例26同样的300毫升高压釜中加入13.4克2,3-二氢呋喃、39.1克合成例2得到的含氟烯丙基醚、
140毫升HCFC-141b和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),边用于冰/甲醇液冷却,边通入氮气充分置换系统内气体。接着从阀门加入36.0克四氟乙烯(TFE),40℃下振动反应12小时。随着反应的进行,表压由反应前的10.1千克力/平方厘米降低到9.7千克力/平方厘米。
放出未反应的单体后,取出聚合溶液用甲醇再沉淀,分离共聚物。真空干燥至恒重,得到了8.8克共聚物。
经19F-NMR和1H-NMR分析得出,此共聚物是组成比为TFE/2,3-二氢呋喃/含氟烯丙基醚=49/32/19(摩尔%)的共聚物。
GPC分析结果得出数均分子量为4500。
实施例86~93(对157nm波长光线的透过系数、对显影液的溶解性以及耐干蚀性的测定)
(1)
消光系数的测定
调制表4所示各3%聚合物的乙酸丁酯溶液,用旋涂器涂布在MgF2基板上,使膜厚达到100~200nm。涂布膜在室温下干燥6小时以上后,与实施例14同样用真空紫外分光光度计测定157nm波长光线的透过率。而且用干涉膜厚计对同一膜测定膜厚,由透过率和膜厚计算出消光系数。结果示于表4之中。
(2)对显影液溶解性的评价
将聚合物溶解在溶剂中,通过与三氟乙酸反应使聚合物所含的叔丁基保护基脱保护。使85%以上叔丁基保护基脱保护,用1H-NMR确认转变成羧基后,脱保护后调制10%聚合物的乙酸溶液,用旋涂器在硅基板上涂布至膜厚为达到200nm,室温下干燥6小时以上。干燥后的膜厚用AFM进行测定后,在35TMAH水溶液中浸渍60秒钟。然后取出每块基板,室温下干燥后用AFM测定膜厚,确认了残膜的有无。结果示于表4之中。
(3)耐腐蚀性的评价
调制10%聚合物的乙酸丁酯溶液,用旋涂器涂布在硅基板上使膜厚达到200nm。120℃下预焙烤2分钟后,用干涉膜厚计测定膜厚。然后放入ICP(感应结合等离子体)腐蚀装置的腔室内进行腐蚀。腐蚀(Ar/N2/C4F8混合气体)压力为10m Torr,等离子炬条件:上电极13.56MHz,900W,下电极400kHz,100W。腐蚀时间60秒钟。
用干涉膜厚计测定腐蚀后的膜厚,计算出腐蚀速率。使用在ArF激光光刻法中采用的光刻胶(东京应化株式会社制造TArF-6a-63型)作参照,同样求出腐蚀速率。用与它的腐蚀速率比较表示。也就是说,各数值表示以参比聚合物(上记的ArF激光用光刻胶)的腐蚀速率为1的比值。结果示于表4中。表4涉及各聚合物157nm下的消光系数、3%TMAH水溶液中的溶解度和耐干蚀性(相对于ArF光刻胶)。
表4
| 实施例号 | 含氟聚合物 | 消光系数(μm-1) | 溶解性 | 腐蚀率(对ArF光刻胶) |
| 86 | 实施例59 | 3.7 | ○ | 1.15 |
| 87 | 实施例61 | 4.9 | ○ | 1.39 |
| 88 | 实施例63 | 2.6 | ○ | 1.21 |
| 89 | 实施例64 | 2.0 | ○ | 1.02 |
| 90 | 实施例65 | 3.9 | ○ | 1.20 |
| 91 | 实施例66 | 3.2 | ○ | 1.04 |
| 92 | 实施例69 | 2.4 | ○ | 1.16 |
| 93 | 实施例73 | 2.6 | ○ | 1.21 |
合成例9(降冰片烯、四氟乙烯和含-COOC(CH3)3的降冰片烯共聚物的合成)
向与实施例26同样的300毫升高压釜中加入27.3克2-降冰片烯、45.4克含-COOC(CH3)3的降冰片烯、
140毫升HCFC-141b、30.0克四氟乙烯和1.0克双(4-叔丁基环己基)过二碳酸酯(TCP),与实施例44同样进行反应,得到了12.5克共聚物。
经19F-NMR、1H-NMR和元素分析得出,此共聚物是组成比为TFE/2-降冰片烯/含-COOC(CH3)3的降冰片烯=49/38/13(摩尔%)的共聚物。
合成例10(四氟乙烯和含-COOC(CH3)3的降冰片烯共聚物的合成)
除用13.6克含-COOC(CH3)3的降冰片烯
代替实施例36中的含氟降冰片烯之外,与实施例43同样进行了反应,分离含氟聚合物后,得到了6.9克白色粉末。
经19F-NMR、1H-NMR和元素分析得出,此共聚物是组成比为TFE/含-COOC(CH3)3的降冰片烯=51/49(摩尔%)的共聚物。
实施例94~101,对照例1、2
(对157nm波长光线的透过系数、对显影液的溶解性以及耐干蚀性的测定)
与实施例86同样对表5所示的各种含降冰片烯的含氟聚合物作:
(1)消光系数的测定
(2)对显影液溶解性评价
(3)耐干蚀性评价。
结果示于表5之中。
表5
| 实施例号 | 含氟聚合物 | 消光系数(μm-1) | 溶解性 | 腐蚀率(对ArF光刻胶) |
| 94 | 实施例38 | 3.8 | ○ | 1.28 |
| 95 | 实施例39 | 2.7 | ○ | 1.22 |
| 96 | 实施例40 | 2.7 | ○ | 0.95 |
| 97 | 实施例41 | 3.1 | ○ | 0.92 |
| 98 | 实施例42 | 2.8 | ○ | 0.85 |
| 99 | 实施例44 | 2.4 | △(有部分残渣) | 0.81 |
| 100 | 实施例45 | 1.1 | ○ | 1.08 |
| 101 | 实施例46 | 0.96 | △(有部分残渣) | 1.02 |
| 比较例1 | 合成例9 | 3.1 | △(有部分残渣) | 1.05 |
| 比较例2 | 合成例10 | 3.9 | ○ | 1.21 |
实施例102~117
(1)涂料组合物的制备
采用与实施例14同样方法,按照表6记载的比例制备了表6所示具有官能团的含氟聚合物(A)、光酸发生剂(B)和溶剂(C)组成的组合物。作为光酸发生剂(B),使用了S-(三氟甲基)-二苯硫鎓三氟甲磺酸盐:
(2)涂布
与实施例14同样涂布在MgF2上,并进行了测定。
(3)真空紫外区透明性的测定
与实施例14同样测定了光刻胶涂膜的透明性。
表6
| 实施例号 | 含氟聚合物(A) | 光酸发生剂(B)[相对于(A)重量%] | 聚合物溶剂(C)(聚合物浓度、重量%) | 膜厚(nm) | 157nm分子消光系数 |
| 102 | 实施例38 | 5.0 | 乙酸丁酯(4.0) | 120 | 4.0 |
| 103 | 实施例39 | 5.0 | 乙酸丁酯(4.0) | 130 | 2.9 |
| 104 | 实施例40 | 5.0 | 乙酸丁酯(4.0) | 110 | 3.0 |
| 105 | 实施例41 | 5.0 | 乙酸丁酯(4.0) | 120 | 3.4 |
| 106 | 实施例42 | 5.0 | 乙酸丁酯(4.0) | 150 | 3.0 |
| 107 | 实施例43 | 5.0 | 乙酸丁酯(4.0) | 130 | 2.7 |
| 108 | 实施例45 | 5.0 | 乙酸丁酯(4.0) | 110 | 1.2 |
| 109 | 实施例46 | 5.0 | 乙酸丁酯(4.0) | 130 | 1.1 |
| 110 | 实施例59 | 5.0 | 乙酸丁酯(4.0) | 110 | 3.9 |
| 111 | 实施例61 | 5.0 | 乙酸丁酯(4.0) | 120 | 5.0 |
| 112 | 实施例63 | 5.0 | 丙酮(4.0) | 100 | 2.8 |
| 113 | 实施例64 | 5.0 | 丙酮(4.0) | 120 | 2.2 |
| 114 | 实施例65 | 5.0 | 丙酮(4.0) | 110 | 4.2 |
| 115 | 实施例66 | 5.0 | 丙酮(4.0) | 100 | 3.4 |
| 116 | 实施例69 | 5.0 | 丙酮(4.0) | 120 | 2.5 |
| 117 | 实施例73 | 5.0 | 丙酮(4.0) | 130 | 2.8 |
产业上利用的可能性
本发明可以提供对真空紫外区(157nm)的能量射线透明性高的具有酸反应性基团的新颖含氟聚合物,使用这种聚合物可以提供适合于光刻胶用含氟基础聚合物用材料以及使用这些物质的化学增幅型光刻胶组合物。
Claims (23)
1、一种化学增幅型光刻胶组合物,是由:
(A)具有酸反应性基团的含氟聚合物,
(B)光酸发生剂,和
(C)溶剂
组成的组合物,
其中所说的具有酸反应性基团的含氟聚合物(A)是由式(2)表示的含氟聚合物,
式(2):
-(M1)-(M2)-(N)- (2)
①结构单元M1是来源于有式(1)的酸反应性基团的含氟脂环式单体的结构单元,
式(1):
式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团,当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基
②结构单元M2是来源于含氟乙烯类单体的结构单元,
③结构单元N是来源于能与M1、M2共聚单体的结构单元
当M1+M2=100摩尔%时,以摩尔%计,M1/M2为1~99/1~99,其中含有1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N。
2、按照权利要求1记载的化学增幅型光刻胶组合物,其中所说的具有酸反应性基团的含氟聚合物(A)还包含结构单元M3,由式(3)表示,
式(3):
-(M1)-(M2)-(M3)-(N)- (3)
①结构单元M1是来源于具有式(1)的酸反应性基团的含氟脂环式单体的结构单元,
式(1):
式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团,当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基
②结构单元M2是来源于含氟乙烯类单体的结构单元,
③结构单元M3是来源于式(4)表示的脂环式单体的结构单元,
式(4):
式中,A1、B1、C1和D1是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基;a是0或者1~3的整数
④结构单元N是来源于能与M1、M2、M3共聚单体的结构单元,当M1+M2+M3=100摩尔%时,以摩尔%计,M1+M3/M2为30/70~70/30,其中含有1~98摩尔%M1、1~98摩尔%M2、1~98摩尔%M3和0~97摩尔%结构单元N。
3、按照权利要求1或2记载的化学增幅型光刻胶组合物,其中构成具有酸反应性基团的含氟聚合物(A)的式(1)中含氟脂环式单体的酸反应性基团Y2,是酸解离性或酸分解性官能团。
4、按照权利要求3所述的化学增幅型光刻胶组合物,其中所说的酸解离性或酸分解性官能团是:
式中,R7、R8、R9、R10、R11、R12、R14、R15、R18、R19、R20、R21、R22、R24、R25、R26、R27、R28、R29相同或不同,是碳原子数1~10的烃基,R13、R16是H或碳原子数1~10的烃基,R17、R23是碳原子数2~10的二价烃基。
6、按照权利要求3记载的化学增幅型光刻胶组合物,其中所说的酸解离性或酸分解性官能团是与酸反应能转变成羧基的官能团。
7、按照权利要求1或2记载的化学增幅型光刻胶组合物,其中所说的酸反应性基团Y2,是酸致缩合反应的官能团。
8、按照权利要求7所述的化学增幅型光刻胶组合物,其中所说的酸致缩合反应官能团,是从羟基、羧基、氰基、磺基和环氧基中选出的。
9、按照权利要求1或2所述的化学增幅型光刻胶组合物,其中在构成具有酸反应性基团的含氟聚合物(A)的式(1)的含氟脂环式单体中,A、B和C中至少一个是氟原子。
10、按照权利要求1或2所述的化学增幅型光刻胶组合物,其中在具有酸反应性基团的含氟聚合物(A)中,结构单元M2是二或三个碳原子的含氟乙烯类单体。
11、按照权利要求10所述的化学增幅型光刻胶组合物,其中在具有酸反应性基团的含氟聚合物(A)中,结构单元M2是来源于从四氟乙烯或一氯三氟乙烯中选出的单体的结构单元。
12、按照权利要求1或2所述的化学增幅型光刻胶组合物,其中在具有酸反应性基团的含氟聚合物(A)中,结构单元M1的存在比例,占构成含氟共聚物的全部结构单元的10摩尔%以上。
13、一种含氟聚合物,其数均分子量为1,000~1,000,000,由式(2)表示,
式(2):
-(M1)-(M2)-(N)- (2)
①结构单元M1是源于具有式(1)的酸反应性基团的含氟脂环式单体的结构单元,
式(1):
式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团,当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基
②结构单元M2是源于含氟乙烯类单体的结构单元,
③结构单元N是源于能与M1、M2共聚单体的结构单元
当M1+M2=100摩尔%时,以摩尔%计,M1/M2为1~99/1~99,所述聚合物由1~99摩尔%M1、1~99摩尔%M2和0~98摩尔%结构单元N组成。
14、按照权利要求13记载的含氟聚合物,其数均分子量为1,000~1,000,000,其中还包含结构单元M3,由式(3)表示,
式(3):
-(M1)-(M2)-(M3)-(N)- (3)
①结构单元M1是源于具有式(1)的酸反应性基团的含氟脂环式单体的结构单元,
式(1):
式中,A、B和C是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基,R是碳原子数1~20的二价烃基、碳原子数1~20的含氟亚烷基或碳原子数2~100的具有醚键的含氟亚烷基,a是0或者1~3的整数,b是0或1,Y2是酸反应性基团,当b为0或R不含氟原子的场合下,A~C中任一个为氟原子或含氟烷基
②结构单元M2是源于含氟乙烯类单体的结构单元,
③结构单元M3是源于式(4)表示的脂环式单体的结构单元
式(4):
式中,A1、B1、C1和D1是H、F、碳原子数1~10的烷基或碳原子数1~10的含氟烷基;a是0或者1~3的整数
④结构单元N是源于能与M1、M2、M3共聚单体的结构单元,
其中当M1+M2+M3=100摩尔%时,以摩尔%计,M1+M3/M2为30/70~70/30,所述聚合物由1~98摩尔%结构单元M1、1~98摩尔%结构单元M2、1~98摩尔%结构单元M3和0~97摩尔%结构单元N组成。
15、按照权利要求13或14记载的含氟聚合物,其中构成具有酸反应性基团的含氟聚合物(A)的式(1)中含氟脂环式单体的酸反应性基团Y2,是酸解离性或酸分解性官能团。
16、按照权利要求15所述的含氟聚合物,其中所说的酸解离性或酸分解性官能团是:
式中,R7、R8、R9、R10、R11、R12、R14、R15、R18、R19、R20、R21、R22、R24、R25、R26、R27、R28、R29相同或不同,是碳原子数1~10的烃基,R13、R16是H或碳原子数1~10的烃基,R17、R23是碳原子数2~10的二价烃基。
18、按照权利要求15记载的含氟聚合物,其中所说的酸解离性或酸分解性官能团是与酸反应能转变成羧基的官能团。
19、按照权利要求13或14记载的含氟聚合物,其中所说的酸反应性基团Y2是酸致缩合反应的官能团。
20、按照权利要求19所述的含氟聚合物,其中所说的酸致缩合反应官能团,是从羟基、羧基、氰基、磺基和环氧基中选出的。
21、按照权利要求13或14所述的含氟聚合物,其中在式(1)的含氟脂环式单体中,A、B和C中至少一个是氟原子。
22、按照权利要求13或14所述的含氟聚合物,其中结构单元M2是二或三个碳原子的含氟乙烯类单体。
23、按照权利要求22所述的含氟聚合物,其中在具有酸反应性基团的含氟聚合物(A)中,结构单元M2是源于从四氟乙烯或一氯三氟乙烯中选出的单体的结构单元。
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP102799/2000 | 2000-04-04 | ||
| JP2000102799 | 2000-04-04 | ||
| JP102799/00 | 2000-04-04 | ||
| JP177494/2000 | 2000-06-13 | ||
| JP2000177494 | 2000-06-13 | ||
| JP177494/00 | 2000-06-13 | ||
| JP61896/01 | 2001-03-06 | ||
| JP2001061896 | 2001-03-06 | ||
| JP61896/2001 | 2001-03-06 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1398271A CN1398271A (zh) | 2003-02-19 |
| CN1225486C true CN1225486C (zh) | 2005-11-02 |
Family
ID=27342993
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB018047963A Expired - Lifetime CN1225486C (zh) | 2000-04-04 | 2001-04-03 | 具有酸反应性基团的新颖含氟聚合物以及使用这些材料的化学增幅型光刻胶组合物 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US6908724B2 (zh) |
| EP (1) | EP1275666A4 (zh) |
| JP (1) | JP4923376B2 (zh) |
| KR (1) | KR20030005177A (zh) |
| CN (1) | CN1225486C (zh) |
| AU (1) | AU2001244719A1 (zh) |
| TW (1) | TW588220B (zh) |
| WO (1) | WO2001074916A1 (zh) |
Families Citing this family (66)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4780262B2 (ja) * | 2000-04-27 | 2011-09-28 | 信越化学工業株式会社 | 高分子化合物、化学増幅レジスト材料及びパターン形成方法 |
| AU2002254232A1 (en) | 2001-03-22 | 2002-10-08 | Shipley Company, L.L.C. | Photoresist composition |
| KR20040030799A (ko) * | 2001-07-12 | 2004-04-09 | 가부시끼가이샤 한도따이 센단 테크놀로지스 | 미세 패턴 형성 방법 |
| KR100873251B1 (ko) * | 2001-07-12 | 2008-12-11 | 다이킨 고교 가부시키가이샤 | 불소 함유 노르보르넨 유도체의 제조 방법 |
| JP4516250B2 (ja) * | 2001-09-13 | 2010-08-04 | パナソニック株式会社 | パターン形成材料及びパターン形成方法 |
| TW591341B (en) * | 2001-09-26 | 2004-06-11 | Shipley Co Llc | Coating compositions for use with an overcoated photoresist |
| EP1319981B1 (en) * | 2001-12-13 | 2012-10-24 | FUJIFILM Corporation | Positive resist composition |
| JP2003186198A (ja) * | 2001-12-19 | 2003-07-03 | Sony Corp | レジスト材料及び露光方法 |
| JP2003186197A (ja) * | 2001-12-19 | 2003-07-03 | Sony Corp | レジスト材料及び露光方法 |
| EP1324133A1 (en) * | 2001-12-31 | 2003-07-02 | Shipley Co. L.L.C. | Photoresist compositions for short wavelength imaging |
| DE10203838B4 (de) * | 2002-01-31 | 2006-12-28 | Infineon Technologies Ag | Fluorhaltiger Fotoresist mit Reaktionsankern für eine chemische Nachverstärkung und verbesserten Copolymerisationseigenschaften |
| DE10203839B4 (de) * | 2002-01-31 | 2007-10-18 | Infineon Technologies Ag | Resist für die Fotolithografie mit reaktiven Gruppen für eine nachträgliche Modifikation der Resiststrukturen |
| US6893792B2 (en) * | 2002-02-19 | 2005-05-17 | Sumitomo Chemical Company, Limited | Positive resist composition |
| US7358027B2 (en) | 2002-03-04 | 2008-04-15 | International Business Machines Corporation | Copolymer for use in chemical amplification resists |
| JP4010160B2 (ja) * | 2002-03-04 | 2007-11-21 | 旭硝子株式会社 | レジスト組成物 |
| JP2003330196A (ja) * | 2002-03-05 | 2003-11-19 | Jsr Corp | 感放射線性樹脂組成物 |
| US7160666B2 (en) | 2002-03-06 | 2007-01-09 | Fuji Photo Film Co., Ltd. | Photosensitive resin composition |
| WO2004016689A1 (ja) * | 2002-08-13 | 2004-02-26 | Daikin Industries, Ltd. | 光硬化性含フッ素ポリマーを含む光学材料および光硬化性含フッ素樹脂組成物 |
| AU2003262070A1 (en) * | 2002-09-13 | 2004-04-30 | Takayuki Araki | Process for production of fluoropolymers for resist |
| KR20050065600A (ko) * | 2002-10-18 | 2005-06-29 | 다이킨 고교 가부시키가이샤 | 불소 함유 중합체의 제조 방법 및 포토레지스트 조성물 |
| US20040091813A1 (en) * | 2002-11-05 | 2004-05-13 | Honeywell International Inc. | Fluorinated polymers |
| CN100367113C (zh) * | 2002-12-11 | 2008-02-06 | 三星电子株式会社 | 用于形成共轭聚合物图案的组合物和使用该组合物形成共轭聚合物图案的方法 |
| WO2004074933A2 (en) * | 2003-02-20 | 2004-09-02 | Promerus Llc | Dissolution rate modifiers for photoresist compositions |
| US20040166434A1 (en) | 2003-02-21 | 2004-08-26 | Dammel Ralph R. | Photoresist composition for deep ultraviolet lithography |
| KR20050098955A (ko) * | 2003-02-21 | 2005-10-12 | 에이제트 일렉트로닉 머트리얼즈 유에스에이 코프. | 원자외선 리소그래피용 포토레지스트 조성물 |
| US7150957B2 (en) * | 2003-04-25 | 2006-12-19 | International Business Machines Corporation | Fluorinated vinyl ethers, copolymers thereof, and use in lithographic photoresist compositions |
| US7781602B2 (en) * | 2003-04-25 | 2010-08-24 | Central Glass Company, Limited | Fluorinated cyclic compound, polymerizable fluoromonomer, fluoropolymer, resist material comprising the same, and method of forming pattern with the same |
| JP4411102B2 (ja) * | 2003-09-01 | 2010-02-10 | 富士フイルム株式会社 | ポジ型レジスト組成物及びそれを用いたパターン形成方法 |
| JP4599948B2 (ja) * | 2003-09-18 | 2010-12-15 | チッソ株式会社 | α−フルオロアクリレート化合物、組成物およびその重合体 |
| KR100852840B1 (ko) * | 2003-11-19 | 2008-08-18 | 다이킨 고교 가부시키가이샤 | 레지스트 적층체의 형성 방법 |
| JP4525912B2 (ja) * | 2004-01-30 | 2010-08-18 | 信越化学工業株式会社 | 高分子化合物、レジスト材料及びパターン形成方法 |
| WO2005081063A1 (ja) * | 2004-02-20 | 2005-09-01 | Daikin Industries, Ltd. | 液浸リソグラフィーに用いるレジスト積層体 |
| JP4484603B2 (ja) * | 2004-03-31 | 2010-06-16 | セントラル硝子株式会社 | トップコート組成物 |
| JP4355944B2 (ja) * | 2004-04-16 | 2009-11-04 | 信越化学工業株式会社 | パターン形成方法及びこれに用いるレジスト上層膜材料 |
| EP1757990B1 (en) * | 2004-05-26 | 2013-10-09 | JSR Corporation | Resin compositions for miniaturizing the resin pattern spaces or holes and method for miniaturizing the resin pattern spaces or holes using the same |
| US20060008730A1 (en) * | 2004-07-09 | 2006-01-12 | Puy Michael V D | Monomers for photoresists bearing acid-labile groups of reduced optical density |
| US20060008731A1 (en) * | 2004-07-09 | 2006-01-12 | Michael Van Der Puy | Novel photoresist monomers and polymers |
| JP4697406B2 (ja) * | 2004-08-05 | 2011-06-08 | 信越化学工業株式会社 | 高分子化合物,レジスト保護膜材料及びパターン形成方法 |
| JP4524154B2 (ja) * | 2004-08-18 | 2010-08-11 | 富士フイルム株式会社 | 化学増幅型レジスト組成物及びそれを用いたパターン形成方法 |
| JP4485922B2 (ja) * | 2004-11-18 | 2010-06-23 | 東京応化工業株式会社 | ネガ型レジスト組成物 |
| JP4655043B2 (ja) * | 2004-11-30 | 2011-03-23 | 旭硝子株式会社 | モールド、および転写微細パターンを有する基材の製造方法 |
| KR100665760B1 (ko) * | 2004-12-29 | 2007-01-09 | 삼성토탈 주식회사 | 불소함유 노르보넨에스테르의 제조방법 및 상기제조방법에 의해 제조된 불소함유 노르보넨에스테르 |
| JP4520364B2 (ja) * | 2005-05-30 | 2010-08-04 | 富士フイルム株式会社 | 非晶質コポリマー、光学部材およびプラスチック光ファイバー |
| JP4617207B2 (ja) * | 2005-06-03 | 2011-01-19 | 丸善石油化学株式会社 | 半導体リソグラフィー用共重合体、組成物及びチオール化合物 |
| JP4684139B2 (ja) * | 2005-10-17 | 2011-05-18 | 信越化学工業株式会社 | レジスト保護膜材料及びパターン形成方法 |
| US20070092829A1 (en) * | 2005-10-21 | 2007-04-26 | Christoph Noelscher | Photosensitive coating for enhancing a contrast of a photolithographic exposure |
| WO2007066481A1 (ja) * | 2005-12-05 | 2007-06-14 | Daikin Industries, Ltd. | α,β-不飽和エステル基を含有する含フッ素ノルボルネン誘導体または含フッ素ノルボルナン誘導体を含む硬化性含フッ素ポリマー組成物 |
| KR101194646B1 (ko) * | 2005-12-30 | 2012-10-24 | 엘지디스플레이 주식회사 | 소프트몰드 제조방법 |
| JP5114021B2 (ja) * | 2006-01-23 | 2013-01-09 | 富士フイルム株式会社 | パターン形成方法 |
| JP2008034787A (ja) * | 2006-06-30 | 2008-02-14 | Matsushita Electric Ind Co Ltd | 固体撮像装置およびその製造方法、並びに半導体装置およびその製造方法 |
| JP5430821B2 (ja) * | 2006-09-19 | 2014-03-05 | 東京応化工業株式会社 | レジストパターン形成方法 |
| JP5228995B2 (ja) * | 2008-03-05 | 2013-07-03 | 信越化学工業株式会社 | 重合性モノマー化合物、パターン形成方法並びにこれに用いるレジスト材料 |
| JP5345379B2 (ja) * | 2008-12-22 | 2013-11-20 | 富士フイルム株式会社 | 光学材料用樹脂組成物とその成形体、光学部品およびレンズ |
| IL211532A0 (en) * | 2010-03-05 | 2011-06-30 | Rohm & Haas Elect Mat | Methods of forming photolithographic patterns |
| US8541523B2 (en) * | 2010-04-05 | 2013-09-24 | Promerus, Llc | Norbornene-type polymers, compositions thereof and lithographic process using such compositions |
| US20120122031A1 (en) * | 2010-11-15 | 2012-05-17 | International Business Machines Corporation | Photoresist composition for negative development and pattern forming method using thereof |
| CN102323717B (zh) * | 2011-06-21 | 2012-07-25 | 吉林大学 | 高含氟芳香-脂肪负性光刻胶及用于制备聚合物波导器件 |
| WO2013134104A2 (en) * | 2012-03-08 | 2013-09-12 | Microchem Corp. | Photoimageable compositions and processes for fabrication of relief patterns on low surface energy substrates |
| JP5934666B2 (ja) * | 2012-05-23 | 2016-06-15 | 富士フイルム株式会社 | パターン形成方法、感活性光線性又は感放射線性樹脂組成物、レジスト膜及び電子デバイスの製造方法 |
| US20160083489A1 (en) * | 2013-06-14 | 2016-03-24 | 3M Innovative Properties Company | Fluoropolymers comprising monomeric units derived from a vinyl perfluoroalkyl or vinyl perfluoroalkylenoxide perfluorovinyl ether |
| EP3256498A1 (en) * | 2015-02-11 | 2017-12-20 | Solvay Specialty Polymers Italy S.p.A. | Novel thermoprocessable fluoropolymer |
| KR102374272B1 (ko) | 2016-05-09 | 2022-03-15 | 쓰리엠 이노베이티브 프로퍼티즈 컴파니 | 하이드로플루오로올레핀 및 이의 사용 방법 |
| JP7140964B2 (ja) * | 2017-06-05 | 2022-09-22 | セントラル硝子株式会社 | 含フッ素単量体、含フッ素重合体およびそれを用いたパターン形成用組成物、並びにそのパターン形成方法 |
| JP6986986B2 (ja) * | 2018-01-30 | 2021-12-22 | 三井化学株式会社 | フッ素含有環状オレフィン系共重合体および成形体 |
| JP7254917B2 (ja) * | 2019-05-29 | 2023-04-10 | 富士フイルム株式会社 | 感活性光線性又は感放射線性樹脂組成物、パターン形成方法、電子デバイスの製造方法 |
| US20210364916A1 (en) * | 2020-05-21 | 2021-11-25 | Taiwan Semiconductor Manufacturing Co., Ltd. | Photoresist composition and method of forming photoresist pattern |
Family Cites Families (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3624053A (en) | 1963-06-24 | 1971-11-30 | Du Pont | Trifluorovinyl sulfonic acid polymers |
| US3282875A (en) | 1964-07-22 | 1966-11-01 | Du Pont | Fluorocarbon vinyl ether polymers |
| JPS5518673A (en) * | 1978-07-28 | 1980-02-08 | Chiyou Lsi Gijutsu Kenkyu Kumiai | Ionized radiation sensitive negative type resist |
| JPS5558211A (en) * | 1978-10-25 | 1980-04-30 | Chiyou Lsi Gijutsu Kenkyu Kumiai | Positive type radiation-sensitive composition and its solution |
| US4596864A (en) | 1984-10-12 | 1986-06-24 | Olin Corporation | Pyrithione-containing bioactive polymers and their use in paint and wood preservative products |
| US4632881A (en) | 1984-10-12 | 1986-12-30 | Olin Corporation | Pyrithione-containing bioactive polymers and their use in paint and wood perservative products |
| JPS6443512A (en) * | 1987-08-10 | 1989-02-15 | Daikin Ind Ltd | Phenyl alpha-trifluoromethylacrylate copolymer and its preparation |
| JP2623309B2 (ja) | 1988-02-22 | 1997-06-25 | ユーシービー ソシエテ アノニム | レジストパターンを得る方法 |
| US4985337A (en) | 1988-11-15 | 1991-01-15 | Konica Corporation | Image forming method and element, in which the element contains a release layer and a photosensitive o-quinone diaziode layer |
| JPH033238A (ja) * | 1989-05-30 | 1991-01-09 | Asahi Glass Co Ltd | 半導体キャリアー |
| US5391465A (en) | 1989-06-20 | 1995-02-21 | Rohm And Haas Company | Method of using selected photoactive compounds in high resolution, acid hardening photoresists with near ultraviolet radiation wherein the photoresist comprise conventional deep UV photoacid generators |
| US5229473A (en) | 1989-07-07 | 1993-07-20 | Daikin Industries Ltd. | Fluorine-containing copolymer and method of preparing the same |
| US5212046A (en) | 1989-10-17 | 1993-05-18 | Shipley Company Inc. | Near UV photoresist |
| US5362606A (en) | 1989-10-18 | 1994-11-08 | Massachusetts Institute Of Technology | Positive resist pattern formation through focused ion beam exposure and surface barrier silylation |
| US5292614A (en) | 1991-08-02 | 1994-03-08 | Mitsubishi Kasei Corporation | Negative photosensitive composition and method for forming a resist pattern |
| US5302490A (en) | 1991-10-21 | 1994-04-12 | Shipley Company Inc. | Radiation sensitive compositions comprising blends of an aliphatic novolak resin and an aromatic novolak resin |
| DE4207261C2 (de) | 1992-03-07 | 2000-03-16 | Clariant Gmbh | Styrol-Monomere mit 2,2-Bis-trifluormethyl-oxaethano-Brückengliedern, Polymere und deren Verwendung |
| DE4319178C2 (de) | 1992-06-10 | 1997-07-17 | Fujitsu Ltd | Resist-Zusammensetzung enthaltend ein Polymermaterial und einen Säuregenerator |
| JP3078153B2 (ja) | 1993-07-08 | 2000-08-21 | 富士写真フイルム株式会社 | 感光性組成物 |
| JP2715881B2 (ja) | 1993-12-28 | 1998-02-18 | 日本電気株式会社 | 感光性樹脂組成物およびパターン形成方法 |
| JP3461377B2 (ja) | 1994-04-18 | 2003-10-27 | 富士写真フイルム株式会社 | 画像記録材料 |
| EP0709410A3 (en) | 1994-10-26 | 1997-03-26 | Ocg Microelectronic Materials | Polymers |
| US5658708A (en) | 1995-02-17 | 1997-08-19 | Fuji Photo Film Co., Ltd. | Image recording material |
| JP3277114B2 (ja) * | 1995-02-17 | 2002-04-22 | インターナショナル・ビジネス・マシーンズ・コーポレーション | 陰画調レジスト像の作製方法 |
| US5900346A (en) | 1995-04-06 | 1999-05-04 | Shipley Company, L.L.C. | Compositions comprising photoactivator, acid, generator and chain extender |
| JPH0950129A (ja) | 1995-05-30 | 1997-02-18 | Shin Etsu Chem Co Ltd | 反射防止膜材料及びパターン形成方法 |
| JP3382081B2 (ja) | 1995-06-01 | 2003-03-04 | 株式会社東芝 | レジストおよびこれを用いたパターン形成方法 |
| US5952150A (en) | 1995-06-08 | 1999-09-14 | Jsr Corporation | Radiation sensitive resin composition |
| JPH0990622A (ja) | 1995-09-22 | 1997-04-04 | Fuji Photo Film Co Ltd | ポジ型フォトレジスト組成物 |
| JP3589365B2 (ja) | 1996-02-02 | 2004-11-17 | 富士写真フイルム株式会社 | ポジ画像形成組成物 |
| JP3804138B2 (ja) | 1996-02-09 | 2006-08-02 | Jsr株式会社 | ArFエキシマレーザー照射用感放射線性樹脂組成物 |
| JP3587325B2 (ja) | 1996-03-08 | 2004-11-10 | 富士写真フイルム株式会社 | ポジ型感光性組成物 |
| US5935733A (en) | 1996-04-05 | 1999-08-10 | Intel Corporation | Photolithography mask and method of fabrication |
| US5876899A (en) | 1996-09-18 | 1999-03-02 | Shipley Company, L.L.C. | Photoresist compositions |
| JP3971476B2 (ja) * | 1996-11-29 | 2007-09-05 | 日本ゼオン株式会社 | エポキシ基含有ノルボルネン系付加型共重合体、その製造方法、及び架橋性重合体組成物 |
| JP3431481B2 (ja) * | 1996-12-24 | 2003-07-28 | 株式会社東芝 | 感光性組成物、およびこれを用いたパターン形成方法ならびに電子部品の製造方法 |
| US6042991A (en) | 1997-02-18 | 2000-03-28 | Fuji Photo Film Co., Ltd. | Positive working photosensitive composition |
| EP0875789A1 (en) | 1997-04-30 | 1998-11-04 | Wako Pure Chemical Industries Ltd | Resist composition and its use for forming pattern |
| JP3650985B2 (ja) | 1997-05-22 | 2005-05-25 | Jsr株式会社 | ネガ型感放射線性樹脂組成物およびパターン製造法 |
| JP3033549B2 (ja) * | 1997-12-12 | 2000-04-17 | 日本電気株式会社 | ネガ型レジスト材料、それを用いたパターン形成方法及び半導体装置の製造方法 |
| JPH11133593A (ja) * | 1997-08-29 | 1999-05-21 | Fuji Photo Film Co Ltd | 感光性組成物 |
| US6143472A (en) * | 1998-11-18 | 2000-11-07 | Wako Pure Chemical Industries, Ltd. | Resist composition and a method for formation of a pattern using the composition |
| JP4034896B2 (ja) * | 1997-11-19 | 2008-01-16 | 松下電器産業株式会社 | レジスト組成物及びこれを用いたパターン形成方法 |
| JP3847454B2 (ja) * | 1998-03-20 | 2006-11-22 | 富士写真フイルム株式会社 | 遠紫外線露光用ポジ型フォトレジスト組成物及びパターン形成方法 |
| EP1131677B1 (en) * | 1998-09-23 | 2005-08-03 | E.I. Dupont De Nemours And Company | Photoresists, polymers and processes for microlithography |
| JP3305293B2 (ja) * | 1999-03-09 | 2002-07-22 | 松下電器産業株式会社 | パターン形成方法 |
| EP1035441A1 (en) | 1999-03-09 | 2000-09-13 | Matsushita Electric Industrial Co., Ltd. | Pattern formation method |
| JP2000292926A (ja) * | 1999-04-01 | 2000-10-20 | Fuji Photo Film Co Ltd | 遠紫外線露光用ポジ型フォトレジスト組成物 |
| JP2000298345A (ja) * | 1999-04-14 | 2000-10-24 | Toray Ind Inc | ポジ型感放射線性組成物 |
| KR20020012206A (ko) * | 1999-05-04 | 2002-02-15 | 메리 이. 보울러 | 플루오르화 중합체, 포토레지스트 및 마이크로리소그래피방법 |
| JP4459327B2 (ja) * | 1999-07-12 | 2010-04-28 | 三菱レイヨン株式会社 | レジスト用樹脂、化学増幅型レジスト組成物およびレジストパターン形成方法 |
| KR100535149B1 (ko) * | 1999-08-17 | 2005-12-07 | 주식회사 하이닉스반도체 | 신규의 포토레지스트용 공중합체 및 이를 이용한 포토레지스트조성물 |
| JP3915870B2 (ja) * | 1999-08-25 | 2007-05-16 | 信越化学工業株式会社 | 高分子化合物、化学増幅レジスト材料及びパターン形成方法 |
| US6379874B1 (en) * | 1999-10-26 | 2002-04-30 | Cornell Research Foundation, Inc. | Using block copolymers as supercritical fluid developable photoresists |
| WO2001037047A2 (en) | 1999-11-17 | 2001-05-25 | E.I. Du Pont De Nemours And Company | Nitrile/fluoroalcohol polymer-containing photoresists and associated processes for microlithography |
| JP3672780B2 (ja) * | 1999-11-29 | 2005-07-20 | セントラル硝子株式会社 | ポジ型レジスト組成物およびパターン形成方法 |
| JP2001183833A (ja) | 1999-12-27 | 2001-07-06 | Sumitomo Chem Co Ltd | レジスト組成物 |
| US6579658B2 (en) | 2000-02-17 | 2003-06-17 | Shin-Etsu Chemical Co., Ltd. | Polymers, resist compositions and patterning process |
| US6468712B1 (en) * | 2000-02-25 | 2002-10-22 | Massachusetts Institute Of Technology | Resist materials for 157-nm lithography |
| JP2001296662A (ja) | 2000-04-13 | 2001-10-26 | Asahi Glass Co Ltd | レジスト組成物 |
| JP2001328964A (ja) | 2000-05-19 | 2001-11-27 | Tokyo Ohka Kogyo Co Ltd | 新規多環式不飽和炭化水素誘導体及びその製造方法 |
| JP4838437B2 (ja) | 2000-06-16 | 2011-12-14 | Jsr株式会社 | 感放射線性樹脂組成物 |
| JP4052943B2 (ja) | 2000-10-31 | 2008-02-27 | ダイセル化学工業株式会社 | 電子吸引性基含有単量体及びその製造法 |
| EP1376230A1 (en) * | 2001-03-09 | 2004-01-02 | Semiconductor Leading Edge Technologies, Inc. | Fine pattern forming method |
-
2001
- 2001-04-03 EP EP01917810A patent/EP1275666A4/en not_active Withdrawn
- 2001-04-03 KR KR1020027009866A patent/KR20030005177A/ko not_active Application Discontinuation
- 2001-04-03 JP JP2001572603A patent/JP4923376B2/ja not_active Expired - Fee Related
- 2001-04-03 TW TW090107955A patent/TW588220B/zh not_active IP Right Cessation
- 2001-04-03 CN CNB018047963A patent/CN1225486C/zh not_active Expired - Lifetime
- 2001-04-03 AU AU2001244719A patent/AU2001244719A1/en not_active Abandoned
- 2001-04-03 WO PCT/JP2001/002897 patent/WO2001074916A1/ja not_active Application Discontinuation
-
2002
- 2002-10-03 US US10/262,893 patent/US6908724B2/en not_active Expired - Lifetime
-
2005
- 2005-01-13 US US11/033,954 patent/US20050287471A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| KR20030005177A (ko) | 2003-01-17 |
| AU2001244719A1 (en) | 2001-10-15 |
| WO2001074916A1 (fr) | 2001-10-11 |
| TW588220B (en) | 2004-05-21 |
| US6908724B2 (en) | 2005-06-21 |
| EP1275666A4 (en) | 2007-10-24 |
| JP4923376B2 (ja) | 2012-04-25 |
| US20050287471A1 (en) | 2005-12-29 |
| US20030152864A1 (en) | 2003-08-14 |
| CN1398271A (zh) | 2003-02-19 |
| EP1275666A1 (en) | 2003-01-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1225486C (zh) | 具有酸反应性基团的新颖含氟聚合物以及使用这些材料的化学增幅型光刻胶组合物 | |
| CN1229693C (zh) | 化学增强型正光刻胶组合物和锍盐 | |
| CN1253759C (zh) | 微石印用光致抗蚀剂、聚合物和工艺 | |
| CN1249126C (zh) | 聚硅氧烷、其生产方法、及辐射敏感树脂组合物 | |
| CN100339767C (zh) | 抗蚀剂组合物 | |
| CN1227569C (zh) | 氟化聚合物,光刻胶和用于显微光刻的方法 | |
| CN1918217A (zh) | 高分子化合物、含有该高分子化合物的光致抗蚀剂组合物以及抗蚀图案形成方法 | |
| CN1251022C (zh) | 光刻胶及微平版印刷术 | |
| CN1145078C (zh) | 聚合物和抗蚀材料 | |
| CN1159623C (zh) | 含有鎓盐型光敏酸发生剂的化学增强辐射敏感组合物 | |
| CN1527808A (zh) | 含氟降冰片烯衍生物的制备方法 | |
| CN1233685C (zh) | 含氟环烯聚合物,其环烯单体,聚合物制备方法及聚合物的应用 | |
| CN1845941A (zh) | 光刻胶聚合物组合物 | |
| CN1550896A (zh) | 光致抗蚀剂组合物及其制备方法 | |
| CN1791573A (zh) | 光活性化合物 | |
| CN1946751A (zh) | 用于形成液浸曝光工艺用光刻胶保护膜的材料、以及使用该保护膜的光刻胶图案形成方法 | |
| CN1737000A (zh) | 聚合体,化学增幅型抗蚀组成物及形成方法 | |
| CN1592870A (zh) | 正型抗蚀剂组合物及使用其形成抗蚀图形的方法 | |
| CN1991585A (zh) | 适合于酸生成剂的盐和含有该盐的化学放大型抗蚀剂组合物 | |
| CN1332205A (zh) | 辐射敏感树脂组合物 | |
| CN1675303A (zh) | 含有光固化型含氟聚合物的光学材料及光固化型含氟树脂组合物 | |
| CN1916760A (zh) | 酸发生剂、磺酸、磺酸衍生物及辐射敏感树脂组合物 | |
| CN1696828A (zh) | 化学放大正性抗蚀剂组合物、卤代酯衍生物及其生产方法 | |
| CN1495526A (zh) | 磺酸盐和光刻胶组合物 | |
| CN1809789A (zh) | 用于远紫外光刻的光致抗蚀剂组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CX01 | Expiry of patent term |
Granted publication date: 20051102 |
|
| CX01 | Expiry of patent term |