ホトレジスト組成物及ぴそれを用いたレジストパターン形成方法 技術分野
本発明は、 リソグラフィ一による半導体集積回路のパターユングに用いられる ホトレジスト組成物おょぴ該組成物明を用いたレジストパターン形成方法に関する もので、 詳しくは、 解像性、 パターン形成田性などのレジスト特性を波長 2 0 0 n m以下の光源、 特に F2エキシマレーザーを用いて微細パターニンク Ίこ適合でき る程度にまで向上させたホトレジスト組成物おょぴ該組成物を用いたレジストパ タ一ン形成方法に関するものである。 背景技術
半導体集積回路パターンの微細化は、 光リソグラフィ一およびその周辺技術の 進歩により達成されてきたといっても過言ではない。 この光リソグラフィ一は、 周知のように、 大きく分けて 2つの技術に支えられている。 一つは、 ステッパー やスキャナーと呼ばれる縮小投影露光装置の露光波長や開口数であり、 他の一つ は、 前記縮小 影露光装置によってマスクパターンが転写されることになるホト レジスト組成物の転写解像性を主体としたレジスト特性である。 これらが車の両 輪のように作用し合つて光リソグラフィ一による半導体集積回路パタ一ンの加工 精度を向上させてきた。
縮小投影露光装置に用いられる光源は、 回路パターンの高解像度化の要請を受 けて、 ますます短波長化されている。 一般に、 レジスト解像性約 0 . 5 μ πでは 水銀ランプの主要スペクトルが 4 3 6 n mの g線が、 約 0 . 5〜0 . 3 0 μ mで は同じく水銀ランプの主要スぺクトルカ S 3 6 5 n mの i線が用いられ、 約 0 . 3
0〜0. 1 5 μπιでは 248 nmの Kr Fエキシマレーザー光が用いられ、 約 0. 1 5 μ m以下では 1 93 n mの A r Fエキシマレーザー光が用いられており、 さ らなる微細化のために 1 57 nmの F2エキシマレーザー光や 1 26 nmの Ar2 エキシマレーザー光、 EUV (極端紫外線 波長 1 3 nm) の使用が検討されて いる。 '
一方、 ホトレジスト組成物について見てみると、 現在では、 有機又は無機反射 防止膜との組み合わせや照明系の工夫もあり、 K r Fエキシマレーザー光を用い たリソグラフィ一において、 Kr F用ホトレジストの延命化がなされ、 λ/2以 下の約 1 1 0 nmを視野に入れたホトレジスト組成物の開発が行われている。 ま た、 A r Fエキシマレーザー光を用いたリソグラフィ一において、 将来の約 90 nmノード以下の量産に向けて、 好適な A r F用ホトレジスト組成物の提供が望 まれている。 そして、 前記 F2エキシマレーザーを用いたリソグラフィ一は、 将 来の 6 5 nm以下の微細加工技術を担うものとして注目されており、 この F2ェ キシマレーザーを用いたリソグラフィ一による微細加工にも十分に適用可能なホ トレジスト,組成物の開発が進められている。
周知のように、 Vソグラフィ一では、 実現しょうとする半導体集積回路パタ一 ンの陰画または陽画パターンを反映したマスクを介して、 短波長光を積層半導体 基板上に塗布したホトレジスト層に照射する (露光) 。 ホトレジスト糸且成物は、 照射光に反応してアルカリに対して不溶化 (ネガ) もしくは溶解可能 (ポジ) に なる感光性ポリマーを主成分として含有しており、 パターン光の照射後、 露光に よるレジスト層の反応を確実にするための加熱 (post exposure bake、 以下 「P EB」 と略すことがある) を行い、 続いて、 現像して溶解可能な部分が除去され ることにより、 実現しょうとする回路パターンを正確に反映したホトレジストパ ターン層を積層半導体基板上に形成する。 この後、 パターン化したホトレジスト 層を加熱 (post bake) により十分に硬ィヒさせて次工程のエッチングへの耐性を 持たせることもある。 エッチング工程では、 パターン化したホトレジスト層をマ
スクとして積層半導体基板の表面層あるいは上部層をパターンに沿ってドライエ
- したがって、 ホトレジスト組成物に要求される主な特性は、 まず解像性を得る ことであり、 そのためにはレジスト層の表面部分ばかりでなく基板側の底面部分 にまでパターン照射光が届き、 照射部分の厚み全体にわたりレジスト層を底面部 分まで十分に感光させることができるような 「照射光に対する透明性」 を有する こと、 そして、 パターン光の照射を受けた後のアル力リ可溶部分とアル力リ不溶 部分とが明確に差別化され、 アルカリ現像液によって高い解像性のパターンが得 られることである。 前述の照射光のさらなる短波長化に対応するレジスト糸且成物 を開発する場合も、 もちろん、 この主要特性を確保することが重要となる。 次世 代のステッパーの光源となる F2エキシマレーザー光によるリ グラフィ一に用 いることのできるレジス .ト,袓成物のベー ポリマーには、 F2エキシマレーザー 光の主要スぺクトルである 1 5 7 n mに高い透明性が必要となる。 しかしながら、 既存のレジスト材料は、 まさに、 この波長 1 5 7 n mに吸収を持っため、 すなわ ち、 波長 1 5 7 n mの照射光に対する透明性が低いため、 既存のレジスト材料か ら次世代のレジスト糸且成物を得ることはできない。 - このように、 ホトレジスト組成物を提供する技術分野では、 現在、 この波長 1 5 7 n mに高い透明性を有する新規なポリマーの開発が課題となっている。 現在 までのとごろ、 フッ素 (F) や.シリコン ,( S i ) を導入することによって波長 1 5 7 n mを主要スぺクトルとする照射光に対する透明性を確保するとともに、 露 光後の現像特性を左右するアルカリ可溶性や、 パターン転写解像性、 そして耐ェ ツチング性といったレジスト性能を兼ね備えた新規なポリマーの開発が進められ ている。 そして、 有望なベースポリマーとして、 フッ素含有ノルボルネンポリマ 一 (非特許文献 1 (M. K. Crawford, et al. , "New Material for 157 nm Photoresists: Characterization and Properties" Proceedings of SPIE, Vol. 3999, (2000) pp357 -364) および特許文献 1 (国際公開第 WO 0 0 / 6 7 0 7
2号パンフレット) ) 、 フッ素含有単環式ポリマー (特許文献 2 (特開 2 0 0 2 - 9 0 9 9 7号公報) 及ぴ非特許文献 2 (Shun-ichi Kodama, et
al. , Synthesis of Novel Fluoropolymer for lb run Photoresists by Cyclo— polymerization" Proceedings of SPIE, Vol. 4690, (2002) pp76 -83) ) 、 テ トラフルォロエチレン共重合ポリマー ' (非特許文献:!および特許文献 1 ) 、 1, 1, 2 , - 3, 3—ペンタフノレオロー 4一トリフスレオロメチノレ一 4—ヒ ドロキシー 1, 6—へブタジエンの環化重合により形成されるフッ素含有単環式ポリマー ( 非特許文献 2 ) 等の数多くのポリマーが、 報告されている。
特許文献 1及び非特許文献 1に開示のフッ素含有ノルポルネンポリマー (以下、 従来ポリマー Aと略す) と特許文献 2及び非特許文献 2に開示のフッ素含有単環 式ポリマー (以下、 従来ポリマー Bと記す) は次世代ホトレジスト組成物のベー スポリマーとして有望であると考えられる。
前記弗特許文献 1には、 従来ポリマー Aの具体的例として、 テトラフルォロ チレン (4 9重量0 /0) /"ノルボルネン ( 5 1重量0 /0) からなる共重合ポリマー ( 以下、 従来ポリマー A 1と記す) 、 テトラフルォロエチレン (4 1重量0 /0) Zノ ルポルネン (4 6重量%) Z酢酸ビュル (1 2重量%) からなる 3元共重合ポリ マー (以下、 従来ポリマー A 2と記す) 、 テトラフルォロエチレン ( 4 3重量% ) /ノルボルネン (3 8重量%) /酢酸ビニル (2 0重量%) からなる 3元共重 合ポリマ (以下、 従来ポリマー A 3と記す) 、 テトラフルォロエチレン (4 3 重量0 /0) ノノルポルネン (2 8重量%) /酢酸ビュル (2 9重量%) からなる 3 元共重合ポリマー (以下、 従来ポリマー A 4と記す) 、 テトラフルォロエチレン ( 3 6重量0 /0) /ノルポルネン (4 7重量0 /0) / t一プチルァクリレート ( 1 7 重量%) からなる 3元共重合ポリマー (以下、 従来ポリマー A 5と記す) 、 テト ラフルォ口ェチレン ( 2 8重量0 /0) /ノルポルネン ( 3 8重量0 /0) / t—プチル アタリレート (3 4重量%) からなる 3元共重合ポリマー (以下、 従来ポリマー A 6と記す) 、 およぴテトラフルォロエチレン (4 2重量%) ノノルポノレネン (
4 1重量%) ノ 5—ノルポルネン _ 2 _カルボン酸 t一プチルエステル (1 7重 ,量%) からなる 3元共重合ポリマー (以下、 従来ポリマー A 7と記す) 力 開示 されている。
この非特許文献 1には、 波長 1 5 7 nmの露光により十分なパターン転写解像 性を得るためには、 膜厚を正規ィヒしたレジスト膜の吸収係数 (光学定数) を 2. 5 (^m"1) 以下とする必要があると教示されているが、 前記各ポリマーの測定 された光学定数は、 それぞれ、 1. 3 (従来ポリマー A 1) 、 2. 0 (従来ポリ マー A2) 、 2. 1 (従来ポリマー A3) 、 2. 6 (従来ポリマー A4) 、 2. 4 (従来ポリマー A 5) 、 3. 6 (従来ポリマー A 6) となっており (従来ポリ マー A7は未測定) 、 概ね良好な値を示している。 したがって、 この従来ポリマ 一 Aは、 波長 1 5 7 n mのレーザー光を露光することを念頭においた場合の透明- 性からは、 次世代レジスト組成物のベースポリマーとして合格圏内に入ることに なる。
一方、 特許文献 1には、 従来ポリマー Aの具体的例として、 多数例が開示され ているが、 例えば、 2元共重合ポリマーとして、 テトラフルォロエチレン (0. 3モル) /へキサフルォロイソプロパノール置換ノルボルネン (0. 2モル) 力 らなる 2元共重合ポリマー (以下、 従来ポリマー A8と記す) が挙げられ、 3元 共重合ポリマーとして、 テトラフロォロエチレン (4 6モル%) /へキサフルォ 口イソプロパノール置換ノルポルネン (2 7モル%) /OCH2C (CF3) 2OC H20 C H3置換ノルポルネン ( 2 7モル0 /0) からなる 3元共重合ポリマー (以下、 従来ポリマー A 9と記す) が挙げられている。 前記従来ポリマー A 8の波長 1 5 7 nm照射光における吸収係数は、 1. 2 7 μπ 1 (膜厚 6 7. 5 nm) 、 1.
40 μ m—1 (膜厚 5 2. 3 nm) と良好であり、 前記従来ポリマー A 9の波長 1
5 7 nmにおける吸収係数は、 2. 4 0 m—1 (膜厚 6 9. 2 nm) , 2. 1 7 μχ 1 (5 . 9 nm) であり、 透明性は、 共に、 次世代レジスト組成物のベー スポリマーとして合格範囲内にある。 さらに、 この特許文献 1では、 得られた従
来ポリマー Aをベースポリマーとして、 ホトレジスト E成物を調製し、 これを基 板上に塗布して、 レジスト膜とし、 この膜にパターンを形成して、 パターン解像 性.を検証している。 例えば、 前記従来ポリマー A 8をベースポリマーとしたホト レジスト組成物では、 0 . 3 1 2重量%の従来ポリマー A 8に対して、 1 . 8 0 0重量0 /0の 2—へプタノン、 1 . 6 4 8重量0 /0のシクロへキサノン、 0 . 0 8 0 重量0 /0の t一プチルリ トコレート、 そして、 0 . 1 6 0重量0 /0のトリフエニルス ルフォ -ゥムトリフラート (5重量%シクロへキサノン溶液) を添加している。 このホトレジスト,祖成物からレジスト膜を形成し、 波長 1 5 7 n mのパターン光 を照射し、 レジストパターンを形成している。 また、 前記従来ポリマー A 9につ いても、 このポリマーをベースポリマーとして、 同様にレジスト膜を形成し、 波 長 1 5 7 n mのパターン光を照射して、 レジストパターンを形成している。 その 他の組成のポリマーについても、 同様にレジスト膜およびそのパターン化が試み られている。 しかしながら、 これらのパターンィ匕の実施例では、 どの程度の解像 性が実現できたのかの評価については、 まったく開示されていない。
したがって、 この特許文献 1においては、 従来ポリマー Aの 1 5 7 n m波長光 に対する透明性が良好であり、 従来ポリマー Aは波長 1 5 7 n mの照射光を用い た微細リソグラフィー用のホトレジスト糸且成物のベースポリマーとして有望であ ることは確認できるものの、 次世代半導体集積回路の実際のパターンに必要とさ れるレジストパターンのライン幅を達成できているか、 できているとすれば、 そ のパターン形状の良否はどうであるのか等のパターン解像性については、 不明で ある。
しかしながら、 前記非特許文献 1および特許文献 1に開示のテトラフルォロェ チレン共重合ポリマー (従来ポリマー A) は、 波長 1 5' 7 n mに対する透明性に 優れ、 耐プラズマエッチング性もあり、 高いガラス転位点を持ち、 慣用の 2 6 Nテトラメチルァンモユウムヒドロキシド現像液に相溶"生があるとされており、 次世代ホトレジスト組成物のベースポリマーとして有望であると考えられる。
他方、 特許文献 2に開示の従来ポリマー Bは、 下記式 (9) で示される化合物 またはその誘導体からなるジェン系モノマー (a) のモノマー単位と含フッ素ビ ニルモノマー (b) のモノマー単位とが環ィ匕反応した環状構造の繰り返し単位を 含み、 かつ含フッ素ビニルモノマーに由来するプロック化された酸性基を有する フッ素含有単環式ポリマーである。 ...
CH2=CH-X-CH=CH2 (9)
上記式 (1) 中、 Xはメチレン基または酸素原子を表す。 また、 前記.(a) の 誘導体には、 アルキル置換体および水酸基置換体を含み、 置換アルキル基は炭素 数 1ないし 4の低級アルキル基が好ましい、 とされている。
特許文献 2には、 従来ポリマー Bの具体的例として、 4つの合成例が開示され ている。
合成例 1では、 13. 6 gの CH2=CHCH2CH=CH (以下、 モノマー 1 と記す) と、 136. 0 gの CF2=CFOCF2CF2C (CF3) OCOC (C H3) 3 (以下、 モノマー 2と記す) と、 10質量0 /0のジイソプロピノレパーォキシ カーボネートのトリクロ口トリフルォロェタン溶液 1 OmLとを、 0. 3Lのト リクロロトリフル^口エタン溶媒に導入し、 加熱、 重合させて、 17. 4 gのポ リマー Bを得ている (以下、 従来ポリマー B 1と記す) 。 この従来ポリマー B 1 における前記モノマー 1単位/モノマー 2単位二 35/65 (モル0 /0) であり、 ポリスチレン換算数平均分子量は 10, 200である。
合成例 2では、 14. 0 gの CH2=CHOCH=CH2 (以下、 モノマー 3と 記す) と、 36. 08 gの前記モノマー 2と、 10質量0 /0のジイソプロピルパー ォキシカーボネートのトリクロ口トリフルォロェタン溶液 1 OmLとを、 150 gのトリクロ口トリフルォロェタン溶媒に導入し、 加熱、 童合させて、 12. 2 gの従来ポリマー Bを得ている (以下、 従来ポリマー B 2と記す) 。 この従来ポ リマー B 2における前記モノマー 3単位/モノマー 2単位 = 31/69 (モル0 /0 ) であり、 ポリスチレン換算数平均分子量は 14, 500である。
合成例 3では、 16. 8 gの CH2-CHCH (OH) CH=CH2 (以下、 モ ノマー 4と-記す) と、 150. 5 gの前記モノマー 2と、 10質量0 /0のジイソプ 口ピノ I ^ 一^キシカーボネ一トのトリクロ口 トリフノレオ口エタン溶液 10 mLと を、 150 gのトリクロ口トリフルォロエタン溶媒に導入し、 加熱、 重合させて、 10. 8 gの従来ポリマー Bを得ている (以下、 従来ポリマー B 3と記す) 。 こ の従来ポリマー B 3における前記モノマー 4単位 Zモノマー 2単位 = 38/62 (モノレ0 /0) であり、 ポリスチレン換算数平均分子量は 12, 300である。
合成例 4では、 13. 6 gのモノマー 1と、 117. 9 gの CF2=CFOC F2CF2C (CF3) (CH3) OCOC (CH3) 3 (以下、 モノマー 5と記す) と、 10質量0 /0のジィソプロピルパーォキシカーボネートのトリクロ口 トリフルォロ エタン溶液 10mLとを、 150 gのトリクロ口トリフルォロエタン溶媒に導入 し、 加熱、 重合させて、 9. 4 gの従来ポリマー Bを得ている (以下、 従来ポリ マー B 4と記す) 。 この従来ポリマー B 4における前記モノマー 1単位/モノマ 一 5単位 = 39/61 (モル0 /0) であり、 ポリスチレン換算数平均分子量は 1 1, 800である。
さらに、 この特許文献 2では、 得られた従来ポリマー Bをベースポリマーとし て、 ホトレジスト組成物を調製し、 これを基板上に塗布して、 レジスト膜とし、 この膜にパターンを形成して、 パターン解像性を検証している。 すなわち、 前記 各従来ポリマー B 1〜B 4の 100質量部と、 トリメチノレスノレホニゥムトリフレ ート 5質量部とを、 プロピレングリコールモノメチルエーテルアセテート 700 質量部に溶解してレジスト組成物を得て、 この ,袓成物をシリコン基板上にスピン コーティングにより均一に塗布し、 80度分間加熱して、 0. (300 η m) のレジスト膜を得ている。 従来ポリマー B 1から B 4に対応するレジスト膜 の 197 nm照射光に対する透過率は、 それぞれ、 Ί 2%、 68%、 65%、 7 1 %であったとしている。 また、 それぞれの角早像度は、 ライン 'アンド'スぺー ス -パターンで 0. 25μπι (250 nm) 、 0. 25 μΐη (250n m) 、 0.
24 m (240 nm) 、 0. 24μπα (240n m) の寸法が可能であつたと している。 '
このように、 特許文献 2では、 レジスト膜厚 0. 3 (300nm) で、 0. 24— 0. 25 μΐη ( 250 n m) のライン 'アンド ·スペースの解像性が得ら れているが、 F2エキシマレーザーの 157 nm波長光での露光は実 されてお らず、 157 nm波長光に対する透明性 (光学定数) およびレジストパターンの 解像性は、 不明である。 F2エキシマレーザーを用いる場合の想定レジスト膜摩 120ないし 150 nmであり、 ライン ·アンド ·スペース .パターンを形成し た場合の所望とされる解像度は、 150 nm以下、 好ましくは 100 nm以下で ある。 また、 レジスト膜の所望とされる透明度については、 前記非特許文献 1に 記載のように、 波長 157 nmの露光により十分なパターン転写解像性を得るた めには、 膜厚を正規ィ匕したレジスト膜の吸収係数 (光学定数) を 2. 5 (μιη"1 ) 以下とする必要がある。
したがって、 この特許文献 2においては、 従来ポリマー Βの 193 nm波長光 に対する透明性が良好であり、 従来ポリマー Bは波長 193 n mの照射光を用い た微細リソグラフィー用のホトレジスト糸且成物のベースポリマーとして有望であ ることは確認できるものの、 次世代半導体集積回路の実際のパターンに必要とさ れる波長 157 nm照射光に対する透明性はどの程度なのか、 そして、 この波長 157 nm照射光によって所望のレジストパターンのライン幅を達成できる力、 できるとすれば、 そのパターン形状の良否はどうであるのか等のパターン;^像个生 については、 不明である。
また、非特許文献 2においては、 1, 1, 2, 3, 3—ペンタフルオロー 4一 トリフルォロメチルー 4ーヒドロキシ一 1, 6—へブタジエンの環ィヒ重合により 形成されるフッ素含有単環式ポリマーについて、 吸光係数、 T g、 現像液への溶 解性、レジスト溶媒への溶解性等を評価し、それらの特性が良好であることを確認 し、レジスト組成物を調整し、 100 nmのレジストパターンを形成している。
このこと力 ら、 従来ポリマー Aと同様に波長 1 5 7 n mの照射光を用いた微細 リソグラフィー用のホトレジスト糸且成物のベースポリマーとして有望であること は確認できる。
他方、 特許文献 1には、 リ トコール酸の tert -ブチルェステルのような公知 の溶解抑制剤を添加することが記載されている。
しかしながら、 上記従来のポリマー Aや Bとある種の溶解抑制剤を組み合わせ て用いても、 9 0 n mや 8 0 n mのレジストパターンは解像はできても、レジスト トップ部分が丸くなるなどのレジストパターン形状は不十分である。 そして、 従 来の技術にも説明したように、 F2エキシマレーザーを用いたリソグラフィ一は、 将来の約 6 5 n m以下の微細加工技術を担うものとして注目されていることから、 7 0 n m以下のレジストパターンで実用化を目指している。 しかしながら、 8 0 ' n m以下のレジストパターンでは、レジストトップ部の丸みは、 いっそう悪化す る。 従って、その問題の解決は重要な課題となっている。
一方、 前記非特許文献 1および特許文献 1に開示のテトラフルォロエチレン共 重合ポリマー (以下、 従来ポリマー Cと記す) は、 波長 1 5 7 n mに対する透明 性に優れ、 耐プラズマエッチング性もあり、 高いガラス転位点を持ち、 慣用の 0 . 2 6 Nテトラメチルアンモニゥムヒドロキシド現像液に相溶性があるとされてお り、 次世代ホトレジスト組成物のベースポリマーとして有望であると考えられる。 前記非特許文献 1には、 従来ポリマー Cの具体的例として、 テトラフルォロェ チレン ( 4 9重量%) /ノルポルネン ( 5 1重量%) カ らなる共重合ポリマー ( 以下、 従来ポリマー C 1と記す) 、 テトラフルォロエチレン (4 1重量0 /0) /ノ ルボルネン (4 6重量%) Z酢酸ビニル (1 2重量%) からなる 3元共重合ポリ マー (以下、 従来ポリマー C 2と記す) 、 テトラフルォロエチレン (4 3重量0 /0 ) /ノルポルネン ( 3 8重量0 /0) 酢酸ビニル ( 2 0重量0 /0) からなる 3元共重 合ポリマー (以下、 従来ポリマー C 3と記す) 、 テトラフルォロエチレン (4 3 重量0 /0) /ノルボルネン ( 2 8重量%) /酢酸ビュル (2 9重量%) か なる 3
元共重合ポリマー (以下、 従来ポリマー C 4と記す) 、 テトラフルォロエチレン (36重量%) /ノルボルネン (47重量%) /t—ブチルアタリレート (17 重量%) 力 らなる 3元共重合ポリマー (以下、 従来ポリマー C 5と記す) 、 テト ラフルォロエチレン (28重量%) /ノルポルネン (38重量%) 7t—プチル アタリレート (34重量%) からなる 3元共重合ポリマー (以下、 従来ポリマー C6と記す) 、 およぴテトラフルォロエチレン (42重量%) Zノルポルネン ( 41重量0 /0) / 5一ノルボルネンー 2—力ルボン酸一 t一プチルエステル ( 17 重量%) からなる 3元共重合ポリマー (以下、 従来ポリマー C 7と記す) 力 開 示され Tいる。
この非特許文献 1には、 波長 157nmの露光により十分なパタ一ン転写解像 性を得るためには、 膜厚を正規化したレジスト膜の吸収係数 (光学定数) を 2. 5 (^m— 以下とする必要があると教示されているが、 前記各ポリマーの測定 された光学定数は、 それぞれ、 1. 3 (従来ポリマー C 1) 、 2. 0 (従来ポリ マー C2) 、 2. 1 (従来ポリマー C 3) 、 2. 6 (従来ポリマー C 4) 、 2. 4 (従来ポリマー C 5) 、 3. 6 (従来ポリマー C 6) となっており (従来ポリ マー C 7は未測定) 、 概ね良好な値を示している。 したがって、 この従来ポリマ 一 Cは、 波長 157 nmのレーザー光を露光することを念頭においた場合の透明 性からは、 次世代レジスト組成物のベースポリマーとして合格圏内に入ることに なる。
一方、 特許文献 1には、 従来ポリマー Cの具体的例として、 多数例が開示され ているが、 例えば、 2元共重合ポリマーとして、 テトラフルォロエチレン (0. 3モル) /へキサフルォロイソプロパノール置換ノルポルネン (0. 2モル) 力、 らなる 2元共重合ポリマー (以下、 従来ポリマー C 8と記す) が挙げられ、 3元 共重合ポリマーとして、 テトラフロォロエチレン (46モル%) /へキサフルォ 口イソプロパノール置換ノルボルネン (27モル%) /OCH C (CF3) 2OC H2OCH3置換ノルボルネン (27モル%) からなる 3元共重合ポリマー (以下、
従来ポリマー C 9と記す) が挙げられている。 前記従来ポリマー C 8の波長 15 7 nm照射光における吸収係数は、 1. S T^um—1 (膜厚 67. 5 nm) 、 1.
40 ^1-1 (膜厚52. 3 nm) と良好であり、 前記従来ポリマー C 9の波長 1
57 nmにおける吸収係数は、 2. 40 m— 1 (膜厚 69. 2 nm) 、 2. 17 m"1 (54. 9 nm) であり、 透明性は、 共に、 次世代レジスト組成物のベー スポリマーとして合格範囲内にある。 さらに、 この特許文献 1では、 得られた従 来ポリマー Cをベースポリマーとして、 -ホトレジスト組成物を調製し、 これを基 板上に塗布して、 レジスト膜とし、 この膜にパターンを形成して、 パターン解像 性を検証している。 例えば、 前記従来ポリマー C 8をベースポリマーとしたホト レジスト組成物では、 0. 312重量%の従来ポリマー C 8に対して、 1. 80 0重量0 /0の 2—へプタノン、 1. 648重量0 /0のシクロへキサノン、 0. 080 重量0 /0の t—プチルリ トコレート、 そして、 0. 160重量0 /0のトリフエニルス ルフォニゥムトリフラート (5重量%シクロへキサノン溶液) を添加している。 このホトレジスト組成物からレジスト膜を形成し、 波長 157 nmのパターン光 を照射し、 レジストパターンを形成している。 また、 前記従来ポリマー C 9につ いても、 このポリマーをベースポリマーとして、 同様にレジスト膜を形成し、 波 長 157 nmのパターン光を照射して、 レジストパターンを形成している。 その 他の組成のポリマーについても、 同様にレジスト膜およびそのパターン化が試み られている。 し力 しながら、 これらのパターン化の実施例では、 どの程度の解像 性が実現できたのかの評価については、 まったく開示されていない。
したがって、 この特許文献 1においては、 従来ポリマー Cの 157 nm波長光 に対する透明性が良好であり、 従来ポリマー Cは波長 157 nmの照射光を用い た微細リソグラフィー用のホトレジスト ,袓成物のベースポリマーとして有望であ ることは確認できるものの、 次世代半導体集積回路の実際のパターンに必要とさ れるレジストパターンのライン幅を達成できているか、 できているとすれば、 そ のパターン形状の良否はどうであるのか等のパターン解像性については、 不明で
ある。
また、非特許文献 2においては、 1, 1, 2, . 3, 3—ペンタフルオロー 4一 トリフルォロメチルー 4ーヒドロキシー 1, 6—へブタジエンの環化重合により 形成されるフッ素含有単環式ポリマー (以下、 従来ポリマー Dと記す) について、 吸光係数、 T g、 現像液への溶解性、レジスト溶媒への溶解性等を評価し、それら の特性が良好であることを確認し、レジスト組成物を調製し、 1 0 0 n mのレジス トパターンを形成している。
このこと力 ら、 従来ポリマー Aと同様に波長 1 5 7 n mの照射光を用いた微細 リソグラフィー用のホトレジスト糸且成物のベースポリマーとして有望であること は確認できる。
他方、下記特許文献 3 (特開 2 0 0 3— 2 9 2 5号公報) には F2用レジストに 公知の含窒素化合物を添加することが記載されている。
しかしながら、 上記従来のポリマー C及ぴ D (以下、従来ポリマー C及び D並ぴ に前述の従来ポリマー A及び Bを合わせて「従来ポリマー」という)とある種の含 窒素化合物を組み合わせて用いても、 9 0 n mや 8 0 n mのレジストパターンは 角像はできても、レジストトップ部分が丸くなるなどのレジストパターン形状は 不十分である。 そして、 従来の技術にも説明したように、 F2エキシマレーザー を用いたリソグラフィ一は、 将来の約 6 5 n m以下の微細加工技術を担うものと して注目されていることから、 7 0 n m以下のレジストパターンで実用化を目指 している。 しかしながら、 8 0 n m以下のレジストパターンでは、レジストトップ 部の丸みは、 いっそう悪化する。 従って、その問題の解決は重要な課題となって いる。
また、 S i O Nのような含窒素膜を有する無機基板や有機反射防止膜を設けた 基板上でも解像性やそのパターン形状も不十分であるなどの問題がある。 発明の開示
本発明は、 前記事情に鑑みてなされたもので、 無機膜付基板や有機反射防止膜 を設けた基板等の各種基板上において 9 0 n m以下といった超微細パターンを形 成する場合であっても、 良好なレジストパターンの角像性及びレジストパターン の形状を得ることを目的とし、次世代の微細加工にも十分に適角可能なレジスト 特性を持ったホトレジスト組成物を提供することを課題とするものである。 前記課題を解決するために、 本願発明者らは、 (A) (i)フッ素原子又はフッ 素化アルキル基及ぴ (ii)アルコール性水酸基を共に有する脂肪族環式基を含むァ ルカリ可溶性の構成単位 ( a 1 ) を含んでなる、 酸の作用によりアルカリ可溶性 が変化する重合体と、 特定の溶解抑止剤又は含窒素化合物とを組み合わせること により、従来の問題点を解決し得、 特にパターン形状を中心としたレジスト特性 を向上させる予想以上の効果を挙げ得ることを見いだした。 そのような溶解抑止 剤としては、 フッ素原子を有し、 芳香族又は脂肪族の環基を有する化合物が適当 である。 また、 そのような含窒素化合物としては、 (d l ) 極性基を有する第 3 級ァミン、 ( d 2 ) 炭素数 7以上 1 5以下の第 3級アルキルァミン又は ( d 3 ) アンモニゥム塩から選ばれる含窒素化合物が適当である。
なお、 重合体 (A) をベースポリマーとするレジスト糸且成物は、 いわゆる化学 増幅型のレジスト組成物であるので、 露光後のレジストのアルカリ可溶化あるい はァノレ力リ不溶化反応の触媒となる酸を発生させる酸発生'剤を必須構成として含 有する。
本発明者らは、 前記知見に基づいて、 本発明ホトレジスト組成物を調製し、 こ のホトレジスト糸且成物を用いて、 半導体基板上にレジスト層を形成し、 このレジ スト層に、 F2ステッパーを用いて、 1 0 0 n m以下のライン 'アンド ' スペース と、 最も微細なレジストパターンでは 5 0 n mのライン ·アンド ·スペースを形 成ずることができたばかりでなく、 その形成ラインの断面形状が矩形を呈するこ とも知見された。
発明を実施するための最良の形態
(A) 成分:
前記構成の本発明にかかるホトレジスト組成物におけるベースポリマーである 重合体 (A) は、 (i)フッ素原子又はフッ素化アルキル基及び (ii)アルコール性 水酸基を共に有する脂肪族環式基を含むアルカリ可溶性の構成単位 ( a 1 ) を含 んでなる、 酸の作用によりアル力リ可溶性が変化する重合体である。
本発明の重合体 (A) は、特許文献 1や非特許文献 2に記載されているように 公知である。 そして、 (i)フッ素原子又はフッ素化アルキル基及ぴ (ii)アルコー • ル性水酸基を共に有する脂肪族環式基を含むアルカリ可溶性の構成単位 ( a 1 ) 有し、 酸の作用によりアル力リ可溶性が変化する重合体であれば、限定されるも のではない。
酸の作用によりアル力リ 溶性が変化するとは、 露光部における該重合体の変 化であり、露光部にてアル力リ可溶性が増大すれば、露光部はアル力リ可溶性とな るため、 ポジ型レジストとして用いられ、他方、 露光部にてアルカリ可溶性が減 少すれば、 露光部はアル力リ不溶性となるため、 ネガ型レジストとして用いるこ とができる。
(i)フッ素原子又はフッ素化アルキル基及ぴ (ii)アルコール性水酸基を共に有 する脂肪族環式基を含むアルカリ可溶性の構成単位 ( a 1 ) とは、 前記 (i)と (ii)をともに有する有機基が脂肪族環式基に結合しており、 該環式基を構成単位 中に有するものであればよい。
該脂肪族環式基とは、 シクロペンタン、シクロへキサン、 ビシクロアルカン、 トリシクロアル力ン、 テロラシクロァノレ力ンなどの単環又は多環式炭化水素から
1個又は複数個の水素原子を除いた基などを例示できる。
多環式炭化水素は、 より具体的には、 ァダマンタン、 ノルボルナン、 イソボル ナン、 トリシクロデカン、 テトラシクロドデカンなどのポリシク口アル力ンから 1個又は複数個の水素原子を除いた基などが挙げられる。
これらの中でもシク口ペンタン、シクロへキサン、 ノルボルナンから水素原子 を除き誘導される基が工業上好ましい。
(i)フッ素原子又はフッ素化アルキル基としては、 フッ素原子又は低級アルキ ル基の水素原子の一部又は全部がフッ素原子で置換されたものが挙げられる。 具 体的には、トリフルォロメチル基、 ペンタフルォロェチル基、 ヘプタフルォロプ 口ピル基、 ノナフルォロブチル基などが挙げられる力 S、工業的には、フッ素原子や トリフルォロメチル基が好ましい。
(ii)アル:?ール性水酸基とは、 単にヒドロキシル基であってもよいし、ヒドロ キシ基を有するアルキルォキシ基、 アルキルォキシアルキル基又はアルキル基の よう.なアルコール性水酸基含有アルキルォキシ基、 アルコール性水酸基含有アル キルォキシアルキル基又はアルコール性水酸基含有アルキル基等が挙げられる。 該アルキルォキシ基、 該アルキルォキシアルキル基又は該アルキル基としては、 低級アルキルォキシ基、 低級アルキルォキシ低級アルキル基、 低級アルキル基が 挙げられる。
低級アルキルォキシ基としては、 具体的には、メチルォキシ基、ェチルォキシ基、 プロピルォキシ基、 プチルォキシ基等が挙げられ、低級アルキルォキシ低級アル キル基としては、 具体的には、メチルォキシメチル基、ェチルォキシメチル基、プ 口ピルォキシメチル基、 ブチルォキシメチル基等が挙げられ、 低級アルキル基と しては、 具体的には、メチル基、ェチル基、プロピル基、 プチル基等が挙げられる。 また、 前記 (ii)のアルコール性水酸基含有アルキルォキシ基、 アルコール性 水酸基含有アルキルォキシアルキル基又はアルコール性水酸基含有アルキル基に おける該アルキルォキシ基、 該アルキルォキシアルキル基又は該アルキル基の水 素原子の一部又は全部がフッ素原子で顰換されたものでもよい。 好ましくは、前 記アルコール性水酸基含有アルキルォキシ基又はアルコール性水酸基含有アルキ ルォキシアルキル基におけるそれらのアルキルォキシ部の水素原子の一部がフッ 素原子で置換されたもの、 前記アルコール性水酸基含有アルキル基では、 そのァ
ルキル基の水素原子の一部がフッ素原子で置換されたもめ、 すなわち、アルコー ル性水酸基含有フルォロアルキルォキシ基、 アルコール性水酸基含有フルォロア ルキルォキシアルキル基又はアルコール性水酸基含有フルォロアルキル基が挙げ られる。
アルコール性水酸基含有フルォロアルキルォキシ基としては、 (HO) C (C F3) 2CH20_基 (2—ビス (へキサフルォロメチル) —2—ヒドロ.キシ一ェチ ルォキシ基、 (HO) C (CF3) 2CH2CH20—基 (3—ビス (へキサフルォ 口メチル) _ 3—ヒドロキシープロピルォキシ基等が挙げられ、 アルコール性水 酸基含有フルォロアルキルォキシアルキル基としては、 (HO) C (CF3) 2C H20— CH2—基、 (HO) C (CF3) 2CH2CH20— CH2—基等が挙げられ、 アルコール性水酸基含有フルォロアルキル基としては、 (HO) C (CF3) 2C H2—基 (2—ビス (へキサフルォロメチル) 一 2—ヒドロキシーェチル基、 ( HO) C (CF3) CH2CH2—基 (3—ビス (へキサフルォロメチル) _3— ヒドロキシ—プロピル基、 等が挙げられる。
これらの(i)や (ii)の基は、 前記脂肪族環式基に直接結合していればよい。 特' には、 (a 1) 構成単位がアルコール性水酸基含有フルォロアルキルォキシ基、 ' アルコール性水酸基含有フルォ口アルキルォキシアルキル基又はアルコ一ル性水 酸基含有フルォロアルキル基がノルボルネン環に結合し、該ノルボルネン環の 2 重結合が開裂して形成される下記一般式 (10) で表される単位が透明性とアル カリ可溶性及ぴ耐ドライエツチング性に優れ、 また工業的に入手しゃすく好まし
(式中、 Zは、 酸素原子、ォキシメチレン基 (一O (CH2) -) 、 または単結合 であり、 n, と m, は、 それぞれ独立して 1〜5の整数である。 )
そして、 そのような (a l) 単位と組み合わせて用いられる重合体単位は、 特 に限定されずこれまで公知のものを用いることができる。 ポジ型の酸の作用によ り'アル力リ可溶性が増大する重合体 (A- 1 ) として用いる場合、公知の酸解離 性溶解抑制基を有する (メタ) アクリルエステルから誘導される構成単位 (a 2 ) が解像性に優れるので好ましい。
このような構成単位 (a 2) としては、 tert—プチル (メタ) ァクリレート、 tert—ァミル (メタ) アタリレートなどの (メタ) アクリル酸の第 3級アルキル エステルから誘導される構成単位が挙げられる。
そして、 本発明の重合体 (A) は、 さらに重合体の透明性を向上させるフッ素 化アルキレン構成単位 (a 3) を含んでなる、 酸の作用によりアル力リ可溶性が 増大する重合体 (A-2) であってもよい。 このような構成単位 (a 3) を含む ことにより、透明性がさらに向上する。 該構成単位 (a 3) としては、 テトラフ ルォロエチレンから誘導される単位が好ましい。
以下に、 重合体 (A_l) と重合体 (A_2) を表す一般式 (11) (12) を示す。
(式中、 Z, n, , m, は前記一般式 (10) の場合と同じであり、 R3は水素 原子またはメチル基であり、 R4は酸解離性溶解抑制基である。 ),
OH
(式中、 Z, n, , m, , R3および R4は前記一般式 (11) の場合と同じであ る。 )
また、 前記した一般式(10)を含む重合体 (A— 1) と重合体 (A-2) とは、 異なる構造式であるが、 (i)フッ素原子又はフッ素化アルキル基及ぴ(ii)アルコ ール性水酸基を共に有する脂肪族環式基を含むアルカリ可溶性の構成単位 (a 1 ) を含んでなる、 酸の作用によりアルカリ可溶性が変化する重合体の概念の中に 含まれる以下のような構成単位を有するものでもよい。
すなわち、 構成単位 (a 1) において、(i)フッ素原子又はフッ素化アルキル基
及び (ii)アルコール性水酸基は脂肪族環式上にそれぞれ結合し、 該環式基が主鎖 を構成しているものである。
該、(i)フッ素原子又はフッ素化アルキノレ基としては、前記したものと同様なも のが挙げられる。 また、 (ii)アルコール性水酸基とは、 単にヒドロキシル基であ る。
このような単位を有する重合体 (A) は、 非特許文献 2に記載されたものであ り、 7R酸基とフッ素原子を有するジェン化合物の環ィ匕重合により形成される。 該 ジェン化合物としては、 透明性、耐ドライエッチング性に優れる 5員環や 6員環 を有する重合体を形成しやすいへブタジエンが好ましく、さらには、 1, 1 2, 3, 3—ペンタフルオロー 4一トリフルォロメチルー 4ーヒドロキシ一 1, 6— へブタジエン (CF2=CFCF2C (CF3) (OH) CH2CH=CH2) の環化重 合により形成される重合体が工業上最も好ましい。
ポジ型の酸の作用によりアル力リ可溶性が増大する重合体 (A— 3 ) として用 レ る場合、そのアルコール性水酸基の水素原子が酸解離性溶解抑制基で置換され た構成単位 (a 4) を含んでなる重合体が好ましい。 その酸解離性溶解抑制基と しては、 鎖状、分岐状又は環状の炭素数 1 15のアルキルォキシメチル基が、 酸の解離性から好ましく、特にはメトキシメチル基のような低級アルコキシメチ ル基が解像性とパターン形状に優れ好ましい。 なお、 該酸解離性溶解抑制基は全 体の水酸基に対して、 10 40。/0、好ましくは 15 30 %の範囲であると、パ ターン形成能に優れ好ましい。
以下に、 重合体 (A-3) を表す一般式 (13) を示す。
(式中、 R
5は水素原子または C 1〜C 15のアルキルォキシメチル基であり、 x、 yはそれぞれ 10〜50モル
0 /
0である。 )
このような重合体 (A) は、 公知の方法、特許文献 1や非特許文献 2に記載の 方法によって、合成できる。 また、 該 (A) 成分の樹脂の G PCによるポリスチ レン換算質量平均分子量は、 特に限定するものではないが 5000〜 80000、 さらに好ましくは 8000〜 50000とされる。
また、 (A) 成分は、 1種または 2種以上の樹脂から構成することができ、 例 えば、 上述の (A_l) 、 (A-2) 、 及ぴ (A— 3) から選ばれる幾つかを 2 種以上混合して用いてもよいし、 さらに、 他に従来公知のホトレジスト組成物用 樹脂を混合レて用いることもできる。
(B) 成分:
(B) 成分としては、 ポジ型、 ネガ型共に従来化学増幅型レジストにおける酸 発生剤として公知のものの中から任意のものを適宜選択して用いることができる。 いろいろな酸発生剤が提案されているが、 特には、ジフエ二ルョードニゥムトリ フルォロメタンスルホネート、 (4—メ トキシフエ二ノレ) フエ二ルョードニゥム トリフルォロメタンスルホネート、 ビス (p— t e r t—プチルフエ二ル) ョー ドニゥムトリフノレ才ロメタンスノレホネート、 トリフエニノレスノレホニゥムトリ フノレ ォロメタンスノレホネート、 (4ーメ トキシ 7ェニノレ) ジフエニノレスノレホニゥムト リフルォロメタンスルホネート、 (4一メチルフエニル) ジフエニルスルホユウ ムノナフルォロプタンスルホネート、 (ρ— t e r t一プチノレフエニル) ジフエ ニノレスノレホニゥムトリフノレオ口メタンスノレホネート、'ジフエニノレョードニゥムノ ナフルォロプタンスノレホネート、 ビス (p_ t e r t—プチノレフエ-ノレ) ョード 二ゥムノナフルォロブタンスルホネート、 トリフエニルスルホニゥムノナフルォ ロブタンスルホネートなどのォニゥム塩などのォニゥム塩、 が好ましい。 なかで もフッ素化アルキルスルホン酸イオンをァニオンとするスルホニゥム塩が適度な
酸の強度とレジスト膜中での拡散性を有することから好ましい。
この (Β ) 成分は単独で用いてもよいし、 2種以上を組み合わせて用いてもよ い。 その配合量は、 例えば (Α) 成分 1 0 0質量部に対し、 0 . 5〜3 0質量部 とされる。 この範囲より少ないと潜像形成が不十分となるし、多いとレジスト組 成物としての保存安定性を損なう恐;^がある。
さらに、 本発明のホトレジスト組成物は、 必須成分として、 下記 (C) 成分及 ぴ (D) 成分の少なくともいずれか一方を含む。
(C) 成分: . - 前記 (C) .成分である、 フッ素原子を有する溶解抑止剤としては、 例えば、 少 なくともひとつのフッ素原子が結合し、かつ酸の作用によりアルカリ現像液への 溶解性が増加する好ましくは分子量 1 0 0以上 5 0 0以下の低分子量フェノール、 アルコールぁる ヽは力ルポン酸化合物における該フエノール、アルコールぁる ヽ はカルボン酸の水酸基の水素原子の一部を酸に不安定で、 アル力リに対する溶解 抑制能を有する置換基 (酸解離性溶解抑制基)で置換した化合物を挙げることでき る。
このような酸解離性置換基としては、 例えば、 第 3級アルキル基、 第 3級アル コキシカルボニル基、 第 3級アルコキシカルポニルアルキル基、 鎖状又は環状の アルコキシアルキル基等を挙げることができる。
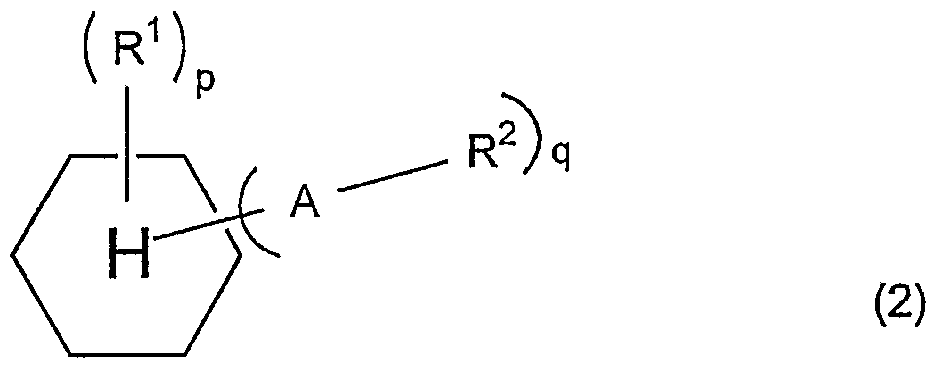
具体的には tert—ブチル基のような第 3級アルキル基、 tert—ブトキシカル ポニル基のような第 3級ァノレコキシカルポニル基、 tert—プトキシカノレボニルメ チル基第 3級アルコキシカルボニルアルキル基、 メトキシメチル基、 tert—ァミ ルォキシメチル基、 4- tertプチルーシク口へキシルォキシメチル基のような鎖 状、分岐状又は環状の炭素数 1〜 1 5のアルキルォキシメチル基が挙げられる。 このような化合物としては、 例えば、 一般式 (1 ) ( 2 )— :
(R1は水素原子、 アルキル基、 アルコキシル基、 フッ素原子であり、 R2は酸解 離性溶解抑制基、 Aは一 C (CnF2n+1) (CmF2rt) — O— CO— O—、 一 C (CnF2n+1 ) (CmF2m+1) 一 O—、 又は一 O— CO— O—であり、 n、 m、 p及ぴ qはそれぞ れ独立して 1—4の整数である。 伹し、 Aがー O— CO— O—のときは、 R1はフ ッ素原子である。 ) で表されるィ匕合物を挙げることができる。 これら一般式で示 される化合物の具体例としては、 下記化学式 (3) 〜 (8) :
W
24
(8) で表される化合物等を挙げることができる。 また、 その他の具体的な化合物とし ては、 3 3 5, 5, ーテトラフルォロ [ (1 1, 一ビフエニル) 一 4 4, 一ジ一 t—ブトキシカルボ二ル]、 4, 4 _[2 2 2—トリフルオロー 1 - (トリフルォロメチル) ェチリデン]ビスフエノール一 4, 4' —ジー t_ トキシカルボ-ル、 2—トリフルォ口メチルべンゼンカルボン酸 1 ' 1一 t—
ブチノレエステノレ、 2—トリフルォロメチルシク口へキサンカルボン酸一 t一プチ ルエステル等が挙げられる。
これらの中でも、 上記 ( 3 ) 〜 (8 ) で表される化合物が透明性が高く、 微細 なパターン形状に優れることから、 好ましい。
前記酸解離性溶解抑制基 R2は、 鎖状、分岐状又は環状の炭素数 1〜: 1 5のアル キルォキシメチル基又は第 3級アルキル基が好ましい。 中でも、 前記化学式 ( 6 ) や (7 ) で表される化合物が好ましい。 ,
本発明にかかるホトレジスト組成物における溶解抑止剤の添加量は、 主成分ポ リマー (A) 成分 1 0 0重量部に対して、 2〜3 0重量部、好ましくは 3〜: 1 0 重量部が適当である。 溶解抑止剤の添加量が 2重量部を下回ると溶解抑止効果が 現れない。 逆に添加量が 3 0重量部を超えると、 レジストの耐熱性が低下してし まう。
溶解抑止剤は、 フッ素原子を含することにより、 1 5 7 n m波長光に対する透 明性が格段に向上する。 本発明者らは、 フッ素原子を有する溶解抑止剤を用いた 場合とフッ素原子を有さない溶解抑止剤を用いた場合とを比較したが、 溶解抑止 剤としてフッ素原子を有するタイプを用いると、 パターン解像性が格段に向上す ることを確認している。
前記 (C) 成分を含む場合の本発明のレジスト組成物には、 パターン光の照射 により露光部に発生した酸の必要以上の拡散を防止する作用を発揮するアミン類 やアンモニゥム塩を添加しても良いし、.添加することが望ましい。 このアミン類 としては、 水酸基を有するアミンまたはァミン塩が適当である。
前記ァミンとしては、 本発明の実施例で用いたトリイソプロパノールァミンの 他に、 ジェチルァミン、 ジプロピルァミン、 ジプチルァミン、 ジペンチルァミン などの脂肪族第二級ァミン、 トリメチノレァミン、 トリエチノレアミン、 トリプロピ ルァミン、 トリプチルァミン、 トリペンチルァミン、 N, N—ジメチルプロピル ァミン、 N—ェチルー N—メチルプチルァミンなどの脂肪族第三級ァミン、 N,
N_ジメチノレモノエタノーノレアミン、 N, N—ジェチノレモノエタノ一/レアミン、 トリエタノールァミンなどの第三級アルカノールァミン、 N, N—ジメチルァニ リン、 N, N—ジェチルァニリン、 N—ェチノレ一N—メチルァニリン、 N, N— ジメチルトノレイジン、 N—メチルジフエニルァミン、 N—ェチルジフエ-ルアミ ン、 N—ェチルジフエニルァミン、 トリフエニルァミンなどの芳香族第三級アミ ンなどを挙げることができる。
また、 前記ァミン塩としては、 本発明の実施例で用いたテトラプチルアンモニ ゥム乳酸塩のようなアンモニゥム塩の他に、 前記ァミンから誘導されたァミン塩 を用いることができる。
これらの中でも、トリエタノールァミン、 トリイソプロパノールァミン、トリブ タノールァミンなどの低級の第 3級アル力ノールァミン;.トリへキシルァミン、 トリヘプチルァミン、トリオクチルァミン、トリデカニルァミン、 トリ ドデシルァ ミン、トリテトラデカ -ルァミンなど炭素数 6以上 1 5以下のトリアルキルァミ ン;アンモニゥムイオン、 テトラメチルアンモニゥムイオン、 テトラェチルアン モニゥムイオン、 テトラプロピルアンモニゥムイオン、 テトラブチルアンモニゥ ムイオン、 テトラペンチルァンモニゥムィオン等の第 4級アルキルァンモニゥム イオンと乳酸のような水酸基を有する有機カルボン酸のイオンとの塩がレジスト パターントップ部分の膜減りの低減効果に優れることから、好ましい。 なお、 上 記トリアルキルァミンにおける窒素に結合する 3つのアルキル基は、 炭素数 6以 上 1 5以下のアルキル基であれば、 同一でも異なってもよい。 . 前記 (C) 成分を含有する場合の本発明のホトレジスト組成物におけるァミン 類やアンモニゥム塩は、 一種を単独で用いてもよく、 2種類以上を組み合わせて 用いてもよい。 また、 このアミン類ゃアンモ-ゥム塩の添加量は、 おおよそ、 主 成分ポリマー (A) 1 0 0重量部に対して、 0 . 0 1〜2重量部が適当である。 アミン類ゃアンモニゥム塩の添加量が 0. 0 1重量部を下回ると、 その添加によ る効果が期待できない。 逆にその添加量が 2重量部を超えると、 感度が劣化する
ため好ましくない。
また、 本発明においては、前記アミン類ゃアンモニゥム塩成分の添加による感 度劣化防止等の目的で、 さらに任意の成分として、 有機カルボン酸又はリンのォ キソ酸若しくはその誘導体を含有させることができる。
有機カルボン酸としては、 例えば、 マロン酸、 クェン酸、 リンゴ酸、 コハク酸、 安息香酸、 サリチル酸などが好適である。
リンのォキソ酸若しくはその誘導体としては、 リン酸、 リン酸ジ - n -プチル エステル、 リン酸ジフエ-ルエステルなどのリン酸又はそれらのエステルのよう な誘導体、 ホスホン酸、 ホスホン酸ジメチルエステノレ、 ホスホン酸-ジ- n -ブ チノレエステノレ、 フエ二ノレホスホン酸、 ホスホン酸ジフエニノレエステノレ、 ホスホン 酸ジベンジルエステルなどのホスホン酸及びそれらのエステルのような誘導体、 ホスフィン酸、 フエニルホスフィン酸などのホスフィン酸及びそれらのエステル のような誘導体が挙げられ、 これらの中で特にホスホン酸が好ましい。 該有機力 ルボン酸又はリンのォキソ酸若しくはその誘導体成分は、 (A) 成分 1 0 0質量 部当り 0 . 0 1〜5 . 0質量部の割合で用いられる。
(D) 成分:
(D) 成分は、 本発明の重合体 (A) と組み合わせて用いた場合、特に微細な パターンの形状改善効果を有するものであり、 (d l ) 極性基を有する第 3級ァ ミン、 (d 2 ) 炭素数 6以上 1 5以下の第 3級アルキルアミン又は (d 3 ) アン モニゥム塩から選ばれる含窒素化合物である。
前記 (d l ) における極性基としては、 ヒドロキシル基力 S、レジストパターン トップ部分の膜減りの低減効果に優れることから、好ましい。 特にはレジスト膜 中への残存しやすさから、 低級の第 3級アルカノールァミンが好ましい。 そのよ うなァミンとしては、トリエタノールァミン、 トリイソプロパノールァミン、トリ プタノールァミンなどが挙げられる。
前記 (d 2 ) としては、 トリへキシノレアミン、 トリへプチルァミン、ドリオク チルァミン、 トリデカニノレアミン、 トリ ドデシルァミン、トリテトラデカエルァミ ンなどが拳げられ、 レジストパターントップ部分の膜減りの低減効果に優れるこ とから、好ましい。 なお、 窒素に結合する 3つのアルキル基は、 炭素数 6以上 1 5以下のアルキル基であれば、 同一でも異なってもよい。
前記 ( d 3 ) としては、 アンモニゥムイオン、 テトラメチルアンモニゥムィォ ン、 テトラェチルアンモニゥムイオン、 テトラプロピルアンモ-ゥムイオン、 テ トラブチルアンモニゥムイオン、 テトラペンチノレアンモニゥムイオン等の第 4級 アルキルアンモニゥムイオンと乳酸のような水酸基を有する有機カルボン酸のィ オンとの塩が挙げられ、 レジストパターントップ部分の膜減りの低減効果に優れ ることから、好ましい。
これらの含窒素化合物は、 (A) 成分 1 0 0質量部に対して通常 0 . 0 1〜2 質量部の範囲で用いられる。 この範囲より少ないと、 パターンの形状改善効果が 得られないし、多すぎると感度が劣化するため好ましくない。
前記 (D) 成分を含む場合においてはさらに、酸の存在下で分解 (例えば、 カロ 水分解される) されることにより、 アルカリ可溶性が増大する低分子量化合物で ある溶解抑止剤を添加してもよい。 溶解抑止剤は、 露光後の不溶部分の現像液に よる溶解作用を抑止することができる。 現像が幾分過度になった場合は、 まずパ ターンの角部分の溶解が進みやすいが、 溶解抑止剤を添加しておけば、 前記パタ ーン角部の溶解を防止することができ、 パターンのコントラストを良好に確保す ることができる。
本発明に用いる溶解抑止剤は、 例えば、 分子量 2 0 0〜 5 0 0の少なくともひ とつの芳香族環又は脂肪族環を有するフエノール性水酸基、 アルコール性水酸基、 カルボキシル基の官能基に酸の存在下で解離し得、アル力リに対する溶解抑制能 を有する一種以上の置換基を導入した化合物を挙げることができる。 このような 酸解離性置換基としては、 例えば、 第 3級アルキル基、 第 3級アルコキシカルボ
ニル基、 第 3級アルコキシカルボニルアルキル基、 鎖状又は環状のアルコキシァ ルキノレ基等を挙げることができる。
具体的には tert—プチル基のような第 3級アルキル基、 tert—ブトキシカル ボニル基のような第 3級アルコキシカルボニル基、 tert—ブトキシカルボニルメ チル基のような第 3級アルコキシカルボニルアルキル基、 メトキシメチル基、 1 —ェトキシェチノレ基、 1一プロポキシェチル基のような鎖状アルコキシァノレキノレ 基、 テトラヒドロピラエル基、テトラヒドロフラニル基のような環状アルコキシ アルキル基等が挙げられる。 ' ' そのような溶解抑制剤としては、 リ トコール酸のような胆汁酸のカノレポキシノレ 基の水素原子を第 3級アルキル基で置換した化合物や次のようなフッ素含有化合 物を好ましいものとして挙げることができる。 特には、後者のフッ素含有化合物 がパターン形状に優れ好ましい。
該フッ素含有化合物としては、 次の化学式で表される化合物が挙げられる。
前記 (D) 成分を含有する本発明のホトレジス 1^組成物における溶解抑止剤の 添加量は、 主成分ポリマー 1 0 0重量部に対して、 2〜 3 0重量部、好ましくは 3〜1 0重量部が適当である。 溶解抑止剤の添加量が 2重量部を下回ると溶解抑 止効果が現れない。 逆に添加量が 3 0重量部を超えると、 レジストの耐熱性が低 下してしまう。
また、 本発明においては、前記 (D) 成分の添加による感度劣化防止等の目的 で、 さらに任意の成分として、 有機カノレポン酸又はリンのォキソ酸若しくはその 誘導体を含有させることができる。
有機カルボン酸としては、 例えば、 マロン酸、 クェン酸、 リンゴ酸、 コハク酸、
安息香酸、 ザリチル酸などが好適である。
リンのォキソ酸若しくはその誘導体としては、 リン酸、 リン酸ジ一 n ―プチル エステル、 リン酸ジフエニルエステルなどのリン酸又はそれらのエステルのよう な誘導体、 ホスホン酸、 ホスホン酸ジメチノレエステ^^ ホスホン酸-ジ - n -ブ · チノレエステノレ、 フエ二ノレホスホン酸、 ホスホン酸ジフエ-ノレエステノレ、 ホスホン 酸ジベンジルエステルなどのホスホン酸及ぴそれらのエステルのような誘導体、 ホスフィン酸、 フエ二ノレホスフィン酸などのホスフィン酸及ぴそれらのエステノレ のような誘導体が挙げられ、 これらの中で特にホスホン酸が好ましい。 該有機力 ルボン酸又はリンのォキソ酸若しくはその誘導体成分は、 (A) 成分 1 0 0質量 部当り 0 . 0 1〜5 . 0質量部の割合で用いられる。 本発明のホトレジスト組成物は、前記 (A) 成分、 前記 (B ) 成分、及ぴ (C ) 成分と (D ) 成分との少なくとも一方、さらに必要に応じて添加される任意成分 を有機溶剤に溶解し、 均一な溶液として用いられる。 そのような有機溶剤として は、具体的には、 例えば、 アセトン、 'メチルェチルケトン、 シクロへキサノン、 メチルイソアミルケトン、 2一へプタノンなどのケトン類;エチレングリコール、 エチレングリコーノレモノアセテート、 ジエチレングリコーノレ、 ジエチレングリコ ールモノアセテート、 プロピレングリコーノレ、 プロピレングリコーノレモノァセテ ート、 ジプロピレングリコー ^、 又はジプロピレングリコーノレモノアセテートの モノメチ/レエーテノレ、 モノェチノレエーテノレ、 モノプロピノレエーテノレ、 モノプチノレ エーテル又はモノフエニルエーテルなどの多価アルコール類及ぴその誘導体;ジ ォキサンのような環式エーテル類;乳酸メチル、 乳酸ェチル、 酢酸メチル、. 酢酸 ェチル、 酢酸プチル、 ピルピン酸メチル、 ピルピン酸ェチル、 メ トキシプロピオ ン酸メチル、 ェトキシプロピオン酸ェチルなどのエステノレ類などを挙げることが できる。 これらの有機溶剤は単独で用いてもよく、 2種以上の混合溶剤として用 いてもよい。 中でもプロピレングリコールモノメチルエーテルアセテート (P G
ME A) 酸ェチル (E L) などが好ましい。
該有機溶剤の量はレジスト膜を形成する上で基板等に塗布可能な濃度とされる。 また、 本発明のホトレジスト組成物には、 さらに所望により混和性のある添加 剤、 例えばレジスト膜の性能を改良するための付加的樹脂、 塗布性を向上させる ための界面活性剤、 溶角抑制剤、 可塑剤、 安定剤、 着色剤、 ハレーション防止剤 などを添加含有させることができる。
本発明のレジストパターンを形成する方法は、 上記説明したホトレジスト組成 物を用いて、通常のリソグラフィープロセスによりレジストパターンを形成する ものである。 そのような方法とは、まず、 基板上にホトレジスト組成物を回転塗 布などにより塗布して、乾燥させレジスト膜を形成する。 次いで、マスクパターン を介して選択的に露光し、 露光後加熱する。 最後にアルカリ水溶液にて現像し、 レジストパターンが形成できる。 なお、さらにボストベータ処理を必要に応じて 行ってもよい。 光源としては、 限定されるものではないが、 2 0 0 n m以下の遠 紫外光、 具体的には A r Fエキシマレーザー、 F2エキシマレーザー、 E UV ( 極端紫外光) など、 電子線、軟 X線、 X線などを使用することができる。 特には、 F2エキシマレーザーが好ましい。 ■
基板には、 有機又は無機の反射防止膜や S i O N、 窒化ケィ素 (S i N) 、 四 窒化三ケィ素 (S i 3N4) 等の各種薄膜を設けた基板が用いられる。 実施例
以下、 本発明を実施例によりさらに詳しく説明する。 以下に示す実施例は、 本 発明を好適に説明する例示に過ぎず、 なんら本発明を限定するものではない。
(実施例 1 )
本発明のホトレジスト組成物の主成分とする共重合ポリマー (A) として、 1 , 1, 2, 3 , 3—ペンタフルオロー 4—トリフルォロメチルー 4—ヒ ドロキシ一
1, 6—へブタジエン (CF2=CFCF2C (CF3) (OH) CH2CH=CH2) とその水酸基の水素原子がメトキシメチル基で置換されたジェン化合物の環化重 合により形成された重合体 (以下ポリマー 1という)を用いた。
この重合体の構造式は下記のとおりである。 その重量平均分子量は 4万であつ た。
(式中、 Rは一 CH2OCH3または水素原子であり、 重合体中の全ての Rのうち.、 — CH2OCH3であるものの割合は 20%であった。 m: nは 50モル0 /0: 50 モル0 /0である。 )
この共重合ポリマー 100重量部に対して、 トリフエニルスノレホニゥムノナフ ルォロブタンスルホネート(以下 TPS- Nf という) を 5重量部、 トリイソプロノ ノ ールァミン 0. 1重量部、 サリチル酸 0. 1重量部及ぴ次の化学式で表される溶 解抑止剤(以下溶解抑止剤 1という) 5重量部をプロピレングリコールモノメチル エーテルアセテート(以下 PGMEAという) 1 100重量部に溶解させて、均一 な溶液として、ホトレジスト組成物を得た。
OCH,
他方、有機系反射防止膜組成物「AR— 19」 (商品名、 S h i p 1 e y社製) を、 スピンナーを用いてシリコンゥエーハ上に塗布し、 ホットプレート上で焼成 して乾燥させることにより、 膜厚 82 nmの有機系反射防止膜を形成した。 そし て、 上記で得られたホトレジスト組成物を、 スピンナーを用いて上記反射防止膜 '上に塗布し、 ホットプレート上で 90°C、 90秒間プレベータして、 乾燥させる ことにより、 反射防止膜上に膜厚 1 50 nmのレジスト層を形成した。
. 次に、 マスクパターンを介して、 Ex i t e c h社製の F2エキシマレーザー 縮小投影露光装置 (NA (開口数) =0. 85, び =0. 3) により、 F2ェキ シマレーザー (157 nm) を用いて、位相シフトマスクを介して選択的に照射 した。 次に 1 10°C、 90秒間の条件で PEB処理し、 さらに 23°Cにてアル力 リ現像液で 60秒間現像した。'アル力リ現像液としては 2. 38質量%テトラメ チルア モニゥムヒドロキシド水溶液を用いた。
このようにして得られたレジストパターンを走査型電子顕微鏡 (SEM) によ り観察したところ、 65 nmのラインアンドスペースパターン 1 : 1が形成され、 そのパターン形状断面は矩形性の高い良好なものであった。 また、その際の感度 は 30. 5mJ/cm2であった。 同様にして、 50 n mのラインアンドスペースパタ ーン 1 : 1. 5も形成でき、そのパターン形状断面は矩形性の高い良好なもので あった。 その際の感度は 28mJ/cm2であった。
(実施例 2— 8と比較例 1—4)
実施例 1において、 表 1に示すようなホトレジスト組成、パターエング条件、露 光装置に変え、パターユングした結果を表 1に示す。 なお、 パターユング条件に て記載してない点は、実施例 1と同じである。
以上、 実施例 2— 8と比較例 1-4においては、 A r Fエキシマレーザーによ る結果では、 特定の含窒素化合物と公知のフ 素化共重合ポリマーを用いると、 レジストパターン形状の垂直性が向上していることがわかる。 そして、実際 2ェ キシマレーザーによる結果では、実施例 1〜 3の結果より、最も微小なパターンで 50 nmのレジストパタ ν-ンが良好な形状で形成できた。 このことから、 波長 1
57 nmの照射光によるリソグラフィ一により 90 nm以下のライン ·アンド · スペースの解像性達成でき、垂直性の高い良好なレジストパターン形状が得られ ることが当業者には明らかである。
(実施例 9)
実施例 1で用いたものと同じフッ素含有単環式ポリマー: 100重量部と、 TP S-NF (トリフエ-ノレスノレホニゥムパーフノレオロブタンスノレホネート) 2. 5 重量部と、 トリ n—ドデシルァミン 0. 1重量部と、 サリチル酸 0. 1重量部と を、 プロピレングリコールモノメチルエーテルアセテート (PGMEA) 126 0重量部に投入、 混合して、 ホトレジスト組成物を得た。
レジスト膜を形成するための半導体基板として、 表面に 84 nm厚の有機反射 防止膜 (DUV— 30 J ブリューヮ 'サイェンスネ ±^)が形成された直径 20 Omm の半導体基板を用いた。 この反射防止膜上に、 前述のホトレジスト組成物をスピ ンコーティングにより均一に塗布し、 70 で 90秒間加熱し、 乾燥させて、 2 00 nmの膜厚のレジスト膜を得た。
前記レジスト膜に F2エキシマレーザー露光装置 (Exitech社製 NA=0. 8 5、 σ = 0. 6) を用いて 157 nm波長光をハーフトーンタイプの位相シフト マスクを介して照射した。
前記露光後、 110°Cにて 90秒間加熱した後、 テトラメチルアンモニゥムヒ ドロキシドの 2. 38重量0 /0濃度の溶液でパターンの現像を行った。 現像温度は 22°C、 現像時間は 60秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾 燥した。 '
その結果、 基板上には、 レジストパターンとして、 孔径 100 nmホールパタ ーン (ホールとスペースの比は 1 : 1) が形成された。 この時の露光,線量は 24. 2m jZcm2であった。 このパターンのラインの断面形状を観察したところ、 はっきりした巨形を呈していた。
下記の実施例 10〜: 17及ぴ比較例 5〜: L 0においては、 200 n m以下の波 長に対しての有効性を確認するために、 Ar Fエキシマレーザー (波長 193 η m) を用いて評価を行った。
(実施例 10)
本発明のホトレジスト組成物の主成分とする共重合ポリマー (A) として、 1, 1, 2, 3, 3—ペンタフルォ口一 4一トリフルォロメチル一 4ーヒドロキシー 1, 6—へブタジエン (CF2=CFCF2C (CF3) (OH) CH2CH=CH2) とその水酸基の水素原子がメトキシメチル基で置換されたジェン化合物の環化重 合により形成された重合体を用いた。
.この重合体の構造式は次のとおり。 その重量平均分子量は 4万であった。 下記 式においては、 R5はメトキシメチル基又は水素原子である。 重合体中の全ての R5のうち、 メトキシメチノレ基であるものの割合は 20%であり、 x、 yはそれ ぞれ 50モノレ%であつた。
(13)
'このフッ素含有単環式ポリマー 100重量部と、 TPS— NF (トリフエニル スルホニゥムパーフルォロブタンスルホネート) 4重量部と、 トリイソプロノくノ ールァミン 0. 4重量部と、 上記化学式 (6) で表されるフッ素原子を有する溶 解抑止剤 5重量部とを、 プロピレングリコールモノメチルエーテルァ.セテート ( PGMEA) 1100重量部に投入、 混合して、 ホトレジスト.組成物を得た。 レジスト膜を形成するための半導体基板として、 表面に 85 nm厚の反射防止 膜 (AR19、 シプレー社製) が形成された半導体基板を用いた。 この半導体基 板上に (すなわち、 前記反射防止膜上に) 、 前述のホトレジスト組成物をスピン
コーティングにより均一に塗布し、 9 5°Cで 90秒間加熱し、 乾燥させて、 2 5 0 nmの膜厚のレジスト膜を得た。
前記レジスト膜に ArF露光装置 S— 30 2A (N i k o n¾S NA= 0. 6 0、 2/3輸帯) を用いて 1 9 3 nm波長光をマスクを介して照射した。
前記露光後、 1 2 0 °Cにて 9 0秒間加熱した後、 テトラメチルァンモユウムヒ ドロキシドの 2. 3 8重量%濃度の溶液でパターンの現像を行つた。 現像温度は 2 3°C、 現像時間は 6 0秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾 燥した。
その結果、 基板上には、 1 20 nmライン ·アンド 'スペース (1 : 1) のパ ターンが形成された。 この時の露光線量は 1 3 m JZ c m2であった。 ' このパターンのラインの断面形状を観察したところ、 はっきりした矩形を呈して いた。
(実施例 1 1 )
上記化学式 (6) 'で表されるフッ素原子を有する溶解抑止剤のかわりに上記化 学式 (7) で表されるフッ素原子を有する溶解抑止剤を用いたこと以外は、 実施 例 1 0と同様にしてレジスト膜の形成、 レジスト膜へのパターン光の照射、 現像、 および洗浄を行った。
その結果、 基板上には、 1 20 nmライン 'アンド 'スペース (1 : 1) のパ ターンが形成された。 この時の露光線量は 1 3m J c m2であった。 このパタ ーンのラインの断面形状を観察したところ、 はっきりした矩形を呈していた。
(比較例 5)
レジスト組成分としてフッ素原子を有する溶解抑止剤を含まないこと以外は前 記実施例 1 0と同様の組成分によりホトレジスト組成分を調製し、 実施例 1 0と 同様にしてレジスト膜の形成、 レジスト膜へのパターン光の照射、 現像、 および 洗浄を行った。 その結果、 20 0 nm以下のライン'アンド 'スペースのパター ンにおいて顕著な膜べりが観察された。 ラインの断面形状は、 角部が丸くなって
おり、 矩形 なかった。
(比較例 6 )
レジスト組成分として上記化学式 ( 6 ) で表されるフッ素原子を有する溶解抑 止剤のかわりに公知の溶解抑止剤として、 リトコール酸 tert—プチノレエステノレ 5重量部を用いたこと以外は前記実施例 1 0と同様の組成分によりホトレジスト 組成分を調製し、 実施例 1 0と同様にしてレジスト膜の形成、 レジスト膜へのパ ターン光の照射、 現像、 および洗浄を行った。 その結果、 2 0 0 n m以下のライ ン 'アンド 'スペースのパターンにおいて顕著な膜ぺりが観察された。 ラインの 断面形状は、 角部が丸くなっており、 矩形でなかった。
前記実施例 1 0〜 1 1では、 次世代レジスト用のベースポリマーとして有望な フッ秦含有単環式ポリマーをベースポリマーに用いるとともに、 レジスト組成物 に、 フッ素原子を有する溶角抑止剤を添加することで 1 2 0 n mライン 'アンド 'スペースのパターンを形成することができた。 しかも、 このパターンのライン の断面形状ははつきりした矩形を保持しており、 波長 1 9 3 n mの光源に対して 有効であることがわかった。
これに対して、 比較例 5は、 フッ素原子を有する溶解抑止剤を添加しないこと 以外、 実施例 1 0と同様の組成にするとともに、 同様にして露光、 現像、 洗浄、 およぴ乾燥して、 パターン形成を実施したが、 2 0 0 n mサイズ以下のパターン では膜べりなどにより形状に大きな乱れが生じて実用にはならない状態であった。 この比較例 5から、 前記フッ素含有単環式ポリマーをベースポリマーに用いたレ ジスト組成物では、 フッ素含有溶解抑止剤が必須であることが分かる。
また、 比較例 6では、 公知の溶解抑止剤を添加したこと以外、 実施例 1 0と同 様の組成にするとともに、 同様にして露光、 現像、 洗浄、 およぴ乾燥して、 パタ ーン形成を実施したが、 2 0 0 n mサイズ以下のパターンでは膜べりなどにより 形状に大きな乱れが生じて実用にはならない状態であった。
実施例 1 0〜1 1において本発明のレジスト,祖成物は A r Fエキシマレーザー
に対して有効であることを確認した。 次に、 実施例 12〜17においては該レジ スト組成物を用いて波長 157 nmの F 2エキシマレーザ 露光装置 (Exitech (NA=0.85、 σ =0.3)を用いて評価を行った。
(実施例 12) .
実施例 10のホトレジスト組成物を用いて F2エキシマレーザー露光を行った。 半導体基板上に、 82 nm厚の反射防止膜 (AR 19 シプレー社製) 設けた後、 ホトレジスト組成物をスピンコーティングにより均一に塗布し、 110°Cで 60 秒間加熱し、 乾燥させて、 150 nmの膜厚のレジスト膜を得た。 尚、 得られた レジスト膜の波長 157 nmに対する光学定数は、 3. 0 (a b s/^m) 以下 であった。
前記レジスト膜に F2エキシマレーザーをマスクを介して照射した。 前記露光 後、 110 °Cにて 90秒間加熱した後、 テトラメチルァンモ-ゥムヒドロキシド の 2. 38重量%濃度の溶液でパターンの現像を行つた。 現像温度は 23 °C、 現 像時間は 60秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾燥した。 その結果、 基板上には、 65 nmライン 'アンド 'スペース (1 : 1) のパタ ーンが形成された。 この時の露光線量は 30. 5m jZcm2であった。 また、
50 nmのライン.アンド .スペース (1 : 1. 5) も形成されていた。 これら のパターンのラインの断面形状を観察したところ、 はっきりした矩形を呈してい た。
(実施例 13 )
実施例 1 1のホトレジスト組成物を用いて評価を行った。 - 半導体基板上に、 82 nm厚の反射防止膜 (AR19 シプレー社製) 設けた 後、 ホトレジスト組成物をスピンコーティングにより均一に塗布し、 1 10。Cで
60秒間加熱し、 乾燥させて、 150 nmの膜厚のレジスト膜を得た。 尚、 得ら れたレジスト膜の波長 157n mに対する光学定数は、 3. 0 (a b s/^m) 以下であった。
前記レジスト膜に F2エキシマレーザーをマスクを介して照射した。 前記露光 後、 1 10 °Cにて 90秒間加熱した後、 テトラメチルァンモ-ゥムヒドロキシド の 2. 38重量%濃度の溶液でパターンの現像を行つた。 現像温度は 23 °C、 現 像時間は 60秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾燥した。 その結果、 基板上には、 65 nmライン 'アンド'スペース (1 : 1) のパタ ーンが形成された。 この時の露光 量は 30. 5 m J/ cm2であった。 また、 50 nmのライン 'アンド'スペース (1 : 1. 5) も形成されていた。 これら のパターンのラインの断面形状を観察したところ、 はっきりした矩形を呈してい た。
(実施例 14) .
実施例 12のホトレジスト組成物にサリチル酸 0. 1重量部添加したこと以外 は、 実施例 12と同様にして行った。
その結果、 基板上には、 65 nmライン 'アンド 'スペース (1 : 1) のパタ ーンが形成された。 また、 50 nmのライン ·アンド ·スペース (1 : 1. 5) も形成されていた。 これらのパターンのラインの断面形状を観察したところ、 は つきりした矩形を呈していた。
(実施例 15)
実施例 13のホトレジスト組成物にサリチル酸 0. 1重量部添加したこと以外 は、 実施例 13と同様にして行った。
その結果、 基板上には、 65 nmライン ·アンド ·スペース (1 : 1) のパタ ーンが形成された。 また、 50 nmのライン 'アンド ·スペース (1 : 1. 5) 'も形成されていた。 これらのパターンのラインの断面形状を観察したところ、 は つきりした矩形を呈していた。
(実施例 16)
実施例 10で用いたものと同じフッ素含有単環式ポリマー 100重量部と、 T P S-NF (トリフエニルスルホニゥムパーフルォロブタンスルホネート) 5重
量部と、 トリイソプロパノールァミン 0. 1重量部と、 サリチル酸 0.1重量部 と、 化学式 (6) で表されるフッ素原子を有する溶解抑止剤 5重量部とを、 プロ ピレンダリコールモノメチルエーテルアセテート (PGMEA) 1260重量部 に投入、 混合して、 ホトレジスト組成物を得た。
レジスト膜を形成するための半導体基板として、 表面に 20 nm厚の無機反射 防止膜 S i ONが形成された直径 200mmの半導体基板を用いた。 この反射防 止膜上に、 前述のホトレジスト組成物をスピンコーティングにより均一に塗布し、 90°Cで 90秒間加熱し、 乾燥させて、 150 nmの膜厚のレジスト膜を得た。 前記レジスト膜に F2エキシマレーザー露光装置 (Exitech社製 NA=0. 8 5、 σ = 0. 3) を用いて 157 nm波長光をレベンソンタイプの位相シフトマ スクを介して照射した。
前記露光後、 110°Cにて 90秒間カロ熱した後、 テトラメチルアンモニゥムヒ ドロキシドの 2. 38重量%濃度の溶液でパターンの現像'を行った。 現像温度は 22°C、 現像時間は 60秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾 燥した。
その結果、 基板上には、 65 nmライン 'アンド 'スペース (1 : 1) のパタ ーンが形成された。 この時の露光 量は 26 m J/cm2であった。 このパター ンのラインの新面形状を観察したところ、 はっきりした失巨形を呈していた。
(実施例 17)
実施例 ί 0で用いたものと同じフッ素含有単環式ポリマー 100重量部と、 Τ PS—NF 5重量部と、 トリイソプロパノールァミン 0. 4重量部と、 上記化学 式 (6) で表されるフッ素原子を有する溶解抑止剤 5重量部とを、 プロピレング リコールモノメチルエーテルアセテート (PGMEA) 1260重量部に投入、 混合して、 ホトレジスト組成物を得た。
レジスト膜を形成するための半導体基板として、 表面に 82 nm厚の有機反射 防止膜 (AR— 19 シップレー社製) が形成された直径 300 mmの半導体基
板を用いた。 この反射防止膜上に、 前述のホトレジスト組成物をスピンコーティ ングにより均一に塗布し、 80°Cで 90秒間加熱し、 乾燥させて、 220 nmの 膜厚のレジスト膜を得た。 .
前記レジスト膜に Ar Fエキシマレーザー露'光装置 NSR— S 305 B (ニコ ン社製 NA=0. 68、 2/ 3輪帯) を用いて 193 n m波長光をマスクを介 して照射した。
前記露光後、 110 °Cにて 90秒間加熱した後、 テトラメチルァンモ-ゥムヒ ドロキシドの 2. 38重量%濃虔の溶液でパターンの現像を行つた。 現像温度は 22°C、 現像時間は 60秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾 燥した。
その結果、 基板上には、 110 nmライン 'アンド 'スペース (1 : 1) のパ ターンが形成された。 この時の露光線量は 1 1. 2mjZcm2であった。 この パターンのラインの断面形状を観察したところ、 はっきりした矩形を呈していた。 また、 本実施例 17 おいては、 半導体基板として直径 300 mmのシリコン ゥエーハという従来よりも大口径基板を用いたので、 基板面内の塗布膜の均一性 (c o a t i n g un i f o rm i t y) と得られたレジストパターンの均一 性 (CD un i f o r m i t y) についても評価した。
まず、 塗布膜の均一性 (c o a t i n g un i f o rm i t y) は、 以下の ようにして求めた。 すなわち、 連続して 13枚の上記半導体基板を作成し、 その 各基板に対して 53点の乾燥後のレジスト膜厚を測定した。 その結果、 目的とす る 220 n mのレジスト膜厚に対して、 基板間での平均膜厚差は 1 %以内であり、 基板面内膜厚差は 2 %以内であった。
次に、 レジストパターンの均一性 (CD un i f o rm i t y) は、 以下の ようにして求めた。 すなわち、 連続して 13枚の上記半導体基板を作成し、 その 各基板に対して上記のようにしてレジストパターンを形成し、 次いで 49点の形 成されたレジストパターンのサイズを測定した。 その結果、 目的とする 110 n
mライン 'アンド 'スペース 1 : 1に対して、 基板間での平均レジストパターン サイズは 2%以内であった。 、
本実施例 17により、 本発明のホトレジスト組成物を用いると、 直径 3 O Om mの半導体基板上でも乾燥後レジスト膜が非常に均一性よく形成できるとともに、 その後に行なわれる選択的露光、 露光後加熱、 現像により形成されたレジストパ ターンにおいても、 均一性の良いレジストパターンが形成されることが明らかと なった。
(比較例 7)
比較例 6のレジスト組成物において、 TP S— NFを 5重量部へ変え、トリイ ソプロパノールアミンを 0. 1重量部へ変え、さらにサリチル酸 0.1重量部を加 えた以外は、同様にしてレジスト組成物を調製して評価を行つた。 半導体基板上 に、 82 nm厚の反射防止膜 (AR 1 9 シプレー社製) 設けた後、 ホトレジス ト組成物をスピンコーティングにより均一に塗布し、 90 °Cで 900秒間加熱し、 乾燥させて、 150 nmの膜厚のレジスト膜を得た。
前記レジスト膜に F2エキシマレーザーをマスクを介して照射した。 前記露光 後、 110 °Cにて 90秒間加熱した後、 テトラメチルァンモニゥムヒドロキシド の 2. '38重量%濃度の溶液でパターンの現像を行った。 現像温度は 23°C、 現 像時間は 60秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾燥した。 その結果、 90 nm以下のライン 'アンド 'スペース (1 ■: 1) パターンが形 成されたものの、パターン膜べりが観測され、 パターン形状は丸くなり矩形では なかった。 この時の露光線量は 26 m JZ cm2であった。 それ以下の微細パタ ーンは形成できなかった。
(比較例 8) ' 比較例 5のレジスト組成物において、 TP S— NFを 5重量部へ変え、トリイ ソプロパノールアミンを 0. 1重量部へ変え、さらにサリチル酸 0.1重量部を加 えた以外は、同様にしてレジスト組成物を調製して評価を行った。 半導体基板上
に、 8 2 nm厚の反射防止膜 (AR 1 9 シプレー社製) 設けた後、 ホトレジス ト糸且成物をスビンコ一ティングにより均一に塗布し、 90。じで 90秒間加熱し、 乾燥させて、 1 50 nmの膜厚のレジスト膜を得た。
前記レジスト膜に F2エキシマレーザーをマスクを介して照射した。 前記露光 後、 1 1 0°Cにて 9 0秒間加熱した後、 テトラメチ アンモ-ゥムヒドロキシド の 2. 3 8重量%濃度の溶液でパターンの現像を行った。 現像温度は 2 3°C、 現 像時間は 6 0秒間であった。 現像後、 脱イオン水にて洗浄を行い、 乾燥した。 その結果、 90 nm以下のライン'アンド ·スペース (1 : 1) パターンが形 成されたものの、顕著なパターン膜べりが観測され、 パターン形状は丸くなり矩 形ではなかった。 この時の露光線量は 28 m jZcm2であった。 それ以下の微 細パターンは形成できなかった。
(比較例 9) .
前記比較例 7のレジスト組成物において、 サリチル酸を用いなかったこと以外 は、同様にしてレジスト組成物を調製して評価を行った。
その結果、 90 nm以下のライン 'アンド 'スペース (1 : 1).パターンが形 成されたものの、パターン膜べりが観測され、 パターン形状は丸くなり矩形では なかった。
(比較例 1 0)
前記比較例 8のレジスト組成物において、 サリチル酸を用いなかったこと以外 は、同様にしてレジスト組成物を調製して評価を行った。
その結果、 9 0 nm以下のライン 'アンド 'スペース (1 : 1) パターンが开 成されたものの、顕著なパターン膜べりが観測され、 パターン形状は丸くなり矩 形ではなかった。 - 前記実施例 1 2〜1 5では、 次世代レジスト用のベーズポリマーとして有望な フッ素含有単環式ポリマーをベースポリマーに用いるとともに、 レジスト組成物 に、 フッ素原子を有する溶解抑止剤を添加することによって、 従来困難であった
65 nm イン 'アンド ·スペース (1 : 1) や 50 nmのライン 'アンド 'ス ペース (1 : 1. 5) のパターンを形成することができた。 しかも、 これらのパ ターンのラインの断面形状ははつきりした矩形を保持していた。
これに対して、 比較例 7と 9は公知の溶解抑制剤を用い、比較例 8と 10は、 溶解抑止剤を添加せずパターン形成を実施したが、 90n m以下のライン'アン ド 'スペース (1 : 1) において、 顕著にパターン膜べりが観測された。 また、 パターン形状は丸くなり矩形ではなく実用にはならない状態であった。 この比較 例 7〜10力 ら、 前記フッ素含有単環式ポリマーをベースポリマーに用いたレジ スト組成物では、 フッ素原子を有する溶解抑止剤が必須であることが分かる。 これらの結果から、 公知のフッ素含有ポリマーを用いて、 波長 200 nm以下、 特に F2エキシマレーザーの照射光によるリソグラフィ一によりライン ·アンド •スペースのサイズが 150 以下、 好ましくは 100 nm以下、 さらに好ま しくは 90 n m以下のパターン解像性を得ることのできるホトレジスト組成物を 得るためには、 前記フッ素含有ポリマーを主成分とし、 光照射により酸を発生す る酸発生剤とフッ素原子を有する溶解抑止剤とを含有していることが重要である ことが、 理角 される。 以上説明したように、 本発明にかかるホトレジスト組成物は、 レジストパター ンとして、 例えば 90 nm以下のライン'アンドスペース (1 : 1) や孑し径 10 0 nm程度のホールパターン (ホールとスペースの比は 1 : 1) 等の各種の超微 細パターンの形状や、 無機基板や有機反射防止膜を設けた基板上での解像性や、 レジストパターン形状の改善が達成される。 また、 レジストパターンの欠陥、ス カム (残さ)、基板密着性のよい矩形性に優れるレジストパターンを形成すること ができる。 本発明では、 力かる波長 157 nmにおける透明性の高いベースポリ マーに対して、 特定の溶解抑制剤を組み合わせることによって、 初めて、 60 η m以下のライン ·アンド ·スペースという微細オーダーのレジストパターン解像
性を実用レベルで可能としており、 さらには大口径基板に対する塗布膜の均一性、 レジストパターンの均一性に優れるものとしうる。 参考文献
非特許文献 1 : M. K. Crawford, et al., "New Material for 157 ma
Photoresists: Characterization and Properties" Proceedings of SPIE, Vol. 3999, (2000) pp357 -364
非特 ff文献 2 : Shun-ichi Kodama, et al., "Synthesis of Novel
Fluoropolymer for lQi i Photoresists by Cyclo— polymerization"
Proceedings of SPIE, Vol. 4690, (2002) pp76 -83
特許文献 1 :国際公開第 WO 0 0/6 7 0 7 2号パンフレツト
特許文献 2 :特開 2 0 0 2— 9 0 9 9 7号公報
特許文献 3 :特開 2 0 0 3 _ 2 9 2 5号公報