트로폴론
Tropolone| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 2-히드록시사이클로헵타-2,4,6-트리엔-1-1 | |||
| 기타 이름 2-히드록시트로폰; 퍼푸로카테콜 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.007.799 | ||
| EC 번호 |
| ||
| 케그 | |||
| 메슈 | D014334 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C7H6O2 | |||
| 어금질량 | 122.12 g/190 | ||
| 녹는점 | 50~52°C(122~126°F, 323~325K) | ||
| 비등점 | 80 ~ 84 °C(176 ~ 183 °F, 353 ~ 357 K)(0.1 mmHg) | ||
| 산도(pKa) | 6.89 (그리고 결합산의 경우 -0.5) | ||
자기 감수성(magnetic susibility) | -61·10cm−63/190cm | ||
| 위험 | |||
| GHS 라벨 표시:[2] | |||
   | |||
| 위험 | |||
| H314, H317, H410 | |||
| P260, P261, P264, P272, P273, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P333+P313, P363, P391, P405, P501 | |||
| 플래시 포인트 | 112°C(234°F, 385K) | ||
| 관련 화합물 | |||
관련 화합물 | 히노키티올(4이소프로필트로폴론) | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
트로폴론은 화학 공식 CH75(OH)O를 가진 유기 화합물이다. 유기용제에 용해되는 옅은 노란색 고체다. 이 화합물은 특이한 전자 구조와 리간드 전구체로서의 역할 때문에 연구 화학자들에게 관심을 가져왔다. 일반적으로 트로폰에서 준비되지는 않지만, 2-위치에 있는 히드록실 그룹과의 파생상품으로 볼 수 있다.
합성 및 반응
많은 방법들이 트로폴론의 합성을 위해 설명되어 왔다.[3] 하나는 N-브로모수치니이드로 1,2-사이클로헥타네디온에 브롬화시킨 후 고온에서 탈수소화시킨 후, 다른 하나는 아클로인이 다시 피멜산의 에틸 에스테르의 아클로인 응축에 이어 브로민에 의한 산화를 사용한다.[4]
대체 루트는 사이클로펜타디엔을 케틴과 함께 자전거[3.2.0]헵틸 구조로 만든 [2+2] 사이클로펜타디엔을 첨가한 후 융접 본드를 가수 분해 및 파손하여 단일 링을 제공하는 것이다.[3]
당신의 트로폴론의 히드록실 그룹은 산성으로 pK가a 7이고 페놀(10)과 벤조산(4) 사이에 있다. 페놀에 비해 산도가 높아진 것은 카보닐과의 공진 안정화, 빈로로그 카르복실산 때문이다.[4]
이 화합물은 쉽게 O-alkylation을 거쳐 사이클로헥타리테닐 파생상품을 제공하며, 이는 다시 다용도 합성 매개체가 된다.[5] 금속 양이온으로 Cu(OCH275)2 콤플렉스처럼 바이덴테이트 리간드를 형성하기 위해 탈조화를 거친다.[4]
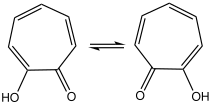
카보닐 집단은 트로폰 집단에 흔히 있는 것처럼 극성이 높다. Hydroxyl 그룹과 그것 사이에 상당한 수소 결합이 있을 수 있고, 빠른 tautomerization으로 이어질 수 있다: 구조는 NMR 시간 척도에서 대칭이다.[6]
자연발생
자연적으로 발생하는 약 200개의 트로폴라 파생상품이 분리되었는데, 주로 식물과 곰팡이에서 나왔다.[7] Tropolone compounds and their derivatives include dolabrins, dolabrinols, thujaplicins, thujaplicinols, stipitatic acid, stipitatonic acid, nootkatin, nootkatinol, puberulic acid, puberulonic acid, sepedonin, 4-acetyltropolone, pygmaein, isopygmaein, procein, chanootin, benzotropolones (such as purpurogallin, crocipodin, goupiolone A and B), theaf라빈 및 파생상품 브로모트로폴론, 트로푸아키놀린 및 트로포아키놀린(그란디루브린, 이미루브린, 이소미메루빈, 파레이트로폰, 파레리루빈 A,[8] B), 콜치콘 및 기타. Tropolone은 링 확장을 거치는 페놀성 중간을 제공하는 폴리케타이드 경로를 통해 발생한다.[5]
그들은 특히 큐프레스과와 릴리과와 같은 특정 식물 종에서 발견된다.[7] 트로폴론은 주로 심목, 잎, 나무껍질 등에 풍부하게 함유되어 있어 에센셜 오일은 다양한 종류의 트로폴이 풍부하다. 최초의 천연 트로폴 파생상품은 1930년대 중반과 40년대 초반에 연구되고 정제되었다.[9] 투자 플리카타, 투조피스 돌라브라타, 차메시파리 오부투사, 차메시파리스 대만에센시스, 쥬니페러스 튜리페라 등이 첫 번째 트로피가 확인되는 나무 리스트에 올랐다. 최초의 합성 트로폴은 랄프 라파엘에 의해 파생된 투자플리신이었다.[10]
생물학적 효과
포도 폴리페놀 산화효소와[11][12] 버섯 티로시나제의 억제제다.[13]
트로폴론 파생상품
| 이름 | 화학구조 | 자연원 |
|---|---|---|
| 트로폴론 | 녹농균 린드베르기, 녹농균 식물성[14] | |
| 히노키티올 | 큐프레스과[15] | |
| 큐피트산 | 탈라로미속[16] | |
| 콜치약 | 콜로키쿰 가을, 글로리오사 슈퍼바[17] |
| 클래스 | 예 | 주요 자연원[8][7][18][19] | 연구 방향[7][20][8][21][22] | 특허받은[7][23] 제품 |
|---|---|---|---|---|
| 단순트로폴리스 | 트로폴론 | 녹농균 린드베르기, 녹농균 식물성 | 항균, 항균, 살충제, 병충해, 식물의 성장 억제, 항염증, 항산화, 신경절제, 항단백질, 항브라우닝(항염증제 및 항폴리페놀 산화효소), 항소성, 킬레이트화 | - |
| 돌라브린스 | β-돌라브린, α-돌라브리놀 | 카라가나피그마에아, 큐프레서스 고베니아나, 큐프레서스 아브람시아나, 투잡시스 돌라브라타 | 항균, 항균, 살충제, 성충제, 식물 성장 억제, 프로테아제 억제 | 방충제, 탈취제 |
| 투자플리신스 | α-thujaplicin, β-thujaplicin(히노키티올), γ-thujaplicin, thujaplicinol. | Chamaecyparis obtusa, Thuja plicata, Thujopsis dolabrata, Juniperus cedrus, Cedrus atlantica, Cupressus lusitanica, Chamaecyparis lawsoniana, Chamaecyparis taiwanensis, Chamaecyparis thyoides, Cupressus arizonica, Cupressus macnabiana, Cupressus macrocarpa, Cupressus guadalupensis, Juniperus chinensis, Juniperus communis, Juniperus californica, Juniperus occidentalis, Juniperus oxycedrus, Juniperus sabina, Calocedrus decurrenes, Calocedrus formosana, Platycardus antiis, Thuja ocidentalis, Thuja standis, Tetraclata, Carya glabra | 항균, 항균, 항브라우닝(안티프로시나제), 킬레이트, 살충제, 성충제, 항염증, 항바이러스, 항염증, 식물 성장 억제, 항단백질, 항당뇨제, 항소화제, 항산화제, 항산화제, 신경치료제, 수의학 | 방충제, 탈취제, 치약, 구강 스프레이, 피부 및 모발 관리, 목재 방부제, 식품 첨가제, 식품 포장 |
| 세스퀴테르펜 트로폴리스 | 누트카틴, 누트카틴톨, 누트카틴톨, 누트카틴, 누트카틴, 누트카톤, 발렌세-13-올, 누트카스타틴 | 카매시파리스 누트카텐시스, 자몽 | 항균, 항브라우닝(안티트로시나제), 살충제, 살균제, 항소성 플라스틱 | 방충제, 향미, 향료 |
| 피그마이인 | 피그마이인, 이소피그마이인 | 카라가나 피그마에아, 큐프레서스 고베니아나, 큐프레서스 아브람시아나 | - | - |
| 벤조트로폴론 | 퍼푸로갈린, 크로키포딘, 구피올론 A, B | 케르쿠스 종, 레치눔 크로키포디움, 구피아 글라브라 | 항균, 식물 성장 억제, 프로테아제 억제, 항염색소, 항말리아, 항산화제, 항바이러스 | 식품첨가물 |
| 테아플라빈스 | 테아플라빈, 테아플라빈산, 테아플라베이트 A와 B | 동백나무, 케르쿠스 종 | 항균, 항염증, 항산화, 항바이러스, 항당뇨, 화학감소화 | - |
| 트로푸아키놀린과 트로포아키놀린 | 그란디루브린, 이미루브린, 이소이메루브린, 파레트로폰, 파레루브린 A, B | 시삼펠로스 파레라, 아부타 그란디폴리아 | 항일레코믹스 | - |
| 트로폰 알칼로이드 | 콜치약, 데메콜신 | 콜로키쿰 가을, 글로리오사 슈퍼바 | 항정신병, 항염증, 항통풍, 식물 번식 | 약제 |
참조
- ^ 시그마알드리히의 트로폴론[permanent dead link]
- ^ "Tropolone". pubchem.ncbi.nlm.nih.gov.
- ^ a b Minns, Richard A. (1977). "Tropolone". Org. Synth. 57: 117. doi:10.15227/orgsyn.057.0117.
- ^ a b c Pauson, Peter L. (1955). "Tropones and Tropolones". Chem. Rev. 55 (1): 9–136. doi:10.1021/cr50001a002.
- ^ a b Pietra, F. (1973). "Seven-membered conjugated carbo- and heterocyclic compounds and their homoconjugated analogs and metal complexes. Synthesis, biosynthesis, structure, and reactivity". Chemical Reviews. 73 (4): 293–364. doi:10.1021/cr60284a002.
- ^ Jin, Lehong (February 1987). Detoxification of thujaplicins in living western red cedar (Thuja plicata Donn.) trees by microorganisms (PhD). University of British Columbia.
- ^ a b c d e Zhao, Jian Zhao and Jian (30 September 2007). "Plant Troponoids: Chemistry, Biological Activity, and Biosynthesis". Current Medicinal Chemistry. 14 (24): 2597–2621. doi:10.2174/092986707782023253. PMID 17979713.
- ^ a b c Liu, Na; Song, Wangze; Schienebeck, Casi M.; Zhang, Min; Tang, Weiping (December 2014). "Synthesis of naturally occurring tropones and tropolones". Tetrahedron. 70 (49): 9281–9305. doi:10.1016/j.tet.2014.07.065. PMC 4228802. PMID 25400298.
- ^ Nakanishi, Koji (June 2013). "Tetsuo Nozoe's "Autograph Books by Chemists 1953-1994": An Essay: Tetsuo Nozoe's "Autograph Books by Chemists 1953-1994": An Essay". The Chemical Record. 13 (3): 343–352. doi:10.1002/tcr.201300007. PMID 23737463.
- ^ Cook, J. W.; Raphael, R. A.; Scott, A. I. (1951). "149. Tropolones. Part II. The synthesis of α-, β-, and γ-thujaplicins". J. Chem. Soc.: 695–698. doi:10.1039/JR9510000695.
- ^ 트로폴론에 의한 포도 폴리페놀 산화효소의 시간 의존적 억제. 에델미라 발레로, 마누엘라 가르시아-모레노, 라몬 바론, 프란시스코 가르시아-카르모나, J. 아그리치. 식품 화학, 1991, 제39권, 페이지 1043–1046, doi:10.1021/jf00006a007
- ^ 체지, 러셀 서양의 붉은 삼나무(Thuja pricata)의 2차 대사물: 이들의 생명공학적 응용과 자연적 내구성을 부여하는 역할. LAP 램버트 학술 출판, 2010, ISBN 3-8383-4661-0, ISBN 978-3-8383-4661-8
- ^ 트로폴론에 의한 버섯 티로시나아제 억제. Varda Kahn and Andrawis Andrawis Andrawis, Pyt화학, 제24권, 제5호, 1985호, 페이지 905-908, doi:10.1016/S0031-9422(00)83150-7
- ^ Liu, Na; Song, Wangze; Schienebeck, Casi M.; Zhang, Min; Tang, Weiping (December 2014). "Synthesis of naturally occurring tropones and tropolones". Tetrahedron. 70 (49): 9281–9305. doi:10.1016/j.tet.2014.07.065. PMC 4228802. PMID 25400298.
- ^ Saniewski, Marian; Horbowicz, Marcin; Kanlayanarat, Sirichai (10 September 2014). "The Biological Activities of Troponoids and Their Use in Agriculture A Review". Journal of Horticultural Research. 22 (1): 5–19. doi:10.2478/johr-2014-0001.
- ^ Davison, J.; al Fahad, A.; Cai, M.; Song, Z.; Yehia, S. Y.; Lazarus, C. M.; Bailey, A. M.; Simpson, T. J.; Cox, R. J. (15 May 2012). "Genetic, molecular, and biochemical basis of fungal tropolone biosynthesis". Proceedings of the National Academy of Sciences. 109 (20): 7642–7647. doi:10.1073/pnas.1201469109. PMC 3356636. PMID 22508998.
- ^ Keith, Michael P.; Gilliland, William R.; Uhl, Kathleen (2009). "GOUT". Pharmacology and Therapeutics: 1039–1046. doi:10.1016/B978-1-4160-3291-5.50079-2. ISBN 9781416032915.
- ^ Karchesy, Joseph J.; Kelsey, Rick G.; González-Hernández, M. P. (May 2018). "Yellow-Cedar, Callitropsis (Chamaecyparis) nootkatensis, Secondary Metabolites, Biological Activities, and Chemical Ecology". Journal of Chemical Ecology. 44 (5): 510–524. doi:10.1007/s10886-018-0956-y. PMID 29654493. S2CID 4839697.
- ^ Goldfrank's toxicologic emergencies. Nelson, Lewis, 1963- (Eleventh ed.). New York. 11 April 2019. ISBN 978-1-259-85961-8. OCLC 1020416505.
{{cite book}}: CS1 maint : 기타(링크) - ^ Carlsson, Blenda; Erdtman, H.; Frank, A.; Harvey, W. E.; Östling, Sven (1952). "The Chemistry of the Natural Order Cupressales. VIII. Heartwood Constituents of Chamaecyparis nootkatensis - Carvacrol, Nootkatin, and Chamic Acid". Acta Chemica Scandinavica. 6: 690–696. doi:10.3891/acta.chem.scand.06-0690.
- ^ Dalbeth, Nicola; Lauterio, Thomas J.; Wolfe, Henry R. (October 2014). "Mechanism of Action of Colchicine in the Treatment of Gout". Clinical Therapeutics. 36 (10): 1465–1479. doi:10.1016/j.clinthera.2014.07.017. PMID 25151572.
- ^ Griffiths AJF, Gelbart WM, Miller JH (1999). "Modern Genetic Analysis: Changes in Chromosome Number". Modern Genetic Analysis. W. H. Freeman, New York.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ US EPA, OCSPP (10 August 2020). "Nootkatone Now Registered by EPA". US EPA.