피파이스틴
Pacifastin| 피라틴_i | |||||||||
|---|---|---|---|---|---|---|---|---|---|
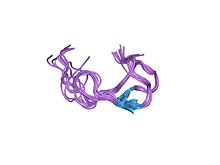 세린단백질가수분해효소억제제 sgci[l30r, k31m]의 용액구조 | |||||||||
| 식별자 | |||||||||
| 기호. | 피라틴_i | ||||||||
| 팜 | PF05375 | ||||||||
| 인터프로 | IPR008037 | ||||||||
| SCOP2 | 1kgm/SCOPe/SUPFAM | ||||||||
| |||||||||
Peacastin은 절지동물에서 [1][2]발견되는 세린단백질가수분해효소 억제제의 한 종류이다.피아스틴은 세린펩티드가수분해효소 트립신 및 키모트립신을 [3]억제한다.
분자 수준에서 특징지어지는 모든 피아스타틴 성분은 N-말단 신호 배열에 이은 전구체 도메인 및 가변 수의 억제제 도메인으로 이루어진 전구체 펩타이드이다.각 억제제 도메인은 6개의 시스테인 모티브를 가지고 있습니다.아래를 참조해 주세요.
확인된 첫 번째 가족 구성원은 HI, LMCI-1(PMP-D2) 및 LMCI-2(PMP-C)[4][5][6]인 Locta migratoria migratoria(이주성 메뚜기)로부터 분리되었다.다음으로 SGPI-1~5의 5개 멤버를 주혈충(사막메뚜기)[7][8]에서 분리하여 헤테로다이머세린단백질가재억제제를 Peacastacus leniusculus(시그널가재)의 혈류에서 분리하여 [9]피파스틴이라고 명명하였다.
기능.
펩타이드단백질가수분해효소억제제는 많은 경우에 프로페타이드 또는 자이모겐으로 불리는 더 큰 전구단백질의 일부로 합성되며, 프로페타이드 또는 자이모겐은 필요할 때까지 기질의 활성부위 접근을 막는 전구체 도메인인 리소좀에서 전구체 도메인이 분리될 때까지 비활성 상태로 남아 있다.분비를 목표로 하는 단백질분해효소 억제제는 신호펩티다아제에 의해 분해되는 추가 N말단 신호펩티드 도메인을 가진다.두 번째 펩티드가수분해효소와의 상호작용 또는 자기촉매분할에 의해 이러한 하나 또는 두 개의 N 말단 억제제 도메인을 제거하면 자이모겐이 [3]활성화된다.
피타스틴 유사 억제제의 내인성 기능에 대해서는 절지동물 면역 및 곤충 [10]번식에 관련된 생리학적 과정의 조절에 역할을 할 수 있다는 점 외에는 거의 알려져 있지 않다.
구조.
피라틴의 억제제 단위는 6개의 시스테인 잔기(Cys1 – Xaa9–12 – Cys2 – Asn – Xaa – Ca3 – Xaa3– 3 – Gly – Xa3– 6 – Cys5 – Thr – Ca3– Cys6)의 보존 패턴이다.3-D 구조를 자세히 분석한 결과, 이들 6개의 잔류물이 3개의 이황화물 브리지(Cys1-4, Cys2-6, Cys3-5)를 형성하여 피아스틴 계열의 구성원들이 전형적인 접힘과 현저한 [11]안정성을 얻을 수 있었다.
Peacastin은 155kDa 단백질로, 2개의 공유결합 서브유닛으로 구성되어 있으며, 이들 서브유닛은 별도로 암호화되어 있다.피타스틴(105kDa)의 중쇄는 3개의 트랜스페린 엽을 가지고 있기 때문에 트랜스페린과 관련이 있으며, 이중 2개는 철 [9]결합에 활성인 것으로 보인다.트랜스페린족도 세린펩티드가수분해효소이며, MEROPS펩티드가수분해효소족 S60(INTERPRO)에 속한다.피타스틴(44kDa)의 경쇄는 단백질 분해효소 억제 서브유닛이며, 서로 상동하는 최대 9개의 시스테인이 풍부한 억제 도메인으로 구성된다.메뚜기 억제제는 6개의 보존된 잔류물을 피파스틴 경쇄와 공유합니다.이 계열의 구성원들은 3개의 이황화 [9]다리로 연결된 3가닥 반평행 베타 시트로 구성되어 있습니다.
이 세린단백질가수분해효소억제제군은 MEROPS억제제족 I19, 클랜 IW에 속한다.그것들은 S1 패밀리(INTERPRO)[1]에 속하는 펩티드가수분해효소인 키모트립신을 억제한다.
레퍼런스
- ^ a b Rawlings ND, Tolle DP, Barrett AJ (2004). "Evolutionary families of peptidase inhibitors". Biochem J. 378 (Pt 3): 705–16. doi:10.1042/BJ20031825. PMC 1224039. PMID 14705960.
- ^ Breugelmans B, Simonet G, van Hoef V, Van Soest S, Vanden Broeck J (2009). "Pacifastin-related peptides: structural and functional characteristics of a family of serine peptidase inhibitors". Peptides. 30 (3): 622–32. doi:10.1016/j.peptides.2008.07.026. PMID 18775459. S2CID 8797134.
- ^ a b Parkinson NM, Conyers C, Keen J, MacNicoll A, Smith I, Audsley N, et al. (2004). "Towards a comprehensive view of the primary structure of venom proteins from the parasitoid wasp Pimpla hypochondriaca". Insect Biochem Mol Biol. 34 (6): 565–71. doi:10.1016/j.ibmb.2004.03.003. PMID 15147757.
- ^ Boigegrain RA, Mattras H, Brehélin M, Paroutaud P, Coletti-Previero MA (December 1992). "Insect immunity: two proteinase inhibitors from hemolymph of Locusta migratoria". Biochem. Biophys. Res. Commun. 189 (2): 790–3. doi:10.1016/0006-291x(92)92271-x. PMID 1472051.
- ^ Nakakura N, Hietter H, Van Dorsselaer A, Luu B (February 1992). "Isolation and structural determination of three peptides from the insect Locusta migratoria. Identification of a deoxyhexose-linked peptide". Eur. J. Biochem. 204 (1): 147–53. doi:10.1111/j.1432-1033.1992.tb16617.x. PMID 1740125.
- ^ Boigegrain RA, Pugnière M, Paroutaud P, Castro B, Brehélin M (February 2000). "Low molecular weight serine protease inhibitors from insects are proteins with highly conserved sequences". Insect Biochem. Mol. Biol. 30 (2): 145–52. doi:10.1016/s0965-1748(99)00109-5. PMID 10696590.
- ^ Hamdaoui A, Wataleb S, Devreese B, Chiou SJ, Vanden Broeck J, Van Beeumen J, De Loof A, Schoofs L (January 1998). "Purification and characterization of a group of five novel peptide serine protease inhibitors from ovaries of the desert locust, Schistocerca gregaria". FEBS Lett. 422 (1): 74–8. doi:10.1016/s0014-5793(97)01585-8. PMID 9475173. S2CID 35980008.
- ^ Gáspári Z, Patthy A, Gráf L, Perczel A (January 2002). "Comparative structure analysis of proteinase inhibitors from the desert locust, Schistocerca gregaria". Eur. J. Biochem. 269 (2): 527–37. doi:10.1046/j.0014-2956.2001.02685.x. PMID 11856311.
- ^ a b c Liang Z, Sottrup-Jensen L, Aspán A, Hall M, Söderhäll K (June 1997). "Pacifastin, a novel 155-kDa heterodimeric proteinase inhibitor containing a unique transferrin chain". Proc. Natl. Acad. Sci. U.S.A. 94 (13): 6682–7. Bibcode:1997PNAS...94.6682L. doi:10.1073/pnas.94.13.6682. PMC 21218. PMID 9192625.
- ^ Wang S, Cui Z, Liu Y, Li Q, Song C (2012). "The first homolog of pacifastin-related precursor in the swimming crab (Portunus trituberculatus): characterization and potential role in immune response to bacteria and fungi". Fish Shellfish Immunol. 32 (2): 331–8. doi:10.1016/j.fsi.2011.11.025. PMID 22154999.
- ^ Breugelmans B, Simonet G, van Hoef V, Van Soest S, Smagghe G, Vanden Broeck J (2009). "A lepidopteran pacifastin member: cloning, gene structure, recombinant production, transcript profiling and in vitro activity". Insect Biochem Mol Biol. 39 (7): 430–9. doi:10.1016/j.ibmb.2009.03.005. PMID 19364530.


