로사르탄
Losartan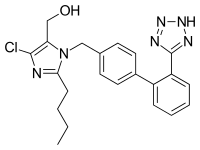 | |
 | |
| 임상 데이터 | |
|---|---|
| 발음 | /loˈsɑrtn/ |
| 상호 | 코자르, 기타 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a695008 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 |
| 약물 클래스 | 앤지오텐신II수용체길항제 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 25–35% |
| 단백질 결합 | 99.7%(알부민 포함) |
| 대사 | 간(CYP2C9, CYP3A4) |
| 반감기 제거 | 1.5~2시간 |
| 배설물 | 신장 13~25%, 담관 50~60% |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.110.555 |
| 화학 및 물리 데이터 | |
| 공식 | C22H23당분이나 지방 말고도N6O |
| 몰 질량 | 422.92g/표준−1 |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
코자르라는 브랜드명으로 판매되는 로사탄은 고혈압(고혈압)[3] 치료에 사용되는 의약품이다.당뇨병성 신장병, 심부전, 좌심실 [3]비대에도 사용된다.입으로 [3]먹는 거예요.단독으로 사용하거나 다른 혈압 [3]약물과 함께 사용할 수 있습니다.완전한 효과가 [3]나타나려면 최대 6주가 걸릴 수 있습니다.
일반적인 부작용으로는 근육경련, 코막힘, 기침, 고칼륨혈증, [3]빈혈 등이 있다.심각한 부작용으로는 혈관부종, 저혈압, 신장 [3]문제가 포함될 수 있다.임신 중에 사용하면 [3][1]아기에게 해를 끼칠 수 있습니다.모유 [1]수유 중에는 사용하지 않는 것이 좋습니다.그것은 앤지오텐신 수용체 차단제 계열의 약물이다.그것은 앤지오텐신II를 차단함으로써 작용한다.[3]
로사탄은 1986년에 특허를 받았으며 [3][4]1995년에 미국에서 의료용으로 승인되었다.그것은 세계보건기구의 필수 [5]의약품 목록에 있다.제네릭 [6]의약품으로 구입할 수 있습니다.2019년에는 미국에서 9번째로 많이 처방된 의약품으로 5천100만 건 이상의 [7][8]처방을 받았다.히드로클로로티아지드와 결합된 버전은 2019년에[3] 미국에서 73번째로 많이 처방된 약으로 1,000만 개 이상의 [7][9]처방을 받았다.
화학
로사탄칼륨은 2-부틸-4-클로로-1-[p-(o-1H-테트라졸-5-일페닐)벤질]이미다졸-5-메타놀 모노칼륨염으로 화학적으로 기술된다.실험식은 CHCIKNO이며22236 분자량은 422.9이다.[10]
로사탄은 일반적으로 "로사탄 칼륨"[11]이라고 불리는 아로마화된 음전하 테트라졸의 (기본) 칼륨 소금으로 판매된다.이 분자는 카르본산 대신 바이오 이소스테어로 [12]사용되는 테트라졸을 가진 확장된 비페닐기를 가지고 있다.
의료 용도
로사탄은 제2형 당뇨병 환자의 [2]좌심실 비대증(심근 확장)과 신장 기능 장애를 가진 사람들을 포함한 고혈압에 사용된다.그것은 또한 당뇨병성 신증의 진행을 지연시킬 수 있다.제2형 당뇨병, 고혈압, 미세알부민뇨(30mg/24시간 이상) 또는 단백뇨(900mg/24시간 [13]이상) 환자의 신장질환 진행저하에 적합한 약리제이다.
칼슘 채널 차단제 및 티아지드형 이뇨제가 대부분의 사람들에게 선호되는 1차 치료제라는 증거가 있지만(유효성과 비용 둘 다로 인해), 55세 미만의 ACE [14]억제제를 견딜 수 없는 사람들에게 1차 치료제로 로사탄과 같은 안지오텐신 II 수용체 길항제(안지오텐신 II 수용체 길항제)가 권장된다.한 연구는 로사르탄이 심혈관 이상 증상(심근경색 또는 뇌졸중)의 1차 예방에 있어 아테놀롤보다 우수하다는 것을 입증했으며, 이와 유사한 혈압 저하에 대한 심혈관 질환과 사망률의 감소가 있었다.혈압에 대한 최대 효과는 보통 로사탄 [15]시작 후 3~6주 내에 발생합니다.
부작용
성인들에게 로사탄에 대한 가장 흔한 부작용은 상기도 감염, 어지럼증, 요통이다.[2]제2형 당뇨병과 신장병이 있는 사람들은 설사, 피로, 저혈압, 저혈당, 높은 칼륨, 가슴 통증 또는 알레르기 반응을 [2]경험할 수 있습니다.로사르탄은 당뇨병이 있고 알리스키렌을 [2]복용하는 사람이 복용해서는 안 된다.레닌-안지오텐신 [16]계통의 억제 때문에 빈혈이 발생할 수 있다.다른 앤지오텐신 수용체 차단제와 마찬가지로 로사탄은 간을 손상시킬 수 있지만 [17]이 효과는 드문 것으로 보인다.전해질 불균형은 로사탄을 [2]복용하는 신장 질환이 있는 사람들에게서 발생할 수 있다.부작용은 성별, 연령 또는 [2]인종에 따라 다르지 않다.
임신
미국 식품의약국(FDA)은 2014년 10월 로사탄이 태아 독성을 유발할 수 있다며 임신 사실이 [18][2]확인되는 대로 사용을 중단해야 한다는 블랙박스를 발령했다.임신 중에 로사탄을 사용하면 태아 부상이나 [18][2]사망에 이를 수 있다.
과다 복용
과다 복용은 혈압 저하를 초래할 가능성이 높으며, 이는 심박수 증가, 어지럼증, 머리가 멍해지는 느낌 또는 의식 상실로 나타날 수 있다.생쥐 연구에 따르면 사망률은 생쥐 [2]체중을 고려한 후 최대 권장 투여량의 약 44~170배에서 발생했다.
상호 작용
로사탄은 페노바르비탈, 리팜핀 또는 플루코나졸과 역작용을 하여 혈압강하 [2]효과를 억제할 수 있다.
오염
FDA는 2018년 11월부터 2019년 9월까지 발암물질 중 하나가 검출됨에 따라 Sandoz, Torrent Pharmacuticals, Hethero Labs, Camber Pharmacuticals, Legacy Pharmacisticals, Teva Pharmacisticals, Vivimed Life Sciencience, Macle Limited의 로사 로사탄이 함유된 태블릿에 대한 다중 리콜을 발표했다.활성 의약품 성분(API)[19][20][21][22][23][24][25][26][27][28][29][30][31][32][33][34][35][36]의 이트로소디에틸아민, N-메틸니트로소낙산 또는 N-니트로소-N-메틸-4-아미노낙산.
작용 메커니즘
Losartan은 앤지오텐신 II 수용체 유형 1(AT1) 길항제로서 앤지오텐신 II에 대한 말단 장기 반응을 감소시킨다.Losartan 투여는 총 말초 저항(후부하)과 심장 정맥 리턴(예부하)의 감소를 초래합니다.알도스테론 방출을 포함한 앤지오텐신II의 모든 생리적 효과는 로사탄 존재 하에서 길항된다.혈압 감소는 레닌-안지오텐신 시스템의 상태와 무관하게 발생한다.로사탄 투여의 결과로, 앤지오텐신 II 피드백의 제거로 인해 혈장 레닌 활성은 증가한다.레닌은 신장 동맥압 감소, 교감 활성화 또는 원위부 신장 [37]세관에 나트륨 공급이 증가하면 신장으로부터 배출됩니다.레닌은 앤지오텐시노겐을 앤지오텐신 I로 변환하고, 앤지오텐신 변환효소(ACE)는 앤지오텐신 I을 앤지오텐신 II로 변환하며, 앤지오텐신 II는 혈관 수축과 알도스테론 [37]방출을 일으킨다.알도스테론은 말단신세관에서 나트륨을 유지하는 역할을 한다.나트륨 보유는 궁극적으로 혈압을 [38]증가시킨다.따라서 로사탄과 같은 앤지오텐신II 수용체 길항제 사용은 레닌, 앤지오텐신II의 하류 효과를 차단하고 궁극적으로 혈압을 낮추는 결과를 초래한다.
앤지오텐신II 수용체 길항제에는 로사탄, 발사르탄, 아질사르탄, 칸데사르탄, 에프로사르탄, 이르베사르탄, 올메사르탄 및 텔미사르탄이 포함된다.그들은 모두 같은 작용 메커니즘을 가지고 있고 잠재적으로 리시노프릴과 같은 ACE 억제제보다 안지오텐신의 작용을 더 잘 억제한다. 왜냐하면 안지오텐신 [37]II를 생산하는 능력을 가진 ACE가 아닌 다른 효소들이 있기 때문이다.
로사탄은 요도 요독증 환자입니다.요산수송체 1의 특이적 저해제(SLC22A12, URAT1)로서 로사탄은 세포로의 요산 흡수를 차단하여 혈류 중에 더 많은 이용가능성을 [39]신장에 의해 여과 및 배설할 수 있도록 한다.로사탄은 고칼륨혈증을 일으킬 수 있기 때문에 의사의 적절한 관찰 [40]없이 칼륨 보충제나 칼륨이 함유된 소금 대체물을 사용해서는 안 된다.
약동학
Losartan은 경구 투여 후 잘 흡수되며, 중요한 1차 대사 과정을 거쳐 EXP3174로 지정된 5-카르본산 대사물을 생성한다.경구 투여량의 약 14%가 이 대사물로 전환되는데, 이 대사물은 장시간(6~8시간) 작용하며 AT 수용체에서1 비경쟁적 길항제로서 로사탄의 약리학적 효과에 기여한다.EXP3174는 로사탄보다 AT 수용체 차단에1 10~40배 더 강력하다.또한 타깃 효소에 대한 결합은 pH 감수성이며, 음의 카르본산 유도체와 크기가 유사한 음의 하전 테트라졸 고리가 [41]약물의 활성에 기여할 수 있다.
Losartan의 생물학적 가용성은 약 33%[42]이다.
신진대사는 주로 시토크롬 P450 이소엔자임 CYP2C9 및 CYP3A4에 [43]의해 이루어진다.losartan과 EXP3174의 피크 혈장 농도는 경구 [44]투여 후 각각 약 1시간과 3~4시간 동안 발생한다.로사탄과 EXP3174는 모두 혈장 [45]단백질에 98% 이상 결합되어 있다.Losartan은 변함이 없는 약물과 [46]대사물로 소변과 담즙을 통해 배설된다.경구용량의 약 4%는 소변에서 변하지 않고 배설되며,[47] 약 6%는 활성대사물로서 소변에서 배설된다.Losartan의 말단 제거 반감기는 약 1.5~2.5시간, EXP3174는 약 3~9시간이다.[48]
로사탄과 다른 앤지오텐신 수용체 길항제들은 태아 독성을 나타내며, 임신 중, 특히 임신 2기와 3기에 [49]피해야 한다.
역사
조사.
2020년 3월에 발표된 의견 논평에서 로사탄과 같은 AT1R 차단제가 COVID-19([50]SARS-CoV-2) 감염 증상을 완화하기 위해 작동할 수 있다는 가설이 나타났다.서로 다른 가설들은 그것이 증상을 [51][52]더 악화시킬 것이라는 것이다.이 질문에 대한 연구는 2020년 [53]3월에 시작되었다.
레퍼런스
- ^ a b c "Losartan (Cozaar) Use During Pregnancy". Drugs.com. Retrieved 10 December 2017.
- ^ a b c d e f g h i j k "Cozaar- losartan potassium tablet, film coated". DailyMed. 14 November 2019. Retrieved 20 March 2020.
- ^ a b c d e f g h i j k "Losartan Potassium". The American Society of Health-System Pharmacists. Retrieved 8 December 2017.
- ^ Fischer, János; Ganellin, C. Robin (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 470. ISBN 9783527607495.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. p. 127. ISBN 9780857111562.
- ^ a b "The Top 300 of 2019". ClinCalc. Retrieved 16 October 2021.
- ^ "Losartan - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ "Hydrochlorothiazide; Losartan - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ "Pharmaceutical formulation of losartan".
- ^ 음전하 테트라졸 구조를 보다
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ Boersma C, Atthobari J, Gansevoort RT, de Jong-Van den Berg LT, de Jong PE, de Zeeuw D, Annemans LJ, Postma MJ (2006). "Pharmacoeconomics of angiotensin II antagonists in type 2 diabetic patients with nephropathy: implications for decision making". PharmacoEconomics. 24 (6): 523–35. doi:10.2165/00019053-200624060-00001. PMID 16761901. S2CID 22960961.
- ^ "Hypertension in adults: diagnosis and management". National Institute for Health and Care Excellence (NICE). Retrieved 8 April 2017.
- ^ Abrams A (2007). 'Clinical Drug Therapy Rationales for Nursing Practice. Philadelphia, Pa.: Lippincott Williams & Wilkins. p. 846. ISBN 978-0-7817-6263-2.
- ^ Cheungpasitporn, W; Thongprayoon, C; Chiasakul, T; Korpaisarn, S; Erickson, SB (November 2015). "Renin-angiotensin system inhibitors linked to anemia: a systematic review and meta-analysis". QJM: Monthly Journal of the Association of Physicians. 108 (11): 879–84. doi:10.1093/qjmed/hcv049. PMID 25697787.
- ^ Patti R, Sinha A, Sharma S, Yoon TS, Kupfer Y (May 2019). "Losartan-induced severe hepatic injury: A case report and literature review". Cureus. 11 (5): e4769. doi:10.7759/cureus.4769. PMC 6663042. PMID 31363450.
- ^ a b "Cozaar (losartan potassium) 25 mg, 50 mg, and 100 mg Tablets". U.S. Food and Drug Administration (FDA). 16 October 2014. Archived from the original on 12 January 2017. Retrieved 21 July 2015.
- ^ "FDA provides update on its ongoing investigation into ARB drug products; reports on finding of a new nitrosamine impurity in certain lots of losartan and product recall" (Press release). U.S. Food and Drug Administration (FDA). 3 October 2019. Archived from the original on 3 October 2019. Retrieved 3 October 2019.
- ^ "Sandoz Inc. Issues Voluntary Nationwide Recall of One Lot of Losartan Potassium and Hydrochlorothiazide Due to the Detection of Trace Amounts of NDEA (N-Nitrosodiethylamine) Impurity Found in the Active Pharmaceutical Ingredient (API)". U.S. Food and Drug Administration (FDA). 8 November 2018. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Torrent Pharmaceuticals Limited Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP". U.S. Food and Drug Administration (FDA). 20 December 2018. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Torrent Pharmaceuticals Limited Expands Voluntary Nationwide Recall of Losartan Potassium Tablets, USP". U.S. Food and Drug Administration (FDA). 3 January 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "UPDATED: Torrent Pharmaceuticals Limited Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP and Losartan Potassium and Hydrochlorothiazide Tablets, USP". U.S. Food and Drug Administration (FDA). 22 January 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Updated: Torrent Pharmaceuticals Limited Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP and Losartan Potassium /Hydrochlorothiazide Tablets, USP". U.S. Food and Drug Administration (FDA). 1 March 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Updated: Torrent Pharmaceuticals Limited Expands Voluntary Nationwide Recall of Losartan Potassium Tablets, USP and Losartan Potassium/Hydrochlorothiazide Tablets, USP". U.S. Food and Drug Administration (FDA). 18 April 2019. Archived from the original on 6 October 2019. Retrieved 5 October 2019.
- ^ "Updated: Torrent Pharmaceuticals Limited Expands Voluntary Nationwide Recall of Losartan Potassium Tablets, USP and Losartan Potassium / Hydrochlorothiazide Tablets, USP". U.S. Food and Drug Administration (FDA). 23 September 2019. Archived from the original on 6 October 2019. Retrieved 23 September 2019.
- ^ "Legacy Pharmaceutical Packaging, LLC Expands Voluntary Nationwide Recall of Losartan Potassium Tablets, USP, 50mg Due to the Detection of Trace Amounts of N-Nitroso N-Methyl 4-amino butyric acid (NMBA) Impurity Found in the Active Pharmaceutical Ingredient (API)". U.S. Food and Drug Administration (FDA). 15 July 2019. Archived from the original on 13 September 2019. Retrieved 5 October 2019.
- ^ "Macleods Pharmaceutical Limited Issues Voluntary Nationwide Consumer Level Recall of Losartan Potassium 50mg and Losartan Potassium/Hydrochlorothiazide combination Tablets 50mg/12.5mg, 100mg/12.5mg and 100mg/25mg due to detection of NMBA (N-Nitroso-N-Methyl-4-aminobutyric acid) Impurity". U.S. Food and Drug Administration (FDA). 26 June 2019. Archived from the original on 1 October 2019. Retrieved 5 October 2019.
- ^ "Teva Pharmaceuticals USA, Inc. Expands Voluntary Nationwide Recall of Losartan Potassium to 50 mg and 100 mg Tablets USP, Sold Exclusively to Golden State Medical Supply, Inc". U.S. Food and Drug Administration (FDA). 11 June 2019. Archived from the original on 13 September 2019. Retrieved 5 October 2019.
- ^ "Vivimed Life Sciences Pvt Ltd Issues Voluntary Nationwide Recall of Losartan Potassium 25 mg, 50 mg and 100 mg Tablets, USP Due to the Detection of Trace Amounts of N-Nitroso-N-methyl-4-aminobutyric acid (NMBA) Impurity". U.S. Food and Drug Administration (FDA). 3 May 2019. Archived from the original on 13 September 2019. Retrieved 5 October 2019.
- ^ "Teva Pharmaceuticals USA, Inc. Issues Voluntary Nationwide Recall of Losartan Potassium 25 mg and 100 mg Tablets USP, Sold Exclusively to Golden State Medical Supply". U.S. Food and Drug Administration (FDA). 26 April 2019. Archived from the original on 13 September 2019. Retrieved 5 October 2019.
- ^ "Legacy Pharmaceutical Packaging, LLC Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP, 25mg, 50mg, And 100mg Due to The Detection of Trace Amounts Of N-Nitroso N-Methyl 4-Amino Butyric Acid (NMBA) Impurity Found in The Active Pharmaceutical Ingredient (API)". U.S. Food and Drug Administration (FDA). 19 March 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Legacy Pharmaceutical Packaging, LLC Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP, 25mg, 50mg, and 100mg Due to the Detection of Trace Amounts of N-Nitroso N-Methyl 4-Amino Butyric Acid (NMBA) Impurity Found in the Active Pharmaceutical Ingredient (API)". U.S. Food and Drug Administration (FDA). 28 March 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Legacy Pharmaceutical Packaging, LLC Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP, 50mg Due to the Detection of Trace Amounts of N-Nitroso N-Methyl 4-amino butyric acid (NMBA) Impurity found in the Active Pharmaceutical Ingredient (API)". U.S. Food and Drug Administration (FDA). 15 March 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Camber Pharmaceuticals, Inc. Issues Voluntary Nationwide Recall of Losartan Potassium Tablets, USP, 25 mg, 50 mg and 100 mg Due to the Detection of Trace Amounts of N-Nitroso N-Methyl 4-amino butyric acid (NMBA) Impurity found in the Active Pharmaceutical Ingredient (API)". U.S. Food and Drug Administration (FDA). 28 February 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ "Macleods Pharmaceuticals Limited Issues Voluntary Nationwide Consumer Level Recall of One Lot (BLM 715A) of Losartan Potassium/Hydrochlorothiazide Combination Tablets 100mg/25mg Due to detection of NDEA (N-Nitrosodiethylamine) Impurity". U.S. Food and Drug Administration (FDA). 22 February 2019. Archived from the original on 7 September 2019. Retrieved 5 October 2019.
- ^ a b c Katzung, Bertram G., editor (30 November 2017). Basic & clinical pharmacology. ISBN 9781259641152. OCLC 1048625746.
{{cite book}}:last=범용명(도움말)이 있습니다.CS1 유지: 여러 이름: 작성자 목록(링크) - ^ Graudal, Niels A.; Hubeck-Graudal, Thorbjørn; Jürgens, Gesche (January 2012). "Effects of low-sodium diet vs. high-sodium diet on blood pressure, renin, aldosterone, catecholamines, cholesterol, and triglyceride (Cochrane Review)". American Journal of Hypertension. 25 (1): 1–15. doi:10.1038/ajh.2011.210. ISSN 1941-7225. PMID 22068710.
- ^ Hamada T, Ichida K, Hosoyamada M, Mizuta E, Yanagihara K, et al. (1 October 2008). "Uricosuric action of losartan via the inhibition of urate transporter 1 (URAT 1) in hypertensive patients". American Journal of Hypertension. 21 (10): 1157–1162. doi:10.1038/ajh.2008.245. PMID 18670416.
- ^ RxList 인터넷 마약 색인입니다코자르의 임상 약리학.2014년 1월 6일 취득.
- ^ 로사르탄의 구속
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ "DailyMed - LOSARTAN POTASSIUM 25 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 50 MG- losartan potassium tablet, film coated LOSARTAN POTASSIUM 100 MG- losartan potassium tablet, film coated". Retrieved 27 April 2022.
- ^ Sica DA, Gehr TW, Ghosh S (2005). "Clinical pharmacokinetics of losartan". Clin Pharmacokinet. 44 (8): 797–814. doi:10.2165/00003088-200544080-00003. PMID 16029066. S2CID 41326620.
- ^ Gurwitz D (March 2020). "Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics". Drug Development Research. 81 (5): 537–540. doi:10.1002/ddr.21656. ISSN 1098-2299. PMC 7228359. PMID 32129518.
- ^ Watkins, John (28 February 2020). "Preventing a covid-19 pandemic". BMJ. 368: m810. doi:10.1136/bmj.m810. ISSN 1756-1833. PMID 32111649.
- ^ Kickbusch, Ilona; Leung, Gabriel (31 January 2020). "Response to the emerging novel coronavirus outbreak". BMJ. 368: m406. doi:10.1136/bmj.m406. ISSN 1756-1833. PMID 32005675.
- ^ "Losartan for Patients With COVID-19 Requiring Hospitalization". ClinicalTrials.gov. 17 March 2020. Retrieved 23 March 2020.
추가 정보
- Al-Majed AR, Assiri E, Khalil NY, Abdel-Aziz HA (2015). "Losartan: Comprehensive Profile". Profiles Drug Subst Excip Relat Methodol. 40: 159–94. doi:10.1016/bs.podrm.2015.02.003. PMID 26051686.
- Sica DA, Gehr TW, Ghosh S (2005). "Clinical pharmacokinetics of losartan". Clin Pharmacokinet. 44 (8): 797–814. doi:10.2165/00003088-200544080-00003. PMID 16029066. S2CID 41326620.
외부 링크
- "Losartan". Drug Information Portal. U.S. National Library of Medicine.



