은행골리드
Ginkgolide은행나무는 은행빌로바에 존재하는 생물학적으로 활성 테르페닉 락톤이다. 그것들은 20개의 탄소 골격을 가진 디테르페노이드로, 제라닐제라닐 피로인산염으로부터 사이즈를 맞춘 것이다.[1]
예
| 이름 | R1 | R2 | R3 |
| 은행가이드A | 오호 | H | H |
| 은행골리드 B | 오호 | 오호 | H |
| 은행골리드 C | 오호 | 오호 | 오호 |
| 은행골리드 J | 오호 | H | 오호 |
| 은행골리드 M | H | 오호 | 오호 |
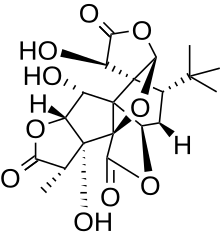
은행골리드 B
특히 은행골리드 B는 디테르페노이드 트릴락톤으로 5mb의 고리 6개가 있다. 스피로[4,4]-논란 카보시클릭 링, 테트라하이드로푸란 링, 링 중 하나에 매우 구체적인 테르트 부틸 그룹을 포함하고 있다(그림 1). 은행나무의 종류는 1932년 은행나무 빌로바 나무에서 처음 분리되었다.[2] 구조적 해명은 마루야마 외 연구원에 의해 1967년에 이루어졌다.[3]
배경
그것은 중국에서 자생한 은행나무의 뿌리 껍질과 잎에서 추출된다. 추출물의 의약품 및 임상적 특성에 대해 한국, 프랑스, 미국 등을 포함한 다른 국가에 판매하고 있다. 현재 나무에는 은행 B의 0.1~0.25% 미만으로 은행 A가 가장 풍부하다.[4]
잠재적 응용 프로그램
이 종류의 분자는 혈소판 활성화 인자 수용체 길항제 역할을 할 수 있는 잠재력으로 연구되어 왔다.[2][5]
은행골리드B는 편두통 발생 빈도를 줄일 수 있는 잠재력으로 조사돼 왔다.[6]
은행골리드B는 뇌혈관질환 치료에도 쓰인다. 은행 B도 젊은 나이에 편두통을 치료할 수 있다는 연구결과가 나왔다.[2][4][6] 문헌에 따르면 은행 B는 이 화합물이 수행하는 신경계에 대한 비경쟁적 억제에 근거하여 글리신 수용체의 선택적 길항제 역할을 한다.[5]
은행구조물의 용해화를 위한 분광학적 연구
은행화 A - C는 대규모 메타놀 추출에서 격리되었고, 액체 유동체 분할, 컬럼 크로마토그래피, 반복 결정화 등이 뒤따랐다. 분자 공식은 고해상도 질량 분광법에 의해 결정되었고, IR 및 NMR 분광 분석과 광범위한 유도 기법에 의해 전체적인 구조가 결정되었다.
은행 B의 생합성
연구자들이 이 분자를 만들기 위한 화학적 경로를 발표했지만, 대부분의 설계 합성물은 너무 복잡하고 실제 물질을 거의 생성하지 않아 완전한 분석을 할 수 없었다.[2] 따라서 분자의 생합성을 연구하는 것이 바람직하다.
대부분의 천연 제품 테르페노이드는 MEP 경로에 의해 합성된 이소펜테닐 디포스포네이트로 시작한다. 또한 이 경로는 피루바이트와 D-glyercaldedh 3-인산염(GAP)으로부터 디메틸알릴 디프인산염을 생성한다. 함께 결합하면 제라닐제라닐디포스포산염과 제라닐제라닐디포산염의 한 분자를 형성한다.
A molecule of GGPP generates (1) (+)-copalyl in the presence of levopimaradiene synthase. (a) Then (1) loses its OPP group catalyzed by this same synthase, performing an intramolecular allylic cyclization with the two alkenes, to form (2) the sandaracopimarenyl cation. (b) This cation then undergoes an internal cyclization to stabilize the carbocat양성자 전달에 의한 링의 이온에서 중간 형태(3)로 형성된다. (c) 이렇게 함으로써 분자는 그 이차 양이온을 안정시키고 (4)에서 3차 탄수화물을 생성하기 위해 스스로 메틸 이동을 위해 설정된다. (d) 이는 양성자의 손실을 유발하여 (5)레보피마라디엔을 얻는다. (e) 산화 작용과 함께 양성자를 상실하여 방향성 고리를 형성하게 되면 (6) 아비에타틴이 생성된다. (g) 이 새로 형성된 아비에타트리엔은 6-엠베트 고리를 (7)에 5-엠베트 고리(더 유리함)로 깨기 위해 1,2알킬 시프트를 거친다. (h) 또 다른 1,2 알킬 교대조에서는 (8) 링 갈라짐 현상이 동시에 일어난다. (i) 알케인이 있는 모든 위치에서 산화 작용은 (9) 중간을 생성하며, 그 다음 (10)에 은행 B를 얻기 위해 1개의 헤미아세탈과 3개의 락톤을 포함하는 링 클로징을 거친다.[4]
참고 항목
참조
- ^ Niels H. Andersen; Niels Johan Christensen; Peter R. Lassen; Teresa B.N. Freedman; Laurence A. Nafie; Kristian Strømgaard; Lars Hemmingsen (February 2010). "Structure and absolute configuration of ginkgolide B characterized by IR- and VCD spectroscopy". Chirality. 22 (2): 217–223. doi:10.1002/chir.20730. PMID 19455619.
- ^ a b c d Stromgaard, K.; Nakanishi, K. (2004). "Chemistry and Biology of Terpene Trilactones from Ginkgo Biloba". Angew. Chem. Int. Ed. 43 (13): 1640–58. doi:10.1002/anie.200300601. PMID 15038029.
- ^ Maruyama, M.; Terahara, A.; Itagaki, Y.; Nakanishi, K. (1967). "The ginkgolides. I. Isolation and characterization of the various groups". Tetrahedron Letters. 8 (4): 299–302. doi:10.1016/S0040-4039(00)71538-3.
- ^ a b c Dewick, P.M. (2012). Medicinal Natural Products: A Biosynthetic Approach (3rd ed.). United Kingdom: John Wiley and Sons, Ltd. pp. 230–232. ISBN 978-0470741672.
- ^ a b Zen, Z.; Zhu, J.; Chen, L.; Wen, W.; Yu, R. (2013). "Biosynthesis pathways of ginkgolides". Pharmacognosy Reviews. 7 (13): 47–52. doi:10.4103/0973-7847.112848. PMC 3731879. PMID 23922456.
- ^ a b Usai, S.; Grazzi, L.; Bussone, G. (2011). "Gingkolide B as migraine preventive treatment in young age: results at 1-year follow-up". Neurol. Sci. 32 (Suppl 1): SI97–SI99. doi:10.1007/s10072-011-0522-7. PMC 3084934. PMID 21533745.