카바지탁셀
Cabazitaxel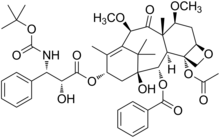 | |
| 임상자료 | |
|---|---|
| 상명 | 젭타나 |
| 기타 이름 | XRP-6258 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a611009 |
| 라이센스 데이터 | |
| 임신 , 카테고리 |
|
| 경로: 행정 | 정맥주사 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.205.741 |
| 화학 및 물리적 데이터 | |
| 공식 | C45H57NO14 |
| 어금질량 | 835.944 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
제브타나라는 상표명으로 판매되는 카바지탁셀은 천연택시이드의 반합성 파생상품이다.[2] 미세관 억제제로,[1] 암 치료제로 승인되는 네 번째 세단이다.[citation needed]
카바지탁셀은 사노피-아벤티스가 개발해 2010년 6월 미국 식품의약국(FDA)으로부터 호르몬 퇴치 전립선암 치료를 승인받았다.[3][4][5] 그것은 일반적인 약으로 이용할 수 있다.[6]
의학적 용법
카바지탁셀은 도세탁셀 기반 치료 후 전이성 거세 저항성 전립선암 치료를 위해 프레드니손과 함께 표시된다.[1]
작용기전
택시는 미세관 안정화를 강화하고 세포 분열과 분열을 억제한다.[7] 더욱이 택사인은 세포 미세관 및 미세관 관련 운동단백질 다이네인을 결합시켜 안드로겐 수용체(AR) 신호를 방지해 AR 핵번역을 회피한다.[8]
임상시험
전이성 거세저항성 전립선암(mCRPC) 환자들의 경우 사전 도큐테탁스 치료 후 카바지탁셀 대 미톡산트론(mitoxantrone)으로 전반적인 생존(OS)이 현저하게 향상된다. 퍼스트애나(ClinicalTrials.gov 식별자: NCT01308567)는 화학요법-나브 mCRPC 환자에서 카바지탁셀 20mg/m2(C20) 또는 25mg/m2(C25)이 docetaxel 75mg/m2(D75)보다 우수한지 여부를 평가했다. 그러나 C20과 C25는 항암화학요법-나선형 mCRPC 환자에서 OS 대 D75에 대한 우월성을 입증하지 못했다. Cabazitaxel과 docetaxel은 서로 다른 독성 프로파일을 보여 주었으며, C20은 전체적으로 가장 낮은 독성을 보였다.[9] 거세 저항성 전립선암 치료를 위해 755명의 남성을 대상으로 한 3단계 임상시험에서 카바지탁셀을 투여한 환자의 경우 중위 생존기간이 15.1개월인 반면 미톡스론 치료를 받은 환자는 12.7개월이었다. 카바지탁셀은 미톡산트론(58%)[10]보다 3-4등급 중성미자(81.7%)가 더 많았다. 카바지탁셀과의 일반적인 부작용으로는 중성미자(열성 중성미자 포함)가 있으며, 주로 설사에 GIT 부작용이 나타나는 반면 신경장애는 거의 발견되지 않았다.[11]
약동학
Cabazitaxel 투여는 삼강 운동학을 나타내는 혈장 농도의 감소를 유발한다: 1단계에서는 평균 반감기(t1/2)가 2.6분, 2단계에서는 평균 t가1/2 1.3시간, 3단계에서는 평균 t가1/2 77.3시간이다.[12]
신진대사
카바지탁셀은 기본적으로 [사이토크롬 P450(CYP)3A4/5 > CYP2C8]에 의해 간에서 대사되며, 이로 인해 7개의 플라즈마 대사물이 발생하고 20개의 대사물이 배설된다. 투여 후 14일 동안 카바지탁셀의 80%가 배설되는데, 이는 대변에서 76%, 신장 배설에서 3.7%이다.[13]
참조
- ^ a b c "Jevtana- cabazitaxel kit". DailyMed. Retrieved December 30, 2021.
- ^ "Cabazitaxel". NCI Drug Dictionary. U.S. Department of Health and Human Services, National Institutes of Health, National Cancer Institute. February 2, 2011.
- ^ "Drug Approval Package: Jevtana (Cabazitaxel) NDA #201023". U.S. Food and Drug Administration (FDA). July 8, 2013. Retrieved December 30, 2021. Lay summary (PDF).
{{cite web}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ "Jevtana (cabazitaxel) Injection Approved by U.S. FDA After Priority Review" (Press release). Sanofi Aventis. June 17, 2010. Retrieved December 30, 2021 – via PR Newswire.
- ^ "Jevtana (cabazitaxel) Injection Approved by U.S. FDA After Priority Review - Jun 17, 2010" (Press release). Sanofi. June 17, 2010. Retrieved December 30, 2021.
- ^ "Cabazitaxel: FDA-Approved Drugs". U.S. Food and Drug Administration (FDA). Retrieved December 30, 2021.
- ^ Jordan MA, Wilson L (April 2004). "Microtubules as a target for anticancer drugs". Nature Reviews. Cancer. 4 (4): 253–65. doi:10.1038/nrc1317. PMID 15057285. S2CID 10228718.
- ^ Darshan MS, Loftus MS, Thadani-Mulero M, Levy BP, Escuin D, Zhou XK, et al. (September 2011). "Taxane-induced blockade to nuclear accumulation of the androgen receptor predicts clinical responses in metastatic prostate cancer". Cancer Research. 71 (18): 6019–29. doi:10.1158/0008-5472.CAN-11-1417. PMC 3354631. PMID 21799031.
- ^ Oudard S, Fizazi K, Sengeløv L, Daugaard G, Saad F, Hansen S, et al. (October 2017). "Cabazitaxel Versus Docetaxel As First-Line Therapy for Patients With Metastatic Castration-Resistant Prostate Cancer: A Randomized Phase III Trial-FIRSTANA". Journal of Clinical Oncology. 35 (28): 3189–3197. doi:10.1200/JCO.2016.72.1068. PMID 28753384.
- ^ "Cabazitaxel Effective for Hormone Refractory Prostate Cancer After Failure of Taxotere".[영구적 데드링크]
- ^ Paller CJ, Antonarakis ES (March 2011). "Cabazitaxel: a novel second-line treatment for metastatic castration-resistant prostate cancer". Drug Design, Development and Therapy. 5: 117–24. doi:10.2147/DDDT.S13029. PMC 3063116. PMID 21448449.
- ^ Mita AC, Denis LJ, Rowinsky EK, Debono JS, Goetz AD, Ochoa L, et al. (January 2009). "Phase I and pharmacokinetic study of XRP6258 (RPR 116258A), a novel taxane, administered as a 1-hour infusion every 3 weeks in patients with advanced solid tumors". Clinical Cancer Research. 15 (2): 723–30. doi:10.1158/1078-0432.CCR-08-0596. PMID 19147780.
- ^ Tsao CK, Cutting E, Martin J, Oh WK (June 2014). "The role of cabazitaxel in the treatment of metastatic castration-resistant prostate cancer". Therapeutic Advances in Urology. 6 (3): 97–104. doi:10.1177/1756287214528557. PMC 4003844. PMID 24883107.
외부 링크
- "Cabazitaxel". Drug Information Portal. U.S. National Library of Medicine.
- "Cabazitaxel Accord 20 mg/mL concentrate for solution infusion: Risk of medication errors and mix-up with Jevtana (60 mg/1.5 mL) solvent infusion". European Medicines Agency (EMA). October 28, 2020.
- ClinicalTrials.gov의 "XRP6258 Plus Prednisone과 호르몬 전립선암(TROPIC)의 Mitoxantrone Plus Prednisone 비교
- 임상시험 번호 NCT01308580은 ClinicalTrials.gov에서 "20mg/m²의 카바지탁셀과 전이성 거세저항 전립선암(PRSELICA) 치료를 위한 프레드니손 25mg/m² 비교"이다.
- Clinical trial number NCT02485691 for "Cabazitaxel Versus the Switch to Alternative AR-targeted Agent (Enzalutamide or Abiraterone) in Metastatic Castration-resistant Prostate Cancer (mCRPC) Patients Previously Treated With Docetaxel and Who Rapidly Failed a Prior AR-targeted Agent (CARD)" at ClinicalTrials.gov


