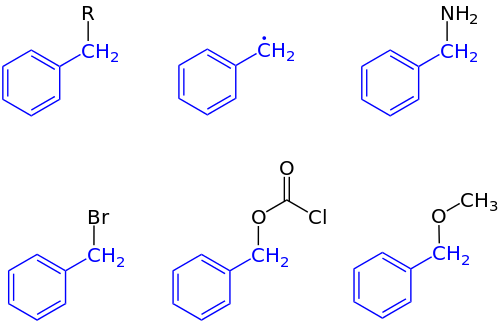
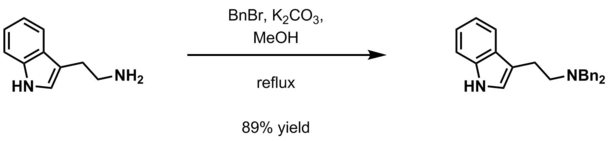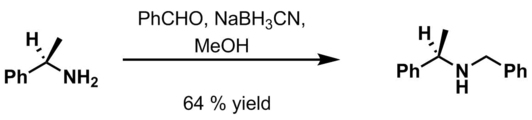벤질 그룹
Benzyl group유기 화학에서 벤질(benzyl)은 CHCH652– 구조를 가진 대체 물질 또는 분자 조각이다. 벤질에는 CH2 그룹에 부착된 벤젠 링이 특징이다.[1]
명명법
IUPAC 명명법에서 접두사 벤질(benzyl)은 예를 들어 염화 벤질(benzyl) 또는 벤질 벤조이트(benzyl benzoate)와 같은 CHCH652 대체물을 가리킨다. Benzyl은 CH라는65페닐과혼동해서는 안 된다 공식으로. 벤질릭(benzylic)이라는 용어는 벤젠이나 다른 방향족 고리에 접합된 첫 번째 탄소의 위치를 설명하는 데 사용된다. 예를 들어 (CH65)(CH3)2C는+ "벤질릭" 탄수화물이라고 한다. 벤질 프리 래디컬은 CHCH라는
6
5•
2 공식을 가지고 있다. 벤질 양이온 또는 페닐카르베늄 이온은 CHCH
6
5+
2 공식의 탄수화물이고, 벤질 음이온 또는 페닐메탄니드 이온은 CHC
6
5−
2 공식의 카르바니온이다. 이러한 종들 중 어떤 종도 정상적인 조건 하에서 해결 단계에서 유의한 양으로 형성될 수 없지만, 그들은 반응 메커니즘에 대한 논의를 위한 유용한 참고자료가 되며 반응 매개체로 존재할 수 있다.
약어
약칭 "Bn"은 벤질(benzyl)을 의미한다. 예를 들어, 벤질 알코올은 BnOH로 표현될 수 있다. 이약어는 벤조일 그룹 CH의65"박사"와혼동해서는 안 된다 약어인 그룹 CHC65(O)-의또는 페닐"벤질"약어인. 혼란스러울 정도로 옛 문헌에서는 'Bz'가 벤질에도 사용되었다.
벤질리크 센터의 반응성
벤질릭 포지션의 반응성이 개선된 것은 벤질릭 C-H 채권에 대한 낮은 본드 분리 에너지 때문이다. 구체적으로 CHCH-H652 채권은 다른 종류의 C-H 채권에 비해 약 10~15% 약하다. 이웃한 방향족은 벤질산소를 안정시킨다. 아래 표에 제시된 데이터는 벤질릭 C-H 본드를 관련 C-H 본드 강도와 비교한다.
| 본드 | 본드 | 결합분리에너지[2][3] | 댓글 | |
|---|---|---|---|---|
| (kcal/message) | (kJ/mol) | |||
| C6H5CH2−H | 벤질 C-H 결합 | 90 | 377 | 동맹 C-H 채권과 유사하다. 그러한 결합은 향상된 반응성을 보여준다. |
| H3C−H | 메틸 C-H 결합 | 105 | 439 | 가장 강력한 하이파틱 C-H 결합의 하나 |
| C2H5−H | 에틸 C-H 결합 | 101 | 423 | HC-H보다3 약간 약한 |
| C6H5−H | 페닐 C-H 결합 | 113 | 473 | 비닐 래디컬에 필적하는, 희귀한 |
| CH2=CHCH2−H | 동맹 C-H사채 | 89 | 372 | 벤질릭 C-H와 비슷한 |
| (C6H4)2CH−H | 형광 C-H 결합 | 80 | 더 활성화 vs 디페닐메틸(pKa = 22.6) | |
| (C6H5)2CH−H | 디페닐메틸 C-H 결합 | 82 | "benzylic"(pKa = 32.2) | |
| (C6H5)3C−H | 트리틀 C-H 결합 | 81 | 339 | "트립 벤질릭" |
C-H 채권의 약점은 벤질릭 급진파의 안정성을 반영한다. 관련 이유 때문에 벤질릭 대체물은 산화, 자유 급진 할로겐화 또는 수소 분해와 같이 반응성이 향상된다. 실제적인 예로서 적절한 촉매들이 존재하는 경우, p-자일렌은 벤질 위치에서 독점적으로 산화하여 테레프탈산을 공급한다.
- CHCH3643 + 3 O2 → HOCCOH2642 + 2 HO2.
이 방법으로 매년 수백만 톤의 테레프탈산이 생산된다.[4]
벤질 위치에서의 기능화
몇 가지 경우, 이러한 벤질리 변환은 실험실 합성에 적합한 조건에서 발생한다. Wohl-Ziegler 반응은 benzylic C–H 결합을 브롬화시킬 것이다: (ArCHR → ARCBRR).2[5] 비 3차 벤질릭 알킬 그룹은 수용성 과망간산칼륨(KMNO4) 또는 농축 질산(HNO3): (ArCHr → ArCOOH)에 의해 카르복실 그룹으로 산화된다.[6] 마지막으로 삼산화 크롬과 3,5-디메틸피라졸(CrO3–dmpyz)의 복합체는 벤질릭 메틸렌 그룹을 카보닐로 선택적으로 산화시킨다. (ArCHr → ARC(O)R).[7] DMSO의 2-iodoxybenzoic acid도 이와 유사하게 작용한다.[8]
보호 그룹으로서
벤질 그룹은 유기적 합성에 있어서 때때로 보호 집단으로 고용된다. 이들의 설치와 특히 제거는 비교적 가혹한 조건을 필요로 하기 때문에 벤질 보호는 일반적으로 선호되지 않는다.[9]
알코올 보호
벤질(Benzyl)은 알코올과 카복실산을 강력하게 보호하는 그룹으로 유기합성에 흔히 사용된다.
- 수산화칼륨 분말 또는 수산화나트륨, 벤질할라이드 등 기초가 강한 알코올(BnCl 또는 BnBr)[9][10]의 처리
- 높은 온도의[11] 주변 환경에서 디메틸포름아미드(DMF)의 AGO를2 사용하여 다이올의 모노벤질화를 달성할 수 있다.
- 1차 알코올은 Cu(acac)2[12]를 사용하여 페놀 기능 그룹이 있는 곳에서 선택적으로 벤질될 수 있다.
절제 방법
벤질 에테르들은 환원 조건, 산화 조건, 루이스 산스의 사용 아래에서 제거될 수 있다.[9]
- 벤질 보호 그룹은 다음을 포함한 광범위한 산화제를 사용하여 제거할 수 있다.
- 주변 온도에서의 CRO3/아세트산
- 오존
- N-브로모수치니미드(NBS)
- NIS(N-Iodosuccinimide)
- 주변 온도에서 디클로로메탄의 트리메틸실릴요오드화합물(MeSiI3) (특정 조건에서 선택성을 얻을 수 있음)
p-methoxybenzyl 보호 그룹
p-Methoxybenzyl(PMB)은 유기합성 시 알코올의 보호 그룹으로 사용된다(4-Methoxybenzylthiol은 티올을 보호하는 데 사용된다).
- 가루로 된 수산화칼륨 또는 수산화나트륨과 p-methoxybenzyl 할라이드(염화물 또는 브롬화물)[14][15]와 같은 강한 염기
- 4-methoxybenzyl-2,2-트리클로아세티미드ate를 사용하여 PMB 그룹을 다음과 같이 설치할 수 있다.
절제 방법
- 2,3-디클로로-5,6-디시카노-p-벤조퀴논(DDQ)[18]
- 벤질 그룹의 절제 조건은 PMB 보호 그룹의 분할에 적용할 수 있다.
아민 보호
벤질 그룹은 유기 합성에서 아민의 보호 그룹으로 가끔 사용된다. 다른 방법이 존재한다.[9]
절제 방법
참고 항목
참조
- ^ Carey, F. A.; Sundberg, R. J. (2008). Advanced Organic Chemistry, Part A: Structure and Mechanisms (5th ed.). New York, NY: Springer. pp. 806–808, 312–313. ISBN 9780387448978.
- ^ Xue, Xiao-Song; Ji, Pengju; Zhou, Biying; Cheng, Jin-Pei (2017). "The Essential Role of Bond Energetics in C–H Activation/Functionalization". Chemical Reviews. 117 (13): 8622–8648. doi:10.1021/acs.chemrev.6b00664. PMID 28281752.
- ^ Zhang, Xian-Man; Bordwell, Frederick G. (1992). "Homolytic bond dissociation energies of the benzylic carbon-hydrogen bonds in radical anions and radical cations derived from fluorenes, triphenylmethanes, and related compounds". Journal of the American Chemical Society. 114 (25): 9787–9792. doi:10.1021/ja00051a010.
- ^ Sheehan, Richard J. "Terephthalic Acid, Dimethyl Terephthalate, and Isophthalic Acid". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a26_193.
- ^ C., Vollhardt, K. Peter (2018-01-29). Organic chemistry : structure and function. Schore, Neil Eric, 1948- (8e ed.). New York. ISBN 9781319079451. OCLC 1007924903.
- ^ Chandler), Norman, R. O. C. (Richard Oswald (1993). Principles of organic synthesis. Coxon, J. M. (James Morriss), 1941- (3rd. ed.). London: Blackie Academic & Professional. ISBN 978-0751401264. OCLC 27813843.
- ^ Johnston, Jeffrey N. (2001), "Chromium(VI) Oxide–3,5-Dimethylpyrazole", Encyclopedia of Reagents for Organic Synthesis, American Cancer Society, doi:10.1002/047084289x.rc170, ISBN 9780470842898
- ^ Baran, Phil S.; Zhong, Yong-Li (2001-04-01). "Selective Oxidation at Carbon Adjacent to Aromatic Systems with IBX". Journal of the American Chemical Society. 123 (13): 3183–3185. doi:10.1021/ja004218x. ISSN 0002-7863. PMID 11457049.
- ^ a b c d Wuts, Peter G. M.; Greene, Theodora W. (2006). Greene's Protective Groups in Organic Synthesis (4th ed.). Wiley Online Library. doi:10.1002/0470053488. ISBN 9780470053485.
- ^ Fukuzawa, Akio; Sato, Hideaki; Masamune, Tadashi (1987-01-01). "Synthesis of (±)-prepinnaterpene, a bromoditerpene from the red alga Yamada". Tetrahedron Letters. 28 (37): 4303–4306. doi:10.1016/S0040-4039(00)96491-8.
- ^ Van Hijfte, Luc; Little, R. Daniel (1985-10-01). "Intramolecular 1,3-diyl trapping reactions. A formal total synthesis of (±)-coriolin". The Journal of Organic Chemistry. 50 (20): 3940–3942. doi:10.1021/jo00220a058. ISSN 0022-3263.
- ^ Sirkecioglu, Okan; Karliga, Bekir; Talinli, Naciye (2003-11-10). "Benzylation of alcohols by using bis[acetylacetonato]copper as catalyst". Tetrahedron Letters. 44 (46): 8483–8485. doi:10.1016/j.tetlet.2003.09.106.
- ^ Smith, Amos B.; Zhu, Wenyu; Shirakami, Shohei; Sfouggatakis, Chris; Doughty, Victoria A.; Bennett, Clay S.; Sakamoto, Yasuharu (2003-03-01). "Total Synthesis of (+)-Spongistatin 1. An Effective Second-Generation Construction of an Advanced EF Wittig Salt, Fragment Union, and Final Elaboration". Organic Letters. 5 (5): 761–764. doi:10.1021/ol034037a. ISSN 1523-7060. PMID 12605509.
- ^ Marco, José L.; Hueso-Rodríguez, Juan A. (1988-01-01). "Synthesis of optically pure 1-(3-furyl)-1,2-dihydroxyethane derivatives". Tetrahedron Letters. 29 (20): 2459–2462. doi:10.1016/S0040-4039(00)87907-1.
- ^ Takaku, Hiroshi; Kamaike, Kazuo; Tsuchiya, Hiromichi (1984-01-01). "Oligonucleotide synthesis. Part 21. Synthesis of ribooligonucleotides using the 4-methoxybenzyl group as a new protecting group for the 2′-hydroxyl group". The Journal of Organic Chemistry. 49 (1): 51–56. doi:10.1021/jo00175a010. ISSN 0022-3263.
- ^ Trost, Barry M.; Waser, Jerome; Meyer, Arndt (2007-11-01). "Total Synthesis of (−)-Pseudolaric Acid B". Journal of the American Chemical Society. 129 (47): 14556–14557. doi:10.1021/ja076165q. ISSN 0002-7863. PMC 2535803. PMID 17985906.
- ^ Mukaiyama, Teruaki; Shiina, Isamu; Iwadare, Hayato; Saitoh, Masahiro; Nishimura, Toshihiro; Ohkawa, Naoto; Sakoh, Hiroki; Nishimura, Koji; Tani, Yu-ichirou (1999-01-04). "Asymmetric Total Synthesis of Taxol\R". Chemistry – A European Journal. 5 (1): 121–161. doi:10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O. ISSN 1521-3765.
- ^ Hanessian, Stephen; Marcotte, Stéphane; Machaalani, Roger; Huang, Guobin (2003-11-01). "Total Synthesis and Structural Confirmation of Malayamycin A: A Novel Bicyclic C-Nucleoside from Streptomyces malaysiensis". Organic Letters. 5 (23): 4277–4280. doi:10.1021/ol030095k. ISSN 1523-7060. PMID 14601979.
- ^ Kuehne, Martin E.; Xu, Feng (1993-12-01). "Total synthesis of strychnan and aspidospermatan alkaloids. 3. The total synthesis of (±)-strychnine". The Journal of Organic Chemistry. 58 (26): 7490–7497. doi:10.1021/jo00078a030. ISSN 0022-3263.
- ^ Cain, Christian M.; Cousins, Richard P. C.; Coumbarides, Greg; Simpkins, Nigel S. (1990-01-01). "Asymmetric deprotonation of prochiral ketones using chiral lithium amide bases". Tetrahedron. 46 (2): 523–544. doi:10.1016/S0040-4020(01)85435-1.
- ^ Zhou, Hao; Liao, Xuebin; Cook, James M. (2004-01-01). "Regiospecific, Enantiospecific Total Synthesis of the 12-Alkoxy-Substituted Indole Alkaloids, (+)-12-Methoxy-Na-methylvellosimine, (+)-12-Methoxyaffinisine, and (−)-Fuchsiaefoline". Organic Letters. 6 (2): 249–252. doi:10.1021/ol0362212. ISSN 1523-7060. PMID 14723540.
- ^ Rong, Yi; Al-Harbi, Ahmed; Parkin, Gerard (2012). "Highly Variable Zr–CH2–Ph Bond Angles in Tetrabenzylzirconium: Analysis of Benzyl Ligand Coordination Modes". Organometallics. 31 (23): 8208–8217. doi:10.1021/om300820b.
외부 링크
| 위키미디어 커먼즈에는 벤질 그룹과 관련된 미디어가 있다. |