Тетразол
| 1H-Тетразол | |
|---|---|

| |
| Ідентифікатори | |
| Номер CAS | 288-94-8 |
| PubChem | 67519 |
| Номер EINECS | 206-023-4 |
| ChEBI | 33193 і 33194 |
| SMILES | C1=NNN=N1 |
| InChI | InChI=1S/CH2N4/c1-2-4-5-3-1/h1H,(H,2,3,4,5) |
| Номер Бельштейна | 105799 |
| Номер Гмеліна | 1790 |
| Властивості | |
| Молекулярна формула | CH2N4 |
| Молярна маса | 70.05 г/моль |
| Густина | 1.477 г/см3 |
| Тпл | 157 to 158 |
| Кислотність (pKa) | 4.90[1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Тетразол — органічна гетероциклічна сполука, що складається з 5-членного кільця з чотирьох атомів азоту та одного атома вуглецю, з формулою CH2N4. Тетразол утворює три ізомери.
Існують три ізомери вихідного тетразолу, що відрізняються положенням подвійних зв'язків: 1H-, 2H- і 5H-тетразол. 1H- і 2H-ізомери є таутомерами, рівновага яких лежить на стороні 1H-тетразолу в твердій фазі.[2][3][4] У газовій фазі домінує 2H-тетразол.[3][5][6] Ці ізомери можна вважати ароматичними з 6 π-електронами, тоді як 5H-ізомер неароматичний.
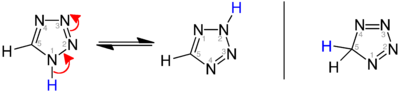
1H-тетразол вперше був отриманий реакцією безводної гідразойної кислоти та ціаністого водню під тиском. Обробка органічних нітрилів азидом натрію в присутності йоду або бісульфату натрію, на основі кремнезему як гетерогенного каталізатора, забезпечує вигідний синтез 5-заміщених 1H-тетразолів.
Іншим методом є дезамінування 5-амінотетразолу, який може бути комерційно придбаний або отриманий своєю чергою з аміногуанідину.[7][8]
Деякі похідні тетразолу з високою енергією були досліджені як високоефективні вибухові речовини як заміна тротилу, а також для використання у високоефективних складах твердого ракетного палива.[9][10] До них належать азидотетразоляти азотистих основ.
Інші тетразоли використовуються через їх вибухові або горючі властивості, такі як сам тетразол і 5-амінотетразол, які іноді використовуються як компонент газогенераторів в автомобільних подушках безпеки . Енергетичні матеріали на основі тетразолу виробляють високотемпературні, нетоксичні продукти реакції, такі як вода та газоподібний азот,[11] і мають високу швидкість горіння та відносну стабільність,[12] всі з яких є бажаними властивостями. Енергія делокалізації в тетразолі дорівнює 209 кДж/моль.
- Триазоли, аналоги з трьома атомами азоту
- Пентазол, аналог з п'ятьма атомами азоту (суворо кажучи, неорганічний гомоцикл, а не гетероцикл)
- Оксатетразол
- Тіатетразол
- ↑ Satchell, Jacqueline F.; Smith, Brian J. (2002). Calculation of aqueous dissociation constants of 1,2,4-triazole and tetrazole: A comparison of solvation models. Phys. Chem. Chem. Phys. 4 (18): 4314—4318. Bibcode:2002PCCP....4.4314S. doi:10.1039/b203118c.
- ↑ Goddard, R.; Heinemann, O.; Krüger, C. (15 травня 1997). α-1H-1,2,3,4-Tetrazole. Acta Crystallographica Section C (англ.). 53 (5): 590—592. doi:10.1107/S0108270197000772. ISSN 0108-2701.
- ↑ а б Kiselev, Vitaly G.; Cheblakov, Pavel B.; Gritsan, Nina P. (10 березня 2011). Tautomerism and Thermal Decomposition of Tetrazole: High-Level ab Initio Study. The Journal of Physical Chemistry A. 115 (9): 1743—1753. Bibcode:2011JPCA..115.1743K. doi:10.1021/jp112374t. ISSN 1089-5639. PMID 21322546.
- ↑ Razynska, A.; Tempczyk, A.; Malinski, E.; Szafranek, J.; Grzonka, Z.; Hermann, P.: in J. Chem. Soc.
- ↑ Wong, Ming Wah; Leung-Toung, Regis; Wentrup, Curt (1 березня 1993). Tautomeric equilibrium and hydrogen shifts of tetrazole in the gas phase and in solution. Journal of the American Chemical Society. 115 (6): 2465—2472. doi:10.1021/ja00059a048. ISSN 0002-7863.
- ↑ Rażyńska, Anna; Tempczyk, Anna; Maliński, Edmund; Szafranek, Janusz; Grzonka, Zbigniew; Hermann, Peter (1 січня 1983). Application of mass spectrometry to the study of prototropic equilibria in 5-substituted tetrazoles in the gas phase; experimental evidence and theoretical considerations. Journal of the Chemical Society, Perkin Transactions 2 (англ.) (3): 379—383. doi:10.1039/P29830000379. ISSN 1364-5471.
- ↑ Henry, Ronald A.; Finnegan, William G. (1 січня 1954). An Improved Procedure for the Deamination of 5-Aminotetrazole. Journal of the American Chemical Society. 76 (1): 290—291. doi:10.1021/ja01630a086. ISSN 0002-7863.
- ↑ Kurzer, F.; Godfrey, L. E. A. (1963). Syntheses of Heterocyclic Compounds from Aminoguanidine. Angewandte Chemie International Edition in English (англ.). 2 (8): 459—476. doi:10.1002/anie.196304591. ISSN 1521-3773.
- ↑ Greener explosives show promise. Chemistry World. 2 жовтня 2008.
- ↑ Niko Fischer, Konstantin Karaghiosoff, Thomas M. Klapötke and Jörg Stierstorfer (April 2010). New Energetic Materials featuring Tetrazoles and Nitramines – Synthesis, Characterization and Properties. Zeitschrift für Anorganische und Allgemeine Chemie. 636 (5): 735—749. doi:10.1002/zaac.200900521.
- ↑ Tore Brinck, Thomas M. Klapötke and Jörg Stierstorfer (2014). Energetic Tetrazole N-oxides. Energetic Tetrazole N -oxides. с. 133—178. doi:10.1002/9781118676448.ch06. ISBN 9781118676448.
{{cite book}}: Проігноровано|journal=(довідка) - ↑ Nicholas Piekiel; Michael R. Zachariah (2012). Decomposition of Aminotetrazole Based Energetic Materials under High Heating Rate Conditions. J. Phys. Chem. A. 116 (6): 1519—1526. Bibcode:2012JPCA..116.1519P. doi:10.1021/jp203957t. PMID 22214278.

