تترازول
| تترازول | |
|---|---|
 |
|
| الاسم النظامي (IUPAC) | |
1H-Tetrazole |
|
| المعرفات | |
| رقم CAS | 288-94-8 |
| بوب كيم (PubChem) | 67519 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | CH2N4 |
| الكتلة المولية | 70.05 غ/مول |
| المظهر | صلب |
| الكثافة | 1.48 غ/سم3 |
| نقطة الانصهار | 157 °س |
| حموضة (pKa) | 4.90 [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
تترازول هو مركب عضوي حلقي غير متجانس له الصيغة الكيميائية CH2N4، ويكون على شكل صلب أبيض اللون.
يتألف المركب بنيوياً من حلقة خماسية غير مشبعة حاوية على أربع ذرات من النتروجين.
التحضير
[عدل]يحضر المركب من تفاعل حمض الهيدرازويك اللامائي مع سيانيد الهيدروجين تحت الضغط؛ كما يمكن تحضير المشتقات من تفاعل النتريلات العضوية مع أزيد الصوديوم بوجود اليود أو بيكبريتات الصوديوم على السيليكا. كما يمكن تحضير مشتقات الأريل في الموقع 2 من خلال تفاعل [2+3]إضافة حلقية بين أريل ديازونيوم ومركب ثلاثي ميثيل سيليل ديازو الميثان.[4]
كما يمكن أن تتم عملية التحضير من مركب أمينوغوانيدين بالمعالجة مع نتريت الصوديوم:[5][6]
الخواص
[عدل]يوجد المركب في الشروط القياسية على شكل صلب سهل الانحلال في الماء والإيثانول؛ لكنه صعب الانحلال في الإيثر.
يبدي التترازول خواصاً حمضية ضعيفة في المحاليل، وله قيمة pKa ثابت تفكك الحمض (4.89) قريبة من حمض الخليك.[7]
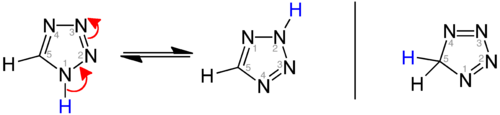
هناك صيغ رنينية من المركب، واحدة منها ضد عطرية (الصورة التي على اليمين):
الاستخدامات
[عدل]يستخدم التترازول ومشتقاته في تحضير الوقود الصاروخي في الصواريخ ذات الوقود الصلب.[8][9]
اقرأ أيضاً
[عدل]المراجع
[عدل]- ^ ا ب ج 1H-Tetrazole (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Satchell, Jacqueline F.؛ Smith, Brian J. (2002). "Calculation of aqueous dissociation constants of 1,2,4-triazole and tetrazole: A comparison of solvation models". Phys. Chem. Chem. Phys. ج. 4 ع. 18: 4314–4318. Bibcode:2002PCCP....4.4314S. DOI:10.1039/b203118c.
- ^ Patouret، Remi؛ Kamenecka، Theodore M. (6 أبريل 2016). "Synthesis of 2-aryl-2H-tetrazoles via a regioselective [3+2] cycloaddition reaction". Tetrahedron Letters. ج. 57 ع. 14: 1597–1599. DOI:10.1016/j.tetlet.2016.02.102. مؤرشف من الأصل في 2019-12-14.
- ^ R.A. Henry, W.G. Finnegan: An Improved Procedure for the Deamination of 5-Aminotetrazole in J. Am. Chem. Soc. 76 (1954) 290–291, دُوِي:10.1021/ja01630a086.
- ^ F. Kurzer, L.E.A. Godfrey: Synthesen heterocyclischer Verbindungen aus Aminoguanidin in Angew. Chem. 75 (1963) 1157–1175, دُوِي:10.1002/ange.19630752303.
- ^ E. Lieber, S.H. Patinkin, H.H. Tao: The Comparative Acidic Properties of Some 5-Substituted Tetrazoles in J. Am. Chem. Soc. 73 (1951) 1792–1795, دُوِي:10.1021/ja01148a111.
- ^ "Greener explosives show promise". Chemistry World. 2 أكتوبر 2008. مؤرشف من الأصل في 2016-03-04.
- ^ Niko Fischer, Konstantin Karaghiosoff, Thomas M. Klapötke and Jörg Stierstorfer (أبريل 2010). "New Energetic Materials featuring Tetrazoles and Nitramines – Synthesis, Characterization and Properties". Zeitschrift für anorganische und allgemeine Chemie. ج. 636 ع. 5: 735–749. DOI:10.1002/zaac.200900521.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)

