WO2014053363A1 - Spaltung von ethern und alkoholen unter verwendung von bor-zeolithen - Google Patents
Spaltung von ethern und alkoholen unter verwendung von bor-zeolithen Download PDFInfo
- Publication number
- WO2014053363A1 WO2014053363A1 PCT/EP2013/069846 EP2013069846W WO2014053363A1 WO 2014053363 A1 WO2014053363 A1 WO 2014053363A1 EP 2013069846 W EP2013069846 W EP 2013069846W WO 2014053363 A1 WO2014053363 A1 WO 2014053363A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- catalyst
- cleavage
- boron
- solid
- isobutene
- Prior art date
Links
- 229910052796 boron Inorganic materials 0.000 title claims abstract description 54
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 title claims abstract description 51
- 150000001298 alcohols Chemical class 0.000 title abstract description 6
- 150000002170 ethers Chemical group 0.000 title abstract description 3
- 239000010457 zeolite Substances 0.000 title description 54
- 238000000354 decomposition reaction Methods 0.000 title 1
- 239000003054 catalyst Substances 0.000 claims abstract description 67
- 238000000034 method Methods 0.000 claims abstract description 60
- BPQQTUXANYXVAA-UHFFFAOYSA-N Orthosilicate Chemical compound [O-][Si]([O-])([O-])[O-] BPQQTUXANYXVAA-UHFFFAOYSA-N 0.000 claims abstract description 14
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 114
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 claims description 108
- VQTUBCCKSQIDNK-UHFFFAOYSA-N Isobutene Chemical compound CC(C)=C VQTUBCCKSQIDNK-UHFFFAOYSA-N 0.000 claims description 105
- 238000003776 cleavage reaction Methods 0.000 claims description 70
- 230000007017 scission Effects 0.000 claims description 67
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 53
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 claims description 46
- 229910001868 water Inorganic materials 0.000 claims description 43
- 239000007787 solid Substances 0.000 claims description 37
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 29
- 230000008569 process Effects 0.000 claims description 27
- 150000003254 radicals Chemical class 0.000 claims description 25
- 238000001354 calcination Methods 0.000 claims description 23
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 19
- -1 alkyl radical Chemical group 0.000 claims description 19
- 239000007789 gas Substances 0.000 claims description 18
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 17
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims description 16
- 229910052782 aluminium Inorganic materials 0.000 claims description 16
- 239000000725 suspension Substances 0.000 claims description 16
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 15
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 15
- 229910052757 nitrogen Inorganic materials 0.000 claims description 14
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 13
- 238000003756 stirring Methods 0.000 claims description 12
- 150000001336 alkenes Chemical class 0.000 claims description 10
- 239000002253 acid Substances 0.000 claims description 9
- 229910052799 carbon Inorganic materials 0.000 claims description 8
- 229910000147 aluminium phosphate Inorganic materials 0.000 claims description 7
- 229910052906 cristobalite Inorganic materials 0.000 claims description 7
- 125000004432 carbon atom Chemical group C* 0.000 claims description 6
- QUPDWYMUPZLYJZ-UHFFFAOYSA-N ethyl Chemical compound C[CH2] QUPDWYMUPZLYJZ-UHFFFAOYSA-N 0.000 claims description 6
- 239000002638 heterogeneous catalyst Substances 0.000 claims description 6
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 claims description 6
- 125000000217 alkyl group Chemical group 0.000 claims description 5
- 239000012298 atmosphere Substances 0.000 claims description 5
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 5
- 238000002955 isolation Methods 0.000 claims description 4
- 239000007900 aqueous suspension Substances 0.000 claims description 2
- 238000005406 washing Methods 0.000 claims description 2
- HNPSIPDUKPIQMN-UHFFFAOYSA-N dioxosilane;oxo(oxoalumanyloxy)alumane Chemical group O=[Si]=O.O=[Al]O[Al]=O HNPSIPDUKPIQMN-UHFFFAOYSA-N 0.000 abstract description 35
- 230000015572 biosynthetic process Effects 0.000 description 37
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 36
- 229910021536 Zeolite Inorganic materials 0.000 description 27
- 238000006243 chemical reaction Methods 0.000 description 27
- 238000003786 synthesis reaction Methods 0.000 description 24
- 238000000926 separation method Methods 0.000 description 18
- 238000000605 extraction Methods 0.000 description 14
- 239000000047 product Substances 0.000 description 13
- 229910000323 aluminium silicate Inorganic materials 0.000 description 12
- 239000011148 porous material Substances 0.000 description 12
- 238000010438 heat treatment Methods 0.000 description 11
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 10
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 10
- 239000012153 distilled water Substances 0.000 description 10
- 229910052710 silicon Inorganic materials 0.000 description 10
- 239000000243 solution Substances 0.000 description 10
- 239000006227 byproduct Substances 0.000 description 9
- 238000004821 distillation Methods 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 235000011007 phosphoric acid Nutrition 0.000 description 9
- 239000010703 silicon Substances 0.000 description 9
- 239000012071 phase Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- NUMQCACRALPSHD-UHFFFAOYSA-N tert-butyl ethyl ether Chemical compound CCOC(C)(C)C NUMQCACRALPSHD-UHFFFAOYSA-N 0.000 description 8
- 238000009833 condensation Methods 0.000 description 7
- 230000005494 condensation Effects 0.000 description 7
- 238000011161 development Methods 0.000 description 7
- 230000018109 developmental process Effects 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 230000002378 acidificating effect Effects 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- IAQRGUVFOMOMEM-UHFFFAOYSA-N but-2-ene Chemical compound CC=CC IAQRGUVFOMOMEM-UHFFFAOYSA-N 0.000 description 6
- 150000001875 compounds Chemical class 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- FXNDIJDIPNCZQJ-UHFFFAOYSA-N 2,4,4-trimethylpent-1-ene Chemical compound CC(=C)CC(C)(C)C FXNDIJDIPNCZQJ-UHFFFAOYSA-N 0.000 description 5
- FVNIMHIOIXPIQT-UHFFFAOYSA-N 2-methoxybutane Chemical compound CCC(C)OC FVNIMHIOIXPIQT-UHFFFAOYSA-N 0.000 description 5
- 238000010306 acid treatment Methods 0.000 description 5
- 238000002425 crystallisation Methods 0.000 description 5
- 230000008025 crystallization Effects 0.000 description 5
- 229930195733 hydrocarbon Natural products 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 150000004760 silicates Chemical class 0.000 description 5
- KAKZBPTYRLMSJV-UHFFFAOYSA-N Butadiene Chemical compound C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 4
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- 238000005661 deetherification reaction Methods 0.000 description 4
- 238000001027 hydrothermal synthesis Methods 0.000 description 4
- 239000012535 impurity Substances 0.000 description 4
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 239000004215 Carbon black (E152) Substances 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 229910004298 SiO 2 Inorganic materials 0.000 description 3
- 235000019647 acidic taste Nutrition 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 3
- 150000001768 cations Chemical class 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000012065 filter cake Substances 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 230000004992 fission Effects 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- 239000007791 liquid phase Substances 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 229910052680 mordenite Inorganic materials 0.000 description 3
- MWUXSHHQAYIFBG-UHFFFAOYSA-N nitrogen oxide Inorganic materials O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 3
- 230000006911 nucleation Effects 0.000 description 3
- 238000010899 nucleation Methods 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- 238000011085 pressure filtration Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000007086 side reaction Methods 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 229910052665 sodalite Inorganic materials 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- HVZJRWJGKQPSFL-UHFFFAOYSA-N tert-Amyl methyl ether Chemical compound CCC(C)(C)OC HVZJRWJGKQPSFL-UHFFFAOYSA-N 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- MYRTYDVEIRVNKP-UHFFFAOYSA-N 1,2-Divinylbenzene Chemical compound C=CC1=CC=CC=C1C=C MYRTYDVEIRVNKP-UHFFFAOYSA-N 0.000 description 2
- LAAVYEUJEMRIGF-UHFFFAOYSA-N 2,4,4-trimethylpent-2-ene Chemical compound CC(C)=CC(C)(C)C LAAVYEUJEMRIGF-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- 229920002367 Polyisobutene Polymers 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 125000005233 alkylalcohol group Chemical group 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000004327 boric acid Substances 0.000 description 2
- 229920005549 butyl rubber Polymers 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 150000001767 cationic compounds Chemical class 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 238000005336 cracking Methods 0.000 description 2
- 230000007547 defect Effects 0.000 description 2
- 230000018044 dehydration Effects 0.000 description 2
- 238000006297 dehydration reaction Methods 0.000 description 2
- 238000001212 derivatisation Methods 0.000 description 2
- NKDDWNXOKDWJAK-UHFFFAOYSA-N dimethoxymethane Chemical compound COCOC NKDDWNXOKDWJAK-UHFFFAOYSA-N 0.000 description 2
- XNMQEEKYCVKGBD-UHFFFAOYSA-N dimethylacetylene Natural products CC#CC XNMQEEKYCVKGBD-UHFFFAOYSA-N 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 239000001282 iso-butane Substances 0.000 description 2
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 238000006384 oligomerization reaction Methods 0.000 description 2
- 150000002894 organic compounds Chemical class 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- 239000010453 quartz Substances 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 239000012429 reaction media Substances 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- SCPYDCQAZCOKTP-UHFFFAOYSA-N silanol Chemical compound [SiH3]O SCPYDCQAZCOKTP-UHFFFAOYSA-N 0.000 description 2
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical class O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000011949 solid catalyst Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 150000003460 sulfonic acids Chemical class 0.000 description 2
- LPSKDVINWQNWFE-UHFFFAOYSA-M tetrapropylazanium;hydroxide Chemical compound [OH-].CCC[N+](CCC)(CCC)CCC LPSKDVINWQNWFE-UHFFFAOYSA-M 0.000 description 2
- 239000010936 titanium Substances 0.000 description 2
- 229910052719 titanium Inorganic materials 0.000 description 2
- 238000003828 vacuum filtration Methods 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- WSWCOQWTEOXDQX-MQQKCMAXSA-M (E,E)-sorbate Chemical compound C\C=C\C=C\C([O-])=O WSWCOQWTEOXDQX-MQQKCMAXSA-M 0.000 description 1
- LQBZMLRJLRSDNW-ONEGZZNKSA-N (e)-1-methoxybut-2-ene Chemical compound COC\C=C\C LQBZMLRJLRSDNW-ONEGZZNKSA-N 0.000 description 1
- UPOMCDPCTBJJDA-UHFFFAOYSA-N 2-methyl-1-[(2-methylpropan-2-yl)oxy]propane Chemical compound CC(C)COC(C)(C)C UPOMCDPCTBJJDA-UHFFFAOYSA-N 0.000 description 1
- FITVQUMLGWRKKG-UHFFFAOYSA-N 2-methyl-2-propoxypropane Chemical compound CCCOC(C)(C)C FITVQUMLGWRKKG-UHFFFAOYSA-N 0.000 description 1
- OHXAOPZTJOUYKM-UHFFFAOYSA-N 3-Chloro-2-methylpropene Chemical compound CC(=C)CCl OHXAOPZTJOUYKM-UHFFFAOYSA-N 0.000 description 1
- MALHZSOXIOUUQH-UHFFFAOYSA-N 3-methoxybut-1-ene Chemical compound COC(C)C=C MALHZSOXIOUUQH-UHFFFAOYSA-N 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- NIPNSKYNPDTRPC-UHFFFAOYSA-N N-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 NIPNSKYNPDTRPC-UHFFFAOYSA-N 0.000 description 1
- 229920005372 Plexiglas® Polymers 0.000 description 1
- 239000012494 Quartz wool Substances 0.000 description 1
- 229910004283 SiO 4 Inorganic materials 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 1
- AYHOQSGNVUZKJA-UHFFFAOYSA-N [B+3].[B+3].[B+3].[B+3].[O-][Si]([O-])([O-])[O-].[O-][Si]([O-])([O-])[O-].[O-][Si]([O-])([O-])[O-] Chemical compound [B+3].[B+3].[B+3].[B+3].[O-][Si]([O-])([O-])[O-].[O-][Si]([O-])([O-])[O-].[O-][Si]([O-])([O-])[O-] AYHOQSGNVUZKJA-UHFFFAOYSA-N 0.000 description 1
- 239000013466 adhesive and sealant Substances 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910001420 alkaline earth metal ion Inorganic materials 0.000 description 1
- 150000005215 alkyl ethers Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 150000001540 azides Chemical class 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229910052790 beryllium Inorganic materials 0.000 description 1
- 238000009529 body temperature measurement Methods 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 239000000571 coke Substances 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 239000007859 condensation product Substances 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 208000012839 conversion disease Diseases 0.000 description 1
- 239000000498 cooling water Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000002178 crystalline material Substances 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 238000007700 distillative separation Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000011143 downstream manufacturing Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000012013 faujasite Substances 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 239000002816 fuel additive Substances 0.000 description 1
- 239000003517 fume Substances 0.000 description 1
- 238000004817 gas chromatography Methods 0.000 description 1
- 238000010574 gas phase reaction Methods 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 239000002815 homogeneous catalyst Substances 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229910001411 inorganic cation Inorganic materials 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000009434 installation Methods 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 239000003879 lubricant additive Substances 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000001457 metallic cations Chemical class 0.000 description 1
- VUZPPFZMUPKLLV-UHFFFAOYSA-N methane;hydrate Chemical compound C.O VUZPPFZMUPKLLV-UHFFFAOYSA-N 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 150000002892 organic cations Chemical class 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 238000002459 porosimetry Methods 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 239000003079 shale oil Substances 0.000 description 1
- 238000005029 sieve analysis Methods 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 229940075554 sorbate Drugs 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- BGQMOFGZRJUORO-UHFFFAOYSA-M tetrapropylammonium bromide Chemical compound [Br-].CCC[N+](CCC)(CCC)CCC BGQMOFGZRJUORO-UHFFFAOYSA-M 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- GPPXJZIENCGNKB-UHFFFAOYSA-N vanadium Chemical compound [V]#[V] GPPXJZIENCGNKB-UHFFFAOYSA-N 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C1/00—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon
- C07C1/20—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only oxygen atoms as heteroatoms
- C07C1/24—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only oxygen atoms as heteroatoms by elimination of water
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J29/00—Catalysts comprising molecular sieves
- B01J29/86—Borosilicates; Aluminoborosilicates
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/40—Catalysts, in general, characterised by their form or physical properties characterised by dimensions, e.g. grain size
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/61—Surface area
- B01J35/615—100-500 m2/g
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/63—Pore volume
- B01J35/635—0.5-1.0 ml/g
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/64—Pore diameter
- B01J35/643—Pore diameter less than 2 nm
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/64—Pore diameter
- B01J35/647—2-50 nm
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/66—Pore distribution
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/06—Washing
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C1/00—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon
- C07C1/20—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only oxygen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/09—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis
- C07C29/10—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis of ethers, including cyclic ethers, e.g. oxiranes
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2229/00—Aspects of molecular sieve catalysts not covered by B01J29/00
- B01J2229/30—After treatment, characterised by the means used
- B01J2229/37—Acid treatment
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2229/00—Aspects of molecular sieve catalysts not covered by B01J29/00
- B01J2229/30—After treatment, characterised by the means used
- B01J2229/40—Special temperature treatment, i.e. other than just for template removal
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2529/00—Catalysts comprising molecular sieves
- C07C2529/86—Borosilicates; Aluminoborosilicates
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Definitions
- the present invention relates to a process for the cleavage of alkyl tert-alkyl ethers in the presence of a heterogeneous catalyst containing at least one boron-containing silicate of zeolitic structure. Furthermore, the invention relates to an analogous process for the cleavage of tertiary alkyl alcohols.
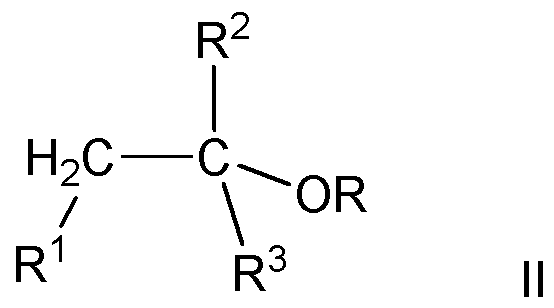
- Alkyl tert-alkyl ethers are compounds of the formula II
- radical R is an alkyl radical having 1 or 2 carbon atom (s)
- radical R 1 is H, methyl or ethyl radical
- radicals R 2 and R 3 are methyl or ethyl radicals, wherein the radicals R 2 and R 3 may be the same or different.
- ATAE substance class methyl tert-butyl ether (MTBE), ethyl tert-butyl ether (ETBE) and tert-amyl methyl ether (TAME).
- MTBE methyl tert-butyl ether
- ETBE ethyl tert-butyl ether
- TAME tert-amyl methyl ether
- Olefins also called alkenes, are unsaturated hydrocarbons of the formula I.
- radical R is an alkyl radical having 1 or 2 carbon atom (s)
- the radical R 1 is H, methyl or ethyl radical and the radicals R 2 and R 3 are methyl or ethyl radicals, wherein the radicals R 2 and R 3 may be the same or different.
- Isobutene is an olefin in the sense of this definition.
- Alcohol in the context of the invention is a compound of formula III R-OH III wherein the radical R is an alkyl radical having 1 or 2 carbon atom (s).
- alcohols examples include methanol and ethanol.
- TAO Tert-alkyl alcohols
- radical R is H
- radical R 1 is H
- radicals R 2 and R 3 are methyl or ethyl radicals, wherein the radicals R 2 and R 3 may be the same or different.
- TAO tert-butanol
- the olefin isobutene is a valuable raw material for the production of a variety of organic compounds in the chemical industry. It is used for the production of butyl rubbers in the tire industry and for the production of
- Polyisobutene a precursor for, among others, lubricant and fuel additives as well as adhesives and sealants.
- isobutene is used as alkylating agent, in particular for the synthesis of tertiary butyl aromatics and as an intermediate for the production of peroxides.
- isobutene can be used as a precursor for methacrylic acid and its esters. As an example, here is
- Methyl methacrylate which is used for the production of Plexiglas®. Further products of isobutene are branched C 5 -aldehydes, -carboxylic acids, -alcohols and C 5 -olefins. Isobutene thus represents a high added value with increasing demand on the world market. The decisive factor for many applications is the chemical purity of isobutene; purities of up to 99.9% are required here.
- the raw material isobutene is obtained in light gasoline fractions, the C 4 fractions from the FCC units or from the steam crackers of the refineries and is thus present in a mixture with other alkenes and saturated hydrocarbons having the same carbon atom number.
- the butadiene which constitutes about 50% of the C 4 fraction, is separated off by extractive rectification or converted by selective hydrogenation to form linear butenes.
- the remaining mixture known as raffinate 1
- raffinate 1 consists of up to 50% isobutene.
- Other essential components of raffinate 1 are n-butane, isobutane, 1-butene, 2-butene. Due to the almost identical physical properties of isobutene and 1-butene, an economical separation of the isobutene by distillation or extraction method is not possible.
- Derivatizing agent can be cleaved. Important processes here are the reactions with water to terf-butanol and with methanol to MTBE. After the Hüls process, MTBE synthesis is acid catalyzed in the liquid phase
- Ion exchangers such as sulfonated
- Copolymers of styrene and divinylbenzene are used here as a heterogeneous catalyst. Following the synthesis, MTBE can be removed from the C 4 cut in a next process step due to the large differences in the
- Methanol can be recirculated to the MTBE synthesis.
- the existing plants for C 4 treatment and MTBE synthesis can thus be extended by the process step of MTBE fission.
- An analogous process is possible in the derivatization with water to tert-butanol.
- TAO water H 2 O
- cleavage of TAO water occurs as a by-product instead of the alcohol according to formula III.
- the cleavages of ATAE or TAO are endothermic equilibrium reactions.
- the thermodynamic equilibrium thus shifts with increasing temperature in the direction of the cleavage products.
- An increase in pressure causes a shift in the chemical equilibrium in the direction of the educt.
- the cleavage can be carried out both homogeneously in the liquid phase and heterogeneously catalyzed in the gas phase. Due to the low stability of the homogeneous catalysts and the lower equilibrium conversions in the liquid phase, the
- Vapor pressures of the expected components in the reaction medium aimed at saving costs for the compression of the gases in the downstream processing and at the same time be able to realize a condensation with cooling water.
- the cleavage of both MTBE and TBA occurs in the presence of an acidic catalyst.
- Amorphous or crystalline aluminosilicates as well as modified aluminosilicates are the subject of numerous publications. When using aluminosilicates usually reaction temperatures of 150 to 300 ° C and pressures of 1 to 7 bar are driven. Many patents claim amorphous or crystalline ones
- Alumosilicates which have a proportion of 0.1 to 80% aluminum and thus reach at conversions of 98% selectivities with respect to isobutene or methanol of up to 99.8% and 99.2%, respectively.
- metal oxides of moderately electronegative elements such as magnesium, titanium, vanadium, chromium, iron, cobalt, manganese, nickel, zirconium and boron, are patented for ether cleavage.
- doping of the aluminosilicates with the metal oxides mentioned can be carried out to influence the acidity of the catalyst.
- Zeolites are hydrated crystalline aluminosilicates with a three-dimensional
- the zeolite framework usually forms a highly ordered
- Molecular diameters are due to the particular suitability of zeolites as selective adsorbents, for which the term "molecular sieves" has been established.
- IZA has included a nomenclature in the "Atlas of Zeolite Structure Types" based on the topology of the
- zeolites Host framework, proposed and approved by the IUPAC. Thus, most synthetic zeolites are named by the combination of a three-letter structure code. Examples include the structural types SOD (sodalite), LTA (zeolite A), MFI (pentasil zeolite), FAU (zeolite X, zeolite Y, faujasite), BEA (zeolite beta) and MOR (mordenite).
- Structure-type zeolites MFI are so-called “medium-pore” zeolites, an advantage of this type of structure being the uniformity compared to the "narrow-pore” structural types (SOD, LTA) and “wide-pore” structural types (FAU, BEA, MOR) Channel Structure
- the MFI type of structure belongs to the series of crystalline, microporous aluminosilicates and is exceptionally shape-selective and temperature-stable, but also highly azide zeolite, but the use of strongly acidic zeolites as catalysts for the MTBE cleavage can, as already stated , lead to a collapse of isobutene selectivities.
- boron zeolites as a catalyst in the cleavage of ATAE or specifically MTBE:
- DE2953858C2 describes the use of "boronites" as catalysts in the MTBE cleavage, which are double oxides of silicon and boron with a porous crystalline structure, which are boron-modified silicic acids and have a zeolitic structure to the structural type of this Boralite.
- boronites as catalysts in the MTBE cleavage, which are double oxides of silicon and boron with a porous crystalline structure, which are boron-modified silicic acids and have a zeolitic structure to the structural type of this Boralite.
- the preparation takes place under hydrothermal conditions at a pH of 9 to 14.
- EP0284677A1 discloses a process for preparing a catalyst for cracking nitrogen-containing oil, such as shale oil, based on a boron-containing crystalline material of zeolitic structure.
- Possible zeolite structures are ZSM-5, ZSM-1 1, ZSM-12, beta and Nu-1. The production takes place in a basic environment. The suitability of these catalysts for MTBE or TBA cleavage is not described.
- the object of the invention is to provide a method for the cleavage of ATBE or TAO, which, in addition to a highly active cleavage of the ether, simultaneously high selectivities to the
- a common subject of the invention is therefore a process for the cleavage of an alkyl tertiary alkyl ether or of tertiary alkyl alcohol of the formula II
- radical R is an alkyl radical having 1 or 2
- radical R 1 is H, methyl or ethyl radical and the radicals R 2 and R 3 are methyl or ethyl radicals, wherein the radicals R 2 and R 3 may be the same or different which is carried out in the presence of a heterogeneous catalyst containing at least one boron-containing silicate zeolitic structure of the MFI type.
- Essential to the invention is the use of boron-containing silicates zeolitic structure of the MFI type as a catalyst.
- Silicates are the salts and esters of orthosilicic acid Si (OH) and their
- a "boron-containing silicate”("boronsilicate” for short) within the meaning of this invention is a silicate containing boron in oxidic form.
- zeolitic structure is to be understood as meaning a morphology corresponding to the zeolites, and the term “zeolite-analogue” is used synonymously.
- zeolites belong to the group of aluminosilicates, ie silicates containing aluminum in oxidic form. Since the boron silicates described here in terms of their morphology the In the following, they are also referred to as "boron zeolites.” However, the use of the term “boron zeolite” does not mean that this material must necessarily contain aluminum. Preferred are
- boron zeolites according to the invention even impurities or trace constituents - even free of aluminum.
- the boron zeolite used according to the invention proves to be an active and selective catalyst for the cleavage of MTBE in isobutene and methanol.
- the result is a process for the production of isobutene by cleavage of MTBE, which has up to 90% conversion at negligible oligomerization rates (up to 0.01% Cs selectivity) and the lowest observed DME selectivities (up to 0.2%).
- the cleavage reaction is carried out on a heterogeneous catalyst containing at least one boron silicate, the catalyst being obtainable by the following steps: Providing an aqueous suspension containing at least one
- boron zeolites of the structural type MFI are used, since they bring many advantages. It has been found that the acidity of a zeolite can be influenced by incorporation of heteroatoms into the silicon skeleton as follows:
- a boron-containing zeolite is a much less acidic zeolite than a zeolite containing only aluminum and silicon. This is not expected as boron has a higher electronegativity than aluminum.
- the Si / B ratio can be varied over a wide range and thus offers many possibilities for adjusting the catalytic properties.
- zeolites of the structural type MFI have a uniform channel structure and are thus characterized as extremely form-selective and temperature-stable. Presumably due to the small dimensioning zeolites of this type of structure are also particularly resistant to coke.
- the boron zeolite used according to the invention is not a zeolite in the strict sense, since it contains no aluminum. It is preferably free of aluminum or it has at most in the form of impurities. An aluminum contamination is tolerable if the content of aluminum is below 0.1 wt .-%.
- the boron content of the catalyst is less than 1% by weight.
- An increased boron content could favor by-product formation.
- the boron content is even below 0.5 wt .-%, most preferably about 0.3 wt .-%.
- the boron zeolite provided still has an excessive boron content, it can be reduced by the acid treatment. Boron is very easy to wash out with acid in comparison to AI. So it has been possible to reduce the boron content of a boron zeolite of 1 wt .-% in the unmodified state by acid treatment to about 0.1% by weight.
- the boron-containing silicate provided in the suspension should have a boron content in the specified range at least after the acid treatment.
- Catalyst has a surface measured by BET between 300 m 2 / g and 500 m 2 / g, preferably between 330 and 470 m 2 / g, more preferably between 370 and 430 m 2 / g.
- hydrothermal synthesis is a preferred method for the synthesis of the zeolites used in the process according to the invention. Further routes to zeolite synthesis are conceivable.
- the educts, which are essential for zeolite synthesis, can be divided into the following four categories: source of T atoms (boron, or
- Silicon source Silicon source
- template Silicon source
- mineralizer mineralizer
- Silicon sources that are commonly used in zeolite synthesis are
- Alkalimetasilicate Common boron sources are boric acid or alkali borates.
- the template compounds have structure-directing properties and stabilize the resulting zeolite structure during the synthesis.
- Templates are usually one or polyvalent inorganic or organic cations.
- bases NaOH
- salts NaCl
- acids HF
- Organic compounds which are suitable for zeolite syntheses are, in particular, alkyl or arylammonium hydroxides.
- the mineral isator catalyzes the formation of the transition states needed for nucleation and crystal formation. This is done by solution, precipitation or
- the mineralizer increases the solubility and thus the concentration of the components in the solution.
- a mineralizer can be any mineralizer.
- Hydroxide ions are used, whereby the ideal pH for the zeolite synthesis can be adjusted. With the increase in OH concentration occurs
- Solvent which is often used in zeolite synthesis, is water.
- the reactive T-atom sources, the mineralizer, the template and the water are mixed to form a suspension.
- the molar composition of the synthesis gel is the most important factor for influencing the reaction products:
- M and N are alkali metal or alkaline earth metal ions and R is an organic template.
- the suspension is transferred to an autoclave and is exposed to alkaline conditions, autogenous pressure and temperatures of 100 to 250 ° C for a few hours to several weeks. Under hydrothermal conditions, there is a supersaturation of the synthesis solution, which initiates the nucleation and the subsequent crystal growth. In addition to the nucleation are in the
- crystallization time depends inter alia on the zeolite structure. In the case of zeolites of the structural type MFI, crystallization is concluded after 36 hours.
- the template is removed by calcination in the air stream at 400 to 600 ° C.
- the organics are burned to carbon dioxide, water and nitrogen oxides.
- an acid treatment is carried out with a reduction of the boron content. This leads to an increase in the activity of the zeolites or to the selective production of desired active centers. In addition, additional stabilization of the scaffold is observed.
- the acid treatment the use of hydrochloric acid, phosphoric acid,
- Sulfuric acid, acetic acid, nitric acid and oxalic acid possible.
- the degree of reduction of the boron content depends primarily on the acid used, its concentration and the temperature of the treatment.
- hydrochloric acid and phosphoric acid unlike sulfuric acid and nitric acid, extract boron even at low concentrations.
- the adjustment of the pH is therefore carried out by adding hydrochloric acid or phosphoric acid.
- stirring of the suspension takes place advantageously at a maximum of 80 ° C. preferred
- the duration of the stirring is at least 6 hours, preferably from
- stirring times can be up to about 36 hours.
- the isolation of the solid can be done by any method. Depending on the particle size, the vacuum or overpressure filtration is suitable.
- the solid may optionally be repeatedly washed with water in a further step. It is possible that the generated defects in the framework are annealed at high calcination temperatures by silanol condensation to form a cristobalite.
- the calcination of the solid takes place preferably at a temperature of at most 500 ° C, more preferably of at most 400 ° C, more preferably of at most 350 ° C.
- the calcination of the solid can be carried out in principle in the air stream.
- Development of the present invention thus consists in that the calcination of the solid takes place in the air stream.
- nitrogen-containing atmosphere is to be understood as a gas or gas mixture containing nitrogen in
- the calcination can therefore be carried out in the presence of molecular nitrogen gas (N 2 ) or in the presence of a gas containing, in addition to nitrogen, other types of molecules, such as hydrogen (H 2 ).
- N 2 molecular nitrogen gas
- H 2 hydrogen
- the solid obtained may, after cooling to room temperature, optionally be washed several times with distilled water. Finally, the calcination in nitrogen flow or
- the solid is immersed in standing methanol or overflowed by flowing methanol.
- the methanol can be liquid, gaseous or mixed liquid / gaseous in both cases.
- the treatment of the solid with methanol causes a reduction in the initial activity of the catalyst, which has proven to be advantageous in industrial use.
- the methanol treatment of the boron-silicate-based catalyst is analogous to the methanol treatment of aluminosilicate-based catalysts, which is described in the German patent application DE102012215956 still unpublished at the time of application. The content of this application is expressly incorporated herein by reference.
- the solid may also be treated with another preferably monohydric alcohol, such as ethanol.
- Contaminants or trace constituents - used aluminum-free catalyst having a molar ratio S1O2 / B2O3 of about 3, a boron content below 0.5 wt .-% and a surface area measured by BET of about 405 m 2 / g and its preparation according to
- the pH is adjusted by addition of hydrochloric acid or phosphoric acid, stirring of the suspension at a temperature between 20 and 80 ° C for a period of at least 24 hours and the isolation of the solid by vacuum filtration or pressure filtration, the Solid is washed with water and the calcination of the solid is carried out at a temperature of at most 350 ° C in pure nitrogen flow or in the air stream.
- the pore volume of the catalyst is preferably from 0.5 to 1.3 ml / g, preferably from 0.65 to 1.1 ml / g.
- the average pore diameter (preferably determined in accordance with DIN 66133) of the catalyst is preferably from 5 to 20 nm, preferably from 8 to 15 nm. More preferably at least 50%, preferably more than 70%, of the catalyst is used Total pore volume (sum of the pore volume of the pores having a pore diameter greater than or equal to 3.5 nm determined by mercury porosimetry according to DIN 66133) of the catalyst on pores having a diameter of 3.5 to 50 nm (mesopores).
- solid catalysts are used which have a mean particle size d50, from 2 to 4 mm, in particular from 3 to 4 mm.
- the catalyst can be used as a shaped body.
- the moldings can take any shape.
- the catalyst can be used as a shaped body.
- the shape of body preferably have the above mean grain sizes.
- the catalyst described is suitable for cleaving any ATAE and TAO.
- the use as a cracking catalyst for MTBE and TBA is particularly preferred.
- MTBE is therefore cleaved to isobutene and methanol or TBA to isobutene and water.
- the cleavage of the MTBE in the gas phase in the temperature range of 120 to 400 ° C, in particular 180 to 350 ° C, and at pressures of 0.1 to 2 MPa (abs), especially at pressures of 0.3 to 1 MPa (abs), completely especially at pressures of 0.5 to 0.8 MPa (abs).
- the cleavage of MTBE into isobutene and methanol is an endothermic reaction, meaning that the reaction mixture cools during the reaction.
- the reactor is preferably operated in such a way that no partial condensation of MTBE and products on the catalyst takes place under the selected pressure conditions.
- the reactor is operated so that the minimum temperature in the reactor at any point of the catalyst bed greater than 150 ° C, most preferably greater 200 ° C is.
- the maximum temperature drop can be adjusted by numerous parameters, such as the temperature of the heat carrier used for heating and by the speed at which the heat carrier flows through the jacket.
- the temperature profile in the catalyst bed by a
- the reactor is preferably operated at a space velocity (weight hourly space velocity (WHSV) in kilograms of starting material per kilogram of catalyst per hour) from 0.1 to 5 h -1 , in particular from 1 to 3 h -1 in a single pass.
- space velocity weight hourly space velocity (WHSV) in kilograms of starting material per kilogram of catalyst per hour
- Educt for the process according to the invention is MTBE. This is preferably from an MTBE synthesis in which in a C 4 hydrocarbon mixture
- Preferred reactors are tubular reactors or tube bundle reactors
- reaction medium and heat transfer medium are conducted in cocurrent, particularly preferably from top to bottom, through the tractor tubes or the reactor jacket.
- Embodiment is described for example in DE102006040433A1.
- plate reactors can be used to carry out the cleavage reaction. Plate reactors are analogous to
- the distance between the plates, between which the catalyst is located is preferably 10-80 mm.
- cleavage of MTBE side reactions occur. These are due either to MTBE or the cleavage products isobutene and methanol.
- DME dimethyl ether
- Two molecules of methanol react to form DME and water.
- Dimerization of isobutene consist mainly of a mixture of 2,4,4-trimethylpentene-1 and 2,4,4-trimethylpentene-2. In general, to a lesser extent, the formation of more
- the isobutene obtained in the MTBE cleavage is present in the reaction mixture with methanol and further by-products and must be isolated from it for further use. This is preferably done by distillation: In the distillation of the cleavage product, isobutene will be obtained as low boilers further C 4 hydrocarbons (1-butene, 2-butenes) and DME. Isoprene and dimethoxymethane are examples of medium boilers with boiling points between MTBE and those of the C4 hydrocarbons.
- the intermediate boilers are formed in part in the reaction or arrive as impurities via the feed into the cleavage. As high boilers, ie components with a higher boiling point than MTBE, terf.-butanol, diisobutene and 2-methoxybutane are included, for example.
- isobutene grades are usually virtually free of methanol.
- the obtained in the distillative separation of the cleavage products Isobutenstrom still contains methanol. This can according to known methods, for example by
- Extraction to be separated.
- the extraction of methanol from the isobutene can, for example, with water or an aqueous solution as extractant z. B. be carried out in an extraction column.
- the extraction is carried out with water or an aqueous solution in an extraction column, which preferably has 4 to 16 theoretical plates.
- the extractant preferably flows countercurrently through the extraction column with respect to the stream to be extracted.
- the extraction is preferably carried out at a temperature of 15 to 50 ° C, preferably 25 to 40 ° C.
- Methanol content of less than 10 ppm can be obtained.
- the obtained during the extraction of methanol-containing water extract can be separated by distillation in water and methanol.
- the water can be recycled as an extraction agent in the extraction stage.
- the methanol is preferably recycled to an MTBE synthesis prior to MTBE cleavage.
- the humid Isobutenstrom from the extraction column can in one or more further distillation columns by separation of water and optionally DME to be worked up dry isobutene.
- the dry isobutene is called as
- liquid can be withdrawn after a phase separation and DME can be withdrawn liquid and / or gaseous with residual amounts of isobutene.
- DME can be withdrawn liquid and / or gaseous with residual amounts of isobutene.
- Distillation column preferably has from 30 to 80 theoretical plates, preferably from 40 to 65 theoretical plates.
- the reflux ratio is, depending on the number of stages realized and the required purity of the isobutene, preferably less than 60, preferably less than 40.
- the operating pressure of the column can preferably be set between 0.1 and 2.0 MPa (abs).
- the DME-rich stream obtained at the top of the column may, if necessary, be separated further by distillation.
- Decanters in the side stream of the column isobutene losses can be minimized.
- Such a method is for example also in the application DE10238370
- the moist Isobutenstrom from the extraction is thereby, optionally after separation of residual heterogeneous water, for example by a decanter or coalescer, fed into a column.
- DME is obtained at the top of the column and dry isobutene in the bottom.
- Eduktein horrin is a side stream taken from the column liquid, which is passed into a decanter.
- the aqueous phase is separated from the water-depleted organic phase.
- the water is discharged, the
- the column preferably has a separation stage number of 30 to 80
- the isobutene to be purified is preferably above the 15 to 30 separation stage, respectively counted from above, fed.
- two to five separation stages are withdrawn above the feed point, the entire condensate this separation stage and passed into the decanter. After separation of the water, the organic phase is recycled one to two separation stages deeper into the column.
- the reflux ratio of the column is, depending on the realized
- Step number and the required purity of the isobutene preferably less than 60, preferably less than 40.
- the operating pressure of the column is preferably between 0.1 and 2.0 MPa (abs), more preferably between 1 .0 and 1 .5 MPa (abs).
- linear butenes (1-butene, 2-butenes) contained in isobutene can not be separated from this technically useful.
- the formation of the linear butenes takes place inter alia from the cleavage of 2-methoxybutane, which may be contained in the MTBE. Therefore, by complete separation of 2-methoxybutane prior to cleavage, formation of the linear butenes can be avoided.
- the isobutene prepared by the process according to the invention can, for. B. for
- Methallylsulfonaten be used.
- the procedure for the MTBE cleavage made in the process according to the invention can also be applied to the use of other alcohols. This applies above all to the synthesis and cleavage of ethyl-tert-butyl ether (use of ethanol as alcohol), n-propyl-tert-butyl ether (use of n-propanol as alcohol), n-butyl terf.- butyl ether (use of n-butanol as alcohol) and iso-butyl tert-butyl ether (use of isobutanol as alcohol). All these alcohols are also added to them the cleavage can be formed by elimination of water olefins, whereby an additional entry of water in the process takes place.
- Tert-butanol is preferably cleaved in the gas phase into isobutene and water, more preferably under these operating conditions: a) temperature of 120 ° C to 400 ° C, preferably 180 ° C to 350 ° C;
- WHSV space velocity
- the catalyst used in TAO cleavage can be prepared in the same manner as the catalyst described for ATBE cleavage.
- the remaining filter cake is washed repeatedly with distilled water and then calcined.
- the calcination of the solid takes place in a muffle furnace in a stream of nitrogen (200 ml / min).
- the heating rate is 1 ° C / min, the final temperature of 500 ° C is held for five hours.
- TPABr tetrapropylammonium bromide
- 4 g of H 3 BO 3 and 524 g of distilled water are processed to form a suspension in a beaker. It turns a pH of 12.57.
- the synthesis solution is transferred to a stirred reactor and stirred for 24 hours at 165 ° C under autogenous pressure. After hydrothermal synthesis, the solid is recovered in the suspension via positive pressure filtration. The remaining filter cake is washed repeatedly with distilled water and then calcined.
- the calcination of the solid takes place in a muffle furnace in a stream of air (200 ml / min). The heating rate is 1 ° C / min, the final temperature of 450 ° C is held for eight hours.
- For ion exchange 5 g of the fine powder in three passes for two hours at room temperature with a solution consisting of 0.1 molar NH Cl and 1 molar NH 4 OH, treated. With constant stirring, a pH between 10 and 1 1 is established. After completion of the ion exchange, the solid is separated again via an overpressure filtration of the suspension.
- the filter cake with 1 molar NH OH is subjected to a diffusion wash.
- the recovered solid is calcined in a muffle furnace in a stream of air (200 ml / min) (heating rate: 1 ° C / min, final temperature: 450 ° C, duration: 8 hours).
- Example 1 3 g of the solid prepared according to Variant 2 are transferred with 300 ml of distilled water into a double-walled container made of glass. This is followed by the addition of 0.01 molar HCl, so that depending on the objective pH values of 1 to 5 can be adjusted. The solution is applied using a magnetic stirrer over the entire
- Heat transfer oil ethylene glycol
- the suspension is cooled to ambient temperature and filtered depending on particle size via vacuum or overpressure filtration.
- the solid obtained from this is repeatedly washed with distilled water and calcined in a final step in a muffle furnace in nitrogen or air stream (200 ml / min) at 350 ° C (heating rate: 7 ° C / min) for 5 hours.
- the reaction components are from separate templates quantity or
- reaction products operated under pressure control via an evaporator on the catalyst beds.
- the analysis of the reaction products is carried out by means of online gas chromatography.
- Table 1 compares the selectivities for conversions by 88%, in Table 2 for conversions by 98%, in both tables the catalysts according to the invention are marked with * .
- Mass flow controller FIC-101 a LIQUI-FLOW® from Bronkhorst.
- the mass flow controllers, EL-FLOW® (Bronkhorst), FIC-102 and FIC-103, are used to dilute the starting material or to flush the equipment.
- the educt current secured by a non-return valve reaches the electrically heated evaporator.
- the evaporator is a tube made of stainless steel (200 mm x 20 mm), which is filled with 3 mm glass balls. Here is the desired
- Reaction temperature set This temperature is maintained after the evaporator to online analytics via electrical heating of the main streams.
- the educt is after the evaporator via a distribution system, the so-called Manifold the company VICI®, equipped with restrictors uniformly divided into twelve streams.
- the restrictors also called flow restrictors, which have a length of 200 mm and an inside diameter of 0.1 mm, are designed so that the
- the output lines of the reactors are bundled led to a switching valve. It is a 12-port switching valve from VICI®, which allows the selection of a stream from a reactor and the subsequent supply to the on-line gas chromatograph.
- the remaining eleven gas streams are combined and directed into the exhaust gas purification.
- high boilers are condensed out via a Liebig condenser and disposed of via the solvent waste.
- the low boilers are sufficiently diluted with nitrogen and fed to the exhaust pipe in the fume hood. Since the reaction is tested at different pressures, an electronic pressure sensor PIC-102, EL-PRESS® (Bronkhorst), is used to continuously control the pressure in the plant.
- HP 6890 Gas Chromatographs (HP 6890) equipped with a Flame Ionization Detector (FID).
- the separating column used is an Agilent HP-1 methylsiloxane column (length: 15 m, thickness: 0.25 mm, film thickness: 1 ⁇ m) with Agilent HP-AL / S downstream (length: 30 m, thickness: 0.25 mm, film thickness: 5 ⁇ ) used.
- the use of two different columns fulfills the high separation efficiency requirements and thus enables the separation of all known and important MTBE cleavage products.
- the HP-1 is suitable for the separation of C4 - C8 compounds.
- the HP-AL / S (Plot) is suitable in this substance system for the separation of C4 hydrocarbons.
- the analysis starts with a starting temperature of 35 ° C in the GC oven, which is held for 2 minutes. It is then heated at 30 ° C / min up to 100 ° C and held the final temperature for 14 minutes before the oven cools again to start the next analysis. With heating and cooling phase thus results in a
- the individual volume flows of the reactors are determined at the outlet of the on-line gas chromatograph by the manual actuation of the switching valve. Thus, the mass flows through the individual reactors during the
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
Die vorliegende Erfindung betrifft Verfahren zur Spaltung von Ethernbzw. Alkoholen, welches dadurch gekennzeichnet ist, dass es an einem Katalysator durchgeführt wird, der ein Bor-Silicat zeolithischer Struktur des Typs MFI enthält.
Description
Spaltung von Ethern und Alkoholen unter Verwendung von Bor-Zeolithen
Die vorliegende Erfindung betrifft ein Verfahren zur Spaltung von Alkyl-tert.-alkylethern in Gegenwart eines heterogenen Katalysators, welcher mindestens ein Bor-haltiges Silicat zeolithischer Struktur enthält. Ferner betrifft die Erfindung ein analoges Verfahren zur Spaltung von tert.-Alkylalkoholen.
Alkyl-tert.-alkylether (ATAE) sind Verbindungen der Formel II
wobei der Rest R für einen Alkylrest mit 1 oder 2 Kohlenstoffatom(en) steht, der Rest R1 für H, Methyl- oder Ethylrest steht und die Reste R2 und R3 für Methyl- oder Ethylreste stehen, wobei die Reste R2 und R3 gleich oder unterschiedlich sein können.
Wichtige Vertreter der Substanzklasse der ATAE sind Methyl- te/t-butylether (MTBE), Ethyl-te/t-butylether (ETBE) und tert.-Amyl-methylether (TAME).
Olefine, auch Alkene genannt, sind ungesättigte Kohlenwasserstoffe der Formel I
R2
/
HC=C
/ \ ,
R1 R3 | wobei der Rest R für einen Alkylrest mit 1 oder 2 Kohlenstoffatom(en) steht, der Rest R1 für H, Methyl- oder Ethylrest steht und die Reste R2 und R3 für Methyl- oder Ethylreste stehen, wobei die Reste R2 und R3 gleich oder unterschiedlich sein können.
Isobuten ist ein Olefin im Sinne dieser Definition.
Alkohol im Sinne der Erfindung ist eine Verbindung der Formel III
R-OH III wobei der Rest R für einen Alkylrest mit 1 oder 2 Kohlenstoffatom(en) steht.
Als Alkohol beispielhaft zu nennen sind Methanol und Ethanol.
Tert.-Alkylalkohole (TAO) sind Verbindungen der Formel II
wobei der Rest R für H steht, der Rest R1 für H, Methyl- oder Ethylrest steht und die Reste R2 und R3 für Methyl- oder Ethylreste stehen, wobei die Reste R2 und R3 gleich oder unterschiedlich sein können.
Wichtiger Vertreter der Substanzklasse TAO ist tert.-Butanol (TBA). Das Olefin Isobuten ist ein wertvoller Ausgangsstoff für die Herstellung einer Vielzahl organischer Verbindungen in der chemischen Industrie. Es wird für die Herstellung von Butylkautschuken in der Reifenindustrie eingesetzt sowie zur Gewinnung von
Polyisobuten, einem Vorprodukt für unter anderem Schmierstoff- und Kraftstoffadditive sowie für Kleb- und Dichtstoffe. Außerdem wird Isobuten als Alkylierungsmittel, insbesondere zur Synthese von tertiären Butylaromaten und als Zwischenprodukt für die Erzeugung von Peroxiden eingesetzt. Darüber hinaus kann Isobuten als Vorstufe für Methacrylsäure und deren Ester verwendet werden. Als Beispiel ist hier
Methylmethacrylat zu nennen, welches zur Herstellung von Plexiglas® verwendet wird. Weitere Produkte aus Isobuten sind verzweigte C5-Aldehyde, -Carbonsäuren, -Alkohole und C5-Olefine. Isobuten stellt damit eine hohe Wertschöpfung mit einer steigenden Nachfrage auf dem Weltmarkt dar. Ausschlaggebend für viele Anwendungen ist die chemische Reinheit des Isobutens; hier sind Reinheiten von bis zu 99.9 % gefordert.
Der Rohstoff Isobuten fällt in Leichtbenzinfraktionen, den C4-Fraktionen aus den FCC- Einheiten oder aus den Steamcrackern der Raffinerien an und liegt somit in einer Mischung mit anderen Alkenen und gesättigten Kohlenwasserstoffen mit gleicher Kohlenstoffatomzahl vor. Bei der Aufarbeitung des C4-Schnitts wird in einer ersten Stufe das Butadien, das ca. 50 % der C4-Fraktion ausmacht, durch Extraktivrektifikation abgetrennt oder durch Selektivhydrierung zu linearen Butenen umgesetzt. Das verbleibende Gemisch, das so genannte Raffinat 1 , besteht aus bis zu 50 % Isobuten. Weitere wesentliche Komponenten des Raffinat 1 sind n-Butan, Isobutan, 1 -Buten, 2- Buten. Aufgrund der nahezu identischen physikalischen Eigenschaften von Isobuten und 1 -Buten, ist eine wirtschaftliche Abtrennung des Isobutens durch Destillations- oder Extraktionsverfahren nicht möglich.
Eine Alternative zu den physikalischen Trennverfahren ist die Derivatisierung des Isobutens, da es eine höhere Reaktionsfähigkeit besitzt als die restlichen C4- Komponenten. Voraussetzung ist, dass die Derivate leicht vom Raffinat 1 abzutrennen sind und anschließend wieder in das gewünschte Produkt Isobuten und das
Derivatisierungsmittel gespalten werden können. Wichtige Verfahren sind hier die Reaktionen mit Wasser zu terf-Butanol und mit Methanol zu MTBE. Nach dem Hüls- Prozess wird die MTBE-Synthese in der Flüssigphase säurekatalysiert bei
Temperaturen unter 100 °C durchgeführt. Ionenaustauscher, wie sulfonierte
Copolymere von Styrol und Divinylbenzol kommen hierbei als heterogener Katalysator zum Einsatz. Im Anschluss an die Synthese kann in einem nächsten Prozessschritt MTBE aus dem C4-Schnitt aufgrund der großen Unterschiede in den
Siedetemperaturen destillativ leicht abgetrennt und anschließend selektiv in die
Produkte Isobuten und Methanol zurück gespalten werden. Das Koppelprodukt
Methanol kann im Kreislauf zurück in die MTBE-Synthese geführt werden. Die bestehenden Anlagen zur C4-Aufbereitung und zur MTBE-Synthese können damit um den Prozessschritt der MTBE-Spaltung erweitert werden.
Eine analoge Prozessführung ist bei der Derivatisierung mit Wasser zu tert.-Butanol möglich. Bei der Spaltung von TAO tritt anstelle des Alkohols gemäß Formel III Wasser (H2O) als Koppelprodukt auf.
Die Spaltungen von ATAE oder TAO sind endotherme Gleichgewichtsreaktionen. Das thermodynamische Gleichgewicht verschiebt sich somit mit steigender Temperatur in Richtung der Spaltprodukte. Eine Druckerhöhung bewirkt eine Verschiebung des chemischen Gleichgewichts in Richtung des Edukts. Die Spaltung kann sowohl homogen in der Flüssigphase als auch heterogen katalysiert in der Gasphase durchgeführt werden. Aufgrund der geringen Beständigkeit der Homogen katalysatoren und der niedrigeren Gleichgewichtsumsätze in der Flüssigphase, wird die
Gasphasenspaltung von an sauren Feststoffkatalysatoren vorgezogen. Bei einer Gasphasenreaktion bei Atmosphärendruck wird bereits oberhalb von 160 °C ein Gleichgewichtsumsatz von etwa 95 % erreicht.
Im technischen Betrieb wird ein Absolutdruck von 7 bar, somit oberhalb der
Dampfdrücke der zu erwartenden Komponenten im Reaktionsmedium, angestrebt, um im Downstream-Processing Kosten für die Kompression der Gase einzusparen und gleichzeitig eine Kondensation mit Kühlwasser realisieren zu können. Die Spaltung sowohl von MTBE als auch von TBA findet in Anwesenheit eines sauren Katalysators statt. In der Literatur wird die Anwendbarkeit von amorphen und kristallinen
Alumosilikaten sowie von Metallsulfaten auf Silizium bzw. Aluminium, geträgerter
Phosphorsäure und von lonenaustauscherharzen berichtet. Der genaue Mechanismus der säurekatalysierten Spaltung von MTBE bzw. TBA wurde jedoch in der Literatur bisher nicht aufgezeigt.
Aufgrund der hohen Reaktionstemperaturen der heterogen katalysierten
Gasphasenspaltung, entstehen neben Isobuten und Methanol bzw. Wasser einige unerwünschte Nebenprodukte. Die Dehydratisierung von Methanol führt im Falle der Spaltung von Methyl-tert.-Alkylethern zum unerwünschten Folgeprodukt Dimethylether (DME). Isobuten dimerisiert zu den Oligomeren 2,4,4 Trimethyl-1 -penten (TMP-1 ) und
2,4,4 Trimethyl-2-penten (TMP-2). Je nach Katalysatorsystem sind weitere Oligomerisierungsreaktionen, wie z.B. die Bildung von Trimeren, nicht auszuschließen. Außerdem ist die Gleichgewichtsreaktion des Isobutens mit Wasser zu te/t -Butanol (TBA) zu erwarten. Weiterhin ist nicht auszuschließen, dass MTBE mit Wasser direkt zu TBA und Methanol reagiert.
Aufgrund der hohen Anforderungen an die Reinheit des Isobutens für
Folgeanwendungen ist die Bildung der vorgenannten unerwünschten Nebenprodukte möglichst zu unterdrücken. Der Fokus liegt hier hauptsächlich in dem Ziel die
Folgereaktion von Isobuten zu den Oligomeren und die Dehydratisierung von Methanol zu Dimethylether zu minimieren, da die Nebenproduktbildung zum einen maßgeblich die Kosten der Aufreinigung festlegt und zum anderen die Ausbeute bezüglich der Produkte Isobuten und Methanol verringert. Der Katalysator, der für die Spaltung von MTBE oder TBA eingesetzt wird, spielt bei der Bildung der unerwünschten
Komponenten eine entscheidende Rolle.
Eine Vielzahl von Katalysatoren mit aziden Eigenschaften sind in der Literatur für die Gasphasenspaltung beschrieben. Mehrere Patente beanspruchen Sulfonsäuren als Katalysator für die Etherspaltung und garantieren Selektivitäten bzgl. der
Hauptkomponenten Isobuten und Methanol von bis zu 89.3 % beziehungsweise 97.8 % bei Umsätzen von bis zu 55 %. Allerdings ist festzustellen, dass der Einsatz stark saurer Katalysatoren, wie Sulfonsäuren und Phosphorsäuren, zu einem Einbruch der Isobuten-Selektivitäten führt.
Amorphe beziehungsweise kristalline Alumosilicate sowie modifizierte Alumosilicate sind Gegenstand zahlreicher Veröffentlichungen. Bei Einsatz von Alumosilicaten werden üblicherweise Reaktionstemperaturen von 150 bis 300 °C und Drücke von 1 bis 7 bar gefahren. Viele Patente beanspruchen amorphe oder auch kristalline
Alumosilicate, die einen Anteil von 0.1 bis zu 80 % Aluminium aufweisen und erreichen damit bei Umsätzen von 98 % Selektvitäten bezüglich Isobuten beziehungsweise Methanol von bis zu 99.8 % beziehungsweise 99.2 %.
Darüber hinaus sind neben den Alumosilicaten Metalloxide mittelstark elektronegativer Elemente, wie Magnesium, Titan, Vanadium, Chrom, Eisen, Kobalt, Mangan, Nickel, Zirkonium und Bor, für die Etherspaltung patentiert. Weiterhin kann eine Dotierung der Alumosilikate mit den genannten Metalloxiden zur Beeinflussung der Azidität des Katalysators vorgenommen werden.
Es wird deutlich, dass alle Katalysatorsysteme hohe Aktivitäten (über 70 %) bezüglich der Spaltung von MTBE aufweisen. Bei Vergleich der Selektivitäten bzgl. Isobuten und Methanol sind Unterschiede unter den Materialien festzustellen. Hierbei ist kein direkter Zusammenhang zur Zusammensetzung, zusätzlichen Dotierung oder
Oberflächenbeschaffenheit der Feststoffe zu erkennen.
Zeolithe sind hydratisierte kristalline Alumosilicate mit einem dreidimensionalen
Anionengerüst aus [SiO4] und [AIO4]-Tetraedern, die durch Sauerstoffatome
miteinander verbunden sind. Das Zeolithgerüst bildet meist eine hochgeordnete
Kristallstruktur aus Kanälen und Hohlräumen aus. Zur Ladungskompensation der anionischen Gerüstladung dienen Kationen, die ausgetauscht bzw. reversibel entfernt werden können. Die chemische Zusammensetzung der Elementarzelle wird mit der folgenden allgemeinen Formel angegeben:
Mx/n[(AIO2)x(SiO2)y] ■ wH2O wobei n die Wertigkeit des Kations M bezeichnet und w die Zahl der Wassermoleküle pro Elementarzelle ist. Für das Si/Al-Verhältnis gilt: y/x > 1 . Die isomorphe Substitution von Aluminium bzw. Silicium durch andere netzwerkbildende Elemente führt zu variantenreichen und vielfältigen zeolith-analogen Materialien. Unter Berücksichtigung der Substitutionsmöglichkeiten ergibt sich folgende Formel für Zeolithe und zeolith- analoge Materialien:
Mx - M'y ■ Nz ■ [Tm ■ T'n ■ 02(m+...-a)■ (OH)2a] ■ (OH)br ■ (aq)p ■ qY T = AI, B, Be, Ga, P, Si, Ti, V usw.
M und M' stehen für austauschbare bzw. nicht austauschbare Kationen, N steht für nichtmetallische Kationen, (aq)p für stark gebundenes Wasser, qY für Sorbatmoleküle, die auch Wasser einschließen und (OH)2a für Hydroxylgruppen an
Netzwerkbruchstellen. Findet der Ladungsausgleich durch Protonen statt, so liegen protonenausgetauschte Zeolithe vor, die je nach Zeolitheigenschaften schwach bis starke Aziditäten aufweisen. Diese Eigenschaft und das definierte Porensystem mit einer großen spezifischen Oberfläche (mehrere 100 m2/g) prädestinieren Zeolithe als Katalysatoren für sauer katalysierte, formselektive, heterogene Umsetzungen. Die Dimension dieser Porenöffnungen, die in der Größenordnung von
Moleküldurchmessern liegen, bedingt die besondere Eignung der Zeolithe als selektive Adsorbentien, wofür sich der Ausdruck„Molekularsiebe" etabliert hat.
Für die natürlichen Zeolithe und zeolithartigen Substanzen wurde von der IZA im "Atlas of Zeolite Structure Types" eine Nomenklatur, basierend auf der Topologie des
Wirtsgerüstes, vorgeschlagen und von der IUPAC genehmigt. So werden die meisten synthetischen Zeolithe durch die Kombination eines dreibuchstabigen Struktur-Codes benannt. Als Beispiele seien die Struktur-Typen SOD (Sodalith), LTA (Zeolith A), MFI (Pentasil Zeolith), FAU (Zeolith X, Zeolith Y, Faujasit), BEA (Zeolith Beta) und MOR (Mordenit) genannt.
Zeolithe vom Struktur-Typ MFI sind sog.„mittelporige" Zeolithe. Ein Vorteil dieses Struktur-Typs ist die im Vergleich zu den„engporigen" Struktur-Typen (SOD, LTA) und „weitporigen" Strukturtypen (FAU, BEA, MOR) einheitliche Kanalstruktur. Der Struktur- Typ MFI gehört zur Reihe der kristallinen, mikroporösen Alumosilikate und ist in seiner Erscheinung ein außerordentlich formselektiver und temperaturstabiler, jedoch auch ein hochazider Zeolith. Der Einsatz stark saurer Zeolithe als Katalysatoren für die MTBE- Spaltung kann jedoch, wie bereits ausgeführt, zu einem Einbruch der Isobuten- Selektivitäten führen.
Im Stand der Technik finden sich einige wenige Nachweise für die Verwendung von Bor-Zeolithen als Katalysator in der Spaltung von ATAE oder speziell MTBE:
So beschreibt DE2953858C2 den Einsatz von„Boraliten" als Katalysatoren in der MTBE-Spaltung. Bei diesen Boraliten handelt es sich um Doppeloxide des Siliciums und des Bors mit poröser kristalliner Struktur, die mit Bor modifizierte Kieselsäuren darstellen und eine zeolithische Struktur besitzen. Es fehlen Angaben zum Struktur-Typ dieser Boralite. Die Herstellung erfolgt unter hydrothermalen Bedingungen bei einem pH-Wert von 9 bis 14.
Aus EP0284677A1 ist ein Verfahren zur Herstellung eines Katalysators zur Spaltung von Stickstoff-haltigem Öl wie Schiefer-Öl bekannt, der auf einem Bor-haltigen kristallinen Material von zeolithischer Struktur basiert. Als mögliche Zeolith -Strukturen sind ZSM-5, ZSM-1 1 , ZSM-12, Beta und Nu-1 genannt. Die Herstellung erfolgt im basischen Milieu. Die Eignung dieser Katalysatoren zur MTBE- oder TBA-Spaltung wird nicht geschildert.
Im Lichte dieses Standes der Technik liegt der Erfindung die Aufgabe zu Grunde ein Verfahren zur Spaltung von ATBE bzw. TAO anzugeben, welches neben einer hochaktiven Spaltung des Ethers gleichzeitig hohe Selektivitäten zu den
Hauptprodukten Olefin und Alkohol bzw. Wasser gewährleistet.
Die Aufgabe wird durch ein Verfahren zur Etherspaltung nach Anspruch 1 gelöst. Eine analoge Lösung zur Spaltung von Alkohol ist in Anspruch 16 niedergelegt.
Gemeinsamer Gegenstand der Erfindung ist mithin ein Verfahren zur Spaltung eines Alkyl-tert.-alkylethers bzw. von tert.-Alkylalkohols der Formel II
/
HC =C
/ \
R R-
und einen Alkohol der Formel III
R-OH III bzw. in Wasser, wobei in den Formeln I bis III der Rest R für einen Alkylrest mit 1 oder 2
Kohlenstoffatom(en) bzw. für H steht, der Rest R1 für H, Methyl- oder Ethylrest steht und die Reste R2 und R3 für Methyl- oder Ethylreste stehen, wobei die Reste R2 und R3 gleich oder unterschiedlich sein können, welches in Gegenwart eines heterogenen Katalysators durchgeführt wird, der mindestens ein Bor-haltiges Silicat zeolithischer Struktur des Typs MFI enthält.
Erfindungswesentlich ist der Einsatz Bor-haltiger Silicate zeolithischer Struktur vom Typs MFI als Katalysator.
Silicate sind die Salze und Ester der Orthokieselsäure Si(OH) und deren
Kondensationsprodukte. Ein„Bor-haltiges Silicat" (kurz:„Bor-Silicat") im Sinne dieser Erfindung ist ein Silicat, welches Bor in oxidischer Form enthält. Unter„zeolithischer Struktur" ist eine Morphologie entsprechend der Zeolithe zu verstehen. Synonym wird der Begriff„zeolith-analog" gebraucht. Der geläufigen Definition nach gehören Zeolithe zu der Gruppe der Alumosilicate, also der Silicate, die Aluminium in oxidischer Form enthalten. Da die hier beschriebenen Bor-Silicate hinsichtlich ihrer Morphologie den
Zeolithen entsprechen, werden sie im Folgenden auch kurz als„Bor-Zeolithe" bezeichnet. Die Verwendung des Begriffes„Bor-Zeolith" bedeutet aber nicht, dass dieses Material zwangsläufig Aluminium enthalten muss. Bevorzugt sind
erfindungsgemäße Bor-Zeolithe - von Verunreinigungen oder Spurenbestandteilen abgesehen - sogar frei von Aluminium.
Der erfindungsgemäß eingesetzte Bor-Zeolith erweist sich als aktiver und selektiver Katalysator für die Spaltung von MTBE in Isobuten und Methanol. Das Resultat ist ein Verfahren zur Herstellung von Isobuten durch Spaltung von MTBE, das bis zu 90 % Umsatz bei vernachlässigbaren Oligomerisierungsraten (bis zu 0.01 % Cs-Selektivität) und die niedrigsten bisher beobachteten DME-Selektivitäten (bis zu 0.2 %) aufweist.
Es steht zu erwarten, dass sich die nachweislich vorteilhaften Eigenschaften der Bor- Zeolithe in der MTBE-Spaltung auch in der Spaltung anderer ATAE wie ETBE oder TAME nutzen lassen. Soweit im Folgenden bevorzugte Weiterbildungen der Erfindung am Beispiel der MTBE-Spaltung offenbart werden, gilt das Gesagte mutatis mutandis auch für andere ATAE-Spaltprozesse.
Da Katalysatoren, welche die Spaltung von ATAE katalysieren in aller Regel auch hervorragende Katalysatoren für die Spaltung von TAO darstellen, ist es naheliegend anzunehmen, dass die in der ATAE-Spaltung eingesetzten Bor-Zeolithe auch als Katalysatoren für die Spaltung von TAO mit gutem Umsatz und guter Selektivität geeignet sind. Soweit im Folgenden bevorzugte Weiterbildungen der Erfindung am Beispiel der MTBE-Spaltung offenbart werden, gilt das Gesagte mutatis mutandis auch für TAO-Spaltprozesse, isnbesondere TBA-Spaltprozesse.
Gemäß dem erfindungsgemäßen Verfahren erfolgt die Spaltreaktion an einem heterogenen Katalysator enthaltend mindestens ein Bor-Silicat, wobei der Katalysator erhältlich ist durch die nachfolgenden Schritte:
Bereitstellung einer wässrigen Suspension enthaltend mindestens ein
Bor-haltiges Silicat mit zeolithischer Struktur vom Typ MFI,
b) Zugabe von Säure zur Einstellung eines pH-Wertes zwischen 1 und 5 c) Rühren der Suspension ,
d) Isolierung des erhaltenen Feststoffs,
e) Optionales Waschen des Feststoffs,
f) Kalzinieren des Feststoffs.
Zur Herstellung des Katalysators werden Bor-Zeolithe vom Struktur-Typ MFI eingesetzt, da sie viele Vorteile mit sich bringen. Es wurde gefunden, dass sich die Acidität eines Zeoliths durch Einbau von Heteroatomen in das Siliciumgerüst wie folgt beeinflussen lässt:
Säurestärke : B « Fe < Ga < AI
Danach ist ein Bor-haltiger Zeolith ein viel weniger saurer Zeolith als ein Zeolith, der lediglich Aluminium und Silizium enthält. Dies ist nicht erwartungsgemäß, da Bor eine höhere Elektronegativität als Aluminium aufweist.
Nach dem erfindungsgemäßen Verfahren kann das Si/B-Verhältnis über einen breiten Bereich variiert werden und offeriert damit viele Möglichkeiten zur Einstellung der katalytischen Eigenschaften. Außerdem besitzen Zeolithe vom Struktur-Typ MFI eine einheitliche Kanalstruktur und zeichnen sich dadurch als außerordentlich formselektiv und temperaturstabil aus. Vermutlich aufgrund der geringen Dimensionierung sind Zeolithe von diesem Struktur-Typ außerdem besonders koksresistent.
Im Rahmen des erfindungsgemäßen Verfahrens weist der Katalysator in
vorteilhafterweise ein molares Verhältnis S1O2 / B2O3 zwischen 2 und 4 auf,
vorzugsweise wischen 2.3 und 3.7, besonders bevorzugt von 3 auf.
Wie bereits ausgeführt, ist der erfindungsgemäß eingesetzte Bor-Zeolith kein Zeolith im strengen Sinne, da er kein Aluminium enthält. Bevorzugt ist er frei von Aluminium oder
weist es allenfalls in Form von Verunreinigungen auf. Eine Aluminium-Verunreinigung ist dann tolerabel, wenn der Gehalt an Aluminium unter 0.1 Gew.-% liegt.
Maßgeblich ist jedoch, dass der Bor-Gehalt des Katalysators unter 1 Gew.-% liegt. Ein erhöhter Bor-Gehalt könnte die Nebenproduktbildung begünstigen. Bevorzugt liegt der Bor-Gehalt sogar unter 0.5 Gew.-%, ganz besonders bevorzugt etwa 0.3 Gew.-%. Weist der bereitgestellte Bor-Zeolith noch einen überhöhten Bor-Gehalt auf, lässt sich dieser durch die Säurebehandlung reduzieren. Bor lässt sich nämlich im Vergleich zu AI recht gut mit Säure herauswaschen. So ist es gelungen, den Bor-Gehalt eines Bor-Zeolithen von 1 Gew.-% im unmodifizierten Zustand durch Säurebehandlung auf etwa 0.1 Gew-% zu senken. Somit sollte das in der Suspension bereitgestellte Bor-haltige Silicat zumindest nach der Säurebehandlung einen Bor-Gehalt im angegebenen Bereich aufweisen.
Darüber hinaus ist es für die katalytischen Eigenschaften von Vorteil, wenn der
Katalysator eine Oberfläche gemessen nach BET zwischen 300 m2/g und 500 m2/g aufweist, vorzugsweise zwischen 330 und 470 m2/g, besonders bevorzugt zwischen 370 und 430 m2/g aufweist.
Von den zahlreichen Methoden, die der Festkörperchemie zur Verfügung stehen, stellt die Hydrothermalsynthese eine bevorzugt geeignete Methode zur Synthese der in dem erfindungsgemäßen Verfahren eingesetzten Zeolithe dar. Es sind weitere Wege zur Zeolithsynthese denkbar. Die Edukte, die essentiell für die Zeolithsynthese sind, lassen sich in folgende vier Kategorien einteilen: Quelle der T-Atome (Bor-, bzw.
Siliciumquelle), Templat, Mineralisator und Lösungsmittel.
Siliciumquellen, die häufig bei der Zeolithsynthese zum Einsatz kommen, sind
Kieselgele, pyrogene Kieselsäuren, Kieselsole (kolloidal gelöstes S1O2) und
Alkalimetasilicate. Geläufige Borquellen sind Borsäure oder Alkaliborate.
Die Templatverbindungen besitzen strukturdirigierende Eigenschaften und stabilisieren die entstehende Zeolithstruktur während der Synthese. Template sind in der Regel ein-
oder mehrwertige anorganische oder organische Kationen. Neben Wasser werden Basen (NaOH), Salze (NaCI) oder Säuren (HF) als anorganische Kationen bzw.
Anionen verwendet. Organische Verbindungen, die für Zeolithsynthesen in Frage kommen, sind vor allem Alkyl- oder Aryl-Ammonium-Hydroxide. Der Mineral isator katalysiert die Bildung der Übergangszustände, die für die Kern- und Kristallbildung benötigt werden. Dies geschieht durch Lösungs-, Fällungs- oder
Kristallisationsvorgänge. Zusätzlich erhöht der Mineralisator die Löslichkeit und damit die Konzentration der Komponenten in der Lösung. Als Mineralisator können
Hydroxidionen eingesetzt werden, wodurch der ideale pH-Wert für die Zeolithsynthese eingestellt werden kann. Mit dem Anstieg der OH-Konzentration kommt es zur
Abnahme der Kondensation der Silicium-Spezies, wohingegen die Kondensation der Aluminiumanionen konstant bleibt. Somit wird bei hohen pH-Werten die Bildung von aluminiumreichen Zeolithen unterstützt; Silicium-reiche Zeolithe werden bevorzugt bei niedrigeren pH-Werten gebildet. Bei weitestgehend aluminiumfreien Bor-Silicaten führen pH-Werte von 9 bis 1 1 zu geringen Bor-Gehalten von unter 1 Gew.-%. Das
Lösungsmittel, das in vielen Fällen bei der Zeolithsynthese eingesetzt wird, ist Wasser.
Für die Synthese der Zeolithe werden die reaktiven T-Atomquellen, der Mineralisator, das Templat und das Wasser vermischt, wobei eine Suspension entsteht. Die molare Zusammensetzung des Synthesegels ist der wichtigste Faktor zur Beeinflussung der Reaktionsprodukte:
SiO2 : a B2O3 : b AI2O3 : c MxO : d NyO : e R
M und N stehen für Alkali- oder Erdalkaliionen und R für ein organisches Templat. Ferner geben die Koeffizienten a bis e die molaren Verhältnisse bezogen auf ein Mol Siliciumdioxid an.
Für die Koeffizienten ergeben sich bevorzugt folgende Werte: a = 0.000001 bis 0.2
b < 0.006
c < 1
d < 1
0 < e < 1
Die Suspension wird in einen Autoklaven überführt und wird alkalischen Bedingungen, autogenem Druck und Temperaturen von 100 bis zu 250 °C für wenige Stunden bis hin zu mehreren Wochen ausgesetzt. Unter hydrothermalen Bedingungen kommt es zu einer Übersättigung der Syntheselösung, welches die Keimbildung und das hieran anknüpfende Kristallwachstum initiiert. Neben der Keimbildung sind bei der
Zeolithsynthese die Kristallisationstemperatur und -dauer für den Ausgang
entscheidend. Da die Kristallisation ein dynamischer Prozess ist, werden gebildete Kristalle wieder gelöst und umgewandelt. Entsprechend der Ostwaldschen Stufenregel bilden sich zunächst die energiereichsten Spezies aus, anschließend erfolgt
stufenweise die Bildung energieärmerer Spezies. Die Kristallisationsdauer hängt unter anderem auch von der Zeolithstruktur ab. Bei Zeolithen vom Struktur-Typ MFI ist erfahrungsgemäß die Kristallisation nach 36 Stunden abgeschlossen.
Im Anschluss an die Hydrothermalsynthese wird das Templat durch die Kalzinierung im Luftstrom bei 400 bis 600 °C entfernt. Dabei wird die Organik zu Kohlendioxid, Wasser und Stickoxiden verbrannt.
Zur Modifizierung des Bor-Silicats wird eine Säurebehandlung durchgeführt, wobei es zu einer Reduzierung des Bor-Gehalts kommt. Dies führt zur Steigerung der Aktivität der Zeolithe bzw. zur selektiven Herstellung gewünschter aktiver Zentren. Außerdem wird eine zusätzliche Stabilisierung des Gerüsts beobachtet.
Für die Säurebehandlung ist die Anwendung von Salzsäure, Phosphorsäure,
Schwefelsäure, Essigsäure, Salpetersäure und Oxalsäure möglich. Der Grad der Reduktion des Bor-Gehalts hängt hier vor allem von der verwendeten Säure, ihrer Konzentration und der Temperatur der Behandlung ab. Im Rahmen der vorliegenden Erfindung wurde festgestellt, dass Salzsäure und Phosphorsäure im Gegensatz zu Schwefelsäure und Salpetersäure schon bei geringen Konzentrationen Bor extrahieren. In einer bevorzugten Weiterbildung der Erfindung erfolgt die Einstellung des pH-Wertes daher durch Zugabe von Salzsäure oder von Phosphorsäure.
Im Rahmen der vorliegenden Erfindung wurde weiterhin festgestellt, dass das Rühren der Suspension in vorteilhafter Weise bei maximal 80 °C erfolgt. Bevorzugte
Weiterbildungen der vorliegenden Erfindung sehen daher vor, dass das Rühren der Suspension bei maximal 80°C erfolgt. Allerdings hängt die maximale Rühr-Temperatur von der verwenden Säure ab. Während HCl eine Temperatur von 80°C erfordert, wurden bei H3PO4 bereits bei 25°C gute Ergebnisse erzielt. Bei der Verwendung von Phosphorsäure sollte die maximale Rührtemperatur daher 25°C betragen. Eine minimale Rührtemperatur von 0°C sollte tunlichst nicht unterschritten werden, da gefrierendes Wasser das Rühren erschwert.
Die Zeitdauer des Rührens beträgt mindestens 6 Stunden, vorzugsweise von
mindestens 12 Stunden, besonders bevorzugt von mindestens 24 Stunden. In der Praxis können Rührzeiten bis etwa 36 h betragen.
Die Isolierung des Feststoffs kann nach jeder beliebigen Methode erfolgen. Je nach Partikelgröße bietet sich dabei die Vakuum- bzw. die Überdruckfiltration an.
Zur Aufreinigung kann der Feststoff in einem weiteren Schritt gegebenenfalls wiederholt mit Wasser gewaschen werden. Es ist möglich, dass die erzeugten Defekte im Gerüst bei hohen Kalziniertemperaturen durch Silanolkondensation unter Entstehung eines Cristobalits ausgeheilt werden. Im Rahmen des erfindungsgemäßen Verfahrens erfolgt das Kalzinieren des Feststoffs
bevorzugt bei einer Temperatur von maximal 500 °C, besonders bevorzugt von maximal 400 °C, insbesondere bevorzugt von maximal 350 °C.
Das Kalzinieren des Feststoffs kann prinzipiell im Luftstrom erfolgen. Eine
Weiterbildung der vorliegenden Erfindung besteht somit darin, dass das Kalzinieren des Feststoffs im Luftstrom erfolgt.
Das Ausheilen der erzeugten Defekte im Gerüst bei hohen Kalziniertemperaturen durch Silanolkondensation kann darüber hinaus vermieden werden, indem die
Abwesenheit von Wasser oder Sauerstoff während des Kalziniervorgangs durch Zufuhr eines Inertgases, wie Stickstoff, gewährleistet wird. In einer Weiterbildung der vorliegenden Erfindung erfolgt daher das Kalzinieren des Feststoffs im reinen Stickstoffstrom.
Da sich sowohl Luft, als auch Stickstoff als Kalzinier-Atmosphäre eignen, lässt sich allgemein vermuten, dass die Kalzinierung vorteilhaft in jedweder Stickstoff-haltigen Atmosphäre durchgeführt werden kann. Eine Weiterbildung der Erfindung sieht demnach die Kalzinierung in Stickstoff-haltiger Atmosphäre vor. Eine„Stickstoff-haltige Atmosphäre" ist als Gas oder Gasgemisch zu verstehen, welches Stickstoff in
molekularer Form enthält. Die Kalzinierung kann daher in Gegenwart von molekularen Stickstoff-Gas (N2) oder in Gegenwart eines Gases durchgeführt werden, das neben Stickstoff weitere Molekülarten enthält, wie beispielsweise Wasserstoff (H2).
Zur Entfernung der überschüssigen Säure kann der erhaltene Feststoff nach Abkühlen auf Raumtemperatur gegebenenfalls mehrmals mit destilliertem Wasser gewaschen werden. Zum Schluss wird die Kalzinierung im Stickstoffstrom beziehungsweise
Luftstrom wiederholt. Eine bevorzugte Weiterbildung der Erfindung ist somit auch das zuvor beschriebene Verfahren, wobei der kalzinierte Feststoff mit Wasser gewaschen und anschließend wiederholt kalziniert wird.
Nach Abschluss der Kalzinierung bietet es sich an, den erhaltenen Feststoff mit
Methanol zu behandeln. Dabei wird der Feststoff in stehendes Methanol eingetaucht oder von fließendem Methanol überströmt. Das Methanol kann in beiden Fällen flüssig, gasförmig oder gemischt flüssig/gasförmig sein. Die Behandlung des Feststoffes mit Methanol bewirkt eine Verringerung der Initialaktivität des Katalysators, was sich im industriellen Einsatz als vorteilhaft erwiesen hat. Die Methanol-Behandlung des auf Bor- Silicat basierenden Katalysators erfolgt analog zu der Methanol-Behandlung von Alumosilicat-basierten Katalysatoren, welche in der zum Zeitpunkt der Anmeldung noch unveröffentlichten deutschen Patentanmeldung DE102012215956 beschrieben ist. Auf den Inhalt dieser Anmeldung wird insoweit ausdrücklich Bezug genommen. Anstelle von Methanol kann der Feststoff auch mit einem anderen bevorzugt einwertigen Alkohol wie beispielsweise Ethanol behandelt werden.
In einer besonders bevorzugten Ausführungsform der Erfindung wird ein - von
Verunreinigungen oder Spurenbestandteilen abgesehen - Aluminium-freier Katalysator eingesetzt, der ein molares Verhältnis S1O2 / B2O3 von etwa 3, einen Bor-Gehalt unter 0.5 Gew.-% und eine Oberfläche gemessen nach BET von etwa 405 m2/g aufweist und dessen Herstellung nach der Folgenden Maßgabe erfolgt: Die Einstellung des pH- Wertes geschieht durch Zugabe von Salzsäure oder Phosphorsäure, das Rühren der Suspension bei einer Temperatur zwischen 20 und 80 °C für einen Zeitraum von mindestens 24 Stunden und die Isolierung des Feststoffs durch Vakuumfiltration oder Überdruckfiltration, der Feststoff wird mit Wasser gewaschen, und das Kalzinieren des Feststoffs erfolgt bei einer Temperatur von maximal 350 °C im reinen Stickstoffstrom oder im Luftstrom.
Das Porenvolumen des Katalysators beträgt vorzugsweise von 0,5 bis 1 ,3 ml/g, bevorzugt von 0,65 bis 1 ,1 ml/g.
Der mittlere Porendurchmesser (vorzugsweise bestimmt in Anlehnung an DIN 66133 ) des Katalysators beträgt vorzugsweise von 5 bis 20 nm, bevorzugt von 8 bis 15 nm. Besonders bevorzugt entfällt mindestens 50%, vorzugsweise über 70% des
Gesamtporenvolumens (Summe des Porenvolumens der Poren mit einem Porendurchmesser von grösser-gleich 3.5 nm bestimmt mit Quecksilberporosimetrie gemäß DIN 66133) des Katalysators auf Poren mit einem Durchmesser von 3.5 bis 50 nm (Mesoporen). Im erfindungsgemäßen Verfahren werden bevorzugt Katalysatoren eingesetzt, die eine mittlere Korngröße (bestimmt durch Siebanalyse) von 10 m bis 10 mm, vorzugsweise 0,5 mm bis 10 mm, besonders bevorzugt eine mittlere Korngröße von 1 bis 5 mm aufweisen. Vorzugsweise werden feste Katalysatoren eingesetzt, die eine mittlere Korngröße d50, von 2 bis 4 mm, insbesondere von 3 bis 4 mm. In dem erfindungsgemäßen Verfahren kann der Katalysator als Formkörper eingesetzt werden. Die Formkörper können jegliche Form einnehmen. Bevorzugt wird der
Katalysator als Formköper in Form von Kugeln, Extrudaten oder Tabletten eingesetzt. Die Form körper weisen vorzugsweise die oben genannten mittleren Korngrößen auf.
Grundsätzlich eignet sich der beschriebene Katalysator zur Spaltung jedweder ATAE und TAO. Besonders bevorzugt ist aber der Einsatz als Spaltkatalysator für MTBE und TBA. In einer bevorzugten Ausführungsform der Erfindung wird demnach MTBE zu Isobuten und Methanol bzw. TBA zu Isobuten und Wasser gespalten.
Vorzugsweise wird die Spaltung des MTBE in der Gasphase im Temperaturbereich von 120 bis 400 °C, insbesondere 180 bis 350 °C, und bei Drücken von 0.1 bis 2 MPa(abs), insbesondere bei Drücken von 0.3 bis 1 MPa(abs), ganz besonders bei Drücken von 0.5 bis 0.8 MPa(abs) durchgeführt.
Die Spaltung von MTBE in Isobuten und Methanol ist eine endotherme Reaktion, dass bedeutet, dass sich die Reaktionsmischung bei der Reaktion abkühlt. Bevorzugt wird der Reaktor derart betrieben, dass es unter den gewählten Druckbedingungen zu keiner Partialkondensation von MTBE und Produkten am Katalysator kommt. Besonders bevorzugt wird der Reaktor so betrieben, dass die Minimaltemperatur im Reaktor an jeder Stelle des Katalysatorbetts größer als 150 °C, ganz besonders bevorzugt größer
200 °C ist. Der maximale Temperaturabfall kann durch zahlreiche Parameter, wie zum Beispiel durch die Temperatur des zum Heizen verwendeten Wärmeträgers sowie durch die Geschwindigkeit, mit der der Wärmträger durch den Mantel strömt, eingestellt werden. Bevorzugt wird das Temperaturprofil im Katalysatorbett durch eine
ausreichende Anzahl von Temperaturmessungen überwacht.
Der Reaktor wird vorzugsweise mit einer Raumgeschwindigkeit (Weight Hourly Space Velocity (WHSV) in Kilogramm Edukt je Kilogramm Katalysator je Stunde) von 0.1 bis 5 h"1, insbesondere von 1 bis 3 h"1 im geraden Durchgang betrieben.
Edukt für das erfindungsgemäße Verfahren ist MTBE. Dieses stammt bevorzugt aus einer MTBE - Synthese, in welcher in einem C4-Kohlenwasserstoffgemisch
enthaltendes Isobuten mit Methanol zu MTBE umgesetzt wird (umgekehrte
Spaltreaktion). Die Kombination von MTBE-Synthese und MTBE-Spaltung wird bei der Aufreinigung von C4-Kohlenwasserstoffgemischen großindustriell angewendet. Das MTBE muss nicht in reiner Form in den Spaltreaktor gefahren werden. Es kann auch von Begleitstoffen begleitet sein, die bei der mit C4-Kohlenwasserstoffströmen gespeisten Synthese von MTBE üblicherweise anfallen.
Als Reaktoren werden bevorzugt Rohrreaktoren oder Rohrbündelreaktoren,
insbesondere solche mit inneren Rohrdurchmessern von 10 bis 60 mm, verwendet. Die Beheizung der Rohre erfolgt über den Reaktormantel durch Dampf, Salzschmelzen oder Wärmeträgeröle. Insbesondere bei Einsatz von flüssigen Heizmedien wird dabei die Mantelseite konstruktiv so ausgeführt, dass ein möglichst homogener
Temperaturgradient an allen Rohren anliegt. Die hierfür notwendigen technischen Maßnahmen sind dem Fachmann bekannt und in der Literatur beschrieben (Einbau von Umlenkblechen, Disc- an Donut-Bauweise, Einspeisung/Abfuhr des Wärmeträgers an verschiedenen Stellen des Reaktors usw.). Bevorzugt werden Reaktionsmedium und Wärmeträger im Gleichstrom, besonders bevorzugt von oben nach unten durch die Traktorrohre beziehungsweise den Reaktormantel geführt. Eine bevorzugte
Ausführungsform ist beispielsweise in DE102006040433A1 beschrieben.
Neben Rohrbündelapparaten können auch Plattenreaktoren für die Durchführung der Spaltungsreaktion eingesetzt werden. Plattenreaktoren sind analog zu
Plattenwärmetauschern aufgebaut. Der Abstand der Platten, zwischen denen sich der Katalysator befindet, beträgt dabei bevorzugt 10-80 mm. Bei der Spaltung von MTBE treten Nebenreaktionen auf. Diese sind entweder auf MTBE oder die Spaltprodukte Isobuten und Methanol zurückzuführen.
Standardmäßig tritt bei der MTBE Spaltung die Bildung von Dimethylether (DME) auf. Dabei reagieren zwei Moleküle Methanol zu DME und Wasser. Vorzugsweise wird der erfindungsgemäße Prozess so betrieben, dass die DME-Selektivität der Reaktion zu DME unter 10% beträgt, bevorzugt unter 4% (DME-Selektivität = 2 * [Mol gebildetes DME]/[Mol umgesetztes MTBE]).
Eine weitere Nebenreaktion ist die Bildung von Cs-Kohlenwasserstoffen durch
Dimerisierung von Isobuten. Diese bestehen hauptsächlich aus einem Gemisch aus 2,4,4-Trimethylpenten-1 und 2,4,4-Trimethylpenten-2. In der Regel in deutlich geringerem Masse wird die Bildung von weiteren
Nebenprodukten beobachtet. Dazu gehören beispielsweise Isobutan, Isopren und Dimethoxymethan sowie höherer Oligomere (C12 und Ci6-Kohlenwasserstoffe).
Zu den Nebenreaktionen kommen meisten noch parallel ablaufende Reaktionen hinzu, bei denen Verunreinigungen aus dem Reaktorzulauf reagieren. Darunter fällt beispielsweise die Spaltung von im MTBE enthaltenen 2-Methoxybutan. Aus diesem können sich durch Abspaltung von Methanol 1 -Buten und 2-Butene bilden. Aus im MTBE enthaltenen 3-Methoxy-1 -buten oder 1 -Methoxy-2-buten kann in der Spaltung 1 ,3-Butadien gebildet werden.
Das in der MTBE-Spaltung anfallende Isobuten liegt in dem Reaktionsgemisch mit Methanol und weiteren Nebenprodukten vor und muss für seine weitere Verwertung daraus noch isoliert werden. Dies geschieht bevorzugt destillativ:
Bei der Destillation des Spaltproduktes werden Isobuten werden als Leichtsieder weitere C4-Kohlenwasserstoffe (1 -Buten, 2-Butene) und DME erhalten. Isopren und Dimethoxymethan sind Beispiele für Mittelsieder mit Siedepunkten, die zwischen MTBE und denen der C4-Kohlenwasserstoffe liegen. Die Mittelsieder werden zum Teil in der Reaktion gebildet oder gelangen als Verunreinigungen über den Zulauf in die Spaltung. Als Hochsieder, also Komponenten mit einem höheren Siedepunkt als MTBE, sind beispielsweise terf.-Butanol, Diisobuten und 2-Methoxybutan enthalten.
Marktgängige Isobutenqualitäten sind üblicherweise praktisch frei von Methanol. Der bei der destillativen Trennung der Spaltprodukte anfallende Isobutenstrom enthält noch Methanol. Dies kann nach an sich bekannten Verfahren, beispielsweise durch
Extraktion, abgetrennt werden. Die Extraktion von Methanol aus dem Isobuten kann beispielsweise mit Wasser oder einer wässrigen Lösung als Extraktionsmittel z. B. in einer Extraktionskolonne durchgeführt werden.
Vorzugsweise wird die Extraktion mit Wasser oder einer wässrigen Lösung in einer Extraktionskolonne durchgeführt, die vorzugsweise 4 bis 16 theoretische Trennstufen aufweist. Das Extraktionsmittel durchströmt die Extraktionskolonne in Bezug auf den zu extrahierenden Strom vorzugsweise im Gegenstrom. Die Extraktion wird vorzugsweise bei einer Temperatur von 15 bis 50 °C, bevorzugt 25 bis 40 °C durchgeführt.
Beispielweise kann bei der Verwendung einer Extraktionskolonne mit mehr als sechs theoretischen Trennstufen, die bei einem Druck von 0.9 MPa(abs) und einer
Temperatur von 40 °C betrieben wird, ein wassergesättigtes Isobuten mit einem
Methanolgehalt von unter 10 ppm erhalten werden.
Der bei der Extraktion anfallende Methanol haltige Wasserextrakt kann destillativ in Wasser und Methanol getrennt werden. Das Wasser kann als Extraktionsmittel in die Extraktionsstufe zurückgeführt werden. Das Methanol wird bevorzugt in eine vor der MTBE-Spaltung angeordnete MTBE Synthese rezykliert.
Der feuchte Isobutenstrom aus der Extraktionskolonne kann in einer oder mehreren weiteren Destillationskolonnen durch Abtrennung von Wasser und optional von DME zu
trockenem Isobuten aufgearbeitet werden. Das trockene Isobuten wird dabei als
Sumpfprodukt erhalten. Im Kondensationssystem am Kopf der Kolonne kann nach einer Phasentrennung Wasser flüssig und DME mit Restmengen Isobuten flüssig und/oder gasförmig abgezogen werden. Eine für die Trocknung bevorzugt eingesetzte
Destillationskolonne weist vorzugsweise von 30 bis 80 theoretische Trennstufen, bevorzugt von 40 bis 65 theoretische Trennstufen auf. Das Rücklaufverhältnis beträgt, in Abhängigkeit von der realisierten Stufenzahl und der erforderlichen Reinheit des Isobutens, vorzugsweise kleiner 60, bevorzugt kleiner 40.
Der Betriebsdruck der Kolonne kann vorzugsweise zwischen 0.1 und 2.0 MPa(abs) eingestellt werden. Der am Kopf der Kolonne erhaltene DME-reiche Strom kann, falls nötig, weiter destillativ getrennt werden.
Besonders bevorzugt wird im erfindungsgemäßen Verfahren eine Kolonne zur
Abtrennung von DME und Wasser mit einem Dekanter zur Abtrennung von Wasser, der sich im Seitenstrom der Kolonne befindet, verwendet. Durch die Einbindung des
Dekanters im Seitenstrom der Kolonne können Isobutenverluste minimiert werden. Ein derartiges Verfahren ist beispielsweise auch in der Anmeldung DE10238370
beschrieben. Der feuchte Isobutenstrom aus der Extraktion wird dabei, gegebenenfalls nach Abtrennung von restlichem heterogenem Wasser, beispielsweise durch einen Dekanter oder Koaleszer, in eine Kolonne eingespeist. Am Kopf der Kolonne wird DME und im Sumpf trockenes Isobuten erhalten. Unterhalb oder oberhalb der
Edukteinleitungsstelle wird ein Seitenstrom aus der Kolonne flüssig entnommen, der in einen Dekanter geführt wird. Im Dekanter wird die wässrige Phase von der an Wasser verarmten organischen Phase getrennt. Das Wasser wird ausgeschleust, die
organische Phase in die Kolonne zurückgeführt. Der Abzug des Stroms zum
Seitendekanter erfolgt dabei bevorzugt unterhalb des Kolonnenzulaufs, die
Rückführung des Stroms vom Dekanter in die Kolonne unterhalb der Entnahmestelle. Die Kolonne weist dabei vorzugsweise eine Trennstufenzahl von 30 bis 80
theoretischen Trennstufen, bevorzugt von 40 bis 65 theoretischen Trennstufen auf. Das zu reinigende Isobuten wird vorzugsweise oberhalb der 15 bis 30 Trennstufe, jeweils
gezählt von oben, eingespeist. Bevorzugt wird zwei bis fünf Trennstufen oberhalb der Einspeisestelle das gesamte Kondensat dieser Trennstufe abgezogen und in den Dekanter geleitet. Nach Abtrennung des Wassers wird die organische Phase ein bis zwei Trennstufen tiefer in die Kolonne zurückgeführt. Das Rücklaufverhältnis der Kolonne beträgt, in Abhängigkeit von der realisierten
Stufenzahl und der erforderlichen Reinheit des Isobutens, vorzugsweise kleiner 60, bevorzugt kleiner 40. Der Betriebsdruck der Kolonne liegt vorzugsweise zwischen 0.1 und 2.0 MPa(abs), besonders bevorzugt zwischen 1 .0 und 1 .5 MPa(abs).
Die im Isobuten enthaltenen linearen Butene (1 -Buten, 2-Butene) sind von diesem technisch sinnvoll nicht abtrennbar. Die Bildung der linearen Butene erfolgt unter anderem aus der Spaltung von 2-Methoxybutan, welches im MTBE enthalten sein kann. Daher kann durch vollständige Abtrennung von 2-Methoxybutan vor der Spaltung die Bildung der linearen Butene vermieden werden. Um die Destillationskosten zu begrenzen, kann es jedoch vorteilhaft sein, eine geringe Konzentration an 2- Methoxybutan zuzulassen. Je nach Reinheitsanforderungen sind aber bei Bedarf auch geringere Konzentrationen der Nebenkomponenten erreichbar.
Das mit dem erfindungsgemäßen Verfahren hergestellte Isobuten kann z. B. zur
Herstellung von Diisobuten, Isobuten-Oligomeren, Polyisobutylen, Butylkautschuk, t- Butylaromaten, Methacrylsäure, Methylmethacrylat, Methallylchlorid, oder
Methallylsulfonaten eingesetzt werden. Insbesondere kann es vorteilhaft sein, sowohl das bei der Spaltung erhaltene Methanol als auch das Isobuten zur Herstellung von Methylmethacrylat einzusetzen.
Das im erfindungsgemäßen Verfahren für die MTBE- Spaltung gemachte Vorgehen lässt sich auch auf den Einsatz anderer Alkohole übertragen. Dies betrifft vor allem die Synthese und Spaltung von Ethyl-te/t-butylether (Einsatz von Ethanol als Alkohol), n- Propyl-te/t-butylether (Einsatz von n-Propanol als Alkohol), n-Butyl-terf.-butylether (Einsatz von n-Butanol als Alkohol) und iso-Butyl-terf.-butylether (Einsatz von iso- Butanol als Alkohol). Bei all diesen Alkoholen kommt zudem hinzu, dass aus ihnen in
der Spaltung durch Abspaltung von Wasser Olefine gebildet werden können, wodurch ein zusätzlicher Eintrag von Wasser in den Prozess erfolgt.
Aufgrund der engen Analogie zwischen der Etherspaltung und Alkoholspaltung lässt sich das Gesagte auch auf die Spaltung von TAO übertragen.
Bevorzugt wird in der Gasphase tert.-Butanol (TBA) in Isobuten und Wasser gespalten und zwar besonders bevorzugt bei diesen Betriebsbedingungen: a) Temperatur von 120°C bis 400°C, bevorzugt 180°C bis 350°C;
b) Druck von 0.1 MPa (absolut) bis 2 MPa (absolut), bevorzugt 0.5 bis 0.8
MPa (absolut);
c) Raumgeschwindigkeit (WHSV) von 0.1 h"1 bis 10 h"1, bevorzugt von 1 h"1 bis 5 h"1.
Der in der TAO-Spaltung eingesetzte Katalysator ist in derselben Weise herstellbar wie der Katalysator, der für die ATBE-Spaltung beschrieben wurde.
Die nachfolgenden Beispiele sollen die vorliegende Erfindung veranschaulichen.
Beispiele
Herstellung Bor-haltiger Silicate vom Struktur-Typ MFI:
Variante 1
90 g TPAOH (Tetrapropylammoniumhydroxid), 1 17 g S1O2 in Form von kolloidalem Silizium (LUDOX AS 40 der Firma Sigma Aldrich), 10 g H3BO3 (Borsäure) und 901 g destilliertes Wasser werden in einem Becherglas zu einer Suspension verarbeitet. Die angesetzte Lösung wird für weitere fünf Stunden gerührt. In diesem Zeitraum stellt sich ein pH-Wert zwischen 9.3 und 9.6 ein. Anschließend wird die Synthese-Lösung in einen doppelwandigen Rührreaktor von Büchi® mit PTFE-Beschichtung überführt und für 24 Stunden bei 185 °C unter autogenem Druck gerührt. Nach der Hydrothermalsynthese wird der Feststoff in der Suspension über eine Vakuumfiltration gewonnen. Der zurückbleibende Filterkuchen wird wiederholt mit destilliertem Wasser gewaschen und anschließend kalziniert. Die Kalzinierung des Feststoffs erfolgt in einem Muffelofen im Stickstoffstrom (200 ml/min). Die Aufheizrate beträgt 1 °C/min, die Endtemperatur von 500 °C wird fünf Stunden gehalten.
Variante 2
79 g TPABr (Tetrapropylammoniumbromid), 6 g NaOH, 72 g SiO2 (LUDOX AS 30 der Firma Sigma Aldrich), 4 g H3BO3 und 524 g destilliertes Wasser werden in einem Becherglas zu einer Suspension verarbeitet. Es stellt sich ein pH-Wert von 12.57 ein. Anschließend wird die Synthese-Lösung in einen Rührreaktor überführt und für 24 Stunden bei 165 °C unter autogenem Druck gerührt. Nach der Hydrothermalsynthese wird der Feststoff in der Suspension über eine Überdruckfiltration gewonnen. Der zurückbleibende Filterkuchen wird wiederholt mit destilliertem Wasser gewaschen und im Anschluss kalziniert. Die Kalzinierung des Feststoffs erfolgt in einem Muffelofen im Luftstrom (200 ml/min). Die Aufheizrate beträgt 1 °C/min, die Endtemperatur von 450 °C wird acht Stunden gehalten. Zum lonenaustausch wird 5 g des feinen Pulvers in drei Durchgängen für zwei Stunden bei Raumtemperatur mit einer Lösung, bestehend aus
0.1 molare NH CI und 1 molarer NH OH, behandelt. Unter ständigem Rühren stellt sich ein pH-Wert zwischen 10 und 1 1 ein. Nach abgeschlossenem lonenaustausch wird der Feststoff erneut über eine Überdruckfiltration von der Suspension separiert.
Anschließend wird der Filterkuchen mit 1 molarer NH OH einer Diffusionswäsche unterzogen. In einem letzten Schritt wird der gewonnene Feststoff in einem Muffelofen im Luftstrom (200 ml/min) kalziniert (Aufheizrate: 1 °C/min; Endtemperatur: 450 °C; Dauer: 8 Stunden).
Modifizierung der Bor-haltigen Silicate:
Beispiel 1 3 g des nach Variante 2 hergestellten Feststoffs werden mit 300 ml destilliertem Wasser in einen Doppelmantel-Behälter aus Glas überführt. Es folgt die Zugabe von 0.01 molarer HCl, so dass je nach Zielsetzung pH-Werte von 1 bis 5 eingestellt werden können. Die Lösung wird unter Einsatz eines Magnetrührers über die gesamte
Behandlungszeit gerührt und über einen angeschlossenen Thermostaten
(Wärmeträgeröl: Ethylenglykol) auf 20 bis 80 °C temperiert. Nach 24 Stunden wird die Suspension auf Umgebungstemperatur abgekühlt und je nach Partikelgröße über Vakuum- oder Überdruckfiltration filtriert. Der hieraus gewonnene Feststoff wird wiederholt mit destilliertem Wasser gewaschen und in einem letzten Schritt in einem Muffelofen im Stickstoff- bzw. Luftstrom (200 ml/min) bei 350 °C (Aufheizrate: 7 °C/min) für 5 Stunden kalziniert.
Beispiel 2
3 g des nach Variante 1 hergestellten Feststoffs werden mit 300 ml destilliertem Wasser in einen Doppelmantel-Behälter aus Glas überführt. Es folgt die Zugabe von 85 %-iger H3PO4, so dass je nach Zielsetzung pH-Werte von 1 bis 5 eingestellt werden können. Die Lösung wird unter Einsatz eines Magnetrührers über die gesamte Behandlungszeit bei Raumtemperatur gerührt. Nach 24 Stunden wird der Feststoff je nach Partikelgröße über Vakuum- oder Überdruckfiltration filtriert, mit destilliertem Wasser gewaschen und
kalziniert. Die Kalzinierung erfolgt in einem Muffelofen im Stickstoff- bzw. Luftstrom (200 ml/min) bei 350 °C (Aufheizrate: 7 °C/min). Zur Entfernung der überschüssigen H3PO4 werden die Proben nach Abkühlen auf Raumtemperatur mehrmals abwechselnd mit destilliertem Wasser gewaschen und filtriert. Zum Schluss wird die Kalzinierung bei 350 °C (Aufheizrate: 7 °C/min) im Stickstoff- bzw. Luftstrom wiederholt.
Erfindungsgemäße Spaltung von MTBE:
Beispiel 3
Die Reaktionskomponenten werden aus getrennten Vorlagen mengen- bzw.
druckgeregelt über einen Verdampfer auf die Katalysatorbetten gefahren. Die Analyse der Reaktionsprodukte erfolgt mittels online-Gaschromatographie.
Durch Variation der Reaktortemperatur zwischen 200 und 230 °C sowie der
Raumgeschwindigkeit (WHSV) zwischen 0.005 und 5 h"1 werden Umsätze zwischen 10 und 100 % eingestellt.
In Tabelle 1 werden die Selektivitäten bei Umsätzen um 88 % verglichen, in Tabelle 2 bei Umsätzen um 98 %, in beiden Tabellen sind die erfindungsgemäßen Katalysatoren sind mit * gekennzeichnet.
Material Modifizierung T P Verweilzeit Umsatz S(DME) S(C8)
°C bar s % % %
AAS 225 7 33 87.6 1 .84 0.08
ZSM-5 90.0 1 .7 0.9
Zeolith Y 90.0 5 0.1
* B-ZSM-5
225 7 40 88.4 1 .31 0.01 Variante 1
* B-ZSM-5
250 7 40 87.9 0.25 0.01 Variante 2
* B-ZSM-5
HCl 225 7 28 88.6 0.34 0.1 Variante 1
* B-ZSM-5
HCl
Variante 2
* B-ZSM-5 H3PO4 250 6 45 80.1 0.21 0.02 Variante 1
* B-ZSM-5 H3PO4
Variante 2
Tabelle 1 Selektivitäten bei MTBE Umsätzen von 88%
Tabelle 2 Selektivitäten bei MTBE Umsätzen von 98%
Erfindungsgemäße Spaltung von TBA:
Zur Testung der Katalysatorsysteme für die TBA-Spaltung wurde eine
Hochdurchsatzapparatur betrieben. Diese ermöglicht die Testung von Katalysatoren in zwölf parallel geschalteten Reaktoren. Aus einer 6 I TBA- Vorlage gelangt das Edukt (TBA/Wasser-Azeotrop mit ca. 12,3 % Wasser-Anteil) über eine Rohrleitung mit einem Druck von 10 bar(ü) zum
Massendurchflussregler FIC-101 , einem LIQUI-FLOW® der Firma Bronkhorst. Über die Massendurchflussregler, EL-FLOW® (Bronkhorst), FIC-102 und FIC-103 wird Stickstoff zur Verdünnung des Edukts bzw. zur Spülung der Apparatur gefahren. Der durch eine Rückschlagarmatur gesicherte Eduktstrom gelangt in den elektrisch beheizten Verdampfer. Der Verdampfer ist ein aus Edelstahl gefertigtes Rohr (200 mm x 20 mm), welches mit 3 mm Glaskugeln befüllt ist. Hier wird die gewünschte
Reaktionstemperatur eingestellt. Diese Temperatur wird nach dem Verdampfer bis zur Online-Analytik über elektrische Beheizungen der Hauptströme gehalten. Das Edukt wird nach dem Verdampfer über ein Verteilersystem, dem so genannten Manifold der Firma VICI®, bestückt mit Restriktoren einheitlich in zwölf Ströme aufgeteilt. Die Restriktoren, auch Durchflussbegrenzer genannt, die eine Länge von 200 mm und einen Innendurchmesser von 0.1 mm aufweisen, sind so ausgelegt, dass der
Druckverlust über diese dreimal so groß ist wie über die nachfolgenden
Anlagenbestandteile. Diese Einstellung gewährleistet, dass Druckverlustschwankungen in der Anlage, vor allem hervorgerufen durch unterschiedliche Eigenschaften der Katalysatorschüttungen in den Reaktoren, keine Auswirkung auf die Gleichverteilung des Volumenstroms haben. Nach Aufteilung des Eduktstroms in zwölf gleiche
Volumenströme gelangt das Edukt in die Reaktoren, die sich in einem Ofen von Agilent Technologies befinden. In diesem Ofen liegen isotherme Bedingungen vor, so dass auch hier gewährleistet ist, dass alle Reaktoren unter gleichen Betriebsbedingungen operieren.
Die Ausgangsleitungen der Reaktoren werden gebündelt zu einem Schaltventil geführt. Es handelt sich hierbei um ein 12-Port-Schaltventil von VICI®, welches die Selektion eines Stromes aus einem Reaktor und die anschließende Zuführung zum online geschalteten Gaschromatographen ermöglicht. Die restlichen elf Gasströme werden zusammengeführt und in die Abgasaufreinigung geleitet. Hierzu werden Hochsieder über einen Liebigkühler auskondensiert und über die Lösemittelabfälle entsorgt. Die Niedrigsieder werden ausreichend mit Stickstoff verdünnt und der Abgasleitung im Abzug zugeführt. Da die Reaktion bei verschiedenen Drücken untersucht wird, wird ein elektronischer Drucksensor PIC-102, EL-PRESS® (Bronkhorst), zur kontinuierlichen Regelung des Druckes in der Anlage verwendet.
Die Analyse der Gasphase erfolgt für beide Anlagen online über einen
Gaschromatographen (HP 6890) ausgestattet mit einem Flammen-Ionisations-Detektor (FID). Als Trennsäule wird eine HP-1 Methylsiloxan Säule von Agilent (Länge: 15 m; Dicke: 0.25 mm, Filmdicke: 1 μιτι) mit einer nachgeschalteten HP-AL/S von Agilent (Länge: 30 m; Dicke:0.25 mm, Filmdicke: 5 μιτι) eingesetzt. Die Verwendung von zwei verschiedenen Säulen erfüllt die hohen Anforderung an die Trennleistung und ermöglicht damit die Auftrennung aller bekannten und wichtigen Produkte der MTBE- Spaltung. Die HP-1 eignet sich zur Trennung von C4 - C8-Verbindungen. Die HP-AL/S (Plot) eignet sich in diesem Stoffsystem zur Trennung von C4-Kohlenwasserstoffen. Die Analyse beginnt mit einer Starttemperatur von 35 °C im GC-Ofen, die für 2 Minuten gehalten wird. Anschließend wird mit 30 °C/min bis auf 100 °C aufgeheizt und die Endtemperatur für 14 Minuten gehalten, bevor der Ofen wieder abkühlt, um die nächste Analyse zu starten. Mit Aufheiz- und Rückkühlphase ergibt sich somit eine
Analysendauer von etwa 21 Minuten. Die zusätzliche Variation des Volumenstroms durch die Säule ermöglicht eine bessere Trennung der C4-Verbindungen bei gleichzeitiger Optimierung der Analysendauer.
Beispiel 4
Zur Testung von verschiedenen Katalysatorsystemen werden zu Beginn einer
Versuchsreihe die zwölf Reaktoren mit ausgewählten Proben erfindungsgemäßer und nicht erfindungsgemäßer Katalysatoren gefüllt. Zum Vergleich werden als nicht erfindungsgemäße Katalysatoren verschiedene amorphe und kristalline Alumosilikate verwendet. Die Ein- und Ausgänge eines jeden Reaktors werden mit Quarzwolle versehen. Für die aktive Schüttung werden 0.2 g Katalysator mit 0.4 g granuliertem Quarz optisch verdünnt. In jeder Versuchsreihe werden zur Erhöhung der statistischen Sicherheit die zu untersuchenden Katalysatoren redundant eingesetzt. Zudem wird jedes Mal ein Referenzsystem mitgefahren, so dass die Versuchsreihen untereinander vergleichbar sind. Als Referenzsystem dient hier ein klassisches amorphes Alumosilikat mit Magnesium-Dotierung (AAS). In jeder Versuchsreihe wird ein Reaktor eingesetzt, der ausschließlich mit Inertmaterial (Quarzbruch) gefüllt ist. Die Besonderheit beim Anfahren einer Hochdurchsatzapparatur ist die Gewährleistung identischer
Volumenströme über alle Reaktoren. Hierzu wird nach Einsatz der mit Katalysator gefüllten Reaktoren Stickstoff mit einem definierten Volumenstrom über die Anlage gefahren. Die einzelnen Volumenströme der Reaktoren werden am Ausgang des Online-Gaschromatographen durch das manuelle Betätigen des Schaltventils bestimmt. Somit sind die Massenströme über die einzelnen Reaktoren auch während des
Versuches bekannt. Durch Einstellen der Reaktortemperatur zwischen 289 und 330 °C sowie der Raumgeschwindigkeit (WHSV) wird der Reaktionsumsatz variiert.
In Tabelle 3 werden die Umsätze und Selektivitäten bei gleichen Reaktionsbedingungen (TR= 289°C, p=7.02 bar, V= 1 .4±0.2 g/h) verglichen. Die erfindungsgemäßen
Katalysatoren sind mit * gekennzeichnet.
Material Modifizierung T P Verweilzeit Umsatz S(IBEN) S(C8)
°C bar s % % %
289 7.02 99.91 99.21 0.78
AAS
329 7.02 99.95 96.79 3.00
B-ZSM-5
* 289 7.02 69.48 99.21 0.66 Variante 1 329 7.02 99.89 99.09 0.63
B-ZSM-5
* 288 7.02 99.91 99.43 0.15
HCl
Variante 1 329 7.02 99.95 99.67 0.10
Tabelle 3 Selektivitäten bei nahezu vollständigen TBA-Umsätzen
Claims
1 . Verfahren zur Spaltung eines Alkyl-tert.-alkylethers der Formel II
R2
/
HC— C
/ \
R1 R3 | und einen Alkohol der Formel III
R-OH III wobei in den Formeln I bis III der Rest R für einen Alkylrest mit 1 oder 2
Kohlenstoffatom(en) steht, der Rest R1 für H, Methyl- oder Ethylrest steht und die Reste R2 und R3 für Methyl- oder Ethylreste stehen, wobei die Reste R2 und R3 gleich oder unterschiedlich sein können, durchgeführt in Gegenwart eines heterogenen Katalysators, welcher mindestens ein Bor-haltiges Silicat zeolithischer Struktur enthält,
dadurch gekennzeichnet,
dass die Struktur des Bor-haltigen Silicats vom Typ MFI ist.
2. Verfahren nach Anspruch 1 gekennzeichnet durch den Einsatz eines
Katalysators, der durch die nachfolgenden Schritte erhältlich ist: a) Bereitstellung einer wässrigen Suspension enthaltend mindestens einen Bor-haltiges Silcicat mit zeolitischer Struktur des Typs MFI, b) Zugabe von Säure zur Einstellung eines pH-Wertes zwischen 1 und 5, c) Rühren der Suspension,
d) Isolierung des erhaltenen Feststoffs,
e) optionales Waschen des Feststoffs,
f) Kalzinieren des Feststoffs.
3. Verfahren nach Anspruch 1 oder 2,
dadurch gekennzeichnet,
dass der Katalysator S1O2 und B2O3 enthält, wobei das molare Verhältnis von S1O2 zu B2O3 zwischen 2 und 4, bevorzugt zwischen 2.3 und 3.7 liegt.
4. Verfahren nach mindestens einem der vorhergehenden Ansprüche,
dadurch gekennzeichnet,
dass der Katalysator einen Aluminium-Gehalt kleiner 0.1 Gew.-% aufweist, insbesondere, dass der Katalysator frei von Aluminium ist.
5. Verfahren nach mindestens einem der vorhergehenden Ansprüche,
dadurch gekennzeichnet,
dass der Katalysator einen Bor-Gehalt kleiner 1 Gew.-% aufweist,
insbesondere, dass der Katalysator einen Bor-Gehalt kleiner 0.5 Gew.-% aufweist.
6. Verfahren nach mindestens einem der vorhergehenden Ansprüche,
dadurch gekennzeichnet,
dass der Katalysator eine Oberfläche gemessen nach BET zwischen 300 m2/g und 500 m2/g aufweist; insbesondere, dass die BET-Oberfläche des
Katalysators zwischen 330 m2/g und 470 m2/g, besonders bevorzugt zwischen 370 m2/g und 430 m2/g liegt.
7. Verfahren nach mindestens einem der Ansprüche 2 bis 6,
dadurch gekennzeichnet, dass die Einstellung des pH-Wertes durch Zugabe von Salzsäure oder von Phosphorsäure erfolgt.
8. Verfahren nach mindestens einem der Ansprüche 2 bis 7,
dadurch gekennzeichnet,
dass das Rühren der Suspension bei einer Temperatur von maximal 80°C, bevorzugt von maximal 25°C erfolgt.
9. Verfahren nach mindestens einem der Ansprüche 2 bis 8,
dadurch gekennzeichnet,
dass das Rühren der Suspension für einen Zeitraum von mindestens 24 Stunden erfolgt.
10. Verfahren nach mindestens einem der Ansprüche 2 bis 9, bei welchem der Feststoff gewaschen wird,
dadurch gekennzeichnet,
dass der Feststoff mit Wasser gewaschen wird, insbesondere, dass der Feststoff wiederholt mit Wasser gewaschen wird.
1 1 . Verfahren nach mindestens einem der Ansprüche 2 bis 10,
dadurch gekennzeichnet,
dass das Kalzinieren des Feststoffs bei einer Temperatur von maximal 500 °C erfolgt, bevorzugt, dass die Kalziniertemperatur maximal 350°C beträgt.
12. Verfahren nach mindestens einem der Ansprüche 2 bis 1 1 ,
dadurch gekennzeichnet,
dass das Kalzinieren des Feststoffs in Stickstoff-haltiger Atmosphäre erfolgt; vorzugweise, dass sie im reinen Stickstoffstrom oder im Luftstrom erfolgt.
13. Verfahren nach mindestens einem der Ansprüche 2 bis 12,
dadurch gekennzeichnet,
dass der Katalysator vor Einsatz in der Spaltung mit Methanol und/oder einem anderen bevorzugt einwertigen Alkohol behandelt wird.
14. Verfahren nach mindestens einem der Ansprüche 1 bis 13,
dadurch gekennzeichnet,
dass Methyl-tert.-butylether (MTBE) zu Isobuten und Methanol gespalten wird.
15. Verfahren nach Anspruch 14,
dadurch gekennzeichnet,
dass die Spaltung des MTBE in der Gasphase bei den folgenden Bedingungen erfolgt:
a) Temperatur von 120°C bis 400°C, bevorzugt 180°C bis 350°C;
b) Druck von 0.1 MPa (absolut) bis 2 MPa (absolut), bevorzugt 0.5 bis 0.8 MPa (absolut);
c) Raumgeschwindigkeit (WHSV) von 0.1 h"1 bis 5 h"1, bevorzugt von 1 h"1 bis
-1
3 h
16 Verfahren zur Spaltung eines tert.-Alkylalkohols der Formel II
R2
/
HC=C
/ \
R1 R3 | und in Wasser, wobei in den Formeln I bis II der Rest R für H steht, der Rest R1 für H, Methyl- oder Ethylrest steht und die Reste R2 und R3 für Methyl- oder Ethylreste stehen, wobei die Reste R2 und R3 gleich oder unterschiedlich sein können, durchgeführt in Gegenwart eines heterogenen Katalysators, welcher mindestens ein Bor-haltiges Silicat zeolithischer Struktur enthält, dadurch gekennzeichnet, dass die Struktur des Bor-haltigen Silicats vom Typ MFI ist.
17. Verfahren nach Anspruch 16,
dadurch gekennzeichnet,
dass tert.-Butanol (TBA) zu Isobuten und Wasser gespalten wird.
18. Verfahren nach Anspruch 17,
dadurch gekennzeichnet,
dass die Spaltung des TBA in der Gasphase bei den folgenden Bedingungen erfolgt:
a) Temperatur von 120°C bis 400°C, bevorzugt 180°C bis 350°C;
b) Druck von 0.1 MPa (absolut) bis 2 MPa (absolut), bevorzugt 0.5 bis 0.8 MPa (absolut);
c) Raumgeschwindigkeit (WHSV) von 0.1 h"1 bis 10 h"1, bevorzugt von 1 h bis 5 h"1.
Verfahren nach Anspruch 16, 17 oder 18,
dadurch gekennzeichnet,
dass der in einem der Verfahren nach Anspruch 2 bis 12 verwendete Katalysator eingesetzt wird.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102012217924.0A DE102012217924A1 (de) | 2012-10-01 | 2012-10-01 | Spaltung von Ethern und Alkoholen unter Verwendung von Bor-Zeolithen |
| DE102012217924.0 | 2012-10-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2014053363A1 true WO2014053363A1 (de) | 2014-04-10 |
Family
ID=49230793
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2013/069846 WO2014053363A1 (de) | 2012-10-01 | 2013-09-24 | Spaltung von ethern und alkoholen unter verwendung von bor-zeolithen |
Country Status (4)
| Country | Link |
|---|---|
| AR (1) | AR092767A1 (de) |
| DE (1) | DE102012217924A1 (de) |
| TW (1) | TW201425271A (de) |
| WO (1) | WO2014053363A1 (de) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114100675B (zh) * | 2021-11-29 | 2023-10-10 | 辽宁石油化工大学 | 含硼分子筛的制备方法及在丁烯双键异构反应中的应用 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4666692A (en) * | 1978-06-22 | 1987-05-19 | Snamprogetti, S.P.A. | Silica-based synthetic material containing titanium in the crystal lattice and process for its preparation |
| EP0284677A1 (de) | 1987-03-31 | 1988-10-05 | Mobil Oil Corporation | Vorbereitung eines Katalysators |
| DE2953858C2 (de) | 1978-06-22 | 1995-03-09 | Snam Progetti | Mit Bor modifizierte Kieselsäuren, deren Herstellung und Verwendung |
| DE10238370A1 (de) | 2002-08-22 | 2004-03-04 | Oxeno Olefinchemie Gmbh | Verfahren zur Herstellung von Isobuten aus technischen Methyl-tert.-butylether |
| DE102006040433A1 (de) | 2006-08-29 | 2008-03-13 | Oxeno Olefinchemie Gmbh | Verfahren zur Herstellung von Isoolefinen |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102012215956A1 (de) | 2012-09-10 | 2014-03-13 | Evonik Industries Ag | Methanolbehandlung von Alumosilicat-haltigen ATAE-Spaltkatalysatoren |
-
2012
- 2012-10-01 DE DE102012217924.0A patent/DE102012217924A1/de not_active Withdrawn
-
2013
- 2013-09-24 WO PCT/EP2013/069846 patent/WO2014053363A1/de active Application Filing
- 2013-09-27 TW TW102135081A patent/TW201425271A/zh unknown
- 2013-10-01 AR ARP130103558A patent/AR092767A1/es unknown
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4666692A (en) * | 1978-06-22 | 1987-05-19 | Snamprogetti, S.P.A. | Silica-based synthetic material containing titanium in the crystal lattice and process for its preparation |
| DE2953858C2 (de) | 1978-06-22 | 1995-03-09 | Snam Progetti | Mit Bor modifizierte Kieselsäuren, deren Herstellung und Verwendung |
| EP0284677A1 (de) | 1987-03-31 | 1988-10-05 | Mobil Oil Corporation | Vorbereitung eines Katalysators |
| DE10238370A1 (de) | 2002-08-22 | 2004-03-04 | Oxeno Olefinchemie Gmbh | Verfahren zur Herstellung von Isobuten aus technischen Methyl-tert.-butylether |
| DE102006040433A1 (de) | 2006-08-29 | 2008-03-13 | Oxeno Olefinchemie Gmbh | Verfahren zur Herstellung von Isoolefinen |
Non-Patent Citations (1)
| Title |
|---|
| KULKARNI S B ET AL: "Studies in the synthesis of ZSM-5 zeolites", ZEOLITES, ELSEVIER SCIENCE PUBLISHING, US, vol. 2, no. 4, 1 October 1982 (1982-10-01), pages 313 - 318, XP002688624, ISSN: 0144-2449, DOI: 10.1016/S0144-2449(82)80077-8 * |
Also Published As
| Publication number | Publication date |
|---|---|
| AR092767A1 (es) | 2015-04-29 |
| DE102012217924A1 (de) | 2014-04-03 |
| TW201425271A (zh) | 2014-07-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101217915B1 (ko) | 에탄올로부터의 올레핀의 제조 방법 | |
| EP1903019B1 (de) | Verfahren zur Herstellung von Isoolefinen | |
| EP1894908B1 (de) | Verfahren zur Spaltung von Methyl-tertiär-butylether | |
| DE60310898T2 (de) | Chabazit mit hohem gehalt an siliciumdioxid, dessen synthese und verwendung zur umwandlung von sauerstoffverbindungen zu olefinen | |
| KR101227221B1 (ko) | 에탄올로부터의 올레핀의 제조 방법 | |
| DE69021588T2 (de) | Verfahren zur herstellung eines äthers. | |
| EP2364285B1 (de) | Reinigung von alkohol vor der verwendung bei vorhandensein eines säurekatalysators | |
| EP1900712B1 (de) | Verfahren zur Spaltung von Methyl-tertiär-butylether | |
| EP1900713B1 (de) | Verfahren zur Spaltung von Methyl-tertiär-butylether | |
| EP2358469A1 (de) | Oligomerisierung von olefinen | |
| DE69003030T2 (de) | Umwandlung von olefinen in ether. | |
| EP2108637A1 (de) | Verfahren zur Herstellung von Olefinen aus Ethanol | |
| WO2014053360A1 (de) | Herstellung von katalysatoren auf basis von bor-zeolithen | |
| EP2528684A1 (de) | Verbesserter katalysator auf zeolithbasis zur herstellung von olefinen und zur oligomerisierung von olefinen | |
| WO2014053363A1 (de) | Spaltung von ethern und alkoholen unter verwendung von bor-zeolithen | |
| EP2108635A1 (de) | Verfahren zur Herstellung von Olefinen aus Ethanol | |
| EP3549671A1 (de) | Verfahren zur herstellung eines strukturselektiven und langzeitstabilen oligomerisierungskatalysators auf basis von nickel-alumosilicat durch fällung |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 13766106 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 13766106 Country of ref document: EP Kind code of ref document: A1 |