Verfahren zur Erhöhung der Trockenfestigkeit von Papier, Pappe und Karton
Beschreibung
Die Erfindung betrifft ein Verfahren zur Herstellung von Papier, Pappe und Karton mit hoher Trockenfestigkeit durch Zugabe mindestens eines kationischen Polymeren und einer polymeren anionischen Verbindung zu einem Papierstoff, Entwässern des Papierstoffs unter Blattbildung und Trocknen der Papierprodukte.
Aus dem CA-Patent 1 1 10 019 ist ein Verfahren zur Herstellung von Papier mit hoher Trockenfestigkeit bekannt, bei dem man zum Papierstoff zunächst ein wasserlösliches kationisches Polymerisat zugibt, danach ein wasserlösliches anionisches Polymerisat dosiert, anschließend den Papierstoff auf der Papiermaschine unter Blattbildung entwässert und die Papierprodukte trocknet. Als anionische Polymerisate kommen bei- spielsweise hydrolysierte Polyacrylamide in Betracht, die bis zu 30 Mol-% Acrylsäure- Einheiten aufweisen können. Als kationische Polymere werden beispielsweise wasserlösliche Homo- und Copolymerisate von kationischen Monomeren wie Vinylpyridin, Vinylimidazolidin, Diallylamine, Ethylenimin sowie basische Acrylate und basische Me- thacrylate eingesetzt. Die basischen (Meth)acrylate können jeweils mit Acrylamid oder Methacrylamid copolymerisiert werden. Diese kationischen Polymeren sowie Polyacrylamide können zu weiteren, für das beschriebene Verfahren geeigneten kationischen Polymeren modifiziert werden, beispielsweise kann man sie einer Mannich-Reaktion oder einem Hofmann-Abbau unterwerfen.
Aus der DE-A 35 06 832 ist ein Verfahren zur Herstellung von Papier mit hoher Trockenfestigkeit bekannt, bei dem man zum Papierstoff zunächst ein wasserlösliches kationisches Polymerisat und anschließend ein wasserlösliches anionisches Polymerisat zugibt. Als anionische Polymerisate kommen beispielsweise Homo- oder Copolymerisate von ethylenisch ungesättigten C3 - Cs-Carbonsäuren in Betracht. Die Copo- lymerisate enthalten mindestens 35 Gew.-% einer ethylenisch ungesättigten C3 - C5- Carbonsäure (z.B. Acrylsäure) einpolymerisiert. Als kationische Polymerisate werden in den Beispielen Polyethylenimin, Polyvinylamin, Polydiallyldimethylammoniumchlorid und mit Epichlorhydrin vernetzte Kondensationsprodukte aus Adipinsäure und Diethy- lentriamin beschrieben. Auch die Verwendung von partiell hydrolysierten Homo- und Copolymerisaten des N-Vinylformamids ist in Betracht gezogen worden.
Die JP-A 1999-140787 betrifft ein Verfahren zur Herstellung von Wellpappe, wobei man zur Verbesserung der Festigkeitseigenschaften eines Papierprodukts zum Papierstoff 0,05 bis 0,5 Gew.-%, bezogen auf trockenen Papierstoff, eines Polyvinylamins, das durch Hydrolyse von Polyvinylformamid mit einem Hydrolysegrad von 25 bis
100 % zugänglich ist, in Kombination mit einem anionischen Polyacrylamid zugibt, den Papierstoff dann unter Blattbildung entwässert und das Papier trocknet.
Aus der WO 03/052206 ist ein Papierprodukt mit verbesserten Festigkeitseigenschaften bekannt, dass dadurch erhältlich ist, dass man auf die Oberfläche eines Papierprodukts ein Polyvinylamin und eine polymere anionische Verbindung, die mit Po- lyvinylamin einen Polyelektrolytkomplex bilden kann, oder eine polymere Verbindung mit Aldehydfunktionen wie Aldehydgruppen enthaltende Polysaccharide aufbringt. Man erhält nicht nur eine Verbesserung der Trocken- und Nassfestigkeit des Papiers, sondern beobachtet auch eine Leimungswirkung der Behandlungsmittel.
Aus der WO 2004/061235 ist ein Verfahren zur Herstellung von Papier, insbesondere Tissue, mit besonders hohen Naß- und/oder Trockenfestigkeiten bekannt, bei dem man zum Papierstoff zunächst ein wasserlösliches kationisches Polymerisat zugibt, dass mindestens 1 ,5 meq/g Polymer an primären Aminofunktionalitäten enthält und ein Molekulargewicht von wenigstens 10.000 Dalton aufweist. Besonders hervorgehoben werden hierbei partiell- und vollhydrolysierte Homopolymerisate des N-Vinylformamids. Anschließend wird ein wasserlösliches anionisches Polymerisat zugegeben, dass anionische und/oder aldehydische Gruppen enthält.
In der DE-A 10 2004 056 551 wird ein weiteres Verfahren zur Verbesserung der Trockenfestigkeit von Papier beschrieben. Bei diesem Verfahren erfolgt eine getrennte Zugabe eines Vinylamineinheiten enthaltenden Polymeren und einer polymeren anionischen Verbindung zu einem Papierstoff, Entwässern des Papierstoffs und Trocknen der Papierprodukte, wobei man als polymere anionische Verbindung mindestens ein Copolymerisat einsetzt, das erhältlich ist durch Copolymerisieren von
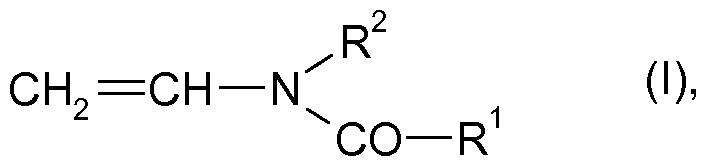
(a) mindestens eines N-Vinylcarbonsäureamids der Formel
in der R1, R2 = H oder d- bis Cβ-Alkyl bedeuten,
(b) mindestens eines Säuregruppen enthaltenden monoethylenisch ungesättigten Monomeren und/oder deren Alkalimetall-, Erdalkalimetall- oder Ammoniumsalzen und gegebenenfalls
(c) anderen monoethylenisch ungesättigten Monomeren, und gegebenenfalls (d) Verbindungen, die mindestens zwei ethylenisch ungesättigte Doppelbindungen im Molekül aufweisen.
Aus der WO 2006/075115 ist die Verwendung von Hofmann-Abbauprodukten von Co- polymeren des Acrylamids oder Methacrylamids in Kombination mit anionischen PoIy- meren mit einer anionischen Ladungsdichte von > 0,1 meq/g zur Herstellung von Papier und Karton mit einer hohen Trockenfestigkeit bekannt.
In WO 2006/120235 wird ein Verfahren zur Herstellung von Papieren mit einem Füllergehalt von mindestens 15 Gew.-% beschrieben, bei dem Füller und Fasern gemeinsam mit kationischen und anionischen Polymeren behandelt werden, wobei die Behandlung abwechselnd mit kationischen und anionischen Polymeren erfolgt und mindestens 3 Schritte umfasst.
Die WO 2006/090076 betrifft ebenfalls ein Verfahren zur Herstellung von Papier und Pappe mit hoher Trockenfestigkeit, wobei dem Papierstoff 3 Komponenten zugesetzt werden:
a) ein Polymer mit primären Aminogruppen und einer Ladungsdichte von > 1 ,0 meq/g b) ein zweites, anderes kationisches Polymer mit einer Ladungsdichte von > 0,1 meq/g, das durch radikalische Polymerisation von kationischen Monomeren er- hältlich ist, und c) ein anionisches Polymer mit einer Ladungsdichte von > 0,1 meq/g.
Der Erfindung liegt die Aufgabe zugrunde, ein weiteres Verfahren zur Herstellung von Papier, Pappe und Karton mit hoher Trockenfestigkeit zur Verfügung zu stellen, wobei die Trockenfestigkeitseigenschaften der Papierprodukte gegenüber denjenigen bekannter Produkte möglichst weiter verbessert sind. Eine weitere Aufgabe der Erfindung besteht darin, gegenüber bekannten Verfahren eine schnellere Entwässerung des Papierstoffs zu erreichen.
Die Aufgaben werden erfindungsgemäß gelöst mit einem Verfahren zur Herstellung von Papier, Pappe und Karton mit hoher Trockenfestigkeit durch Zugabe mindestens eines wasserlöslichen kationischen Polymeren und mindestens einer wasserlöslichen polymeren anionischen Verbindung zu einem Papierstoff, Entwässern des Papierstoffs unter Blattbildung und Trocknen der Papierprodukte, wenn man als wasserlösliche kationische Polymere
(a) Vinylamineinheiten enthaltende Polymere und
(b) Ethylenimineinheiten enthaltende Polymere
in beliebiger Reihenfolge oder als Mischung zu einem Papierstoff dosiert.
Gegenstand der Erfindung sind außerdem Papiere, die nach dem oben beschriebenen Verfahren erhältlich sind.
Polymerisate, die Vinylamineinheiten enthalten, sind bekannt, vgl. die zum Stand der Technik genannten DE-A 35 06 832 und DE-A 10 2004 056551. Bei dem erfindungs-
gemäßen Verfahren setzt man als (a) Vinylamineinheiten enthaltende Polymere beispielsweise die Reaktionsprodukte ein, die erhältlich sind
durch Polymerisieren mindestens eines Monomeren der Formel
in der R1, R2 = H oder d- bis C6-Alkyl bedeuten,
und anschließende teilweise oder vollständige Abspaltung der Gruppen -CO-R1 aus den in das Polymerisat einpolymerisierten Einheiten der Monomeren (I) unter Bildung von Aminogruppen
und/oder
durch Hofmann-Abbau von Polymeren, die Acrylamid- und/oder Methacrylamid- einheiten aufweisen.
Als (a) Vinylamineinheiten enthaltende Polymere setzt man beispielsweise die Reakti- onsprodukte ein, die erhältlich sind durch Polymerisieren von
(i) mindestens eines Monomeren der Formel
in der R1, R2 = H oder d- bis C6-Alkyl bedeuten,
(ii) mindestens eines anderen monoethylenisch ungesättigten Monomeren und gegebenenfalls (iii) mindestens eines vernetzend wirkenden Monomeren mit mindestens zwei Doppelbindungen im Molekül
und anschließende teilweise oder vollständige Abspaltung der Gruppen -CO-R1 aus den in das Polymerisat einpolymerisierten Einheiten der Monomeren (I) unter Bildung von Aminogruppen.
Die Vinylamineinheiten enthaltenden Polymerisate können auch amphoter sein, wenn sie eine kationische Gesamtladung aufweisen. Der Gehalt an kationischen Gruppen im Polymeren soll dabei mindestens 5 Mol-%, vorzugsweise mindestens 10 Mol-% über
dem Gehalt an anionischen Gruppen liegen. Solche Polymere sind beispielsweise erhältlich durch Polymerisieren von
(i) mindestens eines Monomeren der Formel
in der R1, R2 = H oder d- bis C6-Alkyl bedeuten,
(N, a) mindestens jeweils einer monoethylenisch ungesättigten Sulfonsäure, einer mo- noethylenisch ungesättigten Phosphonsäure, einer monoethylenisch ungesättigten Carbonsäure mit 3 bis 8 C-Atomen im Molekül und/oder deren Alkalimetall-, Erdalkalimetall- oder Ammoniumsalzen und gegebenenfalls
(N, b) mindestens eines anderen neutralen und/oder eines kationischen Monomeren und gegebenenfalls
(iii) mindestens eines vernetzend wirkenden Monomeren mit mindestens zwei Doppelbindungen im Molekül
und anschließende teilweise oder vollständige Abspaltung von Gruppen -CO-R1 aus den in das Polymerisat einpolymerisierten Monomeren der Formel I unter Bildung von Aminogruppen, wobei der Gehalt an Aminogruppen im Copolymerisat mindestens 5 Mol-% über dem Gehalt an einpolymerisierten Säuregruppen der Monomere (ii,a) be- trägt.
Vorzugsweise setzt man als (a) Vinylamineinheiten enthaltende Polymere die Reaktionsprodukte ein, die durch Polymerisieren von N-Vinylformamid und anschließende Abspaltung von Formylgruppen aus den in das Polymerisat einpolymerisierten Vinyl- formamideinheiten unter Bildung von Aminogruppen erhältlich sind oder man verwendet die Reaktionsprodukte, die durch Copolymerisieren von
(i) N-Vinylformamid und (ii) Acrylnitril
und anschließende Abspaltung von Formylgruppen aus den in das Copolymerisat einpolymerisierten Vinylformamideinheiten unter Bildung von Aminogruppen erhältlich sind.
Von Interesse sind außerdem amphotere Vinylamineinheiten enthaltende Poly-mere, die eine kationische Gesamtladung tragen und die beispielsweise durch Copo- lymerisieren von
(i) N-Vinylformamid,
(N, a) Acrylsäure, Methacrylsäure und/oder deren Alkalimetall-, Erdalkalimetall- oder
Ammoniumsalzen und gegebenenfalls (N, b) Acrylnitril und/oder Methacrylnitril
und anschließende teilweise oder vollständige Abspaltung von Formylgruppen aus dem in das Polymerisat einpolymerisierten N-Vinylformamid unter Bildung von Ami- nogruppen erhältlich sind, wobei der Gehalt an Aminogruppen im Copolymerisat mindestens 5 Mol-% über dem Gehalt an einpolymerisierten Säuregruppen der Monomere (N, a) beträgt.
Beispiele für Monomere der Formel I sind N-Vinylformamid, N-Vinyl-N-methylformamid, N-Vinylacetamid, N-Vinyl-N-methylacetamid, N-Vinyl-N-ethylacetamid, N- Vinylpropionamid und N-Vinyl-N-methylpropionamid und N-Vinylbutyramid. Die Monomeren der Gruppe (i) können allein oder in Mischung bei der Copolymerisation mit den Monomeren der anderen Gruppen eingesetzt werden. Bevorzugt eingesetztes Monomer dieser Gruppe ist N-Vinylformamid.
Diese Polymere können gegebenenfalls modifiziert sein, indem die N-Vinylcarbon- säureamide (i) zusammen mit (ii) mindestens einem anderen monoethylenisch unge- sättigten Monomeren copolymerisiert und die Copolymerisate anschließend unter Bildung von Aminogruppen hydrolysiert werden. Falls bei der Copolymerisation anionische Monomere eingesetzt werden, so wird die Hydrolyse der einpolymerisierten Vi- nylcarbonsäureamideinheiten so weit geführt, dass der molare Überschuß an Amin- einheiten gegenüber den anionischen Einheiten im Polymerisat mindestens 5 Mol-% beträgt.
Beispiele für Monomere der Gruppe (ii) sind Ester von α,ß-ethylenisch ungesättigten Mono- und Dicarbonsäuren mit Ci-C3o-Alkanolen, C2-C3o-Alkandiolen und C2-C30- Aminoalkoholen, Amide von α,ß-ethylenisch ungesättigten Monocarbonsäuren und deren N-Alkyl- und N,N-Dialkylderivate, Nitrile von α,ß-ethylenisch ungesättigten Mono- und Dicarbonsäuren, Ester von Vinylalkohol und Allylalkohol mit C1-C30- Monocarbonsäuren, N-Vinyllactame, stickstoffhaltige Heterocyclen mit α,ß-ethylenisch ungesättigten Doppelbindungen, Vinylaromaten, Vinylhalogenide, Vinylidenhalogenide, C2-C8-Monoolefine und Mischungen davon.
Geeignete Vertreter sind z.B. Methyl(meth)acrylat (diese Schreibweise symbolisiert hier wie auch im folgenden Text sowohl „Acrylate" als auch „Methacrylate"), Methy-
lethacrylat, Ethyl(meth)acrylat, Ethylethacrylat, n-Butyl(meth)acrylat, Isobu- tyl(meth)acrylat, tert.-Butyl(meth)acrylat, tert.-Butylethacrylat, n-Ocytl(meth)acrylat, 1 ,1 ,3,3-Tetramethylbutyl(meth)acrylat, Ethylhexyl(meth)acrylat und Mischungen davon. Geeignete zusätzliche Monomere der Guppe (ii) sind weiterhin die Ester von α,ß- ethylenisch ungesättigten Mono- und Dicarbonsäuren mit Aminoalkoholen, vorzugsweise C2-Ci2-Aminoalkoholen. Diese können am Aminstickstoff d-Cs-monoalkyliert oder — dialkyliert sein. Als Säurekomponente dieser Ester eignen sich z. B. Acrylsäure, Methacrylsäure, Fumarsäure, Maleinsäure, Itaconsäure, Crotonsäure, Maleinsäureanhydrid, Monobutylmaleat und Gemische davon. Bevorzugt werden Acrylsäure, Methac- rylsäure und deren Gemische eingesetzt. Dazu zählen beispielsweise N- Methylaminomethyl(meth)acrylat, N-Methylaminoethyl(meth)acrylat, N, N- Dimethylaminomethyl(meth)acrylat, N,N-Dimethylaminoethyl(meth)acrylat, N, N- Diethylaminoethyl(meth)acrylat, N,N-Dimethylaminopropyl(meth)acrylat, N, N- Diethylaminopropyl(meth)acrylat und N,N-Dimethylaminocyclohexyl(meth)acrylat.
Weiterhin sind als Monomere der Gruppe (ii) geeignet 2-Hydroxyethyl(meth)acrylat, 2- Hydroxyethylethacrylat, 2-Hydroxypropyl(meth)acrylat, 3-Hydroxypropyl(meth)acrylat, 3-Hydroxybutyl(meth)acrylat, 4-Hydroxybutyl(meth)acrylat, 6- Hydroxyhexyl(meth)acrylat und Mischungen davon.
Geeignete zusätzliche Monomere der Gruppe (ii) sind weiterhin Acrylsäureamid, Me- thacrylsäureamid, N-Methyl(meth)acrylamid, N-Ethyl(meth)acrylamid, n- Propyl(meth)acrylamid, N-(n-Butyl)(meth)acrylamid, tert.-Butyl(meth)acrylamid, n- Octyl(meth)acrylamid, 1 ,1 ,3,3-Tetramethylbutyl(meth)acrylamid, Ethylhe- xyl(meth)acrylamid und Mischungen davon.
Darüber hinaus sind als weitere Monomere der Gruppe (ii) N-[2- (Dimethylamino)ethyl]acrylamid, N-[2-(Dimethylamino)ethyl]methacrylamid, N-[3- (Dimethylamino)propyl]acrylamid, N-[3-(Dimethylamino)propyl]methacrylamid, N-[4- (Dimethylamino)butyl]acrylamid, N-[4-(Dimethylamino)butyl]methacrylamid, N-[2-
(Diethylamino)ethyl]acrylamid, N-[2-(Diethylamino)ethyl]methacrylamid und Mischungen davon geeignet.
Weitere Beispiele für Monomere der Gruppe (ii) sind Nitrile von α,ß-ethylenisch unge- sättigten Mono- und Dicarbonsäuren wie beispielsweise Acrylnitril und Methacrylnitril. Die Anwesenheit von Einheiten dieser Monomeren im Copolymerisat führt während bzw. nach der Hydrolyse zu Produkten, die Amidineinheiten aufweisen, vgl. z.B. EP-A 0 528 409 oder DE-A 43 28 975. Bei der Hydrolyse von N-Vinylcarbonsäure- amidpolymer-en entstehen nämlich in einer sekundären Reaktion Amidineinheiten, indem Vinylami-neinheiten mit einer benachbarten Vinylformamideinheit oder - sofern eine Nitrilgruppe als benachbarte Gruppe im Polymerisat vorhanden ist - damit reagieren. Im Folgenden bedeutet die Angabe von Vinylamineinheiten in den amphoteren
Copolymerisaten oder in nicht modifizierten Homo- bzw. Copolymerisaten immer die Summe aus Vinylamin- und Amidineinheiten.
Geeignete Monomere der Gruppe (ii) sind weiterhin N-Vinyllactame und deren Deriva- te, die z. B. einen oder mehrere d-Cβ-Alkylsubstituenten (wie oben definiert) aufweisen können. Dazu zählen N-Vinylpyrrolidon, N-Vinylpiperidon, N-Vinylcaprolactam, N- Vinyl-5-methyl-2-pyrrolidon, N-Vinyl-5-ethyl-2-pyrrolidon, N-Vinyl-6-methyl-2-piperidon, N-Vinyl-6-ethyl-2-piperidon, N-Vinyl-7-methyl-2-caprolactam, N-Vinyl-7-ethyl-2- caprolactam und deren Mischungen.
Weiterhin sind als Monomere der Gruppe (ii) N-Vinylimidazole und Alkylvinylimidazole geeignet, insbesondere Methylvinylimidazole wie beispielsweise 1-Vinyl-2- methylimidazol, 3-VinylimidazolN-oxid, 2- und4-Vinylpyridin-N-oxide sowie betainische Derivate und Quaternisierungsprodukte dieser Monomere sowie Ethylen, Propylen, Isobutylen, Butadien, Styrol, α-Methylstyrol, Vinylacetat, Vinylpropionat, Vinylchlorid, Vinylidenchlorid, Vinylfluorid, Vinylidenfluorid und Mischungen davon.
Die zuvor genannten Monomeren können einzeln oder in Form von beliebigen Mischungen eingesetzt werden. Typischerweise werden sie in Mengen von 1 bis 90 Mol-%, bevorzugt 10 bis 80 Mol-% und besonders bevorzugt 10 bis 60 Mol-% eingesetzt.
Zur Herstellung von amphoteren Copoylmerisaten kommen als andere monoethyle- nisch ungesättigte Monomere der Gruppe (ii) auch anionische Monomere in Betracht, die oben als Monomere (ii,a) bezeichnet sind. Sie können gegebenenfalls mit den oben beschriebenen neutralen und/oder kationischen Monomeren (ii,b) copolymerisiert werden. Die Mengen an anionischen Monomeren (ii,a) beträgt jedoch höchstens 45 MoI- %, damit das entstehende amphotere Copolymerisat insgesamt eine kationische Ladung aufweist.
Beispiele für anionische Monomere der Gruppe (ii,a) sind ethylenisch ungesättigte C3- bis Cs-Carbonsäuren wie beispielsweise Acrylsäure, Methacrylsäure, Dimethacrylsäu- re, Ethacrylsäure, Maleinsäure, Fumarsäure, Itoconsäure, Mesaconsäure, Citraconsäu- re, Methylenmalonsäure, Allylessigsäure, Vinylessigsäure und Crotonsäure. Als Mo- nomere dieser Gruppe eignen sich außerdem Sulfogruppen enthaltende Monomere wie Vinylsulfonsäure, Acrylamido-2-methyl-propansulfonsäure und Styrolsulfonsäure sowie Phosphongruppen enthaltende Monomere wie Vinylphosphonsäure. Die Monomeren dieser Gruppe können allein oder in Mischung miteinander, in teilweise oder in vollständig neutralisierter Form bei der Copolymerisation eingesetzt werden. Zur Neut- ralisation verwendet man beispielsweise Alkalimetall- oder Erdalkalimetallbasen, Ammoniak, Amine und/oder Alkanolamine. Beispiele hierfür sind Natronlauge, Kalilauge, Soda, Pottasche, Natriumhydrogencarbonat, Magnesiumoxid, Calciumhydroxid, Calci-
umoxid, Triethanolamin, Ethanolamin, Morpholin, Diethylentriamin oder Tetraethylen- pentamin.
Eine weitere Modifizierung der Copolymerisate ist dadurch möglich, dass man bei der Copolymerisation Monomere der Gruppe (iii) einsetzt, die mindestens zwei Doppelbindungen im Molekül enthalten, z. B. Triallylamin, Methylenbisacrylamid, Glykoldiacrylat, Glykoldimethacrylat, Glycerintriacrylat, Pentaerythrittriallylether, mindestens zweifach mit Acrylsäure und/oder Methacrylsäure veresterte Polyalkylenglykole oder Polyole wie Pentaerythrit, Sobit oder Glukose. Falls mindestens ein Monomer der vorstehenden Gruppe bei der Polymerisation eingesetzt wird, so betragen die angewendeten Mengen bis zu 2 Mol-%, z. B. 0,001 bis 1 Mol-%.
Weiterhin kann es zur Modifizierung der Polymeren sinnvoll sein, den Einsatz vorstehender Vernetzter mit dem Zusatz von Reglern zu kombinieren Eingesetzt werden ty- pischerweise 0,001 bis 5 Mol-%. Anwendung finden können alle literturbekannten Regler, z. B. Schwefelverbindungen wie Mercaptoethanol, 2-Ethylhexylthioglycolat, Thi- oglycolsäure und Dodecylmercaptan sowie Natriumhypophosphit, Ameisensäure oder Tribromchlormethan.
Zu den Vinylamineinheiten enthaltenden Polymeren gehören auch hydrolysierte
Pfropfpolymerisate von beispielsweise N-Vinylformamid auf Polyalkylenglykolen, PoIy- vinylacetat, Polyvinylalkolhol, Polyvinylformamiden, Polysacchariden wie Stärke, Oligosacchariden oder Monosacchariden. Die Pfropfpolymerisate sind dadurch erhältlich, dass man beispielsweise N-Vinylformamid in wässrigem Medium in Gegenwart min- destens einer der genannten Pfropfgrundlagen gegebenenfalls zusammen mit copoly- merisierbaren anderen Monomeren radikalisch polymerisiert und die aufgepfropften Vinylformamideinheiten anschließend in bekannten Weise zu Vinylamineinheiten hydrolysiert.
Die Hydrolyse der Copolymerisate kann in Gegenwart von Säuren oder Basen oder auch enzymatisch durchgeführt werden. Bei der Hydrolyse mit Säuren liegen die aus den Vinylcarbonsäureamideinheiten entstehenden Vinylamingruppen in Salzform vor. Die Hydrolyse von Vinylcarbonsäureamidcopolymerisaten ist in der EP-A 0 438 744, Seite 8, Zeile 20 bis Seite 10, Zeile 3, ausführlich beschrieben. Die dort gemachten Ausführungen gelten entsprechend für die Herstellung der erfindungsgemäß einzusetzenden Vinylamineinheiten enthaltenden rein kationischen und/oder amphoteren Polymeren mit einer kationischen Gesamtladung. Die Vinylamineinheiten enthaltenden Polymeren können auch in Form der freien Basen bei dem erfindungsgemäßen Verfahren eingesetzt werden. Solche Polymere fallen beispielsweise bei der Hydrolyse von Vinylcarbonsäureeinheiten enthaltenden Polymeren mit Basen an.
Die Vinylamineinheiten enthaltenden Polymeren haben beispielsweise K-Werte (bestimmt nach H. Fikentscher in 5 %iger wässriger Kochsalzlösung bei pH 7, einer Polymerkonzentration von 0,5 Gew.-% und einer Temperatur von 25°C) in dem Bereich von 20 bis 250, vorzugsweise 50 bis 150.
Die Herstellung der oben beschriebenen Vinylamineinheiten enthaltenden Homo- und Copolymerisate kann durch Lösungs-, Fällungs-, Suspensions- oder Emulsionspolymerisation erfolgen. Bevorzugt ist die Lösungspolymerisation in wässrigen Medien. Geeignete wässrige Medien sind Wasser und Gemische aus Wasser und mindestens einem wassermischbaren Lösungsmittel, z. B. einem Alkohol, wie Methanol, Ethanol, n-Propanol oder Isopropanol. Die kationischen Polymerisate sind wasserlöslich. Die Löslichkeit in Wasser bei einer Temperatur von 20 0C, 1013 mbar und einem pH von 7,0 beträgt beispielsweise mindestens 5 Gew.-%, vorzugsweise mindestens 10 Gew.- %.
Die Ladungsdichte der kationischen Polymeren (ohne Gegenionen) beträgt beispielsweise mindestens 1 ,0 meq/g und liegt vorzugsweise in dem Bereich von 4 bis 10 meq/g.
Als (a) Vinylamineinheiten enthaltende Polymere kommen außerdem die Reaktionsprodukte in Betracht, die durch Hofmann-Abbau von Homo- oder Copolymerisaten des Acrylamids oder Methacrylamids in wäßrigem Medium in Gegenwart von Natronlauge und Natriumhypochlorit und anschließende Decarboxylierung der Carbamatgruppen der Umsetzungsprodukte in Gegenwart einer Säure erhältlich sind. Solche Polymere sind beispielsweise aus EP-A 0 377 313 und WO 2006/0751 15 bekannt. Die Herstellung von Vinylamingruppen enthaltenden Polymeren wird beispielsweise in WO 2006/0751 15, Seite 4, Zeile 25 bis Seite 10, Zeile 22 sowie in den Beispielen auf den Seiten 13 und 14 ausführlich behandelt. Die dort gemachten Angaben gelten für die Charakterisierung der durch Hofmann-Abbau hergestellten Vinylamineinheiten ent- haltenden Polymeren.
Man geht dabei von Polymeren aus, die Acrylamid- und/oder Methacrylamideinheiten enthalten. Es handelt sich dabei um Homo- bzw. Copolymerisate von Acrylamid und Methacrylamid. Als Comonomere kommen beispielsweise Dialkylaminoal- kyl(meth)acrylamide, Diallylamin, Methyldiallylamin und sowie die Salze der Amine und die quaternierten Amine in Betracht. Außerdem eignen sich als Comonomere Di- methyldiallylammonium salze, Acrylamidopropyltrimethylammoniumchlorid und/oder Methacrylamidopropyltrimethylammoniumchlorid, N-Vinylformamid, N-Vinylacetamid, N-Vinylpyrrolidon, Vinylacetat und Acrylsäure- und Methacrylsäureester. Als Comonere kommen gegebenenfalls auch anionische Monomere wie Acrylsäure, Methacrylsäure, Maleinsäureanhydrid, Maleinsäure, Itaconsäure, Acrylamidomethylpropansulfonsäure, Methallylsulfonsäure und Vinylsulfonsäure sowie die Alkalimetall-, Erdalkylimetall- und
Ammoniumsalze der genannten sauren Monomeren in Betracht, wobei nicht mehr als 5 Mol-% dieser Monomeren bei der Polymerisation eingesetzt werden. Die Menge an wassserunlöslichen Monomeren wird bei der Polymerisation so gewählt, dass die entstehenden Polymeren in Wasser löslich sind.
Als Comonomere können gegebenenfalls auch Vernetzer eingesetzt werden, z. B. e- thylenisch ungesättigte Monomere, die mindestens zwei Doppelbindungen im Molekül enthalten wie Triallylamin, Methylenbisacrylamid, Ethylenglykoldiacrylat, Ethylenglykol- dimethacrylat, Polyethylenglykoldimethacrylat, Triallylamin und Trimethyloltrimethacry- lat. Falls ein Vernetzer angewendet wird, so betragen die eingesetzten Mengen beispielsweise 5 bis 5000 ppm. Die Polymerisation der Monomeren kann nach allen bekannten Verfahren erfolgen, z. B. durch radikalisch initiierte Lösungs-, Fällungs- oder Suspensionspolymerisation. Man kann dabei gegebenenfalls in Gegenwart üblicher Polymerisationsregler arbeiten.
Beim Hofmann-Abbau geht man beispielsweise von 20 bis 40 gew.-%igen wässrigen Lösungen mindestens eines Acrylamid- und/oder Methacrylamideinheiten enthaltenden Polymeren aus. Das Verhältnis von Alkalimetallhypochlorit zu (Meth)acrylamideinheiten im Polymer ist maßgebend für den entstehenden Gehalt an Amingruppen im Polymer. Das molare Verhältnis von Alkylimetallhydroxid zu Alkylimetallhypochlorit beträgt beispielsweise 2 bis 6, vorzugsweise 2 bis 5. Für einen bestimmten Amingruppengehalt im abgebauten Polymer berechnet man die für den Abbau des Polymeren erforderliche Menge an Alkalimetallhydroxid.
Der Hofmann-Abbau des Polymeren erfolgt z. B. in dem Temperaturbereich von 0 bis 45 0C, vorzugsweise 10 bis 20 0C in Gegenwart von quaternären Ammoniumsalzen als Stabilisator, um eine Nebenreaktion der entstehenden Aminogruppen mit den A- midgruppen des Ausgangspolymeren zu verhindern. Nach Beendigung der Umsetzung mit Alkylilauge/Alkalimetallhypochlorit wird die wässrige Reaktionslösung in einen Reaktor geleitet, in dem eine Säure für die Decarboxylierung des Umsetzungsprodukts vorgelegt ist. Der pH-Wert des Vinylamineinheiten enthaltenden Reaktionsprodukts wird auf einen Wert von 2 bis 7 eingestellt. Die Konzentration des Vinylamineinheiten enthaltenden Abbauprodukts beträgt beispielsweise mehr als 3,5 Gew.-%, meistens liegt sie oberhalb von 4,5 Gew.-%. Die wässrigen Polymerlösungen können beispiels- weise mit Hilfe einer Ultrafiltration aufkonzentriert werden.
Zu den Ethylenimineinheiten enthaltenden Polymeren gehören alle Polymere, die durch Polymerisation von Ethylenimin in Gegenwart von Säuren, Lewissäuren oder Halogenalkanen erhältlich sind wie Homopolymerisate des Ethylenimins oder Pfropfpo- lymerisate von Ethylenimin, vgl. US 2,182,306 oder in US 3,203,910. Diese Polymeren können gegebenenfalls nachträglich einer Vernetzung unterworfen werden. Als Vernetzer kommen z. B. alle multifunktionellen Verbindungen in Betracht, die gegenüber
primären Aminogruppen reaktive Gruppen enthalten z.B. multifunktionelle Epoxide wie Bisglyciyglether von Oligo- oder Polyethylenoxiden oder anderen multifunktionellen Alkoholen wie Gylcerin oder Zuckern, mulitunktionelle Carbonsäureester, mulifunktio- nelle Isocyante, multifunktionelle Acrylsäure- oder Methacrylsäureester, multifunktionel- Ie Acrylsäure - oder Methacrylsäureamide, Epichlorhydrin, multifunktionelle Säurehalogenide, multifunktionelle Nitrile, α,ω-Chlorhydrinether von Oligo- oder Polyethylenoxiden oder von anderen multifunktio-nellen Alkoholen wie Gylcerin oder Zuckern, Divi- nylsulfon, Maleinsäureanhydrid oder ω-Halogencarbonsäurechloride, multifunktionelle Halogenalkane insbesondere α,ω-Dichloralkane. Weitere Vernetzer sind in WO 97/25367, Seiten 8 bis16 beschrieben.
Ethylenimineinheiten enthaltende Polymere sind beispielsweise aus EP-A- 0411400, DE 2434816 und US 4,066,494 bekannt.
Als (b) Ethylenimineinheiten enthaltende Polymere verwendet man z. B. bei dem erfindungsgemäßen Verfahren mindestens ein wasserlösliches kationisches Polymer aus der Gruppe der
Homopolymerisate des Ethylenimins, - mit mindestens bifunktionellen Vernetzern umgesetzten Polyethylenimine, mit Ethylenimin gepfropften Polyamidoamine, die mit mindestens bifunktionel- lenVernetzern umgesetzt sind,
Umsetzungsprodukte von Polyethyleniminen mit einbasischen Carbonsäuren zu amidierten Polyethyleniminen, - Michaeladditionsprodukte von Polyethyleniminenen an ethylenisch ungesättigte
Säuren, Salze, Ester, Amide oder Nitrile von monoethylenisch ungesätitgten
Carbonsäuren, phosphonomethylierten Polyethylenimine, carboxylierten Polyethylenimine und - alkoxylierten Polyethylenimine.
Polymere, die dadurch erhalten werden, dass man zunächst mindestens eine Polycar- bonsäure mit mindestens einem Polyamin zu Polyamidoamine kondensiert, dann mit Ethylenimin pfropft und die Umsetzungsprodukte anschließend mit einer der oben ge- nanten Verbindungen vernetzt, gehören zu den bevorzugt in Betracht kommenden E- thylenimineinheiten enthaltenden Verbindungen. Ein Verfahren zur Herstellung sol-cher Verbindungen ist beispielsweise in DE-A-2434816 beschrieben, wobei α,ω- Chlorhydrinether von Oligo- oder Polyethylenoxiden als Vernetzer Anwendung finden.
Besonders bevorzugt sind Produkte der beiden vorstehenden Typen, die einer Ultrafiltration unterzogen und so in ihrem Molekulargewichtsverteilung optimiert wurden. SoI-
che ultrafiltrierten Produkte werden ausführlich in WO 00/67884 und WO 97/ 25367 beschrieben.
Umsetzungsprodukte von Polyethyleniminen mit einbasischen Carbonsäuren zu ami- dierten Polyethyleniminen sind aus der WO 94/12560 bekannt. Michaeladditionspro- dukte von Polyethyleniminen an ethylenisch ungesättigte Säuren, Salze, Ester, Amide oder Nitrile von monoethylenisch ungesätitgten Carbonsäuren sind Gegenstand der WO 94/14873. Phosphonomethylierte Polyethylenimine werden ausführlich in der WO 97/25367 beschrieben. Carboxylierten Polyethylenimine sind beispielsweise mit Hilfe einer Steckersynthese durch Umsetzung von Polyethyleniminen mit Formaldehyd und Ammoniak/Cyanwasserstoff und Hydrolyse der Umsetzungsprodukte erhältlich. Alkoxylierte Polyethylenimine sind durch Umsetzung von Polyethyleiminen mit Alkyle- noxiden wie Ethylenoxid und/oder Propylenoxid herstellbar.
Die Ethylenimineinheiten enthaltenden Polymeren haben beispielsweise Molmassen von 10 000 bis 3 000 000. Die kationische Ladung der Ethylenimineinheiten enthaltenden Polymeren beträgt z.B. mindestens 4 meq/g. Sie liegt meistens in dem Bereich von 8 bis 20 meq/g.
Das Gewichtsverhältnis von (a) Vinylamineinheiten enthaltenden Polymeren zu (b) Ethylenimineinheiten enthaltenden Polymeren beträgt bei dem erfindungsgemäßen Verfahren beispielsweise 10 : 1 bis 1 : 10, vorzugsweise 5 : 1 bis 1 : 5. Die Kombination aus Ethylenimineinheiten enthaltenden Polymeren und Vinylamineinheiten enthaltenden Polymeren werden bei dem erfindungsgemäßen Verfahren zur Herstellung von Papier beispielsweise in einer Menge von 0,01 bis 2,0 Gew.-%, vorzugsweise 0,1 bis 1 ,0 Gew.-%, bezogen auf trockenen Papierstoff eingesetzt.
Zu den wasserlöslichen polymeren anionischen Verbindungen gehören alle Polymere, die Säuregruppen oder deren Salze tragen und eine Ladungdichte von > 0,5 meq/g besitzen. Bei den Säuregruppen kann es sich um Carboxylgruppen, Sulfonsäuregrup- pen und Phosphonsäuregruppen handeln. Auch Ester der Phosphorsäure gehören hierzu, wobei mindestens eine Säurefunktion der Phosphorsäure nicht verestert ist. Grundsätzlich Verwendung finden können Polymerisate, Polykondensate z.B. PoIy- asparaginsäure , Polyadditionsverbindungen und auch durch ringöffnende Polymerisation hergestellte Verbindungen mit einer Ladungsdichte von jeweils > 0,5 meq/g. Eben- falls anwendbar sind Polymere, die durch polymeranaloge Reaktionen wie Strecker- Reaktion oder durch Phosphonomethylierung mit sauren Gruppen modifiziert wurden. Bevorzugt sind jedoch Polymerisate folgender Zusammensetzung:
(1 ) wenigstens einem Monomer, das ausgewählt ist aus der Gruppe bestehend aus (1.1 ) monoethylenisch ungesättigten Sulfonsäuren, Phosphonsäuren, Phosphorsäureestern und Derivaten davon, und
(1.2) monoethylenisch ungesättigten Mono- und Dicarbonsäuren, deren Salzen und Dicarbonsäureanhydriden,
(2) gegebenenfalls wenigstens einem von den Komponenten (1.1) und (1.2) ver- schiedenen monoethylenisch ungesättigten Monomer, und
(3) gegebenenfalls wenigstens eine Verbindung, die mindestens zwei ethylenisch ungesättigte Doppelbindungen im Molekül aufweist,
mit der Maßgabe, dass das Monomerengemisch mindestens ein Monomer (1) mit mindestens einer freien Säuregruppe und/oder einer Säuregruppe in Salzform enthält.
Als Monomere der Gruppe (1.1) sind Verbindungen geeignet, die einen organischen Rest mit einer polymerisierbaren, α,ß-ethylenisch ungesättigten Doppelbindung und mindestens einer Sulfonsäure- oder Phosphonsäuregruppe pro Molekül aufweisen. Geeignet sind weiterhin die Salze und Ester der zuvor genannten Verbindungen. Bei den Estern der Phosphonsäuren kann es sich dabei um die Mono- oder die Diester handeln. Geeignete Monomere (1.1 ) sind weiterhin Ester der Phosphorsäure mit Alkoholen mit einer polymersierbaren, α,ß-ethylenisch ungesättigten Doppelbindung. Dabei kann ein Proton der Phosphorsäuregruppe oder es können die beiden übrigen Protonen der Phosphorsäuregruppe durch geeignete Basen neutralisiert oder mit Alkoholen, die keine polymerisierbaren Doppelbindungen aufweisen, verestert sein.
Geeignete Basen zur teilweisen oder vollständigen Neutralisation der Säuregruppen der Monomere (1.1) sind beispielsweise Alkalimetall- oder Erdalkalimetallbasen, Ammoniak, Amine und/oder Alkanolamine. Beispiele hierfür sind Natriumhydroxid, Kaliumhydroxid, Natriumcarbonat, Kaliumcarbonat, Natriumhydrogencarbonat, Kalium- hydrogencarbonat, Magnesiumhydroxid, Magnesiumoxid, Calciumhydroxid, Calcium- oxid, Triethanolamin, Ethanolamin, Morpholin, Diethylentriamin oder Tetraethylenpen- tamin. Geeignete Alkohole zur Veresterung der Phosphorsäure sind beispielsweise d- Cε-Alkanole, wie beispielsweise Methanol, Ethanol, n-Propanol, Isopropanol, n- Butanol, sec.-Butanol, tert.-Butanol, n-Pentanol, n-Hexanol sowie deren Isomere.
Zu den Monomeren (1.1) zählen beispielsweise Vinylsulfonsäure, Allylsulfonsäure, Methallylsulfonsäure, Sulfoethylacrylat, Sulfoethylmethacrylat, Sulfopropylacrylat, SuI- fopropylmethacrylat, 2-Hydroxy-3-acryloxypropylsulfonsäure, 2-Hydroxy-3- methacryloxypropylsulfonsäure, Styrolsulfonsäure, Acrylamidomethylenphosphonsäu- re, 2-Acrylamido-2-methylpropansulfonsäure, Vinylphosphonsäure, CH2=CH-NH-CH2- PO3H, Vinylphosphonsäuremonomethylester, Vinylphosphonsäuredimethylester, Al- lylphosphonsäure, Allylphosphonsäuremonomethylester, Allylphosphonsäuredimethy- lester, Acrylamidomethylpropylphosphonsäure, (Meth)acrylethylenglykolphosphat und Phosphorsäuremonoallylester.
Werden als Komponente (1.1 ) ausschließlich Monomere eingesetzt, bei denen alle Protonen der Säuregruppen verestert sind, wie z. B. Vinylphosphonsäuredimethylester oder Allylphosphonsäuredimethylester, so wird zur Polymerisation wenigstens eine monoethylenisch ungesättigte Mono- und/oder Dicarbonsäure oder ein Salz davon eingesetzt, wie sie im Folgenden als Komponente (1.2) beschrieben werden. Somit ist sichergestellt, dass die erfindungsgemäß eingesetzten Copolymerisate anionische Gruppen aufweisen.
Die zuvor genannten Monomere (1.1 ) können einzeln oder in Form von beliebigen Mi- schungen bei der Herstellung der anionischen Polymeren eingesetzt werden.
Als Monomere der Gruppe (1.2) kommen monoethylenisch ungesättigte Carbonsäuren mit 3 bis 8 C-Atomen sowie die wasserlöslichen Salze wie Akalimetall-, Erdalkalimetalloder Ammoniumsalze dieser Carbonsäuren und die monoethylenisch ungesättigten Carbonsäureanhydride in Betracht. Zu dieser Gruppe von Monomeren gehören beispielsweise Acrylsäure, Methacrylsäure, Dimethacrylsäure, Ethacrylsäure, α- Chloracrylsäure, Maleinsäure, Maleinsäureanhydrid, Fumarsäure, Itaconsäure, Mesa- consäure, Citraconsäure, Glutaconsäure, Aconitsäure, Methylenmalonsäure, Allyles- sigsäure, Vinylessigsäure und Crotonsäure. Die Monomeren der Gruppe (1.2) können allein oder in Mischung miteinander, in teilweise oder in vollständig neutralisierter Form bei der Homo- bzw. Copolymerisation eingesetzt werden. Zur Neutralisation geeignete Basen sind die oben bei der Komponente (1.1) genannten Verbindungen.
Das wasserlösliche anionische Polymerisat enthält wenigstens ein Monomer aus der Gruppe (1), das ausgewählt ist aus den Untergruppen (1.1 ) und/oder (1.2). Selbstverständlich kann das wasserlösliche Copolymerisat auch Mischungen von Monomeren aus den Untergruppen (1.1) und (1.2) einpolymerisiert enthalten.
Die Copolymerisate können zur Modifizierung gegebenenfalls wenigstens ein weiteres Monomer der Gruppe (2) in einpolymerisierter Form enthalten. Vorzugsweise sind diese Monomere ausgewählt unter Estern α,ß-ethylenisch ungesättigter Mono- und Dicar- bonsäuren mit Ci-C3o-Alkanolen, C2-C3o-Alkandiolen und C2-C3o-Aminoalkoholen, Ami- den α,ß-ethylenisch ungesättigter Monocarbonsäuren und deren N-Alkyl- und N, N- Dialkylderivaten, Estern von Vinylalkohol und Allylalkohol mit C1-C30- Monocarbonsäuren, N-Vinyllactamen, stickstoffhaltigen Heterocyclen mit α,ß- ethylenisch ungesättigten Doppelbindungen, Vinylaromaten, Vinylhalogeniden, Vinyl- idenhalogeniden, C2-C8-Monoolefinen und Mischungen davon.
Geeignete Vertreter der Gruppe (2) sind z. B. Methyl(meth)acrylat, Methylethacrylat, Ethyl(meth)acrylat, Ethylethacrylat, n-Butyl(meth)acrylat, lsobutyl(meth)acrylat, tert- Butyl(meth)acrylat, tert.-Butylethacrylat, n-Ocytl(meth)acrylat, 1 ,1 ,3,3- Tetramethylbutyl(meth)acrylat, Ethylhexyl(meth)acrylat und Mischungen davon.
Geeignete zusätzliche Monomere (2) sind weiterhin Acrylsäureamid, Methacrylsäu- reamid, N-Methyl(meth)acrylamid, N-Ethyl(meth)acrylamid, n-Propyl(meth)acrylamid, N-(n-Butyl)(meth)acrylamid, tert.-Butyl(meth)acrylamid, n-Octyl(meth)acrylamid, 1 ,1 ,3,3-Tetramethylbutyl(meth)acrylamid, Ethylhexyl(meth)acrylamid und Mischungen davon.
Weiterhin sind als Monomere (2) geeignet 2-Hydroxyethyl(meth)acrylat, 2- Hydroxyethylethacrylat, 2-Hydroxypropyl(meth)acrylat, 3-Hydroxypropyl(meth)acrylat, 3-Hydroxybutyl(meth)acrylat, 4-Hydroxybutyl(meth)acrylat, 6- Hydroxyhexyl(meth)acrylat und Mischungen davon.
Weiterhin geeignete Monomere der Gruppe (2) sind Nitrile von α,ß-ethylenisch ungesättigten Mono- und Dicarbonsäuren, wie beispielsweise Acrylnitril und Methacrylnitril.
Geeignete Monomere der Gruppe (2) sind weiterhin N-Vinyllactame und deren Derivate, die z. B. einen oder mehrere d-Cε-Alkylsubstituenten (wie oben definiert) aufweisen können. Dazu zählen N-Vinylpyrrolidon, N-Vinylpiperidon, N-Vinylcaprolactam, N- Vinyl-5-methyl-2-pyrrolidon, N-Vinyl-5-ethyl-2-pyrrolidon, N-Vinyl-6-methyl-2-piperidon, N-Vinyl-6-ethyl-2-piperidon, N-Vinyl-7-methyl-2-caprolactam, N-Vinyl-7-ethyl-2- caprolactam und deren Mischungen.
Geeignete zusätzliche Monomere der Gruppe (2) sind weiterhin Ethylen, Propylen, Isobutylen, Butadien, Styrol, α-Methylstyrol, Vinylacetat, Vinylpropionat, Vinylchlorid, Vinylidenchlorid, Vinylfluorid, Vinylidenfluorid und Mischungen davon.
Die zuvor genannten Monomere der Gruppe (2) können bei der Copolymerisation mit mindestens einem anionischen Monomer einzeln oder in Form von beliebigen Mischungen eingesetzt werden.
Eine weitere Modifizierung der Copolymerisate ist dadurch möglich, dass man bei der Copolymerisation Monomere der Gruppe (3) einsetzt, die mindestens zwei Doppelbindungen im Molekül enthalten, z. B. Methylenbisacrylamid, Glykoldiacrylat, Glykoldi- methacrylat, Glycerintriacrylat, Pentaerythrittriallylether, mindestens zweifach mit Ac- rylsäure und/oder Methacrylsäure veresterte Polyalkylenglykole oder Polyole wie Pen- taerythrit, Sobit oder Glukose. Falls mindestens ein Monomer der Gruppe (3) bei der Copolymerisation eingesetzt wird, so betragen die angewendeten Mengen bis zu 2 Mol-%, z. B. 0,001 bis 1 Mol-%.
Weiterhin kann es sinnvoll sein, bei der Polymerisation den Einsatz vorstehender Ver- netzter mit dem Zusatz von Reglern zu kombinieren. Eingesetzt werden typischerweise 0,001 bis 5 Mol-% mindestens eines Reglers. Anwendung finden können alle literatur-
bekannten Regler wie Mercaptoethanol, 2-Ethylhexylthioglycolat, Thioglycolsäure, Do- decylmercaptan, Natriumhypophosphit, Ameisensäure und/oder Tribromchlormethan.
Vorzugsweise verwendet man als anionische polymere Verbindung Homopolymerisate von ethylenisch ungesättigten C3- bis Cs-Carbonsäuren, insbesondere Polyacrylsäure und Polymethacrylsäure sowie hydrolysierte Homopolymerisate von Maleinsäureanhydrid und von Itaconsäureanhydrid. Bevorzugt in Betracht kommende anionische Co- polymerisate enthalten beispielsweise (1 ) 10 bis 99 Gew.-% mindestens einer ethylenisch ungesättigten C3- bis Cs-Carbonsäure und (2) 90 bis 1 Gew.-% mindestens eines Amids, Nitrils und/oder eines Esters einer ethylenisch ungesättigten C3- bis Cs- Carbonsäure in einpolymerisierter Form. Die Summe der Gewichtsprozente aus den Komponenten (1) und (2) beträgt dabei immer 100. Besonders bevorzugt sind Copoly- merisate aus Acrylsäure und Acrylamid, Copoylmerisate aus Acrylsäure und Acrylnitril, Copolymerisate aus Acrylsäure und N-Vinylformamid, Copolymerisate aus Methacryl- säure und Methacrylamid, Copolymerisate aus Methacrylsäure und N-Vinylformamid, Copolymerisate aus Acrylsäure und Methacrylamid, Copolymerisate aus Acrylsäure und Methacrylnitril, Copolymerisate aus Methacrylsäure und Methacrylnitril sowie Copolymerisate aus Acrylsäure, Acrylamid und Acrylnitril.
Die anionischen Polymerisate sind wasserlöslich. Sie können in Form der freien Säuren und/oder als Alkalimetall-, Erdalkalimetall- oder als Ammoniumsalz bei dem erfindungsgemäßen Verfahren eingesetzt werden. Sie haben beispielsweise einen K-Wert von 50 bis 250 (bestimmt nach H. Fikentscher in 5 gew.-%iger wässriger Kochsalzlösung bei 25 0C und pH 7).
Das wasserlösliche anionische Polymer wird bei dem erfindungsgemäßen Verfahren in einer Menge von beispielsweise 0,01 bis 2,0 Gew.-%, vorzugsweise 0,05 bis 1 ,0 Gew.- %, insbesondere 0,1 bis 0,5 Gew.-%, bezogen auf trockenen Papierstoff, eingesetzt. Das Gew.-Verhältnis von kationischen Polymeren (a) Vinylamineinheiten enthaltenden Polymeren und (b) Ethylenimineinheiten enthaltenden Polymeren zu den wasserlöslichen polymeren anionischen Verbindungen beträgt beispielsweise 3 : 1 bis 1 : 3 und liegt vorzugsweise bei 1 : 1.
Für die Papierherstellung kommen als Faserstoffe zur Herstellung der Pulpen kommen sämtliche dafür gebräuchlichen Qualitäten in Betracht, z.B. Holzstoff, gebleichter und ungebleichter Zellstoff sowie Pa-pierstoffe aus allen Einjahrespflanzen. Zu Holzstoff gehören beispielsweise Holzschliff, thermomechanischer Stoff (TMP), chemo- thermomechanischer Stoff (CTMP), Druck-schliff, Halbzellstoff, Hochausbeute-Zellstoff und Refiner Mechanical PuIp (RMP). Als Zellstoff kommen beispielsweise Sulfat-, SuI- fit- und Natronzellstoffe in Betracht. Bei-spielsweise verwendet man ungebleichten Zellstoff, der auch als ungebleichter Kraft-zel Istoff bezeichnet wird. Geeignete Einjah-
respflanzen zur Herstellung von Papierstoffen sind beispielsweise Reis, Weizen, Zuckerrohr und Kenaf.
Das erfindungsgemäße Verfahren eignet sich insbesondere für die Herstellung von trockenfest ausgerüsteten Papieren aus Altpapier (umfassend deinked Altpapier), das entweder allein oder in Mischung mit anderen Faserstoffen eingesetzt wird. Man kann auch von Fasermischungen aus einem Primärstoff und zurückgeführtem gestrichenem Ausschuss ausgehen, z. B. gebleichtes Kiefernsulfat in Mischung mit zurückgeführtem gestrichenem Ausschuss. Das erfindungsgemäße Verfahren ist für die Herstellung von Papier, Pappe und Karton aus Altpapier und in speziellen Fällen auch aus deinked Altpapier von technischem Interesse, weil es die Festigkeitseigenschaften der zurückgeführten Fasern deutlich erhöht. Es hat besondere Bedeutung für die Verbesserung von Festigkeitseigenschaften von graphischen Papieren und von Verpackungspapieren.
Der pH-Wert der Stoffsuspension liegt beispielsweise in dem Bereich von 4,5 bis 8, meisten bei 6 bis 7,5. Zur Einstellung des pH-Wertes kann man beispielsweise eine Säure wie Schwefelsäure oder Aluminiumsulfat verwenden.
Bei dem erfindungsgemäßen Verfahren werden vorzugsweise zunächst die kationischen Polymerisate, nämlich (a) Vinylamineinheiten enthaltende Polymere und (b) E- thylenimineinheiten enthaltende Polymere, zum Papierstoff dosiert. Die Zugabe der kationischen Polymeren kann dabei zum Dickstoff (Faserkonzentration >15 g/l, z.B. in dem Bereich von 25 bis 40 g/l bis zu 60 g/l) oder vorzugsweise zu einem Dünnstoff (Faserkonzentration <15 g/l, z.B. in dem Bereich von 5 bis 12 g/l) erfolgen. Die Zugabestelle liegt vorzugsweise vor den Sieben, sie kann jedoch auch zwischen einer Scherstufe und einem Screen oder danach liegen. Die Dosierung der kationischen Polymeren (a) und (b) zum Papierstoff kann beispielsweise nacheinander, gleichzeitig oder auch als Mischung von (a) und (b) erfolgen.
Die anionische Komponente wird meistens erst nach der Zugabe der kationischen Polymeren (a) und (b) zum Papierstoff zugegeben, kann aber auch gleichzeitig, jedoch getrennt von den kationischen Polymeren zum Papierstoff dosiert werden. Weiterhin ist es auch möglich zuerst die anionische und nachfolgend die kationische Komponente zuzugeben oder zunächst eine der kationischen Komponenten (a) oder (b) zum Papierstoff zu dosieren, dann das anionische Polymer zuzugeben und anschließend die andere kationische Komponente zuzusetzen.
Bei dem erfindungsgemäßen Verfahren können die üblicherweise bei der Papierher- Stellung verwendeten Prozeßchemikalien in den üblichen Mengen eingesetzt werden, z. B. Retentionsmittel, Entwässerungsmittel, andere Trockenverfestiger wie beispiels-
weise Stärke, Pigmente, Füllstoffe, optische Aufheller, Entschäumer, Biozide und Papierfarbstoffe.
Nach dem erfindungsgemäßen Verfahren erhält man trockenfest ausgerüstete Papiere, deren Trockenfestigkeit gegenüber Papieren, die nach bekannten Verfahren hergestellt werden, eine erhöhte Trockenfestigkeit aufweisen. Außerdem ist bei dem erfindungsgemäßen Verfahren die Entwässerungsgeschwindigkeit im Vergleich mit bekannten Verfahren verbessert.
Die Prozentangaben in den Beispielen bedeuten, falls nichts anderes angegeben ist, Gewichtsprozent. Der K-Wert der Polymerisate wurde nach Fikentscher, Cellulose- Chemie, Band 13, 58 - 64 und 71 - 74 (1932) bei einer Temperatur von 25 0C in 5 gew.-%igen wässrigen Kochsalzlösungen bei einem pH-Wert von 7 und einer Polymerkonzentration von 0,5% bestimmt.
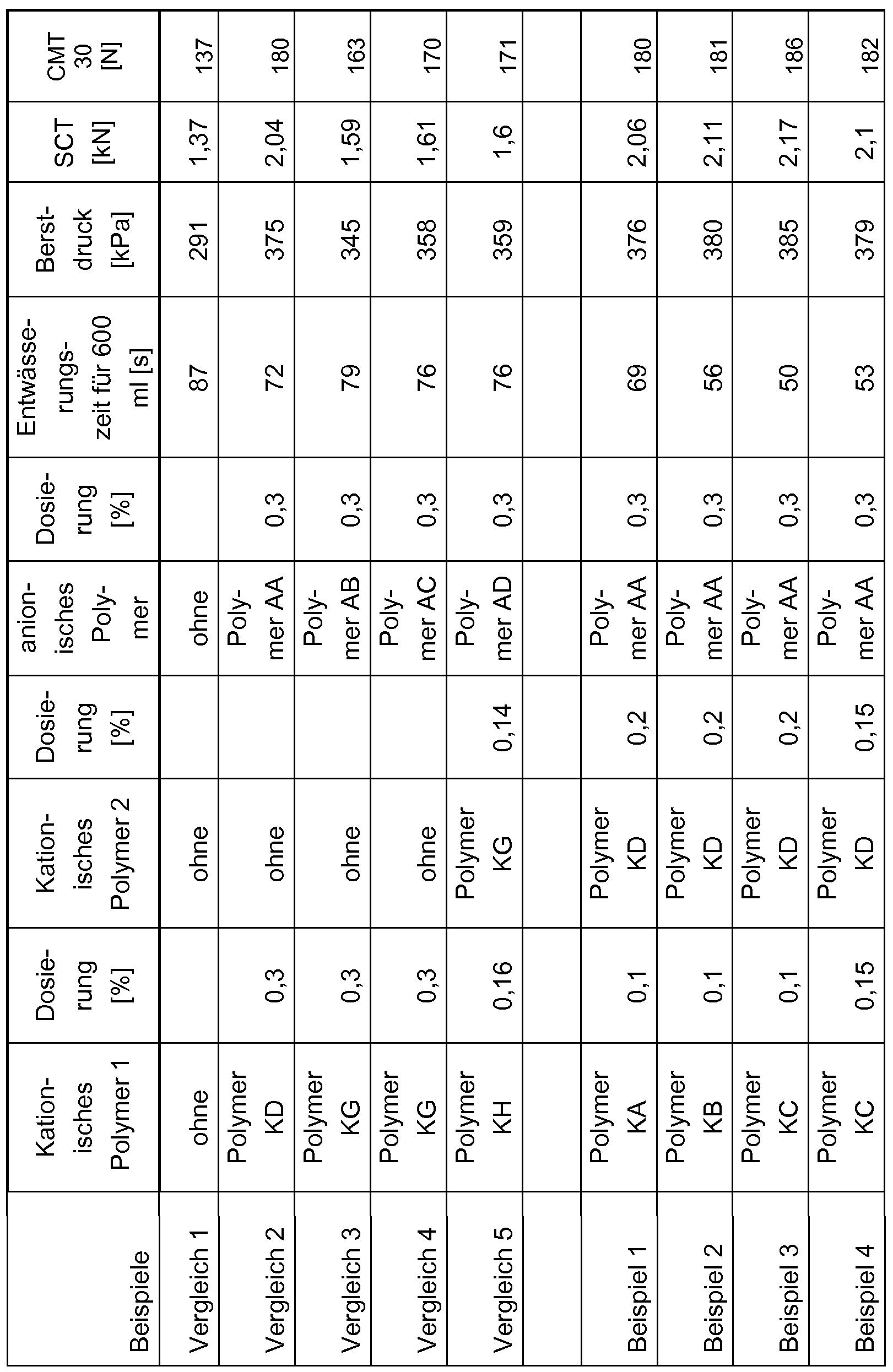
Für die einzelnen Tests wurden in Laborversuchen Blätter in einem Rapid-Köthen- Laborblattbildner hergestellt. Die Blätter wurden für 24 Stunden bei 23 0C und einer Luftfeutchtigkeit von 50 % gelagert. Danach wurden folgende Festigkeitsprüfungen durchgeführt:
Berstdruck nach DIN ISO 2758 (bis 600 kPa), DIN ISO 2759 (ab 600 kPa) SCT nach DIN 54518 (Bestimmung des Streifenstauchwiderstandes) CMT nach DIN EN 23035 (Bestimmung des Flachstauchwiderstandes) DIN EN ISO 7263 (Bestimmung des Flachstauchwiderstandes an labormäßig gewellter Wellpappe)
Beispiele
In den Beispielen und in den Vergleichsbeispielen wurden folgende Polymere verwen- det:
Polymer KA
Polyethylenimin (Polymin® P, BASF SE, D-67056 Ludwigshafen)
Polymer KB
Verwendet wurde ein mit Ethylenimin gepropftes und mit einem Dichlorhydrinether von Polyethylenglykol vernetztes Polyamidoamin, wie in DE-A 2434816, Beispiel 13 beschrieben.
Polymer KC
Verwendet wurde ein mit Ethylenimin gepropftes und vernetztes Polyamidoamin, das zusätzlich noch einer Ultrafiltration unterworfen wurde, vgl. WO 00/67884, Seite 23, Beispiel B1 b.
Polymer KD
Verwendet wurde ein zu 30 % teilhydrolysiertes Polyvinylformamid mit einem K-Wert von 90, wie in DE-A 10 2004 056551 , Seite 9, letzter Abschnitt als PVAm 4 beschrieben.
Polymer KE
Verwendet wurde ein Polymer, das durch saure Hydrolyse eines Copolymers aus 30 Mol-% N-Vinylformamid und 70 Mol-% Acrylnitril hergestellt wurde, wie in DE 4328975 als Beispiel P auf den Seiten 8 und 9 beschrieben.
Polymer KF
Verwendet wurde ein handelsübliches Hofmann-Abbau Produkt der Firrma SNF mit der Bezeichnung RSL HF 70D. Das Produkt hatte einen Festgehalt von 24,2 %, eine Viskosität von 19 mPas (Brookfield, LVT, Spindel 1 , 60 Upm, 200C) und eine Ladungsdichte von 57,2 meq/100 g Produkt (Polyelektrolyttitration).
Polymer KG
Das verwendete Polymer war identisch mit dem in WO 2006/0751 15 auf Seite 13 in der Tabelle als C8 beta 2 bezeichnete Hofmann-Abbauprodukt. Es wurde hergestellt durch Umsetzung von Polyacrylamid mit Natriumhypochlorit im Molverhältnis 1 : 1 , und Natronlauge, wobei das Molverhältnis von Natriumhydroxid zu Natriumhypochlorit 2 : 1 betrug.
Polymer KH
Das verwendete Polymer war identisch mit dem in WO 2006/090076 auf Seite 15, Zeile 23 als C2 bezeichneten glyoxylierten Copolymer aus 95 Mol-% Acrylamid und 5 Mol-% Diallyldimethylammoniumchlorid (DADMAC).
Polymer AA
Copolymer aus 70 % N-Vinylformamid und 30 % Acrylsäure in Form des Na-Salzes mit einem K-Wert von 85, wie in DE 10 2004 056551 auf Seite 9, letzter Abschnitt als Co- polymerisat 4 beschrieben.
Polymer AB
Das verwendete Polymer war identisch mit dem in WO 2006/075115 auf Seite 14 in der Tabelle als A1 bezeichneten Copolymer aus 70 % Acrylamid und 30 % Acrylsäure in Form des Na-Salzes.
Polymer AC
Das verwendete Polymer war identisch mit dem in WO 2006/075115 auf Seite 14 in der Tabelle als A2 bezeichneten Copolymer aus 70 Mol-% Acrylamid und 30 Mol-% Acrylsäure, vernetzt mit Methylenbisacrylamid (MBA) in Form des Na-Salzes. Das Co- polymer hatte eine anionische Ladung von 3,85 meq/g. Polymer AD
Das verwendete Polymer war identisch mit dem in WO 2006/090076 auf Seite 16 in der Tabelle als A2 bezeichneten Copolymer aus 70 Mol-% Acrylamid und 30 Mol-% Acrylsäure, vernetzt mit Methylenbisacrylamid (MBA) in Form des Na-Salzes. Das Co- polymer hatte eine anionische Ladung von 3,85 meq/g.
Herstellung des Papierstoffs für die Beispiele und Vergleichsbeispiele
Ein Papier aus 100 % Altpapier (Mischung der Sorten: 1.02, 1.04, 4.01) wurde mit Trinkwasser bei einer Stoffdichte von 4 % in einem Laborpulper stippenfrei aufgeschlagen und in einem Laborrefiner auf einen Mahlgrad von 40 0SR gemahlen. Dieser Stoff wurde anschließend mit Trinkwasser auf eine Stoffdichte von 0,7 % verdünnt.
Entwässerungsprüfung
In den Beispielen und Vergleichsbeispielen wurde jeweils 1 Liter des oben beschriebenen Papierstoffs verwendet und jeweils nacheinander mit den in der Tabelle jeweils angegebenen wasserlöslichen Polymeren unter Rühren versetzt und danach mit Hilfe eines Schopper-Riegler-Entwässerungsprüfers entwässert, wobei man die Zeit in Se- künden für eine Durchflussmenge (Filtrat) von 600 ml bestimmte. Die Konzentration der wasserlöslichen kationischen und anionischen Polymeren, die jeweils als Trocken- verfestigungsmittel für Papier getestet wurden, betrug jeweils 1 %. Die Messergebnisse sind in der Tabelle angegeben.
Blattbildung
In den Beispielen und Vergleichsbeispielen wurden dem oben beschriebenen Papierstoff unter Rühren die in der Tabelle angegebenen Polymeren nacheinander zugesetzt. Die Polymerkonzentration der wässrigen Lösungen der kationschen und der anioni- sehen Polymeren betrug jeweils 1 %. In der Tabelle sind die jeweils eingesetzten Mengen der Polymeren in Gewichtsprozent, bezogen auf den Festgehalt des Papierstoffs angegeben. Nach der letzten Zugabe eines wasserlöslichen Polymers zum Papierstoff wurde soviel Stoff abgenommen (ca. 500 ml), um auf einem Rapid-Köthen-Blattbildner ein Blatt mit einem Flächengewicht von 120 g/m
2 (3,2 g otro = ofentrocken) herzustel- len. Die Blätter wurden, wie im Rapid-Köthen-Verfahren üblich, abgegautscht und 8 Minuten bei 110
0C in einem Trockenzylinder getrocknet. Die Ergebnisse sind in der Tabelle angegeben.
Tabelle 1 κ> κ>
κ>
Vergleich 2 nach Beispiel 6 der DE-A-10 2004 056551 Vergleich 3 nach Beispiel 17 der WO-A-2006/0751 15 Vergleich 4 nach Beispiel 1 der WO-A-2006/0751 15 Vergleich 5 nach Beispiel 5 der WO-A-2006/090076