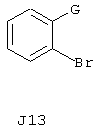
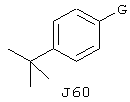
RU2237663C2 - Производное тиобензимидазола и содержащие его фармацевтические композиции - Google Patents
Производное тиобензимидазола и содержащие его фармацевтические композиции Download PDFInfo
- Publication number
- RU2237663C2 RU2237663C2 RU2001104339A RU2001104339A RU2237663C2 RU 2237663 C2 RU2237663 C2 RU 2237663C2 RU 2001104339 A RU2001104339 A RU 2001104339A RU 2001104339 A RU2001104339 A RU 2001104339A RU 2237663 C2 RU2237663 C2 RU 2237663C2
- Authority
- RU
- Russia
- Prior art keywords
- group
- carbon atoms
- linear
- unsubstituted
- thiobenzimidazole
- Prior art date
Links
- KSAPYRIVHFAQGR-UHFFFAOYSA-N 1-sulfanylbenzimidazole Chemical class C1=CC=C2N(S)C=NC2=C1 KSAPYRIVHFAQGR-UHFFFAOYSA-N 0.000 title claims abstract description 55
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 8
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 147
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 48
- 150000003839 salts Chemical class 0.000 claims abstract description 32
- 125000005843 halogen group Chemical group 0.000 claims abstract description 27
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 26
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 23
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 22
- 125000002947 alkylene group Chemical group 0.000 claims abstract description 21
- 201000010099 disease Diseases 0.000 claims abstract description 20
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims abstract description 16
- 101000909983 Homo sapiens Chymase Proteins 0.000 claims abstract description 12
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 9
- 239000003814 drug Substances 0.000 claims abstract description 9
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 9
- 230000000069 prophylactic effect Effects 0.000 claims abstract description 9
- 125000003831 tetrazolyl group Chemical group 0.000 claims abstract description 8
- 125000005730 thiophenylene group Chemical group 0.000 claims abstract description 8
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 7
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims abstract description 7
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 4
- -1 furanylene group Chemical group 0.000 claims description 42
- 125000001424 substituent group Chemical group 0.000 claims description 27
- 229910005965 SO 2 Inorganic materials 0.000 claims description 10
- 125000004953 trihalomethyl group Chemical group 0.000 claims description 10
- 125000004122 cyclic group Chemical group 0.000 claims description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 8
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 claims description 7
- 125000001624 naphthyl group Chemical group 0.000 claims description 7
- 125000005551 pyridylene group Chemical group 0.000 claims description 7
- 125000003107 substituted aryl group Chemical group 0.000 claims description 7
- 229940124597 therapeutic agent Drugs 0.000 claims description 7
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 6
- 125000004429 atom Chemical group 0.000 claims description 6
- 125000001041 indolyl group Chemical group 0.000 claims description 6
- 125000004951 trihalomethoxy group Chemical group 0.000 claims description 6
- 150000003931 anilides Chemical group 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 230000004060 metabolic process Effects 0.000 claims description 5
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 5
- 208000026935 allergic disease Diseases 0.000 claims description 4
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 claims description 4
- 208000027866 inflammatory disease Diseases 0.000 claims description 4
- 208000023504 respiratory system disease Diseases 0.000 claims description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 claims description 3
- 125000000842 isoxazolyl group Chemical group 0.000 claims description 3
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 claims description 3
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 claims description 3
- 125000001544 thienyl group Chemical group 0.000 claims description 3
- 206010020751 Hypersensitivity Diseases 0.000 claims description 2
- 230000007815 allergy Effects 0.000 claims description 2
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims 1
- 150000001875 compounds Chemical class 0.000 abstract description 100
- 239000000203 mixture Substances 0.000 abstract description 80
- 230000000694 effects Effects 0.000 abstract description 11
- 239000001257 hydrogen Substances 0.000 abstract description 4
- 229910052739 hydrogen Inorganic materials 0.000 abstract description 4
- 239000000126 substance Substances 0.000 abstract description 4
- 239000003795 chemical substances by application Substances 0.000 abstract description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 144
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 57
- 239000000243 solution Substances 0.000 description 45
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 44
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 29
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 28
- 238000000034 method Methods 0.000 description 27
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 26
- 238000006243 chemical reaction Methods 0.000 description 25
- 239000002904 solvent Substances 0.000 description 25
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 22
- 229910052760 oxygen Inorganic materials 0.000 description 22
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 21
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 20
- 239000001301 oxygen Substances 0.000 description 20
- 230000002829 reductive effect Effects 0.000 description 19
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 18
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 16
- 150000001556 benzimidazoles Chemical class 0.000 description 16
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 16
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 15
- 125000004434 sulfur atom Chemical group 0.000 description 15
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 14
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 14
- 238000010898 silica gel chromatography Methods 0.000 description 14
- 238000001308 synthesis method Methods 0.000 description 13
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 12
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical compound S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 description 12
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 12
- DPJCXCZTLWNFOH-UHFFFAOYSA-N 2-nitroaniline Chemical class NC1=CC=CC=C1[N+]([O-])=O DPJCXCZTLWNFOH-UHFFFAOYSA-N 0.000 description 11
- 125000001072 heteroaryl group Chemical group 0.000 description 11
- 238000003756 stirring Methods 0.000 description 11
- 125000003118 aryl group Chemical group 0.000 description 10
- 239000003889 eye drop Substances 0.000 description 10
- 229940012356 eye drops Drugs 0.000 description 10
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- 125000005549 heteroarylene group Chemical group 0.000 description 9
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 9
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- 125000000732 arylene group Chemical group 0.000 description 8
- 229910000104 sodium hydride Inorganic materials 0.000 description 8
- 239000005711 Benzoic acid Substances 0.000 description 7
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 7
- 0 Nc1ccc(C[Cn])cc1 Chemical compound Nc1ccc(C[Cn])cc1 0.000 description 7
- 229940058303 antinematodal benzimidazole derivative Drugs 0.000 description 7
- 235000010233 benzoic acid Nutrition 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 229910052717 sulfur Inorganic materials 0.000 description 7
- PHRABVHYUHIYGY-UHFFFAOYSA-N 1-methylnaphthalene Chemical group C1=CC=C2C([CH2])=CC=CC2=C1 PHRABVHYUHIYGY-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 108090000227 Chymases Proteins 0.000 description 6
- 102000003858 Chymases Human genes 0.000 description 6
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 6
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium on carbon Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 6
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 6
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 6
- 239000012312 sodium hydride Substances 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 5
- 101000909992 Papio hamadryas Chymase Proteins 0.000 description 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 239000008187 granular material Substances 0.000 description 5
- 239000003112 inhibitor Substances 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 5
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 239000011593 sulfur Substances 0.000 description 5
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 5
- CKUXMYYDAQIJRQ-UHFFFAOYSA-N 5,6-dimethyl-1,3-dihydrobenzimidazole-2-thione Chemical compound C1=C(C)C(C)=CC2=C1NC(=S)N2 CKUXMYYDAQIJRQ-UHFFFAOYSA-N 0.000 description 4
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 125000002252 acyl group Chemical group 0.000 description 4
- 125000004414 alkyl thio group Chemical group 0.000 description 4
- 239000012267 brine Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 4
- QKASDIPENBEWBU-UHFFFAOYSA-N methyl 2-(bromomethyl)benzoate Chemical compound COC(=O)C1=CC=CC=C1CBr QKASDIPENBEWBU-UHFFFAOYSA-N 0.000 description 4
- 150000004702 methyl esters Chemical class 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 235000019198 oils Nutrition 0.000 description 4
- 125000004043 oxo group Chemical group O=* 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 238000005406 washing Methods 0.000 description 4
- XMWGTKZEDLCVIG-UHFFFAOYSA-N 1-(chloromethyl)naphthalene Chemical compound C1=CC=C2C(CCl)=CC=CC2=C1 XMWGTKZEDLCVIG-UHFFFAOYSA-N 0.000 description 3
- IOHPVZBSOKLVMN-UHFFFAOYSA-N 2-(2-phenylethyl)benzoic acid Chemical compound OC(=O)C1=CC=CC=C1CCC1=CC=CC=C1 IOHPVZBSOKLVMN-UHFFFAOYSA-N 0.000 description 3
- DLURHXYXQYMPLT-UHFFFAOYSA-N 2-nitro-p-toluidine Chemical compound CC1=CC=C(N)C([N+]([O-])=O)=C1 DLURHXYXQYMPLT-UHFFFAOYSA-N 0.000 description 3
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 125000004442 acylamino group Chemical group 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000009833 condensation Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 150000002170 ethers Chemical class 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 210000003630 histaminocyte Anatomy 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- DXPVKEHMQWTSTM-UHFFFAOYSA-N methyl 2-(1h-benzimidazol-2-ylsulfanylmethyl)benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC=CC=C2N1 DXPVKEHMQWTSTM-UHFFFAOYSA-N 0.000 description 3
- 150000002978 peroxides Chemical class 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 230000002335 preservative effect Effects 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- YHMYGUUIMTVXNW-UHFFFAOYSA-N 1,3-dihydrobenzimidazole-2-thione Chemical compound C1=CC=C2NC(S)=NC2=C1 YHMYGUUIMTVXNW-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- UJRAVYVAAGGGDR-UHFFFAOYSA-N 2-[(5,6-dimethyl-1h-benzimidazol-2-yl)sulfanylmethyl]benzonitrile Chemical compound N1C=2C=C(C)C(C)=CC=2N=C1SCC1=CC=CC=C1C#N UJRAVYVAAGGGDR-UHFFFAOYSA-N 0.000 description 2
- AXVGUIUDXAEXRH-UHFFFAOYSA-N 2-[[1-[(2,5-dimethylphenyl)methyl]-5,6-dimethylbenzimidazol-2-yl]sulfanylmethyl]benzonitrile Chemical compound CC1=CC=C(C)C(CN2C3=CC(C)=C(C)C=C3N=C2SCC=2C(=CC=CC=2)C#N)=C1 AXVGUIUDXAEXRH-UHFFFAOYSA-N 0.000 description 2
- DGCYWIJZKNEZSC-UHFFFAOYSA-N 2-n-(naphthalen-1-ylmethyl)pyridine-2,3-diamine Chemical compound NC1=CC=CN=C1NCC1=CC=CC2=CC=CC=C12 DGCYWIJZKNEZSC-UHFFFAOYSA-N 0.000 description 2
- PCJFEVUKVKQSSL-UHFFFAOYSA-N 2h-1,2,4-oxadiazol-5-one Chemical group O=C1N=CNO1 PCJFEVUKVKQSSL-UHFFFAOYSA-N 0.000 description 2
- IGAVZWMNOPFOCW-UHFFFAOYSA-N 2h-1,2,4-thiadiazol-5-one Chemical group O=C1NC=NS1 IGAVZWMNOPFOCW-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- JVSZYSQWDPDRJX-UHFFFAOYSA-N 3-(naphthalen-1-ylmethyl)-1h-imidazo[4,5-b]pyridine-2-thione Chemical compound C1=CC=C2C(CN3C4=NC=CC=C4N=C3S)=CC=CC2=C1 JVSZYSQWDPDRJX-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 206010012438 Dermatitis atopic Diseases 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 2
- 208000031481 Pathologic Constriction Diseases 0.000 description 2
- KFSLWBXXFJQRDL-UHFFFAOYSA-N Peracetic acid Chemical compound CC(=O)OO KFSLWBXXFJQRDL-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 208000001647 Renal Insufficiency Diseases 0.000 description 2
- 206010039085 Rhinitis allergic Diseases 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 2
- 208000024780 Urticaria Diseases 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 201000010105 allergic rhinitis Diseases 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 150000003863 ammonium salts Chemical class 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 201000008937 atopic dermatitis Diseases 0.000 description 2
- 150000001540 azides Chemical class 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 2
- 229960001231 choline Drugs 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 239000000645 desinfectant Substances 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 238000003818 flash chromatography Methods 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 201000006370 kidney failure Diseases 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- FLDMWRZKOSGMIS-UHFFFAOYSA-N methyl 2-[(5,6-dimethyl-1h-benzimidazol-2-yl)sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC(C)=C(C)C=C2N1 FLDMWRZKOSGMIS-UHFFFAOYSA-N 0.000 description 2
- CULHBJZNTLVYMY-UHFFFAOYSA-N methyl 2-[[1-[[2-(phenylcarbamoyl)phenyl]methylsulfanyl]benzimidazol-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC=CC=C2N1SCC1=CC=CC=C1C(=O)NC1=CC=CC=C1 CULHBJZNTLVYMY-UHFFFAOYSA-N 0.000 description 2
- DMVYEFWKZHAPII-UHFFFAOYSA-N methyl 2-[[5,6-dimethyl-1-(2-phenoxyethyl)benzimidazol-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC(C)=C(C)C=C2N1CCOC1=CC=CC=C1 DMVYEFWKZHAPII-UHFFFAOYSA-N 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 2
- 150000002825 nitriles Chemical class 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 201000008482 osteoarthritis Diseases 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 150000002989 phenols Chemical class 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000002784 sclerotic effect Effects 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 230000036262 stenosis Effects 0.000 description 2
- 208000037804 stenosis Diseases 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- ODPHKSUVCOQKGE-UHFFFAOYSA-N tert-butyl 2-[(1-benzoyl-5,6-dimethylbenzimidazol-2-yl)sulfanylmethyl]benzoate Chemical compound C=1C=CC=CC=1C(=O)N1C=2C=C(C)C(C)=CC=2N=C1SCC1=CC=CC=C1C(=O)OC(C)(C)C ODPHKSUVCOQKGE-UHFFFAOYSA-N 0.000 description 2
- 239000002562 thickening agent Substances 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- QDZOEBFLNHCSSF-PFFBOGFISA-N (2S)-2-[[(2R)-2-[[(2S)-1-[(2S)-6-amino-2-[[(2S)-1-[(2R)-2-amino-5-carbamimidamidopentanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-N-[(2R)-1-[[(2S)-1-[[(2R)-1-[[(2S)-1-[[(2S)-1-amino-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]pentanediamide Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](N)CCCNC(N)=N)C1=CC=CC=C1 QDZOEBFLNHCSSF-PFFBOGFISA-N 0.000 description 1
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 description 1
- VLSDXINSOMDCBK-BQYQJAHWSA-N (E)-1,1'-azobis(N,N-dimethylformamide) Chemical compound CN(C)C(=O)\N=N\C(=O)N(C)C VLSDXINSOMDCBK-BQYQJAHWSA-N 0.000 description 1
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical group C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 description 1
- SLLFVLKNXABYGI-UHFFFAOYSA-N 1,2,3-benzoxadiazole Chemical group C1=CC=C2ON=NC2=C1 SLLFVLKNXABYGI-UHFFFAOYSA-N 0.000 description 1
- CSNIZNHTOVFARY-UHFFFAOYSA-N 1,2-benzothiazole Chemical group C1=CC=C2C=NSC2=C1 CSNIZNHTOVFARY-UHFFFAOYSA-N 0.000 description 1
- KTZQTRPPVKQPFO-UHFFFAOYSA-N 1,2-benzoxazole Chemical group C1=CC=C2C=NOC2=C1 KTZQTRPPVKQPFO-UHFFFAOYSA-N 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- OMZINLIPPVNUOG-UHFFFAOYSA-N 1,4-dichloro-2-(chloromethyl)benzene Chemical compound ClCC1=CC(Cl)=CC=C1Cl OMZINLIPPVNUOG-UHFFFAOYSA-N 0.000 description 1
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical group C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 1
- IBNGPIOSWCMJGG-UHFFFAOYSA-N 1-methylindole-2-carbaldehyde Chemical compound C1=CC=C2N(C)C(C=O)=CC2=C1 IBNGPIOSWCMJGG-UHFFFAOYSA-N 0.000 description 1
- QGXNHCXKWFNKCG-UHFFFAOYSA-N 2-(bromomethyl)benzonitrile Chemical compound BrCC1=CC=CC=C1C#N QGXNHCXKWFNKCG-UHFFFAOYSA-N 0.000 description 1
- FEJJHUYQVCTWTP-UHFFFAOYSA-N 2-[2-[(2-methoxycarbonylphenyl)methylsulfanyl]-1h-benzimidazol-4-yl]acetic acid Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=C(CC(O)=O)C=CC=C2N1 FEJJHUYQVCTWTP-UHFFFAOYSA-N 0.000 description 1
- GGMDMQVLLFVWPK-UHFFFAOYSA-N 2-[[1-[(1-methylindol-3-yl)methyl]benzimidazol-2-yl]sulfanylmethyl]benzoic acid Chemical compound C12=CC=CC=C2N(C)C=C1CN(C1=CC=CC=C1N=1)C=1SCC1=CC=CC=C1C(O)=O GGMDMQVLLFVWPK-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 1
- MHQULXYNBKWNDF-UHFFFAOYSA-N 3,4-dimethylbenzene-1,2-diamine Chemical compound CC1=CC=C(N)C(N)=C1C MHQULXYNBKWNDF-UHFFFAOYSA-N 0.000 description 1
- YNJSNEKCXVFDKW-UHFFFAOYSA-N 3-(5-amino-1h-indol-3-yl)-2-azaniumylpropanoate Chemical compound C1=C(N)C=C2C(CC(N)C(O)=O)=CNC2=C1 YNJSNEKCXVFDKW-UHFFFAOYSA-N 0.000 description 1
- XFJOLULOURFFFD-UHFFFAOYSA-N 3-[(2,5-dimethylphenyl)methyl]-1h-imidazo[4,5-b]pyridine-2-thione Chemical compound CC1=CC=C(C)C(CN2C3=NC=CC=C3N=C2S)=C1 XFJOLULOURFFFD-UHFFFAOYSA-N 0.000 description 1
- BPYHGTCRXDWOIQ-UHFFFAOYSA-N 3-nitropyridin-2-amine Chemical compound NC1=NC=CC=C1[N+]([O-])=O BPYHGTCRXDWOIQ-UHFFFAOYSA-N 0.000 description 1
- WEQPBCSPRXFQQS-UHFFFAOYSA-N 4,5-dihydro-1,2-oxazole Chemical compound C1CC=NO1 WEQPBCSPRXFQQS-UHFFFAOYSA-N 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 102400000344 Angiotensin-1 Human genes 0.000 description 1
- 101800000734 Angiotensin-1 Proteins 0.000 description 1
- 102000004266 Collagen Type IV Human genes 0.000 description 1
- 108010042086 Collagen Type IV Proteins 0.000 description 1
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 1
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 1
- 102000002045 Endothelin Human genes 0.000 description 1
- 108050009340 Endothelin Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 102000003777 Interleukin-1 beta Human genes 0.000 description 1
- 108090000193 Interleukin-1 beta Proteins 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- 230000006181 N-acylation Effects 0.000 description 1
- 238000007126 N-alkylation reaction Methods 0.000 description 1
- UEEJHVSXFDXPFK-UHFFFAOYSA-N N-dimethylaminoethanol Chemical compound CN(C)CCO UEEJHVSXFDXPFK-UHFFFAOYSA-N 0.000 description 1
- PLIKAWJENQZMHA-UHFFFAOYSA-N Nc(cc1)ccc1O Chemical compound Nc(cc1)ccc1O PLIKAWJENQZMHA-UHFFFAOYSA-N 0.000 description 1
- CWLKGDAVCFYWJK-UHFFFAOYSA-N Nc1cc(O)ccc1 Chemical compound Nc1cc(O)ccc1 CWLKGDAVCFYWJK-UHFFFAOYSA-N 0.000 description 1
- 102000035092 Neutral proteases Human genes 0.000 description 1
- 108091005507 Neutral proteases Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 239000004373 Pullulan Substances 0.000 description 1
- 229920001218 Pullulan Polymers 0.000 description 1
- ARJUXNOHEOODFI-UHFFFAOYSA-N S1C=CC(CSC=2NC3=CC(C)=C(C)C=C3N=2)=C1C(=O)OC Chemical compound S1C=CC(CSC=2NC3=CC(C)=C(C)C=C3N=2)=C1C(=O)OC ARJUXNOHEOODFI-UHFFFAOYSA-N 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 102400000096 Substance P Human genes 0.000 description 1
- 101800003906 Substance P Proteins 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- 102000003938 Thromboxane Receptors Human genes 0.000 description 1
- 108090000300 Thromboxane Receptors Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 229910001420 alkaline earth metal ion Inorganic materials 0.000 description 1
- 229920013820 alkyl cellulose Polymers 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- ORWYRWWVDCYOMK-HBZPZAIKSA-N angiotensin I Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 ORWYRWWVDCYOMK-HBZPZAIKSA-N 0.000 description 1
- 150000001448 anilines Chemical class 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- OSJRGDBEYARHLX-UHFFFAOYSA-N azido(trimethyl)stannane Chemical compound [N-]=[N+]=[N-].C[Sn+](C)C OSJRGDBEYARHLX-UHFFFAOYSA-N 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical group C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 1
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 125000004106 butoxy group Chemical group [*]OC([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 238000010531 catalytic reduction reaction Methods 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000003601 chymase inhibitor Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- AQEFLFZSWDEAIP-UHFFFAOYSA-N di-tert-butyl ether Chemical compound CC(C)(C)OC(C)(C)C AQEFLFZSWDEAIP-UHFFFAOYSA-N 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 229940052296 esters of benzoic acid for local anesthesia Drugs 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- XCPKCWWYYUFIBC-UHFFFAOYSA-N ethyl 2-[(5,6-dimethyl-1H-benzimidazol-2-yl)sulfanyl]butanoate Chemical compound C(C)OC(C(CC)SC=1NC2=C(N1)C=C(C(=C2)C)C)=O XCPKCWWYYUFIBC-UHFFFAOYSA-N 0.000 description 1
- CUDGEUPMXBOZJX-UHFFFAOYSA-N ethyl 3-(1h-benzimidazol-2-ylsulfanylmethyl)pyridine-2-carboxylate Chemical compound CCOC(=O)C1=NC=CC=C1CSC1=NC2=CC=CC=C2N1 CUDGEUPMXBOZJX-UHFFFAOYSA-N 0.000 description 1
- BLNUHDNZXJPOQW-UHFFFAOYSA-N ethyl 3-[(5,6-dimethyl-1h-benzimidazol-2-yl)sulfanylmethyl]pyridine-2-carboxylate Chemical compound CCOC(=O)C1=NC=CC=C1CSC1=NC2=CC(C)=C(C)C=C2N1 BLNUHDNZXJPOQW-UHFFFAOYSA-N 0.000 description 1
- 239000003885 eye ointment Substances 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 150000002314 glycerols Chemical class 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 150000001469 hydantoins Chemical class 0.000 description 1
- 150000004678 hydrides Chemical class 0.000 description 1
- 238000005913 hydroamination reaction Methods 0.000 description 1
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 1
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 1
- 150000002461 imidazolidines Chemical class 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- KYZUEUHOHYGATM-UHFFFAOYSA-N methyl 2-(1h-benzimidazol-2-ylsulfanylmethyl)-5-chlorobenzoate Chemical compound COC(=O)C1=CC(Cl)=CC=C1CSC1=NC2=CC=CC=C2N1 KYZUEUHOHYGATM-UHFFFAOYSA-N 0.000 description 1
- FFZYLEZBBFRIPU-UHFFFAOYSA-N methyl 2-(1h-benzimidazol-2-ylsulfanylmethyl)furan-3-carboxylate Chemical compound C1=COC(CSC=2NC3=CC=CC=C3N=2)=C1C(=O)OC FFZYLEZBBFRIPU-UHFFFAOYSA-N 0.000 description 1
- RVJALMBTTJQOKN-UHFFFAOYSA-N methyl 2-[(5,6-dichloro-1h-benzimidazol-2-yl)sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC(Cl)=C(Cl)C=C2N1 RVJALMBTTJQOKN-UHFFFAOYSA-N 0.000 description 1
- YDRPCUCUWKCKNL-UHFFFAOYSA-N methyl 2-[(5,6-dichloro-1h-benzimidazol-2-yl)sulfanylmethyl]pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1CSC1=NC2=CC(Cl)=C(Cl)C=C2N1 YDRPCUCUWKCKNL-UHFFFAOYSA-N 0.000 description 1
- QUKWOOAUWJIPMA-UHFFFAOYSA-N methyl 2-[(5,6-dimethyl-1h-benzimidazol-2-yl)sulfanylmethyl]furan-3-carboxylate Chemical compound C1=COC(CSC=2NC3=CC(C)=C(C)C=C3N=2)=C1C(=O)OC QUKWOOAUWJIPMA-UHFFFAOYSA-N 0.000 description 1
- JELITFROKKQIOT-UHFFFAOYSA-N methyl 2-[[1-(2-anilino-2-oxoethyl)benzimidazol-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC=CC=C2N1CC(=O)NC1=CC=CC=C1 JELITFROKKQIOT-UHFFFAOYSA-N 0.000 description 1
- ULFZLRWKMCQTLA-UHFFFAOYSA-N methyl 2-[[1-(2-hydroxyethyl)-5,6-dimethylbenzimidazol-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC(C)=C(C)C=C2N1CCO ULFZLRWKMCQTLA-UHFFFAOYSA-N 0.000 description 1
- IOMZSNBMWMCLBS-UHFFFAOYSA-N methyl 2-[[3-(naphthalen-1-ylmethyl)imidazo[4,5-b]pyridin-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC=CN=C2N1CC1=CC=CC2=CC=CC=C12 IOMZSNBMWMCLBS-UHFFFAOYSA-N 0.000 description 1
- IOJMOCFQVGRXQQ-UHFFFAOYSA-N methyl 2-[[5,6-dimethyl-1-(naphthalen-1-ylmethyl)benzimidazol-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC(C)=C(C)C=C2N1CC1=CC=CC2=CC=CC=C12 IOJMOCFQVGRXQQ-UHFFFAOYSA-N 0.000 description 1
- ICHLLASSTIHSGD-UHFFFAOYSA-N methyl 2-[[6-methyl-1-(naphthalen-1-ylmethyl)benzimidazol-2-yl]sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC=C(C)C=C2N1CC1=CC=CC2=CC=CC=C12 ICHLLASSTIHSGD-UHFFFAOYSA-N 0.000 description 1
- NGVVUSGLFZSRGH-UHFFFAOYSA-N methyl 3-(1h-benzimidazol-2-ylsulfanylmethyl)thiophene-2-carboxylate Chemical compound S1C=CC(CSC=2NC3=CC=CC=C3N=2)=C1C(=O)OC NGVVUSGLFZSRGH-UHFFFAOYSA-N 0.000 description 1
- BBJFIOUFFXWMOX-UHFFFAOYSA-N methyl 5-chloro-2-[(5,6-dichloro-1h-benzimidazol-2-yl)sulfanylmethyl]benzoate Chemical compound COC(=O)C1=CC(Cl)=CC=C1CSC1=NC2=CC(Cl)=C(Cl)C=C2N1 BBJFIOUFFXWMOX-UHFFFAOYSA-N 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 125000004957 naphthylene group Chemical group 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- AKRYBBWYDSDZHG-UHFFFAOYSA-N nitrosobis(2-oxopropyl)amine Chemical compound CC(=O)CN(N=O)CC(C)=O AKRYBBWYDSDZHG-UHFFFAOYSA-N 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- FCYIISMGCSEHFM-UHFFFAOYSA-N o-methyl 4-(1h-benzimidazol-2-yl)butanethioate Chemical compound C1=CC=C2NC(CCCC(=S)OC)=NC2=C1 FCYIISMGCSEHFM-UHFFFAOYSA-N 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- HDOWRFHMPULYOA-UHFFFAOYSA-N piperidin-4-ol Chemical compound OC1CCNCC1 HDOWRFHMPULYOA-UHFFFAOYSA-N 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 230000006626 positive regulation of mast cell degranulation Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- GGHDAUPFEBTORZ-UHFFFAOYSA-N propane-1,1-diamine Chemical compound CCC(N)N GGHDAUPFEBTORZ-UHFFFAOYSA-N 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 235000019423 pullulan Nutrition 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical class N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- GDXWSXWZJVMHDB-UHFFFAOYSA-N tert-butyl 2-(2-bromoethyl)benzoate Chemical compound CC(C)(C)OC(=O)C1=CC=CC=C1CCBr GDXWSXWZJVMHDB-UHFFFAOYSA-N 0.000 description 1
- CZZWLGQCYJDGCR-UHFFFAOYSA-N tert-butyl 2-(bromomethyl)benzoate Chemical compound CC(C)(C)OC(=O)C1=CC=CC=C1CBr CZZWLGQCYJDGCR-UHFFFAOYSA-N 0.000 description 1
- OLBBIUALRCWSKQ-UHFFFAOYSA-N tert-butyl 2-[(5,6-dimethyl-1h-benzimidazol-2-yl)sulfanylmethyl]benzoate Chemical compound N1C=2C=C(C)C(C)=CC=2N=C1SCC1=CC=CC=C1C(=O)OC(C)(C)C OLBBIUALRCWSKQ-UHFFFAOYSA-N 0.000 description 1
- BMYWJEISFNVKDN-UHFFFAOYSA-N tert-butyl 2-[[2-[(2-methoxycarbonylphenyl)methylsulfanyl]benzimidazol-1-yl]methyl]benzoate Chemical compound COC(=O)C1=CC=CC=C1CSC1=NC2=CC=CC=C2N1CC1=CC=CC=C1C(=O)OC(C)(C)C BMYWJEISFNVKDN-UHFFFAOYSA-N 0.000 description 1
- BNWCETAHAJSBFG-UHFFFAOYSA-N tert-butyl 2-bromoacetate Chemical compound CC(C)(C)OC(=O)CBr BNWCETAHAJSBFG-UHFFFAOYSA-N 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 230000003966 vascular damage Effects 0.000 description 1
- 231100000216 vascular lesion Toxicity 0.000 description 1
- 230000002227 vasoactive effect Effects 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/14—Decongestants or antiallergics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/24—Benzimidazoles; Hydrogenated benzimidazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D235/28—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pulmonology (AREA)
- Physical Education & Sports Medicine (AREA)
- Immunology (AREA)
- Rheumatology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Ophthalmology & Optometry (AREA)
- Pain & Pain Management (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Описывается производное тиобензимидазола, представленное формулой (1)
или его приемлемая с медицинской точки зрения соль, где R1 и R2 одновременно или независимо друг от друга представляют собой атом водорода, галогена, тригалогенметильную группу, цианогруппу, гидроксигруппу, алкильную группу с 1-4 атомами углерода, алкоксигруппу с 1-4 атомами углерода или R1 и R2 вместе образуют -О-СН2-О-, -О-СН2-СН2-О- или -СН2-СН2-СН2-, А представляет собой простую связь, линейную алкиленовую группу с 1-6 атомами углерода, необязательно замещенную алкильной группой с 1-4 атомами углерода, замещенную или незамещенную фениленовую группу, незамещенную пиридиленовую группу, фураниленовую или тиофениленовую группу, Е представляет собой COOR3 или тетразолильную группу, R3 представляет собой атом водорода или линейную или разветвленную алкильную группу с 1-4 атомами углерода, G представляет собой незамещенную линейную алкиленовую группу с 1-6 атомами углерода, -CH2CO-, -CH2-CH2-O-, -CH2CONH-, -CO-, -SO2-, -CH2-CH2-S- или -CH2S-, m равен целому числу от 0 до 2, J принимает различные значения в зависимости от m и А, Х представляет СН или атом азота. Описывается также фармацевтическая композиция, обладающая ингибирующей химазу человека активностью, на основе этого соединения. Технический результат – указанная композиция является возможным профилактическим и/или лечебным средством при различных заболеваниях, в которые вовлечена химаза человека. 2 н. и 12 з.п. ф-лы, 52 табл.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к производным тиобензимидазола, представленным формулой (1), и, конкретнее, к производным тиобензимидазола, полезным в качестве ингибиторов химазной активности у человека.
Уровень техники
Химаза является одной из нейтральных протеаз, присутствующих в гранулах тучных клеток, и активно вовлечена в различные биологические процессы, в которых участвуют тучные клетки. Сообщается о разном ее действии, включая, например, стимуляцию дегрануляции из тучных клеток, активацию интерлейкина-1β (IL-1β), активацию протеазы матрикса, разложение фибронектина и коллагена типа IV, стимуляцию высвобождения трансформирующего β-фактора роста (TGF-β), активацию вещества Р и вазоактивного интестинального (кишечного) полипептида (VIP), конверсию ангиотензина I (Аng I) в Аng II, конверсию эндотелина и т.п.
Перечисленное выше показывает, что ингибиторы указанной химазной активности могут быть перспективными в качестве профилактических и/или лечебных средств в случае заболеваний органов дыхания, таких как бронхиальная астма, воспалительных/аллергических заболеваний, например аллергического ринита, атопического дерматита и крапивницы; заболеваний органов системы кровообращения, например склеротических повреждений сосудов, интраваскулярного стеноза, расстройств периферического кровообращения, почечной и сердечной недостаточности; заболеваний, вызванных нарушением костно-хрящевого метаболизма, таких как ревматоидный артрит и остеоартрит, и подобных заболеваний.
В качестве ингибиторов химазной активности известны производные триазина (публикация непрошедшей экспертизу заявки на патент Японии (Kokai) №8-208654); производные гидантоина (публикация непрошедшей экспертизу заявки на патент Японии (Kokai) №9-31061); производные имидазолидина (заявка РСТ WO 96/04248); производные хиназолина (заявка РСТ WO 97/11941); производные гетероциклических амидов (заявка РСТ WO 96/33974); и т.п. Однако строение этих соединений совершенно отличается от строения соединений согласно настоящему изобретению.
С другой стороны, аналоги соединений согласно настоящему изобретению описываются в патенте США №5124336. В указанном патенте производные тиобензимидазола описываются как обладающие антагонистической активностью в отношении тромбоксанового рецептора. Однако в данном описании не указывается на активность указанных соединений в отношении ингибирования химазы человека.
Таким образом, объектом настоящего изобретения являются новые соединения, являющиеся потенциальными и клинически примелемыми ингибиторами химазы человека.
Сущность изобретения
Итак, после интенсивных исследований для достижения вышеуказанных целей авторы настоящего изобретения пришли к перечисленному ниже в пп.1-15, что составляет сущность настоящего изобретения.
1. Производное тиобензимидазола, представленное формулой (1)
где R1 и R2, одновременно или независимо друг от друга, представляют атом водорода, атом галогена, тригалогенметильную группу, цианогруппу, гидроксигруппу, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода, или R1 и R2 вместе образуют -O-СН2-O-, -O-СН2-СН2-O- или -СН2-СН2-СН2-, где атомы углерода могут быть замещены одной или несколькими алкильными группами с 1-4 атомами углерода;
А представляет простую связь, замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, где заместитель представляет атом галогена, ОН, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода (заместители могут быть связаны друг с другом в соседних положениях через ацетальную связь), линейную или разветвленную алкилтиогруппу с 1-6 атомами углерода, линейную или разветвленную алкилсульфонильную группу с 1-6 атомами углерода, линейную или разветвленную ацильную группу с 1-6 атомами углерода, линейную или разветвленную ациламиногруппу с 1-6 атомами углерода, тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу, оксогруппу или феноксигруппу, которая может быть замещена одним или несколькими атомами галогена и где заместители могут находиться независимо в любом одном или нескольких положениях цикла или алкиленовой группы;
Е представляет COOR3, SО3R3, CONHR3, SO2NHR3, тетразольную группу, 5-oкco-1,2,4-оксадиазольную группу или 5-оксо-1,2,4-тиадиазольную группу, где R3 представляет атом водорода или линейную или разветвленную алкильную группу с 1-6 атомами углерода;
G представляет замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, которая может прерываться одним или несколькими О, S, SO2 и NR3, где R3 имеет указанные выше значения, и заместитель представляет атом галогена, ОН, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода (заместители могут быть связаны друг с другом в соседних положениях через ацетальную связь), тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу или оксогруппу;
m равен целому числу от 0 до 2;
когда m равен 0 и А представляет собой замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, тогда J представляет замещенную или незамещенную линейную, циклическую или разветвленную алкильную группу с 3-6 атомами углерода, замещенную или незамещенную арильную группу с 7-9 атомами углерода, замещенную арильную группу с 10-11 атомами углерода, замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы;
когда m равен 0 и А представляет собой замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, тогда J представляет замещенную или незамещенную линейную, циклическую или разветвленную алкильную группу с 1-6 атомами углерода, замещенную или незамещенную арильную группу с 6-11 атомами углерода или замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы; или
когда m равен 0 и А представляет собой простую связь, или когда m равен 1 или 2, тогда J представляет замещенную или незамещенную линейную, циклическую или разветвленную алкильную группу с 1-6 атомами углерода, замещенную или незамещенную арильную группу с 6-11 атомами углерода или замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, где заместитель представляет атом галогена, ОН, NО2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода (заместители могут быть связаны друг с другом в соседних положениях через ацетальную связь), линейную или разветвленную алкилтиогруппу с 1-6 атомами углерода, линейную или разветвленную алкилсульфонильную группу с 1-6 атомами углерода, линейную или разветвленную ацильную группу с 1-6 атомами углерода, линейную или разветвленную ациламиногруппу с 1-6 атомами углерода, замещенную или незамещенную анилидную группу, тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу, оксогруппу, группу COOR3 или феноксигруппу, которая может быть замещена одним или несколькими атомами галогена, и где заместители могут находиться независимо в любом одном или нескольких положениях цикла или алкиленовой группы; и
Х представляет СН или атом азота;
или его приемлемая с медицинской точки зрения соль (далее называемые "производное тиобензимидазола настоящего изобретения").
2. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) А представляет собой замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, или его приемлемая с медицинской точки зрения соль.
3. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) А представляет собой замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, или его приемлемая с медицинской точки зрения соль.
4. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) m равен 1, или его приемлемая с медицинской точки зрения соль.
5. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) m равен 2, или его приемлемая с медицинской точки зрения соль.
6. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) m равен 0, А представляет собой замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, и J представляет собой замещенную или незамещенную арильную группу с 7-9 атомами углерода, замещенную арильную группу с 10-11 атомами углерода или замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, или его приемлемая с медицинской точки зрения соль.
7. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) m равен 0, А представляет собой замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, и J представляет собой замещенную или незамещенную арильную группу с 6-11 атомами углерода или замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, или его приемлемая с медицинской точки зрения соль.
8. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) G представляет собой –СН2-, -СН2-СН2-, -СН2СО-, -СН2СН2O-, -CH2CONH-, -CO-, -SO2-, -CH2SO2-, -CH2S- или –СН2-СН2-S-, или его приемлемая с медицинской точки зрения соль.
9. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) R1 и R2 одновременно представляют атом водорода, атом галогена, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода, или R1 и R2 независимо друг от друга представляют атом водорода, атом галогена, алкильную группу с 1-4 атомами углерода, алкоксигруппу с 1-4 атомами углерода, тригалогенметильную группу, цианогруппу или гидроксигруппу, или его приемлемая с медицинской точки зрения соль.
10. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) Е представляет СООН или тетразольную группу, или его приемлемая с медицинской точки зрения соль.
11. Производное тиобензимидазола, характеризующееся тем, что в приведенной выше формуле (1) Х представляет СН, или его приемлемая с медицинской точки зрения соль.
12. Производное тиобензимидазола, обладающее ингибирующей химазу человека активностью, или его приемлемая с медицинской точки зрения соль.
13. Фармацевтическая композиция, содержащая, по меньшей мере, одно производное тиобензимидазола или его приемлемую с медицинской точки зрения соль и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция, являющаяся профилактическим и/или лечебным средством при заболевании.
15. Профилактическое и/или лечебное средство, когда указанным заболеванием является воспалительное заболевание, аллергия, заболевание органов дыхания, болезнь органов системы кровообращения или заболевание, вызванное нарушением костно-хрящевого метаболизма.
Предпочтительный вариант осуществления изобретения
Теперь настоящее изобретение будет поясняться подробнее. Вышеуказанные определения заместителей в соединениях формулы (1) согласно настоящему изобретению относятся к следующему.
R1 и R2, одновременно или независимо друг от друга, представляют атом водорода, атом галогена, тригалогенметильную группу, цианогруппу, гидроксигруппу, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода, или R1 и R2 вместе образуют -O-СН2-О-, -О-СН2-СН2-О- или –CH2-CH2-CH2-, где атомы углерода могут быть замещены одной или несколькими алкильными группами с 1-4 атомами углерода. В качестве алкильной группы с 1-4 атомами углерода можно назвать метильную группу, этильную группу (н-, изо-)пропильную группу и (н-, изо-, втор-, трет-)бутильную группу, и предпочтительной можно назвать метильную группу. Предпочтительно R1 и R2 одновременно представляют атом водорода, атом галогена, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода, или R1 и R2 независимо друг от друга представляют атом водорода, атом галогена, тригалогенметильную группу, цианогруппу, гидроксигруппу, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода. В данном случае в качестве атома галогена можно назвать атом фтора, атом хлора, атом брома и т.п., и предпочтительными можно назвать атом хлора и атом фтора. В качестве алкильной группы с 1-4 атомами углерода можно назвать метильную группу, этильную группу (н-, изо-)пропильную группу и (н-, изо-, трет-)бутильную группу, и предпочтительной можно назвать метильную группу. В качестве алкоксигруппы с 1-4 атомами углерода можно назвать метоксигруппу, этоксигруппу, (н-, изо-)пропоксигруппу и (н-, изо-, втор-, трет-)бутоксигруппу, и предпочтительной можно назвать метоксигруппу.
А представляет простую связь, замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы. Предпочтительно можно назвать замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы. В качестве замещенной или незамещенной линейной или разветвленной алкиленовой группы с 1-6 атомами углерода можно назвать метиленовую группу, этиленовую группу, (н-, изо-)пропиленовую группу и (н-, изо-, трет-)бутиленовую группу, и предпочтительной можно назвать этиленовую группу. В качестве замещенной или незамещенной ариленовой группы с 6-11 атомами углерода можно назвать фениленовую группу, индениленовую группу и нафтиленовую группу, и т.п., и предпочтительной можно назвать фениленовую группу. В качестве замещенной или незамещенной гетероариленовой группы с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, можно назвать пиридиленовую группу, фураниленовую группу, тиофениленовую группу, имидазоленовую группу, тиазоленовую группу, пиримидиленовую группу, оксазоленовую группу, изоксазоленовую группу, бензофениленовую группу, бензимидазоленовую группу, хинолиленовую группу, индоленовую группу, бензотиазоленовую группу и т.п., и предпочтительными можно назвать пиридиленовую группу, фураниленовую группу и тиофениленовую группу.
Кроме того, в качестве используемых в данном случае заместителей можно назвать атом галогена, ОН, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода, где заместители могут быть связаны друг с другом в соседних положениях через ацетальную связь, линейную или разветвленную алкилтиогруппу с 1-6 атомами углерода, линейную или разветвленную алкилсульфонильную группу с 1-6 атомами углерода, линейную или разветвленную ацильную группу с 1-6 атомами углерода, линейную или разветвленную ациламиногруппу с 1-6 атомами углерода, тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу или феноксигруппу, которые могут быть замещены одним или несколькими атомами галогена. Они могут быть размещены независимо в любом одном или нескольких положениях цикла или алкиленовой группы. Конкретно, можно назвать ОН, хлор, бром, нитрогруппу, метоксигруппу, цианогруппу, метилендиоксигруппу, трифторметильную группу, метильную группу, этильную группу, (н-, изо-)пропильную группу, (н-, изо-, трет-)бутильную группу и т.п.
В качестве Е можно назвать COOR3, SО3R3, CONHR3, SO2NHR3, тетразольную группу, 5-оксо-1,2,4-оксадиазольную группу или 5-оксо-1,2,4-тиадиазольную группу, и предпочтительными можно назвать группу COOR3 или тетразольную группу. В качестве используемого здесь R3 можно назвать атом водорода или линейную или разветвленную алкильную группу с 1-6 атомами углерода, и предпочтительными можно назвать атом водорода, метильную группу, этильную группу или трет-бутильную группу, и наиболее предпочтительным можно назвать атом водорода.
G представляет замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, которая может прерываться одним или несколькими О, S, SO2 и NR3, где R3 имеет указанные выше значения, и заместитель представляет атом галогена, ОН, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода (заместители могут быть связаны друг с другом в соседних положениях через ацетальную связь), тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу или оксогруппу. Конкретно, здесь можно назвать группы –СН2-, -СН2-СН2-, -СН2СО-, -CH2CH2O-, -CH2CONH-, -СО-, -SO2-, -CH2SO2-, -CH2S-, -CH2-CH2-S и т.п., и предпочтительными можно назвать группы -СН2-, -СН2-СН2-, -СН2СО- или -СН2СН2O-.
m равен целому числу от 0 до 2, и предпочтительными значениями можно назвать 0 или 2.
Когда m равен 0 и А представляет собой замещенную или незамещенную линейную или разветвленную алкиленовую группу с 1-6 атомами углерода, тогда J представляет замещенную или незамещенную линейную, циклическую или разветвленную алкильную группу с 3-6 атомами углерода, замещенную или незамещенную арильную группу с 7-9 атомами углерода, замещенную арильную группу с 10-11 атомами углерода, замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы. Предпочтительными можно назвать замещенную арильную группу с 10-11 атомами углерода и замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы. В качестве замещенной или незамещенной линейной, циклической или разветвленной алкильной группы с 1-6 атомами углерода можно назвать (н-, изо-)пропильную группу, (н-, изо-, втор-, трет-)бутильную группу, (н-, изо-, нео-, трет-)пентильную группу и циклогексильную группу. В качестве замещенной или незамещенной арильной группы с 7-9 атомами углерода в данном случае можно назвать инденильную группу, и в качестве замещенной арильной группой с 10-11 атомами углерода можно назвать нафтильную группу. В качестве замещенной или незамещенной гетероарильной группы с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, можно назвать пиридильную группу, фуранильную группу, тиофенильную группу, имидазольную группу, тиазольную группу, пиримидиновую группу, оксазольную группу, изоксазольную группу, бензофурановую группу, бензимидазольную группу, хинолиновую группу, изохинолиновую группу, хиноксалиновую группу, бензоксадиазольную группу, бензотиадиазольную группу, индольную группу, N-метилиндольную группу, бензотиазольную группу, бензотиофенильную группу, бензизоксазольную группу и подобные группы, и предпочтительной можно назвать бензотиофенильную группу или N-метилиндольную группу.
Когда m равен 0 и А представляет собой замещенную или незамещенную ариленовую группу с 6-11 атомами углерода или замещенную или незамещенную гетероариленовую группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, тогда J представляет замещенную или незамещенную линейную, циклическую или разветвленную алкильную группу с 1-6 атомами углерода, замещенную или незамещенную арильную группу с 6-11 атомами углерода или замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, и предпочтительной можно назвать замещенную или незамещенную арильную группу с 6-11 атомами углерода и замещенную или незамещенную гетероарильную группу с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы. В качестве замещенной или незамещенной арильной группы с 6-11 атомами углерода можно назвать фенильную группу, инденильную группу, нафтильную группу и подобные группы, и предпочтительной можно назвать фенильную группу или нафтильную группу. В качестве замещенной или незамещенной линейной, циклической или разветвленной алкильной группы с 1-6 атомами углерода и в качестве замещенной или незамещенной гетероарильной группы с 4-10 атомами углерода, которая может содержать в цикле один или несколько атомов кислорода, азота и серы, можно назвать группы, описанные выше. В качестве заместителя, используемого здесь, можно назвать атом галогена, ОН, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода (заместители могут быть связаны друг с другом в соседних положениях через ацетальную связь), линейную или разветвленную алкилтиогруппу с 1-6 атомами углерода, линейную или разветвленную алкилсульфонильную группу с 1-6 атомами углерода, линейную или разветвленную ацильную группу с 1-6 атомами углерода, линейную или разветвленную ациламиногруппу с 1-6 атомами углерода, замещенную или незамещенную анилидную группу, тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу или феноксигруппу, которая может быть замещена одним или несколькими атомами галогена. Они могут быть размещены независимо в любом одном или нескольких положениях цикла или алкильной группы. Конкретно, в данном случае можно назвать ОН, хлор, бром, нитрогруппу, метоксигруппу, цианогруппу, метилендиоксигруппу, трифторметильную группу, трифторметоксигруппу, метильную группу, этильную группу, (н-, изо-)пропильную группу, (н-, изо-, втор-, трет-)бутильную группу, анилидную группу и подобные группы.
Х представляет СН или атом азота, и предпочтительным значением можно назвать СН.
В качестве соединений формулы (1) предпочтительны соединения, конкретно описанные в таблицах 1-40. Среди них наиболее предпочтительными являются соединения №№37, 50, 63, 64, 65, 84, 115, 117, 119, 121, 123, 130, 143, 147, 168, 174, 256, 264, 272, 311, 319, 320, 321, 324, 349, 352, 354, 355, 358, 364, 380, 392, 395, 398, 401, 402, 444, 455, 459, 460, 506, 863, 866 и 869.
Группы Al-А21 и J1-J85, указанные в таблицах 1-40, представляют собой группы, представленные ниже, в которых Е и G имеют указанные выше значения.
Производное тиобензимидазола (1) согласно настоящему изобретению, где Е представляет собой СООН и m равен 0, можно получить с помощью методов синтеза (А) или (В), описанных ниже (см. в конце описания).
В указанных на схеме способа синтеза (А) формулах Z представляет галоген, и R1, R2, R3, A, G, J и Х имеют значения, указанные выше.
В соответствии с указанным способом восстанавливают нитрогруппу производного 2-нитроанилина (а1) и получают ортофенилендиамин (а2). С этим диамином вводят во взаимодействие СS2, и получают соединение (а3), с которым вводят во взаимодействие галогензамещенный сложный эфир (а4), и получают (а5). Это соединение вводят во взаимодействие с галогензамещенным производным (а6), и получают (а7), которое гидролизуют и получают производное бензимидазола (а8) согласно настоящему изобретению.
Восстановление нитрогруппы можно осуществить в стандартных условиях каталитического восстановления. Например, осуществляют реакцию с газообразным водородом в присутствии катализатора, такого как Pd-C, при температуре от комнатной до 100°С. С другой стороны, можно применить способ обработки с использованием цинка или олова в кислой среде или способ с использованием цинковой пудры в нейтральной или щелочной среде.
Взаимодействие ортофенилендиамина (а2) с CS2 можно осуществить с использованием, например, способа, описанного в J. Org. Chem., 19: 631-637, 1954, или в J. Med. Chem., 36: 1175-1187, 1993 (раствор в EtOH).
Взаимодействие тиобензимидазола (а3) и галогензамещенного эфира (а4) можно осуществить в соответствии с условиями обычного S-алкилирования, например, в присутствии основания, такого как NaH, Et3N, NaOH или К2СО3, при температуре от 0 до 200°С при перемешивании.
Взаимодействие тиобензимидазола (а5) и галогензамещенного производного (а6) можно осуществить в соответствии с условиями обычного N-алкилирования или N-ацилирования, например в присутствии основания, такого как NaH, Et3N, NaOH или К2СО3, при температуре от 0 до 200°С при перемешивании.
Для удаления защитной карбоксигруппы R3 используют предпочтительно метод гидролиза с использованием щелочи, такой как гидроксид лития, или кислоты, такой как трифторуксусная кислота.
В соответствии с указанным способом синтеза (В) аминогруппу производного 2-нитроанилина (а1) можно защитить группой L и получить (b1). Это соединение вводят во взаимодействие с галогензамещенным производным (а6), и получают (b2) с последующим удалением защитной группы L и получением (b3). Нитрогруппу в (b3) восстанавливают, и получают производное ортофенилендиамина (b4). Его вводят во взаимодействие с CS2, и получают соединение (b5), с которым вводят во взаимодействие галогензамещенный эфир (а4), и получают (а7), которое можно гидролизовать и получить производное бензимидазола согласно настоящему изобретению. С другой стороны, также можно получить непосредственно соединение (b3), если ввести во взаимодействие с галогензамещенным производным (а6) или производным альдегида (b6) производное 2-нитроанилина (а1) без защитной группы. В качестве защитной группы L можно назвать трифторацетильную группу, ацетильную группу, трет-бутоксикарбонильную группу, бензильную группу и подобные группы. Взаимодействие производного 2-нитроанилина (а1) и производного альдегида (b6) можно осуществить в соответствии с условиями обычного гидроаминирования с использованием восстановителя, такого как комплексный гидрид, например LiAlH4, NaBH4, NaB3CN, NаВ3CN, NaBH(ОАс)3, и т.п., или диборан, в растворителе, таком как этанол, метанол и дихлорметан, при температуре от 0 до 200°С. Другие реакции можно осуществить так же, как описано в способе (А).
Производное тиобензимидазола (1) согласно настоящему изобретению, где Е представляет собой СООН, m равен 0 и G представляет собой амидную связь, можно получить с помощью способа синтеза (С), описанного ниже (см. в конце описания).
В приведенных на схеме способа синтеза (С) формулах Q представляет метиленовую группу, фениленовую группу и т.п., и Z представляет галоген. R1, R2, R3, A, J и Х имеют значения, указанные выше, при условии, что R3 представляет собой защитную группу, такую как этильная группа, метильная группа и т.п., неактивную в кислой среде.
В соответствии с указанным способом, галогензамещенный сложный трет-бутиловый эфир (c1) вводят во взаимодействие с тиобензимидазолом (а5) и получают соединение (с2), которое подвергают гидролизу в кислой среде и получают (с3). Это соединение вводят во взаимодействие с амином (с4) и получают (с5), которое подвергают гидролизу и получают производное бензимидазола согласно настоящему изобретению.
Амидирование-конденсацию можно осуществить обычным способом с использованием агента конденсации. В качестве агента конденсации можно назвать DCC, DIPC, EDC=WSCl, WSCI·HCl, ВОР, DPPA и т.п., который можно использовать один или в сочетании с HONSu, HOBt, HOOBt и т.п. Эту реакцию можно осуществить в подходящем растворителе, таком как ТГФ, хлороформ, трет-бутанол и т.п., при температуре от 0 до 200°С. Другие реакции можно осуществить так, как описано в способе синтеза (А).
Производное тиобензимидазола (1) согласно настоящему изобретению, где Е представляет собой СООН, m равен 0 и G представляет собой простую эфирную связь, можно получить с помощью способа синтеза (D), описанного ниже (см. в конце описания).
В приведенных на схеме способа синтеза (D) формулах Z представляет галоген, и R1, R2, R3, A, J и Х имеют значения, указанные выше.
В соответствии с указанным способом тиобензимидазол (а5) вводят во взаимодействие, например, с галогензамещенным спиртом (d1) и получают соединение (d2). Его вводят во взаимодействие с производным фенола (d3) и получают простой эфир (d4), который подвергают гидролизу и получают производное бензимидазола (а8) согласно настоящему изобретению.
Этерификацию можно осуществить с использованием фосфина, такого как трифенилфосфин и трибутилфосфин, и азосоединения, такого как DEAD и TMAD, в подходящем растворителе, таком как N-метилморфолин и ТГФ, при температуре от 0 до 200°С по реакции Мицунобу или аналогичным ей реакциям. Другие реакции можно осуществить так, как описано в способе синтеза (А).
Производное тиобензимидазола (1) согласно настоящему изобретению, где Е представляет собой тетразол и m равен 0, можно получить с помощью способа синтеза (Е), описанного ниже (см. в конце описания).
В приведенных на схеме способа синтеза (Е) формулах R1, R2, A, G, J и Х имеют значения, указанные выше.
Нитрил (е1) вводят во взаимодействие с различными азисоединениями для превращения в тетразол (е2).
В качестве азисоединения можно назвать азид триалкилолова, такой как азид триметилолова, и азотисто-водородную кислоту или ее аммониевую соль. Когда используют оловоорганический азид, его используют в 1-4-кратном молярном количестве относительно соединения (e1). Когда используют азотисто-водородную кислоту или ее аммониевую соль, можно использовать 1-5-кратное молярное количество азида натрия или третичного амина, такого как хлорид аммония и триэтиламин, относительно соединения (e1). Каждую реакцию осуществляют при температуре от 0 до 200°С в растворителе, таком как толуол, бензол и ДМФА.
Производное тиобензимидазола (1) согласно настоящему изобретению, где m равен 1 или 2, можно получить с помощью способа синтеза (F), описанного ниже (см. в конце описания).
В приведенных на схеме способа синтеза (F) формулах R1, R2, R3, A, G, J и Х имеют значения, указанные выше.
В соответствии с указанным способом, тиобензимидазол (а7) можно ввести во взаимодействие с пероксидом в подходящей среде и получить производное сульфоксида (f1) и/или производное сульфона (f2). В качестве используемого пероксида можно назвать пербензойную кислоту, м-хлорпербензойную кислоту, перуксусную кислоту, пероксид водорода и подобные соединения, и в качестве используемого растворителя можно назвать хлороформ, дихлорметан и т.п. Количество соединения (а7) относительно используемого пероксида выбирают в соответствующем широком интервале, предпочтительно, как правило, можно использовать 1,2-5-кратное молярное количество, но можно использовать и другое количество. Каждую реакцию осуществляют, как правило, при температуре примерно от 0 до 50°С и предпочтительно от 0°С до комнатной температуры и, как правило, завершают примерно через 4-20 часов.
Производное бензимидазола согласно настоящему изобретению при необходимости можно превратить в приемлемую с медицинской точки зрения нетоксичную катионсодержащую соль. В качестве такой соли можно назвать соль, содержащую ион щелочного металла, такой как Na+ и К+; ион щелочно-земельного металла, такой как Mg2+ и Са2+; ион металла, такой как Аl3+ и Zn2+; или соль органического основания, такого как аммиак, триэтиламин, этилендиамин, пропандиамин, пирролидин, пиперидин, пиперазин, пиридин, лизин, холин, этаноламин, N,N-диэтилэтаноламин, 4-гидроксипиперидин, глюкозамин и N-метилглюкамин. Среди них предпочтительны соли Na+, Са2+, лизина, холина, N,N-диметилэтаноламина и N-метилглюкамина.
Производные бензимидазола согласно настоящему изобретению ингибируют химазную активность у человека. Точнее, их IC50 составляет не более 1000, предпочтительно - не менее 0,01 и менее 1000 и предпочтительнее - не менее 0,05 и менее 500. Производные бензимидазола согласно настоящему изобретению, обладающие таким исключительным ингибирующим химазу человека действием, можно использовать в качестве клинически приемлемых профилактических и/или лечебных средств при различных заболеваниях.
Производные бензимидазола согласно настоящему изобретению можно вводить в виде фармацевтических композиций вместе с фармацевтически приемлемыми носителями пероральным или парентеральным способом после придания им соответствующих различных лекарственных форм. Как парентеральные способы введения можно назвать внутривенный, подкожный, внутримышечный, чрескожный, ректальный, назальный способы введения и введение в виде глазных капель.
Лекарственные формы указанных фармацевтических композиций включают следующие формы. Например, в случае перорального введения можно назвать такие лекарственные формы, как таблетки, пилюли, гранулы, порошки, растворы, суспензии, сиропы и капсулы.
В данном случае таблетки формируют обычным способом с использованием фармацевтически приемлемого носителя, такого как эксципиент, связующее средство и средство, способствующее рассыпанию. Пилюли, гранулы и порошки также можно сформировать обычным способом с использованием эксципиента и т.п. Растворы, суспензии и сиропы можно получить обычным способом с использованием эфиров глицерина, спиртов, воды, растительных масел и т.п. Капсулы можно получить посредством заполнения капсулы, изготовленной из желатина, гранулами, порошком и раствором.
Среди парентеральных препаратов препараты, предназначенные для внутривенного, подкожного и внутримышечного введения, можно вводить посредством инъекций. В случае инъекций производное бензойной кислоты растворяют в растворимой в воде жидкости, такой как физиологический раствор, или в нерастворимой в воде жидкости, содержащей органический сложный эфир, например пропиленгликоль, полиэтиленгликоль, и растительное масло.
В случае чрескожного введения можно использовать такие лекарственные формы, как мази и кремы. Мази можно получить посредством смешивания производного бензойной кислоты с жиром или липидом, вазелином и т.п., а кремы можно получить посредством смешивания производного бензойной кислоты с эмульгатором.
В случае ректального введения для получения суппозиториев можно использовать мягкие желатиновые капсулы.
В случае назального введения можно использовать состав, содержащий жидкую или порошкообразную композицию. В качестве основы для жидкой композиции можно использовать воду, физиологический раствор, фосфатный буфер, ацетатный буфер и т.п., и такие композиции также могут содержать поверхностно-активное вещество, антиоксидант, стабилизатор, консервант и загуститель. В качестве основы для порошкообразной композиции можно назвать соли полиакриловой кислоты, хорошо растворимые в воде, низшие алкиловые эфиры целлюлозы, полиэтиленгликоль, поливинилпирролидон, амилозу, пуллулан и т.п., которые являются водопоглощающими, или целлюлозы, крахмалы, белки, смолы, сшитые виниловые полимеры и т.п., которые плохо растворяются в воде и предпочтительно являются водопоглощающими. С другой стороны, такие вещества можно комбинировать. Кроме того, в случае порошкообразных композиций можно добавлять антиоксидант, краситель, консервант, дезинфицирующее средство, корригент и т.п. Такие жидкие и порошкообразные композиции можно вводить с использованием, например, устройства для распыления.
В случае введения глазных капель их можно использовать в виде водных или неводных глазных капель. Для водных глазных капель в качестве растворителя можно использовать воду, физиологический раствор и т.п. Когда в качестве растворителя используют стерильную воду, можно добавлять суспендирующее средство, такое как поверхностно-активное вещество, и полимерный загуститель, чтобы получить суспензию водных глазных капель. С другой стороны, можно добавить солюбилизатор, такой как неионное поверхностно-активное вещество, и получить раствор водных глазных капель. Для неводных глазных капель в качестве растворителя можно использовать неводный растворитель для инъекций, и их можно применять в виде раствора неводных глазных капель.
В случае, когда введение в глаза осуществляют способом, отличным от введения глазных капель, можно использовать такие лекарственные формы, как глазная мазь, раствор для примочек, наклейка (epipastic) и вкладыш.
В случае назального или перорального введения можно осуществлять ингаляцию раствора или суспензии производного бензимидазола согласно настоящему изобретению с обычно используемым фармацевтическим эксципиентом с использованием, например, аэрозоля для ингаляции, и т.п. С другой стороны, производные бензимидазола согласно настоящему изобретению в форме лиофилизованного порошка можно вводить в легкие с использованием ингалятора, что дает возможность непосредственного контакта с легкими.
К указанным различным композициям при необходимости можно добавлять фармацевтически приемлемые носители, такие как изотоническое средство, консервант, дезинфицирующее средство, смачиватель, буфер, эмульгатор, диспрегирующее средство, стабилизатор и т.п.
Для осуществления стерилизации таких композиций их смешивают с антимикробным средством, обрабатывают, например, посредством фильтрации через задерживающий бактерии фильтр, нагревают, облучают и т.п. С другой стороны, можно получить стерильные твердые композиции, которые можно использовать, посредством растворения или суспендирования их в соответствующем стерильном растворе непосредственно перед применением.
Дозировки производных бензимидазола согласно настоящему изобретению изменяются в зависимости от типа заболевания, способа введения, состояния, возраста, пола, массы тела и т.п. пациента, но, как правило, в случае перорального введения они находятся в интервале от примерно 1 до 500 мг в сутки на пациента, предпочтительно - от 1 до 300 мг в сутки на пациента. В случае парентерального введения, такого как внутривенное, подкожное, внутримышечное, чрескожное, ректальное, назальное, капель в глаза и ингаляции, дозировки могут составлять примерно 0,1-100 мг в сутки на пациента, предпочтительно 0,3-30 мг в сутки на пациента.
Когда производные бензимидазола согласно настоящему изобретению используют в качестве профилактического средства, их можно вводить известными способами в зависимости от конкретных условий.
В качестве болезней, против которых направлены профилактические и/или лечебные средства согласно настоящему изобретению, можно назвать, например, заболевания органов дыхания, такие как бронхиальная астма, воспалительные/аллергические заболевания, такие как аллергический ринит, атопический дерматит и крапивница; болезни органов системы кровообращения, такие как склеротические повреждения сосудов, интраваскулярный стеноз, расстройства периферического кровообращения, почечная и сердечная недостаточность; заболевания, вызванные нарушением костно-хрящевого метаболизма, такие как ревматоидный артрит и остеоартрит.
Сведения, подтверждающие возможность осуществления изобретения
Далее настоящее изобретение будет поясняться подробнее со ссылкой на препаративные примеры, рабочие примеры и примеры испытаний. Однако следует отметить, что эти примеры никоим образом не ограничивают объем изобретения.
Ссылочный пример 1. Получение 5,6-диметилбензимидазол-2-тиола
К 5,6-диметилортофенилендиамину (4,5 г, 33 ммоль) в пиридине (40 мл) добавляют сероуглерод (40 мл, 0,66 моль). Полученный раствор кипятят с обратным холодильником при перемешивании в течение 18 часов, к смеси добавляют воду, и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом магния ее концентрируют, и остаток сушат при пониженном давлении при 80°С в течение 6 часов, и получают названное в заголовке соединение (4,1 г, выход 70%).
Ссылочный пример 2. Получение метилового эфира 2-(5,6-диметилбензимидазол-2-илтио)метил)бензойной кислоты
К полученному 5,6-диметилбензимидазол-2-тиолу (89 мг, 0,50 ммоль) в диметилформамиде (2 мл) добавляют триэтиламин (84 мкл, 0,6 ммоль) и метиловый эфир 2-бромметилбензойной кислоты (137 мг, 0,6 ммоль). После перемешивания полученного раствора при 80°С в течение 1,5 часов добавляют воду, и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом магния ее концентрируют, и остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:1), и получают названное в заголовке соединение (146 мг, выход 90%). Соединение идентифицируют по молекулярной массе с использованием масс-спектрометрии в сочетании с жидкостной хроматографией (ЖХ-м.-с.). Вычислено М=326,11, измерено (М+Н)+=327,2.
Ссылочный пример 3
Способом, подобным способу в ссылочном примере 2, получают соединения, перечисленные далее. Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Этиловый эфир 3-((5,6-диметилбензимидазол-2-илтио)метил)пиридин-2-карбоновой кислоты
Вычислено М=341,12, найдено (M+H)+=342,2.
Метиловый эфир 2-((5,6-диметилбензимидазол-2-илтио)метил)фуран-3-карбоновой кислоты
Вычислено М=316,09, найдено (М+Н)+=317,2.
Метиловый эфир 3-((5,6-диметилбензимидазол-2-илтио)метил)тиофен-2-карбоновой кислоты
Вычислено М=332,07, найдено (М+Н)+=333,2.
Метиловый эфир 2-(бензимидазол-2-илтиометил)бензойной кислоты
Вычислено М=298,08, найдено (М+Н)+=299,2.
Этиловый эфир 3-(бензимидазол-2-илтиометил)пиридин-2-карбоновой кислоты
Вычислено М=313,09, найдено (М+Н)+=314,2.
Метиловый эфир 3-(бензимидазол-2-илтиометил)тиофен-2-карбоновой кислоты
Вычислено М=304,03, найдено (М+Н)+=305,2.
Метиловый эфир 2-(бензимидазол-2-илтиометил)фуран-3-карбоновой кислоты
Вычислено М=288,06, найдено (М+Н)+=289,2.
Метиловый эфир 4-бензимидазол-2-илтиобутановой кислоты
Вычислено М=264,09, найдено (М+Н)+=265,2.
Метиловый эфир 2-((5,6-дихлорбензимидазол-2-илтио)метил)5-хлорбензойной кислоты
Вычислено М=399,96, найдено (М+Н)+=401,2.
Метиловый эфир 2-(бензимидазол-2-илтиометил)-5-хлорбензойной кислоты
Вычислено М=332,04, найдено (М+Н)+=333,2.
Этиловый эфир 4-((5,6-диметилбензимидазол-2-илтио)бутановой кислоты
Вычислено М=292,12, найдено (М+Н)+=293,40.
Метиловый эфир 2-((5,6-дихлорбензимидазол-2-илтио)метил)бензойной кислоты
Вычислено М=366,00, найдено (М+Н)+=367,0.
Метиловый эфир 2-((5,6-дихлорбензимидазол-2-илтио)метил)пиридин-3-карбоновой кислоты
Вычислено М=366,99, найдено (М+Н)+=368,0.
Пример 1. Получение соединения №143
В предварительно высушенный реакционный сосуд загружают гидрид натрия (11 мг, 0,306 ммоль) и 2 мл тетрагидрофурана. К смеси добавляют метиловый эфир 2-((5,6-диметилбензимидазол-2-илтио)метил)бензойной кислоты (50 мг, 0,153 ммоль) и 1-хлорметилнафталин (69 мкл, 0,459 ммоль), полученную смесь перемешивают при 60°С в течение 45 минут. Добавляют воду и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 4:1), получают метиловый эфир 2-((5,6-диметил-1-(1-нафтилметил)бензимидазол-2-илтио)метил)бензойной кислоты (выход 32%).
К метиловому эфиру 2-((5,6-диметил-1-(1-нафтилметил)бензимидазол-2-илтио)метил)бензойной кислоты (23 мг, 0,08 ммоль) в тетрагидрофуране (1 мл) и метаноле (0,5 мл) добавляют 4 N водный раствор гидроксида натрия (0,25 мл). После перемешивания при комнатной температуре в течение 5 часов для прекращения реакции добавляют 6 N соляную кислоту, и затем смесь экстрагируют этилацетатом. Этилацетатную фазу промывают крепким рассолом и затем сушат над безводным сульфатом натрия. Растворитель упаривают при пониженном давлении, и получают названное в заголовке соединение (24 мг, выход количественный).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=452,16, найдено (М+Н)+=453,2.
Пример 2
Способом, подобным способу в рабочем примере 1, синтезируют соединения, указанные в таблицах 41-45, используя соединения, полученные в ссылочных примерах 2 или 3, и различные галогензамещенные производные. Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 3. Получение соединения №547
К 5,6-диметилбензимидазол-2-тиолу (236 мг, 1,32 ммоль) в 2 мл диметилформамида добавляют триэтиламин (276 мкл, 1,98 ммоль) и трет-бутиловый эфир 2-(бромэтил)бензойной кислоты (538 мг, 1,99 ммоль), и смесь перемешивают при 80°С в течение 3 часов. После завершения реакции добавляют воду, и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:1) и получают трет-бутиловый эфир 2-((5,6-диметил-беызимидазол-2-илтио) метил)бензойной кислоты (288 мг, выход 59%).
трет-Бутиловый эфир 2-((5,6-диметилбензимидазол-2-илтио)метил)бензойной кислоты (30 мг, 0,082 ммоль) растворяют в 3 мл хлороформа, к полученному раствору последовательно добавляют триэтиламин (17 мкл, 0,123 ммоль) и бензоилхлорид (14 мкл, 0,123 ммоль), и смесь перемешивают при комнатной температуре в течение 2 часов. После завершения реакции добавляют воду, и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, получают трет-бутиловый эфир 2-((5,6-диметил-1-(фенилкарбонил)бензимидазол-2-илтио)метил)бензойной кислоты (38 мг, выход количественный).
трет-Бутиловый эфир 2-((5,6-диметил-1-(фенилкарбонил)бензимидазол-2-илтио)метил)бензойной кислоты растворяют в 1 мл дихлорметана, к полученному раствору добавляют трифторуксусную кислоту (1 мл), и смесь перемешивают при комнатной температуре в течение 6 часов. После завершения реакции растворитель испаряют при пониженном давлении, и остаток сушат в течение ночи, и получают названное в заголовке соединение (33 мг, выход количественный).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=416,12, найдено (М+Н)+=417,0.
Пример 4. Получение соединения №561
Названное в заголовке соединение получают способом, подобным способу в рабочем примере 3.
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=452,09, найдено (М+Н)+=453,2.
Ссылочный пример 4. Получение 3-(нафтилметил)имидазоло-(5,4-b)пиридин-2-тиола
К 2-амино-3-нитропиридину (1680 мг, 12 ммоль) в диметилформамиде (20 мл) добавляют гидрид натрия (75 мг, 0,55 ммоль) и 1-хлорметилнафталин (74 мкл, 0,55 ммоль). После перемешивания полученного раствора при 80°С в течение 17 часов к нему добавляют воду и смесь экстрагируют этиловым эфиром. После высушивания эфирной фазы над безводным сульфатом магния ее концентрируют и остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 4:1), получают нафтилметил(3-нитро-(2-пиридил))амин (903 мг, выход 27%).
К нафтилметил(3-нитро(2-пиридил))амину (900 мг, 3,2 ммоль) в этаноле (40 мл) добавляют 90,0 мг 10% Pd-C. После перемешивания полученного раствора при 50°С в течение 8 часов в атмосфере водорода его фильтруют через целит для удаления Pd-C. Полученный раствор концентрируют и получают (3-амино(2-пиридил))нафтилметиламин (860 мг, выход 99%). К полученному (3-амино (2-пиридил)) нафтилметиламину (860 мг, 3,2 ммоль) в этаноле (20 мл) добавляют сероуглерод (6,1 мл, 102 ммоль). После кипячения полученного раствора с обратным холодильником при перемешивании в течение 12 часов его оставляют при комнатной температуре на 5 часов. Выпавший осадок отфильтровывают и три раза промывают этанолом (5 мл). Его сушат при 80°С при пониженном давлении в течение 5 часов, и получают названное в заголовке соединение (555 мг, выход 56%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=291,08, найдено (М+Н)+=292,3.
Ссылочный пример 5. Получение 3-((2,5-диметилфенил)метил)имидазоло(5,4-b)пиридин-2-тиола
Названное в заголовке соединение синтезируют способом, подобным способу в ссылочном примере 4.
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=269,01, найдено (М+Н)+=270,2.
Пример 5. Получение соединения №256
С использованием 3-(нафтилметил)имидазоло(5,4-b)пиридин-2-тиола (30 мг, 0,1 ммоль), полученного в ссылочном примере 4, способом, подобным способу в ссылочном примере 2, получают метиловый эфир 2-((3(нафтилметил)имидазоло(5,4-b)пиридин-2-илтио)метил)бензойной кислоты (30 мг, выход 70%).
Полученный таким образом метиловый эфир 2-((3-(нафтилметил)имидазоло(5,4-b)пиридин-2-илтио)метил)бензойной кислоты (30 мг, 0,068 ммоль) подвергают гидролизу способом, подобным способу в примере 1 и получают названное в заголовке соединение (18,3 мг, выход 66%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=425,12, найдено (М+Н)+=426,1.
Пример 6
Соединения, указанные в табл.46, синтезируют с использованием соединений, полученных в ссылочных примерах 4 и 5, и различных производных галогензамещенных эфиров способом, подобным способу в примере 5.
Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 7. Получение соединения №264
4-Метил-2-нитроанилин (913 мг, 6 ммоль) растворяют в ацетонитриле (18 мл), к полученному раствору добавляют безводную трифторуксусную кислоту (1,00 мл, 7,2 ммоль), и смесь подвергают кипячению с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры смесь концентрируют при пониженном давлении, остаток сушат и получают 4-метил-2-нитротрифторацетанилид (1,396 г, выход 94%).
4-Метил-2-нитротрифторацетанилид (1,396 г, 5,63 ммоль) растворяют в диметилформамиде (14 мл), затем при комнатной температуре последовательно добавляют карбонат калия (940 мг, 6,80 ммоль) и 1-хлорметилнафталин (1,15 г, 6,51 ммоль), и смесь нагревают до 100°С. Через 1 ч 40 мин добавляют 5 N водный раствор гидроксида натрия (7,5 мл), и смесь кипятят с обратным холодильником в течение 15 минут. Через 15 минут смесь охлаждают до комнатной температуры, добавляют воду (180 мл), и смесь оставляют на ночь при 4°С. Выпавшие кристаллы отфильтровывают и сушат, получают ((1-нафтил)метил)(4-метил-2-нитрофенил)амин (1,587 г, выход 96%).
К ((1-нафтил)метил)(4-метил-2-нитрофенил)амину (1,0021 г, 3,43 ммоль) добавляют этанол (5 мл) и 1,4-диоксан (5 мл) и затем добавляют 2,058 М водный раствор гидроксида натрия (1 мл), и смесь кипятят с обратным холодильником на масляной бане. Через 15 минут масляную баню убирают, и в смесь по частям добавляют цинковую пудру (897 мг, 13,72 ммоль). Затем смесь снова кипятят с обратным холодильником на масляной бане в течение 2 часов. Через 2 часа смесь концентрируют при пониженном давлении, остаток растворяют в этилацетате (50 мл), и раствор дважды промывают крепким рассолом (25 мл). После высушивания над сульфатом магния раствор концентрируют при пониженном давлении, остаток сушат и получают ((1-нафтил) метил) (2-амино-4-метилфенил) амин (943,1 мг) в виде коричневого масла.
Затем ((1-нафтил)метил)(2-амино-4-метилфенил)амин (943,1 мг, 3,59 ммоль) растворяют в этаноле (6,4 мл), к полученному раствору добавляют сероуглерод (7 мл, 116 ммоль), и затем смесь кипятят с обратным холодильником. Через 10 часов смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. К остатку добавляют этанол (2 мл), смесь перемешивают при комнатной температуре в течение 30 минут и затем перемешивают на льду в течение 30 минут. Образовавшиеся кристаллы отфильтровывают и сушат, и получают ((1-нафтил)метил)-6-метил-бензимидазол-2-тиол (459,1 мг, выход 44%, 2 стадии).
((1-Нафтил)метил)-6-метилбензимидазол-2-тиол (431,1 мг, 1,42 ммоль) растворяют в диметилформамиде (12 мл), к полученному раствору добавляют триэтиламин (0,296 мл, 2,12 ммоль) и метиловый эфир 2-бромметилбензойной кислоты (390,1 мг, 1,70 ммоль), смесь греют при 80°С. Через 5 часов 50 минут добавляют триэтиламин (0,296 мл, 2,12 ммоль) и метиловый эфир 2-бром-метилбензойной кислоты (325 мг, 1,42 ммоль), и смесь греют в течение 1 часа 10 минут. Затем смесь концентрируют при пониженном давлении, остаток растворяют в этилацетате (80 мл), раствор дважды промывают водой (30 мл) и сушат над сульфатом магния. Растворитель испаряют при пониженном давлении. Остаток кристаллизуют из этилацетата и гексана, и получают 410 мг вещества, а маточную жидкость очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 6:1) и извлекают 87 мг той же фракции, что и кристаллы - всего 497 мг метилового эфира 2-((1-((1-нафтил)метил)-6-метилбензимидазол-2-илтио)метил)бензойной кислоты (выход 78%).
Метиловый эфир 2-((1-((1-нафтил)метил)-6-метилбензимидазол-2-илтио) метил) бензойной кислоты (497 мг, 1,098 ммоль) растворяют в метаноле (10 мл) и тетрагидрофуране (10 мл) и к полученному раствору добавляют 4 N водный раствор гидроксида лития (6,86 мл). После перемешивания при комнатной температуре в течение 2 часов 30 минут к смеси для прекращения реакции добавляют насыщенный водный раствор лимонной кислоты (10 мл), смесь концентрируют при пониженном давлении для уменьшения количества растворителя примерно до 1/3 начального объема, полученный остаток растворяют в этилацетате (80 мл) и промывают пять раз водой (20 мл). После концентрирования органического слоя при пониженном давлении к остатку добавляют ацетонитрил (10 мл), этот раствор снова концентрируют при пониженном давлении, и полученные кристаллы отфильтровывают и сушат, получают названное в заголовке соединение (439,1 мг, выход 91%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=438,14, найдено (М+Н)+=439,3.
Пример 8. Получение соединения №272
Названное в заголовке соединение получают способом, подобным способу в рабочем примере 7.
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=454,14, найдено (М+Н)+=455,3.
Пример 9. Получение соединения №65
2-Нитроанилин (829 мг, 6 ммоль) и 1-метилиндолкарбоксальдегид (1242 мг, 7,8 ммоль) растворяют в 20 мл тетрагидрофурана, к полученному раствору последовательно добавляют уксусную кислоту (200 мкл) и NaBH(OAc)3 (5087 мг, 24 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, затем осуществляют экстракцию этилацетатом, экстракт сушат над безводным сульфатом натрия, и испаряют растворитель. После очистки посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 95:5) получают ((1-метилиндол-3-ил)метил)(2-нитрофенил)амин (264 мг, выход 18%).
((1-Метилиндол-3-ил)метил) (2-нитрофенил)амин (264 мг, 0,939 ммоль) растворяют в этаноле (10 мл), к раствору добавляют Pd-C (50 мг, 10% Pd, 0,047 ммоль), и смесь перемешивают в атмосфере водорода при комнатной температуре в течение 6 часов. После завершения реакции Pd-C отфильтровывают, растворитель испаряют, и получают ((1-метилиндол-3-ил)метил)(2-аминофенил)амин (212 мг, выход 90%).
((1-Метилиндол-3-ил)метил)(2-аминофенил)амин (212 мг, 0,845 ммоль) растворяют в пиридине (1 мл) и к раствору добавляют сероуглерод (1 мл, 16,9 ммоль). Смесь кипятят с обратным холодильником в атмосфере азота в течение 1 часа. После испарения растворителя остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 2:1) и получают ((1-метилиндол-3-ил)метил)бензимидазол-2-тиол (96 мг, выход 39%).
В предварительно высушенный реакционный сосуд загружают гидрид натрия (12 мг, 0,342 ммоль) и диметилформамид (2 мл). К этой смеси добавляют ((1-метилиндол-3-ил)метил)бензимидазол-2-тиол (50 мг, 0,171 ммоль) и метиловый эфир 2-бромметилбензойной кислоты (59 мг, 0,257 ммоль), и затем смесь перемешивают при 60°С в течение 1 часа. К смеси добавляют воду и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 2:1), и получают метиловый эфир 2-((1-((1-метил-индол-3-ил)метил)бензимидазол-2-илтио)метил)бензойной кислоты (54 мг, выход 74%).
К метиловому эфиру 2-((1-((1-метилиндол-3-ил)метил)бензимидазол-2-илтио)метил)бензойной кислоты (54 мг, 0,122 ммоль) в тетрагидрофуране (2 мл) и метаноле (1 мл) добавляют 4 N водный раствор гидроксида лития (0,5 мл). После перемешивания при комнатной температуре в течение ночи для прекращения реакции добавляют 6 N соляную кислоту, затем смесь экстрагируют этилацетатом. После промывания этилацетатной фазы крепким рассолом ее сушат над безводным сульфатом натрия. Растворитель испаряют при пониженном давлении, и получают названное в заголовке соединение (48 мг, выход 92%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=427,14, найдено (М+Н)+=428,2.
Пример 10
Соединения, указанные в табл. 47, синтезируют с использованием различных производных галогензамещенных эфиров способом, подобным способу в рабочем примере 9. Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 11. Получение соединения №51
Гидрид натрия (104 мг, 2,86 ммоль) и тетрагидрофуран (16 мл) загружают в предварительно высушенный реакционный сосуд. К смеси добавляют метиловый эфир 2-(бензимидазол-2-илтиометил) бензойной кислоты (428 мг, 1,43 ммоль) и трет-бутиловый эфир 2-(бромметил) бензойной кислоты (466 мг, 3,46 ммоль), затем смесь перемешивают при 60°С в течение 50 минут. К смеси добавляют воду, затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:1), и получают метиловый эфир 2-((1-((2-((трет-бутил)оксикарбонил)фенил) метил)бензимидазол-2-илтио)метил)бензойной кислоты (495 мг, выход 71%).
К метиловому эфиру 2-((1-((2-((трет-бутил) оксикарбонил)фенил)метил)бензимидазол-2-илтио)метил)бензойной кислоты (248 мг, 0,51 ммоль) добавляют 4 N раствор хлороводорода (НСl) в диоксане (1,28 мл, 5,1 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. После испарения растворителя остаток сушат при пониженном давлении и получают 2-((2-((2-метоксикарбонил)фенил)метилтио)бензими-дазолил)метил)бензойную кислоту (220 мг, выход количественный).
2-((2-((2-Метоксикарбонил)фенил)метилтио)бензимидазолил)-метил)бензойную кислоту (180 мг, 0,42 ммоль) растворяют в хлороформе (6 мл), к полученному раствору последовательно добавляют НОВТ (68 мг, 0,504 ммоль), анилин (46 мкл, 0,504 ммоль), трет-бутанол (1,2 мл) и EDCI (97 мг, 0,504 ммоль), смесь перемешивают в течение ночи при комнатной температуре. К смеси добавляют воду, и затем осуществляют экстракцию дихлорметаном. После высушивания экстракта над безводным сульфатом натрия его фильтруют и испаряют растворитель. Остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:2), и получают метиловый эфир 2-((1-((2-(N-фенилкарбамоил)фенил)метилтио)бензимидазол-2-илтио)метил)бензойной кислоты (86 мг, выход 40%).
К полученному таким образом метиловому эфиру 2-((1-((2-(N-фенилкарбамоил)фенил)метилтио)бензимидазол-2-илтио)метил)-бензойной кислоты (86 мг, 0,169 ммоль) в тетрагидрофуране (2 мл) и метаноле (1 мл) добавляют 4 N водный раствор гидроксида лития (0,5 мл), смесь перемешивают при 60°С в течение примерно 2 часов. Добавляют для прекращения реакции 6 N соляную кислоту, и смесь экстрагируют этилацетатом. После промывания этилацетатной фазы крепким рассолом ее сушат над безводным сульфатом натрия. Растворитель испаряют при пониженном давлении, и получают названное в заголовке соединение (83 мг, выход количественный).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=493,15, найдено (М+Н)+=494,2.
Пример 12
Способом, подобным способу в рабочем примере 11, с использованием различных эфиров производных бензойной кислоты получают соединения, перечисленные в табл. 48.
Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 13. Получение соединения №619
Гидрид натрия (400 мг, 10,0 ммоль) и диметилформамид (30 мл) загружают в предварительно высушенный реакционный сосуд. К смеси добавляют метиловый эфир 2-(бензимидазол-2-илтиометил) бензойной кислоты (1500 мг, 5,0 ммоль) и трет-бутиловый эфир бромуксусной кислоты (1463 мг, 7,5 ммоль), затем смесь перемешивают при 80°С в течение 2 часов. К смеси добавляют воду, и затем смесь экстрагируют эфиром. После высушивания эфирной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 5:1), и получают трет-бутиловый эфир 2-(2-((2-(метоксикарбонил)фенил)метилтио)бензимидазолил)уксусной кислоты (1298 мг, выход 63%).
К трет-бутиловому эфиру 2-(2-((2-(метоксикарбонил)фенил)метилтио)бензимидазолил)уксусной кислоты (1290 мг, 3,13 ммоль) добавляют трифторуксусную кислоту (15 мл), и смесь перемешивают при комнатной температуре в течение ночи. После испарения растворителя остаток сушат при пониженном давлении, и получают 2-(2-((2-метоксикарбонил)фенил)метилтио)бензимидазолил)уксусную кислоту (715 мг, выход 64%).
2-(2-((2-Метоксикарбонил)фенил)метилтио)бензимидазолил)-уксусную кислоту (35 мг, 0,1 ммоль) растворяют в тетрагидрофуране (3 мл), к полученному раствору добавляют анилин (11,2 мг, 0,12 ммоль) и EDCI (23 мг, 0,12 ммоль), затем смесь перемешивают в течение ночи при комнатной температуре. К смеси добавляют воду, затем смесь экстрагируют этилацетатом. После высушивания экстракта над безводным сульфатом натрия его фильтруют и упаривают растворитель. Остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:2), и получают метиловый эфир 2-((1-((N-фенилкарбамоил)метил)бензимидазол-2-илтио)метил)бензойной кислоты (27,5 мг, выход 64%).
Полученный таким образом метиловый эфир 2-((1-((N-фенилкарбамоил)метил)бензимидазол-2-илтио)метил)бензойной кислоты (20 мг, 0,046 ммоль) подвергают гидролизу таким же способом, как в рабочем примере 1, и получают названное в заголовке соединение (6,9 мг, выход 36%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=417,11, найдено (М+Н)+=418,0.
Пример 14
Способом, подобным способу в примере 13, с использованием различных производных анилина получают соединения, перечисленные в приведенной ниже табл.49.
Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Ссылочный пример 6. Получение метилового эфира 2-((1-(2-гидроксиэтил)-5,6-диметилбензимидазол-2-илтио)метил)бензойной кислоты
К полученному в ссылочном примере 2 метиловому эфиру 2-((5,6-диметилбензимидазол-2-илтио)метил)бензойной кислоты (326 мг, 1 ммоль) в диметилформамиде добавляют карбонат калия (207 мг, 1,5 ммоль) и 2-бромэтанол (150 мг, 1,2 ммоль), и полученный раствор перемешивают при 80°С в течение 12 часов. После завершения реакции реакционную смесь экстрагируют эфиром, и из экстракта испаряют растворитель. Остаток очищают посредством колоночной флэш-хроматографии (гексан:этилацетат = 4:1) и получают названное в заголовке соединение (248 мг, выход 67%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=370,14, найдено (М+Н)+=371,2.
Пример 15. Получение соединения №736
К метиловому эфиру 2-((1-(2-гидроксиэтил)-5,6-диметилбензимидазол-2-илтио) метил)бензойной кислоты (45 мг, 0,23 ммоль) в N-метилморфолине (3 мл) добавляют РРh3 (62 мг, 0,24 ммоль) и DEAD (10,6 мл, 40% раствор в толуоле, 0,24 ммоль), и смесь перемешивают при комнатной температуре. Через 10 минут к смеси добавляют фенол (11,3 мг, 0,12 ммоль), и смесь перемешивают при комнатной температуре в течение 12 часов. Растворитель испаряют, и остаток очищают посредством тонкослойной хроматографии (гексан:этилацетат = 1:1), получают метиловый эфир 2-((5,6-диметил-1-(2-феноксиэтил)бензимидазол-2-илтио)метил)бензойной кислоты (44 мг, выход 81%).
С использованием метилового эфира 2-((5,6-диметил-1-(2-феноксиэтил)бензимидазол-2-илтио)метил)бензойной кислоты (35 мг, 0,078 ммоль) осуществляют гидролиз способом, подобным способу в примере 1, и получают названное в заголовке соединение (31 мг, выход 94%). Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=432,15, найдено (М+Н)+=433,2.
Пример 16
С использованием различных производных фенола способом, подобным способу в примере 15, получают соединения, перечисленные в табл. 50.
Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 17. Получение соединения №825
К полученному в примере 2 эфиру соединения №68 (33 мг, 0,075 ммоль) в дихлорметане при охлаждении на льду добавляют 50-60% м-хлорпербензойную кислоту (26 мг, 0,083 ммоль). После перемешивания полученного раствора при охлаждении на льду в течение 2 часов добавляют насыщенный раствор гидрокарбоната натрия, и полученный раствор экстрагируют хлороформом. После промывания хлороформной фазы водой ее концентрируют, остаток очищают посредством тонкослойной хроматографии (гексан:этилацетат = 1:1), и получают метиловый эфир 2-((5,6-диметил-1-(1-нафтилметил)бензимидазол-2-ил)сульфинил)метил)бензойной кислоты (7,1 мг, выход 21%).
Указанное соединение подвергают гидролизу способом, подобным способу в примере 1, и получают названное в заголовке соединение (5,2 мг, выход 76%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=440,12, найдено (М+Н)+=441,3.
Пример 18. Получение соединения №869
К полученному в примере 2 эфиру соединения №37 (39 мг, 0,094 ммоль) в дихлорметане (5 мл) при охлаждении на льду добавляют 50-60% м-хлорпербензойную кислоту (64 мг, 0,374 ммоль). После перемешивания полученного раствора при комнатной температуре в течение 4 часов добавляют насыщенный раствор гидрокарбоната натрия, и полученный раствор экстрагируют хлороформом. После промывания хлороформной фазы водой ее концентрируют, остаток очищают посредством тонкослойной флэш-хроматографии (гексан:этилацетат = 5:1), и получают метиловый эфир 2-(((1-((2,5-диметилфенил)метил)бензимидазол-2-ил)сульфонил)метил)бензойной кислоты (37 мг, выход 87%).
Способом, подобным способу в примере 1, метиловый эфир 2-(((1-((2,5-диметилфенил)метил)бензимидазол-2-ил)сульфонил)-метил)бензойной кислоты (64 мг, 0,14 ммоль) подвергают гидролизу, и получают названное в заголовке соединение (53 мг, выход 87%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=434,13, найдено (М+Н)+=435,2.
Пример 19
Способом, подобным способу в примере 18, с использованием сложных эфиров соединений, полученных в рабочем примере 2, синтезируют соединения, перечисленные в табл.51. Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 20. Получение соединения №952
К 5,6-диметилбензимидазол-2-тиолу (713 мг, 4 ммоль) в диметилформамиде (10 мл) добавляют триэтиламин (836 мкл, 6 ммоль) и 2-бромметилбензонитрил (1176 мг, 6 ммоль). После перемешивания при 80°С в течение ночи к смеси добавляют воду, и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:2), и получают 2-((5,6-диметилбензимидазол-2-илтио)метил)бензолкарбонитрил (1159 мг, выход 99%).
В предварительно высушенный реакционный сосуд загружают гидрид натрия (178 мг, 4,90 ммоль) и тетрагидрофуран (30 мл). К смеси добавляют 2-((5,6-диметилбензимидазол-2-илтио)метил)бензолкарбонитрил (719 мг, 2,45 ммоль) и 2,5-дихлорбензилхлорид (543 мкл, 4,90 ммоль), и смесь перемешивают при 60°С в течение 40 минут. К смеси добавляют воду, и затем смесь экстрагируют этилацетатом. После высушивания этилацетатной фазы над безводным сульфатом натрия ее концентрируют, остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат = 3:1), и получают 2-((1-((2,5-диметилфенил)метил)-5,6-диметилбензимидазол-2-илтио)метил)бензолкарбонитрил (370 мг, выход 37%).
2-((1-((2,5-Диметилфенил)метил)-5,6-диметилбензимидазол-2-илтио)метил)бензолкарбонитрил (165 мг, 0,401 ммоль) растворяют в толуоле (3 мл), к полученному раствору добавляют Ме3SnN3 (124 мг, 0,602 ммоль), и смесь кипятят с обратным холодильником в атмосфере азота в течение ночи. После завершения реакции растворитель испаряют, и остаток очищают посредством колоночной хроматографии на силикагеле (дихлорметан:метанол = 19:1), и получают названное в заголовке соединение (75 мг, выход 41%).
Соединение идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Вычислено М=454,19, найдено (М+Н)+=455,2.
Пример 21
Способом, подобным способу в примере 20, получают соединения, перечисленные в табл. 52.
Соединения идентифицируют по молекулярной массе с использованием ЖХ-м.-с.
Пример 22. Получение рекомбинантной химазы тучных клеток человека
Рекомбинантную прохимазу тучных клеток человека получали в соответствии со способом, описанным Urada et al. (Journal of Biological Chemistry, 266: 17173, 1991). В соответствии с указанным способом культуральный супернатант клеток насекомого (Тn5), инфицированных рекомбинантным бакуловирусом, содержащим кДНК, кодирующую химазу тучных клеток человека, очищали с помощью гепарин-сефарозы (Pharmacia). После последующей активации химазы по способу, описанному Murakami et al. (Journal of Biological Chemistry, 270: 2218, 1995), ее очищали с помощью гепарин-сефарозы, и получали активированную химазу тучных клеток человека.
Пример 23. Определение активности ингибирования рекомбинантной химазы тучных клеток человека
После того как раствор, содержащий соединение согласно настоящему изобретению в ДМСО (2 мкл), добавляли к 50 мкл буфера А (0,5-3,0 М NaCl, 50 мМ трис-HCl, рН 8,0), содержащему 1-5 нг активированной химазы тучных клеток человека, полученной в рабочем примере 22, к полученному раствору добавляли 50 мкл буфера А, содержащего в качестве субстрата 0,5 мМ сукцинилаланилгистидилпролилфенилаланилпаранитроанилида (Bacchem), и смесь оставляли для реакции при комнатной температуре на 5 минут. Чтобы оценить ингибирующую активность, проводили измерения изменений поглощения при 405 нм со временем.
В результате для соединений №№63, 64, 65, 143, 174, 256, 264, 272, 311, 354, 319, 349, 358, 395, 401 и 402 наблюдали IC50 не менее 1 нМ, но менее 10 нМ, и для соединений №№37, 50, 84, 115, 117, 119, 121, 123, 130, 147, 168, 256, 320, 321, 324, 352, 355, 364, 380, 392, 398, 444, 455, 459, 460, 506, 863, 866 и 869 наблюдали IC50 не менее 10 нМ и не более 100 нМ.
Как описано выше, производные бензимидазола согласно настоящему изобретению проявляют сильную ингибирующую активность в отношении химазы. Таким образом, показано, что производные бензимидазола согласно настоящему изобретению являются клинически применимыми ингибиторами в отношении активности химазы у человека и могут использоваться для профилактики и/или лечения различных заболеваний, в которые вносит вклад химаза человека.
Пример 24. Получение таблеток
Получают таблетки, содержащие на таблетку следующие ингредиенты.
Соединение (№37) 50 мг
Лактоза 230 мг
Картофельный крахмал 80 мг
Поливинилпирролидон 11 мг
Стеарат магния 5 мг
Соединение согласно настоящему изобретению (соединение, полученное в рабочем примере 2), лактозу и картофельный крахмал смешивают, и эту смесь равномерно пропитывают 20% раствором поливинилпирролидона в этаноле. Смесь фильтруют через сито 20 меш, сушат при 45°С и снова просеивают через сито 15 меш. Гранулы, полученные таким образом, смешивают со стеаратом магния и прессуют в таблетки.
Промышленная применимость
Производные тиобензимидазола согласно настоящему изобретению и их приемлемые с медицинской точки зрения соли обнаруживают сильную активность в отношении ингибирования химазы человека. Таким образом, указанные производные тиобензимидазола и их приемлемые с медицинской точки зрения соли можно применять как ингибиторы химазы человека, в качестве клинически приемлемых профилактических и/или лечебных средств при заболеваниях органов дыхания, заболеваниях органов системы кровообращения или заболеваниях, вызванных нарушением костно-хрящевого метаболизма.
Claims (14)
1. Производное тиобензимидазола, представленное формулой (1)
где R1 и R2 одновременно или независимо друг от друга представляют собой атом водорода, атом галогена, тригалогенметильную группу, цианогруппу, гидроксигруппу, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода или R1 и R2 вместе образуют -О-СН2-О-, -О-СН2-СН2-О- или –СН2-СН2-СН2-;
А представляет собой простую связь, линейную алкиленовую группу с 1-6 атомами углерода, необязательно замещенную алкильной группой с 1-4 атомами углерода, причем заместитель может независимо находиться в любом одном или нескольких положениях алкиленовой группы, замещенную или незамещенную фениленовую группу, в которой заместитель представляет собой атом галогена, NO2, линейную или разветвленную алкоксигруппу с 1-4 атомами углерода и может независимо находится в любом одном или нескольких положениях кольца, или незамещенную пиридиленовую группу, фураниленовую группу или тиофениленовую группу;
Е представляет собой COOR3 или тетразольную группу, где R3 представляет собой атом водорода или линейную или разветвленную алкильную группу с 1-4 атомами углерода;
G представляет собой незамещенную линейную алкиленовую группу с 1-6 атомами углерода, -CH2CO-, -CH2-CH2-O-, -CH2CONH-, -CO-, -SO2-, -CH2-CH2-S- или -CH2S-;
m равен целому числу от 0 до 2;
когда m равен 0 и А представляет собой линейную алкиленовую группу с 1-6 атомами углерода, необязательно замещенную алкильной группой с 1-4 атомами углерода, тогда J представляет собой замещенный нафтил, в котором заместитель представляет собой алкильную группу с 1-4 атомами углерода и может независимо находиться в любом одном или нескольких положениях кольца, необязательно замещенную бензотиофенильную или индолильную группу, в которой заместитель представляет собой атом галогена, алкильную группу с 1-4 атомами углерода, алкоксигруппу с 1-4 атомами углерода, тригалогенметоксигруппу, тригалогенметильную группу и может независимо находиться в любом одном или нескольких положениях кольца;
когда m равен 0 и А представляет собой замещенную или незамещенную фениленовую группу или незамещенную пиридиленовую группу, фураниленовую группу, тиофениленовую группу, тогда J представляет собой незамещенную, линейную, циклическую или разветвленную алкильную группу с 1-6 атомами углерода, незамещенную или замещенную линейной алкильной группой с 1-6 атомами углерода группу, выбранную из бензотиофенильной группы, индолильной группы, тиофенильной группы, изоксазолильной группы, хинолинильной группы, изохинолинильной группы, хиноксалинильной группы, бензоксадиазолинильной группы, бензтиадиазолинильной группы, бензтиазолинильной группы, 2-оксохроменильной группы, или необязательно замещенную арильную группу с 6-11 атомами углерода, где заместитель представляет собой атом галогена, OH, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода, линейную или разветвленную алкилсульфонильную группу с 1-6 атомами углерода, незамещенную анилидную группу, тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу, феноксигруппу, метилендиоксигруппу, и где заместитель может независимо находиться в любом одном или нескольких положениях кольца;
когда m равен 0 и А представляет собой простую связь, тогда J представляет собой нафтил;
когда m равен 1 или 2, тогда J представляет собой необязательно замещенный бензотиофенил, индолил, нафтил, где заместитель представляет собой атом галогена, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода, тригалогенметильную группу, тригалогенметоксигруппу, и где заместитель может находиться в любом одном или нескольких положениях кольца;
Х представляет СН или атом азота;
или его приемлемая с медицинской точки зрения соль.
2. Производное тиобензимидазола по п. 1 приведенной выше формулы (1), где А представляет собой незамещенную линейную алкиленовую группу с 1-6 атомами углерода, незамещенную или замещенную галогеном фениленовую группу или незамещенную пиридиленовую, фураниленовую или тиофениленовую группу.
3. Производное тиобензимидазола по п. 1 приведенной выше формулы (1), где А представляет собой незамещенную пиридиленовую, фураниленовую или тиофениленовую группу.
4. Производное тиобензимидазола по любому из пп. 1-3 приведенной выше формулы (1), где m равен 1, или его приемлемая с медицинской точки зрения соль.
5. Производное тиобензимидазола по любому из пп. 1-3 приведенной выше формулы (1), где m равен 2, или его приемлемая с медицинской точки зрения соль.
6. Производное тиобензимидазола по любому из пп. 1-3 приведенной выше формулы (1), где m равен 0, А представляет собой линейную алкиленовую группу с 1-6 атомами углерода, необязательно замещенную алкильной группой с 1-4 атомами углерода, и J представляет собой замещенный нафтил, в котором заместитель представляет собой алкильную группу с 1-4 атомами углерода и может независимо находиться в любом одном или нескольких положениях кольца, необязательно замещенную бензотиофенильную группу или индолильную группу, в которой заместитель представляет собой атом галогена, алкильную группу с 1-4 атомами углерода, алкоксигруппу с 1-4 атомами углерода, тригалогенметоксигруппу, тригалогенметильную группу и может независимо находиться в любом одном или нескольких положениях кольца; или его приемлемая с медицинской точки зрения соль.
7. Производное тиобензимидазола по любому из пп. 1-3 приведенной выше формулы (1), где m равен 0, А представляет собой замещенную или незамещенную фениленовую группу или незамещенную пиридиленовую группу, фураниленовую группу, тиофениленовую группу, и J представляет собой незамещенную линейную, циклическую или разветвленную алкильную группу с 1-6 атомами углерода, незамещенную или замещенную линейной алкильной группой с 1-6 атомами углерода группу, выбранную из бензотиофенильной группы, индолильной группы, тиофенильной группы, изоксазолильной группы, хинолинильной группы, изохинолинильной группы, хиноксалинильной группы, бензоксадиазолинильной группы, бензтиадиазолинильной группы, бензтиазолинильной группы, 2-оксохроменильной группы или необязательно замещенную арильную группу с 6-11 атомами углерода, где заместитель представляет собой атом галогена, OH, NO2, CN, линейную или разветвленную алкильную группу с 1-6 атомами углерода, линейную или разветвленную алкоксигруппу с 1-6 атомами углерода, линейную или разветвленную алкилсульфонильную группу с 1-6 атомами углерода, незамещенную анилидную группу, тригалогенметильную группу, тригалогенметоксигруппу, фенильную группу, феноксигруппу, метилендиоксигруппу, и где заместитель может независимо находиться в любом одном или нескольких положениях кольца; или его приемлемая с медицинской точки зрения соль.
8. Производное тиобензимидазола по любому из пп. 1-7 приведенной выше формулы (1), где G представляет собой -СН2-, -СН2-СН2-, -СН2СО-, -СН2-СН2-O-, -CH2CONH-, -СО-, -SO2-, -CH2-CH2-S- или -СН2S-; или его приемлемая с медицинской точки зрения соль.
9. Производное тиобензимидазола по любому из пп. 1-8 приведенной выше формулы (1), где R1 и R2 одновременно представляют собой атом водорода, атом галогена, алкильную группу с 1-4 атомами углерода или алкоксигруппу с 1-4 атомами углерода, или R1 и R2 независимо друг от друга представляют собой атом водорода, атом галогена, алкильную группу с 1-4 атомами углерода, алкоксигруппу с 1-4 атомами углерода, тригалогенметильную группу, цианогруппу или гидроксигруппу или его приемлемая с медицинской точки зрения соль.
10. Производное тиобензимидазола по любому из пп. 1-9 приведенной выше формулы (1), где Е представляет СООН или тетразольную группу, или его приемлемая с медицинской точки зрения соль.
11. Производное тиобензимидазола по любому из пп. 1-10 приведенной выше формулы (1), где Х представляет СН, или его приемлемая с медицинской точки зрения соль.
12. Производное тиобензимидазола по любому из пп. 1-11, или его приемлемая с медицинской точки зрения соль, обладающие ингибирующей химазу человека активностью.
13. Фармацевтическая композиция, обладающая ингибирующей химазу человека активностью, содержащая, по меньшей мере, одно производное тиобензимидазола по любому из пп. 1-11 или его приемлемую с медицинской точки зрения соль, и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п. 13 в качестве профилактического и/или лечебного средства при заболевании, которым является воспалительное заболевание, аллергия, заболевание органов дыхания, заболевание органов системы кровообращения или заболевание, вызванное нарушением костно-хрящевого метаболизма.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP10/200250 | 1998-07-15 | ||
| JP20025098 | 1998-07-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2001104339A RU2001104339A (ru) | 2003-01-27 |
| RU2237663C2 true RU2237663C2 (ru) | 2004-10-10 |
Family
ID=16421274
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2001104339A RU2237663C2 (ru) | 1998-07-15 | 1999-07-14 | Производное тиобензимидазола и содержащие его фармацевтические композиции |
Country Status (22)
| Country | Link |
|---|---|
| US (2) | US7268145B2 (ru) |
| EP (1) | EP1097926A4 (ru) |
| JP (1) | JP3923255B2 (ru) |
| KR (1) | KR100903531B1 (ru) |
| CN (1) | CN1187337C (ru) |
| AU (1) | AU758789B2 (ru) |
| BG (1) | BG65514B1 (ru) |
| BR (1) | BR9912098A (ru) |
| CA (1) | CA2336909C (ru) |
| EE (1) | EE04904B1 (ru) |
| HR (1) | HRP20010030A2 (ru) |
| HU (1) | HUP0103256A3 (ru) |
| ID (1) | ID26899A (ru) |
| IL (1) | IL140862A (ru) |
| IS (1) | IS5807A (ru) |
| NO (1) | NO318957B1 (ru) |
| NZ (1) | NZ509207A (ru) |
| PL (1) | PL203730B1 (ru) |
| RU (1) | RU2237663C2 (ru) |
| SK (1) | SK212001A3 (ru) |
| TR (1) | TR200100047T2 (ru) |
| WO (1) | WO2000003997A1 (ru) |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2237663C2 (ru) | 1998-07-15 | 2004-10-10 | Тейдзин Лимитед | Производное тиобензимидазола и содержащие его фармацевтические композиции |
| US20040010004A1 (en) | 2000-01-17 | 2004-01-15 | Naoki Tsuchiya | Benzimidazole derivatives |
| JP2007119478A (ja) * | 1998-07-15 | 2007-05-17 | Teijin Ltd | チオベンズイミダゾール誘導体 |
| EP1167360A1 (en) * | 2000-01-17 | 2002-01-02 | Teijin Limited | Human chymase inhibitors |
| JP4059671B2 (ja) * | 2000-01-17 | 2008-03-12 | 帝人株式会社 | ベンズイミダゾール誘導体 |
| EP1192950B1 (en) | 2000-02-22 | 2006-07-26 | Daiichi Asubio Pharma Co., Ltd. | Therapeutic drugs for dermatitis exhibiting a biphasic skin reaction containing chymase inhibitors as the active ingredient |
| JP4759500B2 (ja) * | 2001-02-22 | 2011-08-31 | 帝人株式会社 | ベンゾ[b]チオフェン誘導体、およびその製造方法 |
| ATE376830T1 (de) * | 2001-02-22 | 2007-11-15 | Teijin Pharma Ltd | Benzo(b(thiophenderivate und verfahren zu deren herstellung |
| AU2003281039A1 (en) * | 2002-07-10 | 2004-02-02 | Sumitomo Pharmaceuticals Co., Ltd. | Imidazole derivative |
| CL2004001034A1 (es) * | 2003-05-14 | 2005-03-28 | Teijin Pharma Ltd | Formas cristalinas de acido 4-(1-((,etilbenzotiofen-3-il)me til)benzimidazol-2-iltio)butanoico; procedimiento de preparacion de las formas cristalinas; composicion farmaceutica; y su uso para el tratamiento de enfermedades inflamatorias, alergicas, r |
| CN1871029A (zh) * | 2003-08-22 | 2006-11-29 | 帝人制药株式会社 | 含有类糜蛋白酶抑制剂作为有效成分的药物 |
| KR101213912B1 (ko) * | 2004-08-26 | 2012-12-18 | 액테리온 파마슈티칼 리미티드 | Crth2 길항제로서의2-설파닐-벤조이미다졸-1-일-아세틱 애시드 유도체 |
| EP1826207A4 (en) * | 2004-11-12 | 2009-05-20 | Teijin Pharma Ltd | ACID SALT OF A BENZIMIDAZOLE DERIVATIVE AND CRYSTAL THEREOF |
| UA95788C2 (en) * | 2005-12-15 | 2011-09-12 | Ф. Хоффманн-Ля Рош Аг | Fused pyrrole derivatives |
| JP4339371B2 (ja) * | 2007-03-22 | 2009-10-07 | 株式会社ソニー・コンピュータエンタテインメント | 情報処理装置および情報処理方法 |
| TW200916098A (en) * | 2007-06-14 | 2009-04-16 | Teijin Pharma Ltd | Agent for lowering uric acid level |
| WO2009133964A1 (ja) * | 2008-04-28 | 2009-11-05 | 国立大学法人九州大学 | 酸化ストレス抑制剤 |
| AU2009296820B2 (en) | 2008-09-26 | 2014-03-20 | Merck Sharp & Dohme Llc | Novel cyclic benzimidazole derivatives useful anti-diabetic agents |
| MX2011004258A (es) | 2008-10-22 | 2011-06-01 | Merck Sharp & Dohme | Derivados de bencimidazol ciclicos novedosos utiles como agentes anti-diabeticos. |
| AU2009309007A1 (en) | 2008-10-29 | 2010-05-06 | Merck Sharp & Dohme Corp. | Novel cyclic benzimidazole derivatives useful anti-diabetic agents |
| CN102271509A (zh) | 2008-10-31 | 2011-12-07 | 默沙东公司 | 用于抗糖尿病药的新型环苯并咪唑衍生物 |
| US8895596B2 (en) | 2010-02-25 | 2014-11-25 | Merck Sharp & Dohme Corp | Cyclic benzimidazole derivatives useful as anti-diabetic agents |
| MY159058A (en) | 2011-02-25 | 2016-12-15 | Merck Sharp & Dohme | Novel cyclic azabenzimidazole derivatives useful as anti-diabetic agent |
| US8889730B2 (en) | 2012-04-10 | 2014-11-18 | Pfizer Inc. | Indole and indazole compounds that activate AMPK |
| CA2880901A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| ES2755087T3 (es) | 2012-08-22 | 2020-04-21 | Merck Sharp & Dohme | Derivados de benzimidazol hexahidrofuro[3,2-b]furano útiles como activadores de proteína cinasa activada por AMP |
| WO2014031465A1 (en) | 2012-08-22 | 2014-02-27 | Merck Sharp & Dohme Corp. | Novel azabenzimidazole tetrahydropyran derivatives |
| KR20150045436A (ko) | 2012-08-22 | 2015-04-28 | 머크 샤프 앤드 돔 코포레이션 | 신규 아자벤즈이미다졸 헥사히드로푸로[3,2-b]푸란 유도체 |
| EP2888007B1 (en) | 2012-08-22 | 2019-09-18 | Merck Sharp & Dohme Corp. | Benzimidazole tetrahydrofuran derivatives useful as amp-activated protein kinase activators |
| US9527839B2 (en) | 2012-08-22 | 2016-12-27 | Merck Sharp & Dohme Corp. | Benzimidazole tetrahydropyran derivatives |
| EP2888008B1 (en) | 2012-08-22 | 2018-12-26 | Merck Sharp & Dohme Corp. | Novel azabenzimidazole tetrahydrofuran derivatives |
| KR101435496B1 (ko) * | 2012-10-22 | 2014-08-28 | 한국과학기술연구원 | 미토콘드리아 기능 조절제로서의 벤즈이미다졸 유도체 |
| US9650375B2 (en) | 2013-03-14 | 2017-05-16 | Merck Sharp & Dohme Corp. | Indole derivatives useful as anti-diabetic agents |
| EP2970177A1 (en) | 2013-03-15 | 2016-01-20 | Pfizer Inc. | Indole compounds that activate ampk |
| WO2015051496A1 (en) | 2013-10-08 | 2015-04-16 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| ES2747973T3 (es) | 2013-11-15 | 2020-03-12 | Merck Sharp & Dohme | Compuestos tricíclicos antidiabéticos |
| WO2015089809A1 (en) | 2013-12-19 | 2015-06-25 | Merck Sharp & Dohme Corp. | Antidiabetic substituted heteroaryl compounds |
| US11351149B2 (en) | 2020-09-03 | 2022-06-07 | Pfizer Inc. | Nitrile-containing antiviral compounds |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5617073B2 (ru) * | 1971-10-28 | 1981-04-20 | ||
| DE2648411C2 (de) * | 1976-10-26 | 1984-05-17 | Mtu Motoren- Und Turbinen-Union Friedrichshafen Gmbh, 7990 Friedrichshafen | Mehrzylindrige Dieselbrennkraftmaschine |
| FR2430950A1 (fr) | 1978-07-10 | 1980-02-08 | Delalande Sa | Nouveaux derives heterocycliques de la benzimidazole, leur procede de preparation et leur application en therapeutique |
| US4312308A (en) * | 1980-02-21 | 1982-01-26 | Slattery Gordon C | Compression relief system for internal combustion engine |
| JPS62212386A (ja) * | 1986-03-14 | 1987-09-18 | Suntory Ltd | 2−ピリジルメチルベンズイミダゾ−ル誘導体 |
| EP0251536A1 (en) | 1986-06-24 | 1988-01-07 | FISONS plc | Benzimidazoles, their production, formulation and use as gastric acid secretion inhibitors |
| US4839365A (en) | 1987-05-19 | 1989-06-13 | Shinogi & Co., Ltd. | Thienopyridine derivatives useful in treating gastric ulcers |
| AT389107B (de) | 1987-12-03 | 1989-10-25 | Fisons Plc | Neue benzimidazole, verfahren zu deren herstellung und sie enthaltende pharmazeutische zusammensetzungen |
| JPH01265089A (ja) | 1988-04-15 | 1989-10-23 | Zeria Pharmaceut Co Ltd | 新規1−(イミダゾール−4−イル)メチルベンズイミダゾール誘導体およびその製造法ならびにこれを含有する抗潰瘍剤 |
| US5128339A (en) | 1990-11-01 | 1992-07-07 | Sterling Winthrop Inc. | Proteolytic enzyme inhibition method |
| GB8911453D0 (en) | 1989-05-18 | 1989-07-05 | Minnesota Mining & Mfg | Speed and contrast promoted silver halide rhodium doped emulsions |
| IL94390A (en) | 1989-05-30 | 1996-03-31 | Merck & Co Inc | The 6-membered trans-nitrogen-containing heterocycles are compressed with imidazo and pharmaceutical preparations containing them |
| JPH0314566A (ja) | 1989-06-09 | 1991-01-23 | Sankyo Co Ltd | ベンズイミダゾール誘導体 |
| US5449682A (en) | 1990-02-13 | 1995-09-12 | Merck & Co., Inc. | Angiotensin II antagonists incorporating a substituted benzyl element |
| US5128359A (en) | 1990-02-16 | 1992-07-07 | Laboratoires Upsa | Benzimidazole and azabenzimidazole derivatives which are thromboxane receptor antagonists, their methods of preparation |
| FR2658511B1 (fr) * | 1990-02-16 | 1992-06-19 | Union Pharma Scient Appl | Nouveaux derives de benzimidazole et d'azabenzimidazole, antagonistes des recepteurs au thromboxane; leurs procedes de preparation, compositions pharmaceutiques les contenant. |
| US5196444A (en) | 1990-04-27 | 1993-03-23 | Takeda Chemical Industries, Ltd. | 1-(cyclohexyloxycarbonyloxy)ethyl 2-ethoxy-1-[[2'-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl]benzimidazole-7-carboxylate and compositions and methods of pharmaceutical use thereof |
| US5374615A (en) | 1990-10-31 | 1994-12-20 | E. R. Squibb & Sons, Inc. | Indole- and benzimidazole-substituted imidazole and benzimidazole derivatives |
| CA2061159A1 (en) | 1991-02-26 | 1992-08-27 | Michael A. Poss | Imidazole and benzimidazole derivatives |
| US5191086A (en) | 1991-03-19 | 1993-03-02 | E.R. Squibb & Sons, Inc. | Imidazole and benzimidazole derivatives |
| US5128327A (en) | 1991-03-25 | 1992-07-07 | Merck & Co., Inc. | Angiotensin II antagonists incorporating a nitrogen containing six membered ring heterocycle |
| TW300219B (ru) | 1991-09-14 | 1997-03-11 | Hoechst Ag | |
| JPH05112559A (ja) | 1991-10-18 | 1993-05-07 | Morishita Roussel Kk | 4−アミノ−5−ピリミジンカルボン酸誘導体 |
| EP0577023A3 (en) | 1992-07-01 | 1996-12-18 | Hoechst Ag | Angiotensin-ii receptor-antagonists for the treatment of arrhythmices |
| JPH0820584A (ja) | 1994-07-04 | 1996-01-23 | Takeda Chem Ind Ltd | イミダゾール誘導体及びその用途 |
| DE69519921T2 (de) | 1994-07-29 | 2001-06-13 | Suntory Limited, Osaka | Imidazolidin-derivate und ihre verwendung |
| JPH08208654A (ja) | 1994-11-24 | 1996-08-13 | Wakamoto Pharmaceut Co Ltd | キマーゼ活性を阻害し、かつ一酸化窒素生成を抑制する新規トリアジン誘導体 |
| CN1131210C (zh) | 1995-04-27 | 2003-12-17 | 三菱制药株式会社 | 杂环类酰胺化合物及其医药用途 |
| EP0849259A4 (en) | 1995-07-17 | 1998-11-11 | Fuji Photo Film Co Ltd | BENZIMIDAZOLE COMPOUNDS |
| JP3537231B2 (ja) | 1995-07-24 | 2004-06-14 | 第一サントリーファーマ株式会社 | ヒダントイン誘導体およびその用途 |
| US5814631A (en) | 1995-09-28 | 1998-09-29 | Suntory Limited | Quinazoline derivatives and applications thereof |
| WO1998008818A1 (en) | 1996-08-26 | 1998-03-05 | Genetics Institute, Inc. | Inhibitors of phospholipase enzymes |
| KR20000052775A (ko) * | 1996-10-25 | 2000-08-25 | 가마쿠라 아키오 | 신규한 헤테로사이클릭 아미드 화합물 및 의약으로서의 그의 용도 |
| WO1999026932A1 (en) | 1997-11-26 | 1999-06-03 | Axys Pharmaceuticals, Inc. | By amidino group substituted heterocyclic derivatives and their use as anticoagulants |
| AU3538899A (en) | 1998-04-30 | 1999-11-23 | Nippon Chemiphar Co. Ltd. | Condensed imidazole derivative and therapeutic agent for liver disease |
| RU2237663C2 (ru) | 1998-07-15 | 2004-10-10 | Тейдзин Лимитед | Производное тиобензимидазола и содержащие его фармацевтические композиции |
| CN1171887C (zh) | 1999-06-28 | 2004-10-20 | 詹森药业有限公司 | 呼吸道合胞病毒复制抑制剂 |
-
1999
- 1999-07-14 RU RU2001104339A patent/RU2237663C2/ru not_active IP Right Cessation
- 1999-07-14 AU AU46519/99A patent/AU758789B2/en not_active Ceased
- 1999-07-14 CN CNB998108162A patent/CN1187337C/zh not_active Expired - Fee Related
- 1999-07-14 HU HU0103256A patent/HUP0103256A3/hu unknown
- 1999-07-14 TR TR2001/00047T patent/TR200100047T2/xx unknown
- 1999-07-14 ID IDW20010090A patent/ID26899A/id unknown
- 1999-07-14 EP EP99929832A patent/EP1097926A4/en not_active Withdrawn
- 1999-07-14 NZ NZ509207A patent/NZ509207A/xx not_active IP Right Cessation
- 1999-07-14 BR BR9912098-4A patent/BR9912098A/pt not_active Application Discontinuation
- 1999-07-14 SK SK21-2001A patent/SK212001A3/sk unknown
- 1999-07-14 JP JP2000560104A patent/JP3923255B2/ja not_active Expired - Fee Related
- 1999-07-14 EE EEP200100022A patent/EE04904B1/xx not_active IP Right Cessation
- 1999-07-14 KR KR1020017000503A patent/KR100903531B1/ko not_active IP Right Cessation
- 1999-07-14 CA CA002336909A patent/CA2336909C/en not_active Expired - Fee Related
- 1999-07-14 WO PCT/JP1999/003799 patent/WO2000003997A1/ja active IP Right Grant
- 1999-07-14 PL PL345540A patent/PL203730B1/pl not_active IP Right Cessation
- 1999-07-14 IL IL14086299A patent/IL140862A/xx not_active IP Right Cessation
-
2001
- 2001-01-12 NO NO20010193A patent/NO318957B1/no not_active IP Right Cessation
- 2001-01-12 HR HR20010030A patent/HRP20010030A2/hr not_active Application Discontinuation
- 2001-01-12 IS IS5807A patent/IS5807A/is unknown
- 2001-01-15 BG BG105149A patent/BG65514B1/bg unknown
-
2004
- 2004-10-14 US US10/963,710 patent/US7268145B2/en not_active Expired - Fee Related
-
2007
- 2007-05-09 US US11/797,975 patent/US20070275995A1/en not_active Abandoned
Non-Patent Citations (1)
| Title |
|---|
| J. Med. Chem., 1993, v. 36, № 9, 1175-1187. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2237663C2 (ru) | Производное тиобензимидазола и содержащие его фармацевтические композиции | |
| JP4059671B2 (ja) | ベンズイミダゾール誘導体 | |
| EP1448561B1 (en) | Beta 3 adrenergic agonists | |
| WO2005030206A1 (en) | Aryl-1,3-azole derivatives and methods for inhibiting heparnase activity | |
| JP2009527509A (ja) | イミダゾール−5−カルボン酸系誘導体、製造方法及びその応用 | |
| WO2001053272A1 (fr) | Inhibiteurs de chymase humaine | |
| WO1999000373A1 (fr) | Derives de benzimidazole | |
| JPS6377878A (ja) | 4、5−ジヒドロ−オキサゾ−ルの新規誘導体、その製造方法及びその使用法 | |
| US7176320B2 (en) | Benzimidazole derivative | |
| JP2001199968A (ja) | アミノベンズイミダゾール誘導体 | |
| JP2007119478A (ja) | チオベンズイミダゾール誘導体 | |
| JP2001199983A (ja) | ベンズイミダゾール誘導体 | |
| US20050267148A1 (en) | Benzimidazole derivative | |
| FR2781221A1 (fr) | Piperazinones substituees en alpha | |
| CZ2001153A3 (cs) | Thiobenzimidazolové deriváty | |
| AU2007234538B2 (en) | Benzimidazole derivatives | |
| MXPA01000011A (en) | Thiobenzimidazole derivatives | |
| Sharma et al. | SYNTHESIS AND BIOLOGICAL ACTIVITY OF 4'-(5-AMINO-6-CHLORO-2-SUBSTITUTED-BENZOIMIDAZOL-1-YLMETHYL)]-BIPHENYL-2-CARBOXYLIC ACID AS ANTIHYPERTENSIVE AGENTS. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20110715 |