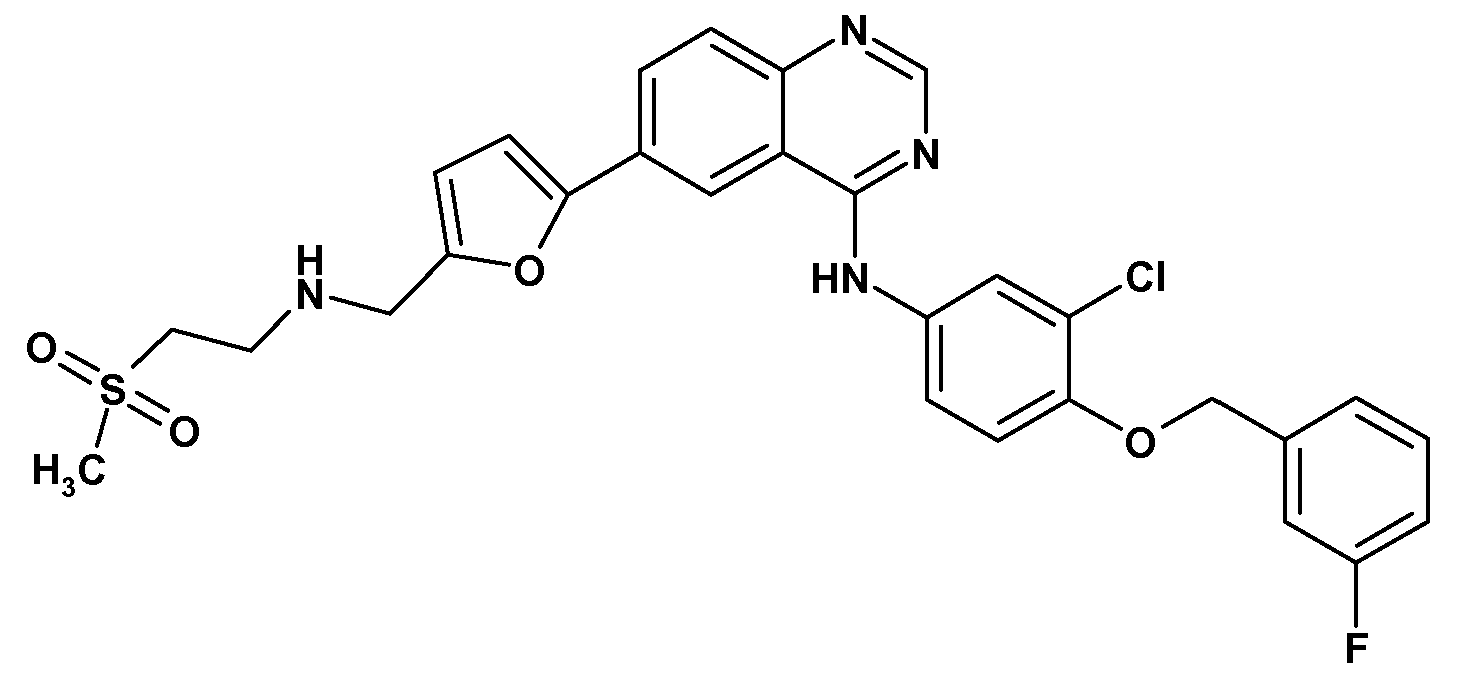
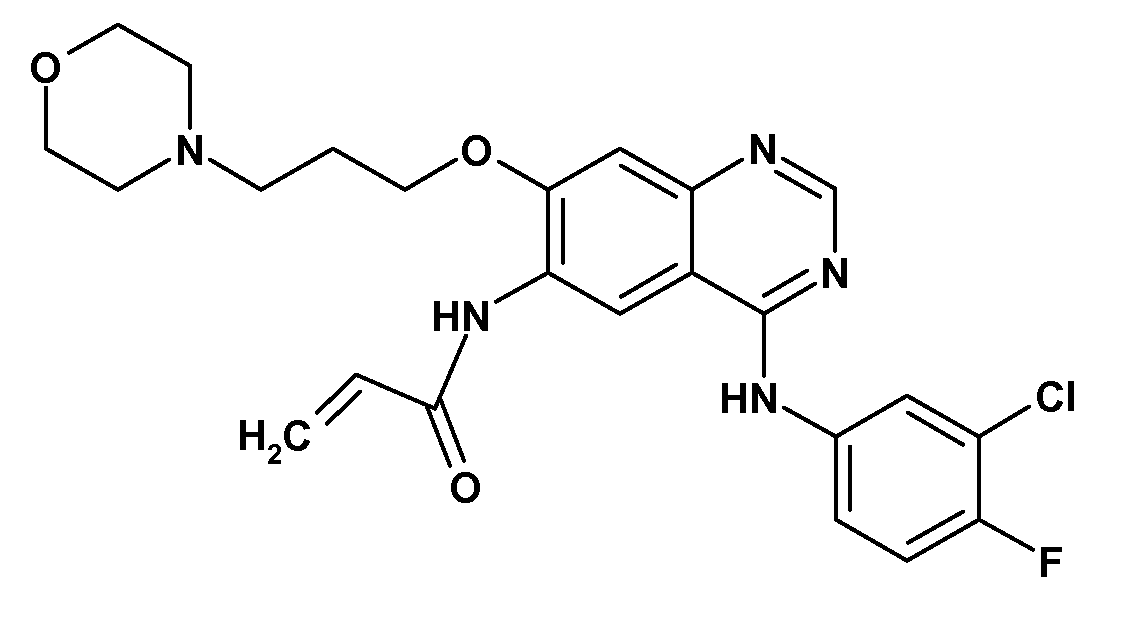
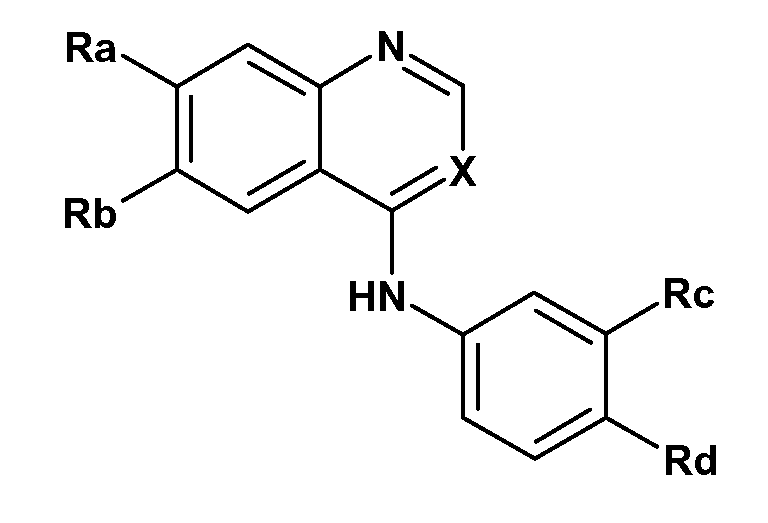
KR102115047B1 - 티로신 키나제 억제제들을 갖는 조합 제품 및 그의 용도 - Google Patents
티로신 키나제 억제제들을 갖는 조합 제품 및 그의 용도 Download PDFInfo
- Publication number
- KR102115047B1 KR102115047B1 KR1020147030326A KR20147030326A KR102115047B1 KR 102115047 B1 KR102115047 B1 KR 102115047B1 KR 1020147030326 A KR1020147030326 A KR 1020147030326A KR 20147030326 A KR20147030326 A KR 20147030326A KR 102115047 B1 KR102115047 B1 KR 102115047B1
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- combination
- met
- methyl
- compounds
- Prior art date
Links
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 title description 15
- 239000005483 tyrosine kinase inhibitor Substances 0.000 title description 15
- 238000011282 treatment Methods 0.000 claims abstract description 69
- 150000003839 salts Chemical class 0.000 claims abstract description 59
- 229940121647 egfr inhibitor Drugs 0.000 claims abstract description 48
- 239000000825 pharmaceutical preparation Substances 0.000 claims abstract description 6
- 229940127557 pharmaceutical product Drugs 0.000 claims abstract description 6
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 claims description 63
- 239000005411 L01XE02 - Gefitinib Substances 0.000 claims description 62
- 229960002584 gefitinib Drugs 0.000 claims description 62
- 239000003795 chemical substances by application Substances 0.000 claims description 36
- 208000020816 lung neoplasm Diseases 0.000 claims description 19
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 17
- 201000005202 lung cancer Diseases 0.000 claims description 17
- 239000013066 combination product Substances 0.000 claims description 13
- 229940127555 combination product Drugs 0.000 claims description 13
- 229940122661 MET tyrosine kinase inhibitor Drugs 0.000 claims description 12
- 239000003937 drug carrier Substances 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 229940126601 medicinal product Drugs 0.000 claims description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 57
- 239000003112 inhibitor Substances 0.000 abstract description 54
- 201000010099 disease Diseases 0.000 abstract description 48
- 238000000034 method Methods 0.000 abstract description 28
- 229940002612 prodrug Drugs 0.000 abstract description 25
- 239000000651 prodrug Substances 0.000 abstract description 25
- 239000008194 pharmaceutical composition Substances 0.000 abstract description 11
- 230000002062 proliferating effect Effects 0.000 abstract description 7
- 230000008569 process Effects 0.000 abstract description 4
- 150000001875 compounds Chemical class 0.000 description 194
- 125000000217 alkyl group Chemical group 0.000 description 130
- 230000000694 effects Effects 0.000 description 114
- 206010028980 Neoplasm Diseases 0.000 description 97
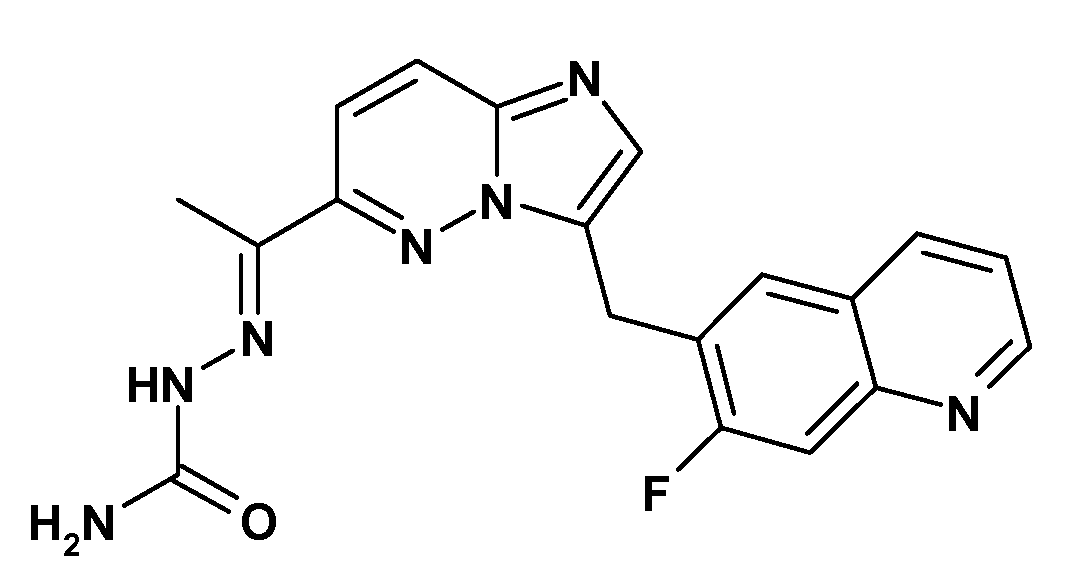
- -1 1- (3-((7-fluoroquinolin-6-yl) methyl) imidazo [1, 2-b] pyridazine-6-yl) ethylidene Chemical group 0.000 description 70
- 125000005843 halogen group Chemical group 0.000 description 64
- 210000004027 cell Anatomy 0.000 description 63
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 60
- 125000003118 aryl group Chemical group 0.000 description 54
- 125000000753 cycloalkyl group Chemical group 0.000 description 52
- 125000001072 heteroaryl group Chemical group 0.000 description 52
- 229910052739 hydrogen Inorganic materials 0.000 description 46
- 102000001301 EGF receptor Human genes 0.000 description 43
- 125000003545 alkoxy group Chemical group 0.000 description 43
- 201000011510 cancer Diseases 0.000 description 43
- 108060006698 EGF receptor Proteins 0.000 description 42
- 125000001424 substituent group Chemical group 0.000 description 42
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 description 39
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 34
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 34
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 32
- 239000003814 drug Substances 0.000 description 31
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 30
- 239000000203 mixture Substances 0.000 description 30
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 29
- 241001465754 Metazoa Species 0.000 description 27
- 229910052799 carbon Inorganic materials 0.000 description 27
- 239000001257 hydrogen Substances 0.000 description 26
- 239000004480 active ingredient Substances 0.000 description 25
- 229940079593 drug Drugs 0.000 description 24
- 230000002401 inhibitory effect Effects 0.000 description 22
- 229910052805 deuterium Inorganic materials 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 19
- 125000004432 carbon atom Chemical group C* 0.000 description 19
- 230000007423 decrease Effects 0.000 description 19
- 108090000623 proteins and genes Proteins 0.000 description 19
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 18
- 230000008685 targeting Effects 0.000 description 18
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 17
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 17
- 150000002431 hydrogen Chemical class 0.000 description 17
- 125000003710 aryl alkyl group Chemical group 0.000 description 16
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 16
- 238000009472 formulation Methods 0.000 description 16
- 229910052757 nitrogen Inorganic materials 0.000 description 16
- 239000003981 vehicle Substances 0.000 description 16
- 125000004737 (C1-C6) haloalkoxy group Chemical group 0.000 description 15
- 230000001404 mediated effect Effects 0.000 description 15
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 14
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 14
- 125000003342 alkenyl group Chemical group 0.000 description 14
- 102000004169 proteins and genes Human genes 0.000 description 14
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 14
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 14
- 108091000080 Phosphotransferase Proteins 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- 125000000304 alkynyl group Chemical group 0.000 description 13
- 230000014509 gene expression Effects 0.000 description 13
- 102000020233 phosphotransferase Human genes 0.000 description 13
- 230000000259 anti-tumor effect Effects 0.000 description 12
- 125000004429 atom Chemical group 0.000 description 12
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 12
- 229910052717 sulfur Inorganic materials 0.000 description 12
- 238000002474 experimental method Methods 0.000 description 11
- 102000005962 receptors Human genes 0.000 description 11
- 108020003175 receptors Proteins 0.000 description 11
- 239000003826 tablet Substances 0.000 description 11
- 230000001225 therapeutic effect Effects 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 10
- 239000005557 antagonist Substances 0.000 description 10
- 238000001727 in vivo Methods 0.000 description 10
- 238000010348 incorporation Methods 0.000 description 10
- 230000035772 mutation Effects 0.000 description 10
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 10
- 230000001603 reducing effect Effects 0.000 description 10
- 108091008794 FGF receptors Proteins 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 9
- 206010039491 Sarcoma Diseases 0.000 description 9
- 208000035475 disorder Diseases 0.000 description 9
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 9
- 125000004433 nitrogen atom Chemical group N* 0.000 description 9
- 238000001543 one-way ANOVA Methods 0.000 description 9
- 229910052760 oxygen Inorganic materials 0.000 description 9
- 206010009944 Colon cancer Diseases 0.000 description 8
- 230000003321 amplification Effects 0.000 description 8
- 238000000540 analysis of variance Methods 0.000 description 8
- 230000037396 body weight Effects 0.000 description 8
- 230000003247 decreasing effect Effects 0.000 description 8
- 230000001965 increasing effect Effects 0.000 description 8
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 8
- 239000003446 ligand Substances 0.000 description 8
- 238000003199 nucleic acid amplification method Methods 0.000 description 8
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 7
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 7
- 239000000556 agonist Substances 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 230000001419 dependent effect Effects 0.000 description 7
- 102000052178 fibroblast growth factor receptor activity proteins Human genes 0.000 description 7
- 125000005842 heteroatom Chemical group 0.000 description 7
- 230000003993 interaction Effects 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 7
- 230000037361 pathway Effects 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- 210000001519 tissue Anatomy 0.000 description 7
- 125000006590 (C2-C6) alkenylene group Chemical group 0.000 description 6
- 125000006591 (C2-C6) alkynylene group Chemical group 0.000 description 6
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 230000002159 abnormal effect Effects 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 6
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 6
- 125000001188 haloalkyl group Chemical group 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 125000002950 monocyclic group Chemical group 0.000 description 6
- 239000003755 preservative agent Substances 0.000 description 6
- 210000004881 tumor cell Anatomy 0.000 description 6
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 description 5
- 229940126062 Compound A Drugs 0.000 description 5
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 5
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 5
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 5
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 5
- 108091008606 PDGF receptors Proteins 0.000 description 5
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 5
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 5
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 5
- 206010060862 Prostate cancer Diseases 0.000 description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 5
- 208000005718 Stomach Neoplasms Diseases 0.000 description 5
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 125000000732 arylene group Chemical group 0.000 description 5
- 239000011230 binding agent Substances 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 238000002512 chemotherapy Methods 0.000 description 5
- 125000004093 cyano group Chemical group *C#N 0.000 description 5
- 125000002993 cycloalkylene group Chemical group 0.000 description 5
- 206010017758 gastric cancer Diseases 0.000 description 5
- 150000002367 halogens Chemical class 0.000 description 5
- 125000005549 heteroarylene group Chemical group 0.000 description 5
- 239000003276 histone deacetylase inhibitor Chemical class 0.000 description 5
- 230000005865 ionizing radiation Effects 0.000 description 5
- 210000004185 liver Anatomy 0.000 description 5
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 5
- 238000001959 radiotherapy Methods 0.000 description 5
- 150000003431 steroids Chemical class 0.000 description 5
- 201000011549 stomach cancer Diseases 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 230000002195 synergetic effect Effects 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000002054 transplantation Methods 0.000 description 5
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 5
- 229960000237 vorinostat Drugs 0.000 description 5
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 4
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 4
- 206010005003 Bladder cancer Diseases 0.000 description 4
- 206010006187 Breast cancer Diseases 0.000 description 4
- 208000026310 Breast neoplasm Diseases 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- 201000009030 Carcinoma Diseases 0.000 description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 4
- 230000004544 DNA amplification Effects 0.000 description 4
- 208000032612 Glial tumor Diseases 0.000 description 4
- 206010018338 Glioma Diseases 0.000 description 4
- 101710113864 Heat shock protein 90 Proteins 0.000 description 4
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 4
- 102000003964 Histone deacetylase Human genes 0.000 description 4
- 108090000353 Histone deacetylase Proteins 0.000 description 4
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 4
- 206010027476 Metastases Diseases 0.000 description 4
- 101710181812 Methionine aminopeptidase Proteins 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 102000008022 Proto-Oncogene Proteins c-met Human genes 0.000 description 4
- 108010089836 Proto-Oncogene Proteins c-met Proteins 0.000 description 4
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 4
- 125000002252 acyl group Chemical group 0.000 description 4
- 230000000996 additive effect Effects 0.000 description 4
- 125000003282 alkyl amino group Chemical group 0.000 description 4
- 230000001028 anti-proliverative effect Effects 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 230000009286 beneficial effect Effects 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 229910002091 carbon monoxide Inorganic materials 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 208000029742 colonic neoplasm Diseases 0.000 description 4
- 125000004966 cyanoalkyl group Chemical group 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 229960001433 erlotinib Drugs 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- 208000005017 glioblastoma Diseases 0.000 description 4
- 229910052736 halogen Inorganic materials 0.000 description 4
- 125000005311 halosulfanyl group Chemical group 0.000 description 4
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 4
- 229960002411 imatinib Drugs 0.000 description 4
- 230000000155 isotopic effect Effects 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 229940043355 kinase inhibitor Drugs 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 230000002503 metabolic effect Effects 0.000 description 4
- 230000009401 metastasis Effects 0.000 description 4
- 229920000609 methyl cellulose Polymers 0.000 description 4
- 239000001923 methylcellulose Substances 0.000 description 4
- 235000010981 methylcellulose Nutrition 0.000 description 4
- 239000001301 oxygen Substances 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 4
- 125000003367 polycyclic group Chemical group 0.000 description 4
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 4
- 229920000053 polysorbate 80 Polymers 0.000 description 4
- 125000004076 pyridyl group Chemical group 0.000 description 4
- 108010014186 ras Proteins Proteins 0.000 description 4
- 102000016914 ras Proteins Human genes 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 210000002784 stomach Anatomy 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 125000001544 thienyl group Chemical group 0.000 description 4
- 230000000699 topical effect Effects 0.000 description 4
- 231100000419 toxicity Toxicity 0.000 description 4
- 230000001988 toxicity Effects 0.000 description 4
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 description 3
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 3
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 3
- 108091006112 ATPases Proteins 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 3
- 206010003571 Astrocytoma Diseases 0.000 description 3
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 description 3
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000009024 Epidermal Growth Factor Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 102000014150 Interferons Human genes 0.000 description 3
- 108010050904 Interferons Proteins 0.000 description 3
- 208000008839 Kidney Neoplasms Diseases 0.000 description 3
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 102000029749 Microtubule Human genes 0.000 description 3
- 108091022875 Microtubule Proteins 0.000 description 3
- 208000034578 Multiple myelomas Diseases 0.000 description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 3
- CXQHYVUVSFXTMY-UHFFFAOYSA-N N1'-[3-fluoro-4-[[6-methoxy-7-[3-(4-morpholinyl)propoxy]-4-quinolinyl]oxy]phenyl]-N1-(4-fluorophenyl)cyclopropane-1,1-dicarboxamide Chemical compound C1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1OC(C(=C1)F)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 CXQHYVUVSFXTMY-UHFFFAOYSA-N 0.000 description 3
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 3
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 3
- PLXBWHJQWKZRKG-UHFFFAOYSA-N Resazurin Chemical compound C1=CC(=O)C=C2OC3=CC(O)=CC=C3[N+]([O-])=C21 PLXBWHJQWKZRKG-UHFFFAOYSA-N 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 108010017842 Telomerase Proteins 0.000 description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 3
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 3
- 102000016548 Vascular Endothelial Growth Factor Receptor-1 Human genes 0.000 description 3
- 125000002947 alkylene group Chemical group 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 230000033115 angiogenesis Effects 0.000 description 3
- 230000001772 anti-angiogenic effect Effects 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 229960000397 bevacizumab Drugs 0.000 description 3
- 150000005347 biaryls Chemical group 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- OMZCMEYTWSXEPZ-UHFFFAOYSA-N canertinib Chemical compound C1=C(Cl)C(F)=CC=C1NC1=NC=NC2=CC(OCCCN3CCOCC3)=C(NC(=O)C=C)C=C12 OMZCMEYTWSXEPZ-UHFFFAOYSA-N 0.000 description 3
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 239000000460 chlorine Substances 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- 238000011284 combination treatment Methods 0.000 description 3
- 239000003246 corticosteroid Substances 0.000 description 3
- 229960001334 corticosteroids Drugs 0.000 description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 229940088679 drug related substance Drugs 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 229940082789 erbitux Drugs 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 235000003599 food sweetener Nutrition 0.000 description 3
- 239000007903 gelatin capsule Substances 0.000 description 3
- 230000004077 genetic alteration Effects 0.000 description 3
- 231100000118 genetic alteration Toxicity 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- 125000006588 heterocycloalkylene group Chemical group 0.000 description 3
- 229940121372 histone deacetylase inhibitor Drugs 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 208000032839 leukemia Diseases 0.000 description 3
- 201000007270 liver cancer Diseases 0.000 description 3
- 208000014018 liver neoplasm Diseases 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 230000036210 malignancy Effects 0.000 description 3
- 229960001428 mercaptopurine Drugs 0.000 description 3
- 210000004688 microtubule Anatomy 0.000 description 3
- BMGQWWVMWDBQGC-IIFHNQTCSA-N midostaurin Chemical compound CN([C@H]1[C@H]([C@]2(C)O[C@@H](N3C4=CC=CC=C4C4=C5C(=O)NCC5=C5C6=CC=CC=C6N2C5=C43)C1)OC)C(=O)C1=CC=CC=C1 BMGQWWVMWDBQGC-IIFHNQTCSA-N 0.000 description 3
- 229950010895 midostaurin Drugs 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 230000002246 oncogenic effect Effects 0.000 description 3
- 201000008968 osteosarcoma Diseases 0.000 description 3
- 210000001672 ovary Anatomy 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 239000000816 peptidomimetic Substances 0.000 description 3
- 238000002428 photodynamic therapy Methods 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 239000003765 sweetening agent Substances 0.000 description 3
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 3
- 125000000335 thiazolyl group Chemical group 0.000 description 3
- 230000005740 tumor formation Effects 0.000 description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 3
- 201000005112 urinary bladder cancer Diseases 0.000 description 3
- 230000002485 urinary effect Effects 0.000 description 3
- DNXHEGUUPJUMQT-UHFFFAOYSA-N (+)-estrone Natural products OC1=CC=C2C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 DNXHEGUUPJUMQT-UHFFFAOYSA-N 0.000 description 2
- NBRQRXRBIHVLGI-OWXODZSWSA-N (4as,5ar,12ar)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1C2=CC=CC(O)=C2C(O)=C(C2=O)[C@@H]1C[C@@H]1[C@@]2(O)C(O)=C(C(=O)N)C(=O)C1 NBRQRXRBIHVLGI-OWXODZSWSA-N 0.000 description 2
- GVJHHUAWPYXKBD-IEOSBIPESA-N (R)-alpha-Tocopherol Natural products OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- UMGQVUWXNOJOSJ-KMHUVPDISA-N (e)-2-cyano-3-(3,4-dihydroxyphenyl)-n-[(1r)-1-phenylethyl]prop-2-enamide Chemical compound N([C@H](C)C=1C=CC=CC=1)C(=O)C(\C#N)=C\C1=CC=C(O)C(O)=C1 UMGQVUWXNOJOSJ-KMHUVPDISA-N 0.000 description 2
- KPPVNWGJXFMGAM-UUILKARUSA-N (e)-2-methyl-1-(6-methyl-3,4-dihydro-2h-quinolin-1-yl)but-2-en-1-one Chemical compound CC1=CC=C2N(C(=O)C(/C)=C/C)CCCC2=C1 KPPVNWGJXFMGAM-UUILKARUSA-N 0.000 description 2
- YJZSUCFGHXQWDM-UHFFFAOYSA-N 1-adamantyl 4-[(2,5-dihydroxyphenyl)methylamino]benzoate Chemical compound OC1=CC=C(O)C(CNC=2C=CC(=CC=2)C(=O)OC23CC4CC(CC(C4)C2)C3)=C1 YJZSUCFGHXQWDM-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 2
- JVKUCNQGESRUCL-UHFFFAOYSA-N 2-Hydroxyethyl 12-hydroxyoctadecanoate Chemical compound CCCCCCC(O)CCCCCCCCCCC(=O)OCCO JVKUCNQGESRUCL-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- OTXNTMVVOOBZCV-UHFFFAOYSA-N 2R-gamma-tocotrienol Natural products OC1=C(C)C(C)=C2OC(CCC=C(C)CCC=C(C)CCC=C(C)C)(C)CCC2=C1 OTXNTMVVOOBZCV-UHFFFAOYSA-N 0.000 description 2
- NHFDRBXTEDBWCZ-ZROIWOOFSA-N 3-[2,4-dimethyl-5-[(z)-(2-oxo-1h-indol-3-ylidene)methyl]-1h-pyrrol-3-yl]propanoic acid Chemical compound OC(=O)CCC1=C(C)NC(\C=C/2C3=CC=CC=C3NC\2=O)=C1C NHFDRBXTEDBWCZ-ZROIWOOFSA-N 0.000 description 2
- JRWCBEOAFGHNNU-UHFFFAOYSA-N 6-[difluoro-[6-(1-methyl-4-pyrazolyl)-[1,2,4]triazolo[4,3-b]pyridazin-3-yl]methyl]quinoline Chemical compound C1=NN(C)C=C1C1=NN2C(C(F)(F)C=3C=C4C=CC=NC4=CC=3)=NN=C2C=C1 JRWCBEOAFGHNNU-UHFFFAOYSA-N 0.000 description 2
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- 102000005758 Adenosylmethionine decarboxylase Human genes 0.000 description 2
- 108010070753 Adenosylmethionine decarboxylase Proteins 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 229940122361 Bisphosphonate Drugs 0.000 description 2
- 108091007914 CDKs Proteins 0.000 description 2
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 0 Cc1ncc(*)[n]1C Chemical compound Cc1ncc(*)[n]1C 0.000 description 2
- 101150015280 Cel gene Proteins 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 2
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 238000001061 Dunnett's test Methods 0.000 description 2
- 101150039808 Egfr gene Proteins 0.000 description 2
- 102400001047 Endostatin Human genes 0.000 description 2
- 108010079505 Endostatins Proteins 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- DNXHEGUUPJUMQT-CBZIJGRNSA-N Estrone Chemical compound OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 DNXHEGUUPJUMQT-CBZIJGRNSA-N 0.000 description 2
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102400000932 Gonadoliberin-1 Human genes 0.000 description 2
- 108010069236 Goserelin Proteins 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 101500026183 Homo sapiens Gonadoliberin-1 Proteins 0.000 description 2
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 2
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 102000010638 Kinesin Human genes 0.000 description 2
- 108010063296 Kinesin Proteins 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 229930182816 L-glutamine Natural products 0.000 description 2
- 102000008072 Lymphokines Human genes 0.000 description 2
- 108010074338 Lymphokines Proteins 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 206010027406 Mesothelioma Diseases 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 229940079156 Proteasome inhibitor Drugs 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 108090000315 Protein Kinase C Proteins 0.000 description 2
- 102000003923 Protein Kinase C Human genes 0.000 description 2
- 102000009516 Protein Serine-Threonine Kinases Human genes 0.000 description 2
- 108010009341 Protein Serine-Threonine Kinases Proteins 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- 229940127395 Ribonucleotide Reductase Inhibitors Drugs 0.000 description 2
- BCZUAADEACICHN-UHFFFAOYSA-N SGX-523 Chemical compound C1=NN(C)C=C1C1=NN2C(SC=3C=C4C=CC=NC4=CC=3)=NN=C2C=C1 BCZUAADEACICHN-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- 206010041067 Small cell lung cancer Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 229920001304 Solutol HS 15 Polymers 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 2
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 2
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 125000004423 acyloxy group Chemical group 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 125000005236 alkanoylamino group Chemical group 0.000 description 2
- 125000005083 alkoxyalkoxy group Chemical group 0.000 description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 2
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 2
- RZFHLOLGZPDCHJ-DLQZEEBKSA-N alpha-Tocotrienol Natural products Oc1c(C)c(C)c2O[C@@](CC/C=C(/CC/C=C(\CC/C=C(\C)/C)/C)\C)(C)CCc2c1C RZFHLOLGZPDCHJ-DLQZEEBKSA-N 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Chemical group C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 230000008485 antagonism Effects 0.000 description 2
- 230000002280 anti-androgenic effect Effects 0.000 description 2
- 229940046836 anti-estrogen Drugs 0.000 description 2
- 230000001833 anti-estrogenic effect Effects 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 229940124599 anti-inflammatory drug Drugs 0.000 description 2
- 230000000719 anti-leukaemic effect Effects 0.000 description 2
- 239000000051 antiandrogen Substances 0.000 description 2
- 229940124623 antihistamine drug Drugs 0.000 description 2
- 239000000739 antihistaminic agent Substances 0.000 description 2
- 239000002814 antineoplastic antimetabolite Substances 0.000 description 2
- 239000000074 antisense oligonucleotide Substances 0.000 description 2
- 238000012230 antisense oligonucleotides Methods 0.000 description 2
- 239000003886 aromatase inhibitor Substances 0.000 description 2
- 125000004350 aryl cycloalkyl group Chemical group 0.000 description 2
- 125000004104 aryloxy group Chemical group 0.000 description 2
- 238000011717 athymic nude mouse Methods 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- 150000004663 bisphosphonates Chemical class 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 229940124630 bronchodilator Drugs 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 229940127093 camptothecin Drugs 0.000 description 2
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 2
- 229950002826 canertinib Drugs 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 229960005395 cetuximab Drugs 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 238000009096 combination chemotherapy Methods 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 239000003954 decarboxylase inhibitor Substances 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 150000001975 deuterium Chemical group 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 2
- 239000000890 drug combination Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000008472 epithelial growth Effects 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- 229940011871 estrogen Drugs 0.000 description 2
- 239000000262 estrogen Substances 0.000 description 2
- 239000000328 estrogen antagonist Substances 0.000 description 2
- 229960003399 estrone Drugs 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 229960005420 etoposide Drugs 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 229960005167 everolimus Drugs 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 235000008191 folinic acid Nutrition 0.000 description 2
- 239000011672 folinic acid Substances 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- QTQAWLPCGQOSGP-GBTDJJJQSA-N geldanamycin Chemical class N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(OC)C(=O)C=C1C2=O QTQAWLPCGQOSGP-GBTDJJJQSA-N 0.000 description 2
- 210000004392 genitalia Anatomy 0.000 description 2
- 238000003205 genotyping method Methods 0.000 description 2
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 2
- 229960001442 gonadorelin Drugs 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 210000003128 head Anatomy 0.000 description 2
- 201000010536 head and neck cancer Diseases 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 2
- 125000005349 heteroarylcycloalkyl group Chemical group 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- 229960000908 idarubicin Drugs 0.000 description 2
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 2
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 description 2
- 239000000367 immunologic factor Substances 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 239000003701 inert diluent Substances 0.000 description 2
- 230000004968 inflammatory condition Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 229940084651 iressa Drugs 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- 229960004891 lapatinib Drugs 0.000 description 2
- 229960001691 leucovorin Drugs 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- KHPKQFYUPIUARC-UHFFFAOYSA-N lumiracoxib Chemical compound OC(=O)CC1=CC(C)=CC=C1NC1=C(F)C=CC=C1Cl KHPKQFYUPIUARC-UHFFFAOYSA-N 0.000 description 2
- 208000037841 lung tumor Diseases 0.000 description 2
- 229940124302 mTOR inhibitor Drugs 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 2
- 125000005322 morpholin-1-yl group Chemical group 0.000 description 2
- 210000003739 neck Anatomy 0.000 description 2
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 2
- 238000010899 nucleation Methods 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 231100000590 oncogenic Toxicity 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 125000004043 oxo group Chemical group O=* 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- FPOHNWQLNRZRFC-ZHACJKMWSA-N panobinostat Chemical compound CC=1NC2=CC=CC=C2C=1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FPOHNWQLNRZRFC-ZHACJKMWSA-N 0.000 description 2
- 201000010279 papillary renal cell carcinoma Diseases 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 230000002165 photosensitisation Effects 0.000 description 2
- 239000003504 photosensitizing agent Substances 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 239000002599 prostaglandin synthase inhibitor Substances 0.000 description 2
- 239000003207 proteasome inhibitor Substances 0.000 description 2
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 2
- 229940121649 protein inhibitor Drugs 0.000 description 2
- 239000012268 protein inhibitor Substances 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- DRYRBWIFRVMRPV-UHFFFAOYSA-N quinazolin-4-amine Chemical compound C1=CC=C2C(N)=NC=NC2=C1 DRYRBWIFRVMRPV-UHFFFAOYSA-N 0.000 description 2
- 150000003254 radicals Chemical class 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- QXKJWHWUDVQATH-UHFFFAOYSA-N rogletimide Chemical compound C=1C=NC=CC=1C1(CC)CCC(=O)NC1=O QXKJWHWUDVQATH-UHFFFAOYSA-N 0.000 description 2
- 229960003452 romidepsin Drugs 0.000 description 2
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 2
- 229960002052 salbutamol Drugs 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 2
- DUIOPKIIICUYRZ-UHFFFAOYSA-N semicarbazide Chemical compound NNC(N)=O DUIOPKIIICUYRZ-UHFFFAOYSA-N 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 238000002603 single-photon emission computed tomography Methods 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 229940054269 sodium pyruvate Drugs 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- HKSZLNNOFSGOKW-FYTWVXJKSA-N staurosporine Chemical class C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1[C@H]1C[C@@H](NC)[C@@H](OC)[C@]4(C)O1 HKSZLNNOFSGOKW-FYTWVXJKSA-N 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 230000009044 synergistic interaction Effects 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 229940120982 tarceva Drugs 0.000 description 2
- 239000003277 telomerase inhibitor Substances 0.000 description 2
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 2
- 229960001278 teniposide Drugs 0.000 description 2
- AHYMHWXQRWRBKT-UHFFFAOYSA-N tepotinib Chemical compound C1CN(C)CCC1COC1=CN=C(C=2C=C(CN3C(C=CC(=N3)C=3C=C(C=CC=3)C#N)=O)C=CC=2)N=C1 AHYMHWXQRWRBKT-UHFFFAOYSA-N 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 229960003604 testosterone Drugs 0.000 description 2
- 229960003433 thalidomide Drugs 0.000 description 2
- AYEKOFBPNLCAJY-UHFFFAOYSA-O thiamine pyrophosphate Chemical compound CC1=C(CCOP(O)(=O)OP(O)(O)=O)SC=[N+]1CC1=CN=C(C)N=C1N AYEKOFBPNLCAJY-UHFFFAOYSA-O 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- PLHJCIYEEKOWNM-HHHXNRCGSA-N tipifarnib Chemical compound CN1C=NC=C1[C@](N)(C=1C=C2C(C=3C=C(Cl)C=CC=3)=CC(=O)N(C)C2=CC=1)C1=CC=C(Cl)C=C1 PLHJCIYEEKOWNM-HHHXNRCGSA-N 0.000 description 2
- 238000011269 treatment regimen Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical class C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- 230000004584 weight gain Effects 0.000 description 2
- 235000019786 weight gain Nutrition 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- GZIFEOYASATJEH-VHFRWLAGSA-N δ-tocopherol Chemical compound OC1=CC(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1 GZIFEOYASATJEH-VHFRWLAGSA-N 0.000 description 2
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 description 1
- XMAYWYJOQHXEEK-OZXSUGGESA-N (2R,4S)-ketoconazole Chemical compound C1CN(C(=O)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 XMAYWYJOQHXEEK-OZXSUGGESA-N 0.000 description 1
- CNPVJJQCETWNEU-CYFREDJKSA-N (4,6-dimethyl-5-pyrimidinyl)-[4-[(3S)-4-[(1R)-2-methoxy-1-[4-(trifluoromethyl)phenyl]ethyl]-3-methyl-1-piperazinyl]-4-methyl-1-piperidinyl]methanone Chemical compound N([C@@H](COC)C=1C=CC(=CC=1)C(F)(F)F)([C@H](C1)C)CCN1C(CC1)(C)CCN1C(=O)C1=C(C)N=CN=C1C CNPVJJQCETWNEU-CYFREDJKSA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- SWDZPNJZKUGIIH-QQTULTPQSA-N (5z)-n-ethyl-5-(4-hydroxy-6-oxo-3-propan-2-ylcyclohexa-2,4-dien-1-ylidene)-4-[4-(morpholin-4-ylmethyl)phenyl]-2h-1,2-oxazole-3-carboxamide Chemical compound O1NC(C(=O)NCC)=C(C=2C=CC(CN3CCOCC3)=CC=2)\C1=C1/C=C(C(C)C)C(O)=CC1=O SWDZPNJZKUGIIH-QQTULTPQSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- 125000006564 (C4-C8) cycloalkyl group Chemical group 0.000 description 1
- GWCNJMUSWLTSCW-SFQUDFHCSA-N (e)-2-cyano-3-(3,4-dihydroxyphenyl)-n-(4-phenylbutyl)prop-2-enamide Chemical compound C1=C(O)C(O)=CC=C1\C=C(/C#N)C(=O)NCCCCC1=CC=CC=C1 GWCNJMUSWLTSCW-SFQUDFHCSA-N 0.000 description 1
- ZJLFOOWTDISDIO-ZRDIBKRKSA-N (e)-3-[6-[(2,6-dichlorophenyl)sulfanylmethyl]-3-(2-phenylethoxy)pyridin-2-yl]prop-2-enoic acid Chemical compound C=1C=C(OCCC=2C=CC=CC=2)C(/C=C/C(=O)O)=NC=1CSC1=C(Cl)C=CC=C1Cl ZJLFOOWTDISDIO-ZRDIBKRKSA-N 0.000 description 1
- PMGQWSIVQFOFOQ-BDUVBVHRSA-N (e)-but-2-enedioic acid;(2r)-2-[2-[1-(4-chlorophenyl)-1-phenylethoxy]ethyl]-1-methylpyrrolidine Chemical compound OC(=O)\C=C\C(O)=O.CN1CCC[C@@H]1CCOC(C)(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 PMGQWSIVQFOFOQ-BDUVBVHRSA-N 0.000 description 1
- BWDQBBCUWLSASG-MDZDMXLPSA-N (e)-n-hydroxy-3-[4-[[2-hydroxyethyl-[2-(1h-indol-3-yl)ethyl]amino]methyl]phenyl]prop-2-enamide Chemical compound C=1NC2=CC=CC=C2C=1CCN(CCO)CC1=CC=C(\C=C\C(=O)NO)C=C1 BWDQBBCUWLSASG-MDZDMXLPSA-N 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- FTNJQNQLEGKTGD-UHFFFAOYSA-N 1,3-benzodioxole Chemical compound C1=CC=C2OCOC2=C1 FTNJQNQLEGKTGD-UHFFFAOYSA-N 0.000 description 1
- BJHCYTJNPVGSBZ-YXSASFKJSA-N 1-[4-[6-amino-5-[(Z)-methoxyiminomethyl]pyrimidin-4-yl]oxy-2-chlorophenyl]-3-ethylurea Chemical compound CCNC(=O)Nc1ccc(Oc2ncnc(N)c2\C=N/OC)cc1Cl BJHCYTJNPVGSBZ-YXSASFKJSA-N 0.000 description 1
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- ZESRJSPZRDMNHY-YFWFAHHUSA-N 11-deoxycorticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 ZESRJSPZRDMNHY-YFWFAHHUSA-N 0.000 description 1
- KUFRQPKVAWMTJO-QSTRRNJOSA-N 17-dmag Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(NCCN(C)C)C(=O)C=C1C2=O KUFRQPKVAWMTJO-QSTRRNJOSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- FPYJSJDOHRDAMT-KQWNVCNZSA-N 1h-indole-5-sulfonamide, n-(3-chlorophenyl)-3-[[3,5-dimethyl-4-[(4-methyl-1-piperazinyl)carbonyl]-1h-pyrrol-2-yl]methylene]-2,3-dihydro-n-methyl-2-oxo-, (3z)- Chemical compound C=1C=C2NC(=O)\C(=C/C3=C(C(C(=O)N4CCN(C)CC4)=C(C)N3)C)C2=CC=1S(=O)(=O)N(C)C1=CC=CC(Cl)=C1 FPYJSJDOHRDAMT-KQWNVCNZSA-N 0.000 description 1
- CKTSBUTUHBMZGZ-SHYZEUOFSA-N 2'‐deoxycytidine Chemical class O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 CKTSBUTUHBMZGZ-SHYZEUOFSA-N 0.000 description 1
- GFMMXOIFOQCCGU-UHFFFAOYSA-N 2-(2-chloro-4-iodoanilino)-N-(cyclopropylmethoxy)-3,4-difluorobenzamide Chemical compound C=1C=C(I)C=C(Cl)C=1NC1=C(F)C(F)=CC=C1C(=O)NOCC1CC1 GFMMXOIFOQCCGU-UHFFFAOYSA-N 0.000 description 1
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 1
- 150000004046 2-(N-anilino)pyrimidines Chemical class 0.000 description 1
- PXBFMLJZNCDSMP-UHFFFAOYSA-N 2-Aminobenzamide Chemical compound NC(=O)C1=CC=CC=C1N PXBFMLJZNCDSMP-UHFFFAOYSA-N 0.000 description 1
- NZQDWKCNBOELAI-KSFYIVLOSA-N 2-[(3s,4r)-3-benzyl-4-hydroxy-3,4-dihydro-2h-chromen-7-yl]-4-(trifluoromethyl)benzoic acid Chemical compound C([C@@H]1[C@H](C2=CC=C(C=C2OC1)C=1C(=CC=C(C=1)C(F)(F)F)C(O)=O)O)C1=CC=CC=C1 NZQDWKCNBOELAI-KSFYIVLOSA-N 0.000 description 1
- PDMUGYOXRHVNMO-UHFFFAOYSA-N 2-[4-[3-(6-quinolinylmethyl)-5-triazolo[4,5-b]pyrazinyl]-1-pyrazolyl]ethanol Chemical compound C1=NN(CCO)C=C1C1=CN=C(N=NN2CC=3C=C4C=CC=NC4=CC=3)C2=N1 PDMUGYOXRHVNMO-UHFFFAOYSA-N 0.000 description 1
- FSPQCTGGIANIJZ-UHFFFAOYSA-N 2-[[(3,4-dimethoxyphenyl)-oxomethyl]amino]-4,5,6,7-tetrahydro-1-benzothiophene-3-carboxamide Chemical compound C1=C(OC)C(OC)=CC=C1C(=O)NC1=C(C(N)=O)C(CCCC2)=C2S1 FSPQCTGGIANIJZ-UHFFFAOYSA-N 0.000 description 1
- SPCKHVPPRJWQRZ-UHFFFAOYSA-N 2-benzhydryloxy-n,n-dimethylethanamine;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 SPCKHVPPRJWQRZ-UHFFFAOYSA-N 0.000 description 1
- BLRCPPIAOOGKDP-UHFFFAOYSA-N 2-benzylidene-3-hydroxybutanedinitrile Chemical class N#CC(O)C(C#N)=CC1=CC=CC=C1 BLRCPPIAOOGKDP-UHFFFAOYSA-N 0.000 description 1
- FZZMTSNZRBFGGU-UHFFFAOYSA-N 2-chloro-7-fluoroquinazolin-4-amine Chemical compound FC1=CC=C2C(N)=NC(Cl)=NC2=C1 FZZMTSNZRBFGGU-UHFFFAOYSA-N 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- CFMZSMGAMPBRBE-UHFFFAOYSA-N 2-hydroxyisoindole-1,3-dione Chemical class C1=CC=C2C(=O)N(O)C(=O)C2=C1 CFMZSMGAMPBRBE-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- ODADKLYLWWCHNB-UHFFFAOYSA-N 2R-delta-tocotrienol Natural products OC1=CC(C)=C2OC(CCC=C(C)CCC=C(C)CCC=C(C)C)(C)CCC2=C1 ODADKLYLWWCHNB-UHFFFAOYSA-N 0.000 description 1
- DDYUBCCTNHWSQM-UHFFFAOYSA-N 3-(3-cyclopentyloxy-4-methoxyphenyl)-3-(1,3-dioxoisoindol-2-yl)propanamide Chemical compound COC1=CC=C(C(CC(N)=O)N2C(C3=CC=CC=C3C2=O)=O)C=C1OC1CCCC1 DDYUBCCTNHWSQM-UHFFFAOYSA-N 0.000 description 1
- YWYUQSGYKDEAMJ-QFIPXVFZSA-N 3-[(2s)-7-[3-[2-(cyclopropylmethyl)-3-methoxy-4-(methylcarbamoyl)phenoxy]propoxy]-8-propyl-3,4-dihydro-2h-chromen-2-yl]propanoic acid Chemical compound O([C@H](CCC(O)=O)CCC=1C=C2)C=1C(CCC)=C2OCCCOC1=CC=C(C(=O)NC)C(OC)=C1CC1CC1 YWYUQSGYKDEAMJ-QFIPXVFZSA-N 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- 125000006284 3-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C(F)=C1[H])C([H])([H])* 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- QSFREBZMBNRGOK-UHFFFAOYSA-N 4-[(2,5-dihydroxyphenyl)methylamino]benzoic acid methyl ester Chemical compound C1=CC(C(=O)OC)=CC=C1NCC1=CC(O)=CC=C1O QSFREBZMBNRGOK-UHFFFAOYSA-N 0.000 description 1
- 125000000590 4-methylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- NMUSYJAQQFHJEW-UHFFFAOYSA-N 5-Azacytidine Natural products O=C1N=C(N)N=CN1C1C(O)C(O)C(CO)O1 NMUSYJAQQFHJEW-UHFFFAOYSA-N 0.000 description 1
- IHOXNOQMRZISPV-YJYMSZOUSA-N 5-[(1r)-1-hydroxy-2-[[(2r)-1-(4-methoxyphenyl)propan-2-yl]azaniumyl]ethyl]-2-oxo-1h-quinolin-8-olate Chemical compound C1=CC(OC)=CC=C1C[C@@H](C)NC[C@H](O)C1=CC=C(O)C2=C1C=CC(=O)N2 IHOXNOQMRZISPV-YJYMSZOUSA-N 0.000 description 1
- JOPSSWGWLCLPPF-RUDMXATFSA-N 5-[2-(2-carboxyethyl)-3-[(e)-6-(4-methoxyphenyl)hex-5-enoxy]phenoxy]pentanoic acid Chemical compound C1=CC(OC)=CC=C1\C=C\CCCCOC1=CC=CC(OCCCCC(O)=O)=C1CCC(O)=O JOPSSWGWLCLPPF-RUDMXATFSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- CIUKPBWULKEZMF-UHFFFAOYSA-N 6-(1-methylpyrazol-4-yl)-2-[[3-[5-(2-morpholin-4-ylethoxy)pyrimidin-2-yl]phenyl]methyl]pyridazin-3-one Chemical compound C1=NN(C)C=C1C1=NN(CC=2C=C(C=CC=2)C=2N=CC(OCCN3CCOCC3)=CN=2)C(=O)C=C1 CIUKPBWULKEZMF-UHFFFAOYSA-N 0.000 description 1
- DWHXUGDWKAIASB-CQSZACIVSA-N 6-[(1r)-1-[8-fluoro-6-(1-methylpyrazol-4-yl)-[1,2,4]triazolo[4,3-a]pyridin-3-yl]ethyl]-3-(2-methoxyethoxy)-1,6-naphthyridin-5-one Chemical compound C=1N2C([C@@H](C)N3C=CC4=NC=C(C=C4C3=O)OCCOC)=NN=C2C(F)=CC=1C=1C=NN(C)C=1 DWHXUGDWKAIASB-CQSZACIVSA-N 0.000 description 1
- PBCZSGKMGDDXIJ-HQCWYSJUSA-N 7-hydroxystaurosporine Chemical compound N([C@H](O)C1=C2C3=CC=CC=C3N3C2=C24)C(=O)C1=C2C1=CC=CC=C1N4[C@H]1C[C@@H](NC)[C@@H](OC)[C@]3(C)O1 PBCZSGKMGDDXIJ-HQCWYSJUSA-N 0.000 description 1
- PBCZSGKMGDDXIJ-UHFFFAOYSA-N 7beta-hydroxystaurosporine Natural products C12=C3N4C5=CC=CC=C5C3=C3C(O)NC(=O)C3=C2C2=CC=CC=C2N1C1CC(NC)C(OC)C4(C)O1 PBCZSGKMGDDXIJ-UHFFFAOYSA-N 0.000 description 1
- JJTNLWSCFYERCK-UHFFFAOYSA-N 7h-pyrrolo[2,3-d]pyrimidine Chemical class N1=CN=C2NC=CC2=C1 JJTNLWSCFYERCK-UHFFFAOYSA-N 0.000 description 1
- 101710168331 ALK tyrosine kinase receptor Proteins 0.000 description 1
- HEAIZQNMNCHNFD-UHFFFAOYSA-N AMG-208 Chemical compound C=1C=NC2=CC(OC)=CC=C2C=1OCC(N1N=2)=NN=C1C=CC=2C1=CC=CC=C1 HEAIZQNMNCHNFD-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 1
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 description 1
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 229940097396 Aminopeptidase inhibitor Drugs 0.000 description 1
- 102000007299 Amphiregulin Human genes 0.000 description 1
- 108010033760 Amphiregulin Proteins 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 108090000644 Angiozyme Proteins 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 101100067974 Arabidopsis thaliana POP2 gene Proteins 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 229940122815 Aromatase inhibitor Drugs 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 102100022718 Atypical chemokine receptor 2 Human genes 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- MBUVEWMHONZEQD-UHFFFAOYSA-N Azeptin Chemical compound C1CN(C)CCCC1N1C(=O)C2=CC=CC=C2C(CC=2C=CC(Cl)=CC=2)=N1 MBUVEWMHONZEQD-UHFFFAOYSA-N 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- QULDDKSCVCJTPV-UHFFFAOYSA-N BIIB021 Chemical compound COC1=C(C)C=NC(CN2C3=NC(N)=NC(Cl)=C3N=C2)=C1C QULDDKSCVCJTPV-UHFFFAOYSA-N 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 102400001242 Betacellulin Human genes 0.000 description 1
- 101800001382 Betacellulin Proteins 0.000 description 1
- 208000031648 Body Weight Changes Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000003170 Bronchiolo-Alveolar Adenocarcinoma Diseases 0.000 description 1
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 1
- 102100031172 C-C chemokine receptor type 1 Human genes 0.000 description 1
- 101710149814 C-C chemokine receptor type 1 Proteins 0.000 description 1
- 102100031151 C-C chemokine receptor type 2 Human genes 0.000 description 1
- 101710149815 C-C chemokine receptor type 2 Proteins 0.000 description 1
- 102100024167 C-C chemokine receptor type 3 Human genes 0.000 description 1
- 101710149862 C-C chemokine receptor type 3 Proteins 0.000 description 1
- 102100037853 C-C chemokine receptor type 4 Human genes 0.000 description 1
- 101710149863 C-C chemokine receptor type 4 Proteins 0.000 description 1
- 102100036302 C-C chemokine receptor type 6 Human genes 0.000 description 1
- 101710149871 C-C chemokine receptor type 6 Proteins 0.000 description 1
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 1
- 101710149858 C-C chemokine receptor type 7 Proteins 0.000 description 1
- 102100036305 C-C chemokine receptor type 8 Human genes 0.000 description 1
- 101710149872 C-C chemokine receptor type 8 Proteins 0.000 description 1
- 102100036303 C-C chemokine receptor type 9 Human genes 0.000 description 1
- 101710149857 C-C chemokine receptor type 9 Proteins 0.000 description 1
- 102100036166 C-X-C chemokine receptor type 1 Human genes 0.000 description 1
- 102100028989 C-X-C chemokine receptor type 2 Human genes 0.000 description 1
- 102100028990 C-X-C chemokine receptor type 3 Human genes 0.000 description 1
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 1
- 102100031658 C-X-C chemokine receptor type 5 Human genes 0.000 description 1
- 239000005461 Canertinib Substances 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- ZKLPARSLTMPFCP-UHFFFAOYSA-N Cetirizine Chemical compound C1CN(CCOCC(=O)O)CCN1C(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 ZKLPARSLTMPFCP-UHFFFAOYSA-N 0.000 description 1
- 102000009410 Chemokine receptor Human genes 0.000 description 1
- 108050000299 Chemokine receptor Proteins 0.000 description 1
- 229940122444 Chemokine receptor antagonist Drugs 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000000668 Chronic Pancreatitis Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- LUKZNWIVRBCLON-GXOBDPJESA-N Ciclesonide Chemical compound C1([C@H]2O[C@@]3([C@H](O2)C[C@@H]2[C@@]3(C[C@H](O)[C@@H]3[C@@]4(C)C=CC(=O)C=C4CC[C@H]32)C)C(=O)COC(=O)C(C)C)CCCCC1 LUKZNWIVRBCLON-GXOBDPJESA-N 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- OMFXVFTZEKFJBZ-UHFFFAOYSA-N Corticosterone Natural products O=C1CCC2(C)C3C(O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 OMFXVFTZEKFJBZ-UHFFFAOYSA-N 0.000 description 1
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 1
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 1
- 229940122204 Cyclooxygenase inhibitor Drugs 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- GZIFEOYASATJEH-UHFFFAOYSA-N D-delta tocopherol Natural products OC1=CC(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1 GZIFEOYASATJEH-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- 229940123736 Decarboxylase inhibitor Drugs 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 102400001329 Epiregulin Human genes 0.000 description 1
- 101800000155 Epiregulin Proteins 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- QXRSDHAAWVKZLJ-OXZHEXMSSA-N Epothilone B Natural products O=C1[C@H](C)[C@H](O)[C@@H](C)CCC[C@@]2(C)O[C@H]2C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C QXRSDHAAWVKZLJ-OXZHEXMSSA-N 0.000 description 1
- XOZIUKBZLSUILX-SDMHVBBESA-N Epothilone D Natural products O=C1[C@H](C)[C@@H](O)[C@@H](C)CCC/C(/C)=C/C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C XOZIUKBZLSUILX-SDMHVBBESA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 102000056372 ErbB-3 Receptor Human genes 0.000 description 1
- 102000044591 ErbB-4 Receptor Human genes 0.000 description 1
- 102100038595 Estrogen receptor Human genes 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- 229940124226 Farnesyltransferase inhibitor Drugs 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- RRJFVPUCXDGFJB-UHFFFAOYSA-N Fexofenadine hydrochloride Chemical compound Cl.C1=CC(C(C)(C(O)=O)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 RRJFVPUCXDGFJB-UHFFFAOYSA-N 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 108010082772 GFB 111 Proteins 0.000 description 1
- 101710113436 GTPase KRas Proteins 0.000 description 1
- 102100039788 GTPase NRas Human genes 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 150000004924 Gefitinib derivatives Chemical class 0.000 description 1
- JRZJKWGQFNTSRN-UHFFFAOYSA-N Geldanamycin Natural products C1C(C)CC(OC)C(O)C(C)C=C(C)C(OC(N)=O)C(OC)CCC=C(C)C(=O)NC2=CC(=O)C(OC)=C1C2=O JRZJKWGQFNTSRN-UHFFFAOYSA-N 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 1
- VPNYRYCIDCJBOM-UHFFFAOYSA-M Glycopyrronium bromide Chemical compound [Br-].C1[N+](C)(C)CCC1OC(=O)C(O)(C=1C=CC=CC=1)C1CCCC1 VPNYRYCIDCJBOM-UHFFFAOYSA-M 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 229920002971 Heparan sulfate Polymers 0.000 description 1
- 102100024025 Heparanase Human genes 0.000 description 1
- 229940122588 Heparanase inhibitor Drugs 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 102400001369 Heparin-binding EGF-like growth factor Human genes 0.000 description 1
- 101800001649 Heparin-binding EGF-like growth factor Proteins 0.000 description 1
- 208000027927 Hereditary papillary renal cell carcinoma Diseases 0.000 description 1
- 101000600756 Homo sapiens 3-phosphoinositide-dependent protein kinase 1 Proteins 0.000 description 1
- 101000678892 Homo sapiens Atypical chemokine receptor 2 Proteins 0.000 description 1
- 101000777558 Homo sapiens C-C chemokine receptor type 10 Proteins 0.000 description 1
- 101000947174 Homo sapiens C-X-C chemokine receptor type 1 Proteins 0.000 description 1
- 101000916050 Homo sapiens C-X-C chemokine receptor type 3 Proteins 0.000 description 1
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 1
- 101000922405 Homo sapiens C-X-C chemokine receptor type 5 Proteins 0.000 description 1
- 101100118549 Homo sapiens EGFR gene Proteins 0.000 description 1
- 101000744505 Homo sapiens GTPase NRas Proteins 0.000 description 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 description 1
- 101000624643 Homo sapiens M-phase inducer phosphatase 3 Proteins 0.000 description 1
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 description 1
- 101000580039 Homo sapiens Ras-specific guanine nucleotide-releasing factor 1 Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- 101001117146 Homo sapiens [Pyruvate dehydrogenase (acetyl-transferring)] kinase isozyme 1, mitochondrial Proteins 0.000 description 1
- SHBUUTHKGIVMJT-UHFFFAOYSA-N Hydroxystearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OO SHBUUTHKGIVMJT-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108010018951 Interleukin-8B Receptors Proteins 0.000 description 1
- 208000005016 Intestinal Neoplasms Diseases 0.000 description 1
- 241000764238 Isis Species 0.000 description 1
- PWWVAXIEGOYWEE-UHFFFAOYSA-N Isophenergan Chemical compound C1=CC=C2N(CC(C)N(C)C)C3=CC=CC=C3SC2=C1 PWWVAXIEGOYWEE-UHFFFAOYSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002176 L01XE26 - Cabozantinib Substances 0.000 description 1
- UCEQXRCJXIVODC-PMACEKPBSA-N LSM-1131 Chemical compound C1CCC2=CC=CC3=C2N1C=C3[C@@H]1C(=O)NC(=O)[C@H]1C1=CNC2=CC=CC=C12 UCEQXRCJXIVODC-PMACEKPBSA-N 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 206010024641 Listeriosis Diseases 0.000 description 1
- 102100023330 M-phase inducer phosphatase 3 Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 229940124647 MEK inhibitor Drugs 0.000 description 1
- 101150105382 MET gene Proteins 0.000 description 1
- 229940124761 MMP inhibitor Drugs 0.000 description 1
- 229920004011 Macrolon® Polymers 0.000 description 1
- 102100034184 Macrophage scavenger receptor types I and II Human genes 0.000 description 1
- 101710134306 Macrophage scavenger receptor types I and II Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102100027754 Mast/stem cell growth factor receptor Kit Human genes 0.000 description 1
- 101710087603 Mast/stem cell growth factor receptor Kit Proteins 0.000 description 1
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 1
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 1
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 1
- PVLJETXTTWAYEW-UHFFFAOYSA-N Mizolastine Chemical compound N=1C=CC(=O)NC=1N(C)C(CC1)CCN1C1=NC2=CC=CC=C2N1CC1=CC=C(F)C=C1 PVLJETXTTWAYEW-UHFFFAOYSA-N 0.000 description 1
- UCHDWCPVSPXUMX-TZIWLTJVSA-N Montelukast Chemical compound CC(C)(O)C1=CC=CC=C1CC[C@H](C=1C=C(\C=C\C=2N=C3C=C(Cl)C=CC3=CC=2)C=CC=1)SCC1(CC(O)=O)CC1 UCHDWCPVSPXUMX-TZIWLTJVSA-N 0.000 description 1
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- VNBRGSXVFBYQNN-UHFFFAOYSA-N N-[4-[(2-amino-3-chloro-4-pyridinyl)oxy]-3-fluorophenyl]-4-ethoxy-1-(4-fluorophenyl)-2-oxo-3-pyridinecarboxamide Chemical compound O=C1C(C(=O)NC=2C=C(F)C(OC=3C(=C(N)N=CC=3)Cl)=CC=2)=C(OCC)C=CN1C1=CC=C(F)C=C1 VNBRGSXVFBYQNN-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-UHFFFAOYSA-N N-[4-cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methylpropanamide Chemical compound C=1C=C(C#N)C(C(F)(F)F)=CC=1NC(=O)C(O)(C)CS(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- 125000004633 N-oxo-pyridyl group Chemical group 0.000 description 1
- JAUOIFJMECXRGI-UHFFFAOYSA-N Neoclaritin Chemical compound C=1C(Cl)=CC=C2C=1CCC1=CC=CN=C1C2=C1CCNCC1 JAUOIFJMECXRGI-UHFFFAOYSA-N 0.000 description 1
- MSHZHSPISPJWHW-UHFFFAOYSA-N O-(chloroacetylcarbamoyl)fumagillol Chemical compound O1C(CC=C(C)C)C1(C)C1C(OC)C(OC(=O)NC(=O)CCl)CCC21CO2 MSHZHSPISPJWHW-UHFFFAOYSA-N 0.000 description 1
- MBJMCOJMDMARNB-UHFFFAOYSA-N O.O.O.O.[Na].[Na].OP(O)(=O)C(Cl)(Cl)P(O)(O)=O Chemical compound O.O.O.O.[Na].[Na].OP(O)(=O)C(Cl)(Cl)P(O)(O)=O MBJMCOJMDMARNB-UHFFFAOYSA-N 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- 206010033647 Pancreatitis acute Diseases 0.000 description 1
- 206010033649 Pancreatitis chronic Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229940123932 Phosphodiesterase 4 inhibitor Drugs 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 229920002556 Polyethylene Glycol 300 Polymers 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 1
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 102000052575 Proto-Oncogene Human genes 0.000 description 1
- 108700020978 Proto-Oncogene Proteins 0.000 description 1
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108091005682 Receptor kinases Proteins 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 101710151245 Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 229940123934 Reductase inhibitor Drugs 0.000 description 1
- 241000219061 Rheum Species 0.000 description 1
- 102000000505 Ribonucleotide Reductases Human genes 0.000 description 1
- 108010041388 Ribonucleotide Reductases Proteins 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- IIDJRNMFWXDHID-UHFFFAOYSA-N Risedronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CC1=CC=CN=C1 IIDJRNMFWXDHID-UHFFFAOYSA-N 0.000 description 1
- 101100123851 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) HER1 gene Proteins 0.000 description 1
- 229940124639 Selective inhibitor Drugs 0.000 description 1
- GIIZNNXWQWCKIB-UHFFFAOYSA-N Serevent Chemical compound C1=C(O)C(CO)=CC(C(O)CNCCCCCCOCCCCC=2C=CC=CC=2)=C1 GIIZNNXWQWCKIB-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 108091027967 Small hairpin RNA Proteins 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 102000004584 Somatomedin Receptors Human genes 0.000 description 1
- 108010017622 Somatomedin Receptors Proteins 0.000 description 1
- 108050001286 Somatostatin Receptor Proteins 0.000 description 1
- 102000011096 Somatostatin receptor Human genes 0.000 description 1
- 229940121856 Somatostatin receptor antagonist Drugs 0.000 description 1
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- JXAGDPXECXQWBC-LJQANCHMSA-N Tanomastat Chemical compound C([C@H](C(=O)O)CC(=O)C=1C=CC(=CC=1)C=1C=CC(Cl)=CC=1)SC1=CC=CC=C1 JXAGDPXECXQWBC-LJQANCHMSA-N 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- 229940123582 Telomerase inhibitor Drugs 0.000 description 1
- 108091033399 Telomestatin Proteins 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 208000033781 Thyroid carcinoma Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- DKJJVAGXPKPDRL-UHFFFAOYSA-N Tiludronic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)SC1=CC=C(Cl)C=C1 DKJJVAGXPKPDRL-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 1
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 1
- 102100037236 Tyrosine-protein kinase receptor UFO Human genes 0.000 description 1
- 102400000757 Ubiquitin Human genes 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 description 1
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 description 1
- 229940122803 Vinca alkaloid Drugs 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- YEEZWCHGZNKEEK-UHFFFAOYSA-N Zafirlukast Chemical compound COC1=CC(C(=O)NS(=O)(=O)C=2C(=CC=CC=2)C)=CC=C1CC(C1=C2)=CN(C)C1=CC=C2NC(=O)OC1CCCC1 YEEZWCHGZNKEEK-UHFFFAOYSA-N 0.000 description 1
- YPFLFUJKZDAXRA-UHFFFAOYSA-N [3-(carbamoylamino)-2-(2,4-dichlorobenzoyl)-1-benzofuran-6-yl] methanesulfonate Chemical compound O1C2=CC(OS(=O)(=O)C)=CC=C2C(NC(N)=O)=C1C(=O)C1=CC=C(Cl)C=C1Cl YPFLFUJKZDAXRA-UHFFFAOYSA-N 0.000 description 1
- 102100024148 [Pyruvate dehydrogenase (acetyl-transferring)] kinase isozyme 1, mitochondrial Human genes 0.000 description 1
- AIWRTTMUVOZGPW-HSPKUQOVSA-N abarelix Chemical compound C([C@@H](C(=O)N[C@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)N(C)C(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 AIWRTTMUVOZGPW-HSPKUQOVSA-N 0.000 description 1
- 229960002184 abarelix Drugs 0.000 description 1
- 108010023617 abarelix Proteins 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 201000003229 acute pancreatitis Diseases 0.000 description 1
- 125000004442 acylamino group Chemical group 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 239000000048 adrenergic agonist Substances 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 201000006966 adult T-cell leukemia Diseases 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 238000003349 alamar blue assay Methods 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000005115 alkyl carbamoyl group Chemical group 0.000 description 1
- 125000004687 alkyl sulfinyl alkyl group Chemical group 0.000 description 1
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 1
- 125000004688 alkyl sulfonyl alkyl group Chemical group 0.000 description 1
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium chloride Substances Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229940009868 aluminum magnesium silicate Drugs 0.000 description 1
- WMGSQTMJHBYJMQ-UHFFFAOYSA-N aluminum;magnesium;silicate Chemical compound [Mg+2].[Al+3].[O-][Si]([O-])([O-])[O-] WMGSQTMJHBYJMQ-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- AEMFNILZOJDQLW-QAGGRKNESA-N androst-4-ene-3,17-dione Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 AEMFNILZOJDQLW-QAGGRKNESA-N 0.000 description 1
- 229960005471 androstenedione Drugs 0.000 description 1
- AEMFNILZOJDQLW-UHFFFAOYSA-N androstenedione Natural products O=C1CCC2(C)C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 AEMFNILZOJDQLW-UHFFFAOYSA-N 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- PYKYMHQGRFAEBM-UHFFFAOYSA-N anthraquinone Natural products CCC(=O)c1c(O)c2C(=O)C3C(C=CC=C3O)C(=O)c2cc1CC(=O)OC PYKYMHQGRFAEBM-UHFFFAOYSA-N 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940124650 anti-cancer therapies Drugs 0.000 description 1
- 230000001078 anti-cholinergic effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 230000002001 anti-metastasis Effects 0.000 description 1
- 230000001022 anti-muscarinic effect Effects 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000008209 arabinosides Chemical class 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 229950004810 atamestane Drugs 0.000 description 1
- PEPMWUSGRKINHX-TXTPUJOMSA-N atamestane Chemical compound C1C[C@@H]2[C@@]3(C)C(C)=CC(=O)C=C3CC[C@H]2[C@@H]2CCC(=O)[C@]21C PEPMWUSGRKINHX-TXTPUJOMSA-N 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 108010023337 axl receptor tyrosine kinase Proteins 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 229960004574 azelastine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 125000000043 benzamido group Chemical group [H]N([*])C(=O)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- BNBQRQQYDMDJAH-UHFFFAOYSA-N benzodioxan Chemical compound C1=CC=C2OCCOC2=C1 BNBQRQQYDMDJAH-UHFFFAOYSA-N 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 238000010256 biochemical assay Methods 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 201000001531 bladder carcinoma Diseases 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000004579 body weight change Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- MJQUEDHRCUIRLF-TVIXENOKSA-N bryostatin 1 Chemical compound C([C@@H]1CC(/[C@@H]([C@@](C(C)(C)/C=C/2)(O)O1)OC(=O)/C=C/C=C/CCC)=C\C(=O)OC)[C@H]([C@@H](C)O)OC(=O)C[C@H](O)C[C@@H](O1)C[C@H](OC(C)=O)C(C)(C)[C@]1(O)C[C@@H]1C\C(=C\C(=O)OC)C[C@H]\2O1 MJQUEDHRCUIRLF-TVIXENOKSA-N 0.000 description 1
- 229960005539 bryostatin 1 Drugs 0.000 description 1
- 229960004436 budesonide Drugs 0.000 description 1
- 239000000337 buffer salt Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960001292 cabozantinib Drugs 0.000 description 1
- ONIQOQHATWINJY-UHFFFAOYSA-N cabozantinib Chemical compound C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 ONIQOQHATWINJY-UHFFFAOYSA-N 0.000 description 1
- HFCFMRYTXDINDK-WNQIDUERSA-N cabozantinib malate Chemical compound OC(=O)[C@@H](O)CC(O)=O.C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 HFCFMRYTXDINDK-WNQIDUERSA-N 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 208000025188 carcinoma of pharynx Diseases 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 229940047495 celebrex Drugs 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 229960004342 cetirizine hydrochloride Drugs 0.000 description 1
- CFBUZOUXXHZCFB-OYOVHJISSA-N chembl511115 Chemical compound COC1=CC=C([C@@]2(CC[C@H](CC2)C(O)=O)C#N)C=C1OC1CCCC1 CFBUZOUXXHZCFB-OYOVHJISSA-N 0.000 description 1
- ZGHQGWOETPXKLY-XVNBXDOJSA-N chembl77030 Chemical compound NC(=S)C(\C#N)=C\C1=CC=C(O)C(O)=C1 ZGHQGWOETPXKLY-XVNBXDOJSA-N 0.000 description 1
- 239000002559 chemokine receptor antagonist Substances 0.000 description 1
- 230000002113 chemopreventative effect Effects 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- ZPEIMTDSQAKGNT-UHFFFAOYSA-N chlorpromazine Chemical compound C1=C(Cl)C=C2N(CCCN(C)C)C3=CC=CC=C3SC2=C1 ZPEIMTDSQAKGNT-UHFFFAOYSA-N 0.000 description 1
- 229960001076 chlorpromazine Drugs 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 230000008711 chromosomal rearrangement Effects 0.000 description 1
- 229960003728 ciclesonide Drugs 0.000 description 1
- 229950001653 cilomilast Drugs 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 229960002689 clemastine fumarate Drugs 0.000 description 1
- 229960002286 clodronic acid Drugs 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 230000007748 combinatorial effect Effects 0.000 description 1
- 230000001447 compensatory effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 230000006552 constitutive activation Effects 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- OMFXVFTZEKFJBZ-HJTSIMOOSA-N corticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OMFXVFTZEKFJBZ-HJTSIMOOSA-N 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 229960005061 crizotinib Drugs 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 239000002875 cyclin dependent kinase inhibitor Substances 0.000 description 1
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 1
- 125000000000 cycloalkoxy group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000002188 cycloheptatrienyl group Chemical group C1(=CC=CC=CC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- ZESRJSPZRDMNHY-UHFFFAOYSA-N de-oxy corticosterone Natural products O=C1CCC2(C)C3CCC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 ZESRJSPZRDMNHY-UHFFFAOYSA-N 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 235000010389 delta-tocopherol Nutrition 0.000 description 1
- BTNBMQIHCRIGOU-UHFFFAOYSA-N delta-tocotrienol Natural products CC(=CCCC(=CCCC(=CCCOC1(C)CCc2cc(O)cc(C)c2O1)C)C)C BTNBMQIHCRIGOU-UHFFFAOYSA-N 0.000 description 1
- 229960003654 desoxycortone Drugs 0.000 description 1
- XOZIUKBZLSUILX-UHFFFAOYSA-N desoxyepothilone B Natural products O1C(=O)CC(O)C(C)(C)C(=O)C(C)C(O)C(C)CCCC(C)=CCC1C(C)=CC1=CSC(C)=N1 XOZIUKBZLSUILX-UHFFFAOYSA-N 0.000 description 1
- 230000000368 destabilizing effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- OTKJDMGTUTTYMP-UHFFFAOYSA-N dihydrosphingosine Natural products CCCCCCCCCCCCCCCC(O)C(N)CO OTKJDMGTUTTYMP-UHFFFAOYSA-N 0.000 description 1
- 229960000525 diphenhydramine hydrochloride Drugs 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000009513 drug distribution Methods 0.000 description 1
- 229940112141 dry powder inhaler Drugs 0.000 description 1
- 229960001971 ebastine Drugs 0.000 description 1
- MJJALKDDGIKVBE-UHFFFAOYSA-N ebastine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)CCCN1CCC(OC(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 MJJALKDDGIKVBE-UHFFFAOYSA-N 0.000 description 1
- FSIRXIHZBIXHKT-MHTVFEQDSA-N edatrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CC(CC)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FSIRXIHZBIXHKT-MHTVFEQDSA-N 0.000 description 1
- 229950006700 edatrexate Drugs 0.000 description 1
- 230000002888 effect on disease Effects 0.000 description 1
- 230000005670 electromagnetic radiation Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- INVTYAOGFAGBOE-UHFFFAOYSA-N entinostat Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC(=O)OCC1=CC=CN=C1 INVTYAOGFAGBOE-UHFFFAOYSA-N 0.000 description 1
- 230000029578 entry into host Effects 0.000 description 1
- 108060002566 ephrin Proteins 0.000 description 1
- 102000012803 ephrin Human genes 0.000 description 1
- 229960003449 epinastine Drugs 0.000 description 1
- WHWZLSFABNNENI-UHFFFAOYSA-N epinastine Chemical compound C1C2=CC=CC=C2C2CN=C(N)N2C2=CC=CC=C21 WHWZLSFABNNENI-UHFFFAOYSA-N 0.000 description 1
- YJGVMLPVUAXIQN-UHFFFAOYSA-N epipodophyllotoxin Natural products COC1=C(OC)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YJGVMLPVUAXIQN-UHFFFAOYSA-N 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- HESCAJZNRMSMJG-HGYUPSKWSA-N epothilone A Natural products O=C1[C@H](C)[C@H](O)[C@H](C)CCC[C@H]2O[C@H]2C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C HESCAJZNRMSMJG-HGYUPSKWSA-N 0.000 description 1
- QXRSDHAAWVKZLJ-PVYNADRNSA-N epothilone B Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 QXRSDHAAWVKZLJ-PVYNADRNSA-N 0.000 description 1
- XOZIUKBZLSUILX-GIQCAXHBSA-N epothilone D Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](C)[C@@H](O)[C@@H](C)CCC\C(C)=C/C[C@H]1C(\C)=C\C1=CSC(C)=N1 XOZIUKBZLSUILX-GIQCAXHBSA-N 0.000 description 1
- 150000003883 epothilone derivatives Chemical class 0.000 description 1
- GTTBEUCJPZQMDZ-UHFFFAOYSA-N erlotinib hydrochloride Chemical compound [H+].[Cl-].C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 GTTBEUCJPZQMDZ-UHFFFAOYSA-N 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 108010038795 estrogen receptors Proteins 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- SBVYURPQULDJTI-UHFFFAOYSA-N ethyl n-[amino-[4-[[3-[[4-[2-(4-hydroxyphenyl)propan-2-yl]phenoxy]methyl]phenyl]methoxy]phenyl]methylidene]carbamate Chemical compound C1=CC(C(=N)NC(=O)OCC)=CC=C1OCC1=CC=CC(COC=2C=CC(=CC=2)C(C)(C)C=2C=CC(O)=CC=2)=C1 SBVYURPQULDJTI-UHFFFAOYSA-N 0.000 description 1
- 125000000219 ethylidene group Chemical group [H]C(=[*])C([H])([H])[H] 0.000 description 1
- 229960004945 etoricoxib Drugs 0.000 description 1
- MNJVRJDLRVPLFE-UHFFFAOYSA-N etoricoxib Chemical compound C1=NC(C)=CC=C1C1=NC=C(Cl)C=C1C1=CC=C(S(C)(=O)=O)C=C1 MNJVRJDLRVPLFE-UHFFFAOYSA-N 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 229960001022 fenoterol Drugs 0.000 description 1
- LSLYOANBFKQKPT-UHFFFAOYSA-N fenoterol Chemical compound C=1C(O)=CC(O)=CC=1C(O)CNC(C)CC1=CC=C(O)C=C1 LSLYOANBFKQKPT-UHFFFAOYSA-N 0.000 description 1
- 229960000354 fexofenadine hydrochloride Drugs 0.000 description 1
- 229960000556 fingolimod Drugs 0.000 description 1
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229960000289 fluticasone propionate Drugs 0.000 description 1
- WMWTYOKRWGGJOA-CENSZEJFSA-N fluticasone propionate Chemical compound C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@@H](C)[C@@](C(=O)SCF)(OC(=O)CC)[C@@]2(C)C[C@@H]1O WMWTYOKRWGGJOA-CENSZEJFSA-N 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 229950008692 foretinib Drugs 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- 229960002848 formoterol Drugs 0.000 description 1
- BPZSYCZIITTYBL-UHFFFAOYSA-N formoterol Chemical compound C1=CC(OC)=CC=C1CC(C)NCC(O)C1=CC=C(O)C(NC=O)=C1 BPZSYCZIITTYBL-UHFFFAOYSA-N 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- OTXNTMVVOOBZCV-YMCDKREISA-N gamma-Tocotrienol Natural products Oc1c(C)c(C)c2O[C@@](CC/C=C(\CC/C=C(\CC/C=C(\C)/C)/C)/C)(C)CCc2c1 OTXNTMVVOOBZCV-YMCDKREISA-N 0.000 description 1
- 235000010382 gamma-tocopherol Nutrition 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- UIVFUQKYVFCEKJ-OPTOVBNMSA-N gimatecan Chemical compound C1=CC=C2C(\C=N\OC(C)(C)C)=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UIVFUQKYVFCEKJ-OPTOVBNMSA-N 0.000 description 1
- 229950009073 gimatecan Drugs 0.000 description 1
- 229940080856 gleevec Drugs 0.000 description 1
- 229950007540 glesatinib Drugs 0.000 description 1
- 229940084910 gliadel Drugs 0.000 description 1
- 229940124750 glucocorticoid receptor agonist Drugs 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 229940015042 glycopyrrolate Drugs 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 229960003690 goserelin acetate Drugs 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000009033 hematopoietic malignancy Effects 0.000 description 1
- 108010037536 heparanase Proteins 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 102000057308 human HGF Human genes 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 229940072106 hydroxystearate Drugs 0.000 description 1
- 230000037417 hyperactivation Effects 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 229960003685 imatinib mesylate Drugs 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000000814 indol-3-yl group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C([*])C2=C1[H] 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 229960001361 ipratropium bromide Drugs 0.000 description 1
- KEWHKYJURDBRMN-ZEODDXGYSA-M ipratropium bromide hydrate Chemical compound O.[Br-].O([C@H]1C[C@H]2CC[C@@H](C1)[N@@+]2(C)C(C)C)C(=O)C(CO)C1=CC=CC=C1 KEWHKYJURDBRMN-ZEODDXGYSA-M 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000004628 isothiazolidinyl group Chemical group S1N(CCC1)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 229960004125 ketoconazole Drugs 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 238000000021 kinase assay Methods 0.000 description 1
- 238000010983 kinetics study Methods 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 230000006651 lactation Effects 0.000 description 1
- 208000003849 large cell carcinoma Diseases 0.000 description 1
- 230000002045 lasting effect Effects 0.000 description 1
- VHOGYURTWQBHIL-UHFFFAOYSA-N leflunomide Chemical compound O1N=CC(C(=O)NC=2C=CC(=CC=2)C(F)(F)F)=C1C VHOGYURTWQBHIL-UHFFFAOYSA-N 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- VNYSSYRCGWBHLG-AMOLWHMGSA-N leukotriene B4 Chemical compound CCCCC\C=C/C[C@@H](O)\C=C\C=C\C=C/[C@@H](O)CCCC(O)=O VNYSSYRCGWBHLG-AMOLWHMGSA-N 0.000 description 1
- YEESKJGWJFYOOK-IJHYULJSSA-N leukotriene D4 Chemical compound CCCCC\C=C/C\C=C/C=C/C=C/[C@H]([C@@H](O)CCCC(O)=O)SC[C@H](N)C(=O)NCC(O)=O YEESKJGWJFYOOK-IJHYULJSSA-N 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 238000012153 long-term therapy Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 229950005069 luminespib Drugs 0.000 description 1
- 229960000994 lumiracoxib Drugs 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- OCSMOTCMPXTDND-OUAUKWLOSA-N marimastat Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)[C@H](O)C(=O)NO OCSMOTCMPXTDND-OUAUKWLOSA-N 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229940121386 matrix metalloproteinase inhibitor Drugs 0.000 description 1
- 239000003771 matrix metalloproteinase inhibitor Substances 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- LMOINURANNBYCM-UHFFFAOYSA-N metaproterenol Chemical compound CC(C)NCC(O)C1=CC(O)=CC(O)=C1 LMOINURANNBYCM-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- VMVNZNXAVJHNDJ-UHFFFAOYSA-N methyl 2,2,2-trifluoroacetate Chemical compound COC(=O)C(F)(F)F VMVNZNXAVJHNDJ-UHFFFAOYSA-N 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 229960001144 mizolastine Drugs 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 229960002744 mometasone furoate Drugs 0.000 description 1
- WOFMFGQZHJDGCX-ZULDAHANSA-N mometasone furoate Chemical compound O([C@]1([C@@]2(C)C[C@H](O)[C@]3(Cl)[C@@]4(C)C=CC(=O)C=C4CC[C@H]3[C@@H]2C[C@H]1C)C(=O)CCl)C(=O)C1=CC=CO1 WOFMFGQZHJDGCX-ZULDAHANSA-N 0.000 description 1
- VYGYNVZNSSTDLJ-HKCOAVLJSA-N monorden Natural products CC1CC2OC2C=C/C=C/C(=O)CC3C(C(=CC(=C3Cl)O)O)C(=O)O1 VYGYNVZNSSTDLJ-HKCOAVLJSA-N 0.000 description 1
- 229960005127 montelukast Drugs 0.000 description 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- NPGREARFJMFTDF-UHFFFAOYSA-N n-(3,5-dichloro-1-hydroxypyridin-4-ylidene)-8-methoxy-2-(trifluoromethyl)quinoline-5-carboxamide Chemical compound C12=CC=C(C(F)(F)F)N=C2C(OC)=CC=C1C(=O)N=C1C(Cl)=CN(O)C=C1Cl NPGREARFJMFTDF-UHFFFAOYSA-N 0.000 description 1
- DPHDSIQHVGSITN-UHFFFAOYSA-N n-(3,5-dichloropyridin-4-yl)-2-[1-[(4-fluorophenyl)methyl]-5-hydroxyindol-3-yl]-2-oxoacetamide Chemical compound C1=C(C(=O)C(=O)NC=2C(=CN=CC=2Cl)Cl)C2=CC(O)=CC=C2N1CC1=CC=C(F)C=C1 DPHDSIQHVGSITN-UHFFFAOYSA-N 0.000 description 1
- BLCLNMBMMGCOAS-UHFFFAOYSA-N n-[1-[[1-[[1-[[1-[[1-[[1-[[1-[2-[(carbamoylamino)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amin Chemical compound C1CCC(C(=O)NNC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)C(COC(C)(C)C)NC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 BLCLNMBMMGCOAS-UHFFFAOYSA-N 0.000 description 1
- YRCHYHRCBXNYNU-UHFFFAOYSA-N n-[[3-fluoro-4-[2-[5-[(2-methoxyethylamino)methyl]pyridin-2-yl]thieno[3,2-b]pyridin-7-yl]oxyphenyl]carbamothioyl]-2-(4-fluorophenyl)acetamide Chemical compound N1=CC(CNCCOC)=CC=C1C1=CC2=NC=CC(OC=3C(=CC(NC(=S)NC(=O)CC=4C=CC(F)=CC=4)=CC=3)F)=C2S1 YRCHYHRCBXNYNU-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- XGXNTJHZPBRBHJ-UHFFFAOYSA-N n-phenylpyrimidin-2-amine Chemical class N=1C=CC=NC=1NC1=CC=CC=C1 XGXNTJHZPBRBHJ-UHFFFAOYSA-N 0.000 description 1
- 125000003506 n-propoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005893 naphthalimidyl group Chemical group 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 210000001989 nasopharynx Anatomy 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 230000012106 negative regulation of microtubule depolymerization Effects 0.000 description 1
- 229950010159 nemorubicin Drugs 0.000 description 1
- CTMCWCONSULRHO-UHQPFXKFSA-N nemorubicin Chemical compound C1CO[C@H](OC)CN1[C@@H]1[C@H](O)[C@H](C)O[C@@H](O[C@@H]2C3=C(O)C=4C(=O)C5=C(OC)C=CC=C5C(=O)C=4C(O)=C3C[C@](O)(C2)C(=O)CO)C1 CTMCWCONSULRHO-UHQPFXKFSA-N 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 229950008835 neratinib Drugs 0.000 description 1
- JWNPDZNEKVCWMY-VQHVLOKHSA-N neratinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 JWNPDZNEKVCWMY-VQHVLOKHSA-N 0.000 description 1
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- QNDVLZJODHBUFM-WFXQOWMNSA-N okadaic acid Chemical compound C([C@H](O1)[C@H](C)/C=C/[C@H]2CC[C@@]3(CC[C@H]4O[C@@H](C([C@@H](O)[C@@H]4O3)=C)[C@@H](O)C[C@H](C)[C@@H]3[C@@H](CC[C@@]4(OCCCC4)O3)C)O2)C(C)=C[C@]21O[C@H](C[C@@](C)(O)C(O)=O)CC[C@H]2O QNDVLZJODHBUFM-WFXQOWMNSA-N 0.000 description 1
- VEFJHAYOIAAXEU-UHFFFAOYSA-N okadaic acid Natural products CC(CC(O)C1OC2CCC3(CCC(O3)C=CC(C)C4CC(=CC5(OC(CC(C)(O)C(=O)O)CCC5O)O4)C)OC2C(O)C1C)C6OC7(CCCCO7)CCC6C VEFJHAYOIAAXEU-UHFFFAOYSA-N 0.000 description 1
- 210000004248 oligodendroglia Anatomy 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 229950000846 onartuzumab Drugs 0.000 description 1
- 230000006548 oncogenic transformation Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 229960002657 orciprenaline Drugs 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- NVOYVOBDTVTBDX-PMEUIYRNSA-N oxitropium Chemical compound CC[N+]1(C)[C@H]2C[C@@H](C[C@@H]1[C@H]1O[C@@H]21)OC(=O)[C@H](CO)C1=CC=CC=C1 NVOYVOBDTVTBDX-PMEUIYRNSA-N 0.000 description 1
- 229960000797 oxitropium Drugs 0.000 description 1
- 125000005429 oxyalkyl group Chemical group 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 238000007427 paired t-test Methods 0.000 description 1
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 108700017947 pasireotide Proteins 0.000 description 1
- 229960005415 pasireotide Drugs 0.000 description 1
- NEEFMPSSNFRRNC-HQUONIRXSA-N pasireotide aspartate Chemical compound OC(=O)[C@@H](N)CC(O)=O.OC(=O)[C@@H](N)CC(O)=O.C([C@H]1C(=O)N2C[C@@H](C[C@H]2C(=O)N[C@H](C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@H](C(N[C@@H](CC=2C=CC(OCC=3C=CC=CC=3)=CC=2)C(=O)N1)=O)CCCCN)C=1C=CC=CC=1)OC(=O)NCCN)C1=CC=CC=C1 NEEFMPSSNFRRNC-HQUONIRXSA-N 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 201000002689 pediatric hepatocellular carcinoma Diseases 0.000 description 1
- WVUNYSQLFKLYNI-AATRIKPKSA-N pelitinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC1=CC=C(F)C(Cl)=C1 WVUNYSQLFKLYNI-AATRIKPKSA-N 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- XDRYMKDFEDOLFX-UHFFFAOYSA-N pentamidine Chemical compound C1=CC(C(=N)N)=CC=C1OCCCCCOC1=CC=C(C(N)=N)C=C1 XDRYMKDFEDOLFX-UHFFFAOYSA-N 0.000 description 1
- 229960004448 pentamidine Drugs 0.000 description 1
- YWAKXRMUMFPDSH-UHFFFAOYSA-N pentene Chemical compound CCCC=C YWAKXRMUMFPDSH-UHFFFAOYSA-N 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 125000005010 perfluoroalkyl group Chemical group 0.000 description 1
- SZFPYBIJACMNJV-UHFFFAOYSA-N perifosine Chemical compound CCCCCCCCCCCCCCCCCCOP([O-])(=O)OC1CC[N+](C)(C)CC1 SZFPYBIJACMNJV-UHFFFAOYSA-N 0.000 description 1
- 229950010632 perifosine Drugs 0.000 description 1
- 229940021222 peritoneal dialysis isotonic solution Drugs 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 230000002974 pharmacogenomic effect Effects 0.000 description 1
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 125000003356 phenylsulfanyl group Chemical group [*]SC1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- 239000002587 phosphodiesterase IV inhibitor Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000005545 phthalimidyl group Chemical group 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000004194 piperazin-1-yl group Chemical group [H]N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 150000003058 platinum compounds Chemical class 0.000 description 1
- 229960001237 podophyllotoxin Drugs 0.000 description 1
- YJGVMLPVUAXIQN-XVVDYKMHSA-N podophyllotoxin Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@H](O)[C@@H]3[C@@H]2C(OC3)=O)=C1 YJGVMLPVUAXIQN-XVVDYKMHSA-N 0.000 description 1
- YVCVYCSAAZQOJI-UHFFFAOYSA-N podophyllotoxin Natural products COC1=C(O)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YVCVYCSAAZQOJI-UHFFFAOYSA-N 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 229960002288 procaterol Drugs 0.000 description 1
- FKNXQNWAXFXVNW-BLLLJJGKSA-N procaterol Chemical compound N1C(=O)C=CC2=C1C(O)=CC=C2[C@@H](O)[C@@H](NC(C)C)CC FKNXQNWAXFXVNW-BLLLJJGKSA-N 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 229960003910 promethazine Drugs 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 150000003834 purine nucleoside derivatives Chemical class 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 1
- 239000002718 pyrimidine nucleoside Substances 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- CZAAKPFIWJXPQT-UHFFFAOYSA-N quinazolin-2-amine Chemical class C1=CC=CC2=NC(N)=NC=C21 CZAAKPFIWJXPQT-UHFFFAOYSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical class N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 239000002534 radiation-sensitizing agent Substances 0.000 description 1
- AECPBJMOGBFQDN-YMYQVXQQSA-N radicicol Chemical compound C1CCCC(=O)C[C@H]2[C@H](Cl)C(=O)CC(=O)[C@H]2C(=O)O[C@H](C)C[C@H]2O[C@@H]21 AECPBJMOGBFQDN-YMYQVXQQSA-N 0.000 description 1
- 229930192524 radicicol Natural products 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- BKXVVCILCIUCLG-UHFFFAOYSA-N raloxifene hydrochloride Chemical compound [H+].[Cl-].C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 BKXVVCILCIUCLG-UHFFFAOYSA-N 0.000 description 1
- 229960002119 raloxifene hydrochloride Drugs 0.000 description 1
- 229940099538 rapamune Drugs 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 201000002793 renal fibrosis Diseases 0.000 description 1
- OAKGNIRUXAZDQF-TXHRRWQRSA-N retaspimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(O)C1=CC(O)=C2NCC=C OAKGNIRUXAZDQF-TXHRRWQRSA-N 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 229960000759 risedronic acid Drugs 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- MNDBXUUTURYVHR-UHFFFAOYSA-N roflumilast Chemical compound FC(F)OC1=CC=C(C(=O)NC=2C(=CN=CC=2Cl)Cl)C=C1OCC1CC1 MNDBXUUTURYVHR-UHFFFAOYSA-N 0.000 description 1
- 229960002586 roflumilast Drugs 0.000 description 1
- 229950005230 rogletimide Drugs 0.000 description 1
- VHXNKPBCCMUMSW-FQEVSTJZSA-N rubitecan Chemical compound C1=CC([N+]([O-])=O)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VHXNKPBCCMUMSW-FQEVSTJZSA-N 0.000 description 1
- 229950009213 rubitecan Drugs 0.000 description 1
- 229950008902 safingol Drugs 0.000 description 1
- 229960004017 salmeterol Drugs 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229950003647 semaxanib Drugs 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- MFBOGIVSZKQAPD-UHFFFAOYSA-M sodium butyrate Chemical compound [Na+].CCCC([O-])=O MFBOGIVSZKQAPD-UHFFFAOYSA-M 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- OTKJDMGTUTTYMP-ZWKOTPCHSA-N sphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@@H](N)CO OTKJDMGTUTTYMP-ZWKOTPCHSA-N 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 125000004089 sulfido group Chemical group [S-]* 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000003319 supportive effect Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000007761 synergistic anti-cancer Effects 0.000 description 1
- 206010042863 synovial sarcoma Diseases 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- UXXQOJXBIDBUAC-UHFFFAOYSA-N tandutinib Chemical compound COC1=CC2=C(N3CCN(CC3)C(=O)NC=3C=CC(OC(C)C)=CC=3)N=CN=C2C=C1OCCCN1CCCCC1 UXXQOJXBIDBUAC-UHFFFAOYSA-N 0.000 description 1
- 229950007866 tanespimycin Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- YVSQVYZBDXIXCC-INIZCTEOSA-N telomestatin Chemical compound N=1C2=COC=1C(N=1)=COC=1C(N=1)=COC=1C(N=1)=COC=1C(N=1)=COC=1C(=C(O1)C)N=C1C(=C(O1)C)N=C1[C@@]1([H])N=C2SC1 YVSQVYZBDXIXCC-INIZCTEOSA-N 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- 229960000195 terbutaline Drugs 0.000 description 1
- 229960005353 testolactone Drugs 0.000 description 1
- BPEWUONYVDABNZ-DZBHQSCQSA-N testolactone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(OC(=O)CC4)[C@@H]4[C@@H]3CCC2=C1 BPEWUONYVDABNZ-DZBHQSCQSA-N 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000004001 thioalkyl group Chemical group 0.000 description 1
- 125000003396 thiol group Chemical class [H]S* 0.000 description 1
- 125000005505 thiomorpholino group Chemical group 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 1
- 229960005324 tiludronic acid Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- LERNTVKEWCAPOY-DZZGSBJMSA-N tiotropium Chemical class O([C@H]1C[C@@H]2[N+]([C@H](C1)[C@@H]1[C@H]2O1)(C)C)C(=O)C(O)(C=1SC=CC=1)C1=CC=CS1 LERNTVKEWCAPOY-DZZGSBJMSA-N 0.000 description 1
- 238000003354 tissue distribution assay Methods 0.000 description 1
- 229950005976 tivantinib Drugs 0.000 description 1
- 239000012443 tonicity enhancing agent Substances 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 230000037317 transdermal delivery Effects 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- RTKIYFITIVXBLE-QEQCGCAPSA-N trichostatin A Chemical compound ONC(=O)/C=C/C(/C)=C/[C@@H](C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-QEQCGCAPSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 231100000588 tumorigenic Toxicity 0.000 description 1
- 230000000381 tumorigenic effect Effects 0.000 description 1
- 229940094060 tykerb Drugs 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- TUCIOBMMDDOEMM-RIYZIHGNSA-N tyrphostin B42 Chemical compound C1=C(O)C(O)=CC=C1\C=C(/C#N)C(=O)NCC1=CC=CC=C1 TUCIOBMMDDOEMM-RIYZIHGNSA-N 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 208000010570 urinary bladder carcinoma Diseases 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 229960002004 valdecoxib Drugs 0.000 description 1
- LNPDTQAFDNKSHK-UHFFFAOYSA-N valdecoxib Chemical compound CC=1ON=C(C=2C=CC=CC=2)C=1C1=CC=C(S(N)(=O)=O)C=C1 LNPDTQAFDNKSHK-UHFFFAOYSA-N 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- YCOYDOIWSSHVCK-UHFFFAOYSA-N vatalanib Chemical compound C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 YCOYDOIWSSHVCK-UHFFFAOYSA-N 0.000 description 1
- 229940099039 velcade Drugs 0.000 description 1
- YTZALCGQUPRCGW-ZSFNYQMMSA-N verteporfin Chemical compound N1C(C=C2C(=C(CCC(O)=O)C(C=C3C(CCC(=O)OC)=C(C)C(N3)=C3)=N2)C)=C(C=C)C(C)=C1C=C1C2=CC=C(C(=O)OC)[C@@H](C(=O)OC)[C@@]2(C)C3=N1 YTZALCGQUPRCGW-ZSFNYQMMSA-N 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229940061392 visudyne Drugs 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 229960004764 zafirlukast Drugs 0.000 description 1
- 229960004276 zoledronic acid Drugs 0.000 description 1
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 1
- CGTADGCBEXYWNE-JUKNQOCSSA-N zotarolimus Chemical compound N1([C@H]2CC[C@@H](C[C@@H](C)[C@H]3OC(=O)[C@@H]4CCCCN4C(=O)C(=O)[C@@]4(O)[C@H](C)CC[C@H](O4)C[C@@H](/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C3)OC)C[C@H]2OC)C=NN=N1 CGTADGCBEXYWNE-JUKNQOCSSA-N 0.000 description 1
- 229950009819 zotarolimus Drugs 0.000 description 1
- RZFHLOLGZPDCHJ-XZXLULOTSA-N α-Tocotrienol Chemical compound OC1=C(C)C(C)=C2O[C@@](CC/C=C(C)/CC/C=C(C)/CCC=C(C)C)(C)CCC2=C1C RZFHLOLGZPDCHJ-XZXLULOTSA-N 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
- 239000011730 α-tocotrienol Substances 0.000 description 1
- 235000019145 α-tocotrienol Nutrition 0.000 description 1
- 239000002478 γ-tocopherol Substances 0.000 description 1
- QUEDXNHFTDJVIY-DQCZWYHMSA-N γ-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1 QUEDXNHFTDJVIY-DQCZWYHMSA-N 0.000 description 1
- OTXNTMVVOOBZCV-WAZJVIJMSA-N γ-tocotrienol Chemical compound OC1=C(C)C(C)=C2O[C@@](CC/C=C(C)/CC/C=C(C)/CCC=C(C)C)(C)CCC2=C1 OTXNTMVVOOBZCV-WAZJVIJMSA-N 0.000 description 1
- 239000011722 γ-tocotrienol Substances 0.000 description 1
- 235000019150 γ-tocotrienol Nutrition 0.000 description 1
- 239000002446 δ-tocopherol Substances 0.000 description 1
- ODADKLYLWWCHNB-LDYBVBFYSA-N δ-tocotrienol Chemical compound OC1=CC(C)=C2O[C@@](CC/C=C(C)/CC/C=C(C)/CCC=C(C)C)(C)CCC2=C1 ODADKLYLWWCHNB-LDYBVBFYSA-N 0.000 description 1
- 239000011729 δ-tocotrienol Substances 0.000 description 1
- 235000019144 δ-tocotrienol Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4706—4-Aminoquinolines; 8-Aminoquinolines, e.g. chloroquine, primaquine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/498—Pyrazines or piperazines ortho- and peri-condensed with carbocyclic ring systems, e.g. quinoxaline, phenazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/5025—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/53—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with three nitrogens as the only ring hetero atoms, e.g. chlorazanil, melamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/86—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 4
- C07D239/94—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명은 증식성 질환의 치료에서 연합 활성인 (i) MET 억제제 및 (ii) EGFR 억제제 또는 각각의 그의 제약상 허용되는 염 또는 그의 전구약물의 조합물을 포함하는 제약 제품, 상응하는 제약 제제, 용도, 방법, 공정, 상업용 패키지 및 관련된 본 발명의 실시양태에 관한 것이다.
Description
본 발명은 증식성 질환의 치료에서 연합 활성인 (i) MET 억제제 및 (ii) EGFR (ErbB-1) 억제제 또는 각각의 그의 제약상 허용되는 염 또는 그의 전구약물의 조합물을 포함하는 제약 조합물, 예를 들어 제품, 상응하는 제약 제제, 용도, 방법, 공정, 상업용 패키지 및 관련된 본 발명의 실시양태에 관한 것이다.
개별 분자 표적에 대해 작용하도록 설계된 약물은 종종 암 또는 다른 증식성 질환과 같은 원인으로서 하나 초과의 표적을 갖는 질환 (다유전자성 질환)을 방지하는데 적절하지 않다.
이러한 질환을 방지하기 위해, 한가지 접근법은 단일 다중-표적 약물을 사용하는 것이지만 - 여기서 질환의 징후에 인과적으로 관여하는 표적이, 고려되는 약물에 의해 모두 공격받는 것이 요구된다. 한편으로는, 다중-표적 약물은 이들이 또한 질환 징후에 관여하지 않는 표적에 영향을 줄 수 있기 때문에, 바람직하지 않은 부작용으로 이어질 수 있다.
다른 접근법은 다중-표적 약물로서 약물들의 조합물을 사용하는 것이다. 최선의 시나리오에서, 이는 조합 효율, 예를 들어 상승작용으로 이어질 수 있으며, 따라서 심지어 단독으로 사용되는 경우에 단일 약물에 의해 초래되는 부작용의 감소를 가능하게 한다.
때때로, 이러한 약물들의 성분들 (조합 파트너)은 개별 표적에 영향을 주어 조합 효과를 생성할 수 있으며, 따라서 이는 동일 경로 또는 별개의 경로에서, 개별 세포 내에서 또는 개별 조직에서의 별개의 세포 내에서, 각각, 단일 화합물을 사용하여 달성가능한 것 및/또는 이의 단리된 효과를 고려하는 경우를 초과하는 조합 효과를 생성할 수 있다. 대안적으로, 하나의 성분은 또 다른 성분의 능력을 변경하여, 예를 들어 유출 펌프 등을 억제함으로써 그의 표적에 도달할 수 있다. 또한 대안적으로, 조합 파트너는 동일한 표적의 개별 부위에 결합될 수 있다. 이들 표적 연결성의 변이는, 조합물에 유용하거나 유용하지 않을 수 있는 가능한 유형의 상호작용을 과도하게 증가시킴으로써 적절한 조합물에 대한 조사를 방해한다.
그러나, 이러한 약물을 사용한 목적하는 협동 또는 심지어 상승작용이 많은 경우에 확인되지 않을 수 있다. 쌍별 (r = 2) 약물 조합물의 수가 식 n!/(r!(n-r)!) (작용제의 수 n이 사용됨)에 따라 증가하기 때문에 (예를 들어 2000종의 작용제를 시험하는 것은 이미 1,999,000종의 독특한 쌍별 조합물을 생성할 수 있음), 높은 효율을 가능하게 하는 적절한 스크리닝 방법이 필수적이다.
또한, 임의의 조합물이 고려되기 전에, 질환 징후에서 인과적으로 또는 지지하는 방식으로 관여하는 경로, 효소, 대사 상태 등을 확인하기 위한 중요한 요구사항이 존재한다.
많은 경우에, 심지어 주어진 질환이 다유전자성인 것으로 전혀 공지되어 있지 않다.
따라서, 적절한 조합물 및 양에 대한 조사는 건초더미에서 바늘을 찾는 것에 상응하는 것으로 적절하게 기재될 수 있다.
원종양유전자 cMET (MET)는, 티로신 키나제 활성을 가지며 배아 발생 및 상처 치유에 필수적인 단백질 간세포 성장 인자 수용체 (HGFR)를 코딩한다. 간세포 성장 인자 (HGF)의 자극시, MET는 침습성 성장을 일으키는 여러 생물학적 반응을 유도한다. 비정상적 MET 활성화는 신장, 간, 위, 유방 및 뇌의 암을 비롯한 다양한 유형의 악성종양에서 종양 성장, 새로운 혈관의 형성 (혈관신생) 및 전이를 유발한다. 다수의 MET 키나제 억제제가 공지되어 있으며, 대안적으로 HGF-유도 MET (=HGFR) 활성화의 억제제가 있다. 정상 조직 및 인간 악성종양, 예컨대 암에서의 c-MET의 생물학적 기능 (또는 c-MET 신호전달 경로)은 널리 기록되어 있다 (문헌 [Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26; Corso, S. et al., Trends in Mol. Med. 2005, 11(6):284-292]).
조절이상 c-Met (c-MET) 경로는 종양 형성, 성장, 유지 및 진행에 중요하고 때때로 원인이 되는 (유전자 변경의 경우에) 역할을 한다 (문헌 [Birchmeier, C. et al., Nat. Rev. Mol. Cell. Biol. 2003, 4(12):915-925; Boccaccio, C. et al., Nat. Rev. Cancer 2006, 6(8):637-645; Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26]). HGF 및/또는 c-Met는 대부분의 인간 암의 상당한 부분에서 과다발현되며, 종종 불량한 임상적 결과, 예컨대 보다 공격적인 질환, 질환 진행, 종양 전이 및 단축된 환자 생존과 연관된다. 추가로, 높은 수준의 HGF/c-Met 단백질을 갖는 환자는 화학요법 및 방사선요법에 대해 보다 저항성이다. 비정상적 HGF/c-Met 발현 이외에도, c-Met 수용체는 또한 유전자 돌연변이 (배선 및 체성 둘 다) 및 유전자 증폭을 통해 암 환자에서 활성화될 수 있다. 유전자 증폭 및 돌연변이가 환자에서 보고된 가장 통상적인 유전자 변경이지만, 수용체는 또한 결실, 절단, 유전자 재배열에 의해 활성화될 수 있다.
c-MET가 관련되는 다양한 암은 암종 (예를 들어, 방광, 유방, 자궁경부, 담관암종, 결장직장, 식도, 위, 두경부, 신장, 간, 폐, 비인두, 난소, 췌장, 전립선, 갑상선); 근골격 육종 (예를 들어, 골육종, 활막 육종, 횡문근육종); 연부 조직 육종 (예를 들어, MFH/섬유육종, 평활근육종, 카포시 육종); 조혈 악성종양 (예를 들어, 다발성 골수종, 림프종, 성인 T 세포 백혈병, 급성 골수 백혈병, 만성 골수성 백혈병); 및 다른 신생물 (예를 들어, 교모세포종, 성상세포종, 흑색종, 중피종 및 윌름스 종양을 포함하나, 이에 제한되지는 않는다 (www.vai.org/met/; 문헌 [Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26]).
활성화 c-MET 경로가 종양 형성 및 진행에 기여하며 효과적인 암 개입에 우수한 표적일 수 있다는 개념은 다수의 전임상 연구에 의해 추가로 확고해졌다 (문헌 [Birchmeier, C. et al., Nat. Rev. Mol. Cell Biol. 2003, 4(12):915-925; Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26; Corso, S. et al., Trends in Mol. Med. 2005, 11(6): 284-292]). 예를 들어, 연구는 tpr-met 융합 유전자, c-met의 과다발현 및 활성화 c-met 돌연변이 (본원에서 MET로서 총칭됨) 모두가 다양한 모델 세포주의 종양원성 형질전환을 야기하며 마우스에서 종양 형성 및 전이를 초래하는 것으로 제시하였다. 보다 중요하게는, 상당한 항종양 (때때로 종양 퇴행) 및 항전이 활성은, 특이적으로 HGF/c-MET 신호전달을 손상시키고/거나 차단하는 작용제를 사용하여 시험관내 및 생체내 입증되었다. 이들 작용제는 항-HGF 및 항-c-Met 항체, HGF 펩티드 길항제, 디코이 c-Met 수용체, c-Met 펩티드 길항제, 우성 음성 c-Met 돌연변이, c-Met 특이적 안티센스 올리고뉴클레오티드 및 리보자임, 및 선택적 소분자 c-Met 키나제 억제제를 포함한다 (문헌 [Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26]).
암에서의 확립된 역할 이외에도, 비정상적 HGF/MET 신호전달은 또한 아테롬성동맥경화증, 폐 섬유증, 신섬유증 및 재생, 간 질환, 알레르기성 장애, 염증성 및 자가면역 장애, 뇌혈관 질환, 심혈관 질환, 기관 이식과 연관된 상태에 관련된다 (문헌 [Ma, H. et al., Atherosclerosis. 2002, 164(1):79-87; Crestani, B. et al., Lab. Invest. 2002, 82(8):1015-1022; Sequra-Flores, A.A. et al., Rev. Gastroenterol. Mex. 2004, 69(4)243-250; Morishita, R. et al., Curr. Gene Ther. 2004, 4(2)199-206; Morishita, R. et al., Endocr. J. 2002, 49(3)273-284; Liu, Y., Curr. Opin. Nephrol. Hypertens. 2002, 11(1):23-30; Matsumoto, K. et al., Kidney Int. 2001, 59(6):2023-2038; Balkovetz, D.F. et al., Int. Rev. Cytol. 1999, 186:225-250; Miyazawa, T. et al., J. Cereb. Blood Flow Metab. 1998, 18(4)345-348; Koch, A.E. et al., Arthritis Rheum. 1996, 39(9):1566-1575; Futamatsu, H. et al., Circ. Res. 2005, 96(8)823-830; Eguchi, S. et al., Clin. Transplant. 1999, 13(6)536-544]).
표피 성장 인자 수용체 (EGFR, 일명 ErbB-1; 인간에서의 HER1)는 표피 성장 인자 부류의 리간드에 대한 수용체이다. 몇몇 유형의 암, 예컨대 폐암, 항문암, 다형성 교모세포종 및 다수의 다른 주로 상피암은 EGFR 과다-활성 또는 과다-발현에 의존성인 것으로 공지되어 있다.
암은 종종 예를 들어 점 돌연변이, 유전자 증폭 또는 염색체 전위에 의해 수용체 티로신 키나제 (RTK)의 유전자 변경에 의존하며, 이는 이들 RTK의 비제어된 활성으로 이어지고 따라서 종양원성이 된다. 암 세포의 세포 증식은 이들 이상 RTK의 활성에 의존한다.
발생된 증식성 질환을 치료하는 경우에, 연관된 종양유전자 RTK의 억제제가 종종 사용된다. 그러나, 종종, 특정 치료 시간 후에, 사용되는 약물에 대한 내성이 관찰된다. 내성의 한 메카니즘은 치료제의 결합 또는 활성을 손상시키는 표적 RTK를 수반할 수 있다. 또 다른 메카니즘은 일차 키나제가 억제되는 경우에 암 성장을 지속적으로 구동하는 대안적인 키나제의 보상적인 활성화이다. 메카니즘의 두 유형을 포괄하는 잘 특성화된 예는 활성화 표피 성장 인자 수용체 (EGFR) 돌연변이를 보유하는 비소형 암 (NSCLC)에서 EGFR 게피티닙 및 에를로티닙에 대한 획득 저항성이다 (문헌 [Lynch, T. J., et al.,. N Engl J Med, 350: 2129-2139, 2004; 또는 Paez, J. G., et al., Science, 304: 1497-1500, 2004] 참조). 예를 들어, MET 활성화는 HER3과 같은 신호 분자의 하류 활성화에 의해 EGFR 활성 (억제에 의한)의 손실을 보상할 수 있고, 예컨대 MET 증폭이 보상할 수 있거나, 또는 그의 리간드 간세포 성장 인자는 MET를 활성화할 수 있다 (문헌 [Engelman, J. A., et al., Science, 316: 1039-1043, 2007; Yano, S., et al., Cancer Res, 68: 9479-9487, 2008; 및 Turke, A. B., et al., Cancer Cell, 17: 77-88, 2010] 참조). MET-의존성 암 세포주 (이의 증식이 MET의 활성에 의존함)가 리간드-유도된 EGFR 활성화에 의해 MET 억제제로부터 구출될 수 있는 것으로 또한 공지되어 있다 (문헌 [Bachleitner-Hofmann, T., et al.,. Mol Cancer Ther, 7: 3499-3508, 2008] 참조).
본래 MET 및/또는 EGFR에 의존성인 암 세포의 사용시 (즉, 그의 활성), 대안적 수용체 티로신 키나제 (RTK)의 리간드-매개 활성화를 통한 의존성의 우회가 관찰되었다. MET- 또는 FGFR-의존성 세포주를 상응하는 선택적 억제제로 (즉, MET-의존성 세포주를 MET 억제제로, 및 FGFR-의존성 세포주를 FGFR 억제제로) 처리하고 동시에 다양한 분비형 단백질을 코딩하는 cDNA로 형질감염된 세포로부터의 상청액을 첨가하는 경우에 우회 메카니즘이 발견되었다. MET 및 FGFR RTK가 서로의 손실을 보상할 수 있으며, 따라서 이들 RTK 중 단 하나만이 적절한 약물에 의해 억제되는 경우에 증식하는 세포의 "구출"을 일으키는 것으로 제시될 수 있다.
놀랍게도, 이들 RTK의 조합된 억제는, 특히 MET 및 FGFR RTK가 둘 다 활성이며 이어서 본 발명에 따라 동시에 또는 함께 순차적으로 억제될 수 있는 경우에 상승작용적 항암 활성을 생성할 수 있는 것으로 밝혀졌다.
제1 실시양태에 따르면, 본 발명은 (i) MET 억제제 및 (ii) EGFR 억제제 또는 각각의 그의 제약상 허용되는 염 또는 각각의 그의 전구약물, 및 하나 이상의 제약상 허용되는 담체를 포함하는 제약 조합물 (예를 들어 조합 제품)에 관한 것이다.
본 발명의 추가 실시양태는 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암에 대한 연합 치료 유효량의, 조합 파트너 (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제 또는 각각의 그의 제약상 허용되는 염, 및 하나 이상의 제약상 허용되는 담체 물질을 포함하는 조합물 (예를 들어 조합 제품)을 제공한다.
추가 실시양태는 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암을 치료하기 위한 본 발명의 조합물 (예를 들어 조합 제품)의 용도에 관한 것이다.
추가 실시양태는 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암을 치료하기 위한 의약 또는 제약 제품의 제조를 위한, (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제 또는 각각의 그의 제약상 허용되는 염의 조합물의 용도에 관한 것이다.
추가 실시양태는 (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제 또는 각각의 그의 제약상 허용되는 염의 조합물을 사용하여 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암을 치료하는 방법에 관한 것이다.
추가 실시양태는 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암의 치료를 필요로 하는 대상체, 예컨대 온혈 동물, 특히 인간에게 (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제를 포함하는 유효량의 조합물 또는 조합 제품을 투여하는 것을 포함하는, EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암을 치료하는 방법에 관한 것이다.
본 발명의 추가 실시양태는 본원에 기재된 본 발명에 따른 조합 제품을, 특히 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암의 치료에서의 그의 동시, 개별 또는 순차적 사용을 위한 (특히 연합 활성이 되도록) 지침과 함께 포함하는, 특히 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암의 치료에 사용하기 위한 제약 제품 또는 상업용 패키지에 관한 것이다.
본 발명의 추가 실시양태는 본 발명에 따른 조합물 (예를 들어 조합 제품)의 제조를 위한, (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제 또는 각각의 그의 제약상 허용되는 염의 용도에 관한 것이다.
하기 정의는 상기 및 하기에 기재된 본 발명의 실시양태에서 하나, 하나 초과 또는 모든 일반적 특징 또는 표현을 대체하는데 사용될 수 있으며 따라서 보다 구체적인 본 발명의 실시양태를 생성할 수 있는 일반적 특징 또는 표현의 보다 구체적인 실시양태를 나타낸다.
본 발명에 따라 유용한 MET 티로신 키나제 억제제 중에, WO 2011/018454 (특히 본원에 개시된 화합물 및 화합물의 부류에 대해 본원에 참조로 포함됨)에 개시된 것, 특히 하기 화학식 I의 것 또는 그의 제약상 허용되는 염이 특정한 실시양태이다.
<화학식 I>
상기 식에서,
Y는 C 또는 N이고;
X는 CH 또는 N이고;
B는 CH 또는 N이고;
A는 고리이고;
여기서, X가 CH이고 B가 N인 경우에, 고리 A는 하기 고리 Ai 또는 고리 Aii이고;
X가 N이고 B가 N인 경우에, 고리 A는 하기 Aiii이고;
X가 N이고 B가 N이거나, 또는 X가 N이고 B가 CH인 경우에, 고리 A는 하기 Ai이고;
R1은 하기 i, ii 및 iii으로부터 선택된 기이고:
식 중, R5는 헤테로아릴이고;
R6은 수소, 중수소, OH, 메틸 또는 할로이고;
R7은 수소, 중수소, 할로 또는 (C1-C3)알킬이고, 여기서 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되거나;
또는 R6 및 R7는 이들이 부착되어 있는 탄소와 함께 시클로프로필을 형성하고, 여기서 상기 시클로프로필은 메틸에 의해 임의로 치환되고;
n은 0, 1 또는 2이고;
R2는 수소, NH2 또는 (C1-C4)알킬이고, 여기서 상기 (C1-C4)알킬은 OH, NH2 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고;
R3은 수소, -CONH2, -CONH(C1-C4)알킬, -CONH페닐이고, 여기서 상기 CONH페닐의 페닐은 1개 이상의 할로, -(C1-C4)알킬, -CO(C1-C4)알킬, -CO2(C1-C4)알킬, 페닐, 헤테로아릴, -CO헤테로아릴, -CSNH2, -CSNH(C1-C4)알킬, -CSNH벤질, -SO2(C1-C4)알킬 또는 -COCH2헤테로시클릴에 의해 임의로 치환되고, 상기 헤테로시클릴은 (C1-C3)알킬에 의해 임의로 치환되고;
R4는 수소 또는 (C1-C3)알킬이거나;
또는 R3 및 R4는 이들이 부착되어 있는 질소와 함께 R3 및 R4가 부착되어 있는 1개의 고리 N 원자 및 임의로 N, O 및 S로부터 독립적으로 선택된 1개의 추가의 고리 헤테로원자를 포함하는 5 또는 6원 포화 또는 부분 불포화 모노시클릭 기를 형성하고, 여기서 상기 모노시클릭 기는 1 또는 2개의 =O 치환기에 의해 치환된다.
MET 티로신 키나제 억제제인 화학식 I의 화합물의 특히 바람직한 군은 하기 화학식을 갖는 명칭 (E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (또한 하기에 화합물 A로 명명됨)를 갖는 것이다.
WO 11 018454, 실시예 1을 참조한다.
본 발명에 따라 유용한 MET 티로신 키나제 억제제 중에, 특정한 실시양태로서는 WO 2008/064157 (특히 개시된 화합물 및 화합물 부류에 대해 본원에 참조로 포함됨)에서 그의 제조 방법과 함께 기재된 것, 특히 하기 화학식 III을 갖는 화합물 또는 그의 제약상 허용되는 염 또는 그의 전구약물이 또한 언급된다.
<화학식 III>
상기 식에서,
A는 N 또는 CR3이고;
Cy1은 1, 2, 3, 4 또는 5개의 -W-X-Y-Z에 의해 각각 임의로 치환된 아릴, 헤테로아릴, 시클로알킬 또는 헤테로시클로알킬이고;
Cy2는 1, 2, 3, 4 또는 5개의 -W'-X'-Y'-Z'에 의해 각각 임의로 치환된 아릴, 헤테로아릴, 시클로알킬 또는 헤테로시클로알킬이고;
L1은 (CR4R5)m, (CR4R5)p-(시클로알킬렌)-(CR4R5)q, (CR4R5)p-(아릴렌)-(CR4R5)q, (CR4R5)p-(헤테로시클로알킬렌)-(CR4R5)q, (CR4R5)p-(헤테로아릴렌)-(CR4R5)q, (CR4R5)pO(CR4R5)q, (CR4R5)pS(CR4R5)q, (CR4R5)pC(O)(CR4R5)q, (CR4R5)pC(O)NR6(CR4R5)q, (CR4R5)pC(O)O(CR4R5)q, (CR4R5)pOC(O)(CR4R5)q, (CR4R5)pOC(O)NR6(CR4R5)q, (CR4R5)pNR6(CR4R5)q, (CR4R5)pNR6C(O)NR6(CR4R5)q, (CR4R5)pS(O)(CR4R5)q, (CR4R5)pS(O)NR6(CR4R5)q, (CR4R5)pS(O)2(CR4R5)q 또는 (CR4R5)pS(O)2NR6(CR4R5)q이고, 여기서 상기 시클로알킬렌, 아릴렌, 헤테로시클로알킬렌 또는 헤테로아릴렌은 Cy3, 할로, C1-6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, N3, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)NRcRd, NRcC(O)ORa, C(=NRg)NRcRd, NRcC(=NRg)NRcRd, P(Rf)2, P(ORe)2, P(O)ReRf, P(O)OReORf, S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb 및 S(O)2NRcRd로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되고;
L2는 (CR7R8)r, (CR7R8)s-(시클로알킬렌)-(CR7R8)t, (CR7R8)s-(아릴렌)-(CR7R8)t, (CR7R8)s-(헤테로시클로알킬렌)-(CR7R8)t, (CR7R8)s-(헤테로아릴렌)-(CR7R8)t, (CR7R8)sO(CR7R8)t, (CR7R8)sS(CR7R8)t, (CR7R8)sC(O)(CR7R8)t, (CR7R8)sC(O)NR9(CR7R8)t, (CR7R8)sC(O)O(CR7R8)t, (CR7R8)sOC(O)(CR7R8)t, (CR7R8)sOC(O)NR9(CR7R8)t, (CR7R8)sNR9(CR7R8)t, (CR7R8)sNR9C(O)NR9(CR7R8)t, (CR7R8)sS(O)(CR7R8)t, (CR7R8)sS(O)NR7(CR8R9)t, (CR7R8)sS(O)2(CR7R8)t 또는 (CR7R8)sS(O)2NR9(CR7R8)t이고, 여기서 상기 시클로알킬렌, 아릴렌, 헤테로시클로알킬렌 또는 헤테로아릴렌은 Cy4, 할로, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, N3, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, NRc1Rd1, NRc1C(O)Rb1, NRc1C(O)NRc1Rd1, NRc1C(O)ORa1, C(=NRg)NRc1Rd1, NRc1C(=NRg)NRc1Rd1, P(Rf1)2, P(ORe1)2, P(O)Re1Rf1, P(O)ORe1ORf1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, NRc1S(O)2Rb1 및 S(O)2NRc1Rd1로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되고;
R1은 H 또는 -W"-X"-Y"-Z"이고;
R2는 H, 할로, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, CN, NO2, ORA, SRA, C(O)RB, C(O)NRCRD, C(O)ORA, OC(O)RB, OC(O)NRCRD, NRCRD, NRCC(O)RB, NRCC(O)NRCRD, NRCC(O)ORA, S(O)RB, S(O)NRCRD, S(O)2RB, NRCS(O)2RB 또는 S(O)2NRCRD이고;
R3은 H, 시클로알킬, 아릴, 헤테로시클로알킬, 헤테로아릴, 할로, C1 -6 알킬, C2-6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, CN, NO2, ORA, SRA, C(O)RB, C(O)NRCRD, C(O)ORA, OC(O)RB, OC(O)NRCRD, NRCRD, NRCC(O)RB, NRCC(O)NRCRD, NRCC(O)ORA, S(O)RB, S(O)NRCRD, S(O)2RB, NRCS(O)2RB 및 S(O)2NRCRD이고; 여기서 상기 시클로알킬, 아릴, 헤테로시클로알킬, 헤테로아릴 또는 C1 -6 알킬은 Cy5, 할로, C1 -6 알킬, C2 -6 알케닐, C2-6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, N3, ORa1, SRa1, C(O)Rb1, C(O)NRc1Rd1, C(O)ORa1, OC(O)Rb1, OC(O)NRc1Rd1, NRc1Rd1, NRc1C(O)Rb1, NRc1C(O)NRc1Rd1, NRc1C(O)ORa1, C(=NRg)NRc1Rd1, NRc1C(=NRg)NRc1Rd1, P(Rf1)2, P(ORe1)2, P(O)Re1Rf1, P(O)ORe1ORf1, S(O)Rb1, S(O)NRc1Rd1, S(O)2Rb1, NRc1S(O)2Rb1 및 S(O)2NRc1Rd1로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되거나;
또는 R2 및 -L2-Cy2는 함께 연결되어 하기 화학식의 기를 형성하고:
식 중, 고리 B는 1, 2 또는 3개의 -W'-X'-Y'-Z'로 각각 임의로 치환된 융합된 아릴 또는 융합된 헤테로아릴 고리이고;
R4 및 R5는 독립적으로 H, 할로, OH, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 알콕시, 알콕시알킬, 시아노알킬, 헤테로시클로알킬, 시클로알킬, C1 -6 할로알킬, CN 및 NO2로부터 선택되거나;
또는 R4 및 R5는 이들이 부착되어 있는 C 원자와 함께 할로, OH, C1 -6 알킬, C2 -6 알케닐, C2-6 알키닐, C1 -6 알콕시, 알콕시알킬, 시아노알킬, 헤테로시클로알킬, 시클로알킬, C1 -6 할로알킬, CN 및 NO2로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 각각 임의로 치환된 3, 4, 5, 6 또는 7-원 시클로알킬 또는 헤테로시클로알킬 고리를 형성하고;
R6은 H, C1 -6 알킬, C2 -6 알케닐 또는 C2 -6 알키닐이고;
R7 및 R8은 독립적으로 H, 할로, OH, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 알콕시, C1 -6 할로알킬, CN 및 NO2로부터 선택되거나;
또는 R7 및 R8은 이들이 부착되어 있는 C 원자와 함께 할로, OH, C1 -6 알킬, C2-6 알케닐, C2 -6 알키닐, C1 -6 알콕시, C1 -6 할로알킬, CN 및 NO2로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 각각 임의로 치환된 3, 4, 5, 6 또는 7-원 시클로알킬 또는 헤테로시클로알킬 고리를 형성하고;
R9는 H, C1 -6 알킬, C2 -6 알케닐 또는 C2 -6 알키닐이고;
W, W' 및 W"는 독립적으로 부재하거나 또는 독립적으로 C1 -6 알킬렌, C2 -6 알케닐렌, C2 -6 알키닐렌, O, S, NRh, CO, COO, CONRh, SO, SO2, SONRh 및 NRhCONRi로부터 선택되고, 여기서 각각의 C1 -6 알킬렌, C2 -6 알케닐렌 및 C2 -6 알키닐렌은 할로, C1-6 알킬, C1 -6 할로알킬, OH, C1 -6 알콕시, C1 -6 할로알콕시, 아미노, C1 -6 알킬아미노 및 C2-8 디알킬아미노로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 임의로 치환되고;
X, X' 및 X"는 독립적으로 부재하거나 또는 독립적으로 C1 -6 알킬렌, C2 -6 알케닐렌, C2 -6 알키닐렌, 아릴렌, 시클로알킬렌, 헤테로아릴렌 및 헤테로시클로알킬렌으로부터 선택되고, 여기서 각각의 C1 -6 알킬렌, C2 -6 알케닐렌, C2 -6 알키닐렌, 아릴렌, 시클로알킬렌, 헤테로아릴렌 및 헤테로시클로알킬렌은 할로, CN, NO2, OH, C1-6 알킬, C1 -6 할로알킬, C2 -8 알콕시알킬, C1 -6 알콕시, C1 -6 할로알콕시, C2 -8 알콕시알콕시, 시클로알킬, 헤테로시클로알킬, C(O)ORj, C(O)NRhRi, 아미노, C1 -6 알킬아미노 및 C2 -8 디알킬아미노로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 임의로 치환되고;
Y, Y' 및 Y"는 독립적으로 부재하거나 또는 독립적으로 C1 -6 알킬렌, C2 -6 알케닐렌, C2 -6 알키닐렌, O, S, NRh, CO, COO, CONRh, SO, SO2, SONRh 및 NRhCONRi로부터 선택되고, 여기서 각각의 C1 -6 알킬렌, C2 -6 알케닐렌 및 C2 -6 알키닐렌은 할로, C1 -6 알킬, C1 -6 할로알킬, OH, C1 -6 알콕시, C1 -6 할로알콕시, 아미노, C1 -6 알킬아미노 및 C2 -8 디알킬아미노로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 임의로 치환되고;
Z, Z' 및 Z"는 독립적으로 H, 할로, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, N3, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)NRc2Rd2, NRc2C(O)ORa2, C(=NRg)NRc2Rd2, NRc2C(=NRg)NRc2Rd2, P(Rf2)2, P(ORe2)2, P(O)Re2Rf2, P(O)ORe2ORf2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, NRc2S(O)2Rb2, S(O)2NRc2Rd2, 아릴, 시클로알킬, 헤테로아릴 및 헤테로시클로알킬로부터 선택되고, 여기서 상기 C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴 및 헤테로시클로알킬은 할로, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, N3, ORa2, SRa2, C(O)Rb2, C(O)NRc2Rd2, C(O)ORa2, OC(O)Rb2, OC(O)NRc2Rd2, NRc2Rd2, NRc2C(O)Rb2, NRc2C(O)NRc2Rd2, NRc2C(O)ORa2, C(=NRg)NRc2Rd2, NRc2C(=NRg)NRc2Rd2, P(Rf2)2, P(ORe2)2, P(O)Re2Rf2, P(O)ORe2ORf2, S(O)Rb2, S(O)NRc2Rd2, S(O)2Rb2, NRc2S(O)2Rb2 및 S(O)2NRc2Rd2로부터 독립적으로 선택된 1, 2, 3, 4 또는 5개의 치환기에 의해 임의로 치환되고;
여기서 2개의 인접한 -W-X-Y-Z는 이들이 부착되어 있는 원자와 함께 임의로, 할로, C1-6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)NRc3Rd3, NRc3C(O)ORa3, C(=NRg)NRc3Rd3, NRc3C(=NRg)NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, NRc3S(O)2Rb3, S(O)2NRc3Rd3, 아릴, 시클로알킬, 헤테로아릴 및 헤테로시클로알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 각각 임의로 치환된 융합된 4-20원 시클로알킬 고리 또는 융합된 4-20원 헤테로시클로알킬 고리를 형성하고;
여기서 2개의 인접한 -W'-X'-Y'-Z'는 이들이 부착되어 있는 원자와 함께 임의로, 할로, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, ORa3, SRa3, C(O)Rb3, C(O)NRc3Rd3, C(O)ORa3, OC(O)Rb3, OC(O)NRc3Rd3, NRc3Rd3, NRc3C(O)Rb3, NRc3C(O)NRc3Rd3, NRc3C(O)ORa3, C(=NRg)NRc3Rd3, NRc3C(=NRg)NRc3Rd3, S(O)Rb3, S(O)NRc3Rd3, S(O)2Rb3, NRc3S(O)2Rb3, S(O)2NRc3Rd3, 아릴, 시클로알킬, 헤테로아릴 및 헤테로시클로알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 각각 임의로 치환된 융합된 4-20원 시클로알킬 고리 또는 융합된 4-20원 헤테로시클로알킬 고리를 형성하고;
Cy3, Cy4 및 Cy5는 독립적으로 할로, C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 할로알킬, 할로술파닐, CN, NO2, N3, ORa4, SRa4, C(O)Rb4, C(O)NRc4Rd4, C(O)ORa4, OC(O)Rb4, OC(O)NRc4Rd4, NRc4Rd4, NRc4C(O)Rb4, NRc4C(O)NRc4Rd4, NRc4C(O)ORa4, C(=NRg)NRc4Rd4, NRc4C(=NRg)NRc4Rd4, P(Rf4)2, P(OR4)2, P(O)Re4Rf4, P(O)ORe4ORf4, S(O)Rb4, S(O)NRc4Rd4, S(O)2Rb4, NRc4S(O)2Rb4 및 S(O)2NRc4Rd4로부터 독립적으로 선택된 1, 2, 3, 4 또는 5개의 치환기에 의해 각각 임의로 치환된 아릴, 시클로알킬, 헤테로아릴 및 헤테로시클로알킬로부터 선택되고;
RA는 H, C1 -4 알킬, C2 -4 알케닐, C2 -4 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴 또는 헤테로아릴이고, 여기서 상기 C1 -4 알킬, C2 -4 알케닐, C2 -4 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴 또는 헤테로아릴은 OH, CN, 아미노, 할로 및 C1 -4 알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되고;
RB는 H, C1 -4 알킬, C2 -4 알케닐, C2 -4 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴 또는 헤테로아릴이고, 여기서 상기 C1 -4 알킬, C2 -4 알케닐 또는 C2 -4 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴 또는 헤테로아릴은 OH, CN, 아미노, 할로 및 C1 -4 알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되고;
RC 및 RD는 독립적으로 H, C1 -4 알킬, C2 -4 알케닐 또는 C2 -4 알키닐로부터 선택되고, 여기서 상기 C1 -4 알킬, C2 -4 알케닐 또는 C2 -4 알키닐은 OH, CN, 아미노, 할로 및 C1 -4 알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되거나;
또는 RC 및 RD는 이들이 부착되어 있는 N 원자와 함께 OH, CN, 아미노, 할로 및 C1 -4 알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환된 4-, 5-, 6- 또는 7-원 헤테로시클로알킬 기 또는 헤테로아릴 기를 형성하고;
Ra, Ra1, Ra2, Ra3 및 Ra4는 독립적으로 H, C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 및 헤테로시클로알킬알킬로부터 선택되고, 여기서 상기 C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되고;
Rb, Rb1, Rb2, Rb3 및 Rb4는 독립적으로 H, C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 및 헤테로시클로알킬알킬로부터 선택되고, 여기서 상기 C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되고;
Rc 및 Rd는 독립적으로 H, C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬로부터 선택되고, 여기서 상기 C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되거나;
또는 Rc 및 Rd는 이들이 부착되어 있는 N 원자와 함께 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환된 4-, 5-, 6- 또는 7-원 헤테로시클로알킬 기 또는 헤테로아릴 기를 형성하고;
Rc1 및 Rd1은 독립적으로 H, C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬로부터 선택되고, 여기서 상기 C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되거나;
또는 Rc1 및 Rd1은 이들이 부착되어 있는 N 원자와 함께 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환된 4-, 5-, 6- 또는 7-원 헤테로시클로알킬 기 또는 헤테로아릴 기를 형성하고;
Rc2 및 Rd2는 독립적으로 H, C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬, 헤테로시클로알킬알킬, 아릴시클로알킬, 아릴헤테로시클로알킬, 아릴헤테로아릴, 비아릴, 헤테로아릴시클로알킬, 헤테로아릴헤테로시클로알킬, 헤테로아릴아릴 및 비헤테로아릴로부터 선택되고, 여기서 상기 C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬, 헤테로시클로알킬알킬, 아릴시클로알킬, 아릴헤테로시클로알킬, 아릴헤테로아릴, 비아릴, 헤테로아릴시클로알킬, 헤테로아릴헤테로시클로알킬, 헤테로아릴아릴 및 비헤테로아릴은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬, C1 -6 할로알콕시, 히드록시알킬, 시아노알킬, 아릴, 헤테로아릴, C(O)ORa4, C(O)Rb4, S(O)2Rb3, 알콕시알킬 및 알콕시알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환되거나;
또는 Rc2 및 Rd2는 이들이 부착되어 있는 N 원자와 함께 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬, C1 -6 할로알콕시, 히드록시알킬, 시아노알킬, 아릴, 헤테로아릴, C(O)ORa4, C(O)Rb4, S(O)2Rb3, 알콕시알킬 및 알콕시알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환된 4-, 5-, 6- 또는 7-원 헤테로시클로알킬 기 또는 헤테로아릴 기를 형성하고;
Rc3 및 Rd3은 독립적으로 H, C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬로부터 선택되고, 여기서 상기 C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되거나;
또는 Rc3 및 Rd3은 이들이 부착되어 있는 N 원자와 함께 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환된 4-, 5-, 6- 또는 7-원 헤테로시클로알킬 기 또는 헤테로아릴 기를 형성하고;
Rc4 및 Rd4는 독립적으로 H, C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬로부터 선택되고, 여기서 상기 C1 -10 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 헤테로아릴, 시클로알킬, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬은 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환되거나;
또는 Rc4 및 Rd4는 이들이 부착되어 있는 N 원자와 함께 OH, CN, 아미노, 할로, C1 -6 알킬, C1 -6 알콕시, C1 -6 할로알킬 및 C1 -6 할로알콕시로부터 독립적으로 선택된 1, 2 또는 3개의 치환기로 각각 임의로 치환된 4-, 5-, 6- 또는 7-원 헤테로시클로알킬 기 또는 헤테로아릴 기를 형성하고;
Re, Re1, Re2 및 Re4는 독립적으로 H, C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, (C1-6 알콕시)-C1 -6 알킬, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴, 헤테로시클로알킬, 아릴알킬, 시클로알킬알킬, 헤테로아릴알킬 및 헤테로시클로알킬알킬로부터 선택되고;
Rf, Rf1, Rf2 및 Rf4는 독립적으로 H, C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2-6 알키닐, 아릴, 시클로알킬, 헤테로아릴 및 헤테로시클로알킬로부터 선택되고;
Rg는 H, CN 및 NO2이고;
Rh 및 Ri는 독립적으로 H 및 C1 -6 알킬로부터 선택되고;
Rj는 H, C1 -6 알킬, C1 -6 할로알킬, C2 -6 알케닐, C2 -6 알키닐, 아릴, 시클로알킬, 헤테로아릴, 헤테로시클로알킬, 아릴알킬, 헤테로아릴알킬, 시클로알킬알킬 또는 헤테로시클로알킬알킬이고;
m은 0, 1, 2, 3, 4, 5 또는 6이고;
p는 0, 1, 2, 3 또는 4이고;
q는 0, 1, 2, 3 또는 4이고;
r은 0, 1, 2, 3, 4, 5 또는 6이고;
s는 0, 1, 2, 3 또는 4이고;
t는 0, 1, 2, 3 또는 4이다.
일부 실시양태에서, 본 발명에 따라 유용한 화학식 III의 화합물은 하기 화학식 IIIA를 갖는다:
<화학식 IIIA>
일부 실시양태에서, 본 발명에 따라 유용한 화학식 III의 화합물은 하기 화학식 IIIB를 갖는다:
<화학식 IIIB>
특히 상기 식에서,
A는 CH 또는 N, 특히 N이고;
L1은 (CR4R5)m이고, 여기서 각각의 R4 및 R5는 서로 독립적으로 H 또는 C1 -6-알킬이고, m은 0, 1 또는 2이고,
L2는 (CR7R8)r이고, 여기서 각각의 R7 및 R8은 서로 독립적으로 H 또는 C1 -6-알킬이고, r은 0, 1 또는 2이고,
R1은 H, 할로 또는 C1 -6-알킬이고;
R2는 H, 할로 또는 C1 -6-알킬이고;
Cy2는 아릴, 특히 페닐이고, 여기서 상기 아릴 또는 페닐은 비치환되거나 또는 -C(=O)-NRc2Rd2 및 할로로 이루어진 군으로부터 독립적으로 선택된 1 내지 3개의 모이어티에 의해 치환되고, 여기서 Rc2 및 Rd2는 독립적으로 H, C1 -10-알킬 및 C1 -6 할로알킬로부터 선택되며;
여기서, 화합물은 또한 또는 대안적으로 제약상 허용되는 염의 형태로 존재할 수 있다.
화학식 III의 화합물의 특히 바람직한 군은 하기 화학식을 갖는 명칭 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 (또한 하기에 화합물 B로 명명됨)를 갖는 것이다.
WO 2008/064157, 실시예 7을 참조한다. 이는 가장 바람직한 MET 티로신 키나제 억제제이다.
상기 언급된 2종의 MET 억제제 (화합물 A 및 화합물 B)가 특히 관심 대상이며, 또한 다른 MET 억제제가 본 발명의 범위에 포함된다.
이러한 다른 MET 억제제 (이는 또한 HGF에 대해 활성인 화합물 또는 항체를 포함함)는 예를 들어 하기 (그의 제약상 허용되는 염 및 그의 전구약물 포함)로부터 선택된다:
하기 화학식을 갖는 크리조티닙 (화이자(Pfizer)) (일명 PF02341066) (대단히 바람직한 화합물)
하기 화학식을 갖는 카보잔티닙 (엑셀릭시스(Exelixis)) (일명 XL-184) (대단히 바람직한 화합물)
하기 화학식을 갖는 티바티닙 (아큘(ArQule), 다이이치(daiichi), 교와(Kyowa)) (일명 ARQ-197) (대단히 바람직한 화합물)
하기 화학식을 갖는 포레티닙 (엑셀릭시스, 글락소스미스클라인(GlaxoSmithKline)) (일명 XL-880) (대단히 바람직한 화합물)
하기 화학식을 갖는 MGCD-265 (메틸젠(MethylGene)) (대단히 바람직한 화합물)
하기 화학식을 갖는 AMG-208 (암젠(Amgen)) (또한 WO 2008/008539 참조)
AMG-337 (암젠);
하기 화학식을 갖는 JNJ-38877605 (존슨 앤 존슨(Johnson & Johnson)) (일명 BVT051) (또한 WO 2007/075567 참조)
하기 화학식을 갖는 MK-8033 (머크 앤 캄파니(Merck & Co))
하기 화학식을 갖는 E-7050 (에이사이(Eisai))
EMD-1204831 (머크 세로노(Merck Serono));
하기 화학식을 갖는 EMD-1214063 (머크 세로노) (또한 WO 2007/019933 참조)
하기 화학식을 갖는 아무바티닙 (슈퍼젠(SuperGen)) (일명 MP-470)
LY-2875358 (일라이 릴리(Eli Lilly));
하기 화학식을 갖는 BMS-817378 (브리스톨마이어스스큅(BristolMyersSquibb), 심시어(Simcere))
DP-3590 (데시페라(Deciphera));
ASP-08001 (수조우 아세피온 파마슈티칼스(Suzhou Ascepion Pharmaceuticals));
HM-5016504 (허치슨 메디파마(Hutchison Medipharma));
하기 화학식을 갖는 PF-4217903 (화이자) (또한 US2007/0265272 참조);
하기 화학식을 갖는 SGX523 (SGX) (또한 WO 2008/051808 참조)
또는 항체 또는 관련된 분자, 예를 들어
HGF에 대한 피클라투주맙 (아베오(AVEO)) 모노클로날 항체 (바람직함); MET에 대한 오나르투주맙 (로슈(Roche)) 모노클로날 항체 (바람직함); HGF에 대해 릴로투주맙 (암젠) 모노클로날 항체 (바람직함); HGF에 대한 Tak-701 (다케다(Takeda)) 모노클로날 항체); MET에 대한 LA-480 (일라이 릴리) 모노클로날 항체; 및/또는 MET에 대한 LY.2875358 (일라이 릴리) 모노클로날 항체.
본 발명에 따라 유용한 EGFR 티로신 키나제 억제제 중에, 퀴나졸린아민 부류의 것이 특히 언급될 것이다.
특히, 여기서 WO 96/30347 (이는 그 안에 개시된 일반적 및 구체적 화합물에 대해 본원에 참조로 포함됨)에 개시된 EGFR 티로신 키나제 억제제, 특히 하기 화학식의 4-(치환된 페닐아미노)퀴나졸린 유도체 및 그의 제약상 허용되는 염 및 전구약물
(상기 식에서,
각각의 Ra, Rb, Rc 및 Rd는 독립적으로 수소, 할로, 히드록시, 아미노, 히드록시아미노, 카르복시, C1 - 8알콕시카르보닐, 니트로, 구아니디노, 우레이도, 카르바모일, 시아노, 트리플루오로메틸, (R6)2N-카르보닐 및 페닐-W-알킬로부터 선택되고, 여기서 W는 단일 결합, O, S 및 NH로부터 선택되거나;
또는 각각의 Ra 또는 Rb는 독립적으로 시아노-C1 - 8알킬 및 R9로부터 선택되고, 여기서 R9는 R5, R5O, (R5)2N, R7C(=O), R5ONH, A 및 R5Y로 이루어진 군으로부터 선택되고; 여기서
R5는 C1 - 8알킬이고;
R6은 수소 또는 R5이고, 여기서 R5는 1개 초과가 존재하는 경우에 동일하거나 상이하고;
R7은 R5, R5O 또는 (R6)2N이고;
A는 피페리디노, 모르폴리노, 피롤리디노 및 4-R6-피페라진-1-일, 이미다졸-1-일, 4-피리돈-1-일, 카르복시-C1 - 8알킬, 페녹시, 페닐, 페닐술파닐, C2 - 8알케닐, (R5)2N-카르보닐-C1 - 8알킬로부터 선택되고;
Y는 S, SO, SO2로부터 선택되고; R5, R5O 및 (R5)2N에서의 알킬 모이어티는 할로 또는 R9로 임의로 치환되고, 여기서 R9는 상기와 같이 정의되고, 여기서 생성된 기는 할로 또는 R9로 임의로 치환되며, 단 질소, 산소 또는 황 원자 및 또 다른 헤테로원자는 동일한 탄소 원자에 부착될 수 없고, 추가로 단 Ra 및 Rb는 3개 초과의 R9 단위를 포함할 수 없거나;
또는 각각의 Ra 또는 Rb는 독립적으로 R5-술포닐아미노, 프탈이미도-C1 - 8알킬술포닐아미노, 벤즈아미도, 벤젠술포닐아미노, 3-페닐우레이도, 2-옥소피롤리딘-1-일, 2,5-디옥소피롤리딘-1-일 및 R10-C2 - 4알카노일아미노로부터 선택되고, 여기서 R10은 할로, R5O, C2 - 4알카노일옥시, B7C(=O) 및 (R6)2N으로부터 선택되고; 여기서 Ra 또는 Rb에서의 상기 벤즈아미도 또는 벤젠술포닐아미노 또는 페닐 또는 페녹시 또는 아닐리노 또는 페닐술파닐 치환기는 임의로 1 또는 2개의 할로겐, C1 - 8알킬, 시아노, 메탄술포닐 또는 C1 - 8알콕시 치환기를 보유할 수 있거나;
또는 임의의 2개의 Ra 및 Rb는 이들이 부착되어 있는 탄소와 함께 산소, 황 또는 질소로부터 선택된 1개 또는 2개 이상의 헤테로원자를 포함하는 5-8원 고리를 포함하고; 여기서 알킬 기, 및 알콕시 또는 알킬아미노 기의 알킬 부분은 직쇄형일 수 있거나, 또는 3개 이상의 탄소로 구성되는 경우에 분지형 또는 시클릭일 수 있고;
각각의 Rc 및 Rd는 독립적으로 수소, 임의로 치환된 C1 - 8알킬, 임의로 치환된 아미노, 할로, 히드록시, 임의로 치환된 히드록시; 또는 아지도 또는 R11-에티닐로부터 선택되고, 여기서 R11은 수소, 임의로 치환된 C1 - 8알킬로부터 선택되고, 여기서 치환기는 수소, 아미노, 히드록시, R5O, R5NH 및 (R5)2N으로부터 선택되고;
X는 N 또는 C(CN)이며, 단 치환기 R5는 또 다른 치환기 R5를 포함하지 않을 수 있음);
특히 INN 명칭 에를로티닙 (타르세바(Tarceva)®, 로슈, 스위스 바젤에서 시판됨) = N-(3-에티닐페닐)-6,7-비스-(2-메톡시에톡시)퀴나졸린-4-아민을 갖는 하기 화학식의 화합물 또는 그의 제약상 허용되는 염
이 제1 군으로서 언급될 것이다. 상기 화합물 및 그의 제조는 예를 들어 WO 9630347, 실시예 20에 개시되어 있다.
특히, 여기서 WO 96/33980 또는 US 5,616,582 (이들은 그 안에 개시된 일반적 및 구체적 화합물에 대해 본원에 참조로 포함됨)에 개시된 EGFR 티로신 키나제 억제제, 특히 하기 화학식의 4-(치환된 페닐아미노)퀴나졸린 유도체 또는 그의 제약상 허용되는 염 또는 전구약물
(상기 식에서,
X는 N이고;
Ra는 C1 - 8알킬옥시이고;
Rb는 디-(C1 - 8알킬)-아미노-C1 - 8알콕시, 피롤리딘-1-일-C1 - 8알콕시, 피페리디노-C1 - 8알콕시, 모르폴리노-C1 - 8알콕시, 피페라진-1-일-C1 - 8알콕시, 4-C1 - 8알킬피페라진-1-일-C1 - 8알콕시, 이미다졸-1-일-C1 - 8알콕시, 디-(C1 - 8알콕시-C1 - 8알킬)-아미노-C1 - 8알콕시, 티오모르폴리노-C1 - 8알콕시, 1-옥소티오모르폴리노-C1 - 8알콕시 또는 1,1-디옥소티오모르폴리노-C1 - 8알콕시이고, 여기서 N 또는 O 원자에 부착되지 않은 CH2 (메틸렌) 기를 포함하는 임의의 상기 언급된 Rb 치환기는 임의로 상기 CH2 기 상에 히드록시 치환기를 보유하고;
각각의 Rc 및 Rd는 서로 독립적으로 할로, 트리플루오로메틸 또는 C1 - 8알킬임);
가장 특히 INN 명칭 게피티닙 (이레사(Iressa)®, 아스트라제네카(AstraZeneca)에서 시판됨) = N-(3-클로로-4-플루오로페닐)-7-메톡시-6-[3-(모르폴린-4-일)프로폭시]퀴나졸린-4-아민을 갖는 하기 화학식의 화합물 또는 그의 제약상 허용되는 염 (W=96/33980, 실시예 1 참조)
이 제2 군으로서 언급될 것이다. 상기 화합물 또는 그의 제약상 허용되는 염은 본 발명의 실시양태에서 특히 바람직하다.
특히, 여기서 US 6,391,874, US 7,157,466, US 6,828,320, US 6,713,485 및 특히 US 6,727,256 (= WO9935146) (이들은 그 안에 개시된 일반적 및 구체적 화합물에 대해 본원에 참조로 포함됨)에 개시된 EGFR 티로신 키나제 억제제, 특히 하기 화학식의 4-(치환된 페닐아미노)퀴나졸린 유도체 또는 그의 제약상 허용되는 염 또는 전구약물
(상기 식에서, X는 N이고;
Ra 및 Rb 중 하나는 기 CH3SO2CH2CH2NHCH2-Ar-이고, 여기서 Ar은 페닐, 푸라닐, 티오페닐, 피롤릴 및 티아졸릴로부터 선택되고, 이들 각각은 1 또는 2개의 할로, C1 - 8알킬 및 C1 - 8알콕시로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 임의로 치환될 수 있고; Ra 및 Rb 중 다른 것은 수소, 할로, 히드록시, C1 -8알킬, C1 - 8알콕시, C1 - 8알킬아미노 및 디(C1-8알킬)아미노로 이루어진 군으로부터 선택되고;
Rc 및 Rd 중 하나는 벤질, 할로-, 디할로- 또는 트리할로벤질, 트리할로메틸벤질, 벤조일, 피리딜메틸, 피리딜메톡시, 페녹시, 벤질옥시, 할로-, 디할로- 또는 트리할로벤질옥시, 트리할로메틸벤질옥시, 벤젠술포닐 또는 수소를 나타내고;
Rc 및 Rd 중 다른 것은 수소 또는 히드록시, 할로, C1 - 8알킬, C2 - 8알케닐, C2 - 8알키닐, C1 - 8알콕시, 아미노, C1 - 8알킬아미노, 디(C1-8알킬)아미노, C1 - 8알킬티오, C1 - 8알킬술피닐, C1 - 8알킬술포닐, C1 -8알킬카르보닐, 카르복실, 카르바모일, C1 - 8알콕시카르보닐, C1 - 8알카노일아미노, N-(C1 - 8알킬)카르바모일, N,N-디(C1-8알킬)카르바모일, 시아노, 니트로 또는 트리플루오로메틸임);
보다 특히 INN 명칭 라파티닙 (타이커브(Tykerb)® (USA), 타이버브(Tyverb)® (EP), 글락소스미스클라인에서 시판됨)을 갖는 명칭 N-[3-클로로-4-(3-플루오로벤질옥시)페닐]-6-{5-[4-(메틸술포닐)-2-아자부틸]-2-푸릴} 퀴나졸린-4-아민을 갖는 하기의 화합물 또는 그의 제약상 허용되는 염 또는 전구약물 (예를 들어 WO9935146 (실시예 29) 참조)
이 제3 군으로서 언급될 것이다.
특히, 여기서 WO97/38983 또는 특히 WO2000031048 (이들은 그 안에 개시된 일반적 및 구체적 화합물에 대해 본원에 참조로 포함됨)에 개시된 EGFR 티로신 키나제 억제제, 특히 하기 화학식의 4-(치환된 페닐아미노)퀴나졸린 유도체 또는 그의 제약상 허용되는 염 또는 전구약물
(상기 식에서,
X는 N이고,
Ra는 -D-E-F이고, Rb는 -SR4 *, 할로, -OR4 *, -NHR3 * 또는 수소이거나, 또는
Rb는 -D-E-F이고, Ra는 -SR4 *, 할로, -OR4 *, -NHR3 * 또는 수소이고,
여기서, 각각,
D는 -N(R2 *)-, -O-, -CH(R2 *)-, -N(R2 *)-NH-, -N(R2 *)-O-, -CH(R2 *)-NH-, -CH(R2 *)-O-, -CH(R2*)-CH2-, -NH-CH(R2 *)-, -O-CH(R2 *)-, -S-CH(R2 *)-이거나 또는 부재하고;
E는 -C(=O)-, -S(=O)2-, -P(=O)(OR2 *)- 또는 -S(=O)-이고,
F는 -C(R1 *)=CHR5 *, -C≡C-R5 * 또는 -C(R1 *)=C=CHR5 *이며;
단 E가 S(=O)2- 또는 -S(=O)-인 경우에, D는 -NH-CH(R2 *)- 또는 -O-CH(R2 *)-가 아니고;
R1 *는 수소, 할로겐 또는 C1 - 8알킬이고,
R2 *, R3 * 및 R4 *는 독립적으로 수소, C1 - 8알킬, -(CH2)n*-N-피페리디닐, -(CH2)n*-N-피페라지닐, -(CH2)n*-N1-피페라지닐(N4-C1 - 6알킬), -(CH2)n*-N-피롤리디닐, -(CH2)n*-N-피리디닐, -(CH2)n*-N-이미다졸릴, -(CH2)n*-N-모르폴리닐, -(CH2)n*-N-티오모르폴리닐, -(CH2)n*-N-헥소히드로아제피닐 또는 치환된 C1 - 8알킬이고, 여기서 치환기는 -OH, -NH2 또는 -N(B*)(A*)로부터 선택되고, 여기서 A* 및 B*는 독립적으로 수소, C1 - 8알킬, -(CH2)n*-OH, -(CH2)n*-N-피페리디닐, -(CH2)n*-N-피페라지닐, -(CH2)n*-N1-피페라지닐(N4-C1 - 8알킬), -(CH2)n*-N-피롤리디닐, -(CH2)n*-N-피리딜 및 -(CH2)n*-N-이미다졸릴이고;
Rc 및 Rd는 독립적으로 수소, 할로, C1 - 8알킬, C3 - 8시클로알킬, C1 - 8알콕시, C3 -8시클로알콕시, 니트로, C1 - 8퍼플루오로알킬, 히드록시, C1 - 8아실옥시, 아미노, -NH(C1-8알킬), -N(C1 - 8알킬)2, -NH(C3 - 8시클로알킬), -NH(C3 - 8시클로알킬)2, 히드록시메틸, C1 - 8아실, 시아노, 아지도, C1 - 8티오알킬, C1 - 8술피닐알킬, C1 - 8술포닐알킬, C3 - 8티오시클로알킬, C3 - 8술피닐시클로알킬, C3 - 8술포닐시클로알킬, 메르캅토, C1 - 8알콕시카르보닐, C3 - 8시클로알콕시카르보닐, C2 - 8알케닐, C4 - 8시클로알케닐 또는 C2 - 8알키닐이고;
R5 *는 수소, 할로, C1 - 6퍼플루오로알킬, 1,1-디플루오로-C1 - 6알킬, C1 - 6알킬, -(CH2)n*-N-피페리디닐, -(CH2)n*-N-피페라지닐, -(CH2)n*-N1-피페라지닐(N4-C1 - 8알킬), -(CH2)n*-N-피롤리디닐, -(CH2)n*-N-피리딜, -(CH2)n*-N-이미다졸릴, -(CH2)n*-N-모르폴리닐, -(CH2)n*-N-티오모르폴리닐, -CH=CH2, -CH=CH-C1 - 8알킬, -(CH2)n*-N-헥사히드로아제피닐, -(CH2)n*-NH2, -(CH2)n*-NH-(C1 -8)알킬, -(CH2)n*-N(C1 - 8알킬)2, -1-옥소-C1-8알킬, 카르복시, C1 - 8알콕시카르보닐, N-C1 - 8알킬-카르바모일, 페닐 또는 치환된 페닐이고, 여기서 페닐은 Rc 및 Rd, 또는 피리딜, 티에닐 및 이미다졸릴로 이루어진 군으로부터 선택된 모노시클릭 헤테로아릴 기로부터 독립적으로 선택된 1 내지 3개의 치환기를 가질 수 있고, R5 *에서의 상기 각각의 C1 - 8알킬 기는 -OH, -NH2 또는 NA*B*로 치환될 수 있고, 여기서 A* 및 B*는 상기 정의된 바와 같고;
R6 *는 수소 또는 C1 - 8알킬이고;
n*는 1 내지 8, 특히 1 내지 4임);
특히 INN 명칭 카네르티닙 (화이자) (예를 들어 디히드로클로라이드로서 사용됨) N-[4-[(3-클로로-4-플루오로페닐)아미노]-7-(3-모르폴린-4-일프로폭시)퀴나졸린-6-일]프로프-2-엔아미드를 갖는 하기 화학식의 화합물 또는 그의 제약상 허용되는 염 또는 전구약물 (특히 WO2000031048 참조)
이 제4 군으로서 언급될 것이다.
특히, 여기서 WO2005028443 (이는 그 안에 개시된 일반적 및 구체적 화합물에 대해 본원에 참조로 포함됨)에 개시된 EGFR 티로신 키나제 억제제, 특히 하기 화학식의 4-(치환된 페닐아미노)퀴나졸린 유도체 또는 그의 제약상 허용되는 염 또는 전구약물
(상기 식에서, X는 C-CN이고;
Ra는 C1 - 8알콕시이고;
Rb는 아미노- 또는 N-[N'-모노- 또는 N',N'-디(C1 - 8알킬)]아미노}-C4 - 8알케노일)-아미노이고;
Rc는 할로 또는 R2**-(CH2)n**-R3**-이고,
여기서 R2**는 C1 - 8알킬, C1 - 8알콕시 및 할로겐으로부터 선택된 3개 이하의 치환기로 각각 임의로 치환된 피리딜, 티오페닐, 피리미디닐, 티아졸릴 또는 페닐이고, R3**는 -O- 또는 -S-이고, n**는 0 내지 8, 바람직하게는 0 또는 1이고;
Rd는 할로임);
특히 INN 명칭 펠리티닙 (와이어쓰(Wyeth), 화이자에 의해 소유됨)을 갖는 명칭 (2E)-N-[4-[(3-클로로-4-플루오로페닐)아미노]-3-시아노-7-에톡시-6-퀴놀리닐]-4-(디메틸아미노)-2-부텐아미드를 갖는 하기 화학식의 화합물 (WO2005028443 (실시예 20) 참조)
또는 INN 명칭 네라티닙 (화이자 인크.), (2E)-N-[4-[[3-클로로-4-[(피리딘-2-일)메톡시]페닐]아미노]-3-시아노-7-에톡시퀴놀린-6-일]-4-(디메틸아미노)부트-2-엔아미드를 갖는 하기 화학식의 화합물 (예를 들어 WO2005028443 실시예 2 참조)
또는 각각의 그의 제약상 허용되는 염 또는 전구약물이 제5 군으로서 언급될 것이다.
가능한 EGFR 억제제 중에서, 또한 항체가 언급될 수 있고, 예를 들어 표피 성장 인자 수용체 (EGFR) 억제제로서 활성인 키메라 (마우스/인간) 모노클로날 항체인 세툭시맙 (에르비툭스(Erbitux)®) (임클론 시스템즈(ImClone Systems), 브리스톨-마이어스 스큅(Bristol-Myers Squibb) 및 머크 카게아아(Merck KgaA))가 있으며, 이는 예를 들어 정맥내로 투여될 수 있다.
각 경우에 본 발명 실시양태의 특정한 실시양태는 하기 화학식의 EGFR 억제제 또는 각각의 그의 제약상 허용되는 염 또는 전구약물에 관한 것이다.
상기 식에서,
X는 N 또는 C(CN)이고;
Ra는 C1 - 8알킬옥시 또는 (C1 - 8알킬옥시, 1-피페리딘-1-일, 1-피페라진-1-일, 4-C1 - 8알킬-피페라진-1-일, 모르폴린-1-일, 티오모르폴리노-1-일, S-옥소-티오모르폴린-1-일 또는 S,S-디옥소티오모르폴리닐-1-일)-C1 - 8알킬옥시로 이루어진 군으로부터 선택되고;
Rb는 C3 - 8알케노일, {아미노- 또는 N-[N'-모노- 또는 N',N'-디(C1 - 8알킬)]아미노}-C4 - 8알케노일)-아미노, [(C1 - 8알킬술포닐-C1 - 8알킬아미노)-C1 - 8알킬]-푸릴 또는 (C1 -8알킬옥시, 1-피페리딘-1-일, 1-피페라진-1-일, 4-C1 - 8알킬-피페라진-1-일, 모르폴린-1-일, 티오모르폴린-1-일, S-옥소-티오모르폴린-1-일 또는 S,S-디옥소티오모르폴리닐-1-일)-C1 - 8알킬옥시로부터 선택되고;
Rc는 할로 또는 C2 - 8알키닐이고;
Rd는 수소, 피리디닐-C1 - 8알킬옥시 또는 비치환된 또는 할로겐 치환된 페닐-C1 - 8알킬옥시이고;
특히 상기 식에서:
X는 N 또는 C(CN)이고;
Ra는 메톡시, 에톡시, 3-모르폴리노프로필옥시 또는 2-메톡시에톡시이고;
Rb는 4-(디메틸아미노)-부트-2-에노일아미노, 프로프-2-에노일아미노, 5-[(2-메틸술포닐-에틸)-아미노메틸]-푸란-2-일, 2-메톡시에톡시 또는 3-모르폴리노프로폭시이고;
Rc는 클로로 또는 에티닐이고;
Rd는 수소, 플루오로, 피리딘-2-일메톡시 또는 3-플루오로페닐-메톡시이다.
달리 언급되지 않는 한, 하기 정의는 구체적인 변형에 의해 상기 및 하기에 사용되는 보다 일반적 표현을 정의하며, 따라서 하나, 하나 초과 또는 모든 일반적 표현이 이들 하기 정의에 의해 정의되는 보다 특정한 본 발명의 실시양태를 정의하고자 한다.
상기 및 하기 정의에서, C1 -8은 바람직하게는 C1 -6, 보다 바람직하게는 C1 -4이며, 이는 각각 1 내지 8개, 1 내지 6개 또는 1 내지 4개의 탄소 원자를 갖는 선형 또는 분지형 모이어티를 의미한다.
상기 및 하기 정의에서, C2 -8은 바람직하게는 C2 -6, 보다 바람직하게는 C2 -4이며, 이는 각각 2 내지 8개, 2 내지 6개 또는 2 내지 4개의 탄소 원자를 갖는 선형 또는 분지형 모이어티를 의미한다.
상기 및 하기 정의에서, C3 -8은 바람직하게는 C3 -6, 보다 바람직하게는 C3 -4이며, 이는 각각 3 내지 8개, 3 내지 6개 또는 3 내지 4개의 탄소 원자를 갖는 모이어티를 의미한다.
상기 및 하기 정의에서, C4 -8은 바람직하게는 C4 -6, 보다 바람직하게는 C4이며, 이는 각각 4 내지 8개, 4 내지 6개 또는 4개의 탄소 원자를 갖는 선형 또는 분지형 모이어티를 의미한다.
달리 정의되지 않는 한, "저급"은 8개 이하, 특히 6개 이하의 탄소 원자를 갖는 기를 지칭한다. 예를 들어, 저급 알킬은 C1 -8 알킬, 예를 들어 C1 -6 알킬, 예컨대 메틸, 에틸, n-프로필, 이소프로필, n-부틸, sec-부틸, 이소부틸 또는 tert-부틸을 지칭한다.
본 명세서의 다양한 곳에서, 본 발명에 따라 유용한 화합물의 치환기는 군 또는 범위로 개시된다. 이는 구체적으로 본 발명이 이러한 군 및 범위의 구성원 중 각각 및 모든 개별 하위조합을 포함하는 것으로 의도된다. 예를 들어, 용어 "C1 -6 알킬"은 구체적으로 메틸, 에틸, C3 알킬, C4 알킬, C5 알킬 및 C6 알킬을 개별적으로 개시하는 것으로 의도된다.
추가로, 본 발명에 따라 유용한 화합물은 안정한 것으로 의도된다. 본원에서 사용되는 "안정한"은 반응 혼합물로부터 유용한 순도 등급으로의 단리에서 살아남기에 충분히 강건하고, 바람직하게는 효과적인 치료제로 제제화될 수 있는 화합물을 지칭한다.
추가로, 명확성을 위해 개별 실시양태의 문맥으로 기재된 본 발명의 특정 특징은 또한 단일 실시양태와 조합하여 제공될 수 있는 것으로 이해된다. 반대로, 간결성을 위해 단일 실시양태의 문맥으로 기재된 본 발명의 다양한 특징은 또한 개별적으로 또는 임의의 적합한 하위조합으로 제공될 수 있다.
본원에 사용된 용어 "알킬" (또한 알콕시, 아릴알킬, 헤테로아릴알킬, 할로알킬 등에서)은 직쇄형 또는 분지형인 포화 탄화수소 기를 지칭하는 것으로 의도된다. 예를 들어, 알킬 기는 메틸 (Me), 에틸 (Et), 프로필 (예를 들어, n-프로필 및 이소프로필), 부틸 (예를 들어, n-부틸, 이소부틸, t-부틸), 펜틸 (예를 들어, n-펜틸, 이소펜틸, 네오펜틸) 등을 포함한다. 알킬 기는 1 내지 약 20개, 2 내지 약 20개, 1 내지 약 10개, 1 내지 약 8개, 1 내지 약 6개, 1 내지 약 4개 또는 1 내지 약 3개의 탄소 원자를 함유할 수 있다.
본원에 사용된 용어 "알킬렌"은 연결 알킬 기를 지칭한다.
본원에 사용된 "알케닐"은 1개 이상의 이중 탄소-탄소 결합을 갖는 알킬 기를 지칭한다. 예를 들어, 알케닐 기는 에테닐, 프로페닐 등을 포함한다.
본원에 사용된 "알케닐렌"은 연결 알케닐 기를 지칭한다.
본원에 사용된 "알키닐"은 1개 이상의 삼중 탄소-탄소 결합을 갖는 알킬 기를 지칭한다. 예를 들어, 알키닐 기는 에티닐, 프로피닐 등을 포함한다.
본원에 사용된 "알키닐렌"은 연결 알키닐 기를 지칭한다.
본원에 사용된 "할로알킬"은 1개 이상의 할로겐 치환기를 갖는 알킬 기를 지칭한다. 예를 들어, 할로알킬 기는 CF3, C2F5, CHF2, CCl3, CHCl2, C2Cl5 등을 포함한다.
본원에 사용된 "아릴"은 모노시클릭 또는 폴리시클릭 (예를 들어, 2, 3 또는 4개의 융합된 고리를 가짐) 방향족 탄화수소, 예컨대, 예를 들어 페닐, 나프틸, 안트라세닐, 페난트레닐, 인다닐, 인데닐 등을 지칭한다. 일부 실시양태에서, 아릴 기는 6 내지 약 20개의 탄소 원자를 갖는다.
본원에 사용된 "아릴렌"은 연결 아릴 기를 지칭한다.
본원에 사용된 "시클로알킬"은 고리화 알킬, 알케닐 및 알키닐 기를 비롯한 비-방향족 카르보사이클을 지칭한다. 시클로알킬 기는 스피로사이클을 비롯한 모노- 또는 폴리시클릭 (예를 들어, 2, 3 또는 4개의 융합된 고리를 가짐) 고리계를 포함할 수 있다. 일부 실시양태에서, 시클로알킬 기는 3 내지 약 20개의 탄소 원자, 3 내지 약 14개의 탄소 원자, 3 내지 약 10개의 탄소 원자, 또는 3 내지 7개의 탄소 원자를 가질 수 있다. 시클로알킬 기는 추가로 0, 1, 2 또는 3개의 이중 결합 및/또는 0, 1 또는 2개의 삼중 결합을 가질 수 있다. 또한, 시클로알킬의 정의에는 시클로알킬 고리에 융합된 (즉, 그와 공통된 결합을 갖는) 1개 이상의 방향족 고리를 갖는 모이어티, 예를 들어 펜탄, 펜텐, 헥산 등의 벤조 유도체가 포함된다. 하나 이상의 융합된 방향족 고리를 갖는 시클로알킬 기는 방향족 또는 비-방향족 부분을 통해 부착될 수 있다. 시클로알킬 기의 1개 이상의 고리-형성 탄소 원자는 산화될 수 있으며, 예를 들어 옥소 또는 술피도 치환기를 가질 수 있다. 예를 들어, 시클로알킬 기는, 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸, 시클로펜테닐, 시클로헥세닐, 시클로헥사디에닐, 시클로헵타트리에닐, 노르보르닐, 노르피닐, 노르카르닐, 아다만틸 등을 포함한다.
본원에 사용된 "시클로알킬렌"은 연결 시클로알킬 기를 지칭한다.
본원에 사용된, "헤테로아릴" 기는 1개 이상의 헤테로원자 고리원, 예컨대 황, 산소 또는 질소를 갖는 방향족 헤테로사이클을 지칭한다. 헤테로아릴 기는 모노시클릭 및 폴리시클릭 (예를 들어, 2, 3 또는 4개의 융합된 고리를 가짐) 계를 포함한다. 헤테로아릴 기에서 임의의 고리-형성 N 원자는 또한 N-옥소 모이어티를 형성하기 위해 산화될 수 있다. 헤테로아릴 기의 예는 비제한적으로 피리딜, N-옥소피리딜, 피리미디닐, 피라지닐, 피리다지닐, 트리아지닐, 푸릴, 퀴놀릴, 이소퀴놀릴, 티에닐, 이미다졸릴, 티아졸릴, 인돌릴, 피릴, 옥사졸릴, 벤조푸릴, 벤조티에닐, 벤즈티아졸릴, 이속사졸릴, 피라졸릴, 트리아졸릴, 테트라졸릴, 인다졸릴, 1,2,4-티아디아졸릴, 이소티아졸릴, 벤조티에닐, 퓨리닐, 카르바졸릴, 벤즈이미다졸릴, 인돌리닐 등을 포함한다. 일부 실시양태에서, 헤테로아릴 기는 1 내지 약 20개의 탄소 원자를 가지고, 추가 실시양태에서 약 3 내지 약 20개의 탄소 원자를 갖는다. 일부 실시양태에서, 헤테로아릴 기는 3 내지 약 14개, 3 내지 약 7개, 또는 5 내지 6개의 고리-형성 원자를 함유한다. 일부 실시양태에서, 헤테로아릴 기는 1 내지 약 4개, 1 내지 약 3개 또는 1 내지 2개의 헤테로원자를 갖는다.
본원에 사용된 "헤테로아릴렌"은 연결 헤테로아릴 기를 지칭한다.
본원에 사용된 "헤테로시클로알킬" 또는 "헤테로시클릴"은 고리-형성 원자 중 1개 이상이 헤테로원자, 예컨대 O, N 또는 S 원자인 비-방향족 헤테로사이클을 지칭한다. 헤테로시클로알킬 기는 모노- 또는 폴리시클릭 (예를 들어, 2, 3 또는 4개의 융합된 고리를 가짐) 고리계 뿐만 아니라 스피로사이클을 포함할 수 있다. 예를 들어, "헤테로시클로알킬" 기는 모르폴리노, 티오모르폴리노, 피페라지닐, 테트라히드로푸라닐, 테트라히드로티에닐, 2,3-디히드로벤조푸릴, 1,3-벤조디옥솔, 벤조-1,4-디옥산, 피페리디닐, 피롤리디닐, 이속사졸리디닐, 이소티아졸리디닐, 피라졸리디닐, 옥사졸리디닐, 티아졸리디닐, 이미다졸리디닐 등을 포함한다. 또한, 헤테로시클로알킬의 정의에는 비방향족 헤테로시클릭 고리에 융합된 (즉, 그와 공통된 결합을 갖는) 1개 이상의 방향족 고리를 갖는 모이어티, 예를 들어 프탈이미딜, 나프탈이미딜 및 헤테로사이클의 벤조 유도체가 포함된다. 1개 이상의 융합된 방향족 고리를 갖는 헤테로시클로알킬 기는 방향족 또는 비-방향족 부분을 통해 부착될 수 있다. 또한, 헤테로시클로알킬의 정의에는 1개 이상의 고리-형성 원자가 1 또는 2개의 옥소 또는 술피도 기에 의해 치환된 모이어티가 포함된다. 일부 실시양태에서, 헤테로시클로알킬 기는 1 내지 약 20개의 탄소 원자를 가지고, 추가 실시양태에서 약 3 내지 약 20개의 탄소 원자를 갖는다. 일부 실시양태에서, 헤테로시클로알킬 기는 3 내지 약 20개, 3 내지 약 14개, 3 내지 약 7개, 또는 5 내지 6개의 고리-형성 원자를 함유한다. 일부 실시양태에서, 헤테로시클로알킬 기는 1 내지 약 4개, 1 내지 약 3개, 또는 1 내지 2개의 헤테로원자를 갖는다. 일부 실시양태에서, 헤테로시클로알킬 기는 0 내지 3개의 이중 결합을 함유한다. 일부 실시양태에서, 헤테로시클로알킬 기는 0 내지 2개의 삼중 결합을 함유한다.
본원에 사용된 "헤테로시클로알킬렌"은 연결 헤테로시클로알킬 기를 지칭한다.
본원에 사용된 "비아릴"은 또 다른 아릴 기에 의해 치환된 아릴 기를 지칭한다.
본원에 사용된 "비헤테로아릴"은 또 다른 헤테로아릴 기에 의해 치환된 헤테로아릴 기를 지칭한다.
본원에 사용된 "할로" 또는 "할로겐"은 플루오로, 클로로, 브로모 및 아이오도를 포함한다.
본원에 사용된 "알콕시"는 -O-알킬 기를 지칭한다. 예를 들어, 알콕시 기는 메톡시, 에톡시, 프로폭시 (예를 들어, n-프로폭시 및 이소프로폭시), t-부톡시 등을 포함한다.
본원에 사용된 "아실"은, 예를 들어 히드록실 기가 제거된 유기 산의 잔기에 상응하는 유기 라디칼, 즉 화학식 RA-C(O)-를 갖는 라디칼을 포함하며, 여기서 RA는 특히 지방족 또는 치환된 지방족일 수 있거나 또는 예를 들어 치환 또는 비치환된 모노- 또는 비-시클릭 고리일 수 있다. 따라서, R은 저급 C1 -C6 알킬, C3 -C7 시클로알킬, 페닐, 벤질 또는 페네틸 기로부터 선택될 수 있다. 그 중에서도, 예시적인 아실은 알킬-카르보닐이다. 아실 기의 예는 아세틸, 프로피오닐 및 부티릴을 포함하나, 이에 제한되지는 않는다. 저급 아실은 예를 들어 포르밀 또는 저급 알킬카르보닐, 특히 아세틸이다.
MET 및 FGFR 억제제는 상기 언급된 특허 출원 및 특허에 기재된 바와 같이 제조될 수 있으며, 이는 또한 특히 그의 제조 방법에 대해 참조로 포함된다.
본 발명에 따라 유용한 화합물은 또한 중간체 또는 최종 화합물 내에서 발생하는 원자의 모든 동위원소를 포함할 수 있다. 동위원소는 동일한 원자 번호를 갖지만 상이한 질량수를 갖는 원자를 포함한다. 본 발명의 화합물 내로 혼입될 수 있는 동위원소의 예는 수소, 탄소, 질소, 산소, 인, 플루오린 및 염소의 동위원소, 예컨대 각각 2H, 3H, 11C, 13C, 14C, 15N, 18F, 31P, 32P, 35S, 36Cl, 125I를 포함한다. 본 발명의 다양한 동위원소 표지된 화합물은, 예를 들어 방사성 동위원소, 예컨대 3H, 13C 및 14C가 혼입된 것이다. 이러한 동위원소 표지된 화합물은 대사 연구 (바람직하게는, 14C를 가짐), 반응 동역학적 연구 (예를 들어, 2H 또는 3H를 가짐), 검출 또는 영상화 기술 [예컨대 양전자 방출 단층촬영 (PET) 또는 단일-광자 방출 컴퓨터 단층촬영 (SPECT)], 예를 들어 약물 또는 기질 조직 분포 검정, 또는 환자의 방사성 치료에 유용하다. 특히, 18F 또는 표지된 화합물이 PET 또는 SPECT 연구에 특히 바람직할 수 있다. 추가로, 보다 무거운 동위원소, 예컨대 중수소 (즉, 2H)로의 치환은 보다 큰 대사 안정성, 예를 들어 증가된 생체내 반감기 또는 감소된 투여량 요건으로부터 야기되는 특정의 치료 이점을 제공할 수 있다. 본 발명의 동위원소 표지된 화합물 및 그의 전구약물은 일반적으로 용이하게 이용가능한 동위원소 표지된 시약으로 동위원소 표지되지 않은 시약을 치환함으로써 하기 기재된 반응식 또는 실시예 및 제조예에 개시된 절차를 수행함으로써 제조될 수 있다.
추가로, 보다 무거운 동위원소, 특히 중수소 (즉, 2H 또는 D)로의 치환은 보다 큰 대사 안정성, 예를 들어 증가된 생체내 반감기 또는 감소된 투여량 요건 또는 치료 지수의 개선으로부터 야기되는 특정의 치료 이점을 제공할 수 있다. 이러한 문맥에서 중수소는 화학식 I의 화합물의 치환기로서 간주되는 것으로 이해된다. 이러한 보다 무거운 동위원소, 구체적으로 중수소의 농도는, 동위원소 농축 계수에 의해 규정될 수 있다. 본원에 사용된 용어 "동위원소 농축 계수"는 특정된 동위원소의 동위원소 존재비와 천연 존재비 사이의 비율을 의미한다. 본 발명의 화합물 내 치환기가 표시된 중수소인 경우에, 이러한 화합물은 각각의 지정된 중수소 원자에 대해 적어도 3500 (각각의 지정된 중수소 원자에서 52.5% 중수소 혼입), 적어도 4000 (60% 중수소 혼입), 적어도 4500 (67.5% 중수소 혼입), 적어도 5000 (75% 중수소 혼입), 적어도 5500 (82.5% 중수소 혼입), 적어도 6000 (90% 중수소 혼입), 적어도 6333.3 (95% 중수소 혼입), 적어도 6466.7 (97% 중수소 혼입), 적어도 6600 (99% 중수소 혼입) 또는 적어도 6633.3 (99.5% 중수소 혼입)의 동위원소 농축 계수를 갖는다. 본 발명의 화합물에서, 특정한 동위원소로서 구체적으로 지정되지 않은 임의의 원자는 상기 원자의 임의의 안정성 동위원소를 나타내는 것을 의미한다. 달리 언급되지 않는 한, 위치가 "H" 또는 "수소"로서 구체적으로 지정된 경우에, 상기 위치는 그의 천연 존재비 동위원소 조성물에 수소를 갖는 것으로 이해된다. 따라서, 본 발명의 화합물에서 중수소 (D)로서 구체적으로 지정된 임의의 원자는, 예를 들어 상기 제시된 범위의 중수소를 나타내는 것을 의미한다.
본 발명에 따른 조합 제품의 일부를 형성하는 동위원소-표지된 MET 및/또는 EGFR 티로신 키나제 억제제 화합물은 일반적으로 당업자에게 공지된 통상의 기술에 의해 또는 첨부된 실시예 및 제조예에 기재된 방법과 유사한 방법에 의해 이전에 사용된 비-표지된 시약 대신 적절한 동위원소-표지된 시약을 사용하여 제조될 수 있다.
본 발명의 실시양태는 또한 본원에 기재된 본 발명에 따라 유용한 화합물의 제약상 허용되는 염을 포함한다. 본원에 사용된 "제약상 허용되는 염"은 모 화합물이 기존의 산 또는 염기 모이어티를 그의 염 형태로 전환시킴으로써 변형된 것인 개시된 화합물의 유도체를 지칭한다. 제약상 허용되는 염의 예는 염기성 잔기, 예컨대 아민의 무기 또는 유기 산 염; 산성 잔기, 예컨대 카르복실산의 알칼리 또는 유기 염 등을 포함하나, 이에 제한되지는 않는다. 본 발명의 제약상 허용되는 염은, 예를 들어 비-독성 무기 또는 유기 산으로부터 형성된 모 화합물의 통상의 비-독성 염을 포함한다. 본 발명의 제약상 허용되는 염은 통상의 화학적 방법에 의해 염기성 또는 산성 모이어티를 함유하는 모 화합물로부터 합성될 수 있다. 일반적으로, 이러한 염은 물 또는 유기 용매 중에서, 또는 둘의 혼합물 중에서 유리 산 또는 염기 형태의 이들 화합물을 화학량론적 양의 적절한 염기 또는 산과 반응시킴으로써 제조할 수 있고; 일반적으로, 에테르, 에틸 아세테이트, 에탄올, 이소프로판올 또는 아세토니트릴과 같은 비수성 매질이 바람직하다. 적합한 염의 목록은 문헌 [Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418 및 Journal of Pharmaceutical Science, 66, 2 (1977)]에서 확인되며, 이들 각각은 그 전문이 본원에 참고로 포함된다.
어구 "제약상 허용되는"은 합리적인 의학적 판단의 범주 내에서, 합당한 유익/유해 비에 상응하는, 과도한 독성, 자극, 알레르기 반응, 또는 다른 문제 또는 합병증이 없이 인간 및 동물의 조직과의 접촉에 사용하기에 적합한 화합물, 물질, 조성물 및/또는 투여 형태를 지칭하기 위해 본원에 사용된다.
본 발명은 또한 본 발명에 따라 유용한 화합물의 전구약물을 포함한다. 본원에 사용된 "전구약물"은 포유동물 대상체에게 투여된 경우에 활성 모 약물을 방출하는 임의의 공유 결합된 담체를 지칭한다. 전구약물은 상용 조작으로 또는 생체내에서 모 화합물로 절단되도록 하는 방식으로, 화합물 내에 존재하는 관능기를 변형시킴으로써 제조할 수 있다. 전구약물은 포유동물 대상체에게 투여된 경우에 절단되어 각각 유리 히드록실, 아미노, 술프히드릴 또는 카르복실 기를 형성하는, 히드록실, 아미노, 술프히드릴 또는 카르복실 기가 임의의 기에 결합된 화합물을 포함한다. 전구약물의 예는 본 발명의 화합물 내의 알콜 및 아민 관능기의 아세테이트, 포르메이트 및 벤조에이트 유도체를 포함하나, 이에 제한되지는 않는다. 전구약물의 제조 및 용도는 문헌 [T. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems," Vol. 14 of the A.C.S. Symposium Series, 및 Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987]에서 논의되며, 상기 문헌은 둘다 그 전문이 본원에 참조로 포함된다.
본 발명에 따라 유용한 화합물 (= 각각 본 발명에 따른 조합물, 특히 조합 제품 중에 포함되거나 또는 본 발명에 따라 사용되고, 임의로 또한 하기 정의되는 공동-작용제, 즉 모든 활성 성분을 추가로 포함함), 뿐만 아니라 그의 제약상 허용되는 염 또는 전구약물은 또한 호변이성질체, N-옥시드 또는 용매화물, 예를 들어 수화물로서 존재할 수 있다. 모든 이들 변이체, 뿐만 아니라 그의 임의의 단일 변이체, 또는 둘 이상 내지 이러한 변이체의 전체 미만의 조합물이 포괄되며, 본원에서 본 발명의 조합 제품 내에 포함된 화합물, 예를 들어 EGFR 티로신 키나제 억제제 및/또는 MET 티로신 키나제 억제제가 언급되는 경우에 이들로 해석되어야 한다.
상기 및 하기 언급된 제1 실시양태에 따른 본 발명은 언급된 조합 파트너 및 하나 이상의 제약상 허용되는 담체를 포함하는 제약 조합물, 특히 제약 조합 제품에 관한 것이다.
"조합물"은 조합 사용을 위한 지침을 포함하거나 포함하지 않는 개별 파트너의 제제, 또는 조합 제품을 지칭한다. 따라서, 조합 파트너는 완전 개별 제약 투여 형태 또는 제약 조성물일 수 있고, 이는 또한 서로 독립적으로 시판되며, 여기서 단지, 특히 하기 정의된 바와 같이 연합 활성이 되도록 동시에 또는 순차적으로 사용하기 위한 그의 조합 사용을 위한 지침이 패키지 용품, 예를 들어 리플렛 등, 또는 예를 들어 의사 및 의료진에게 제공되는 다른 정보 (예를 들어 구두 커뮤니케이션, 서면 커뮤니케이션 등)에 제공된다.
"조합 제품"은 특히 하나의 투여 단위 형태 내의 고정 조합물을 지칭하거나, 또는 EGFR 티로신 키나제 억제제 및 MET 티로신 키나제 억제제 및 임의로 추가의 조합 파트너 (예를 들어 또한 "공동-작용제"로 지칭되는, 하기 설명된 바와 같은 기타 약물)가 독립적으로 동시에 또는 시간 간격을 두고 개별적으로 투여될 수 있으며, 특히 여기서 이들 시간 간격은 조합 파트너가 협동 (= 연합), 예를 들어 상승작용 효과를 나타내도록 하는 것인 조합 투여를 위한 부분들의 키트를 지칭한다. 본원에 사용된 용어 "공-투여" 또는 "조합 투여" 등은 선택된 조합 파트너를 이를 필요로 하는 단일 대상체 (예를 들어, 환자)에게 투여하는 것을 포괄하는 것을 의미하고, 작용제가 반드시 동일한 투여 경로에 의해 및/또는 동시에 투여되는 것은 아닌 치료 요법을 포함하는 것으로 의도된다.
따라서, 본원에 사용된 용어 "조합 제품"은 하나 초과의 활성 성분의 혼합 또는 조합으로부터 생성된 제약 제품을 의미하고, 활성 성분 (또한 조합될 수 있음)의 고정 및 비-고정 조합물 둘 다를 포함한다.
용어 "고정 조합물"은 활성 성분, 예를 들어 EGFR 티로신 키나제 억제제 및 MET 티로신 키나제 억제제를 둘 다 환자에게 단일 개체 또는 투여량의 형태로 동시에 투여하는 것을 의미한다. 달리 말하면: 활성 성분들은 하나의 투여 형태 내에, 예를 들어 하나의 정제 내에 또는 하나의 캡슐 내에 존재한다.
용어 "비-고정 조합물"은, 활성 성분을 둘 다 환자에게 개별 개체로서 동시에, 공동으로, 또는 특정 시간 제한 없이 순차적으로 투여하며 여기서 이러한 투여가 환자의 체내에서 두 화합물의 치료상 유효한 수준을 제공하는 것을 의미한다. 후자는 또한 칵테일 요법, 예를 들어 3종 이상의 활성 성분의 투여에 적용된다. 따라서, 용어 "비-고정 조합물"은 특히, 본원에 정의된 바와 같은 조합 파트너 (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제 (및 존재하는 경우에 추가의 하나 이상의 공동-작용제)가 서로 독립적으로 또는 구별되는 양의 조합 파트너를 갖는 상이한 고정 조합물의 사용에 의해, 즉 동시에 또는 상이한 시점에 투여될 수 있으며 여기서 조합 파트너가 또한 완전 개별 제약 투여 형태 또는 제약 제제로서 사용될 수 있고 이는 또한 서로 독립적으로 판매되며 단지 그의 조합 사용의 가능성의 지침이 패키지 용품, 예를 들어 리플렛 등, 또는 예를 들어 의사 및 의료진에게 제공되는 다른 정보 내에 있거나 그에 제공된다는 관점에서 "부분들의 키트"를 정의한다. 이어서, 독립적 제제 또는 부분들의 키트의 부분은, 예를 들어 동시에, 또는 시차를 두고, 즉 상이한 시점에, 및 부분들의 키트의 임의의 부분에 대해 동일하거나 상이한 시간 간격으로 투여될 수 있다. 매우 바람직하게는, 시간 간격은, 부분들의 조합 사용에 있어서 치료되는 질환에 대한 효과가 조합 파트너 (i) 및 (ii) 중 어느 하나만을 사용하여 얻는 효과보다 더 크도록, 따라서 연합 활성이 되도록 선택된다. 예를 들어, 치료되는 환자 하위-집단의 요구 또는 단일 환자의 요구 (환자의 연령, 성별, 체중 등으로 인해 다양한 요구가 있을 수 있음)에 대처하기 위해, 조합 제제로 투여될 조합 파트너 (i) 대 조합 파트너 (ii)의 총량의 비가 달라질 수 있다.
본 발명은 또한 EGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환, 특히 암의 치료 방법에서의 조합 사용을 위한, (i) MET 억제제 및 (ii) EGFR 억제제 또는 그의 제약상 허용되는 염에 관한 것이다.
추가 실시양태에서, 상기 단락에 따른 사용을 위한 MET 억제제 및 EGFR 억제제는 다음과 같이 선택된다: MET 티로신 키나제 억제제는 (E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 및/또는 (특히 또는) 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 또는 각각의 그의 제약상 허용되는 염 또는 전구약물로 이루어진 군으로부터 선택되고,
EGFR 억제제는 게피티닙 및/또는 (특히 또는) 에를로티닙 또는 그의 제약상 허용되는 염 또는 전구약물이다.
임의의 본 발명의 실시양태에서 조합 파트너 (i) 및 (ii)는 바람직하게는 연합 (예방 또는 특히 치료) 활성이도록 제제화되거나 사용된다. 이는 특히 하나 이상의 유익한 효과, 예를 들어 조합 파트너 (i) 및 (ii)의 효과의 상호 증진, 특히 상승작용, 예를 들어 상가 효과를 초과하는 효과, 추가의 유리한 효과 (예를 들어 추가의 치료 효과는 임의의 단일 화합물에 대해 확인되지 않음), 더 적은 부작용, 조합 파트너 (i) 및 (ii) 중 하나 또는 둘 다의 비-유효 투여량에서의 조합 치료 효과, 및 매우 바람직하게는 조합 파트너 (i) 및 (ii)의 명백한 상승작용을 의미한다.
예를 들어, 용어 "연합 (치료) 활성"은 화합물이 바람직하게는 치료되는 온혈 동물, 특히 인간에서 여전히 (바람직하게는 상승작용적) 상호작용 (연합 치료 효과)을 나타내도록 하는 시간 간격으로 개별적으로 또는 순차적으로 (시차를 두는 방식, 특히 순서-특이적 방식으로) 제공될 수 있다는 것을 의미할 수 있다. 특히, 연합 치료 효과는 화합물 둘 다가 적어도 특정 시간 간격 동안에 치료되는 인간의 혈액 내에 존재하는 것을 보여주는 혈액 수준에 따라 결정될 수 있으나, 이는 화합물이 혈액 중에 동시에 존재하지 않더라도 연합 활성인 경우를 배제하지는 않는다.
따라서, 본 발명은 동시, 개별 또는 순차적 사용을 위한 조합 제품, 예컨대 조합 제제 또는 제약 고정 조합물, 또는 이러한 제제 및 조합물의 조합물에 관한 것이다.
본 발명의 조합 요법에서, 본 발명에 따라 유용한 화합물은 동일하거나 상이한 제조업체에 의해 제조 및/또는 제제화될 수 있다. 더욱이, 조합 파트너는 (i) 의사로부터 조합 제품으로 배포되기 전에 (예를 들어, 본 발명의 화합물 및 다른 치료제를 포함하는 키트의 경우); (ii) 투여 직전에 의사 자신에 의해 (또는 의사 지시 하에서); (iii) 예를 들어 본 발명의 화합물 및 다른 치료제의 순차 투여 동안에 환자 자신에서, 조합 요법으로 합해질 수 있다.
특정 실시양태에서, 임의의 상기 방법은 하나 이상의 다른 (예를 들어 제3) 공동-작용제, 특히 화학요법제를 추가로 투여하는 것을 포함한다.
따라서, 추가 실시양태에서 본 발명은 치료 유효량의 (i) EGFR 티로신 키나제 억제제 및 (ii) MET 티로신 키나제 억제제 또는 각각의 그의 제약상 허용되는 염, 및 하나 이상의 제3 치료 활성제 (공동-작용제), 예를 들어 또 다른 화합물 (i) 및/또는 (ii) 또는 상이한 공동-작용제를 포함하는 조합 제품, 특히 제약 조성물에 관한 것이다. 추가의 공동-작용제는 바람직하게는 항암제; 항염증제로 이루어진 군으로부터 선택된다.
또한 이 경우에, 본 발명에 따른 상응하는 제품을 형성하는 조합 파트너는 혼합되어 고정 제약 조성물을 형성할 수 있거나, 또는 이들은 개별적으로 또는 쌍을 이루어 (즉, 다른 약물 물질(들) 전에, 그와 동시에 또는 그 후에) 투여될 수 있다.
게다가 또는 추가로, 본 발명에 따른 조합 제품은 화학요법, 방사선요법, 면역요법, 외과적 개입 또는 이들의 조합과 조합되어 특히 암 요법을 위해 투여될 수 있다. 장기 요법이 상기 기재된 바와 같은 다른 치료 전략과 관련하여 아주반트 요법과 동등하게 가능하다. 다른 가능한 치료는 종양 퇴행 후에 환자의 상태를 유지하기 위한 요법, 또는 심지어 예를 들어 위험에 있는 환자에서의 화학예방 요법이다.
공동-작용제로서 가능한 항암제 (예를 들어 화학요법용)는 아로마타제 억제제; 항에스트로겐; 토포이소머라제 I 억제제; 토포이소머라제 II 억제제; 미세관 활성 화합물; 알킬화 화합물; 히스톤 데아세틸라제 억제제; 세포 분화 과정을 유도하는 화합물; 시클로옥시게나제 억제제; MMP 억제제; mTOR 억제제; 항신생물성 항대사물; 플라틴 화합물; 단백질 또는 지질 키나제 활성을 표적화하는/감소시키는 화합물; 항혈관신생 화합물; 단백질 또는 지질 포스파타제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물; 고나도렐린 효능제; 항안드로겐; 메티오닌 아미노펩티다제 억제제; 비스포스포네이트; 생물학적 반응 조절제; 항증식성 항체; 헤파라나제 억제제; Ras 종양원성 이소형의 억제제; 텔로머라제 억제제; 프로테아솜 억제제; 혈액 악성종양의 치료에 사용되는 화합물; Flt-3의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물; Hsp90 억제제; 키네신 스핀들 단백질 억제제; MEK 억제제; 류코보린; EDG 결합제; 항백혈병 화합물; 리보뉴클레오티드 리덕타제 억제제; S-아데노실메티오닌 데카르복실라제 억제제; 혈관신생억제 스테로이드; 코르티코스테로이드; 다른 화학요법 화합물 (하기 정의된 바와 같음); 광증감 화합물을 포함하나, 이에 제한되지는 않는다.
게다가, 대안적으로 또는 추가로, 본 발명에 따른 조합 제품은 수술, 이온화 방사선, 광역학 요법, 예를 들어 코르티코스테로이드, 호르몬을 함유한 이식물을 비롯한 다른 종양 치료 접근법과 조합하여 사용될 수 있거나, 또는 이들은 방사선증감제로서 사용될 수 있다.
본원에 사용된 용어 "아로마타제 억제제"는 에스트로겐 생산을 억제하는 화합물, 즉 기질 안드로스텐디온 및 테스토스테론을 각각 에스트론 및 에스트라디올로 전환시키는 것을 억제하는 화합물에 관한 것이다. 상기 용어는 스테로이드, 특히 아타메스탄, 엑세메스탄 및 포르메스탄, 및 특히 비-스테로이드, 특히 아미노글루테티미드, 로글레티미드, 피리도글루테티미드, 트릴로스탄, 테스토락톤, 케토코나졸, 보로졸, 파드로졸, 아나스트로졸 및 레트로졸을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "항에스트로겐"은 에스트로겐 수용체 수준에서 에스트로겐의 효과에 대해 길항작용을 하는 화합물에 관한 것이다. 상기 용어는 타목시펜, 풀베스트란트, 랄록시펜 및 랄록시펜 히드로클로라이드를 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "항안드로겐"은 안드로겐 호르몬의 생물학적 효과를 억제할 수 있는 임의의 물질에 관한 것이며, 예를 들어 US 4,636,505에 개시된 바와 같이 제제화될 수 있는 비칼루타미드 (카소덱스(CASODEX))를 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "고나도렐린 효능제"는 아바렐릭스, 고세렐린 및 고세렐린 아세테이트를 포함하나, 이에 제한되지는 않는다. 본원에 사용된 용어 "토포이소머라제 I 억제제"는 토포테칸, 기마테칸, 이리노테칸, 캄프토테신 및 그의 유사체인 9-니트로캄프토테신 및 거대분자 캄프토테신 접합체 PNU-166148 (WO99/ 17804의 화합물 A1)을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "토포이소머라제 II 억제제"는 안트라시클린, 예컨대 독소루비신 (리포솜 제제, 예를 들어 케릭스(CAELYX) 포함), 다우노루비신, 에피루비신, 이다루비신 및 네모루비신, 안트라퀴논 미톡산트론 및 로속산트론, 및 포도필로톡신 에토포시드 및 테니포시드를 포함하나, 이에 제한되지는 않는다.
용어 "미세관 활성 화합물"은 탁산, 예를 들어 파클리탁셀 및 도세탁셀, 빈카 알칼로이드, 예를 들어 빈블라스틴, 특히 빈블라스틴 술페이트, 빈크리스틴, 특히 빈크리스틴 술페이트, 및 비노렐빈, 디스코데르몰리드, 콜키신 및 에포틸론 및 그의 유도체, 예를 들어 에포틸론 B 또는 D 또는 그의 유도체를 포함하나 이에 제한되지는 않는, 미세관 안정화, 미세관 탈안정화 화합물 및 마이크로튜불린 중합 억제제에 관한 것이다.
본원에 사용된 용어 "알킬화 화합물"은 시클로포스파미드, 이포스파미드, 멜팔란 또는 니트로소우레아 (BCNU 또는 글리아델(Gliadel))를 포함하나, 이에 제한되지는 않는다.
용어 "히스톤 데아세틸라제 억제제" 또는 "HDAC 억제제"는 히스톤 데아세틸라제를 억제하며 항증식성 활성을 보유하는 화합물에 관한 것이다. 이는 WO 02/22577에 개시된 화합물, 특히 N-히드록시-3-[4-[[(2-히드록시에틸)[2-(1H-인돌-3-일)에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드, N-히드록시-3-[4-[[[2-(2-메틸-1H-인돌-3-일)-에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드 및 그의 제약상 허용되는 염을 포함한다. 이는 특히 수베로일아닐리드 히드록삼산 (SAHA)을 추가로 포함한다. 히스톤 데아세틸라제 (HDAC) 억제제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 부티르산나트륨 및 수베로일아닐리드 히드록삼산 (SAHA)은 히스톤 데아세틸라제로 공지된 효소의 활성을 억제한다. 구체적인 HDAC 억제제는 MS275, SAHA, FK228 (이전에 FR901228), 트리코스타틴 A, 및 US 6,552,065에 개시된 화합물, 특히 N-히드록시-3-[4-[[[2-(2-메틸-1H-인돌-3-일)-에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드 또는 그의 제약상 허용되는 염 및 N-히드록시-3-[4-[(2-히드록시에틸){2-(1H-인돌-3-일)에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드 또는 그의 제약상 허용되는 염, 특히 락테이트 염을 포함한다.
용어 "항신생물 항대사물"은 5-플루오로우라실 또는 5-FU, 카페시타빈, 겜시타빈, DNA 탈메틸화 화합물, 예컨대 5-아자시티딘 및 데시타빈, 메토트렉세이트 및 에다트렉세이트, 및 폴산 길항제, 예컨대 페메트렉세드를 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "플라틴 화합물"은 카르보플라틴, 시스-플라틴, 시스플라티눔 및 옥살리플라틴을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "단백질 또는 지질 키나제 활성을 표적화하는/감소시키는 화합물"; 또는 "단백질 또는 지질 포스파타제 활성"; 또는 "추가의 항혈관신생 화합물"은 c-Met 티로신 키나제 및/또는 세린 및/또는 트레오닌 키나제 억제제 또는 지질 키나제 억제제, 예를 들어 하기를 포함하나, 이에 제한되지는 않는다:
a) 혈소판-유래 성장 인자-수용체 (PDGFR)의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 PDGFR의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 특히 PDGF 수용체를 억제하는 화합물, 예를 들어 N-페닐-2-피리미딘-아민 유도체, 예를 들어 이마티닙, SU101, SU6668 및 GFB-111;
b) 인슐린-유사 성장 인자 수용체 I (IGF-IR)의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 IGF-IR의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 특히 IGF-I 수용체의 키나제 활성을 억제하는 화합물, 예컨대 WO 02/092599에 개시된 화합물, 또는 IGF-I 수용체 또는 그의 성장 인자의 세포외 도메인을 표적화하는 항체;
c) Trk 수용체 티로신 키나제 부류의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 또는 에프린 키나제 부류 억제제;
d) Axl 수용체 티로신 키나제 부류의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물;
e) Ret 수용체 티로신 키나제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물;
f) Kit/SCFR 수용체 티로신 키나제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예를 들어 이마티닙;
g) c-Kit 수용체 티로신 키나제 - (PDGFR 부류의 일부)의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 c-Kit 수용체 티로신 키나제 부류의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 특히 c-Kit 수용체를 억제하는 화합물, 예를 들어 이마티닙;
h) c-Abl 부류의 구성원, 이들의 유전자-융합 산물 (예를 들어, BCR-Abl 키나제) 및 돌연변이체의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 c-Abl 부류 구성원 및 이들의 유전자-융합 산물의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예를 들어 N-페닐-2-피리미딘-아민 유도체, 예를 들어 이마티닙 또는 닐로티닙 (AMN107); PD180970; AG957; NSC 680410; 파크데이비스(ParkeDavis)로부터의 PD173955; 또는 다사티닙 (BMS-354825);
i) 단백질 키나제 C (PKC) 및 세린/트레오닌 키나제의 Raf 부류의 구성원, MEK, SRC, JAK, FAK, PDK1, PKB/Akt의 구성원, 및 Ras/MAPK 부류 구성원, 및/또는 시클린-의존성 키나제 부류 (CDK)의 구성원의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 및 특히 US 5,093,330에 개시된 이들 스타우로스포린 유도체, 예를 들어 미도스타우린임; 추가의 화합물의 예는, 예를 들어 UCN-01, 사핀골, BAY 43-9006, 브리오스타틴 1, 페리포신; 일모포신; RO 318220 및 RO 320432; GO 6976; 이시스 3521; LY333531/LY379196; WO 00/09495에 개시된 것과 같은 이소키놀린 화합물; FTI; PD184352 또는 QAN697 (P13K 억제제) 또는 AT7519 (CDK 억제제)를 포함함;
j) 단백질-티로신 키나제 억제제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 이마티닙 메실레이트 (글리벡(GLEEVEC)) 또는 티르포스틴을 포함하는 단백질-티로신 키나제 억제제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물; 티르포스틴은 바람직하게는 저분자량 (Mr < 1500) 화합물 또는 그의 제약상 허용되는 염, 특히 벤질리덴말로니트릴 부류 또는 S-아릴벤젠말로니트릴로부터 선택된 화합물 또는 이중기질 퀴놀린 부류의 화합물, 보다 특히 티르포스틴 A23/RG-50810; AG 99; 티르포스틴 AG 213; 티르포스틴 AG 1748; 티르포스틴 AG 490; 티르포스틴 B44; 티르포스틴 B44 (+) 거울상이성질체; 티르포스틴 AG 555; AG 494; 티르포스틴 AG 556, AG957 및 아다포스틴 (4-{[(2,5-디히드록시페닐)메틸]아미노}-벤조산 아다만틸 에스테르; NSC 680410, 아다포스틴)으로 이루어진 군으로부터 선택된 임의의 화합물임;
k) 수용체 티로신 키나제의 상피 성장 인자 부류 (동종이량체 또는 이종이량체로서의 EGFR, ErbB2, ErbB3, ErbB4) 및 이들의 돌연변이체의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 상피 성장 인자 수용체 부류의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물은 특히 EGF 수용체 티로신 키나제 부류의 구성원, 예를 들어 EGF 수용체, ErbB2, ErbB3 및 ErbB4를 억제하거나 또는 EGF 또는 EGF 관련 리간드에 결합하는 화합물, 단백질 또는 항체이고, 특히 WO 97/02266 (예를 들어, 실시예 39의 화합물) 또는 EP 0 564 409, WO 99/03854, EP 0520722, EP 0 566 226, EP 0 787 722, EP 0 837 063, US 5,747,498, WO 98/10767, WO 97/30034, WO 97/49688, WO 97/38983 및, 특히 WO 96/30347 (예를 들어, CP 358774로 공지된 화합물), WO 96/33980 (예를 들어, 화합물 ZD 1839) 및 WO 95/03283 (예를 들어, 화합물 ZM105180)에 일반적으로 및 구체적으로 개시된 화합물, 단백질 또는 모노클로날 항체; 예를 들어 트라스투주맙 (헤르셉틴(Herceptin)™), 세툭시맙 (에르비툭스(Erbitux)™), 이레사(Iressa), 타르세바(Tarceva), OSI-774, CI-1033, EKB-569, GW-2016, E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 또는 E7.6.3, 및 7H-피롤로-[2,3-d]피리미딘 유도체 (이는 WO 03/013541에 개시되어 있음)임; 및
l); c-Met 수용체의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 c-Met의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 특히 c-Met 수용체의 키나제 활성을 억제하는 화합물, 또는 c-Met의 세포외 도메인을 표적화하거나 또는 HGF에 결합하는 항체;
m) Ron 수용체 티로신 키나제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물.
추가의 항혈관신생 화합물은 그의 활성에 대한 또 다른 메카니즘, 예를 들어 단백질 또는 지질 키나제 억제와 무관한 메카니즘을 갖는 화합물, 예를 들어 탈리도미드 (탈로미드(THALOMID)) 및 TNP-470을 포함한다.
용어 "단백질 또는 지질 포스파타제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물"은 포스파타제 1, 포스파타제 2A 또는 CDC25의 억제제, 예를 들어 오카다산 또는 그의 유도체를 포함하나, 이에 제한되지는 않는다.
용어 "세포 분화 과정을 유도하는 화합물"은, 예를 들어 레티노산, α-, γ- 또는 δ-토코페롤, 또는 α-, γ- 또는 δ-토코트리에놀을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "시클로옥시게나제 억제제"는, 예를 들어 Cox-2 억제제, 5-알킬 치환된 2-아릴아미노페닐아세트산 및 유도체, 예컨대 셀레콕시브 (셀레브렉스(CELEBREX)), 로페콕시브 (비옥스(VIOXX)), 에토리콕시브, 발데콕시브 또는 5-알킬-2-아릴아미노페닐아세트산, 예를 들어 5-메틸-2-(2'-클로로-6'-플루오로아닐리노)페닐 아세트산, 루미라콕시브를 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "비스포스포네이트"는 에트리돈산, 클로드론산, 틸루드론산, 파미드론산, 알렌드론산, 이반드론산, 리세드론산 및 졸레드론산을 포함하나, 이에 제한되지는 않는다.
용어 "mTOR 억제제"는, 라파마이신 (mTOR)의 포유동물 표적을 억제하고 항증식성 활성을 보유하는 화합물, 예컨대 시롤리무스 (라파뮨(Rapamune)®), 에베롤리무스 (세르티칸(Certican)™), CCI-779 및 ABT578에 관한 것이다.
본원에 사용된 용어 "헤파라나제 억제제"는 헤파린 술페이트 분해를 표적화하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 상기 용어는 PI-88을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "생물학적 반응 조절제"는 림포카인 또는 인터페론, 예를 들어 인터페론 γ를 지칭한다.
본원에 사용된 용어 "Ras 종양원성 이소형 (예를 들어, H-Ras, K-Ras 또는 N-Ras)의 억제제"는 Ras의 종양원성 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물, 예를 들어 "파르네실 트랜스퍼라제 억제제", 예를 들어 L-744832, DK8G557 또는 R115777 (자르네스트라(Zarnestra))을 지칭한다.
본원에 사용된 용어 "텔로머라제 억제제"는 텔로머라제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 텔로머라제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물은 특히 텔로머라제 수용체를 억제하는 화합물, 예를 들어 텔로메스타틴이다.
본원에 사용된 용어 "메티오닌 아미노펩티다제 억제제"는 메티오닌 아미노펩티다제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 메티오닌 아미노펩티다제의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물은, 예를 들어 벤가미드 또는 그의 유도체이다.
본원에 사용된 용어 "프로테아솜 억제제"는 프로테아솜의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 프로테아좀의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물은, 예를 들어 보르테조미드(Bortezomid) (벨케이드(Velcade)™) 및 MLN 341을 포함한다.
본원에 사용된 용어 "매트릭스 메탈로프로테이나제 억제제" 또는 ("MMP" 억제제)는 콜라겐 펩티드모방체 및 비-펩티드모방체 억제제, 테트라시클린 유도체, 예를 들어 히드록사메이트 펩티드모방체 억제제 바티마스타트 및 그의 경구로 생체이용가능한 유사체 마리마스타트 (BB-2516), 프리노마스타트 (AG3340), 메타스타트 (NSC 683551) BMS-279251, BAY 12-9566, TAA211, MMI270B 또는 AAJ996을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "혈액 악성종양의 치료에 사용되는 화합물"은 FMS-유사 티로신 키나제 억제제, 예를 들어 FMS-유사 티로신 키나제 수용체 (Flt-3R)의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물; 인터페론, 1-b-D-아라비노푸란실시토신 (ara-c) 및 비술판; 및 ALK 억제제, 예를 들어 역형성 림프종 키나제를 표적화하거나, 감소시키거나 또는 억제하는 화합물을 포함하나, 이에 제한되지는 않는다.
용어 "FMS-유사 티로신 키나제 수용체 (Flt-3R)의 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물"은 특히 Flt-3R 수용체 키나제 부류의 구성원을 억제하는 화합물, 단백질 또는 항체, 예를 들어 PKC412, 미도스타우린, 스타우로스포린 유도체, SU11248 및 MLN518이다.
본원에 사용된 용어 "HSP90 억제제"는 HSP90의 내인성 ATPase 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물; 유비퀴틴 프로테오솜 경로를 통해 HSP90 클라이언트 단백질을 분해하거나, 표적화하거나, 감소시키거나 또는 억제하는 화합물을 포함하나, 이에 제한되지는 않는다. HSP90의 내인성 ATPase 활성을 표적화하거나, 감소시키거나 또는 억제하는 화합물은 특히 HSP90의 ATPase 활성을 억제하는 화합물, 단백질 또는 항체, 예를 들어 17-알릴아미노, 17-데메톡시겔다나마이신 (17AAG, 17-DMAG), 겔다나마이신 유도체, 기타 겔다나마이신 관련 화합물, 라디시콜 및 HDAC 억제제; 컨포마 테라퓨틱스(Conforma Therapeutics)로부터의 IPI-504, CNF1010, CNF2024, CNF1010; 노파르티스(Novartis)로부터의 테모졸로미드, AUY922이다.
본원에 사용된 용어 "항증식성 항체"는 에르비툭스, 베바시주맙, 리툭시맙, PRO64553 (항-CD40) 및 2C4 항체를 포함하나, 이에 제한되지는 않는다. 항체는, 예를 들어 무손상 모노클로날 항체, 폴리클로날 항체, 2종 이상의 무손상 항체로부터 형성된 다중특이적 항체, 및 목적하는 생물학적 활성을 나타내는 한 항체 단편을 의미한다.
용어 "항백혈병 화합물"은 예를 들어 Ara-C, 피리미딘 유사체 (이는 데옥시시티딘의 2'-알파-히드록시 리보스 (아라비노시드) 유도체임)를 포함한다. 또한 하이포크산틴, 6-메르캅토퓨린 (6-MP) 및 플루다라빈 포스페이트의 퓨린 유사체가 포함된다. 급성 골수성 백혈병 (AML)의 치료를 위해, 화학식 I의 화합물은 표준 백혈병 요법과 조합하여, 특히 AML의 치료에 사용되는 요법과 조합하여 사용될 수 있다. 특히, 화학식 I의 화합물은 예를 들어 파르네실 트랜스퍼라제 억제제 및/또는 AML의 치료에 유용한 기타 약물, 예컨대 다우노루비신, 아드리아마이신, Ara-C, VP-16, 테니포시드, 미톡산트론, 이다루비신, 카르보플라티눔 및 PKC412와 조합하여 투여될 수 있다.
본원에 사용된 "소마토스타틴 수용체 길항제"는 소마토스타틴 수용체를 표적화하거나, 치료하거나 또는 억제하는 화합물, 예컨대 옥트레오티드 및 SOM230을 지칭한다.
"종양 세포 손상 접근법"은 이온화 방사선과 같은 접근법을 지칭한다. 상기 및 하기에 지칭되는 용어 "이온화 방사선"은 전자기선 (예컨대 X선 및 감마선) 또는 입자 (예컨대 알파 및 베타 입자)로 발생하는 이온화 방사선을 의미한다. 이온화 방사선은 비제한적으로 방사선 요법에서 제공되며, 당업계에 공지되어 있다. 문헌 [Hellman, Principles of Radiation Therapy, Cancer, in Principles and Practice of Oncology, Devita et al., Eds., 4th Edition, Vol. 1, pp. 248-275 (1993)]을 참조한다.
본원에 사용된 용어 "EDG 결합제"는 림프구 재순환을 조절하는 면역억제제의 부류, 예컨대 FTY720을 지칭한다.
용어 "키네신 스핀들 단백질 억제제"는 당업계에 공지되어 있고, 글락소스미스클라인으로부터의 SB715992 또는 SB743921 및 콤비네이토알엑스(CombinatoRx)로부터의 펜타미딘/클로르프로마진을 포함한다.
용어 "MEK 억제제"는 당업계에 공지되어 있고, 어레이 피오파마(Array PioPharma)로부터의 ARRY142886, 아스트라제네카로부터의 AZD6244, 화이자로부터의 PD181461, 류코보린을 포함한다.
용어 "리보뉴클레오티드 리덕타제 억제제"는, 플루다라빈 및/또는 시토신 아라비노시드 (ara-C), 6-티오구아닌, 5-플루오로우라실, 클라드리빈, 6-메르캅토퓨린 (특히, ALL에 대해 ara-C와 조합됨) 및/또는 펜토스타틴을 포함하나 이에 제한되지는 않는 피리미딘 또는 퓨린 뉴클레오시드 유사체를 포함하나, 이에 제한되지는 않는다. 리보뉴클레오티드 리덕타제 억제제는 특히 히드록시우레아 또는 2-히드록시-1H-이소인돌-1,3-디온 유도체, 예컨대 PL-1, PL-2, PL-3, PL-4, PL-5, PL-6, PL-7 또는 PL-8이다 (문헌 [Nandy et al., Acta Oncologica, Vol. 33, No. 8, pp. 953-961 (1994)]에 언급되어 있음).
본원에 사용된 용어 "S-아데노실메티오닌 데카르복실라제 억제제"는 US 5,461,076에 개시된 화합물을 포함하나, 이에 제한되지는 않는다.
또한, 특히 WO 98/35958에 개시된 화합물, 단백질 또는 VEGF / VEGFR의 모노클로날 항체, 예를 들어 1-(4-클로로아닐리노)-4-(4-피리딜메틸)프탈라진 또는 그의 제약상 허용되는 염, 예를 들어 숙시네이트, 또는 WO 00/09495, WO 00/27820, WO 00/59509, WO 98/11223, WO 00/27819 및 EP 0 769 947에 개시된 것; 문헌 [Prewett et al., Cancer Res, Vol. 59, pp. 5209-5218 (1999); Yuan et al., Proc Natl Acad Sci U S A, Vol. 93, pp. 14765-14770 (1996); Zhu et al., Cancer Res, Vol. 58, pp. 3209-3214 (1998); 및 Mordenti et al., Toxicol Pathol, Vol. 27, No. 1, pp. 14-21 (1999)]; WO 00/37502 및 WO 94/10202에 기재된 것; 문헌 [O'Reilly et al., Cell, Vol. 79, pp. 315-328 (1994)]에 기재된 안지오스타틴(ANGIOSTATIN); 문헌 [O'Reilly et al., Cell, Vol. 88, pp. 277-285 (1997)]에 기재된 엔도스타틴(ENDOSTATIN); 안트라닐산 아미드; ZD4190; ZD6474; SU5416; SU6668; 베바시주맙; 또는 항-VEGF 항체 또는 항-VEGF 수용체 항체, 예를 들어 rhuMAb 및 RHUFab, VEGF 압타머, 예를 들어 마큐곤; FLT-4 억제제, FLT-3 억제제, VEGFR-2 IgG1 항체, 안지오자임 (RPI 4610) 및 베바시주맙이 포함된다.
본원에 사용된 "광역학 요법"은 암을 치료 또는 예방하기 위해 광증감 화합물로 공지된 특정 화학물질을 사용하는 요법을 지칭한다. 광역학 요법의 예는, 예를 들어 비수다인(VISUDYNE) 및 포르피머 소듐과 같은 화합물을 사용한 치료를 포함한다.
본원에 사용된 "혈관신생억제 스테로이드"는 혈관신생을 차단하거나 억제하는 화합물, 예컨대, 예를 들어 아네코르타브, 트리암시놀론, 히드로코르티손, 11-α-에피히드로코티솔, 코르텍솔론, 17α-히드록시프로게스테론, 코르티코스테론, 데스옥시코르티코스테론, 테스토스테론, 에스트론 및 덱사메타손을 지칭한다.
본원에 사용된 "코르티코스테로이드"는, 예를 들어 특히 이식물 형태의 플루오시놀론, 덱사메타손과 같은 화합물을 포함하나, 이에 제한되지는 않는다.
다른 화학요법 화합물은 식물 알칼로이드, 호르몬 화합물 및 길항제; 생물학적 반응 조절제, 바람직하게는 림포카인 또는 인터페론; 안티센스 올리고뉴클레오티드 또는 올리고뉴클레오티드 유도체; shRNA 또는 siRNA; 또는 기타 화합물 또는 다른 또는 미지의 작용 메카니즘을 갖는 화합물을 포함하나, 이에 제한되지는 않는다.
본 발명에 따른 조합 제품은 또한 항염증 약물 물질; 항히스타민제 약물 물질; 기관지확장 약물 물질, NSAID; 케모카인 수용체의 길항제의 군으로부터 선택된 하나 이상의 추가의 약물 물질과 조합하여 사용되거나 또는 이를 포함할 수 있다.
적합한 항염증 약물은 스테로이드, 특히 글루코코르티코스테로이드, 예컨대 부데소니드, 베클라메타손 디프로피오네이트, 플루티카손 프로피오네이트, 시클레소니드 또는 모메타손 푸로에이트, 또는 WO 02/88167, WO 02/12266, WO 02/100879, WO 02/00679 (특히, 실시예 3, 11, 14, 17, 19, 26, 34, 37, 39, 51, 60, 67, 72, 73, 90, 99 및 101의 것), WO 03/035668, WO 03/048181, WO 03/062259, WO 03/064445, WO 03/072592에 기재되어 있는 스테로이드, WO 00/00531, WO 02/10143, WO 03/082280, WO 03/082787, WO 03/104195, WO 04/005229에 기재되어 있는 것과 같은 비-스테로이드성 글루코코르티코이드 수용체 효능제;
LTB4 길항제, 예컨대 LY293111, CGS025019C, CP-195543, SC-53228, BIIL 284, ONO 4057, SB 209247 및 US 5451700에 기재된 것; LTD4 길항제, 예컨대 몬테루카스트 및 자피르루카스트; PDE4 억제제, 예컨대 실로밀라스트, 로플루밀라스트 (빅 굴덴(Byk Gulden)),V-11294A (나프(Napp)), BAY19-8004 (바이엘(Bayer)), SCH-351591 (쉐링-플라우(Schering-Plough)), 아로필린 (알미랄 프로데스파르마(Almirall Prodesfarma)), PD189659 / PD168787 (파크-데이비스(Parke-Davis)), AWD-12-281 (아스타 메디카(Asta Medica)), CDC-801 (셀진(Celgene)), SelCID(TM) CC-10004 (셀진), VM554/UM565 (베르날리스(Vernalis)), T-440 (다나베(Tanabe)), KW-4490 (교와 핫코 고교(Kyowa Hakko Kogyo)), 및 WO 92/19594, WO 93/19749, WO 93/19750, WO 93/19751, WO 98/18796, WO 99/16766, WO 01/13953, WO 03/104204, WO 03/104205, WO 03/39544, WO 04/000814, WO 04/000839, WO 04/005258, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/ 018431, WO 04/018449, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/019944, WO 04/019945, WO 04/045607 및 WO 04/037805에 개시된 것; A2a 효능제, 예컨대 EP 409595A2, EP 1052264, EP 1241176, WO 94/17090, WO 96/02543, WO 96/02553, WO 98/28319, WO 99/24449, WO 99/24450, WO 99/24451, WO 99/38877, WO 99/41267, WO 99/67263, WO 99/67264, WO 99/67265, WO 99/67266, WO 00/23457, WO 00/77018, WO 00/78774, WO 01/23399, WO 01/27130, WO 01/27131, WO 01/60835, WO 01/94368, WO 02/00676, WO 02/22630, WO 02/96462, WO 03/086408, WO 04/ 039762, WO 04/039766, WO 04/045618 및 WO 04/046083에 개시된 것; A2b 길항제, 예컨대 WO 02/42298에 기재된 것; 및 베타-2 아드레날린수용체 효능제, 예컨대 알부테롤 (살부타몰), 메타프로테레놀, 테르부탈린, 살메테롤, 페노테롤, 프로카테롤, 및 특히 포르모테롤 및 그의 제약상 허용되는 염, 및 WO 0075114 (상기 문헌은 본원에 참조로 포함됨)의 화학식 I의 화합물 (유리 형태, 염 형태 또는 용매화물 형태), 바람직하게는 상기 문헌의 실시예의 화합물, 특히 하기 화학식의 화합물 및 그의 제약상 허용되는 염
뿐만 아니라 WO 04/16601의 화학식 I의 화합물 (유리 형태, 염 형태 또는 용매화물 형태), 및 또한 WO 04/033412의 화합물을 포함한다.
적합한 기관지확장 약물은 항콜린성 또는 항무스카린성 화합물, 특히 이프라트로피움 브로마이드, 옥시트로피움 브로마이드, 티오트로피움 염 및 CHF 4226 (키에시(Chiesi)), 및 글리코피롤레이트, 뿐만 아니라 WO 01/04118, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/87094, WO 04/05285, WO 02/00652, WO 03/53966, EP 424021, US 5171744, US 3714357, WO 03/33495 및 WO 04/018422에 기재된 것을 포함한다.
적합한 케모카인 수용체는, 예를 들어 CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 및 CCR10, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, 특히 CCR-5 길항제, 예컨대 쉐링-플라우 길항제 SC-351125, SCH-55700 및 SCH-D, 다케다 길항제, 예컨대 N-[[4-[[[6,7-디히드로-2-(4-메틸페닐)-5H-벤조-시클로헵텐-8-일]카르보닐]아미노]페닐]-메틸]테트라히드로-N,N-디메틸-2H-피란-4-아미늄 클로라이드 (TAK-770), 및 US 6166037 (특히 특허청구범위 제18항 및 제19항), WO 00/66558 (특히 특허청구범위 제8항), WO 00/66559 (특히 특허청구범위 제9항), WO 04/018425 및 WO 04/026873에 기재된 CCR-5 길항제를 포함한다.
적합한 항히스타민 약물 물질은 세티리진 히드로클로라이드, 아세트아미노펜, 클레마스틴 푸마레이트, 프로메타진, 로라티딘, 데스로라티딘, 디펜히드라민 및 펙소페나딘 히드로클로라이드, 악티바스틴, 아스테미졸, 아젤라스틴, 에바스틴, 에피나스틴, 미졸라스틴 및 테페나딘, 뿐만 아니라 WO 03/099807, WO 04/026841 및 JP 2004107299에 개시된 것을 포함한다.
코드 번호, 일반명 또는 상품명으로 확인되는 활성제의 구조는 표준 개론 "The Merck Index" 현행판 또는 데이터베이스, 예를 들어 페이턴츠 인터내셔널(Patents International) (예를 들어, IMS 월드 퍼블리케이션즈(IMS World Publications))로부터 얻을 수 있다. 그의 상응하는 내용은 본원에 참조로 포함된다.
용어 "제약상 유효한"은 바람직하게는 치료량에 관한 것이거나, 또는 보다 광범위한 의미에서는 또한 본원에 개시된 바와 같은 질환 또는 장애의 진행에 대해 예방적으로도 유효한 양에 관한 것이다.
본원에 사용된 용어 "상업용 패키지"는 특히, 상기 및 하기 정의된 바와 같은 성분 (a) MET 티로신 키나제 억제제 및 (b) FGFR 티로신 키나제 억제제, 및 임의로 추가의 공동-작용제가 독립적으로 또는 구별되는 양의 성분 (a) 및 (b)를 함유하는 상이한 고정 조합물의 사용에 의해, 즉 동시에 또는 상이한 시점에 투여될 수 있다는 관점에서 "부분들의 키트"를 정의한다. 더욱이, 이들 용어는 활성 성분으로서의 성분 (a) 및 (b)를 (특히, 조합하여) 증식성 질환의 진행의 지연 또는 치료에서의 그의 동시, 순차 (시차를 두고, 시간-특이적 순서로, 우선적으로) 또는 (덜 바람직하게는) 개별적 사용을 위한 지침과 함께 포함하는 상업용 패키지를 포함한다. 이어서, 부분들의 키트의 부분들은, 예를 들어 동시에 또는 시차를 두고 (즉, 상이한 시점에), 부분들의 키트의 임의의 부분에 대해서 동일하거나 상이한 시간 간격으로 투여될 수 있다. 매우 바람직하게는, 시간 간격은, 부분들의 조합 사용에 있어서 치료되는 질환에 대한 효과가 조합 파트너 (a) 및 (b) 중의 어느 하나만을 사용하여 얻는 효과보다 더 크도록 선택된다 (표준 방법에 따라 결정될 수 있음). 조합 제제로 투여되는 조합 파트너 (a) 대 조합 파트너 (b)의 총량의 비는, 예를 들어 치료되는 환자 하위-집단의 요구 또는 단일 환자의 요구 (환자의 특정한 질환, 연령, 성별, 체중 등으로 인해 다양한 요구가 있을 수 있음)에 대처하기 위해 달라질 수 있다. 바람직하게는, 하나 이상의 유익한 효과, 예를 들어 조합 파트너 (a) 및 (b)의 효과의 상호 증진, 특히 상가 효과를 초과하는 효과 (따라서 이는 조합되지 않은 개별 약물만으로 치료한 경우에 허용되는 것보다 낮은 용량의 각각의 조합된 약물 각각에 의해 달성될 수 있음), 추가의 유리한 효과의 창출, 예를 들어 더 적은 부작용 또는 조합 파트너 (성분) (a) 및 (b) 중 하나 또는 둘 다의 비-유효 투여량에서의 조합 치료 효과, 및 매우 바람직하게는 조합 파트너 (a) 및 (b)의 강한 상승작용이 있다.
성분 (a) 및 (b)의 조합물 및 상업용 패키지를 사용하는 경우 둘 다에서 동시, 순차적 및 개별 사용의 임의의 조합이 또한 가능하며, 이는 성분 (a) 및 (b)를 하나의 시점에서 동시에 투여한 후에 이후의 시점에서는 더 낮은 숙주 독성을 갖는 하나의 성분만을 장기적으로, 예를 들어 3-4주 초과의 1일 투여로 투여하고, 보다 이후의 시점에는 다른 성분 또는 성분 둘 다의 조합물을 후속으로 투여하는 것 (최적 효과를 위한 후속적 약물 조합물 치료 과정) 등을 의미한다.
본 발명에 따른 조합 제품은 각각의 EGFR 및/또는 MET 티로신 키나제의 활성에 의해 매개되는, 특히 그에 의존적인 다양한 질환의 치료에 적절하다. 따라서, 이들은 EGFR 티로신 키나제 억제제 및 MET 티로신 키나제 억제제에 의해 치료될 수 있는 임의의 질환의 치료에 사용될 수 있다.
용어 "FGFR 티로신 키나제 활성 및/또는 MET 티로신 키나제 활성 매개 질환"은 특히, 하나의 또는 둘 다의 키나제의 활성이 두 키나제 중 하나를 포함하는 조절 경로의 비정상적 활성을 유발하는 질환, 특히 키나제 중 하나 또는 둘 다가 예를 들어 과다발현, 돌연변이, 또는 세포 내 다른 조절 경로의 상대적 활성 결여로 인해 과다활성인 질환, 예를 들어 선행 또는 후속 조절 요소의 증폭, 구성적 활성화 및/또는 과다활성화가 있는 질환을 지칭한다.
EGFR 억제제는 예를 들어 EGFR 활성의 억제에 반응하는 질환, 특히 신생물성 또는 종양 질환, 특히 고형 종양, 보다 특히 EGFR 키나제가 관여된 암, 예를 들어 유방암, 위암, 폐암, 전립선암, 방광암 및 자궁내막암 중 하나 이상의 치료에 유용하다. 추가의 암은 신장, 간, 부신, 위, 난소, 결장, 직장, 췌장, 질 또는 갑상선의 암, 육종, 교모세포종 및 두경부의 다수의 종양, 뿐만 아니라 백혈병 및 다발성 골수종을 포함한다. 특히 바람직하게는, 유방암 또는 난소암; 폐암, 예를 들어 NSCLC 또는 SCLC; 두경부암, 신장암, 결장직장암, 췌장암, 방광암, 위암 또는 전립선암; 또는 신경교종; 특히, 신경교종 또는 결장암, 직장암 또는 결장직장암, 보다 특히 폐암이 언급될 수 있다. 또한, EGFR, 예컨대 EGF; TGF-α; HB-EGF; 암피레귤린; 에피레귤린; 베타셀룰린의 리간드에 의존하는 질환이 포함된다.
MET 억제제는 예를 들어 MET 관련 질환, 특히 유전자 증폭, 활성화 돌연변이, 동족 RTK 리간드의 발현, 활성화를 나타내는 잔기에서의 RTK의 인산화를 비롯한, MET 및 FGFR의 동시 활성화에 대한 증거를 나타내는 암의 치료에 유용하고, 예를 들어 여기서 암은 뇌암, 위암, 생식기암, 비뇨기암, 전립선암, (비뇨기) 방광암 (표재성 및 근육 침습성), 유방암, 자궁경부암, 결장암, 결장직장암, 신경교종 (교모세포종, 역형성 성상세포종, 핍지교성상세포종, 핍지교종 포함), 식도암, 위암, 위장암, 간암, 간세포성 암종 (HCC), 예를 들어 소아 HCC, 두경부암 (두경부 편평-세포 암종, 비인두 암종 포함), 휘르틀레 세포 암종, 상피암, 피부암, 흑색종 (악성 흑색종 포함), 중피종, 림프종, 골수종 (다발성 골수종 포함), 백혈병, 폐암 (비소세포 폐암 (모든 조직학적 하위유형: 선암종, 편평 세포 암종, 기관지폐포 암종, 대세포 암종 및 선편평상피 혼합 유형 포함), 소세포 폐암 포함), 난소암, 췌장암, 전립선암, 신장암 (유두상 신세포 암종을 포함하나, 이에 제한되지는 않음), 장암, 신세포암 (유전성 및 산발성 유두상 신세포암, 제I형 및 제II형, 및 투명 세포 신세포암 포함); 육종, 특히 골육종, 투명 세포 육종 및 연부 조직 육종 (폐포 및 (예를 들어 배아성) 횡문근육종, 폐포 연부 육종 포함); 갑상선 암종 (유두상 및 다른 하위유형)으로 이루어진 군으로부터 선택된다.
MET 억제제는 또한 예를 들어 위암, 결장암, 간암, 생식기암, 비뇨기암, 흑색종 또는 전립선암인 암의 치료에 유용하다. 특정한 실시양태에서, 암은 간암 또는 식도암이다.
MET 억제제는 또한 예를 들어 전이 (예를 들어 간에서의)를 포함하는 결장암, 및 비소세포 폐 암종의 치료에 유용하다.
MET 억제제는 또한 예를 들어 유전성 유두상 신세포 암종 (문헌 [Schmidt, L. et al. Nat. Genet. 16, 68-73, 1997]) 및 c-MET가 돌연변이 (문헌 [Jeffers and Vande Woude. Oncogene 18, 5120-5125, 1999]; 및 여기에 인용된 참고문헌) 또는 염색체 재배열 (예를 들어 TPR-MET; 문헌 [Cooper et al. Nature 311, 29-33, 1984; Park. et al. Cell 45, 895-904, 1986])에 의해 과다발현되거나 또는 구성적으로 활성화되는 다른 증식성 질환의 치료에 사용될 수 있다.
MET 억제제는 예를 들어 본원에 제공되거나 또는 당업계에 공지된 바와 같은 추가의 암 및 상태의 치료에 추가로 유용하다.
MET 억제제는 예를 들어 하나 이상의 염증성 상태의 치료에 또한 적합하다.
추가 실시양태에서, 염증성 상태는 감염으로 인한 것이다. 한 실시양태에서, 치료 방법은 병원체 감염의 차단일 것이다. 특정한 실시양태에서, 감염은 박테리아 감염, 예를 들어 리스테리아(Listeria) 감염이다. 예를 들어, 박테리아 표면 단백질이 수용체의 세포외 도메인에 결합함으로써 동족 리간드 HGF/SF의 효과를 모방하는 것을 통해 c-Met 키나제를 활성화하는 내용의 문헌 [Shen et al. Cell 103: 501-10, (2000)]을 참조한다.
본 발명의 조합 제품은 특히 EGFR 또는 Met 억제제 치료에 순응하는 임의의 상기 언급된 암, 특히 선암종 (특히 유방의 또는 보다 특히 폐의 선암종), 횡문근육종, 골육종, 방광 암종, 결장직장암 및 신경교종으로부터 선택된 암의 치료에 적절하다.
용어 본 발명의 화합물의 "치료 유효량"은 대상체의 생물학적 또는 의학적 반응, 예를 들어 효소 또는 단백질 활성의 감소 또는 억제, 또는 증상의 개선, 상태의 완화, 질환 진행의 둔화 또는 지연, 또는 질환의 예방 등을 도출할 본 발명의 화합물의 양을 지칭한다. 한 비제한적 실시양태에서, 용어 "치료 유효량"은 대상체에게 투여되는 경우에, (1) (i) cMet (MET)에 의해 매개되고/거나 EGFR 활성에 의해 매개되거나, 또는 (ii) cMet 및/또는 EGFR의 활성 (정상 또는 비정상)을 특징으로 하는 상태 또는 장애 또는 질환을 적어도 부분적으로 완화, 억제, 예방 및/또는 개선하는데 효과적이거나; 또는 (2) cMet 및/또는 EGFR의 활성을 감소 또는 억제하는데 효과적이거나; 또는 (3) cMet 및/또는 EGFR의 발현을 감소 또는 억제하는데 효과적인 본 발명의 화합물의 양을 지칭한다. 또 다른 비제한적 실시양태에서, 용어 "치료 유효량"은, 세포, 또는 조직, 또는 비-세포 생물학적 물질, 또는 배지에 투여되는 경우에 cMet 및/또는 EGFR의 활성을 적어도 부분적으로 감소 또는 억제하는데 효과적이거나; 또는 Met 및/또는 EGFR의 발현을 적어도 부분적으로 감소 또는 억제하는데 효과적인 본 발명의 화합물의 양을 지칭한다.
본원에 사용된 용어 "대상체"는 동물을 지칭한다. 전형적으로, 동물은 포유동물이다. 대상체는 또한, 예를 들어 영장류 (예를 들어, 인간), 소, 양, 염소, 말, 개, 고양이, 토끼, 래트, 마우스, 어류, 조류 등을 지칭한다. 특정 실시양태에서, 대상체는 영장류이다. 또 다른 실시양태에서, 대상체는 인간이다.
"및/또는"은 목록의 성분 또는 특징 중 각각의 하나 또는 둘 다 또는 모두가, 특히 그 중 둘 이상이 대안적 또는 누가적 방식으로 가능한 변수임을 의미한다.
본원에 사용된 용어 "억제하다", "억제" 또는 "억제하는"은 주어진 상태, 증상 또는 장애 또는 질환의 감소 또는 억제, 또는 생물학적 활성 또는 과정의 기저 활성에서의 유의한 감소를 지칭한다.
본원에 사용된 용어 임의의 질환 또는 장애를 "치료하다", "치료하는" 또는 그의 "치료"는, 한 실시양태에서, 질환 또는 장애의 개선 (즉, 질환 또는 그의 하나 이상의 임상적 증상의 발달의 둔화 또는 정지 또는 감소)을 지칭한다. 또 다른 실시양태에서, "치료하다", "치료하는" 또는 "치료"는 하나 이상의 물리적 파라미터 (환자에 의해 인식가능하지 않을 수 있는 것들 포함)의 완화 또는 개선을 지칭한다. 또 다른 실시양태에서, "치료하다", "치료하는" 또는 "치료"는 질환 또는 장애를 물리적으로 (예를 들어, 인식가능한 증상의 안정화), 생리학적으로 (예를 들어, 물리적 파라미터의 안정화) 또는 둘 다의 방식으로 조절하는 것을 지칭한다. 또 다른 실시양태에서, "치료하다", "치료하는" 또는 "치료"는 질환 또는 장애의 발병 또는 발달 또는 진행의 예방 또는 지연을 지칭한다.
용어 "치료"는 예를 들어 질환을 치유하거나, 또는 질환 퇴행 또는 질환의 진행의 지연에 대한 효과를 갖도록 하는 목표를 갖는 치료를 필요로 하는 온혈 동물, 바람직하게는 인간에 대한 조합 파트너의 예방적 또는 특히 치료적 투여를 포함한다.
본원에 사용된 바와 같이, 대상체가 치료로부터 생물학적으로, 의학적으로 또는 삶의 질에 있어 유익할 경우에, 상기 대상체는 이러한 치료를 "필요로 한다".
본원에 사용된 바와 같이, 본 발명의 문맥에서 (특히, 특허청구범위의 문맥에서) 사용된 단수 용어 및 유사한 용어들은, 본원에 달리 나타내거나 또는 문맥상 명백히 모순되지 않는 한, 단수형 및 복수형 둘 다를 포함하는 것으로 해석되어야 한다.
본 발명에 따른 조합물은 그 자체로 공지된 방식으로 제조될 수 있으며, 이는 치료 유효량의 하나 이상의 약리학적 활성 조합 파트너를 단독으로, 또는 특히 경장 또는 비경구 적용에 적합한 하나 이상의 제약상 허용되는 담체와 조합하여 포함하는, 인간을 비롯한 포유동물 (온혈 동물)로의 경장, 예컨대 경구 또는 직장, 및 비경구 투여에 적합한 것들이다. 본 발명의 한 실시양태에서, 활성 성분 중 하나 이상은 경구 투여된다.
본원에 사용된 용어 "담체" 또는 "제약상 허용되는 담체"는 당업자에게 공지된 임의의 및 모든 용매, 분산 매질, 코팅, 계면활성제, 항산화제, 보존제 (예를 들어, 항박테리아제, 항진균제), 등장화제, 흡수 지연제, 염, 보존제, 약물, 약물 안정화제, 결합제, 부형제, 붕해제, 윤활제, 감미제, 향미제, 염료 등, 및 그의 조합을 포함한다 (예를 들어, 문헌 [Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289- 1329] 참조). 임의의 통상의 담체가 활성 성분과 상용적이지 않은 경우를 제외하고는, 치료 또는 제약 조성물에서의 사용이 고려된다.
본 발명에 따른 제약 조합 제품은 (고정 조합물로서, 또는 키트로서, 예를 들어 고정 조합물 및 하나 또는 둘 다의 조합 파트너에 대한 개별 제제의 조합물로서, 또는 조합 파트너의 개별 제제의 키트로서) 본 발명의 조합 파트너 (하나 이상의 MET 티로신 키나제 억제제, 하나 이상의 EGFR 티로신 키나제 억제제, 및 임의로 하나 이상의 추가의 공동-작용제) 및 하나 이상의 제약상 허용되는 담체 물질 (담체, 부형제)을 포함한다. 이를 구성하는 조합 제품 또는 조합 파트너는 특정한 투여 경로, 예컨대 경구 투여, 비경구 투여 및 직장 투여 등을 위해 제제화될 수 있다. 또한, 본 발명의 조합 제품은 고체 형태 (비제한적으로 캡슐, 정제, 환제, 과립, 분말 또는 좌제 포함), 또는 액체 형태 (비제한적으로 용액, 현탁액 또는 에멀젼 포함)로 제조될 수 있다. 조합 제품 및/또는 그의 조합 파트너는 통상의 제약 작업, 예컨대 멸균에 적용될 수 있고/거나, 통상의 불활성 희석제, 윤활제 또는 완충제, 뿐만 아니라 아주반트, 예컨대 보존제, 안정화제, 습윤제, 유화제 및 완충제 등을 함유할 수 있다.
한 실시양태에서, 제약 조성물은 활성 성분을 하나 이상의 통상적으로 공지된 담체, 예를 들어
a) 희석제, 예를 들어 락토스, 덱스트로스, 수크로스, 만니톨, 소르비톨, 셀룰로스 및/또는 글리신;
b) 윤활제, 예를 들어 실리카, 활석, 스테아르산, 그의 마그네슘 또는 칼슘 염 및/또는 폴리에틸렌글리콜; 정제의 경우에 또한
c) 결합제, 예를 들어 규산알루미늄마그네슘, 전분 페이스트, 젤라틴, 트라가칸트, 메틸셀룰로스, 소듐 카르복시메틸셀룰로스 및/또는 폴리비닐피롤리돈; 원하는 경우에
d) 붕해제, 예를 들어 전분, 한천, 알긴산 또는 그의 나트륨 염 또는 발포성 혼합물; 및
e) 흡수제, 착색제, 향미제 및 감미제
로 이루어진 군으로부터 선택된 하나 이상의 담체와 함께 포함하는 정제 또는 젤라틴 캡슐이다.
정제는 당업계에 공지된 방법에 따라 필름 코팅 또는 장용 코팅될 수 있다.
경구 투여에 적합한 조성물은 특히 유효량의 하나 이상의 또는 고정 조합 제제의 경우에 각각의 조합 파트너 (활성 성분)를 정제, 로젠지, 수성 또는 유성 현탁액, 분산성 분말 또는 과립, 에멀젼, 경질 또는 연질 캡슐 또는 시럽 또는 엘릭시르의 형태로 포함한다. 경구 사용을 위해 의도된 조성물은 제약 조성물의 제조에 대해 당업계에 공지된 임의의 방법에 따라 제조되며, 이러한 조성물은 제약상 우아하고 맛우수한 제제를 제공하기 위해 감미제, 향미제, 착색제 및 보존제로 이루어진 군으로부터 선택된 하나 이상의 작용제를 함유할 수 있다. 정제는 활성 성분(들)을 정제의 제조에 적합한 비독성 제약상 허용되는 부형제와 혼합하여 함유할 수 있다. 이들 부형제는, 예를 들어 불활성 희석제, 예컨대 탄산칼슘, 탄산나트륨, 락토스, 인산칼슘 또는 인산나트륨; 과립화제 및 붕해제, 예를 들어 옥수수 전분 또는 알긴산; 결합제, 예를 들어 전분, 젤라틴 또는 아카시아; 및 윤활제, 예를 들어 스테아르산마그네슘, 스테아르산 또는 활석이다. 정제는 코팅되지 않거나, 또는 공지된 기술에 의해 코팅되어 위장관에서의 붕해 및 흡수를 지연시켜 보다 장기간에 걸쳐 지속되는 작용을 제공한다. 예를 들어, 시간 지연 물질, 예컨대 글리세릴 모노스테아레이트 또는 글리세릴 디스테아레이트가 사용될 수 있다. 경구 사용을 위한 제제는, 활성 성분이 불활성 고체 희석제, 예를 들어 탄산칼슘, 인산칼슘 또는 카올린과 혼합되어 있는 경질 젤라틴 캡슐로서, 또는 활성 성분이 물 또는 오일 매질, 예를 들어 땅콩 오일, 액상 파라핀 또는 올리브 오일과 혼합되어 있는 연질 젤라틴 캡슐로서 제공될 수 있다.
특정 주사가능한 조성물 (예를 들어 항체가 EGFR 억제제로서 사용되는 경우에 특히 유용한)은 수성 등장성 용액 또는 현탁액이고, 좌제는 지방성 에멀젼 또는 현탁액으로부터 유리하게 제조된다. 상기 조성물은 멸균될 수 있고/거나, 아주반트, 예컨대 보존제, 안정화제, 습윤제 또는 유화제, 용해 촉진제, 삼투압 조절을 위한 염 및/또는 완충제를 함유할 수 있다. 게다가, 이는 또한 다른 치료상 유익한 물질을 함유할 수 있다. 상기 조성물은 각각 통상적인 혼합, 과립화 또는 코팅 방법에 따라 제조되며, 약 0.1-75% 또는 약 1-50%의 활성 성분을 함유한다.
경피 적용에 적합한 조성물은 유효량의 하나 이상의 활성 성분을 적합한 담체와 함께 포함한다. 경피 전달에 적합한 담체는 흡수가능한 약리학상 허용되는 용매를 포함하여 숙주의 피부를 통한 통과를 보조한다. 예를 들어, 경피 장치는 백킹 부재, 화합물을 임의로 담체와 함께 함유하는 저장소, 임의로 장기간에 걸쳐 제어된 예정 속도로 숙주의 피부에 화합물을 전달하기 위한 속도 제어 장벽, 및 장치가 피부에 부착되도록 하는 수단을 포함하는 붕대 형태이다.
예를 들어, 피부 및 눈으로의 국소 적용에 적합한 조성물은 수용액, 현탁액, 연고, 크림, 겔, 또는 예를 들어 에어로졸 등에 의한 전달을 위한 분무가능한 제제를 포함한다. 이러한 국소 전달 시스템은, 예를 들어 피부암의 치료를 위해, 예를 들어 예방적 사용을 위해 선 크림, 로션, 스프레이 등으로 피부 적용하기에 특히 적절할 것이다. 따라서, 이는 당업계에 널리 공지된 화장품을 비롯한 국소 제제에 사용하기에 특히 적합하다. 이러한 것은 가용화제, 안정화제, 장성 증진제, 완충제 및 보존제를 함유할 수 있다.
본원에 사용된 바와 같은 국소 적용은 또한 흡입 또는 비강내 적용에 관한 것일 수 있다. 이는 편리하게는, 적합한 추진제를 사용하거나 또는 사용하지 않고, 건조 분말 흡입기로부터 건조 분말의 형태로 (단독으로, 혼합물로서, 예를 들어 락토스와의 건조 블렌드로서, 또는 예를 들어 인지질과의 혼합 성분 입자로서), 또는 가압 용기, 펌프, 스프레이, 아토마이저 또는 네뷸라이저로부터 에어로졸 스프레이 제형으로 전달될 수 있다.
본 발명은 또한 유효량, 특히 상기 언급된 질환 중 하나의 치료에 유효한 양의 하나 이상의 MET 티로신 키나제 억제제, 하나 이상의 EGFR 티로신 키나제 억제제 또는 각각의 그의 제약상 허용되는 염, 및 임의로 하나 이상의 추가의 공동-작용제 또는 그의 제약상 허용되는 염을, 국소, 경장, 예를 들어 경구 또는 직장 또는 비경구 투여에 적합하고 무기 또는 유기, 고체 또는 액체일 수 있는 하나 이상의 제약상 허용되는 담체와 함께 포함하는 부분들의 키트 또는 고정 제약 조성물에 관한 것이다.
모든 제제에서, 본 발명에 따른 조합 제품의 부분을 형성하는 활성 성분(들)은 각각 상응하는 제제 (포장 및 리플렛이 없는 그대로의 제제에 관함)의 0.5 내지 95 중량%, 예를 들어 각각 1 내지 90, 5 내지 95, 10 내지 98 또는 10 내지 60 또는 40 내지 80 중량%의 상대적 양으로 존재할 수 있다.
온혈 동물에게 적용될 활성 성분의 투여량은 환자의 유형, 종, 연령, 체중, 성별 및 의학적 상태; 치료할 질환의 중증도; 투여 경로; 환자의 신장 및 간의 기능; 및 사용되는 특정 화합물을 비롯한 다양한 인자에 따라 달라진다. 당업계의 전문의, 임상의 또는 수의사는 상태를 예방하거나 호전시키거나 그의 진행을 정지시키는데 필요한 약물의 유효량을 용이하게 결정하고 처방할 수 있다. 독성 없이 효능을 나타나도록 하는 범위 내에서 약물의 농도를 달성하는데 있어 최적인 정확한 양은, 표적 부위에 대한 약물의 이용가능성의 동역학에 기반한 요법을 요구한다. 이는 약물의 분포, 평형 및 제거에 대한 고려를 포함한다. 온혈 동물, 예를 들어 대략 70 kg 체중의 인간에게 투여되는 조합 파트너 또는 그의 제약상 허용되는 염 각각의 용량은 1명당 1일당 바람직하게는 대략 3 mg 내지 대략 5 g, 보다 바람직하게는 대략 10 mg 내지 대략 1.5 g이고, 이는 예를 들어 매일 1회 또는 2회의 사용을 위해 예를 들어 바람직하게는 1회 내지 3회의 단일 용량으로 분할되며, 이는 예를 들어 동일한 크기의 것일 수 있다. 통상적으로, 소아는 성인 용량의 절반이 제공된다.
본 발명의 제약 조합 제품은 예를 들어 약 50-70 kg의 대상체에 대해 약 1-1000 mg의 활성 성분(들), 또는 약 1-500 mg 또는 약 1-250 mg 또는 약 1-150 mg 또는 약 0.5-100 mg, 또는 약 1-50 mg의 활성 성분 중 임의의 하나 또는 특히 활성 성분의 합; 또는 (특히 EGFR 억제제에 대해) 각각 50 내지 900, 60 내지 850, 75 내지 800 또는 100 내지 600 mg의 활성 성분 중 임의의 하나 또는 특히 활성 성분의 합의 단위 투여량일 수 있다. 화합물, 제약 조성물 또는 그의 조합물의 치료 유효 투여량은 대상체의 종, 체중, 연령 및 개별 상태, 치료할 장애 또는 질환, 또는 그의 중증도에 따라 달라진다. 통상의 기술을 가진 의사, 임상의 또는 (동물 사용에서) 수의사는 장애 또는 질환의 진행을 예방, 치료 또는 억제하는데 필요한 각 활성 성분의 유효량을 용이하게 결정할 수 있다.
본 발명의 구체적 실시양태는 또한 여기에 참고로 포함되는 특허청구범위, 뿐만 아니라 실시예에 제공된다.
<도면의 설명>
도 1: HCC827 GR 폐암 세포에서 단일 작용제 게피티닙에 대한 저항성을 극복하는 MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 EGFR 억제제 게피티닙의 조합물의 시험관내 효과의 그래프 표현; 둥근 반점: 게피티닙; 정사각형: 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드; 삼각형: 게피티닙 및 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 조합물.
도 2: HCC827 세포에게 게피티닙에 대한 저항성을 주는 외인성 HGF (간세포 성장 인자)의 시험관내 효과의 그래프 표현.
도 3: 실시예에서 제공된 마우스 (생체내)에서의 MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 EGFR 억제제 게피티닙의 제1 조합 실험의 그래프 표현. HCC827GR5 피하 이종이식편을 보유하는 암컷 무흉선 마우스를 나타낸 용량 및 스케줄에서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드, 게피티닙, 두 작용제의 조합물 또는 비히클 대조군으로 처치하였다. 처치를 종양 세포 이식 11일 후에 시작하였고, 연속 13일 동안 지속하였다. 비히클 대조군에 대해 처치군을 비교하기 위한 일원 ANOVA, 사후 던넷 (*p<0.05 vs. 비히클 대조군), 및 일원 ANOVA, 사후 터키 포트 쌍별 비교 (연결 군 사이의 *p<0.05)로 Δ 종양 부피 및 Δ 체중에 대한 통계를 수행하였다. 좌측: 시간에 걸친 종양 부피. 우측 그래프: 시간에 걸친 체중.
도 4: 실시예에서 제공된 마우스 (생체내)에서의 MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 EGFR 억제제 게피티닙의 제2 조합 실험의 그래프 표현. HCC827GR5 피하 이종이식편을 보유하는 암컷 무흉선 마우스를 나타낸 용량 및 스케줄에서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드, 게피티닙, 두 작용제의 조합물 또는 비히클 대조군으로 처치하였다. 처치를 종양 세포 이식 11일 후에 시작하였고, 연속 13일 동안 지속하였다. 비히클에 대한 군을 비교하기 위한 일원 ANOVA, 사후 던넷 (*p<0.05 vs. 비히클 대조군), 및 일원 ANOVA, 사후 터키 포트 쌍별 비교 (연결 군 사이의 *p<0.05)로 Δ 종양 부피 및 Δ 체중에 대한 통계를 수행하였다.
도 5: 실시예에서 보다 상세히 기재된 마우스 (생체내)에서 처치 중단 후 시간에 걸친 종양 부피의 변화의 그래프 표현. HCC827GR5 피하 이종이식편을 보유하는 암컷 무흉선 마우스를 나타낸 용량 및 스케줄에서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드, 게피티닙, 두 작용제의 조합물 또는 비히클 대조군으로 처치하였다. 처치를 종양 세포 이식 11일 후에 시작하였고, 연속 13일 동안 지속하였다. 제2 효능 실험의 종결시 (세포 주사 후 24일), 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드로 처치된 군 및 조합물 군을 각각 4마리 동물의 2개의 군으로 분할하였다. 4마리 동물을 임의의 처치 없이 관찰 하에 유지시키면서 (좌측 패널), 2개의 다른 군의 4마리 동물 각각을 이전과 같은 매일 처치 하에 유지시켰다 (우측 패널). 종양 부피 및 체중을 단지 1주 1회 기록하였다. 수평 라인은 100 및 500 mm3 종양 부피에 놓여 있다.
실시예:
하기 실시예는 본 발명을 예시하며 구체적 실시양태를 제공하나, 본 발명의 범위를 제한하는 것은 아니다.
회사 및 세포 기탁 기관의 약어
ATCC = 아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection), 미국 버지니아주 마나사스
아미메드(Amimed) = 바이오콘셉트(BioConcept)의 상표명, 스위스 알슈빌
어플라이드 바이오시스템즈(Applied Biosystems) = 어플라이드 바이오시스템즈, 미국 캘리포니아주 포스터 시티
깁코(Gibco) = 라이프 테크놀로지스 코포레이션(Life Technologies Corporation)의 소유, 미국 뉴욕주 그랜드 아일랜드
페프로 테크(Pepro Tech) = 페프로테크(PeproTech), 미국 뉴저지주 록키 힐
퀴아젠(Quiagen) = 퀴아젠 아게(Quiagen AG), 독일 힐덴
TPP = 테크노 플라스틱 프로덕츠 아게(Techno Plastic Products AG), 스위스 트라자딩겐
다른 약어:
DMSO = 디메틸 술폭시드
실시예 1: 시험관내 폐암 모델에서의 MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 EGFR 억제제 게피티닙의 조합물
조합 처치의 근거를 확인하기 위해, 표제 화합물의 조합물을 폐암 세포주 HCC827 및 그의 게피티닙-저항성 유도체, HCC827 GR에서 시험하였다. MET 억제제 및 EGFR 억제제의 조합물이 하기와 같이 보다 효과적인 것으로 제시될 수 있었다:
방법:
HCC827 GR (게피티닙 저항성)을 파시 에이. 잔 박사 (다나-파버 암 연구소(Dana-Farber Cancer Institute), 미국 매사추세츠주 보스턴)로부터 입수하였으며, 또한 문헌 [J.A. Engelman et al., Science 316, 1039 ff (2007)]을 참조한다. 세포주 동일성을 SNP 유전자형 결정에 의해 확인하였다. 모 HCC827 세포는 ATCC (ATCC 번호 CRL-2868)로부터 상업적으로 입수가능하였다. 모든 두 NSCLC 세포주는 10% 열 불활성화 FCS, (아미메드, 카탈로그 번호 2-01F16-I), 2 mM L-글루타민 (아미메드, 카탈로그 번호 5-10K00-H), 1 mM 피루브산나트륨 (아미메드, 카탈로그 번호 5-60F00-H) 및 10 mM HEPES (깁코, 카탈로그 번호 15630)로 보충된 RPMI 1640 배지 (아미메드, 카탈로그 번호 1-41F01-I)에서 성장시켰다. 세포를 5% CO2를 갖는 습한 분위기에서 37℃에서 인큐베이션하였다. DNA를 DNeasy 혈액 및 조직 키트 (퀴아젠, 인크(QIAGEN, Inc))로 추출하였다.
MET 억제제 및 게피티닙 10 mM 원액을 DMSO 중에서 제조하고, -20℃에서 보관하였다.
증식 검정
세포를 96-웰 플레이트 (TPP, 편평 바닥, 조직 배양-처리됨, 제품 # 92096) 중에 웰당 3000개로 시딩하였다. 24시간 후, 각각의 화합물의 10-포인트 희석 시리즈를 DMSO 중에서 제조하였다. 게피티닙에 대해: 3-배 단계, 10 mM 내지 0.5 μM 범위; 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드에 대해: 3-배 단계, 1 μM 내지 0.05 μM 범위. 이어서, 화합물을 성장 배지 중에서 2 단계로 1000-배 희석하고, 세포에 3중으로 첨가하여 웰당 100 μL의 최종 부피 및 게피티닙에 대해 10 μM 및 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드에 대해 1μM의 최대 최종 화합물 농도를 생성하였다. DMSO-단독 대조군이 포함되었다. 조합 처치를 위해, 게피티닙 및 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 희석 시리즈를 세포에 동시에 첨가하였으며, 즉 화합물을 10:1의 일정한 비로 혼합하였다. 재조합 인간 HGF (페프로테크, 카탈로그 번호 100-39)를 개별 실험에서 나타낸 바와 같이 일정한 농도에서 화합물과 함께 첨가하였다. 세포를 72 내지 96시간 동안 인큐베이션한 다음, 생존 세포의 양을 레자주린 나트륨 염 염료 감소 판독 (알라마르블루(AlamarBlue)® 검정으로 상업적으로 공지됨, 인비트로젠(Invitrogen), 라이프 테크놀로지스 코포레이션, 미국 뉴욕주 그랜드 아일랜드)을 사용하여 평가하였다. 값을 정규화하고, 100%로 설정된 DMSO 대조군으로 "대조군의 %" 또는 "배수 시딩 세포"로서 플로팅하였다. 이 경우에, 정규화를 위한 "시딩된 세포" 값을 결정하기 위해 시딩한지 24시간 후에 처리되지 않은 세포를 갖는 개별 웰의 레자주린 판독을 수득하였다. 데이터의 플로팅 및 곡선-피팅을 윈도우용 그래프패드 프리즘(GraphPad Prism) 버전 5.00 (그래프패드 소프트웨어, 인크.(GraphPad Software, Inc.), 미국 캘리포니아주 라 졸라)을 사용하여 수행하였다.
결과:
도 1은 실험 결과를 나타낸다. HCC827 세포는, 예상된 바와 같이, 3 내지 4 nM의 IC50으로 게피티닙에 대해 고도로 민감성이었다. 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드는 HCC827 세포의 증식에 대한 어떠한 실질적인 효과 또는 게피티닙/2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 조합물의 효과에 대한 어떠한 기여도 나타내지 않았다. 명백히 대조적으로, HCC827 GR 세포는 게피티닙 단독에 완전히 저항성이었으며, 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 단독요법의 효과는 보통이었다. 그러나, 두 작용제의 조합물은 약 4 nM 게피티닙 및 0.4 nM 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드의 IC50으로 10:1 혼합물 중에서 게피티닙 억제된 모 (GR 아님) 세포만큼 효율적으로 증식을 억제하였다.
실시예 2: MET 활성화의 대안적 방법으로서의 외인성 HGF는 게피티닙에 대한 HCC827 세포의 저항성을 야기함
실험부:
HCC827 세포를 50 ng/ml 재조합 HGF (페프로테크, 카탈로그 번호 100-39)의 존재 또는 부재 하에 게피티닙의 희석 시리즈로 처치하였다. 세포 생존율을 알라마르블루 검정을 사용하여 96시간 후에 측정하였다. 세포의 초기 양을 화합물 첨가의 시간 (파선)에서 정량화하였으며, y 축 상의 세포 성장은 이러한 값의 배수로 표현되었다.
결과:
재조합 간세포 성장 인자 (HGF)의 고정 조합물의 존재 또는 부재 하에 게피티닙의 연속 희석에 노출된 HCC827 세포의 성장을 검사하였다. 도 2에 나타난 바와 같이, 게피티닙-민감성 폐암 세포주 HCC827에 대해, HGF-매개 MET 활성화는 게피티닙에 의해 야기된 성장 억제를 부분적으로 복귀시킬 수 있었으며, 이는 MET 활성화가 폐암 모델에서 EGFR 활성의 손실에 대해 보상할 수 있다는 개념을 확인하였다. 이어서, MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드의 첨가는 HGF에 의해 야기되는 세포 성장의 "구출"을 복귀시키는 것으로 예상될 것이다.
qPCT를 사용하는 정량적 유전자 카피수 분석에 의해 (나타내지 않음), HCC827 GR 및 HCC827 세포에서 평균 MET 카피수가 각각 7.50±0.18 및 1.92±0.36이었음을 확인하였으며, 따라서 이는 EGFR 억제제 게피티닙에 대한 HCC827 GR의 획득 저항성이 MET 증폭을 기초로 한다는 개념을 확인하였다.
실시예 3: 생체내 폐암 모델에서의 MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 EGFR 억제제 게피티닙의 조합물
2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드를 HCC827 GR5 피하 이종이식편에 대해 단독으로 또는 게피티닙과 조합하여 시험하였다. 이 종양 모델은 활성화 EGFR 돌연변이 뿐만 아니라 MET 유전자의 증폭을 수반하였다.
실험은 바젤주 수의 사무국(Basel Cantonal Veterinary Office)에 의한 승인 하에 수행하였다.
실험을 하를란 빈켈만(Harlan Winkelmann) (독일)으로부터 입수된 암컷 Hsd: 무흉선 누드-nu CPB 마우스에서 수행하였다. 동물은 처치 시작시 대략 11 주령이었으며, 마크롤론 유형 III 케이지 (케이지당 최대 5마리 동물) 내에서 최적화된 위생 조건 (OHC) 하에 음식물 및 물에 대한 자유로운 접근으로 거주시켰다.
HCC827GR5 (또한 문헌 [J.A. Engelman et al., Science 316, 1039 ff (2007); gefitinib resistant lung tumor cells] 참조)를 파시 잔 박사 (다나-파버 암 연구소, 미국 매사추세츠주 보스턴)로부터 입수하였다. 세포주 동일성을 SNP 유전자형 결정에 의해 확인하였다. 세포를 10% 열 불활성화 FCS, (아미메드 # 2-01F16-I), 2 mM L-글루타민 (아미메드 # 5-10K00-H), 1 mM 피루브산나트륨 (아미메드 # 5-60F00-H) 및 10 mM HEPES (깁코 # 15630)로 보충된 RPMI 1640 배지 (아미메드 #1-41F01-I)에서 성장시켰다. 0.1 μM 게피티닙 농도를 세포 배양 배지 내에서 항상 유지함으로써 선택적인 압력을 세포 상에서 유지하였다. 세포를 5% CO2를 갖는 습한 분위기에서 37℃에서 인큐베이션하였다.
50% 매트리겔 (v/v) (엥겔브레트-홀름-스웜(Engelbreth-Holm-Swarm) (EHS) 마우스 육종 세포에 의해 분비된 젤라틴성 단백질 혼합, BD 바이오사이언시스(BD Biosciences), 미국 뉴저지주 프랭클린 레이크스)을 함유하는 115μl HBSS (행크 완충 염 용액) 중의 5x106개의 세포를 마우스의 우측 측복부에, 포렌(Forene)® (이소플루란; 애보트(Abott), 스위스) 마취 하에 13 게이지 투관침 바늘을 사용하여 피하 주사함으로써 HCC827GR5 종양을 확립하였다. 효능 실험에서, 종양 이식 11일 후, 종양이 150mm3의 평균 크기에 도달한 경우에 처치를 시작하였다. PK/PD 실험에서, 종양 이식 15일 후, 평균 종양 크기가 450mm3인 경우에 처치를 시작하였다.
2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드를 물 중 0.25% 메틸셀룰로스 및 0.05% 트윈(Tween) 80 중에서 수조 소니케이터 (33kHz, 1시간)를 사용하여 제제화하였다. 적용 부피는 단일 작용제 및 비히클 대조군에 대해 10ml/kg 또는 시험 화합물이 조합물로 제공되는 경우에 5ml/kg이었다. 모든 나타낸 용량은 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 (디히드로클로라이드 염)의 유리 염기 당량을 지칭한다. 게피티닙을 N-메틸-2-피롤리돈:PEG300:솔루톨(Solutol) HS15:물 (10:30:20:40 v/v) 중에서 제제화하였다.
(상표명: 트윈 80 = 폴리소르베이트(Polysorbat) 80 (ICI 아메리카스, 인크.(ICI Americas, Inc.), 미국); 솔루톨 HS15= 마크로골(Macrogol) 15 히드록시스테아레이트 (바스프(BASF), 독일 루드빅샤펜)).
종양 부피는 캘리퍼스를 사용하여 측정하고, 식: 길이 x 직경2 x π/6에 따라 결정하였다. 처치 과정에 걸쳐 종양 부피의 변화를 나타내는 것 이외에도, 항종양 활성을 T/C% ((처치된 동물의 평균 종양 부피 변화/대조군 동물의 평균 종양 부피 변화) x 100)로서 나타내었다. 퇴행 (%)는 식: ((처치 종결시의 평균 종양 부피 - 처치 시작시의 평균 종양 부피)/처치 시작시의 평균 종양 부피) x 100에 따라 계산하였다. 체중 및 종양 부피를 1주 2회 기록하였다.
통계: 적용가능한 경우에, 데이터를 평균 ± SEM으로 나타내었다. 모든 시험에 대해, 유의성 수준은 p<0.05로 설정하였다. 종양 부피에 대해, 처치군과 비히클 대조군과의 비교는 일원 ANOVA에 이어서 던넷 검정을 사용하여 수행하였다. 쌍별 비교는 일원 ANOVA에 이어서 터키 검정을 사용하여 수행하였다. 처치 기간의 시작과 종료 사이에 군 내에서의 체중 변화의 유의성 수준은 대응표본 t-검정을 사용하여 결정하였다. 처치군과 비히클 대조군 사이의 델타 체중의 비교는 일원 ANOVA에 이어서 사후 던넷 검정에 의해 수행하였다. 계산은 윈도우용 그래프패드 프리즘 4 (그래프패드 소프트웨어 인크.)를 사용하여 수행하였다. 추가로, 약물 상호작용의 근사치는 클라크 (문헌 [Clarke R., Breast Cancer Research and Treatment 46, 255-278 (1997)])에 의해 기재된 방법을 사용하여 만들었다. 이를 델타 종양 부피에 적용하였고, 제한된 데이터로부터 상호작용을 추정할 수 있다. 간단히 말하면, 조합 데이터를 제한된 데이터로부터 상호작용을 추정할 수 있는 클라크에 의해 제시된 방법을 사용하여 평가하였다. 화합물 A, B 또는 조합물 AB (대조군 C와 함께)에 대해, 길항작용은 계산 AB/C > A/C x B/C인 경우에 예상되며, 상가 효과: AB/C = A/C x B/C, 상승작용적 상호작용은 AB/C < A/C x B/C인 경우에 발생하는 것으로 예상된다.
한 실험에서, 도 3을 참조하며, 암컷 무흉선 누드 마우스를 3mg/kg 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 단독으로 또는 25mg/kg 게피티닙과 조합하여 1일 1회 경구로 처치하였다. 비히클 대조군은 물 중 0.25% 메틸셀룰로스 및 0.05% 트윈 80의 매일 경구 투여를 받은 동물로 구성되었다. 모든 투여 부피는 조합 화학요법 군에서 제외하고 10ml/kg이었으며, 여기서 각각의 단일 작용제를 5ml/kg으로 투여하였다. 단일 작용제로서 투여되는 경우에, 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 게피티닙은 둘 다 각각 22.9% 퇴행 및 32.5%의 T/C로 통계적으로 유의한 항종양 효과를 생성하였다 (p<0.05, ANOVA). 조합물로 제공되는 경우에, 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 게피티닙은 87.3%의 통계적으로 유의한 퇴행을 생성하였다 (p<0.05, ANOVA). 사후 터키 분석은 또한 단일 작용제로서 투여된 게피티닙에 의해 생성된 항종양 효과가 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 단독 및 조합물 둘 다와 통계적으로 상이한 것을 나타내었다 (p<0.05, ANOVA). 추가로, 단일 작용제로서 투여된 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드는 조합물과 비교하는 경우에 유의한 효과를 생성하지 않았다 (p>0.05, ANOVA, 사후 터키). 모든 처치군에서의 체중 변화는 비히클 대조군과 유의하게 상이하지 않으며 (p>0.05, 일원 ANOVA, 사후 던넷), 처치 기간 동안의 체중 증가는 단지 비히클 대조군에서 유의하였다 (p<0.05, 대응표본 t-검정). 더욱이, 클라크 (상기 인용문헌)에 의해 기재된 방법으로의 가능한 화합물 상호작용의 분석은 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 (3mg/kg) 및 게피티닙 (25mg/kg)의 조합물로의 상승작용적 항종양 효과를 나타내었으며, 하기 표 1을 참조한다:
<표 1> 클라크의 방법에 의한 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 ("MET 억제제") 및 게피티닙 ("EGFR 억제제")의 조합물의 항종양 효과의 평가
조합 데이터를 제한된 데이터로부터 상호작용을 추정할 수 있는 클라크에 의해 제시된 방법을 사용하여 평가하였다. 화합물 A, B 또는 조합물 AB (대조군 C와 함께)에 대해, 길항작용은 계산 AB/C > A/C x B/C인 경우에 예상되며, 상가 효과: AB/C = A/C x B/C, 상승작용적 상호작용은 AB/C < A/C x B/C인 경우에 발생하는 것으로 예상된다.
추가의 실험에서, 도 4를 참조하며, 암컷 무흉선 누드 마우스를 3mg/kg 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 단독으로 또는 25mg/kg 게피티닙과 조합하여 1일 1회 경구로 처치하였다. 비히클 대조군은 물 중 0.25% 메틸셀룰로스 및 0.05% 트윈 80의 매일 경구 투여를 받은 동물로 구성되었다. 모든 투여 부피는 조합 화학요법 군에서 제외하고 10ml/kg이었으며, 여기서 각각의 단일 작용제를 5ml/kg으로 투여하였다. 단일 작용제로서 투여되는 경우에, 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 게피티닙은 둘 다 각각 21.4% 퇴행 및 49.4%의 T/C로 통계적으로 유의한 항종양 효과를 생성하였다 (p<0.05, ANOVA). 조합물로 제공되는 경우에, 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 게피티닙은 86.4%의 통계적으로 유의한 퇴행을 생성하였다 (p<0.05, ANOVA). 사후 터키 분석은 단일 작용제로서 투여된 게피티닙에 의해 생성된 항종양 효과가 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 단독 및 조합물 둘 다와 통계적으로 상이한 것을 나타내었다 (p<0.05, ANOVA). 추가로, 단일 작용제로서 투여된 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드는 조합물과 비교하는 경우에 유의한 효과를 생성하지 않았다 (p>0.05, ANOVA, 사후 터키). 모든 처치군에서의 체중 변화는 비히클 대조군과 유의하게 상이하지 않았다 (p>0.05, 일원 ANOVA, 사후 던넷). 체중 증가는 조합물 군을 제외한 모든 군에서 통계적으로 유의하였다 (p<0.05, 대응표본 t-검정). 도 4를 참조한다.
이전 연구에서와 같이, 클라크 (문헌 [Clarke 1997])에 의해 기재된 방법으로의 가능한 화합물 상호작용의 분석은 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 (3mg/kg) 및 게피티닙 (25mg/kg)의 조합물로의 상승작용적 항종양 효과를 나타내었으며, 하기 표 2를 참조한다:
<표 2> 클라크의 방법에 의한 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 ("MET 억제제") 및 게피티닙 ("EGFR 억제제")의 조합물의 항종양 효과의 평가
(표 1 아래의 설명 참조)
추가의 실험에서, HCC827GR5 피하 이종이식편을 보유하는 암컷 무흉선 마우스를 도 3에 나타낸 용량 및 스케줄에서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드, 게피티닙, 두 작용제의 조합물 또는 비히클 대조군으로 처치하였다. 처치를 종양 세포 이식 11일 후에 시작하였고, 연속 13일 동안 지속하였다. 제2 효능 실험의 종결시 (세포 주사 후 24일), 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드로 처치된 군 및 조합물 군을 각각 4마리 동물의 2개의 군으로 분할하였다. 4마리 동물을 임의의 처치 없이 관찰 하에 유지시키면서 (좌측 패널), 2개의 다른 군의 4마리 동물 각각을 이전과 같은 매일 처치 하에 유지시켰다 (우측 패널). 종양 부피 및 체중을 단지 1주 1회 기록하였다. 수평 라인은 각각 100 및 500 mm3 종양 부피에 놓여 있다. 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 단독으로 사전에 처치된 동물에서의 종양이 516 +/- 112 mm3의 평균 +/- SEM 부피로 지속적으로 성장한 반면에, 조합물 군에서의 동물의 종양은 90 +/- 27 mm3에 도달하였으며, 도 5, 좌측 그래프를 참조한다. 대조적으로, 처치를 연장한 군에서의 동물은 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드-처치된 동물에 대해 단지 평균 400 +/- 80 mm3으로 증가하였다. 조합 요법을 받은 동물에서의 종양은 지속적으로 33 +/- 1.3 내지 26.3 +/- 2.8 mm3의 평균 부피 (초기 부피로부터 89.2% 퇴행의 평균을 나타냄)로부터 퇴행하였다.
논의: 3 mg/kg의 용량의 MET 억제제 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드는 약간 통계적으로 유의한 종양 퇴행을 나타내었다. 이러한 퇴행은 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드가 게피티닙과 조합된 경우에 유의하게 증가하였다. 단일 작용제로서, 25 mg/kg의 용량으로 투여된 게피티닙은 지속적으로 통계적으로 유의한 항종양 효과를 일으켰으나, 퇴행은 전혀 없었다. 약역학적 분석은 MET 신호전달 경로가 MET 억제제의 투여 후 8시간 이상 동안 하향 조절되며 이러한 하향 조절이 EGFR 억제제 게피티닙의 동시 투여에 의해 강화되는 것을 나타내며, 이는 조합물 군에서 80% 초과의 강한 종양 퇴행을 설명한다. 반복된 투여 후의 약물 농도의 분석 (나타내지 않음)은 게피티닙의 수준이 이것이 조합물로 투여되는 경우에 2- 내지 4-배 증가되는 것을 나타내었다. 따라서, 종양 조직에서의 게피티닙에 대한 증가된 노출이 조합물 군에서 관찰된 개선된 항종양 효과에 기여하는 것이 가능하였다.
실시예 4: 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드는 높은 효력 (시험관내 키나제 검정에서의 IC50 = 0.13 ± 0.05 nM) 및 선택성 (56종의 다른 인간 키나제의 패널에 비해 > 10,000-배 선택성)을 보유하는 c-MET 키나제에 대한 ATP-경쟁적 및 가역적 소분자 억제제이다. 강력한 활성 (IC50 값: 0.2 - 2 nM)은 또한 c-MET-매개 신호 전달, 뿐만 아니라 c-MET-의존성 세포 증식, 생존 및 이동을 측정하는 세포-기재 생화학적 및 기능적 검정에서 입증되었다. c-MET-구동 또는 HGF/c-MET-구동 이종이식편 마우스 종양 모델에서, 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드의 경구 투여는 c-MET 인산화 및 종양 성장 둘 다를 차단함에 있어 유의한 생체내 활성을 입증하였다. 추가로, EGFR 억제제 게피티닙과의 조합물은 게피티닙-민감성 EGFR 돌연변이 및 c-MET 증폭을 수반하는 게피티닙-저항성 폐암 모델의 성장을 억제함에 있어 시험관내 및 생체내에서 효과적이었다. 다양한 계통으로부터 유래하는 암 세포주의 큰 패널의 유전자 카피수 변이 및 mRNA 발현 프로파일링은 c-MET 증폭이 여러 암 유형에 존재하지만, 폐, 위, 유방 및 난소의 암에서 상대적으로 보다 빈번한 것으로 제안하였다. HGF 발현은 또한 계통 연합을 나타내고, 혈액, 뇌, 연부 조직, 폐 및 간의 암에서 보다 빈번하게 검출되었다. 표적화된 작용제의 큰 패널을 갖는 이들 암 세포주의 약리유전학적 프로파일링은 c-MET 증폭 또는 동시 HGF 및 c-MET 발현이 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드를 포함하는 c-MET 억제제에 대한 반응을 고도로 예측가능한 것으로 나타내었다. 게다가, 표적에 의해 분류된 화합물의 484개 부류 중에, c-MET 억제제는 c-MET 증폭 또는 동시 HGF 및 c-MET 발현을 갖는 세포주의 성장을 억제함에 있어 가장 활성인 화합물의 부류이다. 중요하게는, 동시 HGF 및 c-MET 발현을 갖는 세포주는 또한 HGF 발현이 결핍된 유사한 c-MET 수준을 갖는 세포주와 비교하여 EGFR 억제제에 대해 비교적 저항성이 있었다.
실시예 5: 비소세포 폐 암종 (NSCLC)을 위한 임상 시험
EGFRi 처치 후에 진행된 EGFR 돌연변이된, c-MET-증폭된 NSCLC를 갖는 환자에서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 및 게피티닙의 안전성 및 효능 연구를 수행하였다. 시험은 EGFR 억제제 처치 후에 진행된 EGFR 돌연변이된 c-MET-증폭된 비소세포 폐암을 갖는 성인 환자에서 게피티닙과 조합하여 경구 투여된 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드의 IB/II상, 개방 표지, 다기관 연구이다.
포함 기준:
-기록된 EGFR 돌연변이 -기록된 c-MET 증폭 -EGFR 억제제에 대한 이전 임상적 이익 및 이어서 후속 진행
-EGFR 억제제에 대한 진행 이후 다른 처치를 시작하지 않음
-≥ 18세 -≥ 3개월의 기대 수명
-ECOG 수행 상태 ≤ 2
-성별: 둘 다; 최소 나이 16세
배제 기준:
-정제를 매일 1회 또는 2회 삼킬 수 없음
-c-MET 억제제를 사용한 이전 처치
-등급 1 초과의 이전 항암 요법으로부터의 임의의 미분해 독성 -낭성 섬유증의 병력
-급성 또는 만성 췌장염의 병력
-MRI 또는 CT 스캔을 겪을 수 없음
-HIV의 공지된 병력
-골수 또는 고형 기관 이식을 겪음
-증가된 출혈 가능성을 갖는 임상적으로 유의한 상처 또는 폐 종양 병변
-임신 또는 수유 다른 프로토콜-정의된 포함/배제 기준이 적용될 수 있음
하기 데이터를 수득하였다:
1차 결과 측정
2차 결과 측정
실시예 6: EGFR 억제제 처치 후에 진행된 EGFR 돌연변이된 c-MET-증폭된 비소세포 폐암을 갖는 성인 환자에서 게피티닙과 조합하여 경구 투여된 화합물 A 또는 화합물 B의 IB/II상, 개방 표지, 다기관 연구
프로토콜 개요:
Claims (21)
- (i) MET 티로신 키나제 억제제로서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 또는 그의 제약상 허용되는 염 및 (ii) EGFR 티로신 키나제 억제제로서 게피티닙 또는 그의 제약상 허용되는 염, 및
하나 이상의 제약상 허용되는 담체를 포함하는, 폐암 치료용 제약 조합물. - 제1항에 있어서, 성분 (i) 및 (ii)의 동시, 개별 또는 순차적 사용을 위한 제약 조합물.
- 제1항에 있어서, 고정 조합물 형태인 제약 조합물.
- 제1항에 있어서, 성분 (i) 및 (ii)가 독립적으로 동시에 또는 시간 간격을 두고 개별적으로 투여될 수 있는 조합 투여를 위한 형태 또는 부분들의 키트인 제약 조합물.
- 삭제
- 삭제
- 삭제
- 제1항 내지 제4항 중 어느 한 항에 있어서, 추가의 공동-작용제 또는 그의 제약상 허용되는 염을 포함하는 제약 조합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 폐암에 대한 연합 치료 유효량의, 조합 파트너인 성분 (i) 및 (ii), 및 하나 이상의 제약상 허용되는 담체, 및 임의로 추가의 공동-작용제 또는 그의 제약상 허용되는 염을 포함하는 제약 조합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 조합 제품 형태인 제약 조합물.
- 삭제
- 삭제
- 폐암을 치료하기 위한 의약 또는 제약 제품의 제조를 위한, (i) MET 티로신 키나제 억제제로서 2-플루오로-N-메틸-4-[(7-퀴놀린-6-일-메틸)-이미다조[1,2-b]트리아진-2-일]벤즈아미드 또는 그의 제약상 허용되는 염 및 (ii) EGFR 티로신 키나제 억제제로서 게피티닙 또는 그의 제약상 허용되는 염의 조합물.
- 삭제
- 제1항 내지 제4항 중 어느 한 항에 따른 제약 조합물을, 폐암의 치료에서의 그의 동시, 개별 또는 순차적 사용을 위한 지침과 함께 포함하는, 폐암의 치료에서의 사용을 위한 제약 제품 또는 상업용 패키지.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261619490P | 2012-04-03 | 2012-04-03 | |
| US61/619,490 | 2012-04-03 | ||
| PCT/CN2013/073678 WO2013149581A1 (en) | 2012-04-03 | 2013-04-03 | Combination products with tyrosine kinase inhibitors and their use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20150001782A KR20150001782A (ko) | 2015-01-06 |
| KR102115047B1 true KR102115047B1 (ko) | 2020-05-26 |
Family
ID=49300000
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147030326A KR102115047B1 (ko) | 2012-04-03 | 2013-04-03 | 티로신 키나제 억제제들을 갖는 조합 제품 및 그의 용도 |
Country Status (11)
| Country | Link |
|---|---|
| US (4) | US20150297604A1 (ko) |
| EP (2) | EP3964513A1 (ko) |
| JP (3) | JP2015512425A (ko) |
| KR (1) | KR102115047B1 (ko) |
| CN (2) | CN104245701A (ko) |
| AU (4) | AU2013243097A1 (ko) |
| CA (1) | CA2868202C (ko) |
| ES (1) | ES2894830T3 (ko) |
| MX (1) | MX371119B (ko) |
| RU (1) | RU2660354C2 (ko) |
| WO (1) | WO2013149581A1 (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2660354C2 (ru) * | 2012-04-03 | 2018-07-05 | Новартис Аг | Комбинированные продукты, содержащие ингибиторы тирозинкиназ, и их применение |
| KR20160106147A (ko) * | 2014-01-07 | 2016-09-09 | 메르크 파텐트 게엠베하 | 항암 활성을 갖는 6-옥소-1,6-디히드로-피리다진 유도체와 게피티닙의 조합 |
| WO2016011658A1 (en) | 2014-07-25 | 2016-01-28 | Novartis Ag | Combination therapy |
| BR112017001695A2 (pt) | 2014-07-31 | 2017-11-21 | Novartis Ag | terapia de combinação |
| US20170304313A1 (en) * | 2014-10-06 | 2017-10-26 | Novartis Ag | Therapeutic Combination For The Treatment Of Cancer |
| BR112017012136A2 (pt) * | 2014-12-12 | 2018-01-02 | Merck Patent Gmbh | Combinação de um derivado de 6-oxo-1,6-di-hidro- piridazina tendo atividade anticâncer com um inibidor de egfr |
| CN108069913B (zh) * | 2016-11-18 | 2022-03-01 | 陕西师范大学 | 双(吗啉基烷氧基)喹唑啉衍生物及其在抗肿瘤方面的用途 |
| AU2020242287A1 (en) | 2019-03-21 | 2021-09-02 | INSERM (Institut National de la Santé et de la Recherche Médicale) | A Dbait molecule in combination with kinase inhibitor for the treatment of cancer |
| CN114761006A (zh) | 2019-11-08 | 2022-07-15 | Inserm(法国国家健康医学研究院) | 对激酶抑制剂产生耐药性的癌症的治疗方法 |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| WO2022007752A1 (zh) * | 2020-07-06 | 2022-01-13 | 苏州晶云药物科技股份有限公司 | 苯甲酰胺类化合物及其二盐酸盐的新晶型及其制备方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008064157A1 (en) * | 2006-11-22 | 2008-05-29 | Incyte Corporation | Imidazotriazines and imidazopyrimidines as kinase inhibitors |
| WO2011018454A1 (en) * | 2009-08-12 | 2011-02-17 | Novartis Ag | Heterocyclic hydrazone compounds and their uses to treat cancer and inflammation |
Family Cites Families (155)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1219606A (en) | 1968-07-15 | 1971-01-20 | Rech S Et D Applic Scient Soge | Quinuclidinol derivatives and preparation thereof |
| EP0100172B1 (en) | 1982-07-23 | 1987-08-12 | Imperial Chemical Industries Plc | Amide derivatives |
| US5093330A (en) | 1987-06-15 | 1992-03-03 | Ciba-Geigy Corporation | Staurosporine derivatives substituted at methylamino nitrogen |
| GB8916480D0 (en) | 1989-07-19 | 1989-09-06 | Glaxo Group Ltd | Chemical process |
| GB8923590D0 (en) | 1989-10-19 | 1989-12-06 | Pfizer Ltd | Antimuscarinic bronchodilators |
| US5395855A (en) | 1990-05-07 | 1995-03-07 | Ciba-Geigy Corporation | Hydrazones |
| PT100441A (pt) | 1991-05-02 | 1993-09-30 | Smithkline Beecham Corp | Pirrolidinonas, seu processo de preparacao, composicoes farmaceuticas que as contem e uso |
| US5451700A (en) | 1991-06-11 | 1995-09-19 | Ciba-Geigy Corporation | Amidino compounds, their manufacture and methods of treatment |
| NZ243082A (en) | 1991-06-28 | 1995-02-24 | Ici Plc | 4-anilino-quinazoline derivatives; pharmaceutical compositions, preparatory processes, and use thereof |
| GB9300059D0 (en) | 1992-01-20 | 1993-03-03 | Zeneca Ltd | Quinazoline derivatives |
| US5605923A (en) | 1992-04-02 | 1997-02-25 | Smithkline Beecham Corporation | Compounds useful for treating inflammatory diseases and inhibiting production of tumor necrosis factor |
| JP3192424B2 (ja) | 1992-04-02 | 2001-07-30 | スミスクライン・ビーチャム・コーポレイション | アレルギーまたは炎症疾患の治療用化合物 |
| CA2133439C (en) | 1992-04-02 | 2005-07-26 | Siegfried Benjamin Christensen, Iv | Compounds useful for treating allergic and inflammatory diseases |
| TW225528B (ko) | 1992-04-03 | 1994-06-21 | Ciba Geigy Ag | |
| WO1994010202A1 (en) | 1992-10-28 | 1994-05-11 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| GB9301000D0 (en) | 1993-01-20 | 1993-03-10 | Glaxo Group Ltd | Chemical compounds |
| GB9314893D0 (en) | 1993-07-19 | 1993-09-01 | Zeneca Ltd | Quinazoline derivatives |
| GB9414208D0 (en) | 1994-07-14 | 1994-08-31 | Glaxo Group Ltd | Compounds |
| GB9414193D0 (en) | 1994-07-14 | 1994-08-31 | Glaxo Group Ltd | Compounds |
| EP3103799B1 (en) | 1995-03-30 | 2018-06-06 | OSI Pharmaceuticals, LLC | Quinazoline derivatives |
| GB9508538D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| US5747498A (en) | 1996-05-28 | 1998-05-05 | Pfizer Inc. | Alkynyl and azido-substituted 4-anilinoquinazolines |
| US5880141A (en) | 1995-06-07 | 1999-03-09 | Sugen, Inc. | Benzylidene-Z-indoline compounds for the treatment of disease |
| NZ312665A (en) | 1995-07-06 | 1999-08-30 | Novartis Ag | Rrolopyrimidines(7h-pyrrolo[2,3-d]pyrimidine and preparation of these |
| US5760041A (en) | 1996-02-05 | 1998-06-02 | American Cyanamid Company | 4-aminoquinazoline EGFR Inhibitors |
| GB9603095D0 (en) | 1996-02-14 | 1996-04-10 | Zeneca Ltd | Quinazoline derivatives |
| CN100503580C (zh) | 1996-04-12 | 2009-06-24 | 沃尼尔·朗伯公司 | 酪氨酸激酶的不可逆抑制剂 |
| CA2258548C (en) | 1996-06-24 | 2005-07-26 | Pfizer Inc. | Phenylamino-substituted tricyclic derivatives for treatment of hyperproliferative diseases |
| PT912559E (pt) | 1996-07-13 | 2003-03-31 | Glaxo Group Ltd | Compostos heterociclicos fundidos como inibidores de proteina tirosina quinase |
| DE19638745C2 (de) | 1996-09-11 | 2001-05-10 | Schering Ag | Monoklonale Antikörper gegen die extrazelluläre Domäne des menschlichen VEGF - Rezeptorproteins (KDR) |
| CA2265630A1 (en) | 1996-09-13 | 1998-03-19 | Gerald Mcmahon | Use of quinazoline derivatives for the manufacture of a medicament in the treatment of hyperproliferative skin disorders |
| EP0837063A1 (en) | 1996-10-17 | 1998-04-22 | Pfizer Inc. | 4-Aminoquinazoline derivatives |
| GB9622386D0 (en) | 1996-10-28 | 1997-01-08 | Sandoz Ltd | Organic compounds |
| TW528755B (en) | 1996-12-24 | 2003-04-21 | Glaxo Group Ltd | 2-(purin-9-yl)-tetrahydrofuran-3,4-diol derivatives |
| CO4950519A1 (es) | 1997-02-13 | 2000-09-01 | Novartis Ag | Ftalazinas, preparaciones farmaceuticas que las comprenden y proceso para su preparacion |
| CO4940418A1 (es) | 1997-07-18 | 2000-07-24 | Novartis Ag | Modificacion de cristal de un derivado de n-fenil-2- pirimidinamina, procesos para su fabricacion y su uso |
| US6166037A (en) | 1997-08-28 | 2000-12-26 | Merck & Co., Inc. | Pyrrolidine and piperidine modulators of chemokine receptor activity |
| WO1999016766A1 (fr) | 1997-10-01 | 1999-04-08 | Kyowa Hakko Kogyo Co., Ltd. | Derives de benzodioxole |
| GB9721069D0 (en) | 1997-10-03 | 1997-12-03 | Pharmacia & Upjohn Spa | Polymeric derivatives of camptothecin |
| GB9723589D0 (en) | 1997-11-08 | 1998-01-07 | Glaxo Group Ltd | Chemical compounds |
| GB9723566D0 (en) | 1997-11-08 | 1998-01-07 | Glaxo Group Ltd | Chemical compounds |
| GB9723590D0 (en) | 1997-11-08 | 1998-01-07 | Glaxo Group Ltd | Chemical compounds |
| RS49779B (sr) | 1998-01-12 | 2008-06-05 | Glaxo Group Limited, | Biciklična heteroaromatična jedinjenja kao inhibitori protein tirozin kinaze |
| YU44900A (sh) | 1998-01-31 | 2003-01-31 | Glaxo Group Limited | Derivati 2-(purin-9-il)tetrahidrofuran-3,4-diola |
| AR017457A1 (es) | 1998-02-14 | 2001-09-05 | Glaxo Group Ltd | Compuestos derivados de 2-(purin-9-il)-tetrahidrofuran-3,4-diol, procesos para su preparacion, composiciones que los contienen y su uso en terapia para el tratamiento de enfermedades inflamatorias. |
| SK19542000A3 (sk) | 1998-06-23 | 2001-09-11 | Glaxo Group Limited | 2-(purin-9-yl)-tetrahydrofurn-3,4-diolov derivty, spsob ich vroby, farmaceutick prostriedok s ich obsahom, ich pouitie a medziprodukty |
| GB9813535D0 (en) | 1998-06-23 | 1998-08-19 | Glaxo Group Ltd | Chemical compounds |
| GB9813565D0 (en) | 1998-06-23 | 1998-08-19 | Glaxo Group Ltd | Chemical compounds |
| GB9813540D0 (en) | 1998-06-23 | 1998-08-19 | Glaxo Group Ltd | Chemical compounds |
| DE69827673T2 (de) | 1998-06-30 | 2005-04-21 | Dow Global Technologies Inc | Polymerpolyole und ein verfahren zu ihrer darstellung |
| CN1152031C (zh) | 1998-08-11 | 2004-06-02 | 诺瓦提斯公司 | 具有血管生成抑制活性的异喹啉衍生物 |
| JP3602445B2 (ja) | 1998-10-16 | 2004-12-15 | ファイザー・インク | アデニン誘導体 |
| GB9824579D0 (en) | 1998-11-10 | 1999-01-06 | Novartis Ag | Organic compounds |
| UA71587C2 (uk) | 1998-11-10 | 2004-12-15 | Шерінг Акцієнгезелльшафт | Аміди антранілової кислоти та їхнє застосування як лікарських засобів |
| NZ512189A (en) | 1998-11-19 | 2003-10-31 | Warner Lambert Co | N-[4-(3-chloro-4-fluoro-phenylamino)-7-(3-morpholin-4- yl-propoxy)-quinazolin-6-yl]-acrylamide useful as an irreversible inhibitor of tyrosine kinases |
| DE69926536T3 (de) | 1998-12-22 | 2013-09-12 | Genentech, Inc. | Antagonisten von vaskular-endothelialen zellwachstumsfaktoren und ihre anwendung |
| ATE329596T1 (de) | 1999-03-30 | 2006-07-15 | Novartis Pharma Gmbh | Phthalazinderivate zur behandlung von entzündlicher erkrankungen |
| GB9913083D0 (en) | 1999-06-04 | 1999-08-04 | Novartis Ag | Organic compounds |
| HUP0203528A3 (en) | 1999-05-04 | 2003-11-28 | Schering Corp | Piperidine derivatives useful as ccr5 antagonists, pharmaceutical compositions containing them and their use |
| DE60045528D1 (de) | 1999-05-04 | 2011-02-24 | Schering Corp | Pharmazeutische zusammensetzungen, die ccr5-antagonisierende piperazinderivate enthalten |
| YU25500A (sh) | 1999-05-11 | 2003-08-29 | Pfizer Products Inc. | Postupak za sintezu analoga nukleozida |
| GB9913932D0 (en) | 1999-06-15 | 1999-08-18 | Pfizer Ltd | Purine derivatives |
| US6322771B1 (en) | 1999-06-18 | 2001-11-27 | University Of Virginia Patent Foundation | Induction of pharmacological stress with adenosine receptor agonists |
| ES2165768B1 (es) | 1999-07-14 | 2003-04-01 | Almirall Prodesfarma Sa | Nuevos derivados de quinuclidina y composiciones farmaceuticas que los contienen. |
| DE60043318D1 (de) | 1999-08-21 | 2010-01-14 | Nycomed Gmbh | Synergistische kombination von pumafentrine und salmeterol |
| CO5180581A1 (es) | 1999-09-30 | 2002-07-30 | Pfizer Prod Inc | Compuestos para el tratamiento de la isquemia ciones farmaceuticas que los contienen para el tratamiento de la isquemia |
| GB9924361D0 (en) | 1999-10-14 | 1999-12-15 | Pfizer Ltd | Purine derivatives |
| GB9924363D0 (en) | 1999-10-14 | 1999-12-15 | Pfizer Central Res | Purine derivatives |
| GB0003960D0 (en) | 2000-02-18 | 2000-04-12 | Pfizer Ltd | Purine derivatives |
| TWI227240B (en) | 2000-06-06 | 2005-02-01 | Pfizer | 2-aminocarbonyl-9H-purine derivatives |
| WO2002000652A1 (es) | 2000-06-27 | 2002-01-03 | Laboratorios S.A.L.V.A.T., S.A. | Carbamatos derivados de arilalquilaminas |
| GB0015727D0 (en) | 2000-06-27 | 2000-08-16 | Pfizer Ltd | Purine derivatives |
| GB0015876D0 (en) | 2000-06-28 | 2000-08-23 | Novartis Ag | Organic compounds |
| AU7307101A (en) | 2000-06-30 | 2002-01-14 | Glaxo Group Ltd | Quinazoline ditosylate salt compounds |
| DE10038639A1 (de) | 2000-07-28 | 2002-02-21 | Schering Ag | Nichtsteroidale Entzündungshemmer |
| AU7576001A (en) | 2000-08-05 | 2002-02-18 | Glaxo Group Ltd | 6.alpha., 9.alpha.-difluoro-17.alpha.-`(2-furanylcarboxyl) oxy]-11.beta.-hydroxy-16.alpha.-methyl-3-oxo-androst-1,4,-diene-17-carbothioic acid s-fluoromethyl ester as an anti-inflammatory agent |
| PE20020354A1 (es) | 2000-09-01 | 2002-06-12 | Novartis Ag | Compuestos de hidroxamato como inhibidores de histona-desacetilasa (hda) |
| GB0022695D0 (en) | 2000-09-15 | 2000-11-01 | Pfizer Ltd | Purine Derivatives |
| GB0028383D0 (en) | 2000-11-21 | 2001-01-03 | Novartis Ag | Organic compounds |
| RU2296762C2 (ru) | 2000-12-22 | 2007-04-10 | Альмиралль Продесфарма Аг | Карбаматы хинуклидина, способы их получения и фармацевтическая композиция на их основе |
| IL156558A0 (en) | 2000-12-28 | 2004-01-04 | Almirall Prodesfarma Ag | Novel quinuclidine derivatives and medicinal compositions containing the same |
| EP1241176A1 (en) | 2001-03-16 | 2002-09-18 | Pfizer Products Inc. | Purine derivatives for the treatment of ischemia |
| MY137522A (en) | 2001-04-30 | 2009-02-27 | Glaxo Group Ltd | Novel anti-inflammatory androstane derivatives. |
| AR035885A1 (es) | 2001-05-14 | 2004-07-21 | Novartis Ag | Derivados de 4-amino-5-fenil-7-ciclobutilpirrolo (2,3-d)pirimidina, un proceso para su preparacion, una composicion farmaceutica y el uso de dichos derivados para la preparacion de una composicion farmaceutica |
| KR20030097901A (ko) | 2001-05-25 | 2003-12-31 | 화이자 인코포레이티드 | 폐쇄성 기도 질환의 치료를 위한 아데노신 a2a 수용체작용제 및 항콜린제의 조합물 |
| US20040248867A1 (en) | 2001-06-12 | 2004-12-09 | Keith Biggadike | Novel anti-inflammatory 17.alpha.-heterocyclic-esters of 17.beta.carbothioate androstane derivatives |
| EP2039762A3 (en) | 2001-06-21 | 2009-07-29 | Verenium Corporation | Nitralases |
| GB0119249D0 (en) | 2001-08-07 | 2001-10-03 | Novartis Ag | Organic compounds |
| JP2005512974A (ja) | 2001-10-17 | 2005-05-12 | ユ セ ベ ソシエテ アノニム | キヌクリジン誘導体、その調製方法、及びm2及び/又はm3ムスカリン受容体阻害剤としてのその使用 |
| GB0125259D0 (en) | 2001-10-20 | 2001-12-12 | Glaxo Group Ltd | Novel compounds |
| MY130622A (en) | 2001-11-05 | 2007-07-31 | Novartis Ag | Naphthyridine derivatives, their preparation and their use as phosphodiesterase isoenzyme 4 (pde4) inhibitors |
| AU2002356759A1 (en) | 2001-12-01 | 2003-06-17 | Glaxo Group Limited | 17.alpha. -cyclic esters of 16-methylpregnan-3,20-dione as anti-inflammatory agents |
| GEP20063958B (en) | 2001-12-20 | 2006-11-10 | Chiesi Farma Spa | 1-alkyl-1-azoniabicyclo [2.2.2] octane carbamate derivatives and their use as muscarinic receptor antagonists |
| AU2003202044A1 (en) | 2002-01-15 | 2003-09-09 | Glaxo Group Limited | 17.alpha-cycloalkyl/cycloylkenyl esters of alkyl-or haloalkyl-androst-4-en-3-on-11.beta.,17.alpha.-diol 17.beta.-carboxylates as anti-inflammatory agents |
| AU2003201693A1 (en) | 2002-01-21 | 2003-09-02 | Glaxo Group Limited | Non-aromatic 17.alpha.-esters of androstane-17.beta.-carboxylate esters as anti-inflammatory agents |
| GB0202216D0 (en) | 2002-01-31 | 2002-03-20 | Glaxo Group Ltd | Novel compounds |
| PL373043A1 (en) | 2002-03-26 | 2005-08-08 | Boehringer Ingelheim Pharmaceuticals, Inc. | Glucocorticoid mimetics, methods of making them, pharmaceutical compositions, and uses thereof |
| JP2005521717A (ja) | 2002-03-26 | 2005-07-21 | ベーリンガー インゲルハイム ファーマシューティカルズ インコーポレイテッド | グルココルチコイドミメチックス、その製造方法、その医薬組成物、及び使用 |
| US20090170803A1 (en) | 2002-04-10 | 2009-07-02 | Linden Joel M | Adjunctive treatment of biological diseases |
| ES2206021B1 (es) | 2002-04-16 | 2005-08-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de pirrolidinio. |
| ES2201907B1 (es) | 2002-05-29 | 2005-06-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de indolilpiperidina como potentes agentes antihistaminicos y antialergicos. |
| DE10224888A1 (de) | 2002-06-05 | 2003-12-24 | Merck Patent Gmbh | Pyridazinderivate |
| US7074806B2 (en) | 2002-06-06 | 2006-07-11 | Boehringer Ingelheim Pharmaceuticals, Inc. | Glucocorticoid mimetics, methods of making them, pharmaceutical compositions, and uses thereof |
| DE10225574A1 (de) | 2002-06-10 | 2003-12-18 | Merck Patent Gmbh | Aryloxime |
| DE10227269A1 (de) | 2002-06-19 | 2004-01-08 | Merck Patent Gmbh | Thiazolderivate |
| ATE356808T1 (de) | 2002-06-25 | 2007-04-15 | Merck Frosst Canada Ltd | 8-(biaryl)chinolin-pde4-inhibitoren |
| ES2204295B1 (es) | 2002-07-02 | 2005-08-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de quinuclidina-amida. |
| US20060004056A1 (en) | 2002-07-02 | 2006-01-05 | Bernard Cote | Di-aryl-substituted-ethan pyridone pde4 inhibitors |
| CA2491994C (en) | 2002-07-08 | 2013-11-05 | Pfizer Products Inc. | Modulators of the glucocorticoid receptor |
| AR040962A1 (es) | 2002-08-09 | 2005-04-27 | Novartis Ag | Compuestos derivados de tiazol 1,3-2-ona, composicion farmaceutica y proceso de preparacion del compuesto |
| JP2005538138A (ja) | 2002-08-10 | 2005-12-15 | アルタナ ファルマ アクチエンゲゼルシャフト | Pde4インヒビターとしてのピリダジノン誘導体 |
| US20060094710A1 (en) | 2002-08-10 | 2006-05-04 | Altana Pharma Ag | Piperidine-pyridazones and phthalazones as pde4 inhibitors |
| AU2003255376A1 (en) | 2002-08-10 | 2004-03-11 | Altana Pharma Ag | Piperidine-derivatives as pde4 inhibitors |
| PL373597A1 (en) | 2002-08-10 | 2005-09-05 | Altana Pharma Ag | Piperidine-n-oxide-derivatives |
| JP2005537312A (ja) | 2002-08-17 | 2005-12-08 | アルタナ ファルマ アクチエンゲゼルシャフト | 新規のフェナントリジン |
| AU2003263216A1 (en) | 2002-08-17 | 2004-03-11 | Nycomed Gmbh | Benzonaphthyridines with PDE 3/4 inhibiting activity |
| SE0202483D0 (sv) | 2002-08-21 | 2002-08-21 | Astrazeneca Ab | Chemical compounds |
| AU2002326072A1 (en) | 2002-08-23 | 2004-03-11 | Ranbaxy Laboratories Limited | Fluoro and sulphonylamino containing 3,6-disubstituted azabicyclo (3.1.0) hexane derivatives as muscarinic receptor antagonists |
| CA2495827C (en) | 2002-08-29 | 2012-05-08 | Altana Pharma Ag | 2-hydroxy-6-phenylphenanthridines as pde-4 inhibitors |
| EP1536798B1 (en) | 2002-08-29 | 2007-02-07 | ALTANA Pharma AG | 3-hydroxy-6-phenylphenanthridines as pde-4 inhibitors |
| JP2006096662A (ja) | 2002-09-18 | 2006-04-13 | Sumitomo Pharmaceut Co Ltd | 新規6−置換ウラシル誘導体及びアレルギー性疾患の治療剤 |
| CN1688577A (zh) | 2002-09-18 | 2005-10-26 | 小野药品工业株式会社 | 三氮杂螺[5.5]十一烷衍生物及以它为活性成分的药物 |
| JP2004107299A (ja) | 2002-09-20 | 2004-04-08 | Japan Energy Corp | 新規1−置換ウラシル誘導体及びアレルギー性疾患の治療剤 |
| DE10246374A1 (de) | 2002-10-04 | 2004-04-15 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Betamimetika mit verlängerter Wirkungsdauer, Verfahren zu deren Herstellung und deren Verwendung als Arzneimittel |
| AP2021A (en) | 2002-10-23 | 2009-08-03 | Glenmark Pharmaceuticals Ltd | Novel tricyclic compounds useful for the treatmentof inflammatory and allergic disorders: Process f or their preparation and pharmaceutical compositions containing them |
| GB0225540D0 (en) | 2002-11-01 | 2002-12-11 | Glaxo Group Ltd | Medicinal compounds |
| GB0225535D0 (en) | 2002-11-01 | 2002-12-11 | Glaxo Group Ltd | Medicinal compounds |
| DE10253426B4 (de) | 2002-11-15 | 2005-09-22 | Elbion Ag | Neue Hydroxyindole, deren Verwendung als Inhibitoren der Phosphodiesterase 4 und Verfahren zu deren Herstellung |
| DE10253282A1 (de) | 2002-11-15 | 2004-05-27 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Arzneimittel zur Behandlung von chronisch obstruktiver Lungenerkrankung |
| DE10253220A1 (de) | 2002-11-15 | 2004-05-27 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Dihydroxy-Methyl-Phenyl-Derivate, Verfahren zu deren Herstellung und deren Verwendung als Arzneimittel |
| US7399865B2 (en) | 2003-09-15 | 2008-07-15 | Wyeth | Protein tyrosine kinase enzyme inhibitors |
| PE20070207A1 (es) | 2005-07-22 | 2007-03-09 | Genentech Inc | Tratamiento combinado de los tumores que expresan el her |
| DE102005038537A1 (de) | 2005-08-16 | 2007-02-22 | Merck Patent Gmbh | 1-Acyldihydropyrazolderivate |
| DK1966214T3 (en) | 2005-12-21 | 2017-02-13 | Janssen Pharmaceutica Nv | TRIAZOLPYRIDAZINES AS TYROSINKINASA MODULATORS |
| WO2007091422A1 (ja) | 2006-02-06 | 2007-08-16 | Nittoh Kogaku K.K | 信号処理装置 |
| NZ570381A (en) * | 2006-02-09 | 2011-02-25 | Daiichi Sankyo Co Ltd | Anti-cancer pharmaceutical composition |
| NL2000613C2 (nl) | 2006-05-11 | 2007-11-20 | Pfizer Prod Inc | Triazoolpyrazinederivaten. |
| PE20121506A1 (es) | 2006-07-14 | 2012-11-26 | Amgen Inc | Compuestos triazolopiridinas como inhibidores de c-met |
| DK2084162T3 (da) | 2006-10-23 | 2012-10-01 | Sgx Pharmaceuticals Inc | Bicykliske triazoler som proteinkinasemodulatorer |
| CN101605540A (zh) | 2006-12-14 | 2009-12-16 | 埃克塞利希斯股份有限公司 | 使用mek抑制剂的方法 |
| US20110052580A1 (en) | 2008-02-08 | 2011-03-03 | Poniard Pharmaceuticals, Inc. | Use of picoplatin and bevacizumab to treat colorectal cancer |
| DK2300455T3 (en) * | 2008-05-21 | 2017-10-30 | Incyte Holdings Corp | SALTS OF 2-FLUORO-N-METHYL-4- [7- (QUINOLIN-6-YL-METHYL) - IMIDAZO [1,2-B] [1,2,4] TRIAZIN-2-YL] BENZAMIDE AND PROCEDURES WITH THE PREPARATION THEREOF |
| AU2009287163B2 (en) | 2008-08-29 | 2014-11-13 | Les Laboratoires Servier | Recombinant anti-Epidermal Growth Factor Receptor antibody compositions |
| JP5579699B2 (ja) * | 2009-03-27 | 2014-08-27 | クリングルファーマ株式会社 | 分子標的薬に対する感受性が低下している癌の治療薬および分子標的薬に対する感受性を増強する医薬組成物 |
| KR101870878B1 (ko) | 2010-02-03 | 2018-06-25 | 인사이트 홀딩스 코포레이션 | C―MET 억제제로서의 이미다조〔1,2―b〕〔1,2,4〕트리아진 |
| RU2660354C2 (ru) * | 2012-04-03 | 2018-07-05 | Новартис Аг | Комбинированные продукты, содержащие ингибиторы тирозинкиназ, и их применение |
| JO3300B1 (ar) | 2012-06-06 | 2018-09-16 | Novartis Ag | مركبات وتركيبات لتعديل نشاط egfr |
| KR102245985B1 (ko) | 2012-08-16 | 2021-04-30 | 노파르티스 아게 | Pi3k 억제제와 c-met 억제제의 조합물 |
| JOP20200097A1 (ar) | 2013-01-15 | 2017-06-16 | Aragon Pharmaceuticals Inc | معدل مستقبل أندروجين واستخداماته |
| WO2014122582A1 (en) | 2013-02-05 | 2014-08-14 | Nestec S.A. | Drug selection for non-small cell lung cancer therapy |
| KR101418970B1 (ko) | 2013-03-20 | 2014-07-11 | (주)제욱 | 야생형 EGFR를 가진 비소세포폐암에서 EGFR 억제제와 c-MET 억제제 병용투여에 대한 반응 예측 인자 |
| WO2016011658A1 (en) | 2014-07-25 | 2016-01-28 | Novartis Ag | Combination therapy |
| MY187276A (en) | 2014-07-25 | 2021-09-17 | Novartis Ag | Tablet formulation of 2-fluoro-n-methyl-4-[7-(quinolin-6-ylmethyl)imidazo[1,2-b][1,2,4]triazin-2-yl]benzamide |
| BR112017001695A2 (pt) | 2014-07-31 | 2017-11-21 | Novartis Ag | terapia de combinação |
| EP3389713A2 (en) | 2015-12-17 | 2018-10-24 | Novartis AG | Combination of c-met inhibitor with antibody molecule to pd-1 and uses thereof |
-
2013
- 2013-04-03 RU RU2014144254A patent/RU2660354C2/ru active
- 2013-04-03 KR KR1020147030326A patent/KR102115047B1/ko active IP Right Grant
- 2013-04-03 EP EP21187376.5A patent/EP3964513A1/en active Pending
- 2013-04-03 CN CN201380018866.9A patent/CN104245701A/zh active Pending
- 2013-04-03 AU AU2013243097A patent/AU2013243097A1/en not_active Abandoned
- 2013-04-03 CA CA2868202A patent/CA2868202C/en active Active
- 2013-04-03 CN CN201910637930.0A patent/CN110507654A/zh active Pending
- 2013-04-03 JP JP2015503740A patent/JP2015512425A/ja active Pending
- 2013-04-03 ES ES13772621T patent/ES2894830T3/es active Active
- 2013-04-03 US US14/388,334 patent/US20150297604A1/en not_active Abandoned
- 2013-04-03 MX MX2014012012A patent/MX371119B/es active IP Right Grant
- 2013-04-03 EP EP13772621.2A patent/EP2834246B1/en not_active Revoked
- 2013-04-03 WO PCT/CN2013/073678 patent/WO2013149581A1/en active Application Filing
-
2016
- 2016-06-03 AU AU2016203741A patent/AU2016203741A1/en not_active Abandoned
-
2017
- 2017-10-25 AU AU2017251741A patent/AU2017251741A1/en not_active Abandoned
- 2017-12-08 JP JP2017235647A patent/JP2018052974A/ja not_active Withdrawn
- 2017-12-13 US US15/839,964 patent/US20180098995A1/en not_active Abandoned
-
2019
- 2019-05-24 AU AU2019203645A patent/AU2019203645B2/en not_active Ceased
-
2020
- 2020-06-18 US US16/905,161 patent/US11096947B2/en active Active
- 2020-07-01 JP JP2020113681A patent/JP2020172504A/ja active Pending
-
2021
- 2021-07-23 US US17/383,691 patent/US20220184090A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008064157A1 (en) * | 2006-11-22 | 2008-05-29 | Incyte Corporation | Imidazotriazines and imidazopyrimidines as kinase inhibitors |
| WO2011018454A1 (en) * | 2009-08-12 | 2011-02-17 | Novartis Ag | Heterocyclic hydrazone compounds and their uses to treat cancer and inflammation |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020172504A (ja) | 2020-10-22 |
| US20180098995A1 (en) | 2018-04-12 |
| US20150297604A1 (en) | 2015-10-22 |
| CN104245701A (zh) | 2014-12-24 |
| US20200316081A1 (en) | 2020-10-08 |
| AU2017251741A1 (en) | 2017-11-16 |
| US20220184090A1 (en) | 2022-06-16 |
| AU2013243097A1 (en) | 2014-10-09 |
| RU2660354C2 (ru) | 2018-07-05 |
| CA2868202A1 (en) | 2013-10-10 |
| US11096947B2 (en) | 2021-08-24 |
| EP2834246A4 (en) | 2015-10-28 |
| AU2019203645B2 (en) | 2020-02-06 |
| RU2014144254A (ru) | 2016-05-27 |
| EP2834246B1 (en) | 2021-07-28 |
| EP3964513A1 (en) | 2022-03-09 |
| ES2894830T3 (es) | 2022-02-16 |
| MX371119B (es) | 2020-01-17 |
| CA2868202C (en) | 2021-08-10 |
| JP2018052974A (ja) | 2018-04-05 |
| AU2016203741A1 (en) | 2016-06-23 |
| KR20150001782A (ko) | 2015-01-06 |
| EP2834246A1 (en) | 2015-02-11 |
| AU2019203645A1 (en) | 2019-06-13 |
| CN110507654A (zh) | 2019-11-29 |
| MX2014012012A (es) | 2015-05-08 |
| JP2015512425A (ja) | 2015-04-27 |
| WO2013149581A1 (en) | 2013-10-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102115047B1 (ko) | 티로신 키나제 억제제들을 갖는 조합 제품 및 그의 용도 | |
| TW201605450A (zh) | Mdm2抑制劑與BRAF抑制劑之組合及其用途 | |
| US20200101077A1 (en) | Combination therapy | |
| ES2831416T3 (es) | Terapia de combinación de un inhibidor de MET y un inhibidor de EGFR |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |