KR101506919B1 - 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 - Google Patents
신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 Download PDFInfo
- Publication number
- KR101506919B1 KR101506919B1 KR1020080107606A KR20080107606A KR101506919B1 KR 101506919 B1 KR101506919 B1 KR 101506919B1 KR 1020080107606 A KR1020080107606 A KR 1020080107606A KR 20080107606 A KR20080107606 A KR 20080107606A KR 101506919 B1 KR101506919 B1 KR 101506919B1
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- aryl
- ring
- compound
- arylsilyl
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 135
- 239000012776 electronic material Substances 0.000 title claims abstract description 32
- 239000000126 substance Substances 0.000 claims abstract description 33
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 31
- 239000001257 hydrogen Substances 0.000 claims abstract description 31
- -1 diphenylamino Chemical group 0.000 claims abstract description 30
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 5
- 125000001072 heteroaryl group Chemical group 0.000 claims description 54
- 125000006743 (C1-C60) alkyl group Chemical group 0.000 claims description 53
- 125000005104 aryl silyl group Chemical group 0.000 claims description 51
- 125000006749 (C6-C60) aryl group Chemical group 0.000 claims description 46
- 229910052736 halogen Inorganic materials 0.000 claims description 43
- 125000003118 aryl group Chemical group 0.000 claims description 41
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 claims description 40
- 229910052805 deuterium Inorganic materials 0.000 claims description 40
- 150000002367 halogens Chemical class 0.000 claims description 34
- 125000001424 substituent group Chemical group 0.000 claims description 33
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 31
- 125000005103 alkyl silyl group Chemical group 0.000 claims description 28
- 150000002431 hydrogen Chemical class 0.000 claims description 26
- 125000006752 (C6-C60) arylthio group Chemical group 0.000 claims description 23
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 23
- 125000006751 (C6-C60) aryloxy group Chemical group 0.000 claims description 21
- 125000002947 alkylene group Chemical group 0.000 claims description 21
- 150000001602 bicycloalkyls Chemical group 0.000 claims description 21
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 21
- 125000004450 alkenylene group Chemical group 0.000 claims description 20
- 125000005549 heteroarylene group Chemical group 0.000 claims description 20
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 19
- 125000000217 alkyl group Chemical group 0.000 claims description 19
- 125000005129 aryl carbonyl group Chemical group 0.000 claims description 19
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 19
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 claims description 18
- 125000003282 alkyl amino group Chemical group 0.000 claims description 17
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 17
- 125000006745 (C2-C60) alkynyl group Chemical group 0.000 claims description 16
- 125000002950 monocyclic group Chemical group 0.000 claims description 16
- 125000003367 polycyclic group Chemical group 0.000 claims description 16
- 125000002723 alicyclic group Chemical group 0.000 claims description 15
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 15
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 15
- 125000006744 (C2-C60) alkenyl group Chemical group 0.000 claims description 14
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 13
- 125000006818 (C3-C60) cycloalkyl group Chemical group 0.000 claims description 12
- 125000001769 aryl amino group Chemical group 0.000 claims description 12
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 11
- 229910052760 oxygen Inorganic materials 0.000 claims description 11
- 125000003342 alkenyl group Chemical group 0.000 claims description 10
- 229910052717 sulfur Inorganic materials 0.000 claims description 10
- 125000006761 (C6-C60) arylene group Chemical group 0.000 claims description 9
- 125000004414 alkyl thio group Chemical group 0.000 claims description 9
- 125000000732 arylene group Chemical group 0.000 claims description 9
- 125000006820 (C1-C60) alkylthio group Chemical group 0.000 claims description 7
- 125000004957 naphthylene group Chemical group 0.000 claims description 7
- 150000001732 carboxylic acid derivatives Chemical class 0.000 claims description 6
- 238000000034 method Methods 0.000 claims description 5
- 125000002993 cycloalkylene group Chemical group 0.000 claims description 4
- 125000005105 dialkylarylsilyl group Chemical group 0.000 claims description 4
- 125000004665 trialkylsilyl group Chemical group 0.000 claims description 4
- 125000005106 triarylsilyl group Chemical group 0.000 claims description 4
- 125000004653 anthracenylene group Chemical group 0.000 claims description 3
- 125000005505 thiomorpholino group Chemical group 0.000 claims description 3
- 125000003837 (C1-C20) alkyl group Chemical group 0.000 claims description 2
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 2
- 125000006760 (C2-C60) alkynylene group Chemical group 0.000 claims description 2
- 125000005571 adamantylene group Chemical group 0.000 claims description 2
- 125000004104 aryloxy group Chemical group 0.000 claims description 2
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 claims description 2
- 125000005567 fluorenylene group Chemical group 0.000 claims description 2
- 125000005562 phenanthrylene group Chemical group 0.000 claims description 2
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims description 2
- 125000000623 heterocyclic group Chemical group 0.000 claims 9
- 125000005241 heteroarylamino group Chemical group 0.000 claims 2
- 150000002440 hydroxy compounds Chemical group 0.000 claims 1
- 239000000463 material Substances 0.000 abstract description 43
- 238000002347 injection Methods 0.000 abstract description 11
- 239000007924 injection Substances 0.000 abstract description 11
- 230000005525 hole transport Effects 0.000 abstract description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 56
- 239000010410 layer Substances 0.000 description 52
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 51
- 238000004519 manufacturing process Methods 0.000 description 29
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 24
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 22
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 20
- 238000006243 chemical reaction Methods 0.000 description 19
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 18
- 125000004432 carbon atom Chemical group C* 0.000 description 15
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 15
- 239000000203 mixture Substances 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 13
- 125000006746 (C1-C60) alkoxy group Chemical group 0.000 description 12
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 12
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 12
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 12
- 239000012153 distilled water Substances 0.000 description 11
- 239000012044 organic layer Substances 0.000 description 11
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 10
- 239000002019 doping agent Substances 0.000 description 10
- 125000000168 pyrrolyl group Chemical group 0.000 description 10
- 125000005843 halogen group Chemical group 0.000 description 8
- 238000003756 stirring Methods 0.000 description 8
- 238000004440 column chromatography Methods 0.000 description 7
- 239000000758 substrate Substances 0.000 description 7
- 125000000304 alkynyl group Chemical group 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 238000001035 drying Methods 0.000 description 6
- 238000000605 extraction Methods 0.000 description 6
- 229910052751 metal Inorganic materials 0.000 description 6
- 239000002184 metal Substances 0.000 description 6
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 6
- 229910000029 sodium carbonate Inorganic materials 0.000 description 6
- 238000001771 vacuum deposition Methods 0.000 description 6
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 5
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 5
- 229910052786 argon Inorganic materials 0.000 description 5
- UFVXQDWNSAGPHN-UHFFFAOYSA-K bis[(2-methylquinolin-8-yl)oxy]-(4-phenylphenoxy)alumane Chemical compound [Al+3].C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC([O-])=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-K 0.000 description 5
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 5
- 230000000052 comparative effect Effects 0.000 description 4
- 239000010949 copper Substances 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 150000002894 organic compounds Chemical class 0.000 description 4
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 4
- MXVIRUOHPRXGTG-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1.OB(O)C1=CC=CC=C1 MXVIRUOHPRXGTG-UHFFFAOYSA-N 0.000 description 4
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- MICMHFIQSAMEJG-UHFFFAOYSA-N 1-bromopyrrolidine-2,5-dione Chemical compound BrN1C(=O)CCC1=O.BrN1C(=O)CCC1=O MICMHFIQSAMEJG-UHFFFAOYSA-N 0.000 description 3
- BOUGCJDAQLKBQH-UHFFFAOYSA-N 1-chloro-1,2,2,2-tetrafluoroethane Chemical compound FC(Cl)C(F)(F)F BOUGCJDAQLKBQH-UHFFFAOYSA-N 0.000 description 3
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 3
- 229940126062 Compound A Drugs 0.000 description 3
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 3
- 108010021119 Trichosanthin Proteins 0.000 description 3
- 125000003545 alkoxy group Chemical group 0.000 description 3
- 150000004770 chalcogenides Chemical class 0.000 description 3
- JNGZXGGOCLZBFB-IVCQMTBJSA-N compound E Chemical compound N([C@@H](C)C(=O)N[C@@H]1C(N(C)C2=CC=CC=C2C(C=2C=CC=CC=2)=N1)=O)C(=O)CC1=CC(F)=CC(F)=C1 JNGZXGGOCLZBFB-IVCQMTBJSA-N 0.000 description 3
- FVIZARNDLVOMSU-UHFFFAOYSA-N ginsenoside K Natural products C1CC(C2(CCC3C(C)(C)C(O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC1OC(CO)C(O)C(O)C1O FVIZARNDLVOMSU-UHFFFAOYSA-N 0.000 description 3
- ZTQSADJAYQOCDD-UHFFFAOYSA-N ginsenoside-Rd2 Natural products C1CC(C2(CCC3C(C)(C)C(OC4C(C(O)C(O)C(CO)O4)O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC(C(C(O)C1O)O)OC1COC1OCC(O)C(O)C1O ZTQSADJAYQOCDD-UHFFFAOYSA-N 0.000 description 3
- 230000009477 glass transition Effects 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 229910044991 metal oxide Inorganic materials 0.000 description 3
- 150000004706 metal oxides Chemical class 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 239000010409 thin film Substances 0.000 description 3
- 125000000923 (C1-C30) alkyl group Chemical group 0.000 description 2
- 125000006582 (C5-C6) heterocycloalkyl group Chemical group 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Substances BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 2
- 150000004982 aromatic amines Chemical class 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 239000008139 complexing agent Substances 0.000 description 2
- 229940125904 compound 1 Drugs 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 239000010408 film Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- BXXLTVBTDZXPTN-UHFFFAOYSA-N methyl 2-iodobenzoate Chemical compound COC(=O)C1=CC=CC=C1I BXXLTVBTDZXPTN-UHFFFAOYSA-N 0.000 description 2
- VAMXMNNIEUEQDV-UHFFFAOYSA-N methyl anthranilate Chemical compound COC(=O)C1=CC=CC=C1N VAMXMNNIEUEQDV-UHFFFAOYSA-N 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- GTLACDSXYULKMZ-UHFFFAOYSA-N pentafluoroethane Chemical compound FC(F)C(F)(F)F GTLACDSXYULKMZ-UHFFFAOYSA-N 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 229910052761 rare earth metal Inorganic materials 0.000 description 2
- 150000002910 rare earth metals Chemical class 0.000 description 2
- 230000027756 respiratory electron transport chain Effects 0.000 description 2
- 150000003839 salts Chemical group 0.000 description 2
- DXBHBZVCASKNBY-UHFFFAOYSA-N 1,2-Benz(a)anthracene Chemical class C1=CC=C2C3=CC4=CC=CC=C4C=C3C=CC2=C1 DXBHBZVCASKNBY-UHFFFAOYSA-N 0.000 description 1
- KLCLIOISYBHYDZ-UHFFFAOYSA-N 1,4,4-triphenylbuta-1,3-dienylbenzene Chemical class C=1C=CC=CC=1C(C=1C=CC=CC=1)=CC=C(C=1C=CC=CC=1)C1=CC=CC=C1 KLCLIOISYBHYDZ-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 1
- SKMKJBYBPYBDMN-RYUDHWBXSA-N 3-(difluoromethoxy)-5-[2-(3,3-difluoropyrrolidin-1-yl)-6-[(1s,4s)-2-oxa-5-azabicyclo[2.2.1]heptan-5-yl]pyrimidin-4-yl]pyridin-2-amine Chemical compound C1=C(OC(F)F)C(N)=NC=C1C1=CC(N2[C@H]3C[C@H](OC3)C2)=NC(N2CC(F)(F)CC2)=N1 SKMKJBYBPYBDMN-RYUDHWBXSA-N 0.000 description 1
- JOIWPNKDLJXKJX-UHFFFAOYSA-N BrC1CC(=O)NC1=O.BrN1C(=O)CCC1=O Chemical compound BrC1CC(=O)NC1=O.BrN1C(=O)CCC1=O JOIWPNKDLJXKJX-UHFFFAOYSA-N 0.000 description 1
- 229910004261 CaF 2 Inorganic materials 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 229910018068 Li 2 O Inorganic materials 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 229910003564 SiAlON Inorganic materials 0.000 description 1
- XSTXAVWGXDQKEL-UHFFFAOYSA-N Trichloroethylene Chemical group ClC=C(Cl)Cl XSTXAVWGXDQKEL-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001339 alkali metal compounds Chemical class 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- MPJHCHQZABSXMJ-UHFFFAOYSA-N aluminum;quinolin-8-ol Chemical compound [Al+3].C1=CN=C2C(O)=CC=CC2=C1 MPJHCHQZABSXMJ-UHFFFAOYSA-N 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 150000001454 anthracenes Chemical class 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 150000004984 aromatic diamines Chemical class 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 125000005566 carbazolylene group Chemical group 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- XCJYREBRNVKWGJ-UHFFFAOYSA-N copper(II) phthalocyanine Chemical compound [Cu+2].C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 XCJYREBRNVKWGJ-UHFFFAOYSA-N 0.000 description 1
- 150000001893 coumarin derivatives Chemical class 0.000 description 1
- 238000005137 deposition process Methods 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 1
- 125000001183 hydrocarbyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 150000002736 metal compounds Chemical class 0.000 description 1
- 229910001507 metal halide Inorganic materials 0.000 description 1
- 150000005309 metal halides Chemical class 0.000 description 1
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 150000004866 oxadiazoles Chemical class 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000005564 oxazolylene group Chemical group 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- 125000005563 perylenylene group Chemical group 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 239000002861 polymer material Substances 0.000 description 1
- 125000005550 pyrazinylene group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000005548 pyrenylene group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000005551 pyridylene group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000005576 pyrimidinylene group Chemical group 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 229910052814 silicon oxide Inorganic materials 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000002344 surface layer Substances 0.000 description 1
- 125000005247 tetrazinyl group Chemical group N1=NN=NC(=C1)* 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000005557 thiazolylene group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000005556 thienylene group Chemical group 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 125000006822 tri(C1-C30) alkylsilyl group Chemical group 0.000 description 1
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 1
- 238000004506 ultrasonic cleaning Methods 0.000 description 1
- 238000007738 vacuum evaporation Methods 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/06—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/36—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/16—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D497/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having oxygen and sulfur atoms as the only ring hetero atoms
- C07D497/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having oxygen and sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D497/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0803—Compounds with Si-C or Si-Si linkages
- C07F7/081—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te
- C07F7/0812—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te comprising a heterocyclic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0803—Compounds with Si-C or Si-Si linkages
- C07F7/081—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te
- C07F7/0812—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te comprising a heterocyclic ring
- C07F7/0816—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te comprising a heterocyclic ring said ring comprising Si as a ring atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6564—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms
- C07F9/6568—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus atoms as the only ring hetero atoms
- C07F9/65683—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus atoms as the only ring hetero atoms the ring phosphorus atom being part of a phosphine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/40—Organosilicon compounds, e.g. TIPS pentacene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/624—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing six or more rings
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1033—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1092—Heterocyclic compounds characterised by ligands containing sulfur as the only heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/18—Metal complexes
- C09K2211/185—Metal complexes of the platinum group, i.e. Os, Ir, Pt, Ru, Rh or Pd
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Physics & Mathematics (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Electroluminescent Light Sources (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Photovoltaic Devices (AREA)
Abstract
본 발명은 신규한 유기 전자재료용 화합물 및 이를 포함하고 있는 유기 전자 소자에 관한 것으로, 상세하게는 본 발명에 따른 유기 전자재료용 화합물은 하기 화학식 1 또는 화학식 2로 표시되는 것을 특징으로 한다.
[화학식 1]
[화학식 2]
본 발명에 따른 유기 전자재료용 화합물은 발광효율이 좋고 재료의 수명특성이 뛰어나 소자의 구동수명이 매우 양호한 OLED 소자를 제조할 수 있는 장점이 있 다. 또한, 본 발명에 따른 유기 전자재료용 화합물은 정공전달층 또는 정공주입층에 포함되거나 인광발광체의 호스트로 사용되어 구동전압을 낮춤으로서 소비전력을 현저히 감소시킬 뿐만 아니라 동등 이상의 발광효율을 나타내는 장점이 있다.
유기 전자재료용, 정공전달층, 정공주입층, 호스트, 유기 전자 소자
Description
본 발명은 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자에 관한 것으로서, 더욱 상세하게는 고효율의 특성을 가지는 신규한 유기 전자재료용 화합물 및 이를 정공전달층 또는 정공주입층에 포함하거나 인광발광체의 호스트로서 발광층에 포함하는 유기 전자 소자에 관한 것이다.
표시 소자 중, 전기 발광 소자(electroluminescence device: EL device)는 자체 발광형 표시 소자로서 시야각이 넓고 콘트라스트가 우수할 뿐만 아니라 응답속도가 빠르다는 장점을 가지고 있으며, 1987년 이스트만 코닥(Eastman Kodak)사에서는 발광층 형성용 재료로서 저분자인 방향족 디아민과 알루미늄 착물을 이용하고 있는 유기 EL 소자를 처음으로 개발하였다[Appl. Phys. Lett. 51, 913, 1987].
유기 EL 소자는 전자 주입 전극(음극) 과 정공 주입 전극(양극) 사이에 형성된 유기막에 전하를 주입하면 전자와 정공이 쌍을 이룬 후 소멸하면서 빛을 내는 소자이다. 플라스틱 같은 휠 수 있는(flexible) 투명 기판 위에도 소자를 형성할 수 있을 뿐 아니라, 플라즈마 디스플레이 패널(Plasma Display Panel)이나 무기 EL 디스플레이에 비해 낮은 전압에서 (10V이하) 구동이 가능하고, 또한 전력 소모가 비교적 적으며, 색감이 뛰어나다는 장점이 있다.
유기 EL 소자에서 발광 효율, 수명 등의 성능을 결정하는 가장 중요한 요인은 발광 재료로서, 이러한 발광 재료에 요구되는 몇 가지 특성으로는 고체상태에서 형광 양자 수율이 커야하고, 전자와 정공의 이동도가 높아야 하며, 진공 증착시 쉽게 분해되지 않아야 하고, 균일한 박막을 형성, 안정해야한다.
유기 발광 재료는 크게 고분자 재료와 저분자 재료로 나눌 수 있는데, 저분자 계열의 재료는 분자 구조 면에서 금속 착화합물과 금속을 포함하지 않는 순수 유기 발광 재료가 있다. 이러한 발광 재료로는 트리스(8-퀴놀리놀라토)알루미늄 착제 등의 킬레이트 착제, 쿠마린 유도체, 테트라페닐부타디엔 유도체, 비스스타이릴아릴렌 유도체, 옥사다이아졸 유도체 등의 발광 재료가 알려져 있고, 이들로부터는 청색에서 적색까지의 가시 영역 발광을 얻을 수 있다고 보고되었다.
풀칼라 OLED 디스플레이의 구현을 위해서는 RGB 3가지의 발광재료를 사용하게 되는데 유기 EL 전체의 특성을 향상시키는데 고효율 장수명의 RGB 발광재료의 개발이 중요한 과제라고 할 수 있다. 발광재료는 기능적인 측면에서 호스트 재료와 도판트 재료로 구분될 수 있는데 일반적으로 EL 특성이 가장 우수한 소자 구조로는 호스트에 도판트를 도핑하여 발광층을 만드는 것으로 알려져 있다. 최근에 고효율, 장수명 유기 EL 소자의 개발이 시급한 과제로 대두되고 있으며, 특히 중대형 OLED 패널에서 요구하고 있는 EL 특성 수준을 고려해 볼 때 기존의 발광재료에 비해 매 우 우수한 재료의 개발이 시급한 실정이다.
한편, 인광 발광체의 호스트 재료로는 현재까지 CBP가 가장 널리 알려져 있으며, BCP 및 BAlq 등의 정공차단층을 적용한 고효율의 OLED가 공지되어 있으며, 일본의 파이오니어 등에서는 BAlq 유도체를 호스트로 이용한 고성능의 OLED가 공지되어 있다.
그러나 기존의 재료들은 발광 특성 측면에서는 유리한 면이 있으나, 유리전이온도가 낮고 열적 안정성이 매우 좋지 않아서, 진공 하에서 고온 증착 공정을 거칠 때, 물질이 변하는 등 단점을 갖고 있다. OLED에서 전력효율 = (π/전압) × 전류효율 이므로, 전력효율은 전압에 반비례하는데, OLED의 소비 전력이 낮으려면 전력 효율이 높아야한다. 실제 인광 발광 재료를 사용한 OLED는 형광 발광 재료를 사용한 OLED에 비해 전류 효율(cd/A)이 상당히 높으나, 인광 발광 재료의 호스트로 BAlq 나 CBP 등 종래의 재료를 사용할 경우, 형광재료를 사용한 OLED에 비해 구동 전압이 높아서 전력 효율(lm/w)면에서 큰 이점이 없었고, OLED 소자에서의 수명 측면에서도 결코 만족할만한 수준이 되질 못하여 더욱 안정되고, 더욱 성능이 뛰어난 호스트 재료의 개발이 요구되고 있다.
또한 전공주입, 수송재료로는 구리 프탈로시아닌(CuPc), 4,4'-비스[N-(1-나프틸)-N-페닐아미노]바이페닐(NPB) 및 MTDATA가 있다.
유기 EL소자의 내구성을 높이기 위해서는 박막 안정성이 양호한 화합물과 비결정성이 높은 화합물일수록 박막 안정성이 높다고 보고되어 있다. 이때 비결정성의 지표로서 유리전이점(Tg)이 사용된다.
기존의 MTDATA의 유리전이도는 76℃로서 비결정성이 높다고는 할 수 없다. 이 때문에 유기 EL 소자의 내구성면에서, 또한 정공주입, 수송의 특성에 기인하는 발광효율에서도 만족스러운 특성을 얻지 못하였다.
따라서 본 발명의 목적은 첫째로, 상기한 문제점들을 해결하기 위하여 기존의 인광발광체의 호스트 재료보다 발광 효율 및 소자 수명이 좋으며, 적절한 색좌표를 갖는 우수한 골격의 유기 전자재료용 화합물을 제공하는 것이며, 둘째로 신규한 유기 전자재료용 화합물을 정공주입층, 정공전달층 또는 발광층에 채용하는 유기 전자 소자를 제공하는 것이다. 셋째로는 신규한 유기 전자재료용 화합물을 포함하는 유기 태양 전지를 제공하는 것이다.
본 발명은 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자에 관한 것으로, 상세하게는 본 발명에 따른 신규한 유기 전자재료용 화합물은 하기 화학식 1 또는 화학식 2로 표시된다.
[화학식 1]
[화학식 2]
상기 화학식 1 및 화학식 2에서,
L1, L2 및 L3는 서로 독립적으로 화학결합이거나, (C6-C60)아릴렌, (C3-C60)헤테로아릴렌, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬렌, (C3-C60)시클로알킬렌, 아다만틸렌, (C7-C60)바이시클로알킬렌, (C2-C60)알케닐렌, (C2-C60)알키닐렌, (C6-C60)아르(C1-C60)알킬렌, (C1-C60)알킬렌티오, (C1-C60)알킬렌옥시, (C6-C60)아릴렌옥시 또는 (C6-C60)아릴렌티오이고;
R1, R2 및 R3는 서로 독립적으로 수소, 중수소, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오 또는 NR11R12이거나, 하기 구조에서 선택되는 치환기이고, R1, R2 및 R3가 동시에 수소인 경우는 제외하고;
R11 및 R12는 서로 독립적으로 (C6-C60)아릴 또는 (C3-C60)헤테로아릴이거나, 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고;
R13 내지 R30은 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 또는 하이드록시이거나, R13 내지 R25는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
A, B, X, Y 및 Z는 서로 독립적으로 화학결합이거나, -(CR31R32)a-, -N(R33)-, -S-, -O-, -Si(R34)(R35)-, -P(R36)-, -C(=O)-, -B(R37)-, -In(R38)-, -Se-, -Ge(R39)(R40)-, -Sn(R41)(R42)-, -Ga(R43)- 또는 -(R44)C=C(R45)-이며;
R31 내지 R45는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 또는 하이드록시이거나, R31과 R32, R34와 R35, R39와 R40, R41와 R42 및 R44와 R45는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
상기 L1, L2 및 L3의 아릴렌, 헤테로아릴렌, 아릴렌옥시 및 아릴렌티오; R1, R2, R3, R11 및 R12의 아릴 및 헤테로아릴; R13 내지 R30 및 R31 내지 R45의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 아르알킬, 알킬옥시, 알킬티오, 아릴옥시, 아릴티오, 알킬아미노, 아릴아미노, 알콕시카보닐, 알킬카보닐 또는 아릴카보닐은 중수소, 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C60)알킬, (C6-C60)아릴, (C6-C60)아릴로 치환 또는 비치환된 (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, 카바졸릴, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬(C6-C60)아릴, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 또는 하이드록시로부터 이루어진 군으로부터 선택되는 하나 이상의 치환기로 더 치환될 수 있고;
a, x, y 및 z는 서로 독립적으로 0 내지 4의 정수이고;
본 발명에 기재된 "알킬" 및 그 외 "알킬" 부분을 포함하는 치환체는 직쇄 또는 분쇄 형태를 모두 포함한다.
본 발명에 기재된 「아릴」은 하나의 수소 제거에 의해서 방향족 탄화수소로부터 유도된 유기 라디칼로, 각 고리에 적절하게는 4 내지 7개, 바람직하게는 5 또는 6개의 고리원자를 포함하는 단일 또는 융합고리계를 포함한다. 구체적인 예로 페닐, 나프틸, 비페닐, 안트릴, 인데닐(indenyl), 플루오레닐, 페난트릴, 트라이페닐레닐, 피렌일, 페릴렌일, 크라이세닐, 나프타세닐, 플루오란텐일 등을 포함하지만, 이에 한정되지 않는다.
본 발명에 기재된 「헤테로아릴」은 방향족 고리 골격 원자로서 N, O 및 S로부터 선택되는 1 내지 4개의 헤테로원자를 포함하고, 나머지 방향족 고리 골격 원자가 탄소인 아릴 그룹을 의미하는 것으로, 5 내지 6원 단환 헤테로아릴, 및 하나 이상의 벤젠 환과 축합된 다환식 헤테로아릴이며, 부분적으로 포화될 수도 있다. 상기 헤테로아릴기는 고리내 헤테로원자가 산화되거나 사원화되어, 예를 들어 N-옥사이드 또는 4차 염을 형성하는 2가 아릴 그룹을 포함한다. 구체적인 예로 퓨릴, 티오펜일, 피롤릴, 이미다졸릴, 피라졸릴, 티아졸릴, 티아디아졸릴, 이소티아졸릴, 이속사졸릴, 옥사졸릴, 옥사디아졸릴, 트리아진일, 테트라진일, 트리아졸릴, 테트라졸릴, 퓨라잔일, 피리딜, 피라진일, 피리미딘일, 피리다진일 등의 단환 헤테로아릴, 벤조퓨란일, 벤조티오펜일, 이소벤조퓨란일, 벤조이미다졸릴, 벤조티아졸릴, 벤조이소티아졸릴, 벤조이속사졸릴, 벤조옥사졸릴, 이소인돌릴, 인돌릴, 인다졸릴, 벤조티아디아졸릴, 퀴놀릴, 이소퀴놀릴, 신놀리닐, 퀴나졸리닐, 퀴녹살리닐, 카바졸릴, 페난트리딘일, 벤조디옥솔릴 등의 다환식 헤테로아릴 및 이들의 상응하는 N-옥사이드(예를 들어, 피리딜 N-옥사이드, 퀴놀릴 N-옥사이드), 이들의 4차 염 등을 포함하지만, 이에 한정되지 않는다.
또한, 본 발명에 기재되어 있는 "(C1-C60)알킬" 부분이 포함되어 있는 치환체들은 1 내지 60개의 탄소수를 가질 수도 있고, 1 내지 20개의 탄소수를 가질 수도 있고, 1 내지 10개의 탄소수를 가질 수도 있다. “(C6-C60)아릴”부분이 포함되어 있는 치환체들은 6 내지 60개의 탄소수를 가질 수도 있고, 6 내지 20개의 탄소수를 가질 수도 있고, 6 내지 12개의 탄소수를 가질 수도 있다. “(C3-C60)헤테로아릴”부분이 포함되어 있는 치환체들은 3 내지 60개의 탄소수를 가질 수도 있고, 4 내지 20개의 탄소수를 가질 수도 있고, 4 내지 12개의 탄소수를 가질 수도 있다. “(C3-C60)시클로알킬”부분이 포함되어 있는 치환체들은 3 내지 60개의 탄소수를 가질 수도 있고, 3 내지 20개의 탄소수를 가질 수도 있고, 3 내지 7개의 탄소수를 가질 수도 있다. “(C2-C60)알케닐 또는 알키닐”부분이 포함되어 있는 치환체들은 2 내지 60개의 탄소수를 가질 수도 있고, 2 내지 20개의 탄소수를 가질 수도 있고, 2 내지 10개의 탄소수를 가질 수도 있다.
상기 화학식 1 및 2에서 , 또는 가 서로 독립적으로 디페닐아미노() 기인 경우, 즉 L1, L2 또는 L3가 화학결합이고 R1, R2 또는 R3가 NR11R12이면서 R11 및 R12가 동시에 페닐인 경우에는 최소 1개 이상의 페닐은 수소 이외의 치환체로 치환되어야 한다.
본 발명에 따른 유기 전자재료용 화합물은 하기 화학식 3 내지 화학식 6으로부터 선택될 수 있다.
[화학식 3]
[화학식 4]
[화학식 5]
[화학식 6]
상기 화학식 3 내지 6에서, L1, L2, L3, R1, R2, R3, R31 및 R32는 상기 화학식 1 및 2에서의 정의와 동일하다.
상기 R1, R2 및 R3는 서로 독립적으로 수소, 중수소 또는 NR11R12이거나, 하기 구조에서 선택되어지나, 이에 한정되는 것은 아니다.
[R11 및 R12는 상기 화학식 1 및 2에서의 정의와 동일하며;
R51 내지 R64는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, 할로(C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬(C6-C60)아릴, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카복실산, 나이트로 또는 하이드록시이며;
A 및 B는 서로 독립적으로 -C(R31)(R32)-, -N(R33)-, -S-, -O-, -Si(R34)(R35)-, -P(R36)-, -C(=O)-, -B(R37)-, -In(R38)-, -Se-, -Ge(R39)(R40)-, -Sn(R41)(R42)-, -Ga(R43)- 또는 -(R44)C=C(R45)-이며;
R31 내지 R45는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1- C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카복실산, 나이트로 또는 하이드록시이거나, R31과 R32, R34와 R35, R39와 R40, R41와 R42 및 R44와 R45는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
상기 R31 내지 R45 및 R51 내지 R64의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 알킬아미노 또는 아릴아미노는 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C6-C60)아릴카보닐, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, 카르복실, 나이트로 또는 하이드록시로 더 치환될 수 있으며;
b는 1 내지 5의 정수이고, c는 1 내지 4의 정수이고, d는 1 내지 3의 정수이다.]
보다 구체적으로, 상기 R1, R2 및 R3는 서로 독립적으로 하기 구조로 예시될 수 있으나, 이에 한정되는 것은 아니다.
또한, 상기 L1, L2 및 L3는 서로 독립적으로 화학결합이거나, 페닐렌, 나프틸렌, 비페닐렌, 플루오레닐렌, 페난트릴렌, 안트릴렌, 플루오란테닐렌, 트리페닐레닐렌, 피레닐렌, 크라이세닐렌, 나프타세닐렌, 페릴레닐렌, 스피로바이플루오레닐렌, 테트라하이드로나프틸렌, 아세나프테닐렌, 인데닐렌, 피리딜렌, 바이피리딜렌, 피롤릴렌, 퓨릴렌, 티에닐렌, 이미다졸릴렌, 벤조이미다졸릴렌, 피라지닐렌, 피리미디닐렌, 피리다지닐렌, 퀴놀릴렌, 트리아지닐렌, 벤조퓨릴렌, 디벤조퓨릴렌, 벤조티에닐렌, 디벤조티에닐렌, 피라졸릴렌, 인돌릴렌, 카바졸릴렌, 인데노카바졸릴렌, 티아졸릴렌, 옥사졸릴렌, 벤조티아졸릴렌, 벤조옥사졸릴렌, 페난트리디닐렌, 페난트롤리닐렌, 피페리디닐렌, 퀴나졸리닐렌, 또는 에서 선택되는 아릴렌 또는 헤테로아릴렌이고; 상기 L1, L2 및 L3의 아릴렌, 헤테로아릴렌은 중수소, 할로겐, (C1-C60)알킬, 할로(C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 시아노, 카바졸릴, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, 카르복실, 나이트로 및 하이드록시로부터 이루어진 군으로부터 선택되는 하나 이상의 치환기로 더 치환될 수 있다.
본 발명에 따른 유기 발광 화합물은 보다 구체적으로 하기의 화합물로서 예시될 수 있으나, 하기 화합물이 본 발명을 한정하는 것은 아니다.
본 발명에 따른 유기 전자재료용 화합물은 하기 반응식 1에 나타난 바와 같이, 제조될 수 있다.
[반응식 1]
[상기 반응식 1에서, L1, L2, L3, R1, R2, R3, R31 및 R32는 화학식 1 및 화학식 2에서의 정의와 동일하다.]
또한 본 발명은 유기 태양 전지를 제공하며, 본 발명에 따른 유기 태양 전지는 상기 화학식 1 또는 화학식 2의 유기 전자재료용 화합물을 하나 이상 포함하는 것을 특징으로 한다.
또한 본 발명은 유기 전자 소자를 제공하며, 본 발명에 따른 유기 전자 소자는 제1 전극; 제2 전극; 및 상기 제1 전극과 제2 전극 사이에 개재되는 1층 이상의 유기물층으로 이루어진 유기 전자 소자에 있어서, 상기 유기물층은 상기 화학식 1 또는 화학식 2의 유기 전자재료용 화합물을 하나 이상 포함하는 것을 특징으로 한다. 상기 유기 전자재료용 화합물은 정공주입층 또는 정공전달층의 재료로 사용되거나, 발광층의 호스트 물질로 사용되어진다.
또한, 상기 유기물층은 발광층을 포함하며, 상기 발광층은 상기 화학식 1 또는 화학식 2의 유기 전자재료용 화합물 하나 이상 이외에 하나 이상의 도판트를 더 포함하는 것을 특징으로 하며, 본 발명의 유기 전자 소자에 적용되는 도판트는 특별히 제한되지는 않으나, 하기 화학식 7로 표시되는 화합물로부터 선택되는 것이 바람직하다.
[화학식 7]
M
1
L
101
L
102
L
103
상기 화학식 7에서 M1은 7족, 8족, 9족, 10족, 11족, 13족, 14족, 15족 및 16족의 금속으로 이루어진 군으로부터 선택되고, 리간드 L101, L102 및 L103 는 서로 독립적으로 하기 구조로부터 선택되어진다.
[R101 내지 R103은 서로 독립적으로 수소, 중수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알킬로 치환되거나 치환되지 않은 (C6-C60)아릴 또는 할로겐이고;
R104 내지 R119는 서로 독립적으로 수소, 중수소, (C1-C60)알킬, (C1-C30)알킬옥시, (C3-C60)시클로알킬, (C2-C30)알케닐, (C6-C60)아릴, 모노 또는 디(C1-C30) 알킬아미노, 모노 또는 디(C6-C30)아릴아미노, SF5, 트리(C1-C30)알킬실릴, 디(C1-C30)알킬(C6-C30)아릴실릴, 트리(C6-C30)아릴실릴, 시아노 또는 할로겐이고, 상기 R104 내지 R119의 알킬, 시클로알킬, 알케닐 또는 아릴은 중수소, (C1-C60)알킬, (C6-C60)아릴 또는 할로겐으로부터 선택되는 하나 이상의 치환기로 더 치환될 수 있으며;
R120 내지 R123는 서로 독립적으로 수소, 중수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬 또는 (C1-C60)알킬로 치환되거나 치환되지 않은 (C6-C60)아릴이고;
R124 및 R125는 서로 독립적으로 수소, 중수소, (C1-C60)알킬, (C6-C60)아릴 또는 할로겐이거나, R124와 R125는 융합고리를 포함하거나 포함하지 않는 (C3-C12)알킬렌 또는 (C3-C12)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성하며, 상기 R124 및 R125의 알킬, 아릴 또는 융합고리를 포함하거나 포함하지 않는 (C3-C12)알킬렌 또는 (C3-C12)알케닐렌으로 연결되어 형성된 지환족 고리 및 단일환 또는 다환의 방향족 고리는 중수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C30)알킬옥시, 할로겐, 트리(C1-C30)알킬실릴, 트리(C6-C30)아릴실릴 및 (C6-C60)아릴로부터 선택되는 하나 이상의 치환기로 더 치환될 수 있으며;
R126은 (C1-C60)알킬, (C6-C60)아릴, (C5-C60)헤테로아릴 또는 할로겐이고;
R127 내지 R129은 서로 독립적으로 수소, 중수소, (C1-C60)알킬, (C6-C60)아릴 또는 할로겐이고, 상기 R126 내지 R129의 알킬 및 아릴은 할로겐 또는 (C1-C60)알킬로 더 치환될 수 있으며;
Q는 , 또는 이며, R201 내지 R212는 서로 독립적으로 수소, 중수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C30)알킬옥시, 할로겐, (C6-C60)아릴, 시아노, (C5-C60)시클로알킬이거나, R201 내지 R212는 서로 인접한 치환체와 알킬렌 또는 알케닐렌으로 연결되어 (C5-C7)스피로고리 또는 (C5-C9)융합고리를 형성하거나, R107 또는 R108과 알킬렌 또는 알케닐렌으로 연결되어 (C5-C7)융합고리를 형성할 수 있다.]
상기 화학식 7의 도판트 화합물은 하기 구조의 화합물로 예시될 수 있으나, 이에 한정되는 것은 아니다.
본 발명의 유기 전자 소자에 있어서, 화학식 1 또는 화학식 2의 유기 전자재료용 화합물을 포함하고, 동시에 아릴아민계 화합물 및 스티릴아릴아민계 화합물로 이루어진 군으로부터 선택된 하나 이상의 화합물을 포함할 수 있으며, 아릴아민계 화합물 또는 스티릴아릴아민계 화합물의 예로 하기의 화학식 8의 화합물이 있으나, 이에 한정되는 것을 아니다.
[화학식 8]
상기 화학식 8에서, Ar1 및 Ar2은 서로 독립적으로 (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, (C6-C60)아릴아미노, (C1-C60)알킬아미노, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬 또는 (C3-C60)시클로알킬이거나, Ar1 및 Ar2은 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고;
상기 Ar1 및 Ar2의 아릴, 헤테로아릴, 아릴아미노 또는 헤테로시클로알킬은 중수소, 할로겐, (C1-C60)알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C6-C60)아릴카보닐, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, 카르복실산, 나이트로 및 하이드록시로부터 선택된 하나 이상으로 더 치환될 수 있고;
e가 1인 경우 Ar3은 (C6-C60)아릴 또는 (C4-C60)헤테로아릴 또는 하기 구조에서 선택되는 치환기이고;
e가 2인 경우 Ar3는 (C6-C60)아릴렌, (C4-C60)헤테로아릴렌 또는 하기 구조에서 선택되는 치환기이고;
Ar4 은 (C6-C60)아릴렌 또는 (C4-C60)헤테로아릴렌이고;
R221, R222 및 R223는 서로 독립적으로 수소, 중수소, (C1-C60)알킬 또는 (C6-C60)아릴이고;
f는 1 내지 4의 정수이며, g는 0 또는 1의 정수이고,
상기 Ar1 및 Ar2의 알킬, 아릴, 헤테로아릴, 아릴아미노, 알킬아미노, 시클로알킬 또는 헤테로시클로알킬, 또는 상기 Ar3의 아릴, 헤테로아릴, 아릴렌 또는 헤테로아릴렌, 또는 상기 Ar4 및 Ar5의 아릴렌 및 헤테로아릴렌, 또는 R221 내지 R223의 알킬 또는 아릴은 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C1-C60)알킬옥시, (C6-C60)아릴티오, (C1-C60)알킬티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로, 하이드록시로 이루어진 군에서 선택되는 하나 이상의 치환기로 더 치환될 수 있다.
상기 아릴아민계 화합물 또는 스티릴아릴아민계 화합물은 보다 구체적으로 하기의 화합물로서 예시될 수 있으나, 하기 화합물로 한정되는 것은 아니다.
또한, 본 발명의 유기 전자 소자에 있어서, 유기물층에 상기 화학식 1 또는 화학식 2의 유기 전자재료용 화합물 이외에 1족, 2족, 4주기, 5주기 전이금속, 란탄계열금속 및 d-전이원소의 유기금속으로 이루어진 군으로부터 선택되는 하나 이상의 금속을 더 포함할 수도 있고, 상기 유기물층은 발광층과 전하생성층을 동시에 포함할 수 있다.
본 발명의 화학식 1 또는 화학식 2의 유기 전자재료용 화합물을 포함하는 유기 전자 소자를 서브픽셀로 하고, Ir, Pt, Pd, Rh, Re, Os, Tl, Pb, Bi, In, Sn, Sb, Te, Au 및 Ag로 이루어진 군에서 선택되는 하나 이상의 금속화합물을 포함하는 서브픽셀 하나 이상을 동시에 병렬로 패터닝한 독립발광방식의 픽셀구조를 가진 유기 전자 소자를 구현할 수도 있다.
또한, 상기 유기 전자 소자는 발광층에 청색, 녹색, 적색 파장을 발광피크로 갖는 화합물로부터 선택되는 하나 이상을 동시에 포함하는 유기 디스플레이며, 청색, 녹색, 적색 파장을 발광피크로 갖는 화합물은 하기 화학식 9 내지 화학식 12로 예시될 수 있으나 이에 한정되는 것은 아니다.
[화학식 9]
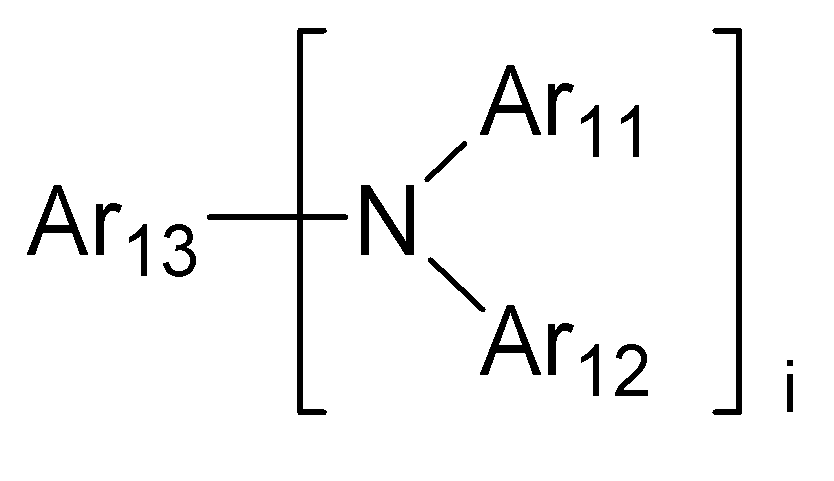
상기 화학식 9에서, Ar11 및 Ar12는 서로 독립적으로 (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, (C6-C60)아릴아미노, (C1-C60)알킬아미노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬이거나, Ar11 및 Ar12은 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고;
i가 1인 경우 Ar13은 (C6-C60)아릴 또는 (C4-C60)헤테로아릴 또는 하기 구조에서 선택되는 치환기이고;
i가 2인 경우 Ar13는 (C6-C60)아릴렌, (C4-C60)헤테로아릴렌 또는 하기 구조에서 선택되는 치환기이고;
Ar14 은 (C6-C60)아릴렌 또는 (C4-C60)헤테로아릴렌이고;
R231, R232 및 R233는 서로 독립적으로 수소, 중수소, (C1-C60)알킬 또는 (C6-C60)아릴이고;
j는 1 내지 4의 정수이며, k는 0 또는 1의 정수이고,
상기 Ar11 및 Ar12의 알킬, 아릴, 헤테로아릴, 아릴아미노, 알킬아미노, 시클로알킬 또는 헤테로시클로알킬, 또는 상기 Ar13의 아릴, 헤테로아릴, 아릴렌 또는 헤테로아릴렌, 또는 상기 Ar14의 아릴렌 및 헤테로아릴렌, 또는 R231 내지 R233의 알킬 또는 아릴은 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C1-C60)알킬옥시, (C6-C60)아릴티오, (C1-C60)알킬티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 및 하이드록시로 이루어진 군에서 선택되는 하나 이상의 치환기로 더 치환될 수 있다.
[화학식 10]
상기 화학식 10에서, R301 내지 R304는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카르복실산, 나이트로 또는 하이드록시이거나, R301 내지 R304은 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고,
상기 R301 내지 R304의 알킬, 알케닐, 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴, 헤테로아릴, 아릴실릴, 알킬실릴, 알킬아미노, 아릴아미노 및 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리는 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카르복실산, 나이트로 및 하이드록시로부터 선택된 하나 이상으로 더 치환될 수 있다.
[화학식 11]
(Ar31)p-L11-(Ar32)q
[화학식 12]
(Ar33)r-L12-(Ar34)s
상기 화학식 11 및 화학식 12에서,
L11는 (C6-C60)아릴렌 또는 (C4-C60)헤테로아릴렌이고;
L12는 안트라세닐렌이며;
Ar31 내지 Ar34은 서로 독립적으로 수소, 중수소이거나, (C1-C60)알킬, (C1-C60)알콕시, 할로겐, (C4-C60)헤테로아릴, (C5-C60)시클로알킬 또는 (C6-C60)아릴로부터 선택되고, 상기 Ar31 내지 Ar34의 시클로알킬, 아릴 또는 헤테로아릴은 중수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어진 군으로부터 선택된 하나 이상으로 치환되거나 치환되지 않은 (C6-C60)아릴 또는 (C4-C60)헤테로아릴, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어지는 군에서 선택되는 하나 이상의 치환기로 더 치환될 수 있고;
p, q, r 및 s는 서로 독립적으로 0 내지 4의 정수이다.
상기 화학식 11 및 화학식 12의 화학식은 화학식 13 내지 화학식 16으로 표시되는 안트라센 유도체 또는 벤즈[a]안트라센 유도체로 예시될 수 있다.
[화학식 13]
[화학식 14]
[화학식 15]
[Ar41 및 Ar42는 (C4-C60)헤테로아릴 또는 하기 구조에서 선택되는 아릴이며,
상기 Ar41 및 Ar42의 아릴 또는 헤테로아릴은 중수소, (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴 및 (C4-C60)헤테로아릴로부터 선택된 치환기 하나 이상으로 치환될 수 있고;
L31는 (C6-C60)아릴렌, (C4-C60)헤테로아릴렌 또는 하기 구조의 화합물이며,
상기 L31의 아릴렌 또는 헤테로아릴렌은 중수소, (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴, (C4-C60)헤테로아릴 및 할로겐으로부터 선택된 치환기 하나 이상으로 치환될 수 있으며;
R321, R322, R323 및 R324는 서로 독립적으로 수소, 중수소, (C1-C60)알킬 또는 (C6-C60)아릴이거나, 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며,
R331, R332, R333 및 R334는 서로 독립적으로 수소, 중수소, (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴, (C4-C60)헤테로아릴 또는 할로겐이거나, 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있다.]
[화학식 16]
상기 화학식 16에서,
L41 및 L42는 서로 독립적으로 화학결합이거나, (C6-C60)아릴렌 또는 (C3-C60)헤테로아릴렌이고, 상기 L41 및 L42의 아릴렌 또는 헤테로아릴렌은 중수소, (C1-C60)알킬, 할로겐, 시아노, (C1-C60)알콕시, (C3-C60)시클로알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 트리(C1-C30)알킬실릴, 디(C1-C30)알킬(C6-C30)아릴실릴 및 트리(C6-C30)아릴실릴로부터 선택된 하나 이상으로 더 치환될 수 있으며;
R401 내지 R419는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6- C60)아릴티오, (C1-C60)알콕시카보닐, 카르복실, 나이트로 또는 하이드록시이거나, R401 내지 R419는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고,
Ar51은 (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 아다만틸, (C7-C60)바이시클로알킬이거나, 하기 구조에서 선택되는 치환기이고,
상기 R420 내지 R432는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카르복실, 나이트로 또는 하이드록시이고;
E 및 F는 서로 독립적으로 화학결합이거나, -(CR433R434)w-, -N(R435)-, -S-, -O-, -Si(R436)(R437)-, -P(R438)-, -C(=O)-, -B(R439)-, -In(R440)-, -Se-, -Ge(R441)(R442)-, -Sn(R443)(R444)-, -Ga(R445)- 또는 -(R446)C=C(R447)- 이며;
R433 내지 R445는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카르복실, 나이트로 또는 하이드록시이거나, R433 내지 R445는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
상기 Ar51의 아릴, 헤테로아릴, 헤테로시클로알킬, 아다만틸, 바이시클로알킬 또는 R401 내지 R445의 알킬, 알케닐, 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴, 헤테로아릴, 아릴실릴, 알킬실릴, 알킬아미노 및 아릴아미노는 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카르복실, 나이트로 및 하이드록시로부터 선택된 하나 이상으로 더 치환될 수 있으며;
t 및 w는 서로 독립적으로 1 내지 4의 정수이다.
상기 발광층에 청색, 녹색 또는 적색 파장을 발광피크로 갖는 화합물은 하기 화합물로 예시될 수 있으나, 이에 한정되는 것은 아니다.
본 발명의 유기 전자 소자에 있어서, 한 쌍의 전극의 적어도 한쪽의 내측표면에, 칼코제나이드(chalcogenide)층, 할로겐화 금속층 및 금속 산화물층으로부터 선택되는 일층(이하, 이들을 "표면층"이라고 지칭함) 이상을 배치하는 것이 바람직하다. 구체적으로는, 발광 매체층 측의 양극 표면에 규소 및 알루미늄의 금속의 칼코제나이드(산화물을 포함한다)층을, 또한 발광매체층 측의 음극 표면에 할로겐화 금속층 또는 금속 산화물층을 배치하는 것이 바람직하다. 이것에 의해, 구동의 안정화를 얻을 수 있다.
상기 칼코제나이드로서는 예컨대 SiOx(1≤X≤2), AlOX(1≤X≤1.5), SiON, SiAlON 등을 바람직하게 들 수 있으며, 할로겐화 금속으로서는 예컨대 LiF, MgF2, CaF2, 불화 희토류 금속 등을 바람직하게 들 수 있으며, 금속 산화물로서는 예컨대 Cs2O, Li2O, MgO, SrO, BaO, CaO 등을 바람직하게 들 수 있다.
또한, 본 발명의 유기 전자 소자에 있어서, 이렇게 제작된 한 쌍의 전극의 적어도 한쪽의 표면에 전자 전달 화합물과 환원성 도판트의 혼합 영역 또는 정공 전달 화합물과 산화성 도판트의 혼합 영역을 배치하는 것도 바람직하다. 이러한 방식으로, 전자 전달 화합물이 음이온으로 환원되므로 혼합 영역으로부터 발광 매체에 전자를 주입 및 전달하기 용이해진다. 또한, 정공 전달 화합물은 산화되어 양이온으로 되므로 혼합 영역으로부터 발광 매체에 정공을 주입 및 전달하기 용이해진다. 바람직한 산화성 도판트로서는 각종 루이스산 및 억셉터(acceptor) 화합물을 들 수 있다. 바람직한 환원성 도판트로서는 알칼리 금속, 알칼리 금속 화합물, 알칼리 토류 금속, 희토류 금속 및 이들의 혼합물을 들 수 있다.
본 발명에 따른 유기 전자재료용 화합물은 발광효율이 좋고 재료의 수명특성이 뛰어나 소자의 구동수명이 매우 양호한 OLED 소자를 제조할 수 있는 장점이 있다. 또한, 본 발명에 따른 유기 전자재료용 화합물은 정공전달층 또는 정공주입층에 포함되거나 인광발광체의 호스트로 사용되어 구동전압을 낮춤으로서 소비전력을 현저히 감소시킬 뿐만 아니라 동등 이상의 발광효율을 나타내는 장점이 있다.
이하에서, 본 발명의 상세한 이해를 위하여 본 발명의 대표 화합물을 들어 본 발명에 따른 유기 전자재료용 화합물, 이의 제조방법 및 소자의 발광특성을 설명하나, 이는 단지 그 실시 양태를 예시하기 위한 것일 뿐, 본 발명의 범위를 한정하는 것은 아니다.
[제조예]
[제조예 1] 화합물 1의 제조
화합물
A
의 제조
카바졸 (20 g, 119.6 mmol), 메틸-2-아이오도벤조에이트 (26.4 mL, 179.4 mmol), K2CO3 (21.5 g,155.5 mmol), Cu (1.52 g, 23.9 mmol) 및 CuI (1.14 g, 5.98 mmol)를 다이부틸에테르 500mL에 녹인 후 아르곤 조건하에서 48시간 동안 환류 교반시켰다. 반응이 완결되면 실온에서 식히고 물 800 mL로 추출하여 유기층을 감압 건조시켰다. 이를 헥산 : 에틸 아세테이트 = 4:1로 컬럼 크로마토그래피하여 분리한 후 다시 에탄올 300 mL로 재결정하여 화합물 A (24.5g, 68%)를 얻었다.
화합물
B
의 제조
화합물 A (15.0 g ,49.8 mmol)를 100mL 에테르에 녹이고, -78℃로 냉각시킨 후 메틸리튬 (에테르 중 1.6M, 78 mL, 124.4 mmol)을 넣고 1시간 동안 교반하였다. 이를 서서히 실온으로 올려 4시간 동안 더 교반하였다. 반응이 완료되면 물 200 mL로 추출하여 유기층을 감압 건조시켰다. 이를 에탄올/아세톤(부피비 1:1)로 재결정하여 화합물 B (10.1g, 67%)를 얻었다.
화합물
C
의 제조
화합물 B (14.0 g, 46.5 mmol)를 150 mL conc. H3PO4에 녹인후 5시간 반 동안 교반 하였다. 이를 물 200 mL와 에틸 아세테이트 200 mL로 추출하고 유기층을 감압 건조시켰다. 이를 에탄올 150 mL로 재결정하여 화합물 C (9.48g, 72%)를 얻었다.
화합물
D
의 제조
화합물 C (7 g , 24.7 mmol)을 다이클로로메탄 100 mL에 녹인 후 0℃에서 N-브로모숙신이미드(N-bromosuccinimide)(5.28 g, 29.6 mmol)를 첨가하였다. 이 온도를 계속 유지하면서 4시간 동안 교반하였다. 그런 다음 증류수 150 mL를 가해 반응을 종료하고 디클로로메탄 100 mL로 추출, 감압 건조시켰다. 이를 에탄올/아세톤(부피비 1:2)으로 재결정하여 화합물 D (6.4g, 72%)를 얻었다.
화합물
1
의 제조
화합물 D (5 g, 13.8 mmol), 페닐보론산(Phenylboronic acid)(1.9 g, 15.18 mmol) 및 테트라키스 팔라듐(0) 트리페닐포스핀(Pd(PPh3)4)(0.8 g, 0.52 mmol)을 톨루엔 100 mL와 에탄올 50 mL에 녹인 다음, 2M 탄산나트륨 수용액 50 mL을 넣고 120℃에서 4시간 동안 환류 교반하였다. 그런 다음 온도를 25℃로 낮추고 증류수 200 mL를 가해 반응을 종료하고, 에틸아세테이트 150 mL로 추출, 감압 건조시켰다. 이를 컬럼 크로마토그래피를 이용하여 목적 화합물 1 (1.6 g, 3.33 mmol)을 얻었다.
[제조예 2] 화합물 320의 제조
화합물
E
의 제조
화합물 C (7 g , 24.7 mmol )을 다이클로로메탄 100 mL에 녹인 후 0℃에서 N-브로모숙신이미드(N-bromosuccinimide)(10.5 g, 59.2 mmol)를 첨가하였다. 이 온도를 계속 유지하면서 5시간 동안 교반하였다. 그런 다음 증류수 150 mL를 가해 반응을 종료하고 디클로로메탄 100 mL로 추출, 감압 건조시켰다. 이를 에탄올/아세톤(부피비 1:2)으로 재결정하여 화합물 E (7.4 g, 68%)를 얻었다.
화합물
320
의 제조
화합물 E (5 g, 13.8 mmol), 페닐보론산(Phenylboronic acid) (3.8 g, 30.36 mmol) 및 테트라키스 팔라듐(0) 트리페닐포스핀(Pd(PPh3)4)(1.6 g, 1.04 mmol)을 톨루엔 100 mL와 에탄올 50 mL에 녹인 다음, 2M 탄산나트륨 수용액 50 mL을 넣고 120℃에서 4시간 동안 환류 교반하였다. 그런 다음 온도를 25℃로 낮추고 증류수 200 mL를 가해 반응을 종료하고, 에틸 아세테이트 150 mL로 추출, 감압 건조시켰다. 이를 컬럼 크로마토그래피를 이용하여 목적 화합물 320 (3.9 g, 8.95 mmol)을 얻었다.
[제조예 3] 화합물 462의 제조
화합물
F
의 제조
카바졸 (20 g, 119.6 mmol), 5-브로모-메틸-2-아이오도벤조에이트 (26.4 mL, 179.4 mmol), K2CO3 (21.5 g ,155.5 mmol), Cu (1.52 g, 23.9 mmol) 및 CuI (1.14 g , 5.98 mmol)를 다이부틸에테르 500mL에 녹인 다음 아르곤 조건하에서 48시간 동안 환류 교반시켰다. 반응이 완결되면 실온에서 식히고 물 800 mL로 추출하여 유기층을 감압 건조시켰다. 이를 헥산 : 에틸 아세테이트 = 4:1로 컬럼 분리한 후, 다시 에탄올 300 mL로 재결정하여 화합물 F (24.5 g, 58 %)를 얻었다.
화합물
G
의 제조
화합물 F (15.0 g ,49.8 mmol)를 100mL 에테르에 녹이고, -78℃로 냉각시킨 후 메틸리튬 (1.6M in Ether, 78 mL, 124.4 mmol)을 넣고 1시간 동안 교반하였다. 이를 서서히 실온으로 올려 4시간 동안 더 교반하였다. 반응이 완료되면 물 200 mL로 추출하여 유기층을 감압 건조시켰다. 이를 에탄올/아세톤(부피비 1:1)으로 재결정하여 화합물 G (10.1 g, 57 %)를 얻었다.
화합물
H
의 제조
화합물 G (14.0 g, 46.5 mmol)를 150 mL의 진한 H3PO4에 녹인 후 5시간 반 동안 교반하였다. 이를 물 200 mL와 에틸 아세테이트 200mL로 추출한 후, 유기층을 감압 건조시켰다. 이를 에탄올 150 mL로 재결정하여 화합물 H (9.48 g, 62 %)를 얻었다.
화합물
I
의 제조
화합물 H (7 g, 24.7 mmol )을 다이클로로메탄 100 mL에 녹인 후 0℃에서 N-브로모숙신이미드(N-bromosuccinimide)(5.28 g, 29.6 mmol)를 첨가하였다. 이 온도를 계속 유지하면서 4시간 동안 교반하였다. 그런 다음 증류수 150 mL를 가해 반응을 종료하고 디클로로메탄 100 mL로 추출, 감압 건조시켰다. 이를 에탄올/아세톤(부피비 1:2)으로 재결정하여 화합물 I (6.4 g, 62 %)를 얻었다.
화합물
462
의 제조
화합물 I (5 g, 13.8 mmol), 페닐보론산(Phenylboronic acid) (5.7 g, 45.54 mmol) 및 테트라키스 팔라듐(0)트리페닐포스핀(Pd(PPh3)4)(2.4 g, 1.56 mmol)을 톨루엔 100 mL와 에탄올 50 mL에 녹인 다음, 2M 탄산나트륨 수용액 50 mL을 넣고 120℃에서 4시간 동안 환류 교반하였다. 그런 다음 온도를 25℃로 낮추고 증류수 200 mL를 가해 반응을 종료하고, 에틸 아세테이트 150 mL로 추출, 감압 건조시켰다. 이를 컬럼 크로마토그래피를 이용하여 목적 화합물 462(1.6 g, 3.12 mmol)를 얻었다.
[제조예 4] 화합물 498의 제조
화합물
J
의 제조
카바졸 (20 g, 119.6 mmol), 다이메틸-2-아이오도아이소프탈레이트 (49.8 g, 155.5 mmol), K2CO3 (21.5 g ,155.5 mmol), Cu (1.52 g, 23.9 mmol) 및 CuI (1.14 g, 5.98 mmol)를 다이부틸에테르 800 mL에 녹인 다음 아르곤 조건하에서 48시간 동안 환류 교반시켰다. 반응이 완결되면 실온에서 식히고 물 800 mL로 추출하여 유기층을 감압 건조시켰다. 이를 헥산 : 에틸 아세테이트 = 4:1로 컬럼 분리한 후, 다시 에탄올 300 mL로 재결정하여 화합물 J (27.1 g, 63 %)를 얻었다.
화합물
K
의 제조
화합물 J (15.0 g ,41.7 mmol)를 300 mL 에테르에 녹이고, -78℃로 냉각시킨 후 메틸리튬 (에테르 중 1.6M, 120 mL, 187.8 mmol)을 넣고 1시간 동안 교반하였다. 이를 서서히 실온으로 올려 4시간 동안 더 교반하였다. 반응이 완료되면 물 200 mL로 추출하여 유기층을 감압 건조시켰다. 이를 에탄올/아세톤(부피비 1:1)으로 재결정하여 화합물 K (8.7 g, 58 %)를 얻었다.
화합물
L
의 제조
화합물 K (14.0 g, 38.9 mmol)를 150 mL의 진한 H3PO4에 녹인 후 5시간 반 동안 교반하였다. 이를 물 200 mL와 에틸 아세테이트 200 mL로 추출한 후, 유기층을 감압 건조시켰다. 이를 에탄올 150 mL로 재결정하여 화합물 L (7.68 g, 61 %)을 얻었다.
화합물
M
의 제조
화합물 L (7 g, 21.6 mmol)을 다이클로로메탄 100 mL에 녹인 후 0℃에서 N-브로모숙신이미드(N-bromosuccinimide)(5.28 g, 28.1 mmol)를 첨가하였다. 이 온도를 계속 유지하면서 4시간 동안 교반하였다. 그런 다음 증류수 150 mL를 가해 반응을 종료하고 디클로로메탄 100 mL로 추출, 감압 건조시켰다. 이를 에탄올/아세톤 (부피비 1:2)으로 재결정하여 화합물 M (5.7 g, 66 %)을 얻었다.
화합물
498
의 제조
화합물 M (5 g, 12.4 mmol), 페닐보론산(Phenylboronic acid) (1.9 g, 15.18 mmol) 및 테트라키스 팔라듐(0) 트리페닐포스핀(Pd(PPh3)4)(0.8 g, 0.52 mmol)을 톨루엔 100 mL와 에탄올 50 mL에 녹인 다음, 2M 탄산나트륨 수용액 50 mL을 넣고 120℃에서 4시간 동안 환류 교반하였다. 그런 다음 온도를 25℃로 낮추고 증류수 200 mL를 가해 반응을 종료하고, 에틸아세테이트 150 mL로 추출, 감압 건조시켰다. 이를 컬럼 크로마토그래피를 이용하여 목적 화합물 498 (1.5 g, 3.75 mmol)을 얻었다.
[제조예 5] 화합물 811의 제조
화합물
N
의 제조
아닐린 (4.89 mL, 53.7 mmol), 메틸-2-아이오도벤조에이트 (23.7 mL, 161 mmol), K2CO3 (15.6 g ,113 mmol), Cu (0.68 g, 10.7 mmol) 및 CuI (0.51 g, 2.69 mmol) 와 다이-n-부틸에테르 50 mL를 넣고 아르곤 조건하에 48시간 동안 환류시켰다. 헥산 : 에틸 아세테이트 = 4:1로 컬럼 분리 후, 에탄올로 재결정하여 화합물 N (15.7 g, 81 %)을 얻었다.
화합물
O
의 제조
화합물 N (15.0 g ,41.5 mmol)를 에테르 80mL에 녹이고, -78℃에서 메틸리튬 (에테르 중, 45 mmol)을 넣고 상온으로 온도를 올린 후 4시간 동안 반응시킨다. 에탄올/아세톤(부피비 1:1)으로 재결정하여 화합물 O (7.68 g, 61 %)를 얻었다.
화합물
P
의 제조
화합물 O (14.0 g, 38.7 mmol)를 진한 H3PO4 150 mL에 넣고 5시간 반 동안 교반시켰다. 물/에틸 아세테이트로 추출한 후 에탄올로 재결정하여 화합물 P (7.8 g, 68%)를 얻었다.
화합물
Q
의 제조
화합물 P (7 g ,21.5 mmol)를 메틸렌클로라이드에 녹인 후 0℃에서 NBS (4.98 g, 27.95 mmol)를 첨가하였다. 5시간 후 추출하여 에탄올/아세톤(부피비 1:2)으로 재결정하여 화합물 Q (6 g, 75%)를 얻었다.
화합물
811
의 제조
화합물 Q (5 g, 12.4 mmol), 페닐보론산 (1.9 g, 15.18 mmol) 및 테트라키스 팔라듐(0) 트리페닐포스핀(Pd(PPh3)4)(0.8 g, 0.52 mmol)을 톨루엔 100 mL와 에탄올 50 mL에 녹인 다음, 2M 탄산나트륨 수용액 50 mL를 넣고 120℃에서 4시간 동안 환류 교반하였다. 그런 다음 온도를 25℃로 낮추고 증류수 200 mL를 가해 반응을 종료하고, 에틸 아세테이트 150 mL로 추출, 감압 건조시켰다. 이를 컬럼 크로마토그래피를 이용하여 목적 화합물 811 (1.5 g, 3.75 mmol)을 얻었다.
[제조예 6] 화합물 1221의 제조
화합물
R
의 제조
안스라닉산 메틸 에스테르(Anthranilic acid methyl ester) (10 g, 66.2 mmol), 메틸-2-아이오도벤조에이트 (28.2 mL, 191.98 mmol), K2CO3 (19.2 g ,139.02 mmol), Cu (0.84 g, 13.24 mmol) 및 CuI (0.63 g, 3.31 mmol)와 다이-n-부틸 에테르 120 mL를 넣고 아르곤 조건하에 48시간 동안 환류시켰다. 헥산 : 에틸아세테이트 = 4:1로 컬럼 분리한 후, 에탄올로 재결정하여 화합물 R (21.7 g, 78 %)을 얻었다.
화합물
S
의 제조
화합물 R (15.0 g, 35.8 mmol)을 에테르 100mL에 녹이고, -78℃에서 메틸리튬 (에테르 중 1.6M, 145 mL, 232.46 mmol)을 넣고 실온으로 올린 후 4시간 동안 반응시켰다. 에탄올/아세톤(부피비 1:1)으로 재결정하여 화합물 S (10.4 g, 69 %)를 얻었다.
화합물
T
의 제조
화합물 S (14.0 g, 33.4 mmol)를 진한 H3PO4 150mL에 넣고 5시간 반 동안 교반시켰다. 믈/에틸 아세테이트로 추출한 후 에탄올로 재결정하여 화합물 T (9.15 g, 75%)를 얻었다.
화합물
U
의 제조
화합물 T (7 g, 19.2 mmol)을 메틸렌클로라이드에 녹인 후 0℃에서 NBS (4.09 g, 23.0 mmol)를 첨가한다. 5시간 후 물과 에틸 아세테이트를 이용하여 유기층을 추출하여 에탄올/아세톤(부피비 1:2)으로 재결정하여 화합물 U (6.4 g, 75%)를 얻었다.
화합물
1221
의 제조
화합물 U (5 g, 11.3 mmol), 페닐보론산 (1.9 g, 15.18 mmol) 및 테트라키스 팔라듐(0)트리페닐포스핀(Pd(PPh3)4)(0.8 g, 0.52 mmol)을 톨루엔 100 mL와 에탄올 50 mL에 녹인 다음, 2M 탄산나트륨 수용액 50 mL을 넣고 120℃에서 4시간 동안 환류 교반하였다. 그런 다음 온도를 25℃로 낮추고 증류수 200 mL를 가해 반응을 종료하고, 에틸 아세테이트 150 mL로 추출, 감압 건조시켰다. 이를 컬럼 크로마토그래피를 이용하여 목적화합물 1221 (1.5 g, 3.75 mmol)을 얻었다.
상기 제조예 1 내지 6의 방법을 이용하여 유기 발광 화합물 1 내지 화합물 1528을 제조하였으며, 표 1에 제조된 유기 발광 화합물들의 1H NMR 및 MS/FAB를 나타내었다.
[표 1]
[실시예 1] 본 발명에 따른 유기 전자재료용 화합물을 이용한 OLED 소자의 발광 특성(I)
본 발명의 전자재료용 화합물을 이용한 구조의 OLED 소자를 제작하였다.
우선, OLED용 글래스(삼성-코닝사 제조)(1)로부터 얻어진 투명전극 ITO 박막(15 Ω/□) (2)을, 트리클로로에틸렌, 아세톤, 에탄올, 증류수를 순차적으로 사용하여 초음파 세척을 실시한 후, 이소프로판올에 넣어 보관한 후 사용하였다.
다음으로, 진공 증착 장비의 기판 폴더에 ITO 기판을 설치하고, 진공 증착 장비 내의 셀에 하기 구조의 4,4',4"-트리스(N,N-(2-나프틸)-페닐아미노)트리페닐아민(2-TNATA)을 넣고, 챔버 내의 진공도가 10-6 torr에 도달할 때까지 배기시킨 후, 셀에 전류를 인가하여 2-TNATA를 증발시켜 ITO 기판 상에 60 nm 두께의 정공주입층(3)을 증착하였다.
이어서, 진공 증착 장비 내의 다른 셀에 하기구조 N,N'-비스(α-나프틸)-N,N'-디페닐-4,4'-디아민(NPB)을 넣고, 셀에 전류를 인가하여 NPB를 증발시켜 정공주입층 위에 20 nm 두께의 정공전달층(4)을 증착하였다.
정공주입층, 정공전달층을 형성시킨 후, 그 위에 발광층을 다음과 같이 증착시켰다. 진공 증착 장비 내의 한쪽 셀에 호스트 재료로 10-6 torr하에서 진공 승화 정제된 본 발명에 따른 화합물(예 : 화합물 279)을 넣고, 다른쪽 셀에는 발광 도판트(예 :화합물 (piq)2Ir(acac))를 각각 넣은 후, 두 물질을 다른 속도로 증발시켜 4 내지 10중량%로 도핑함으로써 상기 정공 전달층 위에 30 nm 두께의 발광층(5)을 증착하였다.
이어서 상기 발광층 위에 정공차단층으로 비스(2-메틸-8-퀴놀리나토)-(p-페닐페놀라토)알루미늄(III)(BAlq)을 5 nm의 두께로 증착시키고, 이어서 전자전달층(6)으로써 하기 구조의 트리스(8-하이드록시퀴놀린)-알루미늄(III) (Alq)를 20 nm 두께로 증착한 다음, 전자주입층(7)으로 하기 구조의 화합물 리튬 퀴놀레이트(Liq)를 1 내지 2 nm 두께로 증착한 후, 다른 진공 증착 장비를 이용하여 Al 음극(8)을 150 nm의 두께로 증착하여 OLED를 제작하였다.
[비교예 1] 종래의 발광 재료를 이용한 OLED 소자의 발광 특성
진공 증착 장비 내의 다른 셀에 발광 호스트 재료로서 본 발명에 따른 전기 발광 화합물 대신에 비스(2-메틸-8-퀴놀리나토)(p-페닐페놀라토)알루미늄(III) (BAlq)을 넣은 것 이외에는 실시예 1과 동일하게 OLED 소자를 제작하였다.
상기 실시예 1과 비교예 1에서 제조된 본 발명에 따른 전자재료용 화합물과 종래의 발광 화합물을 함유하는 OLED 소자의 구동전압 및 전력효율을 1,000 cd/㎡ 에서 측정하여 하기 표 2에 나타내었다.
[표 2]
상기 표 2로부터 본 발명에서 개발한 착물들의 발광 특성이 종래의 재료 대비 우수한 특성을 보이는 것을 확인할 수 있었다.
따라서, 본 발명에 따른 전기 발광 화합물을 호스트 재료로 사용한 소자는 발광특성이 뛰어나며, 또한 구동전압을 강하시켜줌으로써 0.8~2.2 lm/W의 전력효율의 상승을 유도하여 소비전력을 개선시킬 수 있다.
[실시예 2] 본 발명에 따른 유기 전자재료용 화합물을 이용한 OLED 소자의 발광 특성(II)
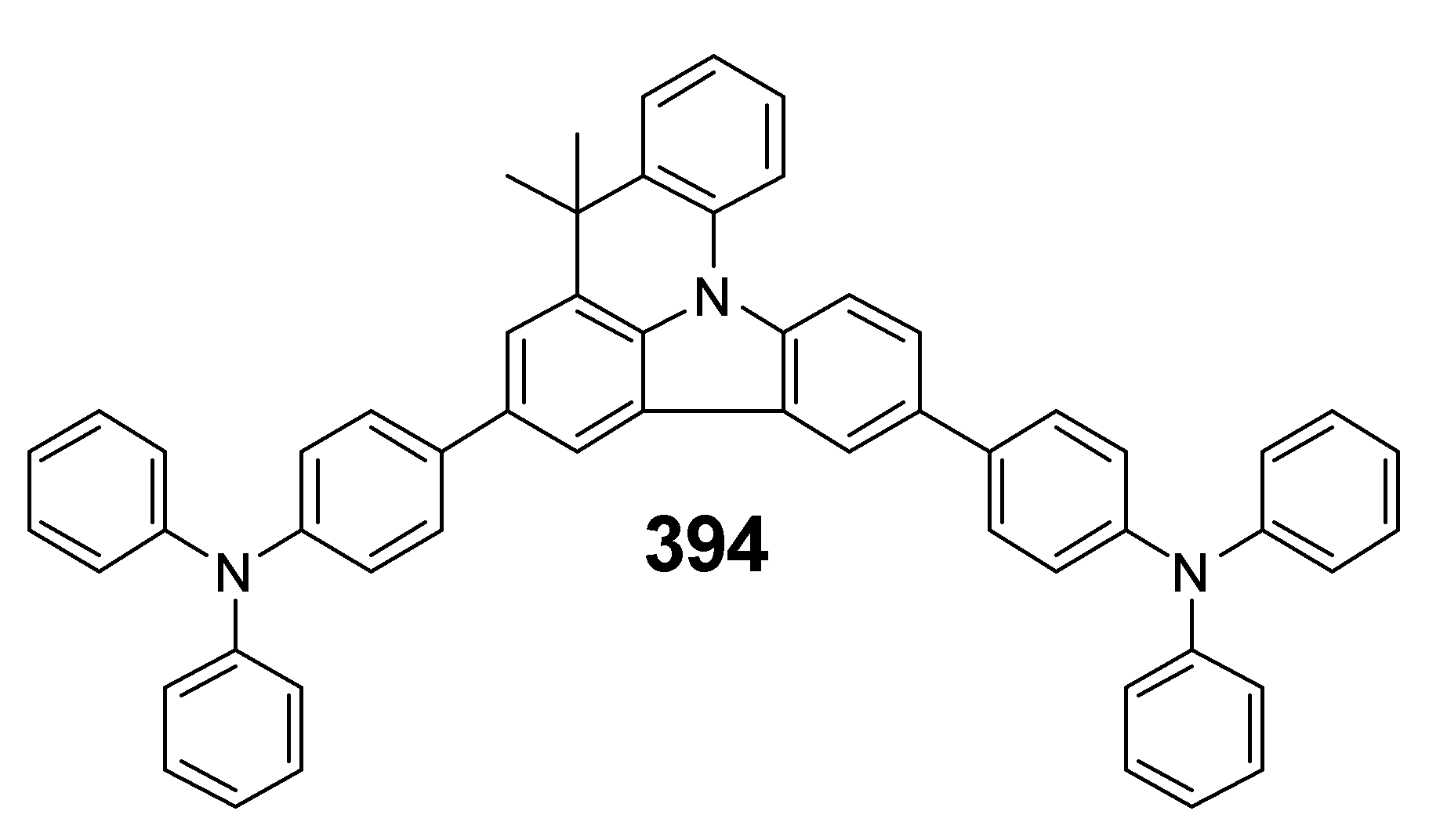
실시예 1과 동일한 방법으로 정공주입층(3)을 형성시킨 후, 이어서, 진공 증착 장비 내의 다른 셀에 하기구조 화합물 394를 넣고, 셀에 전류를 인가하여 증발시켜 정공주입층 위에 20 nm 두께의 정공전달층(4)을 증착하였다.
그 이외에는 실시예 1과 동일한 방법으로 OLED 소자를 제작하였다.
상기 실시예 2 및 비교예 1에서 제조된 본 발명에 따른 전자재료용 화합물과 종래의 발광 화합물을 함유하는 OLED 소자의 발광 효율을 각각 5,000 cd/m2에서 측정하여 하기 표 3에 나타내었다.
[표 3]
본 발명에서 개발한 화합물들이 성능 측면에서 종래의 재료 대비 우수한 특성을 보이는 것을 확인할 수 있었다.
[실시예 3] 본 발명에 따른 유기 전자재료용 화합물을 이용한 OLED 소자의 발광 특성(III)
실시예 1과 동일한 방법으로 진공 증착 장비의 기판 폴더에 ITO 기판을 설치하고, 장비 내의 셀에 하기구조의 화합물 494를 넣고, 챔버 내의 진공도가 10-6 torr에 도달할 때까지 배기시킨 후, 셀에 전류를 인가하여 화합물 494를 증발시켜 ITO 기판 상에 60 nm 두께의 정공주입층(3)을 증착하였다.
그 이외에는 실시예 1과 동일한 방법으로 OLED 소자를 제작하였다.
상기 실시예 3 및 비교예 1에서 각각 제조된 본 발명에 따른 유기 발광 화합물 및 종래의 발광 화합물을 함유하는 OLED 소자의 발광 효율을 각각 5,000 cd/m2에서 측정하여 하기 표 4에 나타내었다.
[표 4]
본 발명에서 개발한 화합물들이 성능 측면에서 종래의 재료 대비 우수한 특성을 보이는 것을 확인할 수 있었다.
도 1 - OLED 소자의 단면도
<도면 주요 부분에 대한 부호의 설명>
1 - 글래스 2 - 투명전극
3 - 정공주입층 4 - 정공전달층
5 - 발광층 6 - 전자전달층
7 - 전자주입층 8 - Al 음극
Claims (12)
- 하기 화학식 1로 표시되는 유기 전자재료용 화합물.[화학식 1]상기 화학식 1에서,X 및 Y는 서로 독립적으로 화학결합이거나, -(CR31R32)a-, -S- 또는 -O-이고;L1, L2 및 L3는 서로 독립적으로 화학결합이거나, (C6-C60)아릴렌, (C3-C60)헤테로아릴렌, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬렌, (C3-C60)시클로알킬렌, 아다만틸렌, (C7-C60)바이시클로알킬렌, (C2-C60)알케닐렌, (C2-C60)알키닐렌, (C6-C60)아르(C1-C60)알킬렌, (C1-C60)알킬렌티오, (C1-C60)알킬렌옥시, (C6-C60)아릴렌옥시 또는 (C6-C60)아릴렌티오이고;R1, R2 및 R3는 서로 독립적으로 수소, 중수소, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오 또는 NR11R12이거나, 하기 구조에서 선택되는 치환기이고, R1, R2 및 R3가 동시에 수소인 경우는 제외하고;R11 및 R12는 서로 독립적으로 (C6-C60)아릴 또는 (C3-C60)헤테로아릴이거나, 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고;R13 내지 R30은 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 또는 하이드록시이거나, R13 내지 R25는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;A 및 B는 서로 독립적으로 화학결합이거나, -(CR31R32)a-, -N(R33)-, -S-, -O-, -Si(R34)(R35)-, -P(R36)-, -C(=O)-, -B(R37)-, -In(R38)-, -Se-, -Ge(R39)(R40)-, -Sn(R41)(R42)-, -Ga(R43)- 또는 -(R44)C=C(R45)-이며;R31 내지 R45는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 또는 하이드록시이거나, R31과 R32, R34와 R35, R39와 R40, R41와 R42 및 R44와 R45는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;상기 L1, L2 및 L3의 아릴렌, 헤테로아릴렌, 아릴렌옥시 및 아릴렌티오; R1, R2, R3, R11 및 R12의 아릴 및 헤테로아릴; R13 내지 R30 및 R31 내지 R45의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 아르알킬, 알킬옥시, 알킬티오, 아릴옥시, 아릴티오, 알킬아미노, 아릴아미노, 알콕시카보닐, 알킬카보닐 또는 아릴카보닐은 중수소, 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C60)알킬, (C6-C60)아릴, (C6-C60)아릴로 치환 또는 비치환된 (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, 카바졸릴, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬(C6-C60)아릴, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카르복실, 나이트로 및 하이드록시로 이루어진 군으로부터 선택되는 하나 이상의 치환기로 더 치환될 수 있고;x 및 y는 1이고;a는 0 내지 1의 정수이고;단, X 및 Y가 서로 동일한 경우는 제외하고;단, , 또는 가 서로 독립적으로 디(C6-C60)아릴아미노기, ((C6-C60)아릴)((C3-C60)헤테로아릴)아미노기 또는 디(C3-C60)헤테로아릴아미노기인 경우는 제외되고,X가 CR31R32이고 R31 및 R32가 페닐인 경우, 페닐의 치환기에서 디(C6-C60)아릴아미노 또는 (C6-C60)아릴은 제외된다.
- 제2항에 있어서,상기 R1, R2 및 R3는 서로 독립적으로 수소, 중수소 또는 NR11R12이거나, 하기 구조에서 선택되는 것인, 유기 전자재료용 화합물.[R11 및 R12는 청구항 제1항에서의 정의와 동일하며;R51 내지 R64는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, 할로(C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬(C6-C60)아릴, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카복실산, 나이트로 또는 하이드록시이며;A 및 B는 서로 독립적으로 -C(R31)(R32)-, -N(R33)-, -S-, -O-, -Si(R34)(R35)-, -P(R36)-, -C(=O)-, -B(R37)-, -In(R38)-, -Se-, -Ge(R39)(R40)-, -Sn(R41)(R42)-, -Ga(R43)- 또는 -(R44)C=C(R45)-이며;R31 내지 R45는 서로 독립적으로 수소, 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, (C6-C60)아릴카보닐, 카복실산, 나이트로 또는 하이드록시이거나, R31과 R32, R34와 R35, R39와 R40, R41와 R42 및 R44와 R45는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;상기 R31 내지 R45 및 R51 내지 R64의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 알킬아미노 또는 아릴아미노는 중수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C6-C60)아릴카보닐, (C1-C60)알콕시카보닐, (C1-C60)알킬카보닐, 카르복실, 나이트로 또는 하이드록시로 더 치환될 수 있으며;b는 1 내지 5의 정수이고, c는 1 내지 4의 정수이고, d는 1 내지 3의 정수이다.]
- 제2항에 있어서,상기 L1, L2 및 L3는 서로 독립적으로 화학결합이거나, 페닐렌, 나프틸렌, 비페닐렌, 플루오레닐렌, 페난트릴렌, 안트릴렌, 플루오란테닐렌, 트리페닐레닐렌, 피레닐렌, 크라이세닐렌, 나프타세닐렌, 페릴레닐렌, 스피로바이플루오레닐렌, 테트라하이드로나프틸렌, 아세나프테닐렌, 인데닐렌, 피리딜렌, 바이피리딜렌, 피롤릴렌, 퓨릴렌, 티에닐렌, 이미다졸릴렌, 벤조이미다졸릴렌, 피라지닐렌, 피리미디닐렌, 피리다지닐렌, 퀴놀릴렌, 트리아지닐렌, 벤조퓨릴렌, 디벤조퓨릴렌, 벤조티에닐렌, 디벤조티에닐렌, 피라졸릴렌, 인돌릴렌, 카바졸릴렌, 인데노카바졸릴렌, 티아졸릴렌, 옥사졸릴렌, 벤조티아졸릴렌, 벤조옥사졸릴렌, 페난트리디닐렌, 페난트롤리닐렌, 피페리디닐렌, 퀴나졸리닐렌, 또는 에서 선택되는 아릴렌 또는 헤테로아릴렌이고; 상기 L1, L2 및 L3의 아릴렌, 헤테로아릴렌은 중수소, 할로겐, (C1-C60)알킬, 할로(C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 모폴리노, 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 시아노, 카바졸릴, (C6-C60)아르(C1-C60)알킬, (C1-C60)알킬옥시, (C1-C60)알킬티오, (C6-C60)아릴옥시, (C6-C60)아릴티오, 카르복실, 나이트로 및 하이드록시로 이루어진 군으로부터 선택되는 하나 이상의 치환기로 더 치환될 수 있는 것인 유기 전자재료용 화합물.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Priority Applications (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020080107606A KR101506919B1 (ko) | 2008-10-31 | 2008-10-31 | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 |
| EP09156604A EP2182040A3 (en) | 2008-10-31 | 2009-03-30 | Aromatic compounds and organic electronic device using the same |
| TW098136835A TW201114770A (en) | 2008-10-31 | 2009-10-30 | Novel compounds for organic electronic material and organic electronic device using the same |
| PCT/KR2009/006350 WO2010050778A1 (en) | 2008-10-31 | 2009-10-30 | Novel compounds for organic electronic material and organic electronic device using the same |
| JP2011534394A JP2012507507A (ja) | 2008-10-31 | 2009-10-30 | 新規な有機電子材料用化合物及びこれを含む有機電子素子 |
| CN201410060622.3A CN103864789A (zh) | 2008-10-31 | 2009-10-30 | 用于有机电子材料的新型化合物和使用该化合物的有机电子器件 |
| CN2009801431149A CN102203212A (zh) | 2008-10-31 | 2009-10-30 | 用于有机电子材料的新型化合物和使用该化合物的有机电子器件 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020080107606A KR101506919B1 (ko) | 2008-10-31 | 2008-10-31 | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020130045570A Division KR101546215B1 (ko) | 2013-04-24 | 2013-04-24 | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20100048447A KR20100048447A (ko) | 2010-05-11 |
| KR101506919B1 true KR101506919B1 (ko) | 2015-03-30 |
Family
ID=41611302
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020080107606A KR101506919B1 (ko) | 2008-10-31 | 2008-10-31 | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 |
Country Status (6)
| Country | Link |
|---|---|
| EP (1) | EP2182040A3 (ko) |
| JP (1) | JP2012507507A (ko) |
| KR (1) | KR101506919B1 (ko) |
| CN (2) | CN102203212A (ko) |
| TW (1) | TW201114770A (ko) |
| WO (1) | WO2010050778A1 (ko) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20130101726A (ko) * | 2012-03-06 | 2013-09-16 | 덕산하이메탈(주) | 아크리딘 유도체를 포함하는 유기전기소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2019151697A1 (ko) * | 2018-02-01 | 2019-08-08 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US10538538B2 (en) | 2017-01-13 | 2020-01-21 | Samsung Display Co., Ltd. | Polycyclic compound and organic electroluminescence device including the same |
| US10658594B2 (en) | 2017-12-06 | 2020-05-19 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and novel compound |
| US11557734B2 (en) | 2020-03-27 | 2023-01-17 | Samsung Display Co., Ltd. | Organic electroluminescence device and polycyclic compound for organic electroluminescence device |
| US11605788B2 (en) | 2019-06-28 | 2023-03-14 | Samsung Display Co., Ltd. | Organic electroluminescence device and polycyclic compound for organic electroluminescence device |
Families Citing this family (259)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102009005290A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| KR20100106014A (ko) * | 2009-03-23 | 2010-10-01 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 포함하고 있는 유기 전계발광 소자 |
| JP5202730B2 (ja) | 2009-04-24 | 2013-06-05 | 出光興産株式会社 | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| KR101120892B1 (ko) * | 2009-06-19 | 2012-02-27 | 주식회사 두산 | 아크리딘 유도체 및 이를 포함하는 유기 전계 발광 소자 |
| DE102009041289A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009048791A1 (de) * | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| CN102471320A (zh) | 2009-10-16 | 2012-05-23 | 出光兴产株式会社 | 含芴芳香族化合物、有机电致发光元件用材料及使用其的有机电致发光元件 |
| DE102010005697A1 (de) * | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010014933A1 (de) * | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| KR20120057561A (ko) | 2010-04-20 | 2012-06-05 | 이데미쓰 고산 가부시키가이샤 | 비스카르바졸 유도체, 유기 일렉트로루미네선스 소자용 재료 및 그것을 사용한 유기 일렉트로루미네선스 소자 |
| WO2011157339A1 (de) | 2010-06-15 | 2011-12-22 | Merck Patent Gmbh | Metallkomplexe |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010027319A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027317A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| KR20120011445A (ko) * | 2010-07-29 | 2012-02-08 | 롬엔드하스전자재료코리아유한회사 | 신규한 유기 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| DE102010045405A1 (de) * | 2010-09-15 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| JP5656534B2 (ja) * | 2010-09-29 | 2015-01-21 | キヤノン株式会社 | インドロ[3,2,1−jk]カルバゾール化合物及びこれを有する有機発光素子 |
| JP2012082344A (ja) * | 2010-10-13 | 2012-04-26 | Sumitomo Chemical Co Ltd | 縮合芳香族化合物、有機半導体材料及び有機トランジスタ |
| KR101305934B1 (ko) * | 2010-11-19 | 2013-09-12 | 한국과학기술연구원 | 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| JP5980796B2 (ja) | 2010-11-24 | 2016-08-31 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子のための材料 |
| JP5669539B2 (ja) | 2010-12-01 | 2015-02-12 | キヤノン株式会社 | キノリノ[3,2,1−kl]フェノキサジン化合物及びこれを用いた有機発光素子 |
| JP5669550B2 (ja) * | 2010-12-10 | 2015-02-12 | キヤノン株式会社 | インドロフェノキサジン化合物及びこれを用いた有機発光素子 |
| DE102011106849A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Verfahren zur Synthese N-N verknüpfter und um die N-N Bindung rotationsgehinderter bis-N-heterocyclische Carbene und deren Einsatz als Liganden für Metallkomplexe |
| EP2694523B1 (de) | 2011-04-04 | 2017-01-11 | Merck Patent GmbH | Metallkomplexe |
| JP6215192B2 (ja) | 2011-04-18 | 2017-10-18 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子用材料 |
| KR101123047B1 (ko) * | 2011-04-29 | 2012-03-16 | 덕산하이메탈(주) | 화합물 및 이를 이용한 유기전기소자, 그 전자장치 |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| DE102012007810A1 (de) | 2011-05-16 | 2012-11-22 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| JP5782836B2 (ja) * | 2011-05-27 | 2015-09-24 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置、照明装置、並びに化合物 |
| US9118022B2 (en) | 2011-06-03 | 2015-08-25 | Merck Patent Gmbh | Organic electroluminescent device |
| US10103340B2 (en) | 2011-06-03 | 2018-10-16 | Merck Patent Gmbh | Metal complexes |
| KR101943676B1 (ko) | 2011-06-28 | 2019-01-29 | 메르크 파텐트 게엠베하 | 금속 착물 |
| EP3439065B1 (de) * | 2011-08-03 | 2022-01-12 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| CN103732602B (zh) | 2011-08-10 | 2017-02-08 | 默克专利有限公司 | 金属络合物 |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2748878B1 (de) | 2011-08-22 | 2020-04-01 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtung |
| BR112014006697A2 (pt) | 2011-09-21 | 2017-03-28 | Merck Patent Gmbh | derivados de carbazol para dispositivos eletroluminescentes orgânicos |
| JP6165746B2 (ja) | 2011-10-20 | 2017-07-19 | メルク パテント ゲーエムベーハー | 有機エレクトロルミッセンス素子のための材料 |
| US9812643B2 (en) | 2011-10-27 | 2017-11-07 | Merck Patent Gmbh | Materials for electronic devices |
| CN104024371B (zh) | 2011-11-01 | 2015-11-25 | 默克专利有限公司 | 有机电致发光器件 |
| WO2013107487A1 (en) | 2012-01-16 | 2013-07-25 | Merck Patent Gmbh | Organic metal complexes |
| JP5981770B2 (ja) | 2012-01-23 | 2016-08-31 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子、有機電界発光素子用電荷輸送材料、並びに、該素子を用いた発光装置、表示装置及び照明装置 |
| KR102015765B1 (ko) | 2012-02-14 | 2019-10-21 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 스피로비플루오렌 화합물 |
| US9386657B2 (en) | 2012-03-15 | 2016-07-05 | Universal Display Corporation | Organic Electroluminescent materials and devices |
| JP5888032B2 (ja) * | 2012-03-16 | 2016-03-16 | 東ソー株式会社 | アリールアミン化合物、その製造法、及びその用途 |
| JP6009817B2 (ja) * | 2012-05-22 | 2016-10-19 | ユー・ディー・シー アイルランド リミテッド | 電荷輸送材料、有機電界発光素子、発光装置、表示装置および照明装置 |
| KR102028204B1 (ko) | 2012-05-24 | 2019-10-02 | 유디씨 아일랜드 리미티드 | 유기 전계 발광 소자, 유기 전계 발광 소자용 전하 수송 재료, 그리고 그 소자를 사용한 발광 장치, 표시 장치 및 조명 장치 |
| KR101586531B1 (ko) * | 2012-05-31 | 2016-01-18 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| EP2872589B1 (de) * | 2012-07-10 | 2017-07-26 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| KR102076481B1 (ko) | 2012-07-13 | 2020-02-12 | 메르크 파텐트 게엠베하 | 금속 착물 |
| WO2014015931A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014017045A1 (ja) * | 2012-07-26 | 2014-01-30 | 保土谷化学工業株式会社 | アクリダン環構造を有する化合物および有機エレクトロルミネッセンス素子 |
| CN104520308B (zh) | 2012-08-07 | 2018-09-28 | 默克专利有限公司 | 金属络合物 |
| JP6271550B2 (ja) | 2012-08-10 | 2018-01-31 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子のための材料 |
| WO2014042163A1 (ja) | 2012-09-12 | 2014-03-20 | 出光興産株式会社 | 新規化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子および電子機器 |
| WO2014044344A1 (de) * | 2012-09-18 | 2014-03-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| WO2014056567A1 (de) | 2012-10-11 | 2014-04-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102012020167A1 (de) | 2012-10-13 | 2014-04-17 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2014067614A1 (de) | 2012-10-31 | 2014-05-08 | Merck Patent Gmbh | Elektronische vorrichtung |
| DE102012021650A1 (de) | 2012-11-03 | 2014-05-08 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| JP2014103212A (ja) | 2012-11-19 | 2014-06-05 | Samsung Display Co Ltd | アクリジン部位及びカルバゾール部位を有するアミン誘導体を含む有機el材料及びそれを用いた有機el素子 |
| CN104756273B (zh) | 2012-11-20 | 2017-10-24 | 默克专利有限公司 | 用于制造电子器件的高纯度溶剂中的制剂 |
| TW201427925A (zh) | 2012-11-26 | 2014-07-16 | 喜星素材股份有限公司 | 多環芳香族化合物及使用其之有機發光裝置 |
| KR101468088B1 (ko) * | 2012-11-28 | 2014-12-05 | 주식회사 엘엠에스 | 신규한 화합물, 이를 포함하는 발광 소자 및 전자 장치 |
| EP2941472B1 (de) | 2013-01-03 | 2018-07-25 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| JP2016506414A (ja) | 2013-01-03 | 2016-03-03 | メルク パテント ゲーエムベーハー | 電子素子のための材料 |
| US9502667B2 (en) * | 2013-01-24 | 2016-11-22 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence |
| KR101503431B1 (ko) | 2013-01-30 | 2015-03-17 | 주식회사 엘엠에스 | 신규한 화합물, 이를 포함하는 발광 소자 및 전자 장치 |
| JP2014196252A (ja) * | 2013-03-29 | 2014-10-16 | 出光興産株式会社 | ヘテロアレーン誘導体、有機エレクトロルミネッセンス素子用材料、及び有機エレクトロルミネッセンス素子 |
| DE102013008189A1 (de) | 2013-05-14 | 2014-12-04 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| JP6223558B2 (ja) * | 2013-06-14 | 2017-11-01 | エルジー・ケム・リミテッド | 有機太陽電池およびその製造方法 |
| CN111848659A (zh) | 2013-10-02 | 2020-10-30 | 默克专利有限公司 | 用于oled中的含硼化合物 |
| KR101993129B1 (ko) | 2013-12-12 | 2019-06-26 | 메르크 파텐트 게엠베하 | 전자 소자용 물질 |
| JP6542228B2 (ja) | 2013-12-19 | 2019-07-10 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 複素環式スピロ化合物 |
| EP2896660A1 (en) * | 2014-01-16 | 2015-07-22 | Ecole Polytechnique Federale De Lausanne (Epfl) | Hole transporting and light absorbing material for solid state solar cells |
| WO2015167300A1 (en) * | 2014-05-02 | 2015-11-05 | Rohm And Haas Electronic Materials Korea Ltd. | Organic electroluminescent compound and organic electroluminescent device comprising the same |
| KR102372950B1 (ko) * | 2014-05-02 | 2022-03-14 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| WO2015169412A1 (de) | 2014-05-05 | 2015-11-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102015006708A1 (de) | 2014-06-12 | 2015-12-17 | Merck Patent Gmbh | Metallkomplexe |
| CN104072529A (zh) * | 2014-07-07 | 2014-10-01 | 太仓博亿化工有限公司 | 一种三芳基-2-硼酸的合成方法 |
| KR102317448B1 (ko) | 2014-07-17 | 2021-10-28 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| DE102014012818A1 (de) | 2014-08-28 | 2016-03-03 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| KR102304723B1 (ko) * | 2014-10-01 | 2021-09-27 | 삼성디스플레이 주식회사 | 화합물 및 이를 포함한 유기 발광 소자 |
| EP3218368B1 (de) | 2014-11-11 | 2020-11-25 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| GB2533268A (en) * | 2014-12-02 | 2016-06-22 | Cambridge Display Tech Ltd | Organic light-emitting device |
| EP3029036A1 (en) * | 2014-12-05 | 2016-06-08 | Solvay SA | Acridine derivatives and their use in organic electronic devices |
| WO2016091353A1 (de) * | 2014-12-12 | 2016-06-16 | Merck Patent Gmbh | Organische verbindungen mit löslichen gruppen |
| JP6732755B2 (ja) * | 2014-12-23 | 2020-07-29 | メルク パテント ゲーエムベーハー | ジベンゾアザピン構造をもつヘテロ環化合物 |
| DE102015108023A1 (de) * | 2015-01-20 | 2016-07-21 | Cynora Gmbh | Organische Moleküle, inbesondere zur Verwendung in optoelektronischen Bauelementen |
| EP3254317B1 (de) | 2015-02-03 | 2019-07-31 | Merck Patent GmbH | Metallkomplexe |
| US20180148428A1 (en) * | 2015-05-29 | 2018-05-31 | Commonwealth Scientific And Industrial Research Organisation | Organic light emitting device with thermally activated delayed fluorescent light emitting material |
| JP6661289B2 (ja) | 2015-07-08 | 2020-03-11 | 三星ディスプレイ株式會社Samsung Display Co.,Ltd. | 有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
| EP3326218B1 (en) | 2015-07-22 | 2021-02-17 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| GB201513037D0 (en) | 2015-07-23 | 2015-09-09 | Merck Patent Gmbh | Phenyl-derived compound for use in organic electronic devices |
| CN107922312B (zh) | 2015-07-29 | 2021-05-25 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP3334708B1 (en) | 2015-08-13 | 2020-08-19 | Merck Patent GmbH | Hexamethylindanes |
| EP3334731B1 (en) | 2015-08-14 | 2021-03-03 | Merck Patent GmbH | Phenoxazine derivatives for organic electroluminescent devices |
| US10211411B2 (en) * | 2015-08-25 | 2019-02-19 | Arizona Board Of Regents On Behalf Of Arizona State University | Thermally activated delayed fluorescent material based on 9,10-dihydro-9,9-dimethylacridine analogues for prolonging device longevity |
| DE102015013381A1 (de) | 2015-10-14 | 2017-04-20 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| CN105348300B (zh) * | 2015-11-10 | 2018-04-10 | 中节能万润股份有限公司 | 一种有机光电材料及其制备方法和用途 |
| JP6593114B2 (ja) * | 2015-11-11 | 2019-10-23 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置及び芳香族複素環誘導体 |
| KR101798597B1 (ko) | 2015-11-16 | 2017-11-17 | 부산대학교 산학협력단 | 신규한 트리페닐아민 유도체 및 이를 포함하는 광기전력 소자 |
| DE102015016016A1 (de) | 2015-12-10 | 2017-06-14 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| US10336772B2 (en) | 2015-12-28 | 2019-07-02 | Samsung Electronics Co., Ltd. | Bicarbazole compound, material for organic light-emitting device including bicarbazole compound, and organic light-emitting device including bicarbazole compound |
| US10135006B2 (en) | 2016-01-04 | 2018-11-20 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US20190040034A1 (en) | 2016-02-05 | 2019-02-07 | Merck Patent Gmbh | Materials for electronic devices |
| KR20240011864A (ko) | 2016-03-03 | 2024-01-26 | 메르크 파텐트 게엠베하 | 유기 전계 발광 장치용 재료 |
| TWI745361B (zh) | 2016-03-17 | 2021-11-11 | 德商麥克專利有限公司 | 具有螺聯茀結構之化合物 |
| KR102636244B1 (ko) * | 2016-03-30 | 2024-02-15 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| CN105801569B (zh) * | 2016-04-14 | 2018-11-23 | 中节能万润股份有限公司 | 一种有机光电材料以及包含该材料的有机电致发光器件 |
| CN109071580B (zh) | 2016-04-29 | 2022-05-24 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP3978477A3 (en) | 2016-06-03 | 2022-06-22 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| KR102696804B1 (ko) * | 2016-06-22 | 2024-08-21 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| JP7039549B2 (ja) | 2016-07-14 | 2022-03-22 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| KR102455107B1 (ko) | 2016-07-25 | 2022-10-14 | 메르크 파텐트 게엠베하 | 트리포달 두자리 부분 리간드를 함유하는 이핵 및 올리고핵 금속 착물 및 전자 소자에서의 이들의 용도 |
| KR102449937B1 (ko) | 2016-07-25 | 2022-09-30 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자에서 방사체로서 사용하기 위한 금속 착물 |
| WO2018041769A1 (de) | 2016-08-30 | 2018-03-08 | Merck Patent Gmbh | Bl- und trinukleare metallkomplexe aufgebaut aus zwei miteinander verknüpften tripodalen hexadentaten liganden zur verwendung in elektrolumineszenzvorrichtungen |
| EP3512841B1 (de) | 2016-09-14 | 2023-04-26 | Merck Patent GmbH | Verbindungen mit spirobifluoren-strukturen |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| JP6999655B2 (ja) | 2016-09-21 | 2022-02-10 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子における発光体として使用するための二核の金属錯体 |
| TWI766884B (zh) | 2016-09-30 | 2022-06-11 | 德商麥克專利有限公司 | 具有二氮雜二苯并呋喃或二氮雜二苯并噻吩結構的化合物、其製法及其用途 |
| US20200028091A1 (en) | 2016-09-30 | 2020-01-23 | Merck Patent Gmbh | Carbazoles with diazadibenzofurane or diazadibenzothiophene structures |
| TWI764942B (zh) | 2016-10-10 | 2022-05-21 | 德商麥克專利有限公司 | 電子裝置 |
| CN109791989B (zh) * | 2016-10-11 | 2022-01-18 | 罗门哈斯电子材料韩国有限公司 | 有机电致发光装置 |
| WO2018069196A1 (de) | 2016-10-12 | 2018-04-19 | Merck Patent Gmbh | Binukleare metallkomplexe sowie elektronische vorrichtungen, insbesondere organische elektrolumineszenzvorrichtungen, enthaltend diese metallkomplexe |
| US11322696B2 (en) | 2016-10-12 | 2022-05-03 | Merck Patent Gmbh | Metal complexes |
| KR102472249B1 (ko) | 2016-10-13 | 2022-11-29 | 메르크 파텐트 게엠베하 | 금속 착물 |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| US20190280220A1 (en) | 2016-10-25 | 2019-09-12 | Merck Patent Gmbh | Metal complexes |
| EP3535240B1 (de) | 2016-11-02 | 2022-11-16 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| US11440925B2 (en) | 2016-11-08 | 2022-09-13 | Merck Patent Gmbh | Compounds for electronic devices |
| US11345687B2 (en) | 2016-11-09 | 2022-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR20180054963A (ko) | 2016-11-14 | 2018-05-25 | 삼성디스플레이 주식회사 | 헤테로환 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| TWI756292B (zh) | 2016-11-14 | 2022-03-01 | 德商麥克專利有限公司 | 具有受體基團與供體基團之化合物 |
| EP3541890B1 (en) | 2016-11-17 | 2020-10-28 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| TW201833118A (zh) | 2016-11-22 | 2018-09-16 | 德商麥克專利有限公司 | 用於電子裝置之材料 |
| TW201829385A (zh) | 2016-11-30 | 2018-08-16 | 德商麥克專利有限公司 | 具有戊內醯胺結構之化合物 |
| TW201831468A (zh) | 2016-12-05 | 2018-09-01 | 德商麥克專利有限公司 | 含氮的雜環化合物 |
| CN106800570B (zh) * | 2016-12-15 | 2018-11-27 | 南京邮电大学 | 基于硅嗪单元的光电功能材料及其制备方法和应用 |
| JP7051868B2 (ja) | 2016-12-22 | 2022-04-11 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 電子素子のための材料 |
| CN110088925A (zh) | 2016-12-22 | 2019-08-02 | 默克专利有限公司 | 包含至少两种有机功能化合物的混合物 |
| CN106800556A (zh) * | 2017-01-13 | 2017-06-06 | 南京信息工程大学 | 一种立体的三苯胺类空穴传输材料的结构、合成及应用 |
| JP2020506912A (ja) | 2017-01-25 | 2020-03-05 | メルク パテント ゲーエムベーハー | カルバゾール誘導体 |
| KR102683465B1 (ko) | 2017-02-02 | 2024-07-09 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| WO2018159662A1 (ja) * | 2017-02-28 | 2018-09-07 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| EP3590141A1 (en) | 2017-03-01 | 2020-01-08 | Merck Patent GmbH | Organic electroluminescent device |
| EP3589624A1 (de) | 2017-03-02 | 2020-01-08 | Merck Patent GmbH | Materialien für organische elektronische vorrichtungen |
| TW201843143A (zh) | 2017-03-13 | 2018-12-16 | 德商麥克專利有限公司 | 含有芳基胺結構之化合物 |
| WO2018166934A1 (de) | 2017-03-15 | 2018-09-20 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US11104628B2 (en) | 2017-03-29 | 2021-08-31 | Merck Patent Gmbh | Aromatic compounds |
| US11649249B2 (en) | 2017-04-25 | 2023-05-16 | Merck Patent Gmbh | Compounds for electronic devices |
| KR20230117645A (ko) | 2017-04-26 | 2023-08-08 | 오티아이 루미오닉스 인크. | 표면의 코팅을 패턴화하는 방법 및 패턴화된 코팅을포함하는 장치 |
| WO2018206526A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Organoboron complexes for organic electroluminescent devices |
| WO2018206537A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Carbazole-based bodipys for organic electroluminescent devices |
| US10615349B2 (en) | 2017-05-19 | 2020-04-07 | Arizona Board Of Regents On Behalf Of Arizona State University | Donor-acceptor type thermally activated delayed fluorescent materials based on imidazo[1,2-F]phenanthridine and analogues |
| US10392387B2 (en) | 2017-05-19 | 2019-08-27 | Arizona Board Of Regents On Behalf Of Arizona State University | Substituted benzo[4,5]imidazo[1,2-a]phenanthro[9,10-c][1,8]naphthyridines, benzo[4,5]imidazo[1,2-a]phenanthro[9,10-c][1,5]naphthyridines and dibenzo[f,h]benzo[4,5]imidazo[2,1-a]pyrazino[2,3-c]isoquinolines as thermally assisted delayed fluorescent materials |
| US11535619B2 (en) | 2017-05-22 | 2022-12-27 | Merck Patent Gmbh | Hexacyclic heteroaromatic compounds for electronic devices |
| JP2018206793A (ja) * | 2017-05-30 | 2018-12-27 | 株式会社カネカ | 正孔輸送性材料、及びこれを含む有機el素子、並びにこれを備える照明器具、及びディスプレイ装置 |
| TW201920343A (zh) | 2017-06-21 | 2019-06-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| EP3642185B1 (en) | 2017-06-23 | 2024-04-03 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| WO2019002198A1 (en) | 2017-06-26 | 2019-01-03 | Merck Patent Gmbh | HOMOGENEOUS MIXTURES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| TWI776926B (zh) | 2017-07-25 | 2022-09-11 | 德商麥克專利有限公司 | 金屬錯合物 |
| EP3658541A1 (en) | 2017-07-28 | 2020-06-03 | Merck Patent GmbH | Spirobifluorene derivatives for use in electronic devices |
| CN111051294B (zh) | 2017-09-08 | 2024-04-19 | 默克专利有限公司 | 用于电子器件的材料 |
| CN107739380A (zh) * | 2017-09-11 | 2018-02-27 | 陕西莱特光电材料股份有限公司 | 一种吖啶衍生物及其制备方法 |
| WO2019052933A1 (de) | 2017-09-12 | 2019-03-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019052939A1 (en) * | 2017-09-12 | 2019-03-21 | Cynora Gmbh | ORGANIC MOLECULES, IN PARTICULAR FOR USE IN OPTOELECTRONIC DEVICES |
| KR102671945B1 (ko) | 2017-10-06 | 2024-06-03 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| CN108675975A (zh) | 2017-10-17 | 2018-10-19 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| JP2021504356A (ja) | 2017-11-23 | 2021-02-15 | メルク パテント ゲーエムベーハー | 電子デバイス用材料 |
| TWI820057B (zh) | 2017-11-24 | 2023-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| TWI838352B (zh) | 2017-11-24 | 2024-04-11 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| EP3724202B1 (de) | 2017-12-13 | 2022-08-17 | Merck Patent GmbH | Metallkomplexe |
| CN111465599A (zh) | 2017-12-15 | 2020-07-28 | 默克专利有限公司 | 用于有机电致发光器件中的取代芳族胺 |
| TW201938562A (zh) | 2017-12-19 | 2019-10-01 | 德商麥克專利有限公司 | 雜環化合物 |
| JP7402800B2 (ja) | 2017-12-20 | 2023-12-21 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | ヘテロ芳香族化合物 |
| CN111655674B (zh) | 2018-01-29 | 2024-01-23 | 出光兴产株式会社 | 化合物和使用该化合物的有机电致发光元件 |
| US11751415B2 (en) | 2018-02-02 | 2023-09-05 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| US20220289778A1 (en) | 2018-02-13 | 2022-09-15 | Merck Patent Gmbh | Metal complexes |
| TWI802656B (zh) | 2018-03-06 | 2023-05-21 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TW201938761A (zh) | 2018-03-06 | 2019-10-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| EP3765444A1 (en) | 2018-03-16 | 2021-01-20 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| TWI828664B (zh) | 2018-03-19 | 2024-01-11 | 愛爾蘭商Udc愛爾蘭責任有限公司 | 金屬錯合物 |
| CN110407710B (zh) * | 2018-04-28 | 2022-05-06 | 香港科技大学深圳研究院 | 一种三苯胺衍生物类的纯有机室温磷光材料及其制备方法 |
| KR102659436B1 (ko) | 2018-06-27 | 2024-04-23 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함하는 유기 발광 소자 |
| US12108659B2 (en) * | 2018-07-19 | 2024-10-01 | Lg Display Co., Ltd. | Organic electroluminescent device |
| KR20210033497A (ko) | 2018-07-20 | 2021-03-26 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| WO2020022381A1 (en) * | 2018-07-25 | 2020-01-30 | Ricoh Company, Ltd. | Electrochromic compound, electrochromic composition, and electrochromic element |
| JP7367363B2 (ja) * | 2018-07-25 | 2023-10-24 | 株式会社リコー | エレクトロクロミック組成物及びエレクトロクロミック素子 |
| TWI823993B (zh) | 2018-08-28 | 2023-12-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TWI837167B (zh) | 2018-08-28 | 2024-04-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| EP3844243B1 (en) | 2018-08-28 | 2022-06-22 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| KR102670447B1 (ko) * | 2018-08-31 | 2024-06-03 | 삼성디스플레이 주식회사 | 유기 발광 소자 및 화합물 |
| CN109761981A (zh) * | 2018-09-07 | 2019-05-17 | 北京拓彩光电科技有限公司 | 具有蒽环和吡啶并吲哚环结构的化合物及含该化合物的有机发光二极管器件 |
| TW202030902A (zh) | 2018-09-12 | 2020-08-16 | 德商麥克專利有限公司 | 電致發光裝置 |
| TWI826522B (zh) | 2018-09-12 | 2023-12-21 | 德商麥克專利有限公司 | 電致發光裝置 |
| US20220048836A1 (en) | 2018-09-12 | 2022-02-17 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN109232419B (zh) * | 2018-09-17 | 2021-01-05 | 宁波卢米蓝新材料有限公司 | 一种9,10-二氢吖啶衍生物及其制备方法和用途 |
| US10593889B1 (en) | 2018-09-26 | 2020-03-17 | Idemitsu Kosan Co., Ltd. | Compound and organic electroluminescence device |
| EP3856717A2 (de) | 2018-09-27 | 2021-08-04 | Merck Patent GmbH | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| KR20210068054A (ko) | 2018-09-27 | 2021-06-08 | 메르크 파텐트 게엠베하 | 유기 전자 디바이스에서 활성 화합물로 사용될 수 있는 화합물 |
| JP2022509407A (ja) | 2018-10-31 | 2022-01-20 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子のための材料 |
| US11917906B2 (en) | 2018-11-05 | 2024-02-27 | Merck Patent Gmbh | Compounds that can be used in an organic electronic device |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| KR102094830B1 (ko) * | 2018-11-30 | 2020-03-30 | 에스에프씨 주식회사 | 다환 방향족 유도체 화합물 및 이를 이용한 유기발광소자 |
| US11985891B2 (en) | 2018-11-30 | 2024-05-14 | Sfc Co., Ltd. | Polycyclic aromatic compounds and organic electroluminescent devices using the same |
| KR102719524B1 (ko) | 2018-12-10 | 2024-10-22 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 및 유기 전계 발광 소자용 다환 화합물 |
| KR20200075193A (ko) | 2018-12-17 | 2020-06-26 | 삼성디스플레이 주식회사 | 축합환 화합물, 이를 포함하는 유기 발광 소자 및 이를 포함하는 표시 장치 |
| KR102714930B1 (ko) * | 2018-12-19 | 2024-10-10 | 삼성디스플레이 주식회사 | 헤테로시클릭 화합물 및 이를 포함한 유기 발광 소자 |
| WO2020148243A1 (en) | 2019-01-16 | 2020-07-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI850329B (zh) | 2019-02-11 | 2024-08-01 | 愛爾蘭商Udc愛爾蘭責任有限公司 | 金屬錯合物 |
| US20220127286A1 (en) | 2019-03-04 | 2022-04-28 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2020178804A1 (en) | 2019-03-07 | 2020-09-10 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| KR102700509B1 (ko) * | 2019-04-10 | 2024-08-30 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| CN113646315A (zh) | 2019-04-11 | 2021-11-12 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR20210151905A (ko) | 2019-04-15 | 2021-12-14 | 메르크 파텐트 게엠베하 | 금속 착물 |
| WO2020212953A1 (en) | 2019-04-18 | 2020-10-22 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating the same |
| US12069938B2 (en) | 2019-05-08 | 2024-08-20 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| CN110028505B (zh) * | 2019-05-28 | 2020-12-22 | 吉林奥来德光电材料股份有限公司 | 有机电致发光化合物及其制备方法和有机电致发光装置 |
| CN110078727B (zh) * | 2019-05-28 | 2021-01-08 | 吉林奥来德光电材料股份有限公司 | 一种有机电致发光化合物及其制法和有机电致发光器件 |
| US11944005B2 (en) * | 2019-07-30 | 2024-03-26 | Samsung Display Co., Ltd. | Organic molecules in particular for use in optoelectronic devices |
| CN110511223B (zh) | 2019-08-13 | 2020-10-13 | 武汉华星光电半导体显示技术有限公司 | 空穴传输材料及其制备方法、有机电致发光器件 |
| EP4031546A1 (en) | 2019-09-16 | 2022-07-27 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| US20220416172A1 (en) | 2019-10-22 | 2022-12-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021089450A1 (en) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN110938074B (zh) * | 2019-11-10 | 2022-08-12 | 天津大学 | 具有可交联基团的平面型三苯胺衍生物及其合成方法 |
| TW202134252A (zh) | 2019-11-12 | 2021-09-16 | 德商麥克專利有限公司 | 有機電致發光裝置用材料 |
| CN112341461B (zh) * | 2019-11-27 | 2022-05-27 | 广东聚华印刷显示技术有限公司 | 有机化合物、聚合物及包含其的有机发光二极管 |
| CN114787173B (zh) | 2019-12-04 | 2024-10-18 | Udc爱尔兰有限公司 | 金属络合物 |
| TW202136181A (zh) | 2019-12-04 | 2021-10-01 | 德商麥克專利有限公司 | 有機電致發光裝置用的材料 |
| EP3876296A1 (en) * | 2020-03-05 | 2021-09-08 | Samsung Electronics Co., Ltd. | Organic light-emitting device |
| KR20210118293A (ko) | 2020-03-19 | 2021-09-30 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 및 유기 전계 발광 소자용 축합환 화합물 |
| EP4126884A1 (en) | 2020-03-23 | 2023-02-08 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| JP6753545B1 (ja) * | 2020-03-23 | 2020-09-09 | 東洋紡株式会社 | 含窒素複素環化合物及びその利用 |
| TW202208594A (zh) | 2020-05-27 | 2022-03-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| KR20210148463A (ko) | 2020-05-28 | 2021-12-08 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 유기 전계 발광 소자용 다환 화합물 |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| WO2022017997A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN111875608B (zh) * | 2020-08-07 | 2021-04-02 | 长春海谱润斯科技股份有限公司 | 一种七元含氮杂环衍生物及其有机电致发光器件 |
| WO2022034046A1 (de) | 2020-08-13 | 2022-02-17 | Merck Patent Gmbh | Metallkomplexe |
| US20230329028A1 (en) | 2020-09-18 | 2023-10-12 | Cynora Gmbh | Organic electroluminescent device |
| CN116113676A (zh) | 2020-09-29 | 2023-05-12 | 默克专利有限公司 | 用于oled中的单核三足六齿铱络合物 |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| CN114133333B (zh) * | 2021-08-06 | 2024-03-19 | 陕西莱特迈思光电材料有限公司 | 含氮化合物、电子元件和电子装置 |
| CN115925691A (zh) * | 2021-09-30 | 2023-04-07 | 广州华睿光电材料有限公司 | 咔唑类化合物、混合物、组合物及有机电子器件 |
| CN114044778B (zh) * | 2021-11-24 | 2023-04-18 | 西安瑞联新材料股份有限公司 | 三(1,2-苯基)二胺衍生物有机光电材料及其应用 |
| CN118303151A (zh) | 2021-11-30 | 2024-07-05 | 默克专利有限公司 | 具有芴结构的化合物 |
| EP4453129A1 (en) | 2021-12-21 | 2024-10-30 | Merck Patent GmbH | Electronic devices |
| WO2023117835A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| EP4311849A1 (en) | 2022-07-27 | 2024-01-31 | UDC Ireland Limited | Metal complexes |
| WO2024105066A1 (en) | 2022-11-17 | 2024-05-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024170605A1 (en) | 2023-02-17 | 2024-08-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006033563A1 (en) * | 2004-09-24 | 2006-03-30 | Lg Chem. Ltd. | Organic light emitting device |
| WO2007031165A2 (de) * | 2005-09-12 | 2007-03-22 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| KR20080049942A (ko) * | 2006-12-01 | 2008-06-05 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05107784A (ja) * | 1991-04-29 | 1993-04-30 | Kao Corp | 電子写真感光体 |
| JPH11339868A (ja) * | 1998-05-29 | 1999-12-10 | Fuji Photo Film Co Ltd | 電荷輸送材料、光電変換素子及び光再生型光電気化学電池 |
| JP4708749B2 (ja) * | 2004-09-14 | 2011-06-22 | 富士フイルム株式会社 | 有機電界発光素子、並びにアゼピン系化合物およびその製造方法 |
| WO2006070185A1 (en) * | 2004-12-29 | 2006-07-06 | Cambridge Display Technology Limited | Rigid amines |
| KR100788254B1 (ko) * | 2005-08-16 | 2007-12-27 | (주)그라쎌 | 녹색 발광 화합물 및 이를 발광재료로서 채용하고 있는발광소자 |
| CN101143830A (zh) * | 2007-01-31 | 2008-03-19 | 清华大学 | 一种有机电致发光材料及其应用 |
| CN101279969B (zh) * | 2007-01-31 | 2011-03-30 | 北京维信诺科技有限公司 | 一种有机电致发光材料及其应用 |
| KR100987822B1 (ko) * | 2007-12-17 | 2010-10-13 | (주)씨에스엘쏠라 | 유기 발광 화합물 및 이를 구비한 유기 발광 소자 |
| JP5483962B2 (ja) * | 2008-09-04 | 2014-05-07 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子 |
-
2008
- 2008-10-31 KR KR1020080107606A patent/KR101506919B1/ko not_active IP Right Cessation
-
2009
- 2009-03-30 EP EP09156604A patent/EP2182040A3/en not_active Withdrawn
- 2009-10-30 JP JP2011534394A patent/JP2012507507A/ja active Pending
- 2009-10-30 WO PCT/KR2009/006350 patent/WO2010050778A1/en active Application Filing
- 2009-10-30 CN CN2009801431149A patent/CN102203212A/zh active Pending
- 2009-10-30 CN CN201410060622.3A patent/CN103864789A/zh active Pending
- 2009-10-30 TW TW098136835A patent/TW201114770A/zh unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006033563A1 (en) * | 2004-09-24 | 2006-03-30 | Lg Chem. Ltd. | Organic light emitting device |
| WO2007031165A2 (de) * | 2005-09-12 | 2007-03-22 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| KR20080049942A (ko) * | 2006-12-01 | 2008-06-05 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20130101726A (ko) * | 2012-03-06 | 2013-09-16 | 덕산하이메탈(주) | 아크리딘 유도체를 포함하는 유기전기소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR101968925B1 (ko) | 2012-03-06 | 2019-04-16 | 덕산네오룩스 주식회사 | 아크리딘 유도체를 포함하는 유기전기소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US10538538B2 (en) | 2017-01-13 | 2020-01-21 | Samsung Display Co., Ltd. | Polycyclic compound and organic electroluminescence device including the same |
| US10658594B2 (en) | 2017-12-06 | 2020-05-19 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and novel compound |
| US10672989B2 (en) | 2017-12-06 | 2020-06-02 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and novel compound |
| WO2019151697A1 (ko) * | 2018-02-01 | 2019-08-08 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US11605788B2 (en) | 2019-06-28 | 2023-03-14 | Samsung Display Co., Ltd. | Organic electroluminescence device and polycyclic compound for organic electroluminescence device |
| US11557734B2 (en) | 2020-03-27 | 2023-01-17 | Samsung Display Co., Ltd. | Organic electroluminescence device and polycyclic compound for organic electroluminescence device |
Also Published As
| Publication number | Publication date |
|---|---|
| CN102203212A (zh) | 2011-09-28 |
| TW201114770A (en) | 2011-05-01 |
| EP2182040A3 (en) | 2011-06-22 |
| KR20100048447A (ko) | 2010-05-11 |
| EP2182040A2 (en) | 2010-05-05 |
| JP2012507507A (ja) | 2012-03-29 |
| WO2010050778A1 (en) | 2010-05-06 |
| CN103864789A (zh) | 2014-06-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101506919B1 (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 | |
| KR101495547B1 (ko) | 신규한 전자 재료용 화합물 및 이를 포함하는 유기 전자소자 | |
| KR101561479B1 (ko) | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 발광소자 | |
| JP5690276B2 (ja) | 新規な電界発光用有機金属化合物及びこれを発光材料として用いた電界発光素子 | |
| KR101477613B1 (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 | |
| KR101551207B1 (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 | |
| JP5727376B2 (ja) | 新規な有機発光化合物及びこれを含む有機発光素子 | |
| KR101427605B1 (ko) | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 전계발광 소자 | |
| EP2145936A2 (en) | Fluorene and pyrene derivatives and organic electroluminescent device using the same | |
| EP2281863A2 (en) | Fluorene-derivatives and organic electroluminescent device using the same | |
| CN101550085B (zh) | 新颖的有机电致发光化合物和使用该化合物的有机电致发光器件 | |
| KR101546215B1 (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 | |
| KR20110112098A (ko) | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 전계 발광 소자 | |
| KR20110015836A (ko) | 신규한 유기 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20120009761A (ko) | 신규한 유기 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| CN101805266A (zh) | 新颖的有机电致发光化合物和使用该化合物的有机电致发光器件 | |
| KR20120011445A (ko) | 신규한 유기 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20100109293A (ko) | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 전계발광 소자 | |
| KR20110132721A (ko) | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 전계 발광 소자 | |
| KR20090098585A (ko) | 유기발광화합물을 발광재료로서 채용하고 있는유기전기발광소자 | |
| KR20110113297A (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20090105495A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 전기 발광 소자 | |
| KR20120020901A (ko) | 신규한 유기 전자재료용 화합물 및 이를 채용하고 있는 유기 전계 발광 소자 | |
| KR20120033017A (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20120038056A (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전계 발광 소자 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| AMND | Amendment | ||
| A302 | Request for accelerated examination | ||
| E902 | Notification of reason for refusal | ||
| A107 | Divisional application of patent | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| B701 | Decision to grant | ||
| LAPS | Lapse due to unpaid annual fee |