JP6195817B2 - Method and system for clipping intravascular and repairing intracavitary and tissue defects - Google Patents
Method and system for clipping intravascular and repairing intracavitary and tissue defects Download PDFInfo
- Publication number
- JP6195817B2 JP6195817B2 JP2014234876A JP2014234876A JP6195817B2 JP 6195817 B2 JP6195817 B2 JP 6195817B2 JP 2014234876 A JP2014234876 A JP 2014234876A JP 2014234876 A JP2014234876 A JP 2014234876A JP 6195817 B2 JP6195817 B2 JP 6195817B2
- Authority
- JP
- Japan
- Prior art keywords
- occlusion
- anchor
- implantable device
- aneurysm
- shape
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 230000007547 defect Effects 0.000 title claims description 59
- 238000000034 method Methods 0.000 title description 57
- 210000004204 blood vessel Anatomy 0.000 claims description 57
- 239000000463 material Substances 0.000 claims description 57
- 239000012528 membrane Substances 0.000 claims description 30
- 230000003014 reinforcing effect Effects 0.000 claims description 18
- 230000002093 peripheral effect Effects 0.000 claims description 7
- 230000002787 reinforcement Effects 0.000 claims description 6
- 230000001131 transforming effect Effects 0.000 claims 2
- 206010002329 Aneurysm Diseases 0.000 description 135
- 210000001519 tissue Anatomy 0.000 description 35
- 230000008439 repair process Effects 0.000 description 32
- 239000000126 substance Substances 0.000 description 32
- 229910001000 nickel titanium Inorganic materials 0.000 description 25
- HLXZNVUGXRDIFK-UHFFFAOYSA-N nickel titanium Chemical compound [Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni] HLXZNVUGXRDIFK-UHFFFAOYSA-N 0.000 description 24
- 229910045601 alloy Inorganic materials 0.000 description 23
- 239000000956 alloy Substances 0.000 description 23
- 239000010409 thin film Substances 0.000 description 22
- 239000003550 marker Substances 0.000 description 14
- 230000007246 mechanism Effects 0.000 description 12
- 230000002792 vascular Effects 0.000 description 12
- 230000003073 embolic effect Effects 0.000 description 11
- -1 polytetrafluoroethylene copolymer Polymers 0.000 description 11
- 230000004913 activation Effects 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 9
- 238000009434 installation Methods 0.000 description 9
- 229910001285 shape-memory alloy Inorganic materials 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 8
- 229910052804 chromium Inorganic materials 0.000 description 8
- 239000011651 chromium Substances 0.000 description 8
- 230000001788 irregular Effects 0.000 description 8
- 229920000642 polymer Polymers 0.000 description 8
- 230000017531 blood circulation Effects 0.000 description 7
- 238000000576 coating method Methods 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 208000005189 Embolism Diseases 0.000 description 4
- 239000000853 adhesive Substances 0.000 description 4
- 230000001070 adhesive effect Effects 0.000 description 4
- 239000000560 biocompatible material Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 230000010261 cell growth Effects 0.000 description 4
- 239000011248 coating agent Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 229920001577 copolymer Polymers 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 230000003511 endothelial effect Effects 0.000 description 4
- 208000025339 heart septal defect Diseases 0.000 description 4
- 229910052751 metal Inorganic materials 0.000 description 4
- 239000002184 metal Substances 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 238000004544 sputter deposition Methods 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 238000003466 welding Methods 0.000 description 4
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 3
- 206010053648 Vascular occlusion Diseases 0.000 description 3
- 229920000249 biocompatible polymer Polymers 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 238000005530 etching Methods 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 208000014674 injury Diseases 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000007769 metal material Substances 0.000 description 3
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 3
- 239000004810 polytetrafluoroethylene Substances 0.000 description 3
- 239000004814 polyurethane Substances 0.000 description 3
- 229920002635 polyurethane Polymers 0.000 description 3
- 239000011148 porous material Substances 0.000 description 3
- 239000010703 silicon Substances 0.000 description 3
- 229910052710 silicon Inorganic materials 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- GUVRBAGPIYLISA-UHFFFAOYSA-N tantalum atom Chemical compound [Ta] GUVRBAGPIYLISA-UHFFFAOYSA-N 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 230000008733 trauma Effects 0.000 description 3
- 230000007556 vascular defect Effects 0.000 description 3
- 208000021331 vascular occlusion disease Diseases 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- 101100269850 Caenorhabditis elegans mask-1 gene Proteins 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- 229920004934 Dacron® Polymers 0.000 description 2
- 208000032843 Hemorrhage Diseases 0.000 description 2
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 150000008065 acid anhydrides Chemical class 0.000 description 2
- 210000001367 artery Anatomy 0.000 description 2
- 229910052788 barium Inorganic materials 0.000 description 2
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 2
- 208000034158 bleeding Diseases 0.000 description 2
- 230000000740 bleeding effect Effects 0.000 description 2
- 210000001124 body fluid Anatomy 0.000 description 2
- 239000010839 body fluid Substances 0.000 description 2
- 229920002678 cellulose Chemical class 0.000 description 2
- 239000001913 cellulose Chemical class 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 230000010102 embolization Effects 0.000 description 2
- 210000003038 endothelium Anatomy 0.000 description 2
- 229920000295 expanded polytetrafluoroethylene Polymers 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000003292 glue Substances 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 229910052737 gold Inorganic materials 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 229920000669 heparin Polymers 0.000 description 2
- 229960002897 heparin Drugs 0.000 description 2
- 239000000017 hydrogel Substances 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000001453 nonthrombogenic effect Effects 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 239000005014 poly(hydroxyalkanoate) Substances 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 229920002627 poly(phosphazenes) Polymers 0.000 description 2
- 229920001281 polyalkylene Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920000903 polyhydroxyalkanoate Polymers 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 239000012781 shape memory material Substances 0.000 description 2
- 239000002210 silicon-based material Substances 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 210000003625 skull Anatomy 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- 229910052715 tantalum Inorganic materials 0.000 description 2
- 229920001897 terpolymer Polymers 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000000472 traumatic effect Effects 0.000 description 2
- YFHICDDUDORKJB-UHFFFAOYSA-N trimethylene carbonate Chemical compound O=C1OCCCO1 YFHICDDUDORKJB-UHFFFAOYSA-N 0.000 description 2
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 2
- 229910052721 tungsten Inorganic materials 0.000 description 2
- 239000010937 tungsten Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 229920008347 Cellulose acetate propionate Polymers 0.000 description 1
- 206010008111 Cerebral haemorrhage Diseases 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 229920002567 Chondroitin Polymers 0.000 description 1
- 208000032170 Congenital Abnormalities Diseases 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 1
- 229920000544 Gore-Tex Polymers 0.000 description 1
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- MWCLLHOVUTZFKS-UHFFFAOYSA-N Methyl cyanoacrylate Chemical compound COC(=O)C(=C)C#N MWCLLHOVUTZFKS-UHFFFAOYSA-N 0.000 description 1
- 229920001410 Microfiber Polymers 0.000 description 1
- 229910000990 Ni alloy Inorganic materials 0.000 description 1
- 229920002201 Oxidized cellulose Polymers 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 102000001938 Plasminogen Activators Human genes 0.000 description 1
- 108010001014 Plasminogen Activators Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 208000009443 Vascular Malformations Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- HZEWFHLRYVTOIW-UHFFFAOYSA-N [Ti].[Ni] Chemical compound [Ti].[Ni] HZEWFHLRYVTOIW-UHFFFAOYSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 210000003484 anatomy Anatomy 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 210000005013 brain tissue Anatomy 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical class C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- DLGJWSVWTWEWBJ-HGGSSLSASA-N chondroitin Chemical compound CC(O)=N[C@@H]1[C@H](O)O[C@H](CO)[C@H](O)[C@@H]1OC1[C@H](O)[C@H](O)C=C(C(O)=O)O1 DLGJWSVWTWEWBJ-HGGSSLSASA-N 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 238000003618 dip coating Methods 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 210000004177 elastic tissue Anatomy 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000010291 electrical method Methods 0.000 description 1
- 238000005868 electrolysis reaction Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 210000001105 femoral artery Anatomy 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000002657 fibrous material Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- XUCNUKMRBVNAPB-UHFFFAOYSA-N fluoroethene Chemical compound FC=C XUCNUKMRBVNAPB-UHFFFAOYSA-N 0.000 description 1
- 229920002313 fluoropolymer Polymers 0.000 description 1
- 239000004811 fluoropolymer Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 150000001261 hydroxy acids Chemical class 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000007373 indentation Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 208000020658 intracerebral hemorrhage Diseases 0.000 description 1
- 238000012977 invasive surgical procedure Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 239000002923 metal particle Substances 0.000 description 1
- 239000003658 microfiber Substances 0.000 description 1
- 238000002324 minimally invasive surgery Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 239000004745 nonwoven fabric Substances 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 210000003101 oviduct Anatomy 0.000 description 1
- 229940107304 oxidized cellulose Drugs 0.000 description 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 229940127126 plasminogen activator Drugs 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920002463 poly(p-dioxanone) polymer Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920002239 polyacrylonitrile Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 239000004632 polycaprolactone Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920002721 polycyanoacrylate Polymers 0.000 description 1
- 239000000622 polydioxanone Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920006149 polyester-amide block copolymer Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920001855 polyketal Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 239000002861 polymer material Substances 0.000 description 1
- 239000002952 polymeric resin Substances 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920006324 polyoxymethylene Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000000541 pulsatile effect Effects 0.000 description 1
- 239000012857 radioactive material Substances 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 150000003377 silicon compounds Chemical class 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000007711 solidification Methods 0.000 description 1
- 230000008023 solidification Effects 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000004381 surface treatment Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 229910002070 thin film alloy Inorganic materials 0.000 description 1
- 230000002885 thrombogenetic effect Effects 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000008467 tissue growth Effects 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000007723 transport mechanism Effects 0.000 description 1
- 230000006496 vascular abnormality Effects 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
- 239000002759 woven fabric Substances 0.000 description 1
Images
Landscapes
- Surgical Instruments (AREA)
- Prostheses (AREA)
- Materials For Medical Uses (AREA)
Description
本発明は、低侵襲技術を用いて、哺乳類の血管やガス流路などの内腔内の欠陥を治療する一般的なシステムおよび方法に関する。より詳細には、 動脈瘤や血管不整、中隔欠損およびその他組織欠損、流路不整などの人間および動物の生態構造体における欠損を、低侵襲技術を用いて、閉塞、クリッピングし、治療するシステムおよび方法に関する。 The present invention relates to general systems and methods for treating defects in lumens such as mammalian blood vessels and gas flow paths using minimally invasive techniques. More specifically, a system that uses minimally invasive techniques to occlude, clip, and treat defects in human and animal ecosystems such as aneurysms, vascular irregularities, septal defects and other tissue defects, and flow path irregularities. And methods.
血管や中隔欠損、その他の生理学的欠陥など、身体の内腔や組織を修復したり開口部を閉じるための外科手術の手技は、高い侵襲性を有する。例えば、動脈瘤をクリップで挟むという外科手術の手技では、頭蓋を開頭し、上層を被覆する脳組織を切開ないしは除去し、動脈瘤にクリップをかけることにより血管の修復を行い、脳組織を元に戻して頭蓋を閉頭する。中隔欠損症に用いられる外科手術手技も侵襲性が高い。この種の治療の術中もしくは術後における麻酔、出血、感染等のリスクは高く、手術を施された組織は機能不全に陥ることもある。 Surgical procedures for repairing body lumens and tissues and closing openings, such as blood vessels, septal defects, and other physiological defects, are highly invasive. For example, in a surgical procedure in which an aneurysm is sandwiched between clips, the skull is opened, the brain tissue covering the upper layer is incised or removed, and the aneurysm is clipped to repair the blood vessel. Return to and close the skull. Surgical techniques used for septal defects are also highly invasive. The risk of anesthesia, bleeding, infection, etc. during or after this type of treatment is high, and the tissue that has undergone surgery may become dysfunctional.
低侵襲性の手技として、血管、脊柱、卵管、胆管、気管支気道などの体内開口部や体内管腔部に閉塞装置を設置する手技が代替的に用いられている。一般的に、植え込み型装置は、搬送カテーテルによって所望の場所に誘導され、プッシャーや搬送ワイヤなどの押出機構によって搬送カテーテルの遠位端開口から押し出されて、治療対象部に配置される。閉塞装置が設置された後、押出機構は閉塞装置や周辺組織に損傷を与えることなく抜き取られる。 As a minimally invasive technique, a technique of installing an occluding device in a body opening such as a blood vessel, a spinal column, a fallopian tube, a bile duct, or a bronchial airway, or a body lumen is used instead. In general, the implantable device is guided to a desired place by a delivery catheter, and is pushed out from the distal end opening of the delivery catheter by an extrusion mechanism such as a pusher or a delivery wire, and is placed on a treatment target part. After the occlusion device is installed, the pusher mechanism is withdrawn without damaging the occlusion device or surrounding tissue.
動脈瘤とは、動脈に発生する隆起部分のことであり、一般的に動脈壁の弱体化により生じるとされ、開口や内腔を形成し、しばし脳内出血や脳卒中を起こす部位となる。低侵襲治療の目的は、内腔内にまとめられる物質が血管へ入り込まず、かつ血流が瘤内に入り込まないようにすることにある。このために様々な種類の物質や装置が用いられている。 An aneurysm is a raised portion that occurs in an artery and is generally caused by weakening of the arterial wall, forms an opening or lumen, and is a site that often causes intracerebral hemorrhage or stroke. The purpose of the minimally invasive treatment is to prevent substances collected in the lumen from entering the blood vessels and blood flow from entering the aneurysm. For this purpose, various kinds of substances and devices are used.
各種の塞栓物質や装置により、動脈瘤に関する患者へのリスクが低減されている。塞栓物質の種類の1つに、微小繊維コラーゲン、高分子ビーズ、発泡性ポリビニルアルコールなどの注入流体や緩和剤がある。これら高分子物質は血管内での物質の持続性と関連している。これらの物質はカテーテルを通して血管内に注入される。短期間で優れた閉塞を発揮する物質もあるが、たいていは血液中に吸収されて再疎通を許してしまう。他にも、ホッグ・ヘアーや金属粒子によるサスペンションが動脈瘤の閉塞を促進させるものとして提案され使用されている。シアノアクリレートなどの高分子樹脂も血管閉塞用の注入物質として採用されている。これらの樹脂は、放射線不透過物質と混合して用いられるか、タンタル粉を添加して放射線不透過とするのが通常である。これらの物質はひとたび血管内に設置した後に回収することは、困難もしくは不可能である。 Various embolic materials and devices reduce the risk to the patient regarding aneurysms. One type of embolic material includes injection fluids and relaxation agents such as microfiber collagen, polymer beads, and expandable polyvinyl alcohol. These polymeric substances are associated with the persistence of the substance in blood vessels. These substances are injected into the blood vessel through the catheter. Some substances exhibit excellent occlusion in a short period of time, but are usually absorbed into the blood and allow recanalization. In addition, suspensions using hog hair or metal particles have been proposed and used to promote aneurysm occlusion. Polymer resins such as cyanoacrylate are also employed as injecting substances for vascular occlusion. These resins are usually used by mixing with a radiopaque substance, or added with tantalum powder to make it radiopaque. These materials are difficult or impossible to retrieve once they have been placed in a blood vessel.
植え込み型の血管塞栓用金属組織も広く知られており、使用されている。多くの血管塞栓具は、ヘリカル状コイルや形状記憶金属からなるものであり、搬送カテーテルの遠位端から排出されて所望の形状に形成される。コイルは、欠陥により形成された空間を充填し、塞栓の形成を促進することを目的としている。同一ないし異なる種類の複数個のコイルをひとつの動脈瘤内に連続的に移植することもできる。動脈瘤の壁を安定させるために、コイルなどの塞栓物質を挿入する前に骨格構造体物を移植することもできる。 Implantable metal vessels for vascular embolization are also widely known and used. Many vascular embolic devices are made of a helical coil or shape memory metal, and are discharged from the distal end of the delivery catheter to form a desired shape. The coil is intended to fill the space formed by the defect and promote the formation of an embolus. A plurality of coils of the same or different types can be continuously implanted in one aneurysm. To stabilize the wall of the aneurysm, the skeletal structure can also be implanted before inserting an embolic material such as a coil.
血管塞栓具を目的部位まで搬送するにあたっては、一般的に搬送カテーテルと目的部位にコイルを設置した後に搬送カテーテルからコイルを離脱させる離脱機構とを使用する。まず最初に、マイクロカテーテルが搬送カテーテルを通じて動脈瘤の入口付近へ誘導される。通常はガイドワイヤを用いて行われる。ガイドワイヤやマイクロカテーテルから引き抜かれて、植え込み型の血管内閉塞コイルが留置される。血管内閉塞コイルは、マイクロカテーテル内を進出し、マイクロカテーテルから排出されて動脈瘤や血管奇形部に配置される。血管塞栓具の移植とメンテナンスは極めて重要である。血管塞栓具の移動や挿入は血流や生体構造体に左右され、深刻な健康上のリスクをもたらす。 In transporting the vascular embolus device to the target site, generally, a transport catheter and a detachment mechanism for detaching the coil from the transport catheter after installing the coil at the target site are used. First, a microcatheter is guided through the delivery catheter to the vicinity of the aneurysm entrance. Usually, a guide wire is used. Withdrawn from the guide wire or microcatheter, an implantable intravascular occlusion coil is placed. The intravascular occlusion coil advances through the microcatheter, is discharged from the microcatheter, and is placed in the aneurysm or vascular deformity. Transplantation and maintenance of vascular embolic devices is extremely important. The movement and insertion of vascular embolizers depends on blood flow and anatomy and poses serious health risks.
「ワイドネック型動脈瘤」として知られている動脈瘤のタイプのひとつは、血管内閉塞コイルの配置と保持が難しいとされている。ワイドネック型動脈瘤とは、一般的に 動脈瘤の直径と比較してそれよりも広い頸部またはエントラスゾーンを有する血管壁からなる動脈瘤のことをいい、血管内閉塞コイルを上述の方法によって配置することは困難であることが臨床上確認されている。 One type of aneurysm known as a “wide neck aneurysm” is said to be difficult to place and hold an intravascular occlusion coil. A wide neck aneurysm is generally an aneurysm consisting of a vascular wall having a neck or entropy zone wider than the diameter of the aneurysm. It has been clinically confirmed that it is difficult to place.
コイルや他の塞栓物質を動脈瘤の腔内に配置することは十分には成功していない。配置処置には、コイルなどの複数の塞栓具を血管腔内に連続的に設置する必要があり、困難と時間を伴う。長時間にわたる処置は、動脈瘤から合併症や出血、感染症などを生じさせるリスクが高くなる。さらに、動脈瘤内の空間に物質を配置しても、開口部が完全にふさがれることは一般的になく、再疎通が生じやすく、閉塞物質が動脈瘤内から流出して脳梗塞、血管閉塞、その他の合併症が生じるリスクがある。塞栓物質が流出した後は、血液も動脈瘤内や血管奇形部へ流れ込み、合併症や動脈瘤のさらなる拡張化もたらすリスクが増大する。さらに、従来のコイルや塞栓具がうまく適合しない動脈瘤や欠損も存在する。 Placing coils and other embolic materials within the aneurysm cavity has not been successful enough. The placement procedure requires continuous installation of a plurality of embolic devices such as coils in the blood vessel cavity, which is difficult and time consuming. Long-term treatment increases the risk of complications, bleeding, infections, etc. from the aneurysm. Furthermore, even if a substance is placed in the space within the aneurysm, the opening is generally not completely blocked, and recanalization is likely to occur. There is a risk of other complications. After the embolic material has flowed out, the blood also flows into the aneurysm and into the vascular malformation, increasing the risk of complications and further expansion of the aneurysm. In addition, there are aneurysms and defects where conventional coils and embolic devices do not fit well.
動脈瘤内に血管閉塞コイルを保持するデバイスが提案されている。かかるデバイスのひとつは、米国特許第5980514号明細書に開示されている。このデバイスは、動脈瘤の栄養血管内腔に設置され、コイルを動脈瘤内に保持する。血管壁に作用する高圧力によってデバイスは固定される。デバイスを適当な場所に設置した後、保持デバイス後方からマイクロカテーテルが挿入され、血管閉塞具を配置すべくカテーテルの遠位端が血管腔内に挿入される。この保持デバイスが血管腔内からの閉塞装置の移動を防止する。 Devices have been proposed to hold a vaso-occlusive coil within an aneurysm. One such device is disclosed in US Pat. No. 5,980,514. This device is placed in the feeding vessel lumen of the aneurysm and holds the coil within the aneurysm. The device is fixed by the high pressure acting on the vessel wall. After placing the device in place, the microcatheter is inserted from behind the holding device and the distal end of the catheter is inserted into the vessel lumen to place the vascular obturator. This holding device prevents movement of the occlusion device from within the vessel lumen.
動脈瘤を閉塞する他の方法として、米国特許5749894号明細書に開示された血管閉塞装置がある。この装置は、コイルやひもからなり、凝固により障壁を形成する高分子組成からなる外表面を有している。高分子化合物は光の照射により活性化し、溶け、血管閉塞装置の外側に高分子表面を形成する。該装置はさまざまな部位にくっつき、動脈瘤内に堅固な塊を形成する。 Another method for occluding an aneurysm is the vascular occlusion device disclosed in US Pat. No. 5,749,894. This device consists of a coil or string and has an outer surface made of a polymer composition that forms a barrier upon solidification. The polymer compound is activated by light irradiation, melts, and forms a polymer surface outside the vascular occlusion device. The device sticks to various sites and forms a solid mass within the aneurysm.
動脈瘤の頸部に掛け渡される装置も提案されている。例えば、米国出願2003/0171739 A1には、分岐部に取り付けられた複数のアレイ素子と該アレイ素子や分岐部に取り付けられたカバーとを有するネックブリッジが開示されている。アレイ素子はニトノール合金を採用することができ、カバーには、繊維、メッシュ、その他シート状構造体物を採用することができる。 Devices that span the neck of an aneurysm have also been proposed. For example, US application 2003/0171739 A1 discloses a neck bridge having a plurality of array elements attached to a branch and a cover attached to the array element or the branch. Nitonol alloy can be used for the array element, and fibers, meshes, and other sheet-like structures can be used for the cover.
米国特許出願2004/008799号には、2枚のシートもしくは1枚のシートと1本の支柱構造体により欠陥閉塞具を固定し、開口を閉塞するための装置、および血管閉塞方法が開示されている。本公報は、密着や線維化、組織増殖や内皮増殖を促進するのに用いられる数多くの生体適合材料や物質が列挙されている。 US Patent Application No. 2004/008799 discloses a device for fixing a defect obturator with two sheets or one sheet and one strut structure to close the opening, and a blood vessel occlusion method. Yes. This publication lists a number of biocompatible materials and substances used to promote adhesion, fibrosis, tissue growth and endothelial growth.
米国特許出願2004/0193296号には、少なくとも動脈瘤の一部を閉塞するための装置が開示されており、この装置は、互いに移動して搬送部と配置部との間にブリッジを形成する複数の細長い部材を含んでいる。第1のアレイは動脈瘤内部に配置され、第2のアレイが動脈瘤の外側に配置される2つのアレイブリッジも開示されている。 U.S. Patent Application No. 2004/0193296 discloses a device for occluding at least a portion of an aneurysm, wherein the device moves relative to each other to form a bridge between the delivery portion and the placement portion. The elongate member. Two array bridges are also disclosed in which the first array is placed inside the aneurysm and the second array is placed outside the aneurysm.
中隔欠損を閉塞する装置も広く知られている。かかる装置は、心臓や血管系の内腔や欠損を閉塞する。例えば、米国特許第6077291号明細書や米国特許第6911037号明細書に中隔閉塞装置が開示されている。気管支の内腔をシールする、もしくは一部をシールする気管支血流調整装置も知られており、例えば米国特許第7011094号明細書を参照されたい。 Devices for occluding septal defects are also well known. Such devices occlude lumens and defects in the heart and vascular system. For example, US Pat. No. 6,077,291 and US Pat. No. 6,911,037 disclose septal occlusion devices. Bronchial blood flow regulating devices that seal the bronchial lumen or seal a portion are also known, see for example US Pat. No. 7,011,094.
植え込み型デバイスを配置の後に離脱するために現在用いられている手段には、機械的手法、電気的手法、水圧を用いた手法がある。機械的手法のものは、閉塞装置とプッシュワイヤが機械的接続具ないしは内部ロックにより結合されており、ひとたび離脱されると、装置がカテーテルから排出される。かかる装置の例は、米国特許第5263964号、第5304195号、第5350397号および第5261916号に開示されている。 Currently used means to disengage the implantable device after placement include mechanical techniques, electrical techniques, and hydraulic techniques. In the mechanical approach, the occlusion device and pushwire are coupled by a mechanical connector or internal lock, and once removed, the device is ejected from the catheter. Examples of such devices are disclosed in US Pat. Nos. 5,263,964, 5,304,195, 5,350,397 and 5,261,916.
電気的手法のものは、繊維や接着剤により構成される結合状態がプッシャーワイヤと閉塞装置を連結させている。装置が所望の場所に配置された後に、前記結合を電流や熱(例えばレーザーを用いて)によって術者が電気的に分解する。このような装置の例は米国特許第5624449号明細書に開示されている。かかる装置は、電気分解により発生した物質が動脈瘤内に放出され、患者に潜在的な危険を与えるという欠点を有している。電気的離脱は、閉塞装置を配置させる作業に時間がかかる。 In the electrical method, the pusher wire and the closing device are connected to each other in a bonded state constituted by fibers and an adhesive. After the device is placed in the desired location, the bond is electrolyzed by the operator with current or heat (eg, using a laser). An example of such a device is disclosed in US Pat. No. 5,624,449. Such devices have the disadvantage that the material generated by electrolysis is released into the aneurysm, posing a potential risk to the patient. Electrical detachment takes time to place the occlusion device.
水圧を用いた手法のものは、プッシュワイヤがカップリング重合により閉塞装置と連結されている。プッシュワイヤは、術者がワイヤの近位端から水圧注射を接続するためのマイクロルーメンを有している。注射部に圧力が掛けられると、水圧が上がり、カップリング重合部が破壊され、装置が離脱される。かかる装置の例は、米国特許第6689141号明細書に開示されている。 In the method using water pressure, the push wire is connected to the occlusion device by coupling polymerization. The push wire has a micro lumen for the operator to connect a hydraulic injection from the proximal end of the wire. When pressure is applied to the injection part, the water pressure increases, the coupling polymerization part is destroyed, and the device is detached. An example of such a device is disclosed in US Pat. No. 6,689,141.
低侵襲性の技術を用いた欠損のさまざまな閉塞装置や方法が知られているが、これらの手法は依然として危険を伴い、例え開口を閉塞するのに成功しても、生理的構造体、通常の健康状態に修復されることはほとんどない。本発明における方法およびシステムは、開口の閉塞、組織欠損の治療、血管等生理的構造体の修復、通常の健康状態への修復を行う低侵襲性処置の長さ、煩雑性を低減するものである。 Although various occlusion devices and methods for defects using known minimally invasive techniques are known, these techniques are still dangerous and, even if they successfully occlude the opening, physiological structures, usually There is little to be restored to the health status of. The method and system of the present invention reduce the length and complexity of minimally invasive procedures for obstructing openings, treating tissue defects, repairing physiological structures such as blood vessels, and restoring normal health. is there.
本発明は内腔の開口部または腔内を低侵襲性の技術を用いることにより修復する方法およびシステムに関する。一般的に、これらのシステムおよび方法は、開口部や腔内のような血管異常に関して使用されるものであり、本明細書においては動脈瘤やその他血管欠損への適用に関して開示している。しかしながら、本発明に係るシステムおよび方法は、これらへの適用に限られるものではなく、所望の開口部や腔内や組織を修復し復元すべく様々な形態での医学的適用が可能であることは当然である。 The present invention relates to methods and systems for repairing lumen openings or cavities by using minimally invasive techniques. Generally, these systems and methods are used for vascular abnormalities such as openings and intracavities, and are disclosed herein for application to aneurysms and other vascular defects. However, the system and method according to the present invention are not limited to these applications, and can be applied in various forms to repair and restore desired openings, cavities, and tissues. Is natural.
実施態様の一つとして、本発明に係る方法およびシステムは、閉塞構造体を開口部や腔内に渡って配置し、開口部や腔内に、動脈瘤のような開口部や腔内を切り取り、親動脈から除去する手段として作用する1つ以上のアンカー構造体を使用して閉塞構造体を開口部に保持することにより、血管などの内腔を修復および復元する。配置した後、閉塞構造体は前記開口部や腔内を覆って、健康時の内腔壁とほとんど同じ連続した内腔壁を形成する。アンカー構造体も閉塞構造体も内腔内の血流を妨げることはない。本処置を行っている最中もしくは行った後に、内皮や組織の成長を促進させる物質や、接着剤、治療薬、非血栓形成物質など、さまざまな物質を修復部に提供することができる。 As one embodiment, the method and system according to the present invention includes disposing an occluding structure over an opening or a cavity, and cutting the opening or cavity such as an aneurysm into the opening or cavity. The lumen, such as a blood vessel, is repaired and restored by holding the occlusion structure in the opening using one or more anchor structures that act as a means for removal from the parent artery. After placement, the occlusion structure covers the opening and the cavity to form a continuous lumen wall that is almost the same as the healthy lumen wall. Neither the anchor structure nor the occlusion structure will interfere with blood flow within the lumen. Various substances such as substances that promote the growth of endothelium and tissues, adhesives, therapeutic agents, and non-thrombogenic substances can be provided to the repair site during or after the treatment.
別の実施態様として、本発明に係る方法およびシステムは、開口部をまたぐ欠損の細胞伝達を制限する閉塞構造体を配置し、前記閉塞構造体を1つ以上のアンカー構造体を使用して前記開口部に保持することにより動脈瘤などの欠損を除去する。本発明に係る方法およびシステムは、欠損もしくはその一部を縮小し再吸収させることをさらに促進し、欠損内部の止血を促進する。また本発明における動脈瘤を治療するための方法およびシステムは、欠損部周囲の血管の構造体や機能を回復させるのみならず、動脈瘤内部の物質を安定させ、血流内に破片が入ることを防ぎ、動脈瘤の大きさおよび質量の軽減を促進する。 In another embodiment, the method and system according to the present invention includes placing an occlusion structure that restricts cell transmission of a defect across an opening, said occlusion structure using one or more anchor structures. Defects such as aneurysms are removed by holding in the opening. The method and system according to the present invention further promotes the reduction or reabsorption of a defect or part thereof and promotes hemostasis within the defect. In addition, the method and system for treating an aneurysm according to the present invention not only restores the structure and function of blood vessels around the defect, but also stabilizes the substance inside the aneurysm and allows debris to enter the bloodstream. Prevent the aneurysm size and mass.
内腔内や血管内での処置は、さまざまな種類の医療行為に用いられる植え込み型デバイスや材料の設置に共通して使用される。血管内ガイドカテーテルは患者の血管内に大腿動脈を通じて挿入され、血管内を通って、所望の治療部へ到達する。さらなる搬送機構や特別なカテーテル、マイクロカテーテルやプッシャーデバイスなど、さまざまな種類のデバイスや補機の搬送を用意にするために採用することができる。植え込み型デバイスは一般的に、プッシャーや搬送機構に着脱可能に取り付けられており、ガイドカテーテルを通して目的部に案内され、そこで展開されて搬送機構から分離される。搬送機構は、ガイドカテーテルを通して引き戻され、付加的デバイス、補機、薬剤などは必要であればガイドカテーテルの除去の前に、目的部へ搬送される。 Intraluminal and intravascular procedures are commonly used to install implantable devices and materials used in various types of medical practices. The intravascular guide catheter is inserted into the patient's blood vessel through the femoral artery and reaches the desired treatment site through the blood vessel. It can be employed to prepare transport for various types of devices and accessories, including additional transport mechanisms, special catheters, microcatheters and pusher devices. The implantable device is generally detachably attached to a pusher or a delivery mechanism, guided to a target portion through a guide catheter, and then deployed and separated from the delivery mechanism. The delivery mechanism is pulled back through the guide catheter, and additional devices, auxiliaries, medications, etc. are delivered to the target site prior to removal of the guide catheter if necessary.
本発明にかかる方法は、閉塞構造体と、1つ以上のアンカー構造体と有するデバイスを小さな直径の搬送状態で所望の修復部へ低侵襲性技術を用いて案内することを含んでいる。一実施例として、タイドワイヤはガイドカテーテルを通じて対象とされる修復部へ案内される。閉塞装置は対象とされる修復部へ案内されて、ガイドワイヤの先で展開される。このましい実施例として、閉塞デバイスは搬送カテーテルの遠位端部に予め取り付けられていることが好ましい。ガイドワイヤ、搬送カテーテル、閉塞デバイス、プッシャー、分離デバイスは、適当な大きさを有し、長い内腔内および曲がりくねった通路をしっかり進むために、適度な可撓性、押圧力を有していることが好ましい。長く曲がりくねった通路は妨害されるので、植え込み型デバイスを搬送するためには、搬送カテーテルおよび植え込み型デバイスの双方に、所要の可撓性、押圧性および誘導性をそなえる大きさおよび形状を有していなくてはならない。 The method according to the present invention includes guiding a device having an occlusion structure and one or more anchor structures to a desired repair site in a small diameter delivery state using minimally invasive techniques. In one embodiment, the tide wire is guided through the guide catheter to the targeted repair. The occlusion device is guided to the targeted repair and deployed at the tip of the guide wire. As a preferred embodiment, the occlusion device is preferably pre-attached to the distal end of the delivery catheter. Guidewires, delivery catheters, occlusion devices, pushers, separation devices are of appropriate size and have adequate flexibility and pressure to securely navigate long lumens and tortuous passages It is preferable. Because long and tortuous passages are obstructed, to deliver an implantable device, both the delivery catheter and the implantable device have the size and shape to provide the required flexibility, pushability and inductivity. It must be.
一実施例において、本発明に係る方法は、閉塞装置および少なくとも2つのアンカー構造体を小さな直径の搬送状態において欠損部の近傍に有するさらに欠損閉塞システムを案内し位置させることを含んでいる。一般的に、第一のアンカー構造体は、欠損部もしくは開口部の近傍の表面に接触して、もしくは近傍に設置されて展開される。展開により、第1のアンカー構造体は、円周方向に開いて広がり、閉塞構造体の周囲長よりも大きな周囲長の構造体をなす。閉塞構造体は、欠損部や開口部に渡って配置されて展開し、欠損部や開口部を覆い閉塞する。閉塞構造体が配置された後に、第2のアンカー構造体が、欠損部や開口部と向き合う表面と接触して、もしくは近傍に配置されて展開される。第2のアンカー構造体は、円周方向に開いて広がり、閉塞構造体の周囲長よりも大きな周囲長の構造体をなす。展開した状態でのアンカー構造体は、内腔表面や欠損近傍の組織と接触しているか、近くに位置していることが好ましく、閉塞構造体は開口部を覆い、正常な構造体および形状に回復させるために閉じられている内腔壁や欠損の構造体および形状と一致している。アンカー構造体は、欠損構造体と向かい合う表面と接触する作用を奏し、欠損部近傍の健康な組織と接触し、位置して閉塞構造体を開口部に保持するために拡張する作用を奏している。 In one embodiment, the method according to the present invention includes guiding and positioning a defect closure system having a closure device and at least two anchor structures in the vicinity of the defect in a small diameter transport condition. Generally, the first anchor structure is deployed in contact with the surface in the vicinity of the defect or opening, or installed in the vicinity. By deployment, the first anchor structure opens and expands in the circumferential direction, forming a structure with a perimeter that is greater than the perimeter of the closure structure. The closing structure is arranged and developed over the defect portion and the opening, and covers and closes the defect and the opening. After the closure structure is placed, the second anchor structure is deployed in contact with or near the surface facing the defect or opening. The second anchor structure opens and expands in the circumferential direction, and forms a structure having a peripheral length larger than the peripheral length of the closing structure. The anchor structure in the expanded state is preferably in contact with or located close to the lumen surface or tissue near the defect, and the occlusion structure covers the opening and has a normal structure and shape. Consistent with the structure and shape of the lumen wall or defect that is closed for recovery. The anchor structure acts to contact the surface facing the defect structure, contacts healthy tissue in the vicinity of the defect, and expands to position and hold the occlusion structure in the opening. .
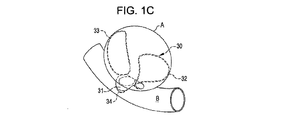
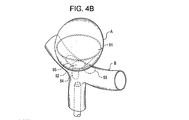
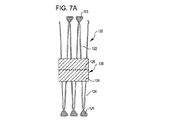
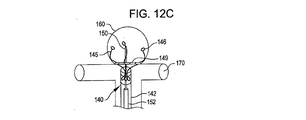
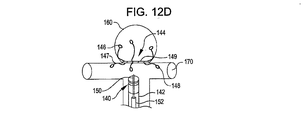
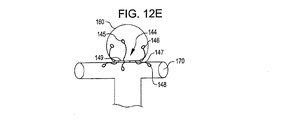
欠損閉塞システムの配置は、放射線不透過性マーカーを搬送カテーテルおよび/または欠損閉塞システムに設置することによりなすこともできる。1つ以上の放射線不透過性マーカーが例えば第1のアンカー構造体である前記デバイスの遠位端(搬送状態において);閉塞構造体である前記デバイスの中間部(搬送状態において);および/または第2のアンカー構造体である前記デバイスの近位端に設けることができる。前記デバイスは、遠位端放射線不透過性マーカーを欠損開口部にわたって、および欠損開口部の近傍に設置し、第1のアンカー構造体を展開する;中央放射線不透過性マーカーを欠損開口部に設置し、閉塞構造体を展開する;近位端放射線不透過性マーカーを開口部のやや外側に設置し第2のアンカー構造体を展開することにより、展開することができる。放射線不透過性マーカーを閉塞デバイスおよび/または搬送カテーテルに関して使用することにより、アンカーおよび閉塞構造体の設置および展開を正確に行うことができる。前記閉塞システムは、アンカー構造体を開口部近傍の組織と向かい合った面に円周状に配置し、閉塞構造体を開口部に配置することにより、しっかり固定されて保持される。閉塞システムの位置は、設置し治療した後に、デバイスに設けられた放射線不透過性マーカーの位置を調べることにより、観測することができる。 The placement of the defect occlusion system can also be done by placing a radiopaque marker on the delivery catheter and / or defect occlusion system. One or more radiopaque markers, for example, a first anchor structure, the distal end of the device (in the transport state); an intermediate portion of the device, in the occlusion structure (in the transport state); and / or A second anchor structure can be provided at the proximal end of the device. The device places a distal end radiopaque marker across and in the vicinity of the defect opening and deploys the first anchor structure; places a central radiopaque marker in the defect opening And deploy the occlusion structure; deploying the proximal anchor radiopaque marker slightly outside the opening and deploying the second anchor structure. By using radiopaque markers with respect to the occlusion device and / or delivery catheter, the anchor and occlusion structure can be placed and deployed accurately. The occlusion system is securely held by placing the anchor structure circumferentially on the surface facing the tissue near the opening and placing the occlusion structure in the opening. The position of the occlusion system can be observed by examining the position of the radiopaque marker provided on the device after installation and treatment.
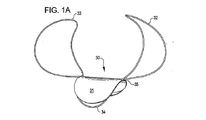
本発明における移植方デバイスは開口部または腔内を閉塞し伸ばすために閉塞構造体を採用している。前記閉塞構造体は、下に述べるさまざまな材料で構成することができる。展開した状態における閉塞構造体の寸法および形状は、少なくとも動脈瘤頚部などの欠損開口部よりも大きく、閉塞構造体が展開したときに開口部を覆うことが好ましい。閉塞構造体は、連続的に閉塞した表面積を有することができ、他の実施例として、ガイドワイヤを使用した設置を容易にするため、および/または補助的植え込み型デバイスの搬送や物質の搬送を容易にするための1つ以上の開口部を有するとすることができる。 The implantation device of the present invention employs an occlusion structure to occlude and extend the opening or cavity. The closure structure can be composed of various materials described below. The size and shape of the occlusion structure in the deployed state is preferably at least larger than the defect opening such as the neck of the aneurysm, and preferably covers the opening when the occlusion structure is deployed. The occlusion structure may have a continuously occluded surface area, as another example, to facilitate installation using a guidewire and / or to transport an auxiliary implantable device or a substance. It may have one or more openings for ease.
閉塞構造体は、ある実施例において 前記構造体を再現し対象組織が移動する(例.拍動性)のに十分な半径方向の可撓性を有している。閉塞構造体が動脈瘤の頸部に配置されると、効果的な血管壁の修復および強度、構造体、可撓性を回復をなしながら、血管の動きに追従する。好ましい実施例においては、閉塞構造体および/またはアンカー構造体は、血管欠損に配置された後に、欠損を修復するだけでなく、細胞の成長を促し、さらに、閉塞構造体を生理的構造体に組み込み、前記構造体が欠陥状態に戻る機会を減少させる。 In one embodiment, the occlusion structure has sufficient radial flexibility to reproduce the structure and move the target tissue (eg, pulsatile). When the occlusion structure is placed in the neck of the aneurysm, it follows the movement of the blood vessel while restoring effective vessel wall repair and strength, structure, and flexibility. In a preferred embodiment, after the occlusion structure and / or anchor structure is placed in the vascular defect, it not only repairs the defect but also promotes cell growth, and further converts the occlusion structure into a physiological structure. Incorporation reduces the chance that the structure will return to a defective state.
閉塞構造体は、表面領域もしくはその構造体の一部分を介して補強構造体を組み込むとすることができる。一実施例として、例えば、弾力性のある可撓性シート材料を定形ないし不定形模様の補強構造体に付けることができる。一実施例において、閉塞構造体は補強力を与えるワイヤループもしくはフレームワーク構造体によって周辺部近傍に支持され、付加的もしくは代替的にアンカー構造体を備えている。一実施例において、補強構造体は1つ以上のアンカー構造体と一体となった、もしくは1つ以上のアンカー構造体を取り付けるための襟構造体を含んでいる。 The occlusion structure may incorporate a reinforcing structure through the surface region or a portion of the structure. As an example, for example, a flexible flexible sheet material can be applied to a stiff or irregular shaped reinforcing structure. In one embodiment, the closure structure is supported in the vicinity of the periphery by a wire loop or framework structure that provides reinforcement, and additionally or alternatively includes an anchor structure. In one embodiment, the reinforcing structure includes a collar structure integral with or attached to one or more anchor structures.
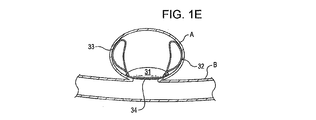
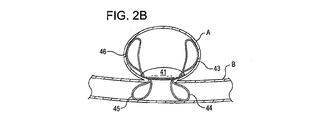
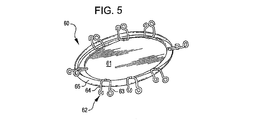
ある実施例において、アンカー構造体は、閉塞構造体を欠損開口部と向かい合った内腔壁へ偏らせている。ある実施例におけるアンカー構造体は複数個設けられており、閉塞構造体を欠損開口部と向かい合った内腔壁へ偏らせている。他の実施例においても、複数個のアンカー構造体が設けられており、少なくとも1つのアンカー構造体は開口部近傍の内腔壁と接触またはその近傍に位置し、少なくとも1つのアンカー構造体は欠損部の外側内腔壁もしくは内側内腔壁と接触またはその近傍に位置している。ある実施例におけるアンカー構造体は、開口部近傍の欠損内腔壁の内側および外側において円周状に位置し、閉塞構造体は開口部に位置して覆い、効果的に開口部の一方側から他方側を締め出し、腔内を原型である閉じた構造体に回復させる。 In certain embodiments, the anchor structure biases the occlusion structure toward the lumen wall opposite the defect opening. In one embodiment, a plurality of anchor structures are provided to bias the occlusion structure toward the lumen wall opposite the defect opening. In another embodiment, a plurality of anchor structures are provided, at least one anchor structure is in contact with or near the lumen wall near the opening, and at least one anchor structure is defective. It is located in contact with or near the outer lumen wall or inner lumen wall of the section. The anchor structure in one embodiment is located circumferentially inside and outside the defect lumen wall near the opening, and the closure structure is located and covers the opening, effectively from one side of the opening. The other side is shut out, and the inside of the cavity is restored to the original closed structure.
ある実施例において、アンカー構造体は少なくとも部分的に開口部近傍の血管の一面もしくは両面と接触し、閉塞構造体を開口部に支持することを目的としている。アンカー構造体は非外傷性で近傍の組織を傷つけたり、血管内の血流を妨げることなく閉塞構造体を支持する。一実施例において、アンカー構造体はループ構造体もしくは開口を有するクリップ構造体をなし、表面部分の物質密度は閉塞構造体の表面部分における密度よりも低い。植え込み型デバイスは一般的に小さな直径を有し、搬送状態において円筒形状をなし、この状態において、アンカー構造体は中央の閉塞構造体から互いに反対の方向へ突出している。設置の際に、アンカー構造体は形を変化させ、外側へ円周形状に開き、より大きな直径のアンカー構造体をなす。搬送状態の位置としての、遠位および近位端アンカー構造体は、腔内の両サイドへ展開され、ほぼ同一の形状および寸法を有するとすることができる。またアンカー構造体は、異なる長さ、形状、構造体からなるとすることもできる。ある実施例において、アンカー構造体は、内腔の内側および外側に位置し互いに整列されており、一方で他の実施例においては互いにジグザグ状をなして配置されている。 In one embodiment, the anchor structure is intended to at least partially contact one or both sides of the blood vessel near the opening to support the occlusion structure in the opening. The anchor structure is non-traumatic and supports the occlusion structure without damaging nearby tissue or obstructing blood flow in the blood vessel. In one embodiment, the anchor structure is a loop structure or a clip structure having an opening, and the material density of the surface portion is lower than the density in the surface portion of the closure structure. Implantable devices generally have a small diameter and have a cylindrical shape in the transport state, in which the anchor structure protrudes from the central closure structure in opposite directions. During installation, the anchor structure changes shape and opens outwardly in a circumferential shape, forming a larger diameter anchor structure. As a delivery position, the distal and proximal end anchor structures may be deployed on both sides within the cavity and have approximately the same shape and dimensions. The anchor structure may be composed of different lengths, shapes, and structures. In some embodiments, the anchor structures are located inside and outside the lumen and are aligned with each other, while in other embodiments, they are arranged in a zigzag manner with respect to each other.
他の実施例において、植え込み型デバイスは上述のように1つ以上のアンカー構造体および/または襟構造体と組み合わされた閉塞構造体を含んでいる。この実施例において、アンカー構造体は閉塞構造体にもうけられた少なくとも2つの位置決めループを含んでいる。位置決めループは、展開した状態において、動脈瘤および/または動脈瘤近傍の血管壁の内壁と接触する大きさおよび形状を有しており、閉塞構造体を動脈瘤の壁側もしくは動脈瘤頚部近傍の血管壁側へと偏らせ、閉塞構造体が動脈瘤の頸部を覆うように固定する。 In other embodiments, the implantable device includes an occlusion structure combined with one or more anchor structures and / or collar structures as described above. In this embodiment, the anchor structure includes at least two positioning loops provided in the closure structure. The positioning loop is sized and shaped to contact the aneurysm and / or the inner wall of the blood vessel wall in the vicinity of the aneurysm in the deployed state. It is biased toward the blood vessel wall side and fixed so that the occlusion structure covers the neck of the aneurysm.
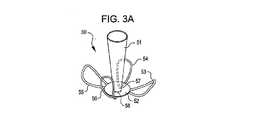
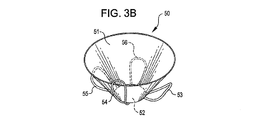
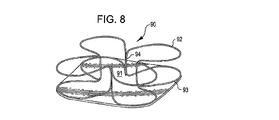
展開した状態において、閉塞構造体およびアンカー構造体は、動脈瘤頚部の内側および/または外側に位置させることができる。ある実施例において、例えば、植え込み型デバイスは動脈瘤内部に位置させ、その結果アンカー構造体は動脈瘤の内壁と接触し、閉塞構造体はその周辺部で動脈瘤の頸部を覆う。別の実施例において、植え込み型デバイスは動脈瘤における血管に配置され、その結果アンカー構造体は血管壁と接触し、閉塞構造体はその周辺部で動脈瘤の頸部を覆う。アンカー構造体の形状によって、複数個のアンカーループが配置の後に動脈瘤の近くの血管壁と接触ないしは近傍に位置するように設けられる。 In the deployed state, the occlusion structure and anchor structure can be located inside and / or outside the aneurysm neck. In certain embodiments, for example, the implantable device is positioned inside the aneurysm so that the anchor structure contacts the inner wall of the aneurysm and the occlusion structure covers the aneurysm neck at its periphery. In another embodiment, the implantable device is placed in a blood vessel in the aneurysm so that the anchor structure contacts the vessel wall and the occlusion structure covers the neck of the aneurysm at its periphery. Depending on the shape of the anchor structure, a plurality of anchor loops are provided so as to be in contact with or near the blood vessel wall near the aneurysm after placement.
さらに別の実施例において、植え込み型デバイスは、閉塞メンブレンンと結合するテーパ状のもしくは円錐状の閉塞構造体と、少なくとも2つの位置決め部材を有するアンカー構造体とを含む。この実施例において、閉塞構造体のテーパ部は、形状変更可能な金属素材からなる非連続的メッシュを含み、配置の際に少なくとも一部が動脈瘤の内壁と接触するように広がる。テーパ状の非連続的メッシュ構造体の基部は閉塞構造体と結合されていることが好ましい。アンカー構造体は閉塞構造体に設けられ、複数の位置決めループを含ませてもよく、展開した状態において少なくとも動脈瘤頸部近傍の血管壁と接触する。他の実施例によれば、アンカー構造体は少なくとも2つの花弁状の構造体を有し、例えば透過性ないし非透過性の皮膜にもうけられた金属構造体を有している。別の実施例によれば、アンカー構造体は、閉塞構造体よりも浅い形状を有した第2のテーパ状の非連続的メッシュ構造体を含むとすることができる。 In yet another embodiment, the implantable device includes a tapered or conical occlusion structure that couples with the occlusion membrane and an anchor structure having at least two positioning members. In this embodiment, the taper portion of the occlusion structure includes a discontinuous mesh made of a metal material that can be reshaped and expands so that at least a portion contacts the inner wall of the aneurysm during placement. Preferably, the base of the tapered discontinuous mesh structure is coupled to the closure structure. The anchor structure is provided in the occlusion structure and may include a plurality of positioning loops and in contact with at least the blood vessel wall near the aneurysm neck in the deployed state. According to another embodiment, the anchor structure has at least two petal-like structures, for example metal structures with a permeable or non-permeable coating. According to another embodiment, the anchor structure may include a second tapered discontinuous mesh structure having a shallower shape than the occlusion structure.
動脈瘤の頸部に配置される閉塞構造体は、別のデバイスのガイドワイヤが通ることのできる、もしくは部品やデバイスなどを閉塞システムに続いて導入するための中央開口部もしくは溝を有していてもよい。本発明における方法によれば、コイルなどの塞栓症デバイスや液体状、微粒子状塞栓が閉塞構造体を設置した後に搬送カテーテルを通して閉塞構造体の開口部に注入される。ある実施例において、塞栓物質および/またはデバイスは、閉塞デバイスの周辺部を動脈瘤の内壁側へ偏らせ、その結果閉塞デバイスを動脈瘤の頸部で固定している。 The occlusion structure placed in the neck of the aneurysm has a central opening or groove through which another device's guidewire can pass or for subsequent introduction of parts, devices, etc. into the occlusion system May be. According to the method of the present invention, an embolic device such as a coil or a liquid or particulate embolus is injected into the opening of the occlusive structure through the delivery catheter after the occlusive structure is installed. In certain embodiments, the embolic material and / or device biases the periphery of the occlusive device toward the inner wall of the aneurysm, thereby securing the occlusive device at the neck of the aneurysm.
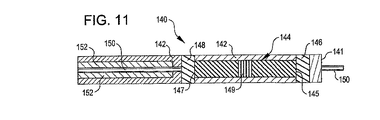
ここに開示した植え込み型デバイスは、目的箇所へ搬送カテーテルを通してプッシャー搬送システムおよび/または離脱機構を使用することにより搬送することができる。閉塞構造体、支持フレームワークおよびアンカー構造体は搬送軸に沿って圧縮されており、搬送状態において円筒形状に配列されている。プッシャー機構を使用する実施例において、プッシャーはアンカーデバイスの近傍に配置されており、閉塞デバイスを搬送カテーテルと関係づけながら移動させることができる。前記デバイスを搬送カテーテルから押し出し、前記デバイスを静的状態に保つ一方でカテーテルを引き戻すことによって展開される。代替実施例において、植え込み型デバイスは、配置された後に切り離される取り外し可能な要素を含んでいる。離脱機構は周知であり、機械的手法、電気的手法、水圧的手法、およびその他のシステムが植え込み型デバイスを展開するために用いられる。 The implantable devices disclosed herein can be delivered through a delivery catheter to a target location by using a pusher delivery system and / or a release mechanism. The closing structure, the support framework, and the anchor structure are compressed along the transport axis and arranged in a cylindrical shape in the transport state. In embodiments that use a pusher mechanism, the pusher is located in the vicinity of the anchor device and can move the occlusion device relative to the delivery catheter. The device is deployed by pushing the device out of the delivery catheter and pulling the catheter back while keeping the device static. In an alternative embodiment, the implantable device includes a removable element that is detached after being placed. Release mechanisms are well known and mechanical, electrical, hydraulic, and other systems are used to deploy implantable devices.
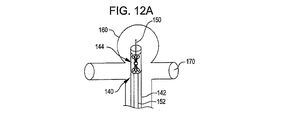
ある展開システムにおいて、デバイスワイヤが本発明における植え込み型デバイスに設けられている。前記デバイスワイヤは、線形であり搬送ワイヤやカテーテルなどの近位端部で固定的に結合されたている形状変形活性化要素を含む離脱機構に、もしくはその近傍に取り付けられている。前記デバイスの近位端部と前記活性化要素の遠位端部は、交配型接続機構でなり、搬送状態において確実に接続され所望の離脱位置に植え込み型デバイスを案内する。デバイスワイヤからの活性化要素の離脱は、所望の位置にデバイスを配置した後に、熱や電流などにより形状変形力を活性化要素に与えることによりなされ、活性化要素の形状が変化することによりデバイスワイヤが解放され、活性化要素および搬送ワイヤを引き戻すことが可能となる。 In certain deployment systems, device wires are provided in the implantable device of the present invention. The device wire is attached to or near a detachment mechanism that includes a shape deforming activation element that is linear and fixedly coupled at a proximal end, such as a delivery wire or catheter. The proximal end of the device and the distal end of the activation element comprise a mating connection mechanism that is securely connected in the transport state and guides the implantable device to the desired disengagement position. The activation element is detached from the device wire by placing the device at a desired position and then applying a shape deformation force to the activation element by heat, current, or the like, and the shape of the activation element changes to change the device. The wire is released and the activation element and the transport wire can be pulled back.
本発明における植え込み型システムは、その詳細を動脈瘤閉塞デバイスへの適用に関して記述および図示している。しかしながら、これらシステムが本適用に限られず、血管、組織、気管支気道などの治療および修復に関して適用できることは当然である。同様に、欠損および開口部を修復するための出願人の方法がここに記載されたシステムに限られないことも当然である。 The details of the implantable system in the present invention are described and illustrated with respect to application to an aneurysm occlusion device. However, it goes without saying that these systems are not limited to this application and can be applied to the treatment and repair of blood vessels, tissues, bronchial airways, and the like. Similarly, it should be understood that Applicants' method for repairing defects and openings is not limited to the system described herein.
本発明における植え込み型閉塞デバイスは、組織欠損に掛け渡される閉塞構造体と、該閉塞構造体を適切な位置に固定するアンカー構造体を含んでいる。多くの代替実施例および構造体がここに開示されている。ここに開示されている閉塞構造体に採用されている可撓性パッチもしくはメンブレンンは、カテーテル内を小さな直径の搬送状態で搬送され、展開状態において大きな寸法の形状となることのできる可撓性材料からなる。ある実施例において、前記閉塞構造体は、血液や体液などの液体を通さない不透過性の材料からなる。もしくは、血液や体液などの液体を半分通すもしくは通す透過性の材料からなしてもよい。閉塞構造体は前記デバイスの適用によってさまざまな形状を採用することができ、一般的には、円形、楕円形、卵形、多角形などが採用される。 The implantable occlusion device of the present invention includes an occlusion structure that spans a tissue defect and an anchor structure that secures the occlusion structure in place. A number of alternative embodiments and structures are disclosed herein. The flexible patch or membrane used in the occlusion structure disclosed herein is flexible so that it can be transported through the catheter in a small diameter transport state and into a large dimension when deployed. Made of material. In one embodiment, the occlusion structure is made of an impermeable material that is impermeable to liquids such as blood and body fluids. Alternatively, it may be made of a permeable material through which a liquid such as blood or body fluid passes halfway or through. The occlusion structure can adopt various shapes depending on the application of the device, and generally, a circular shape, an elliptical shape, an oval shape, a polygonal shape, and the like are adopted.
前記閉塞構造体は、生体適合可能な材料であり、かつ搬送時において小さな直径をなすように圧縮可能、折畳み可能、変形可能な材料からなる。前記閉塞構造体を形成する材料としては、例えば、さまざまな種類の天然もしくは人工ポリマー材料、シリコン材料、ゴム材料、ダクロン(登録商標)のような織布もしくは不織布、テフロン(登録商標)のようなポリテトラフルオロエチレン共重合体(PTFE)やゴアテックス(登録商標)、ソフトフォーム(登録商標)、インプラ(登録商標)のような拡張したポリテトラフルオロエチレン共重合体(ePTFE)のようなフッ素重合体組成物、ポリウレタン材料、ポリウレタンとシリコンの化合物および今日重合体などがある。他の実施例において、閉塞構造体は薄膜形状記憶合金、例えばニチノール合金などの薄膜ニッケルチタン合金である金属材料を含ませてもよい。メンブレンン層およびメンブレンンは複数の成分を含み、組成が与えられる。ある実施例において、前記閉塞構造体は、配置された場所の組織や血管の動作や拍動性に応じて半径方向に可撓性があり、弾力性があり、拡張可能であり、材料から構成される。 The closure structure is a biocompatible material and is made of a material that is compressible, foldable, and deformable so as to have a small diameter during transportation. Examples of the material forming the closed structure include various kinds of natural or artificial polymer materials, silicon materials, rubber materials, woven or non-woven fabrics such as Dacron (registered trademark), and Teflon (registered trademark). Fluorine heavy, such as expanded polytetrafluoroethylene copolymer (ePTFE) such as polytetrafluoroethylene copolymer (PTFE), Gore-Tex (registered trademark), soft foam (registered trademark), Impura (registered trademark) There are coalesced compositions, polyurethane materials, polyurethane and silicon compounds and polymers today. In other embodiments, the occlusion structure may include a metal material that is a thin film shape memory alloy, eg, a thin film nickel titanium alloy such as a nitinol alloy. The membrane layer and the membrane contain a plurality of components and are given a composition. In one embodiment, the occlusive structure is flexible in the radial direction, elastic, expandable, and composed of a material according to the movement and pulsatility of the tissue and blood vessel in the place where it is disposed. Is done.
ある実施例において、前記閉塞構造体は表面に定形ないし不定形のメッシュ類似の構造体を含んでいる。一般的に、メッシュ形状の閉塞構造体は、微細メッシュ構造体を有している。ある実施例における閉塞構造体は、半径方向に拡張可能なメッシュ類似の構造体を有している。他の実施例における閉塞構造体は、1つ以上の軸方向に拡張可能なメッシュ類似の構造体を有している。 In one embodiment, the closure structure includes a regular or irregular mesh-like structure on the surface. In general, a mesh-shaped closing structure has a fine mesh structure. The closure structure in one embodiment has a mesh-like structure that is radially expandable. In other embodiments, the closure structure has one or more axially expandable mesh-like structures.
前記閉塞構造体は、ポーラスもしくは穿孔表面構造体を少なくともその表面積の一部に有していてもよく、穴は一定の気孔率で配列されているか、もしくは、場所によって気孔率が異なって配列されている。標準的な穴の大きさは、閉塞構造体の表面において一定としてもよいし、さまざまな大きさの穴を配置してもよい。一般的に穴の大きさは約0.5から200ミクロンが好ましい。ある実施例における穿孔構造体は、液体が閉塞構造体を横切って流れるのを許すが、赤血球を含む巨大タンパク質や細胞を排除する。一般的に10ミクロン以下の平均的な直径を有する穿孔は巨大タンパク質や細胞を排除し、一方で流体がメンブレンンを横切って流れるのは可能である。前記穿孔の配列は定形ないし不定形のパターンを形成し、前記穿孔の形態は定形でも不定形でもよく、一般的に円形、楕円径、四角形などがある。例えば組織や血管壁と接触する閉塞構造体の周辺部において高気孔率としてもよい。 The occlusion structure may have a porous or perforated surface structure in at least a part of its surface area, and the holes are arranged with a certain porosity or arranged with different porosity depending on the location. ing. The standard hole size may be constant on the surface of the occlusion structure, or holes of various sizes may be placed. Generally, the hole size is preferably about 0.5 to 200 microns. In one embodiment, the perforated structure allows fluid to flow across the occlusion structure, but excludes large proteins and cells including red blood cells. In general, perforations having an average diameter of 10 microns or less exclude large proteins and cells while allowing fluid to flow across the membrane. The arrangement of the perforations forms a regular or irregular pattern, and the shape of the perforations may be regular or irregular, and generally has a circular shape, an elliptical diameter, a quadrangular shape, and the like. For example, the porosity may be high in the periphery of the occlusion structure that is in contact with the tissue or blood vessel wall.
前記閉塞構造体は、代替的もしくは追加的に細胞の付着と成長を促進させるための表面処理加工をその一方もしくは両方の面に施してもよい。例えば、ある実施例において前記閉塞構造体を構成する材料は不規則な粗い面を有しており、細胞の付着を促進させる。別の実施例において、前記閉塞構造体は、くぼみや溝が定形ないし不定形のパターンで組み込まれた3次元形状を有し、細胞の付着と内皮活性化を促進させる。 The occlusion structure may alternatively or additionally be subjected to a surface treatment to promote cell attachment and growth on one or both sides. For example, in one embodiment, the material comprising the occlusion structure has an irregular rough surface that promotes cell attachment. In another embodiment, the occlusion structure has a three-dimensional shape with indentations and grooves incorporated in a regular or irregular pattern to promote cell attachment and endothelial activation.
ここに開示されたデバイスにおいて、閉塞構造体および/または植え込み型デバイスの他の部品は、1つ以上のアンカー構造体を含んでおり、細胞の成長と展開部での付着を促進するよう構造体化されもしくは加工されている、もしくは材料を含んでいる。同様に、本願発明における方法は、細胞の成長と内皮活性化を促す物質をデバイスが展開された箇所において、植え込み型デバイスが設置される以前、最中および/またが以降において注入することを伴う。たとえば血管への適用においては、本発明におけるデバイスが配置されることにより修復される動脈瘤やその他の欠損がある場所で血管の内皮活性化を促すことが望ましい。本発明の方法およびシステムにおいて使用されるさまざまな物質は米国特許公報2004/0087988および2004/0193206に記載されており、これらはその全体を参照することにより本書に組み込まれる。 In the devices disclosed herein, the occlusion structure and / or other components of the implantable device include one or more anchor structures to promote cell growth and attachment at the deployment site. Has been processed or processed, or contains material. Similarly, the method of the present invention involves injecting a substance that promotes cell growth and endothelial activation at the location where the device is deployed before, during and / or after the implantable device is installed. . For example, in vascular applications, it is desirable to promote endothelial activation of blood vessels where there are aneurysms or other defects that are repaired by the placement of the device of the present invention. Various materials used in the methods and systems of the present invention are described in US Patent Publications 2004/0087988 and 2004/0193206, which are hereby incorporated by reference in their entirety.
多数の材料をデバイスを配置する以前、最中、以降にわたって、もしくは植え込み型デバイスと関連させて投与することができ、細胞の成長を促進させる。生体適合性のある材料を本目的に使用することができ、例えば、コラーゲン、フィブリン、フィブロネクチン、抗体、サイトカイン、成長因子、酵素などのタンパク質;ヘパリン、コンドロイチンなどの多糖類;生物固有の架橋ゼラチン;ヒアルロンン酸;ポリ(アルファ.ヒドロキシ 酸);RNA;DNA;その他の核酸;ポリグリコイド、ポリラクチド、ポリラクチドグリコイド(polylactid-co-glycolides)などのポリエステル;ポリカプトラクトンを含むポリラクトン;ポリジオキサノンン;ポリリシンなどのポリアミノ酸;ポリシアノアクリレイト;ポリ(フォスファゼン);ポリ(リン酸エステル);ポリエステルアミド;ポリアクセタール;ポリケタール;トリメチレンカーボネートを含むポリカーボネート;分解性ポリエチレン;ポリアルキレンシュウ酸塩;ポリアルキレンコハク酸エステル;キチン;キトサン;酸化セルロース;ポリハイドロキシ酪酸、ポリハイドロキシ吉草酸およびこれらの共重合体を含むポリハイドロキシアルカノエート;ポリエチレン・オキシドの重合体および共重合体;アクリル酸ポリエチレン;ポリアミド;ポリエチレン;ポリアクリロニトリル;ポリホスファゼン;ポリ(アミド無水物)、ポリ(アミドエステル)無水物、芳香族脂肪酸無水物、芳香族無水物、ポリ(エステル無水物)、脂肪酸無水物などを含むジカルボン酸のモノマーからなる酸無水物;他の生体適合性重合体、共重合体および三元重合体;生物活性物の残留物質;これらの化合物。 Numerous materials can be administered before, during, after, or in conjunction with an implantable device prior to placement of the device to promote cell growth. Biocompatible materials can be used for this purpose, such as proteins such as collagen, fibrin, fibronectin, antibodies, cytokines, growth factors, enzymes; polysaccharides such as heparin, chondroitin; Poly (alpha.hydroxy acid); RNA; DNA; other nucleic acids; polyesters such as polyglycoids, polylactides and polylactid-co-glycolides; polylactones including polycaptolactone; polydioxanones; Polyamino acids such as polylysine; polycyanoacrylates; poly (phosphazenes); poly (phosphate esters); polyesteramides; polyacetals; polyketals; polycarbonates containing trimethylene carbonate; Polyalkylene succinate; polyalkylene succinate; chitin; chitosan; oxidized cellulose; polyhydroxyalkanoate including polyhydroxybutyric acid, polyhydroxyvaleric acid and copolymers thereof; polymers and copolymers of polyethylene oxide; Polyethylene acrylate; polyamide; polyethylene; polyacrylonitrile; polyphosphazene; poly (amide anhydride), poly (amide ester) anhydride, aromatic fatty acid anhydride, aromatic anhydride, poly (ester anhydride), fatty acid anhydride Acid anhydrides consisting of dicarboxylic acid monomers including: other biocompatible polymers, copolymers and terpolymers; bioactive residue materials; these compounds.
ポリラクチド、ポリグリコイド、ポリラクチドグリコイド、酸無水物、ポリp-ジオキサン、トリメチレンカーボネート、ポリカプロラクトン、ポリヒドロキシアルカノエートなどを含む、いくつかの生体適合性ポリマーは十分な生体吸収性を有しており、本発明におけるデバイスおよび方法に関して使用するのに適している。一般に十分な生体吸収性を有していないとされる以下に含まれる生体適合性ポリマーも使用するこことができる。ポリアクリル酸塩;エチレン酸塩ビニル;酢酸酸塩セルロースおよび酢酸プロピオン酸セルロースを含むセルロースおよびセルロース誘導体;非侵食性ポレオレフィン;ポリスチレン;ポリ塩化ビニル;フッ化ビニル樹脂;ポリビニル(イミダゾール);クロロスルホン化ポリエチレン;ポリエチレン・オキシド;ポリエチレン・グリコール;ポリビニル・ピロリドン;ポリウレタン;ポリシロキサン;これらの共重合体および三元重合体;これらの化合物。他の例となるポリマーは広くしられており、当業者であればかかるポリマーはここに列挙できないほど多数あることは容易に理解できる。したがって、本リストは説明のために示したものであり、網羅したものではない。 Some biocompatible polymers have sufficient bioabsorbability, including polylactide, polyglycoid, polylactideglycoid, acid anhydride, poly p-dioxane, trimethylene carbonate, polycaprolactone, polyhydroxyalkanoate, etc. Suitable for use with the devices and methods of the present invention. The biocompatible polymers included below, which are generally considered not to have sufficient bioabsorbability, can also be used. Polyacrylates; Ethylene vinyl acetate; Cellulose and cellulose derivatives including cellulose acetate and cellulose acetate propionate; Non-erodible polyolefins; Polystyrene; Polyvinyl chloride; Vinyl fluoride resin; Polyvinyl (imidazole); Polyethylene oxide; polyethylene glycol; polyvinyl pyrrolidone; polyurethane; polysiloxane; copolymers and terpolymers thereof; Other exemplary polymers have been widened and it will be readily apparent to those skilled in the art that there are so many such polymers that they cannot be listed here. Accordingly, this list is provided for purposes of illustration and is not exhaustive.
非ポリマー材料も本発明における閉塞システムに使用することができる。好ましい非ポリマー材料には、例えば、ホルモン物質や抗新生物薬物質を含む。血管との一体性を促進させる他の生体適合性材料の例は、例えば細胞や細胞片などの処理がなされた人間もしくは動物の組織、人工血管組織、膀胱・胃・肝臓のマトリクス材、天然もしくは人工の遺伝物質を含む。 Non-polymeric materials can also be used in the occlusion system in the present invention. Preferred non-polymeric materials include, for example, hormone substances and anti-neoplastic substances. Examples of other biocompatible materials that promote integration with blood vessels include, for example, human or animal tissue treated with cells or cell debris, artificial vascular tissue, bladder / stomach / liver matrix material, natural or Contains artificial genetic material.
他の種類の組成物も本発明における閉塞デバイスを構成する閉塞構造体またはアンカー構造体に使用することができる。親水性物質および/または疎水性物質または接着剤は、例えば全てのもしくは一部の構造体に使用できる。同様に、PTFEのようなフッ素重合体を含む減摩剤は、全てのもしくは一部の構造体に使用されることにより搬送カテーテルからの展開を促進する。放射線不透過性マーカーや放射線不透過性物質はデバイス構造体の特定構造体ないしは一部に設けられることにより、正確な位置決め、配置、展開されたデバイスの監視を可能にする。例えば、ある実施例において、放射線不透過性物質は、閉塞構造体と一体的に設けたり、閉塞構造体を被覆して設けることができる。他の実施例において、特定の治療薬、抗生物質、血栓形成物質、非血栓形成物質などを前記デバイス構造体の特定構造体ないしは一部に設けたり、植え込み型デバイスを展開する以前、最中もしくは以降に投与してもよい。適切な物質は、広く知られており、他の種類の植え込み型デバイスとともに使用されている。 Other types of compositions can also be used in the occlusive structure or anchor structure that constitutes the occlusive device in the present invention. Hydrophilic substances and / or hydrophobic substances or adhesives can be used, for example, in all or some structures. Similarly, lubricants including fluoropolymers such as PTFE can be used on all or some structures to facilitate deployment from the delivery catheter. A radiopaque marker or radiopaque material is provided on a specific structure or part of the device structure to enable accurate positioning, placement, and monitoring of the deployed device. For example, in certain embodiments, the radiopaque material can be provided integrally with the occlusion structure or coated over the occlusion structure. In other embodiments, certain therapeutic agents, antibiotics, thrombogenic substances, non-thrombogenic substances, etc. may be provided on a specific structure or part of the device structure, or before or during the deployment of the implantable device. It may be administered later. Suitable materials are widely known and are used with other types of implantable devices.
前記閉塞構造体は、複数の層を含み、さまざまな種類の被覆や、付着・接着物質や治療薬、親水性物質ないし疎水性物質、ハイドロジェルのような膨潤性材料、放射線不透過性材料などを使用することができる。ある実施例において、膨潤性ハイドロジェルは、閉塞構造体の表面および/またはアンカー構造体の表面に使用すれば、展開された状態において、動脈瘤の内壁と接触する。他の実施例において、塞栓作用を促進させるある物質もしくは物質の化合物を閉塞構造体の表面および/またはアンカー構造体の表面に使用すれば、展開された状態において動脈瘤の内壁と接触して、動脈瘤の塞栓を進められる。さらに別の実施例においては、ヘパリン、プラスミノーゲン活性化因子(tPA)などの血栓症および血液凝固を軽減させる作用のある、ある物質もしくは物質の化合物を閉塞構造体の表面および/または血管壁の表面に使用する。別の実施例においては、パクリタクセル(Paclitaxel)やその派生物、シロリムス、ステロイドやスタチン、イブプロフェンなどの抑炎症性物質など、再狭窄を防ぐ物質および/または炎症を減少させる物質もしくは物質の化合物を閉塞構造体の表面および/またはアンカー構造体の表面に使用する。別の実施例においては、放射性物質を閉塞構造体の表面および/またはアンカー構造体の表面に治療ないしは結像目的で使用する。 The occlusion structure includes a plurality of layers, and various types of coatings, adhesion / adhesive substances and therapeutic agents, hydrophilic substances or hydrophobic substances, swellable materials such as hydrogels, radiopaque materials, etc. Can be used. In certain embodiments, the swellable hydrogel, when used on the surface of the occlusion structure and / or the surface of the anchor structure, contacts the aneurysm inner wall in the deployed state. In another embodiment, if a substance or compound of substance that promotes embolism is used on the surface of the occlusion structure and / or the surface of the anchor structure, in contact with the inner wall of the aneurysm in the deployed state, The embolization of the aneurysm is advanced. In yet another embodiment, a substance or compound of a substance that acts to reduce thrombosis and blood clotting, such as heparin, plasminogen activator (tPA), and the surface of the occlusive structure and / or the vessel wall Used on the surface. In another embodiment, a substance that prevents restenosis and / or a substance or substance that reduces inflammation, such as paclitaxel and its derivatives, sirolimus, steroids, statins, ibuprofen, and other anti-inflammatory substances is occluded. Used on the surface of the structure and / or the surface of the anchor structure. In another embodiment, radioactive material is used on the surface of the occlusion structure and / or the surface of the anchor structure for therapeutic or imaging purposes.
前記閉塞構造体をなしているメンブレンンは、連続した表面積を有し、植え込み型デバイスの設置または搬送状態における搬送システムへ取付けを容易にする、1つ以上の開口部もしくは溝部を備えている。メンブレンンは、形状記憶合金のような形状変更可能な材料を含んでいるフレームワークもしくはアンカー構造体に固定されている。いくつかのメンブレンン材料はフレームワークもしくはアンカー構造体にも、被覆、浸漬被覆などの方法により適用することができる。 The membrane forming the occlusion structure has a continuous surface area and is provided with one or more openings or grooves that facilitate installation into an implantable device in a set-up or transfer state. The membrane is secured to a framework or anchor structure that includes a shape-changeable material such as a shape memory alloy. Some membrane materials can also be applied to frameworks or anchor structures by methods such as coating or dip coating.
前記閉塞構造体を支持するアンカー構造体や補強構造体のようなフレームワークの組成は、超弾性および/または形状記憶特性を示す形状記憶合金のような生体適合性形状変更可能な材料からなる。形状変形可能な材料は、熱や電流などにより形状変形力が加えられることにより予定されていた形態に形を変え、既定の展開状態へと変形する。形状を変化させる力は、発生した温度の変化により生じ、例えばデバイスを体温環境の下に置いたり、外部装置を使用してデバイスに熱が加えたり、電流を使用してデバイスに熱を加えることにより発生する。形状記憶材料を温めることにより、上記のように、材料が変化し、前記デバイスのフレームワーク構造体および/またはアンカー構造体は予め定められている大きな寸法および形状へ変化する。 The composition of the framework, such as an anchor structure or reinforcement structure that supports the occlusion structure, is made of a biocompatible shape changeable material such as a shape memory alloy that exhibits superelastic and / or shape memory properties. The shape-deformable material changes its shape into a predetermined form when a shape-deformation force is applied by heat, electric current or the like, and deforms into a predetermined unfolded state. The force that changes the shape is caused by a change in the generated temperature, for example, placing the device under a body temperature environment, applying heat to the device using an external device, or applying heat to the device using an electric current. Caused by. By warming the shape memory material, the material changes as described above, and the framework structure and / or anchor structure of the device changes to a predetermined large size and shape.
超弾性および形状記憶特性を示すニチノール合金は本発明におけるデバイスに使用するのが好ましい形状記憶合金である。フレームワークおよびアンカー構造体は、例えば、剛性ワイヤ、管状ワイヤ、編組材料で形成することができ、管状ないしは円筒状の構造体から切断して作られる。フレームワークおよびアンカー構造体は、他のさらなる材料を内蔵していてもよく、フレームワーク構造体同士の間に被覆や部材を有していてもよい。ある実施例において、フレームワークおよびアンカー構造体物は、周知のスパッタリング技術を使用することによりニチノール薄膜合金などの薄膜形状記憶合金からなる。 Nitinol alloys that exhibit superelastic and shape memory properties are preferred shape memory alloys for use in the devices of the present invention. The framework and the anchor structure can be formed of, for example, a rigid wire, a tubular wire, or a braided material, and are cut from a tubular or cylindrical structure. The framework and anchor structure may contain other additional materials and may have a coating or member between the framework structures. In one embodiment, the framework and anchor structure is made of a thin film shape memory alloy, such as a Nitinol thin film alloy, using well known sputtering techniques.
植え込み型デバイスは、プッシャーもしくはロッドを備えた搬送カテーテル、もしくは特性のマイクロカテーテル(“搬送カテーテル”という。)を使用すること、あるいは離脱機構を備えたプッシャーシステムを使用することにより目的箇所へ搬送される。例えばある実施例において、前記閉塞構造体は搬送カテーテルの遠位端において低姿勢の状態で取り外し可能に設けられており、引き込み可能なシースによって覆われ低姿勢の状態で保持されている。前記搬送カテーテルは、周知の技術によって動脈瘤の頸部に位置され、シースが引き込まれると、前記閉塞デバイスは予め定められた形状に展開し、前記動脈瘤の頸部を塞ぐ。より詳細には、シースを引き込む第1のステップにおいて、第1のアンカー構造体が展開され、動脈瘤頸部近傍の組織と接触して、もしくは近傍に位置し;第2のステップにおいて、閉塞構造体またはメンブレンンが動脈瘤の頸部を塞ぎ、第2のアンカー構造体が展開されて動脈瘤頸部近傍の組織と接触して、もしくは近傍に位置する。 Implantable devices can be delivered to their destination by using a delivery catheter with a pusher or rod, or a special microcatheter (referred to as a “delivery catheter”), or by using a pusher system with a release mechanism. The For example, in one embodiment, the occlusion structure is removably provided in a low position at the distal end of the delivery catheter, and is covered and held in a low position by a retractable sheath. The delivery catheter is positioned in the neck of the aneurysm by known techniques, and when the sheath is retracted, the occlusion device deploys to a predetermined shape and closes the neck of the aneurysm. More particularly, in the first step of retracting the sheath, the first anchor structure is deployed and is in contact with or located near tissue in the vicinity of the aneurysm neck; in the second step, the occlusion structure The body or membranous occludes the neck of the aneurysm and the second anchor structure is deployed and is in contact with or located near the tissue near the aneurysm neck.
図1は、2つのアンカー構造体32,33に設けられているパッチ、すなわち閉塞構造体31を有する閉塞デバイス30の実施例を示す。前記閉塞構造体すなわちメンブレンンを形成する好ましい材料は上述のとおりである。閉塞構造体31は、フレームワーク構造体34によって支えられており、フレームワーク構造体34は、少なくとも閉塞構造体31周囲の一部に、接着や縫合などの態様で閉塞構造体31に取り付けられている。フレームワーク構造体34は、翼状のアンカー構造体32,33に設けられている。フレームワーク構造体34およびアンカー構造体32,33は、いずれもニチノール合金などの形状変更可能な材料で形成することが好ましい。
FIG. 1 shows an embodiment of an
アンカー構造体32,33は、高剛性ワイヤすなわちチューブ状構造体、もしくは編み上げ構造体やその他メッシュ構造体などをから成る材料で形成してもよい。設置した状態においてアンカー構造体32,33は、少なくともアンカー構造体32,33の一部が動脈瘤の内壁や血管の内壁に接触する形状となっている。アンカー構造体32,33の形状は、円形、楕円形、その他曲線構造体をなすものとすることができ、多角形状としてもよい。好ましい実施態様としては、図1Aに示されるように、アンカー構造体32,33は、フレームワーク構造体34との結合部35から外方側へ曲線を描き、端部では結合部35より内方側へ互いに向かうよう楕円曲線形状をなしている。
The
図1Aに示された実施例において、アンカーループ32,33は、概して同じ形状の、同じ次元からなり、互いに向かい合った位置に取り付けられている。別の実施例として、異なる構造体、かつ/もしくは、次元からなるアンカー構造体としてもよい。例えば、一方のアンカー構造体が他方のそれよりも、長い、かつ/もしくは、幅広くしたり、両者で異なる3次元の曲線構造体や多面形状を有するとしてもよい。図では2つのアンカー構造体32,33が示されているが、さらなるアンカー構造体を付加してもよい。この場合、フレームワーク構造体34および/または閉塞構造体31に関して、対称となるよう取り付けることが好ましい。
In the embodiment shown in FIG. 1A, the
図1Bは、フレームワーク構造体39の側縁部に向かい合って設けられたアンカー構造体37,38を有する閉塞構造体36である、類似の閉塞デバイスを示す。閉塞構造体36のほぼ中央部に、開口部ないしは溝部を設けてもよい。アンカー構造体37,38は図1Bに示されるように、ほぼ曲線を描いており、その末端部は、対応するフレームワーク構造体および閉塞構造体の末端部を超えて延びている。本実施例における閉塞構造体およびフレームワーク構造体は、動脈瘤の頸部よりも広い表面を有しており、アンカー構造体は動脈瘤の内側に以下に述べる配置形状で設置される。本形状により、閉塞構造体には側方および下方への力が発生するため、動脈瘤の血管内腔の側面に合致し、動脈瘤の頸部を血流からシールして血管を修復する。
FIG. 1B shows a similar occlusion device, which is an
図1C−1Fは、図1Aおよび1Bに示した閉塞デバイスを動脈瘤に配置した状態で図式的に示したものである。血管Bの隆起部が動脈瘤Aを形成している。図1Cおよび1Dに示されるように、閉塞デバイス30は、頸部にわたって、および、動脈瘤の内部に配置され、閉塞構造体31は、動脈瘤の開口部を覆うように、アンカー構造体32,33は動脈瘤の内部において、少なくともその表面の一部が動脈瘤の内壁と接触するように配置されている。本形態において閉塞構造体31および支持部34は、動脈瘤の開口部に支持され、動脈瘤の外方側に位置している。図1Cおよび1Dに示された実施例において、閉塞構造体31および支持部34は、動脈瘤の外側に配置されている。図1Eは別の実施例を示し、閉塞構造体31および支持部34は、動脈瘤の開口部に支持され、動脈瘤の内方側に位置している。
FIGS. 1C-1F are schematic representations of the occlusion device shown in FIGS. 1A and 1B placed in an aneurysm. The raised portion of the blood vessel B forms an aneurysm A. As shown in FIGS. 1C and 1D, the
図1Fは、他の配置システムおよび方法を示し、少なくとも2つのアンカー構造体を有する閉塞デバイスは、閉塞構造体31が動脈瘤の開口部を覆うように、アンカー構造体32,33が動脈瘤の外側に位置し、動脈瘤近傍の血管内壁と接触するように配置されている。本実施例において、アンカー構造体32,33は、動脈瘤の頸部付近の血管内径と同じ大きさおよび形状を有しているため、アンカー構造体は動脈瘤のある血管に損傷を与えたり膨張させることなく、連続的な態様で血管の内壁と接触することができる。これらの実施例において、閉塞構造体は血管の欠陥を効率的に治療すべく動脈瘤の頸部を覆っており、アンカー構造体は血流を妨げることがない。
FIG. 1F shows another deployment system and method in which an occlusive device having at least two anchor structures has
図2Aは、フレームワーク構造体42によって支えられ、アンカー構造体43,44,45,46に設けられた閉塞構造体41を有する、別の閉塞デバイス40を示す。閉塞構造体41の特性や形状は上述のとおりである。閉塞構造体41は、フレームワーク構造体42によって支えられており、フレームワーク構造体41は、少なくとも閉塞構造体41周囲の一部に、接着や縫合などの態様で閉塞構造体41に取り付けられている。フレームワーク構造体42は、一対の翼状アンカー構造体43,44および45,46に設けられている。フレームワーク構造体42およびアンカー構造体43,44,45,46は、いずれもニチノール合金などの形状変更可能な材料で形成することが望ましい。
FIG. 2A shows another
アンカー構造体43,44,45,46は、設置された状態において、アンカー構造体43,44,45,46の少なくとも一部が動脈瘤の内壁もしくは血管の内壁と接触するよう設計されている。アンカー構造体43,44,45,46の設置された状態における形状は、円形、楕円形、その他曲線形状をなすものとすることができ、多角形状としてもよい。好ましい実施態様としては、図2Aに示されるように、アンカー構造体43,44,45,46は、フレームワーク構造体42との結合部から外方側へ曲線を描き、外位端部ではフレームワーク構造体42から内方側へ違いに向かうようほぼ楕円曲線形状をなしている。図2Aに示される実施例において、アンカーループ43,44,45,46は、ほぼ同じ形状、および、ほぼ同じ次元を有している。アンカーループ43および46は、アンカーループ44および45に関して、鏡像をなす位置関係にある。同様に、アンカーループ43および44は、アンカーループ46および45に関して、鏡像をなす位置関係にある。他の実施例として、アンカーループ43,44,45,46のそれぞれの形状、および/または、次元を変化させたり、異なるものとしてもよい。ここでは2対のアンカー構造体が図示されているが、さらなるアンカー構造体つまり対になるアンカー構造体を設けてもよい。アンカー構造体は、フレームワーク構造体42および/または閉塞構造体41に関して対象となるようとりつけることが好ましい。
The
図2Bは、図2Aに示した種類の閉塞デバイスを、2つのアンカー構造体が動脈瘤内部に配置されて少なくとも動脈瘤内壁の一部と接触しながら、パッチ41が動脈瘤の開口部を覆い、動脈瘤の外側に配置された2つのアンカー構造体が動脈瘤近傍の血管内壁に接触した状態で配置した状態で示す図である。図2Aに示されたタイプの閉塞デバイスを使用した血管の治療方法においては、第1のアンカー構造体、例えば動脈瘤A内部のアンカーループ43,46を、動脈瘤内部頸部付近の動脈瘤内壁に接触するよう配置し、閉塞構造体41を動脈瘤の頸部にわたり、頸部を覆うように配置させ、第2のアンカー構造体、例えば動脈瘤頸部の外側にあるアンカーループ44,45を動脈瘤頸部付近の血管内壁に接触するように配置している。
FIG. 2B shows an occlusion device of the type shown in FIG. 2A in which the
動脈瘤の閉塞デバイスに関する別の実施例について、図3Aは、一部を展開した状態で示し、図3Bは全部を展開した状態で示したものである。本実施例において、閉塞デバイス50は、上述の閉塞構造体および複数個の位置決め部材53,54,55,56を備えたメンブレンン52に円錐の先端を切り取った形状に結合されたテーパ状閉塞構造体51を有している。
For another example of an aneurysm occlusion device, FIG. 3A shows a partially expanded state and FIG. 3B shows a fully expanded state. In this embodiment, the
テーパ状閉塞構造体51は、ポーラスすなわち形状変更可能な金属材料から成るメッシュのような構造体が好ましく、搬送時は薄く、小径の構造体をなし、配置時には、広がって少なくとも一部が動脈瘤の内壁に接触する。前記ポーラスすなわちメッシュのような構造体は、該構造体内に大小の空間を有しており、これら空間および構造体は、左右対称でも非対称でもよく、曲線状・線状・角状のいずれでもよい。拡張式の前記メッシュのような構造体は、周知のもの、例えば様々な種類のステントを採用することができる。テーパ状閉塞構造体51は、その少なくとも一部を弾力性のある繊維や、シリコン材料、PFTE材料、ダクロン(登録商標)などの生体適合性のあるメンブレンン材料、線維状材料で覆ってもよい。
The
テーパ状閉塞構造体51は、小径ベース部57において閉塞メンブレンン52に結合ないしは設けられている。閉塞構造体51の周囲長は、小径ベース部57の直径と一致させてもよいし、小径ベース部57の直径より大きくしてもよい。例えば、閉塞構造体51は、フレームワーク構造体58の近傍に設けられており、小径ベース部57はフレームワーク構造体58の内周縁に設けられている。
The
閉塞デバイス50の位置決め部材53、54、55および56には、上述したアンカー構造体に類似したループ構造体を採用することができる。もしくは、硬金属構造体や非連続形のメッシュ、もしくは可撓性材料で前記位置決め部材を形成してもよい。2個以上の部材が、閉塞構造体51に関して、半径方向に対称となるよう配置されている。別の実施例として、テーパ状閉塞構造体51よりも浅く、テーパ形状をなす非連続のメッシュ構造体をアンカー構造体として設けることもできる。
A loop structure similar to the anchor structure described above can be employed for the
図4A−4Cは、閉塞デバイス50を動脈瘤の内側もしくは動脈瘤に掛け渡して設置を行う最中、もしくは設置後の配置された状態を示す図である。図4Aは、一部分が動脈瘤Aに挿入された状態の閉塞デバイス50を示す図である。テーパ状閉塞構造体51は、動脈瘤の頸部を通され第1のアンカー構造体として設置され、動脈瘤内にメンブレン52とともに配置される。メンブレン52は、動脈瘤の頸部に渡って広がっており、頸部を実質的に閉塞している。位置決め部材53、54、55および56は、設置の後に動脈瘤頸部の外側に配置されて、動脈瘤頸部近傍の血管内壁と接触する。このように閉塞デバイスを設置することにより、血管内壁が治療され、通常の健康状態に修復される。
FIGS. 4A to 4C are views showing a state in which the
図5は、埋め込み型デバイス60の別の実施例を示し、可撓性閉塞構造体61は、該閉塞構造体の近傍もしくは周囲に取り付けられた複数個のアンカー部材62を有している。アンカー部材62は、図に示されるように少なくとも2つの相隔たったアーム63、64を有しており、閉塞構造体61の内面ないしは外面に取り付け、もしくは向かい合うアーム63および64が閉塞構造体61の反対側の面から伸びて閉塞構造体61を貫通させた状態で取り付けられている。アーム63、64は、閉塞構造体上に位置するが、閉塞構造体61の外縁部65は、アーム63、64と閉塞構造体61の結合部よりも外側に配置されている。
FIG. 5 shows another embodiment of the
埋め込み型デバイス60は、カテーテルデバイスを介した低侵襲性の搬送を実現するために半径方向に折り畳み可能、もしくは圧縮可能である。搬送状態おいて、デバイスは小さな直径の円筒形状内を移動するため、アーム63、64は実質的に直線形状をなしている。所望の位置にデバイスを搬送した後、搬送状態におけるアームの一つが、拡張展開されて、頸部近傍の動脈瘤内壁に設置される。残りのアームは、一連のアームが、三次元空間内で相隔たって対峙するよう配置され、第2のアーム群は頸部近傍の血管内壁に配置される。閉塞構造体61は、各アンカーアームが展開された状態にあるとき、動脈瘤の頸部開口を覆うよう動脈瘤全体に渡って位置している。埋め込み型デバイス60が動脈瘤頸部に設置されると、閉塞構造体61が頸部を覆い、アーム63、64が動脈瘤内部および血管内に固定点を形成する。外縁部65は、閉塞構造体61のそれよりも大きな直径断面を有しており、動脈瘤頸部および/または頸部近傍の血管内壁に、さらなる被覆を別途形成している。
The
図6A−6Cは、他の実施例である閉塞デバイスを示す。閉塞システム70は、図6Aに示されるように、強化ネック構造体72および複数のアンカー構造体73、74を備えた中央閉塞構造体71を含んでいる。閉塞構造体71には、その中央領域に開口もしくは溝を随意設けてもよい。強化ネック構造体72は、閉塞構造体71と一体、もしくは別体として閉塞構造体71の周縁部に取り付けることができる。ネック構造体72は、補強部材75と可撓性メンブレンン部材とを含む。これらを組み合わせることにより、強化ネック構造体は、円筒形状や卵形状もしくは同種の形状の直立型襟構造体部を有し、これは動脈瘤の頸部に配置された後、動脈瘤内に突き出て、前記頸部を封鎖して血管から分離する。補強部材75は、図に示されるようにジグザグパターンで規定、もしくは、直立したネック構造体を構造体上支持する別の模様で規定することができる。強化ネック構造体72は、閉塞構造体71の平面から垂直に突き出る方向に描かれているが、望ましい適用形態、閉塞するべき身体の組織形状に応じて、強化ネック構造体72は、閉塞構造体71の面に対して鋭角ないしは鈍角をなして突出することが好ましい。
6A-6C show another embodiment of an occlusive device. The
閉塞システム70は、閉塞構造体71もしくはネック構造体72から広がり、前記閉塞構造体71もしくは前記ネック構造体72より大きな径を有している裾部76を含んでいる。裾部は閉塞すべき開口部をより広い領域に渡って閉塞し、開口部の外側に位置して、例えば動脈瘤の例であれば、動脈瘤頸部近傍の血管壁と接触する。裾部を含んだデバイスを開口部の形状が不定形な場合に使用すると特に好ましく、裾部の寸法は開口部に沿って調整される。裾部は、展開したときの直径が少なくとも10%伸びることが好ましい。より好ましくは15%であり、ある実施例においては20%である。さらに他の実施例においても、裾部の展開状態での直径は少なくとも30%伸びることが好ましい。
The
アンカー構造体73,74は、硬い材料から形成することが好ましく、ニチノール合金など形状記憶材料で形成することが好ましい。図6Aに示された実施例において、アンカー構造体73,74は、閉塞構造体71の面に対して両サイドの方向へ突出しており、構造体支持中間体77によって結合している。アンカー構造体は一体的に形成して単体としてもよいし、分離して別体としてもよい。アンカー構造体73,74は、丸角を備えた三角形状のものが図6Aには示されている。図6Bに示された閉塞構造体78の他の実施例において、前記アンカー構造体は、より丸みを帯びたペーパークリップのような構造体をなしている。アンカー構造体は、様々な大きさ、形状および幅をとることができる。使用目的によっては、アンカー構造体はメッシュに類似の、もしくはポーラス形状とすることができる。図では、3組のアンカー構造体が示されているが、当然これよりも数を多くしても少なくしてもよく、中央のパッチに対して対称となるよう放射状に配置する。
The
図6Cは似た構造体の閉塞構造体80を示し、円筒形状の襟領域部82とフレアー裾部83とを備えた中央閉塞構造体81が含まれている。前記襟領域部82と前記フレアー裾部83との境界部は、曲線を描き連続している。反対方向を向いたアンカーアーム84,85により補強がなされ、これらは交互にねじれ形状をなし、かつ放射状に配置されている。
FIG. 6C shows an
図7Aは、本発明における別の実施例である閉塞デバイス120を小さな直径の搬送状態で示す図であり、図7Bは代替例である閉塞デバイス130を大きな直径の展開状態で示す図である。閉塞デバイス120は、第1および第2のアンカー構造体122,124を含み、該アンカー構造体は中間襟構造体126から反対方向へ突出しており、閉塞構造体128の横方向へ伸びている。アンカー構造体122および124は形状変更可能な材料からなり、図7Aに示す搬送状態において全体的に円筒形状をなしている。配置時にアンカー構造体(124,126)は展開状態で実質的に円形のリングのような構造体となるよう外側へ大きく屈曲する。
FIG. 7A is a diagram showing an
アンカー構造体122および124は、展開状態において、実質的に組織を傷つけることがないもの、組織への外傷を最小限におさえるものが好ましい。ある実施例において、アンカー構造体122および124は、ほぼ扁平な構造体、断面形状を有している。図7Aに示された実施例において、アンカー構造体(122,124)は、ほぼ同じ形状および寸法を有しており、中間襟構造体の両面から突出し、ジグザグ状すなわちオフセット形状をなしている。展開した状態において、アンカー構造体122,124は、閉塞する欠損部と向かい合う組織の非重複部分と接触する。この配置により、外傷が与えられることはほとんどなく、閉塞デバイスが当接する領域の組織の生存力や血液の流れを促進し、維持することができる。膨張した遠位端および近位端のパッド123および125がアンカー構造体122および124にそれぞれ設けられており、閉塞装置の設置および展開を行い、組織と接着している領域での接触直径がより大きくなる。
The
図において、アンカー構造体122および124は、ほぼ三角形状の扁平なワイヤ構造体として描かれており、全体の長さは中間襟構造体よりも長いが、当然他の形状を採用することもできる。補強構造体や圧力分散構造体を表面に追加することも可能である。代替的に、もしくは、追加的に閉塞構造体を形成しているメンブレンンを少なくとも1つ以上のアンカー構造体に備えてもよい。
In the figure, the
少なくとも1つ以上の放射線不透過性マーカーが、アンカー構造体122,124の中間襟構造体から離れた端部の近傍に設けられていることが好ましく、すなわち植え込み型デバイスを展開した状態での近位端および遠位端にあたる。例えば、パッド123および125は、放射線不透過性マーカーを内蔵する、そのものから成る、もしくは備えており、設置作業の間もしくは設置した後において、アンカー構造体の末端部をマーキングする。放射線不透過性材料としては、タンタル、金、銀、バリウム、プラチナ、タングステンなどが好ましい。放射線不透過性マーカーは、例えば膠状接着や、粘着、圧着、溶接、レーザー溶接などによりアンカー構造体に結合させることができる。
At least one or more radiopaque markers are preferably provided in the vicinity of the end of the
中間襟構造体126は、リブ127で構成される円筒状の補強構造体を含んでおり、この補強構造体はアンカー構造体よりも密度が高い。リブ127は、可撓性のメンブレンン構造体に結合されており、本実施例において、襟構造体のほぼ全範囲に渡っている。メンブレンン構造体は、閉塞構造体128の横方向に伸びている。放射線不透過性マーカーは襟構造体126および/または閉塞構造体128に設けられるのが好ましい。
The
図7Bは、本発明における他の閉塞装置130の一部を部分的に展開した状態で示す。閉塞装置130は、中間襟構造体136の両面からおよび閉塞構造体138の側方から突出した第1および第2のアンカー構造体132,134を含む。アンカー構造体132,134は形状変更可能な材料から成り、図7Aに示されるように搬送状態においては、ほぼ円筒形状をなし、配置の際に構造体を変化させて、図7Bに示されるようにアンカー構造体132,134を備えたより大きな直径の構造体をなす。アンカー構造体132,134の展開した状態は、図7Bに示されるとおりであり、植え込み型デバイスにより修復される欠損部の種類や構造体に応じて、デバイスの中央線に向かって窪む。同様に、中央襟構造体136は、図7Bに示されるように展開した状態において、ほぼ直立した円筒形状をなして、円周の外方に湾曲しており、アンカー構造体とともに欠損部近傍の組織にデバイスを固定させている。欠損部の大きさや修復部組織の種類や厚さに応じて、デバイスは多様な湾曲形状をなす。
FIG. 7B shows a part of another
アンカー構造体132、134は、展開した状態において、接触する組織に対して実質的に非外傷性、ないしは外傷を最小限にするよう構成されていることが好ましい。ある実施例において、アンカー構造体132および134は、ほぼ円筒形状すなわちチューブ状の構造体をなし、断面形状を有している。図7Bに示されるように、部分的に転換されたアンカー構造体132,134は、中央襟構造体136の両サイドから突出しており、目的部で展開した状態において、アンカー構造体が欠損部の近傍の互いに向かい合う組織表面に接触するように配置されている。アンカー構造体の遠位端部は、広い表面積を形成し、終端部は鈍角をなしているため、組織と良好な姿勢で接触し、閉塞装置が接触する組織に外傷を与えることがほとんどない。
アンカー構造体132、134は、三角形状の扁平なワイヤ構造体として描かれており、全体の長さは中間襟構造体よりも長いが、当然のことながら他の形状を採用することもできる。アンカー構造体は、その表面に補強ないし圧力を分散させる構造体をさらに有していてもよい。閉塞構造体を構成するメンブレンンを代替的にもしくは追加的に1つ以上のアンカー構造体に備えさせてもよい。
The
少なくとも1つ以上の放射線不透過性マーカーが、アンカー構造体132、134の中間襟構造体から離れた端部の近傍に設けられていることが好ましく、すなわち植え込み型デバイスを展開した状態での近位端および遠位端にあたる。放射線不透過性マーカーは、例えば、放射線不透過性物質をアンカー構造体に結合させることで備えさせることができる。放射線不透過性材料としては、タンタル、金、銀、バリウム、プラチナ、タングステンなどが好ましい。放射線不透過性マーカーは、例えば膠状接着や、粘着、圧着、溶接、レーザー溶接などによりアンカー構造体に結合させることができる。バンド133および135は、設置作業の間もしくは設置した後において、アンカー構造体の末端部をマーキングするよう、放射線不透過性マーカーを内蔵する、またはそのものから成る、もしくはマーカーを備えている。
Preferably, at least one or more radiopaque markers are provided near the end of the
中間襟構造体136は、リブ137よりなる円筒形状の補強構造体を含んでおり、該補強構造体はアンカー構造体132,134よりも密度が高い。リブ137は十字形構造体をなし、可撓性のメンブレンン構造体に結合されており、襟構造体と同一の広がりを有している。襟構造体は、展開した状態において、直立した円筒形状を有し、襟構造体およびリブは、外方へ湾曲した円周構造体をなしている。横閉塞構造体138は、中間襟構造体136および/または襟構造体に取り付けられたメンブレンン構造体に設けられ、もしくは結合されており、ガイドワイヤその他の器具を通すための溝すなわち穴を設けてもよい。1つ以上の放射線不透過性マーカーが襟構造体136および/または横閉塞構造体138に設けられていることが好ましい。
The
図8は、別の実施例である閉塞デバイス90を示し、膨張した閉塞デバイス91は中央部に閉塞面と、補強構造体へ連結された基板とを備えている。基板は、複数のアンカー支柱体92および93を有し、向かい合ったアンカー支柱体92および93は花弁のような蹄状紋を左右対称の形状になしている。支柱92、93は中間構造体94によって互いに連結されている。前記補強構造体は、単体で構成してもよいし、複数の独立構造体を接続して構成してもよい。
FIG. 8 shows another embodiment of an
デバイス90は、小さな径の搬送状態で開口の頸部へ搬送された後に展開されると、まずアンカー支柱体92が開口部の内側で展開され、動脈瘤の内壁と接触もしくは近傍に位置され、中間体94は開口部の頸部に位置する。展開過程において、アンカー支柱体93は、展開された後に動脈瘤開口部近傍の血管内壁と接触するため、閉塞デバイス91は開口部において血管の方向へ押しつけられる。本実施例における閉塞デバイス91は不定形な形状の開口部を閉塞することができる。
When the
図9はさらに別の実施例である閉塞デバイス100を拡張された展開状態で示す。閉塞デバイス100は、湾曲した円錐形すなわち球根状の構造体101を含み、これは例えばニチノールのような薄膜上の形状記憶合金からなる。湾曲構造体101の小さな直径を備えた端部は閉塞しており(図示せず)、大きな直径を備えた端部は開口を有している。図9に示された実施例において、湾曲構造体101は、メンブレンン壁102すなわち複数個のリブ103により補強された複数個のメンブレンンパネルを含む。リブ103は、放射線状に対称的な形状に配置されており、数を増やすことも減らすこともできる。他の実施例として、メンブレンン壁102をメッシュ類似の構造体、もしくは別の種類のフレームワーク構造体で補強してもよい。
FIG. 9 shows an
閉塞デバイス100は、該デバイス100を位置決めし、開口部に固定するための、さらに少なくとも1つの固定構造体104を含んでいる。固定構造体104は、曲線状もしくはコイル状の帯の形状としてもよいし、花弁状もしくはループのような構造体としてもよく、さまざまな固定構造体104を採用できる。デバイス100が展開する際に、球根状構造体101は開口部の内側を拡張すべく配置され、固定構造体104は開口頸部の外側に配置されて、開口部付近の内壁と接触することによって、デバイス100を開口部に固定する。
The
図10は、別の実施例であるスパイラル形状の閉塞デバイス110を示す。フレームワーク構造体は、スパイラル構造体の内部境界もしくは外部境界に取り付けられており、メンブレンンがフレームワーク構造体に設けられもしくは一体的に取り付けられている。ある実施例において、スパイラル構造体は、小さな径の直径と大きな径の直径とを有するとすることができる。別の実施例として、閉塞デバイス110は、向かい合った二重スパイラルコイル形状を有している。本実施例において、向かい合ったコイルは、小さな直径部からなる中央部において結合し、互いに反対方向へ拡張している2つのコイルを含んでいる。
FIG. 10 shows another embodiment of a spiral shaped
コイル補強構造体は、ニチノールワイヤもしくはそれと類似の生体適合性があり形状変形可能な材料で形成し、閉塞構造体をなしているメンブレンン材料に埋め込み、ないしは設けてもよい。前記メンブレンンは、コイル補強構造体に貼り付けられてあるメンブレンンのループを重複できる寸法を有し、コイル状に巻かれた状態において、重複境界部を有している。閉塞デバイス110は、終端部すなわち大きな直径のコイルの端部が閉塞すべき開口部の内側に位置し、スパイラル形状が開口部を締め付けるように、展開される。向かい合うコイル構造体が結合している小さな直径の部分は、開口頸部にわたって位置し、開口部の外部領域で展開して、開口部近傍の構造体の内壁(血管内壁など)と接触する。
The coil reinforcing structure may be formed of a nitinol wire or a biocompatible and similar shape deformable material, and may be embedded in or provided in a membrane material forming an occluding structure. The membrane has a dimension capable of overlapping the loop of the membrane attached to the coil reinforcing structure, and has an overlapping boundary portion when wound in a coil shape. The
上記のように、ここに開示した閉塞システムに用いられる閉塞構造体およびメンブレンンは、薄膜ニチノール合金のような、薄膜の形状記憶合金で形成することができる。本願発明におけるメンブレンンや閉塞構造体に用いられる薄膜ニチノール合金は、約0.5−100ミクロンの厚さを有し、より好ましくは約2−50ミクロンの厚さを有し、45−55%のチタンおよびニッケルをそれぞれ含むとしてもよい。 As noted above, the occlusion structures and membranes used in the occlusion system disclosed herein can be formed from thin film shape memory alloys, such as thin film nitinol alloys. The thin-film Nitinol alloy used in the membranes and closure structures in the present invention has a thickness of about 0.5-100 microns, more preferably about 2-50 microns, and 45-55%. Each of titanium and nickel may be included.
薄膜ニチノール合金は、例えば米国特許第6533905号に開示されるような、全体を参照することにより開示は省略するが、スパッタリング技術を用いて製造される。かかる技術は、スパッタ蒸着された薄いニチノール合金の層の上に露出した外表層を有する、鉄やガラス、シリコンなどからなるマンドレルを使用する。スパッタ蒸着の後、マンドレル上に形成されたニチノール合金の薄膜にアーニングを施し、その結果生成された薄膜は、例えばマンドレルおよびマンドレルに形成された薄膜をエッチング液に浸すことによって剥がされる。アニールを施された薄膜上に気孔の模様を含むレジスト層を形成し、気孔の模様に対応した穿孔を作るために薄膜をさらし、レジスト層を除去することにより、穿孔や小さな穴、気孔がニチノール合金の薄膜上に形成されることがある。構造体部材はニチノール合金のスパッタ蒸着に先立って設置されるため、薄膜は直接構造体部材に付着される。 The thin film nitinol alloy is manufactured using sputtering techniques, the disclosure of which is omitted by reference as a whole, for example as disclosed in US Pat. No. 6,533,905. Such a technique uses a mandrel made of iron, glass, silicon or the like having an exposed outer layer on a sputter deposited thin layer of Nitinol alloy. After sputter deposition, the Nitinol alloy thin film formed on the mandrel is subjected to an annealing, and the resulting thin film is peeled off by, for example, immersing the mandrel and the thin film formed on the mandrel in an etching solution. By forming a resist layer containing pore patterns on the annealed thin film, exposing the thin film to create perforations corresponding to the pore patterns, and removing the resist layer, the perforations, small holes, and pores become Nitinol. Sometimes formed on a thin film of alloy. Since the structural member is installed prior to sputter deposition of the Nitinol alloy, the thin film is directly attached to the structural member.
閉塞デバイスに使用されている、フレームワーク、支持部材およびアンカー部材は、チタニウムニッケル合金薄膜(例えばニチノール合金)などの形状記憶合金薄膜からなる管もしくはシリンダから切断ないしはエッチングされる。形状記憶合金薄膜をエッチングする技術は、広く知られている。一実施例として、例えばGupta他(SMST-2003: Proc. Intl. Conf. Shape Memory Superelastic Technol., (Pacific Grove, CA) eds. A.R. Pelton &T. Duerig, p.639,2003)によって説明されているように薄肉管が製造される。簡潔に説明するに、ニチノール合金および犠牲材料(クロムなど)からなる複数の層が、研磨された酸化膜シリコンウエハのような扁平な基板表面に連続的にスパッタ蒸着される。前記シリコンウエハは、クロムからなる第1の蒸着層と、その後に蒸着されたニチノール合金からなる第2のクロム層と分離された2つの蒸着層とを備えている。ニチノール合金層の厚さは、1ないし40ミクロンとすることができ、クロム層の厚さは500オングストロームとすることができる。2枚のフォトマスクプレート(マスク1およびマスク2とする。)を使用し、これらマスクは、結果物の大きさや形状、ここではシリンダないしは管、を決定する既定のパターンが転写されている。マスク1はウエハ上の第2のクロム層からなるパターン形状を含んでおり、マスク2はニチノール合金層のパターン形状を含んでいる。ニチノール合金およびクロム層の薄膜にパターン形成するには、標準的なMEMS技術が用いられる。ウエハ上にニチノール合金およびクロム層の薄膜を蒸着した後に、クロムエッチング液に浸し、クロム層を剥がして第1および第2のニチノール合金層の間にポケットを形成することにより、複数層の薄膜構造体がウエハから除去される。分離された薄膜構造体は、例えばステンレススチールからなるマンドレルを2つのニチノール合金層の間に形成されたポケットに挿入し、真空中で500℃で温めることにより、3次元シリンダへ変形される。標準的なフォトグラフィ技術を用いることにより、所望の寸法、形状および模様の穿孔をニチノール合金層に形成することが可能である。 The framework, support member, and anchor member used in the occlusion device are cut or etched from a tube or cylinder made of a shape memory alloy thin film such as a titanium nickel alloy thin film (eg, Nitinol alloy). Techniques for etching shape memory alloy thin films are widely known. One example is described, for example, by Gupta et al. (SMST-2003: Proc. Intl. Conf. Shape Memory Superelastic Technol., (Pacific Grove, CA) eds. AR Pelton & T. Duerig, p. 639, 2003). Thus, a thin-walled tube is manufactured. Briefly, multiple layers of nitinol alloy and sacrificial material (such as chromium) are continuously sputter deposited onto a flat substrate surface such as a polished oxide silicon wafer. The silicon wafer includes a first vapor-deposited layer made of chromium, and a second vapor-deposited layer made of Nitinol alloy deposited thereafter and two vapor-deposited layers separated from each other. The thickness of the Nitinol alloy layer can be 1 to 40 microns, and the thickness of the chromium layer can be 500 angstroms. Two photomask plates (mask 1 and mask 2) are used, and these masks are transferred with a predetermined pattern for determining the size and shape of the resultant product, in this case, a cylinder or a tube. The mask 1 includes a pattern shape composed of a second chromium layer on the wafer, and the mask 2 includes a pattern shape of a nitinol alloy layer. Standard MEMS techniques are used to pattern Nitinol alloy and chromium layer thin films. After depositing a thin film of Nitinol alloy and a chromium layer on a wafer, a thin film structure having a plurality of layers is formed by dipping in a chromium etching solution and peeling the chromium layer to form a pocket between the first and second Nitinol alloy layers The body is removed from the wafer. The separated thin film structure is transformed into a three-dimensional cylinder by inserting a mandrel made of, for example, stainless steel into a pocket formed between two Nitinol alloy layers and heating in a vacuum at 500 ° C. By using standard photographic techniques, it is possible to form perforations of the desired size, shape and pattern in the Nitinol alloy layer.
また、ここに開示した植え込み型システムは、デバイスワイヤを備えた閉塞デバイスも含み、前記デバイスワイヤは、離脱ジョイントにより植え込み型デバイスを搬送/プッシュワイヤに着脱可能に接続している。デバイスワイヤは、遠位端において離脱ジョイントを介して植え込み型デバイスと一体的に、もしくは付属的に設けられており、植え込み型デバイスを体内の所望の位置にガイドカテーテルの案内により搬送するのに使用される。好ましいデバイスワイヤ、離脱ジョイントおよび搬送/プッシュワイヤは周知であり、本発明における閉塞装置にも使用することができる。デバイスおよびデバイスワイヤに用いられる素材も周知である。 The implantable system disclosed herein also includes an occlusion device with a device wire that removably connects the implantable device to the transport / push wire by a detachment joint. The device wire is provided at the distal end as an integral or ancillary with the implantable device via a detachment joint and is used to deliver the implantable device to a desired position in the body by guiding the guide catheter Is done. Preferred device wires, release joints and transfer / push wires are well known and can also be used in the closure device of the present invention. Materials used for devices and device wires are also well known.
本発明における閉塞システムは動脈瘤などの血管内の欠損や生理的欠損、内腔内や組織の空洞の欠損を治療するのに使用される。本発明における方法およびシステムは、侵襲的な外科処置を伴わない低侵襲性の内腔技術を使用することにより、内腔壁や組織欠損の治療と復元を可能にする。搬送および配置の手順は、他の代替手段にくらべ容易かつ時間がかからないものであり、結果的に合併症の危険を低減できる。 The occlusion system in the present invention is used to treat defects in blood vessels such as aneurysms, physiological defects, and defects in lumens and tissue cavities. The methods and systems in the present invention allow for the treatment and restoration of lumen walls and tissue defects by using minimally invasive lumen technology without invasive surgical procedures. The transport and placement procedure is easier and less time consuming than other alternatives and can consequently reduce the risk of complications.
図11は、本発明における植え込み型デバイスを、治療部に案内し配置するための搬送カテーテルに取り付けた状態で示す図であり、図12A−Eは、搬送および配置方法の例を示す図である。搬送システム140は、動脈瘤や血管内に形成された内腔など目的部分へ案内するために、適切な寸法、可撓性および押圧力を備えた搬送カテーテル142を含んでいる。神経血管の動脈瘤などのように、小さな内腔や入り組んだ通路に案内することが必要である場合には、搬送カテーテル142に、径が小さく、高可撓性を有したマイクロカテーテルを備えさせてもよい。搬送カテーテルの遠位端部は、可撓性がより高く、例えば近位端部よりも可撓性が高い。さまざまな搬送カテーテルが知られており、本発明の搬送システムに使用するのに適している。
FIG. 11 is a view showing the implantable device according to the present invention attached to a delivery catheter for guiding and placing it in a treatment section, and FIGS. 12A to 12E are diagrams showing examples of delivery and placement methods. . The
修復デバイス、ここに開示した2個の向かい合ったアンカー構造体を備えた修復デバイスおよび/または閉塞デバイスのいずれのものであってもよいが、搬送カテーテル142の遠位端141に径の小さな搬送状態で予め取り付けられているのが好ましい。搬送カテーテル142内を搬送される、修復デバイス144の遠位端部145は、動脈瘤や内腔内、搬送路の内壁と向かい合った内腔壁に配置されるアンカー構造体であることが好ましい。1つ以上の放射線不透過性マーカー146を修復デバイス144の遠位端部145ないしその近傍に設けることができる。搬送カテーテル142内を搬送される修復デバイス144の近位端部147は、動脈瘤や内腔内の頸部の近傍である血管壁、搬送路の内壁と向かい合った内腔壁に配置されるアンカー構造体であることが好ましい。1つ以上の放射線不透過性マーカー148を修復デバイス144の近位端部147ないしその近傍に設けることができる。修復デバイス144は、閉塞構造体149にあたるデバイス中央部の近位端に、追加的もしくは代替的に放射線不透過性マーカーを内蔵させてもよい。放射線不透過性マーカーは、搬送カテーテル142に関して、追加的もしくは代替的に設けられ、修復デバイス144の遠位端部および近位端部をそれぞれマーキングする。
A small diameter delivery condition at the
図11および12A−Eに示された搬送システムは、修復デバイス144を案内して位置決めするためのガイドワイヤ150および該ガイドワイヤ用の内腔を備え、修復デバイス144の近位端部147を接触させ、搬送カテーテル142から分離させるプッシャー152を使用している。好ましいガイドワイヤおよびプッシャーは周知であり、本発明の修復および閉塞デバイスでの使用に適している。
The delivery system shown in FIGS. 11 and 12A-E includes a
生理的欠損を修復する、すなわち開口や内腔160を閉塞するための方法においては、修復デバイス144を小さな直径内を搬送状態で目的とする修復箇所へガイドワイヤ150を伝って、非侵襲性ないしは低侵襲性技術を用いて、第1のアンカー構造体に相当する修復デバイス144の遠位端部を、図12Aに示す修復開口部に位置させ案内することを伴う。もしくは、中間襟構造体もしくは閉塞構造体149に設けられた放射線不透過性マーカーにより修復デバイス144を血管170内の動脈瘤や欠損部160に位置させてもよい。一連のアンカーアーム145を含む第1のアンカー構造体は、修復デバイス144の遠位端を搬送カテーテル142から押圧し、および/または、第1のアンカー構造体を図12Bに示されるように頸部近傍の動脈瘤内壁に接触するよう位置づけるために、搬送カテーテル142を引き戻すことにより展開される。展開によって、第1のアンカーアーム145は、円周方向に開いて広がり、アンカー構造体は欠損部の表面もしくは近傍に接触し、もしくは、正確かつ無傷の位置合わせを行うために設置および位置決めの最中は、第1のアンカー構造体に設けられた放射線不透過性マーカー146を監視するようにしてもよい。
In a method for repairing a physiological defect, i.e., closing an opening or
第1のアンカー構造体を配置した後、閉塞構造体149を備えた修復デバイスの中間部が修復対象である開口部を覆って展開され、図12Cに図示されるように欠損開口部を閉塞する。中間閉塞構造体149の展開によって、閉塞構造体は開口部を覆うように、開いて広がる。この状態において、第1のアンカーアーム145は、動脈瘤内壁の一側面と接触し、もしくは一側面の近傍に位置し、閉塞構造体149は、内腔開口部を覆っている。その後に、第2のアンカー構造体147およびそれに備え付けられた放射線不透過性マーカー148を含む修復デバイスの近位端部が、搬送カテーテル142から押し出される、もしくは、閉塞デバイスに対して前記カテーテルを引き戻すことにより、図12Dに示されるように展開される。第2のアンカー構造体が展開されたことにより、アンカーアーム147は外方へ開いて広がり、搬送路を形成する部分との境界部である欠損部表面に接触し、もしくは欠損部表面の近傍に位置する。この時点で、閉塞デバイス144は、しっかりと固定され、ガイドワイヤ150は搬送カテーテル142内に引き戻されている。図12Eに示されるように、搬送システム140は抜き取られ、閉塞デバイスは開口部を修復する。
After placing the first anchor structure, the middle portion of the repair device with the
本発明における方法およびシステムによれば、身体上の欠損部および開口部を、開口部を覆うように閉塞構造体を取り付け、欠損部近傍の内腔もしくは組織の両側面に配置されるアンカー構造体を備えた閉塞構造体を、開口部を越えた位置に支持し、固定することにより、効果的に修復することができる。デバイスが配置された領域における細胞および内皮の再生により、組織機能の回復がすすみ、欠損部が修復される。放射線不透過性マーカーは、デバイスの設置および位置合わせに使用されるが、設置後もさまざまな場面でデバイスの位置を監視することもできる。 According to the method and system of the present invention, the defect structure and the opening on the body are attached to the cavity or the tissue on both sides of the tissue in the vicinity of the defect by attaching the occlusion structure so as to cover the opening. It is possible to effectively repair the occlusion structure provided with the above by supporting and fixing it at a position beyond the opening. Regeneration of cells and endothelium in the area where the device is placed promotes recovery of tissue function and repairs the defect. Radiopaque markers are used for device installation and alignment, but the device position can also be monitored in various situations after installation.
本発明に関する以上の説明は、特定の好ましい実施例との関係で記載されており、説明のために詳細を示したが、実施例の追加と同様に、ここに記された詳細を本願発明を越えない範囲でさまざまな変形や変更が可能であることは当業者にとって自明である。 The foregoing description of the present invention has been set forth in the context of certain preferred embodiments, and details have been set forth for purposes of illustration. However, as with the addition of embodiments, the details set forth herein may be used to It will be apparent to those skilled in the art that various modifications and changes can be made without departing from the scope.
詳細な説明において引用したすべての参考資料および刊行物はその全体を参照することにより本書に組み込まれる。 All references and publications cited in the detailed description are hereby incorporated by reference in their entirety.
30、40、50、60 閉塞デバイス
31、41、51、61 閉塞構造体
32、34、37、38、43、44、45、46 アンカー構造体
84、85、145、147 アンカーアーム
126 襟構造体
140 搬送システム
142 搬送カテーテル
150 ガイドワイヤ
152 プッシャー
A 動脈瘤
B 血管
30, 40, 50, 60
Claims (15)
前記デバイスが前記展開状態であるときに前記腔内を実質的に覆う寸法の閉塞構造体であって、中央部および周辺部を有する閉塞構造体と、
前記閉塞構造体に結合されて、前記対象とする組織欠損において前記植え込み型デバイスを固定するように構成される複数のアンカー構造体と、
前記閉塞構造体の前記周辺部に近接して前記腔内に少なくとも部分的に突出するように構成される補強構造体と
を備え、
前記補強構造体は、前記閉塞構造体の前記周辺部に結合される襟構造体を含み、
前記複数のアンカー構造体のそれぞれは、前記襟構造体の外面に取り付けられた構造体支持中間体と、前記閉塞構造体の面の両側において前記腔内及び血管内に突出した部分とを有し、且つ前記腔内及び血管内に突出した部分のそれぞれが前記構造体支持中間体によって環状に結合している、植え込み型デバイス。 An implantable device capable of repairing a cavity of a target tissue defect and transforming from a delivery state having a small diameter shape to a deployed state having a larger diameter shape,
An occlusion structure sized to substantially cover the interior of the cavity when the device is in the deployed state, the occlusion structure having a central portion and a peripheral portion;
A plurality of anchor structures coupled to the occlusion structure and configured to secure the implantable device in the targeted tissue defect;
A reinforcement structure configured to protrude at least partially into the cavity proximate to the periphery of the occlusion structure;
The reinforcing structure includes a collar structure coupled to the peripheral portion of the closing structure,
Each of the plurality of anchor structures has a structure support intermediate attached to the outer surface of the collar structure, and portions projecting into the cavity and the blood vessel on both sides of the surface of the occlusion structure. and wherein each of the cavity and the projecting portion in a blood vessel is attached to the annular by the structure supporting intermediate, implantable device.
前記デバイスが前記展開状態であるときに前記開口部または腔内を実質的に覆う寸法の閉塞構造体と、
前記閉塞構造体に結合されて前記対象とする組織欠損において前記植え込み型デバイスを固定するように構成される複数のアンカー構造体であって、前記閉塞構造体から離れる方向に少なくとも部分的に突出して、前記植え込み型デバイスが展開状態であるときに略円筒構造をなすアンカー構造体と、
前記閉塞構造体の周辺部に近接して前記腔内に少なくとも部分的に突出するように構成される補強構造体と
を備え、
前記補強構造体は、前記閉塞構造体の前記周辺部に結合される襟構造体を含み、
前記複数のアンカー構造体のそれぞれは、前記襟構造体の外面に取り付けられた構造体支持中間体と、前記閉塞構造体の面の両側において前記腔内及び血管内に突出した部分とを有し、且つ前記腔内及び血管内に突出した部分のそれぞれが前記構造体支持中間体によって環状に結合している、植え込み型デバイス。 An implantable device capable of repairing an opening or cavity of a target tissue defect and transforming from a delivery state having a small diameter shape to a deployed state having a larger diameter shape,
An occlusion structure dimensioned to substantially cover the opening or cavity when the device is in the deployed state;
A plurality of anchor structures coupled to the occlusion structure and configured to secure the implantable device in the targeted tissue defect, wherein the anchor structure protrudes at least partially away from the occlusion structure; An anchor structure having a substantially cylindrical structure when the implantable device is in a deployed state;
A reinforcing structure configured to protrude at least partially into the cavity proximate to a periphery of the occlusion structure;
The reinforcing structure includes a collar structure coupled to the peripheral portion of the closing structure,
Each of the plurality of anchor structures has a structure support intermediate attached to the outer surface of the collar structure, and portions projecting into the cavity and the blood vessel on both sides of the surface of the occlusion structure. and wherein each of the cavity and the projecting portion in a blood vessel is attached to the annular by the structure supporting intermediate, implantable device.
Applications Claiming Priority (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US72805205P | 2005-10-19 | 2005-10-19 | |
| US60/728,052 | 2005-10-19 | ||
| US11/324,827 | 2006-01-03 | ||
| US11/324,827 US8545530B2 (en) | 2005-10-19 | 2006-01-03 | Implantable aneurysm closure systems and methods |
| US74740006P | 2006-05-16 | 2006-05-16 | |
| US60/747,400 | 2006-05-16 | ||
| US80320006P | 2006-05-25 | 2006-05-25 | |
| US60/803,200 | 2006-05-25 | ||
| US82373006P | 2006-08-28 | 2006-08-28 | |
| US60/823,730 | 2006-08-28 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013098487A Division JP5785215B2 (en) | 2005-10-19 | 2013-05-08 | Method and system for clipping intravascular and repairing intracavitary and tissue defects |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015083139A JP2015083139A (en) | 2015-04-30 |
| JP6195817B2 true JP6195817B2 (en) | 2017-09-13 |
Family
ID=48878414
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013098488A Expired - Fee Related JP5955266B2 (en) | 2005-10-19 | 2013-05-08 | Method and system for clipping intravascular and repairing intracavitary and tissue defects |
| JP2013098487A Expired - Fee Related JP5785215B2 (en) | 2005-10-19 | 2013-05-08 | Method and system for clipping intravascular and repairing intracavitary and tissue defects |
| JP2014234876A Expired - Fee Related JP6195817B2 (en) | 2005-10-19 | 2014-11-19 | Method and system for clipping intravascular and repairing intracavitary and tissue defects |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013098488A Expired - Fee Related JP5955266B2 (en) | 2005-10-19 | 2013-05-08 | Method and system for clipping intravascular and repairing intracavitary and tissue defects |
| JP2013098487A Expired - Fee Related JP5785215B2 (en) | 2005-10-19 | 2013-05-08 | Method and system for clipping intravascular and repairing intracavitary and tissue defects |
Country Status (3)
| Country | Link |
|---|---|
| JP (3) | JP5955266B2 (en) |
| CN (2) | CN103230290A (en) |
| HK (1) | HK1134421A1 (en) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2651438T3 (en) | 2009-09-04 | 2018-01-26 | Pulsar Vascular, Inc. | Systems to enclose an anatomical opening |
| EP2713904B1 (en) | 2011-06-03 | 2018-01-10 | Pulsar Vascular, Inc. | Aneurysm devices with additional anchoring mechanisms and associated systems |
| JP6563192B2 (en) | 2011-06-03 | 2019-08-21 | パルサー バスキュラー インコーポレイテッド | Aneurysm device and aneurysm treatment system |
| EP3735916A1 (en) | 2011-10-05 | 2020-11-11 | Pulsar Vascular, Inc. | Devices for enclosing an anatomical opening |
| EP2846706A1 (en) | 2012-05-10 | 2015-03-18 | Pulsar Vascular, Inc. | Coil-tipped aneurysm devices |
| WO2016137997A1 (en) * | 2015-02-25 | 2016-09-01 | Galaxy Therapeutics, Llc | System for and method of treating aneurysms |
| CN106139291A (en) * | 2015-04-20 | 2016-11-23 | 浦易(上海)生物技术有限公司 | A kind of irrigation of sinuses conduit |
| EP3402432B1 (en) * | 2016-01-15 | 2023-05-31 | TVA Medical, Inc. | Devices for forming a fistula |
| US20180049859A1 (en) * | 2016-08-16 | 2018-02-22 | Spartan Micro, Inc. | Intravascular flow diversion devices |
| EP3908208A4 (en) * | 2019-03-15 | 2022-10-19 | Sequent Medical, Inc. | Filamentary devices having a flexible joint for treatment of vascular defects |
| EP3908354A4 (en) * | 2019-03-15 | 2023-04-26 | Sequent Medical, Inc. | Filamentary devices for treatment of vascular defects |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2298637A1 (en) * | 1997-08-04 | 1999-02-11 | Jennifer J. Mccrory | Occlusion system for aneurysm repair |
| FR2767671B1 (en) * | 1997-08-27 | 1999-11-26 | Ethnor | PROSTHETIC SHUTTER DEVICE FOR SHUTTERING HERNARY CHANNELS |
| EP1685808B1 (en) * | 1998-01-30 | 2016-09-14 | St.Jude Medical ATG, Inc. | Device for use in closing septal defects and an installation assembly for such device |
| US6022369A (en) * | 1998-02-13 | 2000-02-08 | Precision Vascular Systems, Inc. | Wire device with detachable end |
| US6015424A (en) * | 1998-04-28 | 2000-01-18 | Microvention, Inc. | Apparatus and method for vascular embolization |
| US6613074B1 (en) * | 1999-03-10 | 2003-09-02 | Cordis Corporation | Endovascular aneurysm embolization device |
| US6551303B1 (en) * | 1999-10-27 | 2003-04-22 | Atritech, Inc. | Barrier device for ostium of left atrial appendage |
| WO2002071977A2 (en) * | 2001-03-08 | 2002-09-19 | Atritech, Inc. | Atrial filter implants |
| US20030181922A1 (en) * | 2002-03-20 | 2003-09-25 | Spiration, Inc. | Removable anchored lung volume reduction devices and methods |
| US20030195553A1 (en) * | 2002-04-12 | 2003-10-16 | Scimed Life Systems, Inc. | System and method for retaining vaso-occlusive devices within an aneurysm |
| US8075585B2 (en) * | 2002-08-29 | 2011-12-13 | Stryker Corporation | Device and method for treatment of a vascular defect |
| BRPI0617652A2 (en) * | 2005-10-19 | 2011-08-02 | Pulsar Vascular Inc | methods and systems for endovascular incision and repair of tissue and lumen defects |
-
2006
- 2006-10-18 CN CN 201310106823 patent/CN103230290A/en active Pending
- 2006-10-18 CN CN201310108702.7A patent/CN103381101B/en not_active Expired - Fee Related
-
2010
- 2010-01-08 HK HK10100192.4A patent/HK1134421A1/en not_active IP Right Cessation
-
2013
- 2013-05-08 JP JP2013098488A patent/JP5955266B2/en not_active Expired - Fee Related
- 2013-05-08 JP JP2013098487A patent/JP5785215B2/en not_active Expired - Fee Related
-
2014
- 2014-11-19 JP JP2014234876A patent/JP6195817B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2013208440A (en) | 2013-10-10 |
| JP5785215B2 (en) | 2015-09-24 |
| CN103230290A (en) | 2013-08-07 |
| CN103381101A (en) | 2013-11-06 |
| JP5955266B2 (en) | 2016-07-20 |
| CN103381101B (en) | 2017-12-01 |
| HK1134421A1 (en) | 2010-04-30 |
| JP2015083139A (en) | 2015-04-30 |
| JP2013226419A (en) | 2013-11-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6195817B2 (en) | Method and system for clipping intravascular and repairing intracavitary and tissue defects | |
| JP2009512515A (en) | Methods and systems for clipping within a vessel and repairing intraluminal and tissue defects. | |
| CA3012247C (en) | Methods and systems for endovascularly clipping and repairing lumen and tissue defects | |
| KR101652804B1 (en) | Systems and methods for supporting or occluding a physiological opening or cavity | |
| US7232461B2 (en) | Neck covering device for an aneurysm | |
| EP1316293A2 (en) | Aneurysm embolic device with an occlusive member | |
| EP1312312A1 (en) | Aneurysm neck cover for sealing an aneurysm | |
| AU2014200427B2 (en) | Methods and systems for endovascularly clipping and repairing lumen and tissue defects |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20151020 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20151021 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160120 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160415 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161004 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170223 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20170330 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20170330 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20170424 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170718 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170816 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6195817 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |