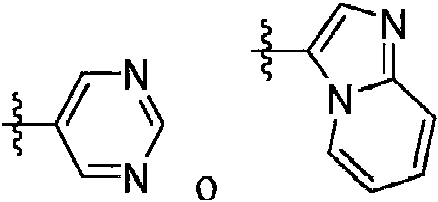
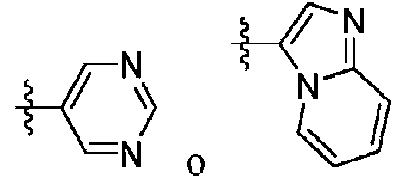
ES2940111T3 - Inhibidores de MAGL de pirazol - Google Patents
Inhibidores de MAGL de pirazol Download PDFInfo
- Publication number
- ES2940111T3 ES2940111T3 ES18806431T ES18806431T ES2940111T3 ES 2940111 T3 ES2940111 T3 ES 2940111T3 ES 18806431 T ES18806431 T ES 18806431T ES 18806431 T ES18806431 T ES 18806431T ES 2940111 T3 ES2940111 T3 ES 2940111T3
- Authority
- ES
- Spain
- Prior art keywords
- compound
- formula
- another embodiment
- alkyl
- pharmaceutically acceptable
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000003112 inhibitor Substances 0.000 title description 10
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 title description 2
- 102100029814 Monoglyceride lipase Human genes 0.000 title 1
- 101710116393 Monoglyceride lipase Proteins 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 1158
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 35
- 125000000217 alkyl group Chemical group 0.000 claims description 518
- 150000003839 salts Chemical class 0.000 claims description 448
- 239000012453 solvate Substances 0.000 claims description 390
- 150000001204 N-oxides Chemical class 0.000 claims description 360
- 229910052736 halogen Inorganic materials 0.000 claims description 206
- 125000001072 heteroaryl group Chemical group 0.000 claims description 205
- 150000002367 halogens Chemical class 0.000 claims description 202
- -1 -C(O)NR 8 R 9 Chemical group 0.000 claims description 193
- 125000003118 aryl group Chemical group 0.000 claims description 189
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 136
- 229910052799 carbon Inorganic materials 0.000 claims description 118
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 113
- 229910052739 hydrogen Inorganic materials 0.000 claims description 108
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 106
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 74
- 125000004737 (C1-C6) haloalkoxy group Chemical group 0.000 claims description 34
- 229910052757 nitrogen Inorganic materials 0.000 claims description 31
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 23
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 21
- 125000000304 alkynyl group Chemical group 0.000 claims description 19
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 17
- 125000003545 alkoxy group Chemical group 0.000 claims description 16
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 15
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 14
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 11
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 6
- 125000005843 halogen group Chemical group 0.000 claims description 3
- 125000000041 C6-C10 aryl group Chemical group 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 73
- 102000005398 Monoacylglycerol Lipase Human genes 0.000 abstract description 24
- 108020002334 Monoacylglycerol lipase Proteins 0.000 abstract description 24
- 238000011282 treatment Methods 0.000 abstract description 13
- 208000002193 Pain Diseases 0.000 abstract description 12
- 150000003217 pyrazoles Chemical class 0.000 abstract description 3
- 235000002639 sodium chloride Nutrition 0.000 description 428
- 238000002360 preparation method Methods 0.000 description 115
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 102
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 98
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 92
- 125000003373 pyrazinyl group Chemical group 0.000 description 90
- 125000004076 pyridyl group Chemical group 0.000 description 90
- 125000000714 pyrimidinyl group Chemical group 0.000 description 90
- 239000000243 solution Substances 0.000 description 76
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 70
- 239000007787 solid Substances 0.000 description 59
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 58
- 125000001309 chloro group Chemical group Cl* 0.000 description 56
- 239000003921 oil Substances 0.000 description 54
- 235000019198 oils Nutrition 0.000 description 54
- 125000000753 cycloalkyl group Chemical group 0.000 description 49
- 238000000034 method Methods 0.000 description 47
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 45
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 39
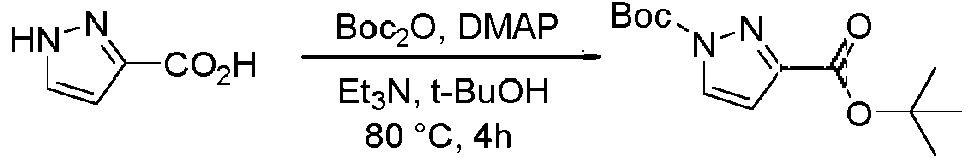
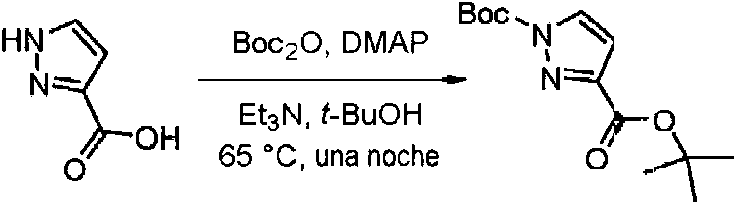
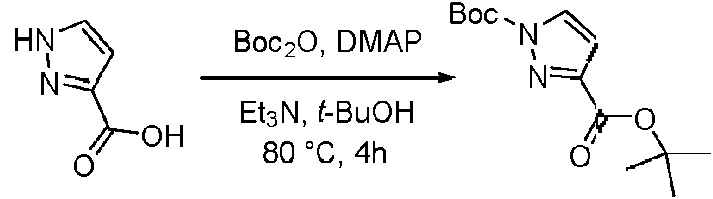
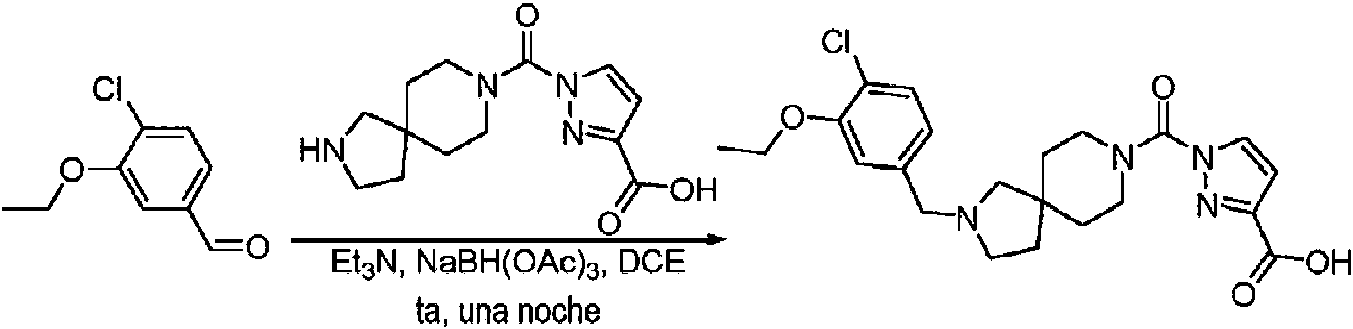
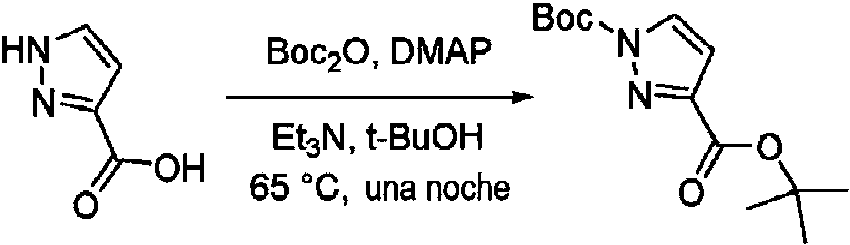
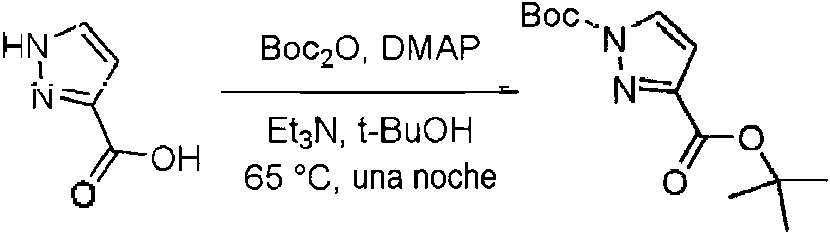
- KOPFEFZSAMLEHK-UHFFFAOYSA-N 1h-pyrazole-5-carboxylic acid Chemical compound OC(=O)C=1C=CNN=1 KOPFEFZSAMLEHK-UHFFFAOYSA-N 0.000 description 36
- 230000002829 reductive effect Effects 0.000 description 34
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 33
- 125000004432 carbon atom Chemical group C* 0.000 description 30
- 239000003937 drug carrier Substances 0.000 description 26
- 239000003814 drug Substances 0.000 description 25
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 24
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 24
- 239000002253 acid Substances 0.000 description 24
- 239000012043 crude product Substances 0.000 description 23
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 22
- 150000003254 radicals Chemical class 0.000 description 22
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 21
- 239000012044 organic layer Substances 0.000 description 21
- 239000000126 substance Substances 0.000 description 21
- 229940124597 therapeutic agent Drugs 0.000 description 20
- 125000001188 haloalkyl group Chemical group 0.000 description 19
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 18
- 125000002947 alkylene group Chemical group 0.000 description 18
- 201000010099 disease Diseases 0.000 description 18
- 125000003710 aryl alkyl group Chemical group 0.000 description 17
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 16
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 16
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 15
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 14
- 238000002953 preparative HPLC Methods 0.000 description 14
- 239000000741 silica gel Substances 0.000 description 14
- 229910002027 silica gel Inorganic materials 0.000 description 14
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 13
- 239000000651 prodrug Substances 0.000 description 13
- 229940002612 prodrug Drugs 0.000 description 13
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 12
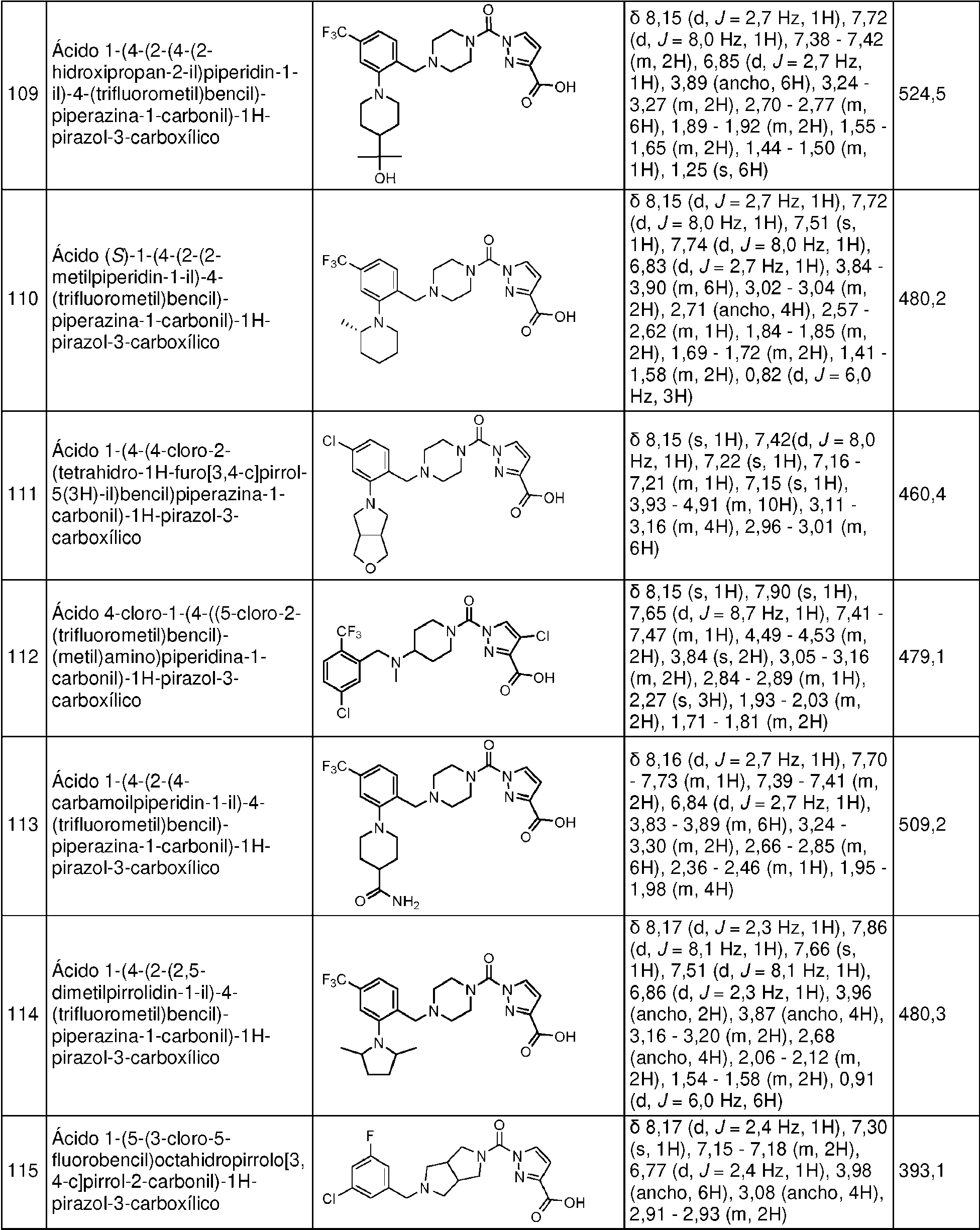
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 12
- 125000004450 alkenylene group Chemical group 0.000 description 11
- 235000019439 ethyl acetate Nutrition 0.000 description 11
- 239000001257 hydrogen Substances 0.000 description 11
- 229920000728 polyester Polymers 0.000 description 11
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 11
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 10
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- 125000004122 cyclic group Chemical group 0.000 description 10
- 239000002904 solvent Substances 0.000 description 10
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 10
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 9
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 9
- 125000003342 alkenyl group Chemical group 0.000 description 9
- 125000001424 substituent group Chemical group 0.000 description 9
- 239000003826 tablet Substances 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 8
- 239000000443 aerosol Substances 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- 239000012267 brine Substances 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 239000012299 nitrogen atmosphere Substances 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 239000002775 capsule Substances 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 229920001223 polyethylene glycol Polymers 0.000 description 7
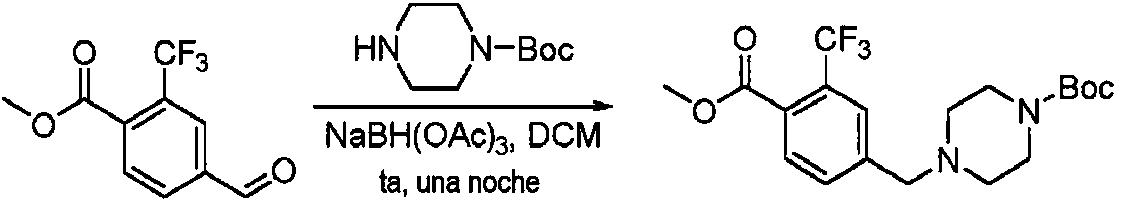
- CNYHXGWMOXZFSK-UHFFFAOYSA-N 2-morpholin-4-yl-4-(trifluoromethyl)benzaldehyde Chemical compound FC(F)(F)C1=CC=C(C=O)C(N2CCOCC2)=C1 CNYHXGWMOXZFSK-UHFFFAOYSA-N 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- RUPAXCPQAAOIPB-UHFFFAOYSA-N tert-butyl formate Chemical compound CC(C)(C)OC=O RUPAXCPQAAOIPB-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 235000019441 ethanol Nutrition 0.000 description 5
- 229930195733 hydrocarbon Natural products 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 5
- 125000004433 nitrogen atom Chemical group N* 0.000 description 5
- 125000004430 oxygen atom Chemical group O* 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 239000003981 vehicle Substances 0.000 description 5
- NXLNNXIXOYSCMB-UHFFFAOYSA-N (4-nitrophenyl) carbonochloridate Chemical compound [O-][N+](=O)C1=CC=C(OC(Cl)=O)C=C1 NXLNNXIXOYSCMB-UHFFFAOYSA-N 0.000 description 4
- ICTJJZZEEDJONJ-UHFFFAOYSA-N 1-[4-[[2-(4-methoxypiperidin-1-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound COC1CCN(CC1)C1=C(CN2CCN(CC2)C(=O)N2C=CC(=N2)C(O)=O)C=CC(=C1)C(F)(F)F ICTJJZZEEDJONJ-UHFFFAOYSA-N 0.000 description 4
- HEPGXLMDVVQGKW-UHFFFAOYSA-N 1-[4-[[3-(1,3,4-oxadiazol-2-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCN(CC2=CC(C3=NN=CO3)=C(C=C2)C(F)(F)F)CC1 HEPGXLMDVVQGKW-UHFFFAOYSA-N 0.000 description 4
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 4
- RCRCTBLIHCHWDZ-UHFFFAOYSA-N 2-Arachidonoyl Glycerol Chemical compound CCCCCC=CCC=CCC=CCC=CCCCC(=O)OC(CO)CO RCRCTBLIHCHWDZ-UHFFFAOYSA-N 0.000 description 4
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 4
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 4
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 4
- 239000004215 Carbon black (E152) Substances 0.000 description 4
- 102100029111 Fatty-acid amide hydrolase 1 Human genes 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- 238000005481 NMR spectroscopy Methods 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 244000000231 Sesamum indicum Species 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 229940024606 amino acid Drugs 0.000 description 4
- 235000001014 amino acid Nutrition 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 4
- 229910000024 caesium carbonate Inorganic materials 0.000 description 4
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- 229920001577 copolymer Polymers 0.000 description 4
- 125000004093 cyano group Chemical group *C#N 0.000 description 4
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 108010046094 fatty-acid amide hydrolase Proteins 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 125000004438 haloalkoxy group Chemical group 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 150000004677 hydrates Chemical class 0.000 description 4
- 125000001841 imino group Chemical group [H]N=* 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 4
- 231100000252 nontoxic Toxicity 0.000 description 4
- 230000003000 nontoxic effect Effects 0.000 description 4
- 125000004043 oxo group Chemical group O=* 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 239000001301 oxygen Chemical group 0.000 description 4
- 239000006187 pill Substances 0.000 description 4
- 125000004194 piperazin-1-yl group Chemical group [H]N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 4
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000000454 talc Substances 0.000 description 4
- 229910052623 talc Inorganic materials 0.000 description 4
- 235000012222 talc Nutrition 0.000 description 4
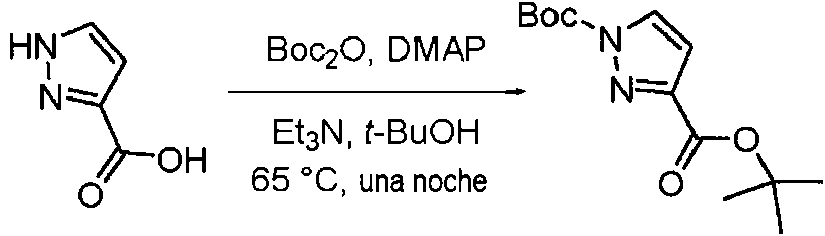
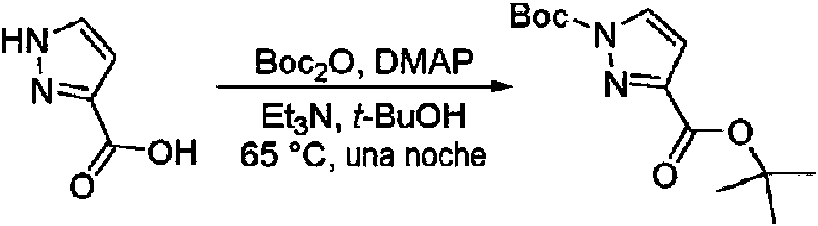
- MGLRGTCTAGDWHH-UHFFFAOYSA-N tert-butyl 1h-pyrazole-5-carboxylate Chemical compound CC(C)(C)OC(=O)C1=CC=NN1 MGLRGTCTAGDWHH-UHFFFAOYSA-N 0.000 description 4
- 238000004809 thin layer chromatography Methods 0.000 description 4
- 125000000464 thioxo group Chemical group S=* 0.000 description 4
- IAYCLPRLPPWDKM-UHFFFAOYSA-N 1-[(3-phenoxyphenyl)methyl]piperazine Chemical compound C=1C=CC(OC=2C=CC=CC=2)=CC=1CN1CCNCC1 IAYCLPRLPPWDKM-UHFFFAOYSA-N 0.000 description 3
- FXSLPMKIRCORBK-UHFFFAOYSA-N 1-[4-(4-chloro-2-pyrrolidin-1-ylphenoxy)piperidine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCC(CC1)OC1=C(C=C(Cl)C=C1)N1CCCC1 FXSLPMKIRCORBK-UHFFFAOYSA-N 0.000 description 3
- BKKFKWMKBYBTKM-UHFFFAOYSA-N 1-[4-[(3-phenoxyphenyl)methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCN(CC2=CC(OC3=CC=CC=C3)=CC=C2)CC1 BKKFKWMKBYBTKM-UHFFFAOYSA-N 0.000 description 3
- SGMDESAZPAMNGY-UHFFFAOYSA-N 1-[4-[(4-chlorophenyl)methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCN(CC2=CC=C(Cl)C=C2)CC1 SGMDESAZPAMNGY-UHFFFAOYSA-N 0.000 description 3
- IUXGEXXNCOFCMX-UHFFFAOYSA-N 1-[4-[[2-(4-cyclopropylpiperazin-1-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCN(CC2=C(C=C(C=C2)C(F)(F)F)N2CCN(CC2)C2CC2)CC1 IUXGEXXNCOFCMX-UHFFFAOYSA-N 0.000 description 3
- BWLCFRNKNSOPJB-UHFFFAOYSA-N 1-[4-[[4-carbamoyl-3-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound NC(=O)C1=C(C=C(CN2CCN(CC2)C(=O)N2C=CC(=N2)C(O)=O)C=C1)C(F)(F)F BWLCFRNKNSOPJB-UHFFFAOYSA-N 0.000 description 3
- IPDIGUOFPDUJNU-UHFFFAOYSA-N 1-[[2-(2H-tetrazol-5-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine Chemical compound FC(F)(F)C1=CC(C2=NN=NN2)=C(CN2CCNCC2)C=C1 IPDIGUOFPDUJNU-UHFFFAOYSA-N 0.000 description 3
- IKCDOGCPDMFWMC-UHFFFAOYSA-N 1-[[2-(4-methoxypiperidin-1-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine Chemical compound COC1CCN(CC1)C1=C(CN2CCNCC2)C=CC(=C1)C(F)(F)F IKCDOGCPDMFWMC-UHFFFAOYSA-N 0.000 description 3
- XMPDDNVWJPKPPA-UHFFFAOYSA-N 2-(4-cyclopropylpiperazin-1-yl)-4-(trifluoromethyl)benzaldehyde Chemical compound C1(CC1)N1CCN(CC1)C1=C(C=O)C=CC(=C1)C(F)(F)F XMPDDNVWJPKPPA-UHFFFAOYSA-N 0.000 description 3
- UKIXYGGGTJTCRZ-UHFFFAOYSA-N 2-[5-(piperazin-1-ylmethyl)-2-(trifluoromethyl)phenyl]-1,3,4-oxadiazole Chemical compound FC(F)(F)C1=C(C=C(CN2CCNCC2)C=C1)C1=NN=CO1 UKIXYGGGTJTCRZ-UHFFFAOYSA-N 0.000 description 3
- CTMZQMJOFDKZSC-UHFFFAOYSA-N 2-[5-(piperazin-1-ylmethyl)-2-(trifluoromethyl)phenyl]-1,3-thiazole Chemical compound N1(CCNCC1)CC=1C=CC(=C(C=1)C=1SC=CN=1)C(F)(F)F CTMZQMJOFDKZSC-UHFFFAOYSA-N 0.000 description 3
- CUKSTNNYAHZPRM-UHFFFAOYSA-N 2-bromo-4-(trifluoromethyl)benzaldehyde Chemical compound FC(F)(F)C1=CC=C(C=O)C(Br)=C1 CUKSTNNYAHZPRM-UHFFFAOYSA-N 0.000 description 3
- KFEHNXLFIGPWNB-UHFFFAOYSA-N 2-fluoro-4-(trifluoromethyl)benzaldehyde Chemical compound FC1=CC(C(F)(F)F)=CC=C1C=O KFEHNXLFIGPWNB-UHFFFAOYSA-N 0.000 description 3
- MWYYNBYTVFKXSD-UHFFFAOYSA-N 3-bromo-4-(trifluoromethyl)benzaldehyde Chemical compound FC(F)(F)C1=CC=C(C=O)C=C1Br MWYYNBYTVFKXSD-UHFFFAOYSA-N 0.000 description 3
- MASPGGIBDSHHMI-UHFFFAOYSA-N 3-pyrrolidin-1-yl-4-(trifluoromethyl)benzaldehyde Chemical compound N1(CCCC1)C=1C=C(C=O)C=CC=1C(F)(F)F MASPGGIBDSHHMI-UHFFFAOYSA-N 0.000 description 3
- HYUNOXQDPPWPNG-UHFFFAOYSA-N 4-(3-chloro-2-pyrrolidin-1-ylphenoxy)piperidine Chemical compound ClC=1C(=C(OC2CCNCC2)C=CC=1)N1CCCC1 HYUNOXQDPPWPNG-UHFFFAOYSA-N 0.000 description 3
- RMWIHKAGTKIREP-UHFFFAOYSA-N 4-(4-chloro-2-pyrrolidin-1-ylphenoxy)piperidine Chemical compound ClC1=CC(=C(OC2CCNCC2)C=C1)N1CCCC1 RMWIHKAGTKIREP-UHFFFAOYSA-N 0.000 description 3
- DBCWXUBBBZVJNH-UHFFFAOYSA-N 4-(piperazin-1-ylmethyl)-2-(trifluoromethyl)benzamide Chemical compound FC(F)(F)C1=C(C(=O)N)C=CC(=C1)CN1CCNCC1 DBCWXUBBBZVJNH-UHFFFAOYSA-N 0.000 description 3
- OJCWHAUBHLREMV-UHFFFAOYSA-N 4-[(3-phenoxyphenyl)methyl]piperazine-1-carbonyl chloride Chemical compound O(C1=CC=CC=C1)C=1C=C(CN2CCN(CC2)C(=O)Cl)C=CC1 OJCWHAUBHLREMV-UHFFFAOYSA-N 0.000 description 3
- OAKIEZUQBAMODH-UHFFFAOYSA-N 4-[(4-chlorophenyl)methyl]piperazine-1-carbonyl chloride Chemical compound C1CN(C(=O)Cl)CCN1CC1=CC=C(Cl)C=C1 OAKIEZUQBAMODH-UHFFFAOYSA-N 0.000 description 3
- CBLJUYRHYBNVRW-UHFFFAOYSA-N 4-[2-(piperazin-1-ylmethyl)-5-(trifluoromethyl)phenyl]morpholine Chemical compound C1COCCN1C1=CC(C(F)(F)F)=CC=C1CN1CCNCC1 CBLJUYRHYBNVRW-UHFFFAOYSA-N 0.000 description 3
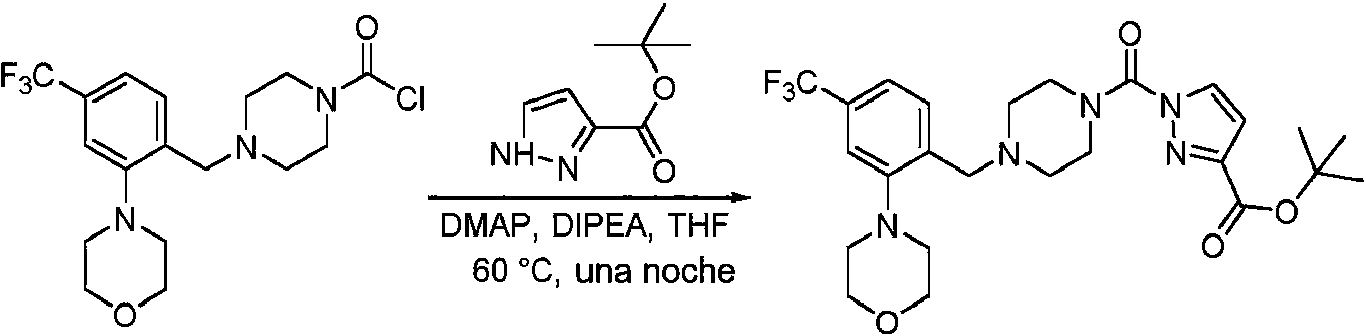
- SNOPGQFJPOWMAL-UHFFFAOYSA-N 4-[[2-morpholin-4-yl-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl chloride Chemical compound O1CCN(CC1)C1=C(CN2CCN(CC2)C(=O)Cl)C=CC(=C1)C(F)(F)F SNOPGQFJPOWMAL-UHFFFAOYSA-N 0.000 description 3
- 208000000094 Chronic Pain Diseases 0.000 description 3
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 206010065390 Inflammatory pain Diseases 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 208000019695 Migraine disease Diseases 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 206010039710 Scleroderma Diseases 0.000 description 3
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 3
- 125000004419 alkynylene group Chemical group 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 150000005840 aryl radicals Chemical group 0.000 description 3
- 235000012216 bentonite Nutrition 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- YAGCIXJCAUGCGI-UHFFFAOYSA-N butoxycarbonyl butyl carbonate Chemical compound CCCCOC(=O)OC(=O)OCCCC YAGCIXJCAUGCGI-UHFFFAOYSA-N 0.000 description 3
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 3
- 229920002301 cellulose acetate Polymers 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 239000012230 colorless oil Substances 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 3
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 3
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 150000007529 inorganic bases Chemical class 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- CGGGWRDRBMSXOL-UHFFFAOYSA-N methyl 4-formyl-2-(trifluoromethyl)benzoate Chemical compound COC(=O)C1=CC=C(C=O)C=C1C(F)(F)F CGGGWRDRBMSXOL-UHFFFAOYSA-N 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 206010027599 migraine Diseases 0.000 description 3
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 3
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 description 3
- 150000007530 organic bases Chemical class 0.000 description 3
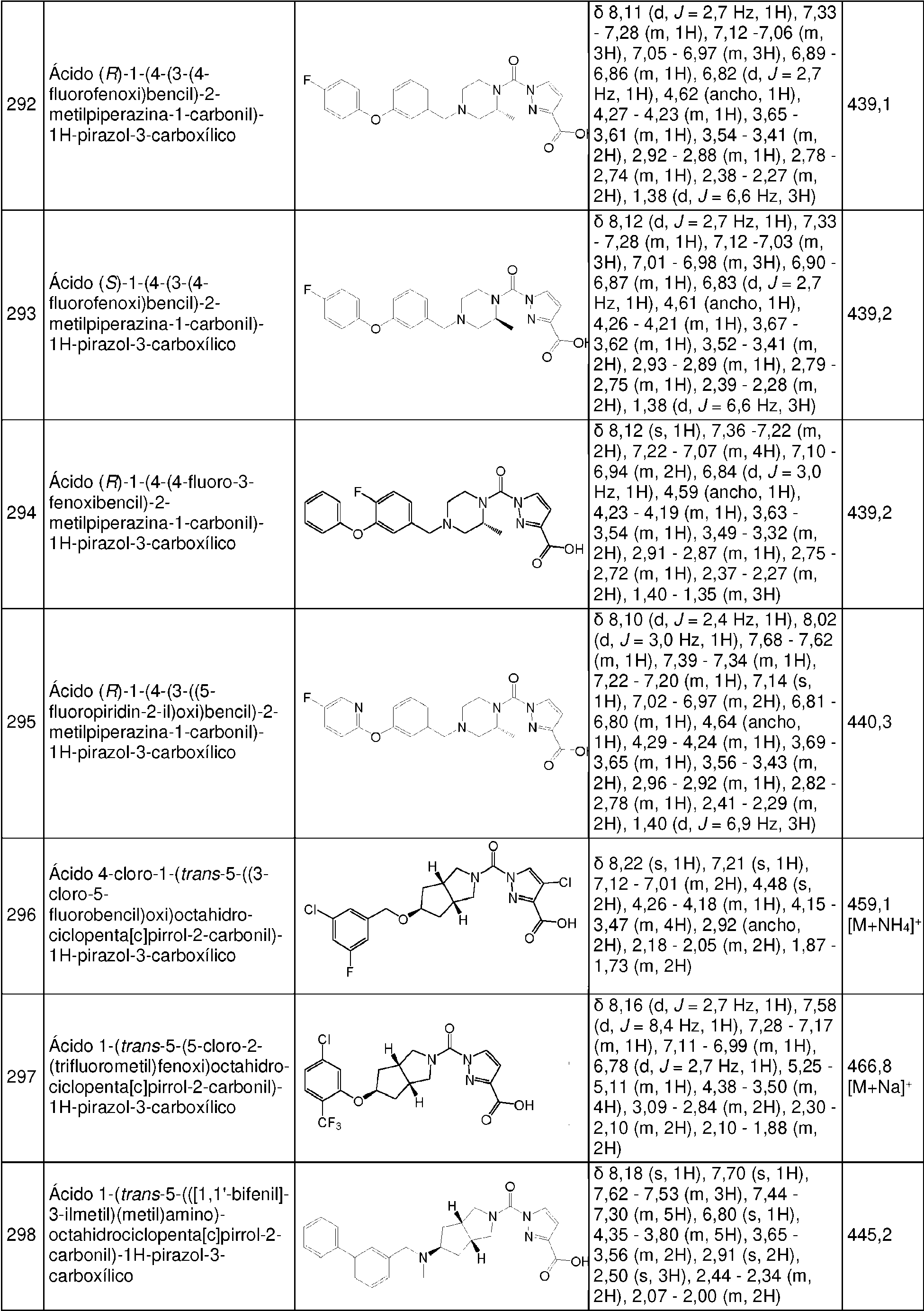
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000003380 propellant Substances 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 239000011593 sulfur Chemical group 0.000 description 3
- 239000000829 suppository Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical group C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 2
- WJQDLIWTNWATDW-UHFFFAOYSA-N 1-[4-(3-chloro-2-pyrrolidin-1-ylphenoxy)piperidine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCC(CC1)OC1=C(N2CCCC2)C(Cl)=CC=C1 WJQDLIWTNWATDW-UHFFFAOYSA-N 0.000 description 2
- XFNQWPHANVRBFG-UHFFFAOYSA-N 1-[4-[[2-morpholin-4-yl-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound O1CCN(CC1)C1=C(CN2CCN(CC2)C(=O)N2N=C(C=C2)C(=O)O)C=CC(=C1)C(F)(F)F XFNQWPHANVRBFG-UHFFFAOYSA-N 0.000 description 2
- XFHATGRFWRRROJ-UHFFFAOYSA-N 1-[4-[[3-(1,3-thiazol-2-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound S1C(=NC=C1)C=1C=C(CN2CCN(CC2)C(=O)N2N=C(C=C2)C(=O)O)C=CC=1C(F)(F)F XFHATGRFWRRROJ-UHFFFAOYSA-N 0.000 description 2
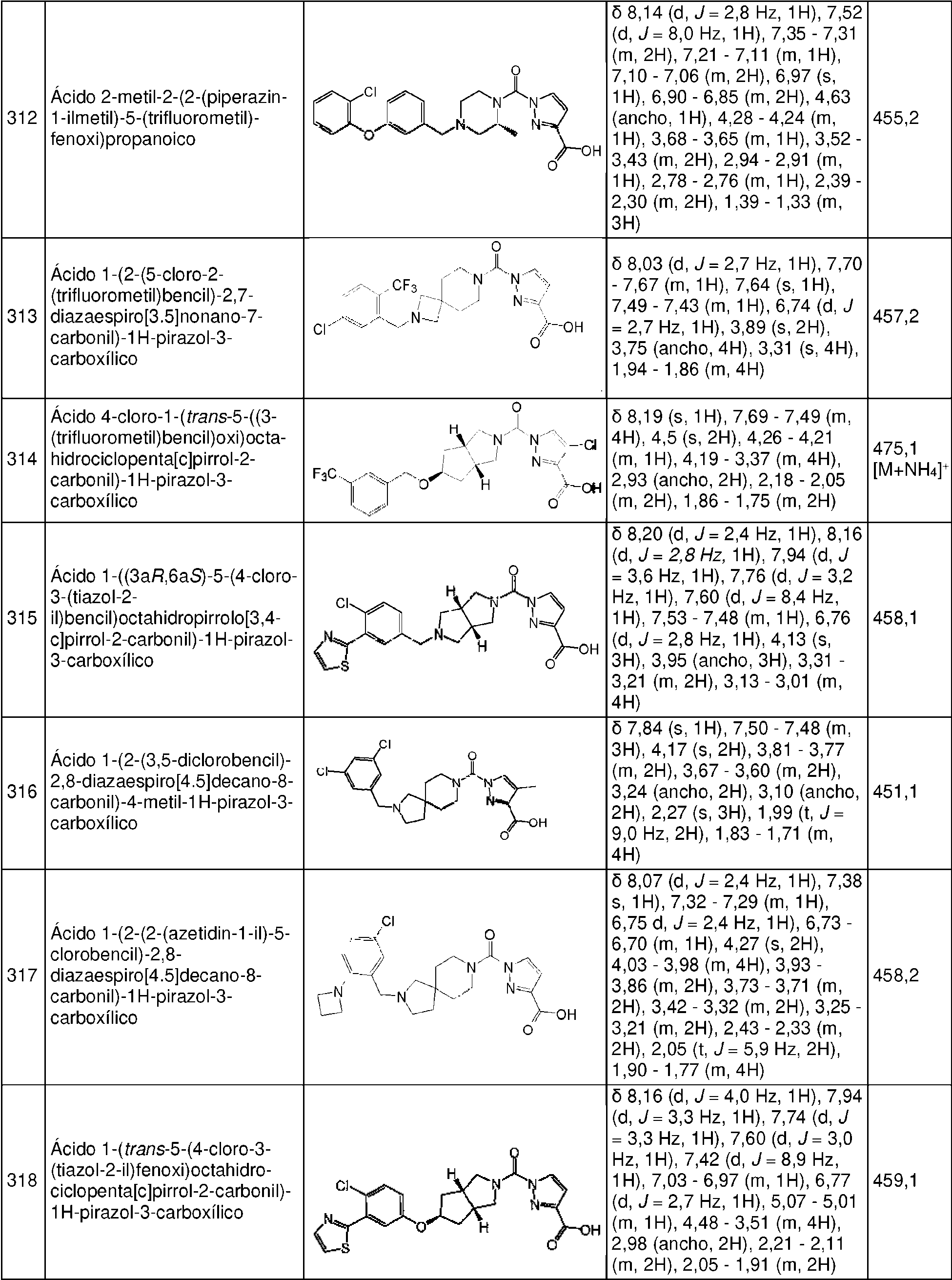
- ZOZAVFGYNHGBKX-UHFFFAOYSA-N 1-[4-[[3-pyrrolidin-1-yl-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound N1(CCCC1)C=1C=C(CN2CCN(CC2)C(=O)N2N=C(C=C2)C(=O)O)C=CC=1C(F)(F)F ZOZAVFGYNHGBKX-UHFFFAOYSA-N 0.000 description 2
- IQXXEPZFOOTTBA-UHFFFAOYSA-N 1-benzylpiperazine Chemical compound C=1C=CC=CC=1CN1CCNCC1 IQXXEPZFOOTTBA-UHFFFAOYSA-N 0.000 description 2
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 2
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical group C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- XNLRUHYWEBAYSK-UHFFFAOYSA-N 4-(4-chloro-2-pyrrolidin-1-ylphenoxy)piperidine-1-carbonyl chloride Chemical compound ClC1=CC(=C(OC2CCN(CC2)C(=O)Cl)C=C1)N1CCCC1 XNLRUHYWEBAYSK-UHFFFAOYSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 2
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 229920002785 Croscarmellose sodium Polymers 0.000 description 2
- 229920000858 Cyclodextrin Polymers 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 241000206672 Gelidium Species 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 102000004157 Hydrolases Human genes 0.000 description 2
- 108090000604 Hydrolases Proteins 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical class C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- 229940122357 Monoacylglycerol lipase inhibitor Drugs 0.000 description 2
- 150000001200 N-acyl ethanolamides Chemical class 0.000 description 2
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical group C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 229930040373 Paraformaldehyde Natural products 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 235000010419 agar Nutrition 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000003125 aqueous solvent Substances 0.000 description 2
- 239000007900 aqueous suspension Substances 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 239000000440 bentonite Substances 0.000 description 2
- 229910000278 bentonite Inorganic materials 0.000 description 2
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 2
- 125000002619 bicyclic group Chemical group 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
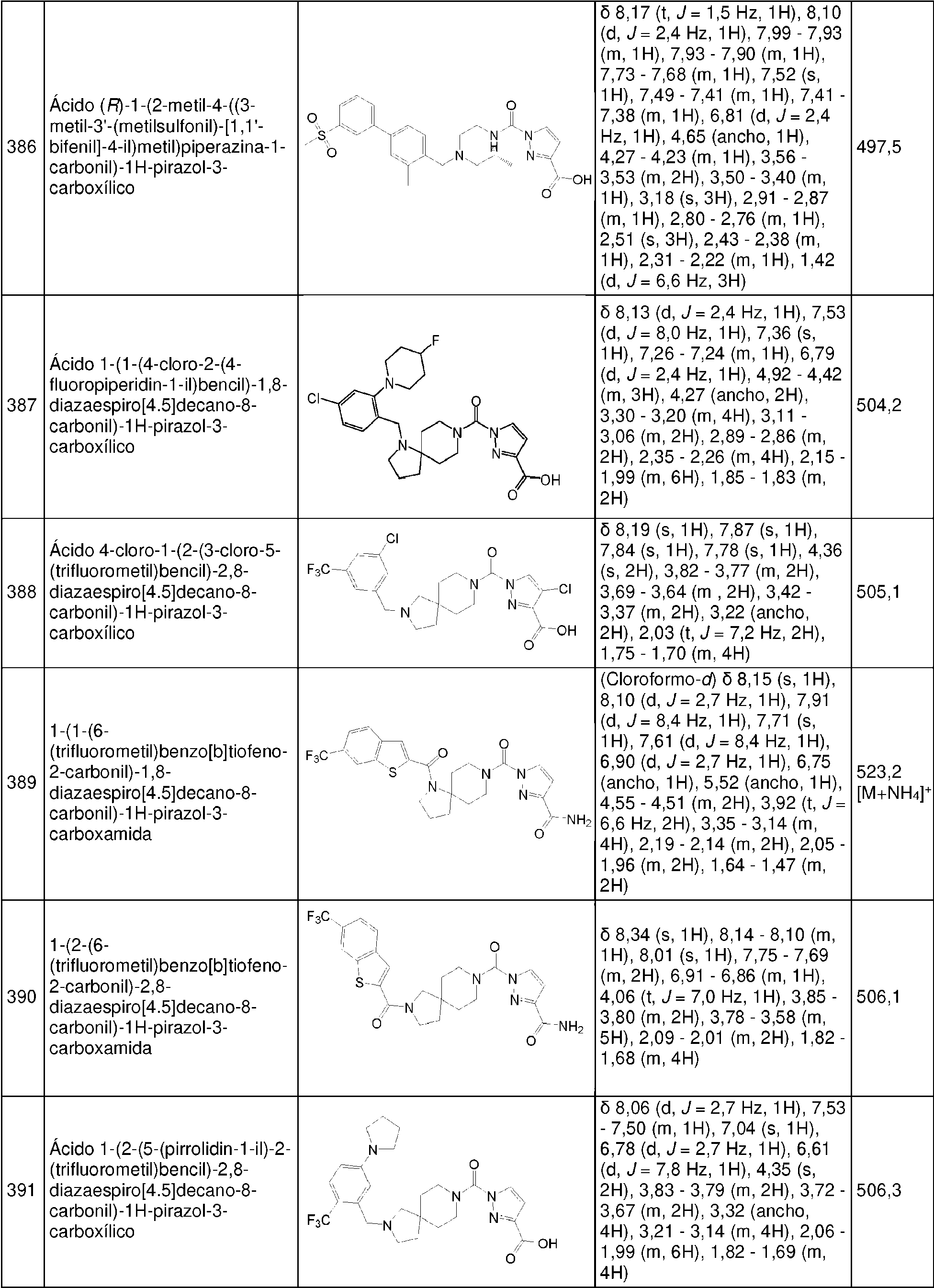
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000011260 co-administration Methods 0.000 description 2
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 2
- 229940097362 cyclodextrins Drugs 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 2
- 229940038472 dicalcium phosphate Drugs 0.000 description 2
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000008298 dragée Substances 0.000 description 2
- 210000001198 duodenum Anatomy 0.000 description 2
- 239000002621 endocannabinoid Substances 0.000 description 2
- 230000008029 eradication Effects 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 2
- 230000003301 hydrolyzing effect Effects 0.000 description 2
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 2
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 2
- 229920000639 hydroxypropylmethylcellulose acetate succinate Polymers 0.000 description 2
- 210000003405 ileum Anatomy 0.000 description 2
- PQNFLJBBNBOBRQ-UHFFFAOYSA-N indane Chemical group C1=CC=C2CCCC2=C1 PQNFLJBBNBOBRQ-UHFFFAOYSA-N 0.000 description 2
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 2
- 239000003701 inert diluent Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 210000001630 jejunum Anatomy 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- 238000000465 moulding Methods 0.000 description 2
- 208000004296 neuralgia Diseases 0.000 description 2
- 208000021722 neuropathic pain Diseases 0.000 description 2
- 150000007523 nucleic acids Chemical group 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 239000004006 olive oil Substances 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 229920002866 paraformaldehyde Polymers 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 150000003014 phosphoric acid esters Chemical class 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- RFIOZSIHFNEKFF-UHFFFAOYSA-M piperazine-1-carboxylate Chemical compound [O-]C(=O)N1CCNCC1 RFIOZSIHFNEKFF-UHFFFAOYSA-M 0.000 description 2
- BCIIMDOZSUCSEN-UHFFFAOYSA-N piperidin-4-amine Chemical compound NC1CCNCC1 BCIIMDOZSUCSEN-UHFFFAOYSA-N 0.000 description 2
- DNUTZBZXLPWRJG-UHFFFAOYSA-M piperidine-1-carboxylate Chemical compound [O-]C(=O)N1CCCCC1 DNUTZBZXLPWRJG-UHFFFAOYSA-M 0.000 description 2
- 229940100467 polyvinyl acetate phthalate Drugs 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 229960004063 propylene glycol Drugs 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- LIXZTXGVUBFISN-UHFFFAOYSA-N pyrazole-1,3-dicarboxylic acid Chemical compound OC(=O)C=1C=CN(C(O)=O)N=1 LIXZTXGVUBFISN-UHFFFAOYSA-N 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- WVYADZUPLLSGPU-UHFFFAOYSA-N salsalate Chemical compound OC(=O)C1=CC=CC=C1OC(=O)C1=CC=CC=C1O WVYADZUPLLSGPU-UHFFFAOYSA-N 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000008109 sodium starch glycolate Substances 0.000 description 2
- 229920003109 sodium starch glycolate Polymers 0.000 description 2
- 229940079832 sodium starch glycolate Drugs 0.000 description 2
- 239000007909 solid dosage form Substances 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 229940032147 starch Drugs 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 125000003107 substituted aryl group Chemical group 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 125000001273 sulfonato group Chemical class [O-]S(*)(=O)=O 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- 150000003512 tertiary amines Chemical class 0.000 description 2
- YAPQBXQYLJRXSA-UHFFFAOYSA-N theobromine Chemical compound CN1C(=O)NC(=O)C2=C1N=CN2C YAPQBXQYLJRXSA-UHFFFAOYSA-N 0.000 description 2
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 238000000844 transformation Methods 0.000 description 2
- WUOFQGMXQCSPPV-UHFFFAOYSA-N tributyl(1,3-thiazol-2-yl)stannane Chemical compound CCCC[Sn](CCCC)(CCCC)C1=NC=CS1 WUOFQGMXQCSPPV-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- RDJGLLICXDHJDY-NSHDSACASA-N (2s)-2-(3-phenoxyphenyl)propanoic acid Chemical compound OC(=O)[C@@H](C)C1=CC=CC(OC=2C=CC=CC=2)=C1 RDJGLLICXDHJDY-NSHDSACASA-N 0.000 description 1
- 125000006645 (C3-C4) cycloalkyl group Chemical group 0.000 description 1
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 1
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- 125000005988 1,1-dioxo-thiomorpholinyl group Chemical group 0.000 description 1
- 229940058015 1,3-butylene glycol Drugs 0.000 description 1
- ROUYUBHVBIKMQO-UHFFFAOYSA-N 1,4-diiodobutane Chemical compound ICCCCI ROUYUBHVBIKMQO-UHFFFAOYSA-N 0.000 description 1
- GSJXJZOWHSTWOX-UHFFFAOYSA-N 1-[(4-chlorophenyl)methyl]piperazine Chemical compound C1=CC(Cl)=CC=C1CN1CCNCC1 GSJXJZOWHSTWOX-UHFFFAOYSA-N 0.000 description 1
- UFUBGKUPTKJBOI-UHFFFAOYSA-N 1-[4-[[2-(2H-tetrazol-5-yl)-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound OC(=O)C1=NN(C=C1)C(=O)N1CCN(CC2=C(C=C(C=C2)C(F)(F)F)C2=NN=NN2)CC1 UFUBGKUPTKJBOI-UHFFFAOYSA-N 0.000 description 1
- WXIKEAGXDXRJCE-UHFFFAOYSA-N 1-[4-methyl-4-[methyl-[[2-(1,3-thiazol-2-yl)-4-(trifluoromethyl)phenyl]methyl]amino]piperidine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound CN(CC1=C(C=C(C=C1)C(F)(F)F)C1=NC=CS1)C1(C)CCN(CC1)C(=O)N1C=CC(=N1)C(O)=O WXIKEAGXDXRJCE-UHFFFAOYSA-N 0.000 description 1
- URTXIRXNHTWPMT-UHFFFAOYSA-N 1-[4-methyl-4-[methyl-[[2-morpholin-4-yl-4-(trifluoromethyl)phenyl]methyl]amino]piperidine-1-carbonyl]pyrazole-3-carboxylic acid Chemical compound CN(CC1=C(C=C(C=C1)C(F)(F)F)N1CCOCC1)C1(C)CCN(CC1)C(=O)N1C=CC(=N1)C(O)=O URTXIRXNHTWPMT-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- HNZJIWIXRPBFAN-UHFFFAOYSA-N 1-cyclopropylpiperazine Chemical compound C1CC1N1CCNCC1 HNZJIWIXRPBFAN-UHFFFAOYSA-N 0.000 description 1
- 125000005987 1-oxo-thiomorpholinyl group Chemical group 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- HCSBTDBGTNZOAB-UHFFFAOYSA-N 2,3-dinitrobenzoic acid Chemical class OC(=O)C1=CC=CC([N+]([O-])=O)=C1[N+]([O-])=O HCSBTDBGTNZOAB-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-UHFFFAOYSA-N 2-(hydroxymethyl)-6-[4,5,6-trihydroxy-2-(hydroxymethyl)oxan-3-yl]oxyoxane-3,4,5-triol Chemical compound OCC1OC(OC2C(O)C(O)C(O)OC2CO)C(O)C(O)C1O GUBGYTABKSRVRQ-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- ZIYRDJLAJYTELF-UHFFFAOYSA-N 2-bromo-4-chlorophenol Chemical compound OC1=CC=C(Cl)C=C1Br ZIYRDJLAJYTELF-UHFFFAOYSA-N 0.000 description 1
- IKCLCGXPQILATA-UHFFFAOYSA-N 2-chlorobenzoic acid Chemical class OC(=O)C1=CC=CC=C1Cl IKCLCGXPQILATA-UHFFFAOYSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- 229940013085 2-diethylaminoethanol Drugs 0.000 description 1
- JNODDICFTDYODH-UHFFFAOYSA-N 2-hydroxytetrahydrofuran Chemical compound OC1CCCO1 JNODDICFTDYODH-UHFFFAOYSA-N 0.000 description 1
- 125000004638 2-oxopiperazinyl group Chemical group O=C1N(CCNC1)* 0.000 description 1
- 125000004637 2-oxopiperidinyl group Chemical group O=C1N(CCCC1)* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- BRMWTNUJHUMWMS-UHFFFAOYSA-N 3-Methylhistidine Natural products CN1C=NC(CC(N)C(O)=O)=C1 BRMWTNUJHUMWMS-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- DFMDAJMTLJGKFW-UHFFFAOYSA-N 3-chloro-2-nitrophenol Chemical compound OC1=CC=CC(Cl)=C1[N+]([O-])=O DFMDAJMTLJGKFW-UHFFFAOYSA-N 0.000 description 1
- MRLGCTNJRREZHZ-UHFFFAOYSA-N 3-phenoxybenzaldehyde Chemical compound O=CC1=CC=CC(OC=2C=CC=CC=2)=C1 MRLGCTNJRREZHZ-UHFFFAOYSA-N 0.000 description 1
- UQIZXHLDJCJWNH-UHFFFAOYSA-N 4-[[4-[(2-methylpropan-2-yl)oxycarbonyl]piperazin-1-yl]methyl]-2-(trifluoromethyl)benzoic acid Chemical compound C(C)(C)(C)OC(=O)N1CCN(CC1)CC1=CC(=C(C(=O)O)C=C1)C(F)(F)F UQIZXHLDJCJWNH-UHFFFAOYSA-N 0.000 description 1
- JPNOSHZBKVMMSB-UHFFFAOYSA-N 4-bromo-3-(trifluoromethyl)benzaldehyde Chemical compound FC(F)(F)C1=CC(C=O)=CC=C1Br JPNOSHZBKVMMSB-UHFFFAOYSA-N 0.000 description 1
- ZEYSHALLPAKUHG-UHFFFAOYSA-N 4-methoxypiperidine Chemical compound COC1CCNCC1 ZEYSHALLPAKUHG-UHFFFAOYSA-N 0.000 description 1
- VVGRROXUVXNCIY-UHFFFAOYSA-N 4-piperazin-1-ylpyrrolidin-2-one Chemical class C1NC(=O)CC1N1CCNCC1 VVGRROXUVXNCIY-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- RSWGJHLUYNHPMX-UHFFFAOYSA-N Abietic-Saeure Natural products C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical class [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- YZXBAPSDXZZRGB-DOFZRALJSA-M Arachidonate Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC([O-])=O YZXBAPSDXZZRGB-DOFZRALJSA-M 0.000 description 1
- 102000009515 Arachidonate 15-Lipoxygenase Human genes 0.000 description 1
- 108010048907 Arachidonate 15-lipoxygenase Proteins 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- KWIUHFFTVRNATP-UHFFFAOYSA-N Betaine Natural products C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 1
- JGLMVXWAHNTPRF-CMDGGOBGSA-N CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O Chemical compound CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O JGLMVXWAHNTPRF-CMDGGOBGSA-N 0.000 description 1
- 101150071146 COX2 gene Proteins 0.000 description 1
- 101100114534 Caenorhabditis elegans ctc-2 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical class [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102000018208 Cannabinoid Receptor Human genes 0.000 description 1
- 108050007331 Cannabinoid receptor Proteins 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 244000201986 Cassia tora Species 0.000 description 1
- 108090000712 Cathepsin B Proteins 0.000 description 1
- 102000004225 Cathepsin B Human genes 0.000 description 1
- 108090000625 Cathepsin K Proteins 0.000 description 1
- 102000004171 Cathepsin K Human genes 0.000 description 1
- 108090000624 Cathepsin L Proteins 0.000 description 1
- 102000004172 Cathepsin L Human genes 0.000 description 1
- 108090000613 Cathepsin S Proteins 0.000 description 1
- 102100035654 Cathepsin S Human genes 0.000 description 1
- 229920008347 Cellulose acetate propionate Polymers 0.000 description 1
- DQEFEBPAPFSJLV-UHFFFAOYSA-N Cellulose propionate Chemical compound CCC(=O)OCC1OC(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C1OC1C(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C(COC(=O)CC)O1 DQEFEBPAPFSJLV-UHFFFAOYSA-N 0.000 description 1
- PTHCMJGKKRQCBF-UHFFFAOYSA-N Cellulose, microcrystalline Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC)C(CO)O1 PTHCMJGKKRQCBF-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 239000004859 Copal Substances 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical class [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- OCUCCJIRFHNWBP-IYEMJOQQSA-L Copper gluconate Chemical class [Cu+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O OCUCCJIRFHNWBP-IYEMJOQQSA-L 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 229920003143 Eudragit® FS 30 D Polymers 0.000 description 1
- 229920003139 Eudragit® L 100 Polymers 0.000 description 1
- 229920003138 Eudragit® L 30 D-55 Polymers 0.000 description 1
- 229920003141 Eudragit® S 100 Polymers 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 241001427367 Gardena Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 241000782205 Guibourtia conjugata Species 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000929834 Homo sapiens Monoacylglycerol lipase ABHD6 Proteins 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- JAQUASYNZVUNQP-USXIJHARSA-N Levorphanol Chemical compound C1C2=CC=C(O)C=C2[C@]23CCN(C)[C@H]1[C@@H]2CCCC3 JAQUASYNZVUNQP-USXIJHARSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical class [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical class [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- ZRVUJXDFFKFLMG-UHFFFAOYSA-N Meloxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=NC=C(C)S1 ZRVUJXDFFKFLMG-UHFFFAOYSA-N 0.000 description 1
- 102100035912 Monoacylglycerol lipase ABHD6 Human genes 0.000 description 1
- JDHILDINMRGULE-LURJTMIESA-N N(pros)-methyl-L-histidine Chemical compound CN1C=NC=C1C[C@H](N)C(O)=O JDHILDINMRGULE-LURJTMIESA-N 0.000 description 1
- KWIUHFFTVRNATP-UHFFFAOYSA-O N,N,N-trimethylglycinium Chemical compound C[N+](C)(C)CC(O)=O KWIUHFFTVRNATP-UHFFFAOYSA-O 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- FFDGPVCHZBVARC-UHFFFAOYSA-N N,N-dimethylglycine Chemical class CN(C)CC(O)=O FFDGPVCHZBVARC-UHFFFAOYSA-N 0.000 description 1
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- UEEJHVSXFDXPFK-UHFFFAOYSA-N N-dimethylaminoethanol Chemical compound CN(C)CCO UEEJHVSXFDXPFK-UHFFFAOYSA-N 0.000 description 1
- HTLZVHNRZJPSMI-UHFFFAOYSA-N N-ethylpiperidine Chemical compound CCN1CCCCC1 HTLZVHNRZJPSMI-UHFFFAOYSA-N 0.000 description 1
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N Nitrogen dioxide Chemical compound O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 102100027069 Odontogenic ameloblast-associated protein Human genes 0.000 description 1
- 101710091533 Odontogenic ameloblast-associated protein Proteins 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- UQCNKQCJZOAFTQ-ISWURRPUSA-N Oxymorphone Chemical compound O([C@H]1C(CC[C@]23O)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O UQCNKQCJZOAFTQ-ISWURRPUSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 101150000187 PTGS2 gene Proteins 0.000 description 1
- 244000025272 Persea americana Species 0.000 description 1
- 235000008673 Persea americana Nutrition 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical class [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 235000004443 Ricinus communis Nutrition 0.000 description 1
- KHPCPRHQVVSZAH-HUOMCSJISA-N Rosin Natural products O(C/C=C/c1ccccc1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 KHPCPRHQVVSZAH-HUOMCSJISA-N 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N Stearinsaeure-hexadecylester Natural products CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical class OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- 229920002494 Zein Polymers 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical class [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- KWENWZBGSPPTLR-UHFFFAOYSA-N [4-[(3-phenoxyphenyl)methyl]piperazin-1-yl]-pyrazol-1-ylmethanone Chemical compound C1CN(CCN1CC2=CC(=CC=C2)OC3=CC=CC=C3)C(=O)N4C=CC=N4 KWENWZBGSPPTLR-UHFFFAOYSA-N 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000003655 absorption accelerator Substances 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- UTKBLLDLHPDWDU-ODZAUARKSA-N acetic acid;(z)-but-2-enedioic acid Chemical compound CC(O)=O.OC(=O)\C=C/C(O)=O UTKBLLDLHPDWDU-ODZAUARKSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- ZUAAPNNKRHMPKG-UHFFFAOYSA-N acetic acid;butanedioic acid;methanol;propane-1,2-diol Chemical compound OC.CC(O)=O.CC(O)CO.OC(=O)CCC(O)=O ZUAAPNNKRHMPKG-UHFFFAOYSA-N 0.000 description 1
- AEMQUICCWRPKDB-UHFFFAOYSA-N acetic acid;cyclohexane-1,2-dicarboxylic acid Chemical compound CC(O)=O.OC(=O)C1CCCCC1C(O)=O AEMQUICCWRPKDB-UHFFFAOYSA-N 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 125000005041 acyloxyalkyl group Chemical group 0.000 description 1
- 125000005042 acyloxymethyl group Chemical group 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000012382 advanced drug delivery Methods 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000005205 alkoxycarbonyloxyalkyl group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- IYABWNGZIDDRAK-UHFFFAOYSA-N allene Chemical group C=C=C IYABWNGZIDDRAK-UHFFFAOYSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- LGEQQWMQCRIYKG-DOFZRALJSA-N anandamide Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)NCCO LGEQQWMQCRIYKG-DOFZRALJSA-N 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 229940114078 arachidonate Drugs 0.000 description 1
- LGEQQWMQCRIYKG-UHFFFAOYSA-N arachidonic acid ethanolamide Natural products CCCCCC=CCC=CCC=CCC=CCCCC(=O)NCCO LGEQQWMQCRIYKG-UHFFFAOYSA-N 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960003121 arginine Drugs 0.000 description 1
- 159000000032 aromatic acids Chemical class 0.000 description 1
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 1
- 150000007860 aryl ester derivatives Chemical class 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical class OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- BVCRERJDOOBZOH-UHFFFAOYSA-N bicyclo[2.2.1]heptanyl Chemical group C1C[C+]2CC[C-]1C2 BVCRERJDOOBZOH-UHFFFAOYSA-N 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M bisulphate group Chemical group S([O-])(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- 235000019437 butane-1,3-diol Nutrition 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- ILAJWURWJKXJPW-UHFFFAOYSA-N butanedioic acid;octanedioic acid Chemical class OC(=O)CCC(O)=O.OC(=O)CCCCCCC(O)=O ILAJWURWJKXJPW-UHFFFAOYSA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Chemical class 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- 229920006217 cellulose acetate butyrate Polymers 0.000 description 1
- 229920006218 cellulose propionate Polymers 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 150000005827 chlorofluoro hydrocarbons Chemical class 0.000 description 1
- ACONPURZGJUVLW-UHFFFAOYSA-N chloroform;palladium Chemical compound [Pd].[Pd].ClC(Cl)Cl ACONPURZGJUVLW-UHFFFAOYSA-N 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229960004126 codeine Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 235000008504 concentrate Nutrition 0.000 description 1
- 229940124301 concurrent medication Drugs 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Chemical class 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 229960000913 crospovidone Drugs 0.000 description 1
- 239000001767 crosslinked sodium carboxy methyl cellulose Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 239000002852 cysteine proteinase inhibitor Substances 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 125000005507 decahydroisoquinolyl group Chemical group 0.000 description 1
- 125000004855 decalinyl group Chemical group C1(CCCC2CCCCC12)* 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- HEFNNWSXXWATRW-JTQLQIEISA-N dexibuprofen Chemical compound CC(C)CC1=CC=C([C@H](C)C(O)=O)C=C1 HEFNNWSXXWATRW-JTQLQIEISA-N 0.000 description 1
- 229960003428 dexibuprofen Drugs 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- FAZJABPYGSTHCD-UHFFFAOYSA-N dicyclohexyl-[2-(2,6-dipropoxyphenyl)phenyl]phosphane Chemical group CCCOC1=CC=CC(OCCC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 FAZJABPYGSTHCD-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- HUPFGZXOMWLGNK-UHFFFAOYSA-N diflunisal Chemical compound C1=C(O)C(C(=O)O)=CC(C=2C(=CC(F)=CC=2)F)=C1 HUPFGZXOMWLGNK-UHFFFAOYSA-N 0.000 description 1
- 229960000616 diflunisal Drugs 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- 235000019329 dioctyl sodium sulphosuccinate Nutrition 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 229960000878 docusate sodium Drugs 0.000 description 1
- OEHFRZLKGRKFAS-UHFFFAOYSA-N droxicam Chemical compound C12=CC=CC=C2S(=O)(=O)N(C)C(C2=O)=C1OC(=O)N2C1=CC=CC=N1 OEHFRZLKGRKFAS-UHFFFAOYSA-N 0.000 description 1
- 229960001850 droxicam Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000003821 enantio-separation Methods 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- OCLXJTCGWSSVOE-UHFFFAOYSA-N ethanol etoh Chemical compound CCO.CCO OCLXJTCGWSSVOE-UHFFFAOYSA-N 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 229940093499 ethyl acetate Drugs 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- GDCRSXZBSIRSFR-UHFFFAOYSA-N ethyl prop-2-enoate;2-methylprop-2-enoic acid Chemical compound CC(=C)C(O)=O.CCOC(=O)C=C GDCRSXZBSIRSFR-UHFFFAOYSA-N 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- OJCSPXHYDFONPU-UHFFFAOYSA-N etoac etoac Chemical compound CCOC(C)=O.CCOC(C)=O OJCSPXHYDFONPU-UHFFFAOYSA-N 0.000 description 1
- XFBVBWWRPKNWHW-UHFFFAOYSA-N etodolac Chemical compound C1COC(CC)(CC(O)=O)C2=N[C]3C(CC)=CC=CC3=C21 XFBVBWWRPKNWHW-UHFFFAOYSA-N 0.000 description 1
- 229960005293 etodolac Drugs 0.000 description 1
- MNJVRJDLRVPLFE-UHFFFAOYSA-N etoricoxib Chemical compound C1=NC(C)=CC=C1C1=NC=C(Cl)C=C1C1=CC=C(S(C)(=O)=O)C=C1 MNJVRJDLRVPLFE-UHFFFAOYSA-N 0.000 description 1
- 229960004945 etoricoxib Drugs 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 229960001419 fenoprofen Drugs 0.000 description 1
- 229960002428 fentanyl Drugs 0.000 description 1
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical group C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000003709 fluoroalkyl group Chemical group 0.000 description 1
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- UPBDXRPQPOWRKR-UHFFFAOYSA-N furan-2,5-dione;methoxyethene Chemical compound COC=C.O=C1OC(=O)C=C1 UPBDXRPQPOWRKR-UHFFFAOYSA-N 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 125000005114 heteroarylalkoxy group Chemical group 0.000 description 1
- 125000005553 heteroaryloxy group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229960002885 histidine Drugs 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical compound C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical compound [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- LLPOLZWFYMWNKH-CMKMFDCUSA-N hydrocodone Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)CC(=O)[C@@H]1OC1=C2C3=CC=C1OC LLPOLZWFYMWNKH-CMKMFDCUSA-N 0.000 description 1
- 229960000240 hydrocodone Drugs 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- WVLOADHCBXTIJK-YNHQPCIGSA-N hydromorphone Chemical compound O([C@H]1C(CC[C@H]23)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O WVLOADHCBXTIJK-YNHQPCIGSA-N 0.000 description 1
- 229960001410 hydromorphone Drugs 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 229960003943 hypromellose Drugs 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 150000004694 iodide salts Chemical class 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical class CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 125000004628 isothiazolidinyl group Chemical group S1N(CCC1)* 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 230000009916 joint effect Effects 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 1
- 229960000991 ketoprofen Drugs 0.000 description 1
- OZWKMVRBQXNZKK-UHFFFAOYSA-N ketorolac Chemical compound OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 OZWKMVRBQXNZKK-UHFFFAOYSA-N 0.000 description 1
- 229960004752 ketorolac Drugs 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 229960003406 levorphanol Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- OXROWJKCGCOJDO-JLHYYAGUSA-N lornoxicam Chemical compound O=C1C=2SC(Cl)=CC=2S(=O)(=O)N(C)\C1=C(\O)NC1=CC=CC=N1 OXROWJKCGCOJDO-JLHYYAGUSA-N 0.000 description 1
- 229960002202 lornoxicam Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 229960002373 loxoprofen Drugs 0.000 description 1
- BAZQYVYVKYOAGO-UHFFFAOYSA-M loxoprofen sodium hydrate Chemical compound O.O.[Na+].C1=CC(C(C([O-])=O)C)=CC=C1CC1C(=O)CCC1 BAZQYVYVKYOAGO-UHFFFAOYSA-M 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- 239000011777 magnesium Chemical class 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 150000004701 malic acid derivatives Chemical class 0.000 description 1
- 150000002690 malonic acid derivatives Chemical class 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical class [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- BCVXHSPFUWZLGQ-UHFFFAOYSA-N mecn acetonitrile Chemical compound CC#N.CC#N BCVXHSPFUWZLGQ-UHFFFAOYSA-N 0.000 description 1
- 229960001929 meloxicam Drugs 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- COTNUBDHGSIOTA-UHFFFAOYSA-N meoh methanol Chemical compound OC.OC COTNUBDHGSIOTA-UHFFFAOYSA-N 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 238000006241 metabolic reaction Methods 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 125000005341 metaphosphate group Chemical group 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical class CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical class COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000007932 molded tablet Substances 0.000 description 1
- CQDGTJPVBWZJAZ-UHFFFAOYSA-N monoethyl carbonate Chemical compound CCOC(O)=O CQDGTJPVBWZJAZ-UHFFFAOYSA-N 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- NOUUUQMKVOUUNR-UHFFFAOYSA-N n,n'-diphenylethane-1,2-diamine Chemical compound C=1C=CC=CC=1NCCNC1=CC=CC=C1 NOUUUQMKVOUUNR-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 229960002009 naproxen Drugs 0.000 description 1
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 1
- 239000000025 natural resin Substances 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 238000013546 non-drug therapy Methods 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000002687 nonaqueous vehicle Substances 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 125000003518 norbornenyl group Chemical group C12(C=CC(CC1)C2)* 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Chemical group C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 125000005060 octahydroindolyl group Chemical group N1(CCC2CCCCC12)* 0.000 description 1
- 125000005061 octahydroisoindolyl group Chemical group C1(NCC2CCCCC12)* 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical class CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 229960002969 oleic acid Drugs 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 238000006053 organic reaction Methods 0.000 description 1
- 239000003791 organic solvent mixture Substances 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 150000003891 oxalate salts Chemical class 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 1
- 229960002739 oxaprozin Drugs 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- 125000005476 oxopyrrolidinyl group Chemical group 0.000 description 1
- 229960005118 oxymorphone Drugs 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- TZRHLKRLEZJVIJ-UHFFFAOYSA-N parecoxib Chemical compound C1=CC(S(=O)(=O)NC(=O)CC)=CC=C1C1=C(C)ON=C1C1=CC=CC=C1 TZRHLKRLEZJVIJ-UHFFFAOYSA-N 0.000 description 1
- 229960004662 parecoxib Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 229940021222 peritoneal dialysis isotonic solution Drugs 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- NCAIGTHBQTXTLR-UHFFFAOYSA-N phentermine hydrochloride Chemical compound [Cl-].CC(C)([NH3+])CC1=CC=CC=C1 NCAIGTHBQTXTLR-UHFFFAOYSA-N 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical class OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 125000005541 phosphonamide group Chemical group 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 125000005498 phthalate group Chemical class 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000004482 piperidin-4-yl group Chemical group N1CCC(CC1)* 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- QYSPLQLAKJAUJT-UHFFFAOYSA-N piroxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=CC=CC=N1 QYSPLQLAKJAUJT-UHFFFAOYSA-N 0.000 description 1
- 229960002702 piroxicam Drugs 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001184 polypeptide Chemical group 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229920002744 polyvinyl acetate phthalate Polymers 0.000 description 1
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 1
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000011591 potassium Chemical class 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Chemical group 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 230000006340 racemization Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000003340 retarding agent Substances 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- JZCPYUJPEARBJL-UHFFFAOYSA-N rimonabant Chemical compound CC=1C(C(=O)NN2CCCCC2)=NN(C=2C(=CC(Cl)=CC=2)Cl)C=1C1=CC=C(Cl)C=C1 JZCPYUJPEARBJL-UHFFFAOYSA-N 0.000 description 1
- 229960003015 rimonabant Drugs 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 229960000953 salsalate Drugs 0.000 description 1
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical class OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 238000010008 shearing Methods 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 1
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000005846 sugar alcohols Chemical class 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical class [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- MLKXDPUZXIRXEP-MFOYZWKCSA-N sulindac Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)=O)C=C1 MLKXDPUZXIRXEP-MFOYZWKCSA-N 0.000 description 1
- 229960000894 sulindac Drugs 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- 238000003419 tautomerization reaction Methods 0.000 description 1
- WZWYJBNHTWCXIM-UHFFFAOYSA-N tenoxicam Chemical compound O=C1C=2SC=CC=2S(=O)(=O)N(C)C1=C(O)NC1=CC=CC=N1 WZWYJBNHTWCXIM-UHFFFAOYSA-N 0.000 description 1
- 229960002871 tenoxicam Drugs 0.000 description 1
- ISIJQEHRDSCQIU-UHFFFAOYSA-N tert-butyl 2,7-diazaspiro[4.5]decane-7-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CCCC11CNCC1 ISIJQEHRDSCQIU-UHFFFAOYSA-N 0.000 description 1
- PNXANGBFABVDMF-UHFFFAOYSA-N tert-butyl 4-[[2-morpholin-4-yl-4-(trifluoromethyl)phenyl]methyl]piperazine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)CCN1CC1=CC=C(C(F)(F)F)C=C1N1CCOCC1 PNXANGBFABVDMF-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 229960004559 theobromine Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000005985 thienyl[1,3]dithianyl group Chemical group 0.000 description 1
- 238000003354 tissue distribution assay Methods 0.000 description 1
- UPSPUYADGBWSHF-UHFFFAOYSA-N tolmetin Chemical compound C1=CC(C)=CC=C1C(=O)C1=CC=C(CC(O)=O)N1C UPSPUYADGBWSHF-UHFFFAOYSA-N 0.000 description 1
- 229960001017 tolmetin Drugs 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M toluenesulfonate group Chemical group C=1(C(=CC=CC1)S(=O)(=O)[O-])C LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229960004380 tramadol Drugs 0.000 description 1
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 1
- KHPCPRHQVVSZAH-UHFFFAOYSA-N trans-cinnamyl beta-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OCC=CC1=CC=CC=C1 KHPCPRHQVVSZAH-UHFFFAOYSA-N 0.000 description 1
- LLPOLZWFYMWNKH-UHFFFAOYSA-N trans-dihydrocodeinone Natural products C1C(N(CCC234)C)C2CCC(=O)C3OC2=C4C1=CC=C2OC LLPOLZWFYMWNKH-UHFFFAOYSA-N 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- GKASDNZWUGIAMG-UHFFFAOYSA-N triethyl orthoformate Chemical compound CCOC(OCC)OCC GKASDNZWUGIAMG-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000005591 trimellitate group Chemical group 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- 125000005455 trithianyl group Chemical group 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940093612 zein Drugs 0.000 description 1
- 239000005019 zein Substances 0.000 description 1
- 239000011701 zinc Chemical class 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/438—The ring being spiro-condensed with carbocyclic or heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/4155—1,2-Diazoles non condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5386—1,4-Oxazines, e.g. morpholine spiro-condensed or forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/10—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D451/00—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof
- C07D451/02—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pain & Pain Management (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Rheumatology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
En la presente se proporcionan compuestos de pirazol y composiciones farmacéuticas que comprenden dichos compuestos. Los compuestos y composiciones en cuestión son útiles como moduladores de la monoacilglicerol lipasa (MAGL). Además, los compuestos y composiciones en cuestión son útiles para el tratamiento del dolor. (Traducción automática con Google Translate, sin valor legal)
Description
DESCRIPCIÓN
Inhibidores de MAGL de pirazol
Antecedentes
La monoacilglicerol lipasa (MAGL) es una enzima responsable de hidrolizar endocannabinoides tales como el 2-AG (2-araquidonoilglicerol), un lípido a base de araquidonato, en el sistema nervioso. La amida hidrolasa de ácidos grasos (FAAH) es otra enzima responsable de hidrolizar endocannabinoides como la anandamida.
El documento WO 2015/179559 describe moduladores de uno o más de MAGL, ABHD6 y FAAH en los que algunos compuestos tienen un resto pirazol.
El documento US 2006/183780 describe moduladores de 15-lipoxigenasa que tienen un resto pirazol.
El documento US 2016/318864 describe compuestos de 4-(piperazin-1 -il)-pirrolidin-2-ona como inhibidores de MAGL. El documento US 7012075 describe compuestos que son inhibidores de cisteína proteasa que incluyen pero no se limitan a inhibidores de catepsinas K, L, S y B.
El documento WO 2017/087858 describe compuestos de pirazol que son útiles como moduladores de MAGL y/o FAAH.
Breve resumen de la invención
Esta descripción proporciona, por ejemplo, compuestos y composiciones que son moduladores de MAGL y su uso como agentes medicinales, procedimientos para su preparación y composiciones farmacéuticas que incluyen compuestos descritos como al menos un ingrediente activo.
El alcance de la invención está definido por las reivindicaciones. Cualquier referencia en la descripción a métodos de tratamiento del cuerpo humano (o animal) mediante terapia (o para diagnóstico) no forma parte de la invención. En un aspecto es un compuesto de Fórmula (I):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)- o -CH2N(R16)CH2-;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , cicloalquilo C3-8, heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, den onde el cicloalquilo C3-8, heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, -alquil(C1-6)-OH, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6 ;
R12 es H, halógeno o alquilo C1-6 ;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)OH, -C(O)NR8 R9 , -SO2-alquilo C1 -6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo(C1-6), -alquil(C1-6)-OH o -CH2CO2H;
R17 es H o alquilo C1-6;
R18 es H o alquilo C1-6;
v es 0 o 1;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otro aspecto es un compuesto de Fórmula (I'):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)- o -CH2N(R16)CH2-;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -aiquil(C1-6>-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 - 6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10, o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8R9 , -SO2-alquilo C1 -6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo(C1-6) o -CH2CO2H;
R17 es H o alquilo C1-6;
R18 es H o alquilo C1-6;
v es 0 o 1;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En algunas realizaciones es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido,
estereoisómero o sal farmacéuticamente aceptable del mismo, en donde . En otra realización es un compuesto de fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde A es C(H). En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde A es N. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R6 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del
mismo, en donde otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R3 es
óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde Z es -S-. En otra realización es un compuesto de fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde Z es -N(H)-. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R3 es
tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde Z es -S-. En otra realización es un compuesto de Fórmula (I) o (!'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal
farmacéuticamente aceptable del mismo, en donde R3 es k ,j r . En otra realización es un compuesto de fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1, y p es 1. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 1, q es 2 y p es 1. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 0 y p es 2. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, donde m es 1, n es 1, q es 1 y p es 0. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero, o sal farmacéuticamente aceptable del mismo, en donde Y es -CH2-. En otra realización es un compuesto de fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde Y es -C(O)-. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R13 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R12 es H. En otra realización es un compuesto de Fórmula (I) o (!'), o un solvato, hidrato, tautómero,
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R3 es . En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal
farmacéuticamente aceptable del mismo, en donde R13 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R12 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del
mismo, en donde R3 es RU • En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde v es 0. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde v es 1. En otra realización, es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde X es -O-. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde X es -N(CH3)-. En otra realización es un compuesto de fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde X es -CH2N(CH3)CH2-. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R3 es
óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde A es C(H). En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde A es N. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R6 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R7 es haloalquilo C1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (!'), o un solvato, hidrato, tautómero, N-óxido,
estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del
mismo, en donde R4 es H "1 > k "j“ > <-C > IN > En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6 o haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R2 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R15 es H. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (I) o (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R10 y R11 son cada uno H.
En otra realización es una composición farmacéutica que comprende un compuesto de Fórmula (I) o (I') descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido o una sal farmacéuticamente aceptable del mismo, y al menos un excipiente farmacéuticamente aceptable.
En otra realización es un método para tratar el dolor en un paciente que lo necesite, que comprende administrar al paciente una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I) o (I') descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido, o una sal farmacéuticamente aceptable del mismo. En otra realización hay un método para tratar el dolor crónico en un paciente que lo necesite, que comprende administrar al paciente una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I) o (I') descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido, o una sal farmacéuticamente aceptable del mismo. En otra realización es un método para tratar el dolor inflamatorio en un paciente que lo necesite, que comprende administrar al paciente una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I) o (I') descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido, o una sal farmacéuticamente aceptable del mismo.
En otra realización es un método para tratar la migraña en un paciente que lo necesite, que comprende administrar al paciente una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I) o (I') descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido, o una sal farmacéuticamente aceptable del mismo.
En otra realización es un método para tratar la esclerodermia en un paciente que lo necesite que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I) o (I') en el presente documento, o un solvato, hidrato, tautómero, W-óxido o una sal farmacéuticamente aceptable del mismo.
En otra realización es un método para tratar la enfermedad del hígado graso no alcohólico (NASH) en un paciente que lo necesite que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I) o (I') descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido, o una de sus sales farmacéuticamente aceptables.
Descripción detallada de la invención
Esta descripción está dirigida, al menos en parte, a moduladores o inhibidores de MAGL. Por ejemplo, en el presente documento se proporcionan compuestos capaces de inhibir la MAGL.
Tal como se utiliza en el presente documento y en las reivindicaciones adjuntas, las formas singulares "un/una", "y" y "el/la" incluyen referentes plurales salvo que el contexto indique claramente lo contrario. Así, por ejemplo, la referencia a "un agente" incluye una pluralidad de dichos agentes, y la referencia a "la célula" incluye la referencia a una o más células (o a una pluralidad de células) y equivalentes de las mismas. Cuando se usan intervalos en el presente documento para propiedades físicas, tales como el peso molecular, o propiedades químicas, tales como fórmulas químicas, se pretende que estén incluidas todas las combinaciones y subcombinaciones de intervalos y realizaciones específicas. El término "aproximadamente" cuando se refiere a un número o intervalo numérico significa que el número o intervalo numérico al que se hace referencia es una aproximación dentro de la variabilidad experimental (o dentro del error experimental estadístico), y por lo tanto el número o intervalo numérico varía entre 1% y 15% del número o intervalo numérico indicado. El término "que comprende" (y términos relacionados tales como "comprender" o "comprende" o "que tiene" o "que incluye") no pretende excluir lo que en otras realizaciones determinadas, por ejemplo, una realización de cualquier composición de la materia, composición, método o procedimiento, o similar, descrito en el presente documento, puede "consistir en" o "consistir esencialmente en" las características descritas.
Definiciones
Tal como se utilizan en la memoria descriptiva y las reivindicaciones adjuntas, a menos que se especifique lo contrario, los siguientes términos tienen el significado que se indica a continuación.
Como se usa en el presente documento, C1-Cx incluye C1 -C2 , C1-C3 ... C1-CX . C1-CX se refiere al número de átomos de carbono que componen el resto al que designa (excluyendo los sustituyentes opcionales).
"Amino" se refiere al radical -NH2.
"Ciano" se refiere al radical -CN.
"Nitro" se refiere al radical -NO2.
"Oxa" se refiere al radical -O-.
"Oxo" se refiere al radical =O.
"Tioxo" se refiere al radical =S.
"Imino" se refiere al radical =N-H.
"Oximo" se refiere al radical =N-OH.
"Alquilo" o "alquileno" se refiere a un radical de cadena hidrocarbonada lineal o ramificada que consiste únicamente en átomos de carbono e hidrógeno, que no contiene insaturación, que tiene de uno a quince átomos de carbono (p. ej., alquilo C1-C15). En ciertas realizaciones, un alquilo comprende de uno a trece átomos de carbono (p. ej., alquilo C1-C13). En ciertas realizaciones, un alquilo comprende de uno a ocho átomos de carbono (p. ej., alquilo C1-C8). En otras realizaciones, un alquilo comprende de uno a seis átomos de carbono (p. ej., alquilo C1-C6). En otras realizaciones, un alquilo comprende de uno a cinco átomos de carbono (p. ej., alquilo C1-C5). En otras realizaciones, un alquilo comprende de uno a cuatro átomos de carbono (p. ej., alquilo C1-C4). En otras realizaciones, un alquilo comprende de uno a tres átomos de carbono (p. ej., alquilo C1-C3). En otras realizaciones, un alquilo comprende de uno a dos átomos de carbono (p. ej., alquilo C1-C2). En otras realizaciones, un alquilo comprende un átomo de carbono (p. ej., alquilo C1). En otras realizaciones, un alquilo comprende de cinco a quince átomos de carbono (p. ej., alquilo C5-C15). En otras realizaciones, un alquilo comprende de cinco a ocho átomos de carbono (p. ej., alquilo C5-C8). En otras realizaciones, un alquilo comprende de dos a cinco átomos de carbono (p. ej., alquilo C2-C5). En otras realizaciones, un alquilo comprende de tres a cinco átomos de carbono (p. ej., alquilo C3-C5). En otras realizaciones, el grupo alquilo se selecciona de metilo, etilo, 1 -propilo (n-propilo), 1 -metiletilo (isopropilo), 1 -butilo (n-butilo), 1 -metilpropilo (sec-butilo), 2-metilpropilo (isobutilo), 1,1 dimetiletilo (terc-butilo) y 1 -pentilo (n-pentilo). El alquilo está unido al resto de la molécula por un enlace sencillo. A menos que se indique específicamente lo contrario en la memoria descriptiva, un grupo alquilo está opcionalmente sustituido con uno o más de los siguientes sustituyentes: halógeno, ciano, nitro, oxo, tioxo, imino, oximo, trimetilsilanilo, -ORa , -SRa , -OC(O)-Rf, -N(Ra)2 , -C(O)Ra , -C(O)ORa , -C(O)N(Ra )2 , -N(Ra )C(O)ORf, -OC(O)-NRa Rf, -N(Ra )C(O)Rf, -N(Ra )S(O)tRf (en
donde t es 1 o 2), -S(O)tORa (en donde t es 1 o 2), -S(O)tRf (en donde t es 1 o 2) y -S(O)tN(Ra)2 (en donde t es 1 o 2) en donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, y cada Rf es independientemente alquilo, haloalquilo, cicloalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo.
"Alcoxi" se refiere a un radical unido a través de un átomo de oxígeno de fórmula -O-alquilo, donde alquilo es una cadena de alquilo como se define anteriormente.
"Alquenilo" se refiere a un grupo radical de cadena hidrocarbonada lineal o ramificada que consiste únicamente en átomos de carbono e hidrógeno, que contiene al menos un doble enlace carbono-carbono y que tiene de dos a doce átomos de carbono. En ciertas realizaciones, un alquenilo comprende de dos a ocho átomos de carbono. En otras realizaciones, un alquenilo comprende de dos a cuatro átomos de carbono. El alquenilo está unido al resto de la molécula por un enlace sencillo, por ejemplo, etenilo (es decir, vinilo), prop-1 -enilo (es decir, alilo), but-1 -enilo, pent-1 -enilo, penta-1,4-dienilo y similares. A menos que se indique específicamente lo contrario en la memoria descriptiva, un grupo alquenilo está opcionalmente sustituido con uno o más de los siguientes sustituyentes: halógeno, ciano, nitro, oxo, tioxo, imino, oximo, trimetilsilanilo, -ORa , -SRa , -OC(O)-Rf, -N(Ra)2 , -C(O)Ra , -C(O)ORa , -C(O)N(Ra)2 , -N(Ra)C(O)ORf, -OC(O)-NRa Rf, - N(Ra)C(O)Rf, -N(Ra)S(O)tRf (en donde t es 1 o 2), -S(O)tORa (en donde t es 1 o 2), -S(O)tRf (en donde t es 1 o 2) y -S(O)tN(Ra)2 (en donde t es 1 o 2) donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, y cada Rf es independientemente alquilo, haloalquilo, cicloalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo.
"Alquinilo" se refiere a un grupo radical de cadena hidrocarbonada lineal o ramificada que consiste únicamente en átomos de carbono e hidrógeno, que contiene al menos un triple enlace carbono-carbono, que tiene de dos a doce átomos de carbono. En ciertas realizaciones, un alquinilo comprende de dos a ocho átomos de carbono. En otras realizaciones, un alquinilo tiene de dos a cuatro átomos de carbono. El alquinilo está unido al resto de la molécula por un enlace simple, por ejemplo, etinilo, propinilo, butinilo, pentinilo, hexinilo y similares. A menos que se indique específicamente lo contrario en la memoria descriptiva, un grupo alquinilo está opcionalmente sustituido con uno o más de los siguientes sustituyentes: halógeno, ciano, nitro, oxo, tioxo, imino, oximo, trimetilsilanilo, -ORa , -SRa , -OC(O)-Rf, -N(Ra)2 , -C(O)Ra , -C(O)ORa , -C(O)N(Ra)2 , -N(Ra)C(O)ORf, -OC(O)-NRa Rf, -N(Ra)C(O)Rf, -N(Ra)S(O)tRf (en donde t es 1 o 2), -S(O)tORa (en donde t es 1 o 2), -S(O)tRf (en donde t es 1 o 2) y -S(O)tN(Ra)2 (en donde t es 1 o 2) en donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, y cada Rf es independientemente alquilo, haloalquilo, cicloalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo.
"Arilo" se refiere a un radical derivado de un sistema de anillos hidrocarbonado monocíclico o multicíclico aromático por eliminación de un átomo de hidrógeno de un átomo de carbono del anillo. El sistema de anillos hidrocarbonado monocíclico o multicíclico aromático contiene solo hidrógeno y carbono, de seis a dieciocho átomos de carbono, donde al menos uno de los anillos en el sistema de anillos está completamente insaturado, es decir, contiene un sistema de (4n+2) electrones n deslocalizados cíclico, de acuerdo con la teoría de Hückel. El sistema de anillos del que derivan los grupos arilo incluye, pero no se limita a, grupos tales como benceno, fluoreno, indano, indeno, tetralina y naftaleno. A menos que se indique específicamente lo contrario en la memoria descriptiva, el término "arilo" o el prefijo "ar-" (tal como en "aralquilo") se pretende que incluya radicales arilo opcionalmente sustituidos con uno o más sustituyentes seleccionados de alquilo, alquenilo, alquinilo, halógeno, haloalquilo, ciano, nitro, arilo, aralquilo, aralquenilo, aralquinilo, cicloalquilo, heterocicloalquilo, heteroarilo, heteroarilalquilo, -Rb-ORa , -Rb-OC(O)-Ra , -Rb-OC(O)-ORa , -Rb-OC(O)-N(Ra)2 , -Rb-N(Ra)2 , -Rb-C(O)Ra , -Rb-C(O)ORa , -Rb-C(O)N(Ra)2 , -Rb-ORc -C(O)N(Ra)2 , -Rb-N(Ra)C(O)ORa , -Rb-N(Ra)C(O)Ra , -Rb-N(Ra)S(O)tRa (en donde t es 1 o 2), -Rb-S(O)tORa (en donde t es 1 o 2), -Rb-S(O)tRa (en donde t es 1 o 2) y -Rb-S(O)tN(Ra)2 (en donde t es 1 o 2), donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, cicloalquilalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, cada Rb es independientemente un enlace directo o una cadena de alquileno o alquenileno lineal o ramificada, y Rc es una cadena de alquileno o alquenileno lineal o ramificada.
"Ariloxi" se refiere a un radical unido a través de un átomo de oxígeno de fórmula -O-arilo, donde arilo es como se define anteriormente.
"Aralquilo" se refiere a un radical de fórmula -Rc -arilo donde RC es una cadena de alquileno como se define anteriormente, por ejemplo, metileno, etileno y similares. La parte de la cadena de alquileno del radical aralquilo está opcionalmente sustituida como se describe anteriormente para una cadena de alquileno. La parte arilo del radical aralquilo está opcionalmente sustituida como se describe anteriormente para un grupo arilo.
"Aralquiloxi" se refiere a un radical unido a través de un átomo de oxígeno de fórmula -O-aralquilo, donde aralquilo es como se define anteriormente.
"Aralquenilo" se refiere a un radical de fórmula -Rd-arilo donde Rd es una cadena de alquenileno como se define anteriormente. La parte arilo del radical aralquenilo está opcionalmente sustituida como se describe anteriormente por un grupo arilo. La parte de la cadena de alquenileno del radical aralquenilo está opcionalmente sustituida como se define anteriormente por un grupo alquenileno.
"Aralquinilo" se refiere a un radical de fórmula -Re -arilo, donde Re es una cadena de alquinileno como se define anteriormente. La parte arilo del radical aralquinilo está opcionalmente sustituida como se describe anteriormente para un grupo arilo. La parte de la cadena de alquinileno del radical aralquinilo está opcionalmente sustituida como se define anteriormente para una cadena de alquinileno.
"Cicloalquilo" se refiere a un radical hidrocarbonado monocíclico o policíclico no aromático estable que consiste únicamente en átomos de carbono e hidrógeno, que incluye sistemas de anillos condensados o con puente, que tienen de tres a quince átomos de carbono. En ciertas realizaciones, un cicloalquilo comprende de tres a diez átomos de carbono. En otras realizaciones, un cicloalquilo comprende de cinco a siete átomos de carbono. El cicloalquilo está unido al resto de la molécula por un enlace sencillo. Los cicloalquilos son saturados (es decir, que contienen solo enlaces simples C-C) o parcialmente insaturados (es decir, que contienen uno o más enlaces dobles o triples). Los ejemplos de cicloalquilos monocíclicos incluyen, p. ej., ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, cicloheptilo y ciclooctilo. En ciertas realizaciones, un cicloalquilo comprende de tres a ocho átomos de carbono (p. ej., cicloalquilo C3-C8). En otras realizaciones, un cicloalquilo comprende de tres a siete átomos de carbono (p. ej., cicloalquilo C3-C7). En otras realizaciones, un cicloalquilo comprende de tres a seis átomos de carbono (p. ej., cicloalquilo C3-C6). En otras realizaciones, un cicloalquilo comprende de tres a cinco átomos de carbono (p. ej., cicloalquilo C3-C5). En otras realizaciones, un cicloalquilo comprende de tres a cuatro átomos de carbono (p.ej., cicloalquilo C3-C4). Un cicloalquilo parcialmente insaturado también se denomina "cicloalquenilo". Los ejemplos de cicloalquenilos monocíclicos incluyen, p. ej., ciclopentenilo, ciclohexenilo, cicloheptenilo y ciclooctenilo. Los radicales cicloalquilo policíclicos incluyen, por ejemplo, adamantilo, norbornilo (es decir, biciclo[2.2.1]heptanilo), norbornenilo, decalinilo, 7,7-dimetilbiciclo[2.2.1]heptanilo y similares. A menos que se indique específicamente lo contrario en la memoria descriptiva, el término "cicloalquilo" pretende incluir radicales cicloalquilo que están opcionalmente sustituidos con uno o más sustituyentes seleccionados de alquilo, alquenilo, alquinilo, halógeno, haloalquilo, oxo, tioxo, ciano, nitro, arilo, aralquilo, aralquenilo, aralquinilo, cicloalquilo, heterocicloalquilo, heteroarilo, heteroarilalquilo, -Rb-ORa , -Rb-OC(O)-Ra , -Rb-OC(O)-ORa , -Rb-OC(O)-N(Ra)2 , -Rb-N(Ra)2 , -Rb-C(O)Ra , -Rb-C(O)ORa , -Rb-C(O)N(R)a)2 , -Rb-O-Rc -C(O)N(Ra)2 , -Rb-N(Ra )C(O)ORa , -Rb-N(Ra )C(O)Ra , -Rb-N(Ra )S(O)tRa (en donde t es 1 o 2), -Rb-S(O)tORa (en donde t es 1 o 2), -Rb-S(O)tRa (en donde t es 1 o 2 ) y -Rb-S(O)tN(Ra)2 (en donde t es 1 o 2), donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, cicloalquilalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, cada Rb es independientemente un enlace directo o una cadena de alquileno o alquenileno lineal o ramificada, y Rc es una cadena de alquileno o alquenileno lineal o ramificada.
"Halo" o "halógeno" se refiere a sustituyentes bromo, cloro, fluoro o yodo.
"Haloalquilo" se refiere a un radical alquilo, como se define anteriormente, que está sustituido con uno o más radicales halógeno, como se define anteriormente.
"Haloalcoxi" se refiere a un radical alcoxi, como se define anteriormente, que está sustituido con uno o más radicales halógeno, como se define anteriormente.
"Fluoroalquilo" se refiere a un radical alquilo, como se define anteriormente, que está sustituido con uno o más radicales fluoro, como se define anteriormente, por ejemplo, trifluorometilo, difluorometilo, fluorometilo, 2,2,2-trifluoroetilo, 1-fluorometil-2-fluoroetilo y similares. La parte alquilo del radical fluoroalquilo está opcionalmente sustituida como se define anteriormente para un grupo alquilo.
"Heterocicloalquilo" se refiere a un radical de anillo no aromático de 3 a 18 miembros estable que comprende de dos a doce átomos de carbono y de uno a seis heteroátomos seleccionados de nitrógeno, oxígeno y azufre. A menos que se indique específicamente lo contrario en la memoria descriptiva, el radical heterocicloalquilo es un sistema de anillos monocíclico, bicíclico, tricíclico o tetracíclico, que incluye sistemas de anillos condensados, espiro o con puente. Los heteroátomos en el radical heterocicloalquilo están opcionalmente oxidados. Uno o más átomos de nitrógeno, si están presentes, están opcionalmente cuaternizados. El radical heterocicloalquilo está parcial o totalmente saturado. En algunas realizaciones, el heterocicloalquilo está unido al resto de la molécula por cualquier átomo del anillo o anillos. Ejemplos de tales radicales heterocicloalquilo incluyen, pero no se limitan a, dioxolanilo, tienil[1,3]ditianilo, decahidroisoquinolilo, imidazolinilo, imidazolidinilo, isotiazolidinilo, isoxazolidinilo, morfolinilo, octahidroindolilo, octahidroisoindolilo, 2-oxopiperazinilo, 2-oxopiperidinilo, 2-oxopirrolidinilo, oxazolidinilo, piperidinilo, piperazinilo, 4-piperidinilo, pirrolidinilo, pirazolidinilo, quinuclidinilo, tiazolidinilo, tetrahidrofurilo, tritianilo, tetrahidropiranilo, tiomorfolinilo, tiamorfolinilo, 1-oxo-tiomorfolinilo y 1,1-dioxo-tiomorfolinilo. A menos que se indique específicamente lo contrario en la memoria descriptiva, el término "heterocicloalquilo" incluye radicales heterocicloalquilo como se definen anteriormente que están opcionalmente sustituidos con uno o más sustituyentes seleccionados de alquilo, alquenilo, alquinilo, halógeno, haloalquilo, oxo, tioxo, ciano, nitro, arilo, aralquilo, aralquenilo, aralquinilo, cicloalquilo, heterocicloalquilo, heteroarilo, heteroarilalquilo, -Rb-ORa , -Rb-OC(O)-Ra , -Rb-OC(O)-ORa , -Rb-OC(O)-N(Ra)2 , -Rb-N(Ra)2 , -Rb-C(O)Ra , -Rb-C(O)ORa , -Rb-C(O)N(Ra)2 , -Rb-O-Rc-C(O)N(Ra)2 , -Rb-N(Ra)C(O)ORa , -Rb-N(Ra)C(O)Ra , -Rb-N(Ra)S(O)tRa (en donde t es 1 o 2), -Rb-S(O)tORa (en donde t es 1 o 2), -Rb-S(O)tRa (en donde t es 1 o 2) y -Rb-S(O)tN(Ra)2 (en donde t es 1 o 2), donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, cicloalquilalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, cada Rb es independientemente un enlace directo o una cadena de alquileno o alquenileno lineal o ramificada, y Rc es una cadena de alquileno o alquenileno lineal o ramificada.
"Heteroarilo" se refiere a un radical derivado de un radical de anillo aromático de 3 a 18 miembros que comprende de uno a diecisiete átomos de carbono y de uno a seis heteroátomos seleccionados de nitrógeno, oxígeno y azufre. Como se usa en el presente documento, el radical heteroarilo es un sistema de anillos monocíclico, bicíclico, tricíclico o tetracíclico, en donde al menos uno de los anillos en el sistema de anillos está completamente insaturado, es decir, contiene un sistema de (4n+2) electrones n deslocalizados cíclico, de acuerdo con la teoría de Hückel. El heteroarilo incluye sistemas de anillos condensados o con puente. El o los heteroátomos en el radical heteroarilo están opcionalmente oxidados. Uno o más átomos de nitrógeno, si están presentes, están opcionalmente cuaternizados. El heteroarilo está unido al resto de la molécula por cualquier átomo del anillo o anillos. A menos que se indique específicamente lo contrario en la memoria descriptiva, el término "heteroarilo" pretende incluir radicales heteroarilo como se definen anteriormente que están opcionalmente sustituidos con uno o más sustituyentes seleccionados de alquilo, alquenilo, alquinilo, halógeno, haloalquilo, oxo, tioxo, ciano, nitro, arilo, aralquilo, aralquenilo, aralquinilo, cicloalquilo, heterocicloalquilo, heteroarilo, heteroarilalquilo, -Rb-ORa, -Rb-OC(O)-Ra, -Rb-OC(O)-ORa, -Rb-OC(O)-N(Ra)2, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (en donde t es 1 o 2), -Rb-S(O)tORa (en donde t es 1 o 2), -Rb-S(O)tRa (en donde t es 1 o 2) y -Rb-S(O)tN(Ra)2 (en donde t es 1 o 2), donde cada Ra es independientemente hidrógeno, alquilo, haloalquilo, cicloalquilo, cicloalquilalquilo, arilo, aralquilo, heterocicloalquilo, heteroarilo o heteroarilalquilo, cada Rb es independientemente un enlace directo o una cadena de alquileno o alquenileno lineal o ramificada, y Rc es una cadena de alquileno o alquenileno lineal o ramificada.
"W-heteroarilo" se refiere a un radical heteroarilo como se define anteriormente que contiene al menos un nitrógeno y donde el punto de unión del radical heteroarilo al resto de la molécula es por un átomo de nitrógeno en el radical heteroarilo. Un radical W-heteroarilo está opcionalmente sustituido como se describe anteriormente para los radicales heteroarilo.
"C-heteroarilo" se refiere a un radical heteroarilo como se define anteriormente y donde el punto de unión del radical heteroarilo al resto de la molécula es por un átomo de carbono en el radical heteroarilo. Un radical C-heteroarilo está opcionalmente sustituido como se describe anteriormente para los radicales heteroarilo.
"Heteroariloxi" se refiere a un radical unido a través de un átomo de oxígeno de fórmula -O-heteroarilo, donde el heteroarilo es como se define anteriormente.
"Heteroarilalquilo" se refiere a un radical de fórmula -Rc-heteroarilo, donde Rc es una cadena de alquileno como se define anteriormente. Si el heteroarilo es un heteroarilo que contiene nitrógeno, el heteroarilo está opcionalmente unido al radical alquilo en el átomo de nitrógeno. La cadena de alquileno del radical heteroarilalquilo está opcionalmente sustituida como se define anteriormente para una cadena de alquileno. La parte heteroarilo del radical heteroarilalquilo está opcionalmente sustituida como se define anteriormente para un grupo heteroarilo.
"Heteroarilalcoxi" se refiere a un radical unido a través de un átomo de oxígeno de fórmula -O-Rc-heteroarilo, donde Rc es una cadena de alquileno como se define anteriormente. Si el heteroarilo es un heteroarilo que contiene nitrógeno, el heteroarilo está opcionalmente unido al radical alquilo en el átomo de nitrógeno. La cadena de alquileno del radical heteroarilalcoxi está opcionalmente sustituida como se define anteriormente para una cadena de alquileno. La parte heteroarilo del radical heteroarilalcoxi está opcionalmente sustituida como se define anteriormente para un grupo heteroarilo.
En algunas realizaciones, los compuestos descritos en el presente documento contienen uno o más centros asimétricos y, por lo tanto, dan lugar a enantiómeros, diastereómeros y otras formas estereoisómeras que se definen, en términos de estereoquímica absoluta, como (R)- o (S)-. A menos que se indique lo contrario, se pretende que todas las formas estereoisómeras de los compuestos descritos en el presente documento estén contempladas en esta descripción. Cuando los compuestos descritos en el presente documento contienen dobles enlaces de alqueno, y a menos que se especifique lo contrario, se pretende que esta descripción incluya los isómeros geométricos E y Z (p. ej., cis o trans). Asimismo, también se pretende incluir todos los isómeros posibles, así como sus formas racémicas y ópticamente puras, y todas las formas tautómeras. La expresión "isómero geométrico" se refiere a los isómeros geométricos E o Z (p. ej., cis o trans) de un doble enlace de alqueno. La expresión "isómero posicional" se refiere a isómeros estructurales alrededor de un anillo central, tales como isómeros orto-, meta- y para- alrededor de un anillo de benceno.
Un "tautómero" se refiere a una molécula en donde es posible un cambio de protón de un átomo de una molécula a otro átomo de la misma molécula. En ciertas realizaciones, los compuestos presentados en el presente documento existen como tautómeros. En circunstancias en las que sea posible la tautomería, existirá un equilibrio químico de los tautómeros. La proporción exacta de los tautómeros depende de varios factores, incluidos el estado físico, la temperatura, el disolvente y el pH. Algunos ejemplos de equilibrio tautomérico incluyen:
"Opcional" u "opcionalmente" significa que un suceso o circunstancia descrito posteriormente puede ocurrir o no y que la descripción incluye casos en los que ocurre el suceso o circunstancia y casos en los que no ocurre. Por ejemplo, "arilo opcionalmente sustituido" significa que los radicales arilo están o no están sustituidos y que la descripción incluye tanto radicales arilo sustituidos como radicales arilo que no tienen sustitución.
"Sal farmacéuticamente aceptable" incluye sales de adición tanto de ácido como de base. Se pretende que una sal farmacéuticamente aceptable de cualquiera de los compuestos de pirazol descritos en el presente documento abarque todas y cada una de las formas de sal farmacéuticamente adecuadas. Las sales farmacéuticamente aceptables preferidas de los compuestos descritos en el presente documento son sales de adición de ácido farmacéuticamente aceptables y sales de adición de base farmacéuticamente aceptables.
"Sal de adición de ácido farmacéuticamente aceptable" se refiere a aquellas sales que conservan la eficacia biológica y las propiedades de las bases libres, que no son indeseables desde el punto de vista biológico o de otro tipo, y que se forman con ácidos inorgánicos tales como ácido clorhídrico, ácido bromhídrico, ácido sulfúrico, ácido nítrico, ácido fosfórico, ácido yodhídrico, ácido fluorhídrico, ácido fosforoso y similares. También se incluyen sales que se forman con ácidos orgánicos tales como ácidos mono y dicarboxílicos alifáticos, ácidos alcanoicos sustituidos con fenilo, ácidos hidroxialcanoicos, ácidos alcanodioicos, ácidos aromáticos, ácidos sulfónicos alifáticos y aromáticos, etc. e incluyen, por ejemplo, ácido acético, ácido trifluoroacético, ácido propiónico, ácido glicólico, ácido pirúvico, ácido oxálico, ácido maleico, ácido malónico, ácido succínico, ácido fumárico, ácido tartárico, ácido cítrico, ácido benzoico, ácido cinámico, ácido mandélico, ácido metanosulfónico, ácido etanosulfónico, ácido p-toluenosulfónico, ácido salicílico y similares. Ejemplos de sales incluyen así sulfatos, pirosulfatos, bisulfatos, sulfitos, bisulfitos, nitratos, fosfatos, monohidrogenofosfatos, dihidrogenofosfatos, metafosfatos, pirofosfatos, cloruros, bromuros, yoduros, acetatos, trifluoroacetatos, propionatos, caprilatos, isobutiratos, oxalatos, malonatos, succinato suberatos, sebacatos, fumaratos, maleatos, mandelatos, benzoatos, clorobenzoatos, metilbenzoatos, dinitrobenzoatos, ftalatos, bencenosulfonatos, toluenosulfonatos, fenilacetatos, citratos, lactatos, malatos, tartratos, metanosulfonatos y similares. También se contemplan sales de aminoácidos, tales como arginatos, gluconatos y galacturonatos (véase, por ejemplo, Berge S.M. et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 66:1-19 (1997)). Las sales de adición de ácidos de compuestos básicos se preparan poniendo en contacto las formas de base libre con una cantidad suficiente del ácido deseado para producir la sal.
"Sal de adición de base farmacéuticamente aceptable" se refiere a aquellas sales que retienen la eficacia biológica y las propiedades de los ácidos libres, que no son indeseables biológicamente o de otro modo. Estas sales se preparan a partir de la adición de una base inorgánica o una base orgánica al ácido libre. En algunas realizaciones, las sales de adición de bases farmacéuticamente aceptables se forman con metales o aminas, tales como metales alcalinos y alcalinotérreos o aminas orgánicas. Las sales derivadas de bases inorgánicas incluyen, pero no se limitan a, sales de sodio, potasio, litio, amonio, calcio, magnesio, hierro, zinc, cobre, manganeso, aluminio y similares. Las sales derivadas de bases orgánicas incluyen, pero no se limitan a, sales de aminas primarias, secundarias y terciarias, aminas sustituidas que incluyen aminas sustituidas naturales, aminas cíclicas y resinas de intercambio iónico básicas, por ejemplo, isopropilamina, trimetilamina, dietilamina, trietilamina, tripropilamina, etanolamina, dietanolamina, 2-dimetilaminoetanol, 2-dietilaminoetanol, diciclohexilamina, lisina, arginina, histidina, cafeína, procaína, N,N-dibenciletilendiamina, cloroprocaína, hidrabamina, colina, betaína, etilendiamina, etilendianilina, N-metilglucamina, glucosamina, metilglucamina, teobromina, purinas, piperazina, piperidina, N-etilpiperidina, resinas de poliamina y similares. Véase Berge et al., véase antes.
Como se usa en el presente documento, "tratamiento" o "tratar" o "paliar" o "mejorar" se usan indistintamente en el presente documento. Estos términos se refieren a un enfoque para obtener resultados beneficiosos o deseados que incluyen, pero no se limitan a, un beneficio terapéutico y/o un beneficio profiláctico. Por "beneficio terapéutico" se entiende la erradicación o mejora del trastorno subyacente que se está tratando. Además, se logra un beneficio terapéutico con la erradicación o la mejora de uno o más de los síntomas fisiológicos asociados con el trastorno subyacente de manera que se observa una mejora en el paciente, a pesar de que el paciente todavía esté afectado por el trastorno subyacente. Para beneficio profiláctico, las composiciones se administran a un paciente en riesgo de desarrollar una enfermedad particular, o a un paciente que comunica uno o más de los síntomas fisiológicos de una enfermedad, aunque no se haya realizado un diagnóstico de esta enfermedad.
Compuestos
Los compuestos de Fórmula (I), (I'), (la), (Ib), (Ic), (Id), (le), (If), (Ig), (Ih) o (li) descritos en el presente documento que son moduladores de la MAGL. En algunas realizaciones, los compuestos son inhibidores de la MAGL. En algunas realizaciones, los compuestos de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descritos en el presente documento, y las composiciones que comprenden estos compuestos, son útiles para el tratamiento del dolor, la migraña, la esclerodermia o la enfermedad del hígado graso no alcohólico (NASH).
En algunas realizaciones es un compuesto de Fórmula (I):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)- o -CH2N(R16)CH2-;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C 1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , cicloalquilo C3-8, heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C 1-9, en donde el cicloalquilo C3-8, heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, -alquil(C1-6)-OH, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C i -6 ;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C 1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)OH, -C(O)NR8R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo(C1-6), -alquil(C1-6)-OH o -CH2CO2H;
R17 es H o alquilo C1-6;
R18 es H o alquilo C1-6;
v es 0 o 1;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)NR10R11, R10 es H, y R11 es H. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)NR10R11, R10 es H, y R11 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (I), en donde R2 es H. En otra realización es un compuesto de Fórmula (I), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (I), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (I), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R2 es -CF3.
N. En otra realización es un compuesto de fórmula (I), en donde A es C(H). En otra realización es un compuesto de
Fórmula I, en donde otra realización es un compuesto de Fórmula I , en donde
es un compuesto de Fórmula (I), en donde • En otra realización es un compuesto de fórmula (I), en donde Z es -S-. En otra realización es un compuesto de fórmula (I), en donde Z es -O-. En otra realización es un compuesto de fórmula (I), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (I), en donde Z es -N(H)-. En otra realización es un compuesto de Fórmula (I), en donde Z es -N(CH3)-. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de Fórmula (I), en donde otra realización es un compuesto de fórmula (I), en donde A es N. En otra realización es un compuesto de fórmula (I), en donde A es
,
compuesto de fórmula (I), en donde Z es -S-. En otra realización es un compuesto de fórmula (I), en donde Z es -O-. En otra realización es un compuesto de fórmula (I), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (I), en donde Z es -N(H)-. En otra realización es un compuesto de Fórmula (I), en donde Z es -N(CH3)-. En otra realización es un compuesto de Fórmula (I), en donde Y es -CH2-. En otra realización es un compuesto de fórmula (I), en donde Y es -C(O)-. En otra realización es un compuesto de fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 1. En otra realización es un compuesto de fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 1, q es 2 y p es 1. En otra realización es un compuesto
de fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 0 y p es 2. En otra realización es un compuesto de fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 0. En otra realización es un compuesto de fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 0, q es 2 y p es 1. En otra realización es un compuesto de fórmula (I), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de Fórmula (I), en donde R3 es • En otra realización es un compuesto de Fórmula (I), en donde R12 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (I), en donde R12 es F. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C 1-6. En otra realización es un compuesto de Fórmula (I), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R12 es alquilo C1-6 y R13 es alquilo C 1-6. En otra realización es un compuesto de Fórmula I, en donde R12 es -CH3 y R13 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R3
realización es un compuesto de fórmula (I), en donde X es -N(R16)-. En otra realización es un compuesto de fórmula (I), en donde X es -N(H)-. En otra realización es un compuesto de Fórmula (I), en donde X es -N(CH3)-. En otra realización es un compuesto de fórmula (I), en donde X es -N(R16)- y R16 es -alquil(C1-6)-OH. En otra realización es un compuesto de Fórmula (I), en donde X es -CH2N(R16)CH2-. En otra realización es un compuesto de Fórmula (I), en donde X es -CH2N(H)CH2-. En otra realización es un compuesto de Fórmula (I), en donde X es -CH2N(CH3)CH2-. En otra realización es un compuesto de fórmula (I), en donde A es N. En otra realización es un compuesto de fórmula (I), en donde A es C H . En otra realización es un compuesto de fórmula (I), en donde v es 0. En otra realización es un
estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , cicloalquilo C3-8, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6, -alquil(C1-6)-OH, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es
haloalquilo C i -6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -alquil(C1-6)-OH. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es cicloalquilo C3-8 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un cicloalquilo C3-8 no sustituido. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido . En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido . En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
En otra realización es un compuesto de Fórmula (I), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (I), en donde R5 es H. En otra realización es un compuesto de Fórmula (I), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (I), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (I), en donde R5 es -F. En otra realización es un compuesto
de Fórmula (I), en donde R5 es alquilo Ci -6. En otra realización es un compuesto de Fórmula (I), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (I), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (I), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (I), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (I), en donde R6 es H. En otra realización es un compuesto de Fórmula (I), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (I), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (I), en donde R6 es -F. En otra realización es un compuesto de Fórmula (I), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I), en donde R6 es -CH3.
En algunas realizaciones es un compuesto de Fórmula (I'):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-, o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)-, o -CH2N(R16)CH2-;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están
unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo(C1-6) o -CH2CO2H;
R17 es H o alquilo C1-6;
R18 es H o alquilo C1-6;
v es 0 o 1;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de fórmula (I'), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de fórmula (I'), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)Nr 10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (I'), en donde R2 es H. En otra realización es un compuesto de fórmula (I'), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (I'), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (I'), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R2 es -CF3.
N. En otra realización es un compuesto de fórmula (I'), en donde A es C(H). En otra realización es un compuesto de
Fórmula I' , en donde En otra realización es un compuesto de Fórmula I' , en donde
es un compuesto de Fórmula (I'), en donde otra realización es un compuesto de fórmula (I'), en donde Z es -S-. En otra realización es un compuesto de fórmula (I'), en donde Z es -O-. En otra realización es un compuesto de fórmula (I'), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (I'), en donde Z es -N(H)-. En otra realización es un compuesto de fórmula (I'), en donde Z es -N(CH3)-. En otra realización es un compuesto de Fórmula (I'), en donde R12 es H y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de Fórmula (I'), en donde otra realización es un compuesto de fórmula (I'), en donde A es N. En otra realización es un compuesto de fórmula (I'), en donde A es
compuesto de fórmula (I'), en donde Z es -S-. En otra realización es un compuesto de fórmula (I'), en donde Z es -O-. En otra realización es un compuesto de fórmula (I'), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (I'), en donde Z es -N(H)-. En otra realización es un compuesto de fórmula (I'), en donde Z es -N(CH3)-. En otra realización es un compuesto de Fórmula (I'), en donde Y es -CH2-. En otra realización es un compuesto de fórmula (I'), en donde Y es -C(O)-. En otra realización es un compuesto de fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 1 En otra realización es un compuesto de fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 1, q es 2 y p es 1. En otra realización es un compuesto
de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, donde m es 1, n es 1, q es 0 y p es 2. En otra realización es un compuesto de fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 0. En otra realización es un compuesto de fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 0, q es 2, y p es 1. En otro una realización es un compuesto de fórmula (I'), en donde R12 es H y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de Fórmula (I'), en donde F¡3 es • En otra realización es un compuesto de Fórmula (I'), en donde R12 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (I'), en donde R12 es F. En otra realización es un compuesto de Fórmula (I'), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R12 es H y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de fórmula (I'), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula I' , en donde F¡12 es - C H 3 y F¡13 es - C H 3 . En otra realización es un compuesto de Fórmula
(I'), en donde • En otra realización es un compuesto de fórmula (I'), en donde X es -O-. En otra realización es un compuesto de fórmula (I'), en donde X es -N(R16)-. En otra realización es un compuesto de fórmula (I'), en donde X es -N(H)-. En otra realización es un compuesto de fórmula (I'), en donde X es -N(CH3)-. En otra realización es un compuesto de Fórmula (I'), en donde X es -CH2N(R16)CH2-. En otra realización es un compuesto de Fórmula (I'), en donde X es -CH2N(H)CH2-. En otra realización es un compuesto de Fórmula (I'), en donde X es -CH2N(CH3)CH2-. En otra realización es un compuesto de fórmula (I'), en donde A es N. En otra realización es un compuesto de fórmula (I'), en donde A es C(H). En otra realización es un compuesto de fórmula (I'), en donde v es 0. En otra realización es un compuesto de fórmula (I'), en donde v es 1. En otra realización es un
farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C 1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C i -6. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (I’), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4
tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (I'), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o
En otra realización es un compuesto de Fórmula (I'), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R5 es H. En otra realización es un compuesto de fórmula (I'), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (I'), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (I'), en donde R5 es -F. En otra realización es un compuesto de Fórmula (I'), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (I'), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (I'), en donde R5 es
haloalcoxi Ci -6. En otra realización es un compuesto de Fórmula (I'), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (I'), en donde R6 es H. En otra realización es un compuesto de fórmula (I'), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (I'), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (I'), en donde R6 es -F. En otra realización es un compuesto de Fórmula (I'), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (I'), en donde R6 es -CH3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Ia):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C 1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C 1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C 1-6, haloalquilo C1-6, alcoxi C1-6-alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8 R9 , -SO2-alquilo C 1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6; y
R17 es H o alquilo C1-6; o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
,
En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ia), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ia), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ia), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Ia), en donde R12 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es F. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R13 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de fórmula (Ia), en donde A es C(H). En otra realización es un compuesto de fórmula (Ia), en donde A es N.
En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido,
estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ia), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (la), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (Ia), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Ia), en donde R6 es H. En otra realización es un compuesto de Fórmula (Ia), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Ia), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Ia), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Ia), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ia), en donde R6 es -CH3.
En otra realización es un compuesto de fórmula (I) que tiene la estructura de fórmula (Ib):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , hete C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10, heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 - 6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo
C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8R9 , -SO2-alquilo C1 -6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R17 es H o alquilo C1-6; y
R18 es H o alquilo C1-6;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ib), en donde
R1 es -C(O)OR15 y R15 es alquilo C i -6. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ib), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ib), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ib), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Ib), en donde R12 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es F. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R13 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de fórmula (Ib), en donde Z es -S-. En otra realización es un compuesto de fórmula (Ib), en donde Z es -O-. En otra realización es un compuesto de fórmula (Ib), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (Ib), en donde Z es -N(H)-. En otra realización es un compuesto de Fórmula (Ib), en donde Z es -N(CH3)-.
En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10, heteroarilo C 1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es
un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ib), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
aceptable del mismo, en donde R4 es Hl En otra realización es un compuesto de Fórmula (Ib), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Ib), en donde R6 es H. En otra realización es un compuesto de Fórmula (Ib), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Ib), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Ib), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Ib), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ib), en donde R6 es -CH3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Ic):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C i -6 o haloalquilo C i - e ;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C i -6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10, o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6 o fenilo;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R17 es H o alquilo C1-6; y
R18 es H o alquilo C1-6;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)OR15 y R15 es alquilo C 1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ic), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ic), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ic), en donde R2 es alquilo C 1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Ic), en donde R12 es H. En otra realización es un compuesto de
Fórmula (Ic), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es F. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R13 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de fórmula (Ic), en donde Z es -S-. En otra realización es un compuesto de fórmula (Ic), en donde Z es -O-. En otra realización es un compuesto de fórmula (Ic), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (Ic), en donde Z es -N(H)-. En otra realización es un compuesto de Fórmula (Ic), en donde Z es -N(CH3)-.
En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C 1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ic), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
aceptable del mismo, en donde R4 es H) En otra realización es un compuesto de Fórmula (Ic), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ic), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Id):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
Y es -CH2- o -C(O)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 - 6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C i -6 ; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6 ;
R12 es H, halógeno o alquilo C1-6 ;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8 R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R17 es H o alquilo C1-6;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Id), en donde R2 es H. En otra realización es un compuesto de Fórmula (Id), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Id), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Id), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Id), en donde R12 es H. En otra realización es un compuesto de Fórmula (Id), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (Id), en donde R12 es F. En otra realización es un compuesto de Fórmula (Id), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R13 es H. En otra realización es un compuesto de Fórmula (Id), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (Id), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (Id), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (Id), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de fórmula (Id), en donde A es C(H). En otra realización es un compuesto de Fórmula (Id), donde A es N.
En otra realización es un compuesto de Fórmula (Id), en donde Y es -CH2-. En otra realización es un compuesto de fórmula (Id), en donde Y es -C(O)-.
En otra realización es un compuesto de fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 1. En otra realización es un compuesto de fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 1, q es 2 y p es 1. En otra realización es un compuesto de fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 0 y p es 2. En otra realización es un compuesto de fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 0. En otra realización es un compuesto de fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 0, q es 2 y p es 1.
En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C 1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal
farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Id), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (Id), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R5 es H. En otra realización es un compuesto de Fórmula (Id), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Id), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Id), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Id), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Id), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Id), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Id), en donde R6 es H. En otra realización es un compuesto de Fórmula (Id), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Id), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Id), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Id), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Id), en donde R6 es -CH3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Ie):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 - 6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R17 es H o alquilo C i -6 ;
R18 es H o alquilo C1-6;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ie), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ie), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ie), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Ie), en donde R12 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es F. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R13 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de fórmula (Ie), en donde Y es -CH2-. En otra realización es un compuesto de fórmula (Ie), en donde Y es -C(O)-.
En otra realización es un compuesto de fórmula (Ie), en donde Z es -S-. En otra realización es un compuesto de fórmula (Ie), en donde Z es -O-. En otra realización es un compuesto de fórmula (Ie), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (Ie), en donde Z es -N(H)-. En otra realización es un compuesto de fórmula (Ie), en donde Z es -N(CH3)-.
En otra realización es un compuesto de fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 1. En otra realización es un compuesto de fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 1, q es 2 y p es 1. En otra realización es un compuesto de fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 0 y p es 2. En otra realización es un compuesto de fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 0. En otra realización es un compuesto de fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 0, q es 2 y p es 1.
En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal
farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (le), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C 1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido . En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ie), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (le), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (Ie), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6,
haloalcoxi Ci -6. En otra realización es un compuesto de Fórmula (le), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Ie), en donde R6 es H. En otra realización es un compuesto de Fórmula (Ie), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Ie), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Ie), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Ie), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ie), en donde R6 es -CH3.
En otra realización es un compuesto de fórmula (I) que tiene la estructura de fórmula (If):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C 1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9)9 , arilo C6-10 o heteroarilo C 1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 -6 o fenilo;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6 ;
R12 es H, halógeno o alquilo C1-6 ;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8 R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R17 es H o alquilo C1-6;
R18 es H o alquilo C1-6;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (If), en donde R2 es H. En otra realización es un compuesto de Fórmula (If), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (If), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (If), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (If), en donde R12 es H. En otra realización es un compuesto de Fórmula (If), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (If), en donde R12 es F. En otra realización es un compuesto de Fórmula (If), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R13 es H. En otra realización es un compuesto de Fórmula (If), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (If), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (If), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (If), en donde R12 es alquilo C1-6 y R13 es alquilo C 1-6. En otra realización es un compuesto de Fórmula (If), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de Fórmula (If), en donde Y es -CH2-. En otra realización es un compuesto de fórmula (If), en donde Y es -C(O)-.
En otra realización es un compuesto de fórmula (If), en donde Z es -S-. En otra realización es un compuesto de fórmula (If), en donde Z es -O-. En otra realización es un compuesto de fórmula (If), en donde Z es -N(R18)-. En otra realización es un compuesto de fórmula (If), en donde Z es -N(H)-. En otra realización es un compuesto de Fórmula (If), en donde Z es -N(CH3)-.
En otra realización es un compuesto de fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 1. En otra realización es un compuesto de fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 1, q es 2 y p es 1. En otra realización es un compuesto de fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 0 y p es 2. En otra realización es un compuesto de fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 1 y p es 0. En otra realización es un compuesto de fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde m es 0, n es 0, q es 2 y p es 1.
En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde
R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C 1-6. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4
En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (If), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (If), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (If), en donde R5 es H. En otra realización es un compuesto de Fórmula (If), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (If), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (If), en donde R5 es -F. En otra realización es un compuesto de Fórmula (If), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (If), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (If), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (If), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (If), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Ig):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)- o -CH2N(R16)CH2-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalq C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C 1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 -6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo
C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6 ;
R12 es H, halógeno o alquilo C1-6 ;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8 R9 , -SO2-alquilo C1 -6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo C1-6, o -CH2CO2H;
R17 es H o alquilo C1-6; y
v es 0 o 1;
o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ig), en donde
R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ig), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ig), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ig), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R2 es haloalquilo
C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Ig), en donde R12 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es halógeno. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es F. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R13 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R13 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es H y R13 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es H y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es H y R13 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es alquilo C1-6 y R13 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es -CH3 y R13 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es alquilo C1-6 y R13 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R12 es -CH3 y R13 es -CH3.
En otra realización es un compuesto de fórmula (Ig), en donde A es N. En otra realización es un compuesto de fórmula (Ig), en donde A es C(H).
En otra realización es un compuesto de fórmula (Ig), en donde X es -O-. En otra realización es un compuesto de fórmula (Ig), en donde X es -N(R16)-. En otra realización es un compuesto de fórmula (Ig), en donde X es -N(H)-. En otra realización es un compuesto de fórmula (Ig), en donde X es -N(CH3)-. En otra realización es un compuesto de Fórmula (Ig), en donde X es -CH2N(R16)CH2-. En otra realización es un compuesto de Fórmula (Ig), en donde X es -CH2N(H)CH2-. En otra realización es un compuesto de Fórmula (Ig), en donde X es -CH2N(CH3)CH2-.
En otra realización es un compuesto de fórmula (Ig), en donde v es 0. En otra realización es un compuesto de fórmula (Ig), en donde v es 1.
En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido . En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ig), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (Ig), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Ig), en donde R6 es H. En otra realización es un compuesto de Fórmula (Ig), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Ig), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Ig), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Ig), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ig), en donde R6 es -CH3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Ih):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)- o -CH2N(R16)CH2-;
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 -6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6 ;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8 R9 , -SO2-alquilo C1 -6 y -N(R17)C(O)-alquilo(C1-6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo C1-6 o -CH2CO2 H;
R17 es H o alquilo C1-6; y
v es 0 o 1;
o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ih), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ih), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ih), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ih), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ih), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R2 es -CF3.
En otra realización es un compuesto de Fórmula (Ih), en donde A es N. En otra realización es un compuesto de Fórmula (Ih), en donde A es C(H).
En otra realización es un compuesto de fórmula (Ih), en donde X es -O-. En otra realización es un compuesto de Fórmula (Ih), en donde X es -N(R16)-. En otra realización es un compuesto de Fórmula (Ih), en donde X es -N(H)-. En otra realización es un compuesto de Fórmula (Ih), en donde X es -N(CH3)-. En otra realización es un compuesto de Fórmula (Ih), en donde X es -CH2N(R16)CH2-. En otra realización es un compuesto de Fórmula (Ih), en donde X es -CH2N(H)CH2-. En otra realización es un compuesto de Fórmula (Ih), en donde X es -CH2N(CH3)CH2-.
En otra realización es un compuesto de fórmula (Ih), en donde v es 0. En otra realización es un compuesto de fórmula (Ih), en donde v es 1.
En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9 -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato,
tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C 1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ih), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (Ih), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ih), en donde R5
es haloalcoxi C i -6. En otra realización es un compuesto de Fórmula (Ih), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Ih), en donde R6 es H. En otra realización es un compuesto de Fórmula (Ih), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Ih), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Ih), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Ih), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ih), en donde R6 es -CH3.
En otra realización es un compuesto de Fórmula (I) que tiene la estructura de Fórmula (Ii):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
R4 es H, halógeno, -OR7 , alquilo C1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9, en donde heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1 -6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de la mano alquilo C1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6 ;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)-OH, cicloalquilo C3-8, -C(O)NR8 R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo (C1-6);
R15 es H o alquilo C1-6; y
R17 es H o alquilo C1-6;
o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)OR15. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)OR15 y R15 es H. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)OR15 y R15 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)OR15 y R15 es -CH3. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)NR10R11. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)NR10R11, R10 es H y R11 es H. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)NR10R11, R10 es H y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)NR10R11, R10 es H y R11 es -CH3. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)NR10R11, R10 es alquilo C1-6 y R11 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R1 es -C(O)NR10R11, R10 es -CH3 y R11 es -CH3.
En otra realización es un compuesto de Fórmula (Ii), en donde R2 es H. En otra realización es un compuesto de Fórmula (Ii), en donde R2 es halógeno. En otra realización es un compuesto de Fórmula (Ii), en donde R2 es -Cl. En otra realización es un compuesto de Fórmula (Ii), en donde R2 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R2 es -CH3. En otra realización es un compuesto de Fórmula (Ii), en donde R2 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R2 es -CF3.
En otra realización es un compuesto de fórmula (Ii), en donde A es N. En otra realización es un compuesto de fórmula
(Ii), en donde A es C(H).
En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7 , haloalquilo C1-6, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -Cl. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -CF3. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C 1-6, arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es -CF3. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es arilo C6-10 o heteroarilo C1-9, en donde el arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están opcionalmente sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo no están sustituidos. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con halógeno o haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es -OR7 y R7 es fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo, en donde el fenilo, piridilo, pirimidinilo, piridizinilo o pirazinilo están sustituidos con -Cl o -CF3. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heterocicloalquilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es
estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C1-9 opcionalmente sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido,
estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heteroarilo C1-9 no sustituido. En otra realización es un compuesto de Fórmula (Ii), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es heteroarilo C2-9 sustituido con 1 o 2 R14. En otra realización es un compuesto de Fórmula (li), o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente
En otra realización es un compuesto de Fórmula (Ii), en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es H. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es halógeno. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es -Cl. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es -F. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es -CH3. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es haloalquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es -CF3. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es haloalcoxi C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R5 es -OCF3.
En otra realización es un compuesto de Fórmula (Ii), en donde R6 es H. En otra realización es un compuesto de Fórmula (Ii), en donde R6 es halógeno. En otra realización es un compuesto de Fórmula (Ii), en donde R6 es -Cl. En otra realización es un compuesto de Fórmula (Ii), en donde R6 es -F. En otra realización es un compuesto de Fórmula (Ii), en donde R6 es alquilo C1-6. En otra realización es un compuesto de Fórmula (Ii), en donde R6 es -CH3.
Otras realizaciones proporcionadas en el presente documento incluyen combinaciones de una o más de las realizaciones particulares expuestas anteriormente.
En algunas realizaciones, el compuesto descrito en el presente documento se selecciona de los ejemplos 1-456.
En el presente documento se describen inhibidores de monoacilglicerol lipasa (MAGL) que tienen la estructura de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii). En una realización, los inhibidores de MAGL son inhibidores covalentes de Ma Gl , es decir, los compuestos de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) reaccionan con un resto de serina de la MAGL para formar un resto de serina modificado, que comprende el grupo permanente de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii); en tal realización, el grupo saliente de la Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) se elimina del compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (ii). En otra realización, los inhibidores covalentes de MAGL reaccionan irreversiblemente con un resto de serina de la MAGL para formar el resto de serina modificado.
compuestos de Fórmula (I La parte de grupo permanente de los compuestos
de Fórmula parte de rupo permanente de los compuestos de fórmula
, ,
Preparación de Compuestos
Los compuestos utilizados en las reacciones descritas en el presente documento se preparan de acuerdo con técnicas de síntesis orgánica, a partir de productos químicos disponibles comercialmente y/o de compuestos descritos en la bibliografía química. Los "productos químicos disponibles comercialmente" se obtienen de fuentes comerciales convencionales que incluyen Acros Organics (Geel, Bélgica), Aldrich Chemical (Milwaukee, WI, incluidos Sigma Chemical y Fluka), Apin Chemicals Ltd. (Milton Park, Reino Unido), Ark Pharm, Inc. (Libertyville, IL), Avocado Research (Lancashire, Reino Unido), BDH Inc. (Toronto, Canadá), Bionet (Cornwall, Reino Unido), Chemservice Inc. (West Chester, PA), Combiblocks (San Diego, CA), Crescent Chemical Co. (Hauppauge, NY), eMolecules (San Diego, CA), Fisher Scientific Co. (Pittsburgh, PA), Fisons Chemicals (Leicestershire, Reino Unido), Frontier Scientific (Logan, UT), ICN Biomedicals, Inc. (Costa Mesa, CA), Key Organics (Cornwall, Reino Unido), Lancaster Synthesis (Windham, NH), Matrix Scientific, (Columbia, SC), Maybridge Chemical Co. Ltd. (Cornwall, Reino Unido), Parish Chemical Co. (Orem, UT), Pfaltz & Bauer, Inc. (Waterbury, CN), Polyorganix (Houston, TX), Pierce Chemical Co. (Rockford, IL), Riedel de Haen AG (Hanover, Alemania), Ryan Scientific, Inc. (Mount Pleasant, SC), Spectrum Chemicals (Gardena, Ca ), Sundia Meditech, (Shanghai, China), TCI America (Portland, Or), Trans World Chemicals, Inc. (Rockville, MD) y WuXi (Shanghai, China).
Los libros de referencia y tratados adecuados que detallan la síntesis de reaccionantes útiles en la preparación de los compuestos descritos en el presente documento, o proporcionan referencias a artículos que describen la preparación, incluyen, por ejemplo, "Synthetic Organic Chemistry", John Wiley & Sons, Inc., Nueva York; S. R. Sandler et al., "Organic Functional Group Preparations", 2.a edición, Academic Press, Nueva York, 1983; H. O. House, "Modern Synthetic Reactions", 2.a edición, W. A. Benjamin, Inc. Menlo Park, California. 1972; T. L. Gilchrist, "Heterocyclic Chemistry", 2.a edición, John Wiley & Sons, Nueva York, 1992; J. March, "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4.a edición, Wiley-Interscience, Nueva York, 1992. Libros de referencia y tratados adicionales adecuados que detallan la síntesis de reaccionantes útiles en la preparación de los compuestos descritos en el presente documento, o proporcionan referencias a artículos que describen la preparación, incluyen, por ejemplo, Fuhrhop, J. y Penzlin G. "Organic Synthesis: Concepts, Methods, Starting Materials", segunda edición revisada y ampliada (1994) John Wiley & Sons iSb N: 3-527-29074-5; Hoffman, R. V. "Organic Chemistry, An Intermediate Text" (1996) Oxford University Press, ISBN 0-19-509618-5; Larock, R. C. "Comprehensive Organic Transformations: A Guide to Functional Group Preparations" 2.a edición (1999) Wiley-VCH, ISBN: 0-471-19031-4; March, J. "Advanced
Organic Chemistry: Reactions, Mechanisms, and Structure" 4.a edición (1992) John Wiley & Sons, ISBN: 0-471-60180 2; Otera, J. (editor) "Modern Carbonyl Chemistry" (2000) Wiley-VCH, ISBN: 3-527-29871-1; Patai, S. "Patai's 1992 Guide to the Chemistry of Functional Groups" (1992) Interscience ISBN: 0-471-93022-9; Solomons, T. W. G. "Organic Chemistry " 7a edición (2000) John Wiley & Sons, ISBN: 0-471-19095-0; Stowell, J. C., "Intermediate Organic Chemistry" 2.a edición (1993) Wiley-Interscience, ISBN: 0-471-57456-2; "Industrial Organic Chemicals: Starting Materials and Intermediates: An Ullmann's Encyclopedia" (1999) John Wiley & Sons, ISBN: 3-527-29645-X, en 8 volúmenes; "Organic Reactions" (1942-2000) John Wiley & Sons, en más de 55 volúmenes; y "Chemistry of Functional Groups" John Wiley & Sons, en 73 volúmenes.
Los reaccionantes específicos y análogos también se identifican a través de los índices de sustancias químicas conocidas preparados por el Chemical Abstract Service de la American Chemical Society, que están disponibles en la mayoría de las bibliotecas públicas y universitarias, así como a través de bases de datos en línea (American Chemical Society, Washington, DC). Los productos químicos que son conocidos pero que no están disponibles comercialmente en los catálogos son preparados opcionalmente por casas comerciales de síntesis química personalizada, donde muchas de las casas comerciales de suministro de productos químicos convencionales (p. ej., las enumeradas anteriormente) proporcionan servicios de síntesis personalizados. Una referencia para la preparación y selección de sales farmacéuticas de los compuestos descritos en este documento es P. H. Stahl y C. G. Wermuth "Handbook of Pharmaceutical Salts", Verlag Helvetica Chimica Acta, Zúrich, 2002.
Formas adicionales de compuestos descritos en el presente documento
Isómeros
Además, en algunas realizaciones, los compuestos descritos en el presente documento existen como isómeros geométricos. En algunas realizaciones, los compuestos descritos en el presente documento poseen uno o más dobles enlaces. Los compuestos presentados en el presente documento incluyen todos los isómeros cis, trans, sin, anti, entgegen (E) y zusammen (Z), así como las correspondientes mezclas de los mismos. En algunas situaciones, los compuestos existen como tautómeros. Los compuestos descritos en el presente documento incluyen todos los tautómeros posibles dentro de las fórmulas descritas en el presente documento. En algunas situaciones, los compuestos descritos en el presente documento poseen uno o más centros quirales y cada centro existe en la configuración R o configuración S. Los compuestos descritos en el presente documento incluyen todas las formas diastereoisómeras, enantiómeras y epímeras, así como sus correspondientes mezclas. En realizaciones adicionales de los compuestos y métodos proporcionados en el presente documento, las mezclas de enantiómeros y/o diastereoisómeros, resultantes de una única etapa preparativa, combinación o interconversión, son útiles para las aplicaciones descritas en el presente documento. En algunas realizaciones, los compuestos descritos en el presente documento se preparan como enantiómeros ópticamente puros mediante resolución cromatográfica quiral de la mezcla racémica. En algunas realizaciones, los compuestos descritos en el presente documento se preparan como sus estereoisómeros individuales haciendo reaccionar una mezcla racémica del compuesto con un agente de resolución ópticamente activo para formar un par de compuestos diastereoisómeros, separando los diastereómeros y recuperando los enantiómeros ópticamente puros. En algunas realizaciones, se prefieren los complejos disociables (p. ej., sales diastereoisómeras cristalinas). En algunas realizaciones, los diastereoisómeros tienen distintas propiedades físicas (p. ej., puntos de fusión, puntos de ebullición, solubilidades, reactividad, etc.) y se separan aprovechando estas diferencias. En algunas realizaciones, los diastereoisómeros se separan mediante cromatografía quiral o, preferiblemente, mediante técnicas de separación/resolución basadas en diferencias de solubilidad. En algunas realizaciones, el enantiómero ópticamente puro se recupera luego, junto con el agente de resolución, por cualquier medio práctico que no dé como resultado la racemización.
Compuestos marcados
En algunas realizaciones, los compuestos descritos en el presente documento existen en sus formas marcadas con isótopos. En algunas realizaciones, los métodos descritos en el presente documento incluyen métodos para tratar enfermedades mediante la administración de tales compuestos marcados con isótopos. En algunas realizaciones, los métodos descritos en el presente documento incluyen métodos para tratar enfermedades mediante la administración de dichos compuestos marcados con isótopos como composiciones farmacéuticas. Por lo tanto, en algunas realizaciones, los compuestos descritos en el presente documento incluyen compuestos marcados con isótopos, que son idénticos a los citados en el presente documento, salvo por el hecho de que uno o más átomos se reemplazan por un átomo que tiene una masa atómica o número de masa diferente de la masa atómica o número de masa que normalmente se encuentra en la naturaleza. Los ejemplos de isótopos que se incorporan en los compuestos descritos en el presente documento incluyen isótopos de hidrógeno, carbono, nitrógeno, oxígeno, fósforo, azufre, flúor y cloruro, tales como 2H, 3H, 13C, 14C, 15N, 18O, 17O 31P, 32P, 35S, 18F y 36Cl, respectivamente. Los compuestos descritos en el presente documento y sus sales, ésteres, profármacos, solvatos, hidratos o derivados farmacéuticamente aceptables que contienen los isótopos mencionados anteriormente y/u otros isótopos de otros átomos están dentro del alcance de esta invención. Ciertos compuestos marcados con isótopos, por ejemplo aquellos en los que se incorporan isótopos radiactivos tales como 3H y 14C, son útiles en ensayos de distribución tisular de fármacos y/o sustratos. Los isótopos tritiados, es decir, 3H y de carbono-14, es decir, 14C son particularmente preferidos por su facilidad de preparación y detectabilidad. Además, la sustitución con isótopos pesados tales como el deuterio, es decir, 2H, produce ciertas ventajas terapéuticas derivadas de una mayor estabilidad metabólica, por ejemplo, mayor semivida in vivo o requisitos de dosis reducidos. En
algunas realizaciones, los compuestos marcados isotópicamente, sus sales, ásteres, profármacos, solvatos, hidratos o derivados farmacéuticamente aceptables se preparan por cualquier método adecuado.
En algunas realizaciones, los compuestos descritos en el presente documento se marcan por otros medios, incluyendo, pero no limitado al uso de cromóforos o restos fluorescentes, marcadores bioluminiscentes o marcadores quimioluminiscentes.
Sales farmacéuticamente aceptables
En algunas realizaciones, los compuestos descritos en el presente documento existen como sus sales farmacéuticamente aceptables. En algunas realizaciones, los métodos descritos en el presente documento incluyen métodos para tratar enfermedades mediante la administración de tales sales farmacéuticamente aceptables. En algunas realizaciones, los métodos descritos en el presente documento incluyen métodos para tratar enfermedades mediante la administración de tales sales farmacéuticamente aceptables como composiciones farmacéuticas.
En algunas realizaciones, los compuestos descritos en el presente documento poseen grupos ácidos o básicos y, por lo tanto, reaccionan con cualquiera de una serie de bases inorgánicas u orgánicas y ácidos inorgánicos y orgánicos para formar una sal farmacéuticamente aceptable. En algunas realizaciones, estas sales se preparan en el sitio durante el aislamiento final y la purificación de los compuestos descritos en el presente documento, o haciendo reaccionar por separado un compuesto purificado en su forma libre con un ácido o base adecuado, y aislando la sal así formada.
Solvatos
En algunas realizaciones, los compuestos descritos en el presente documento existen como solvatos. En algunas realizaciones hay métodos para tratar enfermedades mediante la administración de dichos solvatos. En el presente documento se describen además métodos para tratar enfermedades mediante la administración de tales solvatos como composiciones farmacéuticas.
Los solvatos contienen cantidades estequiométricas o no estequiométricas de un disolvente y, en algunas realizaciones, se forman durante el procedimiento de cristalización con disolventes farmacéuticamente aceptables tales como agua, etanol y similares. Se forman hidratos cuando el disolvente es agua, o se forman alcoholatos cuando el disolvente es alcohol. Los solvatos de los compuestos descritos en el presente documento se preparan o forman convenientemente durante los procedimientos descritos en el presente documento. Únicamente a modo de ejemplo, los hidratos de los compuestos descritos en el presente documento se preparan convenientemente por recristalización en una mezcla de disolventes acuoso/orgánico, utilizando disolventes orgánicos que incluyen, pero no se limitan a dioxano, tetrahidrofurano o MeOH. Además, los compuestos proporcionados en el presente documento existen en formas no solvatadas así como solvatadas. En general, las formas solvatadas se consideran equivalentes a las formas no solvatadas a los efectos de los compuestos y métodos proporcionados en el presente documento.
Profármacos
En algunas realizaciones, los compuestos descritos en el presente documento existen en forma de profármaco. También se describen en el presente documento métodos para tratar enfermedades mediante la administración de dichos profármacos. En el presente documento se describen además métodos para tratar enfermedades mediante la administración de tales profármacos como composiciones farmacéuticas.
En algunas realizaciones, los profármacos incluyen compuestos en los que un resto de aminoácido o una cadena polipeptídica de dos o más (p. ej., dos, tres o cuatro) restos de aminoácidos se une covalentemente por un enlace amida o éster a un grupo amino, hidroxi o ácido carboxílico libre de los compuestos descritos en el presente documento. Los restos de aminoácidos incluyen, pero no se limitan a los 20 aminoácidos naturales y también incluyen 4-hidroxiprolina, hidroxilisina, demosina, isodemosina, 3-metilhistidina, norvalina, beta-alanina, ácido gammaaminobutírico, cirtulina, homocisteína, homoserina, ornitina y metionina sulfona. En otras realizaciones, los profármacos incluyen compuestos en los que un resto de ácido nucleico o un oligonucleótido de dos o más (p. ej., dos, tres o cuatro) restos de ácido nucleico se unen covalentemente a un compuesto descrito en el presente documento.
Los profármacos farmacéuticamente aceptables de los compuestos descritos en el presente documento también incluyen, pero no se limitan a ésteres, carbonatos, tiocarbonatos, derivados de N-acilo, derivados de N-aciloxialquilo, derivados cuaternarios de aminas terciarias, bases de N-Mannich, bases de Schiff, conjugados de aminoácidos, ésteres de fosfato, sales de metales y ésteres de sulfonato. En algunas realizaciones, los compuestos que tienen grupos amino, amido, hidroxi o carboxílico libres se convierten en profármacos. Por ejemplo, los grupos carboxilo libres se derivatizan como amidas o ésteres de alquilo. En ciertos casos, todos estos restos de profármacos incorporan grupos que incluyen, pero no se limitan a, grupos funcionales éter, amina y ácido carboxílico.
Los profármacos de hidroxi incluyen ésteres, tales como, aunque no limitados a, ésteres de aciloxialquilo (p. ej., aciloximetilo, aciloxietilo), ésteres de alcoxicarboniloxialquilo, ésteres de alquilo, ésteres de arilo, ésteres de fosfato, ésteres de sulfonato, ésteres de sulfato y ésteres que contienen disulfuro; éteres, amidas, carbamatos, hemisuccinatos, dimetilaminoacetatos y fosforiloximetiloxicarbonilos, como se describe en “Advanced Drug Delivery
Reviews” 1996, 19, 115.
Los profármacos derivados de amina incluyen, pero no se limitan a los siguientes grupos y combinaciones de grupos:
así como sulfonamidas y fosfonamidas.
En ciertos casos, sitios en cualquier parte del anillo aromático son susceptibles a diversas reacciones metabólicas, por lo tanto, la incorporación de sustituyentes apropiados en las estructuras del anillo aromático reduce, minimiza o elimina esta ruta metabólica.
Composiciones farmacéuticas
En ciertas realizaciones, el compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) como se describe en el presente documento se administra como un producto químico puro. En algunas realizaciones, el compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento se combina con un vehículo farmacéuticamente adecuado o aceptable (también denominado en el presente documento como excipiente farmacéuticamente adecuado (o aceptable), excipiente fisiológicamente adecuado (o aceptable) o vehículo fisiológicamente adecuado (o aceptable)) seleccionado basándose en una vía de administración elegida y la práctica farmacéutica convencional como se describe, por ejemplo, en Remington: The Science and Practice of Pharmacy (Gennaro, 21a Ed. Mack Pub. Co., Easton, PA (2005))).
Por consiguiente, en el presente documento se proporciona una composición farmacéutica que comprende al menos un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento, o un estereoisómero, sal, hidrato, solvato o N-óxido farmacéuticamente aceptable del mismo, junto con uno o más vehículos farmacéuticamente aceptables. El(los) vehículo(s) (o excipiente(s)) son aceptables o adecuados si el vehículo es compatible con los demás ingredientes de la composición y no es perjudicial para el receptor (es decir, el sujeto) de la composición.
Una realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (I), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ia), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ib), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ic), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Id), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ie), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (If), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ig), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ih), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que comprende un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ii), o una sal farmacéuticamente aceptable del mismo.
Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ia), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ib), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ic), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente
farmacéuticamente aceptable y un compuesto de Fórmula (Id), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ie), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (If), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ig), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ih), o una sal farmacéuticamente aceptable del mismo. Otra realización proporciona una composición farmacéutica que consiste esencialmente en un excipiente farmacéuticamente aceptable y un compuesto de Fórmula (Ii), o una sal farmacéuticamente aceptable del mismo.
En ciertas realizaciones, el compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) como se describe en el presente documento es sustancialmente puro, ya que contiene menos de 5%, o menos de 1% o menos de 0,1% de otras moléculas orgánicas pequeñas, tales como compuestos intermedios o subproductos contaminantes que se crean, por ejemplo, en una o más de las etapas de un método de síntesis.
Estas formulaciones incluyen las adecuadas para administración oral, rectal, tópica, bucal, parenteral (p. ej., subcutánea, intramuscular, intradérmica o intravenosa), vaginal, oftálmica o en aerosol, aunque la forma de administración más adecuada en un caso dado dependerá del grado y la gravedad de la afección que se está tratando y de la naturaleza del compuesto particular que se está usando. Por ejemplo, las composiciones descritas se formulan como dosis unitaria y/o se formulan para administración oral o subcutánea.
Las composiciones farmacéuticas de ejemplo se usan en forma de una preparación farmacéutica, por ejemplo, en forma sólida, semisólida o líquida, que incluye uno o más de los compuestos descritos, como un ingrediente activo, en una mezcla con un vehículo o excipiente orgánico o inorgánico adecuado para aplicaciones externas, enterales o parenterales. En algunas realizaciones, el ingrediente activo se combina, por ejemplo, con los vehículos farmacéuticamente aceptables no tóxicos habituales para comprimidos, gránulos, cápsulas, supositorios, soluciones, emulsiones, suspensiones y cualquier otra forma adecuada para su uso. El compuesto activo objetivo se incluye en la composición farmacéutica en una cantidad suficiente para producir el efecto deseado en el proceso o afección de la enfermedad.
En algunas realizaciones para preparar composiciones sólidas tales como comprimidos, el ingrediente activo principal se mezcla con un vehículo farmacéutico, p. ej., ingredientes de formación de comprimidos convencionales tales como almidón de maíz, lactosa, sacarosa, sorbitol, talco, ácido esteárico, estearato de magnesio, fosfato dicálcico o gomas y otros diluyentes farmacéuticos, p. ej., agua, para formar una composición de preformulación sólida que contiene una mezcla homogénea de un compuesto descrito o una sal no tóxica farmacéuticamente aceptable del mismo. Cuando se hace referencia a estas composiciones de preformulación como homogéneas, se quiere decir que el ingrediente activo está uniformemente disperso por toda la composición, de modo que la composición se subdivide fácilmente en formas farmacéuticas unitarias igualmente eficaces, tales como comprimidos, píldoras y cápsulas.
En formas farmacéuticas sólidas para administración oral (cápsulas, comprimidos, píldoras, grageas, polvos, gránulos y similares), la composición objeto se mezcla con uno o más vehículos farmacéuticamente aceptables, tales como citrato de sodio o fosfato dicálcico, y/o cualquiera de los siguientes: (1) cargas o diluyentes, tales como almidones, celulosa, celulosa microcristalina, celulosa microcristalina silicificada, lactosa, sacarosa, glucosa, manitol y/o ácido silícico; (2) aglutinantes, tales como, por ejemplo, carboximetilcelulosa, hipromelosa, alginatos, gelatina, polivinilpirrolidona, sacarosa y/o goma arábiga; (3) humectantes, tales como glicerol; (4) agentes disgregantes, tales como crospovidona, croscarmelosa sódica, glicolato sódico de almidón, agar-agar, carbonato cálcico, almidón de patata o tapioca, ácido algínico, ciertos silicatos y carbonato sódico; (5) agentes retardantes de disolución, tales como parafina; (6) aceleradores de absorción, tales como compuestos de amonio cuaternario; (7) agentes humectantes, tales como, por ejemplo, docusato de sodio, alcohol cetílico y monoestearato de glicerol; (8) absorbentes, tales como caolín y arcilla bentonita; (9) lubricantes, tales como talco, estearato de calcio, estearato de magnesio, polietilenglicoles sólidos, laurilsulfato de sodio y mezclas de los mismos; y (10) agentes colorantes. En el caso de cápsulas, comprimidos y píldoras, en algunas realizaciones, las composiciones comprenden agentes de tamponamiento. En algunas realizaciones, también se emplean composiciones sólidas de un tipo similar como cargas en cápsulas de gelatina rellenas blandas y duras utilizando excipientes como lactosa o azúcares de leche, así como polietilenglicoles de alto peso molecular y similares.
En algunas realizaciones, un comprimido se prepara por compresión o moldeo, opcionalmente con uno o más ingredientes auxiliares. En algunas realizaciones, los comprimidos por compresión se preparan utilizando aglutinante (por ejemplo, gelatina o hidroxipropilmetilcelulosa), lubricante, diluyente inerte, conservante, disgregante (por ejemplo, glicolato sódico de almidón o carboximetilcelulosa sódica reticulada), agente tensioactivo o dispersante. En algunas realizaciones, los comprimidos por moldeo se preparan moldeando en una máquina adecuada una mezcla de la composición objetivo humedecida con un diluyente líquido inerte. En algunas realizaciones, los comprimidos y otras formas farmacéuticas sólidas, tales como grageas, cápsulas, píldoras y gránulos, se ranuran o preparan con recubrimientos y cubiertas, tales como recubrimientos entéricos y otros recubrimientos.
Las composiciones para inhalación o insuflación incluyen soluciones y suspensiones en disolventes acuosos u orgánicos farmacéuticamente aceptables, o mezclas de los mismos, y polvos. Las formas farmacéuticas líquidas para administración oral incluyen emulsiones, microemulsiones, soluciones, suspensiones, jarabes y elixires farmacéuticamente aceptables. Además de la composición objeto, en algunas realizaciones, las formas farmacéuticas líquidas contienen diluyentes inertes, tales como, por ejemplo, agua u otros disolventes, agentes solubilizantes y emulsionantes, tales como alcohol etílico, alcohol isopropílico, carbonato de etilo, acetato de etilo, alcohol bencílico, benzoato de bencilo, propilenglicol, 1,3-butilenglicol, aceites (en particular, aceites de semilla de algodón, cacahuete, maíz, germen, oliva, ricino y sésamo), glicerol, alcohol tetrahidrofurílico, polietilenglicoles y ésteres de ácidos grasos de sorbitán, ciclodextrinas y mezclas de los mismos.
En algunas realizaciones, las suspensiones, además de la composición objeto, contienen agentes de suspensión tales como, por ejemplo, alcoholes isoestearílicos etoxilados, ésteres de sorbitol y sorbitano polioxietilénicos, celulosa microcristalina, metahidróxido de aluminio, bentonita, agar-agar, tragacanto y mezclas de los mismos.
En algunas realizaciones, las formulaciones para la administración rectal o vaginal se presentan como supositorios, que se preparan mezclando una composición objeto con uno o más excipientes o vehículos no irritantes adecuados que comprenden, por ejemplo, manteca de cacao, polietilenglicol, una cera para supositorios o un salicilato, y que es sólido a temperatura ambiente, pero líquido a temperatura corporal y, por lo tanto, se fundirá en la cavidad corporal y liberará el agente activo.
Las formas farmacéuticas para la administración transdérmica de una composición objeto incluyen polvos, aerosoles, pomadas, pastas, cremas, lociones, geles, soluciones, parches e inhalantes. En algunas realizaciones, el componente activo se mezcla en condiciones estériles con un vehículo farmacéuticamente aceptable y con cualquier conservante, tampón o propulsor según se requiera.
En algunas realizaciones, las pomadas, pastas, cremas y geles contienen, además de una composición objeto, excipientes, tales como grasas animales y vegetales, aceites, ceras, parafinas, almidón, tragacanto, derivados de celulosa, polietilenglicoles, siliconas, bentonitas, ácido silícico, talco y óxido de zinc, o mezclas de los mismos.
En algunas realizaciones, los polvos y aerosoles contienen, además de una composición objeto, excipientes tales como lactosa, talco, ácido silícico, hidróxido de aluminio, silicatos de calcio y poliamida en polvo, o mezclas de estas sustancias. En algunas realizaciones, los aerosoles contienen además propulsores habituales, tales como clorofluorohidrocarburos e hidrocarburos volátiles no sustituidos, tales como butano y propano.
En algunas realizaciones, los compuestos descritos en el presente documento se formulan como colirios para administración oftálmica.
Las composiciones y los compuestos descritos en el presente documento se administran alternativamente mediante aerosol. Esto se logra preparando un aerosol acuoso, preparación liposomal o partículas sólidas que contienen el compuesto. En algunas realizaciones, se usa una suspensión no acuosa (p. ej., propulsor de fluorocarburo). En algunas realizaciones, se usan nebulizadores sónicos porque minimizan la exposición del agente al cizallamiento, lo que da como resultado la degradación de los compuestos contenidos en las composiciones objeto. Normalmente, un aerosol acuoso se prepara formulando una solución o suspensión acuosa de una composición objeto junto con vehículos y estabilizantes farmacéuticamente aceptables convencionales. Los vehículos y estabilizantes varían con los requisitos de la composición objeto en particular, pero generalmente incluyen tensioactivos no iónicos (Tweens, Pluronics o polietilenglicol), proteínas inocuas como albúmina sérica, ésteres de sorbitán, ácido oleico, lecitina, aminoácidos tales como glicina tampones, sales, azúcares o alcoholes de azúcar. Los aerosoles generalmente se preparan a partir de soluciones isotónicas.
Las composiciones farmacéuticas adecuadas para la administración parenteral comprenden una composición objeto en combinación con una o más soluciones, dispersiones, suspensiones o emulsiones acuosas o no acuosas isotónicas estériles farmacéuticamente aceptables, o polvos estériles que se reconstituyen en soluciones o dispersiones inyectables estériles justo antes de su uso, que, en algunas realizaciones, contienen antioxidantes, tampones, bacteriostáticos, solutos que hacen que la formulación sea isotónica con la sangre del receptor previsto o agentes de suspensión o espesantes.
Los ejemplos de vehículos acuosos y no acuosos adecuados que se emplean en las composiciones farmacéuticas incluyen agua, etanol, polioles (tales como glicerol, propilenglicol, polietilenglicol y similares) y mezclas adecuadas de los mismos, aceites vegetales tales como aceite de oliva, y ésteres orgánicos inyectables tales como oleato de etilo y ciclodextrinas. La fluidez adecuada se mantiene, por ejemplo, mediante el uso de materiales de revestimiento, tales como la lecitina, mediante el mantenimiento del tamaño de partículas requerido en el caso de las dispersiones y mediante el uso de tensioactivos.
También se contemplan formulaciones farmacéuticas enterales que incluyen un compuesto descrito, un material entérico y un vehículo o excipiente farmacéuticamente aceptable del mismo. Los materiales entéricos se refieren a polímeros que son sustancialmente insolubles en el entorno ácido del estómago y que son predominantemente solubles en líquidos intestinales a pH específicos. El intestino delgado es la parte del tracto gastrointestinal (intestino) entre el estómago y el intestino grueso, e incluye el duodeno, el yeyuno y el íleon. El pH del duodeno es de
aproximadamente 5,5, el pH del yeyuno es de aproximadamente 6,5 y el pH del íleon distal es de aproximadamente 7,5. En consecuencia, los materiales entéricos no son solubles, por ejemplo, hasta un pH de aproximadamente 5,0, de aproximadamente 5,2, de aproximadamente 5,4, de aproximadamente 5,6, de aproximadamente 5,8, de aproximadamente 6,0, de aproximadamente 6,2, de aproximadamente 6,4, de aproximadamente 6,6, de aproximadamente 6,8, de aproximadamente 7,0, de aproximadamente 7,2, de aproximadamente 7,4, de aproximadamente 7,6, de aproximadamente 7,8, de aproximadamente 8,0, de aproximadamente 8,2, de aproximadamente 8,4, de aproximadamente 8,6, de aproximadamente 8,8, de aproximadamente 9,0, de aproximadamente 9,2, de aproximadamente 9,4, de aproximadamente 9,6, de aproximadamente 9,8 o de aproximadamente 10,0. Ejemplos de materiales entéricos incluyen acetato ftalato de celulosa (CAP), ftalato de hidroxipropilmetilcelulosa (HPMCP), ftalato de poli(acetato de vinilo) (PVAP), acetato succinato de hidroxipropilmetilcelulosa (HPMCAS), acetato trimelitato de celulosa, succinato de hidroxipropilmetilcelulosa, acetato succinato de celulosa, acetato hexahidroftalato de celulosa, propionato ftalato de celulosa, acetato maleato de celulosa, acetato butirato de celulosa, acetato propionato de celulosa, copolímero de ácido metilmetacrílico y metacrilato de metilo, copolímero de acrilato de metilo, metacrilato de metilo y ácido metacrílico, copolímero de éter de metilo y vinilo y anhídrido maleico (serie Gantrez ES), copolímero de metacrilato de etilo-metacrilato de metiloacrilato de etilo de clorotrimetilamonio, resinas naturales tales como zeína, goma laca y copal colofonia, y varios sistemas de dispersión entérica disponibles comercialmente (p. ej., Eudragit L30D55, Eudragit FS30D, Eudragit L100, Eudragit S 100, Kollicoat EMM30D, Estacryl 30D, Coateric y Aquateric). La solubilidad de cada uno de los materiales anteriores se conoce o se puede determinar fácilmente in vitro.
La dosis de la composición que comprende al menos un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) como se describe en el presente documento difiere, dependiendo de la afección del paciente (p. ej., ser humano), es decir, la etapa de la enfermedad, el estado de salud general, la edad y otros factores.
Las composiciones farmacéuticas se administran de manera apropiada para la enfermedad que se va a tratar (o prevenir). Una dosis apropiada y una duración y frecuencia de administración adecuadas estarán determinadas por factores tales como la afección del paciente, el tipo y la gravedad de la enfermedad del paciente, la forma particular del ingrediente activo y el método de administración. En general, una dosis y una pauta de tratamiento adecuados proporcionan la(s) composición(es) en una cantidad suficiente para proporcionar un beneficio terapéutico y/o profiláctico (p. ej., un resultado clínico mejorado, tal como remisiones parciales o completas más frecuentes, o una supervivencia sin enfermedad y/o global más prolongada, o una disminución de la gravedad de los síntomas. Las dosis óptimas generalmente se determinan utilizando modelos experimentales y/o ensayos clínicos. En algunas realizaciones, la dosis óptima depende de la masa corporal, peso o volumen de sangre del paciente.
Las dosis orales típicamente están en el intervalo de aproximadamente 1,0 mg a aproximadamente 1000 mg, de una a cuatro veces, o más, por día.
Métodos
En el presente documento se describen métodos para modular la actividad de la MAGL. Los métodos contemplados, por ejemplo, comprenden exponer dicha enzima a un compuesto descrito en el presente documento. En algunas realizaciones, el compuesto utilizado por uno o más de los métodos anteriores es uno de los compuestos genéricos, subgenéricos o específicos descritos en el presente documento, tal como un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii). En algunas realizaciones, en el presente documento se proporciona un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) en donde el compuesto es un inhibidor de MAGL. En algunas realizaciones, en el presente documento se proporciona un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (lg) , (Ih) o (Ii) en donde el compuesto es un inhibidor selectivo de MAGL. La capacidad de los compuestos descritos en el presente documento para modular o inhibir la MAGL se evalúa mediante procedimientos conocidos en la técnica y/o descritos en el presente documento. Otro aspecto de esta descripción proporciona métodos para tratar una enfermedad asociada con la expresión o actividad de MAGL en un paciente. En algunas realizaciones, en el presente documento se proporciona un compuesto de fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) en donde el compuesto es selectivo en la inhibición de MAGL en comparación con la inhibición de otras serina hidrolasas. En algunas realizaciones, en el presente documento se proporciona un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) en donde el compuesto es 10, 100 o 1000 veces más selectivo para inhibir MAGL en comparación con la inhibición de otras serina hidrolasas.
En otra realización es un método para tratar el dolor en un paciente, que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento, o un solvato, hidrato, tautómero, N-óxido o una sal farmacéuticamente aceptable del mismo, a un paciente que lo necesite para tratar dicho dolor. En otra realización es un método para tratar el dolor neuropático en un paciente, que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento, o un solvato, hidrato, tautómero, N-óxido o una sal farmacéuticamente aceptable del mismo, a un paciente que lo necesite para tratar dicho dolor neuropático. En otra realización es un método para tratar el dolor inflamatorio en un paciente, que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (lh) o (Ii) descrito en el presente documento, o un solvato, hidrato, tautómero, N-óxido o una sal farmacéuticamente aceptable del mismo, a un paciente que lo necesite para tratar dicho dolor inflamatorio. En otra realización es un
método para tratar el dolor crónico en un paciente, que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido o una sal farmacéuticamente aceptable del mismo, a un paciente que lo necesite para tratar dicho dolor crónico.
En otra realización es un método para tratar la migraña en un paciente que lo necesita que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido o una sal farmacéuticamente aceptable del mismo.
En otra realización es un método para tratar la esclerodermia en un paciente que lo necesita que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en el presente documento, o un solvato, hidrato, tautómero, W-óxido o una sal farmacéuticamente aceptable del mismo.
En otra realización es un método para tratar la enfermedad del hígado graso no alcohólico (NASH) en un paciente que lo necesita que comprende administrar una cantidad terapéuticamente eficaz de un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii) descrito en este documento, o un solvato, hidrato, tautómero, W-óxido, o una sal farmacéuticamente aceptable del mismo.
En ciertas realizaciones, un compuesto descrito utilizado por uno o más de los métodos anteriores es uno de los compuestos genéricos, subgenéricos o específicos descritos en el presente documento, tal como un compuesto de Fórmula (I), (I'), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) o (Ii).
Los compuestos descritos se administran a pacientes (animales y seres humanos) que necesitan dicho tratamiento en dosis que proporcionarán una eficacia farmacéutica óptima. Se apreciará que la dosis requerida para usar en cualquier aplicación particular variará de paciente a paciente, no solo con el compuesto o composición particular seleccionada, sino también con la vía de administración, la naturaleza de la afección que se trata, la edad y el estado del paciente, medicación concurrente o dietas especiales que el paciente sigue en ese momento, y otros factores, quedando finalmente la dosis adecuada a discreción del médico tratante. Para tratar afecciones y enfermedades clínicas mencionadas anteriormente, un compuesto contemplado descrito en el presente documento se administra por vía oral, subcutánea, tópica, parenteral, por pulverización de inhalación o por vía rectal en formulaciones de unidades de dosificación que contienen excipientes, adyuvantes y vehículos convencionales no tóxicos farmacéuticamente aceptables. La administración parenteral incluye inyecciones subcutáneas, inyecciones intravenosas o intramusculares o técnicas de infusión.
También se contemplan en el presente documento terapias combinadas, por ejemplo, la administración conjunta de un compuesto descrito y un agente activo adicional, como parte de un régimen de tratamiento específico destinado a proporcionar el efecto beneficioso de la acción conjunta de estos agentes terapéuticos. El efecto beneficioso de la combinación incluye, pero no se limita a, la acción conjunta farmacocinética o farmacodinámica resultante de la combinación de agentes terapéuticos. La administración de estos agentes terapéuticos en combinación normalmente se lleva a cabo durante un período de tiempo definido (normalmente semanas, meses o años dependiendo de la combinación seleccionada). La terapia de combinación pretende abarcar la administración de múltiples agentes terapéuticos de forma secuencial, es decir, en donde cada agente terapéutico se administra en un momento diferente, así como la administración de estos agentes terapéuticos, o al menos dos de los agentes terapéuticos, en una manera sustancialmente simultánea.
La administración sustancialmente simultánea se logra, por ejemplo, administrando al sujeto una sola formulación o composición, (p. ej., un comprimido o cápsula que tiene una proporción fija de cada agente terapéutico o múltiples formulaciones únicas (p. ej., cápsulas) para cada uno de los agentes terapéuticos. La administración secuencial o sustancialmente simultánea de cada agente terapéutico se efectúa por cualquier vía apropiada que incluye, pero no se limita a, vías orales, vías intravenosas, vías intramusculares y absorción directa a través de tejidos de membranas mucosas. Los agentes terapéuticos se administran por la misma vía o por vías diferentes. Por ejemplo, un primer agente terapéutico de la combinación seleccionada se administra por inyección intravenosa mientras que los otros agentes terapéuticos de la combinación se administran por vía oral. Alternativamente, por ejemplo, todos los agentes terapéuticos se administran por vía oral o todos los agentes terapéuticos se administran mediante inyección intravenosa.
La terapia de combinación también abarca la administración de los agentes terapéuticos como se describe anteriormente en combinación adicional con otros ingredientes biológicamente activos y terapias no farmacológicas. Cuando la terapia de combinación comprende además un tratamiento no farmacológico, el tratamiento no farmacológico se lleva a cabo en cualquier momento adecuado siempre que se logre un efecto beneficioso de la acción conjunta de la combinación de los agentes terapéuticos y el tratamiento no farmacológico. Por ejemplo, en casos apropiados, el efecto beneficioso aún se logra cuando el tratamiento no farmacológico se retira temporalmente de la administración de los agentes terapéuticos, quizás durante días o incluso semanas.
Los componentes de la combinación se administran a un paciente de forma simultánea o secuencial. Se apreciará
que los componentes están presentes en el mismo vehículo farmacéuticamente aceptable y, por lo tanto, se administran simultáneamente. Alternativamente, los ingredientes activos que están presentes en vehículos farmacéuticos separados, tales como formas farmacéuticas orales convencionales, se administran de forma simultánea o secuencial.
En algunas realizaciones, para el tratamiento contemplado del dolor, se administra conjuntamente un compuesto descrito con otro agente terapéutico para el dolor tal como un opioide, un modulador del receptor cannabinoide (CB-1 o CB-2), un inhibidor de la COX-2, paracetamol y/o un agente antiinflamatorio no esteroideo. Los agentes terapéuticos adicionales, p. ej., para el tratamiento del dolor que se administran conjuntamente incluyen morfina, codeína, hidromorfona, hidrocodona, oximorfona, fentanilo, tramadol y levorfanol.
En algunas realizaciones, para el tratamiento contemplado del dolor, la coadministración de un compuesto descrito incluye aspirina, naproxeno, ibuprofeno, salsalato, diflunisal, dexibuprofeno, fenoprofeno, ketoprofeno, oxaprozina, loxoprofeno, indometacina, tolmetina, sulindaco, etodolaco, ketorolaco, piroxicam, meloxicam, tenoxicam, droxicam, lornoxicam, celecoxib, parecoxib, rimonabant y/o etoricoxib.
Los siguientes ejemplos se proporcionan meramente como ilustrativos de varias realizaciones y no deben interpretarse como limitantes de la invención de ninguna manera.
Ejemplos
Lista de abreviaturas
Como se usa anteriormente, y a lo largo de la descripción de la invención, las siguientes abreviaturas, a menos que se indique lo contrario, se entenderá que tienen los siguientes significados:
ACN o MeCN acetonitrilo
Bn bencilo
BOC o Boc carbamato de ferc-butilo
CDI 1,1'-carbonildiimidazol
Cy ciclohexilo
DCE dicloroetano (ClCH2CH2Cl)
DCM diclorometano (CH2Cl2)
DIPEA o DIEA diisopropiletilamina
DMAP 4-(W,W-dimetilamino)piridina
DMF dimetilformamida
DMA W,W-dimetilacetamida
DMSO dimetilsulfóxido
eq equivalente(s)
Et etilo
EtOH etanol
EtOAc acetato de etilo
HATU hexafluorofosfato de 3-óxido de 1-[bis(dimetilamino)metilen]-1H-1,2,3-triazolo[4,5-b]piridinio HPLC cromatografía líquida de alta resolución
LAH hidruro de litio y aluminio
Me metilo
MeOH metanol
EM espectroscopia de masas
NMM W-metilmorfolina
RMN resonancia magnética nuclear
PMB para-metoxibencilo
TEA trietilamina
TFA ácido trifluoroacético
THF tetrahidrofurano
TLC cromatografía de capa fina
I. Síntesis química
A menos que se indique lo contrario, los reactivos y disolventes se usaron tal como se recibieron de proveedores comerciales. Se utilizaron disolventes anhidros y material de vidrio secado en horno para transformaciones sintéticas sensibles a la humedad y/o al oxígeno. No se optimizaron los rendimientos. Los tiempos de reacción son aproximados y no se optimizaron. La cromatografía en columna y la cromatografía en capa fina (TLC) se realizaron en gel de sílice a menos que se indique lo contrario. Los espectros se dan en ppm (5) y las constantes de acoplamiento (J) se expresan en hercios. Para los espectros de protón, el pico del disolvente se utilizó como pico de referencia.
Ejemplo 1: Ácido 1-(4-(4-clorobencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (5,00 g, 44,6 mmol, 1,00 eq), f-butanol (50 ml), dicarbonato de di-f-butilo (39,0 g, 179 mmol, 4,01 eq), trietilamina (27,0 g, 268 mmol, 6,00 eq) y DMAP (1,10 g, 9,00 mmol, 0,20 eq). La solución resultante se agitó durante una noche a 65°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida para proporcionar 11,2 g (bruto) del 1H-pirazol-1,3-dicarboxilato de di-f-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (5,00 g, 18,6 mmol, 1,00 eq), MeOH (30 ml), NaOH (2,50 g, 62,5 mmol, 3,35 eq) y agua (5 ml). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (10 ml). La mezcla se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida para proporcionar 3,05 g (bruto) del 1H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de cloruro de 4-(4-clorobencil)piperazina-1-carbonilo
Se cargó un matraz con trifosgeno (210 mg, 1,00 mmol, 1,00 eq), DCM (10 ml) y 1-[(4-clorofenil)metil]piperazina (206 mg, 0,698 mmol, 0,70 eq). Se añadió gota a gota DIPEA (516 mg, 3,99 mmol, 4,00 eq) a 0°C. La solución resultante se agitó durante 2 horas a 0°C y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida para proporcionar 250 mg (bruto) del cloruro de 4-(4-clorobencil)piperazina-1-carbonilo como un aceite amarillo.
E tap a 4: P rep a ra c ión de 1 -(4 -(4 -c lo ro b e n c il)p ip e ra z in a -1 -carbon il)-1 H -p ira zo l-3 -ca rb o x ila to de f-butilo
Se cargó un matraz con cloruro de 4-(4-clorobencil)piperazina-1-carbonilo (250 mg, 0,920 mmol, 1,00 eq), THF (10 ml), 1H-pirazol-3-carboxilato de f-butilo (155 mg, 0,920 mmol, 1,01 eq), DIPEA (237 mg, 1,83 mmol, 2,00 eq) y DMAP (22,0 mg, 0,180 mmol, 0,20 eq). La solución resultante se agitó durante una noche a 60°C y se inactivó con agua (5 ml). La mezcla se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 260 mg (70% de rendimiento) del 1-(4-(4-clorobencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 405 [M+H]+.
Etapa 5: Preparación del ácido 1-(4-(4-clorobencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(4-clorobencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo (260 mg, 0,861 mmol, 1,00 eq), DCM (10 ml) y TFA (1 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se concentró a presión reducida. El producto bruto se purificó por HPLC preparativa para proporcionar 66,6 mg (30% de rendimiento) del ácido 1-(4-(4-clorobencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido amarillo. RMN 1H (400 MHz, CD3OD) 58,08 (s, 1H), 7,34 - 7,39 (m, 4H), 6,75 (s, 1H), 3,68 - 4,14 (m, 4H), 3,52 - 3,77 (m, 2H), 2,47 - 2,70 (m, 4H). CLEM (ESI, m/z): 349 [M+H]+.
Ejemplo 2: Acido 1-(4-(3-fenoxibencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (5,00 g, 44,6 mmol, 1,00 eq), f-butanol (50 ml), dicarbonato de di-f-butilo (39,0 g, 179 mmol, 4,01 eq), trietilamina (27,0 g, 268 mmol, 6,00 eq) y DMAP (1,10 g, 9,00 mmol, 0,20 eq). La solución resultante se agitó durante una noche a 65°C y se inactivó con agua (20 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 11,2 g (bruto) del 1H-pirazol-1,3-dicarboxilato de di-f-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (5,00 g, 18,6 mmol, 1,00 eq), MeOH (30 ml), NaOH (2,50 g, 62,5 mmol, 3,35 eq) y agua (5 ml). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 3,05 g (bruto) del 1 H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
E tapa 3: P rep a ra c ión de í-butil 4 -(3 -fe n o x ib e n c il)p ip e ra z in a -1 -c a rb o x ila to
Se cargó un matraz con 3-fenoxibenzaldehído (5,00 g, 25,2 mmol, 1,00 eq), piperazina-1-carboxilato de í-butilo (4,25 g, 22,8 mmol, 0,90 eq) y DCE (100 ml). La mezcla se agitó durante 1 h a temperatura ambiente y luego se añadió triacetoxiborohidruro de sodio (10,6 g, 50,0 mmol, 1,98 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (50 ml). La mezcla se extrajo con DCM (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 8,80 g (95% de rendimiento) del 4-(3-fenoxibencil)piperazina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 369 [M+H]+.
Etapa 4: Preparación de 1-(3-fenoxibencil)piperazina
Se cargó un matraz con 4-(3-fenoxibencil)piperazina-1 -carboxilato de í-butilo (8,80 g, 23,9 mmol, 1,00 eq), 1,4-dioxano (50 ml) y ácido clorhídrico concentrado (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida para proporcionar 6,03 g (bruto) de la 1-(3-fenoxibencil)piperazina como un sólido blanco. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 5: Preparación de cloruro de 4-(3-fenoxibencil)piperazina-1-carbonilo
Se cargó un matraz con 1 -(3-fenoxibencil)piperazina (200 mg, 0,751 mmol, 1,00 eq), DCM (10,0 ml) y trifosgeno (135 mg, 0,451 mmol, 0,70 eq). Se añadió gota a gota DIPEA (388 mg, 3,00 mmol, 4,00 eq) a 0°C. La solución resultante se agitó durante 5 h a 0°C y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 1, Etapa 3, para proporcionar 217 mg (bruto) del cloruro de 4-[(3-fenoxifenil)metil]piperazina-1-carbonilo como un aceite amarillo.
Etapa 6: Preparación de 1-(4-(3-fenoxibencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con cloruro de 4-[(3-fenoxifenil)metil]piperazina-1-carbonilo (217 mg, 0,661 mmol, 1,00 eq), THF (10 ml), 1H-pirazol-3-carboxilato de í-butilo (110 mg, 0,652 mmol, 1,00 eq), Dm A p (16,2 mg, 0,131 mmol, 0,20 eq) y DIPEA (169 mg, 1,31 mmol, 2,00 eq). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 1, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 120 mg (40% de rendimiento) de 1-(4-(3-fenoxibencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo en forma de un aceite amarillo. CLEM (ESI, m/z): 463 [M+H]+
Etapa 7: Preparación del ácido 1-(4-(3-fenoxibencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(3-fenoxibencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo (120 mg, 0,261
mmol, 1,00 eq), DCM (5 ml) y TFA (1 ml). La mezcla resultante se agitó durante una noche a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 81,6 mg (77% de rendimiento) del ácido 1 -(4-(3-fenoxibencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico como un polvo blanco. RMN 1H: (400 MHz, CD3OD) 58,15 (s, 1H), 7,33 - 7,48 (m, 3H), 7,11 -7,27 (m, 2H), 7,06 - 7,11 (s, 1H), 6,99 - 7,06 (m, 2H), 6,90 - 6,99 (m, 1H), 6,75 - 6,90 (m, 1H), 3,82 - 4,13 (s, 4H), 3,70 - 3,82 (d, J = 8,2 Hz, 2H), 2,60 - 2,93 (s, 4H). CLEM (ESI, m/z) : 407 [M+H]+.
Ejemplo 3: Ácido 1-(4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-t-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,2 mmol, 1,00 eq), DMAP (2,15 g, 17,6 mmol, 0,20 eq), trietilamina (27,0 g, 267 mmol, 3,00 eq), dicarbonato de di-t-butilo (80,0 g, 366 mmol, 4,00 equivalentes) y t-butanol (100 ml), como se describe en el Ejemplo 1, Etapa 1. La solución resultante se agitó durante 4 h a 80°C y se concentró a presión reducida para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-t-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de t-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-t-butilo (25,0 g, 93,2 mmol, 1,00 eq), NaOH (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió en una columna de gel de sílice para proporcionar 10,0 g (64% de rendimiento) del 1H- pirazol-3-carboxilato de t-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 2-morfolino-4-(trifluorometil)benzaldehído
Se cargó un matraz con 2-fluoro-4-(trifluorometil)benzaldehído (3,00 g, 15,6 mmol, 1,00 eq), carbonato de potasio (8,62 g, 62,4 mmol, 4,00 eq), morfolina (2,72 g, 31,2 mmol, 2,00 eq) y DMSO (40 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 100°C y luego se inactivó con agua (50 ml). La mezcla resultante se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (100 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo proporcionó 1,86 g (46% de rendimiento) del 2-(morfolin-4-il)-4-(trifluorometil)benzaldehído como un sólido amarillo. CLEM (ESI, m/z): 260 [M+H]+.
Etapa 4: Preparación de 4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carboxilato de t -butilo
Se cargó un matraz con 2-(morfolin-4-il)-4-(trifluorometil)benzaldehído (0,600 g, 2,31 mmol, 1,00 eq), piperazina-1-carboxilato de í-butilo (0,646 g, 3,47 mmol, 1,50 eq) y DCM (20 ml). La mezcla se agitó durante 2 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (1,96 g, 9,23 mmol, 4,00 eq), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 0,920 g (93% de rendimiento) del 4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 430 [M+H]+.
Etapa 5: Preparación de 4-(2-(piperazin-1-ilmetil)-5-(trifluorometil)fenil)morfolina
Se cargó un matraz de fondo redondo de 250 ml con 4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1 -carboxilato de í-butilo (920 mg, 2,14 mmol, 1,00 eq), ácido trifluoroacético (10 ml) y DCM (30 ml), como se describe en el Ejemplo 1, Etapa 5 para proporcionar 700 mg (99% de rendimiento) de la 4-(2-(piperazin-1-ilmetil)-5-(trifluorometil)fenil)morfolina como un aceite marrón. CLEM (ESI, m/z): 330 [M+H]+.
Etapa 6: Preparación de cloruro de 4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonilo
Se cargó un matraz con trifosgeno (226 mg, 0,760 mmol, 0,50 eq), DCM (10 ml). Se añadieron 4-(2-(piperazin-1-ilmetil)-5-(trifluorometil)fenil)morfolina (500 mg, 1,52 mmol, 1,00 eq) y DIPEA (588 mg, 4,56 mmol, 3,00 eq) a 0°C como se describe en el Ejemplo 1, Etapa 3, para proporcionar 500 mg (84% de rendimiento) del cloruro de 4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonilo como un aceite amarillo. CLEM (ESI, m/z): 392 [M+H]+.
Etapa 7: Preparación de 1-(4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con cloruro de 4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonilo (400 mg, 1,02 mmol, 1,00 eq), 1H-pirazol-3-carboxilato de í-butilo (190 mg, 1,13 mmol, 1,10 eq), DMAP (62,0 mg, 0,510 mmol, 0,50 eq), DIPEA (396 mg, 3,07 mmol, 3,00 eq), THF (10 ml) como se describe en el Ejemplo 1, Etapa 4. El residuo se cromatografió para proporcionar 300 mg (56% de rendimiento) del 1 -(4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 524 [M+H]+.
Etapa 8: Preparación de ácido 1-(4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo (140 mg, 0,270 mmol, 1,00 equivalentes), TFA (1 ml) y DCM (10 ml) como se describe en el Ejemplo 1, Etapa 5 para proporcionar el producto bruto (250 mg). El residuo se purificó por HPLC preparativa para proporcionar 78,2 mg (63% de rendimiento) del ácido 1-(4-(2-morfolino-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, metanol-a4) □□8,14 (d, J = 2,6 Hz, 1H), 7,73 (d, J = 8,2 Hz, 1H),
7,41 - 7,42 (m, 2H), 6,83 (d, J= 2,6 Hz, 1 H), 3,81 - 3,88 (m, 10H), 3,01 - 3,02 (m, 4H), 2,71 (ancho, 4H). CLEM (ESI, m/z)\ 468 [M+H]+.
Ejemplo 4: Ácido 1-(4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-t-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,2 mmol, 1,00 eq), DMAP (2,15 g, 17,6 mmol, 0,20 eq), trietilamina (27,0 g, 267 mmol, 3,00 eq), dicarbonato de di-t-butilo (80,0 g, 366 mmol, 4,00 equivalentes) en t-butanol (100 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de t-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-t-butilo (25,0 g, 93,2 mmol, 1,00 eq), NaOH (5,60 g, 140 mmol, 1,50 eq) en agua (80 ml) y MeOH (240 ml) como se describe en el Ejemplo 1, Etapa 2, para proporcionar 10,0 g (64% de rendimiento) del 1 H-pirazol-3-carboxilato de t-butilo en forma de un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+. Etapa 3: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(f-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de t-butilo (2,42 g, 14,4 mmol, 1,00 eq), DCM (20 ml), cloroformiato de 4-nitrofenilo (2,90 g, 14,4 mmol, 1,00 eq) y trietilamina (4,36 g, 43,1 mmol, 3,00 equivalentes). La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida para proporcionar 4,80 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1 -(4-nitrofenilo) como un aceite amarillo. CLEM (ESI, m/z): 334 [M+H]+. Etapa 4: Preparación de 2-morfolino-4-(trifluorometil)benzaldehído
Se cargó un matraz con 2-fluoro-4-(trifluorometil)benzaldehído (5,00 g, 26,0 mmol, 1,00 eq), carbonato de potasio (10,8 g, 78,1 mmol, 3,00 eq), morfolina (6,79 g, 78,0 mmol, 3,00 eq) y DMSO (50 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante una noche a 80°C y se inactivó con agua (50 ml) como se describe en el Ejemplo 3, Etapa 3 para proporcionar 4,00 g (59% de rendimiento) del 2-morfolino-4-(trifluorometil)benzaldehído como un sólido amarillo. CLEM (ESI, m/z): 260 [M+H]+.
E tapa 5: P rep a ra c ión de 4 -m e til-4 -((2 -m o rfo lin o -4 -(tr iflu o ro m e til)b e n c il)a m in o )p ip e rid in a -1 -c a rb o x ila to de í-butilo
Se cargó un matraz de fondo redondo de 100 ml con 2-morfolino-4-(trifluorometil)benzaldehído (2,50 g, 9,64 mmol, 1,00 eq), MeOH (25 ml), AcOH (1,70 g, 28,3 mmol, 3,00 eq) y 4-amino-4-metilpiperidina-1 -carboxilato de í-butilo (2,46 g, 11,5 mmol, 1,20 eq). La solución resultante se agitó durante 30 min a temperatura ambiente. Se añadió cianoborohidruro de sodio (1,78 g, 28,3 mmol, 3,00 equivalentes). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (30 ml). La solución resultante se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para producir 3,51 g (80% de rendimiento) del 4-metil-4-((2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo como un aceite amarillo CLEM (ESI, m/z): 458 [M+H]+.
Etapa 6: Preparación de 4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo
Se cargó un matraz de fondo redondo de 100 ml con 4-metil-4-((2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo (3,51 g, 7,67 mmol, 1,00 equivalentes), paraformaldehído (2,30 g, 76,7 mmol, 10,0 eq), trietilamina (2,30 g, 22,7 mmol, 3,00 eq) y DCE (30 ml). La solución resultante se agitó durante 30 min a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (4,80 g, 22,6 mmol, 3,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (30 ml) como se describe en el Ejemplo 2, Etapa 3, para producir 3,39 g (94% de rendimiento) de 4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 472 [M+H]+.
Etapa 7: Preparación de 4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo
Se cargó un matraz con 4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo (3,39 g, 7,19 mmol, 1,00 eq), DCM (20 ml) y TFA (5 ml) como se describe en el Ejemplo 1, Etapa 5 para producir 3,50 g (bruto) del 4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo como un sólido blanco. CLEM (eS i, m/z): 372 [M+H]+.
Etapa 8: Preparación de 1 -(4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) (3,50 g, 9,43 mmol, 1,00 eq), DCM (20 ml), 4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo (6,28 g, 18,7 mmol, 2,00 eq) y trietilamina (2,86 g, 28,3 mmol, 3,00 eq), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 4,58 g (80% de rendimiento) del 1-(4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 566 [M+H]+.
E tap a 9: P rep a ra c ión de ác ido 1 -(4 -m e til-4 -(m e til(2 -m o rfo lin o -4 -(tr if lu o ro m e til)b e n c il)a m in o )p ip e rid in a -1 -c a rb o n il)-1 H -p ira zo l-3 -ca rb o x ílico
Se cargó un matraz con 1-(4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1 H-pirazol-3-carboxilato de f-butilo (4,58 g, 8,10 mmol, 1,00 eq), DCM (50 ml) y TFA (10 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto (3,50 g) se purificó por HPLC preparativa para proporcionar 694,3 mg (17% de rendimiento) del ácido 1 -(4-metil-4-(metil(2-morfolino-4-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. Rm N 1H (300 MHz, metanol-a^) ó 8,08 (d, J = 2,6 Hz, 1H), 7,84 d, J = 8,4 Hz, 1H), 7,49 - 7,52 (m, 2H), 6,78 (d, J = 2,6 Hz, 1H), 4,12 - 4,25 (m, 4H), 3,84 - 3,87 (m, 4H), 3,54 - 3,65 (m, 2H), 2,93 - 3,07 (m, 4H), 2,41 (ancho, 3H), 2,11 - 2,16 (m, 2H), 2,03 - 2,10 (m, 2H), 1,41 (ancho, 3H). CLEM (ESI, m/z): 510 [M+H]+.
Ejemplo 5: Ácido 1-(4-(2-(1 H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,2 mmol, 1,00 eq), 4-dimetilaminopiridina (2,15 g, 17,6 mmol, 0,20 eq), trietilamina (27,0 g, 267 mmol, 3,00 eq), dicarbonato de di-f-butilo (80,0 g, 366 mmol, 4,00 equivalentes) en f-butanol (100 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (25,0 g, 93,2 mmol, 1,00 eq), NaOH (5,60 g, 140 mmol, 1,50 eq) en agua (80 ml) y MeOH (240 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 10,0 g (64% de rendimiento) del 1 H-pirazol-3-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 4-(2-bromo-4-(trifluorometil)bencil)piperazina-1 -carboxilato de f-butilo
Se cargó un matraz con 2-bromo-4-(trifluorometil)benzaldehído (500 mg, 1,98 mmol, 1,00 eq), trietilamina (600 mg, 5.93 mmol, 3,00 eq), piperazina-1-carboxilato de f-butilo (443 mg, 2,38 mmol, 1,20 equivalentes) en DCE (10 ml). La solución resultante se agitó durante 0,5 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (1,26 g, 5.94 mmol, 3,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 680 mg (81% de rendimiento) del 4-(2-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo como un sólido blanco. CLEM
(ESI, m/z): 423 [M+H]+.
Etapa 4: Preparación de 4-(2-ciano-4-(trifluorometil)bencil)piperazina-1 -carboxilato de í-butilo
Se cargó un matraz con 4-(2-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (680 mg, 1,61 mmol, 1,00 eq), cianuro de zinc (374 mg, 3,22 mmol, 2,00 eq), tetrakis(trifenilfosfina)paladio (170 mg, 0,150 mmol, 0,10 eq) en DMF (10 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante una noche a 120°C y se inactivó con agua (10 ml). La solución resultante se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 230 mg (39% de rendimiento) del 4-(2-ciano-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo en forma de un sólido blanco. CLEM (ESI, m/z): 370 [M+H]+.
Etapa 5: Preparación de 4-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í -butilo
Se cargó un matraz con 4-(2-ciano-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (230 mg, 0,620 mmol, 1,00 eq), azida de sodio (203 mg, 3,12 mmol, 5,00 eq), cloruro de amonio (198 mg, 3,70 mmol, 6,00 eq) en DMF (10 ml). La solución resultante se agitó durante una noche a 120°C y se inactivó con agua (10 ml). La solución resultante se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 140 mg (55% de rendimiento) del 4-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo en forma de un sólido blanco. CLEM (ESI, m/z): 413 [M+H]+.
Etapa 6: Preparación de 1-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina
Se cargó un matraz con 4-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (140 mg, 0,340 mmol, 1,00 eq), 1,4-dioxano (10 ml), ácido clorhídrico concentrado (3 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 130 mg (bruto) de la 1 -(2-(1 H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina como un sólido blanco. CLEM (ESI, m/z): 313 [M+H]+.
Etapa 7: Preparación de 1-(4-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con trifosgeno (38,0 mg, 0,130 mmol, 0,40 eq), 1 H-pirazol-3-carboxilato de í-butilo (70,0 mg, 0,420 mmol, 1,30 eq) en DCM (10 ml) en atmósfera de nitrógeno. Se añadió gota a gota DIPEA (122 mg, 0,960 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 horas a 0°C. Se añadió 1-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina (100 mg, 0,320 mmol, 1,00 eq) como se describe en el Ejemplo 1, Etapa 3, para proporcionar 90,0 mg (55% rendimiento) del 1 -(4-(2-(1 H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 507 [M+H]+.
E tap a 8: P rep a ra c ión de ác ido 1 -(4 -(2 -(1 H -te tra z o l-5 - il)-4 -( tr iflu o ro m e til)b e n c il)p ip e ra z in a -1 -c a rb o n il)-1 H -p ira z o l-3 -c a rb o x ílico
Se cargó un matraz con 1-(4-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo (90,0 mg, 0,180 mmol, 1,00 eq) y TFA (3 ml) en DCM (10 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar el producto bruto (100 mg), que se purificó por HPLC preparativa. La purificación dio como resultado 22,3 mg (28% de rendimiento) del ácido 1-(4-(2-(1H-tetrazol-5-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-o4) ó 8,30 (s, 1H), 8,14 (d, J = 2, Hz, 1H), 7,76 - 7,87 (m, 2H), 6,78 (d, J = 2,7 Hz, 1 H), 4,44 (s, 2H), 4,18 (ancho, 4H), 3,24 (ancho, 4H). CLEM (ESI, m/z): 451 [M+H]+.
Ejemplo 6: Ácido 1 -(4-(2-(4-ciclopropilpiperazin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 2-(4-ciclopropilpiperazin-1-il)-4-(trifluorometil)benzaldehído
Se cargó un matraz con 2-fluoro-4-(trifluorometil)benzaldehído (400 mg, 2,08 mmol, 1,00 eq), DMSO (10 ml), carbonato de potasio (861 mg, 6,24 mmol, 3,00 eq) y 1-ciclopropilpiperazina (524 mg, 4,16 mmol, 2,00 eq) en atmósfera de nitrógeno, como se describe en el Ejemplo 3, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 460 mg (74% de rendimiento) del 2-(4-ciclopropilpiperazin-1-il)-4-(trifluorometil)benzaldehído como un aceite amarillo. CLEM (ESI, m/z): 299 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-f-butilo (77,8 g, 357 mmol, 4,00 equivalentes) y f-butanol (100 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1H -pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite rojo. CLEM (eS i, m/z): 269 [M+H]+.
Etapa 3: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (25,0 g, 93,3 mmol, 1,00 eq), NaOH (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 10,0 g (64% de rendimiento) de 1 H-pirazol-3-carboxilato de í-butilo en forma de un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+
Etapa 4: Preparación de 1-(4-bencilpiperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con trifosgeno (1,24 g, 4,18 mmol, 0,70 eq) y DCM (20 ml). Se añadió 1H-pirazol-3-carboxilato de í-butilo (1,00 g, 5,95 mmol, 1,00 eq) a 0°C. Se añadió DIPEA (3,07 g, 23,8 mmol, 4,00 eq) a 0°C. La mezcla se agitó a temperatura ambiente durante 2 h a 0°C. Se añadió 1 -bencilpiperazina (1,26 g, 7,15 mmol, 1,20 equivalentes) a 0°C, como se describe en el Ejemplo 1, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 1,35 g (61% de rendimiento) de 1-(4-bencilpiperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 371 [M+H]+.
Etapa 5: Preparación de 1-(piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1-(4-bencilpiperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo (1,00 g, 2,70 mmol, 1,00 eq), MeOH (10 ml), EtOAc (10 ml) y paladio sobre carbono (0,400 g). Se introdujo hidrógeno. La solución resultante se agitó durante 3 h a temperatura ambiente y los catalizadores se separaron por filtración. El filtrado se concentró a presión reducida para proporcionar 0,690 g (bruto) de 1-(piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite incoloro. CLEM (ESI, m/z): 281 [M+H]+.
Etapa 6: Preparación de 1 -(4-(2-(4-ciclopropilpiperazin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 2-(4-ciclopropilpiperazin-1-il)-4-(trifluorometil)benzaldehído (92,2 mg, 0,309 mmol, 1,00 eq), 1-[(piperazin-1-il)carbonil]-1H-pirazol-3-carboxilato de í-butilo (130 mg, 0,464 mmol, 1,50 equivalentes), DCE (10 ml). La solución resultante se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (262 mg, 1,24 mmol, 4,00 eq), como se describe en el Ejemplo 2, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 140 mg (81% de rendimiento) del 1-(4-(2-(4-ciclopropilpiperazin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 563 [M+H]+.
Etapa 7: Preparación de ácido 1-(4-(2-(4-ciclopropilpiperazin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(2-(4-ciclopropilpiperazin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo (140 mg , 0,250 mmol, 1,00 eq), d Cm (12 ml) y TFA (2 ml) como se describe en el Ejemplo 1, Etapa 5. El producto bruto (127 mg) se purificó por HPLC preparativa para proporcionar 53,2 mg (42% de rendimiento) del ácido 1 -(4-(2-(4-ciclopropilpiperazin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. Rm N 1H (400 MHz, metanol-a4) 58,14 (s, 1H), 7,70 (d, J = 8,4 Hz, 1H), 7,42 - 7,44 (m, 2H), 6,83 (s, 1H), 3,99 (ancho, 4H), 3,87 (s, 2H), 3,15 (ancho, 8H), 2,69 - 2,70 (m, 4H), 2,28 - 2,34 (m, 1H), 0,65 - 0,84 (m, 4H). CLEM (ESI, m/z): 507 [M+H]+.
Ejemplo 7: Ácido 1-(4-(3-(pirrolidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 3-(pirrolidin-1-il)-4-(trifluorometil)benzaldehído
Se cargó un matraz con 3-bromo-4-(trifluorometil)benzaldehído (380 mg, 1,50 mmol, 1,00 eq), pirrolidina (160 mg, 2,25 mmol, 1,50 eq), tris(dibencilidenacetona)dipaladio (77,6 mg, 0,0750 mmol, 0,05 eq), diciclohexilfosfino-2',6'-di-ipropoxi-1,1 '-bifenilo (52,5 mg, 0,110 mmol, 0,07 eq), carbonato de cesio (978 mg, 3,00 mmol, 3,00 eq) y tolueno (10 ml) en atmósfera de N2. La solución resultante se agitó durante una noche a 80°C y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 84,0 mg (23% de rendimiento) del 3-(pirrolidin-1-il)-4-(trifluorometil)benzaldehído como un aceite amarillo. CLEM (ESI, m/z): 244 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-f-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y f-butanol (200 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite amarillo. CLEM (ESl, m/z): 169 [M+H-Boc]+.
Etapa 3: Preparación de 1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), NaOH (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESl, m/z): 169 [M+H]+.
Etapa 4: Preparación de 1-(4-bencilpiperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-3-carboxilato de f-butilo (1,68 g, 10,0 mmol, 1,00 eq), trifosgeno (1,49 g, 5,00 mmol, 0,50 eq) y DCM (20 ml). Luego se añadió gota a gota DIPEA (3,87 g, 30,0 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente. Luego se añadió 1 -bencilpiperazina (1,76 g, 10,0 mmol, 1,00 eq) como se describe en el Ejemplo 1, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 2,20 g (59% de rendimiento) del 1-[(4-bencilpiperazin-1-il)carbonil]-1H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 371 [M+H]+.
Etapa 5: Preparación de 1-(piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 -[(4-bencilpiperazin-1 -il)carbonil]-1 H-pirazol-3-carboxilato de f-butilo (2,20 g, 5,94 mmol, 1,00 eq), paladio sobre carbono (200 mg) y THF (20 ml) en atmósfera de hidrógeno, como se describe en el Ejemplo 6, Etapa 2, para proporcionar 1,37 g (bruto) del 1-[(piperazin-1-il)carbonil]-1H-pirazol-3-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 281 [M+H]+.
Etapa 6: Preparación de 1 -(4-(3-(pirrolidin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 3-(pirrolidin-1-il)-4-(trifluorometil)benzaldehído (84,0 mg, 0,350 mmol, 1,00 eq), 1-[(piperazin-1 -il)carbonil]-1 H-pirazol-3-carboxilato de f-butilo (106 mg, 0,380 mmol, 1,10 eq) y DCE (10 ml). La solución resultante se agitó durante 1 hora a temperatura ambiente y se añadió triacetoxiborohidruro de sodio (148 mg, 0,700 mmol, 2,00 eq), como se describe en el Ejemplo 2, Etapa ,3 para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 83,0 mg (47% de rendimiento) del 1 -(4-(3-(pirrolidin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite blanco. CLEM (ESI, m/z): 508 [M+H]+.
Etapa 7: Preparación de ácido 1 -(4-(3-(pirrolidin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1 -(4-(3-(pirrolidin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxilato de f-butilo (83,0 mg, 0,160 mmol, 1,00 eq), TFA (1 ml) y DCM (4 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 32,0 mg (43% de rendimiento) del ácido 1-(4-(3-(pirrolidin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-04) 58,08 - 8,15 (m, 1H), 7,45 - 7,56 (m, 1H), 7,13 (s, 1 H), 6,73 - 6,94 (m, 2H), 3,71 - 3,94 (m, 6H), 3,26 - 3,34 (m , 4H), 2,71 - 2,87 (m, 4H), 1,74 - 2,01 (m, 4H). CLEM (ESI, m/z): 452 [M+H]+.
Ejemplo 8: Ácido 1-(4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
E tapa 1: P rep a ra c ión de 1 H -p ira zo l-1 ,3 -d ica rb o x ila to de d i-í-b u tilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-í-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y í-butanol (200 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite amarillo. CLEM (eSi, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), NaOH (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 4-(3-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo
^ N ' Boc
ta, una noche
Se cargó un matraz con 3-bromo-4-(trifluorometil)benzaldehído (1,80 g, 7,11 mmol, 1,10 eq), piperazina-1-carboxilato de í-butilo (1,20 g, 6,44 mmol, 1,00 eq) y DCE (50 ml). La solución resultante se agitó durante 2 h a temperatura ambiente. Luego se añadió triacetoxiborohidruro de sodio (2,74 g, 12,9 mmol, 2,00 eq), como se describe en el Ejemplo 2, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 1,52 g (56% de rendimiento) del 4-(3-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo en forma de un sólido blanco. CLEM (ESI, m/z): 423 [M+H]+.
Etapa 4: Preparación de 4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz con 4-(3-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (423 mg, 1,00 mmol, 1,00 eq), 2-(tributilestannil)-1,3-tiazol (374 mg, 1,00 mmol, 1,20 eq), tetrakis(trifenilfosfina)paladio (115 mg, 0,100 mmol, 0,10 eq) y tolueno (10 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante una noche a 80°C y se diluyó con agua (10 ml). La mezcla se extrajo con acetato de etilo (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (3 x 10 ml) y se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 188 mg (44% de rendimiento) del 4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo en forma de un sólido amarillo. CLEM (ESI, m/z): 428 [M+H]+.
Etapa 5: Preparación de 2-(5-(piperazin-1-ilmetil)-2-(trifluorometil)fenil)tiazol
Se cargó un matraz con 4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (188 mg, 0,440 mmol, 1,00 eq), HCl (1 ml) y 1,4-dioxano (4 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 144 mg (bruto) de 2-(5-(piperazin-1-ilmetil)-2-(trifluorometil)fenil)tiazol como un sólido blanco. Cl e M (ESI, m/z): 328 [M+H]+.
Etapa 6: Preparación de 1-(4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-3-carboxilato de f-butilo (74,0 mg, 0,440 mmol, 1,00 eq), trifosgeno (65,0 mg, 0,220 mmol, 0,50 eq) y DCM (10 ml). Luego se añadió DIPEA (170 mg, 1,32 mmol, 3,00 eq) a 0°C y la solución resultante se agitó durante 2 h a temperatura ambiente. Luego se añadió 2-(5-(piperazin-1-ilmetil)-2-(trifluorometil)fenil)tiazol (144 mg, 0,440 mmol, 1,00 eq), como se describe en el Ejemplo 1, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió para proporcionar 119 mg (52% de rendimiento) del 1-(4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite incoloro. CLEM (ESI, m/z): 522 [M+H]+.
Etapa 7: Preparación de ácido 1 -(4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de fbutilo (119 mg, 0,231 mmol, 1,00 eq), TFA (1 ml) y DCM (4 ml), como se describe en la Etapa 5 del Ejemplo 1 para proporcionar el producto bruto. El producto bruto se purificó por HPLC preparativa para proporcionar 31,2 mg (29% de rendimiento) del ácido 1-(4-(3-(tiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H- pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-aL) ó 8,13 (s, 1 h ), 7,70 - 7,90 (m, 5H), 6,80 - 6,85 (m, 1H), 3,70 - 3,90 (m, 6H), 2,60 - 2,70 (m, 4H). CLEM (ESI, m/z): 466 [M+H]+.
Ejemplo 9: Ácido 1 -(4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 4-(3-bromo-4-(trifluorometil)bencil)piperazina-1 -carboxilato de f-butilo
Se cargó un matraz con piperazina-1-carboxilato de f-butilo (0,800 g, 4,30 mmol, 1,00 eq), 3-bromo-4-(trifluorometil)benzaldehído (1,20 g, 4,74 mmol, 1,10 eq) y DCE (20 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se añadió triacetoxiborohidruro de sodio (1,83 g, 8,63 mmol, 2,00 eq), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 1,56 g (86% de rendimiento) del 4-(3-(metoxicarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 423 [M+H]+.
Etapa 2: Preparación de 4-(3-(metoxicarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo
Un reactor de tanque a presión se cargó con 4-(3-(metoxicarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo (600 mg, 1,42 mmol, 1,00 eq), [1,1'-bis(difenilfosfino)ferroceno]dicloropaladio(II) (203 mg, 0,280 mmol, 0,20 eq), trietilamina (421 mg, 4,16 mmol, 3,00 eq) y MeOH (10 ml). La solución resultante se agitó durante 3 días a 100°C en atmósfera de monóxido de carbono (10 atm) y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 30
ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 560 mg (98% de rendimiento) del 4-(3-(metoxicarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 403 [M+H]+.
Etapa 3: Preparación de 4-(3-(hidrazinacarbonil)-4-(trifluorometil)bencil)piperazina-1 -carboxilato de f-butilo
Se cargó un matraz de fondo redondo de 50 ml con 4-(3-(metoxicarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo (560 mg, 1,39 mmol, 1,00 eq), hidrato de hidrazina (209 mg, 4,17 mmol, 3,00 eq) y EtOH (10 ml). La solución resultante se agitó durante 3 h a 100°C y se concentró a presión reducida para proporcionar 560 mg (bruto) del 4-(3-(hidrazinacarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 403 [M+H]+.
Etapa 4: Preparación de 4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1 -carboxilato de f-butilo
Se cargó un matraz con 4-(3-(hidrazinacarbonil)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo (560 mg, 1,34 mmol, 1,00 eq) y trietoximetano (10 ml). La solución resultante se agitó durante 5 h a 140°C y se concentró a presión reducida. El residuo se cromatografió para proporcionar 540 mg (94% de rendimiento) del 4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 413 [M+H]+.
Etapa 5: Preparación de 2-(5-(piperazin-1 -ilmetil)-2-(trifluorometil)fenil)-1,3,4-oxadiazol
Se cargó un matraz con 4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1 -carboxilato de f-butilo (540 mg, 1,26 mmol, 1,00 eq), HCl (3 ml) y 1,4-dioxano (10 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 409 mg (bruto) del 2-(5-(piperazin-1 -ilmetil)-2-(trifluorometil)fenil)-1,3,4-oxadiazol como un sólido blanco. CLEM (ESI, m/z): 313 [M+H]+.
Etapa 6: Preparación de 1-(4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 2-(5-(piperazin-1 -ilmetil)-2-(trifluorometil)fenil)-1,3,4-oxadiazol (264 mg, 1,57 mmol, 1,20 eq), trifosgeno (235 mg, 0,790 mmol, 0,60 equivalentes) y DCM (10 ml). Luego se añadió gota a gota DIPEA (676 mg, 5,23 mmol, 4,00 eq) a 0°C y la solución resultante se agitó durante 2 h a temperatura ambiente. Después se añadió 1H-pirazol-3-carboxilato de f-butilo (409 mg, 1,31 mmol, 1,00 eq), como se describe en el Ejemplo 1, Etapa 3. El residuo se cromatografió para proporcionar 302 mg (46% de rendimiento) del 1-(4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 507 [M+H]+.
Etapa 7: Preparación de ácido 1 -(4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo (302 mg, 0,600 mmol, 1,00 eq), TFA (1 ml) y DCM (4 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 60,3 mg (22% de rendimiento) del ácido 1-(4-(3-(1,3,4-oxadiazol-2-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-ak) 59,14 (s, 1H), 8,08 - 8,15 (m, 1H), 8,06 (s, 1H), 7,88 - 7,99 (m, 1H), 7,76 -7,88 (m, 1 H), 6,74 - 6,87 (m, 1H), 3,89 (s, 3H), 3,69 - 3,78 (m, 2H), 2,54 - 2,67 (m, 4H). CLEM (ESI, m/z): 451 [M+H]+. Ejemplo 10: Ácido 1 -(4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,2 mmol, 1,00 eq), DMAP (2,15 g, 17,6 mmol, 0,20 eq), trietilamina (27,0 g, 267 mmol, 3,00 eq), dicarbonato de di-f-butilo (80,0 g, 366 mmol, 4,00 eq) en f-butanol (100 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (25,0 g, 93,2 mmol, 1,00 eq), NaOH (5,60 g, 140 mmol, 1,50 eq) en agua (80 ml) y MeOH (240 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 10,0 g (64% de rendimiento) del 1 H-pirazol-3-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+. Etapa 3: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con cloroformiato de 4-nitrofenilo (448 mg, 2,22 mmol, 1,05 equivalentes), 1 H-pirazol-3-carboxilato de f-butilo (356 mg, 2,12 mmol, 1,00 eq), DCM (5 ml) y trietilamina (642 mg, 6,34 mmol, 3,00 eq), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 500 mg (bruto) de 1H-pirazol-1,3-dicarboxilato de 3-f-butilo y 1-(4-nitrofenilo) como un aceite amarillo. CLEM (ESI, m/z): 334 [M+H]+.
Etapa 4: Preparación de 4-((2-bromo-4-(trifluorometil)bencil)amino)-4-metilpiperidina-1-carboxilato de í-butilo
Se cargó un matraz con 2-bromo-4-(trifluorometil)benzaldehído (970 mg, 3,83 mmol, 1,00 eq), 4-amino-4-metilpiperidina-1 -carboxilato de í-butilo (1,07 g, 4,99 mmol, 1,30 eq), MeOH (10 ml) y AcOh (696 mg, 11,6 mmol, 3,00 eq). La solución resultante se agitó durante 1 h a 60°C. Se añadió borohidruro de sodio (441 mg, 11,6 mmol, 3,00 eq). El residuo se cromatografió para proporcionar 1,41 g (81% de rendimiento) de 4-((2-bromo-4-(trifluorometil)bencil)amino)-4-metilpiperidina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 451 [M+H]+.
Etapa 5: Preparación de 4-((2-bromo-4-(trifluorometil)bencil)(metil)amino)-4-metilpiperidina-1-carboxilato de í-butilo
Se cargó un matraz con 4-((2-bromo-4-(trifluorometil)bencil)amino)-4-metilpiperidina-1-carboxilato de í-butilo (1,41 g, 3,12 mmol, 1,00 eq), paraformaldehído (939 mg, 31,2 mmol, 10,0 eq), trietilamina (948 mg, 9,36 mmol, 3,00 equivalentes) y DCE (20 ml). La solución resultante se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (1,99 g, 9,36 mmol, 3,00 eq) como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 1,10 g (76% de rendimiento) del 4-((2-bromo-4-(trifluorometil)bencil)(metil)amino)-4-metilpiperidina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 465 [M+H]+.
Etapa 6: Preparación de 4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidin-1-carboxilato de í-butilo
Se cargó un matraz con 4-((2-bromo-4-(trifluorometil)bencil)(metil)amino)-4-metilpiperidina-1-carboxilato de í-butilo (417 mg, 0,899 mmol, 1,00 eq), 2-(tributilestannil)-1,3-tiazol (506 mg, 1,35 mmol, 1,50 eq), tetrakis(trifenilfosfina)paladio (104 mg, 0,0899 mmol, 0,10 eq) y tolueno (10 ml). La solución resultante se agitó durante la noche a 110°C y se inactivó con agua (10 ml), como se describe en el Ejemplo 8, Etapa 4. El residuo se cromatografió para proporcionar 400 mg (95% de rendimiento) de 4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidin-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 470 [M+H]+.
Etapa 7: Preparación de W,4-dimetil-N-(2-(tiazol-2-il)-4-(trifluorometil)bencil)piperidin-4-amina
Se cargó un matraz con 4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo (495 mg, 1,05 mmol, 1,00 eq), 1,4- dioxano (5 ml), HCl concentrado (1 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 500 mg (bruto) de la W,4-dimetil-N-(2-(tiazol-2-il)-4-(trifluorometil)bencil)piperidin-4-amina como un aceite amarillo. CLEM (ESI, m/z): 370 [M+H]+.
Etapa 8: Preparación de 1-(4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) (708 mg, 2,12 mmol, 2,00 equivalentes), W,4-dimetil-N-(2-(tiazol-2-il)-4-(trifluorometil)bencil)piperidin-4-amina (391 mg, 1,06 mmol, 1,00 eq), d Cm (10 ml) y trietilamina (321 mg, 3,17 mmol, 3,00 eq). La solución resultante se agitó durante 3 h a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió para proporcionar 560 mg (94% de rendimiento) de 1-(4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un amarillo aceite. CLEM (ESI, m/z): 564 [M+H]+.
Etapa 9: Preparación de ácido 1-(4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol- 3-carboxilato de í-butilo (560 mg, 0,990 mmol, 1,00 eq), DCM (10 ml) y TFA (2 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto (400 mg) se purificó por HPLC preparativa para proporcionar 132,0 mg (26% de rendimiento) del ácido 1 -(4-metil-4-(metil(2-(tiazol-2-il)-4-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, metanol-a^) 58,00 - 8,10 (m, 4H), 7,84 - 7,88 (m, 2 H), 6,80 (d, J = 2,7 Hz, 1H), 4,20 - 4,30 (m, 4H), 3,62 (ancho, 2H), 2,38 (ancho, 3H), 2,14 (ancho, 2H), 1,91 (ancho, 2H), 1,36 (ancho, 3H). CLEM (ESI, m/z): 508 [M+H]+.
Ejemplo 11: Ácido 1 -(4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-í-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-í-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y í-butanol (200 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), NaOH (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 4-((metilsulfonil)oxi)piperidina-1 -carboxilato de í-butilo
Se cargó un matraz con 4-hidroxipiperidina-l -carboxilato de í-butilo (1,00 g, 4,97 mmol, 1,00 eq), DCM (20 ml), cloruro de metanosulfonilo (629 mg, 5,47 mmol, 1,10 eq). Se añadió gota a gota trietilamina (1,51 g, 14,9 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante una noche a temperatura ambiente y se concentró a presión reducida para proporcionar 1,29 g (bruto) del 4-(metanosulfoniloxi)piperidin-1-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 280 [M+H]+.
Etapa 4: Preparación de 4-(2-bromo-4-clorofenoxi)piperidina-1-carboxilato de í-butilo
Se cargó un matraz con 2-bromo-4-clorofenol (367 mg, 1,77 mmol, 1,10 eq), DMSO (15 ml), 4-(metanosulfoniloxi)piperidin-1-carboxilato de í-butilo (450 mg, 1,61 mmol, 1,00 eq) y carbonato de potasio (667 mg, 4,83 mmol, 3,00 eq). La solución resultante se agitó durante una noche a 80°C y se inactivó con agua (30 ml). La mezcla se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 400 mg (64% de rendimiento) del 4-(2-bromo-4-clorofenoxi)piperidin-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 390 [M+H]+.
Etapa 5: Preparación de 4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1-carboxilato de í-butilo
Se cargó un matraz con 4-(2-bromo-4-clorofenoxi)piperidina-1-carboxilato de í-butilo (400 mg, 1,02 mmol, 1,00 eq), tolueno (15 ml), pirrolidina (109 mg, 1,53 mmol, 1,50 eq), carbonato de cesio (665 mg, 2,04 mmol, 2,00 eq), tris(dibenilidenacetona)dipaladio-cloroformo (52,8 mg, 0,0510 mmol, 0,05 eq) y diciclohexilfosfino-2',6'-di-i-propoxi-1,1 '-bifenilo (35,7 mg, 0,0714 mmol, 0,07 eq), como se describe en el Ejemplo 7, Etapa 1. El residuo se cromatografió para proporcionar 220 mg (56% de rendimiento) del 4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidin-1 -carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 381 [M+H]+.
Etapa 6 : Preparación de 4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina
Se cargó un matraz con 4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carboxilato de í-butilo (220 mg, 0,582 mmol, 1,00 eq), 1,4-dioxano (10 ml) y HCl (2 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 150 mg (bruto) del 4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina como un aceite amarillo. CLEM (ESI, m/z): 281 [M+H]+.
Etapa 7: Preparación de cloruro de 4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonilo
Se cargó un matraz con 4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina (150 mg, 0,532 mmol, 1,00 eq), DCM (10 ml) y trifosgeno (79,3 mg, 0,266 mmol, 0,50 equivalente). Se añadió gota a gota DMAP (207 mg, 1,60 mmol, 3,00 eq) a 0°C, como se describe en el Ejemplo 1, Etapa 3, para proporcionar 183 mg (bruto) del cloruro de 4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1 -carbonilo como un aceite amarillo.
Etapa 8: Preparación de 1 -(4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con cloruro de 4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidin-1-carbonilo (183 mg, 0,530 mmol, 1,00 eq), THF (10 ml), 1 H-pirazol-3-carboxilato de í-butilo (89,7 mg, 0,530 mmol, 1,00 eq), DIPEA (138 mg, 1,07 mmol, 2,00 eq) y DMAP (13,1 mg, 0,107 mmol, 0,20 eq). La solución resultante se agitó durante la noche a 60eC y se inactivó con agua (20 ml), como se describe en el Ejemplo 1, Etapa 4. El residuo se cromatografió para proporcionar 135 mg (53% de rendimiento) del 1-(4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 475 [M+H]+.
Etapa 9: Preparación de ácido 1-(4-(4-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1 -(4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo (135 mg, 0,282 mmol, 1,00 eq), DCM (5 ml) y TFA (1 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 12,6 mg (11% de rendimiento) del ácido 1-(4-(4-cloro-2-(pirrolidin-1 -il)fenoxi)piperidin-1 -carbonil)-1 H-pirazol-3-carboxílico como un sólido amarillo. RMN 1H: (300 MHz, metanol-aL) 58,12 (s, 1H), 6,87 - 6,95 (m, 1H), 6,82 (m, 1H), 6,66 - 6,75 (m, 2H), 4,60 (m, 1H), 3,92 - 4,11 (m, 2H), 3,60 - 3,80 (m, 2H), 3,32 (m, 2H), 3,29 (m, 2H), 2,00 - 2,20 (m, 2H), 1,80 - 2,00 (m, 6H). CLEM (ESI, m/z): 419 [M+H]+.
Ejemplo 12: Ácido 1-(4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-í-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-í-butilo (77,8 g, 357 mmol, 4,00 eq), í-butanol (100 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) de 1 H-pirazol-1,3-dicarboxilato de 1,3-dií-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (25,0 g, 93,3 mmol, 1,00 eq), NaOH (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml), como se describe en Ejemplo 1, Etapa 2. El residuo se cromatografió en una columna de gel de sílice para proporcionar 10,0 g (64% de rendimiento) del 1 H-pirazol-3-carboxilato de í-butilo
como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 4-(2-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz con 2-bromo-4-(trifluorometil)benzaldehído (2,00 g, 7,90 mmol, 1,00 eq), piperazina-1-carboxilato de í-butilo (2,94 g, 15,8 mmol, 2,00 eq) y DCM (30 ml). La mezcla se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (6,70 g, 31,6 mmol, 4,00 eq), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 3,25 g (97% de rendimiento) del 4-(2-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo como un aceite incoloro. CLEM (ESI, m/z): 423 [M+H]+.
Etapa 4: Preparación de 4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz con 4-(2-bromo-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (0,500 g, 1,18 mmol, 1,00 eq), 4-metoxipiperidina (0,271 g, 2,36 mmol, 2,00 eq), tris(dibencilidenacetona)dipaladio (0,162 g, 0,177 mmol, 0,15 eq), 2,2'-bis(difenilfosfino)-1, 1 '-binaftilo (0,331 g, 0,531 mmol, 0,45 eq), carbonato de cesio (1,73 g, 5,31 mmol, 4,50 eq), y tolueno (15 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 100°C y luego se inactivó con agua (30 ml). La solución resultante se extrajo con DCM (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,200 g (37% de rendimiento) del 4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 458 [M+H]+.
Etapa 5: Preparación de 1-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina
Se cargó un matraz con 4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (200 mg, 0,438 mmol, 1,00 eq), 1,4-dioxano (5 ml) y HCl concentrado (1 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 210 mg (bruto) de la 1-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina como un aceite amarillo. CLEM (ESI, m/z): 358 [M+H]+.
Etapa 6: Preparación de 1-(4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con trifosgeno (90,9 mg, 0,306 mmol, 0,70 equivalentes) y DCM (10 ml). Se añadió 1H-pirazol-3-carboxilato de í-butilo (147 mg, 0,874 mmol, 2,00 eq) a 0°C. Se añadió DIPEA (283 mg, 2,19 mmol, 5,00 eq) a 0°C. La mezcla se agitó durante 2 h a temperatura ambiente. Se añadió 1-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina (156 mg, 0,437 mmol, 1,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (15 ml), como se describe en el Ejemplo 1, Etapa 3, para
proporcionar 220 mg (92% de rendimiento) del 1-(4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 552 [M+H]+.
Etapa 7: Preparación de ácido 1 -(4-(2-(4-metoxipiperidin-1 -il)-4-(trifluorometil)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo (220 mg, 0,400 mmol, 1,00 eq), dCm (5 ml) y TFA (2 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto (195 mg) se purificó por HPLC preparativa para proporcionar 68,4 mg (35% de rendimiento) del ácido 1-(4-(2-(4-metoxipiperidin-1-il)-4-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, metanol-o4) 58,14 (s, 1H), 7,69 (d, J = 7,6 Hz, 1H), 7,36 - 7,38 (m, 2H), 6,83 (s, 1H), 3,70 - 3,99 (m, 6H), 3,39 - 3,48 (m, 4H), 3,12 - 3,15 (m, 2H), 2,66 - 2,82 (m, 6H), 2,05 - 2,08 (m, 2H), 1,69 - 1,77 (m, 2H). CLEM (ESI, m/z): 496 [M+H]+.
Ejemplo 13: Ácido 1 -(4-(3-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-f-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y f-butanol (200 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), NaOH (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 4-((metilsulfonil)oxi)piperidina-1 -carboxilato de f-butilo
Se cargó un matraz con 4-hidroxipiperidina-1-carboxilato de f-butilo (2,00 g, 9,94 mmol, 1,00 eq), trietilamina (3,01 g, 29,8 mmol, 3,00 eq) y DCM (30 ml). Luego se añadió gota a gota cloruro de metanosulfonilo (1,71 g, 14,9 mmol, 1,50 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (30 ml), como se
describe en el Ejemplo 11, Etapa 3, para proporcionar 2,50 g (bruto) del 4-((metilsulfonil)oxi)piperidina-1-carboxilato de f-butilo como un sólido blanco.
Etapa 4: Preparación de 4-(3-cloro-2-nitrofenoxi)piperidina-1-carboxilato de f-butilo
Se cargó un vial con 3-cloro-2-nitrofenol (0,500 g, 2,88 mmol, 1,00 eq), 4-((metilsulfonil)oxi)piperidin-1-carboxilato de f-butilo (0,804 g, 2,88 mmol, 1,00 eq), carbonato de cesio (1,88 g, 5,77 mmol, 2,00 eq) y DMF (15 ml). La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (10 ml). La mezcla se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,714 g (69% de rendimiento) del 4-(3-cloro-2-nitrofenoxi)piperidin-1-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 357 [M+H]+.
Etapa 5: Preparación de 4-(2-amino-3-clorofenoxi)piperidina-1-carboxilato de f-butilo
Se cargó un vial con 4-(3-cloro-2-nitrofenoxi)piperidina-1-carboxilato de f-butilo (0,400 g, 1,12 mmol, 1,00 eq), hierro (0,628 g, 11,2 mmol, 10,00 eq), cloruro de amonio (1,21 g, 22,6 mmol, 20,00 equivalentes) y EtOH (15 ml). La solución resultante se agitó durante 2 h a 80°C y se inactivó con agua (10 ml). La mezcla se extrajo con d Cm (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,327 g (89% de rendimiento) del 4-(2-amino-3-clorofenoxi)piperidina-1-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 327 [M+H]+.
Etapa 6: Preparación de 4-(3-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carboxilato de f-butilo
Se cargó un vial con 4-(2-amino-3-clorofenoxi)piperidina-1-carboxilato de f-butilo (327 mg, 1,00 mmol, 1,00 eq), 1,4-diyodobutano (324 mg, 1,05 mmol, 1,50 eq) y THF (15 ml). Se añadió gota a gota hidruro de sodio (486 mg, 20,3 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante una noche a 60°C y se inactivó con agua (10 ml). La mezcla se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 270 mg (71% de rendimiento) de 4-(3-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 381 [M+H]+.
Etapa 7: Preparación de 4-(3-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina
Se cargó un vial con 4-(3-cloro-2-(pirrolidin-1 -il)fenox¡)p¡peridina-1 -carboxilato de f-butilo (270 mg, 0,710 mmol, 1,00 eq), TFA (1 ml) y DCM (5 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar 200 mg (bruto) de 4-(3-cloro-2-(pirrolidin-1-il)fenoxi)piperidina como un sólido blanco. CLEM (ESI, m/z): 281 [M+H]+.
Etapa 8: Preparación de 1-(4-(3-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un vial con 1 H-pirazol-3-carboxilato de í-butilo (120 mg, 0,710 mmol, 1,00 eq), trietilamina (287 mg, 2,84 mmol, 4,00 eq) y DCM (15 ml). Se añadió gota a gota cloroformiato de 4-nitrofenilo (174 mg, 0,860 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente. Luego se añadió 4-(3-cloro-2-(pirrolidin-1-il)fenoxi)piperidina (200 mg, 0,710 mmol, 1,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 180 mg (53% de rendimiento) del 1-(4-(3-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1-carbonil)-1 H-pirazol-3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 475 [M+H]+. Etapa 9: Preparación de ácido 1 -(4-(3-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico
Se cargó un vial con 1 -(4-(3-cloro-2-(pirrolidin-1-il)fenoxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo (180 mg, 0,380 mmol, 1,00 eq), TFA (1 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en solución saturada de NaHCÜ3 (10 ml) y se extrajo con DCM (3 x 20 ml). Las capas orgánicas se combinaron, se lavaron con salmuera (10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El producto bruto se purificó por HPLC preparativa para proporcionar 65,1 mg (41% de rendimiento) del ácido 1 -(4-(3-cloro-2-(pirrolidin-1 -il)fenoxi)piperidina-1 -carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 m Hz , metanol-aL) ó 7,92 - 8,22 (m, 1H), 6,88 - 7,12 (m, 3H), 6,58 - 6,85 (m, 1H), 4,66 - 4,75 (m, 1H), 3,61 - 4,20 (m, 4H), 3,18 - 3,29 (m, 4H), 2,04 - 2,25 (m, 2H), 1,77 - 2,02 (m, 6H). CLEM (ESI, m/z): 419 [M+H]+.
Ejemplo 14: Acido 1-(4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-í-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), di- dicarbonato de í-butilo (77,8 g, 357 mmol, 4,00 eq), í-butanol (100 ml). La solución resultante se agitó durante 4 h a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (25,0 g, 93,3 mmol, 1,00 eq), hidróxido de sodio (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 horas a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió para proporcionar 10,0 g (64% de rendimiento) del 1H-pirazol-3-carboxilato de -butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1 H-pirazol-3-carboxilato de í-butilo (2,00 g, 11,9 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (2,87 g, 14,2 mmol, 1,20 eq), trietilamina (3,61 g, 35,7 mmol, 3,00 eq) y DCM (20 ml), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 3,90 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) como un sólido amarillo. CLe M (ESI, m/z): 334 [M+H]+.
Etapa 4: Preparación de 4-formil-2-(trifluorometil)benzoato de metilo
Se cargó un matraz con 4-bromo-3-(trifluorometil)benzaldehido (1,61 g, 6,36 mmol, 1,00 eq), dicloruro de 1,1'-bis(difenilfosfino)ferrocenopaladio (0,466 g, 0,636 mmol, 0,10 eq), trietilamina (1,93 g, 19,1 mmol, 3,00 equivalentes) y MeOH (15 ml). Se introdujo monóxido de carbono (10 atm). La solución resultante se agitó durante la noche a 80°C y luego se inactivó con agua (30 ml), como se describe en el Ejemplo 9, Etapa 2. El residuo se cromatografió para proporcionar 1,00 g (68% de rendimiento) del 4-formil-2-(trifluorometil)benzoato de metilo como un aceite amarillo.
Etapa 5: Preparación de 4-(4-(metoxicarbonil)-3-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz con 4-formil-2-(trifluorometil)benzoato de metilo (0,800 g, 3,45 mmol, 1,00 eq), piperazina-1-carboxilato de í-butilo (0,962 g, 5,17 mmol, 1,50 eq) y DCM (15 ml). La mezcla se agitó durante 2 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (2,93 g, 13,8 mmol, 4,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (30 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 1,26 g (91% de rendimiento) del 4-(4-(metoxicarbonil)-3-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 403 [M+H]+.
Etapa 6: Preparación de ácido 4-((4-(t-butoxicarbonil)piperazin-1-il)metil)-2-(trifluorometil)benzoico
Se cargó un matraz con 4-(4-(metoxicarbonil)-3-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo (1,21 g, 3,01 mmol, 1,00 eq), THF (10 ml), agua (2 ml) y NaOH (2,41 g, 60,2 mmol, 20,00 eq). La solución resultante se agitó durante una noche a 60°C. El pH de la solución se ajustó a 6 con HCl (1 M). La solución resultante se extrajo con DCM (3 x 80 ml). Las capas orgánicas se combinaron, se lavaron con salmuera (100 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida para proporcionar 1,40 g (bruto) del ácido 4-((4-(íbutoxicarbonil)piperazin-1-il)metil)-2-(trifluorometil)benzoico como un sólido blanco. CLEM (ESI, m/z): 389 [M+H]+.
Etapa 7: Preparación de 4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz con ácido 4-((4-(f-butoxicarbonil)piperazin-1-il)metil)-2-(trifluorometil)benzoico (1,24 g, 3,19 mmol, 1,00 eq), hexafluorofosfato de N,N,N',N'-tetrametil-O-(7-azabenzotriazol-1-il)uronio (2,43 g, 6,39 mmol, 2,00 eq), DIPEA (1,24 g, 12,8 mmol, 4,00 eq), DMF (10 ml) y amoníaco (solución 0,5 M en 1,4-dioxano, 63,8 ml, 31,9 mmol, 10,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y luego se concentró a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 1,00 g (81% de rendimiento) del 4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 388 [M+H]+.
Etapa 8: Preparación de 4-(piperazin-1-ilmetil)-2-(trifluorometil)benzamida
Se cargó un matraz con 4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carboxilato de f-butilo (520 mg, 1,34 mmol, 1,00 eq), DCM (10 ml) y TFA (3 ml), como se describe en el Ejemplo 1 , Etapa 5, para proporcionar 550 mg (bruto) de 4-(piperazin-1-ilmetil)-2-(trifluorometil)benzamida como un aceite amarillo. CLEM (ESI, m/z): 288 [M+H]+.
Etapa 9: Preparación de 1-(4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 4-(piperazin-1 -ilmetil)-2-(trifluorometil)benzamida (185 mg, 0,645 mmol, 1,00 eq), 1 H-pirazol-,3-dicarboxilato de 3-f-butilo y 1 -(4-nitrofenilo) (322 mg, 0,968 mmol, 1,50 eq), DCM (10 ml) y trietilamina (261 mg, 2,58 mmol, 4,00 eq), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 200 mg (67% de rendimiento) del 1-(4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 466 [M+H]+.
Etapa 10: Preparación de ácido 1-(4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de fbutilo (200 mg, 0,430 mmol, 1,00 equivalentes), DCM (15 ml), TFA (4 ml) como se describe en el Ejemplo 1, Etapa 5. El producto bruto (280 mg) se purificó por HPLC preparativa para proporcionar 25,6 mg (14% de rendimiento) de ácido 1-(4-(4-carbamoil-3-(trifluorometil)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, m etano ld) ó 8,14 (d, J = 2,7 Hz, 1H), 7,80 (s, 1H), 7,70 (d, J = 8,1 Hz, 1H), 7,57 (d, J = 7,8 Hz, 1H), 6,83 (d, J = 2,7 Hz, 1H), 3,87 (ancho, 4H), 3,72 (s, 2H), 2,63 - 2,64 (m, 4H). CLEM (ESI, m/z): 424 [M-H]-.
Ejemplo 15: Ácido 1-(frans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-í-butilo (77,8 g, 357 mmol, 4,00 eq), í-butanol (100 ml). La solución resultante se agitó durante 4 h a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (25,0 g, 93,3 mmol, 1,00 eq), hidróxido de sodio (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió para proporcionar 10,0 g (64% de rendimiento) del 1H-pirazol- 3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de í-butilo (225 mg, 1,34 mmol, 1,00 eq), DCM (10 ml) y trietilamina (406 mg, 4,01 mmol, 3,00 eq). Se añadió cloroformiato de 4-nitrofenilo (296 mg, 1,47 mmol, 1,10 equivalentes) a 0°C, como se describe en el Ejemplo 4, Etapa 3, para proporcionar 500 mg (bruto) del 1 H-pirazol-1,3-dicarboxilato de 3-(íbutilo) y 1 -(4-nitrofenilo) como un sólido amarillo. Cl Em (ESI, m/z): 334 [M+H]+.
Etapa 4: Preparación de írans-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,6aS)-5-oxohexahidrociclopenta[c]pirrol-2(1H)-carboxilato de -butilo (1,00 g, 4,44 mmol, 1,00 eq) y MeOH (15 ml). Se añadió borohidruro de sodio (0,507 g, 13,4 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (20 ml). La solución resultante se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida para proporcionar 0,950 g (94% de rendimiento) del írans-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 228 [M+H]+.
Etapa 5: Preparación de írans-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con írans-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (0,500 g, 2,20 mmol, 1,00 eq), ácido 4-nitrobenzoico (0,735 g, 4,40 mmol, 2,00 eq), trifenilfosfina (1,15 g, 4,40 mmol, 2,00 eq) y t Hf (10 ml) en atmósfera de nitrógeno. Se añadió azodicarboxilato de dietilo (0,766 g, 4,40 mmol, 2,00 equivalentes) a 0°C. La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (20 ml). La solución resultante se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 0,540 g (65% de rendimiento) del írans-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 377 [M+H]+.
Etapa 6: Preparación de írans-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con írans-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (540 mg, 1,43 mmol, 1,00 eq), carbonato de potasio (396 mg, 2,87 mmol, 2,00 eq), MeOH (15 ml) y agua (5 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (15 ml). La solución resultante se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 270 mg (83% de rendimiento) del írans-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 228 [M+H]+.
Etapa 7: Preparación de írans-5-((2-clorobencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con írans-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (270 mg, 1,19 mmol, 1,00 eq) y DMF (10 ml). Se añadió hidruro de sodio (95,2 mg, 60% en aceite mineral, 2,38 mmol, 2,00 eq) a 0°C. La mezcla se agitó durante 20 min a temperatura ambiente. Se añadió 1-(bromometil)-2-clorobenceno (291 mg, 1,42 mmol, 1,20 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (15 ml). La solución resultante se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 380 mg (91% de rendimiento) del írans-5-((2-clorobencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 352 [M+H]+.
Etapa 8: Preparación de trans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol
Se cargó un matraz con írans-5-((2-clorobencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (380 mg, 1,08 mmol, 1,00 eq), DCM (10 ml) y TFA (2 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar 450 mg (bruto) del írans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol como un aceite amarillo. CLEM (ESI, m/z): 252 [M+H]+.
Etapa 9: Preparación de 1-(írans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con írans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol (260 mg, 1,03 mmol, 1,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1 -(4-nitrofenilo) (448 mg, 1,34 mmol, 1,30 eq), trietilamina (314 mg, 3,10 mmol, 3,00 eq) y DCM (10 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 340 mg (74% de rendimiento) del 1-(írans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite incoloro.
CLEM (ESI, m/z): 446 [M+H]+.
E tap a 10: P rep a ra c ión de ác ido 1 -(fra n s -5 -((2 -c lo ro b e n c il)o x i)o c ta h id ro c ic lo p e n ta [c ]p irro l-2 -c a rb o n il)-1 H -p ira z o l-3 -ca rb o x ílico
Se cargó un matraz con 1-(frans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de f-butilo (210 mg, 0,470 mmol, 1,00 eq), DCM (10 ml) y TFA (2 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5, para proporcionar 66,2 mg (36% de rendimiento) del ácido 1-(frans-5-((2-clorobencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. r Mn 1H (300 MHz, metanol-a*) ó 8,14 (d, J = 2,7 Hz, 1H), 7,47 - 7,50 (m, 1 H), 7,32 - 7,38 (m, 1 H), 7,23 - 7,30 (m, 2H), 6,74 (d, J = 2,7 Hz, 1 H), 4,56 (s, 2H), 4,23 - 4,29 (m, 1 H), 3,40 - 4,20 (m, 4H), 2,92 (ancho, 2H), 2,10 - 2,16 (m, 2H), 1,76 - 1,84 (m, 2H). CLEM (ESI, m/z): 412 [M+Na]+.
Ejemplo 16: Ácido 1 -(4-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 3-metil-[1,1'-bifenil]-4-carbaldehido
Se cargó un matraz con 4-bromo-2-metilbenzaldehído (5,00 g, 25,1 mmol, 1,00 eq), ácido fenilborónico (3,98 g, 32,6 mmol, 1,30 eq), tetrakis(trifenilfosfina)paladio (2,90 g, 2,51 mmol, 0,10 eq), carbonato de potasio (10,4 g, 75,3 mmol, 3,00 eq), 1,4-dioxano (200 ml) y agua (40 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante una noche a 80°C y luego se inactivó con agua (250 ml). La solución resultante se extrajo con DCM (3 x 250 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 150 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 4,79 g (97% de rendimiento) del 3-metil-[1,1'-bifenil]-4-carbaldehído como un aceite incoloro. CLEM (ESI, m/z): 197 [M+H]+.
Etapa 2: Preparación de 4-((3-metil-[1,1 '-bifenil]-4-il)metil)piperazina-1 -carboxilato de f-butilo
Se cargó un matraz con 3-metil-[1,1'-bifenil]-4-carbaldehído (0,700 g, 3,57 mmol, 1,00 eq), piperazina-1 -carboxilato de f-butilo (0,797 g, 4,28 mmol, 1,20 eq) y DCM (20 ml). La mezcla se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (2,27 g, 10,7 mmol, 3,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 1,00 g (76% de rendimiento) del 4-((3-metil-[1,1 '-bifenil]-4-il)metil)piperazina-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 367 [M+H]+.
Etapa 3: Preparación de 1-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina
Se cargó un matraz con 4-((3-metil-[1,1 '-bifenil]-4-il)metil)piperazina-1 -carboxilato de f-butilo (300 mg, 0,820 mmol, 1,00 eq), DCM (8 ml) y TFA (3 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar 218 mg (bruto) de
la 1 -((3-metil-[1,1'-bifenil]-4-il)metil)piperazina como un aceite amarillo. CLEM (ESI, m/z): 267 [M+H]+.
Etapa 4: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-í-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-í-butilo (77,8 g, 357 mmol, 4,00 eq), í-butanol (100 ml). La solución resultante se agitó durante 4 h a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 5: Preparación de 1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (25,0 g, 93,3 mmol, 1,00 eq), hidróxido de sodio (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 horas a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió para proporcionar 10,0 g (64% de rendimiento) del 1H-pirazol-3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 6: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1 H-pirazol-3-carboxilato de í-butilo (2,00 g, 11,9 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (2,87 g, 14,2 mmol, 1,20 eq), trietilamina (3,61 g, 35,7 mmol, 3,00 eq) eq) y d Cm (20 ml), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 4,50 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo) como un sólido amarillo. CLEM (ESI, m/z): 334 [M+H]+.
Etapa 7: Preparación de 1-(4-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo) (218 mg, 0,820 mmol, 1,00 eq), 1-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina (410 mg, 1,23 mmol, 1,50 eq), DCM (5 ml) y trietilamina (331 mg, 3,27 mmol, 4,00 eq), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 200 mg (53% de rendimiento) del 1-(4-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 461 [M+H]+.
Etapa 8: Preparación de ácido 1-(4-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina-1-carbonil)-1 H-pirazol-3-carboxilato de í-butilo (200 mg, 0,430 mmol, 1,00 eq), DCM (5 ml) y TFA (2 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en solución saturada de NaHCO3 (10 ml) y se extrajo con DCM (3 x 20 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar 87,1 mg (50% de rendimiento) del ácido 1-(4-((3-metil-[1,1'-bifenil]-4-il)metil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-d*) 58,12 (d, J = 2,4 Hz, 1H), 7,59 (d, J = 7,2 Hz, 2H), 7,29 - 7,46 (m, 6H), 6,81 (d, J = 2,4 Hz, 1H), 3,97 (ancho, 4H), 3,74 (s, 2H), 2,76 (ancho, 4H), 2,48 (s, 3H). CLEM (ESI, m/z): 405 [M+H]+.
Ejemplo 17: 1-(5-(4-morfolino-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1 H-pirazol-3-carboxamida
Etapa 1: Preparación de 4-morfolino-2-(trifluorometil)benzaldehído
Se cargó un matraz con ACN (100 ml), morfolina (4,50 g, 51,7 mmol, 1,00 eq), 4-fluoro-2-(trifluorometil)benzaldehido (10,0 g, 51,7 mmol, 1,00 eq) y carbonato de potasio (14,0 g, 101 mmol, 2,00 eq) en atmósfera de nitrógeno. La solución resultante se agitó durante una noche a 80°C y se inactivó con agua (150 ml). La mezcla se extrajo con DCM (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 10,0 g (75% de rendimiento) de 4-morfolino-2-(trifluorometil)benzaldehído como un sólido amarillo. CLEM (ESI, m/z): 260 [M+H]+.
Etapa 2: Preparación de 5-(4-morfolino-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un matraz con 4-morfolino-2-(trifluorometil)benzaldehído (5,00 g, 19,3 mmol, 1,00 eq), octahidropirrolo[3,4-c]pirrol-2-carboxilato de í-butilo (4,10 g, 19,3 mmol, 1,00 eq) y DCE (100 ml). La mezcla se agitó durante 2 h a temperatura ambiente, luego se añadió triacetoxiborohidruro de sodio (8,20 g, 38,7 mmol, 2,00 eq), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 6,00 g (68% de rendimiento) del 5-(4-morfolino-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carboxilato de í-butilo como un aceite amarillo claro. CLEM (ESI, m/z): 456 [M+H]+.
Etapa 3: Preparación de 4-(4-((hexahidropirrolo[3,4-c]pirrol-2(1 H)-il)metil)-3-(trifluorometil)fenil)morfolina
Se cargó un matraz con 5-(4-morfolino-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carboxilato de í-butilo (6,00 g, 13,2 mmol, 1,00 eq), 1,4-dioxano (100 ml) y HCl concentrado (20 ml), como se describe en el Ejemplo 2, Etapa 4, para proporcionar 4,00 g (bruto) de la 4-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)morfolina como un sólido rosa. CLEM (ESI, m/z): 356 [M+H]+.
E tap a 4: P rep a ra c ión de c lo ru ro de 5 -(4 -m o rfo lin o -2 -(tr if lu o ro m e til)b e n c il)h e xa h id ro p irro lo [3 ,4 -c ]p irro l-2 (1 H )-ca rbon ilo
Se cargó un matraz con 4-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)morfolina (1,00 g, 2,81 mmol, 1,00 eq), DCM (10 ml) y trifosgeno (0,335 g, 1,14 mmol, 0,40 eq). Se añadió gota a gota DIPEA (1,09 g, 8,45 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 h a 0°C y se inactivó con agua (5 ml), como se describe en el Ejemplo 1, Etapa 3, para proporcionar 1,12 g (bruto) del cloruro de 5-(4-morfolino-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1H)-carbonilo como un aceite amarillo.
Etapa 5: Preparación de 1-(5-(4-morfolino-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1H-pirazol-3-carboxamida
Se cargó con cloruro de 5-(4-morfolino-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carbonilo (235 mg, 0,560 mmol, 1,00 eq), 1H-pirazol- 3-carboxamida (62,0 mg, 0,560 mmol, 1,00 eq), DIPEA (147 mg, 1,14 mmol, 2,00 eq), DMAP (14,0 mg, 0,110 mmol, 0,20 eq) y THF (10 ml). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (10 ml), como se describe en el Ejemplo 1, Etapa 4. El producto bruto se purificó por HPLC preparativa para proporcionar 35,8 mg (13% de rendimiento) de la 1-(5-(4-morfolino-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1 H-pirazol-3-carboxamida como un aceite amarillo. RMN 1H (300 MHz, cloroformo-a) 58,30 (d, J = 2,6 Hz, 1 H), 7,50 -7,60 (m, 1 H), 6,80 - 7,20 (m, 3H), 6,60 -6,80 (m ancho 1H), 5,56 - 5,70 (ancho, 1H), 4,00 - 4,30 (m, 2H), 3,60 -3,90 (m, 8H), 3,18 - 2,26 (m, 4H), 2,80 - 3,00 (m, 2H), 2,50 -2,76 (m, 4H). CLEM (ESI, m/z): 493 [M+H]+.
Ejemplo 18: Acido 1 -(4-(3-(piridin-3-iloxi)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-f-butilo (77,8 g, 357 mmol, 4,00 eq), f-butanol (100 ml). La solución resultante se agitó durante 4 h a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (25,0 g, 93,3 mmol, 1,00 eq), hidróxido de sodio (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 h a temperatura
ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió para proporcionar 10,0 g (64% de rendimiento) del 1H-pirazol- 3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1 H-pirazol-3-carboxilato de í-butilo (2,00 g, 11,9 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (2,87 g, 14,2 mmol, 1,20 eq), trietilamina (3,61 g, 35,7 mmol, 3,00 eq) y DCM (20 ml), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 3,90 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) como un sólido amarillo. CLeM (ESI, m/z): 334 [M+H]+.
Etapa 4: Preparación de 3-(piridin-3-iloxi)benzaldehído
Se cargó un matraz con 3-yodobenzaldehído (0,928 g, 4,00 mmol, 1,00 eq), yoduro de cobre (I) (0,152 g, 0,800 mmol, 0,20 eq), L-prolina (0,184 g, 1,60 mmol, 0,40 eq), cesio carbonato (3,91 g, 12,0 mmol, 3,00 eq), piridin-3-ol (0,570 g, 6,00 mmol, 1,50 eq) y DMF (15 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 120°C y luego se inactivó con agua (15 ml). La solución resultante se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,160 g (20% de rendimiento) de 3-(piridin-3-iloxi)benzaldehído como un aceite amarillo. CLEM (ESI, m/z): 200 [M+H]+.
Etapa 5: Preparación de 4-(3-(piridin-3-iloxi)bencil)piperazina-1-carboxilato de í-butilo
ta, una noche
Se cargó un matraz con 3-(piridin-3-iloxi)benzaldehído (160 mg, 0,800 mmol, 1,00 eq), piperazina-1-carboxilato de í-butilo (179 mg, 0,960 mmol, 1,20 eq) y DCM (15 ml). La mezcla se agitó durante 2 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (678 mg, 3,20 mmol, 4,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y luego se inactivó con agua (20 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 270 mg (91% de rendimiento) del 4-(3-(piridin-3-iloxi)bencil)piperazina-1-carboxilato de í-butilo como un aceite pardo.
Etapa 6: Preparación de 1-(3-(piridin-3-iloxi)bencil)piperazina
Se cargó un matraz con 4-(3-(piridin-3-iloxi)bencil)piperazina-1-carboxilato de í-butilo (270 mg, 0,730 mmol, 1,00 eq), DCM (15 ml) y TFA (3 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar 197 mg (cuantitativo) de 1-(3-(piridin-3-iloxi)bencil)piperazina como un aceite amarillo. CLEM (ESI, m/z): 270 [M+H]+.
E tap a 7: P rep a ra c ión de 1 -(4 -(3 -(p ir id in -3 -ilo x i)b e n c il)p ip e ra z in a -1 -ca rb o n il)-1 H -p ira zo l-3 -ca rb o x ila to de í-bu tilo
Se cargó un matraz con 1-(3-(piridin-3-iloxi)bencil)piperazina (197 mg, 0,730 mmol, 1,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) (340 mg, 1,02 mmol, 1,40 eq), DCM (15 ml) y trietilamina (222 mg, 2,19 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (20 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió para proporcionar 200 mg (59% de rendimiento) del 1 -(4-(3-(piridin-3-iloxi)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 464 [M+H]+.
Etapa 8: Preparación de ácido 1-(4-(3-(piridin-3-iloxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-(3-(piridin-3-iloxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo (200 mg, 0,430 mmol, 1,00 eq), DCM (15 ml) y TFA (3 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 17,9 mg (10% de rendimiento) del ácido 1-(4-(3-(piridin-3-iloxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-d*) 5 8,28 - 8,30 (m, 2H), 8,06 (d, J = 2,7 Hz, 1H), 7,36 - 7,44 (m, 3H), 7,20 - 7,22 (m, 1H), 7,11 - 7,12 (m, 1H), 6,96 - 7,00 (m, 1 H), 6,74 (d, J = 2,7 Hz, 1H), 3,86 (ancho, 4H), 3,60 (s, 2H), 2,57 - 2,60 (m, 4H). CLEM (ESI, m/z): 408 [M+H]+.
Ejemplo 19: Acido 1-(4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de tetrafluoroborato de bis(4-clorofenil)yodonio
Se cargó un matraz con ácido m-cloroperoxibenzoico (1,60 g, 9,27 mmol, 1,10 eq), DCM (10 ml), complejo de éter y trifluoruro de boro (3,58 g, 25,2 mmol, 3,00 eq) y 1-cloro-4-yodobenceno (2,00 g, 8,39 mmol, 1,00 eq). La solución resultante se agitó durante 0,5 h a temperatura ambiente. Luego se añadió ácido (4-clorofenil)borónico (1,44 g, 9,22 mmol, 1,10 equivalentes) a 0°C. La solución resultante se agitó durante 20 min a temperatura ambiente y se concentró a presión reducida. El producto bruto se trituró para proporcionar 3,00 g (78% de rendimiento) de tetrafluoroborato de bis(4-clorofenil)yodonio como un sólido blanco. CLEM (ESI, m/z): 349 [M-BF4]+.
Etapa 2: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-í-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-í-butilo (77,8 g, 357 mmol, 4,00 eq), í-butanol (100 ml). La solución resultante se agitó durante 4 h a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
E tapa 3: P rep a ra c ión de 1 H -p ira zo l-3 -ca rb o x ila to de í-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (25,0 g, 93,3 mmol, 1,00 eq), hidróxido de sodio (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió para proporcionar 10,0 g (64% de rendimiento) del 1H-pirazol-3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 4: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1-(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de í-butilo (208 mg, 1,24 mmol, 1,00 eq), DCM (10 ml), cloroformiato de 4-nitrofenilo (264 mg, 1,30 mmol, 1,05 eq) y trietilamina (378 mg, 3,72 mmol, 3,00 eq), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 450 mg (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-t-butilo y 1 -(4-nitrofenilo) como un aceite amarillo. CLEM (ESI, m/z): 334 [M+H]+.
Etapa 5: Preparación de 4-(3-cloro-5-hidroxibencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz con 3-cloro-5-hidroxibenzaldehído (300 mg, 1,92 mmol, 1,00 eq), DCE (10 ml), piperazina-1-carboxilato de í-butilo (536 mg, 2,88 mmol, 1,50 eq) y trietilamina (582 mg, 5,76 mmol, 3,00 eq). La solución resultante se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (1,21 g, 5,76 mmol, 3,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 460 mg (73% de rendimiento) del 4-(3-cloro-5-hidroxibencil)piperazina-1-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 327 [M+H]+.
Etapa 6: Preparación de 4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carboxilato de í-butilo
Se cargó un matraz de fondo redondo de 50 ml con 4-(3-cloro-5-hidroxibencil)piperazina-1-carboxilato de í-butilo (300 mg, 0,920 mmol, 1,00 eq), THF (10 ml) y NaOH (40,4 mg, 1,01 mmol, 1,10 eq). La solución resultante se agitó durante 15 min a 0°C. Luego se añadió tetrafluoroborato de bis(4-clorofenil)yodonio (440 mg, 1,01 mmol, 1,10 eq). La solución resultante se agitó durante una noche a 40°C y se inactivó con agua (10 ml). La mezcla se extrajo con EtOAc (3 x 10 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 15 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 100 mg (25% de rendimiento) del 4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carboxilato de í-butilo como un aceite incoloro. CLEM (ESI, m/z): 437 [M+H]+.
Etapa 7: Preparación de 1-(3-cloro-5-(4-clorofenoxi)bencil)piperazina
Se cargó un matraz con 4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carboxilato de í-butilo (100 mg, 0,229 mmol, 1,00 eq), DCM (5 ml) y TFA (1 ml), como se describe en Ejemplo 1, Etapa 5, para proporcionar 80,0 mg (bruto) de 1 -(3-cloro-5-(4-clorofenoxi)bencil)piperazina como un aceite amarillo. CLEM (ESI, m/z): 337 [M+H]+.
E tapa 8: P reparac ión de 1 -(4 -(3 -c lo ro -5 -(4 -c lo ro feno x i)b enc il)p ipe raz in a -1 -ca rbo n il)-1H -p irazo l-3 -ca rbo x ila to de f-butilo
Se cargó un matraz con 1-[[3-cloro-5-(4-clorofenoxi)fenil]metil]piperazina (80,0 mg, 0,238 mmol, 1,00 eq), DCM (10 ml), 1 H-pirazol-1,3-dicarboxilato de 3-f-butilo y 1 -(4-nitrofenilo) (159 mg, 0,476 mmol, 2,00 eq) y trietilamina (72,1 mg, 0,714 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió para proporcionar 100 mg (79% de rendimiento) del 1-(4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. Cl Em (ESI, m/z): 531 [M+H]+.
Etapa 9: Preparación del ácido 1-(4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1 -(4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxilato de f-butilo (70,0 mg, 0,132 mmol, 1,00 equivalentes), DCM (5 ml) y TFA (1 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en DCM (10 ml). El valor de pH de la solución se ajustó a 8 con solución saturada de NaHCO3, como se describe en el Ejemplo 1, Etapa 5. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 15,4 mg (25% de rendimiento) del ácido 1-(4-(3-cloro-5-(4-clorofenoxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-04) 58,14 (d, J = 2,7 Hz, 1H), 7,35 - 7,43 (m, 2H), 7,19 (ancho, 1H), 7,02 - 7,06 (m, 2H), 6,93 -6,97 (m, 1 H), 6,92 (s, 1H), 6,82 (d, J = 2,7 Hz, 1H), 3,86 (ancho, 4H), 3,60 (s, 2H), 2,57 - 2,67 (m, 4H). CLEM (ESI, m/z): 475 [M+H]+.
Ejemplo 20: Ácido 4-cloro-1-(5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 4-cloro-1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con ácido 4-cloro-1 H-pirazol-3-carboxílico (2,00 g, 13,6 mmol, 1,00 eq), dicarbonato de di-f-butilo (11,9 g, 54,5 mmol, 4,00 eq), DMAP (332 mg, 2,72 mmol, 0,20 eq), trietilamina (4,12 g, 40,8 mmol, 3,00 eq), f-BuOH (20 ml). La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1. El residuo se cromatografió para proporcionar 260 mg (9% de rendimiento) del 4-cloro-1H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 203 [M+H]+.
Etapa 2: Preparación de 4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-2-(trifluorometil)benzaldehído
Se cargó un matraz con 4-bromo-2-(trifluorometil)benzaldehído (2,00 g, 7,90 mmol, 1,00 eq), dicloruro de 1,1'-bis(difenilfosfino)ferrocenopaladio (578 mg, 0,790 mmol, 0,10 eq), acetato de potasio (2,32 g, 23,7 mmol, 3,00 eq), DMSO (30 ml), 4,4,5,5-tetrametil-2-(tetrametil-1,3,2-dioxaborolan-2-il)-1,3,2-dioxaborolano (2,40 g, 9,45 mmol, 1,20 eq) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (3 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 2,00 g (84% de rendimiento) del 4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)-2-(trifluorometil)benzaldehído como un sólido blanco. CLEM (ESI, m/z): 301 [M+H]+.
Etapa 3: Preparación de 4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)benzaldehído
Se cargó un matraz con 4-(tetrametil-1,3,2-dioxaborlan-2-il)-2-(trifluorometil)benzaldehído (900 mg, 3,00 mmol, 1,00 eq), 3-bromoimidazo[1,2-a]piridina (886 mg, 4,50 mmol, 1,50 eq), tetrakis(trifenilfosfina)paladio (173 mg, 0,151 mmol, 0,05 eq), carbonato de potasio (1,24 g, 8,97 mmol, 3,00 eq), 1,4-dioxano (10 ml) y agua (10 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (3 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 740 mg (85% de rendimiento) de 4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)benzaldehído como un sólido amarillo. CLEM (ESI, m/z): 291 [M+H]+.
Etapa 4: Preparación de 5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con 4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)benzaldehido (290 mg, 1,00 mmol, 1,00 eq), DCE (5 ml) y octahidropirrolo[3,4-c]pirrol-2-carboxilato de í-butilo (233 mg, 1,10 mmol, 1,10 eq). La solución resultante se agitó durante 2 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (636 mg, 3,00 mmol, 3,00 eq), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió para proporcionar 430 mg (88% de rendimiento) del 5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carboxilato de í-butilo como un aceite amarillo claro. CLEM (ESI, m/z): 487 [M+H]+.
Etapa 5: Preparación de 3-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)imidazo[1,2-a]piridina
Se cargó un matraz con 5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1H)-carboxilato de í-butilo (430 mg, 0,881 mmol, 1,00 eq), dioxano (6 ml) y HCl concentrado (1 ml), como se describe en el Ejemplo 2, Etapa 4. La solución resultante se agitó durante la noche a temperatura ambiente y se concentró a presión reducida para proporcionar 341 mg (bruto) de la 3-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)imidazo[1,2-a]piridina como un aceite amarillo. CLEM (ESI, m/z): 387 [M+H]+.
Etapa 6: Preparación de 4-cloro-1-(5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con carbonocloridato de 4-nitrofenilo (212 mg, 1,05 mmol, 1,20 eq), 4-cloro-1H-pirazol-3-carboxilato de terc-butilo (212 mg, 1,05 mmol, 1,20 eq) y DCM (5 ml). Se añadió DIPEA (340 mg, 2,64 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente. Se añadió 3-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)imidazo[1,2-a]piridina (340 mg, 0,881 mmol, 1,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 1, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 274 mg (51% de rendimiento) del 4-cloro-1-(5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1 H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 615 [M+H]+.
Etapa 7: Preparación de ácido 4-cloro-1-(5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol- 2-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 4-cloro-1-(5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)octahidropirrolo[3,4-c ]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de f-butilo (274 mg, 0,45 mmol, 1,00 eq), DCM (5 ml) y TFA (1 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto (301 mg) se purificó por HPLC preparativa para proporcionar 101,1 mg (41% de rendimiento) del ácido 4-cloro-1-(5-(4-(imidazo[1,2-a]piridin-3-il)-2-(trifluorometil)bencil)octahidropirrolo[3,4-c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, cloroformo-d) 58,23 - 8,29 (m, 2H), 7,92 - 8,02 (m, 2H), 7,75 - 7,79 (m, 3H), 7,27 - 7,32 (m, 1 H), 6,93 - 7,00 (m, 1 H), 3,86 - 4,37 (m, 4H), 3,72 (ancho, 2H), 2,62 - 3,04 (m, 5H), 2,40 (ancho, 1H). CLEM (ESI, m/z): 559 [M+H]+.
Ejemplo 21: Acido 1-(2-(4-cloro-3-etoxibencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxilico (22,4 g, 200 mmol, 1,00 eq), f-butanol (100 ml), trietilamina (60,6 g, 599 mmol, 3,00 eq), DMAP (4,88 g, 39,9 mmol, 0,20 eq) y dicarbonato de di-f-butilo (174 g, 797 mmol, 4,00 eq). La solución resultante se agitó durante 2 h a 80°C y se inactivó con agua (100 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 62,5 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite marrón. CLEM (ESI, m/z): 269 [M+H]+.
E tapa 2: P rep a ra c ión de 1 H -p ira zo l-3 -ca rb o x ila to de t-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-t-butilo (62,5 g, 233 mmol, 1,00 eq), MeOH (240 ml), agua (80 ml) e hidróxido de sodio (14,0 g, 350 mmol, 1,50 eq). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió en una columna de gel de sílice para proporcionar 16,2 g (41% de rendimiento) del 1 H-pirazol-3-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 8-(3-(í-butoxicarbonil)-1H-pirazol-1-carbonil)-2,8-diazaespiro [4.5] decano-2-carboxilato de t-butilo
Se cargó un matraz con 1 H-pirazol-3-carboxilato de t-butilo (2,52 g, 15,0 mmol, 1,50 eq), cloroformiato de 4-nitrofenilo (3,02 g, 15,0 mmol, 1,50 eq), DCM (50 ml) y trietilamina (3,03 g, 29,9 mmol, 3,00 equivalente). La solución resultante se agitó durante 2 h a temperatura ambiente. Se añadió 2,8-diazaespiro[4.5]decano-2-carboxilato de t-butilo (2,40 g, 9,99 mmol, 1,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 4,16 g (96% de rendimiento) del 8-(3-(t-butoxicarbonil)-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de t-butilo como un sólido blanco. CLEM (ESI, m/z): 435 [M+H]+.
Etapa 4: Preparación del ácido 1-(2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 8-(3-(í-butoxicarbonil)-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de t-butilo (1740 mg, 4,00 mmol, 1,00 eq), DCM (15 ml) y TFA (5 ml). La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida para proporcionar 1116 mg (cuantitativo) de ácido 1 -(2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico como un aceite amarillo. CLEM (ESI, m/z): 279 [M+H]+.
Etapa 5: Preparación de 4-cloro-3-etoxibenzaldehído
Se cargó un matraz con 4-cloro-3-hidroxibenzaldehido (785 mg, 5,01 mmol, 1,00 eq), DMF (10 ml), yodoetano (1560 mg, 10,0 mmol, 2,00 eq) y carbonato de cesio (4890 mg, 15,0 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 40°C y se inactivó con agua (10 ml). La solución resultante se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 710 mg (77% de rendimiento) de 4-cloro-3-etoxibenzaldehído como un aceite amarillo. RMN 1H (300 MHz, cloroformod) 59,94 (s, 1H), 7,55 (d, J = 7,8 Hz, 1H), 7,42 (s, 1H), 7,39 (d, J = 7,8 Hz, 1H), 4,20 (m, 2H), 1,51 (t, J = 6,9 Hz, 3H).
Etapa 6 : Preparación de ácido 1-(2-(4-cloro-3-etoxibencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 4-cloro-3-etoxibenzaldehído (92,5 mg, 0,501 mmol, 1,00 eq) en DCE (10 ml), ácido 1 -(2,8 diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico (278 mg, 1,00 mmol, 2,00 eq) y trietilamina (152 mg, 1,50 mmol, 3,00 eq). La solución resultante se agitó durante 2 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (318 mg, 1,50 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con una solución saturada de NaHCO3 (10 ml), como se describe en el Ejemplo 2, Etapa 3. El producto bruto (500 mg) se purificó por HPLC preparativa para proporcionar 92,9 mg (41% de rendimiento) de ácido 1-(2-(4-cloro-3-etoxibencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (300 MHz, MeOH-d4) 58,06 (d, J = 2,7 Hz, 1 H), 7,43 (d, J = 8,1 Hz, 1 H), 7,29 (d, J = 2,1 Hz, 1H), 7,08 - 7,05 (m, 1H), 6,76 (d, J = 2,7 Hz, 1H), 4,34 (s, 2H), 4,14 - 4,07 (m, 2H), 3,86 - 3,69 (m, 4H), 3,44 (t, J = 6,9 Hz, 2H), 3,28 (s, 2H), 2,07 (t, J = 4,2 Hz, 2H), 1,89 - 1,77 (m, 4H), 1,41 (t, J = 6,9 Hz, 3H). CLEM (ESI, m/z): 447 [M+H]+.
Ejemplo 22: 1 -(1 -((6-(T rifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxamida
Etapa 1: Preparación de 4-nitrofenil 3-carbamoil-1 H-pirazol-1-carboxilato
Se cargó un matraz con 1 H-pirazol-3-carboxamida (73,4 mg, 0,660 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (159 mg, 0,790 mmol, 1,20 eq), DCM (10 ml) y trietilamina (200 mg, 1,98 mmol, 3,00 eq), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 182 mg (bruto) de 3-carbamoil-1 H-pirazol-1-carboxilato de 4-nitrofenilo como un aceite amarillo. CLEM (ESI, m/z): 277 [M+H]+.
Etapa 2: Preparación de 1-(6-(trifluorometil)benzo[b]tiofeno-2-carbonil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo
Se cargó un matraz con ácido 6-(trifluorometil)-1-benzotiofen-2-carboxílico (0,492 g, 2,00 mmol, 1,00 eq), 1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo (0,720 g, 3,00 mmol, 1,50 eq), DMF (10 ml), N,N,N',N'-tetrametil-O-(7-azabenzotriazol)-1 -il)uronio (1,52 g, 4,00 mmol, 2,00 eq) y DIPEA (0,774 g, 6,00 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 14, Etapa 7. El residuo se cromatografió en una columna de gel de sílice para proporcionar 800 mg (85% de rendimiento) del 1-(6-(trifluorometil)benzo[b]tiofeno-2-carbonil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 469 [M+H]+.
Etapa 3: Preparación de 1-((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo
Se cargó un matraz con 1 -(6-(trifluorometil)benzo[b]tiofeno-2-carbonil)-1,8-diazaespiro[4.5]decano-8-carboxilato de fbutilo (300 mg, 0,640 mmol, 1,00 eq), THF (3 ml) y borano (solución 1 M en THF, 2,56 ml, 2,56 mmol, 4,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente. Se añadió MeOH (20 ml) y la mezcla resultante se agitó a 60°C durante 1 h y se inactivó con agua (20 ml). La solución resultante se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 200 mg (69% de rendimiento) del 1-((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo como un aceite incoloro. CLEM (ESI, m/z): 455 [M+H]+.
Etapa 4: Preparación de 1-((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano
Se cargó un matraz con 1-((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo (200 mg, 0,440 mmol, 1,00 eq), DCM (10 ml) y TFA (2 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida para proporcionar 156 mg (cuantitativo) de 1 -((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano como un aceite amarillo. CLEM (ESI, m/z): 355 [M+H]+.
Etapa 5: Preparación de 1-(1-((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3 -carboxamida
Se cargó un matraz con 1-((6-(trifluorometil)benzo[b]tiofen-2-il)metil)-1,8-diazaespiro[4.5]decano (156 mg, 0,440 mmol, 1,00 eq), 3-carbamoil-1H-pirazol-1-carboxilato de 4-nitrofenilo (182 mg, 0,660 mmol, 1,50 eq), DCM (10 ml) y trietilamina (133 mg, 1,32 mmol, 3,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y luego se inactivó con agua (20 ml), como se describe en el Ejemplo 4, Etapa 3. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 80,6 mg (37% de rendimiento) de la 1-[(1-[[6-(trifluorometil)-1-benzotiofen-2-il]metil]-1,8-diazaespiro[4.5]decan-8-il)carbonil]-1H-pirazol-3-carboxamida como un sólido blanco. RMN 1H (300 MHz, cloroformo-d) 58,09 (d, J = 2,7 Hz, 1H), 8,04 (s, 1 H), 7,74 (d, J = 8,4 Hz, 1H), 7,53 (d, J = 8,7 Hz, 1H), 7,20 (s, 1H), 6,91 (d, J = 2,7 Hz, 1H), 6,64 (ancho, 1H), 5,47 (ancho, 1 H), 4,60 - 4,47 (m, 2H), 3,96 (s, 2H), 3,15 (t, J = 12,9 Hz, 2H), 2,85 (t, J = 6,3 Hz, 2H), 2,01 - 1,78 (m, 6H), 1,62 - 1,57 (m, 2H). CLEM (ESI, m/z): 492 [M+H]+.
Ejemplo 23: Ácido 1-(frans-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
E tapa 1: P rep a ra c ión de 1 H -p ira zo l-1 ,3 -d ica rb o x ila to de d i-í-b u tilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-í-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y í-butanol (200 ml). La solución resultante se agitó durante una noche a 65°C y se inactivó con agua (200 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), hidróxido de sodio (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1-(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de í-butilo (1,68 g, 9,99 mmol, 1,00 eq), DCM (20 ml) y trietilamina (3,03 g, 29,9 mmol, 3,00 eq). Se añadió cloroformiato de 4-nitrofenilo (2,42 g, 12,0 mmol, 1,20 eq) a 0°C como se describe en el Ejemplo 4, Etapa 3, para proporcionar 3,33 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1-(4-nitrofenilo) como un sólido amarillo.
Etapa 4: Preparación de (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,6aS)-5-oxohexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (3,00 g, 13,3 mmol, 1,00 eq), MeOH (20 ml) y borohidruro de sodio (0,760 g, 20,1 mmol, 1,50 eq). La solución resultante se agitó durante 5 h a temperatura ambiente y se concentró a presión reducida. La mezcla resultante se diluyó con agua (40 ml), se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 15, Etapa 4, para proporcionar 3,01 g (bruto) de (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 228 [m +H]+.
Etapa 5: Preparación de (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (1,00 g, 4,40 mmol, 1,00 eq), DCM (20 ml) y trietilamina (1,34 g, 13,2 mmol, 3,00 eq). Se añadió gota a gota cloruro de metanosulfonilo (0,608 g, 5,28 mmol, 1,20 eq) a 0°C como se describe en el Ejemplo 11, Etapa 3, para proporcionar
1,34 g (bruto) del (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 306 [M+H]+.
Etapa 6 : Preparación de 3-(pirimidin-5-il)fenol
Se cargó un vial con 5-bromopirimidina (1,58 g, 10,0 mmol, 1,00 eq), ácido (3-hidroxifenil)borónico (2,07 g, 15,0 mmol, 1,50 eq), dicloruro de 1,1'-bis(difenilfosfino)ferrocenopaladio (0,731 g , 1,00 mmol, 0,10 eq), carbonato de potasio (4,14 g, 30,0 mmol, 3,00 eq), éter dimetílico del etilenglicol (16 ml) y agua (4 ml). La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice (1/1) para proporcionar 1,27 g (74% de rendimiento) de 3-(pirimidin-5-il)fenol como un sólido amarillo. CLEM (ESI, m/z): 173 [M+H]+.
Etapa 7: Preparación de (3aR,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un vial con 3-(pirimidin-5-il)fenol (206 mg, 1,20 mmol, 1,00 eq), (3aR,5r,6aS)-5-(metanosulfoniloxi)-octahidrociclopenta[c]pirrol-2-carboxilato de í-butilo (366 mg, 1,20 mmol, 1,00 eq), carbonato de cesio (782 mg, 2,40 mmol, 2,00 eq) y d Mf (15 ml). La solución resultante se agitó durante una noche a 100°C y se inactivó con agua (10 ml), como se describe en el Ejemplo 13, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 320 mg (70% de rendimiento) del (3aR,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 382 [M+H]+.
Etapa 8 : Preparación de (3aR,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol
Se cargó un vial con (3aR,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (200 mg, 0,520 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5, para proporcionar 147 mg (cuantitativo) del (3aR,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol como un aceite amarillo. CLEM (ESI, m/z): 282 [M+H]+.
Etapa 9: Preparación de 1-(írans-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un vial con (3aR,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol (147 mg, 0,520 mmol, 1,00 eq), trietilamina (263 mg, 2,60 mmol, 5,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) (260 mg, 0,780 mmol, 1,50 eq) y DCM (15 ml). La solución resultante se agitó durante 2 h a temperatura ambiente como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 166 mg (67% de rendimiento) del 1-(írans-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 476 [M+H]+.
Etapa 10: Preparación de ácido 1-(frans-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico
Se cargó un vial con 1-((3afi,5s,6aS)-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de f-butilo (166 mg, 0,350 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante una noche a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 82,1 mg (56% de rendimiento) del ácido 1-(frans-5-(3-(pirimidin-5-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H: (300 MHz, MeOH-d4) 59,14 (s, 1H), 9,05 (s, 2H), 8,17 (d, J = 9,3 Hz, 1H), 7,43 (t, J = 8,0 Hz, 1H), 7,27 - 7,18 (m, 2H), 7,08 - 6,98 (m, 1H), 6,80 (d, J = 2,7 Hz, 1H), 5,17 - 5,08 (m, 1H), 4,35 - 3,51 (m, 4H), 3,08 - 2,88 (m, 2H), 2,28 -2,15 (m, 2H), 2,08 - 1,92 (m, 2H)). CLEM (ESI, m/z): 420 [M+H]+.
Ejemplo 24: 1 -((2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxamida
Etapa 1: Preparación de (2S,4S)-4-hidroxi-2-metilpiperidina-1-carboxilato de f-butilo y (2S,4R)-4-hidroxi-2-metilpiperidina-1 -carboxilato de f-butilo
Se cargó un matraz con (2S)-2-metil-4-oxopiperidina-1-carboxilato de f-butilo (10,0 g, 46,9 mmol, 1,00 eq) y THF (36 ml). Se añadieron gota a gota borohidruro de sodio (1,07 g, 28,2 mmol, 0,60 eq) y MeOH (12 ml) a 0°C. La solución resultante se agitó durante 1 h a 0°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 15, Etapa 4. El producto bruto (11,0 g) se purificó por HPLC preparativa para proporcionar 4,90 g (49% de rendimiento) del (2S,4S)-4-hidroxi-2-metilpiperidina-1-carboxilato de f-butilo como un aceite amarillo (LCMS (ESI, m/z): 216 [M+H]+) y 4,10 g (41% de rendimiento) del (2S,4R)-4-hidroxi-2-metilpiperidina-1-carboxilato de f-butilo como un sólido blanco LCMS (ESI, m/z): 216 [M+H]+.
Etapa 2: Preparación de (2S,4fi)-2-metil-4-((metilsulfonil)oxi)piperidina-1-carboxilato de f -butilo
Se cargó un matraz con (2S,4fi)-4-hidroxi-2-metilpiperidina-1-carboxilato de f-butilo (600 mg, 2,79 mmol, 1,00 eq), DCM (15 ml) y trietilamina (845 mg, 8,35 mmol, 3,00 eq). Se añadió gota a gota cloruro de metanosulfonilo (417 mg, 3,63 mmol, 1,30 eq) a 0°C como se describe en el Ejemplo 11, Etapa 3, para proporcionar 817 mg (bruto) del (2S,4R)-2-metil-4-((metilsulfonil)oxi)piperidin-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 294 [M+H]+. Etapa 3: Preparación de (2S,4S)-2-metil-4-(metilamino)piperidina-1-carboxilato de f-butilo
Se cargó un matraz con (2S,4R)-4-(metanosulfoniloxi)-2-metilpiperidina-1-carboxilato de f-butilo (817 mg, 2,78 mmol, 1,00 eq), ACN (10 ml) y metilamina (2,2 ml, 27,8 mmol, 10,0 equiv, 40% en agua). La solución resultante se agitó durante 3 días a 60°C y se concentró a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 420 mg (66% de rendimiento) del (2S,4S)-2-metil-4-(metilamino)piperidina-1-carboxilato de f-butilo como un aceite amarillo. c Le M (ESI, m/z): 229 [M+h ]+.
E tap a 4: P rep a ra c ión de (2 S ,4 S )-2 -m e til-4 -(m e til(3 -( tr iflu o ro m e til)b e n c il)a m in o )p ip e rid in a -1 -c a rb o x ila to de í-bu tilo
Se cargó un matraz con 3-(trifluorometil)benzaldehído (264 mg, 1,52 mmol, 1,00 eq), (2S,4S)-2-metil-4-(metilamino)piperidina-1 -carboxilato de í-butilo (380 mg, 1,66 mmol, 1,10 eq), DCE (10 ml) y trietilamina (460 mg, 4,55 mmol, 3,00 eq). La solución resultante se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (967 mg, 4,56 mmol, 3,00 eq) como se describe en el Ejemplo 2, Etapa 3, para proporcionar el producto bruto. El residuo se cromatografió en una columna de gel de sílice para proporcionar 400 mg (68% de rendimiento) del (2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidin-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 387 [M+H]+.
Etapa 5: Preparación de (2S,4S)-W,2-dimetil-W-(3-(trifluorometil)bencil)piperidin-4-amina
Se cargó un matraz con (2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidina-1 -carboxilato de í-butilo (400 mg, 1,04 mmol, 1,00 eq), 1,4-dioxano (10 ml) y ácido clorhídrico concentrado (2,5 ml). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida para proporcionar 296 mg (cuantitativo) de (2S,4S)-A/,2-dimetil-A/-(3-(trifluorometil)bencil)piperidin-4-amina como un aceite amarillo. CLEM (ESI, m/z): 287 [M+H]+.
Etapa 6 : Preparación de cloruro de (2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidina-1-carbonilo
Se cargó un matraz con (2S,4S)-W,2-dimetil-W-(3-(trifluorometil)bencil)piperidin-4-amina (296 mg, 1,03 mmol, 1,00 eq), DCM (10 ml) y trifosgeno (154 mg, 0,520 mmol, 0,50 eq) en atmósfera de nitrógeno. Se añadió gota a gota DIPEA (402 mg, 3,12 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 3 h a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 1, Etapa 3, para proporcionar 362 mg (bruto) del cloruro de (2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidin-1-carbonilo como un aceite amarillo. CLEM (ESI, m/z): 349 [M+H]+.
Etapa 7: Preparación de 1-((2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxamida
Se cargó un matraz con cloruro de (2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidina-1-carbonilo (181 mg, 0,520 mmol, 1,00 eq), 1H-pirazol-3-carboxamida (86,6 mg, 0,780 mmol, 1,50 eq), THF (10 ml), DMAP (12,7 mg, 0,104 mmol, 0,20 eq) y DIPEA (201 mg, 1,56 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (10 ml), como se describe en el Ejemplo 1, Etapa 4. El producto bruto (300 mg) se purificó por HPLC preparativa para proporcionar 54,6 mg (25% de rendimiento) de la 1-((2S,4S)-2-metil-4-(metil(3-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxamida como un semisólido blanco. RMN 1H (300 MHz, cloroformo-d) 58,09 (d, J = 2,7 Hz, 1H), 7,60 (s, 1H), 7,53 - 7,51 (m, 2H), 7,46 - 7,41 (m, 1H), 6,90 (d, J = 2,7 Hz, 1H), 6,68 (ancho, 1H), 5,61 (ancho, 1H), 4,32 - 4,21 (m, 1H), 4,14 - 4,07 (m, 1H), 3,64 (ancho, 2H), 3,52 - 3,42 (m, 1H), 2,82 (ancho, 1H), 2,20 (s, 3H), 2,07 - 2,03 (m, 2H), 1,83 - 1,73 (m, 2H), 1,48 (d, J = 6,3 Hz, 3H). CLEM (ESI, m/z): 424 [M+H]+.
Ejemplo 25: Ácido 1-(frans-5-(3-(oxazol-2-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-f-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y f-butanol (200 ml). La solución resultante se agitó durante la noche a 65°C y se inactivó con agua (200 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1H-pirazol-1,3-dicarboxilato de di-f-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de di-f-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), hidróxido de sodio (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) de 1H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1 H-pirazol-3-carboxilato de f-butilo (1,68 g, 9,99 mmol, 1,00 eq), DCM (20 ml) y trietilamina (3,03 g, 29,9 mmol, 3,00 eq). Se añadió cloroformiato de 4-nitrofenilo (2,42 g, 12,0 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 4, Etapa 3, para proporcionar 3,33 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-(f-butilo) y 1 -(4-nitrofenilo) como un sólido amarillo.
Etapa 4: Preparación de (3afi,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo
Se cargó un matraz con (3afi,6aS)-5-oxo-hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo (3,00 g, 13,3 mmol, 1,00 eq), MeOH (20 ml) y borohidruro de sodio (0,760 g, 20,1 mmol, 1,50 eq). La solución resultante se agitó durante 5 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 15, Etapa 4, para proporcionar 3,01 g (bruto) del (3afi,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 228 [M+H]+.
E tap a 5: P rep a ra c ión de (3 a fi,5 r,6 a S )-5 -((m e tils u lfo n il)o x i)h e x a h id ro c ic lo p e n ta [c ]p irro l-2 (1 H )-ca rb o x ila to de f-butilo
Se cargó un vial con (3afi,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo (200 mg, 0,881 mmol, 1,00 eq), trietilamina (267 mg, 2,64 mmol, 3,00 eq) y DCM (15 ml). Se añadió gota a gota cloruro de metanosulfonilo (152 mg, 1,32 mmol, 1,50 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente. La mezcla se inactivó con agua (10 ml), se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en Ejemplo 11, Etapa 3, para proporcionar 268 mg (bruto) del (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo como un aceite amarillo.
Etapa 6: Preparación de 3-(oxazol-2-il)fenol
Se cargó un matraz con 1,3-oxazol (1,00 g, 14,5 mmol, 1,00 eq), 3-bromofenol (1,25 g, 7,25 mmol, 0,50 eq), carbonato de potasio (6,00 g, 43,5 mmol, 3,00 eq), ácido piválico (0,592 g, 5,80 mmol, 0,40 eq) y tolueno (100 ml). Se añadieron acetato de paladio (II) (0,326 g, 1,45 mmol, 0,10 eq) y 2-diciclohexilfosfino-2',6'-di-i-propoxi-1,1 '-bifenilo (1,35 g, 2,90 mmol, 0,20 eq) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 110°C. La mezcla se inactivó con agua (20 ml), se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (3 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,220 g (9% de rendimiento) del 3-(oxazol-2-il)fenol como un aceite amarillo. CLEM (ESI, m/z): 162 [M+H]+.
Etapa 7: Preparación de (3aR,5s,6aS)-5-(3-(oxazol-2-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo
Se cargó un vial con 3-(oxazol-2-il)fenol (142 mg, 0,88 mmol, 1,00 eq), carbonato de cesio (860 mg, 2,63 mmol, 3,00 eq), (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo (268 mg, 0,881 mmol, 1,00 eq) y DMF (15 ml). La solución resultante se agitó durante 2 h a 80°C. La mezcla se inactivó con agua (10 ml), se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 13, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 105 mg (32% de rendimiento) del (3aR,5s,6aS)-5-(3-(oxazol-2-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 371 [M+H]+.
Etapa 8: Preparación de 2-(3-(((3aR,5s,6aS)-octahidrociclopenta[c]pirrol-5-il)oxi)fenil)oxazol
Se cargó un vial con (3aR,5s,6aS)-5-(3-(oxazol-2-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo (105 mg, 0,284 mmol, 1,00 eq), TFA (2 ml) y DCM (10 ml), como se describe en el Ejemplo 1, Etapa 5, para proporcionar 76,6 mg (cuantitativo) de 2-(3-(((3aR,5s,6aS)-octahidrociclopenta[c]pirrol-5-il)oxi)fenil)oxazol como un aceite amarillo. CLEM (ESI, m/z): 271 [M+H]+.
Etapa 9: Preparación de 1-((3afl,5s,6aS)-5-(3-(oxazol-2-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de f-butilo
Se cargó un vial con 2-(3-(((3afl,5s,6aS)-octahidrociclopenta[c]pirrol-5-il)oxi)fenil)oxazol (76,6 mg, 0,284 mmol, 1,00 eq), trietilamina (115 mg, 1,14 mmol, 4,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1-(4-nitrofenilo) (142 mg, 0,426 mmol, 1,50 eq) y DCM (15 ml). La solución resultante se agitó durante la noche a temperatura ambiente. La mezcla se inactivó con agua (10 ml), se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 108 mg (82% de rendimiento) del 1-((3afi,5s,6aS)-5-(3-(oxazol-2-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 465 [M+H]+.
Etapa 10: Preparación de ácido 1-(frans-5-(3-(oxazol-2-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico
Se cargó un vial con 1-((3aR,5s,6aS)-5-(3-(oxazol-2-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de f-butilo (108 mg, 0,232 mmol, 1,00 eq), TFA (2 ml) y DCM (10 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 71,0 mg (75% de rendimiento) del ácido 1 -(rans-5-(3-(oxazol-2-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H: (300 MHz, MeOH-ck) 58,17 (d, J = 2,7 Hz, 1H), 8,02 - 7,95 (m, 1H), 7,67 - 7,56 (m, 1H), 7,56 - 7,49 (m, 1H), 7,45 - 7,37 (m, 1H), 7,31 - 7,27 (m, 1H), 7,10 - 6,99 (m, 1H), 6,76 (d, J = 2,7 Hz, 1H), 5,14 - 5,05 (m, 1H), 4,30 - 3,82 (ancho, 3H), 3,82 -3,57 (ancho, 1 H), 3,11 - 2,84 (ancho, 2H), 2,30 - 2,11 (m, 2H), 2,11 - 1,89 (m, 2H). CLEM (ESI, m/z): 409 [M+H]+.
Ejemplo 26: Ácido 4-cloro-1-(2-(3-cloro-2-(trifluorometil)bencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 3-cloro-2-(trifluorometil)benzaldehído
Se cargó un matraz con 1-bromo-3-cloro-2-(trifluorometil)benceno (500 mg, 1,94 mmol, 1,00 eq) y THF (20 ml) en atmósfera de nitrógeno. Se añadió gota a gota n-butillitio (0,93 ml, 2,32 mmol, 1,20 equivalentes, 2,5 M en hexano) a -78°C. La solución resultante se agitó durante 2 horas a -78°C. Se añadió DMF (10 ml). La solución resultante se agitó durante 2 h a -78°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 25 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 130 mg (32% de rendimiento) del 3-cloro-2-(trifluorometil)benzaldehído como un aceite amarillo. CLEM (ESI, m/z): 209 [M+H]+.
E tap a 2: P rep a ra c ión de 4 -c lo ro -1 H -p ira z o l-3 -c a rb o x ila to de í-bu tilo
Se cargó un matraz con ácido 4-cloro-1 H-pirazol-3-carboxílico (4,00 g, 27,4 mmol, 1,00 eq), í-butanol (50 ml), dicarbonato de di-í-butilo (21,5 g, 98,6 mmol, 3,60 eq), DMAP (468 mg, 3,83 mmol, 0,14 eq) y trietilamina (8,30 g, 82,2 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 65°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1. El residuo se cromatografió en una columna de gel de sílice para proporcionar 520 mg (9% de rendimiento) del 4-cloro-1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 203 [M+H]+.
Etapa 3: Preparación de 8-(3-(í-butoxicarbonil)-4-cloro-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de í-butilo
Se cargó un matraz con 4-cloro-1H-pirazol-3-carboxilato de í-butilo (355 mg, 1,75 mmol, 1,20 eq), DCM (20 ml), cloroformiato de 4-nitrofenilo (442 mg, 2,19 mmol, 1,50 eq) y DIPEA (565 mg, 4,38 mmol, 3,00 eq). La solución resultante se agitó durante 3 h a temperatura ambiente. Se añadió 2,8-diazaespiro[4.5]decano-2-carboxilato de í-butilo (350 mg, 1,46 mmol, 1,00 eq). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 25 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en gel de sílice para proporcionar 650 mg (95% de rendimiento) del 8-(3-(t-butoxicarbonil)-4-cloro-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 469 [M+H]+.
Etapa 4: Preparación de ácido 4-cloro-1 -(2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 8-(3-(t-butoxicarbonil)-4-cloro-1 H-pirazol-1 -carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de í-butilo (650 mg, 1,39 mmol, 1,00 eq), DCM (10 ml) y TFA (3 ml) como se describe en el Ejemplo 1, Etapa 5, para proporcionar 433 mg (cuantitativo) de ácido 4-cloro-1 -(2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico como un aceite amarillo. CLEM (ESI, m/z): 313 [M+H]+.
Etapa 5: Preparación de ácido 4-cloro-1 -(2-(3-cloro-2-(trifluorometil)bencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 3-cloro-2-(trifluorometil)benzaldehído (77,8 mg, 0,374 mmol, 1,00 eq), DCE (20 ml), ácido 4-cloro-1-(2,8-diazaespiro[4.5]decano-8 -carbonil)-1H-pirazol-3-carboxílico (140 mg, 0,449 mmol, 1,20 eq) y trietilamina (113 mg, 1,12 mmol, 3,00 eq). La solución resultante se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (238 mg, 1,12 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con una solución saturada de NaHCÜ3 (20 ml), como se describe en el Ejemplo 2, Etapa 3. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 10,8 mg (6% de rendimiento) del ácido 4-cloro-1 -(2-(3-cloro-2-(trifluorometil)bencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
como un sólido blanco. RMN 1H (300 MHz, MeOH-o^) 58,13 (s, 1H), 7,90 - 7,88 (m, 1H), 7,82 - 7,80 (m, 1H), 7,57 -7,52 (m, 1H), 4,26 (ancho, 2H), 3,93 - 3,79 (m, 2H), 3,69 - 3,57 (m, 2H), 3,14 - 3,07 (m, 2H), 2,99 - 2,84 (m, 2H), 1,94 (t, J = 7,2 Hz, 2H), 1,84 - 1,72 (m, 4H). CLEM (ESI, m/z): 505 [M+H]+.
Ejemplo 27: Acido 1 -(4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1 -carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (10,0 g, 89,3 mmol, 1,00 eq), DMAP (2,18 g, 17,9 mmol, 0,20 eq), trietilamina (27,1 g, 268 mmol, 3,00 eq), dicarbonato de di-f-butilo (77,8 g, 357 mmol, 4,00 eq) y f-butanol (100 ml). La solución resultante se agitó durante 4 h a 80°C y se inactivó con agua (50 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 25,0 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite rojo. CLEM (ESI, m/z): 269 [M+H]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo (25,0 g, 93,3 mmol, 1,00 eq), hidróxido de sodio (5,60 g, 140 mmol, 1,50 eq), agua (80 ml) y MeOH (240 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 1, Etapa 2. El residuo se cromatografió en una columna de gel de sílice para proporcionar 10,0 g (64% de rendimiento) de 1H-pirazol-3-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1 H-pirazol-3-carboxilato de f-butilo (2,00 g, 11,9 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (2,87 g, 14,2 mmol, 1,20 eq), trietilamina (3,61 g, 35,7 mmol, 3,00 eq) y DCM (20 ml). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida para proporcionar 3,90 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 3-f-butilo como un sólido amarillo. CLEM (ESI, m/z): 334 [M+H]+.
Etapa 4: Preparación de tetrafluoroborato de bis(4-clorofenil)yodonio
Se cargó un matraz con m-CPBA (3,18 g, 18,4 mmol, 1,10 eq) y DCM (25 ml). Se añadieron complejo de éter y trifluoruro de boro (7,16 g, 50,4 mmol, 3,00 eq) y 1 -cloro-4-yodobenceno (4,00 g, 16,8 mmol, 1,00 eq) a 0°C. La solución resultante se agitó durante 0,5 h a temperatura ambiente. Se añadió ácido (4-clorofenil)borónico (2,89 g, 18,5 mmol,
1,10 eq) a 0°C, como se describe en el Ejemplo 19, Etapa 1. La solución resultante se agitó durante 0,5 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se trituró con éter etílico para proporcionar 5,50 g (75% de rendimiento) del tetrafluoroborato de bis(4-clorofenil)yodonio en forma de un sólido blanco. CLEM (ESI, m/z): 349 [M-BF4]+ .
Etapa 5: Preparación de 3-cloro-5-(4-clorofenoxi)benzaldehído
Se cargó un matraz con í-butóxido de potasio (0,840 g, 7,50 mmol, 1,50 eq) y THF (20 ml). Se añadió 3-cloro-5-hidroxibenzaldehído (780 mg, 5,00 mmol, 1,00 eq) a 0°C y la reacción se agitó durante 20 min. Se añadió tetrafluoroborato de bis(4-clorofenil)yodonio (2,62 g, 6,00 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante la noche a 40°C y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 40 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 300 mg (19% de rendimiento) de 3-cloro-5-(4-clorofenoxi)benzaldehído como un aceite incoloro. CLEM (ESI, m/z): 267 [M+H]+.
Etapa 6 : Preparación de (3-cloro-5-(4-clorofenoxi)fenil)MeOH
Se cargó un matraz con 3-cloro-5-(4-clorofenoxi)benzaldehído (310 mg, 1,16 mmol, 1,00 eq), MeOH (15 ml) y borohidruro de sodio (129 mg, 3,41 mmol, 3,00 eq). La solución resultante se agitó durante 2 h a temperatura ambiente y luego se inactivó con agua (20 ml), como se describe en el Ejemplo 15, Etapa 4, para proporcionar 303 mg (97% de rendimiento) del (3-cloro-5-(4-clorofenoxi)fenil)MeOH como un aceite incoloro. CLEm (ESI, m/z): 269 [M+H]+.
Etapa 7: Preparación de 1-(bromometil)-3-cloro-5-(4-clorofenoxi)benceno
Se cargó un matraz con (3-cloro-5-(4-clorofenoxi)fenil)MeOH (303 mg, 1,13 mmol, 1,00 eq) y DCM (15 ml). Se añadió tribromuro de fósforo (610 mg, 2,25 mmol, 2,00 eq) a 0°C. La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (20 ml). La solución resultante se extrajo con DCM (3 x 40 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida para proporcionar 200 mg (54% de rendimiento) del 1-(bromometil)-3-cloro-5-(4-clorofenoxi)benceno como un aceite amarillo. CLEM (ESI, m/z): 331 [M+H]+.
Etapa 8 : Preparación de 4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carboxilato de í-butilo
Se cargó un matraz con 4-hidroxipiperidina-1-carboxilato de í-butilo (183 mg, 0,910 mmol, 1,50 eq) y DMF (5 ml). Se añadió hidruro de sodio (72,8 mg, 60% en aceite mineral, 1,82 mmol, 3,00 eq) a 0°C. La mezcla se agitó a 0°C durante 5 min. Se añadió 1-(bromometil)-3-cloro-5-(4-clorofenoxi)benceno (200 mg, 0,606 mmol, 1,00 eq) a 0°C. La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (10 ml), como se describe en el Ejemplo 15, Etapa 7. El residuo se cromatografió en una columna de gel de sílice para proporcionar 150 mg (55% de rendimiento) del 4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidin-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 452 [M+H]+.
Etapa 9: Preparación de 4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina
Se cargó un matraz con 4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carboxilato de f-butilo (150 mg, 0,330 mmol, 1,00 eq), DCM (10 ml) y TFA (3 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida para proporcionar 117 mg (cuantitativo) de la 4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina como un aceite amarillo. CLEM (ESI, m/z): 352 [M+H]+.
Etapa 10: Preparación de 1-(4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con 4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina (117 mg, 0,330 mmol, 1,00 eq), 1H- pirazol-1,3-dicarboxilato de 3-f-butilo y 1 -(4-nitrofenilo) (166 mg, 0,500 mmol, 1,50 eq), DCM (10 ml) y trietilamina (100 mg, 0,990 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (10 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 160 mg (88% de rendimiento) del 1-(4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z) : 546 [M+H]+.
Etapa 11: Preparación de ácido 1-(4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 1-(4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de fbutilo (160 mg, 0,290 mmol, 1,00 eq), DCM (10 ml) y TFA (3 ml), como se describe en el Ejemplo 1, Etapa 5. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 60,7 mg (42% de rendimiento) del ácido 1-(4-((3-cloro-5-(4-clorofenoxi)bencil)oxi)piperidina-1-carbonil)-1H-pirazol-3-carboxílico como un aceite amarillo. RMN 1H (300 MHz, MeOH-d4) 58,05 (d, J = 2,7 Hz, 1H), 7,41 - 7,35 (m, 2H), 7,15 (s, 1H), 7,04 - 6,99 (m, 2H), 6,92 - 6,89 (m, 2H), 6,76 (d, J = 2,7 Hz, 1H), 4,55 (s, 2H), 4,00 (ancho, 2H), 3,76 - 3,71 (m, 1H), 3,70 - 3,54 (m, 2H), 2,03 - 1,96 (m, 2H), 1,79 - 1,68 (m, 2H). CLEM (ESI, m/z): 490 [M+H]+.
Ejemplo 28: Ácido 1-(frans-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
E tap a 1: P rep a ra c ión de 1 H -p ira zo l-1 ,3 -d ica rb o x ila to de d i-í-b u tilo
Se cargó un matraz con ácido 1H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-í-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y í-butanol (200 ml). La solución resultante se agitó durante la noche a 65°C y se inactivó con agua (200 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), hidróxido de sodio (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1-(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de í-butilo (1,68 g, 9,99 mmol, 1,00 eq), DCM (20 ml) y trietilamina (3,03 g, 29,9 mmol, 3,00 eq). Se añadió cloroformiato de 4-nitrofenilo (2,42 g, 12,0 mmol, 1,20 eq) a 0°C), como se describe en el Ejemplo 4, Etapa 3, para proporcionar 3,33 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1-(4-nitrofenilo) como un sólido amarillo.
Etapa 4: Preparación de (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,6aS)5-oxo-hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (3,00 g, 13,3 mmol, 1,00 eq), MeOH (20 ml) y borohidruro de sodio (0,760 g, 20,1 mmol, 1,50 eq). La solución resultante se agitó durante 5 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 15, Etapa 4, para proporcionar 3,01 g (bruto) del (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. Cl Em (ESI, m/z): 228 [M+H]+.
Etapa 5: Preparación de (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (2,27 g, 9,99 mmol, 1,00 eq), ácido 4-nitrobenzoico (6,68 g, 40,0 mmol, 4,00 eq), trifenilfosfina (10,5 g, 40,0 mmol, 4,00 eq) y THF (30 ml). Se añadió gota a gota azodicarboxilato de dietilo (6,96 g, 40,0 mmol, 4,00 eq) a 0°C. La solución resultante
se agitó durante la noche a temperatura ambiente en atmósfera de nitrógeno y se inactivó con agua (50 ml), como se describe en el Ejemplo 15, Etapa 5. El residuo se cromatografió en una columna de gel de sílice para proporcionar 2,36 g (62% de rendimiento) del (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 377 [M+H]+.
Etapa 6 : Preparación de (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (2,36 g, 6,27 mmol, 1,00 eq), MeOH (30 ml), carbonato de potasio (2,60 g, 18,8 mmol, 3,00 eq) y agua (5 ml). La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 15, Etapa 6, para proporcionar 1,31 g (bruto) del (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato como un sólido blanco. CLEM (ESI, m/z): 228 [M+H]+.
Etapa 7: Preparación de 1-(bromometil)-3-metil-2-(trifluorometil)benceno
Se cargó un vial con 1-cloro-3-metil-2-(trifluorometil)benceno (800 mg, 4,11 mmol, 1,00 eq), peróxido de dibenzoilo (264 mg, 1,03 mmol, 0,250 eq), 1-bromo-2,5-pirrolidindiona (956 mg, 5,37 mmol, 1,30 eq) y tetracloruro de carbono (15 ml). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 400 mg (36% de rendimiento) de 1-(bromometil)-3-metil-2-(trifluorometil)benceno como un aceite amarillo. RMN 1H (300 MHz, cloroformo-d) 57,60 - 7,38 (m, 3H), 4,67 (ancho, 2H).
Etapa 8 : Preparación de (3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-hidroxi-octahidrociclopenta[c]pirrol-2-carboxilato de í-butilo (227 mg, 1,00 mmol, 1,00 eq) y DMF (15 ml). Luego se añadió hidruro de sodio (60% en aceite, 80,0 mg, 2,00 mmol, 2,00 eq) a 0°C. La solución resultante se agitó durante 0,5 h a temperatura ambiente. Luego se añadió 1-(bromometil)-3-metil-2-(trifluorometil)benceno (228 mg, 0,830 mmol, 0,800 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 15, Etapa 7. El residuo se cromatografió en una columna de gel de sílice para proporcionar 85,0 mg (24% de rendimiento) del (3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 420 [M+H]+.
Etapa 9: Preparación de (3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol
Se cargó un matraz con (3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (85,0 mg, 0,200 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. Esto dio como resultado 65,0 mg (cuantitativo) del (3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol como un sólido amarillo. CLEM (ESI, m/z): 320 [M+H]+.
Etapa 10: Preparación de 1-((3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol -3-carboxilato de f-butilo
Se cargó un vial con (3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol (65,0 mg, 0,200 mmol, 1,00 eq), trietilamina (124 mg, 1,23 mmol, 6,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-f-butilo y 1 -(4-nitrofenilo) (99,9 mg, 0,300 mmol, 1,50 eq) y DCM (15 ml). La solución resultante se agitó durante la noche a temperatura ambiente. La mezcla se inactivó con agua (10 ml) como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 50,0 mg (48% de rendimiento) del 1-((3aR,5s,6aS)-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 514 [M+H]+.
Etapa 11: Preparación de ácido 1-(frans-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un vial con 1-((3aR,5s,6aS)-5-(3-cloro-2-(trifluorometil)benciloxi)-octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3 -carboxilato de f-butilo (50,0 mg, 0,100 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 30,3 mg (68% de rendimiento) del ácido 1-(frans-5-((3-cloro-2-(trifluorometil)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, M eO H d) ó 8,15 (d, J = 4,0 Hz, 1H), 7,67 - 7,61 (m, 1H), 7,55 - 7,48 (m, 2H), 6,74 (d, J = 2,8 Hz, 1H), 4,64 (d, J = 2,0 Hz, 2H), 4,25 - 4,19 (m, 1H), 4,15 - 3,48 (m, 4H), 2,90 (ancho, 2H), 2,15 - 2,05 (m, 2H), 1,85 - 1,75 (m, 2H). CLEM (ESI, m/z): 458 [M+H]+.
Ejemplo 29: Ácido 1-(frans-5-(2-(1 H-pirazol-1-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-f-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-f-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y f-butanol (200 ml). La solución resultante se agitó durante la noche a 65°C y se inactivó con agua (200 ml), como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 1,3-di-f-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
E tap a 2: P rep a ra c ión de 1 H -p ira zo l-3 -ca rb o x ila to de í-bu tilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de 1,3-di-í-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeOH (80 ml), hidróxido de sodio (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1-(4-nitrofenilo)
Se cargó un matraz con N-(1 H-pirazol-3-il)metanosulfonamida (1,68 g, 9,99 mmol, 1,00 eq), DCM (20 ml) y trietilamina (3,03 g, 29,9 mmol, 3,00 eq). Se añadió cloroformiato de 4-nitrofenilo (2,42 g, 12,0 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida para proporcionar 3,33 g (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo) como un amarillo sólido.
Etapa 4: Preparación de 2-(1 H-pirazol-1 -il)fenol
Se cargó un vial con 2-yodofenol (2,00 g, 9,09 mmol, 1,00 eq), 1 H-pirazol (0,741 g, 10,9 mmol, 1,20 eq), carbonato de potasio (3,15 g, 22,8 mmol, 2,50 eq), yoduro de cobre (I) (433 mg, 2,27 mmol, 0,25 eq), dioxano (8 ml) y agua (8 ml) en atmósfera de N2. La solución resultante se agitó durante 5 h a 100°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 700 mg (48% de rendimiento) del 2-(1 H-pirazol-1 -il)fenol como un aceite amarillo claro. CLEM (ESI, m/z): 161 [M+H]+.
Etapa 5: Preparación de (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,6aS)- 5-oxo-hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo (3,00 g, 13,3 mmol, 1,00 eq), MeOH (20 ml) y borohidruro de sodio (0,760 g, 20,1 mmol, 1,50 eq). La solución resultante se agitó durante 5 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 15, Etapa 4, para proporcionar 3,01 g (bruto) del (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. Cl Em (ESI, m/z): 228 [M+H]+.
Etapa 6 : Preparación de (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (1,00 g, 4,40 mmol, 1,00 eq), DCM (20 ml) y trietilamina (1,34 g, 13,2 mmol, 3,00 eq). Se añadió gota a gota cloruro de metanosulfonilo (0,608 g, 5,28 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante 3 h a temperatura
ambiente y se concentró a presión reducida para proporcionar 1,34 g (bruto) del (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de t-butilo como un aceite amarillo. CLEM (ESI, m/z): 306 [M+H]+.
Etapa 7: Preparación de (3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un vial con 2-(1 H-pirazol-1 -il)fenol (160 mg, 1,00 mmol, 1,00 eq), (3aR,5r,6a,S)-5-(metilsulfoniloxi)-hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de t- butilo (305 mg, 1,00 mmol, 1,00 eq), carbonato de potasio (652 mg, 2,00 mmol, 2,00 eq) y DMF (15 ml). La solución resultante se agitó durante la noche a 100°C y se inactivó con agua (20 ml), como se describe en el Ejemplo 13, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 313 mg (85% de rendimiento) del (3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de t-butilo como un aceite amarillo claro. CLe M (ESI, m/z): 370 [M+H]+.
Etapa 8 : Preparación de (3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)octahidrociclopenta[c]pirrol
Se cargó un matraz con (3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de t-butilo (313 mg, 0,850 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5, proporcionando 228 mg (cuantitativo) de (3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)octahidrociclopenta[c]pirrol como un aceite amarillo claro. CLEM (ESI, m/z): 270 [M+H]+.
Etapa 9: Preparación de 1-((3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de t-butilo
Se cargó un vial con (3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)-octahidrociclopenta[c]pirrol (228 mg, 0,850 mmol, 1,00 eq), trietilamina (429 mg , 4,25 mmol, 5,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo) (426 mg, 1,28 mmol, 1,50 eq) y DCM (15 ml). La solución resultante se agitó durante 2 h a temperatura ambiente. La mezcla se inactivó con agua (10 ml), se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 295 mg (75% de rendimiento) del 1-((3aR,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de t-butilo como un aceite incoloro. CLEM (ESI, m/z):464 [M+H]+.
Etapa 10: Preparación de ácido 1 -(trans-5-(2-(1 H-pirazol-1 -il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un vial con 1-((3afl,5s,6aS)-5-(2-(1H-pirazol-1-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de t-butilo (166 mg, 0,360 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en solución saturada de NaHCÜ3 (10 ml) y se extrajo con DCM (3 x 20 ml). Las capas orgánicas se combinaron, se lavaron con salmuera (10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 61,2 mg (42% de rendimiento) del ácido 1 -(trans-5-(2-(1 H-pirazol-1 -il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H: (300 MHz, MeÜH-ó^) ó 8,25 (d, J = 2,7 Hz, 1H), 8,14 (d, J = 2,1 Hz, 1H), 7,71 (d, J = 1,8 Hz, 1 H), 7,57 - 7,54 (m, 1H), 7,41 - 7,33 (m, 1H), 7,24 - 7,19 (m, 1H), 7,12 - 7,05 (m, 1H), 6,79 (d, J = 2,7 Hz, 1 H), 6,50 (t, J = 2,1 Hz, 1H), 5,13 - 5,08 (m, 1H), 4,35 - 3,41 (m, 4H), 2,82 (ancho, 2H), 2,21 - 2,11 (m, 2H), 2,01 - 1,89 (m, 2H). CLEM (ESI, m/z): 430 [M+Na]+.
Ejemplo 30: Acido 1-(frans-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de di-t-butilo
Se cargó un matraz con ácido 1 H-pirazol-3-carboxílico (20,0 g, 179 mmol, 1,00 eq), dicarbonato de di-t-butilo (158 g, 714 mmol, 4,00 eq), DMAP (4,35 g, 35,7 mmol, 0,20 eq), trietilamina (54,1 g, 536 mmol, 3,00 eq) y t-butanol (200 ml). La solución resultante se agitó durante la noche a 65°C y se inactivó con agua (200 ml) como se describe en el Ejemplo 1, Etapa 1, para proporcionar 20,0 g (bruto) del 1H-pirazol-1,3-dicarboxilato de di-t-butilo como un aceite amarillo. CLEM (ESI, m/z): 169 [M+H-Boc]+.
Etapa 2: Preparación de 1 H-pirazol-3-carboxilato de t-butilo
Se cargó un matraz con 1H-pirazol-1,3-dicarboxilato de di-t-butilo (20,0 g, 74,6 mmol, 1,00 eq), MeÜH (80 ml), hidróxido de sodio (10,0 g, 250 mmol, 3,35 eq) y agua (40 ml). La solución resultante se agitó durante una noche a temperatura ambiente y se inactivó con agua (40 ml) como se describe en el Ejemplo 1, Etapa 2, para proporcionar 6,70 g (bruto) del 1H-pirazol-3-carboxilato de t-butilo como un sólido amarillo. CLEM (ESI, m/z): 169 [M+H]+.
Etapa 3: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1-(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de t-butilo (1,68 g, 9,99 mmol, 1,00 eq), DCM (20 ml) y trietilamina (3,03 g, 29,9 mmol, 3,00 eq). Se añadió cloroformiato de 4-nitrofenilo (2,42 g, 12,0 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 4, Etapa 3, para proporcionar 3,33 g (bruto) del 1 H-pirazol-1,3-dicarboxilato de 3-(t-butilo) y 1-(4-nitrofenilo) como un sólido amarillo.
E tap a 4: P rep a ra c ión de (3 a fl,5 r,6 a S )-5 -h id ro x ih e x a h id ro c ic lo p e n ta [c ]p irro l-2 (1 H )-ca rb o x ila to de f-bu tilo
Se cargó un matraz con (3afl,6aS)-5-oxohexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo (3,00 g, 13,3 mmol, 1,00 eq), MeOH (20 ml) y borohidruro de sodio (0,760 g, 20,1 mmol, 1,50 eq). La solución resultante se agitó durante 5 h a temperatura ambiente y se concentró a presión reducida. La mezcla resultante se diluyó con agua (40 ml), se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 15, Etapa 4, para proporcionar 3,01 g (bruto) del (3afl,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo en forma de un sólido blanco. Cl Em (ESI, m/z): 228 [M+H]+.
Etapa 5: Preparación de (3afi,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo
Se cargó un matraz con (3afl,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo (1,00 g, 4,40 mmol, 1,00 eq), DCM (20 ml) y trietilamina (1,34 g, 13,2 mmol, 3,00 eq). Se añadió gota a gota cloruro de metanosulfonilo (0,608 g, 5,28 mmol, 1,20 eq) a 0°C. La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 4, Etapa 3, para proporcionar 1,34 g (bruto) del (3afi,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 306 [M+H]+.
Etapa 6: Preparación de 4-(3-bromofenil)pirimidina
Se cargó un vial con N-(diformamidometil)formamida (1,45 g, 9,99 mmol, 1,00 eq), 1-(3-bromofenil)etan-1-ona (4,00 g, 20,10 mmol, 2,00 eq), ácido 4-metilbencenosulfónico (172 mg, 1,00 mmol, 0,05 eq) y DMF (10 ml). La solución resultante se agitó durante 2 h a 160°C y se inactivó con agua (10 ml). La mezcla se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 1,05 g (45% de rendimiento) de la 4-(3-bromofenil)pirimidina como un sólido blanco. CLEM (ESI, m/z): 235 [M+H]+.
Etapa 7: Preparación de 3-(pirimidin-4-il)fenol
Se cargó un vial con 4-(3-bromofenil)pirimidina (940 mg, 4,00 mmol, 1,00 eq), 2-di-f-butilfosfino-2',4',6'-tri-i-propil-1,1 '-bifenilo (339 mg, 0,800 mmol, 0,20 eq), hidróxido de potasio (896 mg, 16,0 mmol, 4,00 eq), tris(dibencilidenacetona)dipaladio (414 mg, 0,450 mmol, 0,10 eq), dioxano (10 ml) y agua (10 ml) en atmósfera de N2. La solución resultante se agitó durante una noche a 80°C y se inactivó con agua (10 ml). La mezcla se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 460 mg (67% de rendimiento) de 3-(pirimidin-4-il)fenol como un sólido amarillo. CLEM (ESI, m/z): 173 [M+H]+.
Etapa 8 : Preparación de (3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con 3-(pirimidin-4-il)fenol (172 mg, 1,00 mmol, 1,00 eq), (3aR,5r,6aS)-5-((metilsulfonil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (305 mg, 1,00 mmol, 1,00 eq), carbonato de cesio (978 mg, 3,00 mmol, 3,00 eq) y DMF (15 ml). La solución resultante se agitó durante la noche a 100°C y se inactivó con agua (40 ml) como se describe en el Ejemplo 13, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 263 mg (69% de rendimiento) del (3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo como un aceite incoloro. CLEM (ESI, m/z): 382 [M+H]+.
Etapa 9: Preparación de (3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol
Se cargó un matraz con (3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (263 mg, 0,690 mmol, 1,00 eq), TFA (2 ml) y DCM (10 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 5, para proporcionar 267 mg (cuantitativo) del (3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol como un aceite amarillo claro. CLEM (ESI, m/z): 282 [M+H]+.
Etapa 10: Preparación de 1-((3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilatode í-butilo
Se cargó un vial con (3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol (267 mg, 0,950 mmol, 1,00 eq), trietilamina (576 mg, 5,70 mmol, 6,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo) (476 mg, 1,43 mmol, 1,50 eq) y DCM (15 ml). La solución resultante se agitó durante la noche a temperatura ambiente. La mezcla se inactivó con agua (10 ml), se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como descrito en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 302 mg (67% de rendimiento) del 1-((3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite incoloro. CLEM (ESI, m/z): 476 [M+H]+.
Etapa 11: Preparación de ácido 1-(írans-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico
Se cargó un vial con 1-((3aR,5s,6aS)-5-(3-(pirimidin-4-il)fenoxi)-octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo (238 mg, 0,500 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 131,3 mg (63% de rendimiento) del ácido 1-(írans-5-(3-(pirimidin-4-il)fenoxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H: (400 MHz, MeOH-aL) 59,16 (s, 1H), 8,78 - 8,72 (m, 1H), 8,18 - 8,12 (d, J = 2,8 Hz, 1H), 8,01 - 7,91 (m, 1H), 7,72 - 7,65
(m, 2H), 7,44 - 7,37 (m, 1H), 7,12 - 7,08 (m, 1H), 6,78 - 6,72 (d, J = 2,4 Hz, 1H), 5,12 - 5,08 (m, 1H), 4,28 - 3,61 (m, 4H), 2,98 (ancho, 2H), 2,25 - 2,11 (m, 2H), 2,09 - 1,95 (m, 2H). CLEM (ESI, m/z): 420 [M+H]+.
Ejemplo 31: Ácido 1-(2-(3-(pirimidin-5-iloxi)bencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 3-(pirimidin-5-iloxi)benzaldehído
Se cargó un vial con 5-bromopirimidina (500 mg, 3,14 mmol, 1,00 eq), yoduro de cobre (I) (30,0 mg, 0,160 mmol, 0,05 eq), ácido picolínico (38,9 mg, 0,320 mmol, 0,10 eq), 3-hidroxibenzaldehído (463 mg, 3,79 mmol, 1,20 eq), fosfato de potasio tribásico (1,30 g, 6,13 mmol, 2,00 eq) y Dm So (15 ml). La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (20 ml). La solución resultante se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 130 mg (21% de rendimiento) del 3-(pirimidin-5-iloxi)benzaldehído como un aceite amarillo. CLEM (ESI, m/z): 201 [M+H]+.
Etapa 2: Preparación de 8-(3-(f-butoxicarbonil)-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de f-butilo
Se cargó un matraz con 1 H-pirazol-3-carboxilato de f-butilo (3,15 g, 18,8 mmol, 1,50 eq), DCM (20 ml), cloroformiato de 4-nitrofenilo (3,80 g, 18,8 mmol, 1,50 eq) y DIPEA (4,83 g, 37,5 mmol, 3,00 eq). La solución resultante se agitó durante 3 h a temperatura ambiente. Se añadió 2,8-diazaespiro[4.5]decano-2-carboxilato de f-butilo (3,00 g, 12,5 mmol, 1,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (20 ml). La mezcla se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 25 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 4,00 g (74% de rendimiento) del 8-(3-(fbutoxicarbonil)-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de f-butilo como un sólido amarillo claro. CLEM (ESI, m/z): 435 [M+H]+.
Etapa 3: Preparación de ácido 1-(2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 8-(3-(f-butoxicarbonil)-1H-pirazol-1-carbonil)-2,8-diazaespiro[4.5]decano-2-carboxilato de f-butilo (380 mg, 0,870 mmol, 1,00 eq), DCM (10 ml) y TFA (3 ml), como se describe en el Ejemplo 1, Etapa 5. La solución resultante se agitó durante la noche a temperatura ambiente y se concentró a presión reducida para proporcionar 242 mg (cuantitativo) del ácido 1-(2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico como un aceite amarillo. CLEM (ESI, m/z): 279 [M+H]+.
Etapa 4: Preparación de ácido 1-(2-(3-(pirimidin-5-iloxi)bencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxílico
Se cargó un matraz con 3-(pirimidin-5-iloxi)benzaldehído (130 mg, 0,650 mmol, 1,00 eq), ácido 1 -(2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico (217 mg, 0,780 mmol, 1,20 eq), trietilamina (196 mg, 1,94 mmol, 3,00 eq) y DCE (10 ml). La mezcla se agitó durante 0,5 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (413 mg, 1,95 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con una solución saturada de NaHCO3 (20 ml), como se describe en el Ejemplo 2, Etapa 3, para proporcionar el producto bruto. El producto bruto (400 mg) se purificó por HPLC preparativa para proporcionar 30,7 mg (10% de rendimiento) del ácido 1-(2-(3-(pirimidin-5-iloxi)bencil)-2,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. Rm N 1H (300 MHz, MeOH-o4) ó 8,90 (s, 1H), 8,54 (d, J = 6,0 Hz, 2H), 8,03 (d, J = 2,7 Hz, 1H), 7,50 (m, 1 H), 7,39 (d, J = 7,5 Hz, 1 H), 7,34 (s, 1H), 7,21 - 7,18 (m, 1H), 6,72 (d, J = 2,7 Hz, 1 H), 4,26 (s, 2H), 3,83 - 3,65 (m, 4H), 3,33 - 3,28 (m, 2H), 3,15 (s, 2H), 2,01 (t, J = 7,2 Hz, 2H), 1,82 - 1,72 (m, 4H). CLEM (ESI, m/z): 463 [M+H]+.
Ejemplo 32: Ácido 1 -(1 -(3-(1 H-pirazol-1 -il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(f-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1 H-pirazol-3-carboxilato de f-butilo (70,0 mg, 0,420 mmol, 1,00 eq), DCM (10 ml), trietilamina (126 mg, 1,25 mmol, 3,00 eq). Se añadió carbonocloridato de 4-nitrofenilo (92,1 mg, 0,460 mmol, 1,10 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 4, Etapa 3, para proporcionar 137 mg (bruto) del 1H-pirazol-1,3-dicarboxilato de 3-(f-butilo) y 1-(4-nitrofenilo) como un aceite amarillo. CLEM (ESI, m/z): 334 [M+H]+.
Etapa 2: Preparación de 1-(3-bromo-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo
Se cargó un matraz con 3-bromo-5-(trifluorometil)benzaldehído (0,504 g, 1,99 mmol, 1,00 eq), 1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo (0,576 g, 2,40 mmol, 1,20 eq) y DCE (20 ml). La mezcla se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (1,27 g, 5,99 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,790 g (83% de rendimiento) del 1-(3-bromo-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carboxilato de f-butilo como un aceite amarillo. CLe M (ESI, m/z): 477 [M+H]+.
Etapa 3: Preparación de 1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carboxilato de í-butilo
Se cargó un tubo de microondas con 1-(3-bromo-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carboxilato de í-butilo (0,600 g, 1,26 mmol, 1,00 eq), 1 H-pirazol (0,128 g, 1,88 mmol, 1,50 eq), yoduro de cobre (I) (0,0479 g, 0,250 mmol, 0,20 eq), carbonato de cesio (1,23 g, 3,78 mmol, 3,00 eq), 1,4,7,10,13,16-hexaoxaciclooctadecano (0,0333 g, 0,130 mmol, 0,10 eq) y sulfóxido de dimetilo (10 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante 6 h a 120°C en microondas y se inactivó con agua (20 ml). La solución resultante se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,100 g (17% de rendimiento) del 1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 465 [M+H]+.
Etapa 4: Preparación de 1-(3-(1 H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano
Se cargó un matraz con 1-[[3-(1H-pirazol-1-il)-5-(trifluorometil)fenil]metil]-1,8-diazaespiro[4.5]decano-8-carboxilato de í-butilo (100 mg , 0,220 mmol, 1,00 eq), DCM (15 ml) y TfA (1 ml). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida para proporcionar 78,4 mg (cuantitativo) del 1 -(3-(1 H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano como un aceite amarillo. CLEm (ESI, m/z): 365 [M+H]+.
Etapa 5: Preparación de 1-(1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con 1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano (78,4 mg, 0,220 mmol, 1,00 eq), 1 H-pirazol-1,3-dicarboxilato de 3-(í-butilo) y 1 -(4-nitrofenilo) (108 mg, 0,320 mmol, 1,50 eq), trietilamina (65,3 mg, 0,650 mmol, 3,00 eq) y DCM (10 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (15 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 96,0 mg (80% de rendimiento) del 1-(1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 559 [M+H]+.
Etapa 6 : Preparación de ácido 1-(1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1-(1-(3-(1H-pirazol-1-il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1H-pirazol-3-carboxilato de í-butilo (96,0 mg, 0,170 mmol, 1,00 eq), DCM (7 ml) y TFA (1 ml). La solución resultante se
agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en DCM (15 ml). El valor de pH de la solución se ajustó a 8 con solución saturada de NaHCO3. La mezcla se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 15 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 1, Etapa 5. El producto bruto (230 mg) se purificó por HPLC preparativa para proporcionar 46,1 mg (53% de rendimiento) del ácido 1 -(1 -(3-(1 H-pirazol-1 -il)-5-(trifluorometil)bencil)-1,8-diazaespiro[4.5]decano-8-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, MeOH-cfc) 58,41 (d, J = 2,4 Hz, 1H), 8,18 (s, 1H), 8,13 - 8,11 (m, 2H), 7,79 - 7,74 (m, 2H), 6,82 (d, J = 2,4 Hz, 1H), 6,60 (s, 1H), 4,63 (ancho, 2H), 4,19 (s, 2H), 3,33 - 3,20 (m, 2H), 3,10 - 3,08 (m, 2H), 2,24 - 2,15 (m, 4H), 2,04 - 1,99 (m, 2H), 1,79 - 1,76 (m, 2H). CLEM (ESI, m/z): 503 [M+H]+.
Ejemplo 33: Ácido 4-cloro-1-((2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 4-cloro-1 H-pirazol-3-carboxilato de f-butilo
Se cargó un matraz con ácido 4-cloro-1H-pirazol-3-carboxílico (1,60 g, 10,9 mmol, 1,00 eq), f-butanol (100 ml), dicarbonato de di-f-butilo (9,50 g, 43,6 mmol, 4,00 eq) eq), trietilamina (3,30 g, 32,7 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 90°C y se inactivó con agua (100 ml), como se describe en el Ejemplo 1, Etapa 1. El residuo se cromatografió en una columna de gel de sílice para proporcionar 800 mg (36% de rendimiento) del 4-cloro-1 H-pirazol-3-carboxilato de f-butilo como un sólido amarillo. CLEM (ESI, m/z): 405 [2M+H]+.
Etapa 2: Preparación de (2S)-2-metil-4-(metilamino)piperidina-1-carboxilato de f-butilo
Se cargó un matraz con (2S)-2-metil-4-oxopiperidina-1 -carboxilato de f-butilo (300 mg, 1,41 mmol, 1,00 eq), metilamina (5,00 ml, 2,82 mmol, 2,00 eq, 2 M en THF), DIPEA (545 mg, 4,23 mmol, 3,00 eq) y tetraisopropóxido de titanio (4 ml). La mezcla se agitó durante 1 h a temperatura ambiente. Se añadió tetrahidroborato de sodio (54,0 mg, 1,41 mmol, 1,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (30 ml). La mezcla se extrajo con DCM (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (3 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 250 mg (78% de rendimiento) del (2S)-2-metil-4-(metilamino)piperidina-4-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 229 [M+H]+.
Etapa 3: Preparación de 2-(pirrolidin-1 -il)-4-(trifluorometil)benzaldehído
Se cargó un matraz con 2-fluoro-4-(trifluorometil)benzaldehído (4,00 g, 20,8 mmol, 1,00 eq), ACN (15 ml), pirrolidina (2,21 g, 31,0 mmol, 1,50 eq) y bicarbonato de sodio (4,37 g , 52,0 mmol, 2,50 eq). La solución resultante se agitó durante una noche a 80°C y se inactivó con agua (30 ml). La solución resultante se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (3 x 30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 2,20 g (43% de rendimiento) del 2-(pirrolidin-1-il)-4-(trifluorometil)benzaldehído como un aceite amarillo. CLEM (ESI, m/z): 244 [M+H]+.
Etapa 4: Preparación de (2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo
Se cargó un matraz con 2-(pirrolidin-1-il)-4-(trifluorometil)benzaldehído (200 mg, 0,820 mmol, 1,00 eq), DCE (10 ml), (2S)-2-metil-4-(metilamino)piperidina-1-carboxilato de í-butilo (225 mg, 0,990 mmol, 1,20 eq), trietilamina (249 mg, 2,46 mmol, 3,00 eq). La mezcla se agitó durante 1 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (523 mg, 2,46 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 2, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 300 mg (80% de rendimiento) del (2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidin-1-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 456 [M+H]+.
Etapa 5: Preparación de (2S)-N,2-dimetil-N-(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)piperidin-4-amina
Se cargó un matraz con (2S)-2-metil-4-(metil(2-(pirrolidin-1 -il)-4-(trifluorometil)bencil)amino)piperidina-1 -carboxilato de í-butilo (300 mg, 0,660 mmol, 1,00 eq), 1,4- dioxano (8 ml) y ácido clorhídrico concentrado (2 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en una solución de NaOH 1 M (30 ml) y se extrajo con DCM (3 x 50 ml). Las capas orgánicas se combinaron, se lavaron con salmuera (10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 2, Etapa 4, para proporcionar 200 mg (85% de rendimiento) del (2S)-N,2-dimetil-N-(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)piperidin-4-amina como un aceite amarillo. CLEM (ESI, m/z): 356 [M+H]+.
Etapa 6 : Preparación de cloruro de (2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonilo
Se cargó un matraz con (2S)-N,2-dimetil-N-(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)piperidin-4-amina (200 mg, 0,560 mmol, 1,00 eq), DCM (5 ml) y trifosgeno (84,0 mg, 0,280 mmol, 0,50 eq). Se añadió DIPEA (218 mg, 1,68 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 3, para proporcionar 234 mg (bruto) del cloruro de (2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidin-1-carbonilo como un aceite amarillo. CLEM (ESI, m/z): 418 [M+H]+.
Etapa 7: Preparación de 4-cloro-1-((2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxilato de í-butilo
Se cargó un matraz con cloruro de (2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonilo (150 mg, 0,360 mmol, 1,00 eq), THF (5 ml), 4-cloro-1 H-pirazol-3-carboxilato de í-butilo (87,0 mg, 0,430 mmol, 1,20 eq), DMAP (9,00 mg, 0,0700 mmol, 0,20 eq), DIPEA (201 mg, 1,08 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (10 ml), se extrajo con DCM (3 x 20 ml) y las capas orgánicas se
combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 1, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 100 mg (48% de rendimiento) del 4-cloro-1-((2S)-2-metil-4-(metil(2-(pirrolidin-1 -il)-4-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 584 [M+H]+.
Etapa 8 : Preparación de ácido 4-cloro-1-((2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 4-cloro-1-((2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1 H-pirazol-3-carboxilato (100 mg, 0,170 mmol, 1,00 eq), DCM (3 ml) y TFA (1 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en DCM (20 ml). El valor de pH de la solución se ajustó a 8 con solución saturada de NaHCO3. La mezcla se extrajo con DCM (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 1, Etapa 5. El producto bruto (150 mg) se purificó por HPLC preparativa para proporcionar 8,70 mg (10% de rendimiento) del ácido 4-cloro-1 -((2S)-2-metil-4-(metil(2-(pirrolidin-1-il)-4-(trifluorometil)bencil)amino)piperidin-1-carbonil)-1 H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, MeOH-o4) 58,21 (s, 1H), 7,68 (d, J = 8,0 Hz, 1H), 7,52 (s, 1 H), 7,40 (d, J = 7,6 Hz, 1H), 5,11 (ancho, 1H), 4,58 - 4,43 (m, 3H), 4,27 - 3,41 (m, 2H), 3,36 - 3,19 (m, 4H), 2,73 - 2,71 (m, 3H), 2,20 - 1,89 (m, 8H), 1,45 - 1,35 (m, 3H). CLEM (ESI, m/z): 528 [M+H]+.
Ejemplo 34: Ácido 1 -(frans-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de (3-(ciclopent-1-en-1-il)fenil)metanol
Se cargó un vial con 2-(ciclopent-1-en-1-il)-4,4,5,5-tetrametil-1,3,2-dioxaborolano (747 mg, 3,85 mmol, 1,50 eq), (3 yodofenil)MeOH (600 mg, 2,56 mmol, 1,00 eq), dicloruro de 1,1'-bis(difenilfosfino)ferrocenopaladio (365 mg, 0,500 mmol, 0,20 eq), carbonato de potasio (704 mg, 5,09 mmol, 2,00 eq), éter dimetílico del etilenglicol (16 ml) y agua (4 ml). La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida, como se describe en el Ejemplo 23, Etapa 6. El residuo se cromatografió en una columna de gel de sílice para proporcionar 350 mg (78% de rendimiento) del (3-(ciclopent-1 -en-1-il)fenil)MeOH como un aceite amarillo. CLEM (ESI, m/z): 175 [M+H]+.
Etapa 2: Preparación de (3-ciclopentilfenil)metanol
Se cargó un vial con (3-(ciclopent-1 -en-1 -il)fenil)metanol (0,525 g, 3,01 mmol, 1,00 eq), 4-metilbencenosulfonhidrazida (1,12 g, 6,02 mmol, 2,00 eq), acetato de sodio anhidro (0,738 g, 9,00 mmol, 3,00 eq), dioxano (8 ml) y agua (2 ml) en atmósfera de N2. La solución resultante se agitó durante la noche a 90°C y se inactivó con agua (20 ml). La mezcla se extrajo con EtOAc (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna
de gel de sílice para proporcionar 0,130 g (24% de rendimiento) del (3-ciclopentilfenil)metanol como un aceite amarillo.
Etapa 3: Preparación de 1-(bromometil)-3-ciclopentilbenceno
Se cargó un vial con (3-ciclopentilfenil)metanol (0,130 g, 0,740 mmol, 1,00 eq) y DCM (15 ml). Luego se añadió gota a gota tribromofosfina (1,00 g, 3,69 mmol, 5,00 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 27, Etapa 7. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,095 g (54% de rendimiento) del 1 -(bromometil)-3-ciclopentilbenceno como un aceite amarillo.
Etapa 4: Preparación de (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,6aS)- 5-oxo-hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo (3,00 g, 13,3 mmol, 1,00 eq), MeOH (20 ml) y borohidruro de sodio (0,760 g, 20,1 mmol, 1,50 eq). La solución resultante se agitó durante 5 h a temperatura ambiente y se concentró a presión reducida. La mezcla resultante se diluyó con agua (40 ml), se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 15, Etapa 4, para proporcionar 3,01 g (bruto) del (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo en forma de un sólido blanco. Cl Em (ESI, m/z): 228 [M+H]+.
Etapa 5: Preparación de (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (2,27 g, 9,99 mmol, 1,00 eq), ácido 4-nitrobenzoico (6,68 g, 40,0 mmol, 4,00 eq), trifenilfosfina (10,5 g, 40,0 mmol, 4,00 eq) y THF (30 ml). Se añadió gota a gota azodicarboxilato de dietilo (6,96 g, 40,0 mmol, 4,00 eq) a 0°C. La solución resultante se agitó durante la noche a temperatura ambiente en atmósfera de nitrógeno y se inactivó con agua (50 ml), como se describe en el Ejemplo 15, Etapa 5. El residuo se cromatografió en una columna de gel de sílice para proporcionar 2,36 g (62% de rendimiento) del (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. c Le M (ESl, m/z): 377 [M+H]+.
Etapa 6 : Preparación de (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (2,36 g, 6,27 mmol, 1,00 eq), MeOH (30 ml), carbonato de potasio (2,60 g, 18,8 mmol, 3,00 eq) y agua (5 ml). La solución resultante se agitó durante 3 h a temperatura ambiente y se concentró a presión reducida. Luego, la reacción se diluyó con agua (30 ml), se extrajo con EtOAc (3 x 50 ml) y las capas orgánicas se combinaron, se lavaron con agua (3 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 3, Etapa 3, para proporcionar 1,31 g (bruto) del (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo en forma de un sólido blanco. CLEM (ESl, m/z): 228 [M+H]+.
Etapa 7: Preparación de (3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (135 mg, 0,590 mmol, 1,50 eq) y DMF (15 ml). Luego se añadió hidruro de sodio (60% en aceite, 32,0 mg, 0,800 mmol, 2,00 eq) a 0°C. La solución resultante se agitó durante 0,5 h a temperatura ambiente, seguido de la adición de 1-(bromometil)-3-ciclopentilbenceno (95 mg, 0,400 mmol, 1,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (20 ml) como se describe en el Ejemplo 15, Etapa 7. El residuo se cromatografió en una columna de gel de sílice para proporcionar 135 mg (88% de rendimiento) del (3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo como un aceite amarillo. CLEM (ESI, m/z): 386 [M+H]+.
Etapa 8 : Preparación de (3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol
Se cargó un matraz con (3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (135 mg, 0,350 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5, para proporcionar 100 mg (cuantitativo) del (3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol como un aceite amarillo. CLEM (ESI, m/z): 286 [M+H]+.
Etapa 9: Preparación de 1 -((3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol--carboxilato de í-butilo
Se cargó un vial con (3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol (100 mg, 0,350 mmol, 1,00 eq), trietilamina (212 mg, 2,10 mmol, 6,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) (175 mg, 0,525 mmol, 1,50 eq) y DCM (15 ml). La solución resultante se agitó durante la noche a temperatura ambiente. La mezcla se inactivó con agua (10 ml), se extrajo con DCM (3 x 20 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (2 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 144 mg (86% de rendimiento) del 1-((3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol-2- carbonil)-1H-pirazol-3-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 480 [M+H]
Etapa 10: Preparación de ácido 1-(írans-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3- carboxílico
Se cargó un vial con 1-((3aR,5s,6aS)-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo (144 mg, 0,300 mmol, 1,00 eq), TFA (2 ml) y DCM (5 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se disolvió en solución saturada de
NaHCÜ3 (10 ml) y se extrajo con DCM (3 x 20 ml). Las capas orgánicas se combinaron, se lavaron con salmuera (10 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida como se describe en el Ejemplo 1, Etapa 5. El producto bruto se purificó por HPLC preparativa para proporcionar 47,6 mg (37% rendimiento) del ácido 1-(fr'ans-5-((3-ciclopentilbencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H: (400 MHz, MeOH-d4) 58,16 (s, 1H), 7,23 - 7,18 (m, 2H), 7,16 - 7,07 (m, 2H), 6,75 (d, J = 2,8 Hz, 1 H), 4,41 (s, 2H), 4,25 - 4,15 (m, 1H), 4,11 - 3,48 (m, 4H), 3,01 - 2,91 (m, 1H), 2,88 (ancho, 2H), 2,15 - 1,98 (m, 4H), 1,85 - 1,51 (m, 8H). CLEM (ESI, m/z): 424 [M+H]+.
Ejemplo 35: Ácido 4-(4-((5-(3-carbamoil-1 H-pirazol-1-carbonil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-il)metil)-3-(trifluorometil)fenil)tetrahidro-2H-pirano-4-carboxílico
Etapa 1: Preparación de 3-carbamoil-1 H-pirazol-1-carboxilato de 4-nitrofenilo
Se cargó un matraz con 1 H-pirazol-3-carboxamida (64,0 mg, 0,580 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (129 mg, 0,640 mmol, 1,10 eq), trietilamina (176 mg, 1,74 mmol, 3,00 eq) y DCM (10 ml). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida para proporcionar 160 mg (bruto) de 3-carbamoil-1H-pirazol-1-carboxilato de 4-nitrofenilo como un aceite amarillo. CLEM (ESI, m/z): 277 [M+H]+.
Etapa 2: Preparación de ((5-(terc-butoxicarbonil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-il)metil)trifluoroborato de potasio
Se cargó un matraz con octahidropirrolo[3,4-c]pirrol-2-carboxilato de terc-butilo (1,20 g, 5,65 mmol, 1,00 eq), (bromometil)trifluoroboranuida de potasio (1,13 g, 5,63 mmol, 1,00 eq) y THF (15 ml) en atmósfera de nitrógeno. La mezcla se agitó durante la noche a 80°C y se concentró a presión reducida. Se añadieron carbonato de potasio (0,781 g, 5,65 mmol, 1,00 eq) y acetona (10 ml). La solución resultante se agitó durante 2 h a temperatura ambiente, se disolvió en acetona (2 x 200 ml) y se filtró. El filtrado se concentró a presión reducida para proporcionar 1,40 g (75% de rendimiento) del ((5-(terc-butoxicarbonil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-il)metil)trifluoroborato de potasio como un amarillo sólido. CLEM (ESI, m/z): 293 [M-K]-.
Etapa 3: Preparación de 2-(4-cloro-3-(trifluorometil)fenil)acetato de f-butilo
Se cargó un matraz con ácido 2-(4-cloro-3-(trifluorometil)fenil)acético (1,00 g, 4,19 mmol, 1,00 eq), f-butanol (25 ml), trietilamina (1,27 g, 12,6 mmol, 3,00 eq) y dicarbonato de di-f-butilo (4,58 g, 20,9 mmol, 5,00 eq). La solución resultante se agitó durante la noche a 90°C y luego se inactivó con agua (25 ml), como se describe en el Ejemplo 1, Etapa 1. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,810 g (66% de rendimiento) del 2-(4-cloro-3-(trifluorometil)fenil)acetato de f-butilo como un aceite amarillo. RMN 1H (300 MHz, cloroformo-a) 57,60 (s, 1H), 7,48 - 7,40 (m, 2H), 3,56 (s, 2H), 1,45 (s, 9H).
Etapa 4: Preparación de 4-(4-cloro-3-(trifluorometil)fenil)tetrahidro-2H-piran-4-carboxilato de t-butilo
Se cargó un matraz con 2-(4-cloro-3-(trifluorometil)fenil)acetato de í-butilo (500 mg, 1,70 mmol, 1,00 eq) y DMF (10 ml). Se añadió hidruro de sodio (340 mg, 8,50 mmol, 5,00 equivalentes, 60% en aceite mineral) a 02C. Se añadió 1-bromo-2-(2-bromoetoxi)etano (782 mg, 3,37 mmol, 2,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (10 ml). La mezcla resultante se extrajo con EtOAc (3 x 15 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 190 mg (31% de rendimiento) de 4-(4-cloro-3-(trifluorometil)fenil)tetrahidro-2H-piran-4-carboxilato de t-butilo como un aceite amarillo. RMN 1H (300 MHz, cloroformo-d) 57,69 (s, 1H), 7,48 (ancho, 2H), 3,97 - 3,93 (m, 2H), 3,61 - 3,55 (m, 2H), 2,48 - 2,44 (m, 2H), 1,92 - 1,85 (m, 2H), 1,39 (s, 9H).
Etapa 5: Preparación de 5-(4-(4-(t-butoxicarbonil)tetrahidro-2H-piran-4-il)-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1H)-carboxilato de t-butilo
Se cargó un matraz 4-(4-cloro-3-(trifluorometil)fenil)tetrahidro-2H-piran-4-carboxilato de t-butilo (364 mg, 1,00 mmol, 1,00 eq), ((5-(t-butoxicarbonil)hexah¡drop¡rrolo[3,4-c]p¡rrol-2(1 H)-il)metil)trifluoroborato de potasio (398 mg, 1,20 mmol, 1,20 eq), acetato de paladio (22,4 mg, 0,100 mmol, 0,10 eq), 2-(diciclohexilfosfino)-2',4',6'-triisopropilbifenilo (95,0 mg, 0,200 mmol, 0,20 eq), carbonato de cesio (978 mg, 3,00 mmol, 3,00 eq), 1,4-dioxano (10 ml) y agua (2 ml) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 90°C y luego se inactivó con agua (10 ml). La mezcla resultante se extrajo con DCM (3 x 15 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 250 mg (45% de rendimiento) del 5-(4-(4-(tbutoxicarbonil)tetrahidro-2H-piran-4-il)-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carboxilato de t-butilo como un aceite amarillo. Cl Em (ESI, m/z): 555 [M+H]+.
Etapa 6 : Preparación de ácido 4-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)tetrahidro-2H-piran-4-carboxílico
Se cargó un matraz con 5-(4-(4-(t-butoxicarbonil)tetrahidro-2H-piran-4-il)-2-(trifluorometil)bencil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-carboxilato de t-butilo (250 mg, 0,450 mmol, 1,00 eq), ácido clorhídrico concentrado (4 ml) y 1,4-dioxano (10 ml). La solución resultante se agitó durante una noche a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 2, Etapa 4, para proporcionar 180 mg (cuantitativo) del ácido 4-(4-((hexahidropirrolo[3,4-c]pirrol-2(1 H)-il)metil)-3-(trifluorometil)fenil)tetrahidro-2H-pirano-4-carboxílico como un aceite amarillo. CLEM (ESI, m/z): 399 [M+H]+.
Etapa 7: Preparación de ácido 4-(4-((5-(3-carbamoil-1H-pirazol-1-carbonil)hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)tetrahidro-2H-pirano-4-carboxílico
Se cargó un matraz con ácido 4-(4-((hexahidropirrolo[3,4-c]pirrol-2(1H)-il)metil)-3-(trifluorometil)fenil)tetrahidro-2H-pirano-4-carboxílico (180 mg, 0,450 mmol, 1,00 eq), 3-carbamoil-1H-pirazol-1-carboxilato de 4-nitrofenilo (138 mg, 0,500 mmol, 1,10 eq), trietilamina (137 mg, 1,35 mmol, 3,00 eq) y DCM (10 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y luego se inactivó con agua (10 ml), como se describe en el Ejemplo 4, Etapa 3. El producto bruto (300 mg) se purificó por HPLC preparativa para proporcionar 126,1 mg (52% de rendimiento) del ácido 4-(4-((5-(3-carbamoil-1 H-pirazol-1-carbonil)hexahidropirrolo[3,4-c]pirrol-2(1 H)-il)metil)-3-(trifluorometil)fenil)tetrahidro-2H-pirano-4-carboxílico como un sólido blanco. RMN 1H (300 MHz, metanol-a^) ó 8,30 (d, J = 2,7 Hz, 1H), 7,77 - 7,72 (m, 2H), 7,67 - 7,65 (m, 1 H), 6,88 (d, J = 2,7 Hz, 1 H), 4,23 - 3,83 (m, 8H), 3,65 - 3,56 (m, 2H), 2,98 (ancho, 2H), 2,74 - 2,67 (m, 4H), 2,55 - 2,51 (m, 2H), 1,94 - 1,87 (m, 2H). CLEM (ESI, m/z) : 536 [M+H]+.
Ejemplo 36: 1 -(4-((2-Hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxamida
Etapa 1: Preparación de 4-((3-(trifluorometil)bencil)amino)piperidina-1-carboxilato de f-butilo
Se cargó un matraz con 3-(trifluorometil)benzaldehído (522 mg, 3,00 mmol, 1,00 eq), 4-aminopiperidina-1-carboxilato de f-butilo (1,20 g, 6,00 mmol, 2,00 eq) y MeOH (15 ml). La mezcla se agitó durante 4 h a 60°C. Se añadió borohidruro de sodio (456 mg, 12,0 mmol, 4,00 eq). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (20 ml), como se describe en el Ejemplo 15, Etapa 4. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,800 g (74% de rendimiento) del 4-((3-(trifluorometil)bencil)amino)piperidina-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 359 [M+H]+.
Etapa 2: Preparación de 4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1-carboxilato de f-butilo
Se cargó un matraz con 4-((3-(trifluorometil)bencil)amino)piperidina-1-carboxilato de f-butilo (358 mg, 1,00 mmol, 1,00 eq), 2,2-dimetiloxirano (360 mg, 5,00 mmol, 5,00 eq), MeOH (10 ml) y bromuro de litio (258 mg, 3,00 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 60°C y se inactivó con agua (20 ml). La mezcla resultante se extrajo con DCM (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 230 mg (53% de rendimiento) del 4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1-carboxilato de f-butilo como un aceite amarillo. CLEM (ESI, m/z): 431 [M+H]+.
Etapa 3: Preparación de 2-metil-1-(piperidin-4-il(3-(trifluorometil)bencil)amino)propan-2-ol
Se cargó un matraz con 4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1-carboxilato de í-butilo (215 mg, 0,500 mmol, 1,00 eq), DCM (10 ml) y TFA (2 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5, para proporcionar 165 mg (cuantitativo) de 2-metil-1 -(piperidin-4-il(3-(trifluorometil)bencil)amino)propan-2-ol como un aceite amarillo. CLEM (ESI, m/z): 331 [M+H]+.
Etapa 4: Preparación de cloruro de 4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1-carbonilo
Se cargó un matraz con trifosgeno (104 mg, 0,350 mmol, 0,70 eq) y DCM (10 ml). Se añadieron 2-metil-1 -(piperidin-4-il(3-(trifluorometil)bencil)amino)propan-2-ol (165 mg, 0,500 mmol, 1,00 eq) y DIPEA (258 mg, 2,00 mmol, 4,00 eq) a 0°C. La solución resultante se agitó durante 1 h a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 1, Etapa 3, para proporcionar 196 mg (bruto) del cloruro de 4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidin-1-carbonilo como un aceite marrón. CLEM (ESI, m/z): 393 [M+H]+.
Etapa 5: Preparación de 1-(4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1-carbonil)-1H-pirazol-3-carboxamida
Se cargó un matraz con cloruro de 4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1 -carbonilo (196 mg, 0,500 mmol, 1,00 eq), 1H-pirazol-3-carboxamida (66,6 mg, 0,600 mmol, 1,20 eq), THF (10 ml), DIPEA (258 mg, 2,00 mmol, 4,00 eq) y DMAP (6,1 mg, 0,0500 mmol, 0,10 eq) en atmósfera de nitrógeno. La solución resultante se agitó durante la noche a 60°C y luego se inactivó con agua (20 ml), como se describe en el Ejemplo 1, Etapa 4. El producto bruto (280 mg) se purificó por HPLC preparativa para proporcionar 106,9 mg (46% de rendimiento) de 1-(4-((2-hidroxi-2-metilpropil)(3-(trifluorometil)bencil)amino)piperidina-1 -carbonil)-1 H-pirazol-3-carboxamida como un sólido blanquecino. RMN 1H (400 MHz, metanol-a^) ó 8,16 (d, J = 2,4 Hz, 1H), 7,77 (s, 1H), 7,71 (d, J = 7,2 Hz, 1H), 7,55 - 7,49 (m, 2H), 6,87 (d, J = 2,4 Hz, 1 H), 4,49 - 4,46 (m, 2H), 3,95 (s, 2H), 3,00 - 2,86 (m, 3H), 2,56 (s, 2H), 1,97 -1,94 (m, 2H), 1,75 - 1,64 (m, 2H), 1,17 (s, 6H). CLEM (ESI, m/z): 468 [M+H]+.
Ejemplo 37: 1 -(4-(2-Cloro-3-(2-hidroxi-2-metilpropoxi)bencil)piperazina-1 -carbonil)-1 H-pirazol-3-carboxamida
Etapa 1: Preparación de 2-cloro-3-(2-hidroxi-2-metilpropoxi)benzaldehído
Se cargó un matraz con 2-cloro-3-hidroxibenzaldehído (0,624 g, 4,00 mmol, 1,00 eq), 2,2-dimetiloxirano (0,576 g, 8,00 mol, 2,00 eq), DMSO (10 ml) y carbonato de potasio (1,66 g, 12,0 mmol, 3,00 eq). La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (30 ml). La mezcla resultante se extrajo con EtOAc (3 x 40 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (30 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió para proporcionar 550 mg (60% de rendimiento) del 2-cloro-3-(2-hidroxi-2-metilpropoxi)benzaldehído como un aceite incoloro. CLEM (ESI, m/z): 229 [M+H]+.
Etapa 2: Preparación de 3-carbamoil-1H-pirazol-1-carboxilato de 4-nitrofenilo
Se cargó un matraz con 1H-pirazol-3-carboxamida (0,555 g, 5,00 mmol, 1,00 eq), cloroformiato de 4-nitrofenilo (1,21 g, 6,00 mmol, 1,20 eq), DCM (20 ml) y trietilamina (1,51 g, 15,0 mmol, 3,00 eq). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida para proporcionar 1,38 g (bruto) del 3-carbamoil-1H-pirazol-1-carboxilato de 4-nitrofenilo como un aceite amarillo. CLEM (ESI, m/z): 277 [M+H]+.
Etapa 3: Preparación de 4-(3-carbamoil-1H-pirazol-1-carbonil)piperazina-1-carboxilato de f-butilo
Se cargó un matraz con 3-carbamoil-1 H-pirazol-1 -carboxilato de 4-nitrofenilo (1,38 g, 5,00 mmol, 1,00 eq), piperazina-1-carboxilato de f-butilo (0,930 g, 5,00 mol, 1,00 eq), DCM (15 ml) y trietilamina (1,51 g, 15,0 mmol, 3,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 0,500 g (31% de rendimiento) del 4-(3-carbamoil-1H-pirazol-1-carbonil)piperazina-1-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 324 [M+H]+.
Etapa 4: Preparación de 1-(piperazina-1-carbonil)-1H-pirazol-3-carboxamida
Se cargó un matraz con 4-(3-carbamoil-1 H-pirazol-1 -carbonil)piperazina-1 -carboxilato de f-butilo (150 mg, 0,460 mmol, 1,00 eq), DCM (10 ml) y TFA (2 ml). La solución resultante se agitó durante 2 h a temperatura ambiente y se concentró a presión reducida como se describe en el Ejemplo 1, Etapa 5, para proporcionar 110 mg (cuantitativo) de 1-(piperazina-1-carbonil)-1H-pirazol-3-carboxamida como un aceite amarillo. CLEM (ESI, m/z): 224 [M+H]+.
Etapa 5: Preparación de 1-(4-(2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxamida
Se cargó un matraz con 1-(piperazina-1-carbonil)-1H-pirazol-3-carboxamida (75,8 mg, 0,340 mmol, 1,20 eq), 2-cloro-3-(2-hidroxi-2-metilpropoxi)benzaldehído (64,7 mg, 0,280 mmol, 1,00 eq) y DCM (15 ml). La mezcla se agitó durante 2 h a temperatura ambiente. Se añadió triacetoxiborohidruro de sodio (241 mg, 1,14 mmol, 4,00 eq). La solución resultante se agitó durante la noche a temperatura ambiente y luego se inactivó con agua (20 ml), como se describe en el Ejemplo 2, Etapa 3. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 52,7 mg (36% de rendimiento) de la 1-(4-(2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)piperazina-1-carbonil)-1H-pirazol-3-carboxamida
como un sólido blanco. RMN 1H (300 MHz, cloroformo-a) 58,09 (d, J = 2,7 Hz, 1H), 7,25 (d, J = 7,8 Hz, 1H), 7,12 (ancho, 1 H), 6,90 (d, J = 2,7 Hz, 1 H), 6,86 (d, J = 7,8 Hz, 1H), 6,65 (ancho, 1H), 5,47 (ancho, 1H), 3,85 (s, 6H), 3,71 (s, 2H), 2,65 (ancho, 4H), 2,40 (s, 1 H), 1,39 (s, 6H). CLEM (ESI, m/z): 436 [M+H]+.
Ejemplo 38: Ácido 1 -(frans-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Etapa 1: Preparación de 1 H-pirazol-1,3-dicarboxilato de 3-(f-butilo) y 1 -(4-nitrofenilo)
Se cargó un matraz con 1H-pirazol-3-carboxilato de f-butilo (138 mg, 0,822 mmol, 1,00 eq), carbonocloridato de 4-nitrofenilo (198 mg, 0,986 mmol, 1,20 eq), trietilamina (249 mg, 2,46 mmol, 3,00 eq) eq) y DCM (10 ml), como se describe en el Ejemplo 4, Etapa 3. La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida para proporcionar 274 mg (bruto) del 1 H-pirazol-1,3-dicarboxilato de 3-terc-butilo y 1 -(4-nitrofenilo) como un aceite amarillo. c Le M (ESI, m/z): 334 [M+H]+.
Etapa 2: Preparación de (3aR,5r,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo
Se cargó un matraz con (3aR, 6aS)-5-oxo-octahidrociclopenta[c]pirrol-2-carboxilato de f-butilo (1,00 g, 4,44 mmol, 1,00 eq) y MeOH (15 ml). Se añadió borohidruro de sodio (0,507 g, 13,4 mmol, 3,00 eq) a 0°C. La solución resultante se agitó durante 2 h a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 15, Etapa 4, para proporcionar 0,950 g (94% de rendimiento) del (3aR,5r,6aS)-5-hidroxi-hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de terc-butilo como un aceite amarillo. CLEM (ESI, m/z) : 228 [M+H]+.
Etapa 3: Preparación de (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo
Se cargó un matraz con (3aR,5r,6aS)-5-hidroxi-hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo (2,00 g, 8,81 mmol, 1,00 eq), ácido 4-nitrobenzoico (1,470 g, 8,80 mmol, 2,00 eq), trifenilfosfina (2,30 g, 8,80 mmol, 2,00 eq) y THF (20 ml) en atmósfera de nitrógeno. Se añadió azodicarboxilato de dietilo (1,53 g, 8,80 mmol, 2,00 eq) a 0°C. La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (40 ml), como se describe en el Ejemplo 15, Etapa 5. El residuo se cromatografió en una columna de gel de sílice para proporcionar 1,8 g (54% de rendimiento) del (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo como un sólido blanco. CLEM (ESI, m/z): 377 [M+H]+.
Etapa 4: Preparación de (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de f-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-((4-nitrobenzoil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de f-butilo
(1,8 g, 4,79 mmol, 1,00 eq), carbonato de potasio (1,32 g, 9,58 mmol, 2,00 eq), MeOH (30 ml) y agua (10 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (30 ml), como se describe en el Ejemplo 15, Etapa 6. El residuo se cromatografió en una columna de gel de sílice para proporcionar 900 mg (82% de rendimiento) del (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 228 [M+H]+.
Etapa 5: Preparación de (3aR,5s,6aS)-5-((3-bromo-2-clorobencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-hidroxihexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (600 mg, 2,64 mmol, 1,00 eq), 1-bromo-3-(bromometil)-2-clorobenceno (820 mg, 2,91 mmol, 1,10 eq), NaH (211 mg, 5,28 mmol, 2,00 eq) y DMF (10 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 15, Etapa 7. El residuo se cromatografió en una columna de gel de sílice para proporcionar 660 mg (60% de rendimiento) del (3aR,5s,6aS)-5-((3-bromo-2-clorobencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido amarillo. CLEM (ESI, m/z): 430 [M+H]+.
Etapa 6 : Preparación de (3aR,5s,6aS)-5-((2-cloro-3-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-((3-bromo-2-clorobencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (500 mg, 1,16 mmol, 1,00 eq), 4,4,4',4',5,5,5',5'-octametil-2,2'-bi(1,3,2-dioxaborolano) (444 mg, 1,75 mmol, 1,50 eq), dicloruro de bis(trifenilfosfina)paladio (246 mg, 0,35 mmol, 0,30 eq), acetato de potasio (341 mg, 3,48 mmol, 3,00 eq), 1,4-dioxano (10 ml) y nitrógeno. La solución resultante se agitó durante la noche a 80°C y se inactivó con agua (20 ml). La solución resultante se extrajo con EtOAc (3 x 30 ml) y las capas orgánicas se combinaron, se lavaron con salmuera (1 x 20 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 480 mg (86% de rendimiento) del (3aR,5s,6aS)-5-((2-cloro-3-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 478 [M+H]+.
Etapa 7: Preparación de (3aR,5s,6aS)-5-((2-cloro-3-hidroxibencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-((2-cloro-3-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1 H)-carboxilato de í-butilo (430 mg, 0,90 mmol, 1,00 eq), hidróxido de sodio (72 mg, 1,80 mmol, 2,00 eq), peróxido de hidrógeno (1,80 ml, 1,80 mmol, 2,00 eq) y THF (10 ml). La solución resultante se agitó durante 4 h a temperatura ambiente y se inactivó con agua (5 ml). La mezcla se extrajo con EtOAc (3 x 40 ml) y las capas orgánicas se combinaron, se lavaron con agua (1 x 50 ml), se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a presión reducida. El residuo se cromatografió en una columna de gel de sílice para proporcionar 260 mg (cuantitativo) del (3aR,5s,6aS)-5-((2-cloro-3-hidroxibencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESl, m/z): 368 [M+H]+.
Etapa 8 : Preparación de (3aR,5s,6aS)-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo
Se cargó un matraz con (3aR,5s,6aS)-5-((2-cloro-3-hidroxibencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (260 mg, 0,708 mmol, 1,00 eq), 2,2-dimetiloxirano (61 mg, 0,850 mmol, 1,20 eq), carbonato de potasio (294 mg, 2,12 mmol, 3,00 eq) y DMSO (5 ml). La solución resultante se agitó durante la noche a 100°C y se inactivó con agua (5 ml), como se describe en el Ejemplo 41, Etapa 1. El residuo se cromatografió en una columna de gel de sílice para proporcionar 200 mg (64% de rendimiento) del (3aR,5s,6aS)-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo como un sólido blanco. CLEM (ESI, m/z): 440 [M+H]+.
Etapa 9: Preparación de 1-(2-cloro-3-((((3aR,5s,6aS)-octahidrociclopenta[c]pirrol-5-il)oxi)metil)fenoxi)-2-metilpropan-2 -ol
Se cargó un matraz con (3aR,5s,6aS)-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)hexahidrociclopenta[c]pirrol-2(1H)-carboxilato de í-butilo (200 mg, 0,456 mmol, 1,00 eq), DCM (8 ml) y TFA (2 ml). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida. El producto bruto se trató como se describe en el Ejemplo 1, Etapa 5, para proporcionar 136 mg (cuantitativo) de 1-(2-cloro-3-((((3aR,5s,6aS)-octahidrociclopenta[c]pirrol-5-il)oxi)metil)fenoxi)-2-metilpropan-2-ol como un sólido blanco. Cl Em (ESI, m/z): 340 [M+H]+.
Etapa 10: Preparación de 1-(írans-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol -3-carboxilato de í-butilo
Se cargó un matraz con 1 -(2-cloro-3-((((3aR,5s,6aS)-octahidrociclopenta[c]pirrol-5-il)oxi)metil)fenoxi)-2-metilpropan-2-ol (136 mg, 0,401 mmol, 1,00 eq), 1H-pirazol-1,3-dicarboxilato de 3-í-butilo y 1 -(4-nitrofenilo) (160 mg, 0,481 mmol, 1,20 eq), trietilamina (121 mg, 1,20 mmol, 3,00 eq) y DCM (5 ml). La solución resultante se agitó durante la noche a temperatura ambiente y se inactivó con agua (20 ml), como se describe en el Ejemplo 4, Etapa 3. El residuo se cromatografió en una columna de gel de sílice para proporcionar 180 mg (82% de rendimiento) del 1-((3aR,5s,6aS)-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxilato de í-butilo como un sólido blanco. Cl Em (ESI, m/z): 534 [M+H]+.
Etapa 11: Preparación de ácido 1-(írans-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1 H-pirazol-3-carboxílico
Se cargó un matraz con 1-((3aR,5s,6aS)-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxilato de í-butilo (180 mg, 0,338 mmol, 1,00 eq), DCM (8 ml) y TFA (1 ml). La solución resultante se agitó durante 1 h a temperatura ambiente y se concentró a presión reducida, como se describe en el Ejemplo 1, Etapa 5. El producto bruto (200 mg) se purificó por HPLC preparativa para proporcionar 32,8 mg (21% de rendimiento) del ácido 1 -(írans-5-((2-cloro-3-(2-hidroxi-2-metilpropoxi)bencil)oxi)octahidrociclopenta[c]pirrol-2-carbonil)-1H-pirazol-3-carboxílico como un sólido blanco. RMN 1H (400 MHz, metanol-aL) 58,16 (d, J = 2,6 Hz, 1H),
7,26 (t, J = 7,9 Hz, 1 H), 7,12 (d, J = 7,7 Hz, 1H), 7,01 (d, J = 8,2 Hz, 1H), 6,76 (d, J = 2,6 Hz, 1H), 4,59 (s, 2H), 4,28 (t, J = 4,1 Hz, 1 H), 3,85 (s, 6H), 2,94 (s, 2H), 2,14 (s, 2H), 1,84 (dd, J = 13,1,6,4 Hz, 2H), 1,38 (s, 6H). CLEM (ESI, m/z): 495 [M+NH4]+.
Ejemplos 39-456: Los ejemplos 39-456 se prepararon por procedimientos similares a los descritos en los ejemplos 1-38
II. Evaluación biológica
Perfiles competitivos de proteínas basados en la actividad in vitro.
Se preincubaron proteomas (fracción de membrana de cerebro de ratón para ensayos de ratón; fracciones de membrana de corteza prefrontal humana para ensayos humanos) (50 ml, concentración de proteína total 1,0 mg/ml) con concentraciones variables de inhibidores a 37°C. Después de 30 min, se añadió FP-Rh (1,0 ml, 50 mM en DMSO) y la mezcla se incubó durante otros 30 min a 37°C. Las reacciones se inactivaron con tampón de carga de SDS (15 pl - 4X) y se ejecutaron en SDS-PAGE. Después de la formación de imágenes del gel, se determinó la actividad de la serina hidrolasa midiendo la intensidad fluorescente de las bandas del gel correspondientes a MAGL y FAAH utilizando el software ImageJ 1.43u. Los datos de CI50 de este ensayo se muestran en la Tabla 1. Todos los compuestos de la Tabla 1 fueron inhibidores más potentes de MAGL que FAAH
Preparación de proteomas de cerebro de ratón de ratones tratados con inhibidores.
Los inhibidores se administraron a C57B1/6J silvestres por sonda oral en un vehículo de polietilenglicol. Cada animal se sacrificó 4 h después de la administración y los proteomas cerebrales se prepararon y analizaron de acuerdo con los métodos previamente establecidos (Véase Niphakis, M.J., et al. (2011) ACS Chem. Neurosci. y Long, J. Z., et al. Nat. Chem. Biol. 5:37-44). Los compuestos demostraron actividad en los ensayos descritos en el presente documento como se indica en la Tabla 1.
Tabla 1
*** CI50 es menor o igual a 100 nM; ** CI50 es mayor que 100 nM y menor que 1 gM; * CI50 es mayor o igual a 1 gM y menor o igual a 10 gM.
A =% de inhibición es mayor o igual a 75%; B =% de inhibición es mayor o igual a 50% y menor de 75%; C =% de inhibición es mayor o igual a 25% y menor de 50%; D =% de inhibición es mayor o igual a 0% y menor de 25%.
Claims (21)
1. Un compuesto de fórmula (I):
en donde:
R1 es -C(O)OR15 o -C(O)NR10R11;
R2 es H, halógeno, alquilo C1-6 o haloalquilo C1-6;
A es N o C(H);
X es -O-, -N(R16)- o -CH2N(R16)CH2-;
Y es -CH2- o -C(O)-;
Z es -S-, -O- o -N(R18)-;
R4 es H, halógeno, -OR7 , alquilo C 1-6, alquenilo C2-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8 R9 , cicloalquilo C3-8, heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C 1-9, en donde el cicloalquilo C3-8, heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6, haloalcoxi C1-6 o fenilo;
R6 es H, halógeno o alquilo C1-6;
R7 es H, alquilo C1-6, haloalquilo C1-6, -alquil(C1-6)-OH, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14;
cada R8 y cada R9 se seleccionan independientemente de H y alquilo C 1-6; o R8 y R9 junto con el nitrógeno al que están unidos se combinan para formar un anillo de heterocicloalquilo;
R10 y R11 son cada uno independientemente H o alquilo C1-6;
R12 es H, halógeno o alquilo C1-6;
R13 es H o alquilo C1-6;
cada R14 se selecciona independientemente de halógeno, -OH, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, -alquil(C1-6)OH, cicloalquilo C3-8, -C(O)OH, -C(O)NR8 R9 , -SO2-alquilo C1-6 y -N(R17)C(O)-alquilo(Ci -6);
R15 es H o alquilo C1-6;
R16 es H, alquilo C1-6, -C(O)-alquilo(C1-6), -alquil(C1-6)-OH o -CH2CO2H;
R17 es H o alquilo C1-6;
R18 es H o alquilo C1-6;
v es 0 o 1;
n es 0 o 1;
m es 0 o 1;
p es 0, 1 o 2; y
q es 0, 1 o 2;
o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo.
3. El compuesto de la reivindicación 2, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde m es 1, n es 1, q es 0 y p es 2.
4. El compuesto de una cualquiera de las reivindicaciones 2-3, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde Y es -CH2-.
5. El compuesto de una cualquiera de las reivindicaciones 1-4, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R13 es H y R12 es H.
6. El compuesto de una cualquiera de las reivindicaciones 2-5, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde A es C(H).
7. El compuesto de una cualquiera de las reivindicaciones 2-6, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R6 es H.
8. El compuesto de una cualquiera de las reivindicaciones 1-7, o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno, -OR7, alquilo C1-6, alquinilo C2-6, haloalquilo C1-6, -C(O)NR8R9, heterocicloalquilo C2-9, arilo C6-10 o heteroarilo C1-9, en donde el heterocicloalquilo C2-9, -alquil(C1-6)-heterocicloalquilo(C2-9), arilo C6-10, heteroarilo C1-9 están opcionalmente sustituidos con 1 o 2 R14.
9. El compuesto de la reivindicación 8, o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es halógeno o R4 es heterocicloalquilo C2-9 opcionalmente sustituido con 1 o 2 R14.
10. El compuesto de la reivindicación 9, o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R4 es un heterocicloalquilo C2-9 no sustituido.
11. El compuesto de una cualquiera de las reivindicaciones 1-10, o un solvato, hidrato, tautómero, W-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R5 es H, halógeno, alquilo C1-6, haloalquilo C1-6 o haloalcoxi C1-6.
12. El compuesto de una cualquiera de las reivindicaciones 1-11, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R2 es H.
13. El compuesto de una cualquiera de las reivindicaciones 1-12, o un solvato, hidrato, tautómero, N-óxido, estereoisómero o sal farmacéuticamente aceptable del mismo, en donde R1 es -C(O)OR15 y R15 es H.
21. Una composición farmacéutica que comprende un compuesto de una cualquiera de las reivindicaciones 1-20, o un solvato, hidrato, tautómero, W-óxido, o una sal farmacéuticamente aceptable del mismo, y al menos un excipiente farmacéuticamente aceptable.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762510213P | 2017-05-23 | 2017-05-23 | |
| PCT/US2018/033959 WO2018217805A1 (en) | 2017-05-23 | 2018-05-22 | Pyrazole magl inhibitors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2940111T3 true ES2940111T3 (es) | 2023-05-03 |
Family
ID=64397020
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES18806431T Active ES2940111T3 (es) | 2017-05-23 | 2018-05-22 | Inhibidores de MAGL de pirazol |
Country Status (39)
| Country | Link |
|---|---|
| US (2) | US10266497B2 (es) |
| EP (2) | EP4198024A1 (es) |
| JP (2) | JP7157771B2 (es) |
| KR (2) | KR102679766B1 (es) |
| CN (2) | CN116473965A (es) |
| AR (1) | AR112907A1 (es) |
| AU (1) | AU2018271876B2 (es) |
| BR (1) | BR112019024566A2 (es) |
| CA (1) | CA3063993A1 (es) |
| CL (1) | CL2019003397A1 (es) |
| CO (1) | CO2019013013A2 (es) |
| CR (1) | CR20190536A (es) |
| DK (1) | DK3630744T3 (es) |
| DO (1) | DOP2019000283A (es) |
| EA (1) | EA201992409A1 (es) |
| EC (1) | ECSP19084085A (es) |
| ES (1) | ES2940111T3 (es) |
| FI (1) | FI3630744T3 (es) |
| GE (1) | GEP20217318B (es) |
| HR (1) | HRP20230233T1 (es) |
| HU (1) | HUE061614T2 (es) |
| IL (1) | IL270473B (es) |
| JO (1) | JOP20190262B1 (es) |
| LT (1) | LT3630744T (es) |
| MA (1) | MA50406B1 (es) |
| MX (1) | MX2019014042A (es) |
| MY (1) | MY200738A (es) |
| NI (1) | NI201900115A (es) |
| PE (1) | PE20200445A1 (es) |
| PH (1) | PH12019502548A1 (es) |
| PL (1) | PL3630744T3 (es) |
| PT (1) | PT3630744T (es) |
| RS (1) | RS64006B1 (es) |
| SA (1) | SA519410589B1 (es) |
| SI (1) | SI3630744T1 (es) |
| TW (1) | TWI786117B (es) |
| UA (1) | UA124990C2 (es) |
| WO (1) | WO2018217805A1 (es) |
| ZA (1) | ZA201908070B (es) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017096315A1 (en) | 2015-12-02 | 2017-06-08 | The Scripps Research Institute | TRIAZOLE DAGL(α) INHIBITORS |
| JOP20190107A1 (ar) | 2016-11-16 | 2019-05-09 | Lundbeck La Jolla Research Center Inc | مثبطات أحادي أسيل جليسرول ليباز (magl) |
| US10927105B1 (en) | 2017-05-23 | 2021-02-23 | Lundbeck La Jolla Research Center, Inc. | Pyrazole MAGL inhibitors |
| ES2940111T3 (es) | 2017-05-23 | 2023-05-03 | H Lundbeck As | Inhibidores de MAGL de pirazol |
| JOP20190267A1 (ar) | 2017-05-23 | 2019-11-18 | Lundbeck La Jolla Research Center Inc | مثبطات بيرازول magl |
| KR20210097734A (ko) * | 2018-11-28 | 2021-08-09 | 하. 룬드벡 아크티에셀스카브 | Magl 저해제에 의해 질병을 치료하는 방법 |
| TW202239402A (zh) | 2021-01-29 | 2022-10-16 | 美商賽迪拉治療股份有限公司 | Cdk2抑制劑及其使用方法 |
| TW202317560A (zh) | 2021-06-26 | 2023-05-01 | 美商賽迪拉治療股份有限公司 | Cdk2抑制劑及其使用方法 |
| US20230265095A1 (en) | 2021-11-02 | 2023-08-24 | H. Lundbeck A/S | Crystalline forms of a magl inhibitor |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3308130A (en) | 1962-04-26 | 1967-03-07 | Du Pont | N-disubstituted carbamyl pyrazoles |
| DK1309591T3 (da) * | 2000-08-14 | 2007-03-26 | Ortho Mcneil Pharm Inc | Substituerede pyrazoler |
| WO2002069901A2 (en) * | 2001-03-02 | 2002-09-12 | Merck Frosst Canada & Co. | Cathepsin cysteine protease inhibitors |
| US6727364B2 (en) | 2001-04-30 | 2004-04-27 | The Procter & Gamble Company | Triazole compounds useful in treating diseases associated with unwanted cytokine activity |
| JP4422488B2 (ja) | 2002-02-19 | 2010-02-24 | テバ ファーマシューティカル インダストリーズ リミティド | アトルバスタチンヘミカルシウム溶媒和物の脱溶媒和法及び有機溶媒を本質的に含まないアトルバスタチンヘミカルシウム |
| SE0300705D0 (sv) * | 2003-03-14 | 2003-03-14 | Biolipox Ab | New compounds |
| JP2006520373A (ja) * | 2003-03-14 | 2006-09-07 | バイオリポックス エービー | 炎症の治療に有用なピラゾール化合物 |
| WO2008023720A1 (fr) | 2006-08-23 | 2008-02-28 | Astellas Pharma Inc. | COMPOSÉ D'URÉE OU SEL DUDIT COMPOSé |
| CA2743861A1 (en) | 2008-11-14 | 2010-05-20 | The Scripps Research Institute | Methods and compositions related to targeting monoacylglycerol lipase |
| US9353082B2 (en) | 2008-12-24 | 2016-05-31 | Bial—Portela & Ca, S.A. | Pharmaceutical compounds |
| JP2012524804A (ja) | 2009-04-22 | 2012-10-18 | ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ | モノアシルグリセロールリパーゼ阻害剤としてのアゼチジニルジアミド |
| WO2012138877A1 (en) | 2011-04-06 | 2012-10-11 | The Scripps Research Institute | N1- and n2-carbamoyl-1,2,3-triazole serine hydrolase inhibitors and methods |
| CN103130723B (zh) | 2011-11-30 | 2015-01-14 | 成都地奥制药集团有限公司 | 一种多聚(adp-核糖)聚合酶抑制剂 |
| CA2862417C (en) | 2012-01-06 | 2017-09-05 | Abide Therapeutics, Inc. | Carbamate compounds and of making and using same |
| WO2015099196A1 (en) * | 2013-12-26 | 2015-07-02 | Takeda Pharmaceutical Company Limited | 4-(piperrazin-1-yl)-pyrrolidin-2-one compounds as monoacylglycerol lipase (magl) inhibitors |
| US10093630B2 (en) | 2014-05-21 | 2018-10-09 | Abide Therapeutics, Inc. | Pyrazole compounds and methods of making and using same |
| WO2016014975A2 (en) | 2014-07-25 | 2016-01-28 | Northeastern University | Urea/carbamates faah magl or dual faah/magl inhibitors and uses thereof |
| JP6832914B2 (ja) | 2015-07-31 | 2021-02-24 | ファイザー・インク | Magl阻害薬としての1,1,1−トリフルオロ−3−ヒドロキシプロパン−2−イルカルバマート誘導体および1,1,1−トリフルオロ−4−ヒドロキシブタン−2−イルカルバマート誘導体 |
| WO2017087858A1 (en) * | 2015-11-20 | 2017-05-26 | Abide Therapeutics, Inc. | Pyrazole compounds and methods of making and using same |
| WO2017087863A1 (en) | 2015-11-20 | 2017-05-26 | Abide Therapeutics, Inc. | Pyrazole compounds and methods of making and using same |
| ES2822979T3 (es) | 2015-11-20 | 2021-05-05 | Lundbeck La Jolla Research Center Inc | Derivados de pirazol, procesos para su preparación, y sus usos |
| WO2017096315A1 (en) | 2015-12-02 | 2017-06-08 | The Scripps Research Institute | TRIAZOLE DAGL(α) INHIBITORS |
| AU2017361254B2 (en) | 2016-11-16 | 2021-09-23 | H. Lundbeck A/S. | Pharmaceutical formulations |
| JOP20190106A1 (ar) | 2016-11-16 | 2019-05-09 | Lundbeck La Jolla Research Center Inc | مثبطات أحادي أسيل جليسرول ليباز (magl) |
| JOP20190107A1 (ar) | 2016-11-16 | 2019-05-09 | Lundbeck La Jolla Research Center Inc | مثبطات أحادي أسيل جليسرول ليباز (magl) |
| ES2900016T3 (es) | 2016-11-16 | 2022-03-15 | H Lundbeck As | Una forma cristalina de un inhibidor de MAGL |
| ES2940111T3 (es) | 2017-05-23 | 2023-05-03 | H Lundbeck As | Inhibidores de MAGL de pirazol |
| US10927105B1 (en) | 2017-05-23 | 2021-02-23 | Lundbeck La Jolla Research Center, Inc. | Pyrazole MAGL inhibitors |
| JOP20190267A1 (ar) | 2017-05-23 | 2019-11-18 | Lundbeck La Jolla Research Center Inc | مثبطات بيرازول magl |
| KR20210097734A (ko) | 2018-11-28 | 2021-08-09 | 하. 룬드벡 아크티에셀스카브 | Magl 저해제에 의해 질병을 치료하는 방법 |
| US20220018695A1 (en) | 2018-11-30 | 2022-01-20 | Baker Hughes Holdings Llc | In situ ultrasonic flow meter validation |
-
2018
- 2018-05-22 ES ES18806431T patent/ES2940111T3/es active Active
- 2018-05-22 DK DK18806431.5T patent/DK3630744T3/da active
- 2018-05-22 RS RS20230152A patent/RS64006B1/sr unknown
- 2018-05-22 EP EP23151106.4A patent/EP4198024A1/en active Pending
- 2018-05-22 CN CN202310407761.8A patent/CN116473965A/zh active Pending
- 2018-05-22 PT PT188064315T patent/PT3630744T/pt unknown
- 2018-05-22 MX MX2019014042A patent/MX2019014042A/es unknown
- 2018-05-22 EA EA201992409A patent/EA201992409A1/ru unknown
- 2018-05-22 AR ARP180101355A patent/AR112907A1/es unknown
- 2018-05-22 LT LTEPPCT/US2018/033959T patent/LT3630744T/lt unknown
- 2018-05-22 US US15/986,747 patent/US10266497B2/en active Active
- 2018-05-22 CA CA3063993A patent/CA3063993A1/en active Pending
- 2018-05-22 JO JOP/2019/0262A patent/JOP20190262B1/ar active
- 2018-05-22 MA MA50406A patent/MA50406B1/fr unknown
- 2018-05-22 BR BR112019024566A patent/BR112019024566A2/pt unknown
- 2018-05-22 AU AU2018271876A patent/AU2018271876B2/en active Active
- 2018-05-22 JP JP2019565384A patent/JP7157771B2/ja active Active
- 2018-05-22 KR KR1020247006820A patent/KR102679766B1/ko active IP Right Grant
- 2018-05-22 HU HUE18806431A patent/HUE061614T2/hu unknown
- 2018-05-22 FI FIEP18806431.5T patent/FI3630744T3/fi active
- 2018-05-22 CR CR20190536A patent/CR20190536A/es unknown
- 2018-05-22 US US16/615,747 patent/US11655217B2/en active Active
- 2018-05-22 WO PCT/US2018/033959 patent/WO2018217805A1/en active Application Filing
- 2018-05-22 PE PE2019002378A patent/PE20200445A1/es unknown
- 2018-05-22 SI SI201830852T patent/SI3630744T1/sl unknown
- 2018-05-22 PL PL18806431.5T patent/PL3630744T3/pl unknown
- 2018-05-22 EP EP18806431.5A patent/EP3630744B1/en active Active
- 2018-05-22 GE GEAP201815219A patent/GEP20217318B/en unknown
- 2018-05-22 CN CN201880033044.0A patent/CN110678456B/zh active Active
- 2018-05-22 KR KR1020197037042A patent/KR102643778B1/ko active IP Right Grant
- 2018-05-22 HR HRP20230233TT patent/HRP20230233T1/hr unknown
- 2018-05-22 UA UAA201911547A patent/UA124990C2/uk unknown
- 2018-05-22 MY MYPI2019006597A patent/MY200738A/en unknown
- 2018-05-23 TW TW107117623A patent/TWI786117B/zh active
-
2019
- 2019-11-06 IL IL270473A patent/IL270473B/en unknown
- 2019-11-08 DO DO2019000283A patent/DOP2019000283A/es unknown
- 2019-11-11 NI NI201900115A patent/NI201900115A/es unknown
- 2019-11-14 PH PH12019502548A patent/PH12019502548A1/en unknown
- 2019-11-18 SA SA519410589A patent/SA519410589B1/ar unknown
- 2019-11-21 CO CONC2019/0013013A patent/CO2019013013A2/es unknown
- 2019-11-21 CL CL2019003397A patent/CL2019003397A1/es unknown
- 2019-11-26 EC ECSENADI201984085A patent/ECSP19084085A/es unknown
- 2019-12-04 ZA ZA2019/08070A patent/ZA201908070B/en unknown
-
2022
- 2022-07-15 JP JP2022113928A patent/JP7320652B2/ja active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2940111T3 (es) | Inhibidores de MAGL de pirazol | |
| CN107660199B (zh) | 哌嗪氨基甲酸酯及其制备和使用方法 | |
| ES2793148T3 (es) | Compuestos de carbamato y métodos para fabricarlos y usarlos | |
| ES2822979T3 (es) | Derivados de pirazol, procesos para su preparación, y sus usos | |
| JP7162622B2 (ja) | ピラゾールmagl阻害剤 | |
| ES2892952T3 (es) | Carbamatos de piperazina como moduladores del MAGL y/o ABHD6 y su uso | |
| ES2952332T3 (es) | Compuestos espirocíclicos y sus métodos de preparación y uso | |
| EA027569B1 (ru) | Производные пиридина | |
| JP2016514709A (ja) | ヤヌスキナーゼ阻害剤としてのジェミナル置換シアノエチルピラゾロピリドン | |
| US20230219897A1 (en) | Pyrazole magl inhibitors | |
| AU2018236161B9 (en) | Dual MAGL and FAAH inhibitors | |
| RU2789157C2 (ru) | Ингибиторы magl на основе пиразола | |
| EA047826B1 (ru) | Ингибиторы magl на основе пиразола | |
| EA040984B1 (ru) | Ингибиторы magl на основе пиразола |