ES2699827T3 - Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto - Google Patents
Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto Download PDFInfo
- Publication number
- ES2699827T3 ES2699827T3 ES17203913T ES17203913T ES2699827T3 ES 2699827 T3 ES2699827 T3 ES 2699827T3 ES 17203913 T ES17203913 T ES 17203913T ES 17203913 T ES17203913 T ES 17203913T ES 2699827 T3 ES2699827 T3 ES 2699827T3
- Authority
- ES
- Spain
- Prior art keywords
- certain cases
- antisense compound
- dose
- antisense
- administered
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 102100021947 Survival motor neuron protein Human genes 0.000 title claims description 122
- 101000617738 Homo sapiens Survival motor neuron protein Proteins 0.000 title claims description 71
- 238000000034 method Methods 0.000 title description 148
- 239000000203 mixture Substances 0.000 title description 15
- 150000001875 compounds Chemical class 0.000 claims abstract description 305
- 230000000692 anti-sense effect Effects 0.000 claims abstract description 279
- 239000002777 nucleoside Substances 0.000 claims abstract description 137
- 108091034117 Oligonucleotide Proteins 0.000 claims abstract description 135
- 239000000074 antisense oligonucleotide Substances 0.000 claims abstract description 101
- 238000012230 antisense oligonucleotides Methods 0.000 claims abstract description 101
- 235000000346 sugar Nutrition 0.000 claims abstract description 93
- 210000001175 cerebrospinal fluid Anatomy 0.000 claims abstract description 66
- 108020004999 messenger RNA Proteins 0.000 claims abstract description 60
- 150000003833 nucleoside derivatives Chemical class 0.000 claims abstract description 60
- 238000011282 treatment Methods 0.000 claims abstract description 55
- 230000000295 complement effect Effects 0.000 claims abstract description 38
- 101100203485 Homo sapiens SMN2 gene Proteins 0.000 claims abstract description 30
- 102000053564 human SMN2 Human genes 0.000 claims abstract description 30
- 238000007913 intrathecal administration Methods 0.000 claims abstract description 18
- 208000002320 spinal muscular atrophy Diseases 0.000 claims abstract description 16
- 230000037396 body weight Effects 0.000 claims description 35
- 208000024891 symptom Diseases 0.000 claims description 34
- 238000007910 systemic administration Methods 0.000 claims description 34
- 238000001990 intravenous administration Methods 0.000 claims description 24
- 238000007920 subcutaneous administration Methods 0.000 claims description 23
- 210000003169 central nervous system Anatomy 0.000 claims description 16
- 239000003814 drug Substances 0.000 claims description 13
- 238000004519 manufacturing process Methods 0.000 claims description 9
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 claims description 9
- 239000007928 intraperitoneal injection Substances 0.000 claims description 3
- 208000032225 Proximal spinal muscular atrophy type 1 Diseases 0.000 claims 1
- 239000007788 liquid Substances 0.000 claims 1
- 208000032471 type 1 spinal muscular atrophy Diseases 0.000 claims 1
- 125000003835 nucleoside group Chemical group 0.000 description 93
- 241000699670 Mus sp. Species 0.000 description 91
- 239000008194 pharmaceutical composition Substances 0.000 description 85
- 230000000694 effects Effects 0.000 description 67
- 150000007523 nucleic acids Chemical class 0.000 description 57
- 108020004707 nucleic acids Proteins 0.000 description 56
- 102000039446 nucleic acids Human genes 0.000 description 56
- 238000001802 infusion Methods 0.000 description 54
- 238000002347 injection Methods 0.000 description 50
- 239000007924 injection Substances 0.000 description 50
- 238000000185 intracerebroventricular administration Methods 0.000 description 47
- WWFDJIVIDXJAQR-FFWSQMGZSA-N 1-[(2R,3R,4R,5R)-4-[[(2R,3R,4R,5R)-5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[(2R,3R,4R,5R)-3-[[(2R,3R,4R,5R)-5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[(2R,3R,4R,5R)-5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxy-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-sulfanylphosphoryl]oxy-4-(2-methoxyethoxy)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(2-amino-6-oxo-1H-purin-9-yl)-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(6-aminopurin-9-yl)-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(6-aminopurin-9-yl)-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(6-aminopurin-9-yl)-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(6-aminopurin-9-yl)-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-4-(2-methoxyethoxy)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(hydroxymethyl)-3-(2-methoxyethoxy)oxolan-2-yl]-5-methylpyrimidine-2,4-dione Chemical group COCCO[C@@H]1[C@H](O)[C@@H](COP(O)(=S)O[C@@H]2[C@@H](COP(S)(=O)O[C@@H]3[C@@H](COP(O)(=S)O[C@@H]4[C@@H](COP(O)(=S)O[C@@H]5[C@@H](COP(O)(=S)O[C@@H]6[C@@H](COP(O)(=S)O[C@@H]7[C@@H](COP(O)(=S)O[C@@H]8[C@@H](COP(O)(=S)O[C@@H]9[C@@H](COP(O)(=S)O[C@@H]%10[C@@H](COP(O)(=S)O[C@@H]%11[C@@H](COP(O)(=S)O[C@@H]%12[C@@H](COP(O)(=S)O[C@@H]%13[C@@H](COP(O)(=S)O[C@@H]%14[C@@H](COP(O)(=S)O[C@@H]%15[C@@H](COP(O)(=S)O[C@@H]%16[C@@H](COP(O)(=S)O[C@@H]%17[C@@H](COP(O)(=S)O[C@@H]%18[C@@H](CO)O[C@H]([C@@H]%18OCCOC)n%18cc(C)c(=O)[nH]c%18=O)O[C@H]([C@@H]%17OCCOC)n%17cc(C)c(N)nc%17=O)O[C@H]([C@@H]%16OCCOC)n%16cnc%17c(N)ncnc%16%17)O[C@H]([C@@H]%15OCCOC)n%15cc(C)c(N)nc%15=O)O[C@H]([C@@H]%14OCCOC)n%14cc(C)c(=O)[nH]c%14=O)O[C@H]([C@@H]%13OCCOC)n%13cc(C)c(=O)[nH]c%13=O)O[C@H]([C@@H]%12OCCOC)n%12cc(C)c(=O)[nH]c%12=O)O[C@H]([C@@H]%11OCCOC)n%11cc(C)c(N)nc%11=O)O[C@H]([C@@H]%10OCCOC)n%10cnc%11c(N)ncnc%10%11)O[C@H]([C@@H]9OCCOC)n9cc(C)c(=O)[nH]c9=O)O[C@H]([C@@H]8OCCOC)n8cnc9c(N)ncnc89)O[C@H]([C@@H]7OCCOC)n7cnc8c(N)ncnc78)O[C@H]([C@@H]6OCCOC)n6cc(C)c(=O)[nH]c6=O)O[C@H]([C@@H]5OCCOC)n5cnc6c5nc(N)[nH]c6=O)O[C@H]([C@@H]4OCCOC)n4cc(C)c(N)nc4=O)O[C@H]([C@@H]3OCCOC)n3cc(C)c(=O)[nH]c3=O)O[C@H]([C@@H]2OCCOC)n2cnc3c2nc(N)[nH]c3=O)O[C@H]1n1cnc2c1nc(N)[nH]c2=O WWFDJIVIDXJAQR-FFWSQMGZSA-N 0.000 description 35
- 230000004048 modification Effects 0.000 description 33
- 238000012986 modification Methods 0.000 description 33
- 210000002161 motor neuron Anatomy 0.000 description 32
- 108090000623 proteins and genes Proteins 0.000 description 32
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 30
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 28
- 238000002560 therapeutic procedure Methods 0.000 description 28
- 210000002569 neuron Anatomy 0.000 description 26
- 230000006698 induction Effects 0.000 description 25
- 102000004169 proteins and genes Human genes 0.000 description 25
- 201000010099 disease Diseases 0.000 description 24
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 24
- 230000014509 gene expression Effects 0.000 description 24
- 210000004556 brain Anatomy 0.000 description 23
- 210000000278 spinal cord Anatomy 0.000 description 23
- 238000012423 maintenance Methods 0.000 description 22
- 230000004083 survival effect Effects 0.000 description 22
- 210000001519 tissue Anatomy 0.000 description 22
- 108020004414 DNA Proteins 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- 101150081851 SMN1 gene Proteins 0.000 description 20
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 20
- 210000004027 cell Anatomy 0.000 description 19
- 230000009885 systemic effect Effects 0.000 description 19
- 150000001413 amino acids Chemical class 0.000 description 18
- 238000002474 experimental method Methods 0.000 description 18
- 238000001415 gene therapy Methods 0.000 description 18
- 230000008901 benefit Effects 0.000 description 17
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 16
- -1 bicyclic nucleoside Chemical class 0.000 description 16
- 230000002829 reductive effect Effects 0.000 description 16
- 239000011780 sodium chloride Substances 0.000 description 16
- 230000001225 therapeutic effect Effects 0.000 description 16
- 241000699666 Mus <mouse, genus> Species 0.000 description 14
- 229920001184 polypeptide Polymers 0.000 description 14
- 108090000765 processed proteins & peptides Proteins 0.000 description 14
- 102000004196 processed proteins & peptides Human genes 0.000 description 14
- 125000001424 substituent group Chemical group 0.000 description 14
- YIMATHOGWXZHFX-WCTZXXKLSA-N (2r,3r,4r,5r)-5-(hydroxymethyl)-3-(2-methoxyethoxy)oxolane-2,4-diol Chemical compound COCCO[C@H]1[C@H](O)O[C@H](CO)[C@H]1O YIMATHOGWXZHFX-WCTZXXKLSA-N 0.000 description 12
- 241000282693 Cercopithecidae Species 0.000 description 11
- 101150069235 Snrpn gene Proteins 0.000 description 11
- 239000003795 chemical substances by application Substances 0.000 description 11
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 11
- 210000003205 muscle Anatomy 0.000 description 11
- 239000008177 pharmaceutical agent Substances 0.000 description 11
- 239000002953 phosphate buffered saline Substances 0.000 description 11
- 241000282412 Homo Species 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 125000003729 nucleotide group Chemical group 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 230000000875 corresponding effect Effects 0.000 description 9
- 210000004291 uterus Anatomy 0.000 description 9
- 108700024394 Exon Proteins 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 238000009396 hybridization Methods 0.000 description 8
- 230000006872 improvement Effects 0.000 description 8
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- 239000002773 nucleotide Substances 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 238000010254 subcutaneous injection Methods 0.000 description 8
- 108091027974 Mature messenger RNA Proteins 0.000 description 7
- 230000027455 binding Effects 0.000 description 7
- 230000008499 blood brain barrier function Effects 0.000 description 7
- 210000001218 blood-brain barrier Anatomy 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 239000012530 fluid Substances 0.000 description 7
- 210000000663 muscle cell Anatomy 0.000 description 7
- 230000032405 negative regulation of neuron apoptotic process Effects 0.000 description 7
- 230000003955 neuronal function Effects 0.000 description 7
- 210000000056 organ Anatomy 0.000 description 7
- 238000003757 reverse transcription PCR Methods 0.000 description 7
- 239000007929 subcutaneous injection Substances 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 101710163270 Nuclease Proteins 0.000 description 6
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 6
- 239000003623 enhancer Substances 0.000 description 6
- 229910052698 phosphorus Inorganic materials 0.000 description 6
- 235000021092 sugar substitutes Nutrition 0.000 description 6
- 239000003765 sweetening agent Substances 0.000 description 6
- 238000011830 transgenic mouse model Methods 0.000 description 6
- 241000699660 Mus musculus Species 0.000 description 5
- 210000001124 body fluid Anatomy 0.000 description 5
- 239000010839 body fluid Substances 0.000 description 5
- 238000011260 co-administration Methods 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 239000003085 diluting agent Substances 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 5
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 238000010348 incorporation Methods 0.000 description 5
- 210000003140 lateral ventricle Anatomy 0.000 description 5
- 150000002632 lipids Chemical class 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 238000012545 processing Methods 0.000 description 5
- 230000001105 regulatory effect Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- 238000011269 treatment regimen Methods 0.000 description 5
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 4
- 208000026350 Inborn Genetic disease Diseases 0.000 description 4
- 101100203487 Mus musculus Smn1 gene Proteins 0.000 description 4
- 101100148113 Mus musculus Snrpn gene Proteins 0.000 description 4
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 4
- 108020005067 RNA Splice Sites Proteins 0.000 description 4
- RTKIYFITIVXBLE-UHFFFAOYSA-N Trichostatin A Natural products ONC(=O)C=CC(C)=CC(C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-UHFFFAOYSA-N 0.000 description 4
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 230000003111 delayed effect Effects 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 208000016361 genetic disease Diseases 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 210000005230 lumbar spinal cord Anatomy 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 230000007659 motor function Effects 0.000 description 4
- 238000001964 muscle biopsy Methods 0.000 description 4
- 239000011574 phosphorus Substances 0.000 description 4
- 238000003753 real-time PCR Methods 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 230000029058 respiratory gaseous exchange Effects 0.000 description 4
- 238000010561 standard procedure Methods 0.000 description 4
- 150000008163 sugars Chemical class 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- RTKIYFITIVXBLE-QEQCGCAPSA-N trichostatin A Chemical compound ONC(=O)/C=C/C(/C)=C/[C@@H](C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-QEQCGCAPSA-N 0.000 description 4
- 238000001262 western blot Methods 0.000 description 4
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 3
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 3
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical group OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 3
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 3
- 108091092195 Intron Proteins 0.000 description 3
- 108091005461 Nucleic proteins Proteins 0.000 description 3
- FTALBRSUTCGOEG-UHFFFAOYSA-N Riluzole Chemical compound C1=C(OC(F)(F)F)C=C2SC(N)=NC2=C1 FTALBRSUTCGOEG-UHFFFAOYSA-N 0.000 description 3
- 101150015954 SMN2 gene Proteins 0.000 description 3
- 230000001594 aberrant effect Effects 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000007385 chemical modification Methods 0.000 description 3
- 229940104302 cytosine Drugs 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000007717 exclusion Effects 0.000 description 3
- 210000004055 fourth ventricle Anatomy 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 229960001330 hydroxycarbamide Drugs 0.000 description 3
- 238000010255 intramuscular injection Methods 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 230000013011 mating Effects 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 150000004713 phosphodiesters Chemical class 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 229960004181 riluzole Drugs 0.000 description 3
- 230000000087 stabilizing effect Effects 0.000 description 3
- 210000002330 subarachnoid space Anatomy 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 210000000211 third ventricle Anatomy 0.000 description 3
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 3
- MSRILKIQRXUYCT-UHFFFAOYSA-M valproate semisodium Chemical compound [Na+].CCCC(C(O)=O)CCC.CCCC(C([O-])=O)CCC MSRILKIQRXUYCT-UHFFFAOYSA-M 0.000 description 3
- 229960000604 valproic acid Drugs 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- QGVQZRDQPDLHHV-DPAQBDIFSA-N (3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthrene-3-thiol Chemical compound C1C=C2C[C@@H](S)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 QGVQZRDQPDLHHV-DPAQBDIFSA-N 0.000 description 2
- ABEXEQSGABRUHS-UHFFFAOYSA-N 16-methylheptadecyl 16-methylheptadecanoate Chemical compound CC(C)CCCCCCCCCCCCCCCOC(=O)CCCCCCCCCCCCCCC(C)C ABEXEQSGABRUHS-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 125000000824 D-ribofuranosyl group Chemical group [H]OC([H])([H])[C@@]1([H])OC([H])(*)[C@]([H])(O[H])[C@]1([H])O[H] 0.000 description 2
- 101000746373 Homo sapiens Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 241000764238 Isis Species 0.000 description 2
- 241000282567 Macaca fascicularis Species 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 208000033522 Proximal spinal muscular atrophy type 2 Diseases 0.000 description 2
- 208000033526 Proximal spinal muscular atrophy type 3 Diseases 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 2
- 230000009102 absorption Effects 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 125000000304 alkynyl group Chemical group 0.000 description 2
- 210000000576 arachnoid Anatomy 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 230000003915 cell function Effects 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical group C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 210000002987 choroid plexus Anatomy 0.000 description 2
- 230000002354 daily effect Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 230000001934 delay Effects 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 150000002243 furanoses Chemical group 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 238000005417 image-selected in vivo spectroscopy Methods 0.000 description 2
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 238000012739 integrated shape imaging system Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 231100000518 lethal Toxicity 0.000 description 2
- 230000001665 lethal effect Effects 0.000 description 2
- 238000009593 lumbar puncture Methods 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 125000004437 phosphorous atom Chemical group 0.000 description 2
- 238000000554 physical therapy Methods 0.000 description 2
- 229920000768 polyamine Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- 208000022074 proximal spinal muscular atrophy Diseases 0.000 description 2
- 230000004202 respiratory function Effects 0.000 description 2
- 210000001324 spliceosome Anatomy 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- 210000000115 thoracic cavity Anatomy 0.000 description 2
- 229940113082 thymine Drugs 0.000 description 2
- 208000032521 type II spinal muscular atrophy Diseases 0.000 description 2
- 208000032527 type III spinal muscular atrophy Diseases 0.000 description 2
- 229940035893 uracil Drugs 0.000 description 2
- 230000003442 weekly effect Effects 0.000 description 2
- 230000004584 weight gain Effects 0.000 description 2
- 235000019786 weight gain Nutrition 0.000 description 2
- MDKGKXOCJGEUJW-VIFPVBQESA-N (2s)-2-[4-(thiophene-2-carbonyl)phenyl]propanoic acid Chemical compound C1=CC([C@@H](C(O)=O)C)=CC=C1C(=O)C1=CC=CS1 MDKGKXOCJGEUJW-VIFPVBQESA-N 0.000 description 1
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- 125000004400 (C1-C12) alkyl group Chemical group 0.000 description 1
- DIIIISSCIXVANO-UHFFFAOYSA-N 1,2-Dimethylhydrazine Chemical compound CNNC DIIIISSCIXVANO-UHFFFAOYSA-N 0.000 description 1
- LRANPJDWHYRCER-UHFFFAOYSA-N 1,2-diazepine Chemical compound N1C=CC=CC=N1 LRANPJDWHYRCER-UHFFFAOYSA-N 0.000 description 1
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- ZMZGFLUUZLELNE-UHFFFAOYSA-N 2,3,5-triiodobenzoic acid Chemical compound OC(=O)C1=CC(I)=CC(I)=C1I ZMZGFLUUZLELNE-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- OALHHIHQOFIMEF-UHFFFAOYSA-N 3',6'-dihydroxy-2',4',5',7'-tetraiodo-3h-spiro[2-benzofuran-1,9'-xanthene]-3-one Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 OALHHIHQOFIMEF-UHFFFAOYSA-N 0.000 description 1
- ACEMKCOYIINOHN-UHFFFAOYSA-N 5-methyl-1h-pyrimidine-2,4-dione;pyrimidine Chemical compound C1=CN=CN=C1.CC1=CNC(=O)NC1=O ACEMKCOYIINOHN-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- AXXVSCRPHPIDIW-UHFFFAOYSA-N 7h-purin-6-amine;7h-purine Chemical compound C1=NC=C2NC=NC2=N1.NC1=NC=NC2=C1NC=N2 AXXVSCRPHPIDIW-UHFFFAOYSA-N 0.000 description 1
- 208000035657 Abasia Diseases 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 229930186147 Cephalosporin Natural products 0.000 description 1
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- MPJKWIXIYCLVCU-UHFFFAOYSA-N Folinic acid Natural products NC1=NC2=C(N(C=O)C(CNc3ccc(cc3)C(=O)NC(CCC(=O)O)CC(=O)O)CN2)C(=O)N1 MPJKWIXIYCLVCU-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010062767 Hypophysitis Diseases 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108020004485 Nonsense Codon Proteins 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 229910003849 O-Si Inorganic materials 0.000 description 1
- 229910004679 ONO2 Inorganic materials 0.000 description 1
- REYJJPSVUYRZGE-UHFFFAOYSA-N Octadecylamine Chemical compound CCCCCCCCCCCCCCCCCCN REYJJPSVUYRZGE-UHFFFAOYSA-N 0.000 description 1
- 229910003872 O—Si Inorganic materials 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 102000006335 Phosphate-Binding Proteins Human genes 0.000 description 1
- 108010058514 Phosphate-Binding Proteins Proteins 0.000 description 1
- 108091036407 Polyadenylation Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 230000007022 RNA scission Effects 0.000 description 1
- 238000010240 RT-PCR analysis Methods 0.000 description 1
- 102000004598 Small Nuclear Ribonucleoproteins Human genes 0.000 description 1
- 108010003165 Small Nuclear Ribonucleoproteins Proteins 0.000 description 1
- 101150113275 Smn gene Proteins 0.000 description 1
- 101100054666 Streptomyces halstedii sch3 gene Proteins 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 240000002871 Tectona grandis Species 0.000 description 1
- JZRWCGZRTZMZEH-UHFFFAOYSA-N Thiamine Natural products CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N JZRWCGZRTZMZEH-UHFFFAOYSA-N 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- XVIYCJDWYLJQBG-UHFFFAOYSA-N acetic acid;adamantane Chemical compound CC(O)=O.C1C(C2)CC3CC1CC2C3 XVIYCJDWYLJQBG-UHFFFAOYSA-N 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 125000005600 alkyl phosphonate group Chemical group 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 125000005122 aminoalkylamino group Chemical group 0.000 description 1
- MDFFNEOEWAXZRQ-UHFFFAOYSA-N aminyl Chemical compound [NH2] MDFFNEOEWAXZRQ-UHFFFAOYSA-N 0.000 description 1
- PYKYMHQGRFAEBM-UHFFFAOYSA-N anthraquinone Natural products CCC(=O)c1c(O)c2C(=O)C3C(C=CC=C3O)C(=O)c2cc1CC(=O)OC PYKYMHQGRFAEBM-UHFFFAOYSA-N 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003178 anti-diabetic effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 239000003472 antidiabetic agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 208000025341 autosomal recessive disease Diseases 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- 229940125717 barbiturate Drugs 0.000 description 1
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N benzo-alpha-pyrone Natural products C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000008436 biogenesis Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 150000004648 butanoic acid derivatives Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- IVUMCTKHWDRRMH-UHFFFAOYSA-N carprofen Chemical compound C1=CC(Cl)=C[C]2C3=CC=C(C(C(O)=O)C)C=C3N=C21 IVUMCTKHWDRRMH-UHFFFAOYSA-N 0.000 description 1
- 229960003184 carprofen Drugs 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000006727 cell loss Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000004700 cellular uptake Effects 0.000 description 1
- 229940124587 cephalosporin Drugs 0.000 description 1
- 150000001780 cephalosporins Chemical class 0.000 description 1
- 210000003037 cerebral aqueduct Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 210000004289 cerebral ventricle Anatomy 0.000 description 1
- 210000004720 cerebrum Anatomy 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 108091006116 chimeric peptides Proteins 0.000 description 1
- 229960002155 chlorothiazide Drugs 0.000 description 1
- 150000001841 cholesterols Chemical class 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- 125000003716 cholic acid group Chemical group 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 230000008045 co-localization Effects 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 235000001671 coumarin Nutrition 0.000 description 1
- 150000004775 coumarins Chemical class 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 239000005549 deoxyribonucleoside Substances 0.000 description 1
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 239000003596 drug target Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 231100001129 embryonic lethality Toxicity 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 229960001395 fenbufen Drugs 0.000 description 1
- ZPAKPRAICRBAOD-UHFFFAOYSA-N fenbufen Chemical compound C1=CC(C(=O)CCC(=O)O)=CC=C1C1=CC=CC=C1 ZPAKPRAICRBAOD-UHFFFAOYSA-N 0.000 description 1
- LPEPZBJOKDYZAD-UHFFFAOYSA-N flufenamic acid Chemical compound OC(=O)C1=CC=CC=C1NC1=CC=CC(C(F)(F)F)=C1 LPEPZBJOKDYZAD-UHFFFAOYSA-N 0.000 description 1
- 229960004369 flufenamic acid Drugs 0.000 description 1
- 229940014144 folate Drugs 0.000 description 1
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 238000007306 functionalization reaction Methods 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 125000003827 glycol group Chemical group 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 210000004705 lumbosacral region Anatomy 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical class CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000000626 neurodegenerative effect Effects 0.000 description 1
- 208000018360 neuromuscular disease Diseases 0.000 description 1
- 210000000715 neuromuscular junction Anatomy 0.000 description 1
- 125000001893 nitrooxy group Chemical group [O-][N+](=O)O* 0.000 description 1
- 231100000989 no adverse effect Toxicity 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 231100000915 pathological change Toxicity 0.000 description 1
- 230000036285 pathological change Effects 0.000 description 1
- ONTNXMBMXUNDBF-UHFFFAOYSA-N pentatriacontane-17,18,19-triol Chemical compound CCCCCCCCCCCCCCCCC(O)C(O)C(O)CCCCCCCCCCCCCCCC ONTNXMBMXUNDBF-UHFFFAOYSA-N 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 229960002895 phenylbutazone Drugs 0.000 description 1
- VYMDGNCVAMGZFE-UHFFFAOYSA-N phenylbutazonum Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=CC=C1 VYMDGNCVAMGZFE-UHFFFAOYSA-N 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 210000003635 pituitary gland Anatomy 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 229960003101 pranoprofen Drugs 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 210000000449 purkinje cell Anatomy 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 125000002294 quinazolinyl group Chemical class N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 239000002342 ribonucleoside Substances 0.000 description 1
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 230000028527 righting reflex Effects 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000003584 silencer Effects 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229960004492 suprofen Drugs 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000011191 terminal modification Methods 0.000 description 1
- KYMBYSLLVAOCFI-UHFFFAOYSA-N thiamine Chemical compound CC1=C(CCO)SCN1CC1=CN=C(C)N=C1N KYMBYSLLVAOCFI-UHFFFAOYSA-N 0.000 description 1
- 235000019157 thiamine Nutrition 0.000 description 1
- 229960003495 thiamine Drugs 0.000 description 1
- 239000011721 thiamine Substances 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- ZMANZCXQSJIPKH-UHFFFAOYSA-O triethylammonium ion Chemical compound CC[NH+](CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-O 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- PJVWKTKQMONHTI-UHFFFAOYSA-N warfarin Chemical compound OC=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 PJVWKTKQMONHTI-UHFFFAOYSA-N 0.000 description 1
- 229960005080 warfarin Drugs 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7115—Nucleic acids or oligonucleotides having modified bases, i.e. other than adenine, guanine, cytosine, uracil or thymine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
- A61K48/0066—Manipulation of the nucleic acid to modify its expression pattern, e.g. enhance its duration of expression, achieved by the presence of particular introns in the delivered nucleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0075—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the delivery route, e.g. oral, subcutaneous
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/712—Nucleic acids or oligonucleotides having modified sugars, i.e. other than ribose or 2'-deoxyribose
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/315—Phosphorothioates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/352—Nature of the modification linked to the nucleic acid via a carbon atom
- C12N2310/3525—MOE, methoxyethoxy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/33—Alteration of splicing
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Epidemiology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Neurology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Dermatology (AREA)
- Hospice & Palliative Care (AREA)
- Pulmonology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Un compuesto antisentido que comprende oligonucleótido antisentido complementario al intrón 7 de un pre-ARNm que codifica SMN2 humano, para su uso en el tratamiento de un sujeto humano que tiene atrofia muscular espinal (SMA), donde el compuesto se administra en el líquido cefalorraquídeo en el espacio intratecal del sujeto humano, donde el oligonucleótido antisentido tiene una secuencia de nucleobases que consiste en la secuencia de nucleobases de SEQ ID NO: 1, donde cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado, donde cada resto de azúcar modificado es un resto de azúcar 2'-metoxietilo y donde cada enlace internucleosídico es un enlace de fosforotioato.
Description
DESCRIPCIÓN
Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto
LISTA DE SECUENCIAS
La presente solicitud se presenta junto con una Lista de Secuencias en formato electrónico. La Lista de Secuencias se proporciona como un fichero titulado 20100617_CORE0086WOSEQ.txt, creado el 17 de junio de 2010, tiene 5 Kb de tamaño.
ANTECEDENTES DE LA INVENCIÓN
Las moléculas de ARNm eucariotas recientemente sintetizadas, conocidas como transcripciones o pre-ARNm primarias, se procesan antes de la traducción. El procesamiento de los pre-ARNm incluye la adición de una caperuza metilada 5' y una cola poli(A) de aproximadamente 200-250 bases al extremo 3' de la transcripción. El procesamiento de ARNm a partir de pre-ARNm también implica frecuentemente el corte y empalme del pre-ARNm, lo cual ocurre en la maduración del 90-95% de los ARNm de mamífero. Los intrones (o secuencias intermedias) son regiones de un pre-ARNm (o el ADN que lo codifica) que no se incluyen en la secuencia de codificación del ARNm maduro. Los exones son regiones de una transcripción primaria que permanecen en el ARNm maduro. Los exones se cortan y empalman juntos para formar la secuencia de ARNm maduro. Las uniones de corte y empalme también se denominan como sitios de corte y empalme con el lado 5' de la unión denominado a menudo "sitio de corte y empalme 5'", o "sitio donante de corte y empalme" y el lado 3' del "sitio de corte y empalme 3'" o "sitio aceptor de corte y empalme". En el corte y empalme, el extremo 3' de un exón aguas arriba se une al extremo 5' del exón aguas abajo. Por lo tanto, el pre-ARNm sin corte y empalme tiene una unión de exón/intrón en el extremo 5' de un intrón de una unión de intrón/exón en el extremo 3' de un intrón. Después de que el intrón se elimina, los exones están contiguos en lo que a veces se denomina como la unión de exón/exón o límite en el ARNm maduro. Los sitios de corte y empalme crípticos son aquellos que son utilizados con menos frecuencia, pero que se pueden utilizar cuando el sitio de corte y empalme usual está bloqueado o no disponible. El corte y empalme alternativo, definido como el corte y empalme en conjunto de diferentes combinaciones de exones, con frecuencia da como resultado múltiples transcripciones de ARNm de un solo gen.
Hasta el 50% de enfermedades genéticas humanas que son resultado de una mutación puntual, dan como resultado un procesamiento aberrante de pre-ARNm. Dichas mutaciones puntuales pueden interrumpir un sitio de corte y empalme actual o crear un sitio de corte y empalme nuevo, dando como resultado transcripciones de ARNm compuestas por una combinación diferente de exones o con eliminaciones en los exones. Las mutaciones puntuales también pueden dar como resultado la activación de un sitio de corte y empalme críptico o interrumpir los elementos cis de regulación (es decir, potenciadores o silenciadores de corte y empalme (Cartegni et al., Nat. Rev. Genet., 2002, 3, 285-298; Drawczak et al., Hum. Genet., 1992, 90, 41-54). Los oligonucleótidos antisentido han sido utilizados para dirigir mutaciones que conducen a un corte y empalme aberrante en varias enfermedades genéticas, con el objeto de redirigir el corte y empalme para dar un producto de corte y empalme deseable (Kole, Acta Biochimica Polonica, 1997, 44, 231-238).
Los compuestos antisentido también se han utilizado para alterar la relación de variantes de corte y empalme alternativas de origen natural, tal como las formas largas y cortas del pre-ARNm de Bcl-x (Patente de Estados Unidos 6.172.216; Patente de Estados Unidos 6.214.986; Taylor et al., Nat. Biotechnol. 1999, 17, 1097-1100) o para forzar el salto de los exones específicos que contienen codones de terminación prematuros (Wilton et al., Neuromuscul. Disord., 1999, 9, 330-338). La Patente de Estados Unidos 5.627.274 y el documento WO 94/26887 describen composiciones y métodos para combatir el corte y empalme aberrante en una molécula de pre-ARNm que contiene una mutación que utiliza oligonucleótidos antisentido, que no activan ARNsa H.
La atrofia muscular espinal próxima, (SMA) es un trastorno neurodegenerativo, genético, caracterizado por la pérdida de neuronas motoras espinales. SMA es una enfermedad recesiva autosómica de aparición temprana, y actualmente es la causa principal de muerte entre infantes. La severidad de SMA varía entre pacientes y, por lo tanto, se ha clasificado en tres tipos. SMA de tipo I es la forma más grave con aparición en el momento del nacimiento o a los 6 meses, y típicamente da como resultado la muerte a los 2 años. Los niños con SMA de tipo I no tienen la capacidad de sentarse o caminar. SMA de tipo II es la forma intermedia y los pacientes tienen la capacidad de sentarse, pero no de ponerse en pie o caminar. Los pacientes con SMA de tipo III, una forma crónica de la enfermedad, típicamente desarrollan SMA después de los 18 meses de edad (Lefebvre et al., Hum. Mol. Genet., 1998, 7, 1531-1536).
La base molecular de SMA se origina por la pérdida tanto de copias del gen de supervivencia de la neurona motora 1 (SMN1), que también se conoce como SMN telomérico, una proteína que es parte de un complejo multiproteico considerado como implicado en la biogénesis y reciclaje de snRNP. Un gen casi idéntico, SMN2, que también puede conocerse como SMN Centromérico, existe en una región duplicada en el cromosoma 5q13 y modula la gravedad de la enfermedad. La expresión del gen SMN1 normal da como resultado únicamente la expresión de una proteína de supervivencia de la neurona motora (SMN). Aunque SMN1 y SMN2 tienen el potencial de codificar la misma proteína, SMN2 contiene una mutación silenciosa en la traducción en la posición 6 del exón 7, que da como resultado una inclusión ineficiente del exón 7 en las transcripciones de SMN2. Por lo tanto, la forma predominante de SMN2 es una versión truncada, que carece del exón 7, el cual es inestable e inactivo (Cartegni y Krainer, Nat. Genet., 2002, 30, 377-384). La expresión del gen SMN2 da como resultado aproximadamente del 10-20% de la proteína SMN y del 80-90% de la proteína SMN delta 7 no estable/no funcional. La proteína SMN desempeña una función bien establecida en el ensamblaje del espliceosoma y también puede transmitir el tráfico del ARNm en el axón y el extremo nervioso de las neuronas.
La tecnología antisentido es un medio eficaz para modular la expresión de uno o más productos génicos específicos, incluyendo productos de corte y empalme alternativos, y es útil únicamente en varias aplicaciones terapéuticas, de diagnóstico y de investigación. El principio detrás de la tecnología antisentido, es que un compuesto antisentido, que híbrida en un ácido nucleico diana, modula actividades de expresión genética tales como transcripción, corte y empalme o traducción a través de uno de varios mecanismos antisentido. La especificidad de secuencia de los compuestos antisentido los hace extremadamente atractivos como herramientas para validación de dianas y la funcionalización génica, así como productos terapéuticos para modular selectivamente la expresión de genes implicados en la enfermedad.
Se conocen en la técnica ciertos compuestos antisentido complementarios a SMN2. Véase, por ejemplo, el documento WO 2007/002390; Hua et al., American J. of Human Genetics (abril de 2008) 82, 1-15; Singh et al., RNA Bio. 6:3, 1-10 (2009). Ciertos compuestos antisentido y métodos descritos en el presente documento, poseen características deseables en comparación con los compuestos y métodos conocidos en la técnica. Se han descrito moléculas de ácido nucleico de péptido quimérico diseñadas para modular el corte y empalme de SMN2 y (documento WO 02/38738; Cartegni y Krainer, Nat. Struct. Biol., 2003, 10, 120-125). Hua Y et al (2008) The American Journal of Human Genetics 82: 834-848, describen compuestos antisentido que se dirigen al pre-ARNm de Smn2 humano, y su prueba de un efecto sobre la inclusión del exón 7 en ratones transgénicos SMN2 humanos.
RESUMEN DE LA INVENCIÓN
En un aspecto, la presente invención proporciona un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un pre-ARNm que codifica SMN2 humano, para su uso en el tratamiento de un sujeto humano que tiene atrofia muscular espinal (SMA), donde el compuesto se administra en el líquido cefalorraquídeo en el espacio intratecal del sujeto humano, donde el oligonucleótido antisentido tiene una secuencia de nucleobases que consiste en la secuencia de nucleobases de SEQ ID NO: 1, donde cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado, donde cada resto de azúcar modificado es un resto de azúcar 2'-metoxietilo y donde cada enlace internucleosídico es un enlace de fosforotioato.
La invención también proporciona el uso de un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un pre-ARNm que codifica SMN2 humano en la fabricación de un medicamento para su uso en el tratamiento de un sujeto humano que tiene atrofia muscular espinal (SMA), donde el medicamento se administra en el líquido cefalorraquídeo en el espacio intratecal del sujeto humano, donde el oligonucleótido antisentido tiene una secuencia de nucleobases que consiste en la secuencia de nucleobases de SEQ ID NO: 1, donde cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado, donde cada resto de azúcar modificado es un resto de azúcar 2'-metoxietilo y donde cada enlace internucleosídico es un enlace de fosforotioato.
Otros aspectos de la invención se exponen en las presentes reivindicaciones.
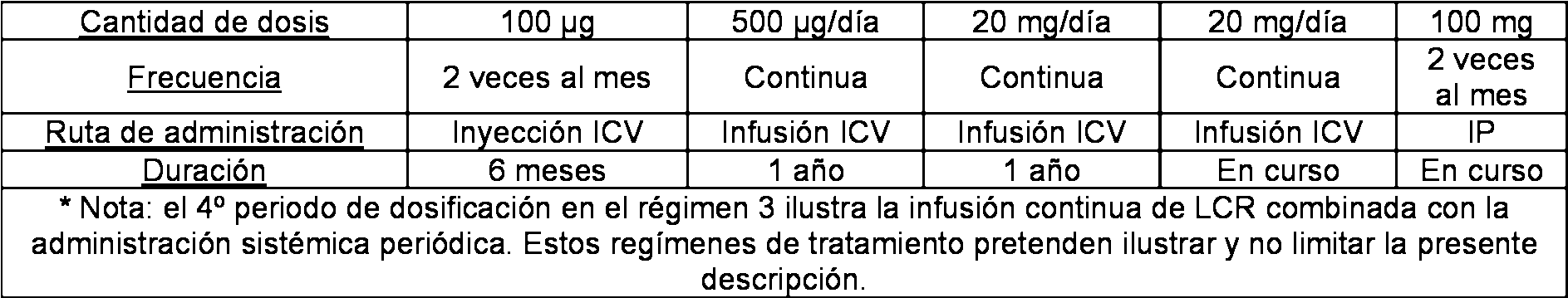
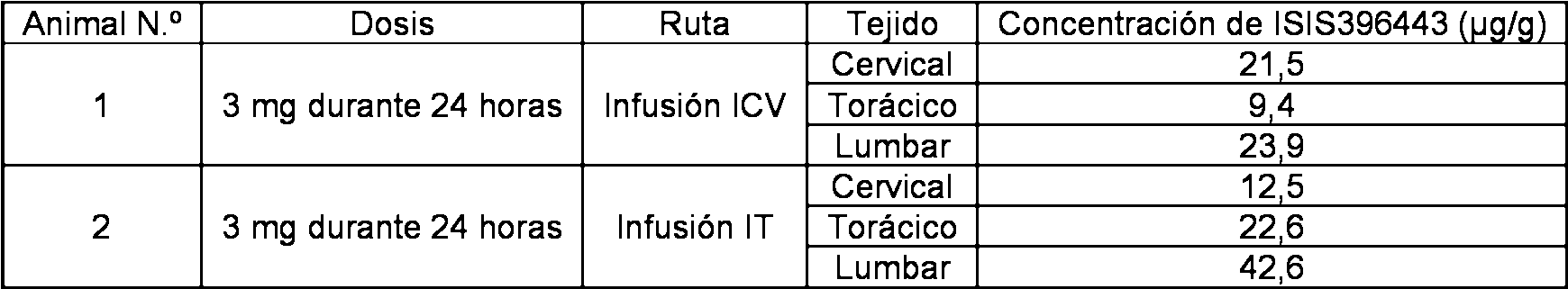
En ciertos casos, la presente divulgación proporciona métodos que comprenden administrar a un sujeto un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano pre-ARNm, donde el compuesto antisentido se administra en el líquido cefalorraquídeo. En ciertos casos, la administración es en el espacio intratecal. En ciertos casos, la administración es en el líquido cefalorraquídeo en el cerebro. En ciertos casos, la administración comprende un bolo intravenoso. En ciertos casos, la administración comprende una infusión con una bomba de administración.
En ciertos casos, el compuesto antisentido se administra a una dosis de 0,01 a 10 miligramos de compuesto
antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,01 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,01 a 5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,05 a 1 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,01 a 0,5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,05 a 0,5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
En ciertos casos, la dosis se administra a diario. En ciertos casos, la dosis se administra semanalmente. En ciertos casos, el compuesto antisentido se administra continuamente y donde la dosis es la cantidad administra al día. En ciertos casos, el método comprende administrar al menos una dosis de inducción durante una fase de inducción y administrar al menos una dosis de mantenimiento durante una fase de mantenimiento. En ciertos casos, la dosis de inducción es de 0,05 a 5,0 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis de mantenimiento es de 0,01 a 1,0 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la duración de la fase de inducción es de al menos 1 semana. En ciertos casos, la duración de la fase de mantenimiento es de al menos 1 semana. En ciertos casos, cada dosis de inducción y cada dosis de mantenimiento comprende una única inyección. En ciertos casos, cada dosis de inducción y cada dosis de mantenimiento comprenden independientemente dos o más inyecciones. En ciertos casos, el compuesto antisentido se administra al menos 2 veces durante un periodo de tratamiento de al menos 1 semana. En ciertos casos, el periodo de tratamiento es de al menos un mes. En ciertos casos, el periodo de tratamiento es de al menos 2 meses. En ciertos casos, el periodo de tratamiento es de al menos 4 meses. En ciertos casos, la dosis de inducción se administra por uno o más bolos intravenosos y la dosis de mantenimiento se administra mediante una bomba de infusión.
En ciertos casos, el método comprende evaluar la tolerabilidad y/o la eficacia del compuesto antisentido. En ciertos casos, la cantidad de dosis o frecuencia del compuesto antisentido se reduce después de una indicación de que la administración del compuesto antisentido no se tolera. En ciertos casos, la cantidad de dosis o frecuencia del compuesto antisentido se mantiene o se reduce tras una indicación de que la administración del compuesto antisentido es eficaz. En ciertos casos, la dosis de compuesto antisentido se aumenta después de una indicación de que la administración del compuesto antisentido no es eficaz. En ciertos casos, la frecuencia de administración del compuesto antisentido se reduce tras una indicación de que la administración del compuesto antisentido es eficaz. En ciertos casos, la frecuencia de administración del compuesto antisentido se aumenta después de una indicación de que la administración del compuesto antisentido no es eficaz.
En ciertos casos, los métodos comprenden la coadministración del compuesto antisentido y al menos otra terapia. En ciertos casos, un compuesto antisentido y al menos otra terapia se coadministran al mismo tiempo. En ciertos casos, un compuesto antisentido se administra antes de la administración de la al menos otra terapia. En ciertos casos, un compuesto antisentido se administra después de la administración de la al menos otra terapia. En ciertos casos, la al menos otra terapia comprende la administración de uno o más de ácido valproico, riluzol, hidroxiurea y butirato. En ciertos casos, al menos otra terapia comprende la administración de tricostatina A. En ciertos casos, la al menos otra terapia comprende la administración de células madre. En ciertos casos, al menos otra terapia es una terapia génica. En ciertos casos, la terapia génica se administra al LCR y un compuesto antisentido se administra por vía sistémica. En ciertos casos, la terapia génica se administra al LCR y un compuesto antisentido se administra por vía sistémica y al LCR. En ciertos casos, la descripción proporciona regímenes de tratamiento en los que inicialmente, se administra un compuesto antisentido al LCR y por vía sistémica, seguido de la administración de terapia génica al LCR y la administración sistémica del compuesto antisentido. En ciertos casos de este tipo, el sujeto es un infante en el momento del tratamiento inicial. En ciertos casos de este tipo, el sujeto tiene menos de 2 años. En ciertos casos, el compuesto antisentido se administra al SNC de un sujeto hasta que el sujeto tiene la edad suficiente para la terapia génica. En ciertos casos, el compuesto antisentido se administra por vía sistémica.
En ciertos casos, el compuesto antisentido se administra a una concentración de aproximadamente 0,01 mg/ml, aproximadamente 0,05 mg/ml, aproximadamente 0,1 mg/ml, aproximadamente 0,5 mg/ml, aproximadamente 1 mg/ml, aproximadamente 5 mg/ml, aproximadamente 10 mg/ml, aproximadamente 50 mg/ml, o aproximadamente 100 mg/ml.
En ciertos casos, la inclusión del exón 7 del ARNm de SMN2 en una neurona motora en el sujeto se aumenta. En ciertos casos, la inclusión de los aminoácidos del exón 7 en el polipéptido SMN2 en una neurona motora en el sujeto se aumenta.
En ciertos casos, la descripción proporciona métodos para aumentar la inclusión del exón 7 del ARNm de SMN2 en una neurona motora en un sujeto que comprende administrar al sujeto un compuesto antisentido que comprende un
oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano, y aumentar de este modo la inclusión del exón 7 del ARNm de SMN2 en la neurona motora en el sujeto.
En ciertos casos, la descripción proporciona métodos para aumentar la inclusión de los aminoácidos de exón 7 en el polipéptido SMN2 en una neurona motora en un sujeto que comprende administrar al sujeto un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano, y aumentar de este modo la inclusión de los aminoácidos del exón 7 en el polipéptido SMN2 en la neurona motora en el sujeto.
En ciertos casos, el sujeto tiene SMA. En ciertos casos, el sujeto tiene SMA de tipo I. En ciertos casos, el sujeto tiene SMA de tipo II. En ciertos casos, el sujeto tiene SMA de tipo III.
En ciertos casos, una primera dosis se administra en el útero. En ciertos casos, la primera dosis se administra antes de completar la formación de la barrera hematoencefálica. En ciertos casos, una primera dosis se administra dentro de la primera semana del nacimiento del sujeto. En ciertos casos, una primera dosis se administra dentro del primer mes del nacimiento del sujeto. En ciertos casos, una primera dosis se administra dentro de los 3 meses del nacimiento del sujeto. En ciertos casos, una primera dosis se administra dentro de los 6 meses del nacimiento del sujeto. En ciertos casos, una primera dosis se administra cuando el sujeto tiene de 1 a 2 años de edad. En ciertos casos, una primera dosis se administra cuando el sujeto tiene de 1 a 15 años de edad. En ciertos casos, una primera dosis se administra cuando el sujeto es mayor de 15 años de edad.
En ciertos casos, el sujeto es un mamífero. En ciertos casos, el sujeto es un ser humano.
En ciertos casos, los métodos comprenden identificar un sujeto que tiene SMA. En ciertos casos, el sujeto se identifica midiendo la actividad eléctrica de uno o más músculos del sujeto. En ciertos casos, el sujeto se identifica por una prueba genética para determinar si el sujeto tiene una mutación en el gen SMN1 del sujeto. En ciertos casos, el sujeto se identifica por biopsia muscular.
En ciertos casos, la administración del compuesto antisentido da como resultado un aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 de al menos el 10%. En ciertos casos, el aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 es de al menos el 20%. En ciertos casos, el aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 es de al menos el 50%. En ciertos casos, la cantidad de ARNm de SMN2 que tiene el exón 7 es de al menos el 70%.
En ciertos casos, la administración del compuesto antisentido da como resultado un aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 de al menos el 10%. En ciertos casos, donde el aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 es de al menos el 20%. En ciertos casos, el aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 es de al menos el 50%. En ciertos casos, el aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 es de al menos el 70%. En ciertos casos, la administración del compuesto antisentido mejora al menos un síntoma de SMA en el sujeto. En ciertos casos, la administración del compuesto antisentido da como resultado una función motora mejorada en el sujeto. En ciertos casos, la administración del compuesto antisentido da como resultado una pérdida de la función motora retrasada o reducida en el sujeto. En ciertos casos, la administración del compuesto antisentido da como resultado una función respiratoria mejorada. En ciertos casos, la administración del compuesto antisentido da como resultado una mejora de la supervivencia.
En ciertos casos, al menos un nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado. En ciertos casos, al menos un resto de azúcar modificado comprende un resto de azúcar 2'-metoxietilo. En ciertos casos, esencialmente cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado. En ciertos casos, los nucleósidos que comprenden un resto de azúcar modificado comprenden todos la misma modificación de azúcar. En ciertos casos, donde cada resto de azúcar modificado comprende un resto de azúcar 2'-metoxietilo. En ciertos casos, cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado. En ciertos casos, todos los nucleósidos comprenden la misma modificación de azúcar. En ciertos casos, cada resto de azúcar modificado comprende un resto de azúcar 2'-metoxietilo. En ciertos casos, al menos un enlace internucleosídico es un enlace internucleosídico de fosforotioato. En ciertos casos, cada enlace internucleosídico es un enlace internucleosídico de fosforotioato.
En ciertos casos, el oligonucleótido antisentido consiste en 10 a 25 nucleósidos unidos. En ciertos casos, el oligonucleótido antisentido consiste en 12 a 22 nucleósidos unidos. En ciertos casos, el oligonucleótido antisentido
consiste en 15 a 20 nucleósidos unidos. En ciertos casos, el oligonucleótido antisentido consiste en 18 nucleósidos unidos.
En ciertos casos, el oligonucleótido antisentido es al menos un 90% complementario al ácido nucleico que codifica SMN2 humano. En ciertos casos, el oligonucleótido antisentido es completamente complementario al ácido nucleico que codifica SMN2 humano. En ciertos casos, el oligonucleótido tiene una secuencia de nucleobases que comprende al menos 10 nucleobases contiguas de la secuencia de nucleobases de SEQ ID NO: 1. En ciertos casos, el oligonucleótido tiene una secuencia de nucleobases que comprende al menos 15 nucleobases contiguas de la secuencia de nucleobases de SEQ ID NO: 1. En ciertos casos, el oligonucleótido tiene una secuencia de nucleobases que comprende la secuencia de nucleobases de SEQ ID NO: 1. En ciertos casos, el oligonucleótido tiene una secuencia de nucleobases que consiste en la secuencia de nucleobases de SEQ ID NO: 1.
En ciertos casos, el compuesto antisentido comprende un grupo conjugado o grupo terminal.
En ciertos casos, el compuesto antisentido consiste en el oligonucleótido antisentido.
En ciertos casos, el compuesto antisentido también se administra por vía sistémica. En ciertos casos, la administración sistémica es por inyección intravenosa o intraperitoneal. En ciertos casos, la administración sistémica y la administración al sistema nervioso central se realizan al mismo tiempo. En ciertos casos, la administración sistémica y la administración al sistema nervioso central se realizan en diferentes momentos.
En ciertos casos, la descripción proporciona la administración sistémica de compuestos antisentido, en solitario o junto con la administración al LCR. En ciertos casos, las composiciones farmacéuticas se administran por vía sistémica. En ciertos casos, las composiciones farmacéuticas se administran por vía subcutánea. En ciertos casos, las composiciones farmacéuticas se administran por vía intravenosa. En ciertos casos, las composiciones farmacéuticas se administran por inyección intramuscular.
En ciertos casos, las composiciones farmacéuticas se administran tanto directamente al LCR (por ejemplo, inyección IT y/o ICV y/o infusión) como por vía sistémica.
En ciertos casos, la descripción proporciona métodos para administrar a un sujeto que tiene al menos un síntoma asociado con SMA, al menos una dosis de un compuesto antisentido que comprende un oligonucleótido que consiste en 15 a 20 nucleósidos unidos y que tiene una secuencia de nucleobases que es complementaria al 100% con la SEQ ID NO. 7 en toda su longitud, y donde cada nucleósido es un nucleósido modificado por 2'-MOE; y donde al menos una dosis se administra entre 0,1 mg/kg y 5 mg/kg al LCR. En ciertos casos de este tipo, la dosis es entre 0,5 mg/kg y 2 mg/kg. En ciertos casos, al menos una dosis se administra por bolo intravenoso. En ciertos casos de este tipo, la dosis se administra por inyección de bolo intratecal. En ciertos casos, se administra al menos una segunda dosis. En ciertos casos de este tipo, la segunda dosis se administra al menos 2 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 4 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 8 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 12 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 16 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 20 semanas después de la primera dosis. En ciertos casos, el sujeto tiene menos de 2 años de edad en el momento de la primera dosis. En ciertos casos, el sujeto tiene entre 2 y 15 años de edad. En ciertos casos, el sujeto tiene entre 15 y 30 años de edad. En ciertos casos, el sujeto tiene más de 30 años de edad. En ciertos casos, al menos un síntoma asociado con SMA se reduce o su progresión se ha ralentizado. En ciertos casos, el oligonucleótido es ISIS396443.
En ciertos casos, la descripción proporciona métodos para administrar a un sujeto que tiene al menos un síntoma asociado con SMA, al menos una dosis de un compuesto antisentido que comprende un oligonucleótido que consiste en 15 a 20 nucleósidos unidos y que tiene una secuencia de nucleobases que comprende que es complementario al 100% con la SEQ ID NO. 7 en toda su longitud, y donde cada nucleósido es un nucleósido modificado por 2'-MOE; y donde al menos una dosis se administra por vía sistémica. En ciertos casos de este tipo, al menos una dosis se administra por bolo intravenoso. En ciertos casos de este tipo, la dosis se administra por inyección de bolo intravenoso. En ciertos casos, la dosis administrada es entre 0,5 mg/kg y 50 mg/kg. En ciertos casos, la dosis es entre 1 mg/kg y 10 mg/kg. En ciertos casos, la dosis es entre 1 mg/kg y 5 mg/kg. En ciertos casos, la dosis es entre 0,5 mg/kg y 1 mg/kg. En ciertos casos, se administra al menos una segunda dosis. En ciertos casos de este tipo, la segunda dosis se administra al menos 2 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 4 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 8 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al
menos 12 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 16 semanas después de la primera dosis. En ciertos casos, la segunda dosis se administra al menos 20 semanas después de la primera dosis. En ciertos casos, el sujeto tiene menos de 2 años de edad en el momento de la primera dosis. En ciertos casos, el sujeto tiene entre 2 y 15 años de edad. En ciertos casos, el sujeto tiene entre 15 y 30 años de edad. En ciertos casos, el sujeto tiene más de 30 años de edad. En ciertos casos, al menos un síntoma asociado con SMA se reduce o su progresión se ha ralentizado. En ciertos casos, el oligonucleótido es ISIS396443.
En ciertos casos, la descripción proporciona métodos para administrar a un sujeto que tiene al menos un síntoma asociado con SMA, al menos una dosis al LCR y al menos una dosis sistémica de un compuesto antisentido que comprende un oligonucleótido que consiste en 15 a 20 nucleósidos unidos y que tiene una secuencia de nucleobases que es complementaria al 100% con la SEQ ID NO. 7 en toda su longitud, y donde cada nucleósido es un nucleósido modificado por 2'-MOE. En ciertos casos de este tipo, la dosis al LCR es entre 0,1 mg/kg y 5 mg/kg. En ciertos casos, la dosis sistémica es entre 0,5 mg/kg y 50 mg/kg. En ciertos casos, al menos una dosis al LCR se administra por bolo intravenoso. En ciertos casos de este tipo, al menos una dosis al LCR se administra por inyección de bolo intratecal. En ciertos casos, al menos una dosis sistémica se administra por bolo intravenoso. En ciertos casos de este tipo, al menos una dosis sistémica se administra por inyección subcutánea. En ciertos casos, la dosis al LCR y la dosis sistémica se administran al mismo tiempo. En ciertos casos, la dosis al LCR y la dosis sistémica se administran en momentos diferentes. En ciertos casos, el sujeto tiene menos de 2 años de edad en el momento de la primera dosis. En ciertos casos, el sujeto tiene entre 2 y 15 años de edad. En ciertos casos, el sujeto tiene entre 15 y 30 años de edad. En ciertos casos, el sujeto tiene más de 30 años de edad. En ciertos casos, al menos un síntoma asociado con SMA se reduce o su progresión se ha ralentizado. En ciertos casos, el oligonucleótido es ISIS396443.
En ciertos casos, la descripción proporciona métodos para administrar a un sujeto que tiene al menos un síntoma asociado con SMA, al menos una dosis sistémica de un compuesto antisentido que comprende un oligonucleótido que consiste en 15 a 20 nucleósidos unidos y que tiene una secuencia de nucleobases que es complementaria al 100% con la SEQ ID NO. 7 en toda su longitud, y donde cada nucleósido es un nucleósido modificado por 2'-MOE; y al menos una dosis de un agente de terapia génica. En ciertos casos, la dosis sistémica es entre 0,5 mg/kg y 50 mg/kg. En ciertos casos, al menos una dosis sistémica se administra por bolo intravenoso. En ciertos casos de este tipo, al menos una dosis sistémica se administra por inyección subcutánea. En ciertos casos, la dosis sistémica y el agente de terapia génica se administran al mismo tiempo. En ciertos casos, la dosis sistémica y el agente de terapia génica se administran en momentos diferentes. En ciertos casos, el agente de terapia génica se administra al lCr . En ciertos casos de este tipo, el agente de terapia génica se administra por inyección intratecal y/o infusión. En ciertos casos de este tipo, el agente de terapia génica se administra por inyección intracerebroventricular y/o infusión. En ciertos casos, el sujeto tiene menos de 2 años de edad en el momento de la primera dosis. En ciertos casos, el sujeto tiene entre 2 y 15 años de edad. En ciertos casos, el sujeto tiene entre 15 y 30 años de edad. En ciertos casos, el sujeto tiene más de 30 años de edad. En ciertos casos, al menos un síntoma asociado con SMA se reduce o su progresión se ha ralentizado. En ciertos casos, el oligonucleótido es ISIS396443.
En ciertos casos, la descripción proporciona métodos para seleccionar un sujeto que tenga al menos un síntoma asociado con SMA y administrar un compuesto antisentido de acuerdo con cualquiera de los métodos anteriores. En ciertos casos de este tipo, al menos un síntoma de SMA se evalúa después de la administración. En ciertos casos de este tipo, se mejora al menos un síntoma de SMA. En ciertos casos de este tipo, al menos un síntoma de SMA no progresa o progresa más lentamente en comparación con un sujeto que no ha recibido la administración de un compuesto antisentido.
En ciertos casos, la descripción proporciona un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano, para su uso en cualquier de los métodos anteriores. En ciertos casos, la descripción proporciona tal compuesto para su uso en el tratamiento de una enfermedad o afección asociada con la supervivencia de la neurona motora 1 (SMN1).
En ciertos casos, la descripción proporciona uso de un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano en la fabricación de un medicamento, para su uso en cualquier de los métodos anteriores. En ciertos casos, el medicamento es para tratar una enfermedad o afección asociada con la supervivencia de la neurona motora 1 (SMN1).
BREVE DESCRIPCIÓN DE LAS FIGURAS
La figura 1 muestra resultados de la duración de acción del estudio descrito en el Ejemplo 4, en el que el porcentaje de SMN2 que incluye el exón 7 (eje y) se evaluó a las 0, 2, 4, 6, y 8 semanas después de la terminación de 7 días de
tratamiento (eje x). La muestra de la semana "0" se tomó el 1 día después de la terminación del tratamiento. CON representa ratones tratados con solución salina. No hubo diferencia en el % de inclusión entre ratones tratados con solución salina de control en diferentes puntos de tiempo de 0 a 6 meses.
La figura 2 muestra resultados de la duración de acción de un estudio descrito en el Ejemplo 4, en el que se evaluó el porcentaje de SMN2 que incluye el exón 7 a los 0, 0,5, 1, 2, 5, y 6 meses después de la terminación de 7 días de tratamiento. La muestra del mes "0" se tomó el 1 día después de la terminación del tratamiento. CON representa ratones tratados con solución salina. No hubo diferencia en el % de inclusión entre ratones tratados con solución salina de control en diferentes puntos de tiempo de 0 a 6 meses.
La figura 3 muestra los resultados de un experimento analizado en el Ejemplo 6 que mide el efecto de la administración embrionaria de ISIS396443 en la longitud de la cola en la cepa de ratones con SMA de Taiwán. La figura 3A muestra el primero de dichos experimentos y la figura 3B muestra un experimento repetido que puede probar una concentración diferente de compuesto antisentido, como se observa, y que incluye datos de ratones normales para comparación.
La figura 4 muestra resultados de western blots analizados en el Ejemplo 7. El eje Y es el porcentaje de SMN en las diversas muestras que incluyen el exón 7.
Las figuras 5 y 6 muestran resultados de experimentos analizados en el Ejemplo 7. Se realizaron varias evaluaciones de ratones con SMA (cepa de Taiwán) después del tratamiento con un compuesto antisentido o con un nucleótido de control.
La figura 7 muestra una curva de supervivencia de un experimento analizado en el Ejemplo 7.
La figura 8 muestra resultados de una evaluación de varias neuronas motoras en diferentes porciones de médula espinal, después del tratamiento con un compuesto antisentido o con un oligonucleótido de control, como se describe en el Ejemplo 7.
La figura 9 muestra resultados de una evaluación de un ARN de SMN completo (incluyendo exón 7) en animales tratados con antisentido, como se analiza en el Ejemplo 7.
La figura 10 muestra la curva de supervivencia de un experimento analizado en el Ejemplo 7, en el que los animales (1) estaban sin tratar; (2) se les administró una dosis simple de compuesto antisentido al nacer (Día P0); o (3) se les administró una primera dosis en P0 y una segunda dosis el día 21 (P21).
La figura 11 muestra una curva de supervivencia de un experimento descrito en el Ejemplo 7, que compara animales que recibieron la segunda dosis con animales que recibieron únicamente la primera dosis.
La figura 12 muestra resultados de un experimento analizado en el Ejemplo 9, en el que se administró el compuesto antisentido a monos mediante infusión intratecal y la concentración del compuesto se evaluó en diferentes tejidos después de 96 horas.
La figura 13 muestra una curva de supervivencia para los experimentos analizados en el Ejemplo 12, en los que se administran diferentes de compuesto antisentido a ratones con SMA grave mediante inyección subcutánea.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN
Debe interpretarse que tanto la descripción general anterior como la siguiente descripción detallada son solamente ejemplares y explicativos, y no restringen la invención, según se reivindica. En el presente documento, el uso del singular incluye el plural, a menos que se indique específicamente otra cosa. Como se usa en el presente documento, el uso de "o" significa "y/o" a menos que se indique otra cosa. Además, el uso del término "que incluye", así como otras formas, tales como "incluye" e "incluido", no es limitante. Además, términos tales como "elemento" o "componente" incluyen tanto elementos como componentes que comprenden una unidad y elementos y componentes que comprenden más de una subunidad a menos que se indique específicamente otra cosa.
Los encabezados de sección utilizados en el presente documento son solo para fines organizativos y no deben interpretarse como limitantes de la materia objeto descrita.
I. Definiciones
A menos que se proporcionen definiciones específicas, la nomenclatura utilizada en relación con los procedimientos y técnicas química analítica, química orgánica sintética y química medicinal y farmacéutica que se describe en el presente documento es la bien conocida y usada comúnmente en la técnica. Las técnicas estándar pueden usarse para síntesis químicas, y análisis químico. Se pueden encontrar ciertas técnicas y procedimientos de este tipo, por ejemplo, en "Carbohydrate Modifications in Antisense Research" Editado por Sangvi y Cook, American Chemical Society, Washington D.C., 1994; "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, Pa., 18a edición, 1990; y "Antisense Drug Technology, Principles, Strategies, and Applications" Editado por Stanley T. Crooke, CRC Press, Boca Raton, Florida; y Sambrook et al., "Molecular Cloning, A laboratory Manual", 2a Edición, Cold Spring Harbor Laboratory Press, 1989.
A menos que se indique otra cosa, los siguientes términos tienen los siguientes significados:
"Nucleósido" significa un compuesto que comprende un resto de base heterocíclica y un resto de azúcar. Los nucleósidos incluyen, pero sin limitación, nucleósidos de origen natural, nucleósidos modificados, y nucleósidos que tienen bases miméticas y/o grupos de azúcar. Los nucleósidos pueden ser modificados con cualquiera de una diversidad de sustituyentes.
El "resto de azúcar" significa un azúcar o sustituto de azúcar natural o modificado.
"Azúcar natural" significa un resto de ribofuranosa de ADN (2'-H) o ARN (2'-OH).
"Azúcar modificado" significa un resto de ribofuranosa que comprende al menos un sustituyente diferente de un azúcar natural.
"Sustituto de azúcar" significa una estructura diferente de un anillo de ribofuranosa, que tiene la capacidad de sustituir el azúcar de un nucleósido. Los ejemplos de sustitutos de azúcar incluyen, pero sin limitación, sistemas de apertura de anillo, anillos de 6 miembros, azúcares en los que el oxígeno se reemplaza con, por ejemplo, azufre o nitrógeno. Por ejemplo, los sustitutos de azúcar incluyen, pero sin limitación, morfolinos y azúcares que contienen 4'-tio.
"Nucleobase" significa la porción base heterocíclica de un nucleósido. Las nucleobases pueden ser de origen natural o pueden ser modificadas. En ciertos casos, una nucleobase puede comprender cualquier átomo o grupo de átomos con la capacidad de que el hidrógeno se una a una nucleobase de otro ácido nucleico.
El "nucleótido" significa un nucleósido que comprende un grupo de unión a fosfato. Como se usa en el presente documento, los nucleósidos incluyen nucleótidos.
El "nucleósido modificado" es un nucleósido que comprende al menos una modificación comparada con nucleósidos de ARN o ADN de origen natural. Dicha modificación puede estar en el resto de azúcar y/o en la nucleobase.
El "nucleósido bicíclico" o "BNA" significa un nucleósido, donde el resto de azúcar del nucleósido comprende un puente que conecta dos átomos de carbono del anillo de azúcar, formando de este modo un resto de azúcar bicíclica.
"Nucleósido bicíclico 4'-2'" significa un nucleósido bicíclico que comprende un anillo de furanosa que comprende un puente que conecta dos átomos de carbono del anillo de furanosa que conecta el átomo de carbono 2' y el átomo de carbono 4' del anillo de azúcar.
"Modificado en 2'" o "2'-sustituido" significa un nucleósido que un azúcar que comprende un sustituyente en la posición 2' diferente a H u OH.
"2'-OMe" o "2 -OCH3" o "2'-O-metilo" significa cada uno un nucleósido que comprende un azúcar que comprende un grupo -OCH3 en la posición 2' del anillo de azúcar.
"MOE" o "2'-MOE" o "2'-OCH2CH2OCH3" o "2'-O-metoxietilo" significa cada uno un nucleósido que comprende un azúcar que comprende un grupo -OCH2 CH2 OCH3 en la posición 2' del anillo de azúcar.
"Oligonucleótido" significa un compuesto que comprende una pluralidad de nucleósidos unidos. En ciertos casos, una o más de la pluralidad de nucleósidos está modificada. En ciertos casos, un oligonucleótido comprende uno o más ribonucleósidos (ARN) y/o desoxirribonucleósidos (ADN).
"Oligonucleósido" significa un oligonucleótido en el que ninguno de los enlaces de internucleósido contiene un átomo de fósforo. Como se usa en el presente documento, oligonucleótidos incluye oligonucleósidos.
"Oligonucleótido modificado" significa un oligonucleótido que comprende al menos un nucleósido modificado y/o al menos un enlace de internucleósido modificado.
"Enlace de internucleósido" significa un enlace covalente entre los nucleósidos adyacentes de un oligonucleótido. "Enlace de internucleósido de origen natural" significa un enlace de fosfodiéster de 3' a 5'.
"Enlace de internucleósido modificado" significa cualquier enlace de internucleósido además de un enlace de internucleósido de origen natural.
"Compuesto oligomérico" significa un compuesto que comprende un oligonucleótido. En ciertos casos, un compuesto oligomérico consiste en un oligonucleótido. En ciertos casos, el compuesto oligomérico comprende además uno o más grupos conjugados y/o terminales.
"Compuesto antisentido" significa un compuesto oligomérico, al menos una porción del cual es al menos parcialmente complementaria con un ácido nucleico diana con el que se híbrida, donde dicha hibridación da como resultado al menos una actividad antisentido.
"Oligonucleótido antisentido" significa un compuesto antisentido donde el compuesto oligomérico consiste en un oligonucleótido.
"Actividad antisentido" se refiere a cualquier efecto detectable y/o medible atribuible a la hibridación de un compuesto antisentido con su ácido nucleico diana. En ciertos casos, dicha actividad antisentido es un aumento o disminución en una cantidad de ácido nucleico o proteína. En ciertos casos, dicha actividad antisentido es un cambio en la relación de variantes de corte y empalme de un ácido nucleico o proteína. En ciertos casos, dicha actividad antisentido es un cambio fenotípico en una célula y/o sujeto.
"Detección" o "medición" de la actividad antisentido puede ser directa o indirecta. Por ejemplo, en ciertos casos, la actividad antisentido se evalúa detectando y/o midiendo la cantidad de ácido nucleico o proteína diana o las cantidades relativas de las variantes de corte y empalme de un ácido nucleico o proteína diana. En ciertos casos, la actividad antisentido se detecta observando un cambio fenotípico en una célula o animal. En relación con cualquier actividad, respuesta o efecto, los términos "detectar" y "medir", indican que se realiza una prueba de detección o medición. Dicha detección y/o medición puede incluir valores de cero. Por lo tanto, si una prueba de detección o medición da como resultado un hallazgo de una falta de actividad (actividad de cero), no obstante, se ha realizado la etapa para detectar o medir la actividad.
"Ácido nucleico diana" se refiere a cualquier molécula de ácido nucleico cuya expresión, cantidad, o actividad tiene la capacidad de modularse a través de un compuesto antisentido.
"ARNm diana" significa una molécula de ARN preseleccionada que codifica una proteína.
"pre-ARNm diana" significa una transcripción de ARN preseleccionada que no se ha procesado completamente en el ARNm. Particularmente, el pre-ARNm incluye uno o más intrones.
"Proteína diana" significa una proteína codificada por un ácido nucleico diana.
"Modulación" significa una perturbación de función o actividad. En ciertos casos, la modulación significa un aumento en la expresión génica. En ciertos casos, la modulación significa una disminución de la expresión génica.
"Expresión" significa cualquier función y etapas mediante las cuales una información codificada de un gen se convierte en estructuras presentes y que operan en una célula.
"Secuencia de nucleobases" significa el orden de nucleobases contiguas, en una orientación 5' a 3', independiente de cualquier modificación de azúcar, enlace y/o nucleobase.
"Nucleobase contigua" significa nucleobases inmediatamente adyacentes entre sí en un ácido nucleico.
"Complementariedad de nucleobases" significa la capacidad de dos nucleobases de emparejarse de forma no covalente a través de un enlace de hidrógeno.
"Complementariedad" significa que un primer ácido nucleico tiene la capacidad de hibridar un segundo ácido nucleico en condiciones de hibridación rigurosas. Por ejemplo, un compuesto antisentido es complementario con su ácido nucleico diana, si es capaz de hibridarse con el ácido nucleico diana en condiciones de hibridación rigurosas. "Completamente complementario" significa que cada nucleobase de un primer ácido nucleico es capaz de emparejarse con una nucleobase en cada posición contigua correspondiente en un segundo ácido nucleico.
"Porcentaje de complementariedad" de un compuesto antisentido significa el porcentaje de nucleobases del compuesto antisentido que son complementarias con porción de longitud igual de un ácido nucleico diana. El porcentaje de complementariedad se calcula dividiendo el número de nucleobases del oligonucleótido antisentido, que son complementarias con las nucleobases en las posiciones contiguas correspondientes en el ácido nucleico diana a través de la longitud total del compuesto antisentido.
"Porcentaje de identidad" significa el número de nucleobases en el primer ácido nucleico que son idénticas a las nucleobases en las posiciones correspondientes en un segundo ácido nucleico, dividido entre el número total de nucleobases en el primer ácido nucleico.
"Hibridar" significa la hibridación de los ácidos nucleicos complementarios que tiene lugar a través de la complementariedad de nucleobases.
"Apareamiento incorrecto" significa una nucleobase en un primer ácido nucleico que es capaz de emparejarse con una nucleobase en una posición correspondiente de un segundo ácido nucleico.
"Secuencia de nucleobases idéntica" significa que tiene la misma secuencia de nucleobases, independiente de cualquier modificación química con respecto a los nucleósidos.
Las "modificaciones diferentes" o "modificadas en forma diferentes" se refieren a nucleósidos o enlaces internucleosídicos que tienen modificaciones de nucleósido o enlaces nucleosídicos diferentes de cualquier otro, incluyendo la ausencia de modificaciones. Por lo tanto, por ejemplo, un nucleósido MOE y un nucleósido de ADN no modificado están "modificados de forma diferente" incluso aunque el nucleósido de ADN no esté modificado. Asimismo, el ADN y el ARNm están "modificados de forma diferente" incluso aunque ambos sean nucleósidos no modificados de origen natural. Los nucleósidos que son los mismos pero que comprenden diferentes nucleobases no están modificados de forma diferente, a menos que se indique otra cosa. Por ejemplo, un nucleótido que comprende un azúcar modificado por 2'-OMe y una nucleobase de adenina y un nucleósido que comprende un azúcar modificado por 2'-OMe y una nucleobase de tiamina no están modificados de forma diferente.
"Las mismas modificaciones" se refiere a nucleósidos y enlaces internucleosídicos (incluyendo nucleósidos y enlaces internucleosídicos no modificados) que son iguales que otros. Por lo tanto, por ejemplo, dos nucleósidos de ADN no modificados tienen la "misma modificación" incluso aunque el nucleósido de ADN no esté modificado.
"Tipo de modificación" o nucleósido de un "tipo" significa la modificación de un nucleósido e incluye nucleósidos modificados y no modificados. Por consiguiente, a menos que se indique otra cosa, un "nucleósido" que tiene una modificación de un primer tipo" puede ser un nucleósido no modificado.
Las "regiones separadas" de un oligonucleótido significa una porción de un oligonucleótido, donde los nucleósidos y enlaces internucleosídicos dentro de la región comprenden todos las mismas modificaciones; y los nucleósidos y/o enlaces internucleosídicos de cualquier porción adyacente, incluyen al menos una modificación diferente.
"Motivo" significa un patrón de nucleobases modificadas y/o no modificadas, azúcares y/o enlaces internucleosídicos en un oligonucleótido.
"Oligonucleótido completamente modificado" significa que cada nucleobase, cada azúcar y/o cada enlace internucleosídico está modificado.
"Oligonucleótido modificado de manera uniforme" significa que cada nucleobase, cada azúcar, y/o cada enlace internucleosídico tiene la misma modificación en todo el oligonucleótido modificado.
"Motivo alterno" significa un oligonucleótido o una porción del mismo, que tiene al menos cuatro regiones separadas de nucleósidos modificados en un patrón (AB)nAm, donde A representa una región de nucleósidos que tiene un primer tipo de modificación; B representa una región de nucleósidos que tiene un diferente tipo de modificación; n es 2-15; y m es 0 o 1. Por lo tanto, en ciertos casos, los motivos alternos incluyen 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, o 20 o más regiones alternas. En ciertos casos, cada región A y cada región B comprenden independientemente 1-4 nucleósidos.
"Sujeto" significa un ser humano o animal no humano seleccionado para tratamiento o terapia.
"Sujeto que lo necesita" significa un sujeto identificado como que necesita una terapia o tratamiento. En dichos
casos, un sujeto tiene una o más indicaciones de tener o desarrollar SMA.
"Administración" significa proporcionar un agente o composición farmacéutica a un sujeto, e incluye, pero sin limitación, la administración por parte de un profesional médico o autoadministración.
"Administración parenteral" significa administración a través de inyección o infusión. La administración parenteral incluye, pero sin limitación, administración subcutánea, administración intravenosa, o administración intramuscular. "Administración sistémica" significa administración a un área diferente del lugar de actividad previsto. Los ejemplos de administración sistémica son la administración subcutánea y administración intravenosa, y administración intraperitoneal.
"Administración subcutánea" significa administración justo debajo de la piel.
"Administración intravenosa" significa administración en una vena.
"Líquido cefalorraquídeo" o "LCR" significa el fluido que llena el espacio alrededor del cerebro y la médula espinal. "Administración al líquido cefalorraquídeo" significa cualquier administración que administra una sustancia directamente al LCR.
"Intracerebroventricular" o "ICV", significa administración en un sistema ventricular del cerebro.
"Intratecal" o "IT" significa administración al LCR debajo de la membrana aracnoidea, que cubre el cerebro y la médula espinal. La inyección IT se realiza a través de la teca de la médula espinal en el espacio subaracnoideo, donde se inyecta un agente farmacéutico en la capa que rodea la médula espinal.
"Fase de inducción" significa una fase de dosificación durante la cual se inicia la administración y se logran concentraciones de estado estable del agente farmacéutico activo en un tejido diana. Por ejemplo, una fase de inducción es una fase de dosificación durante la cual se logran concentraciones de estado estable del oligonucleótido antisentido en el hígado.
"Fase de mantenimiento" significa una fase de dosificación después de que se han logrado las concentraciones de estado estable del tejido diana del fármaco.
"Duración" significa el periodo de tiempo durante el cual continua una actividad o evento. Por ejemplo, la duración de una fase de inducción es el periodo de tiempo durante el cual se administran las dosis de inducción.
"Dosis de mantenimiento" significa una dosis administrada en una sola administración durante la fase de mantenimiento. Como se usa en el presente documento, "dosis de inducción" significa una dosis administrada en una sola administración durante la fase de inducción.
"Coadministración" significa la administración de dos o más agentes farmacéuticos a un sujeto. Los dos o más agentes farmacéuticos pueden estar en una sola composición farmacéutica o pueden estar en composiciones farmacéuticas separadas. Cada uno de los dos o más agentes farmacéuticos pueden administrarse a través de las mismas, o diferentes rutas de administración. La coadministración incluye la administración en paralelo o secuencialmente.
"Terapia" significa un método de tratamiento de enfermedad. En ciertos casos, la terapia incluye, pero sin limitación, terapias quirúrgicas, terapias químicas e intervenciones físicas, tal como respiración asistida, tubos de alimentación y terapia física, para el propósito de aumentar la resistencia.
"Tratamiento" significa la aplicación de uno o más procedimientos específicos usados para la curación o mejoría de una enfermedad. En ciertos casos, el procedimiento específico es la administración de uno o más agentes farmacéuticos.
"Mejora" significa una disminución de la gravedad de al menos un indicador de una afección o enfermedad. En ciertos casos, la mejora incluye un retraso o disminución en el progreso de uno o más indicadores de una afección o enfermedad. La gravedad de indicadores puede determinarse mediante medidas subjetivas u objetivos, que se conocen por los expertos en la técnica.
"Prevenir de la aparición de" significa que se evita el desarrollo de una afección o enfermedad en un sujeto que está en riesgo de desarrollar la enfermedad o afección. En ciertos casos, un sujeto en riesgo de desarrollar la enfermedad o afección recibe un tratamiento similar al tratamiento recibido por un sujeto que ya tiene la enfermedad o afección. "Retraso de la aparición de" significa retrasar el desarrollo de una afección o enfermedad en un sujeto que está en riesgo de desarrollar la enfermedad o afección.
"Ralentizar el progreso de" significa que la gravedad de al menos un síntoma asociado con una enfermedad o afección empeora de forma menos rápida.
"Aminoácidos del exón 7" significa la porción de una proteína SMN que corresponde al exón 7 del ARNm de SMN. Los aminoácidos del exón 7 están presentes en la proteína SMN expresada de ARNm de SMN, donde el exón 7 se excluyó durante el corte y empalme.
"Proteína SMN" significa una proteína de supervivencia de la neurona motora de longitud completa normal. SMN puede expresarse en un gen SMN1 o de un gen SMN2, con la condición de que el exón 7 esté presente en el ARNm maduro y los aminoácidos del exón 7 estén presentes en la proteína SMN.
"Dosis" significa una cantidad especificada de un agente farmacéutico proporcionada en una sola administración o durante una cantidad de tiempo especificada. En ciertos casos, se puede administrar una dosis en dos o más bolos, comprimidos o inyecciones. Por ejemplo, en ciertos casos, donde se desea una administración subcutánea o intratecal o ICV, la dosis deseada requiere un volumen que no se adapta fácilmente a través de una sola inyección. En dichos casos, se pueden utilizar dos o más inyecciones para lograr la dosis deseada. En el establecimiento de una infusión continua, la dosis puede expresarse como la cantidad de un agente farmacéutico administrada por unidad de tiempo.
"Unidad de dosificación" significa una forma en la que se proporciona un agente farmacéutico. En ciertos casos, una unidad de dosificación es un vial que contiene un oligonucleótido liofilizado. En ciertos casos, una unidad de dosificación es un vial que contiene un oligonucleótido reconstituido.
"Cantidad terapéuticamente eficaz" significa una cantidad de un agente farmacéutico que proporciona un beneficio terapéutico para un animal.
"Composición farmacéutica" significa una mezcla de sustancias adecuadas para administración a un individuo que incluye un agente farmacéutico. Por ejemplo, una composición farmacéutica puede comprender un oligonucleótido modificado y una solución acuosa estéril.
"Perfil de seguridad aceptable" significa un patrón de efectos secundarios que está dentro de los límites clínicamente aceptables.
"Efecto secundario" significa una respuesta fisiológica atribuible a un tratamiento diferente de los efectos deseados.
1. Ciertos oligonucleótidos modificados
En ciertos casos, la presente descripción proporciona métodos y composiciones que implican oligonucleótidos antisentido que comprenden una o más modificaciones en comparación con oligonucleótidos de oligómeros de origen natural, tal como ADN o ARN. Dichos oligonucleótidos antisentido modificados pueden poseer una o más propiedades deseables. Ciertas modificaciones de este tipo alteran la actividad antisentido del oligonucleótido antisentido, por ejemplo, aumentando la afinidad del oligonucleótido antisentido por su ácido nucleico diana, aumentando su resistencia a una o más nucleasas, y/o alterando las farmacocinéticas o distribución tisular del oligonucleótido. En ciertos casos, dichos oligonucleótidos antisentido modificados comprenden uno o más nucleósidos modificados y/o uno o más enlaces de nucleósido modificados y/o uno o más grupos conjugados.
a. Ciertos nucleósidos modificados
En ciertos casos, los oligonucleótidos antisentido comprenden uno o más nucleótidos modificados. Dichos nucleósidos modificados pueden incluir un azúcar modificado y/o una nucleobase modificada. En ciertos casos, la incorporación de dichos nucleósidos modificados en un oligonucleótido da como resultado una afinidad aumentada por un ácido nucleico diana y/o estabilidad aumentada, incluyendo, pero sin limitación, degradación de la resistencia
a la nucleasa aumentada, y/o propiedades de toxicidad y/o captación mejoradas del oligonucleótido modificado.
i. Ciertas nucleobases
La porción de base de origen natural de los nucleósidos son de base heterocíclica, típicamente purinas y pirimidinas. Además de las nucleobases "no modificadas" o "naturales", tal como las nucleobases de purina adenina (A) y guanina (G), y las nucleobases de pirimidina timina (T), citosina (C) y uracilo (U), muchas nucleobases modificadas o miméticos de nucleobases que se conocen por los expertos en la técnica, son adecuados para la incorporación en los compuestos descritos en el presente documento. En ciertos casos, una nucleobase modificada es una nucleobase que es muy similar en estructura a la nucleobase parental, tal como, por ejemplo, una purina 7-deaza, una citosina 5-metilo, o abrazadera de G. En ciertos casos, el mimético de nucleobases incluye estructuras más complicadas, tal como, por ejemplo, un mimético de nucleobase de fenoxazina tricíclica. Los métodos para la preparación de las nucleobases modificadas mencionadas anteriormente se conocen bien por los expertos en la técnica.
ii. Ciertos azúcares modificados y sustitutos de azúcar
Los oligonucleótidos antisentido de la presente descripción pueden contener opcionalmente uno o más nucleósidos, donde el resto de azúcar está modificado, en comparación con un azúcar natural. Los oligonucleótidos que comprenden dichos nucleósidos modificados de azúcar pueden tener estabilidad de nucleasa aumentada, afinidad de unión aumentada, o alguna otra propiedad biológica beneficiosa. Dichas modificaciones incluyen, sin limitación, adición de grupos sustituyentes, puenteo de átomos de anillo no germinal para formar un ácido nucleico bicíclico (BNA), reemplazo de un átomo de oxígeno de anillo de ribosilo con S, N(R), o C(Ri )(R)2 (R = H, alquilo C1-C12 o un grupo protector) y combinaciones de estos, tal como, por ejemplo, un nucleósido 2'-F-5'-metilo-sustituido (véase la Solicitud Internacional PCT WO 2008/101157 Publicada el 8/21/08 para otros nucleósidos 5',2'-bis sustituidos descritos) o reemplazo del átomo de oxígeno del anillo de ribosilo con S con sustitución adicional en la posición 2' (véase la Solicitud de Patente de Estados Unidos publicada US2005-0130923, publicada el 16 de junio de 2005) o, como alternativa, sustitución 5' de BNA (véase la Solicitud Internacional pCt WO 2007/134181 Publicada el 11/22/07 donde LNA está sustituido, por ejemplo, con un grupo 5'-metilo o 5'-vinilo).
Los ejemplos de nucleósidos que tienen restos de azúcar modificados incluyen, sin limitación, nucleósidos que comprenden grupos de sustituyentes 5'-vinilo, 5'-metilo (R o S), 4'-S, 2'-F, 2 -OCH3 y 2'-O(CH2)2OCH3. El sustituyente en la posición 2' puede seleccionarse también de alilo, amino, azido, tio, O-alilo, O-alquilo C1-C10, OCF3 , O(CH2)2SCH3, O(CH2)2-O-N(Rm)(Rn), y O-CH2-C(=O)-N(Rm)(Rn), donde cada Rm y Rn es, independientemente, H o alquilo C1-C10 sustituido o sin sustituir.
Los ejemplos de ácidos nucleicos bicíclicos (BNA) incluyen, sin limitación, nucleósidos que comprenden un puente entre los átomos del anillo ribosilo 4' y 2'. En ciertos casos, los compuestos antisentido proporcionados en el presente documento incluyen uno o más nucleósidos de BNA donde el puente comprende una de las fórmulas: 4'-p-D-(CH2)-O-2' (P-D-LNA); 4'-(CH2)-S-2'; 4'-a-L-(CH2)-O-2' (a-L-LNA); 4'-(CH2)2-O-2' (ENA); 4'-C(CH3)2-O-2' (véase el documento PCT/US2008/068922, publicado como el documento WO 2009/006478); 4'-CH(CH3)-O-2' y 4'-CH(CH2OCH3)-O-2' (véase la Patente de Estados Unidos 7.399.845, presentada el 15 de julio de 2008); 4 -CH2-N(OCH3)-2' (véase el documento PCT/US2008/ 064591, publicado como el documento WO 2008/150729); 4 -CH2-O-N(CH3)-2' (véase la Solicitud de Patente de Estados Unidos publicada US2004-0171570, publicada el 2 de septiembre de 2004); 4'-CH2-N(R)-O-2' (véase la Patente de Estados Unidos 7.427.672, presentada el 23 de septiembre de 2008); 4'-CH2-C(Ch 3)-2' y 4'-CH2-C(=CH2)-2' (véase el documento PCT/US2008/ 066154, publicado como el documento WO 2008/154401); y donde R es, independientemente, H, alquilo C1-C12, o un grupo protector.
En ciertos casos, la presente descripción proporciona nucleósidos modificados que comprenden restos de azúcar modificados que no son restos de azúcar bicíclicos. Se conocen ciertos nucleósidos modificados de este tipo. En ciertos casos, el anillo de azúcar de un nucleósido puede modificarse en cualquier posición. Los ejemplos de modificaciones de azúcar útiles en esta descripción incluyen, pero sin limitación, compuestos que comprenden un grupo sustituyente de azúcar seleccionado de: OH, F, O-alquilo, S-alquilo, N-alquilo, o O-alquil-O-alquilo, donde el alquilo, alquenilo y alquinilo pueden ser alquilo C1 a C10 sustituido o sin sustituir o alquenilo y alquinilo C2 a C10. En ciertos casos, dichos sustituyentes están en la posición 2' del azúcar.
En ciertos casos, los nucleósidos modificados comprenden un sustituyente en la posición 2' del azúcar. En ciertos casos, dichos sustituyentes se seleccionan de entre: un haluro (incluyendo, pero sin limitación, F), alilo, amino, azido, tio, O-alilo, O-alquilo C1-C10, -OCF3 , O-(CH2)2-O-CH3, 2'-O(CH2)2SCH3, O-(CH2 )2 -O-N(Rm)(Rn), u O-CH2-C(=O)-N(Rm)(Rn), donde cada Rm y Rn es, independientemente, H o alquilo C1-C10 sustituido o sin sustituir.
En ciertos casos, los nucleósidos modificados adecuados para su uso en la presente descripción son: 2-metoxietoxi, 2'-O-metilo (2'-O-CH3), 2'-fluoro (2'-F).
En ciertos casos, los nucleósidos modificados que tienen un grupo sustituyente en la posición 2' se seleccionan de: O[(CH2)nO]mCH3, O(CH2 )nNH2 , O(CH2)nCH3, O(CH2 )nONH2 , OCH2C(=O)N(H)CH3, y O(CH2)nON[(CH2)nCH3]2, donde n y m son de 1 a aproximadamente 10. Otros grupos sustituyentes de azúcar 2' incluyen: alquilo C1 a C10, alquilo sustituido, alquenilo, alquinilo, alcarilo, aralquilo, O-alcarilo o O-aralquilo, SH, SCH3 , OCN, Cl, Br, CN, CF3 , OCF3 , SOCH3 , SO2CH3 , ONO2 , NO2 , N3 , NH2 , heterocicloalquilo, heterocicloalcarilo, aminoalquilamino, polialquilamino, sililo sustituido, un grupo de escisión de ARN, un grupo indicador, un intercalador, un grupo para mejorar las propiedades farmacocinéticas, o un grupo para mejorar las propiedades farmacocinéticas de un compuesto oligomérico, y otros sustituyentes que tienen propiedades similares.
En ciertos casos, los nucleósidos modificados comprenden una cadena lateral 2'-MOE (Baker et al., J. Biol. Chem., 1997, 272, 11944-12000). Dicha sustitución 2'-MOE se ha descrito con una afinidad de unión mejorada en comparación con los nucleósidos no modificados y con otros nucleósidos modificados, tales como 2'-O-metilo, O-propilo y O-aminopropilo. Los oligonucleótidos que tienen el sustituyente 2'-MOE también han demostrado ser inhibidores antisentido de la expresión génica con características prometedoras para su uso in vivo (Martin, P., Helv. Chim. Acta, 1995, 78, 486-504; Altmann et al., Chimia, 1996, 50, 168-176; Altmann et al., Biochem. Soc. Trans., 1996, 24, 630-637; y Altmann et al., Nucleosides Nucleotides, 1997, 16, 917-926).
En ciertos casos, los grupos de sustituyentes de 2'-azúcar están en la posición arabino (arriba) o en la posición ribo (abajo). En ciertos casos, una modificación 2'-arabino es 2'-F arabino (FANA). También se pueden hacer modificaciones similares en otras posiciones en el azúcar, particularmente la posición 3' del azúcar en un nucleósido terminal 3' o en los oligonucleótidos unidos por 2'-5' y la posición 5' del nucleótido terminal 5'.
En ciertos casos, los nucleósidos adecuados para su uso en la presente descripción tienen sustitutos de azúcar tales como ciclobutilo en lugar del azúcar ribofuranosilo. Las patentes de Estados Unidos representativas que enseñan la preparación de tales estructuras de azúcar modificadas incluyen, los documentos U.S.: 4.981.957; 5.118.800; 5.319.080; 5.359.044; 5.393.878; 5.446.137; 5.466.786; 5.514.785; 5.519.134; 5.567.811; 5.576.427; 5.591.722; 5.597.909; 5.610.300; 5.627.053; 5.639.873; 5.646.265; 5.658.873; 5.670.633; 5.792.747; y 5.700.920.
En ciertos casos, la presente divulgación proporciona nucleósidos que comprenden una modificación en la posición 2' del azúcar. En ciertos casos, la descripción proporciona nucleósidos que comprenden una modificación en la posición 5' del azúcar. En ciertos casos, la descripción proporciona nucleósidos que comprenden modificaciones en la posición 2' y la posición 5' del azúcar. En ciertos casos, los nucleósidos modificados pueden ser útiles para la incorporación en oligonucleótidos. En cierto caso, los nucleósidos modificados se incorporan en los oligonucleósidos en el extremo 5' del oligonucleótido.
b. Ciertos enlaces internucleosídicos
Los oligonucleótidos antisentido de la presente descripción pueden contener opcionalmente uno o más enlaces internucleosídicos modificados. Las dos clases principales de grupos de unión se definen por la presencia o ausencia de un átomo de fósforo. Los enlaces que contienen fósforo representativos incluyen, pero sin limitación, fosfodiésteres (P=O), fosfotriésteres, metilfosfonatos, fosforamidato y fosforotioatos (P=S). Los grupos de unión representativos que no contienen fósforo incluyen, pero sin limitación, metilenmetilimino (-CH2-N(CH3)-O-CH2-), tiodiéster (-O-C(O)-S-), tionocarbamato (-O-C(O)(NH)-S-); siloxano (-O-Si(H)2-O-); y N,N'-dimetilhidrazina (-CH2-N(CH3)-N(CH3)-). Los oligonucleótidos que tienen grupos de unión sin fósforo se denominan oligonucleósidos. Se pueden usar enlaces modificados, en comparación con enlaces fosfodiéster naturales, para alterar, típicamente aumentar, la resistencia a la nucleasa de los oligonucleótidos. En ciertos casos, los enlaces que tienen un átomo quiral se pueden preparar como mezclas racémicas, como enantiómeros separados. Los enlaces quirales representativos incluyen, pero sin limitación, alquilfosfonatos y fosforotioatos. Los métodos de preparación de enlaces que contienen fósforo y que no contienen fósforo se conocen bien por los expertos en la técnica.
Los oligonucleótidos antisentido descritos en el presente documento contienen uno o más centros asimétricos y, por lo tanto, dan lugar a enantiómeros, diastereómeros y otras configuraciones estereoisómeras que pueden definirse, en términos de estereoquímica absoluta, como (R) o (S), tal como para anómeros de azúcar, o como (D) o (L), tal como para los aminoácidos et al. Incluidos en los compuestos antisentido proporcionados en el presente documento están todos los isómeros posibles, así como sus formas racémicas y ópticamente puras.
En ciertos casos, los oligonucleótidos antisentido tienen al menos un enlace internucleosídico modificado. En ciertos casos, los oligonucleótidos antisentido tienen al menos 2 enlaces internucleosídicos modificados. En ciertos casos, los oligonucleótidos antisentido tienen al menos 3 enlaces internucleosídicos modificados. En ciertos casos, los oligonucleótidos antisentido tienen al menos 10 enlaces internucleosídicos modificados. En ciertos casos, cada enlace internucleosídico de un oligonucleótido antisentido es un enlace internucleosídico modificado. En ciertos casos, dichos enlaces internucleosídicos modificados son enlaces fosforotioato.
c. Longitudes
En ciertos casos, la presente descripción proporciona oligonucleótidos antisentido de cualquiera de una diversidad de intervalos de longitudes. En ciertos casos, la descripción proporciona compuestos antisentido u oligonucleósidos antisentido que comprenden o que consisten en nucleósidos unidos a X-Y, donde X e Y se seleccionan cada uno independientemente de 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, y 50; con la condición de que X<Y. Por ejemplo, en ciertos casos, la descripción proporciona compuestos antisentido u oligonucleótidos antisentido que comprenden o que consisten en: 8-9, 8-10, 8-11, 8-12, 8-13, 8-14, 8-15, 8-16, 8-17, 8-18, 8-19, 8-20, 8-21, 8-22, 8-23, 8-24, 8-25, 8 26, 8-27, 8-28, 8-29, 8-30, 9-10, 9-11, 9-12, 9-13, 9-14, 9-15, 9-16, 9-17, 9-18, 9-19, 9-20, 9-21, 9-22, 9-23, 9-24, 9 25, 9-26, 9-27, 9-28, 9-29, 9-30, 10-11, 10-12, 10-13, 10-14, 10-15, 10-16, 10-17, 10-18, 10-19, 10-20, 10-21, 10-22, 10-23,10-24,10-25,10-26,10-27,10-28,10-29,10-30, 11-12, 11-13, 11-14, 11-15, 11-16, 11-17, 11-18, 11-19, 11-20, 11-21, 11-22, 11-23, 11-24, 11-25, 11-26, 11-27, 11-28, 11-29, 11-30, 12-13, 12-14, 12-15, 12-16, 12-17, 12-18, 12 19, 12-20, 12-21, 12-22, 12-23, 12-24, 12-25, 12-26, 12-27, 12-28, 12-29, 12-30, 13-14, 13-15, 13-16, 13-17, 13-18, 13-19, 13-20, 13-21, 13-22, 13-23, 13-24, 13-25, 13-26, 13-27, 13-28, 13-29, 13-30, 14-15, 14-16, 14-17, 14-18, 14 19, 14-20, 14-21, 14-22, 14-23, 14-24, 14-25, 14-26, 14-27, 14-28, 14-29, 14-30, 15-16, 15-17, 15-18, 15-19, 15-20, 15-21, 15-22, 15-23, 15-24, 15-25, 15-26, 15-27, 15-28, 15-29, 15-30, 16-17, 16-18, 16-19, 16-20, 16-21, 16-22, 16 23, 16-24, 16-25, 16-26, 16-27, 16-28, 16-29, 16-30, 17-18, 17-19, 17-20, 17-21, 17-22, 17-23, 17-24, 17-25, 17-26, 17-27, 17-28, 17-29, 17-30, 18-19, 18-20, 18-21, 18-22, 18-23, 18-24, 18-25, 18-26, 18-27, 18-28, 18-29, 18-30, 19 20, 19-21, 19-22, 19-23, 19-24, 19-25, 19-26, 19-29, 19-28, 19-29, 19-30, 20-21, 20-22, 20-23, 20-24, 20-25, 20-26, 20-27, 20-28, 20-29, 20-30, 21-22, 21-23, 21-24, 21-25, 21-26, 21-27, 21-28, 21-29, 21-30, 22-23, 22-24, 22-25, 22 26, 22-27, 22-28, 22-29, 22-30, 23-24, 23-25, 23-26, 23-27, 23-28, 23-29, 23-30, 24-25, 24-26, 24-27, 24-28, 24-29, 24-30, 25-26, 25-27, 25-28, 25-29, 25-30, 26-27, 26-28, 26-29, 26-30, 27-28, 27-29, 27-30, 28-29, 28-30, o 29-30 nucleósidos unidos.
En ciertos casos, los compuestos antisentido u oligonucleótidos antisentido de la presente descripción tienen una longitud de 15 nucleósidos. En ciertos casos, los compuestos antisentido u oligonucleótidos antisentido de la presente descripción tienen una longitud de 16 nucleósidos. En ciertos casos, los compuestos antisentido u oligonucleótidos antisentido de la presente descripción tienen una longitud de 17 nucleósidos. En ciertos casos, los compuestos antisentido u oligonucleótidos antisentido de la presente descripción tienen una longitud de 18 nucleósidos. En ciertos casos, los compuestos antisentido u oligonucleótidos antisentido de la presente descripción tienen una longitud de 19 nucleósidos. En ciertos casos, los compuestos antisentido u oligonucleótidos antisentido de la presente descripción tienen una longitud de 20 nucleósidos.
d. Ciertos motivos oligonucleotídicos
En ciertos casos, los oligonucleótidos antisentido tienen subunidades químicamente modificadas dispuestas en orientaciones específicas a lo largo de su longitud. En ciertos casos, los oligonucleótidos antisentido de la descripción están completamente modificados. En ciertos casos, los oligonucleótidos antisentido de la descripción están modificados de manera uniforme. En ciertos casos, los oligonucleótidos antisentido de la descripción están modificados de manera uniforme, y cada nucleósido comprende una resto de azúcar 2'-MOE. En ciertos casos, los oligonucleótidos antisentido de la descripción están modificados de manera uniforme, y cada nucleósido comprende una resto de azúcar 2'-OMe. En ciertos casos, los oligonucleótidos antisentido de la descripción están modificados de manera uniforme, y cada nucleósido comprende un resto de azúcar morfolino.
En ciertos casos, los oligonucleótidos antisentido de la descripción comprenden un motivo alterno. En ciertos casos de este tipo, los tipos de modificación alterna se seleccionan de entre 2'-MOE, 2'-F, un nucleósido modificado por azúcar bicíclico, y ADN (2'-desoxi no modificado). En ciertos casos de este tipo, cada región alterna comprende un solo nucleósido.
En ciertos casos, los oligonucleótidos de la presente descripción comprenden uno o más bloques de nucleósidos de un primer tipo y uno o más bloques de nucleósidos de un segundo tipo.
En ciertos casos, una o más regiones alternas en un motivo alterno incluyen más de un solo nucleósido de un tipo. Por ejemplo, los compuestos oligoméricos de la presente descripción pueden incluir una o más regiones de cualquiera de los siguientes motivos de nucleósidos:
Nu1 Nu1 Nu2 Nu2 Nu1 Nu1;
Nu1 Nu2 Nu2 Nu1 Nu2 Nu2;
Nu1 Nu1 Nu2 Nu1 Nu1 Nu2;
Nu1 Nu2 Nu2 Nu1 Nu2 Nu1 Nu1 Nu2 Nu2 ;
Nu1 Nu2 Nu1 Nu2 Nu1 Nu1;
Nu1 Nu1 Nu2 Nu1 Nu2 Nu1 Nu2;
Nu1 Nu2 Nu1 Nu2 Nu1 Nu1;
Nu1 Nu2 Nu2 Nu1 Nu1 Nu2 Nu2 Nu1 Nu2 Nu1 Nu2 Nu1 Nu1;
Nu2 Nu1 Nu2 Nu2 Nu1 Nu1 Nu2 Nu2 Nu1 Nu2 Nu1Nu2 Nu1 Nu1 ; o
Nu1 Nu2 Nu1 Nu2 Nu2 Nu1 Nu1 Nu2 Nu2 Nu1 Nu2 Nu1 Nu2 Nu1 Nu1 ;
donde Nu1 es un nucleósido de un primer tipo y Nu2 es un nucleósido de un segundo tipo. En ciertos casos, uno de Nu1 y Nu2 es un nucleósido 2'-MOE y el otro de Nu1 y Nu2 es uno seleccionado de: un nucleósido modificado de 2'-OMe, BNA, y un nucleósido de ADN o ARN no modificado.
2. Compuestos oligoméricos
En ciertos casos, la presente divulgación proporciona compuestos oligoméricos. En ciertos casos, los compuestos oligoméricos están compuestos solo por un oligonucleótido. En ciertos casos, un compuesto oligomérico comprende un oligonucleótido y uno o más grupos conjugados y/o terminales. Dichos grupos conjugados y/o terminales pueden añadirse a oligonucleótidos que tengan cualquiera de los motivos químicos analizados anteriormente. Por lo tanto, por ejemplo, un compuesto oligomérico que comprende un oligonucleótido que tiene una región de nucleósidos alternos puede comprender un grupo terminal.
a. Ciertos grupos conjugados
En ciertos casos, los oligonucleótidos de la presente descripción se modifican mediante la unión de uno o más grupos conjugados. En general, los grupos conjugados modifican una o más propiedades del compuesto oligomérico unido, incluyen, pero sin limitación, farmacodinámica, farmacocinética, estabilidad, unión, absorción, distribución celular, captación celular, carga y depuración. Los grupos conjugados se utilizan de forma rutinaria en las técnicas químicas y se unen directamente o a través de un resto de unión a conjugado opcional o un grupo de unión a de conjugado a un compuesto precursor tal como un compuesto oligomérico, tal como un oligonucleótido. Los grupos conjugados incluyen, sin limitación, intercaladores, moléculas indicadoras, poliaminas, poliamidas, polietilenglicoles, tioéteres, poliéteres, colesteroles, tiocolesteroles, restos de ácido cólico, folato, lípidos, fosfolípidos, biotina, fenazina, fenantridina, antraquinona, adamantano, acridina, fluoresceínas, rodaminas, cumarinas y colorantes. Ciertos grupos conjugados se han descrito previamente, por ejemplo: resto de colesterol (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), ácido cólico (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), un tioéter, por ejemplo, hexil-S-tritiltiol (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), un tiocolesterol (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533 538), una cadena alifática, por ejemplo, residuos do-decan-diol o undecilo (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), un fosfolípido, por ejemplo, di-hexadecil-rac-glicerol o trietil-amonio 1,2-di-O-hexadecil-rac-glicero-3-H-fosfonato (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), una poliamina o una cadena de polietilenglicol (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973), o ácido adamantano acético (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), un resto palmitilo (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237), o un resto octadecilamina o hexilamino-carbonil-oxicolesterol (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277, 923-937).
En ciertos casos, un grupo conjugado comprende una sustancia de fármaco activa, por ejemplo, aspirina, warfarina, fenilbutazona, ibuprofeno, suprofeno, fenbufeno, ketoprofeno, (S)-(+)-pranoprofeno, carprofeno, dansilsarcosina, ácido 2,3,5-triyodobenzoico, ácido flufenámico, ácido folínico, una benzotiadiazida, clorotiazida, una diazepina, indometacina, un barbitúrico, una cefalosporina, un fármaco sulfa, un antidiabético, un antibacteriano o un antibiótico. Se describen conjugados de oligonucleótido-fármaco y sus preparación en la Solicitud de Patente de Estados Unidos 09/334.130, publicada como el documento US 6.656.730.
Las patentes de Estados Unidos representativas que enseñan la preparación de conjugados oligonucleotídicos
incluyen, pero sin limitación, los documentos U.S.: 4.828.979; 4.948.882; 5.218.105; 5.525.465; 5.541.313 5.545.730 5.552.538 5.578.717 5.580.731 5.580.731 5.591.584 5.109.124 5.118.802 5.138.045 5.414.077 5.486.603 5.512.439 5.578.718 5.608.046 4.587.044 4.605.735 4.667.025 4.762.779 4.789.737 4.824.941 4.835.263 4.876.335 4.904.582 4.958.013 5.082.830 5.112.963 5.214.136 5.082.830 5.112.963 5.214.136 5.245.022 5.254.469 5.258.506 5.262.536 5.272.250 5.292.873 5.317.098 5.371.241 5.391.723 5.416.203 5.451.463 5.510.475 5.512.667 5.514.785 5.565.552 5.567.810 5.574.142 5.585.481 5.587.371 5.595.726 5.597.696 5.599.923; 5.599.928 y 5.688.941.
Los grupos conjugados pueden unirse a uno o ambos extremos de un oligonucleótido (grupos conjugados terminales) y/o en cualquier posición interna.
b. Grupos terminales
En ciertos casos, los compuestos oligoméricos comprenden grupos terminales en uno o ambos extremos. En ciertos casos, un grupo terminal puede comprender cualquiera de los grupos conjugados analizados anteriormente. En ciertos casos, los grupos terminales pueden comprender nucleósidos adicionales y/o nucleósidos abásicos invertidos. En ciertos casos, un grupo terminal es un grupo estabilizador.
En ciertos casos, los compuestos oligoméricos comprenden uno o más grupos estabilizadores terminales que potencian las propiedades tales como, por ejemplo, la estabilidad de la nucleasa. Se incluyen en los grupos estabilizadores las estructuras de caperuza. Los términos "estructura de caperuza" o "resto de caperuza terminal", como se usa en el presente documento, se refieren a modificaciones químicas, que pueden unirse a uno o ambos extremos de un compuesto oligomérico. Ciertas modificaciones terminales de este tipo protegen los compuestos oligoméricos que tienen restos de ácido nucleico terminal de la degradación de la exonucleasa, y pueden ayudar en el suministro y/o localización dentro de una célula. La caperuza puede estar presente en el extremo 5' (5'-cap) o en el extremo 3' (3'-cap), o puede estar presente en ambos extremos. (para más detalles, véanse, Wincott et al., Publicación PCT Internacional N.° WO 97/26270; Beaucage y Tyer, 1993, Tetrahedron 49, 1925; Publicación de Solicitud de Patente de Estados Unidos N.° US 2005/0020525; y el documento WO 03/004602.
En ciertos casos, uno o más nucleósidos adicionales se añaden a uno o ambos extremos terminales de un oligonucleótido de un compuesto oligomérico. Dichos nucleósidos terminales adicionales se denominan en el presente documento como nucleósidos de grupo terminal. En un compuesto bicatenario, dichos nucleósidos de grupo terminal son salientes terminales (3' y/o 5'). En el establecimiento de compuestos antisentido bicatenarios, dichos nucleósidos de grupo terminal pueden o no ser complementarios con un ácido nucleico diana. En ciertos casos, el grupo terminal es un grupo terminal no nucleósido. Dichos grupos no terminales pueden ser cualquier grupo terminal distinto de un nucleósido.
c. Motivos de compuestos oligoméricos
En ciertos casos, los compuestos oligoméricos de la presente descripción comprenden un motivo: T1-(Nu1 )n1-(Nu2)n2-(Nu1)n3-(Nu2)n4-(Nu1)n5-T2, donde:
Nu1, es un nucleósido de un primer tipo;
Nu2 , es un nucleósido de un segundo tipo;
cada uno de n1 y n5 es, independientemente, de 0 a 3;
la suma de n2 más n4 es entre 10 y 25;
n3 es de 0 y 5; y
cada T1 y T2 es independientemente, H, un grupo protector hidroxilo, un grupo conjugado unido opcionalmente, o un grupo de protección.
En ciertos casos de este tipo, la suma de n2 y n4 es 13 o 14; n1 es 2; n3 es 2 o 3; y n5 es 2. En ciertos casos de este tipo, los compuestos oligoméricos de la presente descripción comprenden un motivo seleccionado de la Tabla A.
La Tabla A pretende ilustrar, pero no limitar, la presente descripción. Los compuestos oligoméricos representados en la Tabla A comprenden cada uno 20 nucleósidos. Los compuestos oligoméricos que comprenden más o menos nucleósidos pueden diseñarse fácilmente seleccionando diferentes números de nucleósidos para uno o más de n1-n5. En ciertos casos, Nu1 y Nu2 se seleccionan cada uno de entre: 2'-MOE, 2'-OMe, ADN, y un nucleósido bicíclico.
3. Antisentido
En ciertos casos, los compuestos oligoméricos de la presente descripción son compuestos antisentido. Por consiguiente, en tales casos, los compuestos oligoméricos se hibridan con un ácido nucleico diana, dando como resultado una actividad antisentido.
a. Hibridación
En ciertos casos, la descripción proporciona compuestos antisentido que se hibridan específicamente con un ácido nucleico diana cuando existe un grado de complementariedad suficiente para evitar unión inespecífica del compuesto antisentido a secuencias de ácido nucleico no diana en condiciones en las que se desea unión específica, es decir, en condiciones fisiológicas en el caso de ensayos in vivo o tratamiento terapéutico, y en condiciones en las que se realizan ensayos en el caso de ensayos in vitro.
Por lo tanto, "condiciones de hibridación rigurosas" o "condiciones rigurosas" significa condiciones en las que un compuesto antisentido se hibrida con una secuencia diana, pero con un número mínimo de otras secuencias. Las condiciones rigurosas dependen de la secuencia y serán diferentes en diferentes circunstancias, y las "condiciones rigurosas" en las que los oligonucleótidos antisentido que hibridan con una secuencia diana se determinan por la naturaleza y composición de los oligonucleótidos antisentido y los ensayos en los que se están investigando.
Se entiende en la técnica que la incorporación de modificaciones de afinidad de nucleótidos puede permitir un mayor número de apareamientos incorrectos en comparación con un compuesto no modificado. De manera similar, ciertas secuencias de nucleobases pueden ser más tolerantes a los emparejamientos incorrectos que otras secuencias de nucleobases. Un experto en la técnica es capaz de determinar un número apropiado de emparejamientos incorrectos entre oligonucleótidos, o entre un oligonucleótido antisentido y un ácido nucleico diana, tal como mediante la determinación de la temperatura de fusión (Tm). Tm o ATm pueden calcularse mediante técnicas que son familiares para un experto en la técnica. Por ejemplo, las técnicas descritas en Freier et al. (Nucleic Acids Research, 1997, 25, 22: 4429-4443) permiten que un experto en la técnica evalúe modificaciones de nucleótidos para determinar su capacidad para aumentar la temperatura de fusión de un dúplex de ARN:ADN.
b. Procesamiento de pre-ARNm
En ciertos casos, los compuestos antisentido proporcionados en el presente documento son complementarios a un pre-ARNm. En ciertos casos, dichos compuestos antisentido alteran el corte y empalme del pre-ARNm. En ciertos casos de este tipo, se altera la relación de una variante de un ARNm maduro correspondiente a un pre-ARNm diana
con respecto a otra variante de ese ARNm maduro. En ciertos casos de este tipo, la relación de una variante de una proteína expresada desde el pre-ARNm diana con respecto a otra variante de la proteína se altera. Ciertos compuestos oligoméricos y secuencias de nucleobases que pueden usarse para alterar el corte y empalme de un pre-ARNm se pueden encontrar, por ejemplo, en los documentos US 6.210.892; US 5.627.274; uS 5.665.593; 5.916.808; US 5.976.879; US2006/0172962; US2007/002390; US2005/0074801; US2007/0105807; US2005/0054836; WO 2007/090073; WO2007/047913, Hua et al., PLoS Biol 5(4):e73; Vickers et al., J. Immunol.
2006 Mar 15; 176(6):3652-61; y Hua et al., American J. of Human Genetics (April 2008) 82, 1-15. En ciertos casos, las secuencias antisentido que alteran el corte y empalme se modifican de acuerdo con los motivos de la presente descripción.
El antisentido es un medio eficaz para modular la expresión de uno o más productos génicos específicos, y es útil únicamente en varias aplicaciones terapéuticas, de diagnóstico y de investigación. En el presente documento se proporcionan compuestos antisentido útiles para modular la expresión génica a través de mecanismos de acción antisentido, incluyendo mecanismos antisentido basados en la ocupación de la diana. En un aspecto, los compuestos antisentido proporcionados en el presente documento modulan el corte y empalme de un gen diana. Dicha modulación incluye promover o inhibir la inclusión de exones. Además, en el presente documento se proporcionan compuestos antisentido dirigidos a elementos reguladores de corte y empalme cis presentes en moléculas de pre-ARNm, incluyendo potenciadores de corte y empalme exónicos, silenciadores de corte y empalme exónicos, potenciadores de corte y empalme intrónicos y silenciadores de corte y empalme intrónicos. Se piensa que los elementos reguladores de corte y empalme cis alteran la selección del sitio de corte y empalme, lo que puede conducir a una alteración en la composición de los productos de corte y empalme.
El procesamiento de pre-ARNm eucariotas es un proceso complejo que requiere una multitud de señales y factores proteicos para lograr un corte y empalme de ARNm apropiado. La definición de exón por el espliceosoma requiere más que las señales de corte y empalme canónicas que definen los límites intrón-exón. Una señal adicional de este tipo se proporciona por las secuencias de potenciador regulador y silenciador que actúan en cis. Se han identificado potenciadores de corte y empalme exónicos (ESE), silenciadores de corte y empalme exónicos (ESS), potenciadores de corte y empalme intrónicos (ISE) y silenciadores de corte y empalme intrónico (ISS) que reprimen o mejoran el uso de sitios donantes de corte y empalme o sitios aceptores de corte y empalme, dependiendo de su sitio y modo de acción (Yeo et al. 2004, Proc. Natl. Acad. Sci. U.S.A. 101(44):15700-15705). La unión de proteínas específicas (factores trans) a estas secuencias reguladoras dirige el proceso de corte y empalme, ya sea promoviendo o inhibiendo el uso de sitios de corte y empalme particulares y, por lo tanto, modulando la proporción de productos de corte y empalme (Scamborova et al. 2004, Mol. Cell. Biol. 24(5):1855-1869; Hovhannisyan y Carstens, 2005, Mol. Cell. Biol. 25(1 ):250-263; Minovitsky et al. 2005, Nucleic Acids Res. 33(2):714-724).
4. Composiciones farmacéuticas
En ciertos casos, la presente descripción proporciona composiciones farmacéuticas que comprenden uno o más compuestos antisentido. En ciertos casos, dicha composición farmacéutica comprende una solución salina estéril y uno o más compuestos antisentido. En ciertos casos, dicha composición farmacéutica consiste en una solución salina estéril y uno o más compuestos antisentido.
En ciertos casos, los compuestos antisentido se pueden mezclar con sustancias activas y/o inertes farmacéuticamente aceptables para la preparación de composiciones o formulaciones farmacéuticas. Las composiciones y los métodos para la formulación de composiciones farmacéuticas dependen de una serie de criterios, incluyendo, pero sin limitación, la ruta de administración, la extensión de la enfermedad, o la dosis que se administrará.
En ciertos casos, los compuestos antisentido se pueden utilizar en composiciones farmacéuticas combinando dichos compuestos oligoméricos con un diluyente o vehículo farmacéuticamente aceptable adecuado. Un diluyente farmacéuticamente aceptable incluye una solución salina tamponada con fosfato (PBS). PBS es un diluyente adecuado para su uso en composiciones para administración parenteral. Por consiguiente, en ciertos casos, en los métodos descritos en el presente documento se emplea una composición farmacéutica que comprende un compuesto antisentido y un diluyente farmacéuticamente aceptable. En ciertos casos, el diluyente farmacéuticamente aceptable es PBS.
Las composiciones farmacéuticas que comprenden compuestos antisentido incluyen cualquier sal, éster o sal aceptables de dichos ésteres. En ciertos casos, las composiciones farmacéuticas que comprenden compuestos antisentido comprenden uno o más oligonucleótidos que, tras la administración a un animal, incluido un ser humano, es capaz de proporcionar (directa o indirectamente) el metabolito biológicamente activo o residuo del mismo. Por
consiguiente, por ejemplo, la descripción también se refiere a sales farmacéuticamente aceptables de compuestos antisentido, profármacos, sales farmacéuticamente aceptables de tales profármacos, y otros bioequivalentes. Las sales farmacéuticamente aceptables adecuadas incluyen, pero sin limitación, sales de sodio y potasio.
Un profármaco puede incluir la incorporación de nucleósidos adicionales en uno o ambos extremos de un compuesto oligomérico que se escinden por nucleasas endógenas dentro del cuerpo, para formar el compuesto oligomérico antisentido activo.
Los vectores a base de lípidos se han usado en terapias de ácidos nucleicos en una diversidad de métodos. Por ejemplo, en un método, el ácido nucleico se introduce en liposomas preformados o lipoplejos hechos de mezclas de lípidos catiónicos y lípidos neutros. En otro método, los complejos de ADN con lípidos mono o policatiónicos se forman sin la presencia de un lípido neutro.
Se describen ciertas preparaciones en Akinc et al., Nature Biotechnology 26, 561 - 569 (01 de mayo de 2008).
5. Administración a un sujeto
En ciertos casos, las composiciones farmacéuticas que comprenden uno o más compuestos antisentido se administran a un sujeto. En ciertos casos, dichas composiciones farmacéuticas se administran por inyección. En ciertos casos, dichas composiciones farmacéuticas se administran por infusión.
En ciertos casos, las composiciones farmacéuticas se administran por inyección o infusión en el LCR. En ciertos casos, las composiciones farmacéuticas se administran mediante inyección directa o infusión en la columna vertebral. En ciertos casos, las composiciones farmacéuticas se administran mediante inyección o infusión en el cerebro. En ciertos casos, las composiciones farmacéuticas se administran mediante inyección intratecal o infusión en lugar de en el propio tejido de la médula espinal. Sin desear quedar ligado a la teoría, en ciertos casos, el compuesto antisentido se libera en el LCR circundante y puede penetrar en el parénquima de la médula espinal. Una ventaja adicional de la administración intratecal es que la vía intratecal imita la administración de la punción lumbar (es decir, la punción lumbar) que ya se usa en forma rutinaria en serse humanos.
En ciertos casos, las composiciones farmacéuticas se administran mediante inyección o infusión intracerebroventricular (ICV). La administración intracerebroventricular o intraventricular de una composición farmacéutica que comprende uno o más compuestos antisentido se puede realizar en uno o más de los ventrículos del cerebro, que están llenos de líquido cefalorraquídeo (LCR). El LCR es un líquido transparente que llena los ventrículos, está presente en el espacio subaracnoideo y rodea el cerebro y la médula espinal. El LCR es producido por los plexos coroideos y a través de la exudación o la transmisión de líquido tisular por el cerebro a los ventrículos. El plexo coroideo es una estructura que reviste el suelo del ventrículo lateral y la parte superior del tercer y cuarto ventrículos. Ciertos estudios han indicado que estas estructuras son capaces de producir 400-600 cc de líquido al día, en consonancia con una cantidad para llenar los espacios del sistema nervioso central cuatro veces en un día. En seres humanos adultos, el volumen de este fluido se ha calculado entre 125 y 150 ml (4-5 oz). El LCR está en continua formación, circulación y absorción. Ciertos estudios han indicado que se pueden producir aproximadamente 430 a 450 ml (casi 2 tazas) de LCR cada día. Ciertos cálculos estiman que la producción equivale a aproximadamente 0,35 ml por minuto en adultos y 0,15 por minuto en bebés humanos. Los plexos coroideos de los ventrículos laterales producen la mayoría de los LCR. Fluye a través del agujero de Monro hacia el tercer ventrículo, donde se añade a la producción desde el tercer ventrículo y continúa hacia abajo a través del acueducto de Sylvius hasta el cuarto ventrículo. El cuarto ventrículo añade más LCR; el fluido viaja entonces hasta el espacio subaracnoideo a través de los agujeros de Magendie y Luschka. Después, circula por toda la base del cerebro, hacia abajo alrededor de la médula espinal y hacia arriba sobre los hemisferios cerebrales. El LCR se vacía en la sangre a través de las vellosidades aracnoideas y los senos vasculares intracraneales.
En ciertos casos, dichas composiciones farmacéuticas se administran por vía sistémica. En ciertos casos, las composiciones farmacéuticas se administran por vía subcutánea. En ciertos casos, las composiciones farmacéuticas se administran por vía intravenosa. En ciertos casos, las composiciones farmacéuticas se administran por inyección intramuscular.
En ciertos casos, las composiciones farmacéuticas se administran tanto directamente al LCR (por ejemplo, inyección IT y/o ICV y/o infusión) como por vía sistémica.
En ciertos casos, un compuesto antisentido administrado por vía sistémica entra en las neuronas. En ciertos casos, los compuestos antisentido administrados por vía sistémica pueden penetrar en la barrera hematoencefálica,
particularmente en sujetos jóvenes en los que la barrera hematoencefálica no está completamente formada (por ejemplo, en sujetos en el útero y/o en sujetos recién nacidos). En ciertos casos, las células nerviosas pueden absorber cierta cantidad de compuesto antisentido administrado por vía sistémica, incluso en sujetos en los que la barrera hematoencefálica está completamente formada. Por ejemplo, los compuestos antisentido pueden entrar en una neurona en o cerca de la unión neuromuscular (captación retrógrada). En ciertos casos, dicha captación retrógrada da como resultado una actividad antisentido dentro de la neurona, incluyendo, pero sin limitación, una neurona motora, y proporciona un beneficio terapéutico por la actividad antisentido en el interior de la neurona.
En ciertos casos, la administración sistémica proporciona un beneficio terapéutico por la actividad antisentido que se produce en células y/o tejidos distintos de las neuronas. Si bien la evidencia sugiere que se requiere SMN funcional en el interior de las neuronas para la función neuronal normal, la consecuencia de la reducción de SMN funcional en otras células y tejidos no está bien caracterizada. En ciertos casos, la actividad antisentido en células no neuronales da como resultado la restauración de la función de SMN en esas células no neuronales, lo que a su vez da como resultado un beneficio terapéutico.
En ciertos casos, la función de SMN mejorada en células no neuronales proporciona una función celular neuronal mejorada, ya sea que se mejore o no la función de SMN en el interior de las neuronas. Por ejemplo, en ciertos casos, la administración sistémica de composiciones farmacéuticas de la presente descripción da como resultado una actividad antisentido en células musculares. Dicha actividad antisentido en las células musculares puede proporcionar un beneficio para las neuronas motoras asociadas con esa célula muscular o para las neuronas en general. En dichos casos, la célula muscular que tiene la función de SMN restaurada puede proporcionar un factor que mejora la viabilidad y/o función neuronal. En ciertos casos, dicha actividad antisentido es independiente del beneficio de la actividad antisentido que se produce a partir de compuestos antisentido dentro de las neuronas. En ciertos casos, la administración sistémica de composiciones farmacéuticas de la presente descripción da como resultado una actividad antisentido en otras células no neuronales, incluyendo las células que no están en asociación inmediata con las neuronas. Dicha actividad antisentido en células no neuronales puede mejorar la función de las neuronas. Por ejemplo, la actividad antisentido en una célula no neuronal (por ejemplo, una célula hepática) puede dar como resultado que esa célula produzca un factor que mejore la función de las neuronas. Nota: dado que el término "actividad antisentido" incluye actividades directas e indirectas, un beneficio para la función neuronal es una "actividad antisentido", incluso si no entra ningún compuesto antisentido en la neurona.
En ciertos casos, la administración sistémica de una composición farmacéutica da como resultado un beneficio terapéutico independiente de las actividades antisentido directas o indirectas en las neuronas. Típicamente, en el contexto de SMA, la función neuronal disminuye, dando como resultado síntomas significativos. Los síntomas adicionales pueden ser resultado de la disminución de la actividad de SMN en otras células. Ciertos síntomas pueden estar enmascarados por la gravedad relativa de los síntomas de la función neuronal disminuida. En ciertos casos, la administración sistémica da como resultado una función SMN restaurada o mejorada en células no neuronales. En ciertos casos de este tipo, dicha función de SMN restaurada o mejorada en células no neuronales tiene un beneficio terapéutico. Por ejemplo, en ciertos casos, los sujetos que tienen SMA tienen un crecimiento reducido. Dicho crecimiento reducido puede no ser resultado de una función disminuida en las células neuronales. De hecho, el crecimiento reducido puede estar relacionado con una función alterada de las células en otro órgano, tal como la glándula pituitaria, y/o puede ser el resultado de deficiencias de SMN en todas las células del cuerpo. En tales casos, la administración sistémica puede dar como resultado una actividad de SMN mejorada en células hipofisarias y/u otras células, dando como resultado un crecimiento mejorado. En ciertos casos, la administración al LCR restaura la función neuronal suficiente para permitir que un sujeto viva más tiempo, sin embargo, uno o más síntomas se desconocen previamente porque los sujetos típicamente murieron antes de que aparecieran tales síntomas, porque el sujeto vive más tiempo. Ciertos síntomas emergentes pueden ser letales. En ciertos casos, los síntomas emergentes son tratados por administración sistémica. Independientemente del mecanismo, en ciertos casos, una diversidad de síntomas de SMA, incluyendo, pero sin limitación, síntomas enmascarados previamente por síntomas más graves asociados con una función neuronal alterada, pueden tratarse mediante administración sistémica.
En ciertos casos, la administración sistémica de composiciones farmacéuticas de la presente descripción da como resultado un aumento de la actividad de SMN en células musculares. En ciertos casos, dicha actividad de SMN mejorada en las células musculares proporciona un beneficio terapéutico. Se ha informado que la actividad de SMN mejorada en el músculo solo es insuficiente para proporcionar un beneficio terapéutico(por ejemplo, Gravrilina, et al., Hum Mol Genet 2008 17(8):1063-1075). En ciertos casos, la presente descripción proporciona métodos que mejoran la función de SMN en el músculo y proporcionan un beneficio terapéutico. En ciertos casos, el beneficio terapéutico puede atribuirse a una función de SMN mejorada en otras células (en solitario o en combinación con células musculares). En ciertos casos, la función de SMN mejorada en el músculo solo puede proporcionar beneficios.
En ciertos casos, la administración sistémica da como resultado una supervivencia mejorada.
6. Atrofia muscular espinal (SMA)
SMA es un trastorno genético caracterizado por la degeneración de las neuronas motoras espinales. La SMA es causada por la pérdida homocigota de ambas copias funcionales del gen SMN1. Sin embargo, el gen SMN2 tiene el potencial de codificar la misma proteína que SMN1 y superar de este modo el defecto genético de los pacientes con SMA. SMN2 contiene una mutación silenciosa en la traducción (C ^ T) en la posición 6 del exón 7, lo que da como resultado una inclusión ineficiente del exón 7 en las transcripciones de SMN2. Por lo tanto, la forma predominante de SMN2, que carece del exón 7, es inestable e inactiva. Por lo tanto, los compuestos terapéuticos capaces de modular el corte y empalme de SMN2 de tal manera que el porcentaje de las transcripciones de SMN2 que contienen el exón 7 se aumenta, serán útiles para el tratamiento de SMA.
En ciertos casos, la presente descripción proporciona compuestos antisentido complementarios con un pre-ARNm que codifica SMN2. En ciertos casos, el compuesto antisentido altera el corte y empalme de SMN2. Ciertas secuencias y regiones útiles para alterar el corte y empalme de SMN2 se pueden encontrar en el documento PCT/US06/024469, publicado como el documento WO 2007/002390. En ciertos casos, los compuestos oligoméricos que tienen cualquier motivo descrito en el presente documento tienen una secuencia de nucleobases complementaria con el intrón 7 de SMN2. Algunas de estas secuencias de nucleobases se ilustran en la tabla no limitante a continuación.
Los compuestos antisentido de la presente descripción se pueden usar para modular la expresión de SMN2 en un sujeto, tal como un ser humano. En ciertos casos, el sujeto tiene atrofia muscular espinal. En ciertos sujetos de este tipo, el gen SMN1 está ausente o, de lo contrario, no produce cantidades suficientes de proteína SMN funcional. En ciertos casos, los compuestos antisentido de la presente descripción modulan eficazmente el corte y empalme de SMN2, dando como resultado un aumento en la inclusión del exón 7 en el ARNm de SMN2 y, finalmente, en la proteína SMN2 que incluye los aminoácidos correspondientes al exón 7. Dicha proteína SMN2 alternativa se parece a la proteína SMN de tipo silvestre. Los compuestos antisentido de la presente descripción que modulan eficazmente la expresión de ARNm de SMN2 o productos proteicos de expresión se consideran compuestos antisentido activos.
La modulación de la expresión de SMN2 se puede medir en un fluido corporal, que puede o no contener células; tejido; u órgano del animal. Los métodos de obtención de muestras para análisis, tales como fluidos corporales (por ejemplo, esputo, suero, LCR), tejidos (por ejemplo, biopsia) u órganos, y los métodos de preparación de las
muestras para permitir el análisis se conocen bien por los expertos en la técnica. Los métodos para el análisis de los niveles de ARN y proteínas se analizan anteriormente y se conocen bien por los expertos en la técnica. Los efectos del tratamiento pueden evaluarse midiendo los biomarcadores asociados con la expresión del gen diana en los fluidos, tejidos u órganos mencionados anteriormente, recogidos de un animal en contacto con uno o más compuestos de la descripción, mediante métodos clínicos de rutina conocidos en la técnica.
También se contemplan los métodos por los cuales los fluidos corporales, órganos o tejidos se ponen en contacto con una cantidad eficaz de uno o más de los compuestos antisentido o composiciones de la descripción. Los fluidos corporales, órganos o tejidos pueden ponerse en contacto con uno o más de los compuestos de la descripción que dan como resultado la modulación de la expresión de SMN2 en las células de fluidos corporales, órganos o tejidos. Se puede determinar una cantidad eficaz controlando el efecto modulador del compuesto antisentido o los compuestos o composiciones sobre los ácidos nucleicos diana o sus productos por métodos rutinarios para el experto en la técnica.
La descripción también proporciona un compuesto antisentido como se describe en el presente documento, para su uso en cualquiera de los métodos como se describe en el presente documento. Por ejemplo, la descripción proporciona un compuesto antisentido que comprende un oligonucleótido antisentido complementario a un ácido nucleico que codifica SMN2 humano, para su uso en el tratamiento de una enfermedad o afección asociada con la proteína de la supervivencia de la neurona motora (SMN), tal como atrofia muscular espinal (SMA). Como un ejemplo adicional, la descripción proporciona un compuesto antisentido que comprende un oligonucleótido antisentido complementario a un ácido nucleico que codifica SMN2 humano, para su uso en el tratamiento de una enfermedad o afección asociada con la proteína de la supervivencia de la neurona motora (SMN) administrando el compuesto antisentido directamente en el sistema nervioso central (SNC) o el LCR.
La divulgación también proporciona el uso de un compuesto antisentido como se describe en el presente documento en la fabricación de un medicamento para su uso en cualquiera de los métodos como se describe en el presente documento. Por ejemplo, la descripción proporciona el uso de un compuesto antisentido que comprende un oligonucleótido antisentido complementario con un ácido nucleico que codifica SMN2 humano en la fabricación de un medicamento para tratar una enfermedad o afección asociada con la proteína de la supervivencia de la neurona motora (SMN), tal como atrofia muscular espinal (SMA). Como ejemplo adicional, la descripción proporciona el uso de un compuesto antisentido que comprende un oligonucleótido antisentido complementario con un ácido nucleico que codifica SMN2 humano en la fabricación de un medicamento para tratar una enfermedad o afección asociada con la proteína de la supervivencia de la neurona motora (SMN) mediante la administración del medicamento directamente en el sistema nervioso central (SNC) o el LCR.
En ciertos casos, los compuestos oligoméricos que tienen cualquier motivo descrito en el presente documento tienen una secuencia de nucleobases complementaria con el exón 7 de SMN2.
En ciertos casos, los compuestos oligoméricos que tienen cualquier motivo descrito en el presente documento tienen una secuencia de nucleobases complementaria con el intrón 6 de SMN2.
En ciertos casos, un compuesto antisentido comprende un oligonucleótido antisentido que tiene una secuencia de nucleobases que comprende al menos 10 nucleobases de la secuencia: TCACTTTCATAATGCTGG (SEQ ID NO: 1). En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 11 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 12 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 13 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 14 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 15 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 16 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende al menos 17 nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que comprende las nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido tiene una secuencia de nucleobases que consiste en las nucleobases de dicha secuencia. En ciertos casos, un oligonucleótido antisentido consiste en 10-18 nucleósidos unidos y tiene una secuencia de nucleobases un 100% idéntica a una porción de longitud equivalente de la secuencia: TCACTTTCATAATGCTGG (SEQ ID NO: 1).
7. Ciertos sujetos
En ciertos casos, un sujeto tiene uno o más indicadores de SMA. En ciertos casos, el sujeto ha reducido la actividad eléctrica de uno o más músculos. En ciertos casos, el sujeto tiene un gen SMN1 mutante. En ciertos casos, el gen SMN1 del sujeto está ausente o es incapaz de producir proteína SMN funcional. En ciertos casos, el sujeto es diagnosticado por una prueba genética. En ciertos casos, el sujeto se identifica por biopsia muscular. En ciertos casos, un sujeto no puede sentarse erguido. En ciertos casos, un sujeto no puede ponerse en pie o caminar. En ciertos casos, un sujeto requiere asistencia para respirar y/o comer. En ciertos casos, un sujeto se identifica mediante la medición electrofisiológica de músculo y/o biopsia muscular.
En ciertos casos, el sujeto tiene SMA de tipo I. En ciertos casos, el sujeto tiene SMA de tipo II. En ciertos casos, el sujeto tiene SMA de tipo III. En ciertos casos, se diagnostica que el sujeto tiene SMA en el útero. En ciertos casos, se diagnostica que el sujeto tiene SMA dentro de la primera semana después del nacimiento. En ciertos casos, se diagnostica que el sujeto tiene SMA dentro del primer mes del nacimiento. En ciertos casos, se diagnostica que el sujeto tiene SMA a los 3 meses de edad. En ciertos casos, se diagnostica que el sujeto tiene SMA a los 6 meses de edad. En ciertos casos, se diagnostica que el sujeto tiene SMA a la edad de 1 año. En ciertos casos, se diagnostica que el sujeto tiene SMA entre 1 y 2 años de edad. En ciertos casos, se diagnostica que el sujeto tiene SMA entre 1 y 15 años de edad. En ciertos casos, se diagnostica que el sujeto tiene SMA cuando el sujeto es mayor de 15 años de edad.
En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra en el útero. En ciertos casos, la primera dosis se administra antes del desarrollo completo de la barrera hematoencefálica. En ciertos casos, la primera dosis se administra sistemáticamente al sujeto en el útero. En ciertos casos, la primera dosis se administra en el útero después de la formación de la barrera hematoencefálica. En ciertos casos, la primera dosis se administra al LCR.
En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de una semana de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de un mes de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de 3 meses de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de 6 meses de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de un año de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de 2 años de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene menos de 15 años de edad. En ciertos casos, la primera dosis de una composición farmacéutica de acuerdo con la presente descripción se administra cuando el sujeto tiene más de 15 años de edad.
8. Ciertas dosis
En ciertos casos, la presente divulgación proporciona cantidades y frecuencias de dosis. En ciertos casos, las composiciones farmacéuticas se administran como un bolo intravenoso. En ciertos casos de este tipo, la dosis del bolo intravenoso es de 0,01 a 25 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos de este tipo, la dosis del bolo intravenoso es de 0,01 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,05 a 5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,1 a 2 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, la dosis es de 0,5 a 1 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto. En ciertos casos, dichas dosis se administran dos veces al mes. En ciertos casos, dichas dosis se administran cada mes. En ciertos casos, dichas dosis se administran cada 2 meses. En ciertos casos, dichas dosis se administran cada 6 meses. En ciertos casos, dichas dosis se administran mediante bolo intravenoso al LCR. En ciertos casos, dichas dosis se administran por bolo intravenoso intratecal. En ciertos casos, dichas dosis se administran mediante inyección sistémica en bolo (por ejemplo, inyección subcutánea, intramuscular o intravenosa). En ciertos casos, los sujetos reciben bolos intravenosos en el LCR y los bolos intravenosos sistémicos. En dichos casos, las dosis del bolo al LCR y el bolo sistémico pueden ser iguales o diferentes entre sí. En ciertos casos, el LCR y las dosis sistémicas se administran a diferentes frecuencias. En ciertos casos, la descripción proporciona un régimen de dosificación que comprende al menos una inyección intratecal en bolo y al menos una inyección subcutánea en bolo.
En ciertos casos, las composiciones farmacéuticas se administran por infusión continua. Dicha infusión continua se puede lograr mediante una bomba de infusión que administra composiciones farmacéuticas al LCR. En ciertos casos, dicha bomba de infusión administra la composición farmacéutica IT o ICV. En ciertos casos de este tipo, la dosis administrada es entre 0,05 y 25 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto al día. En ciertos casos, la dosis administrada es de 0,1 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto al día. En ciertos casos, la dosis administrada es de 0,5 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto al día. En ciertos casos, la dosis administrada es de 0,5 a 5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto al día. En ciertos casos, la dosis administrada es de 1 a 5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto al día. En ciertos casos, la descripción proporciona un régimen de dosificación que comprende infusión en el SNC y al menos una inyección sistémica en bolo. En ciertos casos, la descripción proporciona un régimen de dosificación que comprende infusión en el SNC y al menos una inyección subcutánea en bolo. En ciertos casos, la dosis, ya sea por bolo o por infusión, se ajusta para lograr o mantener una concentración de compuesto antisentido de 0,1 a 100 microgramos por gramo de tejido del SNC. En ciertos casos, la dosis, ya sea por bolo o por infusión, se ajusta para lograr o mantener una concentración de compuesto antisentido de 1 a 10 microgramos por gramo de tejido del SNC. En ciertos casos, la dosis, ya sea por bolo o por infusión, se ajusta para lograr o mantener una concentración de compuesto antisentido de 0,1 a 1 microgramos por gramo de tejido del SNC.
En ciertos casos, la dosificación de un sujeto se divide en una fase de inducción y una fase de mantenimiento. En ciertos casos, la dosis administrada durante la fase de inducción es mayor que la dosis administrada durante la fase de mantenimiento. En ciertos casos, la dosis administrada durante la fase de inducción es menor que la dosis administrada durante la fase de mantenimiento. En ciertos casos, la fase de inducción se logra mediante bolo intravenoso y la fase de mantenimiento se logra mediante infusión continua.
En ciertos casos, la descripción proporciona la administración sistémica de compuestos antisentido, en solitario o junto con la administración al LCR. En ciertos casos, la dosis para administración sistémica es de 0,1 mg/kg a 200 mg/kg. En ciertos casos, la dosis para administración sistémica es de 0,1 mg/kg a 100 mg/kg. En ciertos casos, la dosis para administración sistémica es de 0,5 mg/kg a 100 mg/kg. En ciertos casos, la dosis para administración sistémica es de 1 mg/kg a 100 mg/kg. En ciertos casos, la dosis para administración sistémica es de 1 mg/kg a 50 mg/kg. En ciertos casos, la dosis para administración sistémica es de 1 mg/kg a 25 mg/kg. En ciertos casos, la dosis para administración sistémica es de 0,1 mg/kg a 25 mg/kg. En ciertos casos, la dosis para administración sistémica es de 0,1 mg/kg a 10 mg/kg. En ciertos casos, la dosis para administración sistémica es de 1 mg/kg a 10 mg/kg. En ciertos casos, la dosis para administración sistémica es de 1 mg/kg a 5 mg/kg. En ciertos casos que comprenden la administración tanto sistémica como al LCR, las dosis para estos dos rutas se determinan independientemente.
a. Cálculo de las dosis humanas adecuadas
En ciertos casos, el sujeto es un ser humano. En ciertos casos, una dosis humana se calcula o se estima a partir de datos de experimentos con animales, tales como los que se describen en el presente documento. En ciertos casos, una dosis humana se calcula o se estima a partir de datos de experimentos con monos y/o ratones, tales como los descritos en el presente documento. En ciertos casos, una dosis humana se calcula o se estima a partir de datos de experimentos con ratones, tales como los que se describen en el presente documento. En ciertos casos, las dosis humanas adecuadas se pueden calcular usando datos farmacocinéticos del ratón junto con el conocimiento del peso cerebral y/o las tasas de rotación del líquido cefalorraquídeo (LCR). Por ejemplo, el peso del cerebro del ratón es de aproximadamente 0,4 g, que es aproximadamente el 2% de su peso corporal. En los seres humanos, el peso promedio del cerebro es de 1,5 kg, que es aproximadamente el 2,5% del peso corporal. En ciertos casos, la administración en el LCR da como resultado la eliminación de una porción del compuesto a través de la captación en el tejido cerebral y el metabolismo posterior. Al utilizar la relación entre el peso del cerebro humano y de ratón como factor de escala, se puede calcular una estimación de la eliminación y la depuración a través del tejido cerebral. Además, la tasa de rotación del LCR se puede usar para estimar la eliminación del compuesto del LCR a la sangre. La tasa de rotación del LCR del ratón es de aproximadamente 10-12 veces al día (0,04 ml producidos a 0,325 pl/min). La tasa de rotación del LCR humano es de aproximadamente 4 veces al día (100-160 ml producidos a 350 -400 pl/min). La depuración, y por lo tanto, los requisitos de dosificación pueden basarse en la escala de eliminación del peso del cerebro, y/o la escala de rotación del LCR. La depuración extrapolada del LCR humano se puede usar para estimar dosis equivalentes en seres humanos que se aproximan a las dosis en ratones. De esta manera, se pueden estimar las dosis en seres humanos que tienen en cuenta las diferencias en el metabolismo tisular basándose en el peso del cerebro y las tasas de rotación del LCR. Dichos métodos de cálculo y estimación se conocen por los expertos en la técnica.
A modo de ejemplo no limitativo, en ciertos casos, se puede estimar una dosis humana equivalente a partir de una
dosis de ratón deseada multiplicando la dosis de ratón mg/kg por un factor de aproximadamente 0,25 a aproximadamente 1,25, dependiendo de la depuración y la eliminación de un compuesto particular. Por lo tanto, por ejemplo, en ciertos casos, una dosis equivalente en seres humanos de una dosis de 0,01 mg para un ratón de 20 g variará de aproximadamente 8,75 mg a aproximadamente 43,75 mg de dosis total para un ser humano de 70 kg. Asimismo, por ejemplo, en ciertos casos, una dosis equivalente en seres humanos de una dosis de 0,01 mg para un ratón recién nacido de 4 g variará de aproximadamente 1,9 mg a aproximadamente 9,4 mg de dosis total para un ser humano recién nacido de 3 kg. Estas dosis de ejemplo son simplemente para ilustrar cómo un experto puede determinar una dosis humana adecuada y no pretende limitar la presente descripción.
En ciertos casos, una dosis humana para administración sistémica (ya sea administrada sola o en combinación con la administración al LCR) se calcula o se estima a partir de datos de experimentos con animales, tales como los descritos en el presente documento. Típicamente, una dosis adecuada para seres humanos (en mg/kg) para la dosis sistémica es entre 0,1 y 10 veces una dosis eficaz en animales. Por lo tanto, únicamente con fines ejemplares, una dosis subcutánea de 50 pg en un ratón recién nacido de 2 g es una dosis de 25 mg/kg. Se predice que la dosis correspondiente para un ser humano está entre 2,5 mg/kg y 250 mg/kg. Para un bebé de 3 kilogramos, la dosis correspondiente es de entre 7,5 mg y 750 mg. Para un niño de 25 kg, la dosis correspondiente es de 62,5 mg a 6250 mg.
9. Regímenes de tratamiento
En ciertos casos, las cantidades de dosis anteriores, las frecuencias de dosis, las vías de administración, las fases de inducción y mantenimiento, y el momento de la primera dosis se combinan para proporcionar regímenes de dosificación para sujetos que tienen SMA. Dichos regímenes de dosificación pueden seleccionarse y ajustarse para proporcionar una mejoría de uno o más síntomas de SMA y/o para reducir o evitar la toxicidad o los efectos secundarios atribuibles a la administración de la composición farmacéutica. En ciertos casos, los sujetos están en el útero o son recién nacidos. En dichos casos, la administración de composiciones farmacéuticas, particularmente por infusión continua, presenta desafíos particulares. Por consiguiente, en ciertos casos, la presente descripción proporciona la administración de composiciones farmacéuticas por administración en bolo mientras el sujeto está en el útero o es muy joven, seguido de una infusión continua a través de una bomba de infusión implantada cuando el sujeto es mayor y la colocación de dicha bomba es más práctica. Además, en ciertos casos, a medida que el sujeto crece, la dosis absoluta se aumenta para lograr la misma relación dosis: peso corporal o similar. La siguiente tabla está destinada a ilustrar regímenes de tratamiento y no pretende limitar las posibles combinaciones de tratamientos que se realizarán fácilmente por un experto en la técnica.
En ciertos casos, el régimen de dosificación comprende una administración sistémica, en solitario o en combinación con la administración en el LCR (por ejemplo, el régimen 3, anterior). La tabla, a continuación, ilustra adicionalmente dichos regímenes.
Estos regímenes de tratamiento pretenden ilustrar y no limitar la presente descripción. Un experto en la técnica será capaz de seleccionar una combinación apropiada de las dosis y las administraciones en vista de la presente descripción y basándose en una diversidad de factores, tales como la gravedad de la afección y la salud general y la edad del sujeto.
10. Coadministración
En ciertos casos, las composiciones farmacéuticas de la presente descripción se coadministran con al menos otra composición farmacéutica para tratar SMA y/o para tratar uno o más síntomas asociados con SMA. En ciertos casos, dicha otra composición farmacéutica se selecciona de tricostatina A, ácido valproico, riluzol, hidroxiurea y un butirato o derivado de butirato. En ciertos casos, las composiciones farmacéuticas de la presente descripción se coadministran con tricostatina A. En ciertos casos, las composiciones farmacéuticas de la presente descripción se coadministran con un derivado de quinazolina, por ejemplo, como se describe en Thurmond, et al., J. Med Chem.
2008, 51, 449-469. En ciertos casos, una composición farmacéutica de la presente descripción y al menos otra composición farmacéutica se coadministran al mismo tiempo. En ciertos casos, una composición farmacéutica de la presente descripción y al menos otra composición farmacéutica se coadministran en diferentes momentos.
En ciertos casos, las composiciones farmacéuticas de la presente descripción se coadministran con un agente de terapia génica. En ciertos casos de este tipo, el agente de terapia génica se administra al LCR y la composición farmacéutica de la presente descripción se administra por vía sistémica. En ciertos casos de este tipo, el agente de terapia génica se administra al LCR y la composición farmacéutica de la presente descripción se administra al LCR y por vía sistémica. En ciertos casos, una composición farmacéutica de la presente divulgación y un agente de terapia génica se coadministran al mismo tiempo. En ciertos casos, una composición farmacéutica de la presente divulgación y un agente de terapia génica se coadministran en momentos diferentes. Se han informado ciertos enfoques de terapia génica para el tratamiento de SMA (por ejemplo, Coady et al., PLoS ONE 2008 3(10): e3468; Passini et al., J Clin Invest 2010 Apr 1, 120(4): 1253-64).
En ciertos casos, las composiciones farmacéuticas de la presente descripción se coadministran con al menos otra terapia para SMA. En ciertos casos, dicha otra terapia para SMA es la cirugía. En ciertos casos, dicha otra terapia es la terapia física, incluyendo, pero sin limitación, ejercicios diseñados para fortalecer los músculos necesarios para respirar, tal como la terapia para la tos. En ciertos casos, otra terapia es una intervención física, tal como una sonda de alimentación o un dispositivo para la respiración asistida.
En ciertos casos, las composiciones farmacéuticas de la presente descripción se coadministran con una o más composiciones farmacéuticas que reducen un efecto secundario no deseado de las composiciones farmacéuticas de la presente descripción.
11. Efectos fenotípicos
En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción da como resultado un cambio fenotípico en el sujeto. En ciertos casos, dichos cambios fenotípicos incluyen, pero sin limitación: aumento de la cantidad absoluta de ARNm de SMN que incluye el exón 7; aumento en la relación de ARNm de SMN que incluye el exón 7 con respecto al ARNm de SMN que carece del exón 7; aumento de la cantidad absoluta de proteína SMN que incluye el exón 7; aumento en la relación de proteína SMN que incluye el exón 7 con respecto a la proteína SMN que carece del exón 7; mejora de la fuerza muscular, mejora la actividad eléctrica en al menos un músculo; mejora de la respiración; aumento de peso; y supervivencia. En ciertos casos, al menos un cambio fenotípico se detecta en una neurona motora del sujeto. En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción da como resultado que un sujeto pueda sentarse, ponerse en pie y/o caminar. En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción da como resultado que un sujeto pueda comer, beber y/o respirar sin ayuda. En ciertos casos, la eficacia del tratamiento se evalúa mediante la evaluación electrofisiológica del músculo. En ciertos casos, la administración de una composición farmacéutica de la presente divulgación mejora al menos un síntoma de SMA y tiene poco o ningún efecto antiinflamatorio. En cierto caso de este tipo, la ausencia de efecto inflamatorio está determinada por la ausencia de un aumento significativo en los niveles de Alfl durante el tratamiento.
En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción retrasa la aparición de al menos un síntoma de SMA. En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción retarda la progresión de al menos un síntoma de SMA. En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción reduce la gravedad de al menos un síntoma de SMA.
En ciertos casos, la administración de al menos una composición farmacéutica de la presente descripción da como resultado un efecto secundario no deseado. En ciertos casos, se identifica un régimen de tratamiento que da como resultado la mejoría deseada de los síntomas y mientras se evitan los efectos secundarios no deseados.
12. Unidades de dosificación
En ciertos casos, las composiciones farmacéuticas de la presente descripción se preparan como unidades de dosificación para administración. Ciertas unidades de dosificación de este tipo se encuentran en concentraciones seleccionadas de 0,01 mg a 100 mg. En ciertos casos de este tipo, una composición farmacéutica de la presente divulgación comprende una dosis de compuesto antisentido seleccionado de 0,01 mg, 0,1 mg, 0,5 mg, 1 mg, 5 mg, 10 mg, 20 mg, 25 mg, 50 mg, 75 mg, 100 mg, 150 mg, y 200 mg. En ciertos casos, una composición farmacéutica comprende una dosis de oligonucleótido seleccionada de 0,1 mg, 0,5 mg, 1 mg, 5 mg, 10 mg, 25 mg, y 50 mg.
13. Kits
En ciertos casos, la presente descripción proporciona kits que comprenden al menos una composición farmacéutica. En ciertos casos, dichos kits comprenden además un medio de administración, por ejemplo, una jeringa o una bomba de infusión.
Descripción no limitante
Mientras que ciertos compuestos, composiciones y métodos descritos en el presente documento se han descrito con especificidad de acuerdo con ciertos casos, los siguientes ejemplos sirven solo para ilustrar los compuestos descritos en el presente documento y no pretenden limitarlos. Aunque la lista de secuencias que acompaña a esta presentación identifica cada secuencia como "ARN" o "ADN" según se requiera, en realidad, esas secuencias pueden modificarse con cualquier combinación de modificaciones químicas. Un experto en la técnica apreciará fácilmente que tal designación como "ARN" o "ADN" para describir oligonucleótidos modificados es, en ciertos casos, arbitraria. Por ejemplo, un oligonucleótido que comprende un nucleósido que comprende un resto de azúcar 2'-OH y una base de timina podría describirse como un ADN que tiene un azúcar modificado (2'-OH para 2'-H natural del ADN) o como un ARN que tiene una base modificada (timina (uracilo metilado) para el uracilo natural del ARN). Por consiguiente, las secuencias de ácido nucleico proporcionadas en el presente documento, incluyendo, pero sin limitación, las de la lista de secuencias, pretenden incluir ácidos nucleicos que contienen cualquier combinación de ARN y/o ADN natural o modificado, incluyendo, pero sin limitación, tales ácidos nucleótidos que tienen nucleobases modificadas. A modo de ejemplo adicional y sin limitación, un compuesto oligomérico que tiene la secuencia de nucleobases "ATCGATCG" incluye cualquier compuesto oligomérico que tenga dicha secuencia de nucleobases, ya
sea modificada o no modificada, incluyendo, pero sin limitación, dichos compuestos que comprenden bases de ARN, tal como las que tienen secuencia "AUCGAUCG" y aquellas que tienen algunas bases de ADN y algunas bases de ARN tal como "AUCGATCG" y compuestos oligoméricos que tienen otras bases modificadas, tales como "ATmeCGAUCG", donde meC indica una base de citosina que comprende un grupo metilo en la posición 5.
Ejemplo 1 - Compuestos antisentido dirigidos a SMN2
Los siguientes oligonucleótidos se sintetizaron usando técnicas estándar previamente indicadas.
Ejemplo 2 - Ratones transgénicos de SMN Smn-/-
La eficacia terapéutica y la seguridad usando los compuestos antisentido como se describe anteriormente se pueden probar en un modelo animal apropiado. Por ejemplo, los modelos animales que parecen más similares a las enfermedades humanas incluyen especies animales que desarrollan espontáneamente una alta incidencia de la enfermedad en particular o aquellas que han sido inducidas a hacerlo.
En particular, se conocen modelos animales para SMA. Como se ha explicado anteriormente, la base molecular de SMA, un trastorno neuromuscular autosómico recesivo, es la pérdida homocigota del gen 1 de la supervivencia de la neurona motora (SMN1). Una copia casi idéntica del gen SMN1, llamada SMN2, se encuentra en los seres humanos y modula la gravedad de la enfermedad. A diferencia de los seres humanos, los ratones tienen un solo gen (Smn) que es equivalente a SMN1. La pérdida homocigota de este gen es letal para los embriones y produce una muerte celular masiva, lo que indica que el producto del gen Smn es necesario para la función y la supervivencia celular. La introducción de 2 copias de SMN2 en ratones que carecen de SMN rescata la letalidad embrionaria, dando como resultado ratones con el fenotipo SMA (Monani et al., Hum. Mol. Genet. (2000) 9:333-339. Un alto número de copias de SMN2 rescata a los ratones porque se produce suficiente proteína SMN en las neuronas motoras. Véase, también, Hsieh-Li, et al., Nat. Genet. (2000) 24:66-70, que informa sobre la producción de líneas de ratones transgénicos que expresan SMN2 humano. En particular, los ratones transgénicos que albergaban SMN2 en el fondo Smn -/- mostraron cambios patológicos en la médula espinal y músculos esqueléticos similares a los de los pacientes con SMA. La gravedad de los cambios patológicos en estos ratones se correlacionó con la cantidad de proteína SMN que contenía la región codificada por el exón 7. Los ratones heterocigotos que carecen de una copia de Smn se denominan Smn -/+ y son un modelo para la forma menos grave de SMA, tipo III.
La severidad del fenotipo SMA va en función del número de copias de SMN2 humano en los ratones. La cepa "Taiwán" tiene 4 copias de SMN2 humano, dando como resultado ratones que tienen un fenotipo de SMA moderado a grave, similar al Tipo I o Tipo II.
Los ratones Delta-7 (Smn'7', hSMN2+/+, SMNA7+/+) también carecen de Smn de ratón y expresan SMN2 humano. Los ratones Delta 7 tienen un fenotipo más grave y mueren poco después del nacimiento, típicamente, aproximadamente 15-20 días después del nacimiento.
Ejemplo 3 - Administración sistémica de compuestos antisentido in vivo en SMN2 (cepa de Taiwán) de Smn -/-
Los ratones de Taiwán se trataron mediante inyección intraperitoneal con solución salina o con 35 mg/kg de ISIS396443 o un control de oligonucleótidos antisentido apareado incorrectamente una vez al día durante 5 días y se sacrificaron 2 días después el día 7. Se recogieron el hígado y el riñón y el ARN se aisló usando técnicas estándar. SMN2 con y sin el exón 7 se visualizó mediante RT-PCR. La administración con ISIS396443 dio como resultado un aumento sustancial en la inclusión del exón 7 en el SMN2 de riñón e hígado en comparación con los animales tratados con solución salina y control de apareamiento incorrecto.
Ejemplo 4 - Administración intracerebroventricular (ICV) de compuestos antisentido in vivo en SMN2 (cepa de Taiwán) de Smn -/
A los ratones de Taiwán se les inyectó ICV con solución salina o con 150 pg de ISIS396443 cada día durante 7 días. Los ratones se sacrificaron el día 8 y se extrajo el ARN del cerebro y la médula espinal. El análisis por RT-PCR
mostró un aumento sustancial en la inclusión del exón 7 en el SMN2 en muestras de cerebro y médula espinal obtenidas de animales tratados con ISIS396443. Estos resultados indican que el tratamiento ICV con oligonucleótido antisentido dirigido a SMN puede rescatar la condición de SMA porque la exclusión del exón 7 está asociada con el fenotipo de SMA.
Dosis-respuesta
A los ratones de Taiwán se les inyectó ICV solución salina o 10, 50, 100, o 150 pg de ISIS396443 cada día durante 7 días (5 ratones en cada grupo de tratamiento) y se sacrificaron el día 8. Se aisló el ARN y se analizó mediante RT-PCR. El grupo de tratamiento de 10 pg mostró una inclusión moderada del exón 7. Los grupos de 50 pg, 100 pg y 150 pg mostraron una inclusión sustancial del exón 7.
Duración de respuesta
Para determinar la duración del efecto, 24 ratones se inyectaron ICV con 50 pg de ISIS396443 cada día durante 7 días. Cuatro ratones se sacrificaron en el momento de la dosis final (tiempo 0), y cuatro ratones se sacrificaron en cada una de: 1 semana, 2 semanas, 4 semanas y 8 semanas después de la dosis final. Todos los ratones tratados mostraron una inclusión sustancial en el exón 7 por RT-PCR y el efecto en la semana 8 no mostró diferencias con los otros grupos, como se muestra en la figura 1:
Estos resultados indican que la administración ICV de ISIS396443 a 50 pg al día durante 7 días es eficaz durante al menos 8 semanas después del tratamiento.
El experimento se repitió para probar puntos de tiempo más largos. Los ratones de tipo III se trataron mediante infusión con ICV de ISIS396443 a 50 pg/día durante 7 días. Los ratones se sacrificaron 0, 0,5, 1, 2, 4 y 6 meses después del final del periodo de infusión de 7 días. El ARN se recogió de las médulas espinales y se analizó por transferencia Northern. Como se muestra en el gráfico a continuación, el efecto de la infusión de ISIS396443 persistió durante 6 meses después de la infusión, como se muestra en la figura 2. Esta larga duración del efecto tiene varias explicaciones posibles. Puede reflejar la estabilidad de ISIS396443, la estabilidad de la proteína SMN corregida y/o que la dosis fue lo suficientemente alta como para que, incluso después de la pérdida del compuesto con respecto al metabolismo, la dosis restante continuara proporcionando beneficios. Por lo tanto, estos datos pueden respaldar la administración de dosis más bajas, así como dosis poco frecuentes.
Ejemplo 5 - Administración de compuestos antisentido por infusión intracerebroventricular continua (ICV) Usando una bomba micro-osmótica (Azlet Osmotic Pumps, Cupertino, CA, Estados Unidos), se administró ISIS396443 en el líquido cefalorraquídeo (LCR) a través del ventrículo lateral derecho en ratones adultos SMA Smn+/- o Smn-/- de tipo III con un transgen SMN2 humano (cepa de Taiwán). Los estudios de dosis-respuesta revelaron que la infusión intracerebroventricular (ICV) del ISIS396443 incrementó la inclusión del exón 7 de SMN2 en la médula espinal a ~90%, en comparación con ~10% en ratones tratados con solución salina. El análisis Western blotting e inmunohistoquímico demostraron un fuerte aumento de los niveles de proteína SMN transgénica humana en neuronas motoras de la médula espinal. Estos resultados indican que la infusión en el SNC del oligonucleótido antisentido ISIS396443 puede rescatar la condición de SMA porque la exclusión del exón 7 está asociada con el fenotipo de SMA.
Ejemplo 6 - Administración embrionaria
Se administró una única inyección ICV de 20 pg o 10 pg de ISIS396443 a ratones embrionarios de Taiwán en el día 15 de gestación (E15). Los animales se sacrificaron el día 7 después del nacimiento (P7). El ARN se aisló de la médula espinal lumbar y se analizó mediante RT-PCR. La administración embrionaria única de ISIS 396443 dio como resultado una inclusión sustancial del exón 7. Estos resultados indican que el tratamiento con el oligonucleótido antisentido ISIS396443 en el útero puede rescatar la condición de SMA porque la exclusión del exón 7 está asociada con el fenotipo de SMA.
Se repitió el experimento anterior y los animales se sacrificaron a las 11 semanas. Los ratones taiwaneses sin tratar desarrollan colas necróticas, que se acortan con el tiempo. La inyección embrionaria única de 20 pg de ISIS396443 retrasó significativamente el inicio de la degradación de la cola, como se muestra en la figura 3A. Estos resultados indican que el tratamiento embrionario con oligonucleótido antisentido dirigido a SMN retrasa el inicio de SMA.
Estos resultados se confirmaron en otro estudio usando las mismas condiciones, excepto que las dosis probadas fueron de 20 pg y 10 pg de ISIS396443 y el estudio incluyó ratones normales para la comparación. Los resultados
de ese experimento se muestran en la figura 3B.
Ejemplo 7 - Administración in vivo en el modelo de ratón delta-7
Se aparearon parejas reproductivas de heterocigoto (SMN+/-, hSMN2+/+, SMNA7+/+) y, el día del nacimiento (P0), las crías recién nacidas se trataron con ISIS396443 (18-mer, SEQ ID NO. 1), ISIS396449 (15-mer, SEQ ID NO. 2), ISIS387954 (20-mer, SEQ ID NO.7) o un ASO de control desordenado (ISIS439273; 18-mer). Los ratones se inyectaron bilateralmente en los ventrículos laterales cerebrales para una dosis total de 8 pg (4 pg en cada ventrículo lateral). Todas las inyecciones se realizaron con una aguja de micropipeta de vidrio finamente estirada según se describe (Passini et al, J. Virol. (2001) 75:12382-12392). Después de las inyecciones, a las crías se les amputó el dedo y se genotiparon (Le et al., Hum. Mol. Genet. (2005) 14:845-857) para identificar los ratones con SMA (SMN-/", hSMN2+/+, SMNA7+/+), heterocigotos, y de tipo silvestre (SMN+/+, hSMN2+/+, SMNA7+/+). De todas las camadas se seleccionaron 7 crías para controlar el tamaño de la camada en la supervivencia. Algunas de las camadas no se inyectaron con el objeto de generar grupos de control no tratados.
La amplia distribución de 18-mer, se detectó en la médula espinal a los 14 días posteriores a la inyección en ratones SMA, incluyendo regiones torácicas, lumbares y cervicales de la médula espinal. Además, los estudios de colocalización con ChAT, confirmaron que la gran mayoría de las células dirigidas mediante ISIS396443 en la médula espinal, eran neuronas motoras. No se detectó señal en ratones no tratados, de control.
El análisis de Western blot a los 14 días, mostró una cantidad de SMN en el cerebro y la médula espinal que fueron del 40-60% de los niveles de tipo silvestre, en comparación con el 10% en controles de SMA sin tratar. No se detectó señal por encima del antecedente en ratones de control tratados con una versión desordenada de ASO. Los resultados de los Western blots se proporcionan en la figura 4.
Los ratones con SMA tratados con ASO de SMA también presentaron un aumento significativo del peso, la función ambulatoria (reflejo del enderezamiento y fuerza de agarre), y coordinación (extensión de miembros posteriores) independientemente de la longitud del ASO en comparación con los ratones con SMA sin tratar o ratones con SMA tratados con un ASO desordenado. No se observó un aumento significativo en el peso corporal, la función ambulatoria (reflejo de enderezamiento y fuerza de agarre), o coordinación en ratones con SMA tratados con un ASO desordenado, en comparación con ratones con SMA sin tratar. Los resultados se proporcionan en las figuras 5 y 6.
De manera importante, los ratones con SMA tratados con ASO independientemente de la longitud de ASO, produjeron un aumento significativo en la supervivencia promedio como se muestra en la figura 7. La supervivencia desde el nacimiento fue de 31,5 (15-mer), 27,0 (18-mer), y 28,0 (20-mer) días, en comparación con 16,0 días en controles con SMA no tratados. En contraste, los ratones con SMA tratados con un control desordenado 18-mer, no mejoraron la supervivencia. Estos resultados demuestran que el tratamiento con oligonucleótido antisentido que se dirige al tratamiento con SMN incrementa la duración de la vida en sujetos afectados por SMA.
El ASO de SMA también aumento los recuentos de células de neuronas motoras en la médula espinal como se muestra en la figura 8.
Se midió el ARN de SMN mediante RT-PCR. Los ratones tratados con ASO de SMA habían aumentado los niveles de ARN de SMN en comparación con ratones con SMA sin tratar. Los resultados de ratones tratados con ASO 20-mer, en comparación con ratones con SMA sin tratar se muestran en la figura 9.
Para determinar si la supervivencia puede aumentarse adicionalmente mediante la administración de una segunda dosis, se repitió el experimento anterior con una dosis adicional de 20 pg el día 21. Los resultados se muestran en la figura 10. La gráfica anterior muestra el efecto de la primera dosis de 8 pg el día 0. El día P21, a la mitad de los ratones tratados se les proporcionó un segundo tratamiento.
El efecto del segundo tratamiento en comparación con ratones que recibieron únicamente el primer tratamiento se muestra en la figura 11. Este resultado indica que el segundo tratamiento ICV con oligonucleótido antisentido, aumentó adicionalmente la supervivencia.
Ejemplo 8 - Actividad en ratones con SMA de tipo III
Se probaron dos compuestos antisentido y un compuesto de control en un modelo de ratón de SMA. Los compuestos se describen en la tabla a continuación.
m r n r n n MA l T iw n
Se obtuvieron ratones de la cepa Taiwán con SMA de tipo III en The Jackson Laboratory (Bar Harbor, Maine). Estos ratones carecen de SMN de ratón y son homocigotos para SMN2 humano (mSMN -/-; hSMN2 /+). Estos ratones se han descrito en Hsieh-Li HM, et al., Nature Genet. 24, 66-702000.
Los ratones se trataron con 3, 10, 30, o 100 pg de ISIS396443 o ISIS449220 al día o con 30 o 100 pg de compuesto de control ISIS439272 al día en solución salina tamponada con fosfato (PBS). Los ratones de control se trataron con PBS solo (dosis de 0). Todos los tratamientos se administraron mediante infusión intracerebroventricular (ICV) utilizando una bomba osmótica Azlet 1007D. Hubo cinco animales para cada dosis, sin embargo, dos de los ratones de la dosis más alta de ISIS449220 murieron antes del término del estudio. Los animales se sacrificaron el día 9 (dos días después de la dosis final) y se recogieron de cada animal secciones de cerebro y lumbares de las médulas espinales. Se realizó el análisis por PCR en tiempo real en cada muestra para determinar la cantidad de mensaje de s MN2 humano que incluye el exón 7 ((+)exón 7) y la cantidad de mensaje de SMN2 humano que carece del exón 7((-)exón 7). El análisis por PCR en tiempo real también se realizó para determinar los niveles de expresión del factor inflamatorio de aloinjerto (AIF1) y deshidrogenasa de gliceraldehído 3-fosfato (GADPH).
Los niveles de expresión para (+)exón 7 y (-)exón 7 se normalizaron para los niveles de GADPH. Los niveles de expresión normalizados posteriormente se dividieron por los niveles normalizados con GADPH procedentes de ratones de control tratados con PBS. Los valores de control de aumento resultante se indican en la tabla 17 a continuación. Los datos representan el aumento del control de los cinco ratones en cada grupo, excepto la dosis más alta de ISIS449220, que representan los 3 ratones supervivientes.
La administración de ISIS396443 dio como resultado un aumento notable en la inclusión del exón 7. A 10 pg/día, ISIS396443 dio como resultado casi dos veces (1,8 veces) de mensaje de SMN2 retenido por exón 7 en el cerebro, y en la médula espinal lumbar fue más de dos veces en comparación en comparación con el control sin tratar.
Capacidad de los com uestos antisentido ara alterar el corte em alme en ratones con SMA
Se probó la expresión del factor inflamatorio de aloinjerto (AlF 1) como una medida de inflamación. Después de la normalización de todas las muestras para (GADPH), se dividió la relación de AIF1 para cada grupo de tratamiento mediante el valor para el control de PBS. ISIS396443 no dio resultado ningún aumento en AIF1, incluso a la dosis más alta. ISIS449220 dio como resultado un aumento de AIF1 en la médula espinal tanto de cerebro como lumbar. Los datos en la Tabla 18 representan el aumento del control de los cinco ratones en cada grupo, excepto la dosis
más alta de ISIS449220, que representan los 3 ratones supervivientes.
Toxicidad de com uestos antisentido en ratones con SMA
Ejemplo 9 - Administración a monos
Se usaron monos Cynomolgus para evaluar la distribución de ISIS395443 a diferentes dosis y rutas de administración. Se administró ISIS396443 a 2 monos. Un mono recibió una dosis de 3 mg mediante infusión ICV y el otro mono recibió una dosis de 3 mg mediante infusión IT. Ambas infusiones se administraron durante un periodo de 24 horas. Los monos se sacrificaron y los tejidos se recolectaron 96 horas después del final del periodo de infusión. La concentración de ISIS396443 se midió en muestras de secciones cervicales, torácicas y lumbares de la médula espinal. Los resultados se resumen en la tabla a continuación.
Dado que los monos cynomolgus son de aproximadamente 3 kg, esta dosis es de aproximadamente 1 mg/kg.
Para evaluar adicionalmente la distribución de ISIS39644, se dividieron veintiséis monos en seis grupos como se proporciona en la tabla a continuación.
La velocidad de infusión para todos los grupos fue de 100 pl/hora. Todos los monos recibieron un total de 3 mg de ISIS39644 en solución salina, excepto el grupo 1, que recibió únicamente una solución salina. Los monos se sacrificaron y los tejidos se recogieron 5 días después del final de la infusión.
Las concentraciones de ISIS39644 en muestras de tejido de monos se evaluaron usando técnicas estándar. Los resúmenes de los resultados se proporcionan en los gráficos en la figura 12. Las muestras también se evaluaron mediante histología. La histología no mostró ningún efecto adverso del tratamiento y confirmó la presencia de ISIS396443. No hubo evidencia de pérdida de células de Purkinje.
La infusión rápida pareció tener más ISIS396443 que la infusión lenta. Estos resultados sugieren que las velocidades de infusión más rápidas o la inyección en bolo pueden preferirse en ciertos casos. Dado que la administración en bolo tiene ciertas ventajas prácticas con respecto a la infusión, en ciertos casos, es el método de administración preferido en el LCR. En ciertos casos, el método de administración preferido en el LCR es mediante inyección IT en bolo.
Ejemplo 10 - Generación de un modelo de ratón de SMA grave y tratamiento ICV
Se generaron ratones que tenían un fenotipo de SMA grave (ratones con sSMA). Los ratones con sSMA homocigotos llevan 2 copias de SMN2 humano y no de SMN de ratón. La vida promedio es de aproximadamente 10 días. Además, los ratones con SMA son más pequeños y tienen colas más cortas. Los heterocigotos portan SMN de ratón y se desarrollan de manera normal.
Para estudiar el efecto de los compuestos antisentido en estos ratones con sSMA, se inyectaron ICV 20 pg de ISIS396443 el día P1. El tratamiento dio como resultado un aumento de la supervivencia promedio de 9,9 días (control tratado con solución salina) a 16,7 días. El análisis por RT-PCR mostró un aumento del ARN de SMN de longitud completa en tejidos de ratones tratados.
Ejemplo 11 - Administración sistémica de ISIS 396443
Los ratones con sSMA y los ratones de control heterocigoto sanos se dividieron en grupos para estudiar el efecto de ISIS396443 mediante inyección ICV en bolo y/o inyección subcutánea (SC) en bolo como se indica a continuación:
Grupo 1 - ICV+SC
Una inyección ICV de 20 pg en P1 o P2 (día 1 o 2 después del nacimiento); y dos inyecciones subcutáneas de 50 pg/g administradas entre P0 y P3.
Grupo 2 - SC+SC
Dos inyecciones SC de 50 pg/g administradas entre P0 y P3; y una inyección subcutánea de 50 pg/g administrada entre P5 y P6; y una inyección subcutánea de 50 pg/g administrada entre P9 y P10.
Grupo 3 - SC
Dos inyecciones SC de 50 pg/g administradas entre P0 y P3.
Grupo 4 - control de solución salina de SMA
Una inyección ICV de solución salina en P1 o P2; y dos inyecciones subcutáneas de solución salina administradas entre P0 y P3.
Grupo 5 - Control heterocigoto
Una inyección ICV de 20 pg en P1 o P2; y dos inyecciones subcutáneas de 50 pg/g administradas entre P0 y P3 de ratones heterocigotos.
Cada grupo incluyó de 14 a 22 ratones. La supervivencia (en días) para ratones individuales en cada grupo se proporciona en la tabla a continuación. Muchos ratones en este estudio siguen vivos en el momento en que se prepara la presente solicitud de patente. Por lo tanto, un valor precedido de un ">" indica que el ratón ha vivido ese número de días y aún está vivo.
Ejemplo 12 - Respuesta a la dosis de la administración SC
La supervivencia en ratones con sSMA que recibieron diferentes dosis de ISIS396443 subcutánea se evaluó a través de los siguientes grupos de dosificación.
Grupo 1-SC400 (intervalos de dosis de 80 mg/kg a 180 mg/kg)
Dos inyecciones SC con un total de 400 pg por ratón, administradas entre P0 a P3, la primera dosis fue de 150 pg en P0 o P1 (volumen de 3 pl) y la segunda fue de 250 pg administrada en P2 o P3 (volumen de 5 pl).
Grupo 2-SC200 (intervalos de dosis de 40 mg/kg a 90 mg/kg)
Dos inyecciones SC con un total de 200 pg por ratón, administradas entre P0 y P3, la primera dosis fue de 75 pg en P0-P1 (volumen de 1,5 pl) y la segunda fue de 125 pg administrada en P2 o p3 (volumen de 2,5 pl).
Grupo 3-SC100 (intervalos de dosis de 20 mg/kg a 45 mg/kg)
Dos inyecciones SC con un total de 100 pg por ratón, administradas entre P0 y P3, la primera dosis fue de 40 pg en P0 o P1 (volumen de 2 pl) y la segunda fue de 60 pg administrada en P2 o P3 (volumen de 3 pl).
Grupo 4-SMA solución salina (controles negativos)
Dos inyecciones SC de solución salina entre P0 y P3, la primero fue en P0 o P1 (volumen de 5 pl) y la segunda administrada en P2 o P3 (volumen de 5 pl).
Grupo 5 - Control heterocigoto (controles positivos)
Ratones sin ningún tratamiento.
Cada grupo incluyó de 14 a 26 ratones. La supervivencia (en días) para ratones individuales en cada grupo se proporciona en la tabla a continuación. Muchos ratones en este estudio siguen vivos en el momento en que se prepara la presente solicitud de patente. Por lo tanto, un valor precedido de un ">" indica que el ratón ha vivido ese número de días y aún está vivo.
Ejemplo 13 - Infusión ICV frente a bolo ICV
La administración mediante inyección de bolo intracerebroventricular (bolo ICV) se comparó con la administración mediante infusión intracerebroventricular continua (infusión ICV). Los ratones transgénicos con SMA de tipo III se dosificaron con ISIS387954. A los ratones de infusión ICV se les dio una dosis total de 0 (control de PBS), 87,5 pg, 175 pg, 350 pg, o 700 pg infundida durante 7 días y se sacrificaron 2 días más tarde. A los ratones de bolo ICV se les dio las mismas dosis totales, 0 (control de PBS), 87,5 pg, 175 pg, 350 pg, o 700 pg, en una sola inyección ICV y se sacrificaron 9 días más tarde. Hubo 5 ratones en cada grupo. Se recogió el ARN de la médula espinal lumbar y se analizó mediante PCR en tiempo real. Se normalizó la inclusión del intrón 7 para los controles tratados con solución salina. Los resultados se resumen en la tabla a continuación.
En este experimento, la misma dosis cuando se administró mediante inyección en bolo ICV dio como resultado mayor actividad que cuando se administró mediante infusión ICV durante 7 días.
También se realizó el análisis por PCR en tiempo real para determinar los niveles de expresión del factor inflamatorio de aloinjerto (AIF1) para evaluar la inflamación. Ninguna de las muestras de los ratones tratados mostró una diferencia significativa de los ratones de control.
Ejemplo 14 - Respuesta a la dosis por bolo ICV
La administración mediante bolo intracerebroventricular se probó en dosis adicionales. A los ratones transgénicos se les administró 0, 10,9 pg, 21,9 pg, 43,4 pg, 87,5 pg, o 175 pg de ISIS387954 mediante una única inyección de bolo ICV, y se sacrificaron 9 días después como se ha descrito en el Ejemplo 13. Las muestras se recogieron del cerebro y de la médula espinal lumbar. Se preparó el ARN y se analizó mediante RT-PCR para determinar los cambios en la inclusión del intrón 7 y para determinar el cambio en AIF1. Ninguna de las muestras mostró un cambio en AIF1 en comparación con el control. Los resultados de la inclusión del intrón 7 se resumen en la tabla a continuación. El ED50 es a aproximadamente 22 pg.
La divulgación incluye además la material objeto de las reivindicaciones del documento WO 2010/148249 del que se deriva esta solicitud, cuyo contenido se reproduce a continuación como párrafos numerados.
1. Un método que comprende administrar a un sujeto un compuesto antisentido, que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica un pre-ARNm de SMN2 humano, donde el compuesto antisentido se administra en el líquido cefalorraquídeo.
2. El método del párrafo 1, donde la administración es en el espacio intratecal.
3. El método del párrafo 1, donde la administración es en el líquido cefalorraquídeo en el cerebro.
4. El método de cualquiera de los párrafos 1-3, donde la administración comprende un bolo intravenoso.
5. El método de cualquiera de los párrafos 1-3, donde la administración comprende infusión con una bomba de administración.
6. El método de cualquiera de los párrafos 1-5, donde el compuesto antisentido se administra a una dosis de 0,01 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
7. El método del párrafo 6, donde la dosis es de 0,01 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
8. El método del párrafo 6, donde la dosis es de 0,01 a 5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
9. El método del párrafo 6, donde la dosis es de 0,05 a 1 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
10. El método del párrafo 6, donde la dosis es de 0,01 a 0,5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
11. El método del párrafo 6, donde la dosis es de 0,05 a 0,5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
12. El método de cualquiera de los párrafos 6-11, donde la dosis se administra a diario.
13. El método de cualquiera de los párrafos 6-11, donde la dosis se administra semanalmente.
14. El método de cualquiera de los párrafos 6-11, donde el compuesto antisentido se administra continuamente y donde la dosis es la cantidad administra al día.
15. El método de cualquiera de los párrafos 1-13 que comprende administrar al menos una dosis de inducción durante una fase de inducción y administrar al menos una dosis de mantenimiento durante una fase de mantenimiento.
16. El método del párrafo 15, donde la dosis de inducción es de 0,05 a 5,0 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
17. El método del párrafo 15 o 16, donde la dosis de mantenimiento es de 0,01 a 1,0 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto.
18. El método de cualquiera de los párrafos 15-17, donde la duración de la fase de inducción es de al menos 1 semana.
19. El método de cualquiera de los párrafos 15-18, donde la duración de la fase de mantenimiento es de al menos 1 semana.
20. El método de cualquiera de los párrafos 15-19, donde cada dosis de inducción y cada dosis de mantenimiento comprende una sola inyección.
21. El método de cualquiera de los párrafos 15-19, donde cada dosis de inducción y cada dosis de mantenimiento comprenden independientemente dos o más inyecciones.
22. El método de cualquiera de los párrafos 1-21, donde el compuesto antisentido se administra al menos 2 veces durante un periodo de tratamiento de al menos 1 semana.
23. El método del párrafo 22, donde el periodo de tratamiento es de al menos un mes.
24. El método del párrafo 22, donde el periodo de tratamiento es de al menos 2 meses.
25. El método del párrafo 22, donde el periodo de tratamiento es de al menos 4 meses.
26. El método de cualquiera de los párrafos 15-25, donde la dosis de inducción se administra por uno o más bolos intravenosos y la dosis de mantenimiento se administra mediante una bomba de infusión.
27. El método de cualquiera de los párrafos 1-26 que comprende evaluar la tolerabilidad y/o la eficacia del compuesto antisentido.
28. El método de cualquiera de los párrafos 1-27, donde la cantidad de dosis o frecuencia del compuesto antisentido se reduce después de una indicación de que la administración del compuesto antisentido no se tolera.
29. El método de cualquiera de los párrafos 1-28, donde la cantidad de dosis o frecuencia del compuesto antisentido se mantiene o se reduce tras una indicación de que la administración del compuesto antisentido es eficaz.
30. El método de cualquiera de los párrafos 1-29, donde la dosis de compuesto antisentido se aumenta después de una indicación de que la administración del compuesto antisentido no es eficaz.
31. El método de cualquiera de los párrafos 1-30, donde la frecuencia de administración del compuesto antisentido se reduce tras una indicación de que la administración del compuesto antisentido es eficaz.
32. El método de cualquiera de los párrafos 1-31, donde la frecuencia de administración del compuesto antisentido se aumenta después de una indicación de que la administración del compuesto antisentido no es eficaz.
33. El método de cualquiera de los párrafos anteriores, que comprende la coadministración del compuesto
antisentido y al menos otra terapia.
34. El método del párrafo 33, donde el compuesto antisentido y al menos otra terapia se coadministran al mismo tiempo.
35. El método del párrafo 34, donde el compuesto antisentido se administra antes de la administración de la al menos otra terapia.
36. El método del párrafo 34, donde el compuesto antisentido se administra después de la administración de la al menos otra terapia.
37. El método de cualquiera de los párrafos 33-36 donde la al menos otra terapia comprende la administración de uno o más de ácido valproico, riluzol, hidroxiurea y butirato.
38. El método de cualquiera de los párrafos 33-37, donde la al menos otra terapia comprende la administración de tricostatina-A.
39. El método de cualquiera de los párrafos 33-38, donde la al menos otra terapia comprende la administración de células madre.
40. El método de cualquiera de los párrafos 33-39, donde la al menos otra terapia es terapia génica.
41. El método de cualquiera de los párrafos anteriores, donde el compuesto antisentido se administra a una concentración de aproximadamente 0,01 mg/ml, aproximadamente 0,05 mg/ml, aproximadamente 0,1 mg/ml, aproximadamente 0,5 mg/ml, aproximadamente 1 mg/ml, aproximadamente 5 mg/ml, aproximadamente 10 mg/ml, aproximadamente 50 mg/ml, o aproximadamente 100 mg/ml.
42. El método de cualquiera de los párrafos 1-41, donde la inclusión del exón 7 del ARNm de SMN2 en una neurona motora en el sujeto se aumenta.
43. El método de cualquiera de los párrafos 1-42, donde la inclusión de los aminoácidos del exón 7 en el polipéptido SMN2 en una neurona motora en el sujeto se aumenta.
44. Un método para aumentar la inclusión del exón 7 del ARNm de SMN2 en una neurona motora en un sujeto que comprende administrar al sujeto un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano y aumentar de este modo la inclusión del exón 7 del ARNm de SMN2 en la neurona motora en el sujeto.
45. Un método para aumentar la inclusión de aminoácidos del exón 7 en el polipéptido SMN2 en una neurona motora en un sujeto que comprende administrar al sujeto un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un ácido nucleico que codifica SMN2 humano y aumentar de este modo la inclusión de los aminoácidos del exón 7 en el polipéptido SMN2 en la neurona motora en el sujeto.
46. El método de cualquiera de los párrafos 1-45, donde el sujeto tiene SMA.
47. El método de cualquiera de los párrafos 1-45, donde el sujeto tiene SMA de tipo I.
48. El método de cualquiera de los párrafos 1-45, donde el sujeto tiene SMA de tipo II.
49. El método de cualquiera de los párrafos 1-45, donde el sujeto tiene SMA de tipo III.
50. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra en el útero.
51. El método del párrafo 50, donde la primera dosis se administra antes de completar la formación de la barrera hematoencefálica.
52. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra dentro de la primera semana del nacimiento del sujeto.
53. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra dentro del primer mes del nacimiento del sujeto.
54. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra dentro de los 3 meses del nacimiento del sujeto.
55. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra dentro de los 6 meses del nacimiento del sujeto.
56. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra cuando el sujeto tiene de 1 a 2 años de edad.
57. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra cuando el sujeto tiene de 1 a 15 años de edad.
58. El método de cualquiera de los párrafos 1-49, donde una primera dosis se administra cuando el sujeto es mayor de 15 años de edad.
59. El método de cualquiera de los párrafos 1-58, donde el sujeto es un mamífero.
60. El método del párrafo 59, donde el sujeto es un ser humano.
61. El método de cualquiera de los párrafos 1-60, que comprende identificar un sujeto que tiene SMA.
62. El método del párrafo 61, donde el sujeto se identifica midiendo la actividad eléctrica de uno o más músculos del sujeto.
63. El método del párrafo 61, donde el sujeto se identifica por una prueba genética para determinar si el sujeto tiene una mutación en el gen SMN1 del sujeto.
64. El método del párrafo 61, donde el sujeto se identifica por una biopsia muscular.
65. El método del párrafo 42, donde la administración del compuesto antisentido da como resultado un aumento en
la cantidad de ARNm de SMN2 que tiene el exón 7 de al menos el 10%.
66. El método del párrafo 65, donde el aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 es de al menos el 20%.
67. El método del párrafo 65, donde el aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 es de al menos el 50%.
68. El método del párrafo 65, donde el aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 es de al menos el 70%.
69. El método del párrafo 43, donde la administración del compuesto antisentido da como resultado un aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 de al menos el 10%.
70. El método del párrafo 69, donde el aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 es de al menos el 20%.
71. El método del párrafo 69, donde el aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 es de al menos el 50%.
72. El método del párrafo 69, donde el aumento en la cantidad de polipéptido SMN2 que tiene aminoácidos del exón 7 es de al menos el 70%.
73. El método de cualquiera de los párrafos 1-72, donde la administración del compuesto antisentido mejora al menos un síntoma de s Ma en el sujeto.
74. El método del párrafo 73, donde la administración del compuesto antisentido da como resultado una función motora mejorada en el sujeto.
75. El método del párrafo 73, donde la administración del compuesto antisentido da como resultado una pérdida de la función motora retrasada o reducida en el sujeto.
76. El método del párrafo 73, donde la administración del compuesto antisentido da como resultado una función respiratoria mejorada.
77. El método del párrafo 73, donde la administración del compuesto antisentido da como resultado una mejora de la supervivencia.
78. El método de cualquiera de los párrafos 1-77, donde al menos un nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado.
79. El método del párrafo 78, donde el al menos un resto de azúcar modificado comprende un resto de azúcar 2'-metoxietilo.
80. El método de cualquiera de los párrafos 1-79, donde esencialmente cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado.
81. El método del párrafo 80, donde los nucleósidos que comprenden un resto de azúcar modificado comprenden todos la misma modificación de azúcar.
82. El método del párrafo 81, donde cada resto de azúcar modificado comprende un resto de azúcar 2'-metoxietilo.
83. El método de cualquiera de los párrafos 1-79, donde cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado.
84. El método del párrafo 83, donde todos los nucleósidos comprenden la misma modificación de azúcar.
85. El método del párrafo 84, donde cada resto de azúcar modificado comprende un resto de azúcar 2'-metoxietilo.
86. El método de cualquiera de los párrafos 1-85, donde al menos un enlace internucleosídico es un enlace internucleosídico de fosforotioato.
87. El método del párrafo 86, donde cada enlace internucleosídico es un enlace internucleosídico de fosforotioato.
88. El método de cualquiera de los párrafos 1-87, donde el oligonucleótido antisentido consiste en 10 a 25 nucleósidos unidos.
89. El método de cualquiera de los párrafos 1-87, donde el oligonucleótido antisentido consiste en 12 a 22 nucleósidos unidos.
90. El método de cualquiera de los párrafos 1-87, donde el oligonucleótido antisentido consiste en 15 a 20 nucleósidos unidos.
91. El método de cualquiera de los párrafos 1-87, donde el oligonucleótido antisentido consiste en 18 nucleósidos unidos.
92. El método de cualquiera de los párrafos 1-91, donde el oligonucleótido antisentido es al menos un 90% complementario al ácido nucleico que codifica SMN2 humano.
93. El método del párrafo 92, donde el oligonucleótido antisentido es completamente complementario al ácido nucleico que codifica SMN2 humano.
94. El método de cualquiera de los párrafos 1-93, donde el oligonucleótido tiene una secuencia de nucleobases que comprende al menos 10 nucleobases contiguas de la secuencia de nucleobases de SEQ ID NO: 1.
95. El método del párrafo 94, donde el oligonucleótido tiene una secuencia de nucleobases que comprende al menos 15 nucleobases contiguas de la secuencia de nucleobases de SEQ ID NO: 1.
96. El método del párrafo 94, donde el oligonucleótido tiene una secuencia de nucleobases que comprende la secuencia de nucleobases de SEQ ID NO: 1.
97. El método del párrafo 94, donde el oligonucleótido tiene una secuencia de nucleobases que consiste en la
Claims (17)
1. Un compuesto antisentido que comprende oligonucleótido antisentido complementario al intrón 7 de un pre-ARNm que codifica SMN2 humano, para su uso en el tratamiento de un sujeto humano que tiene atrofia muscular espinal (SMA), donde el compuesto se administra en el líquido cefalorraquídeo en el espacio intratecal del sujeto humano, donde el oligonucleótido antisentido tiene una secuencia de nucleobases que consiste en la secuencia de nucleobases de SEQ ID NO: 1, donde cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado, donde cada resto de azúcar modificado es un resto de azúcar 2'-metoxietilo y donde cada enlace internucleosídico es un enlace de fosforotioato.
2. Uso de un compuesto antisentido que comprende un oligonucleótido antisentido complementario al intrón 7 de un pre-ARNm que codifica SMN2 humano en la fabricación de un medicamento para su uso en el tratamiento de un sujeto humano que tiene atrofia muscular espinal (SMA), donde el medicamento se administra en el líquido cefalorraquídeo en el espacio intratecal del sujeto humano, donde el oligonucleótido antisentido tiene una secuencia de nucleobases que consiste en la secuencia de nucleobases de SEQ ID NO: 1, donde cada nucleósido del oligonucleótido antisentido comprende un resto de azúcar modificado, donde cada resto de azúcar modificado es un resto de azúcar 2'-metoxietilo y donde cada enlace internucleosídico es un enlace de fosforotioato.
3. El compuesto antisentido para su uso de acuerdo con la reivindicación 1, o el uso de un compuesto antisentido de acuerdo con la reivindicación 2 donde la administración comprende un bolo intravenoso.
4. El compuesto antisentido para su uso de acuerdo con la reivindicación 1 o 3, o el uso de un compuesto antisentido de acuerdo con la reivindicación 2 o 3, donde el compuesto antisentido se administra a una dosis de 0,01 a 10 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto humano.
5. El compuesto antisentido para su uso de acuerdo con la reivindicación 4, o el uso de un compuesto antisentido de acuerdo con la reivindicación 4, donde la dosis es:
(a) de 0,01 a 5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto humano;
(b) de 0,05 a 1 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto humano;
(c) de 0,01 a 0,5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto humano; o (d) de 0,05 a 0,5 miligramos de compuesto antisentido por kilogramo de peso corporal del sujeto humano.
6. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-5, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-5, para su uso en el tratamiento de un sujeto humano que tiene (i) SMA de tipo I; (ii) SMA de tipo II; o (iii) SMA de tipo III.
7. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-6, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-6, donde la administración del compuesto antisentido da como resultado un aumento en la cantidad de ARNm de SMN2 que tiene el exón 7 de al menos el 10%.
8. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-7, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-7, donde el sujeto humano tiene uno o más indicadores de SMA.
9. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-8, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-8, donde el sujeto humano tiene al menos un síntoma asociado con SMA.
10. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde el compuesto antisentido se administra tanto por vía sistémica como al sistema nervioso central y donde la administración sistémica y la administración al sistema nervioso central se realizan en diferentes momentos.
11. El compuesto antisentido para su uso, o el uso de un compuesto antisentido de acuerdo con la reivindicación 10, donde la administración sistémica es por administración subcutánea, inyección intravenosa o intraperitoneal.
12. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el
uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde una primera dosis del compuesto antisentido se administra dentro de la primera semana del nacimiento del sujeto humano.
13. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde una primera dosis del compuesto antisentido se administra dentro del primer mes del nacimiento del sujeto humano.
14. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde una primera dosis del compuesto antisentido se administra dentro de los tres meses del nacimiento del sujeto humano.
15. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde una primera dosis del compuesto antisentido se administra dentro de los seis meses del nacimiento del sujeto humano.
16. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde una primera dosis del compuesto antisentido se administra cuando el sujeto humano tiene de 1 a 2 años de edad.
17. El compuesto antisentido para su uso de acuerdo con cualquiera de las reivindicaciones 1 o 3-9, o el uso de un compuesto antisentido de acuerdo con cualquiera de las reivindicaciones 2-9, donde una primera dosis del compuesto antisentido se administra cuando el sujeto humano tiene de 1 a 15 años de edad.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US21803109P | 2009-06-17 | 2009-06-17 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2699827T3 true ES2699827T3 (es) | 2019-02-13 |
Family
ID=43356760
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES17203913T Active ES2699827T3 (es) | 2009-06-17 | 2010-06-17 | Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto |
| ES18185820T Active ES2761614T3 (es) | 2009-06-17 | 2010-06-17 | Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES18185820T Active ES2761614T3 (es) | 2009-06-17 | 2010-06-17 | Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto |
Country Status (24)
| Country | Link |
|---|---|
| US (5) | US8980853B2 (es) |
| EP (4) | EP2442816A4 (es) |
| JP (7) | JP5707396B2 (es) |
| KR (8) | KR101965868B1 (es) |
| CN (5) | CN102665731A (es) |
| AU (2) | AU2010262862C1 (es) |
| CA (1) | CA2765396C (es) |
| CY (2) | CY1120807T1 (es) |
| DK (2) | DK3449926T3 (es) |
| ES (2) | ES2699827T3 (es) |
| HK (1) | HK1246648B (es) |
| HR (2) | HRP20181712T1 (es) |
| HU (2) | HUE039741T2 (es) |
| IL (2) | IL217014A (es) |
| LT (2) | LT3449926T (es) |
| MX (3) | MX361732B (es) |
| NO (1) | NO2020008I1 (es) |
| NZ (2) | NZ597071A (es) |
| PL (2) | PL3449926T3 (es) |
| PT (2) | PT3449926T (es) |
| RU (2) | RU2683772C2 (es) |
| SI (2) | SI3305302T1 (es) |
| TR (1) | TR201816256T4 (es) |
| WO (1) | WO2010148249A1 (es) |
Families Citing this family (110)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1855694B1 (en) | 2005-02-09 | 2020-12-02 | Sarepta Therapeutics, Inc. | Antisense composition for treating muscle atrophy |
| PL2548560T3 (pl) * | 2005-06-23 | 2015-11-30 | Biogen Ma Inc | Kompozycje i sposoby modulowania splicingu SMN2 |
| US8067571B2 (en) | 2005-07-13 | 2011-11-29 | Avi Biopharma, Inc. | Antibacterial antisense oligonucleotide and method |
| ES2616051T3 (es) | 2008-12-02 | 2017-06-09 | Wave Life Sciences Japan, Inc. | Método para la síntesis de ácidos nucleicos modificados en el átomo de fósforo |
| PT3449926T (pt) * | 2009-06-17 | 2019-11-12 | Cold Spring Harbor Laboratory | Composições e métodos de modulação de excisões de smn2 em um sujeito |
| US9744183B2 (en) | 2009-07-06 | 2017-08-29 | Wave Life Sciences Ltd. | Nucleic acid prodrugs and methods of use thereof |
| US8802642B2 (en) | 2010-04-28 | 2014-08-12 | Iowa State University Research Foundation, Inc. | Spinal muscular atrophy treatment via targeting SMN2 catalytic core |
| TWI620756B (zh) | 2010-05-28 | 2018-04-11 | 薩羅塔治療公司 | 具有經修飾之單元間連結及/或末端基團之寡核苷酸類似物 |
| TWI541024B (zh) | 2010-09-01 | 2016-07-11 | 日本新藥股份有限公司 | 反義核酸 |
| WO2012031243A2 (en) | 2010-09-03 | 2012-03-08 | Avi Biopharma, Inc. | dsRNA MOLECULES COMPRISING OLIGONUCLEOTIDE ANALOGS HAVING MODIFIED INTERSUBUNIT LINKAGES AND/OR TERMINAL GROUPS |
| EP2620428B1 (en) | 2010-09-24 | 2019-05-22 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| US9920317B2 (en) | 2010-11-12 | 2018-03-20 | The General Hospital Corporation | Polycomb-associated non-coding RNAs |
| WO2012065143A1 (en) | 2010-11-12 | 2012-05-18 | The General Hospital Corporation | Polycomb-associated non-coding rnas |
| IL273838B (en) | 2011-05-05 | 2022-09-01 | Sarepta Therapeutics Inc | Peptide and oligonucleotide conjugates, preparations containing them and their uses |
| CA2836364C (en) | 2011-05-25 | 2021-01-26 | Universite Paris Descartes | Erk inhibitors for use in treating spinal muscular atrophy |
| KR20140068884A (ko) | 2011-07-19 | 2014-06-09 | 웨이브 라이프 사이언시스 피티이. 리미티드 | 관능화된 핵산의 합성 방법 |
| US20130085139A1 (en) | 2011-10-04 | 2013-04-04 | Royal Holloway And Bedford New College | Oligomers |
| CA2855241A1 (en) | 2011-11-11 | 2013-05-16 | Santaris Pharma A/S | Compounds for the modulation of smn2 splicing |
| WO2013074834A1 (en) | 2011-11-18 | 2013-05-23 | Sarepta Therapeutics, Inc. | Functionally-modified oligonucleotides and subunits thereof |
| CA2857664A1 (en) | 2011-11-30 | 2013-06-06 | Sarepta Therapeutics, Inc. | Antisense oligonucleotides targeting within the smn2 pre-mrna for use ininduced exon inclusion in spinal muscle atrophy |
| US9725716B2 (en) | 2011-12-06 | 2017-08-08 | Ohio State Innovation Foundation and Research Institute at Nationwide Children's Hospital | Non-ionic, low osmolar contrast agents for delivery of antisense oligonucleotides and treatment of disease |
| CA2866392C (en) | 2012-03-30 | 2023-10-24 | Washington University | Methods for modulating tau expression for reducing seizure and modifying a neurodegenerative syndrome |
| JP6268157B2 (ja) | 2012-07-13 | 2018-01-24 | 株式会社Wave Life Sciences Japan | 不斉補助基 |
| CN112007045A (zh) | 2012-07-13 | 2020-12-01 | 波涛生命科学有限公司 | 手性控制 |
| US9926559B2 (en) | 2013-01-09 | 2018-03-27 | Biogen Ma Inc. | Compositions and methods for modulation of SMN2 splicing in a subject |
| WO2014113540A1 (en) * | 2013-01-16 | 2014-07-24 | Iowa State University Research Foundation, Inc. | A deep intronic target for splicing correction on spinal muscular atrophy gene |
| WO2014153236A1 (en) | 2013-03-14 | 2014-09-25 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulating tau expression |
| US9885040B2 (en) | 2013-04-12 | 2018-02-06 | The Curators Of The University Of Missouri | SMN2 element 1 antisense compositions and methods and uses thereof |
| TW202246503A (zh) | 2013-07-19 | 2022-12-01 | 美商百健Ma公司 | 用於調節τ蛋白表現之組合物 |
| JP6697384B2 (ja) | 2013-07-25 | 2020-05-20 | イグジキュア, インコーポレーテッドExicure, Inc. | 予防的および治療的使用のための免疫刺激剤としての球状の核酸ベース構築物 |
| WO2015023797A1 (en) | 2013-08-13 | 2015-02-19 | Northwestern University | Lipophilic nanoparticles for drug delivery |
| WO2015023941A1 (en) | 2013-08-16 | 2015-02-19 | Rana Therapeutics, Inc. | Oligonucleotides targeting euchromatin regions of genes |
| AU2014315183B2 (en) | 2013-09-04 | 2021-03-04 | Cold Spring Harbor Laboratory | Reducing nonsense-mediated mRNA decay |
| TWI736514B (zh) | 2013-09-05 | 2021-08-21 | 美商薩羅塔治療公司 | 酸性α葡萄糖苷酶之反義股誘導之外顯子2包含 |
| WO2015108048A1 (ja) | 2014-01-15 | 2015-07-23 | 株式会社新日本科学 | 抗腫瘍作用を有するキラル核酸アジュバンド及び抗腫瘍剤 |
| JPWO2015108047A1 (ja) | 2014-01-15 | 2017-03-23 | 株式会社新日本科学 | 免疫誘導活性を有するキラル核酸アジュバンド及び免疫誘導活性剤 |
| PL3094728T3 (pl) | 2014-01-16 | 2022-07-04 | Wave Life Sciences Ltd. | Projekt chiralny |
| WO2015161170A2 (en) | 2014-04-17 | 2015-10-22 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulation of smn2 splicing in a subject |
| GB201410693D0 (en) | 2014-06-16 | 2014-07-30 | Univ Southampton | Splicing modulation |
| CN104163871A (zh) * | 2014-08-12 | 2014-11-26 | 大连医科大学 | 抗肿瘤的特异性剪接因子及制备方法 |
| BR112017004056A2 (pt) | 2014-09-12 | 2017-12-05 | Biogen Ma Inc | composições e métodos para detecção da proteína smn em um indivíduo e tratamento de um indivíduo |
| CN107109411B (zh) | 2014-10-03 | 2022-07-01 | 冷泉港实验室 | 核基因输出的定向增加 |
| US10858650B2 (en) | 2014-10-30 | 2020-12-08 | The General Hospital Corporation | Methods for modulating ATRX-dependent gene repression |
| WO2016085986A1 (en) | 2014-11-24 | 2016-06-02 | Northwestern University | High density lipoprptein nanoparticles for inflammation |
| US10900036B2 (en) | 2015-03-17 | 2021-01-26 | The General Hospital Corporation | RNA interactome of polycomb repressive complex 1 (PRC1) |
| MA41795A (fr) | 2015-03-18 | 2018-01-23 | Sarepta Therapeutics Inc | Exclusion d'un exon induite par des composés antisens dans la myostatine |
| WO2016164896A2 (en) | 2015-04-10 | 2016-10-13 | Ionis Pharmaceuticals, Inc. | Modulation of smn expression |
| JP6873052B2 (ja) | 2015-06-01 | 2021-05-19 | サレプタ セラピューティクス,インコーポレイテッド | Vii型コラーゲンにおけるアンチセンス誘導エクソン排除 |
| WO2016196897A1 (en) | 2015-06-04 | 2016-12-08 | Sarepta Therapeutics, Inc. | Methods and compounds for treatment of lymphocyte-related diseases and conditions |
| AU2016317667A1 (en) * | 2015-08-28 | 2018-03-22 | Sarepta Therapeutics, Inc. | Modified antisense oligomers for exon inclusion in spinal muscular atrophy |
| KR20220105174A (ko) | 2015-10-09 | 2022-07-26 | 유니버시티 오브 사우스앰톤 | 유전자 발현의 조절 및 탈조절된 단백질 발현의 스크리닝 |
| EP3858993A1 (en) | 2015-10-09 | 2021-08-04 | Sarepta Therapeutics, Inc. | Compositions and methods for treating duchenne muscular dystrophy and related disorders |
| WO2017087486A1 (en) | 2015-11-16 | 2017-05-26 | Ohio State Innovation Foundation | Methods and compositions for treating disorders and diseases using survival motor neuron (smn) protein |
| EP3389671A4 (en) | 2015-12-14 | 2019-07-17 | Cold Spring Harbor Laboratory | ANTISENSE OLIGOMERS FOR THE TREATMENT OF ALAGILLE'S SYNDROME |
| JP7049249B2 (ja) | 2015-12-14 | 2022-04-06 | コールド スプリング ハーバー ラボラトリー | 中枢神経系疾患の処置のための組成物および方法 |
| WO2017106377A1 (en) | 2015-12-14 | 2017-06-22 | Cold Spring Harbor Laboratory | Antisense oligomers for treatment of autosomal dominant mental retardation-5 and dravet syndrome |
| US11096956B2 (en) | 2015-12-14 | 2021-08-24 | Stoke Therapeutics, Inc. | Antisense oligomers and uses thereof |
| JP7054675B2 (ja) | 2015-12-14 | 2022-04-14 | コールド スプリング ハーバー ラボラトリー | 網膜色素変性症18と網膜色素変性症13の処置のための組成物と方法 |
| JP2019500345A (ja) | 2015-12-14 | 2019-01-10 | コールド スプリング ハーバー ラボラトリー | 肝臓病の処置のための組成物および方法 |
| AU2017254106B2 (en) | 2016-04-18 | 2024-07-11 | Sarepta Therapeutics, Inc. | Antisense oligomers and methods of using the same for treating diseases associated with the acid alpha-glucosidase gene |
| WO2017193087A1 (en) | 2016-05-06 | 2017-11-09 | Exicure, Inc. | Liposomal spherical nucleic acid (sna) constructs prsenting antisense oligonucleotides(aso) for specific knockdown of interleukin 17 receptor mrna |
| JP7075359B2 (ja) | 2016-06-14 | 2022-05-25 | バイオジェン・エムエイ・インコーポレイテッド | オリゴヌクレオチドの精製のための疎水性相互作用クロマトグラフィー |
| EP3471779A4 (en) | 2016-06-16 | 2020-07-08 | Ionis Pharmaceuticals, Inc. | COMBINATIONS FOR MODULATING THE SMN EXPRESSION |
| CN109689668B (zh) | 2016-06-24 | 2023-02-17 | 比奥根Ma公司 | 无加帽步骤的硫醇化寡核苷酸的合成 |
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| JOP20190065A1 (ar) | 2016-09-29 | 2019-03-28 | Ionis Pharmaceuticals Inc | مركبات وطرق لتقليل التعبير عن tau |
| EP4035659A1 (en) | 2016-11-29 | 2022-08-03 | PureTech LYT, Inc. | Exosomes for delivery of therapeutic agents |
| SI3589730T1 (sl) | 2017-02-28 | 2024-04-30 | The Trustees Of The University Of Pennsylvania | Adeno-povezan virus (AAV) clade F vektor in njihova uporaba |
| JOP20190200A1 (ar) | 2017-02-28 | 2019-08-27 | Univ Pennsylvania | تركيبات نافعة في معالجة ضمور العضل النخاعي |
| EP3594346A4 (en) * | 2017-03-10 | 2020-12-16 | National Center For Child Health And Development | ANTISENSE OLIGONUCLEOTIDE AND COMPOSITION FOR THE PREVENTION OR TREATMENT OF GLYCOGEN STORAGE DISEASE TYPE IA |
| WO2018195338A1 (en) | 2017-04-20 | 2018-10-25 | Atyr Pharma, Inc. | Compositions and methods for treating lung inflammation |
| US11696954B2 (en) | 2017-04-28 | 2023-07-11 | Exicure Operating Company | Synthesis of spherical nucleic acids using lipophilic moieties |
| US11685839B2 (en) | 2017-06-19 | 2023-06-27 | Sumitomo Metal Mining Co., Ltd. | Near-infrared curable ink composition and production method thereof, near-infrared cured layer, and stereolithography |
| MA49555A (fr) | 2017-07-10 | 2021-04-28 | Geron Corp | Procédé amélioré de préparation d'imetelstat |
| BR122020005073A2 (pt) | 2017-08-04 | 2020-10-13 | Skyhawk Therapeutics, Inc. | Composto, composição farmacêutica e uso do composto |
| FI3673080T3 (fi) | 2017-08-25 | 2023-11-23 | Stoke Therapeutics Inc | Antisense-oligomeerejä häiriötilojen ja sairauksien hoitoon |
| SG11202001783YA (en) * | 2017-10-12 | 2020-03-30 | Wave Life Sciences Ltd | Oligonucleotide compositions and methods thereof |
| JP7394753B2 (ja) | 2017-10-18 | 2023-12-08 | サレプタ セラピューティクス, インコーポレイテッド | アンチセンスオリゴマー化合物 |
| CA3079729A1 (en) | 2017-10-23 | 2019-05-02 | Stoke Therapeutics, Inc. | Antisense oligomers for treatment of non-sense mediated rna decay based conditions and diseases |
| SG11202004406VA (en) | 2017-11-08 | 2020-06-29 | Avexis Inc | Means and method for preparing viral vectors and uses of same |
| TW201940695A (zh) * | 2018-01-12 | 2019-10-16 | 英商卡美納生物科學公司 | 用於無模板幾何型酶催化性核酸合成之組成物和方法 |
| JP7455746B2 (ja) | 2018-01-12 | 2024-03-26 | ブリストル-マイヤーズ スクイブ カンパニー | アルファ-シヌクレインを標的とするアンチセンスオリゴヌクレオチドおよびその使用 |
| MX2020007852A (es) | 2018-01-25 | 2021-01-29 | Biogen Ma Inc | Metodos para el tratamiento de la atrofia muscular espinal. |
| WO2019169203A1 (en) * | 2018-02-28 | 2019-09-06 | Exicure, Inc. | Liposomal spherical nucleic acid (sna) constructs for survival of motor neuron (sma) inhibitors |
| WO2019168558A1 (en) * | 2018-02-28 | 2019-09-06 | Exicure, Inc. | Liposomal spherical nucleic acid (sna) constructs for survival of motor neuron (sma) inhibitors |
| EP3763815A4 (en) | 2018-03-09 | 2021-12-15 | Daiichi Sankyo Company, Limited | THERAPEUTIC AGENT FOR GLYCOGEN STORAGE DISEASE TYPE IA |
| EP3769769A4 (en) | 2018-03-19 | 2022-05-04 | National University Corporation Tokyo Medical and Dental University | NUCLEIC ACID WITH REDUCED TOXICITY |
| MX2020011695A (es) | 2018-05-04 | 2021-02-26 | Stoke Therapeutics Inc | Métodos y composiciones para el tratamiento de la enfermedad por almacenamiento de éster de colesterilo. |
| CN112601557A (zh) | 2018-06-08 | 2021-04-02 | 诺华股份有限公司 | 用于测量药物产品效力的基于细胞的测定 |
| MX2020014116A (es) | 2018-06-27 | 2021-06-15 | Reborna Biosciences Inc | Agente profilactico o terapeutico para atrofia muscular espinal. |
| JP2021534154A (ja) * | 2018-08-15 | 2021-12-09 | バイオジェン・エムエイ・インコーポレイテッドBiogen MA Inc. | 脊髄性筋萎縮症のための併用療法 |
| EP3873934A2 (en) | 2018-10-29 | 2021-09-08 | Biogen MA Inc. | Humanized and stabilized fc5 variants for enhancement of blood brain barrier transport |
| US20220001028A1 (en) | 2018-11-30 | 2022-01-06 | Novartis Ag | Aav viral vectors and uses thereof |
| WO2020157760A1 (en) | 2019-01-31 | 2020-08-06 | Bar Ilan University | Neoantigens created by aberrant-induced splicing and uses thereof in enhancing immunotherapy |
| KR20210135241A (ko) | 2019-02-05 | 2021-11-12 | 스카이호크 테라퓨틱스, 인코포레이티드 | 스플라이싱을 조절하는 방법 및 조성물 |
| KR20210135507A (ko) | 2019-02-06 | 2021-11-15 | 스카이호크 테라퓨틱스, 인코포레이티드 | 스플라이싱을 조절하는 방법 및 조성물 |
| CA3162618A1 (en) | 2019-03-20 | 2020-09-24 | Peter Jungsoo PARK | Antisense oligonucleotide-based progranulin augmentation therapy in neurodegenerative diseases |
| JP2022531876A (ja) | 2019-05-08 | 2022-07-12 | バイオジェン・エムエイ・インコーポレイテッド | オリゴヌクレオチドの収束液相合成 |
| PL3999643T3 (pl) * | 2019-07-19 | 2024-02-19 | Biogen Ma Inc. | Sposoby leczenia rdzeniowego zaniku mięśni i zapobiegania mu |
| JP2022544538A (ja) * | 2019-08-15 | 2022-10-19 | バイオジェン・エムエイ・インコーポレイテッド | 脊髄性筋萎縮症のための併用療法 |
| WO2021089736A1 (en) * | 2019-11-06 | 2021-05-14 | Association Institut De Myologie | Combined therapy for muscular diseases |
| RU2738093C9 (ru) * | 2019-12-23 | 2020-12-29 | Общество с ограниченной ответственностью "Гелеспон" | Способ синтеза 2'-о-(2-метоксиэтил) тиофосфатного олигонуклеотида |
| CN115279379A (zh) * | 2020-02-28 | 2022-11-01 | Ionis 制药公司 | 用于调节smn2的化合物和方法 |
| CN113444722B (zh) * | 2020-03-24 | 2024-09-24 | 中国科学院脑科学与智能技术卓越创新中心 | 单碱基编辑介导的剪接修复在制备治疗脊髓性肌萎缩症中的应用 |
| MX2022014151A (es) | 2020-05-11 | 2022-11-30 | Stoke Therapeutics Inc | Oligomeros antisentido de opa1 para tratamiento de afecciones y enfermedades. |
| WO2022022617A1 (en) * | 2020-07-31 | 2022-02-03 | Ractigen Therapeutics | Combinatory treatment of sma with sarna and mrna modulators |
| AR125239A1 (es) | 2021-04-02 | 2023-06-28 | Kumiai Chemical Industry Co | Compuesto heterocíclico y uso del mismo |
| WO2023073526A1 (en) | 2021-10-25 | 2023-05-04 | Novartis Ag | Methods for improving adeno-associated virus (aav) delivery |
| KR20240123838A (ko) | 2021-12-20 | 2024-08-14 | 프라이 유니베르시탯 베를린 | Rbm3 발현을 증가시키는 방법 및 제제 |
| WO2023240236A1 (en) | 2022-06-10 | 2023-12-14 | Voyager Therapeutics, Inc. | Compositions and methods for the treatment of spinal muscular atrophy related disorders |
Family Cites Families (125)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5927900A (ja) | 1982-08-09 | 1984-02-14 | Wakunaga Seiyaku Kk | 固定化オリゴヌクレオチド |
| FR2540122B1 (fr) | 1983-01-27 | 1985-11-29 | Centre Nat Rech Scient | Nouveaux composes comportant une sequence d'oligonucleotide liee a un agent d'intercalation, leur procede de synthese et leur application |
| US4605735A (en) | 1983-02-14 | 1986-08-12 | Wakunaga Seiyaku Kabushiki Kaisha | Oligonucleotide derivatives |
| US4948882A (en) | 1983-02-22 | 1990-08-14 | Syngene, Inc. | Single-stranded labelled oligonucleotides, reactive monomers and methods of synthesis |
| US4824941A (en) | 1983-03-10 | 1989-04-25 | Julian Gordon | Specific antibody to the native form of 2'5'-oligonucleotides, the method of preparation and the use as reagents in immunoassays or for binding 2'5'-oligonucleotides in biological systems |
| US4587044A (en) | 1983-09-01 | 1986-05-06 | The Johns Hopkins University | Linkage of proteins to nucleic acids |
| US5118800A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | Oligonucleotides possessing a primary amino group in the terminal nucleotide |
| US5118802A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | DNA-reporter conjugates linked via the 2' or 5'-primary amino group of the 5'-terminal nucleoside |
| FR2567892B1 (fr) | 1984-07-19 | 1989-02-17 | Centre Nat Rech Scient | Nouveaux oligonucleotides, leur procede de preparation et leurs applications comme mediateurs dans le developpement des effets des interferons |
| US5258506A (en) | 1984-10-16 | 1993-11-02 | Chiron Corporation | Photolabile reagents for incorporation into oligonucleotide chains |
| US5430136A (en) | 1984-10-16 | 1995-07-04 | Chiron Corporation | Oligonucleotides having selectably cleavable and/or abasic sites |
| US4828979A (en) | 1984-11-08 | 1989-05-09 | Life Technologies, Inc. | Nucleotide analogs for nucleic acid labeling and detection |
| US4762779A (en) | 1985-06-13 | 1988-08-09 | Amgen Inc. | Compositions and methods for functionalizing nucleic acids |
| US5317098A (en) | 1986-03-17 | 1994-05-31 | Hiroaki Shizuya | Non-radioisotope tagging of fragments |
| JPS638396A (ja) | 1986-06-30 | 1988-01-14 | Wakunaga Pharmaceut Co Ltd | ポリ標識化オリゴヌクレオチド誘導体 |
| US4904582A (en) | 1987-06-11 | 1990-02-27 | Synthetic Genetics | Novel amphiphilic nucleic acid conjugates |
| US5585481A (en) | 1987-09-21 | 1996-12-17 | Gen-Probe Incorporated | Linking reagents for nucleotide probes |
| US5525465A (en) | 1987-10-28 | 1996-06-11 | Howard Florey Institute Of Experimental Physiology And Medicine | Oligonucleotide-polyamide conjugates and methods of production and applications of the same |
| DE3738460A1 (de) | 1987-11-12 | 1989-05-24 | Max Planck Gesellschaft | Modifizierte oligonukleotide |
| US5082830A (en) | 1988-02-26 | 1992-01-21 | Enzo Biochem, Inc. | End labeled nucleotide probe |
| US5109124A (en) | 1988-06-01 | 1992-04-28 | Biogen, Inc. | Nucleic acid probe linked to a label having a terminal cysteine |
| US5262536A (en) | 1988-09-15 | 1993-11-16 | E. I. Du Pont De Nemours And Company | Reagents for the preparation of 5'-tagged oligonucleotides |
| US5512439A (en) | 1988-11-21 | 1996-04-30 | Dynal As | Oligonucleotide-linked magnetic particles and uses thereof |
| US5176996A (en) | 1988-12-20 | 1993-01-05 | Baylor College Of Medicine | Method for making synthetic oligonucleotides which bind specifically to target sites on duplex DNA molecules, by forming a colinear triplex, the synthetic oligonucleotides and methods of use |
| US5599923A (en) | 1989-03-06 | 1997-02-04 | Board Of Regents, University Of Tx | Texaphyrin metal complexes having improved functionalization |
| US5457183A (en) | 1989-03-06 | 1995-10-10 | Board Of Regents, The University Of Texas System | Hydroxylated texaphyrins |
| FR2645345A1 (fr) | 1989-03-31 | 1990-10-05 | Thomson Csf | Procede de modulation dirigee de la composition ou du dopage de semi-conducteurs, notamment pour la realisation de composants electroniques monolithiques de type planar, utilisation et produits correspondants |
| US5391723A (en) | 1989-05-31 | 1995-02-21 | Neorx Corporation | Oligonucleotide conjugates |
| US5256775A (en) | 1989-06-05 | 1993-10-26 | Gilead Sciences, Inc. | Exonuclease-resistant oligonucleotides |
| US4958013A (en) | 1989-06-06 | 1990-09-18 | Northwestern University | Cholesteryl modified oligonucleotides |
| US5451463A (en) | 1989-08-28 | 1995-09-19 | Clontech Laboratories, Inc. | Non-nucleoside 1,3-diol reagents for labeling synthetic oligonucleotides |
| US5254469A (en) | 1989-09-12 | 1993-10-19 | Eastman Kodak Company | Oligonucleotide-enzyme conjugate that can be used as a probe in hybridization assays and polymerase chain reaction procedures |
| US5591722A (en) | 1989-09-15 | 1997-01-07 | Southern Research Institute | 2'-deoxy-4'-thioribonucleosides and their antiviral activity |
| ATE269870T1 (de) | 1989-10-24 | 2004-07-15 | Isis Pharmaceuticals Inc | 2'-modifizierte oligonukleotide |
| US5292873A (en) | 1989-11-29 | 1994-03-08 | The Research Foundation Of State University Of New York | Nucleic acids labeled with naphthoquinone probe |
| US5486603A (en) | 1990-01-08 | 1996-01-23 | Gilead Sciences, Inc. | Oligonucleotide having enhanced binding affinity |
| US5646265A (en) | 1990-01-11 | 1997-07-08 | Isis Pharmceuticals, Inc. | Process for the preparation of 2'-O-alkyl purine phosphoramidites |
| US6753423B1 (en) | 1990-01-11 | 2004-06-22 | Isis Pharmaceuticals, Inc. | Compositions and methods for enhanced biostability and altered biodistribution of oligonucleotides in mammals |
| US5670633A (en) | 1990-01-11 | 1997-09-23 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides that detect and modulate gene expression |
| US5578718A (en) | 1990-01-11 | 1996-11-26 | Isis Pharmaceuticals, Inc. | Thiol-derivatized nucleosides |
| US5214136A (en) | 1990-02-20 | 1993-05-25 | Gilead Sciences, Inc. | Anthraquinone-derivatives oligonucleotides |
| AU7579991A (en) | 1990-02-20 | 1991-09-18 | Gilead Sciences, Inc. | Pseudonucleosides and pseudonucleotides and their polymers |
| GB9009980D0 (en) | 1990-05-03 | 1990-06-27 | Amersham Int Plc | Phosphoramidite derivatives,their preparation and the use thereof in the incorporation of reporter groups on synthetic oligonucleotides |
| DK0455905T3 (da) | 1990-05-11 | 1998-12-07 | Microprobe Corp | Dipsticks til nukleinsyrehybridiseringsassays og fremgangsmåde til kovalent immobilisering af oligonukleotider |
| US5218105A (en) | 1990-07-27 | 1993-06-08 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5688941A (en) | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5245022A (en) | 1990-08-03 | 1993-09-14 | Sterling Drug, Inc. | Exonuclease resistant terminally substituted oligonucleotides |
| US5512667A (en) | 1990-08-28 | 1996-04-30 | Reed; Michael W. | Trifunctional intermediates for preparing 3'-tailed oligonucleotides |
| KR930702373A (ko) | 1990-11-08 | 1993-09-08 | 안토니 제이. 페이네 | 합성 올리고누클레오티드에 대한 다중 리포터(Reporter)그룹의 첨합 |
| US6582908B2 (en) | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| US5371241A (en) | 1991-07-19 | 1994-12-06 | Pharmacia P-L Biochemicals Inc. | Fluorescein labelled phosphoramidites |
| DE59208572D1 (de) | 1991-10-17 | 1997-07-10 | Ciba Geigy Ag | Bicyclische Nukleoside, Oligonukleotide, Verfahren zu deren Herstellung und Zwischenprodukte |
| US5359044A (en) | 1991-12-13 | 1994-10-25 | Isis Pharmaceuticals | Cyclobutyl oligonucleotide surrogates |
| US5595726A (en) | 1992-01-21 | 1997-01-21 | Pharmacyclics, Inc. | Chromophore probe for detection of nucleic acid |
| US5565552A (en) | 1992-01-21 | 1996-10-15 | Pharmacyclics, Inc. | Method of expanded porphyrin-oligonucleotide conjugate synthesis |
| FR2687679B1 (fr) | 1992-02-05 | 1994-10-28 | Centre Nat Rech Scient | Oligothionucleotides. |
| EP0577558A2 (de) | 1992-07-01 | 1994-01-05 | Ciba-Geigy Ag | Carbocyclische Nukleoside mit bicyclischen Ringen, Oligonukleotide daraus, Verfahren zu deren Herstellung, deren Verwendung und Zwischenproduckte |
| US5272250A (en) | 1992-07-10 | 1993-12-21 | Spielvogel Bernard F | Boronated phosphoramidate compounds |
| US5574142A (en) | 1992-12-15 | 1996-11-12 | Microprobe Corporation | Peptide linkers for improved oligonucleotide delivery |
| ES2107205T3 (es) | 1993-03-30 | 1997-11-16 | Sanofi Sa | Analogos de nucleosidos aciclicos y secuencias oligonucleotidas que los contienen. |
| DE4311944A1 (de) | 1993-04-10 | 1994-10-13 | Degussa | Umhüllte Natriumpercarbonatpartikel, Verfahren zu deren Herstellung und sie enthaltende Wasch-, Reinigungs- und Bleichmittelzusammensetzungen |
| JPH08510130A (ja) | 1993-05-11 | 1996-10-29 | ザ・ユニヴァーシティ・オヴ・ノース・キャロライナ・アト・チャペル・ヒル | 異常スプライシングを阻害するアンチセンスオリゴヌクレオチドと同物質の利用法 |
| US5801154A (en) | 1993-10-18 | 1998-09-01 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide modulation of multidrug resistance-associated protein |
| US5446137B1 (en) | 1993-12-09 | 1998-10-06 | Behringwerke Ag | Oligonucleotides containing 4'-substituted nucleotides |
| US5519134A (en) | 1994-01-11 | 1996-05-21 | Isis Pharmaceuticals, Inc. | Pyrrolidine-containing monomers and oligomers |
| NZ282981A (en) | 1994-02-28 | 1998-08-26 | Agritech Lab Inc | Increasing egg production in female birds by administering heterologous inhibin protein and a carrier protein |
| US5627053A (en) | 1994-03-29 | 1997-05-06 | Ribozyme Pharmaceuticals, Inc. | 2'deoxy-2'-alkylnucleotide containing nucleic acid |
| US5597696A (en) | 1994-07-18 | 1997-01-28 | Becton Dickinson And Company | Covalent cyanine dye oligonucleotide conjugates |
| US5597909A (en) | 1994-08-25 | 1997-01-28 | Chiron Corporation | Polynucleotide reagents containing modified deoxyribose moieties, and associated methods of synthesis and use |
| US5580731A (en) | 1994-08-25 | 1996-12-03 | Chiron Corporation | N-4 modified pyrimidine deoxynucleotides and oligonucleotide probes synthesized therewith |
| EP0708178A1 (en) * | 1994-10-19 | 1996-04-24 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Survival motor neuron (SMN) gene: a gene for spinal muscular atrophy |
| US5792747A (en) | 1995-01-24 | 1998-08-11 | The Administrators Of The Tulane Educational Fund | Highly potent agonists of growth hormone releasing hormone |
| US7034009B2 (en) | 1995-10-26 | 2006-04-25 | Sirna Therapeutics, Inc. | Enzymatic nucleic acid-mediated treatment of ocular diseases or conditions related to levels of vascular endothelial growth factor receptor (VEGF-R) |
| AU1430097A (en) | 1996-01-16 | 1997-08-11 | Ribozyme Pharmaceuticals, Inc. | Synthesis of methoxy nucleosides and enzymatic nucleic acid molecules |
| US7875733B2 (en) | 2003-09-18 | 2011-01-25 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising 4′-thionucleosides for use in gene modulation |
| US20030228597A1 (en) | 1998-04-13 | 2003-12-11 | Cowsert Lex M. | Identification of genetic targets for modulation by oligonucleotides and generation of oligonucleotides for gene modulation |
| US6172216B1 (en) | 1998-10-07 | 2001-01-09 | Isis Pharmaceuticals Inc. | Antisense modulation of BCL-X expression |
| US6214986B1 (en) | 1998-10-07 | 2001-04-10 | Isis Pharmaceuticals, Inc. | Antisense modulation of bcl-x expression |
| US6210892B1 (en) | 1998-10-07 | 2001-04-03 | Isis Pharmaceuticals, Inc. | Alteration of cellular behavior by antisense modulation of mRNA processing |
| DE60033927T2 (de) | 1999-05-04 | 2007-11-29 | Santaris Pharma A/S | L-ribo-lna analoge |
| US6656730B1 (en) | 1999-06-15 | 2003-12-02 | Isis Pharmaceuticals, Inc. | Oligonucleotides conjugated to protein-binding drugs |
| US6649411B2 (en) | 1999-07-30 | 2003-11-18 | The United States Of America As Represented By The Department Of Health And Human Services | Methods of inhibiting cancer cells with ADNF III antisense oligonucleotides |
| US6770633B1 (en) | 1999-10-26 | 2004-08-03 | Immusol, Inc. | Ribozyme therapy for the treatment of proliferative skin and eye diseases |
| US20050020525A1 (en) | 2002-02-20 | 2005-01-27 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| US6962906B2 (en) | 2000-03-14 | 2005-11-08 | Active Motif | Oligonucleotide analogues, methods of synthesis and methods of use |
| US20020013287A1 (en) | 2000-05-09 | 2002-01-31 | Reliable Biopharmaceuticals, Inc. St Louis Missouri | Polymeric compounds useful as prodrugs |
| AU2002232536A1 (en) | 2000-11-09 | 2002-05-21 | Cold Spring Harbor Laboratory | Chimeric molecules to modulate gene expression |
| US6376508B1 (en) | 2000-12-13 | 2002-04-23 | Academia Sinica | Treatments for spinal muscular atrophy |
| EP1499627A2 (en) | 2001-07-03 | 2005-01-26 | ISIS Pharmaceuticals, Inc. | Nuclease resistant chimeric oligonucleotides |
| GB0219143D0 (en) | 2002-08-16 | 2002-09-25 | Univ Leicester | Modified tailed oligonucleotides |
| AU2003291753B2 (en) | 2002-11-05 | 2010-07-08 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| EP2278005A3 (en) | 2002-11-14 | 2012-05-23 | Dharmacon, Inc. | Fuctional and hyperfunctional sirna |
| JP2004344072A (ja) * | 2003-05-22 | 2004-12-09 | Japan Science & Technology Agency | Smn遺伝子のスプライシング調節エレメント |
| WO2004113867A2 (en) | 2003-06-16 | 2004-12-29 | University Of Massachusetts | Exon analysis |
| EP1661905B9 (en) | 2003-08-28 | 2012-12-19 | IMANISHI, Takeshi | Novel artificial nucleic acids of n-o bond crosslinkage type |
| US20050074801A1 (en) | 2003-09-09 | 2005-04-07 | Monia Brett P. | Chimeric oligomeric compounds comprising alternating regions of northern and southern conformational geometry |
| GB0425625D0 (en) * | 2004-11-22 | 2004-12-22 | Royal College Of Surgeons Ie | Treatment of disease |
| US7838657B2 (en) | 2004-12-03 | 2010-11-23 | University Of Massachusetts | Spinal muscular atrophy (SMA) treatment via targeting of SMN2 splice site inhibitory sequences |
| US7879992B2 (en) | 2005-01-31 | 2011-02-01 | Isis Pharmaceuticals, Inc. | Modification of MyD88 splicing using modified oligonucleotides |
| PL2548560T3 (pl) * | 2005-06-23 | 2015-11-30 | Biogen Ma Inc | Kompozycje i sposoby modulowania splicingu SMN2 |
| JP4223027B2 (ja) | 2005-06-30 | 2009-02-12 | シャープ株式会社 | 画像形成装置及び秘匿データ送信方法 |
| WO2007047913A2 (en) | 2005-10-20 | 2007-04-26 | Isis Pharmaceuticals, Inc | Compositions and methods for modulation of lmna expression |
| CA2629323A1 (en) | 2005-11-10 | 2007-05-24 | The University Of North Carolina At Chapel Hill | Splice switching oligomers for tnf superfamily receptors and their use in treatment of disease |
| EP2428227B1 (en) * | 2006-01-26 | 2016-06-22 | Ionis Pharmaceuticals, Inc. | Compositions and their uses directed to Huntingtin |
| EP1984499B1 (en) | 2006-01-27 | 2015-05-27 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for the use in modulation of micrornas |
| WO2007090071A2 (en) | 2006-01-27 | 2007-08-09 | Isis Pharmaceuticals, Inc. | 6-modified bicyclic nucleic acid analogs |
| EP2066684B1 (en) | 2006-05-11 | 2012-07-18 | Isis Pharmaceuticals, Inc. | 5'-modified bicyclic nucleic acid analogs |
| WO2008101157A1 (en) | 2007-02-15 | 2008-08-21 | Isis Pharmaceuticals, Inc. | 5'-substituted-2'-f modified nucleosides and oligomeric compounds prepared therefrom |
| EP2170917B1 (en) | 2007-05-30 | 2012-06-27 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| DK2173760T4 (en) | 2007-06-08 | 2016-02-08 | Isis Pharmaceuticals Inc | Carbocyclic bicyclic nukleinsyreanaloge |
| WO2009006478A2 (en) | 2007-07-05 | 2009-01-08 | Isis Pharmaceuticals, Inc. | 6-disubstituted bicyclic nucleic acid analogs |
| WO2009120700A2 (en) | 2008-03-26 | 2009-10-01 | Families Of Spinal Muscular Atrophy | Inhibition of dcps |
| EP2119783A1 (en) | 2008-05-14 | 2009-11-18 | Prosensa Technologies B.V. | Method for efficient exon (44) skipping in Duchenne Muscular Dystrophy and associated means |
| WO2010123594A2 (en) | 2009-01-15 | 2010-10-28 | Children's Medical Center Corporation | Device for filtration of fluids there through and accompanying method |
| WO2010091308A2 (en) * | 2009-02-06 | 2010-08-12 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and methods |
| WO2010120820A1 (en) | 2009-04-13 | 2010-10-21 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulation of smn2 splicing |
| PT3449926T (pt) * | 2009-06-17 | 2019-11-12 | Cold Spring Harbor Laboratory | Composições e métodos de modulação de excisões de smn2 em um sujeito |
| WO2011032109A1 (en) | 2009-09-11 | 2011-03-17 | Sma Foundation | Biomarkers for spinal muscular atrophy |
| US8183002B2 (en) | 2009-12-03 | 2012-05-22 | Abbott Laboratories | Autoantibody enhanced immunoassays and kits |
| US10653713B2 (en) | 2010-10-06 | 2020-05-19 | Medtronic, Inc. | Methods for distributing agents to areas of brain |
| CN103782171B (zh) | 2011-07-13 | 2016-12-14 | 默沙东公司 | 用于检测流体样品中淀粉状蛋白β寡聚体的方法及其用途 |
| US9926559B2 (en) | 2013-01-09 | 2018-03-27 | Biogen Ma Inc. | Compositions and methods for modulation of SMN2 splicing in a subject |
| US20140367278A1 (en) | 2013-06-12 | 2014-12-18 | PharmOptima, LLC | Methods for Detecting Survival Motor Neuron (SMN) Protein in Whole Blood or Cerebral Spinal Fluid |
-
2010
- 2010-06-17 PT PT181858200T patent/PT3449926T/pt unknown
- 2010-06-17 EP EP10790221.5A patent/EP2442816A4/en not_active Withdrawn
- 2010-06-17 HU HUE17203913A patent/HUE039741T2/hu unknown
- 2010-06-17 HU HUE18185820A patent/HUE046966T2/hu unknown
- 2010-06-17 WO PCT/US2010/039077 patent/WO2010148249A1/en active Application Filing
- 2010-06-17 LT LTEP18185820.0T patent/LT3449926T/lt unknown
- 2010-06-17 KR KR1020197003809A patent/KR101965868B1/ko active IP Right Grant
- 2010-06-17 CN CN2010800368070A patent/CN102665731A/zh active Pending
- 2010-06-17 LT LTEP17203913.3T patent/LT3305302T/lt unknown
- 2010-06-17 KR KR1020217014192A patent/KR20210057223A/ko not_active Application Discontinuation
- 2010-06-17 KR KR1020177011876A patent/KR20170054537A/ko not_active IP Right Cessation
- 2010-06-17 EP EP19201392.8A patent/EP3643783A1/en active Pending
- 2010-06-17 CN CN202310217516.0A patent/CN116440150A/zh active Pending
- 2010-06-17 CN CN202210541466.7A patent/CN115227710A/zh active Pending
- 2010-06-17 KR KR1020227019810A patent/KR20220084437A/ko active Application Filing
- 2010-06-17 KR KR1020197009268A patent/KR20190037378A/ko active Application Filing
- 2010-06-17 EP EP17203913.3A patent/EP3305302B1/en active Active
- 2010-06-17 AU AU2010262862A patent/AU2010262862C1/en active Active
- 2010-06-17 EP EP18185820.0A patent/EP3449926B1/en active Active
- 2010-06-17 PL PL18185820T patent/PL3449926T3/pl unknown
- 2010-06-17 KR KR1020127001244A patent/KR20120093138A/ko not_active Application Discontinuation
- 2010-06-17 TR TR2018/16256T patent/TR201816256T4/tr unknown
- 2010-06-17 KR KR1020247007557A patent/KR20240036132A/ko active Search and Examination
- 2010-06-17 MX MX2015008433A patent/MX361732B/es unknown
- 2010-06-17 JP JP2012516315A patent/JP5707396B2/ja active Active
- 2010-06-17 US US13/380,021 patent/US8980853B2/en active Active
- 2010-06-17 ES ES17203913T patent/ES2699827T3/es active Active
- 2010-06-17 SI SI201031784T patent/SI3305302T1/sl unknown
- 2010-06-17 RU RU2015139553A patent/RU2683772C2/ru active
- 2010-06-17 SI SI201031946T patent/SI3449926T1/sl unknown
- 2010-06-17 CN CN202210540428.XA patent/CN115227709A/zh active Pending
- 2010-06-17 CA CA2765396A patent/CA2765396C/en active Active
- 2010-06-17 PT PT17203913T patent/PT3305302T/pt unknown
- 2010-06-17 KR KR1020207012412A patent/KR20200047790A/ko active Application Filing
- 2010-06-17 DK DK18185820T patent/DK3449926T3/da active
- 2010-06-17 CN CN201710003678.9A patent/CN106983768B/zh active Active
- 2010-06-17 DK DK17203913.3T patent/DK3305302T3/en active
- 2010-06-17 NZ NZ597071A patent/NZ597071A/en unknown
- 2010-06-17 PL PL17203913T patent/PL3305302T3/pl unknown
- 2010-06-17 RU RU2012101491A patent/RU2566724C9/ru active
- 2010-06-17 ES ES18185820T patent/ES2761614T3/es active Active
- 2010-06-17 NZ NZ624712A patent/NZ624712A/en unknown
- 2010-06-17 MX MX2011014004A patent/MX2011014004A/es active IP Right Grant
-
2011
- 2011-12-15 IL IL217014A patent/IL217014A/en active Protection Beyond IP Right Term
- 2011-12-16 MX MX2018015635A patent/MX2018015635A/es unknown
-
2015
- 2015-02-09 US US14/617,388 patent/US9717750B2/en active Active
- 2015-03-02 JP JP2015040152A patent/JP6064139B2/ja active Active
-
2016
- 2016-01-21 AU AU2016200344A patent/AU2016200344B2/en active Active
- 2016-04-13 IL IL245096A patent/IL245096B/en active Protection Beyond IP Right Term
- 2016-11-04 JP JP2016216200A patent/JP6370860B2/ja active Active
-
2018
- 2018-02-09 US US15/892,560 patent/US20190030058A1/en not_active Abandoned
- 2018-05-10 HK HK18106100.4A patent/HK1246648B/zh unknown
- 2018-07-06 JP JP2018128926A patent/JP6637121B2/ja active Active
- 2018-10-19 HR HRP20181712TT patent/HRP20181712T1/hr unknown
- 2018-11-01 CY CY181101134T patent/CY1120807T1/el unknown
-
2019
- 2019-10-31 HR HRP20191978TT patent/HRP20191978T1/hr unknown
- 2019-12-10 US US16/708,739 patent/US20200376018A1/en not_active Abandoned
- 2019-12-18 JP JP2019227997A patent/JP2020073498A/ja active Pending
- 2019-12-19 CY CY20191101339T patent/CY1122687T1/el unknown
-
2020
- 2020-04-01 NO NO2020008C patent/NO2020008I1/no unknown
-
2021
- 2021-11-05 JP JP2021180965A patent/JP2022025131A/ja active Pending
-
2023
- 2023-10-25 US US18/494,445 patent/US20240238326A1/en not_active Abandoned
- 2023-10-30 JP JP2023185174A patent/JP2024012416A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2699827T3 (es) | Composiciones y métodos para la modulación de corte y empalme de SMN2 en un sujeto | |
| ES2932304T3 (es) | Composiciones y métodos para la modulación del empalme de SMN2 en un sujeto |