EP0000368B1 - D-Homosteroide und solche enthaltende Präparate sowie Verfahren zur Herstellung solcher D-Homosteroide - Google Patents
D-Homosteroide und solche enthaltende Präparate sowie Verfahren zur Herstellung solcher D-Homosteroide Download PDFInfo
- Publication number
- EP0000368B1 EP0000368B1 EP78100302A EP78100302A EP0000368B1 EP 0000368 B1 EP0000368 B1 EP 0000368B1 EP 78100302 A EP78100302 A EP 78100302A EP 78100302 A EP78100302 A EP 78100302A EP 0000368 B1 EP0000368 B1 EP 0000368B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- formula
- homosteroid
- homosteroids
- hydrogen atom
- homo
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired
Links
- 0 *C(CC1)(C(CCC2([C@](*)(CCC(I)=O)C=CCC22)N)C2IC2(*)N)C2=CC1=O Chemical compound *C(CC1)(C(CCC2([C@](*)(CCC(I)=O)C=CCC22)N)C2IC2(*)N)C2=CC1=O 0.000 description 3
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J63/00—Steroids in which the cyclopenta(a)hydrophenanthrene skeleton has been modified by expansion of only one ring by one or two atoms
- C07J63/008—Expansion of ring D by one atom, e.g. D homo steroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
Definitions
- the invention relates to new D-homosteroids of the formula wherein the dotted line in the A ring is an optional CC bond; X and Y together are an OC bond or X is hydrogen and Y is hydroxy; R 6 is hydrogen and R 7 is hydrogen or acylthio or R 6 and R 7 together are a C - C bond, and physiologically acceptable salts thereof.
- the invention further relates to a process for the preparation of the compounds I and pharmaceutical preparations which contain a compound of the formula.
- acyl refers to the residue of a saturated or unsaturated aliphatic carboxylic acid, a cycloaliphatic, an araliphatic or aromatic carboxylic acid with preferably up to 15 carbon atoms.
- acids are formic, acetic, pivalic, propionic, butteric, capronic, oenanthic, undecylene, oleic, cyclohexylpropionic, cyclopentylpropionic, phenylacetic and benzoic acids.
- Particularly preferred acyl groups are C 1-7 alkanoyl groups, especially actyl.
- physiologically acceptable salts of the acids of formula I come in particular alkali metal salts, for. B. the Na and K salts and the ammonium salts; and alkaline earth metal salts, e.g. B. the calcium salts into consideration.
- alkali metal salts for. B. the Na and K salts and the ammonium salts
- alkaline earth metal salts e.g. B. the calcium salts into consideration.
- the potassium salts are preferred.
- the methyl group in the 6-position can be ⁇ - or ⁇ -permanent, the 6 ⁇ -methyl isomers are preferred.
- a preferred group of compounds of formula 1 are those compounds in which R 7 is acylthio, in particular C 1 7-alkanoylthio.
- the lactones of the formula are also preferred.
- the hydrogenation of the 6-methylene group in a D-homosteroid of the formula II according to process variant a) can be carried out in a manner known per se by means of hydrogenation catalysts, for. B. noble metal catalysts, such as palladium.
- the isomerization of the 6-methylene group to form a 6-methyl- ⁇ 6 group can also in a conventional manner, for. B. be carried out catalytically.
- isomerization catalysts are, for. B. metal catalysts as used for example in hydrogenations, especially palladium in ethanol.
- a hydrogen donor, such as cyclohexene, is expediently added as an activator for the catalyst. Undesired side reactions, such as hydrogenations by means of the hydrogen donor, can be avoided by buffering the reaction mixture.
- 1,2-saturated compounds of the formula I are obtained in which R 6 and R 7 are hydrogen or together are a CC bond.
- An acylthio substituent R 7 can be introduced into a D-homosteroid of the formula 111 (process variant b) in a manner known per se by treating the steroid with an appropriate thiocarboxylic acid.
- the reaction can be carried out in an inert solvent such as an ether, e.g. B. dioxane or tetrahydrofuran, or an alcohol such as methanol or ethanol, or in a chlorinated hydrocarbon such as chloroform; the reagent, e.g. B. the thiocarboxylic acid is advantageously used in excess and can serve as a solvent.
- Process variant b) gives 1,2-saturated D-homosteroids of the formula in which R 6 is hydrogen and R 7 is acylthio.
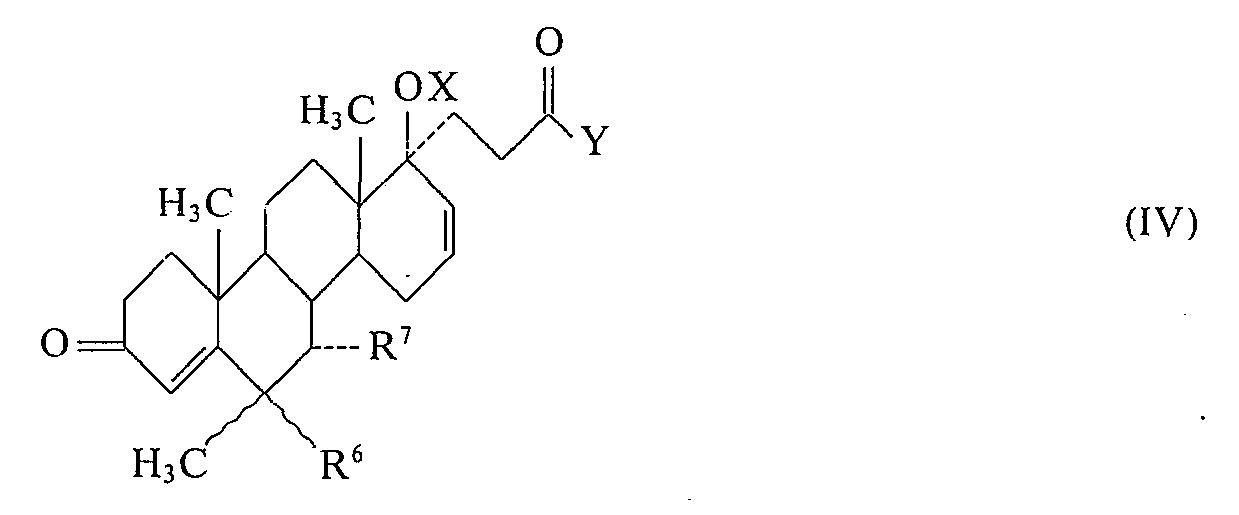
- the 1,2-dehydrogenation of a D-homosteroid of the formula IV can be carried out in a manner known per se, for. B. microbiologically or by means of dehydrating agents such as selenium dioxide, 2,3-dichloro-5,6-dicyanobenzoquinone, chloranil, thallium triacetate or lead tetraacetate.
- Suitable microorganisms for 1,2-dehydrogenation are, for example, schizomycetes, in particular those of the Genera Arthrobacter, e.g. B. A. simplex ATCC 6946; Bacillus, e.g. B. B. lentus ATCC 13805 and B.
- sphaericus ATCC 7055 Pseudomonas, e.g. B. P. aeruginosa IFO 3505; Flavobacterium, e.g. B. F. flavescens IFO 3058; Lactobacillus, e.g. B. L. brevis IFO 3345 and Nocardia, e.g. B. N. opaca ATCC 4276.
- a ⁇ 6 double bond can e.g. B. with a substituted benzoquinone, such as chloranil [cf. J. Am. Chem. Soc. 82, 4293 (1960); 81, 5951 (1959)] or with 2,3-dichloro-5,6-dicyanobenzoquinone or with manganese dioxide [cf. J. Am. Chem. Soc. 75, 5932 (1953)].
- a substituted benzoquinone such as chloranil [cf. J. Am. Chem. Soc. 82, 4293 (1960); 81, 5951 (1959)] or with 2,3-dichloro-5,6-dicyanobenzoquinone or with manganese dioxide [cf. J. Am. Chem. Soc. 75, 5932 (1953)].
- the 2,3,6-trisdehydro compound can also be obtained directly with 2,3-dichloro-5,6-dicyanobenzoquinone or chloranil.
- Process variant c) leads to 4,6-diene, 1,4-diene and 1,4,6-triene-D homosteroids of the formula I.
- the lactone ring can be split in accordance with process variant d) in a manner known per se, e.g. B. using a base such as potassium or sodium hydroxide in a solvent, e.g. B. an alcohol such as methanol, ethanol or isopropanol, at a temperature between about 0 ° C and the reflux temperature of the reaction mixture, advantageously at about 50 ° C.
- a base such as potassium or sodium hydroxide
- a solvent e.g. B. an alcohol such as methanol, ethanol or isopropanol
- the salts obtained in this way, corresponding to the base used can be acidified, for. B. by means of hydrochloric acid, are converted into the free acids.
- the latter can be converted into salts by reaction with suitable bases.
- Process variant d provides compounds of the formula in which X is hydrogen and Y is hydroxy, and their salts.
- lactonization of a compound of formula VI (variant e) or a salt thereof can be carried out in a manner known per se, e.g. B. using a strong acid, such as hydrochloric acid, sulfuric acid or p-toluenesulfonic acid, in a solvent, e.g. B. water, an alcohol, such as methanol, or mixtures thereof, at a temperature between about -50 ° and 100 ° C, advantageously at room temperature.
- a strong acid such as hydrochloric acid, sulfuric acid or p-toluenesulfonic acid
- the oxidation of a compound of formula VII can, according to Oppenauer, e.g. B. by means of aluminum isopropylate, or with oxidizing agents such as chromium trioxide (z. B. Jones'Reagens), or according to Pfitzner-Moffatt using dimethyl sulfoxide / dicyclohexylcarbodiimide (the d 5- 3-ketone initially obtained is then isomerized to the d 4- 3-ketone must), or be carried out using pyridine / S0 3 .
- oxidizing agents such as chromium trioxide (z. B. Jones'Reagens)
- Pfitzner-Moffatt using dimethyl sulfoxide / dicyclohexylcarbodiimide (the d 5- 3-ketone initially obtained is then isomerized to the d 4- 3-ketone must), or be carried out using pyridine / S0 3 .
- the D-homosteroids of the formula and the salts thereof show pharmacological activity. Among other things, they are diuretically effective and are suitable for blocking the action of aldosterone or deoxycorticosterone acetate and can therefore be used, for example, as potassium-sparing diuretics or for flushing out edema. Approximately 0.1 to 10 mg / kg per day can be used as a dosage guideline.
- D-homosteroids of the formula according to the invention do not contain a methyl radical in the 6-position.
- the 6-methyl-D-homosteroids according to the invention are known Considerably superior to 6-unsubstituted D-homosteroids.
- D-homosteroids of the invention have the formula I (compounds A and B in the test report) a stronger potassium p arende diuretic activity than those known from the German Offenlegungsschrift Nr. 2424752 D-homo steroids (compounds C and D).
- test substance is administered orally to episiotomized and catheterized dogs in a gelatin capsule. Immediately afterwards, animals were injected with 0.5 ⁇ g / kg aldosterone subcutaneously. The urine of the animals is collected over a period of 6 hours. The Na + / K + ratio calculated from the total excretion is obtained as a measure of the aldosterone antagonism.
- the compounds of formula I and the salts thereof can be used as medicaments, e.g. B. in the form of pharmaceutical preparations are used, which they or their salts in a mixture with a suitable for enteral or parenteral application organic or inorganic inert carrier material, such as. B. water, gelatin, gum arabic, milk sugar, starch, magnesium stearate, talc, vegetable oils, polyalkylene glycols, petroleum jelly, etc. contain.
- the pharmaceutical preparations can be in solid form, e.g. B. as tablets, dragees, suppositories, capsules; or in liquid form, e.g. B. as solutions, suspensions or emulsions.
- auxiliaries such as preservatives, stabilizers, wetting agents or emulsifiers, salts for changing the osmotic pressure or buffers. They can also contain other therapeutically valuable substances.
- the pharmaceuticals can be prepared in a manner known per se by combining the compound of the formula with non-toxic, inert, solid and / or liquid carrier materials which are conventional in such preparations and are suitable for therapeutic administration. B. the above, mixed and optionally brings into the desired shape.
- This compound can also be obtained by acidifying a solution of potassium 17a-hydroxy-6-methyl-3-oxo-D-homo-17a ⁇ -pregna-4,6,16-triene-21-carboxylate with dilute hydrochloric acid.
- the solution obtained is mixed with 6 ml of glacial acetic acid, poured onto 1000 ml of water and extracted with 3 ⁇ 400 ml of ether-methylene chloride (4: 1). The organic phases are saturated. Washed sodium chloride solution until neutral, dried with magnesium sulfate and evaporated to dryness.
- the crude product is purified by chromatography on 100 times the amount of silica gel with methylene chloride-acetone (98: 2). The fractions containing the product are pooled and recrystallized from acetone-hexane.
- the starting material can be prepared as follows: Dimethylsulfoxonium methylide is converted to 17,20-epoxy-3ß-hydroxy-6-methyl-21-norpregn-5 with 3 ⁇ -hydroxy-6-methyl-androst-5-en-17-one in dimethylsulfoxide -en implemented. The latter is opened with ammonia under pressure to give 20-amino-3 ⁇ , 17-dihydroxy-6-methyl-21-norpregn-5-ene.
- 3ß-hydroxy-6-methyl-D-homoandrost-5-en-17a-one is obtained, which by bromination with copper II-bromide in boiling methanol and subsequent elimination of hydrogen bromide with calcium carbonate in boiling dimethylacetamide over 17x-bromo 3ß-hydroxy-6-methyl-D-homoandrost-5-en-17a-one is converted into 3ß-hydroxy-6-methyl-D-homoandrosta-5,16-dien-17a-one.
- a lithium Grignard reaction with 3-bromopropionaldehyde dimethylacetal and subsequent acetylation with acetic anhydride pyridine yield 3 ⁇ -acetoxy-21-dimethylacetal-17a-hydroxy-6-methyl-D-homo-17a ⁇ -pregna-5,16-diene.
- This acetal is split with an aqueous 70% acetic acid solution to the corresponding aldehyde. This cyclizes spontaneously to 3 ⁇ -acetoxy-6-methyl-D-homo-17a ⁇ -pregna-5,16-diene-21, 17a-carbolactol.
- a tablet for oral administration can have the following composition:
- a capsule for oral administration can have the following composition:
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Steroid Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Furan Compounds (AREA)
Description
- Die Erfindung betrifft neue D-Homosteroide der Formel
und physiologisch verträgliche Salze hiervon. - Die Erfindung betrifft weiterhin ein Verfahren zur Herstellung der Verbindungen I sowie pharmazeutische Präparate, welche eine Verbindung der Formel enthalten.
- Der Ausdruck »Acyl« bezieht sich auf den Rest einer gesättigten oder ungesättigten aliphatischen Carbonsäure, einer cycloaliphatischen, einer araliphatischen oder aromatischen Carbonsäure mit vorzugsweise bis zu 15 C-Atomen. Beispiele solcher Säuren sind Ameisen-, Essig-, Pivalin-, Propion-, Butter-, Capron-, Oenanth-, Undecylen-, Öl-, Cyclohexylpropion-, Cyclopentylpropion-, Phenylessig-und Benzoesäure. Besonders bevorzugte Acylgruppen sind C1-7-Alkanoylgruppen, insbesondere Actyl.
- Als physiologisch verträgliche Salze der Säuren der Formel I kommen insbesondere Alkalimetallsalze, z. B. die Na- und K-Salze sowie die Ammoniumsalze; und Erdalkalimetallsalze, z. B. die Calciumsalze in Betracht. Von den Salzen sind die Kaliumsalze bevorzugt.
- Die Methylgruppe in 6-Stellung kann α- oder β-ständig sein, bevorzugt sind die 6α-Methyl-Isomeren.
- Eine bevorzugte Gruppe von Verbindungen der Formel 1 sind diejenigen Verbindungen, in denen R7 Acylthio, insbesondere C1 7-Alkanoylthio ist. Weiterhin sind die Lactone der Formel bevorzugt.
- Die Verbindungen der Formel können erfindungsgemäß dadurch hergestellt werden, daß man
- a) ein D-Homosteroid der Formel
- b) ein D-Homosteroid der Formel
- c) ein D-Homosteroid der Formel
- d) in einem D-Homosteroid der Formel
- e) ein D-Homosteroid der Formel
- f) ein D-Homosteroid der Formel
- Die Hydrierung der 6-Methylengruppe in einem D-Homosteroid der Formel II gemäß Verfahrensvariante a) kann in an sich bekannter Weise mittels Hydrierkatalysatoren, z. B. Edelmetallkatalysatoren, wie Palladium, durchgeführt werden.
- Die Isomerisierung der 6-Methylengruppe unter Ausbildung einer 6-Methyl-Δ 6-Gruppierung kann ebenfalls in an sich bekannter Weise, z. B. katalytisch durchgeführt werden. Als Isomerisierungskatalysatoren eignen sich z. B. Metallkatalysatoren wie sie beispielsweise auch bei Hydrierungen verwendet werden, insbesondere Palladium in Äthanol. Zweckmäßig setzt man noch einen Wasserstoffdonator, wie Cyclohexen, als Aktivator für den Katalysator zu. Unerwünschte Nebenreaktionen, wie Hydrierungen durch den Wasserstoffdonator, können durch Pufferung des Reaktionsgemisches vermieden werden.
- Nach der Verfahrensvariante a) werden 1,2-gesättigte Verbindungen der Formel I erhalten, in denen R6 und R7 Wasserstoff oder zusammen eine C-C-Bindung darstellen.
- Die Einführung eines Acylthio-Substituenten R7 in ein D-Homosteroid der Formel 111 (Verfahrensvariante b) kann in an sich bekannter Weise durch Behandlung des Steroids mit einer entsprechenden Thiocarbonsäure erfolgen. Die Reaktion kann in einem inerten Lösungsmittel wie einem Äther, z. B. Dioxan oder Tetrahydrofuran, oder einem Alkohol, wie Methanol oder Äthanol, oder in einem Chlorkohlenwasserstoff, wie Chloroform durchgeführt werden; das Reagens, z. B. die Thiocarbonsäure wird zweckmäßigerweise im Überschuß eingesetzt und kann dabei als Lösungsmittel dienen.
- Mittels der Verfahrensvariante b) erhält man 1,2-gesättigte D-Homosteroide der Formel in denen R6 Wasserstoff und R7 Acylthio darstellen.
- Die 1,2-Dehydrierung eines D-Homosteroids der Formel IV (Verfahrensvariante c) kann in an sich bekannter Weise z. B. auf mikrobiologischem Wege oder mittels Dehydrierungsmitteln wie Selendioxyd, 2,3-Dichlor-5,6-dicyanobenzochinon, Chloranil, Thalliumtriacetat oder Bleitetraacetat vorgenommen werden. Geeignete Mikroorganismen für die 1,2-Dehydrierung sind beispielsweise Schizomyceten, insbesondere solche der Genera Arthrobacter, z. B. A. simplex ATCC 6946; Bacillus, z. B. B. lentus ATCC 13805 und B. sphaericus ATCC 7055; Pseudomonas, z. B. P. aeruginosa IFO 3505; Flavobacterium, z. B. F. flavescens IFO 3058; Lactobacillus, z. B. L. brevis IFO 3345 und Nocardia, z. B. N. opaca ATCC 4276.
- Die Einführung einer Δ6-Doppelbindung kann z. B. mit einem substituierten Benzochinon, wie Chloranil [vgl. J. Am. Chem. Soc. 82, 4293 (1960); 81, 5951 (1959)] oder mit 2,3-Dichlor-5,6-dicyanoben- zochinon oder mit Mangandioxid [vgl. J. Am. Chem. Soc. 75,5932 (1953)] erfolgen.
- Mit 2,3-Dichlor-5,6-dicyanobenzochinon oder Chloranil kann auch direkt die 1,4,6-Trisdehydro-Verbindung erhalten werden.
- Die Verfahrensvariante c) führt zu 4,6-Dien-, 1,4-Dien- und 1,4,6-Trien-D-Homosteroiden der Formel I.
- Die Aufspaltung des Lactonrings gemäß Verfahrensvariante d) kann in an sich bekannter Weise durchgeführt werden, z. B. mittels einer Base, wie Kalium- oder Natriumhydroxyd, in einem Lösungsmittel, z. B. einem Alkohol wie Methanol, Äthanol oder Isopropanol, bei einer Temperatur zwischen etwa 0° C und Rückflußtemperatur des Reaktionsgemisches, zweckmäßig bei etwa 50° C. Die so erhaltenen, der verwendeten Base entsprechenden Salze können durch Ansäuern, z. B. mittels Chlorwasserstoffsäure, in die freien Säuren übergeführt werden. Letztere können durch Umsetzung mit geeigneten Basen in Salze übergeführt werden.
- Die Verfahrensvariante d) liefert Verbindungen der Formel in denen X Wasserstoff und Y Hydroxy darstellen, und deren Salze.
- Die Lactonisierung einer Verbindung der Formel VI (Variante e) oder eines Salzes hiervon kann in an sich bekannter Weise durchgeführt werden, z. B. mittels einer starken Säure, wie Chlorwasserstoffsäure, Schwefelsäure oder p-Toluolsulfonsäure, in einem Lösungsmittel, z. B. Wasser, einem Alkohol, wie Methanol, oder Gemischen hiervon, bei einer Temperatur zwischen etwa -50° und 100°C, zweckmäßig bei Zimmertemperatur.
- Die Oxydation einer Verbindung der Formel VII (Verfahrensvariante f) kann nach Oppenauer, z. B. mittels Aluminiumisopropylat, oder mit Oxydationsmitteln wie Chromtrioxid (z. B. Jones'Reagens), oder nach Pfitzner-Moffatt mittels Dimethylsulfoxid/Dicyclohexylcarbodiimid (wobei das primär erhaltene d5-3-Keton anschließend zum d4-3-Keton isomerisiert werden muß), oder mittels Pyridin/S03 vorgenommen werden. Bei Anwendung der vorstehend genannten Oxydationsmittel wie Br2/LiBr/Li2C03 in Dimethylformamid oder bei der Oxydation nach Oppenauer in Gegenwart von Benzochinon liefert die Oxydation eine 3-Keto-Δ4,6-Gruppierung. Füpr die Oxydation zu einem 3-Keto-Δ1,4,6-steroid ist beispielsweise 2,3-Dichlor-5,6-dicyano-benzochinon (DDQ) geeignet.
- Die Ausgangsverbindungen der Formeln II-VII können, sofern ihre Herstellung nicht bereits bekannt oder nachstehend beschrieben ist, in Analogie zu bekannten bzw. den nachstehend beschriebenen Methoden hergestellt werden.
- Die D-Homosteroide der Formel und die Salze hiervon zeigen pharmakologische Wirkung. Unter anderem sind sie diuretisch wirksam und geeignet, die Wirkung von Aldosteron oder von Desoxycorticosteron-acetat zu blockieren und können somit beispielsweise als kaliumsparende Diuretika oder zur Ausschwemmung von Ödemen Anwendung finden. Als Dosierungsrichtlinie kommen etwa 0,1 bis 10 mg/kg pro Tag in Betracht.
- Im Gegensatz zu den erfindungsgemäßen D-Homosteroiden der Formel enthalten die aus der französischen Anmeldung Nr. 2244497 und der deutschen Offenlegungsschrift Nr. 2424752 bekannten D-Homosteroide keinen Methylrest in 6-Stellung Überraschender Weise sind die erfindungsgemäßen 6-Methyl-D-homosteroide den vorbekannten 6-unsubstituierten D-Homosteroiden beträchtlich überlegen. Wie beispielsweise aus dem nachstehenden Versuchsbericht ersichtlich, haben die erfindungsgemäßen D-Homosteroide der Formel I (Verbindungen A und B im Versuchsbericht) eine stärkere kaliumsparende diuretische Wirksamkeit als die aus der deutschen Offenlegungsschrift Nr. 2 424 752 bekannten D-Homosteroide (Verbindungen C und D).
- Die Testsubstanz wird episiotomisierten und catheterisierten Hunden in einer Gelatinekapsel peroral verabreicht. UnmittelbardanachwerdendenTieren 0,5 µg/kg Aldosteron subcutan injiziert. Der Harn der Tiere wird über eine Periode von 6 Stunden gesammelt) Das aus der Gesamtausscheidung errechnete Na+/K+ Verhältnis wird als Maß für den Aldosteron-Antagonismus gewonnen. Bei Durchführung des Versuchs mit 7x-Acetylthio-6oc-methyl-3-oxo-D-homo-17ax-pregna-4,16-dien-21,17a-carbolacton (Verbindung A), 7α-Acetylthio-6α-methyl-3-oxo-D-homo-17aα-pregna-1,4,16- trien-21,17a-carbolacton (Verbindung B), 7α-Acetylthio-3-oxo-D-homo-17aα-pregna-4-en-21,17a-carbolacton (Verbindung C) und 7α-Acetylthio-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17α-carbo- lacton (Verbindung D) wurden folgende Ergebnisse erhalten:
- Die Verbindungen der Formel I und die Salze hiervon können als Heilmittel z. B. in Form pharmazeutischer Präparate Verwendung finden, welche sie oder ihre Salze in Mischung mit einem für die enterale oder parenterale Applikation geeigneten organischen oder anorganischen inerten Trägermaterial, wie z. B. Wasser, Gelatine, Gummi arabicum, Milchzucker, Stärke, Magnesiumstearat, Talk, pflanzliche Öle, Polyalkylenglykole, Vaseline, usw. enthalten. Die pharmazeutischen Präparate können in fester Form, z. B. als Tabletten, Dragees, Suppositorien, Kapseln; oder in flüssiger Form, z. B. als Lösungen, Suspensionen oder Emulsionen, vorliegen. Gegebenenfalls sind sie sterilisiert und bzw. oder enthalten Hilfsstoffe, wie Konservierungs-, Stabilisierungs-, Netz- oder Emulgiermittel, Salze zur Veränderung des osmotischen Druckes oder Puffer. Sie können auch noch andere therapeutisch wertvolle Stoffe enthalten.
- Die Herstellung der Arzneimittel kann in an sich bekannter Weise erfolgen, indem man die Verbindung der Formel mit zur therapeutischen Verabreichung geeigneten, nicht-toxischen, inerten, an sich in solchen Präparaten üblichen festen und/oder flüssigen Trägermaterialien, wie z. B. den vorstehend genannten, vermischt und gegebenenfalls in die gewünschte Form bringt.
- Eine Mischung von 1,0 g 6-Methylen-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolacton, 0,5 g Natriumacetat, 50 mg 5% Palladium/Kohle und 35 ml Äthanol wurde 15 Stunden unter Rückfluß erhitzt. Gleichzeitig wurden pro Stunde 2 ml einer 0,5%igen Lösung von Cyclohexen in Äthanol zugetropft. Zur Aufarbeitung wurde der Katalysator abfiltriert und das Filtrat im Vakuum eingedampft. Der Rückstand wurde auf 55 g Silicagel chromatographiert. Mit Methylenchlorid-Aceton (98 : 2) konnten 820 mg reines 6-Methyl-3-oxo-D-homo-17aα-pregna-4,6,16-trien-21,17a-carbolacton eluiert werden. Smp. 197-198° (ausAceton-Hexan). [α]25 D = +41° (c=0,1 in Dioxan), ε287=22 100.
- Diese Verbindung kann auch durch Ansäuern einer Lösung des Kalium-17a-hydroxy-6-methyl-3-oxo-D-homo-17aα-pregna-4,6,16-trien-21-carboxylats mit verdünnter Salzsäure erhalten werden.
- Das Ausgangsmaterial wurde wie folgt hergestellt:
- 3-Oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolacton wurde mit Pyrrolidin in Methanol in das Enamin 3-(1-Pyrrolidinyl)-D-homo-17aα-prgna-3,5-16-trien-21,17a-carbolacton übergeführt. Durch Reaktion dieser Verbindung mit Formaldehyd in Benzol-Methanol-Wasser erhielt man 6ß-Hydroxymethyl-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolacton, Smp. 246-249°, [α]25 D = +6° (c=0,1 in Dioxan). Behandlung dieser Verbindung mit wässeriger HCI in Dioxan führte zu 6-Methylen-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolacton, Smp.216-220°, [α]25 D =+175° (c=0,1 in Dioxan).
- Eine Lösung von 1,0 g 6-Methyl-3-oxo-D-homo-17aα-pregna-4,6,16-trien-21,17a-carbolacton in 10 ml Thioessigsäure wurde 6 Stunden zum Rückfluß erhitzt. Die überschüssige Thioessigsäure wurde im Vakuum abgedampft und der Rückstand auf 100 g Silicagel chromatographiert. Mit Hexan-Aceton konnten 0,9 g reines 7α-Acetylthio-6α-methyl-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolac- ton eluiertwerden. Smp. 215-217° (ausAceton-Hexan). [α]25 D = -16° (c=0,1 in Dio×an) · ε237=19 900.
- Eine Lösung von 1,0 g 7α-Acetylthio-6α-methyl-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbo- lacton und 0,9 g DDQ in 50 ml Dioxan wurde 48 Stunden unter Rückfluß gekocht. Die abgekühlte Lösung wurde durch 20 g Alox Akt. II filtriert und das Produkt mit 300 ml Essigester vollständig eluiert. Das Eluat ergab nach Abdampfen des Lösungsmittels 1,0 g Rohprodukt, das auf 50 g Silicagel chromatographiert wurde. Mit Hexan-Aceton (6 : 1) konnten 730 mg reines 7α-Acetylthio-6α-methyl-3-oxo-D-homo-17aα-pregna-1,4,16-trien-21,17a-carbolacton eluiert werden. Smp. 160-162°. [α]25 D =-29° (c=1,0 in Dioxan) · ε240=17 400.
- Zu einer Lösung von 700 mg 6-Methyl-3-oxo-D-homo-17aa-pregna-4,6,16-trien-21,17a-carbolacton in 7 ml 2-Propanol gab man eine Lösung von 126 mg KOH (85%) in 0,68 ml Wasser und erhitzte die Mischung 30 Minuten zum Rückfluß. Die Lösung wurde im Vakuum zur Trockene verdampft, der Rückstand durch Zugabe und Abdampfen von abs. Alkohol wasserfrei gemacht. Den Rückstand suspendiert man in 30 ml Essigester und nutschte das Produkt ab. Nach Trocknen über Nacht im Vakuum bei 60° erhielt man 800 mg reines 17a-Hydroxy-6-methyl-3-oxo-D-homo-17aα-pregna-4,6,16- trien-21-carbonsäure-Kaliumsalz. [α]25 D =-120° (c=0,1 in Methanol) . ε290=22 800.
- Eine Mischung von 1,0 g 6-Methylen-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolacton, 200 mg 5% Pd/C, 5 ml Benzol und 5 ml Cyclohexen wurde 12 Stunden unter Argon am Rückfluß erhitzt. Die abgekühlte Mischung wurde filtriert und das Filtrat im Vakuum eingedampft. Durch Umkristallisieren des Rohproduktes aus Alkohol und Aceton erhielt man reines 6ß-Methyl-3-oxo-D-homo-17aα-pregna-4,16-dien-21,17a-carbolacton, Smp. 238-240°. [α]25 D=+2° (c=0,1 in Dioxan) · ε241 =15 700.
- 2,5g 3ß-Hydroxy-6-methyl-D-homo-17ax-pregna-5,16-dien-21,17a-carbolacton werden in 67 ml Dimethylformamid gelöst. Dem Gemisch werden 3,1 g Lithiumbromid und 3,1 g Lithiumcarbonat zugegeben. Die weiße Suspension wird unter Rühren und Argonbegasung auf 80°C erwärmt. Bei dieser Temperatur wird innert 80 Minuten eine Lösung von 2,62 g Brom in 21 ml Dioxan zugetropft. Nach beendigter Zugabe wird die gelb-orange Suspension noch weitere 30 Minuten bei 80°C gerührt. Zur Aufarbeitung wird die erhaltene Lösung mit 6 ml Eisessig versetzt, auf 1000 ml Wasser gegossen und mit 3x400 ml Äther-Methylenchlorid (4: 1) extrahiert. Die organischen Phasen werden mit ges. Natriumchloridlösung neutral gewaschen, mit Magnesiumsulfat getrocknet und zur Trockene eingeengt. Das Rohprodukt wird durch Chromatographie an der 100fachen Menge Kieselgel mit Methylenchlorid-Aceton (98:2) gereinigt. Die das Produkt enthaltenden Fraktionen werden zusammengenommen und aus Aceton-Hexan umkristallisiert. Man erhält so 3-Oxo-6-methyl-D-homo-17aα-pregna-4,6,16-trien-21,17a-carbolacton in Form von farblosen Kristallen vom Schmelzpunkt 197-198°, [α]D =+41° (Dioxan c=0,1).
- Das Ausgangsmaterial kann wie folgt hergestellt werden: Dimethylsulfoxoniummethylid wird mit 3ß-Hydroxy-6-methyl-androst-5-en-17-on in Dimethylsulfoxid zu 17,20-Epoxy-3ß-hydroxy-6-methyl-21-norpregn-5-en umgesetzt. Letzteres wird mit Ammoniak unter Druck zu 20-Amino-3ß,17-dihydroxy-6-methyl-21-norpregn-5-en geöffnet. Durch Demjanov-Ringerweiterung wird 3ß-Hydroxy-6-methyl-D-homoandrost-5-en-17a-on erhalten, welches durch Bromierung mit Kupfer II-bromid in siedendem Methanol und nachfolgende Bromwasserstoffabspaltung mit Calciumcarbonat in siedendem Dimethylacetamid über 17x-Brom-3ß-hydroxy-6-methyl-D-homoandrost-5-en-17a-on in 3ß-Hydroxy-6-methyl-D-homoandrosta-5,16-dien-17a-on übergeführt wird. Eine Lithium-Grignard-Reaktion mit 3-Brompropionaldehyd-dimethylacetal und nachfolgende Acetylierung mit Acetanhydrid-Pyridin liefern 3β-Acetoxy-21-dimethylacetal-17a-hydroxy-6-methyl-D-homo-17aα-pregna-5,16-dien. Dieses Acetal wird mit einer wäßrigen 70%igen Essigsäurelösung zum entsprechenden Aldehyd gespalten. Dieser cyclisiert spontan zu 3β-Acetoxy-6-methyl-D-homo-17aα-pregna-5,16-dien-21, 17a-carbolactol. Jones-Oxidation liefert das entsprechende 21,17a-carbclacton, das mit Kaliumcarbonat in Methanol zu 3β-Hydroxy-6-methyl-D-homo-17aα-pregna-5,16-dien-29,17a-carbolacton verseift wird.
-
-
Claims (11)
und physiologisch verträgliche Salze hiervon.
und physiologisch verträgliche Salze hiervon, dadurch gekennzeichnet daß man
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| LU77699 | 1977-07-06 | ||
| LU77699A LU77699A1 (de) | 1977-07-06 | 1977-07-06 | Verfahren zur herstellung von neuen d-homosteroiden |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0000368A1 EP0000368A1 (de) | 1979-01-24 |
| EP0000368B1 true EP0000368B1 (de) | 1981-04-29 |
Family
ID=19728632
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP78100302A Expired EP0000368B1 (de) | 1977-07-06 | 1978-07-04 | D-Homosteroide und solche enthaltende Präparate sowie Verfahren zur Herstellung solcher D-Homosteroide |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US4202823A (de) |
| EP (1) | EP0000368B1 (de) |
| JP (1) | JPS5414959A (de) |
| AU (1) | AU3760378A (de) |
| DE (2) | DE2829403A1 (de) |
| DK (1) | DK304778A (de) |
| ES (1) | ES471470A1 (de) |
| FI (1) | FI782137A (de) |
| FR (1) | FR2396767A1 (de) |
| GB (1) | GB2000781A (de) |
| IL (1) | IL55049A0 (de) |
| IT (1) | IT1096965B (de) |
| LU (1) | LU77699A1 (de) |
| NL (1) | NL7805939A (de) |
| NO (1) | NO782349L (de) |
| PT (1) | PT68254A (de) |
| SE (1) | SE7807586L (de) |
| ZA (1) | ZA783731B (de) |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3766213A (en) * | 1966-04-19 | 1973-10-16 | Hoffmann La Roche | Retrosteroid a ring formation |
| CH601352A5 (de) * | 1973-09-26 | 1978-07-14 | Hoffmann La Roche | |
| DE2424752A1 (de) * | 1974-05-22 | 1975-12-04 | Schering Ag | Verfahren zur herstellung von steroidspiro-lactonen |
| AT351191B (de) * | 1976-12-20 | 1979-07-10 | Hoffmann La Roche | Verfahren zur herstellung von neuen d-homo- steroiden |
-
1977
- 1977-07-06 LU LU77699A patent/LU77699A1/de unknown
-
1978
- 1978-05-31 NL NL7805939A patent/NL7805939A/xx not_active Application Discontinuation
- 1978-06-29 AU AU37603/78A patent/AU3760378A/en active Pending
- 1978-06-29 ZA ZA00783731A patent/ZA783731B/xx unknown
- 1978-06-30 US US05/921,036 patent/US4202823A/en not_active Expired - Lifetime
- 1978-06-30 IL IL7855049A patent/IL55049A0/xx unknown
- 1978-07-03 FI FI782137A patent/FI782137A/fi not_active Application Discontinuation
- 1978-07-04 JP JP8060578A patent/JPS5414959A/ja active Granted
- 1978-07-04 DE DE19782829403 patent/DE2829403A1/de not_active Withdrawn
- 1978-07-04 FR FR7819872A patent/FR2396767A1/fr active Granted
- 1978-07-04 IT IT25305/78A patent/IT1096965B/it active
- 1978-07-04 EP EP78100302A patent/EP0000368B1/de not_active Expired
- 1978-07-04 DE DE7878100302T patent/DE2860642D1/de not_active Expired
- 1978-07-05 SE SE7807586A patent/SE7807586L/xx unknown
- 1978-07-05 GB GB7828869A patent/GB2000781A/en not_active Withdrawn
- 1978-07-05 PT PT68254A patent/PT68254A/pt unknown
- 1978-07-05 DK DK783047A patent/DK304778A/da unknown
- 1978-07-05 ES ES471470A patent/ES471470A1/es not_active Expired
- 1978-07-05 NO NO782349A patent/NO782349L/no unknown
-
1979
- 1979-10-05 US US06/082,269 patent/US4285880A/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| EP0000368A1 (de) | 1979-01-24 |
| FI782137A (fi) | 1979-01-07 |
| US4285880A (en) | 1981-08-25 |
| IL55049A0 (en) | 1978-08-31 |
| JPS5414959A (en) | 1979-02-03 |
| ZA783731B (en) | 1979-07-25 |
| LU77699A1 (de) | 1979-03-26 |
| NO782349L (no) | 1979-01-09 |
| DK304778A (da) | 1979-01-07 |
| FR2396767A1 (fr) | 1979-02-02 |
| DE2829403A1 (de) | 1979-01-25 |
| US4202823A (en) | 1980-05-13 |
| IT7825305A0 (it) | 1978-07-04 |
| IT1096965B (it) | 1985-08-26 |
| ES471470A1 (es) | 1979-09-16 |
| SE7807586L (sv) | 1979-01-07 |
| DE2860642D1 (en) | 1981-08-06 |
| JPS6160839B2 (de) | 1986-12-23 |
| NL7805939A (nl) | 1979-01-09 |
| PT68254A (en) | 1978-08-01 |
| FR2396767B1 (de) | 1980-07-18 |
| AU3760378A (en) | 1980-01-03 |
| GB2000781A (en) | 1979-01-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0122232B1 (de) | 20-Spiroxane und Analoge mit geöffnetem Ring E, Verfahren zu ihrer Herstellung, sowie pharmazeutische Präparate davon | |
| DE3402330A1 (de) | 1(alpha),2(alpha)-methylen-6-methylen- und 6(alpha)-methyl-pregnene, verfahren zu deren herstellung und diese enthaltende pharmazeutische praeparate | |
| EP0000368B1 (de) | D-Homosteroide und solche enthaltende Präparate sowie Verfahren zur Herstellung solcher D-Homosteroide | |
| DE2445783A1 (de) | Neue d-homosteroide | |
| EP0019247B1 (de) | 16-Alpha-Alkylsteroide, Verfahren zu ihrer Herstellung und diese enthaltende pharmazeutische Präparate | |
| DE2636405C2 (de) | Δ↑1↑↑5↑-17α-Chloräthinyl- und -Propinylsteroide der Östranreihe, Verfahren zu ihrer Herstellung sowie diese enthaltende pharmazeutische Präparate | |
| DE1277253B (de) | Ungesaettigte 16-Methylen-17ª‡-alkoxy-3, 20-diketo-steroide der Pregnanreihe sowie ein Verfahren zu ihrer Herstellung | |
| DE1668205C3 (de) | 16 alpha-Alkylthio-9beta, lOalpha-Steroide, Verfahren zu ihrer Herstellung und diese enthaltende pharmazeutische Präparate | |
| DE2651364A1 (de) | Neue d-homosteroide | |
| DE1947221A1 (de) | 3-Aza-19-hydroxy-3,19-cyclo-A-homosteroide und ein Verfahren zu deren Herstellung | |
| EP0014966B1 (de) | Neue deA-Steroide, ihre Herstellung und deA-Steroide zur Verwendung als Pharmazeutika | |
| DE2756654A1 (de) | Neue d-homosteroide | |
| DE1643054C3 (de) | 1 alpha,2alpha-Methylen-4-chlor-DeHa hoch 4- bzw. Delta hoch 4,6 -7-methyl-Verbindungen der Pregnan-relhe, Verfahren zu ihrer Herstellung sowie diese enthaltende Arzneimittel | |
| CH616436A5 (en) | Process for the preparation of D-homosteroids. | |
| AT270893B (de) | Verfahren zur Herstellung von neuen 19-Alkenylsteroiden | |
| DE1768161C (de) | Äther des 1 a, 2 a-Methylen-19-nor-testosterons und seiner 18- Alkylhomologen, Verfahren zu ihrer Herstellung, diese enthaltende Arzneimittel sowie entsprechende S a-östran-Zwischenprodukte | |
| DE2533496A1 (de) | Neue difluorsteroide und verfahren zu ihrer herstellung | |
| DE2544701A1 (de) | Neue steroide | |
| DE1643054B2 (de) | 1alpha,2alpha-methylen-4-chlor- delta hoch 4 -bzw. delta hoch 4,6- 7-methyl-verbindungen der pregnanreihe, verfahren zu ihrer herstellung sowie diese enthaltende arzneimittel | |
| DE1242609B (de) | Verfahren zur Herstellung von 1, 2beta-Methylen-5alpha-androstanderivaten | |
| CH609712A5 (en) | Process for the preparation of novel D-homosteroids | |
| CH620456A5 (en) | Process for the preparation of D-homosteroids | |
| DE1923746A1 (de) | 9beta,10Alpha-Steroide | |
| DE2755578A1 (de) | C-homo-oestratriene | |
| DE1094258B (de) | Verfahren zur Herstellung von fluorierten 16-Methylsteroiden |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Designated state(s): BE CH DE FR GB LU NL SE |
|
| 17P | Request for examination filed | ||
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Designated state(s): BE CH DE FR GB LU NL SE |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Effective date: 19810429 Ref country code: NL Effective date: 19810429 Ref country code: BE Effective date: 19810429 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19810731 |
|
| REF | Corresponds to: |
Ref document number: 2860642 Country of ref document: DE Date of ref document: 19810806 |
|
| NLV1 | Nl: lapsed or annulled due to failure to fulfill the requirements of art. 29p and 29m of the patents act | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19840704 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19840709 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19840711 Year of fee payment: 7 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: CH Effective date: 19870731 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19880331 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19880503 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19881117 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |