-
Die
vorliegende Erfindung betrifft ein mit insektiziden Wirkstoffen
getränktes
Papier, Verfahren zu dessen Herstellung und dessen Verwendung zur
Bekämpfung
von Insekten.
-
Bekannt
ist, dass zur Abtötung
bzw. Repellierung von Insekten, z.B. Stechmücken, mit Hilfe von elektrischen
Heizgeräten
z.B. so genannte Plättchenverdampfer
benutzt werden können.
Bei diesem Verfahren werden geeignete Stoffe, wie z.B. Zellstoff
und Baumwollkarton, Asbest, Keramik und/oder poröse Kunstharze mit insektiziden
Wirkstoff Lösungen
imprägniert,
wobei Insektizidplättchen
erhalten werden. Die Insektizide werden durch die Wirkung eines
Heizgerätes,
das eine Temperatur von 120 bis 190°C erzeugt, verflüchtigt.
-
Ein
erheblicher Nachteil dieser Plättchenverdampfer
besteht darin, dass diese Verdampfer die Wirkstoffe über die
vorgesehene Wirkdauer nicht gleichmäßig abgeben. Die Wirkstoffabgabe
ist zu Anfang der Inbetriebnahme meist unnötig hoch und fallt dann kontinuierlich
und stark ab. Die Wirksamkeit dieser Verdampferplättchen lässt im Verlauf
der vorgegebenen Anwendungsdauer nach.
-
Seit
längerer
Zeit sind auch Verdampfergeräte
für den
Hausgebrauch bekannt, wie sie beispielsweise in der GB-B-2 153 227
beschrieben sind; hier erfolgt die Verdampfung einer Lösung, wobei
der Wirkstoff z.B. in einem Gemisch gesättigter, aliphatischer Kohlenwasserstoffe
gelöst
ist, mittels eines elektrisch beheizten Dochtes.
-
Die
in diesen so genannten Flüssigverdampfern
benötigte,
im Verhältnis
zur Wirkstoffmenge erhebliche Menge an organischem Lösemittel
führt bei
der Produktanwendung zu einer unerwünscht hohen Konzentration von
Lösungsmittel
im Raum, was unter anderem zu einer – häufig von Verbrauchern beanstandeten – Verschmutzung
von Wänden
und Gegenständen,
die sich in der Nähe
dieser Geräte
befinden, führt.
-
Zur
Abwehr der lästigen
Insektenplage sind batteriebetriebene Insektizid-Verdampfer bekannt,
bei denen die Oberfläche
einer Strahlungsplatte zum Verdampfen eines Insektizids auf eine
Temperatur zwischen 90 und 130°C
erhitzt wird (
DE 195
25 782 A1 ).
-
Darüber hinaus
sind aus der
DE
20 2004 008 226 U1 Brennstoffkörper zur Insektenbekämpfung,
insbesondere beim Grillen, bekannt, welche eine mit Poren und/oder
Hohlräumen
versehene Trägerstruktur
und einen Brennstoff aus Wachs und/oder Paraffin und/oder Stearin
umfasst, wobei der Brennstoff einen Anteil an Citronellöl aufweist.
-
Weiterhin
bekannt ist die Verdampfung von Insektiziden mit Hilfe elektrisch
betriebener Ventilatoren, die einen Luftstrom über einen mit einer insektiziden
Wirkstofflösung
imprägnierten
Träger
blasen. Solche Ventilatorsysteme sind z.B. in WO-A-96/32843 beschrieben.
-
Aus
der EP-B- 0 279 325 sind mit Transfluthrin imprägnierte Naturstoffe und synthetische
Stoffe, z.B. auch Mottenpapiere, bekannt.
-
Ferner
sind Räucherspiralen,
wie beispielsweise Baygon® Spiralen (Coils) bekannt,
welche für
einen Zeitraum von 6 bis 12 Stunden vor Mücken beispielsweise auf der
Terrasse, auf dem Balkon, beim Camping oder im Zimmer schützen. Zur
Verwendung der Ringe werden diese angezündet, wobei der Ring verglimmt, so
dass der enthaltende Wirkstoff langsam und kontinuierlich im Freien
oder im Raum abgegeben wird. Für einen
Raum von ca. 20 m2 wird ein kommerziell
erhältlicher
Ring benötigt.
Nachteilig an diesen Ringen ist jedoch, dass sie dazu neigen, bei
der Verwendung leicht zu brechen, so dass sie nur zum Teil zur Anwendung kommen.
-
Darüber hinaus
werden zur Bekämpfung
von Insekten Aerosole oder Ölsprühmittel
verwendet, um geschlossene Räume
schnell von Insekten zu befreien. Derart behandelte Räume können dann
im Anschluss wieder gelüftet
werden, sofern der Zugang von neuen Insekten verhindert werden kann.
Dementsprechende Systeme weisen jedoch den Nachteil auf, dass sich
der Aerosolnebel bzw. der Ölsprühnebel aufgrund
ihrer Masse in den Räumen
nicht ausreichend fein verteilen.
-
Allen
diesen Produkten ist gemein, dass sie technisch und logistisch aufwendig,
langsam und damit teuer herzustellen sind. Des weiteren erfordert
die Herstellung der weltweit mengenmäßig größten Produkte Aerosole, Ölsprühmittel
und Spiralen den Verbrauch enormer Mengen natürlicher Ressourcen wie Kerosen, Propan/Butan,
Holzmehl, Kleber, Stärke
sowie verschiedener Formulierhilfsmittel. Ferner bedingt ihre Verwendung
meist die spätere
Entsorgung von entsprechenden Verpackungen, wie beispielsweise von
Dosen, Ventilen, Kunststoffflaschen, Umverpackungen etc.
-
Somit
stellt sich für
den Fachmann unter Berücksichtigung
des oben beschriebenen Standes der Technik die Aufgabe, eine Vorrichtung
zur Insektenbekämpfung
bereitzustellen, welches die oben dargestellten Nachteile weitgehend
vermeidet.
-
Die
Lösung
dieser Aufgabe geht aus von einer Vorrichtung zur Insektenbekämpfung,
welche einen glimmfähigen
Papierträger
umfasst.
-
Der
Papierträger
ist dann dadurch gekennzeichnet, dass er mit mindestens einem insektiziden
Wirkstoff versehen ist.
-
Erfindungsgemäß ist somit
die Bereitstellung einer Vorrichtung zur Bekämpfung von Insektiziden vorgesehen,
die einem mit mindestens einem insektiziden Wirkstoff getränkten glimmfähigen Papierträger umfasst.
Der Papierträger
ist erfindungsgemäß so ausgebildet,
dass er – einmal
mit Feuer angezündet – nach dem
Löschen,
beispielsweise durch Auspusten oder einen Windstoß, weiter
glimmt und nicht vollständig
verlöscht.
Durch das Glühen
setzt der Papierträger
den mindestens einen insektiziden Wirkstoff frei, wodurch eine Bekämpfung von
Insekten erfolgt.
-
In
einer besonderen Ausführungsform
der vorliegenden Erfindung besteht die erfindungsgemäße Vorrichtung
aus dem Papierträger,
dem mindestens einen insektiziden Wirkstoff und gegebenenfalls weiteren
Zusatzstoffen, wie beispielsweise Kaliumnitrat. Weitere Zusatzstoffe
sind weiter unten beschrieben.
-
Papierträger
-
Die
erfindungsgemäße Vorrichtung
umfasst einen Papierträger.
-
Papierträger der
erfindungsgemäßen Art
sind bereits seit vielen Jahren, nicht jedoch im Bereich der Bekämpfung von
Insektiziden bekannt. So wurde seit ungefähr 150 Jahre ein Papierträger mit
dem asiatischen Baumharz „Styrax" getränkt, wobei
das resultierende Produkt als „armenisches
Papier" bezeichnet
wird. Dieses „armenische
Papier" wird verwendet,
um Gerüche
von Essen und Tabak oder andere unangenehme Gerüche zu neutralisieren. Der
Franzose Auguste Poncet hatte das Harz, das auch zur Herstellung
von Weihrauch verwendet wird und deshalb an dessen Geruch erinnert,
von einer Reise nach Armenien mitgebracht. Das Papier wird in Heften
mit einer unterschiedlichen Anzahl an Blättern vertrieben. Bei der Verwendung
dieses Papiers wird ein Blatt aus dem Heft entnommen, auf einem
Aschenbecher entzündet
und wieder gelöscht, damit
es langsam verglimmt. Während
dem Verglimmen setzt das Papier die gewünschten Duftstoffe frei und sorgt
im Umfeld somit für
einen angenehmen Duft. Auf ähnliche
Weise wird auch das erfindungsgemäße Papiersubstrat verwendet.
-
Grundsätzlich unterliegt
der dabei verwendete Papierträger
keinen besonderen Beschränkungen,
so lange er im Allgemeinen dazu geeignet ist, mindestens einen entsprechenden
insektiziden Wirkstoff aufzunehmen, und nach einem Anzünden und
einem Erlöschen
des Papierträgers
den mindestens einen insektiziden Wirkstoff ohne im Wesentlichen
zu einer Zersetzung zu führen
freizusetzen.
-
Es
hat sich jedoch herausgestellt, dass Papierträger mit einem Papiergewicht
von vorzugsweise 25 bis 300 g/m2, insbesondere
25 bis 270 g/m2, besonders bevorzugt 25
bis 250 g/m2, ganz besonders bevorzugt 25
bis 230 g/m2, weiter ganz besonders bevorzugt
25 bis 215 g/m2, speziell 25 bis 200 g/m2, für
den erfindungsgemäßen Zweck
besonders geeignet sind.
-
Darüber hinaus
ist es bevorzugt, wenn die Dicke des Papierträgers in einem Bereich von 0,1
bis 0,5 mm, besonders bevorzugt 0,15 bis 0,45 mm, ganz besonders
bevorzugt 0,15 bis 0,40, weiter ganz besonders bevorzugt zwischen
0,15 und 0,34 mm, speziell 0,15 bis 0,32 mm, liegt.
-
Hinsichtlich
der Größe der einzelnen
Papierträger
unterliegt die vorliegende Erfindung keinerlei Einschränkungen.
Der erfindungsgemäße Papierträger sollte
jedoch so zugeschnitten vorliegen, dass er anwenderseits geeignet
verwendet werden, d.h., dass er beispielsweise eine Größe aufweist,
die es ermöglicht,
den Papierträger
in einem Gefäß, beispielsweise
einem Aschenbecher, zu verglimmen.
-
Insektizider
Wirkstoff
-
In
der erfindungsgemäßen Vorrichtung
kann ein Papierträger
verwendet werden, der nur mit einem insektiziden Wirkstoff versehen
ist. Alternativ ist es auch möglich,
dass zwei oder mehrere insektizide Wirkstoffe gleichzeitig auf dem
Papierträger
vorgesehen sind, wie beispielsweise 2, 3 oder 4 insektizide Wirkstoffe.
-
Die
Auswahl an geeignetem insektiziden Wirkstoff unterliegt grundsätzlich nur
der Beschränkung, dass
der insektizide Wirkstoff bei der Glimmtemperatur des Papierträgers von
ungefähr
350 bis 600°C
im Wesentlichen ohne Zersetzung in die umgebende Atmosphäre abgegeben
wird, ohne dass er seine insektizide Wirkungsweise im Wesentlich
verliert. Unter „im
Wesentlichen ohne Zersetzung" wird
im Rahmen der vorliegenden Erfindung verstanden, wenn eine Zersetzung
von höchstens
80%, vorzugsweise höchstens
70%, besonders bevorzugt höchstens
60%, insbesondere höchstens
50%, speziell höchstens
40%, eintritt. In einer ersten Ausführungsform der vorliegenden
Erfindung wird das Papiersubstrat mit mindestens einem insektiziden
Wirkstoff, ausgewählt
aus der Gruppe, bestehend aus den Pyrethroiden, insbesondere ausgewählt aus der
Gruppe, bestehend aus Acrinathrin, Allethrin, d-Allethrin, d-trans
Allethrin, d-cis-trans Allethrin, Alphamethrin, Bathrin, Bifenthrin,
Bioallethrin, S-Bioallethrin, Bioallethrin-S-cyclopentyl-isomer,
Bioethanomethrin, Biopermethrin, Bioresmethrin, Clocythrin, Chlovaporthrin,
Cycloprothrin, Cyfluthrin, beta-Cyfluthrin, Cyhalothrin, gamma-Cyhalothrin,
lambda-Cyhalothrin, Cypermethrin, alpha-Cypermethrin, beta-Cypermethrin, cis-Cypermethrin,
theta-Cypermethrin, zeta-Cypermethrin, Cyphenotrin; Deltamethrin,
Depallethrin, Empenthrin, Empenthrin (1R-isomer), Esbiothrin, Esfenvalerat,
Etophenprox, Fenfluthrin, Fenpropathrin, Fenpyrithrin, Fenvalerat,
Flubrocythrinate, Flucythrinat, Flumethrin, Fubfenprox, Imiprothrin,
Kadethrin, Metofluthrin, Neopynamin, Permethrin, cis-Permethrin,
trans-Permethrin, Phenothrin, Phenothrin (1R-trans Isomer), d-Phenothrin,
Prallethrin, Profluthrin, Protrifenbute, Pynamin forte, Pyresmethrin,
Pyrethrin, Resmethrin, cis-Resmethrin, RU 15525, Silafluofen, Tau-Fluvalinat,
Tefluthrin, Tetramethrin (Phthalthrin), Tetra methrin(-1R-Isomer),
Terallethrin, Tralomethrin, Transfluthrin, ZXI 8901, Pyrethrins
(pyrethrum) und jedwede Mischung der zuvor genannten Wirkstoffe.
-
In
einer weiteren Ausführungsform
kann der insektizide Wirkstoff aus den folgenden Wirkstoffen ausgewählt werden,
wobei die folgenden insektiziden Wirkstoffe alleine oder in jedweder
Kombination untereinander sowie in jedweder Kombination mit den
vorgenannten insektiziden Wirkstoffen verwendet werden können.
-
Acetylcholinesterase (AChE)
Inhibitoren
-
- Carbamate,
- zum Beispiel Alanycarb, Aldicarb, Aldoxycarb, Allyxycarb, Aminocarb,
Bendiocarb, Benfuracarb, Bufencarb, Butacarb, Butocarboxim, Butoxycarboxim,
Carbaryl, Carbofuran, Carbosulfan, Cloethocarb, Dimetilan, Ethiofencarb,
Fenobucarb, Fenothiocarb, Formetanate, Furathiocarb, Isoprocarb,
Metam-sodium, Methiocarb, Methomyl, Metolcarb, Oxamyl, Pirimicarb,
Promecarb, Propoxur, Thiodicarb, Thiofanox, Trimethacarb, XMC, Xylylcarb,
Triazamate
- Organophosphate,
- zum Beispiel Acephate, Azamethiphos, Azinphos(-methyl, -ethyl),
Bromophos-ethyl, Bromfenvinfos(-methyl), Butathiofos, Cadusafos,
Carbophenothion, Chlorethoxyfos, Chlorfenvinphos, Chlormephos, Chlorpyrifos(-methyl/-ethyl),
Coumaphos, Cyanofenphos, Cyanophos, Chlorfenvinphos, Demeton-S-methyl, Demeton-S-methylsulphon,
Dialifos, Diazinon, Dichlofenthion, Dichlorvos/DDVP, Dicrotophos,
Dimethoate, Dimethylvinphos, Dioxabenzofos, Disulfoton, EPN, Ethion,
Ethoprophos, Etrimfos, Famphur, Fenamiphos, Fenitrothion, Fensulfothion,
Fenthion, Flupyrazofos, Fonofos, Formothion, Fosmethilan, Fosthiazate,
Heptenophos, Iodofenphos, Iprobenfos, Isazofos, Isofenphos, Isopropyl
O-salicylate, Isoxathion, Malathion, Mecarbam, Methacrifos, Methamidophos,
Methidathion, Mevinphos, Monocrotophos, Naled, Omethoate, Oxydemeton-methyl,
Parathion(-methyl/-ethyl),
Phenthoate, Phorate, Phosalone, Phosmet, Phosphamidon, Phosphocarb,
Phoxim, Pirimiphos(-methyl/-ethyl), Profenofos, Propaphos, Propetamphos,
Prothiofos, Prothoate, Pyraclofos, Pyridaphenthion, Pyridathion,
Quinalphos, Sebufos, Sulfotep, Sulprofos, Tebupirimfos, Temephos,
Terbufos, Tetrachlorvinphos, Thiometon, Triazophos, Triclorfon,
Vamidothion
-
Natrium-Kanal-Modulatoren/Spannungsabhängige Natrium-Kanal-Blocker
-
- DDT
- Oxadiazine,
- zum Beispiel Indoxacarb
- Semicarbazon,
- zum Beispiel Metaflumizon (BAS3201)
-
Acetylcholin-Rezeptor-Agonisten/-Antagonisten
-
- Chloronicotinyle,
- zum Beispiel Acetamiprid, Clothianidin, Dinotefuran, Imidacloprid,
Nitenpyram, Nithiazine, Thiacloprid, Thiamethoxam
- Nicotine, Bensultap, Cartap
-
Acetylcholin-Rezeptor-Modulatoren
-
- Spinosyne,
- zum Beispiel Spinosad
-
GABA-gesteuerte Chlorid-Kanal-Antagonisten
-
- Organochlorine,
- zum Beispiel Camphechlor, Chlordane, Endosulfan, Gamma-HCH,
HCH, Heptachlor, Lindane, Methoxychlor
- Fiprole,
- zum Beispiel Acetoprole, Ethiprole, Fipronil, Pyrafluprole,
Pyriprole, Vaniliprole
-
Chlorid-Kanal-Aktivatoren
-
- Mectine,
- zum Beispiel Abamectin, Emamectin, Emamectin-benzoate, Ivermectin,
Lepimectin, Milbemycin
-
Juvenilhormon-Mimetika,
-
- zum Beispiel Diofenolan, Epofenonane, Fenoxycarb, Hydroprene,
Kinoprene, Methoprene, Pyriproxifen, Triprene
-
Ecdysonagonisten/disruptoren
-
- Diacylhydrazine,
- zum Beispiel Chromafenozide, Halofenozide, Methoxyfenozide,
Tebufenozide
-
Inhibitoren der Chitinbiosynthese
-
- Benzoylharnstoffe,
- zum Beispiel Bistrifluron, Chlofluazuron, Diflubenzuron, Fluazuron,
Flucycloxuron, Flufenoxuron, Hexaflumuron, Lufenuron, Novaluron,
Noviflumuron, Penfluron, Teflubenzuron, Triflumuron
- Buprofezin
- Cyromazine
-
Inhibitoren der oxidativen
Phosphorylierung, ATP-Disruptoren
-
- Diafenthiuron
- Organozinnverbindungen,
- zum Beispiel Azocyclotin, Cyhexatin, Fenbutatin-oxide
-
Entkoppler der oxidativen
Phoshorylierung durch Unterbrechung des H-Protongradienten
-
- Pyrrole,
- zum Beispiel Chlorfenapyr
- Dinitrophenole,
- zum Beispiel Binapacyrl, Dinobuton, Dinocap, DNOC
-
Seite-I-Elektronentransportinhibitoren
-
- METI's,
- zum Beispiel Fenazaquin, Fenpyroximate, Pyrimidifen, Pyridaben,
Tebufenpyrad, Tolfenpyrad
- Hydramethylnon
- Dicofol
-
Seite-II-Elektronentransportinhibitoren
-
-
Seite-III-Elektronentransportinhibitoren
-
- Acequinocyl, Fluacrypyrim
-
Mikrobielle Disruptoren
der Insektendarmmembran
-
- Bacillus thuringiensis-Stämme
-
Inhibitoren der Fettsynthese
-
- Tetronsäuren,
- zum Beispiel Spirodiclofen, Spiromesifen,
- Tetramsäuren,
- zum Beispiel Spirotetramat, cis-3-(2,5-dimethylphenyl)-4-hydroxy-8-methoxy-1-azaspiro[4.5]dec-3-en-2-on
- Carboxamide,
- zum Beispiel Flonicamid
- Oktopaminerge Agonisten,
- zum Beispiel Amitraz
-
Inhibitoren der Magnesium-stimulierten
ATPase,
-
- Propargite
- Nereistoxin-Analoge,
- zum Beispiel Thiocyclam hydrogen oxalate, Thiosultap-sodium
-
Agonisten des Ryanodin-Rezeptors,
-
- Benzoesäuredicarboxamide,
- zum Beispiel Flubendiamid
- Anthranilamide,
- zum Beispiel Rynaxypyr(3-bromo-N-{4-chloro-2-methyl-6-[(methylamino)carbonyl]phenyl}-1-(3-chloropyridin-2-yl)-1H-pyrazole-5-carboxamide)
-
Biologika, Hormone oder
Pheromone
-
- Azadirachtin, Bacillus spec., Beauveria spec., Codlemone,
Metanhizium spec., Paecilomyces spec., Thuringiensin, Verticillium
spec.
-
Wirkstoffe mit unbekannten
oder nicht spezifischen Wirkmechanismen
-
- Begasungsmittel,
- zum Beispiel Aluminium phosphide, Methyl bromide, Sulfuryl fluoride
Fraßhemmer,
- zum Beispiel Cryolite, Flonicamid, Pymetrozine
- Milbenwachstumsinhibitoren,
- zum Beispiel Clofentezine, Etoxazole, Hexythiazox
- Amidoflumet, Benclothiaz, Benzoximate, Bifenazate, Bromopropylate,
Buprofezin, Chinomethionat, Chlordimeform, Chlorobenzilate, Chloropicrin,
Clothiazoben, Cycloprene, Cyflumetofen, Dicyclanil, Fenoxacrim, Fentrifanil,
Flubenzimine, Flufenerim, Flutenzin, Gossyplure, Hydramethylnone,
Japonilure, Metoxadiazone, Petroleum, Piperonyl butoxide, Potassium
oleate, Pyridalyl, Sulfluramid, Tetradifon, Tetrasul, Trarathene,
Verbutin Unter einem insektiziden Wirkstoff wird im Rahmen der vorliegenden
Erfindung auch ein repellierender Wirkstoff oder Synergeisten verstanden.
-
Auch
repellierend wirkende Wirkstoffe können alleine oder in Kombination
mit anderen Wirkstoffen verwendet werden wie Diethyltoluamid (DEET)
und Picanidin.
-
Hinsichtlich
des Gehalts an insektizidem Wirkstoff unterliegt der erfindungsgemäß vorgesehene
Papierträger
keinen besonderen Beschränkungen.
Es hat sich jedoch als bevorzugt herausgestellt, dass der Gehalt
an insektizidem Wirkstoff 0,01 bis 100,0 mg/24 cm2 Papierfläche, besonders
bevorzugt 0,05 bis 80 mg/24 cm2 Papierfläche, ganz
besonders bevorzugt 0,1 bis 60 mg/24 cm2 Papierfläche, weiter
ganz besonders bevorzugt 0,15 bis 40 mg/24 cm2 Papierfläche, speziell
0,20 bis 20 mg/24 cm2 Papierfläche, beträgt, wobei
jeweils ein Papierträger
zugrunde gelegt wird, welcher das oben genannte Papiergewicht und
die oben genannte Papierdicke aufweist.
-
Der
Papierträger
in dem erfindungsgemäßen Insektenbekämpfungsmittel
kann darüber
hinaus weitere Inhaltsstoffe enthalten. Ein wesentlicher Bestandteil
hierbei ist Kaliumnitrat, wodurch erreicht wird, dass das Papier
nicht vollständig
verbrennt, sondern nach dem Anzünden
und dem anschlie ßenden
Löschen
verglimmt. Die Menge an Kaliumnitrat, welche sich auf dem erfindungsgemäßen Papierträger befindet,
unterliegt grundsätzlich
keiner Beschränkung.
Es hat sich jedoch als bevorzugt herausgestellt, wenn die Menge
an Kaliumnitrat 5 bis 50 g/m2, besonders
bevorzugt 7 bis 45 g/m2, ganz besonders
bevorzugt 9 bis 40 g/cm2, weiter ganz besonders
bevorzugt 10 bis 35 g/cm2, speziell 12 bis
30 g/cm2, beträgt.
-
Die
erfindungsgemäß zu verwendenden
Papierträger
können
außerdem
natürliche
und/oder synthetische Duftstoffe sowie organische und anorganische
Farbstoffe enthalten.
-
Natürlich Duftstoffe
können
beispielsweise ausgewählt
sein aus der Gruppe, bestehend aus Moschus, Zibet, Ambra, Castereum
und ähnliche
Duftstoffe: Ajowaöl,
Mandelöl,
Ambrettesamen absol., Angelikawurzelöl, Anisol, Basilikumöl, Lorbeeröl, Benzoinresinoid,
Bergamottessenz, Birkenöl,
Rosenholzöl,
Pfriemenkraut absol., Cajeputöl,
Canangaöl,
Gapiscumöl,
Kümmelöl, Cardamonöl, Möhrensainenöl, Cassiaöl, Zedernholzöl, Selleriesamenol,
Zimtrindenöl,
Zitronellöl,
Muskattellersalbeiöl,
Nelkenöl,
Kognaköl,
Korianderöl,
Cubebenöl, Kampferöl, Dillöl, Estragonöl. Eukalyptusöl, Fenchelöl süß, Calbanumresinoid,
Knoblauchöl,
Geraniumöl,
Ingweröl,
Grapefruitöl,
Hopfenöl,
Hyacinthe absol., Jasmin absol., Wacholderbeerenöl, Labdanumresinoid, Lavandelöl, Lorbeerblätteröl, Zitronenöl, Lemonengrasöl, Liebstöckelöl, Macisöl, Mandarinenöl, Nfisoma
absol., Myrrhe absol., Senföl,
Narcisse absol., Neroliöl,
Muskatnußöl, Eichenmoos
absol., Olibanumresinoid, Zwiebelöl, Opoponaxresinoid, Orangenöl, Orangen-blütenöl, Iris
konkret, Pfefferöl,
Pfefferminzöl,
Perubalsam, Petitgrainöl,
Fichtennadelöl,
Rose absol., Rosenöl,
Rosmarinöl,
Sandelholzöl,
Salbeiöl,
Krauseminzöl,
Styraxöl, Thymianöl, Tolubalsam,
Tonkabohnen absol., Tuberose absol., Terpentinöl, Vanilleschoten absol., Vetiveröl, Veilchenblätter absol.,
Ylang-Ylang-Öl
und ähnliche
Pflanzenöle
usw.
-
Als
synthetische Duftstoffe können
den erfindungsgemäßen Papierträgern zugefügt werden:
Pinen,
Limonen und ähnliche
Kohlenwasserstoffe, 3,3,5-Trimethylcyclohexanol, Linalool, Geraniol,
Nerol, Citronellol, Menthol, Borneol, Borneylmethoxycyclohexanol,
Benzylalkohol, Anisalkohol, Zimtalkohol, β-Phenylethylalkohol, cis-3-Hexanol,
Terpineol und ähnliche
Alkohole; Anethole, Moschusxylol, Isoeugenol, Methyleugenol und ähnliche
Phenole; Amylzimtaldehyd, Anisaldehyd, n-Butyraldehyd, Cuminaldehyd,
Cyclamenaldehyd, Decylaldehyd, Isobutyraldehyd, Hexylaldehyd, Heptylaldehyd,
n-Nonylaldehydnonadienol, Citral, Citronellal, Hydroxycitronellal,
Benzaldehyd, Methylnonylacetaldehyd, Zimtaldehyd, Dodecanol, Hexylzimtaldehyd,
Undekanal, Heliotropin, Vanillin, Ethylvanillin und ähnliche
Aldehyde, Methylamylketon, Methyl-β-naphthylketon, Methylnonylketon, Moschusketon,
Diacetyl, Acetylpropionyl, Acetylbutyryl, Carvon, Methon, Campher,
Acetophenon, p-Methylacetophenon, Jonon, Methylionon und ähnliche
Ketone; Amylbutyrolacton, Diphenyloxid, Methylphenylglycidat, Nonylaceton,
Cumarin, Cineol, Ethylmethylphenylglycidat und ähnliche Lactone bzw. Oxide,
Methylfornüat,
Isopropylformiat, Linalylforniat, Ethylacetat, Octylacetat, Methylacetat;
Benzylacetat, Cinnamylacetat, Butylpropionat, Isoamylacetat, Isopropyl-isobutyrat,
Geranylisovalerat, Allyleapronat Butylheptylat, Octylcaprylat, Methylheptincarboxylat,
Methyloctincarboxylat, Isoamylcaprylat, Methyllaurat, Ethylmyristat,
Methylmyristat, Ethylbenzoat, Benzylbenzoat, Methylcarbinylphenylacetat,
Isobutylphenylacetat, Methyleinnamat, Styracin, Methylsalicylat,
Ethylanisat, Methylanthranilat, Ethylpyruvat, Ethylbutylbutyrat,
Benzylpropionat, Butylacetat, Butylbutyrat, p-tert.-Butylcyclohexylacetat
Cedrylacetat, Citronellylacetat, Citronellylformiat, p-Cresylacetat,
Ethylbutyrat, Ethylcaproat, Ethylcinnamat, Ethylphenylacetat, Ethylenbrassylat,
Geranylacetat, Geranylformiat, Isoamylsalicylat, Isoarnylvalerat,
Isobomylacetat, Linalylacetat, Methylanthranilat, Methyldihydrojasmonat,
Nonylacetat, β-Phenylethylacetat,
Trichlormethylenphenylcarbinylacetat, Terpinylacetat, Vetiverylacetat
und ähnliche
Ester. Diese Duftstoffe können
einzeln verwendet werden, oder mindestens zwei davon können im
Gemisch miteinander verwendet werden. Neben dem Duftstoff kann die
erfindungsgemäße Formulierung
gegebenenfalls zusätzlich
die in der Duftstoffindustrie üblichen
Zusatzstoffe, wie Patchouliöl bzw. ähnliche
flüchtigkeitshemmende
Mittel, wie Eugenol bzw. ähnliche
viskositätsregulierende
Mittel enthalten.
-
Den
erfindungsgemäßen Produkten
können
auch desodorierende Mittel enthalten, wie z.B. Laurylmethacrylat,
Geranylcrotonat, Acetophenon-myristat, p-Methylacetophenon-benzaldehyd,
Benzylacetat, Benzylpropionat, Amylzimtaldehyd, Anisaldehyd, Diphenyloxid,
Methylbenzoat, Ethylbenzoat, Methylphenylacetat, Ethylphenylacetat,
Neolin, Safrol, usw.
-
Die
erfindungsgemäßen Papierträger können ferner
alleine oder in Kombination mit den vorgenannten insektiziden Wirkstoffen
Synergisten, wie Octachlorodipropylether und Piperonylbutoxid, enthalten.
-
Herstellung
-
Die
erfindungsgemäß zu verwendenden
imprägnierten
Papierträgermaterialien
können
mit allen gängigen
Imprägniermethoden
hergestellt werden, sofern der Papierträger bei der Imprägnierung
nicht beschädigt wird,
beispielsweise durch Besprühen
des Trägers
mit einer Lösung
des Insektizides und anschließendes Trocknen,
z.B. an der Luft, oder durch Tauchen des Trägers in eine Insektizidlösung und
anschließendes Trocknen,
z.B. an der Luft. Weitere geeignete Imprägniermethoden sind Imprägnieren
mittels einer Pipette, Ink-jet-Verfahren sowie Siebdruck-Verfahren.
-
Die
Papierträger
der erfindungsgemäßen Insektenbekämpfungsmittel
können
daher in einer Ausführungsform
beispielsweise durch Tränken
von geeignetem Papier mit einer entsprechenden Lö sung oder Emulsion hergestellt
werden. Dabei werden als Ausgangsmaterial vorzugsweise Papierträger der
oben genannten Spezifikationen verwendet, die bereits mit der entsprechenden
Menge an Kaliumnitrat versehen sind. In einer weiteren Ausführungsform
der vorliegenden Erfindung ist der Papierträger mit einem Glühhilfsstoff
(glowing synergist) ausgestattet. Hierbei kann es sich beispielsweise
um Kaliumnitrat oder Kaliumpermanganat handeln.
-
Entsprechende
Lösungen
bzw. Emulsionen mit dem mindestens einen insektiziden Wirkstoff
können auf
Wasser oder auf Öl
basieren. Sie enthalten – neben
dem mindestens einen insektiziden Wirkstoff – gegebenenfalls noch weitere
Inhaltsstoffe, wie beispielsweise Kaliumnitrat, Antioxidantien,
beispielsweise Phenolderivate, insbesondere Butylhydroxytoluol (BHT),
Butylhydroxyanisol (BHA), Bisphenol-Derivate, Arylamine, wie zum
beispiel Phenyl-α-naphthylamin,
ein Kondensat aus Phenetidin und Aceton oder ähnliche oder Benzophenone,
und Emulgierhilfsmittel, beispielsweise Span 80 oder Fettsäureester.
-
Als
organische und anorganische Hilfsstoffe kommen in Frage: Ammoniumsalze
und natürliche
Gesteinsmehle wie Kaoline, Tonerden, Talkum, Kreide, Quarz, Attapulgit,
Montmorillonit oder Diatomeenerde und synthetische Gesteinsmehle,
wie hochdisperse Kieselsäure,
Aluminiumoxid und Silicate; als feste Trägerstoffe für Granulate kommen in Frage:
z.B. gebrochene und fraktionierte, natürliche Gesteine wie Calcit,
Marmor, Bims, Sepiolith, Dolomit sowie synthetische Granulate aus
anorganischen und organischen Mehlen sowie Granulate aus organischem
Material wie Sägemehl,
Kokosnussschalen, Maiskolben und Tabakstengel; als Emulgier- und/oder
schaumerzeugende Mittel kommen in Frage: z.B. nicht ionogene und
anionische Emulgatoren, wie Polyoxyethylen-Fettsäure-Ester, Polyoxyethylen-Fettalkohol-Ether,
z.B. Alkylaryl-polyglycol-Ether, Alkylsulfonate, Alkylsulfate, Arylsulfonate
sowie Eiweisshydrolisate; als Dispergiermittel kommen in Frage:
z.B. Lignin-Sulfitablaugen und Methylcellulose.
-
Es
können
in den erfindungsgemässen
Insektzid-enthaltenden Gelformulierungen Haftmittel wie Carboxymethylcellulose,
natürliche
und synthetische, pulvrige, körnige
oder latexförmige
Polymere verwendet werden, wie Gummiarabicum, Polyvinylalkohol,
Polyvinylacetat sowie natürliche
Phopholipide, wie Kephaline und Lecithine und synthetische Phospholipide.
Weitere Additive können
mineralische und vegetabile Öle
sein.
-
Es
können
Farbstoffe wie anorganische Pigmente, z.B. Eisenoxid, Titanoxid,
Ferrocyanblau und organische Farbstoffe, wie Alizaryn, Azo- und
Metallphthalocyanin-Farbstoffe und Spurennähr stoffe, wie Salze von Eisen,
Mangan, Bohr, Kupfer, Cobalt, Molybdän und Zink verwendet werden.
-
In
einer ersten Ausführungsform
wird zum Auftragen des insektiziden Wirkstoffs auf den Papierträger vorzugsweise
eine Lösung
oder Emulsion auf Wasserbasis verwendet.
-
In
einer zweiten Ausführungsform
wird zum Auftragen des insektiziden Wirkstoffs auf den Papierträger vorzugsweise
eine Lösung
oder Emulsion auf Ölbasis
verwendet, wobei die Lösung
vorzugsweise auf Kerosen, wie beispielsweise Isopar, und Paraffin
haltigen Lösemitteln,
beispielsweise Isopar® (Exxon), basiert.
-
Die
erfindungsgemäßen Insektenbekämpfungsmittel
eignen sich insbesondere für
die Bekämpfung von
fliegenden Insekten, beispielsweise Mücken und Fliegen, beispielsweise
der Gattung Musca domestica, zur Bekämpfung von Motten, Ameisen,
Milben, Schaben und Silberfischen. Zu diesem Zweck werden die Papierträger angezündet und
gleich wieder verloschen, um dann beispielsweise in einem geeigneten
Gefäß zu verglimmen.
Die Dauer des Verglimmens ist abhängig von der Größe der Papierträger und
der Menge an Kaliumnitrat, welches sich auf dem Papierträger befindet. Üblicherweise
betragen die Glühzeiten
1 Minute bis mehrere Stunden in Abhängigkeit von Papierart, -qualität und der
Art der Beladung des Papiers.
-
Die
erfindungsgemäßen Insektenbekämpfmgsmittel
eignen sich insbesondere für
die Anwendung in geschlossenen Räumen,
beispielsweise in Zimmern, Kellerräumen, Vorratsräumen, Lagern,
Silos, Ställen.
Im Rahmen der vorliegenden Erfindung ist jedoch auch eine Anwendung
im freien möglich,
beispielsweise auf der Terrasse oder beim Camping.
-
Die
vorliegende Erfindung wird anhand der nachfolgenden Beispiele näher erläutert, ist
jedoch keineswegs auf die in den Beispielen beschrieben Ausführungsformen
beschränkt. 1.
Versuch Insektenbekämpfung
(1 m
3 Testkammer) 1.1
Materialien
| Testinsektizide: | 1.
Aedes aegypti, Stamm BioGenius 04, sensibel, 3 Tage alt, unterschiedliches
Geschlecht
2. Culex quinquefasciatus, Stamm BioGenius 05, sensibel,
3 Tage alt, unterschiedliches Geschlecht |
1.2
Ausstattung
| Drahtkörbe: | Länge 8,5
cm, ∅ 8 cm |
| Plastikbecher: | ∅ cm,
Höhe 4,5
cm |
| Tupfer: | Cellulose |
| Zuckerwasser: | 10%
Kristallzucker (Pfeiffer & Langen)
in Leitungswasser |
| Testraum: | 1
m3 Kammer mit Ausstattung |
1.3
Umgebungsbedingungen
| Temperatur: | 22°C |
| Relative
Feuchtigkeit: | 40% |
| Licht: | elektrische
Beleuchtungen |
-
1.4 Mittel zur Bekämpfung
-
- a) Baygon-Ringe:
0,03% Transfluthrin (0,5
g entspricht 0,15 mg Transfluthrin)
- b) Testpapier (erfindungsgemäß)
Testpapiere
mit einer Fläche
von 82,2 cm2 werden mit 0,66 mg Transfluthrin
imprägniert.
In den Testversuchen werden Papierträger folgender Abmaße verwendet:
- (1) 35,7 cm2 (entsprechend 0,290 mg
Transfluthrin)
- (2) 27,9 cm2 (entsprechend 0,225 mg
Transfluthrin)
- (3) 18,6 cm2 (entsprechend 0,150 mg
Transfluthrin)
-
1.5 Durchführung des
Versuches
-
Biologischer Test mit
Moskitoringe mit definierter Produktmenge in Kammern mit 1 m3 mit eingesperrten Insekten
-
In
Testkammern aus Glas mit Stahlböden
der Größe (innere
Abmessungen) 0,84 m × 0.87
m × 1.37 m
(= 1 m3 Kapazität) werden drei Körbe (Länge 8,5
cm, Durchmesser 8 cm), die jeweils 20 Testinsekten enthalten (Alter:
3 bis 4 Tage), in den oberen Drittel der Kammer positioniert. Eine
definierte Menge an Papierträger
bzw. Ring (üblicherweise
0,5 g) wird in die Mitte des Bodens gestellt und an einem Ende angezündet.
-
Es
wird die Zeit bestimmt, in welcher 10%, 50% und 95% der Insekten
getötet
werden (KT 10, KT 50 und KT 95). Die Testinsekten blieben für 60 Minuten
in den Kammern. Dann wurde die abschließende Anzahl an getöteten Insekten
bestimmt. Alle Insekten werden aus den Behältern entfernt und in einen
von Insektizid freien transparenten Plastikbehälter überführt. Die Becher werden mit
perforierten Deckeln verschlossen und mit Cellulosetupfer, welche
in 10%iger Zuckerlösung
getränkt
wurden, versehen. Nachdem die Insekten für 24 Stunden in dieser von
Insektizid freien Atmosphäre
aufbewahrt wurden, wird die Mortalität bestimmt.
-
Die
Versuche werden drei- bis fünfmal
wiederholt.
| Modifikation: | 100%
Mortalität
(know down) (KT 100) wird anstelle einer 95 Mortalität (KT 95)
bestimmt. Keine Wiederholungen werden aufgrund erster Screeningtests
durchgeführt. |
-
1.5
Ergebnisse Effizienz
von imprägnierten
Papierträgern
(erfindungsgemäß) zu Baygon-Ringen
in 1 m
3 Kammern gegenüber Gelbfieber auslösenden Moskitos
Aedes aegypti Stamm BioGenius 04, sensibel
-
-
Effizienz
von imprägnierten
Papierträgern
(erfindungsgemäß) zu Baygon-Ringen
in 1 m
3 Kammern gegenüber Gelbfieber auslösenden Moskitos
Culex quinquefasciatus Stamm BioGenius 05, sensibel
-
1.6 Bewertung
-
Ein
Vergleich der obigen Ergebnisse zeigt, dass die erfindungsgemäßen Papierträger einen
schneller knock-down-Effekt als die Baygon-Ringe gegenüber Aedes
agypti und Culex quinquefasciatus zeigen. 2.
Versuch Insektenbekämpfung
(20 m
3 Testraum) 2.1
Materialien
| Testinsektizide: | 1.
Aedes aegypti, Stamm BioGenius 04, sensibel, 3 Tage alt, unter schiedliches
Geschlecht
2. Culex quinquefasciatus, Stamm BioGenius 05, sensibel,
3 Tage alt, unterschiedliches Geschlecht |
2.2
Ausstattung
| Drahtkörbe: | Länge 8,5
cm, ∅ 8 cm |
| Plastikbecher: | ∅ 9,5
cm, Höhe
4,5 cm |
| Tupfer: | Cellulose |
| Zuckerwasser: | 10%
Kristallzucker (Pfeiffer & Langen)
in Leitungswasser |
| Testraum: | 20
m3 Raum mit Ausstattung, Glassschüssel mit
einer Haltevorrichtung für
einen Coil, Ventilator |
2.3
Umgebungsbedingungen
| Temperatur: | 23–26 |
| Relative
Feuchtigkeit: | 40–47% |
| Licht: | elektrische
Beleuchtungen |
-
2.4 Mittel zur Bekämpfung
-
- a) Baygon-Ringe:
0,03% Transfluthrin (2,0
g entspricht 0,6 mg Transfluthrin)
- b) Testpapier (erfindungsgemäß)
Die
Testpapiere werden durch Imprägnieren
mit den folgenden Mengen einer Lösung
hergestellt, die 3 mg Transfluthrin in 1 ml Aceton enthält.
- (1) 0,6 mg Transfluthrin (0,2 ml Lösung imprägniert auf einem 18,6 cm2 Blatt)
- (2) 1,2 mg Transfluthrin (0,4 ml Lösung imprägniert auf einem 27,9 cm2 Blatt)
- (3) 2,4 mg Transfluthrin (0,8 ml Lösung imprägniert auf einem 35.7 cm2 Blatt)
-
2.5 Durchführung des
Versuches
-
Die
Versuche werden in einem Raum gemäß unten stehender Abbildung
mit einer Größe von 20
m3 (1 = 2,84 m, w = 2,33 m, h = 3,03 m)
durchgeführt,
wobei die Innenwände
und die Dachverkleidung aus Stahl bestehen (DIN 4571) und der Raum
fünf Fenster
aufwies. Der Boden besteht aus unverglasten Fliesen. Drei Drahtkörbe (1 =
8,4 cm, Durchmesser = 8,0 cm, Maschenweite = 1,0 mm), welche jeweils
20 Testinsekten enthalten (Alter 3 bis 4 Tage) werden in dem Testraum
ausgehend von dem Boden auf eine Höhe von 1,80 m und (1,45 m von
den jeweiligen Seite an den Positionen A, B und C verteilt.
-
-
Ein
Ring wird in eine Glassschale gelegt, welche in einer Höhe von 0,5
m in der Mitte des Raumes auf einem Ständer angebracht ist. Der Ring
wird an einem kommerziellen Ringhalter fixiert und an einem Ende angezündet. Ein
Ventilator (Durchmesser 0,2 m) mit aufwärts gerichteten Flügeln befindet
sich unterhalb der Schüssel
und rotiert auf der Stufe 1 für
die gesamte Testzeit (Firma Progress (Italien), Typ: 956 5780-04
W 11, 220 Volt, 25 Watt, 50 Hz).
-
Es
wird die Zeit bestimmt, in der 10%, 50% und 95% der Insekten getötet werden
(KT 1.0, KT 50 und KT 95). Die Testinsekten bleiben für 60 Minuten
in dem Raum. Dann wird die abschließende Anzahl an getöteten Insekten
bestimmt. Alle Insekten werden aus den Behältern entfernt und in einen
von Insektizid freien transparenten Plastikbehälter überführt. Die Becher werden mit
perforierten Deckeln verschlossen und mit Cellulosetupfer, welche
in 10%iger Zuckerlösung
getränkt
wurden, versehen. Nachdem die Insekten für 24 Stunden in dieser von
Insektizid freien Atmosphäre
aufbewahrt wurden, wird die Mortalität bestimmt.
-
Die
Versuche werden drei- bis fünfmal
wiederholt.
-
2.6
Ergebnisse Aerosol-Effizienz
von imprägnierten
Papierträgern
(erfindungsgemäß) zu Baygon-Ringen
in 20 m
3 Räumen gegenüber Gelbfieber auslösenden Moskitos
Aedes aegypti Stamm Bio-Genius
04, sensibel
-
Aerosol-Effizienz
von imprägnierten
Papierträgern
(erfindungsgemäß) zu Baygon-Ringen
in 1 m
3 Kammern gegebener Gelbfieber auslösenden Moskitos
Culex quinquefasciatus Stamm BioGenius 05, sensibel
-
2.7 Bewertung
-
Ein
Vergleich der obigen Ergebnisse zeigt, dass die erfindungsgemäßen Papierträger einen
schneller knock-down-Effekt als die Baygon
® Ringe
gegenüber
Aedes agypti (Faktor 2 bis 3,5) und Culex quinquefasciatus (Faktor
2 bis 5) zeigen. 3.
Versuch Insektenbekämpfung
(20 m
3 Testraum) 3.1
Materialien
| Testinsektizide: | 1.
Aedes aegypti, Stamm BioGenius 04 anfällig, 3 Tage alt, unterschiedliches
Geschlecht
2. Culex quinquefasciatus, Stamm BioGenius 05, anfällig, 3
Tage alt, unterschiedliches Geschlecht |
3.2
Ausstattung
| Drahtkörbe: | Länge 8,5
cm, ∅ 8 cm |
| Plastikbecher: | ∅ 9,5
cm, Höhe
4,5 cm |
| Tupfer: | Cellulose |
| Zuckerwasser: | 10%
Kristallzucker (Pfeiffer & Langen)
in Leitungswasser |
| Testraum: | 20
m3 Raum mit Ausstattung, Glassschüssel mit
einer Haltevorrichtung für
einen Coil, Ventilator |
3.3
Umgebungsbedingungen
| Temperatur: | 24–25°C |
| Relative
Feuchtigkeit: | 36–47% |
| Licht: | elektrische
Beleuchtungen |
-
3.4 Mittel zur Bekämpfung
-
Testpapier (erfindungsgemäß)
-
Die
Testpapiere werden durch Imprägnieren
mit den folgenden Mengen einer Lösung
hergestellt, die 3 mg Transfluthrin in 1 ml Aceton enthält.
- (1) 0,15 mg Transfluthrin (0,2 ml Lösung imprägniert auf
einem 18,6 cm2 Blatt)
- (2) 0,30 mg Transfluthrin (0,4 ml Lösung imprägniert auf einem 27,9 cm2 Blatt)
- (3) 0,60 mg Transfluthrin (0,8 ml Lösung imprägniert auf einem 35,7 cm2 Blatt)
-
3.5 Durchführung des
Versuches
-
Die
Versuche werden in einem Raum gemäß unten stehender Abbildung
mit einer Größe von 20
m3 (1 = 2,84 m, w = 2,33 m, h = 3,03 m)
durchgeführt,
wobei die Innenwände
und die Dachverkleidung aus Stahl bestehen (DIN 4571) und der Raum
fünf Fenster
aufwies. Der Boden besteht aus unverglasten Fliesen. Drei Drahtkörbe (1 =
8,4 cm, Durchmesser = 8,0 cm, Maschenweite = 1,0 mm), welche jeweils
20 Testinsekten enthalten (Alter 3 bis 4 Tage) werden in dem Testraum
ausgehend von dem Boden auf eine Höhe von 1,80 m und 0,45 m von
den jeweiligen Seite an den Positionen A, B und C verteilt.
-
-
Ein
Ring wird in eine Glassschale gelegt, welche in einer Höhe von 0,5
m in der Mitte des Raumes auf einem Ständer angebracht ist. Der Ring
wird an einem kommerziellen Ringhalter fixiert und an einem Ende angezündet. Ein
Ventilator (Durchmesser 0,2 m) mit aufwärts gerichteten Flügeln befindet
sich unterhalb der Schüssel
und rotiert auf der Stufe 1 für
die gesamte Testzeit (Details: siehe oben).
-
Es
wird die Zeit bestimmt, in welcher 10%, 50% und 95% der Insekten
getötet
werden (KT 10, KT 50 und KT 95). Die Testinsekten blieben für 60 Minuten
in dem Raum. Dann wurde die abschließende Anzahl an getöteten Insekten
bestimmt. Alle Insekten werden aus den Behältern entfernt und in einen
von Insektizid freien transparenten Plastikbehälter überführt. Die Becher werden mit
perforierten Deckeln verschlossen und mit Cellulosetupfer, welche
in 10%iger Zuckerlösung
getränkt
wurden, versehen. Nachdem die Insekten für 24 Stunden in dieser von
Insektizid freien Atmosphäre
aufbewahrt wurden, wird die Mortalität bestimmt.
-
Die
Versuche werden drei- bis fünfmal
wiederholt.
-
3.6
Ergebnisse Aerosol-Effizienz
von imprägnierten
Papierträgern
(erfindungsgemäß) in 20
m
3 Räumen
gegenüber
Gelbfieber auslösenden
Moskitos Aedes aegypti Stamm BioGenius 04, sensibel
-
Aerosol-Effizienz
von imprägnierten
Papierträgern
(erfindungsgemäß in 1 m
3 Kammern gegenüber Gelbfieber auslösenden Moskitos
Culex quinquefasciatus Stamm BioGenius 05, sensibel
-
-
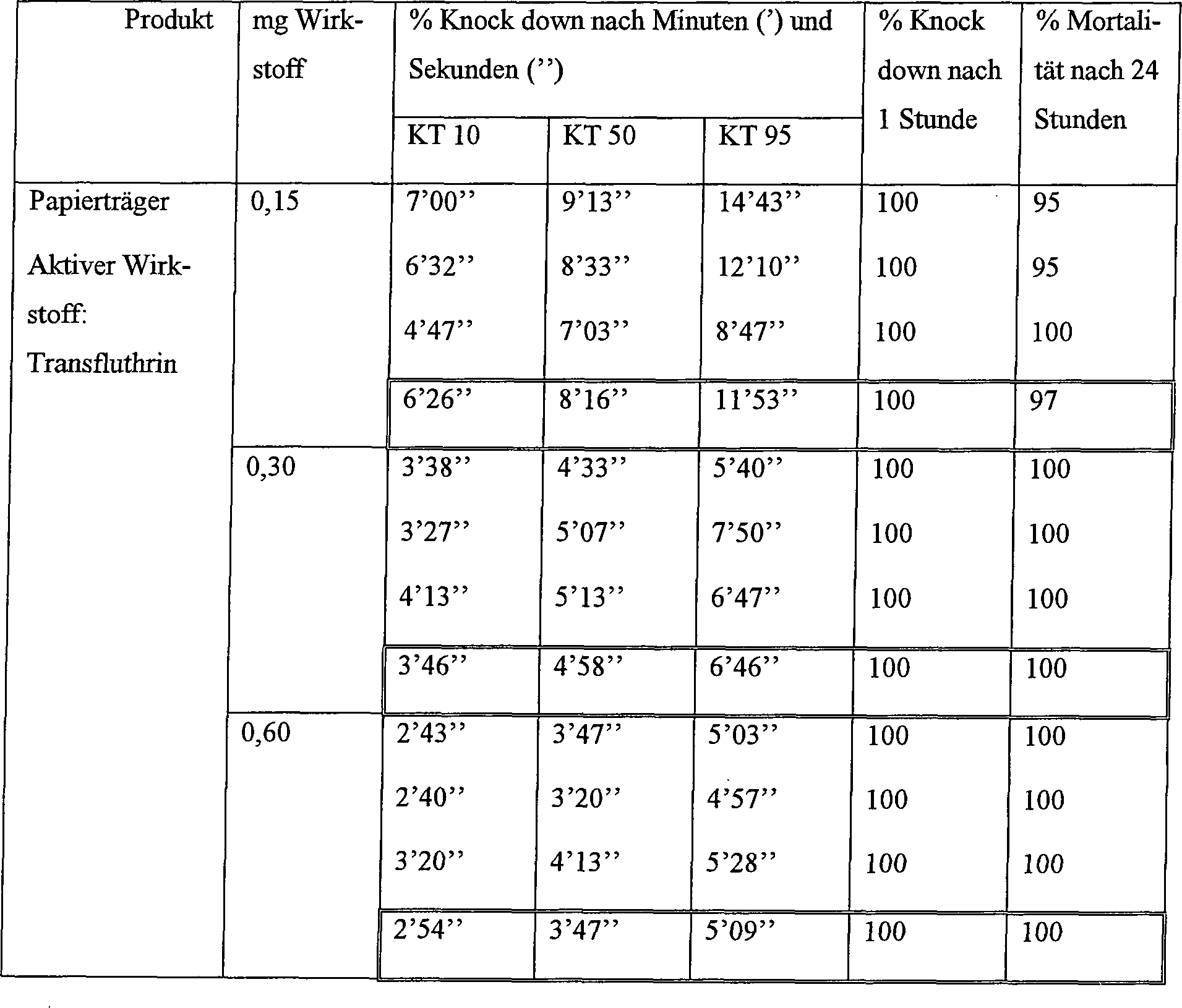
3.7 Bewertug
-
Die
obigen Versuche zeigen, dass die Verwendung von mindestens 0,6 mg
Transfluthrin für
Räume mit
20 m3 besonders geeignet sind.
-
4. Bestimmung des Abbrandverhaltens
(Glühverhalten)
von papierbasierenden Verdampfern
-
4.1 Ausstattung
-
- • Standard
Laborausstattung
- • Stoppuhr
- • 1
m3 Kammern oder 20 m3 Kammer
- • Ventilator
(nur bei 20 m3 Kammerprüfung)
- • Klammervorrichtung
zur Befestigung der Prüflinge
- • Feuerzeug
- • Auffangschalen
-
4.2 Durchführung
-
Vor
Beginn der Prüfung
wird das Prüfmuster
eindeutig gekennzeichnet.
-
Die
zu prüfenden
Prüfmuster
werden in die dafür
vorgesehene Klemmvorrichtung gesteckt: Hierbei ist darauf zu achten
das die Prüfmuster
so ausgerichtet ist das kein Kontakt zu anderen Oberflächen wie
z. Boden oder Auffangschalen vorhanden ist der den Testverlauf (Glühen des
Prüfmusters)
negativ beeinflusst.
-
Das
Prüfmuster
wird in die Testkammer (1 m3 oder 20 m3) gestellt und so positioniert, dass das
Prüfmuster
während
des gesamten Testphase beobachtet werden kann. Bei Prüfungen in
der 20 m3 Kammer kann optional ein Ventilator
zur Simulation der Luftzirkulation verwendet werden (Positionierung
siehe Skizze unten). Das Prüfmuster
wird mit einem Feuerzeug entzündet
bis eine sichtbare Flamme entsteht. Die Flamme wird umgehend ausgeblasen
damit das Prüfmuster
selbstständig
weiterglühen
kann. Gleichzeitig wird die Stoppuhr eingeschaltet mit der die Glühdauer des
Prüfmusters
ermittelt wird. Während
der gesamten Testzeit (Glühdauer)
wird das Prüfmuster
beobachtet, wobei darauf zu achten ist, ob:
- – das Prüfmuster
kontinuierlich durchglüht
- – das
Prüfmuster
gleichmäßig durchglüht oder
nur Teilbereiche
- – Teile
des Prüfmusters
während
des Test abfallen
-
Die
Messung wird mindestens dreimal durchgeführt
-
4.3 Auswertung
-
Die
Ergebnisse der Prüfung
werden in eine Tabelle übertragen
und ausgewertet. Mindestens folgende wichtige Faktoren sind auszuwerten
und tabellarisch darzustellen:
- – Dauer
der Glühphase
(mittelwert aus drei Messungen)
- – Visuelles
Bild während
der Glühphase
-
4.4 Auswertefaktoren der
visuellen Beurteilung
-
-
- a
- = brennt optimal durch
- b
- = Teile fallen beim
glühen
ab
- c
- = Glut geht aus
- sF
- = sprüht Funken
-
4.5
Testkammern a)
1 m
3 Kammer-Prüfung
-
-
5. Prüfmusterherstellung verglühbaren papierbasierenden
Verdampfern
-
5.1 Ausstattung
-
- • Standard
Laborausstattung
- • Stoppuhr
- • V4A
-Schalen (35 × 22
cm)
- • Trockenschrank
(bis 50°C)
- • Fotowalzenstuhl
- • Eppendorfpipetten
20–500 μL (inkl.
Pipettenspitzen)
- • Auffangschalen
für Photowalzenstuhl
-
5.2 Vorbehandlung des
Papiers
-
Das
für die
Vorbehandlung bestimmte Papier wird auf DIN A 4 Größe geschnitten
und eindeutig mit der entsprechenden Entwicklungs-Nr. gekennzeichnet.
Der DIN A 4 Papierbogen wird genau ausgewogen (Nettogewicht).
-
Anschließend werden
500 g wässrige
6%igen KNO3-Lösung hergestellt. Hierbei ist
darauf zu achten das für
die Herstellung der Lösung
deionisiertes Wasser verwendet wird. Die fertige Lösung wird
mit der entsprechenden Entwicklungs-Nr. gekennzeichnet und in eine
V4A-Schale mit einem Gesamtvolumen von ca. 1.1 überführt. Das Papier wird in die
6%ige KNO3 Lösung eingetaucht. Es ist darauf
zu achten das der gesamte DIN A 4 Papierbogen in die Lösung eintaucht.
Nach 20 Minuten wird der Papierbogen aus der Lösung genommen und direkt über einen
Fotowalzenstuhl ausgepresst um die überschüssige Flüssigkeit aus dem Papier herauszudrücken.
-
Nach
dem Pressen wird der Papierbogen im Trockenschrank (bei ca. 50°C) bis zur
Massenkonstanz getrocknet und erneut genau ausgewogen. (Bruttogewicht).
-
Der
fertig vorbehandelte Papierbogen wird in Prüfmusterstreifen von 12 × 2 cm geschnitten
und entsprechend gekennzeichnet.
-
5.3 Imprägnierung
des Prüfmusterstreifen
-
Mit
einer Eppendorfpipette wird ein definiertes Volumen der Wirkstofflösung auf
den Prüfmusterstreifen
gegeben. Hierbei ist darauf zu achten das die Gesamtmenge gleichmäßig auf
der Oberfläche
verteilt wird. Der imprägnierte
Prüfmusterstreifen
wird mit der entsprechenden Entwicklungs-Nr. gekennzeichnet und in Aluminiumfolie
Luftdicht eingeschlagen. Nach frühestens
24 h Einwirkzeit kann der Prüfmusterstreifen
für die
entsprechenden Prüfungen
aus der Aluminiumfolie entnommen. Wichtig ist das eine ausreichende
Menge pro Prüfmusterstreifen
hergestellt wird um die vorgesehenen Prüfungen wie biologische Wirknachweise
und begleitende analytische Untersuchungen durchführen zu
können.
Prüfmuster
die zu einem spätern
Zeitpunkt verwendet werden, werden im Kühlschrank aufbewahrt.
-
5.4 Auswertung KNO3 Menge
-
Die
Auswertung der KNO3 Menge erfolgt wie folgt:
- – Menge
KNO3/DIN A 4 Bogen
Bruttogewicht Papierbogen – Nettogewicht
Papierbogen = Menge an KNO3
- – Flächengewicht
an KNO3
Menge an KNO3 pro
Bogen × 1
m2/Fläche
DIN A 4 Bogen = KNO3/m2
-
6. Wirkungsaktivität von verschiedenen
Wirkstoffen
-
6.1 Testproben
-
- 1.–4.
Papier, welches mit verschiedenen Wirkstoffen imprägniert ist
(Papiergröße 1,8 cm × 15,7 cm
= 28,3 cm2)
- 1. Transfluthrin: Anwendungsmenge: 0,60 mg
- 2. Metofluthrin: Anewndungsmenge: 0,20 mg
- 3. Etoc: Anwendungsmenge: 0,60 mg
- 4. Pynamin forte: Anwendungsmenge: 4,00 mg
- 5. Kontrolle: Papier ohne Wirkstoff
-
6.2 Testinsektizide:
-
- 1. Aedes aegypti, Stamm BioGenius 04 sensibel,
3 Tage alt, unterschiedliches Geschlecht
- 2. Culex quinquefasciatus, Stamm BioGenius 05, sensibel, 3 Tage
alt, unterschiedliches Geschlecht
-
6.3
Ausstattung
| Drahtkörbe: | Länge 8,5
cm, ∅ 8 cm |
| Plastikbecher: | ∅ 9,5
cm, Höhe
4,5 cm |
| Tupfer: | Cellulose |
| Zuckerwasser: | 10%
Kristallzucker (Pfeiffer & Langen)
in Leitungswasser |
| Testraum: | 20
m3 Raum mit Ausstattung, Glassschüssel mit
einer Haltevorrichtung für
einen Coil, Ventilator |
-
6.4
Umgebungsbedingungen
| Temperatur: | 23–25°C |
| Relative
Feuchtigkeit: | 35–57% |
| Licht: | elektrische
Beleuchtungen |
-
6.5 Probenanzahl
-
-
6.6 Durchführung des
Versuches
-
Die
Versuche werden in einem Raum mit einer Größe von 20 m3 (1
= 2.84 m, w = 2.33 m, h = 3.03 m) durchgeführt, wobei die Innenwände und
die Dachverkleidung aus Stahl bestehen (DIN 4571) und der Raum fünf Fenster
aufwies. Der Boden besteht aus urverglasten Fliesen. Drei Drahtkörbe (1 =
8.4 cm, Durchmesser = 8.0 cm, Maschenweite = 1.0 mm), welche jeweils
20 Testinsekten enthalten (Alter 3 bis 4 Tage) werden in dem Testraum
ausgehend von dem Boden auf eine Höhe von 1,80 m und 0,45 m von
den jeweiligen Seite an den Positionen A, B und C verteilt.
-
-
Ein
Ring wird in eine Glassschale gelegt, welche in einer Höhe von 0,5
m in der Mitte des Raumes auf einem Ständer angebracht ist. Der Ring
wird an einem kommerziellen Ringhalter fixiert und an einem Ende angezündet. Ein
Ventilator (Durchmesser 0,2 m) mit auf wärts gerichteten Flügeln befindet
sich unterhalb der Schüssel
und rotiert auf der Stufe 1 für
die gesamte Testzeit.
-
Es
wird die Zeit bestimmt, in welcher 10%, 50% und 95% der Insekten
getötet
werden (KT 10, KT 50 und KT 95). Die Testinsekten blieben für 60 Minuten
in dem Raum. Dann wurde die abschließende Anzahl an getöteten Insekten
bestimmt. Alle Insekten werden aus den Behältern entfernt und in einen
Insektizid freien transparenten Plastikbehälter überführt. Die Becher werden mit
perforierten Deckeln verschlossen und mit Cellulosetupfer, welche
in 10%iger Zuckerlösung
getränkt
wurden, versehen. Nachdem die Insekten für 24 Stunden in dieser Insektizid
freien Atmosphäre
aufbewahrt wurden, wird die Mortalität bestimmt.
-
Die
Versuche werden drei- bis fünfmal
wiederholt.
-
-
6.7
Ergebnisse Tabelle
1 Aerosol-Effizienz
von imprägniertem
Papier in 20 m
3 Testkammern gegenüber Aedes
aegypti, sensibel
-
Tabelle
2 Aerosol-Effizienz von imprägniertem
Papier in 20 m
3 Testkammern gegenüber Culex
quinquefasciatus, sensibel
-
6.8 Ergebnisse
-
Gegenüber Aedes
aegypti zeigten alle imprägnierten
Papiere (0,6 mg Transfluthrin, 0,2 mg Metofluthrin, 0,6 mg Etoc
oder 4,0 mg Pynamin forte) einen schnellen Knock-down-Effekt in
der folgenden Reihenfolge:
-
-
Alle
Papiere bewirkten eine hohe Sterblichkeitsrate (Pynamin forte, Transfluthrin
und Metofluthrin 100% Sterblichkeit; Etoc 97% Sterblichkeit).
-
Gegenüber Culex
quinquefasciatus zeigten alle imprägnierten Papiere (0,6 mg Transfluthrin,
0,2 mg Metofluthrin, 0,6 mg Etoc oder 4,0 mg Pynamin forte) einen
schnellen Knock-down-Effekt
in der folgenden Reihenfolge:
-
-
Gegenüber Culex
mosquitoes zeigen die Produkte signifikante Unterschiede in der
Sterblichkeitsrate. Nur Transfluthrin eribt 100% Sterblichkeit,
gefolgt von Metofluthrin (84%), Etoc (35%) und Pynamin forte (22%).
-
7. Aufzuchtbedingungen
für die
verwendeten Insektenarten
-
7.1 Culex quinquefasciatus
-
Die
Mücken
werden in Käfigen
(48 × 48 × 39 cm)
mit Gazeeinsätzen
an den Seiten und im Deckel gehalten. Die Beleuchtung (Tag-/Nachtrhythmus)
wird über
eine Zeitschaltuhr (12 Stunden Licht/12 Stunden Dunkelheit) geregelt,
bei einer Temperatur von 26°C ± 1°C und einer
relativen Luftfeuchtigkeit von 60% ± 10%. Zur Aufnahme von Flüssigkeit
wird den Mücken
ein in 10%iger Traubenzuckerlösung
getränkter
Watteball in den Kasten gestellt. Eine künstliche Blutfütterung
wird zweimal pro Woche durchgeführt.
Rinderblut, gemischt mit einem Blutgerinnungshemmungsmittel, wird
mit Hilfe eines Magnetrührers
auf 40°C
erwärmt.
Ca. 50 ml dieses Blutes wird in ein Stück Schweinedarm gefüllt und
an schließend
in den Zuchtkasten gelegt. Dadurch wird den Mücken die Blutaufnahme ermöglicht.
Zur Eiablage wird eine Schale (Durchmesser 10 cm), die 2 cm hoch
mit Leitungswasser gefüllt
ist, in den Zuchtkasten gestellt. Die abgelegten Eier werden in
eine Plastikschale (25 × 37
cm) überführt, die
mit 5 Litern entmineralisiertem Wasser gefüllt ist und auf einer Terrarienheizmatte
steht. Einmal pro Tag werden die Mückenlarven mit handelsüblichem
Zierfischtrockenfutter (z.B. Vita®) gefüttert. Nach
ca. 6 Tagen ist das Puppenstadium erreicht. Diese werden, mit einer
geringen Menge Wasser, zum Schlupf der Mücken, in 10 Liter Kunststoffeimer überführt. Die
daraus schlüpfenden
Mücken
können
dann für Prüfungen oder
für die
Weiterzucht abgefangen werden.
-
7.2 Aedes aegypti
-
Die
Mücken
werden in Käfigen
(48 × 48 × 39 cm)
mit Gazeeinsätzen
an den Seiten und im Deckel gehalten. Die Beleuchtung (Tag-/Nachtrhythmus)
wird über
eine Zeitschaltuhr (12 Stunden Licht/12 Stunden Dunkelheit) geregelt,
bei einer Temperatur von 26°C ± 1°C und einer
relativen Luftfeuchtigkeit von 60% ± 10%. Zur Aufnahme von Flüssigkeit
wird den Mücken
ein in 10%iger Traubenzuckerlösung
getränkter
Watteball in den Kasten gestellt. Eine künstliche Blutfütterung
wird einmal pro Woche durchgeführt.
Rinderblut, gemischt mit einem Blutgerinnungshemmungsmittel, wird
mit Hilfe eines Magnetrührers
auf 40°C
erwärmt.
Ca. 50 ml dieses Blutes wird in ein Stück Schweinedarm gefüllt und
anschließend
in den Zuchtkasten gelegt. Dadurch wird den Mücken die Blutaufnahme ermöglicht.
Zur Eiablage werden in Schalen (250 ml), die zur Hälfte mit
Leitungswasser gefüllt
sind, 10 cm hohe Filterpapierrollen gestellt. Nach der Eiablage
werden diese Rollen in Kunststoffeimern gelagert. Um ein Austrocknen
der Eier zu verhindern, wird der Boden vorher mit einer 3 cm hohen und
feuchten Zellstoffschicht belegt. Zum Schlupf der Mückenlarven
wird ca. die Hälfte
eines Filterpapiers, nach einer vorherigen Lagerzeit von 2–4 Wochen,
in eine Plastikschale (25 × 37
cm) getaucht, die mit 5 Litern entmineralisiertem Wasser gefüllt ist
und auf einer Terrarienheizmatte steht. Einmal pro Tag werden die
Mückenlarven
mit handelsüblchem
Zierfischstrockenfutter (z.B. Vita
®) gefüttert. Nach
4–5 Tagen
ist das Puppenstadium erreicht. Diese werden, mit einer geringen
Menge Wasser, zum Schlupf der Mücken,
in 10 Liter Kunststoffeimer überführt. Die
daraus schlüpfenden
Mücken
können
dann für
Prüfungen
oder für
die Weiterzucht abgefangen werden. 8.
Effizienzvergleich Aerosol gegenüber
erfindungsgemäßen Papierträger 8.1
Materialien
| Testinsektizide: | 1.
Aedes aegypti, Stamm BioGenius 04 anfällig, 3 Tage alt, unterschiedliches
Geschlecht
2. Culex quinquefasciatus, Stamm BioGenius 05, anfällig, 3
Tage alt, unterschiedliches Geschlecht |
8.1
Ausstattung
| Drahtkörbe: | ∅ 8
cm, Höhe
4,5 cm |
| Plastikbecher: | ∅ 9,5
cm, Höhe
4,5 cm |
| Tupfer: | Cellulose |
| Zuckerwasser: | 10%
Kristallzucker (Pfeiffer & Langen)
in Leitungswasser |
8.2
Umgebungsbedingungen
| Temperatur: | 21°C |
| Relative
Feuchtigkeit: | 40–56% |
| Licht: | elektrische
Beleuchtungen |
8.3
Mittel zur Bekämpfung
| Transfluthrin | 0.5/0.25/0.1/0.05/0.025/0.01
Wirkstoff/m3 |
-
8.4 Durchführung
-
In
Testkammern aus Glas mit Stahlböden
der Größe (innere
Abmessungen) 0,84 m × 0.87
m × 1.37 m
(= 1 m3 Kapazität) werden drei Körbe (Länge 8,5
cm, Durchmesser 8 cm), die jeweils 20 Testinsekten enthalten (Alter:
3 bis 4 Tage), in den oberen Drittel der Kammer positioniert.
-
Eine
bestimmte menge des aktiven Wirkstoffs wird in 2 cm3 Aceton
gelöst
und auf den Boden der Kammer gesprüht.
-
Es
wird die Zeit bestimmt, in welcher 10%, 50% und 95% der Insekten
getötet
werden (KT 10, KT 50 und KT 95). Die Testinsekten blieben für 60 Minuten
in den Kammern. Dann wurde die abschließende Anzahl an getöteten Insekten
bestimmt. Alle Insekten werden aus den Behältern entfernt und in einen
von Insektizid freien transparenten Plastikbehälter überführt. Die Becher werden mit
perforierten Deckeln verschlossen und mit Cellu losetupfer, welche
in 10%iger Zuckerlösung
getränkt
wurden, versehen. Nachdem die Insekten für 24 Stunden in dieser von
Insektizid freien Atmosphäre
aufbewahrt wurden, wird die Mortalität bestimmt.
-
8.5
Ergebnisse Aerosol-Effizienz
in 1 m
3 Kammern gegenüber Gelbfieber auslösenden Moskitos
Aedes aegypti, Stamm BioGenius 04, sensibel
-
Aerosol-Effizienz
in 1 m
3 Kammern gegenüber Gelbfieber auslösenden Moskitos
Culex quinquefasciatus Stamm BioGenius 05, sensibel
-
Aus
einem vergleich wird ersichtlich, dass im Allgemeinen 0,1 mg/m3 Transfluthrin für eine Aerosol-Anwendung erforderlich
ist, während
mit den erfindungsgemäßen Vorrichtungen
bereits eine Wirksamkeit bei 0,03 mg/km3 vorliegt.