CN1349498A - 含有链烯基和炔基的金属蛋白酶抑制剂 - Google Patents
含有链烯基和炔基的金属蛋白酶抑制剂 Download PDFInfo
- Publication number
- CN1349498A CN1349498A CN00806919A CN00806919A CN1349498A CN 1349498 A CN1349498 A CN 1349498A CN 00806919 A CN00806919 A CN 00806919A CN 00806919 A CN00806919 A CN 00806919A CN 1349498 A CN1349498 A CN 1349498A
- Authority
- CN
- China
- Prior art keywords
- amino
- alkyl
- group
- heteroaryl
- aryl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 125000000304 alkynyl group Chemical group 0.000 title claims description 124
- 239000003475 metalloproteinase inhibitor Substances 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 313
- 150000003839 salts Chemical class 0.000 claims abstract description 51
- 230000000694 effects Effects 0.000 claims abstract description 38
- 150000002148 esters Chemical class 0.000 claims abstract description 33
- 150000001408 amides Chemical class 0.000 claims abstract description 23
- 230000003287 optical effect Effects 0.000 claims abstract description 11
- 150000003949 imides Chemical class 0.000 claims abstract description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 6
- 125000000217 alkyl group Chemical group 0.000 claims description 341
- 125000003118 aryl group Chemical group 0.000 claims description 179
- 229910052739 hydrogen Inorganic materials 0.000 claims description 176
- 239000001257 hydrogen Substances 0.000 claims description 175
- 125000001072 heteroaryl group Chemical group 0.000 claims description 168
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 156
- 125000004415 heterocyclylalkyl group Chemical group 0.000 claims description 149
- 150000002431 hydrogen Chemical class 0.000 claims description 143
- 125000002521 alkyl halide group Chemical group 0.000 claims description 126
- 125000003342 alkenyl group Chemical group 0.000 claims description 125
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 116
- -1 4-benzenesulfonyl Chemical group 0.000 claims description 78
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 78
- 229910052736 halogen Inorganic materials 0.000 claims description 75
- 150000002367 halogens Chemical class 0.000 claims description 75
- 125000004429 atom Chemical group 0.000 claims description 74
- 125000003545 alkoxy group Chemical group 0.000 claims description 73
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 73
- 201000010099 disease Diseases 0.000 claims description 72
- 125000000623 heterocyclic group Chemical group 0.000 claims description 51
- 238000011282 treatment Methods 0.000 claims description 51
- 230000007062 hydrolysis Effects 0.000 claims description 40
- 238000006460 hydrolysis reaction Methods 0.000 claims description 40
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 34
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 27
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 23
- 102000035195 Peptidases Human genes 0.000 claims description 21
- 108091005804 Peptidases Proteins 0.000 claims description 21
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 19
- 125000004104 aryloxy group Chemical group 0.000 claims description 18
- 229910052751 metal Inorganic materials 0.000 claims description 18
- 239000002184 metal Substances 0.000 claims description 18
- 201000008482 osteoarthritis Diseases 0.000 claims description 18
- 230000002265 prevention Effects 0.000 claims description 17
- 125000003368 amide group Chemical group 0.000 claims description 16
- 239000003814 drug Substances 0.000 claims description 16
- 229910052760 oxygen Inorganic materials 0.000 claims description 14
- 235000019833 protease Nutrition 0.000 claims description 14
- 206010028980 Neoplasm Diseases 0.000 claims description 13
- 239000003937 drug carrier Substances 0.000 claims description 13
- 239000001301 oxygen Substances 0.000 claims description 13
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 12
- 125000005553 heteroaryloxy group Chemical group 0.000 claims description 11
- 125000005842 heteroatom Chemical group 0.000 claims description 11
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 claims description 9
- 201000011510 cancer Diseases 0.000 claims description 9
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 9
- 206010061218 Inflammation Diseases 0.000 claims description 6
- 206010039361 Sacroiliitis Diseases 0.000 claims description 6
- 230000004054 inflammatory process Effects 0.000 claims description 6
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 claims description 5
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 5
- 206010056370 Congestive cardiomyopathy Diseases 0.000 claims description 4
- 201000010046 Dilated cardiomyopathy Diseases 0.000 claims description 4
- 208000019693 Lung disease Diseases 0.000 claims description 4
- 238000002399 angioplasty Methods 0.000 claims description 4
- 208000024693 gingival disease Diseases 0.000 claims description 4
- 125000004475 heteroaralkyl group Chemical group 0.000 claims description 4
- 229910052757 nitrogen Inorganic materials 0.000 claims description 4
- 238000012546 transfer Methods 0.000 claims description 4
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 claims description 3
- 206010007559 Cardiac failure congestive Diseases 0.000 claims description 3
- 206010019280 Heart failures Diseases 0.000 claims description 3
- 230000001684 chronic effect Effects 0.000 claims description 3
- 230000004614 tumor growth Effects 0.000 claims description 3
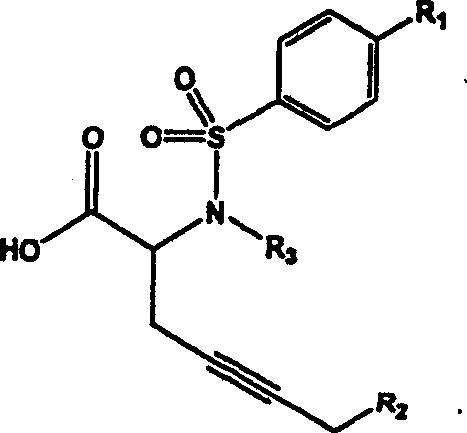
- PNIXVBYHTPBBCQ-UHFFFAOYSA-N 2-amino-5-phenyl-2-(4-phenyldiazenylphenyl)sulfonylpent-3-ynoic acid Chemical compound C=1C=C(N=NC=2C=CC=CC=2)C=CC=1S(=O)(=O)C(N)(C(O)=O)C#CCC1=CC=CC=C1 PNIXVBYHTPBBCQ-UHFFFAOYSA-N 0.000 claims description 2
- 206010003497 Asphyxia Diseases 0.000 claims description 2
- 201000001320 Atherosclerosis Diseases 0.000 claims description 2
- 206010063837 Reperfusion injury Diseases 0.000 claims description 2
- 208000007474 aortic aneurysm Diseases 0.000 claims description 2
- 230000000414 obstructive effect Effects 0.000 claims description 2
- 208000037803 restenosis Diseases 0.000 claims description 2
- 208000024172 Cardiovascular disease Diseases 0.000 claims 2
- 125000003277 amino group Chemical group 0.000 claims 2
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims 2
- 238000000034 method Methods 0.000 abstract description 47
- 102000005741 Metalloproteases Human genes 0.000 abstract description 42
- 108010006035 Metalloproteases Proteins 0.000 abstract description 42
- 239000003112 inhibitor Substances 0.000 abstract description 38
- 102000004190 Enzymes Human genes 0.000 abstract description 15
- 108090000790 Enzymes Proteins 0.000 abstract description 15
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 371
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 219
- 239000000203 mixture Substances 0.000 description 153
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 146
- 235000019439 ethyl acetate Nutrition 0.000 description 124
- 238000002360 preparation method Methods 0.000 description 102
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 102
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 95
- 239000007787 solid Substances 0.000 description 95
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 84
- 229960001866 silicon dioxide Drugs 0.000 description 79
- 239000000741 silica gel Substances 0.000 description 78
- 229910002027 silica gel Inorganic materials 0.000 description 78
- 239000002253 acid Substances 0.000 description 77
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 75
- 239000002994 raw material Substances 0.000 description 70
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 63
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 52
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 51
- 238000005406 washing Methods 0.000 description 51
- 239000012043 crude product Substances 0.000 description 47
- 239000000243 solution Substances 0.000 description 43
- 239000012044 organic layer Substances 0.000 description 41
- 150000004702 methyl esters Chemical class 0.000 description 40
- 238000001704 evaporation Methods 0.000 description 39
- 230000008020 evaporation Effects 0.000 description 37
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 36
- 239000003921 oil Substances 0.000 description 36
- 235000019198 oils Nutrition 0.000 description 36
- 239000000047 product Substances 0.000 description 35
- FDDDEECHVMSUSB-UHFFFAOYSA-N sulfanilamide Chemical compound NC1=CC=C(S(N)(=O)=O)C=C1 FDDDEECHVMSUSB-UHFFFAOYSA-N 0.000 description 34
- 229940124530 sulfonamide Drugs 0.000 description 34
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 33
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 32
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 32
- 229910052799 carbon Inorganic materials 0.000 description 32
- 239000002585 base Substances 0.000 description 29
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 26
- 238000001953 recrystallisation Methods 0.000 description 25
- 239000000463 material Substances 0.000 description 24
- 239000002904 solvent Substances 0.000 description 24
- 210000001519 tissue Anatomy 0.000 description 23
- 239000003795 chemical substances by application Substances 0.000 description 22
- 238000007127 saponification reaction Methods 0.000 description 22
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 22
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 21
- 150000001721 carbon Chemical group 0.000 description 21
- 238000003756 stirring Methods 0.000 description 21
- 238000006243 chemical reaction Methods 0.000 description 20
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 17
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 17
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 16
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 16
- 238000012545 processing Methods 0.000 description 16
- 235000017550 sodium carbonate Nutrition 0.000 description 16
- 229910000029 sodium carbonate Inorganic materials 0.000 description 16
- XBXCNNQPRYLIDE-UHFFFAOYSA-N tert-butylcarbamic acid Chemical compound CC(C)(C)NC(O)=O XBXCNNQPRYLIDE-UHFFFAOYSA-N 0.000 description 16
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 16
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 15
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 15
- 239000000376 reactant Substances 0.000 description 15
- 235000017557 sodium bicarbonate Nutrition 0.000 description 15
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 15
- 230000000699 topical effect Effects 0.000 description 15
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 14
- 229940088598 enzyme Drugs 0.000 description 14
- 230000004044 response Effects 0.000 description 14
- 230000032050 esterification Effects 0.000 description 13
- 238000005886 esterification reaction Methods 0.000 description 13
- 241000124008 Mammalia Species 0.000 description 12
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 12
- 238000010168 coupling process Methods 0.000 description 12
- 238000010790 dilution Methods 0.000 description 12
- 239000012895 dilution Substances 0.000 description 12
- 239000000284 extract Substances 0.000 description 12
- 239000011541 reaction mixture Substances 0.000 description 12
- 230000002829 reductive effect Effects 0.000 description 12
- 239000003826 tablet Substances 0.000 description 12
- 150000001412 amines Chemical class 0.000 description 11
- 238000000605 extraction Methods 0.000 description 11
- 235000015110 jellies Nutrition 0.000 description 11
- 239000010410 layer Substances 0.000 description 11
- 239000011734 sodium Substances 0.000 description 11
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 10
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 10
- 230000008878 coupling Effects 0.000 description 10
- 238000005859 coupling reaction Methods 0.000 description 10
- 239000008274 jelly Substances 0.000 description 10
- 210000003491 skin Anatomy 0.000 description 10
- 235000014347 soups Nutrition 0.000 description 10
- CKDWPUIZGOQOOM-UHFFFAOYSA-N Carbamyl chloride Chemical compound NC(Cl)=O CKDWPUIZGOQOOM-UHFFFAOYSA-N 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 150000007513 acids Chemical class 0.000 description 9
- 150000001336 alkenes Chemical class 0.000 description 9
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 9
- 239000000460 chlorine Substances 0.000 description 9
- 239000004567 concrete Substances 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 239000003480 eluent Substances 0.000 description 9
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 9
- 239000000843 powder Substances 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- YSUQLAYJZDEMOT-UHFFFAOYSA-N 2-(butoxymethyl)oxirane Chemical group CCCCOCC1CO1 YSUQLAYJZDEMOT-UHFFFAOYSA-N 0.000 description 8
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 8
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 8
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 8
- 150000001345 alkine derivatives Chemical class 0.000 description 8
- 239000002775 capsule Substances 0.000 description 8
- 239000004202 carbamide Substances 0.000 description 8
- 239000013078 crystal Substances 0.000 description 8
- 238000003810 ethyl acetate extraction Methods 0.000 description 8
- 230000003203 everyday effect Effects 0.000 description 8
- 238000002390 rotary evaporation Methods 0.000 description 8
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 8
- 239000003643 water by type Substances 0.000 description 8
- NEAQRZUHTPSBBM-UHFFFAOYSA-N 2-hydroxy-3,3-dimethyl-7-nitro-4h-isoquinolin-1-one Chemical compound C1=C([N+]([O-])=O)C=C2C(=O)N(O)C(C)(C)CC2=C1 NEAQRZUHTPSBBM-UHFFFAOYSA-N 0.000 description 7
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 7
- 125000002252 acyl group Chemical group 0.000 description 7
- OSVHLUXLWQLPIY-KBAYOESNSA-N butyl 2-[(6aR,9R,10aR)-1-hydroxy-9-(hydroxymethyl)-6,6-dimethyl-6a,7,8,9,10,10a-hexahydrobenzo[c]chromen-3-yl]-2-methylpropanoate Chemical compound C(CCC)OC(C(C)(C)C1=CC(=C2[C@H]3[C@H](C(OC2=C1)(C)C)CC[C@H](C3)CO)O)=O OSVHLUXLWQLPIY-KBAYOESNSA-N 0.000 description 7
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 229960001701 chloroform Drugs 0.000 description 7
- 230000006378 damage Effects 0.000 description 7
- 235000011187 glycerol Nutrition 0.000 description 7
- 150000002430 hydrocarbons Chemical group 0.000 description 7
- 230000005764 inhibitory process Effects 0.000 description 7
- 238000000746 purification Methods 0.000 description 7
- 238000010898 silica gel chromatography Methods 0.000 description 7
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 7
- 239000000375 suspending agent Substances 0.000 description 7
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 6
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 6
- 239000004278 EU approved seasoning Substances 0.000 description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- 229920002472 Starch Polymers 0.000 description 6
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 6
- 229930006000 Sucrose Natural products 0.000 description 6
- 229960001413 acetanilide Drugs 0.000 description 6
- 230000037396 body weight Effects 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 125000004093 cyano group Chemical group *C#N 0.000 description 6
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 6
- 235000011194 food seasoning agent Nutrition 0.000 description 6
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 6
- 239000012266 salt solution Substances 0.000 description 6
- 229960002920 sorbitol Drugs 0.000 description 6
- 235000019698 starch Nutrition 0.000 description 6
- 239000008107 starch Substances 0.000 description 6
- 229960004793 sucrose Drugs 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 102000029816 Collagenase Human genes 0.000 description 5
- 108060005980 Collagenase Proteins 0.000 description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 5
- 229930195725 Mannitol Natural products 0.000 description 5
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 5
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 5
- 229930040373 Paraformaldehyde Natural products 0.000 description 5
- 150000001413 amino acids Chemical class 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- 229960002424 collagenase Drugs 0.000 description 5
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 239000003995 emulsifying agent Substances 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 125000000524 functional group Chemical group 0.000 description 5
- 238000010438 heat treatment Methods 0.000 description 5
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000000594 mannitol Substances 0.000 description 5
- 235000010355 mannitol Nutrition 0.000 description 5
- 229920002866 paraformaldehyde Polymers 0.000 description 5
- 238000010992 reflux Methods 0.000 description 5
- 239000000600 sorbitol Substances 0.000 description 5
- 239000005720 sucrose Substances 0.000 description 5
- WLWNRAWQDZRXMB-YLFCFFPRSA-N (2r,3r,4r,5s)-n,3,4,5-tetrahydroxy-1-(4-phenoxyphenyl)sulfonylpiperidine-2-carboxamide Chemical compound ONC(=O)[C@H]1[C@@H](O)[C@H](O)[C@@H](O)CN1S(=O)(=O)C(C=C1)=CC=C1OC1=CC=CC=C1 WLWNRAWQDZRXMB-YLFCFFPRSA-N 0.000 description 4
- YFLKVSOKVKZERQ-UHFFFAOYSA-N 4-acetyl-4-aminocyclohexa-1,5-diene-1-sulfonyl chloride Chemical compound CC(=O)C1(N)CC=C(S(Cl)(=O)=O)C=C1 YFLKVSOKVKZERQ-UHFFFAOYSA-N 0.000 description 4
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- YXHKONLOYHBTNS-UHFFFAOYSA-N Diazomethane Chemical compound C=[N+]=[N-] YXHKONLOYHBTNS-UHFFFAOYSA-N 0.000 description 4
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 4
- 108010010803 Gelatin Proteins 0.000 description 4
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical group NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- 239000003810 Jones reagent Substances 0.000 description 4
- 102000000422 Matrix Metalloproteinase 3 Human genes 0.000 description 4
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 4
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 4
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 4
- 208000025865 Ulcer Diseases 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 4
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 210000004087 cornea Anatomy 0.000 description 4
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 4
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 4
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 125000001153 fluoro group Chemical group F* 0.000 description 4
- 229920000159 gelatin Polymers 0.000 description 4
- 239000008273 gelatin Substances 0.000 description 4
- 235000019322 gelatine Nutrition 0.000 description 4
- 235000011852 gelatine desserts Nutrition 0.000 description 4
- 125000005843 halogen group Chemical group 0.000 description 4
- HGALOWHSZJDJIR-UHFFFAOYSA-N iodobenzene;sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O.IC1=CC=CC=C1 HGALOWHSZJDJIR-UHFFFAOYSA-N 0.000 description 4
- 125000000468 ketone group Chemical group 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 4
- 239000000178 monomer Substances 0.000 description 4
- 239000012434 nucleophilic reagent Substances 0.000 description 4
- 239000002674 ointment Substances 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 231100000241 scar Toxicity 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 238000010561 standard procedure Methods 0.000 description 4
- 108091007196 stromelysin Proteins 0.000 description 4
- 239000011701 zinc Substances 0.000 description 4
- VRPJIFMKZZEXLR-UHFFFAOYSA-N 2-[(2-methylpropan-2-yl)oxycarbonylamino]acetic acid Chemical compound CC(C)(C)OC(=O)NCC(O)=O VRPJIFMKZZEXLR-UHFFFAOYSA-N 0.000 description 3
- YUEREUIIUISPFV-UHFFFAOYSA-N 4-(4-iodophenyl)morpholine Chemical class C1=CC(I)=CC=C1N1CCOCC1 YUEREUIIUISPFV-UHFFFAOYSA-N 0.000 description 3
- KMMHZIBWCXYAAH-UHFFFAOYSA-N 4-bromobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=C(Br)C=C1 KMMHZIBWCXYAAH-UHFFFAOYSA-N 0.000 description 3
- POXFXTSTVWDWIR-UHFFFAOYSA-N 4-iodobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=C(I)C=C1 POXFXTSTVWDWIR-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 3
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 3
- 108010026132 Gelatinases Proteins 0.000 description 3
- 102000013382 Gelatinases Human genes 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 101710172711 Structural protein Proteins 0.000 description 3
- 239000005864 Sulphur Substances 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- MXMOTZIXVICDSD-UHFFFAOYSA-N anisoyl chloride Chemical compound COC1=CC=C(C(Cl)=O)C=C1 MXMOTZIXVICDSD-UHFFFAOYSA-N 0.000 description 3
- 208000006673 asthma Diseases 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 3
- 239000004327 boric acid Substances 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 210000000845 cartilage Anatomy 0.000 description 3
- 238000010523 cascade reaction Methods 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 125000001309 chloro group Chemical group Cl* 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 238000005336 cracking Methods 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 150000002118 epoxides Chemical class 0.000 description 3
- 230000003628 erosive effect Effects 0.000 description 3
- KDKYADYSIPSCCQ-UHFFFAOYSA-N ethyl acetylene Natural products CCC#C KDKYADYSIPSCCQ-UHFFFAOYSA-N 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 235000003599 food sweetener Nutrition 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 230000035876 healing Effects 0.000 description 3
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 230000002045 lasting effect Effects 0.000 description 3
- 235000012204 lemonade/lime carbonate Nutrition 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 230000005499 meniscus Effects 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 230000002969 morbid Effects 0.000 description 3
- 201000006417 multiple sclerosis Diseases 0.000 description 3
- 230000000269 nucleophilic effect Effects 0.000 description 3
- 239000006186 oral dosage form Substances 0.000 description 3
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 3
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 3
- 229960003415 propylparaben Drugs 0.000 description 3
- UORVCLMRJXCDCP-UHFFFAOYSA-N propynoic acid Chemical compound OC(=O)C#C UORVCLMRJXCDCP-UHFFFAOYSA-N 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 230000006103 sulfonylation Effects 0.000 description 3
- 238000005694 sulfonylation reaction Methods 0.000 description 3
- 239000003765 sweetening agent Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- 125000005323 thioketone group Chemical group 0.000 description 3
- 229910052725 zinc Inorganic materials 0.000 description 3
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 2
- MEIRRNXMZYDVDW-MQQKCMAXSA-N (2E,4E)-2,4-hexadien-1-ol Chemical compound C\C=C\C=C\CO MEIRRNXMZYDVDW-MQQKCMAXSA-N 0.000 description 2
- WQADWIOXOXRPLN-UHFFFAOYSA-N 1,3-dithiane Chemical compound C1CSCSC1 WQADWIOXOXRPLN-UHFFFAOYSA-N 0.000 description 2
- UUUHXMGGBIUAPW-UHFFFAOYSA-N 1-[1-[2-[[5-amino-2-[[1-[5-(diaminomethylideneamino)-2-[[1-[3-(1h-indol-3-yl)-2-[(5-oxopyrrolidine-2-carbonyl)amino]propanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-methylpentanoyl]pyrrolidine-2-carbon Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(C(C)CC)NC(=O)C(CCC(N)=O)NC(=O)C1CCCN1C(=O)C(CCCN=C(N)N)NC(=O)C1CCCN1C(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C1CCC(=O)N1 UUUHXMGGBIUAPW-UHFFFAOYSA-N 0.000 description 2
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical compound C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 2
- YZUPZGFPHUVJKC-UHFFFAOYSA-N 1-bromo-2-methoxyethane Chemical compound COCCBr YZUPZGFPHUVJKC-UHFFFAOYSA-N 0.000 description 2
- ZACIRAVARVYABO-UHFFFAOYSA-N 4-(3-iodophenyl)morpholine Chemical compound IC1=CC=CC(N2CCOCC2)=C1 ZACIRAVARVYABO-UHFFFAOYSA-N 0.000 description 2
- DENKGPBHLYFNGK-UHFFFAOYSA-N 4-bromobenzoyl chloride Chemical compound ClC(=O)C1=CC=C(Br)C=C1 DENKGPBHLYFNGK-UHFFFAOYSA-N 0.000 description 2
- RKIDDEGICSMIJA-UHFFFAOYSA-N 4-chlorobenzoyl chloride Chemical compound ClC(=O)C1=CC=C(Cl)C=C1 RKIDDEGICSMIJA-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 102000016284 Aggrecans Human genes 0.000 description 2
- 108010067219 Aggrecans Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 101800001224 Disintegrin Proteins 0.000 description 2
- 102000002322 Egg Proteins Human genes 0.000 description 2
- 108010000912 Egg Proteins Proteins 0.000 description 2
- 206010014989 Epidermolysis bullosa Diseases 0.000 description 2
- 239000001856 Ethyl cellulose Substances 0.000 description 2
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 2
- UEXCJVNBTNXOEH-UHFFFAOYSA-N Ethynylbenzene Chemical group C#CC1=CC=CC=C1 UEXCJVNBTNXOEH-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 229920002907 Guar gum Polymers 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- OWYWGLHRNBIFJP-UHFFFAOYSA-N Ipazine Chemical compound CCN(CC)C1=NC(Cl)=NC(NC(C)C)=N1 OWYWGLHRNBIFJP-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- 102000004270 Peptidyl-Dipeptidase A Human genes 0.000 description 2
- 108090000882 Peptidyl-Dipeptidase A Proteins 0.000 description 2
- 102100038567 Properdin Human genes 0.000 description 2
- 108010005642 Properdin Proteins 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical class [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical class OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 125000004423 acyloxy group Chemical group 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- XXROGKLTLUQVRX-UHFFFAOYSA-N allyl alcohol Chemical compound OCC=C XXROGKLTLUQVRX-UHFFFAOYSA-N 0.000 description 2
- 150000001414 amino alcohols Chemical class 0.000 description 2
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 2
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229960000686 benzalkonium chloride Drugs 0.000 description 2
- 235000019445 benzyl alcohol Nutrition 0.000 description 2
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 2
- 208000002352 blister Diseases 0.000 description 2
- 210000004204 blood vessel Anatomy 0.000 description 2
- WTEOIRVLGSZEPR-UHFFFAOYSA-N boron trifluoride Chemical compound FB(F)F WTEOIRVLGSZEPR-UHFFFAOYSA-N 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 239000007810 chemical reaction solvent Substances 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 235000008504 concentrate Nutrition 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 229960000956 coumarin Drugs 0.000 description 2
- 235000001671 coumarin Nutrition 0.000 description 2
- 239000000287 crude extract Substances 0.000 description 2
- 230000006837 decompression Effects 0.000 description 2
- 230000006866 deterioration Effects 0.000 description 2
- 229940043279 diisopropylamine Drugs 0.000 description 2
- 238000007865 diluting Methods 0.000 description 2
- 239000006196 drop Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 235000019325 ethyl cellulose Nutrition 0.000 description 2
- 229920001249 ethyl cellulose Polymers 0.000 description 2
- 230000003176 fibrotic effect Effects 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 208000007565 gingivitis Diseases 0.000 description 2
- 235000010417 guar gum Nutrition 0.000 description 2
- 239000000665 guar gum Substances 0.000 description 2
- 229960002154 guar gum Drugs 0.000 description 2
- 239000008240 homogeneous mixture Substances 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 239000013067 intermediate product Substances 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 210000003127 knee Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- HSZCZNFXUDYRKD-UHFFFAOYSA-M lithium iodide Chemical compound [Li+].[I-] HSZCZNFXUDYRKD-UHFFFAOYSA-M 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- 208000002780 macular degeneration Diseases 0.000 description 2
- 206010025482 malaise Diseases 0.000 description 2
- OCSMOTCMPXTDND-OUAUKWLOSA-N marimastat Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)[C@H](O)C(=O)NO OCSMOTCMPXTDND-OUAUKWLOSA-N 0.000 description 2
- 229950008959 marimastat Drugs 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 229940121386 matrix metalloproteinase inhibitor Drugs 0.000 description 2
- 239000003771 matrix metalloproteinase inhibitor Substances 0.000 description 2
- 229940041616 menthol Drugs 0.000 description 2
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical class CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- 239000002324 mouth wash Substances 0.000 description 2
- 229940051866 mouthwash Drugs 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000004681 ovum Anatomy 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 208000028169 periodontal disease Diseases 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 235000019419 proteases Nutrition 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 230000000630 rising effect Effects 0.000 description 2
- 210000000582 semen Anatomy 0.000 description 2
- 239000008159 sesame oil Substances 0.000 description 2
- 235000011803 sesame oil Nutrition 0.000 description 2
- 238000007086 side reaction Methods 0.000 description 2
- 210000001626 skin fibroblast Anatomy 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical class [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 2
- PUZPDOWCWNUUKD-UHFFFAOYSA-M sodium fluoride Chemical compound [F-].[Na+] PUZPDOWCWNUUKD-UHFFFAOYSA-M 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- DMPIUZWQZODITO-UHFFFAOYSA-N sulfamoyl iodide Chemical compound NS(I)(=O)=O DMPIUZWQZODITO-UHFFFAOYSA-N 0.000 description 2
- 150000003462 sulfoxides Chemical class 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- AMZJHBQITVMFNI-UHFFFAOYSA-N tert-butyl 1,3-oxazolidine-3-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCOC1 AMZJHBQITVMFNI-UHFFFAOYSA-N 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 2
- 231100000397 ulcer Toxicity 0.000 description 2
- 235000013311 vegetables Nutrition 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- 235000010493 xanthan gum Nutrition 0.000 description 2
- 239000000230 xanthan gum Substances 0.000 description 2
- 229920001285 xanthan gum Polymers 0.000 description 2
- 229940082509 xanthan gum Drugs 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- HBENZIXOGRCSQN-VQWWACLZSA-N (1S,2S,6R,14R,15R,16R)-5-(cyclopropylmethyl)-16-[(2S)-2-hydroxy-3,3-dimethylpentan-2-yl]-15-methoxy-13-oxa-5-azahexacyclo[13.2.2.12,8.01,6.02,14.012,20]icosa-8(20),9,11-trien-11-ol Chemical compound N1([C@@H]2CC=3C4=C(C(=CC=3)O)O[C@H]3[C@@]5(OC)CC[C@@]2([C@@]43CC1)C[C@@H]5[C@](C)(O)C(C)(C)CC)CC1CC1 HBENZIXOGRCSQN-VQWWACLZSA-N 0.000 description 1
- GLGNXYJARSMNGJ-VKTIVEEGSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[(1-ethyl-6-methoxy-2-oxo-4,5-dihydro-3h-1-benzazepin-7-yl)amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound CCN1C(=O)CCCC2=C(OC)C(NC=3N=C(C(=CN=3)Cl)N[C@H]3[C@H]([C@@]4([H])C[C@@]3(C=C4)[H])C(N)=O)=CC=C21 GLGNXYJARSMNGJ-VKTIVEEGSA-N 0.000 description 1
- WUKFVPJVGIPEPL-UHFFFAOYSA-N (2-methoxyphenyl) thiohypobromite Chemical compound COC1=CC=CC=C1SBr WUKFVPJVGIPEPL-UHFFFAOYSA-N 0.000 description 1
- SHAHPWSYJFYMRX-GDLCADMTSA-N (2S)-2-(4-{[(1R,2S)-2-hydroxycyclopentyl]methyl}phenyl)propanoic acid Chemical compound C1=CC([C@@H](C(O)=O)C)=CC=C1C[C@@H]1[C@@H](O)CCC1 SHAHPWSYJFYMRX-GDLCADMTSA-N 0.000 description 1
- URLVCROWVOSNPT-XOTOMLERSA-N (2s)-4-[(13r)-13-hydroxy-13-[(2r,5r)-5-[(2r,5r)-5-[(1r)-1-hydroxyundecyl]oxolan-2-yl]oxolan-2-yl]tridecyl]-2-methyl-2h-furan-5-one Chemical compound O1[C@@H]([C@H](O)CCCCCCCCCC)CC[C@@H]1[C@@H]1O[C@@H]([C@H](O)CCCCCCCCCCCCC=2C(O[C@@H](C)C=2)=O)CC1 URLVCROWVOSNPT-XOTOMLERSA-N 0.000 description 1
- VOAAEKKFGLPLLU-UHFFFAOYSA-N (4-methoxyphenyl)boronic acid Chemical compound COC1=CC=C(B(O)O)C=C1 VOAAEKKFGLPLLU-UHFFFAOYSA-N 0.000 description 1
- XYTFTMCHRJGNSM-UHFFFAOYSA-N (4-phenoxyphenoxy)boronic acid Chemical compound C1=CC(OB(O)O)=CC=C1OC1=CC=CC=C1 XYTFTMCHRJGNSM-UHFFFAOYSA-N 0.000 description 1
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical class C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 1
- VVJZQKRLJJMREA-UHFFFAOYSA-N 1,2,4,5-tetrazine 1,2,4-triazine Chemical compound N1=NC=NN=C1.N1=NC=NC=C1 VVJZQKRLJJMREA-UHFFFAOYSA-N 0.000 description 1
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical class C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 1
- RMJHGWFYNDUDRZ-UHFFFAOYSA-N 1,3-benzodioxol-5-yloxyboronic acid Chemical compound OB(O)OC1=CC=C2OCOC2=C1 RMJHGWFYNDUDRZ-UHFFFAOYSA-N 0.000 description 1
- XPLROCSZTBDCFO-UHFFFAOYSA-N 1,4-dithiane Chemical compound C1CSCCS1.C1CSCCS1 XPLROCSZTBDCFO-UHFFFAOYSA-N 0.000 description 1
- BIAAQBNMRITRDV-UHFFFAOYSA-N 1-(chloromethoxy)-2-methoxyethane Chemical compound COCCOCCl BIAAQBNMRITRDV-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 1
- QSSXJPIWXQTSIX-UHFFFAOYSA-N 1-bromo-2-methylbenzene Chemical compound CC1=CC=CC=C1Br QSSXJPIWXQTSIX-UHFFFAOYSA-N 0.000 description 1
- DQKTZKYEOYBUSN-UHFFFAOYSA-N 1-bromo-4-(2-methoxyethoxy)benzene Chemical compound COCCOC1=CC=C(Br)C=C1 DQKTZKYEOYBUSN-UHFFFAOYSA-N 0.000 description 1
- RHDYQUZYHZWTCI-UHFFFAOYSA-N 1-methoxy-4-phenylbenzene Chemical group C1=CC(OC)=CC=C1C1=CC=CC=C1 RHDYQUZYHZWTCI-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 1
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- BCSHRERPHLTPEE-NRFANRHFSA-N 2-[[5-chloro-2-[[(6s)-6-[4-(2-hydroxyethyl)piperazin-1-yl]-1-methoxy-6,7,8,9-tetrahydro-5h-benzo[7]annulen-2-yl]amino]pyrimidin-4-yl]amino]-n-methylbenzamide Chemical compound CNC(=O)C1=CC=CC=C1NC1=NC(NC=2C(=C3CCC[C@@H](CC3=CC=2)N2CCN(CCO)CC2)OC)=NC=C1Cl BCSHRERPHLTPEE-NRFANRHFSA-N 0.000 description 1
- UHGULLIUJBCTEF-UHFFFAOYSA-N 2-aminobenzothiazole Chemical compound C1=CC=C2SC(N)=NC2=C1 UHGULLIUJBCTEF-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- FFCSRWGYGMRBGD-UHFFFAOYSA-N 3-iodoaniline Chemical compound NC1=CC=CC(I)=C1 FFCSRWGYGMRBGD-UHFFFAOYSA-N 0.000 description 1
- KSZVOXHGCKKOLL-UHFFFAOYSA-N 4-Ethynyltoluene Chemical compound CC1=CC=C(C#C)C=C1 KSZVOXHGCKKOLL-UHFFFAOYSA-N 0.000 description 1
- YGIHPJPEUFRZDN-UHFFFAOYSA-N 4-aminobenzenesulfonamide;aniline Chemical compound NC1=CC=CC=C1.NC1=CC=C(S(N)(=O)=O)C=C1 YGIHPJPEUFRZDN-UHFFFAOYSA-N 0.000 description 1
- VLVCDUSVTXIWGW-UHFFFAOYSA-N 4-iodoaniline Chemical compound NC1=CC=C(I)C=C1 VLVCDUSVTXIWGW-UHFFFAOYSA-N 0.000 description 1
- IWYVYUZADLIDEY-UHFFFAOYSA-N 4-methoxybenzenesulfonic acid Chemical compound COC1=CC=C(S(O)(=O)=O)C=C1 IWYVYUZADLIDEY-UHFFFAOYSA-N 0.000 description 1
- IQOZTIKBIHWYQQ-UHFFFAOYSA-N 4h-1,3-oxazine Chemical compound C1C=COC=N1 IQOZTIKBIHWYQQ-UHFFFAOYSA-N 0.000 description 1
- XAZNOOMRYLFDQO-UHFFFAOYSA-N 4h-3,1-benzoxazine Chemical compound C1=CC=C2COC=NC2=C1 XAZNOOMRYLFDQO-UHFFFAOYSA-N 0.000 description 1
- RAQLHHNBGLJEAK-UHFFFAOYSA-N 5-propyl-2-pyridinecarboxylic acid Chemical compound CCCC1=CC=C(C(O)=O)N=C1 RAQLHHNBGLJEAK-UHFFFAOYSA-N 0.000 description 1
- JNYLMODTPLSLIF-UHFFFAOYSA-N 6-(trifluoromethyl)pyridine-3-carboxylic acid Chemical group OC(=O)C1=CC=C(C(F)(F)F)N=C1 JNYLMODTPLSLIF-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 241000224422 Acanthamoeba Species 0.000 description 1
- 206010048998 Acute phase reaction Diseases 0.000 description 1
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N Adamantane Natural products C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 241000224489 Amoeba Species 0.000 description 1
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 229910015900 BF3 Inorganic materials 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical group C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- WCSSIBGBFATRNI-UHFFFAOYSA-N C1=CC=CC=2C3=CC=CC=C3NC12.N1=CC=CC=C1.O1C=NC2=C1C=CC=C2.S2C=NC1=C2C=CC=C1 Chemical compound C1=CC=CC=2C3=CC=CC=C3NC12.N1=CC=CC=C1.O1C=NC2=C1C=CC=C2.S2C=NC1=C2C=CC=C1 WCSSIBGBFATRNI-UHFFFAOYSA-N 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- 208000009043 Chemical Burns Diseases 0.000 description 1
- 102000003914 Cholinesterases Human genes 0.000 description 1
- 108090000322 Cholinesterases Proteins 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 102000002734 Collagen Type VI Human genes 0.000 description 1
- 108010043741 Collagen Type VI Proteins 0.000 description 1
- 206010010984 Corneal abrasion Diseases 0.000 description 1
- 208000028006 Corneal injury Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 241000271532 Crotalus Species 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 241000790917 Dioxys <bee> Species 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 241001125671 Eretmochelys imbricata Species 0.000 description 1
- 229920003134 Eudragit® polymer Polymers 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108050001049 Extracellular proteins Proteins 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 208000036993 Frustration Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- 206010062717 Increased upper airway secretion Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 206010060820 Joint injury Diseases 0.000 description 1
- 238000006809 Jones oxidation reaction Methods 0.000 description 1
- 208000016593 Knee injury Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 102000000380 Matrix Metalloproteinase 1 Human genes 0.000 description 1
- 108010016113 Matrix Metalloproteinase 1 Proteins 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 102000006386 Myelin Proteins Human genes 0.000 description 1
- 108010083674 Myelin Proteins Proteins 0.000 description 1
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 1
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 1
- AFBPFSWMIHJQDM-UHFFFAOYSA-N N-methylaniline Chemical compound CNC1=CC=CC=C1 AFBPFSWMIHJQDM-UHFFFAOYSA-N 0.000 description 1
- NPUJKEHSCJSDGW-UHFFFAOYSA-N N1=CC=CC2=CC=CC=C12.N1N=CC2=CC=CC=C12.N1=CN=C2N=CNC2=C1 Chemical compound N1=CC=CC2=CC=CC=C12.N1N=CC2=CC=CC=C12.N1=CN=C2N=CNC2=C1 NPUJKEHSCJSDGW-UHFFFAOYSA-N 0.000 description 1
- 102000003729 Neprilysin Human genes 0.000 description 1
- 108090000028 Neprilysin Proteins 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- AIWIIWSGVVFPCD-UHFFFAOYSA-N O1CCCC1.N1CCC1.C1CCO1.N1CC1 Chemical compound O1CCCC1.N1CCC1.C1CCO1.N1CC1 AIWIIWSGVVFPCD-UHFFFAOYSA-N 0.000 description 1
- PLBJUYMKNCQQKL-UHFFFAOYSA-N O1NCC=C1.O1N=CCC1.S1CSCC1.S1SCCC1.O1COCC1 Chemical compound O1NCC=C1.O1N=CCC1.S1CSCC1.S1SCCC1.O1COCC1 PLBJUYMKNCQQKL-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- YTKHATNFOMQGFZ-UHFFFAOYSA-N Obtusilic acid Natural products CC1C(CCC2(C)CCC3(COC(=O)C=C/c4ccc(O)cc4)C(=CCC5C6(C)CCC(O)C(C)(C)C6CCC35C)C12)C(=O)O YTKHATNFOMQGFZ-UHFFFAOYSA-N 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- WYNCHZVNFNFDNH-UHFFFAOYSA-N Oxazolidine Chemical compound C1COCN1 WYNCHZVNFNFDNH-UHFFFAOYSA-N 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000006399 Premature Obstetric Labor Diseases 0.000 description 1
- 206010036600 Premature labour Diseases 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 206010037211 Psychomotor hyperactivity Diseases 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 208000033464 Reiter syndrome Diseases 0.000 description 1
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 1
- 206010038910 Retinitis Diseases 0.000 description 1
- 241000219061 Rheum Species 0.000 description 1
- 206010061494 Rhinovirus infection Diseases 0.000 description 1
- 241000220010 Rhode Species 0.000 description 1
- 206010039705 Scleritis Diseases 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 206010061363 Skeletal injury Diseases 0.000 description 1
- 208000028990 Skin injury Diseases 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 239000004141 Sodium laurylsulphate Substances 0.000 description 1
- 208000002847 Surgical Wound Diseases 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 206010046865 Vaccinia virus infection Diseases 0.000 description 1
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000016383 Zea mays subsp huehuetenangensis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- 244000126002 Ziziphus vulgaris Species 0.000 description 1
- AOWPVIWVMWUSBD-RNFRBKRXSA-N [(3r)-3-hydroxybutyl] (3r)-3-hydroxybutanoate Chemical compound C[C@@H](O)CCOC(=O)C[C@@H](C)O AOWPVIWVMWUSBD-RNFRBKRXSA-N 0.000 description 1
- DPDMMXDBJGCCQC-UHFFFAOYSA-N [Na].[Cl] Chemical compound [Na].[Cl] DPDMMXDBJGCCQC-UHFFFAOYSA-N 0.000 description 1
- AENJTRPJFHRERX-UHFFFAOYSA-N [O].C1=CC=C2SC=NC2=C1 Chemical compound [O].C1=CC=C2SC=NC2=C1 AENJTRPJFHRERX-UHFFFAOYSA-N 0.000 description 1
- ILAQRZBYOROJAI-UHFFFAOYSA-N [O].C1=COC=N1 Chemical compound [O].C1=COC=N1 ILAQRZBYOROJAI-UHFFFAOYSA-N 0.000 description 1
- RHJFWPOOZFAPEB-UHFFFAOYSA-N [O].C1=CSC=N1 Chemical compound [O].C1=CSC=N1 RHJFWPOOZFAPEB-UHFFFAOYSA-N 0.000 description 1
- SXMUSCUQMMSSKP-UHFFFAOYSA-N [O].C=1C=CSC=1 Chemical compound [O].C=1C=CSC=1 SXMUSCUQMMSSKP-UHFFFAOYSA-N 0.000 description 1
- HQHFTCAKZCPJBC-UHFFFAOYSA-N [O].C=1C=NOC=1 Chemical compound [O].C=1C=NOC=1 HQHFTCAKZCPJBC-UHFFFAOYSA-N 0.000 description 1
- UHJXEQCVCQFFLS-UHFFFAOYSA-N [O].N1=C(N=CC=C1)OC1=NC=CN=C1 Chemical compound [O].N1=C(N=CC=C1)OC1=NC=CN=C1 UHJXEQCVCQFFLS-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- QUHYUSAHBDACNG-UHFFFAOYSA-N acerogenin 3 Natural products C1=CC(O)=CC=C1CCCCC(=O)CCC1=CC=C(O)C=C1 QUHYUSAHBDACNG-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 125000004442 acylamino group Chemical group 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 208000011341 adult acute respiratory distress syndrome Diseases 0.000 description 1
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000005257 alkyl acyl group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 230000009285 allergic inflammation Effects 0.000 description 1
- 125000005336 allyloxy group Chemical group 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000002141 anti-parasite Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000003096 antiparasitic agent Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 230000005784 autoimmunity Effects 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 210000002469 basement membrane Anatomy 0.000 description 1
- 229910052728 basic metal Inorganic materials 0.000 description 1
- 150000003818 basic metals Chemical class 0.000 description 1
- XFILPEOLDIKJHX-QYZOEREBSA-N batimastat Chemical compound C([C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)[C@H](CSC=1SC=CC=1)C(=O)NO)C1=CC=CC=C1 XFILPEOLDIKJHX-QYZOEREBSA-N 0.000 description 1
- 229950001858 batimastat Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- RWCCWEUUXYIKHB-UHFFFAOYSA-N benzophenone Chemical compound C=1C=CC=CC=1C(=O)C1=CC=CC=C1 RWCCWEUUXYIKHB-UHFFFAOYSA-N 0.000 description 1
- 239000012965 benzophenone Substances 0.000 description 1
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 1
- 229960003328 benzoyl peroxide Drugs 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- 150000003938 benzyl alcohols Chemical class 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108010051210 beta-Fructofuranosidase Proteins 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- YFNONBGXNFCTMM-UHFFFAOYSA-N butoxybenzene Chemical compound CCCCOC1=CC=CC=C1 YFNONBGXNFCTMM-UHFFFAOYSA-N 0.000 description 1
- KFKQQQMTUPJTIN-UHFFFAOYSA-N butoxybenzene;sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O.CCCCOC1=CC=CC=C1 KFKQQQMTUPJTIN-UHFFFAOYSA-N 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 150000001728 carbonyl compounds Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- QHTOIDKCEPKVCM-ZCFIWIBFSA-N cepham Chemical compound S1CCCN2C(=O)C[C@H]21 QHTOIDKCEPKVCM-ZCFIWIBFSA-N 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000007910 chewable tablet Substances 0.000 description 1
- 229940068682 chewable tablet Drugs 0.000 description 1
- 229940112822 chewing gum Drugs 0.000 description 1
- 235000015218 chewing gum Nutrition 0.000 description 1
- 230000035606 childbirth Effects 0.000 description 1
- DDKMFOUTRRODRE-UHFFFAOYSA-N chloromethanone Chemical compound Cl[C]=O DDKMFOUTRRODRE-UHFFFAOYSA-N 0.000 description 1
- 229940048961 cholinesterase Drugs 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 125000000259 cinnolinyl group Chemical class N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- XKZKQTCECFWKBN-SREVYHEPSA-N cis-4-decenoic acid Chemical compound CCCCC\C=C/CCC(O)=O XKZKQTCECFWKBN-SREVYHEPSA-N 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 229940125758 compound 15 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 210000000795 conjunctiva Anatomy 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- ZKXWKVVCCTZOLD-FDGPNNRMSA-N copper;(z)-4-hydroxypent-3-en-2-one Chemical compound [Cu].C\C(O)=C\C(C)=O.C\C(O)=C\C(C)=O ZKXWKVVCCTZOLD-FDGPNNRMSA-N 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000020335 dealkylation Effects 0.000 description 1
- 238000006900 dealkylation reaction Methods 0.000 description 1
- 238000007872 degassing Methods 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- URLVCROWVOSNPT-QTTMQESMSA-N desacetyluvaricin Natural products O=C1C(CCCCCCCCCCCC[C@@H](O)[C@H]2O[C@@H]([C@@H]3O[C@@H]([C@@H](O)CCCCCCCCCC)CC3)CC2)=C[C@H](C)O1 URLVCROWVOSNPT-QTTMQESMSA-N 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 1
- 235000013681 dietary sucrose Nutrition 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 208000007784 diverticulitis Diseases 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 208000026500 emaciation Diseases 0.000 description 1
- 238000003821 enantio-separation Methods 0.000 description 1
- 150000002085 enols Chemical class 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 235000010944 ethyl methyl cellulose Nutrition 0.000 description 1
- 239000001761 ethyl methyl cellulose Substances 0.000 description 1
- PQVSTLUFSYVLTO-UHFFFAOYSA-N ethyl n-ethoxycarbonylcarbamate Chemical compound CCOC(=O)NC(=O)OCC PQVSTLUFSYVLTO-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- AGMKVZDPATUSMS-UHFFFAOYSA-N ethyl pent-2-enoate Chemical compound CCOC(=O)C=CCC AGMKVZDPATUSMS-UHFFFAOYSA-N 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 210000000887 face Anatomy 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 238000005187 foaming Methods 0.000 description 1
- 239000008369 fruit flavor Substances 0.000 description 1
- 238000007306 functionalization reaction Methods 0.000 description 1
- 150000002240 furans Chemical class 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000003779 hair growth Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 125000004404 heteroalkyl group Chemical group 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000037189 immune system physiology Effects 0.000 description 1
- 238000013198 immunometric assay Methods 0.000 description 1
- 230000002637 immunotoxin Effects 0.000 description 1
- 229940051026 immunotoxin Drugs 0.000 description 1
- 239000002596 immunotoxin Substances 0.000 description 1
- 231100000608 immunotoxin Toxicity 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 235000011073 invertase Nutrition 0.000 description 1
- 210000005067 joint tissue Anatomy 0.000 description 1
- 206010023332 keratitis Diseases 0.000 description 1
- BWHLPLXXIDYSNW-UHFFFAOYSA-N ketorolac tromethamine Chemical compound OCC(N)(CO)CO.OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 BWHLPLXXIDYSNW-UHFFFAOYSA-N 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 229940040692 lithium hydroxide monohydrate Drugs 0.000 description 1
- GLXDVVHUTZTUQK-UHFFFAOYSA-M lithium hydroxide monohydrate Substances [Li+].O.[OH-] GLXDVVHUTZTUQK-UHFFFAOYSA-M 0.000 description 1
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 230000002934 lysing effect Effects 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- PIOZZBNFRIZETM-UHFFFAOYSA-L magnesium;2-carbonoperoxoylbenzoic acid;2-oxidooxycarbonylbenzoate Chemical compound [Mg+2].OOC(=O)C1=CC=CC=C1C([O-])=O.OOC(=O)C1=CC=CC=C1C([O-])=O PIOZZBNFRIZETM-UHFFFAOYSA-L 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 235000009973 maize Nutrition 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- GRVDJDISBSALJP-UHFFFAOYSA-N methyloxidanyl Chemical group [O]C GRVDJDISBSALJP-UHFFFAOYSA-N 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000007932 molded tablet Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229940045641 monobasic sodium phosphate Drugs 0.000 description 1
- 150000002780 morpholines Chemical class 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 210000005012 myelin Anatomy 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- MDWVESJPENAAKU-UHFFFAOYSA-N n-bromothiophene-2-sulfonamide Chemical compound BrNS(=O)(=O)C1=CC=CS1 MDWVESJPENAAKU-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000005186 naphthyloxy group Chemical group C1(=CC=CC2=CC=CC=C12)O* 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 238000005935 nucleophilic addition reaction Methods 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 229940100691 oral capsule Drugs 0.000 description 1
- 239000007935 oral tablet Substances 0.000 description 1
- 229940096978 oral tablet Drugs 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 206010033103 otosclerosis Diseases 0.000 description 1
- 230000016087 ovulation Effects 0.000 description 1
- CFHIDWOYWUOIHU-UHFFFAOYSA-N oxomethyl Chemical compound O=[CH] CFHIDWOYWUOIHU-UHFFFAOYSA-N 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 210000004417 patella Anatomy 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- HHXMXAQDOUCLDN-RXMQYKEDSA-N penem Chemical compound S1C=CN2C(=O)C[C@H]21 HHXMXAQDOUCLDN-RXMQYKEDSA-N 0.000 description 1
- 239000007967 peppermint flavor Substances 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 201000001245 periodontitis Diseases 0.000 description 1
- JOBMECFYTIRZMW-UHFFFAOYSA-N phenyl-(4-phenylphenyl)diazene;sulfuryl dichloride Chemical class ClS(Cl)(=O)=O.C1=CC=CC=C1N=NC1=CC=C(C=2C=CC=CC=2)C=C1 JOBMECFYTIRZMW-UHFFFAOYSA-N 0.000 description 1
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 1
- 208000026435 phlegm Diseases 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- DHRLEVQXOMLTIM-UHFFFAOYSA-N phosphoric acid;trioxomolybdenum Chemical compound O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.OP(O)(O)=O DHRLEVQXOMLTIM-UHFFFAOYSA-N 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical class C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 150000003053 piperidines Chemical class 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 208000026440 premature labor Diseases 0.000 description 1
- 230000001855 preneoplastic effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 201000001474 proteinuria Diseases 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000005554 pyridyloxy group Chemical group 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- OWECKHSCCDVJCN-UHFFFAOYSA-N quinazoline;quinoxaline Chemical compound N1=CN=CC2=CC=CC=C21.N1=CC=NC2=CC=CC=C21 OWECKHSCCDVJCN-UHFFFAOYSA-N 0.000 description 1
- 208000002574 reactive arthritis Diseases 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 208000013223 septicemia Diseases 0.000 description 1
- 239000003352 sequestering agent Substances 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 235000013024 sodium fluoride Nutrition 0.000 description 1
- 239000011775 sodium fluoride Substances 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- PODWXQQNRWNDGD-UHFFFAOYSA-L sodium thiosulfate pentahydrate Chemical compound O.O.O.O.O.[Na+].[Na+].[O-]S([S-])(=O)=O PODWXQQNRWNDGD-UHFFFAOYSA-L 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 235000015096 spirit Nutrition 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical class [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 1
- 150000003527 tetrahydropyrans Chemical class 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- AJSTXXYNEIHPMD-UHFFFAOYSA-N triethyl borate Chemical compound CCOB(OCC)OCC AJSTXXYNEIHPMD-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 239000000439 tumor marker Substances 0.000 description 1
- 238000007514 turning Methods 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 206010055031 vascular neoplasm Diseases 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 230000037303 wrinkles Effects 0.000 description 1
- 125000005023 xylyl group Chemical group 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/32—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/33—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms with substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/337—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/15—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings
- C07C311/21—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings having the nitrogen atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/22—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound oxygen atoms
- C07C311/29—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound oxygen atoms having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/30—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/37—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring
- C07C311/38—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring having sulfur atoms of sulfonamide groups and amino groups bound to carbon atoms of six-membered rings of the same carbon skeleton
- C07C311/39—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring having sulfur atoms of sulfonamide groups and amino groups bound to carbon atoms of six-membered rings of the same carbon skeleton having the nitrogen atom of at least one of the sulfonamide groups bound to hydrogen atoms or to an acyclic carbon atom
- C07C311/42—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring having sulfur atoms of sulfonamide groups and amino groups bound to carbon atoms of six-membered rings of the same carbon skeleton having the nitrogen atom of at least one of the sulfonamide groups bound to hydrogen atoms or to an acyclic carbon atom to an acyclic carbon atom of a hydrocarbon radical substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/30—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/45—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups at least one of the singly-bound nitrogen atoms being part of any of the groups, X being a hetero atom, Y being any atom, e.g. N-acylaminosulfonamides
- C07C311/46—Y being a hydrogen or a carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/30—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/45—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups at least one of the singly-bound nitrogen atoms being part of any of the groups, X being a hetero atom, Y being any atom, e.g. N-acylaminosulfonamides
- C07C311/47—Y being a hetero atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/57—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being further substituted by nitrogen atoms, not being part of nitro or nitroso groups
- C07C323/58—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being further substituted by nitrogen atoms, not being part of nitro or nitroso groups with amino groups bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/64—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and sulfur atoms, not being part of thio groups, bound to the same carbon skeleton
- C07C323/67—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and sulfur atoms, not being part of thio groups, bound to the same carbon skeleton containing sulfur atoms of sulfonamide groups, bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/30—Indoles; Hydrogenated indoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to carbon atoms of the hetero ring
- C07D209/42—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/54—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/55—Acids; Esters
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
- C07D213/82—Amides; Imides in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/06—1,2,4-Oxadiazoles; Hydrogenated 1,2,4-oxadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D285/00—Heterocyclic compounds containing rings having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by groups C07D275/00 - C07D283/00
- C07D285/01—Five-membered rings
- C07D285/02—Thiadiazoles; Hydrogenated thiadiazoles
- C07D285/04—Thiadiazoles; Hydrogenated thiadiazoles not condensed with other rings
- C07D285/08—1,2,4-Thiadiazoles; Hydrogenated 1,2,4-thiadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D285/00—Heterocyclic compounds containing rings having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by groups C07D275/00 - C07D283/00
- C07D285/01—Five-membered rings
- C07D285/02—Thiadiazoles; Hydrogenated thiadiazoles
- C07D285/04—Thiadiazoles; Hydrogenated thiadiazoles not condensed with other rings
- C07D285/12—1,3,4-Thiadiazoles; Hydrogenated 1,3,4-thiadiazoles
- C07D285/125—1,3,4-Thiadiazoles; Hydrogenated 1,3,4-thiadiazoles with oxygen, sulfur or nitrogen atoms, directly attached to ring carbon atoms, the nitrogen atoms not forming part of a nitro radical
- C07D285/135—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/08—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms
- C07D295/084—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms with the ring nitrogen atoms and the oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
- C07D295/088—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms with the ring nitrogen atoms and the oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings to an acyclic saturated chain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/14—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D295/145—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals with the ring nitrogen atoms and the carbon atoms with three bonds to hetero atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/185—Radicals derived from carboxylic acids from aliphatic carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/192—Radicals derived from carboxylic acids from aromatic carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/195—Radicals derived from nitrogen analogues of carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/22—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with hetero atoms directly attached to ring nitrogen atoms
- C07D295/26—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/34—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D307/38—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D307/54—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/34—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D307/56—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D307/68—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D317/00—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D317/08—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3
- C07D317/44—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D317/46—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D317/48—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/06—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to the ring carbon atoms
- C07D333/24—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/26—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D333/30—Hetero atoms other than halogen
- C07D333/34—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Rheumatology (AREA)
- Epidemiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Pain & Pain Management (AREA)
- Vascular Medicine (AREA)
- Ophthalmology & Optometry (AREA)
- Dermatology (AREA)
- Urology & Nephrology (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Furan Compounds (AREA)
- Pyridine Compounds (AREA)
- Pyrrole Compounds (AREA)
- Indole Compounds (AREA)
- Thiazole And Isothizaole Compounds (AREA)
- Nitrogen- Or Sulfur-Containing Heterocyclic Ring Compounds With Rings Of Six Or More Members (AREA)
Abstract
本发明公开了作为金属蛋白酶抑制剂的化合物,它可有效治疗以这些酶活性过量为特征的病况。具体地说,化合物具有式(I)结构,其中X,W,Z,A,G,R1,R2,R3,R4,R5,R5′和k具有说明书中描述的意义。本发明还包括所述化合物的光学异构体、非对映体和对映体及其药学上可接受的盐、生物可水解的酰胺、酯和酰亚胺。本发明还描述了含有这些化合物的药物组合物,用该化合物或药物组合物治疗或预防与金属蛋白酶有关的疾病的方法。
Description
技术领域
本发明涉及用于治疗与金属蛋白酶活性、尤其是含锌金属蛋白酶活性有关的疾病的化合物。本发明还涉及包含该化合物的药物组合物,用该化合物或药物组合物治疗金属蛋白酶有关疾病的方法。
背景
有许多结构上相关的金属蛋白酶会破坏结构蛋白。这些金属蛋白酶通常作用于胞间基质,因此它们涉及组织的破坏和重建。这些蛋白称为金属蛋白酶或MP。
本领域中已公开了几个通过序列同源性分类的不同的MP家族。这些MP包括基质-金属蛋白酶[MMP]、含锌金属蛋白酶、多种膜结合金属蛋白酶、TNF转化酶、血管紧张肽转化酶(ACE)、裂解素(disintegrin)(包括ADAM(见Wolfsberg等,131 J.Cell.Bio.275-78,1995年10月))和脑啡肽酶。MP的例子包括人皮肤成纤维细胞胶原酶、人皮肤成纤维细胞明胶酶、人痰胶原酶、聚集蛋白聚糖酶(aggrecanse)和明胶酶、人溶基质素。胶原酶、溶基质素、聚集蛋白聚糖酶和相关的酶在介导多种疾病症状中被认为是重要的。
在文献中已经讨论了MP抑制剂的潜在治疗适应征。例如参见美国专利5,506,242(Ciba Geigy Corp.);美国专利5,403,952(Merck&Co.);PCT公开的申请WO96/06074(British Bio Tech Ltd);WO 96/00214(Ciba Geigy);WO95/35275(British BioTech Ltd);WO95/35276(British Bio Tech Ltd);WO95/33731(Hoffman-LaRoche);WO95/33709(Hoffman-LaRoche);WO95/32944 (British Bio Tech Ltd);WO95/26989(Merck);WO 9529892(DuPont Merck);WO 95/24921(Inst.Opthamology);WO95/23790(Smith Kline Beecham);WO 95/22966(Sanofi Winthrop);WO95/19965(Glycomed);WO 95 19956(British Bio Tech Ltd);WO 95/19957(British BioTech Ltd);WO 95/19961(British Bio Tech Ltd);WO 95/13289(Chiroscience Ltd.);WO95/12603(Syntex);WO 95/09633(Florida State Univ);WO 95/09620(Florida State Univ.);WO 95/04033(Celltech);WO 94/25434(Celltech);WO 94/25435(Celltech);WO93/14112(Merck);WO 94/0019(Glaxo);WO 93/21942(Britich Bio Tech Ltd);WO92/22523(Res.Corp.Tech.Inc.);WO 94/10990(Britich Bio Tech Ltd);WO93/09090(Yamanouchi)和英国专利GB 2282598(Merck)和GB 2268934(Britich Bio TechLtd);公开的欧洲专利申请EP 95/684240(Hoffman LaRoche);EP 574758(HoffmanLaRoche);EP 575844(Hoffman LaRoche);公开的日本专利申请JP 08053403(FujusowaPharm.Co.Ltd.);JP 7304770 (Kanebo Ltd.);和Bird等,J.Med.Chem 37卷,158-69页(1994)。
MP抑制剂的潜在治疗用途的例子包括:类风湿性关节炎(D.E.Mullins等,Biochim Biophys Acta(1983)695:117-214);骨关节炎(Henderson,B.等,Drugs of theFuture(1990)15:495-508);癌症(Yu,A.E.等人,《基质金属蛋白酶-定向癌治疗的新靶标》,Drugs & Aging,11(3)卷,229-244页(1997年9月);Chamber,A.E和Matrisian,L.M.,《综述:改变基质金属蛋白酶在病灶转移中作用的看法》,J.of the Nat'l CancerInst.,89(17)卷,1260-1270(1997年9月),Bramhall,S.R.《胰癌中的基质金属蛋白酶及其抑制剂》,Internat'l J.of Pancreatology,第4卷,1101-1109页(1998年5月),Nemunaitis,J.等人,《基质金属蛋白酶抑制剂Marimastat对于进展的癌中血清肿瘤标记的影响的组合分析研究:长期研究的生物活性和耐受性剂量选择》,Clin.Cancer Res.卷4,1101-1109页(1998年5月),和Rasmussen,H.S.和McCann,P.P.《作为新的抗癌策略的基质金属蛋白酶抑制剂:特别侧重于Batimastat和Marimastat的综述》,Pharmacol.Ther,卷75(1),69-75页(1997);肿瘤细胞转移(同上,Broadhurst,M.J.等,欧洲专利申请276,436(1987年公布),Reich,R.等,48 Cancer Res 3307-3312(1988));多发性硬化(Gijbels等人,J.Clin.Invest.,卷94,2177-2182页(1994))和各种组织溃烂或溃疡性疾病。例如,由于碱烧伤或绿脓杆菌(Pseudomonas aeruginosa)、棘变形虫属寄生虫(Acanthamoeba)、单纯疱疹和牛痘病毒感染,角膜中会导致溃疡性疾病。以不合需要的金属蛋白酶活性为特征的疾病的其它例子包括牙周病、大疱性表皮松解、发热、炎症和巩膜炎(Cf.DeCicco等,WO 95 29892,1995年11月9日公布)。
鉴于这种金属蛋白酶参与许多病症,已经有制备这些酶的抑制剂的各种尝试。许多种此类抑制剂公开在文献中。例子包括美国专利No.5,183,900(1993年2月2日授予Galary);美国专利No.4,996,358(1991年2月26日授予Handa等);美国专利No.4,771,038(1988年9月13日授予Wolanin等);美国专利No.4,743,587(1988年5月10日授予Dickens等);1993年12月29日公布的Broadhurst等的欧洲专利申请No.575,844;1993年5月13日公布的Isomura等的国际专利申请WO93/09090;1992年10月15日公布的Markwell等的国际专利申请WO 92/17460和1992年8月12日公布的Beckett等的欧洲专利申请No.498,665。
在治疗与不希望的金属蛋白酶活性有关的疾病中,抑制这些金属蛋白酶是有益处的。虽然已制得各种抑制剂,但仍需要用于治疗此类与金属蛋白酶活性有关的疾病的基质金属蛋白酶的强效抑制剂。
发明概述
(A)X选自-OH和-NHOH;
(B)W选自-S-,-O-,-N(R33),-C(R33)=C(R33′)-,-N=C(R33)-和-N=N-,其中R33和R33'是各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(C)R1是-(CR6R6′)l-R34,其中l为0-4;R6和R6′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R34选自氢、羟基、烷氧基、烷基、链烯基、炔基、杂烷基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(D)R2是-(CR7R7′)m-R35,其中m为0-4;R7和R7'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R35选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;
(E)R3是-(CR8R8′)n-R9,其中n为0-4;R8和R8′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R9选自氢、羟基、烷氧基、烷基、链烯基、炔基、芳氧基、杂烷基、杂芳氧基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(F)R4是-(CR10R10')z-A'-(CR10″R10)o-R11,其中A'选自共价键、-O-、-S-和SO2;z为0-4;o为0-4;R10、R10'、R10″和R10各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R11选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(G)R5和R5′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;k为0-4;
(1)R13和R13'各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基和杂芳基或
(2)R13和R13'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(I)G选自
(1)氢;
(2)-(CR14R14′)p-R15,其中p为0-4;R14和R14'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R15选自氢、烷基、芳基、杂芳基、环烷基、杂环烷基、芳烷基和杂芳烷基;
(3)-(CR16R16)q-Y-(CR17R17′)r-R18,其中q为1-4;r为0-4;R16,R16',R17和R17′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;Y选自-O-和-S-;R18选自氢、羟基、烷氧基、烷基、杂烷基、卤烷基、环烷基、杂环烷基、芳基和杂芳基;条件是当r=0时,R18不是羟基或烷氧基;
(4)-CONR37R37',其中(a)R37和R37'各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或(b)R37和R37′和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;和
(5)-(CR19R19′)s-NR20R20′,其中s为1-4;R19和R19'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R20和R20′各自独立选自:
(a)氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;
(b)-C(O)R21,其中R21选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R21和R20和它们连接的酰胺基团一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(c)-SO2-(CR22R22′)t-R23,其中t为0-4;R22和R22'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R23选自烷基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R23和R20和它们连接的氨磺酰基团一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(d)-C(O)NR24R24',其中(i)R24和R24′各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R24和R24'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(e)-C(O)OR25,其中R25选自烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或
(f)R20和R20'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;和
(J)Z选自
(1)环烷基和杂环烷基;
(2)-D-(CR26R26')uR27,其中
(a)u为0-4;
(b)D选自-C≡C-,-CH=CH-,-N=N-,-O-,-S-和-SO2-;
(c)R26和R26'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;和
(d)R27选自芳基、杂芳基、烷基、链烯基、炔基、杂烷基、卤烷基、杂环烷基、环烷基,如果D是-C≡C-或-CH=CH-,那么R27也可选自
-CONR28R28′,其中(i)R28和R28′各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R28和R28′和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(3)-NR29R29′,其中
(a)R29和R29'各自独立选自氢;烷基;链烯基;炔基;杂烷基;卤烷基;芳基;杂芳基;环烷基;杂烷基;和C(O)-Q-(CR30R30′)vR31,其中v是0-4,Q选自共价键和-NR32-,R30和R30'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R31和R32(i)各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基,或(ii)R31和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或R29和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或
(a)E和J独立选自-CH-和-N-;
(b)L选自-S-,-O-,-N(R38)-,-C(R38)=(R38')-,-N=C(R38)-和-N=N-,其中R38和R38′各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(c)w是0-4;
(d)R36和R36′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;
(e)M选自共价键、-O-、-SOx-、-C(O)-、-C(O)NR39-、-NR39-、和-NR39C(O)-;其中x为0-2;R39选自氢、烷基、链烯基、炔基、芳基、杂芳基、杂烷基、杂芳基、环烷基、杂环烷基和卤烷基;和
(f)T是-(CR40R40′)yR41,其中y为0-4;R40和R40′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基、烷氧基和芳氧基;和R41选自氢、烷基、链烯基、炔基、卤素、杂烷基、卤烷基、芳基、杂芳基、环烷基、杂环烷基;或R39和R41与它们连接的原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或R38和R41与它们连接的原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
或式(I)的光学异构体、非对映体或对映体,或其药学上可接受的盐、可生物水解的酰胺、酯或酰亚胺。
本发明还包括上式的光学异构体、非对映体和对映体,其药学上可接受的盐、可生物水解的酰胺、酯或酰亚胺。
本发明化合物可用来治疗以不合需要的金属蛋白酶活性为特征的疾病和情况。因此,本发明还提供了包含这些化合物的药物组合物。本发明还进一步提供了治疗与金属蛋白酶有关的疾病的方法。
发明详述
I.术语和定义:
下面是本文所用术语的定义的清单。
“酰基”或“羰基”是指能过除去羧酸中的羟基形成的基团(即,R-C(=O)-)。较佳的酰基例如包括乙酰基、甲酰基和丙酰基。
“烷基”是有1-15个碳原子的饱和烃链基团,较佳地有1-10个碳原子,更佳地有1-4个碳原子。“烯基”是有至少一个(较佳的仅有一个)碳碳双键且有2-15个碳原子的烃链,它较佳地有2-10个碳原子,更佳地有2-4个碳原子。“炔”是有至少一个(较佳的仅有一个)碳碳三键且有2-15个碳原子的烃链,它较佳地有2-10个碳原子,更佳地有2-4个碳原子。烷基、烯和炔链(统称为“烃链”)可以是直链或支链,可以是取代或未取代。较佳的支链烷基、烯和炔链有一个或两个支链,较佳的有一个支链。较佳的链是烷基。烷基、烯和炔烃链各自可被1-4个取代基取代或没有取代;当有取代时,较佳的链被单、双或三取代。烷基、烯和炔链可以各自被卤素、羟基、芳氧基(如苯氧基)、杂芳氧基、酰氧基(如乙酰氧基)、羧基、芳基(如苯基)、杂芳基、环烷基、杂环烷基、螺环、氨基、酰胺基、酰基氨基、酮基、硫酮基、氰基或其任何组合取代。较佳的烃链基团包括甲基、乙基、丙基、异丙基、丁基、乙烯基、烯丙基、丁烯基和外亚甲基(exomethylenyl)。
同样,如本文所述的,“低级”烷基、烯或炔部分(如“低级烷基”)是有1-6个碳原子(较佳的有1-4个碳原子)的链(在烷基情况下),以及有2-6个、较佳2-4个碳原子的链(在烯和炔情况下)。
“烷氧基”是有烃链取代基、且其中烃链是烷基或链烯基的氧基(即,-O-烷基或-O-链烯基)。较佳的烷氧基包括(例如)甲氧基、乙氧基、丙氧基和烯丙氧基。
“芳基”是芳族烃环。芳环是单环或稠合的双环系统。单环芳环的环中含有6个碳原子。单环芳环也称为苯环。双环芳环在环中含有8-17个碳原子,较佳的有9-12个碳原子。双环芳环包括这样的环系统,其中一个环是芳基,另一个环是芳基、环烷基或杂环烷基。较佳的双环芳环包含5元、6元或7元环与5元、6元或7元环稠合。芳环可以未取代或在环上被1-4个取代基取代。芳基可被卤素、氰基、硝基、羟基、羧基、氨基、酰氨基、烷基、杂烷基、卤烷基、苯基、芳氧基、烷氧基、杂烷氧基、氨基甲酰基、卤烷基、亚甲基二氧基、杂芳氧基或其任何组合取代。较佳的芳环包括萘基、甲苯基、二甲苯基和苯基。最佳的芳环基团是苯基。
“芳氧基”是有芳基取代基的氧基(即-O-芳基)。较佳的芳氧基包括(例如)苯氧基、萘氧基、甲氧基苯氧基和亚甲基二氧基苯氧基。
“环烷基”是饱和或不饱和的碳环。环烷基环不是芳族的。环烷基环是单环,或是稠合的、螺接或桥接双环系统。单环环烷基中有大约3-9个碳原子,较佳的有3-7个碳原子。双环环烷基中有7-17个碳原子,较佳的有7-12个碳原子。较佳的双环环烷基包含与5元、6元或7元环稠合的4元、5元、6元或7元环。环烷基环可以未取代,或在环上被1-4个取代基取代。环烷基可被卤素、氰基、烷基、杂烷基、卤烷基、苯基、酮基、羟基、羧基、氨基、酰氨基、芳氧基、杂芳氧基或其任何组合取代。较佳的环烷基环包括环丙基、环戊基和环己基。
“卤代”或“卤素”指氯、溴、氟或碘。较佳的卤代是氟代、氯代和溴代;更佳的通常是氯代和氟代,尤其是氟代。
“卤烷基”是被一个或多个卤代取代基取代的直链、支链或环状烃。较佳的是C1-C12卤烷基;更佳的是C1-C6卤烷基;还要佳的是C1-C3卤烷基。较佳的卤素取代基是氟代和氯代。最佳的卤烷基是三氟甲基。
“杂原子”是氮、硫或氧原子。含有一个以上杂原子的基团可以含有不同的杂原子。
“杂烷基”是含有碳和至少一个杂原子的饱和或不饱和的链,其中没有两个杂原子是毗邻的。杂烷基链中有2-15个组成原子(碳和杂原子),较佳的有2-10个,更佳的有2-5个组成原子。例如,烷氧基(即,-O-烷基或-O-杂烷基)包括在杂烷基内。杂烷基链可以是直链或支链。较佳的支链杂烷基有1或2个支链,较佳的有一个支链。较佳的杂烷基是饱和的。不饱和的杂烷基有一个或多个碳碳双键和/或一个或多个碳碳三键。较佳的不饱和杂烷基具有一个或两个双键或一个三键,更佳的有一个双键。杂烷基链可被1-4个取代基取代或没有取代。较佳的取代的杂烷基可以是单、二或三取代的。杂烷基可被低级烷基、卤烷基、卤素、羟基、芳氧基、杂芳氧基、酰氧基、羧基、单环芳基、杂芳基、环烷基、杂环烷基、螺环、氨基、酰氨基、酰胺基、酮基、硫酮基、氰基或其任何组合取代。
“杂芳基”是环中含有碳原子和1-6个杂原子的芳族环。杂芳环是单环或稠合的双环系统。单环杂芳环中有大约5-9个组成原子(碳和杂原子),较佳的有5或6个组成原子。双环杂芳环中有8-17个组成原子,较佳有8-12个组成原子。双环杂芳环包括环系统,其中一个环是杂芳基,另一个环是芳基、杂芳基、环烷基或杂环烷基。较佳的双环杂芳环系统包含与5元、6元或7元环稠合的5元、6元或7元环。杂芳环可以没有取代,或在环上被1-4个取代基取代。杂芳基可被卤素、氰基、硝基、羟基、羧基、氨基、酰胺基、烷基、杂烷基、卤烷基、苯基、烷氧基、芳氧基、杂芳氧基、或其任何组合取代。较佳的杂芳环包括但不局限于下列:
呋喃 噻吩 吡咯 吡唑 咪唑 噁唑 异噁唑
异噻唑 噻唑 1,2,5-噻二唑 1,2,3-三唑 1,3,4噻二唑 呋咱
1,2,3-噻二唑 1,2,4-噻二唑 苯并三唑 1,2,4-三唑 四唑
1,2,4-噁二唑 1,3,4-噁二唑 1,2,3,4-噁三唑 1,2,3,4-噻三唑 1,2,3,5-噻三唑
1,2,3,5-噁三唑 1,2,3-三嗪 1,2,4-三嗪 1,2,4,5-四嗪 二苯并呋喃
吡啶 哒嗪 嘧啶 吡嗪 1,3,5-三嗪 中氮茚 吲哚 异吲哚 苯并呋喃 苯并噻吩 1H-吲唑 嘌呤 喹啉
苯并咪唑 苯并噻唑 苯并噁唑 喋啶 咔唑 异喹啉 噌啉 酞嗪 喹唑啉 喹喔啉 1,8-萘吡啶
吖啶 吩嗪
“杂芳氧基”是有一个杂芳基取代基的氧基(即-O-杂芳基)。较佳的杂芳氧基包括(例如)吡啶氧基、呋喃氧基、(噻吩)氧基、(噁唑)氧基、(噻唑)氧基、(异噁唑)氧基、嘧啶氧基、吡嗪氧基和苯并噻唑氧基。
“杂环烷基”是环中有碳原子和1-4个(较佳1-3个)杂原子的饱和或不饱和的环。杂环烷基环不是芳族的。杂环烷基环是单环,或是稠合的、桥接的或螺接的双环系统。单环杂环烷基含有3-9个组成原子(碳和杂原子),较佳的有5-7个组成原子。双环杂环烷基中有7-17个组成原子,较佳的有7-12个组成原子。双环杂环烷基含有7-17个环原子,较佳的有7-12个环原子。双环杂环烷基可以是稠合的、螺接的或桥接的环系统。较佳的双环杂环烷基包含与5元、6元或7元环稠合的5元、6元或7元环。杂环烷基环可以没有取代,或在环上被1-4个取代基取代。杂环烷基可被卤素、氰基、羟基、羧基、酮基、硫酮基、氨基、酰氨基、酰基、酰胺基、烷基、杂烷基、卤烷基、苯基、烷氧基、芳氧基、或其任何组合取代。杂环烷基上较佳的取代基包括卤素和卤烷基。较佳的杂环烷基环包括但不局限于下列:
环氧乙烷 氮丙啶 氧杂环丁烷 吖丁啶 四氢呋喃 吡咯烷 3H-吲哚
1,3-二氧戊环 1,2-二硫戊环 1,3-二硫戊环 4,5-二氢异噁唑 2,3-二氢异噁唑
4,5-二氢吡唑 咪唑烷 二氢吲哚 2H-吡咯 吩噁嗪 4H-喹嗪
吡唑烷 2H-吡喃 3,4-二氢-2H-吡喃 四氢吡喃 2H-色烯
色酮 苯并二氢吡喃 哌啶 吗啉 4H-1,3-噁嗪 6H-1,3-噁嗪
5,6-二氢-4H-1,3-噁嗪 4H-3,1-苯并噁嗪 吩噻嗪 1,3-二噁烷
Cepham 哌嗪 六氢氮杂环庚稀 1,3-二噻烷 1,4-二噁烷 Penem
香豆素 硫代吗啉 尿嘧啶 胸腺嘧啶 胞嘧啶 硫杂环戊烷(thiolane)
2,3-二氢-1H-异吲哚 phthalan 1,4-二硫杂环己烷 1,4-二硫杂环己烷 六氢-哌嗪1,3-二氢异苯并呋喃
1,2-苯并异噻唑啉 苯磺内酰胺
本文所用的术语“哺乳动物金属蛋白酶”指在本申请“背景”部分中公开的蛋白酶。本发明的化合物宜对“哺乳动物金属蛋白酶”有活性作用,包括在动物(较佳是哺乳动物)来源发现的、能在合适的测定条件下催化胶原、明胶或蛋白聚糖降解的任何含有金属(较佳的是含有锌)的酶。合适的测定条件例如可在美国专利No.4,743,587中找到,该文参考了Cawston等在Anal.Biochem.(1979)99:340-345中的步骤,并采用了Weingarten,H.等在Biochem.Biophy.Res.Comm.(1984)139:1184-1187中描述的合成底物。另见,Knight,C.G.等人,"一种用于连续灵敏测定基质金属蛋白酶的新的香豆素标记的肽",FEBS Letters,296卷,263-266页(1992)。当然,可以用分析这些结构蛋白降解的任何标准方法。更佳的本发明化合物是对这样的金属蛋白酶有活性,该酶是含锌的蛋白酶,其结构与例如人溶基质素或皮肤成纤维细胞胶原酶相似。当然,候选化合物抑制金属蛋白酶活性的能力可在上述测定中进行测试。可采用分离的金属蛋白酶或是含有一定范围的能分解组织的酶的粗提物来确认本发明化合物所具有的抑制活性。
“螺环”是指烷基或杂烷基的烷基或杂烷基双基取代基,其中所述双基取代基是孪位连接的,其中所述双基取代基形成了一个环,所述环有4-8个组成原子(碳原子或杂原子),较佳的有5或6个组成原子。
尽管如上所述,烷基、杂烷基、环烷基和杂环烷基可被羟基、氨基和酰胺基取代,本发明没有预想到下列这些:
1.烯醇(OH与携带双键的碳相连)。
2.氨基与携带双键的碳相连(除插烯的酰胺类外)。
3.多个羟基、氨基或酰胺基与单个碳相连(除了两个氮原子与一个碳相连且所有三个原子均是杂环烷基环中的组成原子外)。
4.羟基、氨基或酰胺基与另有一个杂原子与其相连的碳相连。
5.羟基、氨基、或酰胺基与另有一个卤原子与其相连的碳相连。
“药学上可接受的盐”是在任何酸性基团(如异羟肟酸或羧酸)上形成的阳离子盐,或是在任何碱性基团(如氨基)上形成的阴离子盐。这些盐有许多是本领域已知的,如在国际专利出版物87/05297(Johnston等,1987年9月11日公开)所述的那些,该文纳入本文作参考。较佳的阳离子盐包括碱金属(如钠和钾)和碱土金属(如镁和钙)的盐以及有机盐。较佳的阴离子盐包括卤化物(如氯化物)、磺酸盐、羧酸盐、磷酸盐等。
这些盐是本领域技术人员所熟知的,本领域技术人员能根据本领域的知识制得任何种盐。另外,本领域技术人员也能认识到,出于溶解度、稳定性、便于配制等原因,一种盐比其它盐更优先选择。这些盐的测定和优化是本领域技术人员力所能及的。
“可生物水解的酰胺”是含有异羟肟酸(即式(I)中R1是-NHOH)的金属蛋白酶抑制剂的酰胺,它不会干扰化合物的抑制活性,或很容易由动物(较佳为哺乳动物,更佳为人)在体内转化产生有活性的金属蛋白酶抑制剂。这些酰胺衍生物例如是烷氧基酰胺,其中式(I)的异羟肟酸的羟基氢被烷基部分取代,以及酰氧基酰胺,其中羟基氢被酰基部分(即,R-C(=O)-)取代。
“可生物水解的羟基酰亚胺”是含有异羟肟酸的金属蛋白酶抑制剂的酰亚胺,它不会干扰这些化合物的抑制活性,或很容易由动物(较佳为哺乳动物,更佳为人)在体内转化产生有活性的金属蛋白酶抑制剂。这些酰亚胺衍生物例如是式(I)的异羟肟酸的氨基氢被酰基部分(即,R-C(=O)-)取代的酰亚胺衍生物。
“可生物水解的酯”指含有羧酸(即式(I)中R1是-OH)的金属蛋白酶抑制剂的酯,它不会干扰这些化合物的抑制金属蛋白酶的活性,或很容易由动物转化产生有活性的金属蛋白酶抑制剂。这些酯包括低级烷酯,低级酰氧基烷酯(如乙酰氧基甲酯、乙酰氧基乙酯、氨基羰基氧甲酯、新戊酰氧甲酯和新戊酰氧乙酯)、内酯(如苯并呋喃酮酯和硫代苯并呋喃酮酯)、低级烷氧基酰氧基烷酯(如甲氧基羰基氧甲酯、乙氧基羰基氧乙酯和异丙氧基羰基氧乙酯)、烷氧基烷酯、胆碱酯和烷基酰基氨基烷酯(如乙酰氨基甲酯)。
“溶剂化物”是溶质(如金属蛋白酶抑制剂)和溶剂(如水)组合形成的配合物。参见J.Honig等,The Van Nostrand Chemist’s Dictionary,p.650(1953)。本发明采用的药学上可接受的溶剂包括不干扰金属蛋白酶抑制剂的生物活性的那些溶剂(例如,水、乙醇、乙酸、N,N-二甲基甲酰胺以及该领域技术人员所知的或容易确定的其它溶剂)。
术语“光学异构体”、“立体异构体”、“非对映体”具有标准技术所认同的意义(Cf.,Hawley’s Condensed Chemical Dictionar,第11版)。对本发明化合物的具体保护方式和其它衍生物的描述没有限制。采用其它适用的保护基团、盐形式等是本领域技术人员力所能及的。
II.化合物
X选自-OH和-NHOH。
W选自-S-,-O-,-N(R33)-,-C(R33)=C(R33′)-,-N=C(R33)-和-N=N-;在较佳的实施方案中,W是-S-或-C(R33)=C(R33')-。R33和R33′各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;较佳的是,R33和R33'中的至少一个是氢,更佳的是两个都是氢。
R1是-(CR6R6')l-R34。l为0-4,较佳的为0或1,更佳的为0。R6和R6'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,R6或R6'中的至少一个是氢,更佳的是R6和R6′都是氢。R34选自氢、羟基、烷氧基、烷基、链烯基、炔基、杂烷基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;较佳的是,R34为氢、烷基、芳基、杂芳基或杂环烷基,更佳的是氢。
R2是-(CR7R7')m-R35。m为0-4,较佳的m是0。R7和R7'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,R7或R7'中的至少一个是氢,更佳的是R7和R7′都是氢。R35选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;R35较佳为氢或烷基,更佳为氢。
R3是-(CR8R8')n-R9。n为0-4,较佳为0或1。R8和R8'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,R8或R8'中的至少一个是氢,更佳的是R8和R8'都是氢。R9选自氢、羟基、烷氧基、烷基、链烯基、炔基、芳氧基、杂烷基、杂芳氧基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;R9较佳为氢、羟基、烷氧基、烷基、芳氧基或芳基。
R4是-(CR10R10′)z-A'-(CR10″R10)o-R11。z为0-4。A'选自共价键、-O-、-S-和SO2;o为0-4,较佳为0。R10、R10'、R10″和R10各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基。R11选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;R11较佳为氢或低级烷基。
R5和R5'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,R5或R5'中的至少一个是氢,更佳的是R5和R5′都是氢。
k为0-4;k较佳为0或1,更佳为0。
A选自含有顺式双键的部分,含有反式双键的部分,或含有三键的部分,如下所述:和-C≡C-
R12和R12'各自独立选自氢、烷基、链烯基、炔基、卤烷基、芳基、杂烷基、杂芳基、杂环烷基、环烷基、卤素和-CONR13R13′;较佳的是,其中R12和R12'都是氢或低级烷基。R13和R13′各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基和杂芳基;较佳的为氢、低级烷基或芳基。或者,R13和R13'和与它们连接的氮原子一起连接形成含有5-8个(较佳5或6个)环原子、其中有1-3个(较佳为1或2个)为杂原子的任选取代的杂环。
G选自氢;-(CR14R14')p-R15;-(CR16R16′)q-Y-(CR17R17′)r-R18;-CONR37R37′;和-(CR19R19′)s-NR20R20′。
当G是-(CR14R14')p-R15时,p为0-4,较佳为0-2。R14和R14'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,每个R14为氢,每个R14′独立为氢或低级烷基。R15选自氢、烷基、芳基、杂芳基、环烷基、杂环烷基、芳烷基和杂芳烷基,较佳为烷基、芳基、杂芳基、环烷基、杂环烷基、芳基烷基和杂芳基烷基。
当G是-(CR16R16′)q-Y-(CR17R17′)r-R18时,q为1-4,较佳为1-2,更佳为1。r为0-4,较佳为0或1。R16,R16',R17和R17'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,R16,R16',R17和R17'都是氢或低级烷基。Y选自-O-和-S-。R18选自氢、羟基、烷氧基、烷基、杂烷基、卤烷基、环烷基、杂环烷基、芳基和杂芳基;条件是当r=0时,R18不是羟基或烷氧基;
当G是-CONR37R37′时,R37和R37′各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;较佳为氢、烷基、杂烷基、芳基或杂芳基。或者,R37和R37'和与它们连接的氮原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个杂原子(较佳为1或2个)的任选取代的杂环。在一个特别佳的实施方案中,R37和R37'连接形成一个环。
当G是-(CR19R19′)s-NR20R20′时,s为1-4,较佳为1或2。R19和R19'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,每个R19是氢,每个R19'独立为氢或低级烷基。R20和R20'各自独立选自:
(a)氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;较佳为烷基或芳基;
(b)-C(O)R21,其中R21选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;较佳为低级烷基、芳基或杂芳基。或者,R21和R20和与它们连接的酰胺基团一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环;
(c)-SO2-(CR22R22')t-R23,其中t为0-4,较佳为0。R22和R22'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳为氢或低级烷基。R23选自烷基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;较佳的是,R23是低级烷基、芳基或杂芳基。或R23和R20和与它们连接的氨磺酰基团一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环;
(d)-C(O)NR24R24',其中R24和R24各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;较佳为氢或低级烷基。或者,R24和R24'和与它们连接的氮原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环;
(e)-C(O)OR25,其中R25选自烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;较佳为烷基、芳基或杂芳基。
或者,R20和R20'和与它们连接的氮原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环。
Z选自环烷基和杂环烷基;-D-(CR26R26′)uR27;-NR29R29′;和
其中当Z是环烷基或杂环烷基时,较佳的是Z是任选取代的哌啶或哌嗪。
当Z是-D-(CR26R26')uR27时,u为0-4,较佳为0或1。D选自-C≡C-,-CH=CH-,-N=N-,-O-,-S-和-SO2-。较佳的是,D是-C≡C-,-CH=CH-,-N=N-,-O-或-S-;更佳的是-C≡C-,-CH=CH-或-N=N-。R26和R26'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,每个R26是氢,每个R26′独立为氢或低级烷基。R27选自芳基、杂芳基、烷基、链烯基、炔基、杂烷基、卤烷基、杂环烷基、环烷基;较佳的是,R27是芳基、杂芳基、杂环烷基或环烷基。然而,如果D是-C≡C-或-CH=CH-,那么R27也可选自-CONR28R28′,其中(i)R28和R28′各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R28和R28′和与它们连接的氮原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环;
当Z是-NR29R29′时,R29和R29'各自独立选自氢;烷基;链烯基;炔基;杂烷基;卤烷基;芳基;杂芳基;环烷基;杂烷基;和C(O)-Q-(CR30R30′)vR31;较佳的是,R29和R29′均为氢、烷基或芳基。当R29和/或R29'为C(O)-Q-(CR30R30′)vR31时,v是0-4,较佳为0或1。Q选自共价键和-NR32-,较佳为共价键。R30和R30′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,每个R30是氢,每个R30′独立为氢或低级烷基。R31和R32(i)各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基,或(ii)R31和R32和与它们连接的氮原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环;较佳的是,R31是烷基、芳基、杂芳基、环烷基或杂环烷基。或者,R29和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个杂原子的任选取代的杂环。
或者,R29和R29'和与它们连接的氮原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)为杂原子的任选取代的杂环。
当Z是
(本文称为式(A))时,E和J独立选自-CH-和-N-;较佳的是E是-CH,J是-CH。L选自-S-,-O-,-N(R38)-,-C(R38)=(R38′)-,-N=C(R38)-和-N=N-;较佳的L是-N=C(R38)-或-C(R38)=(R38′)-。R38和R38′各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;较佳是氢或低级烷基。w是0-4,较佳为0或1。R36和R36′各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;较佳的是,每个R36是氢,每个R36′独立为氢或低级烷基。M选自共价键、-O-、-SOx-、-C(O)-、-C(O)NR39-、-NR39-和-NR39C(O)-;较佳的M为-O-、-S-、-SO2-、-C(O)NR39-、-NR39-和-NR39C(O)-;更佳的M为-O-。x为0-2。R39选自氢、烷基、链烯基、炔基、芳基、杂芳基、杂烷基、杂芳基、环烷基、杂环烷基和卤烷基;较佳的R39为低级烷基或芳基。T是-(CR40R40')yR41。y为0-4,较佳为0或1。R40和R40'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基、烷氧基和芳氧基;较佳的是,每个R40是氢,每个R40′独立为氢或低级烷基。R41选自氢、烷基、链烯基、炔基、卤素、杂烷基、卤烷基、芳基、杂芳基、环烷基、杂环烷基;较佳的是,R41是低级烷基或芳基。或者,R39和R41与它们连接的原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)杂原子的任选取代的杂环。或者,R38和R41与它们连接的原子一起连接形成含有5-8个(较佳为5或6个)环原子、其中有1-3个(较佳的为1或2个)杂原子的任选取代的杂环。
III.化合物制备:
本发明的化合物可用各种步骤制得。
用于制备本发明化合物的原料是已知的,可用已知的方法制得,或可购得。在下文的通用反应方案中描述了特别佳的合成方法。(用来描述反应方案的R基团不必与描述式I化合物各个方面的各R基团有关。即,例如,式(I)中的R1不必在这里表示成与R1相同。)制备本发明化合物的具体实施例在下文第VIII部分中有所描述。
方案1
在方案1中,所示作为原料的乙酸酯S1a可从市售原料制得,并可如TetrahedronLett.1994,35(22),3669中所述那样转变成各种链烯基和炔基-甲基衍生物(如S1b)。然后,这些烯和炔可用本领域技术人员已知的允许对这些基团进行操作的任何方法作进一步官能团化。一个较佳的方法包括曼尼希型方法,以提供S1c型氨基甲基化合物。
另一个较佳的方法包括,但不局限于,本领域技术人员熟知的金属催化的偶联反应,该反应提供了范围广泛的官能团(S1d),包括芳族和杂芳族环,以及含有烯烃的取代基。
所选烯或炔中所含的氨基官能团可以去保护,然后用本领域技术人员熟知的方法来乙酰化。该方法可用来获得范围广泛的官能团,包括但不局限于,酰胺、脲、氨基甲酸酯或磺酰胺,如方案1中所示的S1e。如果需要,这些酰基型衍生物可用熟知的方法再次作进一步官能化。
如果需要,S1e型化合物中的酯官能团可以进行酯交换、皂化成酸、或用碱性羟胺处理,以得到异羟肟酸。
所示作为原料的环氧化物S2a可以两种对映体形式从商业来源获得,R2是各种可除去的保护基团。该环氧化物被炔基锂亲核试剂亲核开环是众所周知的,它产生了S2c型化合物。其它许多烷基、链烯基、芳基和杂芳基阴离子亲核试剂以及含有杂原子亲核试剂的基团以类似方式打开环氧化物也是众所周知的,任何这些均可用来对系统作类似的衍生处理。
用氨基取代S2c中的羟基可根据许多熟知的方法来实现,其中包括用邻苯二甲酰亚胺进行Mitsunobu转变,得到S2d,然后用肼分解,得到游离的胺S2e。
然后可这样得到本发明的化合物:首先使游离的胺磺酰化,然后对所得磺酰胺进行进一步操作,得到更复杂的形式S2f。最后,除去R2保护基团,通过任何熟知的氧化性方法(包括Jones氧化),将所得伯醇转变成所选羧酸衍生物,得到S2g。
方案3
Q=O,S或H2
X=卤素,OR或H
由氨基酸缩合物S3a产生的阴离子与各种亲核试剂(如S3b)的亲核加成是以不对称方式产生S3d型氨基酸的熟知方法(《光学活性氨基酸的合成》,Robert M.Williams;Pergamon Press,New York,1989)。然后,这些可根据已知的方法官能化,如上所述所述那样向前进行,产生各种在本发明范围内的化合物。
可根据已知方法将烯丙醇的酯与Boc-甘氨酸相偶连,得到S4c型酯。当在某些双配位螯合剂(如Zn++)存在下用两个当量的强碱处理时,这些分子经历Claisen重排,得到S4d型氨基酸,然后,该氨基酸可根据已知方法官能化,然后向前进行反应以产生各种在本发明范围内的化合物(Synlett,1996,975)。
利用上述方案的指导可以类似方式产生各种化合物。
认识到在形成磺内酰胺酯期间宜对任何反应性官能团(如羧基、羟基等)采用保护基团。这是标准的技术,是本领域普通技术人员众所周知的。
在上述方案中,当R是烷氧基或烷硫基时,可用标准的脱烷基化步骤从最终化合物衍生获得对应的羟基或硫醇化合物(Bhatt等人,"醚的断裂",Synthesis,1983,249-281页)。
这些步骤可加以改变,以提高所需产物的得率。本领域技术人员会认识到,适当地选择反应物、溶剂和温度是任何成功的合成的重要部分。最优条件等的确定是常规的。因此,本领域技术人员能利用上述方案的指导来制备各种化合物。
可以认识到,有机化学领域的技术人员无需进一步指导就能容易地实施有机化合物的标准操作;即,这样的操作是本领域技术人员完全能够实现的。这些操作包括(但不局限于):羰基化合物还原成其相应的醇、羟基等的氧化、酰基化、芳族取代(亲电和亲核)、醚化、酯化和皂化等。这些操作的例子在标准书本,例如March,AdvancedOrganic Chemistry(Wiley),Carey和Sunberg,Advanced Organic Chemistry(第2卷)以及本领域技术人员知晓的其它技术中有所描述。
本领域技术人员也容易理解,某些反应最好是在分子中其它有潜在反应性的官能团被屏蔽或保护下进行,从而避免任何不希望的副反应和/或提高反应得率。本领域技术人员常用保护基团来提高得率或避免不希望的反应。这些反应可在文献中找到,并且也是本领域技术人员所熟知的。这些操作中有许多例子可以在例如T. Greene,Protecting Groups in Organic Synthesis中找到。当然,用有反应性侧链的氨基酸作为原料时最好进行保护,以防止不必要的副反应。
本发明的化合物可以有一个或多个手性中心。因此,可以选择性地通过例如手性起始材料、催化剂或溶剂来制得一种光学异构体(包括非对映体和对映体),或者可以一次性制得两个立体异构体或两个光学异构体(包括非对映体和对映体)(外消旋混合物)。由于本发明的化合物可以外消旋混合物形式存在,因此光学异构体(包括非对映体和对映体)或立体异构体的混合物可用已知的方法(如手性盐、手性色谱法等)分离获得。
另外,应当理解,一种光学异构体(包括非对映体和对映体)或立体异构体可能比另一种具有更佳的性质。因此,在公开和要求本发明时,当揭示一种外消旋混合物时,同时也就明确地认为揭示和要求了基本上不含另一种异构体的两种光学异构体(包括非对映体和对映体)或立体异构体。
使用方法
机体中发现的金属蛋白酶(MP)部分通过裂解细胞外基质(包括细胞外蛋白质和糖蛋白)而起作用。金属蛋白酶抑制剂在治疗至少部分由此类蛋白质和糖蛋白的裂解所引起的疾病上是有用的。这些蛋白质和糖蛋白在维持机体组织的体积、形状、结构和稳定性上起着重要作用。因此,MP与组织重建密切相关。
作为这种活性的结果,MP被认为在很多疾病中有活性,这些疾病涉及:(1)组织的损坏,包括眼部疾病;退行性疾病,如关节炎、多发性硬化等;体内组织的转移或迁移;或(2)组织的重建,包括心脏疾病、纤维化疾病、瘢痕形成、良性增生等。
本发明的化合物预防或治疗以MP的不希望或升高的活性为特征的失调、疾病和/或不希望出现的状态。例如,这些化合物可用来抑制MP,该蛋白酶
1.损坏结构蛋白(即维持组织稳定性和结构的蛋白);
2.干扰细胞间/细胞内信号传导,包括涉及细胞因子上调的信号传导,和/或细胞因子加工和/或炎症、组织退化和其它疾病(Mohler KM,等人.,Nature 370(1994)218-220,Gearing AJH,等人,Nature 370(1994)555-557,McGeehan GM,等人,Nature370(1994)558-561〕;和
3.促进受治疗者不希望有的过程,例如精子成熟、卵受精等过程。
本文所用的“MP相关的失调”或“MP相关的疾病”是在疾病或失调的生物学表现中、导致疾病的生物学级联反应中、或作为一种疾病症状涉及的不希望出现的或升高的MP活性的疾病。MP的“涉及”包括:
1.不希望出现的或升高的MP活性作为疾病或生物学表现的“原因”,无论该活性的升高是由于遗传、感染、自身免疫、外伤、生物力学的原因、生活方式(如肥胖)还是其它一些原因所致;
2.MP作为疾病或失调的可观察的表现的一部分,即,依据升高的MP活性或从临床角度来看,疾病或失调是可测量的,不希望出现的或升高的MP水平表明有病。但MP无须是疾病或失调的“标志”;
3.不希望出现的或升高的MP活性是导致疾病或失调或与其有关的生化或细胞级联反应的一部分。在这方面,MP活性的抑制阻断级联反应,从而控制了疾病。
术语“治疗”在本文中用来指,给予本发明化合物至少缓和了哺乳动物对象(较佳的是人)中与不希望的或升高的MP活性有关的疾病。因此,术语“治疗”包括:预防哺乳动物发生MP介导的疾病,尤其当哺乳动物有获得该疾病的倾向但还未诊断出患该疾病时;抑制MP介导的疾病;和/或缓解或逆转MP介导的疾病。由于本发明方法涉及预防与不合需要的MP活性有关的疾病状态,因此可以理解,术语“预防”无需完全阻碍该疾病状态。(见Webster’s Ninth Collegiate Dictionary)。相反,如本文所用的,术语“预防”指技术人员能鉴定出一个群体有患MP相关疾病的倾向,从而可在疾病发生前给予本发明的化合物。该术语并未暗示可完全避免疾病状态。例如,骨关节炎(OA)是最常见的类风湿性疾病,在80%的55岁以上人中可用放射方法检测到有一些关节发生改变。Fife,R.S.,“骨关节炎的短暂历史”,《骨关节炎:诊断和医学/外科处理》,R.W.Moskowitz,D.S.Howell,V.M.Goldberg和H.J.Mankin编,11-14页(1992)。增加OA发病率的一个常见的危险因素是关节的创伤性受损。在膝盖受伤后用外科方法除去半月板增加了患放射可检测OA的危险性,且该危险性随着时间而增加。Roos,H等人,"切除半月板后的膝盖骨关节炎:与匹配的对照相比,21年后射线变化的发病率"Arthritis Rheum.,41卷,687-693页;Roos,H等人,"前部十字韧带或半月板受伤后膝盖的骨关节炎:时间和年龄的影响"Osteoarthritis Cartilege.,卷3,261-267页(1995)。因此,此类患者群是可以鉴定的,可在疾病进展之前给予本发明的化合物。因此,将能“预防”这些个体中骨关节炎的进展。
有利的是,很多MP不是平均分布于全身的。因此,各种组织中表达的MP的分布对这些组织常常是特异性的。例如,关节组织损伤中涉及的金属蛋白酶的分布与见于其它组织中的金属蛋白酶的分布不同。因此,以作用于身体受影响组织或区域的特异性MP的化合物来治疗某些疾病、失调和不希望发生的状况较为适宜,尽管对于活性或效能来说不是必须的。例如,对关节(例如软骨细胞)中的MP显示高度亲和力和抑制作用的化合物对于该处所见疾病、失调或不需要出现的情况的治疗比特异性较低的其它化合物为佳。
另外,某些抑制剂对某些组织比对其它组织的生物利用度高。选择对某一组织更具生物利用率且作用于该组织中所见特异性MP的MP抑制剂提供了对失调、疾病或不希望有的情况的特殊治疗。例如,本发明的化合物渗透到中枢神经系统的能力不同。因此,可选择化合物用以产生通过特异地在中枢神经系统外发现的MP来介导的效应。
测定MP抑制剂对特定MP的特异性属于本领域技术人员的技术。在文献中可找到合适的测试条件。具体地说,溶基质素和胶原酶的测定方法是已知的。例如美国专利No.4,743,587介绍了Cawston等人,Anal Biochem(1979)99:340-345的方法。另见,Knight,C.G.等人,"一种用于连续灵敏测定基质金属蛋白酶的新的香豆素标记的肽",FEBS Letters,296卷,263-266页(1992)。Weingarten,H.等人,Biochem Biophy ResComm(1984)139:1184-1187描述了检测中使用合成底物。当然,分析MP降解结构蛋白的任何标准方法均可使用。本发明化合物抑制金属蛋白酶活性的能力当然可以用文献中所见的方法或经改变的方法加以测试。可用分离的金属蛋白酶确证本发明化合物的抑制活性,或可使用含有能裂解组织的一系列酶的粗提物。
本发明化合物还可用于预防或急性治疗。它们可以医学或药理学领域熟练技术人员希望的任何方法给药。熟练技术人员即刻可明了的是,较佳的给药途径取决于受治疗的疾病状态和所选的剂型。较佳的全身给药途径包括口服给药或肠胃外给药。
但是,熟练技术人员会容易理解将MP抑制剂直接给予受影响部位对很多疾病、失调或不希望的病情是有利的。例如,将MP抑制剂直接给予疾病、失调或不希望出现的情况的区域(如外科创伤(如血管成形术)、瘢痕或烧伤(如皮肤局部)或眼部和牙周病适应症的受累区)可能是有益的。
由于骨的重建涉及MP,因此本发明化合物可用来预防假体松脱。本领域众所周知,经历一段时间后,假体松脱,产生疼痛,并可能导致进一步骨损伤,因此需要更换。对这些假体更换的需求包括例如关节更换(如髋、膝和肩更换)、假牙,包括托牙、齿桥和依托于上颌骨和/或下颌骨的假牙。
MP在重建心血管系统(如充血性心力衰竭)上也有作用。有人提出,血管成形术的长期失败率(过一段时间后重新闭合)高于预期值的原因之一是对于被机体识别为的血管基底膜“损伤”产生应答反应,MP活性是不合需要的或引起MP活性升高。因此,在以下适应症中,MP活性的调节可提高任何其它治疗的长期成功率,或其本身可作为一种治疗,这些适应症是例如扩张性心肌病、充血性心力衰竭、动脉粥样硬化、斑块破裂、再灌注损伤、局部缺血、慢性阻塞性肺部疾病、血管成形术再狭窄和主动脉瘤。
在皮肤护理上,皮肤的重建或“更新”涉及到MP。结果,MP的调节改善了皮肤状况的处理,包括(但不限于)皱纹修复、紫外线诱导皮肤损伤的调节、预防和修复。这样的处理包括预防性处理或在生理学表现明显之前的处理。例如,可涂敷MP用作暴露前处理来预防紫外线损伤,和/或作为暴露时或暴露后处理来预防或减小暴露后损伤。另外,与异常更新(包括金属蛋白酶活性)所致的异常组织相关皮肤失调和疾病(如大疱性表皮松解症、牛皮癣、硬皮病和特应性皮炎)涉及到MP。本发明化合物对于治疗皮肤“正常”损伤的后果(包括组织瘢痕或“收缩”,例如烧伤后所见)也是有用的。MP抑制剂在涉及皮肤的预防瘢痕的外科手术和在促进正常组织生长(包括诸如肢体复置术和难治性手术(无论用激光或切开))中也是有用的。
另外,MP与涉及诸如骨等其它组织的不规则重建的疾病,如耳硬化症和/或骨质疏松症,或与特殊器官(如肝硬变和肺纤维化疾病)有关。同样,在诸如多发性硬化症的疾病中,MP可能与血脑屏障和/或神经组织的髓鞘的不规则建造有关。因此,调节MP活性可用作治疗、预防和控制这些疾病的策略。
MP还被认为与很多感染有关,包括巨细胞病毒(CMV);视网膜炎;HIV以及引起的综合征AIDS。
MP还可能与血管过度形成有关(这时周围组织需要破坏而使新血管生成),例如血管纤维瘤和血管瘤。
由于MP破坏细胞外基质,因此考虑到这些酶的抑制剂可用作计划生育剂,例如用来阻止排卵、阻止精子渗入或通过卵子的细胞外环境、阻止受精卵的植入和阻止精子成熟。
而且,它们还被考虑用于预防或终止早产和分娩。
由于MP与炎症反应和细胞因子的加工有关,因此这些化合物还用作抗炎剂,用于以炎症为主的疾病,包括炎性肠道疾病、克罗恩氏病、溃疡性结肠炎、胰腺炎、憩室炎、哮喘或有关的肺部疾病、类风湿性关节炎、痛风和Reiter′s综合征。
当自身免疫引起疾病时,免疫应答常触发MP和细胞因子活性。在治疗这些自身免疫性疾病中,MP的调节是有用的治疗方针。因此,MP抑制剂可用于治疗包括红斑狼疮、关节强硬性脊椎炎和自身免疫性角膜炎等疾病。有时,自身免疫治疗的副作用导致MP介导的其它病症的恶化,此时MP抑制剂治疗也是有效的,例如,在自身免疫治疗诱导的纤维变性中。
另外,其它纤维化疾病也有可能采用这类治疗,这些疾病包括肺部疾病、支气管炎、肺气肿、囊性纤维变性和急性呼吸窘迫综合征(特别是急性期反应)。
当外源性物质引起不希望有的组织裂解中涉及MP时,可用MP抑制剂治疗。例如,它们作为响尾蛇咬伤解毒药、作为抗发疱剂(anti-vessicant),在治疗变态反应性炎症、败血症和休克上是有效的。而且,它们可作为抗寄生虫药(如疟疾)和抗感染剂。例如,人们认为它们可用于治疗或预防病毒感染,包括会引起疱疹的感染、“感冒”(如鼻病毒感染)、脑膜炎、肝炎、HIV感染和AIDS。
同样认为MP抑制剂可用于治疗阿尔茨海默病、肌萎缩性侧索硬化(ALS)、肌营养障碍、糖尿病引起的并发症(特别是涉及丧失组织活力的并发症)、凝血、移植物抗宿主疾病、白血病、恶病质、厌食、蛋白尿,或许还调节头发生长。
对于某些疾病、病症或失调而言,MP抑制被认为是较佳的治疗方法。这些疾病、病症或失调包括关节炎(包括骨关节炎和类风湿性关节炎)、癌症(特别是预防或阻止肿瘤生长和转移)、眼科疾病(特别是角膜溃疡、角膜愈合不良、黄斑变性和翼状胬肉)和齿龈疾病(特别是牙周疾病和齿龈炎)。
对于(但不限于)关节炎(包括骨关节炎和类风湿性关节炎)的治疗,较佳的化合物是对金属蛋白酶和裂解素(disintegrin)金属蛋白酶有选择性的化合物。
对于(但不限于)癌症(特别是预防或阻止肿瘤生长和转移)的治疗,较佳的化合物是优先抑制明胶酶或IV型胶原酶的化合物。
对于(但不限于)眼科疾病(特别是角膜溃疡、角膜愈合不良、黄斑变性和翼状胬肉)的治疗,较佳的化合物是广泛抑制金属蛋白酶的化合物。这些化合物以局部给药为佳,更佳是以滴剂或凝胶形式给药。
对于(但不限于)齿龈疾病(特别是牙周疾病和齿龈炎)的治疗,较佳的化合物是优先抑制胶原酶的化合物。
V.组合物
本发明的组合物包含:
(a)安全有效量的本发明化合物;和
(b)药学上可接受的载体。
如上面所讨论的,已知许多疾病是由过量或不希望有的金属蛋白酶活性所介导的。它们包括肿瘤转移、骨关节炎、类风湿性关节炎、皮炎和溃疡,尤其是角膜、对感染的反应和牙周炎等。因此,本发明化合物可用于治疗与该不希望有的活性有关的疾病。
本发明化合物可因此制成用于治疗或预防这些情况的药物组合物。可使用标准的药物制剂技术,如Remington’s Pharmaceutical Sciences,Mack Publishing Company,Easton,Pa.最新版中公开的那些技术。
式(I)化合物的“安全有效量”是指可有效地抑制动物(较佳的是哺乳动物,更佳的是人)受治疗者的金属蛋白酶活性部位而无过分的不良副作用(如毒性、刺激或变态反应等)的用量,且用本发明的方式使用时,具有合理的利益/风险比。显而易见,具体的“安全有效量”将根据需治疗的具体疾病、患者的身体状况、疗程以及并行治疗(若有的话)的性质、使用的特定剂型、使用的载体、所含式(I)化合物的溶解度和组合物所需的给药方案等因素而变化。
除了主题化合物,本发明的组合物还包含药学上可接受的载体。此处使用的术语“药学上可接受的载体”是指适合给予动物(较佳为哺乳动物,更佳为人)的一种或几种相容的固体或液体填充剂、稀释剂或胶囊化物质。此处所用的术语“相容的”是指组合物的组分能与主题化合物掺和、且彼此之间的掺和方式在通常使用的情况下没有大大降低组合物药效的相互作用。当然,药学上可接受的载体必须有足够高的纯度和足够低的毒性,使其适合给予受治疗动物,较佳的是受治疗的哺乳动物,更佳的是受治疗的人。
可作为药学上可接受的载体或其组分的物质例如有:糖类,如乳糖、葡萄糖和蔗糖;淀粉类,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和甲基纤维素;粉状黄蓍胶;麦芽;明胶;滑石粉;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可豆油;多元醇类、如丙二醇、甘油、山梨醇、甘露醇和聚乙二醇;海藻酸;乳化剂,如吐温Tween;湿润剂,如十二烷基硫酸钠;着色剂;调味剂;压片剂;稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐水;和磷酸盐缓冲液。
与主题化合物合用的药学上可接受的载体基本上根据化合物的给药方式加以选择。
如果主题化合物是注射使用的,较佳的药学上可接受的载体是无菌生理盐水,具有与血相容的助悬剂,其pH调节至约7.4。
尤其是用于全身给药的药学上可接受的载体包括糖、淀粉、纤维素及其衍生物、麦芽、明胶、滑石粉、硫酸钙、植物油、合成油、多元醇、海藻酸、磷酸盐缓冲溶液、乳化剂、等渗盐水和无热原水。优选的用于胃肠外给药的载体包括丙二醇、油酸乙酯、吡咯烷酮、乙醇和芝麻油。在用于胃肠外给药的组合物中,药学上可接受的载体宜占组合物总重量的至少约90%。
本发明组合物最好以单位剂量形式提供。此处使用的“单位剂量形式”一词是指含一定量式(I)化合物的适合根据良好医疗实践而以单剂给予受治疗动物(较佳为哺乳类受治疗者,更佳为人对象)的本发明组合物。这些组合物宜含约5-1000毫克、更好约10-500毫克、还要好的约10-300毫克的式(I)化合物。
本发明组合物可以是适合(例如)口服、直肠给药、局部给药、经鼻、经眼或胃肠外给药的各种形式。根据所需的具体给药途径,可使用本领域熟知的各种药学上可接受的载体。它们包括固体或液体填充剂、稀释剂、助水溶物、表面活性剂和包囊材料。其中可任选地包括基本不影响式(I)化合物抑制活性的药学活性物质。与式(I)化合物一起使用的载体的量足以为给予每单位剂量的式(I)化合物提供实际的物质量。制备用于本发明方法的剂型的技术和组合物在下述文献中有所描述,它们均在此处引作参考:Modem Pharmaceutics,第9和第10章(Banker&Rhodes编辑,1979);Lieberman等,Pharmaceutical Dosage Forms:Tablets(1981);和Ansel,Introduction to PharmaceuticalDosage Forms第2版(1976)。
可使用各种口服剂型,包括片剂、胶囊、颗粒剂和散剂等固体剂型。这些口服剂型包含安全有效量的,通常至少约5%、较佳约25-50%的式(I)化合物。片剂可以是压片、研制片、肠溶包衣片、糖衣片、薄膜包衣片或多层压片。片剂含有合适的粘合剂、润滑剂、稀释剂、崩解剂、着色剂、调味剂、助流剂(flow-inducing agent)和助熔剂(melting agent)。液体口服剂型包括水溶液、乳剂、悬浮剂、从非泡腾的颗粒剂临用时配制成的溶液和/或悬浮液以及从泡腾颗粒剂临用时配制成的泡腾制剂,它含有合适的溶剂、防腐剂、乳化剂、助悬剂、稀释剂、增甜剂、助熔剂、着色剂和调味剂。
适合制备口服给药单位剂型的药学上可接受的载体是本领域熟知的。片剂通常包含常规的药学上相容的佐剂作为惰性稀释剂,如碳酸钙、碳酸钠、甘露醇、乳糖和纤维素;粘合剂,如淀粉、明胶和蔗糖;崩解剂,如淀粉、海藻酸和交联羧甲基纤维素(croscarmelose);润滑剂,如硬脂酸镁、硬脂酸和滑石粉。助流剂(如二氧化硅)可用来改善粉状混合物的流动性能。为了外观美观,可加入着色剂,如FD&C染料。甜味剂和调味剂(如阿司帕坦、糖精、薄荷醇、薄荷及果味剂)对于咀嚼片剂是有用的助剂。胶囊通常包含一种或多种上述固体稀释剂。载体组分根据第二位的考虑,如口味、费用和储藏稳定性来加以选择,它们对于本发明的目的不是关键的,并且可由本领域技术人员容易地选择。
口服组合物还包括液体溶液、乳剂、悬浮剂等。适于制备这些组合物的药学上可接受的载体是本领域熟知的。糖浆剂、酏剂、乳剂和悬浮剂的典型载体组分包括乙醇、甘油、丙二醇、聚乙二醇、液状蔗糖、山梨醇和水。对于悬浮剂来说,典型的助悬剂包括甲基纤维素、羧甲基纤维素钠、Avicel“RC-591、黄蓍胶和海藻酸钠;典型的湿润剂包括卵磷脂和聚山梨醇酯80;典型的防腐剂包括对羟苯甲酸甲酯和苯甲酸钠。口服液体组合物还可包含一种或多种上述甜味剂、调味剂和着色剂。
还可用常规的方法,以pH或时间依赖性包衣剂对这些组合物进行包衣,从而使主题化合物在胃肠道内邻近所需局部给药的部位释放,或在不同的时间释放以延长所需的作用。这样的剂型通常含有(但不限于)一种或多种醋酸邻苯二甲酸纤维素、聚乙酸邻苯二甲酸乙烯酯、邻苯二甲酸羟丙基甲基纤维素、乙基纤维素、Eudragit包衣剂、蜡和虫胶。
本发明的组合物可任意地包含其它活性药物。
用来全身性给予主题化合物的其它组合物包括舌下剂、颊剂和鼻用剂型。这些组合物通常包含一种或多种水溶性填充剂,如蔗糖、山梨醇和甘露醇;粘合剂,如阿拉伯胶、微晶纤维素、羧甲基纤维素和羟丙基甲基纤维素。上述助流剂、润滑剂、甜味剂、着色剂、抗氧剂和调味剂也可包含在内。
本发明组合物还可给对象外用,即,将组合物直接放在或涂在对象的表皮或上皮组织上,或通过“贴剂”经皮给药。此类组合物包括例如洗液、软膏、溶液、凝胶和固体。这些外用组合物宜包含安全有效量(通常至少约为0.1%,较佳约为1-5%)的式(I)化合物。适合外用的载体最好作为连续膜留在皮肤上并不会因出汗或浸泡在水中而被除去。载体一般是有机质的并可能将式(I)化合物分散或溶解在其中。载体可包括药学上可接受的软化剂、乳化剂、增稠剂和溶剂等。
VI.给药方法:
本发明还提供了治疗或预防人或其它动物体内与过量或不合需要的金属蛋白酶活性相关的疾病的方法,方法是给予所述患者安全有效量的式(I)化合物。本文所用的术语“与过量或不合需要的金属蛋白酶活性相关的疾病”是任何以基质蛋白质降解为特征的疾病。本发明的方法可用于治疗或预防上述失调。
本发明组合物能局部给药或全身给药。全身给药包括将式(I)化合物导入体内组织的任何方法,例如关节内(尤其在治疗类风湿性关节炎中)、鞘内、硬膜外、肌内、经皮、静脉内、腹膜内、皮下、舌下、直肠和口服给药。本发明的式(I)化合物最好进行口服给药。
给予抑制剂的具体剂量以及治疗时间和是局部治疗还是全身治疗之间是相互依赖的。剂量和治疗方案还取决于以下这些因素,例如采用的具体的式(I)化合物、治疗的适应征、式(I)化合物在待抑制金属蛋白酶部位达到最低抑制浓度的能力、对象的个人属性(如体重)、对治疗方案的顺应性、以及任何治疗副作用的存在及其严重程度。
通常,对于成年人(体重约为70公斤)来说,全身给药应每日给予约5-3000毫克的式(I)化合物,较佳的为5-1000毫克,更佳的为10-100毫克。应当理解,这些剂量只是作为例子,而每日的给药量可以根据上述因素来调节。
用来治疗类风湿性关节炎的较佳的给药方法是口服或经关节内注射的肠胃外给药。如现有技术中已知的并已经实践的那样,用于肠胃外给药的所有制剂必须无菌。对于哺乳动物,尤其是人类(假定体重约为70公斤),个体剂量宜在约10-1000毫克之间。
全身给药的较佳方法是口服。个体剂量宜在约10-1000毫克之间,较佳的在10-300毫克之间。
可用局部给药来全身性给予式(I)化合物,或用来对个体进行局部治疗。打算局部给药的式(I)化合物的量取决于以下这些因素,例如皮肤敏感程度、待治疗组织的类型和部位、待给药的组合物和载体(如果有的话)、待给药的特定的式(I)化合物、待治疗的特定疾病以及所希望的全身性(与局部不同)效应的程度。
通过采用靶向配体,本发明的抑制剂可被靶向金属蛋白酶蓄积的特定部位。例如,为了使抑制剂集中到肿瘤中含有的金属蛋白酶处,使抑制剂与抗体或其片段偶联,其中抗体或其片段对肿瘤标记物有免疫反应性,这是制备免疫毒素中通常知道的。靶向配体也可是适合肿瘤中某一受体的配体。可以采用能与预期的目标组织的标记物发生特异反应的任何靶向配体。将本发明的化合物与靶向配体结合的方法是众所周知的,其与下述的与载体的结合类似。偶联物可以如上所述那样进行配制和给药。
对于局部性疾病,宜采用局部给药。例如,为了治疗溃疡的角膜,可以用诸如滴眼剂或气雾剂之类的制剂直接用于受累眼睛。对于角膜的治疗,本发明的化合物也可配制成凝胶剂、滴剂或软膏剂,或可掺入胶原或亲水聚合物的眼罩中。该材料也可作为接触透镜或储库(reservoi)或结膜下制剂插入。为治疗皮肤炎症,化合物可以凝胶剂、糊剂、油膏剂或软膏剂形式进行局部给药和表面给药。为了治疗口疾病,化合物可以凝胶剂、糊剂、漱口液或植入物形式局部施加。治疗模式反映了疾病的性质,对于任何选定的途径,本领域中均有合适的制剂形式。
当然,在前述所有内容中,本发明的化合物均可单独给药,或以合剂形式给药,组合物还包括适用于该适应征的其它药物或赋形剂。
本发明中的一些化合物还能抑制细菌金属蛋白酶。一些细菌的金属蛋白酶可能与抑制剂的立体化学特征没有很大关系,但是却发现各非对映体在灭活哺乳动物蛋白酶的能力上有显著区别。因此,这种作用模式可用于对哺乳动物酶和细菌性酶进行区分。
VII.抗体的制备和应用:
通过将本发明化合物与对于该部位标记物有特异性的靶向配体(如抗体或其片段或受体配体)偶联,可以靶向在特别不希望的位置(如器官或某些类型的细胞)上有活性的金属蛋白酶。偶联方法是现有技术中已知的。
本发明还涉及利用这些化合物的独特性质的其它各种方法。因此,本发明另一方面涉及与固体载体偶联的式(I)化合物。这些偶联物可用作纯化所需金属蛋白酶的亲合试剂。
另一方面,本发明涉及与标记物偶联的式(I)化合物。当本发明化合物与至少一种金属蛋白酶偶联时,标记物可用来检测体内或体外细胞培养物中相当高水平金属蛋白酶的存在。
另外,式(I)化合物可与载体偶联,这些载体使得这些化合物能用于免疫过程,以制备与本发明化合物有特异性免疫反应性的抗体。典型的偶联方法是本领域中已知的。然后,这些抗体可用于治疗和监测抑制剂的剂量。
本发明化合物也可用标准的结合方法与标记物(如闪烁扫描标记物,如锝99或I-131)结合。给予患者标记过的化合物,以确定过量的一种或多种金属蛋白酶在体内的部位。这样,就能利用抑制剂选择性结合金属蛋白酶的能力画出这些酶的原位分布图。该方法还可用于组织学操作中,标记过的本发明化合物可用于竞争性免疫测定。
下列非限制性实施例描述了本发明的化合物、组合物及其应用。
VIII.化合物的制备
用合适的1H和13C NMR、元素分析、质谱和/或IR光谱分析化合物。
通常从钠和二苯甲酮中蒸馏四氢呋喃(THF),从氢化钙里蒸馏二异丙胺,所有其它的溶剂按合适的级别购得。在硅胶(70-230目;Aldrich)或(230-400目;Merk)上进行色谱层析。在固定于玻璃上的硅胶板(200-300目;Baker)上进行薄层层析分析(TLC),用UV或5%乙醇(EtOH)里的磷钼酸显色。
本文采用下列缩写:
MeOH:甲醇 Et3N:三乙胺
EtOAc:乙酸乙酯 Et2O:(二)乙醚
Ph:苯基 boc:叔丁氧羰基
DMF:N,N-二甲基甲酰胺 acac:乙酰基乙酸盐
DME:二甲氧基乙烷 dil:稀释的
conc.浓缩的 wrt.:关于
DCC:1,3-二环己基碳化二亚胺 HOBT:1-羟基苯并三唑
用来描述化合物例子的R基团与用于描述式(I)各部分的各个R基团无关。就是说,例如,在发明概述部分和详述部分II中用来描述式(I)的R1,R2和R3不表示与本部分VIII中的R1,R2和R3相同。
实施例1-24
实施例1
2-{[4'-氟-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4'-氟-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:取原料2-N-叔丁氧羰基-氨基-5-苯基戊-4-炔酸甲酯1c(382毫克,1.26毫摩尔,如Tetrahedron Lett.,1994,35,3669所述制得)加入10毫升甲醇中,用0.5毫升SO2Cl处理。所得混合物搅拌4小时,然后蒸发至干。将所得固体加入含有0.5毫升三乙胺的6毫升二氯甲烷中,用2-4'-氟联苯基磺酰氯(306毫克,1.13毫摩尔)处理,所得混合物在室温下(rt)搅拌18小时,然后在1N HCl和乙酸乙酯之间分配。然后用盐水洗涤有机层,用硫酸镁干燥,过滤并蒸发,得到浅黄色固体,从乙酸乙酯∶己烷中重结晶,得到白色固体。
ESI MS:m/z(相对强度)455.0(100,M+NH4 +),437.7(20,M+H+)。
b.用含KOH(250毫克,4.46毫摩尔)的15毫升甲醇∶水(10∶1)处理甲酯1a(110毫克,0.25毫摩尔),在室温下搅拌24小时。溶液中出现白色沉淀。浓缩该物质,在1N HCl和乙酸乙酯之间分配。用盐水洗涤有机层,用硫酸镁干燥,过滤并蒸发。从乙酸乙酯∶己烷(2∶1)中重结晶固体残余物,得到白色晶体标题化合物。
ESI MS:m/z(相对强度)441.0(100,M+NH4 +),424.0(85,M+H+)。
实施例2
2-(4-苯氧基苯磺酰基)-氨基-5-苯基戊-4-炔酸的制备
a.2-(4-苯氧基苯磺酰基)-氨基-5-苯基戊-4-炔酸甲酯:如实施例1a所述,将原料氨基甲酸叔丁酯1c(734毫克,2.42毫摩尔)转变成标题所示的磺酰胺。让残余物粗品吸附到硅胶上,然后用己烷∶乙酸乙酯(2∶1至1∶2)洗脱通过快速硅胶柱,得到澄清的浆状物,该浆状物在静置后固化。
ESI MS:m/z(相对强度)466.9(80,M+NH4 +),449.9(100,M+H+)。
b.如实施例1b所述,将甲酯2a(308毫克,0.71毫摩尔)水解成其对应的羧酸。从乙酸乙酯∶己烷(1∶1)中重结晶固体残余物,得到白色晶体标题化合物。
ESI MS:m/z(相对强度)453.0(100,M+NH4 +),435.9(75,M+H+)。
实施例3
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-(4-碘苯磺酰基)-氨基-5-苯基戊-4-炔酸甲酯:如实施例1a所述,用4-碘苯磺酰氯(4.05克,13.4毫摩尔)处理,将原料氨基甲酸叔丁酯1c(3.38克,11.22毫摩尔)转变成标题所示的磺酰胺。让残余物粗品吸附到硅胶上,然后用己烷∶二乙醚(7∶3至2∶3)洗脱通过硅胶,得到黄色胶状物,该胶状物在静置后固化。
ESI MS:m/z(相对强度)486.9(100,M++NH4 +),469.8(25,M+H+)。
b.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:取原料磺酰胺3a(804毫克,1.71毫摩尔)和4-甲氧基苯基硼酸(391毫克,2.57毫摩尔),加入15毫升苯、2毫升乙醇和2毫升水中,用Pd(PPh3)4和100毫克碳酸钠处理。使该混合物温和回流18小时,然后在1N HCl和乙酸乙酯之间分配。用盐水洗涤有机层,用硫酸镁干燥,过滤并蒸发。残余物在己烷∶乙酸乙酯(2∶1)中重结晶,得到灰白色固体。
ESI MS:m/z(相对强度)449.9(100,M+NH4 +),466.9(75,M+H+)。
c.如实施例1b所述,将甲酯3b(286毫克,0.64毫摩尔)水解成其对应的羧酸。从乙酸乙酯∶己烷(1∶1)中重结晶固体残余物,得到白色晶体。
ESI MS:m/z(相对强度)453.0(100,M+NH4 +),436.0(60,M+H+)。
实施例4
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(4-吗啉代苯基)-戊-4-炔酸的制
备
a.2-N-叔丁氧羰基-氨基-5-(4-吗啉代苯基)-戊-4-炔酸甲酯:将4-碘苯胺(6.2克,28.4毫摩尔)加入有8毫升溴乙醚和10毫升三乙胺的50毫升DMF中,于60℃加热24小时。然后用乙酸乙酯稀释该混合物,用稀碳酸氢钠洗涤3次,用盐水洗涤一次,用硫酸镁干燥,过滤并蒸发。然后在甲醇中重结晶残余物,得到4.21克4-碘苯基吗啉(浅棕色固体)。
将原料2-N-叔丁氧羰基-氨基-5-戊-4-炔酸甲酯4e(1.62克,7.14毫摩尔,Tetrahedron Lett.,1994,35,3669)和4-碘苯基吗啉(2.06克,7.14毫摩尔)加入含1.6毫升三乙胺、Pd(PPh3)4(650毫克,0.56毫摩尔)和CuI(240毫克,1.26毫摩尔)的DMF中。该混合物于60℃下加热20小时,然后在乙酸乙酯和稀碳酸氢钠之间分配。有机层用水洗涤两次,用盐水洗涤一次,用硫酸镁干燥,过滤并蒸发,得到深红色残余物,将该残余物吸附到硅胶上,用己烷∶乙酸乙酯(4∶1至1∶1)洗脱通过快速硅胶柱,得到黄色固体。
ESI MS:m/z(相对强度)389.1(100,M+H+)。
b.2-(4-碘苯磺酰基)-氨基-5-(4-吗啉代苯基)-戊-4-炔酸甲酯:如实施例1a所述,用4-碘苯磺酰氯(1.15克,3.80毫摩尔)进行处理后,将氨基甲酸叔丁酯4a(1.23克,3.17毫摩尔)转变成标题所示的磺酰胺。使残余物粗品吸附在硅胶上,然后用己烷∶乙酸乙酯(3∶1至1∶2)洗脱通过快速硅胶柱,得到浅黄色固体。
ESI MS:m/z(相对强度)554.0(100,M+H+)。
c.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(4-吗啉代苯基)-戊-4-炔酸甲酯:如化合物3b所述,用4-甲氧基苯基硼酸(172毫克,1.14毫摩尔)将原料磺酰胺4b(420毫克,0.76毫摩尔)转变成标题化合物。在乙酸乙酯中重结晶所得固体,得到浅黄色固体。
ESI MS:m/z(相对强度)535.0(100,M+H+)。
d.如实施例1b所述,将甲酯4c(128毫克,0.24毫摩尔)水解成其对应的羧酸。从乙酸乙酯∶甲醇(10∶1)中重结晶固体残余物,得到白色晶体。
ESI MS:m/z(相对强度)543.0(40,M+Na+),521.0(100,M+H+)。
实施例5
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(3-吗啉代苯基)-戊-4-炔酸的制
备
a.2-N-叔丁氧羰基-氨基-5-(3-吗啉代苯基)-戊-4-炔酸甲酯:如4a所述,将3-碘苯胺转变成3-碘苯基吗啉。然后将残余物吸附到硅胶上,用己烷∶乙酸乙酯(1∶1至0∶1)洗脱通过快速硅胶柱,得到3-碘苯基吗啉黄色胶状物。
如4a所述,将原料游离的乙炔4e(1.4克,6.1毫摩尔)与4-碘苯基吗啉(1.68克,5.81毫摩尔)偶合。使粗品吸附到硅胶上,用己烷∶乙酸乙酯(4∶1)洗脱通过快速硅胶柱,得到黄色胶状物。
ESI MS:m/z(相对强度)389.1(100,M+H+)。
b.2-(4-碘苯磺酰基)-氨基-5-(3-吗啉代苯基)-戊-4-炔酸甲酯:如实施例1a所述,用4-碘苯磺酰氯(1.11克,3.66毫摩尔)进行处理,将氨基甲酸叔丁酯5a(1.58克,4.07毫摩尔)转变成标题所示的磺酰胺。使残余物粗品吸附在硅胶上,然后用己烷∶乙酸乙酯(4∶1至0∶1)洗脱通过快速硅胶柱,得到浅黄色固体。
ESI MS:m/z(相对强度)554.8(100,M+H+)。
c.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(3-吗啉代苯基)-戊-4-炔酸甲酯:如化合物3b所述,用4-甲氧基苯基硼酸(151毫克,1.14毫摩尔)将原料磺酰胺5b(367毫克,0.66毫摩尔)转变成标题化合物。将粗品吸附到硅胶上,然后用己烷∶乙酸乙酯(4∶1至1∶1)洗脱通过快速硅胶柱,得到浅的橙色-黄色发泡固体。
ESI MS:m/z(相对强度)535.0(100,M+H+)。
d.如实施例4d所述,将甲酯5c(250毫克,0.47毫摩尔)水解成其对应的羧酸。用乙酸乙酯∶甲醇(1∶0至4∶1)将固体残余物洗脱通过短的硅胶柱,得到棕色固体。
ESI MS:m/z(相对强度)521.0(100,M+H+)。
实施例6
2-{[(1,1'-4',1″-三苯基)-4-基]-磺酰基}-氨基-5-苯基戊4-炔酸的制备
a.2-{[(1,1'-4',1″-三苯基)]-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:原料磺酰胺3a(1.0克,2.13毫摩尔)和联苯基硼酸(633毫克,3.2毫摩尔)如化合物3b所述那样偶联。残余物在己烷∶乙酸乙酯(1∶10)中重结晶,得到灰白色固体。
ESI MS:m/z(相对强度)513.2(30,M+NH4 +),496.1(25,M+H+)。
b.如实施例1b所述,将甲酯6a(497毫克,1.0毫摩尔)水解成其相应的羧酸。固体残余物在乙酸乙酯∶己烷(2∶1)中重结晶,得到褐色固体。
ESI MS:m/z(相对强度)505.0(12,M+Na+),499.0(40,M+NH4 +),482.0(100,M+H+)。
实施例7
2-{[4'-甲硫基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{{[4'-甲硫基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:原料磺酰胺3a(1.0克,2.13毫摩尔)和4-甲硫基苯基硼酸(540毫克,3.2毫摩尔)如化合物3b所述那样偶联。残余物在己烷∶乙酸乙酯(1∶5)中重结晶,得到橙色固体。
ESI MS:m/z(相对强度)483.0(20,M+NH4 +),466.0(60,M+H+),279.0(100)。
b.如实施例1b所述,将甲酯7a(665毫克,1.4毫摩尔)水解成其相应的羧酸。固体残余物在乙酸乙酯∶己烷(2∶1)中重结晶,得到黄色固体。
ESI MS:m/z(相对强度)469.0(30,M+NH4 +),452.0(60,M+H+),279.0(100)。
实施例8
2-{[3',4'-亚甲二氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[3',4'-亚甲二氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:原料磺酰胺3a(804克,1.72毫摩尔)和4-亚甲二氧基苯基硼酸(430毫克,2.59毫摩尔)如化合物3b所述那样偶联,得到标题化合物。将粗品吸附在硅胶上,用己烷∶乙酸乙酯(2∶1至1∶3)洗脱通过快速硅胶柱,得到浅黄色固体。
ESI MS:m/z(相对强度)481.0(100,M+NH4 +),464.7(7,M+H+)。
b.如实施例1b所述,将甲酯8a(391毫克,0.84毫摩尔)水解成其相应的羧酸。固体残余物在乙酸乙酯∶己烷(2∶1)中重结晶,得到白色晶体。
ESI MS:m/z(相对强度)466.9(70,M+NH4 +),449.9(100,M+H+)。
实施例9
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
见M.D.Vleeschauwer和J.Y.Gauthier,Synlett,1997,375.
a.4-苯氧基苯基硼酸:在装有加料漏斗和冷凝器的三颈烧瓶中,将Mg屑(turnings)(820毫克,34.2毫摩尔)悬浮于THF(60毫升)中。在该悬浮液中加入一颗碘晶体。用加液漏斗将含苯氧基苯基溴(5毫升,28.5毫摩尔)的THF(15毫升)滴加入Mg/I2悬浮液中,保持溶剂缓慢回流,在加完后,再使混合物回流3小时。在使混合物冷却至室温后,通过加液漏斗滴加入硼酸三乙酯(5.8毫升,34.20毫摩尔)的THF(15毫升)。在混合物中加入10%氯化铵(50毫升),分层,用乙酸乙酯(50毫升)萃取水层。合并的有机萃取物用硫酸镁干燥,过滤,旋转蒸发除去溶剂。在乙酸乙酯/己烷混合物中重结晶固体粗品,得到灰白色硼酸产物,冰箱中保存。
b.甲基-[4'-苯氧基-(1,1'-联苯基)-4-基]-硫醚:将溴代硫代苯甲醚(500毫克,2.39毫摩尔)和Pd(PPh3)4(138毫克,0.12毫摩尔)混合在脱气的苯(20毫升)中。在该混合物中加入2M碳酸钠(3毫升,6.0毫摩尔),然后加入硼酸(563毫克,2.63毫摩尔)。使双相混合物回流过夜。在冷却的反应混合物中加入水(10毫升)。分层,用乙酸乙酯萃取水层(2×10毫升)。合并的有机萃取物用硫酸镁干燥。过滤该混合物,然后用旋转蒸发除去溶剂,得到固体粗品,用乙酸乙酯作为溶剂,使其过滤通过硅胶垫。蒸发滤液,固体残余物用甲醇重结晶,得到标题化合物。
c.甲基-[4'-苯氧基-(1,1'-联苯基)-4-基]-亚砜:将上述硫醚(460毫克,1.58毫摩尔)溶解在二氯甲烷(50毫升)中。将溶液冷却至0℃,在10分钟内分4次加入mCPBA(388毫克,1.58毫摩尔)。反应混合物用10%硫代硫酸钠(10毫升)淬灭。分层,用饱和碳酸氢钠(5毫升)洗涤有机层。洗涤的有机层用硫酸镁干燥,过滤并用旋转蒸发浓缩,得到亚砜粗品,该粗品直接用于下一步而不进行进一步的纯化。
d.乙酰氧甲基-[4'-苯氧基-(1,1'-联苯基)-4-基]-硫醚:将上述亚砜粗品与NaOAc(750毫克,过量)混合在Ac2O(5毫升)中。悬浮液于140℃加热3小时。旋转蒸发除去溶剂,残余物溶解在乙酸乙酯(10毫升)中。溶液用饱和碳酸氢钠洗涤,分层,有机层用硫酸镁干燥。过滤溶剂,然后旋转蒸发浓缩,得到乙酰氧基硫醚,其作为粗品用于下一步。
e.乙酰氧甲基-[4'-苯氧基-(1,1'-联苯基)-4-基]-砜:将硫醚粗品9d溶解在1∶2甲醇/二氯甲烷(12毫升)中,冷却至0℃。一次加入MMPP(1.08克,1.74毫摩尔)。反应混合物于0℃搅拌30分钟。在反应混合物中加入水(5毫升)和二氯甲烷(5毫升),分层。有机层用饱和碳酸氢钠溶液洗涤,然后用硫酸镁干燥。过滤,然后用旋转蒸发除去溶剂,得到固体,在乙酸乙酯/己烷混合物中重结晶纯化,得到白色固体。
f.[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酸盐。将上述砜(400毫克,1.09毫摩尔)溶解在1∶2甲醇/THF(9毫升)中。将溶液冷却至0℃,滴加入1M NaOH(1.1毫升,1.1毫摩尔)。旋转蒸发除去溶剂,残余的水通过与苯共沸来除去。该固体可以粗品形式用于下一步。
g.[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰氯:将上述亚磺酸盐粗品溶解在0℃二氯甲烷(10毫升)中。在溶液中加入1M磺酰氯(1.1毫升,1.1毫摩尔)。加完后,使反应混合物再于0℃下搅拌30分钟。在反应混合物中加入水(5毫升)。分层,有机层用硫酸镁干燥,最后过滤。旋转蒸发除去有机溶剂,得到磺酰氯粗品,该粗品在硅胶上色谱纯化(3∶1己烷/乙酸乙酯),得到纯的磺酰氯。
h.如化合物1a所述,使磺酰氯9a与甲酯1c偶联。然后如实施例1所述,使该材料皂化并纯化。
实施例10
2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制
备
a.[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰氯:根据化合物9a-g的步骤次序,将1-溴-4-(2-甲氧基乙氧基)-苯转变成标题磺酰氯。
b.如化合物1a所述,使磺酰氯10e与甲酯1c连接。然后如实施例1所述,使该材料皂化并纯化。
ESI MS:m/z(相对强度)497.0(50,M+NH4 +),479.9(50,M+H+)。
实施例11
2-{[4'-(2-N-吡咯烷子基(pyrrolidino)-乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-
苯基戊-4-炔酸的制备
a.[4'-(2-N-吡咯烷子基-乙氧基)-(1,1'-联苯基)-4-基]-磺酰氯:根据化合物9a-g的步骤次序,将1-溴-4-(2-N-吡咯烷子基-乙氧基)-苯转变成标题所示的磺酰氯。
b.如化合物1a所述,使磺酰氯11e与甲酯1c偶连。然后如实施例1所述,使该材料皂化并纯化。
ESI MS:m/z(相对强度)519.1(100,M+H+)。
实施例12
2-{[3'-乙氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[3'-乙氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:如化合物3b所述,将原料磺酰胺3a(1.0克,2.13毫摩尔)和3-乙氧基苯基硼酸(532毫克,3.2毫摩尔)相连。将残余物吸附在硅胶上,用己烷∶乙酸乙酯(9∶1至4∶1)洗脱通过快速硅胶柱,得到黄色-橙色胶状物。
ESI MS:m/z(相对强度)498.0(25),466.0(100,M-H+)。
b.如实施例1b所述,将甲酯12a(526毫克,1.1毫摩尔)水解成其相应的羧酸。将固体残余物吸附在硅胶上,用乙酸乙酯∶甲醇(1∶0至4∶1)洗脱通过快速硅胶柱,得到黄色固体。
ESI MS:m/z(相对强度)467.0(30,M+NH4 +),449.9(35,M+H+),279.0(100)。
实施例13
2-[4-(4-甲基苯基)-乙炔基苯磺酰基]-氨基-5-苯基-戊-4-炔酸的制备
a.2-[4-(4-甲基苯基)-乙炔基苯磺酰基]-氨基-5-苯基-戊-4-炔酸甲酯:将原料碘代磺酰胺3a(0.7克,1.49毫摩尔)和4-乙炔基甲苯(0.21克,1.79毫摩尔)加入含0.42毫升三乙胺、Pd(PPh3)2Cl2(26.1毫克,0.037毫摩尔)和CuI(15毫克,0.074毫摩尔)的10毫升DMF中。然后,混合物于50℃下加热18小时,然后在乙酸乙酯和水之间分配。有机层用1N HCl、碳酸氢钠水溶液和盐水洗涤,硫酸镁干燥,过滤并蒸发,得到红色残余物,将该残余物吸附到硅胶上,用己烷∶乙酸乙酯(4∶1)洗脱通过快速硅胶柱,得到浅黄色固体。
ESI MS:m/z(相对强度)475.1(10,M+NH4 +),458.1(100,M+H+)。
b.如实施例1b所述,将甲酯13a(330毫克,0.72毫摩尔)水解成其相应的羧酸。在乙酸乙酯∶己烷中研制固体残余物,得到白色晶体。
ESI MS:m/z(相对强度)444.1(100,M+H+)。
实施例14
2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-5-苯基-戊-4-炔酸的制备
a.2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-5-苯基-戊-4-炔酸甲酯:将原料碘代磺酰胺3a(0.54克,1.15毫摩尔)和4-甲氧基苯基乙炔(0.2克,1.49毫摩尔)加入含0.32毫升三乙胺、Pd(PPh3)2Cl2(40.4毫克,0.058毫摩尔)和CuI(24毫克,0.128毫摩尔)的10毫升DMF中。然后,混合物于55℃下加热18小时,然后在乙酸乙酯和水之间分配。有机层用1N HCl、碳酸氢钠水溶液和盐水洗涤,硫酸镁干燥,过滤并蒸发,得到残余物,将该残余物吸附到硅胶上,用己烷∶乙酸乙酯(4∶1至2∶1)洗脱通过快速硅胶柱,得到所需产物。
ESI MS:m/z(相对强度)474.1(100,M+H+)。
b.如实施例1b所述,将甲酯14a(260毫克,0.55毫摩尔)水解成其相应的羧酸。在乙酸乙酯∶己烷中重结晶固体残余物,得到所需产物。
ESI MS:m/z(相对强度)477.1(66,M+NH4 +),460.1(100,M+H+)。
实施例15
2-(4-苯基偶氮苯磺酰基)-氨基-5-苯基戊炔酸
a.2-(4-苯基偶氮苯磺酰基)-氨基-5-苯基戊炔酸甲酯:如实施例1所述,用4-苯基偶氮苯磺酰氯(700毫克,2.5毫摩尔)处理后,将原料氨基甲酸叔丁酯1c(500毫克,2.09毫摩尔)转变成标题磺酰胺。将粗品残余物吸附到硅胶上,然后用己烷∶二乙醚(7∶3至2∶3)洗脱通过快速硅胶柱,得到黄色胶状物,该胶状物在静置后固化。
ESI MS:m/z(相对强度)465.2(16,M+Na),448.3(100,M+H+)。
b.用含氢氧化锂(132毫克,3.1毫摩尔)的10毫升THF∶水(1∶1)处理甲酯15a(0.46克,1.04毫摩尔),在室温下搅拌17小时。溶液用1N HCl酸化至pH2-3,然后用乙酸乙酯萃取。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。固体残余物在乙酸乙酯∶己烷(1∶2)中重结晶,得到橙色固体标题化合物。
ESI MS:m/z(相对强度)451.3(21,M+NH4 +),434.2(100,M+H+)。
实施例16
2-{[4'-苯氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(吡啶-3-基)-戊-4-炔酸的制备
如实施例9所述,将原料2-N-叔丁氧羰基-氨基-5-(吡啶-3-基)-戊-4-炔酸甲酯16a(如Tetrahedron Lett.,1994,35,3669所述制得)转变成标题化合物。
实施例17
2-[4-(4-甲氧基苯基)乙炔基苯磺酰基]-氨基-5-(吡啶-3-基)-戊-4-炔酸的制备
如实施例14所述,将原料2-N-叔丁氧羰基-氨基-5-(吡啶-3-基)-戊-4-炔酸甲酯16a转变成标题化合物。
实施例18
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(吡啶-3-基)-戊-4-炔酸的制备
如实施例1所述,将原料2-N-叔丁氧羰基-氨基-5-(吡啶-3-基)-戊-4-炔酸甲酯16a转变成标题化合物。
实施例19
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(呋喃-2-基)-戊-4-炔酸的制备
如实施例1所述,将原料2-N-叔丁氧羰基-氨基-5-(呋喃-2-基)-戊-4-炔酸甲酯16a(如Tetrahedron Lett.,1994,35,3669所述制得)转变成标题化合物。
实施例20
2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(呋喃-2-基)-戊-4-炔
酸的制备
如实施例10所述,将原料2-N-叔丁氧羰基-氨基-5-(呋喃-2-基)-戊-4-炔酸甲酯19a转变成标题化合物。
实施例21
2-{[4'-(2-N-吡咯烷子基-乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(呋喃-2-基)-
戊-4-炔酸的制备
如实施例11所述,将原料2-N-叔丁氧羰基-氨基-5-(呋喃-2-基)-戊-4-炔酸甲酯19a转变成标题化合物。
实施例22
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(噻吩-2-基)-戊-4-炔酸的制备
如实施例1所述,将原料2-N-叔丁氧羰基-氨基-5-(噻吩-2-基)-戊-4-炔酸甲酯22a(如Tetrahedron Lett.,1994,35,3669所述制得)转变成标题化合物。
实施例23
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(N-甲基吡咯-2-基)-戊-4-炔酸
的制备
如实施例1所述,将原料2-N-叔丁氧羰基-氨基-5-(N-甲基吡咯-2-基)-戊-4-炔酸甲酯19a(如Tetrahedron Lett.,1994,35,3669所述制得)转变成标题化合物。
实施例24
2-(4-正-丁氧基苯)-磺酰氨基-5-苯基戊-4-炔酸的制备
如化合物1a所述,将原料氨基甲酸叔丁酯1c去保护,与正丁氧基苯磺酰氯相连,然后如化合物1b所述转变成其相应的异羟肟酸。
实施例25-30
下列化学式和表2显示了根据下文实施例25-30的描述制得的化合物的结构:
实施例25
2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-苯基-戊-4-炔酸的制备
a.2-[(5-溴噻吩-2-基)-磺酰基]-氨基-5-苯基戊-4-炔酸甲酯:如实施例1a所述,用5-溴噻吩-2-基磺酰氯(4.05克,13.4毫摩尔)处理后,将原料氨基甲酸叔丁酯1c(3.38克,11.2毫摩尔)转变成标题所示的磺酰胺。将粗品残余物吸附到硅胶上,然后用己烷∶二乙醚(7∶3至2∶3)洗脱通过快速硅胶柱,得到3.9克黄色胶状物,该胶状物在静置后固化。
ESI MS:m/z(相对强度)447.1(100,M++Na+),445.2(85,M++Na+),430.1(45,M+H+),428.1(42,M+H+)。
b.2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-苯基-戊-4-炔酸甲酯:将原料磺酰胺25a(430毫克,1.0毫摩尔)和4-(甲氧基苯基硼酸(230毫克,1.5毫摩尔)加入15毫升苯、0.5毫升乙醇和1毫升水中,用Pd(PPh3)4(35毫克,0.03毫摩尔)和碳酸钠(0.21克,2毫摩尔)处理。使混合物温和回流18小时,然后在乙酸乙酯和1N HCl之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。残余物在己烷∶乙酸乙酯(7∶3)中重结晶,得到270毫克灰白色固体。
ESI MS:m/z(相对强度)473(100,M+NH4 +),456(75,M+H+)。
c.如实施例1b所述,将甲酯25b(237毫克,0.5毫摩尔)水解成其相应的羧酸。固体残余物在乙酸乙酯∶己烷中重结晶,得到130毫克所需产物。
ESI MS:m/z(相对强度)459(100,M+NH4 +),442(94,M+H+)。
实施例26
2-{[5-(4-甲氧基苯基乙炔基)-噻吩-2-基]-磺酰基}-氨基-5-苯基-戊-4-炔酸的制备
a.2-{[5-(4-甲氧基苯基乙炔基)-噻吩-2-基]-磺酰基}-氨基-5-苯基-戊-4-炔酸甲酯:将原料溴代噻吩磺酰胺25a(0.47克,1.1毫摩尔)和4-甲氧基苯基乙炔(0.19克,1.42毫摩尔)加入含0.31毫升三乙胺、Pd(PPh3)2Cl2(38.6毫克,0.055毫摩尔)和CuI(21毫克,0.11毫摩尔)的10毫升DMF中。然后,混合物于55℃加热18小时,然后在乙酸乙酯和水之间分配。有机层用1N HCl、碳酸氢钠水溶液和盐水洗涤,用硫酸镁干燥,过滤并蒸发,得到红色残余物,该残余物吸附在硅胶上并用己烷∶乙酸乙酯(4∶1)洗脱通过快速硅胶柱,得到0.21克浅黄色固体。
ESI MS:m/z(相对强度)497.1(28,M+NH4 +),480.3(100,M+H+)。
b.如实施例1b所述,将甲酯25b(110毫克,0.23毫摩尔)水解成其相应的羧酸。固体残余物在乙酸乙酯∶己烷中重结晶,得到80毫克白色晶体。
ESI MS:m/z(相对强度)483.3(16,M+NH4 +),466.2(100,M+H+)。
实施例27
2-{[(4-苯磺酰基)-噻吩-2-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备:
a.2-{[(4-苯磺酰基)-噻吩-2-基]-磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:如实施例1a所述,用2-{[(4-苯磺酰基)-噻吩-2-基]-磺酰基}氯(340毫克,1.05毫摩尔)处理,将原料氨基甲酸叔丁酯1c(0.276毫克,1.16毫摩尔)转变成标题所示的磺酰胺。
ESI MS:m/z(相对强度)570(46,M+NH4 +),490(100,M+H+)。
b.用3毫升甲醇和5毫升水中的氢氧化钠(61毫克,1.5毫摩尔)处理甲酯27a(0.15克,0.30毫摩尔),在室温下搅拌17小时。溶液用1N HCl酸化至pH2-3,然后用乙酸乙酯萃取。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。固体残余物在乙酸乙酯/己烷(1∶4)中重结晶,得到所需产物。
ESI MS:m/z(相对强度)493(100,M+NH4 +),476(12,M+H+)。
实施例28
2-{[(5-苯磺酰基)-噻吩-2-基]-磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a:2-{[(5-苯磺酰基)-噻吩-2-基]-磺酰基}-氨基-5-苯基戊炔酸甲酯:如实施例1a所述,用2-{[(5-苯磺酰基)-噻吩-2-基]-磺酰基}氯(620毫克,1.93毫摩尔)处理,将原料氨基甲酸叔丁酯1c(0.42毫克,1.75毫摩尔)转变成标题所示的磺酰胺。
ESI MS:m/z(相对强度)507(75,M+NH4 +),490(100,M+H+)。
b.如化合物27b所述,将甲酯28a(0.185克,0.39毫摩尔)转变成标题所示的酸。
ESI MS:m/z(相对强度)493(86,M+NH4 +),476(100,M+H+)。
实施例29
2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-(3-N-吗啉代)-苯基戊-4-炔酸的
制备
如实施例25所述,将甲酯5a转变成标题化合物。
实施例30
2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-(3-N,N-二甲氨基)-苯基戊-4-炔
酸的制备
如化合物5a所述,制备甲酯5a的二甲氨基类似物,然后如实施例25所述,转变成标题化合物。
实施例31-58
实施例31
2-[(1,1'-联苯基-4-基)-磺酰基]-氨基-6-吡咯烷子基己-4-炔酸的制备
a.叔丁氧羰基氨基-6-吡咯烷子基己-4-炔酸甲酯:取吡咯烷(936毫升,11.2毫摩尔)在6毫升二噁烷中,用多聚甲醛(对于单体而言,337毫克,11.2毫摩尔)处理,搅拌所得混合物30分钟。将游离的乙炔4e(1.7克,7.49毫摩尔)另外溶解到二噁烷中,加入前述溶液,用Cu(acac)2(392毫克,1.5毫摩尔)处理,90℃加热3小时,然后在乙酸乙酯和稀释的碳酸钠之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。然后将粗制残余物吸附到硅胶上,用乙酸乙酯∶甲醇(1∶0至5∶1)洗脱通过快速硅胶柱,得到浅黄色浆状物。
ESI MS:m/z(相对强度)311.1(100,M+H+),255.0(65),211.0(10)。
b.2-(4-碘苯磺酰基)-氨基-6-吡咯烷子基己-4-炔酸甲酯:将原料氨基甲酸叔丁酯31a(1.04克,3.35毫摩尔)加入15毫升甲醇中,用2毫升亚硫酰氯处理。搅拌所得混合物30分钟,并蒸发至干。然后将残余物加入二氯甲烷和3毫升三乙胺中,用对碘苯磺酰氯(1.32克,4.36毫摩尔)处理,搅拌该混合物18小时,然后在三氯甲烷和稀释碳酸钠之间分配。有机层用硫酸镁干燥,过滤并蒸发,将粗品吸附到硅胶上,用乙酸乙酯∶甲醇(1∶0至2∶1)洗脱通过快速硅胶柱,得到标题化合物31b和未磺酰化的游离的胺31c。
31b:ESI MS:m/z(相对强度)476.9(100,M+H+),211.1(20)。
31c:ESI MS:m/z(相对强度)211.1(100,M+H+),102.1(100)。
d.2-[(1,1'-联苯基-4-基)-磺酰基]-氨基-6-吡咯烷子基己-4-炔酸甲酯:将游离的胺31c(132毫克,0.628毫摩尔)和联苯基磺酰氯(190毫克,0.754毫摩尔)加入含0.5毫升三乙胺的3毫升三氯甲烷中,搅拌18小时。然后在三氯甲烷和稀释的三氯甲烷之间分配。有机层用硫酸镁干燥,过滤并蒸发。残余物吸附到硅胶上,用乙酸乙酯∶甲醇(1∶0至5∶1)洗脱通过快速硅胶柱,得到浅黄色浆状物。
ESI MS:m/z(相对强度)457.0(7,M+H+)。
e.将甲酯31d(105毫克,0.25毫摩尔)加入10毫升甲醇∶水(10∶1)中,用氢氧化钾(115毫克,2.05毫摩尔)处理。搅拌所得混合物18小时,蒸发至干,在饱和磷酸二氢钠和三氯甲烷∶甲醇(15∶1)之间分配。分层,类似地萃取水层两次。合并有机层,用硫酸镁干燥,过滤并蒸发。然后在甲醇∶乙酸乙酯(4∶1)中重结晶浅橙色残余物粗品,得到灰白色固体。
ESI MS:m/z(相对强度)443.0(100,M+H+)。
实施例32
2-{[4'-甲氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吡咯烷子基己-4-炔酸的制备
a.2-{[4'-甲氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吡咯烷子基己-4-炔酸甲酯:将原料磺酰胺31b(403毫克,0.847毫摩尔)和4-甲氧基苯基硼酸(193毫克,1.27毫摩尔)加入含有Pd(PPh3)4(29毫克,0.025毫摩尔)和200毫克碳酸钠的10毫升苯、1.5毫升乙醇和1.5毫升水中,回流18小时。然后使混合物在乙酸乙酯和稀释的碳酸钠之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。将粗品吸附到硅胶上,用乙酸乙酯∶甲醇(1∶0至4∶1)洗脱通过快速硅胶,得到浅橙色焦油。
ESI MS:m/z(相对强度)457.0(100,M+H+)。
b.如化合物31e所述,使甲酯32a(201毫克,0.44毫摩尔)皂化。然后在甲醇∶乙酸乙酯(4∶1)中重结晶浅橙色粗品残余物,得到浅橙色固体。
ESI MS:m/z(相对强度)443.(100,M+H+)。
实施例33
2-[(1,1'-联苯基)-4-基-磺酰基]-氨基-6-吗啉代己-4-炔酸的制备
a.2-N-叔丁氧羰基氨基-6-吗啉代己-4-炔酸甲酯:如化合物31a所述,使吗啉(3.23毫升,37.1毫摩尔)与多聚甲醛(对于单体而言,1.12毫克,37.1毫摩尔)和游离的乙炔4e(5.62克,24.8毫摩尔)相连,得到标题化合物为浅黄色浆状物。
ESI MS:m/z(相对强度)327.1(85,M+H+),227.1(100)。
b.2-[(1,1'-联苯基)-4-基-磺酰基]-氨基-6-吗啉代己-4-炔酸甲酯:使原料氨基甲酸叔丁酯33a(614毫克,1.39毫摩尔)去保护,如化合物31b所述与联苯基磺酰氯(702毫克,2.78毫摩尔)连接,得到标题化合物为浅黄色焦油。
ESI MS:m/z(相对强度)476.9(100,M+H+),211.1(20)。
c.如化合物31e所述,使甲酯33b(252毫克,0.57毫摩尔)水解,得到标题化合物。
ESI MS:m/z(相对强度)429.0(100,M+H+)。
实施例34
2-{[4'-甲氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸的制备
a.2-(4-碘苯磺酰基)-氨基-6-吗啉代己-4-炔酸甲酯:如化合物31b所述,使料氨基甲酸叔丁酯31a(6.10克,18.7毫摩尔)去保护,与对碘苯磺酰氯(5.01克,16.84毫摩尔)连接,得到标题化合物为浅黄色焦油。
ESI MS:m/z(相对强度)492.9(100,M+H+)。
b.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸甲酯:如化合物32a所述,使原料磺酰胺34a(500毫克,1.02毫摩尔)与4-甲氧基苯基-硼酸(233毫克,1.53毫摩尔)相连,得到标题化合物为浅棕色固体。
ESI MS:m/z(相对强度)473.0(100,M+H+)。
c.如化合物31e所述,使甲酯34b(36毫克,0.076毫摩尔)水解,得到标题化合物为黄色固体。
ESI MS:m/z(相对强度)459.1(100,M+H+)。
实施例35
2-{[4'-甲硫基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代-4-炔酸的制备
a.2-{[4'-甲硫基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸甲酯:如化合物32a所述,使原料磺酰胺34a(500毫克,1.02毫摩尔)与4-甲硫基苯基-硼酸(257毫克,1.53毫摩尔)相连,得到标题化合物为浅橙色固体。
ESI MS:m/z(相对强度)489.0(100,M+H+)。
b.如化合物31e所述,使甲酯35b(40毫克,0.081毫摩尔)水解,得到16毫克标题化合物黄色固体。
ESI MS:m/z(相对强度)475.0(100,M+H+)。
实施例36
2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-6-吗啉代己-4-炔酸的制备
a.2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-6-吗啉代己-4-炔酸甲酯:将原料磺酰胺31b(1.00克,2.03毫摩尔)和4-甲氧基苯基乙炔(350毫克,2.64毫摩尔)加入含Pd(PPh3)2Cl2(72毫克,0.102毫摩尔)、CuI(40毫克,0.20毫摩尔)和三乙胺(0.565毫升,4.06毫摩尔)的20毫升DMF中,于55℃搅拌16小时。然后将混合物稀释在乙酸乙酯中,用稀释的碳酸钠洗涤三次,用盐水洗涤一次,用硫酸镁干燥,过滤并浓缩。将粗品吸附在硅胶上,用乙酸乙酯∶己烷(1∶1至1∶0)洗脱通过快速硅胶,得到浅橙色焦油。
ESI MS:m/z(相对强度)497.4(100,M+H+)。
b.如化合物30e所述,使甲酯36a(920毫克,1.85毫摩尔)水解,得到标题化合物为固体。
ESI MS:m/z(相对强度)521.0(100,M+K+)。
实施例37
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸的制备
如化合物31b所述,使磺酰氯9g与氨基甲酸叔丁酯33a相连,所得磺酰胺如化合物31e所述那样水解,得到标题化合物。
实施例38
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-苯基哌嗪-1N-基)-己-4-炔
酸的制备
a.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-戊-4-炔酸甲酯:将(±)炔丙基甘氨酸(propargyl glycene)(2.15克,18.9毫摩尔)加入50毫升甲醇中,用3毫升亚硫酰氯处理。在室温下搅拌所得混合物16小时,然后蒸发至干。将所得残余物溶解在40毫升三氯甲烷、20毫升DMF和25毫升三乙胺中,用4-甲氧基联苯基磺酰氯处理,在室温下搅拌16小时。然后在5%碳酸氢钠和己烷∶乙酸乙酯(1∶3)之间分配。有机层用5%碳酸氢钠洗涤两次,用盐水洗涤一次,用硫酸镁干燥,过滤并蒸发,得到黄-棕色固体,该固体在异丙醇∶己烷中重结晶,得到褐色固体。
b.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-苯基哌嗪-1N-基)-己-4-炔酸甲酯:如化合物31a所述,使N-苯基-1,4-哌嗪(478毫克,2.95毫摩尔)与多聚甲醛(对于单体而言,96毫克,3.21毫摩尔)和游离的乙炔38e(1.0克,2.68毫摩尔)相连,得到标题化合物为白色固体。
ESI MS:m/z(相对强度)548.2(100,M+H+)。
c.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-苯基哌嗪-1N-基)-己-4-炔酸:如化合物31e所述,使甲酯38a水解,得到标题所示的酸。
ESI MS:m/z(相对强度)556.1(25,M+Na+),534.1(100,M+H+)。
实施例39
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-叔丁氧羰基哌嗪-1N-基)-
己-4-炔酸的制备
a.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-叔丁氧羰基哌嗪-1N-基)-己-4-炔酸甲酯:如化合物31a所述,使N-叔丁氧羰基-1,4-哌嗪(8.14克,4.37毫摩尔)与多聚甲醛(对于单体而言,143毫克,4.7毫摩尔)和游离的乙炔38e(1.48克,3.97毫摩尔)相连,得到标题化合物为浅黄色浆状物,该浆状物在静置后固化。
ESI MS:m/z(相对强度)572.2(100,M+H+)。
b.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-叔丁氧羰基哌嗪-1N-基)-己-4-炔酸:如化合物31e所述,使甲酯39a水解,得到标题所示的酸。
ESI MS:m/z(相对强度)558.2(100,M+H+)。
实施例40
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-甲磺酰基哌嗪-1N-基)-己-
4-炔酸的制备
a.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-甲磺酰基哌嗪-1N-基)-己-4-炔酸甲酯:将保护的哌嗪31a(213毫克,0.37毫摩尔)加入25毫升二氯甲烷中,在室温下用4毫升三氟乙酸处理。搅拌所得混合物3小时,然后蒸发至干,用三氯甲烷研制。将残余物溶解在25毫升二氯甲烷中,用3毫升三乙胺处理,然后用甲磺酰氯(0.032毫升,0.41毫摩尔)处理。搅拌所得混合物3小时,然后在5%碳酸氢钠和乙酸乙酯之间分配。用盐水洗涤有机层,用硫酸镁干燥,过滤并蒸发,得到灰白色固体,用乙酸乙酯对该固体进行快速色谱纯化,得到白色固体。
ESI MS:m/z(相对强度)550.0(100,M+H+)。
b.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-叔丁氧羰基哌嗪-1N-基)-己-4-炔酸:如化合物31e所述,使甲酯40a水解,得到标题所示的酸。
ESI MS:m/z(相对强度)536.0(100,M+H+)。
实施例41
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-乙酰基哌嗪-1N-基)-己-4-
炔酸的制备
a.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-甲磺酰基哌嗪-1N-基)-己-4-炔酸甲酯:如化合物40a所述,使有保护的哌嗪31a(210毫克,0.37毫摩尔)去保护,用乙酸酐处理,转变成乙酸衍生物。
ESI MS:m/z(相对强度)514.1(85,M+H+)。
b.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-叔丁氧羰基哌嗪-1N-基)-己-4-炔酸:如化合物31e所述,使甲酯40a水解,得到标题所示的酸。
ESI MS:m/z(相对强度)500.1(85,M+H+)。
实施例42
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吡咯烷子基-己-4-炔酸的制备
如化合物31b所述,使磺酰氯9g与氨基甲酸叔丁酯31a相连,如化合物31e所述,使所得磺酰胺水解,得到标题化合物。
实施例43
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(N,N-二甲氨基)-己-4-炔酸的制
备
a.叔丁氧羰基氨基-6-(N,N-二甲氨基)-己-4-炔酸甲酯:如化合物30a所述,使二甲胺与多聚甲醛和游离的乙炔4e相连,得到标题化合物。
b.如化合物31b所述,使磺酰氯9g与氨基甲酸叔丁酯43a相连,如化合物31e所述,使所得磺酰胺水解,得到标题化合物。
实施例44
2-[4-(N-4-甲氧基苯甲酰基)-氨基苯磺酰基]-氨基-6-吗啉代己-4-炔酸的制备
a.2-(4-乙酰氨基苯磺酰基)-氨基-6-吗啉代己-4-炔酸甲酯:如化合物31b所述,使氨基甲酸叔丁酯33a去保护,并与4-乙酰氨基苯磺酰氯相连,得到标题化合物。
b.2-[4-(N-4-甲氧基苯甲酰基)-氨基苯磺酰基]-氨基-6-吗啉代己-4-炔酸甲酯:使乙酰胺44a在3N HCl中加热回流3小时,然后浓缩至干,与甲苯共沸。将所得残余物溶解在甲醇中,然后缓慢加入亚硫酰氯。搅拌混合物18小时,减压除去溶剂。将粗制的苯胺磺胺中间产物溶解在二氯甲烷中,冷却至0℃。加入4-甲基吗啉,然后加入4-甲氧基苯甲酰氯。搅拌反应混合物18小时,用水稀释,然后用乙酸乙酯萃取三次。合并的乙酸乙酯层用稀释的碳酸钠、水、盐水洗涤,用硫酸镁干燥,浓缩成固体,用乙酸乙酯将该固体洗脱通过快速硅胶,得到标题化合物。
ESI MS:m/z(相对强度)516.1(100,M+H+)。
c.如化合物31e所述,使甲酯44b水解,得到标题化合物为固体。
ESI MS:m/z(相对强度)524.1(25,M+Na+),502.1(100,M+H+)。
实施例45
2-[4-(N-4-正丁氧基苯甲酰基)-氨基苯磺酰基]-氨基-6-吗啉代己-4-炔酸的制备
a.2-[4-(N-4-正丁氧基苯甲酰基)-氨基苯磺酰基]-氨基-6-吗啉代己-4-炔酸甲酯:如化合物44b所述,用正丁氧基苯处理,将乙酰胺44a转变成标题化合物。
b.如化合物31e所述,使甲酯45b水解,得到标题化合物为固体。
实施例46
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔酸的制备
a.丁基-2-羟基-6-苯基己-4-炔基醚:将原料3-苯基-1-丙炔(2.71克,23.4毫摩尔)加入氩气下的100毫升干THF中,冷却至-78℃。滴加入正丁基锂(9.36毫升,23.4毫摩尔)溶液,使该混合物搅拌15分钟,滴加乙醚和三氟化硼(BF3·OEt2)(2.91毫升,23.4毫摩尔),再搅拌15分钟。然后滴加入叔丁基缩水甘油基醚(3.01毫升,21.2毫摩尔)。使混合物搅拌15分钟,然后除去冷却浴,使溶液变为室温1小时。用饱和氯化铵淬灭反应物,然后在水和乙酸乙酯之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发,得到粗制的浆状物,使其吸附在硅胶上,用己烷∶乙酸乙酯(10∶1至2∶1)洗脱通过快速硅胶柱,得到标题所示的醚为澄清的浆状物。
b.叔丁基-2-甲磺酰基氧-6-苯基己-4-炔基醚:将原料醇46a(2.61克,10.6毫摩尔)加入含2毫升三乙胺的100毫升二氯甲烷中,用甲磺酰氯(1.64毫升,21.2毫摩尔)处理,然后搅拌18小时。然后使混合物在三氯甲烷和1N HCl之间分配。有机层用硫酸镁干燥,过滤并蒸发。将粗品吸附在硅胶上,用己烷∶乙酸乙酯(10∶1至2∶1)洗脱通过快速硅胶,得到所需物质为浅黄色浆状物。
c.1-羟基-2-叠氮基-6-苯基己-4-炔;将甲烷磺酸46b(1.05克,3.24毫摩尔)加入25毫升二氯甲烷,用2毫升三氟乙酸处理,搅拌所得深棕色溶液2小时。用二氯甲烷稀释该混合物,用稀释的碳酸氢钠洗涤,用硫酸镁干燥,过滤并蒸发。将残余物加入10毫升DMF中,用1克叠氮钠处理,65℃下加热18小时。用己烷∶乙酸乙酯(1∶2)稀释该混合物,用水洗涤三次,用盐水洗涤一次,用硫酸镁干燥,过滤并蒸发。使棕色残余物吸附到硅胶上,用己烷∶乙酸乙酯(4∶1至1∶3)洗脱通过快速硅胶,得到标题化合物为褐色胶状物。
d.1-羟基-2-(4-溴苯磺酰基)-氨基-6-苯基己-4-炔:将叠氮物46c(443毫克,2.06毫摩尔)加入含有三苯膦(1.08克,4.12毫摩尔)的5毫升THF中,用0.3毫升水处理。搅拌该混合物18小时,用10毫升二噁烷、1毫升水和2.5毫升三乙胺稀释,然后用4-溴苯磺酰氯处理。搅拌该混合物2小时,然后在乙酸乙酯和1N HCl之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。然后将褐色残余物吸附到硅胶上,用己烷∶乙酸乙酯(4∶1至1∶4)洗脱通过快速硅胶柱,得到标题化合物为浅黄色固体。
e.1-羟基-2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔:在4-甲氧基苯硼酸、四三苯膦合钯(50毫克)、碳酸钠(150毫克)、1毫升水和1毫升乙醇存在下,将溴化物46d(330毫克,0.81毫摩尔)加入10毫升苯中。使该混合物回流18小时,然后在水和己烷∶乙酸乙酯(1∶2)之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发,得到残余物吸附硅胶上,并用己烷∶乙酸乙酯(2∶1至1∶3)洗脱通过快速硅胶,得到标题化合物为浅黄色油。
f.将醇46e(159毫克,0.36毫摩尔)加入100毫升丙酮中,滴加入琼斯试剂处理,直至橙色持续存在。搅拌该混合物50分钟,然后用过量异丙醇淬灭,再搅拌30分钟。过滤出细小的绿色沉淀,蒸发溶剂。残余物用三氯甲烷∶甲醇(1∶0至5∶1)洗脱通过短的快速硅胶柱,得到标题化合物为灰白色固体。
实施例47
2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔酸的制
备
a.1-羟基-2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔:如化合物46d所述,使叠氮物46c与磺酰氯10a相连,得到标题化合物。
b.如化合物46f所述,将醇47a氧化成标题所示的酸。
实施例48
2-{[4'-(2-N-吡咯烷子基-乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔
酸的制备
a.1-羟基-2-{[4-(2-N-吡咯烷子基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔:如化合物46d所述,使叠氮物46c与磺酰氯11a相连,得到标题化合物。
b.如化合物46f所述,将醇48a氧化成标题所示的酸。
实施例49
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯氧基己-4-炔酸的制备
a.叔丁基-2-羟基-6-苯氧基己-4-炔基醚:如化合物46a所述,使原料3-苯氧基-1-丙炔与叔丁基缩水甘油基醚相连。
b.按照化合物46b-f所述的次序进行反应,从化合物49a制得作为标题所示的酸。
实施例50
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
a.叔丁基-2-羟基-6-甲氧基己-4-炔基醚:如化合物46a所述,使原料3-甲氧基-1-丙炔与叔丁基缩水甘油基醚相连。
b.1-羟基-2-叠氮基-6-甲氧基己-4-炔基醚:按照化合物46b-c的反应次序,将原料醚50a变成标题所示的叠氮物。
c.根据化合物46d-f描述的反应次序,从化合物50b制得标题所示的酸。
实施例51
2-{[4'-溴-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
a.叔丁基-2-羟基-6-甲氧基己-4-炔基醚:按照化合物46b-c所述的反应次序,将原料甲氧基炔50a变成其相应的2-叠氮基衍生物。
b.1-羟基-2-{[4'-溴-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔:在三苯膦(9.6克,37毫摩尔)存在下,将叠氮物51c(2.5克,14.7毫摩尔)加入30毫升THF中,用5毫升水处理。使混合物在1N HCl和己烷∶乙酸乙酯(1∶3)之间分配。有机层用1N HCl提取,用固体碳酸氢钠中和合并的水层,用等体积二噁烷稀释,用[4'-溴-(1,1'-联苯基)-4-基]-磺酰氯(5.3克,16.7毫摩尔)处理,搅拌所得溶液16小时,然后在乙酸乙酯和水之间分配。有机层1N HCl和盐水洗涤,用硫酸镁干燥,过滤并蒸发。所得固体用己烷∶乙酸乙酯(1∶1)的柱色谱纯化,得到标题化合物为白色固体。
b.如化合物46f所述,从化合物51b制得标题所示的酸。
实施例52
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-N-甲基-氨基-6-甲氧基己-4-炔酸的制
备
a.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-N-甲基-氨基-6-甲氧基己-4-炔酸甲酯:将酸51(500毫克,1.23毫摩尔)溶解在20毫升甲醇中,用8毫升亚硫酰氯处理。在室温下搅拌所得混合物18小时,然后蒸发。将残余物固体溶解在10毫升二甲基乙酰胺中,在600毫克Cs2CO3存在下,用甲基碘(0.092毫升,1.47毫摩尔)处理。搅拌所得混合物2小时,然后在乙酸乙酯和水之间分配。用水洗涤有机层,然后用盐水洗涤,用硫酸镁干燥,过滤并蒸发,得到黄色油。
如化合物46f所述,从化合物52b制得标题所示的酸。
实施例53
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(2-甲氧基乙氧基)-甲氧基己-4-
炔酸的制备
a.叔丁基2-羟基-6-叔丁基二甲基甲硅烷氧基己-4-炔基醚:如化合物46a所述,将原料叔丁基二甲基甲硅烷基-1-丙炔(20克,133毫摩尔)转变成标题所示的醚。
b.叔丁基2-甲磺酰基氧-6-叔丁基二甲基甲硅烷氧基己-4-炔基醚:如化合物46b所述,将原料醇46a(34.3克,114毫摩尔)转变成其相应的甲磺酸酯。
c.叔丁基2-甲磺酰氧基-6-苯甲酰氧基己-4-炔基醚:将原料甲硅烷氧基醚(28克,74毫摩尔)加入500毫升四氢呋喃中,用四丁基氟化铵(96毫升,96毫摩尔)处理,所得混合物在室温下搅拌1小时,然后在乙酸乙酯和水之间分配。有机层用水然后用盐水洗涤,用硫酸镁干燥并蒸发。将残余物加入100毫升二氯甲烷和40毫升吡啶中,用苯甲酰氯(12毫升,101毫摩尔)处理。室温下搅拌所得混合物3天,并蒸发。将残余物加入己烷中过滤。将滤液加入己烷∶乙酸乙酯(1∶4)中,用水和盐水洗涤,用硫酸镁干燥,过滤并蒸发。残余物用己烷∶乙酸乙酯(9∶1)进行色谱纯化,得到黄色固体。
d.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯甲酰氧基己-4-炔酸:按照46c-f的反应次序,将甲磺酸酯53c(12克,32.6毫摩尔)转变成标题所示的酸。
e.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-羟基己-4-炔酸:将原料酸53d(3.14克,6.36毫摩尔)加入25毫升甲醇中,用1.9毫升亚硫酰氯处理。所得混合物在室温下搅拌16小时,然后蒸发至干。残余物用己烷∶乙酸乙酯(7∶3至1∶1)色谱纯化,得到产物为白色固体。
f.2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(2-甲氧基-乙氧基)-甲氧基己-4-炔酸甲酯:在0.3毫升二异丙基乙胺存在下,将原料醇53e(419毫克1.04毫摩尔)加入4毫升二氯甲烷中,用甲氧基乙氧基甲基氯处理。所得溶液搅拌16小时,蒸发。残余物用己烷∶乙酸乙酯(4∶1至1∶1)色谱纯化,得到产物为白色泡沫。
g.将原料酯53f(29毫克,0.06毫摩尔)加入70毫升THF∶水(1∶1)中,用氢氧化锂(25毫克,0.6毫摩尔)处理。在室温下搅拌所得溶液1小时,然后在1N HCl和乙酸乙酯之间分配。有机层用硫酸镁干燥,过滤并蒸发,得到标题所示的酸为无色胶状物。
ESI MS:m/z(相对强度)495.0(100,M+NH4 +),476.0(100,M-H+)。
实施例54
2-{[4'-溴-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯氧基己-4-炔酸的制备
按照化合物46b-f所述的反应次序,将原料叔丁氧基-2-羟基-6-苯氧基己-4-炔基醚49a转变成标题所示的酸。
实施例55
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
a.叔丁基2-羟基-6-甲氧基己-4-炔基醚:如化合物46a所述,使原料3-苯基-1-丙炔与叔丁基缩水甘油基醚相连。
b.1-羟基-2-叠氮基-6-甲氧基己-4-炔:根据46b-c的反应次序,从化合物55a制得标题所示的叠氮物。
c.根据46d所述的步骤,使叠氮物55b分解,并与磺酰氯9g相连,随后根据46f所述的步骤使所得磺酰胺氧化。
实施例56
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯硫基己-4-炔酸的制备
a.叔丁基2-羟基-6-苯硫基己-4-炔基醚:如化合物46a所述,使原料3-苯硫基-1-丙炔与叔丁基缩水甘油基醚相连。
b.根据化合物46b-f所述的反应次序,从化合物56a制得标题所示的酸。
实施例57
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-[5-(呋喃-2-基)-噁二唑-2-基]-硫
代己-4-炔酸的制备
a.叔丁基2-羟基-6-[5-(呋喃-2-基)-噁二唑-2-基]-硫代己-4-炔基醚:如化合物46a所述,使原料3-[5-(呋喃-2-基)-噁二唑-2-基]-硫代-1-丙炔与叔丁基缩水甘油基醚相连。
b.根据化合物46b-f所述的反应次序,从化合物57a制得标题所示的酸。
实施例58
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-[5-(N-吡咯烷基)-噻二唑-2-基]-
硫代己-4-炔酸的制备
a.叔丁基2-羟基-6-[5-(N-吡咯烷基)-噻二唑-2-基]-硫代己-4-炔基醚:如化合物46a所述,使原料3-[5-(N-吡咯烷基)-噻二唑-2-基]-硫代-1-丙炔与叔丁基缩水甘油基醚相连。
根据化合物46b-f所述的反应次序,从化合物58a制得标题所示的酸。
实施例59-62
表4
实施例59
反式2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-烯酸的制备
a.反式2-(4-碘苯磺酰基)-氨基-5-苯基戊烯酸甲酯:如3a所述,使原料反式2-N-叔丁氧羰基-氨基-5-苯基戊-4-烯酸(700毫克,2.3毫摩尔,如Tetrahedron Lett.,1994,35,3669所述制得)去保护,用对碘苯磺酰氯(626毫克,2.07毫摩尔)磺酰化,得到217毫克白色固体。
ESI MS:m/z(相对强度)488.9(100,M+NH4 +),471.9(50,M+H+)。
b.反式2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊烯酸甲酯:如化合物3b所述,使原料磺酰胺59a(217毫克,0.46毫摩尔)与4-甲氧基苯基硼酸(105毫克,0.69毫摩尔)相连,得到130标题化合物为浅橙色固体。
ESI MS:m/z(相对强度)499.0(70,M+NH4 +),452.0(100,M+H+)。
c.在碘化锂(152毫克,1.14毫摩尔)存在下,将原料磺酰胺59b(43毫克,0.46毫摩尔)溶解在吡啶中,回流5小时。然后将混合物浓缩至干,用乙酸乙酯吸收,用1N HCl洗涤三次,用盐水洗涤一次,硫酸镁干燥,过滤并蒸发。粗品用乙酸乙酯∶甲醇(1∶0至4∶1)进行快速硅胶纯化,得到24毫克黄色油,其在静置后固化。
ESI MS:m/z(相对强度)455.0(50,M+NH4 +),438.0(100,M+H+)。
实施例60
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-3-苯甲酰氧甲基-戊-4-烯酸的制
备
a.N-叔丁氧羰基-甘氨酸(glycene)-(顺式-4-苯甲酰氧丁-2-烯基)酯:将N-叔丁氧羰基-甘氨酸(21.9克,0.125摩尔)、顺式-4-苯甲酰氧-2-丁烯-1-醇(25毫升,0.15摩尔)和4-二甲氨基吡啶(1.5克,0.013摩尔)溶解在二氯甲烷中,于0℃下搅拌。然后,加入在30毫升二氯甲烷中的N,N-二环己基-碳化二亚胺(31克,0.15摩尔),反应物于0℃搅拌5分钟。然后,使反应物于25℃搅拌12小时。加热额外量的二氯甲烷,用1NHCl、碳酸氢钠、然后盐水洗涤反应物。有机萃取物用硫酸镁干燥,真空蒸发溶剂,得到橙色油,将其吸附到硅胶上,施加到干的硅胶柱上,用己烷∶乙酸乙酯(9∶1)、然后是己烷∶乙酸乙酯(8∶2)洗脱。合并产物组分,真空干燥,得到标题化合物为固体。
b.2-N-叔丁氧羰基-氨基-3-苯甲酰氧甲基-戊-4-烯酸:从THF(30毫升,冷却至-20℃)和正丁基锂(3.7毫升,10M在己烷中,37.3毫摩尔)中的N,N-二异丙胺(5.2毫升,37.2毫摩尔)制得LDA溶液(37.3毫摩尔)。将THF中的LDA溶液加入含烯丙基酯60a(5.0克,14.9毫摩尔)和氯化锌(17.9毫摩尔)的100毫升THF(-78℃)的搅拌溶液中。使该混合物回至室温过夜。使粗制的混合物在700毫升乙酸乙酯和1N HCl之间分配。有机层用150毫升碳酸氢钠烯溶液洗涤(3次)。碳酸氢钠洗液用浓盐酸酸化至pH1,用700毫升乙酸乙酯萃取。乙酸乙酯层用硫酸镁干燥,真空除去溶剂,得到白色固体。
c.2-N-(4-溴苯磺酰基)-氨基-3-苄氧基甲基-戊-4-烯酸甲酯:将烯烃物质60b(1.8克,5.27毫摩尔)溶解在54毫升甲醇中,在混合物中滴加入8.3毫升亚硫酰氯,在室温下搅拌直至反应完全(用薄层色谱法)。干燥粗制的反应物,用甲醇(3X)再蒸发。干燥的反应物用二氯甲烷(30毫升)和三乙胺(7毫升)吸收。加入4-溴苯磺酰氯(1.23克,4.83毫摩尔),搅拌反应物过夜。真空除去反应溶剂,用乙酸乙酯吸收,用1N HCl洗涤,然后用碳酸氢钠溶液洗涤,最后用盐水洗涤,然后用硫酸镁干燥,真空除去溶剂。将粗品吸附到硅胶上,用己烷、然后是己烷∶乙酸乙酯(8∶2)洗脱,在硅胶柱上纯化。合并产物组分,干燥得到黄色油。
d.2-N-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-3-苯甲酰氧甲基-戊-4-烯酸甲酯:将烯烃物质60c(320毫克,0.683毫摩尔)溶解在苯(4毫升)中,将碳酸钠(148毫克)(水(0.6毫升)中)和四(三苯膦)合钯一起加入。加入含4-甲氧基苯基硼酸(157毫克,1.03毫摩尔)的甲醇(0.4毫升)中,使混合物回流过夜。在反应物中加入乙醚,用水(2x)和盐水(1x)洗涤,有机层用硫酸镁干燥,真空除去溶剂,得到黄色固体。将粗品吸附在硅胶上,用己烷∶乙酸乙酯(9∶1)、然后是己烷∶乙酸乙酯(1∶1)洗脱,进行硅胶柱纯化。合并产物组分,干燥得到标题所示的化合物为黄色油。
e.将烯烃物质60d(207毫克,0.42毫摩尔)溶解在甲醇∶水(10∶1)(5.5毫升)中,加入氢氧化钾(424毫克,7.52毫摩尔),然后在室温下搅拌该混合物直至反应完全。加入乙酸乙酯,用1N HCl(1x)和盐水(1x)洗涤粗制的反应物。有机层用硫酸镁干燥,真空除去溶剂。将粗品吸附在硅胶上,用乙酸乙酯∶己烷(1∶1)、然后是乙酸乙酯洗脱,在硅胶柱上纯化。然后用乙酸乙酯∶甲醇(9∶1)洗脱产物,合并产物组分,真空除去溶剂,得到标题化合物为异构体的混合物。
ESI MS:m/z(相对强度)486.2(100,M+H+)。
实施例61
2-[(1,1'-联苯基)-4-基]-磺酰基-氨基-3-苯甲酰氧甲基-戊-4-烯酸的制备
a.2-[(1,1'-联苯基)-4-基]-磺酰基-氨基-3-苯甲酰氧甲基-戊-4-烯酸甲酯:将烯烃物质60b(200毫克,0.597毫摩尔)溶解在甲醇(5.4毫升)中,在混合物中滴加入亚硫酰氯(830毫升),在室温下搅拌,直至薄层色谱确定反应完全。蒸干粗制的反应物,用甲醇(3X)再蒸发。干燥的反应物用二氯甲烷(3毫升)和三乙胺(0.7毫升)吸收。加入联苯基-4-苯磺酰氯(136毫克,0.537毫摩尔),搅拌反应物过夜。真空除去反应溶剂,用乙酸乙酯吸收油,用1N HCl洗涤,然后用碳酸氢钠溶液洗涤,最后用盐水洗涤,然后用硫酸镁干燥,真空除去溶剂。将粗品吸附到硅胶上,用己烷、然后是己烷∶乙酸乙酯(8∶2)洗脱,在硅胶柱上纯化。合并产物组分,干燥得到黄色油。
b.将甲酯61a(40毫克,0.086毫摩尔)溶解在甲醇∶水(10∶1)(1.1毫升)中,加入氢氧化钾(90毫克,1.6毫摩尔),然后在室温下搅拌该混合物直至反应完全。加入乙酸乙酯,用1N HCl(1x)和盐水(1x)洗涤粗制的反应物。有机层用硫酸镁干燥,真空除去溶剂。将粗品吸附在硅胶上,用乙酸乙酯∶己烷(1∶1)、然后是乙酸乙酯洗脱,在硅胶柱上纯化。然后用乙酸乙酯∶甲醇(9∶1)洗脱产物,合并产物组分,真空除去溶剂,得到标题化合物。
ESI MS:m/z(相对强度)469.1(45,M+NH4 +),452.1(100,M+H+)。
实施例62
顺式2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(N-吡咯烷子基羰基)-戊-
4-烯酸的制备
a.顺式-2-溴-N-吡咯烷子基羰基乙烯:将顺式-3-溴戊烯酸乙酯加入二氯甲烷,用过量吡咯烷处理2小时,得到所需酰胺。
b.叔丁基2-羟基-6-苯基己-4-烯基醚:在氩气下将原料溴代链烯62a加入干的THF中,冷却至-78℃。滴加入2当量叔丁基锂溶液,使混合物搅拌20分钟,然后滴加入1当量叔丁基缩水甘油基醚在THF中的溶液。搅拌混合物15分钟,然后移去冷却浴,使溶液温至室温1小时。反应物用饱和氯化铵淬灭,然后在水和乙酸乙酯之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发,得到粗品。将其吸附到硅胶上,用快速硅胶柱洗脱,得到标题所示的酰胺。
c.如化合物46b-f所述,将酰胺62b转变成标题所示的酸。
实施例63-68
下列化学式和表5显示了根据下文实施例63-68的描述制得的化合物的结构:
实施例63
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸
的制备
a.(4S,1'R)-2,2-二甲基-4-(1'-羟基-3'-苯基丙-2'-炔基)噁唑烷-3-羧酸叔丁酯:将含苯乙炔(1.73克,17毫摩尔)的THF(75毫升)溶液冷却至-78℃,然后加入正丁基锂(2.5M,6.3毫升,15.7毫摩尔)。将所得混合物温至-20℃,搅拌15分钟。将混合物重新冷却至-78℃,然后缓慢加入在THF(10毫升)中的(S)-4-甲酰基-2,2-二甲基-3-噁唑烷羧酸叔丁酯(3克,13.1毫摩尔)。然后使混合物温至-20℃,搅拌30分钟。通过加入饱和氯化铵溶液(30毫升),将反应物淬灭。然后将混合物倒入水中,用二氯甲烷萃取。用硫酸镁干燥有机萃取物,然后减压浓缩成油。用9∶1的己烷∶乙酸乙酯作为洗脱剂,在硅胶上色谱纯化油,得到2.20克所需化合物作为浅色油。
ESI MS:m/z(相对强度)332(100,M+H+)。
b.(4S,1'R)-2,2-二甲基-4-(1'-甲氧基-3'-苯基丙-2'-炔基)-噁唑烷-3-羧酸叔丁酯:在0℃下搅拌THF(150毫升)中的醇63a(10.04克,30.3毫摩尔),然后加入六甲基二硅烷氮化钠(0.6M,60毫升,36.4毫摩尔)。0℃下搅拌该混合物15分钟,然后加入碘代甲烷(4.73克,33.3毫摩尔)。室温下搅拌所得混合物过夜,然后加入饱和氯化铵溶液(20毫升),将反应淬灭。将混合物导入水中,然后用二氯甲烷萃取。用硫酸钠干燥有机萃取物,然后减压浓缩成油。油用9∶1己烷∶乙酸乙酯作为洗脱剂来硅胶色谱纯化,得到所需产物为无色油。
ESI MS:m/z(相对强度)346(100,M+H+)。
c.(1S,2R)-N-[2-甲氧基-1-(羟甲基)-4-苯基丁-2-炔基)-氨基甲酸叔丁酯:在室温下搅拌甲醇(150毫升)中的丙酮化物63b(9.22克,26.7毫摩尔),然后加入大孔树脂Amberlyst 15(15克)。室温下搅拌所得非均相混合物24小时。在甲醇帮助下,使混合物通过硅藻土过滤。产物用7∶3己烷∶乙酸乙酯作为洗脱剂在硅胶上进行色谱。获得产物为无色油,它在静置后固化成白色固体。
ESI MS:m/z(相对强度)306(100,M+H+)。
d.(1S,2R)-N-[2-甲氧基-1-(羟甲基)-1-氨基4-苯基丁-2-炔:室温下搅拌在二噁烷中的氨基甲酸酯63c(5.0克,16.4毫摩尔),然后加入4N HCl(15毫升)。室温下搅拌所得混合物14小时。加入饱和碳酸氢钠溶液,使反应混合物呈碱性。用二氯甲烷萃取所得混合物。用硫酸镁干燥有机萃取物,然后减压浓缩成油。
ESI MS:m/z(相对强度)206(100,M+H+)。
e.[(2R)-甲氧基-1-(羟甲基)-(1S)-(4'-碘代苯磺酰基)-氨基-4-苯基丁-2-炔:在室温下搅拌在二噁烷(30毫升)和水(30毫升)中的氨基醇63d(3.30克,16.1毫摩尔),然后加入三乙胺(3.25克,32.2毫摩尔),再加入对碘苯磺酰氯(5.3克,17.7毫摩尔)。室温下搅拌所得混合物过夜。用1N HCl稀释反应物,然后用二氯甲烷萃取。干燥有机萃取物,然后减压浓缩成油。
ESI MS:m/z(相对强度)472(100,M+H+)。
f.(2R)-(4'-碘代苯磺酰基)-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸甲酯:在室温下搅拌在丙酮(100毫升)中的醇63e(2.0克,4.24毫摩尔),然后缓慢加入琼斯试剂(8N,30毫升,过量)。所得混合物在室温下搅拌4小时,然后加入异丙醇将反应淬灭。搅拌混合物30分钟后,形成绿色沉淀。然后在丙酮的帮助下,使溶液通过硅藻土过滤。将滤液减压浓缩成油。将油溶解在甲醇中,然后加入重氮甲烷的醚制溶液。当加入了过量重氮甲烷后,混合物稍稍变黄。浓缩混合物,得到浅黄色固体。用8∶2的己烷∶乙酸乙酯作为洗脱剂,硅胶色谱纯化固体,得到产物为黄色固体。
ESI MS:m/z(相对强度)500(100,M+H+)。
g.(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸甲酯:在Pd(PPh3)4(35毫克,0.03毫摩尔)和200毫克碳酸钠存在下,将原料磺酰胺63f(510毫克,1.02毫摩尔)和4-甲氧基苯基硼酸(230毫克,1.53毫摩尔)吸收在10毫升苯、1.5毫升乙醇和1.5毫升水中,回流18小时。使混合物冷却至室温,倒入水中,用二氯甲烷萃取。有机层用硫酸镁干燥,过滤并蒸发。粗品用9∶1己烷∶乙酸乙酯来硅胶色谱纯化,得到所需产物为无色油。
ESI MS:m/z(相对强度)480.0(100,M+H+)。
h.(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸:将甲酯63g(360毫克,0.73毫摩尔)溶解在水∶甲醇∶THF(5毫升∶5毫升∶5毫升)中,然后加入氢氧化锂(1克,过量)。在室温下搅拌所得混合物过夜。反应物用1NHCl酸化,然后用二氯甲烷萃取混合物。有机萃取物用硫酸镁干燥,然后减压浓缩成油。采用水到乙腈梯度的反相HPLC纯化。获得产物为白色粉末。
ESI MS:m/z(相对强度)464(100,M-H+)。
实施例64
(2R)-{[4'-硫代甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-
炔酸
a.(2R)-(4'-硫代甲氧基联苯基磺酰基)-氨基-(3S)-甲氧基-5-苯基-戊-4-炔酸甲酯:在Pd(PPh3)4(43毫克,0.03毫摩尔)和262毫克碳酸钠存在下,将原料磺酰胺63f(620毫克,1.24毫摩尔)和4-硫代甲氧基苯基硼酸(310毫克,1.53毫摩尔)加入10毫升苯、1.5毫升乙醇和1.5毫升水中,回流4小时。使混合物冷却至室温,倒入水中,用二氯甲烷萃取。有机层用硫酸镁干燥,过滤并蒸发。粗品用9∶1己烷∶乙酸乙酯来硅胶色谱纯化,得到所需产物为无色油。
ESI MS:m/z(相对强度)496.0(35,M+H+)。
h.(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸:将甲酯64a(450毫克,0.91毫摩尔)溶解在水/甲醇/THF(5毫升/5毫升/5毫升)中,然后加入氢氧化锂(1克,过量)。在室温下搅拌所得混合物过夜。反应物用1N HCl酸化,产物从溶液中沉淀出来。所得产物为白色粉末。
ESI MS:m/z(相对强度)484.(100,M-H+)。
实施例65
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-苄氧基-5-苯基戊-4-炔酸
a.(4S,1'R)-2,2-二甲基-4-(1'-苄氧基-3'-苯基丙-2'-炔基)噁唑烷-3-羧酸叔丁酯:0℃下搅拌含醇63a(7.80克,23.5毫摩尔)的DME(150毫升),然后加入氢化钠(1.13克,28.2毫摩尔)。0℃搅拌混合物15分钟,然后加入苄基溴(4.43克,25.9毫摩尔)。室温下搅拌所得混合物过夜,然后加入饱和氯化铵溶液(20毫升)淬灭反应。将混合物倒入水中,然后用二氯甲烷萃取。用硫酸钠干燥有机萃取物,然后减压浓缩成油。该油的纯化采用以9∶1己烷∶乙酸乙酯为洗脱剂的硅胶色谱,得到所需产物为无色油。
ESI MS:m/z(相对强度)422(100,M+H+)。
b.(1S,2R)-N-[2-苄氧基-1-(羟甲基)4-苯基丁-2-炔基)-氨基甲酸叔丁酯:在室温下搅拌甲醇(150毫升)中的丙酮化物65a(8.80克,20.9毫摩尔),然后加入大孔树脂Amberlyst 15(12克)。室温下搅拌所得非均相混合物24小时。在甲醇帮助下,使混合物通过硅藻土过滤。产物用7∶3己烷∶乙酸乙酯作为洗脱剂在硅胶上进行色谱。获得产物为无色油。
ESI MS:m/z(相对强度)382(20,M+H+)。
c.(1S,2R)-N-[2-苄氧基-1-(羟甲基)-1-氨基-4-苯基丁-2-炔:室温下搅拌在二噁烷中的氨基甲酸酯65b(5.60克,14.6毫摩尔),然后加入4N HCl(15毫升)。室温下搅拌所得混合物14小时。加入饱和碳酸氢钠溶液,使反应混合物呈碱性。用二氯甲烷萃取所得混合物。用硫酸镁干燥有机萃取物,然后减压浓缩成油。
ESI MS:m/z(相对强度)282(100,M+H+)。
d.[(2R)-苄氧基-1-(羟甲基)-(1S)-(4'-碘代苯磺酰基)-氨基-4-苯基丁-2-炔:在室温下搅拌在二噁烷(30毫升)和水(30毫升)中的氨基醇65c(4.0克,14.2毫摩尔),然后加入三乙胺(2.88克,28.4毫摩尔),再加入4-溴苯磺酰氯(3.81克,14.9毫摩尔)。室温下搅拌所得混合物过夜。用1N HCl稀释反应物,然后用二氯甲烷萃取。干燥有机萃取物,然后减压浓缩成油。
ESI MS:m/z(相对强度)501(100,M+H+)。
e.(2R)-(4'-溴代苯磺酰基)-氨基-(3S)-苄氧基-5-苯基戊-4-炔酸甲酯:在室温下搅拌在丙酮(100毫升)中的醇65d(5.30克,10.6毫摩尔),然后缓慢加入琼斯试剂(8N,40毫升,过量)。所得混合物在室温下搅拌4小时,然后加入异丙醇将反应淬灭。搅拌混合物30分钟后,形成绿色沉淀。然后在丙酮的帮助下,使溶液通过硅藻土过滤。将滤液减压浓缩成油。将油溶解在甲醇中,然后加入重氮甲烷的乙醚溶液。当加入了过量重氮甲烷后,混合物稍稍变黄。浓缩混合物,得到浅黄色固体。用8∶2的己烷∶乙酸乙酯作为洗脱剂,对该固体进行硅胶色谱纯化,得到产物为黄色固体。
ESI MS:m/z(相对强度)545,547(100,M+NH3 +)。
f.(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-苄氧基-5-苯基戊-4-炔酸甲酯:在Pd(PPh3)4(61毫克,0.05毫摩尔)和371毫克碳酸钠存在下,将原料磺酰胺65e(927毫克,1.75毫摩尔)和4-甲氧基苯基硼酸(400毫克,2.63毫摩尔)加入25毫升苯、1.5毫升乙醇和1.5毫升水中,回流4小时。使混合物冷却至室温,倒入水中,用二氯甲烷萃取。有机层用硫酸镁干燥,过滤并蒸发。粗品用9∶1己烷∶乙酸乙酯来硅胶色谱纯化,得到所需产物为无色油。
ESI MS:m/z(相对强度)556.0(20,M+H+)。
g.(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-苄氧基-5-苯基戊-4-炔酸:将甲酯65f(360毫克,1.13毫摩尔)溶解在水∶甲醇∶THF(5毫升∶5毫升∶5毫升)中,然后加入氢氧化锂(1克,过量)。在室温下搅拌所得混合物过夜。反应物用1NHCl酸化,然后产物从溶液中沉淀出来。所得产物为浅褐色粉末。
ESI MS:m/z(相对强度)540.(100,M-H+)。
实施例66
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-(2-甲氧基乙氧基)-5-苯基
戊-4-炔酸的制备
a.(4S,1'R)-2,2-二甲基-4-[1'-(2-甲氧基乙氧基)-3'-苯基丙-2'-炔基]-噁唑烷-3-羧酸叔丁酯:如化合物65a所述,使醇63a与1-氯-2-甲氧基乙烷相连,得到标题所示的醚。
b.根据65b-g所述的反应次序,将醚66a转变成标题所示的酸。
实施例67
(2R)-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-(2-甲氧基乙氧基)-5-苯基
戊-4-炔酸的制备
a.(1S,2R)-N-[2-(2-甲氧基乙氧基)-1-(羟甲基)-1-氨基-4-苯基丁-2-炔:根据65b-c所述的反应次序,将醚66a转变成标题所示的胺。
b.[(2R)-(2-甲氧基乙氧基)-1-(羟甲基)-(1S)-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-4-苯基丁-2-炔:根据65d所述的步骤,使胺67a与磺酰氯9g相连。
c.根据化合物65e所述的步骤,将醇67b氧化成标题所示的酸。
实施例68
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-(2-甲氧基乙氧基)-5-苯硫
基甲基-戊-4-炔酸的制备
a.(4S,1'R)-2,2-二甲基-4-(1'-羟基-3'-苯硫基甲基-丙-2'-炔基)-噁唑烷-3-羧酸叔丁酯:如化合物63a所述,使苯硫基甲基乙炔与(S)-4-甲酰基-2,2-二甲基-3-噁唑烷羧酸叔丁酯亲核连接。
b.(4S,1'R)-2,2-二甲基-4-(1′-(2-甲氧基乙氧基)-3'-苯基丙-2'-炔基)-噁唑烷-3-羧酸叔丁酯:根据63b描述的步骤,使醇68a与1-氯-2-甲氧基乙烷相连,得到标题所示的醚。
c.根据63c-h描述的反应次序,使噁唑烷68b转变成标题所示的酸。
实施例69-94
实施例69
2-{[4-(4-氯苯甲酰基)氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-(4-乙酰氨基苯磺酰基)-氨基-5-苯基-戊-4-炔酸甲酯:在含叔丁氧羰基胺1c(0.6克,2.5毫摩尔)的二氯甲烷(15毫升)溶液中,加入TFA(1毫升)。搅拌该混合物1小时,然后减压浓缩,得到残余物,将其加入二噁烷(8毫升)、水(5毫升)和三乙胺(1.39毫升,10毫摩尔)中。在室温下在其中缓慢加入4-乙酰氨基苯磺酰氯(650毫克,3.0毫摩尔)。搅拌反应混合物过夜,用水稀释,用乙酸乙酯萃取三次。用1N HCl、水、盐水洗涤合并的乙酸乙酯层,用硫酸镁干燥,浓缩得到所需产物为灰白色固体。
b.2-{[4-(4-氯苯甲酰基)氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:在含乙酰胺69a(0.21克,0.5毫摩尔)的水(5毫升)中,缓慢加入浓盐酸(1毫升,12毫摩尔)。使反应混合物加热回流3小时,然后浓缩至干,与甲苯共沸。将所得残余物溶解在10毫升甲醇中,然后缓慢加入0.5毫升亚硫酰氯。搅拌混合物过夜,减压除去溶剂。将粗制的苯胺中间产物溶解在二氯甲烷(3毫升)中,冷却至0℃。加入4-甲基吗啉(0.16毫升,1.4毫摩尔),然后加入4-氯苯甲酰氯(0.091毫升,0.71毫摩尔)。搅拌反应混合物过夜,用水稀释,然后用乙酸乙酯萃取三次。合并的乙酸乙酯层用1N HCl、水、盐水洗涤,用硫酸镁干燥,浓缩成固体,用己烷∶乙酸乙酯(6∶4)洗脱,对该固体进行柱色谱纯化,得到所需产物为固体。
c.用在3毫升THF和3毫升水中的氢氧化锂一水合物(100毫克,2.4毫摩尔)处理甲酯69b(120毫克,0.24毫摩尔),室温下搅拌2小时,然后浓缩至干,用水稀释。混合物用二乙醚萃取两次。弃去二乙醚层,水层用0.5毫升稀释的磷酸二氢钠稀释,用1N HCl仔细中和至pH6,然后用乙酸乙酯萃取三次。用盐水洗涤合并的乙酸乙酯层,用硫酸镁干燥,浓缩成固体,在乙酸乙酯/己烷中重结晶,得到所需产物为白色固体。
实施例70
2-{[4-(4-甲氧基苯甲酰基)氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备:
a.2-{[4-(4-甲氧基苯甲酰基)氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:如化合物69b所述,使乙酰胺69a水解、酯化,用4-甲氧基苯甲酰氯转变成标题所示的酰胺,得到标题所示的酯。
b.根据化合物69c所述的方法,使原料酯70a皂化,得到标题所示的酸。
实施例71
2-{[4-(4-甲氧基苯甲酰基)氨基]-苯磺酰基}-氨基-6-甲氧基己-4-炔酸的制备:
a.1-羟基-2-(4-乙酰氨基苯磺酰基)-氨基-6-甲氧基己-4-炔:如化合物46d所述,使原料叠氮物50b分解,与4-乙酰氨基苯磺酰氯相连,得到标题所示的磺酰胺。
b.2-(4-乙酰氨基苯磺酰基)-氨基-6-甲氧基己-4-炔酸:如化合物46f所述,使原料醇71a氧化成其相应的羧酸。
c.2-(4-氨基苯磺酰基)-氨基-6-甲氧基己-4-炔酸甲酯:将原料酰胺71b(2.12克,6毫摩尔)加入25毫升甲醇中,用10滴浓硫酸处理,搅拌24小时,用碳酸钠中和并蒸发。使残余物在乙酸乙酯和5%碳酸氢钠之间分配。有机层用盐水洗涤、用硫酸镁干燥,过滤并蒸发,得到黄色油,该油无需纯化可直接使用。
d.2-{[4-(4-甲氧基苯甲酰基)氨基]-苯磺酰基}-氨基-6-甲氧基己-4-炔酸甲酯:在1毫升三乙胺存在下,将原料胺71c(500毫克,1.5毫摩尔)加入10毫升二氯甲烷中,用4-甲氧基苯磺酰氯(341毫克,1.65毫摩尔)处理。搅拌所得溶液16小时,然后在1N HCl和乙酸乙酯之间分配。有机层用盐水洗涤,用硫酸镁干燥,过滤并蒸发。粗品用己烷∶乙酸乙酯(1∶1)在快速硅胶上进行色谱,得到白色固体。
e.如化合物69c所述,使原料酯71d水解,得到标题所示的酸。
ESI MS:m/z(相对强度)402.0(100,M-H+)。
实施例72
2-{[4-(5-正丙基吡啶-2-甲酰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备:
a.2-{[4-(5-正丙基吡啶-2-甲酰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:如化合物69b所述,使乙酰胺69a水解并酯化。然后在DCC和HOBT存在下将该粗品加入二氯甲烷中,用5-正丙基吡啶-2-基羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯72a皂化,得到标题所示的酸。
实施例73
2-{[4-(6-N-吡咯基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制
备:
a.2-{[4-(6-N-吡咯烷基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:如化合物69b所述,使乙酰胺69a水解并酯化。然后在DCC和HOBT存在下将该粗品加入二氯甲烷中,用6-N-吡咯基吡啶-3-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯73a皂化,得到标题所示的酸。
实施例74
2-{[4-(4-甲氧基苯甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸的制备:
a.1-羟基-2-叠氮基-6-苯氧基己-4-炔:如化合物46b-c的反应次序所述,将原料醇49a转变成标题所示的叠氮物。
b.1-羟基-2-(4-乙酰氨基苯磺酰基)-氨基-6-苯氧基己-4-炔:如化合物46d所述,用三苯膦使原料叠氮物74a分解成其相应的胺,然后与4-乙酰氨基苯磺酰氯相连,得到标题所示的磺酰胺。
c.2-(4-乙酰氨基苯磺酰基)-氨基-苯磺酰基}-氨基-6-苯氧基己-4-炔酸:如化合物46f所述,用琼斯试剂使原料醇74b氧化,得到标题所示的酸。
d.2-{[4-(4-甲氧基苯甲酰基)氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74c水解,酯化,用4-甲氧基苯甲酰氯转变成标题所示的酰胺,得到标题所示的酯。
e.根据化合物69c所述的步骤,使原料酯74d皂化,得到标题所示的酸。
ESI MS:m/z(相对强度)526.0(50,M+NH4 +),509.0(100,M+H+)。
实施例75
2-{[4-(4-溴苯甲酰基)氨基]-苯磺酰基}-氨基-6-吗啉代己-4-炔酸的制备
如化合物71c-e所述,使原料乙酰胺44a去保护,与4-溴苯甲酰氯相连并水解,得到标题所示的酸。
ESI MS:m/z(相对强度)571.8(23,M+Na+),573.8(50,M+Na+),549.9(100,M+H+),551.9(100,M+H+)。
实施例76
2-{[4-(4-氯苯甲酰基)氨基]-苯磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
如化合物71d-e所述,使原料71c与4-氯苯甲酰氯相连并水解,得到标题所示的酸。
实施例77
2-{[4-(4-溴苯甲酰基)氨基]-苯磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
如化合物71d-e所述,使原料71c与4-溴苯甲酰氯相连并水解,得到标题所示的酸。
实施例78
2-{[4-(6-三氟甲基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸的制
备
a.2-{[4-(6-三氟甲基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在DCC和HOBT存在下,将该粗品加入二氯甲烷中,用6-三氟甲基吡啶-2-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯78a皂化,得到标题所示的酸。
实施例79
2-{[4-(6-氰基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸的制备:
a.2-{[4-(6-氰基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在DCC和HOBT存在下,将该粗品加入二氯甲烷中,用6-氰基吡啶-2-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯79a皂化,得到标题所示的酸。
实施例80
2-{[4-(6-三氟甲基甲氧基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔
酸的制备:
a.2-{[4-(6-三氟甲基甲氧基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在DCC和HOBT存在下,将该粗品加入二氯甲烷中,用6-三氟甲基甲氧基吡啶-2-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯80a皂化,得到标题所示的酸。
实施例81
2-{[4-(5-甲基哌嗪-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸的制备
a.2-{[4-(5-甲基哌嗪-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在DCC和HOBT存在下,将该粗品加入二氯甲烷中,用5-甲基哌嗪-2-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯81a皂化,得到标题所示的酸。
实施例82
2-{[4-(5-甲氧基吲哚-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸的制备
a.2-{[4-(5-甲氧基吲哚-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在DCC和HOBT存在下将该粗品加入二氯甲烷中,用5-甲氧基吲哚-2-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯82a皂化,得到标题所示的酸。
实施例83
2-{[4-(1N-甲基吲哚-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸的制备
a.2-{[4-(1N-甲基吲哚-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在DCC和HOBT存在下,将该粗品加入二氯甲烷中,用1N-甲基吲哚-2-基-羧酸处理,产生标题所示的酰胺。
b.根据化合物69c所述的步骤,使原料酯83a皂化,得到标题所示的酸。
实施例84
2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4-(氯羰基氨基]-苯磺酰基}-氨基-5-苯基-戊-4-炔酸甲酯:如化合物69b所述,使乙酰胺69a水解并酯化。然后在三乙胺存在下,将该粗品加入二氯甲烷中,用过量三光气处理,产生标题所示的氨基甲酰氯。
b.2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:在0℃、三乙胺存在下,将氨基甲酰氯84a加入二氯甲烷中,用1当量吗啉处理,得到标题所示的脲。
c.根据化合物69c所述的步骤,使原料酯84a皂化,得到标题所示的酸。
实施例85
2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-苯氧基己-4-炔酸的制备
a.2-{[4-(氯羰基氨基]-苯磺酰基}-氨基-5-苯氧基-己-4-炔酸甲酯:如化合物69b所述,使乙酰胺74a水解并酯化。然后在三乙胺存在下,将该粗品加入二氯甲烷中,用过量三光气处理,产生标题所示的氨基甲酰氯。
b.2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-苯氧基己-4-炔酸甲酯:在0℃、三乙胺存在下,将氨基甲酰氯85a加入二氯甲烷中,用1当量吗啉处理,得到标题所示的脲。
c.根据化合物69c所述的步骤,使原料酯82b皂化,得到标题所示的酸。
实施例86
2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-甲氧基己-4-炔酸的制备
如化合物71d-e所述,使原料胺71c与N-吗啉代羰基氯相连并水解,得到标题所示的酸。
ESI MS:m/z(相对强度)448.1(25,M+NH4 +),426.2(10,M+H+)。
实施例87
2-{[4-(N-吡咯烷子基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4-(N-吡咯烷子基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:在0℃、三乙胺存在下,将氨基甲酰氯84a加入二氯甲烷中,用1当量吗啉处理,得到标题所示的脲。
b.根据化合物69c所述的步骤,使原料酯87a皂化,得到标题所示的酸。
实施例88
2-{[4-(N-吡咯烷羰基)-氨基]-苯磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
如化合物71d-e所述,使原料胺71c与N-吡咯烷羰基氯相连并水解,得到标题所示的酸。
ESI MS:m/z(相对强度)427.2(40,M+NH4 +),410.2(100,M+H+)。
实施例89
2-{[4-(N-苯基氨基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4-(N-苯基氨基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:在三乙胺存在下,将氨基甲酰氯84a加入二氯甲烷中,用1当量苯胺处理,得到标题所示的脲。
b.根据化合物69c所述的步骤,使原料酯89a皂化,得到标题所示的酸。
实施例90
2-{[4-(N,N-甲基苯基氨基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4-{[4-(N,N-甲基苯基氨基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸甲酯:在三乙胺存在下,将氨基甲酰氯84a加入二氯甲烷中,用1当量甲基苯胺处理,得到标题所示的脲。
b.根据化合物69c所述的步骤,使原料酯90a皂化,得到标题所示的酸。
实施例91
2-{[4-(N-[4-甲基噁唑-2-基]-羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4-(N-[4-甲基噁唑-2-基]-羰基)-氨基]-氨基-5-苯基戊-4-炔酸甲酯:在三乙胺存在下,将氨基甲酰氯84a加入二氯甲烷中,用1当量2-氨基-4-甲基噁唑处理,得到标题所示的脲。
b.根据化合物69c所述的步骤,使原料酯91a皂化,得到标题所示的酸。
实施例92
2-{[4-(N-[苯并噻唑-2-基]-羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸的制备
a.2-{[4-(N-[苯并噻唑-2-基]-羰基)-氨基]-氨基-5-苯基戊-4-炔酸甲酯:在三乙胺存在下,将氨基甲酰氯84a加入二氯甲烷中,用1当量2-氨基-苯并噻唑处理,得到标题所示的脲。
b.根据化合物69c所述的步骤,使原料酯92a皂化,得到标题所示的酸。
实施例93
2-(4-乙酰基氨基)-苯磺酰基-氨基-6-甲氧基己-4-炔酸的制备
如化合物71d-e所述,使原料胺71c与乙酸酐相连,并水解,得到标题所示的酸。
实施例94
2-(4-(4-甲氧基苯磺酰基)-氨基)-苯磺酰基}-氨基-6-甲氧基己-4-炔酸的制备
如化合物71d-e所述,使原料71c与4-甲氧基苯磺酰氯相连,并水解,得到标题所示的酸。
IX.实施例一组合物和使用方法
本发明的化合物可用来制备治疗与不希望出现的MP活性有关的疾病的组合物。下列组合物和方法实施例并不是用来限制本发明,而是为本领域技术人员制备并使用本发明的化合物、组合物和方法提供指导。在每一例中,实施例化合物可用本发明的其它化合物代替,并具有相似的结果。本领域技术人员应当理解,实施例只是提供指导,其可根据疾病及患者的情况不同而改变。
在本部分中采用了下列缩写:
EDTA:乙二胺四乙酸
SDA:合成的变性酒精
USP:美国药典
实施例A
根据本发明制得口服片剂组合物,其包含:
组分 用量
实施例1的化合物 15毫克
乳糖 120毫克
玉米淀粉 70毫克
滑石粉 4毫克
硬脂酸镁 1毫克
用本发明的方法来治疗体重60公斤(132磅)、患类风湿性关节炎的女性患者。具体方法是,使所述对象每天口服三片片剂,持续2年。
在治疗期的最后检查对象,发现炎症减轻,活动能力得到改善而没有伴发的疼痛。
实施例B
根据本发明制备口服胶囊剂,胶囊剂包含:
组分 用来(%w/w)
实施例4的化合物 15%
聚乙二醇 85%
用本发明的方法来治疗体重90公斤(198磅)、患骨关节炎的男性患者。具体方法是,每天给予所述患者含有70毫克实施例3化合物的胶囊剂,持续5年。
在治疗期的最后通过x射线、关节镜检查术和/或MRI检查患者,发现关节软骨没有进一步的侵蚀/原纤维形成。
实施例C
根据本发明制备用来局部给药的以盐水为基础的组合物,组合物包含:
组分 剂量(%w/w)
实施例7的化合物 5%
聚乙烯醇 15%
盐水 80%
对患深度角膜擦伤的患者每只眼睛滴眼,每天两次。愈合速度加快且没有视觉后遗症。
实施例D
根据本发明制备用于局部给药的外用组合物,组合物包含:
组分 组成(%w/v)
实施例9的化合物 0.20
苯扎氯铵 0.02
硫柳汞 0.002
d-山梨糖醇 5.00
甘氨酸 0.35
芳香剂 0.075
纯化水 余量
总量= 100.00
患化学灼伤的患者在每次更换敷料时敷用该组合物(b.i.d.)。伤疤基本上消除。
实施例E
根据本发明制备吸入气雾剂组合物,组合物包含:
组分 组成(%w/v)
实施例13的化合物 5.0
乙醇 33.0
抗坏血酸 0.1
薄荷醇 0.1
糖精钠 0.2
抛射剂(F12,F114) 余量
总量= 100.0
哮喘患者在吸气时通过泵的推动钮将0.01毫升组合物喷入口中。哮喘症状消除。
实施例F
根据本发明制备局部眼用组合物,组合物包含:
组分 组成(%w/v)
实施例16的化合物 0.10
苯扎氯铵 0.01
EDTA 0.05
羟乙基纤维素(NATROSOL M) 0.50
偏亚硫酸氢钠 0.10
氯化钠(0.9%) 余量
总量= 100.0
用本发明的方法来治疗体重90公斤(198磅)、患有角膜溃疡的男性患者。具体方法是所述对象受累眼内给予含有10毫克实施例16化合物的盐水溶液,每天2次,持续2个月。
实施例G
制备用于肠胃外给药的组合物,组合物包含:
组合物 用量
实施例12的化合物 100毫克/毫升 载体
载体:
含有以下组分的柠檬酸钠缓冲液(载体重量的百分数):
卵磷脂 0.48%
羧甲基纤维素 0.53
聚乙烯吡咯烷酮 0.50
对羟苯甲酸甲酯 0.11
对羟苯甲酸丙酯 0.011
混合上述组分,形成一悬浮液。将约2.0毫升的悬浮液通过注射给予患转移前肿瘤的患者。注射位置对准肿瘤部位。每天重复注射两次,持续约30天。30天后,疾病症状消退,逐渐减少剂量至维持量。
实施例H
制备漱口剂组合物:
组分 %w/v
实施例14的化合物 3.00
SDA 40醇 8.00
调味香料 0.08
乳化剂 0.08
氟化钠 0.05
甘油 10.00
增甜剂 0.02
苯甲酸 0.05
氢氧化钠 0.20
染料 0.04
水 补至100%患牙龈疾病患者使用1毫升漱口剂,每天三次,以防止进一步的口腔变性。
实施例I制备锭剂组合物:
组分 %w/v
实施例35的化合物 0.01
山梨糖醇 17.50
甘露糖醇 17.50
淀粉 13.60
增甜剂 1.20
调味香料 11.70
色料 0.10
玉米糖浆 补至100%患者使用锭剂以防止上颌骨中的移植物松动。
实施例J
口香糖组合物
组分 w/v%
实施例55的化合物 0.03
山梨糖醇晶体 38.44
Paloja-T胶基 20.00山梨糖醇(70%水溶液) 22.00
甘露糖醇 10.00
甘油 7.56
调味香料 1.00
患者可以咀嚼口香糖,以防止托牙松动。
实施例K
组分 w/v%
实施例28的化合物 4.0
USP水 50.656
对羟苯甲酸甲酯 0.05
对羟苯甲酸丙酯 0.01
黄原胶 0.12
瓜耳胶 0.09
碳酸钙 12.38
防沫剂 1.27
蔗糖 15.0
山梨糖醇 11.0
甘油 5.0
苄醇 0.2
柠檬酸 0.15
清凉剂 0.00888
调味香料 0.0645
着色剂 0.0014
组合物是这样制备的:首先混合80千克甘油和所有苄醇,加热至65℃,然后缓缓加入对羟苯甲酸甲酯、对羟苯甲酸丙酯、水、黄原胶和瓜耳胶并混合。用Silverson串联混合器使这些组分混合约12分钟。然后以下列次序缓缓加入下列组分:其余的甘油、山梨糖醇、防沫剂C、碳酸钙、柠檬酸和蔗糖。另行混合调味香料和清凉剂,然后缓缓加入其它组分中。混合约40分钟。患者服用该制剂以防止突发结肠炎。
实施例L
将实施例B所述的胶囊给予经确定易患骨关节炎的肥胖女性患者,以防骨关节炎症状。具体地说,将胶囊给予该对象。
用X射线、关节镜检术和/或MRI检查该患者,发现关节软骨没有明显的侵蚀/原纤维形成。
实施例M
将实施例B所述的胶囊给予重90公斤(198磅)、患运动损伤的男性患者,以防骨关节炎症状。具体地说,将胶囊给予该对象。
用X射线、关节镜检术和/或MRI检查该患者,发现关节软骨没有明显的侵蚀/原纤维形成。
本文引述的所有文献均纳入本文作参考。
尽管本发明描述了具体的例子,但是有一点对于本领域技术人员来说是明显的,即在不脱离本发明的精神和范围的前提下可对本发明作各种变化和改动。因此,所附权利要求覆盖了所有这些在本发明范围内的变动。
Claims (13)
(A)X选自-OH和-NHOH;
(B)W选自-S-,-O-,-N(R33),-C(R33)=C(R33')-,-N=C(R33)-和-N=N-,其中R33和R33′是各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(C)R1是-(CR6R6')l-R34,其中l为0-4;R6和R6'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R34选自氢、羟基、烷氧基、烷基、链烯基、炔基、杂烷基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(D)R2是-(CR7R7')m-R35,其中m为0-4;R7和R7'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R35选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;
(E)R3是-(CR8R8')n-R9,其中n为0-4;R8和R8'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R9选自氢、羟基、烷氧基、烷基、链烯基、炔基、芳氧基、杂烷基、杂芳氧基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(F)R4是-(CR10R10')z-A'-(CR10″R10)o-R11,其中A'选自共价键、-O-、-S-和SO2;z为0-4;o为0-4;R10、R10'、R10″和R10各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R11选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(G)R5和R5'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;k为0-4;
(1)R13和R13'各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基和杂芳基或
(2)R13和R13'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(I)G选自
(1)氢;
(2)-(CR14R14')p-R15,其中p为0-4;R14和R14'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R15选自氢、烷基、芳基、杂芳基、环烷基、杂环烷基、芳烷基和杂芳烷基;
(3)-(CR16R16')q-Y-(CR17R17')r-R18,其中q为1-4;r为0-4;R16,R16',R17和R17'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;Y选自-O-和-S-;R18选自氢、羟基、烷氧基、烷基、杂烷基、卤烷基、环烷基、杂环烷基、芳基和杂芳基;条件是当r=0时,R18不是羟基或烷氧基;
(4)-CONR37R37',其中(a)R37和R37'各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或(b)R37和R37'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;和
(5)-(CR19R19')s-NR20R20',其中s为1-4;R19和R19'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R20和R20'各自独立选自:
(a)氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;
(b)-C(O)R21,其中R21选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R21和R20和与它们连接的酰胺基团一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(c)-SO2-(CR22R22')t-R23,其中t为0-4;R22和R22'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R23选自烷基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R23和R20和它们连接的磺酰胺基团一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(d)-C(O)NR24R24',其中(i)R24和R24'各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R24和R24'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(e)-C(O)OR25,其中R25选自烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或
(f)R20和R20'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;和
(J)Z选自
(1)环烷基和杂环烷基;
(2)-D-(CR26R26')uR27,其中
(a)u为0-4;
(b)D选自-C≡C-,-CH=CH-,-N=N-,-O-,-S-和-SO2-;
(c)R26和R26'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;和
(d)R27选自芳基、杂芳基、烷基、链烯基、炔基、杂烷基、卤烷基、杂环烷基、环烷基,如果D是-C≡C-或-CH=CH-,那么R27也可选自
-CONR28R28',其中(i)R28和R28'各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R28和R28'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(3)-NR29R29',其中
(a)R29和R29'各自独立选自氢;烷基;链烯基;炔基;杂烷基;卤烷基;芳基;杂芳基;环烷基;杂烷基;和C(O)-Q-(CR30R30')vR31,其中v是0-4,Q选自共价键和-NR32-,R30和R30'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R31和R32(i)各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基,或(ii)R31和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或R29和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或
(a)E和J独立选自-CH-和-N-;
(b)L选自-S-,-O-,-N(R38)-,-C(R38)=(R38')-,-N=C(R38)-和-N=N-,其中R38和R38'各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(c)w是0-4;
(d)R36和R36'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;
(e)M选自共价键、-O-、-SOx-、-C(O)-、-C(O)NR39-、-NR39-、和-NR39C(O)-;其中x为0-2;R39选自氢、烷基、链烯基、炔基、芳基、杂芳基、杂烷基、杂芳基、环烷基、杂环烷基和卤烷基;和
(f)T是-(CR40R40')yR41,其中y为0-4;R40和R40'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基、烷氧基和芳氧基;和R41选自氢、烷基、链烯基、炔基、卤素、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R39和R41和与它们连接的原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或R38和R41与和它们连接的原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
或式(I)的光学异构体、非对映体或对映体,或其药学上可接受的盐、可生物水解的酰胺、酯或酰亚胺。
(A)W选自-S-,-O-,-N(R33)-,-C(R33)=C(R33')-,-N=C(R33)-和-N=N-,其中R33和R33'各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(B)R3是-(CR8R8′)n-R9,其中n为0-4;R8和R8'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R9选自氢、羟基、烷氧基、烷基、链烯基、炔基、芳氧基、杂烷基、杂芳氧基、卤烷基、环烷基、杂环烷基、芳基、杂芳基和卤素;
(C)A选自和-C≡C-其中R12和R12'各自独立选自氢、烷基、链烯基、炔基、卤烷基、芳基、杂烷基、杂芳基、杂环烷基、环烷基、卤素和-CONR13R13',其中
(1)R13和R13'各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基和杂芳基;或
(2)R13和R13'和与它们连接的氮原子一起连接形成含有5-8个环原子、有1-3个杂原子的任选取代的杂环;
(D)G选自
(1)氢;
(2)-(CR14R14')p-R15,其中p为0-4;R14和R14'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R15选自氢、烷基、芳基、杂芳基、环烷基、杂环烷基、芳烷基和杂芳烷基;
(3)-(CR16R16')q-Y-(CR17R17')r-R18,其中q为1-4;r为0-4;R16,R16',R17和R17'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;Y选自-O-和-S-;R18选自氢、羟基、烷氧基、烷基、杂烷基、卤烷基、环烷基、杂环烷基、芳基和杂芳基;条件是当r=0时,R18不是羟基或烷氧基;
(4)-CONR37R37',其中(a)R37和R37'各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或(b)R37和R37′和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;和
(5)-(CR19R19′)s-NR20R20',其中s为1-4;R19和R19'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R20和R20'各自独立选自:
(a)氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;
(b)-C(O)R21,其中R21选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R21和R20和它们连接的酰胺基团一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(c)-SO2-(CR22R22')t-R23,其中t为0-4;R22和R22'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R23选自烷基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R23和R20和它们连接的磺酰胺基团一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(d)-C(O)NR24R24',其中(i)R24和R24'各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R24和R24'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(e)-C(O)OR25,其中R25选自烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或
(f)R20和R20'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;和
(E)Z选自
(1)环烷基和杂环烷基;
(2)-D-(CR26R26')uR27,其中
(a)u为0-4;
(b)D选自-C≡C-,-CH=CH-,-N=N-,-O-,-S-和-SO2-;
(c)R26和R26'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;和
(d)R27选自芳基、杂芳基、烷基、链烯基、炔基、杂烷基、卤烷基、杂环烷基、环烷基,如果D是-C≡C-或-CH=CH-,那么R27也可选自
-CONR28R28',其中(i)R28和R28'各自独立选自氢、烷基、链烯基、炔基、卤烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或(ii)R28和R28'和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
(3)-NR29R29',其中
(a)R29和R29'各自独立选自氢;烷基;链烯基;炔基;杂烷基;卤烷基;芳基;杂芳基;环烷基;杂烷基;和C(O)-Q-(CR30R30')vR31,其中v是0-4,Q选自共价键和-NR32-,R30和R30'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;R31和R32(i)各自独立选自氢、烷基、链烯基、炔基、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基,或(ii)R31和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或R29和R32和与它们连接的氮原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或
(a)E和J独立选自-CH-和-N-;
(b)L选自-S-,-O-,-N(R38)-,-C(R38)=(R38')-,-N=C(R38)-和-N=N-,其中R38和R38'各自独立选自氢、烷基、链烯基、炔基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(c)w是0-4;
(d)R36和R36'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基和烷氧基;
(e)M选自共价键、-O-、-SOx-、-C(O)-、-C(O)NR39-、-NR39-、和-NR39C(O)-;其中x为0-2;R39选自氢、烷基、链烯基、炔基、芳基、杂芳基、杂烷基、杂芳基、环烷基、杂环烷基和卤烷基;和
(f)T是-(CR40R40')vR41,其中y为0-4;R40和R40'各自独立选自氢、烷基、链烯基、炔基、芳基、杂烷基、杂芳基、环烷基、杂环烷基、卤素、卤烷基、羟基、烷氧基和芳氧基;和R41选自氢、烷基、链烯基、炔基、卤素、杂烷基、卤烷基、芳基、杂芳基、环烷基和杂环烷基;或R39和R41与它们连接的原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;或R38和R41与它们连接的原子一起连接形成含有5-8个环原子、其中有1-3个为杂原子的任选取代的杂环;
或式(I)的光学异构体、非对映体或对映体,或其药学上可接受的盐、可生物水解的酰胺、酯或酰亚胺。
3.根据权利要求1或2所述的化合物,其特征在于,A是-C≡C-。
4.根据权利要求1至3任一项所述的化合物,其特征在于,W选自-S-和-CH=CH-。
6.根据权利要求1至5任一项所述的化合物,其特征在于,
(a)当Z是-D-(CR26R26')uR27时,D选自-C≡C-,-C=C-和-N=N-,u是0,R27选自芳基、杂芳基、杂环烷基或环烷基;
(b)当Z是-NR29R29'时,R29是氢,R29'是C(O)-Q-(CR30R30')vR31,其中Q为共价键,v是0,其中R31宜选自芳基、杂芳基、环烷基和杂环烷基;和
(c)当Z是
时,E和J均为-CH-,w是0,L是-C(R38)=C(R38′)-(较佳的L是-HC=CH-),R38和T连接形成含有0-2个环杂原子的任选取代的5元环。
7.根据权利要求1-6任一项所述的化合物,其特征在于,M选自共价键、-O-和-S-;T是-(CR40R40')yR41,其中y为0;R41选自烷基、杂烷基、芳基、杂芳基、环烷基、杂环烷基。
8.根据权利要求1-7任一项所述的化合物,其特征在于,对于R3,n是0或1;R8和R8'中的一个或两个,当存在时,是氢;R9选自氢、羟基、烷氧基、烷基、芳氧基和芳基。
9.根据权利要求1-8任一项所述的化合物,其中
(A)W是-CH=H-;
(C)G选自
(1)氢;
(2)-(CR14R14')p-R15,其中p为0或1;R14和R14'各自为氢;R15选自烷基、芳基、杂芳基、环烷基和杂环烷基;
(3)-(CR16R16')q-Y-(CR17R17')r-R18,其中q为1;r为0或1;R16,R16',R17和R17'各自为氢;Y选自-O-和-S-;R18选自氢、烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基;和
(4)-(CR19R19')s-NR20R20',其中s为1;R19和R19'各自为氢;R20和R20'各自独立选自:
(a)氢、烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;
(b)-C(O)R21,其中R21选自氢、烷基、杂烷基、芳基、杂芳基、环烷基和杂环烷基;或R21和R20和它们连接的酰胺基团一起连接形成含有5或6个环原子、其中有1或2个杂原子的任选取代的杂环;
(c)-SO2-(CR22R22')t-R23,其中t为0;R23选自烷基、芳基和杂芳基;和
(d)R20和R20'和与它们连接的氮原子一起连接形成含有5或6个环原子、其中有1或2个杂原子的任选取代的杂环。
10.一种化合物,它选自:
2-{[4'-氟-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-(4-苯氧基苯磺酰基)-氨基-5-苯基戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(4-吗啉代苯基)-戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(3-吗啉代苯基)-戊-4-炔酸;
2-{[(1,1'-4',1″-三苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4'-甲硫基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[3',4'-亚甲二氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4'-(2-N-吡咯烷子基-乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[3'-乙氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-[4-(4-甲基苯基)-乙炔基苯磺酰基]-氨基-5-苯基-戊-4-炔酸;
2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-5-苯基-戊-4-炔酸;
2-(4-苯基偶氮苯磺酰基)-氨基-5-苯基戊炔酸;
2-{[4'-苯氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(吡啶-3-基)-戊-4-炔酸;
2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-5-(吡啶-3-基)-戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(吡啶-3-基)-戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(呋喃-2-基)-戊-4-炔酸;
2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(呋喃-2-基)-戊-4-炔酸;
2-{[4'-(2-N-吡咯烷子基-乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(呋喃-2-基)-戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(噻吩-2-基)-戊-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(N-甲基吡咯-2-基)-戊-4-炔酸;
2-(4-正-丁氧基苯)-磺酰氨基-5-苯基戊-4-炔酸;
2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-苯基-戊-4-炔酸;
2-{[5-(4-甲氧基苯基乙炔基)-噻吩-2-基]-磺酰基}-氨基-5-苯基-戊-4-炔酸;
2-{[(4-苯磺酰基)-噻吩-2-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[(5-苯磺酰基)-噻吩-2-基]-磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-(3-N-吗啉代)-苯基戊-4-炔酸;
2-{[5-(4-甲氧基苯基)-噻吩-2-基]-磺酰基}-氨基-5-(3-N,N-二甲氨基)-苯基戊-4-炔酸;
2-[(1,1'-联苯基-4-基)-磺酰基]-氨基-6-吡咯烷己-4-炔酸;
2-{[4'-甲氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吡咯烷子基己-4-炔酸;
2-[(1,1'-联苯基)-4-基-磺酰基]-氨基-6-吗啉代己-4-炔酸;
2-{[4'-甲氧基(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸;
2-{[4'-甲硫基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸;
2-[4-(4-甲氧基苯基)-乙炔基苯磺酰基]-氨基-6-吗啉代己-4-炔酸;
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吗啉代己-4-炔酸;
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-乙酰基哌嗪-1N-基)-己-4-炔酸;
4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-甲磺酰基哌嗪-1N-基)-己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-叔丁氧羰基哌嗪-1N-基)-己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(4N-苯基哌嗪-1N-基)-己-4-炔酸;
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-吡咯烷子基-己-4-炔酸;
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(N,N-二甲氨基)-己-4-炔酸;
2-[4-(N-4-甲氧基苯甲酰基)-氨基苯磺酰基]-氨基-6-吗啉代己-4-炔酸;
2-[4-(N-4-正丁氧基苯甲酰基)-氨基苯磺酰基]-氨基-6-吗啉代己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔酸;
2-{[4'-(2-甲氧基乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔酸;
2-{[4'-(2-N-吡咯烷子基-乙氧基)-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯基己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-甲氧基己-4-炔酸;
2-{[4'-溴-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-甲氧基己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基-N-甲基}-氨基-6-甲氧基己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-(2-甲氧基乙氧基)-甲氧基己-4-炔酸;
2-{[4'-溴-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-甲氧基己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-苯硫基己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-[5-(呋喃-2-基)-噁二唑-2-基]-硫代己-4-炔酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-6-[5-(N-吡咯烷基)-噻二唑-2-基]-硫代己-4-炔酸;
反式2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-苯基戊-4-烯酸;
2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-3-苯甲酰氧甲基-戊-4-烯酸;
2-[(1,1'-联苯基)-4-基]-磺酰基-氨基-3-苯甲酰氧甲基-戊-4-烯酸;
顺式-2-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-5-(N-吡咯烷子基羰基)-戊-4-烯酸;
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸;
(2R)-{[4'-硫代甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-甲氧基-5-苯基戊-4-炔酸;
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-苄氧基-5-苯基戊-4-炔酸;
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-(2-甲氧基乙氧基)-5-苯基戊-4-炔酸;
(2R)-{[4'-苯氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-(2-甲氧基乙氧基)-5-苯基戊-4-炔酸;
(2R)-{[4'-甲氧基-(1,1'-联苯基)-4-基]-磺酰基}-氨基-(3S)-(2-甲氧基乙氧基)-5-苯硫基甲基-戊-4-炔酸;
2-{[4-(4-氯苯甲酰基)氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(4-甲氧基苯甲酰基)氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(5-正丙基吡啶-2-甲酰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(6-N-吡咯基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(4-甲氧基苯甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(6-三氟甲基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(6-氰基吡啶-3-酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(6-三氟甲基甲氧基吡啶-3-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(5-甲基哌嗪-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(5-甲氧基吲哚-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(1N-甲基吲哚-2-甲酰基)-氨基]-苯磺酰基}-氨基-6-苯氧基己-4-炔酸;
2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(N-吗啉代羰基)-氨基]-苯磺酰基}-氨基-5-苯氧基己-4-炔酸;
2-{4-(N-吡咯烷子基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(N-苯基氨基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{4-(N,N-甲基苯基氨基羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;
2-{[4-(N-[4-甲基噁唑-2-基]-羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸;和
2-{[4-(N-[苯并噻唑-2-基]-羰基)-氨基]-苯磺酰基}-氨基-5-苯基戊-4-炔酸。
11.一种药物组合物,它包含:
(a)安全有效量的权利要求1-10任一项所述的化合物;和
(b)药学上可接受的载体。
12.含有安全有效量的权利要求1-10任一项所述的化合物的药物的生产,其中将该药物给予哺乳动物对象来治疗与不希望的金属蛋白酶活性有关的疾病。
13.含有安全有效量的权利要求1-10任一项所述的化合物的药物的生产,其特征在于,将该药物给予哺乳动物对象来治疗与不希望的金属蛋白酶活性有关的疾病,该疾病选自关节炎、癌症、心血管疾病、皮肤病、眼疾病、炎症和牙龈疾病。
14.根据权利要求13所述的药物,其特征在于,该疾病是(a)关节炎,选自骨关节炎和类风湿性关节炎;(b)癌症,该治疗预防或停止肿瘤生长和转移;或(c)心血管疾病,选自扩张性心肌病、充血性心力衰竭、动脉粥样硬化、斑块破裂、再灌注损伤、局部缺血、慢性阻塞性肺部疾病、血管成形术再狭窄和主动脉瘤。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12264499P | 1999-03-03 | 1999-03-03 | |
| US60/122,644 | 1999-03-03 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1349498A true CN1349498A (zh) | 2002-05-15 |
Family
ID=22403942
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN00806919A Pending CN1349498A (zh) | 1999-03-03 | 2000-03-01 | 含有链烯基和炔基的金属蛋白酶抑制剂 |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US6197770B1 (zh) |
| EP (1) | EP1165501A1 (zh) |
| JP (1) | JP2002538136A (zh) |
| KR (1) | KR20010102486A (zh) |
| CN (1) | CN1349498A (zh) |
| AU (1) | AU764051B2 (zh) |
| BR (1) | BR0008716A (zh) |
| CA (1) | CA2364878A1 (zh) |
| CO (1) | CO5150219A1 (zh) |
| CZ (1) | CZ20013176A3 (zh) |
| HK (1) | HK1044754A1 (zh) |
| HU (1) | HUP0202199A2 (zh) |
| IL (1) | IL145089A0 (zh) |
| MA (1) | MA25391A1 (zh) |
| MX (1) | MXPA01008855A (zh) |
| NO (1) | NO20014242L (zh) |
| NZ (1) | NZ513831A (zh) |
| PE (1) | PE20001565A1 (zh) |
| PL (1) | PL350340A1 (zh) |
| RU (1) | RU2001126721A (zh) |
| SK (1) | SK12452001A3 (zh) |
| TR (1) | TR200102523T2 (zh) |
| WO (1) | WO2000051975A1 (zh) |
| ZA (1) | ZA200106967B (zh) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7108982B1 (en) * | 1999-02-19 | 2006-09-19 | University Of Iowa Research Foundation | Diagnostics and the therapeutics for macular degeneration |
| US20030149997A1 (en) * | 1999-02-19 | 2003-08-07 | Hageman Gregory S. | Diagnostics and therapeutics for arterial wall disruptive disorders |
| JP2003519100A (ja) * | 1999-10-14 | 2003-06-17 | ザ プロクター アンド ギャンブル カンパニー | ベータ二置換メタロプロテアーゼ阻害剤 |
| US6696456B1 (en) * | 1999-10-14 | 2004-02-24 | The Procter & Gamble Company | Beta disubstituted metalloprotease inhibitors |
| US6897237B2 (en) | 2000-04-28 | 2005-05-24 | Shionogi & Co. Ltd. | MMP-12 inhibitors |
| AU2001292285A1 (en) * | 2000-09-29 | 2002-04-15 | Shionogi And Co., Ltd. | Thiazole or oxazole derivatives |
| US7312358B2 (en) | 2000-10-17 | 2007-12-25 | Laboratoires Serono Sa | Pharmaceutically active sulfanilide derivatives |
| WO2003080042A1 (fr) * | 2002-03-27 | 2003-10-02 | Shionogi & Co., Ltd. | Inhibiteur de decomposition pour matrice extracellulaire de cartilage |
| TWI281914B (en) | 2002-05-29 | 2007-06-01 | Glaxo Group Ltd | Compounds |
| WO2003103660A1 (en) * | 2002-06-11 | 2003-12-18 | Wyeth | Substituted phenylsulfonamide inhibitors of beta amyloid production |
| EP1624866A2 (en) * | 2003-05-16 | 2006-02-15 | Arriva Pharmaceuticals, Inc. | Treatment of respiratory disease by inhalation of synthetic matrix metalloprotease inhibitors |
| WO2005005393A2 (en) * | 2003-07-02 | 2005-01-20 | Janssen Pharmaceutica N.V. | Cck-1 receptor modulators |
| US20050020565A1 (en) * | 2003-07-02 | 2005-01-27 | Jones Todd K. | CCK-1 receptor modulators |
| US20080119513A1 (en) * | 2004-09-06 | 2008-05-22 | Fumihiko Watanabe | Sulfonamide Derivative Selectively Inhibiting Mmp-13 |
| US7576222B2 (en) * | 2004-12-28 | 2009-08-18 | Wyeth | Alkynyl-containing tryptophan derivative inhibitors of TACE/matrix metalloproteinase |
| AP2616A (en) | 2005-01-13 | 2013-03-18 | Univ Wollongong | Peptidic compounds |
| US20070275944A1 (en) * | 2006-04-05 | 2007-11-29 | The Board Of Trustees Operating Michigan State University | Antioxidants and methods of their use |
| RU2591210C2 (ru) * | 2011-03-02 | 2016-07-20 | Аквилус Фармасьютикалз, Инк. | Соединения и способы лечения боли и других расстройств |
| WO2013151584A1 (en) | 2011-10-31 | 2013-10-10 | The Methodist Hospital Research Institute | Compound comprising a mao targeting/ seeker moiety for treating human gliomas |
| WO2015107139A1 (en) | 2014-01-17 | 2015-07-23 | Proyecto De Biomedicina Cima, S.L. | Compounds for use as antifibrinolytic agents |
Family Cites Families (60)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4954158A (en) | 1983-08-16 | 1990-09-04 | University Of Georgia Research Foundation, Inc. | 2,3-methanoproline |
| GB8601368D0 (en) | 1986-01-21 | 1986-02-26 | Ici America Inc | Hydroxamic acids |
| DK77487A (da) | 1986-03-11 | 1987-09-12 | Hoffmann La Roche | Hydroxylaminderivater |
| ZA877471B (en) | 1986-10-08 | 1988-04-05 | Bristol-Myers Company | 1-tertiary-alkyl-substituted naphthyridine-and quinoline-carboxylic acid antibacterial agents |
| FR2609289B1 (fr) | 1987-01-06 | 1991-03-29 | Bellon Labor Sa Roger | Nouveaux composes a activite d'inhibiteurs de collagenase, procede pour les preparer et compositions pharmaceutiques contenant ces composes |
| GB8827305D0 (en) | 1988-11-23 | 1988-12-29 | British Bio Technology | Compounds |
| GB8919251D0 (en) | 1989-08-24 | 1989-10-04 | British Bio Technology | Compounds |
| DE4011172A1 (de) | 1990-04-06 | 1991-10-10 | Degussa | Verbindungen zur bekaempfung von pflanzenkrankheiten |
| US5189178A (en) | 1990-11-21 | 1993-02-23 | Galardy Richard E | Matrix metalloprotease inhibitors |
| US5183900A (en) | 1990-11-21 | 1993-02-02 | Galardy Richard E | Matrix metalloprotease inhibitors |
| GB9102635D0 (en) | 1991-02-07 | 1991-03-27 | British Bio Technology | Compounds |
| GB9107368D0 (en) | 1991-04-08 | 1991-05-22 | Smithkline Beecham Plc | Novel compounds |
| IL98681A (en) | 1991-06-30 | 1997-06-10 | Yeda Rehovot And Dev Company L | Pharmaceutical compositions comprising hydroxamate derivatives for iron removal from mammalian cells and from pathogenic organisms and some novel hydroxamate derivatives |
| DE4127842A1 (de) | 1991-08-22 | 1993-02-25 | Rhone Poulenc Rorer Gmbh | 5-((omega)-arylalky)-2-thienyl alkansaeuren, ihre salze und/oder ihre derivate |
| JPH05125029A (ja) | 1991-11-06 | 1993-05-21 | Yamanouchi Pharmaceut Co Ltd | 新規なアミド化合物又はその塩 |
| GB9200245D0 (en) | 1992-01-07 | 1992-02-26 | British Bio Technology | Compounds |
| WO1993020047A1 (en) | 1992-04-07 | 1993-10-14 | British Bio-Technology Limited | Hydroxamic acid based collagenase and cytokine inhibitors |
| EP1002556A3 (en) | 1992-05-01 | 2001-01-10 | British Biotech Pharmaceuticals Limited | Use of MMP inhibitors |
| AU666727B2 (en) | 1992-06-25 | 1996-02-22 | F. Hoffmann-La Roche Ag | Hydroxamic acid derivatives |
| GB9215665D0 (en) | 1992-07-23 | 1992-09-09 | British Bio Technology | Compounds |
| GB9223904D0 (en) | 1992-11-13 | 1993-01-06 | British Bio Technology | Inhibition of cytokine production |
| US5506242A (en) * | 1993-01-06 | 1996-04-09 | Ciba-Geigy Corporation | Arylsufonamido-substituted hydroxamic acids |
| US5552419A (en) * | 1993-01-06 | 1996-09-03 | Ciba-Geigy Corporation | Arylsulfonamido-substituted hydroxamic acids |
| US5455258A (en) * | 1993-01-06 | 1995-10-03 | Ciba-Geigy Corporation | Arylsulfonamido-substituted hydroxamic acids |
| NZ262942A (en) | 1993-03-29 | 1997-07-27 | Zeneca Ltd | Pyridyl substituted piperazine and various other derivatives of azaheteroaryl substituted piperazines; pharmaceutical compositions |
| ATE182581T1 (de) | 1994-06-22 | 1999-08-15 | British Biotech Pharm | Metalloproteinase-inhibitoren |
| EP0775139A1 (en) | 1994-08-10 | 1997-05-28 | British Biotech Pharmaceuticals Limited | Imidazopyridine derivatives as dual histamine (h1) and platelet activating factor (paf) antagonists |
| ATE198326T1 (de) | 1995-04-20 | 2001-01-15 | Pfizer | Arylsulfonamido-substituierte hydroxamsäure derivate als inhibitoren von mmp und tnf |
| KR980009238A (ko) * | 1995-07-28 | 1998-04-30 | 우에노 도시오 | 설포닐아미노산 유도체 |
| PT757984E (pt) * | 1995-08-08 | 2003-02-28 | Ono Pharmaceutical Co | Derivados de acido hidroxamico uteis para inibir a gelatinase |
| JPH11511137A (ja) | 1995-08-08 | 1999-09-28 | ファイブロゲン,インコーポレーテッド | コラーゲンの過剰生産に関係した疾患を治療するためのc−プロテイナーゼ阻害剤 |
| US5795890A (en) * | 1995-09-27 | 1998-08-18 | Ono Pharmaceutical Co., Ltd. | Sulfonamide derivatives |
| AU725831C (en) | 1995-12-08 | 2002-10-17 | Agouron Pharmaceuticals, Inc. | Metalloproteinase inhibitors, pharmaceutical compositions containing them and their pharmaceutical uses, and methods and intermediates useful for their preparation |
| EP0900791A1 (en) | 1995-12-27 | 1999-03-10 | Ono Pharmaceutical Co., Ltd. | Tetrazole derivatives and drugs containing the same as the active ingredient |
| FR2743073B1 (fr) | 1995-12-29 | 1998-02-20 | Fournier Ind & Sante | Nouveaux composes de 1-benzenesulfonylpyrrolidine, procede de preparation et utilisation en therapeutique |
| FR2743562B1 (fr) | 1996-01-11 | 1998-04-03 | Sanofi Sa | Derives de n-(arylsulfonyl) aminoacides, leur preparation, les compositions pharmaceutiques en contenant |
| CN100413859C (zh) | 1996-01-23 | 2008-08-27 | 盐野义制药株式会社 | 磺化的氨基酸衍生物及含有它的金属蛋白酶抑制剂 |
| TW448172B (en) | 1996-03-08 | 2001-08-01 | Pharmacia & Upjohn Co Llc | Novel hydroxamic acid derivatives useful for the treatment of diseases related to connective tissue degradation |
| WO1997045402A1 (fr) * | 1996-05-24 | 1997-12-04 | Ono Pharmaceutical Co., Ltd. | Derives de phenylsulfonamide |
| GB9613547D0 (en) | 1996-06-27 | 1996-08-28 | Pharmacia Spa | Matrix metalloproteinase inhibitors |
| GB9715962D0 (en) | 1996-08-23 | 1997-10-01 | Zeneca Ltd | Sulfonamides |
| NZ334251A (en) | 1996-08-28 | 2000-11-24 | Procter & Gamble | 1,3-diheterocyclic metalloprotease inhibitors |
| AU741893B2 (en) | 1996-08-28 | 2001-12-13 | Procter & Gamble Company, The | Substituted cyclic amine metalloprotease inhibitors |
| AU734834B2 (en) | 1996-08-28 | 2001-06-21 | Procter & Gamble Company, The | Heterocyclic metalloprotease inhibitors |
| BR9712792A (pt) | 1996-08-28 | 1999-12-14 | Procter & Gamble | Inibidores de metaloprotease bidentada. |
| IL128663A0 (en) | 1996-08-28 | 2000-01-31 | Procter & Gamble | 1,4-heterocyclic metalloprotease inhibitors |
| CZ63799A3 (cs) | 1996-08-28 | 1999-08-11 | The Procter & Gamble Company | Spirocyklické metalloproteázové inhibitory |
| DE69716619T2 (de) | 1996-08-28 | 2003-06-26 | The Procter & Gamble Company, Cincinnati | Phosphinsäureamide als matrix metalloprotease inhibitoren |
| EP0934267B1 (en) | 1996-10-22 | 2002-01-30 | PHARMACIA & UPJOHN COMPANY | Alpha-amino sulfonyl hydroxamic acids as matrix metalloproteinase inhibitors |
| AU720615B2 (en) | 1997-01-17 | 2000-06-08 | Pharmacia & Upjohn Company | Bis-sulfonomides hydroxamic acids as MMP inhibitors |
| JPH10204054A (ja) * | 1997-01-21 | 1998-08-04 | Ono Pharmaceut Co Ltd | フェニルスルホンアミド誘導体 |
| WO1998033768A1 (en) | 1997-02-03 | 1998-08-06 | Pfizer Products Inc. | Arylsulfonylamino hydroxamic acid derivatives |
| GB9706255D0 (en) | 1997-03-26 | 1997-05-14 | Smithkline Beecham Plc | Novel compounds |
| WO1998043963A1 (en) | 1997-04-01 | 1998-10-08 | Agouron Pharmaceuticals, Inc. | Metalloproteinase inhibitors, pharmaceutical compositions containing them and their pharmaceutical uses |
| DE59802394D1 (de) * | 1997-05-09 | 2002-01-24 | Hoechst Ag | Substituierte Diaminocarbonsäuren |
| AU7294098A (en) * | 1997-05-09 | 1998-11-27 | Agouron Pharmaceuticals, Inc. | Metalloproteinase inhibitors, pharmaceutical compositions containing them and their pharmaceutical uses |
| HUP0004595A3 (en) * | 1997-07-31 | 2001-12-28 | Procter & Gamble | Acyclic metalloprotease inhibitors |
| CN1195735C (zh) * | 1998-02-04 | 2005-04-06 | 诺瓦提斯公司 | 抑制使基质退化的金属蛋白酶的磺酰氨基衍生物 |
| JPH11246527A (ja) * | 1998-03-02 | 1999-09-14 | Shionogi & Co Ltd | Mmp−8阻害剤 |
| ID26829A (id) * | 1998-04-03 | 2001-02-15 | Sankyo Co | Turunan-turunan sulfonamida |
-
2000
- 2000-03-01 CN CN00806919A patent/CN1349498A/zh active Pending
- 2000-03-01 EP EP00912064A patent/EP1165501A1/en not_active Withdrawn
- 2000-03-01 IL IL14508900A patent/IL145089A0/xx unknown
- 2000-03-01 BR BR0008716-5A patent/BR0008716A/pt not_active IP Right Cessation
- 2000-03-01 JP JP2000602203A patent/JP2002538136A/ja not_active Withdrawn
- 2000-03-01 RU RU2001126721/04A patent/RU2001126721A/ru unknown
- 2000-03-01 HU HU0202199A patent/HUP0202199A2/hu unknown
- 2000-03-01 TR TR2001/02523T patent/TR200102523T2/xx unknown
- 2000-03-01 CZ CZ20013176A patent/CZ20013176A3/cs unknown
- 2000-03-01 KR KR1020017011236A patent/KR20010102486A/ko not_active Application Discontinuation
- 2000-03-01 MX MXPA01008855A patent/MXPA01008855A/es unknown
- 2000-03-01 CA CA002364878A patent/CA2364878A1/en not_active Abandoned
- 2000-03-01 PL PL00350340A patent/PL350340A1/xx not_active Application Discontinuation
- 2000-03-01 NZ NZ513831A patent/NZ513831A/en unknown
- 2000-03-01 WO PCT/US2000/005162 patent/WO2000051975A1/en not_active Application Discontinuation
- 2000-03-01 SK SK1245-2001A patent/SK12452001A3/sk unknown
- 2000-03-01 US US09/517,080 patent/US6197770B1/en not_active Expired - Fee Related
- 2000-03-01 AU AU33860/00A patent/AU764051B2/en not_active Ceased
- 2000-03-03 CO CO00015564A patent/CO5150219A1/es unknown
- 2000-03-16 PE PE2000000232A patent/PE20001565A1/es not_active Application Discontinuation
-
2001
- 2001-08-23 ZA ZA200106967A patent/ZA200106967B/en unknown
- 2001-08-31 NO NO20014242A patent/NO20014242L/no not_active Application Discontinuation
- 2001-09-03 MA MA26310A patent/MA25391A1/fr unknown
-
2002
- 2002-06-24 HK HK02104689.6A patent/HK1044754A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| NO20014242D0 (no) | 2001-08-31 |
| CA2364878A1 (en) | 2000-09-08 |
| PL350340A1 (en) | 2002-12-02 |
| HK1044754A1 (zh) | 2002-11-01 |
| EP1165501A1 (en) | 2002-01-02 |
| WO2000051975A1 (en) | 2000-09-08 |
| PE20001565A1 (es) | 2001-02-02 |
| KR20010102486A (ko) | 2001-11-15 |
| AU3386000A (en) | 2000-09-21 |
| US6197770B1 (en) | 2001-03-06 |
| MA25391A1 (fr) | 2002-04-01 |
| JP2002538136A (ja) | 2002-11-12 |
| RU2001126721A (ru) | 2004-02-20 |
| BR0008716A (pt) | 2002-09-24 |
| NO20014242L (no) | 2001-09-27 |
| SK12452001A3 (sk) | 2002-04-04 |
| AU764051B2 (en) | 2003-08-07 |
| ZA200106967B (en) | 2002-03-13 |
| HUP0202199A2 (en) | 2002-10-28 |
| NZ513831A (en) | 2001-09-28 |
| CZ20013176A3 (cs) | 2002-04-17 |
| TR200102523T2 (tr) | 2002-02-21 |
| CO5150219A1 (es) | 2002-04-29 |
| IL145089A0 (en) | 2002-06-30 |
| MXPA01008855A (es) | 2002-07-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1349498A (zh) | 含有链烯基和炔基的金属蛋白酶抑制剂 | |
| CN1207289C (zh) | 金属蛋白酶抑制剂,含有它们的药物组合物和其药物用途,其制备方法和中间体 | |
| CN1265647A (zh) | 无环金属蛋白酶抑制剂 | |
| CN1195735C (zh) | 抑制使基质退化的金属蛋白酶的磺酰氨基衍生物 | |
| CN1418193A (zh) | 含有杂环侧链的金属蛋白酶抑制剂 | |
| CN1232457A (zh) | 1,4-杂环类金属蛋白酶抑制剂 | |
| CN1362951A (zh) | 二杂-取代的金属蛋白酶抑制剂 | |
| CN1230884A (zh) | 硫羟砜金属蛋白酶抑制剂 | |
| CN1228771A (zh) | 1,3-二杂环金属蛋白酶抑制剂 | |
| CN1232451A (zh) | 取代的环状胺金属蛋白酶抑制剂 | |
| CN1228772A (zh) | 杂环金属蛋白酶抑制剂 | |
| CN1420881A (zh) | 作为基质金属蛋白酶和TNF-α抑制剂的β-氨基酸衍生物 | |
| CN1243505A (zh) | 苯甲脒衍生物 | |
| CN1481377A (zh) | 作为基质金属蛋白酶和TNF-α的抑制剂的环β-氨基酸衍生物 | |
| CN1653047A (zh) | 抗炎症药物单环芳酰吡啶酮 | |
| CN1747936A (zh) | 作为治疗试剂的取代吡咯衍生物 | |
| CN1518541A (zh) | 苯基衍生物 | |
| CN1076345C (zh) | 2,3-二氨基丙酸衍生物 | |
| CN1305454A (zh) | 作为cgmp-磷酸二酯酶抑制剂的邻氨基苯甲酸衍生物 | |
| CN1297436A (zh) | 取代的异羟肟酸吡咯烷酯金属蛋白酶抑制剂 | |
| CN1071930A (zh) | 用作治疗艾滋病的人免疫缺陷病毒蛋白酶的抑制剂 | |
| CN1178915C (zh) | 含有炔基的异羟肟酸衍生物、其制备及其作为基质金属蛋白酶抑制剂/TNF-α转变酶抑制剂的用途 | |
| CN1656086A (zh) | 苯并呋喃衍生物 | |
| CN1764655A (zh) | 芳族砜异羟肟酸酯及其作为蛋白酶抑制剂的用途 | |
| CN1183107C (zh) | 作为tace抑制剂的含炔基的异羟肟酸化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C06 | Publication | ||
| PB01 | Publication | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |