Alkoholo
Alkoholo povas:
- specife rilati al la substanco, kiu troviĝas en fermentintaj trinkaĵoj, kaj kiun oni povas koncentri per distilado; pli precize nomata "etil-alkoholo" aŭ "etanolo".
- priskribi iun ajn anon el la klaso de kemiaj kombinaĵoj, kiuj havas hidroksilan grupon senpere konektitan al la atomo de karbono (kaj el kiuj etilalkoholo estas unu ekzemplo).
La vorto devenas de la araba al-kohl, kiel oni nomas antimonan sulfidon. La ligo inter ili estas, ke alkemiistoj izolis antimonan sulfuridon (por uzo kiel kontraŭsepsaĵo kaj kosmetikaĵo) per sublimado. Oni latinigis la vorton kiel alcohol, kaj uzis ĝin por nomi ankaŭ aliajn produktojn de sublimado aŭ distilado, inkluzivante la distilaĵon de vino
Historio
[redakti | redakti fonton]
La vorto alkoholo devenas de la araba الكحول al-kukhūl 'la spirito', de al- (artikolo)) kaj kuḥūl kio signifas 'subtila'. Tio rilatas al la fakto ke antikve "spirito" aludis al alkoholoj. Por ekzemplo "spirito de vino" aludis al etanolo, kaj "spirito de ligno" al metanolo.
La metodo de distilado estis malkovrita per persoj en la araba imperio, per "alambiko" (distililo). Muhammad ibn Zakariya al-Razi, persa kuracisto (864-925), unue priskribis science principojn de alkohola distilado, la ilojn bezonatajn, kaj elfarado de brando. Aviceno, persa filozofo (980-1037) plibonigis la distililon per elpensado de la distil-serpento.
La araboj konis la alkoholon produktita el vino per distilado. Tamen, ties malkovron foje oni datigis ĉe la 14a jarcento, atribuante al la kuracisto Arnoldo de Vilanova, alkemia saĝulo kaj profesoro de medicino en Montpeliero. La kvinesenco de Ramon Lullo estis nur alkoholo ŝanĝita je milda temperaturo.
Distililo kaj brando alvenis Andaluzion, kaj poste disvastiĝis tra Eŭropo. Ofte la monaĥoj en la abatejoj estis la unuaj produktantoj kaj vendistoj de tiaj "akvoj", kiel oni tiam ilin nomis. Tiel la abatejoj de Irlando jam distilis la uisce beatha en 1170, kiam la soldatoj de Henriko la 2-a invadis Irlandon.
En 1661, per la distilado de buksa ligno, izolis Robert Boyle la substancon (ne taŭga por trinki), kiun li nomis spirit of box (spirito de bukso). Pli malfrue oni nomis tion substancon "ligna alkoholo", "metilalkoholo", "metanolo".
Antoine Lavoisier estis kiu diskonigis la devenon kaj la manieron produkti alkoholon pere de la fermentado vina, pruvante ke sub la influo de bier-gisto la sukero el binvero transformiĝas en karbonata acido kaj alkoholo. Ĝi estis studita ankaŭ de Scheele, Gehle, Thénard, Duma kaj Boullay kaj en 1854 Berthelot akiris ĝin per sintezado.[1]
Variaj signifoj
[redakti | redakti fonton]
Oni diras alkoholo, kiam oni pensas pri alkoholaĵo, ebriigaĵo, trinkaĵo. La efika parto de la naturaj ebriigaĵoj estas kemie etanolo.
Malsaneca ĉiama sopiro je alkoholo nomiĝas alkoholismo.
Alkoholoj kiel klaso de kombinaĵoj
[redakti | redakti fonton]En nuntempa kemio, la vorto "alkoholo" signifas ne nur la etanolon (aŭ etilalkoholon) en trinkaĵoj. Anstataŭe, la vorto signifas iun ajn anon de klaso de kombinaĵoj, inter kiuj etanolo estas unu.
Alkoholoj estas organikaj substancoj kun OH-grupo.
Alkoholoj kun unu hidroksilo
[redakti | redakti fonton]
Pri monooloj, inter aliaj formuloj, la plej komuna formulo estas CnH2n+1OH.
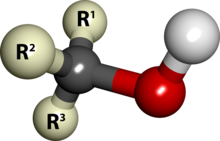
Primara alkoholo, sekundara alkoholo kaj terciara alkoholo rilatas al alkoholoj kun respektive unu, du aŭ tri alkiloj (Vd la apudajn desegnojn).
El alkanoj, alkenoj kaj alkinoj eblas obteni respektive alkanolojn, alkenolojn kaj alkinolojn, kiuj laŭ la kazoj estas pli aŭ malpli stabilaj.
Alkoholoj kun unu aŭ pluraj hidroksiloj
[redakti | redakti fonton]Depende de la nombro de la OH-grupoj, oni parolas pri 1-,2-,3 ktp valoraj alkoholoj:
- unuvalora alkoholo (monoolo) kiel etanolo,
- duvalora alkoholo (diolo) kiel etilenalkoholo (glikolo uzata kiel malfrostilo)
- trivalora alkoholo (triolo) kiel glicerino.
Per la uzo de la neoficiala postafikso ol-, PIV[2] priskribas la alkoholon kun unu, du, tri, kvar kaj pluraj hidroksiloj per respektive la terminoj monoolo, diolo, triolo, tetraolo kaj poliolo.
Se la grupo ligiĝas al karbono de aromata ciklo (aromataj kombinaĵoj) temas pri fenoloj.
Ĝeneralaj ecoj
[redakti | redakti fonton]Alkoholoj estas senkoloraj kaj preskaŭ senodoraj. Ili estas likvoj aŭ eĉ (se ili estas grandmolekulaj) solidaj je 20 °C, ĉar la hidroksila grupo ebligas hidrogenajn ligojn, kaj tiuj malplifaciligas gasiĝon. La malgrand-molekulaj alkoholoj solveblas en akvo, ĉar la hidroksila grupo facile ligiĝas kun ĝi.
La fizikaj kaj kemiaj proprecoj dependas de la loko de la OH-grupo kaj de la bazmolekulo (R), kiu povas enhavi aliajn funkciajn grupojn. Fakte, alkoholoj, kiel akvo, povas montri aŭ acidajn aŭ bazajn proprecojn de la -OH grupo. Kun pKa de ĉirkaŭ 16-19, ili estas, ĝenerale, iomete pli malfortaj acidoj ol pura akvo, sed ili ankoraŭ povas reagi kun fortaj bazoj kiel natria hidrido aŭ reakciaj metaloj (M) kiel natrio. La saloj, kiuj rezultas, respondas al la ĝenerala formulo RO-M+.
Nature troviĝas multe en la volatilaj oleoj. Ili estas partoj (kiel esteroj) en oleoj kaj vaksoj.
El tiuj kombinaĵoj, kelkaj estas venenaj, eĉ en malgrandaj kvantoj. Ekzemple, konsumo de metanolo (aŭ metilalkoholo) povas kaŭzi dumvivan blindecon, ĉar la metabolo de mamulo ŝanĝas ĝin en formaldehidon kaj formikan acidon.
Uzo de alkoholo
[redakti | redakti fonton]Alkoholo estas uzata en diversaj sferoj tra la tuta mondo jam dum longa tempo. Oni trovas ĝin en alkoholaĵoj, kiujn oni vendas al plenkreskuloj, en brulaĵo, kaj krome ĝi estas uzata por pluraj sciencaj, medicinaj kaj industriaj aplikoj. La vorto "senalkohola" ofte rilatas al produktaĵoj kiuj ne enhavas alkoholon, partikulare al trinkaĵoj similaj (laŭ gusto, koloro, teksturo, tradicia uzado ktp) al alkoholaĵoj, sed sen enhavo de alkoholo kaj foje kun ege malgranda kvanto da alkoholo.
Certaj grupoj de konsumantoj povas havi diversajn limigojn pri la konsumo de nutraĵoj kiuj povas enhavi alkoholon (infanoj), ekzemple en kukoj kaj aliaj dolĉaĵoj kiuj povas enhavi alkoholon.
Alkoholaĵoj
[redakti | redakti fonton]Alkoholaĵoj kutime enhavas 3–40% da etanolo (volumenaj elcentoj) kaj estis produktitaj kaj aktive konsumataj pere de homoj jam ekde antaŭ-prahistoria tempo. Aliaj oftaj alkoholoj estas 2-metilo-2-butanolo (troviĝas en biero) kaj gama-hidroksibuterata acido (GHB) estas konsumataj pro ties psikaj efektoj.
Kontraŭfrostaj kemiaĵoj
[redakti | redakti fonton]50% (volumena) solvaĵo de etilenglikolo en akvo estas kutime uzata por preventi frostiĝon (malfrostilo).
Antisepsaĵoj
[redakti | redakti fonton]Etanolo povas esti uzata kiel kontraŭsepsaĵo por seninfektigi haŭton antaŭ injekto, ofte kune kun jodo. Sapoj surbaze de etanol fariĝas nun kutimaj en restoracioj kaj estas utila metodo por ne instali sekigan aŭtomaton por manoj kaj fariĝas modernaj metodoj por lavi manojn, ĉar tiu sapo mem elvaporiĝas.
Fizika tabelo de la alkoholoj
| |||||||
CAS numero |
Kemia formulo |
Specifa maso g/cm3 |
|||||
CH4O |
-97 |
65 |
11 |
0,791 |
1.328
| ||
C2H6O |
-114 |
79 |
13 |
0,789 |
1.361
| ||
C3H8O |
-90 |
82 |
11,7 |
0,786 |
1.377
| ||
C3H8O |
-127 |
97 |
14 |
0,804 |
1.386
| ||
C4H10O2 |
-50 |
192 |
90 |
1,006 |
1.4378
| ||
C4H10O2 |
-50 |
210 |
108 |
1,005 |
1.4401
| ||
C4H10O2 |
19 |
183 |
85 |
0,987 |
1.4350
| ||
C4H10O |
-115 |
99 |
26 |
0,807 |
1.395
| ||
C4H10O |
-90 |
118 |
35 |
0,81 |
1.399
| ||
C4H8O |
122,5 |
262,5 |
21 |
0,921 |
1.435
| ||
C4H10O |
23-26 |
77,9 |
11,1 |
0,786 |
1.386
| ||
C5H12O |
92,5 |
112 |
113 |
0,81 |
1.4091
| ||
C5H12O |
70 |
130 |
43,3 |
0,819 |
1.411
| ||
C5H12O |
12 |
102 |
67 |
0,805 |
1.404
| ||
C5H12O |
-73 |
118 |
34 |
0,805 |
1.404
| ||
C5H12O |
-117 |
113 |
26 |
0,819 |
1.4091
| ||
C5H12O |
-64 |
116 |
40 |
0,816 |
1.408
| ||
C5H10O |
-19 |
139-140 |
51,11 |
0,949 |
1.453
| ||
C5H12O |
-79 |
138 |
49 |
0,814 |
1.409
| ||
C6H14O |
-23 |
140 |
45 |
0,811 |
1.413
| ||
C6H14O |
-57 |
136 |
35 |
0,814 |
1.414
| ||
C6H12O |
23 |
73 |
67,8 |
0,948 |
1.4630
| ||
C6H14O |
-47 |
158 |
59 |
0,814 |
1.418
| ||
C7H16O |
-30,2 |
161 |
64,4 |
0,814 |
1.419
| ||
C7H16O |
-70 |
157 |
54,4 |
0,817 |
1.420
| ||
C7H16O |
-42 |
155 |
61,8 |
0,815 |
1.418
| ||
C7H8O |
-15,2 |
205,3 |
93 |
1,044 |
1.5396
| ||
C7H14O |
2 |
185 |
71 |
0,948 |
1.463
| ||
C7H16O |
-33 |
175 |
73 |
0,819 |
1.423
| ||
C8H18O |
-32 |
180 |
71,1 |
0,819 |
1.424
| ||
C8H18O |
-45 |
175 |
65,6 |
0,818 |
1.421
| ||
C8H18O |
-41 |
177 |
71,1 |
0,815 |
1.423
| ||
C8H18O |
-16 |
194 |
81 |
0,827 |
1.427
| ||
C9H20O |
-35 |
199 |
82 |
0,82 |
1.429
| ||
C9H20O |
22 |
195 |
79,5 |
0,821 |
1.429
| ||
C9H20O |
25 |
193 |
79,5 |
0,822 |
1.428
| ||
C9H20O |
5 |
195 |
79,5 |
0,818 |
1.427
| ||
C9H20O |
-4 |
212 |
74 |
0,827 |
1.433
| ||
C10H22O |
-5 |
210 |
85 |
0,822 |
1.432
| ||
C10H22O |
-5 |
213,4 |
87,1 |
0,823 |
1.432
| ||
C10H22O |
-11 |
210 |
82 |
0,82 |
1.431
| ||
C10H22O |
8 |
201 |
87,1 |
0,82 |
1.431
| ||
C10H22O |
6 |
233 |
108 |
0,829 |
1.437
| ||
C11H24O |
2 |
230 |
92,4 |
0,823 |
1.435
| ||
C11H24O |
11 |
132 |
38 |
0,825 |
1.437
| ||
C11H24O |
-13 |
229,7 |
94 |
0.828 |
1.435
| ||
C11H24O |
-4 |
229 |
94 |
0,83 |
1.436
| ||
C11H24O |
14 |
244 |
113 |
0,83 |
1.439
| ||
C12H26O |
19 |
249 |
97,8 |
0,826 |
1.440
| ||
C12H26O |
25 |
245,5 |
100,1 |
0,828 |
1.440
| ||
C12H26O |
11 |
225 |
100,1 |
0,826 |
1.439
| ||
C12H26O |
16 |
250 |
100,1 |
0,826 |
1.439
| ||
C12H26O |
26 |
265 |
115,4 |
0,831 |
1.441
| ||
C13H28O |
30,5-33,5 |
272,1 |
121,1 |
0.822 |
1.4433
| ||
C13H28O |
25 |
268 |
102,3 |
0,828 |
1.443
| ||
C13H28O |
32 |
257,3 |
105,5 |
0,831 |
1.442
| ||
C13H28O |
26 |
268 |
105,5 |
0,819 |
1.436
| ||
C14H30O |
34 |
284 |
106 |
0,831 |
1.444
| ||
C14H30O |
32 |
284,5 |
110,4 |
0,809 |
1.434
| ||
C14H30O |
32 |
275,5 |
110,4 |
0,81 |
1.4237
| ||
C14H30O |
35-39 |
289 |
145 |
0,823 |
1.4358
| ||
C14H30O |
39 |
264 |
261 |
0,833 |
1.443
| ||
C15H32O |
33 |
283,8 |
109 |
0.833 |
1.445
| ||
C15H32O |
38,8 |
290,2 |
114,1 |
0.833 |
1.4249
| ||
C15H32O |
46 |
300,2 |
114,7 |
0.822 |
1.4249
| ||
C15H32O |
46 |
270 |
130,1 |
0,834 |
1.446
| ||
C16H34O |
47 |
314 |
111,3 |
0,833 |
1.447
| ||
C16H34O |
50 |
304,4 |
118,6 |
0,834 |
1.576
| ||
C16H34O |
38 |
128 |
... |
0,834 |
…
| ||
C16H34O |
49 |
344 |
135 |
0,818 |
1.428
| ||
C16H34O |
48-50 |
310,9 |
135 |
0,818 |
1.4283
| ||
C17H36O |
54 |
308 |
111,3 |
0,835 |
1.448
| ||
C17H36O |
51,5 |
329,7 |
... |
0,841 |
1.4305
| ||
C17H36O |
54... |
318,2 |
122 |
0,835 |
1.448
| ||
C17H36O |
54 |
338 |
136,4 |
0,836 |
1.432
| ||
C18H38O |
52 |
319,3 |
114,2 |
0.836 |
1.449
| ||
C18H38O |
51 |
331,6 |
124,9 |
0.836 |
1.4567
| ||
C18H38O |
49 |
270,5 |
81 |
0.835 |
1.4500
| ||
C18H38O |
58 |
336 |
185 |
0,812 |
1.451.
| ||
Referencoj
[redakti | redakti fonton]- ↑ Diccionario enciclopédico popular ilustrado Salvat (1906-1915)
- ↑ Vd la postafikson ol- [1] en Plena Ilustrita Vortaro
Vidu ankaŭ
[redakti | redakti fonton]Eksteraj ligiloj
[redakti | redakti fonton]
| ||||
