Benzylalkohol
| Benzylalkohol | |
|---|---|
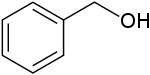 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | fenylmethanol |
| Ostatní názvy | fenylmethylalkohol, E 1519 |
| Sumární vzorec | C7H8O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 100-51-6 |
| PubChem | 244 |
| SMILES | c1ccc(cc1)CO |
| InChI | InChI=1/C7H8O/c8-6-7-4-2-1-3-5-7/h1-5,8H,6H2 |
| Vlastnosti | |
| Molární hmotnost | 108,14 g/mol |
| Teplota tání | −15,2 °C (258,0 K) |
| Teplota varu | 205,3 °C (478,4 K) |
| Hustota | 1,044 g/cm3 |
| Index lomu | 1,5396 |
| Disociační konstanta pKa | 15,40 |
| Rozpustnost ve vodě | 3,50 g/100 ml (20 °C) 4,29 g/100 ml (25 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu, ethanolu a acetonu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru, chloroformu a benzenu |
| Tlak páry | 180 Pa (60 °C) |
| Měrná magnetická susceptibilita | −6,64×105 μm3/g |
| Struktura | |
| Dipólový moment | 1,67 D |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −352 kJ/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 93 °C (366 K) |
| Teplota vznícení | 436 °C (709 K) |
| Meze výbušnosti | 1,3 až 13 % |
Některá data mohou pocházet z datové položky. | |
Benzylalkohol je organická sloučenina se vzorcem C6H5CH2OH. Jedná se o bezbarvou kapalinu se slabou aromatickou vůní. Tato látka se často používá jako rozpouštědlo, a to díky své polaritě, nízké toxicitě a nízkému tlaku syté páry. Benzylalkohol se slabě rozpouští ve vodě (kolem 4 g/100 ml) a mísí se s alkoholy a diethyletherem. Anion vzniklý deprotonací alkoholové skupiny benzylalkoholu se nazývá benzylát nebo benzyloxid.
Výskyt
[editovat | editovat zdroj]Benzylalkohol se přirozeně vytváří v mnoha rostlinách a často se vyskytuje v ovoci. Rovněž je obsažen v silicích mnoha rostlin, jako jsou například jasmín, hyacint a ylang-ylang. Obsahuje jej též kastoreum.[2]
Výroba
[editovat | editovat zdroj]Benzylalkohol se vyrábí hydrolýzou benzylchloridu za přítomnosti hydroxidu sodného:
- C6H5CH2Cl + NaOH → C6H5CH2OH + NaCl
Také se dá získat reakcí fenylmagnesiumbromidu s formaldehydem.
Reakce
[editovat | editovat zdroj]Benzylalkohol, podobně jako většina alkoholů, reaguje s karboxylovými kyselinami za vzniku esterů. V organické syntéze se benzylestery často používají jako chránicí skupiny, které lze odstranit mírnou hydrogenolýzou.[3]
Benzylalkohol reaguje s akrylonitrilem za tvorby N-benzylakrylamidu:[4]
- C6H5CH2OH + NCCHCH2 → C6H5CH2N(H)C(O)CHCH2
Použití
[editovat | editovat zdroj]Benzylalkohol je častým rozpouštědlem inkoustů, vosků, barev, laků a epoxidových pryskyřic a bývá tak součástí směsí na odstraňování nátěrů, obzvláště ve směsi s látkami zvyšujícími viskozitu, které usnadňují přichycení k natřenému povrchu.[5]
Také se používá jako prekurzor řady esterů, využívaných například při výrobě mýdel a parfémů. Často bývá součástí náplní elektronických cigaret, kde navyšuje obsah vůní. Při styku 10% benzylalkoholu s poškozenou kůží nebo sliznicí funguje jako lokální anestetikum a antimikrobiální látka. Slouží také jako odmašťovací přísada v prostředcích na čištění koberců. Jakožto rozpouštědlo barev benzylalkohol usnadňuje barvení vlny, nylonu a kůže.[6] Může být také součástí repelentů.
V nanotechnologiích
[editovat | editovat zdroj]Benzylalkohol se používá jako dielektrické rozpouštědlo při dielektroforetické rekonfiguraci nanovláken.[7][8]
Ve zdravotnictví
[editovat | editovat zdroj]Benzylalkohol může být při nízkých koncentracích použit jako bakteriostatický konzervant u nitrožilních a povrchových léků a také v kosmetice; zabraňuje zavírání průduchů u vší, které se tak ucpou vodou nebo olejem a vši se tak udusí. Obvyklá koncentrace je 5 %.
Ostatní použití
[editovat | editovat zdroj]Benzylalkohol má téměř stejný index lomu jako křemen a vlna; pokud se předmět z čistého křemene ponoří do benzylalkoholu, stane se téměř neviditelným, což lze využít k ověření, zda je tvořen skutečným křemenem. Obdobně vlna ponořená do benzylalkoholu také téměř přestane být viditelná, čímž je možné odhalit nečistoty jako jsou rostlinné materiály.
Bezpečnost
[editovat | editovat zdroj]Benzylalkohol má nízkou akutní toxicitu, smrtelná dávka u krys je přibližně 1,2 g/kg[9] Rychle se oxiduje na kyselinu benzoovou, která v játrech reaguje s glycinem a vylučuje se jako kyselina hippurová. Vysoké koncentrace mohou vést k toxickým účinkům, kterými jsou selhání dechu, vazodilatace, nízký krevní tlak, křeče a ochrnutí.
Benzylalkohol silně dráždí oči,[9] v čisté podobě způsobuje odumírání rohovky.[10]
Benzylalkohol není považován za karcinogen a nejsou u něj potvrzené ani teratogenní účinky nebo reprodukční toxicita.[9]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Benzyl alcohol na anglické Wikipedii.
- ↑ a b Benzyl alcohol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Dietland Muller-Schwarze. The Beaver: Its Life and Impact. [s.l.]: [s.n.], 2003. Dostupné online. S. 43.
- ↑ FURUTA, Kyoji; GAO, Qing-Zhi; YAMAMOTO, Hisashi. Chiral (Acyloxy)borane Complex-Catalyzed Asymmetric Diels-Alder Reaction: (1R)-1,3,4-Trimethyl-3-Cyclohexene-1-Carboxaldehyde. Org. Synth.. 1995, s. 86. Dostupné online.; Coll. Vol.. S. 722.
- ↑ PARRIS, Chester L. N-benzylacrylamide. Org. Synth.. 1962, s. 16. Dostupné online.; Coll. Vol.. S. 73.
- ↑ Benzyl alcohol [online]. chemicalland21.com [cit. 2019-05-14]. Dostupné v archivu pořízeném dne 2009-04-21.
- ↑ Michael Ash; Irene Ash. Handbook of Preservatives. [s.l.]: Synapse Info Resources, 2004. Dostupné online. ISBN 978-1-890595-66-1. S. 292.
- ↑ Alex Wissner-Gross. Dielectrophoretic reconfiguration of nanowire interconnects. Nanotechnology. 2006, s. 4986–4990. Dostupné online.[nedostupný zdroj]
- ↑ Nanowires get reconfigured [online]. Nanotechweb.org, 19.10. 2006 [cit. 2019-05-15]. Dostupné v archivu pořízeném dne 2010-10-28.
- ↑ a b c Friedrich Brühne; Elaine Wright. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: John Wiley & Sons, 2007. S. 7–8.
- ↑ Swarupa G. Kulkarni; Harihara M. Mehendale. Encyclopedia of Toxicology. 2. vyd. [s.l.]: Elsevier, 2005. S. 262–264.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu benzyl alkohol na Wikimedia Commons
Obrázky, zvuky či videa k tématu benzyl alkohol na Wikimedia Commons

