인산삼칼슘
Tricalcium phosphate | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 삼칼슘비스(인산) | |
| 기타 이름 삼염기 인산칼슘 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.028.946 |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
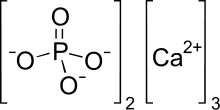
| Ca3(PO4)2 | |
| 몰 질량 | 310.18 |
| 외모 | 백색 비정질 분말 |
| 밀도 | 3.14g/cm3[1] |
| 녹는점 | 1,670 °C (3,040 °F, 1,940 K)[1] |
| 1.2mg/kg[1] | |
용해도 제품(Ksp) | 2.07×10−33[2] |
| 열화학 | |
표준 엔탈피/ 형성 (δHf⦵298) | -4126 kJ/mol(α형)[3] |
| 약리학 | |
| A12AA01(WHO) | |
| 위험 요소 | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | 불연성 |
| 관련 화합물 | |
기타 음이온 | 피로인산칼슘 |
기타 캐티온 | 인산트리마그네슘 인산삼나트륨 인산삼칼륨 |
관련 화합물 | 인산 단칼슘 인산 이칼슘 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
인산삼칼슘(TCP)은 화학식이3 Ca(PO4)2인 인산칼슘염이다.삼염기 인산칼슘과 석회의 골인산염(BPL)으로도 알려져 있습니다.용해도가 낮은 흰색 고체입니다."인산삼칼슘"의 상업적인 샘플은 사실 히드록시아파타이트이다.[4]
그것은 세 가지 결정성 다형체α,α', β로 존재한다.α와 α' 상태는 고온에서 안정적이다.
명명법
인산칼슘은 칼슘이온2+(Ca)과 오르토인산염(PO43−), 중인산염(Metaphosphate) 또는 피로인산염(PO274−), 때로는 산화물 및 수산화물 이온으로 구성된 수많은 물질을 말한다.특히 일반5 미네랄 아파타이트는 식 Ca(PO4)3X를 가지며, X는 F, Cl, OH 또는 혼합물이며, 여분의 이온이 주로 수산화물인 경우에는 히드록시아파타이트이다.시중에 유통되는 인산삼칼슘의 대부분은 실제로 히드록시아파타이트 분말이다.
준비
인산삼칼슘은 히드록시아파타이트를 인산 및 [4]소석회로 처리하여 상업적으로 제조된다.
수용액에서 직접 침전할 수는 없다.일반적으로 수용성 인산염과 칼슘염을 포함하는 이중 분해 반응이 사용된다. 예를 들어 (NH4)2HPO4 + Ca(NO3)2[5]는 신중하게 제어된 pH 조건에서 수행됩니다.침전물은 "아모르퍼스 인산 삼칼슘", ATCP 또는 칼슘 결핍 히드록시아파타이트, CDHA9, Ca44(HPO)(5OH)(CDHA는 때때로 아파타이트칼슘 [5][6][7]삼인산염으로 불린다).침전물을 소성함으로써 결정성 인산삼칼슘을 얻을 수 있다.β-Ca3(PO4)2는 일반적으로 형성되며, α-Ca3(2PO4)를 생성하기 위해서는 더 높은 온도가 필요하다.
습식 절차 대신 피로인산칼슘과 [6]탄산칼슘의 혼합물을 가열하는 방법이 있습니다.
- CaCO3 + CaPO227 → Ca3(PO4)2 + CO2
β-, α- 및 α'- Ca3(PO4)2 다형체의 구조
Tricalcium 인산는 동안 가장 높은 온도 형태 밀도가 낮아진 있β-tricalcium 인산 3.066 gcm−3의 결정 학적인 밀도가, α-tricalcium 인산 2.866 gcm−3과 α'-tricalcium의 밀도가 p. 3인식 동소체, 사방 6면체의.β- 형태(위에서 제시한), 그리고 두개의 고온 형태, 단사 α-과 육방 α'-다hosp증오는 2.702 g−3 cm의 밀도를 가지고 있다. 모든 형태는 산소를 통해 칼슘 [8]이온에 연결된 사면체 인산염 중심으로 구성된 복잡한 구조를 가지고 있다.고온 형태에는 각각 칼슘 이온만 포함된 기둥과 칼슘과 [9]인산염이 포함된 기둥 두 종류가 있습니다.
베타 형태와 알파 형태 사이에는 화학적, 생물학적 성질에 차이가 있으며, 알파 형태는 더 잘 용해되고 생분해됩니다.두 형태 모두 상업적으로 제공되며 의료 [9]및 치과 용도로 사용되는 제제로 제공됩니다.
발생.
인산칼슘은 뼈의 주요 연소 생성물 중 하나입니다(골재 참조).인산칼슘은 또한 일반적으로 [10]광물암과 같은 무기원으로부터 얻어진다.인산삼칼슘은 다음과 같은 여러 가지 형태로 자연적으로 발생합니다.
- 모로코, 이스라엘, 필리핀, 이집트, 콜라(러시아)에서는 암석으로, 다른 나라에서는 소량이다.자연의 형태는 완전히 순수하지 않으며, 모래나 석회 같은 다른 성분들도 성분을 바꿀 수 있습니다.PO의25 경우 대부분의 인산칼슘 암석은 30~40%의25 중량을 가지고 있다.
- 척추동물의 뼈와 이빨에
- 우유에 넣어주세요.
인산 삼칼슘, BCP
Biphasic phosphate, BCP는 원래 인산 삼칼슘으로 보고되었지만, X-레이 회절 기술은 이 물질이 히드록시아파타이트(HA)와 인산 [11]β-삼칼슘의 두 상으로 이루어진 긴밀한 혼합물임을 보여주었다.그것은 [12]도자기입니다.제제는 칼슘 결핍[6] 아파타이트의 비가역적 분해를 일으키는 소결작용을 수반하며, 예를 들어 [13]다음과 같다.[14]
- Ca10−δ(PO4)(6−δHPO4)(δOH)2−δ → (1-1)Ca10(PO4)(6OH)2 + 3µCa3(PO4)2
β-TCP는 피로인산칼슘, CaPO27, 아파타이트 등의 불순물을 포함할 수 있다.β-TCP는 생체 흡수가 가능하다.BCP의 생분해는 β-TCP 단계의 빠른 용해와 그에 이은 HA 결정의 제거를 포함한다. β-TCP는 생리학적 pH 수준에서 체액에 녹지 않기 때문에 용해는 산성 [6]pH를 생성하는 세포 활동을 필요로 한다.
사용하다
식품첨가물
인산삼칼슘은 예를 들어 식탁용 소금의 고화를 방지하기 위해 항고화제로 분말 향신료에 사용된다.칼슘 인산염은 유럽 식품 첨가물 번호 E341로 지정되었다.
건강 및 미용 제품
그것은 또한 베이비 파우더, 제산제,[4] 치약에서도 발견됩니다.
바이오메디컬
그것은 또한 영양 보충제로[15] 사용되며 [citation needed]소젖에서 자연적으로 발생하지만, 보충을 위한 가장 흔하고 경제적인 형태는 탄산칼슘과 [16]구연산칼슘이다.다른 칼슘 소금들의 다른 생물학적 가용성에 대한 몇 가지 논란이 있다.
자가 골이식이 불가능하거나 [17][18][19]불가능한 경우 골격 결손을 복구하기 위한 조직 대체제로 사용할 수 있습니다.단독으로 사용하거나 폴리글리콜산과 [20]같은 생분해성 흡수성 폴리머와 함께 사용할 수 있습니다.그것은 또한 골이식을 [21][22]위한 자가 재료와 결합될 수 있다.
다공질 베타-인산삼칼슘 발판은 뼈 [23]내 국소 약물 전달을 위한 약물 운반 시스템으로서 사용된다.
자연발생
오르토인산삼칼슘(V)의 천연 유사체인 투아이트는 일부 운석의 희귀한 성분이다.그것의 형성은 충격 [24]변성과 관련이 있다.
레퍼런스
- ^ a b c Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). Boca Raton, FL: CRC Press. p. 4.54. ISBN 9781498754293.
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99 ed.). CRC Press. pp. 5–188. ISBN 978-1138561632.
- ^ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b c Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2012). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ a b Destainville, A., Champion, E., Bernache-Assollant, D., Laborde, E. (2003). "Synthesis, characterization and thermal behavior of apatitic tricalcium phosphate". Materials Chemistry and Physics. 80 (1): 269–277. doi:10.1016/S0254-0584(02)00466-2.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ a b c d Rey, C.; Combes, C.; Drouet, C.; Grossin, D. (2011). "1.111 – Bioactive Ceramics: Physical Chemistry". In Ducheyne, Paul (ed.). Comprehensive Biomaterials. Vol. 1. Elsevier. pp. 187–281. doi:10.1016/B978-0-08-055294-1.00178-1. ISBN 978-0-08-055294-1.
- ^ Dorozhkin, Sergey V. (December 2012). "Amorphous calcium (ortho)phosphates". Acta Biomaterialia. 6 (12): 4457–4475. doi:10.1016/j.actbio.2010.06.031. PMID 20609395.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Yashima, M.; Sakai, A.; Kamiyama, T.; Hoshikawa, A. (2003). "Crystal structure analysis of β-tricalcium phosphate Ca3(PO4)2 by neutron powder diffraction". RNAl of Solid State Chemistry. 175 (2): 272–p277. Bibcode:2003JSSCh.175..272Y. doi:10.1016/S0022-4596(03)00279-2.
- ^ a b Carrodeguas, R.G.; De Aza, S. (2011). "α-Tricalcium phosphate: Synthesis, properties and biomedical applications". Acta Biomaterialia. 7 (10): 3536–3546. doi:10.1016/j.actbio.2011.06.019. PMID 21712105.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Yacoubou, Jeanne, MS. 채식 저널의 식재료 가이드 "식재료 가이드"The Vegetarian Resource Group, Web, 2012년 9월 14일
- ^ Daculsi, G.; Legeros, R. (2008). "17 – Tricalcium phosphate/hydroxyapatite biphasic ceramics". In Kokubo, Tadashi (ed.). Bioceramics and their Clinical Applications. Woodhead Publishing. pp. 395–423. doi:10.1533/9781845694227.2.395. ISBN 978-1-84569-204-9.
- ^ Salinas, Antonio J.; Vallet-Regi, Maria (2013). "Bioactive ceramics: from bone grafts to tissue engineering". RSC Advances. 3 (28): 11116–11131. Bibcode:2013RSCAd...311116S. doi:10.1039/C3RA00166K.
- ^ Elliott, J.C. (1994). "3 – Hydroxyapatite and Nonstoichiometric Apatites". Studies in Inorganic Chemistry. Vol. 18. Elsevier. pp. 111–189. doi:10.1016/B978-0-444-81582-8.50008-0. ISBN 9780444815828.
- ^ Vallet-Regí, M.;Rodríguez-Lorenzo, L.M. (November 1997). "Synthesis and characterisation of calcium deficient apatite". Solid State Ionics. 101–103, Part 2: 1279–1285. doi:10.1016/S0167-2738(97)00213-0.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Bonjour JP, Carrie AL, Ferrari S, Clavien H, Slosman D, Theintz G, Rizzoli R (March 1997). "Calcium-enriched foods and bone mass growth in prepubertal girls: a randomized, double-blind, placebo-controlled trial". J. Clin. Invest. 99 (6): 1287–94. doi:10.1172/JCI119287. PMC 507944. PMID 9077538.
- ^ Straub DA (June 2007). "Calcium supplementation in clinical practice: a review of forms, doses, and indications". Nutr Clin Pract. 22 (3): 286–96. doi:10.1177/0115426507022003286. PMID 17507729.
- ^ Paderni S, Terzi S, Amendola L (September 2009). "Major bone defect treatment with an osteoconductive bone substitute". Musculoskelet Surg. 93 (2): 89–96. doi:10.1007/s12306-009-0028-0. PMID 19711008. S2CID 33413039.
- ^ Moore DC, Chapman MW, Manske D (1987). "The evaluation of a biphasic calcium phosphate ceramic for use in grafting long-bone diaphyseal defects". Journal of Orthopaedic Research. 5 (3): 356–65. doi:10.1002/jor.1100050307. PMID 3040949. S2CID 41579389.
- ^ Lange TA, Zerwekh JE, Peek RD, Mooney V, Harrison BH (1986). "Granular tricalcium phosphate in large cancellous defects". Annals of Clinical and Laboratory Science. 16 (6): 467–72. PMID 3541772.
- ^ Cao H, Kuboyama N (September 2009). "A biodegradable porous composite scaffold of PGA/β-TCP for bone tissue engineering". Bone. 46 (2): 386–95. doi:10.1016/j.bone.2009.09.031. PMID 19800045.
- ^ Erbe EM, Marx JG, Clineff TD, Bellincampi LD (October 2001). "Potential of an ultraporous β-tricalcium phosphate synthetic cancellous bone void filler and bone marrow aspirate composite graft". European Spine Journal. 10 Suppl 2: S141–6. doi:10.1007/s005860100287. PMC 3611552. PMID 11716011.
- ^ Bansal S, Chauhan V, Sharma S, Maheshwari R, Juyal A, Raghuvanshi S (July 2009). "Evaluation of hydroxyapatite and beta-tricalcium phosphate mixed with bone marrow aspirate as a bone graft substitute for posterolateral spinal fusion". Indian Journal of Orthopaedics. 43 (3): 234–9. doi:10.4103/0019-5413.49387. PMC 2762171. PMID 19838344.
- ^ Kundu, B; Lemos A; Soundrapandian C; Sen PS; Datta S; Ferreira JMF; Basu D (2010). "Development of porous HAp and β-TCP scaffolds by starch consolidation with foaming method and drug-chitosan bilayered scaffold based drug delivery system". J. Mater. Sci. Mater. Med. 21 (11): 2955–69. doi:10.1007/s10856-010-4127-0. PMID 20644982. S2CID 6483779.
- ^ Tuite. Mindat.org



