P-TEFb
P-TEFb양전사인자 P-TEFb는 진핵생물에서 [1]RNA 중합효소 II(Pol II)에 의한 전사의 조절에 필수적인 역할을 하는 다단백질 복합체이다.개시 직후 Pol II는 대부분의 인간 유전자의 프로모터 근위부 정지 위치에 갇힌다(그림 1).[2][3]이번 생산적인 신장으로 전환 mRNAs의 합성으로 이어지게 되며, 국방 자원국 감도 인자와 부정적인 신장 인자(NELF)[5](DSIF)[4]유도뿐만 아니라 폴 II[6]의 거대한 소단위의 카르복시 말단 도메인 phosphorylate 수 있P-TEFb는 사이클린 의존성 인산화 효소. P-TEFb이 211에 의해 규제된다ersible7SK [7]snRNP와의 연관성. P-TEFb 억제제 DRB 또는 플라보피디롤을 사용한 세포 처리는 mRNA 생산 손실을 초래하고 궁극적으로 세포 [6][8]사멸을 초래한다.
검출, 구성 및 구조
P-TEFb는 드로소필라 [9]세포에서 파생된 시험관내 전사 시스템을 사용하여 긴 런오프 전사 생성에 필요한 인자로 확인 및 정제되었다.Cdk9 촉매 서브유닛과 Drosophila의 조절 서브유닛인 사이클린 T를 포함하는 사이클린 의존성 키나제이다.[10]인간에게는 Cdk9와 여러 사이클린 서브유닛 중 하나인 사이클린 T1, T2, [11][12]K-TEFb를 포함하는 여러 형태의 P-TEFb가 있으며, 이는 브로모도메인 단백질 [13]BRD4를 포함한 다른 인자와 관련되며, 초연장 [14][15]복합체라고 불리는 단백질의 큰 복합체와 관련되어 있다.중요한 것은 에이즈 바이러스인 HIV에서 P-TEFb는 정상적인 세포 P-TEFb 제어를 우회하여 HIV [17][18]게놈의 프로모터 정지 중합효소까지 직접 P-TEFb를 가져오는 HIV Tat[16] 단백질에 의해 표적이 된다는 것이다.
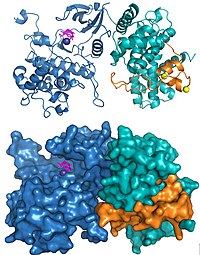
Cdk9와 사이클린 T1을 포함한 인간 P-TEFb의 구조와 HIV Tat·P-TEFb 복합체는 X선 결정학을 사용하여 해결되었다.해결된 첫 번째 구조는 두 개의 서브유닛이 다른 사이클린 의존성 [19]키나아제에서 발견된 것처럼 배열되었음을 입증했다.원래 구조에 사용된 서브유닛에 세 가지 아미노산 치환이 무심코 도입되었고, 올바른 배열을 사용한 후속 구조 결정은 활성 [20]부위 주변의 몇 가지 중요한 변화를 제외하고 동일한 전체 구조를 보여주었다.P-TEFb에 결합된 HIV Tat의 구조는 바이러스 단백질이 사이클린 T1 서브유닛과 광범위한 접촉을 형성한다는 것을 보여주었다(그림2).[20]
P-TEFb의 규제
진핵 세포 유전자 발현 조절의 핵심 역할 때문에, P-TEFb 엄격한 규제에 대한 유전자를 서브 유닛 인코딩의 전사, 벅차mRNAs의 번역, 서브 유닛의 매출액 수준은 또한 비정상적인 메커니즘을 7SK snRNP.[7]로 그림에 3P-TEFb은 7SK snR에서 열린다 보여 준 의식으로에서 받아야 한다.NP이중가닥 RNA결합단백질 HEXIM(HEXIM1 또는 HEX)에 의해IM2(인간의IM2).7SK RNA 또는 모든 이중 가닥 RNA에 결합된 HEXIM은 P-TEFb에 결합하고 키나아제 [21][22]활성을 억제한다.7SK RNA에는 항상 두 개의 다른 단백질이 관련되어 있습니다.메틸포스파아제 캡핑효소 MEPCE는 7SK[23] RNA의 첫 번째 뉴클레오티드의 감마 인산염에 메틸기를 가하고, La 관련 단백질 LARP7은 [24][25]7SK의 3' 말단에 결합한다.7SK snRNP에서 P-TEFb를 추출하면 7SK RNA가 배좌 변화를 겪게 되고 HEXIM이 배출되고 제거된 [7]인자를 대신하게 된다.P-TEFb의 재순서는 RNA의 또 다른 재배열, HEXIM의 결합, 그리고 P-TEFb의 결합을 필요로 한다.빠르게 성장하는 세포에서 7SK snRNP는 P-TEFb의 주요 형태이다.리뷰용.[26]
레퍼런스
- ^ Zhou Q, Li T, 가격 DH. RNA 중합효소 II 신장 제어.Annu Rev Phiology 2012.
- ^ Rahl PB, Lin CY, Seila AC, Flyn RA, McCuine S, Burge CB, 등 c-Myc는 전사 일시정지 해제를 규제한다.셀 2010; 141:432-45
- ^ Cheng B, Li T, Rahl PB, Adamson TE, Loudas NB, Guo J 등Gdown1과 RNA중합효소II의 기능적 연관성.Mol Cell 2012; 45:38-50.
- ^ 와다T, 다카기T, 야마구치Y, 페르두스A, 이마이T, 히로세S 등RNA 중합효소 II의 진행을 조절하는 새로운 전사 신장인자 DSIF는 인간의 Spt4와 Spt5 상동인자로 구성되어 있다.유전자 개발 1998; 12:343-56.
- ^ 야마구치 Y, 다카기 T, 와다 T, 야노 K, 후루야 A, 스기모토 S 등RD를 포함하는 멀티 서브유닛 복합체인 NELF는 DSIF와 협력하여 RNA 중합효소 II의 신장을 억제합니다.세포 1999; 97:41-51
- ^ a b Marshall NF, Peng J, Xie Z, Price DH. 새로운 카르복실 말단 도메인 키나제에 의한 RNA 중합효소 II 신장 전위 제어.J Biol Chem 1996; 271:27176-83.
- ^ a b c Peterlin BM, Brogie JE, Price DH. 7SK snRNA: 진핵생물 전사를 조절하는 데 중요한 역할을 하는 비코드 RNA.Wiley Interdiscip Rev RNA 2012; 3:92-103.
- ^ Chao SH, Price DH. Flavopiridol은 P-TEFb를 비활성화하고 대부분의 RNA 중합효소 II 전사를 생체 내에서 차단합니다.J Biol Chem 2001; 276:31793-9.
- ^ 마셜 NF, Price DH. P-TEFb의 정제. 생산적 신장으로의 전환에 필요한 전사 인자.J Biol Chem 1995; 270:12335-8.
- ^ Peng J, Marshall NF, Price DH. Drosophila P-TEFb의 기능에 필요한 사이클린 서브유닛 식별.J Biol Chem 1998; 273:13855-60.
- ^ Fu TJ, Peng J, Lee G, Price DH, Flores O.사이클린 K는 CDK9 조절 서브유닛으로 기능하며 RNA 중합효소 II 전사에 참여합니다.J Biol Chem 1999; 274:34527-30.
- ^ Peng J, Zhu Y, Milton JT, Price DH. 인간 P-TEFb의 다중 사이클린 서브유닛 식별.유전자 개발 1998; 12:755-62.
- ^ Yang Z, Yik JH, Chen R, He N, Jang MK, Ozato K 등브로모도메인 단백질 Brd4에 의한 전사 신장 촉진을 위한 P-TEFb의 모집.Mol Cell 2005; 19:535-45.
- ^ 스미스 E, 린 C, 실라티퍼드 A발육과 질병에서의 SEC(Super Rengthion Complex)와 MLL.유전자 개발 2011; 25:661-72.
- ^ He N, Liu M, Hsu J, Xue Y, Chou S, Burlingame A 등HIV-1 Tat 및 숙주 AFF4는 HIV-1 전사의 조정된 활성화를 위해 2개의 전사 신장 인자를 2개의 기능성 복합체에 모집한다.몰셀 2010; 38:428-38.
- ^ Kao SY, Calman AF, Luciw PA, Peterlin BMtat 유전자 생성물에 의한 HIV-1의 장기 말기 반복 내에서의 전사의 항종단.네이처 1987; 330:489-93
- ^ Zhu Y, Pe'ery T, Peng J, Ramanathan Y, Marshall N, Marshall T 등시험관내 HIV-1 tat 트랜스활성화를 위해서는 전사신장인자 P-TEFb가 필요하다.유전자 개발 1997; 11:2622-32.
- ^ 거버 ME, 웨이 P, 존스 KAHIV-1 Tat은 사이클린 T1과 상호작용하여 P-TEFb CTD 키나아제 복합체를 TAR RNA로 유도한다.콜드 스프링 하버 1998년 정량 생물학 심포지엄; 63:371-80.
- ^ Baumli S, Lolli G, Lowe ED, Troiani S, Rusconi L, Block AN 등P-TEFb(CDK9/사이클린 T1)의 구조는 플라보피리돌과 복합체이며, 인산화에 의한 조절이다.EMBO J 2008; 27:1907-18.
- ^ a b Tahirov TH, Babayeva ND, Varzavand K, Cooper JJ, Sedore SC, Price DH. 인간 P-TEFb와 복합된 HIV-1 Tat의 결정 구조.네이처 2010; 465:747-51.
- ^ Li Q, Cooper JJ, Altwerger GH, Feldkamp MD, Shea MA, Price DH. HEXIM1은 혼합 이중 가닥 RNA 결합 단백질로 배양 세포에서 7SK 외에 RNA와 상호작용한다.핵산 2007; 35:2503-12.
- ^ Michels AA, Fraldi A, Li Q, Adamson TE, 보닛 F, Nguyen VT 등7SK snRNA의 결합에 의해 HEXIM1 단백질이 P-TEFb(CDK9/사이클린T) 억제제로 변화한다.EMBO J 2004; 23:2608-19.
- ^ Jeronimo C, Forget D, Bouchard A, Li Q, Chua G, Poitras C 등인간전사기계에 대한 단백질 상호작용 네트워크의 체계적 분석은 7SK 캡핑 효소의 정체를 밝혀낸다.Mol Cell 2007; 27:262-74
- ^ Krueger BJ, Jeronimo C, Roy BB, Bouchard A, Barrandon C, Byers SA 등LARP7은 7SK snRNP의 안정 성분이며, P-TEFb, HEXIM1 및 hnRNP A1은 가역적으로 관련되어 있다.핵산 Res 2008; 36:2219-29.
- ^ He N, Jahchan NS, Hong E, Li Q, Bayfield MA, Maria RJ 등La 관련 단백질은 7SK snRNP 무결성을 변조하여 P-TEFb 의존성 전사 신장 및 종양 발생을 억제한다.Mol Cell 2008; 29:588-99
- ^ Quaresma, AJ; Bugai A; Barboric M. (2016). "Cracking the control of RNA polymerase II elongation by 7SK snRNP and P-TEFb". Nucleic Acids Research. 44 (8): 7527–7539. doi:10.1093/nar/gkw585. PMC 5027500. PMID 27369380.