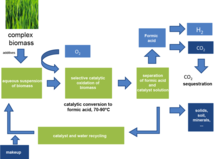
옥스FA 공정
OxFA process옥스FA 공정은 분자 산소나 공기를 이용한 촉매 산화에 의해 바이오매스로부터 폼산을 생산하는 공정이다.케긴형의 폴리옥소메탈레이트가 촉매로 사용된다.
OxFA-프로세스
일반 설명
폼산은 습식 바이오매스의 수용 촉매 부분 산화에 의해 얻어진다.[1][2][3]케긴형 폴리옥소메탈레이트(HPVMoO)521040는 당류, 목재, 폐지 또는 시아노박테리아를 유일한 부산물로 형성산과 CO로2 변환하는 균질 촉매로 사용된다.최대 53%의 포름산 수율을 달성할 수 있다.
촉매로 서스펜션에서 수용성 바이오매스를 변환할 수 있다.반응 후 포름산은 반응 혼합물에서 분리된다.분리과정에 따라 포름산을 더 정제하거나 그대로 사용할 수 있다.촉매의 남은 용액, 잔류 폼산 및 첨가제는 반응에 재활용된다.이 단계에서 고형분(예: 더러운 바이오매스로부터의 토양) 또는 비활성 비활동적 비생물(예: 바이오매스 천연염 함량으로부터의 무기염)은 촉매 용액에서 분리될 수 있다.
포도당과 같은 단순한 설탕에 대한 일반적인 반응은 다음과 같이 요약할 수 있다.
C6H12O6 + wO2 → xHCOOH + yCO2 + zH2O
바이오매스 전처리
수용성 바이오매스는 반응이 일어나는 표면적을 향상시키기 위해 적절한 크기로 잘게 찢어야 한다.수용성 바이오매스는 특별한 전처리가 필요하지 않다.
바이오매스 산화
반응은 순수 산소 또는 공기로서 363K 및 30bar 산소 부분압에서 수행된다.뜨거운 폼산은 부식성이 있으므로 적절한 오토클라브(예: 해스텔로이)를 사용해야 한다.반응 시간은 사료의 반응도에 따라 달라진다.예를 들어 마이크로크리스탈린 셀룰로오스는 24시간, 66시간 이후 각각 15%, 22%로 전환되는 반면 반응성이 높은 자일란은 각각 88%, 94%로 전환된다.특히 내화성분 셀룰로오스에는 반응률이 두 배 이상 높은 첨가제를 사용한다.p-toluenesulfonic acid를 첨가제로 사용하면 66h 이후 셀룰로오스 변환이 22%에서 68%로 증가한다.반응 조건에서는 생성된 폼산의 과산화 현상이 발생하지 않는다.또 다른 최근의 사례에서, 포뮬릭산은 과산화수소를 이기종 촉매에 대한 산화제로 사용하는 바이오매스 유래 당에서 생성되었다.[4][5]
제품 분리
포름산은 증류나 추출에 의해 반응 혼합물로부터 분리될 수 있다.
반응 혼합물을 증류하면 물과 폼산이 높은 끓는 아저트로프를 형성하기 때문에 응축수가 높은 수분이 나온다.포름산은 여전히 밑바닥에 농축되어 있다.모든 휘발성 화합물이 증류된 경우, 받은 폼산의 농도는 원래 반응 혼합물의 농도로 한다.
포름산의 추출은 여러 용제로 효과를 볼 수 있다.
| 에이전트 추출 중 | 칸막이 계수 | 촉매 분포 |
|---|---|---|
| 디부틸 에테르 | 0.59 | 수상 |
| 메틸리소부틸케톤 | 0.88 | 수성+유기농 단계 |
| 아세테이트 에틸 | 1.07 | 수성+유기농 단계 |
| 디부틸포르마미드 | 0.98 | 유기상 |
표에 기재된 용제는 촉매에 의한 산화에 대해 안정성이 있는 것으로 밝혀졌다.용매 Dibutyl 에테르만이 촉매를 수성 단계로 남기는 반면, Dibutylformamide를 사용하면 촉매가 유기 단계로 완전히 추출된다.
촉매 재활용 및 정화
대부분의 또는 전부가 반응 혼합물에서 분리된 후, 나머지 용액에는 물과 촉매, 첨가물 및 잔류 폼산이 들어 있다.이 용액은 성능 저하 없이 반응에 직접 재활용할 수 있다.
바이오바이드 폼산의 잠재적 사용
포름산은 수소 저장 재료로 여겨져 왔다.[6]이 과정을 통해 화석 기반 폼산이 아닌 바이오 기반 포뮬러를 사용할 수 있게 된다.
참조
- ^ R. Wölfel; N. Taccardi; A. Bösmann; P. Wasserscheid (2011). "Selective catalytic conversion of biobased carbohydrates to formic acid using molecular oxygen". Green Chem. 13 (10): 2759. doi:10.1039/C1GC15434F.
- ^ J. Albert; R. Wölfel; A. Bösmann; P. Wasserscheid (2012). "Selective oxidation of complex, water-insoluble biomass to formic acid using additives as reaction accelerators". Energy Environ. Sci. 5 (7): 7956. doi:10.1039/C2EE21428H.
- ^ J. Li; D.-J. Ding; L. Deng; Q.-X. Guo; Y. Fu (2012). "Catalytic Air Oxidation of Biomass-Derived Carbohydrates to Formic Acid". ChemSusChem. 5 (7): 1313–1318. doi:10.1002/cssc.201100466. PMID 22499553.
- ^ H. Choudhary; S. Nishimura; K. Ebitani (2015). "Synthesis of high-value organic acids from sugars promoted by hydrothermally loaded Cu oxide species on magnesia". Applied Catalysis B: Environmental. 162: 1. doi:10.1016/j.apcatb.2014.05.012.
- ^ R. Sato; H. Choudhary; S. Nishimura; K. Ebitani (2015). "Synthesis of Formic Acid from Monosaccharides using Calcined Mg-Al Hydrotalcite as Reusable Catalyst in the Presence of Aqueous Hydrogen Peroxide". Organic Process Research & Development. 19 (3): 449. doi:10.1021/op5004083.
- ^ Joó, Ferenc (2008). "Breakthroughs in Hydrogen Storage - Formic Acid as a Sustainable Storage Material for Hydrogen". ChemSusChem. 1 (10): 805–8. doi:10.1002/cssc.200800133. PMID 18781551.