핵액컴벤스
Nucleus accumbens| 핵액컴벤스 | |
|---|---|
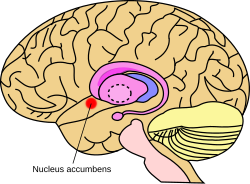 뇌에서 핵의 대략적인 위치 | |
 마우스 뇌의 핵 축적 | |
| 세부 사항 | |
| 일부 | 중림동 경로 기저신경절(복부 선조체) |
| 부품. | 핵 어컴벤스 셸 원자핵 어컴벤스코어 |
| 식별자 | |
| 라틴어 | 중격핵 |
| 약어 | NAc 또는 NACC |
| 메쉬 | D009714 |
| 신경명 | 277 |
| NeuroLex ID | Birnlex_727 |
| TA98 | A14.1.09.440 |
| TA2 | 5558 |
| FMA | 61889 |
| 신경해부술의 해부학적 용어 | |
nucleus [1]accumbens(NAC 또는 NACC; nucleus accumbens nucleus, 또는 이전 nucleus accumbens septi, 라틴어로 septum에 인접한 nucleus)는 시상하부의 광학 전 영역에 있는 기저 전뇌 로스트에 있는 영역이다.핵과 후각결절은 복부 선조체를 형성한다.복부 선조체와 등부 선조체는 전체적으로 선조체를 형성하는데, 이것은 기저 신경절의 [2]주요 구성요소이다.중림부 경로의 도파민성 뉴런은 핵의 외측과 후각결절의 [3][4]GABAergic 중간 가시가 있는 뉴런에 투영된다.각각의 대뇌 반구는 두 가지 구조로 나눌 수 있는 자체 핵을 가지고 있다: 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 핵 세포.이들 하부구조는 형태와 기능이 다르다.
각 영역 내 서로 다른 NACC 하위 영역(핵심 대 셸)과 뉴런 하위 집단(D1-type 대 D2-type 중간 가시 뉴런)이 서로 다른 인지 [5][6]기능을 담당한다.전체적으로, 핵은 동기 부여, 혐오, 보상(즉, 동기 부여, 즐거움, 긍정 강화) 및 강화 학습(예: 파블로비안-기구 이전)[4][7][8][9][10]의 인지 처리에서 중요한 역할을 한다. 따라서 [4][8]중독에서 중요한 역할을 한다.또한, 어큐멘스 코어의 일부는 슬로파 [11][12][13][14]수면의 유도에 중심적으로 관여한다.핵 어컴벤스는 공포, 충동성,[15][16][17] 플라시보 효과를 처리하는 데 덜 중요한 역할을 한다.새로운 모터 프로그램의 인코딩에도 [4]관여하고 있습니다.
구조.
핵 어컴벤스는 외각과 [4]내핵을 가지고 있는 것으로 묘사되는 뉴런의 집합체이다.
입력
핵에 대한 주요 글루탐산성 입력은 전전두엽 피질(특히 예비피질 및 인프롤림비크 피질), 기저외측 편도체, 복측 해마, 시상핵(특히 시상핵의 중간선 및 시상내핵) 및 복측피질(V)로부터의 글루탐산성 투영을 포함한다.A)[18] 핵 어컴벤스는 복측 피개부로부터 도파민 작동성 입력을 받고, 복측 피개부는 중림부 경로를 통해 연결된다.핵 어컴벤스는 종종 피질 기저부 신경절 시상피질 [19]루프의 일부로 설명된다.
VTA로부터의 도파민 작동성 입력은 핵 어큐멘스 내에서 GABAergic 뉴런의 활동을 조절한다.이러한 뉴런은 행복제(예: 암페타민, 아편제 등)와 보람 있는 경험(예: 섹스, 음악, 운동 등)[20][21]에 참여함으로써 직간접적으로 활성화된다.
또 다른 주요 투입원은 CA1과 해마의 복부 서브클럼에서 핵의 배쪽 영역까지 온다.핵세포의 약간의 탈분극은 해마의 뉴런의 양성과 상관관계가 있어 더 흥분하기 쉽다.핵낭에 있는 중간 가시가 있는 뉴런의 들뜬 상태의 상관 세포는 소정맥과 CA1 사이에서 동등하게 공유된다.소정맥 [22]뉴런은 과분극(부정성을 증가)하는 반면 CA1 뉴런은 이 프라이밍을 달성하기 위해 "파급"하는 것으로 밝혀졌다.
핵 어컴벤스는 뇌에서 [23]히스타민 뉴런의 유일한 공급원인 결핵균 핵으로부터 높은 밀도의 히스타민성 돌기를 받는 몇 안 되는 영역 중 하나입니다.
산출량
핵의 출력 뉴런은 축삭돌기를 기저신경절과 복측벽돌기(VP)로 알려져 있는 글로부스 팔리두스의 복측유사체로 보냅니다.VP는, 차례로, 등 시상 안쪽의 등핵에 투영합니다.등쪽은 복측과 등쪽 선조체뿐만 아니라 전전두피질에 투영됩니다.침윤핵으로부터의 다른 유출물로는 복측피질부위 [24]꼬리와의 연결, 실질적으로 흑색,[1] 그리고 송곳니의 망상형성이 포함된다.
껍데기
nucle accumbens shell(NACC 쉘)은 nuclear accumbens의 하위 구조입니다.껍질과 핵은 함께 전체 핵을 형성한다.
장소:껍질은 핵의 외측 영역이며, 핵과는 달리 외측 극에 위치한 확장된 편도체의 일부로 간주된다.
셀 유형:세포핵의 뉴런은 주로 D1형(즉, DRD1과 DRD5) 또는 D2형(즉, DRD2, DRD3, 및 DRD4) 도파민 수용체를 포함하는 중간 가시 뉴런(MSNs)이다.MSN의 하위집단은 D1형 수용체와 D2형 수용체를 모두 포함하고 있으며, 선조체 MSN의 약 40%는 DRD1과 DRD2 [19][25][26]mRNA를 모두 발현한다.D1형 수용체와 D2형 수용체를 모두 가진 이러한 혼합형 NAcc MSN은 대부분 NAcc [19]껍질에 국한된다.껍질 속의 뉴런은, 핵에 비해, 수지상 가시의 밀도가 낮고, 말단 부분이 적고, 가지 부분이 적습니다.껍데기 뉴런은 복부 팔리디움의 경막하 부분과 복부 피개 부분, 시상하부와 확장된 [27][28][29]편도체의 광범위한 영역에 돌출되어 있습니다.
기능:핵의 껍질은 특정한 즐거운 자극에 대한 주관적인 "좋아요" 반응, 동기부여적 만족감, 그리고 긍정적인 [4][5][30][31]강화를 포함한 보상의 인지적 처리에 관여합니다.NACC 쉘은 또한 고전적으로 조절된 자극이 오퍼런트 [32][9][10]행동을 수정하는 현상인 파블로브-계기적 전달을 중재하는 것으로 나타났다.일부 내적 보상의 쾌적함 또는 "좋음" 요소를 책임지는 "쾌락적 핫스팟" 또는 쾌락 센터도 중앙 국가 [30][33][34]조치실 내의 작은 칸막이에 위치해 있다.중독성 약물은 [4]핵심보다 껍질에서 도파민 방출에 더 큰 영향을 미친다.
핵심
nuclear accumbens core(NACC core)는 nuclear accumbens의 내부 하부 구조입니다.
장소:어컴번스 핵은 기저신경절 내에 위치한 복측 선조체의 일부입니다.셀 유형:NACC의 핵은 주로 D1형 또는 D2형 도파민 수용체를 포함하는 중간 가시가 있는 뉴런으로 구성되어 있다.D1형 중형 가시가 있는 뉴런은 보상과 관련된 인지 [5][35][36]과정을 중개하고, D2형 중형 가시가 있는 뉴런은 혐오와 관련된 [6]인지 과정을 중개한다.핵심의 뉴런은 껍데기의 뉴런에 비해 수지상 가시, 가지, 말단 세그먼트의 밀도가 높아집니다.핵심에서 뉴런은 글로부스 팔리두스와 흑색체 같은 다른 피질하 영역으로 돌출된다.GABA는 NACC의 주요 신경전달물질 중 하나이며 GABA 수용체 또한 풍부하다.[27][29]
기능:핵 어컴벤스 코어는 보상과 강화와 관련된 운동 기능의 인지 처리와 느린 파장의 [4][11][12][13]수면 조절에 관여합니다.구체적으로는 [4]코어는 장래에 주어진 보상을 획득하는 것을 용이하게 하는 새로운 모터 프로그램을 부호화한다.아데노신2A A 수용체 활성화를 공동 발현하는 NAcc 코어의 간접 경로(D2-type) 뉴런은 느린 파장의 [11][12][13]수면을 촉진한다.NACC 코어는 또한 고전적으로 조절된 자극이 오퍼런트 [32][9][10]동작을 수정하는 현상인 파블로브-계기적 전달을 중재하는 것으로 나타났다.
셀 타입
NACC의 뉴런의 약 95%는 주로 D1형 또는 D2형 [20]수용체를 발현하는 GABAergic 중간가시뉴런(MSN)이며, 나머지 뉴런 유형의 약 1~2%는 대형 가시가시콜린성 인터뉴론이고,[20] 다른 1~2%는 GABAergic 인터뉴론이다.셸의 GABAergic MSN에 비해 코어 내의 GABAergic MSN은 수지상 가시, 가지 세그먼트 및 말단 세그먼트의 밀도가 높아집니다.핵심에서 뉴런은 글로부스 팔리두스와 흑색체 같은 다른 피질하 영역으로 돌출된다.GABA는 NACC의 주요 신경전달물질 중 하나이며 GABA 수용체 또한 풍부하다.[27][29]이 뉴런들은 또한 핵의 주요 투사 또는 출력 뉴런이다.
신경화학
신경전달물질, 신경조절제, 호르몬 중 일부는 핵 내 수용체를 통해 신호를 보낸다.
도파민:도파민은 대체 암페타민, 코카인, 니코틴, [37][38]모르핀과 같은 레크리에이션 약물을 포함한 보상적인 자극에 노출된 후 핵으로 방출된다.
페네틸아민 및 티라민:페네틸아민과 티라민은 모든 도파민성 [39]뉴런을 포함하는 방향족 아미노산 하이드록실화효소(AADC) 효소를 발현하는 뉴런에서 합성되는 미량 아민이다.두 화합물 모두 도파민 신경조절제로서 기능하며, 중림부 도파민 뉴런의 축삭 말단에서 VMAT2 및 TAAR1과의 상호작용을 통해 도파민의 Nacc로의 재흡입 및 방출을 조절한다.
글루코코르티코이드와 도파민:글루코콜티코이드 수용체는 핵 어컴벤스 쉘에 있는 유일한 코르티코스테로이드 수용체이다.L-DOPA, 스테로이드, 특히 글루코코르티코이드는 현재 정신병적 문제를 유발할 수 있는 유일한 내인성 화합물로 알려져 있으므로 글루코코르티코이드 수용체에 대한 도파민 작동성 투영에 대한 호르몬 제어를 이해하면 정신병적 증상에 대한 새로운 치료법으로 이어질 수 있다.최근의 연구는 글루코콜티코이드 수용체의 억제가 도파민 방출의 감소로 이어졌고, 이는 잠재적으로 정신병 [40]증상을 완화시키기 위한 항글루코콜티코이드 약물을 포함하는 미래 연구로 이어질 수 있다는 것을 보여주었다.
GABA: GABA 작용제와 길항제 사용 쥐에 대한 최근 연구는 NACC 쉘의 GABAA 수용체가 도파민에 의해 영향을 받는 회전 행동에 대한 억제 제어를 가지고 있고, GABAB 수용체는 아세틸콜린에 [27][41]의해 매개되는 회전 행동에 대한 억제 제어를 가지고 있다는 것을 보여줍니다.
글루탐산염:연구에 따르면 NACC 코어에서 글루탐산성 NMDA 수용체의 국소 차단이 공간 [42]학습을 손상시켰다.또 다른 연구는 NMDA와 AMPA(글루탐산 수용체 모두)가 기구 [43]학습을 조절하는 데 중요한 역할을 한다는 것을 보여주었다.
세로토닌(5-HT):전반적으로, 5-HT 시냅스는 코어보다 NAcc 쉘에서 더 풍부하고 더 많은 시냅스 접점을 가진다.그들은 또한 더 크고 두껍고, 핵에 있는 다른 소포들보다 더 크고 밀도가 높은 핵 소포를 포함하고 있습니다.
기능.
보상 및 강화
보상 시스템의 한 부분인 핵 축적물은 보상 자극 처리, 자극 강화(예: 음식 및 물), 보상과 강화(중독 약물, 섹스 및 운동)[4][44]에 중요한 역할을 한다.보상 수크로스에 축적된 핵의 뉴런의 주요 반응은 억제이다; 혐오성 키닌의 [45]투여에 대한 반응으로 그 반대이다.또한 약리학적 조작의 실질적인 증거는 예를 들어 μ-오피오이드 수용체 [46]자극의 경우처럼, 핵 어컴벤스에서 뉴런의 흥분성을 감소시키는 것이 유익하다는 것을 시사한다.핵의 혈중 산소 농도 의존 신호(BOLD)는 기분 좋고 감정적으로 자극적인 사진을 인지하는 동안 및 기분 좋고 감정적인 장면의 정신적 이미지 동안 선택적으로 증가한다.그러나 BOLD는 억제까지의 국소 순 들뜸의 간접적인 측정으로 생각되기 때문에 BOLD가 원가의존적 처리를 측정하는 정도는 알려져 있지 않다.[47][48]변연계 영역으로부터의 NAcc 입력이 풍부하고 운동 영역에 대한 강력한 NAcc 출력으로 인해, Gordon Mogensen은 핵 어컴벤스를 변연계와 운동계 [49][50]사이의 인터페이스로 묘사했다.

핵은 쾌락의 체험과 인과 관계가 있다.내측 쉘의 로스트로도르살 사분면에 μ-오피오이드 작용제, γ-오피오이드 작용제 또는 γ-오피오이드 작용제의 미세 주입은 "좋음"을 높이는 반면, 더 많은 미간 주입은 혐오 반응, 반응 호감 또는 [30]둘 다 억제할 수 있다.오피오이드 작용제 외에 오직 엔도카나비노이드만이 호감을 증진시킬 수 있기 때문에, 쾌락의 생성에서 인과적 역할로 간주될 수 있는 핵의 부위는 해부학적으로나 화학적으로 모두 제한된다.핵 전체에서는 도파민, GABA 수용체 작용제 또는 AMPA 길항제만이 동기를 변화시키는 반면, 내측 쉘의 핫스팟 외부에 있는 오피오이드 및 엔도카나비노이드도 마찬가지다.전통적으로 후자는 D1 수용체 기능만을 필요로 하고 전자는 D1 및 D2 기능을 모두 필요로 하는 것으로 생각되는 식욕 대 공포 반응의 향상을 위해 스트로-카우달 구배가 존재한다.이 발견의 해석 중 하나인 금지 가설은 어컴벤스 MSN(GABAergic)의 억제가 하류 구조를 억제하지 않고, 식욕적 또는 소모적 [52]행동의 표현을 가능하게 한다고 가정한다.AMPA 길항제 및 GABA 작용제의 동기부여 효과는 해부학적으로 유연하다.스트레스를 받는 환경은 공포 유발 영역을 넓히는 반면 익숙한 환경은 공포 유발 영역의 크기를 줄일 수 있다.또한 안와전두피질(OFC)로부터의 피질 입력은 식욕행동의 반응을 바이어스하고 인간의 아장성 대상피질에 상당하는 피질 입력은 [30]원자에 관계없이 반응을 억제한다.
조작이 기기 학습 과제 수행에 영향을 미칠 수 있지만, 핵 축적량은 기기 학습에 필요하지도 않고 충분하지도 않다.NACC 병변의 영향이 분명한 작업 중 하나는 파블로브-계기적 전이(PIT)이며, 여기서 특정 보상 또는 일반 보상과 쌍을 이루는 큐는 기구적 반응을 향상시킬 수 있다.NACC의 핵심에 대한 병변은 평가절하 후 성능을 저하시키고 일반적인 PIT의 효과를 억제합니다.반면 쉘에 대한 병변은 특정 PIT의 효과만 손상시킵니다.이러한 구별은 NACC 쉘과 NACC 코어의 소모적 및 욕구적 조건부 반응을 [53]각각 반영하는 것으로 생각된다.
배면 선조체에서는 D1-MSNs와 D2-MSNs의 이분법이 관찰되고 있으며, D1-MSNs와 D2-MSNs의 이분법은 D1-MSNs가 강화 및 강화되고 있으며, D2-MSNs는 거부 및 감소된 운동이다.그러한 구별은 전통적으로 핵 축적에도 적용되는 것으로 가정되어 왔지만, 약리학적 및 광유전학 연구의 증거는 상충된다.또한 NAcc MSN의 서브셋은 D1 및 D2 MSN을 발현하며, D1 수용체와 D2 수용체의 약리학적 활성화는 신경 집단을 정확하게 활성화할 필요가 없다.대부분의 연구는 D1 또는 D2 MSN의 선택적 광유전학적 자극이 운동 활동에 미치는 영향을 보여주지 않는 반면, 한 연구는 D2-MSN 자극과 함께 기초 이동의 감소를 보고했다.두 연구는 D2-MSN 활성화로 코카인의 강화 효과가 감소했다고 보고한 반면, 한 연구는 효과가 없다고 보고했습니다.또한 NAcc D2-MSN 활성화는 PIT에 의해 평가된 바와 같이 동기부여를 증진시키는 것으로 보고되었으며, VTA [54]자극의 강화 효과를 위해 D2 수용체 활성이 필요하다.2018년 한 연구에서는 D2 MSN 활성화가 복측 팔리덤 억제를 통해 동기부여를 증가시켜 VTA를 [55]억제하지 않는다고 보고하였다.
모성 행동
2005년에 실시된 fMRI 연구는 어미 쥐가 새끼를 낳았을 때 핵을 포함한 강화에 관여하는 뇌의 부위가 매우 [56]활발하다는 것을 발견했다.모성 행동 중에 핵의 도파민 수치가 증가하는 반면, 이 부위의 병변은 모성 [57]행동을 악화시킨다.여성이 관련 없는 영아 사진을 제시받았을 때, fMRI는 여성들이 이러한 영아를 "귀여워"[58]하는 정도에 비례하여 핵과 인접한 미상핵의 뇌 활동이 증가했음을 보여준다.
혐오
어큐멘스의 D1형 MSN 활성화는 보상에 관여하는 반면 어큐멘스의 D2형 MSN 활성화는 [6]혐오감을 촉진한다.
슬로웨이브 슬립
2017년 말 광유전학적 및 화학유전학적 방법을 이용한 설치류 연구는 아데노신2A A 수용체를 공동 발현하고 복부 팔리둠에 투영하는 핵의 간접 경로(D2-type) 중 가시 뉴런이 느린 파동 [11][12][13][14]수면 조절에 관여한다는 것을 발견했다.특히 이러한 간접경로 NAcc 코어 뉴런의 광유전학적 활성화는 느린 파장의 수면을 유도하고, 동일한 뉴런의 화학적 활성화는 느린 파장의 [12][13][14]수와 지속시간을 증가시킨다.이러한 NACC 코어 뉴런의 화학유전학적 억제는 [12][13]수면을 억제한다.이와는 대조적으로2A 아데노신 A 수용체를 발현하는 NAcc 쉘의 D2형 중가시 뉴런은 느린 파장의 [12][13]수면을 조절하는 역할을 하지 않는다.
임상적 의의
중독
만성 약물 사용으로 인한 중독의 현재 모델은 중피질 색소 [20][59][60]투영에서 유전자 발현 변화를 포함한다.이러한 변화를 일으키는 가장 중요한 전사 인자는 δFosB, 고리형 아데노신 일인산(cAMP) 반응 요소 결합 단백질(CREB) 및 핵 인자 카파 B(NFκB)[20]이다.δFosB는 약물 중독에서 [20][35][61]나타나는 많은 신경 적응과 행동 효과(예: 자기 투여의 발현 의존성 증가 및 보상 민감성)에 필요하고 충분하기 때문에 중독에서 가장 중요한 유전자 전사 인자이다.δFosB 과잉발현은 알코올(에탄올), 칸나비노이드, 코카인, 메틸페니다이트, 니코틴, 오피오이드, 펜시클리딘, 프로포폴 및 치환 암페타민 중독과 [20][59][61][62][63]관련이 있다.accumbens δJunD 발현 증가는 만성 약물 남용에서 볼 수 있는 대부분의 신경 변화를 감소시키거나 심지어 차단할 수 있다(즉, δFosB에 [20]의해 매개되는 변화).
δFosB는 또한 입맛에 맞는 음식, 섹스,[20][21] 운동과 같은 자연스러운 보상에 대한 행동 반응을 조절하는 데 중요한 역할을 한다.남용 약물과 마찬가지로 자연 보상은 핵에서 fFosB를 유도하며, 이러한 보상의 만성 획득은 δFosB 과발현을 [20][21][44]통해 유사한 병리학적 중독 상태를 초래할 수 있다.따라서 [20][21][44]δFosB는 자연보상에 대한 중독에도 관여하는 주요 전사인자이며, 특히 성보상의 [21]강화효과에 있어서 핵 중의 δFosB가 중요하다.자연적 보상과 약물 보상 사이의 상호작용에 대한 연구는 정신 자극제와 성행동이 핵의 umbFosB를 유도하기 위해 유사한 생체 분자 메커니즘에 작용하고 δFosB를 [44][64]통해 매개되는 교차 감수성 효과를 갖는다는 것을 시사한다.
약물 보상과 유사하게, 비약물 보상 또한 NACC 쉘의 세포 외 도파민 수치를 증가시킨다.NACC 쉘과 NACC 코어에서 약물 유도 도파민 방출은 일반적으로 습관화되기 쉽다(즉, 약물 내성의 발달: 반복적인 약물 노출의 결과로서 향후 약물 노출로부터의 도파민 방출 감소). 반대로, NACC 쉘과 코어에서 도파민 방출을 유도하는 약물에 대한 반복 노출은 전형적이다.감작성의 붓기(즉, 향후 약물 노출에서 NACC에서 방출되는 도파민의 양은 반복 약물 노출의 결과로 증가한다.반복적인 약물 노출 후 NACC 쉘에서 도파민 방출의 감작성은 자극-약물 연관성(즉, 약물 사용이 환경 자극과 반복적으로 쌍을 이룰 때 발생하는 고전적 조건화)을 강화하며, 이러한 연관성은 멸종될 가능성이 낮아진다(즉, "학습하지 않는" 이러한 고전적 조건화된 연관성).약물 사용과 환경 자극 사이의 이온은 더욱 어려워진다.)반복적인 페어링 후, 이러한 고전적 조건의 환경 자극(예: 약물 사용과 자주 페어링되는 컨텍스트와 물체)은 종종 약물 사용의 2차 강화제로서 기능하는 약물 단서가 된다(즉, 이러한 연관성이 확립되면, 페어링된 환경 자극에 대한 노출은 사용 욕구 또는 욕구를 유발한다). 약물과 [27][38]관련이 있습니다.)
약물과는 대조적으로, 많은 유형의 보상 비약물 자극에 의한 NACC 쉘의 도파민 방출은 일반적으로 반복 노출 후에 습관화된다(즉, 보상 비약물 자극에 대한 미래 노출에서 방출되는 도파민의 양은 일반적으로 해당 [27][38]자극에 대한 반복 노출의 결과로 감소한다).
| 신경가소성의 형태 또는 행동의 가소성 | 보강재의 종류 | 원천 | |||||
|---|---|---|---|---|---|---|---|
| 오피제 | 정신 자극제 | 고지방 또는 당질 식품 | 성관계 | 운동 (표준) | 환경의 풍부. | ||
| δFosB 표현 핵 어컴벤스 D1형MSNs | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [44] |
| 행동 가소성 | |||||||
| 섭취량 증가 | 네. | 네. | 네. | [44] | |||
| 정신 자극제 교잡화 | 네. | 해당 없음 | 네. | 네. | 감쇠 | 감쇠 | [44] |
| 정신 자극제 자기 관리 | ↑ | ↑ | ↓ | ↓ | ↓ | [44] | |
| 정신 자극제 조건부 장소 설정 | ↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [44] |
| 약물탐색행위의 회복 | ↑ | ↑ | ↓ | ↓ | [44] | ||
| 신경화학적 가소성 | |||||||
| CREB인산화 핵에 | ↓ | ↓ | ↓ | ↓ | ↓ | [44] | |
| 감작성 도파민 반응 핵에 | 아니요. | 네. | 아니요. | 네. | [44] | ||
| 선조체 도파민 시그널링의 변화 | ↓ DRD2, ↑ DRD3 | ↑ DRD1, ↓ DRD2, ↑ DRD3 | ↑ DRD1, ↓ DRD2, ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | [44] | |
| 선조체 오피오이드 신호 변경 | 변경 없음 또는 ↑μ-오피오이드 수용체 | ↑μ-오피오이드 수용체 ↑피오피오이드 수용체 | ↑μ-오피오이드 수용체 | ↑μ-오피오이드 수용체 | 변경 없음 | 변경 없음 | [44] |
| 선조체 오피오이드 펩타이드의 변화 | ↑디모르핀 변경 없음: enkephalin | ↑디모르핀 | ↓엔케팔린 | ↑디모르핀 | ↑디모르핀 | [44] | |
| 메조콜리모니아 시냅스 가소성 | |||||||
| 누핵 내 수상돌기의 수 | ↓ | ↑ | ↑ | [44] | |||
| 수지상 척추 밀도 누핵 | ↓ | ↑ | ↑ | [44] | |||
우울증.
2007년 4월, 두 연구팀은 심각한 [65]우울증을 치료하기 위해 깊은 뇌 자극을 사용하기 위해 전극을 핵에 삽입했다고 보고했다.2010년, 실험은 전기 경련 [66]치료와 같은 다른 치료법에 반응하지 않는 환자의 50%에서 핵의 깊은 뇌 자극이 우울증 증상을 감소시키는 데 성공했다고 보고했습니다.Nucleus accumbens는 또한 치료-반환성 강박증-강박장애를 [67]가진 소수의 환자들을 치료하기 위한 표적으로 사용되어 왔다.
절제
중독을 치료하고 정신질환을 치료하기 위해 핵의 무선주파수 절제술이 시행되었다.그 결과는 결정적이지 않고 논란의 여지가 [68][69]있다.
플라시보 효과
NACC의 활성화는 사용자에게 위약을 투여할 때 약물의 효과 예상에서 발생하는 것으로 나타나 위약 [16][70]효과에서 핵의 축적 작용이 있음을 나타낸다.
기타 이미지
「 」를 참조해 주세요.
레퍼런스
- ^ a b Carlson NR (2013). Physiology of Behavior (11th ed.). Boston: Pearson.[페이지 필요]
- ^ 핵 어컴번스
- ^ Ikemoto S (November 2010). "Brain reward circuitry beyond the mesolimbic dopamine system: a neurobiological theory". Neuroscience and Biobehavioral Reviews. 35 (2): 129–50. doi:10.1016/j.neubiorev.2010.02.001. PMC 2894302. PMID 20149820.
Recent studies on intracranial self-administration of neurochemicals (drugs) found that rats learn to self-administer various drugs into the mesolimbic dopamine structures–the posterior ventral tegmental area, medial shell nucleus accumbens and medial olfactory tubercle. ... In the 1970s it was recognized that the olfactory tubercle contains a striatal component, which is filled with GABAergic medium spiny neurons receiving glutamatergic inputs form cortical regions and dopaminergic inputs from the VTA and projecting to the ventral pallidum just like the nucleus accumbens
그림 3: 암페타민의 복부 선조체와 자가 투여 - ^ a b c d e f g h i j Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147–148, 367, 376. ISBN 978-0-07-148127-4.
VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards. ...
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner. ...
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc. - ^ a b c Saddoris MP, Cacciapaglia F, Wightman RM, Carelli RM (August 2015). "Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation". The Journal of Neuroscience. 35 (33): 11572–82. doi:10.1523/JNEUROSCI.2344-15.2015. PMC 4540796. PMID 26290234.
Here, we have found that real-time dopamine release within the nucleus accumbens (a primary target of midbrain dopamine neurons) strikingly varies between core and shell subregions. In the core, dopamine dynamics are consistent with learning-based theories (such as reward prediction error) whereas in the shell, dopamine is consistent with motivation-based theories (e.g., incentive salience).
- ^ a b c Calipari ES, Bagot RC, Purushothaman I, Davidson TJ, Yorgason JT, Peña CJ, Walker DM, Pirpinias ST, Guise KG, Ramakrishnan C, Deisseroth K, Nestler EJ (March 2016). "In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward". Proceedings of the National Academy of Sciences of the United States of America. 113 (10): 2726–31. Bibcode:2016PNAS..113.2726C. doi:10.1073/pnas.1521238113. PMC 4791010. PMID 26831103.
Increased activity of the mesolimbic dopamine system is a central mechanism underlying the reinforcing and rewarding actions of drugs of abuse, including cocaine, as well as the compulsive drug seeking that develops over time and characterizes an addicted state (10–12). Dopamine action in NAc is mediated predominantly via activation of D1 or D2 dopamine receptors that are expressed by largely nonoverlapping populations of medium spiny neurons (MSNs) (13). These two subtypes of MSNs exert opposite effects on behavior, with optogenetic activation of D1-type neurons promoting positive reinforcement and increasing the formation of cocaine reward–context associations and activation of D2-type neurons being aversive and decreasing cocaine reward (14, 15); related differences in behavioral responses are seen in response to D1 vs. D2 receptor agonists or antagonists (16). ... Previous work has demonstrated that optogenetically stimulating D1 MSNs promotes reward, whereas stimulating D2 MSNs produces aversion.
- ^ Wenzel JM, Rauscher NA, Cheer JF, Oleson EB (January 2015). "A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature". ACS Chemical Neuroscience. 6 (1): 16–26. doi:10.1021/cn500255p. PMC 5820768. PMID 25491156.
Thus, fear-evoking stimuli are capable of differentially altering phasic dopamine transmission across NAcc subregions. The authors propose that the observed enhancement in NAcc shell dopamine likely reflects general motivational salience, perhaps due to relief from a CS-induced fear state when the US (foot shock) is not delivered. This reasoning is supported by a report from Budygin and colleagues112 showing that, in anesthetized rats, the termination of tail pinch results in augmented dopamine release in the shell.
- ^ a b Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 266. ISBN 978-0-07-148127-4.
Dopamine acts in the nucleus accumbens to attach motivational significance to stimuli associated with reward.
- ^ a b c Salamone JD, Pardo M, Yohn SE, López-Cruz L, SanMiguel N, Correa M (2016). "Mesolimbic Dopamine and the Regulation of Motivated Behavior". Current Topics in Behavioral Neurosciences. 27: 231–57. doi:10.1007/7854_2015_383. ISBN 978-3-319-26933-7. PMID 26323245.
Considerable evidence indicates that accumbens DA is important for Pavlovian approach and Pavlovian-to-instrumental transfer [(PIT)] ... PIT is a behavioral process that reflects the impact of Pavlovian-conditioned stimuli (CS) on instrumental responding. For example, presentation of a Pavlovian CS paired with food can increase output of food-reinforced instrumental behaviors, such as lever pressing. Outcome-specific PIT occurs when the Pavlovian unconditioned stimulus (US) and the instrumental reinforcer are the same stimulus, whereas general PIT is said to occur when the Pavlovian US and the reinforcer are different. ... More recent evidence indicates that accumbens core and shell appear to mediate different aspects of PIT; shell lesions and inactivation reduced outcome-specific PIT, while core lesions and inactivation suppressed general PIT (Corbit and Balleine 2011). These core versus shell differences are likely due to the different anatomical inputs and pallidal outputs associated with these accumbens subregions (Root et al. 2015). These results led Corbit and Balleine (2011) to suggest that accumbens core mediates the general excitatory effects of reward-related cues. PIT provides a fundamental behavioral process by which conditioned stimuli can exert activating effects upon instrumental responding
- ^ a b c Corbit LH, Balleine BW (2016). "Learning and Motivational Processes Contributing to Pavlovian-Instrumental Transfer and Their Neural Bases: Dopamine and Beyond". Current Topics in Behavioral Neurosciences. 27: 259–89. doi:10.1007/7854_2015_388. ISBN 978-3-319-26933-7. PMID 26695169.
Such effects suggest that specific motivational states gate the arousing effects of Pavlovian incentives processes on instrumental performance ... Behavioral findings are supported by evidence that distinct neural circuits centered on the NAc core and shell mediate the general and specific forms of transfer, respectively, and ongoing work is beginning to explain how Pavlovian and instrumental learning processes that occur independently and at separate times are integrated within neural circuits that govern behavioral control.
- ^ a b c d Cherasse Y, Urade Y (November 2017). "Dietary Zinc Acts as a Sleep Modulator". International Journal of Molecular Sciences. 18 (11): 2334. doi:10.3390/ijms18112334. PMC 5713303. PMID 29113075.
More recently, Fuller's laboratory also discovered that sleep can be promoted by the activation of a gamma-aminobutyric acid-ergic (GABAergic) population of neurons located in the parafacial zone [11,12], while the role of the GABAergic A2AR-expressing neurons of the nucleus accumbens [13] and the striatum has just been revealed [14,15].
- ^ a b c d e f g Valencia Garcia S, Fort P (February 2018). "Nucleus Accumbens, a new sleep-regulating area through the integration of motivational stimuli". Acta Pharmacologica Sinica. 39 (2): 165–166. doi:10.1038/aps.2017.168. PMC 5800466. PMID 29283174.
The nucleus accumbens comprises a contingent of neurons specifically expressing the post-synaptic A2A-receptor (A2AR) subtype making them excitable by adenosine, its natural agonist endowed with powerful sleep-promoting properties[4]. ... In both cases, large activation of A2AR-expressing neurons in NAc promotes slow wave sleep (SWS) by increasing the number and duration of episodes. ... After optogenetic activation of the core, a similar promotion of SWS was observed, whereas no significant effects were induced when activating A2AR-expressing neurons within the shell.
- ^ a b c d e f g Oishi Y, Xu Q, Wang L, Zhang BJ, Takahashi K, Takata Y, Luo YJ, Cherasse Y, Schiffmann SN, de Kerchove d'Exaerde A, Urade Y, Qu WM, Huang ZL, Lazarus M (September 2017). "Slow-wave sleep is controlled by a subset of nucleus accumbens core neurons in mice". Nature Communications. 8 (1): 734. Bibcode:2017NatCo...8..734O. doi:10.1038/s41467-017-00781-4. PMC 5622037. PMID 28963505.
Here, we show that chemogenetic or optogenetic activation of excitatory adenosine A2A receptor-expressing indirect pathway neurons in the core region of the NAc strongly induces slow-wave sleep. Chemogenetic inhibition of the NAc indirect pathway neurons prevents the sleep induction, but does not affect the homoeostatic sleep rebound.
- ^ a b c Yuan XS, Wang L, Dong H, Qu WM, Yang SR, Cherasse Y, Lazarus M, Schiffmann SN, d'Exaerde AK, Li RX, Huang ZL (October 2017). "2A receptor neurons control active-period sleep via parvalbumin neurons in external globus pallidus". eLife. 6: e29055. doi:10.7554/eLife.29055. PMC 5655138. PMID 29022877.
- ^ Schwienbacher I, Fendt M, Richardson R, Schnitzler HU (November 2004). "Temporary inactivation of the nucleus accumbens disrupts acquisition and expression of fear-potentiated startle in rats". Brain Research. 1027 (1–2): 87–93. doi:10.1016/j.brainres.2004.08.037. PMID 15494160. S2CID 18338111.
- ^ a b Zubieta JK, Stohler CS (March 2009). "Neurobiological mechanisms of placebo responses". Annals of the New York Academy of Sciences. 1156 (1): 198–210. Bibcode:2009NYASA1156..198Z. doi:10.1111/j.1749-6632.2009.04424.x. PMC 3073412. PMID 19338509.
- ^ Basar K, Sesia T, Groenewegen H, Steinbusch HW, Visser-Vandewalle V, Temel Y (December 2010). "Nucleus accumbens and impulsivity". Progress in Neurobiology. 92 (4): 533–57. doi:10.1016/j.pneurobio.2010.08.007. PMID 20831892. S2CID 16964212.
- ^ Gipson CD, Kupchik YM, Kalivas PW (January 2014). "Rapid, transient synaptic plasticity in addiction". Neuropharmacology. 76 Pt B: 276–86. doi:10.1016/j.neuropharm.2013.04.032. PMC 3762905. PMID 23639436.
Within a simplified PFC-NAc-VTA circuit, the NAc serves as a "gateway" through which information regarding the direction of behavioral output is processed from limbic cortex to motor subcircuits. It is thought that the transition to compulsive drug seeking arises from an impaired ability of this subcircuit to effectively process information about negative environmental contingencies, leading to an inability to inhibit prepotent drug-associated responses; thereby the addict is rendered prone to relapse.
그림 1: 중독성 행동에 관여하는 핵에 대한 글루탐산성 구심성 물질 - ^ a b c Yager LM, Garcia AF, Wunsch AM, Ferguson SM (August 2015). "The ins and outs of the striatum: Role in drug addiction". Neuroscience. 301: 529–541. doi:10.1016/j.neuroscience.2015.06.033. PMC 4523218. PMID 26116518.
[The striatum] receives dopaminergic inputs from the ventral tegmental area (VTA) and the substantia nigra (SNr) and glutamatergic inputs from several areas, including the cortex, hippocampus, amygdala, and thalamus (Swanson, 1982; Phillipson and Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). These glutamatergic inputs make contact on the heads of dendritic spines of the striatal GABAergic medium spiny projection neurons (MSNs) whereas dopaminergic inputs synapse onto the spine neck, allowing for an important and complex interaction between these two inputs in modulation of MSN activity ... It should also be noted that there is a small population of neurons in the NAc that coexpress both D1 and D2 receptors, though this is largely restricted to the NAc shell (Bertran- Gonzalez et al., 2008). ... Neurons in the NAc core and NAc shell subdivisions also differ functionally. The NAc core is involved in the processing of conditioned stimuli whereas the NAc shell is more important in the processing of unconditioned stimuli; Classically, these two striatal MSN populations are thought to have opposing effects on basal ganglia output. Activation of the dMSNs causes a net excitation of the thalamus resulting in a positive cortical feedback loop; thereby acting as a 'go' signal to initiate behavior. Activation of the iMSNs, however, causes a net inhibition of thalamic activity resulting in a negative cortical feedback loop and therefore serves as a 'brake' to inhibit behavior ... there is also mounting evidence that iMSNs play a role in motivation and addiction (Lobo and Nestler, 2011; Grueter et al., 2013). ... Together these data suggest that iMSNs normally act to restrain drug-taking behavior and recruitment of these neurons may in fact be protective against the development of compulsive drug use.
- ^ a b c d e f g h i j k Robison AJ, Nestler EJ (October 2011). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews. Neuroscience. 12 (11): 623–37. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states. ... 95% of NAc neurons are GABAergic MSNs (medium spiny neurons), which can be further differentiated into those MSNs that express the D1 dopamine receptor (D1-type MSNs) and express dynorphin and substance P and those that express the D2 dopamine receptor (D2-type MSNs) and express enkephalin132. Drug induction of ΔFosB133,134, and the effects of ΔFosB and G9a on cell morphology and behavior, differ between D1-type and D2-type MSNs135, and neuronal activity of these two cell types causes opposing effects on the rewarding properties of cocaine131. ... About 1–2% of NAc neurons are aspiny large cholinergic interneurons, which have been shown to play an important role in cocaine reward130, and a similar number are GABAergic interneurons, the function of which are less well understood.
- ^ a b c d e Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Gold M (2012). "Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms". Journal of Psychoactive Drugs. 44 (1): 38–55. doi:10.1080/02791072.2012.662112. PMC 4040958. PMID 22641964.
It has been found that deltaFosB gene in the NAc is critical for reinforcing effects of sexual reward. Pitchers and colleagues (2010) reported that sexual experience was shown to cause DeltaFosB accumulation in several limbic brain regions including the NAc, medial pre-frontal cortex, VTA, caudate, and putamen, but not the medial preoptic nucleus. Next, the induction of c-Fos, a downstream (repressed) target of DeltaFosB, was measured in sexually experienced and naive animals. The number of mating-induced c-Fos-IR cells was significantly decreased in sexually experienced animals compared to sexually naive controls. Finally, DeltaFosB levels and its activity in the NAc were manipulated using viral-mediated gene transfer to study its potential role in mediating sexual experience and experience-induced facilitation of sexual performance. Animals with DeltaFosB overexpression displayed enhanced facilitation of sexual performance with sexual experience relative to controls. In contrast, the expression of DeltaJunD, a dominant-negative binding partner of DeltaFosB, attenuated sexual experience-induced facilitation of sexual performance, and stunted long-term maintenance of facilitation compared to DeltaFosB overexpressing group. Together, these findings support a critical role for DeltaFosB expression in the NAc in the reinforcing effects of sexual behavior and sexual experience-induced facilitation of sexual performance. ... both drug addiction and sexual addiction represent pathological forms of neuroplasticity along with the emergence of aberrant behaviors involving a cascade of neurochemical changes mainly in the brain's rewarding circuitry.
- ^ Goto Y, O'Donnell P (February 2001). "Synchronous activity in the hippocampus and nucleus accumbens in vivo". The Journal of Neuroscience. 21 (4): RC131. doi:10.1523/jneurosci.21-04-j0003.2001. PMC 6762233. PMID 11160416.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 175–176. ISBN 978-0-07-148127-4.
Within the brain, histamine is synthesized exclusively by neurons with their cell bodies in the tuberomammillary nucleus (TMN) that lies within the posterior hypothalamus. There are approximately 64000 histaminergic neurons per side in humans. These cells project throughout the brain and spinal cord. Areas that receive especially dense projections include the cerebral cortex, hippocampus, neostriatum, nucleus accumbens, amygdala, and hypothalamus. ... While the best characterized function of the histamine system in the brain is regulation of sleep and arousal, histamine is also involved in learning and memory ... It also appears that histamine is involved in the regulation of feeding and energy balance.
- ^ Barrot M, Sesack SR, Georges F, Pistis M, Hong S, Jhou TC (October 2012). "Braking dopamine systems: a new GABA master structure for mesolimbic and nigrostriatal functions". The Journal of Neuroscience. 32 (41): 14094–101. doi:10.1523/JNEUROSCI.3370-12.2012. PMC 3513755. PMID 23055478.
- ^ Ferré S, Lluís C, Justinova Z, Quiroz C, Orru M, Navarro G, Canela EI, Franco R, Goldberg SR (June 2010). "Adenosine-cannabinoid receptor interactions. Implications for striatal function". Br. J. Pharmacol. 160 (3): 443–453. doi:10.1111/j.1476-5381.2010.00723.x. PMC 2931547. PMID 20590556.
Two classes of MSNs, which are homogeneously distributed in the striatum, can be differentiated by their output connectivity and their expression of dopamine and adenosine receptors and neuropeptides. In the dorsal striatum (mostly represented by the nucleus caudate-putamen), enkephalinergic MSNs connect the striatum with the globus pallidus (lateral globus pallidus) and express the peptide enkephalin and a high density of dopamine D2 and adenosine A2A receptors (they also express adenosine A1 receptors), while dynorphinergic MSNs connect the striatum with the substantia nigra (pars compacta and reticulata) and the entopeduncular nucleus (medial globus pallidus) and express the peptides dynorphin and substance P and dopamine D1 and adenosine A1 but not A2A receptors ... These two different phenotypes of MSN are also present in the ventral striatum (mostly represented by the nucleus accumbens and the olfactory tubercle). However, although they are phenotypically equal to their dorsal counterparts, they have some differences in terms of connectivity. First, not only enkephalinergic but also dynorphinergic MSNs project to the ventral counterpart of the lateral globus pallidus, the ventral pallidum, which, in fact, has characteristics of both the lateral and medial globus pallidus in its afferent and efferent connectivity. In addition to the ventral pallidum, the medial globus pallidus and the substantia nigra-VTA, the ventral striatum sends projections to the extended amygdala, the lateral hypothalamus and the pedunculopontine tegmental nucleus. ... It is also important to mention that a small percentage of MSNs have a mixed phenotype and express both D1 and D2 receptors (Surmeier et al., 1996).
- ^ Nishi A, Kuroiwa M, Shuto T (July 2011). "Mechanisms for the modulation of dopamine d(1) receptor signaling in striatal neurons". Front Neuroanat. 5: 43. doi:10.3389/fnana.2011.00043. PMC 3140648. PMID 21811441.
Dopamine plays critical roles in the regulation of psychomotor functions in the brain (Bromberg-Martin et al., 2010; Cools, 2011; Gerfen and Surmeier, 2011). The dopamine receptors are a superfamily of heptahelical G protein-coupled receptors, and are grouped into two categories, D1-like (D1, D5) and D2-like (D2, D3, D4) receptors, based on functional properties to stimulate adenylyl cyclase (AC) via Gs/olf and to inhibit AC via Gi/o, respectively ... It has been demonstrated that D1 receptors form the hetero-oligomer with D2 receptors, and that the D1–D2 receptor hetero-oligomer preferentially couples to Gq/PLC signaling (Rashid et al., 2007a,b). The expression of dopamine D1 and D2 receptors are largely segregated in direct and indirect pathway neurons in the dorsal striatum, respectively (Gerfen et al., 1990; Hersch et al., 1995; Heiman et al., 2008). However, some proportion of medium spiny neurons are known to expresses both D1 and D2 receptors (Hersch et al., 1995). Gene expression analysis using single cell RT-PCR technique estimated that 40% of medium spiny neurons express both D1 and D2 receptor mRNA (Surmeier et al., 1996).
- ^ a b c d e f Shirayama Y, Chaki S (October 2006). "Neurochemistry of the nucleus accumbens and its relevance to depression and antidepressant action in rodents". Current Neuropharmacology. 4 (4): 277–91. doi:10.2174/157015906778520773. PMC 2475798. PMID 18654637.
- ^ Meredith GE, Agolia R, Arts MP, Groenewegen HJ, Zahm DS (September 1992). "Morphological differences between projection neurons of the core and shell in the nucleus accumbens of the rat". Neuroscience. 50 (1): 149–62. doi:10.1016/0306-4522(92)90389-j. PMID 1383869. S2CID 11278705.
- ^ a b c Meredith GE, Pennartz CM, Groenewegen HJ (1993). "The cellular framework for chemical signalling in the nucleus accumbens". Chemical Signalling in the Basal Ganglia. Progress in Brain Research. Vol. 99. pp. 3–24. doi:10.1016/s0079-6123(08)61335-7. ISBN 978-0-444-81562-0. PMID 7906426.
- ^ a b c d Berridge KC, Kringelbach ML (May 2015). "Pleasure systems in the brain". Neuron. 86 (3): 646–64. doi:10.1016/j.neuron.2015.02.018. PMC 4425246. PMID 25950633.
- ^ Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV (October 2013). "Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain". The Journal of Neuroscience. 33 (41): 16383–93. doi:10.1523/JNEUROSCI.1731-13.2013. PMC 3792469. PMID 24107968.
Recent evidence indicates that inactivation of D2 receptors, in the indirect striatopallidal pathway in rodents, is necessary for both acquisition and expression of aversive behavior, and direct pathway D1 receptor activation controls reward-based learning (Hikida et al., 2010; Hikida et al., 2013). It seems we can conclude that direct and indirect pathways of the NAc, via D1 and D2 receptors, subserve distinct anticipation and valuation roles in the shell and core of NAc, which is consistent with observations regarding spatial segregation and diversity of responses of midbrain dopaminergic neurons for rewarding and aversive conditions, some encoding motivational value, others motivational salience, each connected with distinct brain networks and having distinct roles in motivational control (Bromberg-Martin et al., 2010; Cohen et al., 2012; Lammel et al., 2013). ... Thus, the previous results, coupled with the current observations, imply that the NAc pshell response reflects a prediction/anticipation or salience signal, and the NAc pcore response is a valuation response (reward predictive signal) that signals the negative reinforcement value of cessation of pain (i.e., anticipated analgesia).
- ^ a b Cartoni E, Puglisi-Allegra S, Baldassarre G (November 2013). "The three principles of action: a Pavlovian-instrumental transfer hypothesis". Frontiers in Behavioral Neuroscience. 7: 153. doi:10.3389/fnbeh.2013.00153. PMC 3832805. PMID 24312025.
- ^ Richard JM, Castro DC, Difeliceantonio AG, Robinson MJ, Berridge KC (November 2013). "Mapping brain circuits of reward and motivation: in the footsteps of Ann Kelley". Neuroscience and Biobehavioral Reviews. 37 (9 Pt A): 1919–31. doi:10.1016/j.neubiorev.2012.12.008. PMC 3706488. PMID 23261404.
- ^ Berridge KC, Robinson TE, Aldridge JW (February 2009). "Dissecting components of reward: 'liking', 'wanting', and learning". Current Opinion in Pharmacology. 9 (1): 65–73. doi:10.1016/j.coph.2008.12.014. PMC 2756052. PMID 19162544.
- ^ a b Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues in Clinical Neuroscience. 15 (4): 431–43. doi:10.31887/DCNS.2013.15.4/enestler. PMC 3898681. PMID 24459410.
DESPITE THE IMPORTANCE OF NUMEROUS PSYCHOSOCIAL FACTORS, AT ITS CORE, DRUG ADDICTION INVOLVES A BIOLOGICAL PROCESS: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type NAc neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... For example, the shell and core subregions of NAc display differences in drug-induced synaptic plasticity, as do D1- versus D2-type medium spiny neurons within each subregion.60,63,64,67
- ^ Dumitriu D, Laplant Q, Grossman YS, Dias C, Janssen WG, Russo SJ, Morrison JH, Nestler EJ (May 2012). "Subregional, dendritic compartment, and spine subtype specificity in cocaine regulation of dendritic spines in the nucleus accumbens". The Journal of Neuroscience. 32 (20): 6957–66. doi:10.1523/JNEUROSCI.5718-11.2012. PMC 3360066. PMID 22593064.
The enduring spine density change in core but not shell fits well with the established idea that the shell is preferentially involved in the development of addiction, while the core mediates the long-term execution of learned addiction-related behaviors (Ito et al., 2004; Di Chiara, 2002; Meredith et al., 2008). Consistent with the idea of NAc core being the locus of long-lasting drug-induced neuroplasticity, several studies have shown that electrophysiological changes in core persist longer than their shell counterparts. ... Furthermore, data presented here support the idea that NAc shell is preferentially involved in immediate drug reward, while the core might play a more explicit role in longer-term aspects of addiction.
- ^ Pontieri FE, Tanda G, Di Chiara G (December 1995). "Intravenous cocaine, morphine, and amphetamine preferentially increase extracellular dopamine in the "shell" as compared with the "core" of the rat nucleus accumbens". Proceedings of the National Academy of Sciences of the United States of America. 92 (26): 12304–8. Bibcode:1995PNAS...9212304P. doi:10.1073/pnas.92.26.12304. JSTOR 2369093. PMC 40345. PMID 8618890.
- ^ a b c Di Chiara G (December 2002). "Nucleus accumbens shell and core dopamine: differential role in behavior and addiction". Behavioural Brain Research. 137 (1–2): 75–114. doi:10.1016/s0166-4328(02)00286-3. PMID 12445717. S2CID 54410118.
- ^ Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Annals of the New York Academy of Sciences. 1216 (1): 86–98. Bibcode:2011NYASA1216...86E. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC).
- ^ Barrot M, Marinelli M, Abrous DN, Rougé-Pont F, Le Moal M, Piazza PV (March 2000). "The dopaminergic hyper-responsiveness of the shell of the nucleus accumbens is hormone-dependent". The European Journal of Neuroscience. 12 (3): 973–9. doi:10.1046/j.1460-9568.2000.00996.x. PMID 10762327. S2CID 6111417.
- ^ Akiyama G, Ikeda H, Matsuzaki S, Sato M, Moribe S, Koshikawa N, Cools AR (June 2004). "GABAA and GABAB receptors in the nucleus accumbens shell differentially modulate dopamine and acetylcholine receptor-mediated turning behaviour". Neuropharmacology. 46 (8): 1082–8. doi:10.1016/j.neuropharm.2004.02.007. PMID 15111014. S2CID 25631633.
- ^ Smith-Roe SL, Sadeghian K, Kelley AE (August 1999). "Spatial learning and performance in the radial arm maze is impaired after N-methyl-D-aspartate (NMDA) receptor blockade in striatal subregions". Behavioral Neuroscience. 113 (4): 703–17. doi:10.1037/0735-7044.113.4.703. PMID 10495079.
- ^ Giertler C, Bohn I, Hauber W (March 2005). "Involvement of NMDA and AMPA/KA receptors in the nucleus accumbens core in instrumental learning guided by reward-predictive cues". The European Journal of Neuroscience. 21 (6): 1689–702. doi:10.1111/j.1460-9568.2005.03983.x. PMID 15845096. S2CID 14206373.
- ^ a b c d e f g h i j k l m n o p q Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–22. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
Cross-sensitization is also bidirectional, as a history of amphetamine administration facilitates sexual behavior and enhances the associated increase in NAc DA ... As described for food reward, sexual experience can also lead to activation of plasticity-related signaling cascades. The transcription factor delta FosB is increased in the NAc, PFC, dorsal striatum, and VTA following repeated sexual behavior (Wallace et al., 2008; Pitchers et al., 2010b). This natural increase in delta FosB or viral overexpression of delta FosB within the NAc modulates sexual performance, and NAc blockade of delta FosB attenuates this behavior (Hedges et al., 2009; Pitchers et al., 2010b). Further, viral overexpression of delta FosB enhances the conditioned place preference for an environment paired with sexual experience (Hedges et al., 2009). ...
Table 1 - ^ Day JJ, Carelli RM (April 2007). "The nucleus accumbens and Pavlovian reward learning". The Neuroscientist. 13 (2): 148–59. doi:10.1177/1073858406295854. PMC 3130622. PMID 17404375.
Consistent with other reports (Nicola and others 2004; Taha and Fields 2006), the predominant response of NAc neurons to sucrose infusions was a decrease in activity (Fig. 2). As is evident in Figure 2, the same neurons exhibited opposite responses when an aversive quinine solution was delivered intra-orally. One hypothesis suggests that inhibitions observed during reward delivery occur among GABA-containing NAc neurons that project to important motor areas such as the ventral pallidum (VP).
- ^ Carlezon WA, Thomas MJ (2009). "Biological substrates of reward and aversion: a nucleus accumbens activity hypothesis". Neuropharmacology. 56 Suppl 1: 122–32. doi:10.1016/j.neuropharm.2008.06.075. PMC 2635333. PMID 18675281.
When considered together, these studies provided two critical pieces of evidence that have played a prominent role in the formulation of our current working hypothesis: first, that dopamine-dependent reward is attenuated by blockade of D2-like receptors, which are inhibitory receptors expressed predominately in the NAc on the MSNs of the indirect pathway; and second, that events that would be expected to reduce the overall excitability of the NAc (e.g., stimulation of Gi-coupled opioid receptors, reduced stimulation of excitatory NMDA receptors, reduced excitatory input) are sufficient for reward. This interpretation led to the development of a model of reward in which the critical event is reduced activation of MSNs in the NAc
- ^ Costa VD, Lang PJ, Sabatinelli D, Versace F, Bradley MM (September 2010). "Emotional imagery: assessing pleasure and arousal in the brain's reward circuitry". Human Brain Mapping. 31 (9): 1446–57. doi:10.1002/hbm.20948. PMC 3620013. PMID 20127869.
- ^ Sabatinelli D, Bradley MM, Lang PJ, Costa VD, Versace F (September 2007). "Pleasure rather than salience activates human nucleus accumbens and medial prefrontal cortex". Journal of Neurophysiology. 98 (3): 1374–9. doi:10.1152/jn.00230.2007. PMID 17596422. S2CID 14938485.
- ^ Mogenson GJ, Jones DL, Yim CY (1980). "From motivation to action: functional interface between the limbic system and the motor system". Progress in Neurobiology. 14 (2–3): 69–97. doi:10.1016/0301-0082(80)90018-0. PMID 6999537. S2CID 14029796.
- ^ Hart G, Leung BK, Balleine BW (February 2014). "Dorsal and ventral streams: the distinct role of striatal subregions in the acquisition and performance of goal-directed actions". Neurobiology of Learning and Memory. 108: 104–18. doi:10.1016/j.nlm.2013.11.003. PMC 4661143. PMID 24231424.
- ^ Castro DC, Cole SL, Berridge KC (2015). "Lateral hypothalamus, nucleus accumbens, and ventral pallidum roles in eating and hunger: interactions between homeostatic and reward circuitry". Frontiers in Systems Neuroscience. 9: 90. doi:10.3389/fnsys.2015.00090. PMC 4466441. PMID 26124708.
- ^ Berridge KC, Kringelbach ML (June 2013). "Neuroscience of affect: brain mechanisms of pleasure and displeasure". Current Opinion in Neurobiology. 23 (3): 294–303. doi:10.1016/j.conb.2013.01.017. PMC 3644539. PMID 23375169.
- ^ Yin HH, Ostlund SB, Balleine BW (October 2008). "Reward-guided learning beyond dopamine in the nucleus accumbens: the integrative functions of cortico-basal ganglia networks". The European Journal of Neuroscience. 28 (8): 1437–48. doi:10.1111/j.1460-9568.2008.06422.x. PMC 2756656. PMID 18793321.
- ^ Soares-Cunha C, Coimbra B, Sousa N, Rodrigues AJ (September 2016). "Reappraising striatal D1- and D2-neurons in reward and aversion" (PDF). Neuroscience and Biobehavioral Reviews. 68: 370–386. doi:10.1016/j.neubiorev.2016.05.021. hdl:1822/47044. PMID 27235078. S2CID 207092810.
- ^ Soares-Cunha C, Coimbra B, Domingues AV, Vasconcelos N, Sousa N, Rodrigues AJ (19 April 2018). "Nucleus Accumbens Microcircuit Underlying D2-MSN-Driven Increase in Motivation". eNeuro. 5 (2): ENEURO.0386–18.2018. doi:10.1523/ENEURO.0386-18.2018. PMC 5957524. PMID 29780881.
D2-MSN optogenetic activation decreased ventral pallidum (VP) activity, reducing the inhibitory tone to VTA, leading to increased dopaminergic activity. Importantly, optogenetic activation of D2-MSN terminals in the VP was sufficient to recapitulate the motivation enhancement
- ^ Ferris CF, Kulkarni P, Sullivan JM, Harder JA, Messenger TL, Febo M (January 2005). "Pup suckling is more rewarding than cocaine: evidence from functional magnetic resonance imaging and three-dimensional computational analysis". The Journal of Neuroscience. 25 (1): 149–56. arXiv:1510.02343. doi:10.1523/jneurosci.3156-04.2005. PMC 6725197. PMID 15634776.
- ^ Numan M (January 2007). "Motivational systems and the neural circuitry of maternal behavior in the rat". Developmental Psychobiology. 49 (1): 12–21. doi:10.1002/dev.20198. PMID 17186513.
- ^ Glocker ML, Langleben DD, Ruparel K, Loughead JW, Valdez JN, Griffin MD, Sachser N, Gur RC (June 2009). "Baby schema modulates the brain reward system in nulliparous women". Proceedings of the National Academy of Sciences of the United States of America. 106 (22): 9115–9. Bibcode:2009PNAS..106.9115G. doi:10.1073/pnas.0811620106. JSTOR 40482823. PMC 2690007. PMID 19451625.
- ^ a b Hyman SE, Malenka RC, Nestler EJ (2006). "Neural mechanisms of addiction: the role of reward-related learning and memory". Annual Review of Neuroscience. 29: 565–98. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597.
- ^ Steiner H, Van Waes V (January 2013). "Addiction-related gene regulation: risks of exposure to cognitive enhancers vs. other psychostimulants". Progress in Neurobiology. 100: 60–80. doi:10.1016/j.pneurobio.2012.10.001. PMC 3525776. PMID 23085425.
- ^ a b Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–37. doi:10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure. The formation of ΔFosB in multiple brain regions, and the molecular pathway leading to the formation of AP-1 complexes is well understood. The establishment of a functional purpose for ΔFosB has allowed further determination as to some of the key aspects of its molecular cascades, involving effectors such as GluR2 (87,88), Cdk5 (93) and NFkB (100). Moreover, many of these molecular changes identified are now directly linked to the structural, physiological and behavioral changes observed following chronic drug exposure (60,95,97,102). New frontiers of research investigating the molecular roles of ΔFosB have been opened by epigenetic studies, and recent advances have illustrated the role of ΔFosB acting on DNA and histones, truly as a molecular switch (34).
- ^ Kanehisa Laboratories (29 October 2014). "Alcoholism – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (February 2009). "Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens". Proceedings of the National Academy of Sciences of the United States of America. 106 (8): 2915–20. Bibcode:2009PNAS..106.2915K. doi:10.1073/pnas.0813179106. PMC 2650365. PMID 19202072.
- ^ Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (February 2013). "Natural and drug rewards act on common neural plasticity mechanisms with ΔFosB as a key mediator". The Journal of Neuroscience. 33 (8): 3434–42. doi:10.1523/JNEUROSCI.4881-12.2013. PMC 3865508. PMID 23426671.
Drugs of abuse induce neuroplasticity in the natural reward pathway, specifically the nucleus accumbens (NAc), thereby causing development and expression of addictive behavior. ... Together, these findings demonstrate that drugs of abuse and natural reward behaviors act on common molecular and cellular mechanisms of plasticity that control vulnerability to drug addiction, and that this increased vulnerability is mediated by ΔFosB and its downstream transcriptional targets. ... Sexual behavior is highly rewarding (Tenk et al., 2009), and sexual experience causes sensitized drug-related behaviors, including cross-sensitization to amphetamine (Amph)-induced locomotor activity (Bradley and Meisel, 2001; Pitchers et al., 2010a) and enhanced Amph reward (Pitchers et al., 2010a). Moreover, sexual experience induces neural plasticity in the NAc similar to that induced by psychostimulant exposure, including increased dendritic spine density (Meisel and Mullins, 2006; Pitchers et al., 2010a), altered glutamate receptor trafficking, and decreased synaptic strength in prefrontal cortex-responding NAc shell neurons (Pitchers et al., 2012). Finally, periods of abstinence from sexual experience were found to be critical for enhanced Amph reward, NAc spinogenesis (Pitchers et al., 2010a), and glutamate receptor trafficking (Pitchers et al., 2012). These findings suggest that natural and drug reward experiences share common mechanisms of neural plasticity
- ^ 뇌전극이 우울증 치료에 도움이 된다, 테크놀로지 리뷰, 2007년 4월 26일
- ^ Bewernick BH, Hurlemann R, Matusch A, Kayser S, Grubert C, Hadrysiewicz B, Axmacher N, Lemke M, Cooper-Mahkorn D, Cohen MX, Brockmann H, Lenartz D, Sturm V, Schlaepfer TE (January 2010). "Nucleus accumbens deep brain stimulation decreases ratings of depression and anxiety in treatment-resistant depression". Biological Psychiatry. 67 (2): 110–6. doi:10.1016/j.biopsych.2009.09.013. PMID 19914605. S2CID 26242126.
- ^ Ooms P, Mantione M, Figee M, Schuurman PR, van den Munckhof P, Denys D (February 2014). "Deep brain stimulation for obsessive-compulsive disorders: long-term analysis of quality of life". Journal of Neurology, Neurosurgery, and Psychiatry. 85 (2): 153–8. doi:10.1136/jnnp-2012-302550. PMID 23715912. S2CID 54572260.
- ^ 논란이 되고 있는 중독수술은 뇌의 쾌락중추를 태워버린다.2012년 12월 13일
- ^ "중국은 되돌릴 수 없는 뇌 시술을 금지한다" 저자 자미스카 니콜라스.2008년 4월 28일월스트리트 저널
- ^ Scott DJ, Stohler CS, Egnatuk CM, Wang H, Koeppe RA, Zubieta JK (July 2007). "Individual differences in reward responding explain placebo-induced expectations and effects". Neuron. 55 (2): 325–36. doi:10.1016/j.neuron.2007.06.028. PMID 17640532.
- "Brain region central to placebo effect identified". EurekAlert! (Press release). 18 July 2007.
외부 링크
- 보상 회로에서 핵의 역할이 축적됩니다.thebrain.mcgill.ca에 있는 "The Brain From Top to Bottom"의 일부
- Nucleus Accumbens – 셀 중심 데이터베이스
- BrainMaps 프로젝트의 "nucleus%20accumbens"를 포함하는 염색된 뇌 슬라이스 이미지






