가도부트롤
Gadobutrol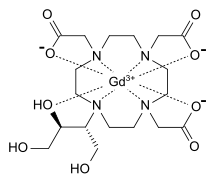 | |
| 임상자료 | |
|---|---|
| AHFS/Drugs.com | 국제 마약 이름 |
| 라이센스 데이터 | |
| 경로: 행정 | IV |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| 화학 및 물리적 데이터 | |
| 공식 | C18H31GdN4O9 |
| 어금질량 | 604.72 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
가도부트롤(INN) (Gd-DO3A-butrol)은 가돌리늄 기반의 MRI 조영제(GBCA)이다.
캐나다와 미국에서 마케팅 승인을 받았다.[1][2][3][4]
2007년 현재 1.0 어금니 농도로 승인된 유일한 GBCA이다.[5]
가도부트롤은 바이엘 AG가 가도비스트로, 바이엘헬스케어제약이 가도비스트로 각각 마케팅한다.[6]
인도에서도 비베레이미징이 비비부트롤로 마케팅하고 있다.[7]
의학적 용법
가도부트롤은 성인과 어린이의 자기공명영상(MRI) 진단에 쓰이는 약품이다. 그것은 두개골, 척추, 유방 또는 다른 조사 중에 대조력 향상을 제공한다. 중추신경계에서는 가도부트롤이 혈액뇌장벽(BBB)에 이상이 있거나 혈관 이상이 있는 부위를 강조하여 작용한다. 유방조직에서 가도부트롤은 악성 유방질환의 유무와 정도를 노출시킨다. 마찬가지로, 가도부트롤은 뇌졸중 진단, 종양관류 검출, 초점 대뇌 허혈 유무를 위한 대조 강화 자기공명 혈관조영술(CE-MRA)에도 사용된다.[6][8]
Gadobutrol은 의료 전문가들에 의해서만 정맥주사로 투여되어야 한다. 주입을 준비하고 관리할 때는 항상 멸균 기법을 사용해야 한다. 가도부트롤은 다른 GBCA에 비해 고농축 형태(1mmol/mL)로 이용 가능하여 높은 투여량을 완화할 수 있다. 권장 선량은 0.1 mL/kg 체중이다.[6]
역효과
가도부트롤의 안전성은 임상시험과 시판 후, 다양한 모집단 및 다회량에서 평가되었다.[6][8]
가도부트롤에 대한 가장 심각한 반응은 약물 제거 장애가 있는 환자들 사이에서 신프로겐계 섬유증(NSF)이다. 이 위험은 만성적이고 신장 기능이 손상된 환자와 급성 신장 손상이 있는 환자 중에서 가장 높다. NSF는 피부, 근육 및 내부 장기에 사망 또는 심각한 손상을 초래할 수 있다.[6]
다른 조영제에 대해 이전에 이상 반응을 경험한 적이 있는 환자, 기관지 천식 및/또는 알레르기 질환은 가도부트롤에 대한 과민성 반응의 위험이 증가한다. 과민성 반응은 가벼운 것부터 심한 것까지 다양한 아나필락토이드와 아나필락틱 반응을 포함할 수 있다. 그러나 이러한 반응은 드물지만, 가도부트롤 투여 중이나 투여 후 환자의 징후와 증상을 감시할 필요가 있다.[6][8]
그 밖에 투여 후 소량의 환자에서 보다 가벼운 이상반응이 관찰되었다. 이러한 반응은 다음을 포함할 수 있지만 이에 국한되지는 않는다.[6]
- 두통
- 메스꺼움 및/또는 구토
- 주사부위 반응(냉감, 온기, 통증, 화상)
- 디스게이시아(입에 불쾌한 맛)
- 덥다
- 현기증
- 발진
- 에리테마(피부 붉어짐)
- 호흡곤란(호흡곤란)
- 파스텔레스 (불타는 느낌)
특정 모집단에서 사용
임신
FDA는 가도부트롤을 임신 범주 C로 분류했다. 임신한 인간 여성의 가도부트롤에 대한 충분한 연구가 수행되지 않았다. 그러나 다른 GBCA는 인간에서 태반을 건너 태아의 노출을 초래하는 것으로 나타났지만 태아에게 악영향을 미치지는 않는다.[6]
임신한 쥐와 토끼를 각각 신체 표면적을 기준으로 인간 등가선량의 12배, 8배에 노출시킨 동물 연구가 진행돼 왔다. 이러한 노출은 종종 배아 발육 지연과 배아 사망을 초래했다. 인간 권장량의 8배까지 투여된 원숭이에서는 배아 지연이 발생하지 않았지만 배아 사망으로 이어졌다. 이 동물들은 며칠에 걸쳐 여러 번 투여되었고, 따라서 그들의 노출 수준은 인간에서 경험한 것보다 훨씬 더 높았다.[6]
가도부트롤은 잠재적인 이익이 태아의 위험보다 큰 경우에만 임산부에게 투여해야 한다.[6][8]
모유수유
가도부트롤이 인간에게서 우유로 옮겨진 양은 알려지지 않았다. 인간 모유에서 다른 GBCA의 배설물에 대한 제한된 데이터가 존재하지만, 모유에 투여된 물질의 0.01%에서 0.04%의 전달률을 제안한다. 가드로부트롤에 대한 비임상 데이터는 권장량을 정맥 투여할 때 0.01% 미만이 모유에 배설된다는 것을 보여준다. 추가 데이터를 보면 GI 트랙을 통한 흡수가 매우 불량하다는 것을 알 수 있다(약 5%). 최고 수준의 안전을 위해, 모유 수유는 가도부트롤을 투여한 후 24시간 동안 중단해야 한다.[6][8]
소아과
안전성과 효능, 약동학은 2~17세 아동에게 잘 확립되어 있다. 권장 체중 0.1 mL/kg의 조정은 필요 없는 것으로 나타났다.[6][8]
2세 미만 아동의 안전 및 효능 데이터는 제한적이지만 0.1 mL/kg 체중 선량의 사용이 이 모집단에 사용될 수 있음을 입증했다. 단, 가능한 최저 선량을 사용하고 선량의 중간에서 최소 7일의 기간을 체내에서 제거하는 것이 좋다.[8]
노인학
임상 자료에 따르면 65세 이상 대상자와 65세 미만 대상자의 경우 가도부트롤의 안전성이나 효능에는 차이가 없는 것으로 나타났다. 신장 손상이 없는 사람에 대해 필요한 특별한 예방조치 및/또는 선량 조정은 없다.[6][8]
신장 장애 인구
가도부트롤 투여 전에 모든 환자에 대해 신장 손상을 평가할 것을 권고한다. 이러한 모집단의 선량을 조정할 필요는 없지만 혈액투석을 사용하여 가도부트롤을 몸에서 제거해야 한다.[6]
상호작용
Gadobutrol과 알려진 약물 상호작용은 없다. 그러나 다른 약과 섞어서도 안 된다.[6]
작용기전
가도부트롤은 자기공명영상(Magnetic macrocyclic contrast)에 사용하기 위해 정맥으로 투여되는 파라자성 매크로클릭 대조약이다. 대비 강화 효과는 가돌리늄과 디히드록시-하이드록시메틸프로필-테트라아자시클로데케인-트리아세트산(부트롤)의 중성복합체 결과로서 종방향 이완시간(T1)과 스핀 스핀스핀 또는 횡방향 이완시간(T2)의 차이를 감소시키는 효과가 있다. 이러한 이완 시간은 양성자 밀도의 차이와 결합되어 MRI의 조직 시각화 기능에 기여하는 무선 주파수 신호의 강도 변화에 책임이 있다. T1과 T2의 단축을 증가시킴으로써 더 큰 신호 향상, 따라서 더 큰 조직 시각화를 달성할 수 있다.[8][9]
역사
상용화
가도부트롤은 1998년 스위스에서 뇌와 척수의 조영 증강된 MRI 촬영에 사용하도록 처음 승인되었다. 그 이후로, 그것은 미국, 캐나다, 멕시코, 호주, 뉴질랜드, 중국, 한국, 러시아, 브라질을 포함한 65개국에서 다수의 용도로 승인되고 판매되었다.[10] 가도부트롤은 2011년 미국 중앙신경계 MRI에 처음 사용 승인을 받았다. 현재 바이엘헬스케어제약이 제조하고 있으며 가다비스트라는 브랜드명으로 판매되고 있다.[10][11] 2015년 가다비스트는 FDA로부터 2세 미만 어린이에게 사용할 수 있는 최초의 콘트라스트제로 승인을 받았다. 가장 최근인 2016년 초, 가다비스트는 대조 강화 자기공명 혈관조영술에 사용하기 위해 미국에서 승인을 받았다.[11]
연구 및 임상시험
가다비스트는 미국에서 시행된 1단계 임상 2상, 2단계 임상 3상 외에 주로 아시아와 유럽연합(EU)에서 이뤄졌던 43개 임상 연구에서 나온 연구 결과를 제시해 2011년 미국에서 승인을 받았다.[10] 다중 중심 무작위 이중 블라인드 임상 3상(활성 대조군 팔 없이 완료된 임상 1상)[12][13]에는 18세 이상 남녀 모두 CNS의 조영 증강 MRI를 요청한 402명의 환자가 등록되었다. 각 환자들은 정맥주사를 통해 가도부트롤(0.1mmol/kg 체중)을 1회 복용한 후 정맥주사를 통해 승인된 용량(0.1mmol/kg 체중)으로 가도세리돌(ProHance)을 1회 복용하거나 그 반대의 경우도 있었다. 이 연구는 가도부트롤의 안전성과 효능을 평가했다. 이러한 3단계 임상시험에서 다음과 같은 결론을 내렸다.[10]
- 강화되지 않은 이미지에 비해 향상된 가도부트롤 및 개선되지 않은 이미지를 결합한 경우:
- 탁월한 진단 성능
- 병변 시각화 변수 대비 강화, 경계 및 내부 형태학에 우수함
- 감지된 병변 수에 대한 비이차
- Gadobutrol은 시각화 변수 대비 강화, 테두리 표현 및 내부 형태학, 검출된 병변 수와 관련하여 ProHance에 비우호적인 것으로 나타났다.
- 가도부트롤은 병변 악성종양 판정 시 프로한스보다 높은 민감도를 보였다.
- 가도부트롤이 강화된 이미지는 눈이 먼 세 명의 독자 모두 프로한스가 강화된 이미지보다 꾸준히 선호되었다.
2015년 만 2세 미만 아동에 대한 사용 승인에 앞서 임상 1상이 진행됐다. 정기적인 조영 증강 MRI 검사를 예정하고 있는 소아과 환자는 2세 미만 남녀 모든 신체 부위의 MRI 검사를 받을 수 있다. 개방형 라벨, 다중 중심, 약동학 및 안전 검사는 가도부트롤을 섭취하고 이동시키는 방법을 연구했으며, 유아들의 몸에서 제거되었다. 본 연구는 또한 몸무게 0.1 mmol/kg(0.1 mL/kg)의 가도부트롤 표준 선량에 대한 안전성, 허용성 및 유효성을 평가했다. 임상시험은 바이엘헬스케어제약이 후원했다.[14]
2006년 초 자기공명 혈관조영술(MRA)에 대한 사용 승인에 앞서 임상 3상이 실시되었다. 남성과 여성 모두 18세 이상의 일상적인 자기공명 혈관조영술(MRA)을 필요로 하는 환자들은 연구에 등록될 수 있다. 개방형 라벨, 뮤티-센터, 블라인드 독서 안전 및 효능 연구에서는 가도부트롤 강화 MRA 영상에 대한 진단 결과를 비대조 MRA 영상과 비교했다. 환자들은 스캔하기 전에 0.1mmol/kg 가도부트롤의 정맥주사를 한 번 맞았다. MRA 영상 결과는 자격을 갖춘 인력에 의해 맹목적으로 판독되었다. 임상시험은 바이엘헬스케어제약이 후원했다.[15]
규제
가도부트롤에 대한 유일한 미국 특허는 US5980864A로, 1999년 11월 9일 셰링 AG에 허가되었다.[16] The patent is for the process using 1,4,7,10-tetraazacyclododecane butyltriols to produce the gadolinium (III) complex of 10-(1-hydroxymethyl-2,3-dihydroxypropyl)-1,4,7-triscarboxymethyl-1,4,7,10-tetraazacyclododecane (gadobutrol). 이 특허는 이 금속 단지를 우수한 진단 매체로 사용하는 것을 방어한다. 2006년 바이엘헬스케어제약이 셰링AG를 흡수했고, 2007년 11월 바이엘 셰링파마(Bayer Schering Pharma)에 특허권이 넘어갔다. 2011년 FDA 승인 후 특허는 1,470일 연장을 허가받았고, 상품명인 가다비스트는 특허와 연관되게 되었다. 2016년 2월 특허는 연임이 허가됐지만 2016년 11월 만료됐다.[17]
포장 및 구매
Gadobutrol contrast media is a clear, colorless-to-pale yellow solution of 1 mmol/mL formulation, available in single dose vials (2 mL, 7.5 mL, 10mL, and 15 mL), single dose pre-filled injections (7.5 mL, 10 mL, 15 mL), and pharmacy bulk packages (30 mL and 65 mL) containing multiple vials.[18] 가도부트롤은 현재 미국에서 가다비스트라는 이름으로, 다른 대부분의 나라에서는 가도비스트 또는 가도비스트 1.0이라는 이름으로 시판되고 있다.[10]
가도부트롤은 처방이 불가능하고 훈련된 인력에 의해서만 투여할 수 있다. 2016년 바이엘-유엔은 이 제품의 가격을 발표했다.[19]
참조
- ^ Cheng KT (2007). "Gadobutrol" (PDF). Molecular Imaging and Contrast Agent Database (MICAD). PMID 20641787. NBK23589.
- ^ "Bayer in Radiology – Gadavist® (gadobutrol) injection 1 mmol/mL". bayerimaging.com. Retrieved 20 May 2015.
- ^ "FDA approves imaging agent for central nervous system scans" (Press release). U.S. Food and Drug Administration (FDA). March 15, 2011. Retrieved March 31, 2011.
- ^ "U.S. FDA Approves Bayer's Gadavist (Gadobutrol) Injection for MRI of the Central Nervous System" (Press release). Bayer HealthCare Pharmaceuticals. March 14, 2011. Archived from the original on May 2, 2011. Retrieved March 31, 2011.
- ^ "Education for Cardiology Disease Professionals" (PDF). touchcardiology.com. Radcliffecardiology. Retrieved 20 May 2015.
- ^ a b c d e f g h i j k l m n o "Gadavist full prescribing information" (PDF). Retrieved 2011-03-14.
- ^ "Viv-Butrol - Vivere Imaging".
- ^ a b c d e f g h i "GadovistProduct Monograph" (PDF). Bayer Inc. August 12, 2016. Retrieved November 11, 2016.
- ^ "Gadobutrol". DrugBank. 2016-11-19.
- ^ a b c d e "Briefing Document for Gadobutrol Injection, NDA 201,277" (PDF). FDA.Gov. Food and Drug Administration. January 21, 2011. Retrieved November 11, 2016.
- ^ a b "Gadavist (gadobutrol) FDA Approval History". www.drugs.com. Retrieved 2016-11-19.
- ^ Stinson B (March 6, 2009). "Clinical Review" (PDF). FDA.Gov. FDA. Retrieved November 11, 2016.
- ^ "Safety and Efficacy of Gadobutrol 1.0 Molar (Gadavist) in Patients for Central Nervous System (CNS) Imaging". ClinicalTrials.gov. 8 December 2014. Retrieved 2016-11-19.
- ^ "Gadobutrol Pharmacokinetic and Safety Study in Pediatric Subjects Aged <2 Years". ClinicalTrials.gov. Retrieved 2016-11-19.
- ^ "Gadobutrol Enhanced MRA of the Supra-aortic Vessels". ClinicalTrials.gov. Retrieved 2016-11-19.
- ^ Platzek J, Gries H, Weinmann H, Schuhmann-Giampieri G, Press W (Nov 9, 1999), 1,4,7,10-tetraazacyclododecane butyltriols, processes for their production and pharmaceutical agents containing them, retrieved 2016-11-19
- ^ "Patent US5980864A". Google Patents. Retrieved March 4, 2019.
- ^ "Bayer in Radiology Gadavist® (gadobutrol) injection 1 mmol/mL". www.radiologysolutions.bayer.com. Retrieved 2016-11-20.
- ^ "2016 Price List" (PDF). Bayer-UK. June 16, 2016. Retrieved November 19, 2016.


