Antimon pentaflorür

| |
| |
| Adlandırmalar | |
|---|---|
antimon(V) florür | |
Diğer adlar antimon pentaflorür pentaflorürantimon | |
| Tanımlayıcılar | |
| ChemSpider | |
| ECHA InfoCard | 100.029.110 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
| UN numarası | 1732 |
CompTox Bilgi Panosu (EPA)
|
|
| Özellikler | |
| Molekül formülü | SbF5 |
| Molekül kütlesi | 216.74 g/mol |
| Görünüm | Renksiz, yağlı sıvı higroskopik |
| Koku | Keskin |
| Yoğunluk | 2,99 g/cm³ |
| Erime noktası | 8,3 °C (281 K) |
| Kaynama noktası | 149,5 °C (422 K) |
| Çözünürlük (su içinde) | Tepki verir |
| Çözünürlük | KF ve sıvı SO2 |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Suyla veya biyolojik dokularla temas ettiğinde hidroflorik asit açığa çıkarır, son derece toksik, oksitleyici, son derece aşındırıcıdır |
| GHS etiketleme sistemi: | |
| Piktogramlar |    
|
| İşaret sözcüğü | Danger |
| Tehlike ifadeleri | H300+H310+H330, H314, H411, H412 |
| Önlem ifadeleri | P260, P261, P264, P270, P271, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P312, P304+P340, P305+P351+P338, P310, P312, P321, P330, P363, P391, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | TWA 0.5 mg/m3 (as Sb)[1] |
| REL (tavsiye edilen) | TWA 0.5 mg/m3 (as Sb)[1] |
| Güvenlik bilgi formu (SDS) | ICSC 0220 |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Antimon pentaklorür |
Diğer katyonlar
|
Fosfor pentaflorür Arsenik pentaflorür Bizmut pentaflorür |
Benzeyen bileşikler
|
Antimon triflorür |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Antimon pentaflorür, SbF5 formülüne sahip bir inorganik bileşiktir. Bu kokusuz, viskoz sıvı güçlü bir Lewis asididir ve sıvı HF ile sıvı SbF5'in 1:1 oranında karıştırılmasıyla oluşan süperasit floroantimonik asidin bir bileşenidir. Güçlü lewis asitliği ve neredeyse tüm bilinen bileşiklerle reaksiyona girme yeteneği ile dikkat çekicidir.
Hazırlanışı
[değiştir | kaynağı değiştir]Antimon pentaflorür, antimon pentaklorür ile susuz hidrojen florürün:[3] tepkimeye girmesiyle hazırlanır
- SbCl5 + 5 HF → SbF5 + 5 HCl
Aynı şekilde antimon triflorür ile flordan da hazırlanabilir.
Yapısı ve kimyasal tepkimeleri
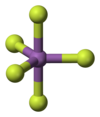
[değiştir | kaynağı değiştir]Gaz fazındayken, SbF5, D3h nokta grubu simetrisinin üçgen bipiramidal yapısını benimser. Bu materyal, sıvı ve katı hallerde daha karmaşık yapıları benimser. Her bir Sb'nin oktahedral olduğu polimerler içerir, formül [SbF4(μ-F)2]n (μ-F) ile açıklanan yapı, florür merkezlerinin iki Sb merkezini köprülediği gerçeğini belirtir. Kristal malzeme bir tetramerdir, yani [SbF4(μ-F)]4 formülüne sahiptir. Sb-F bağları, sekiz üyeli Sb4F4 halkası içinde 2,02 Å; dört Sb merkezinden yayılan kalan florür ligandları 1,82 Å'de daha kısadır.[4] PF5 ve AsF5 ilgili türleri, muhtemelen koordinasyon sayılarını sınırlayan merkez atomun daha küçük boyutları nedeniyle katı ve sıvı hallerde monomeriktir. BiF5 bir polimerdir.[5]
SbF5 in HF'nin Brønsted asitliğini arttırdığı gibi, F2 nin oksitleyici gücünü de arttırır. Bu etki, oksijenin oksidasyonu ile gösterilmektedir:
- 2 SbF5 + F2 + 2 O2 → 2 [O2]+[SbF6]−
Antimon pentaflorür, florür bileşiklerinden flor gazı üreten ilk keşfedilen kimyasal reaksiyonda da kullanılmıştır:
- 4 SbF5 + 2 K2MnF6 → 4 KSbF6 + 2 MnF3 + F2
Bu reaksiyonun itici gücü, SbF5 in F-'ye, olan yüksek afinitesidir; bu, SbF5'in süper asitler oluşturmak için kullanılmasını öneren aynı özelliktir.
Hekzafloroantimonat
[değiştir | kaynağı değiştir]SbF5, hekzafloroantimonat olarak adlandırılan çok kararlı [SbF6]− anyonunu vermek için F− kaynaklarına karşı istisnai olarak güçlü bir Lewis asididir. [SbF6]−, PF6−'ye benzer zayıf koordine edici bir anyondur. Sadece zayıf temel olmasına rağmen, [SbF6]−, merkez simetrik bir eklenti vermek için ek SbF5 ile reaksiyona girer:
- SbF5 + [SbF6]− → [Sb2F11]−
Güvenlik
[değiştir | kaynağı değiştir]SbF5 birçok bileşikle şiddetli reaksiyona girerek genellikle tehlikeli hidrojen florür salar. Cilt ve gözler için oldukça aşındırıcıdır. Güçlü bir oksitleyicidir.[6][7]
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b NIOSH Pocket Guide to Chemical Hazards. "#0036". National Institute for Occupational Safety and Health (NIOSH).
- ^ "World of Chemicals SDS". 18 Ağustos 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Şubat 2023.
- ^ Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig, Hans Uwe Wolf "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a03_055.pub2
- ^ Edwards, A. J.; Taylor, P. "Crystal structure of Antimony Pentafluoride" Journal of the Chemical Society, Chemical Communications 1971, pp. 1376-7.DOI:10.1039/C29710001376
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. 0-12-352651-5
- ^ International Programme on Chemical Safety (2005). "Antimony pentafluoride". Commission of the European Communities (CEC). 18 Ağustos 2002 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mayıs 2010.
- ^ Barbalace, Kenneth (2006). "Chemical Database - Antimony Pentafluoride". Environmental Chemistry. Erişim tarihi: 10 Mayıs 2010.
Dış bağlantılar
[değiştir | kaynağı değiştir]- WebBook page for SbF5 3 Şubat 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- National Pollutant Inventory - Antimony and compounds fact sheet 31 Temmuz 2022 tarihinde Wayback Machine sitesinde arşivlendi.
- National Pollutant Inventory - Fluoride compounds fact sheet 3 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi.

